Évaluation préalable pour le Défi concernant le
Archivée
l'oxyde de butyle
et de 2,3-époxypropyle
Numéro de registre du Chemical Abstracts Service
2426-08-6
Environnement Canada
Santé Canada
Mars 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Estimations de la limite supérieure de l'exposition à l'oxyde de butyle et de 2,3époxypropyle par les produits de consommation
- Annexe 2 : Résumé des données sur les effets de l'oxyde de butyle et de 2,3-époxypropyle sur la santé
- Annexe 3 : Structures et classifications relatives à l'l'oxyde de butyle et de 2,3-époxypropyle et aux substances similaires prises en compte dans cette évaluation
- Annexe 4 : Résumé de tous les renseignements relatifs à la cancérogénicité et à la génotoxicité des substances jugées similaires à l'oxyde de butyle et de 2,3-époxypropyle disponibles dans cette évaluation
Les ministres de l'Environnement et de la Santé ont effectué une évaluation préalable de l'oxyde de butyle et de 2,3-époxypropyle, dont le numéro de registre du Chemical Abstracts Service est 2426-08-6. Une priorité élevée a été accordée à la prise de mesures à l'égard de cette substance lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres. L'oxyde de butyle et de 2,3époxypropyle présente un risque d'exposition intermédiaire pour les Canadiens et il a été classé par d'autres organismes sur la base de sa cancérogénicité et de sa génotoxicité. La substance ne répondait pas aux critères de persistance, de bioaccumulation ou de toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée sur les aspects relatifs à la santé humaine.
Selon les renseignements transmis conformément à l'article 71 de la LCPE (1999), aucune entreprise canadienne n'a déclaré avoir fabriqué en 2006 de l'oxyde de butyle et de 2,3-époxypropyle en une quantité égale ou supérieure au seuil de 100 kg. Cependant, il a été signalé que de 10 000 à 100 000 kg ont été importés au Canada en 2006. L'oxyde de butyle et de 2,3-époxypropyle est employé comme diluant réactif des résines époxydes servant de réducteur de viscosité, comme produit chimique intermédiaire et comme accepteur d'acide pour stabiliser les solvants chlorés. Au Canada, il est principalement utilisé dans les formulations de résines époxydes qui ont des applications dans les revêtements, les adhésifs, les liants, les matériaux d'étanchéité, les bouche-pores et les résines.
Les émissions d'oxyde de butyle et de 2,3-époxypropyle dans l'environnement ambiant proviendraient vraisemblablement de sources anthropiques, plus précisément de l'utilisation et de la production commerciale des résines époxydes. D'après les propriétés physiques et chimiques, les utilisations et les rejets déclarés, la principale voie d'exposition de la population générale à cette substance est sans doute par inhalation de l'air, et l'exposition par d'autres milieux est vraisemblablement négligeable.
D'après ses propriétés physiques et chimiques, l'oxyde de butyle et de 2,3-époxypropyle ne devrait pas présenter de risque de persistance ou de bioaccumulation dans l'environnement. Cette substance ne répond pas aux critères de la persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. En outre, les données empiriques de la toxicité aquatique aiguë indiquent que la substance représente un danger faible à modéré pour les organismes aquatiques. Selon une comparaison de la concentration estimée sans effet toxique et de la concentration estimée raisonnable d'exposition dans l'environnement, il est conclus que l'oxyde de butyle et de 2,3-époxypropyle l'oxyde de butyle et de 2,3-époxypropyle ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou encore à mettre en danger l’environnement essentiel pour la vie.
Bien qu'aucune étude de cancérogénicité à long terme n'ait été menée sur l'oxyde de butyle et de 2,3-époxypropyle, il s'est révélé génotoxique dans plusieurs essais in vivoet in vitro. De plus, des analogues structuraux de l'oxyde de butyle et de 2,3-époxypropyle se sont révélés cancérogènes chez les animaux de laboratoire et génotoxiques dans divers essais in vivo et in vitro. Étant donné les résultats positifs de génotoxicité pour l'oxyde de butyle et de 2,3-époxypropyle ainsi que la génotoxicité et la cancérogénicité des analogues de l'oxyde de butyle et de 2,3-époxypropyle, il a été conclu que l'oxyde de butyle et de 2,3-époxypropyle pourrait présenter une possibilité d'effets nocifs quel que soit le degré d'exposition. En conséquence, on peut conclure que l'oxyde de butyle et de 2,3-époxypropyle est une substance pouvant pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D'après les renseignements disponibles, on peut conclure que l'oxyde de butyle et de 2,3-époxypropyle répond à au moins un des critères de l'article 64 de la LCPE(1999).
De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
De plus, s'il y a lieu, des activités de recherche et de surveillance viendront appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
Conformément à la Loi canadienne sur la protection de l’environnement (1999) [LCPE(1999)] (Canada, 1999), les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui ont été jugées prioritaires dans le cadre de la catégorisation de la Liste intérieure des substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine. Selon les résultats de cette évaluation, les ministres peuvent proposer de ne rien faire à l'égard de la substance, de l'inscrire sur la Liste des substances d'intérêt prioritaire en vue d'une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l'annexe 1 de la Loi et, s'il y a lieu, sa quasi-élimination.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques et que l'on estime commercialisées;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada(Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances d'importance prioritaire.
L'oxyde de butyle et de 2,3-époxypropyle est une substance dont l'évaluation des risques pour la santé humaine a été jugée hautement prioritaire, car on considère qu'il présente un REI et il a été classé par d'autres organismes en fonction de sa cancérogénicité et de sa génotoxicité.
Le volet du Défi portant sur l'oxyde de butyle et de 2,3-époxypropyle a été lancé au moyen d'un avis paru dans la Gazette du Canada le 30 août 2008 (Canada, 2008). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. De nouveaux renseignements sur la substance ont été communiqués en réponse au Défi.
Une priorité élevée a été donnée à l'évaluation des risques que présente l'oxyde de butyle et de 2,3-époxypropyle pour la santé humaine. Cette substance ne répond pas aux critères environnementaux de la catégorisation relatifs à la persistance, à la bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE(1999) mettent l'accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de l'article 64 de la Loi. Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l'évaluation préalable de l'oxyde de butyle et de 2,3-époxypropyle ont été relevées dans des publications originales, des rapports de synthèse et d'évaluation, des rapports de recherche de parties intéressées et d'autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en avril 2009 (exposition et effets sur la santé humaine) et jusqu'en février 2009 (propriétés physiques et chimiques, exposition et effets sur l'environnement). Les études les plus importantes ont fait l'objet d'une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble et de l'information sur les dangers et les risques pour la santé (fondée principalement sur les évaluations effectuées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur l'écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, et ce, dans le contexte d'une évaluation préalable. La présente évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion proposée.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. Cette évaluation préalable a fait l'objet d'une consultation et d'une étude consignée par des pairs. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment M. Bernard Gadagbui (TERA), M. Michael Jayjock (The Lifeline Group) et Mme Susan Griffin (Environmental Protection Agency des États-Unis). Les portions de la présente évaluation préalable qui portent sur l'écologie ont fait l'objet d’une consultation ou d'une étude rédigée par des pairs. Par ailleurs, l'ébauche de cette évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Aux fins du présent document, la substance est appelée oxyde de butyle et de 2,3époxypropyle, appellation correspondant à son nom commun. Les renseignements relatifs à l'identité de cette substance sont résumés au tableau 1.
Tableau 1. Identité de la substance
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 2426-08-6 |
| Nom dans la LIS1 | Oxyde de butyle et de 2,3-époxypropyle |
| Noms relevés dans les National Chemical Inventories (NCI)2 | Oxirane, (butoxymethyl)- (TSCA, AICS, SWISS, PICCS, ASIA-PAC, NZIoC); oxyde de butyle et de 2,3époxypropyle (EINECS) butylglycidylether (ENCS); n-butyl glycidyl ether (ENCS, PICCS); (butoxymethyl)oxirane (ECL); butyl glycidyl ether (PICCS); normal butyl glycidyl ether (PICCS) |
| Autres noms | (±)-Butyl glycidyl ether;1butoxy-2,3-epoxypropane; 1butyl glycidyl ether; 2,3-epoxypropyl butyl ether;2-(butoxymethyl)oxirane;3-butoxy-1,2-epoxypropane; BGE; BGE-C; BGE-R; DYBP; DY-BP (epoxide); Epi-Rez 501; Epodil 741; Epodil 741HP; ERL 0810; glycidyl butyl ether; glycidyl n-butyl ether; N 10; N 10 (ether); NSC 83413; propane, 1butoxy-2,3-epoxy- |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Époxydes |
| Principale sous-classe chimique | Époxydes alkylés; éthers de glycidyle |
| Formule chimique | C7H14O2 |
| Structure chimique | |
| SMILES3 | O(C1COCCCC)C1 |
| Masse moléculaire | 130,185 g/mol |
| 1 LIS : Liste intérieure des substances. 2 National Chemical Inventories (NCI), 2008 : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique); ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). 3 SMILES : Simplified Molecular Input Line Entry. |
|
Les principales propriétés physiques et chimiques de l'oxyde de butyle et de 2,3époxypropyle sont décrites dans le tableau 2.
Tableau 2. Propriétés physiques et chimiques de l'oxyde de butyle et de 2,3époxypropyle
| Propriété | Type | Valeur | Cote† | Référence |
|---|---|---|---|---|
| † Cote qualitative relative du paramètre physico-chimique de la substance. | ||||
| Point de fusion (°C) | Modélisé | -30,96 | MPBPWIN, 2000 | |
| Point d'ébullition (°C) | Expérimental | 164 | Lewis, 2001 | |
| Masse volumique (g/mL à 25 °C) | Expérimental | 0,908 | Lewis, 2001 | |
| Pression de vapeur (Pa à 25 °C) | Expérimental | 427 (3,2 mm Hg) |
Élevée | Lewis, 2001 |
| Constante de la loi de Henry (Pa·m3/mol) | Modélisé (méthode de liaison) | 0.443 (4,37 x 10-6 atm·m3/mol) |
Modérée | HENRYWIN, 2000 |
| Solubilité dans l'eau (mg/L à 20 °C) | Expérimental | 20 000 | Très élevée | Bingham et al., 2001 |
| Log Koe (coefficient de partage octanol/eau) [sans dimension] | Expérimental | 0,63 | Faible | Hansch et al., 1995 |
| Log Kco (coefficient de partage carbone organique) [sans dimension] | Modélisé | 1,09-1,16 | Très faible | KOCWIN, 2009 |
Aucun renseignement indiquant que l'oxyde de butyle et de 2,3-époxypropyle serait naturellement présent dans l'environnement n'a été relevé. Cette substance est produite par la condensation de l'épichlorhydrine et de l'alcool n-butylique afin de former une chlorhydrine intermédiaire, qui est ensuite déshydrochlorée pour former un groupe époxyde (NTP, 2004; Bosch et al., 1985).
L'oxyde de butyle et de 2,3-époxypropyle peut être libéré dans l'environnement par des émissions d'installations industrielles produisant, manipulant ou utilisant des résines, des revêtements et des adhésifs à base d'époxy.
Selon les renseignements transmis conformément à l'article 71 de la LCPE(1999), aucune entreprise canadienne n'a déclaré avoir fabriqué en 2006 de l'oxyde de butyle et de 2,3-époxypropyle en une quantité égale ou supérieure au seuil de 100 kg. Toutefois, 10 000 à 100 000 kg ont été importés au Canada en 2006 (Environnement Canada, 2008).
L'oxyde de butyle et de 2,3-époxypropyle est classé comme produit chimique produit en grandes quantités aux États-Unis. Les volumes produits et/ou importés cumulés aux États-Unis en 2006 sont compris entre 1 million et 10 millions de livres (US EPA, 2008a), soit entre 454 et 4 536 tonnes métriques.
L'oxyde de butyle et de 2,3-époxypropyle est employé comme diluant réactif des résines époxydes, produit chimique intermédiaire ou accepteur d'acide pour stabiliser les solvants chlorés (NTP, 2004; Bingham et al., 2001). Le diluant réactif agit dans les systèmes en résine époxyde en tant qu'agent de réduction de la viscosité, permettant une manipulation plus facile de la résine non traitée (Lee, 1989; Bosch et al., 1985). En raison de la présence du groupe époxyde fonctionnel, l'oxyde de butyle et de 2,3-époxypropyle participe à la polymérisation et aux réactions de réticulation, créant une liaison covalente au réseau époxyde au cours du traitement (Hamerton, 1996; Lee, 1989; Bosch et al.,1985).
Selon les renseignements présentés en application de l'article 71 de la LCPE(1999), l'oxyde de butyle et de 2,3-époxypropyle est employé au Canada dans la formulation des résines époxydes, lesquelles sont utilisées comme revêtements, adhésifs, liants, produits d'étanchéité, bouche-pores et résines (Environnement Canada, 2008). Une faible quantité (2 kg d'oxyde de butyle et de 2,3-époxypropyle) soit importée en tant qu'impureté dans un agent de conservation pour les peintures (Environnement Canada, 2008). La substance n'est pas un ingrédient actif et n'entre pas dans la composition des produits antiparasitaires homologués au Canada, mais elle peut être présente comme impureté de formulant (PMRA 2009).
L'oxyde de butyle et de 2,3-époxypropyle n'a pas été enregistré dans le Système de déclaration des cosmétiques et n'est donc pas délibérément incorporé dans des cosmétiques (SDC, 2009); toutefois, cette substance n'est actuellement pas répertoriée dans la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques établie par Santé Canada. Son utilisation dans les produits cosmétiques n'est donc pas interdite (Santé Canada, 2009a). Cependant, la Commission européenne a classé cette substance dans l'annexe II de la liste des substances et ingrédients cosmétiques, indiquant que la substance ne doit pas entrer dans la composition des produits cosmétiques dans l'Union européenne (CosIng, 2009).
Au Canada, l'oxyde de butyle et de 2,3-époxypropyle n'est pas répertorié dans la Base de données sur les produits pharmaceutiques, la Base de données sur les ingrédients des produits de santé naturels ou la Base de données des produits de santé naturels homologués (Santé Canada, 2009b; Santé Canada, 2009c). De même, son utilisation dans les produits thérapeutiques n'a pas été signalée en application de l'article 71 (Environnement Canada, 2008); il est donc peu probable que cette substance se retrouve dans des produits pharmaceutiques ou de santé naturels. La Direction générale des produits de santé et des aliments de Santé Canada a indiqué que l'oxyde de butyle et de 2,3-époxypropyle est peu susceptible d'être utilisé dans les conditionnements alimentaires actuels (courriel envoyé en 2009 par la Direction des aliments au Bureau d'évaluation des risques, source non citée dans les références).
Le Règlement sur les produits contrôlés établi en vertu de la Loi sur les produits dangereux exige que cette substance soit déclarée sur la fiche technique santé/sécurité qui doit accompagner les substances chimiques sur les lieux de travail lorsqu'elles sont présentes à une concentration égale ou supérieure à 0,1 %, conformément aux instructions de la Liste de divulgation des ingrédients (Santé Canada, 2009d).
L'oxyde de butyle et de 2,3-époxypropyle n'est pas fabriqué en quantités justifiant leur déclaration au Canada; toutefois, certaines installations industrielles qui traitent, manipulent ou stockent du matériau importé peuvent émettre des rejets dans l'environnement. Les renseignements obtenus aux termes de l'article 71 de la LCPE(1999) indiquent que la quantité de rejets de cette substance dans l'air par les importateurs canadiens s'est établie dans une fourchette de 100 à 1 000 kg en 2006 (Environnement Canada, 2008). Aucun rejet dans l'eau ou le sol n'a été rapporté (Environnement Canada, 2008).
Quant à l'exposition provenant de sources environnementales, aucune donnée de surveillance environnementale canadienne n'a été relevée. L'oxyde de butyle et de 2,3époxypropyle n'est pas déclarable à l'Inventaire national des rejets de polluants (INRP, 2007); aucun renseignement sur les rejets ne peut donc être obtenu de cette source.
D'après les propriétés physiques et chimiques de l'oxyde de butyle et de 2,3époxypropyle (tableau 2), les résultats de la modélisation de la fugacité de niveau III (tableau 3) semblent indiquer que cette substance devrait demeurer principalement dans le milieu dans lequel elle est rejetée.
Tableau 3. Résultats du modèle de fugacité de niveau III (EQC, 2003) de l'oxyde de butyle et de 2,3-époxypropyle
| Substance rejetée dans : | Fraction de la substance se répartissant dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 64 | 17 | 19 | 0,0 |
| l'eau (100 %) | 0,0 | 99,8 | 0,0 | 0,2 |
| le sol (100 %) | 0,0 | 20,0 | 80,0 | 0,0 |
Le tableau 4a présente les données empiriques sur la dégradation de l'oxyde de butyle et de 2,3-époxypropyle.
Tableau 4a. Données empiriques sur la dégradation de l'oxyde de butyle et de 2,3époxypropyle
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre et unités de la dégradation | Référence |
|---|---|---|---|---|
| Eau | Biodégradation | 40 | Biodégradation, % | MITI, 2002 |
| Eau | Biodégradation | 25 | Biodégradation, % | US EPA, 2008b |
| Eau | Biodégradation | 4 et 12 | Biodégradation, % | US EPA, 2008b |
| Eau | Hydrolyse | 20,3 | Demi-vie, jours | IUCLID, 2006 |
L'étude du MITI (2002) indique un taux de biodégradation de 40 % sur 28 jours au cours d'un essai de biodégradation immédiate de l'oxyde de butyle et de 2,3-époxypropyle. Compte tenu d’une cinétique de dégradation du premier ordre, la demi-vie estimée dans l'eau est d'environ 38 jours, ce qui indiquerait que l'oxyde de butyle et de 2,3-époxypropyle n'est pas persistant dans l'eau.
Deux études de dégradation supplémentaires ont été citées dans un sommaire de rigueur d'étude élaboré par l'Environmental Protection Agency (US EPA, 2008b). Durant un essai en fiole fermée (directive d’essai 301D de l’Organisation de coopération et de développement économiques [OCDE]), l'oxyde de butyle et de 2,3-époxypropyle est oxydé à hauteur de 25 % de la demande théorique d'oxygène au jour 28, ce qui indique que la substance est partiellement biodégradable. En supposant une cinétique de dégradation de premier ordre, la demi-vie prévue dans l'eau selon ce résultat serait d'environ 70 jours. Au cours d'un essai Sturm modifié (directive d’essai 301B de l’OCDE), 4 % et 12 % de la formation de dioxyde de carbone théorique possible ont été observés, ce qui amène les auteurs de l'étude à conclure à l'absence de preuve de biodégradabilité. Il existe des incertitudes concernant les faibles résultats empiriques de biodégradation, qui pourraient être dus à la volatilisation. La consultation détaillée des études d'origine est impossible, car seul le sommaire de rigueur d'étude établi par l'Environmental Protection Agency des États-Unis (US EPA, 2008b) est disponible.
Une étude visant à déterminer le taux approximatif d'hydrolyse de l'oxyde de butyle et de 2,3-époxypropyle indique une demi-vie d'hydrolyse de 20,3 jours (486,7 heures) à 20 °C et à pH 7. Le taux d'hydrolyse diminue lorsque le pH augmente (IUCLID, 2006). D'après ces résultats, l'hydrolyse serait un processus important régissant le devenir de cette substance dans l’environnement. Bien que les produits de l'hydrolyse ne soient pas connus, ils devraient être plus solubles dans l'eau et moins bioaccumulables que la substance elle-même.
En raison du peu de données expérimentales sur la dégradation de l'oxyde de butyle et de 2,3-époxypropyle, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) [Environnement Canada, 2007] a également été utilisée. Les résultats de ces modèles de dégradation sont indiqués dans le tableau 4b. Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et que l'oxyde de butyle et de 2,3-époxypropyle peut être libéré dans ce milieu, la biodégradation a été principalement étudiée à l'aide de modèles prédictifs RQSA pour la biodégradation.
Tableau 4b. Données modélisées sur la dégradation de l'oxyde de butyle et de 2,3-époxypropyle
| Processus du devenir | Résultat et prévision du modèle | Demi-vie extrapolée (jours) | Modèle et base du modèle |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade and Industry, Japon; s.o., sans objet; t½, demi-vie. 1 Le modèle ne précise pas d'estimation pour ce type de structure. 2 Le résultat s'exprime par une valeur numérique. 3 Le résultat s'exprime par un taux de probabilité. |
|||
| Air | |||
| Oxydation atmosphérique | t½ = 0,54 jour | < 2 | AOPWIN, 2000 |
| Réaction avec l'ozone | s.o.1 | s.o. | AOPWIN, 2000 |
| Eau | |||
| Biodégradation (aérobie) | 3,192 « semaines » |
< 182 | BIOWIN, 2000 Sous-modèle 3 : enquête d'expert (biodégradation ultime) |
| Biodégradation (aérobie) | 3,912 « jours » |
< 182 | BIOWIN, 2000 Sous-modèle 4 : enquête d'expert (biodégradation primaire) |
| Biodégradation (aérobie) | 0,563 « se biodégrade rapidement » |
< 182 | BIOWIN, 2000 Sous-modèle 5 : MITI, probabilité linéaire |
| Biodégradation (aérobie) | 0,603 « se biodégrade rapidement » |
< 182 | BIOWIN, 2000 Sous-modèle 6 : MITI, probabilité non linéaire |
| Biodégradation (aérobie) | 1,03 « se biodégrade rapidement » |
< 182 | TOPKAT, 2004 probabilité |
| Biodégradation (aérobie) | % DBO = 60 « se biodégrade rapidement » |
< 182 | CATABOL ©2004-2008 % DBO |
Une demi-vie d'oxydation atmosphérique dans l'air de 0,54 jour (voir le tableau 4b) démontre que cette substance est susceptible de s'oxyder rapidement. Cette substance ne devrait pas réagir dans l'atmosphère avec d'autres espèces photo-oxydantes, comme l'ozone, et elle ne devrait pas se dégrader par photolyse directe. Des réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus régissant le devenir de la substance dans l'atmosphère. Étant donné la demi-vie estimée de 0,54 jour, l'oxyde de butyle et de 2,3-époxypropyle est considéré comme non persistant dans l'air.
Les résultats des modèles indiquent que la biodégradation est rapide. Les quatre modèles de biodégradation immédiate – sous-modèles BIOWIN 5 et 6 (BIOWIN, 2000), CATABOL (c2004-2008) et TOPKAT (2004) – indiquent une demi-vie de dégradation ultime d’au plus 182 jours. Les résultats des sous-modèles BIOWIN 3 et 4 (BIOWIN, 2000) montrent que la substance subit sa dégradation primaire et sa dégradation ultime probablement en moins de 182 jours. Les prévisions de CATABOL (c2004-2008) et TOPKAT (2004) sont similaires à celles des deux modèles (et indiquent une biodégradation rapide). Les modèles tendent donc à indiquer que la demi-vie de dégradation ultime (et par conséquent primaire) est bien inférieure à 182 jours.
Les résultats détaillés des études de dégradation expérimentales ci-dessus divergent; l'une des études indiquant une dégradation ultime relativement rapide (MITI, 2002) alors que les autres font état d'une biodégradabilité partielle voire négligeable (US EPA, 2008b). Les résultats contradictoires des études empiriques seraient en partie dus à la volatilité élevée de la substance. Il est donc difficile de tirer des conclusions quant à la dégradabilité uniquement à partir des données empiriques sur la dégradation ultime. Toutefois, étant donné que les données expérimentales indiquent une hydrolyse relativement rapide (ECB, 2006) et que l'ensemble des modèles prévoient une dégradation ultime rapide, l'oxyde de butyle et de 2,3-époxypropyle devrait généralement avoir une demivie de biodégradation primaire (et probablement ultime) dans l'eau inférieure à 182 jours selon la méthode du poids de la preuve.
D’après un ratio d'extrapolation de 1 : 1 : 4 pour extrapoler la demi-vie de biodégradation dans l'eau, le sol et les sédiments (Boethling et al., 1995) et une demi-vie de dégradation ultime d'environ 38 jours dans l'eau (MITI, 2002), on estime que la demi-vie dans le sol est inférieure à 182 jours et que celle dans les sédiments est inférieure à 365 jours. L'oxyde de butyle et de 2,3-époxypropyle n'est donc pas censé être persistant dans le sol ou les sédiments.
L'oxyde de butyle et de 2,3-époxypropyle ne répond donc pas aux critères de la persistance dans l'air (demi-vie > 2 jours), l'eau et le sol (demi-vie > 182 jours), ou les sédiments (demi-vie > 365 jours), tels qu'ils sont définis dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La faible valeur expérimentale du log Koe pour l'oxyde de butyle et de 2,3-époxypropyle (voir le tableau 2 ci-dessus) indique que cette substance présente un faible potentiel de bioaccumulation dans les organismes.
Faute de données expérimentales disponibles sur les facteurs de bioaccumulation (FBA) et de bioconcentration (FBC) de l'oxyde de butyle et de 2,3-époxypropyle, une méthode prédictive a été appliquée au moyen des modèles de FBA et de FBC disponibles. Les résultats sont présentés au tableau 5.
Tableau 5. FBA et FBS prévus pour l'oxyde de butyle et de 2,3-époxypropyle chez les poissons au moyen du modèle cinétique d’Arnot et de Gobas (2003) sans le métabolisme
| Organisme d'essai | Log Koe | Paramètre | Valeur en poids humide (L/kg) | Référence |
|---|---|---|---|---|
| Poissons | 0,63 | FBA | 1,173 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBA) |
| Poissons | 0,63 | FBC | 1,173 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBC) |
| Poissons | 0,63 | FBC | 3,162 | BCFWIN, 2000 |
Le modèle modifié de FBA de Gobas pour le niveau trophique intermédiaire chez le poisson a estimé le facteur de bioaccumulation à 1,173 L/kg, ce qui indique que l'oxyde de butyle et de 2,3-époxypropyle ne présente pas de potentiel significatif de bioconcentration chez les poissons ou de bioamplification dans les réseaux trophiques. Les résultats des calculs du modèle de FBC fournissent une preuve additionnelle qui appuie le faible potentiel de bioconcentration de cette substance. Si l'on se fonde sur les valeurs empiriques et sur celles obtenues par modélisation cinétique, l'oxyde de butyle et de 2,3époxypropyle ne répond pas au critère de la bioaccumulation (FBC/FBA = 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
La démarche suivie dans cette évaluation consistait à examiner les divers renseignements scientifiques existants et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE(1999). Les éléments de preuve pris en compte comprenaient les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Comme il est décrit précédemment, l'oxyde de butyle et de 2,3-époxypropyle a des demi-vies relativement courtes dans tous les milieux. Il devrait également présenter un faible potentiel de bioaccumulation. Les volumes moyens d'oxyde de butyle et de 2,3époxypropyle importés au Canada et les informations relatives à son utilisation n'indiquent pas de risque de rejet massif dans l'environnement au Canada. Une fois rejetée dans l'environnement, la substance tend à rester dans le milieu où elle a été rejetée.
Des données expérimentales et modélisées concernant les effets de cette substance sur l'environnement sont disponibles; la valeur expérimentale la plus faible a été utilisée pour estimer la toxicité potentielle pour les organismes aquatiques. Les tableaux 6a et 6b présentent les valeurs expérimentales et prévues concernant l'écotoxicité qui ont été jugées fiables et qui ont été utilisées avec la méthode du poids de la preuve pour la toxicité aquatique (Environnement Canada, 2007). Les données expérimentales et modélisées concordent bien. Les valeurs de la concentration efficace médiane et de la concentration létale médiane aiguë (CL50/CE50) varient entre 3,9 et 65 mg/L, en comparaison aux données de modèles qui varient entre 3,7 et à moins de 967 mg/L, ce qui indique que l'oxyde de butyle et de 2,3époxypropyle devrait représenter un danger faible à modéré pour les organismes aquatiques.
Tableau 6a : Données empiriques sur la toxicité de l'oxyde de butyle et de 2,3époxypropyle pour les organismes aquatiques
| Organisme d’essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50, concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50, concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai. | ||||
| Salmo gairdneri | Toxicité aiguë | CL50 après 96 heures | 65 | US EPA, 2008a |
| Daphnia magna | Toxicité aiguë | CE50 après 48 heures | 3,9 | US EPA, 2008a |
| CE50 après 24 heures | 22 | US EPA, 2008a | ||
| Pseudokirchneriella subcapitata | Toxicité aiguë | CE50 (croissance) après 96 heures | 35 | US EPA, 2008a |
Tableau 6b. Données modélisées sur la toxicité pour les organismes aquatiques
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50, concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50, concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai. 1 Valeurs ECOSAR basées sur la classe SAR de monoépoxyde |
||||
| Poissons | Toxicité aiguë (14 jours) | CL50 | 27,61 | ECOSAR, 2004 |
| Poissons | Toxicité aiguë (96 h) | CL50 | 41,161 | ECOSAR, 2004 |
| Poissons | Toxicité aiguë (96 h) | CL50 | <967,81 | OASIS Forecast, 2005 |
| Poissons | Toxicité aiguë (96 h) | CL50 | 125 | AIES, 2003-2005 |
| Daphnies | Toxicité aiguë (48 h) | CE50 | 97,22 | AIES, 2003-2005 |
| Daphnies | Toxicité aiguë (48 h) | CE50 | 3,7 | TOPKAT, 2004 |
| Algues | Toxicité aiguë (48 h) | CE50 | 137,051 | ECOSAR, 2004 |
Étant donné l'utilisation de l'oxyde de butyle et de 2,3-époxypropyle dans l'industrie, des rejets dans l'eau sont possibles. Un scénario générique a donc été établi à l'aide de l'outil d'exposition générique industriel – milieu aquatique (Industrial Generic Exposure Tool – Aquatic, ou IGETA) d'Environnement Canada afin d'estimer la concentration d'oxyde de butyle et de 2,3-époxypropyle résultant d'un rejet industriel. La concentration environnementale estimée (CEE) de 0,0021 mg/L se base sur la quantité maximale utilisée dans une installation, la fraction rejetée vers une usine de traitement des eaux usées, le taux d'élimination et le débit d'effluents de cette usine ainsi que la capacité de dilution (supposée faible) des eaux réceptrices. Les paramètres principaux entrant dans l'estimation de la CEE incluent une perte estimée à 0,25 % dans les eaux usées au cours de la fabrication ou de la manipulation. Les détails des éléments utilisés pour l'estimation de cette concentration et les résultats du modèle sont décrits dans le rapport d'Environnement Canada de 2009.
Une valeur prudente de la concentration estimée sans effet (CESE) a également été déterminée à partir de la plus faible valeur empirique de toxicité : une CE50 aiguë de 3,9 mg/L pour les daphnies. Cette valeur, choisie comme valeur critique de la toxicité, a été divisée par un facteur d'évaluation de 100 afin de tenir compte des incertitudes liées aux variations de sensibilité interspécifique et intraspécifique et à l'extrapolation d'une CE50 estimée à une valeur sans effet sur le terrain. La CESE obtenue était de 0,037 mg/L.
Le quotient de risque prudent (CEE/CESE) de 0,057 ainsi calculé indique que les concentrations dans l'environnement estimées seraient trop faibles pour avoir des effets nocifs sur les organismes aquatiques. Les résultats de la modélisation de fugacité indiquent qu'en cas de rejet dans l'eau, la plus grande partie de la substance reste dans ce milieu. L'exposition des organismes à d'autres types d’emplacement ou dans d'autres milieux que l'eau est moins probable. Selon l'information diffusée aux termes de l'article 71, bien que des rejets dans l'air soient possibles, la forte capacité de dilution de l'air rend peu probable la nocivité de la substance.
À la lumière des renseignements disponibles, il est donc improbable que l'oxyde de butyle et de 2,3-époxypropyle cause des effets nocifs sur l’environnement au Canada. Cette conclusion a été formulée malgré les incertitudes liées au manque de données empiriques sur les concentrations dans l'environnement au Canada. Les concentrations dans l'eau ont été modélisées sur la base d'hypothèses prudentes. Il existe également des incertitudes liées aux CESE utilisées pour le calcul du quotient de risque, notamment en raison de la quantité limitée de données empiriques relatives à la toxicité. Ce problème a été en partie résolu en divisant la valeur critique de la toxicité par un facteur d'évaluation.
Des incertitudes sont également liées à l'utilisation des modèles QSAR pour estimer les propriétés de l'oxyde de butyle et de 2,3-époxypropyle (p. ex. persistance et potentiel de bioaccumulation). Cependant, étant donné que la composition structurelle de la substance était couverte par les domaines des modèles et que les différents modèles QSAR utilisés ont donné des résultats uniformes, les conclusions tirées sont jugées crédibles et comparables aux prévisions pour cette structure relativement simple. Le fait que l'oxyde de butyle et de 2,3-époxypropyle est une substance à faible masse moléculaire sans groupe fonctionnel extrême qui ne peut pas être traitée par le modèle et que les monoépoxydes ont été utilisés dans le modèle ECOSAR constitue une preuve supplémentaire de la crédibilité des valeurs de QSAR.
Évaluation de l'exposition
Aucune concentration mesurable d'oxyde de butyle et de 2,3-époxypropyle dans l'air, l'eau ou le sol n'a été relevée. Les estimations modélisées de l'exposition environnementale, basées sur les quantités rejetées les plus élevées déclarées conformément à l'avis publié récemment en application de l'article 71 (Environnement Canada, 2008), prévoient des concentrations d'oxyde de butyle et de 2,3-époxypropyle faibles dans l'air et dans l'eau, respectivement d'environ 0,8 ng/m3 et 0,5 ng/L (ChemCAN, 2003). Les concentrations prévues dans le sol et les sédiments sont estimées à moins de 10-3 ng/g (ChemCAN, 2003). Les estimations de la limite supérieure de l'absorption par la population générale par le biais de tous les milieux environnementaux, basées sur ces concentrations prévues, sont donc très basses (c.-à-d. inférieures à
10-3 µg/kg p.c./j).
Une seule étude mesurant la quantité d'oxyde de butyle et de 2,3-époxypropyle dans l'environnement a été relevée. Clark et al. (1991) ont analysé les polluants semi-volatils dans les effluents de trois usines de traitement des eaux usées de l'État du New Jersey. Trois jeux d'échantillons ont été prélevés pour chaque installation; à chaque prélèvement, trois échantillons de 15 L ont été recueillis et combinés sur place. Dans l'effluent de l'installation A, de l'oxyde de butyle et de 2,3-époxypropyle n'a été détecté que dans le troisième jeu d’échantillons, à une concentration estimée de 0,5 µg/L. L'n-oxyde de butyle et de 2,3-époxypropyle n'a été détecté ni dans les deux autres échantillons de l'installation A, ni dans les échantillons des installations B et C.
Au Canada, l'oxyde de butyle et de 2,3-époxypropyle est utilisé dans la production de résines époxydes qui ont des applications dans les revêtements, les adhésifs, les liants, les matériaux d'étanchéité, les bouche-pores et les résines (Environnement Canada, 2008). Toutefois, il n'entre dans la composition d'aucun produit de consommation identifié dans des documents publics repérés au cours d’une recherche approfondie, ni lors de la consultation de divers programmes de Santé Canada. L'Association canadienne de l'industrie de la peinture et des revêtements a déclaré que toutes les applications de revêtement utilisant l'oxyde de butyle et de 2,3-époxypropyle sont, à sa connaissance, industrielles (courriel envoyé en 2009 par l'Association canadienne de l'industrie de la peinture et des revêtements au Bureau d'évaluation des risques de Santé Canada; source non citée).
Aucune étude n'a été trouvée concernant les risques d'exposition à des résidus d'oxyde de butyle et de 2,3-époxypropyle de résines époxydes traitées. On suppose généralement que l'éther de glycidyl n'est plus présent dans le produit traité (CIRC, 1989). Le rapport d'évaluation de la sécurité des produits de la Dow Chemical portant sur les diluants réactifs fait état de « peu ou pas » d'éther de glycidyl inaltéré dans les produits finis (Dow, 2009). L'exposition à l'oxyde de butyle et de 2,3époxypropyle par le contact avec des époxydes traités est donc jugée négligeable.
Toutefois, l'oxyde de butyle et de 2,3-époxypropyle est présent en tant qu'impureté dans un agent de conservation utilisé pour le latex et les peintures oléorésineuses. Cet agent, qui peut contenir jusqu'à 4,2 % d'oxyde de butyle et de 2,3-époxypropyle (Environnement Canada, 2008), est ajouté aux peintures d'intérieur à hauteur de 0,8 % du poids total (courriel envoyé en 2009 par l'Agence de réglementation de la lutte antiparasitaire au Bureau d'évaluation des risques; source non citée dans les références), ce qui entraîne une concentration maximale de 336 ppm. Étant donné que seuls 2 kg de substance ont été importés à ces fins en 2006 (Environnement Canada, 2008), le nombre de personnes risquant d'être exposées à l'oxyde de butyle et de 2,3-époxypropyle par le biais de l'utilisation de ce produit est faible. Malgré le faible nombre de consommateurs potentiellement exposés, le logiciel de modélisation ConsExpo version 4.1 (RIVM, 2006) a été utilisé pour prévoir des estimations élevées de la concentration médiane dans l'air et de la dose dermique, respectivement de 6 mg/m3 et 0,02 mg/kg. Toutefois, étant donné la nature réactive de l'oxyde de butyle et de 2,3-époxypropyle, les quantités restant dans le produit utilisé par le consommateur final devraient être beaucoup plus faibles. De plus, vu la très faible quantité de substance importée en tant qu'impureté de ce type de produit, l'exposition massive de la population générale sur le territoire canadien est peu probable.
Cet agent de conservation a été détecté dans un produit de finition pour le bois, à une concentration plusieurs fois supérieure à celle présente dans les peintures d'intérieur; toutefois, le fabricant a indiqué que la formule de cette gamme de produits est sur le point d'être modifiée et que l’agent en question ne sera plus utilisé (courriel envoyé en 2009 par le Bureau de gestion des risques au Bureau d'évaluation des risques, source non citée dans les références).
Dans l'étude récemment publiée et intitulée « Initial Risk-Based Prioritization of High Production Volume Chemicals for n-butyl glycidyl ether », l'Environmental Protection Agency des États-Unis (US EPA) a qualifié d'élevé le risque d'exposition des consommateurs, d'après les données de la règle de mise à jour des inventaires (Inventory Update Rule, IUR) et l'utilisation de l'oxyde de butyle et de 2,3-époxypropyle dans les adhésifs et les produits d'étanchéité (US EPA, 2008a). Toutefois, cette qualification se base sur les volumes de production et sur les catégories d'utilisation générale, et non sur les produits spécifiques contenant cette substance (courriel envoyé en 2009 par la Chemical Control Division de l'EPA au Bureau d'évaluation des risques de Santé Canada; source non citée dans les références).
La caractérisation de l'exposition humaine se heurte à des incertitudes notables. En l'absence de données environnementales mesurées, des estimations de l'exposition ont été établies à partir des quantités maximales rejetées dans l'environnement par les installations industrielles. La base de données d'exposition correspondante est jugée peu fiable. Malgré la quantité très limitée de données, la nature réactive du groupe oxirane, l'application principale dans les époxydes traités où l'oxyde de butyle et de 2,3époxypropyle intervient dans des réactions de réticulation, ainsi que l'estimation très faible de l'absorption quotidienne laissent à penser que l'exposition de la population générale devrait être faible.
Évaluation des effets sur la santé
L'annexe 2 comporte un résumé des renseignements disponibles relatifs aux effets de l'oxyde de butyle et de 2,3-époxypropyle sur la santé.
La Commission européenne a classé l'oxyde de butyle et de 2,3-époxypropyle dans la catégorie 3 pour la cancérogénicité (substances préoccupantes pour l'homme en raison d'effets cancérogènes possibles) et également dans la catégorie 3 pour la mutagénicité (substances préoccupantes pour l'homme en raison de la possibilité d'effets irréversibles; ESIS, 2009). En raison du manque de données à long terme pour l'oxyde de butyle et de 2,3époxypropyle, la classification de cancérogénicité de la Commission européenne repose à la fois sur les données de génotoxicité de la substance évaluées selon la méthode du poids de la preuve et sur les données de cancérogénicité de l'analogue structurel qu'est l'oxyde d'allyle et de glycidyle. La classification de la mutagénicité se base essentiellement sur les résultats positifs de tests du micronoyau in vivo.
Pour cette évaluation, les données de plusieurs substances analogues (annexe 3) ont été étudiées afin de mieux comprendre les effets possibles sur la santé de l'exposition à l'oxyde de butyle et de 2,3-époxypropyle. L'utilisation de substances analogues comme substituts a été adoptée par plusieurs agences de réglementation nationales et internationales. Les responsables du programme HPV Challenge de l'EPA américaine, de la réglementation REACH de l'Agence européenne des produits chimiques et du programme HPV Chemicals de l'OCDE ont tous établi des documents de référence concernant cette approche. L'approche adoptée dans la présente évaluation correspond aux principes généraux décrits par les autorités susmentionnées, soit la sélection des analogues chimiques inclus dans ce rapport qui repose sur la présence du groupement fonctionnel (d'éthers) de glycidyle et d'autres similarités structurelles, sur les propriétés physiques et chimiques, sur la disponibilité des données de cancérogénicité et sur leur identification comme analogue à l'oxyde de butyle et de 2,3-époxypropyle par différentes agences de réglementation. C'est pourquoi certains analogues structurels tels que l'oxyde de tert-butyle et de glycidyle, n'ont pas été pris en compte en raison d'un manque de données relatives à la cancérogénicité. Le groupement (d'éthers) de glycidyle a été considéré comme le critère le plus important dans l'évaluation du potentiel cancérogène en raison de la présence de l'anneau époxyde. Les époxydes sont des agents alkylants qui peuvent interagir avec l'ADN (NTP, 2004); ils peuvent donc être impliqués dans le risque de cancérogénicité de l'oxyde de butyle et de 2,3-époxypropyle.
Bien que l'oxyde d'allyle et de glycidyle soit le seul substitut utilisé par la Commission européenne pour la classification de l'oxyde de butyle et de 2,3-époxypropyle et soit considéré comme la substance la plus proche pour laquelle des données de cancérogénicité sont disponibles, d'autres substances (telles que le glycidol, l'éther de phényle et de glycidyle et l'éther de bisphénol A et de diglycidyle) ont également été prises en compte dans cette évaluation, afin d'étayer les preuves relatives à la cancérogénicité. Une brève présentation des données de cancérogénicité et de génotoxicité de ces substances est proposée ci-après et détaillée à l'annexe 4.
La base de données de cancérogénicité pour l'oxyde d'allyle et de glycidyle se limite à une étude par inhalation sur deux ans, au cours de laquelle des rats et des souris mâles et femelles ont été exposés à 0, 23 ou 47 mg/m3 (NTP, 1990a). Les auteurs de l'étude ont conclu à une preuve équivoque de cancérogénicité chez les rats Osborne-Mendel mâles, à certaines indications chez les souris B6C3F1 mâles et à une preuve équivoque chez les souris B6C3F1 femelles, étayées par la présence de différents types de tumeurs nasales. Bien que les incidences des tumeurs primaires ne soient pas statistiquement significatives, elles ont été considérées comme telles d'un point de vue biologique, en raison du fait que les tumeurs nasales primaires sont rares chez les rongeurs; de plus, la néoplasie a été précédée ou accompagnée de lésions non néoplasiques et des lésions pré-néoplasiques ont été observées chez les souris exposées.
En ce qui concerne le glycidol, la cancérogénicité est plus évidente, car il a induit des tumeurs dans de nombreux tissus différents et chez plusieurs espèces exposées par administration orale. Des rats et souris mâles et femelles ont été exposés à 0, 37,5 ou 75 mg/kg p.c./j (rats) et 0, 25 ou 50 mg/kg p.c./j (souris) de glycidol par gavage pendant deux ans (NTP, 1990b). L'étude a fourni des preuves manifestes de cancérogénicité chez les mâles et les femelles des deux espèces, en raison de l'observation de plusieurs lésions néoplasiques dans différents tissus incluant l'utérus, la tunique vaginale, le gland du clitoris, la glande de Harder, les glandes mammaires, le cerveau, la muqueuse buccale, le secteur gastrique antérieur, l'intestin, le foie, les poumons, la peau, les tissus sous-cutanés, le sang, la glande de Zymbal et la glande thyroïde. Dans une étude menée sur des souris haploïdes semi-dominantes génétiquement modifiées, les animaux ont été exposés à 0, 25, 50, 100 ou 200 mg/kg p.c./j de glycidol par gavage pendant 40 semaines (NTP, 2007). Les auteurs ont conclu à une indication claire de cancérogénicité chez les mâles, à la suite de l'observation de sarcomes histiocytaires, et à des indications de cancérogénicité chez les femelles, à la suite de l'observation d'adénomes bronchiolo-alvéolaires. Le nombre élevé d'adénomes bronchiolo-alvéolaires chez les mâles et de papillomes du secteur gastrique antérieur chez les femelles a également été considéré comme lié à l'administration de glycidol. Au cours d'une étude où des hamsters ont été exposés à 100 mg/kg p.c./j par gavage pendant 60 semaines, des tumeurs ont été observées dans la rate, la corticosurrénale, le secteur gastrique antérieur ainsi que l'utérus et le col utérin (Lijinski, 1992). Les auteurs ont précisé que les tumeurs de la corticosurrénale sont courantes chez cette espèce de hamster, mais que les hémangiomes et hémangiosarcomes de la rate sont très rares. Toutefois, aucune augmentation de tumeurs ou lésions cutanées n'a été observée chez les souris exposées à une solution de glycidol à 5 % appliquée sur la peau pendant 520 jours (Van Duuren, 1967).
Au cours de la seule étude de cancérogénicité recensée pour l'éther de phényle et de glycidyle, des rats ont été exposés à 0, 6 ou 74 mg/m3 pendant 24 mois par inhalation (Lee, 1983). Des tumeurs nasales liées à cette exposition ont été observées uniquement pour la concentration la plus élevée (signification statistique non précisée). Une augmentation du nombre de rhinites et de métaplasies squameuses a également été observée pour la concentration de 74 mg/m3; elle est estimée liée aux tumeurs nasales.
Concernant l'éther de bisphénol A et de diglycidyle (BADGE), la plupart des études de cancérogénicité ont été réalisées sur des résines de classe commerciale. Une seule étude a été réalisée sur du BADGE pur. Des souris ont été exposées à une solution de BADGE à 0, 1 ou 10 % par application cutanée pendant 2 ans (Peristianis, 1988). Bien que des tumeurs aient été observées sur le site d'application et ailleurs, leur nombre n'est pas statistiquement significatif. Une tendance marquée au développement de lymphosarcomes thymiques chez les femelles a été observée. Toutefois, les auteurs ont souligné une incidence sous-jacente relativement importante de néoplasies lymphoréticulaires et hématopoïétiques pour cette souche particulière dans le laboratoire, qui a pu être causée par une infection virale.
Bien qu'aucun essai biologique de cancérogénicité n'ait été effectué sur l'oxyde de butyle et de 2,3-époxypropyle, la substance a été soumise à un ensemble de tests de génotoxicité à court terme, dont plusieurs ont eu des résultats positifs. In vivo, la substance a induit des aberrations chromosomiques et la formation de micronoyaux chez les souris exposées par injection intrapéritonéale, bien qu'elle n'ait pas causé de formation de micronoyaux lorsqu'elle a été administrée par voie orale. L'oxyde de butyle et de 2,3époxypropyle a également entraîné des mutations létales dominantes chez les souris, à l'exception d'un essai au cours duquel le taux de mortalité fœtale était élevé chez les groupes témoins. L'oxyde de butyle et de 2,3-époxypropyle a également donné des résultats positifs dans un certain nombre d'essais de génotoxicité in vitro. Des mutations inverses ont été observées dans plusieurs souches (et non la totalité) de Salmonella typhimurium avec et sans activation. Les tests sur l'urine et les essais par passage sur hôte ont donné des résultats négatifs. Toutefois, l'oxyde de butyle et de 2,3-époxypropyle a induit des mutations dans des cellules de lymphome de souris, des cellules de hamster chinois et des lymphocytes de sang périphérique humain.
Les résultats des tests de génotoxicité pour les substances analogues estimées pertinentes sont résumés à l'annexe 4. Il existe donc des preuves convaincantes de la génotoxicité de l'éther d'allyle et de glycidyle et du glycidol, avec des résultats comparables à ceux obtenus avec l'oxyde de butyle et de 2,3-époxypropyle, alors que l'éther de phényle et de glycidyle et le BADGE semblent faiblement génotoxiques.
Afin de fournir des informations plus précises quant au risque de cancérogénicité de l'oxyde de butyle et de 2,3-époxypropyle, des modèles RQSA ont été utilisés dans le but de prévoir la toxicité de la substance et des substances considérées comme analogues. Les prévisions pour toutes les substances sont généralement similaires; en effet, CASETOX, DEREK et TOPKAT indiquent une génotoxicité probable/plausible pour l'oxyde de butyle et de 2,3-époxypropyle et ses analogues, en raison de la présence de la fraction d'éther de glycidyle (TOPKAT, 2004; CASETOX, 2008; DEREK, 2008), ce qui correspond aux données empiriques disponibles. Concernant les estimations de la cancérogénicité, le modèle DEREK estime que l'oxyde de butyle et de 2,3-époxypropyle et ses analogues sont des cancérogènes plausibles; les estimations de CASETOX sont essentiellement positives, alors que celles de TOPKAT sont négatives. Bien que différents modèles puissent donner des résultats différents pour une substance (principalement en raison des différentes hypothèses et jeux de données du modèle), la similarité des estimations de chaque modèle pour ce groupe de composés permet de définir l'éther d'allyle et de glycidyle, le glycidol, l'éther de phényle et de glycidyle et le BADGE comme analogues pour l'évaluation du risque de cancérogénicité de l'oxyde de butyle et de 2,3-époxypropyle.
Bien que le mode d'action sur le développement de tumeurs des analogues de l'oxyde de butyle et de 2,3-époxypropyle n'ait pas été clairement défini, le potentiel d'interaction de l'anneau époxyde présent dans le groupe de glycidyles avec l'ADN suggère un mécanisme de cancérogénicité génotoxique. La possibilité que l'oxyde de butyle et de 2,3époxypropyle ait une action cancérogène directe est étayée par les données de génotoxicité disponibles.
L'oxyde de butyle et de 2,3-époxypropyle a également induit des effets non néoplasiques chez les animaux soumis aux expériences, notamment une irritation et une sensibilisation de la peau. L'exposition des yeux de lapins à la substance non diluée a entraîné des conjonctivites et des dommages oculaires graves (Rhone-Poulenc, 1973). De même, l'application cutanée d'oxyde de butyle et de 2,3-époxypropyle pur ou dilué (solutions à 1 ou 25 %) a entraîné un érythème léger à modéré chez les lapins et les cobayes (RhonePoulenc, 1973; Reichold Chem. Co., 1978).
Au cours de plusieurs études, des tests de sensibilisation ont été effectués sur des cobayes (Weil et al., 1963; Ciba-Geigy, 1977; Reichold Chem. Co., 1978); tous ces tests ont démontré une sensibilisation chez la majorité des animaux après exposition à la substance diluée (solutions à 0,1 % jusqu'à 25 %) par voie intracutanée ou par application d’un timbre suivie d'une dose déclenchante.
Plusieurs études se sont également intéressées aux réactions allergiques chez l'humain, principalement chez les ouvriers exposés dans le cadre de leur profession. Le taux de réponse était généralement inférieur à celui constaté chez l'animal, le taux de réactions allergiques positives allant de 0/343 à 3/20.
Bien qu'aucune étude à long terme n'ait été répertoriée, la toxicité de l'oxyde de butyle et de 2,3-époxypropyle a été abordée dans un petit nombre d'études à court terme. Au cours d'une étude d'exposition de rats par inhalation pendant 4 semaines, une dose minimale avec effet observé (DMEO) de 500 mg/m3 (94 ppm) pour une exposition à court terme a été déterminée pour la dégénérescence de la muqueuse olfactive et des modifications hyperplasiques/métaplasiques de l'épithélium respiratoire cilié dans l'étude (Ciba-Geigy, 1985a; idem, 1985b). Concernant l'exposition cutanée, une DMEO de 100 mg/kg p.c./j a été déterminée pour des lésions du foie chez des lapins exposés 5 fois par semaine pendant 4 semaines (NTP, 2004). Les autres tissus atteints à la suite d’une exposition à court terme à l'oxyde de butyle et de 2,3-époxypropyle sont le sang, le foie, les reins et les poumons.
Aucune étude évaluant la toxicité de l'oxyde de butyle et de 2,3-époxypropyle pour la reproduction ou le développement n'a été répertoriée. Toutefois, il existe des informations provenant d'études à court terme et d'essais de létalité dominante. Lors de l'exposition de rats jusqu'à 1 600 mg/m3 d'oxyde de butyle et de 2,3-époxypropyle par inhalation pendant 10 semaines, une atrophie testiculaire a été observée à partir de 400 mg/m3 (Shell Oil Co., 1957). Au cours d'un essai de létalité dominante, une baisse du taux de grossesses, une augmentation du taux de mortalité fœtale et une baisse du nombre de nidations ont été observées chez des femelles accouplées avec des mâles exposés à 1 500 mg/kg p.c./j, 3 fois par semaine pendant 3 semaines, par application cutanée (Rhone-Poulenc, 1977). L'atrophie testiculaire, ainsi qu'une réduction de la capacité de reproduction, a également été observée chez des rats exposés à l'éther d'allyle et de glycidyle de même qu'à l'éther de phényle et de glycidyle (CIRC, 1989; NTP, 1990a; NTP, 2004).
La base de données de toxicité est jugée modérément fiable. Les informations qu'elle contient permettent de déterminer les effets potentiellement préoccupants à la suite d’une brève exposition. Malgré l'absence d'études chroniques de cancérogénicité pour l'oxyde de butyle et de 2,3-époxypropyle, les renseignements provenant d'études sur des substances analogues permettent d'évaluer le risque de cancérogénicité de l'oxyde de butyle et de 2,3époxypropyle. Les données de cancérogénicité sont étayées par les résultats de tests de génotoxicité in vivo et in vitro réalisés avec l'oxyde de butyle et de 2,3-époxypropyle et ses analogues.
Caractérisation des risques pour la santé humaine
En s'appuyant principalement sur l’évaluation reposant sur le poids de la preuve réalisée par la Commission européenne, la cancérogénicité constitue un effet critique pour la caractérisation des risques que présente l'oxyde de butyle et de 2,3-époxypropyle pour la santé humaine. Bien qu'aucun essai biologique à long terme sur le cancer n'ait été effectué pour l'oxyde de butyle et de 2,3-époxypropyle, une augmentation du nombre de tumeurs dans plusieurs organes a été observée chez les rongeurs après une exposition par voie cutanée ou orale ou par inhalation à diverses substances analogues à l'oxyde de butyle et de 2,3époxypropyle. La génotoxicité de l'oxyde de butyle et de 2,3époxypropyle a également été démontrée par une série de tests in vivo et in vitro; de même, les tests de génotoxicité in vivo et in vitro ont révélé des résultats positifs pour différents paramètres pour les analogues structurels que sont l'éther d'allyle et de glycidyle et le glycidol. En conséquence, étant donné la génotoxicité de l'oxyde de butyle et de 2,3-époxypropyle, ainsi que la cancérogénicité et la génotoxicité des composés de structure similaire, on ne peut exclure l'influence de l'oxyde de butyle et de 2,3époxypropyle dans le développement de tumeurs par un mode d'action impliquant une interaction directe avec le matériel génétique.
En ce qui concerne les effets non cancérogènes, la DMEO la plus faible associée à l'exposition par inhalation est de 400 mg/m3 pour une atrophie testiculaire chez des rats exposés 5 jours par semaine pendant 10 semaines (Shell Oil Co., 1957). La comparaison de cette valeur avec l'estimation modélisée de la concentration d'oxyde de butyle et de 2,3-époxypropyle dans l'air extérieur (c.-à-d., < 1 ng/m3) permet d'obtenir une marge d'exposition d'environ huit ordres de grandeur. Bien que l'oxyde de butyle et de 2,3époxypropyle soit utilisé dans la fabrication de résines époxydes et dans d'autres formules employées dans d'autres produits, l'exposition des consommateurs devrait être minime selon les renseignementss disponibles. Étant donné les expositions très faibles prévues, la marge d'exposition est donc estimée suffisante pour éviter le développement d'effets non cancérogènes dans la population générale du Canada.
Incertitudes de l'évaluation des risques pour la santé humaine
La présente évaluation préalable ne comprend pas l'analyse complète du mode d'action de l'oxyde de butyle et de 2,3-époxypropyle ou de ses analogues, et ne tient pas non plus compte des possibles différences de sensibilité entre l'espèce humaine et les espèces ayant fait l'objet d'expériences. De plus, il existe des incertitudes quant à l'utilisation des données sur des substances analogues afin d'extrapoler le risque de cancérogénicité de l'oxyde de butyle et de 2,3-époxypropyle en raison du manque d'études chroniques. Il existe également des incertitudes quant à la toxicité de l'oxyde de butyle et de 2,3époxypropyle pour la reproduction et le développement, car les renseignements disponibles sont limitées aux effets observés sur les organes reproducteurs dans le cadre d'études à court terme et d'essais de létalité dominante, bien qu'il soit probable que ces effets ne soient induits qu'à des doses ou des concentrations d'exposition supérieures à celles auxquelles la population générale est exposée.
Malgré les données très limitées disponibles permettant de quantifier l'exposition de la population, étant donné le manque de renseignements sur la présence de la substance dans les produits de consommation, la nature réactive du groupe oxirane, ainsi que l'estimation très faible de l'absorption quotidienne basée sur des hypothèses prudentes, il est probable que l'exposition de la population générale à l'oxyde de butyle et de 2,3époxypropyle soit faible. Des données supplémentaires sur les concentrations résiduelles, le cas échéant, dans les résines époxydes traitées, ainsi que des données de surveillance environnementale, permettraient une caractérisation plus fiable du risque d'exposition humaine à l'oxyde de butyle et de 2,3-époxypropyle au Canada.
D'après les renseignements contenus dans la présente ébauche d'évaluation préalable, il a été conclu que l'oxyde de butyle et de 2,3-époxypropyle ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
Étant donné la génotoxicité de l'oxyde de butyle et de 2,3-époxypropyle ainsi que la génotoxicité et la cancérogénicité des substances analogues à celui-ci, il a été conclu que l'oxyde de butyle et de 2,3-époxypropyle pourrait présenter une possibilité d'effets nocifs quel que soit le degré d'exposition. En conséquence, l'oxyde de butyle et de 2,3époxypropyle est considéré comme une substance pouvant pénétrer dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
En conséquence, il a été conclu que l'oxyde de butyle et de 2,3-époxypropyle remplit au moins un des critères de l’article 64 de la LCPE(1999), En outre, la substance ne répond pas aux critères de la persistance et du potentiel de bioaccumulation définis dans le Règlement sur la persistance et la bioaccumulation.
De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
[ACGIH] American Conference of Governmental Industrial Hygienists. 2003. TLVs and BEIs: Based on the Documentation of the Threshold Limit Values for Chemical Substances and Physical Agents and Biological Exposure Indices. Cincinnati (OH) : ACGIH, p. 18.
[AIES] Artificial Intelligence Expert System. 2003-2005. Version 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès de la Division des substances nouvelles et de la Division des substances existantes, Environnement Canada
Andersen, M., Kiel, P., Larsen, H. 1957. Results of range-finding toxicological tests on nbutyl glycidyl ether. [cité par Gardiner et al., 1992, 1993].
Andersen, M., Kiel, P., Larsen, H., Maxild, J. 1978. Mutagenic action of aromatic epoxy resins. Nature 276:391-392.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345.
[BCFBAF] BioConcentration Factor Program for Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Bingham, E., Cohrssen, B., Powell, C.H. (éd.). 2001. Patty's Toxicology [en ligne]. John Wiley & Sons, Inc. Accès : http://mrw.interscience.wiley.com/emrw/9780471125471/pattys/
tox/article/tox082/current/html
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Boeing Company. 1986. Auburn reproductive health survey with cover letter dated 020888. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0515097. No de document : 88-88000002.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Bosch, S., Meylan, W., Becker, J., Neal, M. 1985. Monograph on human exposure to chemicals in the workplace: Glycidyl ethers. Syracuse (NY) : Syracuse Research Corporation, Center for Chemical Hazard Assessment.
Brooks, T.M., Meyer, A.L., Hodson-Walker, G., Crabtree, A.N., Jones, L., Wiggins, D.E. 1981. Toxicity Studies with Epoxy Resins: In Vitro Genotoxicity Studies with Diglycidyl Ether of Bispheno1 A, Epikote 828, Epikote 1001. Epikote 1007. Shell Toxicology Laboratory TLGR.80.123
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, no 3. Accès : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures de gestion et d'évaluation des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2008. Loi canadienne sur la protection de l'environnement (1999) : Avis de septième divulgation d'information technique concernant les substances identifiées dans le Défi.Gazette du Canada, Partie I, vol. 142, no 35, p. 2497-2501. Accès : http://www.gazette.gc.ca/rp-pr/p1/2008/2008-08-30/pdf/g1-14235.pdf
Canter, D.A., Zeiger, E., Haworth, S., Lawlor, T., Mortelmans, K., Speck, W. 1986. Comparative mutagenicity of aliphatic epoxides in Salmonella. Mutat. Res. 172:105-138.
CASETOX [module de prédiction]. 2008. Version 2.0. Beachwood (OH) : MultiCASE. Accès : http://www.multicase.com/products/prod03.htm[réserve de consultation].
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
ChemCAN [Level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/CC600.html
Ciba-Geigy. 1977. Skin sensitizing (contact allergenic) effect in guinea pigs of TK 10408 (glycidyl n-butyl ether) with cover letter dated 072887. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0515486. No de document : 86-870001325.
Ciba-Geigy. 1985a. Appendices I to V to the 28-day inhalation study of glycidyl n-butyl ether (TK10408) in the rat with cover letter dated 072887. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0515489. No de document : 86-870001328.
Ciba-Geigy. 1985b. 28-Day inhalation exposure to glycidyl n-butyl ether (TK-10408) in the rat (final report) with cover letter dated 072887. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0515488. No de document : 86870001327.
[CIRC] Centre international de recherche sur le cancer. 1989. IARC monographs on the evaluation of carcinogenic risks to human. Some organic solvents, resin monomers and related compounds, pigments and occupational exposures in paint manufacture and painting. Volume 47. Lyon (France) : Organisation mondiale de la Santé.
[CIRC] Centre international de recherche sur le cancer. 1999. IARC monographs on the evaluation of carcinogenic risks to human. Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. Volume 71. Lyon (France) : Organisation mondiale de la Santé.
[CIRC] Centre international de recherche sur le cancer. 2000. IARC monographs on the evaluation of carcinogenic risks to human. Some industrial chemicals. Volume 77. Lyon (France) : Organisation mondiale de la Santé.
Clark, L.B., Rosen, R.T., Hartman, T.G., Alaimo, L.H., Louis, J.B., Hertz, C., Ho, C., Rosen, J.D. 1991. Determination of nonregulated pollutants in three New Jersey publicly owned treatment works (POTWs). Research Journal of the Water Pollution Control Federation. 63(2):104-113.
[CMA] Chemical Manufacturing Association. 1984. Comments in response to advance notice of proposed rulemaking in testing of glycidol and its derivatives with attachments and cover letter dated 022884. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0522547. No de document : 40-8440196. Résumé du SRC.
Confidentiel. 1964. Biological test for safety request and report. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0206089. No de document : 878212393.
Confidentiel. 1977. Activity of J7004; the Salmonella/microsomal assay for bacterial mutagenicity with cover; industrial biological test for safety. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0206089. No de document : 878212443.
Connor, T.H., Pullin, T.G., Meyne, J., Frost, A.F., Legator, M.S. 1980b. Résumé de 1980a. Evaluation of the mutagenicity of n-BGE and t-BGE in a battery of short-term assay. Résumé Ec-12. Environ. Mutagen. 2:284.
Connor, T.H., Ward, J.B., Meyne, J., Frost, A.F., Legator, M.S. 1980a. The evaluation of the epoxide diluent, n-butyl glycidyl ether in a series of mutagenicity assays. Environ. Mutagen. 2:521530.
[CosIng] Cosmetic Ingredients and Substances. Substance: Butyl glycidyl ether [consulté le 16 février 2009]. Accès : http://ec.europa.eu/enterprise/cosmetics/cosing/index.cfm?fuseaction=search.details&id=30077
[DEREK] Deducting Estimation from Existing Knowledge [module prédictif sur cédérom]. 2008. Version 10.0.2. Cambridge (MA) : Harvard University, LHASA Group. Accès : http://lhasa.harvard.edu/?page=toxicology.htm [réserve de consultation].
[Dow] Dow Chemical Company. 2009. Product Safety Assessment: Reactive Diluents [consulté le 9 mars 2009]. Accès : http://www.dow.com/PublishedLiterature/dh_00eb/0901b803800eb28e.pdf?filepath=
productsafety/pdfs/noreg/233-00316.pdf&fromPage=GetDoc
[ECOSAR] Ecological Structural Activity Relationships [en ligne]. 2004. Version 0.99h. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
El Ramy, R., Ould Elhkim, M., Lezmi, S., Poul, J.M. 2007. Evaluation of the genotoxic potential of 3-monochloropropane-1,2-diol (3-MCPD) and its metabolites, glycidol and beta-chlorolactic acid, using the single cell gel/comet assay. Food Chem. Toxicol. 45(1):41-48.
Environnement Canada. 2007. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series: draft module on QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environnement Canada. 2008. Données sur les substances du lot 7 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le septième lot du Défi. Données produites par le Programme des substances existantes, Environnement Canada.
Environnement Canada. 2009. IGETA Report: CASRN 2426-08-6, 2009-05-06. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre [consulté le 7 janvier 2009]. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
[ESIS] European Chemical Substances Information System [base de données en ligne]. [s.d.]. Bureau européen des substances chimiques (ECB). [consulté en 2009]. Accès : http://ecb.jrc.it/esis
Fregert, S., Rorsman, H. 1964. Allergens in epoxy resins. Acta Allergol. 19:296-299.
Frost, A.F., Legator, M.S. 1982. Unscheduled DNA synthesis induced in human lymphocytes by butyl glycidyl ethers. Mutat. Res. 102:193-200.
Gardiner, T.H., Waechter, J.M. Jr., Wiedow, M.A., Solomon, W.T. 1992. Glycidyloxy compounds used in epoxy resin systems: A toxicology review. Regul. Toxicol. Pharmacol.15(Partie 2):S1-S77.
Greene, E.J., Friedman, M.A., Sherrod, J.A., Salerno, A.J. 1979. In vitro mutagenicity and cell transformation screening of phenylglycidyl ether. Mut. Res. 67:9-19.
Hamerton, I. 1996. Recent Developments in Epoxy Resins. iSmithers Rapra. 176 p.
Hansch, C., Leo, A., Hoekman, D. 1995. Exploring QSAR – Hydrophobic, electronic, and steric constants. Washington (DC) : American Chemical Society.
Hemminki, K., Falck, K., Vainio, H. 1980. Comparison of alkylation rates and mutagenicity of directly acting industrial and laboratory chemicals. Arch. Toxicol. 46:277-285.
Hemminki, K., Vainio, H. 1980. Alkylation of nucleic acid bases by epoxides and phenyl glycidyl ethers. Dev. Toxicol. Environ. Sci. 8:241-244.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2000. Version 3.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Hine, C.H., Kodama, J.K., Wellington, J.S., Dunlap, M.K., Anderson, H.H. 1956. The toxicology of glycidol and some glycidyl ethers. AMA Arch. Ind Health 14:250-264.
Hine, C.H., Guzman, R.J., Coursey, M.M., Wellington, J.S. 1958. An investigation of the ocongenic activity of two representative epoxy resins. Cancer Res. 18:20-26.
Hine, C.H., Rowe, V.K., White, E.R., Darmer, K.I., Yougblood, G.T. 1981. Epoxy compounds. In : Clayton, G.D., Clayton, F.E. (éd.). Patty's Industrial Hygiene and Toxicology. Vol. 2A. Toxicology. 3e éd. rév., chap. 32. New York : Interscience.
Holland, J.M., Gosslee, D.G., Williams, N.J. 1979. Epidermal carcinogenicity of bis(2,3epoxycyclopentyl)ether, 2,2-b(p-glycidoloxyphenyl)propane, and m-phenylenediamine in male and female C3H and C57BL/6 mice. Cancer Res.39:1718-1725.
Hubinski, H., Gutzke, G.E., Kubinski, Z. 1981. DNA-cell-binding (DCB) assay for suspected carcinogens and mutagens. Mutat. Res. 89:95-136.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2007. Gatineau (Qc) : Environnement Canada. [consultée le 16 février 2009]. Accès : http://www.ec.gc.ca/pdb/querysite/query_f.cfm
[IUCLID] International Uniform Chemicals Information Database. 2006. Ensemble de données sur le 2426-08-6. [consultée le 10 juillet 2009]. Belgique : Commission européenne, Bureau européen des substances chimiques. Accès : http://www.epa.gov/hpv/pubs/summaries/nbtglyet/c13352rr2.pdf
Ivie, G.W., MacGregor, J.T., Hammock, B.D. 1980. Mutagenicity of psoralen epoxides. Mutat. Res. 79:73-77.
Jolanki, R., Kanerva, L., Estlander, T., Tarvainen, K., Keskinen, H., Eckerman, M. 1990. Occupational dermatoses from epoxy resin compounds. Contact Dermatitis 23:172-183.
Kanerva, L., Jolanki, R., Alanko, K., Estlander, T. 1999. Patch-test reactions to plastic and glue allergens. Acta Dermat. Venereol. 79(4):296-300.
Kanerva, L., Jolanki, R., Estlander, T. 1997. Allergic and irritant patch test reactions to plastic and glue allergens. Contact Dermatitis 37(6):301-302.
[KOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Lee, K.P., Schneider, P.W., Trochimowicz, H.J. 1983. Morphologic expression of glandular differentiation in the epidermoid nasal carcinomas induced by phenylglycidyl ether inhalation. Am. Asso. Pathol. 111:140-148.
Lee, S. 1989. Reference book for composites technology. CRC Press, 336 p.
Lewis, R.J. Sr. (éd.). 2001. Hawley's Condensed Chemical Dictionary, 14e éd., New York : John Wiley & Sons, Inc.
Lijinsky, W., Kovatch, R.M. 1992. A study of the carcinogenicity of glycidol in Syrian hamsters. Toxicol. Ind. Health8(5):267-271.
Lockwood, D.D., Taylor, H.W. 1982. Acute toxicological properties and industrial handling hazards of D.E.R. 361 Epoxy Resin. Dow Chemical Company. [cité par Gardiner et al.,1992].
Loquet, C., Toussaint, G., Letalaer, J.Y. 1981. Studies on mutagenic constituents of apple brandy and various alcoholic beverages collected in western France, a high incidence area for esophageal cancer. Mutat. Res. 88(2):155-164.
McCann, J., Choi, E., Yamasaki, E., Ames, B.N. 1975. Detection of carcinogens as mutagens in the Salmonella/microsome assay of 300 chemicals. Proc. Natl. Acad. Sci.U.S.A. 72:5135-5139.
[MITI] Ministry of International Trade & Industry. 2002. Biodegradation and bioaccumulation: data of existing chemicals based on the CSCL. Japon. Publié sous la direction du Chemicals Inspection & Testing Institute, Japon. Chemical Products Safety Division, Basic Industries Bureau, Ministry of Internation Trade & Industry, Tokyo (Japon).
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[NCI] National Chemical Inventories [base de données sur cédérom]. 2008. Issue 1. Columbus (OH) : American Chemical Society. [consultée le 11 décembre 2006]. Accès : http://www.cas.org/products/cd/nci/index.html
[NTP] National Toxicology Program. 1990a. Toxicology and carcinogenesis studies of allyl glycidyl ether (CASNo. 106-92-3) in Osborne-Mendel rats and B6C3F1 mice (inhalation studies). TR-376. Accès : http://ntp-server.niehs.nih.gov/htdocs/LT-Studies/TR376.html.
[NTP] National Toxicology Program. 1990b. Toxicology and carcinogenesis studies of glycidol (CASNo. 556-52-6) in F344/N rats and B6C3F1 mice (gavage study). TR-374.
[NTP] National Toxicology Program. 2004. n-butyl glycidyl ether (BGE) [CAS No. 2426-08-6] review of toxicological literature. Accès : http://ntp.niehs.nih.gov/ntp/htdocs/Chem_Background/ExSumPdf/Butyl_glycidyl_ether.pdf
[NTP] National Toxicology Program. 2007. Toxicology and carcinogenesis study of glycidol (CAS No. 556-52-5) in genetically modified haploinsufficient p16Ink4a/p19Arf mice (gavage study). GMM-13. Accès : http://ntp.niehs.nih.gov/files/gmm13_web1.pdf
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [consulté le 7 janvier 2009]. Accès : http://oasis-lmc.org/?section=software
Ohtani, H., Nishioka, H. 1981. Mutagenic activity of epoxide compounds as constituents of resins in bacterial test systems. Sci. Eng. Rev. 21:247-265.
Persitianis, G.C., Doak, S.M., Cole, P.N., Hend, R.W. (1988). Two-year carcinogenicity study on three aromatic epoxy resins applied cutaneously to CF1 mice. Food. Chem. Toxicol.26(7):611-624.
[PhysProp] Interactive PhysProp Database [base de données en ligne]. 2006. Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.syrres.com/esc/physdemo.htm
Plna, K., Sagerback, D. 1997. 32P-Postlabelling of DNA adducts formed by allyl glycidyl ether in vitro and in vivo. Carcinogenesis 18(8):1457-62.
Prens, E.P., de Jong, G., van Joost, T. 1986. Sensitization to epichlorohydrin and epoxy system components. Contact Derm.15(2):85-90.
Procter and Gamble Company. 1979. Letter from Procter and Gamble Company to USEPA submitting reports, protocols and data on n-alkyl glycidyl ethers with attachments. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0200642. No de document : 88-7900293.
Pullin, T. (University of Texas Medical Branch, Galveston, TX). 1977. Report to the Dow Chemical Company Integrated Mutagenicity Testing Program, 71 p. [présenté à l'Environmental Protection Agency conformément à la section 8(e) de la TSCA par Rhone-Poulenc, Inc. et la Shell Oil Company.] –> identique à Rhone-Poulenc, 1977.
Reichhold, Chemical Company. 1978. Letter from Reichhold Chemicals Inc to US EPA regarding submission of 8D studies with attachments. TSCATS. No de microfiche : OTS0523514. No de document : 40-7840108.
Rhone-Poulenc Inc. 1973. Initial submission: Toxicology of epoxide no. 8 with cover letter dated 102792. TSCATS. No de microfiche : OTS0571540. No de document : 88-920009887.
Rhone-Poulenc Inc. 1977. Initial submission: Report to the Dow Chemical Company integrated mutagenicity testing program regarding genotoxicity studies of epoxides with over letter dated 102992. TSCATS. No de microfiche : OTS0571373. No de document : 88-920009716.
Ringo, D.L., Brennan, E.F., Cota-Robles, E.H. 1982. Expoxy resins are mutagenic: Implications for electron microscopists. J. Ultrastruct. Res. 80(3):280-287.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo) Model [en ligne]. Version 4.1. Pays-Bas : National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
Santé Canada. 2009a. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques. [consulté le 20 février 2009]. Accès : http://www.hc-sc.gc.ca/cps-spc/person/cosmet/info-ind-prof/_hot-list-critique/hotlist-liste-fra.php
Santé Canada. 2009b. Recherche de produits pharmaceutiques en ligne. [consulté le 19 février 2009]. Accès : http://webprod.hc-sc.gc.ca/dpd-bdpp/language-langage.do?url=t.search.recherche&lang=fra
Santé Canada. 2009c. Base de données des produits de santé naturels homologués. [consultée le 20 février 2009]. Accès : http://webprod.hc-sc.gc.ca/lnhpd-bdpsnh/language-langage.do?url=t.search.recherche&lang=fra
Santé Canada. 2009d. Liste de divulgation des ingrédients, Loi sur les produits dangereux. [consulté en mars 2009]. Accès : http://laws.justice.gc.ca/fr/showdoc/cr/DORS-88-64/sc:1/20090901/fr?page=1
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2009. Disponible auprès de Santé Canada, Division des cosmétiques.
Seiler, J.P. 1984a. The mutagenicity of mono- and di-functional aromatic glycidyl compounds. Mutat. Res. 135 (3):159-167.
Seiler, J.P. 1984b. Uptake, metabolism and mutagenic activity of aromatic glycidyl compounds. Chem. Biol. Int.51(3):347-356.
Shell Chemical Company. 1956. The toxicology of glycidol and some glycidyl ethers. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0523687. No de document : 40-5640496.
Shell Oil Company. 1957. Chronic Vapor Toxicity of nBGE with attachments and cover letter dated 071278. No de microfiche : OTS0200451. No de document : 88-7800213.
Shell Oil Company. 1978. Toxicity studies with n-butyl glycidyl ether: In vitro mutation studies with letter dated 031679. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0200451. No de document : 887900213.
Steiner, S., Hönger, G., Sagelsdorff, P. 1992. Molecular dosimetry of DNA adducts in C3H mice treated with bisphenol A diglycidylether. Carcinogenesis 13(6):969-972.
Tarvainen, K. 1995. Analysis of patients with allergic patch test reactions to a plastics and glues series. Contact Derm. 32(6):346-351.
Terrill, J.B., Lee, K.P., Culik, R., Kennedy, G.L. Jr. 1982. The inhalation toxicity of phenyl phenylglycidyl ether: reproduction, mutagenic, teratogenic, and cytogenic studies. Toxicol. Appl. Pharmacol. 64(2): 204-212.
Thompson, E.D., Coppinger, W.J., Piper, C.E., McCarroll, N., Oberly, T.J., Robinson, D. 1981. Mutagenicity of alkyl glycidyl ethers in three short-term assays. Mutat. Res.90(3):213-231.
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. [consulté le 7 janvier 2009]. Accès : http://www.accelrys.com/products/topkat/index.html
[US EPA] United States Environmental Protection Agency. 1979. USEPA status report: Butyl glycidyl ether (4/479). TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0200451. No de document : 8EHQ0279-0213.
[US EPA] United States Environmental Protection Agency. 2008a. Supporting Documents for Initial Risk-Based Prioritization of High Production Volume Chemicals - Sponsored Chemical n-Butyly glycidyl ether (CAS No. 2426-08-6) [consulté le 11 mars 2009]. Accès : http://www.epa.gov/hpvis/rbp/2426086_Butyl%20glycidyl%
20ether_Web_RBPSuppDocs.July2008.pdf
[US EPA] U.S. Environmental Protection Agency. 2008b. Robust Study Summary. Test substance – biodegradation. Oxirane, (butoxymethyl)- [en ligne]. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics [consulté le 22 avril 2009]. Accès : http://iaspub.epa.gov/oppthpv/Public_Search.PublicEndPointReport?robust_summary_id=
25096210&WhichButton=PrintTab&ep_name=Biodegradation&selchemid=101064
Van Duuren, B.L., Langseth, L., Goldschmidt, B.M., Orris, L. 1967. Carcinogenicity of epoxides, lactones and peroxy compounds. VI. Structure and carcinogenicity activity. J. Natl Cancer Inst. 39:1217-1228.
Von der Hude, W., Carstensen, S., Obe, G. 1991. Structure-activity relationships of epoxides: Induction of sister-chromatid exchanges in Chinese hamster V79 cells. Mutat. Res. 249(1):55-70.
Von der Hude, W., Seelbach, A., Basler, A. 1990. Epoxides: Comparison of the induction of SOS repair in Escherichia coli PQ37 and the bacterial mutagenicity in the Ames test. Mutat. Res. 231(2):205-218.
Voogd, C.E., Stel Van, J.J., Jacobs, J.A. 1981. The mutagenic action of aliphatic epoxides. Mutat. Res.89(4):269-282.
Wade, M.J., Moyer, J.W., Hine, C.H. 1979. Mutagenic action of a series of epoxides. Mut. Res. 66(4):367-371.
Wallace, E. 1979. Effects of n-butyl glycidyl ether exposure. J. Soc. Occup. Med. 29(4):142-143.
Weil, C.S., Condra, N., Haun, C., Striegel, J.A. 1963. Experimental carcinogenicity and acute toxicity of representative exposides. Am. Ind. Hyg. J.24(4):305-324.
Whorton, E.B. Jr., Pullin, T.G., Frost, A.F., Onofre, A., Lagator, M.S., Fols, D.S. 1983. Dominant lethal effects of n-butyl glycidyl ether in mice. Mutat. Res.124(3-4):225-253
Wooder, M.F., Creedy, C.L. 1981. Studies on the effects of diglycidyl ether of bisphenol A on the liver DNA in vivo. Shell Research Report TLGR.81.102.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm.
Zakova, N., Zak, F., Froehlich, E., Hess, R. 1985. Evaluation of skin carcinogenicity of technical 2,2-bis-(p-glycidyloxyphenyl)-propane in CF1 mice. Food Chem. Toxicol. 23(12):1081-1089.
Annexe 1 : Estimations de la limite supérieure de l'exposition à l'oxyde de butyle et de 2,3époxypropyle par les produits de consommation
| Scénario concernant les produits de consommation | Hypothèses | Estimation de l'exposition |
|---|---|---|
| Peinture | Pourcentage massique de l'oxyde de butyle et de 2,3époxypropyle : 0,0336 % Fréquence d'exposition : 1 x/an (RIVM, 2006) Poids du corps : 70,9 kg (Santé Canada, 1998) Quantité appliquée : 1,3 × 103 g (RIVM, 2006) Modèle d'inhalation : exposition à la vapeur, évaporation : Durée d'exposition de 132 minutes (RIVM, 2006) Volume de la pièce : 20 m3 (RIVM 2006) Débit de ventilation : 0,6 changement d'air/h (RIVM, 2006) Absorption par inhalation : 100 % Débit d'inhalation : 16,2 m3/j (Santé Canada, 1998) Modèle cutané : contact cutané direct avec le produit à taux constant Surface exposée : 0,367 m2(RIVM, 2006, fiche d'information générale par zone concernant les mains et bras) Taux de contact : 30 mg/min (RIVM, 2006) Durée d'émission : 7,2 × 103 s (RIVM, 2006) Absorption cutanée : 100 % |
Inhalation – Concentration moyenne par événement : 6 mg/m3 Dose cutanée aiguë : 0,02 mg/kg p.c. |
Annexe 2 : Résumé des données sur les effets de l'oxyde de butyle et de 2,3-époxypropyle sur la santé
| Paramètre | Doses ou concentrations minimales avec effet1/Résultats |
|---|---|
| 1 DL50 = dose létale médiane CL50 = concentration létale médiane DMEO = dose minimale avec effet observé CMEO = concentration minimale avec effet observé DSEO = dose sans effet observé |
|
| Toxicité aiguë | DL50 la plus faible, par voie orale (souris) = 1 530 mg/kg p.c. (souris de Webster). (Shell Oil Co., 1956). DL50 la plus faible, par voie cutanée (lapin) = 788 mg/kg p.c. (souche non précisée) (Lockwood et Taylor, 1982). CL50 la plus faible, par inhalation (rats) =5,484 g/m3 (1 030 ppm) chez les rats de Long-Evans (Shell Oil Co., 1956). Autres études : ACGIH, 1986; Hine et al., 1956. |
| Toxicité à court terme en doses répétées | DMEO par voie orale : Aucune étude répertoriée. CMEO par inhalation : 500 mg/m3(94 ppm) selon la dégénérescence de la muqueuse olfactive et les modifications hyperplasiques/métaplasiques de l'épithélium respiratoire cilié de rats mâles et femelles. Ces effets ont été légèrement plus prononcés chez les mâles que chez les femelles. D'autres effets ont été observés à 1 000 mg/m3 (188 ppm), notamment une perte de poids chez les mâles, ainsi qu'une augmentation des taux d'aspartate transaminase (AST) et d'hémoglobine. Les effets sur l'hémoglobine sont réversibles chez l'animal après l'arrêt de l'exposition et deux semaines de mise au repos. Le protocole d'exposition était le suivant : les rats ont été exposés 6 h par jour, 5 jours par semaine, pendant 28 jours à 0, 100, 500, 1 000 mg/m3 (0, 18, 94, 188 ppm) (Ciba-Geigy, 1985a; idem, 1985b). Aucune autre étude de ce type n'a été recensée. DMEO par voie cutanée : 100 mg/kg p.c./j selon l'apparition de petites lésions blanches sur le foie chez l'un des cinq lapins exposés. La substance a été appliquée 5 fois par semaine pendant 4 semaines. Aucune autre information n'a été fournie dans la source secondaire (Confidentiel, 1964). Aucune autre étude de ce type n'a été recensée. |
| Toxicité subchronique | CMEO par inhalation : Des rats mâles ont été exposés à la substance à des concentrations de 0, 200, 400, 800 et 1 600 mg/m3 (0, 38, 75, 150, 300 ppm) 7 h par jour, 5 jours par semaine pendant 10 semaines. À 800 mg/m3(150 ppm), un retard de croissance et le décès d'un rat ont été observés. L'exposition à une dose élevée de 1 600 mg/m3 (300 ppm) a entraîné une nécrose du foie, un amaigrissement, une apparence de mauvaise santé et une augmentation des ratios poids du rein/poids du corps et poids du poumon/poids du corps (Shell Oil Co., 1957, voir également Toxicité pour la reproduction). Aucune autre étude subchronique n'a été recensée. |
| Toxicité chronique/ cancérogénicité |
Aucune étude de toxicité chronique n'a été recensée. |
| Toxicité pour le développement | Voir les résultats des essais de létalité dominante. |
| Toxicité pour la reproduction | Concentration minimale avec effet observé (CMEO) – inhalation : 400 mg/m3. Atrophie testiculaire observée chez 1 rat sur 10 à 400 mg/m3 et 4 rats sur 5 à 1 600 mg/m3. Légère atrophie présente chez 1 rat sur 10 à 400 mg/m3 et atrophie testiculaire observée chez 1 rat sur 10 à 800 mg/m3(cité dans NTP, 2004). Dans une étude publiée en 1979, l'EPA américaine a abordé les effets de l'exposition à l'oxyde de butyle et de 2,3-époxypropyle. Voir Shell Oil Co., 1957 dans la section Toxicité subchronique pour connaître les détails du protocole d'étude. Voir les Résultats des essais de létalité dominante. |
| Génotoxicité et paramètres connexes : in vivo | Essai de létalité dominante : Résultats positifs : Au moins 10 souris mâles B6D2F1, âgées de 8 à 10 semaines, ont été exposées localement à une solution d'oxyde de butyle et de 2,3époxypropyle à plus de 95 % à un dosage de 1 500 mg/kg p.c. 3 fois/semaine pendant 8 semaines. L'étude inclut des témoins non exposés et des témoins positifs exposés à la triéthylènemélamine (TEM). Après l'exposition, les mâles ont été accouplés avec trois femelles vierges par semaine pendant trois semaines. Une augmentation significative du ratio décès/grossesses (p=0,04) a été observée. Une baisse significative du nombre de nidations par grossesse (p=0,01) et du nombre de femelles gestantes (p=0,05) par rapport aux témoins non exposés a été observée (Rhone-Poulenc, 1977). Résultats équivoques : Des groupes de 36 à 44 souris BDF mâles ont été exposés à 0, 375, 750 ou 1 500 mg/kg p.c./j d'oxyde de butyle et de 2,3-époxypropyle (pur à 95 %) par application cutanée 3 fois par semaine pendant 8 semaines. Les témoins ont été exposés à une solution saline à 0,9 %. Les mâles ont été accouplés avec trois femelles non exposées chaque semaine pendant les trois semaines suivant l'exposition initiale. Deux essais ont été menés selon le même protocole. Une augmentation significative du taux de mortalité fœtale a été observée pour le dosage le plus élevé dans l'expérience 1, ainsi que lors de la combinaison des résultats des deux essais (p < 0,05). L'augmentation du taux de mortalité du second essai seul n'est pas significatif, car la mortalité fœtale a été anormalement élevée dans le groupe témoin de cette expérience. Aucun changement du taux de grossesses ou du nombre de nidations par femelle gestante n'a été observé lors des essais (Whorton et al., 1983; Shell Oil Co., 1957). Aberrations chromosomiques : Résultats positifs : Des rats CR-1 Sprague-Dawley ont reçu une injection intrapéritonéale de 0, 31,3, 104,2 ou 312,5 mg/kg p.c. 5 fois pendant 5 jours. L'exposition à la TEM a été utilisée comme témoin positif. Une augmentation du nombre d'aberrations chromosomiques, liée à la dose injectée, a été observée dans des cellules de moelle osseuse de rat. Ces aberrations incluent des ruptures de chromatides et de chromosomes, des aberrations de type de marqueur et des graves dommages chromosomiques (Procter and Gamble, 1979). Test du micronoyau : Résultats négatifs : Des souris BDF femelles ont été exposées par voie orale pendant 5 jours à une dose de 200 mg/kg (Connor et al., 1980a). Résultats positifs : Des souris BDF femelles ont reçu une injection intrapéritonéale de 225, 450, 675 ou 900 mg/kg pendant 1 à 2 jours. Les souris ont réagi en fonction de la dose (Connor et al., 1980a). Résultats positifs : Des souris ont reçu une injection intrapéritonéale de 200, 225, ou 675 mg/kg pendant respectivement 5 jours, 2 jours et 1 jour. Une augmentation du nombre de micronoyaux a été observée à 225 mg/kg pendant 2 jours et à 675 mg/kg pendant 1 jour (CMA, 1984). |
| Génotoxicité et paramètres connexes : in vitro | Mutagénicité : Résultats positifs pour la mutation inverse de bactéries : Test d’Ames – Salmonella typhimurium de types TA100 et TA1535 avec et sans activation métabolique. Occasionnellement positif sur les espèces TA97 et TA1538. (Confidentiel, 1977; Rhone-Poulenc, 1977; Shell Oil Co., 1978; Procter and Gamble Co., 1979; Wade et al., 1979; Connor et al., 1980a; Thompson et al., 1981; Canter et al., 1986). Résultats négatifs : test des urines – Résultats négatifs pour la Salmonella typhimurium de type TA1535. Urine obtenue de souris B6D2F1 ou ICR femelles exposées par voie orale à 200 mg/kg p.c./j pendant 4 jours (Rhone-Poulenc, 1977). Test des urines – Négatif pour la Salmonella typhimurium de types TA98 et TA1535. Urine obtenue de souris BDF mâles traitées localement à 1 500 mg/kg, 3 fois par semaine pendant 8 semaines, ou à 750, 1 500, 3 000 mg/kg, 3 fois par semaine pendant 16 semaines. (Connor et al., 1980a) Test des urines – Négatif pour la Salmonella typhimurium de type TA1535 à partir d'urines obtenues de souris ICR femelles traitées par voie orale à 200 mg/kg une fois par jour pendant 4 jours (Connor et al., 1980a). Résultats négatifs : Essai par passage sur hôte – Salmonella typhimurium (espèces non indiquées). Dix souris ICR femelles traitées par voie orale pendant 5 jours se sont vu inoculer de la S.typhimurium. Les bactéries ont été recueillies et examinées à la recherche de mutations inverses (Rhone-Poulenc, 1977). Résultats positifs : Cellules de lymphomes de souris (mutants déficients en TK) avec et sans activation (Thompson et al., 1981). Échange de chromatides sœurs : Résultats positifs : Cellules V79 de hamsters chinois (von der Hude et al,. 1991). Transformation : Résultats négatifs : Cellules de souris BALB/3T3 exposées 1 x 2 h ou 2 x 2 h avec une période de repos de 24 h entre chaque exposition (Connor et al., 1980a). Dommages à l'ADN : Résultats positifs : Synthèse non programmée d'ADN dans des lymphocytes de sang périphérique humain (Frost et Legator, 1982; Rhone-Poulenc, 1977). Faible réponse de synthèse non programmée d'ADN dans des cellules W138, non considérée comme positive par les auteurs (Thompson et al., 1981). Résultats positifs : ADN endommagé présent dans les lymphocytes humains cultivés (protocole d'exposition non indiqué dans la source secondaire – CIRC, 1999) (Connor et al., 1980b). |
| Irritation/sensibilisation | Une dose de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle non dilué a été administrée dans un œil à 3 lapins blancs albinos de Nouvelle-Zélande. La substance a causé de graves dommages oculaires irréversibles dans un cas. Les deux autres cas ont montré des zones diffuses de translucidité de la cornée et une conjonctivite légère à modérée qui a disparu en 4 jours (Rhone-Poulenc, 1973) Une dose de 0,5 mL d'oxyde de butyle et de 2,3-époxypropyle non dilué a été appliquée sur des tampons de gaze, qui ont ensuite été appliqués sur des zones normales et abrasées du dos de lapins blancs albinos de Nouvelle-Zélande. Les expériences ont été effectuées à la fois dans des conditions occluses et non occluses. Après 24 h, les tampons ont été retirés et les animaux ont été observés. La substance a causé de graves irritations dans toutes les conditions (Rhone-Poulenc, 1973; Reichold Chem. Co., 1978). Des cobayes ont reçu une injection intra-cutanée de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle dilué 3 fois par semaine, un jour sur deux, et ont reçu huit injections au total. Une dose déclenchante, estimée à une injection de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle dilué (bien que non mentionnée par les auteurs), a été administrée après une incubation de trois semaines. La sensibilisation des animaux a été évaluée 24 et 48 h plus tard. Une sensibilisation a été constatée chez 16 des 17 animaux (Weil et al., 1963). Dix cobayes de Pirbright mâles et 10 cobayes de Pirbright femelles ont reçu une injection intra-cutanée de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle à 0,1 % à l'arrière du flanc droit, un jour sur deux, pour un total de 10 injections. Des doses déclenchantes équivalentes ont été injectées deux semaines plus tard sur le flanc gauche. Onze des 19 animaux ont montré des signes de sensibilisation. Un décès a été constaté (Ciba-Geigy, 1977). Douze cobayes albinos femelles ont reçu trois injections intra-cutanées de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle à 10 %. Une semaine plus tard, les cobayes ont reçu une application topique pendant 48 h. Après deux semaines d'incubation, les cobayes ont subi un test par application de timbre d'oxyde de butyle et de 2,3-époxypropyle à 0,1 %. Six des 12 animaux ont montré des signes de sensibilisation (Reichold Chem Co., 1978, cité dans NTP, 2004).* Des cobayes de Hartley ont été exposés à une application de timbre d'oxyde de butyle et de 2,3-époxypropyle à 25 % sur le dos, une fois par semaine pendant trois semaines. Après deux semaines de repos, les animaux ont reçu une dose déclenchante (oxyde de butyle et de 2,3-époxypropyle à 1 %) et des observations ont été effectuées 24 h et 48 h après l'administration de cette dose. Un animal sur 20 a présenté un érythème modéré. Dix-huit des 20 animaux ont présenté un érythème confluent léger ou modéré et localisé (Reichold Chem Co., 1978, cité dans NTP, 2004). * La méthode décrite peut contenir des erreurs en raison de la qualité médiocre de la microfiche OTS0523514 (NTP, 2004). |
| Études chez les humains | |
| Immunotoxicité | Des patients présentant des allergies de contact connues aux résines époxydes ont été exposés à de l'oxyde de butyle et de 2,3-époxypropyle dilué à 0,25 % dans de l'acétone (aucune information supplémentaire fournie). Trois patients sur 20 ont présenté une réaction positive (Fregert et Rorsman 1964). Des ouvriers, employés dans une usine de fabrication de résines époxydes à base de bisphénol A, ayant présenté des éruptions cutanées par le passé, ont été soumis à des tests par application de diverses substances chimiques utilisées au cours du processus de fabrication. Un sujet sur 19 a réagi positivement à l'oxyde de butyle et de 2,3-époxypropyle (Prens et al., 1986). Des patients (soit 140) présentant une dermatite de contact aux résines époxydes ont subi des tests par application de timbre. Une solution d'oxyde de butyle et de 2,3-époxypropyle à 0,25 % a été appliquée en haut du dos, sous pansement occlusif pendant 24 ou 48 h. Les résultats ont été lus 24, 48 et 120 h après le retrait. Deux des 140 patients testés ont présenté des réactions positives (Jolanki et al., 1990). Des tests ont été effectués sur 343 sujets selon la méthode employée dans l'étude de Jolanki et al. Aucun des 343 patients n'a présenté de réaction à la solution d'oxyde de butyle et de 2,3-époxypropyle à 0,25 % (Tarvainen, 1995). Des patients ayant une suspicion de dermatose liée à la profession ont subi un test par application de timbre d'une solution d'oxyde de butyle et de 2,3-époxypropyle 0,25 % sous pansement occlusif pendant 48 h. Des examens ont été effectués 2, 3 et 4 à 6 jours après le retrait. Deux réactions allergiques et une réaction d'irritation ont été observées dans un groupe de 310 patients (Kanerva et al., 1997, 1999). |
| Autres études | Rapports d'étude : Wallace, 1979 Étude sur la santé de la reproduction : Une étude sur la santé de la reproduction a été effectuée en raison de cas groupés de fausses couches chez des employées d'une usine de fabrication de plastiques. De l'oxyde de butyle et de 2,3-époxypropyle a été trouvé dans plusieurs produits utilisés dans l'usine (Epibond 8543-A, Epocast 167-A et résines époxydes). L'oxyde de butyle et de 2,3-époxypropyle est lié à l'une des fausses couches. Aucun agent responsable unique n'a pu être identifié (Boeing Co., 1986). |
Annexe 3 : Structures et classifications relatives à l'l'oxyde de butyle et de 2,3-époxypropyle et aux substances similaires prises en compte dans cette évaluation
| Nom et numéro de registre CAS | Classification | Structure | |
|---|---|---|---|
| CIRC | Commission européenne | ||
| Oxyde de butyle et de 2,3époxypropyle 2426-08-6 |
Cancérogénicité : Cat. 3 Mutagénicité : Cat. 3 |
 |
|
| Oxyde d'allyle et de glycidyle 106-92-3 |
Cancérogénicité : Cat. 3 Mutagénicité : Cat. 3 Reprod. Cat. 3 |
 |
|
| Éther de phényle et de glycidyle 122-60-1 |
Cancérogénicité : Groupe 2B | Cancérogénicité : Cat. 2 Mutagénicité : Cat. 3 |
 |
| Éther de bisphénol A et de diglycidyle 1675-54-3 |
Non classifiable |  |
|
| Glycidol 556-52-5 |
Cancérogénicité : Groupe 2A | Cancérogénicité : Cat. 2 Mutagénicité : Cat. 3 Reprod. Cat. 2 |
 |
Annexe 4 : Résumé de tous les renseignements relatifs à la cancérogénicité et à la génotoxicité des substances jugées similaires à l'oxyde de butyle et de 2,3-époxypropyle disponibles dans cette évaluation
| Oxyde d'allyle et de glycidyle |
|---|
| Cancérogénicité |
| Inhalation : Des rats Osborne-Mendel et des souris B6C3F1 ont été exposés à 0, 23, 47 mg/m3 (0, 5 et 10 ppm), 6 heures par jour, 5 jours par semaine (50 animaux de chaque sexe dans chaque groupe) pendant 102 ou 103 semaines par inhalation globale. Un nombre statistiquement significatif de lésions nasales (inflammation, dégénérescence, métaplasie et hyperplasie) a été constaté chez les rats et les souris, quel que soit le niveau d'exposition. Chez les rats Osborne-Mendel mâles exposés à 47 mg/m3, un adénome papillaire de l'épithélium respiratoire, un carcinome à cellules squameuses de l'épithélium respiratoire et un adénocarcinome de l'épithélium olfactif ont été observés. Chez les souris mâles, trois adénomes de l'épithélium respiratoire, quatre cas de dysplasie et sept cas d'hyperplasie basocellulaire focale ont été observés à 47 mg/m3. Chez les souris femelles, un adénome de l'épithélium respiratoire et sept cas d'hyperplasie basocellulaire focale ont été observés à 47 mg/m3. Les cas de tumeurs primaires n'ont pas été considérés comme statistiquement significatifs, mais sont à prendre en compte d'un point de vue biologique (NTP, 1990a). |
| Génotoxicité |
In vivo Injection intrapéritonéale : Trois souris C3H/Hej mâles ont reçu une injection de 40 mg/mL d'une solution d'oxyde d'allyle et de glycidyle dissous dans de la tricapryline, pour une dose totale de 148 mg/kg par souris. Les animaux ont été euthanasiés 24 h après le traitement et leurs tissus ont été collectés. L'ADN du foie des souris traitées et non traitées a été isolé et testé afin de détecter la présence d'adduits d'AGE. L'AGE était lié à la guanine et à l'adénine dans l'ADN du foie des souris traitées (Plna et Segerback, 1997). Exposition cutanée : De l'oxyde d'allyle et de glycidyle a été appliqué localement sur une zone rasée de 4 × 4 cm du dos de 3 souris C3H/Hej, pour une dose totale de 60,5 mg/kg. Une journée (24 h) après le traitement, les souris ont été euthanasiées et leur peau a été prélevée. L'ADN de la peau des souris traitées et non traitées a été isolé et testé afin de détecter la présence d'adduits d'AGE. L’AGE a formé des adduits avec l'adénine et la guanine (Plna et Segerback, 1997). Exposition par voie orale : Des Drosophila melanogaster Canton-S mâles ont été nourries avec 5,5 mg/mL (5 500 ppm) d'AGE dans une solution de saccharose à 5 % pendant 3 jours. Une augmentation du nombre de mutations récessives selon le sexe a été observée. Au même dosage, l'AGE n'a pas entraîné d'augmentation du nombre de translocations réciproques (NTP, 1990a). In vitro Tests d’Ames – L'AGE a entraîné des mutations chez les Salmonella typhimurium de type de substitution de base TA100 et TA1535 à des doses comprises entre 10 et 10 000 µg/boîte. L'AGE s'est révélé mutagène en présence et en l'absence de S9. L'AGE ne s'est pas révélé mutagène chez les souches mutées par déphasage TA98 et TA1537 avec ou sans S9 (Canter et al., 1986; NTP, 1990a). Des cellules d'ovaires de hamsters chinois ont été incubées pendant 2 h à 37 ºC avec de l'AGE (1 à 50,2 µg/mL –S9 ou 3,3 à 100 µg/mL +S9). Toutes les concentrations ont fortement favorisé un échange de chromatides sœurs et des aberrations chromosomiques (tendance du test : p < 0,001 dans toutes les conditions). Aux concentrations les plus élevées, le retard du cycle cellulaire était évident (NTP, 1990a). Chromotest SOS – Positif lors de l'incubation de 250 µL d'Escherichia coli PQ37 avec 10 µL d'AGE dissous pendant 2 h (von der Hude, 1990). L'ADN de testicules de saumon a été incubé directement avec l'AGE (500 mM) pendant 24 h à 37 ºC. L'AGE a réagi directement avec l'adénine et la guanine pour former des adduits d'ADN (Plna et Segerback, 1997). |
| Glycidol |
| Cancérogénicité |
Exposition par voie orale : Des groupes de 15 souris haploïdes semi-dominantes p16Ink4a/p19Arf de chaque sexe ont été exposés à 0, 25, 50, 100 ou 200 mg/kg p.c./j de glycidol administré dans de l'eau désionisée, par gavage, 5 jours par semaine pendant 40 semaines. Le locus supprimé CDKN2A est responsable de deux protéines de suppression, l'une régulant le cycle cellulaire (p16Ink4a) et l'autre induisant la phase G1 et l'apoptose (p19Arf). La suppression de CDKN2A prédispose ainsi les souris au cancer sur différents sites. Les études utilisant ces souris requièrent donc une exposition plus brève et moins d'animaux. Des augmentations statistiquement significatives des sarcomes histiocytaires, en comparaison avec les témoins, ont été observées à 50 et 200 mg/kg p.c. chez les mâles (augmentation également constatée dans tous les groupes des deux sexes exposés à 50 mg/kg et plus, sans être statistiquement significative), ainsi que des adénomes alvéolaires/bronchiolaires à 100 mg/kg p.c. chez les mâles et à 200 mg/kg p.c. chez les femelles. Une augmentation statistiquement significative du nombre d'hyperplasies épithéliales du secteur gastrique antérieur a été constatée chez les mâles et les femelles à 200 mg/kg p.c. Les effets non néoplasiques constatés se caractérisent par un gonflement de la rate et des foyers dans le foie à 200 mg/kg p.c. chez les mâles, une neuropathie, une gliose et des hémorragies cérébrales à 200 mg/kg p.c. ainsi qu’à 100 et 200 mg/kg p.c. chez les femelles, de même qu'une atrophie des organes reproducteurs mâles et une baisse de la numération de spermatozoïdes à 200 mg/kg p.c. (NTP, 2007). Des rats F344N1 et des souris B6C3F1 ont été exposés respectivement à 0, 37,5 ou 75 mg/kg p.c./j et à 0, 25 ou 50 mg/kg p.c./j de glycidol par gavage 5 jours par semaine pendant 103 semaines. Chaque dose a été administrée à un groupe de 50 animaux de chaque sexe. Les constatations suivantes ont été considérées comme des preuves évidentes de cancérogénicité : des mésothéliomes de la tunique vaginale (3/49, 34/50, 39/47), des fibroadénomes des glandes mammaires (3/45, 8/39, 7/17), des gliomes du cerveau (0/46, 5/50, 6/30), ainsi que des tumeurs du secteur gastrique antérieur (1/46, 2/50, 6/32), de l'intestin (0/47, 1/50, 4/37), de la peau (0/45, 5/41, 4/18), de la glande de Zymbal (1/49, 3/50, 6/48) et de la glande thyroïde (1/46, 4/42, 6/19) chez les rats mâles; des fibroadénomes (14/49, 32/46, 29/44) et des adénocarcinomes (1/50, 11/48, 16/48) des glandes mammaires, des gliomes du cerveau (0/49, 4/46, 4/46), de la leucémie (13/49, 14/44, 20/41) et des tumeurs de la muqueuse buccale (1/46, 3/37, 7/26), du secteur gastrique antérieur (0/47, 4/38, 11/30), du gland du clitoris (5/49, 9/47, 12/45) et de la glande thyroïde (0/49, 1/38, 3/35) chez les rats femelles; des tumeurs de la glande de Harder (8/46, 12/41, 22/44), du secteur gastrique antérieur (1/50, 2/50, 10/50), de la peau (0/50, 0/50, 4/50), du foie (24/50, 31/50, 35/50) et du poumon (13/50, 11/50, 21/50) chez les souris mâles, ainsi que des tumeurs de la glande de Harder (4/46, 11/43, 17/43), des glandes mammaires (2/50, 6/50, 15/50), de l'utérus (0/50, 3/50, 3/50), du tissu souscutané (3/50, 3/50, 9/50) et de la peau (0/50, 0/50, 2/50) chez les souris femelles. Aucun signe clinique lié au composé ou de toxicité non néoplasique n'a été constaté chez les rats ou les souris (NTP, 1990b). Des hamsters dorés, ou syriens (20 animaux de chaque sexe) ont été exposés à 100 mg/kg p.c./j de glycidol (en solution 1:1 avec de l'acétate d'éthyle et de l'huile de maïs) par gavage, 2 fois par semaine pendant 60 semaines. Les groupes témoins comportent 12 animaux de chaque sexe, exposés à la solution sans glycidol pendant 90 semaines. Les nombres de tumeurs observées respectivement chez les mâles et les femelles exposés et témoins, pour les types de tumeurs les plus fréquents, sont les suivants : rate (2, 4, 0, 0), corticosurrénale (3, 2, 4, 3), secteur gastrique antérieur (3, 0, 0, 0) et utérus/col de l'utérus (0, 1, 0, 2). Aucune analyse statistique n'a été présentée. Le nombre d'animaux examinés à la recherche de tumeurs dans chaque groupe n'est pas clairement indiqué. Les auteurs ont précisé que les tumeurs de la corticosurrénale sont communes chez cette espèce de hamster, mais que les hémangiomes et hémangiosarcomes de la rate sont très rares (Lijinski, 1992). Exposition cutanée : Un groupe de 20 souris suisses IRC/Ha femelles a été exposé à une solution de glycidol à 5 % dilué dans l'acétone, par application sur la peau du dos, 3 fois par semaine pendant 520 jours. Les groupes témoins comportent trois groupes de respectivement 40, 50 et 30 animaux de même espèce et de même sexe, exposés au solvant, et trois groupes de 100 animaux ne recevant aucun traitement. Les taux de survie des groupes exposés et témoins sont comparables, et aucune tumeur ou lésion cutanée n'a été observée (Van Duuren, 1967). |
| Génotoxicité |
In vivo Injection intrapéritonéale : Des souris B6C3F1 mâles (5 par groupe) ont reçu deux injections intrapéritonéales de glycidol dissous dans une solution saline tamponnée au phosphate (PBS), à 24 h d'intervalle (27,5, 75 ou 150 mg/kg). Le volume total de chaque dose était de 0,4 mL. Les animaux témoins n'ont reçu que la PBS par injection intrapéritonéale. De la mitomycine C a été administrée aux animaux témoins positifs. Les souris ont été euthanasiées 24 h après la seconde injection et leurs érythrocytes polychromatiques (PCE) ont été examinées à la recherche de cellules micronucléaires. Le nombre de ces cellules a augmenté de façon significative (essai 1, p < 0,001; essai 2, p < 0,05) à la dose la plus élevée, pour chacun des deux essais (NTP, 1990b). Exposition par voie orale : Des Drosophila melanogaster mâles ont été nourris avec une solution de saccharose à 5 % contenant 1,23 mg/mL (1 230 ppm) de glycidol pendant 3 jours. Les mâles ont ensuite été accouplés à 3 femelles pendant 3 jours, puis à des femelles vierges à 2 jours d'intervalle, pour un total de 3 couvées. Le glycidol a entraîné des mutations récessives liées au sexe. La même dose a également causé des translocations réciproques (NTP, 1990b) . In vitro Tests d’Ames – Le glycidol s'est révélé mutagène à des doses comprises entre 1 et 10 000 µg/boîte sur les espèces de Salmonella typhimurium TA97, TA98, TA100, TA1535 et TA1537 avec ou sans activation métabolique S9 (NTP, 1990b). Autres études (tests d’Ames) : McCann et al., 1975; Loquet et al., 1981. Des cellules L1578Y/TK ont été exposées à du glycidol, à des concentrations comprises entre 0,313 nL/mL et 40 nL/mL. Les cellules ont été traitées à 37 ºC pendant 4 h, puis mises en incubation pendant 48 h dans un milieu dépourvu de glycidol. La résistance des cellules à la trifluorothymidine (Tft) a ensuite été testée. Le glycidol a entraîné une résistance à la Tft à des niveaux de concentration bas (dès 1,25 nL/mL). Le test a été effectué sans activation métabolique uniquement (NTP, 1990b). Des cellules d'ovaires de hamsters chinois (CHO) traitées à un dosage compris entre 1,1 et 150 µg/mL, en présence ou non de S9, ont montré des échanges de chromatides sœurs importants à tous les dosages testés (NTP, 1990b). Les cellules de CHO mises en incubation avec du glycidol (12,5 à 400 µg/mL) avec et sans activation ont démontré des aberrations chromosomiques importantes à toutes les doses (NTP, 1990b). Les dommages subis par l'ADN ont été évalués par électrophorèse en gel de cellules simples/essai comète. Des cellules de CHO exposées pendant 3 h à 5, 10, 20 ou 30 µg/mL ont présenté un ADN endommagé pour toutes les doses. Des augmentations statistiquement significatives (p <0,05) ont été observées à 20 et 30 µg/mL (El Ramy et al., 2007). |
| Éther de phényle et de glycidyle |
| Cancérogénicité |
| Exposition par inhalation : Des rats Sprague-Dawley (100 animaux de chaque sexe par groupe de dosage) ont été exposés à 0, 6, 74 mg/m3 (0, 1 ou 12 ppm) d'éther de phényle et de glycidyle (pur à 99,6 %) 6 heures/jour, 5 jours/semaine pendant 24 mois par inhalation globale (Lee, 1983). Aucune information relative à la survie n'a été fournie. Des tumeurs nasales liées à l'exposition ont été observées à 74 mg/m3 uniquement (signification statistique non précisée) avec une incidence de 0/89, 0/83 et 9/85 et 1/87, 0/88 et 4/89 chez les mâles et les femelles, respectivement. Une augmentation du nombre de rhinites et de métaplasies squameuses a également été observée à 74 mg/m3; elle est estimée liée aux tumeurs nasales. Le CIRC indique des valeurs p respectives de 0,007 et 0,06 pour la rhinite et la métaplasie aux doses élevées pour les mâles et les femelles (Lee, 1983). |
| Génotoxicité |
In vivo Exposition par inhalation : Essai de létalité dominante – Des rats mâles ont été exposés à 0, 12,3, 36,8 ou 67,6 mg/m3 (0, 2, 6, ou 11 ppm) 6 h par jour pendant 19 jours consécutifs, puis accouplés avec 3 femelles non traitées, chacun pendant 6 semaines. Aucune modification indiquant un effet de létalité dominante n'a été observée (Terrill et al., 1982). Exposition par inhalation : Des rats mâles ont été exposés à 0, 12,3, 36,8 ou 67,6 mg/m3 (0, 2, 6, ou 11 ppm) d'éther de phényle et de glycidyle, 6 h par jour pendant 19 jours consécutifs. Aucune augmentation du nombre d'aberrations chromosomiques n'a été observée dans les cellules de moelle osseuse (Terrill et al., 1982). Exposition par voie orale : Des souris ayant été exposées à une dose unique allant jusqu'à 1 000 mg/kg p.c. ont été euthanasiées 24 h après le traitement et les cellules de leur moelle osseuse ont été examinées à la recherche d'érythrocytes micronucléaires. Aucune augmentation du nombre de micronoyaux n'a été observée (Seiler, 1984a). Exposition par voie orale : Des souris ont reçu une dose unique de 500 mg/kg. La synthèse d'ADN testiculaire a été examinée. L'éther de phényle et de glycidyle n'a pas eu d'effet sur la capacité de la [3H]thymidine à atteindre les testicules ou sur la synthèse de l'ADN, selon la mesure de l'activité spécifique de la [3H]thymidine incorporée à l'ADN (Greene et al., 1979) In vitro Test d’Ames – L'éther de phényle et de glycidyle s'est avéré mutagène dans les souches de Salmonella typhimurium TA97, TA100 et TA1535 (sensibles aux mutagènes de paires de bases) mais pas dans les souches TA98, TA1537 et TA1538 (sensibles aux mutagènes par déphasage) avec et sans activation métabolique (Canter et al.,1986; Greene et al., 1979; Ivie et al., 1980; Neau et al., 1982; Ohtani et Nishioka, 1981; Seiler, 1984b). Essai par passage sur hôte – Des souris ont reçu une dose unique de 2 500 mg/kg p.c. par voie orale, intrapéritonéale ou intramusculaire. Des réactions positives faibles ont été observées chez les souris traitées par voie orale et intramusculaire. Le test s'est révélé négatif pour l'administration par voie intrapéritonéale (Greene et al., 1979). Des cellules d'ovaires de hamsters chinois (CHO) ont été incubées avec de l'éther de phényle et de glycidyle (6,25 à 100 µg/mL) pendant 6 ou 18 à 24 h sans S9 ou pendant 6 h avec S9. Aucune des conditions de test n'a permis d'observer des mutations des cellules de CHO (Greene et al., 1979). La substance s'est avérée mutagène sur la Klebsiellapneumoniae et l'Escherichia coli WP2 uvrA (Voogd et al., 1981; Hemminki et Vanio, 1980; Ohtani et Nishioka, 1981). Chromotest SOS – Positif lors de l'incubation de 250 µL d'Escherichia coli PQ37 avec 10 µl d'éther de phényle et de glycidyle dissous pendant 2 h (von der Hude, 1990). Une alkylation de l'ADN par l'éther de phényle et de glycidyle a été observée in vitro. (Hemminki et al., 1980). La substance ne se lie pas à l'ADN dans l'Escherichia coli avec ou sans activation métabolique (Hubinski et al., 1981). |
| Éther de bisphénol A et de diglycidyle |
| Cancérogénicité |
Exposition par voie cutanée : Des groupes de 50 souris CF1 de chaque sexe (99 mâles et 100 femelles pour les groupes témoins) ont été exposés à une solution de 0, 1 % ou 10 % (0,2 mL) de BADGE pur dilué dans l'acétone, appliqué localement 2 fois par semaine pendant 103 semaines. Les témoins ont été exposés à de l'acétone uniquement. Un groupe témoin positif a été exposé à de la ß-propiolactone. L'exposition n'a eu aucune incidence sur la survie. Trois mâles du groupe exposé à une solution à 10 % et 1 femelle du groupe exposé à 1 % ont développé des tumeurs au niveau du site d'exposition. Trois femelles du groupe exposé à une solution à 1 % ont développé des tumeurs cutanées distantes du site d'exposition. Le nombre de tumeurs cutanées, aussi bien au niveau du site d'exposition que de l'ensemble des sites, n'est pas significatif. Aucune tumeur systémique liée à l'exposition n'a été détectée chez les mâles. Une tendance significative au développement de lymphosarcomes thymiques a été observée chez les femelles. Les auteurs ont relevé une incidence sous-jacente relativement élevée de néoplasies lymphoréticulaires et hématopoïétiques pour cette souche particulière dans le laboratoire, qui a pu être causée par un virus (Persitianis, 1988). Autres études par exposition cutanée : Zakova, 1985; Holland, 1979; Weil, 1963; Hine, 1958. |
| Génotoxicité |
In vivo Exposition par voie orale : Dix souris B6D2F1 femelles ont reçu 1 000 mg/kg p.c./j pendant 5 jours consécutifs. Aucune augmentation du nombre de micronoyaux par rapport au groupe témoin non exposé n'a été observée (Pullin, 1977). Exposition par voie orale : La capacité du BADGE à endommager l'ADN a été étudiée. Une dose unique de 500 mg/kg p.c. a été administrée à des rats Wistar mâles et femelles. Les dommages subis par l'ADN ont été évalués grâce à un essai d'élution alcaline. Aucun dommage détectable de l'ADN monocaténaire n'a été observé dans des cellules du foie 6 heures après l'administration de la dose (Wooder et Creedy, 1981). Exposition cutanée : Essai de létalité dominante – 10 souris B6D2F1 mâles ont été traitées localement à un dosage de 3 000 mg/kg p.c., 3 fois par semaine pendant au moins 8 semaines. Après l'exposition, les mâles ont été accouplés avec 3 femelles vierges par semaine pendant 2 semaines. Deux semaines plus tard, les femelles ont été euthanasiées et l'on a recherché le nombre de grossesses, le nombre de nidations et la mortalité fœtale. Aucun effet néfaste n'a été observé en comparaison avec le groupe témoin (Pullin, 1977). Une autre étude de létalité dominante a également indiqué l'absence d'effets néfastes liés à l'administration de BADGE. Toutefois, aucun détail n'a été fourni dans cette étude (Hine et al., 1981). Exposition cutanée : Des souris mâles C3H ont été traitées avec 20 mg/mL de BADGE, sous pansement occlusif. Les animaux ont été euthanasiés à 48, 96 ou 122 h et l'ADN de l'épiderme a été isolé. On a observé des liaisons de métabolites de BADGE avec l'adénine dans l'ADN, à une fréquence d'environ 0,1 à 0,8 adduit pour 106nucléotides (Steiner et al., 1992). In vitro Test d’Ames – Des Salmonella typhimurium TA1535, TA1537, TA1538, TA98 et TA100 ont été traitées avec du BADGE, avec et sans activation métabolique. Les effets du BADGE ont été négatifs sur toutes les souches en l'absence d'activation métabolique. Avec activation, le BADGE a entraîné des mutations chez les souches TA1535 et TA1537 7 à 10 fois supérieures à l'incidence sous-jacente. Les résultats ont été négatifs sur toutes les autres souches testées. Le BADGE ne s'est pas révélé mutagène sur l'E. coli WP2 ou WP2 uvrA (Brooks et al., 1981). Le BADGE a été testé sur les souches TA100 et TA1538 avec des doses allant de 10 à 10 000 µg/boîte. Sans activation, une réaction positive faible a été observée. Des réactions positives ont été observées avec activation métabolique par S9 dérivé de foie de rat ou de hamster (Canter et al., 1986). Autres études de mutations sur les bactéries : Pullin, 1977; Andersen, 1978; Wade et al., 1979; Ringo et al.,1982. Test des urines – Négatif : l'urine de souris exposées par gavage une fois par jour à un dosage de 1 000 mg/kg de BADGE ne s'est pas révélée mutagène sur la souche TA1535 (Pullin, 1977). Essai par passage sur hôte – Négatif : De la S. typhimurium a été inoculée dans la cavité péritonéale de souris exposées par gavage pendant 5 jours à un dosage de 1 000 mg/kg de BADGE. Aucune augmentation du nombre de révertants n'a été observée (Pullin, 1977). Des cellules de S. cerevisiae JD1 ont donné un résultat positif pour la conversion génique mitotique lors de leur incubation avec du BADGE, avec ou sans enzymes microsomales (Brooks et al., 1981). Des cellules de foie de rat ont été mises en culture en présence de BADGE (3,75, 5, 7,5, 10, 15 et 20 µg/mL). Une augmentation des aberrations chromosomiques liée à la dose a été constatée dans les cellules traitées avec une dose variant de 10 à 20 µg/mL (Brooks et al., 1981). La capacité du BADGE à entraîner des transformations néoplasiques a été évaluée dans des cellules de reins de jeunes hamsters. La fréquence des transformations néoplasiques observée a été multipliée par cinq. Aucune autre information n'a été fournie à titre de référence secondaire (Brooks et al., 1981) |
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
l'oxyde de butyle
et de 2,3-époxypropyle
Numéro de registre du Chemical Abstracts Service
2426-08-6
Environnement Canada
Santé Canada
Mars 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Estimations de la limite supérieure de l'exposition à l'oxyde de butyle et de 2,3époxypropyle par les produits de consommation
- Annexe 2 : Résumé des données sur les effets de l'oxyde de butyle et de 2,3-époxypropyle sur la santé
- Annexe 3 : Structures et classifications relatives à l'l'oxyde de butyle et de 2,3-époxypropyle et aux substances similaires prises en compte dans cette évaluation
- Annexe 4 : Résumé de tous les renseignements relatifs à la cancérogénicité et à la génotoxicité des substances jugées similaires à l'oxyde de butyle et de 2,3-époxypropyle disponibles dans cette évaluation
Les ministres de l'Environnement et de la Santé ont effectué une évaluation préalable de l'oxyde de butyle et de 2,3-époxypropyle, dont le numéro de registre du Chemical Abstracts Service est 2426-08-6. Une priorité élevée a été accordée à la prise de mesures à l'égard de cette substance lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres. L'oxyde de butyle et de 2,3époxypropyle présente un risque d'exposition intermédiaire pour les Canadiens et il a été classé par d'autres organismes sur la base de sa cancérogénicité et de sa génotoxicité. La substance ne répondait pas aux critères de persistance, de bioaccumulation ou de toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée sur les aspects relatifs à la santé humaine.
Selon les renseignements transmis conformément à l'article 71 de la LCPE (1999), aucune entreprise canadienne n'a déclaré avoir fabriqué en 2006 de l'oxyde de butyle et de 2,3-époxypropyle en une quantité égale ou supérieure au seuil de 100 kg. Cependant, il a été signalé que de 10 000 à 100 000 kg ont été importés au Canada en 2006. L'oxyde de butyle et de 2,3-époxypropyle est employé comme diluant réactif des résines époxydes servant de réducteur de viscosité, comme produit chimique intermédiaire et comme accepteur d'acide pour stabiliser les solvants chlorés. Au Canada, il est principalement utilisé dans les formulations de résines époxydes qui ont des applications dans les revêtements, les adhésifs, les liants, les matériaux d'étanchéité, les bouche-pores et les résines.
Les émissions d'oxyde de butyle et de 2,3-époxypropyle dans l'environnement ambiant proviendraient vraisemblablement de sources anthropiques, plus précisément de l'utilisation et de la production commerciale des résines époxydes. D'après les propriétés physiques et chimiques, les utilisations et les rejets déclarés, la principale voie d'exposition de la population générale à cette substance est sans doute par inhalation de l'air, et l'exposition par d'autres milieux est vraisemblablement négligeable.
D'après ses propriétés physiques et chimiques, l'oxyde de butyle et de 2,3-époxypropyle ne devrait pas présenter de risque de persistance ou de bioaccumulation dans l'environnement. Cette substance ne répond pas aux critères de la persistance ou de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. En outre, les données empiriques de la toxicité aquatique aiguë indiquent que la substance représente un danger faible à modéré pour les organismes aquatiques. Selon une comparaison de la concentration estimée sans effet toxique et de la concentration estimée raisonnable d'exposition dans l'environnement, il est conclus que l'oxyde de butyle et de 2,3-époxypropyle l'oxyde de butyle et de 2,3-époxypropyle ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou encore à mettre en danger l’environnement essentiel pour la vie.
Bien qu'aucune étude de cancérogénicité à long terme n'ait été menée sur l'oxyde de butyle et de 2,3-époxypropyle, il s'est révélé génotoxique dans plusieurs essais in vivoet in vitro. De plus, des analogues structuraux de l'oxyde de butyle et de 2,3-époxypropyle se sont révélés cancérogènes chez les animaux de laboratoire et génotoxiques dans divers essais in vivo et in vitro. Étant donné les résultats positifs de génotoxicité pour l'oxyde de butyle et de 2,3-époxypropyle ainsi que la génotoxicité et la cancérogénicité des analogues de l'oxyde de butyle et de 2,3-époxypropyle, il a été conclu que l'oxyde de butyle et de 2,3-époxypropyle pourrait présenter une possibilité d'effets nocifs quel que soit le degré d'exposition. En conséquence, on peut conclure que l'oxyde de butyle et de 2,3-époxypropyle est une substance pouvant pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
D'après les renseignements disponibles, on peut conclure que l'oxyde de butyle et de 2,3-époxypropyle répond à au moins un des critères de l'article 64 de la LCPE(1999).
De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
De plus, s'il y a lieu, des activités de recherche et de surveillance viendront appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
Conformément à la Loi canadienne sur la protection de l’environnement (1999) [LCPE(1999)] (Canada, 1999), les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui ont été jugées prioritaires dans le cadre de la catégorisation de la Liste intérieure des substances afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine. Selon les résultats de cette évaluation, les ministres peuvent proposer de ne rien faire à l'égard de la substance, de l'inscrire sur la Liste des substances d'intérêt prioritaire en vue d'une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l'annexe 1 de la Loi et, s'il y a lieu, sa quasi-élimination.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques et que l'on estime commercialisées;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada(Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances d'importance prioritaire.
L'oxyde de butyle et de 2,3-époxypropyle est une substance dont l'évaluation des risques pour la santé humaine a été jugée hautement prioritaire, car on considère qu'il présente un REI et il a été classé par d'autres organismes en fonction de sa cancérogénicité et de sa génotoxicité.
Le volet du Défi portant sur l'oxyde de butyle et de 2,3-époxypropyle a été lancé au moyen d'un avis paru dans la Gazette du Canada le 30 août 2008 (Canada, 2008). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. De nouveaux renseignements sur la substance ont été communiqués en réponse au Défi.
Une priorité élevée a été donnée à l'évaluation des risques que présente l'oxyde de butyle et de 2,3-époxypropyle pour la santé humaine. Cette substance ne répond pas aux critères environnementaux de la catégorisation relatifs à la persistance, à la bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE(1999) mettent l'accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de l'article 64 de la Loi. Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l’exposition à celle-ci, y compris l’information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l'évaluation préalable de l'oxyde de butyle et de 2,3-époxypropyle ont été relevées dans des publications originales, des rapports de synthèse et d'évaluation, des rapports de recherche de parties intéressées et d'autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en avril 2009 (exposition et effets sur la santé humaine) et jusqu'en février 2009 (propriétés physiques et chimiques, exposition et effets sur l'environnement). Les études les plus importantes ont fait l'objet d'une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble et de l'information sur les dangers et les risques pour la santé (fondée principalement sur les évaluations effectuées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur l'écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, et ce, dans le contexte d'une évaluation préalable. La présente évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des renseignements essentiels qui appuient la conclusion proposée.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. Cette évaluation préalable a fait l'objet d'une consultation et d'une étude consignée par des pairs. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment M. Bernard Gadagbui (TERA), M. Michael Jayjock (The Lifeline Group) et Mme Susan Griffin (Environmental Protection Agency des États-Unis). Les portions de la présente évaluation préalable qui portent sur l'écologie ont fait l'objet d’une consultation ou d'une étude rédigée par des pairs. Par ailleurs, l'ébauche de cette évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Aux fins du présent document, la substance est appelée oxyde de butyle et de 2,3époxypropyle, appellation correspondant à son nom commun. Les renseignements relatifs à l'identité de cette substance sont résumés au tableau 1.
Tableau 1. Identité de la substance
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 2426-08-6 |
| Nom dans la LIS1 | Oxyde de butyle et de 2,3-époxypropyle |
| Noms relevés dans les National Chemical Inventories (NCI)2 | Oxirane, (butoxymethyl)- (TSCA, AICS, SWISS, PICCS, ASIA-PAC, NZIoC); oxyde de butyle et de 2,3époxypropyle (EINECS) butylglycidylether (ENCS); n-butyl glycidyl ether (ENCS, PICCS); (butoxymethyl)oxirane (ECL); butyl glycidyl ether (PICCS); normal butyl glycidyl ether (PICCS) |
| Autres noms | (±)-Butyl glycidyl ether;1butoxy-2,3-epoxypropane; 1butyl glycidyl ether; 2,3-epoxypropyl butyl ether;2-(butoxymethyl)oxirane;3-butoxy-1,2-epoxypropane; BGE; BGE-C; BGE-R; DYBP; DY-BP (epoxide); Epi-Rez 501; Epodil 741; Epodil 741HP; ERL 0810; glycidyl butyl ether; glycidyl n-butyl ether; N 10; N 10 (ether); NSC 83413; propane, 1butoxy-2,3-epoxy- |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Époxydes |
| Principale sous-classe chimique | Époxydes alkylés; éthers de glycidyle |
| Formule chimique | C7H14O2 |
| Structure chimique | |
| SMILES3 | O(C1COCCCC)C1 |
| Masse moléculaire | 130,185 g/mol |
| 1 LIS : Liste intérieure des substances. 2 National Chemical Inventories (NCI), 2008 : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique); ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). 3 SMILES : Simplified Molecular Input Line Entry. |
|
Les principales propriétés physiques et chimiques de l'oxyde de butyle et de 2,3époxypropyle sont décrites dans le tableau 2.
Tableau 2. Propriétés physiques et chimiques de l'oxyde de butyle et de 2,3époxypropyle
| Propriété | Type | Valeur | Cote† | Référence |
|---|---|---|---|---|
| † Cote qualitative relative du paramètre physico-chimique de la substance. | ||||
| Point de fusion (°C) | Modélisé | -30,96 | MPBPWIN, 2000 | |
| Point d'ébullition (°C) | Expérimental | 164 | Lewis, 2001 | |
| Masse volumique (g/mL à 25 °C) | Expérimental | 0,908 | Lewis, 2001 | |
| Pression de vapeur (Pa à 25 °C) | Expérimental | 427 (3,2 mm Hg) |
Élevée | Lewis, 2001 |
| Constante de la loi de Henry (Pa·m3/mol) | Modélisé (méthode de liaison) | 0.443 (4,37 x 10-6 atm·m3/mol) |
Modérée | HENRYWIN, 2000 |
| Solubilité dans l'eau (mg/L à 20 °C) | Expérimental | 20 000 | Très élevée | Bingham et al., 2001 |
| Log Koe (coefficient de partage octanol/eau) [sans dimension] | Expérimental | 0,63 | Faible | Hansch et al., 1995 |
| Log Kco (coefficient de partage carbone organique) [sans dimension] | Modélisé | 1,09-1,16 | Très faible | KOCWIN, 2009 |
Aucun renseignement indiquant que l'oxyde de butyle et de 2,3-époxypropyle serait naturellement présent dans l'environnement n'a été relevé. Cette substance est produite par la condensation de l'épichlorhydrine et de l'alcool n-butylique afin de former une chlorhydrine intermédiaire, qui est ensuite déshydrochlorée pour former un groupe époxyde (NTP, 2004; Bosch et al., 1985).
L'oxyde de butyle et de 2,3-époxypropyle peut être libéré dans l'environnement par des émissions d'installations industrielles produisant, manipulant ou utilisant des résines, des revêtements et des adhésifs à base d'époxy.
Selon les renseignements transmis conformément à l'article 71 de la LCPE(1999), aucune entreprise canadienne n'a déclaré avoir fabriqué en 2006 de l'oxyde de butyle et de 2,3-époxypropyle en une quantité égale ou supérieure au seuil de 100 kg. Toutefois, 10 000 à 100 000 kg ont été importés au Canada en 2006 (Environnement Canada, 2008).
L'oxyde de butyle et de 2,3-époxypropyle est classé comme produit chimique produit en grandes quantités aux États-Unis. Les volumes produits et/ou importés cumulés aux États-Unis en 2006 sont compris entre 1 million et 10 millions de livres (US EPA, 2008a), soit entre 454 et 4 536 tonnes métriques.
L'oxyde de butyle et de 2,3-époxypropyle est employé comme diluant réactif des résines époxydes, produit chimique intermédiaire ou accepteur d'acide pour stabiliser les solvants chlorés (NTP, 2004; Bingham et al., 2001). Le diluant réactif agit dans les systèmes en résine époxyde en tant qu'agent de réduction de la viscosité, permettant une manipulation plus facile de la résine non traitée (Lee, 1989; Bosch et al., 1985). En raison de la présence du groupe époxyde fonctionnel, l'oxyde de butyle et de 2,3-époxypropyle participe à la polymérisation et aux réactions de réticulation, créant une liaison covalente au réseau époxyde au cours du traitement (Hamerton, 1996; Lee, 1989; Bosch et al.,1985).
Selon les renseignements présentés en application de l'article 71 de la LCPE(1999), l'oxyde de butyle et de 2,3-époxypropyle est employé au Canada dans la formulation des résines époxydes, lesquelles sont utilisées comme revêtements, adhésifs, liants, produits d'étanchéité, bouche-pores et résines (Environnement Canada, 2008). Une faible quantité (2 kg d'oxyde de butyle et de 2,3-époxypropyle) soit importée en tant qu'impureté dans un agent de conservation pour les peintures (Environnement Canada, 2008). La substance n'est pas un ingrédient actif et n'entre pas dans la composition des produits antiparasitaires homologués au Canada, mais elle peut être présente comme impureté de formulant (PMRA 2009).
L'oxyde de butyle et de 2,3-époxypropyle n'a pas été enregistré dans le Système de déclaration des cosmétiques et n'est donc pas délibérément incorporé dans des cosmétiques (SDC, 2009); toutefois, cette substance n'est actuellement pas répertoriée dans la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques établie par Santé Canada. Son utilisation dans les produits cosmétiques n'est donc pas interdite (Santé Canada, 2009a). Cependant, la Commission européenne a classé cette substance dans l'annexe II de la liste des substances et ingrédients cosmétiques, indiquant que la substance ne doit pas entrer dans la composition des produits cosmétiques dans l'Union européenne (CosIng, 2009).
Au Canada, l'oxyde de butyle et de 2,3-époxypropyle n'est pas répertorié dans la Base de données sur les produits pharmaceutiques, la Base de données sur les ingrédients des produits de santé naturels ou la Base de données des produits de santé naturels homologués (Santé Canada, 2009b; Santé Canada, 2009c). De même, son utilisation dans les produits thérapeutiques n'a pas été signalée en application de l'article 71 (Environnement Canada, 2008); il est donc peu probable que cette substance se retrouve dans des produits pharmaceutiques ou de santé naturels. La Direction générale des produits de santé et des aliments de Santé Canada a indiqué que l'oxyde de butyle et de 2,3-époxypropyle est peu susceptible d'être utilisé dans les conditionnements alimentaires actuels (courriel envoyé en 2009 par la Direction des aliments au Bureau d'évaluation des risques, source non citée dans les références).
Le Règlement sur les produits contrôlés établi en vertu de la Loi sur les produits dangereux exige que cette substance soit déclarée sur la fiche technique santé/sécurité qui doit accompagner les substances chimiques sur les lieux de travail lorsqu'elles sont présentes à une concentration égale ou supérieure à 0,1 %, conformément aux instructions de la Liste de divulgation des ingrédients (Santé Canada, 2009d).
L'oxyde de butyle et de 2,3-époxypropyle n'est pas fabriqué en quantités justifiant leur déclaration au Canada; toutefois, certaines installations industrielles qui traitent, manipulent ou stockent du matériau importé peuvent émettre des rejets dans l'environnement. Les renseignements obtenus aux termes de l'article 71 de la LCPE(1999) indiquent que la quantité de rejets de cette substance dans l'air par les importateurs canadiens s'est établie dans une fourchette de 100 à 1 000 kg en 2006 (Environnement Canada, 2008). Aucun rejet dans l'eau ou le sol n'a été rapporté (Environnement Canada, 2008).
Quant à l'exposition provenant de sources environnementales, aucune donnée de surveillance environnementale canadienne n'a été relevée. L'oxyde de butyle et de 2,3époxypropyle n'est pas déclarable à l'Inventaire national des rejets de polluants (INRP, 2007); aucun renseignement sur les rejets ne peut donc être obtenu de cette source.
D'après les propriétés physiques et chimiques de l'oxyde de butyle et de 2,3époxypropyle (tableau 2), les résultats de la modélisation de la fugacité de niveau III (tableau 3) semblent indiquer que cette substance devrait demeurer principalement dans le milieu dans lequel elle est rejetée.
Tableau 3. Résultats du modèle de fugacité de niveau III (EQC, 2003) de l'oxyde de butyle et de 2,3-époxypropyle
| Substance rejetée dans : | Fraction de la substance se répartissant dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 64 | 17 | 19 | 0,0 |
| l'eau (100 %) | 0,0 | 99,8 | 0,0 | 0,2 |
| le sol (100 %) | 0,0 | 20,0 | 80,0 | 0,0 |
Le tableau 4a présente les données empiriques sur la dégradation de l'oxyde de butyle et de 2,3-époxypropyle.
Tableau 4a. Données empiriques sur la dégradation de l'oxyde de butyle et de 2,3époxypropyle
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre et unités de la dégradation | Référence |
|---|---|---|---|---|
| Eau | Biodégradation | 40 | Biodégradation, % | MITI, 2002 |
| Eau | Biodégradation | 25 | Biodégradation, % | US EPA, 2008b |
| Eau | Biodégradation | 4 et 12 | Biodégradation, % | US EPA, 2008b |
| Eau | Hydrolyse | 20,3 | Demi-vie, jours | IUCLID, 2006 |
L'étude du MITI (2002) indique un taux de biodégradation de 40 % sur 28 jours au cours d'un essai de biodégradation immédiate de l'oxyde de butyle et de 2,3-époxypropyle. Compte tenu d’une cinétique de dégradation du premier ordre, la demi-vie estimée dans l'eau est d'environ 38 jours, ce qui indiquerait que l'oxyde de butyle et de 2,3-époxypropyle n'est pas persistant dans l'eau.
Deux études de dégradation supplémentaires ont été citées dans un sommaire de rigueur d'étude élaboré par l'Environmental Protection Agency (US EPA, 2008b). Durant un essai en fiole fermée (directive d’essai 301D de l’Organisation de coopération et de développement économiques [OCDE]), l'oxyde de butyle et de 2,3-époxypropyle est oxydé à hauteur de 25 % de la demande théorique d'oxygène au jour 28, ce qui indique que la substance est partiellement biodégradable. En supposant une cinétique de dégradation de premier ordre, la demi-vie prévue dans l'eau selon ce résultat serait d'environ 70 jours. Au cours d'un essai Sturm modifié (directive d’essai 301B de l’OCDE), 4 % et 12 % de la formation de dioxyde de carbone théorique possible ont été observés, ce qui amène les auteurs de l'étude à conclure à l'absence de preuve de biodégradabilité. Il existe des incertitudes concernant les faibles résultats empiriques de biodégradation, qui pourraient être dus à la volatilisation. La consultation détaillée des études d'origine est impossible, car seul le sommaire de rigueur d'étude établi par l'Environmental Protection Agency des États-Unis (US EPA, 2008b) est disponible.
Une étude visant à déterminer le taux approximatif d'hydrolyse de l'oxyde de butyle et de 2,3-époxypropyle indique une demi-vie d'hydrolyse de 20,3 jours (486,7 heures) à 20 °C et à pH 7. Le taux d'hydrolyse diminue lorsque le pH augmente (IUCLID, 2006). D'après ces résultats, l'hydrolyse serait un processus important régissant le devenir de cette substance dans l’environnement. Bien que les produits de l'hydrolyse ne soient pas connus, ils devraient être plus solubles dans l'eau et moins bioaccumulables que la substance elle-même.
En raison du peu de données expérimentales sur la dégradation de l'oxyde de butyle et de 2,3-époxypropyle, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) [Environnement Canada, 2007] a également été utilisée. Les résultats de ces modèles de dégradation sont indiqués dans le tableau 4b. Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et que l'oxyde de butyle et de 2,3-époxypropyle peut être libéré dans ce milieu, la biodégradation a été principalement étudiée à l'aide de modèles prédictifs RQSA pour la biodégradation.
Tableau 4b. Données modélisées sur la dégradation de l'oxyde de butyle et de 2,3-époxypropyle
| Processus du devenir | Résultat et prévision du modèle | Demi-vie extrapolée (jours) | Modèle et base du modèle |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade and Industry, Japon; s.o., sans objet; t½, demi-vie. 1 Le modèle ne précise pas d'estimation pour ce type de structure. 2 Le résultat s'exprime par une valeur numérique. 3 Le résultat s'exprime par un taux de probabilité. |
|||
| Air | |||
| Oxydation atmosphérique | t½ = 0,54 jour | < 2 | AOPWIN, 2000 |
| Réaction avec l'ozone | s.o.1 | s.o. | AOPWIN, 2000 |
| Eau | |||
| Biodégradation (aérobie) | 3,192 « semaines » |
< 182 | BIOWIN, 2000 Sous-modèle 3 : enquête d'expert (biodégradation ultime) |
| Biodégradation (aérobie) | 3,912 « jours » |
< 182 | BIOWIN, 2000 Sous-modèle 4 : enquête d'expert (biodégradation primaire) |
| Biodégradation (aérobie) | 0,563 « se biodégrade rapidement » |
< 182 | BIOWIN, 2000 Sous-modèle 5 : MITI, probabilité linéaire |
| Biodégradation (aérobie) | 0,603 « se biodégrade rapidement » |
< 182 | BIOWIN, 2000 Sous-modèle 6 : MITI, probabilité non linéaire |
| Biodégradation (aérobie) | 1,03 « se biodégrade rapidement » |
< 182 | TOPKAT, 2004 probabilité |
| Biodégradation (aérobie) | % DBO = 60 « se biodégrade rapidement » |
< 182 | CATABOL ©2004-2008 % DBO |
Une demi-vie d'oxydation atmosphérique dans l'air de 0,54 jour (voir le tableau 4b) démontre que cette substance est susceptible de s'oxyder rapidement. Cette substance ne devrait pas réagir dans l'atmosphère avec d'autres espèces photo-oxydantes, comme l'ozone, et elle ne devrait pas se dégrader par photolyse directe. Des réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus régissant le devenir de la substance dans l'atmosphère. Étant donné la demi-vie estimée de 0,54 jour, l'oxyde de butyle et de 2,3-époxypropyle est considéré comme non persistant dans l'air.
Les résultats des modèles indiquent que la biodégradation est rapide. Les quatre modèles de biodégradation immédiate – sous-modèles BIOWIN 5 et 6 (BIOWIN, 2000), CATABOL (c2004-2008) et TOPKAT (2004) – indiquent une demi-vie de dégradation ultime d’au plus 182 jours. Les résultats des sous-modèles BIOWIN 3 et 4 (BIOWIN, 2000) montrent que la substance subit sa dégradation primaire et sa dégradation ultime probablement en moins de 182 jours. Les prévisions de CATABOL (c2004-2008) et TOPKAT (2004) sont similaires à celles des deux modèles (et indiquent une biodégradation rapide). Les modèles tendent donc à indiquer que la demi-vie de dégradation ultime (et par conséquent primaire) est bien inférieure à 182 jours.
Les résultats détaillés des études de dégradation expérimentales ci-dessus divergent; l'une des études indiquant une dégradation ultime relativement rapide (MITI, 2002) alors que les autres font état d'une biodégradabilité partielle voire négligeable (US EPA, 2008b). Les résultats contradictoires des études empiriques seraient en partie dus à la volatilité élevée de la substance. Il est donc difficile de tirer des conclusions quant à la dégradabilité uniquement à partir des données empiriques sur la dégradation ultime. Toutefois, étant donné que les données expérimentales indiquent une hydrolyse relativement rapide (ECB, 2006) et que l'ensemble des modèles prévoient une dégradation ultime rapide, l'oxyde de butyle et de 2,3-époxypropyle devrait généralement avoir une demivie de biodégradation primaire (et probablement ultime) dans l'eau inférieure à 182 jours selon la méthode du poids de la preuve.
D’après un ratio d'extrapolation de 1 : 1 : 4 pour extrapoler la demi-vie de biodégradation dans l'eau, le sol et les sédiments (Boethling et al., 1995) et une demi-vie de dégradation ultime d'environ 38 jours dans l'eau (MITI, 2002), on estime que la demi-vie dans le sol est inférieure à 182 jours et que celle dans les sédiments est inférieure à 365 jours. L'oxyde de butyle et de 2,3-époxypropyle n'est donc pas censé être persistant dans le sol ou les sédiments.
L'oxyde de butyle et de 2,3-époxypropyle ne répond donc pas aux critères de la persistance dans l'air (demi-vie > 2 jours), l'eau et le sol (demi-vie > 182 jours), ou les sédiments (demi-vie > 365 jours), tels qu'ils sont définis dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La faible valeur expérimentale du log Koe pour l'oxyde de butyle et de 2,3-époxypropyle (voir le tableau 2 ci-dessus) indique que cette substance présente un faible potentiel de bioaccumulation dans les organismes.
Faute de données expérimentales disponibles sur les facteurs de bioaccumulation (FBA) et de bioconcentration (FBC) de l'oxyde de butyle et de 2,3-époxypropyle, une méthode prédictive a été appliquée au moyen des modèles de FBA et de FBC disponibles. Les résultats sont présentés au tableau 5.
Tableau 5. FBA et FBS prévus pour l'oxyde de butyle et de 2,3-époxypropyle chez les poissons au moyen du modèle cinétique d’Arnot et de Gobas (2003) sans le métabolisme
| Organisme d'essai | Log Koe | Paramètre | Valeur en poids humide (L/kg) | Référence |
|---|---|---|---|---|
| Poissons | 0,63 | FBA | 1,173 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBA) |
| Poissons | 0,63 | FBC | 1,173 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBC) |
| Poissons | 0,63 | FBC | 3,162 | BCFWIN, 2000 |
Le modèle modifié de FBA de Gobas pour le niveau trophique intermédiaire chez le poisson a estimé le facteur de bioaccumulation à 1,173 L/kg, ce qui indique que l'oxyde de butyle et de 2,3-époxypropyle ne présente pas de potentiel significatif de bioconcentration chez les poissons ou de bioamplification dans les réseaux trophiques. Les résultats des calculs du modèle de FBC fournissent une preuve additionnelle qui appuie le faible potentiel de bioconcentration de cette substance. Si l'on se fonde sur les valeurs empiriques et sur celles obtenues par modélisation cinétique, l'oxyde de butyle et de 2,3époxypropyle ne répond pas au critère de la bioaccumulation (FBC/FBA = 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
La démarche suivie dans cette évaluation consistait à examiner les divers renseignements scientifiques existants et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE(1999). Les éléments de preuve pris en compte comprenaient les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Comme il est décrit précédemment, l'oxyde de butyle et de 2,3-époxypropyle a des demi-vies relativement courtes dans tous les milieux. Il devrait également présenter un faible potentiel de bioaccumulation. Les volumes moyens d'oxyde de butyle et de 2,3époxypropyle importés au Canada et les informations relatives à son utilisation n'indiquent pas de risque de rejet massif dans l'environnement au Canada. Une fois rejetée dans l'environnement, la substance tend à rester dans le milieu où elle a été rejetée.
Des données expérimentales et modélisées concernant les effets de cette substance sur l'environnement sont disponibles; la valeur expérimentale la plus faible a été utilisée pour estimer la toxicité potentielle pour les organismes aquatiques. Les tableaux 6a et 6b présentent les valeurs expérimentales et prévues concernant l'écotoxicité qui ont été jugées fiables et qui ont été utilisées avec la méthode du poids de la preuve pour la toxicité aquatique (Environnement Canada, 2007). Les données expérimentales et modélisées concordent bien. Les valeurs de la concentration efficace médiane et de la concentration létale médiane aiguë (CL50/CE50) varient entre 3,9 et 65 mg/L, en comparaison aux données de modèles qui varient entre 3,7 et à moins de 967 mg/L, ce qui indique que l'oxyde de butyle et de 2,3époxypropyle devrait représenter un danger faible à modéré pour les organismes aquatiques.
Tableau 6a : Données empiriques sur la toxicité de l'oxyde de butyle et de 2,3époxypropyle pour les organismes aquatiques
| Organisme d’essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50, concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50, concentration d’une substance qu’on estime létale pour 50 % des organismes d’essai. | ||||
| Salmo gairdneri | Toxicité aiguë | CL50 après 96 heures | 65 | US EPA, 2008a |
| Daphnia magna | Toxicité aiguë | CE50 après 48 heures | 3,9 | US EPA, 2008a |
| CE50 après 24 heures | 22 | US EPA, 2008a | ||
| Pseudokirchneriella subcapitata | Toxicité aiguë | CE50 (croissance) après 96 heures | 35 | US EPA, 2008a |
Tableau 6b. Données modélisées sur la toxicité pour les organismes aquatiques
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50, concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50, concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai. 1 Valeurs ECOSAR basées sur la classe SAR de monoépoxyde |
||||
| Poissons | Toxicité aiguë (14 jours) | CL50 | 27,61 | ECOSAR, 2004 |
| Poissons | Toxicité aiguë (96 h) | CL50 | 41,161 | ECOSAR, 2004 |
| Poissons | Toxicité aiguë (96 h) | CL50 | <967,81 | OASIS Forecast, 2005 |
| Poissons | Toxicité aiguë (96 h) | CL50 | 125 | AIES, 2003-2005 |
| Daphnies | Toxicité aiguë (48 h) | CE50 | 97,22 | AIES, 2003-2005 |
| Daphnies | Toxicité aiguë (48 h) | CE50 | 3,7 | TOPKAT, 2004 |
| Algues | Toxicité aiguë (48 h) | CE50 | 137,051 | ECOSAR, 2004 |
Étant donné l'utilisation de l'oxyde de butyle et de 2,3-époxypropyle dans l'industrie, des rejets dans l'eau sont possibles. Un scénario générique a donc été établi à l'aide de l'outil d'exposition générique industriel – milieu aquatique (Industrial Generic Exposure Tool – Aquatic, ou IGETA) d'Environnement Canada afin d'estimer la concentration d'oxyde de butyle et de 2,3-époxypropyle résultant d'un rejet industriel. La concentration environnementale estimée (CEE) de 0,0021 mg/L se base sur la quantité maximale utilisée dans une installation, la fraction rejetée vers une usine de traitement des eaux usées, le taux d'élimination et le débit d'effluents de cette usine ainsi que la capacité de dilution (supposée faible) des eaux réceptrices. Les paramètres principaux entrant dans l'estimation de la CEE incluent une perte estimée à 0,25 % dans les eaux usées au cours de la fabrication ou de la manipulation. Les détails des éléments utilisés pour l'estimation de cette concentration et les résultats du modèle sont décrits dans le rapport d'Environnement Canada de 2009.
Une valeur prudente de la concentration estimée sans effet (CESE) a également été déterminée à partir de la plus faible valeur empirique de toxicité : une CE50 aiguë de 3,9 mg/L pour les daphnies. Cette valeur, choisie comme valeur critique de la toxicité, a été divisée par un facteur d'évaluation de 100 afin de tenir compte des incertitudes liées aux variations de sensibilité interspécifique et intraspécifique et à l'extrapolation d'une CE50 estimée à une valeur sans effet sur le terrain. La CESE obtenue était de 0,037 mg/L.
Le quotient de risque prudent (CEE/CESE) de 0,057 ainsi calculé indique que les concentrations dans l'environnement estimées seraient trop faibles pour avoir des effets nocifs sur les organismes aquatiques. Les résultats de la modélisation de fugacité indiquent qu'en cas de rejet dans l'eau, la plus grande partie de la substance reste dans ce milieu. L'exposition des organismes à d'autres types d’emplacement ou dans d'autres milieux que l'eau est moins probable. Selon l'information diffusée aux termes de l'article 71, bien que des rejets dans l'air soient possibles, la forte capacité de dilution de l'air rend peu probable la nocivité de la substance.
À la lumière des renseignements disponibles, il est donc improbable que l'oxyde de butyle et de 2,3-époxypropyle cause des effets nocifs sur l’environnement au Canada. Cette conclusion a été formulée malgré les incertitudes liées au manque de données empiriques sur les concentrations dans l'environnement au Canada. Les concentrations dans l'eau ont été modélisées sur la base d'hypothèses prudentes. Il existe également des incertitudes liées aux CESE utilisées pour le calcul du quotient de risque, notamment en raison de la quantité limitée de données empiriques relatives à la toxicité. Ce problème a été en partie résolu en divisant la valeur critique de la toxicité par un facteur d'évaluation.
Des incertitudes sont également liées à l'utilisation des modèles QSAR pour estimer les propriétés de l'oxyde de butyle et de 2,3-époxypropyle (p. ex. persistance et potentiel de bioaccumulation). Cependant, étant donné que la composition structurelle de la substance était couverte par les domaines des modèles et que les différents modèles QSAR utilisés ont donné des résultats uniformes, les conclusions tirées sont jugées crédibles et comparables aux prévisions pour cette structure relativement simple. Le fait que l'oxyde de butyle et de 2,3-époxypropyle est une substance à faible masse moléculaire sans groupe fonctionnel extrême qui ne peut pas être traitée par le modèle et que les monoépoxydes ont été utilisés dans le modèle ECOSAR constitue une preuve supplémentaire de la crédibilité des valeurs de QSAR.
Évaluation de l'exposition
Aucune concentration mesurable d'oxyde de butyle et de 2,3-époxypropyle dans l'air, l'eau ou le sol n'a été relevée. Les estimations modélisées de l'exposition environnementale, basées sur les quantités rejetées les plus élevées déclarées conformément à l'avis publié récemment en application de l'article 71 (Environnement Canada, 2008), prévoient des concentrations d'oxyde de butyle et de 2,3-époxypropyle faibles dans l'air et dans l'eau, respectivement d'environ 0,8 ng/m3 et 0,5 ng/L (ChemCAN, 2003). Les concentrations prévues dans le sol et les sédiments sont estimées à moins de 10-3 ng/g (ChemCAN, 2003). Les estimations de la limite supérieure de l'absorption par la population générale par le biais de tous les milieux environnementaux, basées sur ces concentrations prévues, sont donc très basses (c.-à-d. inférieures à
10-3 µg/kg p.c./j).
Une seule étude mesurant la quantité d'oxyde de butyle et de 2,3-époxypropyle dans l'environnement a été relevée. Clark et al. (1991) ont analysé les polluants semi-volatils dans les effluents de trois usines de traitement des eaux usées de l'État du New Jersey. Trois jeux d'échantillons ont été prélevés pour chaque installation; à chaque prélèvement, trois échantillons de 15 L ont été recueillis et combinés sur place. Dans l'effluent de l'installation A, de l'oxyde de butyle et de 2,3-époxypropyle n'a été détecté que dans le troisième jeu d’échantillons, à une concentration estimée de 0,5 µg/L. L'n-oxyde de butyle et de 2,3-époxypropyle n'a été détecté ni dans les deux autres échantillons de l'installation A, ni dans les échantillons des installations B et C.
Au Canada, l'oxyde de butyle et de 2,3-époxypropyle est utilisé dans la production de résines époxydes qui ont des applications dans les revêtements, les adhésifs, les liants, les matériaux d'étanchéité, les bouche-pores et les résines (Environnement Canada, 2008). Toutefois, il n'entre dans la composition d'aucun produit de consommation identifié dans des documents publics repérés au cours d’une recherche approfondie, ni lors de la consultation de divers programmes de Santé Canada. L'Association canadienne de l'industrie de la peinture et des revêtements a déclaré que toutes les applications de revêtement utilisant l'oxyde de butyle et de 2,3-époxypropyle sont, à sa connaissance, industrielles (courriel envoyé en 2009 par l'Association canadienne de l'industrie de la peinture et des revêtements au Bureau d'évaluation des risques de Santé Canada; source non citée).
Aucune étude n'a été trouvée concernant les risques d'exposition à des résidus d'oxyde de butyle et de 2,3-époxypropyle de résines époxydes traitées. On suppose généralement que l'éther de glycidyl n'est plus présent dans le produit traité (CIRC, 1989). Le rapport d'évaluation de la sécurité des produits de la Dow Chemical portant sur les diluants réactifs fait état de « peu ou pas » d'éther de glycidyl inaltéré dans les produits finis (Dow, 2009). L'exposition à l'oxyde de butyle et de 2,3époxypropyle par le contact avec des époxydes traités est donc jugée négligeable.
Toutefois, l'oxyde de butyle et de 2,3-époxypropyle est présent en tant qu'impureté dans un agent de conservation utilisé pour le latex et les peintures oléorésineuses. Cet agent, qui peut contenir jusqu'à 4,2 % d'oxyde de butyle et de 2,3-époxypropyle (Environnement Canada, 2008), est ajouté aux peintures d'intérieur à hauteur de 0,8 % du poids total (courriel envoyé en 2009 par l'Agence de réglementation de la lutte antiparasitaire au Bureau d'évaluation des risques; source non citée dans les références), ce qui entraîne une concentration maximale de 336 ppm. Étant donné que seuls 2 kg de substance ont été importés à ces fins en 2006 (Environnement Canada, 2008), le nombre de personnes risquant d'être exposées à l'oxyde de butyle et de 2,3-époxypropyle par le biais de l'utilisation de ce produit est faible. Malgré le faible nombre de consommateurs potentiellement exposés, le logiciel de modélisation ConsExpo version 4.1 (RIVM, 2006) a été utilisé pour prévoir des estimations élevées de la concentration médiane dans l'air et de la dose dermique, respectivement de 6 mg/m3 et 0,02 mg/kg. Toutefois, étant donné la nature réactive de l'oxyde de butyle et de 2,3-époxypropyle, les quantités restant dans le produit utilisé par le consommateur final devraient être beaucoup plus faibles. De plus, vu la très faible quantité de substance importée en tant qu'impureté de ce type de produit, l'exposition massive de la population générale sur le territoire canadien est peu probable.
Cet agent de conservation a été détecté dans un produit de finition pour le bois, à une concentration plusieurs fois supérieure à celle présente dans les peintures d'intérieur; toutefois, le fabricant a indiqué que la formule de cette gamme de produits est sur le point d'être modifiée et que l’agent en question ne sera plus utilisé (courriel envoyé en 2009 par le Bureau de gestion des risques au Bureau d'évaluation des risques, source non citée dans les références).
Dans l'étude récemment publiée et intitulée « Initial Risk-Based Prioritization of High Production Volume Chemicals for n-butyl glycidyl ether », l'Environmental Protection Agency des États-Unis (US EPA) a qualifié d'élevé le risque d'exposition des consommateurs, d'après les données de la règle de mise à jour des inventaires (Inventory Update Rule, IUR) et l'utilisation de l'oxyde de butyle et de 2,3-époxypropyle dans les adhésifs et les produits d'étanchéité (US EPA, 2008a). Toutefois, cette qualification se base sur les volumes de production et sur les catégories d'utilisation générale, et non sur les produits spécifiques contenant cette substance (courriel envoyé en 2009 par la Chemical Control Division de l'EPA au Bureau d'évaluation des risques de Santé Canada; source non citée dans les références).
La caractérisation de l'exposition humaine se heurte à des incertitudes notables. En l'absence de données environnementales mesurées, des estimations de l'exposition ont été établies à partir des quantités maximales rejetées dans l'environnement par les installations industrielles. La base de données d'exposition correspondante est jugée peu fiable. Malgré la quantité très limitée de données, la nature réactive du groupe oxirane, l'application principale dans les époxydes traités où l'oxyde de butyle et de 2,3époxypropyle intervient dans des réactions de réticulation, ainsi que l'estimation très faible de l'absorption quotidienne laissent à penser que l'exposition de la population générale devrait être faible.
Évaluation des effets sur la santé
L'annexe 2 comporte un résumé des renseignements disponibles relatifs aux effets de l'oxyde de butyle et de 2,3-époxypropyle sur la santé.
La Commission européenne a classé l'oxyde de butyle et de 2,3-époxypropyle dans la catégorie 3 pour la cancérogénicité (substances préoccupantes pour l'homme en raison d'effets cancérogènes possibles) et également dans la catégorie 3 pour la mutagénicité (substances préoccupantes pour l'homme en raison de la possibilité d'effets irréversibles; ESIS, 2009). En raison du manque de données à long terme pour l'oxyde de butyle et de 2,3époxypropyle, la classification de cancérogénicité de la Commission européenne repose à la fois sur les données de génotoxicité de la substance évaluées selon la méthode du poids de la preuve et sur les données de cancérogénicité de l'analogue structurel qu'est l'oxyde d'allyle et de glycidyle. La classification de la mutagénicité se base essentiellement sur les résultats positifs de tests du micronoyau in vivo.
Pour cette évaluation, les données de plusieurs substances analogues (annexe 3) ont été étudiées afin de mieux comprendre les effets possibles sur la santé de l'exposition à l'oxyde de butyle et de 2,3-époxypropyle. L'utilisation de substances analogues comme substituts a été adoptée par plusieurs agences de réglementation nationales et internationales. Les responsables du programme HPV Challenge de l'EPA américaine, de la réglementation REACH de l'Agence européenne des produits chimiques et du programme HPV Chemicals de l'OCDE ont tous établi des documents de référence concernant cette approche. L'approche adoptée dans la présente évaluation correspond aux principes généraux décrits par les autorités susmentionnées, soit la sélection des analogues chimiques inclus dans ce rapport qui repose sur la présence du groupement fonctionnel (d'éthers) de glycidyle et d'autres similarités structurelles, sur les propriétés physiques et chimiques, sur la disponibilité des données de cancérogénicité et sur leur identification comme analogue à l'oxyde de butyle et de 2,3-époxypropyle par différentes agences de réglementation. C'est pourquoi certains analogues structurels tels que l'oxyde de tert-butyle et de glycidyle, n'ont pas été pris en compte en raison d'un manque de données relatives à la cancérogénicité. Le groupement (d'éthers) de glycidyle a été considéré comme le critère le plus important dans l'évaluation du potentiel cancérogène en raison de la présence de l'anneau époxyde. Les époxydes sont des agents alkylants qui peuvent interagir avec l'ADN (NTP, 2004); ils peuvent donc être impliqués dans le risque de cancérogénicité de l'oxyde de butyle et de 2,3-époxypropyle.
Bien que l'oxyde d'allyle et de glycidyle soit le seul substitut utilisé par la Commission européenne pour la classification de l'oxyde de butyle et de 2,3-époxypropyle et soit considéré comme la substance la plus proche pour laquelle des données de cancérogénicité sont disponibles, d'autres substances (telles que le glycidol, l'éther de phényle et de glycidyle et l'éther de bisphénol A et de diglycidyle) ont également été prises en compte dans cette évaluation, afin d'étayer les preuves relatives à la cancérogénicité. Une brève présentation des données de cancérogénicité et de génotoxicité de ces substances est proposée ci-après et détaillée à l'annexe 4.
La base de données de cancérogénicité pour l'oxyde d'allyle et de glycidyle se limite à une étude par inhalation sur deux ans, au cours de laquelle des rats et des souris mâles et femelles ont été exposés à 0, 23 ou 47 mg/m3 (NTP, 1990a). Les auteurs de l'étude ont conclu à une preuve équivoque de cancérogénicité chez les rats Osborne-Mendel mâles, à certaines indications chez les souris B6C3F1 mâles et à une preuve équivoque chez les souris B6C3F1 femelles, étayées par la présence de différents types de tumeurs nasales. Bien que les incidences des tumeurs primaires ne soient pas statistiquement significatives, elles ont été considérées comme telles d'un point de vue biologique, en raison du fait que les tumeurs nasales primaires sont rares chez les rongeurs; de plus, la néoplasie a été précédée ou accompagnée de lésions non néoplasiques et des lésions pré-néoplasiques ont été observées chez les souris exposées.
En ce qui concerne le glycidol, la cancérogénicité est plus évidente, car il a induit des tumeurs dans de nombreux tissus différents et chez plusieurs espèces exposées par administration orale. Des rats et souris mâles et femelles ont été exposés à 0, 37,5 ou 75 mg/kg p.c./j (rats) et 0, 25 ou 50 mg/kg p.c./j (souris) de glycidol par gavage pendant deux ans (NTP, 1990b). L'étude a fourni des preuves manifestes de cancérogénicité chez les mâles et les femelles des deux espèces, en raison de l'observation de plusieurs lésions néoplasiques dans différents tissus incluant l'utérus, la tunique vaginale, le gland du clitoris, la glande de Harder, les glandes mammaires, le cerveau, la muqueuse buccale, le secteur gastrique antérieur, l'intestin, le foie, les poumons, la peau, les tissus sous-cutanés, le sang, la glande de Zymbal et la glande thyroïde. Dans une étude menée sur des souris haploïdes semi-dominantes génétiquement modifiées, les animaux ont été exposés à 0, 25, 50, 100 ou 200 mg/kg p.c./j de glycidol par gavage pendant 40 semaines (NTP, 2007). Les auteurs ont conclu à une indication claire de cancérogénicité chez les mâles, à la suite de l'observation de sarcomes histiocytaires, et à des indications de cancérogénicité chez les femelles, à la suite de l'observation d'adénomes bronchiolo-alvéolaires. Le nombre élevé d'adénomes bronchiolo-alvéolaires chez les mâles et de papillomes du secteur gastrique antérieur chez les femelles a également été considéré comme lié à l'administration de glycidol. Au cours d'une étude où des hamsters ont été exposés à 100 mg/kg p.c./j par gavage pendant 60 semaines, des tumeurs ont été observées dans la rate, la corticosurrénale, le secteur gastrique antérieur ainsi que l'utérus et le col utérin (Lijinski, 1992). Les auteurs ont précisé que les tumeurs de la corticosurrénale sont courantes chez cette espèce de hamster, mais que les hémangiomes et hémangiosarcomes de la rate sont très rares. Toutefois, aucune augmentation de tumeurs ou lésions cutanées n'a été observée chez les souris exposées à une solution de glycidol à 5 % appliquée sur la peau pendant 520 jours (Van Duuren, 1967).
Au cours de la seule étude de cancérogénicité recensée pour l'éther de phényle et de glycidyle, des rats ont été exposés à 0, 6 ou 74 mg/m3 pendant 24 mois par inhalation (Lee, 1983). Des tumeurs nasales liées à cette exposition ont été observées uniquement pour la concentration la plus élevée (signification statistique non précisée). Une augmentation du nombre de rhinites et de métaplasies squameuses a également été observée pour la concentration de 74 mg/m3; elle est estimée liée aux tumeurs nasales.
Concernant l'éther de bisphénol A et de diglycidyle (BADGE), la plupart des études de cancérogénicité ont été réalisées sur des résines de classe commerciale. Une seule étude a été réalisée sur du BADGE pur. Des souris ont été exposées à une solution de BADGE à 0, 1 ou 10 % par application cutanée pendant 2 ans (Peristianis, 1988). Bien que des tumeurs aient été observées sur le site d'application et ailleurs, leur nombre n'est pas statistiquement significatif. Une tendance marquée au développement de lymphosarcomes thymiques chez les femelles a été observée. Toutefois, les auteurs ont souligné une incidence sous-jacente relativement importante de néoplasies lymphoréticulaires et hématopoïétiques pour cette souche particulière dans le laboratoire, qui a pu être causée par une infection virale.
Bien qu'aucun essai biologique de cancérogénicité n'ait été effectué sur l'oxyde de butyle et de 2,3-époxypropyle, la substance a été soumise à un ensemble de tests de génotoxicité à court terme, dont plusieurs ont eu des résultats positifs. In vivo, la substance a induit des aberrations chromosomiques et la formation de micronoyaux chez les souris exposées par injection intrapéritonéale, bien qu'elle n'ait pas causé de formation de micronoyaux lorsqu'elle a été administrée par voie orale. L'oxyde de butyle et de 2,3époxypropyle a également entraîné des mutations létales dominantes chez les souris, à l'exception d'un essai au cours duquel le taux de mortalité fœtale était élevé chez les groupes témoins. L'oxyde de butyle et de 2,3-époxypropyle a également donné des résultats positifs dans un certain nombre d'essais de génotoxicité in vitro. Des mutations inverses ont été observées dans plusieurs souches (et non la totalité) de Salmonella typhimurium avec et sans activation. Les tests sur l'urine et les essais par passage sur hôte ont donné des résultats négatifs. Toutefois, l'oxyde de butyle et de 2,3-époxypropyle a induit des mutations dans des cellules de lymphome de souris, des cellules de hamster chinois et des lymphocytes de sang périphérique humain.
Les résultats des tests de génotoxicité pour les substances analogues estimées pertinentes sont résumés à l'annexe 4. Il existe donc des preuves convaincantes de la génotoxicité de l'éther d'allyle et de glycidyle et du glycidol, avec des résultats comparables à ceux obtenus avec l'oxyde de butyle et de 2,3-époxypropyle, alors que l'éther de phényle et de glycidyle et le BADGE semblent faiblement génotoxiques.
Afin de fournir des informations plus précises quant au risque de cancérogénicité de l'oxyde de butyle et de 2,3-époxypropyle, des modèles RQSA ont été utilisés dans le but de prévoir la toxicité de la substance et des substances considérées comme analogues. Les prévisions pour toutes les substances sont généralement similaires; en effet, CASETOX, DEREK et TOPKAT indiquent une génotoxicité probable/plausible pour l'oxyde de butyle et de 2,3-époxypropyle et ses analogues, en raison de la présence de la fraction d'éther de glycidyle (TOPKAT, 2004; CASETOX, 2008; DEREK, 2008), ce qui correspond aux données empiriques disponibles. Concernant les estimations de la cancérogénicité, le modèle DEREK estime que l'oxyde de butyle et de 2,3-époxypropyle et ses analogues sont des cancérogènes plausibles; les estimations de CASETOX sont essentiellement positives, alors que celles de TOPKAT sont négatives. Bien que différents modèles puissent donner des résultats différents pour une substance (principalement en raison des différentes hypothèses et jeux de données du modèle), la similarité des estimations de chaque modèle pour ce groupe de composés permet de définir l'éther d'allyle et de glycidyle, le glycidol, l'éther de phényle et de glycidyle et le BADGE comme analogues pour l'évaluation du risque de cancérogénicité de l'oxyde de butyle et de 2,3-époxypropyle.
Bien que le mode d'action sur le développement de tumeurs des analogues de l'oxyde de butyle et de 2,3-époxypropyle n'ait pas été clairement défini, le potentiel d'interaction de l'anneau époxyde présent dans le groupe de glycidyles avec l'ADN suggère un mécanisme de cancérogénicité génotoxique. La possibilité que l'oxyde de butyle et de 2,3époxypropyle ait une action cancérogène directe est étayée par les données de génotoxicité disponibles.
L'oxyde de butyle et de 2,3-époxypropyle a également induit des effets non néoplasiques chez les animaux soumis aux expériences, notamment une irritation et une sensibilisation de la peau. L'exposition des yeux de lapins à la substance non diluée a entraîné des conjonctivites et des dommages oculaires graves (Rhone-Poulenc, 1973). De même, l'application cutanée d'oxyde de butyle et de 2,3-époxypropyle pur ou dilué (solutions à 1 ou 25 %) a entraîné un érythème léger à modéré chez les lapins et les cobayes (RhonePoulenc, 1973; Reichold Chem. Co., 1978).
Au cours de plusieurs études, des tests de sensibilisation ont été effectués sur des cobayes (Weil et al., 1963; Ciba-Geigy, 1977; Reichold Chem. Co., 1978); tous ces tests ont démontré une sensibilisation chez la majorité des animaux après exposition à la substance diluée (solutions à 0,1 % jusqu'à 25 %) par voie intracutanée ou par application d’un timbre suivie d'une dose déclenchante.
Plusieurs études se sont également intéressées aux réactions allergiques chez l'humain, principalement chez les ouvriers exposés dans le cadre de leur profession. Le taux de réponse était généralement inférieur à celui constaté chez l'animal, le taux de réactions allergiques positives allant de 0/343 à 3/20.
Bien qu'aucune étude à long terme n'ait été répertoriée, la toxicité de l'oxyde de butyle et de 2,3-époxypropyle a été abordée dans un petit nombre d'études à court terme. Au cours d'une étude d'exposition de rats par inhalation pendant 4 semaines, une dose minimale avec effet observé (DMEO) de 500 mg/m3 (94 ppm) pour une exposition à court terme a été déterminée pour la dégénérescence de la muqueuse olfactive et des modifications hyperplasiques/métaplasiques de l'épithélium respiratoire cilié dans l'étude (Ciba-Geigy, 1985a; idem, 1985b). Concernant l'exposition cutanée, une DMEO de 100 mg/kg p.c./j a été déterminée pour des lésions du foie chez des lapins exposés 5 fois par semaine pendant 4 semaines (NTP, 2004). Les autres tissus atteints à la suite d’une exposition à court terme à l'oxyde de butyle et de 2,3-époxypropyle sont le sang, le foie, les reins et les poumons.
Aucune étude évaluant la toxicité de l'oxyde de butyle et de 2,3-époxypropyle pour la reproduction ou le développement n'a été répertoriée. Toutefois, il existe des informations provenant d'études à court terme et d'essais de létalité dominante. Lors de l'exposition de rats jusqu'à 1 600 mg/m3 d'oxyde de butyle et de 2,3-époxypropyle par inhalation pendant 10 semaines, une atrophie testiculaire a été observée à partir de 400 mg/m3 (Shell Oil Co., 1957). Au cours d'un essai de létalité dominante, une baisse du taux de grossesses, une augmentation du taux de mortalité fœtale et une baisse du nombre de nidations ont été observées chez des femelles accouplées avec des mâles exposés à 1 500 mg/kg p.c./j, 3 fois par semaine pendant 3 semaines, par application cutanée (Rhone-Poulenc, 1977). L'atrophie testiculaire, ainsi qu'une réduction de la capacité de reproduction, a également été observée chez des rats exposés à l'éther d'allyle et de glycidyle de même qu'à l'éther de phényle et de glycidyle (CIRC, 1989; NTP, 1990a; NTP, 2004).
La base de données de toxicité est jugée modérément fiable. Les informations qu'elle contient permettent de déterminer les effets potentiellement préoccupants à la suite d’une brève exposition. Malgré l'absence d'études chroniques de cancérogénicité pour l'oxyde de butyle et de 2,3-époxypropyle, les renseignements provenant d'études sur des substances analogues permettent d'évaluer le risque de cancérogénicité de l'oxyde de butyle et de 2,3époxypropyle. Les données de cancérogénicité sont étayées par les résultats de tests de génotoxicité in vivo et in vitro réalisés avec l'oxyde de butyle et de 2,3-époxypropyle et ses analogues.
Caractérisation des risques pour la santé humaine
En s'appuyant principalement sur l’évaluation reposant sur le poids de la preuve réalisée par la Commission européenne, la cancérogénicité constitue un effet critique pour la caractérisation des risques que présente l'oxyde de butyle et de 2,3-époxypropyle pour la santé humaine. Bien qu'aucun essai biologique à long terme sur le cancer n'ait été effectué pour l'oxyde de butyle et de 2,3-époxypropyle, une augmentation du nombre de tumeurs dans plusieurs organes a été observée chez les rongeurs après une exposition par voie cutanée ou orale ou par inhalation à diverses substances analogues à l'oxyde de butyle et de 2,3époxypropyle. La génotoxicité de l'oxyde de butyle et de 2,3époxypropyle a également été démontrée par une série de tests in vivo et in vitro; de même, les tests de génotoxicité in vivo et in vitro ont révélé des résultats positifs pour différents paramètres pour les analogues structurels que sont l'éther d'allyle et de glycidyle et le glycidol. En conséquence, étant donné la génotoxicité de l'oxyde de butyle et de 2,3-époxypropyle, ainsi que la cancérogénicité et la génotoxicité des composés de structure similaire, on ne peut exclure l'influence de l'oxyde de butyle et de 2,3époxypropyle dans le développement de tumeurs par un mode d'action impliquant une interaction directe avec le matériel génétique.
En ce qui concerne les effets non cancérogènes, la DMEO la plus faible associée à l'exposition par inhalation est de 400 mg/m3 pour une atrophie testiculaire chez des rats exposés 5 jours par semaine pendant 10 semaines (Shell Oil Co., 1957). La comparaison de cette valeur avec l'estimation modélisée de la concentration d'oxyde de butyle et de 2,3-époxypropyle dans l'air extérieur (c.-à-d., < 1 ng/m3) permet d'obtenir une marge d'exposition d'environ huit ordres de grandeur. Bien que l'oxyde de butyle et de 2,3époxypropyle soit utilisé dans la fabrication de résines époxydes et dans d'autres formules employées dans d'autres produits, l'exposition des consommateurs devrait être minime selon les renseignementss disponibles. Étant donné les expositions très faibles prévues, la marge d'exposition est donc estimée suffisante pour éviter le développement d'effets non cancérogènes dans la population générale du Canada.
Incertitudes de l'évaluation des risques pour la santé humaine
La présente évaluation préalable ne comprend pas l'analyse complète du mode d'action de l'oxyde de butyle et de 2,3-époxypropyle ou de ses analogues, et ne tient pas non plus compte des possibles différences de sensibilité entre l'espèce humaine et les espèces ayant fait l'objet d'expériences. De plus, il existe des incertitudes quant à l'utilisation des données sur des substances analogues afin d'extrapoler le risque de cancérogénicité de l'oxyde de butyle et de 2,3-époxypropyle en raison du manque d'études chroniques. Il existe également des incertitudes quant à la toxicité de l'oxyde de butyle et de 2,3époxypropyle pour la reproduction et le développement, car les renseignements disponibles sont limitées aux effets observés sur les organes reproducteurs dans le cadre d'études à court terme et d'essais de létalité dominante, bien qu'il soit probable que ces effets ne soient induits qu'à des doses ou des concentrations d'exposition supérieures à celles auxquelles la population générale est exposée.
Malgré les données très limitées disponibles permettant de quantifier l'exposition de la population, étant donné le manque de renseignements sur la présence de la substance dans les produits de consommation, la nature réactive du groupe oxirane, ainsi que l'estimation très faible de l'absorption quotidienne basée sur des hypothèses prudentes, il est probable que l'exposition de la population générale à l'oxyde de butyle et de 2,3époxypropyle soit faible. Des données supplémentaires sur les concentrations résiduelles, le cas échéant, dans les résines époxydes traitées, ainsi que des données de surveillance environnementale, permettraient une caractérisation plus fiable du risque d'exposition humaine à l'oxyde de butyle et de 2,3-époxypropyle au Canada.
D'après les renseignements contenus dans la présente ébauche d'évaluation préalable, il a été conclu que l'oxyde de butyle et de 2,3-époxypropyle ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
Étant donné la génotoxicité de l'oxyde de butyle et de 2,3-époxypropyle ainsi que la génotoxicité et la cancérogénicité des substances analogues à celui-ci, il a été conclu que l'oxyde de butyle et de 2,3-époxypropyle pourrait présenter une possibilité d'effets nocifs quel que soit le degré d'exposition. En conséquence, l'oxyde de butyle et de 2,3époxypropyle est considéré comme une substance pouvant pénétrer dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
En conséquence, il a été conclu que l'oxyde de butyle et de 2,3-époxypropyle remplit au moins un des critères de l’article 64 de la LCPE(1999), En outre, la substance ne répond pas aux critères de la persistance et du potentiel de bioaccumulation définis dans le Règlement sur la persistance et la bioaccumulation.
De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
[ACGIH] American Conference of Governmental Industrial Hygienists. 2003. TLVs and BEIs: Based on the Documentation of the Threshold Limit Values for Chemical Substances and Physical Agents and Biological Exposure Indices. Cincinnati (OH) : ACGIH, p. 18.
[AIES] Artificial Intelligence Expert System. 2003-2005. Version 1.25. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès de la Division des substances nouvelles et de la Division des substances existantes, Environnement Canada
Andersen, M., Kiel, P., Larsen, H. 1957. Results of range-finding toxicological tests on nbutyl glycidyl ether. [cité par Gardiner et al., 1992, 1993].
Andersen, M., Kiel, P., Larsen, H., Maxild, J. 1978. Mutagenic action of aromatic epoxy resins. Nature 276:391-392.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345.
[BCFBAF] BioConcentration Factor Program for Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Bingham, E., Cohrssen, B., Powell, C.H. (éd.). 2001. Patty's Toxicology [en ligne]. John Wiley & Sons, Inc. Accès : http://mrw.interscience.wiley.com/emrw/9780471125471/pattys/
tox/article/tox082/current/html
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Boeing Company. 1986. Auburn reproductive health survey with cover letter dated 020888. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0515097. No de document : 88-88000002.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Bosch, S., Meylan, W., Becker, J., Neal, M. 1985. Monograph on human exposure to chemicals in the workplace: Glycidyl ethers. Syracuse (NY) : Syracuse Research Corporation, Center for Chemical Hazard Assessment.
Brooks, T.M., Meyer, A.L., Hodson-Walker, G., Crabtree, A.N., Jones, L., Wiggins, D.E. 1981. Toxicity Studies with Epoxy Resins: In Vitro Genotoxicity Studies with Diglycidyl Ether of Bispheno1 A, Epikote 828, Epikote 1001. Epikote 1007. Shell Toxicology Laboratory TLGR.80.123
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, ch. 33, Gazette du Canada, Partie III, vol. 22, no 3. Accès : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures de gestion et d'évaluation des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2008. Loi canadienne sur la protection de l'environnement (1999) : Avis de septième divulgation d'information technique concernant les substances identifiées dans le Défi.Gazette du Canada, Partie I, vol. 142, no 35, p. 2497-2501. Accès : http://www.gazette.gc.ca/rp-pr/p1/2008/2008-08-30/pdf/g1-14235.pdf
Canter, D.A., Zeiger, E., Haworth, S., Lawlor, T., Mortelmans, K., Speck, W. 1986. Comparative mutagenicity of aliphatic epoxides in Salmonella. Mutat. Res. 172:105-138.
CASETOX [module de prédiction]. 2008. Version 2.0. Beachwood (OH) : MultiCASE. Accès : http://www.multicase.com/products/prod03.htm[réserve de consultation].
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
ChemCAN [Level III fugacity model of 24 regions of Canada]. 2003. Version 6.00. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/CC600.html
Ciba-Geigy. 1977. Skin sensitizing (contact allergenic) effect in guinea pigs of TK 10408 (glycidyl n-butyl ether) with cover letter dated 072887. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0515486. No de document : 86-870001325.
Ciba-Geigy. 1985a. Appendices I to V to the 28-day inhalation study of glycidyl n-butyl ether (TK10408) in the rat with cover letter dated 072887. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0515489. No de document : 86-870001328.
Ciba-Geigy. 1985b. 28-Day inhalation exposure to glycidyl n-butyl ether (TK-10408) in the rat (final report) with cover letter dated 072887. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0515488. No de document : 86870001327.
[CIRC] Centre international de recherche sur le cancer. 1989. IARC monographs on the evaluation of carcinogenic risks to human. Some organic solvents, resin monomers and related compounds, pigments and occupational exposures in paint manufacture and painting. Volume 47. Lyon (France) : Organisation mondiale de la Santé.
[CIRC] Centre international de recherche sur le cancer. 1999. IARC monographs on the evaluation of carcinogenic risks to human. Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. Volume 71. Lyon (France) : Organisation mondiale de la Santé.
[CIRC] Centre international de recherche sur le cancer. 2000. IARC monographs on the evaluation of carcinogenic risks to human. Some industrial chemicals. Volume 77. Lyon (France) : Organisation mondiale de la Santé.
Clark, L.B., Rosen, R.T., Hartman, T.G., Alaimo, L.H., Louis, J.B., Hertz, C., Ho, C., Rosen, J.D. 1991. Determination of nonregulated pollutants in three New Jersey publicly owned treatment works (POTWs). Research Journal of the Water Pollution Control Federation. 63(2):104-113.
[CMA] Chemical Manufacturing Association. 1984. Comments in response to advance notice of proposed rulemaking in testing of glycidol and its derivatives with attachments and cover letter dated 022884. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0522547. No de document : 40-8440196. Résumé du SRC.
Confidentiel. 1964. Biological test for safety request and report. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0206089. No de document : 878212393.
Confidentiel. 1977. Activity of J7004; the Salmonella/microsomal assay for bacterial mutagenicity with cover; industrial biological test for safety. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0206089. No de document : 878212443.
Connor, T.H., Pullin, T.G., Meyne, J., Frost, A.F., Legator, M.S. 1980b. Résumé de 1980a. Evaluation of the mutagenicity of n-BGE and t-BGE in a battery of short-term assay. Résumé Ec-12. Environ. Mutagen. 2:284.
Connor, T.H., Ward, J.B., Meyne, J., Frost, A.F., Legator, M.S. 1980a. The evaluation of the epoxide diluent, n-butyl glycidyl ether in a series of mutagenicity assays. Environ. Mutagen. 2:521530.
[CosIng] Cosmetic Ingredients and Substances. Substance: Butyl glycidyl ether [consulté le 16 février 2009]. Accès : http://ec.europa.eu/enterprise/cosmetics/cosing/index.cfm?fuseaction=search.details&id=30077
[DEREK] Deducting Estimation from Existing Knowledge [module prédictif sur cédérom]. 2008. Version 10.0.2. Cambridge (MA) : Harvard University, LHASA Group. Accès : http://lhasa.harvard.edu/?page=toxicology.htm [réserve de consultation].
[Dow] Dow Chemical Company. 2009. Product Safety Assessment: Reactive Diluents [consulté le 9 mars 2009]. Accès : http://www.dow.com/PublishedLiterature/dh_00eb/0901b803800eb28e.pdf?filepath=
productsafety/pdfs/noreg/233-00316.pdf&fromPage=GetDoc
[ECOSAR] Ecological Structural Activity Relationships [en ligne]. 2004. Version 0.99h. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
El Ramy, R., Ould Elhkim, M., Lezmi, S., Poul, J.M. 2007. Evaluation of the genotoxic potential of 3-monochloropropane-1,2-diol (3-MCPD) and its metabolites, glycidol and beta-chlorolactic acid, using the single cell gel/comet assay. Food Chem. Toxicol. 45(1):41-48.
Environnement Canada. 2007. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series: draft module on QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environnement Canada. 2008. Données sur les substances du lot 7 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le septième lot du Défi. Données produites par le Programme des substances existantes, Environnement Canada.
Environnement Canada. 2009. IGETA Report: CASRN 2426-08-6, 2009-05-06. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre [consulté le 7 janvier 2009]. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
[ESIS] European Chemical Substances Information System [base de données en ligne]. [s.d.]. Bureau européen des substances chimiques (ECB). [consulté en 2009]. Accès : http://ecb.jrc.it/esis
Fregert, S., Rorsman, H. 1964. Allergens in epoxy resins. Acta Allergol. 19:296-299.
Frost, A.F., Legator, M.S. 1982. Unscheduled DNA synthesis induced in human lymphocytes by butyl glycidyl ethers. Mutat. Res. 102:193-200.
Gardiner, T.H., Waechter, J.M. Jr., Wiedow, M.A., Solomon, W.T. 1992. Glycidyloxy compounds used in epoxy resin systems: A toxicology review. Regul. Toxicol. Pharmacol.15(Partie 2):S1-S77.
Greene, E.J., Friedman, M.A., Sherrod, J.A., Salerno, A.J. 1979. In vitro mutagenicity and cell transformation screening of phenylglycidyl ether. Mut. Res. 67:9-19.
Hamerton, I. 1996. Recent Developments in Epoxy Resins. iSmithers Rapra. 176 p.
Hansch, C., Leo, A., Hoekman, D. 1995. Exploring QSAR – Hydrophobic, electronic, and steric constants. Washington (DC) : American Chemical Society.
Hemminki, K., Falck, K., Vainio, H. 1980. Comparison of alkylation rates and mutagenicity of directly acting industrial and laboratory chemicals. Arch. Toxicol. 46:277-285.
Hemminki, K., Vainio, H. 1980. Alkylation of nucleic acid bases by epoxides and phenyl glycidyl ethers. Dev. Toxicol. Environ. Sci. 8:241-244.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2000. Version 3.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Hine, C.H., Kodama, J.K., Wellington, J.S., Dunlap, M.K., Anderson, H.H. 1956. The toxicology of glycidol and some glycidyl ethers. AMA Arch. Ind Health 14:250-264.
Hine, C.H., Guzman, R.J., Coursey, M.M., Wellington, J.S. 1958. An investigation of the ocongenic activity of two representative epoxy resins. Cancer Res. 18:20-26.
Hine, C.H., Rowe, V.K., White, E.R., Darmer, K.I., Yougblood, G.T. 1981. Epoxy compounds. In : Clayton, G.D., Clayton, F.E. (éd.). Patty's Industrial Hygiene and Toxicology. Vol. 2A. Toxicology. 3e éd. rév., chap. 32. New York : Interscience.
Holland, J.M., Gosslee, D.G., Williams, N.J. 1979. Epidermal carcinogenicity of bis(2,3epoxycyclopentyl)ether, 2,2-b(p-glycidoloxyphenyl)propane, and m-phenylenediamine in male and female C3H and C57BL/6 mice. Cancer Res.39:1718-1725.
Hubinski, H., Gutzke, G.E., Kubinski, Z. 1981. DNA-cell-binding (DCB) assay for suspected carcinogens and mutagens. Mutat. Res. 89:95-136.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[INRP] Inventaire national des rejets de polluants [base de données en ligne]. 2007. Gatineau (Qc) : Environnement Canada. [consultée le 16 février 2009]. Accès : http://www.ec.gc.ca/pdb/querysite/query_f.cfm
[IUCLID] International Uniform Chemicals Information Database. 2006. Ensemble de données sur le 2426-08-6. [consultée le 10 juillet 2009]. Belgique : Commission européenne, Bureau européen des substances chimiques. Accès : http://www.epa.gov/hpv/pubs/summaries/nbtglyet/c13352rr2.pdf
Ivie, G.W., MacGregor, J.T., Hammock, B.D. 1980. Mutagenicity of psoralen epoxides. Mutat. Res. 79:73-77.
Jolanki, R., Kanerva, L., Estlander, T., Tarvainen, K., Keskinen, H., Eckerman, M. 1990. Occupational dermatoses from epoxy resin compounds. Contact Dermatitis 23:172-183.
Kanerva, L., Jolanki, R., Alanko, K., Estlander, T. 1999. Patch-test reactions to plastic and glue allergens. Acta Dermat. Venereol. 79(4):296-300.
Kanerva, L., Jolanki, R., Estlander, T. 1997. Allergic and irritant patch test reactions to plastic and glue allergens. Contact Dermatitis 37(6):301-302.
[KOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation [consulté le 7 janvier 2009]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
Lee, K.P., Schneider, P.W., Trochimowicz, H.J. 1983. Morphologic expression of glandular differentiation in the epidermoid nasal carcinomas induced by phenylglycidyl ether inhalation. Am. Asso. Pathol. 111:140-148.
Lee, S. 1989. Reference book for composites technology. CRC Press, 336 p.
Lewis, R.J. Sr. (éd.). 2001. Hawley's Condensed Chemical Dictionary, 14e éd., New York : John Wiley & Sons, Inc.
Lijinsky, W., Kovatch, R.M. 1992. A study of the carcinogenicity of glycidol in Syrian hamsters. Toxicol. Ind. Health8(5):267-271.
Lockwood, D.D., Taylor, H.W. 1982. Acute toxicological properties and industrial handling hazards of D.E.R. 361 Epoxy Resin. Dow Chemical Company. [cité par Gardiner et al.,1992].
Loquet, C., Toussaint, G., Letalaer, J.Y. 1981. Studies on mutagenic constituents of apple brandy and various alcoholic beverages collected in western France, a high incidence area for esophageal cancer. Mutat. Res. 88(2):155-164.
McCann, J., Choi, E., Yamasaki, E., Ames, B.N. 1975. Detection of carcinogens as mutagens in the Salmonella/microsome assay of 300 chemicals. Proc. Natl. Acad. Sci.U.S.A. 72:5135-5139.
[MITI] Ministry of International Trade & Industry. 2002. Biodegradation and bioaccumulation: data of existing chemicals based on the CSCL. Japon. Publié sous la direction du Chemicals Inspection & Testing Institute, Japon. Chemical Products Safety Division, Basic Industries Bureau, Ministry of Internation Trade & Industry, Tokyo (Japon).
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm
[NCI] National Chemical Inventories [base de données sur cédérom]. 2008. Issue 1. Columbus (OH) : American Chemical Society. [consultée le 11 décembre 2006]. Accès : http://www.cas.org/products/cd/nci/index.html
[NTP] National Toxicology Program. 1990a. Toxicology and carcinogenesis studies of allyl glycidyl ether (CASNo. 106-92-3) in Osborne-Mendel rats and B6C3F1 mice (inhalation studies). TR-376. Accès : http://ntp-server.niehs.nih.gov/htdocs/LT-Studies/TR376.html.
[NTP] National Toxicology Program. 1990b. Toxicology and carcinogenesis studies of glycidol (CASNo. 556-52-6) in F344/N rats and B6C3F1 mice (gavage study). TR-374.
[NTP] National Toxicology Program. 2004. n-butyl glycidyl ether (BGE) [CAS No. 2426-08-6] review of toxicological literature. Accès : http://ntp.niehs.nih.gov/ntp/htdocs/Chem_Background/ExSumPdf/Butyl_glycidyl_ether.pdf
[NTP] National Toxicology Program. 2007. Toxicology and carcinogenesis study of glycidol (CAS No. 556-52-5) in genetically modified haploinsufficient p16Ink4a/p19Arf mice (gavage study). GMM-13. Accès : http://ntp.niehs.nih.gov/files/gmm13_web1.pdf
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [consulté le 7 janvier 2009]. Accès : http://oasis-lmc.org/?section=software
Ohtani, H., Nishioka, H. 1981. Mutagenic activity of epoxide compounds as constituents of resins in bacterial test systems. Sci. Eng. Rev. 21:247-265.
Persitianis, G.C., Doak, S.M., Cole, P.N., Hend, R.W. (1988). Two-year carcinogenicity study on three aromatic epoxy resins applied cutaneously to CF1 mice. Food. Chem. Toxicol.26(7):611-624.
[PhysProp] Interactive PhysProp Database [base de données en ligne]. 2006. Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.syrres.com/esc/physdemo.htm
Plna, K., Sagerback, D. 1997. 32P-Postlabelling of DNA adducts formed by allyl glycidyl ether in vitro and in vivo. Carcinogenesis 18(8):1457-62.
Prens, E.P., de Jong, G., van Joost, T. 1986. Sensitization to epichlorohydrin and epoxy system components. Contact Derm.15(2):85-90.
Procter and Gamble Company. 1979. Letter from Procter and Gamble Company to USEPA submitting reports, protocols and data on n-alkyl glycidyl ethers with attachments. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0200642. No de document : 88-7900293.
Pullin, T. (University of Texas Medical Branch, Galveston, TX). 1977. Report to the Dow Chemical Company Integrated Mutagenicity Testing Program, 71 p. [présenté à l'Environmental Protection Agency conformément à la section 8(e) de la TSCA par Rhone-Poulenc, Inc. et la Shell Oil Company.] –> identique à Rhone-Poulenc, 1977.
Reichhold, Chemical Company. 1978. Letter from Reichhold Chemicals Inc to US EPA regarding submission of 8D studies with attachments. TSCATS. No de microfiche : OTS0523514. No de document : 40-7840108.
Rhone-Poulenc Inc. 1973. Initial submission: Toxicology of epoxide no. 8 with cover letter dated 102792. TSCATS. No de microfiche : OTS0571540. No de document : 88-920009887.
Rhone-Poulenc Inc. 1977. Initial submission: Report to the Dow Chemical Company integrated mutagenicity testing program regarding genotoxicity studies of epoxides with over letter dated 102992. TSCATS. No de microfiche : OTS0571373. No de document : 88-920009716.
Ringo, D.L., Brennan, E.F., Cota-Robles, E.H. 1982. Expoxy resins are mutagenic: Implications for electron microscopists. J. Ultrastruct. Res. 80(3):280-287.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo) Model [en ligne]. Version 4.1. Pays-Bas : National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
Santé Canada. 2009a. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques. [consulté le 20 février 2009]. Accès : http://www.hc-sc.gc.ca/cps-spc/person/cosmet/info-ind-prof/_hot-list-critique/hotlist-liste-fra.php
Santé Canada. 2009b. Recherche de produits pharmaceutiques en ligne. [consulté le 19 février 2009]. Accès : http://webprod.hc-sc.gc.ca/dpd-bdpp/language-langage.do?url=t.search.recherche&lang=fra
Santé Canada. 2009c. Base de données des produits de santé naturels homologués. [consultée le 20 février 2009]. Accès : http://webprod.hc-sc.gc.ca/lnhpd-bdpsnh/language-langage.do?url=t.search.recherche&lang=fra
Santé Canada. 2009d. Liste de divulgation des ingrédients, Loi sur les produits dangereux. [consulté en mars 2009]. Accès : http://laws.justice.gc.ca/fr/showdoc/cr/DORS-88-64/sc:1/20090901/fr?page=1
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2009. Disponible auprès de Santé Canada, Division des cosmétiques.
Seiler, J.P. 1984a. The mutagenicity of mono- and di-functional aromatic glycidyl compounds. Mutat. Res. 135 (3):159-167.
Seiler, J.P. 1984b. Uptake, metabolism and mutagenic activity of aromatic glycidyl compounds. Chem. Biol. Int.51(3):347-356.
Shell Chemical Company. 1956. The toxicology of glycidol and some glycidyl ethers. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0523687. No de document : 40-5640496.
Shell Oil Company. 1957. Chronic Vapor Toxicity of nBGE with attachments and cover letter dated 071278. No de microfiche : OTS0200451. No de document : 88-7800213.
Shell Oil Company. 1978. Toxicity studies with n-butyl glycidyl ether: In vitro mutation studies with letter dated 031679. TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0200451. No de document : 887900213.
Steiner, S., Hönger, G., Sagelsdorff, P. 1992. Molecular dosimetry of DNA adducts in C3H mice treated with bisphenol A diglycidylether. Carcinogenesis 13(6):969-972.
Tarvainen, K. 1995. Analysis of patients with allergic patch test reactions to a plastics and glues series. Contact Derm. 32(6):346-351.
Terrill, J.B., Lee, K.P., Culik, R., Kennedy, G.L. Jr. 1982. The inhalation toxicity of phenyl phenylglycidyl ether: reproduction, mutagenic, teratogenic, and cytogenic studies. Toxicol. Appl. Pharmacol. 64(2): 204-212.
Thompson, E.D., Coppinger, W.J., Piper, C.E., McCarroll, N., Oberly, T.J., Robinson, D. 1981. Mutagenicity of alkyl glycidyl ethers in three short-term assays. Mutat. Res.90(3):213-231.
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. [consulté le 7 janvier 2009]. Accès : http://www.accelrys.com/products/topkat/index.html
[US EPA] United States Environmental Protection Agency. 1979. USEPA status report: Butyl glycidyl ether (4/479). TSCATS [études non publiées sur la santé et la sécurité remises à l'Environmental Protection Agency]. No de microfiche : OTS0200451. No de document : 8EHQ0279-0213.
[US EPA] United States Environmental Protection Agency. 2008a. Supporting Documents for Initial Risk-Based Prioritization of High Production Volume Chemicals - Sponsored Chemical n-Butyly glycidyl ether (CAS No. 2426-08-6) [consulté le 11 mars 2009]. Accès : http://www.epa.gov/hpvis/rbp/2426086_Butyl%20glycidyl%
20ether_Web_RBPSuppDocs.July2008.pdf
[US EPA] U.S. Environmental Protection Agency. 2008b. Robust Study Summary. Test substance – biodegradation. Oxirane, (butoxymethyl)- [en ligne]. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics [consulté le 22 avril 2009]. Accès : http://iaspub.epa.gov/oppthpv/Public_Search.PublicEndPointReport?robust_summary_id=
25096210&WhichButton=PrintTab&ep_name=Biodegradation&selchemid=101064
Van Duuren, B.L., Langseth, L., Goldschmidt, B.M., Orris, L. 1967. Carcinogenicity of epoxides, lactones and peroxy compounds. VI. Structure and carcinogenicity activity. J. Natl Cancer Inst. 39:1217-1228.
Von der Hude, W., Carstensen, S., Obe, G. 1991. Structure-activity relationships of epoxides: Induction of sister-chromatid exchanges in Chinese hamster V79 cells. Mutat. Res. 249(1):55-70.
Von der Hude, W., Seelbach, A., Basler, A. 1990. Epoxides: Comparison of the induction of SOS repair in Escherichia coli PQ37 and the bacterial mutagenicity in the Ames test. Mutat. Res. 231(2):205-218.
Voogd, C.E., Stel Van, J.J., Jacobs, J.A. 1981. The mutagenic action of aliphatic epoxides. Mutat. Res.89(4):269-282.
Wade, M.J., Moyer, J.W., Hine, C.H. 1979. Mutagenic action of a series of epoxides. Mut. Res. 66(4):367-371.
Wallace, E. 1979. Effects of n-butyl glycidyl ether exposure. J. Soc. Occup. Med. 29(4):142-143.
Weil, C.S., Condra, N., Haun, C., Striegel, J.A. 1963. Experimental carcinogenicity and acute toxicity of representative exposides. Am. Ind. Hyg. J.24(4):305-324.
Whorton, E.B. Jr., Pullin, T.G., Frost, A.F., Onofre, A., Lagator, M.S., Fols, D.S. 1983. Dominant lethal effects of n-butyl glycidyl ether in mice. Mutat. Res.124(3-4):225-253
Wooder, M.F., Creedy, C.L. 1981. Studies on the effects of diglycidyl ether of bisphenol A on the liver DNA in vivo. Shell Research Report TLGR.81.102.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [consulté le 6 mars 2006]. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm.
Zakova, N., Zak, F., Froehlich, E., Hess, R. 1985. Evaluation of skin carcinogenicity of technical 2,2-bis-(p-glycidyloxyphenyl)-propane in CF1 mice. Food Chem. Toxicol. 23(12):1081-1089.
Annexe 1 : Estimations de la limite supérieure de l'exposition à l'oxyde de butyle et de 2,3époxypropyle par les produits de consommation
| Scénario concernant les produits de consommation | Hypothèses | Estimation de l'exposition |
|---|---|---|
| Peinture | Pourcentage massique de l'oxyde de butyle et de 2,3époxypropyle : 0,0336 % Fréquence d'exposition : 1 x/an (RIVM, 2006) Poids du corps : 70,9 kg (Santé Canada, 1998) Quantité appliquée : 1,3 × 103 g (RIVM, 2006) Modèle d'inhalation : exposition à la vapeur, évaporation : Durée d'exposition de 132 minutes (RIVM, 2006) Volume de la pièce : 20 m3 (RIVM 2006) Débit de ventilation : 0,6 changement d'air/h (RIVM, 2006) Absorption par inhalation : 100 % Débit d'inhalation : 16,2 m3/j (Santé Canada, 1998) Modèle cutané : contact cutané direct avec le produit à taux constant Surface exposée : 0,367 m2(RIVM, 2006, fiche d'information générale par zone concernant les mains et bras) Taux de contact : 30 mg/min (RIVM, 2006) Durée d'émission : 7,2 × 103 s (RIVM, 2006) Absorption cutanée : 100 % |
Inhalation – Concentration moyenne par événement : 6 mg/m3 Dose cutanée aiguë : 0,02 mg/kg p.c. |
Annexe 2 : Résumé des données sur les effets de l'oxyde de butyle et de 2,3-époxypropyle sur la santé
| Paramètre | Doses ou concentrations minimales avec effet1/Résultats |
|---|---|
| 1 DL50 = dose létale médiane CL50 = concentration létale médiane DMEO = dose minimale avec effet observé CMEO = concentration minimale avec effet observé DSEO = dose sans effet observé |
|
| Toxicité aiguë | DL50 la plus faible, par voie orale (souris) = 1 530 mg/kg p.c. (souris de Webster). (Shell Oil Co., 1956). DL50 la plus faible, par voie cutanée (lapin) = 788 mg/kg p.c. (souche non précisée) (Lockwood et Taylor, 1982). CL50 la plus faible, par inhalation (rats) =5,484 g/m3 (1 030 ppm) chez les rats de Long-Evans (Shell Oil Co., 1956). Autres études : ACGIH, 1986; Hine et al., 1956. |
| Toxicité à court terme en doses répétées | DMEO par voie orale : Aucune étude répertoriée. CMEO par inhalation : 500 mg/m3(94 ppm) selon la dégénérescence de la muqueuse olfactive et les modifications hyperplasiques/métaplasiques de l'épithélium respiratoire cilié de rats mâles et femelles. Ces effets ont été légèrement plus prononcés chez les mâles que chez les femelles. D'autres effets ont été observés à 1 000 mg/m3 (188 ppm), notamment une perte de poids chez les mâles, ainsi qu'une augmentation des taux d'aspartate transaminase (AST) et d'hémoglobine. Les effets sur l'hémoglobine sont réversibles chez l'animal après l'arrêt de l'exposition et deux semaines de mise au repos. Le protocole d'exposition était le suivant : les rats ont été exposés 6 h par jour, 5 jours par semaine, pendant 28 jours à 0, 100, 500, 1 000 mg/m3 (0, 18, 94, 188 ppm) (Ciba-Geigy, 1985a; idem, 1985b). Aucune autre étude de ce type n'a été recensée. DMEO par voie cutanée : 100 mg/kg p.c./j selon l'apparition de petites lésions blanches sur le foie chez l'un des cinq lapins exposés. La substance a été appliquée 5 fois par semaine pendant 4 semaines. Aucune autre information n'a été fournie dans la source secondaire (Confidentiel, 1964). Aucune autre étude de ce type n'a été recensée. |
| Toxicité subchronique | CMEO par inhalation : Des rats mâles ont été exposés à la substance à des concentrations de 0, 200, 400, 800 et 1 600 mg/m3 (0, 38, 75, 150, 300 ppm) 7 h par jour, 5 jours par semaine pendant 10 semaines. À 800 mg/m3(150 ppm), un retard de croissance et le décès d'un rat ont été observés. L'exposition à une dose élevée de 1 600 mg/m3 (300 ppm) a entraîné une nécrose du foie, un amaigrissement, une apparence de mauvaise santé et une augmentation des ratios poids du rein/poids du corps et poids du poumon/poids du corps (Shell Oil Co., 1957, voir également Toxicité pour la reproduction). Aucune autre étude subchronique n'a été recensée. |
| Toxicité chronique/ cancérogénicité |
Aucune étude de toxicité chronique n'a été recensée. |
| Toxicité pour le développement | Voir les résultats des essais de létalité dominante. |
| Toxicité pour la reproduction | Concentration minimale avec effet observé (CMEO) – inhalation : 400 mg/m3. Atrophie testiculaire observée chez 1 rat sur 10 à 400 mg/m3 et 4 rats sur 5 à 1 600 mg/m3. Légère atrophie présente chez 1 rat sur 10 à 400 mg/m3 et atrophie testiculaire observée chez 1 rat sur 10 à 800 mg/m3(cité dans NTP, 2004). Dans une étude publiée en 1979, l'EPA américaine a abordé les effets de l'exposition à l'oxyde de butyle et de 2,3-époxypropyle. Voir Shell Oil Co., 1957 dans la section Toxicité subchronique pour connaître les détails du protocole d'étude. Voir les Résultats des essais de létalité dominante. |
| Génotoxicité et paramètres connexes : in vivo | Essai de létalité dominante : Résultats positifs : Au moins 10 souris mâles B6D2F1, âgées de 8 à 10 semaines, ont été exposées localement à une solution d'oxyde de butyle et de 2,3époxypropyle à plus de 95 % à un dosage de 1 500 mg/kg p.c. 3 fois/semaine pendant 8 semaines. L'étude inclut des témoins non exposés et des témoins positifs exposés à la triéthylènemélamine (TEM). Après l'exposition, les mâles ont été accouplés avec trois femelles vierges par semaine pendant trois semaines. Une augmentation significative du ratio décès/grossesses (p=0,04) a été observée. Une baisse significative du nombre de nidations par grossesse (p=0,01) et du nombre de femelles gestantes (p=0,05) par rapport aux témoins non exposés a été observée (Rhone-Poulenc, 1977). Résultats équivoques : Des groupes de 36 à 44 souris BDF mâles ont été exposés à 0, 375, 750 ou 1 500 mg/kg p.c./j d'oxyde de butyle et de 2,3-époxypropyle (pur à 95 %) par application cutanée 3 fois par semaine pendant 8 semaines. Les témoins ont été exposés à une solution saline à 0,9 %. Les mâles ont été accouplés avec trois femelles non exposées chaque semaine pendant les trois semaines suivant l'exposition initiale. Deux essais ont été menés selon le même protocole. Une augmentation significative du taux de mortalité fœtale a été observée pour le dosage le plus élevé dans l'expérience 1, ainsi que lors de la combinaison des résultats des deux essais (p < 0,05). L'augmentation du taux de mortalité du second essai seul n'est pas significatif, car la mortalité fœtale a été anormalement élevée dans le groupe témoin de cette expérience. Aucun changement du taux de grossesses ou du nombre de nidations par femelle gestante n'a été observé lors des essais (Whorton et al., 1983; Shell Oil Co., 1957). Aberrations chromosomiques : Résultats positifs : Des rats CR-1 Sprague-Dawley ont reçu une injection intrapéritonéale de 0, 31,3, 104,2 ou 312,5 mg/kg p.c. 5 fois pendant 5 jours. L'exposition à la TEM a été utilisée comme témoin positif. Une augmentation du nombre d'aberrations chromosomiques, liée à la dose injectée, a été observée dans des cellules de moelle osseuse de rat. Ces aberrations incluent des ruptures de chromatides et de chromosomes, des aberrations de type de marqueur et des graves dommages chromosomiques (Procter and Gamble, 1979). Test du micronoyau : Résultats négatifs : Des souris BDF femelles ont été exposées par voie orale pendant 5 jours à une dose de 200 mg/kg (Connor et al., 1980a). Résultats positifs : Des souris BDF femelles ont reçu une injection intrapéritonéale de 225, 450, 675 ou 900 mg/kg pendant 1 à 2 jours. Les souris ont réagi en fonction de la dose (Connor et al., 1980a). Résultats positifs : Des souris ont reçu une injection intrapéritonéale de 200, 225, ou 675 mg/kg pendant respectivement 5 jours, 2 jours et 1 jour. Une augmentation du nombre de micronoyaux a été observée à 225 mg/kg pendant 2 jours et à 675 mg/kg pendant 1 jour (CMA, 1984). |
| Génotoxicité et paramètres connexes : in vitro | Mutagénicité : Résultats positifs pour la mutation inverse de bactéries : Test d’Ames – Salmonella typhimurium de types TA100 et TA1535 avec et sans activation métabolique. Occasionnellement positif sur les espèces TA97 et TA1538. (Confidentiel, 1977; Rhone-Poulenc, 1977; Shell Oil Co., 1978; Procter and Gamble Co., 1979; Wade et al., 1979; Connor et al., 1980a; Thompson et al., 1981; Canter et al., 1986). Résultats négatifs : test des urines – Résultats négatifs pour la Salmonella typhimurium de type TA1535. Urine obtenue de souris B6D2F1 ou ICR femelles exposées par voie orale à 200 mg/kg p.c./j pendant 4 jours (Rhone-Poulenc, 1977). Test des urines – Négatif pour la Salmonella typhimurium de types TA98 et TA1535. Urine obtenue de souris BDF mâles traitées localement à 1 500 mg/kg, 3 fois par semaine pendant 8 semaines, ou à 750, 1 500, 3 000 mg/kg, 3 fois par semaine pendant 16 semaines. (Connor et al., 1980a) Test des urines – Négatif pour la Salmonella typhimurium de type TA1535 à partir d'urines obtenues de souris ICR femelles traitées par voie orale à 200 mg/kg une fois par jour pendant 4 jours (Connor et al., 1980a). Résultats négatifs : Essai par passage sur hôte – Salmonella typhimurium (espèces non indiquées). Dix souris ICR femelles traitées par voie orale pendant 5 jours se sont vu inoculer de la S.typhimurium. Les bactéries ont été recueillies et examinées à la recherche de mutations inverses (Rhone-Poulenc, 1977). Résultats positifs : Cellules de lymphomes de souris (mutants déficients en TK) avec et sans activation (Thompson et al., 1981). Échange de chromatides sœurs : Résultats positifs : Cellules V79 de hamsters chinois (von der Hude et al,. 1991). Transformation : Résultats négatifs : Cellules de souris BALB/3T3 exposées 1 x 2 h ou 2 x 2 h avec une période de repos de 24 h entre chaque exposition (Connor et al., 1980a). Dommages à l'ADN : Résultats positifs : Synthèse non programmée d'ADN dans des lymphocytes de sang périphérique humain (Frost et Legator, 1982; Rhone-Poulenc, 1977). Faible réponse de synthèse non programmée d'ADN dans des cellules W138, non considérée comme positive par les auteurs (Thompson et al., 1981). Résultats positifs : ADN endommagé présent dans les lymphocytes humains cultivés (protocole d'exposition non indiqué dans la source secondaire – CIRC, 1999) (Connor et al., 1980b). |
| Irritation/sensibilisation | Une dose de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle non dilué a été administrée dans un œil à 3 lapins blancs albinos de Nouvelle-Zélande. La substance a causé de graves dommages oculaires irréversibles dans un cas. Les deux autres cas ont montré des zones diffuses de translucidité de la cornée et une conjonctivite légère à modérée qui a disparu en 4 jours (Rhone-Poulenc, 1973) Une dose de 0,5 mL d'oxyde de butyle et de 2,3-époxypropyle non dilué a été appliquée sur des tampons de gaze, qui ont ensuite été appliqués sur des zones normales et abrasées du dos de lapins blancs albinos de Nouvelle-Zélande. Les expériences ont été effectuées à la fois dans des conditions occluses et non occluses. Après 24 h, les tampons ont été retirés et les animaux ont été observés. La substance a causé de graves irritations dans toutes les conditions (Rhone-Poulenc, 1973; Reichold Chem. Co., 1978). Des cobayes ont reçu une injection intra-cutanée de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle dilué 3 fois par semaine, un jour sur deux, et ont reçu huit injections au total. Une dose déclenchante, estimée à une injection de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle dilué (bien que non mentionnée par les auteurs), a été administrée après une incubation de trois semaines. La sensibilisation des animaux a été évaluée 24 et 48 h plus tard. Une sensibilisation a été constatée chez 16 des 17 animaux (Weil et al., 1963). Dix cobayes de Pirbright mâles et 10 cobayes de Pirbright femelles ont reçu une injection intra-cutanée de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle à 0,1 % à l'arrière du flanc droit, un jour sur deux, pour un total de 10 injections. Des doses déclenchantes équivalentes ont été injectées deux semaines plus tard sur le flanc gauche. Onze des 19 animaux ont montré des signes de sensibilisation. Un décès a été constaté (Ciba-Geigy, 1977). Douze cobayes albinos femelles ont reçu trois injections intra-cutanées de 0,1 mL d'oxyde de butyle et de 2,3-époxypropyle à 10 %. Une semaine plus tard, les cobayes ont reçu une application topique pendant 48 h. Après deux semaines d'incubation, les cobayes ont subi un test par application de timbre d'oxyde de butyle et de 2,3-époxypropyle à 0,1 %. Six des 12 animaux ont montré des signes de sensibilisation (Reichold Chem Co., 1978, cité dans NTP, 2004).* Des cobayes de Hartley ont été exposés à une application de timbre d'oxyde de butyle et de 2,3-époxypropyle à 25 % sur le dos, une fois par semaine pendant trois semaines. Après deux semaines de repos, les animaux ont reçu une dose déclenchante (oxyde de butyle et de 2,3-époxypropyle à 1 %) et des observations ont été effectuées 24 h et 48 h après l'administration de cette dose. Un animal sur 20 a présenté un érythème modéré. Dix-huit des 20 animaux ont présenté un érythème confluent léger ou modéré et localisé (Reichold Chem Co., 1978, cité dans NTP, 2004). * La méthode décrite peut contenir des erreurs en raison de la qualité médiocre de la microfiche OTS0523514 (NTP, 2004). |
| Études chez les humains | |
| Immunotoxicité | Des patients présentant des allergies de contact connues aux résines époxydes ont été exposés à de l'oxyde de butyle et de 2,3-époxypropyle dilué à 0,25 % dans de l'acétone (aucune information supplémentaire fournie). Trois patients sur 20 ont présenté une réaction positive (Fregert et Rorsman 1964). Des ouvriers, employés dans une usine de fabrication de résines époxydes à base de bisphénol A, ayant présenté des éruptions cutanées par le passé, ont été soumis à des tests par application de diverses substances chimiques utilisées au cours du processus de fabrication. Un sujet sur 19 a réagi positivement à l'oxyde de butyle et de 2,3-époxypropyle (Prens et al., 1986). Des patients (soit 140) présentant une dermatite de contact aux résines époxydes ont subi des tests par application de timbre. Une solution d'oxyde de butyle et de 2,3-époxypropyle à 0,25 % a été appliquée en haut du dos, sous pansement occlusif pendant 24 ou 48 h. Les résultats ont été lus 24, 48 et 120 h après le retrait. Deux des 140 patients testés ont présenté des réactions positives (Jolanki et al., 1990). Des tests ont été effectués sur 343 sujets selon la méthode employée dans l'étude de Jolanki et al. Aucun des 343 patients n'a présenté de réaction à la solution d'oxyde de butyle et de 2,3-époxypropyle à 0,25 % (Tarvainen, 1995). Des patients ayant une suspicion de dermatose liée à la profession ont subi un test par application de timbre d'une solution d'oxyde de butyle et de 2,3-époxypropyle 0,25 % sous pansement occlusif pendant 48 h. Des examens ont été effectués 2, 3 et 4 à 6 jours après le retrait. Deux réactions allergiques et une réaction d'irritation ont été observées dans un groupe de 310 patients (Kanerva et al., 1997, 1999). |
| Autres études | Rapports d'étude : Wallace, 1979 Étude sur la santé de la reproduction : Une étude sur la santé de la reproduction a été effectuée en raison de cas groupés de fausses couches chez des employées d'une usine de fabrication de plastiques. De l'oxyde de butyle et de 2,3-époxypropyle a été trouvé dans plusieurs produits utilisés dans l'usine (Epibond 8543-A, Epocast 167-A et résines époxydes). L'oxyde de butyle et de 2,3-époxypropyle est lié à l'une des fausses couches. Aucun agent responsable unique n'a pu être identifié (Boeing Co., 1986). |
Annexe 3 : Structures et classifications relatives à l'l'oxyde de butyle et de 2,3-époxypropyle et aux substances similaires prises en compte dans cette évaluation
| Nom et numéro de registre CAS | Classification | Structure | |
|---|---|---|---|
| CIRC | Commission européenne | ||
| Oxyde de butyle et de 2,3époxypropyle 2426-08-6 |
Cancérogénicité : Cat. 3 Mutagénicité : Cat. 3 |
 |
|
| Oxyde d'allyle et de glycidyle 106-92-3 |
Cancérogénicité : Cat. 3 Mutagénicité : Cat. 3 Reprod. Cat. 3 |
 |
|
| Éther de phényle et de glycidyle 122-60-1 |
Cancérogénicité : Groupe 2B | Cancérogénicité : Cat. 2 Mutagénicité : Cat. 3 |
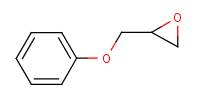 |
| Éther de bisphénol A et de diglycidyle 1675-54-3 |
Non classifiable |  |
|
| Glycidol 556-52-5 |
Cancérogénicité : Groupe 2A | Cancérogénicité : Cat. 2 Mutagénicité : Cat. 3 Reprod. Cat. 2 |
 |
Annexe 4 : Résumé de tous les renseignements relatifs à la cancérogénicité et à la génotoxicité des substances jugées similaires à l'oxyde de butyle et de 2,3-époxypropyle disponibles dans cette évaluation
| Oxyde d'allyle et de glycidyle |
|---|
| Cancérogénicité |
| Inhalation : Des rats Osborne-Mendel et des souris B6C3F1 ont été exposés à 0, 23, 47 mg/m3 (0, 5 et 10 ppm), 6 heures par jour, 5 jours par semaine (50 animaux de chaque sexe dans chaque groupe) pendant 102 ou 103 semaines par inhalation globale. Un nombre statistiquement significatif de lésions nasales (inflammation, dégénérescence, métaplasie et hyperplasie) a été constaté chez les rats et les souris, quel que soit le niveau d'exposition. Chez les rats Osborne-Mendel mâles exposés à 47 mg/m3, un adénome papillaire de l'épithélium respiratoire, un carcinome à cellules squameuses de l'épithélium respiratoire et un adénocarcinome de l'épithélium olfactif ont été observés. Chez les souris mâles, trois adénomes de l'épithélium respiratoire, quatre cas de dysplasie et sept cas d'hyperplasie basocellulaire focale ont été observés à 47 mg/m3. Chez les souris femelles, un adénome de l'épithélium respiratoire et sept cas d'hyperplasie basocellulaire focale ont été observés à 47 mg/m3. Les cas de tumeurs primaires n'ont pas été considérés comme statistiquement significatifs, mais sont à prendre en compte d'un point de vue biologique (NTP, 1990a). |
| Génotoxicité |
In vivo Injection intrapéritonéale : Trois souris C3H/Hej mâles ont reçu une injection de 40 mg/mL d'une solution d'oxyde d'allyle et de glycidyle dissous dans de la tricapryline, pour une dose totale de 148 mg/kg par souris. Les animaux ont été euthanasiés 24 h après le traitement et leurs tissus ont été collectés. L'ADN du foie des souris traitées et non traitées a été isolé et testé afin de détecter la présence d'adduits d'AGE. L'AGE était lié à la guanine et à l'adénine dans l'ADN du foie des souris traitées (Plna et Segerback, 1997). Exposition cutanée : De l'oxyde d'allyle et de glycidyle a été appliqué localement sur une zone rasée de 4 × 4 cm du dos de 3 souris C3H/Hej, pour une dose totale de 60,5 mg/kg. Une journée (24 h) après le traitement, les souris ont été euthanasiées et leur peau a été prélevée. L'ADN de la peau des souris traitées et non traitées a été isolé et testé afin de détecter la présence d'adduits d'AGE. L’AGE a formé des adduits avec l'adénine et la guanine (Plna et Segerback, 1997). Exposition par voie orale : Des Drosophila melanogaster Canton-S mâles ont été nourries avec 5,5 mg/mL (5 500 ppm) d'AGE dans une solution de saccharose à 5 % pendant 3 jours. Une augmentation du nombre de mutations récessives selon le sexe a été observée. Au même dosage, l'AGE n'a pas entraîné d'augmentation du nombre de translocations réciproques (NTP, 1990a). In vitro Tests d’Ames – L'AGE a entraîné des mutations chez les Salmonella typhimurium de type de substitution de base TA100 et TA1535 à des doses comprises entre 10 et 10 000 µg/boîte. L'AGE s'est révélé mutagène en présence et en l'absence de S9. L'AGE ne s'est pas révélé mutagène chez les souches mutées par déphasage TA98 et TA1537 avec ou sans S9 (Canter et al., 1986; NTP, 1990a). Des cellules d'ovaires de hamsters chinois ont été incubées pendant 2 h à 37 ºC avec de l'AGE (1 à 50,2 µg/mL –S9 ou 3,3 à 100 µg/mL +S9). Toutes les concentrations ont fortement favorisé un échange de chromatides sœurs et des aberrations chromosomiques (tendance du test : p < 0,001 dans toutes les conditions). Aux concentrations les plus élevées, le retard du cycle cellulaire était évident (NTP, 1990a). Chromotest SOS – Positif lors de l'incubation de 250 µL d'Escherichia coli PQ37 avec 10 µL d'AGE dissous pendant 2 h (von der Hude, 1990). L'ADN de testicules de saumon a été incubé directement avec l'AGE (500 mM) pendant 24 h à 37 ºC. L'AGE a réagi directement avec l'adénine et la guanine pour former des adduits d'ADN (Plna et Segerback, 1997). |
| Glycidol |
| Cancérogénicité |
Exposition par voie orale : Des groupes de 15 souris haploïdes semi-dominantes p16Ink4a/p19Arf de chaque sexe ont été exposés à 0, 25, 50, 100 ou 200 mg/kg p.c./j de glycidol administré dans de l'eau désionisée, par gavage, 5 jours par semaine pendant 40 semaines. Le locus supprimé CDKN2A est responsable de deux protéines de suppression, l'une régulant le cycle cellulaire (p16Ink4a) et l'autre induisant la phase G1 et l'apoptose (p19Arf). La suppression de CDKN2A prédispose ainsi les souris au cancer sur différents sites. Les études utilisant ces souris requièrent donc une exposition plus brève et moins d'animaux. Des augmentations statistiquement significatives des sarcomes histiocytaires, en comparaison avec les témoins, ont été observées à 50 et 200 mg/kg p.c. chez les mâles (augmentation également constatée dans tous les groupes des deux sexes exposés à 50 mg/kg et plus, sans être statistiquement significative), ainsi que des adénomes alvéolaires/bronchiolaires à 100 mg/kg p.c. chez les mâles et à 200 mg/kg p.c. chez les femelles. Une augmentation statistiquement significative du nombre d'hyperplasies épithéliales du secteur gastrique antérieur a été constatée chez les mâles et les femelles à 200 mg/kg p.c. Les effets non néoplasiques constatés se caractérisent par un gonflement de la rate et des foyers dans le foie à 200 mg/kg p.c. chez les mâles, une neuropathie, une gliose et des hémorragies cérébrales à 200 mg/kg p.c. ainsi qu’à 100 et 200 mg/kg p.c. chez les femelles, de même qu'une atrophie des organes reproducteurs mâles et une baisse de la numération de spermatozoïdes à 200 mg/kg p.c. (NTP, 2007). Des rats F344N1 et des souris B6C3F1 ont été exposés respectivement à 0, 37,5 ou 75 mg/kg p.c./j et à 0, 25 ou 50 mg/kg p.c./j de glycidol par gavage 5 jours par semaine pendant 103 semaines. Chaque dose a été administrée à un groupe de 50 animaux de chaque sexe. Les constatations suivantes ont été considérées comme des preuves évidentes de cancérogénicité : des mésothéliomes de la tunique vaginale (3/49, 34/50, 39/47), des fibroadénomes des glandes mammaires (3/45, 8/39, 7/17), des gliomes du cerveau (0/46, 5/50, 6/30), ainsi que des tumeurs du secteur gastrique antérieur (1/46, 2/50, 6/32), de l'intestin (0/47, 1/50, 4/37), de la peau (0/45, 5/41, 4/18), de la glande de Zymbal (1/49, 3/50, 6/48) et de la glande thyroïde (1/46, 4/42, 6/19) chez les rats mâles; des fibroadénomes (14/49, 32/46, 29/44) et des adénocarcinomes (1/50, 11/48, 16/48) des glandes mammaires, des gliomes du cerveau (0/49, 4/46, 4/46), de la leucémie (13/49, 14/44, 20/41) et des tumeurs de la muqueuse buccale (1/46, 3/37, 7/26), du secteur gastrique antérieur (0/47, 4/38, 11/30), du gland du clitoris (5/49, 9/47, 12/45) et de la glande thyroïde (0/49, 1/38, 3/35) chez les rats femelles; des tumeurs de la glande de Harder (8/46, 12/41, 22/44), du secteur gastrique antérieur (1/50, 2/50, 10/50), de la peau (0/50, 0/50, 4/50), du foie (24/50, 31/50, 35/50) et du poumon (13/50, 11/50, 21/50) chez les souris mâles, ainsi que des tumeurs de la glande de Harder (4/46, 11/43, 17/43), des glandes mammaires (2/50, 6/50, 15/50), de l'utérus (0/50, 3/50, 3/50), du tissu souscutané (3/50, 3/50, 9/50) et de la peau (0/50, 0/50, 2/50) chez les souris femelles. Aucun signe clinique lié au composé ou de toxicité non néoplasique n'a été constaté chez les rats ou les souris (NTP, 1990b). Des hamsters dorés, ou syriens (20 animaux de chaque sexe) ont été exposés à 100 mg/kg p.c./j de glycidol (en solution 1:1 avec de l'acétate d'éthyle et de l'huile de maïs) par gavage, 2 fois par semaine pendant 60 semaines. Les groupes témoins comportent 12 animaux de chaque sexe, exposés à la solution sans glycidol pendant 90 semaines. Les nombres de tumeurs observées respectivement chez les mâles et les femelles exposés et témoins, pour les types de tumeurs les plus fréquents, sont les suivants : rate (2, 4, 0, 0), corticosurrénale (3, 2, 4, 3), secteur gastrique antérieur (3, 0, 0, 0) et utérus/col de l'utérus (0, 1, 0, 2). Aucune analyse statistique n'a été présentée. Le nombre d'animaux examinés à la recherche de tumeurs dans chaque groupe n'est pas clairement indiqué. Les auteurs ont précisé que les tumeurs de la corticosurrénale sont communes chez cette espèce de hamster, mais que les hémangiomes et hémangiosarcomes de la rate sont très rares (Lijinski, 1992). Exposition cutanée : Un groupe de 20 souris suisses IRC/Ha femelles a été exposé à une solution de glycidol à 5 % dilué dans l'acétone, par application sur la peau du dos, 3 fois par semaine pendant 520 jours. Les groupes témoins comportent trois groupes de respectivement 40, 50 et 30 animaux de même espèce et de même sexe, exposés au solvant, et trois groupes de 100 animaux ne recevant aucun traitement. Les taux de survie des groupes exposés et témoins sont comparables, et aucune tumeur ou lésion cutanée n'a été observée (Van Duuren, 1967). |
| Génotoxicité |
In vivo Injection intrapéritonéale : Des souris B6C3F1 mâles (5 par groupe) ont reçu deux injections intrapéritonéales de glycidol dissous dans une solution saline tamponnée au phosphate (PBS), à 24 h d'intervalle (27,5, 75 ou 150 mg/kg). Le volume total de chaque dose était de 0,4 mL. Les animaux témoins n'ont reçu que la PBS par injection intrapéritonéale. De la mitomycine C a été administrée aux animaux témoins positifs. Les souris ont été euthanasiées 24 h après la seconde injection et leurs érythrocytes polychromatiques (PCE) ont été examinées à la recherche de cellules micronucléaires. Le nombre de ces cellules a augmenté de façon significative (essai 1, p < 0,001; essai 2, p < 0,05) à la dose la plus élevée, pour chacun des deux essais (NTP, 1990b). Exposition par voie orale : Des Drosophila melanogaster mâles ont été nourris avec une solution de saccharose à 5 % contenant 1,23 mg/mL (1 230 ppm) de glycidol pendant 3 jours. Les mâles ont ensuite été accouplés à 3 femelles pendant 3 jours, puis à des femelles vierges à 2 jours d'intervalle, pour un total de 3 couvées. Le glycidol a entraîné des mutations récessives liées au sexe. La même dose a également causé des translocations réciproques (NTP, 1990b) . In vitro Tests d’Ames – Le glycidol s'est révélé mutagène à des doses comprises entre 1 et 10 000 µg/boîte sur les espèces de Salmonella typhimurium TA97, TA98, TA100, TA1535 et TA1537 avec ou sans activation métabolique S9 (NTP, 1990b). Autres études (tests d’Ames) : McCann et al., 1975; Loquet et al., 1981. Des cellules L1578Y/TK ont été exposées à du glycidol, à des concentrations comprises entre 0,313 nL/mL et 40 nL/mL. Les cellules ont été traitées à 37 ºC pendant 4 h, puis mises en incubation pendant 48 h dans un milieu dépourvu de glycidol. La résistance des cellules à la trifluorothymidine (Tft) a ensuite été testée. Le glycidol a entraîné une résistance à la Tft à des niveaux de concentration bas (dès 1,25 nL/mL). Le test a été effectué sans activation métabolique uniquement (NTP, 1990b). Des cellules d'ovaires de hamsters chinois (CHO) traitées à un dosage compris entre 1,1 et 150 µg/mL, en présence ou non de S9, ont montré des échanges de chromatides sœurs importants à tous les dosages testés (NTP, 1990b). Les cellules de CHO mises en incubation avec du glycidol (12,5 à 400 µg/mL) avec et sans activation ont démontré des aberrations chromosomiques importantes à toutes les doses (NTP, 1990b). Les dommages subis par l'ADN ont été évalués par électrophorèse en gel de cellules simples/essai comète. Des cellules de CHO exposées pendant 3 h à 5, 10, 20 ou 30 µg/mL ont présenté un ADN endommagé pour toutes les doses. Des augmentations statistiquement significatives (p <0,05) ont été observées à 20 et 30 µg/mL (El Ramy et al., 2007). |
| Éther de phényle et de glycidyle |
| Cancérogénicité |
| Exposition par inhalation : Des rats Sprague-Dawley (100 animaux de chaque sexe par groupe de dosage) ont été exposés à 0, 6, 74 mg/m3 (0, 1 ou 12 ppm) d'éther de phényle et de glycidyle (pur à 99,6 %) 6 heures/jour, 5 jours/semaine pendant 24 mois par inhalation globale (Lee, 1983). Aucune information relative à la survie n'a été fournie. Des tumeurs nasales liées à l'exposition ont été observées à 74 mg/m3 uniquement (signification statistique non précisée) avec une incidence de 0/89, 0/83 et 9/85 et 1/87, 0/88 et 4/89 chez les mâles et les femelles, respectivement. Une augmentation du nombre de rhinites et de métaplasies squameuses a également été observée à 74 mg/m3; elle est estimée liée aux tumeurs nasales. Le CIRC indique des valeurs p respectives de 0,007 et 0,06 pour la rhinite et la métaplasie aux doses élevées pour les mâles et les femelles (Lee, 1983). |
| Génotoxicité |
In vivo Exposition par inhalation : Essai de létalité dominante – Des rats mâles ont été exposés à 0, 12,3, 36,8 ou 67,6 mg/m3 (0, 2, 6, ou 11 ppm) 6 h par jour pendant 19 jours consécutifs, puis accouplés avec 3 femelles non traitées, chacun pendant 6 semaines. Aucune modification indiquant un effet de létalité dominante n'a été observée (Terrill et al., 1982). Exposition par inhalation : Des rats mâles ont été exposés à 0, 12,3, 36,8 ou 67,6 mg/m3 (0, 2, 6, ou 11 ppm) d'éther de phényle et de glycidyle, 6 h par jour pendant 19 jours consécutifs. Aucune augmentation du nombre d'aberrations chromosomiques n'a été observée dans les cellules de moelle osseuse (Terrill et al., 1982). Exposition par voie orale : Des souris ayant été exposées à une dose unique allant jusqu'à 1 000 mg/kg p.c. ont été euthanasiées 24 h après le traitement et les cellules de leur moelle osseuse ont été examinées à la recherche d'érythrocytes micronucléaires. Aucune augmentation du nombre de micronoyaux n'a été observée (Seiler, 1984a). Exposition par voie orale : Des souris ont reçu une dose unique de 500 mg/kg. La synthèse d'ADN testiculaire a été examinée. L'éther de phényle et de glycidyle n'a pas eu d'effet sur la capacité de la [3H]thymidine à atteindre les testicules ou sur la synthèse de l'ADN, selon la mesure de l'activité spécifique de la [3H]thymidine incorporée à l'ADN (Greene et al., 1979) In vitro Test d’Ames – L'éther de phényle et de glycidyle s'est avéré mutagène dans les souches de Salmonella typhimurium TA97, TA100 et TA1535 (sensibles aux mutagènes de paires de bases) mais pas dans les souches TA98, TA1537 et TA1538 (sensibles aux mutagènes par déphasage) avec et sans activation métabolique (Canter et al.,1986; Greene et al., 1979; Ivie et al., 1980; Neau et al., 1982; Ohtani et Nishioka, 1981; Seiler, 1984b). Essai par passage sur hôte – Des souris ont reçu une dose unique de 2 500 mg/kg p.c. par voie orale, intrapéritonéale ou intramusculaire. Des réactions positives faibles ont été observées chez les souris traitées par voie orale et intramusculaire. Le test s'est révélé négatif pour l'administration par voie intrapéritonéale (Greene et al., 1979). Des cellules d'ovaires de hamsters chinois (CHO) ont été incubées avec de l'éther de phényle et de glycidyle (6,25 à 100 µg/mL) pendant 6 ou 18 à 24 h sans S9 ou pendant 6 h avec S9. Aucune des conditions de test n'a permis d'observer des mutations des cellules de CHO (Greene et al., 1979). La substance s'est avérée mutagène sur la Klebsiellapneumoniae et l'Escherichia coli WP2 uvrA (Voogd et al., 1981; Hemminki et Vanio, 1980; Ohtani et Nishioka, 1981). Chromotest SOS – Positif lors de l'incubation de 250 µL d'Escherichia coli PQ37 avec 10 µl d'éther de phényle et de glycidyle dissous pendant 2 h (von der Hude, 1990). Une alkylation de l'ADN par l'éther de phényle et de glycidyle a été observée in vitro. (Hemminki et al., 1980). La substance ne se lie pas à l'ADN dans l'Escherichia coli avec ou sans activation métabolique (Hubinski et al., 1981). |
| Éther de bisphénol A et de diglycidyle |
| Cancérogénicité |
Exposition par voie cutanée : Des groupes de 50 souris CF1 de chaque sexe (99 mâles et 100 femelles pour les groupes témoins) ont été exposés à une solution de 0, 1 % ou 10 % (0,2 mL) de BADGE pur dilué dans l'acétone, appliqué localement 2 fois par semaine pendant 103 semaines. Les témoins ont été exposés à de l'acétone uniquement. Un groupe témoin positif a été exposé à de la ß-propiolactone. L'exposition n'a eu aucune incidence sur la survie. Trois mâles du groupe exposé à une solution à 10 % et 1 femelle du groupe exposé à 1 % ont développé des tumeurs au niveau du site d'exposition. Trois femelles du groupe exposé à une solution à 1 % ont développé des tumeurs cutanées distantes du site d'exposition. Le nombre de tumeurs cutanées, aussi bien au niveau du site d'exposition que de l'ensemble des sites, n'est pas significatif. Aucune tumeur systémique liée à l'exposition n'a été détectée chez les mâles. Une tendance significative au développement de lymphosarcomes thymiques a été observée chez les femelles. Les auteurs ont relevé une incidence sous-jacente relativement élevée de néoplasies lymphoréticulaires et hématopoïétiques pour cette souche particulière dans le laboratoire, qui a pu être causée par un virus (Persitianis, 1988). Autres études par exposition cutanée : Zakova, 1985; Holland, 1979; Weil, 1963; Hine, 1958. |
| Génotoxicité |
In vivo Exposition par voie orale : Dix souris B6D2F1 femelles ont reçu 1 000 mg/kg p.c./j pendant 5 jours consécutifs. Aucune augmentation du nombre de micronoyaux par rapport au groupe témoin non exposé n'a été observée (Pullin, 1977). Exposition par voie orale : La capacité du BADGE à endommager l'ADN a été étudiée. Une dose unique de 500 mg/kg p.c. a été administrée à des rats Wistar mâles et femelles. Les dommages subis par l'ADN ont été évalués grâce à un essai d'élution alcaline. Aucun dommage détectable de l'ADN monocaténaire n'a été observé dans des cellules du foie 6 heures après l'administration de la dose (Wooder et Creedy, 1981). Exposition cutanée : Essai de létalité dominante – 10 souris B6D2F1 mâles ont été traitées localement à un dosage de 3 000 mg/kg p.c., 3 fois par semaine pendant au moins 8 semaines. Après l'exposition, les mâles ont été accouplés avec 3 femelles vierges par semaine pendant 2 semaines. Deux semaines plus tard, les femelles ont été euthanasiées et l'on a recherché le nombre de grossesses, le nombre de nidations et la mortalité fœtale. Aucun effet néfaste n'a été observé en comparaison avec le groupe témoin (Pullin, 1977). Une autre étude de létalité dominante a également indiqué l'absence d'effets néfastes liés à l'administration de BADGE. Toutefois, aucun détail n'a été fourni dans cette étude (Hine et al., 1981). Exposition cutanée : Des souris mâles C3H ont été traitées avec 20 mg/mL de BADGE, sous pansement occlusif. Les animaux ont été euthanasiés à 48, 96 ou 122 h et l'ADN de l'épiderme a été isolé. On a observé des liaisons de métabolites de BADGE avec l'adénine dans l'ADN, à une fréquence d'environ 0,1 à 0,8 adduit pour 106nucléotides (Steiner et al., 1992). In vitro Test d’Ames – Des Salmonella typhimurium TA1535, TA1537, TA1538, TA98 et TA100 ont été traitées avec du BADGE, avec et sans activation métabolique. Les effets du BADGE ont été négatifs sur toutes les souches en l'absence d'activation métabolique. Avec activation, le BADGE a entraîné des mutations chez les souches TA1535 et TA1537 7 à 10 fois supérieures à l'incidence sous-jacente. Les résultats ont été négatifs sur toutes les autres souches testées. Le BADGE ne s'est pas révélé mutagène sur l'E. coli WP2 ou WP2 uvrA (Brooks et al., 1981). Le BADGE a été testé sur les souches TA100 et TA1538 avec des doses allant de 10 à 10 000 µg/boîte. Sans activation, une réaction positive faible a été observée. Des réactions positives ont été observées avec activation métabolique par S9 dérivé de foie de rat ou de hamster (Canter et al., 1986). Autres études de mutations sur les bactéries : Pullin, 1977; Andersen, 1978; Wade et al., 1979; Ringo et al.,1982. Test des urines – Négatif : l'urine de souris exposées par gavage une fois par jour à un dosage de 1 000 mg/kg de BADGE ne s'est pas révélée mutagène sur la souche TA1535 (Pullin, 1977). Essai par passage sur hôte – Négatif : De la S. typhimurium a été inoculée dans la cavité péritonéale de souris exposées par gavage pendant 5 jours à un dosage de 1 000 mg/kg de BADGE. Aucune augmentation du nombre de révertants n'a été observée (Pullin, 1977). Des cellules de S. cerevisiae JD1 ont donné un résultat positif pour la conversion génique mitotique lors de leur incubation avec du BADGE, avec ou sans enzymes microsomales (Brooks et al., 1981). Des cellules de foie de rat ont été mises en culture en présence de BADGE (3,75, 5, 7,5, 10, 15 et 20 µg/mL). Une augmentation des aberrations chromosomiques liée à la dose a été constatée dans les cellules traitées avec une dose variant de 10 à 20 µg/mL (Brooks et al., 1981). La capacité du BADGE à entraîner des transformations néoplasiques a été évaluée dans des cellules de reins de jeunes hamsters. La fréquence des transformations néoplasiques observée a été multipliée par cinq. Aucune autre information n'a été fournie à titre de référence secondaire (Brooks et al., 1981) |