Évaluation préalable pour le Défi concernant la 1,3-diphényleguanidine (diphénylguanidine) Numéro de registre du Chemical Abstracts Service 102-06-7 Environnement Canada Santé Canada Juin 2013
Table des matières
- Sommaire
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Résumé des renseignements relatifs effets de la DPG sur la santé
Sommaire
Conformément à l'article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l'Environnement et de la Santé ont procédé à une évaluation préalable de la 1,3 diphénylguanidine, communément appelée diphénylguanidine ou DPG, dont le numéro de registre du Chemical Abstracts Service[1] est 102-06-7. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi, dans le cadre du Plan de gestion des produits chimiques, car elle présente un risque d'exposition intermédiaire pour la population canadienne et qu’elle a été classée par d’autres organismes en fonction de sa toxicité pour la reproduction. Cette substance répond aux critères environnementaux relatifs à la persistance, mais elle ne répond pas à ceux relatifs au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes aquatiques.
Selon les renseignements déclarés conformément à l'article 71 de la LCPE (1999), entre 100 000 et 1 000 000 kg de DPG ont été importés au Canada en 2006 et entre 100 000 et 1 000 000 kg ont été utilisés. Aucune entreprise n'a déclaré avoir fabriqué de la DPG en 2006. Moins de 100 kg de cette substance ont été rejetés dans l'air et également moins de 100 kg ont été rejetés dans l'eau au Canada durant la même année. La DPG est principalement utilisée comme accélérateur pour réduire le temps de cuisson durant le processus de vulcanisation dans la fabrication du caoutchouc pour les pneus et certaines applications industrielles. D'après les données soumises en application de l'article 71 de la LCPE (1999), la DPG est utilisée, au Canada, dans la fabrication de pneus en caoutchouc, de mélanges de caoutchouc, de feuilles industrielles minces en caoutchouc ainsi que dans la fabrication de matériaux d'étanchéité dans les industries automobile et de la marine.
D'après les renseignements disponibles, l'exposition de la population générale canadienne à la DPG dans les milieux naturels (à l'exception du sol) est considérée comme négligeable. Aucune exposition à la DPG provenant de sources alimentaires n’est prévue. Selon les renseignements disponibles et les données de l'industrie rapportées en application de l'article 71 de la LCPE (1999), la DPG est utilisée au Canada dans la fabrication de matériaux de caoutchouc pour les pneus et les applications industrielles. L'exposition à la DPG présente dans le sol qui contient des débris de pneus a été évaluée et jugée faible. Les produits de consommation ne devraient pas être une source d'exposition à cette substance pour la population générale.
L'effet critique sur la santé associé à l'exposition à la DPG est la toxicité pour la reproduction, selon les observations sur des animaux de laboratoire et la classification reposant sur la méthode du poids de la preuve réalisée par des organismes internationaux.
Les marges entre l'estimation de la limite supérieure d'exposition de la population générale à la DPG par contact avec le sol contenant des débris de pneus et la plus faible dose avec effet observé relevée chez les animaux de laboratoire sont considérées comme adéquates pour tenir compte des incertitudes dans les bases de données concernant les effets sur la santé et l'exposition.
À la lumière des renseignements disponibles, il est conclu que la DPG ne satisfait pas au critère énoncé à l’alinéa 64(c) de la LCPE (1999) car elle ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
La DPG répond aux critères de persistance, mais elle ne répond pas à ceux du potentiel de bioaccumulation, tels qu'ils sont énoncés dans le Règlement sur la persistance et la bioaccumulation. Il est prévu que cette substance présentera un potentiel modéré de toxicité pour les organismes aquatiques et un potentiel de toxicité élevé pour certaines espèces d'algues. Une analyse du quotient de risque, intégrant des estimations prudentes de l'exposition aux renseignements liés à la substance, a été réalisée pour le milieu aquatique, afin de déterminer si la substance pourrait avoir des effets nocifs sur l'environnement au Canada. Le quotient de risque obtenu pour ce scénario indiquait que les concentrations de DPG dans l'eau estimées pour l'exposition propre aux sites industriels ne devraient pas causer de tels effets nocifs pour les organismes aquatiques. Selon ces renseignements, il est conclu que la DPG ne satisfait pas aux critères énoncés aux alinéas 64(a) ou (b) de la LCPE (1999) car elle ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l'environnement essentiel pour la vie.
D'après les renseignements disponibles, il est conclu que la DPG ne satisfait à aucun des critères énoncés à l'article 64 de la LCPE (1999).
La possibilité d’inclure cette substance dans la mise à jour de l'inventaire de la Liste intérieure sera envisagée. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
Introduction
La Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999) exige que les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l'on croit être commercialisées au Canada;
- celles qui répondent aux critères de catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements spécifiques qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à développer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires et à élaborer des références.
Une priorité élevée a été accordée à l'évaluation des risques que comporte la diphénylguanidine (DPG) pour la santé humaine étant donné qu'on a déterminé que la substance présente un risque d'exposition intermédiaire (REI) et qu'elle a été classée par d'autres organismes en fonction de sa toxicité pour la reproduction.
Le volet du Défi portant sur la diphénylguanidine a été publié dans la Gazette du Canada le 26 décembre 2009 (Canada, 2009). En même temps a été publié le profil de cette substance, qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements sur les utilisations de la substance ont été reçus en réponse au Défi.
Même s'il a été jugé hautement prioritaire d'évaluer les risques que présente la diphénylguanidine pour la santé humaine et qu'elle répond aux critères environnementaux de catégorisation pour la persistance, elle ne répond pas aux critères liés au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE (1999) sont centrées sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères énoncés à l'article 64 de la Loi. Elles visent à examiner les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence[2].
La présente évaluation préalable finale prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l'exposition, y compris ceux fournis dans le cadre du Défi. Les données utiles à l'évaluation préalable de cette substance sont tirées de publications originales, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et d'autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en août 2010 pour les effets écologiques, et jusqu'en mai 2010 pour les effets sur la santé et l'exposition. Les études importantes ont fait l'objet d'une évaluation critique. Par ailleurs, il est possible que les résultats de modélisation aient servi à formuler des conclusions.
L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition de la population générale (exposition non professionnelle) et de l'information sur les dangers pour la santé (principalement d'après les évaluations s'appuyant sur la méthode du poids de la preuve effectuées par d'autres organismes, lesquelles ont servi à déterminer le caractère prioritaire de la substance). Dans le contexte d'une évaluation préalable, les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur l'écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition, compte tenu de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets. L’évaluation préalable finale ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. On y présente plutôt un sommaire des éléments d'information les plus importants pour appuyer la conclusion proposée.
Cette évaluation préalable finale a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes exécutés par ces ministères. Les parties qui portent sur la santé humaine et l'écologie ont fait l'objet d'une étude rédigée par des pairs ou d'une consultation de ces derniers. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus de la part de Mme Irene Abraham, Ph. D. (Toxicology Excellence for Risk Assessment); de M. Michael Jayjock, Ph. D. (The Lifeline Group) et de Mme Susan Griffin, Ph. D. (USEPA). Les approches suivies pour les évaluations préalables dans le cadre du Défi ont été examinées par un groupe indépendant, soit le Groupe consultatif du Défi. Même si les commentaires venant de l'extérieur ont été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable finale.
Les principales données et considérations sur lesquelles repose la présente évaluation finale sont résumées ci-après.
Identité de la substance
Aux fins du présent document, la 1,3-diphénylguanidine est appelée DPG, soit l'acronyme correspondant au nom commun diphénylguanidine. Les renseignements liés à la DPG sont résumés dans le tableau 1.
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 102-06-7 |
|---|---|
| Nom dans la LIS[1] | 1,3-Diphénylguanidine |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | Guanidine, N,N’-diphenyl- (TSCA, PICCS, ASIA-PAC, NZIOC); 1,3-diphenylguanidine (ENCS, ECL); 1,3-diphénylguanidine (EINECS) diphenylguanidine (ENCS, PICCS); diphenyl guanidine (PICCS); guanidine, N,N’-diphenyl- (AICS, SWISS); N,N'-diphenyl guanidine (PICCS); guanidine, 1,3-diphenyl (PICCS); DPG (Vulcacit D) [PICCS] |
| Autres noms | 1,2-Diphénylguanidine; Accel D; Accel DM-R; Accelerator D; Chlorostain; BR; Denax; Denax DPG; DFG; DPG; N,N'-diphénylguanidine; Nocceler D; NSC 3272; Perkacit DP; Perkacit DPG; Rhenogran DPG; Rhenogran DPG 80; Rhenogran DPG 80P; Sanceler D; Sanceler D-G; Soxinol D; Soxinol DG; sym-Diphénylguanidine; Vanax; DPG; Vulcafor DPG; Vulkacit D; Vulkacit D/C; Vulkazit |
| Groupe chimique (groupe de la LIS) |
Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Amines aromatiques complexes |
| Principale sous-classe chimique | Dérivés de guanidine (phényles) |
| Formule chimique | C13H13N3 |
| Structure chimique (forme neutre : DPG) | 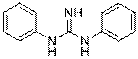 |
| Structure chimique (forme ionique : DPG-H+) | 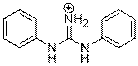 |
| Structure chimique (forme ionique : DGP-H22+) | 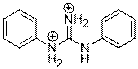 |
| Structure chimique (forme ionique : DGP-H33+) | 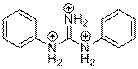 |
| SMILES (forme neutre) [2] | N=C(Nc(cccc1)c1)Nc(cccc2)c2 |
| Masse moléculaire (forme neutre) | 211,27 g/mol |
[2] Simplified Molecular Input Line Entry System
Les impuretés rapportées dans le produit commercial sont des polymères d'aniline et des polymères azotés, à des concentrations inférieures à 1 % (OCDE, 2002).
La DPG devrait se protoner considérablement dans l'eau à des pH ambiants de sorte que la principale forme présente dans l'eau est la forme ionique DPG-H+, comme l'indique le tableau 1.
Selon le programme de modélisation pKa dB de ACD/pKaDB (2005), la DPG s'ionise dans l'eau comme une base en trois étapes, soit en attirant un proton sur chacun des groupes aminés. DPG indique la forme neutre de la substance. Les étapes d'ionisation et les constantes de dissociation acide prévues par le programme sont les suivantes :
DPG-H+ ↔ DPG + H+ pKa1 = 10,12
DGP-H22+ ↔ DPG-H+ + H+ pKa2 = -1,08
DPG-H33+ ↔ DPG-H22+ + H+ pKa3 = -8,16
L'ionisation générale peut être représentée par la formule suivante :
Acide ↔ Base conjuguée + H+
Ka = [Base conjuguée][H+]/[Acide]
Pour un pH donné, le rapport de concentration acide/base est le suivant :
[Acide]/[Base] = 10pKa-pH
La constante de dissociation acide primaire (pKa1 = 10,12) est supérieure à 9, ce qui indique une protonation presque complète de la substance au cours de la première étape sous conditions ambiantes. Par conséquent, la forme neutre (DPG) est présente à des concentrations beaucoup plus faibles dans une solution aqueuse. La constante de dissociation acide secondaire (pKa2 = -1,08) est bien inférieure à 5, ce qui indique que la protonation de la forme basique DPG-H+ dans cette étape est négligeable. Par conséquent, celle-ci sera présente dans une proportion beaucoup plus élevée que les formes acides DPG-H22+ (tableau 2). Enfin, la constante de dissociation acide tertiaire (pKa3 = -8,16) est bien inférieure à 5, ce qui indique qu'il n'y aura pas davantage de protonation de la forme basique DPG-H22+, de sorte que la forme acide DPG-H33+ sera seulement présente dans l'eau à des concentrations beaucoup plus faibles que la DPG-H+.
En résumé, la DPG est considérablement protonée dans l'eau, de telle sorte que la forme prédominante dans ce milieu est la forme ionisée DPG-H+. La proportion des différentes formes dans l'eau est calculée en divisant la concentration relative d'une forme par la concentration totale à un pH donné à l'aide de la formule acide-base ci-dessus. Les résultats sont présentés dans le tableau 2 (Environnement Canada, 2010a).
| pH | Proportion (%) | ||||
|---|---|---|---|---|---|
| DPG | DPG-H+ | DPG-H22+ | DPG-H33+ | Total | |
| 5,0 | 0,0 | 100,0 | 0,0 | 0,0 | 100,0 |
| 6,0 | 0,0 | 100,0 | 0,0 | 0,0 | 100,0 |
| 7,0 | 0,1 | 99,9 | 0,0 | 0,0 | 100,0 |
| 8,0 | 0,8 | 99,2 | 0,0 | 0,0 | 100,0 |
| 9,0 | 7,1 | 92,9 | 0,0 | 0,0 | 100,0 |
Propriétés physiques et chimiques
Le tableau 3 ci-dessous présente les propriétés physiques et chimiques (valeurs expérimentales et modélisées) de la DPG qui se rapportent à son devenir dans l'environnement.
| Propriété | Type | Valeur[1] | Température (°C) | Référence |
|---|---|---|---|---|
| Point de fusion (°C) |
Expérimental | 150* | Howard, 1989; PhysProp, 2006 |
|
| Modélisé | 120,14 | MPBPWIN, 2008 | ||
| Point d'ébullition (°C) |
Modélisé | 360,5** | MPBPWIN, 2008 | |
| Pression de vapeur (Pa) |
Modélisé | 5,29 × 10-4,/ (3,97 × 10-6 mm Hg) |
MPBPWIN, 2008 | |
| Constante de la loi de Henry (Pa m3/mol) |
Modélisé | 1,12 × 10-4 (1,1 × 10-9atm ·m3/mol) |
25 | HENRYWIN, 2008 |
| Log Koe (log du coefficient de partage octanol-eau [sans dimension]) |
Modélisé | 2,89 | EPI Suite (2008) | |
| Log D*** (log du coefficient de partage octanol-eau pour les espèces ioniques [sans dimension]) |
Modélisé (en tenant compte de la forme chargée) |
0,73 (at pH 5) |
ACD/pKaDB, 2005 | |
2,13 (à pH 7) |
||||
| 2,36 (at pH 9) |
||||
| Log Kco (log du coefficient de partage carbone organique-eau [sans dimension]) |
Modélisé | 3,22 | EPI Suite (2008) (méthode de l'ICM) |
|
| Modélisé | 2,44 | EPI Suite (2008) (méthode du log Koe) |
||
| Log Koa (log du coefficient de partage carbone organique-air [sans dimension]) |
Modélisé | 12,43 | EPI Suite (2008) | |
| Solubilité dans l'eau (mg/L) | Expérimental | 1 000* | 25 | MITI, 1992 |
| Modélisé | 68,83 | 25 | WATERNT, 2008 | |
| pKa (constante de dissociation acide [sans dimension]) |
Expérimental | 10,12 (pKa1) -1.08 (pKa2) -8.16 (pKa3) |
Perrin, 1965 |
[*] Valeur choisie pour la modélisation.
[**] Selon le Merck Index, la DPG se décompose à 170 °C.
[***] Le log D est le coefficient de répartition qui tient compte de la présence de l'espèce ionique. Il représente la quantité nette des formes neutres et ioniques qui devraient se répartir dans la phase lipidique ou dans le carbone organique à un pH donné.
Sources
La DPG est une substance anthropique qui n'est pas présente de manière naturelle dans l'environnement. Elle peut être préparée par la réaction de l'aniline avec le chlorure de cyanogène à une température de 160 °C et dans un rapport molaire de 2:1 (GDCh-BUA, 1992). Selon les données présentées conformément à l'article 71 de la LCPE (1999), aucune entreprise canadienne n'a déclaré avoir fabriqué de DPG en une quantité égale ou supérieure au seuil de déclaration de 100 kg en 2006. Cependant, la quantité importée se situait entre 100 000 et 1 000 000 kg pour cette même année (Environnement Canada, 2010a). Pendant l'année civile 1986, environ 250 000 kg de DPG ont été fabriqués, importés ou commercialisés au Canada (Environnement Canada, 1988).
Utilisations
D'après les données soumises en vertu de l'article 71 de la LCPE (1999), la DPG est utilisée, au Canada, dans la fabrication de pneus en caoutchouc, les mélanges de caoutchouc, les toiles cirées industrielles ainsi que les matériaux d'étanchéité dans les industries automobile et maritime (Environnement Canada, 2010a). D'après les renseignements disponibles, la DPG est utilisée au Canada dans la fabrication de matériaux de caoutchouc pour les pneus et les applications industrielles (Environnement Canada, 2010a; courriel du Bureau de la gestion du risque de Santé Canada à la Division des substances existantes de Santé Canada en mai 2010, source non citée). La quantité totale de DPG utilisée au Canada en 2006 selon les déclarations effectuées en vertu de l'article 71 se situait entre 100 000 et 1 000 000 kg (Environnement Canada, 2010a).
À l'échelle mondiale, la DPG est utilisée comme accélérateur pour réduire le temps de cuisson durant le processus de vulcanisation permettant de fabriquer du caoutchouc pour divers produits : pneus, chaussures, gants de caoutchouc, câbles, tuyaux et articles moulés (Ross, 1969; CIRC, 1982; Feinman, 1987; GDCh-BUA, 1992; NTP, 1995; Ohm, 2000). Environ une tonne de DPG a également été utilisée en Allemagne dans des « papiers spéciaux » (p. ex. à l'épreuve de la falsification) en 1991 (GDCh-BUA, 1992).
La DPG n'est pas répertoriée comme additif alimentaire approuvé au titre 16 du Règlement sur les aliments et drogues (Canada, 1978) et n'a jamais été utilisée dans les additifs indirects au Canada (communication personnelle de la Direction des aliments de Santé Canada adressé au Bureau de la gestion du risque de Santé Canada en 2010, source non citée). La Food and Drug Administration des États-Unis classe la DPG comme un additif indirect utilisé dans des articles de caoutchouc qui sont en contact avec les aliments et qui sont destinés à des usages répétés (USFDA, 2008). Une utilisation similaire de la DPG dans les emballages de cafetières à décompression a été signalée au Japon (Baba, 1980). La DPG ne figure pas dans la Base de données sur les ingrédients de produits de santé naturels (BDIPSN) ni dans la Base de données des produits de santé naturels homologués (BDPSNH) en tant qu'ingrédient médicinal ou non médicinal dans les produits de santé naturels homologués au Canada (BDIPSN, 2010; BDPSNH, 2011).
La DPG est actuellement inscrite dans la Base de données sur les produits pharmaceutiques (BDPP) en tant qu'ingrédient médicinal dans un timbre pour des tests épicutanés chez l'humain (BDPP, 2010). Puisque les tests d'allergies sont effectués occasionnellement et que la quantité de DPG n'est que de 0,068 mg par timbre, on ne considère pas qu'il s'agit d'une source d'exposition importante pour la population (BDPP, 2010; communications personnelles adressées par la Direction des produits thérapeutiques de Santé Canada au Bureau de la gestion du risque de Santé Canada en 2010, source non citée). La DPG n'est pas inscrite dans la base de données interne des ingrédients non médicinaux de la Direction des produits thérapeutiques comme ingrédient non médicinal dans les produits pharmaceutiques et ne devrait pas être présente dans les médicaments vétérinaires (communication personnelle adressée par la Direction des produits thérapeutiques et la Direction des médicaments vétérinaires de Santé Canada au Bureau de la gestion du risque de Santé Canada en 2010; source non citée).
L'utilisation de DPG comme marqueur ou colorant (ingrédient non actif) dans six pesticides est réglementée au Canada en vertu de la Loi sur les produits antiparasitaires (Canada, 2002). Les six produits sont classés dans la catégorie « à usage restreint » (seulement aux fins d'utilisation par des applicateurs certifiés). Par conséquent, ils ne sont pas accessibles au grand public (courriel de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada adressé par à la Division des substances existantes de Santé Canada en septembre 2010, source non citée). La DPG n'est pas homologué comme ingrédient actif (ARLA, 2010).
La DPG n'est pas inscrite dans le Système de déclaration des cosmétiques de Santé Canada (SDC, 2010). En outre, elle ne figure pas sur la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques au Canada, liste administrative établie par Santé Canada (Santé Canada, 2007). La DPG ne devrait pas être présente dans des produits cosmétiques homologués au Canada.
Rejets dans l'environnement
La DPG n'est pas produite naturellement dans l'environnement. En réponse à un avis publié en application de l'article 71 de la LCPE (1999), moins de 100 kg de DPG ont été rejetés dans l'air et, de façon similaire, moins de 100 kg ont été rejetés dans l'eau au Canada en 2006. Moins de 100 kg et entre 1 000 à 10 000 kg de DPG ont été déclarés comme des déchets dangereux et non dangereux, respectivement, lesquels ont été transférés à des installations de gestion des déchets hors site au cours de l'année 2006 (Environnement Canada, 2010a). La DPG ne figure pas sur la liste des substances de l'Inventaire national des rejets de polluants (Environnement Canada, 2010c) ni sur la liste des substances devant être déclarées en vertu du Toxic Release Inventory Program des États-Unis (TRI, 2006). Ses utilisations dispersives portent à croire que des rejets pourraient avoir lieu à partir d'usines de traitement des eaux usées et de sites d'enfouissement.
Comme accélérateur utilisé principalement dans le processus de vulcanisation pour la fabrication de pneus de caoutchouc, la DPG peut être présente dans l'environnement en raison de l'usure des pneus sur les routes (GDCh-BUA, 1992); toutefois, la présence de DPG dans les matières particulaires en suspension dans l'air au Canada ou ailleurs n'a pas été relevée.
Devenir dans l'environnement
La DPG se caractérise par une solubilité dans l'eau modérée à élevée (1 000 mg/L), un faible log Doe (2,13 à un pH de 7), un log Koc faible à modéré (2,44 et 3,22) ainsi qu'une faible pression de vapeur (5,29 × 10-4 Pa). À un pH de 7, la molécule de DPG sera principalement chargée positivement (plus de 99 % des molécules seront dans leur forme ionisée). D'après les propriétés physiques et chimiques de la substance (tableau 3) et ses utilisations potentielles, la DPG devrait demeurer principalement dans l'eau ou le sol, si elle est rejetée dans ces milieux.
Compte tenu de sa constante de dissociation acide (pKa), la DPG rejetée dans des plans d'eau aux pH enregistrés dans l'environnement (5à 9) y sera surtout présente sous forme cationique. L'état d'ionisation d'un composé s'avère important pour déterminer son devenir. Une substance sous forme ionisée est plus soluble dans l'eau que sous sa forme neutre et elle se répartira dans une moindre mesure dans les phases organiques comme les lipides et d'autres matières organiques. Toutefois, des substances ionisées peuvent interagir avec des substrats à charge contraire dans les sédiments ou le sol et peuvent donc se répartir davantage dans l'un de ces milieux que ce qu’auraient indiqué certaines de leurs propriétés (hydrosolubilité, log Doe et log Kco. En outre, on ignore l'ampleur de ces interactions.
Si la DPG est rejetée dans l'eau, elle devrait demeurer en grande partie dans ce milieu en raison de sa solubilité moyennement élevée (1 000 mg/L). Les valeurs faibles à modérées du log Doe et du log Koc indiquent que la DPG peut s'adsorber dans une certaine mesure aux matières en suspension et aux sédiments. De plus, puisqu'elle existe principalement en tant que cation aux pH normalement observés dans l’environnement, elle peut s'adsorber fortement aux particules sédimentaires chargées négativement. La volatilisation à partir de la surface de l'eau devrait être un processus relativement peu important de son devenir d'après la constante estimée de la loi de Henry. En outre, en raison de son état d'ionisation dans l'eau à des pH naturels, elle restera dans l'eau ou dans le sol et l'eau en raison des interactions avec des contre-ions ainsi que des liaisons hydrogène. Par conséquent, si l'eau est le milieu récepteur, la DPG devrait principalement demeurer dans ce milieu et sera transportée, dans une certaine mesure, dans les sédiments.
En cas de rejet dans le sol, la DPG peut demeurer dans ce milieu. La volatilisation à partir des surfaces de sol humides serait un processus peu important dans le devenir de cette substance d'après la très faible valeur estimée pour la pression de vapeur et la constante de la loi de Henry. La DPG étant essentiellement non volatile, on ne s'attend donc pas à une volatilisation importante à partir des surfaces de sol sèches. Bien que le ruissellement sur le sol puisse entraîner un certain transfert de la DPG, la quantité transférée serait relativement faible puisque le ruissellement n'affecte qu'une fraction négligeable de tout le sol. Par conséquent, si elle est rejetée dans le sol, elle devrait demeurer principalement dans ce milieu.
D'après la faible valeurmodélisée de la pression de vapeur (5,29 × 10-4), la volatilité de la DPG est considérée comme faible. Si elle est rejetée dans l'air, elle se retrouvera dans le sol ou dans les eaux de surface par suite de dépôts humides. En raison de son hydrosolubilité modérée à élevée et de son point de fusion modéré (150°C), la DPG présente dans l'air pourrait être se retrouver dans la pluie ou la neige lors de précipitations. Puisque la superficie du sol est beaucoup plus grande que celle de l'eau de surface pour une région donnée, les rejets de DPG dans l'air seraient surtout transférés au sol et y demeureraient.
Par ailleurs, l'utilisation de la DPG dans des produits à base de caoutchouc ou pour toute autre utilisation qui produit des déchets solides entraînera le rejet de la substance dans des sites d'enfouissement par suite de l'élimination des déchets. La DPG aura tendance à demeurer dans une large mesure dans les sites d'enfouissement puisqu'elle se fixe normalement dans la matrice des déchets solides où elle a des contacts limités avec les lixiviats ou l'air.
Persistance et potentiel de bioaccumulation
Persistance dans l'environnement
Le tableau 4a présente les données empiriques de biodégradation pour la DPG. Un essai de biodégradation immédiate n'a montré aucune biodégradation sur une période 28 jours (CHRIP, 2008). La demi-vie de biodégradation ultime dans l'eau est donc probablement supérieure à 182 jours (6 mois) et, en conséquence, la substance est considérée comme persistante dans ce milieu. Cependant, dans les essais utilisant des inoculums préadaptés et de l'eau de rivière non adaptée (Bayer, 1990 et Chou et al., 1980, respectivement), une dégradation rapide a été observée, ce qui indique une biodégradation intrinsèque. À l'aide de l'équation du taux cinétique de premier ordre, une demi-vie de dégradation ultime dans l'eau de 13,6 jours a été calculée pour la DPG, en supposant une dégradation de 76 % sur une période de 28 jours.
| Milieu | Processus du devenir | Valeur pour la dégradation | Paramètre de dégradation et unités | Référence |
|---|---|---|---|---|
| Eau | Biodégradation (immédiate) | 0 | % DBO (28 jours) | CHRIP, 2008 |
| Eau | Biodégradation (intrinsèque)[1] | 76 | % DBO (28 jours) | Bayer, 1990 |
| Eau | Biodégradation (primaire) | 100 | % de perte de la substance (14 jours à pH 7,5) |
Chou et al., 1980 |
| Eau | Hydrolyse (80 °C, pH 3,5, 500 heures) |
0 | % | Wohlfahrt et Niebergahl, 1984 |
| Eau | Hydrolyse (80 °C, pH 7,0, 1 000 heures) |
18,1 | % | Wohlfahrt et Niebergahl, 1984 |
| Eau | Hydrolyse (80 °C, pH 10,5, 168 heures) |
50 | % | Wohlfahrt et Niebergahl, 1984 |
En raison du peu de données expérimentales sur la dégradation de la DPG, une méthode du poids de la preuve reposant sur des relations quantitatives structure-activité (RQSA) (Environnement Canada, 2007) a aussi été utilisée avec les modèles de dégradation présentés au tableau 4b ci-après. Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et que la DPG devrait être libérée dans ce milieu, on a principalement étudié la biodégradation dans l'eau. Les études expérimentales indiquent que la DPG est hydrolysée à des températures et à un pH élevés (Wohlfahrt et Niebergahl, 1984), mais il convient de noter que ces températures ne sont pas observées dans l'environnement. L'Environmental Protection Agency des États-Unis (USEPA) estime que l'hydrolyse est négligeable aux températures observées dans l'environnement (USEPA, 2009).
Le tableau 4b résume les résultats des modèles de prévision RQSA disponibles sur la dégradation dans divers milieux naturels.
| Processus du devenir | Modèle et base du modèle |
Résultat et prévision du modèle | Demi-vie extrapolée (jours OU heures) |
|---|---|---|---|
| AIR | |||
| Oxydation atmosphérique | AOPWIN, 2008[1] | t 1/2 = 0,3 jour | inférieure ou égale à 2 |
| Réaction avec l'ozone | AOPWIN, 2008[1] | s. o.[2] | s. o. |
| EAU | |||
| Hydrolyse | HYDROWIN, 2008[1] | s. o.[2] | s. o. |
| Biodégradation primaire[3] | |||
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 4 : enquête d'expert (résultats qualitatifs) |
3,34[4] « se biodégrade rapidement » |
inférieure ou égale à 182 |
| Biodégradation ultime | |||
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 3 : enquête d'expert (résultats qualitatifs) |
2,51[4] « se biodégrade relativement rapidement » |
inférieure ou égale à 182 |
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 5 : Probabilité linéaire, MITI |
-0,15[4] « se biodégrade lentement » |
supérieure ou égale à 182 |
| Biodégradation (aérobie) | BIOWIN, 2008[1] Sous-modèle 6 : Probabilité non linéaire, MITI |
0,008[5] « se biodégrade lentement » |
supérieure ou égale à 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
0[5] « se biodégrade lentement » |
supérieure ou égale à 182 |
| Biodégradation (aérobie) | CPOP, 2008 % DBO (demande biochimique en oxygène) |
% DBO = 0,75 « se biodégrade très lentement » |
supérieure ou égale à 182 |
[2] Le modèle ne donne pas d'estimation pour ce type de structure.
[3] Ce résultat est interprété en tenant compte de la dégradation ultime et sans connaître les produits de biodégradation
[4] Le résultat s'exprime par une valeur numérique de 0 à 5.
[5] Le résultat s'exprime par un taux de probabilité.
Dans l'air, la demi-vie prévue par oxydation atmosphérique de 0,3 jour (voir le tableau 4b) démontre que la DPG est susceptible de s'oxyder rapidement. Cette substance ne devrait pas réagir avec d'autres espèces photooxydantes dans l'atmosphère, notamment O3, et elle ne devrait pas se dégrader par photolyse directe. Les réactions avec des radicaux hydroxyles devraient donc constituer le plus important processus régissant son devenir dans l'atmosphère. Sa demi-vie de 0,3 jour, résultant des réactions avec ces radicaux, permet d'affirmer que la DPG n'est pas persistante dans l'air.
Les résultats des trois modèles de biodégradation ultime BIOWIN (sous-modèles BIOWIN 5 et 6) indiquent que la biodégradation est lente et que la demi-vie dans l'eau serait de 182 jours ou plus. En outre, le résultat du sous-modèle BIOWIN 3 donne à penser que la dégradation ultime pourrait être relativement rapide (demi-vie inférieure à 182 jours). Le résultat du sous-modèle BIOWIN 4 indique que la biodégradation primaire est probablement rapide; toutefois, l'identité des produits de dégradation qui en découlent n'est pas connue. En outre, les prévisions en matière de dégradation ultime issues des modèles TOPKAT et CPOP indiquent un rythme de biodégradation très lent. Par ailleurs, la DPG présente des caractéristiques structurelles associées à des produits chimiques qui ne sont pas facilement biodégradés (p. ex. amines aromatiques). Par conséquent, si l'on tient compte de tous les résultats empiriques et modélisés ainsi que des caractéristiques structurelles, il existe des preuves tangibles permettant d'affirmer que la demi-vie de biodégradation ultime de la DPG dans l'eau est supérieure ou égale à 182 jours.
D'après un rapport d'extrapolation de 1:1:4 pour les demi-vies de biodégradation dans l'eau, le sol et les sédiments (Boethling et al., 1995), la demi-vie de biodégradation ultime dans le sol est aussi supérieure ou égale à 182 jours et la demi-vie dans les sédiments est supérieure ou égale à 365 jours. La DPG devrait donc être persistante dans le sol et les sédiments.
D'après les données empiriques et modélisées (voir les tableaux 4a et 4b), la DPG répond aux critères de persistance dans l'eau, le sol et les sédiments (demi-vies dans le sol et l'eau supérieures ou égales à 182 jours et demi-vie dans les sédiments supérieure ou égale à 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La DPG ne répond pas aux critères de persistance dans l'air (demi-vie dans l'air supérieure ou égale à 2 jours) qui sont énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Les valeurs expérimentales et modélisées du log Doe et du log Koe pour la DPG indiquent que son potentiel de bioaccumulation est relativement faible dans le biote (voir le tableau 3).
Le tableau 5a présente les valeurs empiriques du facteur de bioconcentration (FBC) chez les poissons.
| Organisme d'essai | Paramètre | Valeur (poids humide en L/kg) | Référence |
|---|---|---|---|
| Carpe commune | FBC | plus petit que 2 | NITE, 2002 |
| Poisson | FBC | plus petit que 20 | NITE, 2002 |
Puisque aucune donnée expérimentale sur le facteur de bioaccumulation (FBA) n'a été trouvée et que peu de données expérimentales sur le FBC étaient disponibles, une méthode prédictive a été appliquée au moyen des modèles de FBA et de FBC existants, comme l'indique le tableau 5b ci-dessous
Des estimations du FBC et du FBA, corrigées en fonction d'une biotransformation potentielle, ont été produites à l'aide du modèle BCFBAF (EPI Suite, 2008). Des constantes de vitesse de métabolisation ont été obtenues in vivo en normalisant le FBC selon la méthode décrite par Arnot et al. (2008a, 2008b et 2009). Comme les taux de biotransformation métabolique sont liés au poids et à la température du corps (Hu et Layton, 2001; Nichols et al., 2007), le modèle BCFBAFWIN fournit un des valeurs kM,N « normalisées » pour un poisson de 10 grammes à 15 °C. Pour la DPG, l'estimation est de 10,1 par jour. Des poissons de niveau trophique intermédiaire ont été utilisés pour les éléments de sortie du modèle comme le laisse entendre son concepteur. Ils sont généralement représentatifs des poissons consommés par les oiseaux ou les piscivores terrestres en raison de leur masse. Après avoir adapté les valeurs kM,N des modèles RQSA à un poisson ayant une masse de 184 g (estimation pour un poisson de niveau trophique intermédiaire), la constante du taux est de 4,9 (1/jour). Cette estimation est toutefois incertaine étant donné que les données pour les substances ionisées, particulièrement les substances cationiques, sont limitées dans les ensembles d'étalonnage liés aux valeurs kM des modèles RQSA.
| Organisme d'essai |
Modèle et base du modèle/référence |
Paramètre | Valeur (poids humide en L/kg) |
Référence |
|---|---|---|---|---|
| Poisson | BCFBAF Sous-modèle 1 : régression linéaire |
FBC | 37,7 | BCFBAF, 2008 |
| Poisson | BCFBAF Sous-modèle 2 : bilan massique |
FBC | 22,34 | BCFBAF, 2008 |
| Poisson | BCFBAF Sous-modèle 3 : Bilan massique d'Arnot-Gobas |
FBA | 22,34 | BCFBAF, 2008 |
Les données disponibles indiquent que la DPG devrait présenter un faible potentiel de bioaccumulation chez les poissons. Les valeurs corrigées en fonction du métabolisme pour le FBC et le FBA sont de 22,34, et le sous-modèle avec régression linéaire, qui comprend des facteurs de correction, mais qui ne tient pas explicitement compte de la valeur kM, prévoit un FBC de 37.
Selon la méthode du poids de la preuve qui est fondée sur le FBC mesuré à l'aide du log D et du log Koe ainsi que sur les FBC et FBA modélisés, la DPG présente un faible potentiel de bioaccumulation chez les poissons. Par conséquent, d'après les valeurs empiriques et celles obtenues par modélisation cinétique, la DPG ne satisfait pas aux critères de bioaccumulation (FBA ou FBC supérieur ou égal à 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel d'effets nocifs sur l'environnement
Évaluation des effets sur l'environnement
A – Dans le milieu aquatique
Les données modélisées et expérimentales confirment que la DPG est nocive pour certaines espèces d'organismes aquatiques à des concentrations relativement faibles (plage de 1 à 100 mg/L; voir les tableaux 6a et 6b).
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Algue Selenastrum capricorntum | Toxicité aiguë (96 heures) |
CE50[1] | 1,7 | Bayer, 1990 |
| Daphnie | Aiguë (48 heures) |
CE50[1] | 17 | Bayer, 1990 |
| Daphnie | Toxicité chronique (21 jours) | CSEO[2] | 0,6 | Bayer, 1990 |
| CMEO[3] | 1,9 | |||
| CE50[1] | plus grand que 1,9 à plus petit que 6,0 | |||
| Poisson medaka Oryzias latipes |
Toxicité aiguë (48 heures) |
CL50[4] | 10 | Loeb et Kelly, 1963 |
| Crapet arlequin Lepomis macrochirus | Toxicité aiguë (96 heures) |
CL50[4] | 9,6 | Monsanto, 1979a |
| Truite arc-en-ciel Oncorhynchus mykiss | Toxicité aiguë (96 heures) |
CL50[4] | 11 | Monsanto, 1979b |
| Tête-de-boule Pimephales promelas | Toxicité aiguë (96 heures) |
CL50[4] | 4,2 | Monsanto, 1979c |
[4] CSEO – Concentration sans effet observé, soit la concentration la plus élevée ne causant pas d'effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
[5] CMEO – Concentration minimale avec effet observé est la concentration la plus faible d'une substance causant des effets statistiquement significatifs par rapport au groupe témoin dans un essai de toxicité.
[2] CL50 – Concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai.
Les données expérimentales figurant au tableau 6a indiquent que la DPG serait moyennement toxique pour les organismes aquatiques, comme les poissons (medaka, crapet arlequin, truite arc-en-ciel et tête-de-boule) et les invertébrés (daphnie). De plus, des données montrent que la DPG peut être particulièrement nocive pour certaines espèces d'algues. La valeur de toxicité aigüe la plus faible en milieu aquatique, fondée sur des données fiables, est une CE50 de 1,7 mg/L après 96 heures pour une algue (Selenastrum capricorntum).
Les valeurs d'écotoxicité prévues pour la DPG sont présentées dans le tableau 6b.
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Poisson | Toxicité aiguë (96 heures) |
CL50[1] | 10,75 | ECOSAR, 2008 |
| 0,8 | TOPKAT, 2004 | |||
| 32,6 | OASIS Forecast, 2005 | |||
| Daphnie | Toxicité aiguë (96 heures) |
CE50[2] | 1,30 | ECOSAR, 2008 |
| 6,1 | TOPKAT, 2004 | |||
| Algues vertes | Toxicité aiguë (96 heures) |
CE50[2] | 0,75 | ECOSAR, 2008 |
[2] CE50 - Concentration d'une substance qu'on estime susceptible de causer un effet chez 50 % des organismes d'essai.
Une gamme de prévisions de la toxicité en milieu aquatique a été obtenue à l'aide de modèles RQSA. Ces résultats indiquent que la substance pourrait être dangereuse pour certains organismes aquatiques, y compris certaines espèces d'algues (CL50 et CE50 aiguës égales ou inférieures à 1,0 mg/L).
La méthode du poids de la preuve montre, selon les données expérimentales et modélisées disponibles pour la DPG, que cette substance ne devrait pas entraîner d'effets nocifs chez les organismes aquatiques à de faibles concentrations (presque toutes les CE50 et les CL50 sont supérieures à 1,0 mg/L). La plus faible donnée de toxicité aquatique aiguë est une CE50 de 1,7 mg/L pour 96 heures chez une algue (selenastrum capricorntum).
B – Dans d'autres milieux naturels
On n'a trouvé aucune étude acceptable examinant les effets de cette substance sur l'environnement dans des milieux autres que l'eau.
Évaluation de l'exposition dans l'environnement
Comme on n'a relevé aucune donnée relative aux concentrations de cette substance dans l'eau au Canada, on estime les concentrations dans l'environnement d'après les renseignements disponibles, notamment les estimations des quantités de la substance, les taux de rejet et la dimension des plans d'eau récepteurs.
A – Rejets industriels
Une analyse de l'exposition a été réalisée pour le milieu aquatique sur trois sites où la DPG était utilisée comme additif dans la fabrication de produits à base de caoutchouc. La quantité de cette substance utilisée sur chaque site était comprise entre 10 000 et 100 000 kg/an (Environnement Canada, 2010d). La fraction maximale rejetée dans les eaux usées au cours de la fabrication avant tout traitement a été estimée de façon prudente à 0,5 % (OCDE, 2004). Les eaux usées contenant de la DPG étaient ensuite traitées par des systèmes de traitement secondaire des eaux usées situés à l'extérieur des sites. Les effluents de ces systèmes de traitement étaient rejetés dans des rivières ou des lacs. Un facteur de dilution de 10 a été utilisé pour obtenir les concentrations environnementales estimées (CEE) à partir des concentrations des effluents. Les estimations des CEE pour les 3 sites industriels variaient de 0,05 µg/L à 15,4 µg/L (Environnement Canada, 2010d). Ces valeurs estimées pour les CEE représentent le niveau d'exposition dans les eaux réceptrices près du point de rejet de l'usine de traitement des eaux usées pour chaque site.
Caractérisation des risques pour l'environnement
La démarche suivie dans la présente évaluation écologique préalable consistait à examiner les divers renseignements à l'appui et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprennent les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance dans l'environnement.
La DPG devrait être persistante dans l'eau, le sol et les sédiments, et avoir un faible potentiel de bioaccumulation. Cependant, les quantités élevées de DPG qui sont importées au Canada et les utilisations de cette substance indiquent un risque de rejet généralisé dans l'environnement au Canada. Cette substance demeurera principalement dans l'eau si les rejets ont lieu dans ce milieu et il n'y a pas de pertes importantes liées aux usines de traitement des eaux usées. Il a aussi été démontré que cette substance avait un potentiel modéré de toxicité, dans l'ensemble, pour les organismes aquatiques, et un potentiel de toxicité élevé pour certaines espèces d'algues.
Une analyse du quotient de risque, intégrant des estimations prudentes de l'exposition aux renseignements liés à la substance, a été réalisée pour le milieu aquatique, afin de déterminer si la substance pourrait avoir des effets nocifs sur l'environnement au Canada. Les scénarios industriels propres aux sites (en fonction des plans d'eau récepteurs réels) qui sont présentés ci-dessous ont donné des CEE variant de 0,05 µg/L à 15,4 µg/L (Environnement Canada, 2010d). Une concentration estimée sans effet (CESE) a été calculée pour les algues à partir de la valeur de toxicité aiguë de 1,7 mg/L (valeur expérimentale valide la plus sensible), en divisant cette valeur par un facteur d'évaluation de 100 afin de tenir compte de la variabilité de sensibilité interspécifique et intraspécifique et de l'extrapolation d'un effet aigu mesuré en laboratoire à une valeur sans effet chronique sur le terrain. Cette CESE est de 0,017 mg/L (17 µg/L). Les quotients de risque obtenus (CEE/CESE) étaient tous inférieurs à 1 et variaient de 0,003 à 0,885. Étant donné le calcul prudent du quotient de risque, il est peu probable que des effets nocifs sur les organismes aquatiques aient lieu à ces sites. De plus, étant donné que la DPG se lie en grande partie à la matrice du caoutchouc au cours de la fabrication des produits à base de caoutchouc, les rejets réels pour l'environnement seront probablement négligeables. Ces renseignements portent à croire que la DPG est peu susceptible de causer des effets écologiques nocifs au Canada.
Incertitudes dans l'évaluation des risques pour l'environnement
Il existe des incertitudes liées au manque de données sur les concentrations de DPG dans l'environnement au Canada. Afin de pallier ce manque, des hypothèses prudentes ont été émises pour l'estimation des concentrations environnementales qui pourraient découler de l'utilisation industrielle de DPG.
Des incertitudes sont également liées à l'importance de la répartition de la substance chargée positivement et ayant un log Doe relativement faible dans les matières solides (sédiments et sol).
L'évaluation de la bioaccumulation est limitée par le fait que très peu de données empiriques ont été répertoriées pour la DPG, bien que le FBC mesuré indique que la DPG possède un très faible potentiel de bioaccumulation dans les organismes aquatiques. En raison de ce manque de données, il a fallu utiliser des modèles afin de générer des prévisions. Même si toutes les prévisions découlant des modèles comportent une certaine marge d'erreur, les résultats corrigés en fonction du métabolisme ont confirmé que la DPG, compte tenu de ses caractéristiques structurelles, devrait avoir un faible potentiel de bioaccumulation.
Potentiel d'effets nocifs sur la santé humaine
Évaluation de l'exposition
Milieu naturel
Aucune donnée empirique n'a été relevée dans la littérature en ce qui concerne les concentrations de DPG mesurées directement dans les milieux naturels (air, eau, sol et sédiments) au Canada ou ailleurs. D'après les résultats de l'enquête menée en réponse à l'avis publié en vertu de l'article 71, moins de 100 kg de DPG ont été rejetés dans l'air et moins de 100 kg ont été rejetés dans l'eau au Canada en 2006. Par ailleurs, aucun rejet dans le sol n'a été déclaré (Environnement Canada, 2010b).
Une étude japonaise effectuée en 1978 n'a pas permis de révéler la présence de DPG dans l'eau de surface et les sédiments. Les limites de détection des nombreuses analyses allaient de 2 à 50 ng/mL dans les échantillons d'eau et de 0,1 à 0,5 mg/kg dans les échantillons de sédiments (ME, 2004).
Puisque la DPG est utilisée dans la fabrication de caoutchouc pour les pneus, il a été proposé (GDCh-BUA, 1992; GDCh-BUA, 2007) que la poussière qui se trouve en suspension dans l'air au-dessus des routes et qui contient des particules de pneus pourrait être une source d'exposition de la population générale à cette substance. Aucune étude quantifiant la DPG dans les matières particulaires atmosphériques n'a été répertoriée au Canada ou ailleurs. Les débris de pneus contribuent dans un faible pourcentage (de 1 à 10 %) à la pollution atmosphérique liée aux véhicules (Pierson et Brachazek, 1974; Fauser et al., 2002; GDCh-BUA, 2007) et, dans l'ensemble, les particules provenant de l'usure des pneus ne restent pas en suspension et se déposent près des routes (Pierson et Brachazek, 1974). De plus, la charge commerciale habituelle de DPG dans la fabrication de caoutchouc est de 0,1 à 1,0 % en poids (GDCh-BUA, 1992). Par ailleurs, cette substance ne devrait pas se volatiliser dans l'atmosphère en raison de sa faible pression de vapeur (3,97 × 10-6 mm Hg) et de sa faible constante de la loi de Henry (1,1 × 10-4 Pa×m3/mol). On s'attend que cette substance, si elle présente, soit en grande partie encapsulée dans la matrice de caoutchouc des particules provenant de l'usure des pneus, ce qui limite le potentiel d'exposition par inhalation sur les routes. Compte tenu des considérations ci-dessus, l'exposition de la population générale à la DPG sous forme de poussières atmosphériques contenant des particules de pneus ne devrait pas être importante.
La présence dans le sol, à proximité des routes (à moins de 30 mètres du bord de la chaussée), de particules provenant de l'usure des pneus a également été étudiée. Dans le cadre d'une étude réalisée en Californie, la teneur en caoutchouc du sol variait d'environ 0,02 à environ 0,5 % en poids (ce qui équivaut à 5 mg/g de sol) dans 5 échantillons prélevés à proximité d'une route achalandée (Cadle et Williams, 1979). Les résultats d'une autre étude menée au Danemark ont démontré que les concentrations de particules de pneus étaient inférieures à 1 mg/g de sol à proximité des routes (Fauser et al., 2002). Selon ces deux études, la concentration de particules de pneus dans le sol diminue en fonction de la distance de la chaussée. D'après le pourcentage maximal de DPG dans le caoutchouc de pneu (1,0 % en poids) et le contenu maximal de caoutchouc usé dans le sol (moins de 5 mg/g), la concentration de DPG dans ce milieu a été estimée à 0,05 mg/g. Par ailleurs, les limites supérieures d'exposition quotidienne à cette substance à partir du sol pour différents groupes d'âge ont été estimées. Ces valeurs, qui sont fondées sur l'ingestion accidentelle de sol en raison de la proximité des routes, variaient de 0,02 mg/kg p.c. par jour (20 ans ou plus) à 0,32 mg/kg p.c. par jour (0,5 à 4 ans)[3]. Ces estimations sont considérées comme prudentes, car elles sont fondées sur des hypothèses prudentes, à savoir la concentration potentielle maximale de DPG dans le caoutchouc et le sol à moins de 30 m d'une route achalandée. De plus, on s'attend à ce que les accélérateurs soient en grande partie consommés pendant le procédé de vulcanisation (GDCh-BUA, 1992; ChemRisk, 2008), un facteur qui n'a pas été pris en compte dans le calcul de l'exposition.
La confiance à l'égard de la caractérisation de l'exposition dans les milieux naturels est considérée comme faible en raison du manque de données disponibles. Toutefois, les expositions estimées (en fonction des particules de pneus contenues dans le sol) sont considérées comme la limite supérieure, étant donné qu'elles sont fondées sur des hypothèses prudentes. Le niveau de confiance est donc élevé quant au fait que l'exposition à la DPG à partir des milieux naturels et de la nourriture ne devrait pas être significative.
Produits de consommation
Selon les renseignements disponibles et les données de l'industrie rapportées en application de l'article 71 de la LCPE (1999), la DPG est utilisée au Canada dans la fabrication de matériaux de caoutchouc pour les pneus et les applications industrielles (Environnement Canada, 2010a; courriel du Bureau de la gestion du risque de Santé Canada adressé à la Division des substances existantes de Santé Canada en mai 2010, source non citée).
Une étude japonaise a révélé la présence de DPG dans un emballage de cafetière à décompression (Baba, 1980). Ce type de produit de consommation est considéré comme étant rare en Amérique du Nord. Par conséquent, l'exposition à la DPG à partir ce de type de produit n'a pas été jugé pertinente. De plus, la DPG n'est pas utilisée dans les emballages alimentaires au Canada.
Par conséquent, l'exposition de la population générale à la DPG à partir de produits de consommation est peu probable.
Évaluation des effets sur la santé
L'annexe 1 présente un résumé des renseignements disponibles sur les effets de la DPG sur la santé.
La Commission européenne a classé la DPG dans la catégorie 3 concernant la toxicité pour la reproduction (substance préoccupante pour la fertilité humaine) avec la mention de risque R62 (risque possible d'altération de la fertilité) en se fondant sur le nombre restreint d'études de toxicité de la DPG menées sur des animaux de laboratoire (Commission européenne, 1998; ESIS, 2009).
La toxicité de la DPG pour la reproduction et le développement a été évaluée dans le cadre d'études sur l'exposition subchronique et à court terme chez des souris, des rats et des hamsters. Dans une étude de 15 semaines sur l'exposition par l'eau potable (Bempong et Hall, 1983), une augmentation de l'incidence des anomalies des spermatozoïdes a été observée en fonction de la dose et de la durée d'exposition, tout comme une diminution du nombre de spermatozoïdes et du poids des testicules chez des souris mâles C57BL/6J x DBA2, à partir de la 6e semaine d'exposition à des doses de DPG de 0, 4 ou 8 mg/kg p.c. par jour. Un examen histologique des testicules des souris exposées a révélé la présence de canalicules séminifères de forme irrégulière ainsi qu'une réduction du nombre de spermatides et de spermatozoïdes dans les canalicules. Lorsque, dans le cadre de cette étude, on a accouplé des souris mâles avec des femelles non exposées, une diminution des indices de fertilité et du nombre d'implants par grossesse ainsi qu'une augmentation de la mortalité fœtale ont été observées. Toutefois, dans le cadre d'une étude par gavage sur une période de 56 jours, seule une légère hausse statistiquement significative de la fréquence des anomalies des spermatozoïdes a été observée chez des souris Swiss CD-1 exposées à une dose de 16 mg/kg p.c. par jour; aucun effet sur les caractéristiques spermatiques n'a été observé à des doses allant jusqu'à 4 mg/kg p.c. par jour. Le nombre d'implants par grossesse et le taux de survie des fœtus étaient comparables à ceux du groupe témoin lorsque les mâles traités étaient accouplés avec des femelles non traitées dans une étude de suivi sur la reproduction (Koëter et al., 1992). Dans une étude de 13 semaines sur la toxicité par voie alimentaire (NTP, 1995), on a noté une diminution significative de la motilité des spermatozoïdes aux doses les plus élevées de DPG chez les rats (1 500 ppm, 121 mg/kg p.c. par jour) et les souris (3 000 ppm, 573 mg/kg p.c. par jour). Une perte de fonction de la prostate, une réduction du poids absolu de la prostate et des testicules ainsi qu'une diminution de la spermatogenèse ont été observées chez les rats à la dose la plus élevée (3 000 ppm, équivalant à 200 mg/kg p.c. par jour). L'évaluation des paramètres de reproduction des femelles a révélé une prolongation du cycle œstral chez les rats (à 1 500 ppm, 127 mg/kg p.c. par jour) et les souris (à 3 000 ppm, 691 mg/kg p.c. par jour). Une augmentation en fonction de la dose de la fréquence des anomalies des spermatozoïdes a également été observée chez des hamsters dorés de Syrie mâles exposés ad libitum à la DPG dans l'eau potable à une dose de 4 ou 8 mg/kg p.c. par jour pendant 15 semaines (Bempong et Hall, 1983).
Yasuda et Tanimura (1980) ont signalé une légère réduction, quoique statistiquement significative, du nombre d'implants chez des souris femelles enceintes après une exposition à la DPG par gavage pendant les jours de gestation 0 à 18, à une dose de 10 mg/kg p.c. par jour (la plus forte dose à l'essai). Un retard du développement osseux a été observé chez les fœtus des femelles exposées à la dose moyenne (4 mg/kg p.c. par jour), mais pas chez les fœtus de celles exposées aux doses faible (1 mg/kg p.c. ou moins par jour) ou élevée (10 mg/kg p.c. par jour). Aucun signe manifeste de toxicité chez les mères n'a été constaté.
Chez les rats, une légère augmentation des pertes postimplantation, une légère réduction du poids des fœtus et une légère augmentation de l'incidence de fœtus présentant une ossification incomplète ou des côtes déformées ont été observées à la suite de l'exposition par gavage des mères à une dose de 50 mg/kg p.c. par jour de DPG (la plus forte dose à l'essai) du 6e au 15e jour de gestation. Une diminution du gain de poids corporel chez les mères et d'autres signes cliniques de toxicité ont également été signalés à cette dose (Monsanto, 1986).
Les seules études sur la cancérogénicité de la DPG comportent des problèmes sur le plan de la méthodologie et de la présentation des résultats. Bempong (1986; cité dans OCDE [2002], données non publiées) a signalé des adénosarcomes des nœuds lymphoïdes chez des souris dans une étude de 32 semaines sur la toxicité orale. Cependant, cet effet était limité à 3 des 50 animaux exposés à la plus faible dose (4 mg/kg p.c. par jour). Par ailleurs, aucune tumeur n'a été constatée chez le groupe exposé à la dose la plus élevée ni chez le groupe témoin. Dans une autre étude insuffisamment documentée, aucune lésion pathologique (effet néoplasique ou non néoplasique) n'a été observée chez les souris après 21 mois d'exposition par voie orale à une dose de 103 mg/kg p.c. par jour de DPG (Kurokawa et Ogawa, date non indiquée; étude citée dans OCDE [2002], données non publiées). Étant donné que peu de données étaient disponibles en ce qui a trait à la toxicité chronique de la DPG, les résultats des modèles RQSA ont été pris en considération. Les quatre modèles RQSA utilisés (DEREK, TOPKAT, CASETOX et Leadscope Model Applier) n'ont révélé aucun potentiel de cancérogénicité lié à la structure moléculaire de la DPG.
Le potentiel de génotoxicité de la DPG a été évalué dans des essais in vitro et in vivo. Les résultats sont principalement négatifs. Dans le cadre d'essais in vivo sur la toxicité orale, la DPG n'a pas provoqué la formation de micronoyaux dans les érythrocytes périphériques des souris mâles ni d'aberrations chromosomiques dans les cellules de moelle osseuse des rats (Monsanto, 1989; NTP, 1995). De plus, elle n'a pas induit de mutation génique chez Salmonella typhimurium, Escherichia coli ou Saccharomyces cerevisiae dans la plupart des essais in vitro, avec ou sans activation métabolique[4]. Des réponses faiblement positives ont été rapportées par Bempong et Mantley (1985) chez Salmonella typhimurium en ce qui a trait aux mutations géniques, avec ou sans activation métabolique, ainsi que par Mortelmans et al. (1986) avec activation métabolique. Les résultats in vitro ont été négatifs pour les mutations géniques dans les cellules de lymphomes de souris et les fibroblastes pulmonaires V79 de hamsters de Chine (Monsanto, 1979d; Donner et al., 1983). De plus, la DPG n'a pas provoqué d'aberrations chromosomiques dans les cellules pulmonaires et ovariennes de hamsters de Chine (Monsanto, 1992b; MHLW, 2005).
Diverses études sur la toxicité à court terme et subchronique par voie orale étaient existaient pour la DPG. Une réduction du gain de poids corporel moyen et une baisse de l'apport alimentaire (dans les études sur l'alimentation seulement) significatives ont été observées à des doses de 50 mg/kg p.c. par jour ou plus dans plusieurs études de la toxicité à court terme portant sur des rats (McCormick, 1971; Monsanto, 1980, 1985, 1986). Dans les études sur la toxicité subchronique (90 jours) par voie alimentaire, les doses les plus faibles qui ont causé des effets similaires sur la santé étaient de 500 ppm (37 mg/kg p.c. par jour) chez les rats (Monsanto, 1982a) et de 750 ppm (133 mg/kg p.c. par jour) chez les souris (NTP, 1995). Bien que des effets sur le poids des organes ou sur les paramètres cliniques chimiques et hématologiques aient été fréquemment observés dans ces études, les chercheurs ont jugé que ces résultats étaient liés à une réduction de l'apport alimentaire ou à une mauvaise santé causées par l'exposition à la DPG (NTP, 1995; GDCh-BUA, 1998; OCDE, 2002). Des modifications des paramètres lipidiques causées par une exposition à court terme par voie orale à une dose de 75 mg/kg p.c. par jour de DPG ou plus ont été signalées dans certaines études; toutefois, aucun effet histopathologique correspondant n'a été observé (Trendafilova et Picin, 1971; Trendafilova, 1971, 1972; Picin et Trendafilova, 1972; Picin, 1973). Une réduction de la glycémie (chez les deux sexes) et une augmentation de la numération plaquettaire (chez les femelles seulement) ont été observées à des doses de 30 mg/kg p.c. par jour chez les rats dans le cadre d'une étude de 28 jours (Murata et al., 2001). Des taux de mortalité élevés ont aussi été rapportés dans cette même étude chez les rats exposés à des doses élevées de DPG (c.-à-d. à des doses supérieures à 100 mg/kg p.c. par jour) [Monsanto, 1980, 1985; NTP, 1995].
L’exposition orale à la DPG était liée à une réduction des seuils d'excitabilité nerveuse et musculaire, et à une diminution de l'activité motrice chez les rats et les souris exposés à des doses supérieures à celles provoquant des variations de poids (Orlov et al., 1973; Monsanto, 1980, 1986; NTP, 1995; MHLW, 2005).
Des renseignements limités indiquaient que des rats exposés à l'inhalation de poussière de DPG à une concentration de 220 mg/m3, 2 heures par jour pendant 15 jours, pourraient présenter des processus modifiés d'oxydo-réduction et une altération du fonctionnement du système nerveux (Arkhangel'skaya et Roshchina, 1963).
La seule étude de toxicité par voie cutanée recensée, bien qu'insuffisamment documentée, indiquait que les applications répétées de DPG sur la peau à 1 000 mg/kg p.c. par jour n'ont pas causé de toxicité générale chez les lapins (aucun autre détail n'a été fourni dans la référence, McCormick, 1971).
La DPG est irritante pour les yeux et légèrement irritante pour la peau des lapins (Kowalski et Bassendowska, 1965; Monsanto Company, 1977b, 1977c). Chez les humains, à la suite d'expositions à la DPG dans le milieu de travail, des irritations des yeux et des muqueuses ont été observées (aucune autre donnée n'était disponible; Arkhangel'skaya et Roshchina, 1963). La DPG n'a montré aucun effet sensibilisant chez les cochons d'Inde pendant les tests de maximalisation (MLPC, 1995). Chez les humains, 19 des 49 participants aux tests présentaient des réactions d'irritation après la première application de DPG dans le cadre d'un test épicutané, et deux participants ont été sensibilisés au cours de la phase de tests (Monsanto, 1982b). Chez les patients présentant une dermatite de contact, des réactions cutanées positives à la DPG ont été occasionnellement signalées (environ 0,03 à 12 % du nombre total de sujets testés dans près de 4/5 des études) dans un grand nombre de tests épicutanés[5].
Dans une étude de cohorte occupationnelle menée auprès de travailleurs âgés de 29 à 58 ans qui avaient été en contact avec de la DPG, en plus d'autres produits chimiques, sur une période de 3 à 15 ans pendant la production (aucune autre information disponible), près de 30 % des sujets ont fait état de plusieurs symptômes, notamment plusieurs plaintes liées à l'estomac ou à la vésicule biliaire, des dermatites et une modification des seuils d'irritabilité nerveuse ou musculaire et quelques perturbations du métabolisme hépatique (Orlov et al., 1973). Cependant, en raison d'une exposition à des substances chimiques diverses et du manque de données quantitatives sur les niveaux d'exposition, l'étude n'est pas assez complète pour déterminer les effets de la DPG sur la santé.
On ne dispose d'aucune information concernant l'absorption de la DPG par les voies respiratoires. La DPG administrée par voie orale a été rapidement absorbée par le tractus gastro-intestinal chez les rats, répartie rapidement, métabolisée en trois métabolites non identifiés majeurs et en deux métabolites non identifiés mineurs, puis excrétée en quantités presque égales dans l'urine et les matières fécales (Ioannou et Matthews, 1984). L'absorption, la répartition et l'excrétion de la DPG n'ont pas été grandement affectées par la voie d'administration chez les rats (p. ex. voie orale ou intraveineuse; Ioannou et Matthews, 1984). Aucune accumulation de tissu n'a été constatée chez les lapins (Kazarinova et al., 1975) ou les souris (communication personnelle entre Hunter, Scully et Bempong; citée dans Bempong et Hall, 1983). L’absorption de la DPG par voie cutanée était faible chez les rats avec 10 % d'absorption dans une période de 120 heures (environ 0,08 % par heure). Après absorption, la DPG s'est immédiatement propagée dans l'ensemble de l'organisme et a été éliminé principalement dans les urines et les matières fécales (Shah et al., 1985).
Le niveau de confiance à l'égard de la base de données relative aux effets sur la santé est jugé modéré. Toutefois, aucune étude pertinente sur la toxicité chronique ou la cancérogénicité n'a été réalisée.
Caractérisation des risques pour la santé humaine
D'après l'examen de la classification basée sur le poids de la preuve de la DPG par la Commission européenne et des données disponibles relatives aux effets sur la santé, on considère que l’effet critique associé à l'exposition par voie orale à la DPG est la toxicité pour la reproduction. La dose minimale avec effet nocif observé (DMENO) pour l'altération de la fertilité par la DPG était de 4 mg/kg p.c. par jour dans une étude de la toxicité orale subchronique chez les souris. On s'est fondé sur les variations suivantes liées à la dose : augmentation du nombre d'anomalies des spermatozoïdes,diminution du nombre de spermatozoïdes, diminution du poids des testicules, changements histologiques testiculaire chez les souris mâles traitées, ainsi qu'une diminution du nombre d'implants, augmentation de la mortalité fœtale chez les mères non traitées une fois qu'elles ont été accouplées avec mâles traités à la DPG.
D'autres effets sur la santé, tels qu'une réduction du gain de poids corporel et une baisse de l'apport alimentaire ont été observés chez les animaux de laboratoire dans le cadre d'études de toxicité orale à court terme et subchronique menées sur la DPG à des doses supérieures à celles provoquant des effets sur la reproduction. Une approche fondée sur le seuil d'innocuité a été utilisée afin de déterminer les risques pour la santé humaine.
L'exposition de la population générale à la DPG au Canada peut se produire par une ingestion accidentelle de sol contenant des débris de pneus déposés à proximité des routes. Les estimations prudentes de cette exposition varient de 0,02 mg/kg p.c. par jour (plus de 20 ans) à 0,32 mg/kg p.c. par jour (enfants de 0,5 à 4 ans), basées sur une étude portant sur les particules de caoutchouc de pneu contenues dans le sol, sur une distance de 30 m par rapport à une route, et sur la charge maximale de DPG dans la fabrication de caoutchouc. La comparaison de la concentration associée à un effet critique de 4 mg/kg p.c. par jour (la DMENO pour l'altération de la fertilité des mâles par voie orale) avec l'estimation de la limite supérieure de l'exposition (0,32 mg/kg p.c. par jour) à la DPG potentiellement présente dans les particules de pneus dans le sol a permis d'obtenir une marge d'exposition de 12 500. Cette marge est considérée comme adéquate pour tenir compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
Incertitudes de l’évaluation des risques pour la santé humaine
La présente évaluation préalable n'inclut pas l'analyse complète du mode d'induction des effets de la DPG, ni ne prend en compte les éventuelles différences de sensibilité entre l'homme et les animaux de laboratoire. Aucune étude bien menée sur la cancérogénicité de la DPG n'est actuellement disponible et les données portant sur l'exposition chronique à cette substance sont également limitées. En outre, seuls des renseignements très limités étaient disponibles concernant les effets potentiels sur la santé associés à une exposition à la DPG par inhalation ou par voie cutanée.
Il existe des incertitudes en ce qui concerne la caractérisation de l'exposition de la population générale, car aucune donnée empirique n'a été recensée au sujet des concentrations de DPG mesurées dans les milieux naturels au Canada ou ailleurs (air, eau, sol et sédiments). Les estimations de l’exposition sont basées sur les particules de pneu contenues dans le sol et considérées comme la limite supérieure, étant donné qu'elles sont fondées sur des hypothèses prudentes. Il y a des incertitudes liées à l'utilisation secondaire des pneus (recyclage et production d'énergie) et aux incendies accidentels dans les sites d'entreposage des pneus; cependant, les données sont insuffisantes pour caractériser l'exposition fortuite potentielle liée à ces sources. On peut estimer avec confiance que l'exposition à la DPG à partir des milieux naturels et de la nourriture ne devrait pas être significative, surtout en raison du fait que les accélérateurs sont en grande partie ou complètement brûlés pendant le processus de vulcanisation dans la fabrication de caoutchouc (GDCh-BUA, 1992; ChemRisk, 2008).
Le manque de renseignements en ce qui concerne la quantité de DPG contenue dans les produits de consommation à base de caoutchouc au Canada est également une source d'incertitude. Néanmoins, les renseignements disponibles n'ont pas permis de déterminer la présence de DPG dans les produits de consommation canadiens.
Bien que la DPG soit irritante pour les yeux, les voies respiratoires et la peau, on ne peut pas la considérer comme un agent sensibilisateur, en raison des résultats négatifs enregistrés dans les études menées sur les animaux et du nombre peu élevé d'études réalisées chez l'être humain (possibilité de sensibilisation croisée). Bien qu'il y ait des incertitudes dans l'évaluation de son potentiel de sensibilisation, l'exposition aux produits de consommation par voie cutanée devrait être nulle, en raison du mode d'utilisation de la DPG dans l'industrie.
Conclusion
Selon les renseignements contenus dans la présente évaluation préalable finale, la DPG ne satisfait pas aux critères énoncés aux alinéas 64(a) ou (b) de la LCPE (1999) car il ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie. De plus, cette substance répond aux critères de persistance, mais elle ne répond pas aux critères relatifs au potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
À la lumière des renseignements disponibles sur le potentiel d'effets néfastes sur la santé humaine de la DPG, il est conclu que cette substance ne satisfait pas au critère énoncés à l’alinéa 64(c) de la LCPE (1999) car il ne pénètre pas dans l'environnement en quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Par conséquent, il est conclu que la DPG ne satisfait pas à aucun des critères énoncés dans l'article 64 de la LCPE (1999).
On envisagera d'inclure cette substance dans la mise à jour de l'inventaire de la Liste intérieure des substances. De plus, des activités de recherche et de surveillance viendront, s'il y a lieu, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
Références
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. [consulté le 8 septembre 2010].
Agrup, G. 1969. Hand eczema and other hand dermatoses in south Sweden. Acta derm.-vener, Stockh. 49(Suppl. 61):1-91. [cité dans OCDE, 2002].
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2008. Version 1.92a. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Arkhangel'skaya, L.N., Roshchina, T.A. 1963. Brief account of toxic properties of vulcanisation accelerators diphenylguanidine and furfuramide. Sovjet Rubber Tech. 22:38-39.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2010. Base de données des étiquettes de produits de l'ARLA [en ligne]. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. Accès : http://pr-rp.pmra-arla.gc.ca/portal/page?_pageid=34,17551&_dad=portal&_schema=PORTAL [consultée le 6 juillet 2010].
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341-351.
Arnot, J.A., Mackay, D., Parkerton, T.F., Bonnell, M. 2008b. A database of fish biotransformation rates for organic chemicals. Environ. Toxicol. Chem. 27(11):2263-2270.
Arnot, J.A., Meylan, W., Tunkel, J., Howard, P.H., Mackay, D., Bonnell, M,. Boethling, R.S. 2009. A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish. Environ. Toxicol. Chem. 28(6):1168-1177.
Baba, T. 1980. Hygienic study of rubber articles used in contact with foods. Aqueous extracts and their effects on cultured cells. J. Osaka City Medical Center 29:807-827.
Baer, R.L., Ramsey, D.L., Biondi, E. 1973. The most common contact allergens. Arch. Dermatol. 108:74-78. [cité dans OCDE, 2002].
Bajaj, A.K., Gupta, S.C., Chatterjee, A.K., Singh, K.G. 1988. Shoe dermatitis in India. Contact Derm. 19:372-375.
Bajaj, A.K., Gupta, S.C., Chatterjee, A.K., Singh, K.G. 1991. Shoe dermatitis in India: Further observations. Contact Derm.24:149-151.
Bayer, A.G. 1990. Unpublished data: Study report no. 85 A/89. [cité dans OCDE, 2002]
[BCFBAF] Bi°Concentration Factor Program for Windows [modèle d’estimation]. 2008. Version 3.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
[BDIPSN] Base de données sur les ingrédients des produits de santé naturels [en ligne]. 2010. Ottawa (Ont.) : Santé Canada. [consultée en août 2010].
[BDPP] Base de données sur les produits pharmaceutiques en ligne [en ligne]. 2010. Ottawa (Ont.) : Direction des produits thérapeutiques. [consultée en juillet 2010].
[BDPSNH] Base de données des produits de santé naturels homologués [en ligne]. 2010. Ottawa (Ont.) : Santé Canada. [consultée en août 2010]
Bempong, M.A. 1986. Personal communication between Bempong, M.A., Norfolk State University, Norfolk (VA) and NTP, Bethesda (MD). 1986 November 21. [cité dans OCDE, 2002]
Bempong, M.A., Hall, E.V. 1983. Reproductive toxicology of 1,3-diphenylguanidine: analysis of induced sperm abnormalities in mice and hamsters and reproductive consequences in mice. J. Toxicol. Environ. Health 11:869-878.
Bempong, M.A., Mantley, R.J. 1985. Body fluid analysis of 1,3-diphenylguanidine for mutagenicity as detected by Salmonella strains. J. Environ. Pathol. Toxicol. Oncol. 6:293-301.
[BESC] Bureau Européen des Substances Chimiques. 2000. IUCLID [International Uniform Chemical Information Database] dataset for 1,3-diphenylguanidine (CAS No. 102-06-7).
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2008. Version 4.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Bruze, M., Kestrup, L. 1994. Occupational allergic contact dermatitis from diphenylguanidine in a gas mask. Contact Derm. 31:124-6.
Burov, Y.A. 1964. Influence exercised by tetramethylthiuram disulfide (Thiuram) and diphenyl guanidine (DPG) on the biligenic function of the liver. Farmakol. Toksikol. 27:714-717.
Cadle, S.H., Williams, R.L. 1979. Gas and particle emissions from automobile tires in laboratory and field studies. Rubber Chem. Technol. 52(1):146-158.
Canada. 1978. Règlement sur les aliments et drogues. C.R.C., ch. 870.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III. vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada, Partie II, vol. 134, n° 7, p. 607-612.
Canada. 2002. Loi sur les produits antiparasitaires (2002). L.C., 2002, ch. 28. Gazette du Canada, partie III, vol. 25, no 3.
Canada. Ministère de l’Environnement. 2006. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances considérées comme priorité pour suivi. Gazette du Canada, Partie I, vol. 140, n° 9, p. 435-459.
Canada. Ministère de l'Environnement, ministère de la Santé. 2009. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du groupe 12 du Défi. Gazette du Canada, Partie I, vol. 143, n° 52, p. 3813–3836.
CASETOX [module de prévision]. 2008. Version 2.0. Beachwood (OH) : MultiCASE. [consulté le 8 septembre 2010; réserve de consultation].
ChemRisk, Inc. 2008. Interim report of tire wear particle research [en ligne]. Rapport intérimaire. [consulté en janvier 2010].
Chou, T.W., Mabey, W.R., Spanggord, R., Smith, J.H., Haynes, D., BAraze, A., Burris, D. 1980. Selected environmental fate studies on nine chemical compounds. SRI International, SRI project no. 8669. [cité dans OCDE, 2002].
[CHRIP] Chemical Risk Information Platform [base de données en ligne]. c2008. Tokyo (Japon) : National Institute of Technology and Evaluation, Chemical Management Centre (CMC). [consultée le 4 août 2010].
[CIRC] Centre International de Recherche sur le Cancer. IARC Working Group on the Evaluation of the Carcinogenic Risks to Humans. 1982. The rubber industry. IARC Monogr Eval Carcinog Risks Hum 28.
Comfere, N.I., Davis, M.D., Fett, D.D. 2005. Patch-test reactions to thioureas are frequently relevant. Dermatitis 16:121.
Commission européenne. 1998. Summary Record: Commission Working Group on the Classification and Labelling of Dangerous Substances. Meeting at ECB Ispra, 15-21 October 1997. Commission européenne, Direction générale du CCR, Centre commun de recherche, Institut de l'environnement, Bureau Européen des Substances Chimiques. ECBI/51/97 – Rev. 3.
Conde-Salazar, L., Del-Rio, E., Guimaraens, D., Gonzalez Domingo, A. 1993. Type IV allergy to rubber additives: A 10-year study of 686 cases. J. Am. Acad. Dermatol. 29:176-180.
[CPOP] Canadian POPs Model. 2008. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique; Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. [Modèle basé sur celui de Mekenyan et al., 2005]. Disponible auprès de la Division de l’évaluation écologique d'Environnement Canada.
Crebelli, R., Falcone, E., Aquilina, G., Carere, A. 1984. Mutagenicity studies in a tyre plant: in vitro activity of urine concentrates and rubber chemicals. IARC Sci. Publ. 59:289-295.
Crebelli, R., Paoletti, A., Falcone, E., Aquilina, G., Fabri, G., Carere, A. 1985. Mutagenicity studies in a tyre plant: in vitro activity of workers' urinary concentrates and raw materials. Br. J. Ind. Med. 42:481-487.
[DEREK] Deducting Estimation from Existing Knowledge [module de prévision sur CD-ROM]. 2008. Version 10.0.2. Cambridge (MA) : Harvard University, LHASA Group. [consulté le 8 septembre 2010; réserve de consultation].
Donner, M., Husgafvel-Pursiainen, K., Jenssen, D., Rannug, A. 1983. Mutagenicity of rubber additives and curing fumes. Results form five short-term bioassays. Scand. J. Work Environ. Health 9:27-37.
[ECOSAR] Ecological Structure Activity Relationships [en ligne]. 2009. Version 1.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Enomoto, Y., Shimizu, Y., Okubo, T. 2001. Reverse mutation test of 1,3-diphenylguanidine on bacteria. Toxicity Testing Reports of Environmental Chemicals 8:397-400 et 418-422. [cité dans GDCh-BUA, 2007]
Environnement Canada. 1988. Données de la Liste intérieure des substances (LIS), 1984-1986, recueillies en vertu du paragraphe 25(1) de la Loi canadienne sur la protection de l'environnement (1988), et conformément à la Liste intérieure des substances : guide du déclarant. Données préparées par : Environnement Canada.
Environnement Canada. 2007. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2010a. Ionization Data for Batch 12 - Substance CAS#102-06-7, 2010-02-10. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2010b. Données sur les substances du lot 12 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le douzième lot du Défi. Données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada. 2010c. Inventaire national des rejets de polluants [base de données en ligne]. Gatineau (Qc) : Environnement Canada. [consultée en janvier 2010].
Environnement Canada. 2010d. Site-specific exposure calculation report: CAS RN 102-06-7, 2010-09-28. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique.
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. 2008. Version 4.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
[ESIS] European Chemical Substances Information System. 2009. Résultats sur le n° CAS 102-06-7.
Fauser, P., Tjell, J.C., Mosback, H., Pilegaard, K. 2002. Tire-tread and bitumen particle concentrations in aerosol and soil samples. Pet. Sci. Technol. 20(1 et 2):127-141.
Feinman, E.S. 1987. Sensitivity to rubber chemicals. J. Toxicol.Cutaneous Ocul. Toxicol. 6(2):117-153.
Garcia-Perez, A., Garcia-Bravo, B., Beneit, J.V. 1984. Standard patch tests in agricultural workers. Contact Derm. 10:151-153 [cité dans OCDE, 2002]
[GDCh-BUA] Gesellschaft Deutscher Chemiker (Société allemande des produits chimiques) [traduction] - Beratergremium für Umweltrelevante Altstoffe (Comité consultatif sur les substances chimiques existantes concernant l'environnement) [traduction]. 1992. N,N'-Diphenylguanidine. BUA Report 96. Stuttgart (Allemagne) : Hirzel, S., Wissenschaftliche Verlagsgesellschaft.
[GDCh-BUA] Gesellschaft Deutscher Chemiker (Société allemande des produits chimiques) - Beratergremium für Umweltrelevante Altstoffe (Comité consultatif sur les substances chimiques existantes concernant l'environnement). 1998. BUA Report 210. Supplementary Reports IV. Stuttgart (Allemagne) : Hirzel, S., Wissenschaftliche Verlagsgesellschaft.
[GDCh-BUA] Gesellschaft Deutscher Chemiker (Société allemande des produits chimiques) - Beratergremium für Umweltrelevante Altstoffe (Comité consultatif sur les substances chimiques existantes concernant l'environnement). 2007. BUA Report 270. Supplementary Reports XV. Stuttgart (Allemagne) : Hirzel, S., Wissenschaftliche Verlagsgesellschaft.
Geier, J., Lessmann, H., Uter, W., Schnuch, A. 2003. Occupational rubber glove allergy: results of the Information Network of Departments of Dermatology (IVDK), 1995-2001. Contact Derm. 48:39-44.
Hasegawa, R., Nakaji, Y., Kurokawa, Y., Tobe, M. 1989. Acute toxicity tests on 113 environmental chemicals. Sci. Rep. Res. Inst. Tohoku Univ. Med. 36:10-16. [cité dans IUCLID, 2001]
[HENRYWIN] Henry’s Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Holden, C.R., Gawkrodger, D.J. 2005. 10 years' experience of patch testing with a shoe series in 230 patients: which allergens are important? Contact Derm. 53:37.
Holness, D.L., Nethercott, J.R. 1997. Results of patch testing with a special series of rubber allergens. Contact Derm. 36:207-211.
Howard, P.H. 1989. Handbook of Environmental Fate and Exposure Data for Organic Chemicals. Volume I. Large Production and Priority Pollutants. Chelsea (MI) : Lewis Publishers Inc.
Hu, T.M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality[en ligne]. AAPS PharmSci. Vol.3(4):Article 29. . [consulté le 5 août 2010].
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Ioannou, Y.M., Matthews, H.B. 1984. Absorption, distribution, and excretion of 1,3-diphenylguanidine in the male F344 rat. Fundam. Appl. Toxicol. 4:22-29.
[IUCLID] International Uniform Chemical Information Database. 2001. Record for 1,3-diphenylguanidine, CAS No, 102-06-7.
[JETOC] Japan Chemical Industry Ecology-Toxicology & Information Center. 1996. Mutagenicity test data of existing chemical substances based on the toxicity investigation system of the industrial safety and health law. Ministry of Labour, Japan. [cité dans OCDE, 2002].
Katugampola, R.P., Statham, B.N., English, J.S., Wilkinson, M.M., Foulds, I.S., Green, C.M., Ormerod, A.D., Stone, N.M., Horne, H.L., Chowdhury, M.M. 2005. A multicentre review of the footwear allergens tested in the UK. Contact Derm. 53:133-135.
Kazarinova, N.F., Duchovnaja, I.S., Vlasjuk, M.G. 1975. Bestimmung des Diphenylguanidins in biologischen Medien. Gig. Sanit. 4:63-65.
Kiec-Swierczynska, M. 1995. Occupational sensitivity to rubber. Contact Derm. 32:171-172.
[KOAWIN] Octanol-Air Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
[KOCWIN] The Soil Adsorption Coefficient Program [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Koëter, H.B., Regnier, J.-F., van Marwijk, M.W. 1992. Effect of oral administration of 1,3-diphenylguanidine on sperm morphology and male fertility in mice. Toxicology 71:173–179.
Kowalski, Z., Bassendowska, E. 1965. Vorläufige Untersuchunger über die toxischen Wirkungen einiger Vulkanisationsbeschleuniger (D, M, DM, DFT und P-Extra-N). Med. Pr. 16:35-43.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Kurokawa, Y., Ogawa, Y. [date inconnue]. Cité dans CIRC, Directory of agents being tested for carcinogenicity. Lyon (France) : CIRC, 99 (1992). [cité dans OCDE, 2002].
Leadscope [module de prévision]. 2009. Leadscope Model Applier Version 1.2.0-3. Columbus (OH) : Leadscope, Inc. [consulté le 8 septembre 2010; réserve de consultation].
Liden, C. 1989. Occupational dermatoses at a film laboratory. Follow-up after modernization. Contact Derm. 20:191-200.
Loeb, H.A., Kelly, W.H. 1963. Acute oral toxicity of 1496 chemicals force-fed to carp. Special Scientific Report – Fisheries No. 471. Washington (DC) : U.S. Department of the Interior. [cité dans BESC, 2000]
Lynde, C.W., Warshawski, L., Mitchell, J.C. 1982. Patch test results with a shoewear screening tray in 119 patients, 1977-80. Contact Derm. 8:423-425.
Mancuso, G., Reggiani, M., Berdondini, R.M. 1996. Occupational dermatitis in shoemakers. Contact Derm. 34:17-22.
Marhold, J. 1986. Prehled Prumyslove Toxikologie. Prague (Tchécoslovaquie) : Organicke. Avicenum vol. (numéro) p. 974. [cité dans IUCLID, 2001]
McCormick, W.E. 1971. Environmental health control for the rubber industry. Rubber Chem. Technol. 44:512-533.
[ME] Ministère de l'Environnement (Japon). 2004. Surveyed chemical substances and their detected levels in the environment (a cumulative list for fiscal year 1974-2003). [consulté le 19 février 2009]
Mekenyan, G., Dimitrov, S.D., Pavlov, T.S., Veith, G.D. 2005. POPs: A QSAR system for creating PBT profiles of chemicals and their metabolites. SAR QSAR Environ. Res. 16(1-2):103-133.
Meneghini, C.L., Rantuccio, F., Riboldi, A. 1963. Klinisch-allergologische Beobachtungen bei beruflichen ekzematdsen Kontakt-Derma-tosen. Kontakt-Dermatosen 11:280-293. [cité dans OCDE, 2002].
[MHLW] Ministère de la Santé, du Travail et du Bien-être (Japon). 2005. Japanese Ministry of Health, Labour and Welfare Safety examination of existing chemicals and safety programmes in Japan.
[MITI] Ministère du Commerce international et de l'Industrie (Japon), Basic Industries Bureau, Chemical Products Safety Division. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Tokyo (Japon) : Japan Chemical Industry Ecology-Toxicology & Information Center.
[MLPC] MLPC International. 1995. 1,3-Diphenylguanidine. Skin sensitization test in guinea-pigs (Maximization method of Magnusson and Kligman). CIT report no. 12244 TSG, le 3 février 1995. [cité dans GDCh-BUA, 1998].
[Monsanto] Monsanto Company. 1976. Study BO-76-276 – Ames/Salmonella mutation assay and S. cerevisiae mutation assay. Rapport inédit. [cité dans OCDE, 2002].
Monsanto. 1977. Données inédites. [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1977a. Acute oral toxicity with diphenylguanidine. Younger Laboratories study no. Y-77-61, le 27 avril 1977. Rapport inédit. [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1977b. Acute eye irritation with diphenylguanidine. Younger Laboratories report no. Y-77-254, le 17 octobre 1977. [cité dans IUCLID, 2001].
[Monsanto] Monsanto Company. 1977c. Primary skin irritation with diphenylguanidine. Younger Laboratories report no. YO -77-61, le 27 avril 1977. [cité dans IUCLID, 2001].
[Monsanto] Monsanto Company. 1979a. Study performed by ABC laboratories inc, USA (1979) Study no. 23807 (AB-79-1384358-1c). [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1979b. Study performed by ABC laboratories inc, USA (1979) Study no. 23806 (AB-79-1384358-1b). [cité dans OCDE, 2002]
[Monsanto] Monsanto Company. 1979c. Study performed by ABC laboratories inc, USA (1979) Study no. 23805 (AB-79-1384358-1a). [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1979d. Study BO-78-235 Mouse lymphoma TK LOCUS mutation assay. Rapport inédit. [cité dans GDCh-BUA, 1992].
[Monsanto] Monsanto Company. 1980. Diphenylguanidine: 2 week toxicity study in rats with oral administration via the diet. Inveresk Research international report no. 1774, août 1980. [cité dans IUCLID, 2001].
[Monsanto] Monsanto Company. 1982a. Diphenylguanidine: Toxicity study in rats (oral administration via the diet for 13 weeks). Inveresk Research international report no. 2311, juin 1982 (Monsanto study no. IN-81-303). Rapport inédit. [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1982b. Evaluation to determine potential hazards of dermal contact with SH-82-006, N,N'-diphenylguanidine. Product Investigation report no. 2581 (Monsanto report no. SH -82-006). Rapport inédit. [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1985. A range-finding teratology study in rats with DPG. Wil report no. WIL-50003, le 13 septembre 1985 (Monsanto report no. WI-85-105). Rapport inédit. [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1986. A teratology study in rats with DPG. Wil report no. WIL-50004, le 24 avril 1986 (Monsanto study no. WI-85-197)]. Rapport inédit. [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1987. Schriftliche Mitteilung vom 17.03.1987 zum BUA-Stoffdossier N,N’-Diphenylguanidin. Bruxelles (Belgique) : Monsanto Services International S.A./N.V. [cité dans GDCh-BUA, 1992].
[Monsanto] Monsanto Company. 1989. In vivo rat bone marrow cytogenetics study of 1,3-diphenylguanidine. Study no. ML -89-513. Rapport inédit. [cité dans OCDE, 2002].
[Monsanto] Monsanto Company. 1992a. Acute dermal toxicity study in rabbits with 1,3-diphenyl guanidine. Springborn Laboratories report no. 3044.271 (Monsanto report no. SB -91-448), le 9 avril 1992. Rapport inédit. [cité dans OCDE, 2002; IUCLID, 2001].
[Monsanto] Monsanto Company. 1992b. In vitro cytogenetics assay of 1,3-diphenylguanidine. Study ML-90-553, le 26 février 1992. Rapport inédit. [cité dans OCDE, 2002].
Mortelmans, K., Haworth, S., Lawlor, T., Speck, W., Tainer, B., Zeiger, E. 1986. Salmonella mutagenicity tests: II. Results from the testing of 270 chemicals. Environ. Mutagen. 8:1-119.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Murata, K., Kakamu, S., Iga, T., Mukai, D., Hasegawa, K., Oohashi, N. 2001. Twenty–eight day repeated dose oral toxicity test of 1, 3-diphenylguanidine in rats. Toxicity Testing Reports of Environmental Chemicals 8:397-400 et 403-417. [cité dans GDCh-BUA, 2007].
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2009. Issue 1. Columbus (OH) : American Chemical Society. [consulté en mai 2010].
Nettis, E., Assennato, G., Ferrannini, A., Tursi, A. 2002a. Type I allergy to natural rubber latex and type IV allergy to rubber chemicals in health care workers with glove-related skin symptoms. Clin. Exp. Allergy 32:441-447.
Nettis, E., Colanardi, M.C., Soccio, A.L., Ferrannini, A., Tursi, A. 2002b. Occupational irritant and allergic contact dermatitis among healthcare workers. Contact Derm. 46:101-107.
Nettis, E., Colanardi, M.C., Soccio, A.L., Ferrannini, A., Tursi, A. 2003. Latex hypersensitivity: relationship with positive prick test and patch test responses among hairdressers. Allergy 58:57-61.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26:1304-1319.
[NITE] National Institute of Technology and Evaluation. 2002. Japan. Biodegradation and Bioconcentration of Existing Chemical Substances under the Chemical Substances Control Law.
[NTP] National Toxicology Program. 1995. NTP Technical report on toxicity studies of 1,3-diphenylguanidine (CAS No. 102-06-7) administered in feed to F344/N rats and B6C3F1 mice. Research Triangle Park (NC) : U.S. Department of Health and Human Services, National Toxicology Program. NTP Technical Report 42. NIH Publication No. 95-3933.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (BG) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry.
[OCDE] Organisation de coopération et de développement économiques. 2002. SIDS Initial Assessment Report for 14th SIAM (26−28 March 2002). 1,3-Diphenylguanidine, CAS No. 102-06-7. Paris (France). Publications du PNEU. Comprenant un ensemble de données IUCLID.
[OCDE] Organisation de coopération et de développement économiques. 2004. Emission scenario document on additives in rubber industry [en ligne]. Paris (France) : Direction de l'environnement de l'OCDE. (Series on Emission Scenario Documents No. 6). N° de rapport ENV/JM/EEA(2004)11, JT00166668. Accès : [consulté le 5 août 2010].
Ohm, R.F. 2000. Rubber Chemicals [en ligne].a href="http://mrw.interscience.wiley.com/emrw/9780471238966/kirk/article/rubbohm.a01/current/pdf" plus grand que In : Kirk-Othmer encyclopedia of chemical technology, version en ligne. [réserve de consultation].
Orlov, N.S., Vlasyuk, M.G., Glinyanaya, A.G. 1973. The effect of diphenylguanidine on humans and animals (clinical experiments). Gig. Prim. Polim. Mat. Stroit. 133-137. [cité dans OCDE, 2002].
Perrin, D.D. 1965. Dissociation constants of organic bases in aqueous solution. IUPAC Chemical Data Series. Londres (Angleterre) : Buttersworth. [cité dans HSBD].
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. [consulté le 4 août 2010].
Picin, D.G. 1973. Einfluß von Diphenylguanidin auf die Inkorporation in vivo von 32P-Orthophosphat in die Phospholipidfraktionen der Leber und des Blutserums von Ratten. Farmakol. Toksikol. 36:444-446. [cité dans GDCh-BUA, 1992].
Picin, D.G., Trendafilova, R.B. 1972. Einfluß von Diphenylguanidins auf den Gehalt an Lipidfraktionen in der Leber und im Blutplasma von Ratten dei acuter and subakuter Vergiftung. Farmakol. Toksikol. 35:360-362. [cité dans GDCh-BUA, 1992].
Pierson, W.R., Brachaczek, W.W. 1974. Airborne particulate debris from rubber tires. Rubber Chem. Technol. 47:1275-1299.
Piskin, G., Meijs, M.M,. van der Ham, R., Bos, J.D. 2006. Glove allergy due to 1,3-diphenylguanidine. Contact Derm. 54:61-6.
Rajan, V.S., Khoo, R. 1980. Allergic contact dermatitis in Singapore. Mod. Med. Asia 16:54-56. [cité dans OCDE, 2002].
Rannug, A., Rannug, U., Ramel, C. 1984. Genotoxic effects of additives in synthetic elastomers with special consideration to the mechanism of action of thiurames and dithiocarbamates. Prog. Clin. Biol. Res. 141:407-419.
Reifferscheid, T. 1979. Haeufigkeit und Verteilungsmuster der Kontaktallergene bei Patienten der Universitaets-Hautklinik Duesseldorf in den Jahren 1974-1976. Medizinische Dissertation, Universitaet Duesseldorf. [cité dans OCDE, 2002].
Ross, J.B. 1969. Rubber boot dermatitis in Newfoundland: a survey of 30 patients. Canad. Med. Ass. J. 100:13-19.
Rudzki, E., Kleniewska, D. 1970. The epidemiology of contact dermatitis in Poland. Br. J. Dermatol. 83:543-545. [cité dans OCDE, 2002].
Saha, M., Srinivas, C.R., Shenoy, S.D., Balachandran, C., Acharya, S. 1993. Footwear dermatitis. Contact Derm. 28:260-264.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2007. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques – septembre 2009 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation. [consultée le 14 décembre 2009].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2010. Disponible auprès de Santé Canada, Division des cosmétiques.
Shah, P.V., Sumler, M.R., Ioannou, Y.M., Fisher, H.L., Hall, L.L. 1985. Dermal absorption and disposition of 1,3-diphenylguanidine in rats. J. Toxicol. Environ. Health 15:623-633.
Susitaival, P., Husman, L., Hollmen, A., Horsmanheimo, M., Husman, K., Hannuksela, M. 1995. Hand eczema in Finnish farmers. A questionnaire-based clinical study. Contact Derm. 32:150-155.
Suskind, R.R. 1984. Personal communication, 1984 March 16. Cité dans : Fischer, A.A., 1986. Contact Dermatitis. Philadelphie (PA) : Lea & Febiger, p. 636. [cité dans OCDE, 2002].
[TOPKAT]Toxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. [consulté le 8 septembre 2010].
Trattner, A., Farchi, Y., David, M. 2003. Shoe contact dermatitis in Israel. Am. J. Contact Dermat. 14:12-14.
Trendafilova, R. 1971. Changes in some lipid fractions of liver and blood plasma in acute oral poisoning with diphenylguanidine (DPG). Khig Zdraveopazvane 14:35-41. [cité dans GDCh-BUA, 1992].
Trendafilova, R. 1972. Die Phospholipid-Fraktionen von Leber- und Blutplasma in akuten und subakuten Versuchen mit DFG. Khig. Zdraveopazvane 15:234-238. [cité dans GDCh-BUA, 1992].
Trendafilova, R., Picin, D. 1971. The influence of diphenylguanidine (DFG) in vivo on the incorporation of 32P-orthophosphate in phospholipid fractions of liver and blood plasma of rats. Eksp. Med. Morfol. 10:185-188. [cité dans GDCh-BUA, 1992].
[TRI] Toxics Release Inventory [base de données en ligne]. 2006. TRI Explorer 4.7. Washington (DC) : U.S. Environmental Protection Agency. [consultée le 10 novembre 2009].
[USEPA] United States Environmental Protection Agency. 2009. Initial Risk-Based Prioritization of High Production Volume (HPV) Chemicals. 1,3-Diphenylguanidine (CAS No. 102-06-7) [en ligne]. [consulté le 9 août 2010].
[USFDA] United States Food and Drug Administration. 2008. List of Indirect Additives Used in Food Contact Substances: Doc No. 5548. [en ligne]. Washington (DC) : U.S. Food and Drug Administration, Center for Food Safety and Applied Nutrition, Office of Food Additive Safety. Accès : [consulté en juillet 2010].
Valade, P., Delga, J., Salle, J. 1949. Étude expérimentale des effets physiologiques de la diphénylguanidine. Comptes Rendus Soc. Biol. 143:815-817. [cité dans GDCh-BUA, 1992].
Verchovski. 1952. Cited dans Kowalski, Z. et Bassendowska, E. Med. Pracy. 16:35-43. [cité dans GDCh-BUA, 1992].
Vlasyuk, M.G. 1978. Data for substantiation of the permissible quantity of diphenylguanidine migration from rubbers in contact with foods. Gig. Sanit. 7:35-38. [cité dans GDCh-BUA, 1992].
[WATERNT] Water Solubility Program [modèle d’estimation]. 2008. Version 1.01. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Wohlfahrt, R., Niebergall, H. 1984. Lebensmittelche. Gerichtl. Chem. 38:100-101. [cité dans BESC, 2000].
[WSKOWWIN] Water Solubility for Organic Compounds Program for Windows [modèle d’estimation]. 2000. Version 1.41 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.
Yamaguchi, T., Yamauchi, A., Yamazaki, H., Kakiuchi, Y. 1991. Mutagenicity of rubber additives in tire. Eisei Kagaku 37:6-13. [cité dans GDCh-BUA, 1992].
Yasuda, Y., Tanimura, T. 1980. Effect of diphenylguanidine on development of mouse fetuses. J. Envir. Path. Toxicol. 4:451-456.
You, X., Zhou, Y., Hu, Y. 1982. The mutagenicity of fourteen rubber accelerators. Huan Jing Ke Xue 3:39-42.
Annexe 1 : Résumé des renseignements relatifs effets de la DPG sur la santé
| Paramètre | DL50 ou CL50 ou doses minimales sans effet[1]/résultats |
|---|---|
| Essais sur des animaux de laboratoire et in vitro | |
| Toxicité aiguë | Plus faible DL50 par voie orale (souris) = 150 mg/kg p.c. chez la femelle et 211 mg/kg p.c. chez le mâle (Hasegawa, 1989) DL0 par voie cutanée (lapin) plus grand que 2 000 mg/kg p.c. (Monsanto Company, 1992a). Inhalation CL0 (espèce non précisée) = 500 mg/m3 (Valade et al., 1949). |
| Toxicité à court terme en doses répétées | DMENO par voie orale : Plus faible DMEO par voie orale = 500 mg/kg p.c. par jour (1 000 ppm), d'après une diminution du gain de poids corporel et une baisse de l'apport alimentaire chez les rats (souche, sexe et taille de groupe non précisés) exposés à une dose de 100 ou 1 000 ppm (soit l'équivalent de 5 ou 50 mg/kg p.c. par jour) de DPG dans le régime alimentaire pendant 28 jours (McCormick 1971). Autre DMEO par voie orale = 56 mg/kg p.c. par jour (500 ppm), d'après une baisse du gain de poids corporel et de la consommation alimentaire liées à la dose, chez les rats Sprague-Dawley mâles auxquels on a administré des doses de 500 ppm et plus (5 par sexe par groupe) exposés à la DPG dans leur alimentation à des doses de 0, 300, 500, 800, 1 500 ou 3 000 ppm (soit l'équivalent de 0, 36, 56, 73, 119 or 200 mg/kg p.c. par jour) pendant 14 jours. D'autres signes cliniques de toxicité ont été observés dans les groupes auxquels on a administré des doses plus importantes, notamment un amaigrissement à 800 ppm, une baisse de tonus et une horripilation du corps à 1 500 ppm, une ataxie, une courbure du dos, une apparence engourdie et une perte de poils à 3 000 ppm. Des réductions statistiquement significatives (p plus petit que 0,001) du poids absolu du cœur, du foie, des reins et de la rate ont été observées chez les rats mâles exposés à 800 ppm et plus, et chez les femelles exposées à 3 000 ppm (pour le cerveau, le cœur et la rate seulement). On a noté une augmentation statistiquement significative du poids relatif du cerveau chez les mâles pour tous les groupes de dosage et chez les femelles des groupes exposés à 500 et 1 500 ppm. L’auteur a déclaré que les différences observées dans les profils de poids absolu et relatif des organes entre les rats témoins et les rats traités sont attribuables à la réduction du gain de poids corporel chez les rats traités à la DPG. Deux mâles et trois femelles sont morts après une exposition à 3 000 ppm. Un examen pathologique macroscopique n'a révélé aucune lésion majeure chez les rats traités à la DPG (Monsanto, 1980). Autre DMENO par voie orale = 64 mg/kg p.c. par jour (750 ppm), d'après la baisse du poids corporel moyen ou de gain de poids corporel et la baisse de l'apport alimentaire à la fin de l'étude, à une dose de 750 ppm et plus chez les rats F344/N des deux sexes (5 par sexe par groupe) exposés à des doses de 0, 250, 500, 750, 1 500 ou 3 000 ppm de DPG dans leur régime alimentaire (soit l'équivalent de 0, 22, 45, 64, 121 ou 166 mg/kg p.c. par jour chez les femelles) pendant 14 jours. Des signes cliniques de toxicité, y compris une fourrure froissée et une apparence mince, ont été signalés chez des rats des deux sexes exposés à 3 000 ppm. Aucune lésion macroscopique liée au traitement n'a été observée (NTP, 1995). DMEO : Plus faible DMEO par voie orale = 30 mg/kg p.c. par jour, d'après une baisse du niveau de glycémie, une coloration marron du foie et une augmentation de la salivation chez les rats Crj:CD(SD)IGS des deux sexes (5 par sexe par groupe) exposés à des doses de 0, 10, 30 ou 90 mg/kg p.c. par jour par gavage pendant 28 jours (et une période de rétablissement de 14 jours pour le groupe témoin et celui exposé à des doses élevées). Une hausse de la numération plaquettaire a été observée seulement chez les rates exposées à une dose de 30 mg/kg p.c. par jour. Une augmentation des niveaux d'azote et de la bilirubine totale, ainsi qu'une activité importante de la glutamate pyruvate transaminase et de la phosphatase alcaline dans le sang ont été observées chez les mâles exposés à des doses élevées. Chez les animaux des deux sexes exposés à des doses élevées, on a constaté une position inclinée et latérale, une démarche titubante, une diminution de l'activité motrice et du réflexe de sursaut, une augmentation des changements hydrophobes dans les tubules rénaux, une baisse importante de la consommation de nourriture et une diminution du gain de poids corporel. Un rat mâle et trois femelles exposés à des doses élevées sont morts pendant le traitement. Aucun effet n'a été observé sur le poids ou sur l'apparence pathologique ou microscopique des organes de reproduction chez les rats des deux sexes (Murata et al., 2001). Étude sur l'exposition par inhalation : Étude sur l'exposition par voie cutanée : Autres études : Verchovski, 1952; Burov, 1964; Trendafilova et Picin, 1971; Trendafilova, 1971, 1972; Picin et Trendafilova, 1972; Picin, 1973; NTP 1995. |
| Toxicité subchronique | Plus faible DMENO par voie orale = 37 mg/kg p.c. par jour (500 ppm), d'après une diminution du poids corporel moyen et une baisse de la consommation alimentaire chez les rats Sprague-Dawley des deux sexes (15 par sexe par groupe) exposés à la DPG dans leur alimentation à des doses de 0, 50, 150 ou 500 ppm (soit l'équivalent de 0, 4, 11 ou 37 mg/kg p.c. par jour) pendant 90 jours. Une baisse statistiquement significative du poids absolu et une augmentation du poids relatif des divers organes (cœur, foie, reins et rate chez les mâles et cerveau chez les femelles) ont également été observées dans les groupes exposés à des doses élevées. Les légers changements dans les paramètres de chimie clinique (hausse de la glutamate pyruvate transaminase et de la phosphatase alcaline) et les paramètres hématologiques (augmentation du nombre de globules blancs) n'ont pas été pris en compte par les chercheurs, car ils ne présentaient aucune importance toxicologique. Aucune différence macroscopique de taille n'a été observée à l'autopsie entre les groupes. L'examen histopathologique n'a révélé aucune lésion précise pouvant être attribuée à l'administration de doses de DPG. DMENO par voie orale induisant une toxicité pour la reproduction = 37 mg/kg p.c. par jour (500 ppm), d'après la hausse du poids relatif de l'utérus chez les femelles et du poids relatif des testicules chez les mâles. Aucun changement histopathologique ou du poids n'a été signalé dans les autres organes de reproduction (Monsanto, 1982a). Autre DMENO par voie orale = 64 mg/kg p.c. par jour (750 ppm), d'après la baisse du poids corporel et de l'apport alimentaire à cette dose, et constatée à des doses supérieures chez les rats F344/N des deux sexes (10 par sexe par groupe) exposés à des doses de 0, 250, 500, 750, 1 500 ou 3 000 ppm de DPG dans leur régime alimentaire (soit l'équivalent de 0, 22, 45, 64, 121 ou 200 mg/kg p.c. par jour chez les femelles) pendant 13 semaines. Les signes manifestes de toxicité suivants ont été constatés chez des rats des deux sexes exposés à des doses de 1 500 ppm et plus : fourrure froissée, apparence mince, décoloration des parties du corps, salivation, hypoactivité, convulsions et crises épileptiques, courbure du dos, cas de ptosis, ataxie et dyspnée. Des anomalies ont également été observées à 1 500 ppm et plus dans les domaines suivants : chimie clinique (augmentation de l'activité de la phosphatase alcaline et de la concentration d'acide biliaire, baisse des concentrations totales de protéine, de créatinine, de cholestérol et de triglycérides); et hématologie (augmentation du nombre d'érythrocytes, de la quantité d'hématocrite et des concentrations d’hémoglobine). Les examens histopathologiques ont révélé un appauvrissement et une nécrose des tissus dans un certain nombre d'organes chez les mâles et les femelles exposés à la dose la plus élevée. Une diminution significative du poids des organes a également été observée chez des rats exposés à deux doses élevées. Tous les effets correspondant aux deux doses élevées ont été jugés par l'auteur de l'étude comme le résultat d'une diminution de l'apport alimentaire, d'une diminution du gain de poids corporel et d'un mauvais état corporel. Toutes les femelles et trois mâles des groupes exposés aux doses les plus élevées sont morts avant la fin de l'étude (NTP, 1995). DMENO par voie orale induisant une toxicité pour la reproduction = 64 mg/kg p.c. par jour (750 ppm), d'après une hypoplasie utérine à 750 ppm et plus, et une prolongation du cycle des chaleurs à 1 500 ppm chez les femelles. Une diminution importante de la motilité des spermatozoïdes à une concentration de 1 500 ppm, un appauvrissement de la prostate, une hypospermie, une diminution de la spermatogenèse et une réduction du poids absolu de la prostate et des testicules à 3 000 ppm ont été signalés chez les mâles (NTP, 1995). Autre DMENO par voie orale = 133 mg/kg p.c. par jour (750 ppm), d'après la diminution du poids corporel et du gain de poids corporel (sans baisse marquée de l'apport alimentaire) chez les souris B6C3F1 des deux sexes (10 par sexe et par groupe) exposées à des doses de 0, 250, 500, 750, 1 500 ou 3 000 ppm dans leur régime alimentaire (soit l'équivalent de 0, 48, 92, 133, 266 ou 573 mg/kg p.c. par jour chez les mâles, et de 0, 53, 112, 150, 303 ou 691 mg/kg p.c. par jour chez les femelles) pendant 13 semaines. Une perte de poils, une position anormale et des cas de ptosis ont été observés à 1 500 ppm et plus. Dans le cadre de cette étude, l'auteur n'a pas considéré comme une réponse toxique précise la diminution du poids absolu et l'augmentation importante du poids relatif des organes observées à 1 500 ppm et plus, mais les a plutôt mises en corrélation avec la diminution évidente du poids corporel. DMENO par voie orale concernant la toxicité pour la reproduction = 573 (mâle)/691 (femelle) mg/kg p.c. par jour (3 000 ppm), d'après la réduction de la densité/motilité du sperme chez les mâles, ainsi que de la prolongation de la durée du cycle des chaleurs chez les femelles (NTP, 1995). Autres études : Arkhangel'skaya et Roshchina, 1963; Orlov et al., 1973. Aucune étude de toxicité subchronique par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité chronique et cancérogénicité | Dans une étude insuffisamment documentée, des souris hybrides C57BL/J6XDBA2 des deux sexes (50 par sexe par groupe) ont été exposées à la DPG dans leur régime alimentaire à des doses de 0, 4 ou 8 mg/kg p.c. par jour pendant 32 semaines, avant d'être observées pendant 10 à 16 semaines. Aucune tumeur n'a été observée à la fin de la période de traitement; toutefois, trois des 50 souris exposées à de faibles doses ont développé des adénocarcinomes lymphatiques après la période d'observation. Aucune tumeur de ce type n'a été observée dans les groupes exposés à des doses élevées ou dans les groupes témoins. Des augmentations transitoires de la rate ont également été signalées; aucune autre précision n’a été apportée (Bempong, 1986). Dans une étude insuffisamment documentée, des souris ddy des deux sexes (30 ou 60 par sexe dans le groupe de traitement et le groupe témoin, respectivement) ont été exposées à des doses de 0, 20, 60, 180 ou 540 ppm de DPG (soit l'équivalent de 0, 3, 10, 35, 103 mg/kg p.c. par jour) dans leur alimentation pendant 21 mois. Aucun effet pathologique (néoplasique ou non néoplasique) attribuable au traitement n'a été constaté dans les différents groupes, peu importe les doses d'exposition, et aucune autre précision n'a été apportée (Kurokawa et Ogawa, cité dans OCDE, 2002). Aucune toxicité chronique par voie cutanée ou par inhalation n'a été recensée. |
| Génotoxicité et paramètres connexes : in vivo | Formation de micronoyaux Aberrations chromosomiques |
| Génotoxicité et paramètres connexes : in vitro | Aberrations chromosomiques Mutation génique Inhibition de la formation de colonies Essai mutagène par passage sur hôte |
| Toxicité pour la reproduction | DMENO la plus faible, par voie orale = 4 mg/kg p.c. par jour, d'après une augmentation non linéaire importante de la fréquence des anomalies des spermatozoïdes (à partir de la sixième semaine), une baisse du nombre de spermatozoïdes (à partir de la septième semaine), du poids des testicules (à partir de la cinquième semaine) et de la forme irrégulière des tubules séminifères chez les souris C57BL/6J x DBA2 mâles (20 par groupe) exposées à des doses de 0, 4 ou 8 mg/kg p.c. par jour de DPG dans de l'eau potable acidifiée, pendant une période allant jusqu'à 105 jours. En ce qui concerne les scarifications prévues aux semaines 1, 3, 5, 7, 9 et 15, un examen histologique des testicules de souris exposées a révélé une forme irrégulière des tubules séminifères sans membrane de base définie, une perte des cellules interstitielles et une réduction du nombre de spermatides et de spermatozoïdes dans le lumen du tubule en fonction du temps. Après 7 jours d'exposition, les mâles ont été accouplés à des intervalles hebdomadaires avec des femelles non traitées. Une baisse des indices de fertilité liée à la dose ou du nombre d'implants par gestation, et une augmentation de la mortalité fœtale précoce et tardive (à partir de la septième semaine) ont été signalées chez les femelles non traitées (sacrifiées au treizième jour de la gestation). Plus faible DMENO par voie orale = 4 mg/kg p.c. par jour, d'après une augmentation liée à la dose de la fréquence d'anomalies des spermatozoïdes (qui ont commencé au 30e jour et ont été mis en évidence à partir du 75e jour) chez les hamsters dorés de Syrie mâles (5 par groupe) exposés à des doses de 0, 4 ou 8 mg/kg p.c. par jour de DPG dans de l'eau potable, pendant une période allant jusqu'à 80 jours. Aucun autre effet nocif n'a été signalé (Bempong et Hall 1983). Autre DMENO par voie orale = 16 mg/kg p.c. par jour, d'après une hausse statistiquement significative du nombre de spermatozoïdes avec la queue repliée, mais une tête normale chez les souris CD-1 mâles (25 par groupe) exposées à des doses de 0, 0,06; 0,25; 1; 4 ou 16 mg/kg p.c. par jour de DPG, par gavage pendant 56 jours. Aucun autre effet lié au traitement n'a été observé chez les souris traitées à la dose la plus élevée pendant l'examen microscopique des testicules ou sur la fréquence des anomalies totales des spermatozoïdes. Chez les mâles traités, aucune variation du poids corporel ou des organes, aucune observation microscopique ni aucune mort liée au traitement n'ont été constatées. Après l'accouplement, à la fin du traitement, de mâles exposés à des doses élevées (de 4 à 16 mg/kg p.c. par jour) et de femelles non exposées, on n'a observé aucun effet nocif sur la fertilité ou la performance reproductrice des souris adultes des deux sexes, et aucun changement du développement embryonnaire ou d'autres paramètres des portées n'ont été signalés (les mères ont été sacrifiées au quatorzième jour de gestation). Aucun effet sur le poids corporel n'a été constaté chez les mères non traitées (Koëter et al., 1992). |
| Toxicité pour le développement | DMENO la plus faible par voie orale = 10 mg/kg p.c. par jour, d'après une baisse significative du nombre moyen d'implants chez les souris Jcl:ICR gestantes (20 par groupe) exposées à des doses de 0; 0,25; 1; 4 ou 10 mg/kg p.c. par jour de DPG, par gavage pendant les jours 0 à 18 de la gestation. Aucune toxicité maternelle n'a été observée et on n'a relevé aucune différence significative du pourcentage de fœtus morts, de la taille moyenne de la portée, du rapport des sexes ou du poids corporel moyen entre les groupes témoins et traités. La fréquence des malformations externes ou squelettiques chez les groupes traités était semblable à celle des groupes témoins. Un retard du développement osseux de l'astragale a été observé chez les fœtus des mères traitées avec 4 mg/kg p.c. par jour de DPG, mais pas à des doses faibles ou élevées (Yasuda et Tanimura, 1980). Autre DMENO par voie orale = 50 mg/kg p.c. par jour, d'après une baisse importante du poids du fœtus et une augmentation de l'incidence de fœtus avec une ossification incomplète ou des côtes déformées chez les rates Sprague-Dawley (groupe de 25) exposées à des doses de 0, 5, 25 ou 50 mg/kg p.c. par jour par gavage, pendant les jours 6 à 15 de la gestation (sacrifiés au vingtième jour de la gestation). Aucune autre malformation liée au traitement n'a été constatée chez les fœtus. Le rapport des sexes des fœtus et les nombres moyens de fœtus viables, de sites d'implantation et de corps jaunes étaient comparables à ceux du groupe témoin. Une augmentation des pertes postimplantation a été observée chez les mères recevant des doses élevées. DMENO pour la toxicité maternelle = 50 mg/kg p.c. par jour, d'après une réduction statistiquement significative du poids corporel moyen ou du gain de poids corporel et des signes cliniques de toxicité (perte de poils, léthargie, tachypnée, baisse du ton des membres, courbure du dos, ataxie, etc.) chez les rates gestantes. Aucun effet sur le taux de survie n'a été observé chez les mères, quel que soit le niveau de dose (Monsanto, 1986). Dans une étude de tératologie portant sur la détermination des doses, des rates Sprague-Dawley gestantes (5 par groupe) ont été exposées à des doses de 0, 10, 50, 100, 150 ou 200 mg/kg p.c. par jour de DPG par gavage (solution aqueuse à 0,5 %, Methocel) entre les jours de gestation 6 à 15. Toutes les rates dans les groupes recevant les 2 doses les plus élevées et 4 rates dans le groupe traité avec une dose de 100 mg/kg p.c. par jour sont mortes entre les jours de gestation 7 et 11. Aucun effet sur les pertes postimplantation, le nombre de corps jaunes, le nombre d'implantations ou la viabilité fœtale n'a été observé chez les survivants. Une DMENO pour la toxicité maternelle = 50 mg/kg p.c. par jour, d'après une diminution marquée du gain de poids corporel, a été observée à ce niveau de dose et au-delà. Un comportement léthargique et une ataxie ont été constatés chez 4 rates du groupe traité avec une dose de 50 mg/kg par jour (principalement pendant les jours 6 à 9 de la gestation). Une courbure du dos et une tachypnée ont été observées chez un rat dans chacun des groupes traités avec des doses de 50 et 100 mg/kg par jour. Les observations cliniques ont révélé des anomalies neurocomportementales et motrices chez les sujets morts prématurément qui étaient similaires aux anomalies observées chez les survivants. L'autopsie a révélé une congestion des divers organes (Monsanto, 1985). |
| Sensibilisation | Dans le cadre de tests de maximalisation, 10 cochons d'Inde (sexe et souche non spécifiés) ont reçu des doses de 0,5 ml de DPG à 25 % appliqués sur l'épicutane après la première journée d'induction intracutanée (0,1 mL à 1 % de DPG) et le huitième jour d'induction sur l'épicutane (0,5 mL de 25 % de DPG). Il n'y a eu aucune réaction cutanée attribuable au potentiel de sensibilisation du 1,3-Diphénylguanidine chez les cochons d'Inde traités (MLPC, 1995). |
| Irritation | Irritation cutanée Aucune irritation n'a été signalée dans le cadre d'un test de Draize dans lequel un échantillon de sol de 0,5 g humidifié avec de l'eau a été appliqué sur la peau de lapins (souche, sexe et taille du groupe non précisés) pendant 24 heures (Monsanto Company, 1977c). Une légère irritation causée par la DPG a été signalée dans un autre test de Draize chez des lapins, sans autres détails relatifs à l'étude (Kowalski et Bassendowska, 1965). Irritation oculaire Dans le cadre de tests d'irritation des yeux, 6 lapins (sexe et souche non précisés) ont eu leurs yeux exposés à la DPG pendant 24 heures (aucune précision fournie sur l'essai). Une légère irritation s'est produite à une dose de 20 mg de DPG et une irritation marquée à une dose de 100 mg (Kowalski et Bassendowska 1965; Monsanto, 1977b). |
| Humains | |
| Sensibilisation | Dans le cadre d'un test épicutané chez des volontaires, 49 personnes ont été exposées au pétrolatum contenant de la DPG à 70 %. Aucune réaction positive importante n'a été observée après la première application par induction. Sur les 49 personnes, 19 présentaient des signes d'irritation lors des expositions par induction suivantes. Deux sujets présentaient des réactions positives au cours de la phase d'essai de deux semaines (Monsanto, 1982b). Un certain nombre de tests épicutanés impliquant la DPG (allergènes des chaussures, substances chimiques ou additifs dans le caoutchouc ou des quantités de 0,5 à 2 % de DPG dans le pétrolatum/plastibase) ont été produits sur des groupes importants ayant des dermatites de contact partout dans le monde. Des réactions cutanées positives ont été déclarées selon un ratio de 0,03 à 12 % du nombre total de sujets mis à l'essai dans la plupart des études. Des réactions positives ont été constatées sans corrélation avec les types ou les niveaux de dose de DPG utilisés dans les essais (Meneghini et al., 1963; Agrup, 1969; Rudzki et Kleniewska, 1970; Baer e at., 1973; Reifferscheid, 1979; Rajan et Khoo, 1980; Lynde et al., 1982; Garcia-Perez et al., 1984; Suskind, 1984; Liden, 1989; Bajaj et al., 1988, 1991; Conde-Salazar et al., 1993; Saha et al., 1993; Bruze et Kestrap, 1994; Kiec-Swierczynska, 1995; Susitaival et al., 1995; Mancuso et al., 1996; Holness et Nethercott, 1997; Nettis et al., 2002a, 2002b, 2003; Geier et al., 2003; Trattner et al., 2003; Comfere et al., 2005; Holden et Gawkrodger, 2005; Katugampola et al., 2005; Piskin et al., 2006). |
| Études épidémiologiques | Dans une étude de cohorte occupationnelle menée auprès de travailleurs âgés de 29 à 58 ans (aucune précision fournie, sans groupe témoin; vraisemblablement réalisée en Russie) qui avaient été en contact avec de la DPG sur une période de 3 à 15 ans, des effets nocifs ont été observés chez près de 30 % des travailleurs. Les effets nocifs fréquemment observés étaient notamment la gastrite, la cholangite, la cholécystite, les perturbations neurologiques et les dermatites, et les effets nocifs moins fréquemment observés étaient l'asthme, la rhinite, la neuropathie, la polyarthrite, l'hypertonie, la lithiase, les perturbations de la fonction hépatique, les modifications du métabolisme des protéines et l'augmentation des concentrations de bilirubine (Orlov et al., 1973). Dans une étude de cohorte occupationnelle menée auprès de travailleurs qui avaient été accidentellement en contact avec de la DPG (aucune précision fournie, sans groupe témoin; vraisemblablement réalisée en Russie), des effets nocifs tels que des douleurs des paupières, des rougeurs des yeux, une sensation d'amertume, des douleurs à l'œsophage, des gencives amorphes, une réduction ou absence d'acidité des sucs gastriques et des cas d'achylie ont été observés (Arkhangel'skaya et Roshchina 1963). |
Notes de bas de page
[2] La détermination de la conformité à l'un ou plusieurs des critères énoncés à l'article 64 repose sur une évaluation des risques pour l'environnement ou la santé humaine associés aux expositions dans l'environnement en général. Pour les humains, ceci comprend, sans toutefois s'y limiter, les expositions à l’air ambiant, à l’air intérieur, à l’eau potable, aux produits alimentaires et dues à l’utilisation de produits de consommation. Une conclusion tirée pour des substances du Défi relatif au Plan de gestion des produits chimiques dans le cadre de la LCPE (1999) n’est pas pertinente, ni n’empêche une évaluation en fonction des critères de danger stipulés dans le Règlement sur les produits contrôlés, qui fait partie du cadre réglementaire applicable au Système d’information sur les matières dangereuses utilisées au travail pour les produits destinés à être utilisés au travail. De même, une conclusion basée sur les critères définis à l’article 64 de la LCPE (1999) n’empêche pas la prise de mesures dans le cadre d’autres articles de cette loi ou d’autres lois.
[3] On a présumé que les groupes d'âge suivants ingéraient quotidiennement et de façon accidentelle les quantités de sol indiquées : 0 à 6 mois (poids estimé à 7,5 kg), 30 mg de sol; 0,5 à 4 ans (poids estimé à 15,5 kg), 100 mg de sol; 5 à 11 ans (poids estimé à 31,0 kg), 65 mg de sol; de 12 à 19 ans (poids estimé à 59,4 kg), 30 mg de sol; 20 à 59 ans (poids estimé à 70,9 kg), 30 mg de sol; 60 ans et plus (poids estimé à 72 kg), 30 mg de sol (Santé Canada, 1998)
[4] Liste des références : Monsanto, 1976; You et al., 1982; Crebelli et al., 1984b, 1985; Rannug et al., 1984; Mortelmans et al., 1986; Yamaguchi et al., 1991; NTP, 1995; JETOC, 1996; Enomoto et al., 2001.
[5] Liste des références : Meneghini et al., 1963; Agrup, 1969; Rudzki et Kleniewska, 1970; Baer et al., 1973; Reifferscheid, 1979; Rajan et Khoo, 1980; Lynde et al., 1982; Garcia-Perez et al., 1984; Suskind, 1984; Liden, 1989; Bajaj et al., 1988, 1991; Conde-Salazar et al., 1993; Saha et al., 1993; Bruze et Kestrap, 1994; Kiec-Swierczynska, 1995; Susitaival et al., 1995; Mancuso et al., 1996; Holness et Nethercott, 1997; Nettis et al., 2002a, 2002b, 2003; Geier et al., 2003; Trattner et al., 2003; Comfere et al., 2005; Holden et Gawkrodger, 2005; Katugampola et al., 2005; Piskin et al., 2006.