Évaluation préalable pour le Défi concernant
Archivée
le dodécaméthylcyclohexasiloxane
(D6)
Numéro de registre du Chemical Abstracts Service
540-97-6
Environnement Canada
Santé Canada
Novembre 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexes
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du dodécaméthylcyclohexasiloxane (D6), dont le numéro de registre du Chemical Abstracts Service est 540-97-6. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi lancé par les ministres, car il a été prouvé qu’elle répondait aux critères de la catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque (PBiT) pour les organismes non humains et car elle est commercialisée au Canada.
Bien que le processus de catégorisation n’ait pas déterminé que l’évaluation des risques du D6 pour la santé humaine devait être prioritaire, une évaluation de cette substance en fonction de la santé humaine a été effectuée en raison de la similarité de sa structure et de son profil d’utilisation par rapport à ceux de l’octaméthylcyclotétrasiloxane, qui est également connu sous le nom de D4, une substance dont l’évaluation fait l’objet d’une priorité élevée à cause des risques qu’elle présente tant pour la santé humaine que pour l’environnement conformément à la LCPE (1999).
Le D6 est un produit chimique industriel qui n’était fabriqué par aucune société au Canada en 2006 en quantité supérieure au seuil de déclaration de 100 kg, mais qui y est importé dans des mélanges avec d’autres siloxanes cycliques et comme substance résiduelle dans les polymères de silicone et dans des produits de consommation finis. Les réponses reçues à un avis publié en application de l’article 71 de la LCPE (1999) ont permis de déterminer qu’entre 100 000 et 1 000 000 kg de D6 avaient été importés au Canada en 2006.
Le D6 est susceptible d’être rejeté dans l’environnement lors de processus industriels utilisés dans le cadre d’opérations de mélange, de formulation et de conditionnement, et lors d’opérations de prévention de la mousse et de dégraissage. Il peut également être rejeté à la suite de l’utilisation et de l’élimination de produits d’hygiène. L’air, les eaux usées et les terres agricoles constituent les milieux naturels cibles du D6 à cause de ses propriétés physiques et chimiques et de ses profils d’utilisation.
Le D6 est persistant dans l’air avec des demi-vies atmosphériques calculées de plus de 2 jours. Le D6 pourrait être transporté sur de grandes distances dans l'atmosphère. Toutefois, il risque peu de se déposer dans l'eau ou dans le sol en régions éloignées. On suppose que la demi-vie d’hydrolyse du D6 est supérieure à celle du D4 et du D5, dont la structure est similaire. Une demi-vie d’environ 401 jours a été déterminée par extrapolation pour le D6 en fonction des demi-vies d’hydrolyse (valeurs expérimentales) du D4 et du D5 à pH neutre et température ambiante. On considère que le D6 est persistant dans les conditions typiques des eaux canadiennes. Dans les sédiments, on suppose que la demi-vie du D6 va au-delà de 49 à 588 jours dans des conditions sédimentaires canadiennes réalistes (température comprise entre 5 et 25 °C), ce qui indique que le D6 peut être persistant dans les sédiments. Le D6 ne semble pas être persistant dans le sol selon la dégradation catalysée par l’argile, le diméthylsilanediol correspondant au produit stable de l’hydrolyse. On arrive donc à la conclusion que le D6 répond aux critères de persistance tels que définis dans le Règlement sur la persistance et la bioaccumulation.
La valeur empirique du facteur de bioconcentration empirique est inférieur à 2000, ce qui concorde avec la biodisponibilité réduite de la substance due à sa valeur de log Koeélevée. Les valeurs croisées du facteur de bioamplification du D4 et du D5 déterminées en laboratoire indiquent qu’il n’y a pas de phénomène de bioamplification du D6 dans les poissons d’essai par absorption alimentaire. Bien que le facteur de bioaccumulation modélisé supérieur à 5 000 suggère un potentiel de bioaccumulation élevé, le facteur de bioaccumulation prévu ne peut pas à lui seul suffire à conclure que le potentiel de bioaccumulation du D6 est élevé en raison du haut degré d’incertitude entourant cette prévision. Ainsi, bien qu’on ait établi que le D6 présente un potentiel de bioaccumulation dans le biote, on peut conclure, des données empiriques sur le facteur de bioconcentration et des données sur le D4 et le D5, que le D6 ne répond pas aux critères de bioaccumulation tels que défini dans le Règlement sur la persistance et la bioaccumulation.
Des renseignements sur la toxicité du D6 ne sont pas disponibles pour les organismes vivant dans les sédiments; des données de type « référence croisée » conservatrices du D5 ont été utilisées et il est conclu que la concentration sans effet de D6 sur la communauté benthique est supérieure à 69 mg/kg. Les données de toxicité expérimentale n’ont montré aucun effet nocif chez les organismes aquatiques pélagiques à des concentrations allant jusqu’à 0,0046 mg/L (limite de solubilité approximative dans l’eau). Toutefois, la biodisponibilité réduite du D6 en comparaison de celle de ses analogues étroitement apparentés (le D4 et le D5) tend à indiquer que le D6 ne devrait présenter aucun seuil de toxicité à sa limite de solubilité dans l’eau, et ce, en ce qui concerne les effets nocifs. Compte tenu de la faible biodisponibilité du D6 et de sa faible capacité à causer des effets, on conclut que le D6 présente un faible potentiel d’effets nocifs sur l’environnement.
En ce qui concerne la santé humaine, le foie a été identifié comme organe cible des expositions par voie orale et par inhalation au D6. La concentration à effet critique pour la toxicité des doses répétées est fondée sur une augmentation du poids du foie, des cas de lipidose périportale et des cas d’hypertrophie des cellules folliculaires de la thyroïde au cours d’une étude de 4 semaines chez les rats. La comparaison entre la concentration à effet critique pour les doses répétées par voie orale et la limite supérieure estimée pour l’absorption quotidienne de D6 par la population canadienne donne une marge d’exposition suffisante. Selon une étude indépendante sur l’évaluation précise de l’exposition concernant les produits d’hygiène, on a pu déterminer une marge d’exposition appropriée en comparant la concentration à effet critique des effets des doses répétées par voie orale et la limite supérieure prudente estimée pour l’absorption quotidienne de D6 due à l’utilisation de produits d’hygiène
D’après les informations disponibles sur sa capacité à causer des effets nocifs sur l’environnement, on peut conclure que le D6 ne pénètre pas dans l’environnement en une quantité ou une concentration, ou dans des conditions de nature à avoir, immédiatement ou à long terme , un effet nocif, sur l’environnement ou sur la diversité biologique ou , ou à mettre en danger l’environnement essentiel pour la vie.
Selon les informations disponibles sur son potentiel d’effets nocifs sur la santé humaine, on peut conclure que le D6 ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger pour la vie ou la santé humaines au Canada.
Cette substance s’inscrira dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles définies à l’étape de la gestion des risques.
D'après les renseignements disponibles, le D6 ne remplit aucun des critères de l’article 64 de la LCPE (1999).
La Loi canadienne sur la protection de l'environnement(1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l'Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine. Selon les résultats de cette évaluation, les ministres peuvent proposer de ne rien faire à l'égard de la substance, de l'inscrire sur la Liste des substances d'intérêt prioritaire en vue d'une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l'annexe 1 de la Loi et, s'il y a lieu, sa quasi-élimination.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques, et que l'on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu du classement attribué par d'autres organismes nationaux ou internationaux quant à la cancérogénicité, la génotoxicité ou la toxicité sur le plan du développement ou de la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
L'évaluation des risques que comporte le dodécaméthylcyclohexasiloxane (aussi connu sous le nom de D6) pour l'environnement a été jugée hautement prioritaire car cette substance est persistante, bioaccumulable et intrinsèquement toxique pour les organismes aquatiques et l’on croit qu'elle est commercialisée au Canada. Le volet du Défi portant sur le D6 a été lancé le 12 mai 2007 au moyen d’un avis paru dans la Gazette du Canada (Canada, 2007). En même temps a été publié le profil de cette substance, qui présentait l’information technique et écologique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Grâce à ce Défi, plus de 100 présentations de données relatives à cette substance ont été reçues concernant ses propriétés physiques et chimiques, son potentiel de bioaccumulatiion, sa persistance, son écotoxicologie et les quantités disponibles dans le commerce entre autres.
Bien que le processus de catégorisation n'ait pas permis de déterminer que l'évaluation des risques du D6 pour la santé humaine devait faire l’objet d’une priorité, une évaluation de cette substance en fonction de la santé humaine a été recommandée en raison de la similarité de sa structure et de son profil d'utilisation par rapport à ceux du D4, connu également sous le nom d'octaméthylcyclotétrasiloxane, une substance dont l'évaluation des risques tant pour la santé humaine que pour l'environnement a été jugée hautement prioritaire conformément à la LCPE (1999) et du fait de son utilisation accrue comme solution de rechange au D4. Par conséquent, la présente évaluation porte principalement sur les informations pertinentes pour l’évaluation des risques touchant l'environnement et la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l'accent sur les renseignements essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques énoncés à l'article 64 de la Loi :
« 64. [...] est toxique toute substance qui pénètre ou peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à :
a) avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique;
b) mettre en danger l'environnement essentiel pour la vie;
c) constituer un danger au Canada pour la vie ou la santé humaines. »
Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris ceux fournis dans le cadre du Défi. Les données liées à l'évaluation préalable de cette substance proviennent de documents originaux, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et de recherches documentaires récentes (jusqu'en août 2008) ayant servi de base aux sections du présent document qui portent sur la santé humaine et l'environnement. Les études importantes ont fait l'objet d'une évaluation critique. Les résultats de la modélisation ont pu être utilisés dans la formulation de conclusions. Les renseignements présentés dans des évaluations des dangers réalisées par d'autres instances ont été pris en considération lorsqu'ils étaient disponibles et pertinents. L'évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Elle fait plutôt état des études et des éléments d’information les plus importants en rapport avec la conclusion.
L'évaluation des risques pour la santé humaine tient compte des données qui ont trait à l'estimation de l'exposition (non professionnelle) de la population dans son ensemble et des informations relatives aux dangers pour la santé (fondées essentiellement sur des évaluations réalisées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à établir le caractère prioritaire de la substance). Les décisions reposent sur la nature de l'effet critique retenu ou sur l’écart (ou marge) entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition. Elles tiennent compte de la confiance accordée à l'exhaustivité des bases de données identifiées qui portent sur l'exposition et les effets dans le contexte d'une évaluation préalable. L'évaluation préalable n'est pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'une synthèse des informations les plus importantes permettant d'appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel des programmes des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes de ces ministères. Cette évaluation préalable a fait l'objet d'une consultation et d'un examen externe par des pairs. Des commentaires sur les parties techniques relatives à la santé humaine ont été fournis par le Toxicology Excellence for Risk Assessment (TERA). Bien que les commentaires externes aient été pris en compte, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable. Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Les principales données et considérations sur lesquelles repose la présente évaluation sont résumés ci-après.
Aux fins du présent document, le dodécaméthylcyclohexasiloxane est désigné par le sigle D6, un nom abrégé dérivé de la nomenclature des siloxanes élaborée par General Electric (Hurd, 1946).
Le D6 appartient au groupe des composés cycliques volatils de type méthylsiloxane (cVMS) à poids moléculaire relativement faible (inférieur à 600) et à pression de vapeur élevée. Ces cVMS sont des liquides à base de silicone volatile à faible viscosité, constitués d'unités structurelles [-Si(CH3)2O]x à configuration cyclique. Le D6 comporte six de ces unités structurelles, comme la structure chimique ci-dessous (tableau 1).
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 540-97-6 |
|---|---|
| Nom dans la Liste intérieure des substances (LIS) | Dodécaméthylcyclohexasiloxane - |
| [1] National Chemical Inventories (NCI), 2006 : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique; ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); PICCS (inventaire des produits et substances chimiques des Philippines); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande) ; TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). | |
| Noms dans les National Chemical Inventories (NCI)[1] | Cyclohexasiloxane, 2,2,4,4,6,6,8,8,10,10,12,12-dodecamethyl- (TSCA) Cyclohexasiloxane, dodecamethyl- (AICS, PICCS, ASIA-PAC, NZIoC) Dodécaméthylcyclohexasiloxane (EINECS) Dodecamethylcyclohexasiloxane (ECL) |
| Autres noms | D6; Dodecamethylhexacyclosiloxane; Cyclic hexamer : D6; 2,4,6,8,10,12-Dodecamethylcyclohexasiloxane |
| Principale classe chimique ou utilisation | Composés organosiliciés |
| Principale sous-classe chimique | Méthylsiloxanes cycliques volatils (cVMS) |
| Formule chimique | C12H36O6Si6 |
| Structure chimique |  |
| Simplified Molecular Input Entry (SMILES) | C[Si]1(O[Si](O[Si](O[Si](O[Si](C)(C)O[Si](O1)(C)C)(C)C)(C)C)(C)C)C |
| Masse moléculaire | 444,93 g/mole |
Le D6 est également référencé sous un autre numéro de registre du Chemical Abstracts Service. Ce numéro, n° CAS 69430-24-6, désigne un mélange de cyclosiloxanes substitués par des groupes diméthyl, de structure générale [-Si(CH3)2O-]x, à configuration cyclique, où x est habituellement inférieur à 8 et plus souvent compris entre 3 et 7 (SEHSC, 2007a). Ce n° CAS est associé aux noms suivants : cyclopolydiméthylsiloxane, cyclopolydiméthylsiloxane (DX), diméthylcyclosiloxanes, diméthylcyclopolysiloxane, composés polydiméthylsiloxy cycliques, polydiméthylcyclosiloxane, cyclométhicone et mélanges de cyclosiloxanes. Dans ce rapport, on privilégiera le terme cyclométhicone couramment utilisé pour ce mélange en cosmétologie.
Pour cette évaluation, les données recueillies pour le D4 et le D5 ont également été utilisées étant donné la similarité structurelle des substances, telle qu'elle est illustrée dans le tableau suivant :
| D4 | D5 | D6 |
|---|---|---|
 |
 |
 |
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et modélisées) du D6 qui se rapportent à son devenir dans l'environnement.
| Propriété | Type | Valeur[1] | Température (°C) | Références |
|---|---|---|---|---|
| [1] Les valeurs et unités entre parenthèses représentent celles qui ont été initialement déclarées par les auteurs ou estimées au moyen des modèles. [*] Valeurs utilisées pour la modélisation aux fins de cette évaluation préalable. |
||||
| Point de fusion (ºC) |
Expérimental | -3[*] | PhysProp, 2006 | |
| Modélisé | -8,69 | MPBPWIN, 2000 | ||
| Point d'ébullition (ºC) |
Expérimental | 245[*] | PhysProp, 2006 | |
| Modélisé | 226,77 | MPBPWIN, 2000 | ||
| Masse volumique (kg/m3) |
Expérimental | 963 | 25 | SEHSC, 2005 |
| Pression de vapeur (Pa) |
Expérimental | 4,6[*] (0,0345 mm Hg) |
25 | SEHSC, 2005 |
| 4 (0,03 mm Hg) |
25 | Flaningam, 1986 | ||
| Modélisé | 4,73 (0,0355 mm Hg) |
25 | MPBPWIN, 2000 | |
| Constante de la loi de Henry (Pa·m3/mol) |
Extrapolé à partir des valeurs expérimentales de log Kae pour le D4 et le D5 | 4 950 000[*] (48,9 atm·m3/mol) |
Xu et Kropscott, 2007 | |
| Expérimental | 14 667 (0,145 atm·m3/mol) |
26 | Kochetkov et al., 2001 | |
| 6 712 (0,066 atm·m3/mol) |
26 | Kochetkov et al., 2001 | ||
| Modélisé | 16 212 (0,16 atm·m3/mol) |
25 | HENRIWIN, 2000 | |
| Log Kae (coefficient de partage air-eau; sans dimension) | Extrapolé à partir des valeurs expérimentales de log Kae pour le D4 et le D5 | 3,3[*] | Xu et Kropscott, 2007 | |
| Log Koe (coefficient de partage octanol-eau) [sans dimension] |
Expérimental | 9,06[*] | 22 | SEHSC, 2007d |
| 4,36 | 22,5 | Miller, 2006 | ||
| 5,86 | Bruggeman et al., 1984 | |||
| Modélisé | 6,33 | KOWWIN, 2000 | ||
| Modélisé | 6,07 | PCKOCWIN, 2000 | ||
| Log Kce (coefficient de partage carbone organique-eau) [sans dimension] |
Modélisé | 6,1[*] | PCKOCWIN, 2000 | |
| Solubilité dans l'eau (mg/L) |
Expérimental | 0,00513[*] | 23 | Varaprath et al., 1996 |
| Modélisé | 0,005 | 25 | WSKOWWIN, 2000 | |
| Log Koa (coefficient de partage octanol-air) [sans dimension] |
Expérimental | 5,76[*] | 24 | Xu, 2006 |
| Modélisé | 5,50 | Calculée à partir de la valeur modélisée de log Koe-log Kae | ||
Récemment, des valeurs empiriques du log Koe ont été reçues et soumises à une évaluation critique. On a déterminé une valeur expérimentale de 4,36 pour le log Koe du D6 à l'aide d'une méthode d'agitation lente conforme à la Ligne directrice 123 de l'OCDE (Miller, 2006), avec du D6 marqué au 14C. Cette mesure de Koe a été répétée trois fois avec un blanc comme témoin. La température a été maintenue constante à 22,5 ± 0,5 ºC tout au long de l'étude. L'équilibre a été atteint en 7 jours et la valeur moyenne pondérée de Koe a été calculée en fonction de l'échantillon des quatre derniers jours. Un log Koe de 4,36 a été déterminé. On a dosé le D6 radiomarqué au 14C dans l'eau et l'octanol grâce à la méthode du comptage par scintillation en milieu liquide (CSML). Les analyses de CSML ne permettent pas de distinguer le composé parent de ses produits d'hydrolyse possibles. Selon l'auteur, la surestimation des concentrations de D6 dans l'eau peut être due aux éventuels produits d'hydrolyse solubles dans l'eau. Toutefois, on considère que le potentiel d'hydrolyse du D6 devrait être faible dans les conditions de l'essai mis en place (Xu, 2006). Le D6 devrait avoir une valeur de Koe plus élevée que le D4 et le D5 à cause de sa plus faible solubilité dans l'eau. Étant donné que des valeurs de log Koe acceptables de 4,45 à 6,49 et de 4,76 à 8,03 ont été déclarées pour le D4 et le D5 respectivement, la valeur ci-dessus déclarée pour le D6 a été jugée peu fiable et n'a pas été retenue pour cette évaluation.
Aux fins de la présente évaluation préalable, on a utilisé la valeur de log Koe de 9,06 estimée par Xu pour le D6 (SEHSC, 2007d) par extrapolation des valeurs expérimentales de Koe pour le D4 (Kozerski et Shawl, 2007) et le D5 (Kozerski, 2007).
Bruggeman et al. (1984) ont obtenu une valeur de log Koe de 5,86 à l'aide de la méthode du temps de rétention en chromatographie liquide à haute performance (CLHP). Cette mesure a été effectuée sur une colonne de silice liée par de l'octadécylsilyle, avec une phase mobile méthanol-eau (90:10). Des séries homologues de n-alkylbenzène avec des valeurs connues de log Koe ont été utilisées comme composés de référence pour étalonner la méthode. À ce jour, le protocole expérimental détaillé pour cette étude n'est pas disponible.
De récentes analyses portant sur le coefficient de partage air-eau pour D4 et D5 ont été menées par Xu (Xu et Kropscott, 2007). Au cours de l'expérience, l'équilibre de partage entre l'air, l'eau et une phase organique (octanol) a été atteint simultanément. Les valeurs de log Koa et de log Koe calculées pour le D4 et le D5 sont apparues raisonnablement cohérentes avec les valeurs expérimentales mesurées pour le D4 et le D5 rapportées par Xu (2006) et Kozerski (2007), ainsi qu'avec l'équilibre de log Koe = log Koa + log Kae. Dans le cadre du rapport de cette évaluation préalable, on considère donc l'analyse comme acceptable. Les valeurs moyennes de log Kae pour le D4 et le D5 (2,69 et 3,13 respectivement) ont été déterminées en fonction de la radioactivité totale de ces deux substances dans l'air et l'eau. Par conséquent, il est possible d'extrapoler la valeur de log Kae pour le D6 à 3,3 conformément à l'équation log Kae = log Koe – log Koa. Pour la valeur extrapolée de Kae, on obtient une constante de la loi de Henry égale à 4 950 000 Pa•m3/mol.
Pour le D6, d'autres propriétés physiques et chimiques modélisées correspondent bien aux données expérimentales mesurées. Sauf pour les données examinées ci-dessus, on utilise les données expérimentales les plus prudentes, s'il y a lieu, pour les prévisions indiquées de divers modèles dans le présent rapport d'évaluation préalable.
Il n'existe pas de sources naturelles connues de D6.
Le D6 est un produit chimique industriel qui n'était fabriqué par aucune société au Canada en 2006 en quantité supérieure au seuil de déclaration de 100 kg, mais qui y est importé dans des mélanges avec d'autres siloxanes cycliques et comme substance résiduelle dans les polymères de silicone et comme ingrédient utilisé dans des produits de consommation finis. Les réponses reçues à un avis publié en application de l'article 71 de la LCPE (1999) ont permis de déterminer qu'entre 100 000 et 1 000 000 kg de D6 avaient été importés au Canada en 2006 (Environnement Canada, 2007), sous forme de matière première et dans des produits finis. Les quantités de D6 importées au Canada ont fortement augmenté depuis l'inscription de cette substance sur la LIS (Environnement Canada, 1988).
Le D6 est un constituant du cyclométhicone (n° CAS 69430-24-6) utilisé dans l'industrie cosmétique. Bien que le cyclométhicone n'ait pas été contrôlé directement conformément à l'article 71 de la LCPE (1999) par Environnement Canada et Santé Canada en 2007, on constate dans certains cas que les réponses à l'avis publié en application de cet article pour l'année 2006 contenaient des données sur les quantités de D6 utilisées ou importées sous le n° CAS 69430-24-6 (Environnement Canada, 2007).
La quantité du n° CAS 69430-24-6 proposée dans le commerce au Canada, déclarée pour l'année civile 1986, était de 2 220 000 kg (Environnement Canada, 1988). En 2005, le Canada était un importateur net de 11 500 000 kg de tous les types de polymères de silicone et de siloxanes (Will et al., 2007).
Le D6 est un intermédiaire dans la production des polymères de silicone de type polydiméthylsiloxane (PDMS) et tous les PDMS contiennent des quantités résiduelles de cyclosiloxanes volatils de faible poids moléculaire, notamment du D6. Les polymères à faible poids moléculaire (et par conséquent à faible viscosité) peuvent contenir moins de 0,1 à 0,5 % de cyclosiloxanes volatils tandis que les polymères à poids moléculaire plus élevé (et par conséquent à plus forte viscosité) peuvent en contenir de 1 à 3 %. La proportion des cyclosiloxanes volatils représentée par le D6 varie fortement selon les produits. L'utilisation de certains produits à base de PDMS devrait entraîner des rejets de D6 (SEHSC, 2007b).
Dans d'autres pays, le D6 a été reconnu comme une substance chimique produite en grandes quantités par l'Organisation de coopération et développement économiques (OCDE, 2007) et l'Agence de protection de l'environnement des États-Unis (U.S. EPA, 2007).
Aux États-Unis, l'utilisation de méthylsiloxanes volatils, notamment de D6, a tendance à augmenter car ces substances ne sont pas soumises à la législation sur les composés organiques volatils (COV) de 1994 (U.S. EPA, 1994a). Les méthylsiloxanes volatils ont été utilisés comme solution de rechange aux chlorofluorocarbures (CFC) pour réduire la teneur en COV réglementée de certains produits (en particulier pour les applications de nettoyage de précision et électronique). Selon des informations de l'Agence de protection de l'environnement des États-Unis, l'importation/la production de D6 dans ce pays atteignait 4,5 à 225 tonnes en 1986. Elle se situait entre 450 et 4 500 tonnes en 1990, 1994 et 1998, et entre 4 500 et 45 000 tonnes en 2002.
En Europe, il a été établi que le D6 était une substance chimique produite en petites quantités, dont la Dow Corning Limited (Royaume-Uni) est le seul producteur ou importateur (ECB, 2007). Actuellement, aucun contrôle n'est effectué sur le D6 en Europe. Les données concernant la quantité de D6 utilisée dans l'Union européenne comme intermédiaire limité au site entre 2003 et 2004 sont confidentielles.
Au Canada et dans le monde entier, le D6 est principalement utilisé comme ingrédient dans la formulation de produits d'hygiène et comme intermédiaire dans la production de polymères de silicone de type polydiméthylcyclosiloxane (PDMS). Comme il est indiqué ci-dessus, le D6 est également un constituant du composé portant le n° CAS 69430-24-6, appelé cyclométhicone dans l'industrie cosmétique. Le cyclométhicone est un mélange de siloxanes cycliques volatils à faible poids moléculaire, dont les principaux ingrédients sont l'octaméthylcyclotétrasiloxane (D4), le décaméthylcyclopentasiloxane (D5) et le dodécaméthylcyclohexasiloxane (D6), que l'on retrouve en différentes proportions. Au Canada, les principales utilisations des mélanges à faible poids moléculaire de siloxanes cycliques volatils, qui peuvent contenir un certain pourcentage de D6, concernent la préparation de produits d'hygiène, notamment de produits de soins capillaires, de produits de soins de la peau et d'antitranspirants (Environnement Canada, 2007).
Tous les polymères de silicone contiennent des quantités résiduelles à l'état de traces de cyclosiloxanes volatils, notamment de D6. Les polymères de silicone qui contiennent des quantités à l'état de traces de D6 peuvent être considérés comme des liquides, des gommes et des résines. Les utilisations de tels polymères sont décrites ci-dessous.
Les principales utilisations de liquides à base de silicone concernent notamment les ingrédients qui entrent dans la formulation de produits de soins pour les cheveux et la peau, d'antitranspirants et de déodorants, de produits pharmaceutiques, d'adjuvants de traitement comme des antimousses, des tensioactifs et des agents de démoulage, de lubrifiants, de polis et de revêtements appliqués sur divers substrats comme les textiles, les tapis et les papiers, ainsi que de produits d'étanchéité, d'enduits pour bâtiments, de lubrifiants mécaniques, de liquides caloporteurs et diélectriques et de produits de reprographie (Will et al., 2007).
Alors qu'une utilisation importante de polymères à poids moléculaire plus élevé était attendue dans la plupart de ces applications, l'utilisation de D6 a été signalée pour les antimousses (Environnement Canada, 2007). Les antimousses sont souvent utilisés à des concentrations de l'ordre de quelques parties par million par toute une gamme d'industries de transformation, notamment les pâtes et papiers, l'alimentation, le pétrole et l'industrie pétrochimique, la fabrication de produits chimiques et le traitement de l'eau. Les silicones sont également utilisées comme antimousses dans des produits d'entretien domestique tels que les nettoyants et les détergents (Will et al., 2007).
Au Canada, l'utilisation de produits à base de silicone contenant du D6 dans certains pesticides est réglementée par la Loi sur les produits antiparasitaires (ARLA, 2007).
Des mélanges liquides et en gel à base de silicone sont utilisés pour plusieurs types de produits cosmétiques et médicaux. Les liquides à base de silicone ont été approuvés comme ingrédients actifs ou non dans des produits pharmaceutiques au Canada (BDPP, 2007), le plus souvent dans des médicaments antiflatulences. On note aussi d'autres utilisations biomédicales des liquides à base de silicone au Canada, comme les démoussants utilisés pour le sang dans les équipements de manutention du sang, les barrières protectrices, les lubrifiants et le traitement en surface des pansements.
Les gommes de silicone sont utilisées pour la production d'élastomères dans des produits d'étanchéité et des adhésifs, du caoutchouc de silicone moulé et des revêtements, ainsi que pour encapsuler des médicaments. Les élastomères à base de silicone servent à fabriquer des produits de consommation comme les sucettes. Des élastomères à base de silicone sont également utilisés dans un grand nombre d'applications biomédicales, notamment des implants et des prothèses destinés à des utilisations à court et à long terme, des cathéters, des lentilles cornéennes et des prothèses dentaires (Will et al., 2007).
Les résines de silicone sont principalement utilisées dans des revêtements spéciaux et pour la production de polymères modifiés par des silicones (Will et al., 2007). Les consommateurs peuvent être exposés au D6 s'ils utilisent ces produits et s'ils se trouvent dans des espaces fermés dans lesquels des revêtements, des produits de calfeutrage, des produits d'étanchéité et du caoutchouc de silicone sont utilisés comme matériaux de construction, ou si ces derniers sont présents dans des produits de consommation.
Le D6 n'est pas déclaré à l'Inventaire national des rejets de polluants d'Environnement Canada. Cette substance fait partie d'un groupe de produits chimiques qui peuvent être utilisés pour diverses applications industrielles et de consommation associées à d’éventuels rejets très importants.
Le D6 peut être rejeté dans l’environnement (c.-à-d. dans l'air et les eaux usées) par suite de l'utilisation de produits d'hygiène tels que les produits de soins capillaires et les produits de soins de la peau et les antitranspirants. Selon les estimations, plus de 90 % du D6 utilisé dans les produits d'hygiène passe dans l'atmosphère (Allen et al., 1997). Le D6 peut aussi être rejeté dans l’environnement par des procédés industriels où il sert d’intermédiaire dans la production de polymères de type PDMS et durant des opérations de mélange, de formulation et de conditionnement. Toutes ces opérations ont lieu au Canada (Environnement Canada, 2007). Des rejets industriels de D6 peuvent également se produire lors de l'utilisation de polymères de silicone par des industries de transformation comme démoussants, agents de démoulage ou lubrifiants, ou pour d'autres applications (Environnement Canada, 2007). On pense que les rejets des procédés industriels passent dans l'atmosphère et les eaux usées. Du fait des rejets de D6 dans les eaux usées traitées par les stations d'épuration des eaux d'égout, la substance peut être associée à des boues qui peuvent ensuite être mises en décharge, incinérées ou épandues sur les sols agricoles comme engrais. L'élimination des produits de consommation et des produits industriels contenant du D6 peut aussi entraîner l'élimination de D6 dans les décharges.
La détection du D6 dans les stations d'épuration des eaux d'égout, dans les décharges et à proximité des usines, ainsi que dans l'air intérieur et ambiant à distance des activités industrielles, montre assez bien que des sources ponctuelles et diffuses contribuent à créer des concentrations de D6 dans l'environnement (Norden 2005; Kaj et al., 2005). L'application de pesticides contenant du D6 sur les cultures, l'épandage des boues d'épuration sur les terres agricoles et leur mise en décharge entraînent le rejet de D6 dans les milieux naturels. Selon certaines indications, le D6 est un produit de dégradation transitoire des PDMS en contact avec le sol, alors que les principaux produits de dégradation sont des silanols (Xu et al., 1998). Ainsi, outre les rejets de résidus de D6 provenant de la fabrication des PDMS, une synthèse de novo de ce produit peut se produire dans les décharges et sur les terres agricoles où des boues d'épuration contenant des PDMS sont épandues, bien que la contribution globale de la dégradation des PDMS ne soit pas considérée comme significative dans les conditions environnementales.
Outil de débit massique
Un outil basé sur le débit massique permet d'estimer les rejets possibles de D6 dans l'environnement à différentes étapes de son cycle de vie. Les données empiriques sur les rejets de substances spécifiques dans l'environnement sont rares. On estime donc, pour chaque type d'utilisation connue, la proportion et la quantité des rejets dans les différents milieux naturels, ainsi que la proportion de la substance qui est transformée chimiquement ou envoyée dans des lieux d'élimination des déchets. Les hypothèses et les paramètres d'entrée utilisés pour effectuer ces estimations sont fondés sur des renseignements obtenus auprès de diverses sources dont les réponses à des enquêtes réglementaires, des données de Statistique Canada, les sites Web des fabricants et des bases de données techniques. À cette fin, les facteurs d'émission se révèlent particulièrement utiles; ils sont généralement exprimés en fraction d'une substance rejetée dans l'environnement, notamment pendant sa fabrication, sa transformation et son utilisation associées aux procédés industriels. Ces données découlent notamment de documents sur des scénarios d'émissions, souvent élaborés sous les auspices de l'Organisation de coopération et de développement économiques (OCDE), et d’hypothèses par défaut utilisées par différents organismes internationaux de réglementation des produits chimiques. Le degré d'incertitude associé à la masse de la substance en circulation et à la quantité rejetée dans l'environnement augmente généralement vers la fin du cycle de vie.
| Devenir | Proportion massique (%)[1] | Principale étape du cycle de vie[2] |
|---|---|---|
| [*] Eaux usées avant toute forme de traitement [1] Pour estimer les rejets de D6 dans l'environnement et la répartition de cette substance, comme le montre ce tableau de synthèse, des renseignements sur les scénarios d'émissions de l'OCDE ont été utilisés : OCDE 2004; id., 2006. Les valeurs présentées pour les rejets dans les milieux naturels ne tiennent pas compte des mesures possibles de limitation des rejets qui peuvent être en place à certains endroits (p. ex. leur élimination partielle par les stations d'épuration des eaux d'égout). Les hypothèses particulières utilisées pour ces estimations sont résumées dans Environnement Canada, 2008. [2] Étapes applicables : production, formulation, utilisations industrielles, utilisation par les consommateurs, durée de vie utile de l'article/du produit, élimination des déchets. |
||
| Rejets dans l'environnement : | ||
| Dans le sol | 0 | - |
| Dans l'air | 77,7 | Utilisations industrielles et utilisation par les consommateurs |
| Dans les égouts[*] | 12,3 | Formulation, utilisations industrielles et utilisation par les consommateurs |
| Transformation chimique | 0,2 | Utilisations industrielles |
| Evoi dans des lieux d'élimination des déchets (p. ex. les décharges, les incinérateurs) | 9,8 | Gestion des déchets |
Selon les données obtenues au moyen de l’outil de débit massique (tableau 3), la substance est surtout rejetée dans l'air et dans les eaux usées (égouts). L'air reçoit la plus forte proportion de rejets possible (77,7 %). Cette situation est due à l'utilisation de produits de consommation tels que les lotions pour la peau et les crèmes solaires et à la volatilisation des résidus dans les polymères de silicone, surtout pendant la première année d'utilisation. Les rejets dans les eaux usées attribuables aux utilisations industrielles pendant la formulation de produits sur place et à l'utilisation de produits d'hygiène sont estimés à environ 12,3 %. En outre, 9,8 % de cette substance sont confiés à l’élimination des déchets.
Selon ses propriétés physiques et chimiques (tableau 2) et les résultats de modélisation de la fugacité de niveau III (tableau 4, les paramètres d'entrée de modélisation sont répertoriés à l'annexe 5 de cette évaluation préalable), le D6 peut se répartir en quantités significatives dans tout milieu naturel, selon le milieu de rejet.
| Milieu de rejet de la substance | Fraction de la substance répartie dans chaque milieu |
|||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| Air (100 %) | 99,9 | 0,0 | 0,1 | 0,0 |
| Eau (100 %) | 0,9 | 16,0 | 0,0 | 83,0 |
| Sol (100 %) | 31,8 | 0,0 | 68,1 | 0,1 |
D'après les informations disponibles (tableau 3), les rejets de D6 dans l'environnement s'effectuent principalement dans l'air (77,7 %). Selon sa pression de vapeur qui varie de 4 à 4,73 Pa, sa constante de la loi de Henry de 4 950 000 Pa·m3/mol et sa longue demi-vie dans l'air, le D6 devrait rester dans l’air (plus de 99 %) s'il y est rejeté (tableau 4).
Si le D6 est rejeté dans l'eau (12,3 %, tableau 3), on s'attend à ce qu'il soit adsorbé sur les matières en suspension, comme les boues d'épuration et les sédiments, du fait de ses fortes valeurs estimées de log Kco (plus de 6). Les résultats de la modélisation de la fugacité de niveau III pour les rejets dans l'eau montrent qu'environ 83 % de ce composé restera dans la phase solide (sédiments en suspension et matériaux du lit) et 16 % dans la phase aqueuse (colonne d'eau). Bien que la volatilisation du D6 à partir de la surface de l'eau soit également prévisible selon le coefficient de partage air-eau (Kae), sa forte capacité de sorption sur des matières solides réduit sa volatilisation (0,9 %, tableau 4).
Lorsque le D6 est rejeté sur des sols humides, par exemple par l'application de boues d'épuration sur des terres agricoles, on s'attend à ce qu'il soit fortement adsorbé au sol (c.-à-d. qu'il devrait être immobile), ce qui devrait réduire son potentiel de volatilisation et toute répartition ultérieure dans d'autres milieux. Les résultats du modèle de fugacité de niveau III valident cette hypothèse car en cas de rejet de D6 sur des sols humides, 68,1 % resteront dans le sol, associés à des solides pour les raisons décrites pour les sédiments. On estime qu'environ 31,8 % de la fraction massique passera dans l'air. Cette estimation concorde avec l'observation de Xu (1999) selon laquelle la volatilisation constitue le principal processus de perte de siloxanes cycliques à partir des sols humides. Toutefois, le pourcentage de volatilisation du D6 est inférieur à celui du D5 (environ 71 %) à cause de sa forte capacité d'absorption sur les solides (Kco > 6). Sur un sol sec, le D6 devrait être hydrolysé rapidement par des minéraux argileux pour former du diméthylsilanediol, qui est le produit de dégradation final (Xu, 1999; Xu et Chandra, 1999).
Persistance dans l'environnement
Dégradation atmosphérique
Les résultats du modèle de fugacité de niveau III indiquent que si le D6 est rejeté dans l'air, il y restera en grande partie et devrait y être oxydé lentement par une réaction en phase gazeuse avec des radicaux hydroxyles (OH) d'origine photochimique. Bien qu'aucune donnée expérimentale ne soit disponible, la demi-vie par oxydation atmosphérique du D6 est estimée à 6 jours environ (selon le calcul d'un modèle supposant que les concentrations en radicaux hydroxyles s'établissent à 1,5 × 106 OH/cm3 [tableau 5b]). On peut estimer des demi-vies de 2,6 à 12,8 jours à l'aide du modèle AOPWIN en fonction de la mesure quotidienne de la concentration moyenne en hydroxyles de 3,5 × 106 OH/cm3 et 0,7 × 106 OH/cm3 (concentration moyenne quotidienne = concentration maximale/2), en été et en hiver respectivement (Ren et al., 2003; id., 2006). On peut donc conclure que le D6 pourrait se dégrader plus rapidement dans les centres urbains en été lorsque la concentration en radicaux hydroxyles atmosphériques est la plus élevée. Cependant, si l'on prend en compte une demi-vie d'élimination moyenne annuelle, elle est cohérente avec la demi-vie d’environ 6 jours estimée avec la concentration en radicaux OH de 1,5 × 106 OH/cm3. Le D6 ne devrait pas réagir du tout, ou très peu, avec d'autres espèces photo-oxydantes dans l'atmosphère, par exemple O3, et ne devrait vraisemblablement pas se dégrader par photolyse directe (Atkinson, 1991). Les réactions avec les radicaux hydroxyles devraient donc constituer le principal processus régissant le devenir de cette substance dans l'atmosphère. Par conséquent, la demi-vie de dégradation de 5,69 jours est considérée comme critique et sera utilisée pour le D6 dans la modélisation du devenir dans l'environnement.
Navea et al. (2007) ont étudié les effets de l'ozone, des aérosols et du rayonnement solaire sur le devenir du D4 et du D5 dans une chambre à environnement simulé. Ils sont arrivés à la conclusion que les aérosols minéraux tels que le kaolin et l'hématite peuvent accélérer de façon significative l'élimination du D4 et du D5 dans la phase gazeuse de l'atmosphère, en particulier pendant la journée. Ces résultats indiquent également que l'ozone peut encore accélérer ces processus d'élimination du D4 et du D5. Bien que les données obtenues suggèrent que les aérosols minéraux combinés à l'ozone peuvent avoir des effets significatifs sur le devenir dans l'environnement des méthylsiloxanes cycliques volatils (cVMS) présents dans l'air, il est difficile d'extrapoler de manière quantitative les résultats des simulations dans des conditions environnementales réalistes. Il convient d'abord de noter que l'étude a été effectuée avec des cVMS, en aérosols minéraux et en ozone, d'un niveau élevé irréaliste. Par ailleurs, les échantillons de minéral et de noir de charbon utilisés dans l'étude étaient des échantillons d'analyse très purs (plus de 99 %) qui fournissaient la zone de surface maximale et par conséquent les sites d'adsorption maximale idéaux, c'est-à-dire les conditions optimales pour l'adsorption de D4/D5. On peut se demander si ces minéraux purs sont bien représentatifs des matières particulaires dans l'air. Enfin, on peut raisonnablement penser que des minéraux tels que la kaolinite et l'hématite sont présents dans les particules atmosphériques. Cependant, il est peu probable qu'il s'agisse des composants les plus courants et les plus abondants de la poussière atmosphérique. Il convient par ailleurs de souligner que l'étude a été menée dans une chambre à environnement simulé et a impliqué la réaction des aérosols minéraux avec un seul cVMS (D4 ou D5) à la fois. Dans des conditions environnementales réelles, des milliers de produits chimiques se disputent les sites d'adsorption des aérosols. Dans ces conditions, l'« efficacité » de l'élimination du D4/D5 dans l'air ambiant peut donc être largement inférieure aux résultats observés dans l'atmosphère de la chambre où se trouvait un seul composant.
On peut donc conclure que le degré d'accélération de la dégradation des cVMS dans l'air par les aérosols et l'ozone dans des conditions environnementales réalistes est incertain.
Les données montrent donc que cette substance est persistante dans l'air (demi-vie supérieure à 2 jours) conformément au Règlement sur la persistance et labioaccumulation(Canada, 2000).
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre et unités de dégradation | Références |
|---|---|---|---|---|
| Eau | Biodégradation | 4,47 % | Dégradation 28 j | Springborn Smithers Laboratories, 2005 |
| Eau | Hydrolyse | 401 | Extrapolation à partir de la demi-vie d'hydrolyse du D4 et du D5 (pH neutre, 25 °C) | Xu, 2007 |
| Eau | Hydrolyse | 0,9-733 | Demi-vie (jours) déduite à partir du D4 pH 6-9; 5-25 °C |
Durham, 2006 Kozerski, 2008 Bidleman, 2008 |
| Eau/sédiments | Dégradation abiotique | 49-588 | Demi-vie (jours) déduite à partir du D4 pH neutre; 5-25 °C |
Xu et Miller, 2008 |
| Sol (sols Wahiawa d'Hawaï) | Hydrolyse catalysée par l'argile | 1,38 jour (humidité relative 32 %) |
Demi-vie (jours) | Xu, 1999; Xu et Chandra, 1999 |
| Sol (sols Londo du Michigan) | Hydrolyse catalysée par l'argile | 3,54 jours (humidité relative 32 %); 5,25 jours (humidité relative 93 %) |
Demi-vie (jours) déduite à partir du D4 | Xu et Chandra, 1999 |
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre et unités de dégradation | Modèle |
|---|---|---|---|---|
| [1] Les résultats de la simulation de la biodégradation CATABOL indiquent que le D6 se situe dans le domaine des paramètres mondiaux et dans le domaine métabolique, mais à l'extérieur du domaine structurel. Le plus important de ces domaines est le domaine métabolique, et CATABOL semble indiquer que cette substance ne se dégrade pas étant donné la faible probabilité de l'existence d'un groupe méthyle stable et de produits d'oxydation de l'anneau aromatique. [2] Demi-vies par oxydation atmosphérique recalculées avec des concentrations en radicaux OH mesurées à New York en été et en hiver respectivement. |
||||
| Air | Oxydation atmosphérique | 5,96 | Demi-vie (jours) | AOPWIN, 2000 |
| Air | Oxydation atmosphérique | 2,6-12,8[2] | Demi-vie (jours) | AOPWIN, 2000 |
| Eau | Biodégradation | 60 | Demi-vie (jours) | BIOWIN, 2000, Ultimate survey |
| Eau | Biodégradation | 0 (biodégradation lente) | Probabilité | BIOWIN, 2000; probabilité linéaire du MITI |
| Eau | Biodégradation | 0 (biodégradation lente) | Probabilité | BIOWIN 2000; probabilité non linéaire du MITI |
| Eau | Biodégradation | 2,0 | Demande biochimique en oxygène (DBO), % (MITI 301C)[1] | CATABOL, c2000-2008 |
| Eau | Biodégradation (anaérobique) | 0,1 (biodégradation lente) | Probabilité | BIOWIN, 2000 |
Dégradation dans l'eau et les sédiments
Aucune donnée empirique d'hydrolyse n'est disponible pour le D6. Par conséquent, on a adopté une méthode fondée sur les données déduites à partir d’analogues en utilisant des données relatives à des siloxanes similaires. Des analyses expérimentales de l'hydrolyse menées pour le D4 (Durham et Kozerski, 2005) et le D5 (Durham, 2006), dont la structure est similaire, ont été évaluées par des experts internes (Bidleman, 2008); les résultats de ces analyses et évaluations sont présentés ci-dessous. Pour déterminer la cinétique de l'hydrolyse du D4 et du D5, on a mesuré la disparition de composés parents radiomarqués en fonction du temps conformément à Ligne directrice 111 de l'OCDE. Ces réactions ont été étudiées dans des tubes de verre de borosilicate scellés à la flamme, à des pH de 4, 7 et 9, et à des températures de 10, 25 et 35 °C. Des essais supplémentaires ont été effectués pour le D5 à des pH de 5,5 et 8 et à 25 °C. On a pu constater que les vitesses d'hydrolyse du D4 et du D5 dépendaient du pH et suivaient une cinétique du pseudo-premier ordre. On a pu déterminer que l'hydrolyse du D4 et du D5 s'effectuait selon des demi-vies (t1/2) comprises entre 0,04 et 45 jours pour le D4 et entre 0,9 et 733 jours pour le D5 dans des conditions canadiennes réalistes (pH 6 à 9, température entre 5 et 25 °C) [GEMStat, 2008; NOAA, 2008]. Les valeurs de demi-vie d'hydrolyse du D5 sont supérieures à celles du D4. Par conséquent, on estime que la période de demi-vie du D6, dont la structure est similaire à celle du D4 et du D5, en environnement canadien (pH 6 à 9, température entre 5 et 25 °C) sera supérieure à la plage 0,9 à 733 jours. En fonction des données d'hydrolyse disponibles pour le D4 et le D5 (Xu, 2007), on a pu déterminer par extrapolation une demi-vie d'environ 401 jours pour le D6 (pH neutre et température ambiante).
De nouvelles informations obtenues sur la dégradation par les agents microbiens indiquent que le D6 n'est vraisemblablement pas biodégradé dans l'eau. L'essai de biodégradabilité immédiate de 28 jours a été effectué dans des récipients fermés hermétiquement conformément à la Ligne directrice provisoire 310 de l'OCDE et les résultats ont mis en évidence une biodégradation limitée (4,47 %) du D6 au cours des 28 jours d'essai (Springborn Smithers Laboratories, 2005). Ce pourcentage équivaut approximativement à une demi-vie de 411 jours si l'on considère une cinétique du premier ordre. Ces données sont étayées par deux modèles du tableau 5b, selon lesquels la probabilité de biodégradation du D6 dans l'eau est effectivement nulle. Par conséquent, on considère que le D6 est persistant dans l'eau (t1/2 > 180 jours). Par ailleurs, selon une conclusion générale pondérée obtenue en combinant les résultats des modèles BIOWIN3 et BIOWIN5 (BIOWIN, 2000), ce composé ne se biodégrade pas facilement.
Les données expérimentales et modélisées sur la biodégradation indiquent que le D6 présente un faible potentiel de biodégradation dans les milieux aqueux. L'hydrolyse constitue donc le principal processus de dégradation du D6 dans l'eau. Les données basées sur les demi-vies d'hydrolyse du D4 et du D5 et la demi-vie du D6 déterminée par extrapolation suggèrent que la persistance du D6 dans les eaux canadiennes peut être relativement longue. On arrive donc à la conclusion que le D6 répond aux critères de la persistance dans l'eau (t1/2 > 182 jours) définis dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Aucune information sur la dégradation dans les sédiments n'était disponible pour le D6. Une étude préliminaire sur la dégradation du D4 dans le système eau-sédiments a cependant été reçue récemment (Xu et Miller, 2008). Une ligne directrice 308 modifiée de l'OCDE a été suivie. L'étude a été réalisée à température ambiante (22-25 ºC) avec des sédiments naturels (limon sableux, teneur en carbone organique élevée, environ 70 % d'eau et 11 % de matière organique, pH d'environ 7) et de l'eau prélevés en profondeur dans un lac non contaminé. Le D4 radiomarqué dans le diéthylène glycol méthyl éther a été ajouté à la seringue en 10 à 15 points des sédiments de surface dans chaque flacon après le retrait de l'eau excédentaire. L'eau excédentaire a de nouveau été ajoutée sur les sédiments enrichis avec des perturbations minimales des sédiments. L'enrichissement des sédiments plutôt que de l'eau a permis de garantir la répartition de la substance dans les sédiments. Les propriétés physiques et chimiques de la substance (volatilité élevée et hydrolyse potentielle) ont ainsi été correctement gérées et la reproductibilité de l'étude a pu être améliorée. Les concentrations de D4 mesurées entre le 6e et le 22e jour (fin de l'essai) ont indiqué qu'un équilibre avait été atteint entre l'eau et les sédiments, plus de 95 % de D4 et de la radioactivité ayant été détectés dans les sédiments. Comme l'a montré l'étude de l'hydrolyse du D4, les produits de dégradation dans les sédiments et l'eau étaient des intermédiaires oligomères diols HO(Me2SiO)nH (n=2-4), et le diméthylsilanediol (DMSD) était le produit de dégradation final. La demi-vie calculée pour la dégradation du D4 dans les sédiments était de 49 jours à une température comprise entre 22 et 25 ºC. Les mêmes produits de dégradation observés dans cette étude et dans l'étude de l'hydrolyse du D4 suggéraient que l'hydrolyse constituait le principal processus de dégradation dans le système sédiments-eau. L'incertitude principale de cette étude réside dans l'absence d'autres mesures. Puisqu'aucune donnée n'était disponible pour les demi-vies de dégradation à faible température, une méthode fondée sur les données déduites à partir d’analogues utilisant les données d'hydrolyse du D4 a été appliquée. Les demi-vies d'hydrolyse du D4 dans l'eau étaient environ 6 à 12 fois plus longues lorsque la température de l'eau était ramenée de 25 à 10 ºC, puis à 5 ºC. En supposant une tendance similaire à la baisse dans les sédiments, les demi-vies estimées pour le D4 dans les sédiments sont de 294 et 588 jours à 10 et 5 ºC respectivement.
Les demi-vies de dégradation dans les sédiments du D4 sont utilisées pour le D6 d'après la similarité des deux substances. Par conséquent, on peut conclure que dans certaines conditions climatiques canadiennes (plus froides), la demi-vie du D6 sera supérieure à 182 jours dans l'eau et à 365 jours dans les sédiments. Le D6 est donc jugé persistant dans l'eau et les sédiments, conformément aux critères établis dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000). L'extrapolation de la dégradation du D4 dans les sédiments à faible température selon l'hydrolyse n'est cependant pas exempte d'incertitudes.
Dégradation dans le sol
Bien qu'aucune donnée empirique sur sa biodégradation dans le sol ne soit disponible, comme il est indiqué ci-dessus, la biodégradation du D6 dans l'eau est négligeable selon l'essai de biodégradation immédiate (Springborn Smithers Laboratories, 2005) et selon les prévisions de cinq des six modèles de biodégradation (tableau 5b).
Xu (Xu, 1999; Xu et Chandra, 1999) a effectué des recherches approfondies sur les modes de dégradation potentiels des cyclosiloxanes, notamment du D4, du D5 et du D6, dans le sol Wahiawa d'Hawaï à température ambiante, avec une humidité relative de 32 %. Il en a conclu que la réaction de polymérisation ouvrant l'anneau qui permet de former des polydiméthylsiloxanes (PDMS) et la déméthylation qui donne des cyclosiloxanes ne sont pas significatifs dans le sol à des concentrations inférieures à 200 mg/kg en poids sec. De plus, on a observé l'hydrolyse du D6 catalysée par l'argile dans des sols Wahiawa très altérés et secs. La demi-vie de dégradation du D6 dans le sol Wahiawa (teneur en argile de 55 % avec 2,1 % d'eau) était de 1,38 jour dans des conditions de sol sec. Il semblerait que la sécheresse du sol limite fortement l'activité biologique, mais favorise des réactions abiotiques comme l'hydrolyse catalysée par des conditions acides et en surface des PDMS, un polymère qui présente le même squelette que les cyclosiloxanes (Xu, 1999). Les vitesses de dégradation des cyclosiloxanes étaient déterminées par l'humidité du sol, le type d'argile, la teneur en argile et la taille des molécules de siloxane, qui déterminent à leur tour la vitesse de diffusion vers les sites catalytiques en surface. La dégradation du D6 s'est révélée beaucoup plus lente que celle du D4 et du D5 dans les mêmes conditions de sol (environ 1 et 2 heures de demi-vie pour le D4 et le D5 respectivement) et corrobore l'hypothèse selon laquelle la vitesse de dégradation diminue avec l'augmentation du poids moléculaire pour ces trois cyclosiloxanes : D4 > D5 > D6. Les demi-vies de dégradation du D4 dans le sol Londo étaient comprises entre 3,54 et 5,25 jours à une humidité relative inférieure à 93 %. Pour le D6, on prévoit une demi-vie de dégradation plus lente dans des sols Londo tempérés. Les données réunies selon la méthode du poids de la preuve semblent indiquer que le D6 subit une hydrolyse catalysée par l'argile et n'est pas persistant dans des conditions de sol sec. L'absence de dégradation par hydrolyse du D4 dans des sols Londo saturés d'eau semble aussi indiquer que la dégradation du D6 est négligeable dans les mêmes conditions. La volatilisation représente le principal mécanisme de perte du D6 dans de telles conditions de sol, en système ouvert, et à une vitesse inférieure à celle relevée pour le D4 et le D5.
Alors qu'ils étudiaient l'influence des types d'argile sur le potentiel de dégradation des PDMS, Xu et al. (1998) ont démontré que les PDMS étaient dégradés par les minéraux argileux, même si leurs activités catalytiques étaient différentes. La présence répandue de ces minéraux tend à indiquer que le D6 devrait subir une dégradation catalysée par l'argile dans les divers sols tant que persisteront des conditions pédologiques critiques comme une faible humidité, et ce, malgré l'extrême diversité des sols canadiens.
Selon des études empiriques disponibles qui montrent son potentiel d'hydrolyse rapide catalysée par l'argile dans les sols de surface, le D6 n'a pas été jugé persistant dans le sol car sa demi-vie de dégradation est inférieure au critère de la t1/2 supérieure à 182 jours qui est énoncé dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Les données empiriques et modélisées disponibles indiquent que le D6 satisfait aux critères de la persistance dans l'air (demi-vie ≥ 2 jours), dans l'eau (demi-vie ≥ 182 jours) et dans les sédiments (demi-vie ≥ 365 jours), conformément au Règlement sur la persistance et la bioaccumulation(Canada, 2000), mais pas au critère de la demi-vie dans le sol (demi-vie inférieure à 182 jours).
Potentiel de transport à grande distance
Le modèle régional de niveau III de transport et de persistance (TaPL3, 2000) a été utilisé pour estimer la « distance de transport caractéristique » (DTC) du D6. La DTC est définie comme la distance maximale parcourue dans l'air par 63 % de la substance. Beyer et al. (2000) ont proposé de considérer le potentiel de transport atmosphérique à grande distance comme étant élevé si la DTC est supérieure à 2 000 km, modéré si elle est de 700 à 2 000 km et faible si elle est inférieure à 700 km. D'après une estimation de la DTC de 2 966 km, le potentiel de transport atmosphérique à grande distance du D6 est considéré comme élevé. C’est donc dire que le D6 est sujet au transport atmosphérique vers des régions éloignées comme l'Arctique.
| Distance de transport caractéristique | Modèle (référence) |
|---|---|
| 2 966 km | TaPL3, v. 2.10 (TaPL3, 2000) |
| 2 963 km | Outil LRTP POPs v.2.0 de l'OCDE (Scheringer et al., 2006) |
Le modèle de dépistage de l'OCDE (LTRP POPs) peut être utilisé pour identifier les produits chimiques à fort potentiel de persistance et de transport à grande distance (Scheringer et al., 2006). Le modèle de l'OCDE est un modèle global qui compartimente la terre en air, eau et sol. Ce modèle est « orienté vers le transport » plutôt que vers une « cible » car il identifie simplement la DTC sans préciser l'endroit où une substance peut être transportée en particulier (Fenner et al., 2005). Klasmeier et al. (2006) ont suggéré qu'un seuil de 5 098 km, basé sur l'estimation de la DTC du modèle pour le 2,2',3',4,4',5,5'-heptachlorobiphényle (PCB-180), permettrait d'identifier des substances ayant un fort potentiel de transport à grande distance. Le PCB-180 a été détecté dans des régions éloignées. La DTC calculée pour le D6 à l'aide du modèle de l'OCDE correspond à 2 963 km, ce qui indique que le D6 présente toujours un fort potentiel de transport dans l'air, mais qu’il est inférieur à la limite suggérée par Klasmeier et al. pour les polluants mondiaux. (2006).
Le modèle de dépistage de l'OCDE permet également de calculer l'efficacité du transfert (ET), qui correspond au pourcentage du flux des émissions vers l'atmosphère déposé à la surface (eau et sol) dans une région éloignée (ET = D/E × 100, où E est le flux des émissions vers l'atmosphère et D, le flux du dépôt sur les milieux en surface dans une région cible). L'ET calculée du D6 est de 1,6E-06 %, ce qui est largement inférieur à la limite de 4,65E-04 % (2,4,4'-trichlorobiphényle ou PCB-28) établie pour les substances de référence du modèle dont on sait de manière empirique qu'elles sont déposées de l'air sur le sol ou dans l'eau. Une ET faible indique que le D6 présente un potentiel de transport à grande distance dans l'atmosphère sans être déposé à la surface de la Terre dans une région éloignée donnée. De plus, les valeurs de log Koa et de log Kae du D6 semblent indiquer qu'il présente également un faible potentiel de contamination arctique s'il est examiné à l'aide des parcelles de partage chimique décrites par Wania (2003, 2006).
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement. Les dépôts atmosphériques constituent donc la seule source significative de cVMS dans le lac (Powell, 2008). L'analyse préliminaire d'échantillons de sédiments et zooplancton portant sur les cVMS n'a pas permis de détecter de D6, ce qui semble indiquer que les dépôts atmosphériques ne constituent pas une source significative de D6 pour le lac Opeongo. Les limites de détection étaient de 19,0 ng/g (masse de référence corrigée) pour les sédiments et le zooplancton.
On arrive donc à la conclusion que le D6 présente un potentiel de transport dans l'atmosphère sur de longues distances. Cependant, l'ET modélisée pour le D6 est faible, ce qui tend à indiquer qu’il est peu susceptible de se déposer dans l'eau ou sur le sol dans des régions éloignées. Les résultats de surveillance du lac Opeongo viennent également appuyer la thèse du faible potentiel de dépôt atmosphérique pour le D6. Le D6 transporté dans l'atmosphère sera finalement dégradé par des radicaux hydroxyles dans l'air.
Potentiel de bioaccumulation
Les valeurs empiriques et modélisées de log Koepour le D6 (tableau 2) semblent indiquer que cette substance peut se bioaccumuler dans le biote.
Dans le milieu aquatique
De nouvelles données expérimentales ont été reçues concernant des études sur la bioconcentration chez les organismes aquatiques. On a effectué une étude de bioconcentration du D6 marqué au 14C (pureté radiochimique de 99,57 %) sur des têtes-de-boule (Pimephales promelas) dans un système à écoulement continu avec des concentrations de 4,4 µg/L et 0,41 µg/L pendant une période de 49 jours, suivie d'une période de dépuration de 98 jours (Drottar, 2005). Le facteur de bioconcentration à l'équilibre (FBCéq) moyen calculé était de 1 160 L/kg selon des concentrations mesurées du 35e au 49e jour. Le facteur de bioconcentration cinétique (FBCc) était de 1 660 L/kg selon les vitesses d'absorption et de dépuration (k1/k2) pour les groupes traités à 0,41 µg/L. L'analyse des tissus des poissons a aussi indiqué que la demi-vie de dépuration pour le D6 radiomarqué était de 30 jours. Les faibles valeurs de FBC obtenues pour le D6 (par rapport à un FBCéq de 12 600 et un FBCc de 13 400 pour le D4, et un FBCéq de 7 060 L/kg et un FBCc de 13 300 pour le D5) pourraient expliquer en partie la faible biodisponibilité du D6 (poids moléculaire plus élevé et log Koe d'environ 9 par rapport aux analogues de structure similaire, soit le D4 et le D5) adsorbé sur les particules en suspension (aliments non ingérés et fèces).
Des données expérimentales issues d'études de bioaccumulation (par voie alimentaire) ont été obtenues pour le D4 et le D5 (Drottar, 2006; id., 2007; Domoradzki, 2008a; id., 2008b; SEHSC, 2008b). Les valeurs de FBAmp obtenues (normalisées pour les lipides) pour ces deux substances sont comprises entre 0,6 et 0,9. On peut par conséquent considérer que le D6, un analogue proche du D4 et du D5, peut présenter le même potentiel de bioamplification peu élevé, tel qu’il est suggéré par les études alimentaires menées en laboratoire sur des poissons pour le D4 et le D5.
Une autre étude de bioconcentration a été menée sur des invertébrés (Dow Corning Corporation, 1985). Des Daphnia magna ont été exposés à des concentrations de 4 µg/L de [14C] pour le D6 pendant un période de 32 jours. L'équilibre a été atteint après 21 jours d'exposition et la valeur de FBCéq obtenue correspondait à 2 400 L/kg en poids humide. Malheureusement, l'étude n'a pas été documentée de manière exhaustive et ne présentait aucun renseignement détaillé quant aux sources et à l'acclimatation des organismes, aux conditions et au type de système utilisés pour l'essai. Une analyse critique a pu déterminer que cette étude devait être considérée comme peu fiable.
Le modèle d'Arnot-Gobas (Arnot et Gobas, 2003) permet de prévoir le facteur de bioaccumulation (FBA) de cette substance en tenant compte de tout métabolisme potentiel, à l'aide d'une constante de vitesse de métabolisation (kM). Le FBC disponible dans les données d'essai in vivo a été utilisé pour dériver une constante de vitesse de métabolisation in vivo selon la méthode d'Arnot et al. (2008a). Dans cette méthode, kM est dérivé d'après l'équation suivante :
kM = (k1φ / FBC) – (k2 + kE + kG) (1)
où :
kM = Constante de vitesse de métabolisation (1/jours)
k1 = Constante de vitesse d'absorption (Arnot et Gobas, 2003)
φ = Fraction du produit chimique dissous librement dans l'eau (Arnot et Gobas, 2003)
FBC = Facteur de bioconcentration empirique disponible
k2 = Constante de vitesse d'élimination (Arnot et Gobas, 2003)
kE = Constante de vitesse d'évacuation fécale (Arnot et Gobas, 2003)
kG = Constante de vitesse de croissance (Arnot et Gobas, 2003)
La méthode d'Arnot et al. (2008a) permet d'estimer les facteurs de confiance (FC) pour la valeur de kM afin de tenir compte de l'erreur associée aux données in vivo(variabilité des mesures, incertitude de l'estimation des paramètres et erreur du modèle). Un FC moyen de ± 2,7 a été calculé pour les données de FBC disponibles.
Puisque le potentiel métabolique peut être lié au poids corporel et à la température (voir p. ex. Hu et Layton, 2001; Nichols et al., 2007), la valeur kM a été normalisée davantage à 15 °C, puis corrigée pour le poids corporel des poissons du niveau trophique intermédiaire dans le modèle d'Arnot-Gobas (184 g) [Arnot et al., 2008b]. Des poissons du niveau trophique intermédiaire ont été utilisés pour représenter les résultats d'ensemble du modèle, comme le recommande son concepteur (Arnot, J.A., communication personnelle avec M. Bonnell d’Environnement Canada, 2008; ne figure pas dans les références), et cette valeur est plus représentative du poids des poissons qui sera vraisemblablement consommé par un piscivore aviaire ou terrestre. Après la normalisation, la valeur de kM était comprise entre environ 0,002 et 0,01, avec une valeur médiane d'environ 0,005.
| kM (normalisée pour le niveau trophique intermédiaire) jour-1 | Log Koe utilisé | Modèle du FBC d'Arnot-Gobas | Modèle du FBA d'Arnot-Gobas |
|---|---|---|---|
| 1,70E-03 (2,5 %) | 9,1 | 302 | 323 594 |
| 4,60E-03 (moyenne) | 9,1 | 138 | 109 648 |
| 1,25E-02 (97,5 %) | 9,1 | 56 | 26 303 |
Les valeurs de kM calculées d'après des expériences in vivo semblent indiquer que la vitesse de métabolisation du D6 est relativement faible (≤ 0,01 jour-1 au mieux). L'étude expérimentale sur le FBC chez les têtes-de-boule (Drottar, 2005) a permis de démontrer la présence d'un certain métabolisme, bien que limité, du D6. Le FBC calculé de 302 avec la constante de vitesse de percentile inférieur (env. 0,002) est beaucoup plus faible que les valeurs du FBC rapportées par Fackler et al. (1995). Par conséquent, on peut considérer cette constante de vitesse comme cas de figure optimal. Un FBA correspondant de 323 594 a été calculé pour le D6 pour les poissons des eaux canadiennes (tableau 7) avec cette constante de vitesse de métabolisation.
Dans les sédiments
Aucune information n'est disponible sur la bioaccumulation du D6 dans les sédiments. Il existe toutefois des études sur le facteur d'accumulation dans le biote et les sédiments (FABS) chez les organismes benthiques pour le D5 (Springborn Smithers Laboratories, 2003) et le D4 (Kent et al., 1994). Selon la méthode du poids de la preuve, on a utilisé les données tirées de ces études afin de déterminer le potentiel d'accumulation du D6 dans les sédiments, même si le D6 devrait être encore moins biodisponible (à cause d'une plus grande sorption aux matières organiques) dans les sédiments que le D5 et le D4, et que par conséquent, son potentiel d'accumulation pourrait être plus faible.
Les FABS du D4 ont été calculés à l'aide des données d'une étude de toxicité subchronique chez le moucheron (Chirononmus tentans) [Kent et al., 1994]. Des moucherons ont été exposés à du D4 dans des sédiments présentant une concentration en carbone organique faible, moyenne et élevée comprise entre 0,27 et 4,1 %. Les FABS moyens calculés (FABS = Ctissus des organismesmg/kg/Csédimentsmg/kg) étaient de 0,7, 1,3 et 2,2 respectivement pour les concentrations élevées, moyennes et faibles. Les valeurs de FABS ont été calculées pour le D5 à l'aide de données issues d'une étude de toxicité chronique/aiguë chez le moucheron (Chironomus riparius) [Springborn Smithers Laboratories, 2003]. Les larves de moucherons ont été exposées à des concentrations de D5 comprises entre 13 et 180 mg/kg, et des essais ont été réalisés sur des sédiments contenant 2,0 % de carbone organique. On a pu ainsi calculer les FABS chez les moucherons à 1,2, 1,1, 0,83 et 0,46 pour des niveaux de traitement respectifs de 13, 30, 73 et 180 mg/kg (poids sec).
Les résultats empiriques indiquent que le D4 et le D5 peuvent présenter un certain potentiel (bien que limité [FABS < 2]) de bioaccumulation lié à l'exposition aux sédiments. Les données relatives au FABS pour le D5 peuvent être utilisées pour le D6 selon un scénario prudent du cas le plus défavorable. On estime aussi que le D6 présente un certain potentiel de bioaccumulation lié à l'exposition aux sédiments, bien qu'il ait vraisemblablement une plus faible valeur de FABS à cause de sa plus faible biodisponibilité. Cependant, ni l’une ni l’autre de ces études sur l'accumulation dans les sédiments spécifie si le contenu de l'intestin des organismes soumis à l'essai a été purgé avant le calcul des valeurs de FABS. Ces valeurs risquent donc d'être surestimées en raison de la présence des substances à tester dans les sédiments dans l'intestin des invertébrés.
Dans le sol
Il n'existe pas d'information disponible sur la bioaccumulation du D6 dans le sol.
Dans le milieu terrestre
Le modèle de bioaccumulation à bilan massique de Gobas pour les organismes terrestres (Gobas et al., 2003) utilise les coefficients de partage octanol-air et octanol-eau (Koaet Koe) pour estimer le potentiel de bioamplification (FBAmp) des substances chimiques dans les chaînes trophiques terrestres. Selon les estimations, les substances chimiques dont la valeur de log Koa est supérieure à 5 peuvent se bioamplifier dans les chaînes trophiques terrestres si la valeur de Koe est supérieure à 2 et si la vitesse de transformation chimique ou de métabolisation est faible. Un log Koa de 5,76 indique que le D6 peut présenter un potentiel de bioamplification dans les chaînes trophiques terrestres. Toutefois, le métabolisme des cVMS qui a été démontré au cours d’études en laboratoire menées chez des mammifères peut réduire le potentiel de bioamplification dans le réseau trophique terrestre.
Synthèse du potentiel de bioaccumulation du D6
Dans l'ensemble, les indications concernant le potentiel de bioaccumulation du D6 sont contradictoires. Des essais empiriques sur la bioconcentration ont montré que le FBC est inférieur à 5 000, ce qui est vraisemblablement lié à la biodisponibilité aquatique inférieure du D6 par rapport au D4 et D5 (comme l’indique les propriétés physiques et chimiques des cVMS). Le potentiel de bioconcentration chez les autres organismes aquatiques et benthiques à différents niveaux trophiques devrait être peu élevé compte tenu de la faible valeur de FBC obtenue chez les poissons et de la faible biodisponibilité attendue.
Les valeurs de FBC prévues, corrigées pour le métabolisme, sont relativement faibles par rapport à celles du D4 et du D5. Les valeurs de FBA prévues, également corrigées pour le métabolisme, sont relativement élevées et supérieures à 5 000. Le modèle cinétique à bilan massique utilisé repose sur les « principes fondamentaux », dont le concept clé indique qu'une substance chimique obéit au principal mécanisme du modèle, dans ce cas une diffusion passive. Le D6 respecte ce concept, de même que les limites de log Koe et de poids moléculaire du modèle. Par conséquent, les prévisions de bioaccumulation sont jugées applicables au D6. Cependant, la correspondance entre les valeurs de FBC corrigées pour le métabolisme et les valeurs empiriques est moindre, ce qui suggère une plus grande incertitude concernant les résultats du modèle de FBC et de FBA pour le D6 du fait de l'absence relative de valeurs empiriques pour le FBC et le FBA dans la plage de log Koe utilisée pour le D6 dans le modèle (supérieure ou égale à 9). Par ailleurs, la possibilité que des produits chimiques superhydrophobes n'atteignent pas l'équilibre dans l'environnement (ce que suppose le modèle) rajoute une certaine incertitude (Arnot et Gobas, 2006).
Les valeurs de FABS des sédiments pour le D4 et le D5 semblent indiquer un niveau d'accumulation relativement faible dans les macroinvertébrés présents dans les sédiments pour le D6. Comme il s'agit du seul essai de bioaccumulation dans les sédiments disponible pour les cVMS et qu'il n'existe aucun modèle prédictif pour les organismes des sédiments, des essais ou des données sur le terrain à des charges environnementales plus réalistes permettraient de vérifier ces valeurs. Aucune étude relative au FBAmp chez les poissons n'a été effectuée pour le D6. Si l'on utilise les valeurs du FBAmp obtenues pour le D4 et le D5, il est possible que le facteur de bioamplification obtenu chez les poissons pour le D6 soit également faible, compte tenu de sa faible biodisponibilité. Toutefois, on ne dispose actuellement d'aucun élément qui permette de valider cette hypothèse pour d'autres niveaux trophiques. Des études de mésocosmes sur le terrain sont actuellement en cours afin d'observer le transfert trophique de cVMS dans un réseau alimentaire aquatique, mais ces données ne sont pas encore disponibles pour évaluation complète et n'ont pas été prises en compte dans cette évaluation.
Actuellement, seule une valeur modélisée de FBA supérieure à 5 000 permet d'affirmer que le D6 présente un potentiel de bioaccumulation élevé. Cette valeur utilisée seule comme mesure unique du potentiel de bioaccumulation élevé présente un certain degré d'incertitude si l'on considère les autres données prouvant le faible potentiel de bioaccumulation. Compte tenu de ces indications contradictoires, on ne peut donc pas considérer que la valeur de FBA prévue permette à elle seule de conclure que le potentiel de bioaccumulation du D6 est élevé. Toutefois, on peut raisonnablement conclure que le D6 présente un certain potentiel de bioaccumulation dans le biote, bien que ce potentiel soit susceptible d'être inférieur à celui du D4 et du D5. Par conséquent, étant donné l'absence de potentiel de bioconcentration élevé et des indications de faible bioaccumulation obtenues pour le D4 et le D5 après exposition par voie alimentaire chez les poissons, on peut conclure que le D6 ne satisfait pas au critère de la bioaccumulation (FBC ou FBA ≥ 5 000) défini dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Évaluation des effets sur l’environnement
A – Dans le milieu aquatique
De nouvelles données empiriques sur l'écotoxicité du D6 ont été obtenues et sont examinées en détail ci-dessous (tableau 8a). Ces études indiquent que cette substance ne présente pas d'effets nocifs sur les poissons et les daphnies exposés à des concentrations pouvant atteindre sa limite de solubilité dans l'eau (environ 0,005 mg/L).
Des Daphnia magna juvéniles ont été exposées à des concentrations de D6 de 0,27, 0,57, 1,2, 2,5 et 4,6 µg/L (mesurées) pendant 21 jours dans des conditions de renouvellement statiques, et les solutions d'essai ont été renouvelées toutes les 24 heures (Springborn Smithers Laboratories, 2006). De l'acétone à une concentration de 0,1 mL/L a été utilisée comme agent solubilisant. Le pH était maintenu entre 7,4 et 8,4, la température oscillait entre 18 et 21 °C et la concentration d'oxygène dissous restait supérieure à 60 % de saturation. L'eau d'essai présentait une dureté de 120 à 190 mg CaCO3/L. On n'a pas observé de cas de mortalité, de baisse de la reproduction ou d'autres effets biologiquement significatifs à la concentration la plus élevée, soit 4,6 µg/L (concentration sans effet observé ≥ 4,6 µg/L). La régulation de la température et la dureté de l'eau présentaient des écarts par rapport à la Ligne directrice 211 de l'OCDE, mais on n'a pas jugé qu'il s'agissait de facteurs limitatifs importants pour l'essai. Toutefois, le taux d'alimentation de 0,3 mg C par daphnie par jour appliqué pendant l'essai était supérieur à celui de la ligne directrice de l'OCDE (0,1-0,2 mg C par daphnie par jour), mais on estime que cet écart est favorable à la santé des organismes expérimentaux, qui résistent mieux aux effets toxiques. Une charge de carbone plus élevée dans le système expérimental peut aussi contribuer à réduire la biodisponibilité du D6 en fournissant un substrat pour la sorption. Néanmoins, ces données expérimentales ont été jugées acceptables aux fins de la présente évaluation préalable, en indiquant les limites possibles pour les essais (voir ci-dessus).
| Organisme | Type d'essai | Durée | Paramètre[1] | Valeur (mg/L) | Références |
|---|---|---|---|---|---|
| [1] CSEO : concentration sans effet observé. | |||||
| Puce d'eau Daphnia magna |
Tox. chronique | 21 j | CSEO | 0,0046 | Springborn Smithers Laboratories, 2006 |
| Tête-de-boule Pimephales promelas | Tox. chronique | 49 j | CSEO | 0,0044 | Drottar, 2005 |
La toxicité du D6 chez les têtes-de-boule (Pimephales promelas) a été analysée lors d'une étude relative au FBC décrite à la section « Potentiel de bioaccumulation » (Drottar, 2005). Des têtes-de-boule juvéniles ont été exposées à des concentrations de 0,41 et 4,4 µg/L (mesurées) pendant 49 jours dans des conditions d'écoulement continu. Aucun effet biologique significatif n'a été observé à la concentration d'essai la plus élevée, soit 4,4 µg/L (CSEO ≥ 4,4 µg/L), pendant la phase d'absorption de 49 jours chez les poissons. La toxicité chez les poissons a été déterminée dans le cadre d'une étude de FBC; toutefois, la conception de l'essai ne correspond pas à celle d'un essai de toxicité à long terme pour les premiers stades de l’existence. On ne dispose d’aucune donnée expérimentale sur la toxicité du D6 au cours des premiers stades de la vie des poissons. Sousa et al. ont cependant fait état d’une étude de toxicité de 93 jours concernant le D4 pour cette période. Des embryons de truites arc-en-ciel ont été exposés à du D4 à des niveaux de concentration compris entre 0,00025 et 0,0044 mg/L pendant 93 jours. Aucun effet nocif n'a été observé sur la viabilité des embryons, l'alevinage, la survie des larves et la croissance à tous les niveaux de traitement. La CSEO chronique aux premiers stades de la vie des poissons sur 93 jours est donc de 0,0044 mg/L, la plus forte concentration testée. On peut raisonnablement conclure qu’en raison de sa biodisponibilité réduite, le D6 ne devrait pas présenter d’effets nocifs à la concentration de 0,0044 mg/L.
La toxicité aiguë et chronique du D6 a été évaluée à l'aide du modèle ECOSAR (2004). Les résultats prévus sont présentés dans le tableau 8b.
| Organisme | Type d'essai | Paramètre[1] | Durée | Concentration (mg/L) | Références |
|---|---|---|---|---|---|
| [1] CL50 : concentration minimale causant 50 % de mortalité; CE50 : concentration minimale causant 50 % des effets; ChV correspond à la moyenne géométrique de la CSEO (concentration sans effet observé) et de la CMEO (concentration minimale avec effet observé) | |||||
| Poissons | Tox. aiguë | CL50 | 14 j | 0,0004 | ECOSAR, 2004 |
| Poissons | Tox. chronique | ChV | 30 j | 0,00003 | ECOSAR, 2004 |
| Daphnie | Tox. chronique | CE50 | 16 h | 0,0001 | ECOSAR, 2004 |
Les résultats modélisés à l'aide d'ECOSAR pour le D6 semblent indiquer la possibilité d’un degré élevé d’effets nocifs chroniques (c'est-à-dire une CSEO chronique inférieure à 0,1 mg/L) chez les organismes aquatiques à la limite de solubilité. Les valeurs de toxicité prévues sont cependant considérées comme peu fiables. Le log Koe du D6 (9,07) est supérieur à la valeur de démarcation recommandée par ECOSAR pour ce log (8,0) en ce qui concerne la prévision de la toxicité chronique à l’aide des relations structure-activité pour les composés organiques neutres, et le manque de données empiriques sur les siloxanes dans l’ensemble d’étalonnage du modèle vient limiter leur prise en compte dans la présente évaluation. Les données de toxicité modélisées pour les organismes aquatiques n’ont donc pas été retenues.
D’après les données empiriques, le D6 ne présente aucun effet nocif chez le biote pélagique à des concentrations inférieures à sa limite de solubilité (0,005 mg/L). Néanmoins, on a choisi de comparer la CSEO de 0,0046 mg/L tirée d’un essai de toxicité de 21 jours réalisé chez des daphnies aux concentrations environnementales prévues dans l’eau.
B – Dans d’autres milieux
Dans les sédiments
Aucune étude de toxicité pour les organismes des sédiments n'a été trouvée pour le D6. Toutefois, des études de toxicité chronique effectuées sur les organismes benthiques sont disponibles pour le D5, dont la structure est similaire (Springborn Smithers Laboratories 2003; Krueger et al., 2008). Ces données expérimentales ont été utilisées selon la méthode du poids de la preuve pour déterminer le potentiel de toxicité du D6 dans les sédiments. Toutefois, le D6 pourrait présenter une biodisponibilité moindre (sorption plus élevée aux matières organiques) dans les sédiments que le D5 et, par conséquent, un potentiel de toxicité inférieur.
Des études de toxicité chronique du D5 (Springborn Smithers Laboratories, 2003; Krueger et al., 2008) ont été effectuées chez les moucherons (Chironomus riparius). Dans ces études de 28 jours, la concentration sans effet sur la vitesse de développement des mâles était de 69 à 70 mg/kg en poids sec. On a observé les concentrations minimales ayant un effet sur la croissance et la vitesse de développement des mâles entre 160 et 180 mg/kg en poids sec.
Une étude de 28 jours sur la toxicité chronique du D5 chez le ver de terre (Lumbriculus variegates) a également été effectuée (Krueger et al., 2007). La concentration de D5 sans effet sur la survie et la reproduction était de 1 272 mg/kg en poids sec.
Compte tenu des données sur la toxicité chronique du D5, on considère que les populations de Chironomus riparius sont plus sensibles aux cyclosiloxanes que les vers de terre. Bien que la toxicité du D6 soit vraisemblablement plus faible pour les organismes benthiques à cause de sa biodisponibilité et son hydroaffinité réduites, on peut utiliser les valeurs de toxicité chronique du D5 pour déterminer la toxicité du D6 dans les sédiments selon le scénario d'exposition le plus défavorable et le potentiel de biodisponibilité. On peut ainsi calculer pour le D6 des valeurs prudentes de CSEO (concentration sans effet observé) et de CMEO (concentration minimale avec effet observé) de 69 et 160 mg/kg en poids sec, respectivement.
Dans le sol
Aucune étude concernant les effets du D6 ou de ses analogues sur les organismes du sol n'a été trouvée.
Dans le milieu terrestre
Aucune étude écologique concernant les animaux sauvages terrestres n'a été trouvée. Les études en laboratoire sur des mammifères sont examinées dans la section « Potentiel d'effets nocifs sur la santé humaine » de la présente évaluation préalable.
Évaluation de l'exposition de l’environnement
Dans l'air
Des mesures environnementales préliminaires de méthylsiloxanes volatils, dont le D6, ont été effectuées en février et mars 2006 au Canada, dans la région des Grands Lacs (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références). Dix-huit échantillons d'air extérieur provenant de régions rurales et urbaines de l'Ontario ont été prélevés et le D6 était présent dans presque tous ces échantillons à des concentrations de moins de 1 µg/m3, à l'exception d'une concentration relativement élevée d'environ 16 µg/m3 signalée dans la région urbaine de Toronto. Ce résultat concorde avec les valeurs déclarées par d'autres instances (tableau 9a).
Il est cependant possible que la détection de D6 dans l'air ambiant soit partiellement attribuable à la contamination des échantillons. Les cyclosiloxanes volatils sont présents dans une gamme étendue de produits commerciaux, et les représentants des programmes de surveillance du Canada et des pays nordiques ont indiqué qu'ils avaient eu des problèmes de concentrations élevées de cyclosiloxanes dans des blancs d'échantillons. La méthode utilisée pour mesurer et analyser les concentrations dans l'air à des valeurs comprises entre des ng/m3 et quelques µg/m3 est toujours en voie d'élaboration. Très peu de mesures ont été effectuées en double pour la surveillance de l'air extérieur et les rares données disponibles présentent une mauvaise reproductibilité (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références).
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Des 24 échantillons extérieurs (n = 24) ont été recueillis dans les pays nordiques. La limite de détection était de 0,03 µg/m3 pour le D6. [2] Communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références. |
|||
| Air | Région des Grands Lacs, Canada; février et mars 2006 | < 1-16 µg/m3 | Voir la note 2 |
| Air | Pays nordiques[1]; 2004-2005 | < l. d.-2,1 µg/m3 | Norden, 2005 |
Dans l'eau
Au Canada, on a échantillonné l'eau de 9 stations d'épuration des eaux d'égout (SEEE), dans des grands centres urbains du sud-ouest de l'Ontario, y compris dans des lagunes et dans des installations de traitement secondaire et tertiaire de l'eau en octobre et pendant l'hiver 2005 (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références). Du D6 a été détecté à des concentrations de 0,49 à 27,33 µg/L et de 0,97 à 2,71 µg/L, respectivement, dans les affluents et les effluents. En ce qui concerne les concentrations de D6 des affluents traités par des SEEE, on n'a observé des différences saisonnières que pour trois lagunes, alors que les différences saisonnières des concentrations de D6 dans les effluents étaient plus significatives (de 0,97-1,00 en automne à 2,32-2,71 en hiver). D'autres instances ont déclaré des résultats de surveillance semblables (tableau 9b).
Aux États-Unis, on a détecté du D6 dans des concentrés d'eau potable de deux villes, la Nouvelle-Orléans (Louisiane) et Cincinnati (Ohio) (Lucas, 1984, cité dans U.S. EPA, 1992).
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Total de 28 sites d'échantillonnage à l'exclusion des affluents et des effluents de SEEE [2] 7 sites d'échantillonnage d'affluents de SEEE [3] 12 sites d'échantillonnage d'effluents de SEEE [4] Communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références. l.d.= limite de détection |
|||
| Eau | Grands Lacs, Canada; 2006 | < 17 ng/g (l. d.) | Voir la note 4 |
| Affluents de SEEE | Sud-ouest de l'Ontario, Canada; 2006 | 0,49-27,33 µg/L | Voir la note 4 |
| Effluents de SEEE | Sud-ouest de l'Ontario, Canada; octobre 2005 | 0,97-2,71 µg/L | Voir la note 4 |
| Eau potable | États-Unis | Détection qualitative | Lucas, 1984, cité par la U.S. EPA, 1992 |
| Eau | Sites de fond et sites urbainspays nordiques | < 0,07 µg/L (l.d.) | Norden 2005; Kaj et al., 2005; NILU, 2007 |
| Affluents de SEEE | Pays nordiques[2][1], | 0,12-3,7 µg/L | Norden 2005; Kaj et al., 2005; NILU, 2007 |
| Effluents de SEEE | Pays nordiques[3] | < 0,02 (l.d.)-0,1 µg/L | Norden 2005; Kaj et al., 2005; NILU, 2007 |
Dans les sédiments
Au Canada, on a dosé le D4, le D5 et le D6 de sédiments de surface et de carottes de sédiments prélevés dans le lac Ontario en juillet 2006 (Powell et Kozerski, 2007). Les sédiments de surface étaient constitués de la couche supérieure de 5 cm de sédiments du port de Toronto et du bassin de Kingston. Les carottes de sédiments prélevées dans les bassins de Rochester, de Mississauga et de Niagara ont été découpées en strates d'une épaisseur de 5 mm. Les sédiments de surface du port de Toronto et du bassin de Kingston présentent une teneur en carbone organique total modérée (COT = 2,1-2,4 % p. s. [poids sec]), alors que les carottes de sédiments présentent une teneur en COT élevée (4-5 % p. s.). Une analyse de perte par calcination des sédiments a également indiqué des teneurs en eau plus faibles dans les sédiments de surface (55-70 % p. h. [poids humide]) que dans les carottes de sédiments (80-89 %). On sait que les sédiments du port de Toronto et des quatre bassins sédimentaires sont contaminés par divers composés organiques qui pénètrent dans le lac par des rejets directs d'eaux usées traitées, qui s'écoulent des Grands Lacs supérieurs (Érié, Huron et Michigan) et de la rivière Niagara ou qui proviennent du dépôt atmosphérique. Les sédiments de surface du port de Toronto contenaient les plus fortes concentrations de D6 (0,2 µg/g en poids sec). En revanche, les concentrations de siloxanes cycliques dans les sédiments de surface et les carottes de sédiments des quatre bassins sédimentaires étaient toutes inférieures à la limite de détection de la méthode analytique, qui était fixée à 0,01 µg/g pour le D6. D'autres instances ont déclaré des résultats de surveillance semblables pour la détection du D6 dans les sédiments de surface de régions urbaines et de sources ponctuelles (tableau 9c).
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement (Powell, 2008). L'analyse préliminaire des échantillons de sédiments de surface et de carottes de sédiments n'a pas permis de détecter de D6, la limite de détection étant fixée à 19,0 ng (masse de référence corrigée).
Les résultats de surveillance des sédiments pour les zones du lac Opeongo et du lac Ontario semblent indiquer qu'il est plus probable de détecter une contamination au D6 à proximité des centres urbains et des sources ponctuelles.
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Total de 30 sites d'échantillonnage de sédiments [2] Masse de référence corrigée telle qu’elle est mentionnée dans l’étude préliminaire p. s. = poids sec; l. d. = limite de détection |
|||
| Sédiments de surface | Port de Toronto (Canada); juillet 2006 | 0,2 µg/g p. s. | Powell et Kozerski, 2007 |
| Sédiments de surface | Bassin de Kingston (Canada); juillet 2006 | <0,01 µg/g p. s. (l.d.) | Powell et Kozerski, 2007 |
| Carottes de sédiments | Bassins de Rochester, de Mississauga et de Niagara (Canada); juillet 2006 | <0,01 µg/g p. s. (l.d.) | Powell et Kozerski, 2007 |
| Sédiments de surface | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | <19,0 ng. (l.d.) [2] | Powell, 2008 |
| Carottes de sédiments | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | <19,0 ng. (l.d.) [2] | Powell, 2008 |
| Sédiments | Pays nordiques[1] | < l. d. (variations entre les échantillons) -0,196 µg/g p. s. | Norden, 2005; Kaj et al., 2005; NILU, 2007 |
Dans le sol
Le D6 peut pénétrer dans le sol par l'application de boues d'épuration sur les terres agricoles. Aucune donnée de surveillance n'a été relevée au Canada concernant la présence du D6 dans les boues d'épuration. En Europe, le D6 est présent dans les boues d'épuration à des concentrations comprises entre quelques µg/kg et 14,0 mg/kg en poids sec (Norden, 2005; Kaj et al., 2005; NILU, 2007).
Aucune donnée de surveillance n'est disponible à propos du D6 dans le sol au Canada. Les concentrations de D6 dans deux échantillons de sol des îles Féroé étaient inférieures à la limite de détection (< 4 ng/g p. s.) [Norden, 2005].
Dans le biote
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement (Powell 2008). L'analyse préliminaire d'échantillons de zooplancton n'a pas permis de mettre en évidence la présence de D6. Les échantillons représentatifs de zooplancton ont été regroupés en un échantillon unique pour chacun des deux emplacements sans être classés par espèce. La limite de détection était de 19,0 ng (masse de référence corrigée).
En Europe, on a détecté du D6 dans le foie de poissons d'eau de mer, mais pas dans celui de poissons d'eau douce, principalement dans des zones représentant des sources urbaines ou diffuses. Les concentrations étaient habituellement comprises entre moins de 5 et 10 ng/g (en poids humide), sauf pour un échantillon de foie de morue de Norvège, dans lequel on a mesuré des concentrations extrêmement élevées de siloxanes (74 ng/g de D6 en poids humide). Le programme de suivi des effets sur l'environnement mené par le gouvernement norvégien a permis de confirmer les concentrations de D6 initiales rapportées (NILU, 2007; voir le tableau 9d). Dans le cadre du même programme de suivi, du D6 a également été détecté dans des moules communes, dans les foies et les filets de limandes à queue jaune et dans le contenu de l'estomac de morues de Norvège. Les concentrations variaient selon les espèces, le sexe et l'âge. Chez les mammifères marins surveillés, on a détecté du D6 dans le petit lard de phoque au Danemark à une concentration de 7,9 ng/g en poids humide (Norden, 2005). On n'en a en revanche pas détecté en Suède dans des échantillons de muscles de poissons (Kaj et al., 2005).
La présence de D6 dans le biote en Europe indique que malgré les faibles concentrations détectées, voire la non-détection, de la substance dans l'habitat des poissons ou à proximité, le D6 est présent dans l'environnement pour l'absorption par le biote et l'accumulation dans celui-ci.
| Organisme | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Un total de 11 matrices d'échantillonnage pour les poissons d'eau de mer [2] Un total de 10 matrices d'échantillonnage pour les poissons d'eau douce [3] Un total de 7 matrices d'échantillonnage pour les mammifères marins [4] Un total de 17 matrices d'échantillonnage pour les œufs d'oiseaux de mer [5] Un total de 3 matrices d'échantillonnage pour les moules [6] Un total de 2 matrices d'échantillonnage pour la limande à queue jaune [7] Un total de 3 matrices d'échantillonnage pour la morue p.h. : poids humide; l. d. : limite de détection |
|||
| Zooplancton | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | < 19,0 ng/g (l.d.) | Powell, 2008 |
| Foie de poissons d'eau de mer | Pays nordiques[1], 2002-2004 |
< 5 (l. d.)-74 ng/g p.h. | Norden, 2005 |
| Foie de poissons d'eau douce | Pays nordiques[2]; 2002 | < 5 ng/g p.h. (l.d.) | Norden, 2005 |
| Mammifères marins | Pays nordiques[3]; 2002 | < 5 (l. d.)-7,9 ng/g p.h. | Norden, 2005 |
| Œufs d'oiseaux de mer | Pays nordiques[4], 2000-2005 |
< 5 ng/g p. h. (l.d.) | Norden, 2005 |
| Moules communes | Norvège[5]; 2006 | 1,3-1,8 ng/g p.h. | NILU, 2007 |
| Foies de limandes à queue jaune | Norvège[6]; 2006 | 1,4 ng/g p. h. | NILU, 2007 |
| Filets de limandes à queue jaune | Norvège[6]; 2006 | 0,9 ng/g p. h. | NILU, 2007 |
| Contenu de l'estomac de morues | Norvège[7]; 2006 | 1,8-3,3 ng/g p.h. | NILU, 2007 |
| Foies de morues | Norvège[7]; 2006 | 109,1-151,5 ng/g p.h. | NILU, 2007 |
Caractérisation des risques pour l'environnement
La démarche suivie dans cette évaluation écologique préalable a consisté à examiner les divers renseignements à l’appui de la caractérisation et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence prévus à l’article 76.1 de la LCPE (1999). Une attention particulière a été accordée à l'analyse du quotient de risque, à la persistance, au potentiel de bioaccumulation, à la toxicité, aux sources et au devenir dans l'environnement.
Selon les renseignements disponibles, le D6 est très persistant dans l'eau et présente un certain potentiel de bioaccumulation dans les organismes aquatiques, comme le suggèrent la valeur expérimentale obtenue pour le FBC et sa présence dans certains organismes vivants en Europe. Une évaluation quantitative du quotient de risque de l'exposition et des effets écologiques a donc été réalisée dans le cadre de l'évaluation de l’ensemble des données concernant le potentiel d'effets nocifs du D6.
Deux études expérimentales de toxicité chronique effectuées dans le milieu aquatique, soit l’une portant sur les Daphnia magna et l’autre sur les têtes-de-boule, ont été analysées et validées. Le D6 n'a présenté aucun effet nocif à des niveaux de concentration compris entre 0,0044 et 0,0046 mg/L, concentration très proche de sa limite de solubilité dans l'eau (env. 0,005 mg/L). Aucun facteur d'application n’a été appliqué à la CSEO chronique de 0,0046 mg/L. La concentration estimée sans effet observé (CESE) est donc de 0,0046 mg/L.
Le D6 a été soumis à une analyse du quotient de risque (QR) qui intègre le niveau d'exposition et un seuil de toxicité. Pour tenir compte du risque potentiel du D6 à l'échelle du Canada, on a déterminé une distribution établissant le profil des quotients de risque dans l'eau au niveau de plusieurs sites de rejet de la substance par l'industrie ou les consommateurs (c.-à-d. des stations municipales d’épuration des eaux d’égout). Ce type d'analyse fournit des éléments utiles à l'évaluation des risques d'une substance lorsqu’il est impossible d’établir totalement l'ensemble des emplacements géographiques des rejets effectués par l'activité industrielle et les consommateurs de cette substance.
En particulier lorsque divers secteurs industriels utilisent une substance sans qu’on puisse identifier les installations effectivement impliquées, on peut alors estimer l'exposition en milieu aquatique pour tous les emplacements des installations ayant un lien avec ces secteurs. Par ailleurs, des informations concernant des rejets potentiels attribuables à une utilisation par les consommateurs peuvent être intégrées aux calculs. Une concentration environnementale estimée (CEE) pour le milieu aquatique est déterminée en fonction des quantités utilisées déterminées à partir des réponses à l'enquête menée en application de l’article 71 et des estimations concernant les rejets effectués par l'activité industrielle et les consommateurs. Les eaux réceptrices sont un cours d'eau ou un lac, et un facteur de dilution basé sur la superficie des eaux réceptrices (10 au maximum) est utilisé pour estimer la CEE. Le quotient de risque propre à chacun des sites est ensuite déterminé pour la colonne d'eau. La distribution indique non seulement la proportion ou le nombre de sites dépassant le seuil, mais également l'ordre de grandeur de ce dépassement pour chaque site. Des informations complémentaires sur la méthode utilisée figurent dans le rapport d'Environnement Canada (2008b).
L'analyse des rejets des consommateurs se fonde sur une base de données répertoriant près de 1 000 lieux (ou sites) d'élimination municipaux représentant environ les deux tiers de la population canadienne. L'analyse des rejets industriels a été effectuée pour 27 sites liés à 87 installations industrielles identifiées par leur code NAICS comme des utilisateurs potentiels de D6. Au total, dans ces scénarios, 31 (env. 3,2 %) des lieux d'élimination municipaux évalués au Canada présentent un risque pour les organismes aquatiques, avec des QR supérieurs à 1 (voir la figure 1). L'équation et les paramètres utilisées pour calculer la CEE dans les cours d'eau récepteurs sont décrites dans le rapport d'Environnement Canada (2008c).


Figure 1. Distribution du risque du D6 pour le milieu aquatique (Environnement Canada,
2008b; id., 2008c)
Bien qu'une analyse du quotient de risque ait été effectuée pour le D6, les données empiriques relatives à l'écotoxicité laissent penser que le seuil auquel des effets nocifs sur le biote pélagique sont censés se produire n'a pas été observé durant les essais de toxicité dont on dispose. Dès lors, les QR calculés dans le scénario ci-dessus sont essentiellement « sans limite » et peuvent ne pas représenter les effets observables « réels » prévus aux sites susmentionnés.
La valeur de log Koe très élevée pour le D6 tend à indiquer que celui-ci se trouve dans la classe des produits chimiques « superhydrophobes » qui sont souvent associés à une biodisponibilité faible pour le biote pélagique et benthique. L’absence de bioconcentration sensible chez les organismes d’essai et les valeurs relativement faibles de résidus tissulaires relevées dans les données de surveillance sur le terrain tendent également à indiquer que la faible biodisponibilité vient limiter la possibilité que la charge corporelle atteigne des niveaux internes critiques à la suite d’expositions à de l’eau et des sédiments.
Le D6 a été identifié comme persistant dans l'environnement et présente un potentiel de bioaccumulation relativement faible dans le biote. Comme son profil en matière de propriétés physiques et chimiques, de bioconcentration et d’écotoxicité fournit une base consensuelle à l’établissement d’une conclusion définitive, on peut raisonnablement conclure que le D6 présente un faible potentiel d'effets nocifs sur l'environnement au Canada.
Incertitudes dans l'évaluation des risques pour l’environnement
De grandes quantités de D6 sont importées au Canada. Selon les informations disponibles, les quantités de D6 importées et utilisées au Canada ont fortement augmenté depuis l'inscription de cette substance sur la LIS (Environnement Canada, 1988). La tendance étant à une augmentation de l’utilisation, les rejets de D6 dans l'environnement et le potentiel d'exposition de l’environnement à cette substance augmenteront également. De plus, le D6 est l'un des principaux composants du n° CAS 69430-24-6 et est également présent dans les PDMS dans des proportions pouvant atteindre 3 %. Or, le n° CAS 69430-24-6 (ou cyclométhicone, représentant le mélange) et les PDMS ne figurent pas sur la liste des substances contrôlées dans le cadre du Défi du gouvernement canadien lancé à l'industrie et aux autres parties intéressées (Canada, 2007). Bien qu'il soit établi que certaines sociétés ont déclaré divers cVMS dans le mélange dans le cadre de l'enquête, les quantités de ces substances importées au Canada et leurs utilisations en 2006 ne sont pas totalement connues, et leurs rejets dans l'environnement au pays ne sont pas entièrement pris en compte dans le présent rapport d'évaluation.
Pour l'analyse de distribution du risque, la CESE a été calculée à partir d'une concentration très proche de sa limite de solubilité dans l'eau (env. 0,005 mg/L) et aucun facteur d'application n’a été employé pour extrapoler des données sur le terrain à partir de données de laboratoire en raison de l'absence d'effets nocifs observés à cette concentration. Puisqu'on ne disposait d'aucune information relative aux rejets liés aux activités industrielles pour l'analyse de distribution du risque, il est considéré que les rejets dans les eaux usées sont répartis de manière uniforme entre les 27 sites industriels évalués. En réalité, certains sites industriels peuvent utiliser davantage de D6 que d'autres, ce qui génère des rejets plus importants dans les lieux d'élimination municipaux associés à ces sites et donc un risque supérieur aux prévisions. Dans l'analyse, on a appliqué, aux concentrations de distribution, une dilution instantanée des effluents des SEEE dans les eaux réceptrices. Toutefois, dans des conditions environnementales réalistes, la dilution instantanée ne peut pas être obtenue au-delà d'une certaine distance du point de rejet et la zone proche du point de rejet d'une SEEE peut présenter un risque supérieur aux prévisions.
Les sédiments sont un sujet de préoccupation important concernant le D6. Les études de dégradation du D4 dans les sédiments qui ont été utilisées pour le D6 comportaient des incertitudes. De plus, l'extrapolation des demi-vies à faible température dans les sédiments selon les données d'hydrolyse peut également contribuer à l'incertitude globale concernant la persistance dans les sédiments.
Les données de l'étude de bioconcentration ainsi que les valeurs ayant trait au facteur de bioamplification et à l'accumulation dans les sédiments disponibles pour les substances analogues au D6 ont permis de déduire que le D6 présente un faible potentiel de bioaccumulation lors d'essais en laboratoire. On note un manque de données de terrain sur le potentiel de bioaccumulation par le réseau trophique et chez les organismes non aquatiques.
Les prévisions des modèles ont également été intégrées à la présente évaluation préalable. Il existe des incertitudes accrues concernant les valeurs prévues car seuls quelques siloxanes ou produits chimiques avec des valeurs de log Koe élevées (> 8), comme pour le D6, ont été étudiés et intégrés aux modèles.
Les données de surveillance environnementale au Canada et ailleurs sont limitées. La contamination des échantillons peut représenter un problème pour la surveillance environnementale en raison des nombreuses utilisations du D6. Les données disponibles sur les concentrations environnementales de D6 dans le biote et dans les eaux de surface au Canada sont limitées et peu de concentrations environnementales ont été rapportées pour des régions à l'extérieur des zones urbaines du Canada. Pour ces raisons, le présent rapport utilise des données de surveillance de pays européens. La surveillance a cependant également été identifiée comme un élément essentiel du Plan de gestion des produits chimiques au Canada, et le D6 a été pris en compte pour la surveillance environnementale dans le cadre de ce plan. La surveillance environnementale contribuera à une meilleure compréhension de la présence environnementale et du potentiel réel d'accumulation de la substance dans l'environnement.
Évaluation de l'exposition
La section « Évaluation de l'exposition de l’environnement » de ce rapport présente les données sur les concentrations de D6 détectées dans les milieux naturels, notamment dans l'air ambiant à proximité et à distance des sources ponctuelles, des eaux de surface, des sédiments, des boues d'épuration et du biote. Les données non publiées relatives au Canada incluent des mesures dans l'air à proximité et à distance de sources ponctuelles (communication personnelle, Environnement Canada, Centre de technologie environnementale, 2007; ne figure pas dans les références), des mesures dans l'air et les affluents et effluents de stations d'épuration des eaux usées (communication personnelle, Environnement Canada, Centre de technologie environnementale, 2007; ne figure pas dans les références) ainsi que des mesures dans les sédiments des Grands Lacs (Powell et Kozerski, 2007). De nombreuses analyses de siloxanes volatils ont généré des résultats incohérents en raison de la contamination des échantillons pendant la collecte et l'analyse, responsable de la détection de siloxanes dans les blancs, à des concentrations dans certains cas comparables à celles des échantillons prélevés à proximité de sources ponctuelles. Le Conseil des ministres des pays nordiques et l'Institut de recherche environnementale de la Suède ont publié les résultats de vastes campagnes d'échantillonnage et de mesure des siloxanes dans les milieux naturels en Scandinavie (Norden, 2005; Kaj et al., 2005). Les données de ces rapports, considérées comme fiables, ont été utilisées pour calculer les limites supérieures estimées de l'exposition aux siloxanes dans l'air, l'eau et le sol pour la population du Canada.
L'annexe 1 présente les limites supérieures estimées de l'absorption quotidienne de D6 pour six groupes d'âge de la population canadienne. Les valeurs estimées de l'absorption à partir des milieux naturels et du régime alimentaire sont comprises entre 28,7 et 87 µg/kg p. c./j (kilogramme de poids corporel par jour) respectivement pour les adultes âgés de 60 ans et plus et les enfants de 6 mois à 4 ans. La contribution la plus significative à l'absorption quotidienne due aux milieux naturels est l'inhalation d'air intérieur, selon une étude portant sur 400 domiciles en Suède, au cours de laquelle on a détecté du D6 dans 142 échantillons, soit deux fois plus que pour le D4. Pour cette étude, la concentration moyenne de D6 dans l'air intérieur mesurée dans les chambres des enfants était de 7,9 µg/m3, avec une concentration maximale de 164 µg/m3 (Kaj et al., 2005).
La confiance dans la limite supérieure estimée de l'exposition au D6 dans les milieux naturels et dans le régime alimentaire est modérée. Aucune donnée canadienne n'a été utilisée, mais des données d'études effectuées en Scandinavie étaient disponibles pour l'air ambiant et intérieur, l'eau et le sol. La concentration maximale de D6 mesurée dans l'air intérieur au cours d’une étude suédoise sur les domiciles est plus élevée que celle mesurée tant pour le D4 que pour le D5 dans les habitations suédoises (Kaj et al., 2005). On peut difficilement expliquer ce résultat, étant donné la pression de vapeur du D6 inférieure à celle de ses composés analogues à poids moléculaire plus faible et la prévalence relative prévue de l'utilisation de ces trois cyclosiloxanes en 2004. L'utilisation d'une limite réglementaire pour les PDMS (n° CAS 9006-65-9, diméthylpolysiloxane) dans le quart des produits laitiers et la moitié des aliments transformés peut causer une surestimation de la contribution alimentaire à l'exposition totale, mais la contribution estimée de tous les aliments à l'exposition de la population due aux milieux naturels et au régime alimentaire est inférieure à 5 % de celle de l'air.
À l’aide de la version 4.1 du logiciel ConsExpo, qui est conçu pour estimer l'exposition aux produits de consommation, la dose systémique possible de D6 due à l'utilisation de produits d'hygiène a été estimée pour les femmes qui utilisent des produits de soins de la peau, des produits capillaires et des antitranspirants (RIVM, 2006). Des calculs semblables pour le D4 ont montré que la dose estimée pour les femmes adultes était nettement supérieure à celle des hommes adultes, surtout à cause des produits d'hygiène qui sont laissés sur la peau. Pour cette raison, on ne présente qu'une dose systémique estimée pour les femmes adultes.
Les fabricants de produits d'hygiène doivent signaler à Santé Canada les concentrations de siloxanes, au sein de vastes plages, notamment pour le D6 et les polydiméthylcyclosiloxanes, appelés cyclométhicone dans l'industrie des produits d'hygiène[1]. Santé Canada a été informé qu'environ 530 produits cosmétiques contenaient du D6 comme seul siloxane ou mélangé à d'autres siloxanes et qu'environ 6 000 produits contenant du cyclométhicone ou des mélanges de ce dernier pouvaient contenir du D6 (SDC, 2007). Les données sur la concentration de D6 dans les produits d'hygiène ont été obtenues principalement à partir des renseignements fournis par l'industrie canadienne (Environnement Canada, 2007; SDC, 2007) et complétées par des renseignements issus d'autres sources indiquées dans l'annexe 2. Les données relatives aux parts de marché n'ont pas été utilisées pour déterminer la concentration de D6 dans les produits dominants pour chacune des catégories d'utilisation. Si l'une des concentrations déclarées en réponse à l'avis publié en application de l'article 71 de la LCPE (1999) pour une catégorie de produits était supérieure à celles du SDC, une concentration inférieure de D6 concordant avec la plage des valeurs déclarées au SDC a été utilisée pour cette catégorie de produits afin d'estimer la dose systémique (Environnement Canada, 2007; SDC, 2007).
On a supposé que 20 % du D6 d'un produit appliqué sur la peau s'évaporait et que le reste (80 %) était disponible pour l'absorption cutanée. Cette approche est conforme à l’accent mis sur la prudence dans le cadre des évaluations préalables tout en prenant en compte la pression de vapeur relative du D6 par rapport à celle du D4, pour lequel il existe des données sur l'évaporation (Zareba et al., 2002). Aucune donnée expérimentale pouvant être utilisée pour la répartition des produits d'hygiène liée à l'évaporation sur la peau n'a été trouvée.
Selon des études de dosage oral chez des rats F344, environ 12 % du D6 marqué au 14C était absorbé de façon systémique (Dow Corning, 2004), alors que seulement 0,17 % du D5 marqué au 14C, appliqué topiquement, était absorbé par la peau de ces animaux (Jovanovic et al., 2008). Une étude d'inhalation de 6 heures chez les rats a montré que 1 à 2 % du D5 marqué au 14C était conservé dans le corps (Tobin et al., 2008). On a proposé d'utiliser les valeurs de 12 % pour l'absorption par ingestion, de 0,17 % pour l'absorption par voie cutanée et de 2 % pour l’absorption par inhalation afin d'estimer la dose due aux produits d'hygiène. Les valeurs d'absorption par voie cutanée et par inhalation utilisées pour le D6 correspondent à celles déterminées pour le D5, comme il est indiqué ci-dessus. Cette approche est jugée conforme à l’accent mis sur la prudence dans le cadre des évaluations préalables sans pour autant surestimer les facteurs d'absorption. On fait une distinction entre les produits qui sont retirés de la peau par lavage et ceux qui restent sur le corps. D'autres hypothèses sont formulées à l'annexe 2.
L'annexe 2 présente les résultats d'un exemple de calcul pour l'application d'un produit de coiffure, et le tableau 1, une synthèse de la dose systémique estimée due à l'utilisation de produits d'hygiène par les femmes. Chez les femmes adultes, la limite supérieure estimée de la dose systémique quotidienne pour les produits d'hygiène modélisés, cumulée pour l'exposition par inhalation et par voie cutanée et orale, est de 0,17 mg/kg p. c./j. L'évaluation préalable de l'octaméthylcyclotétrasiloxane (D4) a montré que pour les femmes qui utilisent des produits d'hygiène, la dose systémique est supérieure à celle absorbée par les hommes, ce qui devrait aussi être le cas pour le D6.
Une évaluation de l'exposition au D6, notamment pour les utilisations de produits d'hygiène, a été présentée au gouvernement du Canada dans le cadre du Défi (SEHSC, 2008a). La méthodologie est différente de celle utilisée dans le tableau 1 de l'annexe 2 car elle fait appel à une analyse probabiliste (Monte Carlo) et regroupe les expositions de la population à toutes les sources (notamment les produits d'hygiène) et voies d'exposition (par inhalation, par voie cutanée et par ingestion). On a caractérisé la contribution de l'utilisation des produits d'hygiène à l'exposition totale par plusieurs voies (par inhalation, voie cutanée et ingestion), puis calculé le total pour obtenir une estimation de l'exposition cumulée. Étant donné que le D4 et le D6 ont été utilisés en tant que composés analogues pour déterminer la toxicité orale du D5, ce dernier est utilisé ici comme substitut pour valider l'évaluation d'exposition probabiliste pour le D6. Une évaluation probabiliste de l'exposition pour le D5 a donc été présentée au gouvernement du Canada dans le cadre du programme du Défi (SEHSC, 2008b). Une étude indépendante de l'évaluation probabiliste présentée a conclu que cette évaluation portait sur l'exposition pour les groupes d'utilisateurs et de non-utilisateurs (voir l’annexe 4). Les données ont été réanalysées en fonction des groupes d'utilisateurs afin de comparer les résultats à ceux de l'évaluation déterministe de l'exposition au cours de cette évaluation préalable. Les valeurs probabilistes de l'exposition pour les femmes adultes (groupe d'adultes le plus fortement exposé) basées uniquement sur les groupes d'utilisateurs étaient 10 à 16 fois inférieures aux valeurs déterministes présentées pour le D5. Ainsi, en utilisant le D5 comme composé analogue pour déterminer des valeurs d'exposition probabilistes, on s'attend à ce que les valeurs probabilistes d'exposition pour les femmes adultes (groupe d'adultes le plus fortement exposé) soient 10 à 16 fois inférieures aux valeurs déterministes présentées dans le tableau 1 de l'annexe 2. Il est à noter qu'en raison des exigences relatives à l'analyse détaillée et à la validation des valeurs obtenues au cours d’évaluations probabilistes de l'exposition, ces valeurs se situent normalement hors de portée pour la composante « exposition » d'une évaluation préalable.
Les valeurs probabilistes d'exposition au D5 pour les enfants de 0 à 6 mois (le groupe d'enfants le plus fortement exposé), basées uniquement sur les groupes d'utilisateurs, se situaient entre 0,016 et 0,032 mg/kg p. c./j (voir l’annexe 4). La comparaison avec une évaluation déterministe de l'exposition pour les enfants était impossible en raison du manque de données sur l'utilisation du produit, qui étaient nécessaires à la modélisation de l'exposition pour les enfants lors d'une évaluation déterministe de l'exposition. Les valeurs probabilistes d'exposition pour les enfants sont 5 à 10 fois inférieures aux valeurs déterministes d'exposition au D5 pour les femmes adultes. Ainsi, en utilisant le D5 comme composé analogue pour déterminer des valeurs probabilistes d'exposition pour le D6, on s'attend à ce que les valeurs probabilistes d'exposition pour les enfants soient 5 à 10 fois inférieures aux valeurs déterministes d'exposition pour les femmes adultes en ce qui concerne le D6.
La contribution d'autres types de produits de consommation comme les revêtements de surface, les produits de calfeutrage, les polis et les nettoyants à l'exposition quotidienne due aux utilisations quotidiennes a été jugée beaucoup plus faible; ces produits n'ont donc pas été pris en compte pour la modélisation de la dose quotidienne dans les scénarios d'exposition des consommateurs. Les produits d'hygiène et d'autres produits de consommation contribuent aux concentrations de D6 dans l'air intérieur et ambiant, et ainsi à l'exposition par inhalation. Leur contribution à l'exposition totale des personnes exposées à des sources hors du milieu de travail a été évaluée à partir de l'air intérieur à l'aide du modèle d'exposition de l’environnement à plusieurs milieux, examiné ci-dessus dans cette section.
Le niveau de confiance dans la dose systémique estimée pour le D6 absorbé par l'utilisation des produits d'hygiène est faible. Toutes les valeurs estimées ont été obtenues à l'aide de modèles et de données sur les profils d'utilisation provenant d'études réalisées dans d'autres pays que le Canada. Les valeurs de l'étendue de l'utilisation du D6 dans les produits d'hygiène et de la concentration de D6 dans les produits qui sont commercialisés actuellement peuvent être plus faibles que celles utilisées pour estimer la dose systémique déclarée ci-dessus et dans l'annexe 2 (Environnement Canada, 2007; SEHSC, 2007a). Par conséquent, ces valeurs devraient surestimer l'exposition au D6 due aux produits d'hygiène.
Évaluation des effets sur la santé
L'annexe 3 présente une synthèse des données disponibles relatives aux effets sur la santé du dodécaméthylcyclohexasiloxane (D6).
Aucun organisme international n'a classé le D6 dans une catégorie ou un groupe de substances présentant des propriétés de cancérogénicité, génotoxicité ou toxicité sur le plan de la reproduction ou du développement. Une seule étude nationale concernant les effets sur la santé des cyclosiloxanes a été identifiée à ce jour. Elle émane de l'Agence de protection de l'environnement du Danemark, qui a étudié les effets sur la santé du D4 et du D5, mais pas du D6 (Lassen et al., 2005).
Aucune donnée sur la cancérogénicité du D6 n'a été trouvée. Les résultats des épreuves de mutagénicité avec Salmonella typhimurium ou Escherichia coli(NOTOX, 1990c) étaient négatifs. Aucune autre étude de génotoxicité n'a été trouvée.
En ce qui concerne la toxicité sur le plan de la reproduction, on a déterminé une dose minimale avec effet observé (DMEO) de 1 000 mg/kg p. c./j fondée sur une augmentation (non statistique) du nombre de femelles non gravides après l'accouplement au cours d'une étude à doses répétées sur la toxicité sur le plan de la reproduction et du développement.
Aucun effet sur le développement n'a été observé, quelle que soit la dose. Au cours de cette étude, on a administré à des rats mâles et femelles Sprague-Dawley (SD) des doses de 0, 100, 330 ou 1 000 mg de D6/kg p. c./j dans de l'huile de maïs par gavage oral quotidien 7 jours/semaine, pendant une période maximale de 45 jours consécutifs (Dow Corning, 2006).
Dans la partie de cette étude portant sur les doses répétées, on a déterminé une DMEO de 100 mg/kg p. c./j fondée sur une augmentation du poids du foie et des cas de lipidose périportale dans le foie des femelles, ainsi que des cas d'hypertrophie des cellules folliculaires de la thyroïde chez les rats des deux sexes (effets liés à la dose dans le cas des femelles) en cas d'administration des mêmes doses orales quotidiennes de D6 pendant 28 jours (Dow Corning, 2006). On estime que la valeur de 100 mg/kg p. c./j correspond à la concentration critique pour la toxicité des doses répétées selon cette évaluation fondée sur les effets sur le foie et la thyroïde. Il faut noter que pour le D4 (octaméthylcyclotétrasiloxane) et le D5 (décaméthylcyclopentasiloxane), le foie a également été identifié comme un organe cible pour les expositions par voie orale. L'Agence de protection de l'environnement du Danemark a déterminé que le foie était un organe cible pour les expositions au D4 et on a observé des effets sur le foie dans le cadre d'études d'exposition au D5 par voie orale et par inhalation (Lassen et al., 2005).
Seule une autre étude utilisant des doses répétées a pu être trouvée et aucun signe de toxicité systémique n'a été observé chez des rats SD exposés par gavage oral à 0 ou 1 500 mg/kg p. c./j de D6 pendant quatre semaines (Dow Corning, 1990).
Aucune étude publiée sur la toxicocinétique du D6 n'a été recensée.
Le niveau de confiance dans la base de données de toxicité (surtout pour l'exposition par voie orale) est faible car les données disponibles sur la toxicité aiguë ou à court terme, sur la toxicité pour le développement ou la reproduction ou sur la génotoxicité sont limitées. Par ailleurs, on a noté une pénurie de données sur la toxicité subchronique et chronique, ainsi que sur la cancérogénicité. De plus, on n’a trouvé aucune donnée sur les expositions par inhalation ou par voie cutanée (sauf une étude de toxicité aiguë).
Caractérisation des risques pour la santé humaine
On estime la concentration à effet critique pour la toxicité des doses répétées de D6 à 100 mg/kg p. c./j par voie orale. Cette valeur est fondée sur une augmentation des cas de lipidose périportale et sur des augmentations liées à la dose du poids du foie et de l'hypertrophie des cellules folliculaires de la thyroïde au cours d'une étude de 4 semaines chez les rats. Bien qu'aucune donnée n'ait été trouvée sur l'inhalation de doses répétées, le foie devrait également être un organe cible pour les expositions au D6 par inhalation, car on a déjà observé des effets sur le foie dus à des expositions par inhalation à du D4 et du D5, dont la structure est similaire (voir « Évaluation des effets sur la santé »).
Selon une comparaison entre la concentration à effet critique pour les doses répétées de D6 par voie orale (100 mg/kg p. c./j) et la limite supérieure estimée pour l'absorption quotidienne de D6 par la population canadienne, on obtient une marge d'exposition d'environ 40 000. Cette valeur est fondée sur l'ajustement de la contribution de l'inhalation à l'absorption quotidienne par un facteur d'absorption par inhalation de 2,0 %, ce qui donne une valeur d'exposition systémique de 2,5 µg/kg p. c. /j. Ainsi, les marges d'exposition pour les doses répétées et l'exposition de la population par les milieux naturels sont appropriées pour tenir compte des incertitudes des bases de données sur l'exposition et les effets.
On a corrigé la dose absorbée apparente de 0,09 mg/kg p. c./j pour les produits d'hygiène, qui intègre des facteurs d'absorption pour l'exposition par voies cutanée et orale et par inhalation (tableau 1 de l'annexe 2), en appliquant la réciproque du facteur d'absorption par voie orale pour calculer la dose systémique équivalente de 0,19 mg/kg p. c./j. Si on utilise cette limite supérieure estimée de 0,19 mg/kg p. c./j, la comparaison avec la concentration à effet critique pour les effets des doses répétées par voie orale (100 mg/kg p. c./j) donne une marge d'exposition d'environ 500 pour l'utilisation des produits d'hygiène. Toutefois, on considère que les estimations de l'exposition présentées ci-dessus surestiment l'exposition réelle fondée sur une évaluation probabiliste présentée et sur des renseignements indiquant que le pourcentage de produits d'hygiène commercialisés au Canada contenant du D6 pourrait être inférieur à celui utilisé pour estimer les valeurs d'exposition. D'après les valeurs dérivées d'une étude indépendante de l'évaluation probabiliste de l'exposition pour le D5, qui est considérée comme un substitut de l'évaluation probabiliste de l'exposition pour le D6, il semble que la marge d'exposition pour l'utilisation de produits d'hygiène serait au moins 10 fois plus élevée chez les adultes et 5 fois plus élevée chez les enfants que la marge indiquée ci-dessus (c'est-à-dire > 2 000). D'après les facteurs présentés ci-dessus, notamment le facteur lié à l'étendue de sa base de données, on estime que le D6 ne répond pas aux critères de l'alinéa 64c) de la LCPE (1999).
Incertitudes dans l'évaluation des risques pour la santé humaine
L'analyse complète du mécanisme d'action du dodécaméthylcyclohexasiloxane et les différences possibles entre la sensibilité des humains et celle des animaux de laboratoire aux effets de cette substance n'entrent pas dans le cadre de cette évaluation préalable.
L'estimation de l'exposition et de la dose systémique est incertaine en raison de l'utilisation de la modélisation et du manque de données canadiennes. L'utilisation de modèles et le choix des variables liées à l'utilisation de produits de consommation, notamment la quantité et la fréquence de leur utilisation, la fraction absorbée et les paramètres environnementaux sont également incertains.
La présente évaluation n'examine pas les effets des expositions cumulatives à d'autres cyclosiloxanes dans les polydiméthylsiloxanes (PDMS). Le D4 et le D5 font toutefois l'objet d'évaluations distinctes.
Selon les informations contenues dans la présente évaluation préalable, on conclut que le dodécaméthylcyclohexasiloxane (D6) ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif, sur l'environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Selon les informations disponibles sur son potentiel d'effets nocifs sur la santé humaine, on conclut que le D6 ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
On conclut donc que le D6 ne correspond pas à la définition de « substance toxique » au sens de l'alinéa 64a) de la LCPE (1999). De plus, le D6 ne répond pas aux critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
La conclusion de cette évaluation préalable est basée sur les informations disponibles à l'heure actuelle et tient compte du fait que des incertitudes sont liées à cette évaluation. Des recherches sur les cVMS sont actuellement menées pour surmonter ces incertitudes, mais certaines de ces recherches ne sont pas encore terminées. Dans le cadre du Défi, toute nouvelle information fournie après l'évaluation préalable finale peut être prise en compte lors de l’étape de la gestion des risques.
La surveillance a également été établie comme un élément essentiel du Plan de gestion des produits chimiques au Canada, et la possibilité que le D6 fasse l’objet d’une surveillance environnementale dans le cadre de ce plan est actuellement envisagée. On considère que les données de concentration in situ contribueront à faire mieux comprendre la distribution du D6 dans l'environnement et son potentiel de bioaccumulation dans les réseaux trophiques appropriés.
Allen, R.B., Kochs, P., Chandra, G. 1997. Industrial organic materials, their environmental entry and predicted fate. In : Organosilicon Materials, Hutzinger, O. (éd.), Handbook of Environmental Chemistry. Berlin : Springer-Verlag. P. 1-25.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note réglementaire REG 2007-04 : Liste des produits de formulation de l'ARLA [Internet]. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consulté en septembre 2008].
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci 22(3):337-345.
Arnot, J.A., Gobas, F.A.P.C. 2006. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms. Environ Rev14(4):257-297.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341-351.
Arnot, J.A., MacKay, D., Parkerton, T., Bonnell, M. 2008b. A database of fish biotransformation rate constants. Environ. Sci. Technol. (sous presse).
Atkinson, R. 1991. Kinetics of the gas-phase reactions of a series of organosilicon compounds with OH and NO3 radicals and O3 at 297 ± 2 K. Environ. Sci. Technol. 25(5):863-866.
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing Long-Range Transport Potential of Persistent Organic Pollutants. Environ. Sci. Technol.34(4):699-703.
Bidleman, T.F. 2008. Review of the Dow-Corning Health & Environmental Sciences Technical Reports: "Hydrolysis of Octamethylcyclopentasiloxane (D4)" and "Hydrolysis of Decamethylcyclopentasiloxane (D5)". Centre des recherches atmosphériques (Egbert, Ont.). Direction générale des sciences et de la technologie, Environnement Canada.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. Exposure Assessment Tools and Models.
Bruggeman, W.A., Weber-Fung, D., Opperhuizen, A., Van Der Steen, J., Wijbenga, A., Hutzinger, O. 1984. Absorption and retention of polydimethylsiloxanes (silicones) in fish: preliminary experiments. Toxicol. Environ. Chem. 7:287-296.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, chap. 33. Gazette du Canada, Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107, Gazette du Canada, Partie II, vol. 134, n° 7.
Canada, Ministère de l'Environnement, ministère de la Santé. 2006.Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures de gestion et d'évaluation des risques que certaines substances présentent pour la santé des Canadiens et leur environnement, Gazette du Canada, Partie I, vol. 140, n° 49.
Canada, Ministère de l'Environnement, ministère de la Santé. 2007. Loi canadienne sur la protection de l'environnement (1999) : Avis de deuxième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 141, n° 19.
CATABOL [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatorov University, Laboratory of Mathematical Chemistry. [consulté le 4 février 2008]. OASIS Software.
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
Domoradzki, J. 2008a. Refinement in the determination of the BMF value for D4 from a fish feeding study in rainbow trout. Midland (MI) : Dow Corning Corporation, Health and Environmental Sciences.
Domoradzki, J. 2008b. Refinement in the determination of the BMF value for D5 from a fish feeding study in rainbow trout. Midland (MI) : Dow Corning Corporation, Health and Environmental Sciences.
Dow Corning Corporation. 1985. Bioconcentration of dodecamethylcyclohexasiloxane (D6) in Daphnia magna. Dow Corning, Report No. 1985-I0008-1442.
Dow Corning. 1990. A 28-day subchronic oral gavage feasibility study of various low molecular weight silicone oligomers in rats. Report No. 1990-I0000-35105. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodécaméthylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007]. (D5), n° CAS 541-02-6. 13 novembre 2007].
Dow Corning. 2004. Disposition of 14C-dodecamethylcyclohexasiloxane (D6) following single, oral administration to Fischer 344 rats. Report No. 2004-I0000-53503. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodécaméthylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
Dow Corning. 2006. Combined repeated dose toxicity study with the reproductive/developmental toxicity screening test for dodecamethylcyclohexasiloxane (D6) in rats. Report No. 2006-I0000-56154. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
Drottar, K.R. 2005. 14C- Dodecamethylcyclohexasiloxane (14C-D6): Bioconcentration in the fathead minnow (Pimephales promelas) under flow-through test conditions. Dow Corning Corporation. Silicones Environment, Health and Safety Council. Study No. 9882-102.
Drottar, K. 2006. 14C-Octamethylcyclotetrasiloxane (14C-D4): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Dow Corning Report No. 2007-I0000-57314.
Drottar, K. 2007. 14C-Decamethylcyclopentasiloxane (14C-D5): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Dow Corning Report No. 2007-I0000-57314.
Durham, J., Kozerski, G. 2005. Hydrolysis of octamethylcyclotetrasiloxane (D4). Silicones Environment, Health and Safety Council. Study No. 10000-102.
Durham, J. 2006. Hydrolysis of octamethylcyclotetrasiloxane (D5). Silicones Environment, Health and Safety Council. Study No. 10040-102.
[ECB] Bureau européen des substances chimiques. 2007.
[ESIS] European Chemical Substances Information System, Version 4.60. [consulté en décembre 2007].
[ECOSAR] Ecological Structural Activity Relationships [Internet]. [2004] Version 0.99g. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models
Environnement Canada. 1988. Données relatives à la Liste intérieure des substances
(LIS) 1984-1986, recueillies en vertu du par. 25(1) de la LCPE (1988) et conformément à la Liste intérieure des substances : Guide du déclarant, 1988. Données préparées par : Environnement Canada.
Environnement Canada. 2007. Données sur les substances du lot 2 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances du groupe 2 du Défi. Données préparées par Environnement Canada, Programme des substances existantes.
Environnement Canada. 2008a. Assumptions, limitations and uncertainties of the mass flow tool for dodecamethylcyclohexasiloxane, CAS RN 540-97-6 Ébauche de document interne. Gatineau (Qc) : Environment Canada, Division des substances existantes. Disponible sur demande.
Environnement Canada. 2008b. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series, technical guidance module: Overview of Aquatic Risk Distribution Methodology. Document de travail. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environnement Canada. 2008c. Aquatic risk distribution summary for dodecamethylcyclohexasiloxane, CAS RN 540-97-6. 2008-09-09. Document non publié. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.): Université Trent, The Canadian Centre for Environmental Modelling and Chemistry - EQC Model.
Fackler, P.H., Dionne, E., Hartley, D.A., Hamelink, J.L. 1995. Bioconcentration by fish of a highly volatile silicone compound in a totally enclosed aquatic exposure system. Environ. Toxicol. Chem. 14(10):1649-1656.
Fenner, K., Scheringer, M., MacLeod, M., Matthies, M., McKone, T.E., Stroebe, M., Beyer, A., Bonnell, M., Le Gall, A., Klasmeier, J., et al. 2005. Comparing estimates of persistence and long-range transport potential among multimedia models. Environ. Sci. Technol. 39(7):1932-1942.
Flaningam, O.L. 1986. Vapor pressure of poly (dimethylsiloxane) oligomers. J Chem Eng Data 31(3):266-272.
[GEMStat] Global Water Quality Data and Statistics [base de données sur Internet]. 2008. Burlington (Ont.) : Organisation des Nations Unies, Programme de l'eau du Système mondial de surveillance continue de l'environnement (GEMS). [consulté en septembre 2008].
Gobas, F.A.P.C., Kelly, B.C., Arnot, J.A. 2003. Quantitative structure activity relationship for predicting the bioaccumulation of POPs in terrestrial food-webs. QSAR Comb Sci 22(3):329-335.
Han, X., Nabb, D.L., Mingoia, R.T., Yang, C.-H. 2007. Determination of xenobiotic intrinsic clearance in freshly isolated hepatocytes from rainbow trout (Oncorhynchus mykiss) and rat and its application in bioaccumulation assessment. Environ. Sci. Technol. 41: 3269-3276.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2000. Version 3.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Hu, T.-M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci 3(4), article 29. [consulté en obtobre 2008].
Hurd, C.B. 1946. Studies on siloxanes: 1. The specific volume and viscosity in relation to temperature and constitution. J. Am. Chem. Soc. 68(3):364.
Jovanovic, M.L., McMahaon, J.M., McNett, D.A., Tobin, J.M., Plotzke, K.P. 2008. In vitro and in vivopercutaneous absorption of 14C-octamethylcyclotetrasiloxane (14C-D4) and 14C-decamethylcyclopentasiloxane (14C-D5). Regul. Toxicol. Pharmacol. 50(2):239-248.
Kaj, L., Andersson, J., Palm Cousins, A., Remberger, M., Ekheden, Y., Dusan, B. Bror-ström-Lundén, E. 2005. Results from the Swedish National Screening Programme 2004: Subreport 4: Siloxanes. IVL.
Kent, D.J., McNamara, P.C., Putt, A.E., Hobson, J.F., Silberhorn, E.M. 1994. Octamethylcyclotetrasiloxane in aquatic sediments: toxicity and risk assessment. Ecotox. Environ. Saf. 29(3):372-389.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, A.C., McKone, T.E., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Environ. Sci. Technol. 40(1):53-60.
Kochetkov, A., Smith, J.S., Ravikrishna, R., Valsaraj, K.T., Thibodeaux, L.J. 2001. Air-water partition constants for volatile methyl siloxanes. Environ. Toxicol. Chem. 20(10):2184-2188.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Kozerski, G. 2007. Determination of the 1-octanol/water partition coefficient of decamethylcyclopentasiloxane (D5) by the slow-stirring method using gas chromatography and mass spectrometry. Silicones Environmental, Health, and Safety Council (SEHSC).
Kozerski, G. Shawl, H. 2007. Determination of the 1-octanol/water partition coefficient of octamethylcyclotetrasiloxane (D4) by the slow-stirring method using gas chromatography and mass spectrometry. Silicones Environmental, Health, and Safety Council (SEHSC). Dow Corning Study No. 10198-102.
Kozerski, G. 2008. SEHSC response to Dr. Bidleman's review on hydrolysis studies of D4 and D5. Dow Corning Corporation. Juillet 2008.
Krueger, H., Thomas, S., Kendall, T. 2007. D5: a prolonged sediment toxicity test with Lumbriculus variegatus using spiked sediment. Wildlife International, LTD. Project No. 583A-108. Centre européen des silicones (CES).
Krueger, H.O., Thomas, S.T., Kendall, T.Z. 2008. D5: a prolonged sediment toxicity test with Chironomus riparius using spiked sediment. Wildlife International, LTD. Project No. 583A-108. Silicones Environmental, Health, and Safety Council (SEHSC).
Lassen, C., Hansen, C.L., Mikkelson, S.J., Maag, J. 2005. Siloxanes – consumption, toxicity and alternatives. Danish Ministry of the Environment, Environmental Protection Agency (Danish EPA). Environmental Project No. 1031.
Lucas, S.V. 1984. GC/MS analysis of organics in drinking water concentrates and advanced waste treatment concentrates. Vol. 1. Analysis results for 17 drinking water and 16 advanced waste treatment and 3 process blank concentrate. EPA-600/1-84-020A. (NTIS P85-128221). Columbus (OH) : Columbus Labs, Health Effects Research Laboratory. P. 45, 46, 147 et 150.
Maxim, L.D. 1998. D4, D5, and D6 Exposure in the manufacture and use of personal care products: an interim assessment. Dow Corning Corporation.
Miller, J. 2006. Determination of n-octanol/water partition coefficient of 14C-dodecamethylcyclohexasiloxane (14C-D6) by Liquid Scintillation Counting. Silicones Environmental, Health and Safety Council. Report No. 9890-102.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models
Navea, J.G., Stanier, C.O., Young, M.A., Grassian, V.H. 2007. A laboratory and modeling study at the University of Iowa designed to better understand the atmospheric fate of D4 and D5. Rapport technique annuel (août 2006-juillet 2007). Iowa City (IA) : University of Iowa, Department of Chemistry, and Chemical and Biochemical Engineering.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Columbus (OH) : American Chemical Society. [consulté le 11 octobre 2006]. National Chemical Inventories (NCI) on CD.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26(6):1304-1319.
[NILU] Norsk institutt for luftforskning. 2007. Siloxanes in the Environment of the Inner Oslofjord. Report No. 986/2007. Kjeller (Norvège) : Norwegian Institute for Air Research.
[NMI] Non-Medicinal Ingredients [base de données exclusive]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
[NOAA] National Oceanic and Atmospheric Administration. 2008. NOAA CoastWatch Great Lakes Program. NOAA Great Lakes Environmental Research Laboratory. [consulté en septembre 2008].
Norden. 2005. Siloxanes in the Nordic Environment. TemaNord 2005:593. Copenhague (Danemark) : Conseil des ministres des pays nordiques.
NOTOX. 1990a. Assessment of acute oral toxicity with dodecamethylcyclohexasiloxane in the rat (acute toxic class method). NOTOX, Project 262575. [cité dans SEHSC (Silicones Environmental Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
NOTOX. 1990b. Assessment of acute dermal toxicity with dodecamethylcyclohexasiloxane in the rat. NOTOX, Project 262586. [cité dans SEHSC (Silicones Environmental Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
NOTOX. 1990c. Evaluation of the mutagenic activity of dodecamethylcyclohexasiloxane in the Salmonella Typhimurium reverse mutation assay and the Escherichia Coli reverser mutation assay (with independent repeat). NOTOX, Project 262621. [cité dans SEHSC (Silicones Environmental Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
[NYIEQ] New York Indoor Environmental Quality Center. 2005. Indoor Environmental Quality: Assessing and Mitigating the Impact of Exposure to Multiple Indoor Contaminants. Project No. R828605-01.
[OCDE] Organisation de coopération et de développement économiques. 2004. Emission Scenario Document on Plastics Additives [Internet]. Paris (France) : Direction de l’environnement de l’OCDE, Division de l’hygiène et de la sécurité de l’environnement. [consulté en septembre 2004].
[OCDE] Organisation de coopération et de développement économiques 2006. Draft Emission Scenario Document on Transport and Storage of Chemicals. Préparé par l'Environment Agency (Royaume-Uni). Disponible sur demande auprès de : Environnement Canada, Division des substances existantes, Ottawa, K1A 0H3.
[OCDE] Organisation de coopération et de développement économiques 2007. Manual for investigation of HPV chemicals. OCDE Secretariat, July 2007. [consulté en janvier 2008].
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]. 2000. Version 1.66. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. [consulté en mars 2006].
Powell, D., Kozerski, G. 2007. Cyclic methylsiloxane (cVMS) materials in surface sediments and cores for Lake Ontario. Centre européen des silicones (CES). Rapport préliminaire.
Powell, D.E. 2008. Interim update on cyclic methylsiloxane (cVMS) materials in surface sediment, cores, and zooplankton for Lake Opeongo, Ontario, Canada. Centre européen des silicones (CES). 14 juillet 2008.
Ren, X., Harder, H., Martinez, M., Lesher, R.L., Oliger, A., Shirley, T., Adams, J., Simpas, J.B., Brune, W.H. 2003. HOx concentrations and OH reactivity observations in New York City during PMTACS-NY2001. Atmos. Environ. 37(26):3627-3637.
Ren, X., Brune, W.H., Mao, J., Mitchell, M.J., Lesher, R.L., Simpas, J.B., Metcalf, A.R., Schwab, J.J., Cai, C., Li, Y., et al. 2006. Behaviour of OH and HO2 in the winter atmosphere in New York City. Atmos. Environ. 40:S252-S263.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo 4.1) Model [Internet]. Version 4.1. Pays-Bas : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Document non publié. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu. Disponible sur demande.
[SBSC] Santé et Bien-être social Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : Santé et Bien-être social Canada. [cité dans Santé Canada, 1998].
Scheringer, M., MacLeod, M., Wegmann, F. 2006. The OECD POV and LRTP Screening Tool [Internet - Downloads]. Version 2.0. Distribué lors de l’atelier OCDE-PNUE sur l’utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada), du 31 mai au 3 juin 2006. [consulté en février 2008].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
[SEHSC] Silicones Environmental, Health and Safety Council. 2005. IUCLID Dataset for CAS No. 541-05-9. Submitted by Silicones Environmental, Health and Safety Council, septembre 2005.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007a. Communication du SEHSC à Environnement Canada et Santé Canada sur le n° CAS 69430-24-6, 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007b. Présentations du SEHSC à Environnement Canada et Santé Canada le 2 octobre 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), CAS No. 540-97-6. 13 novembre 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007d. Dodecamethylcyclohexasiloxane (D6), CAS No. 540-97-6. Présentation finale à la LIS. Silicones Environmental, Health and Safety Council, 12 novembre 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2008a. Exposure assessment for D6 – Canada. 2 avril 2008.
[SEHSC] Silicones Environmental, Health and Safety Council. 2008b. Silicone industry comments on Health and Environment Canada's Draft Screening Assessment of D6: Special pattern of cVMS environmental release and its effects on their half-lives in the atmosphere. 16 juillet 2008.
Sousa, J.V., McNamara, P.C., Putt, A.E., Machado, M.W., Surprenant, D.C., Hamelink, J.L., Kent, D.J., Silberhorn, E.M., Hobson, J.F. 1995. Effects of octamethylcyclotetrasiloxane (OMCTS) on freshwater and marine organisms. Environ. Toxicol. Chem. 14(10):1639-1647.
Springborn Smithers Laboratories. 2003. Decamethylcyclopentasiloxane (D5) – the full life-cycle toxicity to midge (Chironomous riparius) under static conditions. Silicones Environmental, Health and Safety Council. Report No. 12023.6140.
Springborn Smithers Laboratories. 2005. Determining the biodegradability of dodecamethylcyclohexasiloxane based on the draft OECD 310 Sealed Vessel CO2 Evolution Biodegradation Test. Silicones Environmental, Health and Safety Council. Study No. 12023.6147.
Springborn Smithers Laboratories. 2006. Dodecamethylcyclohexasiloxane (D6): full life-cycle toxicity test with water fleas, Daphnia magna, under static renewal conditions. Silicones Environmental, Health and Safety Council. Étude no 1203-6149.
[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (Ontario): Université Trent, The Canadian Centre for Environmental Modelling and Chemistry - TaPL3.
Tobin, J.M., McNett, D.A., Durham, J.A., Plotzke, K.P. 2008. Disposition of decamethylcyclopentasiloxane in Fischer 344 rats following single or repeated inhalation exposure to 14C-decamethylcyclopentasiloxane (14C-D5). Inhal Toxicol 20:513-531.
[U.S. EPA] United States Environmental Protection Agency. 1992. Thirtieth report of the Interagency Agency Testing committee to the Administrator, receipt of report and request for comments regarding Priority Testing List of chemicals. 9 juillet 1992. Federal Register. 57(132):30603-30618.
[U.S. EPA] United States Environmental Protection Agency. 1994a. Air quality: revision to definition of volatile organic compounds–exclusion of volatile methyl siloxanes and parachlorobenzotrifluoride. [consulté en février 2008].
[U.S. EPA] United States Environmental Protection Agency. 1994b. Acute toxicity study of KF-996S (dodecamethylcyclohexasiloxane) in rats with cover letter dated 04/08/94. EPA/OTS; Doc. No. 86940001751.
[U.S. EPA] United States Environmental Protection Agency. 2007. High Production Volume (HPV) Challenge Program: Sponsored Chemicals, septembre 2007. [consulté en février 2008].
Varaprath, S., Frye, C.L., Hamelink, J. 1996. Aqueous solubility of permethylsiloxanes (silicones), Short Communication. Environ. Toxicol. Chem. 15(8):1263-1265.
Wania, F. 2003. Assessing the potential of persistent organic chemicals for long-range transport and accumulation in polar regions. Environ. Sci. Technol. 37(7):1344-1351.
Wania, F. 2006. Potential of degradable organic chemicals for absolute and relative enrichment in the Arctic. Environ. Sci. Technol. 40(2):569-577.
Will, R., Löchner, U., Masahiro, Y. 2007. CEH Marketing Research Report Siloxanes. Menlo Park (CA) : SRI Consulting.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models
Xu, S., Lehmann, R.G., Miller, J.R., Chandra, G. 1998. Degradation of polydimethylsiloxanes (silicones) as influenced by clay minerals Environ. Sci. Technol. 32(9):1199-1206.
Xu, S. 1999. Fate of cyclic methylsiloxanes in soils. 1. The degradation pathway. Environ. Sci. Technol. 33(4):603-608.
Xu, S., Chandra, G. 1999. Fate of cyclic methylsiloxanes in soils 2. Rates of degradation and volatilization. Environmental Science and Technology 33(22):4034-4039.
Xu, S. 2006. 1-Octanol/air partitioning coefficients of octamethylcyclotetrasiloxane (D4), decamethylcyclopentasiloxane (D5) and dodecamethylcyclohexasiloxane (D6) at different temperatures. Centre européen des silicones (CES). Rapport CES, 27 décembre 2006.
Xu, S. 2007. Long range transport potential of cyclic methylsiloxanes estimated using a global average chemical fate model: the OECD Tool. Silicones Environmental, Health and Safety Council (SEHSC). Rapport préliminaire.
Xu, S., Kropscott, G. 2007. Simultaneous determination of partition coefficients for octamethylcyclotetrasiloxane and decamethylcyclopentasiloxane. Rapport préliminaire. Dow Corning, rapport technique non réglementé. DCC Study No. 10336-101.
Xu, S., Miller, J.A. 2008. Aerobic transformation of octamethylcyclotetrasiloxane (D4) in water/sediment system. Centre européen des silicones (CES). Rapport intermédiaire.
Zareba, G., Gelein, R., Morrow, P.E., Utell, M.J. 2002. Percutaneous absorption studies of octamethylcyclotetrasiloxane using the human skin /nude mouse model. Skin Pharmacol. Appl. Skin Physiol. 15(3):184-194.
Annexes de l'évaluation préalable
- Annexe 1 : Limites supérieures estimées de l'absorption quotidienne de D6 pour la population canadienne (µg/kg p. c./j pour divers groupes d'âge)
- Annexe 2 : Modélisation de l'exposition des consommateurs
- Annexe 3 : Récapitulatif des informations concernant les effets du dodécaméthylcyclohexasiloxane (D6) sur la santé
- Annexe 4 : Étude de l'évaluation probabiliste de l'exposition au D5
- Annexe 5 : Paramètres d'entrée de la modélisation dans divers milieux applicable au D6 aux dins de l'évaluation écologique préalable
Note de bas de page
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
le dodécaméthylcyclohexasiloxane
(D6)
Numéro de registre du Chemical Abstracts Service
540-97-6
Environnement Canada
Santé Canada
Novembre 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexes
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du dodécaméthylcyclohexasiloxane (D6), dont le numéro de registre du Chemical Abstracts Service est 540-97-6. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi lancé par les ministres, car il a été prouvé qu’elle répondait aux critères de la catégorisation écologique relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque (PBiT) pour les organismes non humains et car elle est commercialisée au Canada.
Bien que le processus de catégorisation n’ait pas déterminé que l’évaluation des risques du D6 pour la santé humaine devait être prioritaire, une évaluation de cette substance en fonction de la santé humaine a été effectuée en raison de la similarité de sa structure et de son profil d’utilisation par rapport à ceux de l’octaméthylcyclotétrasiloxane, qui est également connu sous le nom de D4, une substance dont l’évaluation fait l’objet d’une priorité élevée à cause des risques qu’elle présente tant pour la santé humaine que pour l’environnement conformément à la LCPE (1999).
Le D6 est un produit chimique industriel qui n’était fabriqué par aucune société au Canada en 2006 en quantité supérieure au seuil de déclaration de 100 kg, mais qui y est importé dans des mélanges avec d’autres siloxanes cycliques et comme substance résiduelle dans les polymères de silicone et dans des produits de consommation finis. Les réponses reçues à un avis publié en application de l’article 71 de la LCPE (1999) ont permis de déterminer qu’entre 100 000 et 1 000 000 kg de D6 avaient été importés au Canada en 2006.
Le D6 est susceptible d’être rejeté dans l’environnement lors de processus industriels utilisés dans le cadre d’opérations de mélange, de formulation et de conditionnement, et lors d’opérations de prévention de la mousse et de dégraissage. Il peut également être rejeté à la suite de l’utilisation et de l’élimination de produits d’hygiène. L’air, les eaux usées et les terres agricoles constituent les milieux naturels cibles du D6 à cause de ses propriétés physiques et chimiques et de ses profils d’utilisation.
Le D6 est persistant dans l’air avec des demi-vies atmosphériques calculées de plus de 2 jours. Le D6 pourrait être transporté sur de grandes distances dans l'atmosphère. Toutefois, il risque peu de se déposer dans l'eau ou dans le sol en régions éloignées. On suppose que la demi-vie d’hydrolyse du D6 est supérieure à celle du D4 et du D5, dont la structure est similaire. Une demi-vie d’environ 401 jours a été déterminée par extrapolation pour le D6 en fonction des demi-vies d’hydrolyse (valeurs expérimentales) du D4 et du D5 à pH neutre et température ambiante. On considère que le D6 est persistant dans les conditions typiques des eaux canadiennes. Dans les sédiments, on suppose que la demi-vie du D6 va au-delà de 49 à 588 jours dans des conditions sédimentaires canadiennes réalistes (température comprise entre 5 et 25 °C), ce qui indique que le D6 peut être persistant dans les sédiments. Le D6 ne semble pas être persistant dans le sol selon la dégradation catalysée par l’argile, le diméthylsilanediol correspondant au produit stable de l’hydrolyse. On arrive donc à la conclusion que le D6 répond aux critères de persistance tels que définis dans le Règlement sur la persistance et la bioaccumulation.
La valeur empirique du facteur de bioconcentration empirique est inférieur à 2000, ce qui concorde avec la biodisponibilité réduite de la substance due à sa valeur de log Koeélevée. Les valeurs croisées du facteur de bioamplification du D4 et du D5 déterminées en laboratoire indiquent qu’il n’y a pas de phénomène de bioamplification du D6 dans les poissons d’essai par absorption alimentaire. Bien que le facteur de bioaccumulation modélisé supérieur à 5 000 suggère un potentiel de bioaccumulation élevé, le facteur de bioaccumulation prévu ne peut pas à lui seul suffire à conclure que le potentiel de bioaccumulation du D6 est élevé en raison du haut degré d’incertitude entourant cette prévision. Ainsi, bien qu’on ait établi que le D6 présente un potentiel de bioaccumulation dans le biote, on peut conclure, des données empiriques sur le facteur de bioconcentration et des données sur le D4 et le D5, que le D6 ne répond pas aux critères de bioaccumulation tels que défini dans le Règlement sur la persistance et la bioaccumulation.
Des renseignements sur la toxicité du D6 ne sont pas disponibles pour les organismes vivant dans les sédiments; des données de type « référence croisée » conservatrices du D5 ont été utilisées et il est conclu que la concentration sans effet de D6 sur la communauté benthique est supérieure à 69 mg/kg. Les données de toxicité expérimentale n’ont montré aucun effet nocif chez les organismes aquatiques pélagiques à des concentrations allant jusqu’à 0,0046 mg/L (limite de solubilité approximative dans l’eau). Toutefois, la biodisponibilité réduite du D6 en comparaison de celle de ses analogues étroitement apparentés (le D4 et le D5) tend à indiquer que le D6 ne devrait présenter aucun seuil de toxicité à sa limite de solubilité dans l’eau, et ce, en ce qui concerne les effets nocifs. Compte tenu de la faible biodisponibilité du D6 et de sa faible capacité à causer des effets, on conclut que le D6 présente un faible potentiel d’effets nocifs sur l’environnement.
En ce qui concerne la santé humaine, le foie a été identifié comme organe cible des expositions par voie orale et par inhalation au D6. La concentration à effet critique pour la toxicité des doses répétées est fondée sur une augmentation du poids du foie, des cas de lipidose périportale et des cas d’hypertrophie des cellules folliculaires de la thyroïde au cours d’une étude de 4 semaines chez les rats. La comparaison entre la concentration à effet critique pour les doses répétées par voie orale et la limite supérieure estimée pour l’absorption quotidienne de D6 par la population canadienne donne une marge d’exposition suffisante. Selon une étude indépendante sur l’évaluation précise de l’exposition concernant les produits d’hygiène, on a pu déterminer une marge d’exposition appropriée en comparant la concentration à effet critique des effets des doses répétées par voie orale et la limite supérieure prudente estimée pour l’absorption quotidienne de D6 due à l’utilisation de produits d’hygiène
D’après les informations disponibles sur sa capacité à causer des effets nocifs sur l’environnement, on peut conclure que le D6 ne pénètre pas dans l’environnement en une quantité ou une concentration, ou dans des conditions de nature à avoir, immédiatement ou à long terme , un effet nocif, sur l’environnement ou sur la diversité biologique ou , ou à mettre en danger l’environnement essentiel pour la vie.
Selon les informations disponibles sur son potentiel d’effets nocifs sur la santé humaine, on peut conclure que le D6 ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger pour la vie ou la santé humaines au Canada.
Cette substance s’inscrira dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles définies à l’étape de la gestion des risques.
D'après les renseignements disponibles, le D6 ne remplit aucun des critères de l’article 64 de la LCPE (1999).
La Loi canadienne sur la protection de l'environnement(1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l'Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine. Selon les résultats de cette évaluation, les ministres peuvent proposer de ne rien faire à l'égard de la substance, de l'inscrire sur la Liste des substances d'intérêt prioritaire en vue d'une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l'annexe 1 de la Loi et, s'il y a lieu, sa quasi-élimination.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque (Ti) pour les organismes aquatiques, et que l'on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu du classement attribué par d'autres organismes nationaux ou internationaux quant à la cancérogénicité, la génotoxicité ou la toxicité sur le plan du développement ou de la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
L'évaluation des risques que comporte le dodécaméthylcyclohexasiloxane (aussi connu sous le nom de D6) pour l'environnement a été jugée hautement prioritaire car cette substance est persistante, bioaccumulable et intrinsèquement toxique pour les organismes aquatiques et l’on croit qu'elle est commercialisée au Canada. Le volet du Défi portant sur le D6 a été lancé le 12 mai 2007 au moyen d’un avis paru dans la Gazette du Canada (Canada, 2007). En même temps a été publié le profil de cette substance, qui présentait l’information technique et écologique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Grâce à ce Défi, plus de 100 présentations de données relatives à cette substance ont été reçues concernant ses propriétés physiques et chimiques, son potentiel de bioaccumulatiion, sa persistance, son écotoxicologie et les quantités disponibles dans le commerce entre autres.
Bien que le processus de catégorisation n'ait pas permis de déterminer que l'évaluation des risques du D6 pour la santé humaine devait faire l’objet d’une priorité, une évaluation de cette substance en fonction de la santé humaine a été recommandée en raison de la similarité de sa structure et de son profil d'utilisation par rapport à ceux du D4, connu également sous le nom d'octaméthylcyclotétrasiloxane, une substance dont l'évaluation des risques tant pour la santé humaine que pour l'environnement a été jugée hautement prioritaire conformément à la LCPE (1999) et du fait de son utilisation accrue comme solution de rechange au D4. Par conséquent, la présente évaluation porte principalement sur les informations pertinentes pour l’évaluation des risques touchant l'environnement et la santé humaine.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l'accent sur les renseignements essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques énoncés à l'article 64 de la Loi :
« 64. [...] est toxique toute substance qui pénètre ou peut pénétrer dans l'environnement en une quantité ou concentration ou dans des conditions de nature à :
a) avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique;
b) mettre en danger l'environnement essentiel pour la vie;
c) constituer un danger au Canada pour la vie ou la santé humaines. »
Les évaluations préalables visent à examiner des renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris ceux fournis dans le cadre du Défi. Les données liées à l'évaluation préalable de cette substance proviennent de documents originaux, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et de recherches documentaires récentes (jusqu'en août 2008) ayant servi de base aux sections du présent document qui portent sur la santé humaine et l'environnement. Les études importantes ont fait l'objet d'une évaluation critique. Les résultats de la modélisation ont pu être utilisés dans la formulation de conclusions. Les renseignements présentés dans des évaluations des dangers réalisées par d'autres instances ont été pris en considération lorsqu'ils étaient disponibles et pertinents. L'évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Elle fait plutôt état des études et des éléments d’information les plus importants en rapport avec la conclusion.
L'évaluation des risques pour la santé humaine tient compte des données qui ont trait à l'estimation de l'exposition (non professionnelle) de la population dans son ensemble et des informations relatives aux dangers pour la santé (fondées essentiellement sur des évaluations réalisées par d'autres organismes selon la méthode du poids de la preuve et ayant servi à établir le caractère prioritaire de la substance). Les décisions reposent sur la nature de l'effet critique retenu ou sur l’écart (ou marge) entre les valeurs prudentes donnant lieu à des effets et les estimations de l'exposition. Elles tiennent compte de la confiance accordée à l'exhaustivité des bases de données identifiées qui portent sur l'exposition et les effets dans le contexte d'une évaluation préalable. L'évaluation préalable n'est pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'une synthèse des informations les plus importantes permettant d'appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel des programmes des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes de ces ministères. Cette évaluation préalable a fait l'objet d'une consultation et d'un examen externe par des pairs. Des commentaires sur les parties techniques relatives à la santé humaine ont été fournis par le Toxicology Excellence for Risk Assessment (TERA). Bien que les commentaires externes aient été pris en compte, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable. Par ailleurs, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires du public de 60 jours. Les principales données et considérations sur lesquelles repose la présente évaluation sont résumés ci-après.
Aux fins du présent document, le dodécaméthylcyclohexasiloxane est désigné par le sigle D6, un nom abrégé dérivé de la nomenclature des siloxanes élaborée par General Electric (Hurd, 1946).
Le D6 appartient au groupe des composés cycliques volatils de type méthylsiloxane (cVMS) à poids moléculaire relativement faible (inférieur à 600) et à pression de vapeur élevée. Ces cVMS sont des liquides à base de silicone volatile à faible viscosité, constitués d'unités structurelles [-Si(CH3)2O]x à configuration cyclique. Le D6 comporte six de ces unités structurelles, comme la structure chimique ci-dessous (tableau 1).
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 540-97-6 |
|---|---|
| Nom dans la Liste intérieure des substances (LIS) | Dodécaméthylcyclohexasiloxane - |
| [1] National Chemical Inventories (NCI), 2006 : AICS (inventaire des substances chimiques de l'Australie); ASIA-PAC (listes des substances de l'Asie-Pacifique; ECL (liste des substances chimiques existantes de la Corée); EINECS (Inventaire européen des substances chimiques commerciales existantes); PICCS (inventaire des produits et substances chimiques des Philippines); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande) ; TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). | |
| Noms dans les National Chemical Inventories (NCI)[1] | Cyclohexasiloxane, 2,2,4,4,6,6,8,8,10,10,12,12-dodecamethyl- (TSCA) Cyclohexasiloxane, dodecamethyl- (AICS, PICCS, ASIA-PAC, NZIoC) Dodécaméthylcyclohexasiloxane (EINECS) Dodecamethylcyclohexasiloxane (ECL) |
| Autres noms | D6; Dodecamethylhexacyclosiloxane; Cyclic hexamer : D6; 2,4,6,8,10,12-Dodecamethylcyclohexasiloxane |
| Principale classe chimique ou utilisation | Composés organosiliciés |
| Principale sous-classe chimique | Méthylsiloxanes cycliques volatils (cVMS) |
| Formule chimique | C12H36O6Si6 |
| Structure chimique | 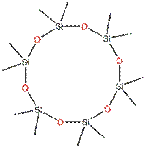 |
| Simplified Molecular Input Entry (SMILES) | C[Si]1(O[Si](O[Si](O[Si](O[Si](C)(C)O[Si](O1)(C)C)(C)C)(C)C)(C)C)C |
| Masse moléculaire | 444,93 g/mole |
Le D6 est également référencé sous un autre numéro de registre du Chemical Abstracts Service. Ce numéro, n° CAS 69430-24-6, désigne un mélange de cyclosiloxanes substitués par des groupes diméthyl, de structure générale [-Si(CH3)2O-]x, à configuration cyclique, où x est habituellement inférieur à 8 et plus souvent compris entre 3 et 7 (SEHSC, 2007a). Ce n° CAS est associé aux noms suivants : cyclopolydiméthylsiloxane, cyclopolydiméthylsiloxane (DX), diméthylcyclosiloxanes, diméthylcyclopolysiloxane, composés polydiméthylsiloxy cycliques, polydiméthylcyclosiloxane, cyclométhicone et mélanges de cyclosiloxanes. Dans ce rapport, on privilégiera le terme cyclométhicone couramment utilisé pour ce mélange en cosmétologie.
Pour cette évaluation, les données recueillies pour le D4 et le D5 ont également été utilisées étant donné la similarité structurelle des substances, telle qu'elle est illustrée dans le tableau suivant :
| D4 | D5 | D6 |
|---|---|---|
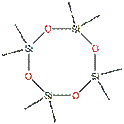 |
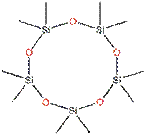 |
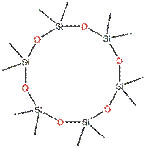 |
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et modélisées) du D6 qui se rapportent à son devenir dans l'environnement.
| Propriété | Type | Valeur[1] | Température (°C) | Références |
|---|---|---|---|---|
| [1] Les valeurs et unités entre parenthèses représentent celles qui ont été initialement déclarées par les auteurs ou estimées au moyen des modèles. [*] Valeurs utilisées pour la modélisation aux fins de cette évaluation préalable. |
||||
| Point de fusion (ºC) |
Expérimental | -3[*] | PhysProp, 2006 | |
| Modélisé | -8,69 | MPBPWIN, 2000 | ||
| Point d'ébullition (ºC) |
Expérimental | 245[*] | PhysProp, 2006 | |
| Modélisé | 226,77 | MPBPWIN, 2000 | ||
| Masse volumique (kg/m3) |
Expérimental | 963 | 25 | SEHSC, 2005 |
| Pression de vapeur (Pa) |
Expérimental | 4,6[*] (0,0345 mm Hg) |
25 | SEHSC, 2005 |
| 4 (0,03 mm Hg) |
25 | Flaningam, 1986 | ||
| Modélisé | 4,73 (0,0355 mm Hg) |
25 | MPBPWIN, 2000 | |
| Constante de la loi de Henry (Pa·m3/mol) |
Extrapolé à partir des valeurs expérimentales de log Kae pour le D4 et le D5 | 4 950 000[*] (48,9 atm·m3/mol) |
Xu et Kropscott, 2007 | |
| Expérimental | 14 667 (0,145 atm·m3/mol) |
26 | Kochetkov et al., 2001 | |
| 6 712 (0,066 atm·m3/mol) |
26 | Kochetkov et al., 2001 | ||
| Modélisé | 16 212 (0,16 atm·m3/mol) |
25 | HENRIWIN, 2000 | |
| Log Kae (coefficient de partage air-eau; sans dimension) | Extrapolé à partir des valeurs expérimentales de log Kae pour le D4 et le D5 | 3,3[*] | Xu et Kropscott, 2007 | |
| Log Koe (coefficient de partage octanol-eau) [sans dimension] |
Expérimental | 9,06[*] | 22 | SEHSC, 2007d |
| 4,36 | 22,5 | Miller, 2006 | ||
| 5,86 | Bruggeman et al., 1984 | |||
| Modélisé | 6,33 | KOWWIN, 2000 | ||
| Modélisé | 6,07 | PCKOCWIN, 2000 | ||
| Log Kce (coefficient de partage carbone organique-eau) [sans dimension] |
Modélisé | 6,1[*] | PCKOCWIN, 2000 | |
| Solubilité dans l'eau (mg/L) |
Expérimental | 0,00513[*] | 23 | Varaprath et al., 1996 |
| Modélisé | 0,005 | 25 | WSKOWWIN, 2000 | |
| Log Koa (coefficient de partage octanol-air) [sans dimension] |
Expérimental | 5,76[*] | 24 | Xu, 2006 |
| Modélisé | 5,50 | Calculée à partir de la valeur modélisée de log Koe-log Kae | ||
Récemment, des valeurs empiriques du log Koe ont été reçues et soumises à une évaluation critique. On a déterminé une valeur expérimentale de 4,36 pour le log Koe du D6 à l'aide d'une méthode d'agitation lente conforme à la Ligne directrice 123 de l'OCDE (Miller, 2006), avec du D6 marqué au 14C. Cette mesure de Koe a été répétée trois fois avec un blanc comme témoin. La température a été maintenue constante à 22,5 ± 0,5 ºC tout au long de l'étude. L'équilibre a été atteint en 7 jours et la valeur moyenne pondérée de Koe a été calculée en fonction de l'échantillon des quatre derniers jours. Un log Koe de 4,36 a été déterminé. On a dosé le D6 radiomarqué au 14C dans l'eau et l'octanol grâce à la méthode du comptage par scintillation en milieu liquide (CSML). Les analyses de CSML ne permettent pas de distinguer le composé parent de ses produits d'hydrolyse possibles. Selon l'auteur, la surestimation des concentrations de D6 dans l'eau peut être due aux éventuels produits d'hydrolyse solubles dans l'eau. Toutefois, on considère que le potentiel d'hydrolyse du D6 devrait être faible dans les conditions de l'essai mis en place (Xu, 2006). Le D6 devrait avoir une valeur de Koe plus élevée que le D4 et le D5 à cause de sa plus faible solubilité dans l'eau. Étant donné que des valeurs de log Koe acceptables de 4,45 à 6,49 et de 4,76 à 8,03 ont été déclarées pour le D4 et le D5 respectivement, la valeur ci-dessus déclarée pour le D6 a été jugée peu fiable et n'a pas été retenue pour cette évaluation.
Aux fins de la présente évaluation préalable, on a utilisé la valeur de log Koe de 9,06 estimée par Xu pour le D6 (SEHSC, 2007d) par extrapolation des valeurs expérimentales de Koe pour le D4 (Kozerski et Shawl, 2007) et le D5 (Kozerski, 2007).
Bruggeman et al. (1984) ont obtenu une valeur de log Koe de 5,86 à l'aide de la méthode du temps de rétention en chromatographie liquide à haute performance (CLHP). Cette mesure a été effectuée sur une colonne de silice liée par de l'octadécylsilyle, avec une phase mobile méthanol-eau (90:10). Des séries homologues de n-alkylbenzène avec des valeurs connues de log Koe ont été utilisées comme composés de référence pour étalonner la méthode. À ce jour, le protocole expérimental détaillé pour cette étude n'est pas disponible.
De récentes analyses portant sur le coefficient de partage air-eau pour D4 et D5 ont été menées par Xu (Xu et Kropscott, 2007). Au cours de l'expérience, l'équilibre de partage entre l'air, l'eau et une phase organique (octanol) a été atteint simultanément. Les valeurs de log Koa et de log Koe calculées pour le D4 et le D5 sont apparues raisonnablement cohérentes avec les valeurs expérimentales mesurées pour le D4 et le D5 rapportées par Xu (2006) et Kozerski (2007), ainsi qu'avec l'équilibre de log Koe = log Koa + log Kae. Dans le cadre du rapport de cette évaluation préalable, on considère donc l'analyse comme acceptable. Les valeurs moyennes de log Kae pour le D4 et le D5 (2,69 et 3,13 respectivement) ont été déterminées en fonction de la radioactivité totale de ces deux substances dans l'air et l'eau. Par conséquent, il est possible d'extrapoler la valeur de log Kae pour le D6 à 3,3 conformément à l'équation log Kae = log Koe – log Koa. Pour la valeur extrapolée de Kae, on obtient une constante de la loi de Henry égale à 4 950 000 Pa•m3/mol.
Pour le D6, d'autres propriétés physiques et chimiques modélisées correspondent bien aux données expérimentales mesurées. Sauf pour les données examinées ci-dessus, on utilise les données expérimentales les plus prudentes, s'il y a lieu, pour les prévisions indiquées de divers modèles dans le présent rapport d'évaluation préalable.
Il n'existe pas de sources naturelles connues de D6.
Le D6 est un produit chimique industriel qui n'était fabriqué par aucune société au Canada en 2006 en quantité supérieure au seuil de déclaration de 100 kg, mais qui y est importé dans des mélanges avec d'autres siloxanes cycliques et comme substance résiduelle dans les polymères de silicone et comme ingrédient utilisé dans des produits de consommation finis. Les réponses reçues à un avis publié en application de l'article 71 de la LCPE (1999) ont permis de déterminer qu'entre 100 000 et 1 000 000 kg de D6 avaient été importés au Canada en 2006 (Environnement Canada, 2007), sous forme de matière première et dans des produits finis. Les quantités de D6 importées au Canada ont fortement augmenté depuis l'inscription de cette substance sur la LIS (Environnement Canada, 1988).
Le D6 est un constituant du cyclométhicone (n° CAS 69430-24-6) utilisé dans l'industrie cosmétique. Bien que le cyclométhicone n'ait pas été contrôlé directement conformément à l'article 71 de la LCPE (1999) par Environnement Canada et Santé Canada en 2007, on constate dans certains cas que les réponses à l'avis publié en application de cet article pour l'année 2006 contenaient des données sur les quantités de D6 utilisées ou importées sous le n° CAS 69430-24-6 (Environnement Canada, 2007).
La quantité du n° CAS 69430-24-6 proposée dans le commerce au Canada, déclarée pour l'année civile 1986, était de 2 220 000 kg (Environnement Canada, 1988). En 2005, le Canada était un importateur net de 11 500 000 kg de tous les types de polymères de silicone et de siloxanes (Will et al., 2007).
Le D6 est un intermédiaire dans la production des polymères de silicone de type polydiméthylsiloxane (PDMS) et tous les PDMS contiennent des quantités résiduelles de cyclosiloxanes volatils de faible poids moléculaire, notamment du D6. Les polymères à faible poids moléculaire (et par conséquent à faible viscosité) peuvent contenir moins de 0,1 à 0,5 % de cyclosiloxanes volatils tandis que les polymères à poids moléculaire plus élevé (et par conséquent à plus forte viscosité) peuvent en contenir de 1 à 3 %. La proportion des cyclosiloxanes volatils représentée par le D6 varie fortement selon les produits. L'utilisation de certains produits à base de PDMS devrait entraîner des rejets de D6 (SEHSC, 2007b).
Dans d'autres pays, le D6 a été reconnu comme une substance chimique produite en grandes quantités par l'Organisation de coopération et développement économiques (OCDE, 2007) et l'Agence de protection de l'environnement des États-Unis (U.S. EPA, 2007).
Aux États-Unis, l'utilisation de méthylsiloxanes volatils, notamment de D6, a tendance à augmenter car ces substances ne sont pas soumises à la législation sur les composés organiques volatils (COV) de 1994 (U.S. EPA, 1994a). Les méthylsiloxanes volatils ont été utilisés comme solution de rechange aux chlorofluorocarbures (CFC) pour réduire la teneur en COV réglementée de certains produits (en particulier pour les applications de nettoyage de précision et électronique). Selon des informations de l'Agence de protection de l'environnement des États-Unis, l'importation/la production de D6 dans ce pays atteignait 4,5 à 225 tonnes en 1986. Elle se situait entre 450 et 4 500 tonnes en 1990, 1994 et 1998, et entre 4 500 et 45 000 tonnes en 2002.
En Europe, il a été établi que le D6 était une substance chimique produite en petites quantités, dont la Dow Corning Limited (Royaume-Uni) est le seul producteur ou importateur (ECB, 2007). Actuellement, aucun contrôle n'est effectué sur le D6 en Europe. Les données concernant la quantité de D6 utilisée dans l'Union européenne comme intermédiaire limité au site entre 2003 et 2004 sont confidentielles.
Au Canada et dans le monde entier, le D6 est principalement utilisé comme ingrédient dans la formulation de produits d'hygiène et comme intermédiaire dans la production de polymères de silicone de type polydiméthylcyclosiloxane (PDMS). Comme il est indiqué ci-dessus, le D6 est également un constituant du composé portant le n° CAS 69430-24-6, appelé cyclométhicone dans l'industrie cosmétique. Le cyclométhicone est un mélange de siloxanes cycliques volatils à faible poids moléculaire, dont les principaux ingrédients sont l'octaméthylcyclotétrasiloxane (D4), le décaméthylcyclopentasiloxane (D5) et le dodécaméthylcyclohexasiloxane (D6), que l'on retrouve en différentes proportions. Au Canada, les principales utilisations des mélanges à faible poids moléculaire de siloxanes cycliques volatils, qui peuvent contenir un certain pourcentage de D6, concernent la préparation de produits d'hygiène, notamment de produits de soins capillaires, de produits de soins de la peau et d'antitranspirants (Environnement Canada, 2007).
Tous les polymères de silicone contiennent des quantités résiduelles à l'état de traces de cyclosiloxanes volatils, notamment de D6. Les polymères de silicone qui contiennent des quantités à l'état de traces de D6 peuvent être considérés comme des liquides, des gommes et des résines. Les utilisations de tels polymères sont décrites ci-dessous.
Les principales utilisations de liquides à base de silicone concernent notamment les ingrédients qui entrent dans la formulation de produits de soins pour les cheveux et la peau, d'antitranspirants et de déodorants, de produits pharmaceutiques, d'adjuvants de traitement comme des antimousses, des tensioactifs et des agents de démoulage, de lubrifiants, de polis et de revêtements appliqués sur divers substrats comme les textiles, les tapis et les papiers, ainsi que de produits d'étanchéité, d'enduits pour bâtiments, de lubrifiants mécaniques, de liquides caloporteurs et diélectriques et de produits de reprographie (Will et al., 2007).
Alors qu'une utilisation importante de polymères à poids moléculaire plus élevé était attendue dans la plupart de ces applications, l'utilisation de D6 a été signalée pour les antimousses (Environnement Canada, 2007). Les antimousses sont souvent utilisés à des concentrations de l'ordre de quelques parties par million par toute une gamme d'industries de transformation, notamment les pâtes et papiers, l'alimentation, le pétrole et l'industrie pétrochimique, la fabrication de produits chimiques et le traitement de l'eau. Les silicones sont également utilisées comme antimousses dans des produits d'entretien domestique tels que les nettoyants et les détergents (Will et al., 2007).
Au Canada, l'utilisation de produits à base de silicone contenant du D6 dans certains pesticides est réglementée par la Loi sur les produits antiparasitaires (ARLA, 2007).
Des mélanges liquides et en gel à base de silicone sont utilisés pour plusieurs types de produits cosmétiques et médicaux. Les liquides à base de silicone ont été approuvés comme ingrédients actifs ou non dans des produits pharmaceutiques au Canada (BDPP, 2007), le plus souvent dans des médicaments antiflatulences. On note aussi d'autres utilisations biomédicales des liquides à base de silicone au Canada, comme les démoussants utilisés pour le sang dans les équipements de manutention du sang, les barrières protectrices, les lubrifiants et le traitement en surface des pansements.
Les gommes de silicone sont utilisées pour la production d'élastomères dans des produits d'étanchéité et des adhésifs, du caoutchouc de silicone moulé et des revêtements, ainsi que pour encapsuler des médicaments. Les élastomères à base de silicone servent à fabriquer des produits de consommation comme les sucettes. Des élastomères à base de silicone sont également utilisés dans un grand nombre d'applications biomédicales, notamment des implants et des prothèses destinés à des utilisations à court et à long terme, des cathéters, des lentilles cornéennes et des prothèses dentaires (Will et al., 2007).
Les résines de silicone sont principalement utilisées dans des revêtements spéciaux et pour la production de polymères modifiés par des silicones (Will et al., 2007). Les consommateurs peuvent être exposés au D6 s'ils utilisent ces produits et s'ils se trouvent dans des espaces fermés dans lesquels des revêtements, des produits de calfeutrage, des produits d'étanchéité et du caoutchouc de silicone sont utilisés comme matériaux de construction, ou si ces derniers sont présents dans des produits de consommation.
Le D6 n'est pas déclaré à l'Inventaire national des rejets de polluants d'Environnement Canada. Cette substance fait partie d'un groupe de produits chimiques qui peuvent être utilisés pour diverses applications industrielles et de consommation associées à d’éventuels rejets très importants.
Le D6 peut être rejeté dans l’environnement (c.-à-d. dans l'air et les eaux usées) par suite de l'utilisation de produits d'hygiène tels que les produits de soins capillaires et les produits de soins de la peau et les antitranspirants. Selon les estimations, plus de 90 % du D6 utilisé dans les produits d'hygiène passe dans l'atmosphère (Allen et al., 1997). Le D6 peut aussi être rejeté dans l’environnement par des procédés industriels où il sert d’intermédiaire dans la production de polymères de type PDMS et durant des opérations de mélange, de formulation et de conditionnement. Toutes ces opérations ont lieu au Canada (Environnement Canada, 2007). Des rejets industriels de D6 peuvent également se produire lors de l'utilisation de polymères de silicone par des industries de transformation comme démoussants, agents de démoulage ou lubrifiants, ou pour d'autres applications (Environnement Canada, 2007). On pense que les rejets des procédés industriels passent dans l'atmosphère et les eaux usées. Du fait des rejets de D6 dans les eaux usées traitées par les stations d'épuration des eaux d'égout, la substance peut être associée à des boues qui peuvent ensuite être mises en décharge, incinérées ou épandues sur les sols agricoles comme engrais. L'élimination des produits de consommation et des produits industriels contenant du D6 peut aussi entraîner l'élimination de D6 dans les décharges.
La détection du D6 dans les stations d'épuration des eaux d'égout, dans les décharges et à proximité des usines, ainsi que dans l'air intérieur et ambiant à distance des activités industrielles, montre assez bien que des sources ponctuelles et diffuses contribuent à créer des concentrations de D6 dans l'environnement (Norden 2005; Kaj et al., 2005). L'application de pesticides contenant du D6 sur les cultures, l'épandage des boues d'épuration sur les terres agricoles et leur mise en décharge entraînent le rejet de D6 dans les milieux naturels. Selon certaines indications, le D6 est un produit de dégradation transitoire des PDMS en contact avec le sol, alors que les principaux produits de dégradation sont des silanols (Xu et al., 1998). Ainsi, outre les rejets de résidus de D6 provenant de la fabrication des PDMS, une synthèse de novo de ce produit peut se produire dans les décharges et sur les terres agricoles où des boues d'épuration contenant des PDMS sont épandues, bien que la contribution globale de la dégradation des PDMS ne soit pas considérée comme significative dans les conditions environnementales.
Outil de débit massique
Un outil basé sur le débit massique permet d'estimer les rejets possibles de D6 dans l'environnement à différentes étapes de son cycle de vie. Les données empiriques sur les rejets de substances spécifiques dans l'environnement sont rares. On estime donc, pour chaque type d'utilisation connue, la proportion et la quantité des rejets dans les différents milieux naturels, ainsi que la proportion de la substance qui est transformée chimiquement ou envoyée dans des lieux d'élimination des déchets. Les hypothèses et les paramètres d'entrée utilisés pour effectuer ces estimations sont fondés sur des renseignements obtenus auprès de diverses sources dont les réponses à des enquêtes réglementaires, des données de Statistique Canada, les sites Web des fabricants et des bases de données techniques. À cette fin, les facteurs d'émission se révèlent particulièrement utiles; ils sont généralement exprimés en fraction d'une substance rejetée dans l'environnement, notamment pendant sa fabrication, sa transformation et son utilisation associées aux procédés industriels. Ces données découlent notamment de documents sur des scénarios d'émissions, souvent élaborés sous les auspices de l'Organisation de coopération et de développement économiques (OCDE), et d’hypothèses par défaut utilisées par différents organismes internationaux de réglementation des produits chimiques. Le degré d'incertitude associé à la masse de la substance en circulation et à la quantité rejetée dans l'environnement augmente généralement vers la fin du cycle de vie.
| Devenir | Proportion massique (%)[1] | Principale étape du cycle de vie[2] |
|---|---|---|
| [*] Eaux usées avant toute forme de traitement [1] Pour estimer les rejets de D6 dans l'environnement et la répartition de cette substance, comme le montre ce tableau de synthèse, des renseignements sur les scénarios d'émissions de l'OCDE ont été utilisés : OCDE 2004; id., 2006. Les valeurs présentées pour les rejets dans les milieux naturels ne tiennent pas compte des mesures possibles de limitation des rejets qui peuvent être en place à certains endroits (p. ex. leur élimination partielle par les stations d'épuration des eaux d'égout). Les hypothèses particulières utilisées pour ces estimations sont résumées dans Environnement Canada, 2008. [2] Étapes applicables : production, formulation, utilisations industrielles, utilisation par les consommateurs, durée de vie utile de l'article/du produit, élimination des déchets. |
||
| Rejets dans l'environnement : | ||
| Dans le sol | 0 | - |
| Dans l'air | 77,7 | Utilisations industrielles et utilisation par les consommateurs |
| Dans les égouts[*] | 12,3 | Formulation, utilisations industrielles et utilisation par les consommateurs |
| Transformation chimique | 0,2 | Utilisations industrielles |
| Evoi dans des lieux d'élimination des déchets (p. ex. les décharges, les incinérateurs) | 9,8 | Gestion des déchets |
Selon les données obtenues au moyen de l’outil de débit massique (tableau 3), la substance est surtout rejetée dans l'air et dans les eaux usées (égouts). L'air reçoit la plus forte proportion de rejets possible (77,7 %). Cette situation est due à l'utilisation de produits de consommation tels que les lotions pour la peau et les crèmes solaires et à la volatilisation des résidus dans les polymères de silicone, surtout pendant la première année d'utilisation. Les rejets dans les eaux usées attribuables aux utilisations industrielles pendant la formulation de produits sur place et à l'utilisation de produits d'hygiène sont estimés à environ 12,3 %. En outre, 9,8 % de cette substance sont confiés à l’élimination des déchets.
Selon ses propriétés physiques et chimiques (tableau 2) et les résultats de modélisation de la fugacité de niveau III (tableau 4, les paramètres d'entrée de modélisation sont répertoriés à l'annexe 5 de cette évaluation préalable), le D6 peut se répartir en quantités significatives dans tout milieu naturel, selon le milieu de rejet.
| Milieu de rejet de la substance | Fraction de la substance répartie dans chaque milieu |
|||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| Air (100 %) | 99,9 | 0,0 | 0,1 | 0,0 |
| Eau (100 %) | 0,9 | 16,0 | 0,0 | 83,0 |
| Sol (100 %) | 31,8 | 0,0 | 68,1 | 0,1 |
D'après les informations disponibles (tableau 3), les rejets de D6 dans l'environnement s'effectuent principalement dans l'air (77,7 %). Selon sa pression de vapeur qui varie de 4 à 4,73 Pa, sa constante de la loi de Henry de 4 950 000 Pa·m3/mol et sa longue demi-vie dans l'air, le D6 devrait rester dans l’air (plus de 99 %) s'il y est rejeté (tableau 4).
Si le D6 est rejeté dans l'eau (12,3 %, tableau 3), on s'attend à ce qu'il soit adsorbé sur les matières en suspension, comme les boues d'épuration et les sédiments, du fait de ses fortes valeurs estimées de log Kco (plus de 6). Les résultats de la modélisation de la fugacité de niveau III pour les rejets dans l'eau montrent qu'environ 83 % de ce composé restera dans la phase solide (sédiments en suspension et matériaux du lit) et 16 % dans la phase aqueuse (colonne d'eau). Bien que la volatilisation du D6 à partir de la surface de l'eau soit également prévisible selon le coefficient de partage air-eau (Kae), sa forte capacité de sorption sur des matières solides réduit sa volatilisation (0,9 %, tableau 4).
Lorsque le D6 est rejeté sur des sols humides, par exemple par l'application de boues d'épuration sur des terres agricoles, on s'attend à ce qu'il soit fortement adsorbé au sol (c.-à-d. qu'il devrait être immobile), ce qui devrait réduire son potentiel de volatilisation et toute répartition ultérieure dans d'autres milieux. Les résultats du modèle de fugacité de niveau III valident cette hypothèse car en cas de rejet de D6 sur des sols humides, 68,1 % resteront dans le sol, associés à des solides pour les raisons décrites pour les sédiments. On estime qu'environ 31,8 % de la fraction massique passera dans l'air. Cette estimation concorde avec l'observation de Xu (1999) selon laquelle la volatilisation constitue le principal processus de perte de siloxanes cycliques à partir des sols humides. Toutefois, le pourcentage de volatilisation du D6 est inférieur à celui du D5 (environ 71 %) à cause de sa forte capacité d'absorption sur les solides (Kco > 6). Sur un sol sec, le D6 devrait être hydrolysé rapidement par des minéraux argileux pour former du diméthylsilanediol, qui est le produit de dégradation final (Xu, 1999; Xu et Chandra, 1999).
Persistance dans l'environnement
Dégradation atmosphérique
Les résultats du modèle de fugacité de niveau III indiquent que si le D6 est rejeté dans l'air, il y restera en grande partie et devrait y être oxydé lentement par une réaction en phase gazeuse avec des radicaux hydroxyles (OH) d'origine photochimique. Bien qu'aucune donnée expérimentale ne soit disponible, la demi-vie par oxydation atmosphérique du D6 est estimée à 6 jours environ (selon le calcul d'un modèle supposant que les concentrations en radicaux hydroxyles s'établissent à 1,5 × 106 OH/cm3 [tableau 5b]). On peut estimer des demi-vies de 2,6 à 12,8 jours à l'aide du modèle AOPWIN en fonction de la mesure quotidienne de la concentration moyenne en hydroxyles de 3,5 × 106 OH/cm3 et 0,7 × 106 OH/cm3 (concentration moyenne quotidienne = concentration maximale/2), en été et en hiver respectivement (Ren et al., 2003; id., 2006). On peut donc conclure que le D6 pourrait se dégrader plus rapidement dans les centres urbains en été lorsque la concentration en radicaux hydroxyles atmosphériques est la plus élevée. Cependant, si l'on prend en compte une demi-vie d'élimination moyenne annuelle, elle est cohérente avec la demi-vie d’environ 6 jours estimée avec la concentration en radicaux OH de 1,5 × 106 OH/cm3. Le D6 ne devrait pas réagir du tout, ou très peu, avec d'autres espèces photo-oxydantes dans l'atmosphère, par exemple O3, et ne devrait vraisemblablement pas se dégrader par photolyse directe (Atkinson, 1991). Les réactions avec les radicaux hydroxyles devraient donc constituer le principal processus régissant le devenir de cette substance dans l'atmosphère. Par conséquent, la demi-vie de dégradation de 5,69 jours est considérée comme critique et sera utilisée pour le D6 dans la modélisation du devenir dans l'environnement.
Navea et al. (2007) ont étudié les effets de l'ozone, des aérosols et du rayonnement solaire sur le devenir du D4 et du D5 dans une chambre à environnement simulé. Ils sont arrivés à la conclusion que les aérosols minéraux tels que le kaolin et l'hématite peuvent accélérer de façon significative l'élimination du D4 et du D5 dans la phase gazeuse de l'atmosphère, en particulier pendant la journée. Ces résultats indiquent également que l'ozone peut encore accélérer ces processus d'élimination du D4 et du D5. Bien que les données obtenues suggèrent que les aérosols minéraux combinés à l'ozone peuvent avoir des effets significatifs sur le devenir dans l'environnement des méthylsiloxanes cycliques volatils (cVMS) présents dans l'air, il est difficile d'extrapoler de manière quantitative les résultats des simulations dans des conditions environnementales réalistes. Il convient d'abord de noter que l'étude a été effectuée avec des cVMS, en aérosols minéraux et en ozone, d'un niveau élevé irréaliste. Par ailleurs, les échantillons de minéral et de noir de charbon utilisés dans l'étude étaient des échantillons d'analyse très purs (plus de 99 %) qui fournissaient la zone de surface maximale et par conséquent les sites d'adsorption maximale idéaux, c'est-à-dire les conditions optimales pour l'adsorption de D4/D5. On peut se demander si ces minéraux purs sont bien représentatifs des matières particulaires dans l'air. Enfin, on peut raisonnablement penser que des minéraux tels que la kaolinite et l'hématite sont présents dans les particules atmosphériques. Cependant, il est peu probable qu'il s'agisse des composants les plus courants et les plus abondants de la poussière atmosphérique. Il convient par ailleurs de souligner que l'étude a été menée dans une chambre à environnement simulé et a impliqué la réaction des aérosols minéraux avec un seul cVMS (D4 ou D5) à la fois. Dans des conditions environnementales réelles, des milliers de produits chimiques se disputent les sites d'adsorption des aérosols. Dans ces conditions, l'« efficacité » de l'élimination du D4/D5 dans l'air ambiant peut donc être largement inférieure aux résultats observés dans l'atmosphère de la chambre où se trouvait un seul composant.
On peut donc conclure que le degré d'accélération de la dégradation des cVMS dans l'air par les aérosols et l'ozone dans des conditions environnementales réalistes est incertain.
Les données montrent donc que cette substance est persistante dans l'air (demi-vie supérieure à 2 jours) conformément au Règlement sur la persistance et labioaccumulation(Canada, 2000).
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre et unités de dégradation | Références |
|---|---|---|---|---|
| Eau | Biodégradation | 4,47 % | Dégradation 28 j | Springborn Smithers Laboratories, 2005 |
| Eau | Hydrolyse | 401 | Extrapolation à partir de la demi-vie d'hydrolyse du D4 et du D5 (pH neutre, 25 °C) | Xu, 2007 |
| Eau | Hydrolyse | 0,9-733 | Demi-vie (jours) déduite à partir du D4 pH 6-9; 5-25 °C |
Durham, 2006 Kozerski, 2008 Bidleman, 2008 |
| Eau/sédiments | Dégradation abiotique | 49-588 | Demi-vie (jours) déduite à partir du D4 pH neutre; 5-25 °C |
Xu et Miller, 2008 |
| Sol (sols Wahiawa d'Hawaï) | Hydrolyse catalysée par l'argile | 1,38 jour (humidité relative 32 %) |
Demi-vie (jours) | Xu, 1999; Xu et Chandra, 1999 |
| Sol (sols Londo du Michigan) | Hydrolyse catalysée par l'argile | 3,54 jours (humidité relative 32 %); 5,25 jours (humidité relative 93 %) |
Demi-vie (jours) déduite à partir du D4 | Xu et Chandra, 1999 |
| Milieu | Processus du devenir | Valeur de dégradation | Paramètre et unités de dégradation | Modèle |
|---|---|---|---|---|
| [1] Les résultats de la simulation de la biodégradation CATABOL indiquent que le D6 se situe dans le domaine des paramètres mondiaux et dans le domaine métabolique, mais à l'extérieur du domaine structurel. Le plus important de ces domaines est le domaine métabolique, et CATABOL semble indiquer que cette substance ne se dégrade pas étant donné la faible probabilité de l'existence d'un groupe méthyle stable et de produits d'oxydation de l'anneau aromatique. [2] Demi-vies par oxydation atmosphérique recalculées avec des concentrations en radicaux OH mesurées à New York en été et en hiver respectivement. |
||||
| Air | Oxydation atmosphérique | 5,96 | Demi-vie (jours) | AOPWIN, 2000 |
| Air | Oxydation atmosphérique | 2,6-12,8[2] | Demi-vie (jours) | AOPWIN, 2000 |
| Eau | Biodégradation | 60 | Demi-vie (jours) | BIOWIN, 2000, Ultimate survey |
| Eau | Biodégradation | 0 (biodégradation lente) | Probabilité | BIOWIN, 2000; probabilité linéaire du MITI |
| Eau | Biodégradation | 0 (biodégradation lente) | Probabilité | BIOWIN 2000; probabilité non linéaire du MITI |
| Eau | Biodégradation | 2,0 | Demande biochimique en oxygène (DBO), % (MITI 301C)[1] | CATABOL, c2000-2008 |
| Eau | Biodégradation (anaérobique) | 0,1 (biodégradation lente) | Probabilité | BIOWIN, 2000 |
Dégradation dans l'eau et les sédiments
Aucune donnée empirique d'hydrolyse n'est disponible pour le D6. Par conséquent, on a adopté une méthode fondée sur les données déduites à partir d’analogues en utilisant des données relatives à des siloxanes similaires. Des analyses expérimentales de l'hydrolyse menées pour le D4 (Durham et Kozerski, 2005) et le D5 (Durham, 2006), dont la structure est similaire, ont été évaluées par des experts internes (Bidleman, 2008); les résultats de ces analyses et évaluations sont présentés ci-dessous. Pour déterminer la cinétique de l'hydrolyse du D4 et du D5, on a mesuré la disparition de composés parents radiomarqués en fonction du temps conformément à Ligne directrice 111 de l'OCDE. Ces réactions ont été étudiées dans des tubes de verre de borosilicate scellés à la flamme, à des pH de 4, 7 et 9, et à des températures de 10, 25 et 35 °C. Des essais supplémentaires ont été effectués pour le D5 à des pH de 5,5 et 8 et à 25 °C. On a pu constater que les vitesses d'hydrolyse du D4 et du D5 dépendaient du pH et suivaient une cinétique du pseudo-premier ordre. On a pu déterminer que l'hydrolyse du D4 et du D5 s'effectuait selon des demi-vies (t1/2) comprises entre 0,04 et 45 jours pour le D4 et entre 0,9 et 733 jours pour le D5 dans des conditions canadiennes réalistes (pH 6 à 9, température entre 5 et 25 °C) [GEMStat, 2008; NOAA, 2008]. Les valeurs de demi-vie d'hydrolyse du D5 sont supérieures à celles du D4. Par conséquent, on estime que la période de demi-vie du D6, dont la structure est similaire à celle du D4 et du D5, en environnement canadien (pH 6 à 9, température entre 5 et 25 °C) sera supérieure à la plage 0,9 à 733 jours. En fonction des données d'hydrolyse disponibles pour le D4 et le D5 (Xu, 2007), on a pu déterminer par extrapolation une demi-vie d'environ 401 jours pour le D6 (pH neutre et température ambiante).
De nouvelles informations obtenues sur la dégradation par les agents microbiens indiquent que le D6 n'est vraisemblablement pas biodégradé dans l'eau. L'essai de biodégradabilité immédiate de 28 jours a été effectué dans des récipients fermés hermétiquement conformément à la Ligne directrice provisoire 310 de l'OCDE et les résultats ont mis en évidence une biodégradation limitée (4,47 %) du D6 au cours des 28 jours d'essai (Springborn Smithers Laboratories, 2005). Ce pourcentage équivaut approximativement à une demi-vie de 411 jours si l'on considère une cinétique du premier ordre. Ces données sont étayées par deux modèles du tableau 5b, selon lesquels la probabilité de biodégradation du D6 dans l'eau est effectivement nulle. Par conséquent, on considère que le D6 est persistant dans l'eau (t1/2 > 180 jours). Par ailleurs, selon une conclusion générale pondérée obtenue en combinant les résultats des modèles BIOWIN3 et BIOWIN5 (BIOWIN, 2000), ce composé ne se biodégrade pas facilement.
Les données expérimentales et modélisées sur la biodégradation indiquent que le D6 présente un faible potentiel de biodégradation dans les milieux aqueux. L'hydrolyse constitue donc le principal processus de dégradation du D6 dans l'eau. Les données basées sur les demi-vies d'hydrolyse du D4 et du D5 et la demi-vie du D6 déterminée par extrapolation suggèrent que la persistance du D6 dans les eaux canadiennes peut être relativement longue. On arrive donc à la conclusion que le D6 répond aux critères de la persistance dans l'eau (t1/2 > 182 jours) définis dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Aucune information sur la dégradation dans les sédiments n'était disponible pour le D6. Une étude préliminaire sur la dégradation du D4 dans le système eau-sédiments a cependant été reçue récemment (Xu et Miller, 2008). Une ligne directrice 308 modifiée de l'OCDE a été suivie. L'étude a été réalisée à température ambiante (22-25 ºC) avec des sédiments naturels (limon sableux, teneur en carbone organique élevée, environ 70 % d'eau et 11 % de matière organique, pH d'environ 7) et de l'eau prélevés en profondeur dans un lac non contaminé. Le D4 radiomarqué dans le diéthylène glycol méthyl éther a été ajouté à la seringue en 10 à 15 points des sédiments de surface dans chaque flacon après le retrait de l'eau excédentaire. L'eau excédentaire a de nouveau été ajoutée sur les sédiments enrichis avec des perturbations minimales des sédiments. L'enrichissement des sédiments plutôt que de l'eau a permis de garantir la répartition de la substance dans les sédiments. Les propriétés physiques et chimiques de la substance (volatilité élevée et hydrolyse potentielle) ont ainsi été correctement gérées et la reproductibilité de l'étude a pu être améliorée. Les concentrations de D4 mesurées entre le 6e et le 22e jour (fin de l'essai) ont indiqué qu'un équilibre avait été atteint entre l'eau et les sédiments, plus de 95 % de D4 et de la radioactivité ayant été détectés dans les sédiments. Comme l'a montré l'étude de l'hydrolyse du D4, les produits de dégradation dans les sédiments et l'eau étaient des intermédiaires oligomères diols HO(Me2SiO)nH (n=2-4), et le diméthylsilanediol (DMSD) était le produit de dégradation final. La demi-vie calculée pour la dégradation du D4 dans les sédiments était de 49 jours à une température comprise entre 22 et 25 ºC. Les mêmes produits de dégradation observés dans cette étude et dans l'étude de l'hydrolyse du D4 suggéraient que l'hydrolyse constituait le principal processus de dégradation dans le système sédiments-eau. L'incertitude principale de cette étude réside dans l'absence d'autres mesures. Puisqu'aucune donnée n'était disponible pour les demi-vies de dégradation à faible température, une méthode fondée sur les données déduites à partir d’analogues utilisant les données d'hydrolyse du D4 a été appliquée. Les demi-vies d'hydrolyse du D4 dans l'eau étaient environ 6 à 12 fois plus longues lorsque la température de l'eau était ramenée de 25 à 10 ºC, puis à 5 ºC. En supposant une tendance similaire à la baisse dans les sédiments, les demi-vies estimées pour le D4 dans les sédiments sont de 294 et 588 jours à 10 et 5 ºC respectivement.
Les demi-vies de dégradation dans les sédiments du D4 sont utilisées pour le D6 d'après la similarité des deux substances. Par conséquent, on peut conclure que dans certaines conditions climatiques canadiennes (plus froides), la demi-vie du D6 sera supérieure à 182 jours dans l'eau et à 365 jours dans les sédiments. Le D6 est donc jugé persistant dans l'eau et les sédiments, conformément aux critères établis dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000). L'extrapolation de la dégradation du D4 dans les sédiments à faible température selon l'hydrolyse n'est cependant pas exempte d'incertitudes.
Dégradation dans le sol
Bien qu'aucune donnée empirique sur sa biodégradation dans le sol ne soit disponible, comme il est indiqué ci-dessus, la biodégradation du D6 dans l'eau est négligeable selon l'essai de biodégradation immédiate (Springborn Smithers Laboratories, 2005) et selon les prévisions de cinq des six modèles de biodégradation (tableau 5b).
Xu (Xu, 1999; Xu et Chandra, 1999) a effectué des recherches approfondies sur les modes de dégradation potentiels des cyclosiloxanes, notamment du D4, du D5 et du D6, dans le sol Wahiawa d'Hawaï à température ambiante, avec une humidité relative de 32 %. Il en a conclu que la réaction de polymérisation ouvrant l'anneau qui permet de former des polydiméthylsiloxanes (PDMS) et la déméthylation qui donne des cyclosiloxanes ne sont pas significatifs dans le sol à des concentrations inférieures à 200 mg/kg en poids sec. De plus, on a observé l'hydrolyse du D6 catalysée par l'argile dans des sols Wahiawa très altérés et secs. La demi-vie de dégradation du D6 dans le sol Wahiawa (teneur en argile de 55 % avec 2,1 % d'eau) était de 1,38 jour dans des conditions de sol sec. Il semblerait que la sécheresse du sol limite fortement l'activité biologique, mais favorise des réactions abiotiques comme l'hydrolyse catalysée par des conditions acides et en surface des PDMS, un polymère qui présente le même squelette que les cyclosiloxanes (Xu, 1999). Les vitesses de dégradation des cyclosiloxanes étaient déterminées par l'humidité du sol, le type d'argile, la teneur en argile et la taille des molécules de siloxane, qui déterminent à leur tour la vitesse de diffusion vers les sites catalytiques en surface. La dégradation du D6 s'est révélée beaucoup plus lente que celle du D4 et du D5 dans les mêmes conditions de sol (environ 1 et 2 heures de demi-vie pour le D4 et le D5 respectivement) et corrobore l'hypothèse selon laquelle la vitesse de dégradation diminue avec l'augmentation du poids moléculaire pour ces trois cyclosiloxanes : D4 > D5 > D6. Les demi-vies de dégradation du D4 dans le sol Londo étaient comprises entre 3,54 et 5,25 jours à une humidité relative inférieure à 93 %. Pour le D6, on prévoit une demi-vie de dégradation plus lente dans des sols Londo tempérés. Les données réunies selon la méthode du poids de la preuve semblent indiquer que le D6 subit une hydrolyse catalysée par l'argile et n'est pas persistant dans des conditions de sol sec. L'absence de dégradation par hydrolyse du D4 dans des sols Londo saturés d'eau semble aussi indiquer que la dégradation du D6 est négligeable dans les mêmes conditions. La volatilisation représente le principal mécanisme de perte du D6 dans de telles conditions de sol, en système ouvert, et à une vitesse inférieure à celle relevée pour le D4 et le D5.
Alors qu'ils étudiaient l'influence des types d'argile sur le potentiel de dégradation des PDMS, Xu et al. (1998) ont démontré que les PDMS étaient dégradés par les minéraux argileux, même si leurs activités catalytiques étaient différentes. La présence répandue de ces minéraux tend à indiquer que le D6 devrait subir une dégradation catalysée par l'argile dans les divers sols tant que persisteront des conditions pédologiques critiques comme une faible humidité, et ce, malgré l'extrême diversité des sols canadiens.
Selon des études empiriques disponibles qui montrent son potentiel d'hydrolyse rapide catalysée par l'argile dans les sols de surface, le D6 n'a pas été jugé persistant dans le sol car sa demi-vie de dégradation est inférieure au critère de la t1/2 supérieure à 182 jours qui est énoncé dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Les données empiriques et modélisées disponibles indiquent que le D6 satisfait aux critères de la persistance dans l'air (demi-vie ≥ 2 jours), dans l'eau (demi-vie ≥ 182 jours) et dans les sédiments (demi-vie ≥ 365 jours), conformément au Règlement sur la persistance et la bioaccumulation(Canada, 2000), mais pas au critère de la demi-vie dans le sol (demi-vie inférieure à 182 jours).
Potentiel de transport à grande distance
Le modèle régional de niveau III de transport et de persistance (TaPL3, 2000) a été utilisé pour estimer la « distance de transport caractéristique » (DTC) du D6. La DTC est définie comme la distance maximale parcourue dans l'air par 63 % de la substance. Beyer et al. (2000) ont proposé de considérer le potentiel de transport atmosphérique à grande distance comme étant élevé si la DTC est supérieure à 2 000 km, modéré si elle est de 700 à 2 000 km et faible si elle est inférieure à 700 km. D'après une estimation de la DTC de 2 966 km, le potentiel de transport atmosphérique à grande distance du D6 est considéré comme élevé. C’est donc dire que le D6 est sujet au transport atmosphérique vers des régions éloignées comme l'Arctique.
| Distance de transport caractéristique | Modèle (référence) |
|---|---|
| 2 966 km | TaPL3, v. 2.10 (TaPL3, 2000) |
| 2 963 km | Outil LRTP POPs v.2.0 de l'OCDE (Scheringer et al., 2006) |
Le modèle de dépistage de l'OCDE (LTRP POPs) peut être utilisé pour identifier les produits chimiques à fort potentiel de persistance et de transport à grande distance (Scheringer et al., 2006). Le modèle de l'OCDE est un modèle global qui compartimente la terre en air, eau et sol. Ce modèle est « orienté vers le transport » plutôt que vers une « cible » car il identifie simplement la DTC sans préciser l'endroit où une substance peut être transportée en particulier (Fenner et al., 2005). Klasmeier et al. (2006) ont suggéré qu'un seuil de 5 098 km, basé sur l'estimation de la DTC du modèle pour le 2,2',3',4,4',5,5'-heptachlorobiphényle (PCB-180), permettrait d'identifier des substances ayant un fort potentiel de transport à grande distance. Le PCB-180 a été détecté dans des régions éloignées. La DTC calculée pour le D6 à l'aide du modèle de l'OCDE correspond à 2 963 km, ce qui indique que le D6 présente toujours un fort potentiel de transport dans l'air, mais qu’il est inférieur à la limite suggérée par Klasmeier et al. pour les polluants mondiaux. (2006).
Le modèle de dépistage de l'OCDE permet également de calculer l'efficacité du transfert (ET), qui correspond au pourcentage du flux des émissions vers l'atmosphère déposé à la surface (eau et sol) dans une région éloignée (ET = D/E × 100, où E est le flux des émissions vers l'atmosphère et D, le flux du dépôt sur les milieux en surface dans une région cible). L'ET calculée du D6 est de 1,6E-06 %, ce qui est largement inférieur à la limite de 4,65E-04 % (2,4,4'-trichlorobiphényle ou PCB-28) établie pour les substances de référence du modèle dont on sait de manière empirique qu'elles sont déposées de l'air sur le sol ou dans l'eau. Une ET faible indique que le D6 présente un potentiel de transport à grande distance dans l'atmosphère sans être déposé à la surface de la Terre dans une région éloignée donnée. De plus, les valeurs de log Koa et de log Kae du D6 semblent indiquer qu'il présente également un faible potentiel de contamination arctique s'il est examiné à l'aide des parcelles de partage chimique décrites par Wania (2003, 2006).
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement. Les dépôts atmosphériques constituent donc la seule source significative de cVMS dans le lac (Powell, 2008). L'analyse préliminaire d'échantillons de sédiments et zooplancton portant sur les cVMS n'a pas permis de détecter de D6, ce qui semble indiquer que les dépôts atmosphériques ne constituent pas une source significative de D6 pour le lac Opeongo. Les limites de détection étaient de 19,0 ng/g (masse de référence corrigée) pour les sédiments et le zooplancton.
On arrive donc à la conclusion que le D6 présente un potentiel de transport dans l'atmosphère sur de longues distances. Cependant, l'ET modélisée pour le D6 est faible, ce qui tend à indiquer qu’il est peu susceptible de se déposer dans l'eau ou sur le sol dans des régions éloignées. Les résultats de surveillance du lac Opeongo viennent également appuyer la thèse du faible potentiel de dépôt atmosphérique pour le D6. Le D6 transporté dans l'atmosphère sera finalement dégradé par des radicaux hydroxyles dans l'air.
Potentiel de bioaccumulation
Les valeurs empiriques et modélisées de log Koepour le D6 (tableau 2) semblent indiquer que cette substance peut se bioaccumuler dans le biote.
Dans le milieu aquatique
De nouvelles données expérimentales ont été reçues concernant des études sur la bioconcentration chez les organismes aquatiques. On a effectué une étude de bioconcentration du D6 marqué au 14C (pureté radiochimique de 99,57 %) sur des têtes-de-boule (Pimephales promelas) dans un système à écoulement continu avec des concentrations de 4,4 µg/L et 0,41 µg/L pendant une période de 49 jours, suivie d'une période de dépuration de 98 jours (Drottar, 2005). Le facteur de bioconcentration à l'équilibre (FBCéq) moyen calculé était de 1 160 L/kg selon des concentrations mesurées du 35e au 49e jour. Le facteur de bioconcentration cinétique (FBCc) était de 1 660 L/kg selon les vitesses d'absorption et de dépuration (k1/k2) pour les groupes traités à 0,41 µg/L. L'analyse des tissus des poissons a aussi indiqué que la demi-vie de dépuration pour le D6 radiomarqué était de 30 jours. Les faibles valeurs de FBC obtenues pour le D6 (par rapport à un FBCéq de 12 600 et un FBCc de 13 400 pour le D4, et un FBCéq de 7 060 L/kg et un FBCc de 13 300 pour le D5) pourraient expliquer en partie la faible biodisponibilité du D6 (poids moléculaire plus élevé et log Koe d'environ 9 par rapport aux analogues de structure similaire, soit le D4 et le D5) adsorbé sur les particules en suspension (aliments non ingérés et fèces).
Des données expérimentales issues d'études de bioaccumulation (par voie alimentaire) ont été obtenues pour le D4 et le D5 (Drottar, 2006; id., 2007; Domoradzki, 2008a; id., 2008b; SEHSC, 2008b). Les valeurs de FBAmp obtenues (normalisées pour les lipides) pour ces deux substances sont comprises entre 0,6 et 0,9. On peut par conséquent considérer que le D6, un analogue proche du D4 et du D5, peut présenter le même potentiel de bioamplification peu élevé, tel qu’il est suggéré par les études alimentaires menées en laboratoire sur des poissons pour le D4 et le D5.
Une autre étude de bioconcentration a été menée sur des invertébrés (Dow Corning Corporation, 1985). Des Daphnia magna ont été exposés à des concentrations de 4 µg/L de [14C] pour le D6 pendant un période de 32 jours. L'équilibre a été atteint après 21 jours d'exposition et la valeur de FBCéq obtenue correspondait à 2 400 L/kg en poids humide. Malheureusement, l'étude n'a pas été documentée de manière exhaustive et ne présentait aucun renseignement détaillé quant aux sources et à l'acclimatation des organismes, aux conditions et au type de système utilisés pour l'essai. Une analyse critique a pu déterminer que cette étude devait être considérée comme peu fiable.
Le modèle d'Arnot-Gobas (Arnot et Gobas, 2003) permet de prévoir le facteur de bioaccumulation (FBA) de cette substance en tenant compte de tout métabolisme potentiel, à l'aide d'une constante de vitesse de métabolisation (kM). Le FBC disponible dans les données d'essai in vivo a été utilisé pour dériver une constante de vitesse de métabolisation in vivo selon la méthode d'Arnot et al. (2008a). Dans cette méthode, kM est dérivé d'après l'équation suivante :
kM = (k1φ / FBC) – (k2 + kE + kG) (1)
où :
kM = Constante de vitesse de métabolisation (1/jours)
k1 = Constante de vitesse d'absorption (Arnot et Gobas, 2003)
φ = Fraction du produit chimique dissous librement dans l'eau (Arnot et Gobas, 2003)
FBC = Facteur de bioconcentration empirique disponible
k2 = Constante de vitesse d'élimination (Arnot et Gobas, 2003)
kE = Constante de vitesse d'évacuation fécale (Arnot et Gobas, 2003)
kG = Constante de vitesse de croissance (Arnot et Gobas, 2003)
La méthode d'Arnot et al. (2008a) permet d'estimer les facteurs de confiance (FC) pour la valeur de kM afin de tenir compte de l'erreur associée aux données in vivo(variabilité des mesures, incertitude de l'estimation des paramètres et erreur du modèle). Un FC moyen de ± 2,7 a été calculé pour les données de FBC disponibles.
Puisque le potentiel métabolique peut être lié au poids corporel et à la température (voir p. ex. Hu et Layton, 2001; Nichols et al., 2007), la valeur kM a été normalisée davantage à 15 °C, puis corrigée pour le poids corporel des poissons du niveau trophique intermédiaire dans le modèle d'Arnot-Gobas (184 g) [Arnot et al., 2008b]. Des poissons du niveau trophique intermédiaire ont été utilisés pour représenter les résultats d'ensemble du modèle, comme le recommande son concepteur (Arnot, J.A., communication personnelle avec M. Bonnell d’Environnement Canada, 2008; ne figure pas dans les références), et cette valeur est plus représentative du poids des poissons qui sera vraisemblablement consommé par un piscivore aviaire ou terrestre. Après la normalisation, la valeur de kM était comprise entre environ 0,002 et 0,01, avec une valeur médiane d'environ 0,005.
| kM (normalisée pour le niveau trophique intermédiaire) jour-1 | Log Koe utilisé | Modèle du FBC d'Arnot-Gobas | Modèle du FBA d'Arnot-Gobas |
|---|---|---|---|
| 1,70E-03 (2,5 %) | 9,1 | 302 | 323 594 |
| 4,60E-03 (moyenne) | 9,1 | 138 | 109 648 |
| 1,25E-02 (97,5 %) | 9,1 | 56 | 26 303 |
Les valeurs de kM calculées d'après des expériences in vivo semblent indiquer que la vitesse de métabolisation du D6 est relativement faible (≤ 0,01 jour-1 au mieux). L'étude expérimentale sur le FBC chez les têtes-de-boule (Drottar, 2005) a permis de démontrer la présence d'un certain métabolisme, bien que limité, du D6. Le FBC calculé de 302 avec la constante de vitesse de percentile inférieur (env. 0,002) est beaucoup plus faible que les valeurs du FBC rapportées par Fackler et al. (1995). Par conséquent, on peut considérer cette constante de vitesse comme cas de figure optimal. Un FBA correspondant de 323 594 a été calculé pour le D6 pour les poissons des eaux canadiennes (tableau 7) avec cette constante de vitesse de métabolisation.
Dans les sédiments
Aucune information n'est disponible sur la bioaccumulation du D6 dans les sédiments. Il existe toutefois des études sur le facteur d'accumulation dans le biote et les sédiments (FABS) chez les organismes benthiques pour le D5 (Springborn Smithers Laboratories, 2003) et le D4 (Kent et al., 1994). Selon la méthode du poids de la preuve, on a utilisé les données tirées de ces études afin de déterminer le potentiel d'accumulation du D6 dans les sédiments, même si le D6 devrait être encore moins biodisponible (à cause d'une plus grande sorption aux matières organiques) dans les sédiments que le D5 et le D4, et que par conséquent, son potentiel d'accumulation pourrait être plus faible.
Les FABS du D4 ont été calculés à l'aide des données d'une étude de toxicité subchronique chez le moucheron (Chirononmus tentans) [Kent et al., 1994]. Des moucherons ont été exposés à du D4 dans des sédiments présentant une concentration en carbone organique faible, moyenne et élevée comprise entre 0,27 et 4,1 %. Les FABS moyens calculés (FABS = Ctissus des organismesmg/kg/Csédimentsmg/kg) étaient de 0,7, 1,3 et 2,2 respectivement pour les concentrations élevées, moyennes et faibles. Les valeurs de FABS ont été calculées pour le D5 à l'aide de données issues d'une étude de toxicité chronique/aiguë chez le moucheron (Chironomus riparius) [Springborn Smithers Laboratories, 2003]. Les larves de moucherons ont été exposées à des concentrations de D5 comprises entre 13 et 180 mg/kg, et des essais ont été réalisés sur des sédiments contenant 2,0 % de carbone organique. On a pu ainsi calculer les FABS chez les moucherons à 1,2, 1,1, 0,83 et 0,46 pour des niveaux de traitement respectifs de 13, 30, 73 et 180 mg/kg (poids sec).
Les résultats empiriques indiquent que le D4 et le D5 peuvent présenter un certain potentiel (bien que limité [FABS < 2]) de bioaccumulation lié à l'exposition aux sédiments. Les données relatives au FABS pour le D5 peuvent être utilisées pour le D6 selon un scénario prudent du cas le plus défavorable. On estime aussi que le D6 présente un certain potentiel de bioaccumulation lié à l'exposition aux sédiments, bien qu'il ait vraisemblablement une plus faible valeur de FABS à cause de sa plus faible biodisponibilité. Cependant, ni l’une ni l’autre de ces études sur l'accumulation dans les sédiments spécifie si le contenu de l'intestin des organismes soumis à l'essai a été purgé avant le calcul des valeurs de FABS. Ces valeurs risquent donc d'être surestimées en raison de la présence des substances à tester dans les sédiments dans l'intestin des invertébrés.
Dans le sol
Il n'existe pas d'information disponible sur la bioaccumulation du D6 dans le sol.
Dans le milieu terrestre
Le modèle de bioaccumulation à bilan massique de Gobas pour les organismes terrestres (Gobas et al., 2003) utilise les coefficients de partage octanol-air et octanol-eau (Koaet Koe) pour estimer le potentiel de bioamplification (FBAmp) des substances chimiques dans les chaînes trophiques terrestres. Selon les estimations, les substances chimiques dont la valeur de log Koa est supérieure à 5 peuvent se bioamplifier dans les chaînes trophiques terrestres si la valeur de Koe est supérieure à 2 et si la vitesse de transformation chimique ou de métabolisation est faible. Un log Koa de 5,76 indique que le D6 peut présenter un potentiel de bioamplification dans les chaînes trophiques terrestres. Toutefois, le métabolisme des cVMS qui a été démontré au cours d’études en laboratoire menées chez des mammifères peut réduire le potentiel de bioamplification dans le réseau trophique terrestre.
Synthèse du potentiel de bioaccumulation du D6
Dans l'ensemble, les indications concernant le potentiel de bioaccumulation du D6 sont contradictoires. Des essais empiriques sur la bioconcentration ont montré que le FBC est inférieur à 5 000, ce qui est vraisemblablement lié à la biodisponibilité aquatique inférieure du D6 par rapport au D4 et D5 (comme l’indique les propriétés physiques et chimiques des cVMS). Le potentiel de bioconcentration chez les autres organismes aquatiques et benthiques à différents niveaux trophiques devrait être peu élevé compte tenu de la faible valeur de FBC obtenue chez les poissons et de la faible biodisponibilité attendue.
Les valeurs de FBC prévues, corrigées pour le métabolisme, sont relativement faibles par rapport à celles du D4 et du D5. Les valeurs de FBA prévues, également corrigées pour le métabolisme, sont relativement élevées et supérieures à 5 000. Le modèle cinétique à bilan massique utilisé repose sur les « principes fondamentaux », dont le concept clé indique qu'une substance chimique obéit au principal mécanisme du modèle, dans ce cas une diffusion passive. Le D6 respecte ce concept, de même que les limites de log Koe et de poids moléculaire du modèle. Par conséquent, les prévisions de bioaccumulation sont jugées applicables au D6. Cependant, la correspondance entre les valeurs de FBC corrigées pour le métabolisme et les valeurs empiriques est moindre, ce qui suggère une plus grande incertitude concernant les résultats du modèle de FBC et de FBA pour le D6 du fait de l'absence relative de valeurs empiriques pour le FBC et le FBA dans la plage de log Koe utilisée pour le D6 dans le modèle (supérieure ou égale à 9). Par ailleurs, la possibilité que des produits chimiques superhydrophobes n'atteignent pas l'équilibre dans l'environnement (ce que suppose le modèle) rajoute une certaine incertitude (Arnot et Gobas, 2006).
Les valeurs de FABS des sédiments pour le D4 et le D5 semblent indiquer un niveau d'accumulation relativement faible dans les macroinvertébrés présents dans les sédiments pour le D6. Comme il s'agit du seul essai de bioaccumulation dans les sédiments disponible pour les cVMS et qu'il n'existe aucun modèle prédictif pour les organismes des sédiments, des essais ou des données sur le terrain à des charges environnementales plus réalistes permettraient de vérifier ces valeurs. Aucune étude relative au FBAmp chez les poissons n'a été effectuée pour le D6. Si l'on utilise les valeurs du FBAmp obtenues pour le D4 et le D5, il est possible que le facteur de bioamplification obtenu chez les poissons pour le D6 soit également faible, compte tenu de sa faible biodisponibilité. Toutefois, on ne dispose actuellement d'aucun élément qui permette de valider cette hypothèse pour d'autres niveaux trophiques. Des études de mésocosmes sur le terrain sont actuellement en cours afin d'observer le transfert trophique de cVMS dans un réseau alimentaire aquatique, mais ces données ne sont pas encore disponibles pour évaluation complète et n'ont pas été prises en compte dans cette évaluation.
Actuellement, seule une valeur modélisée de FBA supérieure à 5 000 permet d'affirmer que le D6 présente un potentiel de bioaccumulation élevé. Cette valeur utilisée seule comme mesure unique du potentiel de bioaccumulation élevé présente un certain degré d'incertitude si l'on considère les autres données prouvant le faible potentiel de bioaccumulation. Compte tenu de ces indications contradictoires, on ne peut donc pas considérer que la valeur de FBA prévue permette à elle seule de conclure que le potentiel de bioaccumulation du D6 est élevé. Toutefois, on peut raisonnablement conclure que le D6 présente un certain potentiel de bioaccumulation dans le biote, bien que ce potentiel soit susceptible d'être inférieur à celui du D4 et du D5. Par conséquent, étant donné l'absence de potentiel de bioconcentration élevé et des indications de faible bioaccumulation obtenues pour le D4 et le D5 après exposition par voie alimentaire chez les poissons, on peut conclure que le D6 ne satisfait pas au critère de la bioaccumulation (FBC ou FBA ≥ 5 000) défini dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Évaluation des effets sur l’environnement
A – Dans le milieu aquatique
De nouvelles données empiriques sur l'écotoxicité du D6 ont été obtenues et sont examinées en détail ci-dessous (tableau 8a). Ces études indiquent que cette substance ne présente pas d'effets nocifs sur les poissons et les daphnies exposés à des concentrations pouvant atteindre sa limite de solubilité dans l'eau (environ 0,005 mg/L).
Des Daphnia magna juvéniles ont été exposées à des concentrations de D6 de 0,27, 0,57, 1,2, 2,5 et 4,6 µg/L (mesurées) pendant 21 jours dans des conditions de renouvellement statiques, et les solutions d'essai ont été renouvelées toutes les 24 heures (Springborn Smithers Laboratories, 2006). De l'acétone à une concentration de 0,1 mL/L a été utilisée comme agent solubilisant. Le pH était maintenu entre 7,4 et 8,4, la température oscillait entre 18 et 21 °C et la concentration d'oxygène dissous restait supérieure à 60 % de saturation. L'eau d'essai présentait une dureté de 120 à 190 mg CaCO3/L. On n'a pas observé de cas de mortalité, de baisse de la reproduction ou d'autres effets biologiquement significatifs à la concentration la plus élevée, soit 4,6 µg/L (concentration sans effet observé ≥ 4,6 µg/L). La régulation de la température et la dureté de l'eau présentaient des écarts par rapport à la Ligne directrice 211 de l'OCDE, mais on n'a pas jugé qu'il s'agissait de facteurs limitatifs importants pour l'essai. Toutefois, le taux d'alimentation de 0,3 mg C par daphnie par jour appliqué pendant l'essai était supérieur à celui de la ligne directrice de l'OCDE (0,1-0,2 mg C par daphnie par jour), mais on estime que cet écart est favorable à la santé des organismes expérimentaux, qui résistent mieux aux effets toxiques. Une charge de carbone plus élevée dans le système expérimental peut aussi contribuer à réduire la biodisponibilité du D6 en fournissant un substrat pour la sorption. Néanmoins, ces données expérimentales ont été jugées acceptables aux fins de la présente évaluation préalable, en indiquant les limites possibles pour les essais (voir ci-dessus).
| Organisme | Type d'essai | Durée | Paramètre[1] | Valeur (mg/L) | Références |
|---|---|---|---|---|---|
| [1] CSEO : concentration sans effet observé. | |||||
| Puce d'eau Daphnia magna |
Tox. chronique | 21 j | CSEO | 0,0046 | Springborn Smithers Laboratories, 2006 |
| Tête-de-boule Pimephales promelas | Tox. chronique | 49 j | CSEO | 0,0044 | Drottar, 2005 |
La toxicité du D6 chez les têtes-de-boule (Pimephales promelas) a été analysée lors d'une étude relative au FBC décrite à la section « Potentiel de bioaccumulation » (Drottar, 2005). Des têtes-de-boule juvéniles ont été exposées à des concentrations de 0,41 et 4,4 µg/L (mesurées) pendant 49 jours dans des conditions d'écoulement continu. Aucun effet biologique significatif n'a été observé à la concentration d'essai la plus élevée, soit 4,4 µg/L (CSEO ≥ 4,4 µg/L), pendant la phase d'absorption de 49 jours chez les poissons. La toxicité chez les poissons a été déterminée dans le cadre d'une étude de FBC; toutefois, la conception de l'essai ne correspond pas à celle d'un essai de toxicité à long terme pour les premiers stades de l’existence. On ne dispose d’aucune donnée expérimentale sur la toxicité du D6 au cours des premiers stades de la vie des poissons. Sousa et al. ont cependant fait état d’une étude de toxicité de 93 jours concernant le D4 pour cette période. Des embryons de truites arc-en-ciel ont été exposés à du D4 à des niveaux de concentration compris entre 0,00025 et 0,0044 mg/L pendant 93 jours. Aucun effet nocif n'a été observé sur la viabilité des embryons, l'alevinage, la survie des larves et la croissance à tous les niveaux de traitement. La CSEO chronique aux premiers stades de la vie des poissons sur 93 jours est donc de 0,0044 mg/L, la plus forte concentration testée. On peut raisonnablement conclure qu’en raison de sa biodisponibilité réduite, le D6 ne devrait pas présenter d’effets nocifs à la concentration de 0,0044 mg/L.
La toxicité aiguë et chronique du D6 a été évaluée à l'aide du modèle ECOSAR (2004). Les résultats prévus sont présentés dans le tableau 8b.
| Organisme | Type d'essai | Paramètre[1] | Durée | Concentration (mg/L) | Références |
|---|---|---|---|---|---|
| [1] CL50 : concentration minimale causant 50 % de mortalité; CE50 : concentration minimale causant 50 % des effets; ChV correspond à la moyenne géométrique de la CSEO (concentration sans effet observé) et de la CMEO (concentration minimale avec effet observé) | |||||
| Poissons | Tox. aiguë | CL50 | 14 j | 0,0004 | ECOSAR, 2004 |
| Poissons | Tox. chronique | ChV | 30 j | 0,00003 | ECOSAR, 2004 |
| Daphnie | Tox. chronique | CE50 | 16 h | 0,0001 | ECOSAR, 2004 |
Les résultats modélisés à l'aide d'ECOSAR pour le D6 semblent indiquer la possibilité d’un degré élevé d’effets nocifs chroniques (c'est-à-dire une CSEO chronique inférieure à 0,1 mg/L) chez les organismes aquatiques à la limite de solubilité. Les valeurs de toxicité prévues sont cependant considérées comme peu fiables. Le log Koe du D6 (9,07) est supérieur à la valeur de démarcation recommandée par ECOSAR pour ce log (8,0) en ce qui concerne la prévision de la toxicité chronique à l’aide des relations structure-activité pour les composés organiques neutres, et le manque de données empiriques sur les siloxanes dans l’ensemble d’étalonnage du modèle vient limiter leur prise en compte dans la présente évaluation. Les données de toxicité modélisées pour les organismes aquatiques n’ont donc pas été retenues.
D’après les données empiriques, le D6 ne présente aucun effet nocif chez le biote pélagique à des concentrations inférieures à sa limite de solubilité (0,005 mg/L). Néanmoins, on a choisi de comparer la CSEO de 0,0046 mg/L tirée d’un essai de toxicité de 21 jours réalisé chez des daphnies aux concentrations environnementales prévues dans l’eau.
B – Dans d’autres milieux
Dans les sédiments
Aucune étude de toxicité pour les organismes des sédiments n'a été trouvée pour le D6. Toutefois, des études de toxicité chronique effectuées sur les organismes benthiques sont disponibles pour le D5, dont la structure est similaire (Springborn Smithers Laboratories 2003; Krueger et al., 2008). Ces données expérimentales ont été utilisées selon la méthode du poids de la preuve pour déterminer le potentiel de toxicité du D6 dans les sédiments. Toutefois, le D6 pourrait présenter une biodisponibilité moindre (sorption plus élevée aux matières organiques) dans les sédiments que le D5 et, par conséquent, un potentiel de toxicité inférieur.
Des études de toxicité chronique du D5 (Springborn Smithers Laboratories, 2003; Krueger et al., 2008) ont été effectuées chez les moucherons (Chironomus riparius). Dans ces études de 28 jours, la concentration sans effet sur la vitesse de développement des mâles était de 69 à 70 mg/kg en poids sec. On a observé les concentrations minimales ayant un effet sur la croissance et la vitesse de développement des mâles entre 160 et 180 mg/kg en poids sec.
Une étude de 28 jours sur la toxicité chronique du D5 chez le ver de terre (Lumbriculus variegates) a également été effectuée (Krueger et al., 2007). La concentration de D5 sans effet sur la survie et la reproduction était de 1 272 mg/kg en poids sec.
Compte tenu des données sur la toxicité chronique du D5, on considère que les populations de Chironomus riparius sont plus sensibles aux cyclosiloxanes que les vers de terre. Bien que la toxicité du D6 soit vraisemblablement plus faible pour les organismes benthiques à cause de sa biodisponibilité et son hydroaffinité réduites, on peut utiliser les valeurs de toxicité chronique du D5 pour déterminer la toxicité du D6 dans les sédiments selon le scénario d'exposition le plus défavorable et le potentiel de biodisponibilité. On peut ainsi calculer pour le D6 des valeurs prudentes de CSEO (concentration sans effet observé) et de CMEO (concentration minimale avec effet observé) de 69 et 160 mg/kg en poids sec, respectivement.
Dans le sol
Aucune étude concernant les effets du D6 ou de ses analogues sur les organismes du sol n'a été trouvée.
Dans le milieu terrestre
Aucune étude écologique concernant les animaux sauvages terrestres n'a été trouvée. Les études en laboratoire sur des mammifères sont examinées dans la section « Potentiel d'effets nocifs sur la santé humaine » de la présente évaluation préalable.
Évaluation de l'exposition de l’environnement
Dans l'air
Des mesures environnementales préliminaires de méthylsiloxanes volatils, dont le D6, ont été effectuées en février et mars 2006 au Canada, dans la région des Grands Lacs (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références). Dix-huit échantillons d'air extérieur provenant de régions rurales et urbaines de l'Ontario ont été prélevés et le D6 était présent dans presque tous ces échantillons à des concentrations de moins de 1 µg/m3, à l'exception d'une concentration relativement élevée d'environ 16 µg/m3 signalée dans la région urbaine de Toronto. Ce résultat concorde avec les valeurs déclarées par d'autres instances (tableau 9a).
Il est cependant possible que la détection de D6 dans l'air ambiant soit partiellement attribuable à la contamination des échantillons. Les cyclosiloxanes volatils sont présents dans une gamme étendue de produits commerciaux, et les représentants des programmes de surveillance du Canada et des pays nordiques ont indiqué qu'ils avaient eu des problèmes de concentrations élevées de cyclosiloxanes dans des blancs d'échantillons. La méthode utilisée pour mesurer et analyser les concentrations dans l'air à des valeurs comprises entre des ng/m3 et quelques µg/m3 est toujours en voie d'élaboration. Très peu de mesures ont été effectuées en double pour la surveillance de l'air extérieur et les rares données disponibles présentent une mauvaise reproductibilité (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références).
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Des 24 échantillons extérieurs (n = 24) ont été recueillis dans les pays nordiques. La limite de détection était de 0,03 µg/m3 pour le D6. [2] Communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références. |
|||
| Air | Région des Grands Lacs, Canada; février et mars 2006 | < 1-16 µg/m3 | Voir la note 2 |
| Air | Pays nordiques[1]; 2004-2005 | < l. d.-2,1 µg/m3 | Norden, 2005 |
Dans l'eau
Au Canada, on a échantillonné l'eau de 9 stations d'épuration des eaux d'égout (SEEE), dans des grands centres urbains du sud-ouest de l'Ontario, y compris dans des lagunes et dans des installations de traitement secondaire et tertiaire de l'eau en octobre et pendant l'hiver 2005 (communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références). Du D6 a été détecté à des concentrations de 0,49 à 27,33 µg/L et de 0,97 à 2,71 µg/L, respectivement, dans les affluents et les effluents. En ce qui concerne les concentrations de D6 des affluents traités par des SEEE, on n'a observé des différences saisonnières que pour trois lagunes, alors que les différences saisonnières des concentrations de D6 dans les effluents étaient plus significatives (de 0,97-1,00 en automne à 2,32-2,71 en hiver). D'autres instances ont déclaré des résultats de surveillance semblables (tableau 9b).
Aux États-Unis, on a détecté du D6 dans des concentrés d'eau potable de deux villes, la Nouvelle-Orléans (Louisiane) et Cincinnati (Ohio) (Lucas, 1984, cité dans U.S. EPA, 1992).
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Total de 28 sites d'échantillonnage à l'exclusion des affluents et des effluents de SEEE [2] 7 sites d'échantillonnage d'affluents de SEEE [3] 12 sites d'échantillonnage d'effluents de SEEE [4] Communication personnelle, Environnement Canada, Centre canadien des eaux intérieures, 2007; ne figure pas dans les références. l.d.= limite de détection |
|||
| Eau | Grands Lacs, Canada; 2006 | < 17 ng/g (l. d.) | Voir la note 4 |
| Affluents de SEEE | Sud-ouest de l'Ontario, Canada; 2006 | 0,49-27,33 µg/L | Voir la note 4 |
| Effluents de SEEE | Sud-ouest de l'Ontario, Canada; octobre 2005 | 0,97-2,71 µg/L | Voir la note 4 |
| Eau potable | États-Unis | Détection qualitative | Lucas, 1984, cité par la U.S. EPA, 1992 |
| Eau | Sites de fond et sites urbainspays nordiques | < 0,07 µg/L (l.d.) | Norden 2005; Kaj et al., 2005; NILU, 2007 |
| Affluents de SEEE | Pays nordiques[2][1], | 0,12-3,7 µg/L | Norden 2005; Kaj et al., 2005; NILU, 2007 |
| Effluents de SEEE | Pays nordiques[3] | < 0,02 (l.d.)-0,1 µg/L | Norden 2005; Kaj et al., 2005; NILU, 2007 |
Dans les sédiments
Au Canada, on a dosé le D4, le D5 et le D6 de sédiments de surface et de carottes de sédiments prélevés dans le lac Ontario en juillet 2006 (Powell et Kozerski, 2007). Les sédiments de surface étaient constitués de la couche supérieure de 5 cm de sédiments du port de Toronto et du bassin de Kingston. Les carottes de sédiments prélevées dans les bassins de Rochester, de Mississauga et de Niagara ont été découpées en strates d'une épaisseur de 5 mm. Les sédiments de surface du port de Toronto et du bassin de Kingston présentent une teneur en carbone organique total modérée (COT = 2,1-2,4 % p. s. [poids sec]), alors que les carottes de sédiments présentent une teneur en COT élevée (4-5 % p. s.). Une analyse de perte par calcination des sédiments a également indiqué des teneurs en eau plus faibles dans les sédiments de surface (55-70 % p. h. [poids humide]) que dans les carottes de sédiments (80-89 %). On sait que les sédiments du port de Toronto et des quatre bassins sédimentaires sont contaminés par divers composés organiques qui pénètrent dans le lac par des rejets directs d'eaux usées traitées, qui s'écoulent des Grands Lacs supérieurs (Érié, Huron et Michigan) et de la rivière Niagara ou qui proviennent du dépôt atmosphérique. Les sédiments de surface du port de Toronto contenaient les plus fortes concentrations de D6 (0,2 µg/g en poids sec). En revanche, les concentrations de siloxanes cycliques dans les sédiments de surface et les carottes de sédiments des quatre bassins sédimentaires étaient toutes inférieures à la limite de détection de la méthode analytique, qui était fixée à 0,01 µg/g pour le D6. D'autres instances ont déclaré des résultats de surveillance semblables pour la détection du D6 dans les sédiments de surface de régions urbaines et de sources ponctuelles (tableau 9c).
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement (Powell, 2008). L'analyse préliminaire des échantillons de sédiments de surface et de carottes de sédiments n'a pas permis de détecter de D6, la limite de détection étant fixée à 19,0 ng (masse de référence corrigée).
Les résultats de surveillance des sédiments pour les zones du lac Opeongo et du lac Ontario semblent indiquer qu'il est plus probable de détecter une contamination au D6 à proximité des centres urbains et des sources ponctuelles.
| Milieu | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Total de 30 sites d'échantillonnage de sédiments [2] Masse de référence corrigée telle qu’elle est mentionnée dans l’étude préliminaire p. s. = poids sec; l. d. = limite de détection |
|||
| Sédiments de surface | Port de Toronto (Canada); juillet 2006 | 0,2 µg/g p. s. | Powell et Kozerski, 2007 |
| Sédiments de surface | Bassin de Kingston (Canada); juillet 2006 | <0,01 µg/g p. s. (l.d.) | Powell et Kozerski, 2007 |
| Carottes de sédiments | Bassins de Rochester, de Mississauga et de Niagara (Canada); juillet 2006 | <0,01 µg/g p. s. (l.d.) | Powell et Kozerski, 2007 |
| Sédiments de surface | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | <19,0 ng. (l.d.) [2] | Powell, 2008 |
| Carottes de sédiments | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | <19,0 ng. (l.d.) [2] | Powell, 2008 |
| Sédiments | Pays nordiques[1] | < l. d. (variations entre les échantillons) -0,196 µg/g p. s. | Norden, 2005; Kaj et al., 2005; NILU, 2007 |
Dans le sol
Le D6 peut pénétrer dans le sol par l'application de boues d'épuration sur les terres agricoles. Aucune donnée de surveillance n'a été relevée au Canada concernant la présence du D6 dans les boues d'épuration. En Europe, le D6 est présent dans les boues d'épuration à des concentrations comprises entre quelques µg/kg et 14,0 mg/kg en poids sec (Norden, 2005; Kaj et al., 2005; NILU, 2007).
Aucune donnée de surveillance n'est disponible à propos du D6 dans le sol au Canada. Les concentrations de D6 dans deux échantillons de sol des îles Féroé étaient inférieures à la limite de détection (< 4 ng/g p. s.) [Norden, 2005].
Dans le biote
Une étude préliminaire de surveillance d'un écosystème éloigné a été effectuée au lac Opeongo, le plus grand lac du parc provincial Algonquin, en Ontario, au Canada. Ce lac est relativement éloigné des sources potentielles de cVMS provenant de stations d'épuration et d'eau de ruissellement (Powell 2008). L'analyse préliminaire d'échantillons de zooplancton n'a pas permis de mettre en évidence la présence de D6. Les échantillons représentatifs de zooplancton ont été regroupés en un échantillon unique pour chacun des deux emplacements sans être classés par espèce. La limite de détection était de 19,0 ng (masse de référence corrigée).
En Europe, on a détecté du D6 dans le foie de poissons d'eau de mer, mais pas dans celui de poissons d'eau douce, principalement dans des zones représentant des sources urbaines ou diffuses. Les concentrations étaient habituellement comprises entre moins de 5 et 10 ng/g (en poids humide), sauf pour un échantillon de foie de morue de Norvège, dans lequel on a mesuré des concentrations extrêmement élevées de siloxanes (74 ng/g de D6 en poids humide). Le programme de suivi des effets sur l'environnement mené par le gouvernement norvégien a permis de confirmer les concentrations de D6 initiales rapportées (NILU, 2007; voir le tableau 9d). Dans le cadre du même programme de suivi, du D6 a également été détecté dans des moules communes, dans les foies et les filets de limandes à queue jaune et dans le contenu de l'estomac de morues de Norvège. Les concentrations variaient selon les espèces, le sexe et l'âge. Chez les mammifères marins surveillés, on a détecté du D6 dans le petit lard de phoque au Danemark à une concentration de 7,9 ng/g en poids humide (Norden, 2005). On n'en a en revanche pas détecté en Suède dans des échantillons de muscles de poissons (Kaj et al., 2005).
La présence de D6 dans le biote en Europe indique que malgré les faibles concentrations détectées, voire la non-détection, de la substance dans l'habitat des poissons ou à proximité, le D6 est présent dans l'environnement pour l'absorption par le biote et l'accumulation dans celui-ci.
| Organisme | Lieu et année | Concentration | Références |
|---|---|---|---|
| [1] Un total de 11 matrices d'échantillonnage pour les poissons d'eau de mer [2] Un total de 10 matrices d'échantillonnage pour les poissons d'eau douce [3] Un total de 7 matrices d'échantillonnage pour les mammifères marins [4] Un total de 17 matrices d'échantillonnage pour les œufs d'oiseaux de mer [5] Un total de 3 matrices d'échantillonnage pour les moules [6] Un total de 2 matrices d'échantillonnage pour la limande à queue jaune [7] Un total de 3 matrices d'échantillonnage pour la morue p.h. : poids humide; l. d. : limite de détection |
|||
| Zooplancton | Lac Opeongo, parc provincial Algonquin, en Ontario (Canada); octobre 2007 | < 19,0 ng/g (l.d.) | Powell, 2008 |
| Foie de poissons d'eau de mer | Pays nordiques[1], 2002-2004 |
< 5 (l. d.)-74 ng/g p.h. | Norden, 2005 |
| Foie de poissons d'eau douce | Pays nordiques[2]; 2002 | < 5 ng/g p.h. (l.d.) | Norden, 2005 |
| Mammifères marins | Pays nordiques[3]; 2002 | < 5 (l. d.)-7,9 ng/g p.h. | Norden, 2005 |
| Œufs d'oiseaux de mer | Pays nordiques[4], 2000-2005 |
< 5 ng/g p. h. (l.d.) | Norden, 2005 |
| Moules communes | Norvège[5]; 2006 | 1,3-1,8 ng/g p.h. | NILU, 2007 |
| Foies de limandes à queue jaune | Norvège[6]; 2006 | 1,4 ng/g p. h. | NILU, 2007 |
| Filets de limandes à queue jaune | Norvège[6]; 2006 | 0,9 ng/g p. h. | NILU, 2007 |
| Contenu de l'estomac de morues | Norvège[7]; 2006 | 1,8-3,3 ng/g p.h. | NILU, 2007 |
| Foies de morues | Norvège[7]; 2006 | 109,1-151,5 ng/g p.h. | NILU, 2007 |
Caractérisation des risques pour l'environnement
La démarche suivie dans cette évaluation écologique préalable a consisté à examiner les divers renseignements à l’appui de la caractérisation et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence prévus à l’article 76.1 de la LCPE (1999). Une attention particulière a été accordée à l'analyse du quotient de risque, à la persistance, au potentiel de bioaccumulation, à la toxicité, aux sources et au devenir dans l'environnement.
Selon les renseignements disponibles, le D6 est très persistant dans l'eau et présente un certain potentiel de bioaccumulation dans les organismes aquatiques, comme le suggèrent la valeur expérimentale obtenue pour le FBC et sa présence dans certains organismes vivants en Europe. Une évaluation quantitative du quotient de risque de l'exposition et des effets écologiques a donc été réalisée dans le cadre de l'évaluation de l’ensemble des données concernant le potentiel d'effets nocifs du D6.
Deux études expérimentales de toxicité chronique effectuées dans le milieu aquatique, soit l’une portant sur les Daphnia magna et l’autre sur les têtes-de-boule, ont été analysées et validées. Le D6 n'a présenté aucun effet nocif à des niveaux de concentration compris entre 0,0044 et 0,0046 mg/L, concentration très proche de sa limite de solubilité dans l'eau (env. 0,005 mg/L). Aucun facteur d'application n’a été appliqué à la CSEO chronique de 0,0046 mg/L. La concentration estimée sans effet observé (CESE) est donc de 0,0046 mg/L.
Le D6 a été soumis à une analyse du quotient de risque (QR) qui intègre le niveau d'exposition et un seuil de toxicité. Pour tenir compte du risque potentiel du D6 à l'échelle du Canada, on a déterminé une distribution établissant le profil des quotients de risque dans l'eau au niveau de plusieurs sites de rejet de la substance par l'industrie ou les consommateurs (c.-à-d. des stations municipales d’épuration des eaux d’égout). Ce type d'analyse fournit des éléments utiles à l'évaluation des risques d'une substance lorsqu’il est impossible d’établir totalement l'ensemble des emplacements géographiques des rejets effectués par l'activité industrielle et les consommateurs de cette substance.
En particulier lorsque divers secteurs industriels utilisent une substance sans qu’on puisse identifier les installations effectivement impliquées, on peut alors estimer l'exposition en milieu aquatique pour tous les emplacements des installations ayant un lien avec ces secteurs. Par ailleurs, des informations concernant des rejets potentiels attribuables à une utilisation par les consommateurs peuvent être intégrées aux calculs. Une concentration environnementale estimée (CEE) pour le milieu aquatique est déterminée en fonction des quantités utilisées déterminées à partir des réponses à l'enquête menée en application de l’article 71 et des estimations concernant les rejets effectués par l'activité industrielle et les consommateurs. Les eaux réceptrices sont un cours d'eau ou un lac, et un facteur de dilution basé sur la superficie des eaux réceptrices (10 au maximum) est utilisé pour estimer la CEE. Le quotient de risque propre à chacun des sites est ensuite déterminé pour la colonne d'eau. La distribution indique non seulement la proportion ou le nombre de sites dépassant le seuil, mais également l'ordre de grandeur de ce dépassement pour chaque site. Des informations complémentaires sur la méthode utilisée figurent dans le rapport d'Environnement Canada (2008b).
L'analyse des rejets des consommateurs se fonde sur une base de données répertoriant près de 1 000 lieux (ou sites) d'élimination municipaux représentant environ les deux tiers de la population canadienne. L'analyse des rejets industriels a été effectuée pour 27 sites liés à 87 installations industrielles identifiées par leur code NAICS comme des utilisateurs potentiels de D6. Au total, dans ces scénarios, 31 (env. 3,2 %) des lieux d'élimination municipaux évalués au Canada présentent un risque pour les organismes aquatiques, avec des QR supérieurs à 1 (voir la figure 1). L'équation et les paramètres utilisées pour calculer la CEE dans les cours d'eau récepteurs sont décrites dans le rapport d'Environnement Canada (2008c).
Figure 1. Distribution du risque du D6 pour le milieu aquatique (Environnement Canada,
2008b; id., 2008c)
Bien qu'une analyse du quotient de risque ait été effectuée pour le D6, les données empiriques relatives à l'écotoxicité laissent penser que le seuil auquel des effets nocifs sur le biote pélagique sont censés se produire n'a pas été observé durant les essais de toxicité dont on dispose. Dès lors, les QR calculés dans le scénario ci-dessus sont essentiellement « sans limite » et peuvent ne pas représenter les effets observables « réels » prévus aux sites susmentionnés.
La valeur de log Koe très élevée pour le D6 tend à indiquer que celui-ci se trouve dans la classe des produits chimiques « superhydrophobes » qui sont souvent associés à une biodisponibilité faible pour le biote pélagique et benthique. L’absence de bioconcentration sensible chez les organismes d’essai et les valeurs relativement faibles de résidus tissulaires relevées dans les données de surveillance sur le terrain tendent également à indiquer que la faible biodisponibilité vient limiter la possibilité que la charge corporelle atteigne des niveaux internes critiques à la suite d’expositions à de l’eau et des sédiments.
Le D6 a été identifié comme persistant dans l'environnement et présente un potentiel de bioaccumulation relativement faible dans le biote. Comme son profil en matière de propriétés physiques et chimiques, de bioconcentration et d’écotoxicité fournit une base consensuelle à l’établissement d’une conclusion définitive, on peut raisonnablement conclure que le D6 présente un faible potentiel d'effets nocifs sur l'environnement au Canada.
Incertitudes dans l'évaluation des risques pour l’environnement
De grandes quantités de D6 sont importées au Canada. Selon les informations disponibles, les quantités de D6 importées et utilisées au Canada ont fortement augmenté depuis l'inscription de cette substance sur la LIS (Environnement Canada, 1988). La tendance étant à une augmentation de l’utilisation, les rejets de D6 dans l'environnement et le potentiel d'exposition de l’environnement à cette substance augmenteront également. De plus, le D6 est l'un des principaux composants du n° CAS 69430-24-6 et est également présent dans les PDMS dans des proportions pouvant atteindre 3 %. Or, le n° CAS 69430-24-6 (ou cyclométhicone, représentant le mélange) et les PDMS ne figurent pas sur la liste des substances contrôlées dans le cadre du Défi du gouvernement canadien lancé à l'industrie et aux autres parties intéressées (Canada, 2007). Bien qu'il soit établi que certaines sociétés ont déclaré divers cVMS dans le mélange dans le cadre de l'enquête, les quantités de ces substances importées au Canada et leurs utilisations en 2006 ne sont pas totalement connues, et leurs rejets dans l'environnement au pays ne sont pas entièrement pris en compte dans le présent rapport d'évaluation.
Pour l'analyse de distribution du risque, la CESE a été calculée à partir d'une concentration très proche de sa limite de solubilité dans l'eau (env. 0,005 mg/L) et aucun facteur d'application n’a été employé pour extrapoler des données sur le terrain à partir de données de laboratoire en raison de l'absence d'effets nocifs observés à cette concentration. Puisqu'on ne disposait d'aucune information relative aux rejets liés aux activités industrielles pour l'analyse de distribution du risque, il est considéré que les rejets dans les eaux usées sont répartis de manière uniforme entre les 27 sites industriels évalués. En réalité, certains sites industriels peuvent utiliser davantage de D6 que d'autres, ce qui génère des rejets plus importants dans les lieux d'élimination municipaux associés à ces sites et donc un risque supérieur aux prévisions. Dans l'analyse, on a appliqué, aux concentrations de distribution, une dilution instantanée des effluents des SEEE dans les eaux réceptrices. Toutefois, dans des conditions environnementales réalistes, la dilution instantanée ne peut pas être obtenue au-delà d'une certaine distance du point de rejet et la zone proche du point de rejet d'une SEEE peut présenter un risque supérieur aux prévisions.
Les sédiments sont un sujet de préoccupation important concernant le D6. Les études de dégradation du D4 dans les sédiments qui ont été utilisées pour le D6 comportaient des incertitudes. De plus, l'extrapolation des demi-vies à faible température dans les sédiments selon les données d'hydrolyse peut également contribuer à l'incertitude globale concernant la persistance dans les sédiments.
Les données de l'étude de bioconcentration ainsi que les valeurs ayant trait au facteur de bioamplification et à l'accumulation dans les sédiments disponibles pour les substances analogues au D6 ont permis de déduire que le D6 présente un faible potentiel de bioaccumulation lors d'essais en laboratoire. On note un manque de données de terrain sur le potentiel de bioaccumulation par le réseau trophique et chez les organismes non aquatiques.
Les prévisions des modèles ont également été intégrées à la présente évaluation préalable. Il existe des incertitudes accrues concernant les valeurs prévues car seuls quelques siloxanes ou produits chimiques avec des valeurs de log Koe élevées (> 8), comme pour le D6, ont été étudiés et intégrés aux modèles.
Les données de surveillance environnementale au Canada et ailleurs sont limitées. La contamination des échantillons peut représenter un problème pour la surveillance environnementale en raison des nombreuses utilisations du D6. Les données disponibles sur les concentrations environnementales de D6 dans le biote et dans les eaux de surface au Canada sont limitées et peu de concentrations environnementales ont été rapportées pour des régions à l'extérieur des zones urbaines du Canada. Pour ces raisons, le présent rapport utilise des données de surveillance de pays européens. La surveillance a cependant également été identifiée comme un élément essentiel du Plan de gestion des produits chimiques au Canada, et le D6 a été pris en compte pour la surveillance environnementale dans le cadre de ce plan. La surveillance environnementale contribuera à une meilleure compréhension de la présence environnementale et du potentiel réel d'accumulation de la substance dans l'environnement.
Évaluation de l'exposition
La section « Évaluation de l'exposition de l’environnement » de ce rapport présente les données sur les concentrations de D6 détectées dans les milieux naturels, notamment dans l'air ambiant à proximité et à distance des sources ponctuelles, des eaux de surface, des sédiments, des boues d'épuration et du biote. Les données non publiées relatives au Canada incluent des mesures dans l'air à proximité et à distance de sources ponctuelles (communication personnelle, Environnement Canada, Centre de technologie environnementale, 2007; ne figure pas dans les références), des mesures dans l'air et les affluents et effluents de stations d'épuration des eaux usées (communication personnelle, Environnement Canada, Centre de technologie environnementale, 2007; ne figure pas dans les références) ainsi que des mesures dans les sédiments des Grands Lacs (Powell et Kozerski, 2007). De nombreuses analyses de siloxanes volatils ont généré des résultats incohérents en raison de la contamination des échantillons pendant la collecte et l'analyse, responsable de la détection de siloxanes dans les blancs, à des concentrations dans certains cas comparables à celles des échantillons prélevés à proximité de sources ponctuelles. Le Conseil des ministres des pays nordiques et l'Institut de recherche environnementale de la Suède ont publié les résultats de vastes campagnes d'échantillonnage et de mesure des siloxanes dans les milieux naturels en Scandinavie (Norden, 2005; Kaj et al., 2005). Les données de ces rapports, considérées comme fiables, ont été utilisées pour calculer les limites supérieures estimées de l'exposition aux siloxanes dans l'air, l'eau et le sol pour la population du Canada.
L'annexe 1 présente les limites supérieures estimées de l'absorption quotidienne de D6 pour six groupes d'âge de la population canadienne. Les valeurs estimées de l'absorption à partir des milieux naturels et du régime alimentaire sont comprises entre 28,7 et 87 µg/kg p. c./j (kilogramme de poids corporel par jour) respectivement pour les adultes âgés de 60 ans et plus et les enfants de 6 mois à 4 ans. La contribution la plus significative à l'absorption quotidienne due aux milieux naturels est l'inhalation d'air intérieur, selon une étude portant sur 400 domiciles en Suède, au cours de laquelle on a détecté du D6 dans 142 échantillons, soit deux fois plus que pour le D4. Pour cette étude, la concentration moyenne de D6 dans l'air intérieur mesurée dans les chambres des enfants était de 7,9 µg/m3, avec une concentration maximale de 164 µg/m3 (Kaj et al., 2005).
La confiance dans la limite supérieure estimée de l'exposition au D6 dans les milieux naturels et dans le régime alimentaire est modérée. Aucune donnée canadienne n'a été utilisée, mais des données d'études effectuées en Scandinavie étaient disponibles pour l'air ambiant et intérieur, l'eau et le sol. La concentration maximale de D6 mesurée dans l'air intérieur au cours d’une étude suédoise sur les domiciles est plus élevée que celle mesurée tant pour le D4 que pour le D5 dans les habitations suédoises (Kaj et al., 2005). On peut difficilement expliquer ce résultat, étant donné la pression de vapeur du D6 inférieure à celle de ses composés analogues à poids moléculaire plus faible et la prévalence relative prévue de l'utilisation de ces trois cyclosiloxanes en 2004. L'utilisation d'une limite réglementaire pour les PDMS (n° CAS 9006-65-9, diméthylpolysiloxane) dans le quart des produits laitiers et la moitié des aliments transformés peut causer une surestimation de la contribution alimentaire à l'exposition totale, mais la contribution estimée de tous les aliments à l'exposition de la population due aux milieux naturels et au régime alimentaire est inférieure à 5 % de celle de l'air.
À l’aide de la version 4.1 du logiciel ConsExpo, qui est conçu pour estimer l'exposition aux produits de consommation, la dose systémique possible de D6 due à l'utilisation de produits d'hygiène a été estimée pour les femmes qui utilisent des produits de soins de la peau, des produits capillaires et des antitranspirants (RIVM, 2006). Des calculs semblables pour le D4 ont montré que la dose estimée pour les femmes adultes était nettement supérieure à celle des hommes adultes, surtout à cause des produits d'hygiène qui sont laissés sur la peau. Pour cette raison, on ne présente qu'une dose systémique estimée pour les femmes adultes.
Les fabricants de produits d'hygiène doivent signaler à Santé Canada les concentrations de siloxanes, au sein de vastes plages, notamment pour le D6 et les polydiméthylcyclosiloxanes, appelés cyclométhicone dans l'industrie des produits d'hygiène[1]. Santé Canada a été informé qu'environ 530 produits cosmétiques contenaient du D6 comme seul siloxane ou mélangé à d'autres siloxanes et qu'environ 6 000 produits contenant du cyclométhicone ou des mélanges de ce dernier pouvaient contenir du D6 (SDC, 2007). Les données sur la concentration de D6 dans les produits d'hygiène ont été obtenues principalement à partir des renseignements fournis par l'industrie canadienne (Environnement Canada, 2007; SDC, 2007) et complétées par des renseignements issus d'autres sources indiquées dans l'annexe 2. Les données relatives aux parts de marché n'ont pas été utilisées pour déterminer la concentration de D6 dans les produits dominants pour chacune des catégories d'utilisation. Si l'une des concentrations déclarées en réponse à l'avis publié en application de l'article 71 de la LCPE (1999) pour une catégorie de produits était supérieure à celles du SDC, une concentration inférieure de D6 concordant avec la plage des valeurs déclarées au SDC a été utilisée pour cette catégorie de produits afin d'estimer la dose systémique (Environnement Canada, 2007; SDC, 2007).
On a supposé que 20 % du D6 d'un produit appliqué sur la peau s'évaporait et que le reste (80 %) était disponible pour l'absorption cutanée. Cette approche est conforme à l’accent mis sur la prudence dans le cadre des évaluations préalables tout en prenant en compte la pression de vapeur relative du D6 par rapport à celle du D4, pour lequel il existe des données sur l'évaporation (Zareba et al., 2002). Aucune donnée expérimentale pouvant être utilisée pour la répartition des produits d'hygiène liée à l'évaporation sur la peau n'a été trouvée.
Selon des études de dosage oral chez des rats F344, environ 12 % du D6 marqué au 14C était absorbé de façon systémique (Dow Corning, 2004), alors que seulement 0,17 % du D5 marqué au 14C, appliqué topiquement, était absorbé par la peau de ces animaux (Jovanovic et al., 2008). Une étude d'inhalation de 6 heures chez les rats a montré que 1 à 2 % du D5 marqué au 14C était conservé dans le corps (Tobin et al., 2008). On a proposé d'utiliser les valeurs de 12 % pour l'absorption par ingestion, de 0,17 % pour l'absorption par voie cutanée et de 2 % pour l’absorption par inhalation afin d'estimer la dose due aux produits d'hygiène. Les valeurs d'absorption par voie cutanée et par inhalation utilisées pour le D6 correspondent à celles déterminées pour le D5, comme il est indiqué ci-dessus. Cette approche est jugée conforme à l’accent mis sur la prudence dans le cadre des évaluations préalables sans pour autant surestimer les facteurs d'absorption. On fait une distinction entre les produits qui sont retirés de la peau par lavage et ceux qui restent sur le corps. D'autres hypothèses sont formulées à l'annexe 2.
L'annexe 2 présente les résultats d'un exemple de calcul pour l'application d'un produit de coiffure, et le tableau 1, une synthèse de la dose systémique estimée due à l'utilisation de produits d'hygiène par les femmes. Chez les femmes adultes, la limite supérieure estimée de la dose systémique quotidienne pour les produits d'hygiène modélisés, cumulée pour l'exposition par inhalation et par voie cutanée et orale, est de 0,17 mg/kg p. c./j. L'évaluation préalable de l'octaméthylcyclotétrasiloxane (D4) a montré que pour les femmes qui utilisent des produits d'hygiène, la dose systémique est supérieure à celle absorbée par les hommes, ce qui devrait aussi être le cas pour le D6.
Une évaluation de l'exposition au D6, notamment pour les utilisations de produits d'hygiène, a été présentée au gouvernement du Canada dans le cadre du Défi (SEHSC, 2008a). La méthodologie est différente de celle utilisée dans le tableau 1 de l'annexe 2 car elle fait appel à une analyse probabiliste (Monte Carlo) et regroupe les expositions de la population à toutes les sources (notamment les produits d'hygiène) et voies d'exposition (par inhalation, par voie cutanée et par ingestion). On a caractérisé la contribution de l'utilisation des produits d'hygiène à l'exposition totale par plusieurs voies (par inhalation, voie cutanée et ingestion), puis calculé le total pour obtenir une estimation de l'exposition cumulée. Étant donné que le D4 et le D6 ont été utilisés en tant que composés analogues pour déterminer la toxicité orale du D5, ce dernier est utilisé ici comme substitut pour valider l'évaluation d'exposition probabiliste pour le D6. Une évaluation probabiliste de l'exposition pour le D5 a donc été présentée au gouvernement du Canada dans le cadre du programme du Défi (SEHSC, 2008b). Une étude indépendante de l'évaluation probabiliste présentée a conclu que cette évaluation portait sur l'exposition pour les groupes d'utilisateurs et de non-utilisateurs (voir l’annexe 4). Les données ont été réanalysées en fonction des groupes d'utilisateurs afin de comparer les résultats à ceux de l'évaluation déterministe de l'exposition au cours de cette évaluation préalable. Les valeurs probabilistes de l'exposition pour les femmes adultes (groupe d'adultes le plus fortement exposé) basées uniquement sur les groupes d'utilisateurs étaient 10 à 16 fois inférieures aux valeurs déterministes présentées pour le D5. Ainsi, en utilisant le D5 comme composé analogue pour déterminer des valeurs d'exposition probabilistes, on s'attend à ce que les valeurs probabilistes d'exposition pour les femmes adultes (groupe d'adultes le plus fortement exposé) soient 10 à 16 fois inférieures aux valeurs déterministes présentées dans le tableau 1 de l'annexe 2. Il est à noter qu'en raison des exigences relatives à l'analyse détaillée et à la validation des valeurs obtenues au cours d’évaluations probabilistes de l'exposition, ces valeurs se situent normalement hors de portée pour la composante « exposition » d'une évaluation préalable.
Les valeurs probabilistes d'exposition au D5 pour les enfants de 0 à 6 mois (le groupe d'enfants le plus fortement exposé), basées uniquement sur les groupes d'utilisateurs, se situaient entre 0,016 et 0,032 mg/kg p. c./j (voir l’annexe 4). La comparaison avec une évaluation déterministe de l'exposition pour les enfants était impossible en raison du manque de données sur l'utilisation du produit, qui étaient nécessaires à la modélisation de l'exposition pour les enfants lors d'une évaluation déterministe de l'exposition. Les valeurs probabilistes d'exposition pour les enfants sont 5 à 10 fois inférieures aux valeurs déterministes d'exposition au D5 pour les femmes adultes. Ainsi, en utilisant le D5 comme composé analogue pour déterminer des valeurs probabilistes d'exposition pour le D6, on s'attend à ce que les valeurs probabilistes d'exposition pour les enfants soient 5 à 10 fois inférieures aux valeurs déterministes d'exposition pour les femmes adultes en ce qui concerne le D6.
La contribution d'autres types de produits de consommation comme les revêtements de surface, les produits de calfeutrage, les polis et les nettoyants à l'exposition quotidienne due aux utilisations quotidiennes a été jugée beaucoup plus faible; ces produits n'ont donc pas été pris en compte pour la modélisation de la dose quotidienne dans les scénarios d'exposition des consommateurs. Les produits d'hygiène et d'autres produits de consommation contribuent aux concentrations de D6 dans l'air intérieur et ambiant, et ainsi à l'exposition par inhalation. Leur contribution à l'exposition totale des personnes exposées à des sources hors du milieu de travail a été évaluée à partir de l'air intérieur à l'aide du modèle d'exposition de l’environnement à plusieurs milieux, examiné ci-dessus dans cette section.
Le niveau de confiance dans la dose systémique estimée pour le D6 absorbé par l'utilisation des produits d'hygiène est faible. Toutes les valeurs estimées ont été obtenues à l'aide de modèles et de données sur les profils d'utilisation provenant d'études réalisées dans d'autres pays que le Canada. Les valeurs de l'étendue de l'utilisation du D6 dans les produits d'hygiène et de la concentration de D6 dans les produits qui sont commercialisés actuellement peuvent être plus faibles que celles utilisées pour estimer la dose systémique déclarée ci-dessus et dans l'annexe 2 (Environnement Canada, 2007; SEHSC, 2007a). Par conséquent, ces valeurs devraient surestimer l'exposition au D6 due aux produits d'hygiène.
Évaluation des effets sur la santé
L'annexe 3 présente une synthèse des données disponibles relatives aux effets sur la santé du dodécaméthylcyclohexasiloxane (D6).
Aucun organisme international n'a classé le D6 dans une catégorie ou un groupe de substances présentant des propriétés de cancérogénicité, génotoxicité ou toxicité sur le plan de la reproduction ou du développement. Une seule étude nationale concernant les effets sur la santé des cyclosiloxanes a été identifiée à ce jour. Elle émane de l'Agence de protection de l'environnement du Danemark, qui a étudié les effets sur la santé du D4 et du D5, mais pas du D6 (Lassen et al., 2005).
Aucune donnée sur la cancérogénicité du D6 n'a été trouvée. Les résultats des épreuves de mutagénicité avec Salmonella typhimurium ou Escherichia coli(NOTOX, 1990c) étaient négatifs. Aucune autre étude de génotoxicité n'a été trouvée.
En ce qui concerne la toxicité sur le plan de la reproduction, on a déterminé une dose minimale avec effet observé (DMEO) de 1 000 mg/kg p. c./j fondée sur une augmentation (non statistique) du nombre de femelles non gravides après l'accouplement au cours d'une étude à doses répétées sur la toxicité sur le plan de la reproduction et du développement.
Aucun effet sur le développement n'a été observé, quelle que soit la dose. Au cours de cette étude, on a administré à des rats mâles et femelles Sprague-Dawley (SD) des doses de 0, 100, 330 ou 1 000 mg de D6/kg p. c./j dans de l'huile de maïs par gavage oral quotidien 7 jours/semaine, pendant une période maximale de 45 jours consécutifs (Dow Corning, 2006).
Dans la partie de cette étude portant sur les doses répétées, on a déterminé une DMEO de 100 mg/kg p. c./j fondée sur une augmentation du poids du foie et des cas de lipidose périportale dans le foie des femelles, ainsi que des cas d'hypertrophie des cellules folliculaires de la thyroïde chez les rats des deux sexes (effets liés à la dose dans le cas des femelles) en cas d'administration des mêmes doses orales quotidiennes de D6 pendant 28 jours (Dow Corning, 2006). On estime que la valeur de 100 mg/kg p. c./j correspond à la concentration critique pour la toxicité des doses répétées selon cette évaluation fondée sur les effets sur le foie et la thyroïde. Il faut noter que pour le D4 (octaméthylcyclotétrasiloxane) et le D5 (décaméthylcyclopentasiloxane), le foie a également été identifié comme un organe cible pour les expositions par voie orale. L'Agence de protection de l'environnement du Danemark a déterminé que le foie était un organe cible pour les expositions au D4 et on a observé des effets sur le foie dans le cadre d'études d'exposition au D5 par voie orale et par inhalation (Lassen et al., 2005).
Seule une autre étude utilisant des doses répétées a pu être trouvée et aucun signe de toxicité systémique n'a été observé chez des rats SD exposés par gavage oral à 0 ou 1 500 mg/kg p. c./j de D6 pendant quatre semaines (Dow Corning, 1990).
Aucune étude publiée sur la toxicocinétique du D6 n'a été recensée.
Le niveau de confiance dans la base de données de toxicité (surtout pour l'exposition par voie orale) est faible car les données disponibles sur la toxicité aiguë ou à court terme, sur la toxicité pour le développement ou la reproduction ou sur la génotoxicité sont limitées. Par ailleurs, on a noté une pénurie de données sur la toxicité subchronique et chronique, ainsi que sur la cancérogénicité. De plus, on n’a trouvé aucune donnée sur les expositions par inhalation ou par voie cutanée (sauf une étude de toxicité aiguë).
Caractérisation des risques pour la santé humaine
On estime la concentration à effet critique pour la toxicité des doses répétées de D6 à 100 mg/kg p. c./j par voie orale. Cette valeur est fondée sur une augmentation des cas de lipidose périportale et sur des augmentations liées à la dose du poids du foie et de l'hypertrophie des cellules folliculaires de la thyroïde au cours d'une étude de 4 semaines chez les rats. Bien qu'aucune donnée n'ait été trouvée sur l'inhalation de doses répétées, le foie devrait également être un organe cible pour les expositions au D6 par inhalation, car on a déjà observé des effets sur le foie dus à des expositions par inhalation à du D4 et du D5, dont la structure est similaire (voir « Évaluation des effets sur la santé »).
Selon une comparaison entre la concentration à effet critique pour les doses répétées de D6 par voie orale (100 mg/kg p. c./j) et la limite supérieure estimée pour l'absorption quotidienne de D6 par la population canadienne, on obtient une marge d'exposition d'environ 40 000. Cette valeur est fondée sur l'ajustement de la contribution de l'inhalation à l'absorption quotidienne par un facteur d'absorption par inhalation de 2,0 %, ce qui donne une valeur d'exposition systémique de 2,5 µg/kg p. c. /j. Ainsi, les marges d'exposition pour les doses répétées et l'exposition de la population par les milieux naturels sont appropriées pour tenir compte des incertitudes des bases de données sur l'exposition et les effets.
On a corrigé la dose absorbée apparente de 0,09 mg/kg p. c./j pour les produits d'hygiène, qui intègre des facteurs d'absorption pour l'exposition par voies cutanée et orale et par inhalation (tableau 1 de l'annexe 2), en appliquant la réciproque du facteur d'absorption par voie orale pour calculer la dose systémique équivalente de 0,19 mg/kg p. c./j. Si on utilise cette limite supérieure estimée de 0,19 mg/kg p. c./j, la comparaison avec la concentration à effet critique pour les effets des doses répétées par voie orale (100 mg/kg p. c./j) donne une marge d'exposition d'environ 500 pour l'utilisation des produits d'hygiène. Toutefois, on considère que les estimations de l'exposition présentées ci-dessus surestiment l'exposition réelle fondée sur une évaluation probabiliste présentée et sur des renseignements indiquant que le pourcentage de produits d'hygiène commercialisés au Canada contenant du D6 pourrait être inférieur à celui utilisé pour estimer les valeurs d'exposition. D'après les valeurs dérivées d'une étude indépendante de l'évaluation probabiliste de l'exposition pour le D5, qui est considérée comme un substitut de l'évaluation probabiliste de l'exposition pour le D6, il semble que la marge d'exposition pour l'utilisation de produits d'hygiène serait au moins 10 fois plus élevée chez les adultes et 5 fois plus élevée chez les enfants que la marge indiquée ci-dessus (c'est-à-dire > 2 000). D'après les facteurs présentés ci-dessus, notamment le facteur lié à l'étendue de sa base de données, on estime que le D6 ne répond pas aux critères de l'alinéa 64c) de la LCPE (1999).
Incertitudes dans l'évaluation des risques pour la santé humaine
L'analyse complète du mécanisme d'action du dodécaméthylcyclohexasiloxane et les différences possibles entre la sensibilité des humains et celle des animaux de laboratoire aux effets de cette substance n'entrent pas dans le cadre de cette évaluation préalable.
L'estimation de l'exposition et de la dose systémique est incertaine en raison de l'utilisation de la modélisation et du manque de données canadiennes. L'utilisation de modèles et le choix des variables liées à l'utilisation de produits de consommation, notamment la quantité et la fréquence de leur utilisation, la fraction absorbée et les paramètres environnementaux sont également incertains.
La présente évaluation n'examine pas les effets des expositions cumulatives à d'autres cyclosiloxanes dans les polydiméthylsiloxanes (PDMS). Le D4 et le D5 font toutefois l'objet d'évaluations distinctes.
Selon les informations contenues dans la présente évaluation préalable, on conclut que le dodécaméthylcyclohexasiloxane (D6) ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif, sur l'environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
Selon les informations disponibles sur son potentiel d'effets nocifs sur la santé humaine, on conclut que le D6 ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
On conclut donc que le D6 ne correspond pas à la définition de « substance toxique » au sens de l'alinéa 64a) de la LCPE (1999). De plus, le D6 ne répond pas aux critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
La conclusion de cette évaluation préalable est basée sur les informations disponibles à l'heure actuelle et tient compte du fait que des incertitudes sont liées à cette évaluation. Des recherches sur les cVMS sont actuellement menées pour surmonter ces incertitudes, mais certaines de ces recherches ne sont pas encore terminées. Dans le cadre du Défi, toute nouvelle information fournie après l'évaluation préalable finale peut être prise en compte lors de l’étape de la gestion des risques.
La surveillance a également été établie comme un élément essentiel du Plan de gestion des produits chimiques au Canada, et la possibilité que le D6 fasse l’objet d’une surveillance environnementale dans le cadre de ce plan est actuellement envisagée. On considère que les données de concentration in situ contribueront à faire mieux comprendre la distribution du D6 dans l'environnement et son potentiel de bioaccumulation dans les réseaux trophiques appropriés.
Allen, R.B., Kochs, P., Chandra, G. 1997. Industrial organic materials, their environmental entry and predicted fate. In : Organosilicon Materials, Hutzinger, O. (éd.), Handbook of Environmental Chemistry. Berlin : Springer-Verlag. P. 1-25.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2000. Version 1.91. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note réglementaire REG 2007-04 : Liste des produits de formulation de l'ARLA [Internet]. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consulté en septembre 2008].
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci 22(3):337-345.
Arnot, J.A., Gobas, F.A.P.C. 2006. A review of bioconcentration factor (BCF) and bioaccumulation factor (BAF) assessments for organic chemicals in aquatic organisms. Environ Rev14(4):257-297.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341-351.
Arnot, J.A., MacKay, D., Parkerton, T., Bonnell, M. 2008b. A database of fish biotransformation rate constants. Environ. Sci. Technol. (sous presse).
Atkinson, R. 1991. Kinetics of the gas-phase reactions of a series of organosilicon compounds with OH and NO3 radicals and O3 at 297 ± 2 K. Environ. Sci. Technol. 25(5):863-866.
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing Long-Range Transport Potential of Persistent Organic Pollutants. Environ. Sci. Technol.34(4):699-703.
Bidleman, T.F. 2008. Review of the Dow-Corning Health & Environmental Sciences Technical Reports: "Hydrolysis of Octamethylcyclopentasiloxane (D4)" and "Hydrolysis of Decamethylcyclopentasiloxane (D5)". Centre des recherches atmosphériques (Egbert, Ont.). Direction générale des sciences et de la technologie, Environnement Canada.
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2000. Version 4.02. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. Exposure Assessment Tools and Models.
Bruggeman, W.A., Weber-Fung, D., Opperhuizen, A., Van Der Steen, J., Wijbenga, A., Hutzinger, O. 1984. Absorption and retention of polydimethylsiloxanes (silicones) in fish: preliminary experiments. Toxicol. Environ. Chem. 7:287-296.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, chap. 33. Gazette du Canada, Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107, Gazette du Canada, Partie II, vol. 134, n° 7.
Canada, Ministère de l'Environnement, ministère de la Santé. 2006.Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures de gestion et d'évaluation des risques que certaines substances présentent pour la santé des Canadiens et leur environnement, Gazette du Canada, Partie I, vol. 140, n° 49.
Canada, Ministère de l'Environnement, ministère de la Santé. 2007. Loi canadienne sur la protection de l'environnement (1999) : Avis de deuxième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 141, n° 19.
CATABOL [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatorov University, Laboratory of Mathematical Chemistry. [consulté le 4 février 2008]. OASIS Software.
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
Domoradzki, J. 2008a. Refinement in the determination of the BMF value for D4 from a fish feeding study in rainbow trout. Midland (MI) : Dow Corning Corporation, Health and Environmental Sciences.
Domoradzki, J. 2008b. Refinement in the determination of the BMF value for D5 from a fish feeding study in rainbow trout. Midland (MI) : Dow Corning Corporation, Health and Environmental Sciences.
Dow Corning Corporation. 1985. Bioconcentration of dodecamethylcyclohexasiloxane (D6) in Daphnia magna. Dow Corning, Report No. 1985-I0008-1442.
Dow Corning. 1990. A 28-day subchronic oral gavage feasibility study of various low molecular weight silicone oligomers in rats. Report No. 1990-I0000-35105. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodécaméthylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007]. (D5), n° CAS 541-02-6. 13 novembre 2007].
Dow Corning. 2004. Disposition of 14C-dodecamethylcyclohexasiloxane (D6) following single, oral administration to Fischer 344 rats. Report No. 2004-I0000-53503. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodécaméthylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
Dow Corning. 2006. Combined repeated dose toxicity study with the reproductive/developmental toxicity screening test for dodecamethylcyclohexasiloxane (D6) in rats. Report No. 2006-I0000-56154. [cité dans SEHCS (Silicones Environmental, Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
Drottar, K.R. 2005. 14C- Dodecamethylcyclohexasiloxane (14C-D6): Bioconcentration in the fathead minnow (Pimephales promelas) under flow-through test conditions. Dow Corning Corporation. Silicones Environment, Health and Safety Council. Study No. 9882-102.
Drottar, K. 2006. 14C-Octamethylcyclotetrasiloxane (14C-D4): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Dow Corning Report No. 2007-I0000-57314.
Drottar, K. 2007. 14C-Decamethylcyclopentasiloxane (14C-D5): Dietary bioaccumulation in the rainbow trout (Oncorhynchus mykiss) under flow-through conditions. Dow Corning Report No. 2007-I0000-57314.
Durham, J., Kozerski, G. 2005. Hydrolysis of octamethylcyclotetrasiloxane (D4). Silicones Environment, Health and Safety Council. Study No. 10000-102.
Durham, J. 2006. Hydrolysis of octamethylcyclotetrasiloxane (D5). Silicones Environment, Health and Safety Council. Study No. 10040-102.
[ECB] Bureau européen des substances chimiques. 2007.
[ESIS] European Chemical Substances Information System, Version 4.60. [consulté en décembre 2007].
[ECOSAR] Ecological Structural Activity Relationships [Internet]. [2004] Version 0.99g. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models
Environnement Canada. 1988. Données relatives à la Liste intérieure des substances
(LIS) 1984-1986, recueillies en vertu du par. 25(1) de la LCPE (1988) et conformément à la Liste intérieure des substances : Guide du déclarant, 1988. Données préparées par : Environnement Canada.
Environnement Canada. 2007. Données sur les substances du lot 2 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances du groupe 2 du Défi. Données préparées par Environnement Canada, Programme des substances existantes.
Environnement Canada. 2008a. Assumptions, limitations and uncertainties of the mass flow tool for dodecamethylcyclohexasiloxane, CAS RN 540-97-6 Ébauche de document interne. Gatineau (Qc) : Environment Canada, Division des substances existantes. Disponible sur demande.
Environnement Canada. 2008b. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series, technical guidance module: Overview of Aquatic Risk Distribution Methodology. Document de travail. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
Environnement Canada. 2008c. Aquatic risk distribution summary for dodecamethylcyclohexasiloxane, CAS RN 540-97-6. 2008-09-09. Document non publié. Gatineau (Qc) : Environnement Canada, Division des substances existantes.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.): Université Trent, The Canadian Centre for Environmental Modelling and Chemistry - EQC Model.
Fackler, P.H., Dionne, E., Hartley, D.A., Hamelink, J.L. 1995. Bioconcentration by fish of a highly volatile silicone compound in a totally enclosed aquatic exposure system. Environ. Toxicol. Chem. 14(10):1649-1656.
Fenner, K., Scheringer, M., MacLeod, M., Matthies, M., McKone, T.E., Stroebe, M., Beyer, A., Bonnell, M., Le Gall, A., Klasmeier, J., et al. 2005. Comparing estimates of persistence and long-range transport potential among multimedia models. Environ. Sci. Technol. 39(7):1932-1942.
Flaningam, O.L. 1986. Vapor pressure of poly (dimethylsiloxane) oligomers. J Chem Eng Data 31(3):266-272.
[GEMStat] Global Water Quality Data and Statistics [base de données sur Internet]. 2008. Burlington (Ont.) : Organisation des Nations Unies, Programme de l'eau du Système mondial de surveillance continue de l'environnement (GEMS). [consulté en septembre 2008].
Gobas, F.A.P.C., Kelly, B.C., Arnot, J.A. 2003. Quantitative structure activity relationship for predicting the bioaccumulation of POPs in terrestrial food-webs. QSAR Comb Sci 22(3):329-335.
Han, X., Nabb, D.L., Mingoia, R.T., Yang, C.-H. 2007. Determination of xenobiotic intrinsic clearance in freshly isolated hepatocytes from rainbow trout (Oncorhynchus mykiss) and rat and its application in bioaccumulation assessment. Environ. Sci. Technol. 41: 3269-3276.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2000. Version 3.10. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Hu, T.-M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci 3(4), article 29. [consulté en obtobre 2008].
Hurd, C.B. 1946. Studies on siloxanes: 1. The specific volume and viscosity in relation to temperature and constitution. J. Am. Chem. Soc. 68(3):364.
Jovanovic, M.L., McMahaon, J.M., McNett, D.A., Tobin, J.M., Plotzke, K.P. 2008. In vitro and in vivopercutaneous absorption of 14C-octamethylcyclotetrasiloxane (14C-D4) and 14C-decamethylcyclopentasiloxane (14C-D5). Regul. Toxicol. Pharmacol. 50(2):239-248.
Kaj, L., Andersson, J., Palm Cousins, A., Remberger, M., Ekheden, Y., Dusan, B. Bror-ström-Lundén, E. 2005. Results from the Swedish National Screening Programme 2004: Subreport 4: Siloxanes. IVL.
Kent, D.J., McNamara, P.C., Putt, A.E., Hobson, J.F., Silberhorn, E.M. 1994. Octamethylcyclotetrasiloxane in aquatic sediments: toxicity and risk assessment. Ecotox. Environ. Saf. 29(3):372-389.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, A.C., McKone, T.E., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Environ. Sci. Technol. 40(1):53-60.
Kochetkov, A., Smith, J.S., Ravikrishna, R., Valsaraj, K.T., Thibodeaux, L.J. 2001. Air-water partition constants for volatile methyl siloxanes. Environ. Toxicol. Chem. 20(10):2184-2188.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.67. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
Kozerski, G. 2007. Determination of the 1-octanol/water partition coefficient of decamethylcyclopentasiloxane (D5) by the slow-stirring method using gas chromatography and mass spectrometry. Silicones Environmental, Health, and Safety Council (SEHSC).
Kozerski, G. Shawl, H. 2007. Determination of the 1-octanol/water partition coefficient of octamethylcyclotetrasiloxane (D4) by the slow-stirring method using gas chromatography and mass spectrometry. Silicones Environmental, Health, and Safety Council (SEHSC). Dow Corning Study No. 10198-102.
Kozerski, G. 2008. SEHSC response to Dr. Bidleman's review on hydrolysis studies of D4 and D5. Dow Corning Corporation. Juillet 2008.
Krueger, H., Thomas, S., Kendall, T. 2007. D5: a prolonged sediment toxicity test with Lumbriculus variegatus using spiked sediment. Wildlife International, LTD. Project No. 583A-108. Centre européen des silicones (CES).
Krueger, H.O., Thomas, S.T., Kendall, T.Z. 2008. D5: a prolonged sediment toxicity test with Chironomus riparius using spiked sediment. Wildlife International, LTD. Project No. 583A-108. Silicones Environmental, Health, and Safety Council (SEHSC).
Lassen, C., Hansen, C.L., Mikkelson, S.J., Maag, J. 2005. Siloxanes – consumption, toxicity and alternatives. Danish Ministry of the Environment, Environmental Protection Agency (Danish EPA). Environmental Project No. 1031.
Lucas, S.V. 1984. GC/MS analysis of organics in drinking water concentrates and advanced waste treatment concentrates. Vol. 1. Analysis results for 17 drinking water and 16 advanced waste treatment and 3 process blank concentrate. EPA-600/1-84-020A. (NTIS P85-128221). Columbus (OH) : Columbus Labs, Health Effects Research Laboratory. P. 45, 46, 147 et 150.
Maxim, L.D. 1998. D4, D5, and D6 Exposure in the manufacture and use of personal care products: an interim assessment. Dow Corning Corporation.
Miller, J. 2006. Determination of n-octanol/water partition coefficient of 14C-dodecamethylcyclohexasiloxane (14C-D6) by Liquid Scintillation Counting. Silicones Environmental, Health and Safety Council. Report No. 9890-102.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models
Navea, J.G., Stanier, C.O., Young, M.A., Grassian, V.H. 2007. A laboratory and modeling study at the University of Iowa designed to better understand the atmospheric fate of D4 and D5. Rapport technique annuel (août 2006-juillet 2007). Iowa City (IA) : University of Iowa, Department of Chemistry, and Chemical and Biochemical Engineering.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2006. Columbus (OH) : American Chemical Society. [consulté le 11 octobre 2006]. National Chemical Inventories (NCI) on CD.
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26(6):1304-1319.
[NILU] Norsk institutt for luftforskning. 2007. Siloxanes in the Environment of the Inner Oslofjord. Report No. 986/2007. Kjeller (Norvège) : Norwegian Institute for Air Research.
[NMI] Non-Medicinal Ingredients [base de données exclusive]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
[NOAA] National Oceanic and Atmospheric Administration. 2008. NOAA CoastWatch Great Lakes Program. NOAA Great Lakes Environmental Research Laboratory. [consulté en septembre 2008].
Norden. 2005. Siloxanes in the Nordic Environment. TemaNord 2005:593. Copenhague (Danemark) : Conseil des ministres des pays nordiques.
NOTOX. 1990a. Assessment of acute oral toxicity with dodecamethylcyclohexasiloxane in the rat (acute toxic class method). NOTOX, Project 262575. [cité dans SEHSC (Silicones Environmental Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
NOTOX. 1990b. Assessment of acute dermal toxicity with dodecamethylcyclohexasiloxane in the rat. NOTOX, Project 262586. [cité dans SEHSC (Silicones Environmental Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
NOTOX. 1990c. Evaluation of the mutagenic activity of dodecamethylcyclohexasiloxane in the Salmonella Typhimurium reverse mutation assay and the Escherichia Coli reverser mutation assay (with independent repeat). NOTOX, Project 262621. [cité dans SEHSC (Silicones Environmental Health and Safety Council). 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), n° CAS 540-97-6. 13 novembre 2007].
[NYIEQ] New York Indoor Environmental Quality Center. 2005. Indoor Environmental Quality: Assessing and Mitigating the Impact of Exposure to Multiple Indoor Contaminants. Project No. R828605-01.
[OCDE] Organisation de coopération et de développement économiques. 2004. Emission Scenario Document on Plastics Additives [Internet]. Paris (France) : Direction de l’environnement de l’OCDE, Division de l’hygiène et de la sécurité de l’environnement. [consulté en septembre 2004].
[OCDE] Organisation de coopération et de développement économiques 2006. Draft Emission Scenario Document on Transport and Storage of Chemicals. Préparé par l'Environment Agency (Royaume-Uni). Disponible sur demande auprès de : Environnement Canada, Division des substances existantes, Ottawa, K1A 0H3.
[OCDE] Organisation de coopération et de développement économiques 2007. Manual for investigation of HPV chemicals. OCDE Secretariat, July 2007. [consulté en janvier 2008].
[PCKOCWIN] Organic Carbon Partition Coefficient Program for Windows [modèle d'estimation]. 2000. Version 1.66. Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models.
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. [consulté en mars 2006].
Powell, D., Kozerski, G. 2007. Cyclic methylsiloxane (cVMS) materials in surface sediments and cores for Lake Ontario. Centre européen des silicones (CES). Rapport préliminaire.
Powell, D.E. 2008. Interim update on cyclic methylsiloxane (cVMS) materials in surface sediment, cores, and zooplankton for Lake Opeongo, Ontario, Canada. Centre européen des silicones (CES). 14 juillet 2008.
Ren, X., Harder, H., Martinez, M., Lesher, R.L., Oliger, A., Shirley, T., Adams, J., Simpas, J.B., Brune, W.H. 2003. HOx concentrations and OH reactivity observations in New York City during PMTACS-NY2001. Atmos. Environ. 37(26):3627-3637.
Ren, X., Brune, W.H., Mao, J., Mitchell, M.J., Lesher, R.L., Simpas, J.B., Metcalf, A.R., Schwab, J.J., Cai, C., Li, Y., et al. 2006. Behaviour of OH and HO2 in the winter atmosphere in New York City. Atmos. Environ. 40:S252-S263.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo 4.1) Model [Internet]. Version 4.1. Pays-Bas : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Document non publié. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu. Disponible sur demande.
[SBSC] Santé et Bien-être social Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : Santé et Bien-être social Canada. [cité dans Santé Canada, 1998].
Scheringer, M., MacLeod, M., Wegmann, F. 2006. The OECD POV and LRTP Screening Tool [Internet - Downloads]. Version 2.0. Distribué lors de l’atelier OCDE-PNUE sur l’utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada), du 31 mai au 3 juin 2006. [consulté en février 2008].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2007. Ottawa (Ont.) : Santé Canada. [consulté en janvier 2008].
[SEHSC] Silicones Environmental, Health and Safety Council. 2005. IUCLID Dataset for CAS No. 541-05-9. Submitted by Silicones Environmental, Health and Safety Council, septembre 2005.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007a. Communication du SEHSC à Environnement Canada et Santé Canada sur le n° CAS 69430-24-6, 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007b. Présentations du SEHSC à Environnement Canada et Santé Canada le 2 octobre 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007c. Additional toxicity and exposure information for a screening health assessment of dodecamethylcyclohexasiloxane (D6), CAS No. 540-97-6. 13 novembre 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2007d. Dodecamethylcyclohexasiloxane (D6), CAS No. 540-97-6. Présentation finale à la LIS. Silicones Environmental, Health and Safety Council, 12 novembre 2007.
[SEHSC] Silicones Environmental, Health and Safety Council. 2008a. Exposure assessment for D6 – Canada. 2 avril 2008.
[SEHSC] Silicones Environmental, Health and Safety Council. 2008b. Silicone industry comments on Health and Environment Canada's Draft Screening Assessment of D6: Special pattern of cVMS environmental release and its effects on their half-lives in the atmosphere. 16 juillet 2008.
Sousa, J.V., McNamara, P.C., Putt, A.E., Machado, M.W., Surprenant, D.C., Hamelink, J.L., Kent, D.J., Silberhorn, E.M., Hobson, J.F. 1995. Effects of octamethylcyclotetrasiloxane (OMCTS) on freshwater and marine organisms. Environ. Toxicol. Chem. 14(10):1639-1647.
Springborn Smithers Laboratories. 2003. Decamethylcyclopentasiloxane (D5) – the full life-cycle toxicity to midge (Chironomous riparius) under static conditions. Silicones Environmental, Health and Safety Council. Report No. 12023.6140.
Springborn Smithers Laboratories. 2005. Determining the biodegradability of dodecamethylcyclohexasiloxane based on the draft OECD 310 Sealed Vessel CO2 Evolution Biodegradation Test. Silicones Environmental, Health and Safety Council. Study No. 12023.6147.
Springborn Smithers Laboratories. 2006. Dodecamethylcyclohexasiloxane (D6): full life-cycle toxicity test with water fleas, Daphnia magna, under static renewal conditions. Silicones Environmental, Health and Safety Council. Étude no 1203-6149.
[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (Ontario): Université Trent, The Canadian Centre for Environmental Modelling and Chemistry - TaPL3.
Tobin, J.M., McNett, D.A., Durham, J.A., Plotzke, K.P. 2008. Disposition of decamethylcyclopentasiloxane in Fischer 344 rats following single or repeated inhalation exposure to 14C-decamethylcyclopentasiloxane (14C-D5). Inhal Toxicol 20:513-531.
[U.S. EPA] United States Environmental Protection Agency. 1992. Thirtieth report of the Interagency Agency Testing committee to the Administrator, receipt of report and request for comments regarding Priority Testing List of chemicals. 9 juillet 1992. Federal Register. 57(132):30603-30618.
[U.S. EPA] United States Environmental Protection Agency. 1994a. Air quality: revision to definition of volatile organic compounds–exclusion of volatile methyl siloxanes and parachlorobenzotrifluoride. [consulté en février 2008].
[U.S. EPA] United States Environmental Protection Agency. 1994b. Acute toxicity study of KF-996S (dodecamethylcyclohexasiloxane) in rats with cover letter dated 04/08/94. EPA/OTS; Doc. No. 86940001751.
[U.S. EPA] United States Environmental Protection Agency. 2007. High Production Volume (HPV) Challenge Program: Sponsored Chemicals, septembre 2007. [consulté en février 2008].
Varaprath, S., Frye, C.L., Hamelink, J. 1996. Aqueous solubility of permethylsiloxanes (silicones), Short Communication. Environ. Toxicol. Chem. 15(8):1263-1265.
Wania, F. 2003. Assessing the potential of persistent organic chemicals for long-range transport and accumulation in polar regions. Environ. Sci. Technol. 37(7):1344-1351.
Wania, F. 2006. Potential of degradable organic chemicals for absolute and relative enrichment in the Arctic. Environ. Sci. Technol. 40(2):569-577.
Will, R., Löchner, U., Masahiro, Y. 2007. CEH Marketing Research Report Siloxanes. Menlo Park (CA) : SRI Consulting.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'estimation]. 2000. Version 1.41 Washington (DC) : U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Exposure Assessment Tools and Models
Xu, S., Lehmann, R.G., Miller, J.R., Chandra, G. 1998. Degradation of polydimethylsiloxanes (silicones) as influenced by clay minerals Environ. Sci. Technol. 32(9):1199-1206.
Xu, S. 1999. Fate of cyclic methylsiloxanes in soils. 1. The degradation pathway. Environ. Sci. Technol. 33(4):603-608.
Xu, S., Chandra, G. 1999. Fate of cyclic methylsiloxanes in soils 2. Rates of degradation and volatilization. Environmental Science and Technology 33(22):4034-4039.
Xu, S. 2006. 1-Octanol/air partitioning coefficients of octamethylcyclotetrasiloxane (D4), decamethylcyclopentasiloxane (D5) and dodecamethylcyclohexasiloxane (D6) at different temperatures. Centre européen des silicones (CES). Rapport CES, 27 décembre 2006.
Xu, S. 2007. Long range transport potential of cyclic methylsiloxanes estimated using a global average chemical fate model: the OECD Tool. Silicones Environmental, Health and Safety Council (SEHSC). Rapport préliminaire.
Xu, S., Kropscott, G. 2007. Simultaneous determination of partition coefficients for octamethylcyclotetrasiloxane and decamethylcyclopentasiloxane. Rapport préliminaire. Dow Corning, rapport technique non réglementé. DCC Study No. 10336-101.
Xu, S., Miller, J.A. 2008. Aerobic transformation of octamethylcyclotetrasiloxane (D4) in water/sediment system. Centre européen des silicones (CES). Rapport intermédiaire.
Zareba, G., Gelein, R., Morrow, P.E., Utell, M.J. 2002. Percutaneous absorption studies of octamethylcyclotetrasiloxane using the human skin /nude mouse model. Skin Pharmacol. Appl. Skin Physiol. 15(3):184-194.
Annexes de l'évaluation préalable
- Annexe 1 : Limites supérieures estimées de l'absorption quotidienne de D6 pour la population canadienne (µg/kg p. c./j pour divers groupes d'âge)
- Annexe 2 : Modélisation de l'exposition des consommateurs
- Annexe 3 : Récapitulatif des informations concernant les effets du dodécaméthylcyclohexasiloxane (D6) sur la santé
- Annexe 4 : Étude de l'évaluation probabiliste de l'exposition au D5
- Annexe 5 : Paramètres d'entrée de la modélisation dans divers milieux applicable au D6 aux dins de l'évaluation écologique préalable