Évaluation préalable pour le Défi concernant le [1R-[1α(R*),2β,4aβ,8aα]]-2-Hydroxy-α,2,5,5,8a-pentaméthyl-α-vinyldécahydronaphtalène-1-propan-1-ol (Sclaréol) Numéro d'enregistrement du Chemical Abstracts Service 515-03-7
Table des matières
- Sommaire
- 1. Introduction
- 2. Identité de la substance
- 3. Propriétés physiques et chimiques
- 4. Sources
- 5. Utilisations
- 6. Rejets dans l'environnement
- 7. Devenir dans l'environnement
- 8. Potentiel d'effets nocifs sur l'environnement
- 9. Potentiel d'effets nocifs sur la santé humaine
- 10. Conclusion
- Références
- Annexes
Liste des tableaux
- Tableau 2–1. Identité de la substance : sclaréol
- Tableau 3–1. Propriétés physiques et chimiques du sclaréol
- Tableau 4–1. Données extrapolées sur la quantité totale annuelle de sclaréol (n° CAS 515-03-7)
- Tableau 7–1. Résultats de la modélisation de la fugacité de niveau III (EQC 2003) pour le pourcentage de répartition du sclaréol dans chaque milieu
- Tableau 7–2. Données modélisées sur la dégradation du sclaréol
- Tableau 7–3. Données modélisées sur la bioaccumulation du sclaréol
- Tableau 8–1. Données modélisées de toxicité du sclaréol pour les organismes aquatiques
- Tableau 8–2. Données empiriques sur la toxicité du sclaréol pour les microbes et champignons
- Tableau 9–1. Estimations de l'exposition cutanée quotidienne par des cosmétiques couramment utilisés – adultes
- Tableau 9–2. Estimation de l'exposition cutanée aiguë par l’utilisation de cosmétiques – adultes
- Tableau 9–3. Estimations de l'exposition cutanée chronique des nourrissons et tout-petits aiguë par l’utilisation de cosmétiques
Sommaire
Conformément à l'article 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE], la ministre de l'Environnement et la ministre de de la Santé, ont effectué une évaluation préalable du [1R-[1α(R*),2β,4aβ,8aα]]-2-hydroxyle-α,2,5,5,8a-pentaméthyl-α-vinyldécahydronaphtalène-1-propan-1-ol, désigné dans la présente évaluation, par son nom commun : sclaréol. Son numéro d'enregistrement du Chemical Abstracts ServiceNote de bas de page1 est : 515-03-7. On a accordé la priorité au sclaréol, car il satisfait aux critères de catégorisation du paragraphe 73(1) de la LCPE.
Le sclaréol est produit naturellement et il est un constituant des huiles essentielles de plusieurs genres (p. ex. Salvia et Stachys) de la famille des menthes (Lamiaceae). Les huiles essentielles contenant du sclaréol pourraient être produites par les plantes pour se protéger des agents pathogènes (bactéries et champignons), prévenir la prédation des herbivores ou modifier la croissance des plantes avoisinantes. Le sclaréol a été isolé dans divers plantes telles que Salviasclarea, Salvia officinalis, Salvia judaica, Salvia palaestina, Juniperus phoenicea, Cistus creticus et Astragalus brachystachys, ainsi que dans quelque 25 espèces du tabac comme Nicotiana glutinosa et Nicotiana tabacum.
On n'a pas déclaré d'importation ou de fabrication de sclaréol au Canada en quantités dépassant le seuil de 100 kg ni d'utilisation de cette substance en quantités excédant le seuil de 1000 kg en 2005 et en 2006. Toutefois, on estime qu'entre 76 et 1350 kg de sclaréol sont annuellement utilisés au Canada. Le sclaréol est un constituant de l'huile essentielle de sauge sclarée, dont on a déclaré la présence dans des produits cosmétiques, des aromatisants, des produits d'aromathérapie et des parfums au Canada.
Lorsqu'il est synthétisé par des plantes, le sclaréol devrait être dégradé par des bactéries du sol ou certaines espèces de champignons, comme plusieurs études qui ont démontré la métabolisation du sclaréol par des micro-organismes du sol. Cependant, lorsque les huiles essentielles contenant du sclaréol sont extraites de ces plantes et sont intégrées à des cosmétiques, le sclaréol rejeté à l'égout devrait, après un passage par un système de traitement des eaux usées, se retrouver dans les effluents atteignant le milieu aquatique où sa dégradation devrait être beaucoup plus lente.
Le sclaréol est très peu hydrosoluble et, lorsqu'il est rejeté dans les eaux de surface, il aura tendance à se répartir dans les sédiments. D'après ses propriétés physiques et chimiques, les données modélisées et une quantité limitée de données expérimentales, le sclaréol devrait persister dans l'eau et les sédiments. Les données modélisées relatives à sa répartition entre l'octanol et l'eau laissent entendre qu'il présente un potentiel élevé de bioaccumulation dans les tissus adipeux des organismes (les valeurs du facteur de bioconcentration, ou BFC, et du facteur de bioaccumulation, ou BAC, se situent entre 4247 et 31 890). Les données modélisées sur la toxicité du sclaréol indiquent que la substance peut avoir des effets nocifs sur les organismes aquatiques. D'après des données expérimentales sur la toxicité pour des organismes microbiens, le sclaréol aurait également des effets nocifs chez les bactéries et champignons.
Compte tenu des petites quantités de sclaréol commercialisées au Canada et des utilisations qui peuvent causer des rejets dispersés, on peut prévoir une faible exposition de l'environnement à la substance. À la lumière des renseignements disponibles présentés dans cette évaluation préalable, le sclaréol pose un risque faible de danger pour les organismes et pour l'environnement en général. Il est donc conclu que le sclaréol ne satisfait pas aux critères énoncés aux alinéas 64(a) ou (b) de la LCPE puisqu'il ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur sa diversité biologique, ou de nature à mettre en danger l'environnement essentiel pour la vie.
D'après les renseignements disponibles, l'exposition de la population générale au sclaréol devrait être négligeable en raison du faible nombre d'utilisations de la substance déclarées au Canada en 2006. La principale voie d'exposition de la population générale devrait être le contact cutané en raison de la présence de sclaréol dans l'huile essentielle de sauge sclarée, un ingrédient de certains cosmétiques. Les renseignements disponibles sur les effets sur la santé nous indiquent que la substance ne présente pas de potentiel de danger élevé. La comparaison des estimations prudentes de la limite supérieure de l'exposition cutanée au sclaréol découlant de la présence d'huile essentielle de sauge sclarée dans les cosmétiques et de la dose sans effet nocif observé chez les animaux de laboratoire nous permet de conclure que les marges d'exposition sont adéquates pour dissiper les incertitudes des bases de données sur les effets sur la santé et l'exposition. À la lumière des renseignements disponibles, il est conclu que le sclaréol ne satisfait pas aux critères de l'alinéa 64(c) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Nous concluons, en nous fondant sur les renseignements disponibles, que le sclaréol ne satisfait à aucun des critères énoncés à l'article 64 de la LCPE.
1. Introduction
La Loi canadienne sur la protection de l'environnement (1999) [LCPE] (Canada 1999) exige que la ministre de l'Environnement et la ministre de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
Se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé que l'on devrait accorder une grande priorité à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l'on croit être commercialisées au Canada
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine sur la base de classements effectués par d'autres organismes nationaux ou internationaux relativement à leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada 2006a), dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a accordé une priorité à l'évaluation du [1R-[1α(R*),2β,4aβ,8aα]]-2-Hydroxy-α,2,5,5,8a-pentaméthyl-α-vinyldécahydronaphtalène-1-propan-1-olR (nom IUPAC : 1R,2R,4aS,8aS)-1-[(3R)-3-Hydroxy-3-méthyl-4-pentén-1-yl]-2,5,5,8a-tétraméthyldécahydro-2-naphtalénol), car il satisfait aux critères formulés au paragraphe 73(1) de la LCPE (ECCC et Santé Canada modifié 2007). Le 26 décembre 2009, la Gazette du Canada (Canada 2009a et 2009b) publiait le volet du Défi de cette substance avec, en parallèle un profil qui reprenait l'information technique obtenue avant décembre 2005 et sur laquelle reposait la catégorisation. Toutefois, aucun renseignement sur les propriétés chimiques, le potentiel de bioaccumulation, la persistance, les dangers, les utilisations, et l'exposition inhérents à la substance n'a pas été communiqué en réponse au Défi.
Les évaluations préalables effectuées aux termes de la LCPE sont axées sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l'article 64 de la Loi. Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudenceNote de bas de page2 .
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l'exposition à celle-ci, y compris l'information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l'évaluation préalable de cette substance sont tirées de publications originales, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et d'autres documents consultés au cours de recherches documentaires menées jusqu'en août 2010 pour les portions de l'évaluation préalable portant sur l'environnement et la santé. En février 2017, une recherche rapide dans les publications scientifiques n'a pas relevé d'information nouvelle ou importante qui aurait pu modifier les conclusions de cette évaluation. Les études les plus importantes ont fait l'objet d'une évaluation critique. De plus, les résultats de modélisation ont pu servir à formuler des conclusions.
Lorsqu'ils étaient disponibles et pertinents, les renseignements contenus dans les évaluations des dangers effectués par d'autres instances ont été utilisés.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement et Changement climatique Canada et elle intègre les résultats d'autres programmes exécutés par ces ministères. Les parties de cette évaluation préalable portant sur l'environnement et la santé ont fait l'objet d'un examen par des pairs externes ou d'une consultation auprès d'eux. Les méthodes utilisées dans les évaluations préalables du Défi ont été examinées par un Groupe consultatif du Défi indépendant. En outre, l'ébauche de cette évaluation préalable a fait l'objet d'une période de commentaires par le public d'une durée de 60 jours. Aucun commentaire de l'extérieur sur l'ébauche d'évaluation préalable n'a été reçu. Santé Canada et Environnement et Changement climatique Canada assument l'entière responsabilité du contenu final et des conclusions de la présente évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation préalable sont résumées plus bas.
2. Identité de la substance
2.1 Nom de la substance
Dans le présent document, nous désignerons le [1R-[1α(R*),2β,4aβ,8aα]]-2-Hydroxy-α,2,5,5,8a-pentaméthyl-α-vinyldécahydronaphtalène-1-propan-1-ol par son nom commun : le sclaréol.
| Numéro de registre du Chemical Abstracts Service (NE CAS) | 515-03-7 |
|---|---|
| Nom dans la LIS[a] | [1R-[1α(R*),2β,4aβ,8aα]]-2-hydroxy-α,2,5,5,8a-pentaméthyl-α-vinyldécahydronaphtalène-1-propan-1-ol |
| Noms relevés dans les National Chemical Inventories (NCI)[b] | 1-naphthalenepropanol, α-ethenyldecahydro-2-hydroxy-α,2,5,5,8α-pentamethyl-, (αR,1R,2R,4αS,8αS)- (TSCA, PICCS, ASIA-PAC, NZIoC) 1-naphthalenepropanol, α-ethenyldecahydro-2-hydroxy-α,2,5,5,8α-pentamethyl-, [1R-[1α(R*),2β,4αβ,8αα]]- (AICS) [1R-[1α(R*),2β,4αβ,8αα]]-2-Hydroxy-α,2,5,5,8a-pentaméthyl-α-vinyldécahydronaphtalène-1-propan-1-ol (EINECS) Sclareol (PICCS) |
| Autres noms | (-)-Sclaréol Labd-14-ene-8,13-diol, (13R)- [1R-[1α(R*),2β,4αβ,8αα]]-2-Hydroxy-α,2,5,5,8a-pentaméthyl-α-vinyldécahydronaphtalène-1-propan-1-ol (1R,2R,4aS,8aS)-1-[(3R)-3-Hydroxy-3-méthyl-4-pentén-1-yl]-2,5,5,8a-tétraméthyldécahydro-2-naphtalénol (nom IUPC français) |
| Groupe chimique (groupe de la LIS) |
Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Diterpènes bicycliques |
| Principale sous-classe chimique | Labdanes diterpènes diols |
| Formule chimique | C20H36O2 |
| Structure chimique | 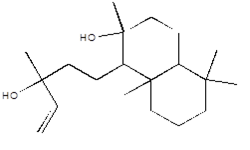 |
| SMILES[c] | OC(C=C)(CCC(C(C(C(CC1)(C)C)CC2)(C1)C)C2(O)C)C |
| Masse moléculaire | 308,51 g/mol |
a Liste intérieure des substances
b National Chemical Inventories (NCI) 2007 : AICS (inventaire des substances chimiques de l'Australie),ASIA-PAC (listes des substances de l'Asie-Pacifique), EINECS (inventaire européen des substances chimiques commercialisées existantes), NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande), PICCS (inventaire des produits et substances chimiques des Philippines), et TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act).
c Simplified Molecular Input Line Entry System : système simplifié d'identification sur une seule ligne
3. Propriétés physiques et chimiques
On trouvera au tableau 3-1, les données physiques et chimiques (valeurs modélisées et expérimentales) du sclaréol importantes pour son devenir dans l'environnement. Le sclaréol est une poudre cristalline blanche. Selon le programme de modélisation ACD/pKaDB (2005) la constante de dissociation acide primaire, pKa1 = à 15,5 et sa constante de dissociation acide secondaire, pKa2 = 14,5. Dans les conditions normales de l'environnement, le sclaréol s'ionise peu dans l'eau et on peut donc l'évaluer au moyen de bilans massiques et de modèles de relations quantitatives structure-activité (RQSA) fondées sur les propriétés des espèces neutres.
Nous avons utilisé les modèles de RQSA pour générer la valeur de certaines propriétés physiques et chimiques du sclaréol. Ces modèles (hormis WSKOWWIN 2008) sont surtout fondés sur des méthodes d'addition de fragments. En d'autres termes, ils s'appuient sur la structure d'une substance donnée. Seules les formes neutres d'un produit chimique peuvent être intégrées comme données d'entrée dans ces modèles (dans le format SMILES). Par conséquent, les valeurs modélisées figurant au tableau 3-1 ne concernent que la forme neutre du sclaréol.
| Propriété | Type | Valeur[a] | Descripteur | Références |
|---|---|---|---|---|
| Point de fusion (°C) | Expérimental | 104 à 105 | S.O. | Jermstad 1927 |
| Point de fusion (°C) | Expérimental | 106[b] | S.O. | RIFM 1992 |
| Point d'ébullition (°C) | Expérimental | 218 à 220[b] (à 19 mmHg) |
S.O. | FTSS Sigma-Aldrich 2010 |
| Point d'ébullition (°C) | Expérimental | > 340 | S.O. | RIFM 1992 |
| Masse volumique (g/cm3) | Expérimental | 0,954 | S.O. | Lookchem 2010 |
| Pression de vapeur (Pa) | Expérimental | < 0,1333[b] (< 0,001 mm Hg) |
25 | RIFM 1992 |
| Pression de vapeur (Pa) | Modélisé | 0,3 (0,00212 mmHg) |
S.O. | EPI Suite 2008 |
| Constante de la loi de Henry (Pa·m3/mol) | Modélisé (méthode d'estimation fondée sur les liaisons) | 0,32 (3,11 × 10−6 atm·m3/mol) |
S.O. | HENRYWIN 2008 |
| Constante de la loi de Henry (Pa·m3/mol) | Modélisé (méthode d'estimation fondée sur les groupes) | Non calculable | S.O. | HENRYWIN 2008 |
| Log Koe (coefficient de partage octanol-eau) (sans dimension) |
Modélisé | 6,0[b] | S.O. | KOWWIN 2008 |
| Log Koe (coefficient de partage octanol-eau) (sans dimension) |
Modélisé | 3,29 | S.O. | TOPKAT 2004 |
| Log Koe (coefficient de partage octanol-eau) (sans dimension) |
Modélisé | 4,93 | S.O. | ALOGPS c2001-2009 |
| Log Kco (coefficient de partage carbone organique/eau) (sans dimension) |
Modélisé | 3,1 à 3,4 | S.O. | KOCWIN 2008 |
| Log Koa (coefficient de partage octanol-air) (sans dimension) | Modélisé | 9,9 | S.O. | KOAWIN 2008 |
| Solubilité dans l'eau (mg/L) | Modélisé | 0,05[b] | 25 | WSKOWWIN 2008 |
| pKa (constante de dissociation acide) (sans dimension) |
Modélisé | pKa1 = 15,5 pKa2 = 14,5 (sous forme d'acide) |
S.O. | ACD/pKaDB 2005 |
a Les valeurs entre parenthèses représentent les valeurs initiales rapportées par les auteurs ou estimées par les modèles.
b Valeur choisie pour la modélisation.
S.O. : sans objet
4. Sources
Le sclaréol est naturellement présent dans l'huile essentielle de sauge. Cette huile essentielle est sécrétée par la plante pour se protéger des agents pathogènes (bactéries et champignons), des herbivores ou pour modifier la croissance des plantes avoisinantes (Sirikanataramas et coll. 2008). Par exemple, la partie supérieure de la feuille est couverte de poils glandulaires qui sécrètent des huiles essentielles qui donnent normalement à la plante son arôme distinct. Si l'on frotte ou brosse ces poils, les cellules contenant ces huiles sont brisées, ce qui la libère. Cela rend souvent la plante peu attirante aux brouteurs et à certains insectes.
La sauge sclarée (Salvia sclarea) est l'espèce végétale la plus utilisée pour la production et l'extraction commerciale du sclaréol. Arbuste bisannuel ou vivace doté d'un parfum aromatique (Pitarokili et coll. 2002, Souleles et Argyriadou 1997, Tutin et coll. 1972), la Salviasclarea été introduite aux États-Unis. Le gouvernement fédéral américain et celui de différents États l'ont désignée comme mauvaise herbe puisqu'elle menace la biodiversité des plantes fourragères en remplaçant notamment des espèces moins compétitives et plus désirables (NRCS 2010, NWCB 2008).
Salvia est l'un des nombreux genres couramment appelés « sauge » et Salvia le plus grand genre de la famille de la menthe (labiées) qui compte entre 700 et 900 espèces d'arbustes, d'herbacées vivaces et annuelles. Quarante-huit de ces espèces de la famille des labiées sont considérées comme naturalisées au Canada, et plusieurs (Salvia sylvestris, Stachys arvenist, Stachys palustris) ont été désignées comme des espèces envahissantes au Canada (ACIA 2008). Salvia sylvestris est déclarée indigène en Ontario, mais introduite (par l'activité humaine, intentionnelle ou accidentelle) en Colombie-Britannique, en Alberta et au Manitoba, et déclarée disparue (indigène mais éradiquée) en Saskatchewan (Brouillet et coll. 2010). Selon Brouillet et coll. (2010), Salvia sclarea qui pousse en Ontario et Salvia officinalis L. qui pousse en Ontario et au Québec ont été déclarées éphémères (c'est-à-dire, non établies de façon permanente, mais qui apparaissent dans la nature presque tous les deux ans, habituellement à cause de sa culture). Sur les quarante-huit espèces de la famille des labiées considérées comme naturalisées au Canada, seules Salvia sclarea et Salvia officinalis produisent une huile essentielle contenant du sclaréol.
Outre la sauge sclarée, on trouve aussi sclaréol dans Salvia officinalis (aussi appelée « sauge commune » ou sauge officinale) et ses cultivars, Salvia judaica (sauge de Judée) (Boszomenyi et coll. 2009), Salvia palaestina (Senatore et coll. 2005), Salvia poculata (Kolak et coll. 2009), Salvia desoleana (Soković et coll. 2008), dans certaines espèces du genre Stachys comme S. ionica, S. sylvatica, et S. swainsonii, ssp scyronica (Piozzi et Bruno 2009), dans les huiles essentielles de feuilles et de baies du Juniperus phoenicea (El-Sawi et coll. 2007), les feuilles du Cistus creticus L. (Demetzos et coll. 1990) et dans l'Astragalus brachystachys (Choudhary et coll. 2006). Les feuilles de certaines espèces de tabac, comme Nicotiana glutinosa, Nicotiana tabacum et 23 autres espèces de Nicotiana contiennent également du sclaréol (Cutler et coll. 1977, Kennedy et coll. 1992).
Les huiles essentielles sont extraites des plantes par distillation à la vapeur ou à l'aide de solvants organiques, normalement pour être intégrées comme ingrédient aromatisant ou de parfum. La quantité de sclaréol dans une huile essentielle extraite d'une plante varie selon la partie de la plante d'où est extraite l'huile essentielle (fleur ou feuilles), le stade de développement de la plante (pleine floraison, pendant la formation des graines, à la formation complète des graines) (Farkas et coll. 2005), les conditions de culture (Peana et coll. 1999), le pays d'origine (Schmiderer et coll. 2008) et la technique d'extraction. On peut extraire de la sauge sclarée son huile essentielle ou sa concrète. En parfumerie, la concrète est une pâte obtenue à partir d'une matière première végétale fraîche par extraction à l'aide d'un solvant. Les huiles essentielles sont obtenues par distillation à la vapeur du végétal (Souleles et Argyriadou 1997), alors que la concrète s'obtient par extraction par solvant (Schmiderer et coll. 2008, Lawrence 1986). Le sclaréol peut être présent à différentes proportions (entre 0,06 et à 20 %) dans l'huile essentielle de diverses espèces de Salvia, les pourcentages les plus élevés se trouvant dans Salvia palaestina (~20 %). Même si le sclaréol est plus concentré (> 70 % dans Salvia sclarea) dans la concrète (Senatore et coll. 2005, Schmiderer et coll. 2008, Esteban et coll. 1996, Lawrence 1986), cette substance est rarement utilisée comme parfum dans l'industrie des cosmétiques (Surburg et Panten 2006).
Historiquement, pendant le processus d'inscription (fondé sur les années 1984 à 1986) sur la Liste intérieure des substances (LIS) les codes d'utilisation de la LIS pour « fragrance/parfum/déodorant/agent aromatisant », ont été déclarés pour le sclaréol. La quantité déclarée se situait dans la fourchette de 1000 à 10 000 kg (Environnement Canada 1988) avec moins de quatre déclarants.
Pour l'année civile 2005, aucune fabrication ou importation de sclaréol supérieure au seuil de 100 kg ni aucune utilisation de sclaréol supérieure au seuil de 1000 kg au Canada n'a été déclarée en réponse à l'avis publié en vertu de l'article 71 de la LCPE (Canada 2006b, Environnement Canada 2006). Toutefois, deux entreprises se sont identifiées comme parties intéressées pour cette substance.
Pour l'année civile 2006, aucune fabrication ou importation de sclaréol supérieure au seuil de 100 kg ni aucune utilisation de sclaréol supérieure au seuil de 1000 kg au Canada n'a été déclarée en réponse à l'avis publié en vertu de l'article 71 de la LCPE (Canada 2009b, Environnement Canada 2010). Une entreprise s'est identifiée comme partie intéressée pour cette substance.
D'autres études (communications personnelles en 2011 de la Fédération canadienne d'aromathérapistes et d'autres associations, source non citée) ont indiqué que le sclaréol était actuellement utilisé au Canada. En combinant les renseignements déclarés et des hypothèses prudentes, nous avons estimé les limites inférieure et supérieure de la quantité de sclaréol commercialisée : entre 76 à 1350 kg de sclaréol seraient utilisés au Canada chaque année (tableau 4-1). La quantité totale de sclaréol importée ou utilisée au Canada a été estimée en additionnant les estimations d'utilisation par les industries du parfum, des aromatisants, des cosmétiques et des agents d'aromathérapie. Cela pourrait entraîner une comptabilisation en double dans certaines estimations, car quelques produits d'aromathérapie peuvent être considérés comme des produits cosmétiques et certains parfums peuvent être utilisés dans la formulation de produits cosmétiques. Ces renseignements ont servi pour l'évaluation
Le calcul des quantités utilisées au Canada repose sur les hypothèses suivantes :
- Les compagnies fabriquant des produits cosmétiques, des parfums et des aromatisants ont indiqué que l'huile essentielle de sauge sclarée contient moins de 5 % de sclaréol. Par conséquent, nous présumons que l'huile essentielle de sauge sclarée utilisée dans des parfums, des produits cosmétiques et des aromatisants contient 5 % de sclaréol.
- Dans le cas des produits d'aromathérapie, les estimations de la limite inférieure reposent sur les renseignements déclarés par des entreprises individuelles à leur association. Pour les estimations de la limite supérieure, nous avons supposé que la quantité qu'ont divulguée les entreprises individuelles s'applique aussi à d'autres entreprises menant des activités semblables.
- Les produits (parfums) vendus aux États-Unis peuvent également l'être au Canada par l'entremise d'activités industrielles (c.-à-d. l'importation). Pour les estimations de la limite supérieure, nous avons appliqué des hypothèses sur les parts relatives de marché entre le Canada et les États-Unis. Pour les estimations de la limite supérieure, nous avons supposé que la quantité qu'ont divulguée les entreprises individuelles s'applique aussi à d'autres entreprises menant des activités semblables.
- Le sclaréol est un aromatisant approuvé aux États-Unis et ailleurs. Nous supposons que des aliments aromatisés au sclaréol sont vendus au Canada. Pour les estimations de la limite supérieure, nous avons appliqué des hypothèses sur les parts relatives de marché entre le Canada et les États-Unis. Pour les estimations de la limite supérieure, nous avons supposé que la quantité qu'ont divulguée les entreprises individuelles s'applique aussi à d'autres entreprises menant des activités semblables.
- En raison de l'interdiction d'ajout d'agents aromatisants aux produits du tabac, on ne retrouve pas d'huile essentielle de sauge sclarée ou de sclaréol dans ces produits au Canada.
Nous considérons que l'huile essentielle de sauge sclarée ou le sclaréol ont une importance commerciale faible ou modérée pour l'industrie, en particulier les entreprises d'aromathérapie. De nombreuses entreprises ont indiqué en utiliser de faibles quantités, d'en réaliser de faibles ventes et de les substituer par d'autres substances (communications personnelles de la Fédération canadienne des aromathérapistes et d'autres associations en 2011, source non citée).
| Secteur/Catégorie de produit | Total substance pure (kg) | Total pure et dans l'huile de sauge sclarée (kg) |
|---|---|---|
| Produits/Produits cosmétiques | 14 à 159 | 62 à 507 |
| Aromatisants | 4 à 40 | 4 à 40 |
| Aromathérapie | N.D. | 10 à 802 |
| Tabac | N.D. | N.D. |
| Total | 18 à 199 | 76 à 1350 |
N.D. : non disponible
5. Utilisations
Au Canada, il n'est pas obligatoire, de déclarer les ingrédients des parfums à Santé Canada, et ainsi le sclaréol n'est pas recensé dans la base de données du Système de déclaration des cosmétiques (SDC). Toutefois, il s'agit d'un constituant de l'huile essentielle de Salvia sclarea et environ 800 produits cosmétiques la contiennent dans des concentrations entre 0,1 % et 30 % figurent au SDC (SDC 2010). Le sclaréol ne figure pas à la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques (souvent appelée simplement la Liste critique) .Santé Canada utilise cet outil administratif pour communiquer aux fabricants et à d'autres que la présence de certaines substances dans des cosmétiques pourrait contrevenir à l'interdiction générale formulée à l'article 16 de la Loi sur les aliments et drogues, ou dans une des dispositions du Règlement sur les cosmétiques (Santé Canada 2011).
L'huile essentielle de sauge sclarée est utilisée comme parfum dans des insectifuges, des insecticides, des traitements intérieurs contre les puces et les tiques pour les animaux domestiques et des désinfectants pour tapis (communication personnelle de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada au Bureau de gestion du risque de Santé Canada en novembre 2010, source non citée). Le sclaréol n'apparaît pas comme additif alimentaire homologué dans les listes d'additifs autorisés en vertu de la Loi sur les aliments et drogues (Santé Canada 2013).
Aux États-Unis, la Flavor and Extract Manufacturers Association (FEMA) a inscrit le sclaréol parmi les 236 nouveaux ingrédients aromatisants généralement reconnus comme sûrs (Smith et coll. 2009). Puisqu'on utilise le sclaréol comme arôme alimentaire aux États-Unis et ailleurs (Smith et coll. 2009, Commission Européenne 2002, Ash et Ash 2003 et 2006), il est possible qu'il serve d'arôme dans les aliments vendus au Canada. Au Canada, les arômes alimentaires ne sont pas considérés comme des additifs alimentaires et ne sont pas soumis à un examen préalable à la mise en marché aux termes du Règlement sur les aliments et drogues. On peut ajouter des aromatisants à tous les aliments dépourvus d'une norme d'identité et de composition du Règlement sur les aliments et drogues et aux aliments assortis d'une norme d'identité et de composition qui permet l'ajout d'arômes aux aliments. De même, les éléments végétaux comme des feuilles, des tiges et des graines contenant du sclaréol peuvent être ajoutés aux aliments non assujettis à une norme réglementaire ou aux aliments assujettis à une norme lorsqu'il existe une disposition permettant l'ajout d'épices ou d'assaisonnement. On n'a pas déclaré la présence de sclaréol dans les emballages alimentaires ou les préparations d'additifs indirects (communication personnelle de la Direction des aliments de Santé Canada au Bureau de gestion du risque de Santé Canada, août 2011, source non citée).
Le sclaréol n'est inscrit ni dans la base de données sur les produits pharmaceutiques (BDPP 2017), ni dans la base de données interne sur les ingrédients non médicinaux de la Direction des produits thérapeutiques, ni dans la base de données sur les ingrédients des produits de santé naturels (BDIPSN 2017), ni dans la base de données sur les produits de santé naturels homologués (BDPSNH 2017) en tant qu'ingrédient médicinal ou non médicinal dans les produits pharmaceutiques finaux, les produits de santé naturels ou les médicaments vétérinaires (Communications de la Direction des produits thérapeutiques, de la Direction des produits de santé naturels et de la Direction des médicaments vétérinaires de Santé Canada adressées au Bureau de gestion du risque de Santé Canada d'août 2010, sources non citées). L'essence essentielle de sauge sclarée qui contient naturellement du sclaréol figure dans la BDIPSN comme ingrédient médicinal, car elle est classée comme une substance à l'article 2 (extrait) de l'annexe 1 du Règlement sur les produits de santé naturels et comme ingrédient médicinal dans Aromathérapie – Huiles essentielles à des concentrations jusqu'à 5 % pour les applications topiques et jusqu'à 8 % pour les applications locales (jusqu'à 10 % de la surface du corps). Elle figure aussi dans la base de données des ingrédients des produits de santé naturels (BDIPSN 2017) comme ingrédient non médicinal pour utilisation orale en tant qu'exhausteur de goût ou ingrédient parfumé pour les utilisations topiques. Elle figure dans la Base de données des produits de santé naturels homologués (BDPSHNH 2017) en tant qu'ingrédient médicinal et ingrédient non médicinal dans les produits de santé naturels actuellement homologués au Canada. Salvia sclarea et d'autres espèces végétales et leurs préparations qui contiennent naturellement du sclaréol figurent aussi à la BDIPSN (2017) avec un rôle médicinal ou non médicinal (ou les deux) ainsi que dans la BDPSNH (2017) et elle est donc présente dans les produits de santé naturels actuellement homologués au Canada.
La Salvia sclarea est une plante indigène du sud de l'Europe et est couramment cultivée dans le midi de la France, en Russie, en Hongrie, en Italie, au Royaume-Uni et aux États-Unis (Pitarokili et coll. 2002). Des extraits de la plante entière, dont le sclaréol est un constituant, sont diversement utilisés. La distillation à la vapeur de l'inflorescence en floraison produit une huile essentielle utilisée dans la préparation de nombreuses boissons alcoolisées (Dzamic et coll. 2008). L'extrait de la partie aérienne de S. sclarea est également largement employé en médecine traditionnelle comme analgésique, anti-inflammatoire, antioxydant, antifongique et antibactérien. Les feuilles fraîches de la plante sont utilisées dans les soupes (Lattoo et coll. 2006). En Grèce, S. sclarea est connue sous le nom commun agiannitis et on l'utilise contre la toux et la grippe, pour purifier le sang et guérir les blessures et les douleurs aux yeux, ainsi que comme diurétique (Pitarokili et coll. 2002).
Le sclaréol est utilisé comme ingrédient de parfums dans les cosmétiques naturels, les parfums fins, les crèmes, les lotions, les shampoings, les savons de toilette et les autres produits de toilette ainsi que dans des produits de consommation comme les produits de nettoyage domestiques et les détergents (Bhatia et coll. 2008, Farkas et coll. 2005, Ash et Ash 2003 et 2006). Il a également été utilisé pour l'activité antibactérienne, le contrôle des moisissures (rouille) et l'inhibition de la croissance des plantes (Dimas et coll. 2007, Choudhary et coll. 2006, Lattoo et coll. 2006, Jasinsky et coll. 2001, Ulubelen et coll. 1994, Bailey et coll. 1975). Le sclaréol est utilisé commercialement comme fixatif dans les parfumeries (ambre gris), comme aromatisant de tabac, dans les aliments et boissons, et comme synthon pour la synthèse d'une série d'odorants d'ambre et en médecine traditionnelle (Choudhary et coll. 2006, Dimas et coll. 2007, Bailey et coll. 1975, McChesney et Kouzi 1990, Pitarokili et coll. 2002, Kutney et Chen 1994, Leung 1980). On a aussi déposé des brevets pour l'utilisation du sclaréol pour perdre du poids et augmenter la lipolyse (Peele et Dilip 2006). Le sclaréol est également un précurseur de la sclaréolide, un autre additif à saveur de tabac, un rehausseur du sel et un précurseur de l'ambrox, un produit semblable à l'ambre gris dans la parfumerie (Kutney et Chen 1994, Leung 1980). Le Comité mixte de l'Organisation des Nations Unies pour l'alimentation et l'agriculture (FAO) et de l'Organisation mondiale de la Santé (OMS) d'experts des additifs alimentaires (JECFA) a publié une spécification sur l'utilisation du sclaréol comme aromatisant dans les aliments (JECFA 2010a).
6. Rejets dans l'environnement
En 2006 au Canada, aucune réponse à l'avis publié en vertu de l'article 71 de la LCPE ne mentionne l'utilisation, l'importation ou la fabrication de sclaréol en quantités égales ou supérieures au seuil de déclaration (Canada 2009b). On estime toutefois qu'entre 76 et 1350 kg environ sont annuellement utilisés au Canada (tableau 4-1). On sait que le sclaréol est commercialisé au Canada, comme constituant de l'huile essentielle de sauge sclarée dans les cosmétiques. La concentration de sclaréol dans l'huile essentielle de sauge sclarée a été mesurée à des concentrations entre 0,06 % et 6 %. Cependant, aucune donnée mesurée n'a été déclarée pour les concentrations de sclaréol dans les produits cosmétiques. Bhatia et coll. ont estimé que la teneur des produits cosmétiques en sclaréol était de 0,03 % (2008).
On s'attend à ce que les bactéries du sol ou d'autres espèces fongiques dégradent les plantes qui produisent des huiles essentielles contenant du sclaréol, puisque plusieurs études ont démontré que les micro-organismes endogés peuvent métaboliser cette substance (section 7.1) dans leur habitat terrestre naturel. Cependant, lorsque les huiles essentielles contenant du sclaréol sont extraites de ces plantes et sont intégrées à divers produits de consommation, le sclaréol rejeté à l'égout devrait, après un passage par un système de traitement des eaux uséesNote de bas de page3 , se retrouver dans les effluents atteignant le milieu aquatique où sa dégradation n'est pas susceptible de se produire (section 7.1).
7. Devenir dans l'environnement
Les résultats de la modélisation de la fugacité de niveau III (tableau 7-1) fondée sur les propriétés physiques et chimiques du sclaréol (tableau 3-1) nous indiquent qu'il devrait demeurer principalement dans l'air, le sol et les sédiments, selon le milieu où il est rejeté. Ces résultats représentent la répartition de la substance dans un environnement d'évaluation hypothétique découlant d'une répartition entre les milieux, ainsi que la perte tant par les processus de transport d'advection (à l'extérieur du milieu modélisé) que de dégradation ou de transformation. Les valeurs de répartition présentées dans le tableau 7-1 représentent les effets nets de ces processus dans des conditions de rejets continus lorsqu'un « état stable » hors de l'équilibre est atteint.
| Substance rejetée dans : | Air | Eau | Sol | Sédiment |
|---|---|---|---|---|
| l'air (100 %) | 99,9 | 0,005 | 0,004 | 0,12 |
| l'eau (100 %) | 0,02 | 4,1 | 0,0000007 | 96 |
| le sol (100 %) | 60 | 0,003 | 40 | 0,07 |
Si le sclaréol est libéré dans l'air, des quantités élevées devraient s'y répartir. Étant donné les valeurs expérimentales modérées de la pression de vapeur de 0,1333 Pa et une valeur modérée de la constante de la loi de Henry estimée à 0,315 Pa·m3/mol, le sclaréolest considéré comme modérément volatil. Donc, s'il n'est rejeté que dans l'air, il y demeurera presque totalement.
S'il était rejeté dans l'eau, le sclaréol devrait s'adsorber sur les particules solides en suspension et les sédiments étant donné sa valeur du log Kco modérée estimée être entre 3,1 et 3,4. La volatilisation du sclaréol depuis la surface de l'eau devrait être un processus peu important pour le devenir dans l'environnement à cause de la valeur modérée de sa constante de la loi de Henry (0,315 Pa·m3/mol). Donc, si l'eau est le milieu récepteur, il devrait surtout se répartir dans les sédiments.
S'il était rejeté dans le sol, le sclaréol devrait avoir une capacité modérée d'adsorption au sol (il aura une certaine mobilité dans les eaux interstitielles) étant donné la valeur estimée de log Kco (entre 3,1 et 3,4). La valeur estimée de la constante de la loi de Henry nous indique que la volatilisation depuis la surface des sols humides serait un processus important pour le devenir de cette substance. Donc, s'il est rejeté dans le sol, le sclaréol y résidera et se volatilisera dans l'air, comme le montrent les résultats de la modélisation de la fugacité de niveau III.
7.1 Persistance dans l'environnement
Peu de données expérimentales sont disponibles pour le sclaréol. Par conséquent, nous avons cherché un certain nombre d'analogues pour appliquer la méthode de lecture croisée, afin d'en déduire les propriétés de persistance et de bioaccumulation. Nous n'avons toutefois pas trouvé de substance analogue acceptable pour lesquelles existent des propriétés mesurées ou des données expérimentales.
Les classes structurales du sclaréol (p. ex. les carbones aliphatiques, les carbones oléfiniques, les alcools) se prêtent bien aux prévisions modélisées, car elles tombent « à l'intérieur du domaine d'applicabilité » (p. ex. domaines de paramètres structurels ou de propriété de la base de données du modèle). Nous considérons, par conséquent, qu'il est approprié d'appliquer des modèles RQSA au sclaréol.
Des données empiriques sur la biodégradation du sclaréol dans l'air ont été publiées. Vlad et Aryku (1992) ont étudié l'ozonolyse du sclaréol dans diverses conditions, par exemple l'ozonolyse dans l'acétate d'éthyle en présence de pyridine ainsi que dans l'acétate d'éthyle avec la décomposition de l'ozonide dans l'eau. Le pourcentage des produits de réaction de 1 g de sclaréol était de 30 à 52 % à des températures de 18 à 70 °C et une période d'ozonation de 60 minutes. Il convient toutefois de noter que ces conditions ne sont pas pertinentes sur le plan environnemental.
En raison du peu de données expérimentales sur la dégradation du sclaréol, une méthode du poids de la preuve reposant sur des RQSA (Environnement Canada 2007) a aussi été utilisée avec les modèles de la dégradation indiqués dans le tableau 7-2 ci-dessous. Le sclaréol devrait être rejeté dans le milieu aquatique et, compte tenu de l'importance écologique de ce dernier et du fait que la plupart des modèles disponibles s'appliquent à l'eau, la biodégradation dans l'eau a été principalement étudiée. Le tableau 7-2 résume les résultats des modèles de prévision RQSA disponibles sur la dégradation dans divers milieux naturels.
| Processus du devenir | Type | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|---|
| Oxydation atmosphérique | abiotique | AOPWIN 2008[a] | t½ = 0,182 jour | < 2 |
| Réaction avec l'ozone | abiotique | AOPWIN 2008[a] | t½ = 6,5 jours | ≥ 2 |
| Hydrolyse | abiotique | HYDROWIN 2008[b] | S.O.[b] | S.O. |
| Biodégradation (aérobie) | primaire | BIOWIN 2008[a] Sous-modèle 4 : étude d'experts (résultats qualitatifs) |
2,8[c] « ne se biodégrade pas rapidement » |
≤ 182 |
| Biodégradation (aérobie) | ultime | BIOWIN 2008[a] Sous-modèle 3 : étude d'experts (résultats qualitatifs) |
1,7[c] « se biodégrade lentement » |
≥ 182 |
| Biodégradation (aérobie) | ultime | BIOWIN 2008[a] Sous-modèle 5 : Probabilité linéaire MITI |
0,31[d] « peut se biodégrader rapidement » |
≤ 182 |
| Biodégradation (aérobie) | ultime | BIOWIN 2008[a] Sous-modèle 6 : probabilité non linéaire MITI |
0,06[d] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | ultime | TOPKAT 2004 Probabilité |
0[d] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | ultime | CATABOL c2004-2008 % de demande biochimique en oxygène (% DBO) |
% DBO = 0,3 « se biodégrade très lentement » |
≥ 182 |
a EPIsuite (2008), en utilisant la notation SMILES donnée au Tableau 2-1
b Le modèle ne donne pas d'estimation pour ce type de structure chimique.
c Le modèle donne un résultat numérique de 0 à 5, lié à un taux prédit de biodégradation.
d Le modèle produit un taux de probabilité.
Dans l'air, la demi-vie prévue par oxydation atmosphérique de 0,182 jour (tableau 7-2) montre que le sclaréol est susceptible de s'oxyder rapidement. La substance ne devrait pas réagir de façon importante avec les autres espèces photo-oxydantes de l'atmosphère, comme l'O3, et ne devrait pas se dégrader rapidement par photolyse directe étant donné la prédiction de 6,5 jours pour la demi-vie de réaction à l'ozone (tableau 7-2b, AOPWIN 2008). Les réactions avec des radicaux hydroxyle devraient donc être le processus le plus important régissant son devenir dans l'atmosphère. Le sclaréol n'est pas considéré comme persistant dans l'air, car les réactions avec les radicaux hydroxyle lui donnent une demi-vie de 0,182 jour qui est un facteur limitatif du taux de réaction avec l'ozone dont la demi-vie est de 6,5 jours.
Dans l'eau, la demi-vie de l'hydrolyse n'était pas calculable, car l'ensemble d'apprentissage de HYDROWIN 2008 ne contient aucun produit chimique de structure comparable. De plus, le sclaréol ne contient pas de groupes fonctionnels qui pourraient être hydrolysés. Or, on doit considérer les autres processus de devenir dans l'eau pour établir sa persistance globale dans ce milieu. Le résultat empirique de l'essai de biodégradation rapide de 28 jours est de 1,5 % (CHRIP c2008). La plupart des modèles de biodégradation indiquent que la biodégradation est très lente et que sa demi-vie dans l'eau est de 182 jours ou plus.
Le sclaréol comporte des structures communes aux substances qui ne se biodégradent pas facilement (par ex., des liens C-C). Par conséquent, si l'on tient compte des résultats des modèles et des caractéristiques structurelles du sclaréol, il existe des preuves suffisantes pour indiquer que la demi-vie de sa biodégradation par minéralisation dans l'eau dépasse 182 jours.
À partir de taux d'extrapolation de 1:1:4 pour les demi-vies de biodégradation dans l'eau, le sol et les sédiments (Boethling et coll. 1995), la demi-vie dans le sol excède aussi 182 jours, tandis que la demi-vie dans les sédiments dépasse à 365 jours. Cela indique que le sclaréol devrait persister dans le sol et les sédiments.
De nombreuses études ont montré que les micro-organismes du sol peuvent métaboliser le sclaréol. Kouzi et McChesney (1990, 1991a et 1991b) indiquent que le sclaréol est métabolisé par six espèces de Cunninghamella (moisissures), trois espèces d'Aspergillus (moisissures), une espèce de Chaetomium (moisissures), des espèces de Mucor (moisissures), le Bacillus cereus (champignon), le Septomyxa (moisissures) et des espèces de Sporobolomyces (champignon). En tout, de 400 mg à 600 mg de sclaréol ont été dissous dans l'éthanol et après 3 à 8 jours, les suspensions ont été filtrées et analysées. Les pourcentages des métabolites étaient de 28 % à 50 %. Abraham (1994) a démontré que de nombreuses souches de champignons (n = 60) et de bactéries (n = 40) étaient capables de transformer le sclaréol, les champignons ayant montré des activités métaboliques supérieures à celles des bactéries. Le Bacillus sphaericus ATCC 13805 (champignon) a converti 20 mg de sclaréol sur une période de 72 heures en deux métabolites à de taux de 5 % et 20 %. La Cunninghamella elegans DSM 1908 (moisissure) a converti 200 mg de sclaréol après 120 heures en cinq métabolites à 40,5 %, 6 %, 10 %, 2,5 % et 18,5 %. La Diplodia gossypina ATCC 10936 (champignon) a converti 10 mg de sclaréol après 96 heures avec un taux de 20 % pour quatre métabolites. Aranda et coll. (1991) ont montré une transformation microbienne du sclaréol par le champignon Mucor plumbeus (champignon) dans lequel 92 % à 99 % de sclaréol (jusqu'à 0,5 g/L) ont été consommés entre deux à quatre jours. Hanson et coll. (1994) ont montré que le champignon Cephalosporium aphidicola effectuait une transformation microbienne du sclaréol en cinq métabolites après 12 jours. Diez et coll. (2005) ont montré une oxydation microbienne de 100 mg de sclaréol par Rhizopus stolonifer (moisissures) après cinq à huit jours à 30 °C dans diverses conditions chimiques. Les meilleures conditions chimiques (2,5 g/L K2HPO4, 2,5 g/L NH4NO3, 0,25 g/L MgSO4, 10−4 M CaCl2 ·6H2O, 1,5 × 10−5 M FeSO4, 10−5 M MnCl2, et 100 mg de sclaréol dissous dans l'éthanol) transformaient entre 87 % et 88 % du sclaréol après cinq jours et 98 % après huit jours. Par conséquent, la plupart de ces études (à l'exception de Diez et coll. 2005) indiquent que la présence de sclaréol dans les sols peut être atténuée par les activités métaboliques d'espèces de bactéries et de champignons. Toutefois, il faut noter que toutes ces études ont été faites dans des milieux autres que le sol et créés en laboratoire (p. ex. milieu liquide, agar). Dans des conditions naturelles, les taux de dégradation présentés peuvent donc être plus lents.
Les huiles essentielles contenant du sclaréol sont extraites de ces plantes et sont intégrées à divers produits de consommation, le sclaréol rejeté à l'égout devrait, après un passage par un système de traitement des eaux usées, se retrouver dans les effluents atteignant le milieu aquatique. Nous n'avons relevé aucun renseignement indiquant que des organismes capables de décomposer le sclaréol, comme ceux vivant dans le sol, seraient présents dans les eaux de surface. De plus, des milieux potentiellement anaérobiques comme les sédiments pourraient ne pas abriter un nombre suffisant de bactéries aérobies qui faciliteraient la dégradation aérobie ou anaérobie.
Nous avons utilisé le modèle de transport et de persistance de niveau III (TaPL3 2000) pour estimer la distance de transport caractéristique (DTC), définie comme la distance maximale parcourue dans l'air par 63 % de la substance. Beyer et coll. (2000) ont proposé que des DTC de plus de 2000 km représentent le potentiel élevé de transport atmosphérique à grande distance (PETGD), celles de 700 km à 2000 km représentent le modéré, et de celles de moins de 700 km représentent le faible. En tenant compte de la DTC estimée de 91 km, nous considérons que le potentiel de transport atmosphérique à grande distance du sclaréol est faible. Cela signifie que le sclaréol ne devrait pas être transporté à grande distance dans l'atmosphère depuis la source de son émission.
Le modèle de dépistage de l'OCDE (LTRP POP) peut également être utilisé pour diagnostiquer les produits chimiques à fort potentiel de persistance et de transport à grande distance (Scheringer et coll. 2006). Il s'agit d'un modèle global qui cloisonne la planète en air, eau et sol. Ce modèle est « orienté vers le transport » plutôt que vers une « cible », car il donne simplement la distance de transport caractéristique (DTC) sans préciser l'endroit où une substance donnée pourra être transportée (Fenner et coll. 2005). Klasmeier et coll. (2006) ont suggéré qu'un seuil de 5098 km, fondé sur l'estimation de la DTC du modèle pour le PCB-180, permettrait de catégoriser les substances présentant un fort potentiel de transport à grande distance. On a détecté du PCB-180 dans des régions éloignées. La DTC calculée pour le sclaréol au moyen du modèle de l'OCDE est de 47 km, ce qui indique un faible potentiel de transport du sclaréol dans l'air. Les données empiriques et modélisées nous portent à croire que le sclaréol est très persistant dans l'eau et les sédiments (sa demi-vie dans l'eau égale ou supérieure à 182 jours, et demi-vie dans les sédiments égale ou supérieure à 365 jours), mais non dans l'air (sa demi-vie est de 2 jours ou moins) ou le sol (sa demi-vie est égale ou inférieure à 365 jours).
7.2 Potentiel de bioaccumulation
En l'absence de donnée expérimentale sur les facteurs de bioaccumulation (FBA) ou de bioconcentration (FBC) pour le sclaréol, nous avons réalisé une prédiction à l'aide des modèles de FBA et de FBC disponibles. Les résultats sont présentés au tableau 7-3.
Comme nous le mentionnions plus haut, les classes structurales du sclaréol (p. ex. les carbones aliphatiques, les carbones oléfiniques, les alcools) se prêtent bien aux prévisions modélisées, car elles tombent « à l'intérieur du domaine d'applicabilité » (p. ex. les domaines de paramètres structurels et/ou de propriété de la base de données du modèle). Par conséquent, l'applicabilité des modèles RQSA pour le sclaréol est considérée comme adéquate.
La valeur modélisée du log Koe de KOWWIN 2008 a été choisie, car nous considérons que ce modèle possède le meilleur ensemble d'apprentissage et la meilleure couverture probable de substances dotées d'une structure proche de celle du sclaréol.La valeur modélisée du log Koe de 6,0 semble indiquer que cette substance est bioaccumulable dans le biote (voir le tableau 7-3).
Il est préférable d'utiliser des mesures du FBA pour estimer le potentiel de bioaccumulation d'une substance. En effet, le FBC ne prend pas en compte de manière adéquate le potentiel de bioaccumulation des substances par l'alimentation, lequel est un facteur majeur pour les substances dont le log Koe est supérieur à environ 4,0 (Arnot et Gobas 2003). La modélisation cinétique du bilan massique devrait constituer la méthode de prévision la plus fiable pour déterminer le potentiel de bioaccumulation du MAPBAP acétate, car elle permet une correction du métabolisme dans la mesure où le log Koe de la substance se trouve dans le domaine du log Koe du modèle. Des estimations du FBC et du FBA, corrigées en fonction d'une biotransformation potentielle, ont été produites à l'aide de modèle BCFBAF (EPI Suite 2008). Les constantes cinétiques de métabolisme ont été calculées à partir des relations structure-activité décrites plus en détail dans Arnot et coll. (2008a, 2008b et 2009). Puisqu'il a été démontré que les constantes du taux de biotransformation métabolique sont une fonction de la température et du poids corporels (Hu et Layton 2001, Nichols et coll. 2006), le modèle BCFBAFWIN fournit une des valeurs kM,N « normalisées » pour un poisson de 10 grammes à 15 °C. Pour le sclaréol, cette estimation des RQSA du kM pour l'évaluation préalable est de 0,062/jour. Des poissons de niveau trophique intermédiaire ont été utilisés pour représenter les sorties globales du modèle, comme l'a laissé entendre le concepteur du modèle, et ce modèle est généralement représentatif des tailles de poissons susceptibles d'être consommés par des piscivores aviaires ou terrestres. Si l'on calcule le kM proportionnel d'un poisson de niveau trophique intermédiaire (masse supposée de ~184 g) à partir d'un kM pour un poisson de 10 g, on obtient kM ~ 0,03/jour.
Les preuves disponibles indiquent que le sclaréol devrait se bioaccumuler dans les poissons étant donné ses propriétés physiques et chimiques (faible hydrosolubilité et log Koe élevé). Les valeurs des FBC et FBA corrigées par le métabolisme se situent entre 4247 et 31 890. Étant donné les hautes valeurs de la modélisation cinétique corrigées pour le métabolisme, nous pouvons considérer que le sclaréol a un fort potentiel de bioaccumulation dans les poissons.
| Organisme d'essai | Paramètre | Valeur (poids humide) (L/kg) | Références |
|---|---|---|---|
| Poisson | FBC | 4247 | BCFBAF 2008 |
| Poisson | FBC | 4445 | BCFBAF 2008 |
| Poisson | FBA | 31 890 | BCFBAF 2008 |
8. Potentiel d'effets nocifs sur l'environnement
8.1 Évaluation des effets sur l'environnement
8.1.1 Milieu aquatique
Nous avons utilisé des données modélisées pour pallier l'absence de données expérimentales sur la toxicité de cette substance pour les organismes aquatiques. Les classes structurales du sclaréol (carbones aliphatiques, carbones oléfiniques, alcools) se prêtent bien aux prévisions modélisées, car elles sont « à l'intérieur du domaine d'applicabilité » (p. ex. domaines de paramètres structurels et/ou de propriété de la base de données du modèle). Par conséquent, l'applicabilité des modèles RQSA pour le sclaréol est considérée comme adéquate.
Les divers modèles de RQSA ont donné une fourchette de valeurs pour la toxicité aquatique. Toutefois, quelques valeurs ont fourni des estimations de la toxicité non fiables pour cette substance, car les prédictions indiquaient des effets aigus à des concentrations bien supérieures à sa solubilité dans l'eau (c.-à-d. que la valeur modélisée de la solubilité dans l'eau est de 0,05 mg/L). Étant donné que les concentrations modélisées pour l'hydrosolubilité sont souvent incertaines (une seule valeur modélisée dans ce cas), nous avons considéré comme acceptables les valeurs de la toxicité dépassant par un facteur 10 les estimations de la solubilité. Par conséquent, les valeurs prédites au tableau 8-1 (indiquées) seraient considérées comme acceptables. Les données modélisées sur le sclaréol indiquent que cette substance devrait avoir un effet nocif aigu pour les organismes aquatiques à de faibles concentrations létales médianes aiguës (concentrations [CL50] est plus petit ou égal à 1,0 mg/L).
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Références |
|---|---|---|---|---|
| Poisson | Toxicité aiguë (96 h) | CL50[b] | 0,16[c] | CPOP 2008 |
| Poisson | Toxicité aiguë (96 h) | CL50[b] | 0,04[c] | AIEPS 2003-2007 |
| Poisson | Toxicité aiguë (96 h) | CL50[b] | 0,03[c] * | TOPKAT 2004 |
| Daphnie | Toxicité aiguë (48 h) | CL50[b] | 0,08[c] | CPOP 2008 |
| Daphnie | Toxicité aiguë (48 h) | CL50[b] | 0,4[c] | AIEPS 2003-2007 |
| Daphnie | Toxicité aiguë (48 h) | CE50[a] | 11,5 | TOPKAT 2004 |
| Algues | Toxicité aiguë (72 h) | CE50[a] | 7,94 | AIEPS 2003-2007 |
a CE50 - Concentration d'une substance qu'on estime susceptible d'avoir un effet sur 50 % des organismes d'essai.
b CL50 - Concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai.
c Acceptable, étant donné que les concentrations modélisées pour l'hydrosolubilité sont souvent incertaines, les valeurs de la toxicité qui ont dépassé les estimations de la solubilité par un facteur allant jusqu'à 10 ont été jugées acceptables.
* Valeur choisie pour la modélisation de l'exposition.
8.1.2 Autres milieux naturels
Choudhary et coll. (2006) ont indiqué que le sclaréol avait des propriétés antibactériennes, régularise la croissance des champignons et inhibe la croissance des plantes.
Bailey et coll. (1974) ont mesuré l'inhibition fongique du sclaréol sur le Cladosporium cucumerinum sur un gel de silice, sur de l'agar et dans un milieu liquide. Le diterpène sclaréol et le 13-epi-sclaréol ont été isolés en mélange eutectiqueNote de bas de page4 des feuilles de Nicotiana glutinosa. À l'essai sur le gel de silice, l'inhibition de la croissance du Cladosporium cucumerinum a eu lieu à une valeur supérieure à 0,10 mg/cm de sclaréol. De plus, lors de l'essai sur une lame porte-objet, les auteurs ont découvert qu'une quantité de sclaréol jusqu'à 500 mg/L n'empêchait pas la germination des spores de plusieurs espèces de champignons (Alternaria brassicicola, A. longipes, Aspergillus niger, Botrytis cinerea, Cladosporium cucumerinum et Colletotrichum lindemuthianum). Toutefois, lorsque les spores germées d'espèces d'Alternaria ont été incubées davantage, on a observé que les colonies produites sur de l'agar contenant du sclaréol croissaient lentement. L'effet du sclaréol sur la croissance du mycélium a démontré que les taux de croissance radiale de 16 espèces de champignons étaient considérablement inférieurs à 20 mg/L de sclaréol. Ces résultats semblent indiquer que le sclaréol influe sur les systèmes de régulation de la croissance des champignons.
Bailey et coll. (1975) ont étudié l'inhibition de la croissance fongique par un mélange épimèreNote de bas de page5 de diterpènes, de sclaréol et de 13-episclaréol sur Uromyces appendiculatus (rouille du haricot), Puccinia recondita f. sp. tritici (rouille brune) et Uromyces viciae-fabae (rouille de la fève). La germination des urédospores a été évaluée par une épreuve sur lame de cupule et un essai sur des surfaces d'agar imprégnées de concentrations de sclaréol de 5 g à 1000 mg/L. Des résultats similaires ont été obtenus dans les deux types d'essais. La rouille du haricot a été complètement inhibée par 25 mg/L de sclaréol et ses filaments germinatifs étaient moins longs à 5 mg/L. La rouille de la fève a produit de petites protubérances à la surface des urédospores, et la croissance normale des filaments germinatifs a eu lieu seulement à des niveaux inférieurs à 25 mg/L de sclaréol. La croissance des filaments germinatifs de la rouille brune était normale seulement lorsque la concentration de sclaréol était inférieure à 25 mg/L.
Kennedy et coll. (1992) ont effectué un bioessai pour évaluer l'effet du sclaréol, isolé de la cuticule des feuilles de diverses espèces de tabac Nicotiana (p. ex. Nicotiana tabacum, Nicotiana glutinosa) sur la germination de Peronospora tabacina (mildiou). Le sclaréol dans l'acétone a ensuite été appliqué aux disques des feuilles de Nicotiana tabacum, qui par la suite furent inoculées avec des sporanges de mildiou. La CI50 de l'inhibition des sporanges de mildiou par le sclaréol était de 0,0047 mg/cm2.
Ulubelen et coll. (1994) ont obtenu du sclaréol d'un extrait d'acétone de la plante entière de Salvia sclarea et ont comparé son activité antimicrobienne avec les souches bactériennes normales (Staphylococcus aureus et Proteus mirabilis) et la levure Candida albicans. La sclaréol était actif sur Staphylococcus aureus à 48,25 mg/L et la levure (aucune concentration fournie), mais non sur Proteus mirabilis.
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L - sauf indication contraire) | Références |
|---|---|---|---|---|
| Bactérie (Staphylococcus aureus) | Toxicité aiguë (24 heures) | Inhibition de la croissance | 48,25 | Ulubelen et coll. 1994 |
| Champignon (Cladosporium cucumerinum) | Inconnu | Inhibition de la croissance | 0,1 mg/kg | Bailey et coll. 1974 |
| Champignon (16 espèces) | Toxicité chronique (10 jours) | Croissance du mycélium | 20 | Bailey et coll. 1974 |
| Spores fongiques de Alternaria brassicicola, A. longipes, Aspergillus niger, Botrytis cinerea, Cladosporium cucumerinum, Colletotrichum lindemuthianum | Toxicité chronique (10 jours) | Germination des spores | > 500 | Bailey et coll. 1974 |
| Champignon (Uromyces appendiculatus) | Inconnu | Germination et croissance des spores | 5 (filament germinatif raccourci) |
Bailey et coll. 1975 |
| Champignon (Uromyces appendiculatus) | Inconnu | Germination et croissance des spores | 25 (inhibition complète) |
Bailey et coll. 1975 |
| Champignon (Uromyces viciae-fabae) | Inconnu | Germination et croissance des spores | > 25 | Bailey et coll. 1975 |
| Champignon (Puccinia recondita f. sp. tritici) | Inconnu | Germination et croissance des spores | > 25 | Bailey et coll. 1975 |
| Mildiou (Peronospora tabacina) | Toxicité aiguë (24 heures à 15 °C) | CI50[a] (inhibition de la germination des sporanges) |
0,0047 mg/cm2 | Kennedy et coll. 1992 |
a CI50 - Concentration inhibitrice pour un pourcentage donné d'un effet. Estimation ponctuelle de la concentration d'une substance d'essai causant une réduction de 50 % d'une mesure biologique quantitative comme le taux de croissance.
8.2 Caractérisation des risques pour l'environnement
Le sclaréol est naturellement répandu dans l'environnement en tant que constituant de l'huile essentielle de plusieurs plantes. Le sclaréol est probablement dégradé par les bactéries du sol ou d'autres espèces fongiques dans leur habitat terrestre naturel.
Si l'on extrait chimiquement de ces plantes, le sclaréol ou une huile essentielle qui en contient et, qu'à la suite de leur utilisation industrielle ou par des consommateurs, ces substances soient ensuite rejetées dans l'environnement par des systèmes de traitement des eaux usées (quantité estimative totale de 76 à 1350 kg/an), le sclaréol se retrouvera surtout dans l'eau et les sédiments où il devrait être très persistant. Les données modélisées indiquent aussi que le sclaréol possède un potentiel élevé de bioaccumulation chez les poissons et qu'il est très dangereux pour certains organismes aquatiques.
Lorsque le sclaréol est rejeté dans un plan d'eau, il se répartit dans les matières particulaires en suspension et les sédiments de fond, où les organismes benthiques sont exposés à la substance. Or, on ne dispose d'aucune donnée de surveillance environnementale ou de toxicité touchant précisément les organismes vivant dans les sédiments pour cette substance.
Les substances persistantes demeurent longtemps dans l'environnement après y avoir été rejetées, ce qui accroît l'ampleur et la durée possibles de l'exposition. Celles dont la demi-vie dans les milieux mobiles (air et eau) est longue et qui sont sujettes à se répartir en proportions appréciables dans ces milieux peuvent causer une contamination étendue. Par ailleurs, le rejet de faibles quantités de substances bioaccumulables peut donner lieu à des concentrations élevées de ces substances dans les organismes exposés. Les substances fortement bioaccumulables et persistantes sont particulièrement préoccupantes en raison de la bioamplification possible dans les réseaux trophiques, ce qui peut entraîner une exposition interne très élevée en particulier chez les prédateurs des niveaux trophiques supérieurs.
Toutefois, compte tenu des quantités relativement faibles de sclaréol connues pour être commercialisées au Canada et de ses utilisations qui peuvent entraîner des rejets dispersés dans l'environnement, l'exposition à la substance dans l'environnement devrait être faible. Il est donc conclu que le sclaréol n'a actuellement aucun effet nocif sur l'environnement au Canada. À la lumière des renseignements disponibles, nous concluons que le sclaréol ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur sa diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
Si, à cause de ses modes d'utilisation et des quantités actuellement commercialisées, il n'y a pas lieu de s'inquiéter du sclaréol, étant donné ses effets sur l'environnement, une hausse des volumes utilisés au Canada pourrait susciter des préoccupations.
8.3 Incertitudes dans l'évaluation des risques pour l'environnement
Étant donné que le sclaréol est utilisé dans d'autres pays, il est possible qu'il entre sur le marché canadien comme élément d'articles manufacturés ou de produits de consommation (Pitarokili et coll. 2002, Lattoo et coll. 2006, Choudhary et coll. 2006, Dimas et coll. 2007, Bailey et coll. 1975, McChesney et Kouzi 1990). Les informations obtenues de diverses sources indiquent que le sclaréol est peut-être présent dans un nombre restreint de ces produits au Canada. Puisqu'il n'existe toutefois aucune donnée sur la quantité de ces importations, il est impossible de dériver une estimation quantitative permettant d'établir l'importance de cette source.
9. Potentiel d'effets nocifs sur la santé humaine
9.1 Évaluation de l'exposition
9.1.1 Milieux naturels et nourriture
Aucune donnée empirique sur les concentrations de sclaréol dans les milieux naturels au Canada n'a été relevée. Aucune entreprise n'a signalé une quantité de sclaréol supérieure au seuil de déclaration en réponse à un avis publié en vertu de l'article 71 de la LCPE pour les années 2005 et 2006. Toutefois, on estime que la substance est utilisée en quantités globales allant de 76 à 1350 kg. Les faibles quantités de sclaréol utilisées indiquent que les rejets dans l'environnement canadien à partir d'une utilisation industrielle ou par les consommateurs devraient être faibles et que l'exposition de la population générale à partir des milieux naturels devrait être négligeable.
Le sclaréol est un constituant de l'huile essentielle de Salvia sclarea (sauge sclarée) qui peut être utilisée comme substance aromatique dans les aliments. Il peut aussi être présent dans la sauge commune, Salvia officinalis, une fine herbe utilisée en cuisine. Plusieurs analyses de la composition de la sauge commune ont été trouvées dans les publications scientifiques (Santos-Gomes et coll.2001, Perry et coll. 1999 1996, Tucker et coll.1990). Une seule d'entre elles indique une concentration de sclaréol allant jusqu'à 5 % (Boszormenyi et coll. 2009). À partir d'une évaluation de l'exposition actuelle, le JECFA (2010b) a récemment conclu que le sclaréol ne constituait pas un danger pour la sécurité (JECFA 2004). L'Autorité européenne de sécurité des aliments a également conclu qu'au niveau de l'absorption alimentaire estimé par le JECFA, le sclaréol ne suscite pas de préoccupations relatives à la santé.
9.1.2 Produits de consommation
9.1.2.1 Produits cosmétiques
Le sclaréol peut être présent dans plusieurs espèces de sauge, mais il se trouve principalement dans Salvia sclarea ou la sauge sclarée (Kuzma et coll. 2009, Bhatia et coll. 2008, Dzamic et coll. 2008, Farkas et coll. 2005, Fraternale et coll. 2005, Pitarokili et coll. 2002, Ronyai et coll. 1999, Esteban et coll. 1996, Lawrence 1994 1986). Au Canada, environ 800 produits cosmétiques contenant de l'huile essentielle de sauge ont été répertoriés dans le Système de déclaration des cosmétiques (SDC 2010). Selon l'information de la base de données du SDC, les cosmétiques peuvent contenir entre 0,1 % et 30 % d'huile essentielle.
Les publications scientifiques mentionnent une grande plage de concentrations de sclaréol dans l'huile essentielle de sauge sclarée (de 0,06 %, selon Dzamic et coll. 2008, à 6 % selon Pitarokili et coll. 2002). La plupart des études indiquent toutefois que les concentrations de sclaréol sont bien en deçà de 5 % (communication personnelle de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de gestion du risque de Santé Canada, août 2010, source non citée). Pour estimer l'exposition de la population générale découlant de l'utilisation de cosmétiques au Canada, nous avons posé l'hypothèse que l'huile essentielle contenait 5 % de sclaréol, ce qui se traduit par une plage de concentration de 0,005 % à 1,5 % de sclaréol dans ces produits. Cette hypothèse est considérée comme prudente, puisque les renseignements fournis par un fabricant de cosmétiques indiquent que le sclaréol est présent dans les produits cosmétiques à une concentration bien inférieure. Bhatia et coll. ont estimé une concentration de sclaréol dans les produits cosmétiques à 0,03 % (2008).
Les estimations de l'exposition de la population générale canadienne au sclaréol causée par l'utilisation des cosmétiques ont été calculées à l'aide de ConsExpo 4.1 (ConsExpo 2006).
Les estimations de la limite supérieure de l'exposition quotidienne par l'usage de cosmétiques contenant du sclaréol sont présentées au tableau 9-1, alors que les détails des scénarios d'exposition sont résumés à l'annexe A.
Le sclaréol a une faible pression de vapeur, et l'exposition par inhalation est peu probable, sauf par l'utilisation d'un atomiseur. La principale voie d'exposition pendant l'utilisation de ces produits est cutanée. Pour les produits à rinçage comme le shampooing et les revitalisants, des facteurs de rétention ont été appliqués selon le cas (voir l'annexe A pour des détails). Pour les produits indiqués au tableau 9-1, la principale contribution à l'exposition globale provenait du parfum (6,06 × 10−4 à 0,404 mg/kg p.c. [kilogrammes du poids corporel] par jour).
| Produit | Plage de concentration d'huile essentielle (%)[b] | Plage de concentration de sclaréol (%)[c] | Fréquence (par an) | Exposition cutanée quotidienne estimée (mg/kg p.c. par jour) |
|---|---|---|---|---|
| Parfum[d] | 0,1 – 30 | 0,005 – 1,5 | 730 – 1095 | 6,06 × 10−4 – 0,404 |
| Hydratant pour la peau (visage, mains ou corps) | 0,1 – 3 | 0,005 – 0,15 | 730 | 1,69 × 10−3 – 0,389 |
| Shampooing | 0,1 – 30 | 0,005 – 0,15 | 260 | 1,02 × 10−3 – 0,301 |
| Revitalisant capillaire | 0,1 – 30 | 0,005 – 1,5 | 260 | 6,95 × 10−4 – 0,209 |
| Tonique pour le visage[e] | 0,1 – 30 | 0,005 – 0,15 | 365 – 730 | 8,46 × 10−4 – 0,106 |
| Produits de soins capillaires[f] | 0,1 – 3 | 0,005 – 0,15 | 274 – 438 | 1,12 × 10−3 – 0,0611 |
| Lotion pour les yeux | 0,1 – 10 | 0,005 – 0,5 | 365 | 3,52 × 10−4 – 0,0352 |
| Nettoyant pour la peau (visage, mains ou corps : en barre ou liquide) | 0,1 – 30 | 0,005 – 1,5 | 329 – 730 | 8,38 × 10−6 – 0,0166 |
| Déodorant (en bâton) | 0,1 – 1 | 0,005 – 0,05 | 473 | 1,10 × 10−3 – 0,0110 |
| Désodorisant pour pieds en aérosol | 0,3 – 1 | 0,015 – 0,05 | 730 | 0,0584 – 0,195 |
| Fond de teint (femmes) | 0,1 – 0,3 | 0,005 – 0,015 | 365 | 5,64 × 10−4 – 0,0017 |
| Produit protecteur pour les cheveux | 0,1 – 0,3 | 0,005 – 0,015 | 260 | 6,22 × 10−4 – 0,0019 |
| Tampons démaquillants (femmes) | < 0,1 | 0,005 | 730 | 0,0004 |
| Rimmel (femmes) | 0,3 – 1 | 0,015 – 0,05 | 365 | 5,29 × 10−5 – 0,0002 |
| Produits de rasage pour hommes | 0,1 – 1 | 0,005 – 0,05 | 365 | 1,41 × 10−5 – 0,00014 |
| TOTAL | S.O. | S.O. | S.O. | 0,0058 – 1,73[g] |
Abréviation – S.O. : sans objet
a Valeurs modélisées à l'aide du modèle ConsExpo 4.1 (RIVM 2006) avec les hypothèses par défaut, sauf mention contraire dans l'annexe A.
b Concentrations d'huile essentielle de sauge sclarée indiquée dans le Système de déclaration des cosmétiques (SDC 2010).
c Concentration de sclaréol dans le produit cosmétique, en supposant une concentration de 5 % de sclaréol dans l'huile essentielle.
d Comprend les parfums (fréquence d'utilisation présumée de 730 fois par année) et l'eau de toilette (fréquence d'utilisation présumée de 1095 fois par année).
e Comprend les lotions après-rasage (fréquence d'utilisation présumée de 365 fois par année) et tonique pour le visage (fréquence d'utilisation présumée de 730 fois par année).
f Comprend la mousse (fréquence d'utilisation de 274 fois par année), le gel (fréquence d'utilisation de 358 fois par année), le fixatif (fréquence d'utilisation de 438 fois par année). Les estimations de l'exposition pour les démêlants à cheveux ont été ajoutées (fréquence d'utilisation de 438 fois par année).
g Ce nombre ne représente pas une estimation propre à un genre. En tenant compte de ce fait, l'estimation de la plage d'exposition pour les femmes serait de 0,0588 - 1,73 mg/kg p.c. par jour, et pour les hommes, de 0,0584 - 1,73 mg/kg p.c. par jour.
Les estimations de l'exposition au sclaréol par des cosmétiques moins couramment utilisés sont résumées au tableau 9-2. Comme ces produits ne sont utilisés qu'à l'occasion, l'exposition au sclaréol par leur utilisation est considérée comme de durée aiguë. L'estimation de l'exposition la plus élevée provient de l'utilisation d'huile à massage, qui était de 0,00564 à 1,69 mg/kg p.c. par utilisation.
| Produit | Plage de concentration d'huile essentielle (%)[b] | Plage de concentration de sclaréol (%)[c] | Fréquence (par an) | Estimation de l'exposition cutanée aiguë (mg/kgp.c.)[d] |
|---|---|---|---|---|
| Huile de massage | 0,1 – 30 | 0,005 – 1,5 | 24 | 0,00564 – 1,69 |
| Masque | 0,1 – 10 | 0,005 – 0,5 | 104 | 0,00141 – 0,141 |
| Décolorant pour cheveux | < 0,1 | 0,005 | 10 | 0,141 |
| Colorant capillaire | 0,3 – 1 | 0,015 – 0,05 | 10 | 0,0212 – 0,0705 |
| Produit bronzant | < 0,1 | 0,005 | 75 | 0,00705 |
| Préparation pour le bain (huile, sels moussants) | 0,1 – 30 | 0,005 – 1,5 | 104 | 9,17 × 10−6 – 2,75 × 10−4 |
a Valeurs modélisées à l'aide du modèle ConsExpo 4.1 (RIVM 2006) avec des hypothèses par défaut, sauf mention contraire dans l'annexe A.
b Concentrations d'huile essentielle de sauge sclarée indiquée dans le Système de déclaration des cosmétiques (SDC 2010).
c En supposant une concentration de sclaréol dans l'huile essentielle de 5 %.
d L'exposition cutanée aiguë est déclarée par application.
Les estimations de l'exposition au sclaréol par l'utilisation de cosmétiques pour les nourrissons et les tout-petits sont présentées au tableau 9-3. Les estimations de la limite supérieure d'exposition étaient de 0,015 à 0,057 mg/kg p.c. par jour, alors que pour un produit moins souvent utilisé, p. ex. l'huile de massage, l'estimation de la limite supérieure d'exposition était de 0,023 à 0,099 mg/kg p.c.
| Produit | Groupe d'âge | Plage de concentration d'huile essentielle[c] (%) | Fréquence (par an) | Exposition cutanée quotidienne (mg/kg p,c/jour) | Estimation de l'exposition cutanée aiguë[d] (mg/kg p,c,) |
|---|---|---|---|---|---|
| Huile de massage pour bébé | 0 – 6 mois | 0,3 – 1 | 24 | S.O. | 0,0296 – 0,0987 |
| Huile de massage pour bébé | 0,5 – 4 ans | 0,3 – 1 | 24 | S.O. | 0,0232 – 0,0774 |
| Shampooing pour bébé | 0 – 6 mois | 0,3 – 1 | 260 | 0,0162 – 0,0539 | S.O. |
| Shampooing pour bébé | 0,5 – 4 ans | 0,3-1 | 365 | 0,0145 – 0,0483 | S.O. |
| Savon pour bébé | 0 – 6 mois | 0,3 – 1 | 329 | 8,11 × 10−4 – 2,7 × 10−3 | S.O. |
| Savon pour bébé | 0,5 – 4 ans | 0,3 – 1 | 329 | 6,38 × 10−4 – 2,13 × 10−3 | S.O. |
| Démêlant pour cheveux pour enfants | 0 – 6 mois | S.O. | S.O. | S.O. | S.O. |
| Démêlant pour cheveux pour enfants | 0,5 – 4 ans | 0,1 – 0,3 | 438 | 0,0003 – 0,0009 | S.O. |
| TOTAL | 0 – 6 mois | – | – | 0,017–0,057 | S.O. |
| TOTAL | 0,5 – 4ans | – | – | 0,015–0,051 | S.O. |
Abréviation – S.O. : sans objet, – : pas de données
a Les nourrissons sont âgés entre 0 et six mois, et les tout-petits, entre six mois et quatre ans.
b Valeurs modélisées à l'aide du modèle ConsExpo 4.1 (RIVM 2006) avec des hypothèses par défaut, sauf mention contraire dans l'annexe A.
c Concentrations d'huile essentielle de sauge sclarée indiquée dans le Système de déclaration des cosmétiques (SDC 2010). La concentration de sclaréol dans l'huile est présumée être de 5 %.
d L'exposition cutanée aiguë est déclarée par application.
Du fait des propriétés physiques et chimiques (log Koe, masse moléculaire, Kp) de la substance, on peut prédire que l'absorption cutanée du sclaréol soit faible. Nous avons calculé une valeur par défaut pour l'absorption cutanée de 10 % à l'aide de la méthode de Kroes et coll. (2007).
Les rouges à lèvres peuvent contenir de l'huile essentielle de sauge sclarée à des concentrations de 0,1 % à 1 % du poids humide. Nous estimons donc que les concentrations de sclaréol dans le rouge à lèvre se situent entre 0,005 % et 0,05 % et l'exposition orale quotidienne par son utilisation entre 2,82 × 10−5 et 2,82 × 10−4 mg/kg p.c. par jour (l'annexe A donne les détails du calcul).
Étant donné les modes d'utilisation de certains cosmétiques contenant du sclaréol, il existe un potentiel d'exposition par inhalation. Les estimations de la concentration moyenne par utilisation des produits appliqués en aérosol ont été calculées (voir l'annexe A) et jugées faibles.
9.1.2.2 Autres produits
Nous avons relevé un nombre limité de produits de santé naturels qui contenaient de l'huile essentielle de sauge sclarée comme ingrédient non médicinal. Nous prévoyons que les scénarios d'exposition aux cosmétiques présentés plus haut soient représentatifs de l'exposition occasionnée par les produits de santé naturels, considérant les conditions d'utilisation formulées dans la monographie Aromathérapie – Huiles Essentielles.
On relevé dans le Système de déclaration des cosmétiques (SDC 2010), un brumisateur dont le parfum contient de l'huile essentielle de sauge sclarée. Dans ce produit, la concentration d'huile de sauge sclarée se situe entre 0,3 % et 1 %, et donc, une concentration correspondante de sclaréol entre 0,015 % et 0,05 %. Étant donné les modes d'utilisation du produit, la voie principale d'absorption devrait être l'inhalation et nous estimons que la concentration moyenne par utilisation se situe entre 2,1 × 10−4 mg/m−3 et 6,99 × 10−4 mg/m−3 (annexe B).
9.2 Évaluation des effets sur la santé
L'annexe C contient un résumé des données relatives à l'effet sur la santé du sclaréol et de ses analogues, le sclaréol glycol.
La toxicité aiguë du sclaréol semble être faible étant donné que les valeurs minimales de la DL50 chez le rat par voie orale et chez le lapin par voie cutanée étaient toutes deux supérieures à 5000 mg/kg p.c. (RIFM 1979a et 1979b). Après l'administration de 100 mg/kg p.c., 316 mg/kg p.c. ou 1000 mg/kg p.c. de sclaréol par une seule injection intrapéritonéale (i.p.) à des rats Sprague-Dawley mâles, des diminutions transitoires de l'activité motrice spontanée, une diminution de la fréquence respiratoire et une augmentation compensatoire de la profondeur respiratoire ont été observées (Malone et coll. 1991).
Du sclaréol non dilué a induit une irritation cutanée chez les lapins à 5000 mg/kg p.c. (RIFM 1979a et 1979b), mais du sclaréol dilué n'a pas induit d'irritation cutanée dans les tests épicutanés ou les tests épicutanés recouverts chez des volontaires humains ou les lapins (RIFM 1975a et 1975b, RIFM 1979c, RIFM 1981, RIFM 1986). Une sensibilisation a été observée dans une seule étude comportant des volontaires humains, dans laquelle le point d'ébullition du sclaréol était de 84 à 90 °C, ce qui indique que la pureté du matériel du test était faible (RIFM 1979c). Le sclaréol ayant un point d'ébullition supérieur à 96 °C dans les autres tests de sensibilisation chez des volontaires humains n'a pas induit de sensibilisation (RIFM 1981 et 1986). L'Association internationale des matières premières pour la parfumerie (IFRA 2009) a déterminé que la sensibilisation était le principal effet du sclaréol, et a fixé la norme selon laquelle le sclaréol utilisé comme parfum devrait avoir une pureté minimale de 98 %, en fonction des résultats de tests de sensibilisation chez des volontaires humains qui montrent un potentiel de sensibilisation pour les échantillons ayant une faible pureté (c.-à-d. un point d'ébullition faible) et aucun effet sensibilisant pour des échantillons ayant une pureté minimale de 98 %.
Pour ce qui est de la dose répétée, une dose sans effet nocif observé (DSENO) de 8,8 mg/kg p.c. par jour a été constatée. Cela était fondé sur l'observation de l'augmentation du poids des reins relativement au poids du cerveau chez les rats mâles, et d'une augmentation du poids moyen du cœur et de la rate par rapport au poids du cerveau des rats femelles, lorsque ces animaux ont reçu du sclaréol tous les jours par intubation orale pendant 30 jours à une dose unique de 8,8 mg/kg p.c. par jour. Des concentrations minimalement mais statistiquement augmentées de protéines, de globuline et de calcium ont été considérées comme de possibles découvertes corroborantes en chimie clinique avec une augmentation du rapport du poids des reins et du cerveau chez les rats traités au sclaréol. Ces effets peuvent être liés au traitement, mais ont été considérés comme non nocifs en raison d'une signification toxicologique limitée (RIFM 2006a). RIFM (2006a) a calculé une DSENO de 8,8 mg/kg p.c. par jour, car les conclusions entre les deux sexes n'étaient pas constantes, et tout changement clinique, pathologique ou histopathologique additionnel comme des changements macroscopiques ou microscopiques ou des augmentations d'enzymes du sérum du foie chez les rats mâles et femelles étaient absents.
Il existe très peu de données sur la génotoxicité du sclaréol. Ce dernier a induit des dommages à l'ADN de cellules de cancer du côlon humain HCT116 in vitro. Il a supprimé la croissance d'une tumeur HCT116 chez une souris mâle atteinte d'immunodéficience grave ayant reçu une injection sous-cutanée à la dose maximale tolérée de 275 mg/kg p.c. qui a été déterminée par l'administration de sclaréol encapsulé dans la bicouche lipide des liposomes pendant cinq jours (Dimas et coll. 2007). Dans une étude antérieure, le sclaréol a induit une fragmentation de l'ADN et une apoptose dans des lignées cellulaires leucémiques humaines (Dimas et coll. 1999). Toutefois, des tests de génotoxicité in vitro étaient tous deux négatifs dans un essai de réversion Salmonella/Microsome et dans un essai de recombinaison Bacillus subtilis sur des huiles essentielles provenant de l'huile de sauge sclarée (Salvia sclarea), dont le sclaréol est un constituant (Zani et coll. 1969, Leung 1980, Lawrence 1986).
Après avoir administré à des rats Wistar mâles des doses de 100 mg/kg p.c. par intraveineuse et des doses de 1000 mg/kg p.c. par gavage oral, Kouzi et coll. (1993) ont trouvé que 0,02 % et 9 % de la dose administrée était excrétée telle quelle respectivement dans la bile et les selles après exposition par voie intraveineuse ou orale. Kouzi et coll. (1993) ont également retrouvé quatre métabolites biliaires du sclaréol chez les rats – le 3-keto-sclaréol, le 3a-hydroxysclaréol, le 3b-hyroxysclaréol et le 18-hydroxysclaréol –, mais on ne dispose d'aucune donnée empirique pertinente sur la toxicité de ces métabolites.
Comme les données disponibles liées aux effets du sclaréol sur la santé étaient limitées, on a également pris en considération l'information pertinente relative à une substance analogue. On a découvert que le sclaréol glycol (n° CAS 55881-96-4) avait une structure similaire à celle du sclaréol (en utilisant le coefficient d'association Tanimoto dans ChemID, la similarité a été quantifiée à 87,33 %).
Le sclaréol glycol stimulait l'activité locomotrice des souris albinos mâles exposées à la substance d'essai par une dose unique d'injection i.p. à 5, 25 ou 50 mg/kg p.c., mais à 100 mg/kg p.c., il diminuait l'activité locomotrice de 30 % comparativement aux contrôles (Georgieva 1988). Il a également été indiqué que le sclaréol glycol inhibait considérablement le comportement agressif induisant de la clonidine chez les souris mâles albinos (Georgieva 1989a). Du sclaréol glycol administré par injection i.p. stimulait le système nerveux central et avait des effets selon la dose sur les crises convulsives (Georgieva 1987 et 1989b). Après une administration à faible dose (5 mg/kg p.c.) par injection i.p., le sclaréol induisait des convulsions cloniques et des fibrillations myocloniques de la tête et des membres antérieurs chez 6 des 10 souris albinos mâles (Georgieva 1989b). La voie d'administration de ces études avait une pertinence limitée pour l'évaluation des risques sur la santé humaine.
Nous avons aussi considéré les résultats de quatre modèles de prévision RQSA : DEREK, TOPKAT, CASETOX et Leadscope Model Applier. Les prévisions relatives à la cancérogénicité, à la génotoxicité et à la toxicité du sclaréol pour le développement ou la reproduction étaient majoritairement négatives (DEREK 2008, TOPKAT 2004, CASETOX 2008, Leadscope, c2005-2008). Un résumé des résultats du modèle est présenté à l'annexe D.
Dans l'ensemble, il a été établi que le potentiel de risque du sclaréol n'est pas élevé.
Peu de confiance est accordée à la base de données relative aux effets sur la santé du sclaréol. En effet, seules des données empiriques sur la toxicité aiguë, répétée à court terme, sur l'irritation et la sensibilisation étaient disponibles.
De plus nous n'avons aucune donnée sur la cancérogénicité subchronique ou chronique, la génotoxicicité in vivo, et la toxicité sur la reproduction ou le développement. Il n'existait que de l'information très limitée sur les effets sur la santé d'un analogue, et les résultats des RQSA étaient surtout négatifs.
9.3 Caractérisation des risques pour la santé humaine
Compte tenu des informations disponibles sur l'utilisation du sclaréol, on peut déduire que l'exposition de la population générale occasionnée par les milieux naturels devrait être négligeable au Canada. L'exposition alimentaire de la population générale au sclaréol devrait être faible et surtout résulter de sa présence naturelle dans les aliments.
L'exposition cutanée au sclaréol par l'utilisation de cosmétiques est considérée comme la principale voie d'exposition de la population générale. Les estimations de l'exposition systémique ont été calculées par une valeur d'absorption cutanée de 10 %. L'exposition quotidienne systémique des adultes est de 0,0058 à 0,173 mg/kg p.c. par jour. Pour les nourrissons et les jeunes enfants, elle est de 0,0015 à 0,0057 mg/kg p.c. par jour.
Une comparaison des estimations de l'exposition au sclaréol provenant de l'utilisation d'un adulte de cosmétiques (entre 0,0058 et 0,173 mg/kg p.c. par jour) à un niveau où aucun effet nocif n'a été observé chez les animaux de laboratoire (8,8 mg/kg p.c. par jour) donne des marges d'exposition entre 50 et 1500. Si l'on suppose que les estimations de l'exposition sont fondées sur une série d'hypothèses prudentes (absorption cutanée de 10 %, 5 % de sclaréol dans l'huile essentielle combinée à un maximum de 30 % d'huile essentielle dans le produit, l'hypothèse selon laquelle tous les types de produits seraient utilisés la même journée, contenant tous du sclaréol à la concentration maximale), les marges réelles devraient être beaucoup plus élevées que celles qui ont été calculées. Les marges seraient supérieures si l'on considère l'estimation de 0,0008 mg/kg p.c./jour produite par la Research Institute for Fragrance Materials (Bhatia et coll. 2008) et correspondant à une exposition de toute la peau humaine au sclaréol présent dans de multiples produits cosmétiques. Nous considérons que ces marges d'exposition tiennent adéquatement compte des incertitudes présentes dans les bases de données sur l'exposition et les effets sur la santé.
Une comparaison des estimations de l'exposition systémique par l'utilisation de cosmétiques destinés aux enfants (entre 0,0015 et 0,0057 mg/kg p.c. par jour) à un niveau auquel aucun effet nocif n'a été observé chez les animaux de laboratoire (8,8 mg/kg p.c. par jour) donne des marges d'exposition de 1500 à 5900. Nous considérons que ces marges sont adéquates pour tenir compte des incertitudes présentes dans les bases relatives aux données sur les effets sur la santé et l'exposition.
Une comparaison de la limite supérieure des estimations de l'exposition cutanée aiguë par l'utilisation moins fréquente de cosmétiques pour adultes (0,00564 à 1,69 mg/kg p.c. par utilisation) et les enfants (0,023 à 0,099 mg/kg p.c. par l'utilisation d'huile de massage) avec le niveau d'effet cutané aigu le plus faible (5000 mg/kg p.c. par jour d'après l'irritation cutanée) donne des marges d'exposition de 2,96 × 103 à 8,87 × 105 pour les adultes et de 5,05 × 104 à 2,17 × 105 pour les enfants. Ces marges d'exposition sont jugées adéquates pour tenir compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
Une comparaison de la limite supérieure des estimations de l'exposition par voie orale provenant de rouges à lèvres (2,82 × 10-−5 à 2,82 × 10−4 mg/kg p.c. par jour) avec un niveau auquel aucun effet nocif n'a été observé chez les animaux de laboratoire (8,8 mg/kg p.c. par jour) donne des marges d'exposition de 9,94 × 103 à 5,2 × 103. Ces marges sont jugées adéquates pour tenir compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition. Ces marges d'exposition sont jugées adéquates pour tenir compte des incertitudes liées aux bases de données concernant les effets sur la santé et l'exposition.
9.4 Incertitudes de l'évaluation des risques pour la santé humaine
La confiance dans les estimations modélisées de l'exposition provenant de produits va de faible à modérée, car l'information directe sur les concentrations de sclaréol dans les produits cosmétiques n'était pas disponible. Il existe une incertitude associée à l'hypothèse selon laquelle le sclaréol est présent dans les cosmétiques principalement dans l'huile essentielle de sauge sclarée. Cette hypothèse est toutefois considérée comme étant raisonnable compte tenu des renseignements contenus dans les publications sur l'utilisation habituelle dans l'industrie cosmétique. De plus, aucune information sur la présence de sclaréol dans les aliments au Canada n'était disponible. Les valeurs de paramètres par défaut dans le modèle ConsExpo (ConsExpo 2006) étaient basées sur des scénarios de la limite supérieure tenant compte d'une population générale qui consomme fréquemment des produits de consommation. Il est reconnu qu'il existe une incertitude avec l'utilisation des paramètres de modèles par défaut qui ne sont pas propres aux Canadiens. Cette incertitude est également reconnue dans l'utilisation de la méthode décrite par Kroes et coll. (2007) pour caractériser l'absorption cutanée de sclaréol lorsqu'il est appliqué comme ingrédient dans un produit cosmétique. Comme des hypothèses prudentes ont été utilisées, on estime probable que les estimations calculées des expositions de la population générale sont considérées comme des surestimations (p.ex, compte tenu du grand nombre de cosmétiques sur le marché, l'hypothèse voulant qu'une personne utilise des produits qui contiennent tous du sclaréol la même journée est très prudente).
En raison du faible nombre de données empiriques sur les effets du sclaréol et de ses analogues sur la santé, et de l'utilisation de modèles de relations qualitatives structure-activité, le niveau de confiance à l'égard de la base de données sur les effets sur la santé est faible.
10. Conclusion
Compte tenu de tous les éléments probants disponibles présentés dans cette évaluation préalable, le sclaréol présente un faible risque d'effet nocif pour les organismes et pour l'intégrité générale de l'environnement. Nous concluons que le sclaréol ne satisfait pas aux critères énoncés aux alinéas 64(a) ou 64(b) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur la diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie.
À la lumière des renseignements disponibles, il est conclu que le sclaréol ne satisfait pas au critère énoncé à l'alinéa 64(c) de la LCPE, car il ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est conclu que le sclaréol ne satisfait à aucun des critères énoncés à l'article 64 de la LCPE.
Références
Abraham, W.-R. 1994. Microbial hydroxylation of sclareol. Phytochemistry 36(6):1421-1424.
ACD/pKaDB [module de prédiction]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès : http://www.acdlabs.com/products/phys_chem_lab/pka/ [consulté le 13 août 2010].
[ACIA] Agence canadienne d'inspection des aliments. 2008. Plantes exotiques envahissantes au Canada – Rapport technique [en ligne]. Ottawa (Ont.) : Agence canadienne d'inspection des aliments. Accès : http://dsp-psd.pwgsc.gc.ca/collection_2008/inspection/A104-74-2008F.pdf [consulté le 5 novembre 2010].
[AIEPS] Artificial Intelligence Expert Predictive System. 2003-2007. Version 2.05. Ottawa (Ont.) : Environnement Canada. Modèle élaboré par Stephen Niculescu. Disponible auprès d'Environnement Canada, Division des évaluations écologiques, Section de l'évaluation des substances chimiques nouvelles.
[ALOGPS] Octanol-Water Partition Coefficient Program. c2001-2009. Version 2.1. Neuherberg (Danemark) : Helmholtz Zentrum Muenchen Institute for Bioinformatics and Systems Biology. Accès : http://www.vcclab.org/about/about1.html.
[AOPWIN] Atmospheric Oxidation Program for Microsoft Windows [modèle d'évaluation]. 2008. Version 1.92a. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm.
Aranda, G., Samir, El., Kortbi, M., Lallemand, J.-Y., Neuman, A., Hammoumi, A., Facon, I., Azerad, R. 1991. Microbial transformation of diterpenes; hydroxylation of sclareol, manool, and derivatives by Mucor plumbeus. Tetrahedron. 47(39):8339-8350.
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337-345.
Arnot, J.A., Mackay, D., Bonnell, M. 2008a. Estimating metabolic biotransformation rates in fish from laboratory data. Environ. Toxicol. Chem. 27(2):341-351.
Arnot, J.A., Mackay, D., Parkerton, T.F., Bonnell, M. 2008b. A database of fish biotransformation rates for organic chemicals. Environ. Toxicol. Chem. 27(11):2263-2270.
Arnot, J.A., Meylan, W., Tunkel, J., Howard, P.H., Mackay, D., Bonnell, M., Boethling, R.S. 2009. A quantitative structure-activity relationship for predicting metabolic biotransformation rates for organic chemicals in fish. Environ. Toxicol. Chem. 28(6):1168-1177.
Ash, M., Ash, I. 2003. Specialty chemicals source book. 3e éd. Endicott (NY) : Synapse Information Resources. SN – 978-1-934764-38-1 AU.
Ash, M., Ash, I. 2006. Handbook of flavors and fragrances. New York (NY) : Synapse Information Resources.
ASTreat Model [modèle sur l'élimination des usines de traitement des eaux usées]. 2006. Version 1.0. Cincinnati (OH) : Procter & Gamble Company.
Bailey, J.A., Vincent, G.G., Burden, R.S. 1974. Diterpenes from Nicotiana glutinosa and their effect on fungal growth. J. Gen. Microbiol. 85:57-64.
Bailey, J.A., Carter, G.A., Burden, R.S., Wain, R.L. 1975. Control of rust diseases from Nicotiana glutinosa. Nature 255:328-329.
[BCFBAF] Bioaccumulation Program for Microsoft Windows [estimation model]. 2008. Ver. 3.00. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
[BDIPSNH] Base de données d'ingrédients de produits de santé naturels homologués. 2017. Direction des produits de santé naturels et sans ordonnance, Santé Canada. Accès : http://www.hc-sc.gc.ca/dhp-mps/prodnatur/applications/online-enligne/nhpid-bipsn-fra.php [consulté en juillet 2017].
[BDPP] Base de données sur les produits pharmaceutiques. 2017. Ottawa (Ont.) : Direction des produits thérapeutiques, Santé Canada. Accès : http://webprod.hc-sc.gc.ca/dpd-bdpp/language-langage.do?url=t.search.recherche&lang=fra [consulté en 2017].
[BDPSNH] Base de données des produits de santé naturels homologués. 2017. Direction des produits de santé naturels et sans ordonnance, Santé Canada. Accès : https://www.canada.ca/fr/sante-canada/services/medicaments-produits-sante/naturels-sans-ordonnance/demandes-presentations/licence-mise-marche/base-donnees-produits-sante-naturels-homologues.html [consulté en 2017].
Belsito, D., Bikers, D., Bruze, M., Calow, P., Greim, H., Hanifin, J.M., Rogers, A.E., Saurat, J.H., Sipes, I.G., Tagami, H. 2008. A toxicological and dermatologic assessment of cyclic and non-cyclic terpene alcohols when used as fragrance ingredients. Food Chem. Toxicol. 46:S1-S71.
Beyer, A., Mackay, D., Matthies, M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ. Sci. Technol. 34(4):699-703.
Bhatia, S.P., McGinty, D., Letizia, C.S., Api, A.M. 2008. Fragrance material review on sclareol. Food Chem. Toxicol. 46:S270-S274.
[BIOWIN] Biodegradation Probability Program for Microsoft Windows [modèle d'évaluation]. 2008. Version 4.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Boszomenyi, A., Hethelyi, E., Farkas, A., Horvath, G., Papp, N., Lemberkovics, E., Szoke, E. 2009. Chemical and genetic relationships among sage (Salvia officinalis L.) cultivars and Judean Sage (Salvia judaica Boiss.). J. Agric. Food Chem. 57:4663-4667.
Brouillet, L., Coursol, F., Favreau, M. et Anions, M. 2010. VASCAN: the database of vascular plants of Canada [en ligne]. Accès : http://data.canadensys.net/vascan/ [consulté le 9 novembre 2010].
Canada. 1978a. Règlement sur les aliments et drogues. C.R.C., ch. 870. Accès : https://www.canlii.org/fr/ca/legis/regl/crc-c-870/derniere/crc-c-870.html.
Canada. 1978b. Règlement sur les aliments et drogues. C.R.C., ch. 870, art. B.07.034. Accès : https://www.canlii.org/fr/ca/legis/regl/crc-c-870/derniere/crc-c-870.html.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, no 3. Accès : http://laws-lois.justice.gc.ca/fra/lois/c-15.31/.
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistence et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada, Partie II, vol. 134, no 7, p. 607-612. Accès : http://laws-lois.justice.gc.ca/fra/reglements/DORS-2000-107/.
Canada. Ministère de l'Environnement, ministère de la Santé. 2006a. Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://www.ec.gc.ca/lcpe-cepa/fra/avis/NoticeTypeList.cfm?intCategory=19 http://publications.gc.ca/gazette/archives/p½006/2006-12-09/pdf/g1-14049.pdf.
Canada. Ministère de l'Environnement. 2006b. Loi canadienne sur la protection de l'environnement (1999) :Avis concernant certaines substances considérées comme priorité pour suivi. Gazette du Canada, Partie I, vol. 140, no 9, p. 435-459. Accès : http://publications.gc.ca/gazette/archives/p½006/2006-03-04/pdf/g1-14009.pdf.
Canada. Ministère de l'Environnement, ministère de la Santé. 2009a. Loi canadienne sur la protection de l'environnement (1999) : Avis de douzième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 143, no 52, p. 3839-3843. Accès : http://publications.gc.ca/gazette/archives/p1/1999/1999-12-26/pdf/g1-14352.pdf
Canada. Ministère de l'Environnement. 2009b. Loi canadienne sur la protection de l'environnement (1999) :Avis concernant les substances du groupe 12 du Défi. Gazette du Canada, Partie I, vol. 143, no 52, p. 3813-3836. Accès : http://www.gazette.gc.ca/rp-pr/p½009/2009-12-26/pdf/g1-14352.pdf#page=7.
CASETOX [module de prévision]. 2008. Version 2.0. Beachwood (OH) : MultiCASE. Accès : http://www.multicase.com/products/prod03.htm [réserve de consultation].
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1.
Choudhary, M.I., Siddiqui, Z.A., Hussain, S., Rahman, A.-U. 2006. Structure elucidation and antibacterial activity of new fungal metabolites of sclareol. Chem. Biodivers. 3:54-61.
[CHRIP] Chemical Risk Information Platform [base de données sur Internet]. c2008. Tokyo (Japon) : National Institute of Technology and Evaluation, Chemical Management Centre (CMC). Accès : http://www.safe.nite.go.jp/english/db.html.
Commission européenne. 2002. « Sclaréol ». Décision de la Commission du 23 janvier 2002 modifiant la décision 1999/217/CE en ce qui concerne le répertoire des substances aromatisantes utilisées dans ou sur les denrées alimentaires. Journal officiel de l'Union européenne 20.2.2002. L 49/1. Accès : http://eur-lex.europa.eu/LexUriServ/LexUriServ.do?uri=OJ:L:2002:049:0001:0160:FR:PDF [consulté en août 2010].
[ConsExpo] Consumer Exposure Model. 2006. Version 4.1. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néerlandais pour la santé publique et l'environnement). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840.
[CPOP] Modèle canadien de du Profil des polluants organiques persistants. 2008. Gatineau (Québec) : Environnement Canada, Division des évaluations écologiques; Bourgas (Bulgarie) :
Université Prof.Assen Zlatarov à Bourgas, Laboratire de chimie mathématique. [Modèle basé sur celui de Mekenyan et coll. 2005].
Cutler, H.G., Reid, W.W., Delétang, J. 1977. Plant growth inhibiting properties of diterpenes from tobacco. Plant Cell. Physiol. 18:711-714.
Demetzos, C., Harvala, C., Philianos, S.M., Skaltsounis, A.L. 1990. A new labdane-type diterpene and other compounds from the leaves of Cistus Incanus ssp. Creticus. J. Nat. Prod.s 53(5):1365-1368.
[DEREK] Deductive Estimation of Risk from Existing Knowledge [module de prévision sur CD-ROM]. 2008. Version 10.0.2. Cambridge (MA) : Harvard University, LHASA Group. Accès : http://lhasa.harvard.edu/?page=toxicology.htm [réserve de consultation].
Diez, D., Sanchez, J.M., Rodilla, J.M., Rocha, P.M., Mendes, R.S., Paulino, C., Marcos, I.S., Basabe, P., Urones, J.G. 2005. Microbial hydroxylation of sclareol by Rhizopus stolonifer. Molecules 10:1005-1009.
Dimas, K., Kokkinopoulos, D., Demetzos, C., Vaos, B., Marselos, M., Malamas, M., Tzavaras, T. 1999. The effect of sclareol on growth and cell cycle progression of human leukemic cell lines. Leuk. Res. 23(3):217-234.
Dimas, K., Hatziantoniou, S., Tseleni, S., Khan, H., Georgopoulos, A., Alevizopoulos, K., Wyche, J.H., Pantazis, P., Demetzos, C. 2007. Sclareol induces apoptosis in human HCT116 colon cancer cells in vitro and suppression of HCT116 tumour growth in immunodeficient mice. Apoptosis 12:685-694.
Dzamic, A., Sokovic, M., Ristic, M., Grujis-Jovanovic, S., Vukojevic, J., Marin, P.D. 2008. Chemical composition and antifungal activity of Salvia Sclarea (Lamiaceae) essential oil. Arch. Biol. Sci. Belgrade 60(2):233-237.
El-Sawi, S.A., Motawe, H.M., Ali, A.M. 2007. Chemical composition, cytotoxic activity and antimicrobial activity of essential oils of leaves and berries of Juiperus phoenicea L. grown in Egypt. Afr J Trad Complement Altern Med. 4(4):417-426.
Environnement Canada. 1988. Données de la Liste intérieure des substances (LIS), 1984-1986, recueillies en vertu du paragraphe 25(1) de la LCPE et conformément au guide de déclaration à la Liste intérieure des substances. Données préparées par Environnement Canada.
Environnement Canada. 2006. Données sur les substances du lot 12 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le douzième lot du Défi. Données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada. 2007. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module: QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2010. Données sur les substances du lot 12 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le douzième lot du Défi. Données recueillies par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement et Changement climatique Canada et Santé Canada. Catégorisation de substances chimiques [version du 20 avril 2007]. Ottawa (ON): Gouvernement du Canada. https://www.canada.ca/fr/sante-canada/services/substances-chimiques/approche-canada/categorisation-produits-chimiques.html.
[EPIsuite] Estimation Programs Interface Suite for Microsoft Windows [modèle d'évaluation]. 2008. Version 4.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Université Trent, Centre canadien pour la modélisation de l'environnement. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html.
Esteban, J.L., Martinez-Castro, I., Morales, R., Fabrellas, B., Sanz, J. 1996. Rapid identification of volatile compounds in aromatic plants by automatic thermal desorption – GC-MS. Chromatographia 43:63-72.
Farkas, P., Holla, M., Tekel, J., Mellen, S., Vaverkova, S. 2005. Composition of the essential oils from the flowers and leaves of Salvia sclarea L. (Lamiaceae) cultivated in Slovak Republic. J. Essent. Oil. Res. 17:141-144.
Fenner, K., Scheringer, M., MacLeod, M., Matthies, M., McKone, T.E., Stroebe, M., Beyer, A., Bonnell, M., Le Gall, A., Klasmeier, et coll. 2005. Comparing estimates of persistence and long-range transport potential among multimedia models. Environ. Sci. Technol. 39:1932-1942.
Fraternale, D., Giamperi, L., Bucchini, A., Ricci, D., Epifano, F., Genovese, S., Curini, M. 2005. Composition and anti-fungal activity of essential oil of Salvia sclarea from Italy. Chem. Nat. Comp. 41(5):604-606.
Georgieva, J.V. 1987. General activity and toxicity of the diterpene sclareol glycol. Contemporary Problems of Experimental and Clinical Oncology 1987:51-56. [cité par Georgieva 1989b].
Georgieva, J.V. 1988. Effects of the diterpene sclareol glycol on the locomotor activity. C R Acad. Bulg. Sci. 41(9):139-142.
Georgieva, J.V. 1989a. Diterpene sclareol glycol inhibits clonidine-induced aggressive responses in mice. Pharmacol. Biochem. Behav. 34(3):503-505.
Georgieva, J.V. 1989b. Effects of the diterpene sclareol glycol on convulsive seizures. Methods and Find. Exp. Clin. Pharmacol. 11(5):335-340.
Hanson, J.R., Hitchcock, P.B., Nasir, H., Truneh, A. 1994. The biotransformation of the diterpenoid, sclareol, by Cephalosporium aphidicola. Phytochemistry 36(4):903-906.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'évaluation]. 2008. Version 3.20. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
Hu, T.M., Layton, W.L. 2001. Allometric scaling of xenobiotic clearance: uncertainty versus universality. AAPS PharmSci. 3(4):29.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'évaluation]. 2008. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
[IFRA] Association internationale des matières premières pour la parfumerie. 2009. IFRA standard specification: sclareol. Association internationale des matières premières pour la parfumerie. Accès : http://www.ifraorg.org/files/documentspublished/1/en-us/STSP/22138_STSP_2009_11_04_Sclar%C3%A9ol.pdf.
Jasinski, M., Stukkens, Y., Degand, H., Purnelle, B., Marchand-Brynaert, J., Boutry, M. 2001. A plant plasma membrane ATP Binding cassette-type transporter is involved in antifungal terpenoid secretion. Plant Cell. 13(5):1095-1107.
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires. 2004. Safety evaluation of certain food additives and contaminants. Série de Rapports techniques de l'OMS no 52. Accès : http://www.who.int/ipcs/publications/jecfa/monographs/en/ [consulté le 13 octobre 2010].
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires. 2010a. Specifications for flavourings. Accès : http://www.fao.org/ag/agn/jecfa-flav/details.html?flavId=7030 [consulté le 13 octobre 2010].
[JECFA] Comité mixte FAO/OMS d'experts des additifs alimentaires. 2010b. 73e réunion, Genève, 8-17 juin 2010. Summary and Conclusions, publié le 24 juin 2010. Accès : http://www.who.int/foodsafety/publications/chem/summary73.pdf [consulté le 13 octobre 2010].
Jermstad, A. 1927. The physical constants and chemical properties of the concrete oil of Salvia sclarea L. and its principal constituent, sclareol. Pharm. Acta Helv. 2:182-190.
Kennedy, B.S., Nielsen, M.T., Severson, R.F., Sisson, V.A., Stephenson, M.K., Jackson, S.M. 1992. Leaf surface chemicals from Nicotiana affecting germination of Peronospora tabacina (adam) sporangia. J. Chem. Ecol. 18(9):1467-1479.
Klasmeier, J., Matthies, M., MacLeod, M., Fenner, K., Scheringer, M., Stroebe, M., Le Gall, A.C., McKone, T.E., van de Meent, D., Wania, F. 2006. Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Environ. Sci. Technol. 40:53-60.
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [modèle d'évaluation]. 2008. Version 1.10. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
[KOCWIN] Soil Adsorption Coefficient Program [modèle d'évaluation]. 2008. Version 2.00. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : www.epa.gov/oppt/exposure/pubs/episuite.htm.
Kolak, U., Hacibekiroĝlu, I., Öztürk, M., Özgökçe, F., Topçu, G., Ulubelen, A. 2009. Antioxidant and anticholinesterase constituents of Salvia poculata. Turk. J. Chem. 33:813-823.
Kouzi, S.A., McChesney, J.D. 1990. Microbial metabolism of the diterpene sclareol: oxidation of the A ring by Septomyxa affinis. Helv. Chim. Acta 73:2157-2164.
Kouzi, S.A., McChesney, J.D. 1991a. Microbial models of mammalian metabolism: fungal metabolism of the diterpene sclareol by Cunninghamella species. J. Nat. Prod. 54(2):483-490.
Kouzi, S.A., McChesney, J.D. 1991b. Hydroxylation and glucoside conjugation in the microbial metabolism of the diterpene sclareol. Xenobiotica 21(10):1311-1323.
Kouzi, S.A., McChesney, J.D., Walker, L.A. 1993. Identification of four biliary metabolites of the diterpene sclareol in the laboratory rat. Xenobiotica 23:621-632.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'évaluation]. 2008. Version 1.67. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
Kroes, R., Renwick, A.G., Feron, V., Galli, C.L., Gibney, M., Greim, H., Guy, R.H., Lhuguenot, J.C., van de Sandt, J.J.M. 2007. Application of the threshold of toxicological concern (TTC) to the safety evaluation of cosmetic ingredients. Food Chem. Toxicol. 45:2533-2562.
Kutney, J.P., Chen, Y. 1994. The chemistry of thujone. XVII. The synthesis of ambergris fragrances and related analogues. Can. J. Chem. 72:1570-1581.
Kuzma, L., Kalemba, D., Rozalski, M., Rozalska, B., Wieckowska-Szakiel, M., Krajewska, U., Wysokinska, H. 2009. Chemical composition and biological activities of essential oil from Salvia sclarea plants regenerated in vitro. Molecules 14:1438-1447.
Lattoo, S.K., Dhar, R.S., Dhar, A.K., Sharma, P.R., Agarwal, S.G. 2006. Dynamics of essential oil biosynthesis in relation to inflorescence and glandular ontogeny in Salvia sclarea. Flavour Fragr. J. 21:817-821.
Lawrence, B.M. 1986. Progress in essential oils: clary sage oil. Perfumer & Flavorist 11:111-118.
Lawrence, B.M. 1994. Production of clary sage oil and sclareol in North America. Actes des Quatrièmes Rencontres Internationales de Nyons. p. 41-48.
Leadscope Enterprise [gestion de données et d'aide à la décision]. c2005-2008. Version 2.4.15. Columbus (OH) : Leadscope Inc. [Consulté le 27 juillet 2010]. Accès : http://www.leadscope.com/lse_product.php [réserve de consultation].
Leung, A.Y. 1980. Encyclopedia of common natural ingredients used in food, drugs and cosmetics. 1re éd. New York (NY) : John Wiley.
LookChem.com. 2008. Sclareol CAS RN 515-03-7. Hangzhou (Chine). Accès : http://www.lookchem.com/cas-515/515-03-7.html [consulté le 9 août 2010].
Malone, M.H., McChesney, J.D., Kouzi, S.A. 1991. A pharmacological evaluation of the diterpene (-)-sclareol in intact rats. Fitoterapia 62(2):123-129.
McChesney, J.D., Kouzi, S.A. 1990. Microbial models of mammalian metabolism: sclareol metabolism. Planta. Med. 56:693.
Mekenyan, G., Dimitrov, S.D., Pavlov, T.S., Veith, G.D. 2005. POPs: A QSAR system for creating PBT profiles of chemicals and their metabolites. SAR QSAR Environ. Res. 16(1-2):103-133.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2007. Numéro 1. Columbus (OH) : American Chemical Society. Accès : http://www.cas.org/products/cd/nci/index.html [consulté le 11 août 2009].
Nichols, J.W., Fitzsimmons, P.N., Burkhard, L.P. 2007. In vitro – in vivo extrapolation of quantitative hepatic biotransformation data for fish. II. Modeled effects on chemical bioaccumulation. Environ. Toxicol. Chem. 26:1304-1319.
[NRCS] Natural Resources Conservation Service. 2010. PLANTS Database [en ligne]. Baton Rouge (LA) : United States Department of Agriculture, Natural Resources Conservation Service. Accès http://plants.usda.gov [consulté le 5 novembre 2010].
[NWCB] Washington State Noxious Weed Control Board. 2008. Class A noxious weed, clary sage, Salvia sclarea [en ligne]. Olympia (WA) : Washington State Noxious Weed Control Board. Accès http://www.nwcb.wa.gov/weed_info/Salvia_sclarea.html [consulté le 5 novembre 2010].
[OCDE] Organisation de coopération et de développement économiques. 2010. Emission scenario document on the blending of fragrance oils into commercial and consumer products [en ligne]. Paris (France) : Direction de l'environnement de l'Organisation de coopération et de développement économiques, Division environnement, santé et sécurité. ENV/JM/MONO(2010)38, JT03287706. Accès : http://www.oecd.org/dataoecd/39/2/46021591.pdf [consulté le 23 novembre 2010].
Peana, A.T., Moretti, M.D.L, Juliano, C. 1999. Chemical composition and antimicrobial action of the essential oils of S. desoleana and S. sclarea. Planta Med. 65:752-754.
Peele, D., Dilip, C. 2006. Compositions comprising sclareol or a derivative thereof bound to a glycoprotein matrix, and therapeutic matrix thereof. Avoca Inc. USA. Patent No. WO 2005-US40212 200551107.
Perry, N.B., Baxter, A.J., Brennan, N.J., van Klink, J.W. 1996. Dalmatian Sage. Part 1. Differing Oil Yields and Compositions from Flowering and Non-Flowering Accessions. Flavour Fragr. J. 11:231-238.
Perry, N.B., Anderson, R.E., Brennan, N.J., Douglas, M.H., Heaney, A.J., McGimpsey, J.A., Smallfield, B.M. 1999. Essential oils from Dalmatian sage (Salvia officinalis L.): variations among individuals, plant parts, seasons, and sites. J. Agric. Food Chem. 47:2048-2054.
Piozzi, F., Bruno, M. 2009. Diterpenoids in the essential oils from the genus Stachys. Rec. Nat. Prod. 3(3):120-125.
Pitarokili, D., Couladis, M., Petsikos-Panayotarou, N., Tzakou, O. 2002. Composition and antifungal activity on soil-borne pathogens of the essential oil of Salvia sclarea from Greece. J. Agric. Food Chem. 50:6668-6691.
[RIFM] Research Institute for Fragrance Materials, Inc. 1975a. Repeated insult patch test with sclareol. Rapport inédit de Givaudan, le 17 juin. Rapport no 45024. Woodcliff Lake (NJ) : Research Institute for Fragrance Materials [cité par Belsito et coll. 2008].
[RIFM] Research Institute for Fragrance Materials, Inc. 1975b. Repeated insult patch test with sclareol. Rapport inédit de Givaudan, le 18 juin. Rapport no 45025. Woodcliff Lake (NJ) : Research Institute for Fragrance Materials. [cité par Belsito et coll. 2008].
[RIFM] Research Institute for Fragrance Materials, Inc. 1979a. Acute toxicity study in rats and rabbits. Rapport no 1924, le 31 mai. Woodcliff Lake (NJ) : Research Institute for Fragrance Materials. [cité par Bhatia et coll. 2008].
[RIFM] Research Institute for Fragrance Materials, Inc. 1979b. Acute toxicity study in rats and rabbits. Rapport no 1697, le 20 avril. Woodcliff Lake (NJ) : Research Institute for Fragrance Materials. [cité par Bhatia et coll. 2008].
[RIFM] Research Institute for Fragrance Materials, Inc. 1979c. Report on human maximization studies. Rapport no 1697, avril à novembre. Woodcliff Lake (NJ) : Research Institute for Fragrance Materials. [cité par Belsito et coll. 2008].
[RIFM] Research Institute for Fragrance Materials, Inc. 1981. Report on human maximization studies. Rapport no 1792, le 18 mars. Woodcliff Lake (NJ) : Research Institute for Fragrance Materials. [cité par Belsito et coll. 2008].
[RIFM] Research Institute for Fragrance Materials Inc. 1986b. Report on human maximization studies. Rapport no 3100, le 15 janvier. Woodcliff Lake (NJ) : Research Institute for Fragrance Materials. [cité par Belsito et coll. 2008].
[RIFM] Research Institute for Fragrance Materials. 1992. Fragrance raw materials monographs. Sclareol. Food. Chem. Toxicol. 30:115S.
[RIFM] Research Institute for Fragrance Materials, Inc. 2006a. Sclareol and cedrol: subchronic toxicity study (28 day repeated dose oral gavage study in rats). Rapport inédit de la Federal Emergency Management Agency. Rapport no 50942. Woodcliff Lake (NJ) : Research Institute for Fragrance Materials. [cité par Bhatia et coll. 2008].
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu.(Institut national néerlandais de la santé publique et de l'environnement) 2006. Cosmetics fact sheet: To assess the risks for the consumer. Version mise a jour pour ConsExpo 4 [dans l'Internet]. Bilthoven (Pays-Bas) : RIVM Report 32010400½006. Accès : http://www.rivm.nl/bibliotheek/rapporten/320104001.pdf [consulté en août 2010].
Ronyai, E., Simandi, B., Lemberkovics, E., Veress, T., Patiaka, D. 1999. Comparison of the volatile composition of clary sage oil obtained by hydro distillation and supercritical fluid extraction. J. Essent. Oil Res. 11:69-71.
Santé Canada. 1995. Enquête sur l'exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l'exposition. Ottawa (Ont.) : Santé Canada.
Santé Canada. 2010. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques – septembre 2009. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation. Accès : http://www.hc-sc.gc.ca/cps-spc/person/cosmet/info-ind-prof/_hot-list-critique/hotlist-liste-fra.php [consulté en juillet 2010].
Santé Canada 2013. Loi sur Aliments et drogues– Liste additifs alimentaires autorisées.
Santos-Gomes, P.C. et Fernandes-Ferreira, M. 2001. Organ- and season-dependent variation in the essential oil composition of Salvia officinalis L. cultivated at two different sites. J. Agric. Food Chem. 49:2908-2916.
Scheringer, M., MacLeod, M., Wegmann, F. 2006. The OECD POV and LRTP Screening Tool [en ligne]. Version 2.0. Organisation de coopération et de développement économiques; Zurich (Suisse) : École polytechnique fédérale. Distribué lors de l'atelier OCDE/PNUE sur l'utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada) du 31 mai au 2 juin 2006. Accès : www.sust-chem.ethz.ch/downloads/Tool2_0_Manual.pdf.
Schmiderer, C., Grassil, P., Novak, J., Weber, M., Franz, C. 2008. Diversity of essential oil glands of clary sage (Salvia sclarea L., Lamiaceae). Plant Biol. 10:433-440.
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2010. Disponible auprès de Santé Canada, Division des cosmétiques. Direction de la sécurité des produits de consommation.
Senatore, F., Formisano, C., Arnold, N.A., Piozzi, F. 2005. Essential oils from Salvia sp. (Lamiaceae). III. Composition and antimicrobial activity of the essential oil of Salvia palaestina Benth. Growing wild in Lebanon. J. Essent. Oil Res. 17:419-421.
Sigma-Aldrich 2010. Sclareol CAS RN 515-03-7. Fiches signalétiques en ligne. St. Louis (MO). Accès : http://www.sigmaaldrich.com/catalog/ProductDetail.do?lang=en&N4=357995|ALDRICH&N5=SEARCH_CONCAT_PNO|BRAND_KEY&F=SPEC [consulté le 9 août 2010].
Sirikanataramas, S., Yamazaki, M., Saito, K. 2008. Mechanisms of resistance to self-produced toxic secondary metabolites in plants. Phytochem. Rev. 7:467-477.
Smith RL, Waddell WJ, Cohen SM, Feron VJ, Marnett LJ, Portoghese PS, Rietjens IMCM, Adams TB, Taylor S, Gavin CL, McGowen MM, Williams MC. 2009. GRAS flavoring substances 24. Food Technol. 63(6):46-105. Accès : http://www.femaflavor.org/GRAS%2024.pdf [consulté en juillet 2010].
Soković, M.D., Brkić, D.D., Džamić, A.M., Ristić, M.S., Marin, P.D. 2009. Chemical composition and antifungal activity of Salvia desoleana Atzei & Picci essential oil and its major components. Flavour Fragr. J. 24:83-87.
Souleles, C., Argyriadou, N. 1997. Constituents of the essential oil of Salvia Sclarea growing wild in Greece. Int. J. Pharmacog. 35(3):218-220.
Surburg, H., Panten, J. 2006. Common fragrance and flavour materials, preparation, properties and uses. 5e éd. Weinheim (Allemagne), Wiley-Vch verlag GmbH & Co. kGaA. p. 229.
[TaPL3] Long Range Transport and Persistence Level III model [en ligne]. 2000. Version 2.10. Peterborough (Ont.) : Université Trent, Centre canadien pour la modélisation de l'environnement. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/TaPL3.html.
[TOPKAT] TOxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2. San Diego (CA) : Accelrys Software Inc. Accès : http://www.accelrys.com/products/topkat/index.html.
Tucker, A.O., Maciarello, M.J. 1990. Essential oils of cultivars of Dalmatian sage (Salvia officinalis L.). J. Essent. Oil Res. 2:139-144.
Tutin, T.G., Heywood, V.H., Burges, N.A., Moore, B.M., Valentine, D.H., Walters, S.M., Webb, D.A. 1972. Flora Europea, III. Londres (Angleterre) : Université de Cambridge. [cité par Souleles et Argyriadou 1997].
Ulubelen, A., Topcu, G., Eris, C., Sonmez, U., Kartal, M., Kurucu, S., Bozok-Johansson, C. 1994. Terpenoids from Salvia Sclarea. Phytochemistry 36(4):971-974.
[USEPA] Environmental Protection Agency des États-Unis. 1986.
Vlad, P.F., Aryku, A.N. 1992. Investigation of the products of the ozonolysis of sclareol and the pathways for their formation. Kishinev (Moldavie) : Institute of Chemistry, Academy of Sciences of the Moldavian SSR. 4:502-511.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d'évaluation]. 2008. Version 1.41. Washington (DC) : Environmental Protection Agency des États-Unis, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/tsca-screening-tools/epi-suitetm-estimation-program-interface.
Zani, F., Massimo, G., Benvenuti, S., Bianchi, A., Albasini, A., Melegari, M., Vampa, G., Bellotti, A., Mazza, P. 1969. Studies on the genotoxic properties of essential oils with Bacillus subtilis rec-Assay and Salmonella/microsome reversion assay. Planta Med. 57:237-241.
Annexes
Annexe A. Limites supérieures de l'exposition au sclaréol présent dans les cosmétiques estimée par le modèle ConsExpo version 4.1 (ConsExpo 2006)
Les notes suivantes s'appliquent aux données des annexes A-1 à A-6 :
- Nous avons utilisé les hypothèses suivantes à tous les scénarios :
- poids corporel : 70,9 kg pour un adulte
- la fraction absorbée de 1 a été utilisée pour tenir compte de la dose externe appliquée
- type d'exposition « contact cutané direct » pour l'application instantanée (ConsExpo 2006)
- concentrations d'huiles essentielles figurant dans le Système de déclaration des cosmétiques (SDC 2010)
- concentration de sclaréol dans l'huile essentielle de 5 %. - La gamme de concentration d'huile essentielle, la fréquence d'exposition, la zone exposée et la quantité appliquée de produit sont les hypothèses par défaut de ConsExpo (RIVM 2006).
- Les données sur la zone exposée proviennent de Santé Canada (1995).
- Dose externe appliquée : nous avons estimé la dose quotidienne appliquée en amortissant sur un an la dose chronique externe appliquée.
- Nous avons appliqué un facteur de rétention aux produits à rincer (2006 Cosmetics Exposure Workbook, Bureau de l'évaluation et du contrôle des substances nouvelles, Santé Canada, source non citée).
- Un facteur de dépôt de 10 % a été appliqué pour les produits utilisés dans les cheveux, mais non directement sur le cuir chevelu (ConsExpo 2006).
- La quantité appliquée d'hydratant pour la peau, de revitalisant pour cheveux, nettoyant pour le visage, tonique pour le visage et Produit protecteur pour les cheveux a été calculée en multipliant la quantité de produit mentionnée dans RIVM (2006) par le quotient de la zone du corps couverte mentionnée dans Santé Canada (1995) sur celle mentionnée par RIVM.
Annexe A-1. Estimations de l'exposition chronique d'un adulte par voie cutanée
- Parfum
- Scénario : parfum
- Hypothèses :
- Plage de concentration d'huile essentielle = 0,1 % – 30 %
- Fréquence d'exposition : 730 – 1095 fois/an
- Surface exposée : 100 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 0,43 – 0,64 g (Ce scénario comprend les parfums, utilisé en dose de 0,43 g, 730 fois par année et les eaux de toilette appliqué en dose de 0,64 g 1095 fois par année).
- Dose externe appliquée : 0,43–0,64 g
- Dose externe appliquée : 6,06 × 10−4 – 0,404 mg/kg p.c./jour
- Hydratant pour la peau – crème pour le visage, les mains ou le corps
- Scénario : Hydratant pour la peau
- Hypothèses :
- Plage de concentration d'huile essentielle : 0,1 % – 3 %
- Fréquence d'exposition : 730 fois/an
- Surface exposée : 637 – 1,76 × 104 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 1,2 – 9,2 g
- Dose externe appliquée : 1,69 × 10−3 – 0,389 mg/kg p.c./jour
- Shampooing
- Scénario : Shampooing
- Hypothèses :
- Plage de concentration d'huile essentielle : 0,1 % – 30 %
- Fréquence d'exposition : 260 fois/an
- Surface exposée : 1,55 × 103 cm2 (Santé Canada 1995)
- Un facteur de rétention de 10 % a été appliqué.
- Quantité de produit appliquée : 60 g
- Dose externe appliquée : 1,02 × 10−3 – 0,301 mg/kg p.c./jour
- Revitalisant capillaire
- Scénario : Revitalisant capillaire
- Hypothèses
- Plage de concentration d'huile essentielle = 0,1 % – 30 %
- Fréquence d'exposition : 260 fois/an
- Surface exposée : 1,55 × 103 cm2 (Santé Canada 1995)
- Un facteur de dépôt de 10 % a été appliquée.
- Quantité de produit appliquée : 54 g
- Dose externe appliquée : 6,95 × 10−4 – 0,209 mg/kg p.c./jour
- Produits de rasage
- Scénario : lotion d'après-rasage
- Hypothèses :
- Plage de concentration d'huile essentielle : < 0,1 % – 1 %
- Fréquence d'exposition : 365 fois/an
- Surface exposée 319 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 1,2 g
- Dose externe appliquée : 8,46 × 10−4 mg/kg p.c./jour
- Tonic pour le visage
- Scénario : lotion nettoyante
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 3 %
- Fréquence d'exposition : 730 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 2,5 g
- Dose externe appliquée : 3,52 × 10−3 – 0,106 mg/kg p.c./jour
- Laque pour cheveux
- Scénario : Laque pour cheveux
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 0,3 %
- Fréquence d'exposition : 438 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Un facteur de rétention de 20 % a été appliqué
- Quantité de produit appliquée : 0,6 g
- Dose externe appliquée : 1,01 × 10−4 – 3,04 × 10−4 mg/kg p.c./jour
- Produits de soins capillaires
- Scénario : Mousse capillaire
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 0,3 %
- Fréquence d'exposition : 274 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 0,3 g
- Dose externe appliquée : 1,59 × 10−4 – 4,76 × 10−4 mg/kg p.c./jour
- Démêlant pour cheveux
- Scénario : Laque pour cheveux avec pulvérisateur
- Hypothèses
- Plage de concentration d'huile essentielle : < 0,1 %
- Fréquence d'exposition : 438 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 0,6 g
- Dose externe appliquée : 1,04 × 10−3 mg/kg p.c./jour
- Produits de soins capillaires
- Scénario : Gel capillaire
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 3 %
- Fréquence d'exposition : 358 fois/ans
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 0,3 g
- Dose externe appliquée : 2,07 × 10−4 – 0,061 mg/kg p.c./jour
- Lotion pour les yeux
- Scénario : Démaquillant pour les yeux
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 10 %
- Fréquence d'exposition : 365 fois/an
- Surface exposée : 50 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 0,5 g
- Dose externe appliquée : 3,52 × 10−4 – 0,0352 mg/kg p.c./jour
- Nettoyant pour le visage, les mains ou le corps (barre ou liquide)
- Scénario : nettoyant pour la peau
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 30 %
- Fréquence d'exposition : 329 – 730 fois/an
- Surface exposée : 637 – 1,76 × 104 cm2 (Santé Canada 1995)
- Un facteur de rétention de 1 % a été appliqué
- Quantité de produit appliquée : 1,78 – 26,2 g
- Dose externe appliquée : 8,38 × 10−6 – 0,0166 mg/kg p.c./jour
- Déodorant (en bâton)
- Scénario : Déodorant
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 1 %
- Fréquence d'exposition : 473 fois/an
- Surface exposée : 240 cm2 (estimation) (Santé Canada 1995)
- Quantité de produit appliquée : 1,2 g
- Dose externe appliquée : 1,10 × 10−3 – 1,1 × 10−2 mg/kg p.c./jour
- Désodorisant pour pieds en aérosol
- Scénario : pulvérisateur à gâchette
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 730 fois/an
- Surface exposée : 1280 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 13,8 g
- Dose externe appliquée : 0,0584 – 0,195 mg/kg p.c./jour
- Nettoyant pour le visage
- Scénario : tampons démaquillants
- Hypothèses
- Plage de concentration d'huile essentielle : < 0,1 %
- Fréquence d'exposition : 730 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Un facteur de rétention de 10 % a été appliqué
- Quantité de produit appliquée : 2,5 g
- Dose externe appliquée : 5,64 × 10−4 – 1,69 × 10−3 mg/kg p.c./jour
- Produit protecteur pour les cheveux
- Scénario : Revitalisant capillaire (aucun facteur de rétention)
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 0,3 %
- Fréquence d'exposition : 260 fois/an
- Surface exposée : 1,44 × 103 cm2 (Santé Canada 1995)
- Un facteur de rétention de 10 % a été appliqué
- Quantité de produit appliquée : 12,4 g
- Dose externe appliquée : 6,22 × 10−4 – 1,9 × 10−3 mg/kg p.c./jour
- Maquillage – fond de teint
- Scénario : Maquillage pour le visage
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 3 %
- Fréquence d'exposition : 365 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 0,8 g
- Dose externe appliquée : 3,52 × 10−4 mg/kg p.c./jour
- Fard à cils
- Scénario : Maquillage pour les yeux
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 365 fois/an
- Surface exposée : 1,6 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 0,025 g
- Dose externe appliquée : 5,29 × 10−5 – 1,76 × 10−4 mg/kg p.c./jour
- Produit de rasage – gel
- Scénario : Crème à raser
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 1 %
- Fréquence d'exposition : 365 fois/an
- Surface exposée : 318 cm2 (Santé Canada 1995)
- Un facteur de rétention de 1 % a été appliqué
- Quantité de produit appliquée : 2 g
- Dose externe appliquée : 1,41 × 10−5 – 1,41 × 10−4 mg/kg p.c./jour
Annexe A-2, Estimations de l'exposition aiguë des adultes par voie cutanée
- Huile de massage
- Scénario : huile de massage
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 30 %
- Fréquence d'exposition : 24 fois/an
- Surface exposée : 1,68 × 104 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 8 g
- Dose externe appliquée : 5,64 × 10−3 – 1,69 mg/kg p.c./jour
- Décolorant pour cheveux
- Scénario : Décolorant pour cheveux
- Hypothèses
- Plage de concentration d'huile essentielle : < 0,1 %
- Fréquence d'exposition : 10 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 200 g
- Dose externe appliquée : 0,141 mg/kg p.c./jour
- Masque purifiant
- Scénario : masque
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 104 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Un facteur de rétention de 10 % a été appliqué
- Quantité de produit appliquée : 20 g
- Dose externe appliquée : 1,41 × 10−3 – 0,141 mg/kg p.c./jour
- Colorant capillaire
- Scénario : Colorant capillaire
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 10 fois/an
- Surface exposée : 637 cm2 (Santé Canada 1995)
- Un facteur de rétention de 10 % a été appliqué
- Quantité de produit appliquée : 100 g
- Dose externe appliquée : 2,12 × 10−2 – 0,0705 mg/kg p.c./jour
- Produit bronzant
- Scénario : Écran solaire
- Hypothèses
- Plage de concentration d'huile essentielle : < 0,1 % – 0,1 %
- Fréquence d'exposition : 75 fois/an
- Surface exposée : 1,69 × 104 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 10 g
- Dose externe appliquée : 7,05 × 10−3 mg/kg p.c./jour
- Préparations pour le bain (huile, mousse, sels)
- Scénario : préparation pour le bain
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 30 %
- Fréquence d'exposition : 104 fois/an
- Surface exposée : 1,63 × 104 cm2 (Santé Canada 1995)
- Un facteur de rétention de 0,1 % a été appliqué
- Quantité de produit appliquée : 1,69 × 104 g
- Dose externe appliquée : 9,17 × 10−6 – 2,75 × 10−4 mg/kg p.c./jour
Annexe A-3. Estimations de l'exposition des adultes par voie orale
- Rouge à lèvres
- Hypothèses :
- Plage de concentration d'huile essentielle : 0,1 % – 1 %
- Fréquence d'exposition : 1,46 × 103 fois/an
- Type d'exposition : absorption directe (ConsExpo 2006)
- Quantité de produit ingérée : 0,01 g
- Poids corporel : 70,9 kg
- Estimation de l'exposition chronique : Dose externe chronique calculée en amortissant sur un an = 2,82 × 10−5–2,82 × 10−4 mg/kg p.c/jour
- Hypothèses :
Annexe A-4 Estimations de l'exposition des adultes par inhalation
- Déodorant – pieds (pulvérisateur)
- Pulvérisateur à gâchette
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Quantité de produit appliquée : 13,8 g
- Fraction absorbée : 100 %
- Poids corporel : 70,9 kg (Santé Canada 1995)
- Exposition aiguë estimée (par application) : concentration moyenne par événement : 0,145 – 0,482 mg/m3
- Parfum
- Scénario : parfum
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 30 %
- Quantité de produit appliquée : 0,43 – 0,64 g
- Fraction absorbée : 100 %
- Poids corporel : 70,9 kg (Santé Canada 1995)
- Exposition aiguë estimée (par application) : concentration moyenne par événement : 1,1 × 10−5 – 0,0033 mg/m3
- Laque pour cheveux
- Scénario : Laque pour cheveux
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 0,3 %
- Quantité de produit appliquée : 0,6 g
- Fraction absorbée : 100 %
- Poids corporel : 70,9 kg (Santé Canada 1995)
- Exposition aiguë estimée (par application) : concentration moyenne par événement : 6,91 × 10−5 – 2,07 × 10−4 mg/m3
- Démêlant pour cheveux
- Scénario : Démêlant pour cheveux avec pulvérisateur
- Hypothèses
- Plage de concentration d'huile essentielle : < 0,1 % – 0,1 %
- Quantité de produit appliquée : 0,6 g
- Fraction absorbée : 100 %
- Poids corporel : 70,9 kg (Santé Canada 1995)
- Concentration moyenne par événement : 3,65 × 10−6 mg/m3
Annexe A-5 Estimations de l'exposition des nourrissons par voie cutanée
- Shampooing pour bébé (exposition chronique)
- Scénario : Shampooing
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 260 fois/an
- Surface exposée : 330 cm2 (Santé Canada 1995)
- Un facteur de rétention de 10 % a été appliqué
- Quantité de produit appliquée : 34,1 g
- Dose externe chronique appliquée : 0,0162 – 0,0539 mg/kg p.c/jour
- Nettoyant pour la peau pour bébé – corps (exposition chronique)
- Scénario : Nettoyant pour la peau
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 329 fois/an
- Surface exposée : 3,02 × 103 cm2 (Santé Canada 1995)
- Un facteur de rétention de 1 % a été appliqué
- Quantité de produit appliquée : 4,5 g
- Dose externe chronique appliquée : 8,11 × 10−4 – 2,7 × 10−3 mg/kg p.c/jour
- Huile de massage pour bébé (exposition aiguë)
- Scénario : Huile de massage
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 24 fois/an
- Surface exposée : 3020 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 1,48
- Dose externe chronique appliquée : 0,0296 – 0,0987 mg/kg p.c/jour
Annexe A-6 Estimations de l'exposition des tout-petits par voie cutanée
- Shampooing pour bébé
- Scénario 365 événements, exposition chronique cutanée
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 365 fois/an
- Surface exposée : 435 cm2 (Santé Canada 1995)
- Un facteur de rétention de 10 % a été appliqué
- Quantité de produit appliquée : 45 g
- Dose externe chronique appliquée : 0,0145 – 0,0483 mg/kg p.c/jour
- Nettoyant pour la peau pour bébé – corps
- Scénario : Nettoyant pour la peau
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 329 fois/an
- Surface exposée : 4,91 × 103 cm2 (Santé Canada 1995)
- Un facteur de rétention de 1 % a été appliqué
- Quantité de produit appliquée : 7,32
- Dose externe chronique appliquée :6,38 × 10−4 – 2,13 × 10−3 mg/kg p.c/jour
- Huile de massage pour bébé
- Scénario : huile de massage pour bébé, exposition cutanée aiguë
- Hypothèses
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fréquence d'exposition : 24 fois/an
- Surface exposée : 4910 cm2 (Santé Canada 1995)
- Quantité de produit appliquée : 2,4
- Dose externe chronique appliquée : 0,0232 – 0,0774 mg/kg p.c/jour
- Démêlant pour cheveux pour enfants (exposition par inhalation)
- Scénario : Laque pour cheveux avec pulvérisateur
- Hypothèses
- Plage de concentration d'huile essentielle : 0,1 % – 0,3 %
- Quantité de produit appliquée : 0,6 g
- Fraction absorbée : 100 %
- Poids corporel : 15,5 kg (Santé Canada 1995)
- Exposition aiguë estimée (par application) :concentration moyenne par événement : 3,65 × 10−6 – 1,1 × 10−5 mg/m3
Annexe B. Produits de consommation
- Brumisateur : limites supérieures estimées à l'aide de la version 4.1 du modèle ConsExpo (ConsExpo 2006)
- Hypothèse
- Plage de concentration d'huile essentielle : 0,3 % – 1 %
- Fraction absorbée : 100 %
- Par inhalation : adapté de ConsExpo 4.1 pulvérisateur (RIVM 2006)
- Exposition au produit en aérosol
- – Durée d'exposition : 240 minutes (estimée)
- – Volume de la pièce : 58 m3 (USEPA 1986)
- – Débit de ventilation : 0,5 h-1 (USEPA 1986)
- – Taux de production massique : 0,75 g/s (RIVM 2006)
- – Durée de vaporisation : 3 min (USEPA 1986)
- – Fraction atmosphérique : 1 (RIVM 2006)
- – Fraction massique non volatile : 0,1
- – Densité de la fraction non volatile : 1,8 g/cm3 (RIVM 2006)
- – Hauteur de la pièce : 2,5 m (estimée)
- – Diamètre minimum d'inhalation : 15 µm (RIVM 2006)
- – Débit d'inhalation : 16,2 m3/jour (Santé Canada 1995)
- Estimation de l'exposition : concentration moyenne par événement : 2,1 × 10−4 - 6,99 × 10−4 mg/m3
- Hypothèse
Annexe C. Sommaire des effets du sclaréol sur la santé
Acronymes :
- CMENO : concentration minimale avec effet nocif observé
- CMEO : concentration minimale avec effet observé
- CSENO : concentration sans effet nocif observé
- DL50 : dose létale médiane
- DMENO : dose minimale avec effet nocif observé
- DMEO : dose minimale avec effet observé
- DSENO : dose sans effet nocif observé
Toxicité aiguë[Aucune étude sur l'exposition par inhalation n'a été recensée.]
DL50 minimale par voie orale > 5000 mg/kg p.c. chez les rats (0/10 mort) (RIFM 1979a, b, cité par Bhatia 2008).
[Aucune autre étude sur l'exposition par voie orale n'a été recensée.]
DL50 minimale par voie cutanée > 5000 mg/kg p.c. chez les lapins (0/6 mort) (RIFM 1979a, b, cité par Bhatia 2008).
[Aucune autre étude sur l'exposition par voie cutanée n'a été recensée.] [Autres études de toxicité aiguë : Malone et coll. 1991]
Toxicité à court terme en doses répétées
DMEO orale = 8,8 mg/kg p.c. par jour, d'après une augmentation du poids moyen des reins relativement à celui du cerveau chez les rats (mâles), augmentation du poids moyen du cœur et de la rate relativement à celui du cerveau chez les rattes, dans une étude menée chez 10 rats et 10 rattes ayant reçu du sclaréol à une dose de 8,8 mg/kg p.c. par jour, sept jours par semaine par intubation orale pendant 30 jours. Aucun changement macroscopique ou microscopique n'a été observé (RIFM 2006a, cité par Bhatia et coll. 2008).
Aucune étude recensée sur les paramètres suivants :
Toxicité subchronique, toxicité chronique et cancérogénicité, toxicité pour le développement, toxicité pour la reproduction
Génotoxicité et paramètres connexes : in vitro
- Résultats positifs : lignée de cellules leucémiques humaines HL60, 20 µg/mL de sclaréol, clivage de l'ADN en fonction de la dose et du temps (Dimas et coll. 1999).
- Résultats positifs : lignée de cellules du cancer du côlon chez l'humain HCT116, 100 µM de sclaréol ont induit des bris d'ADN seulement quatre heures après l'ajout de sclaréol (Dimas et coll. 2007).
Huiles essentielles de sauge sclarée (Salvia sclarea) contenant du sclaréol :
- Mutation génique dans les bactéries : Résultats négatifs : Salmonella typhimurium TA1535, TA1537, TA98 et TA100, avec S9 (Zani et coll. 1969).
- Dommages à l'ADN : Résultats négatifs : souches de Bacillus subtilis PB 1652(trpC2, metB10, lys3, rec+) et PB 1791 (trpC2, metB10, recE4), 10−30 µL de Salvia sclarea L. (Zani et coll. 1969).
Irritation cutanée
- Irritant : chez les lapins, 5000 mg/kg ont produit des effets irritants après une application recouverte pendant 24 heures (RIFM 1979a et 1979 b, cité par Bhatia et coll. 2008).
- Non irritant : chez trois lapins albinos, 3 % de sclaréol dans du pétrolatum ou 3 % de sclaréol dans de l'alcool ASD appliqué à l'aide de timbres sur la peau rasée (RIFM 1975c et 1975d).
Expérience sur l'exposition humaine
- Irritation cutanée
Non irritant : chez 106 volontaires, test épicutané fermé de 48 heures avec 10 % de sclaréol dans du pétrolatum, appliqué sur le dos des volontaires (RIFM 1979c, 1981 et 1986, cité par Bhatia et coll. 2008).
Non irritant : chez 35 volontaires, avec 3 % de sclaréol dans l'alcool ASD 39C, 48 heures, semi-occlusif (induction par HRIPT) (RIFM 1975a, cité par Belsito et coll. 2008). - Non irritant : chez 39 volontaires, avec 3 % de sclaréol dans du pétrolatum, 48 heures, semi-occlusif (induction par HRIPT) (RIFM 1975b, cité par Belsito et coll. 2008).
Sensibilisation
- Sensibilisant : chez 29 et 26 volontaires, avec 10 % de sclaréol dans du pétrolatum, échantillons nos 78-97 (point de fusion 84-90 °C) a produit 1/29 réaction de sensibilisation, et produit 3/26 réactions de sensibilisation lors des nouveaux tests (RIFM 1979c, cité par Bhatia et coll. 2008).
- Non sensibilisant : chez 23 volontaires, avec 10 % de sclaréol dans du pétrolatum, échantillons nos 80-91R (point de fusion 96-106 °C) a produit 0/23 réaction de sensibilisation (RIFM 1981, cité par Bhatia et coll. 2008).
- Non sensibilisant : chez 28 volontaires, avec 10 % de sclaréol dans du pétrolatum, échantillons nos 1140-1185 (point de fusion 98-101 °C) a produit 0/28 réaction de sensibilisation (RIFM 1986, cité par Bhatia et coll. 2008).
Neurotoxicité aiguë
Des effets neurologiques transitoires (diminution de l'activité motrice spontanée, diminution de la fréquence respiratoire et augmentation compensatoire de la profondeur respiratoire) ont été observés chez les rats Sprague-Dawley mâles (taille du groupe inconnue) ayant été exposés à 0, 100, 316 ou 1000 mg/kg p.c. par une injection intrapéritonéale (i.p.) unique (de sclaréol dans 0,25 % d'agar aqueux stérile) (Malone et coll. 1991).
Sclaréol-glycol
DMEO = 5 mg/kg, d'après une diminution de l'activité locomotrice observée dans des groupes de huit souris mâles albinos (souche inconnue) ayant été exposées à 0, 5, 25, 50 ou 100 mg/kg par une injection i.p. unique. L'activité locomotrice était enregistrée toutes les cinq minutes pendant 30 minutes après injection. Le sclaréol glycol stimulait l'activité locomotrice à 5, 25 et 50 mg/kg, mais à 100 mg/kg, il la diminuait de 30 % comparativement au groupe témoin (Georgieva 1988). [Autres études sur la neurotoxicité : Georgieva 1987, 1989a, 1989b]
Annexe D : Sommaire des résultats des modèles RQSA pour le sclaréol
| Modèle/espèce | Souris mâles | Souris femelles | Rats mâle | Rats femelles | Rats | Souris | Rongeur | Mammifères |
|---|---|---|---|---|---|---|---|---|
| Model Applier | N | P | P | N | N | N | N | – |
| Multicase Casetox | N | N | N | N | – | – | – | – |
| TOPKAT | HD | P | NC* | HD | – | – | – | – |
| Derek | – | – | – | – | – | – | – | RAS |
HD : hors domaine (le modèle indique que le produit chimique est hors de son domaine d'applicabilité) « – » aucun modèle disponible dans la suite RQSA RAS : Rien à signaler N : Négatif P : Positif NC* : Non concluant (prévision du modèle non fiable, fondée sur des critères précis du modèle définis par l'utilisateur, autre que le domaine d'applicabilité du modèle)
| Modèle/paramètres | Model Applier |
Multicase Casetox |
TOPKAT |
|---|---|---|---|
| Aberrations chromosomiques. | P | N | – |
| Aberrations – autres rongeurs | P | – | – |
| Aberrations chromosomiques – rats | HD | – | – |
| Test du micronoyau sur des souris | N | N | – |
| Test du micronoyau sur des rongeurs | P | – | – |
| Drosophila | N | HD | – |
| Drosophila (translocations héréditaires) | N | – | – |
| Drosophila (mutations létales récessives liées au sexe) | N | – | – |
| Mutation chez les mammifères | N | – | – |
| Mammifères – essai de mutation létale dominante | N | – | – |
| Synthèse de l'ADN non programmée (UDS) | N | HD | – |
| Synthèse de l'ADN non programmée avec des lymphocytes humains | HD | – | – |
| Synthèse de l'ADN non programmée avec des hépatocytes de rats | N | – | – |
| Mutation – lymphome chez des souris | N | HD | – |
| S. cerevisiae | N | – | – |
| Levure | N | – | – |
| HGPRT | N | – | – |
| E. coli | N | – | – |
| E coli W | N | – | – |
| Activité microbienne | N | – | – |
| Salmonella | N | N | N |
HD : hors domaine (le modèle indique que le produit chimique est hors de son domaine d'applicabilité) « – » : aucun modèle disponible dans la suite RQSA N : Négatif P : Positif
| Paramètre/espèce | Souris | Lapins | Rats | Rongeurs |
|---|---|---|---|---|
| Retard | HD | HD | N | N |
| Diminution du poids | HD | HD | P | N |
| Mortalité fœtale | HD | HD | N | N |
| Pertes postimplantation | HD | HD | P | N |
| Pertes avant l'implantation | HD | HD | N | N |
| Structure | HD | HD | N | N |
| Viscères | HD | HD | N | N |
HD : hors domaine (le modèle indique que le produit chimique est hors de son domaine d'applicabilité) N : Négatif P : Positif
| Paramètre/espèce | Hamster | Mammifères | Divers |
|---|---|---|---|
| Tératogénicité | – | N | N |
| Développement | HD | – | – |
HD : hors domaine (le modèle indique que le produit chimique est hors de son domaine d'applicabilité) « – » aucun modèle disponible dans la suite RQSA N : Négatif
| Modèle/ paramètre |
Souris femelles |
Rats femelles |
Rongeurs femelles |
Souris mâle |
Rats mâles |
Rongeurs mâles |
|---|---|---|---|---|---|---|
| Reproduction | HD | HD | HD | HD | HD | HD |
| Sperme | – | – | – | HD | HD | HD |
HD : hors domaine (le modèle indique que le produit chimique est hors de son domaine d'applicabilité) « – » aucun modèle disponible dans la suite RQSA
| Souris | Rats | Lapins | Humain |
|---|---|---|---|
| N | N | N | HD |
HD – hors domaine (le modèle indique que le produit chimique est hors de son domaine d'applicabilité) N – Négatif