Évaluation préalable pour le Défi concernant
Archivée
le bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle
Numéro de registre du Chemical Abstracts Service
65140-91-2
Environnement Canada
Santé Canada
Septembre 2011
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe I : Sommaires de rigueur d'étude
- Annexe II : Tableau sommaire des intrants des modèles de la persistance, de la bioaccumulation et de la toxicité (PBT)
- Annexe III : Résumé des données relatives aux effets du PADMEC sur la santé
- Annexe IV : Prévisions des modèles R(Q)SA pour le PADMEC
- Annexe V : Structures du PADMEC et des substances de structure analogue
- Annexe VI : Résumé des données relatives aux effets sur la santé de l'Irganox 1330 (n° CAS 1709-70-2) – substance analogue au PADMEC
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle (ci-après appelé PADMEC), dont le numéro de registre du Chemical Abstracts Service[1] est 65140-91-2. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi en vertu du Plan de gestion des produits chimiques, car il a été établi qu’elle répond aux critères environnementaux de catégorisation relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes non humains et il semble qu’elle soit commercialisée au Canada.
L’évaluation des risques que présente le PADMEC pour la santé humaine n’a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d’exposition et du risque pour la santé élaborés aux fins de la catégorisation des substances de la Liste intérieure.
Le PADMEC est une substance organique utilisée comme antioxydant et agent stabilisant dans les plastiques, les fibres synthétiques, les élastomères, les adhésifs, les cires, les huiles et les graisses pour assurer une protection contre la dégradation thermo-oxydante. Cette substance n’est pas produite naturellement dans l’environnement. Des quantités de PADMEC se situant entre 1 000 et 100 000 kg ont été importées au Canada en 2005, et même si on n’a déclaré aucune quantité commercialisée au pays en 2006, une entreprise a indiqué au gouvernement du Canada qu’elle envisageait la possibilité d’importer du PADMEC ultérieurement. D’après ces renseignements, des rejets de cette substance dans l’environnement au Canada sont possibles.
D’après les profils d’utilisation prévus et certaines hypothèses, la plus grande partie de cette substance aboutirait dans les sites d’élimination des déchets. Une petite partie serait rejetée dans l’eau en provenance des eaux usées (0,8 %) et une plus petite partie serait rejetée dans le sol à partir de sites d’enfouissement et par suite de l’épandage de biosolides. Il ne devrait pas y avoir de rejet dans l’air. La forme anionique du PADMEC qui existe à des valeurs de pH normalement observées dans l’environnement est très soluble dans l’eau, n’est pas volatile et devrait s’adsorber fortement sur les surfaces minérales. Par conséquent, le PADMEC est susceptible de se retrouver principalement dans l’eau et les sédiments.
Le PADMEC devrait se dégrader lentement dans le milieu naturel où il pourrait être rejeté. Il est considéré comme persistant dans l’eau et le sol. De nouvelles données expérimentales et modélisées relatives à sa répartition entre l’octanol et l’eau laissent entendre que cette substance a un faible potentiel de bioaccumulation dans les tissus adipeux des organismes. Il a été déterminé que cette substance répond aux critères de persistance, mais non à ceux de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. En outre, de nouvelles données expérimentales sur la toxicité indiquent que le PADMEC présente une faible toxicité pour les organismes aquatiques.
Aux fins de la présente évaluation préalable, un scénario d’exposition très prudent a été élaboré selon lequel la valeur maximale des quantités de PADMEC importées au Canada en 2005 (100 000 kg) était utilisée dans un seul site industriel et qu’il y avait des rejets dans le milieu aquatique. La substance présente un faible potentiel de risque pour les organismes aquatiques comme l’indique la comparaison de la concentration environnementale estimée et de la concentration estimée sans effet.
Aucune donnée empirique relative aux effets sur la santé n’a été relevée pour le PADMEC. Selon les données relatives aux effets d’un analogue sur la santé, on n’a déterminé aucun potentiel de risque élevé pour cette substance. Étant donné que le PADMEC n’est actuellement pas importé ou fabriqué au Canada en des quantités supérieures au seuil de déclaration, la probabilité d’exposition de la population générale du Canada est considérée comme faible. Par conséquent, les risques pour l’ensemble de la population sont aussi considérés comme faibles.
À la lumière des renseignements disponibles, il est conclu que le PADMEC n’est pas une substance qui pénètre dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir un effet nocif immédiat ou à long terme sur la vie et la santé humaines. Il est aussi conclu que le PADMEC ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
D’après les renseignements disponibles, il est conclu que PADMEC ne remplit aucun des critères énoncés à l’article 64 de la LCPE (1999). PADMEC remplit les critères de la persistance and l’eau et le sol mais pas les critères de la bioaccumulation tel que défini dans le Règlement sur la persistance et la bioaccumulation.
On envisagera d’inclure cette substance dans la mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
La Loi canadienne sur la protection de l’environnement [LCPE (1999)] (Canada, 1999) impose aux ministres de l’Environnement et de la Santé de procéder à une évaluation préalable des substances qui répondent aux critères de catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d’intention dans la Partie I de la Gazette du Canada(Canada, 2006a), dans lequel ils priaient l’industrie et les autres parties intéressées à fournir, dans des délais précis, des renseignements spécifiques qui pourraient servir à étayer l’évaluation des risques, à élaborer et à déterminer les meilleures pratiques en matière de gestion des risques et d’intendance des produits des substances jugées hautement prioritaires.
Le bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle est une substance dont l’évaluation des risques pour l’environnement a été jugée hautement prioritaire, car elle est persistante, bioaccumulable et intrinsèquement toxique pour les organismes aquatiques et l’on croit qu’elle est commercialisée au Canada. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 31 janvier 2009 (Canada, 2009a, 2009b). En même temps a été publié le profil de cette substance, qui présentait l’information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements relatifs aux propriétés, au potentiel de bioaccumulation, à la persistance, au danger et aux utilisations de la substance ont été communiqués en réponse au Défi.
Bien que l’évaluation des risques que présente le bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle pour l’environnement soit jugée hautement prioritaire, cette substance ne répond pas aux critères de catégorisation pour le PFRE ou le REI ni aux critères définissant un grave risque pour la santé humaine, compte tenu du classement attribué par d’autres organismes nationaux ou internationaux quant à sa cancérogénicité, à sa génotoxicité ou à sa toxicité pour le développement ou la reproduction.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l’article 64 de laLoi. Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence[2].
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris ceux fournis dans le cadre du Défi. Les données qui ont trait à l’évaluation préalable de cette substance proviennent de documents originaux, de rapports de synthèse et d’évaluation, de rapports de recherche faits par les intervenants et de recherches documentaires récentes échelonnées jusqu’en juillet 2010 et ayant servi de base aux sections du présent document qui portent sur l’environnement et la santé humaine. Les études les plus importantes ont fait l’objet d’une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions.
Lorsqu’ils étaient disponibles et pertinents, les renseignements présentés dans l’évaluation des dangers provenant d’autres instances ont également été utilisés. La présente évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des études et des données probantes appuyant le mieux la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. La partie de la présente évaluation portant sur l’écologie a fait l’objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. En outre, l’ébauche de la présente évaluation a fait l’objet d’une période de commentaires de 60 jours par le public. Bien que les commentaires reçus de l’extérieur aient été pris en considération, Santé Canada et Environnement Canada sont seuls responsables du contenu final et des résultats de l’évaluation préalable. Les approches suivies pour les évaluations préalables dans le cadre du Défi ont été examinées par un groupe indépendant, soit le Groupe consultatif du Défi.
Les principales données et considérations sur lesquelles repose la présente évaluation préalable sont résumées ciaprès.
Nom de la substance
Aux fins du présent document, la substance « bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle » est appelée PADMEC. L’acronyme est formé d’après son appellation anglaise dans la LIS.
Tableau 1. Identité de la substance - PADMEC
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 65140-91-2 |
| Nom dans la LIS | bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | phosphonic acid, [[3,5-bis(1,1-dimethylethyl)-4-hydroxyphenyl]methyl]-, monoethyl ester, calcium salt (2:1) (TSCA, AICS, PICCS, ASIA-PAC) bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle (EINECS) calcium bis[ethyl (3,5-di-tert-butyl-4- hydroxybenzylphosphonate)] (ENCS) [[3,5-Bis(1,1-dimethylethyl)-4-hydroxyphenyl]methyl]phosphonic acid monoethyl ester calcium salt (2:1) (ECL) phosphonic acid, [[3,5-bis(1,1-dimethylethyl)-4-hydroxyphenyl]methyl-monoethylester,calcium salt (2:1) (PICCS) |
| Autres noms | calcium (3,5-di-tert-butyl-4-hydroxybenzyl monoethyl phosphonate); calcium bis(ethyl 3,5-di-tert-butyl-4-hydroxybenzylphosphonate); calcium bis[ethyl (3,5-di-tert-butyl-4-hydroxyphenyl)methanephosphonate]; ethyl 3,5-di-tert-butyl-4-hydroxybenzylphosphonate, calcium salt; IR 1425WL; Irganox 1425; Irganox 1425WL; Irganox I 1425; phosphonic acid, P-[[3,5-bis(1,1-dimethylethyl)-4-hydroxyphenyl]methyl]-, monoethyl ester, calcium salt (2:1) |
Groupe chimique (groupe de la LIS) |
Matières organiques définies |
| Principale classe chimique ou utilisation | Phénols |
| Principale sous-classe chimique | Esters phosphoniques |
| Formule chimique | C34 H56O8 P2Ca |
| Structure chimique |  |
| SMILES[2] | c1(c(C(C)(C)C)cc(cc1C(C)(C)C)CP(=O)([O])OCC)O[Ca]c1 (c(C(C)(C)C)cc(cc1C(C)(C)C)CP(=O)([O-])OCC)O |
| Masse moléculaire | 694,85 g/mol |
[2] Simplified Molecular Input Line Entry System.
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et modélisées) du PADMEC qui se rapportent à son devenir dans l’environnement. La validité des études relatives au log D (registre ou log du coefficient de distribution des entités ioniques dans l’octanol et l’eau; consulter la note de bas de page 1 du tableau 2) et à la solubilité dans l’eau a fait l’objet d’un examen minutieux. Ces examens (sommaires de rigueur d’étude) se trouvent à l’annexe I.
Les contreions du PADMEC devraient s’ioniser (se charger négativement) aux pH enregistrés dans l’environnement (de 6 à 9), si l’on se fie à la première très faible valeur de pKa de 2,38 et à la seconde valeur élevée de pKa de 12,5 (voir le tableau 2). Le PADMEC est aussi un sel et, par conséquent, il se fera un équilibre dans l’eau entre le sel et la forme dissociée. Les propriétés physiques et chimiques de la forme non dissociée et de la forme dissociée du PADMEC sont présentées dans le tableau 2 ciaprès, et sont semblables pour les deux formes.
Les modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés pour générer des données pour les propriétés physiques et chimiques du PADMEC. Ces modèles sont principalement fondés sur les méthodes d’addition de fragments, c.-à-d. qu’ils reposent sur la structure d’une substance chimique. Les substances ionisantes et les sels, comme PADMEC, sont difficiles à modéliser, car la plupart des modèles, comme EPIWIN (2008) et CPOP (2008), acceptent uniquement les codes du SMILES (consulter la note de bas de page 2 du tableau 1) des molécules neutres (non chargées) et ne tiennent pas compte des interactions électrostatiques résultant des espèces chargées. Le modèle ACD/PhysChem Suite (2009), employé pour estimer certaines propriétés comme le log D et la solubilité dans l’eau, a été retenu pour la forme ionisée à différentes valeurs de pH (voir le tableau 2). Cependant, ce modèle n’acceptant pas les sels, le PADMEC a été modélisé selon ACD/PhysChem Suite (2009) comme une molécule dissociée, tel que le montre la figure 1, et est expliqué ciaprès. Le fait que les modèles ne tiennent pas compte des interactions électrostatiques augmente l’incertitude associée aux propriétés prévues.
Les modèles tels que EPIsuite (2008) et CPOP (2008) n’acceptant ni les sels ni les espèces ionisées, la forme neutre d’une moitié de la structure du PADMEC a été introduite dans les modèles pour représenter la forme dissociée (figure 1) (voir SMILES à l’annexe II). Afin de modéliser la structure non dissociée, il a fallu établir des liaisons entre l’ion calcium ion et les atomes d’oxygène des groupes de l’acide phosphonique (voir SMILES à l’annexe I), ce qui a produit aussi une espèce neutre.

Figure 1. Structure dissociée et neutre du PADMEC utilisée pour la modélisation
Les valeurs des propriétés physicochimiques expérimentales présentées dans le tableau 2 tiennent compte des formes du PADMEC qui étaient présentes en solution durant les expériences, à savoir la forme dissociée et la forme non dissociée, même si on ne connaît pas la proportion de chaque forme. En raison de la forte solubilité du PADMEC, on s’attend à ce que les deux formes soient présentes en équilibre en solution.
Tableau 2. Propriétés physiques et chimiques de la forme non dissociée et de la forme dissociée du PADMEC
| Forme du PADMEC | Type | Valeur | Température (°C) | Référence |
|---|---|---|---|---|
| Point de fusion (ºC) | ||||
| Non dissociée | Modélisé | 90,3 | - | MPBPWIN, 2008 |
| Dissociée | Modélisé | 86,4 | - | MPBPWIN, 2008 |
| Les deux formes | Expérimental | > 260 | Présentation de projet, 2010a | |
| Point d’ébullition (ºC) | ||||
| Non dissociée | Modélisé | 480 | - | MPBPWIN, 2008 |
| Dissociée | Modélisé | 440 | - | MPBPWIN, 2008 |
| 408 | - | ACD/ PhysChem Suite, 2009 | ||
| Densité (kg/m3) | ||||
| Les deux formes | Expérimental | 1,2 x 103 (1,2 g/cm3) |
S.O. | Présentation de projet, 2010a |
| Pression de vapeur (Pa) | ||||
| Non dissociée | Modélisé | 6,03 x 10-10 | 25 | MPBPWIN, 2008 |
| Dissociée | Modélisé | 3,25 x 10-9 | 25 | MPBPWIN, 2008 |
| Les deux formes | Expérimental | < 0,01 | 20 | Présentation de projet, 2010a |
| Constante de la loi de Henry (Pa m3/mol) | ||||
| Non dissociée | Calculé[1] | 3,40 x 10-10 | 25 | HENRY, 2008 |
| Dissociée | Modélisé | 2,94 x 10-8 | 25 | HENRY, 2008 |
| Log D (coefficient de distribution)[2] [sans dimension] | ||||
| Non dissociée | Calculé[3] | 1,46 (pH = 7,0) | 25 | - |
| Dissociée | Modélisé | 0,15 (pH = 6,0) -0,031 (pH = 7,0)[*] -0,054 (pH = 8,0) |
25 | ACD/ PhysChem Suite, 2009 |
| Calculé[4] | -0,57 (pH = 7,0) | 25 | - | |
| Les deux formes | Expérimental (étude Koe) | 0,83 (pH = 5,5)[5] | S.O. | Présentation de projet, 2010b |
| Log Kco(coefficient de partage carbone organique-eau) [sans dimension] | ||||
| Non dissociée | Modélisé[6] | 1,84 | 25 | KOCWIN, 2008 |
| Dissociée | 0,85 | |||
| Solubilité dans l’eau (mg/L) | ||||
| Non dissociée | Modélisé | 1 230 | 25 | WSKOWWIN, 2008 |
| Dissociée | Modélisé | 8 222 | 25 | WSKOWWIN, 2008 |
| 743 1 000 1 000 |
pH = 5,5 pH = 7,0 pH = 8,0 |
ACD/ PhysChem Suite, 2009 | ||
| Les deux formes | Expérimental | 2 400 | 20 | Présentation de projet, 2010c |
| pKa (constante de dissociation acide) [sans dimension] | ||||
| Dissociée | Modélisé7 | 12,5 (pKa 2) 2,38 (pKa 1) |
25 | ACD/ PhysChem Suite, 2009 |
[*] Valeur choisie pour la modélisation.
[1] Calculée par HENRY (2008), d’après la pression de vapeur modélisée et la solubilité dans l’eau modélisée de 1 230 mg/L.
[2] Le log D constitue le registre du coefficient de distribution qui prend en considération la présence d’entités ioniques; il représente une quantité nette de formes neutres et ioniques supposées se diviser à la phase lipidique à un pH donné.
[3] Fondé sur un log Koeestimé (forme neutre) de 6,08 (KOWWIN, 2008), ainsi que sur une pKa estimée de 2,38 (log D = log Koe + pKa – pH).
[4] Fondé sur un log Koeestimé (forme neutre) de 4,03 (KOWWIN, 2008), ainsi que sur une pKa estimée de 2,38.
[5] Cette valeur n’est pas jugée fiable, car la substance a été ionisée au pH nécessaire à l’étude.
[6] Fondé sur un log D estimé à pH 7 (1,46 pour la forme non dissociée; -0,031 pour la forme dissociée) et, par conséquent, en tenant compte de l’influence des formes ioniques plus solubles de cette substance, mais sans tenir compte du dosage acide-base ni des interactions électrostatiques avec les substrats solides.
[7] Il a été impossible de modéliser la pKa de la forme non dissociée (car le modèle n’accepte pas les sels).
Le PADMEC n’est pas une substance de composition naturelle.
Des enquêtes menées pour les années 2005 et 2006 par le truchement d’avis publiés dans la Gazette du Canadaconformément à l’article 71 de la LCPE (1999) ont permis d’obtenir des données (Canada, 2006b; Canada, 2009b). Ces deux avis visaient à recueillir des données sur la fabrication, l’importation et l’utilisation de cette substance au Canada.
En 2006, aucune entreprise n’a déclaré avoir fabriqué, importé ou utilisé des quantités de PADMEC en 2006 (Environnement Canada, 2009) supérieures ou inférieures au seuil de déclaration fixé à 100 kg/an au Canada. Cependant, en 2009, une entreprise s’est dit être un futur intervenant lié à l’importation du PADMEC au Canada. En février 2011, cette entreprise n’importe toujours pas, ne fabrique pas et n’utilise pas cette substance au Canada (communication personnelle entre un représentant de l’entreprise et la Division de l’évaluation écologique, Environnement Canada, source non citée). Cette entreprise a fourni au gouvernement du Canada des études empiriques sur les propriétés physiques et chimiques, la persistance, la bioaccumulation et l’écotoxicité, toutes résumées dans le présent rapport. Cette même entreprise a demandé qu’on assure la confidentialité de son identité et des données de ses modèles d’utilisation de cette substance.
En 2005, moins de quatre entreprises ont indiqué avoir importé de 1 001 à 100 000 kg/an de PADMEC, selon le modèle d’utilisation tenu confidentiel (Environnement Canada, 2007a), et une entreprise a indiqué avoir importé moins de 100 kg/an de PADMEC (Environnement Canada, 2007a). Au Canada, le PADMEC ne sert ni de formulant ni matière active dans les produits antiparasitaires (Santé Canada, 2007, 2010).
Le PADMEC figure sur les listes de substances chimiques produites en petites quantités en Europe (ESIS, 2010). Actuellement, le PADMEC n’est pas déclaré (année de déclaration 2009) dans le programme américain Toxics Release Inventory (TRI) (USEPA, 2010a). Cette substance chimique a été déclarée en vertu de la Inventory Update Rule visée par laU.S. Toxic Substances Control Act des ÉtatsUnis pour les périodes de déclaration suivantes : 1986, 1990, 1994, 1998, 2002 et 2006 (USEPA, 2010b; USEPA, 2006a). En 2006, moins de 500 000 livres (227 000 kg) de cette substance ont été produites ou importées aux ÉtatsUnis (USEPA, 2006a). En 1990, 1994, 1998 et 2002, de 10 000 à 500 000 livres (de 4 540 à 227 000 kg) de cette substance ont été produites ou importées aux ÉtatsUnis (USEPA, 2010b).
Le PADMEC a été utilisé en Suède en 2008 (volume de 27 tonnes) et n’y a pas été utilisé en 2007 (0 tonne) (SPIN, 2010). Il a aussi été utilisé en Finlande (consulter la section Utilisations ciaprès), bien qu’on ne dispose d’aucune donnée sur la quantité (SPIN, 2010).
Le PADMEC n’a pas été déclaré avoir été utilisé au Canada en 2006 (voir la section Sources). L’entreprise qui a soumis des renseignements sur le PADMEC au gouvernement du Canada (décrits dans la section Sources) a demandé d’assurer la confidentialité des données de son profil d’utilisation. Par conséquent, l’utilisation du PADMEC déclaré pour 2005 doit demeurer confidentielle. Or, ces données ont été prises en considération dans la présente évaluation. Le PADMEC n’est pas utilisé au Canada comme matière active ou produit de formulation des produits antiparasitaires (ARLA, 2007; ARLA, 2010).
Au Canada, le PADMEC n’est pas répertorié dans leRèglement sur les aliments et drogues comme additif alimentaire; cependant, Santé Canada ne s’est pas objecté à son utilisation dans la composition de certains emballages alimentaires de plastique (communication personnelle en 2010 de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques des substances existantes, Santé Canada; source non citée). Le PADMEC ne figure pas actuellement sur la Liste critique des ingrédients dont l’utilisation est interdite dans les cosmétiques de Santé Canada (Santé Canada, 2009), et aucun produit qui en contient ne se trouve dans la base de données du Système de déclaration des cosmétiques (SDC, 2010).
À l’échelle internationale, le PADMEC sert d’antioxydant à masse moléculaire élevée. Il sert de stabilisant dans les substrats organiques comme le plastique, les fibres synthétiques, les élastomères, les adhésifs, les cires, les huiles et les graisses pour assurer une protection contre la dégradation thermooxydante (Cradlechem, 2003). Le PADMEC peut servir de stabilisant dans les polyoléfines, tout particulièrement les fibres de polypropylène, ainsi que dans le polyester, les élastomères réticulés, les adhésifs de spécialité et les résines donnant du collant (Cradlechem, 2010). Le PADMEC sert aussi de catalyseur d’estérification dans la préparation des esters colophaniques (Cradlechem, 2010).
Le PADMEC figure dans la liste des additifs alimentaires indirects utilisés dans les substances pour contact avec les aliments de la Food and Drug Administration (FDA) des ÉtatsUnis (List of Indirect Food Additives Used in Food Contact Substances) dans la catégorie des antioxydants et des stabilisateurs (USFDA, 2010a). L’utilisation du PADMEC est approuvée dans les copolymères du polypropylène, des polyéthylènes et des oléfines, et des polymères des phtalates de polyéthylène et à des concentrations en poids maximales de 0,2 à 0,3 % et, dans les adhésifs, le ciment servant à sceller les conserves et les résines et les polymères utilisés dans le carton, à des concentrations en poids inférieures à 0,5 % (USFDA, 2010a).
Il sert aussi en Finlande de stabilisant dans la fabrication d’articles de caoutchouc et de plastique (SPIN, 2010). Les volumes d’utilisation n’ont pas été déclarés en raison de leur statut confidentiel (SPIN, 2010).
Une technique a été conçue par Environnement Canada pour estimer les rejets d’une substance dans l’environnement à différentes étapes de son cycle de vie, dont son devenir comme constituant d’un produit fini ou d’un article (Environnement Canada, 2008). Cette méthode comprend une analyse du cycle de vie et un tableur (outil de débit massique) qui intègrent les renseignements sur la fabrication, l’importation et les données d’utilisation disponibles pour la substance donnée. En commençant par une masse définie de la substance, on évalue ensuite les quantités de rejets et de produits à chaque étape de son cycle de vie. Les facteurs pertinents sont étudiés, les incertitudes sont reconnues et des hypothèses prudentes (c.àd. qui protègent l’environnement) peuvent être émises à chaque étape, selon les renseignements disponibles. Dans le cas présent, la plupart des hypothèses sont fondées sur leEmission Scenario Document on Plastics Additives de l’Organisation de coopération et de développement économiques (OCDE, 2009). Ce document porte sur les facteurs d’émission associés aux pertes durant les processus industriels, tels le mélange et la transformation, et des pertes associées à la vie utile du produit. Il précise que les facteurs d’émission représentent les pertes du pire cas raisonnable, de manière à ce que les estimations se situent dans le haut de la plage des valeurs possibles.
Les pertes estimées représentent le bilan massique exhaustif de la substance au cours de son cycle de vie et elles comprennent les rejets dans les eaux usées et d’autres milieux récepteurs (sol, air), la transformation chimique, le transfert vers les activités de recyclage et le transfert vers les sites d’élimination des déchets (sites d’enfouissement, incinération). Toutefois, à moins de disposer de données précises sur le taux ou le potentiel de rejet de cette substance provenant des sites d’enfouissement et des incinérateurs, la méthode ne permet pas de quantifier les rejets dans l’environnement à partir de ces sources. En fin de compte, les pertes estimées fournissent le premier volet de l’analyse de l’exposition à une substance et aident à estimer les rejets dans l’environnement et à mettre l’accent sur la caractérisation de l’exposition dans l’évaluation.
En général, les rejets d’une substance dans l’environnement peuvent découler de différentes pertes de la substance pendant sa fabrication, son utilisation industrielle ainsi que son utilisation commerciale et par les consommateurs. Ces pertes peuvent être regroupées en sept types : 1) déversements dans les eaux usées; 2) émissions atmosphériques; 3) pertes dans le sol; 4) transformation chimique; 5) élimination dans des sites d’enfouissement; 6) élimination par incinération; 7) élimination par recyclage (p. ex. le recyclage est jugé comme une perte et pas pris davantage en considération). Elles sont estimées à partir de données issues d’enquêtes réglementaires, des industries, ainsi qu’en fonction des données publiées par différents organismes. Les pertes dans les eaux usées concernent les déversements des eaux usées brutes non traitées avant traitement, que ce soit un traitement des eaux usées industrielles sur place ou un traitement des eaux usées hors site. De la même manière, les pertes par transformation chimique font référence aux modifications de l’identité de la substance qui ont lieu au cours des étapes de fabrication, d’utilisation industrielle ou d’utilisation commerciale et par les consommateurs, mais elles excluent celles qui ont lieu pendant les opérations de gestion des déchets telles que l’incinération et le traitement des eaux usées. La perte dans les terres inclut le transfert accidentel ou les rejets dans le sol ou les surfaces pavées ou non pavées pendant l’utilisation de la substance et sa durée de vie utile (p. ex à partir de l’utilisation de machinerie agricole ou d’automobiles). La perte dans les terres ne comprend cependant pas le transfert accidentel à la suite d’une utilisation de la substance et sa durée de vie utile (p. ex. l’application au sol de biosolides et les dépôts atmosphériques).
Les pertes estimées du PADMEC au cours de son cycle de vie, fondées sur son utilisation dans la fabrication des plastiques (et fondées sur des hypothèses tirées de OCDE [2009], tel qu’expliqué plus haut) sont présentées au tableau 3 (Environnement Canada, 2010).
Tableau 3. Estimation des rejets et des pertes de PADMEC au cours de son cycle de vie
| Type de perte | Proportion (%) | Étapes pertinentes du cycle de vie |
|---|---|---|
| Rejet des eaux usées | 0,8 | Utilisation industrielle, commerciale et par les consommateurs |
| Émissions atmosphériques | 0 | Utilisation industrielle, commerciale et par les consommateurs |
| Sol | 0[1] | Utilisation industrielle, commerciale et par les consommateurs |
| Transformation chimique | 0[1] | S.O. |
| Site d’enfouissement | 96,2 | Utilisation industrielle, commerciale et par les consommateurs |
| Incinération | 3 | Utilisation industrielle, commerciale et par les consommateurs |
| Recyclage | 0[1] | S.O. |
On estime les rejets de PADMEC dans les eaux usées à 0,8 % de la quantité totale importée (utilisée) à la suite d’une utilisation industrielle, commerciale et par les consommateurs, selon son utilisation comme antioxydant ou stabilisant dans les plastiques. Cette perte résulte principalement de l’utilisation industrielle, qui serait un rejet par des sources ponctuelles (de façon non dispersive). Les hypothèses émises pendant cette étape comprennent les pertes pendant la manutention des matières premières, des opérations de formulation, ainsi que pendant la durée de vie utile. La grande partie des pertes de PADMEC seraient attribuables à l’élimination des déchets, soit l’incinération (3 %) dont la totalité est présumée se transformer chimiquement) et les sites d’enfouissement (96,2 %).
On estime que les rejets dans les eaux usées pendant l’utilisation commerciale et par les consommateurs d’articles contenant du PADMEC constituent le quart des rejets totaux de PADMEC dans les eaux usées. Ces pertes résulteraient d’une accumulation graduelle et auraient été dispersées à grande échelle dans l’environnement plutôt que par des sources ponctuelles.
Les pertes estimées indiquent que le PADMEC présente un potentiel de rejets dans l’environnement. En général, les eaux usées constituent probablement une source courante de rejets de cette substance dans l’eau et une source possible de rejets dans le sol par la gestion subséquente des boues. Les sites d’enfouissement ont le potentiel de lixivier, ou laisser filtrer, des substances dans la nappe phréatique ou de produire des rejets de substances dans l’atmosphère, bien que, en raison de leur volatilité négligeable, les rejets atmosphériques de PADMEC ne seraient pas importants. De plus, le PADMEC devrait être fortement adsorbé sur les surfaces minérales (voir la section Devenir dans l’environnement), et son lessivage depuis les sites d’enfouissement ou depuis le sol ne devrait pas être important.
D’après sa forte solubilité dans l’eau et ses très faibles log D et log KCO (tableau 2) et ses rejets possibles dans les eaux usées (voir le tableau 3), il est prévu que le PADMEC se retrouve principalement dans l’eau. Cependant, les phosphonates s’adsorbent très fortement sur la plupart des surfaces minérales en raison d’interactions électrostatiques (Nowack, 2003). Par conséquent, la grande partie du PADMEC qui est rejetée dans l’eau devrait se retrouver dans les sédiments. La constante de dissociation acide (pKa) relativement faible de 2,38 pour le groupement des phosphonates du PADMEC indique que, dans un environnement comportant des valeurs de pH données (pH de 6 à 9), la grande partie du PADMEC se trouvant dans l’eau sera sous forme dissociée et ionisée.
Si le PADMEC est utilisé dans les plastiques ou à d’autres fins qui produisent des déchets solides, il aboutira dans les sites d’enfouissement à l’étape d’élimination des déchets (tableau 3). Il aurait tendance à demeurer dans les sites d’enfouissement, en raison de la forte adsorption des phosphonates sur les surfaces minérales et de leur faible potentiel de biodégradation (Nowack, 2003).
Le PADMEC ne peut pas quitter le sol ou l’eau pour se volatiliser dans l’atmosphère vu sa faible volatilité et sa faible constante de la loi de Henry. On estime qu’aucun rejet direct de cette substance n’atteindra de manière directe l’atmosphère ou le sol (voir le tableau 3). Les hypothèses concernant l’absence de dégradation de cette substance dans l’eau et dans le sol sont appuyées par l’évaluation de sa persistance dans ces milieux, comme il est présenté ciaprès.
Persistance dans l’environnement
Les données empiriques de biodégradation rapide présentées au tableau 4a indiquent que 1 % et 26 % du PADMEC se dégradent, selon la concentration testée, sur une période de 28 jours dans un essai de biodégradabilité rapide. Le sommaire de rigueur d’étude de la présente étude se trouve à l’annexe I. Il est à souligner qu’une certaine incertitude demeure quant à l’identité de la substance utilisée dans cette étude, car la substance d’essai n’a été identifiée que par son nom commercial et sa pureté n’a pas été déclarée. De plus, les auteurs de cette étude ont utilisé un émulsifiant pour parvenir à une meilleure répartition dans le milieu vu la faible solubilité déclarée de cette substance d’essai. Or, les données présentées dans le tableau 2 du présent rapport d’évaluation préalable indiquent que le PADMEC est très soluble dans l’eau. Il est probable que la substance d’essai, identifiée uniquement par son nom commercial ait été absorbante par voie électrostatique dans le milieu minéral servant au système de mise à l’essai, en raison de sa charge négative à ce niveau de pH ambiant.
Tableau 4a. Données empiriques sur la biodégradation du PADMEC
| Méthode | Valeur de dégradation | Paramètre de dégradation | Durée de l’essai | Référence |
|---|---|---|---|---|
| Méthode 301B de l’OCDE | 1 % (21 mg/L)[1] 26 % (11 mg/L)[1] |
%ThCO2 | 28 jours | Présentation de projet, 2010d |
Ces données d’essai concordent avec les données relatives à d’autres phosphonates, indiquant que la biodégradation est faible ou nulle dans les essais et les milieux naturels (Nowack, 2003).
En raison de l’incertitude liée aux données expérimentales du tableau 4a, on a recouru à une méthode du poids de la preuve reposant sur des RQSA (Environnement Canada, 2007b) à partir des modèles de la dégradation indiqués dans le tableau 4b ci-après. Étant donné l’importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s’appliquent à ce milieu et que le PADMEC devrait y être rejeté (voir tableau 3), c’est la biodégradation dans le milieu aquatique qui a surtout été étudiée. Le tableau 4b résume les résultats des modèles RQSA disponibles sur la dégradation dans l’eau.
Il faut noter que le modèle BIOWIN (2008), qui est fondé sur des fragments structurels, exclut le groupe des phosphonates dans son ensemble d’étalonnage; les fragments structurels qui sont représentés sont les suivants : l’alcool aromatique, et l’atome de carbone à quatre liaisons simples sans hydrogène.
Tableau 4b. Données empiriques modélisées sur la dégradation du PADMEC[1] dans l’eau
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Eau | |||
| Hydrolyse | HYDROWIN, 2008[2] | S.O., structure extérieure au domaine du modèle | S.O. |
| Biodégradation primaire | |||
| Biodégradation (aérobie) | BIOWIN, 2008[2] Sous-modèle 4 : Enquête d’experts (résultats qualitatifs) |
-3,1[3] « se biodégrade rapidement » |
£ 182 |
| Biodégradation ultime | |||
| Biodégradation (aérobie) | BIOWIN, 2008[2] Sous-modèle 3 : Enquête d’experts (résultats qualitatifs) |
2,1[3] « se biodégrade lentement » |
≥ 182 |
| Biodégradation (aérobie) | BIOWIN, 2008[2] Sous-modèle 5 : Probabilité linéaire, MITI |
-0,05[4] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | BIOWIN, 2008[2] Sous-modèle 6 : Probabilité non linéaire, MITI |
0,007[4] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
Structure extérieure au domaine du modèle | S.O. |
| Biodégradation (aérobie) | CATABOL (2004–2008) % DBO (demande biologique en oxygène) |
0,014 « se biodégrade très lentement » |
≥ 182 |
[1] La forme dissociée du PADMEC a été utilisée aux fins de la modélisation (voir la figure 1).
[2] EPIsuite (2008)
[3] L’extrant est une note numérique de 0 à 5.
[4] L’extrant est une note de probabilité.
Tant les résultats expérimentaux (tableau 4a) que les résultats modélisés (tableau 4b) de la biodégradation ultime laissent entendre que le PADMEC ne se biodégradera pas rapidement dans l’environnement. Le PADMEC contient également des propriétés structurelles qui laissent croire qu’il est probablement persistant : la présence de deux groupes tertbutyle sur chaque anneau phénolique, structure très ramifiée, assure la stabilité, ainsi que la liaison CP qui est aussi très stable (Nowack, 2003).
D’après un ratio d’extrapolation de 1:1:4 dans l’eau, une demivie de la biodégradation l’eau:le sol:les sédiments (Boethling et al., 1995), la demivie de biodégradation ultime dans le sol devrait également être supérieure à 182 jours et supérieure à 365 jours dans les sédiments, indiquant que le PADMEC doit être persistant dans le sol et les sédiments.
D’après les données empiriques et modélisées (voir les tableaux 4a et 4b), le PADMEC répond aux critères de persistance dans l’eau et dans le sol (demivies supérieures ou égales à 182 jours) et de persistance dans les sédiments (demivie supérieure ou égale à 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000). On estime que cette substance ne se trouve pas dans l’atmosphère.
Potentiel de bioaccumulation
Les nouvelles valeurs expérimentales et modélisées du log D du PADMEC, qui prennent en considération son caractère ionique, semblent indiquer que cette substance est peu bioaccumulable dans le biote (voir le tableau 2).
Le tableau 5a présente les valeurs empiriques du facteur de bioconcentration (FBC) d’une étude sur le poisson. Le sommaire de rigueur d’étude se trouve à l’annexe I. À partir d’une représentation graphique présentant la bioconcentration du PADMEC dans les tissus de poissons au fil du temps, l’atteinte d’un état d’équilibre semble survenir après six semaines. Par conséquent, les valeurs du FBC à six semaines figurent au tableau 5a. Le FBC moyen est de 30,5 L/kg.
Tableau 5a. Données empiriques sur la biodégradation du PADMEC
| Organisme d’essai | Durée de l’essai | Valeur du FBC en L/kg (poids humide) | Référence |
|---|---|---|---|
| Poisson (carpe) | 6 semaines[1] | 10,3; 20,6 (concentration d’exposition de 2,5 ppm) 38,8; 52,3 (concentration d’exposition de 0,27 ppm) |
Présentation de projet, 2010e |
Une seule étude expérimentale sur le FBC étant disponible, une méthode prévisionnelle a été appliquée au moyen des modèles de facteur de bioaccumulation (FBA) et de FBC disponibles, comme il est présenté au tableau 5b ciaprès.
D’après le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si son FBC ou son FBA est supérieur ou égal à 5 000. Le FBA est l’unité de mesure privilégiée pour l’évaluation du potentiel de bioaccumulation des substances. En effet, le facteur de bioconcentration ne prend pas en compte de manière adéquate le potentiel de bioaccumulation des substances par l’alimentation, lequel est un facteur majeur pour les substances dont le log Koe est supérieur à ~ 4,0 (Arnot et Gobas, 2003). La modélisation cinétique du bilan massique est considérée comme la méthode la plus fiable pour prédire le potentiel de bioaccumulation, car elle permet une correction du métabolisme (Arnot et al., 2008). Cependant, étant donné que la forme ionisée du PADMEC, qui prédomine dans un milieu donné dont le pH atteint des valeurs données, comporte un log D très faible (inférieur à 1), il ne devrait pas être prélevé à partir de la diète (l’absorption par les branchies prédominera) et, par conséquent, les valeurs du FBA et du FBC du PADMEC devraient être essentiellement semblables.
Il n’a pas été possible de modéliser les valeurs du FBC et du FBA du PADMEC à l’aide des deux sousmodèles ArnotGobas fondés sur le bilan massique dans le cadre du programme BCFBAF d’EPIsuite (2008), qui prennent en considération le métabolisme, parce que les substances ionisantes ne sont pas du champ d’application de ces sousmodèles. Par conséquent, seul le résultat du FBC fondé sur une régression obtenue dans le cadre du BCFBAF (2008) est présenté au tableau 5b. Le log D de –0,031 à pH 7 (voir tableau 2) a été entré dans les modèles du FBC dont les résultats sont indiqués au tableau 5b. Le programme BCFBAF (2008) attribue automatiquement un log FBC de 0,50 (FBC = 3,16) aux composés ioniques dont le log KOE est inférieur à 5,0.
Tableau 5b. Données modélisées sur la bioaccumulation du PADMEC dans les poissons
| Structures du PADMEC modélisées | Modèle et base du modèle | Paramètre | Valeur en L/kg (poids humide) | Référence |
|---|---|---|---|---|
| Forme dissociée et forme non dissociée | FBC, maximum | FBC | 3,16 | BCFBAF, 2008 |
| Forme dissociée et forme non dissociée | FBC, maximum | FBC | 10,1 | Dimitrov et al., 2005 |
Il convient de souligner que le modèle prévisionnel de Dimitrov et al. (2005) est valide, car les structures du PADMEC (forme dissociée et forme non dissociée) faisaient partie du domaine des paramètres de ce modèle, et représentaient respectivement 71 % et 73 % du domaine structurel du modèle, étant donné que la base de données d’étalonnage de ce modèle contenait des substances assez similaires au PADMEC.
Un autre modèle utilisé (tableau 5b) est celui tiré duTechnical Guidance Document on Risk Assessment de la Commission européenne (Commission européenne, 2003), qui est fondé sur les travaux de Veith et al. (1979). D’après ce modèle, la valeur du FBC doit être de 1,41 lorsque le log KOE est inférieur à 1.
Les données empiriques et les valeurs modélisées disponibles (tableaux 5a et 5b) indiquent que le PADMEC devrait présenter un faible potentiel de bioaccumulation. Par conséquent, le PADMEC ne répond pas aux critères de bioaccumulation (FBA supérieur ou égal à 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Évaluation des effets sur l’environnement
A – Milieu aquatique
Les données expérimentales concernant la toxicité du PADMEC sont résumées dans le tableau 6 et décrites ciaprès. De plus, une analyse des données modélisées disponibles est également présentée ciaprès. Les données expérimentales et modélisées indiquent que le PADMEC présente une faible toxicité aiguë pour les organismes aquatiques.
Tableau 6. Données empiriques sur la toxicité du PADMEC
| Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/L)[1] | Référence |
|---|---|---|---|---|
| Bactéries aérobies des eaux usées | Toxicité aiguë (3 heures) |
CI20[2] CI50[2] |
> 100 > 100 |
Présentation de projet (2010f) |
| Algues (Scenedesmus subspicatus) | Toxicité aiguë et chronique (72 heures) |
CE50[3] CSEO[4] |
> 100 100 |
Présentation de projet (2010g) |
| Cladocère (Daphnia magna) |
Toxicité aiguë (24 heures) |
CE50[3] CMEO[5] CSEO |
510 320 180 | Présentation de projet (2010h) |
| Poisson zèbre (Brachydanio rerio) | Toxicité aiguë (96 heures) |
CL50[6] CMEO[5] (survie) CMEO[5] (effets sublétaux) |
> 100 100 18 |
Présentation de projet (2010i) |
[2] CIX – Concentration inhibitrice d’un effet à un pourcentage donné. Estimation ponctuelle de la concentration d’une
substance d’essai causant une réduction de X % d’une mesure biologique quantitative comme le taux de croissance.
[3] CEX – Concentration d’une substance qu’on estime susceptible de causer un effet chez X % des organismes d’essai.
[4] CSEO – Concentration sans effet observé, soit la concentration la plus élevée ne causant pas d’effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
[5] CMEO – Concentration minimale avec effet observé, soit la plus faible concentration à laquelle on obtient un effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
[6] CLX – Concentration d’une substance qu’on estime susceptible de causer un effet létal chez X % des organismes d’essai.
Dans toutes les études de toxicité susmentionnées (voir le tableau 6), à l’exception de l’étude sur les algues, la substance d’essai (selon son nom commercial) a été considérée quasi insoluble ou peu soluble. Étant donné la grande solubilité mesurée et modélisée de cette substance (voir le tableau 2), la fiabilité de ces études peut être mise en doute. L’étude sur les algues n’a pas fourni de description de la solubilité de la substance d’essai, mais a indiqué que « la substance d’essai était répartie uniformément dans les récipients d’essai à tous les essais et à toutes les concentrations d’essai. » Dans l’étude sur le cladocère, un émulsifiant a été utilisé (éther de polyglycol alkylphénol) comme agent solubilisant. L’étude sur les bactéries a conclu que « la substance n’était pas dissoute, mais répartie dans le milieu d’essai. » Quant à l’étude sur le poisson zèbre, on a remarqué que, « initialement, un léger dépôt a été observé à toutes les concentrations d’essai. » Après une exposition de 48 h, la substance d’essai semblait répartie uniformément à toutes les concentrations d’essai. » Un sommaire de rigueur de l’étude sur le poisson zèbre se trouve à l’annexe I, car cette étude a été utilisée pour le calcul de la concentration estimée sans effet (CESE) (voir ciaprès).
La pureté de la substance d’essai n’a pas été décrite dans les études susmentionnées, à l’exception de l’étude sur les algues, dans laquelle la substance d’essai a été identifiée par son nom commercial et a été jugée pure à plus de 95 % (impuretés non identifiées). Les concentrations de la substance d’essai dans les échantillons en double n’ont pas été mesurées dans les études susmentionnées. L’ensemble des études résumées au tableau 6 sont considérées comme peu fiables, en raison des questions exposées plus haut et concernant l’identité et la solubilité de la substance ainsi que l’absence de concentrations mesurées.
Dans l’étude sur le poisson zèbre, les concentrations nominales mises à l’essai étaient de 10;18; 32; 58 et 100 mg/L (les concentrations n’ont pas été mesurées). Des cas de mortalité ont été observés seulement à la concentration de 100 mg/L. Dans un groupe de 10 poissons, deux cas de mortalité ont été observés à cette concentration après 24 heures, et le nombre de cas de mortalité n’a pas augmenté après 48, 72 ou 96 heures. Par conséquent, la CMEO de l’essai de survie est de 100 mg/L (concentration nominale). Cependant, aucune relation dose-effet n’a été observée, et on peut donc se demander si les cas de mortalité observés ont été causés par la substance d’essai. Des effets sublétaux ont aussi été observés durant l’étude : un léger effet sur le comportement natatoire aux concentrations de 18 et de 32 mg/L; des effets modérés et graves aux concentrations de 58 et de 100 mg/L, après 48, 72 et 96 heures. De plus, des effets graves sur l’équilibre ont été notés aux concentrations de 58 et de 100 mg/L, et des effets modérés à graves sur la fonction respiratoire, à la concentration de 100 mg/L. D’après ces effets sublétaux, qui indiquent une augmentation de la gravité des effets en fonction de l’augmentation de la concentration, la CMEO est de 18 mg/L en ce qui a trait aux effets sur le comportement natatoire.
Une série de valeurs de toxicité en milieu aquatique ont été tirées des modèles ECOSAR (2008) et CPOP (2008) de RQSA. Les résultats du PADMEC ne font pas partie du champ d’application du modèle TOPKAT (2004). Les ensembles d’étalonnage du AIEPS (20032007) et de la trousse d’application des modèles R(Q)SA de l’OCDE (v. 1.1.02) (OCDE, 2008) n’ayant pas été considérés comme adéquats pour le PADMEC, les résultats issus de ces modèles ne sont donc pas analysés plus longuement.
Tant le log Koe que la masse moléculaire du PADMEC font partie des champs d’application d’ECOSAR (2008). Le PADMEC a été modélisé dans ECOSAR (2008) comme un phénol et une matière organique neutre; cependant, ces ensembles d’étalonnage ne sont pas adéquats pour le PADMEC, car ils ne contiennent aucune substance présentant des valeurs de log Koe inférieures à 1 ni aucune substance de structure chimique semblable au PADMEC comme les sels d’esters phosphoniques. Les ensembles d’étalonnage du AIEPS (20032007) et de la trousse d’application des modèles R(Q)SA de l’OCDE (v. 1.1.02) (OCDE, 2008) n’ayant pas été considérés comme adéquats pour le PADMEC, les résultats issus de ces modèles ne sont donc pas analysés plus longuement.
Dans le modèle CPOP (2008), le PADMEC a été modélisé comme un « réactif, non répertorié », c.àd. qu’il fait partie d’un groupe de substances qui comprend toutes les substances dont les valeurs estimées selon ce modèle indiquent une toxicité supérieure à celle des narcotiques de référence. Le modèle CPOP (2008) ne contient pas de rapport structure–activité (RSA) plus spécifique qui soit approprié pour le PADMEC (p. ex. le groupe des phénols dans le modèle ECOSAR [2008]). Les valeurs estimées de la toxicité sont fondées sur le fait que la toxicité du PADMEC est supérieure à celle d’un narcotique de référence dont la valeur du Koeest semblable. Les résultats du modèle CPOP (2008), tant pour les valeurs de toxicité aiguë des cladocères que pour celles des poissons, indiquent que la toxicité du PADMEC est inférieure à 7 000 mg/L. Cette valeur modélisée de toxicité indique que le PADMEC présente probablement une faible toxicité aiguë pour les organismes aquatiques (CL50 et CE50aiguës > 10 mg/L), ce qui correspond aux données empiriques du tableau 6.
Prudente, la concentration estimée sans effet (CESE) pour les organismes aquatiques a été calculée d’après la valeur empirique de toxicité aquatique la plus faible, à savoir la CMEO de 96 h pour le poisson zèbre (Brachydanio rerio) de 18 mg/L, selon les effets sublétaux (comportement natatoire) (tableau 6). Cette valeur a été retenue comme étant la valeur de toxicité critique, puis divisée par un facteur d’évaluation de 100, pour tenir compte de la variabilité de sensibilité interspécifique et intraspécifique, pour estimer une concentration sans effet à long terme à partir d’une étude à court terme ainsi que pour tenir compte des incertitudes et des limites de l’ensemble des données de toxicité afin de lui attribuer une valeur de CESE de 0,18 mg/L. Étant donné l’estimation de persistance élevée du PADMEC dans l’environnement (voir la section Persistance et bioaccumulation), on peut s’attendre à ce qu’elle entraîne une exposition chronique.
B – Autres milieux
On n’a trouvé aucune étude concernant les effets de cette substance sur l’environnement dans d’autres milieux que l’eau.
Évaluation de l’exposition de l’environnement
Aucune donnée sur les concentrations de PADMEC dans l’eau au Canada n’a été retracée; on a donc évalué les concentrations dans l’environnement à partir de renseignements disponibles, y compris les estimations relatives aux quantités de cette substance, aux taux de rejets et à la taille des cours d’eau récepteurs.
A – Rejets industriels
On estime qu’il y aura exposition en milieu aquatique au PADMEC advenant l’acheminement de rejets industriels de cette substance vers une station d’épuration des eaux usées et que cette station évacue son effluent dans un plan d’eau récepteur. La concentration de cette substance dans les eaux réceptrices près de l’émissaire d’évacuation de la station d’épuration des eaux usées sert de concentration environnementale estimée (CEE) dans l’évaluation du risque que présente cette substance en milieu aquatique. Elle peut être calculée à l’aide de l’équation suivante :
Ceau–ind = [1000 × Q × L × (1 - R)] / [N × F × D]
où
Ceau–ind : concentration en milieu aquatique résultant des rejets industriels, mg/L
Q : quantité de substance totale utilisée chaque année sur un site industriel, kg/an
L : pertes dans les eaux usées, fraction
R : taux d’élimination de la station d’épuration des eaux usées, fraction
N : nombre de jours de rejets annuels, en jour/an
F : débit de l’effluent de la station d’épuration des eaux usées, m3/jour
D : facteur de dilution dans l’eau réceptrice, sans dimension
Un scénario de rejets industriels très prudent a servi au calcul de la concentration de cette substance en milieu aquatique. Ce scénario est hypothétique et il est prudent (c.àd. qu’il protège l’environnement), car il suppose que les 100 000 kg de PADMEC, qui correspondent à la limite supérieure de l’intervalle de 1 000 à 100 000 kg de substance utilisée qui a été déclarée par l’industrie canadienne en 2005 (Environnement Canada, 2007a) (voir la section Sources), l’ont été par une seule installation industrielle sur un petit site hypothétique et que les pertes dans une usine de traitement des eaux usées (UTEE) de la région atteignent 0,65 % de la quantité totale à la suite de manipulations de matières brutes et d’opérations de formulation. Un site aussi petit est estimé présenter un débit d’effluent d’UTEE correspondant au 10e centile (3 456 m3/jour) des taux de rejets des UTEE observés partout au Canada. Ce scénario présume également que les rejets se produisent 250 jours par an, donnée générale pour les petites et moyennes installations, et que le facteur de dilution des eaux réceptrices présente une valeur minimale de 1 (aucune dilution). La quantité d’utilisation industrielle de 100 000 kg est très prudente, si l’on considère qu’aucune quantité de PADMEC n’a été déclarée comme commercialisée au Canada en 2006 (Environnement Canada, 2009).
Selon ce scénario, le taux d’élimination du PADMEC à la STE est de 50 %, ce qui est considéré comme une estimation prudente, car les phosphonates sont très fortement adsorbés sur la plupart des surfaces minérales en raison d’interactions ioniques (Nowack, 2003). L’élimination des phosphonates durant le traitement des eaux usées est très importante, même lorsque les concentrations de phosphonates sont élevées (Nowack, 2003). Cependant, les études citées dans Nowack (2003) ne portent pas spécifiquement sur le PADMEC.
Selon les hypothèses susmentionnées, ce scénario très prudent mène à une concentration de PADMEC en milieu aquatique de 0,38 mg/L.
B – Rejets liés aux produits de consommation
On n’a réalisé aucun scénario de rejet basé sur les utilisations des produits manufacturés contenant du PADMEC, car ces rejets devraient être largement dispersés et ne seraient donc pas attribuables à des sources ponctuelles concentrées produites par des activités industrielles. Le PADMEC sert d’antioxydant et de stabilisant thermique dans divers produits, y compris dans les applications entrant en contact avec des produits alimentaires (voir la section Utilisations). Les rejets de PADMEC dans l’environnement (eaux usées) seraient d’environ 25 % de la quantité totale de rejets dans les eaux usées à la suite d’une utilisation commerciale et par les consommateurs, et ces rejets se disperseraient sur de grandes étendues, comme il est indiqué à la section Rejets dans l’environnement.
Caractérisation des risques pour l’environnement
La démarche suivie dans cette évaluation écologique préalable consistait à examiner les renseignements pertinents et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprennent les résultats d’un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance dans l’environnement.
On estime que le PADMEC est persistant dans l’eau et le sol, qu’il a un faible potentiel de bioaccumulation en raison de la faible valeur du log D de sa forme ionisée, qui prédomine dans l’eau à des valeurs de pH ambiantes. Une fois dans l’environnement, il se trouve principalement dans l’eau et dans les sédiments. D’après les données limitées de toxicité, il a aussi été montré que cette substance présentait un faible potentiel de toxicité pour les organismes aquatiques.
Une analyse du quotient de risque, intégrant des estimations prudentes de l’exposition aux renseignements liés à la substance, a été réalisée pour le milieu aquatique afin de déterminer si la substance pouvait avoir des effets nocifs sur l’environnement au Canada. Le très prudent scénario d’exposition général décrit précédemment a donné une concentration environnementale estimée (CEE) de 0,38 mg/L pour les écosystèmes aquatiques. Une concentration estimée sans effet (CESE) de 0,18 mg/L pour les organismes aquatiques a été calculée d’après la valeur empirique de toxicité du poisson zèbre, après y avoir appliqué un facteur d’évaluation (voir la section Évaluation des effets sur l’environnement). Le quotient de risque qui en résulte (CEE/CESE) est de 2,1. Compte tenu des hypothèses très prudentes utilisées dans le scénario d’exposition, la comparaison des valeurs de la CEE et de la CESE indique un faible risque d’effets nocifs résultant d’un rejet industriel de PADMEC dans l’eau pour les organismes aquatiques.
Incertitudes dans l’évaluation des risques pour l’environnement
Il existe des incertitudes dans cette évaluation des risques en raison du manque de données sur les propriétés physiques et chimiques spécifiques au PADMEC, y compris la constante de dissociation acide, la constante de la loi de Henry et le coefficient de partage solides-eau, ainsi que de la faible qualité de certaines des données empiriques disponibles. Les données modélisées ont servi à combler les lacunes critiques quant aux données relatives aux propriétés physiques et chimiques, à la biodégradation, à la bioaccumulation et à l’exposition. La structure du PADMEC n’est pas bien représentée dans beaucoup de modèles R(Q)SA et de bioaccumulation, et elle est également ionisée, ce qui accroît l’incertitude liée aux résultats modélisés. La modélisation de la bioaccumulation est une modélisation prudente, car elle ne tient pas compte du métabolisme, qui pourrait réduire le potentiel de bioaccumulation de la substance. Les résultats des essais de bioaccumulation empirique correspondent aussi à ce à quoi l’on s’attend pour le PADMEC, compte tenu des propriétés physicochimiques et de la structure de la substance.
Il existe également des incertitudes liées au manque de données sur les concentrations de PADMEC dans l’environnement canadien. Cependant, l’actuelle insuffisance de fabrication et d’importation au Canada laisse supposer de faibles rejets dans l’environnement canadien. Certaines incertitudes sont aussi associées à la fraction des substances rejetées durant leur utilisation. Ces incertitudes ont été prises en charge lors de la formulation des hypothèses prudentes quant à l’estimation des rejets.
Les concentrations expérimentales, associées à la toxicité pour les organismes aquatiques, peuvent constituer une source additionnelle d’incertitude dans ces études, car ces concentrations n’étaient que nominales et non mesurées en solution. En outre, la plupart de ces études ont indiqué que la substance d’essai était peu soluble, en dépit de la grande solubilité mesurée et modélisée. Malgré ce fait, les données empiriques dont on dispose indiquent que le PADMEC n’est pas très dangereux pour les organismes aquatiques. Les résultats modélisés de sa toxicité ont aussi indiqué un faible risque pour les organismes aquatiques. Or, la structure du PADMEC n’est pas bien représentée dans les ensembles de calibrage des modèles. Par conséquent, l’incertitude concernant les résultats de sa toxicité s’accentue.
Étant donné que cette substance est utilisée dans d’autres pays, comme les ÉtatsUnis dans les applications de contact alimentaire indirect (USFDAa, 2010; voir la section Utilisations), il est possible qu’elle entre sur le marché canadien comme constituant d’articles manufacturés ou de produits de consommation. Les renseignements actuellement disponibles ne sont pas suffisants pour calculer une estimation quantitative permettant de déterminer l’importance de cette source. Cependant, on prévoit que les volumes de rejets de PADMEC dans les divers milieux naturels ne différeraient pas énormément des quantités estimées ici (voir la section Rejets dans l’environnement).
Évaluation de l’exposition
Aucune donnée sur les concentrations de PADMEC dans les milieux naturels canadiens n’a été retracée. Les concentrations de PADMEC dans les milieux naturels n’ont pas été calculées, mais on estime qu’elles sont faibles, car l’utilisation globale déclarée de cette substance au Canada était sous le seuil de 100 kg par an en 2006 (Environnement Canada, 2009), et la probabilité des rejets dans l’environnement est minime. Ainsi, on estime que la probabilité d’exposition de l’ensemble de la population canadienne à cette substance est faible.
De faibles quantités de PADMEC peuvent se trouver dans les emballages alimentaires à titre d’antioxydant dans les plastiques. Aucune quantité n’a été relevée dans les données empiriques de surveillance du PADMEC dans les emballages alimentaires et les aliments et les boissons. On estime que l’exposition au PADMEC provenant d’emballages alimentaires serait faible en raison de sa faible utilisation en général.
Aucune donnée empirique sur les concentrations de PADMEC dans les produits de consommation n’a été retracée.
Évaluation des effets sur la santé
Un sommaire des renseignements disponibles relatifs aux effets du PADMEC sur la santé se trouve à l’annexe III.
Aucun classement attribué par d’autres organismes nationaux ou internationaux quant à sa cancérogénicité, à sa génotoxicité ou à sa toxicité sur le plan du développement ou de la reproduction n’a été retracé. Cependant, Santé Canada a émis plusieurs attestations de nonobjection pour des utilisations spécifiques du PADMEC comme composé de divers matériaux d’emballage alimentaires (communication personnelle de la Direction des aliments de Santé Canada adressée en 2010 au Bureau de l’évaluation des risques des substances existantes de Santé Canada; source non citée), semblables aux limites établies par la Food and Drug Administration des États-Unis (USFDA, 2010a) et la Commission européenne (EUROPA, 2008).
Aucun pouvoir mutagène n'a été observé pendant les tests d'Ames effectués sur le PADMEC avec ou sans activation métabolique (S9)[3]. Aucune activité n'a été observée pendant le test d'anomalie du noyau in vivomené chez les hamsters chinois auxquels le PADMEC a été administré par voie orale pendant deux jours consécutifs. Dans la seule étude de toxicité à doses répétées recensée, une dose orale minimale avec effet observé (DMEO) de 6 000 ppm (soit 300 mg kg p.c. par jour, d'après Santé Canada, 1994) a été déterminée à partir d'une légère baisse du gain de poids corporel et d'une activité de toilettage réduite chez les rats des deux sexes, et ce, à des concentrations élevées de phosphatase alcaline sérique chez les rats mâles auxquels on a administré le PADMEC dans la diète à 0, 700, 2 000 ou 6 000 ppm (soit 0, 35, 100 et 300 mg kg p.c. par jour respectivement; source : Santé Canada, 1994) pendant 13 semaines. Le PADMEC n'a pas causé d'irritation oculaire. Seule une légère irritation cutanée a été observée sur la peau scarifiée, qui peut avoir été causée par l'exulcération. Aucune étude empirique de toxicité pour la reproduction et la formation n'a été recensée. Le PADMEC n'a pas présenté de potentiel œstrogénique d'après un essai in vitrodoublehybride de levure (Ogawa et al., 2006). Les modèles de prévision R(Q)SA (TOPKAT, 2004; CASETOX, 2008; DEREK, 2008; Model Applier, 2008; Toxtree, 2009) appliqués au PADMEC ont produit des résultats négatifs quant à la cancérogénicité et la génotoxicité, et des résultats majoritairement négatifs quant à la toxicité pour la reproduction et la formation (annexe IV).
Des substances de structure semblable ont été examinées pour compléter l’évaluation des effets possibles sur la santé liés à l'exposition au PADMEC (annexe V).
Le [[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate de diéthyle (n° CAS 976-56-7) a été considéré comme étant une substance de structure analogue appropriée en raison de sa similarité structurelle avec le PADMEC, tel qu’il a été démontré par un coefficient d’association de Tanimoto de 72 % entre le PADMEC et cette substance (SciFinder; CAS, 2010). Le PADMEC est réglementé et approuvé par la FDA des ÉtatsUnis pour être utilisé comme substance de contact alimentaire (USFDA, 2010b; 2010c). Toutefois, aucune donnée empirique n'a été relevée.
Une autre substance analogue au PADMEC, le 3,3',3'',5,5',5''-hexa-tert-butyl-α,α',α''-(mésitylène-2,4,6-triyl)tri-p-crésol (n° CAS 1709702), a été recensée, vendue sous les noms Irganox 1330, Ethanox 330 ou Ionox 330. Cette substance de structure analogue a un profil d'utilisation semblable au PADMEC, présente une similarité structurelle de 61 % dans SciFinder lorsqu’on la compare au PADMEC (CAS, 2010) et est associée aux données empiriques disponibles. De plus, il a été déterminé que ses propriétés physicochimiques (masse moléculaire, état physique, pression de vapeur) avaient des valeurs du même ordre que celles qui sont associées au PADMEC.
Les études de toxicité recensées pour l’Irganox 1330 sont résumées à l'annexe VI. Les résultats négatifs ont été observés dans les études de génotoxicité in vitromenées au moyen de tests d'Ames (CibaGeigy, 1992b; Akita University, 1984). Aucune tumeur issue du traitement n'a été observée dans plusieurs des études de toxicité chronique sur deux ans menées chez les rats, les souris et les chiens (Shell Research, 1968a; 1968b; 1969). Aucune toxicité pour le développement ou la reproduction n'a été observée dans une étude sur trois générations menée chez les rats (Shell Research, 1970). En ce qui a trait à l'étude de toxicité à doses répétées, la DMEO subchronique la plus faible a été déterminée comme étant 31 600 ppm (soit 1 600 mg/kg p.c. par jour; d'après Santé Canada, 1994) en raison d'une diminution du poids corporel chez les rats femelles après administration par voie orale dans la diète des rats mâles et femelles de l'Irganox 1330 à raison de 0 à 31 600 ppm pendant 90 jours (Stevenson et al., 1965). La DMEO la plus faible à long terme a été de 10 000 ppm (soit 500 mg/kg p.c. par jour; d'après Santé Canada, 1994) en raison d'une diminution du poids corporel et des organes chez les rats femelles après administration par voie orale dans la diète des rats mâles et femelles de l'Irganox 1330 à raison de 0 à 10 000 ppm pendant 2 ans (Shell Research, 1968a). Aucune toxicité pour la reproduction ou pour le développement n’a été observée dans une étude portant sur trois générations de rats (Shell Research, 1970).
Le niveau de confiance à l'égard de la base de données toxicologiques du PADMEC est jugé faible, car les données empiriques retracées sont très limitées. Cependant, le recours à la modélisation et aux données de la substance analogue a permis d'accroître le niveau de confiance accordé à l'évaluation des dangers du PADMEC.
Caractérisation des risques pour la santé humaine
Les données empiriques limitées recensées sur le PADMEC, la modélisation R(Q)SA et les données empiriques d'une substance analogue n'ont pas indiqué de potentiel de danger élevé. On ne relève aucune preuve de mutagénicité, de cancérogénicité, ou de toxicité pour le développement ou la reproduction du PADMEC ou de sa substance analogue. En ce qui a trait à la toxicité à doses répétées, l'effet majeur du PADMEC et de l'Irganox 1330, substance analogue, était la diminution du poids corporel chez les rats. La dose minimale critique avec effet observé (DMEO) était de 300 mg kg p.c. par jour en raison d'une légère diminution du gain de poids corporel et d'une activité de toilettage réduite chez les rats des deux sexes, et ce, à des concentrations élevées de phosphatase alcaline sérique chez les rats mâles dans le cadre d'une étude de 13 semaines du PADMEC administré par voie orale.
Aucun rapport d'activité industrielle touchant le PADMEC en 2006 n'a indiqué de dépassement du seuil des 100 kg par an (Environnement Canada, 2009) et on estime que la probabilité d'exposition de l'ensemble de la population au PADMEC dans les milieux naturels, les aliments et les produits de consommation est faible. Par conséquent, on estime que le risque pour l'ensemble de la population est faible.
Incertitudes de l’évaluation des risques pour la santé humaine
Seules des études de toxicité par voie orale ont été recensées pour le PADMEC. Aucune étude de toxicité du PADMEC par inhalation et par voie cutanée ni aucune donnée sur la toxicité à long terme par voie orale n'ont été recensées. Une substance de structure analogue a été utilisée pour déterminer la cohérence des effets reliés au traitement avec le PADMEC et pour extrapoler la toxicité orale à long terme pour le PADMEC. Cependant, les données de toxicité par voie d’inhalation ou par voie cutanée étaient également manquantes pour la substance de structure analogue. L'extrapolation d’une substance de structure analogue au PADMEC quant à son potentiel de danger laisse une incertitude.
Le manque de données canadiennes sur le PADMEC dans les milieux naturels, les aliments et les produits de consommation constitue une source d'incertitude quant au degré d'exposition de l'ensemble de la population du Canada. Or, la préoccupation liée à cette incertitude est faible compte tenu de la faible activité industrielle déclarée et la présence minimale estimée du PADMEC dans l'environnement.
D’après les renseignements disponibles, le PADMEC ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie. En outre, le PADMEC répond aux critères de persistance, mais ne répond pas aux critères du potentiel de bioaccumulation énoncés dans leRèglement sur la persistance et la bioaccumulation(Canada, 2000).
D’après les renseignements disponibles, le PADMEC ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur la vie ou la santé humaines.
Par conséquent, il est conclu que le PADMEC ne satisfait à aucun des critères énoncés dans l’article 64 de la LCPE (1999).
On envisagera d’inclure cette substance dans la mise à jour de l'inventaire de la Liste intérieure des substances. De plus, des activités de recherche et de surveillance viendront, s'il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
ACD/PhysChem Suite. 2009. Version 12.01. Toronto (Ontario) : Advanced Chemistry Development, Inc. (ACD/Labs). [en anglais seulement; réserve de consultation].
[AIEPS] Artificial Intelligence Expert Predictive System. 2003–2007. Version 2.05. Ottawa (Ont.) : Environnement Canada. Modèle développé par Stephen Niculescu. Disponible à Environnement Canada, Division de l’évaluation écologique, Section de l'évaluation des substances chimiques nouvelles.
Akita University. 1984. Test for mutagenic properties in bacteria with plastic additive Irganox 1330. Japon : Akita University, Department of Medicine [cité dans USEPA, 2006b].
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note réglementaire REG2007-04, Liste des produits de formulation de l'ARLA, Annexe I, Tableau 2 [en ligne], Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consulté le 15 juillet 2010].
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2010. Registre public de l’Agence de réglementation de la lutte antiparasitaire, Information sur les produits – Recherche d’étiquette [en ligne], Ottawa (Ont.), Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consulté le 15 juillet 2010].
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337345.
Arnot, J.A., Mackay, D., Bonnell, M. 2008. Estimating metabolic biotransformation rates in fish from laboratory data. Environ Toxicol Chem 27(2):341–351.
Ash, M., Ash, I. 2004. Handbook of Preservatives. États-Unis : Synapse Information Resources Inc. P. 119120.
[BCFBAF] Bioaccumulation Program for Windows [modèle d’estimation]. 2008. Version 3.00, Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2008. Version 4.10, Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, ch. 33, Gazette du Canada. Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada. Partie II, vol. 134, n° 7
Canada. Ministère de l'Environnement, ministère de la Santé. 2006a. Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, n° 49
Canada. Ministère de l'Environnement. 2006b. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances considérées comme priorité pour suivi.Gazette du Canada, Partie I, vol. 140, n° 9.
Canada. Ministère de l'Environnement, ministère de la Santé. 2009a. Loi canadienne sur la protection de l’environnement (1999) : Avis de huitième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 143, n° 5.
Canada. Ministère de l'Environnement. 2009b. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le huitième lot du Défi. Gazette du Canada, Partie I, vol. 143, n° 5.
[CAS] CAS : Une division de l’American Chemical Society. 2010. Programme SciFinder. [mis à jour en août 2010; consulté le 31 août 2010].
CASETOX [module de prévision]. 2008. Version 2.0. Beachwood (OH) : MultiCASE. [consulté le 19 juillet 2009; réserve de consultation].
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008, Version 5.10.2, Bourgas (Bulgarie): Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. CATALOGIC.
Ciba-Geigy Ltd. 1992a. Acute dermal toxicity study in rat. Bâle (Suisse) : CibaGeigy Ltd. Essai n° 924061 [cité dans USEPA, 2006].
Ciba-Geigy Ltd. 1992b. Bacterial mutagenicity screening test. Bâle (Suisse): CibaGeigy Ltd, Genetic Toxicology [cité dans USEPA, 2006].
[CPOP] Canadian POPs Model. 2008. Gatineau (Québec) : Environnement Canada, Division de l’évaluation écologique; Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry [modèle basé sur celui de Mekenyanet al. (2005)]. Disponible auprès de la Division de l’évaluation écologique d'Environnement Canada.
Cradlechem (Jiangsu) Technology. 2003. Antioxidant-1425. [en anglais seulement; consulté le 12 juillet 2010].
[DEREK] Deductive Estimation of Risk from Existing Knowledge [module de prévision sur CD-ROM]. 2008. Version 10.0.2, Cambridge (MA) : Harvard University, LHASA Group. Prédiction de toxicologie [consulté le 20 juillet 2010; réserve de consultation].
Dimitrov, S., Dimitrova, N., Parkerton, T., Comber, M., Bonnell, M., Mekenyan, O. 2005. Base-line model for identifying the bioaccumulation potential of chemicals. SAR QSAR Environ. Res. 16(6):531554.
Di Toro, D.M., Zarba, C.S., Hansen, D.J., Berry, W.J., Swartz, R.C., Cowan, C.E., Pavlou, S.P., Allen, H.E., Thomas, N.A., Paquin, P.R. 1991. Technical basis for establishing sediment quality criteria for nonionic organic chemicals using equilibrium partitioning. Environ Toxicol Chem 10: 15411583.
[ECHA] Agence européenne des produits chimiques. 2010. Liste des substances candidates extrêmement préoccupantes pour l'autorisation, Agence européenne des produits chimiques. [consulté le 21 juillet 2010].
[ECOSAR] Ecological Structural Activity Relationships [en ligne]. 2008. Version 1.00. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
Environnement Canada. 2007a. Données pour certaines substances recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances considérées comme priorités pour suivi. Données compilées par Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Environnement Canada. 2007b. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module, QSARs.Document de travail préliminaire révisé. Gatineau (Québec) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2008. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module, Mass Flow Tool. Document de travail. Gatineau (Québec) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2009. Données sur les substances du lot 8 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le huitième lot du Défi. Gazette du Canada, Partie I, vol. 143, n° 5, p. 196213. Données compilées par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada. 2010. Assumptions, limitations and uncertainties of the Mass Flow Tool for PADMEC, CAS No. 65140-91-2. Document provisoire interne. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique, disponible sur demande.
[EPIsuite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. 2008. Version 4.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
[ESIS] European Chemical Substances Information System [base de données en ligne]. 2010. Bureau Européen des Substances Chimiques (BESC). [en anglais seulement; consulté le 15 juillet 2010].
EUROPA. 2008. Food Contact Materials Database. Commission européenne. Food [en anglais seulement].
[HENRY] Henry's Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
[KOCWIN] The Soil Adsorption Coefficient Program [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
Lifestream laboratories. 1966a. Fifteen week subacute oral toxicity study in rats, final report. Illinois : Lifestream laboratories. Project No. 15 [cité dans USEPA, 2006].
Lifestream laboratories. 1966b. Fifteen-week sub-acute oral toxicity study of Ionox 330 in beagle dogs, final report. Illinois : Lifestream laboratories, Project No. 14 [cité dans USEPA, 2006].
[Model Applier] Leadscope FDA Model Applier [module de prévision sur CD-ROM]. 2008, Version 1.2.03. Columbus (OH) : Leadscope, Inc. Accès : Modèle QSAR de Leadscope [en anglais seulement; réserve de consultation].
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43, Washington (DC), US Environmental Protection Agency, Office of Pollution Prevention and Toxics, Syracuse (NY), Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
Nowack, B. 2003. Environmental chemistry of phosphonates.Water Research 37: 2533-2546.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005, Version 1.20. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry.Logiciels OASIS [en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques, Direction de l’environnement. 2008. Boite à outil d'application QSAR, Version 1.1.0.2. Développée par : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry, Bourgas (Bulgarie). [en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques. 2009. Emission scenario document on plastics additives [en ligne]. Paris (France), OCDE, Direction de l’environnement. (Series on Emission Scenario Documents No. 3). N° du rapport : ENV/JM/MONO(2004)8, JT0367870. [en anglais seulement; consulté le 29 septembre 2010].
Ogawa, Y., Kawamura, Y., Wakui, C., Mutsuga, M., Nishimura, T., Tanamoto, K. 2006. Estrogenic activities of chemicals related to food contact plastics and rubbers tested by the yeast two-hybrid assay. Food Addit Contam. 23(4):42230.
Présentation de projet. 2010a. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Présentation de projet. 2010b. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912002. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010c. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912001. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010d. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912003. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010e. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912000. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010f. Projet non publié et confidentiel présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010g. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010h. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010i. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912005. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Santé Canada. 2007. Note réglementaire REG 2007-04, Liste des produits de formulation de l'ARLA, annexe I, tableau 2 [en ligne]. Ottawa (Ont.) : Santé Canada, ARLA.[consulté le 15 juillet 2010].
Santé Canada. 2009. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques – septembre 2009 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation. [consulté le 14 mai 2010].
Santé Canada. 2010. Registre public de l'ARLA, recherche d'étiquette d'information sur le produit [en ligne]. Ottawa (Ont.) : Santé Canada, ARLA. [consulté le 15 juillet 2010].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2010. Disponible sur demande auprès de Santé Canada, Division des cosmétiques.
Shell Research Ltd. 1968a. Studies on the oral toxicity of Ionox 330: two year experiment with rats, Londres (Royaume-Uni) : Shell Research Ltd; Sittingbourne (Royaume-Uni) : Tunstall Laboratories, Project No. T507190/1 [cité dans USEPA, 2006b].
Shell Research Ltd. 1968b. Studies on the oral toxicity of Ionox 330: two year experiment with dogs, Londres (Royaume-Uni) : Shell Research Ltd; Sittingbourne (Royaume-Uni) : Tunstall Laboratories, Project No. T507190/1 [cité dans USEPA, 2006b].
Shell Research Ltd. 1969. Studies on the oral toxicity of Ionox 330, carcinogenesis study with rats and mice, Londres (Royaume-Uni) : Shell Research Ltd; Sittingbourne (Royaume-Uni) : Tunstall Laboratories, Project No. T507190/1 [cité dans USEPA, 2006b].
Shell Research Ltd. 1970. Studies on the oral toxicity of Ionox 330: three-generation reproduction study in rats, Londres (Royaume-Uni) : Shell Research Ltd; Sittingbourne (Royaume-Uni) : Tunstall Laboratories, Project No. T507190/1 [cité dans USEPA, 2006b].
[SPIN] Substances in Preparations in Nordic Countries [base de données sur en ligne]. 2010. Copenhague (Danemark), Conseil des ministres des pays nordiques, recherche par n° CAS. [en anglais seulement; consulté le 26 juillet 2010].
Stevenson, D.E., Chambers, P.L., Hunter, C.G. 1965. Toxicological studies with 2, 4, 6-tri (3', 5'-di-tert-butyl-4'-hydroxybenzyl) mesitylene in the rat. Food and Cosmetics Toxicology 3:281288.
[TOPKAT] Toxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2, San Diego (CA), Accelrys Software Inc. [en anglais seulement; consulté le 20 juillet 2010].
[Toxtree] Toxic hazard estimation by decision tree approach. 2009. Version 1.60. Sofia (Bulgarie) : Ideaconsult Ltd. Accès :Toxtree - Estimation des risques toxiques par arbre de décision [en anglais seulement; consulté le 20 juillet 2010].
[USEPA] US Environmental Protection Agency. 2006a. Mise à jour de l'inventaire non-confidentielle classé par produits chimique, Search results for CAS RN 65140-91-2. Washington (DC) : USEPA, Office of Pollution Prevention and Toxics. [en anglais seulement; consulté le 15 juillet 2010].
[USEPA] US Environmental Protection Agency. 2006b. Robust Summaries and Test Plans: Irganox 1330/ Ethanox 330, Washington (DC) : US Environmental Protection Agency, High Production Volume Information System (HPVIS). [en anglais seulement; consulté le 15 juillet 2010].
[USEPA] US Environmental Protection Agency. 2010a. Toxics Release Inventory (TRI) Chemical Lists for 2009, 2008. Liste des produits chimique du TRI [en anglais seulement; consulté le 15 juillet 2010].
[USEPA] US Environmental Protection Agency. 2010b. Inventory Update Reporting for years 1986-2002, records by chemical. Résultats de recherché pour le n° CAS 65140-91-2. Washington (DC) : USEPA, Office of Pollution Prevention and Toxics. [en anglais seulement; consulté le 15 juillet 2010].
USFDA [US Food and Drug Administration] 2010a. Code de régulations fédéral 21CFR178.2010, Part 178 – Indirect Food Additives: Adjuvants, Production Aids and Sanitizers, Subpart C – Antioxidants and Stabilizers, Revised April 1, 2010. [en anglais seulement].
[USFDA] US Food and Drug Administration. 2010b. Inventaire des notifications des substances alimentaires à contact efficace, FCN No. 393, US Food and Drug Administration. [en anglais seulement; consulté le 21 juillet 2010].
USFDA [US Food and Drug Administration]. 2010c.Inventaire des notifications des substances alimentaires à contact efficace, FCN No. 556. US Food and Drug Administration. [en anglais seulement; consulté le 21 juillet 2010].
Veith, G.D., Defoe, D.L., Bergstedt, B.V. 1979. Measuring and estimating the bioconcentration factor of chemicals in fish. J Fish Res Board Can 36:1040-1048 [cité dans Fuet al., 2009].
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
1. Solubilité dans l'eau
Référence (numéro de l'étude) :
- 11165-65140912-001 (le numéro de référence de l'étude est confidentiel)
Substance d'essai :
- Identité : la substance n’est connue que sous son nom commercial.
- Remarques : Aucun détail sur la pureté de la substance d'essai n'a été fourni.
Méthode :
- Méthode : adaptée d'après la Directive 84/449/CEE, A.6 (agitation en flacon)
- Bonnes pratiques de laboratoire (BPL) : Oui [ ] Non [x] non mentionné
- Année : (réalisation de l'étude) 1992
Conditions d'essai (Expliquer en détail et analyser tout écart important par rapport au protocole) :
- Solution d'essai : 5,0378 g de substance d'essai dans 500 mL d'eau filtrée sur Millipore de qualité HPLC (chromatographie en phase liquide à haute résolution) par SQS
- Température de saturation : 30 °C
- Durée de saturation : 24 h
- Température d'équilibration : 20 °C
- Durée d'équilibration : 24 h
- Méthode analytique : détermination photométrique à 276 nm
- Seul le sommaire d'étude ayant été fourni, plusieurs des éléments du rapport du test obligatoire (comme il est mentionné dans la ligne directrice 105 de l'OCDE) n'ont pas été traités dans ce rapport, dont les suivants : les données des essais préliminaires, toutes les déterminations analytiques et la moyenne des différents flacons compris dans l'entente, le pH de chaque échantillon, la preuve de toute instabilité chimique de la substance.
Résultats et conclusions :
- Valeur (mg/L) à la température donnée (°C) : 2,4 g/L valeur du pH et concentration à la température donnée (°C) : non précisée
Fiabilité :
- Peu fiable
- Remarques : Documentation insuffisante pour l'évaluation
2. Coefficient de partage (log D)
Référence :
- 11165-65140912-002 (l'étude est confidentielle)
Substance d'essai :
- Identité : la substance n’est connue que sous son nom commercial.
- Remarques : Pureté de la substance d'essai : non analysée
Méthode :
- Agitation en flacon; méthode non standard
- Bonnes pratiques de laboratoire (BPL) : Oui [ ] Non [ X]
- Année : 1989
Conditions d'essai (Expliquer en détail et analyser tout écart important par rapport au protocole) :
- Les flacons d'essai étaient agités seulement pendant une (1) heure avant d'être centrifugés à 2 700 g pour distinguer les phases. (D'après la ligne directrice 107 de l'OCDE, les flacons d'essai devraient être agités pendant 24 heures.)
- Les méthodes d'essai ne sont pas expliquées en totalité (les concentrations de la substance d'essai testées, le nombre de concentrations testées, l'utilisation ou non de doubles, etc.)
Résultats :
- Log D : -0,08 à un pH de 5,5
- Température (°C) : 25 °C
- Remarques : Cette substance d'essai sera ionisée au pH de l'étude, car l'estimation de son pKa est de 2,4 (ACD/ PhysChem Suite, 2009). Cela vient s'ajouter à l'incertitude du coefficient de partage obtenu, d'après la ligne directrice 107 de l'OCDE mentionnant que « les substances ionisables ne doivent être mesurées que sous leur forme non ionique (acide libre ou base libre), obtenue grâce à un tampon approprié dont le pH a été ajusté à au moins une unité en dessous (acide libre) ou audessus (base libre) du pK. » et que « la dissociation ou l'association des molécules dissoutes entraîne des écarts par rapport à la loi de partage. »
- Le modèle ACD/ PhysChem Suite (2009) a estimé le coefficient de partage, log D, à 3,44 (forme neutre). Ce modèle prévoit un log D de 0,41 à un pH de 5,5.
Conclusions :
- Remarques : voir ci-dessus
Fiabilité :
- Inacceptable.
- Cette donnée est fondée principalement sur l'essai mené sur les espèces ionisées de la substance. Cependant, les critères importants de la méthode standard de l'OCDE n'ont en outre pas été respectés, comme la durée de l'agitation et les réplicats et les doubles.
3. Biodégradation aérobie
Référence :
- 11165-65140912-003
Substance d'essai :
- Identité : la substance n’est connue que sous son nom commercial.
- Remarques : Pureté de la substance d'essai non analysée.
Méthode :
- Méthode ou ligne directrice suivie : 301B de l'OCDE (1981), essai de Sturm modifié
- Type (type d'essai) : Aérobie [ X] Anaérobie [ ]
- Année : (réalisation de l'étude) : 1989
- Durée du contact (unités) : 28 jours
- Inoculum : Les bactéries recueillies des boues activées de l'usine de traitement des eaux usées en Suisse et préparées « (…) d'après la méthode décrite dans la ligne directrice. »
Conditions d'essai (Expliquer en détail et analyser toute dérogation importante par rapport au protocole, en indiquant toute inhibition bactérienne et expliquer en détail les écarts par rapport à la ligne directrice suivie, y compris ce qui suit, le cas échéant) :
- Inoculum (concentration et source) :
- Concentration de la substance d'essai, véhicule utilisé, conditions pré-accoutumance :
- Température de l'incubation (ºC) :22 ± 2 °C
- Procédure de dosage :
- Fréquence de l’échantillonnage :
- Témoins appropriés et essais à blanc utilisés :Substance de référence : Aniline (20 mg/L) contenant une solution 10EO5PO de 0,5 mL de nonylphénol.
- Méthode analytique utilisée pour mesurer la biodégradation : Le CO2 formé a été adsorbé avec de l'hydroxyde de sodium (NaOH) et a été identifié par un analyseur de carbone.
- Méthode utilisée pour calculer les concentrations mesurées (c.àd. moyenne arithmétique, moyenne géométrique, etc.) : Aucune concentration de la substance d'essai n'a été mesurée (concentrations nominales uniquement).
- Autre :
- L'émulsifiant au nonylphénol 10EO5PO a été ajouté à la solution d'essai « (...) en raison de la faible solubilité de la substance d'essai (...) ». Ainsi, 0,5 mL de 10EO5PO a été ajouté aux 20 mg/L de la substance de référence.
- Le volume de la solution d'essai a été réduit, passant de 3 L à 1,5 L.
Résultats :
- Taux (%) de dégradation après le délai (28 jours) : 26 % de ThCO2 a évolué (11,1 mg/L de substance d'essai); 1 % de ThCO2 (20,5 mg/L de substance d'essai).
- Produits de dégradation : Oui [ ] Non [X].
- Remarques : (Fournir tout renseignement supplémentaire qui pourrait être requis pour évaluer adéquatement les données aux fins de fiabilité et d'utilisation, p. ex. inhibition observée, biodégradation excessive, écart-type excessif, cinétique, nombre de microorganismes, temps requis pour une dégradation de 10 % et dégradation totale à la fin de l'essai [p. ex. période de 10 jours].)
Conclusions :
- Remarques : Les auteurs ont conclu que la substance d'essai n'est pas biodégradable.
Fiabilité :
- Peu fiable. L'identité de la substance d'essai n'a été confirmée et sa pureté n'est pas indiquée. La substance d'essai est jugée peu soluble, la solubilité ayant été mesurée à partir de 2 400 mg/L. Les concentrations de la substance d'essai n'ont pas été mesurées.
4. Bioaccumulation
La ligne directrice d'essai relative à ce paramètre est laLigne directrice n° 305 de l'OCDE :Bioconcentration : Essai dynamique chez le poisson.
Référence :
- 11165-65140912-004, (Document sommaire, étude confidentielle) – Le rapport complet est en japonais uniquement; certaines données de ce rapport étaient compréhensibles.
- S.O. = sans objet, ou aucune donnée disponible (seul le rapport sommaire est en anglais).
Substance d'essai :
- Dénomination chimique et n° CAS : la substance est connue par sa formule chimique et sous son nom commercial.
- Remarques sur la substance d'essai : la pureté de la substance d’essai semble être de 98 % (selon l’interprétation du rapport en japonais).
Méthode :
- méthode du MITI
- Nom de l'espèce : Carpe
- Période d'exposition : Phase d'absorption : 56 jours, période passée en eau saine (phase de dépuration) : ?
- Concentration : Concentration en milieu d'essai dans lequel l'étude a été menée (eau, sol, sédiments, eau interstitielle).
- Élimination : Des données sur le « taux de récupération » sont présentées en %
- Bonnes pratiques de laboratoire (BPL) : Non
- Année : 1980
- Écarts : S.O.
- Méthode d'analyse : HPLC, limite de détection? limite de dosage, ou quantification?
- Substance de référence : Oui/Non (Dans l'affirmative, préciser) S.O.
- Méthode d'analyse de la substance de référence
Conditions d'essai :
- Solution d'essai : (Décrire la préparation de la solution de la substance d'essai.) S.O.
- Système d'essai et performance : S.O.
- Si une étude en laboratoire a été effectuée, décrire le système d'essai et la performance d'essai : à savoir, système statique, semistatique; dynamique; détails sur l'appareil et l'équipement;
- Composition des milieux d'essai (ingrédients, agents solubilisants, etc.) : S.O.
- Conditions d'exposition (comprenant l'éclairement et la photopériode),
- écarts-types) des espèces à l'étude (y compris la retenue, l'alimentation, l'adaptation) S.O.
- Nombre d'organismes d'essai, charge : S.O.
- Nombre de réplicats : 2 réplicats par concentration testée
- Détails sur les contrôles : S.O.
- Durée de l'absorption et phase de dépuration : Absorption : 8 semaines; dépuration : ?
- Concentrations de la substance d'essai : 3,0 ppm (2,49 ppm – mesurée); 0,3 ppm (0,27 ppm, mesurée)
- Fréquence des mesures de qualité des milieux d'essai (COD/COT, pH, température) : pH, O.D. et un autre élément mesuré à 0,3 et 7 jours et tous les 7 jours par la suite. Le pH variait de 7 à 7,3; l'O.D. variait de 6,4 à 7,2.
- Les détails sur l'échantillonnage et l'analyse des échantillons des espèces à l'essai et des milieux d'essai (c.àd. calendrier de prélèvement d'échantillons, préparation des échantillons et méthode analytique) : S.O.
Résultats :
- Mortalité/comportement : Mortalité et comportement anormal observés chez les organismes d'essai pendant chacun des régimes d'exposition, selon les contrôles et la substance de référence : S.O.
- Teneur en lipides des organismes d'essai : valeur moyenne : 7,9 ± 2,1 %
- Concentrations des matières à l'étude pendant l'essai : Concentration des matières à l'étude (comprenant l'écarttype et le niveau) pour toutes les périodes d'échantillonnage des organismes d'essai (totales), dans certains de leurs tissus (p. ex. les tissus lipidiques) et dans les milieux environnants; valeurs des concentrations des contrôles et des composés de référence : S.O.
- Facteur de bioconcentration (FBC) : Calculer le FBC à l'état d'équilibre ou le FBCk cinétique (formulé pour la totalité du corps, la teneur totale en lipides ou les tissus précis des organismes d'essai). Les valeurs plafonds du FBC exposées à 0,27 ppm : 52,3; 38,8 (unités non mentionnées, mais présumées être en L/kg). Exposition à 2,49 ppm : 10,3, 20,6. Après 8 semaines : 0,27 ppm : 32,3, 36,9. 2,49 ppm : 14,5, 10,7.
- Constantes d'absorption et du taux de dépuration : Donner les valeurs (niveau de confiance des limites et des écarts-types de 95 %) des constantes relatives aux taux d'absorption et de dépuration (pertes) (toutes formulées pour la totalité du corps, la teneur totale en lipides ou les tissus précis des organismes d'essai); donner les détails pertinents sur le calcul et l'analyse des données : S.O.
- Période de la dépuration : Indiquer la période de dépuration nécessaire pour obtenir l'intervalle requis de 50 % (DT50) et 90 % (DT90) des résidus : S.O.
- Les métabolites : s'ils sont identifiés (utilisation de matières d'essai radiomarquées), tout métabolite accumulé (constituant moins de 10 % des résidus) devrait être détaillé : S.O.
- Autres observations : Signaler toute observation inhabituelle au sujet de l'essai, tout écart par rapport aux procédures et tout autre renseignement pertinent ayant une incidence sur les résultats : S.O.
Conclusions :
- Remarques : conclusions des auteurs de cette étude et approbation du rapporteur : S.O.
Fiabilité :
- Fondée sur les renseignements disponibles dans le sommaire de l’étude en anglais : Inacceptable.
- Trop de données manquantes.
5. Toxicité aiguë
| No | Article | Poids | Oui/Non | Préciser |
|---|---|---|---|---|
| 1 | Essai de toxicité aiguë du {Nom commercial] pour le poisson zèbre (Brachydanio rerio). 1988. Référence : 11165-65140912-005 | |||
| 2 | Identité de la substance : Numéro de registre CAS | S.O. | N | |
| 3 | Identité de la substance : nom(s) chimique(s) | S.O. | N | |
| 4 | Composition chimique de la substance | 2 | N | |
| 5 | Pureté du produit chimique | 1 | N | |
| 6 | Persistance et stabilité de la substance d'essai dans le milieu aqueux déclaré? | 1 | N | |
| Méthode | ||||
| 7 | Référence | 1 | O | Ligne directrice n° 203 de l'OCDE |
| 8 | Méthode de l'OCDE, de l'UE, nationale ou autre méthode standard? | 3 | O | |
| 9 | Justification de la méthode ou du protocole si non standard | 2 | ||
| 10 | Bonnes pratiques de laboratoire (BPL) | 3 | N | |
| Organisme d'essai | ||||
| 11 | Identité de l'organisme : nom | S.O. | O | Poisson zèbre (Brachydanio rerio) |
| 12 | Indication du nom latin ou des deux noms (latin et commun)? | 1 | O | |
| 13 | Durée du cycle de vie et stade de l'organisme d'essai | 1 | O | |
| 14 | Longueur ou poids | 1 | O | Longueur : de 22 à 26 mm; Poids : de 0,1 à 0,15 g |
| 15 | Sexe | 1 | N | |
| 16 | Nombre d'organismes par réplicat | 1 | O | 10 |
| 17 | Taux de charge de l'organisme | 1 | O | 0,09 g/L |
| 18 | Type de nourriture et périodes d'alimentation pendant la période d'acclimatation | 1 | O | Aucun aliment dans les 24 h avant l'exposition |
| Modèle et conditions d'essai | ||||
| 19 | Type d'essai (toxicité aiguë ou chronique) | S.O. | O | Tox. aiguë |
| 20 | Type d'expérience (en laboratoire ou sur le terrain) | S.O. | O | En laboratoire |
| 21 | Voies d'exposition (nourriture, eau, les deux) | S.O. | O | Eau |
| 22 | Durée d'exposition | S.O. | O | 96 h |
| 23 | Contrôles négatifs ou positifs (préciser) | 1 | O | Négatifs |
| 24 | Nombre de réplicats (dont les contrôles) | 1 | O | 6 concentrations, comp. contrôles |
| 25 | Indication des concentrations nominales? | 1 | O | 5 concentrations nominales, de 10 à 100 mg/L |
| 26 | Indication des concentrations mesurées? | 3 | N | |
| 27 | Type de nourriture et périodes d'alimentation pendant les essais à long terme | 1 | O | Aucune alimentation pendant l'essai de toxicité aiguë |
| 28 | Mesure périodique des concentrations (tout particulièrement pendant l'essai de toxicité chronique)? | 1 | N | |
| 29 | Les conditions du milieu d’exposition pertinentes pour cette substance sontelles indiquées? (ex. : pour la toxicité des métaux – pH, COD/COT, dureté de l’eau, température) | 3 | O | |
| 30 | Photopériode et intensité lumineuse | 1 | O | |
| 31 | Préparation de la solution de stock et d'essai | 1 | N | |
| 32 | Emploi d'un agent émulsionnant ou solubilisant si la substance était peu soluble ou instable? | 1 | N | Caractérisation de la substance d'essai : virtuellement insoluble. |
| 33 | Si un agent émulsionnant ou solubilisant a été employé, des données sont-elles fournies sur sa concentration? | 1 | ||
| 34 | Si un agent émulsionnant ou solubilisant a été employé, des données sontelles fournies sur son écotoxicité? | 1 | ||
| 35 | Les intervalles des contrôles (y compris les observations et les paramètres de la qualité de l'eau) sontils indiqués? | 1 | O | |
| 36 | Méthodes statistiques employées | 1 | N | |
| Informations relatives à la qualité des données | ||||
| 37 | Le paramètre déterminé estil directement attribuable à la toxicité de la substance et non pas à l'état de santé des organismes (p. ex., lorsque la mortalité des témoins est inférieure à 10 %) ou à des facteurs physiques (p. ex., « effet d'ombrage »)? | S.O. | O | |
| 38 | L'organisme d'essai était-il pertinent dans l'environnement au Canada? | 3 | O | |
| 39 | Les conditions d'essai (pH, température, O.D., etc.) étaientelles des conditions habituelles pour l'organisme d'essai? | 1 | O | |
| 40 | Le type et la conception du système (statique, semistatique, dynamique; ouvert ou fermé; etc.) correspondentils aux propriétés de la substance et à la nature ou aux habitudes de l'organisme? | 2 | O | |
| 41 | Le pH de l’eau d’essai étaitil dans la plage des valeurs typiques de l’environnement au Canada (de 6 à 9)? | 1 | O | 8,0 – 8,4 |
| 42 | La température de l’eau d’essai étaitelle dans la plage des valeurs typiques de l’environnement au Canada (de 5 °C à 27 °C)? | 1 | O | 22 °C |
| 43 | La valeur de la toxicité étaitelle inférieure à celle de la solubilité de la substance dans l'eau? | 3 | O | |
| Résultats | ||||
| 44 | Valeurs de la toxicité (fournir paramètres et valeurs) | S.O. | S.O. | CL50 de 96 h inférieur à 100 mg/L |
| 45 | Autres paramètres indiqués – p. ex., FBC/FBA, CMEO/CSEO (préciser)? | S.O. | CL50 de 96 h = 58 mg/L | |
| 46 | Autres effets nocifs indiqués (p. ex., cancérogénicité, mutagénicité)? | S.O. | Légère modification sur la nage à 18 mg/L à 48 h et plus; perte d'équilibre grave à 58 mg/L à 72 h et à 96 h; des effets graves sur la fonction respiratoire à 100 mg/L à 72 h et 96 h. | |
| 47 | Note : ... % | 66,7 | ||
| 48 | Code de fiabilité d’Environnement Canada : | 3 | ||
| 49 | Catégorie de fiabilité (élevée, satisfaisante, faible) : | Faible | ||
| 50 | Remarques | |||
Annexe II : Tableau sommaire des intrants des modèles de la persistance, de la bioaccumulation et de la toxicité (PBT)
| Paramètres | Propriétés physiques et chimiques et devenir dans l’environne-ment | Propriétés physiques et chimiques et devenir dans l’environnement | Profil de PBT | Biodégradation et écotoxicité |
|---|---|---|---|---|
| Paramètres des intrants de modélisation | ACD/ PhysChem Suite (2009) | EPIsuite (2008) (tous les modèles, y compris ceuxci : KOWWIN, KOCWIN, BCFBAF BIOWIN et ECOSAR) |
Canadian POPs Model (CPOP, 2008) (comprenant CATABOL, Dimitrov, modèle de toxicité OASIS) |
TOPKAT (2004), AIEPS (20032007), OCDE (2008) |
| Code SMILES, forme dissociée | c1(c(C(C)(C)C)cc(cc1C(C)(C)C)CP(=O)(O)OCC)O | |||
| Code SMILES, forme non dissociée | CCOP(O[Ca] OP(=O)(OCC) Cc2cc(C(C)(C) C)c(O)c(C(C) (C)C)c2)(=O) Cc1cc(C(C)(C) C)c(O)c(C(C) (C)C)c1 |
|||
| Masse moléculaire (g/mol), forme dissociée / forme non dissociée | 328,39 / 694,85 | |||
| Point de fusion (°C) | 270 | |||
| Point d’ébullition (°C) | ||||
| Température (°C) | ||||
| Densité (kg/m3) | ||||
| Pression de vapeur (Pa) | ||||
| Constante de la loi de Henry (Pa m3/mol) | ||||
| Log Kae (coefficient de partage air–eau; sans dimension) |
||||
| Log Koe (coefficient de partage octanol–eau; sans dimension) |
-0,031 | -0,031 | ||
| Log Kco (coefficient de partage carbone organique–eau (L/kg) |
||||
| Solubilité dans l'eau (mg/L) | ||||
| Paramètre | Doses minimales avec effet[i]/résultats |
|---|---|
| Animaux de laboratoire et in vitro | |
| Toxicité aiguë | DL50 par voie orale (rats) supérieure à 2 000 mg/kg p.c. (Ash M. et Ash I., 2004). DL50 par voie orale (rats) supérieure à 6 000 mg/kg p.c. Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité à court terme en doses répétées | Aucune étude n'a été recensée. |
| Toxicité subchronique | DMEO par voie orale : 6 000 ppm (soit 300 mg/kg p.c. par jour; d'après Santé Canada [1994]) a été déterminée à partir d'une légère baisse du gain de poids corporel et d'une activité de toilettage réduite chez les rats des deux sexes, et ce, à des concentrations élevées de phosphatase alcaline sérique chez les rats Sprague Dawley mâles (de 20 à 25 par sexe par groupe) auxquels on a administré le PADMEC dans la diète à 0, 700, 2 000 ou 6 000 ppm (soit 0, 35, 100 et 300 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 13 semaines, suivies d'une période de rétablissement de 4 semaines chez les groupes témoins et ceux ayant reçu un traitement de 6 000 ppm (5 par sexe par groupe). Durant la semaine 8, un certain nombre de rats ont développé le sialodacryoadénite, maladie virale commune à cette souche, et ont présenté une perte d'appétit négligeable. Tous les rats infectés ont connu un rétablissement complet avant la semaine 10 sans présenter d'effets résiduels. On a observé une réduction du toilettage tant chez les mâles que chez les femelles à 6 000 ppm sans rétablissement après l'exposition. Une légère baisse provisoire du gain de poids corporel a été constatée pendant la semaine 6 à 6 000 ppm. Des concentrations élevées de phosphatase alcaline sérique ont été observées chez les mâles à 6 000 ppm durant les semaines 4 et 12. Aucun effet du traitement sur la mortalité, sur la consommation d'aliments, sur la vision et l'audition, sur l'analyse de l'urine, sur l'appareil circulatoire, sur le poids des organes, aucun effet pathologique clinique ni histopathologique n'ont été observés. Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité chronique et cancérogénicité | Aucune étude n'a été recensée. |
| Toxicité pour le développement | Aucune étude n'a été recensée. |
| Toxicité pour la reproduction | Aucune étude n'a été recensée. |
Perturbation endocrinienne in vitro |
Activité œstrogénique : Résultats négatifs : essai doublehybride de levure in vitro fondé sur l'interaction de dépendance aux ligandes du récepteur des œstrogènes α et du coactivateur TIF2. De l'activité œstrogénique a été détectée comme étant une activité βgalactosidase avec ou sans activation métabolique (S9) (Ogawaet al., 2006). |
| Génotoxicité et paramètres apparentés : in vivo | Test d’anomalie du noyau : Résultats négatifs : Les hamsters chinois (3 par sexe par groupe traité et 6 par sexe par groupe témoin) se sont fait administrer du PADMEC par voie orale 0, 1 250, 2 500 ou 5 000 mg/kg p.c. par jour pendant 2 jours consécutifs. Quatre animaux traités sont décédés pendant l'expérience (1 mâle de chaque groupe d'exposition et 1 femelle à une dose de 2 500 mg/kg p.c.). |
| Génotoxicité et paramètres apparentés : in vitro | Mutagénicité : Résultats négatifs : Le test d'Ames, Salmonella typhimurium TA98, TA100, TA1535, TA1537 et TA1538; Escherichia coli Wp2 uvr A avec ou sans activation métabolique (S9). |
| Sensibilisation | Aucune étude n'a été recensée. |
| Irritation | Irritation cutanée : Très légère irritation (érythème léger, sans œdème) sur la peau scarifiée lors des tests sur les lapins. |
Irritation oculaire : Aucune irritation n'a été observée chez les lapins. |
|
| Études menées sur les humains | |
| Aucune étude n'a été recensée. | |
[i] DL50, dose létale médiane; DMEO, dose minimale avec effet observé; DSEO, dose sans effet observé.
Prévisions des modèles R(Q)SA sur la cancérogénicité
| Modèle/Espèces | Souris | Rats | Rats | Souris | Rongeurs | Mammifères | ||
|---|---|---|---|---|---|---|---|---|
| Mâles | Femelles | Mâles | Femelles | |||||
| MA | N | N | N | N | N | N | N | - |
| CT | HC | HC | HC | HC | - | - | HC | - |
| TK | HC | HC | HC | HC | - | - | - | - |
| DEREK | - | - | - | - | - | - | - | HC |
Prévisions des modèles R(Q)SA sur la génotoxicité
| Modèle/ Para- mètre |
aberra- tions chromo-somi- ques |
aberra- tions chromo- somi- ques chez les autres ron- geurs |
aberra- tions chromo- somi- ques chez les rats |
micro- noyaux chez la souris |
micro- noyaux chez le ron- geur |
Synthèse d'ADN non pro- gram- mée |
Lympho- cytes humains par syn- thèse d'ADN non pro- gram- mée |
Hépato- cytes chez le rat par syn- thèse d'ADN non pro- gram- mée |
Droso- phila |
Droso- phila (trans- loca- tions héri- tables) |
Droso- phila (muta- tions létales réces- sives liées au sexe) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| MA | N | N | N | N | N | N | N | N | N | N | N |
| CT | HC | - | - | HC | - | HC | - | - | HC | - | - |
| TK | - | - | - | - | - | - | - | - | - | - | - |
| TT | - | - | - | - | N | - | - | - | - | - | - |
Prévisions des modèles R(Q)SA sur la génotoxicité
| Modèle/ Paramètre |
S. cere- visiae |
Levure | hgprt | mutation des mammi- fères |
mutation létale dominante des mammi- fères |
mutation du lymphome chez des souris | E. coli | E. coli w | activité micro- bienne |
Salmo- nella |
Alerte de cancer BB |
|---|---|---|---|---|---|---|---|---|---|---|---|
| MA | N | N | N | N | N | - | N | N | N | N | - |
| CT | - | - | - | - | - | HC | - | - | - | HC | - |
| TK | - | - | - | - | - | - | - | - | - | HC | - |
| TT | - | - | - | - | - | - | - | - | - | - | N |
| Modèle/Paramètre | Lésions chromosomiques | Génotoxicité | Mutagénicité |
|---|---|---|---|
| DEREK | AR | AR | AR |
Prévisions des modèles R(Q)SA sur la toxicité pour le développement
Model Applier
| Paramètre / Espèces | Souris | Lapins | Rats | Rongeurs |
|---|---|---|---|---|
| Retardement | N | N | N | N |
| Diminution du poids | N | N | HC | N |
| Mortalité fœtale | N | N | N | N |
| Perte après l'implantation | N | N | N | N |
| Perte avant l'implantation | N | N | N | N |
| Structurelle | N | HC | N | N |
| Viscères | N | - | N | N |
Multicase Casetox
| Paramètre / Espèces | Hamsters | Mammifères | Divers |
|---|---|---|---|
| Tératogénicité | - | P | HC |
| Développement | HC | - | - |
Prévisions des modèles R(Q)SA sur la toxicité pour la reproduction
Model Applier
| Modèle / paramètre | Femelles | Mâles | ||||
|---|---|---|---|---|---|---|
| Espèces | Souris | Rats | Rongeurs | Souris | Rats | Rongeurs |
| Reproduction | HC | HC | N | HC | P | N |
| Sperme | - | - | - | N | N | N |
Multicase Casetox
| Souris | Rats | Lapins | Humains |
|---|---|---|---|
| HC | HC | HC | HC |
DEREK
| Mammifères |
|---|
| AR |
| Nom / numéro de registre CAS | Structure |
|---|---|
| Bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle (PADMEC) N° CAS 65140-91-2 Masse moléculaire : 694,85 État physique : solide Pression de vapeur : 6,03 x 10-10 Pa (modélisée, EPIWIN [2008]), < 0,01 Pa (expérimentale, Présentation de projet [2010a]) |
 |
| [[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate de diéthyle N° CAS 976-56-7 Masse moléculaire : 356,44 État physique : solide Pression de vapeur : 1.51 x 10-7 Torr ( 2,01 x 10-5 Pa) (modélisée, CAS [2010]) |
 |
| 3,3',3'',5,5',5''-hexa-tert-butyl-α,α',α''-(mésitylène-2 ,4,6-triyl)tri-p-crésol Mieux connu sur le marché sous les noms Irganox 1330, Ethanox 330, Ionox 330 N° CAS 1709-70-2 Masse moléculaire : 775,22 État physique : solide Pression de vapeur : 1,3 x 10-12 Pa (expérimental, US EPA [2006b]), 5,02 x 10-22 Torr (6,69 x 10-20 Pa) (modélisée, CAS [2010]) |
 |
Annexe VI : Résumé des données relatives aux effets sur la santé de l'Irganox 1330 (n° CAS 1709-70-2) – substance analogue au PADMEC
| Paramètre | Doses minimales avec effet / résultats |
|---|---|
| Animaux de laboratoire et in vitro | |
| Toxicité aiguë | DL50 par voie orale (rats)supérieure à 5 000 mg/kg p.c. (Stevenson et al., 1965). DL50 par voie cutanée (rats)supérieure à 2 000 mg/kg p.c. (CibaGeigy, 1992a). Aucune étude sur l'exposition par inhalation n'a été recensée. |
| Toxicité à court terme en doses répétées | Aucune étude n'a été recensée. |
| Toxicité subchronique | Plus faible DMEO par voie orale = 31 600 ppm (soit 1 600 mg/kg p.c. par jour; d'après Santé Canada [1994]) à partir d'une diminution importante du poids corporel chez les rats femelles Carworth E/N (10 par sexe par groupe) après administration par voie orale dans leur diète de l'Irganox 1330 à 0, 316, 1 000, 3 160, 10 000 ou 31 600 ppm (soit 0, 16, 50, 160, 500 et 1 600 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 90 jours. Aucun effet lié au traitement n'a été noté en ce qui a trait à l'absorption d'aliments, à l'utilisation d'aliments, à l'appareil circulatoire, aux paramètres chimiques cliniques, au poids des organes, ni d'effets pathologiques, ni d'effets sur l'analyse de l'urine (Stevenson et al., 1965). Les rats albinos (de 10 à 12 par sexe par groupe) se sont fait administrer de l'Irganox 1330 par voie orale dans leur diète à 0 ou 5 000 ppm (soit 0 ou 250 mg/kg p.c. par jour; d'après Santé Canada [1994]) pendant 90 jours. Aucun effet du traitement sur le poids des organes ni d'effets histopathologiques n'ont été observés. On a observé la pneumonite des poumons, la péricholangite du foie et la néphrite des reins chez certains animaux témoins et animaux traités. Aucun effet n'a été noté en ce qui a trait à la diminution du poids corporel, à la consommation d'aliments et d'eau, à la mortalité, à l'appareil circulatoire, ni aux études sur les paramètres chimiques cliniques et les analyses d'urine (Lifestream laboratories, 1966a). Les chiens beagle (de 3 à 4 par sexe par groupe) se sont fait administrer de l'Irganox 1330 par voie orale dans leur diète à 0 ou 5 000 ppm (soit 0 ou 150 mg/kg p.c. par jour; d'après Santé Canada [1994]) pendant 90 jours. Aucune anormalité importante du poids relatif des organes ni de changements histopathologiques importants liés au traitement n'ont été observés. Aucun effet n'a été noté en ce qui a trait au poids corporel, à la consommation d'aliments, à la mortalité, aux comportements, à l'appareil circulatoire, ni aux paramètres chimiques cliniques et aux analyses d'urine (Lifestream laboratories, 1966b). Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité chronique et cancérogénicité | Plus faible DMEO par voie orale = 10 000 ppm (soit 500 mg/kg p.c. par jour; d'après Santé Canada [1994]) à partir d'une diminution du poids corporel chez les rats femelles de la souche Carworth Ferme E (un total de 40 par sexe par groupe traité et de 60 par sexe par groupe témoin) après administration par voie orale dans leur diète de l'Irganox 1330 à 0, 400, 2 000, 10 000 ppm (soit 0, 20, 100 et 500 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 2 jours. Cinq par sexe par groupe ont été euthanasiés après 26, 52 et 78 semaines d'alimentation. À l'euthanasie intermédiaire, on a noté une diminution du poids corporel et aucun effet sur les poids absolu et relatif des organes des mâles à 10 000 ppm après 52 semaines. Quant aux animaux traités pendant 2 ans, les femelles à 10 000 ppm ont présenté une diminution du poids corporel, de l'absorption d'aliments, du poids absolu du foie et des reins et du poids relatif du foie. Aucun effet sur l'état de santé général, sur le comportement et sur la mortalité n'a été constaté. Aucun effet nocif n'a été noté en ce qui a trait à la consommation d'aliments, aux comportements, aux analyses d'urine, aux études de pathologie clinique et d'histopathologie. Aucun écart important n'a été relevé dans les études de l'appareil circulatoire et les études cliniques. Aucune lésion pathologique ou microscopique attribuable au traitement n'a été observée. Les auteurs ont laissé entendre que les effets sur le poids corporel et le poids des organes chez les femelles à 10 000 ppm étaient probablement liés au faible poids corporel initial (Shell Research, 1968a). Les rats de souche Carworth Ferme E (30 par sexe par groupe traité et 40 par sexe par groupe témoin) se sont fait administrer de l'Irganox 1330 (pureté de 98 %) par voie orale dans leur diète à 0, 1 000 ou 5 000 ppm (soit 0, 50 et 250 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 2 ans. Une diminution du poids corporel a été observée chez les rats mâles à 5 000 ppm pendant la semaine 78. Pendant les 6 derniers mois du traitement, on a relevé une tendance à la diminution du poids corporel chez tous les mâles traités et les mâles témoins, qui constituerait une « perte attribuable au vieillissement plutôt qu'au traitement », selon les auteurs. Aucun effet sur le comportement, sur l'état de santé général, sur l'absorption d'aliments, ni d'effets pathologiques ni apparition de tumeurs n'ont été constatés. Des lésions rénales (néphropathies) ont été observées chez pratiquement tous les rats à la fin de l'étude. Les tumeurs les plus communes étaient l'adénome de la thyroïde et l'adénome basophile de l'adénome antérieur observé chez les animaux témoins et les animaux traités (Shell Research, 1969). Les souris de souche Carworth Ferme n° 1 (36 par sexe par groupe traité et 36 par sexe par groupe témoin) se sont fait administrer de l'Irganox 1330 (pureté de 98 %) par voie orale dans leur diète à 0, 1 000 ou 5 000 ppm (soit 0, 130 et 650 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 2 ans. Pendant les 3 derniers mois du traitement, on a relevé une diminution du poids corporel chez tous les groupes traités et les groupes témoins, qui constituerait une « perte attribuable au vieillissement plutôt qu'au traitement », selon les auteurs. Ni lésion histopathologique ni tumeur liée au traitement n'a été observée. On n'a relevé aucun écart dans le nombre de tumeurs apparues chez les animaux traités et les animaux témoins (Shell Research, 1969). Aucune donnée histopathologique n'a été présentée dans l'USEPA (2006b). Les chiens beagle (de 4 à 5 par sexe par groupe) se sont fait administrer de l'Irganox 1330 (pureté de 98 %) par voie orale dans leur diète à 0, 2 000 ou 10 000 ppm (soit 0, 60 et 300 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 2 ans. Aucun effet lié au traitement sur l'état de santé général, sur le comportement, sur le poids corporel, sur les poids relatif et absolu des organes, sur l'appareil circulatoire et sur les paramètres chimiques cliniques n'a été observé. Aucun changement pathologique ou microscopique n'a été observé. Les résultats pathologiques ont indiqué des lésions liées à une infestation d'ascarides dans le foie des animaux traités et des animaux témoins. On a constaté des maladies rénales et pulmonaires chez la plupart des animaux traités et des animaux témoins (Shell Research, 1968b). Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité pour la reproduction et pour le développement | DSEO administrée par voie orale chez les rats : 5 000 ppm (soit 250 mg/kg p.c. par jour; d'après Santé Canada [1994]) chez les rats de la souche Carworth Ferme E (20 par sexe par groupe) après administration par voie orale dans la diète de l'Irganox 1330 (pureté de 98 %) à 0 ou 5 000 ppm pour les trois générations (durée précise du traitement non mentionnée dans USEPA [2006b]). Aucun effet sur l'état de santé général, sur le comportement et sur la mortalité n'a été constaté par rapport au groupe témoin. Aucun effet sur la reproduction, sur le nombre de grossesses, sur les portées et sur les nouveaunés du sevrage à la maturité n'a été constaté chez les trois générations par rapport au groupe témoin. Aucune lésion ni changement pathologique ou histologique n'a été observé. Dans USEPA (2006b), on a souligné que « les détails non précisés dans la présentation de l'étude menée sur les trois générations touchent le sexe des nouveaunés, le poids des nouveaunés aux jours 0 et 4, le poids des organes reproducteurs, les données sur la spermatogénèse, les données sur les effets tératogènes observés chez la génération F3, les données de l'examen histopathologique et les analyses statistiques » (Shell Research, 1970). Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Génotoxicité et paramètres apparentés :in vivo | Aucune étude n'a été recensée. |
| Génotoxicité et paramètres apparentés :in vitro | Mutagénicité : Résultats négatifs : Le test d'Ames, Salmonella typhimurium TA98, TA100, TA1535 et TA1537; Escherichia coli WP2 uvA avec ou sans activation métabolique (S9) à des doses variant de 625 à 5 000 µg/plaque (CibaGeigy, 1992b). Résultats négatifs : Le test d'Ames, histidines auxotrophiques mutantes de laSalmonella typhimurium TA97, TA98, TA100; Escherichia coli WP2/pKM101 avec ou sans activation métabolique (S9) à des doses variant de 50 à 2 000 µg/plaque (Akita University, 1984). |
| Sensibilisation | Aucune étude n'a été recensée dans USEPA (2006b). |
| Irritation | Irritation cutanée : Aucune étude n'a été recensée. |
| Irritation oculaire : Aucune étude n'a été recensée. | |
| Études menées sur les humains | |
| Aucune étude n'a été recensée. | |
Notes de bas de page
[2] La détermination de la conformité à l’un ou à plusieurs des critères énoncés à l’article 64 repose sur une évaluation des risques pour l’environnement ou la santé humaine associés aux expositions dans l’environnement en général. Pour les humains, ceci comprend, sans toutefois s’y limiter, les expositions par l’air ambiant et intérieur, l’eau potable, les produits alimentaires et l’utilisation de produits de consommation. Une conclusion établie en vertu de la LCPE 1999 portant sur les substances des lots 1 à 12 du Défi, énumérées dans le Plan de gestion des produits chimiques, n’est pas pertinente, ni ne prévient une évaluation en fonction des critères de danger définis dans leRèglement sur les produits contrôlés, qui fait partie du cadre réglementaire applicable au Système d’information sur les matières dangereuses au travail pour les produits destinés à être utilisés au travail. De la même manière, la conclusion fondée sur les critères énoncés dans l’article 64 de la LCPE (1999) n’empêche pas de prendre des mesures en vertu d’autres articles de cette loi ou d’autres lois.
[3] Les études de toxicité non citées proviennent de la Section des matériaux d'emballage alimentaire de Santé Canada. Les références pour ces données ne peuvent être divulguées en raison de leur confidentialité (communication personnelle de la Direction des aliments de Santé Canada adressée en juillet 2010 au Bureau de l'évaluation des risques des substances existantes de Santé Canada; source non citée).
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
le bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle
Numéro de registre du Chemical Abstracts Service
65140-91-2
Environnement Canada
Santé Canada
Septembre 2011
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe I : Sommaires de rigueur d'étude
- Annexe II : Tableau sommaire des intrants des modèles de la persistance, de la bioaccumulation et de la toxicité (PBT)
- Annexe III : Résumé des données relatives aux effets du PADMEC sur la santé
- Annexe IV : Prévisions des modèles R(Q)SA pour le PADMEC
- Annexe V : Structures du PADMEC et des substances de structure analogue
- Annexe VI : Résumé des données relatives aux effets sur la santé de l'Irganox 1330 (n° CAS 1709-70-2) – substance analogue au PADMEC
Conformément à l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable du bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle (ci-après appelé PADMEC), dont le numéro de registre du Chemical Abstracts Service[1] est 65140-91-2. Une priorité élevée a été accordée à l’évaluation préalable de cette substance inscrite au Défi en vertu du Plan de gestion des produits chimiques, car il a été établi qu’elle répond aux critères environnementaux de catégorisation relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes non humains et il semble qu’elle soit commercialisée au Canada.
L’évaluation des risques que présente le PADMEC pour la santé humaine n’a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d’exposition et du risque pour la santé élaborés aux fins de la catégorisation des substances de la Liste intérieure.
Le PADMEC est une substance organique utilisée comme antioxydant et agent stabilisant dans les plastiques, les fibres synthétiques, les élastomères, les adhésifs, les cires, les huiles et les graisses pour assurer une protection contre la dégradation thermo-oxydante. Cette substance n’est pas produite naturellement dans l’environnement. Des quantités de PADMEC se situant entre 1 000 et 100 000 kg ont été importées au Canada en 2005, et même si on n’a déclaré aucune quantité commercialisée au pays en 2006, une entreprise a indiqué au gouvernement du Canada qu’elle envisageait la possibilité d’importer du PADMEC ultérieurement. D’après ces renseignements, des rejets de cette substance dans l’environnement au Canada sont possibles.
D’après les profils d’utilisation prévus et certaines hypothèses, la plus grande partie de cette substance aboutirait dans les sites d’élimination des déchets. Une petite partie serait rejetée dans l’eau en provenance des eaux usées (0,8 %) et une plus petite partie serait rejetée dans le sol à partir de sites d’enfouissement et par suite de l’épandage de biosolides. Il ne devrait pas y avoir de rejet dans l’air. La forme anionique du PADMEC qui existe à des valeurs de pH normalement observées dans l’environnement est très soluble dans l’eau, n’est pas volatile et devrait s’adsorber fortement sur les surfaces minérales. Par conséquent, le PADMEC est susceptible de se retrouver principalement dans l’eau et les sédiments.
Le PADMEC devrait se dégrader lentement dans le milieu naturel où il pourrait être rejeté. Il est considéré comme persistant dans l’eau et le sol. De nouvelles données expérimentales et modélisées relatives à sa répartition entre l’octanol et l’eau laissent entendre que cette substance a un faible potentiel de bioaccumulation dans les tissus adipeux des organismes. Il a été déterminé que cette substance répond aux critères de persistance, mais non à ceux de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. En outre, de nouvelles données expérimentales sur la toxicité indiquent que le PADMEC présente une faible toxicité pour les organismes aquatiques.
Aux fins de la présente évaluation préalable, un scénario d’exposition très prudent a été élaboré selon lequel la valeur maximale des quantités de PADMEC importées au Canada en 2005 (100 000 kg) était utilisée dans un seul site industriel et qu’il y avait des rejets dans le milieu aquatique. La substance présente un faible potentiel de risque pour les organismes aquatiques comme l’indique la comparaison de la concentration environnementale estimée et de la concentration estimée sans effet.
Aucune donnée empirique relative aux effets sur la santé n’a été relevée pour le PADMEC. Selon les données relatives aux effets d’un analogue sur la santé, on n’a déterminé aucun potentiel de risque élevé pour cette substance. Étant donné que le PADMEC n’est actuellement pas importé ou fabriqué au Canada en des quantités supérieures au seuil de déclaration, la probabilité d’exposition de la population générale du Canada est considérée comme faible. Par conséquent, les risques pour l’ensemble de la population sont aussi considérés comme faibles.
À la lumière des renseignements disponibles, il est conclu que le PADMEC n’est pas une substance qui pénètre dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir un effet nocif immédiat ou à long terme sur la vie et la santé humaines. Il est aussi conclu que le PADMEC ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie.
D’après les renseignements disponibles, il est conclu que PADMEC ne remplit aucun des critères énoncés à l’article 64 de la LCPE (1999). PADMEC remplit les critères de la persistance and l’eau et le sol mais pas les critères de la bioaccumulation tel que défini dans le Règlement sur la persistance et la bioaccumulation.
On envisagera d’inclure cette substance dans la mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
La Loi canadienne sur la protection de l’environnement [LCPE (1999)] (Canada, 1999) impose aux ministres de l’Environnement et de la Santé de procéder à une évaluation préalable des substances qui répondent aux critères de catégorisation énoncés dans la Loi afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti), et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d’intention dans la Partie I de la Gazette du Canada(Canada, 2006a), dans lequel ils priaient l’industrie et les autres parties intéressées à fournir, dans des délais précis, des renseignements spécifiques qui pourraient servir à étayer l’évaluation des risques, à élaborer et à déterminer les meilleures pratiques en matière de gestion des risques et d’intendance des produits des substances jugées hautement prioritaires.
Le bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle est une substance dont l’évaluation des risques pour l’environnement a été jugée hautement prioritaire, car elle est persistante, bioaccumulable et intrinsèquement toxique pour les organismes aquatiques et l’on croit qu’elle est commercialisée au Canada. Le volet du Défi portant sur cette substance a été publié dans la Gazette du Canada le 31 janvier 2009 (Canada, 2009a, 2009b). En même temps a été publié le profil de cette substance, qui présentait l’information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements relatifs aux propriétés, au potentiel de bioaccumulation, à la persistance, au danger et aux utilisations de la substance ont été communiqués en réponse au Défi.
Bien que l’évaluation des risques que présente le bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle pour l’environnement soit jugée hautement prioritaire, cette substance ne répond pas aux critères de catégorisation pour le PFRE ou le REI ni aux critères définissant un grave risque pour la santé humaine, compte tenu du classement attribué par d’autres organismes nationaux ou internationaux quant à sa cancérogénicité, à sa génotoxicité ou à sa toxicité pour le développement ou la reproduction.
Les évaluations préalables effectuées aux termes de la LCPE (1999) mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de toxicité des substances chimiques au sens de l’article 64 de laLoi. Les évaluations préalables visent à étudier les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence[2].
La présente évaluation préalable prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, y compris ceux fournis dans le cadre du Défi. Les données qui ont trait à l’évaluation préalable de cette substance proviennent de documents originaux, de rapports de synthèse et d’évaluation, de rapports de recherche faits par les intervenants et de recherches documentaires récentes échelonnées jusqu’en juillet 2010 et ayant servi de base aux sections du présent document qui portent sur l’environnement et la santé humaine. Les études les plus importantes ont fait l’objet d’une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions.
Lorsqu’ils étaient disponibles et pertinents, les renseignements présentés dans l’évaluation des dangers provenant d’autres instances ont également été utilisés. La présente évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s’agit plutôt d’un sommaire des études et des données probantes appuyant le mieux la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre les résultats d’autres programmes exécutés par ces ministères. La partie de la présente évaluation portant sur l’écologie a fait l’objet d’une étude consignée par des pairs ou d’une consultation de ces derniers. En outre, l’ébauche de la présente évaluation a fait l’objet d’une période de commentaires de 60 jours par le public. Bien que les commentaires reçus de l’extérieur aient été pris en considération, Santé Canada et Environnement Canada sont seuls responsables du contenu final et des résultats de l’évaluation préalable. Les approches suivies pour les évaluations préalables dans le cadre du Défi ont été examinées par un groupe indépendant, soit le Groupe consultatif du Défi.
Les principales données et considérations sur lesquelles repose la présente évaluation préalable sont résumées ciaprès.
Nom de la substance
Aux fins du présent document, la substance « bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle » est appelée PADMEC. L’acronyme est formé d’après son appellation anglaise dans la LIS.
Tableau 1. Identité de la substance - PADMEC
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 65140-91-2 |
| Nom dans la LIS | bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle |
| Noms relevés dans les National Chemical Inventories (NCI)[1] | phosphonic acid, [[3,5-bis(1,1-dimethylethyl)-4-hydroxyphenyl]methyl]-, monoethyl ester, calcium salt (2:1) (TSCA, AICS, PICCS, ASIA-PAC) bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle (EINECS) calcium bis[ethyl (3,5-di-tert-butyl-4- hydroxybenzylphosphonate)] (ENCS) [[3,5-Bis(1,1-dimethylethyl)-4-hydroxyphenyl]methyl]phosphonic acid monoethyl ester calcium salt (2:1) (ECL) phosphonic acid, [[3,5-bis(1,1-dimethylethyl)-4-hydroxyphenyl]methyl-monoethylester,calcium salt (2:1) (PICCS) |
| Autres noms | calcium (3,5-di-tert-butyl-4-hydroxybenzyl monoethyl phosphonate); calcium bis(ethyl 3,5-di-tert-butyl-4-hydroxybenzylphosphonate); calcium bis[ethyl (3,5-di-tert-butyl-4-hydroxyphenyl)methanephosphonate]; ethyl 3,5-di-tert-butyl-4-hydroxybenzylphosphonate, calcium salt; IR 1425WL; Irganox 1425; Irganox 1425WL; Irganox I 1425; phosphonic acid, P-[[3,5-bis(1,1-dimethylethyl)-4-hydroxyphenyl]methyl]-, monoethyl ester, calcium salt (2:1) |
Groupe chimique (groupe de la LIS) |
Matières organiques définies |
| Principale classe chimique ou utilisation | Phénols |
| Principale sous-classe chimique | Esters phosphoniques |
| Formule chimique | C34 H56O8 P2Ca |
| Structure chimique |  |
| SMILES[2] | c1(c(C(C)(C)C)cc(cc1C(C)(C)C)CP(=O)([O])OCC)O[Ca]c1 (c(C(C)(C)C)cc(cc1C(C)(C)C)CP(=O)([O-])OCC)O |
| Masse moléculaire | 694,85 g/mol |
[2] Simplified Molecular Input Line Entry System.
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et modélisées) du PADMEC qui se rapportent à son devenir dans l’environnement. La validité des études relatives au log D (registre ou log du coefficient de distribution des entités ioniques dans l’octanol et l’eau; consulter la note de bas de page 1 du tableau 2) et à la solubilité dans l’eau a fait l’objet d’un examen minutieux. Ces examens (sommaires de rigueur d’étude) se trouvent à l’annexe I.
Les contreions du PADMEC devraient s’ioniser (se charger négativement) aux pH enregistrés dans l’environnement (de 6 à 9), si l’on se fie à la première très faible valeur de pKa de 2,38 et à la seconde valeur élevée de pKa de 12,5 (voir le tableau 2). Le PADMEC est aussi un sel et, par conséquent, il se fera un équilibre dans l’eau entre le sel et la forme dissociée. Les propriétés physiques et chimiques de la forme non dissociée et de la forme dissociée du PADMEC sont présentées dans le tableau 2 ciaprès, et sont semblables pour les deux formes.
Les modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés pour générer des données pour les propriétés physiques et chimiques du PADMEC. Ces modèles sont principalement fondés sur les méthodes d’addition de fragments, c.-à-d. qu’ils reposent sur la structure d’une substance chimique. Les substances ionisantes et les sels, comme PADMEC, sont difficiles à modéliser, car la plupart des modèles, comme EPIWIN (2008) et CPOP (2008), acceptent uniquement les codes du SMILES (consulter la note de bas de page 2 du tableau 1) des molécules neutres (non chargées) et ne tiennent pas compte des interactions électrostatiques résultant des espèces chargées. Le modèle ACD/PhysChem Suite (2009), employé pour estimer certaines propriétés comme le log D et la solubilité dans l’eau, a été retenu pour la forme ionisée à différentes valeurs de pH (voir le tableau 2). Cependant, ce modèle n’acceptant pas les sels, le PADMEC a été modélisé selon ACD/PhysChem Suite (2009) comme une molécule dissociée, tel que le montre la figure 1, et est expliqué ciaprès. Le fait que les modèles ne tiennent pas compte des interactions électrostatiques augmente l’incertitude associée aux propriétés prévues.
Les modèles tels que EPIsuite (2008) et CPOP (2008) n’acceptant ni les sels ni les espèces ionisées, la forme neutre d’une moitié de la structure du PADMEC a été introduite dans les modèles pour représenter la forme dissociée (figure 1) (voir SMILES à l’annexe II). Afin de modéliser la structure non dissociée, il a fallu établir des liaisons entre l’ion calcium ion et les atomes d’oxygène des groupes de l’acide phosphonique (voir SMILES à l’annexe I), ce qui a produit aussi une espèce neutre.
Figure 1. Structure dissociée et neutre du PADMEC utilisée pour la modélisation
Les valeurs des propriétés physicochimiques expérimentales présentées dans le tableau 2 tiennent compte des formes du PADMEC qui étaient présentes en solution durant les expériences, à savoir la forme dissociée et la forme non dissociée, même si on ne connaît pas la proportion de chaque forme. En raison de la forte solubilité du PADMEC, on s’attend à ce que les deux formes soient présentes en équilibre en solution.
Tableau 2. Propriétés physiques et chimiques de la forme non dissociée et de la forme dissociée du PADMEC
| Forme du PADMEC | Type | Valeur | Température (°C) | Référence |
|---|---|---|---|---|
| Point de fusion (ºC) | ||||
| Non dissociée | Modélisé | 90,3 | - | MPBPWIN, 2008 |
| Dissociée | Modélisé | 86,4 | - | MPBPWIN, 2008 |
| Les deux formes | Expérimental | > 260 | Présentation de projet, 2010a | |
| Point d’ébullition (ºC) | ||||
| Non dissociée | Modélisé | 480 | - | MPBPWIN, 2008 |
| Dissociée | Modélisé | 440 | - | MPBPWIN, 2008 |
| 408 | - | ACD/ PhysChem Suite, 2009 | ||
| Densité (kg/m3) | ||||
| Les deux formes | Expérimental | 1,2 x 103 (1,2 g/cm3) |
S.O. | Présentation de projet, 2010a |
| Pression de vapeur (Pa) | ||||
| Non dissociée | Modélisé | 6,03 x 10-10 | 25 | MPBPWIN, 2008 |
| Dissociée | Modélisé | 3,25 x 10-9 | 25 | MPBPWIN, 2008 |
| Les deux formes | Expérimental | < 0,01 | 20 | Présentation de projet, 2010a |
| Constante de la loi de Henry (Pa m3/mol) | ||||
| Non dissociée | Calculé[1] | 3,40 x 10-10 | 25 | HENRY, 2008 |
| Dissociée | Modélisé | 2,94 x 10-8 | 25 | HENRY, 2008 |
| Log D (coefficient de distribution)[2] [sans dimension] | ||||
| Non dissociée | Calculé[3] | 1,46 (pH = 7,0) | 25 | - |
| Dissociée | Modélisé | 0,15 (pH = 6,0) -0,031 (pH = 7,0)[*] -0,054 (pH = 8,0) |
25 | ACD/ PhysChem Suite, 2009 |
| Calculé[4] | -0,57 (pH = 7,0) | 25 | - | |
| Les deux formes | Expérimental (étude Koe) | 0,83 (pH = 5,5)[5] | S.O. | Présentation de projet, 2010b |
| Log Kco(coefficient de partage carbone organique-eau) [sans dimension] | ||||
| Non dissociée | Modélisé[6] | 1,84 | 25 | KOCWIN, 2008 |
| Dissociée | 0,85 | |||
| Solubilité dans l’eau (mg/L) | ||||
| Non dissociée | Modélisé | 1 230 | 25 | WSKOWWIN, 2008 |
| Dissociée | Modélisé | 8 222 | 25 | WSKOWWIN, 2008 |
| 743 1 000 1 000 |
pH = 5,5 pH = 7,0 pH = 8,0 |
ACD/ PhysChem Suite, 2009 | ||
| Les deux formes | Expérimental | 2 400 | 20 | Présentation de projet, 2010c |
| pKa (constante de dissociation acide) [sans dimension] | ||||
| Dissociée | Modélisé7 | 12,5 (pKa 2) 2,38 (pKa 1) |
25 | ACD/ PhysChem Suite, 2009 |
[*] Valeur choisie pour la modélisation.
[1] Calculée par HENRY (2008), d’après la pression de vapeur modélisée et la solubilité dans l’eau modélisée de 1 230 mg/L.
[2] Le log D constitue le registre du coefficient de distribution qui prend en considération la présence d’entités ioniques; il représente une quantité nette de formes neutres et ioniques supposées se diviser à la phase lipidique à un pH donné.
[3] Fondé sur un log Koeestimé (forme neutre) de 6,08 (KOWWIN, 2008), ainsi que sur une pKa estimée de 2,38 (log D = log Koe + pKa – pH).
[4] Fondé sur un log Koeestimé (forme neutre) de 4,03 (KOWWIN, 2008), ainsi que sur une pKa estimée de 2,38.
[5] Cette valeur n’est pas jugée fiable, car la substance a été ionisée au pH nécessaire à l’étude.
[6] Fondé sur un log D estimé à pH 7 (1,46 pour la forme non dissociée; -0,031 pour la forme dissociée) et, par conséquent, en tenant compte de l’influence des formes ioniques plus solubles de cette substance, mais sans tenir compte du dosage acide-base ni des interactions électrostatiques avec les substrats solides.
[7] Il a été impossible de modéliser la pKa de la forme non dissociée (car le modèle n’accepte pas les sels).
Le PADMEC n’est pas une substance de composition naturelle.
Des enquêtes menées pour les années 2005 et 2006 par le truchement d’avis publiés dans la Gazette du Canadaconformément à l’article 71 de la LCPE (1999) ont permis d’obtenir des données (Canada, 2006b; Canada, 2009b). Ces deux avis visaient à recueillir des données sur la fabrication, l’importation et l’utilisation de cette substance au Canada.
En 2006, aucune entreprise n’a déclaré avoir fabriqué, importé ou utilisé des quantités de PADMEC en 2006 (Environnement Canada, 2009) supérieures ou inférieures au seuil de déclaration fixé à 100 kg/an au Canada. Cependant, en 2009, une entreprise s’est dit être un futur intervenant lié à l’importation du PADMEC au Canada. En février 2011, cette entreprise n’importe toujours pas, ne fabrique pas et n’utilise pas cette substance au Canada (communication personnelle entre un représentant de l’entreprise et la Division de l’évaluation écologique, Environnement Canada, source non citée). Cette entreprise a fourni au gouvernement du Canada des études empiriques sur les propriétés physiques et chimiques, la persistance, la bioaccumulation et l’écotoxicité, toutes résumées dans le présent rapport. Cette même entreprise a demandé qu’on assure la confidentialité de son identité et des données de ses modèles d’utilisation de cette substance.
En 2005, moins de quatre entreprises ont indiqué avoir importé de 1 001 à 100 000 kg/an de PADMEC, selon le modèle d’utilisation tenu confidentiel (Environnement Canada, 2007a), et une entreprise a indiqué avoir importé moins de 100 kg/an de PADMEC (Environnement Canada, 2007a). Au Canada, le PADMEC ne sert ni de formulant ni matière active dans les produits antiparasitaires (Santé Canada, 2007, 2010).
Le PADMEC figure sur les listes de substances chimiques produites en petites quantités en Europe (ESIS, 2010). Actuellement, le PADMEC n’est pas déclaré (année de déclaration 2009) dans le programme américain Toxics Release Inventory (TRI) (USEPA, 2010a). Cette substance chimique a été déclarée en vertu de la Inventory Update Rule visée par laU.S. Toxic Substances Control Act des ÉtatsUnis pour les périodes de déclaration suivantes : 1986, 1990, 1994, 1998, 2002 et 2006 (USEPA, 2010b; USEPA, 2006a). En 2006, moins de 500 000 livres (227 000 kg) de cette substance ont été produites ou importées aux ÉtatsUnis (USEPA, 2006a). En 1990, 1994, 1998 et 2002, de 10 000 à 500 000 livres (de 4 540 à 227 000 kg) de cette substance ont été produites ou importées aux ÉtatsUnis (USEPA, 2010b).
Le PADMEC a été utilisé en Suède en 2008 (volume de 27 tonnes) et n’y a pas été utilisé en 2007 (0 tonne) (SPIN, 2010). Il a aussi été utilisé en Finlande (consulter la section Utilisations ciaprès), bien qu’on ne dispose d’aucune donnée sur la quantité (SPIN, 2010).
Le PADMEC n’a pas été déclaré avoir été utilisé au Canada en 2006 (voir la section Sources). L’entreprise qui a soumis des renseignements sur le PADMEC au gouvernement du Canada (décrits dans la section Sources) a demandé d’assurer la confidentialité des données de son profil d’utilisation. Par conséquent, l’utilisation du PADMEC déclaré pour 2005 doit demeurer confidentielle. Or, ces données ont été prises en considération dans la présente évaluation. Le PADMEC n’est pas utilisé au Canada comme matière active ou produit de formulation des produits antiparasitaires (ARLA, 2007; ARLA, 2010).
Au Canada, le PADMEC n’est pas répertorié dans leRèglement sur les aliments et drogues comme additif alimentaire; cependant, Santé Canada ne s’est pas objecté à son utilisation dans la composition de certains emballages alimentaires de plastique (communication personnelle en 2010 de la Direction des aliments de Santé Canada au Bureau de l’évaluation des risques des substances existantes, Santé Canada; source non citée). Le PADMEC ne figure pas actuellement sur la Liste critique des ingrédients dont l’utilisation est interdite dans les cosmétiques de Santé Canada (Santé Canada, 2009), et aucun produit qui en contient ne se trouve dans la base de données du Système de déclaration des cosmétiques (SDC, 2010).
À l’échelle internationale, le PADMEC sert d’antioxydant à masse moléculaire élevée. Il sert de stabilisant dans les substrats organiques comme le plastique, les fibres synthétiques, les élastomères, les adhésifs, les cires, les huiles et les graisses pour assurer une protection contre la dégradation thermooxydante (Cradlechem, 2003). Le PADMEC peut servir de stabilisant dans les polyoléfines, tout particulièrement les fibres de polypropylène, ainsi que dans le polyester, les élastomères réticulés, les adhésifs de spécialité et les résines donnant du collant (Cradlechem, 2010). Le PADMEC sert aussi de catalyseur d’estérification dans la préparation des esters colophaniques (Cradlechem, 2010).
Le PADMEC figure dans la liste des additifs alimentaires indirects utilisés dans les substances pour contact avec les aliments de la Food and Drug Administration (FDA) des ÉtatsUnis (List of Indirect Food Additives Used in Food Contact Substances) dans la catégorie des antioxydants et des stabilisateurs (USFDA, 2010a). L’utilisation du PADMEC est approuvée dans les copolymères du polypropylène, des polyéthylènes et des oléfines, et des polymères des phtalates de polyéthylène et à des concentrations en poids maximales de 0,2 à 0,3 % et, dans les adhésifs, le ciment servant à sceller les conserves et les résines et les polymères utilisés dans le carton, à des concentrations en poids inférieures à 0,5 % (USFDA, 2010a).
Il sert aussi en Finlande de stabilisant dans la fabrication d’articles de caoutchouc et de plastique (SPIN, 2010). Les volumes d’utilisation n’ont pas été déclarés en raison de leur statut confidentiel (SPIN, 2010).
Une technique a été conçue par Environnement Canada pour estimer les rejets d’une substance dans l’environnement à différentes étapes de son cycle de vie, dont son devenir comme constituant d’un produit fini ou d’un article (Environnement Canada, 2008). Cette méthode comprend une analyse du cycle de vie et un tableur (outil de débit massique) qui intègrent les renseignements sur la fabrication, l’importation et les données d’utilisation disponibles pour la substance donnée. En commençant par une masse définie de la substance, on évalue ensuite les quantités de rejets et de produits à chaque étape de son cycle de vie. Les facteurs pertinents sont étudiés, les incertitudes sont reconnues et des hypothèses prudentes (c.àd. qui protègent l’environnement) peuvent être émises à chaque étape, selon les renseignements disponibles. Dans le cas présent, la plupart des hypothèses sont fondées sur leEmission Scenario Document on Plastics Additives de l’Organisation de coopération et de développement économiques (OCDE, 2009). Ce document porte sur les facteurs d’émission associés aux pertes durant les processus industriels, tels le mélange et la transformation, et des pertes associées à la vie utile du produit. Il précise que les facteurs d’émission représentent les pertes du pire cas raisonnable, de manière à ce que les estimations se situent dans le haut de la plage des valeurs possibles.
Les pertes estimées représentent le bilan massique exhaustif de la substance au cours de son cycle de vie et elles comprennent les rejets dans les eaux usées et d’autres milieux récepteurs (sol, air), la transformation chimique, le transfert vers les activités de recyclage et le transfert vers les sites d’élimination des déchets (sites d’enfouissement, incinération). Toutefois, à moins de disposer de données précises sur le taux ou le potentiel de rejet de cette substance provenant des sites d’enfouissement et des incinérateurs, la méthode ne permet pas de quantifier les rejets dans l’environnement à partir de ces sources. En fin de compte, les pertes estimées fournissent le premier volet de l’analyse de l’exposition à une substance et aident à estimer les rejets dans l’environnement et à mettre l’accent sur la caractérisation de l’exposition dans l’évaluation.
En général, les rejets d’une substance dans l’environnement peuvent découler de différentes pertes de la substance pendant sa fabrication, son utilisation industrielle ainsi que son utilisation commerciale et par les consommateurs. Ces pertes peuvent être regroupées en sept types : 1) déversements dans les eaux usées; 2) émissions atmosphériques; 3) pertes dans le sol; 4) transformation chimique; 5) élimination dans des sites d’enfouissement; 6) élimination par incinération; 7) élimination par recyclage (p. ex. le recyclage est jugé comme une perte et pas pris davantage en considération). Elles sont estimées à partir de données issues d’enquêtes réglementaires, des industries, ainsi qu’en fonction des données publiées par différents organismes. Les pertes dans les eaux usées concernent les déversements des eaux usées brutes non traitées avant traitement, que ce soit un traitement des eaux usées industrielles sur place ou un traitement des eaux usées hors site. De la même manière, les pertes par transformation chimique font référence aux modifications de l’identité de la substance qui ont lieu au cours des étapes de fabrication, d’utilisation industrielle ou d’utilisation commerciale et par les consommateurs, mais elles excluent celles qui ont lieu pendant les opérations de gestion des déchets telles que l’incinération et le traitement des eaux usées. La perte dans les terres inclut le transfert accidentel ou les rejets dans le sol ou les surfaces pavées ou non pavées pendant l’utilisation de la substance et sa durée de vie utile (p. ex à partir de l’utilisation de machinerie agricole ou d’automobiles). La perte dans les terres ne comprend cependant pas le transfert accidentel à la suite d’une utilisation de la substance et sa durée de vie utile (p. ex. l’application au sol de biosolides et les dépôts atmosphériques).
Les pertes estimées du PADMEC au cours de son cycle de vie, fondées sur son utilisation dans la fabrication des plastiques (et fondées sur des hypothèses tirées de OCDE [2009], tel qu’expliqué plus haut) sont présentées au tableau 3 (Environnement Canada, 2010).
Tableau 3. Estimation des rejets et des pertes de PADMEC au cours de son cycle de vie
| Type de perte | Proportion (%) | Étapes pertinentes du cycle de vie |
|---|---|---|
| Rejet des eaux usées | 0,8 | Utilisation industrielle, commerciale et par les consommateurs |
| Émissions atmosphériques | 0 | Utilisation industrielle, commerciale et par les consommateurs |
| Sol | 0[1] | Utilisation industrielle, commerciale et par les consommateurs |
| Transformation chimique | 0[1] | S.O. |
| Site d’enfouissement | 96,2 | Utilisation industrielle, commerciale et par les consommateurs |
| Incinération | 3 | Utilisation industrielle, commerciale et par les consommateurs |
| Recyclage | 0[1] | S.O. |
On estime les rejets de PADMEC dans les eaux usées à 0,8 % de la quantité totale importée (utilisée) à la suite d’une utilisation industrielle, commerciale et par les consommateurs, selon son utilisation comme antioxydant ou stabilisant dans les plastiques. Cette perte résulte principalement de l’utilisation industrielle, qui serait un rejet par des sources ponctuelles (de façon non dispersive). Les hypothèses émises pendant cette étape comprennent les pertes pendant la manutention des matières premières, des opérations de formulation, ainsi que pendant la durée de vie utile. La grande partie des pertes de PADMEC seraient attribuables à l’élimination des déchets, soit l’incinération (3 %) dont la totalité est présumée se transformer chimiquement) et les sites d’enfouissement (96,2 %).
On estime que les rejets dans les eaux usées pendant l’utilisation commerciale et par les consommateurs d’articles contenant du PADMEC constituent le quart des rejets totaux de PADMEC dans les eaux usées. Ces pertes résulteraient d’une accumulation graduelle et auraient été dispersées à grande échelle dans l’environnement plutôt que par des sources ponctuelles.
Les pertes estimées indiquent que le PADMEC présente un potentiel de rejets dans l’environnement. En général, les eaux usées constituent probablement une source courante de rejets de cette substance dans l’eau et une source possible de rejets dans le sol par la gestion subséquente des boues. Les sites d’enfouissement ont le potentiel de lixivier, ou laisser filtrer, des substances dans la nappe phréatique ou de produire des rejets de substances dans l’atmosphère, bien que, en raison de leur volatilité négligeable, les rejets atmosphériques de PADMEC ne seraient pas importants. De plus, le PADMEC devrait être fortement adsorbé sur les surfaces minérales (voir la section Devenir dans l’environnement), et son lessivage depuis les sites d’enfouissement ou depuis le sol ne devrait pas être important.
D’après sa forte solubilité dans l’eau et ses très faibles log D et log KCO (tableau 2) et ses rejets possibles dans les eaux usées (voir le tableau 3), il est prévu que le PADMEC se retrouve principalement dans l’eau. Cependant, les phosphonates s’adsorbent très fortement sur la plupart des surfaces minérales en raison d’interactions électrostatiques (Nowack, 2003). Par conséquent, la grande partie du PADMEC qui est rejetée dans l’eau devrait se retrouver dans les sédiments. La constante de dissociation acide (pKa) relativement faible de 2,38 pour le groupement des phosphonates du PADMEC indique que, dans un environnement comportant des valeurs de pH données (pH de 6 à 9), la grande partie du PADMEC se trouvant dans l’eau sera sous forme dissociée et ionisée.
Si le PADMEC est utilisé dans les plastiques ou à d’autres fins qui produisent des déchets solides, il aboutira dans les sites d’enfouissement à l’étape d’élimination des déchets (tableau 3). Il aurait tendance à demeurer dans les sites d’enfouissement, en raison de la forte adsorption des phosphonates sur les surfaces minérales et de leur faible potentiel de biodégradation (Nowack, 2003).
Le PADMEC ne peut pas quitter le sol ou l’eau pour se volatiliser dans l’atmosphère vu sa faible volatilité et sa faible constante de la loi de Henry. On estime qu’aucun rejet direct de cette substance n’atteindra de manière directe l’atmosphère ou le sol (voir le tableau 3). Les hypothèses concernant l’absence de dégradation de cette substance dans l’eau et dans le sol sont appuyées par l’évaluation de sa persistance dans ces milieux, comme il est présenté ciaprès.
Persistance dans l’environnement
Les données empiriques de biodégradation rapide présentées au tableau 4a indiquent que 1 % et 26 % du PADMEC se dégradent, selon la concentration testée, sur une période de 28 jours dans un essai de biodégradabilité rapide. Le sommaire de rigueur d’étude de la présente étude se trouve à l’annexe I. Il est à souligner qu’une certaine incertitude demeure quant à l’identité de la substance utilisée dans cette étude, car la substance d’essai n’a été identifiée que par son nom commercial et sa pureté n’a pas été déclarée. De plus, les auteurs de cette étude ont utilisé un émulsifiant pour parvenir à une meilleure répartition dans le milieu vu la faible solubilité déclarée de cette substance d’essai. Or, les données présentées dans le tableau 2 du présent rapport d’évaluation préalable indiquent que le PADMEC est très soluble dans l’eau. Il est probable que la substance d’essai, identifiée uniquement par son nom commercial ait été absorbante par voie électrostatique dans le milieu minéral servant au système de mise à l’essai, en raison de sa charge négative à ce niveau de pH ambiant.
Tableau 4a. Données empiriques sur la biodégradation du PADMEC
| Méthode | Valeur de dégradation | Paramètre de dégradation | Durée de l’essai | Référence |
|---|---|---|---|---|
| Méthode 301B de l’OCDE | 1 % (21 mg/L)[1] 26 % (11 mg/L)[1] |
%ThCO2 | 28 jours | Présentation de projet, 2010d |
Ces données d’essai concordent avec les données relatives à d’autres phosphonates, indiquant que la biodégradation est faible ou nulle dans les essais et les milieux naturels (Nowack, 2003).
En raison de l’incertitude liée aux données expérimentales du tableau 4a, on a recouru à une méthode du poids de la preuve reposant sur des RQSA (Environnement Canada, 2007b) à partir des modèles de la dégradation indiqués dans le tableau 4b ci-après. Étant donné l’importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s’appliquent à ce milieu et que le PADMEC devrait y être rejeté (voir tableau 3), c’est la biodégradation dans le milieu aquatique qui a surtout été étudiée. Le tableau 4b résume les résultats des modèles RQSA disponibles sur la dégradation dans l’eau.
Il faut noter que le modèle BIOWIN (2008), qui est fondé sur des fragments structurels, exclut le groupe des phosphonates dans son ensemble d’étalonnage; les fragments structurels qui sont représentés sont les suivants : l’alcool aromatique, et l’atome de carbone à quatre liaisons simples sans hydrogène.
Tableau 4b. Données empiriques modélisées sur la dégradation du PADMEC[1] dans l’eau
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Eau | |||
| Hydrolyse | HYDROWIN, 2008[2] | S.O., structure extérieure au domaine du modèle | S.O. |
| Biodégradation primaire | |||
| Biodégradation (aérobie) | BIOWIN, 2008[2] Sous-modèle 4 : Enquête d’experts (résultats qualitatifs) |
-3,1[3] « se biodégrade rapidement » |
£ 182 |
| Biodégradation ultime | |||
| Biodégradation (aérobie) | BIOWIN, 2008[2] Sous-modèle 3 : Enquête d’experts (résultats qualitatifs) |
2,1[3] « se biodégrade lentement » |
≥ 182 |
| Biodégradation (aérobie) | BIOWIN, 2008[2] Sous-modèle 5 : Probabilité linéaire, MITI |
-0,05[4] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | BIOWIN, 2008[2] Sous-modèle 6 : Probabilité non linéaire, MITI |
0,007[4] « se biodégrade très lentement » |
≥ 182 |
| Biodégradation (aérobie) | TOPKAT, 2004 Probabilité |
Structure extérieure au domaine du modèle | S.O. |
| Biodégradation (aérobie) | CATABOL (2004–2008) % DBO (demande biologique en oxygène) |
0,014 « se biodégrade très lentement » |
≥ 182 |
[1] La forme dissociée du PADMEC a été utilisée aux fins de la modélisation (voir la figure 1).
[2] EPIsuite (2008)
[3] L’extrant est une note numérique de 0 à 5.
[4] L’extrant est une note de probabilité.
Tant les résultats expérimentaux (tableau 4a) que les résultats modélisés (tableau 4b) de la biodégradation ultime laissent entendre que le PADMEC ne se biodégradera pas rapidement dans l’environnement. Le PADMEC contient également des propriétés structurelles qui laissent croire qu’il est probablement persistant : la présence de deux groupes tertbutyle sur chaque anneau phénolique, structure très ramifiée, assure la stabilité, ainsi que la liaison CP qui est aussi très stable (Nowack, 2003).
D’après un ratio d’extrapolation de 1:1:4 dans l’eau, une demivie de la biodégradation l’eau:le sol:les sédiments (Boethling et al., 1995), la demivie de biodégradation ultime dans le sol devrait également être supérieure à 182 jours et supérieure à 365 jours dans les sédiments, indiquant que le PADMEC doit être persistant dans le sol et les sédiments.
D’après les données empiriques et modélisées (voir les tableaux 4a et 4b), le PADMEC répond aux critères de persistance dans l’eau et dans le sol (demivies supérieures ou égales à 182 jours) et de persistance dans les sédiments (demivie supérieure ou égale à 365 jours) énoncés dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000). On estime que cette substance ne se trouve pas dans l’atmosphère.
Potentiel de bioaccumulation
Les nouvelles valeurs expérimentales et modélisées du log D du PADMEC, qui prennent en considération son caractère ionique, semblent indiquer que cette substance est peu bioaccumulable dans le biote (voir le tableau 2).
Le tableau 5a présente les valeurs empiriques du facteur de bioconcentration (FBC) d’une étude sur le poisson. Le sommaire de rigueur d’étude se trouve à l’annexe I. À partir d’une représentation graphique présentant la bioconcentration du PADMEC dans les tissus de poissons au fil du temps, l’atteinte d’un état d’équilibre semble survenir après six semaines. Par conséquent, les valeurs du FBC à six semaines figurent au tableau 5a. Le FBC moyen est de 30,5 L/kg.
Tableau 5a. Données empiriques sur la biodégradation du PADMEC
| Organisme d’essai | Durée de l’essai | Valeur du FBC en L/kg (poids humide) | Référence |
|---|---|---|---|
| Poisson (carpe) | 6 semaines[1] | 10,3; 20,6 (concentration d’exposition de 2,5 ppm) 38,8; 52,3 (concentration d’exposition de 0,27 ppm) |
Présentation de projet, 2010e |
Une seule étude expérimentale sur le FBC étant disponible, une méthode prévisionnelle a été appliquée au moyen des modèles de facteur de bioaccumulation (FBA) et de FBC disponibles, comme il est présenté au tableau 5b ciaprès.
D’après le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si son FBC ou son FBA est supérieur ou égal à 5 000. Le FBA est l’unité de mesure privilégiée pour l’évaluation du potentiel de bioaccumulation des substances. En effet, le facteur de bioconcentration ne prend pas en compte de manière adéquate le potentiel de bioaccumulation des substances par l’alimentation, lequel est un facteur majeur pour les substances dont le log Koe est supérieur à ~ 4,0 (Arnot et Gobas, 2003). La modélisation cinétique du bilan massique est considérée comme la méthode la plus fiable pour prédire le potentiel de bioaccumulation, car elle permet une correction du métabolisme (Arnot et al., 2008). Cependant, étant donné que la forme ionisée du PADMEC, qui prédomine dans un milieu donné dont le pH atteint des valeurs données, comporte un log D très faible (inférieur à 1), il ne devrait pas être prélevé à partir de la diète (l’absorption par les branchies prédominera) et, par conséquent, les valeurs du FBA et du FBC du PADMEC devraient être essentiellement semblables.
Il n’a pas été possible de modéliser les valeurs du FBC et du FBA du PADMEC à l’aide des deux sousmodèles ArnotGobas fondés sur le bilan massique dans le cadre du programme BCFBAF d’EPIsuite (2008), qui prennent en considération le métabolisme, parce que les substances ionisantes ne sont pas du champ d’application de ces sousmodèles. Par conséquent, seul le résultat du FBC fondé sur une régression obtenue dans le cadre du BCFBAF (2008) est présenté au tableau 5b. Le log D de –0,031 à pH 7 (voir tableau 2) a été entré dans les modèles du FBC dont les résultats sont indiqués au tableau 5b. Le programme BCFBAF (2008) attribue automatiquement un log FBC de 0,50 (FBC = 3,16) aux composés ioniques dont le log KOE est inférieur à 5,0.
Tableau 5b. Données modélisées sur la bioaccumulation du PADMEC dans les poissons
| Structures du PADMEC modélisées | Modèle et base du modèle | Paramètre | Valeur en L/kg (poids humide) | Référence |
|---|---|---|---|---|
| Forme dissociée et forme non dissociée | FBC, maximum | FBC | 3,16 | BCFBAF, 2008 |
| Forme dissociée et forme non dissociée | FBC, maximum | FBC | 10,1 | Dimitrov et al., 2005 |
Il convient de souligner que le modèle prévisionnel de Dimitrov et al. (2005) est valide, car les structures du PADMEC (forme dissociée et forme non dissociée) faisaient partie du domaine des paramètres de ce modèle, et représentaient respectivement 71 % et 73 % du domaine structurel du modèle, étant donné que la base de données d’étalonnage de ce modèle contenait des substances assez similaires au PADMEC.
Un autre modèle utilisé (tableau 5b) est celui tiré duTechnical Guidance Document on Risk Assessment de la Commission européenne (Commission européenne, 2003), qui est fondé sur les travaux de Veith et al. (1979). D’après ce modèle, la valeur du FBC doit être de 1,41 lorsque le log KOE est inférieur à 1.
Les données empiriques et les valeurs modélisées disponibles (tableaux 5a et 5b) indiquent que le PADMEC devrait présenter un faible potentiel de bioaccumulation. Par conséquent, le PADMEC ne répond pas aux critères de bioaccumulation (FBA supérieur ou égal à 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Évaluation des effets sur l’environnement
A – Milieu aquatique
Les données expérimentales concernant la toxicité du PADMEC sont résumées dans le tableau 6 et décrites ciaprès. De plus, une analyse des données modélisées disponibles est également présentée ciaprès. Les données expérimentales et modélisées indiquent que le PADMEC présente une faible toxicité aiguë pour les organismes aquatiques.
Tableau 6. Données empiriques sur la toxicité du PADMEC
| Organisme d’essai | Type d’essai | Paramètre | Valeur (mg/L)[1] | Référence |
|---|---|---|---|---|
| Bactéries aérobies des eaux usées | Toxicité aiguë (3 heures) |
CI20[2] CI50[2] |
> 100 > 100 |
Présentation de projet (2010f) |
| Algues (Scenedesmus subspicatus) | Toxicité aiguë et chronique (72 heures) |
CE50[3] CSEO[4] |
> 100 100 |
Présentation de projet (2010g) |
| Cladocère (Daphnia magna) |
Toxicité aiguë (24 heures) |
CE50[3] CMEO[5] CSEO |
510 320 180 | Présentation de projet (2010h) |
| Poisson zèbre (Brachydanio rerio) | Toxicité aiguë (96 heures) |
CL50[6] CMEO[5] (survie) CMEO[5] (effets sublétaux) |
> 100 100 18 |
Présentation de projet (2010i) |
[2] CIX – Concentration inhibitrice d’un effet à un pourcentage donné. Estimation ponctuelle de la concentration d’une
substance d’essai causant une réduction de X % d’une mesure biologique quantitative comme le taux de croissance.
[3] CEX – Concentration d’une substance qu’on estime susceptible de causer un effet chez X % des organismes d’essai.
[4] CSEO – Concentration sans effet observé, soit la concentration la plus élevée ne causant pas d’effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
[5] CMEO – Concentration minimale avec effet observé, soit la plus faible concentration à laquelle on obtient un effet statistiquement significatif par rapport au groupe témoin dans un essai de toxicité.
[6] CLX – Concentration d’une substance qu’on estime susceptible de causer un effet létal chez X % des organismes d’essai.
Dans toutes les études de toxicité susmentionnées (voir le tableau 6), à l’exception de l’étude sur les algues, la substance d’essai (selon son nom commercial) a été considérée quasi insoluble ou peu soluble. Étant donné la grande solubilité mesurée et modélisée de cette substance (voir le tableau 2), la fiabilité de ces études peut être mise en doute. L’étude sur les algues n’a pas fourni de description de la solubilité de la substance d’essai, mais a indiqué que « la substance d’essai était répartie uniformément dans les récipients d’essai à tous les essais et à toutes les concentrations d’essai. » Dans l’étude sur le cladocère, un émulsifiant a été utilisé (éther de polyglycol alkylphénol) comme agent solubilisant. L’étude sur les bactéries a conclu que « la substance n’était pas dissoute, mais répartie dans le milieu d’essai. » Quant à l’étude sur le poisson zèbre, on a remarqué que, « initialement, un léger dépôt a été observé à toutes les concentrations d’essai. » Après une exposition de 48 h, la substance d’essai semblait répartie uniformément à toutes les concentrations d’essai. » Un sommaire de rigueur de l’étude sur le poisson zèbre se trouve à l’annexe I, car cette étude a été utilisée pour le calcul de la concentration estimée sans effet (CESE) (voir ciaprès).
La pureté de la substance d’essai n’a pas été décrite dans les études susmentionnées, à l’exception de l’étude sur les algues, dans laquelle la substance d’essai a été identifiée par son nom commercial et a été jugée pure à plus de 95 % (impuretés non identifiées). Les concentrations de la substance d’essai dans les échantillons en double n’ont pas été mesurées dans les études susmentionnées. L’ensemble des études résumées au tableau 6 sont considérées comme peu fiables, en raison des questions exposées plus haut et concernant l’identité et la solubilité de la substance ainsi que l’absence de concentrations mesurées.
Dans l’étude sur le poisson zèbre, les concentrations nominales mises à l’essai étaient de 10;18; 32; 58 et 100 mg/L (les concentrations n’ont pas été mesurées). Des cas de mortalité ont été observés seulement à la concentration de 100 mg/L. Dans un groupe de 10 poissons, deux cas de mortalité ont été observés à cette concentration après 24 heures, et le nombre de cas de mortalité n’a pas augmenté après 48, 72 ou 96 heures. Par conséquent, la CMEO de l’essai de survie est de 100 mg/L (concentration nominale). Cependant, aucune relation dose-effet n’a été observée, et on peut donc se demander si les cas de mortalité observés ont été causés par la substance d’essai. Des effets sublétaux ont aussi été observés durant l’étude : un léger effet sur le comportement natatoire aux concentrations de 18 et de 32 mg/L; des effets modérés et graves aux concentrations de 58 et de 100 mg/L, après 48, 72 et 96 heures. De plus, des effets graves sur l’équilibre ont été notés aux concentrations de 58 et de 100 mg/L, et des effets modérés à graves sur la fonction respiratoire, à la concentration de 100 mg/L. D’après ces effets sublétaux, qui indiquent une augmentation de la gravité des effets en fonction de l’augmentation de la concentration, la CMEO est de 18 mg/L en ce qui a trait aux effets sur le comportement natatoire.
Une série de valeurs de toxicité en milieu aquatique ont été tirées des modèles ECOSAR (2008) et CPOP (2008) de RQSA. Les résultats du PADMEC ne font pas partie du champ d’application du modèle TOPKAT (2004). Les ensembles d’étalonnage du AIEPS (20032007) et de la trousse d’application des modèles R(Q)SA de l’OCDE (v. 1.1.02) (OCDE, 2008) n’ayant pas été considérés comme adéquats pour le PADMEC, les résultats issus de ces modèles ne sont donc pas analysés plus longuement.
Tant le log Koe que la masse moléculaire du PADMEC font partie des champs d’application d’ECOSAR (2008). Le PADMEC a été modélisé dans ECOSAR (2008) comme un phénol et une matière organique neutre; cependant, ces ensembles d’étalonnage ne sont pas adéquats pour le PADMEC, car ils ne contiennent aucune substance présentant des valeurs de log Koe inférieures à 1 ni aucune substance de structure chimique semblable au PADMEC comme les sels d’esters phosphoniques. Les ensembles d’étalonnage du AIEPS (20032007) et de la trousse d’application des modèles R(Q)SA de l’OCDE (v. 1.1.02) (OCDE, 2008) n’ayant pas été considérés comme adéquats pour le PADMEC, les résultats issus de ces modèles ne sont donc pas analysés plus longuement.
Dans le modèle CPOP (2008), le PADMEC a été modélisé comme un « réactif, non répertorié », c.àd. qu’il fait partie d’un groupe de substances qui comprend toutes les substances dont les valeurs estimées selon ce modèle indiquent une toxicité supérieure à celle des narcotiques de référence. Le modèle CPOP (2008) ne contient pas de rapport structure–activité (RSA) plus spécifique qui soit approprié pour le PADMEC (p. ex. le groupe des phénols dans le modèle ECOSAR [2008]). Les valeurs estimées de la toxicité sont fondées sur le fait que la toxicité du PADMEC est supérieure à celle d’un narcotique de référence dont la valeur du Koeest semblable. Les résultats du modèle CPOP (2008), tant pour les valeurs de toxicité aiguë des cladocères que pour celles des poissons, indiquent que la toxicité du PADMEC est inférieure à 7 000 mg/L. Cette valeur modélisée de toxicité indique que le PADMEC présente probablement une faible toxicité aiguë pour les organismes aquatiques (CL50 et CE50aiguës > 10 mg/L), ce qui correspond aux données empiriques du tableau 6.
Prudente, la concentration estimée sans effet (CESE) pour les organismes aquatiques a été calculée d’après la valeur empirique de toxicité aquatique la plus faible, à savoir la CMEO de 96 h pour le poisson zèbre (Brachydanio rerio) de 18 mg/L, selon les effets sublétaux (comportement natatoire) (tableau 6). Cette valeur a été retenue comme étant la valeur de toxicité critique, puis divisée par un facteur d’évaluation de 100, pour tenir compte de la variabilité de sensibilité interspécifique et intraspécifique, pour estimer une concentration sans effet à long terme à partir d’une étude à court terme ainsi que pour tenir compte des incertitudes et des limites de l’ensemble des données de toxicité afin de lui attribuer une valeur de CESE de 0,18 mg/L. Étant donné l’estimation de persistance élevée du PADMEC dans l’environnement (voir la section Persistance et bioaccumulation), on peut s’attendre à ce qu’elle entraîne une exposition chronique.
B – Autres milieux
On n’a trouvé aucune étude concernant les effets de cette substance sur l’environnement dans d’autres milieux que l’eau.
Évaluation de l’exposition de l’environnement
Aucune donnée sur les concentrations de PADMEC dans l’eau au Canada n’a été retracée; on a donc évalué les concentrations dans l’environnement à partir de renseignements disponibles, y compris les estimations relatives aux quantités de cette substance, aux taux de rejets et à la taille des cours d’eau récepteurs.
A – Rejets industriels
On estime qu’il y aura exposition en milieu aquatique au PADMEC advenant l’acheminement de rejets industriels de cette substance vers une station d’épuration des eaux usées et que cette station évacue son effluent dans un plan d’eau récepteur. La concentration de cette substance dans les eaux réceptrices près de l’émissaire d’évacuation de la station d’épuration des eaux usées sert de concentration environnementale estimée (CEE) dans l’évaluation du risque que présente cette substance en milieu aquatique. Elle peut être calculée à l’aide de l’équation suivante :
Ceau–ind = [1000 × Q × L × (1 - R)] / [N × F × D]
où
Ceau–ind : concentration en milieu aquatique résultant des rejets industriels, mg/L
Q : quantité de substance totale utilisée chaque année sur un site industriel, kg/an
L : pertes dans les eaux usées, fraction
R : taux d’élimination de la station d’épuration des eaux usées, fraction
N : nombre de jours de rejets annuels, en jour/an
F : débit de l’effluent de la station d’épuration des eaux usées, m3/jour
D : facteur de dilution dans l’eau réceptrice, sans dimension
Un scénario de rejets industriels très prudent a servi au calcul de la concentration de cette substance en milieu aquatique. Ce scénario est hypothétique et il est prudent (c.àd. qu’il protège l’environnement), car il suppose que les 100 000 kg de PADMEC, qui correspondent à la limite supérieure de l’intervalle de 1 000 à 100 000 kg de substance utilisée qui a été déclarée par l’industrie canadienne en 2005 (Environnement Canada, 2007a) (voir la section Sources), l’ont été par une seule installation industrielle sur un petit site hypothétique et que les pertes dans une usine de traitement des eaux usées (UTEE) de la région atteignent 0,65 % de la quantité totale à la suite de manipulations de matières brutes et d’opérations de formulation. Un site aussi petit est estimé présenter un débit d’effluent d’UTEE correspondant au 10e centile (3 456 m3/jour) des taux de rejets des UTEE observés partout au Canada. Ce scénario présume également que les rejets se produisent 250 jours par an, donnée générale pour les petites et moyennes installations, et que le facteur de dilution des eaux réceptrices présente une valeur minimale de 1 (aucune dilution). La quantité d’utilisation industrielle de 100 000 kg est très prudente, si l’on considère qu’aucune quantité de PADMEC n’a été déclarée comme commercialisée au Canada en 2006 (Environnement Canada, 2009).
Selon ce scénario, le taux d’élimination du PADMEC à la STE est de 50 %, ce qui est considéré comme une estimation prudente, car les phosphonates sont très fortement adsorbés sur la plupart des surfaces minérales en raison d’interactions ioniques (Nowack, 2003). L’élimination des phosphonates durant le traitement des eaux usées est très importante, même lorsque les concentrations de phosphonates sont élevées (Nowack, 2003). Cependant, les études citées dans Nowack (2003) ne portent pas spécifiquement sur le PADMEC.
Selon les hypothèses susmentionnées, ce scénario très prudent mène à une concentration de PADMEC en milieu aquatique de 0,38 mg/L.
B – Rejets liés aux produits de consommation
On n’a réalisé aucun scénario de rejet basé sur les utilisations des produits manufacturés contenant du PADMEC, car ces rejets devraient être largement dispersés et ne seraient donc pas attribuables à des sources ponctuelles concentrées produites par des activités industrielles. Le PADMEC sert d’antioxydant et de stabilisant thermique dans divers produits, y compris dans les applications entrant en contact avec des produits alimentaires (voir la section Utilisations). Les rejets de PADMEC dans l’environnement (eaux usées) seraient d’environ 25 % de la quantité totale de rejets dans les eaux usées à la suite d’une utilisation commerciale et par les consommateurs, et ces rejets se disperseraient sur de grandes étendues, comme il est indiqué à la section Rejets dans l’environnement.
Caractérisation des risques pour l’environnement
La démarche suivie dans cette évaluation écologique préalable consistait à examiner les renseignements pertinents et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprennent les résultats d’un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité, les sources et le devenir de la substance dans l’environnement.
On estime que le PADMEC est persistant dans l’eau et le sol, qu’il a un faible potentiel de bioaccumulation en raison de la faible valeur du log D de sa forme ionisée, qui prédomine dans l’eau à des valeurs de pH ambiantes. Une fois dans l’environnement, il se trouve principalement dans l’eau et dans les sédiments. D’après les données limitées de toxicité, il a aussi été montré que cette substance présentait un faible potentiel de toxicité pour les organismes aquatiques.
Une analyse du quotient de risque, intégrant des estimations prudentes de l’exposition aux renseignements liés à la substance, a été réalisée pour le milieu aquatique afin de déterminer si la substance pouvait avoir des effets nocifs sur l’environnement au Canada. Le très prudent scénario d’exposition général décrit précédemment a donné une concentration environnementale estimée (CEE) de 0,38 mg/L pour les écosystèmes aquatiques. Une concentration estimée sans effet (CESE) de 0,18 mg/L pour les organismes aquatiques a été calculée d’après la valeur empirique de toxicité du poisson zèbre, après y avoir appliqué un facteur d’évaluation (voir la section Évaluation des effets sur l’environnement). Le quotient de risque qui en résulte (CEE/CESE) est de 2,1. Compte tenu des hypothèses très prudentes utilisées dans le scénario d’exposition, la comparaison des valeurs de la CEE et de la CESE indique un faible risque d’effets nocifs résultant d’un rejet industriel de PADMEC dans l’eau pour les organismes aquatiques.
Incertitudes dans l’évaluation des risques pour l’environnement
Il existe des incertitudes dans cette évaluation des risques en raison du manque de données sur les propriétés physiques et chimiques spécifiques au PADMEC, y compris la constante de dissociation acide, la constante de la loi de Henry et le coefficient de partage solides-eau, ainsi que de la faible qualité de certaines des données empiriques disponibles. Les données modélisées ont servi à combler les lacunes critiques quant aux données relatives aux propriétés physiques et chimiques, à la biodégradation, à la bioaccumulation et à l’exposition. La structure du PADMEC n’est pas bien représentée dans beaucoup de modèles R(Q)SA et de bioaccumulation, et elle est également ionisée, ce qui accroît l’incertitude liée aux résultats modélisés. La modélisation de la bioaccumulation est une modélisation prudente, car elle ne tient pas compte du métabolisme, qui pourrait réduire le potentiel de bioaccumulation de la substance. Les résultats des essais de bioaccumulation empirique correspondent aussi à ce à quoi l’on s’attend pour le PADMEC, compte tenu des propriétés physicochimiques et de la structure de la substance.
Il existe également des incertitudes liées au manque de données sur les concentrations de PADMEC dans l’environnement canadien. Cependant, l’actuelle insuffisance de fabrication et d’importation au Canada laisse supposer de faibles rejets dans l’environnement canadien. Certaines incertitudes sont aussi associées à la fraction des substances rejetées durant leur utilisation. Ces incertitudes ont été prises en charge lors de la formulation des hypothèses prudentes quant à l’estimation des rejets.
Les concentrations expérimentales, associées à la toxicité pour les organismes aquatiques, peuvent constituer une source additionnelle d’incertitude dans ces études, car ces concentrations n’étaient que nominales et non mesurées en solution. En outre, la plupart de ces études ont indiqué que la substance d’essai était peu soluble, en dépit de la grande solubilité mesurée et modélisée. Malgré ce fait, les données empiriques dont on dispose indiquent que le PADMEC n’est pas très dangereux pour les organismes aquatiques. Les résultats modélisés de sa toxicité ont aussi indiqué un faible risque pour les organismes aquatiques. Or, la structure du PADMEC n’est pas bien représentée dans les ensembles de calibrage des modèles. Par conséquent, l’incertitude concernant les résultats de sa toxicité s’accentue.
Étant donné que cette substance est utilisée dans d’autres pays, comme les ÉtatsUnis dans les applications de contact alimentaire indirect (USFDAa, 2010; voir la section Utilisations), il est possible qu’elle entre sur le marché canadien comme constituant d’articles manufacturés ou de produits de consommation. Les renseignements actuellement disponibles ne sont pas suffisants pour calculer une estimation quantitative permettant de déterminer l’importance de cette source. Cependant, on prévoit que les volumes de rejets de PADMEC dans les divers milieux naturels ne différeraient pas énormément des quantités estimées ici (voir la section Rejets dans l’environnement).
Évaluation de l’exposition
Aucune donnée sur les concentrations de PADMEC dans les milieux naturels canadiens n’a été retracée. Les concentrations de PADMEC dans les milieux naturels n’ont pas été calculées, mais on estime qu’elles sont faibles, car l’utilisation globale déclarée de cette substance au Canada était sous le seuil de 100 kg par an en 2006 (Environnement Canada, 2009), et la probabilité des rejets dans l’environnement est minime. Ainsi, on estime que la probabilité d’exposition de l’ensemble de la population canadienne à cette substance est faible.
De faibles quantités de PADMEC peuvent se trouver dans les emballages alimentaires à titre d’antioxydant dans les plastiques. Aucune quantité n’a été relevée dans les données empiriques de surveillance du PADMEC dans les emballages alimentaires et les aliments et les boissons. On estime que l’exposition au PADMEC provenant d’emballages alimentaires serait faible en raison de sa faible utilisation en général.
Aucune donnée empirique sur les concentrations de PADMEC dans les produits de consommation n’a été retracée.
Évaluation des effets sur la santé
Un sommaire des renseignements disponibles relatifs aux effets du PADMEC sur la santé se trouve à l’annexe III.
Aucun classement attribué par d’autres organismes nationaux ou internationaux quant à sa cancérogénicité, à sa génotoxicité ou à sa toxicité sur le plan du développement ou de la reproduction n’a été retracé. Cependant, Santé Canada a émis plusieurs attestations de nonobjection pour des utilisations spécifiques du PADMEC comme composé de divers matériaux d’emballage alimentaires (communication personnelle de la Direction des aliments de Santé Canada adressée en 2010 au Bureau de l’évaluation des risques des substances existantes de Santé Canada; source non citée), semblables aux limites établies par la Food and Drug Administration des États-Unis (USFDA, 2010a) et la Commission européenne (EUROPA, 2008).
Aucun pouvoir mutagène n'a été observé pendant les tests d'Ames effectués sur le PADMEC avec ou sans activation métabolique (S9)[3]. Aucune activité n'a été observée pendant le test d'anomalie du noyau in vivomené chez les hamsters chinois auxquels le PADMEC a été administré par voie orale pendant deux jours consécutifs. Dans la seule étude de toxicité à doses répétées recensée, une dose orale minimale avec effet observé (DMEO) de 6 000 ppm (soit 300 mg kg p.c. par jour, d'après Santé Canada, 1994) a été déterminée à partir d'une légère baisse du gain de poids corporel et d'une activité de toilettage réduite chez les rats des deux sexes, et ce, à des concentrations élevées de phosphatase alcaline sérique chez les rats mâles auxquels on a administré le PADMEC dans la diète à 0, 700, 2 000 ou 6 000 ppm (soit 0, 35, 100 et 300 mg kg p.c. par jour respectivement; source : Santé Canada, 1994) pendant 13 semaines. Le PADMEC n'a pas causé d'irritation oculaire. Seule une légère irritation cutanée a été observée sur la peau scarifiée, qui peut avoir été causée par l'exulcération. Aucune étude empirique de toxicité pour la reproduction et la formation n'a été recensée. Le PADMEC n'a pas présenté de potentiel œstrogénique d'après un essai in vitrodoublehybride de levure (Ogawa et al., 2006). Les modèles de prévision R(Q)SA (TOPKAT, 2004; CASETOX, 2008; DEREK, 2008; Model Applier, 2008; Toxtree, 2009) appliqués au PADMEC ont produit des résultats négatifs quant à la cancérogénicité et la génotoxicité, et des résultats majoritairement négatifs quant à la toxicité pour la reproduction et la formation (annexe IV).
Des substances de structure semblable ont été examinées pour compléter l’évaluation des effets possibles sur la santé liés à l'exposition au PADMEC (annexe V).
Le [[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate de diéthyle (n° CAS 976-56-7) a été considéré comme étant une substance de structure analogue appropriée en raison de sa similarité structurelle avec le PADMEC, tel qu’il a été démontré par un coefficient d’association de Tanimoto de 72 % entre le PADMEC et cette substance (SciFinder; CAS, 2010). Le PADMEC est réglementé et approuvé par la FDA des ÉtatsUnis pour être utilisé comme substance de contact alimentaire (USFDA, 2010b; 2010c). Toutefois, aucune donnée empirique n'a été relevée.
Une autre substance analogue au PADMEC, le 3,3',3'',5,5',5''-hexa-tert-butyl-α,α',α''-(mésitylène-2,4,6-triyl)tri-p-crésol (n° CAS 1709702), a été recensée, vendue sous les noms Irganox 1330, Ethanox 330 ou Ionox 330. Cette substance de structure analogue a un profil d'utilisation semblable au PADMEC, présente une similarité structurelle de 61 % dans SciFinder lorsqu’on la compare au PADMEC (CAS, 2010) et est associée aux données empiriques disponibles. De plus, il a été déterminé que ses propriétés physicochimiques (masse moléculaire, état physique, pression de vapeur) avaient des valeurs du même ordre que celles qui sont associées au PADMEC.
Les études de toxicité recensées pour l’Irganox 1330 sont résumées à l'annexe VI. Les résultats négatifs ont été observés dans les études de génotoxicité in vitromenées au moyen de tests d'Ames (CibaGeigy, 1992b; Akita University, 1984). Aucune tumeur issue du traitement n'a été observée dans plusieurs des études de toxicité chronique sur deux ans menées chez les rats, les souris et les chiens (Shell Research, 1968a; 1968b; 1969). Aucune toxicité pour le développement ou la reproduction n'a été observée dans une étude sur trois générations menée chez les rats (Shell Research, 1970). En ce qui a trait à l'étude de toxicité à doses répétées, la DMEO subchronique la plus faible a été déterminée comme étant 31 600 ppm (soit 1 600 mg/kg p.c. par jour; d'après Santé Canada, 1994) en raison d'une diminution du poids corporel chez les rats femelles après administration par voie orale dans la diète des rats mâles et femelles de l'Irganox 1330 à raison de 0 à 31 600 ppm pendant 90 jours (Stevenson et al., 1965). La DMEO la plus faible à long terme a été de 10 000 ppm (soit 500 mg/kg p.c. par jour; d'après Santé Canada, 1994) en raison d'une diminution du poids corporel et des organes chez les rats femelles après administration par voie orale dans la diète des rats mâles et femelles de l'Irganox 1330 à raison de 0 à 10 000 ppm pendant 2 ans (Shell Research, 1968a). Aucune toxicité pour la reproduction ou pour le développement n’a été observée dans une étude portant sur trois générations de rats (Shell Research, 1970).
Le niveau de confiance à l'égard de la base de données toxicologiques du PADMEC est jugé faible, car les données empiriques retracées sont très limitées. Cependant, le recours à la modélisation et aux données de la substance analogue a permis d'accroître le niveau de confiance accordé à l'évaluation des dangers du PADMEC.
Caractérisation des risques pour la santé humaine
Les données empiriques limitées recensées sur le PADMEC, la modélisation R(Q)SA et les données empiriques d'une substance analogue n'ont pas indiqué de potentiel de danger élevé. On ne relève aucune preuve de mutagénicité, de cancérogénicité, ou de toxicité pour le développement ou la reproduction du PADMEC ou de sa substance analogue. En ce qui a trait à la toxicité à doses répétées, l'effet majeur du PADMEC et de l'Irganox 1330, substance analogue, était la diminution du poids corporel chez les rats. La dose minimale critique avec effet observé (DMEO) était de 300 mg kg p.c. par jour en raison d'une légère diminution du gain de poids corporel et d'une activité de toilettage réduite chez les rats des deux sexes, et ce, à des concentrations élevées de phosphatase alcaline sérique chez les rats mâles dans le cadre d'une étude de 13 semaines du PADMEC administré par voie orale.
Aucun rapport d'activité industrielle touchant le PADMEC en 2006 n'a indiqué de dépassement du seuil des 100 kg par an (Environnement Canada, 2009) et on estime que la probabilité d'exposition de l'ensemble de la population au PADMEC dans les milieux naturels, les aliments et les produits de consommation est faible. Par conséquent, on estime que le risque pour l'ensemble de la population est faible.
Incertitudes de l’évaluation des risques pour la santé humaine
Seules des études de toxicité par voie orale ont été recensées pour le PADMEC. Aucune étude de toxicité du PADMEC par inhalation et par voie cutanée ni aucune donnée sur la toxicité à long terme par voie orale n'ont été recensées. Une substance de structure analogue a été utilisée pour déterminer la cohérence des effets reliés au traitement avec le PADMEC et pour extrapoler la toxicité orale à long terme pour le PADMEC. Cependant, les données de toxicité par voie d’inhalation ou par voie cutanée étaient également manquantes pour la substance de structure analogue. L'extrapolation d’une substance de structure analogue au PADMEC quant à son potentiel de danger laisse une incertitude.
Le manque de données canadiennes sur le PADMEC dans les milieux naturels, les aliments et les produits de consommation constitue une source d'incertitude quant au degré d'exposition de l'ensemble de la population du Canada. Or, la préoccupation liée à cette incertitude est faible compte tenu de la faible activité industrielle déclarée et la présence minimale estimée du PADMEC dans l'environnement.
D’après les renseignements disponibles, le PADMEC ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique, ou à mettre en danger l’environnement essentiel pour la vie. En outre, le PADMEC répond aux critères de persistance, mais ne répond pas aux critères du potentiel de bioaccumulation énoncés dans leRèglement sur la persistance et la bioaccumulation(Canada, 2000).
D’après les renseignements disponibles, le PADMEC ne pénètre pas dans l’environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nocif immédiat ou à long terme sur la vie ou la santé humaines.
Par conséquent, il est conclu que le PADMEC ne satisfait à aucun des critères énoncés dans l’article 64 de la LCPE (1999).
On envisagera d’inclure cette substance dans la mise à jour de l'inventaire de la Liste intérieure des substances. De plus, des activités de recherche et de surveillance viendront, s'il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable.
ACD/PhysChem Suite. 2009. Version 12.01. Toronto (Ontario) : Advanced Chemistry Development, Inc. (ACD/Labs). [en anglais seulement; réserve de consultation].
[AIEPS] Artificial Intelligence Expert Predictive System. 2003–2007. Version 2.05. Ottawa (Ont.) : Environnement Canada. Modèle développé par Stephen Niculescu. Disponible à Environnement Canada, Division de l’évaluation écologique, Section de l'évaluation des substances chimiques nouvelles.
Akita University. 1984. Test for mutagenic properties in bacteria with plastic additive Irganox 1330. Japon : Akita University, Department of Medicine [cité dans USEPA, 2006b].
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Note réglementaire REG2007-04, Liste des produits de formulation de l'ARLA, Annexe I, Tableau 2 [en ligne], Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consulté le 15 juillet 2010].
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2010. Registre public de l’Agence de réglementation de la lutte antiparasitaire, Information sur les produits – Recherche d’étiquette [en ligne], Ottawa (Ont.), Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consulté le 15 juillet 2010].
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. 22(3):337345.
Arnot, J.A., Mackay, D., Bonnell, M. 2008. Estimating metabolic biotransformation rates in fish from laboratory data. Environ Toxicol Chem 27(2):341–351.
Ash, M., Ash, I. 2004. Handbook of Preservatives. États-Unis : Synapse Information Resources Inc. P. 119120.
[BCFBAF] Bioaccumulation Program for Windows [modèle d’estimation]. 2008. Version 3.00, Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
[BIOWIN] Biodegradation Probability Program for Windows [modèle d’estimation]. 2008. Version 4.10, Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, ch. 33, Gazette du Canada. Partie III, vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada. Partie II, vol. 134, n° 7
Canada. Ministère de l'Environnement, ministère de la Santé. 2006a. Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Gazette du Canada, Partie I, vol. 140, n° 49
Canada. Ministère de l'Environnement. 2006b. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances considérées comme priorité pour suivi.Gazette du Canada, Partie I, vol. 140, n° 9.
Canada. Ministère de l'Environnement, ministère de la Santé. 2009a. Loi canadienne sur la protection de l’environnement (1999) : Avis de huitième divulgation d'information technique concernant les substances identifiées dans le Défi. Gazette du Canada, Partie I, vol. 143, n° 5.
Canada. Ministère de l'Environnement. 2009b. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le huitième lot du Défi. Gazette du Canada, Partie I, vol. 143, n° 5.
[CAS] CAS : Une division de l’American Chemical Society. 2010. Programme SciFinder. [mis à jour en août 2010; consulté le 31 août 2010].
CASETOX [module de prévision]. 2008. Version 2.0. Beachwood (OH) : MultiCASE. [consulté le 19 juillet 2009; réserve de consultation].
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. c2004-2008, Version 5.10.2, Bourgas (Bulgarie): Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. CATALOGIC.
Ciba-Geigy Ltd. 1992a. Acute dermal toxicity study in rat. Bâle (Suisse) : CibaGeigy Ltd. Essai n° 924061 [cité dans USEPA, 2006].
Ciba-Geigy Ltd. 1992b. Bacterial mutagenicity screening test. Bâle (Suisse): CibaGeigy Ltd, Genetic Toxicology [cité dans USEPA, 2006].
[CPOP] Canadian POPs Model. 2008. Gatineau (Québec) : Environnement Canada, Division de l’évaluation écologique; Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry [modèle basé sur celui de Mekenyanet al. (2005)]. Disponible auprès de la Division de l’évaluation écologique d'Environnement Canada.
Cradlechem (Jiangsu) Technology. 2003. Antioxidant-1425. [en anglais seulement; consulté le 12 juillet 2010].
[DEREK] Deductive Estimation of Risk from Existing Knowledge [module de prévision sur CD-ROM]. 2008. Version 10.0.2, Cambridge (MA) : Harvard University, LHASA Group. Prédiction de toxicologie [consulté le 20 juillet 2010; réserve de consultation].
Dimitrov, S., Dimitrova, N., Parkerton, T., Comber, M., Bonnell, M., Mekenyan, O. 2005. Base-line model for identifying the bioaccumulation potential of chemicals. SAR QSAR Environ. Res. 16(6):531554.
Di Toro, D.M., Zarba, C.S., Hansen, D.J., Berry, W.J., Swartz, R.C., Cowan, C.E., Pavlou, S.P., Allen, H.E., Thomas, N.A., Paquin, P.R. 1991. Technical basis for establishing sediment quality criteria for nonionic organic chemicals using equilibrium partitioning. Environ Toxicol Chem 10: 15411583.
[ECHA] Agence européenne des produits chimiques. 2010. Liste des substances candidates extrêmement préoccupantes pour l'autorisation, Agence européenne des produits chimiques. [consulté le 21 juillet 2010].
[ECOSAR] Ecological Structural Activity Relationships [en ligne]. 2008. Version 1.00. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
Environnement Canada. 2007a. Données pour certaines substances recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances considérées comme priorités pour suivi. Données compilées par Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Environnement Canada. 2007b. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module, QSARs.Document de travail préliminaire révisé. Gatineau (Québec) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2008. Guidance for Conducting Ecological Assessments under CEPA, 1999, Science Resource Technical Series, Technical Guidance Module, Mass Flow Tool. Document de travail. Gatineau (Québec) : Environnement Canada, Division de l’évaluation écologique. Disponible sur demande.
Environnement Canada. 2009. Données sur les substances du lot 8 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le huitième lot du Défi. Gazette du Canada, Partie I, vol. 143, n° 5, p. 196213. Données compilées par Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada. 2010. Assumptions, limitations and uncertainties of the Mass Flow Tool for PADMEC, CAS No. 65140-91-2. Document provisoire interne. Gatineau (Qc) : Environnement Canada, Division de l’évaluation écologique, disponible sur demande.
[EPIsuite] Estimation Programs Interface Suite for Microsoft Windows [modèle d’estimation]. 2008. Version 4.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
[ESIS] European Chemical Substances Information System [base de données en ligne]. 2010. Bureau Européen des Substances Chimiques (BESC). [en anglais seulement; consulté le 15 juillet 2010].
EUROPA. 2008. Food Contact Materials Database. Commission européenne. Food [en anglais seulement].
[HENRY] Henry's Law Constant Program for Microsoft Windows [modèle d’estimation]. 2008. Version 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
[KOCWIN] The Soil Adsorption Coefficient Program [modèle d’estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
Lifestream laboratories. 1966a. Fifteen week subacute oral toxicity study in rats, final report. Illinois : Lifestream laboratories. Project No. 15 [cité dans USEPA, 2006].
Lifestream laboratories. 1966b. Fifteen-week sub-acute oral toxicity study of Ionox 330 in beagle dogs, final report. Illinois : Lifestream laboratories, Project No. 14 [cité dans USEPA, 2006].
[Model Applier] Leadscope FDA Model Applier [module de prévision sur CD-ROM]. 2008, Version 1.2.03. Columbus (OH) : Leadscope, Inc. Accès : Modèle QSAR de Leadscope [en anglais seulement; réserve de consultation].
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.43, Washington (DC), US Environmental Protection Agency, Office of Pollution Prevention and Toxics, Syracuse (NY), Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
Nowack, B. 2003. Environmental chemistry of phosphonates.Water Research 37: 2533-2546.
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005, Version 1.20. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry.Logiciels OASIS [en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques, Direction de l’environnement. 2008. Boite à outil d'application QSAR, Version 1.1.0.2. Développée par : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry, Bourgas (Bulgarie). [en anglais seulement].
[OCDE] Organisation de coopération et de développement économiques. 2009. Emission scenario document on plastics additives [en ligne]. Paris (France), OCDE, Direction de l’environnement. (Series on Emission Scenario Documents No. 3). N° du rapport : ENV/JM/MONO(2004)8, JT0367870. [en anglais seulement; consulté le 29 septembre 2010].
Ogawa, Y., Kawamura, Y., Wakui, C., Mutsuga, M., Nishimura, T., Tanamoto, K. 2006. Estrogenic activities of chemicals related to food contact plastics and rubbers tested by the yeast two-hybrid assay. Food Addit Contam. 23(4):42230.
Présentation de projet. 2010a. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Présentation de projet. 2010b. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912002. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010c. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912001. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010d. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912003. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010e. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912000. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010f. Projet non publié et confidentiel présenté à Environnement Canada, selon le Plan de gestion des produits chimiques. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010g. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010h. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Présentation de projet. 2010i. Projet non publié et confidentiel présenté à Environnement Canada dans le cadre du Plan de gestion des produits chimiques, disponible en tant que Sommaire de rigueur d'étude, n° 1116565140912005. Gatineau (Québec) : Environnement Canada, Division de la mobilisation et de l'élaboration de programmes.
Santé Canada. 2007. Note réglementaire REG 2007-04, Liste des produits de formulation de l'ARLA, annexe I, tableau 2 [en ligne]. Ottawa (Ont.) : Santé Canada, ARLA.[consulté le 15 juillet 2010].
Santé Canada. 2009. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques – septembre 2009 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation. [consulté le 14 mai 2010].
Santé Canada. 2010. Registre public de l'ARLA, recherche d'étiquette d'information sur le produit [en ligne]. Ottawa (Ont.) : Santé Canada, ARLA. [consulté le 15 juillet 2010].
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2010. Disponible sur demande auprès de Santé Canada, Division des cosmétiques.
Shell Research Ltd. 1968a. Studies on the oral toxicity of Ionox 330: two year experiment with rats, Londres (Royaume-Uni) : Shell Research Ltd; Sittingbourne (Royaume-Uni) : Tunstall Laboratories, Project No. T507190/1 [cité dans USEPA, 2006b].
Shell Research Ltd. 1968b. Studies on the oral toxicity of Ionox 330: two year experiment with dogs, Londres (Royaume-Uni) : Shell Research Ltd; Sittingbourne (Royaume-Uni) : Tunstall Laboratories, Project No. T507190/1 [cité dans USEPA, 2006b].
Shell Research Ltd. 1969. Studies on the oral toxicity of Ionox 330, carcinogenesis study with rats and mice, Londres (Royaume-Uni) : Shell Research Ltd; Sittingbourne (Royaume-Uni) : Tunstall Laboratories, Project No. T507190/1 [cité dans USEPA, 2006b].
Shell Research Ltd. 1970. Studies on the oral toxicity of Ionox 330: three-generation reproduction study in rats, Londres (Royaume-Uni) : Shell Research Ltd; Sittingbourne (Royaume-Uni) : Tunstall Laboratories, Project No. T507190/1 [cité dans USEPA, 2006b].
[SPIN] Substances in Preparations in Nordic Countries [base de données sur en ligne]. 2010. Copenhague (Danemark), Conseil des ministres des pays nordiques, recherche par n° CAS. [en anglais seulement; consulté le 26 juillet 2010].
Stevenson, D.E., Chambers, P.L., Hunter, C.G. 1965. Toxicological studies with 2, 4, 6-tri (3', 5'-di-tert-butyl-4'-hydroxybenzyl) mesitylene in the rat. Food and Cosmetics Toxicology 3:281288.
[TOPKAT] Toxicity Prediction by Komputer Assisted Technology [en ligne]. 2004. Version 6.2, San Diego (CA), Accelrys Software Inc. [en anglais seulement; consulté le 20 juillet 2010].
[Toxtree] Toxic hazard estimation by decision tree approach. 2009. Version 1.60. Sofia (Bulgarie) : Ideaconsult Ltd. Accès :Toxtree - Estimation des risques toxiques par arbre de décision [en anglais seulement; consulté le 20 juillet 2010].
[USEPA] US Environmental Protection Agency. 2006a. Mise à jour de l'inventaire non-confidentielle classé par produits chimique, Search results for CAS RN 65140-91-2. Washington (DC) : USEPA, Office of Pollution Prevention and Toxics. [en anglais seulement; consulté le 15 juillet 2010].
[USEPA] US Environmental Protection Agency. 2006b. Robust Summaries and Test Plans: Irganox 1330/ Ethanox 330, Washington (DC) : US Environmental Protection Agency, High Production Volume Information System (HPVIS). [en anglais seulement; consulté le 15 juillet 2010].
[USEPA] US Environmental Protection Agency. 2010a. Toxics Release Inventory (TRI) Chemical Lists for 2009, 2008. Liste des produits chimique du TRI [en anglais seulement; consulté le 15 juillet 2010].
[USEPA] US Environmental Protection Agency. 2010b. Inventory Update Reporting for years 1986-2002, records by chemical. Résultats de recherché pour le n° CAS 65140-91-2. Washington (DC) : USEPA, Office of Pollution Prevention and Toxics. [en anglais seulement; consulté le 15 juillet 2010].
USFDA [US Food and Drug Administration] 2010a. Code de régulations fédéral 21CFR178.2010, Part 178 – Indirect Food Additives: Adjuvants, Production Aids and Sanitizers, Subpart C – Antioxidants and Stabilizers, Revised April 1, 2010. [en anglais seulement].
[USFDA] US Food and Drug Administration. 2010b. Inventaire des notifications des substances alimentaires à contact efficace, FCN No. 393, US Food and Drug Administration. [en anglais seulement; consulté le 21 juillet 2010].
USFDA [US Food and Drug Administration]. 2010c.Inventaire des notifications des substances alimentaires à contact efficace, FCN No. 556. US Food and Drug Administration. [en anglais seulement; consulté le 21 juillet 2010].
Veith, G.D., Defoe, D.L., Bergstedt, B.V. 1979. Measuring and estimating the bioconcentration factor of chemicals in fish. J Fish Res Board Can 36:1040-1048 [cité dans Fuet al., 2009].
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [modèle d’estimation]. 2008. Version 1.41. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Outils d'évaluation de l'exposition et des modèles [en anglais seulement].
1. Solubilité dans l'eau
Référence (numéro de l'étude) :
- 11165-65140912-001 (le numéro de référence de l'étude est confidentiel)
Substance d'essai :
- Identité : la substance n’est connue que sous son nom commercial.
- Remarques : Aucun détail sur la pureté de la substance d'essai n'a été fourni.
Méthode :
- Méthode : adaptée d'après la Directive 84/449/CEE, A.6 (agitation en flacon)
- Bonnes pratiques de laboratoire (BPL) : Oui [ ] Non [x] non mentionné
- Année : (réalisation de l'étude) 1992
Conditions d'essai (Expliquer en détail et analyser tout écart important par rapport au protocole) :
- Solution d'essai : 5,0378 g de substance d'essai dans 500 mL d'eau filtrée sur Millipore de qualité HPLC (chromatographie en phase liquide à haute résolution) par SQS
- Température de saturation : 30 °C
- Durée de saturation : 24 h
- Température d'équilibration : 20 °C
- Durée d'équilibration : 24 h
- Méthode analytique : détermination photométrique à 276 nm
- Seul le sommaire d'étude ayant été fourni, plusieurs des éléments du rapport du test obligatoire (comme il est mentionné dans la ligne directrice 105 de l'OCDE) n'ont pas été traités dans ce rapport, dont les suivants : les données des essais préliminaires, toutes les déterminations analytiques et la moyenne des différents flacons compris dans l'entente, le pH de chaque échantillon, la preuve de toute instabilité chimique de la substance.
Résultats et conclusions :
- Valeur (mg/L) à la température donnée (°C) : 2,4 g/L valeur du pH et concentration à la température donnée (°C) : non précisée
Fiabilité :
- Peu fiable
- Remarques : Documentation insuffisante pour l'évaluation
2. Coefficient de partage (log D)
Référence :
- 11165-65140912-002 (l'étude est confidentielle)
Substance d'essai :
- Identité : la substance n’est connue que sous son nom commercial.
- Remarques : Pureté de la substance d'essai : non analysée
Méthode :
- Agitation en flacon; méthode non standard
- Bonnes pratiques de laboratoire (BPL) : Oui [ ] Non [ X]
- Année : 1989
Conditions d'essai (Expliquer en détail et analyser tout écart important par rapport au protocole) :
- Les flacons d'essai étaient agités seulement pendant une (1) heure avant d'être centrifugés à 2 700 g pour distinguer les phases. (D'après la ligne directrice 107 de l'OCDE, les flacons d'essai devraient être agités pendant 24 heures.)
- Les méthodes d'essai ne sont pas expliquées en totalité (les concentrations de la substance d'essai testées, le nombre de concentrations testées, l'utilisation ou non de doubles, etc.)
Résultats :
- Log D : -0,08 à un pH de 5,5
- Température (°C) : 25 °C
- Remarques : Cette substance d'essai sera ionisée au pH de l'étude, car l'estimation de son pKa est de 2,4 (ACD/ PhysChem Suite, 2009). Cela vient s'ajouter à l'incertitude du coefficient de partage obtenu, d'après la ligne directrice 107 de l'OCDE mentionnant que « les substances ionisables ne doivent être mesurées que sous leur forme non ionique (acide libre ou base libre), obtenue grâce à un tampon approprié dont le pH a été ajusté à au moins une unité en dessous (acide libre) ou audessus (base libre) du pK. » et que « la dissociation ou l'association des molécules dissoutes entraîne des écarts par rapport à la loi de partage. »
- Le modèle ACD/ PhysChem Suite (2009) a estimé le coefficient de partage, log D, à 3,44 (forme neutre). Ce modèle prévoit un log D de 0,41 à un pH de 5,5.
Conclusions :
- Remarques : voir ci-dessus
Fiabilité :
- Inacceptable.
- Cette donnée est fondée principalement sur l'essai mené sur les espèces ionisées de la substance. Cependant, les critères importants de la méthode standard de l'OCDE n'ont en outre pas été respectés, comme la durée de l'agitation et les réplicats et les doubles.
3. Biodégradation aérobie
Référence :
- 11165-65140912-003
Substance d'essai :
- Identité : la substance n’est connue que sous son nom commercial.
- Remarques : Pureté de la substance d'essai non analysée.
Méthode :
- Méthode ou ligne directrice suivie : 301B de l'OCDE (1981), essai de Sturm modifié
- Type (type d'essai) : Aérobie [ X] Anaérobie [ ]
- Année : (réalisation de l'étude) : 1989
- Durée du contact (unités) : 28 jours
- Inoculum : Les bactéries recueillies des boues activées de l'usine de traitement des eaux usées en Suisse et préparées « (…) d'après la méthode décrite dans la ligne directrice. »
Conditions d'essai (Expliquer en détail et analyser toute dérogation importante par rapport au protocole, en indiquant toute inhibition bactérienne et expliquer en détail les écarts par rapport à la ligne directrice suivie, y compris ce qui suit, le cas échéant) :
- Inoculum (concentration et source) :
- Concentration de la substance d'essai, véhicule utilisé, conditions pré-accoutumance :
- Température de l'incubation (ºC) :22 ± 2 °C
- Procédure de dosage :
- Fréquence de l’échantillonnage :
- Témoins appropriés et essais à blanc utilisés :Substance de référence : Aniline (20 mg/L) contenant une solution 10EO5PO de 0,5 mL de nonylphénol.
- Méthode analytique utilisée pour mesurer la biodégradation : Le CO2 formé a été adsorbé avec de l'hydroxyde de sodium (NaOH) et a été identifié par un analyseur de carbone.
- Méthode utilisée pour calculer les concentrations mesurées (c.àd. moyenne arithmétique, moyenne géométrique, etc.) : Aucune concentration de la substance d'essai n'a été mesurée (concentrations nominales uniquement).
- Autre :
- L'émulsifiant au nonylphénol 10EO5PO a été ajouté à la solution d'essai « (...) en raison de la faible solubilité de la substance d'essai (...) ». Ainsi, 0,5 mL de 10EO5PO a été ajouté aux 20 mg/L de la substance de référence.
- Le volume de la solution d'essai a été réduit, passant de 3 L à 1,5 L.
Résultats :
- Taux (%) de dégradation après le délai (28 jours) : 26 % de ThCO2 a évolué (11,1 mg/L de substance d'essai); 1 % de ThCO2 (20,5 mg/L de substance d'essai).
- Produits de dégradation : Oui [ ] Non [X].
- Remarques : (Fournir tout renseignement supplémentaire qui pourrait être requis pour évaluer adéquatement les données aux fins de fiabilité et d'utilisation, p. ex. inhibition observée, biodégradation excessive, écart-type excessif, cinétique, nombre de microorganismes, temps requis pour une dégradation de 10 % et dégradation totale à la fin de l'essai [p. ex. période de 10 jours].)
Conclusions :
- Remarques : Les auteurs ont conclu que la substance d'essai n'est pas biodégradable.
Fiabilité :
- Peu fiable. L'identité de la substance d'essai n'a été confirmée et sa pureté n'est pas indiquée. La substance d'essai est jugée peu soluble, la solubilité ayant été mesurée à partir de 2 400 mg/L. Les concentrations de la substance d'essai n'ont pas été mesurées.
4. Bioaccumulation
La ligne directrice d'essai relative à ce paramètre est laLigne directrice n° 305 de l'OCDE :Bioconcentration : Essai dynamique chez le poisson.
Référence :
- 11165-65140912-004, (Document sommaire, étude confidentielle) – Le rapport complet est en japonais uniquement; certaines données de ce rapport étaient compréhensibles.
- S.O. = sans objet, ou aucune donnée disponible (seul le rapport sommaire est en anglais).
Substance d'essai :
- Dénomination chimique et n° CAS : la substance est connue par sa formule chimique et sous son nom commercial.
- Remarques sur la substance d'essai : la pureté de la substance d’essai semble être de 98 % (selon l’interprétation du rapport en japonais).
Méthode :
- méthode du MITI
- Nom de l'espèce : Carpe
- Période d'exposition : Phase d'absorption : 56 jours, période passée en eau saine (phase de dépuration) : ?
- Concentration : Concentration en milieu d'essai dans lequel l'étude a été menée (eau, sol, sédiments, eau interstitielle).
- Élimination : Des données sur le « taux de récupération » sont présentées en %
- Bonnes pratiques de laboratoire (BPL) : Non
- Année : 1980
- Écarts : S.O.
- Méthode d'analyse : HPLC, limite de détection? limite de dosage, ou quantification?
- Substance de référence : Oui/Non (Dans l'affirmative, préciser) S.O.
- Méthode d'analyse de la substance de référence
Conditions d'essai :
- Solution d'essai : (Décrire la préparation de la solution de la substance d'essai.) S.O.
- Système d'essai et performance : S.O.
- Si une étude en laboratoire a été effectuée, décrire le système d'essai et la performance d'essai : à savoir, système statique, semistatique; dynamique; détails sur l'appareil et l'équipement;
- Composition des milieux d'essai (ingrédients, agents solubilisants, etc.) : S.O.
- Conditions d'exposition (comprenant l'éclairement et la photopériode),
- écarts-types) des espèces à l'étude (y compris la retenue, l'alimentation, l'adaptation) S.O.
- Nombre d'organismes d'essai, charge : S.O.
- Nombre de réplicats : 2 réplicats par concentration testée
- Détails sur les contrôles : S.O.
- Durée de l'absorption et phase de dépuration : Absorption : 8 semaines; dépuration : ?
- Concentrations de la substance d'essai : 3,0 ppm (2,49 ppm – mesurée); 0,3 ppm (0,27 ppm, mesurée)
- Fréquence des mesures de qualité des milieux d'essai (COD/COT, pH, température) : pH, O.D. et un autre élément mesuré à 0,3 et 7 jours et tous les 7 jours par la suite. Le pH variait de 7 à 7,3; l'O.D. variait de 6,4 à 7,2.
- Les détails sur l'échantillonnage et l'analyse des échantillons des espèces à l'essai et des milieux d'essai (c.àd. calendrier de prélèvement d'échantillons, préparation des échantillons et méthode analytique) : S.O.
Résultats :
- Mortalité/comportement : Mortalité et comportement anormal observés chez les organismes d'essai pendant chacun des régimes d'exposition, selon les contrôles et la substance de référence : S.O.
- Teneur en lipides des organismes d'essai : valeur moyenne : 7,9 ± 2,1 %
- Concentrations des matières à l'étude pendant l'essai : Concentration des matières à l'étude (comprenant l'écarttype et le niveau) pour toutes les périodes d'échantillonnage des organismes d'essai (totales), dans certains de leurs tissus (p. ex. les tissus lipidiques) et dans les milieux environnants; valeurs des concentrations des contrôles et des composés de référence : S.O.
- Facteur de bioconcentration (FBC) : Calculer le FBC à l'état d'équilibre ou le FBCk cinétique (formulé pour la totalité du corps, la teneur totale en lipides ou les tissus précis des organismes d'essai). Les valeurs plafonds du FBC exposées à 0,27 ppm : 52,3; 38,8 (unités non mentionnées, mais présumées être en L/kg). Exposition à 2,49 ppm : 10,3, 20,6. Après 8 semaines : 0,27 ppm : 32,3, 36,9. 2,49 ppm : 14,5, 10,7.
- Constantes d'absorption et du taux de dépuration : Donner les valeurs (niveau de confiance des limites et des écarts-types de 95 %) des constantes relatives aux taux d'absorption et de dépuration (pertes) (toutes formulées pour la totalité du corps, la teneur totale en lipides ou les tissus précis des organismes d'essai); donner les détails pertinents sur le calcul et l'analyse des données : S.O.
- Période de la dépuration : Indiquer la période de dépuration nécessaire pour obtenir l'intervalle requis de 50 % (DT50) et 90 % (DT90) des résidus : S.O.
- Les métabolites : s'ils sont identifiés (utilisation de matières d'essai radiomarquées), tout métabolite accumulé (constituant moins de 10 % des résidus) devrait être détaillé : S.O.
- Autres observations : Signaler toute observation inhabituelle au sujet de l'essai, tout écart par rapport aux procédures et tout autre renseignement pertinent ayant une incidence sur les résultats : S.O.
Conclusions :
- Remarques : conclusions des auteurs de cette étude et approbation du rapporteur : S.O.
Fiabilité :
- Fondée sur les renseignements disponibles dans le sommaire de l’étude en anglais : Inacceptable.
- Trop de données manquantes.
5. Toxicité aiguë
| No | Article | Poids | Oui/Non | Préciser |
|---|---|---|---|---|
| 1 | Essai de toxicité aiguë du {Nom commercial] pour le poisson zèbre (Brachydanio rerio). 1988. Référence : 11165-65140912-005 | |||
| 2 | Identité de la substance : Numéro de registre CAS | S.O. | N | |
| 3 | Identité de la substance : nom(s) chimique(s) | S.O. | N | |
| 4 | Composition chimique de la substance | 2 | N | |
| 5 | Pureté du produit chimique | 1 | N | |
| 6 | Persistance et stabilité de la substance d'essai dans le milieu aqueux déclaré? | 1 | N | |
| Méthode | ||||
| 7 | Référence | 1 | O | Ligne directrice n° 203 de l'OCDE |
| 8 | Méthode de l'OCDE, de l'UE, nationale ou autre méthode standard? | 3 | O | |
| 9 | Justification de la méthode ou du protocole si non standard | 2 | ||
| 10 | Bonnes pratiques de laboratoire (BPL) | 3 | N | |
| Organisme d'essai | ||||
| 11 | Identité de l'organisme : nom | S.O. | O | Poisson zèbre (Brachydanio rerio) |
| 12 | Indication du nom latin ou des deux noms (latin et commun)? | 1 | O | |
| 13 | Durée du cycle de vie et stade de l'organisme d'essai | 1 | O | |
| 14 | Longueur ou poids | 1 | O | Longueur : de 22 à 26 mm; Poids : de 0,1 à 0,15 g |
| 15 | Sexe | 1 | N | |
| 16 | Nombre d'organismes par réplicat | 1 | O | 10 |
| 17 | Taux de charge de l'organisme | 1 | O | 0,09 g/L |
| 18 | Type de nourriture et périodes d'alimentation pendant la période d'acclimatation | 1 | O | Aucun aliment dans les 24 h avant l'exposition |
| Modèle et conditions d'essai | ||||
| 19 | Type d'essai (toxicité aiguë ou chronique) | S.O. | O | Tox. aiguë |
| 20 | Type d'expérience (en laboratoire ou sur le terrain) | S.O. | O | En laboratoire |
| 21 | Voies d'exposition (nourriture, eau, les deux) | S.O. | O | Eau |
| 22 | Durée d'exposition | S.O. | O | 96 h |
| 23 | Contrôles négatifs ou positifs (préciser) | 1 | O | Négatifs |
| 24 | Nombre de réplicats (dont les contrôles) | 1 | O | 6 concentrations, comp. contrôles |
| 25 | Indication des concentrations nominales? | 1 | O | 5 concentrations nominales, de 10 à 100 mg/L |
| 26 | Indication des concentrations mesurées? | 3 | N | |
| 27 | Type de nourriture et périodes d'alimentation pendant les essais à long terme | 1 | O | Aucune alimentation pendant l'essai de toxicité aiguë |
| 28 | Mesure périodique des concentrations (tout particulièrement pendant l'essai de toxicité chronique)? | 1 | N | |
| 29 | Les conditions du milieu d’exposition pertinentes pour cette substance sontelles indiquées? (ex. : pour la toxicité des métaux – pH, COD/COT, dureté de l’eau, température) | 3 | O | |
| 30 | Photopériode et intensité lumineuse | 1 | O | |
| 31 | Préparation de la solution de stock et d'essai | 1 | N | |
| 32 | Emploi d'un agent émulsionnant ou solubilisant si la substance était peu soluble ou instable? | 1 | N | Caractérisation de la substance d'essai : virtuellement insoluble. |
| 33 | Si un agent émulsionnant ou solubilisant a été employé, des données sont-elles fournies sur sa concentration? | 1 | ||
| 34 | Si un agent émulsionnant ou solubilisant a été employé, des données sontelles fournies sur son écotoxicité? | 1 | ||
| 35 | Les intervalles des contrôles (y compris les observations et les paramètres de la qualité de l'eau) sontils indiqués? | 1 | O | |
| 36 | Méthodes statistiques employées | 1 | N | |
| Informations relatives à la qualité des données | ||||
| 37 | Le paramètre déterminé estil directement attribuable à la toxicité de la substance et non pas à l'état de santé des organismes (p. ex., lorsque la mortalité des témoins est inférieure à 10 %) ou à des facteurs physiques (p. ex., « effet d'ombrage »)? | S.O. | O | |
| 38 | L'organisme d'essai était-il pertinent dans l'environnement au Canada? | 3 | O | |
| 39 | Les conditions d'essai (pH, température, O.D., etc.) étaientelles des conditions habituelles pour l'organisme d'essai? | 1 | O | |
| 40 | Le type et la conception du système (statique, semistatique, dynamique; ouvert ou fermé; etc.) correspondentils aux propriétés de la substance et à la nature ou aux habitudes de l'organisme? | 2 | O | |
| 41 | Le pH de l’eau d’essai étaitil dans la plage des valeurs typiques de l’environnement au Canada (de 6 à 9)? | 1 | O | 8,0 – 8,4 |
| 42 | La température de l’eau d’essai étaitelle dans la plage des valeurs typiques de l’environnement au Canada (de 5 °C à 27 °C)? | 1 | O | 22 °C |
| 43 | La valeur de la toxicité étaitelle inférieure à celle de la solubilité de la substance dans l'eau? | 3 | O | |
| Résultats | ||||
| 44 | Valeurs de la toxicité (fournir paramètres et valeurs) | S.O. | S.O. | CL50 de 96 h inférieur à 100 mg/L |
| 45 | Autres paramètres indiqués – p. ex., FBC/FBA, CMEO/CSEO (préciser)? | S.O. | CL50 de 96 h = 58 mg/L | |
| 46 | Autres effets nocifs indiqués (p. ex., cancérogénicité, mutagénicité)? | S.O. | Légère modification sur la nage à 18 mg/L à 48 h et plus; perte d'équilibre grave à 58 mg/L à 72 h et à 96 h; des effets graves sur la fonction respiratoire à 100 mg/L à 72 h et 96 h. | |
| 47 | Note : ... % | 66,7 | ||
| 48 | Code de fiabilité d’Environnement Canada : | 3 | ||
| 49 | Catégorie de fiabilité (élevée, satisfaisante, faible) : | Faible | ||
| 50 | Remarques | |||
Annexe II : Tableau sommaire des intrants des modèles de la persistance, de la bioaccumulation et de la toxicité (PBT)
| Paramètres | Propriétés physiques et chimiques et devenir dans l’environne-ment | Propriétés physiques et chimiques et devenir dans l’environnement | Profil de PBT | Biodégradation et écotoxicité |
|---|---|---|---|---|
| Paramètres des intrants de modélisation | ACD/ PhysChem Suite (2009) | EPIsuite (2008) (tous les modèles, y compris ceuxci : KOWWIN, KOCWIN, BCFBAF BIOWIN et ECOSAR) |
Canadian POPs Model (CPOP, 2008) (comprenant CATABOL, Dimitrov, modèle de toxicité OASIS) |
TOPKAT (2004), AIEPS (20032007), OCDE (2008) |
| Code SMILES, forme dissociée | c1(c(C(C)(C)C)cc(cc1C(C)(C)C)CP(=O)(O)OCC)O | |||
| Code SMILES, forme non dissociée | CCOP(O[Ca] OP(=O)(OCC) Cc2cc(C(C)(C) C)c(O)c(C(C) (C)C)c2)(=O) Cc1cc(C(C)(C) C)c(O)c(C(C) (C)C)c1 |
|||
| Masse moléculaire (g/mol), forme dissociée / forme non dissociée | 328,39 / 694,85 | |||
| Point de fusion (°C) | 270 | |||
| Point d’ébullition (°C) | ||||
| Température (°C) | ||||
| Densité (kg/m3) | ||||
| Pression de vapeur (Pa) | ||||
| Constante de la loi de Henry (Pa m3/mol) | ||||
| Log Kae (coefficient de partage air–eau; sans dimension) |
||||
| Log Koe (coefficient de partage octanol–eau; sans dimension) |
-0,031 | -0,031 | ||
| Log Kco (coefficient de partage carbone organique–eau (L/kg) |
||||
| Solubilité dans l'eau (mg/L) | ||||
| Paramètre | Doses minimales avec effet[i]/résultats |
|---|---|
| Animaux de laboratoire et in vitro | |
| Toxicité aiguë | DL50 par voie orale (rats) supérieure à 2 000 mg/kg p.c. (Ash M. et Ash I., 2004). DL50 par voie orale (rats) supérieure à 6 000 mg/kg p.c. Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité à court terme en doses répétées | Aucune étude n'a été recensée. |
| Toxicité subchronique | DMEO par voie orale : 6 000 ppm (soit 300 mg/kg p.c. par jour; d'après Santé Canada [1994]) a été déterminée à partir d'une légère baisse du gain de poids corporel et d'une activité de toilettage réduite chez les rats des deux sexes, et ce, à des concentrations élevées de phosphatase alcaline sérique chez les rats Sprague Dawley mâles (de 20 à 25 par sexe par groupe) auxquels on a administré le PADMEC dans la diète à 0, 700, 2 000 ou 6 000 ppm (soit 0, 35, 100 et 300 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 13 semaines, suivies d'une période de rétablissement de 4 semaines chez les groupes témoins et ceux ayant reçu un traitement de 6 000 ppm (5 par sexe par groupe). Durant la semaine 8, un certain nombre de rats ont développé le sialodacryoadénite, maladie virale commune à cette souche, et ont présenté une perte d'appétit négligeable. Tous les rats infectés ont connu un rétablissement complet avant la semaine 10 sans présenter d'effets résiduels. On a observé une réduction du toilettage tant chez les mâles que chez les femelles à 6 000 ppm sans rétablissement après l'exposition. Une légère baisse provisoire du gain de poids corporel a été constatée pendant la semaine 6 à 6 000 ppm. Des concentrations élevées de phosphatase alcaline sérique ont été observées chez les mâles à 6 000 ppm durant les semaines 4 et 12. Aucun effet du traitement sur la mortalité, sur la consommation d'aliments, sur la vision et l'audition, sur l'analyse de l'urine, sur l'appareil circulatoire, sur le poids des organes, aucun effet pathologique clinique ni histopathologique n'ont été observés. Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité chronique et cancérogénicité | Aucune étude n'a été recensée. |
| Toxicité pour le développement | Aucune étude n'a été recensée. |
| Toxicité pour la reproduction | Aucune étude n'a été recensée. |
Perturbation endocrinienne in vitro |
Activité œstrogénique : Résultats négatifs : essai doublehybride de levure in vitro fondé sur l'interaction de dépendance aux ligandes du récepteur des œstrogènes α et du coactivateur TIF2. De l'activité œstrogénique a été détectée comme étant une activité βgalactosidase avec ou sans activation métabolique (S9) (Ogawaet al., 2006). |
| Génotoxicité et paramètres apparentés : in vivo | Test d’anomalie du noyau : Résultats négatifs : Les hamsters chinois (3 par sexe par groupe traité et 6 par sexe par groupe témoin) se sont fait administrer du PADMEC par voie orale 0, 1 250, 2 500 ou 5 000 mg/kg p.c. par jour pendant 2 jours consécutifs. Quatre animaux traités sont décédés pendant l'expérience (1 mâle de chaque groupe d'exposition et 1 femelle à une dose de 2 500 mg/kg p.c.). |
| Génotoxicité et paramètres apparentés : in vitro | Mutagénicité : Résultats négatifs : Le test d'Ames, Salmonella typhimurium TA98, TA100, TA1535, TA1537 et TA1538; Escherichia coli Wp2 uvr A avec ou sans activation métabolique (S9). |
| Sensibilisation | Aucune étude n'a été recensée. |
| Irritation | Irritation cutanée : Très légère irritation (érythème léger, sans œdème) sur la peau scarifiée lors des tests sur les lapins. |
Irritation oculaire : Aucune irritation n'a été observée chez les lapins. |
|
| Études menées sur les humains | |
| Aucune étude n'a été recensée. | |
[i] DL50, dose létale médiane; DMEO, dose minimale avec effet observé; DSEO, dose sans effet observé.
Prévisions des modèles R(Q)SA sur la cancérogénicité
| Modèle/Espèces | Souris | Rats | Rats | Souris | Rongeurs | Mammifères | ||
|---|---|---|---|---|---|---|---|---|
| Mâles | Femelles | Mâles | Femelles | |||||
| MA | N | N | N | N | N | N | N | - |
| CT | HC | HC | HC | HC | - | - | HC | - |
| TK | HC | HC | HC | HC | - | - | - | - |
| DEREK | - | - | - | - | - | - | - | HC |
Prévisions des modèles R(Q)SA sur la génotoxicité
| Modèle/ Para- mètre |
aberra- tions chromo-somi- ques |
aberra- tions chromo- somi- ques chez les autres ron- geurs |
aberra- tions chromo- somi- ques chez les rats |
micro- noyaux chez la souris |
micro- noyaux chez le ron- geur |
Synthèse d'ADN non pro- gram- mée |
Lympho- cytes humains par syn- thèse d'ADN non pro- gram- mée |
Hépato- cytes chez le rat par syn- thèse d'ADN non pro- gram- mée |
Droso- phila |
Droso- phila (trans- loca- tions héri- tables) |
Droso- phila (muta- tions létales réces- sives liées au sexe) |
|---|---|---|---|---|---|---|---|---|---|---|---|
| MA | N | N | N | N | N | N | N | N | N | N | N |
| CT | HC | - | - | HC | - | HC | - | - | HC | - | - |
| TK | - | - | - | - | - | - | - | - | - | - | - |
| TT | - | - | - | - | N | - | - | - | - | - | - |
Prévisions des modèles R(Q)SA sur la génotoxicité
| Modèle/ Paramètre |
S. cere- visiae |
Levure | hgprt | mutation des mammi- fères |
mutation létale dominante des mammi- fères |
mutation du lymphome chez des souris | E. coli | E. coli w | activité micro- bienne |
Salmo- nella |
Alerte de cancer BB |
|---|---|---|---|---|---|---|---|---|---|---|---|
| MA | N | N | N | N | N | - | N | N | N | N | - |
| CT | - | - | - | - | - | HC | - | - | - | HC | - |
| TK | - | - | - | - | - | - | - | - | - | HC | - |
| TT | - | - | - | - | - | - | - | - | - | - | N |
| Modèle/Paramètre | Lésions chromosomiques | Génotoxicité | Mutagénicité |
|---|---|---|---|
| DEREK | AR | AR | AR |
Prévisions des modèles R(Q)SA sur la toxicité pour le développement
Model Applier
| Paramètre / Espèces | Souris | Lapins | Rats | Rongeurs |
|---|---|---|---|---|
| Retardement | N | N | N | N |
| Diminution du poids | N | N | HC | N |
| Mortalité fœtale | N | N | N | N |
| Perte après l'implantation | N | N | N | N |
| Perte avant l'implantation | N | N | N | N |
| Structurelle | N | HC | N | N |
| Viscères | N | - | N | N |
Multicase Casetox
| Paramètre / Espèces | Hamsters | Mammifères | Divers |
|---|---|---|---|
| Tératogénicité | - | P | HC |
| Développement | HC | - | - |
Prévisions des modèles R(Q)SA sur la toxicité pour la reproduction
Model Applier
| Modèle / paramètre | Femelles | Mâles | ||||
|---|---|---|---|---|---|---|
| Espèces | Souris | Rats | Rongeurs | Souris | Rats | Rongeurs |
| Reproduction | HC | HC | N | HC | P | N |
| Sperme | - | - | - | N | N | N |
Multicase Casetox
| Souris | Rats | Lapins | Humains |
|---|---|---|---|
| HC | HC | HC | HC |
DEREK
| Mammifères |
|---|
| AR |
| Nom / numéro de registre CAS | Structure |
|---|---|
| Bis[[[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate] de calcium et de diéthyle (PADMEC) N° CAS 65140-91-2 Masse moléculaire : 694,85 État physique : solide Pression de vapeur : 6,03 x 10-10 Pa (modélisée, EPIWIN [2008]), < 0,01 Pa (expérimentale, Présentation de projet [2010a]) |
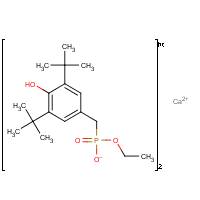 |
| [[3,5-bis(1,1-diméthyléthyl)-4-hydroxyphényl]méthyl]phosphonate de diéthyle N° CAS 976-56-7 Masse moléculaire : 356,44 État physique : solide Pression de vapeur : 1.51 x 10-7 Torr ( 2,01 x 10-5 Pa) (modélisée, CAS [2010]) |
 |
| 3,3',3'',5,5',5''-hexa-tert-butyl-α,α',α''-(mésitylène-2 ,4,6-triyl)tri-p-crésol Mieux connu sur le marché sous les noms Irganox 1330, Ethanox 330, Ionox 330 N° CAS 1709-70-2 Masse moléculaire : 775,22 État physique : solide Pression de vapeur : 1,3 x 10-12 Pa (expérimental, US EPA [2006b]), 5,02 x 10-22 Torr (6,69 x 10-20 Pa) (modélisée, CAS [2010]) |
 |
Annexe VI : Résumé des données relatives aux effets sur la santé de l'Irganox 1330 (n° CAS 1709-70-2) – substance analogue au PADMEC
| Paramètre | Doses minimales avec effet / résultats |
|---|---|
| Animaux de laboratoire et in vitro | |
| Toxicité aiguë | DL50 par voie orale (rats)supérieure à 5 000 mg/kg p.c. (Stevenson et al., 1965). DL50 par voie cutanée (rats)supérieure à 2 000 mg/kg p.c. (CibaGeigy, 1992a). Aucune étude sur l'exposition par inhalation n'a été recensée. |
| Toxicité à court terme en doses répétées | Aucune étude n'a été recensée. |
| Toxicité subchronique | Plus faible DMEO par voie orale = 31 600 ppm (soit 1 600 mg/kg p.c. par jour; d'après Santé Canada [1994]) à partir d'une diminution importante du poids corporel chez les rats femelles Carworth E/N (10 par sexe par groupe) après administration par voie orale dans leur diète de l'Irganox 1330 à 0, 316, 1 000, 3 160, 10 000 ou 31 600 ppm (soit 0, 16, 50, 160, 500 et 1 600 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 90 jours. Aucun effet lié au traitement n'a été noté en ce qui a trait à l'absorption d'aliments, à l'utilisation d'aliments, à l'appareil circulatoire, aux paramètres chimiques cliniques, au poids des organes, ni d'effets pathologiques, ni d'effets sur l'analyse de l'urine (Stevenson et al., 1965). Les rats albinos (de 10 à 12 par sexe par groupe) se sont fait administrer de l'Irganox 1330 par voie orale dans leur diète à 0 ou 5 000 ppm (soit 0 ou 250 mg/kg p.c. par jour; d'après Santé Canada [1994]) pendant 90 jours. Aucun effet du traitement sur le poids des organes ni d'effets histopathologiques n'ont été observés. On a observé la pneumonite des poumons, la péricholangite du foie et la néphrite des reins chez certains animaux témoins et animaux traités. Aucun effet n'a été noté en ce qui a trait à la diminution du poids corporel, à la consommation d'aliments et d'eau, à la mortalité, à l'appareil circulatoire, ni aux études sur les paramètres chimiques cliniques et les analyses d'urine (Lifestream laboratories, 1966a). Les chiens beagle (de 3 à 4 par sexe par groupe) se sont fait administrer de l'Irganox 1330 par voie orale dans leur diète à 0 ou 5 000 ppm (soit 0 ou 150 mg/kg p.c. par jour; d'après Santé Canada [1994]) pendant 90 jours. Aucune anormalité importante du poids relatif des organes ni de changements histopathologiques importants liés au traitement n'ont été observés. Aucun effet n'a été noté en ce qui a trait au poids corporel, à la consommation d'aliments, à la mortalité, aux comportements, à l'appareil circulatoire, ni aux paramètres chimiques cliniques et aux analyses d'urine (Lifestream laboratories, 1966b). Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité chronique et cancérogénicité | Plus faible DMEO par voie orale = 10 000 ppm (soit 500 mg/kg p.c. par jour; d'après Santé Canada [1994]) à partir d'une diminution du poids corporel chez les rats femelles de la souche Carworth Ferme E (un total de 40 par sexe par groupe traité et de 60 par sexe par groupe témoin) après administration par voie orale dans leur diète de l'Irganox 1330 à 0, 400, 2 000, 10 000 ppm (soit 0, 20, 100 et 500 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 2 jours. Cinq par sexe par groupe ont été euthanasiés après 26, 52 et 78 semaines d'alimentation. À l'euthanasie intermédiaire, on a noté une diminution du poids corporel et aucun effet sur les poids absolu et relatif des organes des mâles à 10 000 ppm après 52 semaines. Quant aux animaux traités pendant 2 ans, les femelles à 10 000 ppm ont présenté une diminution du poids corporel, de l'absorption d'aliments, du poids absolu du foie et des reins et du poids relatif du foie. Aucun effet sur l'état de santé général, sur le comportement et sur la mortalité n'a été constaté. Aucun effet nocif n'a été noté en ce qui a trait à la consommation d'aliments, aux comportements, aux analyses d'urine, aux études de pathologie clinique et d'histopathologie. Aucun écart important n'a été relevé dans les études de l'appareil circulatoire et les études cliniques. Aucune lésion pathologique ou microscopique attribuable au traitement n'a été observée. Les auteurs ont laissé entendre que les effets sur le poids corporel et le poids des organes chez les femelles à 10 000 ppm étaient probablement liés au faible poids corporel initial (Shell Research, 1968a). Les rats de souche Carworth Ferme E (30 par sexe par groupe traité et 40 par sexe par groupe témoin) se sont fait administrer de l'Irganox 1330 (pureté de 98 %) par voie orale dans leur diète à 0, 1 000 ou 5 000 ppm (soit 0, 50 et 250 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 2 ans. Une diminution du poids corporel a été observée chez les rats mâles à 5 000 ppm pendant la semaine 78. Pendant les 6 derniers mois du traitement, on a relevé une tendance à la diminution du poids corporel chez tous les mâles traités et les mâles témoins, qui constituerait une « perte attribuable au vieillissement plutôt qu'au traitement », selon les auteurs. Aucun effet sur le comportement, sur l'état de santé général, sur l'absorption d'aliments, ni d'effets pathologiques ni apparition de tumeurs n'ont été constatés. Des lésions rénales (néphropathies) ont été observées chez pratiquement tous les rats à la fin de l'étude. Les tumeurs les plus communes étaient l'adénome de la thyroïde et l'adénome basophile de l'adénome antérieur observé chez les animaux témoins et les animaux traités (Shell Research, 1969). Les souris de souche Carworth Ferme n° 1 (36 par sexe par groupe traité et 36 par sexe par groupe témoin) se sont fait administrer de l'Irganox 1330 (pureté de 98 %) par voie orale dans leur diète à 0, 1 000 ou 5 000 ppm (soit 0, 130 et 650 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 2 ans. Pendant les 3 derniers mois du traitement, on a relevé une diminution du poids corporel chez tous les groupes traités et les groupes témoins, qui constituerait une « perte attribuable au vieillissement plutôt qu'au traitement », selon les auteurs. Ni lésion histopathologique ni tumeur liée au traitement n'a été observée. On n'a relevé aucun écart dans le nombre de tumeurs apparues chez les animaux traités et les animaux témoins (Shell Research, 1969). Aucune donnée histopathologique n'a été présentée dans l'USEPA (2006b). Les chiens beagle (de 4 à 5 par sexe par groupe) se sont fait administrer de l'Irganox 1330 (pureté de 98 %) par voie orale dans leur diète à 0, 2 000 ou 10 000 ppm (soit 0, 60 et 300 mg/kg p.c. par jour respectivement; d'après Santé Canada [1994]) pendant 2 ans. Aucun effet lié au traitement sur l'état de santé général, sur le comportement, sur le poids corporel, sur les poids relatif et absolu des organes, sur l'appareil circulatoire et sur les paramètres chimiques cliniques n'a été observé. Aucun changement pathologique ou microscopique n'a été observé. Les résultats pathologiques ont indiqué des lésions liées à une infestation d'ascarides dans le foie des animaux traités et des animaux témoins. On a constaté des maladies rénales et pulmonaires chez la plupart des animaux traités et des animaux témoins (Shell Research, 1968b). Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Toxicité pour la reproduction et pour le développement | DSEO administrée par voie orale chez les rats : 5 000 ppm (soit 250 mg/kg p.c. par jour; d'après Santé Canada [1994]) chez les rats de la souche Carworth Ferme E (20 par sexe par groupe) après administration par voie orale dans la diète de l'Irganox 1330 (pureté de 98 %) à 0 ou 5 000 ppm pour les trois générations (durée précise du traitement non mentionnée dans USEPA [2006b]). Aucun effet sur l'état de santé général, sur le comportement et sur la mortalité n'a été constaté par rapport au groupe témoin. Aucun effet sur la reproduction, sur le nombre de grossesses, sur les portées et sur les nouveaunés du sevrage à la maturité n'a été constaté chez les trois générations par rapport au groupe témoin. Aucune lésion ni changement pathologique ou histologique n'a été observé. Dans USEPA (2006b), on a souligné que « les détails non précisés dans la présentation de l'étude menée sur les trois générations touchent le sexe des nouveaunés, le poids des nouveaunés aux jours 0 et 4, le poids des organes reproducteurs, les données sur la spermatogénèse, les données sur les effets tératogènes observés chez la génération F3, les données de l'examen histopathologique et les analyses statistiques » (Shell Research, 1970). Aucune étude sur l'exposition par voie cutanée ou par inhalation n'a été recensée. |
| Génotoxicité et paramètres apparentés :in vivo | Aucune étude n'a été recensée. |
| Génotoxicité et paramètres apparentés :in vitro | Mutagénicité : Résultats négatifs : Le test d'Ames, Salmonella typhimurium TA98, TA100, TA1535 et TA1537; Escherichia coli WP2 uvA avec ou sans activation métabolique (S9) à des doses variant de 625 à 5 000 µg/plaque (CibaGeigy, 1992b). Résultats négatifs : Le test d'Ames, histidines auxotrophiques mutantes de laSalmonella typhimurium TA97, TA98, TA100; Escherichia coli WP2/pKM101 avec ou sans activation métabolique (S9) à des doses variant de 50 à 2 000 µg/plaque (Akita University, 1984). |
| Sensibilisation | Aucune étude n'a été recensée dans USEPA (2006b). |
| Irritation | Irritation cutanée : Aucune étude n'a été recensée. |
| Irritation oculaire : Aucune étude n'a été recensée. | |
| Études menées sur les humains | |
| Aucune étude n'a été recensée. | |
Notes de bas de page
[2] La détermination de la conformité à l’un ou à plusieurs des critères énoncés à l’article 64 repose sur une évaluation des risques pour l’environnement ou la santé humaine associés aux expositions dans l’environnement en général. Pour les humains, ceci comprend, sans toutefois s’y limiter, les expositions par l’air ambiant et intérieur, l’eau potable, les produits alimentaires et l’utilisation de produits de consommation. Une conclusion établie en vertu de la LCPE 1999 portant sur les substances des lots 1 à 12 du Défi, énumérées dans le Plan de gestion des produits chimiques, n’est pas pertinente, ni ne prévient une évaluation en fonction des critères de danger définis dans leRèglement sur les produits contrôlés, qui fait partie du cadre réglementaire applicable au Système d’information sur les matières dangereuses au travail pour les produits destinés à être utilisés au travail. De la même manière, la conclusion fondée sur les critères énoncés dans l’article 64 de la LCPE (1999) n’empêche pas de prendre des mesures en vertu d’autres articles de cette loi ou d’autres lois.
[3] Les études de toxicité non citées proviennent de la Section des matériaux d'emballage alimentaire de Santé Canada. Les références pour ces données ne peuvent être divulguées en raison de leur confidentialité (communication personnelle de la Direction des aliments de Santé Canada adressée en juillet 2010 au Bureau de l'évaluation des risques des substances existantes de Santé Canada; source non citée).