Évaluation préalable pour le Défi concernant
Archivée
Acide nitrilotriacétique
Numéro de registre du Chemical Abstracts Service
139-13-9
Environnement Canada
Santé Canada
Juillet 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Valeurs estimatives de la limite supérieure de l'absorption journalière de NTA chez la population générale du Canada
- Annexe 2 : Scénarios ConsExpo de calcul des échantillons
- Annexe 3 : Résumé des données sur les effets du NTA et du Na3NTA sur la santé
En application de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de l’acide nitrilotriacétique ou NTA, dont le numéro de registre du Chemical Abstracts Service est 139-13-9. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance durant la catégorisation visant la Liste intérieure dans le cadre du Défi. On a déterminé que le NTA constitue une priorité élevée, parce qu’on estime qu’il présente un risque d’exposition intermédiaire à la population canadienne et que cette substance est inscrite sur une liste de produits cancérogènes par d'autres agences. Bien que l’on ait conclu que le NTA répond aux critères de catégorisation écologique relatifs à la persistance, il ne répond pas à ceux relatifs au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée principalement sur les risques pour la santé humaine. Les renseignements sur les sels de sodium de l’acide nitrilotriacétique ont également été pris en compte dans le cadre de l’évaluation préalable puisque les paramètres toxicologiques de cet acide et de ses sels de sodium sont similaires et que leur dissociation génère un groupe caractéristique commun. Toutefois, la conclusion de l’évaluation préalable ne porte que sur l’acide nitrilotriacétique; les données liées à ses sels de sodium ne constituent que des renseignements complémentaires.
Selon les données transmises conformément à l’article 71 de la LCPE (1999), aucune entreprise canadienne n'a déclaré avoir fabriqué du NTA en quantité égale ou supérieure au seuil de déclaration fixé à 100 kg pour l'année civile 2006. Cependant, l’importation au Canada d’une quantité de 1 000 à 10 000 kg de cet acide a été déclarée pour cette année. Selon une autre source, la quantité totale d’acide nitrilotriacétique importée en 2006, y compris ses sels, était de 3,9 millions de kilogrammes. Les données scientifiques et techniques ainsi que les réponses à l’enquête réalisée en vertu de l’article 71 indiquent que l’acide nitrilotriacétique est surtout utilisé dans les produits de nettoyage industriels et institutionnels. Il est également utilisé au Canada comme chélateur dans divers procédés industriels, notamment le traitement industriel de l’eau de chaudière et le traitement des pâtes et papiers pour la fabrication de produits de papier et de carton. Auparavant, l’utilisation du sel de trisodium de l’acide nitrilotriacétique (Na3NTA) comme adjuvant pour détergents à lessive était très répandue. De nos jours, ce sel est principalement utilisé au Canada dans des applications industrielles et institutionnelles. Il sert d’ingrédient non actif dans des préparations pesticides canadiennes, et sa présence a été relevée dans un nombre limité de produits de soins personnels canadiens.
Les émissions d’acide nitrilotriacétique et de ses sels dans l’environnement ambiant devraient provenir principalement de sources anthropiques. Ces substances ont été mesurées au Canada dans l’eau potable traitée par les municipalités, l’eau souterraine et l’eau industrielle. L’exposition de la population générale par la consommation d’eau potable et l’utilisation de produits de consommation devrait être faible.
Des études à long terme effectuées sur des rats et des souris ont révélé que la présence de concentrations élevées d’acide nitrilotriacétique dans l’alimentation et l’eau potable provoquait l’apparition de tumeurs primaires à plusieurs endroits du tractus urinaire. Des tumeurs des cellules épithéliales transitionnelles dans les tissus des reins, des uretères et de la vessie, ainsi que des tumeurs des cellules des tubules rénaux ont été observées. De plus, dans le cadre d’études à court et à long terme portant sur l’administration répétée d’acide nitrilotriacétique par voie orale à des animaux de laboratoire, des lésions non néoplasiques ont souvent été observées dans les tissus des reins, des uretères et de la vessie. Les renseignements disponibles indiquent que l’acide nitrilotriacétique n’est vraisemblablement pas génotoxique. Par conséquent, bien que le mode d’induction des tumeurs ne soit pas complètement élucidé, on ne considère pas que les tumeurs observées résultent d’une interaction directe avec le matériel génétique. Une approche fondée sur le seuil d’innocuité a donc été utilisée pour évaluer les risques pour la santé humaine.
D'après la comparaison de l'exposition estimative au NTA au Canada et des seuils d'effet critique, et compte tenu des incertitudes dans les bases de données sur l'exposition et la caractérisation des dangers, on considère que les marges d’exposition sont adéquates pour protéger la santé humaine.
À la lumière des renseignements disponibles sur le potentiel du NTA d'avoir des effets nocifs sur la santé humaine, il est conclu que cette substance ne pénètre pas dans l'environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer au Canada un danger pour la vie ou la santé humaine.
Un scénario d'exposition a été élaboré en fonction de l'information obtenue sur l'utilisation commerciale en vue d'estimer de façon prudente les rejets des exploitations industrielles dans le milieu aquatique ainsi que les concentrations qui en découlent. D’après les estimations, les concentrations dans l’environnement devraient être inférieures à celles pouvant avoir des effets nocifs sur les organismes aquatiques sensibles, ce qui indique que la substance ne nuira vraisemblablement pas au milieu aquatique. De plus, des données permettent de croire que le NTA se dégradera probablement vite dans les milieux naturels.
À la lumière des renseignements disponibles, on peut conclure que le NTA ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur sa diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie. L’acide nitrilotriacétique ne satisfait pas aux critères de la persistance et de la bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation.
D'après des renseignements disponibles, il est conclu que l’acide nitrilotriacétique ne satisfait à aucun des critères de l'article 64 de la LCPE (1999).
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
La Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999) exige que les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti) et que l'on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a jugé que l’acide nitrilotriacétique (NTA) est une substance dont l'évaluation des risques pour la santé humaine est hautement prioritaire, car on considère qu'elle présente un REI et elle a été classée par d'autres organismes en fonction de sa cancérogénicité.
Le volet du Défi portant sur le NTA a été publié dans la Gazette du Canada le 31 janvier 2009 (Canada, 2009). En même temps a été publié le profil de cette substance qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements sur les utilisations de la substance ont été reçus en réponse au Défi.
Même s'il a été jugé hautement prioritaire d'évaluer les risques que présente le NTA pour la santé humaine et que cette substance répond aux critères environnementaux de la catégorisation applicables à la persistance, elle ne répond pas aux critères définissant le potentiel de bioaccumulation ou la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables mettent l'accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères au sens de l'article 64 de la LCPE (1999). Les évaluations préalables examinent les renseignements scientifiques et tirent des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.[1]
La présente évaluation préalable finale prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l'exposition à celle-ci, y compris l'information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l'évaluation préalable de cette substance sont tirées de publications originales, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et d'autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en avril 2009 (pour les sections traitant de la santé humaine et de l'environnement). Les études les plus importantes ont fait l'objet d'une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble et de l'information sur les dangers et les risques pour la santé (principalement d'après les évaluations s'appuyant sur la méthode du poids de la preuve effectuées par d'autres organismes, lesquelles qui ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur la marge entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, et ce, dans le contexte d'une évaluation préalable. L'évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'un sommaire de l'information la plus importante afin d'appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes exécutés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'écologie ont fait l'objet d'une étude consignée par des pairs ou d'une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment Bernard Gadagbui, Ph. D. (TERA), Michael Jayjock, Ph. D. (The LifeLine Group) et Chris Bevans, Ph. D. (CJB Consulting). De plus, la version provisoire de la présente évaluation préalable a fait l'objet d'une consultation publique de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable des risques. Les méthodes utilisées dans les évaluations préalables du Défi ont été examinées par un Groupe consultatif du Défi indépendant.
Les principales données et considérations sur lesquelles repose la présente évaluation préalable sont résumées ci-après.
Aux fins du présent document, la substance est appelée « NTA », appellation tirée du nom commun anglais « nitrilotriacetic acid » (acide nitrilotriacétique). Les renseignements liés au NTA sont résumés dans le tableau 1.
Tableau 1. Identité de la substance
| No CAS | 139-13-9 |
| Nom dans la LIS | Acide nitrilotriacétique |
| Noms relevés dans les NCI | Glycine, N,N-bis(carboxymethyl)- (TSCA) Nitrilotriacetic acid (EINECS) |
| Autres noms | Aminotriacetic acid H3NTA Nitrilotris(methylenecarboxylic acid) NTANTA acid Triglycine |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale sous-classe chimique | Acides; amines tertiaires |
| Formule chimique | C6H9NO6 |
| Structure chimique |  |
| SMILES | O=C(O)CN(CC(=O)O)CC(=O)O |
| Masse moléculaire | 191,14 g/mol |
| Abréviations : no CAS (numéro de registre du Chemical Abstracts Service); LIS (liste intérieure des substances); EINECS, (inventaire européen des substances chimiques commerciales existantes); NCI (National Chemical Inventories); SMILES (simplified molecular input line entry specification); TSCA ( inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). Source : National Chemical Inventories (2008). |
|
Dans le cadre de l'évaluation, l'examen des données portant sur le NTA a été complété par l'information relative au sel de trisodium du NTA, connu plus communément sous le nom de nitrilotriacétate de trisodium (no CAS 5064-31-3). Cette substance existe également sous la forme de monohydrate, aussi connue sous le nom de nitrilotriacétate de trisodium monohydraté (no CAS 18662-53-8). Ces deux types de sels de trisodium seront appelés Na3NTA dans la présente évaluation. Bien que la présente évaluation comprenne des renseignements supplémentaires sur Na3NTA, seul le NTA est évalué en fonction des critères énoncés à l'article 64 de la LCPE (1999).
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et estimées) du NTA qui se rapportent à son devenir dans l'environnement. Les études clés à partir desquelles des données expérimentales ont été utilisées pour certaines de ses propriétés ont fait l'objet d'un examen critique afin d'en assurer la validité. Des modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés pour générer des données pour certaines des propriétés physiques et chimiques du NTA. Ces modèles sont principalement fondés sur des méthodes d'addition de fragments; autrement dit, ils s'appuient sur la structure d'un produit chimique donné. Seules les formes neutres d'un produit chimique (c.-à-d. non ionisé) peuvent être fournies comme données d'entrée à ces modèles (forme SMILES); par conséquent, les valeurs modélisées figurant au tableau 2 concernent la forme neutre du NTA.
Tableau 2. Propriétés physiques et chimiques du NTA
| Propriété | Type | Valeur | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Koa, coefficient de partage octanol-air; Kco, coefficient de partage carbone organique-eau; Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide. | ||||
| État physique | Sous forme d'acide non dissocié | Aiguilles ou cristaux prismatiques | OMS, 1996 | |
| Point de fusion (oC) | Expérimental | 242 | PhysProp, 2006 | |
| Modélisé | 296,63 | MPBPWIN, 2008 | ||
| Point d'ébullition (oC) | Modélisé | 429,28 | MPBPWIN, 2008 | |
| 498,2 | ACD/Labs, 2008 | |||
| Masse volumique (kg/m3) | Modélisé | 1610 | 20 | ACD/Labs, 2008 |
| Pression de vapeur (Pa) | Modélisé | 9,54 10-7 | 25 | MPBPWIN, 2008 |
| 3,7 10-9 | 25 | ACD/Labs, 2008 | ||
| Constante de la loi de Henry (Pa·m3/mol) | Modélisé | 1,21 10-11 | 25 | HENRYWIN, 2008 |
| Log Koe (sans dimension) | Modélisé | -3,81 | 25 | KOWWIN, 2008 |
| -1,764 | 25 | ACD/Labs, 2008 | ||
| Log Kco (sans dimension) | Modélisé | -2,02 | KOCWIN, 2008 | |
| Log Koa (sans dimension) | Modélisé | 10,5 | KOAWIN, 2008 | |
| Solubilité dans l'eau (mg/L) | Expérimental | 59 100 | 25 | Yalkowsky et Dannenfelser, 1992 |
| Modélisé | 249 060 | 25 | WATERNT, 2008 | |
| 1 000 000 | 25 | ACD/Labs, 2008 | ||
| pKa (sans dimension) | Modélisé | pKa1 = 10,3 (le plus basique) pKa2 = 3,05 pKa3 = 2,27 pKa4 = 1,49 (le plus acide) |
25 | ACD/pKaDB, 2005 |
Le NTA est un solide blanc à température et à pression ambiantes.
Le programme de modélisation pKaDB de ACD/pKaDB (2005) prévoit que le NTA s'ionise dans l'eau en quatre étapes : en tant que base à la première étape, en attirant un proton du groupe des amines tertiaires, puis en tant qu'acide aux deuxième, troisième et quatrième étapes, en relâchant un proton de chacun des trois groupes hydroxy. On obtient donc quatre valeurs de pKa, présentées dans le tableau 2.
Avec l'accroissement du PH, l'ampleur de l'ionisation du NTA augmente. Dans des eaux ambiantes, les molécules de NTA chargées négativement forment immédiatement des complexes avec les ions métalliques chargés positivement en solution (EURAR, 2005).
Le NTA est une substance anthropique qui n'est pas présente de manière naturelle dans l'environnement. Il est présent dans l'environnement principalement en raison de son rejet dans les eaux usées par des activités de traitement, d'utilisation et d'élimination de ce dernier (Santé Canada, 1990). Le NTA est obtenu grâce à l'acidification du Na3NTA à pH 1-2 (Gousetis et Opgenorth, 2005). Traditionnellement, la production industrielle de Na3NTA suivait un procédé alcalin qui formait un certain nombre de sous-produits (Coker, 1972). Ainsi, un procédé acide a par la suite été élaboré et est aujourd'hui la méthode utilisée par les principaux fabricants. Dans ledit procédé acide, de l'ammoniaque réagit avec du formaldéhyde pour créer de l'hexaméthylènetétramine, qui est par la suite traitée avec du cyanure d'hydrogène dans de l'acide sulfurique pour obtenir du triscyanométhylamine. Le produit intermédiaire cyanuré est ensuite saponifié avec de l'hydroxyde de sodium pour former du Na3NTA (Gousetis et Opgenorth, 2005). À l'échelle mondiale, les deux fabricants principaux de NTA et de ses sels sont BASF, en Allemagne, et Solutia, aux États-Unis (Suresh et Kishi, 2006). Au Canada, cette substance est principalement vendue sous la forme de Na3NTA (Glauser et al., 2007).
Des enquêtes menées récemment auprès de l'industrie par le truchement d'un avis qui a été publié dans la Gazette du Canada conformément à l'article 71 de la LCPE (1999), ont fourni des renseignements pour l'année 2006 (Canada, 2009). Cet avis demandait des données sur la fabrication, l'importation et l'utilisation de quantités de NTA au Canada.
Selon les renseignements transmis en réponse à l'avis, aucune entreprise au Canada n'a déclaré avoir fabriqué du NTA en quantité égale ou supérieure au seuil de déclaration fixé à 100 kg pour l'année civile 2006. Pourtant, selon les déclarations, entre 1 000 et 10 000 kg de cette substance ont été importés au Canada durant cette même année (Environnement Canada, 2009a). La quantité totale de NTA (y compris ses sels) importée au Canada en 2006 se chiffrait à 3,9 millions de kilogrammes selon une autre source (Glauser et al., 2007).
Selon les données transmises en conformité de l'article 71 de la LCPE (1999) et d'autres sources accessibles au public, le NTA est utilisé au Canada dans les produits de nettoyage industriels et institutionnels, les nettoyants pour véhicules, le bitume routier, les engrais, les solutions de révélateurs photographiques et les produits de détartrage utilisés dans les activités d'exploitation minière et pétrolière (Environnement Canada, 2009a). Selon les données proposées par les publications scientifiques disponibles, le NTA est principalement utilisé au Canada dans les produits de nettoyage industriels et institutionnels, qui comprennent : les agents nettoyants génériques, les dégraissants, les nettoyants pour véhicule, les désinfectants, les produits d'hygiène, les détergents à lessive et les détergents pour lave-vaisselle (Mueller et al., 2006; Glauser et al., 2007; Ahmed, 2009). Le NTA est également utilisé au Canada comme chélateur dans divers procédés industriels, notamment le traitement industriel de l'eau de chaudière et le traitement des pâtes et papiers pour la fabrication de produits de papier et de carton (Eichinger, 2005; Gousetis et Opgenorth, 2005; Bellows, 2006; Glauser et al., 2007; courriel de la Direction des aliments adressé au Bureau de gestion du risque de Santé Canada en 2009; source non citée). Auparavant, les publications scientifiques proposaient le NTA comme chélateur thérapeutique en cas de manganisme et comme traitement contre la surcharge en fer (Kaur et al., 1980; Pollack et Ruocco, 1981).
Les quantités totales de NTA utilisées au Canada et déclarées dans le cadre de l'article 71 de la LCPE (1999) se chiffraient entre 1 000 et 10 000 kg pour l'année civile 2006. Selon les données disponibles dans un rapport technique, la quantité totale de NTA (y compris ses sels) importée au Canada en 2006 (soit 3,9 millions de kilogrammes) a été utilisée au cours de la même année (Glauser et al., 2007).
À l'échelle mondiale, l'utilisation du NTA est similaire à celle que l'on retrouve au Canada : elle est principalement concentrée dans les nettoyants industriels et institutionnels. Le NTA est également utilisé dans le monde en tant qu'adoucisseur d'eau dans diverses applications industrielles, comme la prévention de l'entartrage dans l'eau de chaudière, le tannage du cuir, le traitement et le nettoyage des textiles, le placage et le nettoyage des métaux, la production de caoutchouc et la purification de métaux des terres rares (Gousetis et Opgenorth, 2005; NTP, 2005; Bellows, 2006; Glauser et al., 2007).
Précédemment, le Na3NTA était connu pour son utilisation en tant qu'adjuvant pour les détergents à lessive, remplaçant les phosphates lorsque l'eutrophisation est devenue un enjeu planétaire (Lynn, 2009). Si elle a commencé dans les années 1990, l'utilisation du Na3NTA dans les détergents à lessive a ensuite décliné au Canada (Suresh et Kishi, 2006). D'après les renseignements disponibles, la grande majorité des produits ménagers de lessive actuellement sur le marché canadien ne contiendrait plus de Na3NTA (Modler et al., 2007). De plus, cette substance a été décelée dans quelques produits d'entretien ménagers (SCJGSARA, 2009; courriels du Bureau de la gestion du risque adressés au Bureau de l'évaluation des risques de Santé Canada en 2009). À l'heure actuelle, les utilisations principales du Na3NTA au Canada sont similaires à celles du NTA : nettoyants industriels et institutionnels et adoucisseur d'eau dans les procédés industriels. Au Canada comme ailleurs, le Na3NTA est également utilisé dans les préparations pesticides et les produits de soins personnels (Gousetis et Opgenorth, 2005; Glauser et al., 2007; ARLA, 2007; SDC, 2009).
Ni le NTA, ni le Na3NTA ne figurent à la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques (Santé Canada, 2007). Le Na3NTA n'a pas été décelé dans des cosmétiques dans le cadre de l'enquête réalisée en vertu de l'article 71, mais est actuellement inscrit pour 11 produits de soins personnels du Système de déclaration des cosmétiques de Santé Canada (SDC, 2009).
Au Canada, le NTA n'est utilisé comme formulant ou principe actif dans aucun produit antiparasitaire homologué. Toutefois, le Na3NTA est utilisé comme formulant de produits antiparasitaires (ARLA, 2007), mais n'est pas inscrit en tant que principe actif dans le cadre de la base de données sur les produits homologués (ARLA, 2009; courriels de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada adressés au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée).
Le NTA n'est inscrit ni dans la Base de données sur les produits pharmaceutiques (BDPP), ni dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu'ingrédient médicinal ou non médicinal dans les produits pharmaceutiques finaux, dans les produits de santé naturels ou dans les médicaments vétérinaires fabriqués au Canada (courriels de la Direction des produits de santé naturels et la Direction des médicaments vétérinaires de Santé Canada adressés au Bureau de gestion du risque de Santé Canada en 2009, source non citée). Le Na3NTA ne figure pas non plus à la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH), mais est inscrit en tant qu'ingrédient non médicinal dans les désinfectants (courriels du Bureau de gestion du risque de Santé Canada adressés au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée).
Le NTA est une impureté qui se retrouve dans l'acide éthylènediaminetétracétique (EDTA) et ses sels, collectivement connus sous le nom d'édétates (Dow Chemical Company, 1987; Crosbie et al., 2003; Hart, 2005). Les édétates sont des chélateurs qui peuvent être utilisés dans des produits d'entretien ménagers, la composition de cosmétiques, l'alimentation, les produits agricoles, les produits pharmaceutiques et les procédés industriels (Hart, 2005). Les édétates sont également utilisés pour traiter les empoisonnements aux métaux lourds et pour réduire le taux de cholestérol dans le sang (Lanigan et Yamarik, 2002). Selon la pharmacopée des États-Unis (USP, 2000a, b, c), la Pharmacopée européenne (EP, 2001) et le Food Chemicals Codex, le pourcentage pondéral maximal de NTA dans les édétates est de 0,1 % (courriels de la Direction des aliments de Santé Canada adressés au Bureau de gestion du risque de Santé Canada en 2008; source non citée).
Conformément aux publications techniques disponibles (Glauser et al., 2007; Deligiannis et Piccione, 2008), les renseignements fournis en réponse à l'avis donné en vertu de l'article 71 de la LCPE (1999) indiquaient que le NTA n'était pas fabriqué au Canada en 2006. La présence du NTA (et de ses sels) dans l'environnement résulterait principalement de son rejet dans les eaux usées faisant suite à son utilisation en tant que chélateur ou adoucisseur d'eau dans diverses applications (CMI, 1977; Santé Canada, 1990).
Selon les renseignements sur le NTA obtenus en vertu de l'article 71 de la LCPE (1999), les entreprises n'ont déclaré aucun rejet de cette substance dans l'air ou dans les sols en 2006; cependant, 1 000 à 10 000 kg de NTA ont été rejetés dans l'eau au cours de la même année. Les réponses obtenues à la suite de l'avis publié en vertu de l'article 71 ont également permis de constater le transfert de 145 à 14 500 kg de NTA en tant que déchet dangereux ou recyclable vers des installations de traitement des déchets hors site au cours de l'année 2006.
Des renseignements concernant les rejets et l'élimination du NTA au Canada sont également disponibles dans l'Inventaire national des rejets de polluants (INRP). Il faut noter que les chiffres relatifs au NTA présentés par l'Inventaire national des rejets de polluants peuvent également inclure les quantités rejetées et éliminées de sels de NTA. Les rejets totaux sur place et les éliminations totales hors site du NTA (et de ses sels) sont compilés au tableau 3. Il ressort des renseignements obtenus par l'Inventaire national des rejets de polluants que les rejets sur place de NTA (et de ses sels) au Canada n'ont eu lieu que dans l'air, le plus vraisemblablement par l'entremise de matières particulaires, étant donné les propriétés physiques et chimiques du NTA et de ses sels. Les rejets totaux sur place déclarés en 2006 se chiffraient à 177 kg, soit moins que les quantités déclarées en réponse à l'avis émis en application de l'article 71. Les éliminations totales hors site déclarées en 2006, transférées aux usines de traitement des eaux usées municipales en vue de leur élimination définitive, s'élevaient quant à elles à 5 800 kg (INRP, 2006).
Tableau 3. Quantités rejetées et éliminées de NTA (et de ses sels), entre 1994 et 20071,2
| Année | Rejets sur place (en kg) | Total des rejets sur place (en kg) | Total des éliminations hors site (en kg) | |||
|---|---|---|---|---|---|---|
| dans l'air | dans l'eau | dans le sol | dans un milieu indéterminé | |||
| 1 Le seuil de déclaration à l'INRP est fixé à 10 000 kg de NTA utilisés dans le cadre d'activités de fabrication, de traitement ou autres. 2 L'INRP ne rend compte que d'une fraction du total des quantités de NTA et de ses sels utilisées ailleurs (Glauser et al., 2007). |
||||||
| 1994 | - | - | - | 1 000 | 1 000 | 549 |
| 1995 | 25 | - | - | 601 | 626 | 2 000 |
| 1996 | 25 | - | - | 621 | 646 | 1 600 |
| 1997 | 2 600 | - | - | 300 | 2 900 | 2 900 |
| 1998 | 1 700 | - | - | 100 | 1 800 | 1 800 |
| 1999 | 1 900 | - | - | 100 | 2 000 | 3 300 |
| 2000 | 2 000 | - | - | 100 | 2 100 | 18 000 |
| 2001 | 1 500 | - | - | 0 | 1 500 | 14 000 |
| 2002 | 1 600 | - | - | 0 | 1 600 | 2 600 |
| 2003 | 1 300 | - | - | 0 | 1 300 | 7 300 |
| 2004 | 1 300 | - | - | 200 | 1 500 | 6 500 |
| 2005 | - | - | - | 299 | 299 | 14 000 |
| 2006 | - | - | - | 177 | 177 | 5 800 |
| 2007 | - | - | - | 536 | 536 | 5 400 |
Le NTA est présent dans l'environnement principalement sous la forme de complexes métalliques plutôt que sous sa forme d'acide libre (Santé Canada, 1990). Les complexes métalliques formés dépendent de la composition (y compris la teneur en métal) de l'eau. Par exemple, d'après un modèle de formation des complexes ion métallique-NTA, on a prévu qu'à une concentration de 25 µg/L dans l'eau de rivière, 50 % du NTA sera complexé avec les ions de cuivre, 34 % avec les ions de nickel, 9 % avec les ions de calcium et 5 % avec les ions de zinc (McFuff et Mord, 1973).
D'après les propriétés physiques et chimiques du NTA (tableau 2), les résultats de la modélisation de fugacité de niveau III (tableau 4) indiquent que la forme neutre du NTA devrait demeurer principalement dans l'eau et le sol, selon le milieu où elle est rejetée.
Tableau 4. Résultats de la modélisation de la fugacité de niveau III pour la forme neutre (non ionisé) du NTA (EQC, 2003)
| Substance rejetée dans | Fraction de la substance se répartissant dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 0,0 | 20,4 | 79,6 | 0,04 |
| l'eau (100 %) | 0,0 | 99,8 | 0,0 | 0,2 |
| le sol (100 %) | 0,0 | 16,1 | 83,8 | 0,03 |
Comme la présence du NTA dans l'environnement résulte principalement de son rejet dans les eaux usées, l'évaluation écologique porte sur l'eau et les organismes aquatiques.
Persistance dans l'environnement
Fischer et al. (1974) ont observé, pour le NTA, une demande biologique en oxygène (DBO) dans l'eau après 30 jours de 0 à 4 % par rapport à la demande en oxygène maximale théorique. Cet essai (qui était le fondement d'une décision concernant la persistance pour la catégorisation) porte à croire que la demi-vie du NTA dans l'eau est supérieure à 182 jours (6 mois), soit le critère de la persistance dans l'eau précisé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). Par ailleurs, Santé Canada (1990) a indiqué que le NTA se dégrade rapidement, avec un temps d'élimination dans les lacs et les rivières de 11 jours ou moins, selon des facteurs tels que la concentration du NTA et l'acclimatation des microorganismes. Toutefois, comme il s'agit d'une étude sur le terrain pour laquelle les conditions d'essai ne pouvaient pas être rigoureusement contrôlées, il est possible que des pertes découlant de processus autres que la biodégradation expliquent la disparition du NTA. Les résultats des travaux de Fischer et al. (1974) sont contraires à la plupart des résultats d'autres études sur la dégradation, ce qui indique que le NTA se biodégrade très rapidement dans des conditions aérobie. Il se peut que les résultats des travaux Fischer et al. (1974) aient subi l'influence de la formation de complexes avec des métaux lourds qui peuvent inhiber la dégradation du NTA (EURAR, 2005).
Par conséquent, une méthode du poids de la preuve reposant sur des RQSA (Environnement Canada, 2007) a aussi été appliquée à l'aide des modèles de dégradation présentés au tableau 5. Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et que le NTA devrait être rejeté dans ce milieu, c'est la biodégradation dans l'eau qui a surtout été étudiée. Le tableau 5 résume les résultats des modèles de prédiction RQSA disponibles sur la dégradation dans divers milieux naturels.
Tableau 5. Données estimées concernant la dégradation du NTA
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade and Industry, Japon; s.o., sans objet; t½, demi-vie. 1 Le modèle ne précise pas d'estimation pour ce type de structure. 2 Le résultat s'exprime par une valeur numérique. 3 Les prévisions en matière de demi-vie concernant les modèles BIOWIN et CATABOL sont déterminées en fonction d'Environnement Canada, 2009b. 4 Le résultat s'exprime par un taux de probabilité. |
|||
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2008 | t½ = 1,47 h | <2 |
| Réaction avec l'ozone | AOPWIN, 2008 | s.o.1 | s.o. |
| Eau | |||
| Hydrolyse | HYDROWIN, 2008 | s.o.1 | s.o. |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 3 : enquête d'expert (biodégradation ultime) |
3,622 « Se biodégrade très rapidement » |
<1823 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 4 : enquête d'expert (biodégradation primaire) |
4,442 « Se biodégrade très rapidement » |
<1823 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 5 : MITI probabilité linéaire |
0,754 « Se biodégrade très rapidement » |
<1823 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 6 : MITI, probabilité non linéaire |
0,74 « Se biodégrade rapidement » |
<1823 |
| Biodégradation (aérobie) | CATABOL 2004-2008 % DBO |
% DBO = 0 « se biodégrade lentement » |
>1823 |
Selon les résultats des modèles disponibles et les renseignements signalés par Santé Canada (1990), il est conclu que la demi-vie du NTA dans l'eau est nettement inférieure à 182 jours. D'après un ratio d'extrapolation 1:1:4 de la demi-vie de biodégradation dans l'eau, le sol et les sédiments (Boethling et al., 1995), la demi-vie dans le sol est également inférieure à 182 jours, alors que celle dans les sédiments est inférieure à 365 jours. Cela indique que le NTA ne devrait pas être persistant dans le sol et les sédiments.
Une demi-vie d'oxydation atmosphérique dans l'air de 1,47 heure (tableau 5) démontre que cette substance est susceptible de s'oxyder rapidement. Cela permet de conclure que le NTA n'est pas persistant dans l'air.
En résumé, les données empiriques présentées ci-dessus (Fischer et al., 1974) portent à croire que la demi-vie du NTA dans l'eau est supérieure à 182 jours (6 mois). Ce résultat contredit d'autres études qui estiment l'élimination du NTA dans les eaux des rivières et des lacs à quelques jours ainsi que la plupart des prévisions modélisées figurant au tableau 5 qui indiquent que la substance se biodégrade rapidement. En se basant d'autres études empiriques, la cohérence des prévisions modélisées et en tenant compte de la structure chimique du NTA, qui contient des fragments qui se biodégradent facilement, il est conclu que le NTA ne répond pas aux critères de la persistance dans l'eau, le sol et les sédiments (demi-vies dans le sol et l'eau égales ou supérieures à 182 jours et demi-vie dans les sédiments égale ou supérieure à 365 jours), ni aux critères de la persistance dans l'air (demi-vie dans l'air égale ou supérieure à 2 jours), énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Les valeurs prévues du log Koe du NTA laissent entendre que cette substance chimique est peu bioaccumulable dans le biote (voir le tableau 2 ci-dessus).
Les données limitées sur la bioaccumulation de Na3NTA résumées dans EURAR (2005) indiquent que les FBC de plusieurs espèces aquatiques, y compris les poissons, sont habituellement inférieurs 10 L/kg. Étant donné que l'on disposait de peu de données expérimentales sur le facteur de bioaccumulation (FBA) ou le facteur de bioconcentration (FBC) pour le NTA, une approche prévisionnelle a été adoptée dans le cadre de laquelle on a utilisé les modèles de FBA et de FBC disponibles, tel que l'indique le tableau 6. Selon le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si son FBC ou son FBA s'avère supérieur ou égal à 5 000; toutefois, le calcul des facteurs de bioaccumulation est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances. La modélisation cinétique du bilan massique devrait constituer la méthode de prévision la plus fiable pour déterminer le potentiel de bioaccumulation du NTA, car elle permet une correction du métabolisme dans la mesure où le log Koe de la substance se trouve dans le domaine du log Koe du modèle.
Tableau 6. Prédictions des FBA et des FBC chez les poissons pour le NTA
| Organisme d'essai | Paramètre | Valeur (en poids humide L/kg) | Référence |
|---|---|---|---|
| Poisson | FBA | 0,93 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBA) |
| Poisson | FBC | 0,93 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBC) |
| Poisson | FBC | 8,5 | OASIS Forecast, 2005 |
| Poisson | FBC | 3,2 | BCFBAF, 2008 |
Les données estimées présentées dans le tableau 6 montrent que les potentiels de bioconcentration dans le poisson et de bioamplification dans les réseaux trophiques sont nuls. Les estimations du modèle du FBC et du FBA de Gobas pour le niveau trophique intermédiaire comprennent des estimations des taux de biotransformation (kM = 125 pour 10 g chez le poisson). Santé Canada (1990) indique toutefois que le NTA ne semble pas être métabolisé par les mammifères, chez lesquels un NTA non modifié est éliminé par les voies urinaires. Le FBC de 3,2 L/kg, estimé par BCFBAF (2008) et présenté au tableau 6, n'intègre pas la biotransformation.
D'après les données disponibles, le NTA ne répond pas aux critères de la bioaccumulation (FBA ou FBC ≥ 5000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La démarche suivie dans cette évaluation écologique préalable consistait à examiner les divers renseignements à l'appui et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprenaient les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Comme on a pu le voir précédemment, le NTA n'est pas persistant dans l'air, l'eau, le sol et les sédiments. Il devrait présenter un faible potentiel de bioaccumulation.
Un résumé des données expérimentales sur les effets écologiques est présenté au tableau 7. Ces données indiquent que le NTA, avec des valeurs de toxicité aiguë et chronique supérieures à 1 mg/L, n'est pas très dangereux pour les organismes aquatiques.
Tableau 7. Données empiriques sur la toxicité pour les organismes aquatiques
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50 (dose efficace moyenne), concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50 (concentration létale médiane), concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai; CMEO (concentration minimale avec effet observé), concentration la plus faible d'une substance causant des effets statistiquement significatifs par rapport au groupe témoin dans un essai de toxicité. | ||||
| Algue | Toxicité chronique (5 à 8 jours) | CMEO | 5-510 | ECOTOX, 2006 |
| Daphnie | Toxicité aiguë (24 h) | CE50 | 79-950 | ECOTOX, 2006 |
| Poisson (carpe) | Toxicité aiguë (48 h) | CL50 | 475 | ECOTOX, 2006 |
| Amphibien (Grenouille–léopard du Nord) | Toxicité aiguë (120 h) | CE50 | 60,4 | ECOTOX, 2006 |
La toxicité du sel de trisodium du NTA (no CAS RN 5064-31-3) est relativement similaire à celle du NTA. Les algues (Anabaena flosaquae, Selenastrum capricornutum et Anacystis aeruginosa), avec une toxicité sur 12 jours de 5 mg/L (Sturm et Payne, 1973) sont les organismes aquatiques les plus sensibles à cette substance. Pour les poissons, les valeurs des CL50 après 96 h varient entre 100 et à plus de 300 mg/L concernant le sel de trisodium (Sturm et Payne, 1973; Birge et al., 1979).
Étant donné qu'une part importante du NTA peut être rejetée dans l'eau, un scénario générique a été utilisé pour estimer la concentration (pire éventualité raisonnable) de NTA résultant d'un rejet industriel en utilisant l'outil d'exposition générique industriel – milieu aquatique (Industrial Generic Exposure Tool – Aquatic, ou IGETA) d'Environnement Canada. La valeur de concentration environnementale estimée (CEE) obtenue était de 0,05 mg/L. Des renseignements détaillés concernant les données utilisées pour estimer cette concentration et les résultats obtenus par le modèle sont proposés dans le rapport d'Environnement Canada (2009c).
D'anciennes données de surveillance sont disponibles pour les eaux de surface canadiennes et les effluents des usines de traitement des eaux usées des municipalités. Matheson (1977) a présenté des données de surveillance relatives au NTA à partir d'eaux prélevées dans tout le Canada entre 1971 et 1975. La concentration relevée la plus importante se chiffrait à 0,35 mg/L dans un échantillon provenant du port de Hamilton, en Ontario. Woodiwiss et al. (1979) ont quant à eux relevé des concentrations de NTA dans les cours d'eau du sud de l'Ontario entre 1971 et 1975. La concentration la plus importante se chiffrait à 3,36 mg/L dans un ruisseau en aval d'un émissaire d'évacuation. Woodiwiss et al. (1979) ont relevé des concentrations pouvant atteindre 10,5 mg/L dans les effluents de douze collectivités du sud de l'Ontario. Matheson (1977) a quant à lui relevé des concentrations pouvant atteindre 2,8 mg/L dans les effluents provenant de l'usine de traitement des eaux usées d'Hamilton, en 1973, avant qu'un deuxième traitement soit mis en place dans l'installation. Dans ces études, les concentrations relevées de NTA découleraient de l'utilisation du NTA lui-même et de son sel de sodium. En outre, elles ne seraient pas représentatives des concentrations actuelles étant donné l'utilisation du NTA et de ses sels en 2006 sur le marché canadien (3,9 millions de kilogrammes; Glauser et al., 2007) est à peu près sept fois moins qu'en 1977 (IJC, 1977).
Des données de surveillance plus récentes et représentatives ont été recueillies uniquement pour les effluents des usines de traitement des eaux usées des municipalités canadiennes. Lee et al. (1996) ont signalé des concentrations de NTA atteignant 0,589 mg/L dans l'effluent final de huit usines de traitement des eaux usées de municipalités du Sud de l'Ontario ainsi que de certaines usines de pâtes et papiers de l'Ontario et du Québec. En supposant un facteur de dilution de 10, ces données portent à croire que les concentrations dans les eaux de surface au Canada résultant de l'utilisation de NTA et de ses sels peuvent atteindre 0,059 mg/L.
On a déterminé une valeur prudente de la concentration estimée sans effet (CESE) à partir de la valeur de la toxicité la plus faible. La concentration minimale avec effet observé (CMEO) chronique pour les trois espèces d'algues vertes a été constatée par Millington et al. (1988) et se chiffrait à 5 mg/L. Cette valeur a été choisie en tant que valeur critique de toxicité et divisée par un facteur d'évaluation de 10 pour traduire les incertitudes associées à la variabilité interspécifique et intraspécifique de la sensibilité et à l'extrapolation d'une valeur sans effet sur le terrain à partir d'une CMEO observée en laboratoire. La CESE obtenue était de 0,5 mg/L.
Le quotient de risque prudent (CEE/CESE) de 0,1 (0,05/0,5) en résultant indique qu'il est peu probable que les expositions soient suffisamment élevées pour être nocives pour les organismes aquatiques. Étant donné que la majorité des rejets de cette substance seraient émis dans l'eau sur des sites industriels de fabrication et comme les résultats de la modélisation de la fugacité montrent que la majeure partie de la substance rejetée dans l'eau restera dans ce milieu, il est peu probable que des organismes d'autres sites ou d'autres milieux y soient exposés.
Il est donc peu probable que le NTA cause des effets écologiques nocifs au Canada.
Incertitudes dans l'évaluation des risques pour l'environnement
Des hypothèses prudentes ont été proposées en réponse aux incertitudes subsistant dans l'évaluation. Une incertitude clé est liée au manque de données empiriques récentes sur les concentrations d'eau de surface au Canada, lequel a été traité en prédisant une CESE dans l'eau à l'aide d'un modèle d'exposition industrielle.
Il existe des incertitudes liées à l'utilisation des modèles RQSA pour estimer la persistance et la bioaccumulation. En outre, les valeurs estimées de certaines propriétés physiques et chimiques clés (notamment la pression de vapeur et le log Koe) ont été utilisées en tant que données d'entrée dans les modèles.
Il existe également une incertitude à propos de l'étude sur la toxicité. La concentration minimale avec effet observé (CMEO) de 5 mg/L constatée par Millington et al. (1988) était la concentration la plus faible en condition d'essai; ainsi, aucune concentration sans effet observé n'a été définie. De plus, l'étude n'a pas noté l'importance de la baisse de croissance chez les algues, seulement le fait que cette baisse était statistiquement significative (P = 0,95) par rapport au groupe témoin. Cela ne permet pas de juger si la CESE représente un seuil de concentration toxique.
Puisque les paramètres toxicologiques du NTA et de ses sels de sodium sont similaires et que leur dissociation génère un groupe caractéristique commun (nitrilotriacétate), il a été jugé que le nitrilotriacétate était un groupe caractéristique commun présentant un intérêt toxicologique (voir la figure 1). Par conséquent, des études toxicologiques utilisant le NTA et le Na3NTA ont été prises en compte dans la présente évaluation préalable. Les données provenant d'études sur des sels formés de divers cations tels que le calcium, le magnésium, l'aluminium, le zinc et le fer n'ont pas été incluses. Ces autres sels de NTA n'étaient pas non plus inclus dans l'ébauche du rapport d'évaluation des risques de l'Union européenne (EURAR, 2008).
Figure 1. Dissociation du NTA et du Na3NTA en cations et en nitrilotriacétate, un groupe caractéristique commun présentant un intérêt toxicologique

Dans les produits de consommation, les estimations de l'exposition ont été calculées pour le nitrilotriacétate dont le NTA et le Na3NTA sont des formes contributives. Dans l'environnement, le NTA et le Na3NTA ne peuvent être distingués. Cela est dû au fait que le NTA et le Na3NTA sont convertis en un dérivé d'ester commun; c'est ce dernier qui fait l'objet de mesures analytiques.
Bien que la présente évaluation propose des renseignements sur le NTA et ses sels de sodium, ses conclusions ne concernent que le NTA; les renseignements liés au Na3NTA ne constituent que de la documentation complémentaire.
Évaluation de l'exposition
Milieux naturels et nourriture
Comme il en a été fait mention précédemment, le NTA et le Na3NTA ne peuvent être distingués de façon analytique dans les mesures environnementales. Par souci de simplicité et comme la substance à analyser ne peuvent se distinguer, les espèces chimiques quantirés durant cette anlayse chimique seront appelées NTA dans la présente section.
Aucune donnée concernant les concentrations mesurées de NTA dans l'air, le sol ou les aliments n'a été trouvée. Au contraire, nombreuses sont les études présentant des concentrations chiffrées de NTA dans les eaux potables municipales traitées, les eaux de surface, les eaux souterraines et les eaux industrielles (Matheson, 1977; Malaiyandi et al., 1979; Anderson et al., 1985).
Un programme national de surveillance a permis de relever les concentrations de NTA dans l'eau potable finie et les eaux souterraines de municipalités canadiennes de 1972 à 1975 en vue d'analyser les effets sur l'environnement et la santé publique du remplacement des phosphates par du Na3NTA dans les détergents à lessive (Matheson, 1977). Au début des années 1970, au Canada, le Na3NTA était présent dans la composition des lessives selon un pourcentage pondéral moyen de 6 % (Anderson et al., 1985). Dans les eaux potables municipales traitées, dans la plupart des cas, le NTA restait indétectable (limite de détection : 10 µg/L); la concentration maximale, se chiffrant à 80 µg/L, a été mesurée dans un échantillon provenant de Granby, au Québec, prélevé en 1975. De même, le NTA n'a pas été détecté dans la plupart des échantillons provenant des réserves municipales d'eau souterraine.
Une étude canadienne distincte a été menée par Malaiyandi et ses collaborateurs au cours de l'hiver 1976-1977, une saison durant laquelle des niveaux plus élevés de NTA étaient escomptés en raison d'une biodégradation moindre (Malaiyandi et al., 1979). Au moment de cette étude, le niveau moyen de Na3NTA dans les détergents à lessive au Canada représentait un pourcentage pondéral de 15 % (Anderson et al., 1985). La concentration de NTA dans l'eau potable et les eaux brutes a été calculée dans 70 municipalités disséminées dans tout le pays. À l'échelle nationale, la concentration moyenne de NTA dans l'eau potable se chiffrait à 2,82 µg/L; les résultats se situaient dans une fourchette allant de niveaux inférieurs à la limite de détection (0,2 µg/L) à 20,4 µg/L. La concentration moyenne de NTA dans les réserves d'eau, calculée à partir de puits appartenant à des particuliers, était de 3,88 µg/L (fourchette : < 0,2 à 33,5 µg/L).
Pour 10 villes canadiennes, Malaiyandi et ses collaborateurs ont comparé leurs résultats de l'hiver 1976-1977 avec les données recueillies précédemment entre 1972 et 1975 (Matheson, 1977). Ils ont ainsi démontré que les concentrations de NTA les plus récentes étaient généralement inférieures ou égales à ces mesures passées. Il en ressortait que le NTA ne s'accumulait pas dans les réserves d'eau potable canadiennes alors même que la concentration de Na3NTA dans la composition des lessives avait augmenté. Ces conclusions ont été confirmées par une étude canadienne distincte menée en 1983 sur les concentrations de NTA dans des puits appartenant à des particuliers en Ontario et en Colombie-Britannique (Procter & Gamble Company, 1983a). Soixante-quinze pour cent des échantillons présentaient des concentrations de NTA inférieures à la limite de détection (1 µg/L); l'un des échantillons ontariens se chiffrant à 2,7 µg/L et les échantillons restant, provenant de Colombie-Britannique, affichant une concentration moyenne de 3,6 µg/L.
La concentration maximale de NTA dans l'eau potable traitée observée dans l'étude canadienne de l'hiver 1976-1977, s'élevant à 20,4 µg/L (Malaiyandi et al., 1979), a été utilisée pour calculer les estimations de l'exposition. À titre de comparaison, la concentration maximale admissible de NTA dans l'eau potable définie par les Recommandations pour la qualité de l'eau potable au Canada est de 400 µg/L (Santé Canada, 2008).
Les concentrations de NTA dans l'eau potable traitée et les eaux souterraines ont également été mesurées aux États-Unis au début des années 1970 (NTA indétectable dans la plupart des échantillons; 4,6 % des échantillons affichaient des concentrations situées entre 25 et 125 µg/L) et au début des années 1980 (fourchette : < 1 à 7 µg/L) ainsi qu'en Europe au cours des années 1990 (fourchette : < 1 à 3 µg/L). De la même façon que pour les résultats des études canadiennes, le NTA n'a pas été détecté dans la plupart des études américaines alors que des concentrations plus importantes ont été décelées dans des puits peu profonds (Procter & Gamble Company, 1972, 1981, 1982, 1983b, c; Stabel, 1998; Schmidt et al., 2004).
Le NTA a également été mesuré dans des eaux de surface non traitées aux États-Unis et en Europe (Voulgaropoulos et Tzivanakis, 1992; Pietsch et al., 1995; Kiessling et Kaluza, 1997; Ding et al., 1999; Schmidt et al., 2004) ainsi que dans des eaux industrielles au Canada (fourchette : < 0,5 à >10 000 µg/L), aux États-Unis (fourchette : 30 à 2 400 µg/L) et en Europe (fourchette dans un effluent typique : 100 à 2 000 µg/L) (Matheson, 1977; Woodiwiss et al., 1979; Anderson et al., 1985; Voulgaropoulos et Tzivanakis, 1992; Garric et al., 1996; Lee et al., 1996; Knepper, 2003; EURAR, 2005).
À l'échelle industrielle, le NTA est utilisé comme adoucisseur d'eau dans le traitement des pâtes et papiers pour la fabrication de produits de papier et de carton tels que ceux utilisés dans l'emballage alimentaire. On estime que les niveaux de NTA dans ces produits finis d'emballage sont infimes. Par conséquent, toute exposition liée dans ce cas à la migration dans les aliments serait négligeable (courriel de la Direction des aliments de Santé Canada adressé au Bureau des substances existantes de Santé Canada en 2009; source non citée).
Le NTA est également utilisé comme agent de détartrage dans le traitement de l'eau de chaudière en vue de prévenir tout entartrage (Gousetis et Opgenorth, 2005). On retrouve cette utilisation dans l'industrie alimentaire, lorsque de la vapeur est générée et peut entrer en contact avec la nourriture au moment de sa transformation (AMT, 1995; Bellows, 2006). Étant donné que les points de fusion et d'ébullition du NTA s'établissent respectivement à 242 oC et à 429 oC, on estime que la contamination des aliments par le NTA au cours de leur transformation par des procédés utilisant de la vapeur est négligeable (courriel de la Direction des aliments de Santé Canada adressé au Bureau des substances existantes de Santé Canada en 2009; source non citée).
On peut retrouver le NTA en tant qu'impureté dans les sels de disodium et de calcium disodique de l'EDTA de qualité alimentaire dont l'utilisation est permise en tant qu'agents de séquestration dans bon nombre d'aliments dans le cadre du Règlement sur les aliments et les drogues. Ledit règlement demande à ce que les additifs alimentaires répondent aux spécifications de pureté figurant dans le Food Chemicals Codex. Ainsi, l'EDTA de qualité alimentaire ne peut contenir plus de 0,1 % de NTA par poids. Vu la limite maximale de NTA dans l'EDTA de qualité alimentaire et des niveaux maximaux utilisés pour l'EDTA dans les aliments préconisés par la Loi sur les aliments et drogues, l'exposition au NTA par l'entremise de la nourriture, si elle existe, est estimée négligeable (courriel de la Direction des aliments de Santé Canada adressé au Bureau de gestion du risque de Santé Canada en 2009; source non citée).
Les valeurs estimatives de la limite supérieure de l'absorption journalière de NTA chez divers groupes d'âge de la population générale sont indiquées à l'annexe 1. La concentration maximale de NTA dans l'eau potable traitée observée dans l'étude canadienne de l'hiver 1976-1977, s'élevant à 20,4 µg/L (Malaiyandi et al., 1979), a été utilisée pour calculer les estimations de l'exposition qui se situent entre 0,41 µg/kg p.c. (kilogramme de poids corporel) par jour pour les personnes âgées de 12 à 19 ans, et 2,18 µg/kg p.c. par jour pour les nourrissons nourris au lait maternisé âgés de 0 à 6 mois. Les estimations présentées à l'annexe 1 sont considérées comme prudentes et représentant des surestimations de l'exposition humaine au NTA. En effet, si le Na3NTA a été utilisé de façon intensive pour remplacer les adjuvants au phosphate dans les années 1970 (époque à laquelle ont été réalisées les études), son utilisation dans les détergents à lessive au Canada a chuté brutalement au milieu des années 1990 (Suresh et Kishi, 2006; Glauser et al., 2007; Zoller, 2009). En 2006, l'utilisation du NTA et de ses sels sur le marché canadien (3,9 millions de kilogrammes) était environ sept fois moins importante que celle observée en 1977 (> 27 millions kilogrammes) (CMI, 1977). Cette réduction peut être mise en parallèle avec la tendance générale observée de diminution des niveaux de NTA dans diverses sources d'eau.
On peut estimer avec confiance que l'exposition alimentaire est négligeable pour tous les groupes d'âge et que les estimations de la limite supérieure d'exposition protègent de façon adéquate la population générale canadienne. C'est parce que les estimations de l'exposition ont été calculées en utilisant la concentration maximale de NTA (20,4 µg/L) dans l'eau potable observée dans l'étude canadienne de l'hiver 1976-1977 (Malaiyandi et al., 1979). En outre, on prévoit que les niveaux actuels dans l'eau potable seront moins élevés en raison de l'utilisation en forte diminution du NTA depuis les années 1970. Comme les données de surveillance canadiennes concernant le NTA dans l'eau potable municipale traitée sont très complètes, mais vieillissantes et représentatives d'une période où le NTA était utilisé en abondance, le degré de confiance associé à l'exposition au NTA par l'ingestion d'eau potable est considéré comme modéré. Bien qu'aucune donnée ne soit disponible concernant la concentration de NTA dans d'autres milieux environnementaux, on estime que l'eau potable est le facteur le plus important d'exposition humaine au NTA en raison des propriétés physiques et chimiques de cette substance et de l'utilisation à grande échelle de cette dernière en tant qu'adoucisseur d'eau.
Produits de consommation
Selon les renseignements à notre disposition, le Na3NTA est utilisé plus communément que le NTA dans les produits de consommation.
On retrouve le Na3NTA dans les produits de soins personnels énumérés au tableau 8. On estime que ces produits sont utilisés fréquemment (SDC, 2009). Les concentrations maximales constatées dans ces produits ont été utilisées pour calculer les estimations de l'exposition liée à l'utilisation des produits de consommation. Les expositions par voie cutanée et par inhalation ont été estimées en utilisant la version 4.1 de ConsExpo (ConsExpo, 2006). De plus amples renseignements sont fournis à l'annexe 2.
Dans le cadre d'une étude sur le métabolisme chez un singe de laboratoire ayant absorbé du disodium NTA par voie orale, 14 % de la dose administrée a été récupérée dans ses urines (Michael et Wakim, 1971). Dans une étude distincte sur le métabolisme chez l'homme, l'absorption de nitrilotriacétate par voie orale s'élevait à 12 % (selon la concentration dans les urines), et la récupération de la substance à partir des urines, des selles et du dioxyde de carbone expiré s'élevait à 89 % chez les hommes volontaires soumis à des doses uniques de 10 mg14C[Na3NTA] (Budny et Arnold, 1973). La pénétration dans la peau du Na3NTA a fait l'objet d'études in vitro en Union Européenne à l'aide de Na3NTA radiomarqué (EURAR, 2008). Dans l'ébauche du rapport d'évaluation des risques (EURAR, 2008), le taux d'absorption du Na3NTA à partir de solutions diluées se situait entre 0,042 % et 0,472 %; par conséquent, l'Union européenne a utilisé un taux d'absorption prudent de 1 % pour la caractérisation des risques liés aux solutions diluées de Na3NTA. Pour les produits présentant des concentrations de Na3NTA plus importantes, l'Union européenne a utilisé un taux d'absorption plus élevé (10 %) fondé par défaut sur les propriétés physicochimiques. En appliquant la méthode du poids de la preuve découlant de la faible absorption orale chez les primates et le faible taux d'absorption cutanée observés in vitro, un taux d'absorption cutanée prudent (10 %) a été choisi.
Tableau 8. Expositions estimées1 au Na3NTA (pourcentage pondéral maximal de 0,1 %) liées aux produits de soins personnels utilisés fréquemment (SDC, 2009)
| Produit de consommation | Fréquence d'utilisation (nombre d'applications par année) | Voie cutanée2 (mg/kg p.c. par jour) |
|---|---|---|
| 1 Poids du corps estimé : 70,9 kg (Santé Canada, 1998). 2 Taux d'absorption cutanée estimé : 10 % (EURAR, 2008). 3 L'exposition par inhalation due à l'utilisation de parfum a été jugée minimale (5,24 × 10-7 mg/kg p.c. par jour). 4 Calculé, dans le cadre de la limite supérieure d'exposition, pour les femmes utilisant de la poudre compacte de maquillage pour le visage. |
||
| Poudre compacte de maquillage pour le visage (femmes uniquement) | 365 | 0,00425 |
| Parfum3 | 1 095 | 0,00145 |
| Shampooing | 260 | 0,0201 |
| Nettoyant pour la peau (corps) | 329 | 0,000619 |
| Nettoyant pour la peau (visage) | 730 | 5,65 ´ 10-5 |
| Total4 | 0,0265 Na3NTA ou 0,0197 NTA | |
La pression de vapeur du NTA et de ses sels est très faible. Par conséquent, l'exposition par inhalation au NTA et à ses sels à partir d'évaporations provenant de solutions est jugée négligeable (voir l'annexe 2). Cette estimation est cohérente avec celle d'autres évaluations des risques liés aux sels de NTA qui laissent entendre également une exposition par inhalation négligeable (CanTox Inc., 1996; EURAR, 2008). Il existe une exception lorsque la formation d'aérosols est possible, comme c'est le cas lors de l'utilisation de produits en aérosols. Ce scénario a été pris en compte dans cette évaluation.
L'exposition maximale estimée découlant de l'utilisation de l'un des produits énumérés au tableau 8 s'élève à 0,0201 mg/kg p.c. par jour (correspondant à l'absorption cutanée résultant de l'utilisation d'un shampooing). Au total, l'exposition au Na3NTA se chiffre à 0,0265 mg/kg p.c. par jour; la conversion de ce total en équivalents de NTA, en vue de calculer la marge d'exposition, se traduit par une exposition de 0,0197 mg/kg p.c. par jour.
Le Na3NTA a également été décelé dans un produit d'entretien ménager multiusage. L'exposition au Na3NTA par l'entremise de ce produit a été jugée négligeable (voir l'annexe 2).
En plus des produits de soins personnels fréquemment utilisés énumérés dans le tableau 8, le Na3NTA a été décelé dans les autres produits de consommation énumérés au tableau 9. On estime que ces derniers sont utilisés de façon occasionnelle. Les concentrations maximales constatées dans ces produits ont été utilisées pour calculer les estimations de l'exposition (SDC, 2009).
Tableau 9. Expositions estimées1 au Na3NTA liées aux produits de soins personnels utilisés occasionnellement
| Produit de consommation | Concentration maximale de Na3NTA (pourcentage pondéral [%]) | Fréquence d'utilisation (par an) | Concentration moyenne par événement (mg/m3) | Exposition cutanée4 (mg/kg p.c.) |
|---|---|---|---|---|
| Abréviation : s.o., sans objet. 1 Poids du corps estimé : 70,9 kg (Santé Canada, 1998). 2 SDC (2009). 3 SCJGSARA (2009). Expositions estimées lors de la vaporisation (v) et du nettoyage (n). 4 Taux d'absorption cutanée estimé : 10 % (EURAR 2008). |
||||
| Colorant capillaire, semi-permanent2 | 0,3 | 13 | s.o. | 0,000685 |
| Lotion pour les pieds pour pédicure (femmes uniquement)2 | 0,1 | 156 | s.o. | 0,00656 |
| Protecteur de vernis à ongles pour manucure (femmes uniquement)2 | 0,1 | 156 | s.o. | 0,000121 |
| Nettoyant pour salle de bain3 | 1 | 52 | 0,000229 (v) | 0,000973 (v) 0,00423 (n) |
| Total | 0,000229 | 0,0126 | ||
L'exposition la plus élevée découlant de l'utilisation d'un seul des produits énumérés au tableau 9 s'élève à 0,00656 mg/kg p.c. par jour (correspondant à l'utilisation d'une lotion pour pieds pour pédicure). Toutefois, en raison du manque de données relatives au modèle d'utilisation des lotions pour pieds pour pédicure, la confiance dans cette estimation est faible.
On estime que les expositions potentielles cutanées et par inhalation découlant de l'utilisation de produits antiparasitaires de type insecticides ou acaricides contenant du Na3NTA sont minimes. Il en va de même pour les expositions cutanées et par voie orale découlant de l'utilisation de produits algicides pour piscine contenant du Na3NTA (voir l'annexe 2).
Tous les produits de consommation cités jusqu'à présent dans ce chapitre contiennent du Na3NTA. Comme on a pu le voir dans la section intitulée Utilisations », le NTA est utilisé dans les solutions de révélateurs photographiques. L'utilisation de ces produits est considérée comme professionnelle ou parfois de loisir; ainsi, il est jugé qu'elle ne contribue pas à l'exposition de la population générale au NTA. Il a également été indiqué que le NTA représentait une impureté commune dans les édétates. Selon les renseignements à notre disposition, la présence de NTA résulte généralement d'une telle contamination. On estime que seules des traces de NTA seraient trouvées dans des produits de consommation contenant des édétates comme les engrais, seul type de produits de consommation connu pour lequel le NTA entre dans la composition. L'exposition au NTA par l'entremise de traces d'impuretés dans ces produits a été jugée minime (voir l'annexe 2).
Par conséquent, la confiance portée dans les résultats chiffrés des estimations de l'exposition provenant de produits de consommation est moyenne à faible en l'absence de données expérimentales, mais la confiance reste élevée s'agissant de l'exposition minimale au NTA et à ses sels liée à de tels produits.
Évaluation des effets sur la santé
Un résumé des renseignements disponibles quant aux effets sur la santé du NTA et de ses sels de sodium est donné à l'annexe 3.
Sur la base des études menées sur des animaux de laboratoire, le NTA et ses sels de sodium ont été classés par le Centre international de recherche sur le cancer (CIRC, 1990, 1999) comme substance cancérogène du groupe 2B (« substances pouvant être cancérogènes pour l'homme »). La Commission européenne a classé le Na3NTA (no CAS RN 5064-31-3) comme substance cancérogène de catégorie 3, avec mention de risque R40 (« Effet cancérogène suspecté –preuves insuffisantes ») [Commission européenne, 2007; EURAR, 2008]. Le National Toxicology Program des États-Unis (NTP) classe le NTA parmi les « substances dont on peut raisonnablement présumer qu'elles sont cancérogènes pour l'homme », d'après les éléments suffisants disponibles sur la cancérogénicité sur des animaux de laboratoire (NTP, 2005). Dans les Recommandations pour la qualité de l'eau potable au Canada, le NTA a été classé dans le groupe IIIB (« substances pouvant être cancérogènes pour l'homme »), « étant donné que le NTA n'induit des tumeurs [rénales] qu'à des doses supérieures aux doses néphrotoxiques » (Santé Canada, 1990). La cancérogénicité du NTA et de ses sels de sodium a été démontrée pour la voie orale; aucune toxicité à long terme n'a été mise en évidence pour les voies respiratoires ou la voie cutanée (EURAR, 2008).
Deux essais biologiques visant à déterminer la cancérogénicité du Na3NTA et un pour le NTA ont été menés sur des rats F344 (NCI, 1977). Dans l'un de ces essais biologiques, une augmentation importante des néoplasmes primaires du tractus urinaire a été signalée chez les mâles et les femelles de rats exposés à des doses de 20 000 ppm de Na3NTA dans leur régime alimentaire pendant une période de 24 mois. Une augmentation marginale des lésions hyperplasiques et dysplasiques a pu être observée à une dose de 200 ppm de Na3NTA (soit 10 mg/kg p.c. par jour); cette augmentation était plus marquée lorsque la dose passait à 2 000 ppm de Na3NTA (soit 100 mg/kg p.c. par jour) et plus.
Dans les deux autres essais biologiques, les rats F344 ont été exposés par voie orale à des doses de 0, 7 500 ou 15 000 ppm de Na3NTA ou de NTA pour une période de 18 mois suivie d'une période de rétablissement de 6 mois. Pour les mâles comme pour les femelles, une augmentation importante des néoplasmes primaires du tractus urinaire a été signalée dans les groupes traités au NTA tandis qu'une augmentation (pas importante sur le plan statistique) de tumeurs du même type a été constatée dans le groupe traité au Na3NTA. Des adénomes hépatocellulaires ainsi que des phéochromocytomes surrénaux ont également été observés chez des femelles exposées à des doses élevées de NTA (NCI, 1977). Une hausse importante du nombre d'adénomes et d'adénocarcinomes rénaux a également pu être constatée chez des rats mâles Sprague-Dawley exposés à une dose de 0,1 % de Na3NTA (soit 100 mg/kg p.c. par jour) dans leur eau d'abreuvement pendant une durée de 704 jours (Goyer et al., 1981).
Chez les souris, une importante augmentation des tumeurs rénales, principalement des adénocarcinomes des cellules des tubules rénaux, a été signalée chez les femelles exposées à des doses élevées et chez les mâles (exposés à des doses élevées ou faibles) de 0, 7 500 ou 15 000 ppm de NTA dans leur nourriture pendant une période de 24 mois suivie d'une période de rétablissement de 3 mois. Lorsque les souris ont été exposées au Na3NTA à des doses de 0, 2 500 ou 5 000 ppm dans leur nourriture pendant la même période d'exposition, aucune tumeur du tractus urinaire n'a été observée, mais des tumeurs hématopoïétiques ont été signalées chez des sujets mâles (NCI, 1977).
En ce qui concerne les tumeurs du tractus urinaire, NCI (1977) émet l'hypothèse qu'elles peuvent être dues à un effet localisé qui ne peut résulter que de fortes concentrations [de NTA ou de Na3NTA] ». NCI (1977) n'a tiré aucune conclusion concernant l'importance de l'apparition des tumeurs autres que celles touchant le tractus urinaire.
Les effets d'agent promoteur de tumeurs du Na3NTA ont également été signalés dans plusieurs études en deux étapes d'initiation-promotion. Le développement accéléré de tumeurs dans le système urinaire a été observé chez les souris et les rats traités au préalable avec une substance carcinogène pour les reins, la nitrosamine, puis exposés par voie orale au NTA ou au Na3NTA pendant 28 à 30 semaines. L'apparition d'hyperplasies du système urinaire associées au traitement pendant des périodes plus courtes, comparées aux études à long terme cité ci-dessus (uniquement du NTA ou du Na3NTA administré), a également été signalée dans ces études (Hiasa et al., 1984, 1985a, b; Kitahori et al., 1985, 1988; Matsuki et al., 1992).
In vitro, les essais concernant l'induction de mutations géniques chez les bactéries et les champignons par le NTA et le Na3NTA se sont révélés négatifs tandis que seul le NTA s'est révélé négatif au SOS chromotest (voir l'annexe 3 pour de plus amples renseignements et références). Le Na3NTA n'a pas provoqué de mutation génique ou de transformation cellulaire dans des cellules de mammifères (Celotti et al., 1987; Mitchell et al., 1988; Myhr et Caspary, 1988). Toutefois, des résultats positifs ont été observés avec le NTA (Nesslany et al., 2008). On a pu observer dans des lymphocytes humains exposés au NTA ou au Na3NTA des résultats variables concernant l'induction d'aberrations chromosomiques et de micronoyaux (Montaldi et al., 1987, 1988; Nesslany et al., 2008). L'induction de micronoyaux s'est avérée positive dans les lignées cellulaires de la souris ainsi que dans les cellules primaires du rein et de l'urothélium chez l'homme et chez le rat lorsque ces cellules étaient exposées au NTA (Robbiano et al., 1999, 2002; Nesslany et al., 2008). Le NTA et le Na3NTA n'ont pas induit d'échange de chromatides sœurs ou de synthèse d'ADN non programmée dans les lignées cellulaires de mammifères (Brat et Williams, 1984; Montaldi et al., 1985).
Dans les études in vivo, le NTA et le Na3NTA n'ont pas induit de mutations dans les cellules germinales du Drosophila melanogaster, mais ont (faiblement) induit une aneuploïdie méiotique et une mutation somatique. Ces substances n'ont pas entraîné de mutations létales dominantes, mais ont induit une aneuploïdie dans les spermatocytes de souris après injection intrapéritonéale. Toutefois, elles n'ont pas induit d'aneuploïdie, de micronoyaux ou d'échange de chromatides soeurs dans les cellules de moelle osseuse de la souris in vivo. Certaines études ont constaté que le NTA pouvait endommager l'ADN dans le rein ou la vessie du rat in vivo; néanmoins, des protocoles d'essai non standard ont été utilisés et la relation dose-réponse n'était pas clairement exposée (voir l'annexe 3 pour de plus amples renseignements et références).
Le CIRC (1990, 1999) a conclu que l'acide nitrilotriacétique et ses sels de sodium n'étaient pas génotoxiques dans les systèmes expérimentaux in vivo, à l'exception du fait que l'acide induisait une aneuploïdie dans les cellules germinales de la souris. Ni l'acide, ni ses sels ne se sont avérés génotoxiques pour les cellules de mammifères in vitro. En outre, ce ne sont pas des substances mutagènes pour les bactéries ». Selon les résultats observés dans les cellules somatiques de mammifères in vitro et in vivo, l'Union européenne, dans son ébauche du rapport d'évaluation des risques, déclare qu'« il n'existe aucun élément tangible prouvant la mutagénicité in vivo du NTA et de ses sels de sodium » (EURAR, 2008).
L'élaboration et l'analyse des modes d'action pour les effets toxicologiques induits par le NTA et ses sels de sodium ne sont pas concernées par cette évaluation préalable. Cependant, un mode d'action concernant l'induction de tumeurs du tractus urinaire par le NTA et ses divers sels de sodium a été proposé l'Union européenne dans son ébauche de rapport d'évaluation des risques (EURAR, 2008). Il a été suggéré que le potentiel cancérogène du NTA et du Na3NTA était lié à la stimulation soutenue de la prolifération cellulaire faisant suite à la cytotoxicité induite par les substances; cette hypothèse est fondée sur le fait qu'il n'existe pas de preuve de génotoxicité directe liée au NTA et sur l'incidence accrue de cytotoxicité/d'hyperplasie et de tumeurs observées sur des localisations cibles identiques dans les voies urinaires. Bien que les preuves ne soient pas suffisantes concernant la contribution des cations métalliques et de la formation de complexes de NTA à la cancérogénicité observée, leur implication dans la dérégulation de la croissance des cellules et dans l'apparition accrue de cellules néoplasiques peut être suspectée (EURAR, 2008).
Des données limitées concernant la performance de reproduction ont été signalées dans une étude combinée sur la reproduction et la tératologie. Ses résultats ont indiqué qu'une administration de Na3NTA dans l'alimentation des rats n'avait pas d'effet nocif sur leur performance et leur capacité de reproduction et qu'elle n'induisait pas d'effet sur les embryons ou les fœtus pendant deux générations successives. Des résultats similaires ont été constatés chez les lapins et les souris (Nolen et al., 1971, 1972a, b; Tjälve, 1972).
La dégénérescence hydropique et une dilatation mineure du tubule rénal ont commencé après 6 mois au cours d'une étude de 2 ans menée chez des rats (exposés à des doses de 0 %, de 0,03 %, de 0,15 % ou de 0,5 % de Na3NTA dans leur régime alimentaire). Après 24 mois, une néphrite interstitielle chronique et une néphropathie modérées à graves ont été observées, avec une augmentation de l'incidence et de la gravité liée à la dose administrée de 0,15 % et de 0,5 % de Na3NTA. Il a également pu être observé une augmentation de la concentration de zinc dans l'urine à toutes les doses sauf à la plus faible. Une dose minimale avec effet nocif observé (DMENO) pour le Na3NTA administré par voie orale de 97 mg/kg p.c. (0,15 % de Na3NTA) a été calculée à partir de cette étude (Nixon et al., 1972). Des doses minimales avec effet nocif observé similaires pour le Na3NTA (environ 100 mg/kg p.c. par jour) ont été calculées à partir de deux études (respectivement de 2 ans et de 10 semaines) portant sur l'administration de la substance dans l'eau d'abreuvement chez des rats Sprague-Dawley ainsi qu'à partir d'une étude de 2 ans portant sur l'administration de la substance dans l'alimentation chez des rats F344 (Mahaffey et Goyer, 1972; NCI, 1977; Goyer et al., 1981).
Les études mentionnées ci-dessus montrent que les organes les plus touchés par une administration répétée de NTA ou de Na3NTA par voie orale sont les voies urinaires : des lésions ont été constatées dans les reins, les uretères et la vessie des rongeurs dans les semaines suivant l'administration; la gravité de ces lésions augmentait de concert avec la durée d'administration de la substance (Nixon, 1971; Mahaffey et Goyer, 1972; Nixon et al., 1972; Alden et al., 1981; Merski, 1982; Myers et al., 1982; Kanerva et al., 1984; BASF, 1997a).
Au cours de deux études (respectivement de 4 semaines et de 3 mois) sur l'exposition cutanée chez le lapin, aucune irritation localisée et aucun effet systémique n'ont pu être constatés à des doses 50 mg/kg p.c. par jour de Na3NTA (2,5 % de Na3NTA, la seule dose testée) (Nixon, 1971).
Des renseignements très limités concernant l'exposition par inhalation au NTA figuraient dans une lettre d'un déclarant à la United States Environmental Protection Agency (USEPA). Exposés pendant 4 semaines à une dose de 343 mg/m3 de NTA, les singes traités présentaient des diarrhées. Toutefois, aucune irritation respiratoire ou indisposition n'a été constatée (USEPA, 1980).
Des renseignements limités concernant la toxicité du Na3NTA chez l'homme ont été trouvés. Aucune preuve de sensibilisation n'a été remarquée chez les 66 volontaires soumis à un test épicutané fermé présentant une solution aqueuse à 1 % d'un détergent liquide contenant 20 % de Na3NTA (Nixon, 1971).
L'absorption, la répartition et l'excrétion du NTA et de ses sels de sodium faisant suite à une administration par voie orale ont fait l'objet d'analyses chez le rat, la souris, le lapin, le chien, le singe et l'homme. L'absorption par le tractus gastro-intestinal diffère probablement selon l'espèce : par exemple, l'absorption semble être plus importante chez le rat et le chien que chez le lapin ou le primate. Environ 12 % de la dose administrée étaient excrétés par l'intermédiaire de l'urine chez l'homme, 14 % chez le singe, 23 % chez le lapin, 70 % chez le rat, 80 % chez le chien et 96 % chez la souris. Selon les études menées chez la souris, le rat, le chien et l'homme, au cours desquelles le NTA non modifié est éliminé par les urines, le NTA ne semble pas être métabolisé par les mammifères. Le composé d'origine absorbé est excrété rapidement par l'urine. Moins de 1 % de la dose administrée est excrété par l'air expiré. Après l'absorption, la concentration de NTA la plus élevée a été décelée dans les reins, la vessie et les tissus squelettiques (Michael et Wakim, 1971; Budny, 1972; Tjälve, 1972; Budny et Arnold, 1973; Chu et al., 1978; Anderson et al., 1985; OMS, 1996).
Le niveau de confiance à l'égard de la base de données sur la toxicité du NTA et de ses sels de sodium est jugé modéré à élevé étant donné que des études sur la toxicité aiguë, à court terme, subchronique et chronique, sur la cancérogénicité, sur la génotoxicité et sur la toxicité pour la reproduction et le développement d'une exposition par voie orale sont disponibles, bien que les études sur la cancérogénicité et sur la toxicité pour la reproduction et le développement d'une exposition par inhalation ou cutanée soient limitées.
Caractérisation du risque pour la santé humaine
En s'appuyant principalement sur des évaluations reposant sur le poids de la preuve qui sont réalisées par des organismes internationaux et d'autres organismes nationaux, la cancérogénicité représente un effet critique du NTA pour la caractérisation des risques pour la santé humaine. L'incidence de tumeurs des voies urinaires a augmenté selon la dose administrée dans les études standard sur la cancérogénicité chez les rats et les souris des deux sexes. Selon le poids de la preuve apporté par les données sur la génotoxicité disponibles, le NTA n'est pas considéré comme une substance génotoxique. Bien que le mode d'induction des tumeurs ne soit pas complètement élucidé, il est peu vraisemblable que les tumeurs observées chez les animaux de laboratoire résultent d'une interaction directe avec le matériel génétique (EURAR, 2008). Donc, une approche fondée sur le seuil d'innocuité a été utilisée pour évaluer le risque pour la santé humaine.
Comme les lésions néoplasiques, le NTA et le Na3NTA induisent l'apparition de lésions non néoplasiques principalement dans les reins, les uretères et la vessie des animaux de laboratoire. Il a été noté que des lésions pré-néoplasiques nocives n'apparaissaient principalement qu'à des doses qui induisaient la formation de tumeurs. Une évolution des lésions pré-néoplasiques (dégénérescence, vacuolisation, hyperplasie et dysplasie de l'épithélium) en tumeurs dans le tractus urinaire a été observée chez des rats traités au NTA et au Na3NTA. Par conséquent, des marges d'exposition pour la caractérisation du risque pour la santé humaine sont ainsi calculées à partir des plus faibles degrés d'exposition provoquant ces effets et des estimations de l'exposition de la population au NTA et au Na3NTA.
La dose minimale avec effet nocif observé pour le Na3NTA de 100 mg/kg p.c. par jour (soit 70 mg/kg p.c. par jour sous forme de NTA en unités molaires) découlant d'études à court terme et chroniques a été déterminée dans la base de données sur la toxicité en se basant sur l'hyperplasie des cellules du tubule et des cellules transitionnelles dans les reins, les uretères et la vessie des rats traités (Mahaffey et Goyer, 1972; NCI, 1977; Goyer et al., 1981). Une dégénérescence hydropique des cellules du tubule rénal, une dilatation mineure du tubule et une concentration de zinc en hausse dans les urines ont également été décrites dans une étude chronique sur l'administration de doses similaires par voie orale (soit 97 mg/kg p.c. par jour sous forme de Na3NTA ou 68 mg/kg p.c. par jour sous forme de NTA) (Nixon et al.,1972). Des adénomes et des adénocarcinomes rénaux ont également été constatés chez des rats exposés à une dose de 100 mg/kg p.c. par jour de Na3NTA dans leur eau d'abreuvement pendant une durée de 2 ans (Goyer et al., 1981).
L'une des voies principales d'exposition au NTA serait la voie orale, car la source la plus pertinente d'exposition humaine semble être la consommation d'eau potable étant donné les propriétés physiques et chimiques du NTA. Une comparaison entre la concentration à effet critique pour une toxicité à doses répétées par voie orale (100 mg/kg p.c. par jour sous forme de Na3NTA, soit 70 mg/kg p.c. par jour sous forme de NTA) et l'estimation de la limite supérieure estimative de l'exposition par voie orale de la population générale (2,18 µg/kg p.c. par jour sous forme de NTA), permet d'obtenir une marge d'exposition d'environ 32 000.
L'exposition par voie cutanée provenant de l'utilisation de produits de soins personnels contenant du Na3NTA a également été estimée (voir la section Évaluation de l'exposition »). Étant donné qu'aucune étude sur la toxicité cutanée n'a été trouvée, les effets critiques notés dans les études chroniques sur l'administration de NTA par voie orale ont été rajustés pour qu'ils correspondent aux estimations prudentes d'exposition cutanée découlant de l'utilisation de produits de soins personnels en vue de calculer la marge d'exposition. La concentration à effet critique (100 mg/kg p.c. par jour sous forme de Na3NTA), après correction pour un taux d'absorption cutanée de 10 % (100 mg/kg p.c./10 % = 1 000 mg/kg p.c. par jour), a produit une DMENO pour l'exposition cutanée équivalente de 1 000 mg/kg p.c. par jour sous forme de Na3NTA (soit 700 mg/kg p.c. par jour sous forme de NTA). La comparaison de cette valeur avec une prévision prudente de l'exposition cutanée chronique par l'entremise de produits de soins personnels fréquemment utilisés (0,0197 mg/kg p.c. par jour sous forme de NTA), a permis d'obtenir une marge d'exposition d'environ 35 500.
Même si la DMEO très prudente de 10 mg/kg p.c. par jour sous forme de Na3NTA (soit 7 mg/kg p.c. par jour sous forme de NTA), fondée sur l'augmentation marginale des hyperplasies et des dysplasies des cellules épithéliales des voies urinaires chez les animaux de laboratoire, est utilisée à cette fin, on estime que les marges potentielles d'exposition pour l'exposition par voie orale et par voie cutanée sont importantes (respectivement 3 200 et 3 550).
Bien que des études sur l'exposition cutanée à plus court terme étaient disponibles, les doses les plus élevées utilisées ont seulement permis d'obtenir des doses sans effet nocif observé (DSENO). La comparaison de la DSENO pour l'exposition subchronique (50 mg/kg p.c. par jour sous forme de Na3NTA, soit 35 mg/kg p.c. sous forme de NTA) avec la prévision prudente de l'exposition cutanée chronique (0,0197 mg/kg p.c. par jour sous forme de NTA) a permis d'obtenir une marge d'exposition d'environ 1 770. Si l'étude à court terme avait été extrapoléeà une exposition à plus long terme, étant donné la faible relation dose-réponse dans l'évolution de la toxicité avec le temps (réduite de moitié à partir du niveau d'effet faible de l'étude par voie orale), on pourrait en déduire une DSENO chronique hypothétique de 25 mg/kg p.c. par jour sous forme de Na3NTA (soit 17,5 mg/kg p.c. par jour sous forme de NTA). L'utilisation de cette DSENO (17,5 mg/kg p.c. par jour) permet d'obtenir une marge d'exposition d'environ 900, qui serait toujours considérée comme adéquate pour protéger la santé humaine.
Incertitudes de l'évaluation des risques pour la santé humaine
La portée de la présente évaluation préalable n'inclut pas l'analyse complète du mode d'action du NTA, ni ne prend en compte les différences possibles de sensibilité entre l'homme et les espèces examinées. Bien qu'il n'existe aucune preuve tangible d'une mutagénicité in vivo du NTA et de ses sels de sodium, certains résultats équivoques sont également obtenus dans l'ensemble de données sur la génotoxicité. De plus, il n'y a que très peu d'information disponible sur la toxicité potentielle du NTA à la suite d'une exposition par inhalation et par voie cutanée, de même que pour les études sur la toxicité pour la reproduction et le développement.
Il existe certaines incertitudes à l'égard de l'estimation de l'exposition au NTA découlant de l'environnement et de l'alimentation. Aucune donnée concernant les concentrations mesurées de NTA dans l'air, le sol ou les aliments n'a été trouvée. Cependant, l'exposition de la population à ces sources est probablement négligeable. Par conséquent, les estimations de l'exposition n'ont été calculées qu'à partir des données de surveillance canadiennes datant des années 1970 et relevées dans l'eau potable municipale traitée. Comme les données proviennent d'études de surveillance canadiennes de grande ampleur et comme l'utilisation du NTA a considérablement diminué depuis les années 1970, les estimations de l'exposition au NTA sont jugées prudentes.
Une incertitude existe également quant au manque de renseignements sur la présence ou la concentration de NTA et de Na3NTA dans les produits accessibles au Canada. Les estimations de l'exposition découlant de l'utilisation de produits de consommation contenant du NTA et du Na3NTA ont été basées sur des hypothèses prudentes.
D'après les renseignements contenus dans le présent rapport d'évaluation préalable, le NTA ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nuisible immédiat ou à long terme sur l'environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l'environnement essentiel pour la vie.
À la lumière des renseignements disponibles, il est conclu que le NTA ne pénètre pas dans l'environnement en une quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un risque pour la vie ou la santé humaine au Canada. Par conséquent, il est conclu que le NTA ne satisfait à aucun des critères énoncés à l'article 64 de la LCPE (1999).
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
ACD/Labs. 2008. Logiciel version 8.14 pour Solaris. Toronto (Ont.) : Advanced Chemistry Development.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès : http://www.acdlabs.com/products/phys_chem_lab/pka/. [réserve de consultation]
Ahmed, F.U. 2009. Industrial and institutional cleaners. In : Zoller, U. (éd.), Handbook of detergents. Part E: Applications. Surfactant Science Series, Vol. 141. Boca Raton (FL) : Taylor & Francis. p. 201-286.
Alden, C.L., Kanerva, R.L., Anderson, R.L., Adkins, A.G. 1981. Short-term effects of dietary nitrilotriacetic acid in the male Charles River rat kidney. Vet. Pathol. 18:549-559.
[AMT] Adalia Miljö-och toxikologkunsult. 1995. Nitrilotriacetic acid; trisodium nitrilotriacetate; trisodium nitrilotriacetate monohydrate. Täby (Suède) : Submission to Nordic Steering Group for Assessment of Health Effects of Chemicals.
Anderson, C., Danylchuk, K.D. 1980. The effect of chronic administration of trisodium nitrilotriacetate (Na3NTA) on the Haversian remodelling system in dogs. J. Environ. Pathol. Toxicol. 3:413-420.
Anderson, R.L., Kanerva, R.L. 1978. Hypercalcinuria and crystalluria during ingestion of dietary nitrilotriacetate. Food Cosmet. Toxicol. 16:569-574.
Anderson, R.L., Kanerva, R.L. 1979. Comparisons of response of Fischer-344 and Charles River rats to 1.5% nitrilotriacetic acid and 2% trisodium nitrilotriacetate, monohydrate. Food Cosmet. Toxicol.17:137-140.
Anderson, R.L., Bishop, W.E., Campbell, R.L. 1985. A review of the environmental and mammalian toxicology of nitrilotriacetic acid. CRC Crit. Rev. Toxicol. 15(1):1-102.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2008. Version 1.92. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Liste des produits de formulation de l'ARLA. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consultée le 8 juillet 2009]. Accès : http://www.hc-sc.gc.ca/cps-spc/pubs/pest/_decisions/reg2007-04/index-eng.php
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2009. Base de données des étiquettes de produits de l'ARLA [en ligne]. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consultée le 8 juillet 2009]. Accès : http://pr-rp.pmra-arla.gc.ca/portal/page?_pageid=34,17551&_dad=portal&_schema=PORTAL
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. [en ligne] 22(3):337-345. Accès : http://www3.interscience.wiley.com/journal/104557877/home [réserve de consultation]
Bahnemann, R., Leibold, E., Kittel, B., Mellert, W., Jäckh, R. 1998. Different patterns of kidney toxicity after subacute administration of Na-nitrilotriacetic acid and Fe-nitrilotriacetic acid to Wistar rats. Toxicol. Sci. 46:166-175.
BASF. 1985. Report on the study of acute oral toxicity (Test substance TRILON A 92). Rapport inédit (84/238), daté du 18 mars 1985. Ludwigshafen (Allemagne) : BASF, Département de toxicologie. [cité dans EURAR, 2008].
BASF. 1997a. Screening tests for kidney toxicity with Trilon AS in Wistar rats. No de projet : 25S0109/94021. Ludwigshafen (Allemagne) : BASF. [cité dans EURAR, 2008].
BASF. 1997b. Trilon A 92 –Buehler test in guinea pigs. Rapport inédit (32H0061/952192) daté du 11 déc. 1997. Ludwigshafen (Allemagne) : BASF, Département de toxicologie. [cité dans EURAR, 2008].
BASF. 2004. Cytogenetic study in vivo with Trilon A 92 R. No de projet : 26M0192/024031. Ludwigshafen (Allemagne) : BASF. [cité dans EURAR, 2008].
[BCFBAF] BioConcentration Factor Program for Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BCR] BC Research Inc., Occupational and Environmental Risk Management Group. 2002. Fiche signalétique : Gen-X Micro [en ligne]. Langley (C.-B.) : Grotek. [consulté le 31 août 2009]. Accès : http://www.grotek.net/products/msds.asp
Becking, G.C., Yagminas, A.P. 1978. Relative mammalian toxicity of fulvic acid and trisodium nitritriacetic acid (NTA). Can. Fed. Biol. Soc. Proc. 21:159.
Bellows, J. 2006. Steam [en ligne]. In : Kirk-Othmer encyclopedia of chemical technology, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9780471238966/kirk/article/steabell.a01/current/pdf [réserve de consultation]
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2008. Version 4.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Birge, W.J., Black, J.A., Bruser, D.M. 1979. Toxicity of organic chemicals to embryo-larval stages of fish. EPA-560/11-79-007. U.S. Environmental Protection Agency, Washington (DC). (OECDG Data File).
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Brat, S.V., Williams, G.M. 1984. Nitrilotriacetic acid does not induce sister-chromatid exchanges in hamster or human cells. Food Chem. Toxicol. 22:211-215.
Budny, J.A. 1972. Metabolism and blood pressure effects of disodium nitrilotriacetate (Na2NTA) in dogs. Toxicol. Appl. Pharmacol. 22:655-660.
Budny, J.A., Arnold, J.D. 1973. Nitrilotriacetate (NTA): human metabolism and its importance in the total safety evaluation program. Toxicol. Appl. Pharmacol. 25:48-53.
Budny, J.A., Niewenhuis, R.J., Buehler, E.V., Goldenthal, E.I. 1973. Subacute oral toxicity of trisodium nitrilotriacetate (Na3NTA) in dogs. Toxicol. Appl. Pharmacol. 26:148-153.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, c. 33. Accès : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l'Environnement, ministère de la santé. 2006.Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement, Canada Gazette. Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2009. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du groupe 8 du Défi, Gazette du Canada. Partie I, vol. 143, no 5. Accès : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-01-31/pdf/g1-14305.pdf
CanTox Inc. 1996. Assessment of human exposure to sodium nitrilotriacetate monohydrate from the use of various industrial/institutional and consumer products. Mississauga (Ont.) : Monsanto Company.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. ©2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
Celotti, L., Furlan, D., Seccati, L., Levis, A.G. 1987. Interactions of nitrilotriacetic acid (NTA) with Cr (VI) compounds in the induction of gene mutations in cultured mammalian cells. Mutat. Res. 190:35-39.
Celotti, L., Furlan, D., Ferraro, P., Levis, A.G. 1988. DNA damage and repair induced in vitro by nitrilotriacetic acid (NTA) in human lymphocytes. Mutat. Res. 209:149-154.
Chu, I., Becking, G.C., Villeneuve, D.C., Viau, A. 1978. Metabolism of nitrilotriacetic acid (NTA) in the mouse. Bull. Environ. Contam. Toxicol. 19:417-422.
[CMI] Commission mixte internationale. 1977. A report to the Great Lakes Research Advisory Board of the International Joint Commission on the health implications of NTA. Great Lakes Advisory Board. Disponible sur demande.
Coker, J.N. 1972. Sodium nitrilotriacetate –Two-step alkaline process. Ind. Eng. Chem. Prod. Res. Dev. 11(4):450-454.
Commission européenne. 2007. Summary record. Technical committee on classification and labelling of dangerous substances; meeting on health effects of pesticides, biocides, existing chemicals, new chemicals, and general issues. Rencontre au Bureau Européen des Substances Chimiques à Ispra, du 21 au 24 mars 2006. Direction générale du CCR de la Commission Européenne, Centre commun de recherche, Institute for Health and Consumer Protection. Bureau Européen des Substances Chimiques. ECBI /90/06 Rev. 8. Accès : http://ecb.jrc.ec.europa.eu/documents/Classification-Labelling/ADOPTED_SUMMARY_RECORDS/9006r8_ECB_sr_health_0306.pdf
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais de la santé publique et de l'environnement). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
Costa, R., Russo, A., Zordan, M., Pacchierotti, A., Tavella, A., Levis, A.G. 1988a. Nitrilotriacetic acid (NTA) induces aneuploidy in Drosophila and mouse germ-line cells. Environ. Mol. Mutagen. 12:397-407.
Costa, R., Strolego, G., Levis, A.G. 1988b. Mutagenicity of lead chromate in Drosophila melanogaster in the presence of nitrilotriacetic acid (NTA). Mutat. Res. 204:257-261.
Crebelli, R., Bellincampi, D., Conti, G., Conti, L., Morpurgo, G., Carere, A. 1986. A comparative study on selected chemical carcinogens for chromosome malsegregation, mitotic crossing-over and forward mutation induction in Aspergillus nidulans. Mutat. Res. 172:139-149.
Crosbie, G.A., Lodi, A., Miller, J.H.M., Skellern, G.G. 2003. The control of nitrilotriacetic acid in edetic acid and its salts by liquid chromatography. J. Pharm. Biomed. Anal. 33:435-440.
Deligiannis, G., Piccione, J. (éd.) 2008. 2008 Canadian chemical directory. Scarborough (Ont.) : Camford.
Ding, W.-H., Wu, J., Semadeni, M., Reinhard, M. 1999. Occurrence and behavior of wastewater indicators in the Santa Ana River and the underlying aquifers. Chemosphere 39(11):1781-1794.
Dow Chemical Company. 1987. Food additive petition on pentasodium EDTA and trisodium EDTA. Présenté à la US Food and Drug Administration. FAP 7B4023. [cité dans Lanigan et Yamarik, 2002].
Dunkel, V.C., Zeiger, E., Brusick, D., McCoy, E., McGregor, D., Mortelmans, K., Rosenkranz, H.S., Simmon, V.F. 1985. Reproducibility of microbial mutagenicity assays: II. Testing of carcinogens and noncarcinogens in Salmonella typhimurium and Escherichia coli. Environ. Mutagen. 7:1-248.
Dunkel, V.C., Schechtman, L.M., Tu, A.S., Sivak, A., Lubet, R.A., Cameron, T.P. 1988. Interlaboratory evaluation of the C3H/10T1/2 cell transformation assay. Environ. Mol. Mutagen. 12:21-31.
[ECOTOX] ECOTOXicology database [base de données sur Internet]. 2006. Washington (DC) : US Environmental Protection Agency, Office of Research and Development, National Health and Environmental Effects Research Laboratory, Mid-Continent Ecology Division. Accès : http://cfpub.epa.gov/ecotox
Eichinger, R. 2005. Paper and pulp [en ligne]. In: Ullmann's encyclopedia of industrial chemistry, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9783527306732/ueic/article/a18_545/current/pdf [réserve de consultation]
Environnement Canada. 2007. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series: draft module on QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2009a. Données sur les substances du lot 8 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le huitième lot du Défi. Données préparées par : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2009b. Suggested approach to determining the persistence of a chemical from biodegradation data. Document de travail préliminaire. Gatineau (Qc) : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2009c. Rapport IGETA : CAS RN 139-13-9, 2009-04-08. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
[EP] Pharmacopée européenne. 2001. Edetic acid. In: European pharmacopoeia. 4e éd. (en anglais). Strasbourg (France) : Conseil de l'Europe, Direction Européenne de la Qualité du Médicament. p. 1097-1098.
Epstein, S.S., Arnold, E., Andrea, S., Bass, W., Bishop, Y. 1972. Detection of chemical mutagens by the dominant lethal assay in the mouse. Toxicol. Appl. Pharmacol. 23:288-325.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
[EURAR] European Union risk assessment report: CAS No.: 5064-31-3: trisodium nitrilotriacetate [en ligne]. 2005. Luxembourg : Office des publications officielles des Communautés européennes. Rapport final, 2005. En page couverture, Centre commun de recherche de l'Union européenne. [consulté en juin 2009]. Accès : http://ecb.jrc.ec.europa.eu/esis/index.php? PGM=ora
[EURAR] European Union risk assessment report: CAS No.: 5064-31-3: trisodium nitrilotriacetate [en ligne]. 2008. Ébauche datée du 20 août 2008. [consultée en juillet 2009]. Accès : http://echa.europa.eu/doc/trd_substances/trisodium_nitrilotriacetate/rar/trd_rar_germany_nta.rtf
Fischer, W.K., Gericke, P., Schmid, R. 1974. Methodenkombination zur sukzessiven Prüfung und Bewertung der biologischen Abbaubarkeit synthetischer Substanzen. Wasser Abwasser Forsch. 7(Suppl. 4):99-118.
Fukushima, S., Kurata, Y., Tamano, S., Inoue, K., Ito, N. 1985. Promoting effect of trisodium nitrilotriacetate monohydrate on urinary bladder carcinogenesis in rats. Jpn. J. Cancer. Res. 76:823-827.
Garric, J., Vollat, B., Nguyen, D.K., Bray, M., Migeon, B., Kosmala, A. 1996. Ecotoxicological and chemical characterization of municipal wastewater treatment plant effluents. Water Sci. Technol. 33(6):83-91.
Glauser, J., Blagoev, M., Kishi, A. 2007. CEH product review: chelating agents. Menlo Park (CA) : SRI Consulting. Accès : http://www.sriconsulting.com/CEH/Public/Reports/index.html [réserve de consultation]
Gousetis, C., Opgenorth, H.-J. 2005. Nitrilotriacetic acid [en ligne]. In: Ullmann's encyclopedia of industrial chemistry, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9783527306732/ueic/article/a17_377/current/pdf [réserve de consultation]
Goyer, R.A., Falk, H.L., Hogan, M., Feldman, D.D., Richter, W. 1981. Renal tumours in rats given trisodium nitrilotriacetic acid in drinking water for two years. J. Natl. Cancer Inst. 66:869-880.
Greenblatt, M., Lijinsky, W. 1974. Carcinogenesis and chronic toxicity of nitrilotriacetic acid in Swiss mice. J. Natl. Cancer Inst. 52:1123-1126.
Hart, J.R. 2005. Ethylenediaminetetraacetic acid and related chelating agents. In : Ullmann's encyclopedia of industrial chemistry, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9783527306732/ueic/article/a10_095/current/pdf [réserve de consultation]
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2008. Version 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Hiasa, Y., Kitahor, Y., Konishi, N., Shimoyama, T. 1984. Trisodium nitrilotriacetate monohydrate: promoting effects on the development of renal tubular cell tumours in rats treated with N-ethyl-N-hydroxyethylnitrosamine. J. Natl. Cancer Inst. 72:483-488.
Hiasa, Y., Kitahori, Y., Konishi, N., Shimoyama, T. 1985a. Dose-related effect of trisodium-nitrilotriacetate monohydrate on renal tumourigenesis initiated with N-ethyl-N-hydroxyethyl-nitrosamine in rats. Carcinogenesis 6:907-910.
Hiasa, Y., Kitahori, Y., Konishi, N., Shimoyama, T., Miyashiro, A. 1985b. Trisodium nitrilotriacetate monohydrate: promoting effect in urinary bladder carcinogenesis in rats treated with N-butyl-N-(4-hydroxybutyl) nitrosamine. J. Natl. Cancer Inst. 74:235-239.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[IARC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1990. Nitrilotriacetic acid and its salts. IARC Monogr. Eval. Carcinog. Risks Hum. 48:181-212.
[IARC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1999. Nitrilotriacetic acid and its salts. IARC Monogr. Eval. Carcinog. Risks Hum. 73:385-399.
Inventaire national des rejets de polluants (INRP) [base de données sur Internet]. 2006. Gatineau (Qc) : Environnement Canada. [consultée en mai 2009]. Accès : http://www.ec.gc.ca/inrp-npri/default.asp?lang=Fr&n=4A577BB9-1
Kanerva, R.L., Francis, W.R., Lefever, F.R., Dorr, T., Alden, C.L., Anderson, R.L. 1984. Renal pelvic and ureteral dilatation in male rats ingesting trisodium nitrilotriacetate. Food Chem. Toxicol. 22:749-753.
Kaur, G., Hasan, S.K., Srivastava, R.C. 1980. Effect of nitrilotriacetic acid (NTA) on the distribution of manganese-54 in rats. Arch. Toxicol. 45:203-206.
Kiessling, D., Kaluza, U. 1997. Nitrilotriacetic acid: physicochemical and ecological properties. In: Swuger, M.J. (éd.) 1997. Detergents in the environment. New York (NY) : Marcel Dekker.
Kihlman, B.A., Sturelid, S. 1970. Nitrilotriacetic acid (NTA) and chromosome breakage. Environ. Mutagen. Soc. News l(3): 32-33.
Kitahori, Y., Konishi, N., Shimoyama, T., Hiasa, Y. 1985. Dose-dependent promoting effect of trisodium nitrilotriacetate monohydrate on urinary bladder carcinogenesis in Wistar rats pretreated with N-butyl-N-(4-hydroxybutyl) nitrosamine. Jpn J. Cancer Res. 76:818-822.
Kitahori, Y., Shimoyama, T., Ohshima, M., Matsuki, H., Hashimoto, H., Minami, S., Konishi, N., Hiasa, Y. 1988. Effects of trisodium nitrilotriacetate monohydrate, nitrilotriacetic acid and ammonium chloride on urinary bladder carcinogenesis in rats pretreated with N-bis (2-hydroxypropyl) nitrosamine. Cancer Lett. 43:105-110.
Knepper, T.P. 2003. Synthetic chelating agents and compounds exhibiting complexing properties in the aquatic environment. Trends Anal. Chem. 22(10):708-724.
[KOAWIN] Octanol-Air Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOCWIN] Soil Adsorption Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Kramers, P.G.N. 1976. Mutagenicity studies with nitrilotriacetic acid (NTA) and Citrex S-5 in Drosophila. Mutat. Res. 40:277280.
Krari, N., Allain, P. 1991. Effects of three chelating agents, EDTA, NTA, and TPP, on the concentrations of elements in rat tissues. Biol. Trace Elem. Res. 29:125-131.
Lanfranchi, G., Paglialunga, S., Levis, A.G. 1988. Mammalian cell transformation induced by chromium(VI) compounds in the presence of nitrilotriacetic acid. J. Toxicol. Environ. Health 24:251-260.
Lanigan, R.S., Yamarik, T.A. 2002. Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA. Int. J. Toxicol. 21 (Suppl. 2):95-142.
Lee, H.-B., Peart, T.E., Kaiser, K.L.E. 1996. Determination of nitrilotriacetic, ethylenediaminetetraacetic and diethylenetriaminepentaacetic acids in sewage treatment plant and paper mill effluents. J. Chromatogr. A 738:91-99.
Leibold, E., Deckardt, K., Mellert, W., Potthoff-Karl, B., Grundler, O., Jäckh, R. 2002. NTA and Fe (III) NTA: differential patterns of renal toxicity in subchronic studies. Hum. Exp. Toxicol. 21:445-452.
Lijinsky, W., Greenblatt, M., Kommineni, C. 1973. Brief communication: feeding studies of nitrilotriacetatic acid and derivatives in rats. J. Natl. Cancer Inst. 50:1061-1063.
Loprieno, N., Boncristiani, G., Venier, P., Montaldi, A., Majone, F., Bianchi, V., Paglialunga, S., Levis, A.G. 1985. Increased mutagenicity of chromium compounds by nitrilotriacetic acid. Environ. Mutagen. 7:185-200.
Loveday, K.S., Lug, M.H., Resnick, M.A., Anderson, B.E., Zeiger, E. 1989. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. II. Results with 20 chemicals. Environ. Mol. Mutagen. 13:60-94.
Lynn, J.L. Jr. 2009. Detergency and detergents [en ligne]. In : Kirk-Othmer encyclopedia of chemical technology, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9780471238966/kirk/article/steabell.a01/current/pdf [réserve de consultation]
Mahaffey, K.R., Goyer, R.A. 1972. Trisodium nitrilotriacetate in drinking water. Metabolic and renal effects in rats. Arch. Environ. Health 25:271-275.
Malaiyandi, M., Williams, D.T., O'Grady, R. 1979. A national survey of nitrilotriacetic acid in Canadian drinking water. Environ. Sci. Technol. 13(1):59-62.
Mason, J.M., Valencia, R., Zimmering, S. 1992. Chemical mutagenesis testing in Drosophila: VIII. Reexamination of equivocal results. Environ. Mol. Mutagen. 19:227-234.
Matheson, D.H. 1977. Nitrilotriacetic acid (NTA) in the Canadian environment. Ottawa (Ont.) : Environnement Canada, Direction générale des eaux intérieures, Direction de la qualité des eaux. Scientific Series No. 74. Disponible sur demande.
Matsuki, H., Ozono, S., Yamaguchi, H., Tsunemi, K., Hirao, Y., Okajima, E. 1992. Effects of various chemicals on the development of mouse urinary bladder tumours induced by N-butyl-N-(4-hydroxybutyl) nitrosamine. J. Toxicol. Pathol. 5:55-60.
McFuff, R.E., Mord, F.M. 1973. Description and use of the chemical equilibrium program REDEQL2. Pasadena (CA) : California Institute of Technology, W.M. Keck Laboratory of Environmental Science. Technical Report EQ-73-02. [cité dans Santé Canada, 1990].
Merski, J.A. 1982. Alterations of renal tissue structure during a 30-day gavage study with nitrilotriacetate. Food Chem. Toxicol. 20:433-440.
Michael, W.R., Wakim, J.M. 1971. Metabolism of nitrilotriacetic acid (NTA). Toxicol. Appl. Pharmacol. 18:407-416.
Michael, W.R., Wakim, J.M. 1973. Effect of trisodium nitrilotriacetate (Na3NTA) on the metabolism of selected metal ions. Toxicol. Appl. Pharmacol. 24:519-529.
Millington, L.A., Goulding, K.H., Adams, N. 1988. The influence of growth medium composition on the toxicity of chemicals to algae. Water Res. 22:1593-1597.
Mitchell, A., Rudd, C.J., Caspary, W.J. 1988. Evaluation of the L5178Y mouse lymphoma cell mutagenesis assay: intralaboratory results for sixty-three coded chemicals tested at SRI International. Environ. Mol. Mutagen. 12:37-101.
Modesti, D., Tanzarella, C., Degrassi, F. 1995. Genotoxic activity of nitrilotriacetic acid in Chinese hamster cells. Mutat. Res. 343:1-6.
Modler, R.F., Janshekar, H., Inoguchi, Y. 2007. CEH marketing research report: surfactants, household detergents and their raw materials. Menlo Park (CA) : SRI Consulting. Accès : http://www.sriconsulting.com/CEH/Public/Reports/index.html [réserve de consultation]
Monsanto. 1968. Toxicological investigation of: trisodium nitrilotriacetate (NTA). Rapport inédit. Monsanto, Younger Laboratories. Project No. Y-68-13, daté du 2 février 1968. [cité dans EURAR, 2008].
Montaldi, A., Zentilin, L., Venier, P., Gola, I., Bianchi, V., Paglialunga, S., Levis, A.G. 1985. Interaction of nitrilotriacetic acid with heavy metals in the induction of sister chromatid exchanges in cultured mammalian cells. Environ. Mutagen. 7:381-390.
Montaldi, A., Zentilin, L., Zordan, M., Bianchi, V., Levis, A.G. 1987. Chromosomal effects of heavy metals (Cd, Cr, Hg, Ni and Pb) on cultured mammalian cells in the presence of nitrilotriacetic acid (NTA). Environ. Toxicol. Chem. 14:183-200.
Montaldi, A., Mariot, R., Zordan, M., Paleologo, M., Levis, A.G. 1988. Nitrilotriacetic acid (NTA) does not induce chromosomal damage in mammalian cells either in vitro or in vivo. Mutat. Res. 208:95-100.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Mueller, F., Peggau, J., Arif, S. 2006. Special purpose cleaning formulations: auto care and industrial/institutional products. In : Showell, M.S. (éd.), Handbook of detergents. Part D: Formulations. Surfactant Science Series, Vol. 128. Boca Raton (FL) : Taylor et Francis. p. 261-277.
Myers, M.C., Kanerva, R.L., Alden, C.L., Anderson, R.L. 1982. Reversibility of nephrotoxicity induced in rats by nitrilotriacetate in subchronic feeding studies. Food Chem. Toxicol. 20:925-934.
Myhr, B.C., Caspary, W.J. 1988. Evaluation of the L5178Y mouse lymphoma cell mutagenesis assay: intralaboratory results for sixty-three coded chemicals tested at Litton Bionetics, Inc. Environ. Mol. Mutagen. 12:103-194.
National Chemical Inventories [base de données sur CD-ROM]. 2008. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. Accès : http://www.cas.org/products/cd/nci/require.html
[NCI] National Cancer Institute (US). 1977. Bioassays of nitrilotriacetic acid (NTA) and nitrilotriacetic acid, trisodium salt, monohydrate (Na3NTA·H2O) for possible carcinogenicity. Bethesda (MD) : US Department of Health, Education and Welfare, Public Health Service, National Institutes of Health, National Cancer Institute.
Nesslany, F., Simar-Meintières, S., Watzinger, M., Talahari, I., Marzin, D. 2008. Characterization of the genotoxicity of nitrilotriacetic acid. Environ. Mol. Mutagen. 49:439-452.
Nixon, G.A. 1971. Toxicity evaluation of trisodium nitrilotriacetate. Toxicol. Appl. Pharmacol. 18:398-406.
Nixon, G.A., Buehler, E.V., Niewenhuis, R.J. 1972. Two-year rat feeding study with trisodium nitrilotriacetate and its calcium chelate. Toxicol. Appl. Pharmacol. 21:244-252.
Nolen, G.A., Klusman, L.W., Back, D.L., Buehler, E.V. 1971. Reproduction and teratology studies of trisodium nitrilotriacetate in rats and rabbits. Food Cosmet. Toxicol. 9:509-518.
Nolen, G.A., Bohne, R.L., Buehler, E.V. 1972a. Effects of trisodium nitrilotriacetate, trisodium citrate and a trisodium nitrilotriacetate-ferric chloride mixture on cadmium and methyl mercury toxicity and teratogenicity in rats. Toxicol. Appl. Pharmacol. 23:238-250.
Nolen, G.A., Buehler, E.V., Geil, R.G., Goldenthal, E.I. 1972b. Effects of trisodium nitrilotriacetate on cadmium and methyl mercury toxicity and teratogenicity in rats. Toxicol. Appl. Pharmacol. 23:222-237.
[NTP] National Toxicology Program (US). 2005. Substance profiles: nitrilotriacetic acid. In: 11th report on carcinogens (RoC) [en ligne]. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. [consulté en juillet 2009]. Accès : http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s119nitr.pdf
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software
[OMS] Organisation mondiale de la Santé. 1996. Nitrilotriacetic acid in Drinking-water: Background document for development of WHO Guidelines for Drinking-water Quality.(en anglais seul.)WHO/SDE/WSH/03.04/30. Genève (Suisse) : Organisation mondiale de la santé. Accès : http://www.who.int/water_sanitation_health/dwq/chemicals/en/nitrilotriaceticacid.pdf
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.syrres.com/esc/physdemo.htm
Pietsch, J., Schmidt, W., Sacher, F., Fichtner, S., Brauch, H.-J. 1995. Pesticides and other organic micro pollutants in the river Elbe. Fresenius J. Anal. Chem. 353:75-82.
Pollack, S., Ruocco, S. 1981. Synergistic effect of nitrilotriacetate on iron mobilization by desferrioxamine in vivo. Blood 57(6):1117-1118.
Procter & Gamble Company. 1972. New York State (Long Island Study). Document polycopié le 10 avril 1974. Cincinnati (OH) : Procter & Gamble. [cité dans Matheson, 1977].
Procter & Gamble Company. 1981. Summary of Indiana Monitoring Program for NTA. Présenté à la US Environmental Protection Agency. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Procter & Gamble Company. 1982. Summary of Indiana Monitoring Program for NTA. Présenté à la US Environmental Protection Agency. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Procter & Gamble Company. 1983a. Canadian tap water monitoring for NTA, Phase I--Ottawa-Carleton and Finch, Ontario, and Phase II--Port Kells, British Columbia. Présenté à la New York State Department of Environmental Conservation. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Procter & Gamble Company. 1983b. New York tap water monitoring for NTA, October1981-June 1983. Présenté à la New York State Department of Environmental Conservation. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Procter & Gamble Company. 1983c. Summary of the NTA Environmental Monitoring Program in Indiana. Présenté à la New York State Department of Environmental Conservation. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Ramel, C., Magnusson, J. 1979. Chemical induction of non-disjunction in Drosophila. Environ. Health Perspect. 31:59-66.
RCC-CCR. 2000. Hyperhaploidy-aneuploidy determination in secondary spermatocytes of mice after oral treatment with nitrilotriacetic acid (trisodium salt). Rossdorf (Allemagne) : RCC Cytotest Cell Research. Project 560100. [cité dans EURAR, 2008].
Richardson, M.L. 1992-1994. The dictionary of substances and their effects. Vols. 1-7. Londres (Royaume-Uni) : Royal Society of Chemistry. Accès : http://www.rsc.org/Publishing/CurrentAwareness/DOSE/DOSESearchPage.cfm
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006a. Cosmetics fact sheet: To assess the risks for the consumer. Version mise à jour pour le ConsExpo4 [en ligne]. [consultée le 31 août 2009]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). Rapport RIVM no 320104001/2006. Accès : http://www.rivm.nl/bibliotheek/rapporten/320104008.pdf
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006b. Cleaning products fact sheet: To assess the risks for the consumer. Version mise à jour pour le ConsExpo 4 [en ligne]. [consultée le 31 août 2009]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). Rapport RIVM 320104003/2006. Accès : http://www.rivm.nl/bibliotheek/rapporten/320104003.pdf
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006c. Pest control products fact sheet: To assess the risks for the consumer. Version mise à jour pour le ConsExpo 4 [en ligne]. [consultée le 31 août 2009]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). Rapport RIVM 320005002/2006. Accès : http://www.rivm.nl/bibliotheek/rapporten/320005002.pdf
Robbiano, L., Carrozzino, R., Puglia, C.P., Corbu, C., Brambilla, G. 1999. Correlation between induction of DNA fragmentation and micronuclei formation in kidney cells from rats and humans and tissue-specific carcinogenic activity. Toxicol. Appl. Pharmacol. 161:153-159.
Robbiano, L., Carrozzino, R., Bacigalupo, M., Corbu, C., Brambilla, G. 2002. Correlation between induction of DNA fragmentation in urinary bladder cells from rats and humans and tissue-specific carcinogenic activity. Toxicology 179:115-128.
Russo, A., Pacchierotti, F., Bassani, B., Levis, A.G. 1989. Lack of induction of somatic aneuploidy in the mouse by nitrilotriacetic acid (NTA). Mutat. Res. 226:111-114.
Santé Canada. 1990. Acide nitrilotriacétique (NTA). Ottawa (Ont.) : Santé Canada, Programme de la sécurité des milieux. Accès : http://dsp-psd.pwgsc.gc.ca/Collection/H48-10-1-61-1990F.pdf
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2007. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques –septembre 2009 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation. [consultée le 14 décembre 2009]. Accès : http://www.hc-sc.gc.ca/cps-spc/person/cosmet/info-ind-prof/_hot-list-critique/hotlist-liste-fra.php
Santé Canada. 2008. Recommandations pour la qualité de l'eau potable au Canada--Tableau sommaire. [consulté le 22 juillet 2009]. Ottawa (Ont.) : Santé Canada. Accès : http://www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/water-eau/sum_guide-res_recom/summary-sommaire-fra.pdf
Santé et Bien-être social Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : chez l'auteur. No de catalogue H39-199/1990F. [cité dans Santé Canada, 1998].
Schmidt, C.K., Fleig, M., Sacher, F., Brauch, H.-J. 2004. Occurrence of aminopolycarboxylates in the aquatic environment of Germany. Environ. Pollut. 131:107-124.
[SCJGSARA] S.C. Johnson Global Safety Assessment & Regulatory Affairs. 2009. Fiche signalétique : Scrubbing Bubbles® Bathroom Cleaner –Fresh Clean [en ligne]. Racine (WI) : S.C. Johnson and Son, Limited. [consultée le 26 août 2009]. Accès : http://www.scjohnson.ca/msds/Scrubbing%20Bubbles%20Bathroom%20Cleaner%20-Fresh%20Clean%20Jan%202009.pdf
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2009. Disponible auprès de Santé Canada, Division des cosmétiques.
Stabel, H.-H. 1998. Chemical composition and drinking water quality of the water from Lake Constance. Arch. Hydrobiol. Spec. Issues Adv. Limnol. 53:13-30.
Sturm, R.N., Payne, A.G. 1973. Environmental testing of trisodium nitrilotriacetate: bioassays for aquatic safety and algal stimulation. P. 403-424. In : Glass, G.E. (éd.) Bioassay Techniques and Environmental Chemistry. Ann Arbor (MI) : Ann Arbor Sci. Publ. Inc.
Suresh, B., Kishi, A. 2006. CEH product review: hydrogen cyanide. Menlo Park (CA) : SRI Consulting. Accès : http://www.sriconsulting.com/CEH/Public/Reports/index.html. [réserve de consultation]
Tjälve, H. 1972. A study of the distribution and teratogenicity of nitrilotriacetic acid (NTA) in mice. Toxicol. Appl. Pharmacol. 23:216-221.
[USEPA] US Environmental Protection Agency. 1980. Final report: NTA. Rapport inédit. Washington (DC) : US Environmental Protection Agency, Office of Pesticides and Toxic Substances, Assessment Division.
[USP] United States Pharmacopeia. 2000a. Edetate calcium disodium. In : United States Pharmacopeia 24. Rockville (MD) : US Pharmacopeia. p. 622.
[USP] United States Pharmacopeia. 2000b. Edetate disodium. In : United States Pharmacopeia 24. Rockville (MD) : US Pharmacopeia. p. 622-623.
[USP] United States Pharmacopeia. 2000c. Edetic acid. In : National Formulary 19. Rockville (MD) : US Pharmacopeia. p. 2449-2450.
Venier, P., Montini, R., Zordan, M., Clonfero, E., Paleologo, M., Levis, A.G. 1989. Induction of SOS response in Escherichia coli strain PQ37 by 16 chemical compounds and human urine extracts. Mutagenesis 4:51-57.
Voulgaropoulos, A., Tzivanakis, N. 1992. Use of ion exchangers for the voltammetric determination of NTA and EDTA in natural waters. Electroanalysis 4:647-651.
[WATERNT] Water Solubility Estimate –Fragment Methodology [modèle d'estimation]. 2008. Version 1.01. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Williams, G.M., Laspia, M.F., Dunkel, V.C. 1982. Reliability of the heptatocyte primary culture/DNA repair test in testing of coded carcinogens and noncarcinogens. Mutat. Res. 97:359-370.
Williams, G.M., Mori, H., McQueen, C.A. 1989. Structure-activity relationship in the rat hepatocyte DNA-repair test for 300 chemicals. Mutat. Res. 221:263-286.
Woodiwiss, C.R., Walker, R.D., Brownridge, F.A. 1979. Concentrations of nitrilotriacetate and certain metals in Canadian wastewaters and streams: 1971-1975. Water Res. 13:599-612.
Woodruff, R.C., Mason, J.M., Valencia, R., Zimmering, S. 1985. Chemical mutagenesis testing in Drosophila. V. Results of 53 coded compounds tested for the National Toxicology Program. Environ. Mutagen. 7:677-702.
Yalkowsky, S.H., Dannenfelser, R.M. 1992. The Aquasol database of aqueous solubility. 5th ed. Tucson (AZ) : University of Arizona, College of Pharmacy.
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K. 1992. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ. Mol. Mutagen. 19:2-141.
Zoller, U. (éd.) 2009. Handbook of detergents. Part E: Applications. Surfactant Science Series, Vol. 141. Boca Raton (FL) : Taylor & Francis.
Zordan, M., Russo, A., Costa, R., Bianco, N., Beltrame, C., Levis, A.G. 1990. A concerted approach to the study of the aneuploidonic properties of two chelating agents (EDTA and NTA) in the germ and somatic cell lines of Drosophila and the mouse. Environ. Mol. Mutagen. 15:205-213.
Zordan, M., Graf, U., Singer, D., Cinzia, B., Valle, L.D., Osti, M., Costa, R., Levis, A.G. 1991. The genotoxicity of nitrilotriacetic acid (NTA) in a somatic mutation and recombination test in Drosophila melanogaster. Mutat. Res. 262:253-261.
Annexe 1 : Valeurs estimatives de la limite supérieure de l'absorption journalière de NTA chez la population générale du Canada
| Voie d'exposition | Absorption estimée (µg/kg p.c. par jour) de NTA par divers groupes d'âge | |||||||
|---|---|---|---|---|---|---|---|---|
| 0 à 6 mois1,2,3 | 0,5 à 4 ans4 | 5 à 11 ans5 | 12 à 19 ans6 | 20 à 59 ans7 | 60 ans et plus8 | |||
| Allaités | Nourris au lait maternisé | Sans lait maternisé | ||||||
| Abréviation : s.o. = sans objet. 1 Aucune donnée sur la concentration de NTA dans le lait maternel n'a été trouvée. 2 Hypothèses : poids de 7,5 kg, volume d'air respiré de 2,1 m3/jour, consommation d'eau de 0,8 L/jour (enfants nourris au lait maternisé) ou de 0,3 L/jour (enfants non nourris au lait maternisé) et ingestion de 30 mg/jour de sol (Santé Canada, 1998). 3 Pour les nourrissons exclusivement nourris au lait maternisé, l'absorption d'eau est synonyme d'absorption de nourriture. La concentration de NTA dans l'eau utilisée pour préparer le lait maternisé s'est fondée sur les données disponibles. On n'a répertorié aucune donnée sur les concentrations de NTA dans le lait maternisé au Canada. Environ 50 % des enfants non nourris au lait maternisé ont commencé à manger des aliments solides à 4 mois, et 90 % ont commencé à 6 mois (Santé Canada, 1990). 4 En supposant que l'enfant pèse 15,5 kg, respire 9,3 m3 d'air par jour, qu'il boit 0,7 L d'eau par jour et qu'il ingère 100 mg de sol par jour (Santé Canada 1998). 5 En supposant que l'enfant pèse 31 kg, respire 14,5 m3 d'air par jour, qu'il boit 1,1 L d'eau par jour et qu'il ingère 65 mg de sol par jour (Santé Canada, 1998). 6 En supposant que le jeune pèse 59,4 kg, respire 15,8 m3 d'air par jour, qu'il boit 1,2 L d'eau par jour et qu'il ingère 30 mg de sol par jour (Santé Canada, 1998). 7 En supposant que la personne pèse 70,9 kg, respire 16,2 m3 d'air par jour, qu'elle boit 1,5 L d'eau par jour et qu'elle ingère 30 mg de sol par jour (Santé Canada 1998). 8 En supposant que la personne pèse 72 kg, respire 14,3 m3 d'air par jour, qu'elle boit 1,6 L d'eau par jour et qu'elle ingère 30 mg de sol par jour (Santé Canada, 1998). 9 Aucune donnée sur la concentration de NTA dans l'air ambiant n'a été trouvée. 10 Aucune donnée sur la concentration de NTA dans l'air intérieur n'a été trouvée. 11 Le NTA a été décelé dans des échantillons d'eau potable municipale traitée au Canada au cours de deux études menées à l'échelle nationale (Matheson, 1977; Malaiyandi et al., 1979). La concentration maximale de 20,4 µg/L signalée par Malaiyandi et ses collaborateurs a été utilisée pour estimer l'exposition. 12 Aucune donnée sur la concentration de NTA dans les aliments et les boissons n'a été trouvée. 13 Aucune donnée sur la concentration de NTA dans le sol n'a été trouvée. |
||||||||
| Air ambiant9 | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | ||
| Air intérieur10 | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | ||
| Eau potable11 | s.o. | 2,18 | 0,82 | 0,92 | 0,72 | 0,41 | 0,43 | 0,45 |
| Aliments et boissons12 | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. |
| Sol13 | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | ||
| Absorption totale | s.o. | 2,18 | 0,82 | 0,92 | 0,72 | 0,41 | 0,43 | 0,45 |
Scénarios pour les produits de consommation utilisés fréquemment
| Scénarios concernant les produits de consommation | Hypothèses1,2 | Exposition estimée |
|---|---|---|
| 1 Un débit d'inhalation de 16,2 m3/jour a été utilisé pour toutes les estimations de l'exposition par inhalation (Santé Canada, 1998). 2 Le Système de déclaration des cosmétiques (SDC, 2009) a déterminé que du Na3NTA se trouvait dans les produits de soins personnels figurant dans ce tableau. Une valeur calculée du Koe de -2,62 a été utilisée (EURAR, 2005). 3 La valeur la plus élevée de perméabilité dermique a été estimée en utilisant la méthode de Fiserova-Bergerova (comprise dans la version 4.1 de ConsExpo). On juge que cette méthode permet d'obtenir l'estimation de l'exposition cutanée la plus prudente lorsque l'on utilise le modèle d'absorption par diffusion. 4 Le solvant utilisé traditionnellement dans les parfums est l'éthanol dont la densité est de 0,789 g/cm3. Cela a été pris en compte lorsque le rapport masse-volume (c.-à-d., la concentration du composé) du Na3NTA dans le produit de consommation que représente le parfum a été établi. 5 L'exposition par inhalation a été jugée négligeable. La dose totale chronique (attribuable aux expositions par inhalation et par voie cutanée) provenant du scénario lié aux produits de consommation est illustré. 6 Courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée. |
||
| Poudre compacte de maquillage pour le visage | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 0,00425 mg/kg p.c. par jour |
| Parfum | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Dose chronique = 5,24 × 10-7 mg/kg p.c. par jour par voie cutanée Dose chronique = 0,00145 mg/kg p.c. par jour |
| Shampooing | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 0,0201 mg/kg p.c. par jour |
| Nettoyant pour la peau (corps) | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 0,000619 mg/kg p.c. par jour |
| Nettoyant pour la peau (visage) | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 5,65 × 10-5 mg/kg p.c. par jour |
| Nettoyant multiusage, vaporisation | Concentration : 0,0002 %5 Hypothèses générales
Par inhalation
Voie cutanée
|
Dose chronique totale Dose5 = 5,33 × 10 |
| Nettoyant multiusage, nettoyage | Concentration : 0,0002 %5 Hypothèses générales
Par inhalation
Voie cutanée
|
Dose chronique totale Dose5 = 4,51 x 10-7 mg/kg p.c. par jour |
| Nettoyant pour verre, vaporisation | Concentration : 0,0002 %5 Hypothèses générales
Par inhalation
Voie cutanée
|
Dose chronique5 = 9,08 × 10-8 mg/kg p.c. par jour |
| Nettoyant pour verre, nettoyage | Concentration : 0,0002 % 6 Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 8,17 × 10-7 mg/kg p.c. par jour |
Scénarios pour les produits de consommation utilisés occasionnellement
| Scénarios concernant les produits de consommation | Hypothèses1,2 | Exposition estimée |
|---|---|---|
| 1 Un débit d'inhalation de 16,2 m3/jour a été utilisé pour les estimations de l'exposition par inhalation (Santé Canada, 1998). 2 Le NTA a uniquement été décelé dans les engrais. Pour tous les autres produits, qui contenaient du Na3NTA, une valeur calculée du Koe de -2,62 a été utilisée (EURAR, 2005). 3 Les paramètres relatifs aux colorants capillaires permanents sont indiqués entre parenthèses lorsqu'ils diffèrent de ceux relatifs aux colorants capillaires semi-permanents. 4 La valeur la plus élevée de perméabilité dermique a été estimée en utilisant la méthode de Fiserova-Bergerova (comprise dans la version 4.1 de ConsExpo). On juge que cette méthode permet d'obtenir l'estimation de l'exposition cutanée la plus prudente lorsque l'on utilise le modèle d'absorption par diffusion. 5 Aucun modèle d'utilisation n'était disponible concernant les lotions pour pieds pour pédicure. Selon la Cosmetics Fact Sheet (fiche d'information sur les cosmétiques) de ConsExpo, la fréquence d'utilisation du vernis à ongles est de 156 fois par an (RIVM, 2006a). Le même chiffre a été utilisé concernant l'utilisation de lotion pour pieds pour pédicure par les Canadiennes adultes. 6 Propre au produit. 7 Courriels de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada adressés au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée. 8 Le groupe d'âge de 0,5 à 4 ans était celui qui montrait le plus grand potentiel d'exposition dans un scénario sur la natation. 9 Concentration de la substance dans une piscine extérieure de taille moyenne (48 m3) (RIVM, 2006c), après l'application d'un algicide (quantité moyenne = 384 mL) (RIVM, 2006c). |
||
| Colorant capillaire, semi–permanent (permanent)3 | Concentration : 0,3 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose aiguë = 0,000685 mg/kg p.c. |
| Lotion pour les pieds pour pédicure | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose aiguë = 0,00656 mg/kg p.c. |
| Protecteur de vernis à ongles pour manucure | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 1,91 × 10-11 mg/m3 par voie cutanée Dose aiguë = 0,000121 mg/kg p.c. |
| Nettoyant pour salle de bain, vaporisation | Concentration : 1 % (SCJGSARA , 2009) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 0,000229 mg/m3 par voie cutanée Dose aiguë = 0,000973 mg/kg p.c. |
| Nettoyant pour salle de bain, nettoyage | Concentration : 1 % (SCJGSARA , 2009) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 5,77 × 10-11 mg/m3 par voie cutanée Dose aiguë = 0,00423 mg/kg p.c. |
| Insecticide, acaricide | Concentration : 0,001 %7 Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 4,47 × 10-6 mg/m3 par voie cutanée Dose aiguë = 3,89 × 10-6 mg/kg p.c. |
| Engrais (liquide, mélange et chargement) | Concentration : 1 % (BCR, 2002) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 8,68 × 10-6 mg/m3 par voie cutanée Dose aiguë = 0,000141 mg/kg p.c. |
| Engrais –liquide, dissout (vaporisation dans des installations intérieures) | Concentration : 0,0000487 % (dilué 6) (BCR, 2002) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 1,34 × 10-6 mg/m3 par voie cutanée Dose aiguë = 1,9 × 10-6 mg/kg p.c. |
| Algicide pour piscine (mélange et chargement) | Concentration : 0,000688 %6 Hypothèses générales
Voie cutanée
|
par voie cutanée Dose aiguë = 4,27 × 10-8 mg/kg p.c. |
| Algicide pour piscine (application) | Concentration : 0,000688 %6 Hypothèses générales
Voie cutanée
|
par voie cutanée Dose aiguë = 6,4 × 10-7 mg/kg p.c. |
| Natation (enfant de 0,5 à 4 ans), exposition post-application8 | Concentration : 5,5 × 10-9 %9 Hypothèses générales
Voie cutanée
Voie orale
|
par voie cutanée Dose aiguë = 8,59 × 10-10 mg/kg p.c. par voie orale Dose aiguë = 2,12 × 10-7 mg/kg p.c. |
| Paramètre | Doses ou concentrations minimales avec effet1/Résultats |
|---|---|
| 1 CL50, concentration létale médiane; DL50, dose létale médiane; DMENO, dose minimale avec effet nocif observé; DMEO, dose minimale avec effet observé; DSEO, dose sans effet observé. | |
| Essais sur des animaux de laboratoire et in vitro | |
| Toxicité aiguë | NTADL50 la plus faible, par voie orale (rats) = 1 470 mg/kg p.c. (Richardson 1992-1994).Autre DL50, par voie orale (souris) = 3 160 mg/kg p.c. (Richardson 1992-1994). Na3NTA DL50 la plus faible, par voie orale (singes) = 750 mg/kg p.c. (Nixon, 1971). Autres valeurs de DL50 : 1 300 à 2 220 mg /kg p.c. (rats) (BASF 1985); > 5 000 mg/kg p.c. (chiens) (Nixon, 1971). CL50 par inhalation (rat) = >5 000 mg/m3 (> 5 mg/L) (USEPA, 1980). DL50 par voie cutanée (lapin) = > 10 000 mg/kg p.c. (EURAR, 2008) |
| Dose toxique à court terme pour l'exposition répétée | NTA DMENO minimale par voie orale = 750 mg/kg p.c. par jour (1,5 % de NTA), mesurée d'après une diminution de la croissance et une augmentation relative du poids des reins, du calcium dans l'urine, des hématuries et des hydronéphroses sur des rats Charles River et Fischer mâles et femelles (5 ou 10 par groupe), exposés dans leur alimentation à des doses de NTA de 0 % ou de 1,5 % pendant 4 semaines (Anderson et Kanerva, 1979). [Autres études sur l'exposition par voie orale : Myers et al., 1982; BASF, 1997a] Aucune étude concernant l'absorption cutanée n'a été recensée pour le NTA. |
Na3NTA DMENO minimale par voie orale = 100 mg/kg p.c. par jour (0,1 % de Na3NTA), mesurée d'après une augmentation relative du poids des reins chez des rats Sprague-Dawley mâles exposés à des doses de 0 %, 0,01 %, 0,1 % ou 1 % de Na3NTA (soit l'équivalent de 0, 10, 100 ou 1 000 mg/kg p.c. par jour) dans leur eau d'abreuvement (vacuolisation marquée des tubules rénaux observée à forte dose). DMEO minimale par voie orale = 10 mg/kg p.c. par jour (0,01 % de Na3NTA) d'après le taux élevé de glycémie chez tous les groupes traités. Toutefois, la pathogénie de cette augmentation était inconnue (Mahaffey et Goyer, 1972). Autres DMENO par voie orale = 200 mg/kg p.c. par jour (0,73 mmol par jour), mesurée d'après une vacuolisation cytoplasmique et une hyperplasie du tube contourné proximal chez des rats Sprague-Dawley mâles exposés par gavage à des doses de 0, 0,073 ou 7,3 mmol par jour de Na3NTA (soit l'équivalent de 0, 200 ou 2 000 mg/kg p.c. par jour) pendant 30 jours (Merski,1982).[Autres études sur l'exposition par voie orale : Michael et Wakim, 1973; Anderson et Kanerva, 1978, 1979; Alden et al., 1981; Kanerva et al., 1984; Krari et Allain, 1991; Bahnemann et al., 1998; Leibold et al., 2002] DSENO par voie cutanée = 50 mg/kg p.c. par jour (2,5 % de Na3NTA), mesurée d'après une absence d'anormalité évidente ou histologique chez des lapins néo-zélandais (six par groupe, sexe inconnu) exposés à des doses de 0 % ou 2,5% de Na3NTA (soit l'équivalent de 0 ou 50 mg/kg p.c. par jour) sur une peau intacte ou scarifiée pendant une durée de 28 jours (Nixon, 1971). |
|
NTA ou Na3NTA Étude d'exposition par inhalation : Des renseignements limités d'après une lettre de la part d'un déclarant à l'USEPA : lorsque des rats, des cochons d'Inde et des singes (sexe et races inconnus) ont été exposés à des doses de 0, 10, 213 ou 343 mg/m3, de NTA ou de Na3NTA non micronisé, 6 h par jour pour une période de 4 semaines, des diarrhées ont été observées chez les singes traités et une dyspnée sans irritation respiratoire ni indisposition a été constaté chez les rats et les cochons d'Inde à une dose de 343 mg/m3 de NTA ou de Na3NTA. Lorsque des rats albinos mâles ont été exposés à des doses de 0, 2, 20, 200 ou 2 000 mg/m3 de NTA ou de Na3NTA micronisé, 6 h par jour pour une période de 4 jours, des irritations respiratoires, nasales et des yeux ont été signalées à une dose de 2 000 mg/m3 de NTA ou de Na3NTA (USEPA, 1980). |
|
| Toxicité subchronique | NTA DMENO minimale par voie orale = 710 mg/kg p. c. par jour (1 % de NTA) calculée d'après les hyperplasies de l'épithélium de la vessie constatées chez des rats Wistar mâles (15 à 20 individus par groupe) exposés dans leur alimentation à des doses de 0 % ou de 1 % de NTA pendant 20 semaines (selon les données concernant l'administration de NTA uniquement provenant d'une étude en deux étapes d'initiation-promotion) (Kitahori et al., 1988). DMEO minimale par voie orale = 10 mg/kg p. c. par jour (100 mg/L) calculée d'après la baisse du potassium chez les rats mâles (race inconnue) exposés à des doses de 100, 1 000 ou 5 000 mg/L dans leur eau d'abreuvement pendant 90 jours (Becking et Yagminas, 1978). Aucune étude d'exposition par inhalation ou par voie cutanée n'a été recensée pour le NTA. |
Na3NTA DMENO minimale par voie orale = 150 mg/kg p.c. par jour (3 000 ppm), mesurée d'après une augmentation liée à la dose administrée des hyperplasies simples des cellules des tubules rénaux (nombre moyen de lésions par cm2) dans les groupes de rats Wistar (24 individus par groupe) traités avec des doses faibles et moyennes de 0, 3 000, 10 000 ou 30 000 ppm (soit l'équivalent de 0, 150, 500 ou 1 500 mg/kg p.c. par jour) dans leur alimentation pendant 30 semaines (selon les données concernant l'administration de Na3NTA uniquement provenant d'une étude en deux étapes d'initiation-promotion) (Hiasa et al., 1985a). DMEO minimale par voie orale = 35 mg/kg p.c. par jour (0,15 % de Na3NTA), mesurée d'après une augmentation de l'excrétion moyenne de zinc par des chiens Beagle des deux sexes (liée à la dose administrée pour les mâles traités et non liée à la dose administrée pour les femelles traitées –quatre individus par groupe) exposés à des doses de 0 %, 0,03 %, 0,15 % ou 0,5 % de Na3NTA (soit l'équivalent de 0, 7, 35 ou 116 mg/kg p.c. par jour) dans leur eau d'abreuvement pendant 90 jours (Budny et al., 1973). [Autres études sur l'exposition par voie orale : Nixon, 1971; Anderson et Danylchuk, 1980; Hiasa et al., 1985b; Kitahori et al., 1985] DSENO par voie cutanée = 50 mg/kg p.c. par jour (2,5 % de Na3NTA), mesurée d'après une absence d'anormalité évidente ou histologique chez des lapins néo-zélandais (six par groupe, sexe inconnu) exposés à des doses de 0 % ou 2,5% de Na3NTA (soit l'équivalent de 0 ou 50 mg/kg p.c. par jour) sur une peau intacte ou scarifiée pendant une durée de 91 jours (65 traitements) (Nixon, 1971). Aucune étude d'exposition par inhalation n'a été recensée pour le Na3NTA. |
|
NTA ou Na3NTA Plusieurs études en deux étapes d'initiation-promotion des tumeurs ont été recensées pour le NTA ou le Na3NTA. Dans ces études, les animaux de laboratoire ont tout d'abord été traités avec divers types de nitrosamines par voie orale. Ensuite, du NTA ou du Na3NTA a été administré par voie orale aux animaux traités à la nitrosamine en vue d'analyser l'effet d'agent promoteur de cette substance. Des groupes témoins n'ayant subi aucun traitement préalable à la nitrosamine (NTA ou Na3NTA uniquement) ont également été utilisés. DMENO orale (effet d'agent promoteur pour les tumeurs du rein) = 150 mg/kg p.c. par jour (3 000 ppm de Na3NTA) mesurée d'après l'effet de promotion de la croissance de tumeurs rénales du Na3NTA qui a été observé chez des rats Wistar mâles (24 individus par groupe traité) exposés dans leur alimentation à de la nitrosamine N,N-Diéthylhydroxylamine (NEELA) à des doses de 1 000 ppm pendant 2 semaines puis à du Na3NTA pendant 30 semaines (incidence des tumeurs : 0 %, 16 %, 22 %, 100 % et 100 %, respectivement, dans les groupes témoins, les groupes traités au NEELA uniquement et les groupes traités au NEELA puis à des doses de 3 000, 10 000 et 30 000 ppm de Na3NTA). On a constaté une augmentation des hyperplasies simples liées à la dose administrée chez les groupes traités au Na3NTA (avec ou sans initiation) (Hiasa et al., 1985a). [Autres études sur l'exposition par voie orale : Lijinsky et al., 1973; Greenblatt et Lijinsky, 1974; Hiasa et al., 1984, 1985b; Fukushima et al., 1985; Kitahori et al., 1985, 1988; Matsuki et al., 1992] |
|
| Toxicité chronique et cancérogénicité | NTA ou Na3NTA Cancérogénicité par voie orale chez les rats : Des groupes de 50 rats Fischer 344 de chaque sexe (20 de chaque sexe dans le groupe témoin) ont été exposés à une alimentation contenant : a) du NTA à des doses de 0, 7 500 ou 15 000 ppm (soit l'équivalent de 0, 375 ou 750 mg/kg p.c. par jour) ou b) les mêmes concentrations de Na3NTA (soit l'équivalent de 0, 375 ou 750 mg/kg p.c. par jour) pendant 18 mois suivis d'une période de rétablissement de 6 mois. a) Dans les groupes traités au NTA, on a pu observer une augmentation importante des tumeurs du tractus urinaire (principalement des adénomes et des adénocarcinomes des cellules des tubules rénaux) chez les mâles traités avec des doses élevées (0/20, 1/49 et 7/48, respectivement; p = 0,006 pour la tendance linéaire). Les femelles exposées à des doses élevées ont développé des carcinomes malpighiens et transitionnels au niveau de la vessie (0/18, 2/45 et 12/48, respectivement; p < 0,001 pour la tendance linéaire) ainsi que des phéochromocytomes de la glande surrénale (1/20, 0/50 et 14/48, respectivement; p < 0,001). On a pu constater une augmentation importante de l'incidence d'adénomes du foie chez les femelles traitées avec des doses moyennes et élevées (2/15, 8/49 et 22/49, respectivement; p = 0,001 pour la tendance linéaire). DMENO non néoplasique par voie orale = 375 mg/kg p.c. par jour sous forme de NTA (7 500 ppm), mesurée d'après l'incidence élevée d'inflammations chroniques dans les reins, de lésions hyperplasiques des voies urinaires et d'une baisse du gain de poids corporel liée à la dose administrée pour les deux sexes et quelle que soit la dose. b) Dans les groupes traités au Na3NTA, une augmentation non significative des tumeurs des voies urinaires a été observée. Chez les femelles, on a pu constater, à des doses élevées, un carcinome transitionnel et un papillome de la vessie et, à de faibles doses, un carcinome malpighien et trois carcinomes transitionnels. Un adénome des cellules des tubules rénaux ainsi qu'un papillome de l'uretère ont été observés chez deux mâles distincts traités avec de faibles doses. On a pu constater chez les deux sexes une baisse du gain de poids corporel liée à la dose administrée. L'hyperplasie épithéliale du tractus urinaire ne s'est manifestée que chez les animaux traités (NCI, 1977). |
Cancérogénicité par voie orale chez les souris : Des souris B6C3F1 (50 de chaque sexe par groupe et 20 de chaque sexe dans le groupe témoin) ont été exposées à une alimentation contenant : a) du NTA à des doses de 0, 7 500 ou 15 000 ppm (soit l'équivalent de 0, 975 ou 1 950 mg/kg p.c. par jour) ou b) du Na3NTAà des doses de 0, 2 500 ou 5 000 ppm (soit l'équivalent de 0, 325 ou 650 mg/kg p.c. par jour) pendant 18 mois suivis d'une période de rétablissement de 3 mois. a) Dans les groupes traités au NTA, on a pu observer une augmentation importante de l'incidence de tumeurs rénales (principalement des adénocarcinomes des cellules des tubules rénaux) chez les mâles traités (0/20, 5/49 et 24/44, respectivement; p = 0,001) et chez les femelles exposées à des doses élevées (0/20, 0/39 et 4/50, respectivement; p = 0,041 pour la tendance linéaire). DMENO non néoplasique par voie orale = 975 mg/kg p.c. par jour sous forme de NTA (7 500 ppm), mesurée d'après la baisse du gain de poids corporel chez les groupes de femelles traitées et de mâles exposés une dose élevée. On a observé, principalement chez les groupes exposés à la dose élevée, des lésions non néoplasiques, comme des hydronéphroses, une dégénérescence des cellules des tubules et une inflammation des reins. Une hyperplasie épithéliale transitionnelle a été constatée dans l'uretère d'un mâle exposé à une faible dose et dans le bassinet du rein d'une femelle exposée à une dose élevée. b) Dans les groupes traités au Na3NTA, on a pu observer une augmentation liée à la dose administrée des tumeurs hématopoïétiques chez les mâles (0/20, 4/47 et 9/50, respectivement; p = 0,015); on a également pu constater une augmentation de l'incidence de ces tumeurs chez les femelles, mais aucune relation dose-réponse claire n'a pu être mise en évidence (3/18, 7/47 et 4/47, respectivement). Aucune tumeur au niveau du tractus urinaire n'a été signalée. On a pu constater chez les deux sexes une baisse du gain de poids corporel liée à la dose administrée. L'hydronéphrose, seule lésion non néoplasique, s'est manifestée chez un animal de chaque sexe exposé à une faible dose, et chez 28 mâles et 30 femelles exposés à une dose élevée (NCI, 1977). |
|
Autres études portant sur l'exposition des rats à la substance dans leur alimentation : Des groupes de rats Fischer 344 (24 de chaque sexe) ont été exposés dans leur alimentation à des doses de 0, 200, 2 000 ou 20 000 ppm de Na3NTA (soit l'équivalent de 0, 10, 100 ou 1 000 mg/kg p.c. par jour) pendant 104 semaines. On a pu observer, pour les individus exposés à la dose élevée, des adénomes et des adénocarcinomes rénaux chez 4 mâles sur 24 et 4 femelles sur 24 (p = 0,004 et 0,003, respectivement) ainsi que des carcinomes transitionnels dans les uretères de 8 mâles sur 24 et de 6 femelles sur 24 (p < 0,001), dans le bassinet du rein chez 4 mâles sur 24 (p = 0,003) et dans la vessie de 5 femelles sur 24 (p = 0,001). Une femelle exposée à une dose moyenne a développé un papillome de la vessie. Aucune tumeur n'a été constatée dans les groupes témoins. DMEO non néoplasique par voie orale = 10 mg/kg p.c. par jour sous forme de Na3NTA (200 ppm), mesurée d'après l'augmentation marginale de l'incidence de l'hyperplasie des cellules transitionnelles observée dans le bassinet du rein, les uretères et la vessie des animaux des deux sexes. DMENO non néoplasique par voie orale = 100 mg/kg p.c. par jour sous forme de Na3NTA (2000 ppm), mesurée d'après l'augmentation marginale de l'incidence de l'hyperplasie des cellules transitionnelles observée dans le bassinet du rein, les uretères et la vessie des mâles et des femelles. Le gain de poids corporel et le taux de survie ont diminué chez les mâles exposés à une dose élevée alors que l'hydronéphrose ne s'est avérée évidente que chez les individus des deux sexes exposés à une dose élevée (NCI, 1977). Des rats Charles River CD (50 de chaque sexe par groupe) ont été exposés dans leur alimentation à des doses de 0 %, 0,03 %, 0,15 % ou 0,5 % de Na3NTA (soit l'équivalent de 0, 19, 97 ou 322 mg/kg p.c. par jour) pendant 24 mois. Des taux d'incidence similaires pour divers types de tumeurs ont été relevés dans tous les groupes (y compris le groupe témoins) et il a été estimé que ces tumeurs n'étaient pas liées au traitement. DMENO non néoplasique par voie orale = 97 mg/kg p.c. par jour (0,15 % de Na3NTA) calculée d'après une augmentation de l'incidence et de la gravité des néphrites et des néphroses observées à 0,15 % et 0,5 % de Na3NTA au cours de l'étude. Après 6 mois, on a pu observer chez les animaux exposés à 0,15 % de Na3NTA une néphrose bénigne consistant en une dégénérescence hydropique des cellules du tubule et en une dilatation mineure de ce dernier. Il a également pu être observé, à plusieurs occasions au cours de l'étude, une augmentation de la concentration de zinc dans l'urine à toutes les doses sauf à la plus faible (Nixon et al., 1972). Études sur les rats exposés dans leur eau d'abreuvement : Des groupes de 196 rats Sprague-Dawley mâles ont été exposés à 0 % ou 0,1 % de Na3NTA (soit l'équivalent de 0 ou 100 mg/kg p.c. par jour) dans leur eau d'abreuvement pendant 2 ans. Une augmentation importante des adénomes et des adénocarcinomes rénaux (5/186 dans les groupes témoins et 29/183 dans les groupes exposés, respectivement; p < 0,01) a pu être constatée chez les animaux exposés. L'incidence générale des néphrites et des hyperplasies des cellules des tubules rénaux était semblable dans les groupes témoins et les groupes exposés (atteignant 85 % des animaux). Toutefois, on a constaté que l'incidence d'hyperplasies graves des tubules rénaux était plus importante dans le groupe d'animaux exposés (44/186 dans les groupes témoins contre 67/183 dans les groupes exposés). DMENO non néoplasique par voie orale = 100 mg/kg p.c. par jour (0,1 % de Na3NTA), calculée d'après l'augmentation de l'incidence des hyperplasies graves des tubules rénaux chez les mâles exposés par rapport aux rats des groupes témoins (Goyer et al., 1981). Aucune étude concernant l'exposition chronique par inhalation n'a été recensée pour le NTA. Aucune étude concernant l'exposition cutanée chronique ou l'exposition chronique par inhalation n'a été recensée pour le Na3NTA. |
|
| Génotoxicté et paramètres connexes : in vivo | Mutation et recombinaison géniques NTA Résultat négatif pour les mutations létales récessives liées au sexe dans les cellules germinales chez le Drosophila melanogaster exposé par voie orale pendant 3 jours ou par injection unique (Kramers, 1976; Woodruff et al., 1985; Mason et al., 1992). Résultat négatif pour le test de létalité dominante chez la souris Swiss, exposée par voie orale (1 g/kg p.c. par jour pendant 5 jours) ou par injection intrapéritonéale unique de 125 mg/kg p.c. (Epstein et al., 1972). Na3NTA Résultat négatif pour les mutations létales récessives liées au sexe dans les cellules germinales chez le Drosophila melanogaster (exposé à 50 mmol/L par voie orale pendant 3 jours) (Costa et al., 1988b). Résultat positif au test SMART (« somatic mutation and recombination test ») chez le Drosophila melanogaster exposé par voie orale à 50 mmol/L pendant 24 à 42 h (Zordan et al., 1990, 1991). |
Dommages à l'ADN NTARésultat positif pour la fragmentation de l'ADN dans les cellules du rein et de la vessie chez des rats Sprague-Dawley mâles exposés par voie orale à des doses de 1 000 ou de 2 000 mg/kg p.c. (Nesslany et al., 2008). Résultat positif pour la fragmentation de l'ADN et la formation de micronoyaux dans les cellules du rein (dose de 490 mg/kg p.c. par voie orale, par jour et pendant 3 jours) et de la vessie (dose unique de 490 ou 735 mg/kg p.c. par voie orale) chez des rats Sprague-Dawley mâles (Robbiano et al., 1999, 2002). Na3NTA Résultat négatif pour la formation de micronoyaux dans les cellules de la moelle osseuse après une injection intrapéritonéale unique de 200 à 400 mg/kg p.c. chez la souris Swiss (Montaldi et al., 1988) et dans les cellules de la moelle osseuse après une exposition par voie orale de 500 à 2 000 mg/kg p.c. par jour chez des souris NMRI mâles (BASF, 2004). |
|
Dommages chromosomiques : induction d'aneuploïdie NTARésultat positif dans les cellules germinales des souris mâles (de souche C57BL/Cne × C3H/Cne F1) après une exposition par injection intrapéritonéale unique de 275 mg/kg p.c. (Costa et al., 1988a). Résultat positif dans les cellules germinales du Drosophila melanogaster exposé à 4 000 ppm par voie orale (Ramel et Magnusson, 1979). Na3NTA Résultat positif dans les cellules germinales du Drosophila melanogaster exposé à 50 mmol/L par voie orale pendant 3 jours (Costa et al., 1988a). Résultat positif concernant l'augmentation de la fréquence de l'hyperhaploïdie des spermatocytes chez les souris Charles River après l'exposition à une injection intrapéritonéale unique de 275 mg/kg p.c. (Zordan et al., 1990). Résultat négatif dans les cellules de la moelle osseuse des souris mâles (de l'espèce C57BL/Cne × C3H/Cne F1) après une exposition par injection intrapéritonéale unique de 275 mg/kg p.c. (Russo et al., 1989). Résultat négatif concernant les spermatocytes de souris NMRI exposés à des doses de 100, 330 ou 1 000 mg/kg p.c. par voie orale (RCC-CCR, 2000). |
|
Échange de chromatides sœurs NTA Aucune étude concernant l'échange de chromatides sœurs n'a été recensée pour le NTA. Na3NTA Résultat négatif dans les cellules de la moelle osseuse des souris mâles (de l'espèce C57BL/Cne × C3H/Cne F1) après une exposition par injection intrapéritonéale unique de 275 mg/kg p.c. (Russo et al., 1989). |
|
Produits de réaction de l'ADN NTA Aucune étude concernant les produits de réaction de l'ADN n'a été recensée pour le NTA. Na3NTA Résultat négatif concernant l'absence d'augmentation du niveau de 8–hydroxy-2'-deoxyguanosine chez des rats Wistar mâles exposés à 0, 150 ou 20 000 ppm dans leur alimentation pendant 1 ou 4 semaines (Bahnemann et al., 1998; Leibold et al., 2002). |
|
| Génotoxicté et paramètres connexes : in vitro | Mutation et recombinaison géniques NTARésultat négatifchez S. typhimurium, des souches TA97, TA98, TA100, TA102, TA104, TA1535, TA1537 et TA1538 et chez Escherichia coli WP2 uvrA, sans activation métabolique (Zeiger et al., 1992; Nesslany et al., 2008). Résultat positif concernant la mutation au locus TK des cellules de lymphomes de souris (L5178Y) sans activation métabolique (Nesslany et al., 2008). Na3NTA Résultat négatifchez Salmonella typhimurium, des souches TA97, TA98, TA100, TA102, TA104, TA1535, TA1537 et TA1538 avec ou sans activation métabolique (Dunkel et al., 1985; Lopreno et al., 1985; Zeiger et al., 1992). Résultat négatif pour l'essai de mutation directe chez des souches d'Aspergillus nidulans (diploïde P1 et haploïde 35) et chez Schizosaccharomyces pombe P1, avec ou sans activation métabolique (Loprieno et al., 1985; Crebelli et al. 1986). Résultat négatif concernant l'essai de mutation au locus TK dans les cellules de lymphomes de souris (L5178Y) avec et sans activation (Mitchell et al., 1988; Myhr et Caspary, 1988) Résultat négatif concernant l'essai de mutation au locus HGPRT sur des cellules hétéroploïdes de hamsters chinois (test HPRT), sans activation métabolique (Celotti et al., 1987). |
Altération et réparation de l'ADN NTARésultat positif pour la fragmentation de l'ADN dans les cellules du rein et de l'épithélium de la vessie chez l'homme et le rat, sans activation métabolique; rupture de brins d'ADN et formation de micronoyaux dans les cellules rénales de l'homme et du rat, sans activation métabolique (Robbiano et al., 1999, 2002). Résultat positif concernant l'induction de micronoyaux dans les cellules de lymphomes de souris (L5178Y, CTLL-2 et CTLL-2 bcl2) ainsi que dans les cellules rénales de rats Sprague-Dawley, sans activation métabolique (Nesslany et al., 2008). Résultat négatif concernant l'essai de la fonction SOS chez Escherichia coli (souche PQ37), sans activation métabolique (Venier et al., 1989). Na3NTA Résultat négatif concernant le test du micronoyau chez les humains, sans activation métabolique (Montaldi et al., 1987). Résultat négatif concernant l'essai de la synthèse de l'ADN non programmée dans les principaux hépatocytes du rat, sans activation métabolique (Williams et al., 1982, 1989). Résultat non probant concernant l'essai de la synthèse de l'ADN non programmée dans des lymphocytes humains, sans activation métabolique (Celotti et al., 1988). |
|
Transformation cellulaire NTAAucune étude concernant la transformation cellulaire n'a été recensée pour le NTA. Na3NTA Résultat négatif concernant les fibroblastes BHK 21/C31 chez le hamster de Syrie, sans activation métabolique (Lanfranchi et al., 1988). Résultat négatif concernant les cellules C3H/10T1/2 chez la souris, sans activation métabolique (Dunkel et al., 1988). |
|
Aberrations chromosomiques NTARésultat négatif concernant les cellules ovariennes de hamster chinois, avec et sans activation métabolique (Loveday et al., 1989). Résultat positif pour les lymphocytes humains, sans activation métabolique (Nesslany et al., 2008). Na3NTA Résultat négatif pour les lymphocytes humains, sans activation métabolique (Montaldi et al., 1987, 1988). Résultat faiblement positif concernant les cellules Cl-1 chez le hamster chinois (test d'anomalie chromosomique et du micronoyau), avec activation métabolique (Modesti et al., 1995). Résultat non probant concernant les cellules PT K1 chez le rat kangourou, sans activation métabolique (Kihlman et Sturelid, 1970). |
|
Échange de chromatides soeurs NTARésultat négatif concernant les cellules ovariennes de hamster chinois, avec et sans activation métabolique (Loveday et al., 1989). Résultat négatif pour les lymphocytes humains, sans activation métabolique (Brat et Williams, 1984). Na3NTA Résultat négatif concernant les cellules ovariennes de hamster chinois et les cellules de lymphomes de souris (L5178Y), sans activation métabolique (Montaldi et al., 1985). Résultat négatif pour les cellules ovariennes de hamster chinois, sans activation métabolique (Brat et Williams, 1984). |
|
| Toxicité pour la reproduction | NTA Aucune étude concernant la toxicité pour la reproduction n'a été recensée pour le NTA. |
Na3NTA Un régime alimentaire contenant 0 %, 0,1 % ou 0,5 % de Na3NTA (soit l'équivalent de 0, 90 et 450 mg/kg p.c. par jour) a été administré de façon continue à des rats Charles River CD (20 de chaque sexe par groupe) pendant deux générations ou à des groupes de 20 rats femelles uniquement pendant chaque période d'organogenèse (les jours 6 à 15 de la gestation). DSENO concernant la toxicité pour la reproduction = 450 mg/kg p.c. par jour (0,5 % de Na3NTA) mesurée d'après l'absence de différence significative dans le taux de conception, les taux de fertilité et de lactation, l'indice de lactation, le nombre moyen de ratons nés vivants par portée, le nombre de ratons vivants et le nombre moyen de ratons sevrés par portée réformée. DMENO pour la toxicité générale = 450 mg/kg p.c. par jour (0,5 % de Na3NTA) d'après la toxicité faible (non précisée) (Nole et al., 1971). |
|
| Toxicité pour le développement | NTA Aucune étude concernant la toxicité pour le développement n'a été recensée pour le NTA. Na3NTA Au cours de l'étude sur deux générations susmentionnée, des groupes de 20 rates Charles River CD gravides ont été exposés à un régime alimentaire contenant 0 %, 0,1 % ou 0,5 % de Na3NTA (soit l'équivalent de 0, 90 et 450 mg/kg p.c. par jour) aux jours 6 à 15 de la gestation. Dix mères de chaque groupe ont été sacrifiées aux jours 13 et 21 de la gestation. DSENO concernant la toxicité pour le développement = 450 mg/kg p.c. par jour (0,5 % de Na3NTA) d'après l'absence de signes patents de fœtotoxicité ou d'embryotoxicité ni de tératogénicité. Après leur insémination artificielle, des groupes de 20 lapines néo-zélandaises ont été exposés par gavage dans l'eau distillée à des doses quotidiennes de Na3NTA de 0, 2,5, 25, 100 ou 250 mg/kg p.c. par jour aux jours 7 à 16 de la gestation. Les animaux ont été sacrifiés au jour 28 de la gestation. DSENO concernant la toxicité pour le développement et la toxicité maternelle = 250 mg/kg p.c. par jour d'après l'absence d'effets liés au traitement (Nole et al., 1971). Aucun effet tératogène n'a été observé au cours d'une étude sur des souris NMRI albinos gravides (10 individus par groupe) exposées à des doses de 0 % ou 0,2 % de Na3NTA (soit l'équivalent de 0 ou 570 mg/kg p.c. par jour) dans leur eau d'abreuvement aux jours 6 à 18 de la gestation. DSENO concernant la toxicité pour le développement et la toxicité maternelle = 570 mg/kg p.c. par jour (0,2 % de Na3NTA), d'après l'absence de différence significative dans le poids pris par les mères et d'effets tératogènes observés chez les animaux traités (Tjälve, 1972). REMARQUE : Le Na3NTA administré de concert avec du cadmium dichloride ou de l'hydroxyde de méthylmercure dans de l'eau d'abreuvement à des rates River CD gravides n'a pas augmenté l'incidence de malformations induites par le cadmium ou le mercure (Nolen et al., 1972a, b). |
| Sensibilisation | NTA Aucune étude concernant la sensibilisation n'a été recensée pour le NTA. Na3NTA Sensibilisation cutanée (test épicutané recouvert de Buehler) : Des cochons d'Inde (10 ou 20 individus par groupe) ont été exposés à une solution de 0 % ou 50 % de Na3NTA dans l'eau. Les traitements ont eu lieu aux jours 0, 7 et 14. Aucune irritation cutanée n'a été constatée. Après le test de provocation, aucun des animaux traités ou témoins n'a montré de réaction cutanée (BASF, 1997b). |
| Irritation | NTA Aucune étude concernant l'irritation n'a été recensée pour le NTA. Na3NTA Irritation des yeux (test de Draize) : Un œil de chaque animal de groupes de 3 lapins albinos a été exposé à des doses de 0 ou 100 mg de poudre sèche de Na3NTA pendant 24 heures. Une irritation modérée des yeux a été décelée (Monsanto, 1968). Irritation des yeux : Des groupes de 3 lapins albinos ont été exposés à une solution de 0 ou 38 % de Na3NTA (appliquée dans le sac conjonctival d'un œil de chaque animal). Une irritation modérée des yeux a été signalée (EURAR, 2008). Irritation des voies respiratoires : Des groupes de souris (nombre, sexe et espèce inconnus) ont été exposés à du Na3NTA en aérosol pendant une durée de 5 minutes dans un appareil d'essai spécialement conçu. Les souris exposées ont montré des signes d'irritation; le Na3NTA a été classé comme « légèrement irritant » à 0,22 mg/L, comme moyennement irritant » entre 1,09 et 1,41 mg/L et comme gravement irritant » à 7,6 mg/L (USEPA, 1980). |
| Humains | |
| Sensibilisation | Des tests épicutanés fermés ont été menés chez 66 volontaires humains (sexe inconnu) en utilisant une solution aqueuse à 1 % d'un détergent liquide contenant 20 % de Na3NTA (environ 0,5 mL de la matière d'essai a été appliqué sur la partie supérieure du bras des sujets de l'essai pour une série de 9 applications au totales [24 h par application, 3 fois par semaine pendant 3 semaines], suivie d'un test de provocation deux semaines plus tard). Aucun signe de sensibilisation n'a été rapporté chez ces volontaires (Nixon, 1971). |
Note de bas de page
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
Acide nitrilotriacétique
Numéro de registre du Chemical Abstracts Service
139-13-9
Environnement Canada
Santé Canada
Juillet 2010
- Sommaire
- Introduction
- Identité de la substance
- Propriété physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Valeurs estimatives de la limite supérieure de l'absorption journalière de NTA chez la population générale du Canada
- Annexe 2 : Scénarios ConsExpo de calcul des échantillons
- Annexe 3 : Résumé des données sur les effets du NTA et du Na3NTA sur la santé
En application de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de l’acide nitrilotriacétique ou NTA, dont le numéro de registre du Chemical Abstracts Service est 139-13-9. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance durant la catégorisation visant la Liste intérieure dans le cadre du Défi. On a déterminé que le NTA constitue une priorité élevée, parce qu’on estime qu’il présente un risque d’exposition intermédiaire à la population canadienne et que cette substance est inscrite sur une liste de produits cancérogènes par d'autres agences. Bien que l’on ait conclu que le NTA répond aux critères de catégorisation écologique relatifs à la persistance, il ne répond pas à ceux relatifs au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée principalement sur les risques pour la santé humaine. Les renseignements sur les sels de sodium de l’acide nitrilotriacétique ont également été pris en compte dans le cadre de l’évaluation préalable puisque les paramètres toxicologiques de cet acide et de ses sels de sodium sont similaires et que leur dissociation génère un groupe caractéristique commun. Toutefois, la conclusion de l’évaluation préalable ne porte que sur l’acide nitrilotriacétique; les données liées à ses sels de sodium ne constituent que des renseignements complémentaires.
Selon les données transmises conformément à l’article 71 de la LCPE (1999), aucune entreprise canadienne n'a déclaré avoir fabriqué du NTA en quantité égale ou supérieure au seuil de déclaration fixé à 100 kg pour l'année civile 2006. Cependant, l’importation au Canada d’une quantité de 1 000 à 10 000 kg de cet acide a été déclarée pour cette année. Selon une autre source, la quantité totale d’acide nitrilotriacétique importée en 2006, y compris ses sels, était de 3,9 millions de kilogrammes. Les données scientifiques et techniques ainsi que les réponses à l’enquête réalisée en vertu de l’article 71 indiquent que l’acide nitrilotriacétique est surtout utilisé dans les produits de nettoyage industriels et institutionnels. Il est également utilisé au Canada comme chélateur dans divers procédés industriels, notamment le traitement industriel de l’eau de chaudière et le traitement des pâtes et papiers pour la fabrication de produits de papier et de carton. Auparavant, l’utilisation du sel de trisodium de l’acide nitrilotriacétique (Na3NTA) comme adjuvant pour détergents à lessive était très répandue. De nos jours, ce sel est principalement utilisé au Canada dans des applications industrielles et institutionnelles. Il sert d’ingrédient non actif dans des préparations pesticides canadiennes, et sa présence a été relevée dans un nombre limité de produits de soins personnels canadiens.
Les émissions d’acide nitrilotriacétique et de ses sels dans l’environnement ambiant devraient provenir principalement de sources anthropiques. Ces substances ont été mesurées au Canada dans l’eau potable traitée par les municipalités, l’eau souterraine et l’eau industrielle. L’exposition de la population générale par la consommation d’eau potable et l’utilisation de produits de consommation devrait être faible.
Des études à long terme effectuées sur des rats et des souris ont révélé que la présence de concentrations élevées d’acide nitrilotriacétique dans l’alimentation et l’eau potable provoquait l’apparition de tumeurs primaires à plusieurs endroits du tractus urinaire. Des tumeurs des cellules épithéliales transitionnelles dans les tissus des reins, des uretères et de la vessie, ainsi que des tumeurs des cellules des tubules rénaux ont été observées. De plus, dans le cadre d’études à court et à long terme portant sur l’administration répétée d’acide nitrilotriacétique par voie orale à des animaux de laboratoire, des lésions non néoplasiques ont souvent été observées dans les tissus des reins, des uretères et de la vessie. Les renseignements disponibles indiquent que l’acide nitrilotriacétique n’est vraisemblablement pas génotoxique. Par conséquent, bien que le mode d’induction des tumeurs ne soit pas complètement élucidé, on ne considère pas que les tumeurs observées résultent d’une interaction directe avec le matériel génétique. Une approche fondée sur le seuil d’innocuité a donc été utilisée pour évaluer les risques pour la santé humaine.
D'après la comparaison de l'exposition estimative au NTA au Canada et des seuils d'effet critique, et compte tenu des incertitudes dans les bases de données sur l'exposition et la caractérisation des dangers, on considère que les marges d’exposition sont adéquates pour protéger la santé humaine.
À la lumière des renseignements disponibles sur le potentiel du NTA d'avoir des effets nocifs sur la santé humaine, il est conclu que cette substance ne pénètre pas dans l'environnement en quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer au Canada un danger pour la vie ou la santé humaine.
Un scénario d'exposition a été élaboré en fonction de l'information obtenue sur l'utilisation commerciale en vue d'estimer de façon prudente les rejets des exploitations industrielles dans le milieu aquatique ainsi que les concentrations qui en découlent. D’après les estimations, les concentrations dans l’environnement devraient être inférieures à celles pouvant avoir des effets nocifs sur les organismes aquatiques sensibles, ce qui indique que la substance ne nuira vraisemblablement pas au milieu aquatique. De plus, des données permettent de croire que le NTA se dégradera probablement vite dans les milieux naturels.
À la lumière des renseignements disponibles, on peut conclure que le NTA ne pénètre pas dans l'environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l'environnement ou sur sa diversité biologique, ou à mettre en danger l'environnement essentiel pour la vie. L’acide nitrilotriacétique ne satisfait pas aux critères de la persistance et de la bioaccumulation prévus dans le Règlement sur la persistance et la bioaccumulation.
D'après des renseignements disponibles, il est conclu que l’acide nitrilotriacétique ne satisfait à aucun des critères de l'article 64 de la LCPE (1999).
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
La Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999) exige que les ministres de l'Environnement et de la Santé procèdent à une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou la santé humaine.
En se fondant sur l'information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu'une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères environnementaux de la catégorisation, notamment la persistance (P), le potentiel de bioaccumulation (B) et la toxicité intrinsèque pour les organismes aquatiques (Ti) et que l'on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d'exposition (PFRE) ou qui présentent un risque d'exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine, compte tenu des classifications qui ont été établies par d'autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont donc publié un avis d'intention dans la Partie I de la Gazette du Canada (Canada, 2006) dans lequel ils priaient l'industrie et les autres parties intéressées de fournir, selon un calendrier déterminé, des renseignements précis qui pourraient servir à étayer l'évaluation des risques, ainsi qu'à élaborer et à évaluer les meilleures pratiques de gestion des risques et de bonne gestion des produits pour ces substances jugées hautement prioritaires.
On a jugé que l’acide nitrilotriacétique (NTA) est une substance dont l'évaluation des risques pour la santé humaine est hautement prioritaire, car on considère qu'elle présente un REI et elle a été classée par d'autres organismes en fonction de sa cancérogénicité.
Le volet du Défi portant sur le NTA a été publié dans la Gazette du Canada le 31 janvier 2009 (Canada, 2009). En même temps a été publié le profil de cette substance qui présentait l'information technique (obtenue avant décembre 2005) sur laquelle a reposé sa catégorisation. Des renseignements sur les utilisations de la substance ont été reçus en réponse au Défi.
Même s'il a été jugé hautement prioritaire d'évaluer les risques que présente le NTA pour la santé humaine et que cette substance répond aux critères environnementaux de la catégorisation applicables à la persistance, elle ne répond pas aux critères définissant le potentiel de bioaccumulation ou la toxicité intrinsèque pour les organismes aquatiques. Par conséquent, la présente évaluation est axée principalement sur les renseignements utiles à l'évaluation des risques pour la santé humaine.
Les évaluations préalables mettent l'accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères au sens de l'article 64 de la LCPE (1999). Les évaluations préalables examinent les renseignements scientifiques et tirent des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.[1]
La présente évaluation préalable finale prend en considération les renseignements sur les propriétés chimiques, les dangers, les utilisations de la substance en question et l'exposition à celle-ci, y compris l'information supplémentaire fournie dans le cadre du Défi. Les données pertinentes pour l'évaluation préalable de cette substance sont tirées de publications originales, de rapports de synthèse et d'évaluation, de rapports de recherche de parties intéressées et d'autres documents consultés au cours de recherches documentaires menées récemment, jusqu'en avril 2009 (pour les sections traitant de la santé humaine et de l'environnement). Les études les plus importantes ont fait l'objet d'une évaluation critique. Il est possible que les résultats de modélisation aient servi à formuler des conclusions. L'évaluation des risques pour la santé humaine suppose la prise en compte des données utiles à l'évaluation de l'exposition (non professionnelle) de la population dans son ensemble et de l'information sur les dangers et les risques pour la santé (principalement d'après les évaluations s'appuyant sur la méthode du poids de la preuve effectuées par d'autres organismes, lesquelles qui ont servi à déterminer le caractère prioritaire de la substance). Les décisions concernant la santé humaine reposent sur la nature de l'effet critique retenu ou sur la marge entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l'exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l'exposition et les effets, et ce, dans le contexte d'une évaluation préalable. L'évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Il s'agit plutôt d'un sommaire de l'information la plus importante afin d'appuyer la conclusion.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d'Environnement Canada et elle intègre les résultats d'autres programmes exécutés par ces ministères. Les parties de la présente évaluation préalable qui portent sur la santé humaine et l'écologie ont fait l'objet d'une étude consignée par des pairs ou d'une consultation de ces derniers. Des commentaires sur les parties techniques concernant la santé humaine ont été reçus de la part d'experts scientifiques désignés et dirigés par la Toxicology Excellence for Risk Assessment (TERA), notamment Bernard Gadagbui, Ph. D. (TERA), Michael Jayjock, Ph. D. (The LifeLine Group) et Chris Bevans, Ph. D. (CJB Consulting). De plus, la version provisoire de la présente évaluation préalable a fait l'objet d'une consultation publique de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l'évaluation préalable des risques. Les méthodes utilisées dans les évaluations préalables du Défi ont été examinées par un Groupe consultatif du Défi indépendant.
Les principales données et considérations sur lesquelles repose la présente évaluation préalable sont résumées ci-après.
Aux fins du présent document, la substance est appelée « NTA », appellation tirée du nom commun anglais « nitrilotriacetic acid » (acide nitrilotriacétique). Les renseignements liés au NTA sont résumés dans le tableau 1.
Tableau 1. Identité de la substance
| No CAS | 139-13-9 |
| Nom dans la LIS | Acide nitrilotriacétique |
| Noms relevés dans les NCI | Glycine, N,N-bis(carboxymethyl)- (TSCA) Nitrilotriacetic acid (EINECS) |
| Autres noms | Aminotriacetic acid H3NTA Nitrilotris(methylenecarboxylic acid) NTANTA acid Triglycine |
| Groupe chimique (groupe de la LIS) | Produits chimiques organiques définis |
| Principale sous-classe chimique | Acides; amines tertiaires |
| Formule chimique | C6H9NO6 |
| Structure chimique | 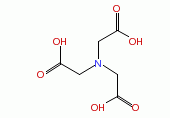 |
| SMILES | O=C(O)CN(CC(=O)O)CC(=O)O |
| Masse moléculaire | 191,14 g/mol |
| Abréviations : no CAS (numéro de registre du Chemical Abstracts Service); LIS (liste intérieure des substances); EINECS, (inventaire européen des substances chimiques commerciales existantes); NCI (National Chemical Inventories); SMILES (simplified molecular input line entry specification); TSCA ( inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). Source : National Chemical Inventories (2008). |
|
Dans le cadre de l'évaluation, l'examen des données portant sur le NTA a été complété par l'information relative au sel de trisodium du NTA, connu plus communément sous le nom de nitrilotriacétate de trisodium (no CAS 5064-31-3). Cette substance existe également sous la forme de monohydrate, aussi connue sous le nom de nitrilotriacétate de trisodium monohydraté (no CAS 18662-53-8). Ces deux types de sels de trisodium seront appelés Na3NTA dans la présente évaluation. Bien que la présente évaluation comprenne des renseignements supplémentaires sur Na3NTA, seul le NTA est évalué en fonction des critères énoncés à l'article 64 de la LCPE (1999).
Le tableau 2 présente les propriétés physiques et chimiques (valeurs expérimentales et estimées) du NTA qui se rapportent à son devenir dans l'environnement. Les études clés à partir desquelles des données expérimentales ont été utilisées pour certaines de ses propriétés ont fait l'objet d'un examen critique afin d'en assurer la validité. Des modèles fondés sur les relations quantitatives structure-activité (RQSA) ont été utilisés pour générer des données pour certaines des propriétés physiques et chimiques du NTA. Ces modèles sont principalement fondés sur des méthodes d'addition de fragments; autrement dit, ils s'appuient sur la structure d'un produit chimique donné. Seules les formes neutres d'un produit chimique (c.-à-d. non ionisé) peuvent être fournies comme données d'entrée à ces modèles (forme SMILES); par conséquent, les valeurs modélisées figurant au tableau 2 concernent la forme neutre du NTA.
Tableau 2. Propriétés physiques et chimiques du NTA
| Propriété | Type | Valeur | Température (°C) | Référence |
|---|---|---|---|---|
| Abréviations : Koa, coefficient de partage octanol-air; Kco, coefficient de partage carbone organique-eau; Koe, coefficient de partage octanol-eau; pKa, constante de dissociation acide. | ||||
| État physique | Sous forme d'acide non dissocié | Aiguilles ou cristaux prismatiques | OMS, 1996 | |
| Point de fusion (oC) | Expérimental | 242 | PhysProp, 2006 | |
| Modélisé | 296,63 | MPBPWIN, 2008 | ||
| Point d'ébullition (oC) | Modélisé | 429,28 | MPBPWIN, 2008 | |
| 498,2 | ACD/Labs, 2008 | |||
| Masse volumique (kg/m3) | Modélisé | 1610 | 20 | ACD/Labs, 2008 |
| Pression de vapeur (Pa) | Modélisé | 9,54 10-7 | 25 | MPBPWIN, 2008 |
| 3,7 10-9 | 25 | ACD/Labs, 2008 | ||
| Constante de la loi de Henry (Pa·m3/mol) | Modélisé | 1,21 10-11 | 25 | HENRYWIN, 2008 |
| Log Koe (sans dimension) | Modélisé | -3,81 | 25 | KOWWIN, 2008 |
| -1,764 | 25 | ACD/Labs, 2008 | ||
| Log Kco (sans dimension) | Modélisé | -2,02 | KOCWIN, 2008 | |
| Log Koa (sans dimension) | Modélisé | 10,5 | KOAWIN, 2008 | |
| Solubilité dans l'eau (mg/L) | Expérimental | 59 100 | 25 | Yalkowsky et Dannenfelser, 1992 |
| Modélisé | 249 060 | 25 | WATERNT, 2008 | |
| 1 000 000 | 25 | ACD/Labs, 2008 | ||
| pKa (sans dimension) | Modélisé | pKa1 = 10,3 (le plus basique) pKa2 = 3,05 pKa3 = 2,27 pKa4 = 1,49 (le plus acide) |
25 | ACD/pKaDB, 2005 |
Le NTA est un solide blanc à température et à pression ambiantes.
Le programme de modélisation pKaDB de ACD/pKaDB (2005) prévoit que le NTA s'ionise dans l'eau en quatre étapes : en tant que base à la première étape, en attirant un proton du groupe des amines tertiaires, puis en tant qu'acide aux deuxième, troisième et quatrième étapes, en relâchant un proton de chacun des trois groupes hydroxy. On obtient donc quatre valeurs de pKa, présentées dans le tableau 2.
Avec l'accroissement du PH, l'ampleur de l'ionisation du NTA augmente. Dans des eaux ambiantes, les molécules de NTA chargées négativement forment immédiatement des complexes avec les ions métalliques chargés positivement en solution (EURAR, 2005).
Le NTA est une substance anthropique qui n'est pas présente de manière naturelle dans l'environnement. Il est présent dans l'environnement principalement en raison de son rejet dans les eaux usées par des activités de traitement, d'utilisation et d'élimination de ce dernier (Santé Canada, 1990). Le NTA est obtenu grâce à l'acidification du Na3NTA à pH 1-2 (Gousetis et Opgenorth, 2005). Traditionnellement, la production industrielle de Na3NTA suivait un procédé alcalin qui formait un certain nombre de sous-produits (Coker, 1972). Ainsi, un procédé acide a par la suite été élaboré et est aujourd'hui la méthode utilisée par les principaux fabricants. Dans ledit procédé acide, de l'ammoniaque réagit avec du formaldéhyde pour créer de l'hexaméthylènetétramine, qui est par la suite traitée avec du cyanure d'hydrogène dans de l'acide sulfurique pour obtenir du triscyanométhylamine. Le produit intermédiaire cyanuré est ensuite saponifié avec de l'hydroxyde de sodium pour former du Na3NTA (Gousetis et Opgenorth, 2005). À l'échelle mondiale, les deux fabricants principaux de NTA et de ses sels sont BASF, en Allemagne, et Solutia, aux États-Unis (Suresh et Kishi, 2006). Au Canada, cette substance est principalement vendue sous la forme de Na3NTA (Glauser et al., 2007).
Des enquêtes menées récemment auprès de l'industrie par le truchement d'un avis qui a été publié dans la Gazette du Canada conformément à l'article 71 de la LCPE (1999), ont fourni des renseignements pour l'année 2006 (Canada, 2009). Cet avis demandait des données sur la fabrication, l'importation et l'utilisation de quantités de NTA au Canada.
Selon les renseignements transmis en réponse à l'avis, aucune entreprise au Canada n'a déclaré avoir fabriqué du NTA en quantité égale ou supérieure au seuil de déclaration fixé à 100 kg pour l'année civile 2006. Pourtant, selon les déclarations, entre 1 000 et 10 000 kg de cette substance ont été importés au Canada durant cette même année (Environnement Canada, 2009a). La quantité totale de NTA (y compris ses sels) importée au Canada en 2006 se chiffrait à 3,9 millions de kilogrammes selon une autre source (Glauser et al., 2007).
Selon les données transmises en conformité de l'article 71 de la LCPE (1999) et d'autres sources accessibles au public, le NTA est utilisé au Canada dans les produits de nettoyage industriels et institutionnels, les nettoyants pour véhicules, le bitume routier, les engrais, les solutions de révélateurs photographiques et les produits de détartrage utilisés dans les activités d'exploitation minière et pétrolière (Environnement Canada, 2009a). Selon les données proposées par les publications scientifiques disponibles, le NTA est principalement utilisé au Canada dans les produits de nettoyage industriels et institutionnels, qui comprennent : les agents nettoyants génériques, les dégraissants, les nettoyants pour véhicule, les désinfectants, les produits d'hygiène, les détergents à lessive et les détergents pour lave-vaisselle (Mueller et al., 2006; Glauser et al., 2007; Ahmed, 2009). Le NTA est également utilisé au Canada comme chélateur dans divers procédés industriels, notamment le traitement industriel de l'eau de chaudière et le traitement des pâtes et papiers pour la fabrication de produits de papier et de carton (Eichinger, 2005; Gousetis et Opgenorth, 2005; Bellows, 2006; Glauser et al., 2007; courriel de la Direction des aliments adressé au Bureau de gestion du risque de Santé Canada en 2009; source non citée). Auparavant, les publications scientifiques proposaient le NTA comme chélateur thérapeutique en cas de manganisme et comme traitement contre la surcharge en fer (Kaur et al., 1980; Pollack et Ruocco, 1981).
Les quantités totales de NTA utilisées au Canada et déclarées dans le cadre de l'article 71 de la LCPE (1999) se chiffraient entre 1 000 et 10 000 kg pour l'année civile 2006. Selon les données disponibles dans un rapport technique, la quantité totale de NTA (y compris ses sels) importée au Canada en 2006 (soit 3,9 millions de kilogrammes) a été utilisée au cours de la même année (Glauser et al., 2007).
À l'échelle mondiale, l'utilisation du NTA est similaire à celle que l'on retrouve au Canada : elle est principalement concentrée dans les nettoyants industriels et institutionnels. Le NTA est également utilisé dans le monde en tant qu'adoucisseur d'eau dans diverses applications industrielles, comme la prévention de l'entartrage dans l'eau de chaudière, le tannage du cuir, le traitement et le nettoyage des textiles, le placage et le nettoyage des métaux, la production de caoutchouc et la purification de métaux des terres rares (Gousetis et Opgenorth, 2005; NTP, 2005; Bellows, 2006; Glauser et al., 2007).
Précédemment, le Na3NTA était connu pour son utilisation en tant qu'adjuvant pour les détergents à lessive, remplaçant les phosphates lorsque l'eutrophisation est devenue un enjeu planétaire (Lynn, 2009). Si elle a commencé dans les années 1990, l'utilisation du Na3NTA dans les détergents à lessive a ensuite décliné au Canada (Suresh et Kishi, 2006). D'après les renseignements disponibles, la grande majorité des produits ménagers de lessive actuellement sur le marché canadien ne contiendrait plus de Na3NTA (Modler et al., 2007). De plus, cette substance a été décelée dans quelques produits d'entretien ménagers (SCJGSARA, 2009; courriels du Bureau de la gestion du risque adressés au Bureau de l'évaluation des risques de Santé Canada en 2009). À l'heure actuelle, les utilisations principales du Na3NTA au Canada sont similaires à celles du NTA : nettoyants industriels et institutionnels et adoucisseur d'eau dans les procédés industriels. Au Canada comme ailleurs, le Na3NTA est également utilisé dans les préparations pesticides et les produits de soins personnels (Gousetis et Opgenorth, 2005; Glauser et al., 2007; ARLA, 2007; SDC, 2009).
Ni le NTA, ni le Na3NTA ne figurent à la Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques (Santé Canada, 2007). Le Na3NTA n'a pas été décelé dans des cosmétiques dans le cadre de l'enquête réalisée en vertu de l'article 71, mais est actuellement inscrit pour 11 produits de soins personnels du Système de déclaration des cosmétiques de Santé Canada (SDC, 2009).
Au Canada, le NTA n'est utilisé comme formulant ou principe actif dans aucun produit antiparasitaire homologué. Toutefois, le Na3NTA est utilisé comme formulant de produits antiparasitaires (ARLA, 2007), mais n'est pas inscrit en tant que principe actif dans le cadre de la base de données sur les produits homologués (ARLA, 2009; courriels de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada adressés au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée).
Le NTA n'est inscrit ni dans la Base de données sur les produits pharmaceutiques (BDPP), ni dans la Base de données sur les ingrédients des produits de santé naturels (BDIPSN), ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH) en tant qu'ingrédient médicinal ou non médicinal dans les produits pharmaceutiques finaux, dans les produits de santé naturels ou dans les médicaments vétérinaires fabriqués au Canada (courriels de la Direction des produits de santé naturels et la Direction des médicaments vétérinaires de Santé Canada adressés au Bureau de gestion du risque de Santé Canada en 2009, source non citée). Le Na3NTA ne figure pas non plus à la Base de données sur les ingrédients des produits de santé naturels (BDIPSN) ni dans la Base de données sur les produits de santé naturels homologués (BDPSNH), mais est inscrit en tant qu'ingrédient non médicinal dans les désinfectants (courriels du Bureau de gestion du risque de Santé Canada adressés au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée).
Le NTA est une impureté qui se retrouve dans l'acide éthylènediaminetétracétique (EDTA) et ses sels, collectivement connus sous le nom d'édétates (Dow Chemical Company, 1987; Crosbie et al., 2003; Hart, 2005). Les édétates sont des chélateurs qui peuvent être utilisés dans des produits d'entretien ménagers, la composition de cosmétiques, l'alimentation, les produits agricoles, les produits pharmaceutiques et les procédés industriels (Hart, 2005). Les édétates sont également utilisés pour traiter les empoisonnements aux métaux lourds et pour réduire le taux de cholestérol dans le sang (Lanigan et Yamarik, 2002). Selon la pharmacopée des États-Unis (USP, 2000a, b, c), la Pharmacopée européenne (EP, 2001) et le Food Chemicals Codex, le pourcentage pondéral maximal de NTA dans les édétates est de 0,1 % (courriels de la Direction des aliments de Santé Canada adressés au Bureau de gestion du risque de Santé Canada en 2008; source non citée).
Conformément aux publications techniques disponibles (Glauser et al., 2007; Deligiannis et Piccione, 2008), les renseignements fournis en réponse à l'avis donné en vertu de l'article 71 de la LCPE (1999) indiquaient que le NTA n'était pas fabriqué au Canada en 2006. La présence du NTA (et de ses sels) dans l'environnement résulterait principalement de son rejet dans les eaux usées faisant suite à son utilisation en tant que chélateur ou adoucisseur d'eau dans diverses applications (CMI, 1977; Santé Canada, 1990).
Selon les renseignements sur le NTA obtenus en vertu de l'article 71 de la LCPE (1999), les entreprises n'ont déclaré aucun rejet de cette substance dans l'air ou dans les sols en 2006; cependant, 1 000 à 10 000 kg de NTA ont été rejetés dans l'eau au cours de la même année. Les réponses obtenues à la suite de l'avis publié en vertu de l'article 71 ont également permis de constater le transfert de 145 à 14 500 kg de NTA en tant que déchet dangereux ou recyclable vers des installations de traitement des déchets hors site au cours de l'année 2006.
Des renseignements concernant les rejets et l'élimination du NTA au Canada sont également disponibles dans l'Inventaire national des rejets de polluants (INRP). Il faut noter que les chiffres relatifs au NTA présentés par l'Inventaire national des rejets de polluants peuvent également inclure les quantités rejetées et éliminées de sels de NTA. Les rejets totaux sur place et les éliminations totales hors site du NTA (et de ses sels) sont compilés au tableau 3. Il ressort des renseignements obtenus par l'Inventaire national des rejets de polluants que les rejets sur place de NTA (et de ses sels) au Canada n'ont eu lieu que dans l'air, le plus vraisemblablement par l'entremise de matières particulaires, étant donné les propriétés physiques et chimiques du NTA et de ses sels. Les rejets totaux sur place déclarés en 2006 se chiffraient à 177 kg, soit moins que les quantités déclarées en réponse à l'avis émis en application de l'article 71. Les éliminations totales hors site déclarées en 2006, transférées aux usines de traitement des eaux usées municipales en vue de leur élimination définitive, s'élevaient quant à elles à 5 800 kg (INRP, 2006).
Tableau 3. Quantités rejetées et éliminées de NTA (et de ses sels), entre 1994 et 20071,2
| Année | Rejets sur place (en kg) | Total des rejets sur place (en kg) | Total des éliminations hors site (en kg) | |||
|---|---|---|---|---|---|---|
| dans l'air | dans l'eau | dans le sol | dans un milieu indéterminé | |||
| 1 Le seuil de déclaration à l'INRP est fixé à 10 000 kg de NTA utilisés dans le cadre d'activités de fabrication, de traitement ou autres. 2 L'INRP ne rend compte que d'une fraction du total des quantités de NTA et de ses sels utilisées ailleurs (Glauser et al., 2007). |
||||||
| 1994 | - | - | - | 1 000 | 1 000 | 549 |
| 1995 | 25 | - | - | 601 | 626 | 2 000 |
| 1996 | 25 | - | - | 621 | 646 | 1 600 |
| 1997 | 2 600 | - | - | 300 | 2 900 | 2 900 |
| 1998 | 1 700 | - | - | 100 | 1 800 | 1 800 |
| 1999 | 1 900 | - | - | 100 | 2 000 | 3 300 |
| 2000 | 2 000 | - | - | 100 | 2 100 | 18 000 |
| 2001 | 1 500 | - | - | 0 | 1 500 | 14 000 |
| 2002 | 1 600 | - | - | 0 | 1 600 | 2 600 |
| 2003 | 1 300 | - | - | 0 | 1 300 | 7 300 |
| 2004 | 1 300 | - | - | 200 | 1 500 | 6 500 |
| 2005 | - | - | - | 299 | 299 | 14 000 |
| 2006 | - | - | - | 177 | 177 | 5 800 |
| 2007 | - | - | - | 536 | 536 | 5 400 |
Le NTA est présent dans l'environnement principalement sous la forme de complexes métalliques plutôt que sous sa forme d'acide libre (Santé Canada, 1990). Les complexes métalliques formés dépendent de la composition (y compris la teneur en métal) de l'eau. Par exemple, d'après un modèle de formation des complexes ion métallique-NTA, on a prévu qu'à une concentration de 25 µg/L dans l'eau de rivière, 50 % du NTA sera complexé avec les ions de cuivre, 34 % avec les ions de nickel, 9 % avec les ions de calcium et 5 % avec les ions de zinc (McFuff et Mord, 1973).
D'après les propriétés physiques et chimiques du NTA (tableau 2), les résultats de la modélisation de fugacité de niveau III (tableau 4) indiquent que la forme neutre du NTA devrait demeurer principalement dans l'eau et le sol, selon le milieu où elle est rejetée.
Tableau 4. Résultats de la modélisation de la fugacité de niveau III pour la forme neutre (non ionisé) du NTA (EQC, 2003)
| Substance rejetée dans | Fraction de la substance se répartissant dans chaque milieu (%) | |||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 0,0 | 20,4 | 79,6 | 0,04 |
| l'eau (100 %) | 0,0 | 99,8 | 0,0 | 0,2 |
| le sol (100 %) | 0,0 | 16,1 | 83,8 | 0,03 |
Comme la présence du NTA dans l'environnement résulte principalement de son rejet dans les eaux usées, l'évaluation écologique porte sur l'eau et les organismes aquatiques.
Persistance dans l'environnement
Fischer et al. (1974) ont observé, pour le NTA, une demande biologique en oxygène (DBO) dans l'eau après 30 jours de 0 à 4 % par rapport à la demande en oxygène maximale théorique. Cet essai (qui était le fondement d'une décision concernant la persistance pour la catégorisation) porte à croire que la demi-vie du NTA dans l'eau est supérieure à 182 jours (6 mois), soit le critère de la persistance dans l'eau précisé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). Par ailleurs, Santé Canada (1990) a indiqué que le NTA se dégrade rapidement, avec un temps d'élimination dans les lacs et les rivières de 11 jours ou moins, selon des facteurs tels que la concentration du NTA et l'acclimatation des microorganismes. Toutefois, comme il s'agit d'une étude sur le terrain pour laquelle les conditions d'essai ne pouvaient pas être rigoureusement contrôlées, il est possible que des pertes découlant de processus autres que la biodégradation expliquent la disparition du NTA. Les résultats des travaux de Fischer et al. (1974) sont contraires à la plupart des résultats d'autres études sur la dégradation, ce qui indique que le NTA se biodégrade très rapidement dans des conditions aérobie. Il se peut que les résultats des travaux Fischer et al. (1974) aient subi l'influence de la formation de complexes avec des métaux lourds qui peuvent inhiber la dégradation du NTA (EURAR, 2005).
Par conséquent, une méthode du poids de la preuve reposant sur des RQSA (Environnement Canada, 2007) a aussi été appliquée à l'aide des modèles de dégradation présentés au tableau 5. Étant donné l'importance écologique du milieu aquatique, le fait que la plupart des modèles disponibles s'appliquent à l'eau et que le NTA devrait être rejeté dans ce milieu, c'est la biodégradation dans l'eau qui a surtout été étudiée. Le tableau 5 résume les résultats des modèles de prédiction RQSA disponibles sur la dégradation dans divers milieux naturels.
Tableau 5. Données estimées concernant la dégradation du NTA
| Processus du devenir | Modèle et base du modèle | Résultat et prévision du modèle | Demi-vie extrapolée (jours) |
|---|---|---|---|
| Abréviations : DBO, demande biologique en oxygène; MITI, Ministry of International Trade and Industry, Japon; s.o., sans objet; t½, demi-vie. 1 Le modèle ne précise pas d'estimation pour ce type de structure. 2 Le résultat s'exprime par une valeur numérique. 3 Les prévisions en matière de demi-vie concernant les modèles BIOWIN et CATABOL sont déterminées en fonction d'Environnement Canada, 2009b. 4 Le résultat s'exprime par un taux de probabilité. |
|||
| Air | |||
| Oxydation atmosphérique | AOPWIN, 2008 | t½ = 1,47 h | <2 |
| Réaction avec l'ozone | AOPWIN, 2008 | s.o.1 | s.o. |
| Eau | |||
| Hydrolyse | HYDROWIN, 2008 | s.o.1 | s.o. |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 3 : enquête d'expert (biodégradation ultime) |
3,622 « Se biodégrade très rapidement » |
<1823 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 4 : enquête d'expert (biodégradation primaire) |
4,442 « Se biodégrade très rapidement » |
<1823 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 5 : MITI probabilité linéaire |
0,754 « Se biodégrade très rapidement » |
<1823 |
| Biodégradation (aérobie) | BIOWIN, 2008 Sous-modèle 6 : MITI, probabilité non linéaire |
0,74 « Se biodégrade rapidement » |
<1823 |
| Biodégradation (aérobie) | CATABOL 2004-2008 % DBO |
% DBO = 0 « se biodégrade lentement » |
>1823 |
Selon les résultats des modèles disponibles et les renseignements signalés par Santé Canada (1990), il est conclu que la demi-vie du NTA dans l'eau est nettement inférieure à 182 jours. D'après un ratio d'extrapolation 1:1:4 de la demi-vie de biodégradation dans l'eau, le sol et les sédiments (Boethling et al., 1995), la demi-vie dans le sol est également inférieure à 182 jours, alors que celle dans les sédiments est inférieure à 365 jours. Cela indique que le NTA ne devrait pas être persistant dans le sol et les sédiments.
Une demi-vie d'oxydation atmosphérique dans l'air de 1,47 heure (tableau 5) démontre que cette substance est susceptible de s'oxyder rapidement. Cela permet de conclure que le NTA n'est pas persistant dans l'air.
En résumé, les données empiriques présentées ci-dessus (Fischer et al., 1974) portent à croire que la demi-vie du NTA dans l'eau est supérieure à 182 jours (6 mois). Ce résultat contredit d'autres études qui estiment l'élimination du NTA dans les eaux des rivières et des lacs à quelques jours ainsi que la plupart des prévisions modélisées figurant au tableau 5 qui indiquent que la substance se biodégrade rapidement. En se basant d'autres études empiriques, la cohérence des prévisions modélisées et en tenant compte de la structure chimique du NTA, qui contient des fragments qui se biodégradent facilement, il est conclu que le NTA ne répond pas aux critères de la persistance dans l'eau, le sol et les sédiments (demi-vies dans le sol et l'eau égales ou supérieures à 182 jours et demi-vie dans les sédiments égale ou supérieure à 365 jours), ni aux critères de la persistance dans l'air (demi-vie dans l'air égale ou supérieure à 2 jours), énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Potentiel de bioaccumulation
Les valeurs prévues du log Koe du NTA laissent entendre que cette substance chimique est peu bioaccumulable dans le biote (voir le tableau 2 ci-dessus).
Les données limitées sur la bioaccumulation de Na3NTA résumées dans EURAR (2005) indiquent que les FBC de plusieurs espèces aquatiques, y compris les poissons, sont habituellement inférieurs 10 L/kg. Étant donné que l'on disposait de peu de données expérimentales sur le facteur de bioaccumulation (FBA) ou le facteur de bioconcentration (FBC) pour le NTA, une approche prévisionnelle a été adoptée dans le cadre de laquelle on a utilisé les modèles de FBA et de FBC disponibles, tel que l'indique le tableau 6. Selon le Règlement sur la persistance et la bioaccumulation (Canada, 2000), une substance est bioaccumulable si son FBC ou son FBA s'avère supérieur ou égal à 5 000; toutefois, le calcul des facteurs de bioaccumulation est la mesure préconisée pour évaluer le potentiel de bioaccumulation des substances. La modélisation cinétique du bilan massique devrait constituer la méthode de prévision la plus fiable pour déterminer le potentiel de bioaccumulation du NTA, car elle permet une correction du métabolisme dans la mesure où le log Koe de la substance se trouve dans le domaine du log Koe du modèle.
Tableau 6. Prédictions des FBA et des FBC chez les poissons pour le NTA
| Organisme d'essai | Paramètre | Valeur (en poids humide L/kg) | Référence |
|---|---|---|---|
| Poisson | FBA | 0,93 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBA) |
| Poisson | FBC | 0,93 | Arnot et Gobas, 2003 (niveau trophique intermédiaire du FBC) |
| Poisson | FBC | 8,5 | OASIS Forecast, 2005 |
| Poisson | FBC | 3,2 | BCFBAF, 2008 |
Les données estimées présentées dans le tableau 6 montrent que les potentiels de bioconcentration dans le poisson et de bioamplification dans les réseaux trophiques sont nuls. Les estimations du modèle du FBC et du FBA de Gobas pour le niveau trophique intermédiaire comprennent des estimations des taux de biotransformation (kM = 125 pour 10 g chez le poisson). Santé Canada (1990) indique toutefois que le NTA ne semble pas être métabolisé par les mammifères, chez lesquels un NTA non modifié est éliminé par les voies urinaires. Le FBC de 3,2 L/kg, estimé par BCFBAF (2008) et présenté au tableau 6, n'intègre pas la biotransformation.
D'après les données disponibles, le NTA ne répond pas aux critères de la bioaccumulation (FBA ou FBC ≥ 5000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
La démarche suivie dans cette évaluation écologique préalable consistait à examiner les divers renseignements à l'appui et à tirer des conclusions suivant la méthode du poids de la preuve et le principe de prudence requis par la LCPE (1999). Les éléments de preuve pris en compte comprenaient les résultats d'un calcul du quotient de risque prudent ainsi que des renseignements sur la persistance, la bioaccumulation, la toxicité intrinsèque, les sources et le devenir de la substance dans l'environnement.
Comme on a pu le voir précédemment, le NTA n'est pas persistant dans l'air, l'eau, le sol et les sédiments. Il devrait présenter un faible potentiel de bioaccumulation.
Un résumé des données expérimentales sur les effets écologiques est présenté au tableau 7. Ces données indiquent que le NTA, avec des valeurs de toxicité aiguë et chronique supérieures à 1 mg/L, n'est pas très dangereux pour les organismes aquatiques.
Tableau 7. Données empiriques sur la toxicité pour les organismes aquatiques
| Organisme d'essai | Type d'essai | Paramètre | Valeur (mg/L) | Référence |
|---|---|---|---|---|
| Abréviations : CE50 (dose efficace moyenne), concentration d'une substance qu'on estime susceptible de causer un effet sublétal toxique chez 50 % des organismes d'essai; CL50 (concentration létale médiane), concentration d'une substance qu'on estime létale pour 50 % des organismes d'essai; CMEO (concentration minimale avec effet observé), concentration la plus faible d'une substance causant des effets statistiquement significatifs par rapport au groupe témoin dans un essai de toxicité. | ||||
| Algue | Toxicité chronique (5 à 8 jours) | CMEO | 5-510 | ECOTOX, 2006 |
| Daphnie | Toxicité aiguë (24 h) | CE50 | 79-950 | ECOTOX, 2006 |
| Poisson (carpe) | Toxicité aiguë (48 h) | CL50 | 475 | ECOTOX, 2006 |
| Amphibien (Grenouille–léopard du Nord) | Toxicité aiguë (120 h) | CE50 | 60,4 | ECOTOX, 2006 |
La toxicité du sel de trisodium du NTA (no CAS RN 5064-31-3) est relativement similaire à celle du NTA. Les algues (Anabaena flosaquae, Selenastrum capricornutum et Anacystis aeruginosa), avec une toxicité sur 12 jours de 5 mg/L (Sturm et Payne, 1973) sont les organismes aquatiques les plus sensibles à cette substance. Pour les poissons, les valeurs des CL50 après 96 h varient entre 100 et à plus de 300 mg/L concernant le sel de trisodium (Sturm et Payne, 1973; Birge et al., 1979).
Étant donné qu'une part importante du NTA peut être rejetée dans l'eau, un scénario générique a été utilisé pour estimer la concentration (pire éventualité raisonnable) de NTA résultant d'un rejet industriel en utilisant l'outil d'exposition générique industriel – milieu aquatique (Industrial Generic Exposure Tool – Aquatic, ou IGETA) d'Environnement Canada. La valeur de concentration environnementale estimée (CEE) obtenue était de 0,05 mg/L. Des renseignements détaillés concernant les données utilisées pour estimer cette concentration et les résultats obtenus par le modèle sont proposés dans le rapport d'Environnement Canada (2009c).
D'anciennes données de surveillance sont disponibles pour les eaux de surface canadiennes et les effluents des usines de traitement des eaux usées des municipalités. Matheson (1977) a présenté des données de surveillance relatives au NTA à partir d'eaux prélevées dans tout le Canada entre 1971 et 1975. La concentration relevée la plus importante se chiffrait à 0,35 mg/L dans un échantillon provenant du port de Hamilton, en Ontario. Woodiwiss et al. (1979) ont quant à eux relevé des concentrations de NTA dans les cours d'eau du sud de l'Ontario entre 1971 et 1975. La concentration la plus importante se chiffrait à 3,36 mg/L dans un ruisseau en aval d'un émissaire d'évacuation. Woodiwiss et al. (1979) ont relevé des concentrations pouvant atteindre 10,5 mg/L dans les effluents de douze collectivités du sud de l'Ontario. Matheson (1977) a quant à lui relevé des concentrations pouvant atteindre 2,8 mg/L dans les effluents provenant de l'usine de traitement des eaux usées d'Hamilton, en 1973, avant qu'un deuxième traitement soit mis en place dans l'installation. Dans ces études, les concentrations relevées de NTA découleraient de l'utilisation du NTA lui-même et de son sel de sodium. En outre, elles ne seraient pas représentatives des concentrations actuelles étant donné l'utilisation du NTA et de ses sels en 2006 sur le marché canadien (3,9 millions de kilogrammes; Glauser et al., 2007) est à peu près sept fois moins qu'en 1977 (IJC, 1977).
Des données de surveillance plus récentes et représentatives ont été recueillies uniquement pour les effluents des usines de traitement des eaux usées des municipalités canadiennes. Lee et al. (1996) ont signalé des concentrations de NTA atteignant 0,589 mg/L dans l'effluent final de huit usines de traitement des eaux usées de municipalités du Sud de l'Ontario ainsi que de certaines usines de pâtes et papiers de l'Ontario et du Québec. En supposant un facteur de dilution de 10, ces données portent à croire que les concentrations dans les eaux de surface au Canada résultant de l'utilisation de NTA et de ses sels peuvent atteindre 0,059 mg/L.
On a déterminé une valeur prudente de la concentration estimée sans effet (CESE) à partir de la valeur de la toxicité la plus faible. La concentration minimale avec effet observé (CMEO) chronique pour les trois espèces d'algues vertes a été constatée par Millington et al. (1988) et se chiffrait à 5 mg/L. Cette valeur a été choisie en tant que valeur critique de toxicité et divisée par un facteur d'évaluation de 10 pour traduire les incertitudes associées à la variabilité interspécifique et intraspécifique de la sensibilité et à l'extrapolation d'une valeur sans effet sur le terrain à partir d'une CMEO observée en laboratoire. La CESE obtenue était de 0,5 mg/L.
Le quotient de risque prudent (CEE/CESE) de 0,1 (0,05/0,5) en résultant indique qu'il est peu probable que les expositions soient suffisamment élevées pour être nocives pour les organismes aquatiques. Étant donné que la majorité des rejets de cette substance seraient émis dans l'eau sur des sites industriels de fabrication et comme les résultats de la modélisation de la fugacité montrent que la majeure partie de la substance rejetée dans l'eau restera dans ce milieu, il est peu probable que des organismes d'autres sites ou d'autres milieux y soient exposés.
Il est donc peu probable que le NTA cause des effets écologiques nocifs au Canada.
Incertitudes dans l'évaluation des risques pour l'environnement
Des hypothèses prudentes ont été proposées en réponse aux incertitudes subsistant dans l'évaluation. Une incertitude clé est liée au manque de données empiriques récentes sur les concentrations d'eau de surface au Canada, lequel a été traité en prédisant une CESE dans l'eau à l'aide d'un modèle d'exposition industrielle.
Il existe des incertitudes liées à l'utilisation des modèles RQSA pour estimer la persistance et la bioaccumulation. En outre, les valeurs estimées de certaines propriétés physiques et chimiques clés (notamment la pression de vapeur et le log Koe) ont été utilisées en tant que données d'entrée dans les modèles.
Il existe également une incertitude à propos de l'étude sur la toxicité. La concentration minimale avec effet observé (CMEO) de 5 mg/L constatée par Millington et al. (1988) était la concentration la plus faible en condition d'essai; ainsi, aucune concentration sans effet observé n'a été définie. De plus, l'étude n'a pas noté l'importance de la baisse de croissance chez les algues, seulement le fait que cette baisse était statistiquement significative (P = 0,95) par rapport au groupe témoin. Cela ne permet pas de juger si la CESE représente un seuil de concentration toxique.
Puisque les paramètres toxicologiques du NTA et de ses sels de sodium sont similaires et que leur dissociation génère un groupe caractéristique commun (nitrilotriacétate), il a été jugé que le nitrilotriacétate était un groupe caractéristique commun présentant un intérêt toxicologique (voir la figure 1). Par conséquent, des études toxicologiques utilisant le NTA et le Na3NTA ont été prises en compte dans la présente évaluation préalable. Les données provenant d'études sur des sels formés de divers cations tels que le calcium, le magnésium, l'aluminium, le zinc et le fer n'ont pas été incluses. Ces autres sels de NTA n'étaient pas non plus inclus dans l'ébauche du rapport d'évaluation des risques de l'Union européenne (EURAR, 2008).
Figure 1. Dissociation du NTA et du Na3NTA en cations et en nitrilotriacétate, un groupe caractéristique commun présentant un intérêt toxicologique
Dans les produits de consommation, les estimations de l'exposition ont été calculées pour le nitrilotriacétate dont le NTA et le Na3NTA sont des formes contributives. Dans l'environnement, le NTA et le Na3NTA ne peuvent être distingués. Cela est dû au fait que le NTA et le Na3NTA sont convertis en un dérivé d'ester commun; c'est ce dernier qui fait l'objet de mesures analytiques.
Bien que la présente évaluation propose des renseignements sur le NTA et ses sels de sodium, ses conclusions ne concernent que le NTA; les renseignements liés au Na3NTA ne constituent que de la documentation complémentaire.
Évaluation de l'exposition
Milieux naturels et nourriture
Comme il en a été fait mention précédemment, le NTA et le Na3NTA ne peuvent être distingués de façon analytique dans les mesures environnementales. Par souci de simplicité et comme la substance à analyser ne peuvent se distinguer, les espèces chimiques quantirés durant cette anlayse chimique seront appelées NTA dans la présente section.
Aucune donnée concernant les concentrations mesurées de NTA dans l'air, le sol ou les aliments n'a été trouvée. Au contraire, nombreuses sont les études présentant des concentrations chiffrées de NTA dans les eaux potables municipales traitées, les eaux de surface, les eaux souterraines et les eaux industrielles (Matheson, 1977; Malaiyandi et al., 1979; Anderson et al., 1985).
Un programme national de surveillance a permis de relever les concentrations de NTA dans l'eau potable finie et les eaux souterraines de municipalités canadiennes de 1972 à 1975 en vue d'analyser les effets sur l'environnement et la santé publique du remplacement des phosphates par du Na3NTA dans les détergents à lessive (Matheson, 1977). Au début des années 1970, au Canada, le Na3NTA était présent dans la composition des lessives selon un pourcentage pondéral moyen de 6 % (Anderson et al., 1985). Dans les eaux potables municipales traitées, dans la plupart des cas, le NTA restait indétectable (limite de détection : 10 µg/L); la concentration maximale, se chiffrant à 80 µg/L, a été mesurée dans un échantillon provenant de Granby, au Québec, prélevé en 1975. De même, le NTA n'a pas été détecté dans la plupart des échantillons provenant des réserves municipales d'eau souterraine.
Une étude canadienne distincte a été menée par Malaiyandi et ses collaborateurs au cours de l'hiver 1976-1977, une saison durant laquelle des niveaux plus élevés de NTA étaient escomptés en raison d'une biodégradation moindre (Malaiyandi et al., 1979). Au moment de cette étude, le niveau moyen de Na3NTA dans les détergents à lessive au Canada représentait un pourcentage pondéral de 15 % (Anderson et al., 1985). La concentration de NTA dans l'eau potable et les eaux brutes a été calculée dans 70 municipalités disséminées dans tout le pays. À l'échelle nationale, la concentration moyenne de NTA dans l'eau potable se chiffrait à 2,82 µg/L; les résultats se situaient dans une fourchette allant de niveaux inférieurs à la limite de détection (0,2 µg/L) à 20,4 µg/L. La concentration moyenne de NTA dans les réserves d'eau, calculée à partir de puits appartenant à des particuliers, était de 3,88 µg/L (fourchette : < 0,2 à 33,5 µg/L).
Pour 10 villes canadiennes, Malaiyandi et ses collaborateurs ont comparé leurs résultats de l'hiver 1976-1977 avec les données recueillies précédemment entre 1972 et 1975 (Matheson, 1977). Ils ont ainsi démontré que les concentrations de NTA les plus récentes étaient généralement inférieures ou égales à ces mesures passées. Il en ressortait que le NTA ne s'accumulait pas dans les réserves d'eau potable canadiennes alors même que la concentration de Na3NTA dans la composition des lessives avait augmenté. Ces conclusions ont été confirmées par une étude canadienne distincte menée en 1983 sur les concentrations de NTA dans des puits appartenant à des particuliers en Ontario et en Colombie-Britannique (Procter & Gamble Company, 1983a). Soixante-quinze pour cent des échantillons présentaient des concentrations de NTA inférieures à la limite de détection (1 µg/L); l'un des échantillons ontariens se chiffrant à 2,7 µg/L et les échantillons restant, provenant de Colombie-Britannique, affichant une concentration moyenne de 3,6 µg/L.
La concentration maximale de NTA dans l'eau potable traitée observée dans l'étude canadienne de l'hiver 1976-1977, s'élevant à 20,4 µg/L (Malaiyandi et al., 1979), a été utilisée pour calculer les estimations de l'exposition. À titre de comparaison, la concentration maximale admissible de NTA dans l'eau potable définie par les Recommandations pour la qualité de l'eau potable au Canada est de 400 µg/L (Santé Canada, 2008).
Les concentrations de NTA dans l'eau potable traitée et les eaux souterraines ont également été mesurées aux États-Unis au début des années 1970 (NTA indétectable dans la plupart des échantillons; 4,6 % des échantillons affichaient des concentrations situées entre 25 et 125 µg/L) et au début des années 1980 (fourchette : < 1 à 7 µg/L) ainsi qu'en Europe au cours des années 1990 (fourchette : < 1 à 3 µg/L). De la même façon que pour les résultats des études canadiennes, le NTA n'a pas été détecté dans la plupart des études américaines alors que des concentrations plus importantes ont été décelées dans des puits peu profonds (Procter & Gamble Company, 1972, 1981, 1982, 1983b, c; Stabel, 1998; Schmidt et al., 2004).
Le NTA a également été mesuré dans des eaux de surface non traitées aux États-Unis et en Europe (Voulgaropoulos et Tzivanakis, 1992; Pietsch et al., 1995; Kiessling et Kaluza, 1997; Ding et al., 1999; Schmidt et al., 2004) ainsi que dans des eaux industrielles au Canada (fourchette : < 0,5 à >10 000 µg/L), aux États-Unis (fourchette : 30 à 2 400 µg/L) et en Europe (fourchette dans un effluent typique : 100 à 2 000 µg/L) (Matheson, 1977; Woodiwiss et al., 1979; Anderson et al., 1985; Voulgaropoulos et Tzivanakis, 1992; Garric et al., 1996; Lee et al., 1996; Knepper, 2003; EURAR, 2005).
À l'échelle industrielle, le NTA est utilisé comme adoucisseur d'eau dans le traitement des pâtes et papiers pour la fabrication de produits de papier et de carton tels que ceux utilisés dans l'emballage alimentaire. On estime que les niveaux de NTA dans ces produits finis d'emballage sont infimes. Par conséquent, toute exposition liée dans ce cas à la migration dans les aliments serait négligeable (courriel de la Direction des aliments de Santé Canada adressé au Bureau des substances existantes de Santé Canada en 2009; source non citée).
Le NTA est également utilisé comme agent de détartrage dans le traitement de l'eau de chaudière en vue de prévenir tout entartrage (Gousetis et Opgenorth, 2005). On retrouve cette utilisation dans l'industrie alimentaire, lorsque de la vapeur est générée et peut entrer en contact avec la nourriture au moment de sa transformation (AMT, 1995; Bellows, 2006). Étant donné que les points de fusion et d'ébullition du NTA s'établissent respectivement à 242 oC et à 429 oC, on estime que la contamination des aliments par le NTA au cours de leur transformation par des procédés utilisant de la vapeur est négligeable (courriel de la Direction des aliments de Santé Canada adressé au Bureau des substances existantes de Santé Canada en 2009; source non citée).
On peut retrouver le NTA en tant qu'impureté dans les sels de disodium et de calcium disodique de l'EDTA de qualité alimentaire dont l'utilisation est permise en tant qu'agents de séquestration dans bon nombre d'aliments dans le cadre du Règlement sur les aliments et les drogues. Ledit règlement demande à ce que les additifs alimentaires répondent aux spécifications de pureté figurant dans le Food Chemicals Codex. Ainsi, l'EDTA de qualité alimentaire ne peut contenir plus de 0,1 % de NTA par poids. Vu la limite maximale de NTA dans l'EDTA de qualité alimentaire et des niveaux maximaux utilisés pour l'EDTA dans les aliments préconisés par la Loi sur les aliments et drogues, l'exposition au NTA par l'entremise de la nourriture, si elle existe, est estimée négligeable (courriel de la Direction des aliments de Santé Canada adressé au Bureau de gestion du risque de Santé Canada en 2009; source non citée).
Les valeurs estimatives de la limite supérieure de l'absorption journalière de NTA chez divers groupes d'âge de la population générale sont indiquées à l'annexe 1. La concentration maximale de NTA dans l'eau potable traitée observée dans l'étude canadienne de l'hiver 1976-1977, s'élevant à 20,4 µg/L (Malaiyandi et al., 1979), a été utilisée pour calculer les estimations de l'exposition qui se situent entre 0,41 µg/kg p.c. (kilogramme de poids corporel) par jour pour les personnes âgées de 12 à 19 ans, et 2,18 µg/kg p.c. par jour pour les nourrissons nourris au lait maternisé âgés de 0 à 6 mois. Les estimations présentées à l'annexe 1 sont considérées comme prudentes et représentant des surestimations de l'exposition humaine au NTA. En effet, si le Na3NTA a été utilisé de façon intensive pour remplacer les adjuvants au phosphate dans les années 1970 (époque à laquelle ont été réalisées les études), son utilisation dans les détergents à lessive au Canada a chuté brutalement au milieu des années 1990 (Suresh et Kishi, 2006; Glauser et al., 2007; Zoller, 2009). En 2006, l'utilisation du NTA et de ses sels sur le marché canadien (3,9 millions de kilogrammes) était environ sept fois moins importante que celle observée en 1977 (> 27 millions kilogrammes) (CMI, 1977). Cette réduction peut être mise en parallèle avec la tendance générale observée de diminution des niveaux de NTA dans diverses sources d'eau.
On peut estimer avec confiance que l'exposition alimentaire est négligeable pour tous les groupes d'âge et que les estimations de la limite supérieure d'exposition protègent de façon adéquate la population générale canadienne. C'est parce que les estimations de l'exposition ont été calculées en utilisant la concentration maximale de NTA (20,4 µg/L) dans l'eau potable observée dans l'étude canadienne de l'hiver 1976-1977 (Malaiyandi et al., 1979). En outre, on prévoit que les niveaux actuels dans l'eau potable seront moins élevés en raison de l'utilisation en forte diminution du NTA depuis les années 1970. Comme les données de surveillance canadiennes concernant le NTA dans l'eau potable municipale traitée sont très complètes, mais vieillissantes et représentatives d'une période où le NTA était utilisé en abondance, le degré de confiance associé à l'exposition au NTA par l'ingestion d'eau potable est considéré comme modéré. Bien qu'aucune donnée ne soit disponible concernant la concentration de NTA dans d'autres milieux environnementaux, on estime que l'eau potable est le facteur le plus important d'exposition humaine au NTA en raison des propriétés physiques et chimiques de cette substance et de l'utilisation à grande échelle de cette dernière en tant qu'adoucisseur d'eau.
Produits de consommation
Selon les renseignements à notre disposition, le Na3NTA est utilisé plus communément que le NTA dans les produits de consommation.
On retrouve le Na3NTA dans les produits de soins personnels énumérés au tableau 8. On estime que ces produits sont utilisés fréquemment (SDC, 2009). Les concentrations maximales constatées dans ces produits ont été utilisées pour calculer les estimations de l'exposition liée à l'utilisation des produits de consommation. Les expositions par voie cutanée et par inhalation ont été estimées en utilisant la version 4.1 de ConsExpo (ConsExpo, 2006). De plus amples renseignements sont fournis à l'annexe 2.
Dans le cadre d'une étude sur le métabolisme chez un singe de laboratoire ayant absorbé du disodium NTA par voie orale, 14 % de la dose administrée a été récupérée dans ses urines (Michael et Wakim, 1971). Dans une étude distincte sur le métabolisme chez l'homme, l'absorption de nitrilotriacétate par voie orale s'élevait à 12 % (selon la concentration dans les urines), et la récupération de la substance à partir des urines, des selles et du dioxyde de carbone expiré s'élevait à 89 % chez les hommes volontaires soumis à des doses uniques de 10 mg14C[Na3NTA] (Budny et Arnold, 1973). La pénétration dans la peau du Na3NTA a fait l'objet d'études in vitro en Union Européenne à l'aide de Na3NTA radiomarqué (EURAR, 2008). Dans l'ébauche du rapport d'évaluation des risques (EURAR, 2008), le taux d'absorption du Na3NTA à partir de solutions diluées se situait entre 0,042 % et 0,472 %; par conséquent, l'Union européenne a utilisé un taux d'absorption prudent de 1 % pour la caractérisation des risques liés aux solutions diluées de Na3NTA. Pour les produits présentant des concentrations de Na3NTA plus importantes, l'Union européenne a utilisé un taux d'absorption plus élevé (10 %) fondé par défaut sur les propriétés physicochimiques. En appliquant la méthode du poids de la preuve découlant de la faible absorption orale chez les primates et le faible taux d'absorption cutanée observés in vitro, un taux d'absorption cutanée prudent (10 %) a été choisi.
Tableau 8. Expositions estimées1 au Na3NTA (pourcentage pondéral maximal de 0,1 %) liées aux produits de soins personnels utilisés fréquemment (SDC, 2009)
| Produit de consommation | Fréquence d'utilisation (nombre d'applications par année) | Voie cutanée2 (mg/kg p.c. par jour) |
|---|---|---|
| 1 Poids du corps estimé : 70,9 kg (Santé Canada, 1998). 2 Taux d'absorption cutanée estimé : 10 % (EURAR, 2008). 3 L'exposition par inhalation due à l'utilisation de parfum a été jugée minimale (5,24 × 10-7 mg/kg p.c. par jour). 4 Calculé, dans le cadre de la limite supérieure d'exposition, pour les femmes utilisant de la poudre compacte de maquillage pour le visage. |
||
| Poudre compacte de maquillage pour le visage (femmes uniquement) | 365 | 0,00425 |
| Parfum3 | 1 095 | 0,00145 |
| Shampooing | 260 | 0,0201 |
| Nettoyant pour la peau (corps) | 329 | 0,000619 |
| Nettoyant pour la peau (visage) | 730 | 5,65 ´ 10-5 |
| Total4 | 0,0265 Na3NTA ou 0,0197 NTA | |
La pression de vapeur du NTA et de ses sels est très faible. Par conséquent, l'exposition par inhalation au NTA et à ses sels à partir d'évaporations provenant de solutions est jugée négligeable (voir l'annexe 2). Cette estimation est cohérente avec celle d'autres évaluations des risques liés aux sels de NTA qui laissent entendre également une exposition par inhalation négligeable (CanTox Inc., 1996; EURAR, 2008). Il existe une exception lorsque la formation d'aérosols est possible, comme c'est le cas lors de l'utilisation de produits en aérosols. Ce scénario a été pris en compte dans cette évaluation.
L'exposition maximale estimée découlant de l'utilisation de l'un des produits énumérés au tableau 8 s'élève à 0,0201 mg/kg p.c. par jour (correspondant à l'absorption cutanée résultant de l'utilisation d'un shampooing). Au total, l'exposition au Na3NTA se chiffre à 0,0265 mg/kg p.c. par jour; la conversion de ce total en équivalents de NTA, en vue de calculer la marge d'exposition, se traduit par une exposition de 0,0197 mg/kg p.c. par jour.
Le Na3NTA a également été décelé dans un produit d'entretien ménager multiusage. L'exposition au Na3NTA par l'entremise de ce produit a été jugée négligeable (voir l'annexe 2).
En plus des produits de soins personnels fréquemment utilisés énumérés dans le tableau 8, le Na3NTA a été décelé dans les autres produits de consommation énumérés au tableau 9. On estime que ces derniers sont utilisés de façon occasionnelle. Les concentrations maximales constatées dans ces produits ont été utilisées pour calculer les estimations de l'exposition (SDC, 2009).
Tableau 9. Expositions estimées1 au Na3NTA liées aux produits de soins personnels utilisés occasionnellement
| Produit de consommation | Concentration maximale de Na3NTA (pourcentage pondéral [%]) | Fréquence d'utilisation (par an) | Concentration moyenne par événement (mg/m3) | Exposition cutanée4 (mg/kg p.c.) |
|---|---|---|---|---|
| Abréviation : s.o., sans objet. 1 Poids du corps estimé : 70,9 kg (Santé Canada, 1998). 2 SDC (2009). 3 SCJGSARA (2009). Expositions estimées lors de la vaporisation (v) et du nettoyage (n). 4 Taux d'absorption cutanée estimé : 10 % (EURAR 2008). |
||||
| Colorant capillaire, semi-permanent2 | 0,3 | 13 | s.o. | 0,000685 |
| Lotion pour les pieds pour pédicure (femmes uniquement)2 | 0,1 | 156 | s.o. | 0,00656 |
| Protecteur de vernis à ongles pour manucure (femmes uniquement)2 | 0,1 | 156 | s.o. | 0,000121 |
| Nettoyant pour salle de bain3 | 1 | 52 | 0,000229 (v) | 0,000973 (v) 0,00423 (n) |
| Total | 0,000229 | 0,0126 | ||
L'exposition la plus élevée découlant de l'utilisation d'un seul des produits énumérés au tableau 9 s'élève à 0,00656 mg/kg p.c. par jour (correspondant à l'utilisation d'une lotion pour pieds pour pédicure). Toutefois, en raison du manque de données relatives au modèle d'utilisation des lotions pour pieds pour pédicure, la confiance dans cette estimation est faible.
On estime que les expositions potentielles cutanées et par inhalation découlant de l'utilisation de produits antiparasitaires de type insecticides ou acaricides contenant du Na3NTA sont minimes. Il en va de même pour les expositions cutanées et par voie orale découlant de l'utilisation de produits algicides pour piscine contenant du Na3NTA (voir l'annexe 2).
Tous les produits de consommation cités jusqu'à présent dans ce chapitre contiennent du Na3NTA. Comme on a pu le voir dans la section intitulée Utilisations », le NTA est utilisé dans les solutions de révélateurs photographiques. L'utilisation de ces produits est considérée comme professionnelle ou parfois de loisir; ainsi, il est jugé qu'elle ne contribue pas à l'exposition de la population générale au NTA. Il a également été indiqué que le NTA représentait une impureté commune dans les édétates. Selon les renseignements à notre disposition, la présence de NTA résulte généralement d'une telle contamination. On estime que seules des traces de NTA seraient trouvées dans des produits de consommation contenant des édétates comme les engrais, seul type de produits de consommation connu pour lequel le NTA entre dans la composition. L'exposition au NTA par l'entremise de traces d'impuretés dans ces produits a été jugée minime (voir l'annexe 2).
Par conséquent, la confiance portée dans les résultats chiffrés des estimations de l'exposition provenant de produits de consommation est moyenne à faible en l'absence de données expérimentales, mais la confiance reste élevée s'agissant de l'exposition minimale au NTA et à ses sels liée à de tels produits.
Évaluation des effets sur la santé
Un résumé des renseignements disponibles quant aux effets sur la santé du NTA et de ses sels de sodium est donné à l'annexe 3.
Sur la base des études menées sur des animaux de laboratoire, le NTA et ses sels de sodium ont été classés par le Centre international de recherche sur le cancer (CIRC, 1990, 1999) comme substance cancérogène du groupe 2B (« substances pouvant être cancérogènes pour l'homme »). La Commission européenne a classé le Na3NTA (no CAS RN 5064-31-3) comme substance cancérogène de catégorie 3, avec mention de risque R40 (« Effet cancérogène suspecté –preuves insuffisantes ») [Commission européenne, 2007; EURAR, 2008]. Le National Toxicology Program des États-Unis (NTP) classe le NTA parmi les « substances dont on peut raisonnablement présumer qu'elles sont cancérogènes pour l'homme », d'après les éléments suffisants disponibles sur la cancérogénicité sur des animaux de laboratoire (NTP, 2005). Dans les Recommandations pour la qualité de l'eau potable au Canada, le NTA a été classé dans le groupe IIIB (« substances pouvant être cancérogènes pour l'homme »), « étant donné que le NTA n'induit des tumeurs [rénales] qu'à des doses supérieures aux doses néphrotoxiques » (Santé Canada, 1990). La cancérogénicité du NTA et de ses sels de sodium a été démontrée pour la voie orale; aucune toxicité à long terme n'a été mise en évidence pour les voies respiratoires ou la voie cutanée (EURAR, 2008).
Deux essais biologiques visant à déterminer la cancérogénicité du Na3NTA et un pour le NTA ont été menés sur des rats F344 (NCI, 1977). Dans l'un de ces essais biologiques, une augmentation importante des néoplasmes primaires du tractus urinaire a été signalée chez les mâles et les femelles de rats exposés à des doses de 20 000 ppm de Na3NTA dans leur régime alimentaire pendant une période de 24 mois. Une augmentation marginale des lésions hyperplasiques et dysplasiques a pu être observée à une dose de 200 ppm de Na3NTA (soit 10 mg/kg p.c. par jour); cette augmentation était plus marquée lorsque la dose passait à 2 000 ppm de Na3NTA (soit 100 mg/kg p.c. par jour) et plus.
Dans les deux autres essais biologiques, les rats F344 ont été exposés par voie orale à des doses de 0, 7 500 ou 15 000 ppm de Na3NTA ou de NTA pour une période de 18 mois suivie d'une période de rétablissement de 6 mois. Pour les mâles comme pour les femelles, une augmentation importante des néoplasmes primaires du tractus urinaire a été signalée dans les groupes traités au NTA tandis qu'une augmentation (pas importante sur le plan statistique) de tumeurs du même type a été constatée dans le groupe traité au Na3NTA. Des adénomes hépatocellulaires ainsi que des phéochromocytomes surrénaux ont également été observés chez des femelles exposées à des doses élevées de NTA (NCI, 1977). Une hausse importante du nombre d'adénomes et d'adénocarcinomes rénaux a également pu être constatée chez des rats mâles Sprague-Dawley exposés à une dose de 0,1 % de Na3NTA (soit 100 mg/kg p.c. par jour) dans leur eau d'abreuvement pendant une durée de 704 jours (Goyer et al., 1981).
Chez les souris, une importante augmentation des tumeurs rénales, principalement des adénocarcinomes des cellules des tubules rénaux, a été signalée chez les femelles exposées à des doses élevées et chez les mâles (exposés à des doses élevées ou faibles) de 0, 7 500 ou 15 000 ppm de NTA dans leur nourriture pendant une période de 24 mois suivie d'une période de rétablissement de 3 mois. Lorsque les souris ont été exposées au Na3NTA à des doses de 0, 2 500 ou 5 000 ppm dans leur nourriture pendant la même période d'exposition, aucune tumeur du tractus urinaire n'a été observée, mais des tumeurs hématopoïétiques ont été signalées chez des sujets mâles (NCI, 1977).
En ce qui concerne les tumeurs du tractus urinaire, NCI (1977) émet l'hypothèse qu'elles peuvent être dues à un effet localisé qui ne peut résulter que de fortes concentrations [de NTA ou de Na3NTA] ». NCI (1977) n'a tiré aucune conclusion concernant l'importance de l'apparition des tumeurs autres que celles touchant le tractus urinaire.
Les effets d'agent promoteur de tumeurs du Na3NTA ont également été signalés dans plusieurs études en deux étapes d'initiation-promotion. Le développement accéléré de tumeurs dans le système urinaire a été observé chez les souris et les rats traités au préalable avec une substance carcinogène pour les reins, la nitrosamine, puis exposés par voie orale au NTA ou au Na3NTA pendant 28 à 30 semaines. L'apparition d'hyperplasies du système urinaire associées au traitement pendant des périodes plus courtes, comparées aux études à long terme cité ci-dessus (uniquement du NTA ou du Na3NTA administré), a également été signalée dans ces études (Hiasa et al., 1984, 1985a, b; Kitahori et al., 1985, 1988; Matsuki et al., 1992).
In vitro, les essais concernant l'induction de mutations géniques chez les bactéries et les champignons par le NTA et le Na3NTA se sont révélés négatifs tandis que seul le NTA s'est révélé négatif au SOS chromotest (voir l'annexe 3 pour de plus amples renseignements et références). Le Na3NTA n'a pas provoqué de mutation génique ou de transformation cellulaire dans des cellules de mammifères (Celotti et al., 1987; Mitchell et al., 1988; Myhr et Caspary, 1988). Toutefois, des résultats positifs ont été observés avec le NTA (Nesslany et al., 2008). On a pu observer dans des lymphocytes humains exposés au NTA ou au Na3NTA des résultats variables concernant l'induction d'aberrations chromosomiques et de micronoyaux (Montaldi et al., 1987, 1988; Nesslany et al., 2008). L'induction de micronoyaux s'est avérée positive dans les lignées cellulaires de la souris ainsi que dans les cellules primaires du rein et de l'urothélium chez l'homme et chez le rat lorsque ces cellules étaient exposées au NTA (Robbiano et al., 1999, 2002; Nesslany et al., 2008). Le NTA et le Na3NTA n'ont pas induit d'échange de chromatides sœurs ou de synthèse d'ADN non programmée dans les lignées cellulaires de mammifères (Brat et Williams, 1984; Montaldi et al., 1985).
Dans les études in vivo, le NTA et le Na3NTA n'ont pas induit de mutations dans les cellules germinales du Drosophila melanogaster, mais ont (faiblement) induit une aneuploïdie méiotique et une mutation somatique. Ces substances n'ont pas entraîné de mutations létales dominantes, mais ont induit une aneuploïdie dans les spermatocytes de souris après injection intrapéritonéale. Toutefois, elles n'ont pas induit d'aneuploïdie, de micronoyaux ou d'échange de chromatides soeurs dans les cellules de moelle osseuse de la souris in vivo. Certaines études ont constaté que le NTA pouvait endommager l'ADN dans le rein ou la vessie du rat in vivo; néanmoins, des protocoles d'essai non standard ont été utilisés et la relation dose-réponse n'était pas clairement exposée (voir l'annexe 3 pour de plus amples renseignements et références).
Le CIRC (1990, 1999) a conclu que l'acide nitrilotriacétique et ses sels de sodium n'étaient pas génotoxiques dans les systèmes expérimentaux in vivo, à l'exception du fait que l'acide induisait une aneuploïdie dans les cellules germinales de la souris. Ni l'acide, ni ses sels ne se sont avérés génotoxiques pour les cellules de mammifères in vitro. En outre, ce ne sont pas des substances mutagènes pour les bactéries ». Selon les résultats observés dans les cellules somatiques de mammifères in vitro et in vivo, l'Union européenne, dans son ébauche du rapport d'évaluation des risques, déclare qu'« il n'existe aucun élément tangible prouvant la mutagénicité in vivo du NTA et de ses sels de sodium » (EURAR, 2008).
L'élaboration et l'analyse des modes d'action pour les effets toxicologiques induits par le NTA et ses sels de sodium ne sont pas concernées par cette évaluation préalable. Cependant, un mode d'action concernant l'induction de tumeurs du tractus urinaire par le NTA et ses divers sels de sodium a été proposé l'Union européenne dans son ébauche de rapport d'évaluation des risques (EURAR, 2008). Il a été suggéré que le potentiel cancérogène du NTA et du Na3NTA était lié à la stimulation soutenue de la prolifération cellulaire faisant suite à la cytotoxicité induite par les substances; cette hypothèse est fondée sur le fait qu'il n'existe pas de preuve de génotoxicité directe liée au NTA et sur l'incidence accrue de cytotoxicité/d'hyperplasie et de tumeurs observées sur des localisations cibles identiques dans les voies urinaires. Bien que les preuves ne soient pas suffisantes concernant la contribution des cations métalliques et de la formation de complexes de NTA à la cancérogénicité observée, leur implication dans la dérégulation de la croissance des cellules et dans l'apparition accrue de cellules néoplasiques peut être suspectée (EURAR, 2008).
Des données limitées concernant la performance de reproduction ont été signalées dans une étude combinée sur la reproduction et la tératologie. Ses résultats ont indiqué qu'une administration de Na3NTA dans l'alimentation des rats n'avait pas d'effet nocif sur leur performance et leur capacité de reproduction et qu'elle n'induisait pas d'effet sur les embryons ou les fœtus pendant deux générations successives. Des résultats similaires ont été constatés chez les lapins et les souris (Nolen et al., 1971, 1972a, b; Tjälve, 1972).
La dégénérescence hydropique et une dilatation mineure du tubule rénal ont commencé après 6 mois au cours d'une étude de 2 ans menée chez des rats (exposés à des doses de 0 %, de 0,03 %, de 0,15 % ou de 0,5 % de Na3NTA dans leur régime alimentaire). Après 24 mois, une néphrite interstitielle chronique et une néphropathie modérées à graves ont été observées, avec une augmentation de l'incidence et de la gravité liée à la dose administrée de 0,15 % et de 0,5 % de Na3NTA. Il a également pu être observé une augmentation de la concentration de zinc dans l'urine à toutes les doses sauf à la plus faible. Une dose minimale avec effet nocif observé (DMENO) pour le Na3NTA administré par voie orale de 97 mg/kg p.c. (0,15 % de Na3NTA) a été calculée à partir de cette étude (Nixon et al., 1972). Des doses minimales avec effet nocif observé similaires pour le Na3NTA (environ 100 mg/kg p.c. par jour) ont été calculées à partir de deux études (respectivement de 2 ans et de 10 semaines) portant sur l'administration de la substance dans l'eau d'abreuvement chez des rats Sprague-Dawley ainsi qu'à partir d'une étude de 2 ans portant sur l'administration de la substance dans l'alimentation chez des rats F344 (Mahaffey et Goyer, 1972; NCI, 1977; Goyer et al., 1981).
Les études mentionnées ci-dessus montrent que les organes les plus touchés par une administration répétée de NTA ou de Na3NTA par voie orale sont les voies urinaires : des lésions ont été constatées dans les reins, les uretères et la vessie des rongeurs dans les semaines suivant l'administration; la gravité de ces lésions augmentait de concert avec la durée d'administration de la substance (Nixon, 1971; Mahaffey et Goyer, 1972; Nixon et al., 1972; Alden et al., 1981; Merski, 1982; Myers et al., 1982; Kanerva et al., 1984; BASF, 1997a).
Au cours de deux études (respectivement de 4 semaines et de 3 mois) sur l'exposition cutanée chez le lapin, aucune irritation localisée et aucun effet systémique n'ont pu être constatés à des doses 50 mg/kg p.c. par jour de Na3NTA (2,5 % de Na3NTA, la seule dose testée) (Nixon, 1971).
Des renseignements très limités concernant l'exposition par inhalation au NTA figuraient dans une lettre d'un déclarant à la United States Environmental Protection Agency (USEPA). Exposés pendant 4 semaines à une dose de 343 mg/m3 de NTA, les singes traités présentaient des diarrhées. Toutefois, aucune irritation respiratoire ou indisposition n'a été constatée (USEPA, 1980).
Des renseignements limités concernant la toxicité du Na3NTA chez l'homme ont été trouvés. Aucune preuve de sensibilisation n'a été remarquée chez les 66 volontaires soumis à un test épicutané fermé présentant une solution aqueuse à 1 % d'un détergent liquide contenant 20 % de Na3NTA (Nixon, 1971).
L'absorption, la répartition et l'excrétion du NTA et de ses sels de sodium faisant suite à une administration par voie orale ont fait l'objet d'analyses chez le rat, la souris, le lapin, le chien, le singe et l'homme. L'absorption par le tractus gastro-intestinal diffère probablement selon l'espèce : par exemple, l'absorption semble être plus importante chez le rat et le chien que chez le lapin ou le primate. Environ 12 % de la dose administrée étaient excrétés par l'intermédiaire de l'urine chez l'homme, 14 % chez le singe, 23 % chez le lapin, 70 % chez le rat, 80 % chez le chien et 96 % chez la souris. Selon les études menées chez la souris, le rat, le chien et l'homme, au cours desquelles le NTA non modifié est éliminé par les urines, le NTA ne semble pas être métabolisé par les mammifères. Le composé d'origine absorbé est excrété rapidement par l'urine. Moins de 1 % de la dose administrée est excrété par l'air expiré. Après l'absorption, la concentration de NTA la plus élevée a été décelée dans les reins, la vessie et les tissus squelettiques (Michael et Wakim, 1971; Budny, 1972; Tjälve, 1972; Budny et Arnold, 1973; Chu et al., 1978; Anderson et al., 1985; OMS, 1996).
Le niveau de confiance à l'égard de la base de données sur la toxicité du NTA et de ses sels de sodium est jugé modéré à élevé étant donné que des études sur la toxicité aiguë, à court terme, subchronique et chronique, sur la cancérogénicité, sur la génotoxicité et sur la toxicité pour la reproduction et le développement d'une exposition par voie orale sont disponibles, bien que les études sur la cancérogénicité et sur la toxicité pour la reproduction et le développement d'une exposition par inhalation ou cutanée soient limitées.
Caractérisation du risque pour la santé humaine
En s'appuyant principalement sur des évaluations reposant sur le poids de la preuve qui sont réalisées par des organismes internationaux et d'autres organismes nationaux, la cancérogénicité représente un effet critique du NTA pour la caractérisation des risques pour la santé humaine. L'incidence de tumeurs des voies urinaires a augmenté selon la dose administrée dans les études standard sur la cancérogénicité chez les rats et les souris des deux sexes. Selon le poids de la preuve apporté par les données sur la génotoxicité disponibles, le NTA n'est pas considéré comme une substance génotoxique. Bien que le mode d'induction des tumeurs ne soit pas complètement élucidé, il est peu vraisemblable que les tumeurs observées chez les animaux de laboratoire résultent d'une interaction directe avec le matériel génétique (EURAR, 2008). Donc, une approche fondée sur le seuil d'innocuité a été utilisée pour évaluer le risque pour la santé humaine.
Comme les lésions néoplasiques, le NTA et le Na3NTA induisent l'apparition de lésions non néoplasiques principalement dans les reins, les uretères et la vessie des animaux de laboratoire. Il a été noté que des lésions pré-néoplasiques nocives n'apparaissaient principalement qu'à des doses qui induisaient la formation de tumeurs. Une évolution des lésions pré-néoplasiques (dégénérescence, vacuolisation, hyperplasie et dysplasie de l'épithélium) en tumeurs dans le tractus urinaire a été observée chez des rats traités au NTA et au Na3NTA. Par conséquent, des marges d'exposition pour la caractérisation du risque pour la santé humaine sont ainsi calculées à partir des plus faibles degrés d'exposition provoquant ces effets et des estimations de l'exposition de la population au NTA et au Na3NTA.
La dose minimale avec effet nocif observé pour le Na3NTA de 100 mg/kg p.c. par jour (soit 70 mg/kg p.c. par jour sous forme de NTA en unités molaires) découlant d'études à court terme et chroniques a été déterminée dans la base de données sur la toxicité en se basant sur l'hyperplasie des cellules du tubule et des cellules transitionnelles dans les reins, les uretères et la vessie des rats traités (Mahaffey et Goyer, 1972; NCI, 1977; Goyer et al., 1981). Une dégénérescence hydropique des cellules du tubule rénal, une dilatation mineure du tubule et une concentration de zinc en hausse dans les urines ont également été décrites dans une étude chronique sur l'administration de doses similaires par voie orale (soit 97 mg/kg p.c. par jour sous forme de Na3NTA ou 68 mg/kg p.c. par jour sous forme de NTA) (Nixon et al.,1972). Des adénomes et des adénocarcinomes rénaux ont également été constatés chez des rats exposés à une dose de 100 mg/kg p.c. par jour de Na3NTA dans leur eau d'abreuvement pendant une durée de 2 ans (Goyer et al., 1981).
L'une des voies principales d'exposition au NTA serait la voie orale, car la source la plus pertinente d'exposition humaine semble être la consommation d'eau potable étant donné les propriétés physiques et chimiques du NTA. Une comparaison entre la concentration à effet critique pour une toxicité à doses répétées par voie orale (100 mg/kg p.c. par jour sous forme de Na3NTA, soit 70 mg/kg p.c. par jour sous forme de NTA) et l'estimation de la limite supérieure estimative de l'exposition par voie orale de la population générale (2,18 µg/kg p.c. par jour sous forme de NTA), permet d'obtenir une marge d'exposition d'environ 32 000.
L'exposition par voie cutanée provenant de l'utilisation de produits de soins personnels contenant du Na3NTA a également été estimée (voir la section Évaluation de l'exposition »). Étant donné qu'aucune étude sur la toxicité cutanée n'a été trouvée, les effets critiques notés dans les études chroniques sur l'administration de NTA par voie orale ont été rajustés pour qu'ils correspondent aux estimations prudentes d'exposition cutanée découlant de l'utilisation de produits de soins personnels en vue de calculer la marge d'exposition. La concentration à effet critique (100 mg/kg p.c. par jour sous forme de Na3NTA), après correction pour un taux d'absorption cutanée de 10 % (100 mg/kg p.c./10 % = 1 000 mg/kg p.c. par jour), a produit une DMENO pour l'exposition cutanée équivalente de 1 000 mg/kg p.c. par jour sous forme de Na3NTA (soit 700 mg/kg p.c. par jour sous forme de NTA). La comparaison de cette valeur avec une prévision prudente de l'exposition cutanée chronique par l'entremise de produits de soins personnels fréquemment utilisés (0,0197 mg/kg p.c. par jour sous forme de NTA), a permis d'obtenir une marge d'exposition d'environ 35 500.
Même si la DMEO très prudente de 10 mg/kg p.c. par jour sous forme de Na3NTA (soit 7 mg/kg p.c. par jour sous forme de NTA), fondée sur l'augmentation marginale des hyperplasies et des dysplasies des cellules épithéliales des voies urinaires chez les animaux de laboratoire, est utilisée à cette fin, on estime que les marges potentielles d'exposition pour l'exposition par voie orale et par voie cutanée sont importantes (respectivement 3 200 et 3 550).
Bien que des études sur l'exposition cutanée à plus court terme étaient disponibles, les doses les plus élevées utilisées ont seulement permis d'obtenir des doses sans effet nocif observé (DSENO). La comparaison de la DSENO pour l'exposition subchronique (50 mg/kg p.c. par jour sous forme de Na3NTA, soit 35 mg/kg p.c. sous forme de NTA) avec la prévision prudente de l'exposition cutanée chronique (0,0197 mg/kg p.c. par jour sous forme de NTA) a permis d'obtenir une marge d'exposition d'environ 1 770. Si l'étude à court terme avait été extrapoléeà une exposition à plus long terme, étant donné la faible relation dose-réponse dans l'évolution de la toxicité avec le temps (réduite de moitié à partir du niveau d'effet faible de l'étude par voie orale), on pourrait en déduire une DSENO chronique hypothétique de 25 mg/kg p.c. par jour sous forme de Na3NTA (soit 17,5 mg/kg p.c. par jour sous forme de NTA). L'utilisation de cette DSENO (17,5 mg/kg p.c. par jour) permet d'obtenir une marge d'exposition d'environ 900, qui serait toujours considérée comme adéquate pour protéger la santé humaine.
Incertitudes de l'évaluation des risques pour la santé humaine
La portée de la présente évaluation préalable n'inclut pas l'analyse complète du mode d'action du NTA, ni ne prend en compte les différences possibles de sensibilité entre l'homme et les espèces examinées. Bien qu'il n'existe aucune preuve tangible d'une mutagénicité in vivo du NTA et de ses sels de sodium, certains résultats équivoques sont également obtenus dans l'ensemble de données sur la génotoxicité. De plus, il n'y a que très peu d'information disponible sur la toxicité potentielle du NTA à la suite d'une exposition par inhalation et par voie cutanée, de même que pour les études sur la toxicité pour la reproduction et le développement.
Il existe certaines incertitudes à l'égard de l'estimation de l'exposition au NTA découlant de l'environnement et de l'alimentation. Aucune donnée concernant les concentrations mesurées de NTA dans l'air, le sol ou les aliments n'a été trouvée. Cependant, l'exposition de la population à ces sources est probablement négligeable. Par conséquent, les estimations de l'exposition n'ont été calculées qu'à partir des données de surveillance canadiennes datant des années 1970 et relevées dans l'eau potable municipale traitée. Comme les données proviennent d'études de surveillance canadiennes de grande ampleur et comme l'utilisation du NTA a considérablement diminué depuis les années 1970, les estimations de l'exposition au NTA sont jugées prudentes.
Une incertitude existe également quant au manque de renseignements sur la présence ou la concentration de NTA et de Na3NTA dans les produits accessibles au Canada. Les estimations de l'exposition découlant de l'utilisation de produits de consommation contenant du NTA et du Na3NTA ont été basées sur des hypothèses prudentes.
D'après les renseignements contenus dans le présent rapport d'évaluation préalable, le NTA ne pénètre pas dans l'environnement en une quantité, à une concentration ou dans des conditions qui ont ou peuvent avoir un effet nuisible immédiat ou à long terme sur l'environnement ou sa diversité biologique, ou qui constituent ou peuvent constituer un danger pour l'environnement essentiel pour la vie.
À la lumière des renseignements disponibles, il est conclu que le NTA ne pénètre pas dans l'environnement en une quantité, à des concentrations ou dans des conditions qui constituent ou peuvent constituer un risque pour la vie ou la santé humaine au Canada. Par conséquent, il est conclu que le NTA ne satisfait à aucun des critères énoncés à l'article 64 de la LCPE (1999).
L’inclusion de cette substance sera considérée dans la prochaine mise à jour de l’inventaire de la Liste intérieure. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l'évaluation préalable.
ACD/Labs. 2008. Logiciel version 8.14 pour Solaris. Toronto (Ont.) : Advanced Chemistry Development.
ACD/pKaDB [module de prévision]. 2005. Version 9.04. Toronto (Ont.) : Advanced Chemistry Development. Accès : http://www.acdlabs.com/products/phys_chem_lab/pka/. [réserve de consultation]
Ahmed, F.U. 2009. Industrial and institutional cleaners. In : Zoller, U. (éd.), Handbook of detergents. Part E: Applications. Surfactant Science Series, Vol. 141. Boca Raton (FL) : Taylor & Francis. p. 201-286.
Alden, C.L., Kanerva, R.L., Anderson, R.L., Adkins, A.G. 1981. Short-term effects of dietary nitrilotriacetic acid in the male Charles River rat kidney. Vet. Pathol. 18:549-559.
[AMT] Adalia Miljö-och toxikologkunsult. 1995. Nitrilotriacetic acid; trisodium nitrilotriacetate; trisodium nitrilotriacetate monohydrate. Täby (Suède) : Submission to Nordic Steering Group for Assessment of Health Effects of Chemicals.
Anderson, C., Danylchuk, K.D. 1980. The effect of chronic administration of trisodium nitrilotriacetate (Na3NTA) on the Haversian remodelling system in dogs. J. Environ. Pathol. Toxicol. 3:413-420.
Anderson, R.L., Kanerva, R.L. 1978. Hypercalcinuria and crystalluria during ingestion of dietary nitrilotriacetate. Food Cosmet. Toxicol. 16:569-574.
Anderson, R.L., Kanerva, R.L. 1979. Comparisons of response of Fischer-344 and Charles River rats to 1.5% nitrilotriacetic acid and 2% trisodium nitrilotriacetate, monohydrate. Food Cosmet. Toxicol.17:137-140.
Anderson, R.L., Bishop, W.E., Campbell, R.L. 1985. A review of the environmental and mammalian toxicology of nitrilotriacetic acid. CRC Crit. Rev. Toxicol. 15(1):1-102.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2008. Version 1.92. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Liste des produits de formulation de l'ARLA. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consultée le 8 juillet 2009]. Accès : http://www.hc-sc.gc.ca/cps-spc/pubs/pest/_decisions/reg2007-04/index-eng.php
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2009. Base de données des étiquettes de produits de l'ARLA [en ligne]. Ottawa (Ont.) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. [consultée le 8 juillet 2009]. Accès : http://pr-rp.pmra-arla.gc.ca/portal/page?_pageid=34,17551&_dad=portal&_schema=PORTAL
Arnot, J.A., Gobas, F.A.P.C. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb. Sci. [en ligne] 22(3):337-345. Accès : http://www3.interscience.wiley.com/journal/104557877/home [réserve de consultation]
Bahnemann, R., Leibold, E., Kittel, B., Mellert, W., Jäckh, R. 1998. Different patterns of kidney toxicity after subacute administration of Na-nitrilotriacetic acid and Fe-nitrilotriacetic acid to Wistar rats. Toxicol. Sci. 46:166-175.
BASF. 1985. Report on the study of acute oral toxicity (Test substance TRILON A 92). Rapport inédit (84/238), daté du 18 mars 1985. Ludwigshafen (Allemagne) : BASF, Département de toxicologie. [cité dans EURAR, 2008].
BASF. 1997a. Screening tests for kidney toxicity with Trilon AS in Wistar rats. No de projet : 25S0109/94021. Ludwigshafen (Allemagne) : BASF. [cité dans EURAR, 2008].
BASF. 1997b. Trilon A 92 –Buehler test in guinea pigs. Rapport inédit (32H0061/952192) daté du 11 déc. 1997. Ludwigshafen (Allemagne) : BASF, Département de toxicologie. [cité dans EURAR, 2008].
BASF. 2004. Cytogenetic study in vivo with Trilon A 92 R. No de projet : 26M0192/024031. Ludwigshafen (Allemagne) : BASF. [cité dans EURAR, 2008].
[BCFBAF] BioConcentration Factor Program for Windows [modèle d'estimation]. 2008. Version 3.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[BCR] BC Research Inc., Occupational and Environmental Risk Management Group. 2002. Fiche signalétique : Gen-X Micro [en ligne]. Langley (C.-B.) : Grotek. [consulté le 31 août 2009]. Accès : http://www.grotek.net/products/msds.asp
Becking, G.C., Yagminas, A.P. 1978. Relative mammalian toxicity of fulvic acid and trisodium nitritriacetic acid (NTA). Can. Fed. Biol. Soc. Proc. 21:159.
Bellows, J. 2006. Steam [en ligne]. In : Kirk-Othmer encyclopedia of chemical technology, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9780471238966/kirk/article/steabell.a01/current/pdf [réserve de consultation]
[BIOWIN] Biodegradation Probability Program for Windows [modèle d'estimation]. 2008. Version 4.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Birge, W.J., Black, J.A., Bruser, D.M. 1979. Toxicity of organic chemicals to embryo-larval stages of fish. EPA-560/11-79-007. U.S. Environmental Protection Agency, Washington (DC). (OECDG Data File).
Boethling, R.S., Howard, P.H., Beauman, J.A., Larosche, M.E. 1995. Factors for intermedia extrapolations in biodegradability assessment. Chemosphere 30(4):741-752.
Brat, S.V., Williams, G.M. 1984. Nitrilotriacetic acid does not induce sister-chromatid exchanges in hamster or human cells. Food Chem. Toxicol. 22:211-215.
Budny, J.A. 1972. Metabolism and blood pressure effects of disodium nitrilotriacetate (Na2NTA) in dogs. Toxicol. Appl. Pharmacol. 22:655-660.
Budny, J.A., Arnold, J.D. 1973. Nitrilotriacetate (NTA): human metabolism and its importance in the total safety evaluation program. Toxicol. Appl. Pharmacol. 25:48-53.
Budny, J.A., Niewenhuis, R.J., Buehler, E.V., Goldenthal, E.I. 1973. Subacute oral toxicity of trisodium nitrilotriacetate (Na3NTA) in dogs. Toxicol. Appl. Pharmacol. 26:148-153.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999), L.C. 1999, c. 33. Accès : http://www.gazette.gc.ca/archives/p3/1999/g3-02203.pdf
Canada. 2000. Loi canadienne sur la protection de l'environnement (1999) : Règlement sur la persistance et la bioaccumulation, C.P. 2000-348, 29 mars 2000, DORS/2000-107. Accès : http://www.gazette.gc.ca/archives/p2/2000/2000-03-29/pdf/g2-13407.pdf
Canada. Ministère de l'Environnement, ministère de la santé. 2006.Loi canadienne sur la protection de l'environnement (1999) : Avis d'intention d'élaborer et de mettre en œuvre des mesures d'évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement, Canada Gazette. Partie I, vol. 140, no 49, p. 4109-4117. Accès : http://www.gazette.gc.ca/archives/p1/2006/2006-12-09/pdf/g1-14049.pdf
Canada. Ministère de l'Environnement, ministère de la Santé. 2009. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant les substances du groupe 8 du Défi, Gazette du Canada. Partie I, vol. 143, no 5. Accès : http://www.gazette.gc.ca/rp-pr/p1/2009/2009-01-31/pdf/g1-14305.pdf
CanTox Inc. 1996. Assessment of human exposure to sodium nitrilotriacetate monohydrate from the use of various industrial/institutional and consumer products. Mississauga (Ont.) : Monsanto Company.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique]. ©2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software&swid=1
Celotti, L., Furlan, D., Seccati, L., Levis, A.G. 1987. Interactions of nitrilotriacetic acid (NTA) with Cr (VI) compounds in the induction of gene mutations in cultured mammalian cells. Mutat. Res. 190:35-39.
Celotti, L., Furlan, D., Ferraro, P., Levis, A.G. 1988. DNA damage and repair induced in vitro by nitrilotriacetic acid (NTA) in human lymphocytes. Mutat. Res. 209:149-154.
Chu, I., Becking, G.C., Villeneuve, D.C., Viau, A. 1978. Metabolism of nitrilotriacetic acid (NTA) in the mouse. Bull. Environ. Contam. Toxicol. 19:417-422.
[CMI] Commission mixte internationale. 1977. A report to the Great Lakes Research Advisory Board of the International Joint Commission on the health implications of NTA. Great Lakes Advisory Board. Disponible sur demande.
Coker, J.N. 1972. Sodium nitrilotriacetate –Two-step alkaline process. Ind. Eng. Chem. Prod. Res. Dev. 11(4):450-454.
Commission européenne. 2007. Summary record. Technical committee on classification and labelling of dangerous substances; meeting on health effects of pesticides, biocides, existing chemicals, new chemicals, and general issues. Rencontre au Bureau Européen des Substances Chimiques à Ispra, du 21 au 24 mars 2006. Direction générale du CCR de la Commission Européenne, Centre commun de recherche, Institute for Health and Consumer Protection. Bureau Européen des Substances Chimiques. ECBI /90/06 Rev. 8. Accès : http://ecb.jrc.ec.europa.eu/documents/Classification-Labelling/ADOPTED_SUMMARY_RECORDS/9006r8_ECB_sr_health_0306.pdf
[ConsExpo] Consumer Exposure Model [en ligne]. 2006. Version 4.1. Bilthoven (Pays-Bas) : Rijksinstituut voor Volksgezondheid en Milieu (Institut national néérlandais de la santé publique et de l'environnement). Accès : http://www.rivm.nl/en/healthanddisease/productsafety/ConsExpo.jsp#tcm:13-42840
Costa, R., Russo, A., Zordan, M., Pacchierotti, A., Tavella, A., Levis, A.G. 1988a. Nitrilotriacetic acid (NTA) induces aneuploidy in Drosophila and mouse germ-line cells. Environ. Mol. Mutagen. 12:397-407.
Costa, R., Strolego, G., Levis, A.G. 1988b. Mutagenicity of lead chromate in Drosophila melanogaster in the presence of nitrilotriacetic acid (NTA). Mutat. Res. 204:257-261.
Crebelli, R., Bellincampi, D., Conti, G., Conti, L., Morpurgo, G., Carere, A. 1986. A comparative study on selected chemical carcinogens for chromosome malsegregation, mitotic crossing-over and forward mutation induction in Aspergillus nidulans. Mutat. Res. 172:139-149.
Crosbie, G.A., Lodi, A., Miller, J.H.M., Skellern, G.G. 2003. The control of nitrilotriacetic acid in edetic acid and its salts by liquid chromatography. J. Pharm. Biomed. Anal. 33:435-440.
Deligiannis, G., Piccione, J. (éd.) 2008. 2008 Canadian chemical directory. Scarborough (Ont.) : Camford.
Ding, W.-H., Wu, J., Semadeni, M., Reinhard, M. 1999. Occurrence and behavior of wastewater indicators in the Santa Ana River and the underlying aquifers. Chemosphere 39(11):1781-1794.
Dow Chemical Company. 1987. Food additive petition on pentasodium EDTA and trisodium EDTA. Présenté à la US Food and Drug Administration. FAP 7B4023. [cité dans Lanigan et Yamarik, 2002].
Dunkel, V.C., Zeiger, E., Brusick, D., McCoy, E., McGregor, D., Mortelmans, K., Rosenkranz, H.S., Simmon, V.F. 1985. Reproducibility of microbial mutagenicity assays: II. Testing of carcinogens and noncarcinogens in Salmonella typhimurium and Escherichia coli. Environ. Mutagen. 7:1-248.
Dunkel, V.C., Schechtman, L.M., Tu, A.S., Sivak, A., Lubet, R.A., Cameron, T.P. 1988. Interlaboratory evaluation of the C3H/10T1/2 cell transformation assay. Environ. Mol. Mutagen. 12:21-31.
[ECOTOX] ECOTOXicology database [base de données sur Internet]. 2006. Washington (DC) : US Environmental Protection Agency, Office of Research and Development, National Health and Environmental Effects Research Laboratory, Mid-Continent Ecology Division. Accès : http://cfpub.epa.gov/ecotox
Eichinger, R. 2005. Paper and pulp [en ligne]. In: Ullmann's encyclopedia of industrial chemistry, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9783527306732/ueic/article/a18_545/current/pdf [réserve de consultation]
Environnement Canada. 2007. Guidance for conducting ecological assessments under CEPA, 1999: science resource technical series: draft module on QSARs. Document de travail préliminaire révisé. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
Environnement Canada. 2009a. Données sur les substances du lot 8 recueillies en vertu de l'article 71 de la Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances identifiées dans le huitième lot du Défi. Données préparées par : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2009b. Suggested approach to determining the persistence of a chemical from biodegradation data. Document de travail préliminaire. Gatineau (Qc) : Environnement Canada, Programme des substances existantes.
Environnement Canada. 2009c. Rapport IGETA : CAS RN 139-13-9, 2009-04-08. Rapport inédit. Gatineau (Qc) : Environnement Canada, Division des évaluations écologiques.
[EP] Pharmacopée européenne. 2001. Edetic acid. In: European pharmacopoeia. 4e éd. (en anglais). Strasbourg (France) : Conseil de l'Europe, Direction Européenne de la Qualité du Médicament. p. 1097-1098.
Epstein, S.S., Arnold, E., Andrea, S., Bass, W., Bishop, Y. 1972. Detection of chemical mutagens by the dominant lethal assay in the mouse. Toxicol. Appl. Pharmacol. 23:288-325.
[EQC] Equilibrium Criterion Model. 2003. Version 2.02. Peterborough (Ont.) : Trent University, Canadian Centre for Environmental Modelling and Chemistry. Accès : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
[EURAR] European Union risk assessment report: CAS No.: 5064-31-3: trisodium nitrilotriacetate [en ligne]. 2005. Luxembourg : Office des publications officielles des Communautés européennes. Rapport final, 2005. En page couverture, Centre commun de recherche de l'Union européenne. [consulté en juin 2009]. Accès : http://ecb.jrc.ec.europa.eu/esis/index.php? PGM=ora
[EURAR] European Union risk assessment report: CAS No.: 5064-31-3: trisodium nitrilotriacetate [en ligne]. 2008. Ébauche datée du 20 août 2008. [consultée en juillet 2009]. Accès : http://echa.europa.eu/doc/trd_substances/trisodium_nitrilotriacetate/rar/trd_rar_germany_nta.rtf
Fischer, W.K., Gericke, P., Schmid, R. 1974. Methodenkombination zur sukzessiven Prüfung und Bewertung der biologischen Abbaubarkeit synthetischer Substanzen. Wasser Abwasser Forsch. 7(Suppl. 4):99-118.
Fukushima, S., Kurata, Y., Tamano, S., Inoue, K., Ito, N. 1985. Promoting effect of trisodium nitrilotriacetate monohydrate on urinary bladder carcinogenesis in rats. Jpn. J. Cancer. Res. 76:823-827.
Garric, J., Vollat, B., Nguyen, D.K., Bray, M., Migeon, B., Kosmala, A. 1996. Ecotoxicological and chemical characterization of municipal wastewater treatment plant effluents. Water Sci. Technol. 33(6):83-91.
Glauser, J., Blagoev, M., Kishi, A. 2007. CEH product review: chelating agents. Menlo Park (CA) : SRI Consulting. Accès : http://www.sriconsulting.com/CEH/Public/Reports/index.html [réserve de consultation]
Gousetis, C., Opgenorth, H.-J. 2005. Nitrilotriacetic acid [en ligne]. In: Ullmann's encyclopedia of industrial chemistry, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9783527306732/ueic/article/a17_377/current/pdf [réserve de consultation]
Goyer, R.A., Falk, H.L., Hogan, M., Feldman, D.D., Richter, W. 1981. Renal tumours in rats given trisodium nitrilotriacetic acid in drinking water for two years. J. Natl. Cancer Inst. 66:869-880.
Greenblatt, M., Lijinsky, W. 1974. Carcinogenesis and chronic toxicity of nitrilotriacetic acid in Swiss mice. J. Natl. Cancer Inst. 52:1123-1126.
Hart, J.R. 2005. Ethylenediaminetetraacetic acid and related chelating agents. In : Ullmann's encyclopedia of industrial chemistry, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9783527306732/ueic/article/a10_095/current/pdf [réserve de consultation]
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2008. Version 3.20. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Hiasa, Y., Kitahor, Y., Konishi, N., Shimoyama, T. 1984. Trisodium nitrilotriacetate monohydrate: promoting effects on the development of renal tubular cell tumours in rats treated with N-ethyl-N-hydroxyethylnitrosamine. J. Natl. Cancer Inst. 72:483-488.
Hiasa, Y., Kitahori, Y., Konishi, N., Shimoyama, T. 1985a. Dose-related effect of trisodium-nitrilotriacetate monohydrate on renal tumourigenesis initiated with N-ethyl-N-hydroxyethyl-nitrosamine in rats. Carcinogenesis 6:907-910.
Hiasa, Y., Kitahori, Y., Konishi, N., Shimoyama, T., Miyashiro, A. 1985b. Trisodium nitrilotriacetate monohydrate: promoting effect in urinary bladder carcinogenesis in rats treated with N-butyl-N-(4-hydroxybutyl) nitrosamine. J. Natl. Cancer Inst. 74:235-239.
[HYDROWIN] Hydrolysis Rates Program for Microsoft Windows [modèle d'estimation]. 2008. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[IARC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1990. Nitrilotriacetic acid and its salts. IARC Monogr. Eval. Carcinog. Risks Hum. 48:181-212.
[IARC] IARC Working Group on the Evaluation of Carcinogenic Risks to Humans. 1999. Nitrilotriacetic acid and its salts. IARC Monogr. Eval. Carcinog. Risks Hum. 73:385-399.
Inventaire national des rejets de polluants (INRP) [base de données sur Internet]. 2006. Gatineau (Qc) : Environnement Canada. [consultée en mai 2009]. Accès : http://www.ec.gc.ca/inrp-npri/default.asp?lang=Fr&n=4A577BB9-1
Kanerva, R.L., Francis, W.R., Lefever, F.R., Dorr, T., Alden, C.L., Anderson, R.L. 1984. Renal pelvic and ureteral dilatation in male rats ingesting trisodium nitrilotriacetate. Food Chem. Toxicol. 22:749-753.
Kaur, G., Hasan, S.K., Srivastava, R.C. 1980. Effect of nitrilotriacetic acid (NTA) on the distribution of manganese-54 in rats. Arch. Toxicol. 45:203-206.
Kiessling, D., Kaluza, U. 1997. Nitrilotriacetic acid: physicochemical and ecological properties. In: Swuger, M.J. (éd.) 1997. Detergents in the environment. New York (NY) : Marcel Dekker.
Kihlman, B.A., Sturelid, S. 1970. Nitrilotriacetic acid (NTA) and chromosome breakage. Environ. Mutagen. Soc. News l(3): 32-33.
Kitahori, Y., Konishi, N., Shimoyama, T., Hiasa, Y. 1985. Dose-dependent promoting effect of trisodium nitrilotriacetate monohydrate on urinary bladder carcinogenesis in Wistar rats pretreated with N-butyl-N-(4-hydroxybutyl) nitrosamine. Jpn J. Cancer Res. 76:818-822.
Kitahori, Y., Shimoyama, T., Ohshima, M., Matsuki, H., Hashimoto, H., Minami, S., Konishi, N., Hiasa, Y. 1988. Effects of trisodium nitrilotriacetate monohydrate, nitrilotriacetic acid and ammonium chloride on urinary bladder carcinogenesis in rats pretreated with N-bis (2-hydroxypropyl) nitrosamine. Cancer Lett. 43:105-110.
Knepper, T.P. 2003. Synthetic chelating agents and compounds exhibiting complexing properties in the aquatic environment. Trends Anal. Chem. 22(10):708-724.
[KOAWIN] Octanol-Air Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOCWIN] Soil Adsorption Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.67. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Kramers, P.G.N. 1976. Mutagenicity studies with nitrilotriacetic acid (NTA) and Citrex S-5 in Drosophila. Mutat. Res. 40:277280.
Krari, N., Allain, P. 1991. Effects of three chelating agents, EDTA, NTA, and TPP, on the concentrations of elements in rat tissues. Biol. Trace Elem. Res. 29:125-131.
Lanfranchi, G., Paglialunga, S., Levis, A.G. 1988. Mammalian cell transformation induced by chromium(VI) compounds in the presence of nitrilotriacetic acid. J. Toxicol. Environ. Health 24:251-260.
Lanigan, R.S., Yamarik, T.A. 2002. Final report on the safety assessment of EDTA, calcium disodium EDTA, diammonium EDTA, dipotassium EDTA, disodium EDTA, TEA-EDTA, tetrasodium EDTA, tripotassium EDTA, trisodium EDTA, HEDTA, and trisodium HEDTA. Int. J. Toxicol. 21 (Suppl. 2):95-142.
Lee, H.-B., Peart, T.E., Kaiser, K.L.E. 1996. Determination of nitrilotriacetic, ethylenediaminetetraacetic and diethylenetriaminepentaacetic acids in sewage treatment plant and paper mill effluents. J. Chromatogr. A 738:91-99.
Leibold, E., Deckardt, K., Mellert, W., Potthoff-Karl, B., Grundler, O., Jäckh, R. 2002. NTA and Fe (III) NTA: differential patterns of renal toxicity in subchronic studies. Hum. Exp. Toxicol. 21:445-452.
Lijinsky, W., Greenblatt, M., Kommineni, C. 1973. Brief communication: feeding studies of nitrilotriacetatic acid and derivatives in rats. J. Natl. Cancer Inst. 50:1061-1063.
Loprieno, N., Boncristiani, G., Venier, P., Montaldi, A., Majone, F., Bianchi, V., Paglialunga, S., Levis, A.G. 1985. Increased mutagenicity of chromium compounds by nitrilotriacetic acid. Environ. Mutagen. 7:185-200.
Loveday, K.S., Lug, M.H., Resnick, M.A., Anderson, B.E., Zeiger, E. 1989. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. II. Results with 20 chemicals. Environ. Mol. Mutagen. 13:60-94.
Lynn, J.L. Jr. 2009. Detergency and detergents [en ligne]. In : Kirk-Othmer encyclopedia of chemical technology, édition en ligne. Accès : http://mrw.interscience.wiley.com/emrw/9780471238966/kirk/article/steabell.a01/current/pdf [réserve de consultation]
Mahaffey, K.R., Goyer, R.A. 1972. Trisodium nitrilotriacetate in drinking water. Metabolic and renal effects in rats. Arch. Environ. Health 25:271-275.
Malaiyandi, M., Williams, D.T., O'Grady, R. 1979. A national survey of nitrilotriacetic acid in Canadian drinking water. Environ. Sci. Technol. 13(1):59-62.
Mason, J.M., Valencia, R., Zimmering, S. 1992. Chemical mutagenesis testing in Drosophila: VIII. Reexamination of equivocal results. Environ. Mol. Mutagen. 19:227-234.
Matheson, D.H. 1977. Nitrilotriacetic acid (NTA) in the Canadian environment. Ottawa (Ont.) : Environnement Canada, Direction générale des eaux intérieures, Direction de la qualité des eaux. Scientific Series No. 74. Disponible sur demande.
Matsuki, H., Ozono, S., Yamaguchi, H., Tsunemi, K., Hirao, Y., Okajima, E. 1992. Effects of various chemicals on the development of mouse urinary bladder tumours induced by N-butyl-N-(4-hydroxybutyl) nitrosamine. J. Toxicol. Pathol. 5:55-60.
McFuff, R.E., Mord, F.M. 1973. Description and use of the chemical equilibrium program REDEQL2. Pasadena (CA) : California Institute of Technology, W.M. Keck Laboratory of Environmental Science. Technical Report EQ-73-02. [cité dans Santé Canada, 1990].
Merski, J.A. 1982. Alterations of renal tissue structure during a 30-day gavage study with nitrilotriacetate. Food Chem. Toxicol. 20:433-440.
Michael, W.R., Wakim, J.M. 1971. Metabolism of nitrilotriacetic acid (NTA). Toxicol. Appl. Pharmacol. 18:407-416.
Michael, W.R., Wakim, J.M. 1973. Effect of trisodium nitrilotriacetate (Na3NTA) on the metabolism of selected metal ions. Toxicol. Appl. Pharmacol. 24:519-529.
Millington, L.A., Goulding, K.H., Adams, N. 1988. The influence of growth medium composition on the toxicity of chemicals to algae. Water Res. 22:1593-1597.
Mitchell, A., Rudd, C.J., Caspary, W.J. 1988. Evaluation of the L5178Y mouse lymphoma cell mutagenesis assay: intralaboratory results for sixty-three coded chemicals tested at SRI International. Environ. Mol. Mutagen. 12:37-101.
Modesti, D., Tanzarella, C., Degrassi, F. 1995. Genotoxic activity of nitrilotriacetic acid in Chinese hamster cells. Mutat. Res. 343:1-6.
Modler, R.F., Janshekar, H., Inoguchi, Y. 2007. CEH marketing research report: surfactants, household detergents and their raw materials. Menlo Park (CA) : SRI Consulting. Accès : http://www.sriconsulting.com/CEH/Public/Reports/index.html [réserve de consultation]
Monsanto. 1968. Toxicological investigation of: trisodium nitrilotriacetate (NTA). Rapport inédit. Monsanto, Younger Laboratories. Project No. Y-68-13, daté du 2 février 1968. [cité dans EURAR, 2008].
Montaldi, A., Zentilin, L., Venier, P., Gola, I., Bianchi, V., Paglialunga, S., Levis, A.G. 1985. Interaction of nitrilotriacetic acid with heavy metals in the induction of sister chromatid exchanges in cultured mammalian cells. Environ. Mutagen. 7:381-390.
Montaldi, A., Zentilin, L., Zordan, M., Bianchi, V., Levis, A.G. 1987. Chromosomal effects of heavy metals (Cd, Cr, Hg, Ni and Pb) on cultured mammalian cells in the presence of nitrilotriacetic acid (NTA). Environ. Toxicol. Chem. 14:183-200.
Montaldi, A., Mariot, R., Zordan, M., Paleologo, M., Levis, A.G. 1988. Nitrilotriacetic acid (NTA) does not induce chromosomal damage in mammalian cells either in vitro or in vivo. Mutat. Res. 208:95-100.
[MPBPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2008. Version 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Mueller, F., Peggau, J., Arif, S. 2006. Special purpose cleaning formulations: auto care and industrial/institutional products. In : Showell, M.S. (éd.), Handbook of detergents. Part D: Formulations. Surfactant Science Series, Vol. 128. Boca Raton (FL) : Taylor et Francis. p. 261-277.
Myers, M.C., Kanerva, R.L., Alden, C.L., Anderson, R.L. 1982. Reversibility of nephrotoxicity induced in rats by nitrilotriacetate in subchronic feeding studies. Food Chem. Toxicol. 20:925-934.
Myhr, B.C., Caspary, W.J. 1988. Evaluation of the L5178Y mouse lymphoma cell mutagenesis assay: intralaboratory results for sixty-three coded chemicals tested at Litton Bionetics, Inc. Environ. Mol. Mutagen. 12:103-194.
National Chemical Inventories [base de données sur CD-ROM]. 2008. Columbus (OH) : American Chemical Society, Chemical Abstracts Service. Accès : http://www.cas.org/products/cd/nci/require.html
[NCI] National Cancer Institute (US). 1977. Bioassays of nitrilotriacetic acid (NTA) and nitrilotriacetic acid, trisodium salt, monohydrate (Na3NTA·H2O) for possible carcinogenicity. Bethesda (MD) : US Department of Health, Education and Welfare, Public Health Service, National Institutes of Health, National Cancer Institute.
Nesslany, F., Simar-Meintières, S., Watzinger, M., Talahari, I., Marzin, D. 2008. Characterization of the genotoxicity of nitrilotriacetic acid. Environ. Mol. Mutagen. 49:439-452.
Nixon, G.A. 1971. Toxicity evaluation of trisodium nitrilotriacetate. Toxicol. Appl. Pharmacol. 18:398-406.
Nixon, G.A., Buehler, E.V., Niewenhuis, R.J. 1972. Two-year rat feeding study with trisodium nitrilotriacetate and its calcium chelate. Toxicol. Appl. Pharmacol. 21:244-252.
Nolen, G.A., Klusman, L.W., Back, D.L., Buehler, E.V. 1971. Reproduction and teratology studies of trisodium nitrilotriacetate in rats and rabbits. Food Cosmet. Toxicol. 9:509-518.
Nolen, G.A., Bohne, R.L., Buehler, E.V. 1972a. Effects of trisodium nitrilotriacetate, trisodium citrate and a trisodium nitrilotriacetate-ferric chloride mixture on cadmium and methyl mercury toxicity and teratogenicity in rats. Toxicol. Appl. Pharmacol. 23:238-250.
Nolen, G.A., Buehler, E.V., Geil, R.G., Goldenthal, E.I. 1972b. Effects of trisodium nitrilotriacetate on cadmium and methyl mercury toxicity and teratogenicity in rats. Toxicol. Appl. Pharmacol. 23:222-237.
[NTP] National Toxicology Program (US). 2005. Substance profiles: nitrilotriacetic acid. In: 11th report on carcinogens (RoC) [en ligne]. Research Triangle Park (NC) : US Department of Health and Human Services, National Toxicology Program. [consulté en juillet 2009]. Accès : http://ntp.niehs.nih.gov/ntp/roc/eleventh/profiles/s119nitr.pdf
[OASIS Forecast] Optimized Approach based on Structural Indices Set [en ligne]. 2005. Version 1.20. Bourgas (Bulgarie) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accès : http://oasis-lmc.org/?section=software
[OMS] Organisation mondiale de la Santé. 1996. Nitrilotriacetic acid in Drinking-water: Background document for development of WHO Guidelines for Drinking-water Quality.(en anglais seul.)WHO/SDE/WSH/03.04/30. Genève (Suisse) : Organisation mondiale de la santé. Accès : http://www.who.int/water_sanitation_health/dwq/chemicals/en/nitrilotriaceticacid.pdf
[PhysProp] Interactive PhysProp Database [base de données sur Internet]. 2006. Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.syrres.com/esc/physdemo.htm
Pietsch, J., Schmidt, W., Sacher, F., Fichtner, S., Brauch, H.-J. 1995. Pesticides and other organic micro pollutants in the river Elbe. Fresenius J. Anal. Chem. 353:75-82.
Pollack, S., Ruocco, S. 1981. Synergistic effect of nitrilotriacetate on iron mobilization by desferrioxamine in vivo. Blood 57(6):1117-1118.
Procter & Gamble Company. 1972. New York State (Long Island Study). Document polycopié le 10 avril 1974. Cincinnati (OH) : Procter & Gamble. [cité dans Matheson, 1977].
Procter & Gamble Company. 1981. Summary of Indiana Monitoring Program for NTA. Présenté à la US Environmental Protection Agency. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Procter & Gamble Company. 1982. Summary of Indiana Monitoring Program for NTA. Présenté à la US Environmental Protection Agency. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Procter & Gamble Company. 1983a. Canadian tap water monitoring for NTA, Phase I--Ottawa-Carleton and Finch, Ontario, and Phase II--Port Kells, British Columbia. Présenté à la New York State Department of Environmental Conservation. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Procter & Gamble Company. 1983b. New York tap water monitoring for NTA, October1981-June 1983. Présenté à la New York State Department of Environmental Conservation. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Procter & Gamble Company. 1983c. Summary of the NTA Environmental Monitoring Program in Indiana. Présenté à la New York State Department of Environmental Conservation. Cincinnati (OH) : Procter & Gamble. [cité dans Anderson et al., 1985].
Ramel, C., Magnusson, J. 1979. Chemical induction of non-disjunction in Drosophila. Environ. Health Perspect. 31:59-66.
RCC-CCR. 2000. Hyperhaploidy-aneuploidy determination in secondary spermatocytes of mice after oral treatment with nitrilotriacetic acid (trisodium salt). Rossdorf (Allemagne) : RCC Cytotest Cell Research. Project 560100. [cité dans EURAR, 2008].
Richardson, M.L. 1992-1994. The dictionary of substances and their effects. Vols. 1-7. Londres (Royaume-Uni) : Royal Society of Chemistry. Accès : http://www.rsc.org/Publishing/CurrentAwareness/DOSE/DOSESearchPage.cfm
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006a. Cosmetics fact sheet: To assess the risks for the consumer. Version mise à jour pour le ConsExpo4 [en ligne]. [consultée le 31 août 2009]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). Rapport RIVM no 320104001/2006. Accès : http://www.rivm.nl/bibliotheek/rapporten/320104008.pdf
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006b. Cleaning products fact sheet: To assess the risks for the consumer. Version mise à jour pour le ConsExpo 4 [en ligne]. [consultée le 31 août 2009]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). Rapport RIVM 320104003/2006. Accès : http://www.rivm.nl/bibliotheek/rapporten/320104003.pdf
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006c. Pest control products fact sheet: To assess the risks for the consumer. Version mise à jour pour le ConsExpo 4 [en ligne]. [consultée le 31 août 2009]. Bilthoven (Pays-Bas) : RIVM (Institut national néérlandais de la santé publique et de l'environnement). Rapport RIVM 320005002/2006. Accès : http://www.rivm.nl/bibliotheek/rapporten/320005002.pdf
Robbiano, L., Carrozzino, R., Puglia, C.P., Corbu, C., Brambilla, G. 1999. Correlation between induction of DNA fragmentation and micronuclei formation in kidney cells from rats and humans and tissue-specific carcinogenic activity. Toxicol. Appl. Pharmacol. 161:153-159.
Robbiano, L., Carrozzino, R., Bacigalupo, M., Corbu, C., Brambilla, G. 2002. Correlation between induction of DNA fragmentation in urinary bladder cells from rats and humans and tissue-specific carcinogenic activity. Toxicology 179:115-128.
Russo, A., Pacchierotti, F., Bassani, B., Levis, A.G. 1989. Lack of induction of somatic aneuploidy in the mouse by nitrilotriacetic acid (NTA). Mutat. Res. 226:111-114.
Santé Canada. 1990. Acide nitrilotriacétique (NTA). Ottawa (Ont.) : Santé Canada, Programme de la sécurité des milieux. Accès : http://dsp-psd.pwgsc.gc.ca/Collection/H48-10-1-61-1990F.pdf
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l'hygiène du milieu.
Santé Canada. 2007. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques –septembre 2009 [en ligne]. Ottawa (Ont.) : Santé Canada, Sécurité des produits de consommation. [consultée le 14 décembre 2009]. Accès : http://www.hc-sc.gc.ca/cps-spc/person/cosmet/info-ind-prof/_hot-list-critique/hotlist-liste-fra.php
Santé Canada. 2008. Recommandations pour la qualité de l'eau potable au Canada--Tableau sommaire. [consulté le 22 juillet 2009]. Ottawa (Ont.) : Santé Canada. Accès : http://www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/water-eau/sum_guide-res_recom/summary-sommaire-fra.pdf
Santé et Bien-être social Canada. 1990. L'allaitement maternel au Canada : pratiques et tendances. Ottawa (Ont.) : chez l'auteur. No de catalogue H39-199/1990F. [cité dans Santé Canada, 1998].
Schmidt, C.K., Fleig, M., Sacher, F., Brauch, H.-J. 2004. Occurrence of aminopolycarboxylates in the aquatic environment of Germany. Environ. Pollut. 131:107-124.
[SCJGSARA] S.C. Johnson Global Safety Assessment & Regulatory Affairs. 2009. Fiche signalétique : Scrubbing Bubbles® Bathroom Cleaner –Fresh Clean [en ligne]. Racine (WI) : S.C. Johnson and Son, Limited. [consultée le 26 août 2009]. Accès : http://www.scjohnson.ca/msds/Scrubbing%20Bubbles%20Bathroom%20Cleaner%20-Fresh%20Clean%20Jan%202009.pdf
[SDC] Système de déclaration des cosmétiques [base de données exclusive]. 2009. Disponible auprès de Santé Canada, Division des cosmétiques.
Stabel, H.-H. 1998. Chemical composition and drinking water quality of the water from Lake Constance. Arch. Hydrobiol. Spec. Issues Adv. Limnol. 53:13-30.
Sturm, R.N., Payne, A.G. 1973. Environmental testing of trisodium nitrilotriacetate: bioassays for aquatic safety and algal stimulation. P. 403-424. In : Glass, G.E. (éd.) Bioassay Techniques and Environmental Chemistry. Ann Arbor (MI) : Ann Arbor Sci. Publ. Inc.
Suresh, B., Kishi, A. 2006. CEH product review: hydrogen cyanide. Menlo Park (CA) : SRI Consulting. Accès : http://www.sriconsulting.com/CEH/Public/Reports/index.html. [réserve de consultation]
Tjälve, H. 1972. A study of the distribution and teratogenicity of nitrilotriacetic acid (NTA) in mice. Toxicol. Appl. Pharmacol. 23:216-221.
[USEPA] US Environmental Protection Agency. 1980. Final report: NTA. Rapport inédit. Washington (DC) : US Environmental Protection Agency, Office of Pesticides and Toxic Substances, Assessment Division.
[USP] United States Pharmacopeia. 2000a. Edetate calcium disodium. In : United States Pharmacopeia 24. Rockville (MD) : US Pharmacopeia. p. 622.
[USP] United States Pharmacopeia. 2000b. Edetate disodium. In : United States Pharmacopeia 24. Rockville (MD) : US Pharmacopeia. p. 622-623.
[USP] United States Pharmacopeia. 2000c. Edetic acid. In : National Formulary 19. Rockville (MD) : US Pharmacopeia. p. 2449-2450.
Venier, P., Montini, R., Zordan, M., Clonfero, E., Paleologo, M., Levis, A.G. 1989. Induction of SOS response in Escherichia coli strain PQ37 by 16 chemical compounds and human urine extracts. Mutagenesis 4:51-57.
Voulgaropoulos, A., Tzivanakis, N. 1992. Use of ion exchangers for the voltammetric determination of NTA and EDTA in natural waters. Electroanalysis 4:647-651.
[WATERNT] Water Solubility Estimate –Fragment Methodology [modèle d'estimation]. 2008. Version 1.01. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. Accès : http://www.epa.gov/oppt/exposure/pubs/episuite.htm
Williams, G.M., Laspia, M.F., Dunkel, V.C. 1982. Reliability of the heptatocyte primary culture/DNA repair test in testing of coded carcinogens and noncarcinogens. Mutat. Res. 97:359-370.
Williams, G.M., Mori, H., McQueen, C.A. 1989. Structure-activity relationship in the rat hepatocyte DNA-repair test for 300 chemicals. Mutat. Res. 221:263-286.
Woodiwiss, C.R., Walker, R.D., Brownridge, F.A. 1979. Concentrations of nitrilotriacetate and certain metals in Canadian wastewaters and streams: 1971-1975. Water Res. 13:599-612.
Woodruff, R.C., Mason, J.M., Valencia, R., Zimmering, S. 1985. Chemical mutagenesis testing in Drosophila. V. Results of 53 coded compounds tested for the National Toxicology Program. Environ. Mutagen. 7:677-702.
Yalkowsky, S.H., Dannenfelser, R.M. 1992. The Aquasol database of aqueous solubility. 5th ed. Tucson (AZ) : University of Arizona, College of Pharmacy.
Zeiger, E., Anderson, B., Haworth, S., Lawlor, T., Mortelmans, K. 1992. Salmonella mutagenicity tests: V. Results from the testing of 311 chemicals. Environ. Mol. Mutagen. 19:2-141.
Zoller, U. (éd.) 2009. Handbook of detergents. Part E: Applications. Surfactant Science Series, Vol. 141. Boca Raton (FL) : Taylor & Francis.
Zordan, M., Russo, A., Costa, R., Bianco, N., Beltrame, C., Levis, A.G. 1990. A concerted approach to the study of the aneuploidonic properties of two chelating agents (EDTA and NTA) in the germ and somatic cell lines of Drosophila and the mouse. Environ. Mol. Mutagen. 15:205-213.
Zordan, M., Graf, U., Singer, D., Cinzia, B., Valle, L.D., Osti, M., Costa, R., Levis, A.G. 1991. The genotoxicity of nitrilotriacetic acid (NTA) in a somatic mutation and recombination test in Drosophila melanogaster. Mutat. Res. 262:253-261.
Annexe 1 : Valeurs estimatives de la limite supérieure de l'absorption journalière de NTA chez la population générale du Canada
| Voie d'exposition | Absorption estimée (µg/kg p.c. par jour) de NTA par divers groupes d'âge | |||||||
|---|---|---|---|---|---|---|---|---|
| 0 à 6 mois1,2,3 | 0,5 à 4 ans4 | 5 à 11 ans5 | 12 à 19 ans6 | 20 à 59 ans7 | 60 ans et plus8 | |||
| Allaités | Nourris au lait maternisé | Sans lait maternisé | ||||||
| Abréviation : s.o. = sans objet. 1 Aucune donnée sur la concentration de NTA dans le lait maternel n'a été trouvée. 2 Hypothèses : poids de 7,5 kg, volume d'air respiré de 2,1 m3/jour, consommation d'eau de 0,8 L/jour (enfants nourris au lait maternisé) ou de 0,3 L/jour (enfants non nourris au lait maternisé) et ingestion de 30 mg/jour de sol (Santé Canada, 1998). 3 Pour les nourrissons exclusivement nourris au lait maternisé, l'absorption d'eau est synonyme d'absorption de nourriture. La concentration de NTA dans l'eau utilisée pour préparer le lait maternisé s'est fondée sur les données disponibles. On n'a répertorié aucune donnée sur les concentrations de NTA dans le lait maternisé au Canada. Environ 50 % des enfants non nourris au lait maternisé ont commencé à manger des aliments solides à 4 mois, et 90 % ont commencé à 6 mois (Santé Canada, 1990). 4 En supposant que l'enfant pèse 15,5 kg, respire 9,3 m3 d'air par jour, qu'il boit 0,7 L d'eau par jour et qu'il ingère 100 mg de sol par jour (Santé Canada 1998). 5 En supposant que l'enfant pèse 31 kg, respire 14,5 m3 d'air par jour, qu'il boit 1,1 L d'eau par jour et qu'il ingère 65 mg de sol par jour (Santé Canada, 1998). 6 En supposant que le jeune pèse 59,4 kg, respire 15,8 m3 d'air par jour, qu'il boit 1,2 L d'eau par jour et qu'il ingère 30 mg de sol par jour (Santé Canada, 1998). 7 En supposant que la personne pèse 70,9 kg, respire 16,2 m3 d'air par jour, qu'elle boit 1,5 L d'eau par jour et qu'elle ingère 30 mg de sol par jour (Santé Canada 1998). 8 En supposant que la personne pèse 72 kg, respire 14,3 m3 d'air par jour, qu'elle boit 1,6 L d'eau par jour et qu'elle ingère 30 mg de sol par jour (Santé Canada, 1998). 9 Aucune donnée sur la concentration de NTA dans l'air ambiant n'a été trouvée. 10 Aucune donnée sur la concentration de NTA dans l'air intérieur n'a été trouvée. 11 Le NTA a été décelé dans des échantillons d'eau potable municipale traitée au Canada au cours de deux études menées à l'échelle nationale (Matheson, 1977; Malaiyandi et al., 1979). La concentration maximale de 20,4 µg/L signalée par Malaiyandi et ses collaborateurs a été utilisée pour estimer l'exposition. 12 Aucune donnée sur la concentration de NTA dans les aliments et les boissons n'a été trouvée. 13 Aucune donnée sur la concentration de NTA dans le sol n'a été trouvée. |
||||||||
| Air ambiant9 | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | ||
| Air intérieur10 | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | ||
| Eau potable11 | s.o. | 2,18 | 0,82 | 0,92 | 0,72 | 0,41 | 0,43 | 0,45 |
| Aliments et boissons12 | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. |
| Sol13 | s.o. | s.o. | s.o. | s.o. | s.o. | s.o. | ||
| Absorption totale | s.o. | 2,18 | 0,82 | 0,92 | 0,72 | 0,41 | 0,43 | 0,45 |
Scénarios pour les produits de consommation utilisés fréquemment
| Scénarios concernant les produits de consommation | Hypothèses1,2 | Exposition estimée |
|---|---|---|
| 1 Un débit d'inhalation de 16,2 m3/jour a été utilisé pour toutes les estimations de l'exposition par inhalation (Santé Canada, 1998). 2 Le Système de déclaration des cosmétiques (SDC, 2009) a déterminé que du Na3NTA se trouvait dans les produits de soins personnels figurant dans ce tableau. Une valeur calculée du Koe de -2,62 a été utilisée (EURAR, 2005). 3 La valeur la plus élevée de perméabilité dermique a été estimée en utilisant la méthode de Fiserova-Bergerova (comprise dans la version 4.1 de ConsExpo). On juge que cette méthode permet d'obtenir l'estimation de l'exposition cutanée la plus prudente lorsque l'on utilise le modèle d'absorption par diffusion. 4 Le solvant utilisé traditionnellement dans les parfums est l'éthanol dont la densité est de 0,789 g/cm3. Cela a été pris en compte lorsque le rapport masse-volume (c.-à-d., la concentration du composé) du Na3NTA dans le produit de consommation que représente le parfum a été établi. 5 L'exposition par inhalation a été jugée négligeable. La dose totale chronique (attribuable aux expositions par inhalation et par voie cutanée) provenant du scénario lié aux produits de consommation est illustré. 6 Courriel du Bureau de gestion du risque de Santé Canada adressé au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée. |
||
| Poudre compacte de maquillage pour le visage | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 0,00425 mg/kg p.c. par jour |
| Parfum | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Dose chronique = 5,24 × 10-7 mg/kg p.c. par jour par voie cutanée Dose chronique = 0,00145 mg/kg p.c. par jour |
| Shampooing | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 0,0201 mg/kg p.c. par jour |
| Nettoyant pour la peau (corps) | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 0,000619 mg/kg p.c. par jour |
| Nettoyant pour la peau (visage) | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 5,65 × 10-5 mg/kg p.c. par jour |
| Nettoyant multiusage, vaporisation | Concentration : 0,0002 %5 Hypothèses générales
Par inhalation
Voie cutanée
|
Dose chronique totale Dose5 = 5,33 × 10 |
| Nettoyant multiusage, nettoyage | Concentration : 0,0002 %5 Hypothèses générales
Par inhalation
Voie cutanée
|
Dose chronique totale Dose5 = 4,51 x 10-7 mg/kg p.c. par jour |
| Nettoyant pour verre, vaporisation | Concentration : 0,0002 %5 Hypothèses générales
Par inhalation
Voie cutanée
|
Dose chronique5 = 9,08 × 10-8 mg/kg p.c. par jour |
| Nettoyant pour verre, nettoyage | Concentration : 0,0002 % 6 Hypothèses générales
Voie cutanée
|
par voie cutanée Dose chronique = 8,17 × 10-7 mg/kg p.c. par jour |
Scénarios pour les produits de consommation utilisés occasionnellement
| Scénarios concernant les produits de consommation | Hypothèses1,2 | Exposition estimée |
|---|---|---|
| 1 Un débit d'inhalation de 16,2 m3/jour a été utilisé pour les estimations de l'exposition par inhalation (Santé Canada, 1998). 2 Le NTA a uniquement été décelé dans les engrais. Pour tous les autres produits, qui contenaient du Na3NTA, une valeur calculée du Koe de -2,62 a été utilisée (EURAR, 2005). 3 Les paramètres relatifs aux colorants capillaires permanents sont indiqués entre parenthèses lorsqu'ils diffèrent de ceux relatifs aux colorants capillaires semi-permanents. 4 La valeur la plus élevée de perméabilité dermique a été estimée en utilisant la méthode de Fiserova-Bergerova (comprise dans la version 4.1 de ConsExpo). On juge que cette méthode permet d'obtenir l'estimation de l'exposition cutanée la plus prudente lorsque l'on utilise le modèle d'absorption par diffusion. 5 Aucun modèle d'utilisation n'était disponible concernant les lotions pour pieds pour pédicure. Selon la Cosmetics Fact Sheet (fiche d'information sur les cosmétiques) de ConsExpo, la fréquence d'utilisation du vernis à ongles est de 156 fois par an (RIVM, 2006a). Le même chiffre a été utilisé concernant l'utilisation de lotion pour pieds pour pédicure par les Canadiennes adultes. 6 Propre au produit. 7 Courriels de l'Agence de réglementation de la lutte antiparasitaire de Santé Canada adressés au Bureau de l'évaluation des risques de Santé Canada en 2009; source non citée. 8 Le groupe d'âge de 0,5 à 4 ans était celui qui montrait le plus grand potentiel d'exposition dans un scénario sur la natation. 9 Concentration de la substance dans une piscine extérieure de taille moyenne (48 m3) (RIVM, 2006c), après l'application d'un algicide (quantité moyenne = 384 mL) (RIVM, 2006c). |
||
| Colorant capillaire, semi–permanent (permanent)3 | Concentration : 0,3 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose aiguë = 0,000685 mg/kg p.c. |
| Lotion pour les pieds pour pédicure | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Voie cutanée
|
par voie cutanée Dose aiguë = 0,00656 mg/kg p.c. |
| Protecteur de vernis à ongles pour manucure | Concentration : 0,1 % (SDC, 2009) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 1,91 × 10-11 mg/m3 par voie cutanée Dose aiguë = 0,000121 mg/kg p.c. |
| Nettoyant pour salle de bain, vaporisation | Concentration : 1 % (SCJGSARA , 2009) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 0,000229 mg/m3 par voie cutanée Dose aiguë = 0,000973 mg/kg p.c. |
| Nettoyant pour salle de bain, nettoyage | Concentration : 1 % (SCJGSARA , 2009) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 5,77 × 10-11 mg/m3 par voie cutanée Dose aiguë = 0,00423 mg/kg p.c. |
| Insecticide, acaricide | Concentration : 0,001 %7 Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 4,47 × 10-6 mg/m3 par voie cutanée Dose aiguë = 3,89 × 10-6 mg/kg p.c. |
| Engrais (liquide, mélange et chargement) | Concentration : 1 % (BCR, 2002) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 8,68 × 10-6 mg/m3 par voie cutanée Dose aiguë = 0,000141 mg/kg p.c. |
| Engrais –liquide, dissout (vaporisation dans des installations intérieures) | Concentration : 0,0000487 % (dilué 6) (BCR, 2002) Hypothèses générales
Par inhalation
Voie cutanée
|
par inhalation Concentration moyenne par événement = 1,34 × 10-6 mg/m3 par voie cutanée Dose aiguë = 1,9 × 10-6 mg/kg p.c. |
| Algicide pour piscine (mélange et chargement) | Concentration : 0,000688 %6 Hypothèses générales
Voie cutanée
|
par voie cutanée Dose aiguë = 4,27 × 10-8 mg/kg p.c. |
| Algicide pour piscine (application) | Concentration : 0,000688 %6 Hypothèses générales
Voie cutanée
|
par voie cutanée Dose aiguë = 6,4 × 10-7 mg/kg p.c. |
| Natation (enfant de 0,5 à 4 ans), exposition post-application8 | Concentration : 5,5 × 10-9 %9 Hypothèses générales
Voie cutanée
Voie orale
|
par voie cutanée Dose aiguë = 8,59 × 10-10 mg/kg p.c. par voie orale Dose aiguë = 2,12 × 10-7 mg/kg p.c. |
| Paramètre | Doses ou concentrations minimales avec effet1/Résultats |
|---|---|
| 1 CL50, concentration létale médiane; DL50, dose létale médiane; DMENO, dose minimale avec effet nocif observé; DMEO, dose minimale avec effet observé; DSEO, dose sans effet observé. | |
| Essais sur des animaux de laboratoire et in vitro | |
| Toxicité aiguë | NTADL50 la plus faible, par voie orale (rats) = 1 470 mg/kg p.c. (Richardson 1992-1994).Autre DL50, par voie orale (souris) = 3 160 mg/kg p.c. (Richardson 1992-1994). Na3NTA DL50 la plus faible, par voie orale (singes) = 750 mg/kg p.c. (Nixon, 1971). Autres valeurs de DL50 : 1 300 à 2 220 mg /kg p.c. (rats) (BASF 1985); > 5 000 mg/kg p.c. (chiens) (Nixon, 1971). CL50 par inhalation (rat) = >5 000 mg/m3 (> 5 mg/L) (USEPA, 1980). DL50 par voie cutanée (lapin) = > 10 000 mg/kg p.c. (EURAR, 2008) |
| Dose toxique à court terme pour l'exposition répétée | NTA DMENO minimale par voie orale = 750 mg/kg p.c. par jour (1,5 % de NTA), mesurée d'après une diminution de la croissance et une augmentation relative du poids des reins, du calcium dans l'urine, des hématuries et des hydronéphroses sur des rats Charles River et Fischer mâles et femelles (5 ou 10 par groupe), exposés dans leur alimentation à des doses de NTA de 0 % ou de 1,5 % pendant 4 semaines (Anderson et Kanerva, 1979). [Autres études sur l'exposition par voie orale : Myers et al., 1982; BASF, 1997a] Aucune étude concernant l'absorption cutanée n'a été recensée pour le NTA. |
Na3NTA DMENO minimale par voie orale = 100 mg/kg p.c. par jour (0,1 % de Na3NTA), mesurée d'après une augmentation relative du poids des reins chez des rats Sprague-Dawley mâles exposés à des doses de 0 %, 0,01 %, 0,1 % ou 1 % de Na3NTA (soit l'équivalent de 0, 10, 100 ou 1 000 mg/kg p.c. par jour) dans leur eau d'abreuvement (vacuolisation marquée des tubules rénaux observée à forte dose). DMEO minimale par voie orale = 10 mg/kg p.c. par jour (0,01 % de Na3NTA) d'après le taux élevé de glycémie chez tous les groupes traités. Toutefois, la pathogénie de cette augmentation était inconnue (Mahaffey et Goyer, 1972). Autres DMENO par voie orale = 200 mg/kg p.c. par jour (0,73 mmol par jour), mesurée d'après une vacuolisation cytoplasmique et une hyperplasie du tube contourné proximal chez des rats Sprague-Dawley mâles exposés par gavage à des doses de 0, 0,073 ou 7,3 mmol par jour de Na3NTA (soit l'équivalent de 0, 200 ou 2 000 mg/kg p.c. par jour) pendant 30 jours (Merski,1982).[Autres études sur l'exposition par voie orale : Michael et Wakim, 1973; Anderson et Kanerva, 1978, 1979; Alden et al., 1981; Kanerva et al., 1984; Krari et Allain, 1991; Bahnemann et al., 1998; Leibold et al., 2002] DSENO par voie cutanée = 50 mg/kg p.c. par jour (2,5 % de Na3NTA), mesurée d'après une absence d'anormalité évidente ou histologique chez des lapins néo-zélandais (six par groupe, sexe inconnu) exposés à des doses de 0 % ou 2,5% de Na3NTA (soit l'équivalent de 0 ou 50 mg/kg p.c. par jour) sur une peau intacte ou scarifiée pendant une durée de 28 jours (Nixon, 1971). |
|
NTA ou Na3NTA Étude d'exposition par inhalation : Des renseignements limités d'après une lettre de la part d'un déclarant à l'USEPA : lorsque des rats, des cochons d'Inde et des singes (sexe et races inconnus) ont été exposés à des doses de 0, 10, 213 ou 343 mg/m3, de NTA ou de Na3NTA non micronisé, 6 h par jour pour une période de 4 semaines, des diarrhées ont été observées chez les singes traités et une dyspnée sans irritation respiratoire ni indisposition a été constaté chez les rats et les cochons d'Inde à une dose de 343 mg/m3 de NTA ou de Na3NTA. Lorsque des rats albinos mâles ont été exposés à des doses de 0, 2, 20, 200 ou 2 000 mg/m3 de NTA ou de Na3NTA micronisé, 6 h par jour pour une période de 4 jours, des irritations respiratoires, nasales et des yeux ont été signalées à une dose de 2 000 mg/m3 de NTA ou de Na3NTA (USEPA, 1980). |
|
| Toxicité subchronique | NTA DMENO minimale par voie orale = 710 mg/kg p. c. par jour (1 % de NTA) calculée d'après les hyperplasies de l'épithélium de la vessie constatées chez des rats Wistar mâles (15 à 20 individus par groupe) exposés dans leur alimentation à des doses de 0 % ou de 1 % de NTA pendant 20 semaines (selon les données concernant l'administration de NTA uniquement provenant d'une étude en deux étapes d'initiation-promotion) (Kitahori et al., 1988). DMEO minimale par voie orale = 10 mg/kg p. c. par jour (100 mg/L) calculée d'après la baisse du potassium chez les rats mâles (race inconnue) exposés à des doses de 100, 1 000 ou 5 000 mg/L dans leur eau d'abreuvement pendant 90 jours (Becking et Yagminas, 1978). Aucune étude d'exposition par inhalation ou par voie cutanée n'a été recensée pour le NTA. |
Na3NTA DMENO minimale par voie orale = 150 mg/kg p.c. par jour (3 000 ppm), mesurée d'après une augmentation liée à la dose administrée des hyperplasies simples des cellules des tubules rénaux (nombre moyen de lésions par cm2) dans les groupes de rats Wistar (24 individus par groupe) traités avec des doses faibles et moyennes de 0, 3 000, 10 000 ou 30 000 ppm (soit l'équivalent de 0, 150, 500 ou 1 500 mg/kg p.c. par jour) dans leur alimentation pendant 30 semaines (selon les données concernant l'administration de Na3NTA uniquement provenant d'une étude en deux étapes d'initiation-promotion) (Hiasa et al., 1985a). DMEO minimale par voie orale = 35 mg/kg p.c. par jour (0,15 % de Na3NTA), mesurée d'après une augmentation de l'excrétion moyenne de zinc par des chiens Beagle des deux sexes (liée à la dose administrée pour les mâles traités et non liée à la dose administrée pour les femelles traitées –quatre individus par groupe) exposés à des doses de 0 %, 0,03 %, 0,15 % ou 0,5 % de Na3NTA (soit l'équivalent de 0, 7, 35 ou 116 mg/kg p.c. par jour) dans leur eau d'abreuvement pendant 90 jours (Budny et al., 1973). [Autres études sur l'exposition par voie orale : Nixon, 1971; Anderson et Danylchuk, 1980; Hiasa et al., 1985b; Kitahori et al., 1985] DSENO par voie cutanée = 50 mg/kg p.c. par jour (2,5 % de Na3NTA), mesurée d'après une absence d'anormalité évidente ou histologique chez des lapins néo-zélandais (six par groupe, sexe inconnu) exposés à des doses de 0 % ou 2,5% de Na3NTA (soit l'équivalent de 0 ou 50 mg/kg p.c. par jour) sur une peau intacte ou scarifiée pendant une durée de 91 jours (65 traitements) (Nixon, 1971). Aucune étude d'exposition par inhalation n'a été recensée pour le Na3NTA. |
|
NTA ou Na3NTA Plusieurs études en deux étapes d'initiation-promotion des tumeurs ont été recensées pour le NTA ou le Na3NTA. Dans ces études, les animaux de laboratoire ont tout d'abord été traités avec divers types de nitrosamines par voie orale. Ensuite, du NTA ou du Na3NTA a été administré par voie orale aux animaux traités à la nitrosamine en vue d'analyser l'effet d'agent promoteur de cette substance. Des groupes témoins n'ayant subi aucun traitement préalable à la nitrosamine (NTA ou Na3NTA uniquement) ont également été utilisés. DMENO orale (effet d'agent promoteur pour les tumeurs du rein) = 150 mg/kg p.c. par jour (3 000 ppm de Na3NTA) mesurée d'après l'effet de promotion de la croissance de tumeurs rénales du Na3NTA qui a été observé chez des rats Wistar mâles (24 individus par groupe traité) exposés dans leur alimentation à de la nitrosamine N,N-Diéthylhydroxylamine (NEELA) à des doses de 1 000 ppm pendant 2 semaines puis à du Na3NTA pendant 30 semaines (incidence des tumeurs : 0 %, 16 %, 22 %, 100 % et 100 %, respectivement, dans les groupes témoins, les groupes traités au NEELA uniquement et les groupes traités au NEELA puis à des doses de 3 000, 10 000 et 30 000 ppm de Na3NTA). On a constaté une augmentation des hyperplasies simples liées à la dose administrée chez les groupes traités au Na3NTA (avec ou sans initiation) (Hiasa et al., 1985a). [Autres études sur l'exposition par voie orale : Lijinsky et al., 1973; Greenblatt et Lijinsky, 1974; Hiasa et al., 1984, 1985b; Fukushima et al., 1985; Kitahori et al., 1985, 1988; Matsuki et al., 1992] |
|
| Toxicité chronique et cancérogénicité | NTA ou Na3NTA Cancérogénicité par voie orale chez les rats : Des groupes de 50 rats Fischer 344 de chaque sexe (20 de chaque sexe dans le groupe témoin) ont été exposés à une alimentation contenant : a) du NTA à des doses de 0, 7 500 ou 15 000 ppm (soit l'équivalent de 0, 375 ou 750 mg/kg p.c. par jour) ou b) les mêmes concentrations de Na3NTA (soit l'équivalent de 0, 375 ou 750 mg/kg p.c. par jour) pendant 18 mois suivis d'une période de rétablissement de 6 mois. a) Dans les groupes traités au NTA, on a pu observer une augmentation importante des tumeurs du tractus urinaire (principalement des adénomes et des adénocarcinomes des cellules des tubules rénaux) chez les mâles traités avec des doses élevées (0/20, 1/49 et 7/48, respectivement; p = 0,006 pour la tendance linéaire). Les femelles exposées à des doses élevées ont développé des carcinomes malpighiens et transitionnels au niveau de la vessie (0/18, 2/45 et 12/48, respectivement; p < 0,001 pour la tendance linéaire) ainsi que des phéochromocytomes de la glande surrénale (1/20, 0/50 et 14/48, respectivement; p < 0,001). On a pu constater une augmentation importante de l'incidence d'adénomes du foie chez les femelles traitées avec des doses moyennes et élevées (2/15, 8/49 et 22/49, respectivement; p = 0,001 pour la tendance linéaire). DMENO non néoplasique par voie orale = 375 mg/kg p.c. par jour sous forme de NTA (7 500 ppm), mesurée d'après l'incidence élevée d'inflammations chroniques dans les reins, de lésions hyperplasiques des voies urinaires et d'une baisse du gain de poids corporel liée à la dose administrée pour les deux sexes et quelle que soit la dose. b) Dans les groupes traités au Na3NTA, une augmentation non significative des tumeurs des voies urinaires a été observée. Chez les femelles, on a pu constater, à des doses élevées, un carcinome transitionnel et un papillome de la vessie et, à de faibles doses, un carcinome malpighien et trois carcinomes transitionnels. Un adénome des cellules des tubules rénaux ainsi qu'un papillome de l'uretère ont été observés chez deux mâles distincts traités avec de faibles doses. On a pu constater chez les deux sexes une baisse du gain de poids corporel liée à la dose administrée. L'hyperplasie épithéliale du tractus urinaire ne s'est manifestée que chez les animaux traités (NCI, 1977). |
Cancérogénicité par voie orale chez les souris : Des souris B6C3F1 (50 de chaque sexe par groupe et 20 de chaque sexe dans le groupe témoin) ont été exposées à une alimentation contenant : a) du NTA à des doses de 0, 7 500 ou 15 000 ppm (soit l'équivalent de 0, 975 ou 1 950 mg/kg p.c. par jour) ou b) du Na3NTAà des doses de 0, 2 500 ou 5 000 ppm (soit l'équivalent de 0, 325 ou 650 mg/kg p.c. par jour) pendant 18 mois suivis d'une période de rétablissement de 3 mois. a) Dans les groupes traités au NTA, on a pu observer une augmentation importante de l'incidence de tumeurs rénales (principalement des adénocarcinomes des cellules des tubules rénaux) chez les mâles traités (0/20, 5/49 et 24/44, respectivement; p = 0,001) et chez les femelles exposées à des doses élevées (0/20, 0/39 et 4/50, respectivement; p = 0,041 pour la tendance linéaire). DMENO non néoplasique par voie orale = 975 mg/kg p.c. par jour sous forme de NTA (7 500 ppm), mesurée d'après la baisse du gain de poids corporel chez les groupes de femelles traitées et de mâles exposés une dose élevée. On a observé, principalement chez les groupes exposés à la dose élevée, des lésions non néoplasiques, comme des hydronéphroses, une dégénérescence des cellules des tubules et une inflammation des reins. Une hyperplasie épithéliale transitionnelle a été constatée dans l'uretère d'un mâle exposé à une faible dose et dans le bassinet du rein d'une femelle exposée à une dose élevée. b) Dans les groupes traités au Na3NTA, on a pu observer une augmentation liée à la dose administrée des tumeurs hématopoïétiques chez les mâles (0/20, 4/47 et 9/50, respectivement; p = 0,015); on a également pu constater une augmentation de l'incidence de ces tumeurs chez les femelles, mais aucune relation dose-réponse claire n'a pu être mise en évidence (3/18, 7/47 et 4/47, respectivement). Aucune tumeur au niveau du tractus urinaire n'a été signalée. On a pu constater chez les deux sexes une baisse du gain de poids corporel liée à la dose administrée. L'hydronéphrose, seule lésion non néoplasique, s'est manifestée chez un animal de chaque sexe exposé à une faible dose, et chez 28 mâles et 30 femelles exposés à une dose élevée (NCI, 1977). |
|
Autres études portant sur l'exposition des rats à la substance dans leur alimentation : Des groupes de rats Fischer 344 (24 de chaque sexe) ont été exposés dans leur alimentation à des doses de 0, 200, 2 000 ou 20 000 ppm de Na3NTA (soit l'équivalent de 0, 10, 100 ou 1 000 mg/kg p.c. par jour) pendant 104 semaines. On a pu observer, pour les individus exposés à la dose élevée, des adénomes et des adénocarcinomes rénaux chez 4 mâles sur 24 et 4 femelles sur 24 (p = 0,004 et 0,003, respectivement) ainsi que des carcinomes transitionnels dans les uretères de 8 mâles sur 24 et de 6 femelles sur 24 (p < 0,001), dans le bassinet du rein chez 4 mâles sur 24 (p = 0,003) et dans la vessie de 5 femelles sur 24 (p = 0,001). Une femelle exposée à une dose moyenne a développé un papillome de la vessie. Aucune tumeur n'a été constatée dans les groupes témoins. DMEO non néoplasique par voie orale = 10 mg/kg p.c. par jour sous forme de Na3NTA (200 ppm), mesurée d'après l'augmentation marginale de l'incidence de l'hyperplasie des cellules transitionnelles observée dans le bassinet du rein, les uretères et la vessie des animaux des deux sexes. DMENO non néoplasique par voie orale = 100 mg/kg p.c. par jour sous forme de Na3NTA (2000 ppm), mesurée d'après l'augmentation marginale de l'incidence de l'hyperplasie des cellules transitionnelles observée dans le bassinet du rein, les uretères et la vessie des mâles et des femelles. Le gain de poids corporel et le taux de survie ont diminué chez les mâles exposés à une dose élevée alors que l'hydronéphrose ne s'est avérée évidente que chez les individus des deux sexes exposés à une dose élevée (NCI, 1977). Des rats Charles River CD (50 de chaque sexe par groupe) ont été exposés dans leur alimentation à des doses de 0 %, 0,03 %, 0,15 % ou 0,5 % de Na3NTA (soit l'équivalent de 0, 19, 97 ou 322 mg/kg p.c. par jour) pendant 24 mois. Des taux d'incidence similaires pour divers types de tumeurs ont été relevés dans tous les groupes (y compris le groupe témoins) et il a été estimé que ces tumeurs n'étaient pas liées au traitement. DMENO non néoplasique par voie orale = 97 mg/kg p.c. par jour (0,15 % de Na3NTA) calculée d'après une augmentation de l'incidence et de la gravité des néphrites et des néphroses observées à 0,15 % et 0,5 % de Na3NTA au cours de l'étude. Après 6 mois, on a pu observer chez les animaux exposés à 0,15 % de Na3NTA une néphrose bénigne consistant en une dégénérescence hydropique des cellules du tubule et en une dilatation mineure de ce dernier. Il a également pu être observé, à plusieurs occasions au cours de l'étude, une augmentation de la concentration de zinc dans l'urine à toutes les doses sauf à la plus faible (Nixon et al., 1972). Études sur les rats exposés dans leur eau d'abreuvement : Des groupes de 196 rats Sprague-Dawley mâles ont été exposés à 0 % ou 0,1 % de Na3NTA (soit l'équivalent de 0 ou 100 mg/kg p.c. par jour) dans leur eau d'abreuvement pendant 2 ans. Une augmentation importante des adénomes et des adénocarcinomes rénaux (5/186 dans les groupes témoins et 29/183 dans les groupes exposés, respectivement; p < 0,01) a pu être constatée chez les animaux exposés. L'incidence générale des néphrites et des hyperplasies des cellules des tubules rénaux était semblable dans les groupes témoins et les groupes exposés (atteignant 85 % des animaux). Toutefois, on a constaté que l'incidence d'hyperplasies graves des tubules rénaux était plus importante dans le groupe d'animaux exposés (44/186 dans les groupes témoins contre 67/183 dans les groupes exposés). DMENO non néoplasique par voie orale = 100 mg/kg p.c. par jour (0,1 % de Na3NTA), calculée d'après l'augmentation de l'incidence des hyperplasies graves des tubules rénaux chez les mâles exposés par rapport aux rats des groupes témoins (Goyer et al., 1981). Aucune étude concernant l'exposition chronique par inhalation n'a été recensée pour le NTA. Aucune étude concernant l'exposition cutanée chronique ou l'exposition chronique par inhalation n'a été recensée pour le Na3NTA. |
|
| Génotoxicté et paramètres connexes : in vivo | Mutation et recombinaison géniques NTA Résultat négatif pour les mutations létales récessives liées au sexe dans les cellules germinales chez le Drosophila melanogaster exposé par voie orale pendant 3 jours ou par injection unique (Kramers, 1976; Woodruff et al., 1985; Mason et al., 1992). Résultat négatif pour le test de létalité dominante chez la souris Swiss, exposée par voie orale (1 g/kg p.c. par jour pendant 5 jours) ou par injection intrapéritonéale unique de 125 mg/kg p.c. (Epstein et al., 1972). Na3NTA Résultat négatif pour les mutations létales récessives liées au sexe dans les cellules germinales chez le Drosophila melanogaster (exposé à 50 mmol/L par voie orale pendant 3 jours) (Costa et al., 1988b). Résultat positif au test SMART (« somatic mutation and recombination test ») chez le Drosophila melanogaster exposé par voie orale à 50 mmol/L pendant 24 à 42 h (Zordan et al., 1990, 1991). |
Dommages à l'ADN NTARésultat positif pour la fragmentation de l'ADN dans les cellules du rein et de la vessie chez des rats Sprague-Dawley mâles exposés par voie orale à des doses de 1 000 ou de 2 000 mg/kg p.c. (Nesslany et al., 2008). Résultat positif pour la fragmentation de l'ADN et la formation de micronoyaux dans les cellules du rein (dose de 490 mg/kg p.c. par voie orale, par jour et pendant 3 jours) et de la vessie (dose unique de 490 ou 735 mg/kg p.c. par voie orale) chez des rats Sprague-Dawley mâles (Robbiano et al., 1999, 2002). Na3NTA Résultat négatif pour la formation de micronoyaux dans les cellules de la moelle osseuse après une injection intrapéritonéale unique de 200 à 400 mg/kg p.c. chez la souris Swiss (Montaldi et al., 1988) et dans les cellules de la moelle osseuse après une exposition par voie orale de 500 à 2 000 mg/kg p.c. par jour chez des souris NMRI mâles (BASF, 2004). |
|
Dommages chromosomiques : induction d'aneuploïdie NTARésultat positif dans les cellules germinales des souris mâles (de souche C57BL/Cne × C3H/Cne F1) après une exposition par injection intrapéritonéale unique de 275 mg/kg p.c. (Costa et al., 1988a). Résultat positif dans les cellules germinales du Drosophila melanogaster exposé à 4 000 ppm par voie orale (Ramel et Magnusson, 1979). Na3NTA Résultat positif dans les cellules germinales du Drosophila melanogaster exposé à 50 mmol/L par voie orale pendant 3 jours (Costa et al., 1988a). Résultat positif concernant l'augmentation de la fréquence de l'hyperhaploïdie des spermatocytes chez les souris Charles River après l'exposition à une injection intrapéritonéale unique de 275 mg/kg p.c. (Zordan et al., 1990). Résultat négatif dans les cellules de la moelle osseuse des souris mâles (de l'espèce C57BL/Cne × C3H/Cne F1) après une exposition par injection intrapéritonéale unique de 275 mg/kg p.c. (Russo et al., 1989). Résultat négatif concernant les spermatocytes de souris NMRI exposés à des doses de 100, 330 ou 1 000 mg/kg p.c. par voie orale (RCC-CCR, 2000). |
|
Échange de chromatides sœurs NTA Aucune étude concernant l'échange de chromatides sœurs n'a été recensée pour le NTA. Na3NTA Résultat négatif dans les cellules de la moelle osseuse des souris mâles (de l'espèce C57BL/Cne × C3H/Cne F1) après une exposition par injection intrapéritonéale unique de 275 mg/kg p.c. (Russo et al., 1989). |
|
Produits de réaction de l'ADN NTA Aucune étude concernant les produits de réaction de l'ADN n'a été recensée pour le NTA. Na3NTA Résultat négatif concernant l'absence d'augmentation du niveau de 8–hydroxy-2'-deoxyguanosine chez des rats Wistar mâles exposés à 0, 150 ou 20 000 ppm dans leur alimentation pendant 1 ou 4 semaines (Bahnemann et al., 1998; Leibold et al., 2002). |
|
| Génotoxicté et paramètres connexes : in vitro | Mutation et recombinaison géniques NTARésultat négatifchez S. typhimurium, des souches TA97, TA98, TA100, TA102, TA104, TA1535, TA1537 et TA1538 et chez Escherichia coli WP2 uvrA, sans activation métabolique (Zeiger et al., 1992; Nesslany et al., 2008). Résultat positif concernant la mutation au locus TK des cellules de lymphomes de souris (L5178Y) sans activation métabolique (Nesslany et al., 2008). Na3NTA Résultat négatifchez Salmonella typhimurium, des souches TA97, TA98, TA100, TA102, TA104, TA1535, TA1537 et TA1538 avec ou sans activation métabolique (Dunkel et al., 1985; Lopreno et al., 1985; Zeiger et al., 1992). Résultat négatif pour l'essai de mutation directe chez des souches d'Aspergillus nidulans (diploïde P1 et haploïde 35) et chez Schizosaccharomyces pombe P1, avec ou sans activation métabolique (Loprieno et al., 1985; Crebelli et al. 1986). Résultat négatif concernant l'essai de mutation au locus TK dans les cellules de lymphomes de souris (L5178Y) avec et sans activation (Mitchell et al., 1988; Myhr et Caspary, 1988) Résultat négatif concernant l'essai de mutation au locus HGPRT sur des cellules hétéroploïdes de hamsters chinois (test HPRT), sans activation métabolique (Celotti et al., 1987). |
Altération et réparation de l'ADN NTARésultat positif pour la fragmentation de l'ADN dans les cellules du rein et de l'épithélium de la vessie chez l'homme et le rat, sans activation métabolique; rupture de brins d'ADN et formation de micronoyaux dans les cellules rénales de l'homme et du rat, sans activation métabolique (Robbiano et al., 1999, 2002). Résultat positif concernant l'induction de micronoyaux dans les cellules de lymphomes de souris (L5178Y, CTLL-2 et CTLL-2 bcl2) ainsi que dans les cellules rénales de rats Sprague-Dawley, sans activation métabolique (Nesslany et al., 2008). Résultat négatif concernant l'essai de la fonction SOS chez Escherichia coli (souche PQ37), sans activation métabolique (Venier et al., 1989). Na3NTA Résultat négatif concernant le test du micronoyau chez les humains, sans activation métabolique (Montaldi et al., 1987). Résultat négatif concernant l'essai de la synthèse de l'ADN non programmée dans les principaux hépatocytes du rat, sans activation métabolique (Williams et al., 1982, 1989). Résultat non probant concernant l'essai de la synthèse de l'ADN non programmée dans des lymphocytes humains, sans activation métabolique (Celotti et al., 1988). |
|
Transformation cellulaire NTAAucune étude concernant la transformation cellulaire n'a été recensée pour le NTA. Na3NTA Résultat négatif concernant les fibroblastes BHK 21/C31 chez le hamster de Syrie, sans activation métabolique (Lanfranchi et al., 1988). Résultat négatif concernant les cellules C3H/10T1/2 chez la souris, sans activation métabolique (Dunkel et al., 1988). |
|
Aberrations chromosomiques NTARésultat négatif concernant les cellules ovariennes de hamster chinois, avec et sans activation métabolique (Loveday et al., 1989). Résultat positif pour les lymphocytes humains, sans activation métabolique (Nesslany et al., 2008). Na3NTA Résultat négatif pour les lymphocytes humains, sans activation métabolique (Montaldi et al., 1987, 1988). Résultat faiblement positif concernant les cellules Cl-1 chez le hamster chinois (test d'anomalie chromosomique et du micronoyau), avec activation métabolique (Modesti et al., 1995). Résultat non probant concernant les cellules PT K1 chez le rat kangourou, sans activation métabolique (Kihlman et Sturelid, 1970). |
|
Échange de chromatides soeurs NTARésultat négatif concernant les cellules ovariennes de hamster chinois, avec et sans activation métabolique (Loveday et al., 1989). Résultat négatif pour les lymphocytes humains, sans activation métabolique (Brat et Williams, 1984). Na3NTA Résultat négatif concernant les cellules ovariennes de hamster chinois et les cellules de lymphomes de souris (L5178Y), sans activation métabolique (Montaldi et al., 1985). Résultat négatif pour les cellules ovariennes de hamster chinois, sans activation métabolique (Brat et Williams, 1984). |
|
| Toxicité pour la reproduction | NTA Aucune étude concernant la toxicité pour la reproduction n'a été recensée pour le NTA. |
Na3NTA Un régime alimentaire contenant 0 %, 0,1 % ou 0,5 % de Na3NTA (soit l'équivalent de 0, 90 et 450 mg/kg p.c. par jour) a été administré de façon continue à des rats Charles River CD (20 de chaque sexe par groupe) pendant deux générations ou à des groupes de 20 rats femelles uniquement pendant chaque période d'organogenèse (les jours 6 à 15 de la gestation). DSENO concernant la toxicité pour la reproduction = 450 mg/kg p.c. par jour (0,5 % de Na3NTA) mesurée d'après l'absence de différence significative dans le taux de conception, les taux de fertilité et de lactation, l'indice de lactation, le nombre moyen de ratons nés vivants par portée, le nombre de ratons vivants et le nombre moyen de ratons sevrés par portée réformée. DMENO pour la toxicité générale = 450 mg/kg p.c. par jour (0,5 % de Na3NTA) d'après la toxicité faible (non précisée) (Nole et al., 1971). |
|
| Toxicité pour le développement | NTA Aucune étude concernant la toxicité pour le développement n'a été recensée pour le NTA. Na3NTA Au cours de l'étude sur deux générations susmentionnée, des groupes de 20 rates Charles River CD gravides ont été exposés à un régime alimentaire contenant 0 %, 0,1 % ou 0,5 % de Na3NTA (soit l'équivalent de 0, 90 et 450 mg/kg p.c. par jour) aux jours 6 à 15 de la gestation. Dix mères de chaque groupe ont été sacrifiées aux jours 13 et 21 de la gestation. DSENO concernant la toxicité pour le développement = 450 mg/kg p.c. par jour (0,5 % de Na3NTA) d'après l'absence de signes patents de fœtotoxicité ou d'embryotoxicité ni de tératogénicité. Après leur insémination artificielle, des groupes de 20 lapines néo-zélandaises ont été exposés par gavage dans l'eau distillée à des doses quotidiennes de Na3NTA de 0, 2,5, 25, 100 ou 250 mg/kg p.c. par jour aux jours 7 à 16 de la gestation. Les animaux ont été sacrifiés au jour 28 de la gestation. DSENO concernant la toxicité pour le développement et la toxicité maternelle = 250 mg/kg p.c. par jour d'après l'absence d'effets liés au traitement (Nole et al., 1971). Aucun effet tératogène n'a été observé au cours d'une étude sur des souris NMRI albinos gravides (10 individus par groupe) exposées à des doses de 0 % ou 0,2 % de Na3NTA (soit l'équivalent de 0 ou 570 mg/kg p.c. par jour) dans leur eau d'abreuvement aux jours 6 à 18 de la gestation. DSENO concernant la toxicité pour le développement et la toxicité maternelle = 570 mg/kg p.c. par jour (0,2 % de Na3NTA), d'après l'absence de différence significative dans le poids pris par les mères et d'effets tératogènes observés chez les animaux traités (Tjälve, 1972). REMARQUE : Le Na3NTA administré de concert avec du cadmium dichloride ou de l'hydroxyde de méthylmercure dans de l'eau d'abreuvement à des rates River CD gravides n'a pas augmenté l'incidence de malformations induites par le cadmium ou le mercure (Nolen et al., 1972a, b). |
| Sensibilisation | NTA Aucune étude concernant la sensibilisation n'a été recensée pour le NTA. Na3NTA Sensibilisation cutanée (test épicutané recouvert de Buehler) : Des cochons d'Inde (10 ou 20 individus par groupe) ont été exposés à une solution de 0 % ou 50 % de Na3NTA dans l'eau. Les traitements ont eu lieu aux jours 0, 7 et 14. Aucune irritation cutanée n'a été constatée. Après le test de provocation, aucun des animaux traités ou témoins n'a montré de réaction cutanée (BASF, 1997b). |
| Irritation | NTA Aucune étude concernant l'irritation n'a été recensée pour le NTA. Na3NTA Irritation des yeux (test de Draize) : Un œil de chaque animal de groupes de 3 lapins albinos a été exposé à des doses de 0 ou 100 mg de poudre sèche de Na3NTA pendant 24 heures. Une irritation modérée des yeux a été décelée (Monsanto, 1968). Irritation des yeux : Des groupes de 3 lapins albinos ont été exposés à une solution de 0 ou 38 % de Na3NTA (appliquée dans le sac conjonctival d'un œil de chaque animal). Une irritation modérée des yeux a été signalée (EURAR, 2008). Irritation des voies respiratoires : Des groupes de souris (nombre, sexe et espèce inconnus) ont été exposés à du Na3NTA en aérosol pendant une durée de 5 minutes dans un appareil d'essai spécialement conçu. Les souris exposées ont montré des signes d'irritation; le Na3NTA a été classé comme « légèrement irritant » à 0,22 mg/L, comme moyennement irritant » entre 1,09 et 1,41 mg/L et comme gravement irritant » à 7,6 mg/L (USEPA, 1980). |
| Humains | |
| Sensibilisation | Des tests épicutanés fermés ont été menés chez 66 volontaires humains (sexe inconnu) en utilisant une solution aqueuse à 1 % d'un détergent liquide contenant 20 % de Na3NTA (environ 0,5 mL de la matière d'essai a été appliqué sur la partie supérieure du bras des sujets de l'essai pour une série de 9 applications au totales [24 h par application, 3 fois par semaine pendant 3 semaines], suivie d'un test de provocation deux semaines plus tard). Aucun signe de sensibilisation n'a été rapporté chez ces volontaires (Nixon, 1971). |