Évaluation préalable groupe des trimellitates
Titre officiel : Évaluation préalable groupe des trimellitates
Nos de registre du Chemical Abstract Service
3319-31-1, 70225-05-7, 94109-09-8
Environnement et Changement climatique Canada
Santé Canada
Février 2019
No de cat. : En14-355/2019F-PDF
ISBN 978-0-660-29236-6
Résumé
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE), la ministre de l’Environnement et la ministre de la Santé ont réalisé l’évaluation préalable de trois des cinq substances collectivement appelées le « groupe des trimellitates » dans le cadre du Plan de gestion des substances chimiques. Ces trois substances ont été évaluées en priorité, car elles répondent aux critères de catégorisation du paragraphe 73(1) de la LCPE. Deux autres substances ont été subséquemment jugées peu préoccupantes par d’autres approches, et les décisions proposées concernant ces substances sont présentées dans un rapport distinctNote de bas de page 1 . En conséquence, la présente évaluation préalable porte sur les trois substances énumérées dans le tableau ci-dessous. Les trois substances visées dans la présente évaluation préalable seront ci-après appelées les substances du groupe des trimellitates.
| No CASa | Nom sur la Liste intérieure (LI) | Nom commun (abréviation) |
|---|---|---|
| 3319-31-1 | Benzène-1,2,4-tricarboxylate de tris(2-éthylhexyle) | Trimellitate de tris(2-éthylhexyle) (TEHT) |
| 70225-05-7 | Mélange d’esters tridécyliques et isodécyliques ramifiés de l’acide benzène-1,2,4-tricarboxylique | Trimellitate de tridécyle et d’isodécyle ramifiés (BTIT) |
| 94109-09-8 | Benzène-1,2,4-tricarboxylate de tri(tridécyle) | Trimellitate de tristridécyle (TTDT) |
a Le no CAS est la propriété de l’American Chemical Society. Toute utilisation ou redistribution, sauf si elle sert à répondre aux besoins législatifs ou si elle est nécessaire aux rapports au gouvernement fédéral lorsque des renseignements ou des rapports au gouvernement fédéral lorsque des renseignements ou des rapports sont exigés par la loi ou une politique administrative, est interdite sans l’autorisation écrite préalable de l’American Chemical Society.
Les trimellitates ne sont pas présents de façon naturelle dans l’environnement. Selon les renseignements fournis en réponse au sondage réalisé en vertu de l’article 71 de la LCPE, plus de 10 millions kg de TEHT ont été fabriqués au Canada, et entre 1 000 000 et 10 000 000 kg ont été importés au Canada en 2011. Au cours de la même année, aucune activité de fabrication ou d’importation au Canada n’a été déclarée pour le BTIT en quantité supérieure au seuil de 100 kg. Le TTDT aurait été importé au Canada en 2009 en quantités comprises entre 1 000 et 10 000 kg, mais cette substance n’a pas été fabriquée en quantité supérieure au seuil de déclaration.
Le TEHT serait utilisé comme plastifiant dans les revêtements de sol, les matériaux de construction, les matériaux en plastique et en caoutchouc, et les dispositifs médicaux. Il est également utilisé comme additif pour carburant, dans les adhésifs et les produits d’étanchéité utilisés dans le secteur du transport comme lubrifiant et additif de lubrifiant, et dans les cosmétiques.
Le BTIT est employé dans les cosmétiques au Canada. Le TTDT est utilisé surtout dans les cosmétiques, mais il sert également d’ingrédient non médicinal dans les médicaments, y compris les produits de santé naturels. Outre les utilisations énumérées ci-dessus, le TEHT et le BTIT sont reconnus comme des ingrédients de certains additifs indirects utilisés dans les établissements de transformation des aliments au Canada.
Les risques des substances du groupe des trimellitates pour l’environnement ont été caractérisés au moyen de l’approche de la classification du risque écologique (CRE) des substances organiques qui est une approche basée sur les risques qui tient compte de plusieurs paramètres liés au risque et à l’exposition et d’une pondération des éléments de preuve pour classer le risque. Les profils de danger ont été principalement établis à l’aide de paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Parmi les paramètres pris en compte pour les profils d’exposition, citons le taux d’émission potentiel, la persistance globale et le potentiel de transport à grande distance. Une matrice de risque est utilisée pour que soit assigné aux substances un risque de préoccupation faible, moyen ou élevé, selon leur profil de danger et d’exposition. D’après les résultats de l’analyse de la CRE, il est peu probable que les trois substances du groupe des trimellitates causent des effets nocifs pour l’environnement.
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le TEHT, le BTIT et le TTDT présentent un risque faible de causer des effets nocifs pour l’environnement. Il a été conclu que le TEHT, le BTIT et le TTDT ne satisfont à aucun des critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l’environnement essentiel pour la vie.
Le TEHT a fait l’objet d’évaluations par l’Organisation de coopération et de développement économiques (OCDE) et par le groupe d’experts chargé de l’analyse des ingrédients cosmétiques (Cosmetic Ingredient Review Expert Panel). Ces évaluations ont servi à étayer la caractérisation des effets sur la santé de la présente évaluation préalable. Le TEHT n’est pas génotoxique, et il n’est pas attendu qu’il soit cancérogène. Les renseignements disponibles sur les effets du TEHT sur la santé indiquent qu’il peut avoir des effets sur le système reproducteur mâle.
Une approche de lecture croisée fondée sur les similitudes structurales, fonctionnelles ou physico-chimiques avec d’autres substances a été employée en l’absence de données propres aux substances, afin d’étayer l’évaluation des effets du BTIT et du TTDT sur la santé humaine. Le TEHT et deux autres trimellitates ont été choisis comme substances analogues pour cette analyse par lecture croisée. Par mesure de prudence, les doses critiques du TEHT (effets possibles sur le système reproducteur masculin), qui a une chaîne alkyle plus courte, sont utilisées pour la caractérisation des risques liés au BTIT et au TTDT, des alkyles à chaînes plus longues.
La population générale canadienne peut être exposée à un ou plusieurs des trimellitates présents dans la poussière et les produits de consommation utilisés, dont les cosmétiques. La comparaison de l’estimation de l’ampleur de l’exposition aux trimellitates et des doses critiques permet d’établir des marges d’exposition qui sont jugées adéquates pour tenir compte des incertitudes dans les bases de données sur l’exposition et les effets sur la santé.
À la lumière des renseignements contenus dans la présente évaluation préalable, il est proposé de conclure que le TEHT, le BTIT et le TTDT ne satisfont pas au critère énoncé à l’alinéa 64c) de la LCPE, car ces substances ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il a été conclu que le TEHT, le BTIT et le TTDT ne satisfont à aucun des critères énoncés à l’article 64 de la LCPE.
1. Introduction
En vertu de l’article 74 de la Loi canadienne sur la protection de l’environnement (1999) (LCPE 1999), la ministre de l’Environnement et du Changement climatique et la ministre de la Santé ont réalisé une évaluation préalable portant sur trois des cinq substances collectivement appelées « groupe des trimellitates » dans le cadre du Plan de gestion des substances chimiques, pour déterminer si elles présentent ou pourraient présenter un risque pour l’environnement ou la santé humaine. Ces trois substances ont été évaluées en priorité, car elles répondent aux critères de catégorisation du paragraphe 73(1) de la LCPE (ECCC, SC [modifié en 2007]). Les trois trimellitates faisant partie de ce groupe appartiennent à la catégorie des triesters de l’acide trimellitique, qui partagent la même structure de base que l’acide benzène-1,2,4‑tricarboxylique, mais ont une longueur de chaîne latérale ou une structure ramifiée différente.
Les deux autres substances (nos CASNote de bas de page 2 53894-23-8, benzène-1,2,4-tricarboxylate de triisononyle et 68515-60-6, acide benzène-1,2,4-tricarboxylique, esters de trialkyles en C7-9, ramifiés et linéaires) ont été examinées par les approches décrites dans les documents Classification des risques écologiques des substances organiques et Approche fondée sur le seuil de préoccupation toxicologique (TTC) pour certaines substances (ECCC 2016a; Santé Canada 2016a), et ont été jugées peu préoccupantes pour ce qui est de la santé humaine et de l’environnement. C’est la raison pour laquelle elles ne seront pas traitées dans le présent rapport. Les conclusions tirées pour ces deux substances sont données dans l’évaluation préalable « Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances » (ECCC, SC, 2017). Les trois substances traitées dans la présente évaluation préalable seront désignées dans les pages qui suivent par l’appellation « groupe des trimellitates ».
Les risques pour l’environnement associés aux trois substances du groupe des trimellitates ont été caractérisés au moyen de l’approche de la CRE. La CRE décrit le danger posé par une substance en utilisant des paramètres clés que sont le mode d’action, la réactivité chimique, les seuils de toxicité interne dérivés du réseau alimentaire, la biodisponibilité et l’activité chimique et biologique. La CRE tient compte de l’exposition possible des organismes dans des environnements terrestres ou aquatiques, sur la base de facteurs comme le taux d’émission potentiel, la persistance globale et le potentiel de transport atmosphérique à grande distance. Les divers éléments de preuve sont groupés pour repérer les substances qui nécessitent une évaluation approfondie en raison de leurs risques pour l’environnement ou celles dont la probabilité de nuire à l’environnement est faible.
Le benzène-1,2,4-tricarboxylate de tris(2-éthylhexyle) (no CAS 3319-31-1, TEHT), qui est l’une des substances du groupe des trimellitates en cours d’évaluation, a été examiné par d’autres pays dans le cadre du Programme d’évaluation coopérative des produits chimiques de l’Organisation de coopération et de développement économiques (OCDE), et un rapport d’évaluation initiale (SIAR) de l’Ensemble de données de dépistage (EDD) de l’OCDE est disponible. Ces évaluations sont soumises à un examen rigoureux (y compris par des pairs) et à des processus d’approbation par des autorités gouvernementales internationales. Santé Canada et Environnement et Changement climatique Canada participent activement à ces processus d’évaluation et considèrent que les résultats sont fiables. Nous avons utilisé le SIAR de l’OCDE concernant le TEHT pour étayer la caractérisation des effets sur la santé lors de la présente évaluation préalable.
Pour la présente évaluation préalable, nous avons pris en compte des renseignements sur les propriétés chimiques, le devenir dans l’environnement, les dangers, les utilisations et l’exposition, y compris des renseignements soumis par des parties intéressées. Nous avons colligé les données pertinentes jusqu’en juin 2017. Des recherches ciblées dans la littérature ont été réalisées jusqu’en mai 2017. Nous avons aussi utilisé des données empiriques tirées d’études clés, ainsi que certains résultats obtenus avec des modèles et des résultats de surveillance et d’approches de lecture croisée pour tirer nos conclusions.
Le personnel du Programme d’évaluation des risques de la LCPE de Santé Canada et d’Environnement et Changement climatique Canada a rédigé la présente évaluation préalable qui inclut la contribution d’autres programmes de ces ministères. Les parties de la présente évaluation préalable portant sur la santé humaine et l’écologie ont fait l’objet d’examens ou de consultations externes. Des commentaires sur les parties techniques pertinentes pour la santé humaine ont été reçus de TetraTech Inc. Le volet écologique de la présente évaluation est basé sur le document de la CRE (publié le 30 juillet 2016), qui a été fait l’objet d’un examen par les pairs et d’une période de consultation publique de 60 jours. En outre, l’ébauche de la présente évaluation préalable (publiée le 1er décembre 2017) a elle aussi fait l’objet d’une consultation publique de 60 jours. Bien que les commentaires de l’extérieur aient été pris en compte, Santé Canada et Environnement et Changement climatique Canada assument l’entière responsabilité du contenu final et des conclusions de la présente évaluation préalable.
La présente évaluation préalable repose sur des renseignements essentiels servant à déterminer si les substances satisfont aux critères énoncés à l’article 64 de la LCPE. À cette fin, des renseignements scientifiques ont été examinés et une approche basée sur une pondération des éléments de preuve et le principe de précautionNote de bas de page 3 a été adoptée. L’évaluation préalable contient des renseignements critiques et décrit les éléments pris en compte pour formuler la conclusion.
2. Identité des substances
Les numéros CAS, les noms figurant dans la Liste intérieure (LI), les noms communs ou les abréviations des diverses substances qui composent le groupe des trimellitates sont présentés dans le tableau 2‑1. Il existe une certaine incertitude concernant l’utilisation des noms communs et des numéros CAS associés. Le TEHT (no CAS 3319-31-1) est souvent appelé trimellitate de trioctyle ou TOTM, qui est aussi le nom commun de la substance désignée par le no CAS 89-04-3. Le no CAS 89-04-3 représente un des analogues utilisés dans la présente évaluation. Le BTIT (no CAS 70225-05-7) est souvent appelé trimellitate de tridécyle, qui est également associé au TTDT (no CAS 94109-09-8). Dans la présente évaluation, les noms communs et les abréviations indiqués dans le tableau 2‑1 seront utilisés. Une liste d’autres noms chimiques (p. ex., noms commerciaux) est disponible auprès du National Chemical Inventories (NCI 2015).
| No CAS (abréviation) | Nom sur la LI (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 3319-31-1 (TEHT) | Benzène-1,2,4-tricarboxylate de tris(2-éthylhexyle) (trimellitate de tris[2-éthylhexyle]; trimellitate de triéthylhexyle) | 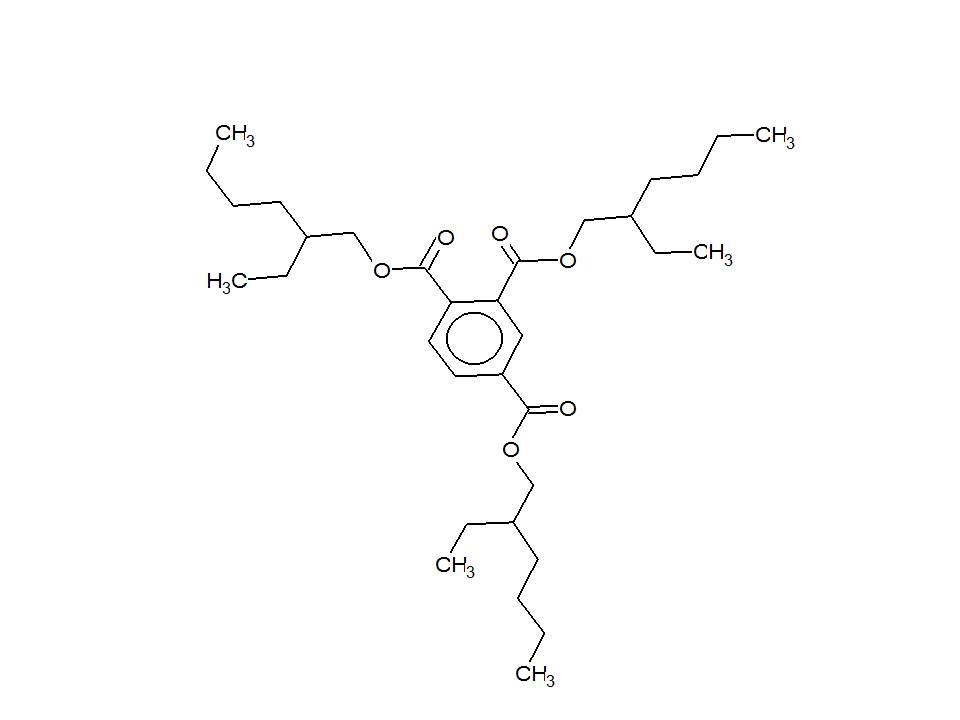 C33H54O6 C33H54O6 |
546,79 |
| 70225-05-7 (BTIT) | Mélange d’esters tridécyliques et isodécyliques ramifiés de l’acide benzène-1,2,4-tricarboxylique (trimellitate de tridécyle et d’isodécyle ramifiés; ester trimellitique triisodécylique et tridécylique) | 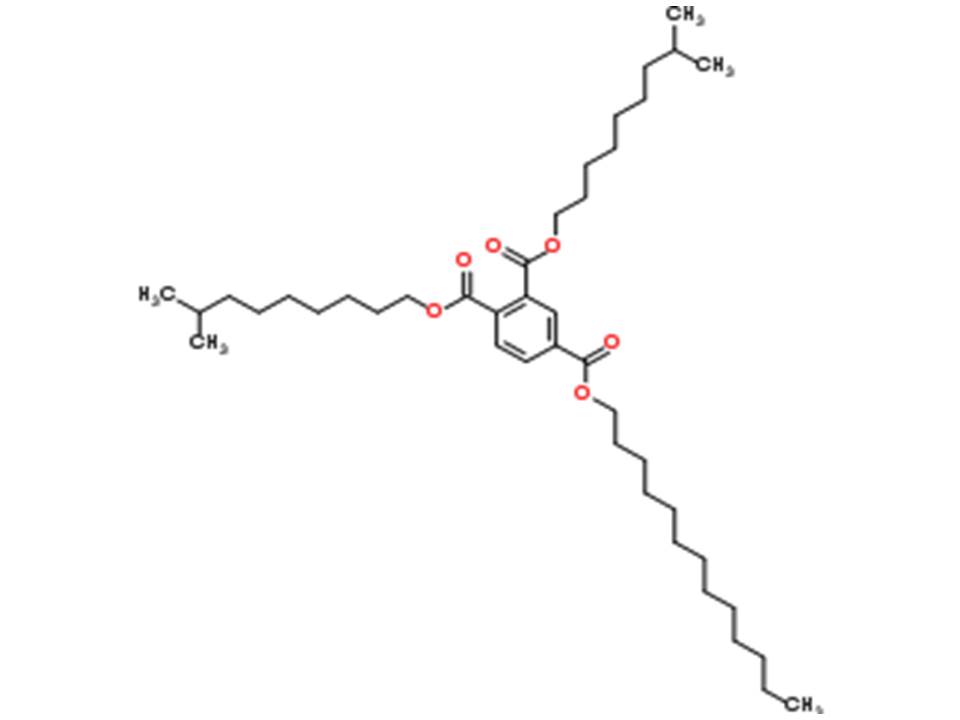 (UVCB, structure représentative) (UVCB, structure représentative) |
673,2 |
| 94109-09-8 (TTDT) | Benzène-1,2,4-tricarboxylate de tri(tridécyle) (trimellitate de tristridécyle) |  C48H84O6 C48H84O6 |
757,19 |
Abréviation : UVCB = Substances de composition inconnue ou variable, produits de réaction complexes ou matières biologiques.
2.1 Sélection d’analogues et utilisation de modèles (Q)SAR
Les trimellitates sont apparentés sur le plan de la structure et appartiennent à une catégorie de triesters de l’acide trimellitique, qui partagent la même structure de base que l’acide benzène-1,2,4-tricarboxylique, mais ils diffèrent par la longueur de la chaîne latérale ou la ramification de leur structure. De ces trois trimellitates, le TEHT a été évalué par deux organisations (OCDE 2002a; CIR 2015), et il existe suffisamment de données empiriques pour caractériser les dangers. Cependant, comme les données empiriques sur les dangers des deux autres produits chimiques sont limitées, leurs propriétés physico-chimiques ont été obtenues à partir de modèles (Q)SAR appropriés.
Une méthode de lecture croisée basée sur des analogues, le cas échéant, a été utilisée pour étayer les évaluations des effets du BTIT et du TTDT sur la santé humaine et l’environnement. Les analogues ont été sélectionnés en fonction de similarités structurales ou fonctionnelles et de la disponibilité de données sur les dangers. Le TEHT, un membre du groupe des trimellitates visé par la présente évaluation, a été choisi comme l’analogue principal dans l’évaluation des dangers des deux autres trimellitates (BTIT et TTDT) à l’aide d’une approche par lecture croisée par catégorie (SRC 2016). L’analogue principal (TEHT) possède des chaînes latérales ramifiées avec 8 atomes de carbone, tandis qu’une des substances chimiques cibles, le BTIT, présente des chaînes latérales ramifiées mixtes avec 10 ou 13 atomes de carbone, et l’autre, le TTDT, possède des chaînes latérales linéaires et plus longues, avec 13 atomes de carbone. En raison des différences de longueur et de linéarité de la chaîne latérale, deux autres analogues, le benzène-1,2,4-tricarboxylate de trioctyle (no CAS 89-04-3, TOTM) et le mélange de triesters décyliques et octyliques de l’acide benzène-1,2,4-tricarboxylique (no CAS 90218-76-1, MDOT), ont également été sélectionnés et sont inclus à l’approche par lecture croisée. La section 6.2 présente plus de détails au sujet de l’approche par lecture croisée. Le tableau 2-2 présente des renseignements sur l’identité et la structure chimique des deux autres analogues.
| No CAS (abréviation) | Nom sur la LI ou autre nom (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 89-04-3 (TOTM) | Benzène-1,2,4-tricarboxylate de trioctyle (trimellitate de trioctyle) |  C33H54O6 C33H54O6 |
546,87 |
| 90218-76-1 (MDOT) | mélange de triesters décyliques et octyliques de l’acide benzène-1,2,4-tricarboxylique | 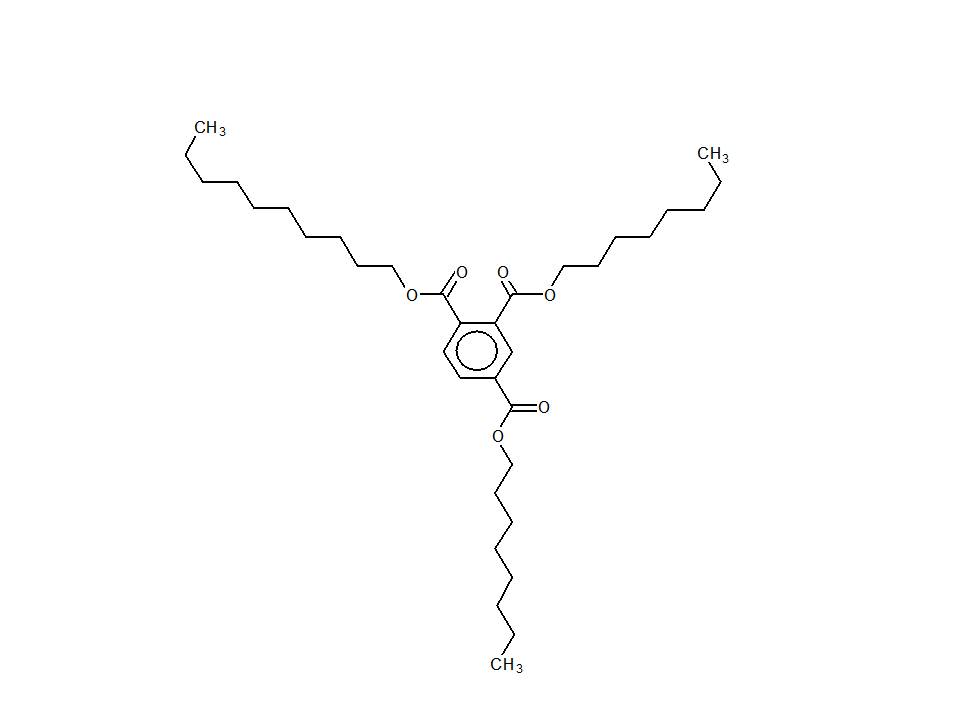 (UVCB, structure représentative) (UVCB, structure représentative) |
602,9 |
a Le TEHT est considéré comme l’analogue principal, et son identité figure dans le tableau 2‑1.
En ce qui concerne l’évaluation de l’exposition, comme les données étaient limitées sur l’absorption des trimellitates par voie cutanée et qu’aucune donnée n’existait pour les analogues du tableau 2-2, des données sur l’absorption par voie cutanée de certains phtalates (DEHP, DIDP) ont été utilisées.
| No CAS (abréviation) | Nom sur la LI ou autre nom (nom commun) | Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 117-81-7 (PDEH) | Phtalate de bis (2-éthylhexyle) | 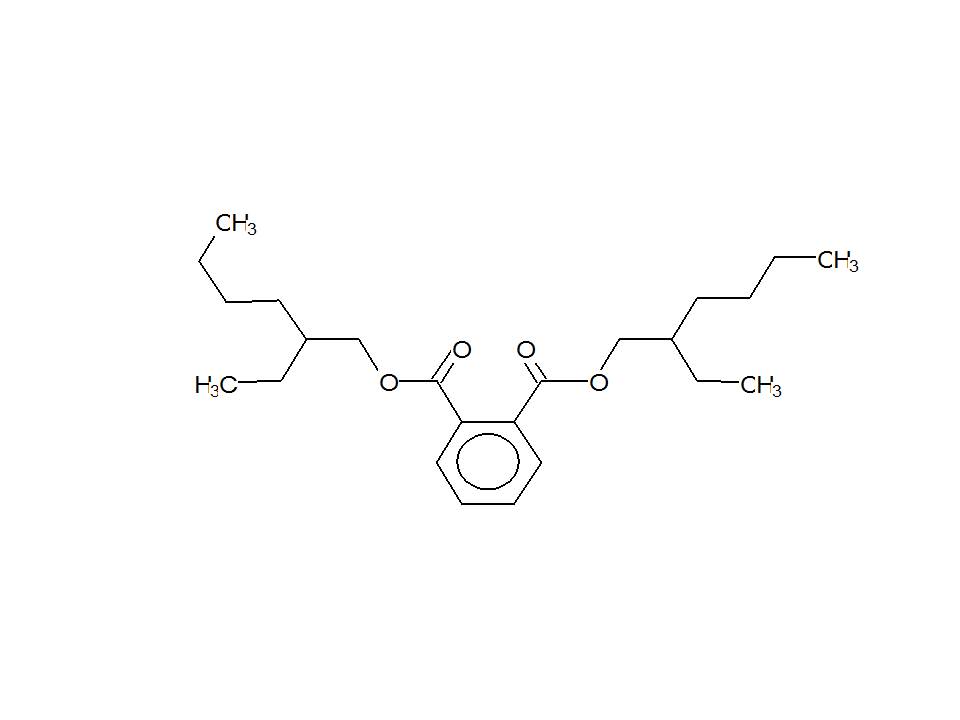 |
390,6 |
| 26761-40-0 (DIDP) | Phtalate de diisodécyle | 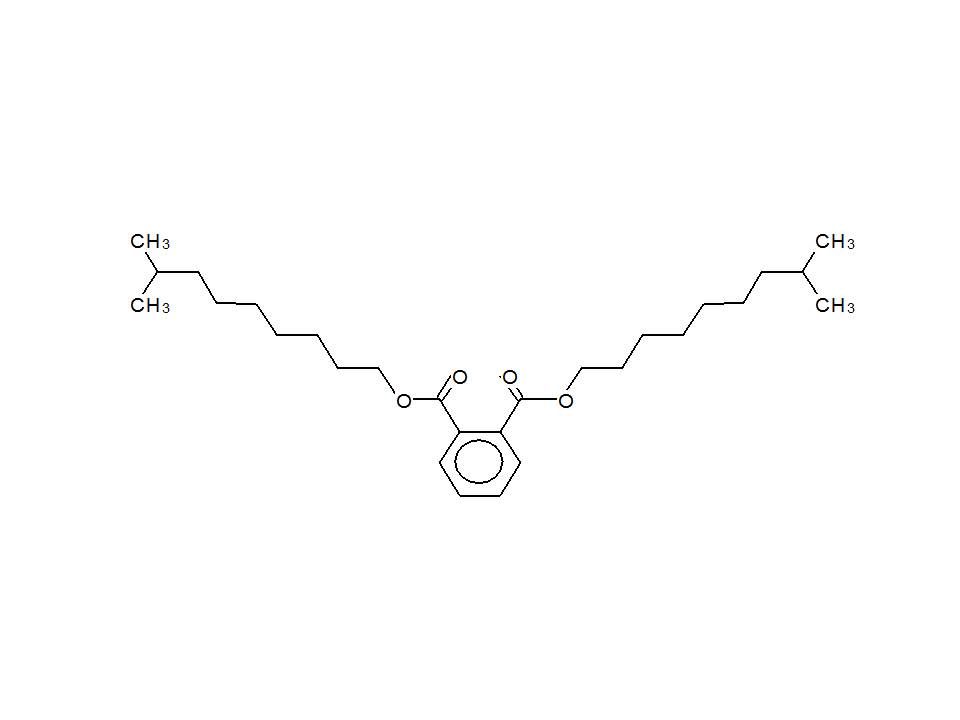 |
446,7 |
3. Propriétés physiques et chimiques
Nous donnons dans le tableau 3‑1 un résumé des propriétés physiques et chimiques des substances du groupe des trimellitates. Des données mesurées étaient disponibles seulement pour le TEHT. Par conséquent, nous avons fait appel à la modélisation à l’aide du logiciel EPI Suite (c2000-2012) pour estimer les propriétés physiques et chimiques de ces substances. Les trimellitates sont des gros composés hydrophobes qui peuvent former des émulsions ou des micelles dans l’eau, tout comme le DEHP et d’autres phtalates (Environnement Canada, Santé Canada 1994; Environnement Canada 2004/2005; Jonker 2016). Cette caractéristique complique la détermination expérimentale des coefficients de solubilité dans l’eau et de partage octanol-eau, et donne un large éventail de valeurs mesurées, ainsi qu’un écart important entre les valeurs mesurées et les paramètres estimés, comme l’indique le tableau 3‑1 (Letinski et al. 2002; Staples et al. 1997; Jonker 2016). La majeure partie des coefficients mesurés de solubilité dans l’eau et de partage octanol-eau pour le TEHT ont été établis à l’aide de la méthode par agitation en flacon, qui est maintenant jugée inadéquate pour les composés hydrophobes (Jonker 2016; Staples et al. 1997; Letinski et al. 2002). Par conséquent, les valeurs estimées des coefficients de solubilité dans l’eau et de partage octanol-eau ou les valeurs obtenues par la méthode à agitation lente seront utilisées pour déterminer le devenir de ces substances et l’exposition à celles-ci. ECCC (2016b) présente d’autres propriétés physiques et chimiques.
| Propriété | TEHT | BTIT | TTDT | Références clés |
|---|---|---|---|---|
| État physique | liquide | liquide | liquide | US EPA 2009, AGDH 2013 |
| Pression de vapeur (Pa) | 5,25 E-09 – 5,9 E-08 | 7,36E-13 | 1,08E-15 | PhysProp c2013, US EPA 2009, EPI Suite c2000-2012 |
| Constante de la loi d’Henry (Pa· m3/mol) | 0,045 – 0,056 | 7,08E-6 | 3,88E-5 | PhysProp c2013, OCDE 2002, US EPA 2009, EPI Suite c2000-2012 |
| Solubilité dans l’eau (mg/L) [valeur mesurée] | 0,003 [3,9 E-04 – 100]a | N.D. | N.D. | OCDE 2002, US EPA 2009, ECHA c2007-2017a, PhysProp c2013, |
| Solubilité dans l’eau (mg/L) (estimation) | 4,5E-8 | 9,73E-13 | 6,09E-16 | EPI Suite c2000-2012 |
| Log Koe (sans dimension) (mesurée) | 8 [4,35 – 5,94]a | N.D. | N.D. | ECHA c2007-2017a, OCDE 2002, US EPA 2009 |
| Log Koe (sans dimension) (estimation) | 8,81 – 12,25 | > 10 | > 10 | OCDE 2002, US EPA 2009, EPI Suite c2000-2012, Sakuratani et al. 2007 |
| Log Kco (sans dimension) (estimation) | 7,20 – 7,83 | 9,69 – 10,17 | 11,40 – 11,84 | EPI Suite c2000-2012 |
Les données mesurées sont indiquées en caractères gras. Abréviations : N.D., non disponible; Koe, coefficient de partage octanol–eau; Koc, coefficient de partage octanol-carbone (coefficient d’adsorption sur le sol).
a Valeurs mesurées par la méthode par agitation en flacon.
4. Sources et utilisations
Les trimellitates ne sont pas présents de façon naturelle dans l’environnement, mais ils sont produits commercialement.
Les substances présentes dans le groupe des trimellitates ont été incluses dans des enquêtes réalisées conformément à l’avis émis en vertu de l’article 71 de la LCPE (Canada 2009 et 2013). Le tableau 4‑1 présente un résumé des renseignements déclarés sur les quantités totales de trimellitates fabriquées ou importées.
| Abréviation | Production totale (kg) | Importations totales (kg) | Année de déclaration | Référence de l’enquête |
|---|---|---|---|---|
| TEHT | Plus de 10 M | 1 000 000 – 10 000 000 | 2011 | Environnement Canada, 2013 |
| BTIT | < 100 | < 100 | 2011 | Environnement Canada, 2013 |
| TTDT | < 100 | 1 000 – 10 000 | 2008 | Environnement Canada, 2009 |
a Les valeurs représentent les quantités déclarées dans le cadre des enquêtes réalisées en vertu de l’article 71 de la LCPE (Environnement Canada, 2009 et 2013). Voir les enquêtes pour des inclusions ou des exclusions spécifiques (annexes 2 et 3).
Le TEHT est fabriqué au Canada et est utilisé comme plastifiant dans les revêtements de sol, dans les matériaux de construction, dans les matières plastiques ou en caoutchouc et dans les dispositifs médicaux. Cette substance est aussi importée au Canada sous forme d’additif pour carburants et produits connexes, pour adhésifs et agents d’étanchéité utilisés dans le secteur du transport, comme lubrifiant et comme additif pour lubrifiants et graisses, et comme plastifiant (Environnement Canada, 2013). À l’échelle internationale, le TEHT est surtout fabriqué pour jouer le rôle de plastifiant dans les produits en polychlorure de vinyle (PVC), surtout pour les applications souples comme les fils et les câbles thermorésistants (OCDE, 2002). Il entre aussi dans la fabrication des pièces pour véhicules automobiles, des tuyaux et tubes thermorésistants, du ruban isolant et de dispositifs médicaux comme les sacs de sang, l’équipement d’infusion, les cathéters et les tubulures d’hémodialyse (OCDE, 2002; CIR, 2015). Le TEHT peut aussi être utilisé dans des articles en PVC comme des jouets ou des revêtements muraux ou de sol (Biedermann‑Brem et al., 2008; Bui et al., 2016).
Le BTIT n’est ni fabriqué ni importé au Canada en quantités supérieures au seuil de déclaration de 100 kg (Environnement Canada, 2013). En Europe, les quantités de BTIT fabriquées ou importées varient entre 100 et 1 000 tonnes par année, et, selon les informations disponibles, il serait utilisé dans les adhésifs et les agents d’étanchéité, dans les fluides caloporteurs, dans les fluides hydrauliques, dans les lubrifiants et les graisses, dans les produits à polir et les cires, ainsi que dans la fabrication d’autres produits chimiques (ECHA c2007‑2017c). Le BTIT est utilisé dans le traitement industriel des lubrifiants et des additifs de lubrifiants, des produits de soins corporels commerciaux ou de consommation et des lubrifiants et des graisses (US CDR, 2012).
Le TTDT est importé au Canada et est utilisé comme agent revitalisant pour la peau, comme solvant et comme ajusteur de viscosité dans le secteur des cosmétiques (Environnement Canada, 2009). D’après la base de données US Chemical Data Reporting (CDR, 2012) et les dossiers d’enregistrement de l’ECHA (ECHA c2007‑2017a), le TTDT ne semble pas être fabriqué ou importé ni aux États‑Unis ni en Europe.
Le tableau 4‑2 présente un résumé des autres utilisations faites de ces substances au Canada, où seuls le TEHT et le BTIT ont été reconnus comme additifs indirects utilisés dans les établissements de transformation des aliments, sans contact direct avec les aliments. Aucun des trimellitates de ce groupe, y compris le TEHT, n’est utilisé dans des applications d’emballage alimentaire (communication personnelle, courriel du 26 septembre 2016 de la Direction des aliments de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence). En 2016, la Food and Drug Administration (FDA) des États-Unis a approuvé l’utilisation du TEHT comme plastifiant dans les polymères de chlorure de vinyle en contact répété avec des aliments à une concentration maximale de 30 % par poids, sauf pour les préparations pour nourrissons et le lait maternel (US FDA, 2016).
Selon des déclarations soumises à Santé Canada en vertu du Règlement sur les cosmétiques, le TEHT, le BTITNote de bas de page 4 et le TTDT sont utilisés dans certains produits cosmétiques au Canada, comme les hydratants corporels, les rouges à lèvres et d’autres produits de soin des lèvres, des produits de maquillage pour les yeux et le visage, des produits nettoyants pour le visage et le corps, des produits pour les cheveux, l’huile de massage, le vernis à ongles et les crèmes pour manucure, et les produits de rasage (communication personnelle, courriel du 5 octobre 2016 de la Direction de la sécurité des produits de consommation de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence).
Le TTDT est un ingrédient non médicinal de produits de santé naturels ou sans ordonnance, comme les hydratants pour le visage, les rouges à lèvres, les produits de maquillage et les rouges à lèvres associés à un facteur de protection solaire (FPS), les produits de traitement de l’acné et les crèmes analgésiques (communication personnelle, courriel du 28 septembre 2016 de la Direction des produits thérapeutiques de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence).
| Utilisation | TEHT | BTIT | TTDT |
|---|---|---|---|
| Additif alimentaire a | N | N | N |
| Matériaux pour emballage alimentaire b | N | N | N |
| Additifs indirects b | O | O | N |
| Dans la base de données sur les produits pharmaceutiques, présents comme ingrédient médicinal ou non médicinal dans les désinfectants ou dans des médicaments destinés aux humains ou aux animaux au Canada c | N | N | O, comme ingrédient non médicinal de produits topiques |
| Base de données d’ingrédients de produits de santé naturels d | N | N | O, comme ingrédient non médicinal en application topique comme agent revitalisant pour la peau |
| Dans la base de données des produits de santé naturels homologués comme ingrédient médicinal ou non médicinal dans des produits de santé naturels au Canada e | N | N | O, comme ingrédient non médicinal de produits topiques |
| Dans la Liste critique des ingrédients des cosmétiques comme ingrédient interdit et d’usage restreint f | N | N | N |
| Présent dans les cosmétiques, basé sur des déclarations faites en vertu du Règlement sur les cosmétiques g | O | O | O |
| Produits de formulation dans des produits antiparasitaires homologués au Canada h | Ni | N | Ni |
Abréviations : O = oui; N = non.
a Communication personnelle, courriels de février et avril 2016 de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence.
b Communication personnelle, courriels de février et avril 2016 de la Direction des aliments de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence.
c BDPP (modifiée en 2016).
d BDIPSN (modifiée en 2018).
e BDPSNH (modifiée en 2018).
f Santé Canada (modifié en 2015).
g Communication personnelle, courriels de décembre 2015 et janvier 2016 de la Direction de la sécurité des produits de consommation de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence.
h Communication personnelle, courriels de 2016 de l’Agence de réglementation de la lutte antiparasitaire de Santé Canada adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence.
i Le TEHT et le TTDT peuvent être utilisés comme produits de formulation des produits antiparasitaires au Canada; toutefois, ils ne sont actuellement homologués dans aucun produit (communication personnelle, courriel du 23 septembre 2006 de l’Agence de réglementation de la lutte antiparasitaire adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence).
Le BTIT a déjà été utilisé aux États‑Unis dans deux nettoyants pour acier inoxydable. Toutefois, selon une enquête sur les produits réalisée en 2016 par l’American Cleaning Institute (ACI), aucun des 1 060 produits de nettoyage examinés ne contenait du BTIT (trimellitate de tridécyle). Pour déterminer la présence de cette substance sur le marché canadien dans cette catégorie de produits, des renseignements ont été demandés à l’Association canadienne de produits de consommation spécialisés (ACPCS). Après enquête auprès de ses membres, l’ACPCS a déclaré qu’aucun des trimellitates visés par la présente évaluation n’est présent dans les produits de nettoyage de ses membres au Canada (communication personnelle, courriels d’avril‑mai 2017 de l’ACPCS adressés au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence). Par conséquent, le grand public canadien ne devrait pas être exposé au TEHT, au BTIT ou au TTDT du fait de l’utilisation de produits de nettoyage ménagers.
5. Risques d’effets nocifs pour l’environnement
5.1 Caractérisation des risques pour l’environnement
Les risques posés à l’environnement par les substances du groupe des trimellitates ont été caractérisés au moyen de la Classification des risques écologiques des substances organiques (CRE) (ECCC 2016a). La CRE est une méthode basée sur les risques qui tient compte de plusieurs paramètres liés au danger et à l’exposition fondée sur la pondération de plusieurs éléments probants. Les divers éléments de preuve sont combinés afin de faire la différence entre des substances plus ou moins dangereuses et des potentiels d’exposition plus ou moins élevés dans divers milieux. Une telle approche permet de réduire l’incertitude globale associée à la caractérisation des risques par rapport à une approche reposant sur un seul paramètre dans un seul milieu (p. ex., la CL50). Nous résumons plus bas cette méthode, qui est décrite en détail dans ECCC (2016a).
Des données sur les propriétés physico‑chimiques, le devenir (les demi‑vies chimiques dans divers milieux et biotes, les coefficients de partage et la bioconcentration dans les poissons), l’écotoxicité aiguë pour les poissons et le volume d’importation et de production au Canada ont été colligées dans les publications scientifiques et dans des bases de données empiriques (p. ex., la boîte à outils [R] QSA de l’OCDE), dans les réponses à des enquêtes menées en vertu de l’article 71 de la LCPE ou ont été générées grâce à des modèles choisis de (R)QSA (relation quantitative structure‑activité), de devenir du bilan massique ou de bioaccumulation. Ces données ont été utilisées comme données d’entrée dans d’autres modèles de bilan massique ou pour compléter les profils de risque et d’exposition à ces substances.
Les profils de danger ont été établis en se basant principalement sur des paramètres liés au mode d’action toxique, à la réactivité chimique, à des seuils de toxicité interne dérivés du réseau trophique, à la biodisponibilité et à l’activité chimique et biologique. Les profils d’exposition ont aussi été calculés à partir de plusieurs paramètres, dont le taux de rejet potentiel, la persistance globale et le transport potentiel à grande distance. Les profils de danger et d’exposition ont été comparés à des critères de décision afin de classer le potentiel de risque et d’exposition de chaque substance organique comme faible, modéré ou élevé. D’autres règles ont été appliquées (p. ex., la cohérence de la classification et la marge d’exposition) pour raffiner les classifications préliminaires du risque et de l’exposition.
Une matrice de risque a été utilisée pour attribuer une classification faible, modérée ou élevée au risque posé par chaque substance, basée sur ses classifications du risque et de l’exposition. Les CRE du risque ont été vérifiées selon une méthode en deux étapes. La première étape permet d’ajuster les résultats de la classification du risque (risque modéré ou élevé à faible) pour les substances pour lesquelles le taux estimé de rejet dans l’eau après leur passage dans une usine de traitement des eaux usées est faible, ce qui constitue un faible potentiel d’exposition. La seconde étape consiste à examiner les résultats d’un classement de potentiel de risque faible à la lumière de scénarios de risque relativement prudents, à l’échelle locale (dans la zone avoisinant une source ponctuelle de rejet), conçus pour protéger l’environnement pour déterminer si la classification du risque potentiel devrait être révisée.
La CRE repose sur une approche pondérée visant à réduire au minimum la possibilité d’attribuer un classement trop faible ou trop élevé au danger et à l’exposition et au risque subséquent. Les approches équilibrées pour tenir compte des incertitudes sont décrites en détail dans le document d’ECCC (2016a). Dans ce qui suit, nous décrivons deux des principaux domaines d’incertitude. L’erreur sur les valeurs de toxicité aiguë empiriques ou modélisées pourrait conduire à des changements de classification du risque, en particulier dans le cas des paramètres liés à des valeurs de résidus dans les tissus (c.‑à‑d. le mode d’action toxique), dont un grand nombre sont des valeurs prédites à partir de modèles de (R)QSA. Toutefois, la fréquence d’une telle erreur est atténuée par le fait qu’une surestimation de la létalité médiane conduira à une valeur prudente (protectrice) des résidus dans les tissus, utilisée pour l’analyse critique des résidus corporels. L’erreur due à une sous‑estimation de la toxicité aiguë sera atténuée par l’utilisation d’autres paramètres de risque comme le profil structurel du mode d’action, la réactivité ou l’affinité de liaison à l’estrogène. Comme les classifications de l’exposition et du risque sont très sensibles au taux de rejet et à la quantité utilisée, les modifications ou les erreurs de quantité de composés chimiques pourraient se traduire par des classifications différentes de l’exposition. Les classifications obtenues avec l’approche CRE reflètent donc l’exposition et le risque au Canada, fondés sur ce que nous pensons être la quantité actuellement utilisée, mais qui pourraient ne pas refléter des tendances futures.
Les données critiques et les considérations prises en compte pour produire les profils spécifiques des trois substances du groupe des trimellitates et déterminer les classifications du danger, de l’exposition et du risque sont présentées dans ECCC (2016b).
Les classifications du danger et de l’exposition des trois substances du groupe des trimellitates sont résumées au tableau 5‑1.
| Nom commun | Classification du danger selon la CRE | Classification de l’exposition selon la CRE | Classification du risque selon la CRE |
|---|---|---|---|
| TEHT | Faible | Faible | Faible |
| BTIT | Faible | Faible | Faible |
| TTDT | Faible | Faible | Faible |
Compte tenu du fait que la CRE attribue un faible danger et une faible exposition au TEHT, au BTIT et au TTDT, ces substances ont été classées comme présentant un faible potentiel de risque pour l’environnement. Il est donc peu probable que ces substances suscitent des préoccupations pour l’environnement au Canada.
6. Risque d’effets nocifs pour la santé humaine
6.1 Évaluation de l’exposition
Milieux naturels et aliments
Ces substances ne sont pas présentes naturellement dans l’environnement. Seules des données empiriques sur la présence du TEHT dans la poussière ont été trouvées. Toutefois, vu la très faible hydrosolubilité, la très faible pression de vapeur et la valeur élevée du log Koe, ces substances ne devraient pas être présentes dans l’air ou dans l’eau. Compte tenu de la valeur estimée élevée du log Kco, elles devraient adsorber les solides et les sédiments en suspension dans l’eau et devraient avoir une faible mobilité dans le sol (US EPA, 2009; HSDB, 1983‑).
La présence de TEHT a été observée dans 14 échantillons de poussières domestiques prélevés dans le cadre d’une étude de terrain menée à Québec dans des maisons d’enfants asthmatiques. Les concentrations de TEHT variaient entre 2,61 et 553,54 mg/kg [µg/g], la moyenne géométrique étant de 21,43 ± 3,70 mg/kg [µg/g] (Won et Lusztyk, 2011). Les concentrations moyennes géométriques de TEHT observées dans la poussière de maison provenant de trois études distinctes réalisées en Allemagne entre 2001 et 2009 variaient entre 1,6 et 2,1 mg/kg, et les concentrations maximales oscillaient entre 22 et 120 mg/kg (Nagorka et al., 2011). En 2011 et en 2012, le TEHT a été détecté dans 63 échantillons de poussières provenant de garderies allemandes, et les concentrations variaient entre une valeur inférieure à la limite de quantification (13 mg/kg) et 107 mg/kg (Fromme et al., 2016). Le TEHT n’a été détecté (limite de détection de 5 à 10 ng/m3) dans aucun des 43 échantillons d’air intérieur prélevés dans ces mêmes garderies (Fromme et al., 2016). La concentration maximale de TEHT observée dans la poussière de maison provenant de l’étude menée à Québec a servi à estimer les taux d’exposition de la population générale. Compte tenu de leur utilisation actuelle et des quantités présentes au Canada, le TTDT et le BTIT ne devraient être présents ni dans la poussière ni ailleurs dans l’environnement.
Stuer‑Lauridsen et al. (2001) ont réalisé une évaluation des risques pour l’environnement et la santé humaine de divers plastifiants de rechange utilisés au Danemark, dont le TEHT. Les estimations des concentrations régionales de TEHT dans l’eau (4E‑5 mg/L), dans l’air (8E‑6 mg/m3), dans le sol (1E‑9 à 5E‑7 mg/kg) et dans les sédiments (5,4E‑3 mg/kg) se basaient sur le pire des scénarios de rejets dans l’environnement danois et ont été établies à l’aide du modèle EUSES (European Union System for the Evaluation of Substances). Ce scénario de la « pire éventualité » se fondait sur l’hypothèse selon laquelle le TEHT remplacerait la totalité (100 %) des phtalates dans la production de PVC au Danemark, d’où un apport de 10 700 tonnes (10 700 000 kg) de TEHT entrant dans le modèle EUSES (Stuer‑Lauridsen et al., 2001). Les estimations des concentrations de TEHT ont aussi été dérivées selon le scénario de la pire éventualité pour le poisson (0,037 mg/kg), la viande (9E‑7 mg/kg de poids humide) et le lait (3E‑7 mg/kg de poids humide) à partir des valeurs estimées de la répartition et de la dégradation.
Une étude réalisée en Espagne sur l’utilisation des plastifiants dans les encres d’imprimerie de certains emballages de produits alimentaires a permis de détecter la présence de TEHT dans les emballages de tablettes de chocolat, de fruits secs, de biscuits, de confiseries et de grignotines. Toutefois, l’étude ne portait pas sur la migration potentielle du TEHT vers ces aliments préemballés (Nerín et al., 1993). Hamdani et Feigenbaum (1996) ont étudié l’utilisation d’isooctane et d’éthanol comme substances potentielles simulant des aliments gras dans des essais de migration dans les emballages de produits alimentaires en comparaison de l’utilisation d’huile de tournesol. La valeur de la migration potentielle du TEHT des emballages en polychlorure de vinyle (PVC) vers les substances simulant des aliments a été mesurée pour les trois substances et oscillait entre 450 mg/dm2 pour l’éthanol et 1 400 mg/dm2 pour l’isooctane à 40 °C après 3 jours, ce qui correspond à une valeur située entre 49 et 94 % du TEHT présent dans le PVC (27,5 %) (Hamdani et Feigenbaum, 1996). Au Canada, aucun des trimellitates de ce groupe n’est utilisé dans les procédés d’emballage de produits alimentaires (communication personnelle, courriel du 26 septembre 2016 de la Direction des aliments de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence).
Aucune donnée relative à la présence de trimellitates dans les aliments n’a été trouvée au Canada ou ailleurs. Aux fins de la présente évaluation, l’ingestion par voie alimentaire de TEHT au sein de la population générale du Canada a aussi été estimée selon le scénario de la pire éventualité à partir de concentrations modélisées observées dans certaines catégories d’aliments présentes dans le rapport danois (Stuer‑Lauridsen et al., 2001). Cette évaluation de l’exposition par voie alimentaire est jugée très prudente, et on ne s’attend pas à ce qu’elle soit représentative de l’exposition réelle de la population canadienne.
Les estimations de l’exposition au TEHT de la population générale du Canada dans les milieux environnementaux et découlant de l’ingestion d’aliments, établies à partir des données de Won et Lusztyk (2011) et de Stuer‑Lauridsen et al. (2001), variaient entre 0,06 µg/kg p.c/j. chez les adultes de plus de 60 ans et 2,8 µg/kg p.c./j chez les nourrissons de 0 à 6 mois, respectivement (voir l’annexe A).
Aucun renseignement ni aucune donnée sur les concentrations de TTDT et de BTIT dans les milieux environnementaux et les aliments n’ont été trouvés. Une comparaison des propriétés physiques et chimiques et des profils actuels d’utilisation laisse croire que l’exposition au TTDT et au BTIT au sein de la population générale du Canada est probablement moindre que celle estimée pour le TEHT. Par conséquent, l’exposition au TTDT et au BTIT dans les milieux environnementaux et par voie alimentaire ne sera pas abordée dans la suite de cette évaluation.
Produits de consommation
Cosmétiques et médicaments, notamment les produits de santé naturels
Les trois trimellitates de ce groupe sont présents dans les cosmétiques, surtout sous forme d’émollients et d’agents revitalisants pour la peau. Le TTDT est aussi un ingrédient non médicinal de produits de santé naturels et sans ordonnance (communication personnelle, courriel du 26 septembre 2016 de la Direction des produits de santé naturels et sans ordonnance de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence).
Les estimations de l’exposition par les voies cutanée et orale n’ont été calculées que pour les scénarios d’alerte (produits pour les lèvres, crèmes hydratantes pour le corps et le visage, produits de maquillage pour le visage, préparations pour manucure en crème et huile de massage) et sont présentées au tableau 6‑1 (produits d’usage quotidien) et au tableau 6‑2 (estimations, par application, pour des produits utilisés moins d’une fois par jour). De plus, on considère que ces estimations tiennent compte de tout cas d’exposition associée à des médicaments en vente libre ou à des produits de santé naturels vu leur grande similitude avec les cosmétiques (p. ex., nettoyants pour le visage, maquillage et produits hydratants). Seules les estimations de l’exposition des adultes et des tout‑petits y sont présentées; elles correspondent toutefois à la plage de valeurs d’exposition potentielle de tous les groupes d’âge. Les cas d’exposition par inhalation n’ont pas été pris en considération compte tenu des pressions de vapeur très faible de ces trois substances (5,9E ‑8 à 7,36 E‑13 Pa; voir le tableau 3‑1). Des précisions sur la méthode et les paramètres utilisés pour produire les estimations de l’exposition par les voies cutanée et orale aux cosmétiques sont présentées à l’annexe B.
| Substance | Scénario d’exposition | Plage de concentration | Exposition estimée des adultes (mg/kg p.c./j) | Exposition estimée des tout‑petits (mg/kg p.c./j) |
|---|---|---|---|---|
| TEHT, TTDT ou BTIT | Produits pour les lèvres a | 0,1 % – 74 % [0,1 % – 30 % pour les tout-petits] | 0,00034 – 0,25 | 0,00038 – 0,11 |
| TTDT ou BTIT | Hydratant pour le corps b | 0,1 % – 10 % | 0,00068 – 0,068 | 0,0015 – 0,15 |
| TEHT, TTDT ou BTIT | Hydratant pour le visage b | 0,1 % – 30 % | 0,0003 – 0,091 | s.o. |
| TEHT, TTDT ou BTIT | Maquillage pour le visage b | 0,1 % – 60 % | 9,4 E-05 – 0,057 | s.o. |
Abréviations : p.c., poids corporel; s.o., sans objet.
a Estimations de l’exposition par voie orale pour les produits pour les lèvres dans l’hypothèse où tout le produit est ingéré.
b Estimations de l’exposition par voie cutanée dans l’hypothèse où 1 % du produit chimique appliqué sur la peau est absorbé.
| Substance | Scénario d’exposition | Plage de concentration | Exposition estimée des adultes (mg/kg p.c./application) |
|---|---|---|---|
| TTDT ou BTIT | Préparations pour manucure en crème a,b | 3 % – 30 % | 0,0072 – 0,072 |
| TTDT ou BTIT | Huile de massage b | 3 % – 35 % | 0,014 – 0,16 |
Abréviations : p.c., poids corporel.
a Estimations de l’exposition par voie cutanée dans l’hypothèse où 1 % du produit chimique appliqué sur la peau est absorbé.
En ce qui concerne les estimations de l’exposition par voie cutanée, un taux d’absorption par voie cutanée de 1 %, fondé sur plusieurs sources de données, a été utilisé. Peu de données étaient disponibles sur le taux d’absorption potentiel par voie cutanée des trois substances du groupe des trimellitates. Seulement deux études d’absorption cutanée in vitro ont été recensées pour le TEHT (Pan et al., 2014; Mielke et al., 2015 [sommaire seulement]). Pan et al. (2014) ont réalisé une étude in vitro d’absorption par voie cutanée du TEHT sur des fragments de peau pleine épaisseur prélevés sur des souris et des porcs dénudés de pelage. Pour leur analyse, ils ont utilisé les cellules à diffusion de Franz. Aucun flux n’a été décelé après 12 heures tant pour la peau de souris que pour la peau porcine dénudées de pelage (Pan et al., 2014). Mielke et al. (2015) ont réalisé une étude de pénétration cutanée in vitro au moyen des cellules à diffusion de Franz et de divers modèles cutanés, dont la peau porcine, la peau humaine et la peau synthétique. Les auteurs ont examiné le taux de pénétration du TEHT par spectroscopie infrarouge à transformée de Fourier (IRTF) et ont démontré que le TEHT pouvait pénétrer la peau porcine après 24 heures. Aucune autre information n’a toutefois été fournie (Mielke et al., 2015 [sommaire seulement]). Ces deux études montrent que le TEHT peut pénétrer la peau, mais elles ne fournissent pas suffisamment d’information pour permettre de dériver une valeur d’absorption par voie cutanée. Par conséquent, compte tenu des similarités structurales entre les trimellitates et les phtalates et de leurs utilisations similaires, les données sur l’absorption par voie cutanée de certains phtalates ont été appliquées aux trimellitates.
Les deux études sur l’absorption par voie cutanée des phtalates ont servi à estimer le taux d’absorption par voie cutanée des trimellitates. Wester et al. (1998) ont fait état d’un taux de 1,8 ± 0,5 % de PDEH absorbé par voie cutanée après 24 heures au cours d’une étude in vivo sur sujets humains réalisée sur 6 participants adultes. Une étude in vivo réalisée sur des rats a établi que le taux d’absorption cutanée de DIDP, un phtalate de plus grande taille, était de 1 % (Elsisi et al., 1989). L’étude a aussi montré que la peau humaine est moins perméable que celle d’autres mammifères, dont les rats (Mint et Hotchkiss, 1993; Mint et al., 1994; Wester et al., 1998). Comme les trimellitates sont de plus grande taille et plus lipophiles que le PDEH et le DIDP (poids moléculaires et log Koe supérieurs, hydrosolubilité moindre), il est peu probable que le taux d’absorption par voie cutanée du TEHT, du BTIT et du TTDT soit supérieur à 1 %.
Les estimations de taux d’exposition présentées au tableau 6‑1 et au tableau 6‑2 ont servi à caractériser le risque associé aux trois trimellitates de ce groupe.
Produits pour les enfants
Aucune information n’a été trouvée sur la présence de TTDT et de BTIT dans des produits pour les enfants, quels qu’ils soient, au Canada ou ailleurs. Toutefois, des concentrations de TEHT ont été mesurées dans des produits pour les enfants en Europe. Une étude portait sur la présence de TEHT et d’autres plastifiants de remplacement des phtalates dans 172 jouets et articles pour enfants, y compris des sandales (252 échantillons) achetées en Allemagne, en Suisse et en Autriche en 2008 (Biedermann‑Brem et al., 2008). La présence de TEHT a été observée dans 3 de ces échantillons (2 poupées et 1 jouet), avec des concentrations comprises entre 13 % et 30 % M/M, et une valeur moyenne de 20 % M/M (Biedermann‑Brem et al. 2008). Au Canada, en 2014, le Laboratoire de la sécurité de Santé Canada a analysé 118 échantillons de produits en plastique disponibles aux consommateurs et destinés aux enfants pour y déceler la présence de phtalates par les techniques de l’IRTF et de CG-SM (chromatographie en phase gazeuse – spectrométrie de masse). Tous les échantillons ont aussi été analysés en mode de balayage pour y déceler tout plastifiant qui n’est pas un phtalate (aucune quantification), y compris le TEHT. Aucun des échantillons ne contenait de TEHT (communication personnelle, courriel du 3 mars 2016 de la Direction de la sécurité des produits de consommation de Santé Canada adressé au Bureau d’évaluation du risque des substances existantes de Santé Canada; sans référence). Compte tenu de ces données canadiennes, il ne devrait pas y avoir d’exposition au TEHT découlant du fait de mastiquer des jouets en plastique.
Le TTDT et le BTIT n’ont pu être décelés dans des jouets pour enfants ni au Canada ni ailleurs et ne sont pas utilisés comme plastifiants. Il ne devrait donc pas y avoir de cas d’exposition au TTDT ni au BTIT associé aux jouets pour enfants.
6.2 Évaluation des effets sur la santé
6.2.1 TEHT
Le TEHT a été étudié par l’OCDE (2002a) et par le CIR (2015). Leurs études servent de base à la caractérisation des effets sur la santé dans la présente évaluation préalable. Une recension des publications scientifiques a été menée à partir d’un an avant la publication de l’OCDE jusqu’en avril 2017, et la présente évaluation des effets sur la santé renferme de nouvelles informations importantes.
Toxicocinétique
La toxicocinétique du TEHT est résumée dans les travaux de l’OCDE (2002a) et du CIR (2015). Chez des rats Sprague‑Dawley mâles ayant reçu une dose unique de 100 mg/kg p.c. de TEHT (marqué au 14C) par gavage oral, on a pu constater 144 heures plus tard que près de 75 % de la dose avait été excrétée dans les matières fécales, 16 % dans l’urine sous forme de métabolites et 1,9 % sous forme de 14CO2 expiré. Dans les matières fécales, la radioactivité a été excrétée sous forme de TEHT non modifié (85 %), de trimellitate de di(2-éthylhexyle) (7 %), de trimellitate de mono(2-éthylhexyle) (1 %) et de métabolites polaires non identifiés. Moins de 0,6 % de la radioactivité était demeurée dans les tissus, ce qui semble indiquer que cette substance présente un faible taux d’accumulation (Eastman Kodak, 1984; revu dans OCDE, 2002a; CIR, 2015).
Cancérogénicité et génotoxicité
Un rapport d’étude portant sur une souche de souris ayant une propension à développer des adénomes pulmonaires ne fait aucunement état d’une hausse de la fréquence des tumeurs chez les animaux exposés au TEHT, mais ne donne aucune autre précision (OCDE 2002a). Même si des structures indicatrices de cancérogénicité ont été signalées dans la modélisation de type (R)QSA (relation quantitative structure‑activité) (Derek Nexus), ces structures ont été associées à la prolifération des peroxysomes, observée chez les rats. Cependant, compte tenu de la faible pertinence de ce mode d’action pour le développement des tumeurs chez les humains, le TEHT devrait être considéré non cancérogène chez les humains (ECHA c2007-2017a). De plus, la modélisation moléculaire (au moyen du logiciel SYBYL V6.9.1) indique que le TEHT ne peut se lier chez les humains aux récepteurs activés par la prolifération des peroxysomes (PPAR) (Kambia et al., 2008).
Le TEHT n’a pas d’effet mutagène sur les souches de Salmonella typhimurium TA98, TA100, TA1535 et TA1537, et ce, ni en présence ni en l’absence d’une activation métabolique (S9). Dans les cellules de mammifère, le TEHT n’a provoqué aucune mutation génique ni dans un essai de mutation génétique sur cellules L5178Y tk+/ – de lymphome de souris ni sur cellules d’ovaire de hamster chinois HPRT, avec ou sans activation métabolique. Le TEHT n’a pas causé d’aberrations chromosomiques dans des lymphocytes humains ou dans des fibroblastes pulmonaires de hamster chinois (V79). De même, il n’a pas accru la synthèse d’ADN non programmée dans les hépatocytes primaires de rat (OCDE 2002a; CIR 2015; AGDH 2017).
Le TEHT n’a pas eu d’effet mutagène lors d’un essai de létalité dominante in vivo sur rongeurs réalisé sur des souris suisses mâles (AGDH 2017). De plus, l’urine des rats ayant reçu la dose de TEHT n’était pas mutagène dans le test d’Ames, ce qui semble indiquer qu’aucun métabolite mutagène important n’a été excrété dans l’urine des animaux traités (Divincenzo et al., 1985; revu dans CIR 2015 et dans AGDH 2017).
Au vu des résultats des études de génotoxicité in vitro et in vivo accessibles, le TEHT n’est pas considéré comme génotoxique.
Toxicité avec doses répétées
Plusieurs études sur la toxicité subchronique par voie orale ont été réalisées, et des doses sans effet nocif observé (DSENO) en sont dérivées. Aucune étude de toxicité avec doses répétées n’est disponible pour le TEHT pour ce qui est de l’exposition par voie cutanée ou par inhalation.
Lors d’une étude de 28 jours sur l’exposition par voie orale menée sur des rats Sprague‑Dawley (5 animaux/sexe/dose) auxquels on avait administré du TEHT par gavage à des doses de 0, 100, 300 et 1 000 mg/kg p.c./j, aucune modification associée à la substance chimique n’a été observée ni du point de vue des signes cliniques, ni du point de vue des effets hématologiques, biochimiques et histopathologiques (OCDE 2002a).
Au cours d’une étude de 28 jours sur l’exposition par voie orale menée sur des rats Fischer 344 (5 animaux/sexe/dose) auxquels on avait administré du TEHT par voie alimentaire dans des proportions de 0 %, 0,2 %, 0,67 % et 2 % (doses équivalentes à 0, 184, 650 et 1 826 mg/kg p.c./j), aucun cas de mortalité associée à la substance chimique n’a été observé quelle que soit la dose. À une dose de 650 mg/kg p.c./j et plus, on a constaté une diminution statistiquement significative de la numération de l’hémoglobine et des leucocytes, du cholestérol sérique et du poids du foie. L’augmentation observée de l’oxydation de la palmitoyl CoA (PCoA) et de l’activité de la catalase dans le foie semble indiquer que les doses élevées induisent la prolifération des peroxysomes. Aucune modification histopathologique associée aux doses n’a été observée dans l’un ou l’autre des groupes traités. La DSENO pour la toxicité par voie orale à doses répétées est estimée à 184 mg/kg p.c./j, et ce, d’après les effets sur les paramètres hématologiques et sur le poids du foie à une dose de 650 mg/kg p.c./j (OCDE 2002a).
Dans une étude d’exposition subchronique par voie orale menée conformément à l’essai 408 des lignes directrices de l’OCDE, on a administré durant 90 jours à des rats Sprague‑Dawley (10 animaux/sexe/dose) du TEHT par voie alimentaire à des doses de 0, 50, 225 et 1 000 mg/kg p.c./j. Il n’y a eu aucune modification importante des signes cliniques, de la mortalité, du poids corporel ou de la consommation d’aliments. À la dose la plus élevée, des modifications statistiquement significatives des paramètres hématologiques (hausse de la numération plaquettaire et des neutrophiles ou diminution des érythrocytes, de l’hémoglobine et de l’hématocrite) ont été signalées chez les rats des deux sexes. Une augmentation importante (> 10 %) du poids du foie (absolu et relatif) a été observée tant chez les mâles que chez les femelles, même à la fin de la période de rétablissement; une diminution du poids de la rate (absolu et relatif) a aussi été observée chez les rats mâles à la dose la plus élevée. L’examen histopathologique a révélé une hypertrophie diffuse des hépatocytes et une fréquence accrue d’hématopoïèse extramédullaire dans la rate. Aucun effet lié au traitement n’a été observé dans le cycle œstral ou dans le cycle de la spermatogenèse. Des modifications liées à la biochimie clinique, dont les taux de phosphatase alcaline (PhoA), d’γ‑glutamyl transférase et de cholestérol, ont aussi été observées à la dose moyenne, mais ces taux sont revenus à des taux similaires aux valeurs témoins au cours de la phase de rétablissement. Dans l’ensemble, on a établi que la DSENO était de 225 mg/kg p.c./j, et ce, en se fondant sur les modifications hématologiques et l’augmentation du poids du foie (ECHA c-2007-2017a).
Les résultats des études de 28 et de 90 jours menées sur des rats par voie alimentaire sont pris en compte globalement pour le choix de la dose critique associée à la toxicité avec doses répétées compte tenu de la nature similaire des effets observés dans les deux études (c.‑à‑d. modifications hématologiques et augmentation du poids du foie). Même si une DSENO de 184 mg/kg p.c./j a été établie au cours de l’étude de 28 jours, la DSENO supérieure (225 mg/kg p.c./j) provenant de l’étude de 90 jours est retenue comme dose critique pour la caractérisation du danger associé à la toxicité avec doses répétées, car elle est basée sur un protocole d’étude plus exhaustif (protocole des lignes directrices d’essais de l’OCDE) et de plus longue durée et parce qu’elle est considérée comme la dose la plus élevée sans effet nocif observé de cette base de données, quoique encore inférieure à la dose minimale avec effet nocif observé (DMENO) de 650 mg/kg p.c./j tirée de l’étude de 28 jours.
Toxicité pour la reproduction et le développement
Une évaluation préliminaire de la toxicité pour la reproduction et le développement du TEHT a été réalisée conformément à l’essai 421 des lignes directrices de l’OCDE. Un groupe de rats Sprague‑Dawley (12/sexe/dose) a reçu par gavage des doses de TEHT de 0, 100, 300 ou 1 000 mg/kg p.c./j. Les mâles ont été traités durant 14 jours avant l’accouplement (46 jours au total), et les femelles ont elles aussi été traitées à partir du 14e jour avant l’accouplement jusqu’au 3e jour de lactation. Il n’y a eu aucun cas de mortalité, aucun signe clinique de toxicité ni d’effets sur le poids corporel, la consommation d’aliments, le poids des organes ou la pathologie clinique. Il n’y a pas eu non plus d’effets sur la fertilité des mâles ou des femelles ni sur le développement fœtal après le traitement au TEHT, quelle que soit la dose. Aucune modification histologique n’a été détectée dans les ovaires des femelles traitées. Ainsi, aucun signe de toxicité pour la reproduction chez les femelles ou de toxicité pour le développement n’a été décelé à des doses allant jusqu’à 1 000 mg/kg p.c./j. Chez les mâles, l’examen histopathologique des testicules a révélé une légère diminution du nombre de spermatides aux stades I à VI du cycle de formation des spermatozoïdes à la dose de 300 mg/kg p.c./j, et une diminution du nombre de spermatocytes et de spermatides ou d’autres paramètres à tous les stades à la dose de 1 000 mg/kg/j. Compte tenu de la toxicité testiculaire, il a été établi que la DSENO pour la toxicité pour la reproduction chez les mâles était de 100 mg/kg p.c./j (OCDE 2002a; CIR 2015). Il faut toutefois noter qu’aucun effet sur le rendement de la reproduction n’a été observé et que les auteurs de l’étude initiale estiment que la dose de 100 mg/kg p.c./j correspond à une dose sans effet observé (DSEO) (OCDE 2002b).
Dans une autre étude, des rates Sprague‑Dawley gravides ont été traitées au TEHT par gavage à des doses de 0, 100, 500 et 1 050 mg/kg p.c./j du 6e au 19e jour de gestation (développement prénatal) (20/groupe) et du 6e jour de gestation au 20e jour de lactation (développement postnatal) (15/groupe). Aucun effet important n’a été détecté sur le poids corporel, sur le poids de l’utérus gravide, sur le nombre d’implantations, sur les pertes post‑implantatoires, sur la durée et l’indice de gestation, ou sur la taille des ratons vivants. Aucune différence importante n’a été observée dans le poids des fœtus, dans les variations ou malformations de l’apparence externe, dans les viscères, le squelette ou la distance anogénitale des petits. Une fréquence supérieure de cas de testicules mal placés chez les fœtus a été constatée pour le groupe ayant reçu la dose la plus élevée; la valeur se situait toutefois à l’intérieur de la plage propre au groupe témoin historique (ECHA c2007-2017a; AGDH 2017). Aucune toxicité maternelle ou pour le développement n’a donc été observée pour les doses administrées allant jusqu’à 1 050 mg/kg p.c./j.
Lors d’une évaluation préliminaire à court terme in vivo, on a administré à des rates gravides des doses allant jusqu’à 1 000 mg/kg p.c./j du 14e au 18e jour de gestation, et on a mesuré le taux de production de testostérone dans les testicules fœtaux (un élément clé de la voie menant aux effets nocifs des phtalates). L’exposition au TEHT n’a pas influé sur la production de testostérone dans les testicules fœtaux (Furr et al., 2014).
6.2.2 BTIT et TTDT
Les données empiriques disponibles sur les dangers associés au TTDT sont limitées, et il n’existe aucune donnée empirique sur le BTIT. La seule étude de toxicité aiguë portant sur le TTDT fait état d’une DL50 par voie orale supérieure à 5 000 mg/kg p.c. chez les souris albinos dérivées de la souche Wistar (AGDH 2013). Vu le manque de données sur le TTDT et le BTIT, on a utilisé une méthode de lecture croisée pour caractériser les effets sur la santé de ces substances en y incorporant des données provenant de deux autres analogues, soit le TOTM et le MDOT.
Une évaluation préliminaire de la toxicité à doses répétées et de la toxicité pour la reproduction et le développement a été réalisée pour le TOTM conformément à l’essai 422 des lignes directrices de l’OCDE. Des groupes de rats Sprague‑Dawley (13/sexe/dose) ont reçu par gavage des doses de TOTM de 0, 30, 125 et 500 mg/kg p.c./j. Les rats mâles ont été traités durant 14 jours avant l’accouplement (42 jours au total), alors que les rates ont été exposées à la substance du 14e jour avant l’accouplement jusqu’au 4e jour de lactation. Une femelle est morte après avoir reçu une dose de 500 mg/kg p.c./j au 23e jour de gestation. On a observé une augmentation du poids du foie et un nombre réduit de globules rouges chez les rates aux doses de 125 et de 500 mg/kg p.c./j; on a aussi observé chez les rats mâles une diminution du poids des testicules à la dose de 125 mg/kg p.c./j, mais non à la dose de 500 mg/kg p.c./j. La DSENO pour la toxicité parentale (doses répétées par voie orale) est estimée à 30 mg/kg p.c./j. Chez la génération F1, aucun effet nocif n’a été observé en ce qui concerne le poids des ratons, la proportion des sexes, l’indice de survie ou l’indice de viabilité aux doses supérieures à 500 mg/kg p.c./j (ECHA 2007-2017c; SRC 2016).
Lors d’un essai de 28 jours avec exposition par voie orale mené sur des rats Sprague‑Dawley (5 mâles/5 femelles) auxquels on a administré du MDOT par gavage à des doses de 0, 100, 300 et 1 000 mg/kg p.cp./j., on a observé une leucocytose statistiquement significative et une augmentation importante du poids du foie, absolu et relatif, chez les individus des deux sexes à la dose la plus élevée. On a aussi observé une augmentation des taux de glutamate pyruvate transaminase (GPT) et d’γ‑glutamyl transférase, et une diminution des taux de bilirubine, de protéines et de sodium chez les mâles et les femelles ayant reçu une dose de 1 000 mg/kg p.c./j. Les effets observés étaient réversibles après une période de rétablissement de 2 semaines chez les animaux ayant reçu la dose la plus élevée. Une DSE(N)O de 300 mg/kg p.c./j a été calculée d’après les effets sur l’hématologie, la chimie clinique et le poids des organes (ECHA c2007-2017d; SRC 2016).
Une étude de la toxicité du MDOT sur le développement prénatal a été réalisée conformément à l’essai 414 des lignes directrices de l’OCDE. Des groupes de rates Sprague‑Dawley accouplées (24/dose) ont reçu par gavage des doses de MDOT de 0, 100, 300 et 1 000 mg/kg/j. de la 6e à la 19e journée de gestation. Des effets maternels comme la perte pondérale, le gain pondéral et le gain pondéral absolu ainsi que la diminution du poids de l’utérus gravide et de la consommation d’aliments ont été observés à la dose la plus élevée. On estime à 300 mg/kg/j. La DSENO relative à la toxicité maternelle. La diminution du poids du fœtus et du poids de la portée, l’ossification tardive et des malformations viscérales ont été observées chez les fœtus à la dose moyenne et à la dose la plus élevée; toutefois, la fréquence des malformations était faible et sans lien avec les doses. La toxicité pour le développement n’a pas été observée aux doses allant jusqu’à 1 000 mg/kg/j. (ECHA c2007-2017d; SRC 2016).
Les deux analogues TOTM et MDOT ne sont pas génotoxiques. Les données critiques sur les aspects physico‑chimiques et toxicologiques des analogues sont résumées à l’annexe C.
Lecture croisée pour la caractérisation du risque
On a utilisé une méthode de lecture croisée par catégorie pour déterminer les effets critiques et les doses critiques nécessaires à la caractérisation du risque associé au TTDT et au BTIT à partir des données disponibles pour les trois analogues (SRC 2016).
Les esters trimellitates forment un groupe de substances chimiques de structure homogène. Toutes les substances de ce groupe sont des triesters de l’acide benzène-1,2,4-tricarboxylique et des alcools aliphatiques contenant huit atomes de carbone ou plus. Toutes ces substances sont hydrophobes et non volatiles, et la similarité de leurs propriétés physico‑chimiques corrobore la prévision selon laquelle elles auront le même taux relativement faible de biodisponibilité, d’absorption, de métabolisation et d’élimination. Aucune différence de structure, de valence fonctionnelle ou d’influences électroniques n’est observable, ce qui laisse croire qu’ils risquent peu de s’écarter de la principale voie de métabolisation. Il n’existe aucune différence stérique ou électronique dans leurs structures chimiques pouvant laisser entrevoir des différences importantes dans la réactivité chimique ou l’activité biologique pour ce qui est des paramètres toxicologiques.
Compte tenu des similarités de leur structure chimique, de leurs propriétés physico‑chimiques, de leur métabolisation potentielle et de leur mode d’action, les membres du groupe des trimellitates peuvent avoir des activités biologiques similaires. Le TEHT est considéré comme l’analogue du BTIT et du TTDT à privilégier pour combler les lacunes dans les données sur la toxicité avec doses répétées, sur la toxicité pour la reproduction et le développement, sur la génotoxicité et sur la cancérogénicité. Le TOTM et le MDOT sont eux aussi considérés comme des analogues utiles aux analyses par lecture croisée. Par comparaison avec les trois analogues, le BTIT et le TTDT ont un poids moléculaire supérieur, des chaînes latérales plus volumineuses, un log Koe supérieur et une hydrosolubilité moindre (d’après les prédictions obtenues par modèle), et on peut ainsi s’attendre à ce qu’ils aient une biodisponibilité et une toxicité moindres. Il est donc jugé sécuritaire d’utiliser les données sur la toxicité relatives au TEHT pour caractériser le danger potentiel associé aux autres membres du groupe.
La toxicité pour la reproduction chez le mâle est reconnue comme l’effet critique des trimellitates. La DSE(N)O calculée de l’analogue principal, le TEHT, est de 100 mg/kg p.c./j, d’après les effets légers sur les paramètres liés aux spermatozoïdes en l’absence d’effet sur le rendement de la reproduction observé chez les rats mâles à la dose de 300 mg/kg p.c./j. Les testicules étaient une autre cible de la toxicité chez les rats mâles exposés au TOTM, car on a pu observer une diminution du poids des testicules à la dose de 125 mg/kg p.c./j, mais non à celle de 500 mg/kg p.c./j (ECHA c2007-2017c). La DSE(N)O de 100 mg/kg p.c./j est donc utilisée comme dose critique pour le TTDT et le BTIT d’après l’approche par lecture croisée par catégorie utilisée pour caractériser le risque des effets préoccupants pour la reproduction.
Pour ce qui est de la lecture croisée appliquée à la toxicité par doses répétées, la DSENO du TEHT était de 225 mg/kg p.c./j, d’après les effets sur les paramètres hématologiques et sur le poids du foie à la dose de 1 000 mg/kg p.c./j, alors que la DSENO de l’analogue TOTM était moins élevée, à 30 mg/kg p.c./j, et que la DSE(N)O du MDOT était plus élevée, à 300 mg/kg p.c./j, d’après des effets toxicologiques similaires. Comme la toxicité a tendance à diminuer lorsque la longueur de la chaîne latérale s’accroît, on s’attend à ce que le TTDT et le BTIT soient moins toxiques que le MDOT en raison de leur chaîne alkyle latérale plus longue et de leur poids moléculaire supérieur. De plus, le BTIT contient des chaînes latérales ramifiées mixtes, similaires à celles du TEHT. En théorie, le BTIT et le TTDT devraient avoir des DSENO supérieures à celle du MDOT. Il est toutefois prudent de choisir la DSENO de 225 mg/kg p.c./j du TEHT pour la caractérisation du risque de toxicité par doses répétées du BTIT et du TTDT (voir l’annexe C).
6.3 Caractérisation des risques pour la santé humaine
Les données toxicologiques empiriques disponibles pour le TEHT et une analyse par lecture croisée par catégorie indiquent que les trimellitates ont une faible toxicité aiguë. Ils ne sont pas génotoxiques, et on ne croit pas qu’ils soient cancérogènes.
Dans un rapport d’évaluation initiale (SIAR) de l’OCDE, on a fait état d’une DSENO de 100 mg/kg p.c./j pour la toxicité pour la reproduction, et ce, à partir de l’observation de légères diminutions du nombre de spermatocytes ou de spermatides uniquement aux premiers stades de la spermatogenèse chez des rats mâles ayant reçu des doses élevées (OCDE 2002a). Cette dose critique est adoptée pour la caractérisation du risque du TEHT. Lors de la même évaluation préliminaire (par gavage), aucun effet nocif sur le rendement de la reproduction des rats mâles ou femelles ou sur le développement fœtal n’a été observé, et ce, jusqu’à la dose la plus élevée administrée. Dans le rapport initial de l’étude, les auteurs estimaient en outre que cette dose était une DSEO plutôt qu’une DSENO (OCDE 2002b). De plus, lors d’une étude à doses répétées de 90 jours conforme aux lignes directrices de l’OCDE menée sur des rats (par le régime alimentaire), aucun effet associé au traitement n’a été observé sur le cycle œstral ni sur la spermatogenèse (ECHA c2007-2017a). Ces sources de données indiquent que l’effet du TEHT sur la toxicité pour la reproduction devrait être considéré comme minimal. Il est donc jugé prudent d’utiliser la DSE(N)O de 100 mg/kg p.c./j, basée sur les effets minimes sur la reproduction (d’importance discutable sur le plan toxicologique), pour la caractérisation du risque associé aux trois trimellitates de ce groupe.
Aucune dose critique n’est disponible pour l’exposition par voie cutanée. Les estimations relatives à l’exposition par voie cutanée sont dérivées d’un taux d’absorption cutanée de 1 % et sont donc considérées comme des cas d’exposition systémique. La dose critique provenant de l’exposition par voie orale a donc été ajustée à une valeur de dose systémique pour le calcul les marges d’exposition. La dose critique (la dose administrée) a été ajustée à une valeur de dose systémique à l’aide d’un taux d’absorption par voie orale de 36 % basé sur les résultats d’une étude portant sur l’absorption par voie orale, la distribution, la métabolisation et l’excrétion, selon laquelle 75 % de la dose de TEHT marqué au 14C administrée par voie orale a été excrétée dans les matières fécales, et 85 % de la radioactivité présente dans les matières fécales l’était sous forme de TEHT inaltéré. Dans l’hypothèse où le TEHT non altéré n’a pas pénétré dans la circulation sanguine, le taux d’absorption par voie orale est estimé à 100 % – (75 %*85 %) = 36 %. Il est à noter qu’en raison d’un manque de données, cette estimation ne tient pas compte de l’importance de l’excrétion biliaire et de la circulation entérohépatique. Aucun ajustement n’est requis pour le calcul des marges d’exposition pour les scénarios d’exposition par voie orale.
Les estimations de l’exposition de la population générale au TEHT dans les milieux environnementaux et par voie alimentaire oscillent entre 6,0 E‑5 mg/kg p.c./j pour les adultes de 60 ans et plus et 2,8 E‑03 mg/kg p.c./j pour les nourrissons de 0 à 6 mois. On estime que les cas d’exposition sont surtout associés à la poussière intérieure et aux aliments (poisson). L’utilisation d’une DSE(N)O de 100 mg/kg p.c./j pour la toxicité pour la reproduction se traduit par des marges d’exposition supérieures à 35 000. Aucun renseignement ni aucune donnée sur les concentrations de TTDT et de BTIT dans les milieux environnementaux et les aliments n’ont été trouvés. Au Canada, le BTIT est peut‑être utilisé comme ingrédient d’additifs indirects destinés à la transformation des aliments, mais on ne s’attend pas à trouver des cas d’exposition associés à un tel usage. Au Canada, l’exposition de la population générale au TTDT et au BTIT est probablement moindre que celle estimée pour le TEHT compte tenu de leur structure chimique plus volumineuse, de leur masse plus importante et de leurs profils d’utilisation actuels.
Le TEHT, le BTIT et le TTDT ont tous été décelés dans des cosmétiques divers, mais similaires. De ce groupe, le TTDT est la substance qui est présente dans le plus grand nombre et dans la plus grande variété de produits et selon les concentrations les plus élevées; on estime qu’il est, parmi les trois substances du groupe, à l’origine des valeurs d’exposition les plus élevées associées aux cosmétiques d’usage quotidien. Les estimations les plus élevées de l’exposition au BTIT ont été observées dans le cas des cosmétiques d’usage moins fréquent, comme l’huile de massage et les préparations pour manucure en crème. Le tableau 6‑3 résume les valeurs d’exposition d’alerte quotidienne au TEHT, au BTIT et au TTDT et les marges d’exposition associées, et le tableau 6‑4 résume les valeurs d’exposition d’alerte par application et les marges d’exposition associées. Une DSE(N)O ajustée de 36 mg/kg p.c./j est utilisée pour calculer les marges d’exposition des valeurs d’exposition par voie cutanée, alors que la DSE(N)O non ajustée est comparée aux valeurs d’exposition par voie orale.
| Substance | Scénario d’exposition | Exposition systémique des adultes (mg/kg p.c./j) | ME pour les adultes | Exposition systémique des tout‑petits (mg/kg p.c./j) | ME pour les tout‑petits |
|---|---|---|---|---|---|
| TEHT, TTDT ou BTIT | Produits pour les lèvres (absorption par voie orale à 100 %) | 0,00034 – 0,25 | 400 – 294 118a | 0,00038 – 0,11 | 909 – 263 158 a |
| TTDT ou BTIT | Hydratant pour le corps b | 0,00068 – 0,068 | 529 – 52 941c | 0,0015 – 0,15 | 240 – 24 000c |
| TEHT, TTDT ou BTIT | Hydratant pour le visage b | 0,0003 – 0,091 | 396 – 120 000c | s.o. | s.o. |
| TEHT, TTDT ou BTIT | Maquillage pour le visage b | 9,4 E-05 – 0,057 | 632 – 382 979c | s.o. | s.o. |
Abréviation : s.o., sans objet.
a Avec DSE(N)O = 100 mg/kg p.c./j.
b Avec taux d’absorption par voie cutanée de 1 %.
c Avec DSE(N)O = 36 mg/kg p.c./j, basée sur une DSE(N)O corrigée de 100 mg/kg p.c./j pour tenir compte du taux d’absorption par voie orale de 36 % [100 % – (75 %*85 %)] compte tenu des taux d’excrétion dans les matières fécales par suite de l’administration par voie orale.
| Substance | Scénario d’exposition | Exposition systémique des adultes (mg/kg p.c./j) | ME pour les adultes | Exposition systémique des tout‑petits (mg/kg p.c./j) | ME pour les tout‑petits |
|---|---|---|---|---|---|
| BTIT ou TTDT | Huile de massage a | 0,014 – 0,16 | 225 – 2 571 b | s.o. | s.o. |
| BTIT ou TTDT | Préparations pour manucure en crème a | 0,0072 – 0,072 | 500 – 5 000 b | s.o. | s.o. |
Abréviation : s.o., sans objet.
a Avec taux d’absorption par voie cutanée de 1 %.
b Avec DSE(N)O = 36 mg/kg p.c./j basée sur une DSE(N)O corrigée de 100 mg/kg p.c./j pour tenir compte du taux d’absorption par voie orale de 36 % [100 % – (75 %*85 %)], compte tenu des taux d’excrétion dans les matières fécales par suite de l’administration par voie orale.
c Avec DSE(N)O = 100 mg/kg p.c.
Compte tenu des paramètres utilisés pour produire des estimations prudentes de l’exposition provenant des milieux environnementaux, des aliments et des produits de consommation (p. ex., utilisation de concentrations maximales ou modélisées dans la poussière, les aliments ou les produits) et de l’utilisation d’une dose critique associée aux effets minimaux de signification incertaine du point de vue toxicologique, les marges d’exposition calculées présentées ci‑dessus sont jugées adéquates pour tenir compte des incertitudes inhérentes aux bases de données sur les effets sur la santé et l’exposition. Même si plusieurs cosmétiques contenant ces substances étaient utilisés dans la même journée (c.‑à‑d. exposition globale), les marges d’exposition seraient jugées adéquates.
6.4 Incertitudes de l’évaluation des risques pour la santé humaine
Les plus importantes sources d’incertitude sont présentées au tableau suivant.
| Principale source d’incertitude | Incidence |
|---|---|
| Vu le manque de données sur la présence du TEHT dans les aliments au Canada ou ailleurs dans le monde, les valeurs modélisées provenant d’un rapport d’évaluation danois ainsi que d’autres hypothèses ont servi à calculer les estimations de l’exposition au TEHT par voie alimentaire, ce qui peut sans doute amener à surestimer les taux réels d’exposition. | + |
| Dans la littérature, on laisse entendre que le TEHT pourrait être présent dans des encres utilisées dans certains emballages de produits alimentaires. Toutefois, on n’a pas recensé d’utilisation du TEHT dans les emballages alimentaires au Canada, et les utilisations approuvées aux États‑Unis n’incluent pas les encres d’impression. S’il existe bien une incertitude concernant l’exposition au TEHT du fait de son utilisation possible dans les matériaux d’emballage alimentaire, on estime qu’il en est tenu compte dans les estimations prudentes calculées pour les milieux environnementaux et les aliments. | +/- |
| L’utilisation de concentrations maximales pour l’estimation des taux d’exposition aux cosmétiques risque de donner lieu à des surestimations. | + |
| En l’absence de données sur l’absorption du TEHT par voie cutanée, on a utilisé un taux de 1 %, fondé sur les données relatives aux phtalates. Aucune information sur les taux d’absorption par voie cutanée du TTDT et du BTIT n’était disponible. | + |
| Il existe une incertitude quant à la nocivité des effets du TEHT sur le système reproducteur observés au cours de l’étude de dépistage; il est établi que les estimations du risque présentées ici sont prudentes. | + |
| Il n’existe aucune étude subchronique ou chronique menée sur des animaux concernant l’exposition par voie cutanée au TEHT. | +/- |
| Vu la quantité limitée de données empiriques sur la toxicité disponibles pour le BTIT et le TTDT, on a eu recours à une méthode de lecture croisée prudente pour déterminer les effets critiques et les doses critiques. | + |
| Il existe une incertitude quant au degré d’absorption gastro‑intestinale et à l’ajustement du seuil d’effets critiques. | +/- |
+ = incertitude quant au potentiel de surestimation de l’exposition/risque;
– = incertitude quant au potentiel de sous‑estimation du risque d’exposition;
+/ – = potentiel inconnu de surestimation ou de sous‑estimation du risque.
Il existe une incertitude quant aux estimations de l’exposition aux trimellitates découlant de l’utilisation des produits de consommation, plus particulièrement en ce qui a trait aux types de produits accessibles aux Canadiens, à la plage de concentrations des divers produits ainsi qu’à l’abondance de ces produits au Canada. Il est fort probable que les estimations de l’exposition maximale associée à l’usage des cosmétiques se traduisent en fait par une surestimation des valeurs d’exposition. De même, il n’existe aucune information disponible sur la présence de TEHT dans les matériaux d’emballage des produits alimentaires au Canada. On croit toutefois que l’exposition au TEHT associée à de telles utilisations se situerait à l’intérieur de la plage de valeurs estimées pour l’exposition provenant des milieux environnementaux et des aliments. Il est donc fort probable que les marges d’exposition associées à ces utilisations seraient encore jugées adéquates.
Des données limitées sur la toxicité sont disponibles pour le BTIT et le TTDT, et la caractérisation du risque a été réalisée par lecture croisée par catégorie. Dans l’ensemble, il est jugé prudent d’utiliser le seuil d’effets critiques pour la toxicité pour la reproduction chez les mâles et de recourir à la méthode de lecture croisée par catégorie pour la caractérisation du risque associé aux trimellitates, car on s’attend à ce que la toxicité du BTIT et du TTDT soit moindre que celle du TEHT compte tenu de leurs chaînes latérales, plus longues.
7. Conclusions
Compte tenu de tous les éléments de preuve contenus dans la présente évaluation préalable, le TEHT, le BTIT et le TTDT présentent un risque faible de causer des effets nocifs pour l’environnement. Il a été conclu que le TEHT, le BTIT et le TTDT ne satisfont à aucun des critères énoncés aux alinéas 64a) et b) de la LCPE, car ils ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ou à mettre en danger l’environnement essentiel pour la vie
À la lumière des renseignements contenus dans la présente évaluation préalable, il a été conclu que le TEHT, le BTIT et le TTDT ne satisfont pas au critère énoncé à l’alinéa 64c) de la LCPE, car ces substances ne pénètrent pas dans l’environnement en une quantité ou concentration, ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il a été conclu que le TEHT, le BTIT et le TTDT ne répondent à aucun des critères énoncés à l’article 64 de la LCPE.
Références
[ACI] American Cleaning Institute [base de données]. c2017. Evaluation of Tridecyl Trimellitate (CAS No. 70225-05-7). Cleaning Product Ingredient Safety Initiative. [consulté le 10 mars 2017] [En anglais seulement]
[AGDH] Australian Government Department of Health. 2013. 1,2,4-Benzenetricarboxylic acid, 1,2,4-tritridecyl ester (INCI name: Tridecyl Trimellitate). Sydney (AU): Department of Health, National Industrial Chemicals Notification and Assessment Scheme (NICNAS). Public Report. File No: LTD/1654, September 2013. [consulté le 6 janvier 2017] [En anglais seulement]
[AGDH] Australian Government Department of Health. 2017. Human health tier II assessment for 1,2,4-Benzenetricarboxylic acid, tris(2-ethylhexyl) ester, CAS RN 3319-31-1. Inventory Multi-Tiered Assessment and Periodization (IMAP). National Industrial Chemicals Notification and Assessment Scheme (NICNAS). [consulté le 6 décembre 2016] [En anglais seulement]
Biedermann-Brem S, Biedermann M, Pfenninger S, Bauer M, Altkofer W, Rieger K, Hauri U, Droz C, Grob. 2008. Plasticizers in PVC toys and childcare products: What succeeds the phthalates? Market survey 2007. Chromatographia. 68:227-234. [En anglais seulement]
Bremmer HF, Prud’homme de Lodder LCH, van Engelen JGM. 2006. Cosmetics Fact Sheet [PDF]. RIVM report 320104001/2006. [En anglais seulement]
Bui TT, Giovanoulis G, Cousins AP, Magnér, Cousins IT, de Wit CA. 2016. Human exposure, hazard and risk of alternative plasticizers to phthalate esters. Sci Total Environ. 541:451-467. [En anglais seulement]
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). L.C. 1999, ch. 33. Gazette du Canada, Partie III, vol. 22, nº 3.
[CIR] Cosmetic Ingredient Review. 2015. Safety assessment of trialkyl trimellitates as used in cosmetics. [PDF] Publié le 22 octobre 2015, Washington. [consulté le 15 décembre 2016]. Washington (DC): Cosmetic Ingredient Review. [En anglais seulement]
[ConsExpo Web] Consumer Exposure Web Model. 2016. Bilthoven (NL): Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment] [En anglais seulement]
Divincenzo GD, Hamilton ML, Mueller KR, Donish WH, Barber ED. 1985. Bacterial mutagenicity testing of urine from rats dosed with 2-ethylhexanol derived plasticizers. Toxicology. 34(3):247-259. [En anglais seulement]
[BDIPSN] Base de données d’ingrédients de produits de santé naturels [base de données]. [modifié le 23 novembre 2015]. Ottawa (Ont.), Santé Canada. [consulté en septembre 2016]
[BDPP] Base de données sur les produits pharmaceutiques [base de données]. [modifié le 17 juillet 2015]. Ottawa (Ont.), Santé Canada. [Consulté en septembre 2016].
[BDPSNH] Base de données des produits de santé naturels homologués [base de données des produits de santé naturels homologués]. [modifié le 27 février 2014]. Ottawa (Ont.), Santé Canada. [consulté en septembre 2016].
Eastman Kodak. 1984. Absorption and metabolism of (hexyl-2-14C) tri-(2-ethylhexyl) trimellitate in the rat. OTS 42040 [cité dans OECD 2002]. Report no.: Doc. ID 408465031. [En anglais seulement]
[ECCC] Environnement et Changement climatique Canada. 2016a. Document sur l’approche scientifique : Classification du risque écologique des substances organiques, Ottawa (Ont.), gouvernement du Canada.
[ECCC] Environnement et Changement climatique Canada. 2016b. Data used to create substance-specific hazard and exposure profiles and assign risk classifications in the Ecological Risk Classification of organic substances. Gatineau (QC). Disponible sur demande à : substances@ec.gc.ca. [En anglais seulement]
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. [modifié le 12 mars 2017]. Catégorisation de substances chimiques, Ottawa (Ont.), gouvernement du Canada. [consulté en juin 2017].
[ECCC, SC] Environnement et Changement climatique Canada, Santé Canada. 2018. Évaluation préalable : Substances jugées comme étant peu préoccupantes au moyen de l’approche de la Classification du risque écologique des substances organiques et de l’approche fondée sur le seuil de préoccupation toxicologique (SPT) pour certaines substances, Ottawa (Ont.), gouvernement du Canada.
[ECHA] Agence européenne des produits chimiques. c2007-2017a. Registered substances database; Registered dossier for Tris(2-ethylhexyl)benzene-1,2,4-tricarboxylate, CAS RN 3319-31-1. Helsinki (FI) : ECHA. [mis à jour le 15 décembre 2016; consulté le 6 janvier 2017]. [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. c2007-2017b. Registered substances database; Registered dossier for 1,2,4-Benzenetricarboxylic acid, mixed branched tridecyl and isodecyl esters, CAS RN 70225-05-7. Helsinki (FI) : ECHA. [mis à jour le 15 décembre 2016; consulté le 6 mars 2017] [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. c2007-2017c. Registered substances database; Registered dossier for Trioctyl benzene-1,2,4-tricarboxylate, CAS RN 89-04-3. Helsinki (FI) : ECHA. [mis à jour le 15 déc. 2016; consulté le 6 janvier 2017] [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. c2007-2017d. Registered substances database; Registered dossier for 1,2,4-Benzenetricarboxylic acid, mixed decyl and octyl triesters, CAS RN 90218-76-1. Helsinki (FI) : ECHA. [mis à jour le 15 déc. 2016; consulté le 6 janvier 2017] [En anglais seulement]
[ECHA] Agence européenne des produits chimiques. 2013. Evaluation of new scientific evidence concerning DINP and DIDP. Final Review Report. [En anglais seulement]
Elsisi AE, Carter DE, Sipes IG. 1989. Dermal absorption of phthalate diesters in rats. Fundam Appl Toxicol. 12:70-77. [En anglais seulement]
Environment Canada. 2004/2005. Response to the American Chemical Council’s Phthalate Esters Panel’s Proposal regarding Environment Canada’s Preliminary Categorization of 93 Phthalate Esters. [En anglais seulement]
Environnement Canada. 2009. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par Environnement Canada, Santé Canada; Programme des substances existantes.
Environnement Canada. 2013. Données de la Mise à jour de l’inventaire de la LIS recueillies en vertu du de l’article 71 de la Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inanimées (chimiques) inscrites sur la Liste intérieure. Données préparées par Environnement Canada, Santé Canada : Programme des substances existantes.
Environnement Canada, Santé Canada. 1994. Loi canadienne sur la protection de l’environnement - Liste des substances d’intérêt prioritaire - Rapport d’évaluation : Phtalate de bis(2-éthylhexyle) [PDF], Ottawa (Ont.), Environnement Canada, Santé Canada. [Consulté le 7 mars 2017].
Environnement Canada, Santé Canada. 2015a. Rapport sur l’état des connaissances scientifiques – Groupe de substances des phtalates : Esters phtaliques à chaîne moyenne : Numéros de registre du Chemical Abstracts Service : 84-61-7; 84-64-0; 84-69-5; 523-31-9; 5334-09-8; 16883-83-3; 27215-22-1; 27987-25-3; 68515-40-2; 71888-89-6, Gatineau (Qc), Environnement Canada, Santé Canada : Programme des substances existantes.
Environnement Canada, Santé Canada. 2015b. Rapport sur l’état des connaissances scientifiques – Groupe des phtalates : Phtalate de diisononyle, Phtalate de dialkyle en C8-10 ramifié, riches en C99, Phtalate de diisononyle (PDIN) : Numéros de registre du Chemical Abstracts Service : 28553-12-0, 68515-48-0, Gatineau (Qc), Environnement Canada, Santé Canada : Programme des substances existantes.
Environnement Canada, Santé Canada. 2015c. Rapport sur l’état des connaissances scientifiques – Groupe de substances des phtalates : Esters phtaliques à chaîne longue : Phtalate de diisodécyle (phtalate de diisodécyle, DIDP) et Phtalate de diundécyle (phtalate de diundécyle, DUP) : Numéros de registre du Chemical Abstracts Service : 26761-40-0, 68515-49-1; 3648-20-2. Gatineau (Qué.), Environnement Canada, Santé Canada : Programme des substances existantes..
[EPI Suite] Estimation Program Interface Suite for Microsoft Windows [estimation model]. c2000-2012. Ver. 4.11. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [En anglais seulement]
European Commission. 2017. CosIng Database: tridecyl trimellitate CAS RN 94109-09-8. [mis à jour le 15 juin 2017] [En anglais seulement]
[EWG] Environmental Working Group. C2007-2017. EWG’s Guide to Healthy Cleaning: Tridecyl trimellitate. Washington (DC): Environmental Working Group. [consulté le 10 mars 2017] [En anglais seulement]
Fromme H, Schütze A, Lahrz T, Kraft M, Fembacher L, Siewering S, Burkardt R, Dietrich S, Koch HM, Völkel W. 2016. Non-phthalate plasticizers in German daycare centers and human biomonitoring of DINCH metabolites in children attending the centers (LUPE3). Int J Hyg Environ Health. 219:33-39. [En anglais seulement]
Furr JR, Lambright CS, Wilson VS, Foster PM, Gray LE Jr. 2014. A short-term in vivo screen using fetal testosterone production, a key event in the phthalate adverse outcome pathway, to predict disruption of sexual differentiation. Toxicol Sci. 140(2):403-424. [En anglais seulement]
Hamdani M, Feigenbaum A. 1996. Migration from plasticized poly(vinyl chloride) into fatty media: importance of simulant selectivity for the choice of volatile fatty simulants. Food Addit Contam. 13(6):717-730. [En anglais seulement]
Household Products Database [base de données]. 2016. Bethesda (MD): US National Library of Medicine. [mis à jour en sept. 2016; consulté en avril 2017]. [En anglais seulement]
[HSDB] Hazardous Substances Data Bank [base de données]. 1983- . Bethesda (MD): National Library of Medicine (US). [mis à jour en févr. 2015; consulté en mai 2017]. [En anglais seulement]
Jonker MTO. 2016. Determining octanol-water partition coefficients for extremely hydrophobic chemicals by combining “slow stirring” and solid-phase microextraction. Environ Toxicol Chem. 35(6):1371-1377. [En anglais seulement]
Kambia K, Dine T, Gressier B, Dupin-Spriet T, Luyckx M, Brunet C. 2004. Evaluation of the direct toxicity of trioctyltrimellitate (TOTM), di(2-ethylhexyl) phthalate (DEHP) and their hydrolysis products on isolated rat hepatocytes. Int J Artif Organs. 27(11):971-978. [En anglais seulement]
KambiaN, Renault N, Dilly S, Farce A, Dine T, Gressier B, Luyckx M, Brunet C, Chavatte P. 2008. Molecular modelling of phthalates -PPARsinteractions. J Enzyme Inhib Med Chem. 23(5):611-6. [En anglais seulement]
Letinski DJ, Connelly MJ Jr, Peterson DR, Parkerton TF. 2002. Slow-stir water solubility measurements of selected alcohols and diesters. Chemosphere. 48:257-265. [En anglais seulement]
Loretz LG, Api AM, Barraj LM, Burdick J, Dressler WE, Gettings SD, Han Hsu H, Pan YHL, Re TA, Renskers KJ, Rothenstein A, Scrafford CG, Sewall C. 2005. Exposure data for cosmetic products: lipstick, body lotion, and face cream. Food Chem Toxicol. 43:279-291. [En anglais seulement]
Loretz L, Api AM, Barraj L, Burdick J, Davis DA, Dressler W, Gilberti E, Jarrett G, Mann S, Pan YHL, Re T, Renskers K, Scrafford C, Vater S. 2006. Exposure data for personal care products: Hairspray, spray perfume, liquid foundation, shampoo, body wash, and solid antiperspirant. Food Chem Toxicol 44:2008-2018. [En anglais seulement]
Mielke N, Hutzler C, Kappenstein O, Vieth B, Luch A. 2015. Consumer products made of polymers: An unfailing source for dermal uptake of potentially harmful substances. Nunyn-Schmiedeberg’s Arch Pharmacol. 388(1):S72. [En anglais seulement]
Nagorka R, Conrad A, Scheller C, Süβenbach B, Moriske HJ. 2011. Plasticizers and flame retardants in household dust – Part 2: Non-phthalates and flame retardants [German]. Gefahrstoffe – Reinhaltung der Luft. 71(6):286-292. [En allemand seulement]
Nerín C, Cacho J, Gancedo P. 1993. Plasticizers from printing inks in a selection of food packagings and their migration to food. Food Addit Contam. 10(4):453-460. [En anglais seulement]
[OCDE] Organisation for Economic Co-operation and Development. 2002a. SIDS initial assessment report: tris(2-ethylhexyl)benzene-1,2-tricarboxylate : CAS No. 3319-31-1. SIAM [in SIDS Initial Assessment Meeting] 14 : mars 2002 : Paris, France [consulté le 6 septembre 2016]. [En anglais seulement]
[OCDE] Organisation for Economic Co-operation and Development. 2002b. SIDS dossier on the HPV chemical tris(2-ethylhexyl)benzene-1,2-tricarboxylate: CAS No. 3319-31-1. In SIDS initial assessment report. SIAM [SIDS Initial Assessment Meeting] 14: mars 2002 : Paris, France [consulté le 6 septembre 2016]. [En anglais seulement]
Pan TL, Wang PW, Aljuffali IA, Hung YY, Lin CF, Fang JY. 2014. Dermal toxicity elicited by phthalates: Evaluation of skin absorption, immunohistology, and functional proteomics. Food Chem Toxicol. 65:105-114. [En anglais seulement]
[PhysProp] Interactive PhysProp Database [base de données]. c2013. Syracuse (NY): SRC, Inc. [consulté le 3 janvier 2017]. [En anglais seulement]
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu [National Institute for Public Health and the Environment]. 2006. Cleaning products fact sheet: to assess the risks for the consumer [PDF]. Bilthoven (NL): RIVM. Report No.: 320104003/2006. [consulté le 13 mars 2017]. [En anglais seulement]
Sakuratani Y, Kasai K, Noguchi Y, Yamada J. 2007. Comparison of predictivities of log P calculation models based on experimental data for 134 simple organic compounds. QSAR Comb Sci. 26(1):109-116. [En anglais seulement]
Santé Canada. 1995. Enquête sur l’exposition des êtres humains aux contaminants dans le milieu : Un guide pour les calculs de l’exposition.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport inédit. Ottawa (Ont.) : Santé Canada, Direction de l’hygiène du milieu. [En anglais seulement]
[SRC] Syracuse Research Corporation, Inc. 2016. Analogue/category approach read-across report of trimellitates. Rapport inédit préparé pour Santé Canada. North Syracuse (NY). [En anglais seulement]
Staples CA, Peterson DR, Parkerton TF, Adams WJ. 1997. The environmental fate of phthalate esters: a literature review. Chemosphere. 35(4):667-749. [En anglais seulement]
Stuer-Lauridsen F, Mikkelsen S, Havelund S, Birkved M, Hansen LP. 2001. Environmental and health assessment of alternatives to phthalates and to flexible PVC [PDF]. Environmental Project No. 590. Denmark: Danish Environmental Protection Agency. [consulté en février 2017]. [En anglais seulement]
Ter Veld MGR, Schouten B, Louisse J, Van Es DS, Van der Saag PT, Rietjens IMC, Murk AJ. 2006. Estrogenic potency of food packaging-associated plasticizers and antioxidants as detected in ERα and ERβ reporter gene cell lines. J Agric Food Chem. 54(12):4407-4416. [En anglais seulement]
[US EPA] United States Environmental Protection Agency. 2009. Screening-level hazard characterization: Trimellitate Category. [consulté le 13 octobre 2016]. Office of Pollution Prevention and Toxics, HPV Challenge Program. [En anglais seulement]
[US EPA] United States Environmental Protection Agency. 2012. Standard Operating Procedures for Residential Pesticide Exposure Assessment [PDF]. Washington (DC): Health Effects Division, Office of Pesticide Programs, Office of Chemical Safety and Pollution Prevention.
[US FDA] United States Food and Drug Administration. 2016. Inventory of Effective Food Contact Substance (FCS) Notifications: FCN No. 1587 BASF Corporation. [Dernière mise à jour le 28 févr.2017; consulté le 15 mars 2017]. [En anglais seulement]
Wester RC, Melendres J, Sedik L, Maibach H, Riviere JE. 1998. Percutaneous absorption of salicylic acid, theophylline, 2,4-dimethylamine, diethyl hexyl phthalic acid, and p-aminobenzoic acid in the isolated perfused porcine skin flap compared to man in vivo. Toxicol Appl Pharmacol. 151:159-165. [En anglais seulement]
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D, Richardson GM. 2013. Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. Human and Ecological Risk Assessment 19(1): 158-188. [En anglais seulement]
Won D, Lusztyk E. 2011. Chemicals Management Plan Health Canada moderate priorities: Data gathering on chemicals released to indoor air of residences from building materials and furnishings. Préparé pour Santé Canada, Report no. B3332.2. Ottawa (Ont.) : Conseil national de recherches Canada. Rapport inédit. [En anglais seulement]
Wormuth M, Scheringer M, Vollenweider M, Hungerbuhler K. 2006. What are the sources of exposure to eight frequently used phthalic acid esters in Europeans? Risk Anal. 26(3):803-824. [En anglais seulement]
Annexe A. Estimations déterministes de l’exposition quotidienne des humains au TEHT dans la poussière et les aliments
| Voie d’exposition | Nourris au sein (0 à 6 moisa) | Nourris au lait maternisé (0 à 6 moisa) | Pas nouris au lait maternisé (0 à 6 moisa) | 6 mois à 4 ansb | 5 à 11 ansc | 12 à 19 ansd | 20 à 59 anse | plus de 60 ansf |
|---|---|---|---|---|---|---|---|---|
| Aliments et boissonsg | 0,00 | 0,00 | 0,00 | 0,13 | 0,11 | 0,06 | 0,06 | 0,04 |
| Poussièreh | 2,8 | 2.8 | 2.8 | 1,5 | 0,6 | 0,02 | 0,02 | 0,02 |
| Absorption totalei | 2,8 | 2,8 | 2,8 | 1,6 | 0,7 | 0,08 | 0,08 | 0,06 |
a Hypothèses : poids de 7,5 kg (Santé Canada, 1998) et ingestion de 38 de sol par jour (Wilson et al., 2013).
b Hypothèses : poids de 15,5 kg (Santé Canada, 1998) et ingestion de 41 de sol par jour (Wilson et al., 2013).
c Hypothèses : poids de 31,0 kg (Santé Canada, 1998) et ingestion de 31 de sol par jour (Wilson et al., 2013).
d Hypothèses : poids de 59,4 kg (Santé Canada, 1998) et ingestion de 2,2 de sol par jour (Wilson et al., 2013).
e Hypothèses : poids de 70,9 kg (Santé Canada, 1998) et ingestion de 2,5 de sol par jour (Wilson et al., 2013).
f Hypothèses : poids de 72,0 kg (Santé Canada, 1998) et ingestion de 2,5 de sol par jour (Wilson et al., 2013).
g Aucune donnée mesurée de la concentration de TEHT dans les aliments n’a été trouvée au Canada ou ailleurs. Les estimations de l’absorption par les aliments sont basées sur les concentrations maximales modélisées selon le « pire scénario » dans le poisson, le lait et la viande (Stuer-Lauridsen et al. 2001). Ces données ont été appliquées de façon générale aux 12 groupes alimentaires et à leurs taux de consommation correspondants spécifiés par Santé Canada (1998) :
Produits laitiers : concentration estimée maximale de 3,0 x 10-4 (µg/kg) de TEHT dans les produits laitiers.
Viande et volaille : concentration estimée maximale de 9,0 x 10-4 (µg/kg) de TEHT dans la viande.
Poisson : concentration estimée maximale de 37 (µg/kg) de TEHT dans le poisson.
h Concentration maximale de 553,540 (µg/kg) de TEHT dans la poussière intérieure, selon 14 échantillons mesurés à Québec (Won et Lusztyk 2011). Le TEHT a également été mesuré dans la poussière intérieure de maisons et de garderies en Allemagne (Fromme et al. 2016, Nagorka et al. 2011).
i Le TEHT n’est pas volatil et il est insoluble, et par conséquent on ne s’attend pas à le trouver dans l’air et dans l’eau. Aucune donnée mesurée sur les concentrations de TEHT dans le sol n’a été trouvée. Les concentrations estimées maximales dans le sol proviennent de Stuer-Lauridsen et al. (2001), et donnent une exposition estimée inférieure à 2,5 ng/kg p.c./j, ce qui est jugé négligeable.
Annexe B. Exposition estimée des humains aux trimellitates par les produits de consommation
L’exposition par les cosmétiques a été estimée à l’aide de ConsExpo Web (2016). L’estimation de l’exposition a été calculée pour un poids corporel par défaut de 70,9 kg pour les adultes (20 ans et plus), et de 15,5 kg pour les tout-petits (6 mois à 4 ans) (Santé Canada 1998). Les paramètres estimés d’exposition par voie cutanée et voie orale, pour les cosmétiques, sont décrits dans les tableaux B-1 et B-2, respectivement. Une valeur prudente d’absorption cutanée de 1 % est présumée.
Substance – produit |
Hypothèsesa |
|---|---|
Hydratant pour le corps (TTDT ou BTIT) |
Concentrationb : 0,1 – 10 %
Adultes : Quantité de produit : 4,4 g/application (Loretz et al. 2005) Fréquence (utilisation/jour) : 1,1 (Loretz et al. 2005) Superficie exposée : corps entier – tête = 16 925 cm2 (Santé Canada 1995)
Tout-petits : Quantité de produit : 1,4 g/application (Wormuth et al., 2006) Fréquence (utilisation/jour) : 1,7 (Wormuth et al. 2006) Superficie exposée : corps entier – tête = 4 910 cm2 (Santé Canada 1995) |
Hydratant pour le visage (TEHT, TTDT ou BTIT) |
Concentration b : 0,1 – 30 %
Adultes : Quantité de produit : 1,2 g/application (Loretz et al., 2005) Fréquence (utilisation/jour) : 1,8 (Loretz et al. 2005) Superficie couverte : moitié de la superficie de la tête = 637,5 cm2 (Santé Canada 1995) |
Maquillage pour le visage (TEHT, TTDT ou BTIT) |
Concentration b : 0,1 – 60 %
Adultes : Quantité de produit : 0,54 g/application (Loretz et al., 2006) Fréquence : 1,2 fois/jour (Loretz et al. 2006) Superficie couverte : moitié de la superficie de la tête = 637,5 cm2 (Santé Canada 1995) |
Huile de massage (TTDT ou BTIT) |
Concentration b : 3 – 35 %
Adultes : Quantité de produit (g/utilisation) : 3,2 (Ficheux et al. 2016) La fréquence est inférieure à une fois par jour; les estimations de l’exposition sont par événement. Superficie exposée : superficie totale du corps – la moitié de la superficie de la tête – la moitié de la superficie du tronc = 14 380 cm2 (Santé Canada 1995) |
Crèmes de préparation pour manucure (TTDT ou BTIT) |
En l’absence de données spécifiques pour ce scénario d’exposition, l’exposition présumée était similaire au scénario avec la crème pour main, mais avec une fréquence plus faible.
Concentration b : 3 – 30 %
Adultes : Quantité de produit (g/utilisation) : 1,7 (Bremmer et al. 2006) La fréquence est inférieure à une fois par jour; les estimations de l’exposition sont par événement. Superficie exposée : mains = 910 cm2 (Santé Canada 1995) |
a Sauf indication contraire, un facteur de rétention de 1 a été utilisé.
b Communication personnelle, courriels de 2016 et 2017 de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation du risque des substances existantes de Santé Canada, sans référence.
Substance – produit |
Hypothèsesa |
|---|---|
Produits pour les lèvres (TEHT, TTDT ou BTIT) |
Concentration b : 0,1 – 74 %
Adultes : Quantité de produit : 0,10 g/application (Loretz et al., 2005) Fréquence (utilisation/jour) : 2,4 (Loretz et al. 2005)
Tout-petit Quantité de produit (g/utilisation) : 0,01 (on présume que la quantité est identique à celle des adultes) La fréquence est inférieure à une fois par jour; les estimations de l’exposition sont par événement. |
a On présume que la quantité appliquée est entièrement ingérée et qu’il n’y a pas d’exposition par voie cutanée.
b Communication personnelle, courriels de 2016 et 2017 de la Direction de la sécurité des produits de consommation de Santé Canada au Bureau de l’évaluation du risque des substances existantes de Santé Canada, sans référence
Annexe C. Tableau de lecture croisée
| Nom chimique | TEHT a | TOTM b | MDOT c | BTIT d | TTDT e |
|---|---|---|---|---|---|
| Rôle | Substance chimique cible et utilisée comme analogue pour le BTIT et le TTDT | Analogue | Analogue | Produit chimique cible | Produit chimique cible |
| no CAS | 3319-31-1 | 89-04-3 | 90218-76-1 | 70225-05-7 | 94109-09-8 |
| Structure chimique |  |
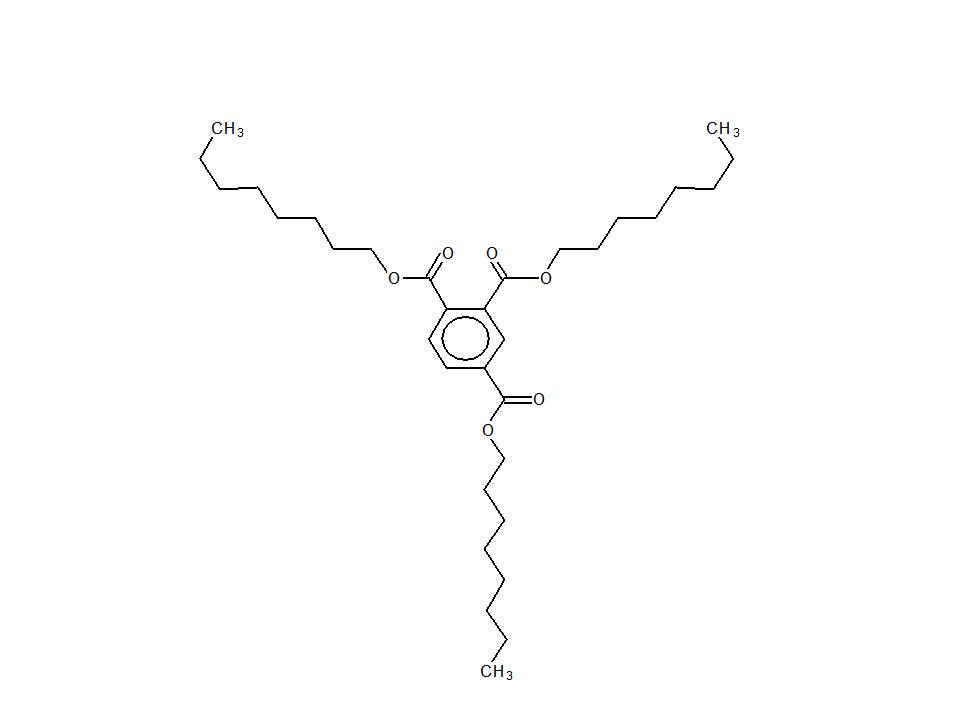 |
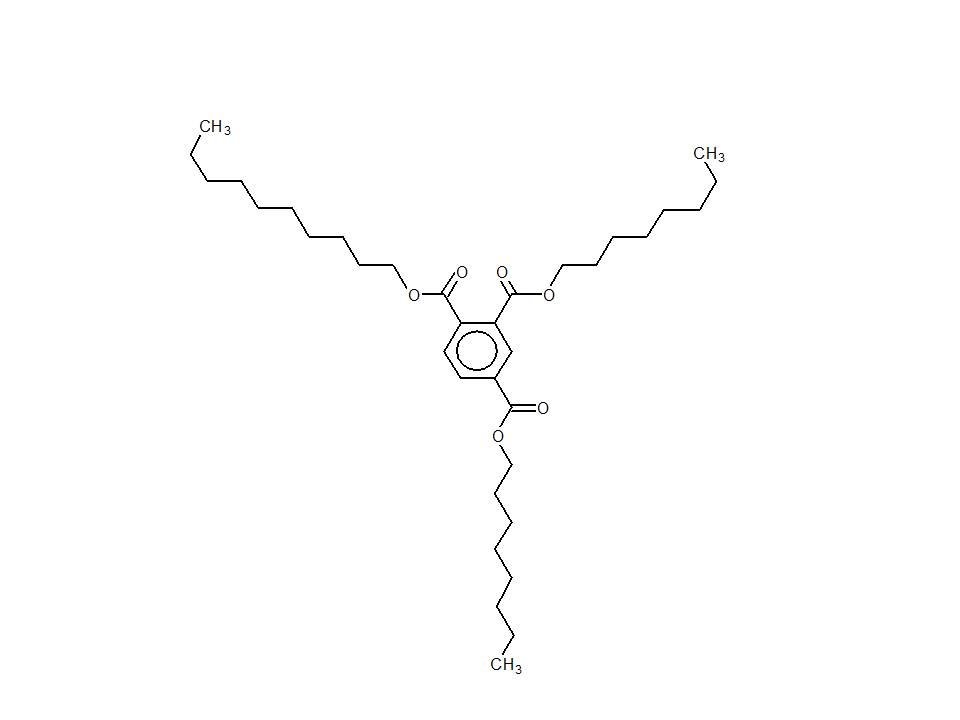 |
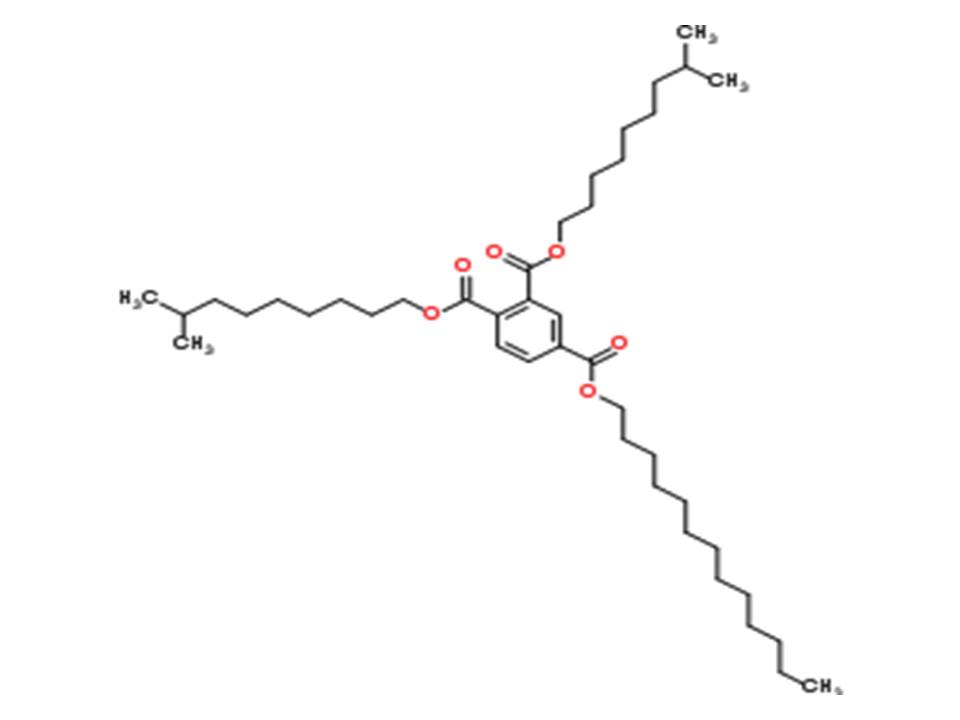 |
 |
| Nombre d’atomes de carbone sur les chaînes latérales | 8 | 8 | 8-10 | 10-13 | 13 |
| Masse moléculaire (g/mol) | 546,78 | 546,78 | 602,9 | 673,04 | 757,18 |
| Coefficient de partage Log Koe | 8 (US EPA) | 9,3 (ECHA c2007-2017c, méthode par CLHP) | 10,6 (ECHA c2007-2017d, méthode CLHP) | >10 (modélisation avec EPI Suite) | >10 (modélisation avec EPI Suite) |
| Solubilité dans l’eau (mg/L) | 3,9 x 10-4; insoluble (< 0,1) | 4,1 x 10-6 à < 1 | < 1 x 10-8 | <1 x 10-8 (modélisation avec EPI Suite) | <1 x 10-8 (modélisation avec EPI Suite) |
| Toxicocinétique et métabolisme | Une quantité limitée a été absorbée et subséquemment métabolisée | N.D. | N.D. | Faible potentiel d’absorption et de métabolisation (selon la lecture croisée) | Faible potentiel d’absorption et de métabolisation (selon la lecture croisée) |
| Toxicité aiguë | DL50 > 1 970 mg/kg p.c. | DL50 > 2 000 mg/kg p.c. | DL50 > 5 000 mg/kg p.c. (voie orale) DL50 > 2 000 mg/kg p.c. (voie cutanée) | Faible (lecture croisée) | DL50 > 1 970 mg/kg p.c. (voie orale) |
| Toxicité avec doses répétées | DSENO = 225 mg/kg p.c./j (changements hématologiques et augmentation du poids du foie) | DSENO = 30 mg/kg p.c./j (femelle) (augmentation du poids du foie et réduction du nombre de globules rouges); DMENO = 125 mg/kg p.c./j | DSE(N)O = 300 mg/kg p.c./j (augmentation du poids du foie, augmentation de la leucocytose et diminution de la globuline) | DSENO = 225 mg/kg p.c./ J (selon la lecture croisée) | DSENO = 225 mg/kg p.c./ J (selon la lecture croisée) |
| Toxicité pour la reproduction et le développement | DSE(N)O = 100 mg/kg p.c./j (diminution des spermatocytes et des spermatides) | DSEO = 500 mg/kg p.c./j (aucun changement en termes de ratio entre les sexes, de poids corporel, de viabilité ou de morphologie des petits [F1]) | DSENO = 300 mg/kg p.c./j (toxicité maternelle : diminution du poids corporel, et de la prise de poids corporel, diminution du poids utérin des animaux en gestation); DSENO = 1 000 mg/kg p.c./j (toxicité pour le développement) | DSE(N)O = 100 mg/kg p.c./j (selon la lecture croisée) | DSE(N)O = 100 mg/kg p.c./j (selon la lecture croisée) |
| Génotoxicité | Substance non génotoxique (résultat négatif pour le test d’Ames, le test tk+/ – chez les cellules de souris L5178Y ou le test CHO/hprt; résultat négatif pour le test d’aberration chromosomique sur des lymphocytes humains ou des cellules V79); résultat négatif pour le test de létalité dominante chez les rongeurs) | Substance non génotoxique (résultat négatif pour le test d’Ames, le test tk+/ – chez les cellules de souris L5178Y ou le test d’aberration chromosomique sur des cellules pulmonaires de hamster chinois) | Substance non génotoxique (résultat négatif pour le test d’Ames, le test tk+/ – chez les cellules de souris L5178Y ou le test d’aberration chromosomique sur des lymphocytes humains) | Non génotoxique (selon la lecture croisée) | Non génotoxique (selon la lecture croisée) |
| Cancérogénicité | Ne devrait pas être cancérogène | N.D. | N.D. | Ne devrait pas être cancérogène (selon la lecture croisée) | Ne devrait pas être cancérogène (selon la lecture croisée) |
Abréviations : N.D. = non disponible.
a Données décrites en détail à la section 6.2.1.
b,c Données provenant du dossier d’homologation de l’ECHA (c2007-2017c,d).
d,e Les données proviennent surtout des approches par lecture croisée par catégorie.
