Rapport d’évaluation écologique préalable
Archivée
Acides perfluorocarboxyliques à longue chaîne (C9à C20), leurs sels et leurs précurseurs
Table des matières
- Sommaire
- Introduction
- Identité de la substanceIdentité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l’environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Conclusion
- Références
- Annexe 1 : Liste des APFC à longue chaîne (C9 à C20), de leurs sels et de leurs précurseurs (cette liste n’est pas exhaustive)
- Annexe 2 : Identification des précurseurs d’APFCà longue chaîne
Sommaire
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation écologique préalable des acides perfluorocarboxyliques (APFC) à longue chaîne (C9 à C20), de leurs sels et de leurs précurseurs. Dans la présente évaluation, les acides perfluorocarboxyliques à longue chaîne (C9 à C20) seront appelés APFC à longue chaîne. Bien que les APFC à longue chaîne eux-mêmes ne figurent pas sur la Liste intérieure des substances (LIS), certains de leurs précurseurs, figurant sur la LIS, ont été catégorisés en vertu de l’article 73 de la LCPE (1999). L’évaluation a été menée en réponse à des données empiriques qui ont démontré que certains APFC se bioaccumulent, qu’ils sont persistants, qu’ils sont susceptibles d’être transportés à grande distance (par l’intermédiaire des précurseurs), qu’ils sont largement répandus et que leurs concentrations dans les tissus de la faune arctique décrivent une tendance à la hausse.
La présente évaluation écologique est axée sur les APFC dont la chaîne carbonée compte de 9 à 20 atomes de carbone inclusivement, ainsi que sur leurs sels et leurs précurseurs. Les précurseurs, à savoir des substances qui pourraient se transformer ou se dégrader en APFC à longue chaîne, sont considérés d’après leur contribution à la présence totale de ces acides à longue chaîne dans l’environnement. Cette évaluation définit les précurseurs comme étant toute substance dont le groupement alkyle perfluoré de formule CnF2n+1 (où 8 = n = 20) est directement lié à n’importe quel groupe fonctionnel autre que le fluor, le chlore ou le brome.
Les APFC à longue chaîne, leurs sels et leurs précurseurs sont d’origine anthropique. En 2000 et 2004, les enquêtes menées auprès de l’industrie par Environnement Canada en vertu de l’article 71 de la LCPE(1999) ont révélé qu’aucun APFC à longue chaîne n’avait été fabriqué ou importé au Canada. Toutefois, les deux enquêtes ont signalé l’importation au Canada de plusieurs précurseurs de ces acides.
Selon les études de toxicité standards sur des organismes aquatiques, les APFC à longue chaîne avaient une toxicité de faible à modérée, les valeurs de toxicité aiguë se situant entre 8,8 et 285 mg/L. Il existe deux études portant sur la toxicité des APFC à longue chaîne chez les espèces terrestres. Dans une de ces études, aucun effet nocif n’a été observé sur des poulets mâles auxquels on a administré jusqu’à 1,0 mg/kg de poids corporel d’APFC en C10, trois fois par semaine pendant trois semaines. Dans une autre étude, l’exposition d’un nématode vivant dans le sol à un APFC en C9 a provoqué la létalité aiguë à 306 mg/L et des effets sur plusieurs générations (diminution de la fécondité) à 0,000464 mg/L.
Différentes études montrent la capacité des APFC à longue chaîne à entraîner d’autres types d’effets. Il a été montré que les APFC en C9 et en C10 compromettent le mécanisme de résistance multixénobiotique chez les moules marines à des concentrations situées entre 2,23 et 3,65 mg/L. Une exposition par voie alimentaire pendant 14 jours à des concentrations d’APFC en C9 à C12 allant de 2,56 × 10-5 à 2 mg/g a provoqué la vitellogenèse chez la truite arc-en-ciel. Un APFC en C9 peut causer du stress oxydatif chez le grand cormoran. Les APFC en C9 à C11 ont activé le récepteur a activé par les proliférateurs des peroxysomes (PPARa) dans le foie de phoques du Baïkal. Le PPARajoue un rôle physiologique essentiel comme détecteur de lipides et régulateur du métabolisme lipidique. Les APFC en C9 et en C10 sont également des sensibilisants chimiques chez la moule marine Mytilus californianus et ils permettent à des substances toxiques qui seraient normalement éliminées de s’accumuler dans les tissus de cette moule. Quant aux APFC en C12 et en C14, ils ont augmenté le potentiel membranaire mitochondrial de l’algue d’eau douce Scenedesmus obliquus, ce qui indique des dommages à la fonction mitochondriale.
On ne dispose d’aucune donnée expérimentale sur la persistance des APFC à longue chaîne dans les conditions environnementales naturelles. Toutefois, la liaison carbone-fluor est l’une des plus fortes existant dans la nature, ce qui rend la molécule très stable et résistante à la dégradation. La chaîne perfluorée offre une résistance exceptionnelle aux attaques chimiques et thermiques. Étant donné la force de la liaison carbone-fluor, on s’attend donc à ce que les APFC à longue chaîne soient persistants. En outre, des APFC à longue chaîne ont été détectés dans des régions éloignées (p. ex., dans l’Arctique canadien). Bien que les mécanismes de transport ne soient pas bien compris, certains précurseurs peuvent être transportés sur de grandes distances jusqu’à des régions éloignées, où ils peuvent ensuite se transformer en APFC à longue chaîne par dégradation.
Des facteurs de bioconcentration (FBC) empiriques supérieurs à 5 000 ont été signalés pour les APFC en C11, en C12 et en C14. De plus, d’après des données empiriques sur les réseaux trophiques, il existe un potentiel significatif de bioamplification ou d’amplification trophique des APFC en C9 à C14 tant chez les organismes à respiration aquatique que chez ceux à respiration aérienne. On ne dispose pas de données expérimentales ou de données prédites sur la bioaccumulation des APFC à longue chaîne de plus de 14 atomes de carbone. Il est néanmoins possible que ces APFC à plus longue chaîne se bioaccumulent ou se bioamplifient chez les espèces marines ou terrestres selon leur conformation chimique. Cependant, les critères numériques de bioaccumulation, énoncés dans le Règlement sur la persistance et la bioaccumulation, ont été calculés à partir des données sur la bioaccumulation chez les espèces aquatiques d’eau douce (poissons) seulement, et pour des substances dont la répartition se fait surtout dans les lipides. Par conséquent, les critères ne reflètent peut-être pas entièrement le potentiel de bioaccumulation des APFC à longue chaîne qui se répartissent surtout dans le foie, le sang et les reins des mammifères terrestres et marins. Ainsi, la plupart des APFC à longue chaîne ainsi que leurs sels et leurs précurseurs ne rencontre pas les critères numériques pour la bioaccumulation tel qu’énoncé dans le Règlement sur la persistance et la bioaccumulation.
Des APFC en C9 à C15 ont été mesurés dans le foie de phoques, de renards, de poissons, d’ours blancs, de requins du Groenland, de narvals, de bélugas et d’oiseaux, dans l’Arctique canadien comme dans la région des Grands Lacs. Les concentrations variaient de valeurs inférieures à la limite de détection jusqu’à 180 ng/g poids humide de foie, les concentrations les plus élevées se trouvant chez les ours blancs, suivis des requins du Groenland, des narvals et des bélugas. Partout à travers le monde, des APFC en C9 à C15 ont été signalés chez le phoque annelé, l’otarie à fourrure et le phoque commun, chez divers dauphins (à flancs blancs, à gros nez, à nez blanc, sotalie de Chine), le marsouin aptère, le goéland bourgmestre, le grand cachalot, le castor, le tigre, les rats sauvages et plusieurs espèces d’oiseaux. Les concentrations variaient de valeurs inférieures à la limite de détection jusqu’à 480 ng/g poids humide, et les concentrations les plus élevées se trouvaient chez le dauphin à nez blanc.
De 1980 à 2000, les concentrations d’APFC à longue chaîne en C10 et en C11 dans le foie de phoques annelés du Groenland ont augmenté de 3,3 et de 6,8 % par an, respectivement. De 1992 à 2005, les concentrations moyennes d’APFC en C9 et en C10 mesurées dans le foie de phoques du Baïkal étaient 1,2 à 1,7 fois plus élevées. Entre 1972 et 2002, le temps moyen de doublement des concentrations dans le foie des ours blancs de l’Arctique se situait entre 5,8 et 9,1 ans, pour les APFC en C9 à C11. De 1993 à 2004, les concentrations dans des échantillons de foie de phoque annelé ont augmenté, avec un temps de doublement des APFC en C9 à C12 allant de 4 à 10 ans. Dans des échantillons de foie de fulmar boréal, les concentrations des APFC en C9 à C15 ont augmenté de 1987 à 1993 et sont restées stables entre 1993 et 2003. Quant aux concentrations d’APFC en C9 à C15 mesurées dans des échantillons de foie de guillemot de Brünnich, elles ont connu une hausse de 1975 à 2004. Les concentrations des APFC en C9 à C13 ont augmenté de façon significative dans les œufs entiers de goélands argentés prélevés en Norvège de 1983 à 1993. En ce qui concerne les bélugas mâles du Nunavut, on a enregistré une augmentation annuelle des APFC en C9 à C12 dans le foie de 1,8 ng/g poids humide de 1980 à 2010.
L’évaluation est fondée sur une méthode du poids de la preuve en ce qui concerne la persistance, la bioaccumulation, la présence répandue, les tendances temporelles chez certaines espèces (c.-à-d. oiseaux de l’Arctique canadien, mammifères terrestres et marins), le transport à grande distance et les concentrations d’APFC à longue chaîne dans l’environnement et le biote (y compris les régions éloignées du Canada).
Selon l’information disponible, il est conclu que les APFC à longue chaîne, leurs sels et leurs précurseurs pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, il est conclu que les APFC à longue chaîne et leurs sels sont extrêmement persistants et qu’ils répondent aux critères de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation. Les APFC à longue chaîne ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. Néanmoins, le poids de la preuve est suffisant pour conclure que les APFC à longue chaîne et leurs sels s’accumulent et se bioamplifient chez les mammifères terrestres et marins.
Il est conclu que les APFC à longue chaîne ainsi que leurs sels et leurs précurseurs satisfont à au moins un des critères énoncés à l’article 64 de la LCPE (1999).
Introduction
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999), le ministre de l’Environnement a effectué une évaluation écologique préalable des acides perfluorocarboxyliques (APFC) à longue chaîne, de leurs sels et de leurs précurseurs. Ils ont été reconnus comme des substances préoccupantes à l’issue du processus de déclaration de substances nouvelles d’Environnement Canada et par l’entremise du Plan d’action pour l’évaluation et la gestion des acides perfluorocarboxyliques et de leurs précurseurs (Canada, 2006). En 2004, Santé Canada et Environnement Canada ont évalué quatre substances à base de télomères fluorés dans le cadre des dispositions de la LCPE (1999) concernant les substances nouvelles. On soupçonnait ces substances d’être « toxiques », car elles contenaient des précurseurs directs des APFC et on les jugeait capables de se décomposer en ces acides. Les modifications au Règlement sur certaines substances toxiques interdites (2005) ont été publiées dans la Partie I de la Gazette du Canada le 17 juin 2006 (Canada, 2006). Ces modifications ont été faites afin d’établir un règlement visant à maintenir les interdictions liées à ces nouvelles sources d’APFC. De plus, les précurseurs, soit les substances portant les nos CAS (numéros de registre du Chemical Abstract Service) 65530-63-4, 65530-71-4, 65530-72-5, 65530-74-7, 68391-08-2, 68412-68-0, 115592-83-1, 65530-61-2, 70969470, 65530-66-7, 65605-58-5, 65605-70-1, 65636-35-3, 68239-43-0 et 11005343-5, répondaient aux critères environnementaux de la catégorisation relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes non humains. L’évaluation des risques que présentent toutes ces substances pour la santé humaine n’a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d’exposition et du risque pour la santé élaborés par Santé Canada aux fins de la catégorisation des substances de la Liste intérieure des substances (LIS).
La présente évaluation écologique est axée sur les APFC dont la chaîne carbonée compte de 9 à 20 atomes de carbone inclusivement, ainsi que sur leurs sels et leurs précurseurs. Cette gamme de longueurs de chaînes carbonées correspond à la gamme prise en compte dans l’évaluation menée en vertu du Programme des substances nouvelles. Les précurseurs ont été pris en compte selon leur contribution à la présence totale des APFC à longue chaîne dans l’environnement.
Les données pertinentes pour l’évaluation préalable des APFC à longue chaîne sont tirées de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées jusqu’en février 2011. En outre, des enquêtes sur les composés perfluoroalkyliques et fluoroalkyliques ont été menées auprès de l’industrie pour les années 2000 et 2004 au moyen d’un avis publié dans la Gazette du Canada conformément à l’article 71 de la LCPE (1999) [Canada, 1999]. Ces enquêtes ont permis de recueillir des données sur la fabrication, l’importation et les utilisations des composés perfluoroalkyliques et fluoroalkyliques au Canada. Des études toxicologiques soumises par l’industrie en application de l’article 70 de la Loi ont également été prises en compte.
Les évaluations préalables mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de l’article 64 de la LCPE (1999) [Canada, 1999]. La démarche suivie dans cette évaluation écologique préalable consistait à examiner les renseignements scientifiques et techniques pertinents et à tirer des conclusions fondées sur de multiples éléments d’information, tels que la persistance, la bioaccumulation, la toxicité, les tendances temporelles dans le biote et la présence répandue dans le biote de la substance. Cette évaluation préalable ne présente pas un examen exhaustif de toutes les données disponibles. Elle fait plutôt état des études et des éléments d’information essentiels qui appuient les conclusions.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes d’Environnement Canada. Cette évaluation écologique a fait l’objet d’une consultation et d’un examen écrit par des pairs. De plus, l’ébauche de cette évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Bien que les commentaires externes et publics aient été pris en considération, Environnement Canada assume la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Identité de la substance
Le présent rapport évalue les APFC à longue chaîne (C9 à C20), leurs sels et leurs précurseurs. L’acide pentadécafluorooctanoïque (APFO ou C8) a fait l’objet d’une évaluation distincte.
Par « perfluorés », on entend les substances chimiques fluorées dans lesquelles les atomes d’hydrogène directement liés aux atomes de carbone sont tous remplacés par des atomes de fluor. Les APFC à longue chaîne et leurs sels constituent une série homologue de substances ayant la formule moléculaire suivante : CnF2n+1CO2H (où 8 = n = 20). Dans le présent document, les acides perfluorocarboxyliques à longue chaîne (C9 à C20) seront appelés « APFC à longue chaîne ».
Les APFC à longue chaîne ne figurent pas sur la LIS et n’ont pas été soumis aux dispositions relatives à la catégorisation de la LCPE (1999) [Canada, 1999]. Certains des 90 précurseurs déterminés figurent toutefois sur cette liste et étaient visés par la catégorisation. La présente évaluation prend en compte tout précurseur des APFC à longue chaîne qui pourrait se transformer ou se dégrader en APFC en C9 à C20, étant donné ses utilisations semblables et ses similarités sur le plan des propriétés physiques et chimiques et des caractéristiques structurelles. Aux fins de la présente évaluation, les précurseurs sont définis comme étant toute substance dont le groupement alkyle perfluoré de formule CnF2n+1 (où 8 = n = 20) est directement lié à n’importe quel groupe fonctionnel autre que le fluor, le chlore ou le brome. On n’a pas directement tenu compte, dans l’évaluation, des possibles effets cumulatifs des APFC à longue chaîne, de leurs précurseurs et de leurs sels, mais on reconnaît que les précurseurs et les sels pourraient contribuer à la présence totale des APFC à longue chaîne dans l’environnement. L’expression « CX » sert à définir la longueur de la chaîne d’atomes de carbone de l’acide perfluorocarboxylique en question; ainsi, C9représente un APFC à neuf atomes de carbone.
Environnement Canada considère quelque 90 composés perfluoroalkylés (ou composés d’alkyles perfluorés) comme des APFC à longue chaîne, des sels ou des précurseurs de ces derniers (voir l’annexe II : Identification des précurseurs d’APFC à longue chaîne). La catégorie des APFC à longue chaîne a été définie d’après le jugement de spécialistes, la structure chimique et l’estimation de la biodégradation à l’aide du modèle CATABOL (Mekenyan et al., 2002). Ainsi, les structures ont été analysées pour déterminer la possibilité que les substances en question se décomposent en APFC à longue chaîne. Le modèle CATABOL, qui a été étalonné à partir des résultats d’essais de biodégradation du MITI (Ministry of International Trade and Industry[ministère du Commerce international et de l’Industrie], Japon), prévoit la biodégradation sur une période de 28 jours. On sait que, étant donné le caractère très limité des données sur la dégradation des composés perfluorés dans l’ensemble d’étalonnage, certains des produits de dégradation prévus par CATABOL pourraient constituer des résultats peu fiables ou non pertinents dans les conditions naturelles. Il est à noter que, dans le cas de la chimie des composés perfluorés, le processus de dégradation sera plus long que ce qu’indique CATABOL, mais il est difficile d’estimer dans quelle mesure, surtout pour les substances de masse moléculaire élevée comme les oligomères et les polymères. La liste à l’annexe I donne des exemples de substances appartenant au groupe des APFC à longue chaîne, mais elle n’est pas exhaustive.
L’Organisation de coopération et de développement économiques (OCDE) a rédigé le document intitulé Preliminary Lists of PFOS, PFAS, PFOA and Related Compounds that may Degrade to PFCA (OCDE, 2007), pour appuyer ses activités de gestion des risques associés aux composés perfluorés; ce document combine les renseignements de divers pays membres, dont le Canada. L’OCDEa dressé une liste préliminaire d’environ 850 substances perfluorées connues, dont la plupart peuvent potentiellement se décomposer en APFC. Les fluoropolymères comme le polytétrafluoroéthylene (PTFE) sont considérés comme stables et ne sont donc pas classés parmi les précurseurs d’APFC sur la liste de l’OCDE. Certains APFC sont utilisés comme agents technologiques dans la fabrication de fluoropolymères, et de très faibles concentrations d’APFC pourraient être présentes dans les produits finis; toutefois, les APFC ne sont pas incorporés à la structure polymérique. Les précurseurs d’APFC à longue chaîne visés par la présente évaluation font aussi partie de la liste de l’OCDE.
Tableau 1. Identité des substances – acides perfluorocarboxyliques à longue chaîne
| Nom dans le Chemical Abstract Index | Sigle | Formule Moléculaire | Formule développée | N° CAS | Autres noms |
|---|---|---|---|---|---|
| Acide hepta-décafluoro-nonanoïque (APFC en C9) |
APFN | C9 H F17 O2 |  |
375-95-1 (LES) | C 1800; acide hepta-déca-fluorono-nanoïque; acide perfluoro-nonanoïque; acide perfluoro-pélargonique |
| Acide nona-décafluoro-décanoïque (APFC en C10) |
APFD | C10 H F19 O2 |  |
335-76-2 (LES) | Acide nona-décafluoro-n-décanoïque; Acide perfluoro-n-décanoïque; Acide perfluoro-caprique; Acide perfluoro-décanoïque |
| Acide hénéicosa-fluoroun-décanoïque (APFC en C11) |
APFUnD | C11 H F21 O2 |  |
2058-94-8 (ne figure ni sur la LIS ni sur la LES) | Acide hénéicosa-fluoroun-décanoïque; Acide perfluoroun-décanoïque; Acide perfluoroun-décylique |
| Acide tricosa-fluorodo-décanoïque (APFC en C12) |
APFTrD | C12 H F23 O2 |  |
307-55-1 (LES) | Acide perfluoro-dodé-canoïque; Acide perfluoro-laurique |
| Acide pentacosa-fluorotri-décanoïque (APFC en C13) |
APFTrD | C13 H F25 O2 |  |
72629-94-8 (not listed on NDSL or DSL) | Acide perfluoro-tri-décanoïque |
| Acide heptacosa-fluorotétra-décanoïque (APFC en C14) |
APFTD | C14 H F27 O2 |  |
376-06-7 (NDSL) | Acide perfluoro-myristique; Acide perfluoro-tétra-décanoïque |
| Acide perfluoro-myristique; Acide perfluoro-tétra-décanoïque | APFPeD | C15H F29O2 |  |
141074-63-7 (not listed on NDSL or DSL) | Acide perfluoro-penta-décanoïque |
| Acide perfluoro-palmitique (APFC en C16) |
APFHxD | C16HF31O2 |  |
67905-19-5 (NDSL) | Acide perfluoro-palmitique; Acide perfluoro-hexa-décanoïque; Acide hexa-décanoïque |
Acide perfluoro-palmitique; Acide perfluoro-hexadécanoïque; Acide hexa-décanoïque |
APFHpD | C17HF33O2 |  |
57475-95-3 (not listed on the NDSL or DSL) | -- |
| Acide perfluoro-stéarique (APFC en C18) |
APFOD | C18HF35O2 |  |
16517-11-6 (NDSL) | Acide perfluoro-stéarique; Acide perfluoro-octa-décanoïque; Acide octa-décanoïque |
| Acide perfluoro-nona-décanoïque (APFC en C19) |
APFND | C19HF37O2 |  |
133921-38-7 (not listed on NDSL or DSL) | -- |
| Acide perfluoro-éicosanoïque (APFC en C20) |
C20HF39O2 |  |
68310-12-3 (NDSL) | Acide nona-triaconta-fluoro-éico-sanoïque; Acide nona-triaconta-fluoro-éico-sanoïque |
LES = Liste extérieure des substances. Les substances qui ne figurent pas sur la LIS sont considérées comme nouvelles au Canada et doivent être déclarées. Les substances figurant sur la LESsont assujetties à une déclaration, mais les exigences en matière de renseignements sont réduites.
Propriétés physiques et chimiques
L’information sur les propriétés physiques et chimiques des APFC à longue chaîne est limitée. Le tableau 2 présente les données sur les propriétés physiques et chimiques disponibles pour les APFC à longue chaîne. L’hypothèse selon laquelle la conformation de la liaison carbone-carbone changerait avec l’allongement de la chaîne a été avancée : les chaînes plus longues deviendraient hélicoïdales (Wang et Ober, 1999), ce qui donnerait des molécules à section transversale plus petite, dans lesquelles la chaîne pourrait se replier sur elle-même ou n’être pas complètement linéaire. Le cas échéant, les propriétés physiques et chimiques des acides à plus longue chaîne seraient ainsi différentes de celles des APFC linéaires (c.-à-d. < C8); toutefois, on ne dispose pas de données sur les propriétés physiques et chimiques des APFC à longue chaîne hélicoïdale.
Tableau 2. Propriétés physiques et chimiques disponibles des APFC à longue chaîne
| Propriété | Valeur | Type | Référence |
|---|---|---|---|
| APFC en C9 | |||
| Masse moléculaire (g/mol) | 464,08 | – | – |
| Point de fusion (°C) | 77 | Expérimental | Fontell et Lindman, 1983 |
| 71 | Blancou et al., 1976 | ||
| 71-72 | Herbst et al., 1985 | ||
| 65 (CCl4) | Beneficemalouet et al., 1991 | ||
| 59,3-61,1 | Kunieda et Shinoda, 1976 | ||
| 69-71 | Ishikawa et al., 1983 | ||
| Point d’ébullition (°C) | 203,4 | Calculé | Kaiser et al., 2005 |
| Pression de vapeur (Pa) à 25 °C | 1,3 à 99,97 kPa (99,6 à 203 °C) |
Calculé | Kaiser et al., 2005 |
| 0,10 | Expérimental | Arp et al., 2006 | |
| Solubilité dans l’eau | < 0,2 en pourcentage pondéral à 60 °C | Expérimental | Fontell et Lindman, 1983[1] |
| 1,3 g/L (concentration micellaire critique) | Expérimental | Kunieda et Shinoda, 1976[1] | |
| pKa (sans dimension) | < 0,8 | Calculé | Goss, 2008 |
| Log Kco (sans dimension) | 2,3-2,48 | Expérimental | Higgins et Luthy, 2006 |
| APFC en C10 | |||
| Masse moléculaire (g/mol) | 514,08 | – | – |
| Point de fusion (°C) | 87,4-88,2 (CCl4) | Expérimental | Bernett et Zisman, 1959 |
| 87,4-88,2 (toluène) | Bernett et Zisman, 1959 | ||
| 83,5-85,5 (CCl4, éthanol) |
Mukerjee et Handa, 1981 | ||
| 76,5 (CCl4) | Ikawa et al., 1988 | ||
| 87,4-88,2 | Hare et al., 1954 | ||
| Point d’ébullition (°C) | 218 | Expérimental | Kauck et Diesslin, 1951 |
| 219,4 | Calculé | Kaiser et al., 2005 | |
| 203,4 | Calculé | Kaiser et al., 2005 | |
| 218 | Expérimental | Sigma Aldrich, 2004 | |
| Pression de vapeur (Pa) à 25 °C | 3,1 à 99,97 kPa (129,6 à 218,9 °C) |
Calculé | Kaiser et al., 2005 |
| –0,64 | Expérimental | Arp et al., 2006 | |
| 0,10 | Expérimental | Arp et al., 2006 | |
| Solubilité dans l’eau (g/L) | 5,14 | Expérimental | Kauck et Diesslin, 1951 |
| 0,40 (concentration micellaire critique) | Bernett et Zisman, 1959[1] | ||
| 0,46 (concentration micellaire critique à 30 °C) | Klevens et Raison, 1954[1] | ||
| pKa (sans dimension) | 2,58 | Calculé | Moroi et al., 2001 |
| Log Kco (sans dimension) | 2,65-2,87 | Expérimental | Higgins et Luthy, 2006 |
| APFC en C11 | |||
| Masse moléculaire (g/mol) | 564,1 | – | – |
| Point de fusion (°C) | 112-114 | Expérimental | Huang et al., 1987 |
| 97,9-100,3 | Kunieda et Shinoda, 1976 | ||
| Point d’ébullition (°C) | 238,4 à 101,325 kPa | Calculé | Kaiser et al., 2005 |
| Pression de vapeur (Pa) à 25 °C | 0,6 à 99,97 kPa (112 à 237,7 °C) |
Calculé | Kaiser et al., 2005 |
| –0,98 | Expérimental | Arp et al., 2006 | |
| Log Kco (sans dimension) | 3,19-3,41 | Expérimental | Higgins et Luthy, 2006 |
| APFC en C12 | |||
| Masse moléculaire (g/mol) | 614,1 | – | – |
| Point de fusion (°C) | 112,6-114,7 (CCl4, toluène) |
Expérimental | Bernett et Zisman, 1959 |
| 112,6-114,7 | Hare et al., 1954 | ||
| 112-114 | Huang et al., 1987 | ||
| Point d’ébullition (°C) | Non disponible | ||
| Pression de vapeur (Pa) à 25 °C | 0,9 à 99,96 kPa (127,6 à 247,7 °C) | Calculé | Kaiser et al., 2005 |
| APFC en C13 | |||
| Masse moléculaire (g/mol) | 664,0989 | – | – |
| Point de fusion (°C) | 117,5-122 | Expérimental | Kunieda et Shinoda, 1976 |
| APFC en C14 | |||
| Masse moléculaire (g/mol) | 714,12 | – | – |
| Point de fusion (°C) | 130,4 (hexane) | Expérimental | Lehmler et al., 2001 |
| 130 | Kunieda et Shinoda, 1976 | ||
| APFC en C15 | |||
| Masse moléculaire (g/mol) | 764,1129 | – | |
Abréviations : Kco, coefficient de partage carbone organique-sédiments; pKa, constante de dissociation acide.
Sources
On ne connaît aucune source naturelle d’APFC à longue chaîne, de leurs sels ou de leurs précurseurs (Kissa, 1994). Leur présence dans l’environnement est attribuable uniquement à l’activité humaine. Une enquête menée auprès de l’industrie par Environnement Canada en 2000, en application de l’article 71 de la LCPE (1999) [Canada, 1999], a permis de recenser 256 composés perfluoroalkylés faisant l’objet d’un commerce au Canada pour les années civiles 1997, 1998, 1999 et 2000 (Environnement Canada, 2001). La fabrication d’APFC à longue chaîne ou leur importation au Canada n’a pas été déclarée. Une autre enquête menée en 2004 auprès de l’industrie par Environnement Canada sur les substances perfluoroalkylées et fluoroalkylées a elle aussi indiqué qu’aucun APFC à longue chaîne n’avait été fabriqué ou importé au Canada (Environnement Canada, 2005). Dans le cadre des deux enquêtes, l’importation au Canada de 1 000 à 100 000 kg de précurseurs d’APFC à longue chaîne a toutefois été déclarée.
Utilisations
L’APFC en C9 est employé dans des agents tensioactifs et dans la production de fluoropolymères, principalement le poly(fluorure de vinylidène) [Prevedouros et al., 2006]. D’après les renseignements dont on dispose, les APFC à longue chaîne sont rarement utilisés de manière intentionnelle dans les produits. Toutefois, des précurseurs couramment utilisés qui sont présent dans des produits commerciaux, tels que les fluorotélomères, soit des substances dérivées d’alcools fluorotélomériques (FTOH) ou d’autres substances à base de fluorotélomères, peuvent se dégrader et produire des APFC à longue chaîne. Les fluorotélomères forment un sous-groupe de substances perfluorées produites par un processus appelé télomerisation, pouvant mettre en jeu des molécules à chaînes fluorocarbonées de diverses longueurs. Les FTOH ne sont pas entièrement fluorés puisqu’une chaîne hydrocarbure à deux carbones est liée à la chaîne perfluorocarbonée. Des époxydes, des oléfines ou des alcools fluorotélomériques sont employés comme unités élémentaires dans la production de substances à base de fluorotélomères. Ces substances rendent les substrats résistants aux huiles, aux graisses, à l’eau et aux taches. Certaines substances fluorotélomériques peuvent aussi être utilisées comme monomères afin de produire des fluorotélomères polymériques possédant les mêmes caractéristiques.
Rejets dans l’environnement
Rejets directs
On ne dispose d’aucune donnée sur les rejets directs d’APFCà longue chaîne, provenant de l’utilisation et de la fabrication industrielles, dans l’environnement, au Canada.
Rejets indirects
On dispose de certaines données empiriques sur la dégradation des polymères à base de fluorotélomères en APFC à longue chaîne. Les alcools fluorotélomériques (FTOH) qui possèdent un nombre x d’atomes de carbone produisent des intermédiaires tels que les acides carboxyliques fluorotélomériques insaturés (ACFTIx:2) et les acides carboxyliques fluorotélomériques (ACFTx:2) qui peuvent à leur tour se décomposer en APFC à longue chaîne. Les FTOH eux-mêmes peuvent donner des APFC par biodégradation ou métabolisation, comme le montrent diverses études (Hagen et al., 1981; Lange, 2002; Dinglasan et al., 2004; Kudo et al., 2005; Martin et al., 2005; Wang et al., 2005a, 2005b; Fasano et al., 2006, 2008; Liu et al., 2007; Nabb et al., 2007). En outre, Kudo et al. (2005), Martin et al. (2005) et Liu et al. (2007) présentent d’autres indications que des ACFT et des ACFTIsont formés comme intermédiaires lors de la biodégradation ou la métabolisation des FTOH. Une faible quantité d’APFCen C9 a été produite dans un système au peroxyde d’hydrogène photoinduit (solutions à 10 mM et 100 μM), ce qui démontre la dégradation rapide de FTOH 8:2 en quelques minutes à quelques heures par l’intermédiaire de la formation d’aldéhydes fluorotélomériques 8:2, d’ACFT 8:2 et d’ACFTI 8:2 (Gauthier et Mabury, 2005).
On a constaté que les FTOH étaient une source potentielle d’APFC à longue chaîne lorsqu’on a trouvé des métabolites de ces alcools dans le biote (Smithwick et al., 2006; Butt et al., 2008; Powley et al., 2008; Furdui et al., 2007). On s’attend à ce que la métabolisation des FTOH forme des intermédiaires comme les ACFT et les ACFTI (Dinglasan et al., 2004; Wang et al., 2005a, 2005b). Houde et al. (2005) ont signalé la présence d’ACFTI 8:2 et 10:2 dans le plasma de dauphins à gros nez de la région du golfe du Mexique, le long de la côte est de l’Atlantique. Aucun ACFT n’a été détecté. Une étude sur les tendances temporelles effectuée par Butt et al. (2008) a également révélé la présence d’ACFTI dans tous les échantillons de foie de phoque annelé provenant de l’Arctique canadien. Furdui et al. (2007) ont indiqué la présence d’ACFTI 8:2 et d’ACFTI 10:2 dans 52 % et 40 %, respectivement, de tous les échantillons de touladis prélevés dans les Grands Lacs. La présence d’ACFT et d’ACFTI dans la faune est également signalée dans un certain nombre d’études comme celles de Taniyasu et al. (2005), Verreault et al. (2005), Powley et al. (2008), Smithwick et al. (2006), Butt et al. (2007a, 2007b, 2008) et Furdui et al. (2007). Dinglasan et Mabury (2005) ont montré que des FTOH 8:2, des ACFT 8:2 et des ACFTI 8:2 sont formés par la dégradation d’un monomère de méthacrylate télomérique 8:2 utilisé dans la fabrication des polymères. Bien que le taux de dégradation n’ait pas été établi, l’inoculat destiné au traitement aérobie des eaux usées a pu décomposer de manière significative le monomère au cours de l’essai d’une durée d’environ 73 jours.
Yoo et al. (2010) ont mesuré les concentrations de FTOH dans le sol de certains champs (près de Decatur, en Alabama) sur lesquels on avait épandu des boues d’épuration. Des boues provenant d’une usine de traitement des eaux usées (UTEU) à Decatur, en Alabama, ont été épandues sur des champs agricoles pendant plus d’une décennie; cette usine de traitement des eaux usées recueillait les flux de déchets des industries qui utilisaient des composés fluorotélomériques (Washington et al., 2010). Yoo et al. (2010) ont constaté que les champs amendés par les boues présentaient des concentrations de FTOH dans le sol de surface de 5 à 73 ng/g poids sec. La concentration de FTOH la plus élevée était celle du FTOH 10:2, dont les concentrations variaient de moins de 5,6 à 166 ng/g poids sec. Les demi-vies des FTOH étaient comprises entre 0,85 et 1,8 année, ce qui laisse entendre que l’épandage des boues est une voie possible pour la dégradation des FTOH en APFO et autres acides perfluorocarboxyliques. Washington et al.(2010) ont également constaté que ces champs amendés par les boues présentaient des concentrations élevées d’APFC, notamment des APFC en C10(< 990 ng/g) et en C11 (< 530 ng/g). Les FTOH 6:2, FTOH 8:2 et FTOH 10:2 ont été mesurés dans l’air à deux sites d’enfouissement en Ontario; les concentrations étaient inférieures à 5 000 pg/m3 (en amont) et variaient entre 0 et moins de 25 000 pg/m3 sur le site (Ahrens et al., 2010a).
L’abondance relative des APFC linéaires par rapport à celle des APFC ramifiés peut donner une idée de leur source possible. Les APFC linéaires peuvent indiquer une dégradation principalement à partir de FTOHlinéaires et peuvent révéler que les APFC résultent de la télomérisation plutôt que de la fluoration électrochimique (procédé qui générerait environ 20 % d’isomères ramifiés). Il a également été suggéré que la dégradation d’un FTOH donné devrait former, par oxydation atmosphérique, un nombre égal d’APFCdont la chaîne compte un nombre pair de carbones et d’APFC dont la chaîne compte un nombre impair de carbones (De Silva et Mabury, 2004; Ellis et al., 2004b). De Silva et Mabury (2004) ont déterminé qu’au moins 99 % des APFC contenus dans les échantillons de foie d’ours blancs provenant du sud-ouest de la baie d’Hudson et de l’est du Groenland étaient des isomères linéaires. Il a été montré que les FTOH donnent, en se décomposant, des concentrations relativement égales d’APFC dont la chaîne compte un nombre pair de carbones et d’APFCdont la chaîne compte un nombre impair de carbones (Ellis et al., 2004b), ce qui indique la possibilité que les FTOH soient une source d’AFPC. Il est proposé que les APFC dont la chaîne compte un nombre impair de carbones soient présents en concentrations légèrement plus élevées dans le biote des niveaux trophiques supérieurs (Martin et al., 2004a). Ce profil a été observé dans les échantillons prélevés chez des ours blancs par Kannan et al. (2005) et Smithwick et al. (2005b). Lorsque les quantités d’APFC dont la chaîne compte un nombre impair de carbones et celles d’APFC dont la chaîne compte un nombre pair de carbones sont corrélées, cela semble indiquer une source unique et uniforme (Smithwick et al., 2005b; van de Vijver et al., 2005). Les FTOH semblent disponibles pour les organismes dans l’environnement et ils sont métabolisés, in vivo, en intermédiaires (d’autres précurseurs d’APFC) qui peuvent mener finalement à la formation d’APFC à longue chaîne. Furdui et al. (2008) ont observé une diminution des isomères ramifiés d’APFC en C11 et C13 chez les touladis du lac Ontario entre 1993 et 2004 et ils ont noté une augmentation des isomères linéaires dans les échantillons plus récents (jusqu’à l’année 2004), ce qui laisse penser que les sources actuelles d’APFC dans le lac Ontario résultent du processus de télomérisation.
Les concentrations de FTOH résiduels dans les polymères ont été mesurées dans le cadre d’une étude effectuée par Dinglasan-Panlilio et Mabury (2006), celle-ci ayant consisté à analyser plusieurs produits contenant des polymères fluorés ou des composés fluorés apparentés. On a détecté des FTOH (4:2 à 12:2) en concentrations de 0,11 à 3,8 %, en poids sec, dans les produits. Le solvant d’extraction utilisé était l’acétate d’éthyle (2 aliquotes de 5 mL subséquemment combinées), sa concentration n’étant pas précisée. Même s’il était impossible de distinguer les FTOH constituant des résidus[1] des FTOH faisant partie de la formulation des produits, la présence de ces alcools indique que les polymères à base de fluorotélomères pourraient en être une source dans l’environnement.
Les concentrations d’APFC à longue chaîne mesurées en milieu aquatique dans les zones urbaines canadiennes semblent indiquer l’existence de sources indirectes, comme les usines de traitement des eaux usées (UTEU) (Boulanger et al., 2005a; Simcik et Dorweiler, 2005; Crozier et al., 2005). Des APFC en C9 à C12 ont été détectés dans les boues d’UTEU dans le cadre d’un certain nombre d’études (Boulanger et al., 2005b; Higgins et al., 2005; Sinclair et Kannan, 2006; Crozier et al., 2005). Higgins et al. (2005) ont révélé la présence de concentrations plus fortes d’APFCà chaîne comptant un nombre pair de carbones (C8 à C12) dans les boues stabilisées par voie aérobie provenant d’une UTEU et dans les sédiments prélevés dans la région de la baie de San Francisco. Sinclair et Kannan (2006) ont fait ressortir un profil caractérisé par des APFC comptant un nombre pair de carbones plus abondants que les APFC comptant un nombre impair de carbones dans les effluents d’UTEU dans l’État de New York.
Les UTEU qui procédaient à un simple traitement primaire n’engendraient pas de rejets d’APFC à longue chaîne. Cependant, dans les UTEU avec traitement secondaire, on a enregistré une présence accrue d’APFCà longue chaîne (Sinclair et Kannan, 2006), ce qui laisse supposer une dégradation biologique ou chimique rapide des précurseurs lors du traitement secondaire. Des précurseurs comme les produits de décomposition des ACFT et des FTOH ont été mesurés dans les échantillons d’influents et d’eaux issues du traitement primaire, mais pas dans les eaux ayant subi un traitement secondaire (Sinclair et Kannan, 2006). Comme on ne trouve des ACFT que dans les échantillons d’eaux issues du traitement primaire, on conclut que la conversion des FTOH en APFC à longue chaîne est incomplète, tandis que l’absence d’ACFT et la présence d’APFC en C9 à C11 dans les échantillons d’eaux ayant subi un traitement secondaire laissent supposer une conversion complète. Crozier et al. (2005) ont mesuré des concentrations d’APFC en C9 et en C10 dans les effluents (concentrations de 3 à 6 ng/L) et les biosolides (concentrations de 0,4 à 5,2 ng/g) d’usines de traitement des eaux d’égout en Ontario. On n’a pas détecté d’APFC en C11 et C12 (limite de détection : 2 ng/L). Crozier et al. (2005) ont également remarqué qu’aucun APFC en C10n’a été relevé dans l’influent d’une usine de traitement des eaux d’égout, mais qu’on en a relevé dans l’effluent à une concentration de 4 ng/L, ce qui indique que les APFC en C10 se sont formés au cours du procédé de l’usine, alors que des APFC en C9 ont été relevés à une concentration de 4 ng/L tant dans l’influent que dans l’effluent de l’usine de traitement, ce qui indique qu’il n’y a pas eu d’élimination du composé.
De Silva et al. (2009) ont laissé entendre que la biodégradation et/ou la métabolisation des acides polyfluorophosphorique (diesters équivalents à des diPAP) tels que les diPAP 10:2 peuvent créer des APFC en C10. Des diPAP ont été mesurés à des concentrations de 50 à 100 ng/g dans les boues d’UTEU.
Guo et al. (2009) ont détecté des APFC en C9 à C12 dans des maisons américaines types contenant des planchers recouverts de tapis, des tapis prétraités et des liquides d’entretien des tapis offerts dans le commerce. Gewurtz et al. (2009) ont décelé des APFC en C9à C14 ainsi que des ACFTI 8:2 et des ACFTI 10:2 dans la pellicule formée par les dépôts accumulés sur des fenêtres échantillonnées à l’intérieur et à l’extérieur, en ville, en banlieue, en campagne et dans des magasins de tapis à Toronto, en Ontario. Les cires à parquet et les produits d’étanchéité pour la pierre, les carreaux et le bois, qui contiennent des produits fluorotélomériques, constituent des sources potentielles d’APFC en C9 à C12 dans les maisons et les bâtiments commerciaux où l’on trouve ces matériaux (Gewurtz et al., 2009; Guo et al., 2009). Les autres sources potentielles comprennent les textiles de maison, les rembourrages et les vêtements traités ainsi que les liquides et les mousses d’entretien des tapis et des tissus (Guo et al., 2009). Nilsson et al. (2010) ont décelé la présence d’APFC en C9 à C11 dans le sang de techniciens de fartage de skis (les concentrations variaient de 0,1 à 535 ng/L). Nilsson et al. (2010) ont mentionné que des composés organiques fluorés sont ajoutés aux farts de glisse pour empêcher l’adhésion de la neige, de la glace et de la poussière. Les farts fluorés sont appliqués par chauffage à environ 130-220 °C, températures auxquelles des particules en suspension dans l’air et des émanations contenant un mélange de composés organochlorés gazeux sont émises. Cependant, les auteurs n’ont pas analysé les farts de glisse eux-mêmes pour déterminer la présence de composés perfluorés. Plusieurs études dans le cadre desquelles l’air intérieur des domiciles a été échantillonné ont mis en évidence le rejet de précurseurs d’APFC à partir de produits ménagers. On a analysé les FTOH (6:2, 8:2 et 10:2) et les APFC (C9 à C12) dans des échantillons archivés de poussière prélevés entre 2000 et 2001 dans des domiciles en Ohio et en Caroline du Nord, aux États-Unis (Strynar et Lindstrom, 2005). Les concentrations moyennes se situaient entre 0,5 et 0,804 μg/g de poussière dans le cas des APFC en C9 à C12. Les concentrations moyennes de FTOH 6:2, 8:2 et 10:2 variaient de 0,4 à 1,0 μg/g de poussière. Les valeurs moyennes mesurées aux deux endroits n’étaient pas significativement différentes, ce qui laisse supposer l’existence de sources similaires comme les tapis ou les textiles traités. Shoeib et al. (2005) ont signalé la présence de FTOH 6:2, 8:2 et 10:2 dans la poussière domestique prélevée dans les aspirateurs de domiciles choisis au hasard à Ottawa, les concentrations moyennes étant respectivement de 0,035, 0,055 et 0,035 μg/g de poussière. En raison de difficultés techniques, on n’a pas recueilli d’échantillons d’air en vue de l’analyse des FTOH. Des FTOH ont également été détectés dans les vêtements de protection contre les intempéries (Berger et Herzke, 2006) ainsi que sous forme d’émissions provenant de poêles à frire antiadhésives (Sinclair et al., 2007).
Des APFC comme tels (et, dans certains cas, des ACFT et des ACFTI) pourraient également être libérés en petites quantités par des produits de consommation, entre autres les vêtements de protection contre les intempéries, les batteries de cuisine, les agents de protection des tissus dans le commerce, ainsi que les matières entrant en contact avec les aliments (Begley et al., 2005; Boulanger et al., 2005b; Mawn et al., 2005; Washburn et al., 2005; Bradley et al., 2007; Sinclair et al., 2007).
Devenir dans l’environnement
On s’attend à ce que les APFC à longue chaîne et leurs sels se répartissent principalement dans les milieux aqueux en raison de leur hydrosolubilité élevée et de leur faible volatilité (tableau 2). D’après les valeurs du log Kco observées par Higgins et Luthy (2006) (tableau 2), les APFC en C9 à C11 devraient se retrouver en partie dans les sédiments et le sol.
La présence d’un groupement fonctionnel acide confère une nature et des caractéristiques distinctes aux APFC à longue chaîne. Le groupement fonctionnel acide est hydrophile et complètement dissocié en phase aqueuse aux pH ambiants (Ellis et al., 2004a). Les substances possédant un groupement perfluoroalkyle sont susceptibles d’avoir des propriétés tensioactives car certaines parties de la molécule sont oléophobes, hydrophobes ou hydrophiles. Alors que les chaînes d’hydrocarbures non substituées sont oléophiles et hydrophobes (Key et al., 1997), la présence d’un groupement fonctionnel sur la chaîne perfluorée (p. ex., un groupement chargé comme l’anion carboxylate) peut rendre une partie de la molécule hydrophile. Cependant, à mesure que la longueur de cette chaîne s’accroît, l’hydrophobicité de la molécule d’APFC va probablement augmenter et sa solubilité dans l’eau diminuer (Ellis et al., 2004a). Les pressions de vapeur calculées pour les APFC en C9 à C12 (Kaiser et al., 2005) laissent penser que ces substances sont volatiles; toutefois, une volatilisation importante dans les conditions environnementales normales est peu probable, car ces substances sont ionisées aux pH qu’on retrouve dans l’environnement.
Persistance et potentiel de bioaccumulation
Persistance
Bien que peu de données empiriques sur la dégradation des APFC à longue chaîne soient disponibles, la liaison carbone-fluor est l’une des plus fortes qui existent dans la nature (~110 kcal/mol), ce qui la rend extrêmement stable et généralement résistante à la dégradation. Le fluor est l’élément le plus électronégatif du tableau périodique, ce qui procure un fort potentiel d’ionisation et une faible polarisabilité, des interactions intermoléculaires et intramoléculaires faibles, ainsi qu’une tension superficielle extrêmement faible. La photolyse directe de la chaîne fluorocarbonée devrait également être très lente : la stabilité à ce degré d’énergie devrait être conservée pendant plus de 1 000 ans (Environnement Canada et Santé Canada, 2006).
Hori et al. (2005a) ont signalé la décomposition de l’APFC en C9 lorsque la concentration de cet acide était de 1,51 mg/L. Hori et al. (2005b) ont également étudié la dégradation des APFC en C9, C10 et en C11 en présence de l’ion persulfate (S2O8-2) dans un système biphasique eau/CO2 liquide. L’APFC en C9 a également été dégradé en ions fluorure et en dioxyde de carbone lorsqu’il était placé dans une solution contenant du S2O8-2 chauffée à 80 °C pendant 6 heures (Hori et al., 2008). Cependant, les conditions mises en place dans ces études n’existent pas dans l’environnement.
Hurley et al. (2004) ont montré que le temps de séjour avant dégradation des APFC à chaîne courte (C3 à C5) en phase gazeuse dans l’atmosphère, en conditions de smog artificiel, était de l’ordre de 130 jours (ce qui équivaut à une demi-vie d’environ 90 jours) en raison des réactions avec les radicaux OH; le temps de séjour avant le dépôt sec ou humide (par l’intermédiaire des particules) est quant à lui de l’ordre de 10 jours (ce qui équivaut à une demi-vie d’environ 7 jours). On n’a observé aucune photolyse directe des acides en phase gazeuse. En outre, Hurley et al. (2004) ont affirmé qu’il est peu probable que ces valeurs changent de manière significative avec l’allongement de la chaîne de l’acide. On ne croit pas que le mécanisme de dégradation commençant par la réaction CnF2n+1COOH + OH ® H2O + CnF2n+1COO (suivie par CnF2n+1COO ® CnF2n+1 + CO2, etc.) soit particulièrement efficace puisque le temps de séjour associé à ce processus (130 jours) est considérablement supérieur au temps de séjour estimé dans le cas du retrait des APFC de l’atmosphère par dépôt sec ou humide (~10 jours). Autrement dit, même si des APFC sont formés dans l’atmosphère à partir de FTOH, ils n’y demeureront pas suffisamment longtemps pour y être fortement dégradés.
La présence d’APFC à longue chaîne dans l’Arctique canadien (Martin et al., 2004a) est révélatrice du transport à grande distance, soit d’APFCà longue chaîne (p. ex., par les courants atmosphériques ou océaniques) (Wania, 2007; Prevedouros et al., 2006), soit de précurseurs volatils d’APFC à longue chaîne comme des FTOH (p. ex., par le transport atmosphérique), soit des deux (Wallington et al., 2006; Stock et al., 2007). Wania (2007) a utilisé des simulations avec le modèle global Globo-POP d’estimation du devenir et du transport à grande distance moyens par zone, en combinaison avec les estimations des émissions historiques de FTOH, pour évaluer l’efficacité et l’importance relatives des voies de transport à grande distance, tandis que Wallington et al. (2006) ont utilisé un modèle tridimensionnel de la composition chimique de l’atmosphère du globe (IMPACT) pour montrer que les FTOH se transforment en APFC en C9.
Une hypothèse avancée pour expliquer la présence d’APFC à longue chaîne dans le biote de régions éloignées est qu’un précurseur (p. ex., des FTOH) serait émis dans l’atmosphère, et que sa dégradation biotique et abiotique finirait par donner des APFC à longue chaîne. Ellis et al. (2004a) ont montré que le temps de séjour des FTOH à chaîne courte dans l’atmosphère, tel qu’il a été déterminé d’après leur réaction avec les radicaux hydroxy, est d’environ 20 jours. Shoeib et al. (2006) ont recueilli des échantillons d’air pendant une traversée de l’Atlantique Nord et de l’archipel canadien effectuée en juillet 2005 pour étudier les concentrations des FTOH. Les plus fortes concentrations étaient celles des FTOH 8:2 (5,8 à 26 pg/m3), suivies par celles des FTOH 10:2 (1,9 à 17 pg/m3), puis des FTOH 6:2 (valeur inférieure à la limite de détection jusqu’à 6,0 pg/3). Ellis et al. (2004a) ont laissé entendre que la nature des APFC, par exemple, leur forte tendance à s’ioniser, devrait les rendre particulièrement abondants dans la phase aqueuse; à l’inverse, on ne s’attend pas à ce qu’ils se retrouvent en grandes quantités dans l’atmosphère. Toutefois, les propriétés tensioactives des APFC ont été étudiées afin de déterminer leur incidence sur la possible formation d’aérosols perfluorés au-dessus du milieu marin (Waterland et al., 2005); elles pourraient d’ailleurs laisser supposer un mécanisme pour le transport à grande distance par les courants océaniques jusque dans les régions éloignées. Toutefois, les résultats des travaux de recherche actuels semblent indiquer que la présence d’APFC à longue chaîne en régions éloignées proviendrait de la dégradation de précurseurs fluoroalylés volatils comme les FTOH. Young et al. (2007) ont laissé entendre que la présence d’APFC en C9, C10 et C11 sur les calottes glaciaires de l’Extrême-Arctique canadien serait l’indication que l’oxydation de précurseurs volatils dans l’atmosphère constitue une source.
Au printemps 2005 et 2006, des APFC en C9 à C11 ont été mesurés sur les calottes glacières polaires de trois régions de l’Extrême-Arctique (calotte glaciaire de Melville, Territoires du Nord-Ouest; calotte glaciaire d’Agassiz, Nunavut; calotte glaciaire de Devon, Nunavut) [Young et al., 2007]. Les concentrations d’APFC en C9 se situaient entre 0,005 à 0,246 ng/L. Les concentrations d’APFCen C10 allaient de valeurs inférieures à la limite de détection à 0,022 ng/L et celles d’APFC en C11variaient de valeurs inférieures à la limite de détection à 0,027 ng/L. Entre 1996 et 2005, les concentrations d’APFCen C9 et C10 ont augmenté (Young et al., 2007). Les flux ont été calculés à l’aide de la concentration corrigée en fonction de la densité, multipliée par l’accumulation annuelle. Les flux calculés pour chaque calotte glaciaire ont été multipliés par la superficie de l’Arctique, afin de donner le flux d’APFC en C9, C10 et C11 vers la région au nord de 65 °N. Ces flux sont des estimations et pourraient ne pas être représentatifs des dépôts réels dans cette région, étant donné les variations importantes des taux de précipitation. En 2005, le flux des APFC en C9 se situait entre 73 et 860 kg/an; celui des APFC en C10entre 16 et 84 kg/an et celui des APFC en C11entre 26 et 62 kg/an (Young et al., 2007).
Webster et Ellis (2010) ont proposé en outre que les embruns pourraient constituer un mécanisme de production d’APFOdans la phase gazeuse à partir de PFO (sa base conjuguée) dans un plan d’eau ayant le potentiel de fournir de grandes quantités d’APFO et d’APFC en général dans l’atmosphère et, donc, de fortement contribuer aux concentrations mesurées dans les régions éloignées. Selon les auteurs, ce mécanisme est comparable aux émissions mondiales des cheminées rejetées dans l’atmosphère.
Il est également possible que la présence de composés perfluorés dans l’Arctique canadien puisse être due, en partie, à la présence de sources locales, en particulier d’anciennes bases militaires (Iqaluit, lac Sarcpa, île Resolution) ou aux stations du réseau d’alerte avancé [DEW] (côtes nord de l’Alaska jusqu’à Cape Dyer sur la côte de l’île de Baffin), qui ont pu utiliser des produits perfluorés (Stow et al., 2005; Poland et al., 2001). Ces sites sont considérés comme assainis, mais on ne sait pas si des composés perfluorés tels que les APFC à longue chaîne ont été décelés ou mesurés, les publications disponibles (Stow et al., 2005; Poland et al., 2001) n’ayant déterminé que les concentrations de biphényles polychlorés (BPC) et de métaux pendant le processus d’assainissement. Néanmoins, les concentrations d’APFO mesurées dans le biote ou l’environnement semblent être éloignées des sources locales possibles.
Par conséquent, d’après les données empiriques et les propriétés physiques et chimiques, les APFC à longue chaîne répondent aux critères de persistance dans l’eau, le sol, les sédiments et l’air (demi-vie dans le sol et dans l’eau = 182 jours et demi-vie dans les sédiments = 365 jours; demi-vie dans l’air = 2 jours ou preuve d’un transport atmosphérique vers des régions éloignées comme l’Arctique) énoncés dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Bioaccumulation
Les APFC sont des molécules qui possèdent des portions oléophobes, des portions hydrophobes et des portions hydrophiles, et ils combinent donc toutes ces propriétés. Par exemple, le groupement carboxylate lié à la chaîne perfluorée rend la molécule polaire. Compte tenu de ces propriétés, l’hypothèse selon laquelle les interactions hydrophobes et lipophiles entre le composé et le substrat constituent les principaux mécanismes régissant la répartition ne s’applique pas dans le cas des APFC à longue chaîne. Houde et al. (2006b) indiquent qu’aucune mesure de Koe n’a été recensée pour quelque APFC à longue chaîne que ce soit, et qu’il est peu probable que cette propriété physique soit utile pour estimer le potentiel de bioaccumulation, car ces substances peuvent demeurer à l’interphase entre les phases organique et aqueuse au lieu de se séparer entre ces deux phases. Toutefois, Webster et Ellis (2011) mentionnent que les APFC, en général, ne sont pas tensioactifs et que le Koe est une variable explicative de la répartition des lipides et des protéines dans le biote. Par conséquent, les auteurs affirment que les modèles de répartition à l’équilibre pour la répartition des molécules neutres hydrophobes des APFC, y compris l’APFO, sont applicables.
Des critères réglementaires (facteurs de bioconcentration [FBC] et facteurs de bioaccumulation [FBA]) définissant si une substance donnée doit ou non être considérée comme bioaccumulable ont été établis en application de la LCPE (1999) [Canada, 1999]. Cependant, ces critères sont fondés sur des connaissances accumulées au fil du temps sur des substances organiques neutres non métabolisées. Ces critères, fixés d’après les critères de persistance et de bioaccumulation définis dans la Politique de gestion des substances toxiques (PGST) fédérale, ont été élaborés au milieu des années 1990 et officiellement publiés en 1995 (Canada, 1995), et ils visent à identifier les substances lipophiles susceptibles de se bioaccumuler essentiellement dans les systèmes aquatiques d’eau douce. Les substances qui répondent aux critères définis (soit FBA ou FBC = 5 000 ou log Koe= 5) sont fortement susceptibles de se bioaccumuler dans un organisme donné et de se bioamplifier à l’intérieur du réseau trophique. Il faut toutefois préciser que les FBA, les FBC et le log Koe ne sont qu’une partie des éléments formant le poids de la preuve qui détermine le potentiel global d’une substance à s’accumuler dans les organismes. En outre, une substance peut être jugée suffisamment bioaccumulable pour susciter des préoccupations même si les critères réglementaires ne sont pas atteints.
Étant donné le nombre d’études expérimentales disponibles, dans le cadre de la présente évaluation, l’accent a été placé sur les résultats des études expérimentales sur la bioaccumulation et la bioamplification.
Parmi les mesures de la bioaccumulation qui décrivent de manière directe le potentiel des substances chimiques à se bioamplifier figurent les facteurs de bioamplification (FBM) et les facteurs d’amplification trophique (FAT; parfois appelés facteurs de bioamplification dans le réseau trophique). Le FBMcorrespond au rapport de la concentration d’une substance chimique dans un prédateur sur sa concentration dans la nourriture ou la proie de ce dernier. Un FBM supérieur à 1 donne à penser qu’il y a bioamplification. Le FBM mesuré pour un aliment donné en laboratoire est parfois appelé « FBA alimentaire ». L’une des incertitudes importantes associées aux mesures du FBM est liée à la difficulté à établir l’état trophique réel d’un prédateur et de sa proie, étant donné que la plupart des organismes sont omnivores (Gray, 2002). On peut voir le FATcomme le rapport moyen de la concentration d’une substance dans les prédateurs et de sa concentration dans les proies dans l’ensemble ou une partie d’un réseau trophique. Comme dans le cas du FBM, un FAT supérieur à 1 indique l’existence d’un phénomène de bioamplification dans le réseau trophique. Les FBM et les FAT sont mesurés le plus souvent sur le terrain, bien que des études en laboratoire sur l’alimentation puissent également être utilisées pour estimer les FBM (ou « FBA alimentaires »). En général, pour les produits chimiques organiques neutres, les concentrations de produits chimiques sont normalisées pour une matrice lipidique avant la détermination des FBM et des FAT; cependant, une telle normalisation pourrait ne pas convenir dans le cas des substances perfluorées puisqu’elles semblent se lier de préférence avec les protéines dans le foie, les reins et le plasma plutôt qu’avec les lipides (Houde et al., 2006b; Martin et al., 2003a). Il n’existe pas de méthode de normalisation pour les substances s’associant aux protéines ou au plasma, ce qui introduit une source d’incertitude dans l’évaluation des FBM et des FAT des APFC.
Certains ont avancé l’idée qu’une autre des hypothèses associées à la méthode fondée sur les FBC, les FBA et les Koe, à savoir que la bioaccumulation est gouvernée par les mêmes mécanismes pour tous les produits chimiques tant chez les animaux à respiration aquatique (p. ex., les poissons et les invertébrés aquatiques) que chez les animaux à respiration aérienne (p. ex., les mammifères terrestres, les oiseaux et les mammifères marins), ce qui donnerait un potentiel de bioaccumulation similaire, pour une substance donnée, chez ces deux catégories d’organismes (Kelly et al., 2004; Mackay et Fraser, 2000). Comme l’ont décrit Kelly et al. (2004), les substances organiques peuvent être regroupés en fonction de leur polarité (comme l’indique le log Koe qui diminue à mesure que la polarité s’accroît, en raison de changements de solubilité dans l’eau), et de leur volatilité (comme l’indique le log Koa [coefficient de partage octanol-air] qui diminue à mesure que la volatilité augmente). De manière générale, les substances non polaires et non volatiles (NPNV) comme les BPC ont des taux de passage dans l’air et dans l’eau faibles, ce qui donne un potentiel de bioaccumulation aussi élevé chez les organismes à respiration aquatique que chez les organismes à respiration aérienne. La solubilité dans l’eau des substances polaires non volatiles (PNV) sera plus élevée que celle des substances NPNV en raison de la polarité et, dans le cas des APFC, de leur potentiel d’ionisation. Pour les organismes à respiration aquatique, cela pourrait entraîner une accélération de l’expulsion des substances PNV dans la phase aqueuse et une diminution du potentiel de bioaccumulation. Cependant, comme le potentiel de bioaccumulation chez les organismes à respiration aérienne est déterminé principalement par la volatilité, et non par la polarité, le caractère non volatil des substances PNV comme les APFC rend leur élimination dans l’air relativement lente, et induit un potentiel de bioaccumulation plus élevé chez ces organismes (Stevenson, 2006).
Même si l’hypothèse générale veut que les propriétés chimiques et le comportement de partage soient les principaux processus qui régissent l’absorption et l’élimination, dans bien des cas, la transformation métabolique d’une substance chimique permet son élimination rapide et abaisse son potentiel de bioaccumulation (Kelly et al., 2004). Cependant, aucune étude n’a été faite sur la transformation métabolique et l’élimination des APFC ou de leurs précurseurs chez les organismes à respiration aérienne.
L’évaluation de la bioaccumulation des APFC à longue chaîne est également compliquée par le fait que les FBC, les FBA, les FBM et les FAT sont souvent établis d’après les concentrations dans des organes distincts, et non d’après la charge dans l’organisme entier. Du point de vue toxicologique, les FBC, FBA, FBM et FAT relatifs à des organes individuels, comme le foie, peuvent être davantage pertinents lorsqu’il s’agit de prévoir le potentiel d’effets toxiques directs sur un organe en particulier (p. ex., toxicité pour le foie). Conder et al. (2008) sont d’avis que, comme la bioaccumulation est habituellement exprimée en fonction de la masse du corps entier, les concentrations d’acides perfluorés dans des tissus comme le foie ne permettent pas d’évaluer le potentiel de bioaccumulation de ces substances. Comme les tissus hépatiques et le sang ne représentent qu’une faible proportion de la masse corporelle, et vu l’ampleur des différences de concentrations entre ces compartiments et les autres tissus, il a été estimé que la concentration d’acides perfluorés exprimée en fonction de la masse du corps entier était 10 fois plus faible que les concentrations d’acides perfluorés dans le plasma chez les dauphins, le narval et le béluga, et 2 à 10 fois plus faible que les concentrations d’acides perfluorés dans le sang et le foie de la truite (Conder et al., 2008).
Toutefois, les mesures de la bioaccumulation (FBC, FBA, FBM) peuvent servir d’indicateurs de la toxicité directe pour les organismes dans lesquels des APFC à longue chaîne se sont accumulés, ou de la toxicité indirecte pour les organismes qui se nourrissent de proies contaminées par ces APFC (toxicité par transfert le long de la chaîne alimentaire). En ce qui concerne le potentiel de toxicité directe, la charge corporelle critique est la concentration minimale d’une substance dans un organisme qui provoque un effet nocif. D’un point de vue physiologique, c’est la concentration d’une substance au site de l’action toxique dans l’organisme qui détermine si une réponse est observée, peu importe la concentration extérieure. Dans le cas des APFC à longue chaîne, on considère souvent que le site d’action est le foie. Quant au potentiel de toxicité pour les organismes prédateurs, il est déterminé d’après la concentration dans le corps entier de la proie puisque celle-ci est habituellement consommée dans sa totalité par le prédateur, y compris les tissus, fluides et organes individuels comme le foie et le sang. Étant donné la répartition des substances perfluorées dans le foie et dans le sang, la plupart des mesures de terrain concernant ces substances ont été effectuées sur ceux-ci en particulier, surtout dans le cas des organismes occupant les niveaux trophiques supérieurs (p. ex., l’ours blanc), pour lesquels l’analyse du corps entier n’est pas possible en raison de contraintes liées à l’échantillonnage ou au traitement en laboratoire. Bien qu’il soit possible de mesurer les FBA dans le corps entier pour les espèces de plus petite taille des niveaux trophiques inférieurs, les FBA estimés globalement pour les substances perfluorées pourraient être sous-estimés en raison de ce statut trophique inférieur. Par conséquent, d’un point de vue toxicologique, les FBC, FBA et FBM établis d’après les concentrations dans des organes individuels, comme le foie, pourraient être plus pertinents pour prévoir le potentiel d’effets toxiques directs sur un organe en particulier (p. ex., la toxicité pour le foie). Les FBC et, en particulier, les FBMfondés sur les concentrations dans les organismes entiers pourraient constituer une mesure utile du potentiel général de transfert dans la chaîne alimentaire. Conder et al.(2008) ont laissé entendre que les valeurs de FBM traduisent adéquatement le potentiel de bioaccumulation dans le biote des niveaux trophiques supérieurs, l’extrapolation des données sur les FBC et les FBA pour les poissons et les invertébrés étant difficile en raison des différences d’ordre biologique entre les niveaux trophiques supérieurs et inférieurs.
Études sur la bioaccumulation, la bioconcentration et la bioamplification
La bioaccumulation d’APFC en C9 à C12 à partir de sédiments enrichis en laboratoire et de sédiments provenant de sites contaminés a été évaluée à l’aide de l’oligochète d’eau douce Lumbriculus variegatus, organisme limivore pouvant être un point d’entrée des contaminants liés aux sédiments dans les réseaux trophiques (Higgins et al., 2007). Des essais à renouvellement périodique ont été menés sur 56 jours. Il est à noter que les concentrations sédimentaires dans les systèmes enrichis en laboratoire ont connu une légère baisse au fil du temps, tandis que les concentrations sédimentaires de presque tous les APFC à longue chaîne sont demeurées à peu près constantes dans les sédiments de sites contaminés. Les facteurs d’accumulation biote-sédiments (FABS) calculés (en poids humide) étaient de : 0,64 à 1,60 (APFC en C9), 0,59 à 1,02 (APFC en C10), 0,42 à 0,62 (APFC en C11) et 0,42 à 0,55 (APFC en C12). Les auteurs ont émis l’hypothèse que les APFC à longue chaîne n’auraient peut-être pas atteint les conditions d’équilibre.
Martin et al. (2003a, 2003b) ont mené leurs études sur des truites arc-en-ciel juvéniles (Oncorhynchus mykiss) qu’ils ont exposées à des APFC en C9 à C14 par voie alimentaire et en milieu aqueux en écoulement continu. Chez la truite arc-en-ciel, les FBCaugmentaient avec la longueur de la chaîne perfluoroalkylée, les valeurs variant de 450 L/kg (APFC en C10) à 23 000 L/kg (APFC en C14) pour le corps entier (Martin et al., 2003b). Aucune donnée expérimentale n’était disponible pour l’APFCen C9 puisque cette substance a été utilisée comme étalon interne dans le cadre de ces études. Dans l’étude sur l’exposition de truites arc-en-ciel juvéniles par voie alimentaire, Martin et al. (2003a, 2003b) présentent également des résultats de « FBA alimentaire ». Cependant, après examen de l’équation de l’accumulation et étant donné que l’exposition se faisait par voie alimentaire plutôt que par l’eau, on peut conclure que les mesures étaient en réalité des FBM. Les FBM mesurés en laboratoire pour la truite arc-en-ciel montraient une tendance à la hausse tendant vers 1 pour les APFC en C14. Les auteurs ont avancé que si l’on n’observait pas de bioamplification (c.-à-d. que les FBM n’étaient pas supérieurs à 1), c’était probablement en raison de la petite taille des poissons étudiés : l’expulsion des produits chimiques dans l’eau serait ainsi plus rapide, relativement à la taille de l’organisme, que dans le cas des espèces ou des classes de taille plus grandes, ce qui réduirait les FBM.
Martin et al. (2004b) ont également mené une étude de terrain sur la bioamplification des APFC en C9 à C14 dans le réseau trophique pélagique du lac Ontario, et ils ont déterminé les FBM du touladi (Salvelinus namaycush) pour diverses proies (gaspareau – Alosa pseudoharengus; éperlan – Osmerus mordax; chabot visqueux – Cottus cognatus), ainsi que les FAT globaux pour le réseau trophique pélagique. Les FBM pour la relation touladi/gaspareau dépassaient 1 pour tous les APFC à longue chaîne mesurés dans le cadre de l’étude (APFC en C9 à C14); les FBM pour la relation touladi/éperlan se situaient entre 0,6 (APFC en C9) et 2,2 (APFC en C14); enfin, les FBM pour la relation touladi/chabot allaient de 0,1 (APFC en C9) à 0,4 (APFC en C13). Les auteurs indiquent que 90 % des proies des touladis sont des gaspareaux, ce qui laisse supposer que les résultats concernant le rapport touladi/gaspareau donnent les meilleures estimations des FBM. Comme les autres espèces-proies représentaient une proportion beaucoup plus faible de l’alimentation du touladi (7 % d’éperlans et 2 % de chabots), les FBM du touladi pour ces proies sont probablement moins fiables. Les auteurs ont notamment souligné que la faible proportion de chabots dans le régime alimentaire du touladi et le fait que le chabot appartienne au réseau trophique benthique plutôt que pélagique pourraient expliquer les faibles FBM observés pour la relation touladi/chabot. Pour tenir compte des différences dans la composition du régime alimentaire, les auteurs ont également calculé les FBM des relations touladi/proie en pondérant la concentration dans chaque espèce-proie selon la proportion de chacune d’entre elles dans le régime alimentaire. Les FBM obtenus étaient supérieurs à 1 pour tous les APFC en C9 à C14, ce qui indique une bioamplification à partir des proies chez le touladi du lac Ontario.
Les facteurs d’amplification trophique (FAT) mesurés dans le réseau trophique pélagique du lac Ontario par Martin et al. (2004b) semblent indiquer une amplification trophique de certains APFC à longue chaîne dans l’ensemble de ce réseau. Les concentrations d’APFC en C10, en C11 et en C13augmentaient de manière significative au sein du réseau trophique pélagique, phénomène traduit par des FAT supérieurs à 1 pour les APFC en C10, C11 et C13. L’amplification trophique la plus importante a été enregistrée pour les APFC en C11(4,7) et elle décroissait pour les APFC à chaîne plus courte ainsi qu’à chaîne plus longue. Les FAT de 1 établis pour les APFC en C9, en C12 et en C14 indiquent soit l’absence de bioamplification, soit la trop grande variabilité des résultats pour permettre de déceler une tendance statistiquement significative quant aux concentrations en fonction de la position trophique au sein de ce réseau.
Gulkowska et al. (2005) ont analysé des échantillons de sang d’oiseaux et de poissons ainsi que des échantillons d’eau provenant du golfe de Gdansk, afin d’y détecter l’éventuelle présence d’APFC en C9. Soixante-cinq échantillons de sang ont été prélevés au cours de l’hiver 2002-2003 chez des sujets appartenant à cinq espèces de sauvagine : le petit pingouin (Alca torda), le plongeon catmarin (Gavia stellata), la macreuse noire (Melanitta nigra), l’harelde kakawi (Clangula hyemalis) et l’eider à duvet (Somateria mollissima), et 18 échantillons de sang ont été prélevés chez la morue (Gadus morhua). La concentration moyenne d’APFC en C9 dans les échantillons sanguins d’oiseaux allait de 0,3 ng/mL, chez le petit pingouin, à 1,1 ng/mL, chez le plongeon catmarin. La concentration moyenne d’APFC en C9dans les échantillons de sang de morue était de 1,2 ng/mL. Les auteurs ont calculé un « FBC » sang:eau d’environ 3 000 pour les APFC en C9chez la morue; cependant, comme il s’agit d’une mesure de terrain, et que les sujets étaient donc exposés par l’eau et par leur alimentation, le FBC obtenu devrait plutôt être considéré comme un FBA. Les FBM des relations oiseau/morue se situaient entre 0,25 et 0,92, mais les auteurs ont rappelé que toutes les espèces d’oiseaux échantillonnées étaient migratoires, et qu’on ne sait pas exactement quelle part de leur régime alimentaire la morue représente. Il n’est pas non plus certain que les FBM fondés sur les concentrations sanguines sont comparables aux FBM dans le corps entier.
Haukås et al. (2007) ont déterminé les FBM des APFC en C9 pour un réseau trophique du front des glaces de la mer de Barents (est de Svalbard), lequel est composé d’amphipodes associés à la glace (Gammarus wilkitzkii), de morues polaires (Boreogadus saida), de guillemots à miroir (Cepphus grylle) et de goélands bourgmestres (Larus hyperboreus). Les FBM n’ont pas été calculés pour les amphipodes, car les APFC en C9n’y étaient pas quantifiables. Toutefois, un FBM de 8,76 a été calculé pour le rapport guillemot à miroir/morue polaire. Le FBM du rapport goéland bourgmestre/morue polaire s’élevait quant à lui à 11,6, et le FBM du rapport goéland bourgmestre/guillemot à miroir était de 9,34.
Jeon et al. (2010a) ont étudié les effets de la salinité sur la bioaccumulation des composés perfluorés, notamment les APFC en C10 et en C11, chez l’huître creuse du Pacifique (Crassostrea gigas). Avec l’augmentation de la salinité (de 10 à 34 unités de salinité pratiques [USP]), on a pu observer une variation du FBC de l’APFC en C10 de 23,9 à 94,4, tandis que le FBA a augmenté de 75,5 à 212,8. Avec l’augmentation de la salinité (10 à 34 USP), le FBC de l’APFCen C11 variait entre 633,9 et 1 652,7, tandis que le FBA a augmenté de 954,6 à 2 555,2. Les auteurs laissent entendre que l’accumulation accrue est due principalement à une augmentation de l’absorption alimentaire provoquée par une possible modification de la physiologie des huîtres avec les changements de salinité, ce qui peut augmenter les risques pour les organismes benthiques et les mollusques bivalves filtreurs.
Jeon et al. (2010b) ont déterminé les FBC des composés perfluroés chez le sébaste noir (Sebastes schlegeli) à divers taux de salinité (10, 17,5, 25 et 34 USP). La bioconcentration des composés perfluorés était supérieure à 34 USP qu’à d’autres taux de salinité. Les FBC dans le sérum pour l’APFCen C10 variaient de 4 321 à 5 239 et les FBC dans le foie variaient de 667 à 811. Les FBC dans le sérum pour l’APFC en C11 variaient de 13 553 à 16 370 et les FBC dans le foie variaient de 1 070 à 1 345. Les auteurs laissent entendre que l’effet du relargage sur l’activité chimique des composés perfluorés peut être important à des taux de salinité élevés. La fugacité accrue dans l’eau salée peut forcer les molécules à passer à d’autres phases, comme la paroi branchiale (site principal de transport actif), ce qui pourrait expliquer l’augmentation des FBC avec des taux de salinité croissants.
Kwadijk et al. (2010) ont déterminé les FBA entre l’eau, les sédiments et l’anguille (Anguilla anguilla) provenant de 21 sites aux Pays-Bas. Le FBA calculé pour l’APFC en C9était de 2,52.
Tomy et al. (2009c) ont calculé les FBM ajustés pour le niveau trophique des APFC en C9 à C11 pour un réseau trophique marin dans l’ouest de l’Arctique canadien (île Hendrickson et île Holman) composé des espèces suivantes : béluga de la mer de Beaufort (Delphinapterus leucas), phoque annelé (Phoca hispida), morue polaire (Boreogadus saida), hareng du Pacifique (Clupea pallasi), cisco arctique (Coregonus autumnalis), un amphipode pélagique (Themisto libellula) et un copépode arctique (Calanus hyperboreus). Les FBM ajustés pour le niveau trophique variaient entre 0,1 (APFC en C10, morue polaire/Themisto libellula) et 353 (APFC en C11, béluga/hareng du Pacifique).
Houde et al. (2006a) ont effectué des études de terrain sur le réseau trophique du dauphin à gros nez à Charleston (Caroline du Sud) et dans la baie de Sarasota (Floride). Les APFC en C9 à C12 ont été mesurés dans l’eau de mer, les sédiments marins, le zooplancton (baie de Sarasota seulement; espèces non précisées) et diverses espèces de poissons ou mammifères marins : tambour brésilien (Micropogonias undulatus), sar salème (Lagodon rhomboides), tambour ocellé (Sciaenops ocellatus), tambour croca (Leiostomus xanthurus), acoupa pintade (Cynoscion nebulosus), mulet cabot (Mugil cephalus) et dauphin à gros nez (Tursiops truncatus). Il est à noter que, dans cette étude, les échantillons n’ont pas tous été prélevés la même année, et que les espèces de proies et de prédateurs peuvent avoir été échantillonnées pendant des saisons ou des années différentes, ce qui peut avoir une incidence sur les FBM et FAT obtenus. Les poissons ont été capturés entre 2002 et 2004, tandis que les échantillons de zooplancton ont été récoltés en 2004. Du plasma, de la peau et des dents de dauphin ont été prélevés aux deux sites à l’été 2004. Des dauphins à gros nez de 2002 et 2003 morts depuis peu ont également été utilisés. Les échantillons provenant de dauphins comprenaient du plasma prélevé dans le cadre d’une étude de capture avec remise à l’eau ainsi que de nombreux échantillons de corps entier de dauphins morts ou échoués depuis peu, ce qui a facilité l’étude de l’amplification trophique tant dans le plasma que dans le corps entier des dauphins. Les FBM ont été exprimés en termes de concentrations dans le corps entier seulement. À Charleston, les FBM dans les poissons marins (acoupa pintade/sar salème) se situaient entre 0,1 (APFC en C12) et 3,7 (APFC en C10); aucune tendance évidente n’a été dégagée en fonction de la longueur de la chaîne des APFC. Les FBM dans les dauphins ont été présentés pour les échantillons de corps entier et une vaste gamme d’espèces-proies de poissons. Les FBM des APFC en C9, en C10 et en C11 étaient supérieurs à 1 pour toutes les relations dauphin/proie. En ce qui concerne les APFC en C12, les FBM dauphin/proie allaient de 0,1 à 1,8. Pour les sujets de la baie de Sarasota, les FBM ont été présentés seulement pour les APFC en C12, et ils se situaient entre 0,2 et 156 pour les relations poisson/proie (diverses espèces); dans le cas dauphin/mulet cabot, le FBM des APFC en C12 était de 0,1. Les FAT dans le réseau trophique du dauphin ont été seulement fournis pour le site de Charleston. Les FAT des APFC en C9 à C11 étaient tous supérieurs à 1, tant d’après les échantillons de corps entier que d’après les échantillons de plasma, alors que les FAT des APFC en C12 ne dépassaient pas 1 pour les deux sortes d’échantillon. Comme les FBM dans le dauphin dépassaient 1 pour les APFC en C9 à C11, il semblerait que ces APFC sont bioamplifiés des poissons aux dauphins dans ce réseau trophique. En ce qui concerne les APFC en C12, vu la variabilité des FBM, il est difficile de tirer des conclusions au sujet de la bioamplification sans connaître les préférences des dauphins à gros nez en matière d’alimentation. Les indications d’une bioamplification de poisson à poisson sont équivoques; cependant, on peut s’attendre à ce que la bioamplification soit moins importante chez les poissons que chez les dauphins puisque les APFC seraient éliminés plus rapidement dans l’eau que dans l’air. Les FAT intègrent les données concernant l’ensemble du réseau trophique. Même si on prévoit une bioamplification moindre chez les poissons, les FAT des APFC en C9 à C11 étaient supérieurs à 1 dans le réseau trophique du dauphin, ce qui indique qu’une amplification trophique se produit.
Martine van den Heuvel-Greve et al. (2009) ont déterminé les FBM des APFC en C11dans le réseau trophique du phoque commun (Phoca vitulina) dans le Westerschelde, un estuaire du sud-ouest des Pays-Bas. Les FBM variaient de 1,9 (hareng/zooplancton) à 53 (phoque commun/hareng), et le FATétait de 1,3.
Katz et al. (2009) ont montré que les APFC en C9 à C12 s’accumulaient dans la chaîne alimentaire terrestre composée de végétation (plantes et lichens), du caribou de la toundra (Rangifer tarandus groenlandicus) et du loup (Canis lupus), dans le nord du Yukon, au Canada. Le lichen reflète l’apport atmosphérique direct d’APFC à longue chaîne puisqu’il n’a pas de racines et reçoit ses éléments nutritifs de l’atmosphère. Le lichen constitue une grande partie du régime alimentaire du caribou. Le caribou est la principale proie du loup qui se trouve au sommet de la chaîne alimentaire de l’écosystème. Les APFC en C9prédominaient dans le foie du loup (6,8 ng/g poids humide) suivis par les APFC en C10(3,1 ng/g poids humide) et les APFC en C11(3,4 ng/g poids humide). Des APFC en C12 et C13 ont également été mesurés à des concentrations moyennes inférieures à 0,6 ng/g poids humide. Cependant, les résultats des analyses des isotopes stables du carbone et de l’azote dans la végétation et dans les muscles du caribou et du loup ont montré que le caribou se nourrissait principalement de lichen et que le loup se nourrissait principalement de caribou.
Powley et al. (2008) ont déterminé les facteurs de bioaccumulation des APFC en C10 à C12dans un réseau trophique de l’ouest de l’Arctique du Canada (île Banks à la limite est de la mer de Beaufort, dans les Territoires du Nord-Ouest) composé de trois différentes espèces de zooplancton (Calanus hyperboreus, Themisto libellula et Chaetognatha), la morue polaire (Boreogadus saida), le phoque annelé (Phoca hispida) et le phoque barbu (Eriganthus barbatus). L’APFCen C11 présentait la plus forte concentration et s’élevait à 10,8 ng/g. Les facteurs de bioaccumulation se situaient entre 0,3 et 3,1.
De nombreuses études (Martin et al., 2004a; Kannan et al., 2005; Smithwick et al., 2005a) ont également révélé la présence de concentrations d’APFCen C9 (108 à 230 ng/kg poids humide), en C10(35 à 76 ng/kg poids humide), en C11 (56 à 78 ng/kg poids humide), en C12 (4,7 à 8,2 ng/kg poids humide), en C13 (7,5 à 14 ng/kg poids humide) et en C14 (< 0,5 à 1,1 ng/kg poids humide) dans le foie d’ours blancs des régions arctiques et subarctiques du Canada. Butt et al. (2008) ont calculé les FBM hépatiques des APFC en C9 à C15 de la relation phoque annelé/ours blanc à l’échelle régionale, et ce, en regroupant 11 populations de phoques annelés avec les populations d’ours blancs correspondantes situées aux mêmes endroits. Les moyennes géométriques des FBM allaient de 2,2 (APFC en C13) à 56 (APFC en C9).
Aucune étude n’a été menée sur la bioaccumulation des APFC dont la chaîne compte plus de 14 atomes de carbone. Cependant, il est possible que les APFC à chaîne plus longue que les APFC en C14s’accumulent ou se bioamplifient chez les mammifères marins ou terrestres. L’hypothèse selon laquelle la conformation de la liaison carbone-carbone changerait avec l’allongement de la chaîne a été avancée : les chaînes plus longues deviendraient hélicoïdales (Wang et Ober, 1999), ce qui donnerait des molécules à section transversale plus petite ayant une plus grande capacité de s’accumuler dans les organismes. Des APFC en C14 et en C15 ont été détectés chez des poissons, des invertébrés, des dauphins et des ours blancs (voir par exemple Martin et al., 2004b; Smithwick et al., 2005a, 2005b, 2006; Houde et al., 2005).
Tableau 3. Sommaire des données sur la bioaccumulation des APFCà longue chaîne
(Les éléments en italique et en gras indiquent des valeurs de FBC ou de FBA qui dépassent les critères de persistance et de bioaccumulation, et les cases ombragées indiquent que le FBM ou le FAT est supérieur à 1.)
| Espèce, prédateur/proie, réseau trophique (tissu indiqué entre parenthèses) | Type d’étude | Lieu | Critère d’effet | Résultat | Référence |
|---|---|---|---|---|---|
| APFC en C9 | |||||
| Lumbriculus variegatus | Laboratoire/ terrain |
Californie, en aval d’une UTEU | FABS en poids humide | 0,64-1,60 | Higgins et al., 2007 |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 39 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM[1] | 0,089 | Martin et al., 2003a |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 5,3 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 0,6 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,1 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 2,3 | Martin et al., 2004b |
| Acoupa pintade/sar salème (entière) | Terrain | Charleston, Caroline du Sud | FBM | 1,5 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Charleston, Caroline du Sud | FBM | 5 | Houde et al., 2006a |
| Dauphin/sar salème (entier) | Terrain | Charleston, Caroline du Sud | FBM | 3,2 | Houde et al., 2006a |
| Dauphin/tambour ocellé (entier) | Terrain | Charleston, Caroline du Sud | FBM | 1,4 | Houde et al., 2006a |
| Dauphin/tambour brésilien (entier) | Terrain | Charleston, Caroline du Sud | FBM | 24 | Houde et al., 2006a |
| Dauphin/tambour croca (entier) | Terrain | Charleston, Caroline du Sud | FBM | 4,6 | Houde et al., 2006a |
| Dauphin/acoupa pintade (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,1 | Houde et al., 2006a |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 1[2] | Martin et al., 2004b |
| Réseau trophique du dauphin à gros nez (plasma)[4] | Terrain | Charleston, Caroline du Sud | FAT | 4,7 | Houde et al., 2006a |
| Réseau trophique du dauphin à gros nez (corps entier)[4] | Terrain | Charleston, Caroline du Sud | FAT | 2,4 | Houde et al., 2006a |
| Morue (sang) | Terrain | Golfe de Gdansk, Pologne | FBA[5] | 3 000 | Gulkowska et al., 2005 |
| Macreuse noire/morue (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,83 | Gulkowska et al., 2005 |
| Eider à duvet (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,33 | Gulkowska et al., 2005 |
| Plongeon catmarin (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,92 | Gulkowska et al., 2005 |
| Petit pingouin (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,25 | Gulkowska et al., 2005 |
| Harelde kakawi (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,50 | Gulkowska et al., 2005 |
| Guillemot à miroir/morue polaire | Terrain | Front des glaces de la mer de Barents | FBM | 8,76 | Haukås et al., 2007 |
| Goéland bourgmestre/morue polaire | Terrain | Front des glaces de la mer de Barents | FBM | 11,6 | Haukås et al., 2007 |
| Goéland bourgmestre/morue polaire | Terrain | Front des glaces de la mer de Barents | FBM | 9,34 | Haukås et al., 2007 |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 56 | Butt et al., 2008 |
| Phoque annelé/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 1,2 | Tomy et al., 2009c |
| Béluga/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 12,9 | Tomy et al., 2009c |
| Béluga/hareng du Pacifique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 5,8 | Tomy et al., 2009c |
| Béluga/cisco arctique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 2,9 | Tomy et al., 2009c |
| Morue (foie)/Calanus hyperboreus (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,7 | Tomy et al., 2009c |
| Morue (foie)/Themisto libellula (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,3 | Tomy et al., 2009c |
| Eau/sédiments/anguille | Terrain | Pays-Bas | FBA | 2,52 | Kwadijk et al., 2010 |
| APFC en C10 | |||||
| Lumbriculus variegatus | Laboratoire/ terrain |
Californie, en aval d’une UTEU | FABS en poids humide | 0,59-1,02 | Higgins et al., 2007 |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 450 L/kg |
Martin et al., 2003b |
| Truite arc-en-ciel juvénile (sang) | Laboratoire | n.d. | FBC | 2 700 L/kg |
Martin et al., 2003b |
| Truite arc-en-ciel juvénile (foie) | Laboratoire | n.d. | FBC | 1 100 L/kg |
Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM1 | 0,23 | Martin et al., 2003a |
| Touladi/concentration dans l’eau de chaque Grand Lac (entier) | Terrain | Tous les Grands Lacs | FBA | 3,9 | Furdui et al., 2007 |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 4,4 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 1 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,2 | Martin et al., 2004b |
| Zooplancton/morue polaire | Terrain | Ouest de l’Arctique canadien | FBA | 0,5 | Powley et al., 2008 |
| Morue polaire/phoque (sang) | Terrain | Ouest de l’Arctique canadien | FBA | 1,4 | Powley et al., 2008 |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 2,7 | Martin et al., 2004b |
| Acoupa pintade/sar salème (entière) | Terrain | Charleston, Caroline du Sud | FBM | 3,7 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,9 | Houde et al., 2006a |
| Dauphin/sar salème (entier) | Terrain | Charleston, Caroline du Sud | FBM | 8,8 | Houde et al., 2006a |
| Dauphin/tambour ocellé (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,4 | Houde et al., 2006a |
| Dauphin/tambour brésilien (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,5 | Houde et al., 2006a |
| Dauphin/tambour croca (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,8 | Houde et al., 2006a |
| Dauphin/acoupa pintade (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,4 | Houde et al., 2006a |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 3,7 | Martin et al., 2004b |
| Réseau trophique du dauphin à gros nez (plasma)[4] | Terrain | Charleston, Caroline du Sud | FAT | 3,4 | Houde et al., 2006a |
| Réseau trophique du dauphin à gros nez (corps entier)[4] | Terrain | Charleston, Caroline du Sud | FAT | 22 | Houde et al., 2006a |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 2,3 | Butt et al., 2008 |
| Phoque annelé/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 2,5 | Tomy et al., 2009b |
| Béluga/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 55 | Tomy et al., 2009b |
| Béluga/hareng du Pacifique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 87 | Tomy et al., 2009b |
| Béluga/cisco arctique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 44 | Tomy et al., 2009b |
| Morue (foie)/Calanus hyperboreus (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,4 | Tomy et al., 2009b |
| Morue (foie)/Themisto libellula (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,1 | Tomy et al., 2009b |
| Eau de mer/huître creuse du Pacifique | Laboratoire | Ferme ostréicole, Corée | FBC | 23,9-94,4 | Jeon et al., 2010a |
| Chlorella ellipsoidea/huître creuse du Pacifique | Laboratoire | Ferme ostréicole, Corée | FBA | 75,5-212,8 | Jeon et al., 2010a |
| Eau de mer/sébaste noir (foie) | Laboratoire | Corée | FBC | 708-811 | Jeon et al., 2010b |
| Eau de mer/sébaste noir (sérum) | Laboratoire | Corée | FBC | 4 321-5 239 | Jeon et al., 2010b |
| APFC en C11 | |||||
| Lumbriculus variegatus | Laboratoire/ terrain |
Californie, en aval d’une UTEU | FABS en poids humide | 0,42-0,62 | Higgins et al., 2007 |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 2 700 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (sang) | Laboratoire | n.d. | FBC | 11 000 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (foie) | Laboratoire | n.d. | FBC | 4 900 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM[1] | 0,28 | Martin et al., 2003a |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 6,4 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 1,2 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,2 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 3,4 | Martin et al., 2004b |
| Morue polaire/phoque (sang) | Terrain | Ouest de l’Arctique canadien | FBA | 3,1 | Powley et al., 2008 |
| Acoupa pintade/sar salème (entière) | Terrain | Charleston, Caroline du Sud | FBM | 0,9 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Charleston, Caroline du Sud | FBM | 1,9 | Houde et al., 2006a |
| Dauphin/sar salème (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,4 | Houde et al., 2006a |
| Dauphin/tambour ocellé (entier) | Terrain | Charleston, Caroline du Sud | FBM | 3,2 | Houde et al., 2006a |
| Dauphin/tambour brésilien (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,1 | Houde et al., 2006a |
| Dauphin/tambour croca (entier) | Terrain | Charleston, Caroline du Sud | FBM | 3,9 | Houde et al., 2006a |
| Dauphin/acoupa pintade (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,5 | Houde et al., 2006a |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 4,7 | Martin et al., 2004b |
| Réseau trophique du dauphin à gros nez (plasma)[4] | Terrain | Charleston, Caroline du Sud | FAT | 3 | Houde et al., 2006a |
| Réseau trophique du dauphin à gros nez (corps entier)[4] | Terrain | Charleston, Caroline du Sud | FAT | 2,3 | Houde et al., 2006a |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 11 | Butt et al., 2008 |
| Hareng/zooplancton | Terrain | Westerschelde, Pays-Bas | FBM | 1,9 | van den Heuvel-Greve et al., 2009 |
| Bar commun/hareng | Terrain | Westerschelde, Pays-Bas | FBM | 3,2 | van den Heuvel-Greve et al., 2009 |
| Phoque commun/hareng | Terrain | Westerschelde, Pays-Bas | FBM | 53 | van den Heuvel-Greve et al., 2009 |
| Phoque commun/bar commun | Terrain | Westerschelde, Pays-Bas | FBM | 17 | van den Heuvel-Greve et al., 2009 |
| Flet/scrobiculaire | Terrain | Westerschelde, Pays-Bas | FBM | 10 | van den Heuvel-Greve et al., 2009 |
| Flet/arénicole | Terrain | Westerschelde, Pays-Bas | FBM | 25 | van den Heuvel-Greve et al., 2009 |
| Phoque commun/flet | Terrain | Westerschelde, Pays-Bas | FBM | 9 | van den Heuvel-Greve et al., 2009 |
| Phoque annelé/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 6,6 | Tomy et al., 2009b |
| Béluga/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 229 | Tomy et al., 2009b |
| Béluga/hareng du Pacifique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 353 | Tomy et al., 2009b |
| Béluga/cisco arctique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 181 | Tomy et al., 2009b |
| Morue (foie)/Calanus hyperboreus (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,3 | Tomy et al., 2009b |
| Morue (foie)/Themisto libellula (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,3 | Tomy et al., 2009b |
| Eau de mer/huître creuse du Pacifique | Laboratoire | Ferme ostréicole, Corée | FBC | 633,9-1 652,7 | Jeon et al., 2010a |
| Chlorella ellipsoidea/huître creuse du Pacifique | Laboratoire | Ferme ostréicole, Corée | FBA | 954,6-2 555,2 | Jeon et al., 2010a |
| Eau de mer/sébaste noir (foie) | Laboratoire | Corée | FBC | 1 070-1 345 | Jeon et al., 2010b |
| Eau de mer/sébaste noir (sérum) | Laboratoire | Corée | FBC | 13 553-16 370 | Jeon et al., 2010b |
| APFC en C12 | |||||
| Lumbriculus variegatus | Laboratoire/ terrain |
Californie, en aval d’une UTEU | FABS en poids humide | 0,42-0,55 | Higgins et al., 2007 |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 18 000L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (sang) | Laboratoire | n.d. | FBC | 40 000L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (foie) | Laboratoire | n.d. | FBC | 18 000L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM[1] | 0,43 | Martin et al., 2003a |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 1,9 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 1 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,3 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 1,6 | Martin et al., 2004b |
| Acoupa pintade/sar salème (entière) | Terrain | Charleston, Caroline du Sud | FBM | 0,1 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,2 | Houde et al., 2006a |
| Dauphin/sar salème (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,1 | Houde et al., 2006a |
| Dauphin/tambour ocellé (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,4 | Houde et al., 2006a |
| Dauphin/tambour brésilien (entier) | Terrain | Charleston, Caroline du Sud | FBM | 1,8 | Houde et al., 2006a |
| Dauphin/tambour croca (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,6 | Houde et al., 2006a |
| Dauphin/acoupa pintade (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,6 | Houde et al., 2006a |
| Mulet cabot/zooplancton (entier) | Terrain | Baie de Sarasota, Floride | FBM | 89 | Houde et al., 2006a |
| Goret mule/zooplancton (entier) | Terrain | Baie de Sarasota, Floride | FBM | 2,5 | Houde et al., 2006a |
| Spare tête-de-mouton/ zooplancton (entier) |
Terrain | Baie de Sarasota, Floride | FBM | 156 | Houde et al., 2006a |
| Sar salème/zooplancton (entière) | Terrain | Baie de Sarasota, Floride | FBM | 2,5 | Houde et al., 2006a |
| Acoupa pintade/zooplancton (entier) | Terrain | Baie de Sarasota, Floride | FBM | 35 | Houde et al., 2006a |
| Acoupa pintade/mulet cabot (entier) | Terrain | Baie de Sarasota, Floride | FBM | 0,4 | Houde et al., 2006a |
| Acoupa pintade/goret mule (entier) | Terrain | Baie de Sarasota, Floride | FBM | 14 | Houde et al., 2006a |
| Acoupa pintade/spare tête-de-mouton (entière) | Terrain | Baie de Sarasota, Floride | FBM | 0,2 | Houde et al., 2006a |
| Acoupa pintade/sar salème (entière) | Terrain | Baie de Sarasota, Floride | FBM | 14 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Baie de Sarasota, Floride | FBM | 0,1 | Houde et al., 2006a |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 12 | Martin et al., 2004b |
| Réseau trophique du dauphin à gros nez (plasma)[4] | Terrain | Charleston, Caroline du Sud | FAT | 0,7 | Houde et al., 2006a |
| Réseau trophique du dauphin à gros nez (corps entier)[4] | Terrain | Charleston, Caroline du Sud | FAT | 0,6 | Houde et al., 2006a |
| Zooplancton/morue polaire | Terrain | Ouest de l’Arctique canadien | FBA | 0,3 | Powley et al., 2008 |
| Morue polaire/phoque (sang) | Terrain | Ouest de l’Arctique canadien | FBA | 0,8 | Powley et al., 2008 |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 2,8 | Butt et al., 2008 |
| Phoque annelé/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,1 | Tomy et al., 2009b |
| Béluga/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 3,2 | Tomy et al., 2009b |
| Béluga/hareng du Pacifique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 7,9 | Tomy et al., 2009b |
| Béluga/cisco arctique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 4,0 | Tomy et al., 2009b |
| Morue (foie)/Calanus hyperboreus (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 1,2 | Tomy et al., 2009b |
| Morue (foie)/Themisto libellula (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 1,3 | Tomy et al., 2009b |
| APFC en C13 | |||||
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 3,1 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 1,2 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,4 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 2,5 | Martin et al., 2004b |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 2,5 | Martin et al., 2004b |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 3,8 | Butt et al., 2008 |
| APFC en C14 | |||||
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 23 000 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (sang) | Laboratoire | n.d. | FBC | 30 000 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (foie) | Laboratoire | n.d. | FBC | 30 000 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM[1] | 1 | Martin et al., 2003a |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | > 2,6 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 2,2 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,3 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | > 2,3 | Martin et al., 2004b |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 5,5 | Butt et al., 2008 |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 1[2] | Martin et al., 2004b |
[2] La pente de la droite de la concentration d’APFC en fonction de la concentration de d15N ne diffère pas significativement de 1.
[3] Parmi les organismes figuraient des mysidacés, des gaspareaux, des éperlans et des touladis.
[4] Parmi les organismes figuraient le mulet cabot, le sar salème, le tambour ocellé, le tambour brésilien, le tambour croca, l’acoupa pintade et le dauphin à gros nez.
[5] Les auteurs présentent cette valeur comme étant un FBC. Cependant, comme elle a été déterminée sur le terrain, là où la morue serait exposée par l’eau et par voie alimentaire, le FBC est analogue à un FBA.
Pour les APFC en C11 (2 700 < FBC < 11 000), C12 (18 000 < FBC < 40 000) et C14 (23 000 < FBC < 30 000), il existe des données empiriques indiquant que ces substances sont très bioaccumulables chez les poissons et qu’elles possèdent un potentiel de bioamplification chez les poissons et les mammifères marins. Bien qu’on ait trouvé des APFC en C14 et en C15 chez les poissons, les invertébrés et les ours blancs, il n’existe pas de données expérimentales ou estimées sur la bioaccumulation des APFC à longue chaîne comptant plus de 14 atomes de carbone. Il est possible néanmoins que les APFC à longue chaîne s’accumulent ou se bioamplifient chez les espèces marines ou terrestres selon leur conformation chimique (Wang et Ober, 1999).
D’après les données empiriques disponibles, les APFC à longue chaîne et leurs sels ne répondent pas aux critères de bioaccumulation (FBA ou FBC = 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). Cependant, le poids de la preuve est suffisant pour affirmer que les APFC à longue chaîne et leurs sels peuvent s’accumuler et se bioamplifier chez les mammifères terrestres et marins.
Potentiel d’effets nocifs sur l’environnement
Évaluation de l’exposition environnementale
Atmosphère
Loewen et al. (2008) ont étudié les concentrations de FTOH dans l’atmosphère et dans l’eau de lac le long d’un transect altitudinal de l’Ouest canadien. Les échantillons d’eau ont été prélevés au lac Cedar (petit lac situé près de Golden, en Colombie-Britannique), au lac Bow dans le parc national Banff (Banff, Alberta) et à un autre petit lac sans nom situé aussi dans ce parc. Des échantillonneurs d’air passifs ont été installés en différents points d’un transect altitudinal (800 à 2 740 m au-dessus du niveau de la mer) allant de Golden, en Colombie-Britannique, jusqu’au parc national de Banff. Les auteurs ont noté que la quantité de FTOH 8:2 et 10:2 dans l’air (< 2,0 ng/échantillonneur) augmentait avec l’altitude, et que les concentrations d’APFC en C10dans l’eau de lac étaient inférieures à 0,2 ng/L.
Stock et al. (2007) ont prélevé des échantillons des phases particulaire et gazeuse de l’air sur l’île Cornwallis, au Nunavut, où les valeurs moyennes des concentrations totales de FTOH étaient comprises entre 2,8 (FTOH 10:2) et 14 pg/m3 (FTOH 8:2). On a mesuré des concentrations moyennes d’ACFTI8:2 et 10:2 se situant entre 0,06 et 0,07 pg/m3. Quant aux concentrations moyennes d’APFC en C9 et C10, elles s’élevaient à 0,4 pg/m3, alors que celles des APFC en C11, C13 et C14 se situaient entre 0,02 et 0,06 pg/m3. Shoeib et al. (2006) ont recueilli 20 échantillons d’air à grand débit pendant une traversée de l’Atlantique Nord et de l’archipel canadien en juillet 2005 (de Gothenburg, Suède, à Barrow, Alaska, en passant par l’Atlantique Nord et l’archipel canadien). Les concentrations les plus élevées (sommes des phases gazeuse et particulaire) de FTOH ont été mesurées pour le FTOH 8:2 (5,8 à 26 pg/m3), suivi par le FTOH 10:2 (1,9 à 17 pg/m3), puis le FTOH 6:2 (sous le seuil de détection à 6,0 pg/m3). À des fins de comparaison, Shoeib et al. (2006) ont également recueilli des échantillons d’air en milieu semi-urbain à Toronto en mars 2006 et la concentration moyenne de FTOH 8:2 y était de 41 pg/m3. Des études menées à Toronto ont révélé des concentrations de FTOH 4:2, 6:2, 8:2 et 10:2 allant de valeurs non détectables (ND) à 650 pg/m3 sur une période de 2 ans, les FTOH 8:2 étant prédominants pendant la première moitié de cette période, et les FTOH10:2, pendant la seconde (Stock et al., 2005). Dreyer et al. (2009) ont effectué un échantillonnage d’air à grand débit au-dessus de l’océan Atlantique, de l’océan Austral et de la mer Baltique. Des APFC en C9, C10, C11, C12 et C13ont été détectés dans la fraction particulaire (< 1 pg/m3). Le FTOH 6:2 et le FTOH 8:2 étaient les formes dominantes dans la fraction de la phase gazeuse. Les concentrations de FTOH 8:2 variaient entre 1,8 et 130 pg/m3. La somme de tous les FTOH (FTOH 4:2, FTOH 6:2, FTOH 8:2, FTOH 10:2 et FTOH 12:2) allait de 0,3 à 47 pg/m3.
Comme on l’a mentionné précédemment, les FTOH peuvent se décomposer pour donner des APFC à longue chaîne; par conséquent, les concentrations de FTOH dans l’atmosphère peuvent être une source d’accroissement des concentrations d’APFCà longue chaîne dans l’environnement, y compris dans l’Arctique canadien. La dégradation des FTOH dans l’atmosphère devrait produire des quantités relativement égales d’APFC dont la chaîne compte un nombre pair de carbones et d’APFC dont la chaîne compte un nombre impair de carbones (Ellis et al., 2004b), tandis que la biodégradation aérobie des FTOH tend à générer surtout des APFC dont la chaîne compte un nombre pair de carbones (Dinglasan et al., 2004).
Eau
Certains APFC à longue chaîne ont été mesurés dans les précipitations dans des régions isolées du Canada de 1998 à 1999 : île Saturna (Colombie-Britannique), Algoma (Ontario) et Kejimkujik (Nouvelle-Écosse) [Scott et al., 2006b]. Scott et al. (2006b) ont enregistré des concentrations d’APFCen C9 de < 0,1 à 7,6 ng/L, la plus forte ayant été mesurée à Algoma (Ontario), soit 7,6 ng/L. En milieu urbain (Egbert et North Toronto, en Ontario), les concentrations d’APFC en C9 se situaient entre 0,4 et 9,7 ng/L. Par ailleurs, des APFCen C9 à C12 n’ont été détectés que dans les zones urbaines, et ce, en concentrations de < 0,07 à 5,2 ng/L. Les auteurs ont également détecté des ACFT et des ACFTI 8:2 et 10:2 à deux sites urbains au Canada (Egbert et North Toronto), à des concentrations allant de < 0,07 à 8,6 ng/L. Loewen et al. (2005) ont aussi mesuré des ACFT et des ACFTI en C10 et en C12 dans des échantillons d’eau de pluie recueillis à Winnipeg (Manitoba).
Simcik et Dorweiler (2005) ont mesuré les concentrations de certains APFC à longue chaîne dans des régions isolées (Tettegouche et Nipisiquit) le long de la rive nord du lac Supérieur et dans le parc national des Voyageurs, à la frontière canado-américaine (lacs Loiten et Little Trout). Ces quatre lacs isolés ne sont accessibles qu’à pied (aucune route carrossable) et n’ont aucune arrivée d’eau en surface. Seul de l’APFC en C9 a été détecté en concentration supérieure à 1 ng/L (à Nipisiquit). Scott et al. (2003, 2006a) ont mesuré des APFC en C9 dans les Grands Lacs (lacs Ontario, Érié, Supérieur et Huron) à des concentrations allant de < 0,5 à 0,11 ng/L. En outre, Simcik et Dorweiler (2005) ont étudié trois lacs urbains interreliés à Minneapolis, au Minnesota (lac des Isles, lac Calhoun et lac Harriet), ainsi que la rivière Minnesota, un affluent important du fleuve Mississippi. De l’APFC en C9 a été décelé dans le lac Calhoun (< 1,0 ng/L) et dans la rivière Minnesota (< 10 ng/L). Le lac Calhoun renfermait également de l’APFC en C10(< 1,0 ng/L).
Stock et al. (2007) ont mesuré les concentrations d’AFPC en C9, C10, C11 et C12 dans des échantillons d’eau prélevés dans trois lacs éloignés de l’Arctique (lacs Resolute, Char et Amituk) sur l’île Cornwallis, au Nunavut, en 2003. Les concentrations moyennes d’APFC en C9 et C10 se situaient respectivement entre 0,3 et 4,1 ng/L et entre 1,1 et 19 ng/L. Les concentrations d’APFC en C11 se situaient quant à elles entre 0,3 et 4,9 ng/L, et celles d’APFC en C12 étaient comprises entre 0,2 et 0,8 ng/L. Les concentrations d’ACFTI 8:2 et d’ACFTI 10:2 ont été mesurées dans les trois lacs et variaient entre 1,1 et 6,4 ng/L.
Scott et al. (2009) ont prélevé des échantillons dans 38 rivières (en amont et en aval de zones peuplées) dans l’ensemble du Canada pour analyser les composés perfluorés au cours de la période de 2001 à 2008. L’APFC en C9était présent dans la majorité des échantillons (< 0,008 à 2,26 ng/L), mais les autres APFC à longue chaîne analysés (C10 à C14) n’étaient pas souvent détectés. Les concentrations d’APFC en C10, C11, C12 et C14 étaient comprises respectivement entre 0,005 et 1,12 ng/L, 0,004 et 0,61 ng/L, 0,001 et 0,06 ng/L et < 0,004 et 2,69 ng/L. L’APFC en C13n’a pas été détecté. La plupart des sites en aval des zones urbaines présentaient des concentrations plus élevées que les sites en amont. Des sites de référence, tels que l’eau de fonte glaciaire en Colombie-Britannique, présentaient des concentrations d’APFCà longue chaîne plus faibles ou non détectables.
Ahrens et al. (2009) ont analysé des échantillons d’eau de surface prélevés en 2007 dans l’océan Atlantique le long du gradient longitudinal entre Las Palmas (Espagne) et St. John’s (Canada) et le long du gradient latitudinal entre le golfe de Gascogne et l’océan Atlantique Sud. Aucun APFC à longue chaîne n’a été détecté dans la phase particulaire ni dans les deux échantillons d’eaux des grands fonds prélevés à 200 m et à 3 800 m. On a mesuré des concentrations d’APFC en C9 en phase dissoute de < 0,0051 à 0,107 ng/L; et, en général, les concentrations d’AFPC en C12 mesurées ne dépassaient pas 0,0014 ng/L. Del Vento et al. (2009) ont mesuré jusqu’à 0,13 ng/L d’APFC en C9dans l’eau de mer de la partie est de la mer de Beaufort, près de l’île Banks. Ahrens et al. (2010b) ont prélevé des échantillons d’eau de surface du 2 novembre au 30 décembre 2008 le long du gradient latitudinal allant de la mer du Nord (nord de l’Europe) à l’Antarctique. Des APFC en C9 à C12 ont été détectés dans les échantillons de la phase dissoute, mais pas dans la phase particulaire. Les concentrations d’APFC en C10allaient de < 0,005 5 à 0,037 ng/L. Les concentrations d’APFCen C9, C11 et C12 étaient situées sous la limite de quantification. Del Vento et al. (2009) ont également mesuré des concentrations d’APFC en C9 à C11 se situant entre 0,035 et 1,3 ng/L dans la neige du golfe Amundsen. En outre, on a détecté des concentrations d’APFC en C9 de l’ordre des ng/L dans de l’eau de mer en Asie; les valeurs étaient trois fois plus élevées dans les régions côtières qu’au large, et leur variabilité était plus grande (So et al., 2004; Yamashita et al., 2004, 2005).
Sédiments
Stock et al. (2007) ont mesuré les concentrations d’APFC en C9, C10, C11 et C12dans les échantillons de carotte de sédiments provenant de trois lacs isolés en Arctique (les lacs Resolute, Char et Amituk) sur l’île Cornwallis, au Nunavut, en 2003. Les concentrations d’AFPC diminuaient avec la profondeur et l’âge des sédiments. On a relevé des APFC en C9 à C12 dans le lac Amituk. Des concentrations d’APFCen C9 à C11 se situant entre 0,6 et 3,3 ng/g ont été mesurées dans le lac Char. Dans le lac Resolute, on a mesuré des concentrations d’APFC en C9allant jusqu’à 3,2 ng/g alors que les concentrations d’APFC en C10, C11 et C12 se trouvaient à la limite de détection de 0,5 ng/g. Des ACFTI 10:2 ont été mesurés dans les lacs Char et Amituk à des concentrations se situant entre 0,5 et 2 ng/g.
Biote
On a signalé des concentrations d’APFC à longue chaîne chez plusieurs animaux d’eau douce et animaux marins en Amérique du Nord et au Groenland, dont l’ours blanc (De Silva et Mabury, 2004; Kannan et al., 2005; Smithwick et al., 2005a, 2005b, 2006; Dietz et al., 2008), le phoque annelé (Bossi et al., 2005; Butt et al., 2008), le dauphin à gros nez (Houde et al., 2005), les animaux d’un réseau trophique du lac Ontario (Martin et al., 2004b), le touladi (Furdui et al., 2007, 2008), le fulmar boréal et le guillemot de Brünnich (Butt et al., 2007a).
Martin et al., (2004b) ont mesuré les concentrations d’APFC en C9 à C15 dans des échantillons d’homogénat entier de divers poissons du lac Ontario; celles-ci allaient de < 0,5 ng/g poids humide (limite de détection : 0,5 ng/g) à 39 μg/kg poids humide (chabot; APFC en C11). Après le déversement accidentel d’une mousse extinctrice aqueuse dans le ruisseau Etobicoke, en Ontario, Moody et al. (2002) ont constaté la présence d’APFC en C10, C11 et C13 dans le foie de ménés à nageoires rouges (Notropus cornutus). Il est à noter que les concentrations dans le biote n’étaient probablement pas toutes attribuables au déversement. Les concentrations allaient de 8,8 à 390 ng/g poids humide, la valeur la plus élevée étant associée à l’APFC en C10.
Martin et al. (2004a) ont établi la présence d’APFCen C9 à C15 dans le foie d’une gamme d’espèces comprenant phoques, renards, poissons, ours blancs et oiseaux, échantillonnées entre 1993 et 2002 dans l’Arctique canadien. Chez toutes les espèces, les concentrations dans le foie se situaient entre des quantités non détectables et 180 ng/g poids humide (limite de détection = 0,5 ng/g). Les valeurs les plus élevées ont été mesurées chez les ours blancs (Ursus maritimus; concentration maximale de 180 ng/g poids humide; APFC en C9), et elles décroissaient à mesure que la longueur de la chaîne augmentait. Stern (2009) a mesuré les concentrations d’APFC en C9 à C11 dans le foie de la lotte du fleuve Mackenzie à Fort Good Hope, dans les Territoires du Nord-Ouest. Trente-sept lottes ont été analysées; on a relevé des concentrations moyennes en poids humide se situant entre 0,89 et 7,97 ng/g pour les APFC en C9, entre 1,2 et 36,85 ng/g pour les APFC en C10 et entre 7,0 et 2,25 ng/g pour les APFC en C11. Butt et al. (2007a) ont noté que les APFC en C11 à C15 prédominaient chez les oiseaux marins de l’Arctique, même si l’APFC détecté chez la plupart des espèces sauvages (p. ex., le phoque annelé) était souvent un APFC en C8 à C11. Powley et al. (2008) ont détecté des APFC en C9 à C12 dans divers organismes de l’île Banks (à la limite est de la mer de Beaufort, dans les Territoires du Nord-Ouest). Les concentrations dans le zooplancton (Calanis hyperboreus, Themisto libellula, Chaetognatha) allaient de quantités non détectables à 1,1 ng/g poids humide. Chez la morue polaire (Boreogadus saida), les concentrations se situaient entre des quantités non détectables et 0,6 ng/g poids humide. Chez le phoque annelé (Phoca hispida), les concentrations dans la graisse variaient de quantités non détectables à 0,2 ng/g poids humide; dans le sang, elles étaient de 1 à 2,5 ng/g et, dans le foie, de 1 à 6,9 ng/g poids humide. Aucune concentration n’a été détectée dans la graisse, le sang ou le foie du phoque barbu (Eriganthus barbatus). Il convient de noter que l’effectif des échantillons était petit (1 à 5). En 2007, Tomy et al.(2009b) ont mesuré les concentrations d’APFC en C8 à C12 dans le foie de divers animaux occupant les niveaux trophiques supérieurs d’un réseau trophique marin de l’est de l’Arctique, dans la baie Cumberland, au Nunavut. Les concentrations hépatiques en poids humide se situaient entre 38,07 et 47,6 ng/g chez le béluga, entre 11,71 et 50,78 ng/g chez le narval, entre 2,93 et 12,78 ng/g chez le phoque du Groenland, entre 2,18 et 23,4 ng/g chez le phoque annelé et entre 17,76 et 110,79 ng/g chez le requin du Groenland. En général, les concentrations d’APFC en C11 prédominaient, sauf chez le requin du Groenland où l’APFC en C12prédominait.
Houde et al. (2006c) ont évalué les concentrations d’APFC en C9 à C12 et en C14 dans le plasma, le lait et l’urine de dauphins à gros nez vivant dans la baie de Sarasota (Floride, États-Unis) et aux alentours. Depuis 35 ans, la population de dauphins résidant à l’année dans la baie (approximativement 160 animaux) fait l’objet d’un projet de surveillance à long terme. Houde et al. (2006c) ont étudié les relations entre les concentrations d’APFC et des paramètres biologiques connus (âge, sexe, antécédents de reproduction et paramètres morphométriques). Le principal APFC détecté était l’APFC en C11. Les concentrations plasmatiques d’APFC en C9 se situaient entre 11,7 et 24,5 ng/g poids humide; dans le lait, la concentration s’établissait à 2,2 ng/g poids humide et, dans l’urine, elle était inférieure à la limite de détection. Les concentrations plasmatiques d’APFC en C10 se situaient entre 15,8 et 35,7 ng/g poids humide; dans le lait, la concentration était de 2,4 ng/g et, dans l’urine, elle était inférieure à la limite de détection. Les concentrations plasmatiques d’APFC en C11 se situaient entre 31,4 et 64,7 ng/g poids humide; dans le lait, la concentration se chiffrait à 3 ng/g poids humide et, dans l’urine, elle était de 0,06 ng/g. Les concentrations plasmatiques d’APFC en C12 se situaient entre 2,7 et 8,2 ng/g poids humide; dans le lait, la concentration se chiffrait à 2,9 ng/g et, dans l’urine, elle était inférieure à la limite de détection. Les concentrations plasmatiques d’APFC en C14 se situaient entre 1,1 et 3,4 ng/g poids humide; le lait et l’urine n’ont fait l’objet d’aucune analyse. On n’a trouvé aucune différence significative entre les dauphins vivant à l’extrémité nord de la baie de Sarasota et les individus fréquentant sa partie sud. La baie de Sarasota est un milieu semi-fermé bordé d’une zone urbaine fortement résidentielle, ce qui pourrait expliquer les concentrations relativement élevées mesurées chez les dauphins résidents. L’analyse des tendances temporelles a montré que les concentrations plasmatiques de composés perfluorés n’étaient pas significativement plus élevées chez les dauphins capturés à l’été 2003 et à l’hiver 2004 par rapport à celles enregistrées pour les autres saisons d’échantillonnage. Les résultats ont révélé des corrélations négatives significatives entre les concentrations d’APFC en C9 à C12 et l’âge des dauphins. Aucune relation significative n’a été établie en fonction du sexe. Les concentrations diminuaient avec l’âge chez les mâles comme chez les femelles.
Delinsky et al. (2010) ont détecté des APFC en C10 à C12 chez le crapet arlequin (Lepomis macrochirus), la marigane noire (Pomoxis nigromaculatus) et le crapet-soleil (Lepomis gibbosus) capturés dans le cours supérieur du fleuve Mississippi, au Minnesota, et dans des lacs situés dans 81 bassins versants majeurs du Minnesota en 2007. Dans ces bassins versants, les utilisations prédominantes des terres se répartissaient ainsi : terres forestières (86 %), terres aménagées (47 %) et terres arables/fourrage/pâturage (87 %). Les concentrations d’APFC en C10 à C12 dans les filets de poisson variaient entre 2,13 et 15,0 ng/g à cinq sites d’échantillonnage et n’étaient pas détectables aux 16 autres sites.
Dans le monde entier, un certain nombre d’études signalent les concentrations de certains APFC à longue chaîne dans le biote, notamment le marsouin (van der Vijver et al., 2004, 2007), les phoques communs (van der Vijver et al., 2005) et les goélands bourgmestres (Verreault et al., 2005). K.I. van de Vijver et al. (2007) ont prélevé des échantillons de foie chez le marsouin commun (Phocena phocena relicta) le long de la côte ukrainienne de la mer Noire. Les concentrations se situaient entre 1,4 et 19 ng/g poids humide, les APFC en C10ayant la plus forte concentration. K.I. van de Vijver et al. (2003) ont également montré la présence d’APFC en C9 à C11 dans le foie de plusieurs mammifères de la côte de la mer du Nord, notamment dans le foie d’un grand cachalot, d’un dauphin à flancs blancs et de dauphins à nez blanc. Les concentrations se situaient entre des quantités non détectables à 480 ng/g poids humide pour les quatre espèces (limite de détection : 30 à 90 ng/g). Les concentrations étaient plus élevées chez le dauphin à nez blanc (Lagenorhynchus albirostris). Leonel et al.(2008) ont mesuré les concentrations d’APFC en C9 à C12 chez le dauphin de la Plata (Pontoporia blainvillei) dans le sud du Brésil. Les concentrations dans le foie allaient de < 0,1 à 0,46 ng/g poids humide, les APFC en C11 ayant la plus forte concentration. Leonel et al. (2008) ont aussi mesuré les concentrations d’APFC en C9 à C12 chez l’otarie à fourrure subantarctique (Arctocephalus tropicalis), également capturée dans le sud du Brésil. Les concentrations dans le foie se situaient entre < 0,1 et 0,74 ng/g poids humide, les APFC en C11 ayant également la plus forte concentration. Les concentrations d’APFC en C9 à C12 ont été mesurées dans le foie de la sotalie de Chine (Sousa chinensis) et du marsouin aptère (Neophocaena phocaenoides) à Hong Kong (Yeung et al., 2009c). Les concentrations d’APFC en C9 à C12 chez la sotalie de Chine se situaient entre 0,243 et 120 ng/g poids humide; celles chez le marsouin aptère, entre 0,522 et 34,3 ng/g poids humide.
Tseng et al. (2006) ont trouvé des APFC en C10dans les huîtres (Crassostrea gigas), le tilapia (Oreochromis sp.) et le bar du Japon (Lateolabrax japonicus) à Taiwan. Les concentrations de cet acide dans les huîtres se situaient entre 140 et 320 ng/g poids humide. Les concentrations hépatiques et musculaires étaient respectivement de 390 et de 250 ng/g poids humide chez le tilapia. Quant à celles mesurées dans le bar du Japon, elles étaient de 480 ng/g poids humide.
Des concentrations d’APFC en C9 à C12 comprises entre 5,7 et 675 ng/g poids humide ont été mesurées dans les jaunes d’œufs de trois espèces d’oiseau – l’aigrette garzette (Egretta garzetta), le pluvier petit-gravelot (Charadrius dubius) et le paradoxornis de Webb (Paradoxornis webbiana) – qui ont été récoltés autour du lac Shihwa, en Corée (Yoo et al., 2008). La plus forte concentration a été relevée chez le pluvier petit-gravelot, soit une concentration d’APFCen C11 de 675 ng/g poids humide. On n’a pas décelé d’APFCen C9 dans le foie du fulmar boréal (Fulmarus glacialis) le long de la côte de Svalbard et de BjØrnØya dans la mer de Barents (Arctique norvégien) (Knudsen et al., 2007). Holmstrom et Berger (2008) ont toutefois tenté de mesurer les concentrations d’APFC en C9 à C16 chez le guillemot marmette (Uria aalge). Les concentrations d’APFC en C16étaient inférieures à la limite de détection. Quant aux concentrations d’APFC en C9 à C15, elles se situaient entre 0,17 et 32 ng/g poids humide. Wang et al. (2008) ont mesuré les concentrations d’APFCen C9 à C12 dans les œufs d’oiseaux aquatiques, dans le sud de la Chine. Les concentrations d’APFCen C9 à C12 mesurées dans les échantillons d’œufs de bihoreau gris (Nycticorax nycticorax) se situaient entre 0,072 et 41,3 ng/g poids humide, chez les grandes aigrettes (Ardea alba), les concentrations étaient comprises entre 0,225 et 5,79 ng/g poids humide et celles relevées chez les aigrettes garzettes variaient de 0,77 à 39,4 ng/g poids humide.
Des concentrations d’APFC en C9 à C12 ont également été mesurées dans le foie de castors capturés en Pologne; elles se situaient entre < 0,04 et 4,46 ng/g poids humide, la plus forte concentration ayant été enregistrée pour l’APFC en C9(Taniyasu et al., 2005). Des rats sauvages mâles (Rattus norvegicus) ont été capturés dans huit sites au Japon (une UTEU, un port, deux zones industrielles, un marché de fruits de mer, un marché, deux sites d’enfouissement et un port de fruits de mer) [Yeung et al., 2009b]. Des échantillons de sang entier ont été analysés pour y vérifier la présence d’APFC en C9 à C12; les concentrations moyennes mesurées se situaient entre 0,792 et 7,3 ng/mL. Li et al. (2008) ont mesuré les concentrations d’APFC en C9 à C10 dans le sérum du tigre de Sibérie (Panthera tigris altaica) vivant dans le nord-est de la Chine, dans l’extrême-est de la Russie et en Corée du Nord. L’APFC en C9, dont les concentrations allaient de 0,13 à 0,89 ng/mL, représentait l’un des composés perfluorés les plus prédominants dans le sérum des tigres de Sibérie. Les concentrations moyennes d’APFC en C10 se situaient entre 0,1 et 0,15 ng/mL. Des différences selon le sexe ont été trouvées en ce qui concerne l’accumulation des APFC en C9 et C10; en effet, les concentrations étaient un peu plus élevées chez les femelles que chez les mâles.
Tendances temporelles et spatiales
Une étude temporelle sur 22 ans (1980 à 2002) a été menée sur les matières en suspension dans la décharge de la rivière Niagara; en général, les concentrations d’APFC observées augmentaient au fil du temps (Lucaciu et al., 2004). Myers et al. (2009) ont étudié la distribution spatiale et les tendances temporelles des composés perfluorés dans les sédiments et les eaux de surface des Grands Lacs. D’après leurs résultats, la distribution spatiale des APFC (en C7 à C12) montre que les activités urbaines et industrielles ont eu une incidence sur les concentrations mesurées dans les sédiments et les eaux des Grands Lacs. Dans les eaux de surface du lac Ontario, les échantillons prélevés dans les affluents contenaient des concentrations d’APFC en C7 à C12 plus élevées que les échantillons prélevés à proximité des rives et au milieu du lac; toutefois, en ce qui concerne les sédiments, les plus fortes concentrations ont été enregistrées dans les échantillons prélevés au milieu du lac. Myers et al. (2009) ont également remarqué que les concentrations d’APFC en C7 à C12 dans les sédiments du lac Ontario sont en augmentation. Ils ont cependant constaté une hausse et une stabilisation des concentrations dans les sédiments du lac Supérieur, ce qui peut refléter le transport atmosphérique des APFC en C7 à C12.
Furdui et al. (2007) ont déterminé les tendances spatiales des APFC à longue chaîne chez les touladis (Salvelinus namaycush, classe d’âge de 4 ans) capturés dans les Grands Lacs en 2001. On a relevé des concentrations d’APFC en C9 à C15 se situant entre 0,37 et 4,9 ng/g poids humide. Les plus fortes concentrations ont été observées dans le lac Érié, puis dans le lac Huron, le lac Ontario, le lac Michigan et le lac Supérieur. Aucune corrélation significative n’a été trouvée entre les concentrations et le poids des poissons. Les tendances temporelles des APFC à longue chaîne ont été déterminées chez les touladis échantillonnés entre 1979 et 2004 dans le lac Ontario (Furdui et al., 2008). Les concentrations d’APFC étaient généralement faibles (ND à 3 ng/g), les concentrations les plus élevées ayant été enregistrées pour les APFC en C11, C12 et C13. La plupart des concentrations d’APFCmesurées en 1988 ou en 1993 (< 3 ng/g) étaient en général plus fortes qu’en 1979 (< 1 ng/g), après quoi on constatait une stabilisation ou une baisse des concentrations. Des analyses de régression pour les divers APFC individuels n’ont pas donné de résultats assez significatifs pour conclure à un déclin au cours des dernières années, après les sommets de 1988 ou 1993.
Une étude des tendances temporelles des concentrations dans le foie du fulmar boréal (Fulmarus glacialis) et du guillemot de Brünnich (Uria lomvia) dans l’Arctique canadien a révélé des hausses globales des APFC au fil du temps chez les deux espèces (Butt et al., 2007a). Les moyennes géométriques des concentrations des ?APFC mesurées chez les guillemots de Brünnich et les fulmars boréaux s’élevaient respectivement à 23,9 ng/g et à 12,4 ng/g. L’APFC en C13était le composé dominant, suivi par les APFC en C11 et en C14. Les concentrations d’APFC chez les guillemots de Brünnich ont augmenté entre 1975 et 2004, le temps de doublement allant de 2,3 ans pour les APFC en C15 à 9,9 ans pour les APFC en C12. En ce qui concerne les fulmars boréaux, le temps de doublement allait de 2,5 ans pour les APFC en C15 à 11,7 ans pour les APFC en C12. Cependant, dans le cas des fulmars boréaux, la plupart des APFC ont atteint des concentrations maximales en 1993 ou des concentrations statistiquement similaires en 1987, 1993 et 2003. Ces résultats peuvent découler des différents trajets migratoires des espèces d’oiseaux (Butt et al., 2007a). Gebbink et al.(2009a) ont déterminé la distribution spatiale, les tendances et les sources des APFC en C9 à C15 dans 16 colonies d’espèces de goéland échantillonnées de l’est (Nouvelle-Écosse, Nouveau-Brunswick, Terre-Neuve) à l’ouest du Canada (Alberta, Colombie-Britannique), en passant par le centre (Québec, Ontario, Manitoba). Les quatre espèces étudiées sont le goéland à ailes grises (Larus glaucescens), le goéland de Californie (Larus californicus), le goéland à bec cerclé (Larus delawarensis) et le goéland argenté (Larus argentatus). Les auteurs ont remarqué que les ?APFC étaient plus élevés dans les œufs de goéland argenté récoltés dans les colonies du sud de l’Ontario et de l’ouest du Québec situées à proximité des sources urbaines. Les APFC en C11 et C13 étaient en général prédominants dans la plupart des colonies, bien que des différences aient été observées entre les colonies. Dans l’ensemble, on juge que la distribution spatiale des APFC dans les œufs de goéland au Canada est essentiellement influencée par l’emplacement et la proximité de sources locales et non par l’alimentation. Gebbink et al. (2009b) ont récolté des œufs de goéland argenté dans 15 colonies situées sur des sites canadiens et quelques sites américains des Grands Lacs. On a relevé des APFC en C9 à C15 parmi lesquels les APFC en C11 et C13 prédominaient. Les APFC en C9étaient plus abondants dans les colonies du lac Supérieur et du lac Michigan et les APFC en C11étaient plus abondants dans les colonies du lac Érié et du lac Ontario. Les plus fortes concentrations d’?APFC (113 ng/g poids humide) ont été mesurées dans les colonies du lac Huron, puis dans les colonies du lac Érié et du lac Ontario. Aucun FTOH 8:2 et 10:2 n’a été détecté dans les œufs de goéland argenté.
Verreault et al. (2007) ont montré des tendances temporelles pour les œufs entiers de goélands argentés dans deux colonies géographiquement isolées (HornØya et RØst) dans le nord de la Norvège. Ces colonies faisaient partie de l’aire de répartition sud et nord des goélands argentés se reproduisant au nord de la Norvège. L’APFC à longue chaîne dominant dans les œufs de goéland argenté était l’APFCen C11 (4,2 ng/g poids humide, HornØya), suivi par l’APFC en C13 (2,8 ng/g poids humide, RØst). Les APFC en C9 à C13 mesurés dans les deux colonies ont significativement augmenté entre 1983 et 1993 et ont continué d’augmenter (APFC en C9, C10 et C11) ou se sont stabilisés (APFC en C12 et C13) après 1993. Les tendances spatiales entre les deux colonies étaient semblables, sauf pour l’APFC en C9 qui était plus élevé dans la colonie de RØst. Les œufs de la colonie de RØst récoltés en 1993 affichaient également des proportions plus élevées d’APFC en C14 et C15comparativement à ceux de la colonie de HornØya et à d’autres années d’échantillonnage. Verreault et al. (2007) laissent entendre que les sources locales ou éloignées directes et indirectes d’APFC à longue chaîne ont probablement changé dans le nord de la Norvège au cours des deux dernières décennies. Sinon, il a pu se produire des changements liés aux préférences alimentaires des goélands argentés adultes du nord de la Norvège; ces goélands ont une aire d’alimentation annuelle limitée et sont principalement piscivores même s’ils peuvent également se nourrir de crustacés, d’oisillons marins, d’œufs et d’autres sources d’alimentation terrestres (déchets produits par les humains). Löfstrand et al. (2008) ont déterminé les tendances spatiales relatives aux œufs de guillemot (Uria aalge) récoltés en Islande, en Suède, dans les îles Féroé et en Norvège (Sklinna et HjelmsØya). L’APFC en C9n’a été détecté qu’en Suède, sa concentration s’élevant à 48 ng/g poids humide. On a relevé des APFC en C10uniquement en Islande et en Norvège, et leurs concentrations se situaient entre 38 et 42 ng/g poids humide. L’APFC en C11semble prédominer avec des concentrations se situant entre 9 et 140 ng/g poids humide, suivis par les APFC en C12dont les concentrations variaient de ND à 81 ng/g poids humide. Les concentrations d’?APFC étaient les plus fortes en Suède (150 ng/g poids humide), puis en Islande (96 ng/g poids humide) et dans les îles Féroé (76 ng/g poids humide). Löfstrand et al. (2008) laissent entendre que les profils spatiaux diffèrent probablement en raison des différences d’habitudes alimentaires des guillemots dans tout l’Atlantique et en raison du fait que les œufs provenant de la Suède ont été échantillonnés à des sites plus proches de zones industrielles et de zones fortement peuplées.
Des tendances temporelles à la hausse des concentrations d’APFC en C9 à C15 dans les œufs de faucon pèlerin (Falco peregrinus) ont été observées de 1974 à 2007 (Holmström et al., 2010). Des œufs de faucon pèlerin ont été récoltés dans le sud-ouest de la Suède. Toutefois, en raison du faible succès de reproduction au cours des 20 premières années, seuls quelques œufs ont été prélevés, et aucun œuf n’a été récolté entre 1987 et 1991. Par conséquent, tous les œufs recueillis jusqu’en 1999 ont été analysés individuellement. Les œufs ont été regroupés à partir de l’année 2000. Des APFC en C13ont été décelés dès 1974 et étaient les AFPC les plus dominants, suivis par les AFPC en C11. Les tendances temporelles ont augmenté de manière exponentielle au fil des ans, malgré un taux d’augmentation variant entre 5,6 % (APFC en C13) et 9 % (APFC en C14) par an. Les APFC en C11 à C15 affichent une tendance à la stabilisation au cours des dernières années.
Les concentrations d’APFC mesurées dans le foie de phoques annelés de l’est et de l’ouest du Groenland entre 1980 et 2000 ont connu une hausse de 3,3 et de 6,8 % par année dans le cas de l’APFC en C10 et de l’APFC en C11, respectivement (Bossi et al., 2005). Butt et al.(2007b) ont examiné les tendances temporelles dans des échantillons de foie prélevés au sein de deux populations de phoques annelés de l’Arctique canadien, soit l’une à Arviat (1992, 1998 et 2005) et l’autre à la baie Resolute (1972, 1993, 2000 et 2005). Les concentrations d’APFC en C9 à C15 ont augmenté de 1992 à 1998, mais les points d’échantillonnage ultérieurs (1998, 2003 et 2005) n’étaient pas différents du point de vue statistique. Les concentrations ont augmenté de 117 % pour les APFC en C14 et de 310 % pour les APFC en C9 entre 1992 et 2005. Ni dans une population ni dans l’autre, on n’a noté de différence significative entre les sexes pour les APFCanalysés. Dans l’ensemble, les concentrations d’APFCont augmenté entre 1993 et 2005; toutefois, les hausses notées ces dernières années n’étaient pas significatives sur le plan statistique. Le temps de doublement se situait entre 10,0 (APFC en C9) et 19,4 ans (APFC en C12). Butt et al. (2008) ont détecté des APFC à longue chaîne dans les échantillons de foie provenant de 11 populations de phoques annelés échantillonnées dans l’Arctique canadien de 2002 à 2005. Les concentrations d’APFC en C9 à C11 se situaient entre 1 et 10 ng/g poids humide, tandis que celles des APFC en C12 à C15 étaient inférieures à 1 ng/g poids humide. En outre, des ACFTI 8:2 et 10:2 ont été analysés chez toutes les populations. Cependant, les concentrations étaient inférieures à la limite de détection (non précisée). Des concentrations quantifiables ont été mesurées chez deux populations de phoques annelés, soit 4 à 6 ng/g poids humide. Certaines tendances spatiales statistiquement significatives ont été observées entre les diverses populations; toutefois, on a conclu que les variations étaient en grande partie attribuables au fait que les concentrations étaient élevées dans deux populations, et plus faibles dans une autre (Butt et al., 2008).
Les tendances temporelles ont été étudiées chez le phoque du Baïkal (Pusa sibirica) du lac Baïkal, dans l’est de la Sibérie, en Russie (Ishibashi et al. 2008b). Les APFC en C9 à C12 ont été mesurés dans le foie et le sérum de ce phoque. Le phoque du Baïkal est une espèce endémique et un prédateur de niveau trophique élevé dans le réseau trophique du lac Baïkal. Dans le foie des phoques mâles et femelles, les concentrations d’APFC en C9 à C12 variaient de < 0,56 à 72 ng/g poids humide. Dans le sérum de mâles et de femelles de cette espèce, les concentrations d’APFC en C9 à C12 se situaient entre < 0,33 et 4 ng/g poids humide (Ishibashi et al., 2008b). Les concentrations moyennes d’APFCen C9 et C10 dans le foie des phoques en 2005 étaient 1,2 et 1,7 fois supérieures à celles mesurées chez les phoques en 1992. Les concentrations d’APFC en C10étaient significativement plus grandes en 2005 qu’en 1992. En ce qui concerne les APFC en C9, bien que la tendance ait été à la hausse entre 1992 à 2005, aucune différence statistiquement significative n’a été observée.
Les études sur l’Arctique nord-américain menées par De Silva et Mabury (2004) ainsi que Smithwick et al. (2005a) ont révélé des concentrations hépatiques d’APFC à longue chaîne en général plus élevées chez les ours blancs de l’est (Groenland), certains éléments indiquant que les concentrations d’APFCen C9 et en C10 étaient quant à elles plus fortes dans l’ouest. L’examen de la circulation troposphérique indique que les régions du centre-est recevraient plus d’air de l’est de l’Amérique du Nord, et que celles de l’est (Groenland) recevraient de l’air de l’Amérique du Nord et de l’Europe (De Silva et Mabury, 2004). Il est possible que de plus fortes émissions d’APFC en C9 et en C10 en Asie explique le fait que les concentrations de ces congénères soient plus élevées chez les ours blancs de l’ouest de l’Arctique (Smithwick et al., 2005a). Une tendance d’ouest en est similaire a été constatée dans le cas des concentrations d’APFC dans des échantillons de foie de phoques annelés, bien que les concentrations les plus fortes aient été observées dans le sud de la baie d’Hudson (Butt et al., 2008). Sur la période de 1984 à 2006, Dietz et al. (2008) ont examiné un sous-échantillon de 128 ours blancs subadultes (âgés de 3 à 5 ans) d’Ittiqqortoormiit (Scoresby Sound) dans le centre du Groenland. Une analyse de régression linéaire des concentrations médianes soumises à une transformation logarithmique a révélé des augmentations annuelles pour les APFC en C9(6,1 %), les APFC en C10(4,3 %), les APFC en C11(5,9 %), les APFC en C12(52 %) et les APFC en C13(8,5 %). Entre 1972 et 2002, le temps de doublement moyen des concentrations dans le foie des ours blancs des régions de l’Arctique nord-américain se situait entre 5,8 ans dans l’est et 9,1 ans dans l’ouest pour les APFC en C9, C10 et C11 (Smithwick et al., 2006).
Tomy et al., (2009a) ont mesuré les tendances temporelles des ?APFC (C8 à C12) chez les bélugas mâles de Pangnirtung, au Nunavut, qui montraient une hausse annuelle de 1,8 ± 0,5 ng/g poids humide des concentrations hépatiques mesurées de 1980 à 2010. Les concentrations d’?APFC (C8 à C12) mesurées chez les bélugas mâles de Pangnirtung se situaient entre 2,4 et 171 ng/g poids humide. On a toutefois observé chez les bélugas mâles de l’île Hendrickson une diminution de 7,41 ± 0,71 ng/g poids humide des concentrations hépatiques relevées de 1980 à 2009 (Tomy et al., 2009a), les concentrations se situant entre 4,87 et 313 ng/g poids humide.
O’Connell et al. (2010) ont analysé des échantillons de plasma et de sérum de 163 tortues caouannes juvéniles (Caretta caretta) afin d’établir les tendances spatiales et temporelles des composés perfluorés. Les tortues ont été capturées sur une distance s’étendant jusqu’à 8,4 km de la rive la plus proche de Charleston (Caroline du Sud), du cap Canaveral (Floride), de Core Sound (Caroline du Nord), de la baie de Chesapeake (Maryland) et de la baie de Floride (Floride). Des APFC en C9 à C14 ont été trouvés dans la plupart des échantillons de plasma et de sérum (de 0,034 à 16,04 ng/g). Sur le plan spatial, il y avait une tendance à la hausse vers le nord, les tortues de la baie de Floride accumulant plus d’APFC en C9 que d’autres APFC, ce qui indique qu’il y aurait des sources locales pour les tortues vivant dans la baie de Floride. Les tendances temporelles chez les tortues caouannes capturées près de Charleston ont été examinées sur une période de neuf ans. Les concentrations d’APFC en C9 ont diminué de 11 % par an; cependant, les concentrations des autres APFC à longue chaîne n’ont pas changé de façon significative avec le temps.
Évaluation des effets sur l’environnement
Organismes aquatiques
Boudreau et al. (2002) ont étudié la toxicité de l’APFC en C10 pour le macrophyte aquatique Lemna gibbaet ont établi la CI50 (concentration inhibitrice médiane à 50 %) sur sept jours (d’après la croissance) à 99 mg/L. Les valeurs de CI50 sur sept jours (d’après la croissance) de l’APFC en C10chez les algues d’eau douce Selenastrum capricornutum et Chlorella vulgaris étaient respectivement de 218 mg/L et de 198 mg/L, ce qui indique qu’il y a peu de différence de sensibilité entre les deux espèces (Boudreau et al.,2002). La toxicité aiguë et chronique de l’APFC en C10 pour deux espèces de daphnies, Daphnia magna et Daphnia pulicaria, a été étudiée. La concentration létale médiane après 48 h (CL50; dose aiguë) et la concentration efficace médiane après 48 h (CE50 – fondée sur l’immobilisation) étaient respectivement de 259 et de 130 mg/L pour le Daphnia magna, et de 285 et de 150 mg/L, respectivement, pour le Daphnia pulicaria (Boudreau et al., 2002). Ces valeurs montrent qu’il y a peu de différence de sensibilité entre les deux espèces. Hoke et al. (2009) ont déterminé les valeurs de toxicité aiguë pour l’APFC en C10 : une CL50 de 32 mg/L après 96 heures pour la truite arc-en-ciel (Oncorhynchus mykiss), une CE50 de plus de 100 mg/L après 48 heures pour la daphnie Daphnia magna et une CE50 de 10,6 mg/L après 72 heures pour l’algue verte Pseudokirchneriella subcapitata.
Les études sur la toxicité chronique de l’APFC en C9 menées sur deux espèces de daphnies ont révélé que le Daphnia pulicaria était plus sensible que le Daphnia magna (Boudreau et al., 2002). Les valeurs de CL50 sur 21 jours étaient respectivement de 8,8 mg/L et de 39 mg/L, d’après la mortalité observée. Les études de toxicité chronique ont également révélé que, chez Daphnia magna, le nombre de descendants produits était un critère d’effet plus sensible que le délai moyen avant la production de la première génération. La concentration sans effet observé (CSEO) sur 21 jours ainsi que la concentration minimale avec effet observé (CMEO) sur 21 jours (toutes deux établies d’après le nombre de descendants produits) étaient respectivement de 13 et de 25 mg/L pour le Daphnia magna, et de 6 et 13 mg/L, respectivement, pour le Daphnia pulicaria.
Organismes terrestres
La CE50 de l’APFC en C9 sur 48 heures (d’après la létalité aiguë) était de 0,66 mM (306,29 mg/L) pour le nématode vivant dans le sol Caenorhabditis elegans; l’exposition s’est faite par contact de surface dans un milieu de croissance propice aux nématodes, composé à 1,7 % d’agar (Tominaga et al., 2004). On a constaté des effets sur plusieurs générations chez les nématodes exposés à des concentrations faibles d’APFC en C9, c’est-à-dire à peine environ 1 nM (0,000464 mg/L), qui ont entraîné un déclin de 70 % de la fécondité à la quatrième génération (Tominaga et al., 2004). Aucune relation génération-réponse ou concentration-réponse n’a été observée, quoique les résultats laissent supposer que l’APFCen C9 pourrait avoir des effets à long terme sur plusieurs générations, et ce, à des concentrations d’exposition relativement faibles.
Yeung et al. (2009a) ont exposé des poulets (Gallus gallus) mâles âgés d’un jour à des APFC en C10 à des doses de 0,1 mg/kg de poids corporel (p.c.) et de 1,0 mg/kg p.c. trois fois par semaine, et ce, pendant trois semaines. On n’a observé aucun effet néfaste sur le poids corporel, les indices relatifs aux organes, les paramètres cliniques sanguins ou l’histopathologie des organes aux doses de 0,1 ou 1,0 mg/kg p.c. d’APFC en C10. Cependant, la demi-vie des APFC en C10était respectivement de 11 et 16 jours aux doses de 0,1 et 1,0 mg/kg p.c., ce qui montre les propriétés de bioaccumulation des APFC en C10 chez les poulets.
Autres effets
Stevenson et al. (2006) ont étudié la toxicité des APFC en C9 et en C10 du point de vue du mécanisme de résistance multixénobiotique chez la moule marine Mytilus californianus. Ce mécanisme joue le rôle de première ligne de défense contre de vastes classes de xénobiotiques; il expulse les produits chimiques modérément hydrophobes de la cellule par l’intermédiaire de protéines de transport transmembranaires dépendant de l’adénosine triphosphate (ATP). Le transporteur le plus étudié est la P-glycoprotéine qui, chez les humains, est active dans les reins, les glandes surrénales, le foie, la barrière hémato-testiculaire et la barrière hémato-encéphalique. Certains xénobiotiques peuvent compromettre ce mécanisme de défense. L’accroissement de sensibilité, appelé chimiosensibilisation, vient de la capacité de la P-glycoprotéine à reconnaître différents substrats xénobiotiques et à s’y lier, ce qui entraîne une saturation de la capacité de liaison. Même les substances non toxiques peuvent être des chimiosensibilisants et avoir des effets néfastes sur les organismes en permettant à des substances toxiques normalement exclues de s’accumuler dans les cellules. Stevenson et al. (2006) ont constaté que les APFC en C9 et en C10 possédaient des CI50 moyennes (d’après l’inhibition de la P-glycoprotéine) de 4,8 μM (2,23 mg/L) et 7,1 μM (3,65 mg/L), respectivement; ces substances inhibaient donc de manière significative la P-glycoprotéine chez le Mytilus californianus. Ce résultat indique que les APFC en C9 et en C10 sont des chimiosensibilisants pour cette espèce. L’APFC en C9inhibe la P-glycoprotéine par un mécanisme indirect, et le phénomène est réversible. De plus, cette substance induit l’expression du transporteur de la P-glycoprotéine après une exposition de deux heures – une réaction au stress pouvant entraîner des coûts métaboliques pour l’organisme.
Liu et al. (2008) ont étudié les effets des APFC en C12 et en C14 sur les systèmes membranaires de l’algue d’eau douce Scenedesmus obliquus. Les APFC en C12 et C14 inhibaient le taux de croissance de l’algue de façon proportionnelle à la concentration (c.-à-d. que l’inhibition augmentait avec l’augmentation de la concentration d’exposition). Les valeurs de CI10, CI50 et CI90 relatives à la densité cellulaire calculées étaient de 90 μM (46,27 mg/L), 183 μM (94,08 mg/L) et 367 μM (188,67 mg/L) pour les APFC en C10 et de 41 μM (29,28 mg/L), 134 μM (95,69 mg/L) et 292 μM (208,52 mg/L) pour les APFC en C14. En ce qui concerne les APFC en C10, on a observé un accroissement du potentiel de la membrane mitochondriale à des concentrations se situant entre 30 et 100 μM (15,42 à 51,40 mg/L). Dans le cas des APFC en C14, on a observé un accroissement du potentiel de la membrane entre 50 et 100 μM (35,70 à 71,41 mg/L). L’accroissement du potentiel de la membrane mitochondriale indique une perturbation de la fonction mitochondriale; les mitochondries sont des organites multitâches participant au métabolisme de l’énergie oxydatif ainsi qu’à l’apoptose en intégrant des signaux de mort. De plus, les APFC en C12 et C14 ont entraîné une hausse de la perméabilité des membranes cellulaires à des concentrations de 20 à 100 μM (12,28 à 61,41 mg/L) pour les APFC en C12 et à des concentrations de 50 à 100 μM (35,70 à 71,41 mg/L) pour les APFCen C14. Les effets sur la perméabilité des membranes cellulaires pourraient contribuer à la médiation des effets néfastes d’autres contaminants.
Benninghoff et al. (2007) ont établi que les APFC en C9 à C12 provoquaient une induction significative de la vitellogénine, qui est un biomarqueur de l’exposition à des œstrogènes, chez la truite arc-en-ciel, dans des essais sur 14 jours. Ces substances ont montré une faible affinité avec les récepteurs œstrogéniques hépatiques de la truite arc-en-ciel. Chez les truites juvéniles exposées in vivo à l’APFC en C10 à des doses de < 1 à 2 000 μg/g de nourriture, on a constaté une augmentation des concentrations plasmatiques de vitellogénine en fonction de la dose (avec des hausses significatives à des concentrations aussi faibles que 0,0256 μg/g de nourriture). Les auteurs ont noté que les récepteurs œstrogéniques hépatiques de la truite arc-en-ciel avaient une plus grande affinité avec un nombre supérieur de xénœstrogènes comparativement aux récepteurs œstrogéniques de mammifères, dont les humains.
Nakayama et al. (2008) ont étudié le grand cormoran (Phalacrocorax carbo), un oiseau piscivore qui est le prédateur à l’extrémité de la chaîne alimentaire dans l’écosystème du lac Biwa, au Japon. Les concentrations d’APFCen C9 ont été mesurées dans le foie de grands cormorans sauvages (mâles et femelles), et mises en relation avec l’expression génique. Les concentrations d’APFC en C9allaient, chez les femelles, de < 0,005 à 0,0088 μg/g poids humide et, chez les mâles, de < 0,005 à 0,043 μg/g poids humide. On n’a relevé aucune différence significative selon le sexe. L’analyse de l’expression génique a révélé des corrélations positives significatives entre la concentration d’APFCen C9 et la glutathion peroxydase 1 (enzyme du système antioxydant) ainsi que la ribonucléoprotéine nucléaire hétérogène U (maturation de l’ARN). Les auteurs laissent entendre que l’induction des enzymes antioxydantes pourrait constituer une réponse adaptative au stress oxydatif causé par l’APFC en C9.
Ishibashi et al. (2008a) ont montré que les APFC en C9 à C11 stimulaient le récepteur a activé par les proliférateurs des peroxysomes (PPARa) dans le foie des phoques du Baïkal (Pusa sibirica) à des concentrations minimales avec effet observé de 125 μM (58,00 mg/L) pour les APFC en C9, de 125 μM (64,26 mg/L) pour les APFC en C10 et de 62,5 μM (35,25 mg/L) pour les APFC en C11. Le PPARajoue un rôle physiologique essentiel en tant que détecteur de lipides et régulateur du métabolisme lipidique. Les niveaux d’expression de l’ARNm du PPARa ont montré une corrélation positive avec les APFC en C9, et l’expression de la protéine hépatique CYP4A était corrélée aux concentrations hépatiques d’APFC en C9 et en C10, ce qui indiquerait une modulation de la voie de signalisation PPARa-CYP4A chez les phoques du Baïkal sauvages.
L’effet possible de l’exposition aux composés perfluorés sur les lésions hépatiques a été étudié chez les ours blancs de l’est du Groenland (Sonne et al., 2007). Parmi les paramètres hépatiques examinés dans cette étude figuraient l’infiltration des cellules mononucléaires, les granulomes lipophagiques, la stéatose, l’hyperplasie des cellules de Ito et du canal cholédoque ainsi que la fibrose portale. La population était composée de 28 femelles et de 29 mâles, échantillonnés par des chasseurs de la région entre 1999 et 2002. Les échantillons de foie ont été analysés afin de déterminer s’ils contenaient plusieurs composés perfluorés, notamment des APFC en C9, C10, C11, C12 et C13. Chez 65 % des ours blancs, la somme des concentrations des composés perfluoroalkylés (c.-à-d. des composés d’alkyles perfluorés; ?APF) était supérieure à 1 000 ng/g poids humide. Chez les femelles, la ?APF variait entre 256 et 2 770 ng/g poids humide, tandis que chez les mâles, elle allait de 114 à 3 052 ng/g poids humide. Comme les concentrations de tous les APF analysés ont été additionnées, il est impossible d’établir une corrélation directe de cause à effet pour un composé perfluoré en particulier, comme les APFC à longue chaîne. En outre, les ours blancs de l’est du Groenland sont également contaminés par d’autres substances comme les organochlorés (BPC, DDT) et le mercure, ce qui peut constituer autant de facteurs confusionnels synergiques dans l’apparition des lésions. Les auteurs ont conclu que l’analyse statistique ne permettait pas de déterminer avec certitude si l’exposition chronique aux composés perfluorés était associée à l’apparition de lésions hépatiques chez les ours blancs; toutefois, ces lésions étaient similaires à celles causées par des composés perfluorés en conditions de laboratoire (Sonne et al., 2007).
Dans une autre étude menée par Flanary et al. (2010), aucune corrélation n’a été trouvée entre les APFC en C9 à C13 et les paramètres chimiques sanguins (p. ex., cholestérol, créatinine, albumine, concentration totale d’ions sériques) chez l’otarie à fourrure (Callorhinus ursinus).
Caractérisation des risques pour l’environnement
La démarche suivie dans la présente évaluation écologique préalable consistait à examiner les renseignements scientifiques et techniques pertinents et à tirer des conclusions fondées sur de multiples éléments d’information, qui comprennent l’examen de la persistance, de l’exposition, des tendances temporelles dans le biote, de la toxicité, de la bioaccumulation et de la présence répandue dans l’environnement.
Dans les études de toxicité traditionnelles (p. ex., létalité, croissance), plusieurs APFC à longue chaîne présentaient une toxicité faible à modérée, les valeurs de toxicité aiguë se situant entre 8,8 et 285 mg/L. Deux études sur la toxicité des APFC à longue chaîne ont été effectuées avec des espèces terrestres. Dans l’une de ces études, aucun effet nocif n’a été observé jusqu’à 1,0 mg/kg p.c. chez des poulets mâles ayant reçu des doses d’APFC en C10 trois fois par semaine pendant trois semaines. Dans l’autre étude, on a constaté une létalité aiguë chez un nématode vivant dans le sol exposé à une concentration de 306 mg/L d’APFC en C9ainsi que des effets sur plusieurs générations (baisse de la fécondité) lorsqu’il était exposé à une concentration de 0,000464 mg/L.
Les APF, notamment les APFC à longue chaîne, peuvent provoquer une toxicité hépatique chez les ours blancs à des concentrations de 114 à 3 052 ng/g en poids humide d’APF totaux (d’après les associations observées dans les études sur le terrain), ainsi que l’activation du PPARa dans le foie des phoques du Baïkal à des concentrations de 35,25 à 64,26 mg/L d’APFC en C9 à C11 (d’après les données tirées des études de laboratoire in vitro). Les APFC à longue chaîne peuvent également perturber le système endocrinien, comme la vitellogenèse chez la truite arc-en-ciel à des concentrations d’APFCen C10 de 0,0256 à 2 000 μg/g de nourriture. Les APFC en C9 à C10 sont également des chimiosensibilisants pour la moule marine Mytilus californianus, car ils permettent à des substances toxiques normalement exclues de s’accumuler dans la moule. Les APFC en C12 et en C14 augmentent le potentiel de la membrane mitochondriale chez l’algue d’eau douce Scenedesmus obliquus, ce qui indique une perturbation de la fonction mitochondriale.
Au Canada, on a mesuré certains APFC à longue chaîne dans le milieu aquatique et leurs concentrations allaient de < 0,5 ng/L à 19 ng/L. Dans les sédiments de l’Arctique canadien, on a mesuré des concentrations d’APFC en C9 à C12 se situant entre 0,5 et 3,3 ng/g. En outre, on a mesuré des APFC en C9 à C15 dans le foie de divers animaux (phoques, renards, poissons, ours blancs, requins du Groenland, narvals, bélugas et oiseaux) de l’Arctique canadien ou de la région des Grands Lacs. Les concentrations se situaient entre des valeurs inférieures à la limite de détection et 180 ng/g de poids humide de foie; les concentrations les plus élevées ayant été enregistrées chez l’ours blanc, puis chez le requin du Groenland, le narval et le béluga. Dans le monde entier, des APFC en C9 à C15 ont été relevés chez le phoque annelé, l’otarie à fourrure et le phoque commun, chez diverses espèces de dauphin (à flancs blancs, à gros nez, à nez blanc, de la Plata, sotalie de Chine), chez le marsouin aptère, le goéland bourgmestre, le grand cachalot, le castor, le tigre de Sibérie, le rat sauvage et plusieurs espèces d’oiseau (l’aigrette garzette, le pluvier petit-gravelot, les paradoxornis et le bihoreau gris). Les concentrations allaient de valeurs inférieures à la limite de détection jusqu’à 480 ng/g poids humide, les concentrations les plus élevées ayant été mesurées chez le dauphin à nez blanc.
On considère que tous les APFC à longue chaîne sont persistants. Pour les APFC en C11 (2 700 < FBC < 11 000), C12 (18 000 < FBC < 40 000) et C14 (23 000 < FBC < 30 000), il existe des données empiriques indiquant que ces substances sont très bioaccumulables chez les poissons et qu’elles possèdent un potentiel de bioamplification chez les poissons et les mammifères marins. Il n’existe pas de données expérimentales ou estimées sur la bioaccumulation des APFC à longue chaîne comptant plus de 14 atomes de carbone. Les APFC à longue chaîne pourraient toutefois, d’après leur conformation chimique, s’accumuler ou se bioamplifier chez les espèces marines ou terrestres. De plus, des APFC en C14 et en C15 ont été détectés chez des poissons, des invertébrés et des ours blancs.
On a montré que les concentrations d’APFC à longue chaîne ont tendance à augmenter chez les ours blancs, les phoques annelés et les oiseaux. Entre 1980 et 2000, les concentrations d’APFC en C10 et C11 mesurées dans le foie de phoques annelés du Groenland ont connu une hausse respective de 3,3 et de 6,8 % par an. Entre 1992 et 2005, les concentrations moyennes d’APFC en C9 et en C10 mesurées dans le foie des phoques du Baïkal étaient 1,2 à 1,7 fois plus élevées. De 1972 à 2002, le temps moyen de doublement des concentrations dans le foie de l’ours blanc de l’Arctique se situait entre 5,8 et 9,1 ans, pour les APFC en C9 à C11. De 1993 à 2004, les concentrations dans les échantillons de foie de phoque annelé ont augmenté, avec un temps de doublement des APFC en C9 à C12 allant de 4 à 10 ans. Les concentrations d’APFC en C9 à C15 dans les échantillons de foie de fulmar boréal ont augmenté entre 1987 et 1993, puis sont restées stables de 1993 à 2003. En ce qui concerne les concentrations d’APFC en C9 à C15 mesurées dans les échantillons de foie du guillemot de Brünnich, elles ont augmenté de 1975 à 2004. De 1983 à 1993, les concentrations d’APFC en C9 à C13 ont augmenté de manière significative dans les œufs entiers de goélands argentés en Norvège. Chez les bélugas mâles du Nunavut, on a observé des hausses temporelles annuelles des APFC en C9 à C12 de 1,8 ng/g de poids humide de foie entre 1980 et 2010.
La présence des APFC à longue chaîne (C9 à C20), de leurs sels et de leurs précurseurs résulte de l’activité humaine. Les APFC à longue chaîne et leurs sels sont persistants. Des données empiriques indiquent une forte accumulation ainsi qu’une bioamplification des APFC à longue chaîne dans les mammifères marins et terrestres. Ils ont été détectés dans des régions éloignées ou isolées, qu’ils ont probablement atteintes par l’intermédiaire du transport atmosphérique ou océanique à grande distance de précurseurs volatils, des acides eux-mêmes ou bien des deux. Les APFC à longue chaîne et leurs précurseurs ont aussi été détectés dans le biote sur de grandes étendues au Canada, notamment dans l’Arctique canadien. Il a été établi que leurs concentrations augmentent avec le temps chez des espèces de l’Arctique canadien telles que l’ours blanc, le phoque annelé, le fulmar boréal et le guillemot de Brünnich. D’après les éléments ci-dessus, il est conclu que les APFC à longue chaîne, leurs sels et leurs précurseurs peuvent avoir des effets nocifs sur l’environnement.
Incertitudes dans l’évaluation des risques pour l’environnement
Il existe certaines lacunes et incertitudes concernant, entre autres, les données limitées sur les propriétés physiques et chimiques, les données expérimentales sur la persistance et les données sur la toxicité. L’ensemble des données sur les APFC à longue chaîne et leurs précurseurs est néanmoins substantiel. Par exemple, bien que les mécanismes de transport des APFC à longue chaîne et de leurs précurseurs vers l’Arctique ne soient pas clairs, ces composés semblent avoir une certaine mobilité, étant donné qu’on a mesuré des APFC à longue chaîne et leurs précurseurs dans le biote dans tout l’Arctique canadien, loin des sources connues.
Les voies environnementales du transfert des APFC à longue chaîne au biote ne sont pas bien comprises en raison du peu de données de surveillance qui existent sur les concentrations de leurs divers précurseurs dans l’air, l’eau, les effluents et les sédiments au Canada. Les mécanismes de toxicité des APFC à longue chaîne sont peu connus; toutefois, on a signalé toute une gamme d’effets toxicologiques chez diverses espèces, notamment l’induction de la vitellogénine et la toxicité hépatique.
En outre, selon des études menées par van Leeuwen et al. (2006) révélant la variabilité des résultats analytiques obtenus par divers laboratoires, il est possible que les résultats des analyses effectuées par ces laboratoires ne soient pas directement comparables.
Enfin, on ne dispose actuellement que de données limitées sur la toxicologie des précurseurs des APFC à longue chaîne, la contribution relative de ces précurseurs provenant de différentes sources (p. ex., l’importance des précurseurs issus de la dégradation des substances fluorotélomériques) et la possibilité d’effets combinés ou synergiques avec d’autres composés perfluorés.
Conclusion
L’évaluation est fondée sur une méthode du poids de la preuve en ce qui concerne la persistance, la bioaccumulation, la présence répandue, les tendances temporelles chez certaines espèces (c.-à-d., les oiseaux de l’Arctique canadien, les mammifères terrestres et marins), le transport à grande distance et les concentrations d’APFC à longue chaîne (C9 à C20) dans l’environnement et le biote (y compris les régions éloignées du Canada).
Selon les renseignements présentés dans la présente évaluation préalable, il est conclu que les APFC à longue chaîne (C9 à C20), leurs sels et leurs précurseurs pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, il est conclu que les APFC à longue chaîne (C9 à C20) et leurs sels sont extrêmement persistants et qu’ils répondent aux critères de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation. Les APFC à longue chaîne (C9 à C20) ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. Néanmoins, le poids de la preuve est suffisant pour conclure que les APFC à longue chaîne (C9 à C20) et leurs sels s’accumulent et se bioamplifient chez les mammifères terrestres et marins.
Il est donc conclu que les APFC à longue chaîne (C9 à C20), leurs sels et leurs précurseurs répondent à au moins un des critères énoncés à l’article 64 de la LCPE (1999).
Des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles définies à l’étape de la gestion des risques.
Références
Ahrens, L., Barber, J.L., Xie, Z., Ebinghaus, R. 2009. Longitudinal and latitudinal distribution of perfluoroalykl compounds in the surface water of the Atlantic Ocean. Environ. Sci. Technol. 43(9) :3122-3127.
Ahrens, L., Shoeib, M., Cheng, C., Lee, S.-C., Harner, T. 2010a. Wastewater treatment plant and landfill inputs of polyfluoroalkyl compounds and siloxanes to the atmosphere. Présentation à l’USEPA PFAA Days III: Recent Advances in Perfluoroalkyl Acid (PFAA) Research, du 8 au 10 juin 2010, Research Triangle Park (NC).
Ahrens, L., Xie, Z., Ebinghaus, R. 2010b. Distribution of perfluoroalkyl compounds in seawater from northern Europe, Atlantic Ocean and Southern Ocean. Chemosphere 78:1011-1016.
Arp, H.P.H., Niederer, C., Goss, K.-U. 2006. Predicting the partitioning behaviour of various fluorinated compounds. Environ. Sci. Technol. 40(23):7298-7304.
Begley, T.H., White, K., Honigfort, P., Twaroski, M.L., Neches, R., Walker, R.A. 2005. Perfluorochemicals: Potential sources of and migration from food packaging. Food Add Contam22(10):1023-1031.
Beneficemalouet, S., Blancou, H., Itier, J, Commeyras, A. 1991. An improved synthesis of perfluorocarboxylic acids. Synthesis (Stuttg):647-648.
Benninghoff, A.D., Field, J.A., Williams, D.E. 2007. In vitro and in vivo assessment of the estrogen activity of perfluorooctanoic acid (PFOA), perfluorooctane sulfonate (PFOS) and other structurally diverse perfluorinated chemicals. 46th Annual Meeting of the Society of Toxicology. Charlotte (NC), 25-29 mars.
Berger, U., Herzke, D., 2006. Per- and polyfluorinated alkyl substances (PFAs) extracted from textile samples. Organohal. Compd 68:2023-2026.
Bernett, M.K., Zisman, W.A. 1959. Wetting of low-energy solids by aqueous solutions of highly fluorinated acids and salts. J. Phys. Chem. 63:1911-1916.
Blancou, H., Moreau, P., Commeyras, A. 1976. Preparation of perfluoroalkane carboxylic and sulfonic-acid derivatives by the action of metallic couples on perfluoroalkyl iodides in dimethyl sulfoxide. J. Chem. Soc. Chem. Commun.:885-886.
Bossi, R., Riget, F.F., Dietz, R. 2005. Temporal and spatial trends of perfluorinated compounds in ringed seal (Phoca hispida) from Greenland. Environ. Sci. Technol. 39:7416-7422.
Boudreau, T.M., Sibley, P., Mabury, S.A., Muir, D.C.G., Solomon, K. 2002. Toxicity of Perfluoroalkyl Carboxylic Acids of Different Chain Length to Selected Freshwater Organisms. In:, Master’s Thesis; Guelph (Ont.) : Université de Guelph, Département de biologie environnementale, p. 134.
Boulanger, B., Peck, A.M., Schnoor, J.L., Hornbuckle, K.C. 2005a. Mass budget of perfluorooctane surfactants in Lake Ontario. Environ. Sci. Technol. 39:74-79.
Boulanger, B., Vargo, J.D., Schnoor, J.L., Hornbuckle, K.C. 2005b. Evaluation of perfluorooctane surfactants in a wastewater treatment system in a commercial surface protection product. Environ. Sci. Technol. 39:5524-5530.
Bradley, E.L., Read, W.A., Castle, L., 2007. Investigation into the migration potential of coating materials from cookware products. Food Add Contam 24(3):326-335.
Butt, C.M., Stock, N.L., Mabury, S.A., Muir, D.C.G., Braune, B.M. 2007a. Prevalence of long-chain perfluorinated carboxylates in seabirds from the Canadian Arctic between 1975 and 2004. Environ. Sci. Technol. 41:3521-3528.
Butt, C.M., Muir, D.C.G., Stirling, I., Kwan, M., Mabury, S.A. 2007b. Rapid response of Arctic ringed seals to changes in perfluroalkyl production. Environ. Sci. Technol. 41(1):42-49.
Butt, C.M., Mabury, S.A., Kwan, M., Wang, X., Muir, D.C.G. 2008. Spatial trends of perfluoroalkyl compounds in ringed seals (Phoca hispida) from the Canadian Arctic. Environ. Toxicol. Chem. 27(3):542-553.
Canada. 1995. Politique de gestion des substances toxiques. Ottawa (Ont.) : sa Majesté la Reine du chef du Canada (Environnement Canada). [réimpression en 2004].
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33. Gazette du Canada, Partie III : vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada, Partie II : vol. 134, n° 7.
Canada. 2006. Loi canadienne sur la protection de l’environnement (1999) : Règlement modifiant le Règlement sur certaines substances toxiques interdites (2005) (quatre substances nouvelles à base de télomères fluorés). 17 juin 2006. Gazette du Canada, Partie I : vol. 140, n° 24.
Conder, J.M., Hoke, R.A., de Wolf, W., Russell, M.H., Buck, R.C. 2008. Are PFCAs bioaccumulative? A critical review and comparison with regulatory criteria and persistent lipophilic compounds. Environ. Sci. Technol. 42:995-1003.
Crozier, P., Furdui, V., Lucaciu, C., Stock, N., Mabury, S.A., Reiner, E. 2005. Detection of perfluoro-alkyl compounds (PFCs) in sewage treatment plant (STP) effluents and biosolids by liquid chromatography - tandem mass spectrometry. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Delinsky, A.D., Strynar, M.J., McCann, P.J., Varns, J.L., McMillan, L., Nakayama, S.F., Lindstrom, A.B. 2010. Geographical distribution of perfluorinated compounds in fish from Minnesota lakes and rivers. Environ. Sci. Technol. 44:2549-2554.
Del Vento, S., Codling, G., Ahrens, L., Ebinghuas, R., Jones, K.C., Halsall, C.J. 2009. Perfluoroalkylcompounds in the Arctic marine system: air, snow, water and sea-ice. Présentation lors de la SETAC North America, novembre 2009, Nouvelle-Orléans (LA).
De Silva, A.O., Mabury, S.A. 2004. Isolating isomers of perfluorocarboxylates in polar bears (Ursus maritimus) from two geographical locations. Environ. Sci. Technol.38:6538-6545.
De Silva, A., Spencer, C., Scott, B., Sekela, M., Gledhill, M., Rondeau, B., Backus, S., Muir, D. 2009. Perfluoroalkyl phosphonic acids and polyfluoroalkyls phosphoric acids in Canadian rivers. Présentation lors de la SETAC North America, novembre 2009, Nouvelle-Orléans (LA).
Dietz, R., Bossi, R., Riget, F.F., Sonne, S., Born, E.W. 2008. Increasing perfluoroalykl contaminants in east Greenland polar bears (Ursus maritimus): a new toxic threat to the Arctic bears. Environ. Sci. Technol. 42(7):2701-2707.
Dinglasan, M.J.A., Mabury, S.A. 2005. Evidence of 8:2 OHFT production from the biodegradation of 8:2 telomer methacrylate under aerobic conditions. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Dinglasan, M.J.A., Ye, Y., Edwards, E.A., Mabury, S.A. 2004. Fluorotelomer alcohol biodegradation yields poly- and perfluorinated acids. Environ. Sci. Technol.38:2857-2864.
Dinglasan-Panlilio, M.J.A., Mabury, S.A. 2006. Significant residual fluorinated alcohols present in various fluorinated materials. Environ. Sci. Technol.40(5):1447-1453.
Dreyer, A., Weinberg, I., Temme, C., Ebinghaus, R. 2009. Polyfluorinated compounds in the atmosphere of the Atlantic and Southern Oceans: evidence for a global distribution. Environ. Sci. Technol. 43(17):6507-6514
Ellis, D.A., Mabury, S.A., Martin, J.W., Stock, N.L. 2004a. Environmental Review of Other (non-C8) Perfluorocarboxylic Acids (PFCAs). Document préparé en vertu d’un contrat pour la Division des substances existantes d’Environnement Canada, Gatineau (Qc). 68 p.
Ellis, D.A., Martin, J.W., De Silva, A.O., Mabury, S.A., Hurley, M.D., Sulbaek Andersen, M.P., Wallington, T.J. 2004b. Degradation of fluorotelomer alcohols: A likely source of perfluorinated carboxylic acids. Environ. Sci. Technol. 38:3316-3321.
Environnement Canada. 2001. Primary Report on PFAs from Section 71 survey. Préparé par la Section de l’utilisation des produits, Division du contrôle des produits chimiques, Direction de l’évaluation des produits chimiques commerciaux. Gatineau (Qc).
Environnement Canada. 2005. Report on PFCAs results of notice issued under Section 71 CEPA for 2004 calendar year.
Environnement Canada. 2006. Plan d’action pour l’évaluation et la gestion des acides perfluorocarboxyliques (APFC) et de leurs précurseurs.
Environnement Canada et Santé Canada. 2006. Substances nouvelles : mises à jour aux rapports d’évaluation des impacts sur l’environnement et la santé humaine – DSN nos12763, 12798, 12863, 13211 et 13395.
Fasano, W.J., Carpenter, S.C., Gannon, S.A., Snow, T.A., Stadler, J.C., Kennedy, G.L., Buck, R.C., Korzeniowski, S.H., Hinderliter, P.M., Kemper, R.A. 2006. Absorption, distribution, metabolism, and elimination of 8-2 fluorotelomer alcohol in the rat. Toxicol. Sci. 91(2):341-355.
Fasano, W.J., Carpenter, S.C., Gannon, S.A., Snow, T.A., Stadler, J.C., Kennedy, G.L., Buck, R.C., Korzeniowski, S.H., Hinderliter, P.M., Kemper, R.A. 2008. Erratum: Absorption, distribution, metabolism, and elimination of 8-2 fluorotelomer alcohol in the rat. Toxicol. Sci. 102(2):455.
Flanary, J.R., Reiner, J.L., Helke, K.L., Kucklick, J.R., Gulland, F.M.D., Becker, P.R. 2010. Measurements of perfluorinated compounds in plasma of northern fur seals (Callorhinus ursinus) and a preliminary assessment of their relationship to peroxisome proliferation and blood chemistry parameters. Présentation à l’USEPA PFAA Days III: Recent Advances in Perfluoroalkyl Acid (PFAA) Research, du 8 au 10 juin 2010, Research Triangle Park (NC).
Fontell, K., Lindman, B. 1983. Fluorocarbon surfactants - phase-equilibria and phase structures in aqueous systems of a totally fluorinated fatty-acid and some of tts salts. J. Phys. Chem. 87:3289-3297.
Furdui, V.I., Stock, N., Ellis, D.A., Butt, C.M., Whittle, D.M., Crozier, P.W., Reiner, E.J., Muir, D.C.G., Mabury, S.A. 2007. Spatial distribution of perfluroalkyl contaminants in lake trout from the Great Lakes. Environ. Sci. Technol. 41(5):1554-1559.
Furdui, V.I., Helm, P.A., Crozier, P.W., Lucaciu, C., Reiner, E.J., Marvin, C.H., Whittle, D.M., Mabury, S.A., Tomy, G.T. 2008. Temporal trends of perfluoroalkyl compounds with isomer analysis in lake trout from Lake Ontario (1979-2004). Environ. Sci. Technol. 42:4739-4744.
Gauthier, S.A., Mabury, S.A. 2005. Aqueous photolysis of 8:2 fluorotelomer alcohol. Environ. Toxicol. Chem. 24:1837-1846.
Gebbink, W.A., Burgess, N., Champoux, L., Elliot, J.E., Hebert, C.E., Martin, P., Wayland, M., Chip Weseloh, D.V., Wilson, L., Letcher, R.J. 2009a. Perfluoroalkyl compounds in the eggs of four species of gulls (Larids) from breeding sites spanning Atlantic to Pacific Canada. SETAC North America, 30thAnnual Meeting, Nouvelle-Orléans (LA).
Gebbink, W.A., Hebert, C.E., Letcher, R.J. 2009b. Perfluorinated carboxylates and sulfonates and precursor compounds in herring gull eggs from colonies spanning the Laurentian Great Lakes of North America. Environ. Sci. Technol. 43:7443-7449.
Gewurtz, S.B., Bhavsar, S.P., Crozier, P.W., Diamond, M.L., Helm, P.A., Marvin, C.H., Reiner, E.J. 2009. Perfluroalkyl contaminants in window film: indoor/outdoor, urban/rural, and winter/summer contamination and assessment of carpet as a possible source. Environ. Sci. Technol. 43(19):7317-7323.
Goss, K.-U. 2008. The pKa values of PFOA and other highly fluorinated carboxylic acids. Environ. Sci. Technol. 42:456-458.
Gray, J.S. 2002. Biomagnification in marine systems: the perspective of an ecologist. Mar. Poll. Bull. 45:46-52.
Gulkowska, A., Falandysz, J., Taniyasu, S., Bochentin, I., Ka So, M., Yamashita, N. 2005. Perfluorinated chemicals in blood of fish and waterfowl from Gulf of Gdansk, Baltic Sea. Présentation lors du Fluoros 2005 en août 2005.
Guo, Z., Liu, X., Krebs, K.A., Roache, N.F. 2009. Perfluorocarboxylic acid content in 116 articles of commerce. EPA/600/R-09/33. Research Triangle Park (NC) : U.S. Environmental Protection Agency.
Hagen, D.F., Belisle, J., Johnson, J.D., Venkateswarlu, P. 1981. Characterization of fluorinated metabolites by a gas chromatographic-helium microwave plasma detector–The biotransformation of 1H,1H,2H,2H-perfluorodecanol to perfluorooctanoate. Anal. Biochem. 118(2):336-343.
Hare, E.F., Shafrin, E.G., Zisman, W.A., 1954. Properties of films of adsorbed fluorinated acids. J. Phys. Chem.58(3):236-239.
Haukås, M., Berger, U., Hop, H., Gulliksen, B., Gabrielsen, G.W. 2007. Bioaccumulation of per- and polyfluorinated alkyl substances (PFAS) in selected species from the Barents Sea food web. Environ. Pollut. 148:360-371.
Herbst, L., Hoffmann, H., Kalus, J., Reizlein, K., Schmelzer, U., Ibel, K. 1985. Small-angle neutron-scattering on nematic lyotropic liquid-crystals. Berichte der Bunsengesellschaft für physikalische Chemie 89(10):1050-1064.
Higgins, C.P., Field, J.A., Criddle, C.S., Luthy, R.G. 2005. Quantitative determination of perfluorochemicals in sediments and domestic sludge. Environ. Sci. Technol. 39:3946-3956.
Higgins, C.P., Luthy, R.G. 2006. Sorption of perfluorinated surfactants on sediments. Environ. Sci. Technol.40:7251-7256.
Higgins, C.P., McLeod, P.B., MacManus-Spencer, L.A., Luthy, R.G. 2007. Bioaccumulation of perfluorochemicals in sediments by the aquatic oligochaete Lumbriculus variegatus. Environ. Sci. Technol. 41:4600-4606.
Hoke, R., Bouchelle, L., Ferrell, B., Sloman, T., Rivenbark, J. 2009. Comparative acute toxicity of a suite of polyfluorinated acids to green algae, an invertebrate and freshwater fish. Présentation lors de la SETAC North America, 30thAnnual Meeting, Nouvelle-Orléans (LA).
Holmström, K.E., Berger, U. 2008. Tissue distribution of perfluorinated surfactants in common guillemot (Uria aalge) from the Baltic Sea. Environ. Sci. Technol.42:5879-5884.
Holmström, K.E., Johansson, A.-K., Bignert, A., Lindberg, P., Berger, U. 2010. Temporal trends of perfluorinated surfactants in Swedish peregrine falcon eggs (Falco peregrinus) 1974-2007. Environ. Sci. Technol. 44(11):4083-4088.
Hori, H., Yamamoto, A., Hayakawa, E., Taniyasu, S., Yamashita, N., Kutsuna, S., Kiatagawa, H., Arakawa, R. 2005a. Efficient decomposition of environmentally persistent perfluorocarboyxlic acids by use of persulfate as a photochemical oxidant. Environ. Sci. Technology 39:2383-2388.
Hori, H., Yamamoto, A., Katsuna, S. 2005b. Efficient photochemical decomposition of long-chain perfluorocarboxylic acids by means of an aqueous/liquid CO2 biphasic system. Environ. Sci. Technol. 39:7692-7697.
Hori, H., Nagaoka, Y., Murayama, M., Kutsuna, S. 2008. Efficient decomposition of perfluorocarboxylic acids and alternative fluorochemical surfactants in hot water. Environ. Sci. Technol. 42(19):7238-7443.
Houde, M., Wells, R.S., Fair, P.A., Bossart, G.D., Hohn, A.A., Rowles, T.K., Sweeney, J.C., Solomon, K.R., Muir, D.C.G. 2005. Polyfluoroalkyl compounds in free-ranging dolphins (Tursiops truncates) from the Gulf of Mexico and the Atlantic Ocean. Environ. Sci. Technol. 39:6591-6598.
Houde, M., Bujas, T.A.D., Small, J., Wells, R.S., Fair, P.A., Bossart, G.D., Solomon, K.R., Muir, D.C.G. 2006a. Biomagnification of perfluoroalkyl compounds in the bottlenose dolphin (Tursiops truncatus) food web. Environ. Sci. Technol.40:4138-4144.
Houde, M., Martin, J.W., Letcher, R.J., Solomon, K.R., Muir, D.G. 2006b. Biological monitoring of polyfluoroalkyl substances: a review. Environ. Sci. Technol. 40:3463-3473.
Houde, M., Balmer, B.C., Brandsma, S., Wells, R.S., Rowles, T.K., Solomon, K.R., Muir, D.C.G. 2006c. Perfluoroalkyl compounds in relation to life-history and reproductive parameters in bottlenose dolphins (Tursiops truncatus) from Sarasota Bay, Florida, USA. Environ. Toxicol. Chem. 25(9): 2405-2412.
Huang, B.-N., Haas, A., Lieb, M. 1987. A new method for the preparation of perfluorocarboxylic acids. J. Fluor. Chem.36:49-62.
Hurley, M.D., Andersen, M.P.S., Wallington, T.J., Ellis, D.A., Martin, J.W., Mabury, S.A. 2004. Atmospheric chemistry of perfluorinated carboxylic acids: reaction with OH radicals and atmospheric lifetimes. J. Phys. Chem. A 108:615-620.
Ishibashi, H., Iwata, H., Kim, E.-Y., Tao, L., Kannan, K., Tanabe, S., Batoev, V., Petrov, E. 2008a.Contamination and effects of perfluorochemicals in Baikal seal (Pusa sibirica). 2. Molecular characterization, expression level, and transcriptional activation of peroxisome proliferator-activated receptor a. Environ. Sci. Technol. 42:2302-2308.
Ishibashi, H., Iwata, H., Kim, E.-Y., Tao, L., Kannan, K., Amano, M., Miyazaki, N., Tanabe, S., Batoev, V.B., Petrov, E. 2008b. Contamination and effects of perfluorochemicals in Baikal seal (Pusa sibirica). 1. Residue level, tissue distribution, and temporal trend. Environ. Sci. Technol. 42:2295-2301.
Ishikawa, N., Takahashi, M., Sato, T., Kitazume, T. 1983. Ultrasound-promoted direct carboxylation of perfluoroalkyl iodides. J. Fluor. Chem. 22:585-587.
Ikawa, Y., Tsuru, S., Murata, Y., Okawauchi, M., Shigematsu, M., Sugihara, G. 1988. A pressure and temperature study on solubility and micelle formation of sodium perfluorodecanoate in aqueous-solution. J. Solution Chem. 17:125-137.
Jeon, J., Kannan, K., Lim, H.K., Moon, H.B., Ra, J.S., Kim, S.D. 2010a. Bioaccumulation of perflurochemicals in Pacific oyster under different salinity gradients. Environ. Sci. Technol. 44(7):2695-2701.
Jeon, J., Kannan, K., Lim, H.K., Moon, H.B., Kim, S.D. 2010b. Bioconcentration of perfluorinated compounds in blackrock fish (Sebastes schlegeli) at different salinity levels. Environ. Toxicol. Chem. 29(11):2529-2535.
Kaiser, M.A., Larsen, B.S., Kao, C.-P., Buck, R.C. 2005. Vapor pressures of perfluorooctanoic, -nonanoic, -decanoic, -undecanoic, and -dodecanoic acids. J. Chem. Eng. Data50:1841-1843.
Kannan, K., Yun, S.H., Evans, T.J. 2005. Chlorinated, brominated and perfluorinated contaminants in livers of polar bears from Alaska. Environ. Sci. Technol. 39:9057-9063.
Kauck, E.A., Diesslin, A.R. 1951. Some properties of perfluorocarboxylic acids. Ind. Eng .Chem.43:2332-2334.
Katz, S., Muir, D., Gamberg, M. 2009. Bioaccumulation of perfluorinated compounds in the vegetation-caribou-wolf food chain. In : Smith, S., Stow, J., Edwards, J. (éd.). Synopsis of research conducted under the 2008-2009 Northern Contaminants Program. Ottawa (Ont.) : Affaires indiennes et du Nord Canada. p. 215-220.
Kelly, B.C., Gobas, F.A.P.C., McLachlan, M.S. 2004. Intestinal absorption and biomagnification of organic contaminants in fish, wildlife and humans. Environ. Toxicol. Chem.23(10):2324–2336.
Key, B.D., Howell, R.D., Criddle, C.S. 1997. Fluorinated organics in the biosphere. Environ. Sci. Technol.31:2445-2454.
Kissa, E. 1994. Fluorinated Surfactants. Synthesis Properties Applications. New York (NY) : Marcel Dekker, Inc.
Klevens, H.B., Raison, M. 1954. Association dans les perfluoroacides. III. Études des tensions superficielles. J. Chim.Phys. Physicochim.Biol. 51.
Knudsen, L.B., Borgå, K., JØrgensen, E.H., van Bavel, B., Schlabach, M., Verreault, J., Gabrielsen, G.W. 2007. Halogenated organic contaminants and mercury in northern fulmars (Fulmarus glacialis): levels, relationships to dietary descriptors and blood to liver comparison. Environ. Pollut. 146:25-33.
Kudo, N., Iwase, Y., Okayachi, H., Yamakawa, Y., Kawashima, Y. 2005. Induction of hepatic peroxisome proliferation by 8-2 telomer alcohol feeding in mice: formation of perfluorooctanoic acid in the liver Toxicol. Sci. 85(2):231-238.
Kunieda, H., Shinoda, K. 1976. Krafft points, critical micelle concentrations, surface tension, and solubilizing power of aqueous solutions of fluorinated surfactants. J. Phys. Chem.80(22):2468-2470.
Kwadijk, C.J.A.F., Korytar, P., Koelmans, A.A. 2010. Distribution of perfluorinated compounds in aquatic systems in The Netherlands. Environ. Sci. Technol. 44(10):3746-3751.
Lange, C.C. 2002. Biodegradation screen study for telomer-type alcohols. Minneapolis (MN) : Pace Analytical Services. U.S. Environmental Protection Agency public docket AR226-1149.
Lehlmer, H.-J., Oyewumi, M.-O., Jay, M., Bummer, P.M. 2001. Behaviour of partially fluorinated carboxylic acids at the air-water interface. J. Fluor. Chem. 107:141-146.
Leonel, J., Kannan, K., Tao, L., Fillmann, G., Montone, R.C. 2008. A baseline study of perfluorochemicals in Franciscana dolphins and Subantarctic fur seal from coastal waters of southern Brazil. Mar. Pollut. Bull. 56:770-797.
Li, X., Yeung, L.W.Y., Taniyasu, S., Li, M., Zhang, H., Liu, D., Lam, P.K.S., Yamashita, N., Dai, J. 2008. Perfluorooctanesulfonate and related fluorochemicals in the Amur tiger (Panthera tigris altaica) from China. Environ. Sci. Technol. 42:7078-7083.
Liu, J., Lee, L.S., Nies, L.F., Nakastu, C.H., Turco, R. 2007. Biotransformation of 8:2 fluorotelomer alcohol in soil and by soil bacteria cultures. Environ. Sci. Technol. 41:8024-8030.
Liu, W., Chen, S., Quan, X., Jin, Y.-H. 2008. Toxic effect of serial perfluorosulfonic and perfluorocarboxylic acids on the membrane system of a freshwater alga measured by flow cytometry. Environ. Toxicol. Chem. 27(7):1597-1604.
Loewen, M., Halldorson, T., Wang, F., Tomy, G. 2005. Fluorotelomer carboxylic acids and PFOS in rainwater from an urban centre in Canada. Environ. Sci. Technol. 39:2944-2951.
Loewen, M., Wania, F., Wang, F., Tomy, G. 2008. Altitudinal transect of atmospheric and aqueous fluorinated organic compounds in western Canada. Environ. Sci. Technol. 42(7):2374-2379.
Löfstrand, K., Jörundsdóttir, H., Tomy, G., Svavarsson, J., Weihe, P., Nygård, T., Bergman, Å. 2008. Spatial trends of polyfluorinated compounds in guillemot (Uria aalge) eggs from north-western Europe. Chemosphere72(10):1475-1480.
Lucaciu, C., Furdui, V., Crozier, P., Marvin, C., Reiner, E., Wania, F., Mabury, S.A. 2004. Temporal study of perfluorinated alkyl substances in Niagara River suspended sediments. SETAC North America 26th Annual Meeting 2004, 13 au 17 novembre.
Mackay, D., Fraser, A. 2000. Bioaccumulation of persistent organic chemicals: mechanisms and models. Environ. Pollut. 110:375-391.
Martin, J.W., Mabury, S.A., Solomon, K.R., Muir, D.C.G. 2003a. Dietary accumulation of perfluorinated acids in juvenile rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 22:189-195.
Martin, J.W., Mabury, S.A., Solomon, K.R., Muir, D.C.G. 2003b. Bioconcentration and tissue distribution of perfluorinated acids in rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 22:196-204.
Martin, J.W., Smithwick, M.M., Braune, B.M., Hoekstra, P.F., Muir, D.C.G., Mabury, S.A. 2004a. Identification of long-chain perfluorinated acids in biota from the Canadian Arctic. Environ. Sci. Technol. 38:373-380.
Martin, J.W., Whittle, M., Muir, D.C.G., Mabury, S.A. 2004b. Perfluoroalkyl contaminants in a food web from Lake Ontario. Environ. Sci. Technol. 38:5379-5385.
Martin, J.W., Mabury, S.A., O’Brien, P.J. 2005. Metabolic products and pathways of fluorotelomer alcohols in isolated rat hepatocytes. Chem.Biol. Interact. 155:165-180.
Mawn, M.P., McKay, R.G., Ryan, T.W., Szostek, B., Powley, C.R., Buck, R.C. 2005. Determination of extractable perfluorooctanoic acid (PFOA) in water, sweat simulant, saliva simulant, and methanol from textile and carpet samples by LC/MS/MS. Analyst130(5):670-678.
Mekenyan, O., Dimitrov, S., Temelkov, S. 2002. PFOS metabolic pathways and metabolic distributions: Generated by catabolic simulator (2001–2002). Résultats compilés et révisés par P. Robinson, Division des substances existantes, Environnement Canada, Gatineau (Qc).
Moody, C.A., Martin, J.W., Kwan, W.C., Muir, D.C.G., Mabury, S.C. 2002. Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into Etobicoke Creek. Environ. Sci. Technol. 36:545-551.
Moroi, Y., Yano, H., Shibata, O., Yonemitsu, T. 2001. Determination of acidity constants of perfluoroalkanoic acids. Bull. Chem. Soc. Jpn. 74:667-672.
Mukerjee, P., Handa, T. 1981. Adsorption of fluorocarbon and hydrocarbon surfactants to air-water, hexane-water, and perfluorohexane-water interfaces: relative affinities and fluorocarbon-hydrocarbon nonideality effects. J. Phys. Chem. 85:2298-2303.
Myers, A.L., Crozier, P.W., Helm, P.A., Reiner, E.J., Burniston, D., Marvin, C.H., McCarry, B.E. 2009. Spatial distribution and temporal trends of perfluorinated compounds in Great Lakes sediments and surface waters. Présentation à la SETAC North America, 30th Annual Meeting, Nouvelle-Orléans (LA).
Nabb, D.L., Szostek, B., Himmelstein, M.W., Mawn, M.P., Gargas, M.L., Sweeney, L.M., Stadler, J.C., Buck, R.C., Fasano, W.J. 2007. In vitro metabolism of 8-2 fluorotelomer alcohol: Interspecies comparisons and metabolic pathway refinement. Toxicol. Sci. 100(2):333-344.
Nakayama, K., Iwata, H., Tao, L., Kannan, K., Imoto, M., Kim, E.-Y., Tashiro, K., Tanabe, S. 2008. Potential effects of perfluorinated compounds in common cormorants from Lake Biwa, Japan: an implication from the hepatic gene expression profiles by microarray. Environ. Toxicol. Chem. 27:2378-2386.
Nilsson, H., Kärrman, A., Westberg, H., Rotander, A., Van Bavel, B., Lindström. G. 2010. A time trend study of significantly elevated perfluorocarboxlate levels in humans after using fluorinated ski wax. Environ. Sci. Technol.44(6):2150-2155.
O’Connell, S.G., Arendt, M., Segars, A., Kimmel, T., Braun-McNeil, J., Avens, L., Schroeder, B., Ngai, L., Kucklick, J.R., Keller, J. 2010. Temporal and spatial trends of perfluorinated compounds in juvenile loggerhead sea turtles (Caretta caretta) along the east cost of the United States. Environ. Sci. Technol. 44:5202-5209.
[OCDE] Organisation de coopération et de développement économiques. 2007. Lists of PFOS, PFAS, PFOA, PFCA, related compounds and chemicals that may degrade to PFCA (as revised in 2007). Paris : OCDE. ENV/JM/MONO (2006)15.
Poland, J.S., Mitchell, S., Rutter, A. 2001. Remediation of former military bases in the Canadian Arctic. Cold Regions Sci. Technol. 32:93-105.
Powley, G.R., George, S.W., Russell, M.H., Hoke, R.A., Buck, R.C. 2008. Polyfluorinated chemicals in a spatially and temporally integrated food web in the Western Arctic. Chemosphere70:664-672.
Prevedouros, K., Cousins, I.T., Buck, R.C., Korzeniowski, S.H. 2006. Sources, fate, and transport of perfluorocarboxylates. Environ. Sci. Technol. 40:32-44.
Scott, B.F., Spencer, C., Moody, C.A., Martin, J.W., Mabury, S.A., Mactavish, D., Muir, D.C.G. 2003. Determination of perfluoroalkanoic acids in the aquatic environment. Présentation lors de la SETAC Europe 23rd Annual Meeting, Hambourg (Allemagne).
Scott, B.F., Moody, C.A., Spencer, C., Small, J.M., Muir, D.C.G., Mabury, S.A. 2006a. Analysis for perfluorocarboxylic acids/anions in surface waters and precipitation using GC-MS and analysis of PFOA from large-volume samples. Environ. Sci. Technol. 40:6405-6410.
Scott, B.F., Spencer, C., Mabury, S.A., Muir, D.C.G. 2006b. Poly and perfluorinated carboxylates in North American precipitation. Environ. Sci. Technol. 40(23):7167-7174.
Scott, B.F., Spencer, C., Lopez, E., Muir, D.C.G. 2009. Perfluorinated alkyl acid concentrations in Canadian rivers and creeks. Water Qual. Res. J. Can. 44(3):263-277.
Shoeib, M., Harner, T., Wilford, B.H., Jones, K.C., Zhu, J. 2005. Polyfluorinated compounds in the home: levels in air and dust and human exposure. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Shoeib, M., Harner, T., Vlahos, P. 2006. Perfluorinated chemicals in the Arctic atmosphere. Environ. Sci. Technol. 40(24):7577-7583.
Sigma-Aldrich Canada Ltd. 2004. Material Safety Data Sheet: Nonadecafluorodecanoic acid, code produit 177741. Oakville (Ont.)
Simcik, M.F., Dorweiler, K.J. 2005. Ratio of perfluorochemical concentrations as a tracer of atmospheric deposition to surface waters. Environ. Sci. Technol. 39:8678-8683.
Sinclair, E., Kannan, K. 2006. Mass loading and fate of perfluoroalkyl surfactants in wastewater treatment plants. Environ. Sci. Technol. 40(5):1408-1414.
Sinclair, E., Kim, S.K., Akinleye, H.B., Kannan, K. 2007. Quantitation of gas-phase perfluoroalkyl surfactants and fluorotelomer alcohols released from nonstick cookware and microwave popcorn bags. Environ. Sci. Technol.41(4):1180-1185.
Smithwick, M., Mabury, S.A., Solomon, K.R., Sonne, C., Martin, J.W., Born, E.W., Dietz, R., Derocher, A.E., Letcher, R.J., Evans, T.J., et al. 2005a. Circumpolar study of perfluoroalkyl contaminants in polar bears (Ursus maritimus). Environ. Sci. Technol. 39:5517-5523.
Smithwick, M., Muir, D.C.G., Mabury, S.A., Solomon, K.R., Martin, J.W., Sonne, C., Born, E.W., Letcher, R.J., Dietz, R. 2005b. Perflouroalkyl contaminants in liver tissue from east Greenland polar bears (Ursus maritimus). Environ. Toxicol. Chem. 24:981-986.
Smithwick, M., Norstrom, R.J., Mabury, S.A., Solomon, K., Evans, T.J., Stirling, I., Taylor, M.K., Muir, D.C.G. 2006. Temporal trends of perfluoroalkyl contaminants in polar bears (Ursus maritimus) from two locations in the North American Arctic, 1972-2002. Environ. Sci. Technol. 40(4):1139-1143.
So, M.K., Taniyasu, S., Yamashita, N., Giesy, J.P., Zheng, J., Fang, Z., Im, S.H., Lam, P.K. 2004. Perfluorinated compounds in coastal waters of Hong Kong, South China, and Korea. Environ. Sci. Technol. 38(15):4056-4063.
Sonne, C., Bossi, R., Dietz, R., Leiffson, P.S., Rigét, F.F., Born, E.W. 2007. Potential correlation between perfluorinated acids and liver morphology in east Greenland polar bears (Ursus maritimus). Toxicol. Environ. Chem. 90(2):275-283.
Stern, G.A. 2009. Temporal trend studies of trace metals and halogenated organic contaminants (HOCs), including new and emerging persistent compounds, in Mackenzie River burbot, Fort Good Hope, NWT. In : Smith, S., Stow, J., Edwards, J. (éd.). Synopsis of research conducted under the 2008-2009 Northern Contaminants Program. Ottawa (Ont.) : Affaires indiennes et du Nord Canada. p. 164-171.
Stevenson, C.N., MacManus-Spencer, L.A., Luckenbach, T., Luthy, R.G., Epel, D. 2006. New perspectives on perfluorochemical ecotoxicology: inhibition and induction of an efflux transporter in the marine mussel, Mytilus californianus. Environ. Sci. Technol. 40:5580-5585.
Stevenson, R. 2006. DRAFT State of the science review of the bioaccumulation of non C8 perfluorocarboxylic acids (PFCAs). Environnement Canada.
Stock, N.L., Muir, D.C.G., Mabury, S.A. 2005. Temporal trends of polyfluorinated sulphonamides and telomer alcohols in Toronto: results of a long-term sampling campaign. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Stock, N.L., Furdui, V.I., Muir, D.C.G., Mabury, S.A. 2007. Perfluoroalkyl contaminants in the Canadian Arctic: evidence of atmospheric transport and local contamination. Environ. Sci. Technol. 41:3529-3536.
Stow, J.P., Sova, J., Reimer, K.J. 2005. The relative influence of distant and local (DEW-line) PCB sources in the Canadian Arctic. Sci. Tot. Environ. 342:107-118.
Strynar, M.J., Lindstrom, A.B. 2005. Perfluorinated compounds in archived house dust samples. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Taniyasu, S., Kannan, K., So, M.K., Gulkowska, A., Sinclair, E., Okazawa, T., Yamashita, N. 2005. Analysis of fluorotelomer alcohols, fluorotelomer acids, and short- and long-chain perfluorinated acids in water and biota. J. Chromatog. A1093(1-2):89-97.
Tominaga, N., Kohra, S., Iguchi, T., Arizono, K. 2004. Effects of perfluoro organic compound toxicity on nematode Caenorhabditis elegans fecundity. J. Health Sci.50:545-550.
Tomy, G., Pleskach, K., Rosenberg, B., Stern, G. 2009a. Temporal trends of halogenated chemicals of emerging concern in beluga whales (Delphinapterus leucas) from Hendrickson Island and Pangnirtung. In : Smith, S., Stow, J., Edwards, J. (éd.). Synopsis of research conducted under the 2008-2009 Northern Contaminants Program. Ottawa (Ont.) : Affaires indiennes et du Nord Canada. p. 99-107.
Tomy, G., Rosenberg, B., Pleskach, K., Fisk, A., Ferguson, S., Muir, D., Marvin, C. 2009b. Trophodynamics of some BFRs, PFCs current use pesticides and legacy persistent organic pollutants in a marine food web from Cumberland Sound. In : Smith, S., Stow, J., Edwards, J. (éd.). Synopsis of research conducted under the 2008-2009 Northern Contaminants Program. Ottawa (Ont.) : Affaires indiennes et du Nord Canada. p. 209-214.
Tomy, G.T., Pleskach, K., Ferguson, S.H., Hare, J., Stern, G., MacInnis, G., Marvin, C.H., Loseto, L. 2009c. Trophodynamics of some PFCs and BFRs in a western Canadian Arctic marine food web. Environ. Sci. Technol. 43:4076-4081.
Tseng, C.-L., Liu, L.-L., Chen, C.-M., Ding, W.-H. 2006. Analysis of perfluorooctanesulfonate and related fluorochemicals in water and biological tissue samples by liquid-chromatography-ion trap mass spectrometry. J. Chromatog. A1105(1-2):119-126.
van de Vijver, K.I., Hoff, P.T., Das, K., Van Dongen, W., Esmans, E.L., Jauniaux, T., Bouquegneau, J.M., Blust, R., De Coen, W. 2003. Perfluorinated chemicals infiltrate ocean waters: link between exposure levels and stable isotope ratios in marine mammals. Environ. Sci. Technol. 37:5545-5550.
van de Vijver, K.I., Hoff, P.T., Das, K., Van Dongen, W., Esmans, E.L., Sieber, U., Bouquegneau, J.M., Blust, R., De Coen, W.M. 2004. Baseline study of perfluorochemicals in harbour porpoises (Phocoena phocoena) from northern Europe. Mar. Pollut. Bull. 48:986-1008.
van de Vijver, K.I., Hoff, P., Das, K., Brasseur, S., Van Dongen, W., Esmans, E., Reijnders, P., Blust, R., De Coen, W. 2005. Tissue distribution of perfluorinated chemicals in harbor seals (Phoca vitulina) from the Dutch Wadden Sea. Environ. Sci. Technol. 39:6878-6884.
van de Vijver, K.I., Holsbeek, L., Das, K., Blust, R., Joiris, C., De Coen, W. 2007. Occurrence of perfluorooctane sulfonate and other perfluorinated alkylated substances in harbour porpoises from the Black Sea. Environ. Sci. Technol. 41:315-320.
van den Heuvel-Greve, M., Leonards, P., Brasseur, S., Kotterman, M., Zabel, A., Vethaak, D. 2009. Bioaccumulation of perfluorinated compounds in a harbour seal food web of the Westerschelde, the Netherlands: a field study. Présentation lors de la SETAC North America, 30th Annual Meeting, Nouvelle-Orléans (LA).
van Leeuwen, S.P.J., Kärrman, A., Van Bavel, B., De Boer, J., Lindstrom, G. 2006. Struggle for quality in determination of perfluorinated contaminants in environmental and human samples. Environ. Sci. Technol. 40(24):7854-7860.
Verreault, J., Houde, M., Gabrielsen, G.W., Berger, U., Haukäs, M., Letcher, R.J., Muir, D.C.G. 2005. Perfluorinated alkyl substances in plasma, liver, brain, and eggs of glaucous gulls (Larus hyperboreus) from the Norwegian Arctic. Environ. Sci. Technol. 39(19):7439-7445.
Verreault, J., Berger, U., Gabrielsen, G.W. 2007. Trends of perfluorinated alkyl substances in herring gull eggs from two coastal colonies in northern Norway: 1983-2003. Environ. Sci. Technol. 41(19):6671-6677.
Wang, J., Ober, C.K. 1999. Solid state crystalline and liquid crystalline structure of semifluorinated 1-bromoalkane compounds. Liq. Cryst. 26:637.
Wang, N., Szostek, B., Buck, R.C., Folsom, P.W., Sulecki, L.M., Capka, V., Berti, W.R., Gannon, J.T. 2005a. Fluorotelomer alcohol biodegradation – direct evidence that perfluorinated carbon chains break down. Environ. Sci. Technol.39:7516-7528.
Wang, N., Szostek, B., Folsom, P.W., Sulecki, L.M., Capka, V., Buck, R.C., Berti, W.R., Gannon, J.T. 2005b. Aerobic biotransformation of 14C-labeled 8-2 telomer B alcohol by activated sludge from a domestic sewage treatment plant. Environ. Sci. Technol. 39:531-538.
Wang, Y., Yeung, L.W.Y., Taniyasu, S., Yamashita, N., Lam, J.C.W., Lam, P.K.S. 2008. Perfluorooctane sulfonate and other fluorochemicals in waterbird eggs from South China. Environ. Sci. Technol. 42:8146-8151.
Wallington, T.J., Hurley, M.D., Xia, J., Wuebbles, D.J., Sillman, S., Ito, A., Penner, J.E., Ellis, D.A., Martin, J., Mabury, S.A., et al. 2006. Formation of C7F15COOH (PFOA) and other perfluorocarboxylic acids during the atmospheric oxidation of 8:2 fluorotelomer alcohol. Environ. Sci. Technol. 40:924-930.
Wania, F. 2007. A global mass balance analysis of the source of perfluorocarboxylic acids in the Arctic Ocean. Environ. Sci. Technol. 41:4529-4535.
Washburn, S.T., Bingman, T.S., Braithwaite, .S.K, Buck, R.C., Buxton, L.W., Clewell, H.J., Haroun, L.A., Kester, J.E., Rickard, R.W., Shipp, A.M., 2005. Exposure assessment and risk characterization for perfluorooctanoate in selected consumer articles. Environ. Sci. Technol. 39(11):39043910.
Washington, J.W., Yoo, H., Ellington, J.J., Jenkins, T.M., Libelo, L. 2010. Concentrations, distribution and persistence of perfluoroalkylates in sludge-applied soils near Decatur, Alabama, USA. Environ. Sci. Technol. 44(22):8390-8396.
Waterland, R.L., Gannon, J., Kaiser, M.A., Botelho, M.A., Harding, T.W., Ellison, G.B., Vaida, V., Tuck, A.F., Murphy, D.M. 2005. Global transport of biogenic and anthropogenic surfactants on marine aerosols. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005. Présentation ENV016.
Webster, E., Ellis, D.A. 2010. Potential role of sea spray generation in the atmospheric transport of perfluorocarboxylic acids. Environ. Toxicol. Chem. 29(8):1703-1708.
Webster, E.M., Ellis, D.A. 2011. Equilibrium modelling: pathway to understanding observed perfluorocarboxylic and perfluorosulfonic acid behaviour. Environ. Toxicol. Chem. (publié en ligne 27 juillet 2011).
Yamashita, N., Kannan, K., Taniyasu, S., Horii, Y., Okazawa, T., Petrick, G., Gamo, T. 2004. Analysis of perfluorinated acids at parts-per-quadrillion levels in seawater using liquid chromatography-tandem mass spectrometry.Environ. Sci. Technol. 38(21):5522-5528.
Yamashita, N., Kannan, K., Taniyasu, S., Horii, Y., Patrick, G., Gamo, T. 2005. A global survey of perfluorinated acids in oceans. Mar. Pollut. Bull. 51:658-668.
Yeung, L.W.Y., Loi, E.I.H., Wong, V.Y.Y., Guruge, K.S., Yamanaka, N., Tanimura, N., Hasegawa, J., Yamashita, N., Miyazaki, S., Lam, P.K.S. 2009a. Biochemical responses and accumulation properties of long-chain perfluorinated compounds (PFOS/PFDA/PFOA) in juvenile chickens (Gallus gallus). Arch. Environ. Contam. Toxicol. 57:377-386.
Yeung, L.W.Y., Miyake, Y., Peng, L., Taniyasu, S., Kannan, K., Guruge, K.S., Lam, P.K.S., Yamashita, N. 2009b. Comparison of total fluorine, extractable organic fluorine and perfluorinated compounds in the blood of wild and perfluorooctanoate (PFOA)–exposed rats: evidence for the presence of other organofluorine compounds. Anal. Chim. Acta 635:108-114.
Yeung, L.W.Y., Miyake, Y., Wang, Y., Taniyasu, S., Yamashita, N., Lam, P.K.S. 2009c. Total fluorine, extractable organic fluorine, perfluorooctane sulfonate and other related fluorochemicals in liver of Indo-Pacific humpback dolphins (Sousa chinensis) and finless porpoises (Neophocaena phocaenoides) from South China. Environ. Pollut. 157:17-23.
Yoo, H., Kannan, K., Kim, S.K., Lee, K.T., Newsted, J.L., Giesy, J.P. 2008. Perfluoroalkyl acids in the egg yolk of birds from Lake Shihwa, Korea. Environ. Sci. Technol. 42:5821-5827.
Yoo, H., Washington, J.W., Ellington, J.J., Jenkins, T.M., Neill, M.P. 2010. Concentrations, distribution and persistence of fluorotelomer alcohols in sludge-applied soils near Decatur, Alabama. Environ. Sci. Technol. 44(22):8397-8402.
Young, C.J., Furdui, V.I., Franklin, J., Koerner, R.M., Muir, D.C.G., Mabury, S.A. 2007. Perfluorinated acids in Arctic snow: new evidence for atmospheric formation. Environ. Sci. Technol.41:3455-3461.
Annexe 1 : Liste des APFC à longue chaîne (C9 à C20), de leurs sels et de leurs précurseurs (cette liste n’est pas exhaustive)
| Numéro CAS | Nom chimique | Type d’APF |
|---|---|---|
| 65530-63-4 | 2,2’-iminodiéthanol, composé (2:1) avec le a-fluoro-?-[2-(phosphonooxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Fluorophosphate |
| 375-95-1 | Acide heptadécafluorononan-1-oïque | APFC à longue chaîne (Absent de la LIS) |
| 335-76-2 | Acide nonadécafluorodécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 2058-94-8 | Acide hénéicosafluoroundécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 307-55-1 | Acide tricosafluorododécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 72629-94-8 | Acide pentacosafluorotridécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 376-06-7 | Acide heptacosafluorotétradécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 141074-63-7 | Acide nonacosafluoropentadécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 67905-19-5 | Acide perfluoropalmitique | APFC à longue chaîne |
| 57475-95-3 | Acide perfluoroheptadécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 16517-11-6 | Acide perfluorostéarique | APFC à longue chaîne (Absent de la LIS) |
| 133921-38-7 | Acide perfluorononadécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 68310-12-3 | Acide nonatriacontafluoroéicosanoïque | APFC à longue chaîne (Absent de la LIS) |
| 65530-64-5 | 2,2’-iminodiéthanol, composé (1:1) avec l’a,a’-[phosphinicobis(oxyéthylène)]bis[?-fluoropoly(difluorométhylène)] | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-69-0 | a-[2-[(2-carboxyéthyl)thio]éthyl]-?-fluoropoly(difluorométhylène), sel de lithium | Précurseur d’APFC > 8 Fluorothioéther |
| 65530-70-3 | a,a’-[phosphinicobis( oxyéthylène)]bis[?-fluoropoly(difluorométhylène)], sel d’ammonium | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-71-4 | a-fluoro-?-[2-(phosphonooxy)éthyl]poly(difluorométhylène), sel de monoammonium | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-72-5 | a-fluoro-?-[2-(phosphonooxy)éthyl]poly(difluorométhylène), sel de diammonium | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-74-7 | 2,2’-iminodiéthanol, composé (1:1) avec l’a-fluoro-?- [2-(phosphonooxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-83-8 | a-[2-[(2-carboxyéthyl)thio]éthyl]-?-fluoropoly(difluorométhylène) | Précurseur d’APFC > 8 Fluorothioéther |
| 65545-80-4 | Éther d’a-hydro-?-hydroxypoly(oxyéthylène) (1:1) avec l’a-fluoro-?- (2-hydroxyéthyl)poly(difluorométhylène) | Précurseur d’APFC > 8 Dérivé d’alcool fluoré |
| 68187-25-7 | Acides N-[3-(diméthylamino)propyl]-2(ou3)-[(?-?-perfluoro- C6-20-alkyl)thio]succinamiques | Précurseur d’APFC > 8 Fluorothioéther |
| 68187-47-3 | Acide 2-méthylpropane-1-sulfonique, dérivés 2-{[(?-?-perluoroalkyl en C4-16) thio]propionamidés}, sel de sodium | Précurseur d’APFC > 8 Fluorothioéther |
| 68391-08-2 | ?-?-perfluoroalcools en C8-14 | Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 68412-68-0 | Dérivés perfluoroalkyles en C6-12 de l’acide phosphonique | Précurseur d’APFC > 8 Fluorophosphate |
| 68412-69-1 | Dérivés bis(perfluoroalkyle en C6-12) de l’acide phosphinique | Précurseur d’APFC > 8 Fluorophosphate |
| 68891-05-4 | Citrate d’a-fluoro-?-(2-hydroxyéthyl)poly(tétrafluoroéthylène), produits de réaction avec le diisocyanate d’hexane-1,6-diyle | Précurseur d’APFC > 8 |
| 86508-42-1 | Composés perfluorés en C5-18 | Précurseur d’APFC > 8 |
| 865-86-1 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,12-hénéicosafluorododécanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 2144-54-9 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,12-hénéicosafluorododécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 4980-53-4 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,16-nonacosafluorohexadécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 6014-75-1 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 17741-60-5 | Acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,12-hénéicosafluorododécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 39239-77-5 | 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 59778-97-1 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,17,17, 18,18,18-tritriacontafluorooctadécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 60699-51-6 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,16-nonacosafluorohexadécanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 65104-65-6 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,17,17, 18,18,19,19,20,20,20-heptatriacontafluoroéicosanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 65104-66-7 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,17,17, 18,18,19,19,20,20,20-heptatriacontafluoroéicosyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 65104-67-8 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,17,17, 18,18,18-tritriacontafluorooctadécanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 115592-83-1 | Acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,12-hénéicosafluorododécyle polymérisé avec l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9,10,10,10-héptadécafluorodécyle, l’acrylate d’hexadécyle, le N-(hydroxyméthyl)acrylamide et l’acrylate d’octadécyle, l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécyle et l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,8-tridécafluorooctyle |
Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 85631-54-5 | Acide propène-2-oïque, esters de ?-?-perfluoro-alkyles en C8-14 | Précurseur d’APFC > 8 Fluoroacrylate |
| 144031-01-6 | Acrylate de dodécyle, polymérisé avec le (1-oxopropén-2-yl)carbamate de butyle et l’acrylate de ?-?-perfluoro-C8-14-alkyle | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 65530-59-8 | a-fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), 2-hydroxypropane-1,2,3-tricarboxylate (3:1) | Précurseur d’APFC > 8 Fluorocarboxylate |
| 65530-66-7 | a-fluoro-?-[2- (méthacryloyloxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Fluoroacrylate |
| 65605-56-3 | a-fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), 2-hydroxypropane-1,2,3-tricarboxylate diacide | Précurseur d’APFC > 8 Fluorocarboxylate |
| 65605-57-4 | a-fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), 2-hydroxypropane-1,2,3-tricarboxylate acide | Précurseur d’APFC > 8 Fluorocarboxylate |
| 65605-58-5 | Méthacrylate de dodécyle polymérisé avec l’a-fluoro-?-[2-(méthacryloyloxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 65605-70-1 | a-fluoro-?-{2-[(1-oxopropén-2-yl)oxy]éthyl}poly(difluorométhylène) | Précurseur d’APFC > 8 Fluoroacrylate |
| 65636-35-3 | Sulfate de N,N-diéthyl-2-(méthacryloyloxy)-N-méthyléthanaminium et de méthyle, polymérisé avec le méthacrylate de 2-éthylhexyle, l’a-fluoro-?-[2-(méthacryloyloxy)éthyl]poly(difluorométhylène), le méthacrylate de 2-hydroxyéthyle et le N-(hydroxyméthyl)acrylamide | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 68239-43-0 | Méthacrylate de 2-éthylhexyle polymérisé avec l’a-fluoro-?-[2-(méthacryloyloxy)éthyl]poly(difluorométhylène), le méthacrylate de 2-hydroxyéthyle et le N-(hydroxyméthyl)acrylamide | Précurseur d’APFC > 8 |
| 71002-41-0 | Hydroxyde d’a-{2-acétoxy-2-[(carboxyméthyl)diméthylammonio]éthyl}-?-fluoropoly (difluoroéthylène), sel interne | Précurseur d’APFC > 8 Dérivé d’alcool fluoré |
| 110053-43-5 | 1,3,5-tris(6-isocyanatohexyl)biuret, produits de réaction avec le 3-chloropropane-1,2-diol et l’a-fluoro-?-(2-ydroxyéthyl)poly(difluorométhylène) | Précurseur d’APFC > 8 Fluorouréthane |
| 123171-68-6 | a-{2-acétoxy-3-[(carboxyméthyl)diméthylammonio]propyl}-?-fluoropoly(difluorométhylène), hydroxyde, sel interne | Précurseur d’APFC > 8 Dérivé d’alcool fluoré |
| 125328-29-2 | Méthacrylates d’alkyles en C10-16, polymérisés avec le méthacrylate de 2-hydroxyméthyle, le méthacrylate de méthyle et un acrylate de perfluoro-C8-14-alkyle | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 129783-45-5 | Acide méthacrylique, esters d’alkyles en C10-16, polymérisés avec le méthacrylate de 2-hydroxyéthyle, le méthacrylate de méthyle et l’acrylate de ?-?-perfluoroalkyles en C8-14 | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 148878-17-5 | Méthacrylates d’alkyles en C2-18polymérisés avec l’a-fluoro-?-[2-(acryloyloxy)éthyl]poly(difluorométhylène) et le chlorure de vinylidène | Précurseur d’APFC > 8 Fluoroester (Absent de la LIS) |
| 70983-60-7 | 2-hydroxy-N,N,N-triméthylpropan-1-aminium, dérivés 3-{[?-?-perfluoro(C6-20-alkyle)]thio}, chlorures | Précurseur d’APFC > 8 (Absent de la LIS) |
| 148240-84-0 | Dérivés 2,2-bis[[(?-?-perfluoro-C4-10-alkyl)thio]méthyle] de 1,3-propanediol, phosphates | Précurseur d’APFC > 8 (Absent de la LIS) |
| 203743-03-7 | Méthacrylate d’hexadécyle polymérisé avec le méthacrylate de 2-hydroxyéthyle, l’acrylate de ?-?-perfluoroalkyle en C10-16 et le méthacrylate de stéaryle | Précurseur d’APFC > 8 (Absent de la LIS) |
| 277752-44-0 | Acide 6-[(di-2-propénylamino)carbonyl](1R, 6R)-3-cyclohexène-1-carboxylique, produits de réaction avec le télomère pentafluoriodoéthane-tétrafluoroéthylène, sels d’ammonium | Précurseur d’APFC > 8 (Absent de la LIS) |
| 333784-46-6 | Polymère greffé de copolymère méthacrylate d’alkyle-anhydride maléique-méthacrylate de 2-[[((mercaptoéthyl)oxy)carbonyl]amino)éthyle et de copolymère méthacrylate d’octadécyle-acrylate de 2-(perfluoro(alkyl(C=6,8,10,12,14)))éthyle | Précurseur d’APFC > 8 (Absent de la LIS) |
| 333784-44-4 | Poly[méthacrylate de 3-chloro-2-hydroxypropyle, méthacrylate de 2,3- dihydroxypropyle, méthacrylate de hydroxypoly(2-23)(oxypropylène), méthacrylate de méthoxypoly(2-23)(oxyéthylène), acrylate de 2-(perhalo(alkyl(C=6,8,10,12,14)))] | Précurseur d’APFC > 8 (Absent de la LIS) |
| 70983-59-4 | a-méthyl-?-hydroxypoly(oxyéthylène), éthers 2-hydroxy-3-[( ?-?-perfluoro-C6-20-alkyl)thio]propyliques | Précurseur d’APFC > 8 (Absent de la LIS) |
| A11863-1 | Acrylate de poly(acrylate d’alkyle-co-2-[perfluoro(alkyl(C=6,8,10,12,14))])éthyle-co-hydroxyméthylcarbamoyléthylène-co-(méthacrylate de 3-chloro-2-hydroxypropyle)-co-(méthacrylate de 2,3 époxypropyle)-co-(méthacrylate de 2-éthylhexyle) | Précurseur d’APFC > 8 |
| A13216-4 | Méthacrylate d’hexadécyle, polymérisé avec l’a-fluoro-[2-[(1-oxo-2-propényl)oxy]éthyl]poly(difluorométhylène), le 2-propénoate d’octadécyle, le 1,1-dichloroéthane, le 2-méthyl-2-propénoate de 2-hydroxyéthyle, le N-(hydroxyméthyl)-2-propénamide et l’a-(2-méthyl-1-oxo-2-propényl)-hydroxypoly(oxy-1,2-éthanediyle) | Précurseur d’APFC > 8 |
| A13498-7 | Produit de la réaction de polymérisation de l’a-fluoro-?-[2-{(2-méthyl-1-oxo-2-propényl)-oxy}éthyl]poly(difluorométhylène), du méthacrylate de (diéthylamino)éthyle, de l’acide éthanoïque et du 2,2’-azobis(2,4-diméthylvaléronitrile) | Précurseur d’APFC > 8 |
| A13887-0 | 1,6-diisocyanatohexane, produit de la réaction de polymérisation avec l’a fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), l’a-méthyl-?-hydroxypoly(oxy-1,2-éthanediol) et l’eau | Précurseur d’APFC > 8 |
| A14064-6 | Copolymère acrylate d’alkyle-acrylate de perfluoroalkyléthyle-dérivé d’acide alkylacrylique substitué-dérivé d’acide méthacrylique alkylé-halogénure de vinyle | Précurseur d’APFC > 8 |
| A15736-4 | Acrylates de ?-?-perfluoro-alkyles en C8-14, polymérisés avec du méthacrylate de perfluoro(C6-C12)alkyléthyle, du stéarylacrylate, de la N-méthylolméthacrylamine, du glycidylméthacrylate et du chlorure de vinylidène | Précurseur d’APFC > 8 |
| No CAS non déterminé | Trichloro(perfluoroalkyléthyl)silane | Précurseur d’APFC > 8 |
| s.o.2 | 2-oxépanone, polymérisé avec du 2,4-diisocyanato-1-méthylbenzène, du méthyloxirane et de l’oxirane, séquencé, du 1-décanol et de la 1H-imidazole-1-propanamine et des ?-?-perfluoroalcools en C8-14 séquencés | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 34395-24-9 | Acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécyle |
Précurseur d’APFC > 8 Polymère de fluoroacrylate (Absent de la LIS) |
| 174125-96-3 | Méthacrylate de 2-(diméthylamino)éthyle, polymérisé avec l’acrylate de d-?-perfluoroalkyle en C10-16 et l’acétate de vinyle | Précurseur d’APFC > 8 (Absent de la LIS) |
| 182700-77-2 | Siloxanes et silicones, diméthyl-, terminés avec un groupement hydroxy, polymérisés avec l’acide tétradécanedioïque, terminés avec le 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13-tricosafluorotridécan-1-ol |
Précurseur d’APFC > 8 (Absent de la LIS) |
| 118102-37-7 | ?-?-perfluoroalcools en C8-14, produits de réaction avec l’épichlorhydrine, l’éther polyéthylène glycol monométhylique et le diamide N,N’,2-tris(6-isocyanatohexyl)imidodicarbonique | Précurseur d’APFC > 8 (Absent de la LIS) |
| 118102-38-8 | ?-?-perfluoroalcools en C8-14, produits de réaction avec l’épichlorhydrine, le tétrahydrofurane homopolymérisé et le diamide N,N’,2-tris(6-isocyanatohexyl)imidodicarbonique diamide | Précurseur d’APFC > 8 (Absent de la LIS) |
| 119973-85-2 | 2-méthacrylate de 3-chloro-2-hydroxypropyle polymérisé avec l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,12-hénéicosafluorododécyle, l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,10- heptadécafluorodécyle, le N-(hydroxyméthyl)acrylamide, l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,16-nonacosafluorohexadécyle, l’acrylate d’octadécyle et l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécyle |
Précurseur d’APFC > 8 Polymère de fluoroacrylate (Absent de la LIS) |
| 178233-67-5 | Acrylate d’hexahydroperfluoroalkyle en C6-12 polymérisé avec l’acrylate de lauryle et l’acroylbutyluréthane | Précurseur d’APFC > 8 Polymère de fluoroacrylate (Absent de la LIS) |
| 178535-23-4 | Esters d’acides gras d’huile de lin et de ?-?-perfluoroalkyles en C8-14 | Précurseur d’APFC > 8 Autres polymères (Absent de la LIS) |
| s.o. | Esters d’acides gras d’huile de canola et de ?-?-perfluoroalkyles en C8-14 | Précurseur d’APFC > 8 Autres polymères |
| s.o. | Esters d’acides gras d’huile de soja et de ?-?-perfluoroalkyles en C8-14 | Précurseur d’APFC > 8 Autres polymères |
| s.o. | Poly{styrène-co-{bis{3-[perfluoroalkyl(C=6,8,10,12,14,16)]-2-hydroxypropyl} maléate}-co-(méthacrylate d’éthyle)-co-(méthacrylate d’éthyle)} | Précurseur d’APFC > 8 Autres polymères |
| s.o. | Poly(acrylate d’octadécyle)-co-acrylate de 2-[perfluoro[alkyl(C=6,8,10,12,14)]]éthyle-co-hydroxyméthylcarbamoyléthylène-co-(méthacrylate de 3-chloro-2-hydroxypropyle)-co-chlorure de vinyle | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| s.o. | (Diméthyl)(hydrogénométhyl)polysiloxanes, produit de réaction avec des alcools en C8-14 et l’éther monoéthylique d’a-?-perfluoropolyéthylèneglycol | Précurseur d’APFC > 8 Alcool fluorotélomérique |
| s.o. | (Diméthyl)(hydrogénométhyl)polysiloxanes, produit de réaction avec des alcools en C8-14, l’éther monoéthylique d’a-?-perfluoropolyéthylèneglycol et le 1-octène | Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 375-95-1 | Acide heptadécafluorononan-1-oïque | APFC > 8 Acide perfluorocarboxylique (Absent de la LIS) |
| 4149-60-4 | Acide heptadécafluorononanoïque, sel d’ammonium | APFC > 8 Acide perfluorocarboxylique (Absent de la LIS) |
| s.o.2 | Acrylate de butyle, polymérisé avec l’acide 2-propénoïque, l’acrylate de 2-hydroxyéthyle, des esters de perfluoroalkyles en C8-14 et le 2-(diméthylamino)éthanol | Précurseur d’APFC > 8 Fluoroester |
| s.o.2 | 1,6-diisocyanatohexane, produit de la réaction de polymérisation avec l’a fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), l’a-méthyl-?-hydroxypoly(oxy-1,2-éthanediol) et l’eau | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 65530-65-6 | a-fluoro-?-[2-stéaroyloxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Fluoroester (Absent de la LIS) |
| 65605-59-6 | Méthacrylate de dodécyle polymérisé avec l’a-fluoro-?-[2-(méthacryloyloxy)éthyl]poly(difluorométhylène) et le N-(hydroxyméthyl)acrylamide | Précurseur d’APFC > 8 Fluoroester (Absent de la LIS) |
| LIS 132164 | Acrylate d’hexadécyle, polymérisé avec l’a-fluoro-?-[2-((1-oxo-2-propényl)oxy)éthyl]poly(difluorométhylène), l’acrylate d’octadécyle, le 1,1-dichloroéthane, le méthacrylate d’hydroxyéthyle et le 2-propénamide | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 126927-97-7 | 1,6-diisocyanatohexane homopolymérisé, produits de réaction avec l’a-fluoro-? (2-hydroxyéthyl)poly(difluorométhylène) | Précurseur d’APFC > 8 Autres polymères (Absent de la LIS) |
| LIS 132175 | Oxime de 2-butanone, produit de la réaction de polymérisation avec le 1,6-diisocyanatohexane, l’a-fluoro-?-(2-hydroxyéthyl)poly(diflurométhylène), l’a-méthyl-?-hydroxypoly(oxy-1,2-éthanediyle) et l’eau | Précurseur d’APFC > 8 Autres polymères |
| s.o. | 1,1-dichloroéthène, polymérisé avec le 2-propénoate de 2-éthylhexyle et l’a fluoro-?-[2[(2-méthyl-1-oxo-2-propényl)oxy]éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| s.o. | Diamide N,N’2-tris(6-isocyanatohexyl)imidodicarbonique, a-fluoro-?-(2 hydroxyéthyl)poly(difluorométhylène), oxiraneméthanol et adduit de 1-octadécanol | Précurseur d’APFC > 8 |
| s.o. | Produit de la réaction de polymérisation de l’a-fluoro-?-[2-[méthyl-1-oxo-2-propényl)oxy]éthyl]poly(difluorométhylène), du méthacrylate de (diéthylamino)éthyle, de l’acide éthanoïque et du 2,2’-azobis[2,2’-azobis(2,4-diméthylvaleronitrile)] | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| s.o. | 1,6-diisocyanatohexane, produit de la réaction de polymérisation avec l’a fluoro-?-(2-hydroxyéthyl)poly(difluorométhylidène), l’a-méthyl-?-hydroxypoly(oxy-1,2-éthanediol) et l’eau | Précurseur d’APFC > 8 |
| s.o. | acide 2-propénoïque, acide butylique, ester 2-hydroxyéthylique, esters de perfluoroalkyles en C8-14et 2-(diméthylamino)éthanol | Précurseur d’APFC > 8 |
| s.o. | a-fluoro-?-[2-[(2-méthyl-1-oxo-2-propényl)oxy]éthyl]poly(difluorométhylène), polymérisé avec le méthacrylate de 2-éthylhexyle et le chlorure de vinylidène | Précurseur d’APFC > 8 |
| 678-39-7 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,10-heptadécafluorodécan-1-ol |
Précurseur d’APFC à longue chaîne |
| 65530-61-2 | a-fluoro-?-[2-(phosphonooxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC à longue chaîne |
| 70969-47-0 | ?-?-perfluorothiols en C8-20télomérisés avec l’acrylamide | Précurseur d’APFC à longue chaîne |
Annexe 2 : Identification des précurseurs d’APFC à longue chaîne
Annexe 2 : Identification des précurseurs d’APFC à longue chaîne - Diagramme : Question 1 : Le produit chimique est-il une substance perfluorée contenant un dérivé ou un polymère de perfluoroalcool, de perfluoroamine, d’acide perfluorocarboxylique, de perfluoroester (y compris l’ester de perfluoroacrylate), de perfluoroéther, de perfluoroiodure ou d’acide phosphonique ou phosphinique perfluoré? Étape 1 : Oui ou non? Oui : Le produit chimique est un précurseur d’APFC. Non : Le produit chimique est-il un composé fluoré comprenant un groupement carboné entièrement fluoré, en plus d’un certain nombre de groupements -CH2-? Le composé fluoré peut être un dérivé ou un polymère de fluoroalcool, de fluoroamine, de fluoroammonium, d’acide fluorocarboxylique, de fluoroester (y compris l’ester de fluoroacrylate), de fluoroéther, de fluoroiodure, de fluorophosphate, de fluorosulfate, de fluorosilicate, de fluorosulfonate, de fluorosulfonamide ou de fluorosulfonyle, de fluorosiloxane, de fluorosilicone ou de fluorosilane, de fluorothioester, de thioéther fluoré, de fluorothiol ou d’uréthane fluoré. Si répondu Si répondu Oui à l'étape 1: Le produit chimique est un précurseur d’APFC. Deux options est offert = 1) Le produit chimique est un précurseur d’APFC à longue chaîne s’il comprend un groupement carboné entièrement fluoré de 8 atomes de carbone ou plus ou 2) Le produit chimique est un précurseur d’APFC à chaîne courte s’il comprend un groupement carboné entièrement fluoré de 6 atomes de carbone ou moins. Si répondu Non à l'étape 1: Deux choix est offert, Oui ou Non: Non: Le produit chimique n’est PAS un précurseur d’APFC. Oui: Le produit chimique est un précurseur d’APFC. Et deux options est offert = 1) Le produit chimique est un précurseur d’APFC à longue chaîne s’il comprend un groupement carboné entièrement fluoré de 8 atomes de carbone ou plus ou 2) Le produit chimique est un précurseur d’APFC à chaîne courte s’il comprend un groupement carboné entièrement fluoré de 6 atomes de carbone ou moins.

Diagramme: Question 1 : Le produit chimique est-il une substance perfluorée contenant un dérivé ou un polymère de perfluoroalcool, de perfluoroamine, d’acide perfluorocarboxylique, de perfluoroester (y compris l’ester de perfluoroacrylate), de perfluoroéther, de perfluoroiodure ou d’acide phosphonique ou phosphinique perfluoré?
Note de bas de page
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
Acides perfluorocarboxyliques à longue chaîne (C9à C20), leurs sels et leurs précurseurs
Table des matières
- Sommaire
- Introduction
- Identité de la substanceIdentité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l’environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Conclusion
- Références
- Annexe 1 : Liste des APFC à longue chaîne (C9 à C20), de leurs sels et de leurs précurseurs (cette liste n’est pas exhaustive)
- Annexe 2 : Identification des précurseurs d’APFCà longue chaîne
Sommaire
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation écologique préalable des acides perfluorocarboxyliques (APFC) à longue chaîne (C9 à C20), de leurs sels et de leurs précurseurs. Dans la présente évaluation, les acides perfluorocarboxyliques à longue chaîne (C9 à C20) seront appelés APFC à longue chaîne. Bien que les APFC à longue chaîne eux-mêmes ne figurent pas sur la Liste intérieure des substances (LIS), certains de leurs précurseurs, figurant sur la LIS, ont été catégorisés en vertu de l’article 73 de la LCPE (1999). L’évaluation a été menée en réponse à des données empiriques qui ont démontré que certains APFC se bioaccumulent, qu’ils sont persistants, qu’ils sont susceptibles d’être transportés à grande distance (par l’intermédiaire des précurseurs), qu’ils sont largement répandus et que leurs concentrations dans les tissus de la faune arctique décrivent une tendance à la hausse.
La présente évaluation écologique est axée sur les APFC dont la chaîne carbonée compte de 9 à 20 atomes de carbone inclusivement, ainsi que sur leurs sels et leurs précurseurs. Les précurseurs, à savoir des substances qui pourraient se transformer ou se dégrader en APFC à longue chaîne, sont considérés d’après leur contribution à la présence totale de ces acides à longue chaîne dans l’environnement. Cette évaluation définit les précurseurs comme étant toute substance dont le groupement alkyle perfluoré de formule CnF2n+1 (où 8 = n = 20) est directement lié à n’importe quel groupe fonctionnel autre que le fluor, le chlore ou le brome.
Les APFC à longue chaîne, leurs sels et leurs précurseurs sont d’origine anthropique. En 2000 et 2004, les enquêtes menées auprès de l’industrie par Environnement Canada en vertu de l’article 71 de la LCPE(1999) ont révélé qu’aucun APFC à longue chaîne n’avait été fabriqué ou importé au Canada. Toutefois, les deux enquêtes ont signalé l’importation au Canada de plusieurs précurseurs de ces acides.
Selon les études de toxicité standards sur des organismes aquatiques, les APFC à longue chaîne avaient une toxicité de faible à modérée, les valeurs de toxicité aiguë se situant entre 8,8 et 285 mg/L. Il existe deux études portant sur la toxicité des APFC à longue chaîne chez les espèces terrestres. Dans une de ces études, aucun effet nocif n’a été observé sur des poulets mâles auxquels on a administré jusqu’à 1,0 mg/kg de poids corporel d’APFC en C10, trois fois par semaine pendant trois semaines. Dans une autre étude, l’exposition d’un nématode vivant dans le sol à un APFC en C9 a provoqué la létalité aiguë à 306 mg/L et des effets sur plusieurs générations (diminution de la fécondité) à 0,000464 mg/L.
Différentes études montrent la capacité des APFC à longue chaîne à entraîner d’autres types d’effets. Il a été montré que les APFC en C9 et en C10 compromettent le mécanisme de résistance multixénobiotique chez les moules marines à des concentrations situées entre 2,23 et 3,65 mg/L. Une exposition par voie alimentaire pendant 14 jours à des concentrations d’APFC en C9 à C12 allant de 2,56 × 10-5 à 2 mg/g a provoqué la vitellogenèse chez la truite arc-en-ciel. Un APFC en C9 peut causer du stress oxydatif chez le grand cormoran. Les APFC en C9 à C11 ont activé le récepteur a activé par les proliférateurs des peroxysomes (PPARa) dans le foie de phoques du Baïkal. Le PPARajoue un rôle physiologique essentiel comme détecteur de lipides et régulateur du métabolisme lipidique. Les APFC en C9 et en C10 sont également des sensibilisants chimiques chez la moule marine Mytilus californianus et ils permettent à des substances toxiques qui seraient normalement éliminées de s’accumuler dans les tissus de cette moule. Quant aux APFC en C12 et en C14, ils ont augmenté le potentiel membranaire mitochondrial de l’algue d’eau douce Scenedesmus obliquus, ce qui indique des dommages à la fonction mitochondriale.
On ne dispose d’aucune donnée expérimentale sur la persistance des APFC à longue chaîne dans les conditions environnementales naturelles. Toutefois, la liaison carbone-fluor est l’une des plus fortes existant dans la nature, ce qui rend la molécule très stable et résistante à la dégradation. La chaîne perfluorée offre une résistance exceptionnelle aux attaques chimiques et thermiques. Étant donné la force de la liaison carbone-fluor, on s’attend donc à ce que les APFC à longue chaîne soient persistants. En outre, des APFC à longue chaîne ont été détectés dans des régions éloignées (p. ex., dans l’Arctique canadien). Bien que les mécanismes de transport ne soient pas bien compris, certains précurseurs peuvent être transportés sur de grandes distances jusqu’à des régions éloignées, où ils peuvent ensuite se transformer en APFC à longue chaîne par dégradation.
Des facteurs de bioconcentration (FBC) empiriques supérieurs à 5 000 ont été signalés pour les APFC en C11, en C12 et en C14. De plus, d’après des données empiriques sur les réseaux trophiques, il existe un potentiel significatif de bioamplification ou d’amplification trophique des APFC en C9 à C14 tant chez les organismes à respiration aquatique que chez ceux à respiration aérienne. On ne dispose pas de données expérimentales ou de données prédites sur la bioaccumulation des APFC à longue chaîne de plus de 14 atomes de carbone. Il est néanmoins possible que ces APFC à plus longue chaîne se bioaccumulent ou se bioamplifient chez les espèces marines ou terrestres selon leur conformation chimique. Cependant, les critères numériques de bioaccumulation, énoncés dans le Règlement sur la persistance et la bioaccumulation, ont été calculés à partir des données sur la bioaccumulation chez les espèces aquatiques d’eau douce (poissons) seulement, et pour des substances dont la répartition se fait surtout dans les lipides. Par conséquent, les critères ne reflètent peut-être pas entièrement le potentiel de bioaccumulation des APFC à longue chaîne qui se répartissent surtout dans le foie, le sang et les reins des mammifères terrestres et marins. Ainsi, la plupart des APFC à longue chaîne ainsi que leurs sels et leurs précurseurs ne rencontre pas les critères numériques pour la bioaccumulation tel qu’énoncé dans le Règlement sur la persistance et la bioaccumulation.
Des APFC en C9 à C15 ont été mesurés dans le foie de phoques, de renards, de poissons, d’ours blancs, de requins du Groenland, de narvals, de bélugas et d’oiseaux, dans l’Arctique canadien comme dans la région des Grands Lacs. Les concentrations variaient de valeurs inférieures à la limite de détection jusqu’à 180 ng/g poids humide de foie, les concentrations les plus élevées se trouvant chez les ours blancs, suivis des requins du Groenland, des narvals et des bélugas. Partout à travers le monde, des APFC en C9 à C15 ont été signalés chez le phoque annelé, l’otarie à fourrure et le phoque commun, chez divers dauphins (à flancs blancs, à gros nez, à nez blanc, sotalie de Chine), le marsouin aptère, le goéland bourgmestre, le grand cachalot, le castor, le tigre, les rats sauvages et plusieurs espèces d’oiseaux. Les concentrations variaient de valeurs inférieures à la limite de détection jusqu’à 480 ng/g poids humide, et les concentrations les plus élevées se trouvaient chez le dauphin à nez blanc.
De 1980 à 2000, les concentrations d’APFC à longue chaîne en C10 et en C11 dans le foie de phoques annelés du Groenland ont augmenté de 3,3 et de 6,8 % par an, respectivement. De 1992 à 2005, les concentrations moyennes d’APFC en C9 et en C10 mesurées dans le foie de phoques du Baïkal étaient 1,2 à 1,7 fois plus élevées. Entre 1972 et 2002, le temps moyen de doublement des concentrations dans le foie des ours blancs de l’Arctique se situait entre 5,8 et 9,1 ans, pour les APFC en C9 à C11. De 1993 à 2004, les concentrations dans des échantillons de foie de phoque annelé ont augmenté, avec un temps de doublement des APFC en C9 à C12 allant de 4 à 10 ans. Dans des échantillons de foie de fulmar boréal, les concentrations des APFC en C9 à C15 ont augmenté de 1987 à 1993 et sont restées stables entre 1993 et 2003. Quant aux concentrations d’APFC en C9 à C15 mesurées dans des échantillons de foie de guillemot de Brünnich, elles ont connu une hausse de 1975 à 2004. Les concentrations des APFC en C9 à C13 ont augmenté de façon significative dans les œufs entiers de goélands argentés prélevés en Norvège de 1983 à 1993. En ce qui concerne les bélugas mâles du Nunavut, on a enregistré une augmentation annuelle des APFC en C9 à C12 dans le foie de 1,8 ng/g poids humide de 1980 à 2010.
L’évaluation est fondée sur une méthode du poids de la preuve en ce qui concerne la persistance, la bioaccumulation, la présence répandue, les tendances temporelles chez certaines espèces (c.-à-d. oiseaux de l’Arctique canadien, mammifères terrestres et marins), le transport à grande distance et les concentrations d’APFC à longue chaîne dans l’environnement et le biote (y compris les régions éloignées du Canada).
Selon l’information disponible, il est conclu que les APFC à longue chaîne, leurs sels et leurs précurseurs pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, il est conclu que les APFC à longue chaîne et leurs sels sont extrêmement persistants et qu’ils répondent aux critères de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation. Les APFC à longue chaîne ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. Néanmoins, le poids de la preuve est suffisant pour conclure que les APFC à longue chaîne et leurs sels s’accumulent et se bioamplifient chez les mammifères terrestres et marins.
Il est conclu que les APFC à longue chaîne ainsi que leurs sels et leurs précurseurs satisfont à au moins un des critères énoncés à l’article 64 de la LCPE (1999).
Introduction
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999), le ministre de l’Environnement a effectué une évaluation écologique préalable des acides perfluorocarboxyliques (APFC) à longue chaîne, de leurs sels et de leurs précurseurs. Ils ont été reconnus comme des substances préoccupantes à l’issue du processus de déclaration de substances nouvelles d’Environnement Canada et par l’entremise du Plan d’action pour l’évaluation et la gestion des acides perfluorocarboxyliques et de leurs précurseurs (Canada, 2006). En 2004, Santé Canada et Environnement Canada ont évalué quatre substances à base de télomères fluorés dans le cadre des dispositions de la LCPE (1999) concernant les substances nouvelles. On soupçonnait ces substances d’être « toxiques », car elles contenaient des précurseurs directs des APFC et on les jugeait capables de se décomposer en ces acides. Les modifications au Règlement sur certaines substances toxiques interdites (2005) ont été publiées dans la Partie I de la Gazette du Canada le 17 juin 2006 (Canada, 2006). Ces modifications ont été faites afin d’établir un règlement visant à maintenir les interdictions liées à ces nouvelles sources d’APFC. De plus, les précurseurs, soit les substances portant les nos CAS (numéros de registre du Chemical Abstract Service) 65530-63-4, 65530-71-4, 65530-72-5, 65530-74-7, 68391-08-2, 68412-68-0, 115592-83-1, 65530-61-2, 70969470, 65530-66-7, 65605-58-5, 65605-70-1, 65636-35-3, 68239-43-0 et 11005343-5, répondaient aux critères environnementaux de la catégorisation relatifs à la persistance, au potentiel de bioaccumulation et à la toxicité intrinsèque pour les organismes non humains. L’évaluation des risques que présentent toutes ces substances pour la santé humaine n’a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d’exposition et du risque pour la santé élaborés par Santé Canada aux fins de la catégorisation des substances de la Liste intérieure des substances (LIS).
La présente évaluation écologique est axée sur les APFC dont la chaîne carbonée compte de 9 à 20 atomes de carbone inclusivement, ainsi que sur leurs sels et leurs précurseurs. Cette gamme de longueurs de chaînes carbonées correspond à la gamme prise en compte dans l’évaluation menée en vertu du Programme des substances nouvelles. Les précurseurs ont été pris en compte selon leur contribution à la présence totale des APFC à longue chaîne dans l’environnement.
Les données pertinentes pour l’évaluation préalable des APFC à longue chaîne sont tirées de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées jusqu’en février 2011. En outre, des enquêtes sur les composés perfluoroalkyliques et fluoroalkyliques ont été menées auprès de l’industrie pour les années 2000 et 2004 au moyen d’un avis publié dans la Gazette du Canada conformément à l’article 71 de la LCPE (1999) [Canada, 1999]. Ces enquêtes ont permis de recueillir des données sur la fabrication, l’importation et les utilisations des composés perfluoroalkyliques et fluoroalkyliques au Canada. Des études toxicologiques soumises par l’industrie en application de l’article 70 de la Loi ont également été prises en compte.
Les évaluations préalables mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de l’article 64 de la LCPE (1999) [Canada, 1999]. La démarche suivie dans cette évaluation écologique préalable consistait à examiner les renseignements scientifiques et techniques pertinents et à tirer des conclusions fondées sur de multiples éléments d’information, tels que la persistance, la bioaccumulation, la toxicité, les tendances temporelles dans le biote et la présence répandue dans le biote de la substance. Cette évaluation préalable ne présente pas un examen exhaustif de toutes les données disponibles. Elle fait plutôt état des études et des éléments d’information essentiels qui appuient les conclusions.
La présente évaluation préalable a été préparée par le personnel du Programme des substances existantes d’Environnement Canada. Cette évaluation écologique a fait l’objet d’une consultation et d’un examen écrit par des pairs. De plus, l’ébauche de cette évaluation préalable a fait l’objet d’une période de commentaires du public de 60 jours. Bien que les commentaires externes et publics aient été pris en considération, Environnement Canada assume la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Identité de la substance
Le présent rapport évalue les APFC à longue chaîne (C9 à C20), leurs sels et leurs précurseurs. L’acide pentadécafluorooctanoïque (APFO ou C8) a fait l’objet d’une évaluation distincte.
Par « perfluorés », on entend les substances chimiques fluorées dans lesquelles les atomes d’hydrogène directement liés aux atomes de carbone sont tous remplacés par des atomes de fluor. Les APFC à longue chaîne et leurs sels constituent une série homologue de substances ayant la formule moléculaire suivante : CnF2n+1CO2H (où 8 = n = 20). Dans le présent document, les acides perfluorocarboxyliques à longue chaîne (C9 à C20) seront appelés « APFC à longue chaîne ».
Les APFC à longue chaîne ne figurent pas sur la LIS et n’ont pas été soumis aux dispositions relatives à la catégorisation de la LCPE (1999) [Canada, 1999]. Certains des 90 précurseurs déterminés figurent toutefois sur cette liste et étaient visés par la catégorisation. La présente évaluation prend en compte tout précurseur des APFC à longue chaîne qui pourrait se transformer ou se dégrader en APFC en C9 à C20, étant donné ses utilisations semblables et ses similarités sur le plan des propriétés physiques et chimiques et des caractéristiques structurelles. Aux fins de la présente évaluation, les précurseurs sont définis comme étant toute substance dont le groupement alkyle perfluoré de formule CnF2n+1 (où 8 = n = 20) est directement lié à n’importe quel groupe fonctionnel autre que le fluor, le chlore ou le brome. On n’a pas directement tenu compte, dans l’évaluation, des possibles effets cumulatifs des APFC à longue chaîne, de leurs précurseurs et de leurs sels, mais on reconnaît que les précurseurs et les sels pourraient contribuer à la présence totale des APFC à longue chaîne dans l’environnement. L’expression « CX » sert à définir la longueur de la chaîne d’atomes de carbone de l’acide perfluorocarboxylique en question; ainsi, C9représente un APFC à neuf atomes de carbone.
Environnement Canada considère quelque 90 composés perfluoroalkylés (ou composés d’alkyles perfluorés) comme des APFC à longue chaîne, des sels ou des précurseurs de ces derniers (voir l’annexe II : Identification des précurseurs d’APFC à longue chaîne). La catégorie des APFC à longue chaîne a été définie d’après le jugement de spécialistes, la structure chimique et l’estimation de la biodégradation à l’aide du modèle CATABOL (Mekenyan et al., 2002). Ainsi, les structures ont été analysées pour déterminer la possibilité que les substances en question se décomposent en APFC à longue chaîne. Le modèle CATABOL, qui a été étalonné à partir des résultats d’essais de biodégradation du MITI (Ministry of International Trade and Industry[ministère du Commerce international et de l’Industrie], Japon), prévoit la biodégradation sur une période de 28 jours. On sait que, étant donné le caractère très limité des données sur la dégradation des composés perfluorés dans l’ensemble d’étalonnage, certains des produits de dégradation prévus par CATABOL pourraient constituer des résultats peu fiables ou non pertinents dans les conditions naturelles. Il est à noter que, dans le cas de la chimie des composés perfluorés, le processus de dégradation sera plus long que ce qu’indique CATABOL, mais il est difficile d’estimer dans quelle mesure, surtout pour les substances de masse moléculaire élevée comme les oligomères et les polymères. La liste à l’annexe I donne des exemples de substances appartenant au groupe des APFC à longue chaîne, mais elle n’est pas exhaustive.
L’Organisation de coopération et de développement économiques (OCDE) a rédigé le document intitulé Preliminary Lists of PFOS, PFAS, PFOA and Related Compounds that may Degrade to PFCA (OCDE, 2007), pour appuyer ses activités de gestion des risques associés aux composés perfluorés; ce document combine les renseignements de divers pays membres, dont le Canada. L’OCDEa dressé une liste préliminaire d’environ 850 substances perfluorées connues, dont la plupart peuvent potentiellement se décomposer en APFC. Les fluoropolymères comme le polytétrafluoroéthylene (PTFE) sont considérés comme stables et ne sont donc pas classés parmi les précurseurs d’APFC sur la liste de l’OCDE. Certains APFC sont utilisés comme agents technologiques dans la fabrication de fluoropolymères, et de très faibles concentrations d’APFC pourraient être présentes dans les produits finis; toutefois, les APFC ne sont pas incorporés à la structure polymérique. Les précurseurs d’APFC à longue chaîne visés par la présente évaluation font aussi partie de la liste de l’OCDE.
Tableau 1. Identité des substances – acides perfluorocarboxyliques à longue chaîne
| Nom dans le Chemical Abstract Index | Sigle | Formule Moléculaire | Formule développée | N° CAS | Autres noms |
|---|---|---|---|---|---|
| Acide hepta-décafluoro-nonanoïque (APFC en C9) |
APFN | C9 H F17 O2 | 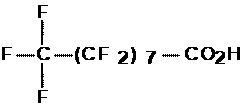 |
375-95-1 (LES) | C 1800; acide hepta-déca-fluorono-nanoïque; acide perfluoro-nonanoïque; acide perfluoro-pélargonique |
| Acide nona-décafluoro-décanoïque (APFC en C10) |
APFD | C10 H F19 O2 |  |
335-76-2 (LES) | Acide nona-décafluoro-n-décanoïque; Acide perfluoro-n-décanoïque; Acide perfluoro-caprique; Acide perfluoro-décanoïque |
| Acide hénéicosa-fluoroun-décanoïque (APFC en C11) |
APFUnD | C11 H F21 O2 | 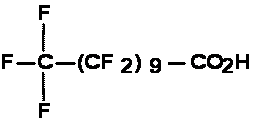 |
2058-94-8 (ne figure ni sur la LIS ni sur la LES) | Acide hénéicosa-fluoroun-décanoïque; Acide perfluoroun-décanoïque; Acide perfluoroun-décylique |
| Acide tricosa-fluorodo-décanoïque (APFC en C12) |
APFTrD | C12 H F23 O2 |  |
307-55-1 (LES) | Acide perfluoro-dodé-canoïque; Acide perfluoro-laurique |
| Acide pentacosa-fluorotri-décanoïque (APFC en C13) |
APFTrD | C13 H F25 O2 |  |
72629-94-8 (not listed on NDSL or DSL) | Acide perfluoro-tri-décanoïque |
| Acide heptacosa-fluorotétra-décanoïque (APFC en C14) |
APFTD | C14 H F27 O2 |  |
376-06-7 (NDSL) | Acide perfluoro-myristique; Acide perfluoro-tétra-décanoïque |
| Acide perfluoro-myristique; Acide perfluoro-tétra-décanoïque | APFPeD | C15H F29O2 | 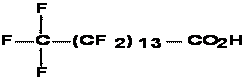 |
141074-63-7 (not listed on NDSL or DSL) | Acide perfluoro-penta-décanoïque |
| Acide perfluoro-palmitique (APFC en C16) |
APFHxD | C16HF31O2 |  |
67905-19-5 (NDSL) | Acide perfluoro-palmitique; Acide perfluoro-hexa-décanoïque; Acide hexa-décanoïque |
Acide perfluoro-palmitique; Acide perfluoro-hexadécanoïque; Acide hexa-décanoïque |
APFHpD | C17HF33O2 |  |
57475-95-3 (not listed on the NDSL or DSL) | -- |
| Acide perfluoro-stéarique (APFC en C18) |
APFOD | C18HF35O2 |  |
16517-11-6 (NDSL) | Acide perfluoro-stéarique; Acide perfluoro-octa-décanoïque; Acide octa-décanoïque |
| Acide perfluoro-nona-décanoïque (APFC en C19) |
APFND | C19HF37O2 | 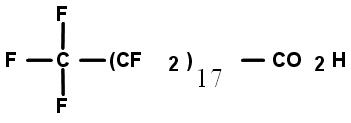 |
133921-38-7 (not listed on NDSL or DSL) | -- |
| Acide perfluoro-éicosanoïque (APFC en C20) |
C20HF39O2 |  |
68310-12-3 (NDSL) | Acide nona-triaconta-fluoro-éico-sanoïque; Acide nona-triaconta-fluoro-éico-sanoïque |
LES = Liste extérieure des substances. Les substances qui ne figurent pas sur la LIS sont considérées comme nouvelles au Canada et doivent être déclarées. Les substances figurant sur la LESsont assujetties à une déclaration, mais les exigences en matière de renseignements sont réduites.
Propriétés physiques et chimiques
L’information sur les propriétés physiques et chimiques des APFC à longue chaîne est limitée. Le tableau 2 présente les données sur les propriétés physiques et chimiques disponibles pour les APFC à longue chaîne. L’hypothèse selon laquelle la conformation de la liaison carbone-carbone changerait avec l’allongement de la chaîne a été avancée : les chaînes plus longues deviendraient hélicoïdales (Wang et Ober, 1999), ce qui donnerait des molécules à section transversale plus petite, dans lesquelles la chaîne pourrait se replier sur elle-même ou n’être pas complètement linéaire. Le cas échéant, les propriétés physiques et chimiques des acides à plus longue chaîne seraient ainsi différentes de celles des APFC linéaires (c.-à-d. < C8); toutefois, on ne dispose pas de données sur les propriétés physiques et chimiques des APFC à longue chaîne hélicoïdale.
Tableau 2. Propriétés physiques et chimiques disponibles des APFC à longue chaîne
| Propriété | Valeur | Type | Référence |
|---|---|---|---|
| APFC en C9 | |||
| Masse moléculaire (g/mol) | 464,08 | – | – |
| Point de fusion (°C) | 77 | Expérimental | Fontell et Lindman, 1983 |
| 71 | Blancou et al., 1976 | ||
| 71-72 | Herbst et al., 1985 | ||
| 65 (CCl4) | Beneficemalouet et al., 1991 | ||
| 59,3-61,1 | Kunieda et Shinoda, 1976 | ||
| 69-71 | Ishikawa et al., 1983 | ||
| Point d’ébullition (°C) | 203,4 | Calculé | Kaiser et al., 2005 |
| Pression de vapeur (Pa) à 25 °C | 1,3 à 99,97 kPa (99,6 à 203 °C) |
Calculé | Kaiser et al., 2005 |
| 0,10 | Expérimental | Arp et al., 2006 | |
| Solubilité dans l’eau | < 0,2 en pourcentage pondéral à 60 °C | Expérimental | Fontell et Lindman, 1983[1] |
| 1,3 g/L (concentration micellaire critique) | Expérimental | Kunieda et Shinoda, 1976[1] | |
| pKa (sans dimension) | < 0,8 | Calculé | Goss, 2008 |
| Log Kco (sans dimension) | 2,3-2,48 | Expérimental | Higgins et Luthy, 2006 |
| APFC en C10 | |||
| Masse moléculaire (g/mol) | 514,08 | – | – |
| Point de fusion (°C) | 87,4-88,2 (CCl4) | Expérimental | Bernett et Zisman, 1959 |
| 87,4-88,2 (toluène) | Bernett et Zisman, 1959 | ||
| 83,5-85,5 (CCl4, éthanol) |
Mukerjee et Handa, 1981 | ||
| 76,5 (CCl4) | Ikawa et al., 1988 | ||
| 87,4-88,2 | Hare et al., 1954 | ||
| Point d’ébullition (°C) | 218 | Expérimental | Kauck et Diesslin, 1951 |
| 219,4 | Calculé | Kaiser et al., 2005 | |
| 203,4 | Calculé | Kaiser et al., 2005 | |
| 218 | Expérimental | Sigma Aldrich, 2004 | |
| Pression de vapeur (Pa) à 25 °C | 3,1 à 99,97 kPa (129,6 à 218,9 °C) |
Calculé | Kaiser et al., 2005 |
| –0,64 | Expérimental | Arp et al., 2006 | |
| 0,10 | Expérimental | Arp et al., 2006 | |
| Solubilité dans l’eau (g/L) | 5,14 | Expérimental | Kauck et Diesslin, 1951 |
| 0,40 (concentration micellaire critique) | Bernett et Zisman, 1959[1] | ||
| 0,46 (concentration micellaire critique à 30 °C) | Klevens et Raison, 1954[1] | ||
| pKa (sans dimension) | 2,58 | Calculé | Moroi et al., 2001 |
| Log Kco (sans dimension) | 2,65-2,87 | Expérimental | Higgins et Luthy, 2006 |
| APFC en C11 | |||
| Masse moléculaire (g/mol) | 564,1 | – | – |
| Point de fusion (°C) | 112-114 | Expérimental | Huang et al., 1987 |
| 97,9-100,3 | Kunieda et Shinoda, 1976 | ||
| Point d’ébullition (°C) | 238,4 à 101,325 kPa | Calculé | Kaiser et al., 2005 |
| Pression de vapeur (Pa) à 25 °C | 0,6 à 99,97 kPa (112 à 237,7 °C) |
Calculé | Kaiser et al., 2005 |
| –0,98 | Expérimental | Arp et al., 2006 | |
| Log Kco (sans dimension) | 3,19-3,41 | Expérimental | Higgins et Luthy, 2006 |
| APFC en C12 | |||
| Masse moléculaire (g/mol) | 614,1 | – | – |
| Point de fusion (°C) | 112,6-114,7 (CCl4, toluène) |
Expérimental | Bernett et Zisman, 1959 |
| 112,6-114,7 | Hare et al., 1954 | ||
| 112-114 | Huang et al., 1987 | ||
| Point d’ébullition (°C) | Non disponible | ||
| Pression de vapeur (Pa) à 25 °C | 0,9 à 99,96 kPa (127,6 à 247,7 °C) | Calculé | Kaiser et al., 2005 |
| APFC en C13 | |||
| Masse moléculaire (g/mol) | 664,0989 | – | – |
| Point de fusion (°C) | 117,5-122 | Expérimental | Kunieda et Shinoda, 1976 |
| APFC en C14 | |||
| Masse moléculaire (g/mol) | 714,12 | – | – |
| Point de fusion (°C) | 130,4 (hexane) | Expérimental | Lehmler et al., 2001 |
| 130 | Kunieda et Shinoda, 1976 | ||
| APFC en C15 | |||
| Masse moléculaire (g/mol) | 764,1129 | – | |
Abréviations : Kco, coefficient de partage carbone organique-sédiments; pKa, constante de dissociation acide.
Sources
On ne connaît aucune source naturelle d’APFC à longue chaîne, de leurs sels ou de leurs précurseurs (Kissa, 1994). Leur présence dans l’environnement est attribuable uniquement à l’activité humaine. Une enquête menée auprès de l’industrie par Environnement Canada en 2000, en application de l’article 71 de la LCPE (1999) [Canada, 1999], a permis de recenser 256 composés perfluoroalkylés faisant l’objet d’un commerce au Canada pour les années civiles 1997, 1998, 1999 et 2000 (Environnement Canada, 2001). La fabrication d’APFC à longue chaîne ou leur importation au Canada n’a pas été déclarée. Une autre enquête menée en 2004 auprès de l’industrie par Environnement Canada sur les substances perfluoroalkylées et fluoroalkylées a elle aussi indiqué qu’aucun APFC à longue chaîne n’avait été fabriqué ou importé au Canada (Environnement Canada, 2005). Dans le cadre des deux enquêtes, l’importation au Canada de 1 000 à 100 000 kg de précurseurs d’APFC à longue chaîne a toutefois été déclarée.
Utilisations
L’APFC en C9 est employé dans des agents tensioactifs et dans la production de fluoropolymères, principalement le poly(fluorure de vinylidène) [Prevedouros et al., 2006]. D’après les renseignements dont on dispose, les APFC à longue chaîne sont rarement utilisés de manière intentionnelle dans les produits. Toutefois, des précurseurs couramment utilisés qui sont présent dans des produits commerciaux, tels que les fluorotélomères, soit des substances dérivées d’alcools fluorotélomériques (FTOH) ou d’autres substances à base de fluorotélomères, peuvent se dégrader et produire des APFC à longue chaîne. Les fluorotélomères forment un sous-groupe de substances perfluorées produites par un processus appelé télomerisation, pouvant mettre en jeu des molécules à chaînes fluorocarbonées de diverses longueurs. Les FTOH ne sont pas entièrement fluorés puisqu’une chaîne hydrocarbure à deux carbones est liée à la chaîne perfluorocarbonée. Des époxydes, des oléfines ou des alcools fluorotélomériques sont employés comme unités élémentaires dans la production de substances à base de fluorotélomères. Ces substances rendent les substrats résistants aux huiles, aux graisses, à l’eau et aux taches. Certaines substances fluorotélomériques peuvent aussi être utilisées comme monomères afin de produire des fluorotélomères polymériques possédant les mêmes caractéristiques.
Rejets dans l’environnement
Rejets directs
On ne dispose d’aucune donnée sur les rejets directs d’APFCà longue chaîne, provenant de l’utilisation et de la fabrication industrielles, dans l’environnement, au Canada.
Rejets indirects
On dispose de certaines données empiriques sur la dégradation des polymères à base de fluorotélomères en APFC à longue chaîne. Les alcools fluorotélomériques (FTOH) qui possèdent un nombre x d’atomes de carbone produisent des intermédiaires tels que les acides carboxyliques fluorotélomériques insaturés (ACFTIx:2) et les acides carboxyliques fluorotélomériques (ACFTx:2) qui peuvent à leur tour se décomposer en APFC à longue chaîne. Les FTOH eux-mêmes peuvent donner des APFC par biodégradation ou métabolisation, comme le montrent diverses études (Hagen et al., 1981; Lange, 2002; Dinglasan et al., 2004; Kudo et al., 2005; Martin et al., 2005; Wang et al., 2005a, 2005b; Fasano et al., 2006, 2008; Liu et al., 2007; Nabb et al., 2007). En outre, Kudo et al. (2005), Martin et al. (2005) et Liu et al. (2007) présentent d’autres indications que des ACFT et des ACFTIsont formés comme intermédiaires lors de la biodégradation ou la métabolisation des FTOH. Une faible quantité d’APFCen C9 a été produite dans un système au peroxyde d’hydrogène photoinduit (solutions à 10 mM et 100 μM), ce qui démontre la dégradation rapide de FTOH 8:2 en quelques minutes à quelques heures par l’intermédiaire de la formation d’aldéhydes fluorotélomériques 8:2, d’ACFT 8:2 et d’ACFTI 8:2 (Gauthier et Mabury, 2005).
On a constaté que les FTOH étaient une source potentielle d’APFC à longue chaîne lorsqu’on a trouvé des métabolites de ces alcools dans le biote (Smithwick et al., 2006; Butt et al., 2008; Powley et al., 2008; Furdui et al., 2007). On s’attend à ce que la métabolisation des FTOH forme des intermédiaires comme les ACFT et les ACFTI (Dinglasan et al., 2004; Wang et al., 2005a, 2005b). Houde et al. (2005) ont signalé la présence d’ACFTI 8:2 et 10:2 dans le plasma de dauphins à gros nez de la région du golfe du Mexique, le long de la côte est de l’Atlantique. Aucun ACFT n’a été détecté. Une étude sur les tendances temporelles effectuée par Butt et al. (2008) a également révélé la présence d’ACFTI dans tous les échantillons de foie de phoque annelé provenant de l’Arctique canadien. Furdui et al. (2007) ont indiqué la présence d’ACFTI 8:2 et d’ACFTI 10:2 dans 52 % et 40 %, respectivement, de tous les échantillons de touladis prélevés dans les Grands Lacs. La présence d’ACFT et d’ACFTI dans la faune est également signalée dans un certain nombre d’études comme celles de Taniyasu et al. (2005), Verreault et al. (2005), Powley et al. (2008), Smithwick et al. (2006), Butt et al. (2007a, 2007b, 2008) et Furdui et al. (2007). Dinglasan et Mabury (2005) ont montré que des FTOH 8:2, des ACFT 8:2 et des ACFTI 8:2 sont formés par la dégradation d’un monomère de méthacrylate télomérique 8:2 utilisé dans la fabrication des polymères. Bien que le taux de dégradation n’ait pas été établi, l’inoculat destiné au traitement aérobie des eaux usées a pu décomposer de manière significative le monomère au cours de l’essai d’une durée d’environ 73 jours.
Yoo et al. (2010) ont mesuré les concentrations de FTOH dans le sol de certains champs (près de Decatur, en Alabama) sur lesquels on avait épandu des boues d’épuration. Des boues provenant d’une usine de traitement des eaux usées (UTEU) à Decatur, en Alabama, ont été épandues sur des champs agricoles pendant plus d’une décennie; cette usine de traitement des eaux usées recueillait les flux de déchets des industries qui utilisaient des composés fluorotélomériques (Washington et al., 2010). Yoo et al. (2010) ont constaté que les champs amendés par les boues présentaient des concentrations de FTOH dans le sol de surface de 5 à 73 ng/g poids sec. La concentration de FTOH la plus élevée était celle du FTOH 10:2, dont les concentrations variaient de moins de 5,6 à 166 ng/g poids sec. Les demi-vies des FTOH étaient comprises entre 0,85 et 1,8 année, ce qui laisse entendre que l’épandage des boues est une voie possible pour la dégradation des FTOH en APFO et autres acides perfluorocarboxyliques. Washington et al.(2010) ont également constaté que ces champs amendés par les boues présentaient des concentrations élevées d’APFC, notamment des APFC en C10(< 990 ng/g) et en C11 (< 530 ng/g). Les FTOH 6:2, FTOH 8:2 et FTOH 10:2 ont été mesurés dans l’air à deux sites d’enfouissement en Ontario; les concentrations étaient inférieures à 5 000 pg/m3 (en amont) et variaient entre 0 et moins de 25 000 pg/m3 sur le site (Ahrens et al., 2010a).
L’abondance relative des APFC linéaires par rapport à celle des APFC ramifiés peut donner une idée de leur source possible. Les APFC linéaires peuvent indiquer une dégradation principalement à partir de FTOHlinéaires et peuvent révéler que les APFC résultent de la télomérisation plutôt que de la fluoration électrochimique (procédé qui générerait environ 20 % d’isomères ramifiés). Il a également été suggéré que la dégradation d’un FTOH donné devrait former, par oxydation atmosphérique, un nombre égal d’APFCdont la chaîne compte un nombre pair de carbones et d’APFC dont la chaîne compte un nombre impair de carbones (De Silva et Mabury, 2004; Ellis et al., 2004b). De Silva et Mabury (2004) ont déterminé qu’au moins 99 % des APFC contenus dans les échantillons de foie d’ours blancs provenant du sud-ouest de la baie d’Hudson et de l’est du Groenland étaient des isomères linéaires. Il a été montré que les FTOH donnent, en se décomposant, des concentrations relativement égales d’APFC dont la chaîne compte un nombre pair de carbones et d’APFCdont la chaîne compte un nombre impair de carbones (Ellis et al., 2004b), ce qui indique la possibilité que les FTOH soient une source d’AFPC. Il est proposé que les APFC dont la chaîne compte un nombre impair de carbones soient présents en concentrations légèrement plus élevées dans le biote des niveaux trophiques supérieurs (Martin et al., 2004a). Ce profil a été observé dans les échantillons prélevés chez des ours blancs par Kannan et al. (2005) et Smithwick et al. (2005b). Lorsque les quantités d’APFC dont la chaîne compte un nombre impair de carbones et celles d’APFC dont la chaîne compte un nombre pair de carbones sont corrélées, cela semble indiquer une source unique et uniforme (Smithwick et al., 2005b; van de Vijver et al., 2005). Les FTOH semblent disponibles pour les organismes dans l’environnement et ils sont métabolisés, in vivo, en intermédiaires (d’autres précurseurs d’APFC) qui peuvent mener finalement à la formation d’APFC à longue chaîne. Furdui et al. (2008) ont observé une diminution des isomères ramifiés d’APFC en C11 et C13 chez les touladis du lac Ontario entre 1993 et 2004 et ils ont noté une augmentation des isomères linéaires dans les échantillons plus récents (jusqu’à l’année 2004), ce qui laisse penser que les sources actuelles d’APFC dans le lac Ontario résultent du processus de télomérisation.
Les concentrations de FTOH résiduels dans les polymères ont été mesurées dans le cadre d’une étude effectuée par Dinglasan-Panlilio et Mabury (2006), celle-ci ayant consisté à analyser plusieurs produits contenant des polymères fluorés ou des composés fluorés apparentés. On a détecté des FTOH (4:2 à 12:2) en concentrations de 0,11 à 3,8 %, en poids sec, dans les produits. Le solvant d’extraction utilisé était l’acétate d’éthyle (2 aliquotes de 5 mL subséquemment combinées), sa concentration n’étant pas précisée. Même s’il était impossible de distinguer les FTOH constituant des résidus[1] des FTOH faisant partie de la formulation des produits, la présence de ces alcools indique que les polymères à base de fluorotélomères pourraient en être une source dans l’environnement.
Les concentrations d’APFC à longue chaîne mesurées en milieu aquatique dans les zones urbaines canadiennes semblent indiquer l’existence de sources indirectes, comme les usines de traitement des eaux usées (UTEU) (Boulanger et al., 2005a; Simcik et Dorweiler, 2005; Crozier et al., 2005). Des APFC en C9 à C12 ont été détectés dans les boues d’UTEU dans le cadre d’un certain nombre d’études (Boulanger et al., 2005b; Higgins et al., 2005; Sinclair et Kannan, 2006; Crozier et al., 2005). Higgins et al. (2005) ont révélé la présence de concentrations plus fortes d’APFCà chaîne comptant un nombre pair de carbones (C8 à C12) dans les boues stabilisées par voie aérobie provenant d’une UTEU et dans les sédiments prélevés dans la région de la baie de San Francisco. Sinclair et Kannan (2006) ont fait ressortir un profil caractérisé par des APFC comptant un nombre pair de carbones plus abondants que les APFC comptant un nombre impair de carbones dans les effluents d’UTEU dans l’État de New York.
Les UTEU qui procédaient à un simple traitement primaire n’engendraient pas de rejets d’APFC à longue chaîne. Cependant, dans les UTEU avec traitement secondaire, on a enregistré une présence accrue d’APFCà longue chaîne (Sinclair et Kannan, 2006), ce qui laisse supposer une dégradation biologique ou chimique rapide des précurseurs lors du traitement secondaire. Des précurseurs comme les produits de décomposition des ACFT et des FTOH ont été mesurés dans les échantillons d’influents et d’eaux issues du traitement primaire, mais pas dans les eaux ayant subi un traitement secondaire (Sinclair et Kannan, 2006). Comme on ne trouve des ACFT que dans les échantillons d’eaux issues du traitement primaire, on conclut que la conversion des FTOH en APFC à longue chaîne est incomplète, tandis que l’absence d’ACFT et la présence d’APFC en C9 à C11 dans les échantillons d’eaux ayant subi un traitement secondaire laissent supposer une conversion complète. Crozier et al. (2005) ont mesuré des concentrations d’APFC en C9 et en C10 dans les effluents (concentrations de 3 à 6 ng/L) et les biosolides (concentrations de 0,4 à 5,2 ng/g) d’usines de traitement des eaux d’égout en Ontario. On n’a pas détecté d’APFC en C11 et C12 (limite de détection : 2 ng/L). Crozier et al. (2005) ont également remarqué qu’aucun APFC en C10n’a été relevé dans l’influent d’une usine de traitement des eaux d’égout, mais qu’on en a relevé dans l’effluent à une concentration de 4 ng/L, ce qui indique que les APFC en C10 se sont formés au cours du procédé de l’usine, alors que des APFC en C9 ont été relevés à une concentration de 4 ng/L tant dans l’influent que dans l’effluent de l’usine de traitement, ce qui indique qu’il n’y a pas eu d’élimination du composé.
De Silva et al. (2009) ont laissé entendre que la biodégradation et/ou la métabolisation des acides polyfluorophosphorique (diesters équivalents à des diPAP) tels que les diPAP 10:2 peuvent créer des APFC en C10. Des diPAP ont été mesurés à des concentrations de 50 à 100 ng/g dans les boues d’UTEU.
Guo et al. (2009) ont détecté des APFC en C9 à C12 dans des maisons américaines types contenant des planchers recouverts de tapis, des tapis prétraités et des liquides d’entretien des tapis offerts dans le commerce. Gewurtz et al. (2009) ont décelé des APFC en C9à C14 ainsi que des ACFTI 8:2 et des ACFTI 10:2 dans la pellicule formée par les dépôts accumulés sur des fenêtres échantillonnées à l’intérieur et à l’extérieur, en ville, en banlieue, en campagne et dans des magasins de tapis à Toronto, en Ontario. Les cires à parquet et les produits d’étanchéité pour la pierre, les carreaux et le bois, qui contiennent des produits fluorotélomériques, constituent des sources potentielles d’APFC en C9 à C12 dans les maisons et les bâtiments commerciaux où l’on trouve ces matériaux (Gewurtz et al., 2009; Guo et al., 2009). Les autres sources potentielles comprennent les textiles de maison, les rembourrages et les vêtements traités ainsi que les liquides et les mousses d’entretien des tapis et des tissus (Guo et al., 2009). Nilsson et al. (2010) ont décelé la présence d’APFC en C9 à C11 dans le sang de techniciens de fartage de skis (les concentrations variaient de 0,1 à 535 ng/L). Nilsson et al. (2010) ont mentionné que des composés organiques fluorés sont ajoutés aux farts de glisse pour empêcher l’adhésion de la neige, de la glace et de la poussière. Les farts fluorés sont appliqués par chauffage à environ 130-220 °C, températures auxquelles des particules en suspension dans l’air et des émanations contenant un mélange de composés organochlorés gazeux sont émises. Cependant, les auteurs n’ont pas analysé les farts de glisse eux-mêmes pour déterminer la présence de composés perfluorés. Plusieurs études dans le cadre desquelles l’air intérieur des domiciles a été échantillonné ont mis en évidence le rejet de précurseurs d’APFC à partir de produits ménagers. On a analysé les FTOH (6:2, 8:2 et 10:2) et les APFC (C9 à C12) dans des échantillons archivés de poussière prélevés entre 2000 et 2001 dans des domiciles en Ohio et en Caroline du Nord, aux États-Unis (Strynar et Lindstrom, 2005). Les concentrations moyennes se situaient entre 0,5 et 0,804 μg/g de poussière dans le cas des APFC en C9 à C12. Les concentrations moyennes de FTOH 6:2, 8:2 et 10:2 variaient de 0,4 à 1,0 μg/g de poussière. Les valeurs moyennes mesurées aux deux endroits n’étaient pas significativement différentes, ce qui laisse supposer l’existence de sources similaires comme les tapis ou les textiles traités. Shoeib et al. (2005) ont signalé la présence de FTOH 6:2, 8:2 et 10:2 dans la poussière domestique prélevée dans les aspirateurs de domiciles choisis au hasard à Ottawa, les concentrations moyennes étant respectivement de 0,035, 0,055 et 0,035 μg/g de poussière. En raison de difficultés techniques, on n’a pas recueilli d’échantillons d’air en vue de l’analyse des FTOH. Des FTOH ont également été détectés dans les vêtements de protection contre les intempéries (Berger et Herzke, 2006) ainsi que sous forme d’émissions provenant de poêles à frire antiadhésives (Sinclair et al., 2007).
Des APFC comme tels (et, dans certains cas, des ACFT et des ACFTI) pourraient également être libérés en petites quantités par des produits de consommation, entre autres les vêtements de protection contre les intempéries, les batteries de cuisine, les agents de protection des tissus dans le commerce, ainsi que les matières entrant en contact avec les aliments (Begley et al., 2005; Boulanger et al., 2005b; Mawn et al., 2005; Washburn et al., 2005; Bradley et al., 2007; Sinclair et al., 2007).
Devenir dans l’environnement
On s’attend à ce que les APFC à longue chaîne et leurs sels se répartissent principalement dans les milieux aqueux en raison de leur hydrosolubilité élevée et de leur faible volatilité (tableau 2). D’après les valeurs du log Kco observées par Higgins et Luthy (2006) (tableau 2), les APFC en C9 à C11 devraient se retrouver en partie dans les sédiments et le sol.
La présence d’un groupement fonctionnel acide confère une nature et des caractéristiques distinctes aux APFC à longue chaîne. Le groupement fonctionnel acide est hydrophile et complètement dissocié en phase aqueuse aux pH ambiants (Ellis et al., 2004a). Les substances possédant un groupement perfluoroalkyle sont susceptibles d’avoir des propriétés tensioactives car certaines parties de la molécule sont oléophobes, hydrophobes ou hydrophiles. Alors que les chaînes d’hydrocarbures non substituées sont oléophiles et hydrophobes (Key et al., 1997), la présence d’un groupement fonctionnel sur la chaîne perfluorée (p. ex., un groupement chargé comme l’anion carboxylate) peut rendre une partie de la molécule hydrophile. Cependant, à mesure que la longueur de cette chaîne s’accroît, l’hydrophobicité de la molécule d’APFC va probablement augmenter et sa solubilité dans l’eau diminuer (Ellis et al., 2004a). Les pressions de vapeur calculées pour les APFC en C9 à C12 (Kaiser et al., 2005) laissent penser que ces substances sont volatiles; toutefois, une volatilisation importante dans les conditions environnementales normales est peu probable, car ces substances sont ionisées aux pH qu’on retrouve dans l’environnement.
Persistance et potentiel de bioaccumulation
Persistance
Bien que peu de données empiriques sur la dégradation des APFC à longue chaîne soient disponibles, la liaison carbone-fluor est l’une des plus fortes qui existent dans la nature (~110 kcal/mol), ce qui la rend extrêmement stable et généralement résistante à la dégradation. Le fluor est l’élément le plus électronégatif du tableau périodique, ce qui procure un fort potentiel d’ionisation et une faible polarisabilité, des interactions intermoléculaires et intramoléculaires faibles, ainsi qu’une tension superficielle extrêmement faible. La photolyse directe de la chaîne fluorocarbonée devrait également être très lente : la stabilité à ce degré d’énergie devrait être conservée pendant plus de 1 000 ans (Environnement Canada et Santé Canada, 2006).
Hori et al. (2005a) ont signalé la décomposition de l’APFC en C9 lorsque la concentration de cet acide était de 1,51 mg/L. Hori et al. (2005b) ont également étudié la dégradation des APFC en C9, C10 et en C11 en présence de l’ion persulfate (S2O8-2) dans un système biphasique eau/CO2 liquide. L’APFC en C9 a également été dégradé en ions fluorure et en dioxyde de carbone lorsqu’il était placé dans une solution contenant du S2O8-2 chauffée à 80 °C pendant 6 heures (Hori et al., 2008). Cependant, les conditions mises en place dans ces études n’existent pas dans l’environnement.
Hurley et al. (2004) ont montré que le temps de séjour avant dégradation des APFC à chaîne courte (C3 à C5) en phase gazeuse dans l’atmosphère, en conditions de smog artificiel, était de l’ordre de 130 jours (ce qui équivaut à une demi-vie d’environ 90 jours) en raison des réactions avec les radicaux OH; le temps de séjour avant le dépôt sec ou humide (par l’intermédiaire des particules) est quant à lui de l’ordre de 10 jours (ce qui équivaut à une demi-vie d’environ 7 jours). On n’a observé aucune photolyse directe des acides en phase gazeuse. En outre, Hurley et al. (2004) ont affirmé qu’il est peu probable que ces valeurs changent de manière significative avec l’allongement de la chaîne de l’acide. On ne croit pas que le mécanisme de dégradation commençant par la réaction CnF2n+1COOH + OH ® H2O + CnF2n+1COO (suivie par CnF2n+1COO ® CnF2n+1 + CO2, etc.) soit particulièrement efficace puisque le temps de séjour associé à ce processus (130 jours) est considérablement supérieur au temps de séjour estimé dans le cas du retrait des APFC de l’atmosphère par dépôt sec ou humide (~10 jours). Autrement dit, même si des APFC sont formés dans l’atmosphère à partir de FTOH, ils n’y demeureront pas suffisamment longtemps pour y être fortement dégradés.
La présence d’APFC à longue chaîne dans l’Arctique canadien (Martin et al., 2004a) est révélatrice du transport à grande distance, soit d’APFCà longue chaîne (p. ex., par les courants atmosphériques ou océaniques) (Wania, 2007; Prevedouros et al., 2006), soit de précurseurs volatils d’APFC à longue chaîne comme des FTOH (p. ex., par le transport atmosphérique), soit des deux (Wallington et al., 2006; Stock et al., 2007). Wania (2007) a utilisé des simulations avec le modèle global Globo-POP d’estimation du devenir et du transport à grande distance moyens par zone, en combinaison avec les estimations des émissions historiques de FTOH, pour évaluer l’efficacité et l’importance relatives des voies de transport à grande distance, tandis que Wallington et al. (2006) ont utilisé un modèle tridimensionnel de la composition chimique de l’atmosphère du globe (IMPACT) pour montrer que les FTOH se transforment en APFC en C9.
Une hypothèse avancée pour expliquer la présence d’APFC à longue chaîne dans le biote de régions éloignées est qu’un précurseur (p. ex., des FTOH) serait émis dans l’atmosphère, et que sa dégradation biotique et abiotique finirait par donner des APFC à longue chaîne. Ellis et al. (2004a) ont montré que le temps de séjour des FTOH à chaîne courte dans l’atmosphère, tel qu’il a été déterminé d’après leur réaction avec les radicaux hydroxy, est d’environ 20 jours. Shoeib et al. (2006) ont recueilli des échantillons d’air pendant une traversée de l’Atlantique Nord et de l’archipel canadien effectuée en juillet 2005 pour étudier les concentrations des FTOH. Les plus fortes concentrations étaient celles des FTOH 8:2 (5,8 à 26 pg/m3), suivies par celles des FTOH 10:2 (1,9 à 17 pg/m3), puis des FTOH 6:2 (valeur inférieure à la limite de détection jusqu’à 6,0 pg/3). Ellis et al. (2004a) ont laissé entendre que la nature des APFC, par exemple, leur forte tendance à s’ioniser, devrait les rendre particulièrement abondants dans la phase aqueuse; à l’inverse, on ne s’attend pas à ce qu’ils se retrouvent en grandes quantités dans l’atmosphère. Toutefois, les propriétés tensioactives des APFC ont été étudiées afin de déterminer leur incidence sur la possible formation d’aérosols perfluorés au-dessus du milieu marin (Waterland et al., 2005); elles pourraient d’ailleurs laisser supposer un mécanisme pour le transport à grande distance par les courants océaniques jusque dans les régions éloignées. Toutefois, les résultats des travaux de recherche actuels semblent indiquer que la présence d’APFC à longue chaîne en régions éloignées proviendrait de la dégradation de précurseurs fluoroalylés volatils comme les FTOH. Young et al. (2007) ont laissé entendre que la présence d’APFC en C9, C10 et C11 sur les calottes glaciaires de l’Extrême-Arctique canadien serait l’indication que l’oxydation de précurseurs volatils dans l’atmosphère constitue une source.
Au printemps 2005 et 2006, des APFC en C9 à C11 ont été mesurés sur les calottes glacières polaires de trois régions de l’Extrême-Arctique (calotte glaciaire de Melville, Territoires du Nord-Ouest; calotte glaciaire d’Agassiz, Nunavut; calotte glaciaire de Devon, Nunavut) [Young et al., 2007]. Les concentrations d’APFC en C9 se situaient entre 0,005 à 0,246 ng/L. Les concentrations d’APFCen C10 allaient de valeurs inférieures à la limite de détection à 0,022 ng/L et celles d’APFC en C11variaient de valeurs inférieures à la limite de détection à 0,027 ng/L. Entre 1996 et 2005, les concentrations d’APFCen C9 et C10 ont augmenté (Young et al., 2007). Les flux ont été calculés à l’aide de la concentration corrigée en fonction de la densité, multipliée par l’accumulation annuelle. Les flux calculés pour chaque calotte glaciaire ont été multipliés par la superficie de l’Arctique, afin de donner le flux d’APFC en C9, C10 et C11 vers la région au nord de 65 °N. Ces flux sont des estimations et pourraient ne pas être représentatifs des dépôts réels dans cette région, étant donné les variations importantes des taux de précipitation. En 2005, le flux des APFC en C9 se situait entre 73 et 860 kg/an; celui des APFC en C10entre 16 et 84 kg/an et celui des APFC en C11entre 26 et 62 kg/an (Young et al., 2007).
Webster et Ellis (2010) ont proposé en outre que les embruns pourraient constituer un mécanisme de production d’APFOdans la phase gazeuse à partir de PFO (sa base conjuguée) dans un plan d’eau ayant le potentiel de fournir de grandes quantités d’APFO et d’APFC en général dans l’atmosphère et, donc, de fortement contribuer aux concentrations mesurées dans les régions éloignées. Selon les auteurs, ce mécanisme est comparable aux émissions mondiales des cheminées rejetées dans l’atmosphère.
Il est également possible que la présence de composés perfluorés dans l’Arctique canadien puisse être due, en partie, à la présence de sources locales, en particulier d’anciennes bases militaires (Iqaluit, lac Sarcpa, île Resolution) ou aux stations du réseau d’alerte avancé [DEW] (côtes nord de l’Alaska jusqu’à Cape Dyer sur la côte de l’île de Baffin), qui ont pu utiliser des produits perfluorés (Stow et al., 2005; Poland et al., 2001). Ces sites sont considérés comme assainis, mais on ne sait pas si des composés perfluorés tels que les APFC à longue chaîne ont été décelés ou mesurés, les publications disponibles (Stow et al., 2005; Poland et al., 2001) n’ayant déterminé que les concentrations de biphényles polychlorés (BPC) et de métaux pendant le processus d’assainissement. Néanmoins, les concentrations d’APFO mesurées dans le biote ou l’environnement semblent être éloignées des sources locales possibles.
Par conséquent, d’après les données empiriques et les propriétés physiques et chimiques, les APFC à longue chaîne répondent aux critères de persistance dans l’eau, le sol, les sédiments et l’air (demi-vie dans le sol et dans l’eau = 182 jours et demi-vie dans les sédiments = 365 jours; demi-vie dans l’air = 2 jours ou preuve d’un transport atmosphérique vers des régions éloignées comme l’Arctique) énoncés dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Bioaccumulation
Les APFC sont des molécules qui possèdent des portions oléophobes, des portions hydrophobes et des portions hydrophiles, et ils combinent donc toutes ces propriétés. Par exemple, le groupement carboxylate lié à la chaîne perfluorée rend la molécule polaire. Compte tenu de ces propriétés, l’hypothèse selon laquelle les interactions hydrophobes et lipophiles entre le composé et le substrat constituent les principaux mécanismes régissant la répartition ne s’applique pas dans le cas des APFC à longue chaîne. Houde et al. (2006b) indiquent qu’aucune mesure de Koe n’a été recensée pour quelque APFC à longue chaîne que ce soit, et qu’il est peu probable que cette propriété physique soit utile pour estimer le potentiel de bioaccumulation, car ces substances peuvent demeurer à l’interphase entre les phases organique et aqueuse au lieu de se séparer entre ces deux phases. Toutefois, Webster et Ellis (2011) mentionnent que les APFC, en général, ne sont pas tensioactifs et que le Koe est une variable explicative de la répartition des lipides et des protéines dans le biote. Par conséquent, les auteurs affirment que les modèles de répartition à l’équilibre pour la répartition des molécules neutres hydrophobes des APFC, y compris l’APFO, sont applicables.
Des critères réglementaires (facteurs de bioconcentration [FBC] et facteurs de bioaccumulation [FBA]) définissant si une substance donnée doit ou non être considérée comme bioaccumulable ont été établis en application de la LCPE (1999) [Canada, 1999]. Cependant, ces critères sont fondés sur des connaissances accumulées au fil du temps sur des substances organiques neutres non métabolisées. Ces critères, fixés d’après les critères de persistance et de bioaccumulation définis dans la Politique de gestion des substances toxiques (PGST) fédérale, ont été élaborés au milieu des années 1990 et officiellement publiés en 1995 (Canada, 1995), et ils visent à identifier les substances lipophiles susceptibles de se bioaccumuler essentiellement dans les systèmes aquatiques d’eau douce. Les substances qui répondent aux critères définis (soit FBA ou FBC = 5 000 ou log Koe= 5) sont fortement susceptibles de se bioaccumuler dans un organisme donné et de se bioamplifier à l’intérieur du réseau trophique. Il faut toutefois préciser que les FBA, les FBC et le log Koe ne sont qu’une partie des éléments formant le poids de la preuve qui détermine le potentiel global d’une substance à s’accumuler dans les organismes. En outre, une substance peut être jugée suffisamment bioaccumulable pour susciter des préoccupations même si les critères réglementaires ne sont pas atteints.
Étant donné le nombre d’études expérimentales disponibles, dans le cadre de la présente évaluation, l’accent a été placé sur les résultats des études expérimentales sur la bioaccumulation et la bioamplification.
Parmi les mesures de la bioaccumulation qui décrivent de manière directe le potentiel des substances chimiques à se bioamplifier figurent les facteurs de bioamplification (FBM) et les facteurs d’amplification trophique (FAT; parfois appelés facteurs de bioamplification dans le réseau trophique). Le FBMcorrespond au rapport de la concentration d’une substance chimique dans un prédateur sur sa concentration dans la nourriture ou la proie de ce dernier. Un FBM supérieur à 1 donne à penser qu’il y a bioamplification. Le FBM mesuré pour un aliment donné en laboratoire est parfois appelé « FBA alimentaire ». L’une des incertitudes importantes associées aux mesures du FBM est liée à la difficulté à établir l’état trophique réel d’un prédateur et de sa proie, étant donné que la plupart des organismes sont omnivores (Gray, 2002). On peut voir le FATcomme le rapport moyen de la concentration d’une substance dans les prédateurs et de sa concentration dans les proies dans l’ensemble ou une partie d’un réseau trophique. Comme dans le cas du FBM, un FAT supérieur à 1 indique l’existence d’un phénomène de bioamplification dans le réseau trophique. Les FBM et les FAT sont mesurés le plus souvent sur le terrain, bien que des études en laboratoire sur l’alimentation puissent également être utilisées pour estimer les FBM (ou « FBA alimentaires »). En général, pour les produits chimiques organiques neutres, les concentrations de produits chimiques sont normalisées pour une matrice lipidique avant la détermination des FBM et des FAT; cependant, une telle normalisation pourrait ne pas convenir dans le cas des substances perfluorées puisqu’elles semblent se lier de préférence avec les protéines dans le foie, les reins et le plasma plutôt qu’avec les lipides (Houde et al., 2006b; Martin et al., 2003a). Il n’existe pas de méthode de normalisation pour les substances s’associant aux protéines ou au plasma, ce qui introduit une source d’incertitude dans l’évaluation des FBM et des FAT des APFC.
Certains ont avancé l’idée qu’une autre des hypothèses associées à la méthode fondée sur les FBC, les FBA et les Koe, à savoir que la bioaccumulation est gouvernée par les mêmes mécanismes pour tous les produits chimiques tant chez les animaux à respiration aquatique (p. ex., les poissons et les invertébrés aquatiques) que chez les animaux à respiration aérienne (p. ex., les mammifères terrestres, les oiseaux et les mammifères marins), ce qui donnerait un potentiel de bioaccumulation similaire, pour une substance donnée, chez ces deux catégories d’organismes (Kelly et al., 2004; Mackay et Fraser, 2000). Comme l’ont décrit Kelly et al. (2004), les substances organiques peuvent être regroupés en fonction de leur polarité (comme l’indique le log Koe qui diminue à mesure que la polarité s’accroît, en raison de changements de solubilité dans l’eau), et de leur volatilité (comme l’indique le log Koa [coefficient de partage octanol-air] qui diminue à mesure que la volatilité augmente). De manière générale, les substances non polaires et non volatiles (NPNV) comme les BPC ont des taux de passage dans l’air et dans l’eau faibles, ce qui donne un potentiel de bioaccumulation aussi élevé chez les organismes à respiration aquatique que chez les organismes à respiration aérienne. La solubilité dans l’eau des substances polaires non volatiles (PNV) sera plus élevée que celle des substances NPNV en raison de la polarité et, dans le cas des APFC, de leur potentiel d’ionisation. Pour les organismes à respiration aquatique, cela pourrait entraîner une accélération de l’expulsion des substances PNV dans la phase aqueuse et une diminution du potentiel de bioaccumulation. Cependant, comme le potentiel de bioaccumulation chez les organismes à respiration aérienne est déterminé principalement par la volatilité, et non par la polarité, le caractère non volatil des substances PNV comme les APFC rend leur élimination dans l’air relativement lente, et induit un potentiel de bioaccumulation plus élevé chez ces organismes (Stevenson, 2006).
Même si l’hypothèse générale veut que les propriétés chimiques et le comportement de partage soient les principaux processus qui régissent l’absorption et l’élimination, dans bien des cas, la transformation métabolique d’une substance chimique permet son élimination rapide et abaisse son potentiel de bioaccumulation (Kelly et al., 2004). Cependant, aucune étude n’a été faite sur la transformation métabolique et l’élimination des APFC ou de leurs précurseurs chez les organismes à respiration aérienne.
L’évaluation de la bioaccumulation des APFC à longue chaîne est également compliquée par le fait que les FBC, les FBA, les FBM et les FAT sont souvent établis d’après les concentrations dans des organes distincts, et non d’après la charge dans l’organisme entier. Du point de vue toxicologique, les FBC, FBA, FBM et FAT relatifs à des organes individuels, comme le foie, peuvent être davantage pertinents lorsqu’il s’agit de prévoir le potentiel d’effets toxiques directs sur un organe en particulier (p. ex., toxicité pour le foie). Conder et al. (2008) sont d’avis que, comme la bioaccumulation est habituellement exprimée en fonction de la masse du corps entier, les concentrations d’acides perfluorés dans des tissus comme le foie ne permettent pas d’évaluer le potentiel de bioaccumulation de ces substances. Comme les tissus hépatiques et le sang ne représentent qu’une faible proportion de la masse corporelle, et vu l’ampleur des différences de concentrations entre ces compartiments et les autres tissus, il a été estimé que la concentration d’acides perfluorés exprimée en fonction de la masse du corps entier était 10 fois plus faible que les concentrations d’acides perfluorés dans le plasma chez les dauphins, le narval et le béluga, et 2 à 10 fois plus faible que les concentrations d’acides perfluorés dans le sang et le foie de la truite (Conder et al., 2008).
Toutefois, les mesures de la bioaccumulation (FBC, FBA, FBM) peuvent servir d’indicateurs de la toxicité directe pour les organismes dans lesquels des APFC à longue chaîne se sont accumulés, ou de la toxicité indirecte pour les organismes qui se nourrissent de proies contaminées par ces APFC (toxicité par transfert le long de la chaîne alimentaire). En ce qui concerne le potentiel de toxicité directe, la charge corporelle critique est la concentration minimale d’une substance dans un organisme qui provoque un effet nocif. D’un point de vue physiologique, c’est la concentration d’une substance au site de l’action toxique dans l’organisme qui détermine si une réponse est observée, peu importe la concentration extérieure. Dans le cas des APFC à longue chaîne, on considère souvent que le site d’action est le foie. Quant au potentiel de toxicité pour les organismes prédateurs, il est déterminé d’après la concentration dans le corps entier de la proie puisque celle-ci est habituellement consommée dans sa totalité par le prédateur, y compris les tissus, fluides et organes individuels comme le foie et le sang. Étant donné la répartition des substances perfluorées dans le foie et dans le sang, la plupart des mesures de terrain concernant ces substances ont été effectuées sur ceux-ci en particulier, surtout dans le cas des organismes occupant les niveaux trophiques supérieurs (p. ex., l’ours blanc), pour lesquels l’analyse du corps entier n’est pas possible en raison de contraintes liées à l’échantillonnage ou au traitement en laboratoire. Bien qu’il soit possible de mesurer les FBA dans le corps entier pour les espèces de plus petite taille des niveaux trophiques inférieurs, les FBA estimés globalement pour les substances perfluorées pourraient être sous-estimés en raison de ce statut trophique inférieur. Par conséquent, d’un point de vue toxicologique, les FBC, FBA et FBM établis d’après les concentrations dans des organes individuels, comme le foie, pourraient être plus pertinents pour prévoir le potentiel d’effets toxiques directs sur un organe en particulier (p. ex., la toxicité pour le foie). Les FBC et, en particulier, les FBMfondés sur les concentrations dans les organismes entiers pourraient constituer une mesure utile du potentiel général de transfert dans la chaîne alimentaire. Conder et al.(2008) ont laissé entendre que les valeurs de FBM traduisent adéquatement le potentiel de bioaccumulation dans le biote des niveaux trophiques supérieurs, l’extrapolation des données sur les FBC et les FBA pour les poissons et les invertébrés étant difficile en raison des différences d’ordre biologique entre les niveaux trophiques supérieurs et inférieurs.
Études sur la bioaccumulation, la bioconcentration et la bioamplification
La bioaccumulation d’APFC en C9 à C12 à partir de sédiments enrichis en laboratoire et de sédiments provenant de sites contaminés a été évaluée à l’aide de l’oligochète d’eau douce Lumbriculus variegatus, organisme limivore pouvant être un point d’entrée des contaminants liés aux sédiments dans les réseaux trophiques (Higgins et al., 2007). Des essais à renouvellement périodique ont été menés sur 56 jours. Il est à noter que les concentrations sédimentaires dans les systèmes enrichis en laboratoire ont connu une légère baisse au fil du temps, tandis que les concentrations sédimentaires de presque tous les APFC à longue chaîne sont demeurées à peu près constantes dans les sédiments de sites contaminés. Les facteurs d’accumulation biote-sédiments (FABS) calculés (en poids humide) étaient de : 0,64 à 1,60 (APFC en C9), 0,59 à 1,02 (APFC en C10), 0,42 à 0,62 (APFC en C11) et 0,42 à 0,55 (APFC en C12). Les auteurs ont émis l’hypothèse que les APFC à longue chaîne n’auraient peut-être pas atteint les conditions d’équilibre.
Martin et al. (2003a, 2003b) ont mené leurs études sur des truites arc-en-ciel juvéniles (Oncorhynchus mykiss) qu’ils ont exposées à des APFC en C9 à C14 par voie alimentaire et en milieu aqueux en écoulement continu. Chez la truite arc-en-ciel, les FBCaugmentaient avec la longueur de la chaîne perfluoroalkylée, les valeurs variant de 450 L/kg (APFC en C10) à 23 000 L/kg (APFC en C14) pour le corps entier (Martin et al., 2003b). Aucune donnée expérimentale n’était disponible pour l’APFCen C9 puisque cette substance a été utilisée comme étalon interne dans le cadre de ces études. Dans l’étude sur l’exposition de truites arc-en-ciel juvéniles par voie alimentaire, Martin et al. (2003a, 2003b) présentent également des résultats de « FBA alimentaire ». Cependant, après examen de l’équation de l’accumulation et étant donné que l’exposition se faisait par voie alimentaire plutôt que par l’eau, on peut conclure que les mesures étaient en réalité des FBM. Les FBM mesurés en laboratoire pour la truite arc-en-ciel montraient une tendance à la hausse tendant vers 1 pour les APFC en C14. Les auteurs ont avancé que si l’on n’observait pas de bioamplification (c.-à-d. que les FBM n’étaient pas supérieurs à 1), c’était probablement en raison de la petite taille des poissons étudiés : l’expulsion des produits chimiques dans l’eau serait ainsi plus rapide, relativement à la taille de l’organisme, que dans le cas des espèces ou des classes de taille plus grandes, ce qui réduirait les FBM.
Martin et al. (2004b) ont également mené une étude de terrain sur la bioamplification des APFC en C9 à C14 dans le réseau trophique pélagique du lac Ontario, et ils ont déterminé les FBM du touladi (Salvelinus namaycush) pour diverses proies (gaspareau – Alosa pseudoharengus; éperlan – Osmerus mordax; chabot visqueux – Cottus cognatus), ainsi que les FAT globaux pour le réseau trophique pélagique. Les FBM pour la relation touladi/gaspareau dépassaient 1 pour tous les APFC à longue chaîne mesurés dans le cadre de l’étude (APFC en C9 à C14); les FBM pour la relation touladi/éperlan se situaient entre 0,6 (APFC en C9) et 2,2 (APFC en C14); enfin, les FBM pour la relation touladi/chabot allaient de 0,1 (APFC en C9) à 0,4 (APFC en C13). Les auteurs indiquent que 90 % des proies des touladis sont des gaspareaux, ce qui laisse supposer que les résultats concernant le rapport touladi/gaspareau donnent les meilleures estimations des FBM. Comme les autres espèces-proies représentaient une proportion beaucoup plus faible de l’alimentation du touladi (7 % d’éperlans et 2 % de chabots), les FBM du touladi pour ces proies sont probablement moins fiables. Les auteurs ont notamment souligné que la faible proportion de chabots dans le régime alimentaire du touladi et le fait que le chabot appartienne au réseau trophique benthique plutôt que pélagique pourraient expliquer les faibles FBM observés pour la relation touladi/chabot. Pour tenir compte des différences dans la composition du régime alimentaire, les auteurs ont également calculé les FBM des relations touladi/proie en pondérant la concentration dans chaque espèce-proie selon la proportion de chacune d’entre elles dans le régime alimentaire. Les FBM obtenus étaient supérieurs à 1 pour tous les APFC en C9 à C14, ce qui indique une bioamplification à partir des proies chez le touladi du lac Ontario.
Les facteurs d’amplification trophique (FAT) mesurés dans le réseau trophique pélagique du lac Ontario par Martin et al. (2004b) semblent indiquer une amplification trophique de certains APFC à longue chaîne dans l’ensemble de ce réseau. Les concentrations d’APFC en C10, en C11 et en C13augmentaient de manière significative au sein du réseau trophique pélagique, phénomène traduit par des FAT supérieurs à 1 pour les APFC en C10, C11 et C13. L’amplification trophique la plus importante a été enregistrée pour les APFC en C11(4,7) et elle décroissait pour les APFC à chaîne plus courte ainsi qu’à chaîne plus longue. Les FAT de 1 établis pour les APFC en C9, en C12 et en C14 indiquent soit l’absence de bioamplification, soit la trop grande variabilité des résultats pour permettre de déceler une tendance statistiquement significative quant aux concentrations en fonction de la position trophique au sein de ce réseau.
Gulkowska et al. (2005) ont analysé des échantillons de sang d’oiseaux et de poissons ainsi que des échantillons d’eau provenant du golfe de Gdansk, afin d’y détecter l’éventuelle présence d’APFC en C9. Soixante-cinq échantillons de sang ont été prélevés au cours de l’hiver 2002-2003 chez des sujets appartenant à cinq espèces de sauvagine : le petit pingouin (Alca torda), le plongeon catmarin (Gavia stellata), la macreuse noire (Melanitta nigra), l’harelde kakawi (Clangula hyemalis) et l’eider à duvet (Somateria mollissima), et 18 échantillons de sang ont été prélevés chez la morue (Gadus morhua). La concentration moyenne d’APFC en C9 dans les échantillons sanguins d’oiseaux allait de 0,3 ng/mL, chez le petit pingouin, à 1,1 ng/mL, chez le plongeon catmarin. La concentration moyenne d’APFC en C9dans les échantillons de sang de morue était de 1,2 ng/mL. Les auteurs ont calculé un « FBC » sang:eau d’environ 3 000 pour les APFC en C9chez la morue; cependant, comme il s’agit d’une mesure de terrain, et que les sujets étaient donc exposés par l’eau et par leur alimentation, le FBC obtenu devrait plutôt être considéré comme un FBA. Les FBM des relations oiseau/morue se situaient entre 0,25 et 0,92, mais les auteurs ont rappelé que toutes les espèces d’oiseaux échantillonnées étaient migratoires, et qu’on ne sait pas exactement quelle part de leur régime alimentaire la morue représente. Il n’est pas non plus certain que les FBM fondés sur les concentrations sanguines sont comparables aux FBM dans le corps entier.
Haukås et al. (2007) ont déterminé les FBM des APFC en C9 pour un réseau trophique du front des glaces de la mer de Barents (est de Svalbard), lequel est composé d’amphipodes associés à la glace (Gammarus wilkitzkii), de morues polaires (Boreogadus saida), de guillemots à miroir (Cepphus grylle) et de goélands bourgmestres (Larus hyperboreus). Les FBM n’ont pas été calculés pour les amphipodes, car les APFC en C9n’y étaient pas quantifiables. Toutefois, un FBM de 8,76 a été calculé pour le rapport guillemot à miroir/morue polaire. Le FBM du rapport goéland bourgmestre/morue polaire s’élevait quant à lui à 11,6, et le FBM du rapport goéland bourgmestre/guillemot à miroir était de 9,34.
Jeon et al. (2010a) ont étudié les effets de la salinité sur la bioaccumulation des composés perfluorés, notamment les APFC en C10 et en C11, chez l’huître creuse du Pacifique (Crassostrea gigas). Avec l’augmentation de la salinité (de 10 à 34 unités de salinité pratiques [USP]), on a pu observer une variation du FBC de l’APFC en C10 de 23,9 à 94,4, tandis que le FBA a augmenté de 75,5 à 212,8. Avec l’augmentation de la salinité (10 à 34 USP), le FBC de l’APFCen C11 variait entre 633,9 et 1 652,7, tandis que le FBA a augmenté de 954,6 à 2 555,2. Les auteurs laissent entendre que l’accumulation accrue est due principalement à une augmentation de l’absorption alimentaire provoquée par une possible modification de la physiologie des huîtres avec les changements de salinité, ce qui peut augmenter les risques pour les organismes benthiques et les mollusques bivalves filtreurs.
Jeon et al. (2010b) ont déterminé les FBC des composés perfluroés chez le sébaste noir (Sebastes schlegeli) à divers taux de salinité (10, 17,5, 25 et 34 USP). La bioconcentration des composés perfluorés était supérieure à 34 USP qu’à d’autres taux de salinité. Les FBC dans le sérum pour l’APFCen C10 variaient de 4 321 à 5 239 et les FBC dans le foie variaient de 667 à 811. Les FBC dans le sérum pour l’APFC en C11 variaient de 13 553 à 16 370 et les FBC dans le foie variaient de 1 070 à 1 345. Les auteurs laissent entendre que l’effet du relargage sur l’activité chimique des composés perfluorés peut être important à des taux de salinité élevés. La fugacité accrue dans l’eau salée peut forcer les molécules à passer à d’autres phases, comme la paroi branchiale (site principal de transport actif), ce qui pourrait expliquer l’augmentation des FBC avec des taux de salinité croissants.
Kwadijk et al. (2010) ont déterminé les FBA entre l’eau, les sédiments et l’anguille (Anguilla anguilla) provenant de 21 sites aux Pays-Bas. Le FBA calculé pour l’APFC en C9était de 2,52.
Tomy et al. (2009c) ont calculé les FBM ajustés pour le niveau trophique des APFC en C9 à C11 pour un réseau trophique marin dans l’ouest de l’Arctique canadien (île Hendrickson et île Holman) composé des espèces suivantes : béluga de la mer de Beaufort (Delphinapterus leucas), phoque annelé (Phoca hispida), morue polaire (Boreogadus saida), hareng du Pacifique (Clupea pallasi), cisco arctique (Coregonus autumnalis), un amphipode pélagique (Themisto libellula) et un copépode arctique (Calanus hyperboreus). Les FBM ajustés pour le niveau trophique variaient entre 0,1 (APFC en C10, morue polaire/Themisto libellula) et 353 (APFC en C11, béluga/hareng du Pacifique).
Houde et al. (2006a) ont effectué des études de terrain sur le réseau trophique du dauphin à gros nez à Charleston (Caroline du Sud) et dans la baie de Sarasota (Floride). Les APFC en C9 à C12 ont été mesurés dans l’eau de mer, les sédiments marins, le zooplancton (baie de Sarasota seulement; espèces non précisées) et diverses espèces de poissons ou mammifères marins : tambour brésilien (Micropogonias undulatus), sar salème (Lagodon rhomboides), tambour ocellé (Sciaenops ocellatus), tambour croca (Leiostomus xanthurus), acoupa pintade (Cynoscion nebulosus), mulet cabot (Mugil cephalus) et dauphin à gros nez (Tursiops truncatus). Il est à noter que, dans cette étude, les échantillons n’ont pas tous été prélevés la même année, et que les espèces de proies et de prédateurs peuvent avoir été échantillonnées pendant des saisons ou des années différentes, ce qui peut avoir une incidence sur les FBM et FAT obtenus. Les poissons ont été capturés entre 2002 et 2004, tandis que les échantillons de zooplancton ont été récoltés en 2004. Du plasma, de la peau et des dents de dauphin ont été prélevés aux deux sites à l’été 2004. Des dauphins à gros nez de 2002 et 2003 morts depuis peu ont également été utilisés. Les échantillons provenant de dauphins comprenaient du plasma prélevé dans le cadre d’une étude de capture avec remise à l’eau ainsi que de nombreux échantillons de corps entier de dauphins morts ou échoués depuis peu, ce qui a facilité l’étude de l’amplification trophique tant dans le plasma que dans le corps entier des dauphins. Les FBM ont été exprimés en termes de concentrations dans le corps entier seulement. À Charleston, les FBM dans les poissons marins (acoupa pintade/sar salème) se situaient entre 0,1 (APFC en C12) et 3,7 (APFC en C10); aucune tendance évidente n’a été dégagée en fonction de la longueur de la chaîne des APFC. Les FBM dans les dauphins ont été présentés pour les échantillons de corps entier et une vaste gamme d’espèces-proies de poissons. Les FBM des APFC en C9, en C10 et en C11 étaient supérieurs à 1 pour toutes les relations dauphin/proie. En ce qui concerne les APFC en C12, les FBM dauphin/proie allaient de 0,1 à 1,8. Pour les sujets de la baie de Sarasota, les FBM ont été présentés seulement pour les APFC en C12, et ils se situaient entre 0,2 et 156 pour les relations poisson/proie (diverses espèces); dans le cas dauphin/mulet cabot, le FBM des APFC en C12 était de 0,1. Les FAT dans le réseau trophique du dauphin ont été seulement fournis pour le site de Charleston. Les FAT des APFC en C9 à C11 étaient tous supérieurs à 1, tant d’après les échantillons de corps entier que d’après les échantillons de plasma, alors que les FAT des APFC en C12 ne dépassaient pas 1 pour les deux sortes d’échantillon. Comme les FBM dans le dauphin dépassaient 1 pour les APFC en C9 à C11, il semblerait que ces APFC sont bioamplifiés des poissons aux dauphins dans ce réseau trophique. En ce qui concerne les APFC en C12, vu la variabilité des FBM, il est difficile de tirer des conclusions au sujet de la bioamplification sans connaître les préférences des dauphins à gros nez en matière d’alimentation. Les indications d’une bioamplification de poisson à poisson sont équivoques; cependant, on peut s’attendre à ce que la bioamplification soit moins importante chez les poissons que chez les dauphins puisque les APFC seraient éliminés plus rapidement dans l’eau que dans l’air. Les FAT intègrent les données concernant l’ensemble du réseau trophique. Même si on prévoit une bioamplification moindre chez les poissons, les FAT des APFC en C9 à C11 étaient supérieurs à 1 dans le réseau trophique du dauphin, ce qui indique qu’une amplification trophique se produit.
Martine van den Heuvel-Greve et al. (2009) ont déterminé les FBM des APFC en C11dans le réseau trophique du phoque commun (Phoca vitulina) dans le Westerschelde, un estuaire du sud-ouest des Pays-Bas. Les FBM variaient de 1,9 (hareng/zooplancton) à 53 (phoque commun/hareng), et le FATétait de 1,3.
Katz et al. (2009) ont montré que les APFC en C9 à C12 s’accumulaient dans la chaîne alimentaire terrestre composée de végétation (plantes et lichens), du caribou de la toundra (Rangifer tarandus groenlandicus) et du loup (Canis lupus), dans le nord du Yukon, au Canada. Le lichen reflète l’apport atmosphérique direct d’APFC à longue chaîne puisqu’il n’a pas de racines et reçoit ses éléments nutritifs de l’atmosphère. Le lichen constitue une grande partie du régime alimentaire du caribou. Le caribou est la principale proie du loup qui se trouve au sommet de la chaîne alimentaire de l’écosystème. Les APFC en C9prédominaient dans le foie du loup (6,8 ng/g poids humide) suivis par les APFC en C10(3,1 ng/g poids humide) et les APFC en C11(3,4 ng/g poids humide). Des APFC en C12 et C13 ont également été mesurés à des concentrations moyennes inférieures à 0,6 ng/g poids humide. Cependant, les résultats des analyses des isotopes stables du carbone et de l’azote dans la végétation et dans les muscles du caribou et du loup ont montré que le caribou se nourrissait principalement de lichen et que le loup se nourrissait principalement de caribou.
Powley et al. (2008) ont déterminé les facteurs de bioaccumulation des APFC en C10 à C12dans un réseau trophique de l’ouest de l’Arctique du Canada (île Banks à la limite est de la mer de Beaufort, dans les Territoires du Nord-Ouest) composé de trois différentes espèces de zooplancton (Calanus hyperboreus, Themisto libellula et Chaetognatha), la morue polaire (Boreogadus saida), le phoque annelé (Phoca hispida) et le phoque barbu (Eriganthus barbatus). L’APFCen C11 présentait la plus forte concentration et s’élevait à 10,8 ng/g. Les facteurs de bioaccumulation se situaient entre 0,3 et 3,1.
De nombreuses études (Martin et al., 2004a; Kannan et al., 2005; Smithwick et al., 2005a) ont également révélé la présence de concentrations d’APFCen C9 (108 à 230 ng/kg poids humide), en C10(35 à 76 ng/kg poids humide), en C11 (56 à 78 ng/kg poids humide), en C12 (4,7 à 8,2 ng/kg poids humide), en C13 (7,5 à 14 ng/kg poids humide) et en C14 (< 0,5 à 1,1 ng/kg poids humide) dans le foie d’ours blancs des régions arctiques et subarctiques du Canada. Butt et al. (2008) ont calculé les FBM hépatiques des APFC en C9 à C15 de la relation phoque annelé/ours blanc à l’échelle régionale, et ce, en regroupant 11 populations de phoques annelés avec les populations d’ours blancs correspondantes situées aux mêmes endroits. Les moyennes géométriques des FBM allaient de 2,2 (APFC en C13) à 56 (APFC en C9).
Aucune étude n’a été menée sur la bioaccumulation des APFC dont la chaîne compte plus de 14 atomes de carbone. Cependant, il est possible que les APFC à chaîne plus longue que les APFC en C14s’accumulent ou se bioamplifient chez les mammifères marins ou terrestres. L’hypothèse selon laquelle la conformation de la liaison carbone-carbone changerait avec l’allongement de la chaîne a été avancée : les chaînes plus longues deviendraient hélicoïdales (Wang et Ober, 1999), ce qui donnerait des molécules à section transversale plus petite ayant une plus grande capacité de s’accumuler dans les organismes. Des APFC en C14 et en C15 ont été détectés chez des poissons, des invertébrés, des dauphins et des ours blancs (voir par exemple Martin et al., 2004b; Smithwick et al., 2005a, 2005b, 2006; Houde et al., 2005).
Tableau 3. Sommaire des données sur la bioaccumulation des APFCà longue chaîne
(Les éléments en italique et en gras indiquent des valeurs de FBC ou de FBA qui dépassent les critères de persistance et de bioaccumulation, et les cases ombragées indiquent que le FBM ou le FAT est supérieur à 1.)
| Espèce, prédateur/proie, réseau trophique (tissu indiqué entre parenthèses) | Type d’étude | Lieu | Critère d’effet | Résultat | Référence |
|---|---|---|---|---|---|
| APFC en C9 | |||||
| Lumbriculus variegatus | Laboratoire/ terrain |
Californie, en aval d’une UTEU | FABS en poids humide | 0,64-1,60 | Higgins et al., 2007 |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 39 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM[1] | 0,089 | Martin et al., 2003a |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 5,3 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 0,6 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,1 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 2,3 | Martin et al., 2004b |
| Acoupa pintade/sar salème (entière) | Terrain | Charleston, Caroline du Sud | FBM | 1,5 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Charleston, Caroline du Sud | FBM | 5 | Houde et al., 2006a |
| Dauphin/sar salème (entier) | Terrain | Charleston, Caroline du Sud | FBM | 3,2 | Houde et al., 2006a |
| Dauphin/tambour ocellé (entier) | Terrain | Charleston, Caroline du Sud | FBM | 1,4 | Houde et al., 2006a |
| Dauphin/tambour brésilien (entier) | Terrain | Charleston, Caroline du Sud | FBM | 24 | Houde et al., 2006a |
| Dauphin/tambour croca (entier) | Terrain | Charleston, Caroline du Sud | FBM | 4,6 | Houde et al., 2006a |
| Dauphin/acoupa pintade (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,1 | Houde et al., 2006a |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 1[2] | Martin et al., 2004b |
| Réseau trophique du dauphin à gros nez (plasma)[4] | Terrain | Charleston, Caroline du Sud | FAT | 4,7 | Houde et al., 2006a |
| Réseau trophique du dauphin à gros nez (corps entier)[4] | Terrain | Charleston, Caroline du Sud | FAT | 2,4 | Houde et al., 2006a |
| Morue (sang) | Terrain | Golfe de Gdansk, Pologne | FBA[5] | 3 000 | Gulkowska et al., 2005 |
| Macreuse noire/morue (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,83 | Gulkowska et al., 2005 |
| Eider à duvet (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,33 | Gulkowska et al., 2005 |
| Plongeon catmarin (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,92 | Gulkowska et al., 2005 |
| Petit pingouin (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,25 | Gulkowska et al., 2005 |
| Harelde kakawi (sang) | Terrain | Golfe de Gdansk, Pologne | FBM | 0,50 | Gulkowska et al., 2005 |
| Guillemot à miroir/morue polaire | Terrain | Front des glaces de la mer de Barents | FBM | 8,76 | Haukås et al., 2007 |
| Goéland bourgmestre/morue polaire | Terrain | Front des glaces de la mer de Barents | FBM | 11,6 | Haukås et al., 2007 |
| Goéland bourgmestre/morue polaire | Terrain | Front des glaces de la mer de Barents | FBM | 9,34 | Haukås et al., 2007 |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 56 | Butt et al., 2008 |
| Phoque annelé/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 1,2 | Tomy et al., 2009c |
| Béluga/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 12,9 | Tomy et al., 2009c |
| Béluga/hareng du Pacifique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 5,8 | Tomy et al., 2009c |
| Béluga/cisco arctique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 2,9 | Tomy et al., 2009c |
| Morue (foie)/Calanus hyperboreus (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,7 | Tomy et al., 2009c |
| Morue (foie)/Themisto libellula (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,3 | Tomy et al., 2009c |
| Eau/sédiments/anguille | Terrain | Pays-Bas | FBA | 2,52 | Kwadijk et al., 2010 |
| APFC en C10 | |||||
| Lumbriculus variegatus | Laboratoire/ terrain |
Californie, en aval d’une UTEU | FABS en poids humide | 0,59-1,02 | Higgins et al., 2007 |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 450 L/kg |
Martin et al., 2003b |
| Truite arc-en-ciel juvénile (sang) | Laboratoire | n.d. | FBC | 2 700 L/kg |
Martin et al., 2003b |
| Truite arc-en-ciel juvénile (foie) | Laboratoire | n.d. | FBC | 1 100 L/kg |
Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM1 | 0,23 | Martin et al., 2003a |
| Touladi/concentration dans l’eau de chaque Grand Lac (entier) | Terrain | Tous les Grands Lacs | FBA | 3,9 | Furdui et al., 2007 |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 4,4 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 1 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,2 | Martin et al., 2004b |
| Zooplancton/morue polaire | Terrain | Ouest de l’Arctique canadien | FBA | 0,5 | Powley et al., 2008 |
| Morue polaire/phoque (sang) | Terrain | Ouest de l’Arctique canadien | FBA | 1,4 | Powley et al., 2008 |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 2,7 | Martin et al., 2004b |
| Acoupa pintade/sar salème (entière) | Terrain | Charleston, Caroline du Sud | FBM | 3,7 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,9 | Houde et al., 2006a |
| Dauphin/sar salème (entier) | Terrain | Charleston, Caroline du Sud | FBM | 8,8 | Houde et al., 2006a |
| Dauphin/tambour ocellé (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,4 | Houde et al., 2006a |
| Dauphin/tambour brésilien (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,5 | Houde et al., 2006a |
| Dauphin/tambour croca (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,8 | Houde et al., 2006a |
| Dauphin/acoupa pintade (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,4 | Houde et al., 2006a |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 3,7 | Martin et al., 2004b |
| Réseau trophique du dauphin à gros nez (plasma)[4] | Terrain | Charleston, Caroline du Sud | FAT | 3,4 | Houde et al., 2006a |
| Réseau trophique du dauphin à gros nez (corps entier)[4] | Terrain | Charleston, Caroline du Sud | FAT | 22 | Houde et al., 2006a |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 2,3 | Butt et al., 2008 |
| Phoque annelé/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 2,5 | Tomy et al., 2009b |
| Béluga/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 55 | Tomy et al., 2009b |
| Béluga/hareng du Pacifique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 87 | Tomy et al., 2009b |
| Béluga/cisco arctique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 44 | Tomy et al., 2009b |
| Morue (foie)/Calanus hyperboreus (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,4 | Tomy et al., 2009b |
| Morue (foie)/Themisto libellula (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,1 | Tomy et al., 2009b |
| Eau de mer/huître creuse du Pacifique | Laboratoire | Ferme ostréicole, Corée | FBC | 23,9-94,4 | Jeon et al., 2010a |
| Chlorella ellipsoidea/huître creuse du Pacifique | Laboratoire | Ferme ostréicole, Corée | FBA | 75,5-212,8 | Jeon et al., 2010a |
| Eau de mer/sébaste noir (foie) | Laboratoire | Corée | FBC | 708-811 | Jeon et al., 2010b |
| Eau de mer/sébaste noir (sérum) | Laboratoire | Corée | FBC | 4 321-5 239 | Jeon et al., 2010b |
| APFC en C11 | |||||
| Lumbriculus variegatus | Laboratoire/ terrain |
Californie, en aval d’une UTEU | FABS en poids humide | 0,42-0,62 | Higgins et al., 2007 |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 2 700 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (sang) | Laboratoire | n.d. | FBC | 11 000 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (foie) | Laboratoire | n.d. | FBC | 4 900 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM[1] | 0,28 | Martin et al., 2003a |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 6,4 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 1,2 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,2 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 3,4 | Martin et al., 2004b |
| Morue polaire/phoque (sang) | Terrain | Ouest de l’Arctique canadien | FBA | 3,1 | Powley et al., 2008 |
| Acoupa pintade/sar salème (entière) | Terrain | Charleston, Caroline du Sud | FBM | 0,9 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Charleston, Caroline du Sud | FBM | 1,9 | Houde et al., 2006a |
| Dauphin/sar salème (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,4 | Houde et al., 2006a |
| Dauphin/tambour ocellé (entier) | Terrain | Charleston, Caroline du Sud | FBM | 3,2 | Houde et al., 2006a |
| Dauphin/tambour brésilien (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,1 | Houde et al., 2006a |
| Dauphin/tambour croca (entier) | Terrain | Charleston, Caroline du Sud | FBM | 3,9 | Houde et al., 2006a |
| Dauphin/acoupa pintade (entier) | Terrain | Charleston, Caroline du Sud | FBM | 2,5 | Houde et al., 2006a |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 4,7 | Martin et al., 2004b |
| Réseau trophique du dauphin à gros nez (plasma)[4] | Terrain | Charleston, Caroline du Sud | FAT | 3 | Houde et al., 2006a |
| Réseau trophique du dauphin à gros nez (corps entier)[4] | Terrain | Charleston, Caroline du Sud | FAT | 2,3 | Houde et al., 2006a |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 11 | Butt et al., 2008 |
| Hareng/zooplancton | Terrain | Westerschelde, Pays-Bas | FBM | 1,9 | van den Heuvel-Greve et al., 2009 |
| Bar commun/hareng | Terrain | Westerschelde, Pays-Bas | FBM | 3,2 | van den Heuvel-Greve et al., 2009 |
| Phoque commun/hareng | Terrain | Westerschelde, Pays-Bas | FBM | 53 | van den Heuvel-Greve et al., 2009 |
| Phoque commun/bar commun | Terrain | Westerschelde, Pays-Bas | FBM | 17 | van den Heuvel-Greve et al., 2009 |
| Flet/scrobiculaire | Terrain | Westerschelde, Pays-Bas | FBM | 10 | van den Heuvel-Greve et al., 2009 |
| Flet/arénicole | Terrain | Westerschelde, Pays-Bas | FBM | 25 | van den Heuvel-Greve et al., 2009 |
| Phoque commun/flet | Terrain | Westerschelde, Pays-Bas | FBM | 9 | van den Heuvel-Greve et al., 2009 |
| Phoque annelé/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 6,6 | Tomy et al., 2009b |
| Béluga/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 229 | Tomy et al., 2009b |
| Béluga/hareng du Pacifique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 353 | Tomy et al., 2009b |
| Béluga/cisco arctique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 181 | Tomy et al., 2009b |
| Morue (foie)/Calanus hyperboreus (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,3 | Tomy et al., 2009b |
| Morue (foie)/Themisto libellula (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,3 | Tomy et al., 2009b |
| Eau de mer/huître creuse du Pacifique | Laboratoire | Ferme ostréicole, Corée | FBC | 633,9-1 652,7 | Jeon et al., 2010a |
| Chlorella ellipsoidea/huître creuse du Pacifique | Laboratoire | Ferme ostréicole, Corée | FBA | 954,6-2 555,2 | Jeon et al., 2010a |
| Eau de mer/sébaste noir (foie) | Laboratoire | Corée | FBC | 1 070-1 345 | Jeon et al., 2010b |
| Eau de mer/sébaste noir (sérum) | Laboratoire | Corée | FBC | 13 553-16 370 | Jeon et al., 2010b |
| APFC en C12 | |||||
| Lumbriculus variegatus | Laboratoire/ terrain |
Californie, en aval d’une UTEU | FABS en poids humide | 0,42-0,55 | Higgins et al., 2007 |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 18 000L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (sang) | Laboratoire | n.d. | FBC | 40 000L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (foie) | Laboratoire | n.d. | FBC | 18 000L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM[1] | 0,43 | Martin et al., 2003a |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 1,9 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 1 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,3 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 1,6 | Martin et al., 2004b |
| Acoupa pintade/sar salème (entière) | Terrain | Charleston, Caroline du Sud | FBM | 0,1 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,2 | Houde et al., 2006a |
| Dauphin/sar salème (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,1 | Houde et al., 2006a |
| Dauphin/tambour ocellé (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,4 | Houde et al., 2006a |
| Dauphin/tambour brésilien (entier) | Terrain | Charleston, Caroline du Sud | FBM | 1,8 | Houde et al., 2006a |
| Dauphin/tambour croca (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,6 | Houde et al., 2006a |
| Dauphin/acoupa pintade (entier) | Terrain | Charleston, Caroline du Sud | FBM | 0,6 | Houde et al., 2006a |
| Mulet cabot/zooplancton (entier) | Terrain | Baie de Sarasota, Floride | FBM | 89 | Houde et al., 2006a |
| Goret mule/zooplancton (entier) | Terrain | Baie de Sarasota, Floride | FBM | 2,5 | Houde et al., 2006a |
| Spare tête-de-mouton/ zooplancton (entier) |
Terrain | Baie de Sarasota, Floride | FBM | 156 | Houde et al., 2006a |
| Sar salème/zooplancton (entière) | Terrain | Baie de Sarasota, Floride | FBM | 2,5 | Houde et al., 2006a |
| Acoupa pintade/zooplancton (entier) | Terrain | Baie de Sarasota, Floride | FBM | 35 | Houde et al., 2006a |
| Acoupa pintade/mulet cabot (entier) | Terrain | Baie de Sarasota, Floride | FBM | 0,4 | Houde et al., 2006a |
| Acoupa pintade/goret mule (entier) | Terrain | Baie de Sarasota, Floride | FBM | 14 | Houde et al., 2006a |
| Acoupa pintade/spare tête-de-mouton (entière) | Terrain | Baie de Sarasota, Floride | FBM | 0,2 | Houde et al., 2006a |
| Acoupa pintade/sar salème (entière) | Terrain | Baie de Sarasota, Floride | FBM | 14 | Houde et al., 2006a |
| Dauphin/mulet cabot (entier) | Terrain | Baie de Sarasota, Floride | FBM | 0,1 | Houde et al., 2006a |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 12 | Martin et al., 2004b |
| Réseau trophique du dauphin à gros nez (plasma)[4] | Terrain | Charleston, Caroline du Sud | FAT | 0,7 | Houde et al., 2006a |
| Réseau trophique du dauphin à gros nez (corps entier)[4] | Terrain | Charleston, Caroline du Sud | FAT | 0,6 | Houde et al., 2006a |
| Zooplancton/morue polaire | Terrain | Ouest de l’Arctique canadien | FBA | 0,3 | Powley et al., 2008 |
| Morue polaire/phoque (sang) | Terrain | Ouest de l’Arctique canadien | FBA | 0,8 | Powley et al., 2008 |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 2,8 | Butt et al., 2008 |
| Phoque annelé/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 0,1 | Tomy et al., 2009b |
| Béluga/morue polaire (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 3,2 | Tomy et al., 2009b |
| Béluga/hareng du Pacifique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 7,9 | Tomy et al., 2009b |
| Béluga/cisco arctique (foie) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 4,0 | Tomy et al., 2009b |
| Morue (foie)/Calanus hyperboreus (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 1,2 | Tomy et al., 2009b |
| Morue (foie)/Themisto libellula (corps entier) | Terrain | Ouest de l’Arctique canadien | FBM (ajusté au niveau trophique) | 1,3 | Tomy et al., 2009b |
| APFC en C13 | |||||
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | 3,1 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 1,2 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,4 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | 2,5 | Martin et al., 2004b |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 2,5 | Martin et al., 2004b |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 3,8 | Butt et al., 2008 |
| APFC en C14 | |||||
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBC | 23 000 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (sang) | Laboratoire | n.d. | FBC | 30 000 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (foie) | Laboratoire | n.d. | FBC | 30 000 L/kg | Martin et al., 2003b |
| Truite arc-en-ciel juvénile (carcasse) | Laboratoire | n.d. | FBM[1] | 1 | Martin et al., 2003a |
| Touladi/gaspareau (entier) | Terrain | Lac Ontario | FBM | > 2,6 | Martin et al., 2004b |
| Touladi/éperlan (entier) | Terrain | Lac Ontario | FBM | 2,2 | Martin et al., 2004b |
| Touladi/chabot (entier) | Terrain | Lac Ontario | FBM | 0,3 | Martin et al., 2004b |
| Touladi/proie (moyenne pondérée) | Terrain | Lac Ontario | FBM | > 2,3 | Martin et al., 2004b |
| Phoque annelé/ours blanc (foie) | Terrain | Arctique canadien | FBM | 5,5 | Butt et al., 2008 |
| Réseau trophique pélagique[3] | Terrain | Lac Ontario | FAT | 1[2] | Martin et al., 2004b |
[2] La pente de la droite de la concentration d’APFC en fonction de la concentration de d15N ne diffère pas significativement de 1.
[3] Parmi les organismes figuraient des mysidacés, des gaspareaux, des éperlans et des touladis.
[4] Parmi les organismes figuraient le mulet cabot, le sar salème, le tambour ocellé, le tambour brésilien, le tambour croca, l’acoupa pintade et le dauphin à gros nez.
[5] Les auteurs présentent cette valeur comme étant un FBC. Cependant, comme elle a été déterminée sur le terrain, là où la morue serait exposée par l’eau et par voie alimentaire, le FBC est analogue à un FBA.
Pour les APFC en C11 (2 700 < FBC < 11 000), C12 (18 000 < FBC < 40 000) et C14 (23 000 < FBC < 30 000), il existe des données empiriques indiquant que ces substances sont très bioaccumulables chez les poissons et qu’elles possèdent un potentiel de bioamplification chez les poissons et les mammifères marins. Bien qu’on ait trouvé des APFC en C14 et en C15 chez les poissons, les invertébrés et les ours blancs, il n’existe pas de données expérimentales ou estimées sur la bioaccumulation des APFC à longue chaîne comptant plus de 14 atomes de carbone. Il est possible néanmoins que les APFC à longue chaîne s’accumulent ou se bioamplifient chez les espèces marines ou terrestres selon leur conformation chimique (Wang et Ober, 1999).
D’après les données empiriques disponibles, les APFC à longue chaîne et leurs sels ne répondent pas aux critères de bioaccumulation (FBA ou FBC = 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000). Cependant, le poids de la preuve est suffisant pour affirmer que les APFC à longue chaîne et leurs sels peuvent s’accumuler et se bioamplifier chez les mammifères terrestres et marins.
Potentiel d’effets nocifs sur l’environnement
Évaluation de l’exposition environnementale
Atmosphère
Loewen et al. (2008) ont étudié les concentrations de FTOH dans l’atmosphère et dans l’eau de lac le long d’un transect altitudinal de l’Ouest canadien. Les échantillons d’eau ont été prélevés au lac Cedar (petit lac situé près de Golden, en Colombie-Britannique), au lac Bow dans le parc national Banff (Banff, Alberta) et à un autre petit lac sans nom situé aussi dans ce parc. Des échantillonneurs d’air passifs ont été installés en différents points d’un transect altitudinal (800 à 2 740 m au-dessus du niveau de la mer) allant de Golden, en Colombie-Britannique, jusqu’au parc national de Banff. Les auteurs ont noté que la quantité de FTOH 8:2 et 10:2 dans l’air (< 2,0 ng/échantillonneur) augmentait avec l’altitude, et que les concentrations d’APFC en C10dans l’eau de lac étaient inférieures à 0,2 ng/L.
Stock et al. (2007) ont prélevé des échantillons des phases particulaire et gazeuse de l’air sur l’île Cornwallis, au Nunavut, où les valeurs moyennes des concentrations totales de FTOH étaient comprises entre 2,8 (FTOH 10:2) et 14 pg/m3 (FTOH 8:2). On a mesuré des concentrations moyennes d’ACFTI8:2 et 10:2 se situant entre 0,06 et 0,07 pg/m3. Quant aux concentrations moyennes d’APFC en C9 et C10, elles s’élevaient à 0,4 pg/m3, alors que celles des APFC en C11, C13 et C14 se situaient entre 0,02 et 0,06 pg/m3. Shoeib et al. (2006) ont recueilli 20 échantillons d’air à grand débit pendant une traversée de l’Atlantique Nord et de l’archipel canadien en juillet 2005 (de Gothenburg, Suède, à Barrow, Alaska, en passant par l’Atlantique Nord et l’archipel canadien). Les concentrations les plus élevées (sommes des phases gazeuse et particulaire) de FTOH ont été mesurées pour le FTOH 8:2 (5,8 à 26 pg/m3), suivi par le FTOH 10:2 (1,9 à 17 pg/m3), puis le FTOH 6:2 (sous le seuil de détection à 6,0 pg/m3). À des fins de comparaison, Shoeib et al. (2006) ont également recueilli des échantillons d’air en milieu semi-urbain à Toronto en mars 2006 et la concentration moyenne de FTOH 8:2 y était de 41 pg/m3. Des études menées à Toronto ont révélé des concentrations de FTOH 4:2, 6:2, 8:2 et 10:2 allant de valeurs non détectables (ND) à 650 pg/m3 sur une période de 2 ans, les FTOH 8:2 étant prédominants pendant la première moitié de cette période, et les FTOH10:2, pendant la seconde (Stock et al., 2005). Dreyer et al. (2009) ont effectué un échantillonnage d’air à grand débit au-dessus de l’océan Atlantique, de l’océan Austral et de la mer Baltique. Des APFC en C9, C10, C11, C12 et C13ont été détectés dans la fraction particulaire (< 1 pg/m3). Le FTOH 6:2 et le FTOH 8:2 étaient les formes dominantes dans la fraction de la phase gazeuse. Les concentrations de FTOH 8:2 variaient entre 1,8 et 130 pg/m3. La somme de tous les FTOH (FTOH 4:2, FTOH 6:2, FTOH 8:2, FTOH 10:2 et FTOH 12:2) allait de 0,3 à 47 pg/m3.
Comme on l’a mentionné précédemment, les FTOH peuvent se décomposer pour donner des APFC à longue chaîne; par conséquent, les concentrations de FTOH dans l’atmosphère peuvent être une source d’accroissement des concentrations d’APFCà longue chaîne dans l’environnement, y compris dans l’Arctique canadien. La dégradation des FTOH dans l’atmosphère devrait produire des quantités relativement égales d’APFC dont la chaîne compte un nombre pair de carbones et d’APFC dont la chaîne compte un nombre impair de carbones (Ellis et al., 2004b), tandis que la biodégradation aérobie des FTOH tend à générer surtout des APFC dont la chaîne compte un nombre pair de carbones (Dinglasan et al., 2004).
Eau
Certains APFC à longue chaîne ont été mesurés dans les précipitations dans des régions isolées du Canada de 1998 à 1999 : île Saturna (Colombie-Britannique), Algoma (Ontario) et Kejimkujik (Nouvelle-Écosse) [Scott et al., 2006b]. Scott et al. (2006b) ont enregistré des concentrations d’APFCen C9 de < 0,1 à 7,6 ng/L, la plus forte ayant été mesurée à Algoma (Ontario), soit 7,6 ng/L. En milieu urbain (Egbert et North Toronto, en Ontario), les concentrations d’APFC en C9 se situaient entre 0,4 et 9,7 ng/L. Par ailleurs, des APFCen C9 à C12 n’ont été détectés que dans les zones urbaines, et ce, en concentrations de < 0,07 à 5,2 ng/L. Les auteurs ont également détecté des ACFT et des ACFTI 8:2 et 10:2 à deux sites urbains au Canada (Egbert et North Toronto), à des concentrations allant de < 0,07 à 8,6 ng/L. Loewen et al. (2005) ont aussi mesuré des ACFT et des ACFTI en C10 et en C12 dans des échantillons d’eau de pluie recueillis à Winnipeg (Manitoba).
Simcik et Dorweiler (2005) ont mesuré les concentrations de certains APFC à longue chaîne dans des régions isolées (Tettegouche et Nipisiquit) le long de la rive nord du lac Supérieur et dans le parc national des Voyageurs, à la frontière canado-américaine (lacs Loiten et Little Trout). Ces quatre lacs isolés ne sont accessibles qu’à pied (aucune route carrossable) et n’ont aucune arrivée d’eau en surface. Seul de l’APFC en C9 a été détecté en concentration supérieure à 1 ng/L (à Nipisiquit). Scott et al. (2003, 2006a) ont mesuré des APFC en C9 dans les Grands Lacs (lacs Ontario, Érié, Supérieur et Huron) à des concentrations allant de < 0,5 à 0,11 ng/L. En outre, Simcik et Dorweiler (2005) ont étudié trois lacs urbains interreliés à Minneapolis, au Minnesota (lac des Isles, lac Calhoun et lac Harriet), ainsi que la rivière Minnesota, un affluent important du fleuve Mississippi. De l’APFC en C9 a été décelé dans le lac Calhoun (< 1,0 ng/L) et dans la rivière Minnesota (< 10 ng/L). Le lac Calhoun renfermait également de l’APFC en C10(< 1,0 ng/L).
Stock et al. (2007) ont mesuré les concentrations d’AFPC en C9, C10, C11 et C12 dans des échantillons d’eau prélevés dans trois lacs éloignés de l’Arctique (lacs Resolute, Char et Amituk) sur l’île Cornwallis, au Nunavut, en 2003. Les concentrations moyennes d’APFC en C9 et C10 se situaient respectivement entre 0,3 et 4,1 ng/L et entre 1,1 et 19 ng/L. Les concentrations d’APFC en C11 se situaient quant à elles entre 0,3 et 4,9 ng/L, et celles d’APFC en C12 étaient comprises entre 0,2 et 0,8 ng/L. Les concentrations d’ACFTI 8:2 et d’ACFTI 10:2 ont été mesurées dans les trois lacs et variaient entre 1,1 et 6,4 ng/L.
Scott et al. (2009) ont prélevé des échantillons dans 38 rivières (en amont et en aval de zones peuplées) dans l’ensemble du Canada pour analyser les composés perfluorés au cours de la période de 2001 à 2008. L’APFC en C9était présent dans la majorité des échantillons (< 0,008 à 2,26 ng/L), mais les autres APFC à longue chaîne analysés (C10 à C14) n’étaient pas souvent détectés. Les concentrations d’APFC en C10, C11, C12 et C14 étaient comprises respectivement entre 0,005 et 1,12 ng/L, 0,004 et 0,61 ng/L, 0,001 et 0,06 ng/L et < 0,004 et 2,69 ng/L. L’APFC en C13n’a pas été détecté. La plupart des sites en aval des zones urbaines présentaient des concentrations plus élevées que les sites en amont. Des sites de référence, tels que l’eau de fonte glaciaire en Colombie-Britannique, présentaient des concentrations d’APFCà longue chaîne plus faibles ou non détectables.
Ahrens et al. (2009) ont analysé des échantillons d’eau de surface prélevés en 2007 dans l’océan Atlantique le long du gradient longitudinal entre Las Palmas (Espagne) et St. John’s (Canada) et le long du gradient latitudinal entre le golfe de Gascogne et l’océan Atlantique Sud. Aucun APFC à longue chaîne n’a été détecté dans la phase particulaire ni dans les deux échantillons d’eaux des grands fonds prélevés à 200 m et à 3 800 m. On a mesuré des concentrations d’APFC en C9 en phase dissoute de < 0,0051 à 0,107 ng/L; et, en général, les concentrations d’AFPC en C12 mesurées ne dépassaient pas 0,0014 ng/L. Del Vento et al. (2009) ont mesuré jusqu’à 0,13 ng/L d’APFC en C9dans l’eau de mer de la partie est de la mer de Beaufort, près de l’île Banks. Ahrens et al. (2010b) ont prélevé des échantillons d’eau de surface du 2 novembre au 30 décembre 2008 le long du gradient latitudinal allant de la mer du Nord (nord de l’Europe) à l’Antarctique. Des APFC en C9 à C12 ont été détectés dans les échantillons de la phase dissoute, mais pas dans la phase particulaire. Les concentrations d’APFC en C10allaient de < 0,005 5 à 0,037 ng/L. Les concentrations d’APFCen C9, C11 et C12 étaient situées sous la limite de quantification. Del Vento et al. (2009) ont également mesuré des concentrations d’APFC en C9 à C11 se situant entre 0,035 et 1,3 ng/L dans la neige du golfe Amundsen. En outre, on a détecté des concentrations d’APFC en C9 de l’ordre des ng/L dans de l’eau de mer en Asie; les valeurs étaient trois fois plus élevées dans les régions côtières qu’au large, et leur variabilité était plus grande (So et al., 2004; Yamashita et al., 2004, 2005).
Sédiments
Stock et al. (2007) ont mesuré les concentrations d’APFC en C9, C10, C11 et C12dans les échantillons de carotte de sédiments provenant de trois lacs isolés en Arctique (les lacs Resolute, Char et Amituk) sur l’île Cornwallis, au Nunavut, en 2003. Les concentrations d’AFPC diminuaient avec la profondeur et l’âge des sédiments. On a relevé des APFC en C9 à C12 dans le lac Amituk. Des concentrations d’APFCen C9 à C11 se situant entre 0,6 et 3,3 ng/g ont été mesurées dans le lac Char. Dans le lac Resolute, on a mesuré des concentrations d’APFC en C9allant jusqu’à 3,2 ng/g alors que les concentrations d’APFC en C10, C11 et C12 se trouvaient à la limite de détection de 0,5 ng/g. Des ACFTI 10:2 ont été mesurés dans les lacs Char et Amituk à des concentrations se situant entre 0,5 et 2 ng/g.
Biote
On a signalé des concentrations d’APFC à longue chaîne chez plusieurs animaux d’eau douce et animaux marins en Amérique du Nord et au Groenland, dont l’ours blanc (De Silva et Mabury, 2004; Kannan et al., 2005; Smithwick et al., 2005a, 2005b, 2006; Dietz et al., 2008), le phoque annelé (Bossi et al., 2005; Butt et al., 2008), le dauphin à gros nez (Houde et al., 2005), les animaux d’un réseau trophique du lac Ontario (Martin et al., 2004b), le touladi (Furdui et al., 2007, 2008), le fulmar boréal et le guillemot de Brünnich (Butt et al., 2007a).
Martin et al., (2004b) ont mesuré les concentrations d’APFC en C9 à C15 dans des échantillons d’homogénat entier de divers poissons du lac Ontario; celles-ci allaient de < 0,5 ng/g poids humide (limite de détection : 0,5 ng/g) à 39 μg/kg poids humide (chabot; APFC en C11). Après le déversement accidentel d’une mousse extinctrice aqueuse dans le ruisseau Etobicoke, en Ontario, Moody et al. (2002) ont constaté la présence d’APFC en C10, C11 et C13 dans le foie de ménés à nageoires rouges (Notropus cornutus). Il est à noter que les concentrations dans le biote n’étaient probablement pas toutes attribuables au déversement. Les concentrations allaient de 8,8 à 390 ng/g poids humide, la valeur la plus élevée étant associée à l’APFC en C10.
Martin et al. (2004a) ont établi la présence d’APFCen C9 à C15 dans le foie d’une gamme d’espèces comprenant phoques, renards, poissons, ours blancs et oiseaux, échantillonnées entre 1993 et 2002 dans l’Arctique canadien. Chez toutes les espèces, les concentrations dans le foie se situaient entre des quantités non détectables et 180 ng/g poids humide (limite de détection = 0,5 ng/g). Les valeurs les plus élevées ont été mesurées chez les ours blancs (Ursus maritimus; concentration maximale de 180 ng/g poids humide; APFC en C9), et elles décroissaient à mesure que la longueur de la chaîne augmentait. Stern (2009) a mesuré les concentrations d’APFC en C9 à C11 dans le foie de la lotte du fleuve Mackenzie à Fort Good Hope, dans les Territoires du Nord-Ouest. Trente-sept lottes ont été analysées; on a relevé des concentrations moyennes en poids humide se situant entre 0,89 et 7,97 ng/g pour les APFC en C9, entre 1,2 et 36,85 ng/g pour les APFC en C10 et entre 7,0 et 2,25 ng/g pour les APFC en C11. Butt et al. (2007a) ont noté que les APFC en C11 à C15 prédominaient chez les oiseaux marins de l’Arctique, même si l’APFC détecté chez la plupart des espèces sauvages (p. ex., le phoque annelé) était souvent un APFC en C8 à C11. Powley et al. (2008) ont détecté des APFC en C9 à C12 dans divers organismes de l’île Banks (à la limite est de la mer de Beaufort, dans les Territoires du Nord-Ouest). Les concentrations dans le zooplancton (Calanis hyperboreus, Themisto libellula, Chaetognatha) allaient de quantités non détectables à 1,1 ng/g poids humide. Chez la morue polaire (Boreogadus saida), les concentrations se situaient entre des quantités non détectables et 0,6 ng/g poids humide. Chez le phoque annelé (Phoca hispida), les concentrations dans la graisse variaient de quantités non détectables à 0,2 ng/g poids humide; dans le sang, elles étaient de 1 à 2,5 ng/g et, dans le foie, de 1 à 6,9 ng/g poids humide. Aucune concentration n’a été détectée dans la graisse, le sang ou le foie du phoque barbu (Eriganthus barbatus). Il convient de noter que l’effectif des échantillons était petit (1 à 5). En 2007, Tomy et al.(2009b) ont mesuré les concentrations d’APFC en C8 à C12 dans le foie de divers animaux occupant les niveaux trophiques supérieurs d’un réseau trophique marin de l’est de l’Arctique, dans la baie Cumberland, au Nunavut. Les concentrations hépatiques en poids humide se situaient entre 38,07 et 47,6 ng/g chez le béluga, entre 11,71 et 50,78 ng/g chez le narval, entre 2,93 et 12,78 ng/g chez le phoque du Groenland, entre 2,18 et 23,4 ng/g chez le phoque annelé et entre 17,76 et 110,79 ng/g chez le requin du Groenland. En général, les concentrations d’APFC en C11 prédominaient, sauf chez le requin du Groenland où l’APFC en C12prédominait.
Houde et al. (2006c) ont évalué les concentrations d’APFC en C9 à C12 et en C14 dans le plasma, le lait et l’urine de dauphins à gros nez vivant dans la baie de Sarasota (Floride, États-Unis) et aux alentours. Depuis 35 ans, la population de dauphins résidant à l’année dans la baie (approximativement 160 animaux) fait l’objet d’un projet de surveillance à long terme. Houde et al. (2006c) ont étudié les relations entre les concentrations d’APFC et des paramètres biologiques connus (âge, sexe, antécédents de reproduction et paramètres morphométriques). Le principal APFC détecté était l’APFC en C11. Les concentrations plasmatiques d’APFC en C9 se situaient entre 11,7 et 24,5 ng/g poids humide; dans le lait, la concentration s’établissait à 2,2 ng/g poids humide et, dans l’urine, elle était inférieure à la limite de détection. Les concentrations plasmatiques d’APFC en C10 se situaient entre 15,8 et 35,7 ng/g poids humide; dans le lait, la concentration était de 2,4 ng/g et, dans l’urine, elle était inférieure à la limite de détection. Les concentrations plasmatiques d’APFC en C11 se situaient entre 31,4 et 64,7 ng/g poids humide; dans le lait, la concentration se chiffrait à 3 ng/g poids humide et, dans l’urine, elle était de 0,06 ng/g. Les concentrations plasmatiques d’APFC en C12 se situaient entre 2,7 et 8,2 ng/g poids humide; dans le lait, la concentration se chiffrait à 2,9 ng/g et, dans l’urine, elle était inférieure à la limite de détection. Les concentrations plasmatiques d’APFC en C14 se situaient entre 1,1 et 3,4 ng/g poids humide; le lait et l’urine n’ont fait l’objet d’aucune analyse. On n’a trouvé aucune différence significative entre les dauphins vivant à l’extrémité nord de la baie de Sarasota et les individus fréquentant sa partie sud. La baie de Sarasota est un milieu semi-fermé bordé d’une zone urbaine fortement résidentielle, ce qui pourrait expliquer les concentrations relativement élevées mesurées chez les dauphins résidents. L’analyse des tendances temporelles a montré que les concentrations plasmatiques de composés perfluorés n’étaient pas significativement plus élevées chez les dauphins capturés à l’été 2003 et à l’hiver 2004 par rapport à celles enregistrées pour les autres saisons d’échantillonnage. Les résultats ont révélé des corrélations négatives significatives entre les concentrations d’APFC en C9 à C12 et l’âge des dauphins. Aucune relation significative n’a été établie en fonction du sexe. Les concentrations diminuaient avec l’âge chez les mâles comme chez les femelles.
Delinsky et al. (2010) ont détecté des APFC en C10 à C12 chez le crapet arlequin (Lepomis macrochirus), la marigane noire (Pomoxis nigromaculatus) et le crapet-soleil (Lepomis gibbosus) capturés dans le cours supérieur du fleuve Mississippi, au Minnesota, et dans des lacs situés dans 81 bassins versants majeurs du Minnesota en 2007. Dans ces bassins versants, les utilisations prédominantes des terres se répartissaient ainsi : terres forestières (86 %), terres aménagées (47 %) et terres arables/fourrage/pâturage (87 %). Les concentrations d’APFC en C10 à C12 dans les filets de poisson variaient entre 2,13 et 15,0 ng/g à cinq sites d’échantillonnage et n’étaient pas détectables aux 16 autres sites.
Dans le monde entier, un certain nombre d’études signalent les concentrations de certains APFC à longue chaîne dans le biote, notamment le marsouin (van der Vijver et al., 2004, 2007), les phoques communs (van der Vijver et al., 2005) et les goélands bourgmestres (Verreault et al., 2005). K.I. van de Vijver et al. (2007) ont prélevé des échantillons de foie chez le marsouin commun (Phocena phocena relicta) le long de la côte ukrainienne de la mer Noire. Les concentrations se situaient entre 1,4 et 19 ng/g poids humide, les APFC en C10ayant la plus forte concentration. K.I. van de Vijver et al. (2003) ont également montré la présence d’APFC en C9 à C11 dans le foie de plusieurs mammifères de la côte de la mer du Nord, notamment dans le foie d’un grand cachalot, d’un dauphin à flancs blancs et de dauphins à nez blanc. Les concentrations se situaient entre des quantités non détectables à 480 ng/g poids humide pour les quatre espèces (limite de détection : 30 à 90 ng/g). Les concentrations étaient plus élevées chez le dauphin à nez blanc (Lagenorhynchus albirostris). Leonel et al.(2008) ont mesuré les concentrations d’APFC en C9 à C12 chez le dauphin de la Plata (Pontoporia blainvillei) dans le sud du Brésil. Les concentrations dans le foie allaient de < 0,1 à 0,46 ng/g poids humide, les APFC en C11 ayant la plus forte concentration. Leonel et al. (2008) ont aussi mesuré les concentrations d’APFC en C9 à C12 chez l’otarie à fourrure subantarctique (Arctocephalus tropicalis), également capturée dans le sud du Brésil. Les concentrations dans le foie se situaient entre < 0,1 et 0,74 ng/g poids humide, les APFC en C11 ayant également la plus forte concentration. Les concentrations d’APFC en C9 à C12 ont été mesurées dans le foie de la sotalie de Chine (Sousa chinensis) et du marsouin aptère (Neophocaena phocaenoides) à Hong Kong (Yeung et al., 2009c). Les concentrations d’APFC en C9 à C12 chez la sotalie de Chine se situaient entre 0,243 et 120 ng/g poids humide; celles chez le marsouin aptère, entre 0,522 et 34,3 ng/g poids humide.
Tseng et al. (2006) ont trouvé des APFC en C10dans les huîtres (Crassostrea gigas), le tilapia (Oreochromis sp.) et le bar du Japon (Lateolabrax japonicus) à Taiwan. Les concentrations de cet acide dans les huîtres se situaient entre 140 et 320 ng/g poids humide. Les concentrations hépatiques et musculaires étaient respectivement de 390 et de 250 ng/g poids humide chez le tilapia. Quant à celles mesurées dans le bar du Japon, elles étaient de 480 ng/g poids humide.
Des concentrations d’APFC en C9 à C12 comprises entre 5,7 et 675 ng/g poids humide ont été mesurées dans les jaunes d’œufs de trois espèces d’oiseau – l’aigrette garzette (Egretta garzetta), le pluvier petit-gravelot (Charadrius dubius) et le paradoxornis de Webb (Paradoxornis webbiana) – qui ont été récoltés autour du lac Shihwa, en Corée (Yoo et al., 2008). La plus forte concentration a été relevée chez le pluvier petit-gravelot, soit une concentration d’APFCen C11 de 675 ng/g poids humide. On n’a pas décelé d’APFCen C9 dans le foie du fulmar boréal (Fulmarus glacialis) le long de la côte de Svalbard et de BjØrnØya dans la mer de Barents (Arctique norvégien) (Knudsen et al., 2007). Holmstrom et Berger (2008) ont toutefois tenté de mesurer les concentrations d’APFC en C9 à C16 chez le guillemot marmette (Uria aalge). Les concentrations d’APFC en C16étaient inférieures à la limite de détection. Quant aux concentrations d’APFC en C9 à C15, elles se situaient entre 0,17 et 32 ng/g poids humide. Wang et al. (2008) ont mesuré les concentrations d’APFCen C9 à C12 dans les œufs d’oiseaux aquatiques, dans le sud de la Chine. Les concentrations d’APFCen C9 à C12 mesurées dans les échantillons d’œufs de bihoreau gris (Nycticorax nycticorax) se situaient entre 0,072 et 41,3 ng/g poids humide, chez les grandes aigrettes (Ardea alba), les concentrations étaient comprises entre 0,225 et 5,79 ng/g poids humide et celles relevées chez les aigrettes garzettes variaient de 0,77 à 39,4 ng/g poids humide.
Des concentrations d’APFC en C9 à C12 ont également été mesurées dans le foie de castors capturés en Pologne; elles se situaient entre < 0,04 et 4,46 ng/g poids humide, la plus forte concentration ayant été enregistrée pour l’APFC en C9(Taniyasu et al., 2005). Des rats sauvages mâles (Rattus norvegicus) ont été capturés dans huit sites au Japon (une UTEU, un port, deux zones industrielles, un marché de fruits de mer, un marché, deux sites d’enfouissement et un port de fruits de mer) [Yeung et al., 2009b]. Des échantillons de sang entier ont été analysés pour y vérifier la présence d’APFC en C9 à C12; les concentrations moyennes mesurées se situaient entre 0,792 et 7,3 ng/mL. Li et al. (2008) ont mesuré les concentrations d’APFC en C9 à C10 dans le sérum du tigre de Sibérie (Panthera tigris altaica) vivant dans le nord-est de la Chine, dans l’extrême-est de la Russie et en Corée du Nord. L’APFC en C9, dont les concentrations allaient de 0,13 à 0,89 ng/mL, représentait l’un des composés perfluorés les plus prédominants dans le sérum des tigres de Sibérie. Les concentrations moyennes d’APFC en C10 se situaient entre 0,1 et 0,15 ng/mL. Des différences selon le sexe ont été trouvées en ce qui concerne l’accumulation des APFC en C9 et C10; en effet, les concentrations étaient un peu plus élevées chez les femelles que chez les mâles.
Tendances temporelles et spatiales
Une étude temporelle sur 22 ans (1980 à 2002) a été menée sur les matières en suspension dans la décharge de la rivière Niagara; en général, les concentrations d’APFC observées augmentaient au fil du temps (Lucaciu et al., 2004). Myers et al. (2009) ont étudié la distribution spatiale et les tendances temporelles des composés perfluorés dans les sédiments et les eaux de surface des Grands Lacs. D’après leurs résultats, la distribution spatiale des APFC (en C7 à C12) montre que les activités urbaines et industrielles ont eu une incidence sur les concentrations mesurées dans les sédiments et les eaux des Grands Lacs. Dans les eaux de surface du lac Ontario, les échantillons prélevés dans les affluents contenaient des concentrations d’APFC en C7 à C12 plus élevées que les échantillons prélevés à proximité des rives et au milieu du lac; toutefois, en ce qui concerne les sédiments, les plus fortes concentrations ont été enregistrées dans les échantillons prélevés au milieu du lac. Myers et al. (2009) ont également remarqué que les concentrations d’APFC en C7 à C12 dans les sédiments du lac Ontario sont en augmentation. Ils ont cependant constaté une hausse et une stabilisation des concentrations dans les sédiments du lac Supérieur, ce qui peut refléter le transport atmosphérique des APFC en C7 à C12.
Furdui et al. (2007) ont déterminé les tendances spatiales des APFC à longue chaîne chez les touladis (Salvelinus namaycush, classe d’âge de 4 ans) capturés dans les Grands Lacs en 2001. On a relevé des concentrations d’APFC en C9 à C15 se situant entre 0,37 et 4,9 ng/g poids humide. Les plus fortes concentrations ont été observées dans le lac Érié, puis dans le lac Huron, le lac Ontario, le lac Michigan et le lac Supérieur. Aucune corrélation significative n’a été trouvée entre les concentrations et le poids des poissons. Les tendances temporelles des APFC à longue chaîne ont été déterminées chez les touladis échantillonnés entre 1979 et 2004 dans le lac Ontario (Furdui et al., 2008). Les concentrations d’APFC étaient généralement faibles (ND à 3 ng/g), les concentrations les plus élevées ayant été enregistrées pour les APFC en C11, C12 et C13. La plupart des concentrations d’APFCmesurées en 1988 ou en 1993 (< 3 ng/g) étaient en général plus fortes qu’en 1979 (< 1 ng/g), après quoi on constatait une stabilisation ou une baisse des concentrations. Des analyses de régression pour les divers APFC individuels n’ont pas donné de résultats assez significatifs pour conclure à un déclin au cours des dernières années, après les sommets de 1988 ou 1993.
Une étude des tendances temporelles des concentrations dans le foie du fulmar boréal (Fulmarus glacialis) et du guillemot de Brünnich (Uria lomvia) dans l’Arctique canadien a révélé des hausses globales des APFC au fil du temps chez les deux espèces (Butt et al., 2007a). Les moyennes géométriques des concentrations des ?APFC mesurées chez les guillemots de Brünnich et les fulmars boréaux s’élevaient respectivement à 23,9 ng/g et à 12,4 ng/g. L’APFC en C13était le composé dominant, suivi par les APFC en C11 et en C14. Les concentrations d’APFC chez les guillemots de Brünnich ont augmenté entre 1975 et 2004, le temps de doublement allant de 2,3 ans pour les APFC en C15 à 9,9 ans pour les APFC en C12. En ce qui concerne les fulmars boréaux, le temps de doublement allait de 2,5 ans pour les APFC en C15 à 11,7 ans pour les APFC en C12. Cependant, dans le cas des fulmars boréaux, la plupart des APFC ont atteint des concentrations maximales en 1993 ou des concentrations statistiquement similaires en 1987, 1993 et 2003. Ces résultats peuvent découler des différents trajets migratoires des espèces d’oiseaux (Butt et al., 2007a). Gebbink et al.(2009a) ont déterminé la distribution spatiale, les tendances et les sources des APFC en C9 à C15 dans 16 colonies d’espèces de goéland échantillonnées de l’est (Nouvelle-Écosse, Nouveau-Brunswick, Terre-Neuve) à l’ouest du Canada (Alberta, Colombie-Britannique), en passant par le centre (Québec, Ontario, Manitoba). Les quatre espèces étudiées sont le goéland à ailes grises (Larus glaucescens), le goéland de Californie (Larus californicus), le goéland à bec cerclé (Larus delawarensis) et le goéland argenté (Larus argentatus). Les auteurs ont remarqué que les ?APFC étaient plus élevés dans les œufs de goéland argenté récoltés dans les colonies du sud de l’Ontario et de l’ouest du Québec situées à proximité des sources urbaines. Les APFC en C11 et C13 étaient en général prédominants dans la plupart des colonies, bien que des différences aient été observées entre les colonies. Dans l’ensemble, on juge que la distribution spatiale des APFC dans les œufs de goéland au Canada est essentiellement influencée par l’emplacement et la proximité de sources locales et non par l’alimentation. Gebbink et al. (2009b) ont récolté des œufs de goéland argenté dans 15 colonies situées sur des sites canadiens et quelques sites américains des Grands Lacs. On a relevé des APFC en C9 à C15 parmi lesquels les APFC en C11 et C13 prédominaient. Les APFC en C9étaient plus abondants dans les colonies du lac Supérieur et du lac Michigan et les APFC en C11étaient plus abondants dans les colonies du lac Érié et du lac Ontario. Les plus fortes concentrations d’?APFC (113 ng/g poids humide) ont été mesurées dans les colonies du lac Huron, puis dans les colonies du lac Érié et du lac Ontario. Aucun FTOH 8:2 et 10:2 n’a été détecté dans les œufs de goéland argenté.
Verreault et al. (2007) ont montré des tendances temporelles pour les œufs entiers de goélands argentés dans deux colonies géographiquement isolées (HornØya et RØst) dans le nord de la Norvège. Ces colonies faisaient partie de l’aire de répartition sud et nord des goélands argentés se reproduisant au nord de la Norvège. L’APFC à longue chaîne dominant dans les œufs de goéland argenté était l’APFCen C11 (4,2 ng/g poids humide, HornØya), suivi par l’APFC en C13 (2,8 ng/g poids humide, RØst). Les APFC en C9 à C13 mesurés dans les deux colonies ont significativement augmenté entre 1983 et 1993 et ont continué d’augmenter (APFC en C9, C10 et C11) ou se sont stabilisés (APFC en C12 et C13) après 1993. Les tendances spatiales entre les deux colonies étaient semblables, sauf pour l’APFC en C9 qui était plus élevé dans la colonie de RØst. Les œufs de la colonie de RØst récoltés en 1993 affichaient également des proportions plus élevées d’APFC en C14 et C15comparativement à ceux de la colonie de HornØya et à d’autres années d’échantillonnage. Verreault et al. (2007) laissent entendre que les sources locales ou éloignées directes et indirectes d’APFC à longue chaîne ont probablement changé dans le nord de la Norvège au cours des deux dernières décennies. Sinon, il a pu se produire des changements liés aux préférences alimentaires des goélands argentés adultes du nord de la Norvège; ces goélands ont une aire d’alimentation annuelle limitée et sont principalement piscivores même s’ils peuvent également se nourrir de crustacés, d’oisillons marins, d’œufs et d’autres sources d’alimentation terrestres (déchets produits par les humains). Löfstrand et al. (2008) ont déterminé les tendances spatiales relatives aux œufs de guillemot (Uria aalge) récoltés en Islande, en Suède, dans les îles Féroé et en Norvège (Sklinna et HjelmsØya). L’APFC en C9n’a été détecté qu’en Suède, sa concentration s’élevant à 48 ng/g poids humide. On a relevé des APFC en C10uniquement en Islande et en Norvège, et leurs concentrations se situaient entre 38 et 42 ng/g poids humide. L’APFC en C11semble prédominer avec des concentrations se situant entre 9 et 140 ng/g poids humide, suivis par les APFC en C12dont les concentrations variaient de ND à 81 ng/g poids humide. Les concentrations d’?APFC étaient les plus fortes en Suède (150 ng/g poids humide), puis en Islande (96 ng/g poids humide) et dans les îles Féroé (76 ng/g poids humide). Löfstrand et al. (2008) laissent entendre que les profils spatiaux diffèrent probablement en raison des différences d’habitudes alimentaires des guillemots dans tout l’Atlantique et en raison du fait que les œufs provenant de la Suède ont été échantillonnés à des sites plus proches de zones industrielles et de zones fortement peuplées.
Des tendances temporelles à la hausse des concentrations d’APFC en C9 à C15 dans les œufs de faucon pèlerin (Falco peregrinus) ont été observées de 1974 à 2007 (Holmström et al., 2010). Des œufs de faucon pèlerin ont été récoltés dans le sud-ouest de la Suède. Toutefois, en raison du faible succès de reproduction au cours des 20 premières années, seuls quelques œufs ont été prélevés, et aucun œuf n’a été récolté entre 1987 et 1991. Par conséquent, tous les œufs recueillis jusqu’en 1999 ont été analysés individuellement. Les œufs ont été regroupés à partir de l’année 2000. Des APFC en C13ont été décelés dès 1974 et étaient les AFPC les plus dominants, suivis par les AFPC en C11. Les tendances temporelles ont augmenté de manière exponentielle au fil des ans, malgré un taux d’augmentation variant entre 5,6 % (APFC en C13) et 9 % (APFC en C14) par an. Les APFC en C11 à C15 affichent une tendance à la stabilisation au cours des dernières années.
Les concentrations d’APFC mesurées dans le foie de phoques annelés de l’est et de l’ouest du Groenland entre 1980 et 2000 ont connu une hausse de 3,3 et de 6,8 % par année dans le cas de l’APFC en C10 et de l’APFC en C11, respectivement (Bossi et al., 2005). Butt et al.(2007b) ont examiné les tendances temporelles dans des échantillons de foie prélevés au sein de deux populations de phoques annelés de l’Arctique canadien, soit l’une à Arviat (1992, 1998 et 2005) et l’autre à la baie Resolute (1972, 1993, 2000 et 2005). Les concentrations d’APFC en C9 à C15 ont augmenté de 1992 à 1998, mais les points d’échantillonnage ultérieurs (1998, 2003 et 2005) n’étaient pas différents du point de vue statistique. Les concentrations ont augmenté de 117 % pour les APFC en C14 et de 310 % pour les APFC en C9 entre 1992 et 2005. Ni dans une population ni dans l’autre, on n’a noté de différence significative entre les sexes pour les APFCanalysés. Dans l’ensemble, les concentrations d’APFCont augmenté entre 1993 et 2005; toutefois, les hausses notées ces dernières années n’étaient pas significatives sur le plan statistique. Le temps de doublement se situait entre 10,0 (APFC en C9) et 19,4 ans (APFC en C12). Butt et al. (2008) ont détecté des APFC à longue chaîne dans les échantillons de foie provenant de 11 populations de phoques annelés échantillonnées dans l’Arctique canadien de 2002 à 2005. Les concentrations d’APFC en C9 à C11 se situaient entre 1 et 10 ng/g poids humide, tandis que celles des APFC en C12 à C15 étaient inférieures à 1 ng/g poids humide. En outre, des ACFTI 8:2 et 10:2 ont été analysés chez toutes les populations. Cependant, les concentrations étaient inférieures à la limite de détection (non précisée). Des concentrations quantifiables ont été mesurées chez deux populations de phoques annelés, soit 4 à 6 ng/g poids humide. Certaines tendances spatiales statistiquement significatives ont été observées entre les diverses populations; toutefois, on a conclu que les variations étaient en grande partie attribuables au fait que les concentrations étaient élevées dans deux populations, et plus faibles dans une autre (Butt et al., 2008).
Les tendances temporelles ont été étudiées chez le phoque du Baïkal (Pusa sibirica) du lac Baïkal, dans l’est de la Sibérie, en Russie (Ishibashi et al. 2008b). Les APFC en C9 à C12 ont été mesurés dans le foie et le sérum de ce phoque. Le phoque du Baïkal est une espèce endémique et un prédateur de niveau trophique élevé dans le réseau trophique du lac Baïkal. Dans le foie des phoques mâles et femelles, les concentrations d’APFC en C9 à C12 variaient de < 0,56 à 72 ng/g poids humide. Dans le sérum de mâles et de femelles de cette espèce, les concentrations d’APFC en C9 à C12 se situaient entre < 0,33 et 4 ng/g poids humide (Ishibashi et al., 2008b). Les concentrations moyennes d’APFCen C9 et C10 dans le foie des phoques en 2005 étaient 1,2 et 1,7 fois supérieures à celles mesurées chez les phoques en 1992. Les concentrations d’APFC en C10étaient significativement plus grandes en 2005 qu’en 1992. En ce qui concerne les APFC en C9, bien que la tendance ait été à la hausse entre 1992 à 2005, aucune différence statistiquement significative n’a été observée.
Les études sur l’Arctique nord-américain menées par De Silva et Mabury (2004) ainsi que Smithwick et al. (2005a) ont révélé des concentrations hépatiques d’APFC à longue chaîne en général plus élevées chez les ours blancs de l’est (Groenland), certains éléments indiquant que les concentrations d’APFCen C9 et en C10 étaient quant à elles plus fortes dans l’ouest. L’examen de la circulation troposphérique indique que les régions du centre-est recevraient plus d’air de l’est de l’Amérique du Nord, et que celles de l’est (Groenland) recevraient de l’air de l’Amérique du Nord et de l’Europe (De Silva et Mabury, 2004). Il est possible que de plus fortes émissions d’APFC en C9 et en C10 en Asie explique le fait que les concentrations de ces congénères soient plus élevées chez les ours blancs de l’ouest de l’Arctique (Smithwick et al., 2005a). Une tendance d’ouest en est similaire a été constatée dans le cas des concentrations d’APFC dans des échantillons de foie de phoques annelés, bien que les concentrations les plus fortes aient été observées dans le sud de la baie d’Hudson (Butt et al., 2008). Sur la période de 1984 à 2006, Dietz et al. (2008) ont examiné un sous-échantillon de 128 ours blancs subadultes (âgés de 3 à 5 ans) d’Ittiqqortoormiit (Scoresby Sound) dans le centre du Groenland. Une analyse de régression linéaire des concentrations médianes soumises à une transformation logarithmique a révélé des augmentations annuelles pour les APFC en C9(6,1 %), les APFC en C10(4,3 %), les APFC en C11(5,9 %), les APFC en C12(52 %) et les APFC en C13(8,5 %). Entre 1972 et 2002, le temps de doublement moyen des concentrations dans le foie des ours blancs des régions de l’Arctique nord-américain se situait entre 5,8 ans dans l’est et 9,1 ans dans l’ouest pour les APFC en C9, C10 et C11 (Smithwick et al., 2006).
Tomy et al., (2009a) ont mesuré les tendances temporelles des ?APFC (C8 à C12) chez les bélugas mâles de Pangnirtung, au Nunavut, qui montraient une hausse annuelle de 1,8 ± 0,5 ng/g poids humide des concentrations hépatiques mesurées de 1980 à 2010. Les concentrations d’?APFC (C8 à C12) mesurées chez les bélugas mâles de Pangnirtung se situaient entre 2,4 et 171 ng/g poids humide. On a toutefois observé chez les bélugas mâles de l’île Hendrickson une diminution de 7,41 ± 0,71 ng/g poids humide des concentrations hépatiques relevées de 1980 à 2009 (Tomy et al., 2009a), les concentrations se situant entre 4,87 et 313 ng/g poids humide.
O’Connell et al. (2010) ont analysé des échantillons de plasma et de sérum de 163 tortues caouannes juvéniles (Caretta caretta) afin d’établir les tendances spatiales et temporelles des composés perfluorés. Les tortues ont été capturées sur une distance s’étendant jusqu’à 8,4 km de la rive la plus proche de Charleston (Caroline du Sud), du cap Canaveral (Floride), de Core Sound (Caroline du Nord), de la baie de Chesapeake (Maryland) et de la baie de Floride (Floride). Des APFC en C9 à C14 ont été trouvés dans la plupart des échantillons de plasma et de sérum (de 0,034 à 16,04 ng/g). Sur le plan spatial, il y avait une tendance à la hausse vers le nord, les tortues de la baie de Floride accumulant plus d’APFC en C9 que d’autres APFC, ce qui indique qu’il y aurait des sources locales pour les tortues vivant dans la baie de Floride. Les tendances temporelles chez les tortues caouannes capturées près de Charleston ont été examinées sur une période de neuf ans. Les concentrations d’APFC en C9 ont diminué de 11 % par an; cependant, les concentrations des autres APFC à longue chaîne n’ont pas changé de façon significative avec le temps.
Évaluation des effets sur l’environnement
Organismes aquatiques
Boudreau et al. (2002) ont étudié la toxicité de l’APFC en C10 pour le macrophyte aquatique Lemna gibbaet ont établi la CI50 (concentration inhibitrice médiane à 50 %) sur sept jours (d’après la croissance) à 99 mg/L. Les valeurs de CI50 sur sept jours (d’après la croissance) de l’APFC en C10chez les algues d’eau douce Selenastrum capricornutum et Chlorella vulgaris étaient respectivement de 218 mg/L et de 198 mg/L, ce qui indique qu’il y a peu de différence de sensibilité entre les deux espèces (Boudreau et al.,2002). La toxicité aiguë et chronique de l’APFC en C10 pour deux espèces de daphnies, Daphnia magna et Daphnia pulicaria, a été étudiée. La concentration létale médiane après 48 h (CL50; dose aiguë) et la concentration efficace médiane après 48 h (CE50 – fondée sur l’immobilisation) étaient respectivement de 259 et de 130 mg/L pour le Daphnia magna, et de 285 et de 150 mg/L, respectivement, pour le Daphnia pulicaria (Boudreau et al., 2002). Ces valeurs montrent qu’il y a peu de différence de sensibilité entre les deux espèces. Hoke et al. (2009) ont déterminé les valeurs de toxicité aiguë pour l’APFC en C10 : une CL50 de 32 mg/L après 96 heures pour la truite arc-en-ciel (Oncorhynchus mykiss), une CE50 de plus de 100 mg/L après 48 heures pour la daphnie Daphnia magna et une CE50 de 10,6 mg/L après 72 heures pour l’algue verte Pseudokirchneriella subcapitata.
Les études sur la toxicité chronique de l’APFC en C9 menées sur deux espèces de daphnies ont révélé que le Daphnia pulicaria était plus sensible que le Daphnia magna (Boudreau et al., 2002). Les valeurs de CL50 sur 21 jours étaient respectivement de 8,8 mg/L et de 39 mg/L, d’après la mortalité observée. Les études de toxicité chronique ont également révélé que, chez Daphnia magna, le nombre de descendants produits était un critère d’effet plus sensible que le délai moyen avant la production de la première génération. La concentration sans effet observé (CSEO) sur 21 jours ainsi que la concentration minimale avec effet observé (CMEO) sur 21 jours (toutes deux établies d’après le nombre de descendants produits) étaient respectivement de 13 et de 25 mg/L pour le Daphnia magna, et de 6 et 13 mg/L, respectivement, pour le Daphnia pulicaria.
Organismes terrestres
La CE50 de l’APFC en C9 sur 48 heures (d’après la létalité aiguë) était de 0,66 mM (306,29 mg/L) pour le nématode vivant dans le sol Caenorhabditis elegans; l’exposition s’est faite par contact de surface dans un milieu de croissance propice aux nématodes, composé à 1,7 % d’agar (Tominaga et al., 2004). On a constaté des effets sur plusieurs générations chez les nématodes exposés à des concentrations faibles d’APFC en C9, c’est-à-dire à peine environ 1 nM (0,000464 mg/L), qui ont entraîné un déclin de 70 % de la fécondité à la quatrième génération (Tominaga et al., 2004). Aucune relation génération-réponse ou concentration-réponse n’a été observée, quoique les résultats laissent supposer que l’APFCen C9 pourrait avoir des effets à long terme sur plusieurs générations, et ce, à des concentrations d’exposition relativement faibles.
Yeung et al. (2009a) ont exposé des poulets (Gallus gallus) mâles âgés d’un jour à des APFC en C10 à des doses de 0,1 mg/kg de poids corporel (p.c.) et de 1,0 mg/kg p.c. trois fois par semaine, et ce, pendant trois semaines. On n’a observé aucun effet néfaste sur le poids corporel, les indices relatifs aux organes, les paramètres cliniques sanguins ou l’histopathologie des organes aux doses de 0,1 ou 1,0 mg/kg p.c. d’APFC en C10. Cependant, la demi-vie des APFC en C10était respectivement de 11 et 16 jours aux doses de 0,1 et 1,0 mg/kg p.c., ce qui montre les propriétés de bioaccumulation des APFC en C10 chez les poulets.
Autres effets
Stevenson et al. (2006) ont étudié la toxicité des APFC en C9 et en C10 du point de vue du mécanisme de résistance multixénobiotique chez la moule marine Mytilus californianus. Ce mécanisme joue le rôle de première ligne de défense contre de vastes classes de xénobiotiques; il expulse les produits chimiques modérément hydrophobes de la cellule par l’intermédiaire de protéines de transport transmembranaires dépendant de l’adénosine triphosphate (ATP). Le transporteur le plus étudié est la P-glycoprotéine qui, chez les humains, est active dans les reins, les glandes surrénales, le foie, la barrière hémato-testiculaire et la barrière hémato-encéphalique. Certains xénobiotiques peuvent compromettre ce mécanisme de défense. L’accroissement de sensibilité, appelé chimiosensibilisation, vient de la capacité de la P-glycoprotéine à reconnaître différents substrats xénobiotiques et à s’y lier, ce qui entraîne une saturation de la capacité de liaison. Même les substances non toxiques peuvent être des chimiosensibilisants et avoir des effets néfastes sur les organismes en permettant à des substances toxiques normalement exclues de s’accumuler dans les cellules. Stevenson et al. (2006) ont constaté que les APFC en C9 et en C10 possédaient des CI50 moyennes (d’après l’inhibition de la P-glycoprotéine) de 4,8 μM (2,23 mg/L) et 7,1 μM (3,65 mg/L), respectivement; ces substances inhibaient donc de manière significative la P-glycoprotéine chez le Mytilus californianus. Ce résultat indique que les APFC en C9 et en C10 sont des chimiosensibilisants pour cette espèce. L’APFC en C9inhibe la P-glycoprotéine par un mécanisme indirect, et le phénomène est réversible. De plus, cette substance induit l’expression du transporteur de la P-glycoprotéine après une exposition de deux heures – une réaction au stress pouvant entraîner des coûts métaboliques pour l’organisme.
Liu et al. (2008) ont étudié les effets des APFC en C12 et en C14 sur les systèmes membranaires de l’algue d’eau douce Scenedesmus obliquus. Les APFC en C12 et C14 inhibaient le taux de croissance de l’algue de façon proportionnelle à la concentration (c.-à-d. que l’inhibition augmentait avec l’augmentation de la concentration d’exposition). Les valeurs de CI10, CI50 et CI90 relatives à la densité cellulaire calculées étaient de 90 μM (46,27 mg/L), 183 μM (94,08 mg/L) et 367 μM (188,67 mg/L) pour les APFC en C10 et de 41 μM (29,28 mg/L), 134 μM (95,69 mg/L) et 292 μM (208,52 mg/L) pour les APFC en C14. En ce qui concerne les APFC en C10, on a observé un accroissement du potentiel de la membrane mitochondriale à des concentrations se situant entre 30 et 100 μM (15,42 à 51,40 mg/L). Dans le cas des APFC en C14, on a observé un accroissement du potentiel de la membrane entre 50 et 100 μM (35,70 à 71,41 mg/L). L’accroissement du potentiel de la membrane mitochondriale indique une perturbation de la fonction mitochondriale; les mitochondries sont des organites multitâches participant au métabolisme de l’énergie oxydatif ainsi qu’à l’apoptose en intégrant des signaux de mort. De plus, les APFC en C12 et C14 ont entraîné une hausse de la perméabilité des membranes cellulaires à des concentrations de 20 à 100 μM (12,28 à 61,41 mg/L) pour les APFC en C12 et à des concentrations de 50 à 100 μM (35,70 à 71,41 mg/L) pour les APFCen C14. Les effets sur la perméabilité des membranes cellulaires pourraient contribuer à la médiation des effets néfastes d’autres contaminants.
Benninghoff et al. (2007) ont établi que les APFC en C9 à C12 provoquaient une induction significative de la vitellogénine, qui est un biomarqueur de l’exposition à des œstrogènes, chez la truite arc-en-ciel, dans des essais sur 14 jours. Ces substances ont montré une faible affinité avec les récepteurs œstrogéniques hépatiques de la truite arc-en-ciel. Chez les truites juvéniles exposées in vivo à l’APFC en C10 à des doses de < 1 à 2 000 μg/g de nourriture, on a constaté une augmentation des concentrations plasmatiques de vitellogénine en fonction de la dose (avec des hausses significatives à des concentrations aussi faibles que 0,0256 μg/g de nourriture). Les auteurs ont noté que les récepteurs œstrogéniques hépatiques de la truite arc-en-ciel avaient une plus grande affinité avec un nombre supérieur de xénœstrogènes comparativement aux récepteurs œstrogéniques de mammifères, dont les humains.
Nakayama et al. (2008) ont étudié le grand cormoran (Phalacrocorax carbo), un oiseau piscivore qui est le prédateur à l’extrémité de la chaîne alimentaire dans l’écosystème du lac Biwa, au Japon. Les concentrations d’APFCen C9 ont été mesurées dans le foie de grands cormorans sauvages (mâles et femelles), et mises en relation avec l’expression génique. Les concentrations d’APFC en C9allaient, chez les femelles, de < 0,005 à 0,0088 μg/g poids humide et, chez les mâles, de < 0,005 à 0,043 μg/g poids humide. On n’a relevé aucune différence significative selon le sexe. L’analyse de l’expression génique a révélé des corrélations positives significatives entre la concentration d’APFCen C9 et la glutathion peroxydase 1 (enzyme du système antioxydant) ainsi que la ribonucléoprotéine nucléaire hétérogène U (maturation de l’ARN). Les auteurs laissent entendre que l’induction des enzymes antioxydantes pourrait constituer une réponse adaptative au stress oxydatif causé par l’APFC en C9.
Ishibashi et al. (2008a) ont montré que les APFC en C9 à C11 stimulaient le récepteur a activé par les proliférateurs des peroxysomes (PPARa) dans le foie des phoques du Baïkal (Pusa sibirica) à des concentrations minimales avec effet observé de 125 μM (58,00 mg/L) pour les APFC en C9, de 125 μM (64,26 mg/L) pour les APFC en C10 et de 62,5 μM (35,25 mg/L) pour les APFC en C11. Le PPARajoue un rôle physiologique essentiel en tant que détecteur de lipides et régulateur du métabolisme lipidique. Les niveaux d’expression de l’ARNm du PPARa ont montré une corrélation positive avec les APFC en C9, et l’expression de la protéine hépatique CYP4A était corrélée aux concentrations hépatiques d’APFC en C9 et en C10, ce qui indiquerait une modulation de la voie de signalisation PPARa-CYP4A chez les phoques du Baïkal sauvages.
L’effet possible de l’exposition aux composés perfluorés sur les lésions hépatiques a été étudié chez les ours blancs de l’est du Groenland (Sonne et al., 2007). Parmi les paramètres hépatiques examinés dans cette étude figuraient l’infiltration des cellules mononucléaires, les granulomes lipophagiques, la stéatose, l’hyperplasie des cellules de Ito et du canal cholédoque ainsi que la fibrose portale. La population était composée de 28 femelles et de 29 mâles, échantillonnés par des chasseurs de la région entre 1999 et 2002. Les échantillons de foie ont été analysés afin de déterminer s’ils contenaient plusieurs composés perfluorés, notamment des APFC en C9, C10, C11, C12 et C13. Chez 65 % des ours blancs, la somme des concentrations des composés perfluoroalkylés (c.-à-d. des composés d’alkyles perfluorés; ?APF) était supérieure à 1 000 ng/g poids humide. Chez les femelles, la ?APF variait entre 256 et 2 770 ng/g poids humide, tandis que chez les mâles, elle allait de 114 à 3 052 ng/g poids humide. Comme les concentrations de tous les APF analysés ont été additionnées, il est impossible d’établir une corrélation directe de cause à effet pour un composé perfluoré en particulier, comme les APFC à longue chaîne. En outre, les ours blancs de l’est du Groenland sont également contaminés par d’autres substances comme les organochlorés (BPC, DDT) et le mercure, ce qui peut constituer autant de facteurs confusionnels synergiques dans l’apparition des lésions. Les auteurs ont conclu que l’analyse statistique ne permettait pas de déterminer avec certitude si l’exposition chronique aux composés perfluorés était associée à l’apparition de lésions hépatiques chez les ours blancs; toutefois, ces lésions étaient similaires à celles causées par des composés perfluorés en conditions de laboratoire (Sonne et al., 2007).
Dans une autre étude menée par Flanary et al. (2010), aucune corrélation n’a été trouvée entre les APFC en C9 à C13 et les paramètres chimiques sanguins (p. ex., cholestérol, créatinine, albumine, concentration totale d’ions sériques) chez l’otarie à fourrure (Callorhinus ursinus).
Caractérisation des risques pour l’environnement
La démarche suivie dans la présente évaluation écologique préalable consistait à examiner les renseignements scientifiques et techniques pertinents et à tirer des conclusions fondées sur de multiples éléments d’information, qui comprennent l’examen de la persistance, de l’exposition, des tendances temporelles dans le biote, de la toxicité, de la bioaccumulation et de la présence répandue dans l’environnement.
Dans les études de toxicité traditionnelles (p. ex., létalité, croissance), plusieurs APFC à longue chaîne présentaient une toxicité faible à modérée, les valeurs de toxicité aiguë se situant entre 8,8 et 285 mg/L. Deux études sur la toxicité des APFC à longue chaîne ont été effectuées avec des espèces terrestres. Dans l’une de ces études, aucun effet nocif n’a été observé jusqu’à 1,0 mg/kg p.c. chez des poulets mâles ayant reçu des doses d’APFC en C10 trois fois par semaine pendant trois semaines. Dans l’autre étude, on a constaté une létalité aiguë chez un nématode vivant dans le sol exposé à une concentration de 306 mg/L d’APFC en C9ainsi que des effets sur plusieurs générations (baisse de la fécondité) lorsqu’il était exposé à une concentration de 0,000464 mg/L.
Les APF, notamment les APFC à longue chaîne, peuvent provoquer une toxicité hépatique chez les ours blancs à des concentrations de 114 à 3 052 ng/g en poids humide d’APF totaux (d’après les associations observées dans les études sur le terrain), ainsi que l’activation du PPARa dans le foie des phoques du Baïkal à des concentrations de 35,25 à 64,26 mg/L d’APFC en C9 à C11 (d’après les données tirées des études de laboratoire in vitro). Les APFC à longue chaîne peuvent également perturber le système endocrinien, comme la vitellogenèse chez la truite arc-en-ciel à des concentrations d’APFCen C10 de 0,0256 à 2 000 μg/g de nourriture. Les APFC en C9 à C10 sont également des chimiosensibilisants pour la moule marine Mytilus californianus, car ils permettent à des substances toxiques normalement exclues de s’accumuler dans la moule. Les APFC en C12 et en C14 augmentent le potentiel de la membrane mitochondriale chez l’algue d’eau douce Scenedesmus obliquus, ce qui indique une perturbation de la fonction mitochondriale.
Au Canada, on a mesuré certains APFC à longue chaîne dans le milieu aquatique et leurs concentrations allaient de < 0,5 ng/L à 19 ng/L. Dans les sédiments de l’Arctique canadien, on a mesuré des concentrations d’APFC en C9 à C12 se situant entre 0,5 et 3,3 ng/g. En outre, on a mesuré des APFC en C9 à C15 dans le foie de divers animaux (phoques, renards, poissons, ours blancs, requins du Groenland, narvals, bélugas et oiseaux) de l’Arctique canadien ou de la région des Grands Lacs. Les concentrations se situaient entre des valeurs inférieures à la limite de détection et 180 ng/g de poids humide de foie; les concentrations les plus élevées ayant été enregistrées chez l’ours blanc, puis chez le requin du Groenland, le narval et le béluga. Dans le monde entier, des APFC en C9 à C15 ont été relevés chez le phoque annelé, l’otarie à fourrure et le phoque commun, chez diverses espèces de dauphin (à flancs blancs, à gros nez, à nez blanc, de la Plata, sotalie de Chine), chez le marsouin aptère, le goéland bourgmestre, le grand cachalot, le castor, le tigre de Sibérie, le rat sauvage et plusieurs espèces d’oiseau (l’aigrette garzette, le pluvier petit-gravelot, les paradoxornis et le bihoreau gris). Les concentrations allaient de valeurs inférieures à la limite de détection jusqu’à 480 ng/g poids humide, les concentrations les plus élevées ayant été mesurées chez le dauphin à nez blanc.
On considère que tous les APFC à longue chaîne sont persistants. Pour les APFC en C11 (2 700 < FBC < 11 000), C12 (18 000 < FBC < 40 000) et C14 (23 000 < FBC < 30 000), il existe des données empiriques indiquant que ces substances sont très bioaccumulables chez les poissons et qu’elles possèdent un potentiel de bioamplification chez les poissons et les mammifères marins. Il n’existe pas de données expérimentales ou estimées sur la bioaccumulation des APFC à longue chaîne comptant plus de 14 atomes de carbone. Les APFC à longue chaîne pourraient toutefois, d’après leur conformation chimique, s’accumuler ou se bioamplifier chez les espèces marines ou terrestres. De plus, des APFC en C14 et en C15 ont été détectés chez des poissons, des invertébrés et des ours blancs.
On a montré que les concentrations d’APFC à longue chaîne ont tendance à augmenter chez les ours blancs, les phoques annelés et les oiseaux. Entre 1980 et 2000, les concentrations d’APFC en C10 et C11 mesurées dans le foie de phoques annelés du Groenland ont connu une hausse respective de 3,3 et de 6,8 % par an. Entre 1992 et 2005, les concentrations moyennes d’APFC en C9 et en C10 mesurées dans le foie des phoques du Baïkal étaient 1,2 à 1,7 fois plus élevées. De 1972 à 2002, le temps moyen de doublement des concentrations dans le foie de l’ours blanc de l’Arctique se situait entre 5,8 et 9,1 ans, pour les APFC en C9 à C11. De 1993 à 2004, les concentrations dans les échantillons de foie de phoque annelé ont augmenté, avec un temps de doublement des APFC en C9 à C12 allant de 4 à 10 ans. Les concentrations d’APFC en C9 à C15 dans les échantillons de foie de fulmar boréal ont augmenté entre 1987 et 1993, puis sont restées stables de 1993 à 2003. En ce qui concerne les concentrations d’APFC en C9 à C15 mesurées dans les échantillons de foie du guillemot de Brünnich, elles ont augmenté de 1975 à 2004. De 1983 à 1993, les concentrations d’APFC en C9 à C13 ont augmenté de manière significative dans les œufs entiers de goélands argentés en Norvège. Chez les bélugas mâles du Nunavut, on a observé des hausses temporelles annuelles des APFC en C9 à C12 de 1,8 ng/g de poids humide de foie entre 1980 et 2010.
La présence des APFC à longue chaîne (C9 à C20), de leurs sels et de leurs précurseurs résulte de l’activité humaine. Les APFC à longue chaîne et leurs sels sont persistants. Des données empiriques indiquent une forte accumulation ainsi qu’une bioamplification des APFC à longue chaîne dans les mammifères marins et terrestres. Ils ont été détectés dans des régions éloignées ou isolées, qu’ils ont probablement atteintes par l’intermédiaire du transport atmosphérique ou océanique à grande distance de précurseurs volatils, des acides eux-mêmes ou bien des deux. Les APFC à longue chaîne et leurs précurseurs ont aussi été détectés dans le biote sur de grandes étendues au Canada, notamment dans l’Arctique canadien. Il a été établi que leurs concentrations augmentent avec le temps chez des espèces de l’Arctique canadien telles que l’ours blanc, le phoque annelé, le fulmar boréal et le guillemot de Brünnich. D’après les éléments ci-dessus, il est conclu que les APFC à longue chaîne, leurs sels et leurs précurseurs peuvent avoir des effets nocifs sur l’environnement.
Incertitudes dans l’évaluation des risques pour l’environnement
Il existe certaines lacunes et incertitudes concernant, entre autres, les données limitées sur les propriétés physiques et chimiques, les données expérimentales sur la persistance et les données sur la toxicité. L’ensemble des données sur les APFC à longue chaîne et leurs précurseurs est néanmoins substantiel. Par exemple, bien que les mécanismes de transport des APFC à longue chaîne et de leurs précurseurs vers l’Arctique ne soient pas clairs, ces composés semblent avoir une certaine mobilité, étant donné qu’on a mesuré des APFC à longue chaîne et leurs précurseurs dans le biote dans tout l’Arctique canadien, loin des sources connues.
Les voies environnementales du transfert des APFC à longue chaîne au biote ne sont pas bien comprises en raison du peu de données de surveillance qui existent sur les concentrations de leurs divers précurseurs dans l’air, l’eau, les effluents et les sédiments au Canada. Les mécanismes de toxicité des APFC à longue chaîne sont peu connus; toutefois, on a signalé toute une gamme d’effets toxicologiques chez diverses espèces, notamment l’induction de la vitellogénine et la toxicité hépatique.
En outre, selon des études menées par van Leeuwen et al. (2006) révélant la variabilité des résultats analytiques obtenus par divers laboratoires, il est possible que les résultats des analyses effectuées par ces laboratoires ne soient pas directement comparables.
Enfin, on ne dispose actuellement que de données limitées sur la toxicologie des précurseurs des APFC à longue chaîne, la contribution relative de ces précurseurs provenant de différentes sources (p. ex., l’importance des précurseurs issus de la dégradation des substances fluorotélomériques) et la possibilité d’effets combinés ou synergiques avec d’autres composés perfluorés.
Conclusion
L’évaluation est fondée sur une méthode du poids de la preuve en ce qui concerne la persistance, la bioaccumulation, la présence répandue, les tendances temporelles chez certaines espèces (c.-à-d., les oiseaux de l’Arctique canadien, les mammifères terrestres et marins), le transport à grande distance et les concentrations d’APFC à longue chaîne (C9 à C20) dans l’environnement et le biote (y compris les régions éloignées du Canada).
Selon les renseignements présentés dans la présente évaluation préalable, il est conclu que les APFC à longue chaîne (C9 à C20), leurs sels et leurs précurseurs pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, il est conclu que les APFC à longue chaîne (C9 à C20) et leurs sels sont extrêmement persistants et qu’ils répondent aux critères de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation. Les APFC à longue chaîne (C9 à C20) ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. Néanmoins, le poids de la preuve est suffisant pour conclure que les APFC à longue chaîne (C9 à C20) et leurs sels s’accumulent et se bioamplifient chez les mammifères terrestres et marins.
Il est donc conclu que les APFC à longue chaîne (C9 à C20), leurs sels et leurs précurseurs répondent à au moins un des critères énoncés à l’article 64 de la LCPE (1999).
Des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles définies à l’étape de la gestion des risques.
Références
Ahrens, L., Barber, J.L., Xie, Z., Ebinghaus, R. 2009. Longitudinal and latitudinal distribution of perfluoroalykl compounds in the surface water of the Atlantic Ocean. Environ. Sci. Technol. 43(9) :3122-3127.
Ahrens, L., Shoeib, M., Cheng, C., Lee, S.-C., Harner, T. 2010a. Wastewater treatment plant and landfill inputs of polyfluoroalkyl compounds and siloxanes to the atmosphere. Présentation à l’USEPA PFAA Days III: Recent Advances in Perfluoroalkyl Acid (PFAA) Research, du 8 au 10 juin 2010, Research Triangle Park (NC).
Ahrens, L., Xie, Z., Ebinghaus, R. 2010b. Distribution of perfluoroalkyl compounds in seawater from northern Europe, Atlantic Ocean and Southern Ocean. Chemosphere 78:1011-1016.
Arp, H.P.H., Niederer, C., Goss, K.-U. 2006. Predicting the partitioning behaviour of various fluorinated compounds. Environ. Sci. Technol. 40(23):7298-7304.
Begley, T.H., White, K., Honigfort, P., Twaroski, M.L., Neches, R., Walker, R.A. 2005. Perfluorochemicals: Potential sources of and migration from food packaging. Food Add Contam22(10):1023-1031.
Beneficemalouet, S., Blancou, H., Itier, J, Commeyras, A. 1991. An improved synthesis of perfluorocarboxylic acids. Synthesis (Stuttg):647-648.
Benninghoff, A.D., Field, J.A., Williams, D.E. 2007. In vitro and in vivo assessment of the estrogen activity of perfluorooctanoic acid (PFOA), perfluorooctane sulfonate (PFOS) and other structurally diverse perfluorinated chemicals. 46th Annual Meeting of the Society of Toxicology. Charlotte (NC), 25-29 mars.
Berger, U., Herzke, D., 2006. Per- and polyfluorinated alkyl substances (PFAs) extracted from textile samples. Organohal. Compd 68:2023-2026.
Bernett, M.K., Zisman, W.A. 1959. Wetting of low-energy solids by aqueous solutions of highly fluorinated acids and salts. J. Phys. Chem. 63:1911-1916.
Blancou, H., Moreau, P., Commeyras, A. 1976. Preparation of perfluoroalkane carboxylic and sulfonic-acid derivatives by the action of metallic couples on perfluoroalkyl iodides in dimethyl sulfoxide. J. Chem. Soc. Chem. Commun.:885-886.
Bossi, R., Riget, F.F., Dietz, R. 2005. Temporal and spatial trends of perfluorinated compounds in ringed seal (Phoca hispida) from Greenland. Environ. Sci. Technol. 39:7416-7422.
Boudreau, T.M., Sibley, P., Mabury, S.A., Muir, D.C.G., Solomon, K. 2002. Toxicity of Perfluoroalkyl Carboxylic Acids of Different Chain Length to Selected Freshwater Organisms. In:, Master’s Thesis; Guelph (Ont.) : Université de Guelph, Département de biologie environnementale, p. 134.
Boulanger, B., Peck, A.M., Schnoor, J.L., Hornbuckle, K.C. 2005a. Mass budget of perfluorooctane surfactants in Lake Ontario. Environ. Sci. Technol. 39:74-79.
Boulanger, B., Vargo, J.D., Schnoor, J.L., Hornbuckle, K.C. 2005b. Evaluation of perfluorooctane surfactants in a wastewater treatment system in a commercial surface protection product. Environ. Sci. Technol. 39:5524-5530.
Bradley, E.L., Read, W.A., Castle, L., 2007. Investigation into the migration potential of coating materials from cookware products. Food Add Contam 24(3):326-335.
Butt, C.M., Stock, N.L., Mabury, S.A., Muir, D.C.G., Braune, B.M. 2007a. Prevalence of long-chain perfluorinated carboxylates in seabirds from the Canadian Arctic between 1975 and 2004. Environ. Sci. Technol. 41:3521-3528.
Butt, C.M., Muir, D.C.G., Stirling, I., Kwan, M., Mabury, S.A. 2007b. Rapid response of Arctic ringed seals to changes in perfluroalkyl production. Environ. Sci. Technol. 41(1):42-49.
Butt, C.M., Mabury, S.A., Kwan, M., Wang, X., Muir, D.C.G. 2008. Spatial trends of perfluoroalkyl compounds in ringed seals (Phoca hispida) from the Canadian Arctic. Environ. Toxicol. Chem. 27(3):542-553.
Canada. 1995. Politique de gestion des substances toxiques. Ottawa (Ont.) : sa Majesté la Reine du chef du Canada (Environnement Canada). [réimpression en 2004].
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33. Gazette du Canada, Partie III : vol. 22, n° 3.
Canada. 2000. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada, Partie II : vol. 134, n° 7.
Canada. 2006. Loi canadienne sur la protection de l’environnement (1999) : Règlement modifiant le Règlement sur certaines substances toxiques interdites (2005) (quatre substances nouvelles à base de télomères fluorés). 17 juin 2006. Gazette du Canada, Partie I : vol. 140, n° 24.
Conder, J.M., Hoke, R.A., de Wolf, W., Russell, M.H., Buck, R.C. 2008. Are PFCAs bioaccumulative? A critical review and comparison with regulatory criteria and persistent lipophilic compounds. Environ. Sci. Technol. 42:995-1003.
Crozier, P., Furdui, V., Lucaciu, C., Stock, N., Mabury, S.A., Reiner, E. 2005. Detection of perfluoro-alkyl compounds (PFCs) in sewage treatment plant (STP) effluents and biosolids by liquid chromatography - tandem mass spectrometry. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Delinsky, A.D., Strynar, M.J., McCann, P.J., Varns, J.L., McMillan, L., Nakayama, S.F., Lindstrom, A.B. 2010. Geographical distribution of perfluorinated compounds in fish from Minnesota lakes and rivers. Environ. Sci. Technol. 44:2549-2554.
Del Vento, S., Codling, G., Ahrens, L., Ebinghuas, R., Jones, K.C., Halsall, C.J. 2009. Perfluoroalkylcompounds in the Arctic marine system: air, snow, water and sea-ice. Présentation lors de la SETAC North America, novembre 2009, Nouvelle-Orléans (LA).
De Silva, A.O., Mabury, S.A. 2004. Isolating isomers of perfluorocarboxylates in polar bears (Ursus maritimus) from two geographical locations. Environ. Sci. Technol.38:6538-6545.
De Silva, A., Spencer, C., Scott, B., Sekela, M., Gledhill, M., Rondeau, B., Backus, S., Muir, D. 2009. Perfluoroalkyl phosphonic acids and polyfluoroalkyls phosphoric acids in Canadian rivers. Présentation lors de la SETAC North America, novembre 2009, Nouvelle-Orléans (LA).
Dietz, R., Bossi, R., Riget, F.F., Sonne, S., Born, E.W. 2008. Increasing perfluoroalykl contaminants in east Greenland polar bears (Ursus maritimus): a new toxic threat to the Arctic bears. Environ. Sci. Technol. 42(7):2701-2707.
Dinglasan, M.J.A., Mabury, S.A. 2005. Evidence of 8:2 OHFT production from the biodegradation of 8:2 telomer methacrylate under aerobic conditions. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Dinglasan, M.J.A., Ye, Y., Edwards, E.A., Mabury, S.A. 2004. Fluorotelomer alcohol biodegradation yields poly- and perfluorinated acids. Environ. Sci. Technol.38:2857-2864.
Dinglasan-Panlilio, M.J.A., Mabury, S.A. 2006. Significant residual fluorinated alcohols present in various fluorinated materials. Environ. Sci. Technol.40(5):1447-1453.
Dreyer, A., Weinberg, I., Temme, C., Ebinghaus, R. 2009. Polyfluorinated compounds in the atmosphere of the Atlantic and Southern Oceans: evidence for a global distribution. Environ. Sci. Technol. 43(17):6507-6514
Ellis, D.A., Mabury, S.A., Martin, J.W., Stock, N.L. 2004a. Environmental Review of Other (non-C8) Perfluorocarboxylic Acids (PFCAs). Document préparé en vertu d’un contrat pour la Division des substances existantes d’Environnement Canada, Gatineau (Qc). 68 p.
Ellis, D.A., Martin, J.W., De Silva, A.O., Mabury, S.A., Hurley, M.D., Sulbaek Andersen, M.P., Wallington, T.J. 2004b. Degradation of fluorotelomer alcohols: A likely source of perfluorinated carboxylic acids. Environ. Sci. Technol. 38:3316-3321.
Environnement Canada. 2001. Primary Report on PFAs from Section 71 survey. Préparé par la Section de l’utilisation des produits, Division du contrôle des produits chimiques, Direction de l’évaluation des produits chimiques commerciaux. Gatineau (Qc).
Environnement Canada. 2005. Report on PFCAs results of notice issued under Section 71 CEPA for 2004 calendar year.
Environnement Canada. 2006. Plan d’action pour l’évaluation et la gestion des acides perfluorocarboxyliques (APFC) et de leurs précurseurs.
Environnement Canada et Santé Canada. 2006. Substances nouvelles : mises à jour aux rapports d’évaluation des impacts sur l’environnement et la santé humaine – DSN nos12763, 12798, 12863, 13211 et 13395.
Fasano, W.J., Carpenter, S.C., Gannon, S.A., Snow, T.A., Stadler, J.C., Kennedy, G.L., Buck, R.C., Korzeniowski, S.H., Hinderliter, P.M., Kemper, R.A. 2006. Absorption, distribution, metabolism, and elimination of 8-2 fluorotelomer alcohol in the rat. Toxicol. Sci. 91(2):341-355.
Fasano, W.J., Carpenter, S.C., Gannon, S.A., Snow, T.A., Stadler, J.C., Kennedy, G.L., Buck, R.C., Korzeniowski, S.H., Hinderliter, P.M., Kemper, R.A. 2008. Erratum: Absorption, distribution, metabolism, and elimination of 8-2 fluorotelomer alcohol in the rat. Toxicol. Sci. 102(2):455.
Flanary, J.R., Reiner, J.L., Helke, K.L., Kucklick, J.R., Gulland, F.M.D., Becker, P.R. 2010. Measurements of perfluorinated compounds in plasma of northern fur seals (Callorhinus ursinus) and a preliminary assessment of their relationship to peroxisome proliferation and blood chemistry parameters. Présentation à l’USEPA PFAA Days III: Recent Advances in Perfluoroalkyl Acid (PFAA) Research, du 8 au 10 juin 2010, Research Triangle Park (NC).
Fontell, K., Lindman, B. 1983. Fluorocarbon surfactants - phase-equilibria and phase structures in aqueous systems of a totally fluorinated fatty-acid and some of tts salts. J. Phys. Chem. 87:3289-3297.
Furdui, V.I., Stock, N., Ellis, D.A., Butt, C.M., Whittle, D.M., Crozier, P.W., Reiner, E.J., Muir, D.C.G., Mabury, S.A. 2007. Spatial distribution of perfluroalkyl contaminants in lake trout from the Great Lakes. Environ. Sci. Technol. 41(5):1554-1559.
Furdui, V.I., Helm, P.A., Crozier, P.W., Lucaciu, C., Reiner, E.J., Marvin, C.H., Whittle, D.M., Mabury, S.A., Tomy, G.T. 2008. Temporal trends of perfluoroalkyl compounds with isomer analysis in lake trout from Lake Ontario (1979-2004). Environ. Sci. Technol. 42:4739-4744.
Gauthier, S.A., Mabury, S.A. 2005. Aqueous photolysis of 8:2 fluorotelomer alcohol. Environ. Toxicol. Chem. 24:1837-1846.
Gebbink, W.A., Burgess, N., Champoux, L., Elliot, J.E., Hebert, C.E., Martin, P., Wayland, M., Chip Weseloh, D.V., Wilson, L., Letcher, R.J. 2009a. Perfluoroalkyl compounds in the eggs of four species of gulls (Larids) from breeding sites spanning Atlantic to Pacific Canada. SETAC North America, 30thAnnual Meeting, Nouvelle-Orléans (LA).
Gebbink, W.A., Hebert, C.E., Letcher, R.J. 2009b. Perfluorinated carboxylates and sulfonates and precursor compounds in herring gull eggs from colonies spanning the Laurentian Great Lakes of North America. Environ. Sci. Technol. 43:7443-7449.
Gewurtz, S.B., Bhavsar, S.P., Crozier, P.W., Diamond, M.L., Helm, P.A., Marvin, C.H., Reiner, E.J. 2009. Perfluroalkyl contaminants in window film: indoor/outdoor, urban/rural, and winter/summer contamination and assessment of carpet as a possible source. Environ. Sci. Technol. 43(19):7317-7323.
Goss, K.-U. 2008. The pKa values of PFOA and other highly fluorinated carboxylic acids. Environ. Sci. Technol. 42:456-458.
Gray, J.S. 2002. Biomagnification in marine systems: the perspective of an ecologist. Mar. Poll. Bull. 45:46-52.
Gulkowska, A., Falandysz, J., Taniyasu, S., Bochentin, I., Ka So, M., Yamashita, N. 2005. Perfluorinated chemicals in blood of fish and waterfowl from Gulf of Gdansk, Baltic Sea. Présentation lors du Fluoros 2005 en août 2005.
Guo, Z., Liu, X., Krebs, K.A., Roache, N.F. 2009. Perfluorocarboxylic acid content in 116 articles of commerce. EPA/600/R-09/33. Research Triangle Park (NC) : U.S. Environmental Protection Agency.
Hagen, D.F., Belisle, J., Johnson, J.D., Venkateswarlu, P. 1981. Characterization of fluorinated metabolites by a gas chromatographic-helium microwave plasma detector–The biotransformation of 1H,1H,2H,2H-perfluorodecanol to perfluorooctanoate. Anal. Biochem. 118(2):336-343.
Hare, E.F., Shafrin, E.G., Zisman, W.A., 1954. Properties of films of adsorbed fluorinated acids. J. Phys. Chem.58(3):236-239.
Haukås, M., Berger, U., Hop, H., Gulliksen, B., Gabrielsen, G.W. 2007. Bioaccumulation of per- and polyfluorinated alkyl substances (PFAS) in selected species from the Barents Sea food web. Environ. Pollut. 148:360-371.
Herbst, L., Hoffmann, H., Kalus, J., Reizlein, K., Schmelzer, U., Ibel, K. 1985. Small-angle neutron-scattering on nematic lyotropic liquid-crystals. Berichte der Bunsengesellschaft für physikalische Chemie 89(10):1050-1064.
Higgins, C.P., Field, J.A., Criddle, C.S., Luthy, R.G. 2005. Quantitative determination of perfluorochemicals in sediments and domestic sludge. Environ. Sci. Technol. 39:3946-3956.
Higgins, C.P., Luthy, R.G. 2006. Sorption of perfluorinated surfactants on sediments. Environ. Sci. Technol.40:7251-7256.
Higgins, C.P., McLeod, P.B., MacManus-Spencer, L.A., Luthy, R.G. 2007. Bioaccumulation of perfluorochemicals in sediments by the aquatic oligochaete Lumbriculus variegatus. Environ. Sci. Technol. 41:4600-4606.
Hoke, R., Bouchelle, L., Ferrell, B., Sloman, T., Rivenbark, J. 2009. Comparative acute toxicity of a suite of polyfluorinated acids to green algae, an invertebrate and freshwater fish. Présentation lors de la SETAC North America, 30thAnnual Meeting, Nouvelle-Orléans (LA).
Holmström, K.E., Berger, U. 2008. Tissue distribution of perfluorinated surfactants in common guillemot (Uria aalge) from the Baltic Sea. Environ. Sci. Technol.42:5879-5884.
Holmström, K.E., Johansson, A.-K., Bignert, A., Lindberg, P., Berger, U. 2010. Temporal trends of perfluorinated surfactants in Swedish peregrine falcon eggs (Falco peregrinus) 1974-2007. Environ. Sci. Technol. 44(11):4083-4088.
Hori, H., Yamamoto, A., Hayakawa, E., Taniyasu, S., Yamashita, N., Kutsuna, S., Kiatagawa, H., Arakawa, R. 2005a. Efficient decomposition of environmentally persistent perfluorocarboyxlic acids by use of persulfate as a photochemical oxidant. Environ. Sci. Technology 39:2383-2388.
Hori, H., Yamamoto, A., Katsuna, S. 2005b. Efficient photochemical decomposition of long-chain perfluorocarboxylic acids by means of an aqueous/liquid CO2 biphasic system. Environ. Sci. Technol. 39:7692-7697.
Hori, H., Nagaoka, Y., Murayama, M., Kutsuna, S. 2008. Efficient decomposition of perfluorocarboxylic acids and alternative fluorochemical surfactants in hot water. Environ. Sci. Technol. 42(19):7238-7443.
Houde, M., Wells, R.S., Fair, P.A., Bossart, G.D., Hohn, A.A., Rowles, T.K., Sweeney, J.C., Solomon, K.R., Muir, D.C.G. 2005. Polyfluoroalkyl compounds in free-ranging dolphins (Tursiops truncates) from the Gulf of Mexico and the Atlantic Ocean. Environ. Sci. Technol. 39:6591-6598.
Houde, M., Bujas, T.A.D., Small, J., Wells, R.S., Fair, P.A., Bossart, G.D., Solomon, K.R., Muir, D.C.G. 2006a. Biomagnification of perfluoroalkyl compounds in the bottlenose dolphin (Tursiops truncatus) food web. Environ. Sci. Technol.40:4138-4144.
Houde, M., Martin, J.W., Letcher, R.J., Solomon, K.R., Muir, D.G. 2006b. Biological monitoring of polyfluoroalkyl substances: a review. Environ. Sci. Technol. 40:3463-3473.
Houde, M., Balmer, B.C., Brandsma, S., Wells, R.S., Rowles, T.K., Solomon, K.R., Muir, D.C.G. 2006c. Perfluoroalkyl compounds in relation to life-history and reproductive parameters in bottlenose dolphins (Tursiops truncatus) from Sarasota Bay, Florida, USA. Environ. Toxicol. Chem. 25(9): 2405-2412.
Huang, B.-N., Haas, A., Lieb, M. 1987. A new method for the preparation of perfluorocarboxylic acids. J. Fluor. Chem.36:49-62.
Hurley, M.D., Andersen, M.P.S., Wallington, T.J., Ellis, D.A., Martin, J.W., Mabury, S.A. 2004. Atmospheric chemistry of perfluorinated carboxylic acids: reaction with OH radicals and atmospheric lifetimes. J. Phys. Chem. A 108:615-620.
Ishibashi, H., Iwata, H., Kim, E.-Y., Tao, L., Kannan, K., Tanabe, S., Batoev, V., Petrov, E. 2008a.Contamination and effects of perfluorochemicals in Baikal seal (Pusa sibirica). 2. Molecular characterization, expression level, and transcriptional activation of peroxisome proliferator-activated receptor a. Environ. Sci. Technol. 42:2302-2308.
Ishibashi, H., Iwata, H., Kim, E.-Y., Tao, L., Kannan, K., Amano, M., Miyazaki, N., Tanabe, S., Batoev, V.B., Petrov, E. 2008b. Contamination and effects of perfluorochemicals in Baikal seal (Pusa sibirica). 1. Residue level, tissue distribution, and temporal trend. Environ. Sci. Technol. 42:2295-2301.
Ishikawa, N., Takahashi, M., Sato, T., Kitazume, T. 1983. Ultrasound-promoted direct carboxylation of perfluoroalkyl iodides. J. Fluor. Chem. 22:585-587.
Ikawa, Y., Tsuru, S., Murata, Y., Okawauchi, M., Shigematsu, M., Sugihara, G. 1988. A pressure and temperature study on solubility and micelle formation of sodium perfluorodecanoate in aqueous-solution. J. Solution Chem. 17:125-137.
Jeon, J., Kannan, K., Lim, H.K., Moon, H.B., Ra, J.S., Kim, S.D. 2010a. Bioaccumulation of perflurochemicals in Pacific oyster under different salinity gradients. Environ. Sci. Technol. 44(7):2695-2701.
Jeon, J., Kannan, K., Lim, H.K., Moon, H.B., Kim, S.D. 2010b. Bioconcentration of perfluorinated compounds in blackrock fish (Sebastes schlegeli) at different salinity levels. Environ. Toxicol. Chem. 29(11):2529-2535.
Kaiser, M.A., Larsen, B.S., Kao, C.-P., Buck, R.C. 2005. Vapor pressures of perfluorooctanoic, -nonanoic, -decanoic, -undecanoic, and -dodecanoic acids. J. Chem. Eng. Data50:1841-1843.
Kannan, K., Yun, S.H., Evans, T.J. 2005. Chlorinated, brominated and perfluorinated contaminants in livers of polar bears from Alaska. Environ. Sci. Technol. 39:9057-9063.
Kauck, E.A., Diesslin, A.R. 1951. Some properties of perfluorocarboxylic acids. Ind. Eng .Chem.43:2332-2334.
Katz, S., Muir, D., Gamberg, M. 2009. Bioaccumulation of perfluorinated compounds in the vegetation-caribou-wolf food chain. In : Smith, S., Stow, J., Edwards, J. (éd.). Synopsis of research conducted under the 2008-2009 Northern Contaminants Program. Ottawa (Ont.) : Affaires indiennes et du Nord Canada. p. 215-220.
Kelly, B.C., Gobas, F.A.P.C., McLachlan, M.S. 2004. Intestinal absorption and biomagnification of organic contaminants in fish, wildlife and humans. Environ. Toxicol. Chem.23(10):2324–2336.
Key, B.D., Howell, R.D., Criddle, C.S. 1997. Fluorinated organics in the biosphere. Environ. Sci. Technol.31:2445-2454.
Kissa, E. 1994. Fluorinated Surfactants. Synthesis Properties Applications. New York (NY) : Marcel Dekker, Inc.
Klevens, H.B., Raison, M. 1954. Association dans les perfluoroacides. III. Études des tensions superficielles. J. Chim.Phys. Physicochim.Biol. 51.
Knudsen, L.B., Borgå, K., JØrgensen, E.H., van Bavel, B., Schlabach, M., Verreault, J., Gabrielsen, G.W. 2007. Halogenated organic contaminants and mercury in northern fulmars (Fulmarus glacialis): levels, relationships to dietary descriptors and blood to liver comparison. Environ. Pollut. 146:25-33.
Kudo, N., Iwase, Y., Okayachi, H., Yamakawa, Y., Kawashima, Y. 2005. Induction of hepatic peroxisome proliferation by 8-2 telomer alcohol feeding in mice: formation of perfluorooctanoic acid in the liver Toxicol. Sci. 85(2):231-238.
Kunieda, H., Shinoda, K. 1976. Krafft points, critical micelle concentrations, surface tension, and solubilizing power of aqueous solutions of fluorinated surfactants. J. Phys. Chem.80(22):2468-2470.
Kwadijk, C.J.A.F., Korytar, P., Koelmans, A.A. 2010. Distribution of perfluorinated compounds in aquatic systems in The Netherlands. Environ. Sci. Technol. 44(10):3746-3751.
Lange, C.C. 2002. Biodegradation screen study for telomer-type alcohols. Minneapolis (MN) : Pace Analytical Services. U.S. Environmental Protection Agency public docket AR226-1149.
Lehlmer, H.-J., Oyewumi, M.-O., Jay, M., Bummer, P.M. 2001. Behaviour of partially fluorinated carboxylic acids at the air-water interface. J. Fluor. Chem. 107:141-146.
Leonel, J., Kannan, K., Tao, L., Fillmann, G., Montone, R.C. 2008. A baseline study of perfluorochemicals in Franciscana dolphins and Subantarctic fur seal from coastal waters of southern Brazil. Mar. Pollut. Bull. 56:770-797.
Li, X., Yeung, L.W.Y., Taniyasu, S., Li, M., Zhang, H., Liu, D., Lam, P.K.S., Yamashita, N., Dai, J. 2008. Perfluorooctanesulfonate and related fluorochemicals in the Amur tiger (Panthera tigris altaica) from China. Environ. Sci. Technol. 42:7078-7083.
Liu, J., Lee, L.S., Nies, L.F., Nakastu, C.H., Turco, R. 2007. Biotransformation of 8:2 fluorotelomer alcohol in soil and by soil bacteria cultures. Environ. Sci. Technol. 41:8024-8030.
Liu, W., Chen, S., Quan, X., Jin, Y.-H. 2008. Toxic effect of serial perfluorosulfonic and perfluorocarboxylic acids on the membrane system of a freshwater alga measured by flow cytometry. Environ. Toxicol. Chem. 27(7):1597-1604.
Loewen, M., Halldorson, T., Wang, F., Tomy, G. 2005. Fluorotelomer carboxylic acids and PFOS in rainwater from an urban centre in Canada. Environ. Sci. Technol. 39:2944-2951.
Loewen, M., Wania, F., Wang, F., Tomy, G. 2008. Altitudinal transect of atmospheric and aqueous fluorinated organic compounds in western Canada. Environ. Sci. Technol. 42(7):2374-2379.
Löfstrand, K., Jörundsdóttir, H., Tomy, G., Svavarsson, J., Weihe, P., Nygård, T., Bergman, Å. 2008. Spatial trends of polyfluorinated compounds in guillemot (Uria aalge) eggs from north-western Europe. Chemosphere72(10):1475-1480.
Lucaciu, C., Furdui, V., Crozier, P., Marvin, C., Reiner, E., Wania, F., Mabury, S.A. 2004. Temporal study of perfluorinated alkyl substances in Niagara River suspended sediments. SETAC North America 26th Annual Meeting 2004, 13 au 17 novembre.
Mackay, D., Fraser, A. 2000. Bioaccumulation of persistent organic chemicals: mechanisms and models. Environ. Pollut. 110:375-391.
Martin, J.W., Mabury, S.A., Solomon, K.R., Muir, D.C.G. 2003a. Dietary accumulation of perfluorinated acids in juvenile rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 22:189-195.
Martin, J.W., Mabury, S.A., Solomon, K.R., Muir, D.C.G. 2003b. Bioconcentration and tissue distribution of perfluorinated acids in rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 22:196-204.
Martin, J.W., Smithwick, M.M., Braune, B.M., Hoekstra, P.F., Muir, D.C.G., Mabury, S.A. 2004a. Identification of long-chain perfluorinated acids in biota from the Canadian Arctic. Environ. Sci. Technol. 38:373-380.
Martin, J.W., Whittle, M., Muir, D.C.G., Mabury, S.A. 2004b. Perfluoroalkyl contaminants in a food web from Lake Ontario. Environ. Sci. Technol. 38:5379-5385.
Martin, J.W., Mabury, S.A., O’Brien, P.J. 2005. Metabolic products and pathways of fluorotelomer alcohols in isolated rat hepatocytes. Chem.Biol. Interact. 155:165-180.
Mawn, M.P., McKay, R.G., Ryan, T.W., Szostek, B., Powley, C.R., Buck, R.C. 2005. Determination of extractable perfluorooctanoic acid (PFOA) in water, sweat simulant, saliva simulant, and methanol from textile and carpet samples by LC/MS/MS. Analyst130(5):670-678.
Mekenyan, O., Dimitrov, S., Temelkov, S. 2002. PFOS metabolic pathways and metabolic distributions: Generated by catabolic simulator (2001–2002). Résultats compilés et révisés par P. Robinson, Division des substances existantes, Environnement Canada, Gatineau (Qc).
Moody, C.A., Martin, J.W., Kwan, W.C., Muir, D.C.G., Mabury, S.C. 2002. Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into Etobicoke Creek. Environ. Sci. Technol. 36:545-551.
Moroi, Y., Yano, H., Shibata, O., Yonemitsu, T. 2001. Determination of acidity constants of perfluoroalkanoic acids. Bull. Chem. Soc. Jpn. 74:667-672.
Mukerjee, P., Handa, T. 1981. Adsorption of fluorocarbon and hydrocarbon surfactants to air-water, hexane-water, and perfluorohexane-water interfaces: relative affinities and fluorocarbon-hydrocarbon nonideality effects. J. Phys. Chem. 85:2298-2303.
Myers, A.L., Crozier, P.W., Helm, P.A., Reiner, E.J., Burniston, D., Marvin, C.H., McCarry, B.E. 2009. Spatial distribution and temporal trends of perfluorinated compounds in Great Lakes sediments and surface waters. Présentation à la SETAC North America, 30th Annual Meeting, Nouvelle-Orléans (LA).
Nabb, D.L., Szostek, B., Himmelstein, M.W., Mawn, M.P., Gargas, M.L., Sweeney, L.M., Stadler, J.C., Buck, R.C., Fasano, W.J. 2007. In vitro metabolism of 8-2 fluorotelomer alcohol: Interspecies comparisons and metabolic pathway refinement. Toxicol. Sci. 100(2):333-344.
Nakayama, K., Iwata, H., Tao, L., Kannan, K., Imoto, M., Kim, E.-Y., Tashiro, K., Tanabe, S. 2008. Potential effects of perfluorinated compounds in common cormorants from Lake Biwa, Japan: an implication from the hepatic gene expression profiles by microarray. Environ. Toxicol. Chem. 27:2378-2386.
Nilsson, H., Kärrman, A., Westberg, H., Rotander, A., Van Bavel, B., Lindström. G. 2010. A time trend study of significantly elevated perfluorocarboxlate levels in humans after using fluorinated ski wax. Environ. Sci. Technol.44(6):2150-2155.
O’Connell, S.G., Arendt, M., Segars, A., Kimmel, T., Braun-McNeil, J., Avens, L., Schroeder, B., Ngai, L., Kucklick, J.R., Keller, J. 2010. Temporal and spatial trends of perfluorinated compounds in juvenile loggerhead sea turtles (Caretta caretta) along the east cost of the United States. Environ. Sci. Technol. 44:5202-5209.
[OCDE] Organisation de coopération et de développement économiques. 2007. Lists of PFOS, PFAS, PFOA, PFCA, related compounds and chemicals that may degrade to PFCA (as revised in 2007). Paris : OCDE. ENV/JM/MONO (2006)15.
Poland, J.S., Mitchell, S., Rutter, A. 2001. Remediation of former military bases in the Canadian Arctic. Cold Regions Sci. Technol. 32:93-105.
Powley, G.R., George, S.W., Russell, M.H., Hoke, R.A., Buck, R.C. 2008. Polyfluorinated chemicals in a spatially and temporally integrated food web in the Western Arctic. Chemosphere70:664-672.
Prevedouros, K., Cousins, I.T., Buck, R.C., Korzeniowski, S.H. 2006. Sources, fate, and transport of perfluorocarboxylates. Environ. Sci. Technol. 40:32-44.
Scott, B.F., Spencer, C., Moody, C.A., Martin, J.W., Mabury, S.A., Mactavish, D., Muir, D.C.G. 2003. Determination of perfluoroalkanoic acids in the aquatic environment. Présentation lors de la SETAC Europe 23rd Annual Meeting, Hambourg (Allemagne).
Scott, B.F., Moody, C.A., Spencer, C., Small, J.M., Muir, D.C.G., Mabury, S.A. 2006a. Analysis for perfluorocarboxylic acids/anions in surface waters and precipitation using GC-MS and analysis of PFOA from large-volume samples. Environ. Sci. Technol. 40:6405-6410.
Scott, B.F., Spencer, C., Mabury, S.A., Muir, D.C.G. 2006b. Poly and perfluorinated carboxylates in North American precipitation. Environ. Sci. Technol. 40(23):7167-7174.
Scott, B.F., Spencer, C., Lopez, E., Muir, D.C.G. 2009. Perfluorinated alkyl acid concentrations in Canadian rivers and creeks. Water Qual. Res. J. Can. 44(3):263-277.
Shoeib, M., Harner, T., Wilford, B.H., Jones, K.C., Zhu, J. 2005. Polyfluorinated compounds in the home: levels in air and dust and human exposure. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Shoeib, M., Harner, T., Vlahos, P. 2006. Perfluorinated chemicals in the Arctic atmosphere. Environ. Sci. Technol. 40(24):7577-7583.
Sigma-Aldrich Canada Ltd. 2004. Material Safety Data Sheet: Nonadecafluorodecanoic acid, code produit 177741. Oakville (Ont.)
Simcik, M.F., Dorweiler, K.J. 2005. Ratio of perfluorochemical concentrations as a tracer of atmospheric deposition to surface waters. Environ. Sci. Technol. 39:8678-8683.
Sinclair, E., Kannan, K. 2006. Mass loading and fate of perfluoroalkyl surfactants in wastewater treatment plants. Environ. Sci. Technol. 40(5):1408-1414.
Sinclair, E., Kim, S.K., Akinleye, H.B., Kannan, K. 2007. Quantitation of gas-phase perfluoroalkyl surfactants and fluorotelomer alcohols released from nonstick cookware and microwave popcorn bags. Environ. Sci. Technol.41(4):1180-1185.
Smithwick, M., Mabury, S.A., Solomon, K.R., Sonne, C., Martin, J.W., Born, E.W., Dietz, R., Derocher, A.E., Letcher, R.J., Evans, T.J., et al. 2005a. Circumpolar study of perfluoroalkyl contaminants in polar bears (Ursus maritimus). Environ. Sci. Technol. 39:5517-5523.
Smithwick, M., Muir, D.C.G., Mabury, S.A., Solomon, K.R., Martin, J.W., Sonne, C., Born, E.W., Letcher, R.J., Dietz, R. 2005b. Perflouroalkyl contaminants in liver tissue from east Greenland polar bears (Ursus maritimus). Environ. Toxicol. Chem. 24:981-986.
Smithwick, M., Norstrom, R.J., Mabury, S.A., Solomon, K., Evans, T.J., Stirling, I., Taylor, M.K., Muir, D.C.G. 2006. Temporal trends of perfluoroalkyl contaminants in polar bears (Ursus maritimus) from two locations in the North American Arctic, 1972-2002. Environ. Sci. Technol. 40(4):1139-1143.
So, M.K., Taniyasu, S., Yamashita, N., Giesy, J.P., Zheng, J., Fang, Z., Im, S.H., Lam, P.K. 2004. Perfluorinated compounds in coastal waters of Hong Kong, South China, and Korea. Environ. Sci. Technol. 38(15):4056-4063.
Sonne, C., Bossi, R., Dietz, R., Leiffson, P.S., Rigét, F.F., Born, E.W. 2007. Potential correlation between perfluorinated acids and liver morphology in east Greenland polar bears (Ursus maritimus). Toxicol. Environ. Chem. 90(2):275-283.
Stern, G.A. 2009. Temporal trend studies of trace metals and halogenated organic contaminants (HOCs), including new and emerging persistent compounds, in Mackenzie River burbot, Fort Good Hope, NWT. In : Smith, S., Stow, J., Edwards, J. (éd.). Synopsis of research conducted under the 2008-2009 Northern Contaminants Program. Ottawa (Ont.) : Affaires indiennes et du Nord Canada. p. 164-171.
Stevenson, C.N., MacManus-Spencer, L.A., Luckenbach, T., Luthy, R.G., Epel, D. 2006. New perspectives on perfluorochemical ecotoxicology: inhibition and induction of an efflux transporter in the marine mussel, Mytilus californianus. Environ. Sci. Technol. 40:5580-5585.
Stevenson, R. 2006. DRAFT State of the science review of the bioaccumulation of non C8 perfluorocarboxylic acids (PFCAs). Environnement Canada.
Stock, N.L., Muir, D.C.G., Mabury, S.A. 2005. Temporal trends of polyfluorinated sulphonamides and telomer alcohols in Toronto: results of a long-term sampling campaign. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Stock, N.L., Furdui, V.I., Muir, D.C.G., Mabury, S.A. 2007. Perfluoroalkyl contaminants in the Canadian Arctic: evidence of atmospheric transport and local contamination. Environ. Sci. Technol. 41:3529-3536.
Stow, J.P., Sova, J., Reimer, K.J. 2005. The relative influence of distant and local (DEW-line) PCB sources in the Canadian Arctic. Sci. Tot. Environ. 342:107-118.
Strynar, M.J., Lindstrom, A.B. 2005. Perfluorinated compounds in archived house dust samples. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005.
Taniyasu, S., Kannan, K., So, M.K., Gulkowska, A., Sinclair, E., Okazawa, T., Yamashita, N. 2005. Analysis of fluorotelomer alcohols, fluorotelomer acids, and short- and long-chain perfluorinated acids in water and biota. J. Chromatog. A1093(1-2):89-97.
Tominaga, N., Kohra, S., Iguchi, T., Arizono, K. 2004. Effects of perfluoro organic compound toxicity on nematode Caenorhabditis elegans fecundity. J. Health Sci.50:545-550.
Tomy, G., Pleskach, K., Rosenberg, B., Stern, G. 2009a. Temporal trends of halogenated chemicals of emerging concern in beluga whales (Delphinapterus leucas) from Hendrickson Island and Pangnirtung. In : Smith, S., Stow, J., Edwards, J. (éd.). Synopsis of research conducted under the 2008-2009 Northern Contaminants Program. Ottawa (Ont.) : Affaires indiennes et du Nord Canada. p. 99-107.
Tomy, G., Rosenberg, B., Pleskach, K., Fisk, A., Ferguson, S., Muir, D., Marvin, C. 2009b. Trophodynamics of some BFRs, PFCs current use pesticides and legacy persistent organic pollutants in a marine food web from Cumberland Sound. In : Smith, S., Stow, J., Edwards, J. (éd.). Synopsis of research conducted under the 2008-2009 Northern Contaminants Program. Ottawa (Ont.) : Affaires indiennes et du Nord Canada. p. 209-214.
Tomy, G.T., Pleskach, K., Ferguson, S.H., Hare, J., Stern, G., MacInnis, G., Marvin, C.H., Loseto, L. 2009c. Trophodynamics of some PFCs and BFRs in a western Canadian Arctic marine food web. Environ. Sci. Technol. 43:4076-4081.
Tseng, C.-L., Liu, L.-L., Chen, C.-M., Ding, W.-H. 2006. Analysis of perfluorooctanesulfonate and related fluorochemicals in water and biological tissue samples by liquid-chromatography-ion trap mass spectrometry. J. Chromatog. A1105(1-2):119-126.
van de Vijver, K.I., Hoff, P.T., Das, K., Van Dongen, W., Esmans, E.L., Jauniaux, T., Bouquegneau, J.M., Blust, R., De Coen, W. 2003. Perfluorinated chemicals infiltrate ocean waters: link between exposure levels and stable isotope ratios in marine mammals. Environ. Sci. Technol. 37:5545-5550.
van de Vijver, K.I., Hoff, P.T., Das, K., Van Dongen, W., Esmans, E.L., Sieber, U., Bouquegneau, J.M., Blust, R., De Coen, W.M. 2004. Baseline study of perfluorochemicals in harbour porpoises (Phocoena phocoena) from northern Europe. Mar. Pollut. Bull. 48:986-1008.
van de Vijver, K.I., Hoff, P., Das, K., Brasseur, S., Van Dongen, W., Esmans, E., Reijnders, P., Blust, R., De Coen, W. 2005. Tissue distribution of perfluorinated chemicals in harbor seals (Phoca vitulina) from the Dutch Wadden Sea. Environ. Sci. Technol. 39:6878-6884.
van de Vijver, K.I., Holsbeek, L., Das, K., Blust, R., Joiris, C., De Coen, W. 2007. Occurrence of perfluorooctane sulfonate and other perfluorinated alkylated substances in harbour porpoises from the Black Sea. Environ. Sci. Technol. 41:315-320.
van den Heuvel-Greve, M., Leonards, P., Brasseur, S., Kotterman, M., Zabel, A., Vethaak, D. 2009. Bioaccumulation of perfluorinated compounds in a harbour seal food web of the Westerschelde, the Netherlands: a field study. Présentation lors de la SETAC North America, 30th Annual Meeting, Nouvelle-Orléans (LA).
van Leeuwen, S.P.J., Kärrman, A., Van Bavel, B., De Boer, J., Lindstrom, G. 2006. Struggle for quality in determination of perfluorinated contaminants in environmental and human samples. Environ. Sci. Technol. 40(24):7854-7860.
Verreault, J., Houde, M., Gabrielsen, G.W., Berger, U., Haukäs, M., Letcher, R.J., Muir, D.C.G. 2005. Perfluorinated alkyl substances in plasma, liver, brain, and eggs of glaucous gulls (Larus hyperboreus) from the Norwegian Arctic. Environ. Sci. Technol. 39(19):7439-7445.
Verreault, J., Berger, U., Gabrielsen, G.W. 2007. Trends of perfluorinated alkyl substances in herring gull eggs from two coastal colonies in northern Norway: 1983-2003. Environ. Sci. Technol. 41(19):6671-6677.
Wang, J., Ober, C.K. 1999. Solid state crystalline and liquid crystalline structure of semifluorinated 1-bromoalkane compounds. Liq. Cryst. 26:637.
Wang, N., Szostek, B., Buck, R.C., Folsom, P.W., Sulecki, L.M., Capka, V., Berti, W.R., Gannon, J.T. 2005a. Fluorotelomer alcohol biodegradation – direct evidence that perfluorinated carbon chains break down. Environ. Sci. Technol.39:7516-7528.
Wang, N., Szostek, B., Folsom, P.W., Sulecki, L.M., Capka, V., Buck, R.C., Berti, W.R., Gannon, J.T. 2005b. Aerobic biotransformation of 14C-labeled 8-2 telomer B alcohol by activated sludge from a domestic sewage treatment plant. Environ. Sci. Technol. 39:531-538.
Wang, Y., Yeung, L.W.Y., Taniyasu, S., Yamashita, N., Lam, J.C.W., Lam, P.K.S. 2008. Perfluorooctane sulfonate and other fluorochemicals in waterbird eggs from South China. Environ. Sci. Technol. 42:8146-8151.
Wallington, T.J., Hurley, M.D., Xia, J., Wuebbles, D.J., Sillman, S., Ito, A., Penner, J.E., Ellis, D.A., Martin, J., Mabury, S.A., et al. 2006. Formation of C7F15COOH (PFOA) and other perfluorocarboxylic acids during the atmospheric oxidation of 8:2 fluorotelomer alcohol. Environ. Sci. Technol. 40:924-930.
Wania, F. 2007. A global mass balance analysis of the source of perfluorocarboxylic acids in the Arctic Ocean. Environ. Sci. Technol. 41:4529-4535.
Washburn, S.T., Bingman, T.S., Braithwaite, .S.K, Buck, R.C., Buxton, L.W., Clewell, H.J., Haroun, L.A., Kester, J.E., Rickard, R.W., Shipp, A.M., 2005. Exposure assessment and risk characterization for perfluorooctanoate in selected consumer articles. Environ. Sci. Technol. 39(11):39043910.
Washington, J.W., Yoo, H., Ellington, J.J., Jenkins, T.M., Libelo, L. 2010. Concentrations, distribution and persistence of perfluoroalkylates in sludge-applied soils near Decatur, Alabama, USA. Environ. Sci. Technol. 44(22):8390-8396.
Waterland, R.L., Gannon, J., Kaiser, M.A., Botelho, M.A., Harding, T.W., Ellison, G.B., Vaida, V., Tuck, A.F., Murphy, D.M. 2005. Global transport of biogenic and anthropogenic surfactants on marine aerosols. Fluoros International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005. Présentation ENV016.
Webster, E., Ellis, D.A. 2010. Potential role of sea spray generation in the atmospheric transport of perfluorocarboxylic acids. Environ. Toxicol. Chem. 29(8):1703-1708.
Webster, E.M., Ellis, D.A. 2011. Equilibrium modelling: pathway to understanding observed perfluorocarboxylic and perfluorosulfonic acid behaviour. Environ. Toxicol. Chem. (publié en ligne 27 juillet 2011).
Yamashita, N., Kannan, K., Taniyasu, S., Horii, Y., Okazawa, T., Petrick, G., Gamo, T. 2004. Analysis of perfluorinated acids at parts-per-quadrillion levels in seawater using liquid chromatography-tandem mass spectrometry.Environ. Sci. Technol. 38(21):5522-5528.
Yamashita, N., Kannan, K., Taniyasu, S., Horii, Y., Patrick, G., Gamo, T. 2005. A global survey of perfluorinated acids in oceans. Mar. Pollut. Bull. 51:658-668.
Yeung, L.W.Y., Loi, E.I.H., Wong, V.Y.Y., Guruge, K.S., Yamanaka, N., Tanimura, N., Hasegawa, J., Yamashita, N., Miyazaki, S., Lam, P.K.S. 2009a. Biochemical responses and accumulation properties of long-chain perfluorinated compounds (PFOS/PFDA/PFOA) in juvenile chickens (Gallus gallus). Arch. Environ. Contam. Toxicol. 57:377-386.
Yeung, L.W.Y., Miyake, Y., Peng, L., Taniyasu, S., Kannan, K., Guruge, K.S., Lam, P.K.S., Yamashita, N. 2009b. Comparison of total fluorine, extractable organic fluorine and perfluorinated compounds in the blood of wild and perfluorooctanoate (PFOA)–exposed rats: evidence for the presence of other organofluorine compounds. Anal. Chim. Acta 635:108-114.
Yeung, L.W.Y., Miyake, Y., Wang, Y., Taniyasu, S., Yamashita, N., Lam, P.K.S. 2009c. Total fluorine, extractable organic fluorine, perfluorooctane sulfonate and other related fluorochemicals in liver of Indo-Pacific humpback dolphins (Sousa chinensis) and finless porpoises (Neophocaena phocaenoides) from South China. Environ. Pollut. 157:17-23.
Yoo, H., Kannan, K., Kim, S.K., Lee, K.T., Newsted, J.L., Giesy, J.P. 2008. Perfluoroalkyl acids in the egg yolk of birds from Lake Shihwa, Korea. Environ. Sci. Technol. 42:5821-5827.
Yoo, H., Washington, J.W., Ellington, J.J., Jenkins, T.M., Neill, M.P. 2010. Concentrations, distribution and persistence of fluorotelomer alcohols in sludge-applied soils near Decatur, Alabama. Environ. Sci. Technol. 44(22):8397-8402.
Young, C.J., Furdui, V.I., Franklin, J., Koerner, R.M., Muir, D.C.G., Mabury, S.A. 2007. Perfluorinated acids in Arctic snow: new evidence for atmospheric formation. Environ. Sci. Technol.41:3455-3461.
Annexe 1 : Liste des APFC à longue chaîne (C9 à C20), de leurs sels et de leurs précurseurs (cette liste n’est pas exhaustive)
| Numéro CAS | Nom chimique | Type d’APF |
|---|---|---|
| 65530-63-4 | 2,2’-iminodiéthanol, composé (2:1) avec le a-fluoro-?-[2-(phosphonooxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Fluorophosphate |
| 375-95-1 | Acide heptadécafluorononan-1-oïque | APFC à longue chaîne (Absent de la LIS) |
| 335-76-2 | Acide nonadécafluorodécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 2058-94-8 | Acide hénéicosafluoroundécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 307-55-1 | Acide tricosafluorododécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 72629-94-8 | Acide pentacosafluorotridécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 376-06-7 | Acide heptacosafluorotétradécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 141074-63-7 | Acide nonacosafluoropentadécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 67905-19-5 | Acide perfluoropalmitique | APFC à longue chaîne |
| 57475-95-3 | Acide perfluoroheptadécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 16517-11-6 | Acide perfluorostéarique | APFC à longue chaîne (Absent de la LIS) |
| 133921-38-7 | Acide perfluorononadécanoïque | APFC à longue chaîne (Absent de la LIS) |
| 68310-12-3 | Acide nonatriacontafluoroéicosanoïque | APFC à longue chaîne (Absent de la LIS) |
| 65530-64-5 | 2,2’-iminodiéthanol, composé (1:1) avec l’a,a’-[phosphinicobis(oxyéthylène)]bis[?-fluoropoly(difluorométhylène)] | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-69-0 | a-[2-[(2-carboxyéthyl)thio]éthyl]-?-fluoropoly(difluorométhylène), sel de lithium | Précurseur d’APFC > 8 Fluorothioéther |
| 65530-70-3 | a,a’-[phosphinicobis( oxyéthylène)]bis[?-fluoropoly(difluorométhylène)], sel d’ammonium | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-71-4 | a-fluoro-?-[2-(phosphonooxy)éthyl]poly(difluorométhylène), sel de monoammonium | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-72-5 | a-fluoro-?-[2-(phosphonooxy)éthyl]poly(difluorométhylène), sel de diammonium | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-74-7 | 2,2’-iminodiéthanol, composé (1:1) avec l’a-fluoro-?- [2-(phosphonooxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Fluorophosphate |
| 65530-83-8 | a-[2-[(2-carboxyéthyl)thio]éthyl]-?-fluoropoly(difluorométhylène) | Précurseur d’APFC > 8 Fluorothioéther |
| 65545-80-4 | Éther d’a-hydro-?-hydroxypoly(oxyéthylène) (1:1) avec l’a-fluoro-?- (2-hydroxyéthyl)poly(difluorométhylène) | Précurseur d’APFC > 8 Dérivé d’alcool fluoré |
| 68187-25-7 | Acides N-[3-(diméthylamino)propyl]-2(ou3)-[(?-?-perfluoro- C6-20-alkyl)thio]succinamiques | Précurseur d’APFC > 8 Fluorothioéther |
| 68187-47-3 | Acide 2-méthylpropane-1-sulfonique, dérivés 2-{[(?-?-perluoroalkyl en C4-16) thio]propionamidés}, sel de sodium | Précurseur d’APFC > 8 Fluorothioéther |
| 68391-08-2 | ?-?-perfluoroalcools en C8-14 | Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 68412-68-0 | Dérivés perfluoroalkyles en C6-12 de l’acide phosphonique | Précurseur d’APFC > 8 Fluorophosphate |
| 68412-69-1 | Dérivés bis(perfluoroalkyle en C6-12) de l’acide phosphinique | Précurseur d’APFC > 8 Fluorophosphate |
| 68891-05-4 | Citrate d’a-fluoro-?-(2-hydroxyéthyl)poly(tétrafluoroéthylène), produits de réaction avec le diisocyanate d’hexane-1,6-diyle | Précurseur d’APFC > 8 |
| 86508-42-1 | Composés perfluorés en C5-18 | Précurseur d’APFC > 8 |
| 865-86-1 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,12-hénéicosafluorododécanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 2144-54-9 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,12-hénéicosafluorododécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 4980-53-4 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,16-nonacosafluorohexadécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 6014-75-1 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 17741-60-5 | Acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,12-hénéicosafluorododécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 39239-77-5 | 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 59778-97-1 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,17,17, 18,18,18-tritriacontafluorooctadécyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 60699-51-6 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,16-nonacosafluorohexadécanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 65104-65-6 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,17,17, 18,18,19,19,20,20,20-heptatriacontafluoroéicosanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 65104-66-7 | Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,17,17, 18,18,19,19,20,20,20-heptatriacontafluoroéicosyle |
Précurseur d’APFC > 8 Fluoroacrylate |
| 65104-67-8 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,17,17, 18,18,18-tritriacontafluorooctadécanol |
Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 115592-83-1 | Acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,12-hénéicosafluorododécyle polymérisé avec l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9, 9,10,10,10-héptadécafluorodécyle, l’acrylate d’hexadécyle, le N-(hydroxyméthyl)acrylamide et l’acrylate d’octadécyle, l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécyle et l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,8-tridécafluorooctyle |
Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 85631-54-5 | Acide propène-2-oïque, esters de ?-?-perfluoro-alkyles en C8-14 | Précurseur d’APFC > 8 Fluoroacrylate |
| 144031-01-6 | Acrylate de dodécyle, polymérisé avec le (1-oxopropén-2-yl)carbamate de butyle et l’acrylate de ?-?-perfluoro-C8-14-alkyle | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 65530-59-8 | a-fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), 2-hydroxypropane-1,2,3-tricarboxylate (3:1) | Précurseur d’APFC > 8 Fluorocarboxylate |
| 65530-66-7 | a-fluoro-?-[2- (méthacryloyloxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Fluoroacrylate |
| 65605-56-3 | a-fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), 2-hydroxypropane-1,2,3-tricarboxylate diacide | Précurseur d’APFC > 8 Fluorocarboxylate |
| 65605-57-4 | a-fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), 2-hydroxypropane-1,2,3-tricarboxylate acide | Précurseur d’APFC > 8 Fluorocarboxylate |
| 65605-58-5 | Méthacrylate de dodécyle polymérisé avec l’a-fluoro-?-[2-(méthacryloyloxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 65605-70-1 | a-fluoro-?-{2-[(1-oxopropén-2-yl)oxy]éthyl}poly(difluorométhylène) | Précurseur d’APFC > 8 Fluoroacrylate |
| 65636-35-3 | Sulfate de N,N-diéthyl-2-(méthacryloyloxy)-N-méthyléthanaminium et de méthyle, polymérisé avec le méthacrylate de 2-éthylhexyle, l’a-fluoro-?-[2-(méthacryloyloxy)éthyl]poly(difluorométhylène), le méthacrylate de 2-hydroxyéthyle et le N-(hydroxyméthyl)acrylamide | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 68239-43-0 | Méthacrylate de 2-éthylhexyle polymérisé avec l’a-fluoro-?-[2-(méthacryloyloxy)éthyl]poly(difluorométhylène), le méthacrylate de 2-hydroxyéthyle et le N-(hydroxyméthyl)acrylamide | Précurseur d’APFC > 8 |
| 71002-41-0 | Hydroxyde d’a-{2-acétoxy-2-[(carboxyméthyl)diméthylammonio]éthyl}-?-fluoropoly (difluoroéthylène), sel interne | Précurseur d’APFC > 8 Dérivé d’alcool fluoré |
| 110053-43-5 | 1,3,5-tris(6-isocyanatohexyl)biuret, produits de réaction avec le 3-chloropropane-1,2-diol et l’a-fluoro-?-(2-ydroxyéthyl)poly(difluorométhylène) | Précurseur d’APFC > 8 Fluorouréthane |
| 123171-68-6 | a-{2-acétoxy-3-[(carboxyméthyl)diméthylammonio]propyl}-?-fluoropoly(difluorométhylène), hydroxyde, sel interne | Précurseur d’APFC > 8 Dérivé d’alcool fluoré |
| 125328-29-2 | Méthacrylates d’alkyles en C10-16, polymérisés avec le méthacrylate de 2-hydroxyméthyle, le méthacrylate de méthyle et un acrylate de perfluoro-C8-14-alkyle | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 129783-45-5 | Acide méthacrylique, esters d’alkyles en C10-16, polymérisés avec le méthacrylate de 2-hydroxyéthyle, le méthacrylate de méthyle et l’acrylate de ?-?-perfluoroalkyles en C8-14 | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 148878-17-5 | Méthacrylates d’alkyles en C2-18polymérisés avec l’a-fluoro-?-[2-(acryloyloxy)éthyl]poly(difluorométhylène) et le chlorure de vinylidène | Précurseur d’APFC > 8 Fluoroester (Absent de la LIS) |
| 70983-60-7 | 2-hydroxy-N,N,N-triméthylpropan-1-aminium, dérivés 3-{[?-?-perfluoro(C6-20-alkyle)]thio}, chlorures | Précurseur d’APFC > 8 (Absent de la LIS) |
| 148240-84-0 | Dérivés 2,2-bis[[(?-?-perfluoro-C4-10-alkyl)thio]méthyle] de 1,3-propanediol, phosphates | Précurseur d’APFC > 8 (Absent de la LIS) |
| 203743-03-7 | Méthacrylate d’hexadécyle polymérisé avec le méthacrylate de 2-hydroxyéthyle, l’acrylate de ?-?-perfluoroalkyle en C10-16 et le méthacrylate de stéaryle | Précurseur d’APFC > 8 (Absent de la LIS) |
| 277752-44-0 | Acide 6-[(di-2-propénylamino)carbonyl](1R, 6R)-3-cyclohexène-1-carboxylique, produits de réaction avec le télomère pentafluoriodoéthane-tétrafluoroéthylène, sels d’ammonium | Précurseur d’APFC > 8 (Absent de la LIS) |
| 333784-46-6 | Polymère greffé de copolymère méthacrylate d’alkyle-anhydride maléique-méthacrylate de 2-[[((mercaptoéthyl)oxy)carbonyl]amino)éthyle et de copolymère méthacrylate d’octadécyle-acrylate de 2-(perfluoro(alkyl(C=6,8,10,12,14)))éthyle | Précurseur d’APFC > 8 (Absent de la LIS) |
| 333784-44-4 | Poly[méthacrylate de 3-chloro-2-hydroxypropyle, méthacrylate de 2,3- dihydroxypropyle, méthacrylate de hydroxypoly(2-23)(oxypropylène), méthacrylate de méthoxypoly(2-23)(oxyéthylène), acrylate de 2-(perhalo(alkyl(C=6,8,10,12,14)))] | Précurseur d’APFC > 8 (Absent de la LIS) |
| 70983-59-4 | a-méthyl-?-hydroxypoly(oxyéthylène), éthers 2-hydroxy-3-[( ?-?-perfluoro-C6-20-alkyl)thio]propyliques | Précurseur d’APFC > 8 (Absent de la LIS) |
| A11863-1 | Acrylate de poly(acrylate d’alkyle-co-2-[perfluoro(alkyl(C=6,8,10,12,14))])éthyle-co-hydroxyméthylcarbamoyléthylène-co-(méthacrylate de 3-chloro-2-hydroxypropyle)-co-(méthacrylate de 2,3 époxypropyle)-co-(méthacrylate de 2-éthylhexyle) | Précurseur d’APFC > 8 |
| A13216-4 | Méthacrylate d’hexadécyle, polymérisé avec l’a-fluoro-[2-[(1-oxo-2-propényl)oxy]éthyl]poly(difluorométhylène), le 2-propénoate d’octadécyle, le 1,1-dichloroéthane, le 2-méthyl-2-propénoate de 2-hydroxyéthyle, le N-(hydroxyméthyl)-2-propénamide et l’a-(2-méthyl-1-oxo-2-propényl)-hydroxypoly(oxy-1,2-éthanediyle) | Précurseur d’APFC > 8 |
| A13498-7 | Produit de la réaction de polymérisation de l’a-fluoro-?-[2-{(2-méthyl-1-oxo-2-propényl)-oxy}éthyl]poly(difluorométhylène), du méthacrylate de (diéthylamino)éthyle, de l’acide éthanoïque et du 2,2’-azobis(2,4-diméthylvaléronitrile) | Précurseur d’APFC > 8 |
| A13887-0 | 1,6-diisocyanatohexane, produit de la réaction de polymérisation avec l’a fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), l’a-méthyl-?-hydroxypoly(oxy-1,2-éthanediol) et l’eau | Précurseur d’APFC > 8 |
| A14064-6 | Copolymère acrylate d’alkyle-acrylate de perfluoroalkyléthyle-dérivé d’acide alkylacrylique substitué-dérivé d’acide méthacrylique alkylé-halogénure de vinyle | Précurseur d’APFC > 8 |
| A15736-4 | Acrylates de ?-?-perfluoro-alkyles en C8-14, polymérisés avec du méthacrylate de perfluoro(C6-C12)alkyléthyle, du stéarylacrylate, de la N-méthylolméthacrylamine, du glycidylméthacrylate et du chlorure de vinylidène | Précurseur d’APFC > 8 |
| No CAS non déterminé | Trichloro(perfluoroalkyléthyl)silane | Précurseur d’APFC > 8 |
| s.o.2 | 2-oxépanone, polymérisé avec du 2,4-diisocyanato-1-méthylbenzène, du méthyloxirane et de l’oxirane, séquencé, du 1-décanol et de la 1H-imidazole-1-propanamine et des ?-?-perfluoroalcools en C8-14 séquencés | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 34395-24-9 | Acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécyle |
Précurseur d’APFC > 8 Polymère de fluoroacrylate (Absent de la LIS) |
| 174125-96-3 | Méthacrylate de 2-(diméthylamino)éthyle, polymérisé avec l’acrylate de d-?-perfluoroalkyle en C10-16 et l’acétate de vinyle | Précurseur d’APFC > 8 (Absent de la LIS) |
| 182700-77-2 | Siloxanes et silicones, diméthyl-, terminés avec un groupement hydroxy, polymérisés avec l’acide tétradécanedioïque, terminés avec le 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13-tricosafluorotridécan-1-ol |
Précurseur d’APFC > 8 (Absent de la LIS) |
| 118102-37-7 | ?-?-perfluoroalcools en C8-14, produits de réaction avec l’épichlorhydrine, l’éther polyéthylène glycol monométhylique et le diamide N,N’,2-tris(6-isocyanatohexyl)imidodicarbonique | Précurseur d’APFC > 8 (Absent de la LIS) |
| 118102-38-8 | ?-?-perfluoroalcools en C8-14, produits de réaction avec l’épichlorhydrine, le tétrahydrofurane homopolymérisé et le diamide N,N’,2-tris(6-isocyanatohexyl)imidodicarbonique diamide | Précurseur d’APFC > 8 (Absent de la LIS) |
| 119973-85-2 | 2-méthacrylate de 3-chloro-2-hydroxypropyle polymérisé avec l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,12-hénéicosafluorododécyle, l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,10- heptadécafluorodécyle, le N-(hydroxyméthyl)acrylamide, l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,15,15,16,16,16-nonacosafluorohexadécyle, l’acrylate d’octadécyle et l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,11,11,12,12,13,13, 14,14,14-pentacosafluorotétradécyle |
Précurseur d’APFC > 8 Polymère de fluoroacrylate (Absent de la LIS) |
| 178233-67-5 | Acrylate d’hexahydroperfluoroalkyle en C6-12 polymérisé avec l’acrylate de lauryle et l’acroylbutyluréthane | Précurseur d’APFC > 8 Polymère de fluoroacrylate (Absent de la LIS) |
| 178535-23-4 | Esters d’acides gras d’huile de lin et de ?-?-perfluoroalkyles en C8-14 | Précurseur d’APFC > 8 Autres polymères (Absent de la LIS) |
| s.o. | Esters d’acides gras d’huile de canola et de ?-?-perfluoroalkyles en C8-14 | Précurseur d’APFC > 8 Autres polymères |
| s.o. | Esters d’acides gras d’huile de soja et de ?-?-perfluoroalkyles en C8-14 | Précurseur d’APFC > 8 Autres polymères |
| s.o. | Poly{styrène-co-{bis{3-[perfluoroalkyl(C=6,8,10,12,14,16)]-2-hydroxypropyl} maléate}-co-(méthacrylate d’éthyle)-co-(méthacrylate d’éthyle)} | Précurseur d’APFC > 8 Autres polymères |
| s.o. | Poly(acrylate d’octadécyle)-co-acrylate de 2-[perfluoro[alkyl(C=6,8,10,12,14)]]éthyle-co-hydroxyméthylcarbamoyléthylène-co-(méthacrylate de 3-chloro-2-hydroxypropyle)-co-chlorure de vinyle | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| s.o. | (Diméthyl)(hydrogénométhyl)polysiloxanes, produit de réaction avec des alcools en C8-14 et l’éther monoéthylique d’a-?-perfluoropolyéthylèneglycol | Précurseur d’APFC > 8 Alcool fluorotélomérique |
| s.o. | (Diméthyl)(hydrogénométhyl)polysiloxanes, produit de réaction avec des alcools en C8-14, l’éther monoéthylique d’a-?-perfluoropolyéthylèneglycol et le 1-octène | Précurseur d’APFC > 8 Alcool fluorotélomérique |
| 375-95-1 | Acide heptadécafluorononan-1-oïque | APFC > 8 Acide perfluorocarboxylique (Absent de la LIS) |
| 4149-60-4 | Acide heptadécafluorononanoïque, sel d’ammonium | APFC > 8 Acide perfluorocarboxylique (Absent de la LIS) |
| s.o.2 | Acrylate de butyle, polymérisé avec l’acide 2-propénoïque, l’acrylate de 2-hydroxyéthyle, des esters de perfluoroalkyles en C8-14 et le 2-(diméthylamino)éthanol | Précurseur d’APFC > 8 Fluoroester |
| s.o.2 | 1,6-diisocyanatohexane, produit de la réaction de polymérisation avec l’a fluoro-?-(2-hydroxyéthyl)poly(difluorométhylène), l’a-méthyl-?-hydroxypoly(oxy-1,2-éthanediol) et l’eau | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 65530-65-6 | a-fluoro-?-[2-stéaroyloxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Fluoroester (Absent de la LIS) |
| 65605-59-6 | Méthacrylate de dodécyle polymérisé avec l’a-fluoro-?-[2-(méthacryloyloxy)éthyl]poly(difluorométhylène) et le N-(hydroxyméthyl)acrylamide | Précurseur d’APFC > 8 Fluoroester (Absent de la LIS) |
| LIS 132164 | Acrylate d’hexadécyle, polymérisé avec l’a-fluoro-?-[2-((1-oxo-2-propényl)oxy)éthyl]poly(difluorométhylène), l’acrylate d’octadécyle, le 1,1-dichloroéthane, le méthacrylate d’hydroxyéthyle et le 2-propénamide | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| 126927-97-7 | 1,6-diisocyanatohexane homopolymérisé, produits de réaction avec l’a-fluoro-? (2-hydroxyéthyl)poly(difluorométhylène) | Précurseur d’APFC > 8 Autres polymères (Absent de la LIS) |
| LIS 132175 | Oxime de 2-butanone, produit de la réaction de polymérisation avec le 1,6-diisocyanatohexane, l’a-fluoro-?-(2-hydroxyéthyl)poly(diflurométhylène), l’a-méthyl-?-hydroxypoly(oxy-1,2-éthanediyle) et l’eau | Précurseur d’APFC > 8 Autres polymères |
| s.o. | 1,1-dichloroéthène, polymérisé avec le 2-propénoate de 2-éthylhexyle et l’a fluoro-?-[2[(2-méthyl-1-oxo-2-propényl)oxy]éthyl]poly(difluorométhylène) | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| s.o. | Diamide N,N’2-tris(6-isocyanatohexyl)imidodicarbonique, a-fluoro-?-(2 hydroxyéthyl)poly(difluorométhylène), oxiraneméthanol et adduit de 1-octadécanol | Précurseur d’APFC > 8 |
| s.o. | Produit de la réaction de polymérisation de l’a-fluoro-?-[2-[méthyl-1-oxo-2-propényl)oxy]éthyl]poly(difluorométhylène), du méthacrylate de (diéthylamino)éthyle, de l’acide éthanoïque et du 2,2’-azobis[2,2’-azobis(2,4-diméthylvaleronitrile)] | Précurseur d’APFC > 8 Polymère de fluoroacrylate |
| s.o. | 1,6-diisocyanatohexane, produit de la réaction de polymérisation avec l’a fluoro-?-(2-hydroxyéthyl)poly(difluorométhylidène), l’a-méthyl-?-hydroxypoly(oxy-1,2-éthanediol) et l’eau | Précurseur d’APFC > 8 |
| s.o. | acide 2-propénoïque, acide butylique, ester 2-hydroxyéthylique, esters de perfluoroalkyles en C8-14et 2-(diméthylamino)éthanol | Précurseur d’APFC > 8 |
| s.o. | a-fluoro-?-[2-[(2-méthyl-1-oxo-2-propényl)oxy]éthyl]poly(difluorométhylène), polymérisé avec le méthacrylate de 2-éthylhexyle et le chlorure de vinylidène | Précurseur d’APFC > 8 |
| 678-39-7 | 3,3,4,4,5,5,6,6,7,7,8,8,9,9, 10,10,10-heptadécafluorodécan-1-ol |
Précurseur d’APFC à longue chaîne |
| 65530-61-2 | a-fluoro-?-[2-(phosphonooxy)éthyl]poly(difluorométhylène) | Précurseur d’APFC à longue chaîne |
| 70969-47-0 | ?-?-perfluorothiols en C8-20télomérisés avec l’acrylamide | Précurseur d’APFC à longue chaîne |
Annexe 2 : Identification des précurseurs d’APFC à longue chaîne
Annexe 2 : Identification des précurseurs d’APFC à longue chaîne - Diagramme : Question 1 : Le produit chimique est-il une substance perfluorée contenant un dérivé ou un polymère de perfluoroalcool, de perfluoroamine, d’acide perfluorocarboxylique, de perfluoroester (y compris l’ester de perfluoroacrylate), de perfluoroéther, de perfluoroiodure ou d’acide phosphonique ou phosphinique perfluoré? Étape 1 : Oui ou non? Oui : Le produit chimique est un précurseur d’APFC. Non : Le produit chimique est-il un composé fluoré comprenant un groupement carboné entièrement fluoré, en plus d’un certain nombre de groupements -CH2-? Le composé fluoré peut être un dérivé ou un polymère de fluoroalcool, de fluoroamine, de fluoroammonium, d’acide fluorocarboxylique, de fluoroester (y compris l’ester de fluoroacrylate), de fluoroéther, de fluoroiodure, de fluorophosphate, de fluorosulfate, de fluorosilicate, de fluorosulfonate, de fluorosulfonamide ou de fluorosulfonyle, de fluorosiloxane, de fluorosilicone ou de fluorosilane, de fluorothioester, de thioéther fluoré, de fluorothiol ou d’uréthane fluoré. Si répondu Si répondu Oui à l'étape 1: Le produit chimique est un précurseur d’APFC. Deux options est offert = 1) Le produit chimique est un précurseur d’APFC à longue chaîne s’il comprend un groupement carboné entièrement fluoré de 8 atomes de carbone ou plus ou 2) Le produit chimique est un précurseur d’APFC à chaîne courte s’il comprend un groupement carboné entièrement fluoré de 6 atomes de carbone ou moins. Si répondu Non à l'étape 1: Deux choix est offert, Oui ou Non: Non: Le produit chimique n’est PAS un précurseur d’APFC. Oui: Le produit chimique est un précurseur d’APFC. Et deux options est offert = 1) Le produit chimique est un précurseur d’APFC à longue chaîne s’il comprend un groupement carboné entièrement fluoré de 8 atomes de carbone ou plus ou 2) Le produit chimique est un précurseur d’APFC à chaîne courte s’il comprend un groupement carboné entièrement fluoré de 6 atomes de carbone ou moins.
Diagramme: Question 1 : Le produit chimique est-il une substance perfluorée contenant un dérivé ou un polymère de perfluoroalcool, de perfluoroamine, d’acide perfluorocarboxylique, de perfluoroester (y compris l’ester de perfluoroacrylate), de perfluoroéther, de perfluoroiodure ou d’acide phosphonique ou phosphinique perfluoré?