Rapport d’évaluation préalable
Archivée
Acide pentadécafluorooctanoïque, ses sels et ses précurseurs
Environnement Canada
Santé Canada
Août 2012
Table des matières
- Sommaire
- Introduction
- Identité de la substanceIdentité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Résumé des renseignements relatifs aux effets de l'APFO sur la santé
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE(1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de l’acide pentadécafluorooctanoïque (APFO), dont le numéro de registre du Chemical Abstracts Service[1] est 335-67-1, ainsi que de ses sels et de ses précurseurs. Le sel d’ammonium de l’APFO et certains précurseurs de l’APFO, figurant sur la Liste intérieure des substances du Canada, ont été catégorisées en vertu de l’article 73 de la LCPE. Bien que l’APFO ne figure pas sur la Liste intérieure des substances, il peut se former dans l’environnement à la suite de la transformation ou dégradation d’une variété d’autres produits chimiques perfluorés. Il a été décidé d’effectuer une évaluation de l’APFO en raison de sa persistance, de sa présence répandue dans le biote, de sa présence dans l’Arctique canadien, étant donné qu’il peut être transporté sur de grandes distances, et de l’intérêt international suscité par les récentes données scientifiques indiquant que l’APFO et ses sels pourraient représenter un risque pour l’environnement et la santé humaine. De plus, les précurseurs de l’APFO ont été pris en compte dans la présente évaluation, compte tenu de leur contribution à la présence totale de l’APFO et de ses sels dans l’environnement.
L’APFOest une substance anthropique appartenant à la classe des acides perfluorocarboxyliques (les APFC), ces derniers faisant partie du grand groupe des substances perfluoroalkyliques (PFA). Dans la présente évaluation, l’abréviation « APFO » peut se rapporter à l’acide lui-même, à sa base conjuguée ou à ses principaux sels. Cet acide a fait l’objet de divers usages dans le passé, notamment dans des procédés industriels et dans la fabrication de produits commerciaux et de consommation. L’APFO et ses sels sont utilisés comme adjuvants de polymérisation dans la production de polymères fluorés et de fluoroélastomères. L’APFO lui-même n’est pas fabriqué au Canada; cependant, son sel d’ammonium est importé.
Environnement
L’APFOpeut être présent dans l’environnement en raison des rejets provenant des installations de fabrication ou de traitement de polymères fluorés et des usines de traitement des eaux usées, ainsi que du lixiviat des sites d’enfouissement, ou encore à la suite de la dégradation ou de la transformation de ses précurseurs. Dans le cadre de la présente évaluation, les précurseurs sont définis comme des substances contenant un groupement alkyle perfluoré dont la formule chimique est CnF2n+1 (où n = 7 ou 8), qui est directement lié à un groupement chimique autre qu’un atome de fluor, de chlore ou de brome. Ces précurseurs peuvent comprendre des composés d’origine, des produits chimiques contenant de l’APFO(dans des préparations ou sous forme de résidus produits de façon imprévue) ou des substances se transformant en intermédiaires qui se dégradent ultimement en APFO. Les précurseurs possibles comprennent également des composés fluorés (p. ex., des alcools, des iodures et des oléfines fluorotélomériques), dont certains sont actuellement présents dans des produits commerciaux et détectables dans l’atmosphère, et peuvent se dégrader ou se transformer en APFO par des voies biotiques ou abiotiques.
Une fois entré dans l’environnement, l’APFO est extrêmement persistent; il ne subirait aucune dégradation importante par voie biotique ou abiotique dans des conditions environnementales normales. Il est très soluble dans l’eau et, en solution, il est généralement présent sous forme d’anion (base conjuguée). Comme il présente une faible pression de vapeur, il est probable que le milieu aquatique sera son puits principal et qu’une fraction se retrouvera dans les sédiments. La présence d’APFOdans l’Arctique canadien est probablement attribuable au transport à longue distance de l’acide lui-même (p. ex., au gré des courants océaniques) ou de ses précurseurs volatils, notamment par voie atmosphérique.
L’APFOa été détecté à l’état de traces dans l’hémisphère Nord. En Amérique du Nord, les concentrations les plus élevées de cet acide ont été mesurées dans l’eau de surface près d’installations de production de polymères fluorés aux États-Unis (< 0,025 à 1 900 µg/L) et dans l’eau souterraine à proximité de bases militaires américaines (de non détecté [ND] à 6 570 µg/L). Il a également été détecté dans les effluents d’usines de traitement des eaux usées au Canada, à des concentrations de 0,007 à 0,055 µg/L, ainsi que dans les affluents d’usines de traitement des eaux usées aux États-Unis, à des concentrations de 0,0074 à 0,089 µg/L.
Au Canada, des concentrations traces d’APFO ont été mesurées dans les eaux douces (ND à 11,3 µg/L) et les sédiments (0,3 à 7,5 µg/kg). De plus, il a été détecté dans le biote canadien (ND à 90 µg/kg poids humide de tissu) du sud de l’Ontario et de l’Arctique canadien. La concentration d’APFO la plus élevée observée pour les organismes prélevés au Canada était de 90 µg/kg poids humide chez l’invertébré benthique Diporeia hoyi, suivie de 26,5 µg/kg poids humide dans le foie de turbots, de 13 µg/kg poids humide dans le foie d’ours blancs, de 12,2 µg/kg poids humide dans le foie de caribous, de 8,7 µg/kg poids humide dans le foie des phoques annelés et de 5,8 µg/kg poids humide dans le foie de morses. À la suite d’un rejet accidentel de mousse extinctrice dans le ruisseau Etobicoke, en Ontario, l’APFO a été mesuré dans le foie de ménés à nageoires rouges à une concentration maximale de 91 µg/kg poids humide Cependant, les concentrations actuelles d’APFO dans le biote canadien (pour un tissu en particulier et pour tout l’organisme) sont inférieures aux concentrations les plus élevées mesurées dans le biote aux États-Unis (jusqu’à 1 934,5 µg/kg poids humide dans le foie d’orphies).
Il n’a pas été possible d’établir de tendances temporelles ou spatiales relativement à la concentration d’APFOdans les œufs de guillemot ainsi que chez le touladi, le guillemot de Brünnich, le fulmar boréal ou le phoque annelé. Par contre, des tendances temporelles ont été observées chez l’ours blanc (de 1972 à 2002 et de 1984 à 2006) et la loutre de mer (de 1992 à 2002). La teneur en APFO des tissus hépatiques a doublé en 7,3 (± 2,8) ans chez l’ours blanc de l’île de Baffin et en 13,9 (± 14,2) ans chez l’ours blanc de Barrow, en Alaska. Elle s’est accrue de 2,3 % par année chez l’ours blanc de la partie centrale de l’est du Groenland. Les concentrations d’APFO ont également augmenté de façon significative en 10 ans chez les loutres de mer femelles adultes.
Contrairement à d’autres polluants organiques persistants que l’on retrouve dans le biote, l’APFO est présent principalement sous forme d’ions dans les milieux naturels. En raison de la perfluoration, les chaînes perfluorées sont oléophobes et hydrophobes. L’APFO se lie principalement aux protéines d’albumine dans le sang du biote et, par conséquent, est présent dans le sang et les tissus très perfusés comme le foie et les reins plutôt que dans les tissus lipidiques. Les critères numériques de bioaccumulation, prévus dans le Règlement sur la persistance et la bioaccumulation pris en application de la LCPE(1999), ont été calculés à partir des données sur la bioaccumulation chez les espèces aquatiques d’eau douce (poissons) seulement, et pour des substances dont la répartition se fait surtout dans les lipides. Par conséquent, les critères ne reflètent pas entièrement le potentiel de bioaccumulation de l’APFO qui se répartit surtout dans les protéines hépatiques, sanguines et rénales des mammifères terrestres et marins. Des expériences ont montré que l’APFO n’est pas très bioaccumulable chez les poissons; des facteurs de bioconcentration de 3,1 à 27 ont été observés en laboratoire, principalement chez la truite arc-en-ciel. Selon deux études portant sur le réseau trophique de la zone pélagique du lac Ontario, les concentrations d’APFO ne se bioamplifient pas d’un niveau trophique à l’autre. Il faut cependant éviter d’extrapoler ces résultats à des espèces non aquatiques, car les branchies des poissons constituent une voie supplémentaire d’élimination de l’APFO, ce dont sont dépourvus les organismes qui respirent dans l’air, comme les oiseaux et les mammifères terrestres et marins. Des études de terrain ayant permis de mesurer des facteurs de bioamplification supérieurs à 1,0 chez certaines espèces de mammifères arctique et d'auter mammifères (p. ex., le narval, le béluga, l’ours blanc, le morse, le dauphin à gros nez et le phoque commun), semblent indiquer un potentiel de bioaccumulation et de bioamplification de l’APFO chez les mammifères terrestres et marins. Des facteurs de bioamplification de 0,03 à 31 ont été observés pour ces mammifères. L’ours blanc, prédateur se situant au sommet du réseau trophique marin de l’Arctique, est l’espèce la plus contaminée par l’APFO, comparativement aux autres organismes terrestres de cette région.
Dans les études de toxicité traditionnelles, l’APFO présentait une toxicité aiguë faible à modérée pour les organismes pélagiques, notamment les poissons (70 à 2 470 mg/L). Par ailleurs, sa toxicité chronique était faible pour les organismes benthiques (> 100 mg/L). Une étude a été réalisée sur la toxicité de l’APFO et de ses sels pour les oiseaux. Celle-ci révèle que l’APFO n’a aucun effet sur le bêchage des embryons de poulets Leghorn blancs à des concentrations allant jusqu’à 10 µg/g d’embryon. Toutefois, l’APFOs’accumule dans le foie de ces embryons à des concentrations de 2,9 à 4,5 fois supérieures à la concentration initiale dans les œufs entiers.
Des études montrent que l’APFO peut avoir une incidence sur le système endocrinien, sans que les effets se manifestent avant que les organismes aient atteint l’âge adulte. Chez les Gobiocypris rarus mâles et femelles, des concentrations d’APFO de 3 à 30 mg/L ont entraîné une inhibition des gènes associés à la biosynthèse des hormones thyroïdiennes, induit l’expression de la vitellogénine chez les mâles, causé le développement d’ovocytes dans les testicules des poissons mâles et provoqué une dégénérescence des ovaires chez les femelles.
Il existe d’autres études qui démontrent une toxicité hépatique, une immunotoxicité et une chimiosensibilité. Par exemple, une concentration d’APFO de 20 mg/L a augmenté la chimiosensibilité des moules marines. À une concentration de 25,9 mg/L, l’APFO a stimulé le récepteur α activé par les proliférateurs des peroxysomes (PPARα) dans le foie des phoques du Baïkal. Ce récepteur joue un rôle physiologique essentiel en tant que détecteur de lipides et régulateur du métabolisme lipidique. Des données recueillies sur le terrain révèlent également une augmentation des indicateurs d’inflammation et d’immunité chez le dauphin à gros nez liée aux concentrations d’APFO, ce qui semble indiquer que cet acide pourrait entraîner une réponse auto-immune. Une autre étude de terrain porte aussi à croire que de faibles concentrations d’APFO peuvent influer sur les biomarqueurs de santé chez la tortue caouanne. Des essais biologiques d’une durée de deux ans sur la cancérogénicité de l’APFO chez les rats ont révélé que les mâles qui recevaient une dose élevée de sel d’ammonium de l’APFO (SAAPFO) dans leur nourriture présentaient une incidence significativement plus élevée d’adénomes des hépatocytes, des cellules de Leydig et des cellules acineuses du pancréas. Les tumeurs hépatiques chez les mâles pourraient être induites par la toxicité hépatique causée par la prolifération des peroxysomes induite par l’APFO. Par ailleurs, d’autres voies pourraient également contribuer à l’apparition de tumeurs dans d’autres tissus. Certaines données laissent croire que l’APFO pourrait provoquer des dommages oxydatifs indirects à l’ADN.
Santé humaine
Chez l’être humain, l’APFO est facilement absorbé quelle que soit la voie d’exposition; en outre, il ne semble pas être métabolisé et présente une demi-vie relativement longue. Les sels de l’APFO devraient se dissocier dans les tissus biologiques en perfluorooctanoate (PFO); par conséquent, on considère que leur toxicité est équivalente à celle de l’APFO. De faibles concentrations d’APFO ont été mesurées dans des échantillons sanguins prélevés chez des Canadiens n’y étant pas exposés au travail, y compris chez des nouveau-nés, ce qui indique une exposition environnementale à cet acide ou aux composés pouvant se dégrader en APFO. Les données disponibles indiquent que les Canadiens sont exposés à l’APFO et à ses précurseurs présents dans l’environnement, notamment l’air, l’eau potable et la nourriture, et par l’utilisation de produits de consommation tels que les ustensiles antiadhésifs, ainsi que de vêtements et de matériaux domestiques traités avec des composés perfluorés, par exemple les tapis et les tissus d’ameublement. Les Canadiens peuvent également être exposés à l’APFO in utero et pendant l’allaitement. La contribution relative de l’APFO, de ses sels et de ses précurseurs à l’exposition totale n’a pas été caractérisée; l’accent a plutôt été mis sur l’exposition globale à la fraction préoccupante sur le plan toxicologique, l’APFO.
Les études épidémiologiques réalisées chez l’être humain n’ont pas permis d’établir une relation causale entre l’exposition à l’APFO et des effets néfastes sur la santé. Des études de toxicité effectuées sur des animaux de laboratoire ont donc été utilisées pour déterminer les effets critiques et les concentrations sériques d’APFO correspondantes. À la suite de l’administration par voie orale du SAAPFO dans le cadre d’études de toxicité à court terme (14 jours), on a observé une augmentation du poids du foie chez les souris et une modification des paramètres lipidiques chez les rats. Une augmentation du poids du foie a également été relevée chez les singes dans une étude de toxicité de 26 semaines. Par ailleurs, une étude de toxicité sur le développement des souris a révélé une augmentation du poids du foie des souris mères, une ossification réduite des os des fœtus et une puberté précoce des souris mâles.
Des essais biologiques d’une durée de deux ans sur la cancérogénicité chez les rats ont révélé que les mâles qui recevaient une dose élevée de SAAPFO dans leur nourriture présentaient une incidence significativement plus élevée d’adénomes des hépatocytes, des cellules de Leydig et des cellules acineuses du pancréas. Aucun signe de cancérogénicité n’a cependant été observé chez les rats femelles. Les tumeurs hépatiques chez les mâles pourraient être induites par la toxicité hépatique causée par la prolifération des peroxysomes induite par l’APFO. Par ailleurs, d’autres voies pourraient également contribuer à l’apparition de tumeurs dans d’autres tissus. Étant donné que la prolifération des peroxysomes est beaucoup moins susceptible de survenir chez les primates que chez les rongeurs, les tumeurs induites par l’APFO chez les rats mâles ne sont pas considérées comme un effet pertinent dans le cas des êtres humains. Même si les concentrations sanguines d’APFO n’ont pas été mesurées dans le cadre d’études sur la toxicité chronique, la dose de SAAPFO administrée par voie orale était plusieurs fois supérieure à celles des études critiques de toxicité à court terme et subchronique. Par ailleurs, bien que certaines données laissent croire que l’APFO pourrait provoquer des dommages oxydatifs indirects à l’ADN, la base de données sur la génotoxicité indique que l’APFO n’est pas mutagène. Par conséquent, étant donné que les tumeurs observées chez les rats mâles ne semblent pas résulter d’une interaction directe avec le matériel génétique, une approche fondée sur le seuil d’innocuité est utilisée afin d’évaluer les risques pour la santé humaine.
L’évaluation de l’APFO repose sur une comparaison de la marge entre les concentrations de cet acide dans le sang (sérum ou plasma) chez les êtres humains et celles associées à l’apparition d’effets néfastes chez les animaux de laboratoire. Cette approche tient compte de toutes les sources d’exposition, notamment les rejets des installations de fabrication ou de traitement de polymères fluorés et les effluents des usines de traitement des eaux usées, ainsi que le lixiviat des sites d’enfouissement, ou encore la dégradation ou la transformation des précurseurs de l’APFO.
La comparaison des concentrations sériques de l’APFO associées à des effets néfastes chez les animaux de laboratoire (13 à 77 µg/mL) avec les concentrations sériques ou plasmatiques mesurées chez les adultes non exposés à cette substance au travail, chez les nourrissons et chez les enfants (0,00162 à 0,0195 µg/mL) donne des marges d’exposition supérieures à 660. Ces marges sont considérées comme suffisantes pour assurer une protection adéquate compte tenu des incertitudes présentes dans les bases de données sur l’exposition et le danger.
Conclusion
L’évaluation écologique est fondée sur une méthode du poids de la preuve en ce qui concerne la persistance, la bioaccumulation, les tendances temporelles chez certaines espèces (p. ex., l’ours blanc), le transport à grande distance, la présence répandue et les concentrations de l’APFO dans l’environnement et le biote (y compris les régions éloignées du Canada). Selon l’information disponible, il est conclu que l’APFO, ses sels et ses précurseurs pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, il est conclu que l’APFO et ses sels répondent aux critères de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation. L’APFO et ses sels ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. Néanmoins, le poids de la preuve est suffisant pour conclure que l’APFO et ses sels s’accumulent et se bioamplifient chez les mammifères terrestres et marins.
À la lumière des renseignements disponibles sur leur potentiel d’effets nocifs sur la santé humaine et les marges d’exposition en découlant, il est conclu que l’APFO et ses sels ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines. Les précurseurs de l’APFO n’ont pas été évalués de façon individuelle, mais ont été pris en compte du point de vue de leur contribution à l’exposition totale étant donné qu’ils peuvent se dégrader en APFO dans l’environnement.
Ainsi, d’après les renseignements disponibles en ce qui concerne les considérations liées à l’environnement et à la santé humaine, il est conclu que l’APFO, ses sels et ses précurseurs répondent à au moins un des critères énoncés à l’article 64 de la LCPE (1999).
Des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles définies à l’étape de la gestion des risques.
La présente évaluation préalable a été effectuée conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE(1999)] (Canada, 1999).
Une évaluation préalable a été réalisée pour l’acide pentadécafluorooctanoïque (APFO) [numéro 335-67-1 du registre du Chemical Abstracts Service (n° CAS)] et ses sels. De plus, les précurseurs de l’APFO ont été pris en compte selon leur contribution à la présence totale de l’APFO et de ses sels. Dans le cadre de cette évaluation, les précurseurs sont définis comme des substances contenant un groupement alkyle perfluoré dont la formule chimique est CnF2n+1 (où n = 7 ou 8), qui est directement lié à un groupement chimique autre qu’un atome de fluor, de chlore ou de brome.
Le sel d’ammonium (n° CAS 3825-26-1) et les précurseurs (nos CAS 53515-73-4, 678-39-7, 65530-61-2 et 70969-47-0) figurent sur la Liste intérieure des substances (LIS) et répondaient aux critères environnementaux de la catégorisation relatifs à la persistance, au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes non humains. Cependant, l’évaluation des risques que présentent toutes ces substances pour la santé humaine n’a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d’exposition et du risque pour la santé élaborés par Santé Canada aux fins de la catégorisation des substances de la LIS.
Les évaluations préalables mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de l’article 64 de la LCPE (1999). Les évaluations préalables visent à examiner les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable contient des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition. Les données pertinentes pour l’évaluation préalable de ces substances sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu’en février 2011 pour les sections traitant des aspects écologiques et jusqu’en avril 2011 pour les sections traitant des effets sur la santé humaine. De plus, une enquête a été menée auprès de l’industrie sur les composés perfluoroalkyliques et fluoroalkyliques pour les années 2000 et 2004 par l’intermédiaire d’avis publiés dans la Gazette du Canada conformément à l’article 71 de la LCPE (1999) [Canada, 1999; Canada, 2000b, 2004]. Ces enquêtes ont permis de recueillir des données sur la fabrication, l’importation, les utilisations et les rejets des composés perfluoroalkyliques et fluoroalkyliques au Canada. Des études toxicologiques ont également été soumises par l’industrie en application de l’article 70 de la LCPE (1999).
La démarche suivie dans cette évaluation écologique préalable consiste à examiner les renseignements scientifiques et techniques pertinents, et à tirer des conclusions fondées sur de multiples éléments d’information, tels que la persistance, l’exposition, les tendances, la toxicité, la bioaccumulation et la présence répandue dans l’environnement. Dans le cas de l’évaluation des risques pour la santé humaine, ces renseignements comprennent les données utiles à l’évaluation de l’exposition de la population générale (exposition non professionnelle) et l’information sur les dangers pour la santé. Les décisions concernant la santé humaine reposent sur la nature de l’effet critique retenu ou sur les marges entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l’exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, et ce, dans le contexte d’une évaluation préalable. L’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Elle fait plutôt état des études et des éléments d'information essentiels qui appuient les conclusions[2].
L’ébauche évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada. L’ébauche d’évaluation écologique a fait l’objet d’un examen écrit par des pairs ou d’une consultation de ces derniers. L’ébauche d’évaluation préalable sur la santé humaine a été soumise à un examen externe réalisé par le personnel de Toxicology Advice and Consulting Limited, Sean Hayes, Ph. D. (Summit Toxicology), Greg Kedderis, Ph. D. (consultant privé), Kannan Krishan, Ph. D. (Université de Montréal) et Donna Vorhees, Ph. D. (Science Collaborative), afin de garantir le caractère adéquat de la couverture des données et les possibilités de défense des conclusions. Les énoncés formulés dans ce document ne reflètent pas nécessairement les opinions des examinateurs. De plus, l’ébauche de la présente évaluation préalable a fait l’objet d’une consultation publique de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
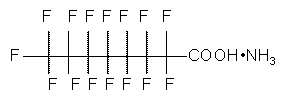
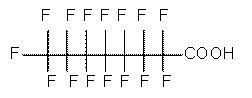
Les renseignements sur l’identité de l’APFO sont présentés au tableau 1. L’APFO est une substance d’origine anthropique à chaîne de huit atomes de carbone, dont sept sont perfluorés. Elle appartient à la classe générale des acides perfluorocarboxyliques (APFC), qui font partie du grand groupe des substances perfluoroalkyliques (PFA). Dans la présente évaluation, l’abréviation « APFO » peut se rapporter à l’acide lui-même, à sa base conjuguée ou à ses principaux sels (tableau 2). Elle ne désigne cependant pas les mélanges commerciaux contenant de l’APFO, car ceux-ci sont souvent mal caractérisés et pourraient comprendre n’importe quel produit qui contient même une infime quantité d’APFO. On désigne aussi l’APFO sous divers noms commerciaux et synonymes, dont C8. Ellis et al.(2004b) traitent plus en détail de l’identité, de la nomenclature et des noms commerciaux de l’APFO. Le sel de l’APFO le plus utilisé commercialement est le sel d’ammonium, appelé SAAPFO(voir la structure chimique dans le tableau 1).
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 335-67-1 |
|---|---|
| Nom chimique | Acide pentadécafluorooctanoïque |
| [1] NCI 2009 : AICS (inventaire des substances chimiques de l’Australie); ASIA-PAC (listes des substances de l’Asie-Pacifique); ECL (liste des substances chimiques existantes de la Corée); EINECS (inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); LES (liste extérieure des substances [Canada]); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); REACH (enregistrement, évaluation, autorisation et restriction des produits chimiques [Commission européenne]); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). [2] Simplified Molecular Input Line Entry Specification. |
|
| Noms relevés dans les National Chemical Inventories (NCI)[1] | Octanoic acid, 2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-pentadecafluoro- (TSCA) Octanoic acid, pentadecafluoro- (AICS, ASIA-PAC, LES, NZloC, PICCS, SWISS) Pentadecafluorooctanoic acid (ECL, EINECS, PICCS, REACH) Perfluorooctanoic acid (ENCS) |
| Autres noms | EF 201; Eftop EF-201; NSC 95114; Pentadecafluoro-1-octanoic acid; Pentadecafluoro-n-octanoic acid; Perfluorocaprylic acid; Perfluoro-1-heptanecarboxylic acid; Perfluoroheptanecarboxylic acid; n-Perfluorooctanoic acid |
| Groupe chimique | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Perfluoroalkyles |
| Principale sous-classe chimique | Acides perfluorocarboxyliques |
| Formule chimique | C8HF15O2 |
| Structure chimique (sel et forme acide) | Sel d’ammonium Acide |
| SMILES[2] | FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(=O)O |
Environnement Canada a examiné les composés perfluoroalkyliques à partir d’avis d’experts, des structures chimiques et des estimations de la biodégradation obtenues à l’aide du modèle CATABOL (c2004-2008) [Mekenyan et al., 2002]. Ces approches ont été utilisées pour évaluer le potentiel de dégradation des structures en APFO. CATABOL (c2004-2008), qu’on a alimenté avec les résultats d’un essai de biodégradation du ministère du Commerce international et de l’Industrie du Japon (Ministry of International Trade and Industry, MITI), prévoit la biodégradation des composés sur une période de 28 jours (LD 301 C de l’OCDE). Les données sur la dégradation des composés perfluorés dans l’ensemble d’étalonnage étant limitées, il se peut que certains produits de dégradation générés par CATABOL (c2004-2008) soient d’une fiabilité restreinte. Il convient également de noter que, dans le cas des composés perfluorés, le temps de dégradation sera plus long, mais il est difficile d’estimer de combien, en particulier dans le cas des substances ayant une masse moléculaire élevée, comme les oligomères et les polymères.
Les précurseurs de l’APFO (tableau 2) ont été pris en compte dans la présente évaluation; toutefois, cette liste ne doit pas être considérée comme exhaustive. Une liste plus complète est présentée dans l’Avis concernant certaines substances perfluoroalkyliques et fluoroalkyliques, publié dans la Gazette du Canada, Partie I : vol. 139, n° 3. Il convient également de noter que certains précurseurs de l’APFOpeuvent aussi être considérés comme des précurseurs des APFC à longue chaîne (C9-C20). Dans le cadre de la présente évaluation, les précurseurs sont définis comme des substances contenant un groupement alkyle perfluoré dont la formule chimique est CnF2n+1 (où n = 7 ou 8), qui est directement lié à un groupement chimique autre qu’un atome de fluor, de chlore ou de brome.
| Nom | N° CAS | Formule moléculaire | Liste (LIS ou LES) |
|---|---|---|---|
| N° CAS : numéro de registre du Chemical Abstracts Service; LIS : Liste intérieure des substances; LES : Liste extérieure des substances; n.d. : non disponible. [1] Les précurseurs, dont la liste n’est pas exhaustive, sont ceux établis à partir de CATABOL (c2004-2008), de l’avis des experts et des ouvrages scientifiques. [2] van Zelm et al.(2008) [3] De Silva et al.(2009) [4] D’Eon et Mabury (2007) |
|||
| Acide libre de l’APFO (acide pentadécafluorooctanoïque) | 335-67-1 | C8HF15O2 | LES |
| Anion perfluorooctanoate (perfluorooctanoate [PFO], base conjuguée de l’acide libre) | 45285-51-6 | C8F15O2– | Non répertoriée |
| Acide pentadécafluorooctanoïque ramifié | 90480-55-0 | C8HF15O2 | Non répertoriée |
| Sels principaux | |||
| Sel d’ammonium de l’APFO (SAAPFO, pentadécafluorooctanoate d’ammonium) | 3825-26-1 | C8F15O2–NH4+ | LIS |
| Sel d’ammonium linéaire ou ramifié de l’acide pentadécafluorooctanoïque (sel d’ammonium ramifié de l’acide pentadécafluorooctanoïque) | 90480-56-1 | C8F15O2–NH4+ | Non répertoriée |
| Sel de sodium de l’APFO (pentadécafluorooctanoate de sodium) | 335-95-5 | C8F15O2–Na+ | LES |
| Sel de potassium de l’APFO (perfluorooctanoate de potassium) | 2395-00-8 | C8F15O2–K+ | Non répertoriée |
| Sel d’argent de l’APFO [perfluorooctanoate d’argent(1+)] | 335-93-3 | C8F15O2–Ag+ | LES |
| Précurseurs potentiels[1] | |||
| Méthacrylate de 2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-pentadécafluorooctyle polymérisé avec l’acide acrylique | 53515-73-4 | (C15H11F15O4)x | LIS |
| 3-[(γ-ω-Perfluoro-C4-10-alkyl)thio]propionamides | 68187-42-8 | n.d. | LIS |
| Sulfate mixte d’α-fluoro-ω-{2-[2-(triméthylammonio)éthylthio]éthyl}poly (difluorométhylène) et de méthyle |
65530-57-6 | n.d. | LIS |
| α,α’-[Phosphinicobis (oxyéthylène)]bis[ω-fluoropoly(difluorométhylène)] | 65530-62-3 | n.d. | LIS |
| α-Fluoro-ω-[2- (phosphonooxy)éthyl]poly (difluorométhylène) |
65530-61-2 | n.d. | LIS |
| γ-ω-Perfluorothiols en C8-20télomérisés avec l’acrylamide | 70969-47-0 | n.d. | LIS |
| [2-(Sulfothio)éthyl]carbamate de C-(3,3,4,4,5,5,6,6,7,7,8,8,8-tridécafluorooctyle), sel monosodique | 82199-07-3 | n.d. | LIS |
| [2-(Sulfothio)éthyl]carbamate de C-(γ-ω-perfluoroalkyle) en C6-9, sels monosodiques | 95370-51-7 | n.d. | LIS |
| Phosphates de dérivés 2,2-bis{[(γ-ω-perfluoro-alkyl en C4-10)thio]méthyliques} de propane-1,3-diol, sels d’ammonium | 148240-85-1 | n.d. | LES |
| Propane-1,3-diol, dérivés 2,2-bis[[(γ-ω-perfluoro-alkyl en C6-12)thio]méthyliques], sels phosphatés et ammoniacaux | 148240-87-3 | n.d. | LES |
| γ-ω-Perfluorothiols en C4-20co-télomérisés avec l’acide acrylique et l’acrylamide | n.d. | n.d. | Non répertoriée |
| 3,3,4,4,5,5,6,6,7,7,8,8,9, 9,10,10,10-Heptadécafluorodécan-1-ol | 678-39-7 | C10F17H5O | LIS |
| Fluorure de pentadécafluorooctyle | 335-66-0 | C8F16O | LES |
| Perfluorooctanoate de méthyle | 376-27-2 | C9H3F15O2 | LES |
| Perfluorooctanoate d’éthyle | 3108-24-5 | C10H5F15O2 | LES |
| 8:2 Polymères d’acrylate de fluorotélomère[2] | n.d. | n.d. | n.d. |
| 1,1,1,2,2,3,3,4,4,5,5,6,6,7,7,8,8-Heptadécafluoro-10-iododécane | 2043-53-0 | n.d. | n.d. |
| Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-heptadécafluorodécyle | 1996-88-9 | n.d. | LIS |
| Acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-heptadécafluorodécyle | 27905-45-9 | n.d. | LIS |
| 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-heptadécafluorodec-1-ène | 21652-58-4 | n.d. | n.d. |
| Agents tensioactifs d’acide phosphorique (p. ex. diester d’acide phosphorique de polyfluoroalkyle 8:2 ou diPAP 8:2)[4] | n.d. | x:2 diPAP (F(CF2)xCH2CH2O)2P(O)OH | n.d. |
| Perfluorooctylsulfonamides[3] | n.d. | F[CF2]8SO2NRR’ où R et R’ peuvent être CH2CH2OH, CH3, CH2CH3 ou H | n.d. |
| Propane-1,3-diol, dérivés 2,2-bis[[(γ-ω-perfluoro-alkyl en C10-20)thio]méthyliques], sels phosphatés et ammoniacaux | 148240-89-5 | n.d. | LES |
| Éthers mono{2-hydroxy-3-[(γ-ω-perfluoroalkyl C8-20)thio]propyliques} du polymère du 2-méthyloxirane avec l’oxirane | 183146-60-3 | n.d. | LES |
| α-Fluoro-ω-(2-sulfoéthyl)poly(difluorométhylène) | 80010-37-3 | n.d. | LES |
| Acrylate de 3,3,4,4,5,5,6, 6,7,7,8,8, 9,9,10,10,11,11,12,12,12- hénéicosafluorododécyle polymérisé avec l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10- héotadécafluorodécyle, l’α- (2-méthyl-1-oxoprop-2-ènyl)-ω-[(2-méthyl-1-oxoprop-2-ènyl)oxy]poly(oxyéthylène), l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10, 11,11,12,12,13,13,14,14,15,15,16,16,16-nonacosafluorohexadécyle, l’acrylate d’octadécyle, l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10, 10,11,11,12,12,13,13,14,14,14-pentacosafluorotétradécyle et l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10, 11,11,12,12,13,13,14,14,15,15,16, 16,17,17,18,18,18-tritriacontafluorooctadécyle |
116984-14-6 | n.d. | Non répertoriée |
| Acide valérique, dérivés 4,4-bis[(γ-ω-perfluoroalkyle en C8-20)thio], composés avec le 2,2’-iminodiéthanol | 71608-61-2 | n.d. | LES |
La solubilité dans l’eau est une propriété importante qui influe sur l’APFO et ses sels dans l’environnement. L’acide libre et le sel d’ammonium sont solides à 20 °C. L’acide libre se dissocie facilement en perfluorooctanoate (PFO), soit la base conjuguée qui est la forme qu’on mesure le plus souvent dans les milieux naturels et les échantillons biologiques. La base conjuguée de l’APFO et de ses sels est très soluble dans l’eau. On a constaté que les sels de l’APFO s’associent les uns aux autres à la surface, mais se dispersent par agitation et forment des micelles à des concentrations élevées (US EPA, 2003).
La solubilité est fonction de la constante de dissociation de la forme acide (pKa), et la valeur de pKa la plus fréquemment rapportée et utilisée est d’environ 2,5 (Kissa, 1994). Burns et al.(2008) ont cependant déterminé une valeur de pKa de 3,8 ± 0,1, ce qui laisse supposer que les espèces neutres peuvent exister dans l’environnement. Jasinski et al. (2009) ont déterminé une valeur de pKa de 3,3 ± 0.4. En se fondant sur des modèles moléculaires et des analogues, Goss et Arp (2009) ont indiqué que la valeur de pKa est comprise entre 0 et 4. Selon Goss (2008), l’APFO devrait avoir une faible valeur de pKa, de sorte que plus de 99 % du composé se trouverait sous forme anionique (c.-à-d. PFO) dans la plupart des conditions environnementales, laissant ainsi supposer que la forme prédominante de l’APFO dans l’environnement serait la forme anionique.
Les propriétés physiques et chimiques de l’APFO sont résumées dans le tableau 3.
| Propriété | Valeur[1] | Type | Référence |
|---|---|---|---|
| Abréviations : Koa, coefficient de partage octanol-air; Koe, coefficient de partage octanol-eau; Kco, coefficient de partage carbone organique-sédiments; pKa, constante de dissociation acide. [1] La valeur entre parenthèses est celle fournie dans la référence originale. |
|||
| Masse moléculaire (g/mol) | 414,0639 | – | – |
| Point de fusion (°C) | 52-54 | Barton et al., 2007 | |
| Pression de vapeur (Pa) | 2,2 (à 20 °C) | Calculé | Barton et al., 2007 |
| Constante de la loi de Henry (Pa·m3/mol) | 2,4 | Calculé | Barton et al., 2007 |
| Log Koe (sans dimension) | 5 ± 0,5 | Modélisé | Jasinski et al., 2009 |
| 3,62-6,30 | Modélisé | Arp et al., 2006 | |
| Log Koa (sans dimension) | 5,73-6,80 | Modélisé | Arp et al., 2006 |
| Log Kco (sans dimension) | 2,06 (sédiments, pH entre 5,7 et 7,6) |
Expérimental | Higgins et Luthy, 2006 |
| Solubilité dans l’eau (g/L) | 3,5 (pH neutre à alcalin) 0,0007 (pH acide) |
Barton et al., 2007 | |
| pKa (sans dimension) | 2,5 | Expérimental | Kissa, 1994 |
| 3,8 ± 0,1 | Expérimental | Burns et al., 2008 | |
| 0-4 | Modélisé et analogues | Goss et Arp, 2009 | |
L’APFOet ses sels sont d’origine anthropique; on n’en connaît pas de sources naturelles (Kissa, 1994). Des enquêtes menées auprès de l’industrie en 2000 et en 2004 en application de l’article 71 de la LCPE(1999) ont permis de recueillir des données sur la fabrication et l’importation au Canada de certaines substances perfluoroalkyliques et fluoroalkyliques, sur leurs dérivés et polymères, y compris l’APFO, et sur leur exportation à l’étranger (Canada, 2000b; Canada, 2004).
Les résultats de l’enquête de 2000 ont indiqué qu’on ne produit pas d’APFO ni de ses sels au Canada. Quelque 600 000 kg de PFA ont été importés au pays de 1997 à 2000. Une entreprise a déclaré avoir importé de l’APFO et de ses sels. L’APFO et ses sels représentaient une très petite proportion (< 1 000 kg) de la quantité de PFA importée; il s’agissait presque exclusivement de sel d’ammonium, qui servait à des applications industrielles. Les volumes déclarés n’incluent pas les quantités pouvant se trouver dans des articles manufacturés qui sont importés (Environnement Canada, 2001). Les utilisations de l’APFO et de ses sels, selon l’enquête, comprenaient l’emploi comme polymères ou comme ingrédients de préparations et d’autres usages, notamment pour la fabrication de batteries, de revêtements et de lubrifiants (Environnement Canada, 2001). À cause de ses propriétés physicochimiques, l’APFO peut remplacer le perfluorooctanesulfonate (PFOS) pour des applications dans lesquelles cet acide n’était pas utilisé auparavant (US EPA, 2002).
Des renseignements ont également été recueillis auprès de l’industrie pour l’année civile 2004 sur la fabrication et l’importation des substances perfluoroalkyliques et fluoroalkyliques au Canada, y compris les APFC, et sur leur exportation à l’étranger (Canada, 2004). Ces renseignements indiquaient qu’il n’y avait pas de fabrication connue de ces substances au Canada. Selon cette enquête, le sel d’ammonium de l’APFO était importé au Canada dans des quantités variant entre 100 et 100 000 kg (Environnement Canada, 2005) sous le code « grossistes de produits chimiques et de produits analogues » du Système de classification des industries de l’Amérique du Nord (SCIAN).
Il existe deux principaux procédés industriels de synthèse de l’APFO, soit le procédé de fluoration électrochimique de Simons et la télomérisation (US EPA, 2002). La première méthode comporte le passage d’un courant électrique dans une solution de fluorure d’hydrogène anhydre qui contient généralement un dérivé d’acide octanoïque. Tous les atomes d’hydrogène sont remplacés par du fluor, ce qui produit du fluorure de perfluorooctanoyle linéaire à 30-45 % ainsi qu’un mélange variable d’autres isomères, homologues et sous-produits (US EPA, 2002). Ensuite, le fluorure de perfluorooctanoyl est séparé et hydrolysé pour produire un mélange d’environ 70 % d’isomères linéaires et ramifiés variés de l’APFO (Riddell et al., 2009). La neutralisation par des bases de l’acide parent à l’aide de la base métallifère appropriée permet de produire les sels de l’APFO. La deuxième méthode, la télomérisation, est basée sur la réaction d’une molécule appelée télogène (de l’iodure de pentafluoroéthyle par exemple) avec au moins deux molécules appelées taxogènes (du tétrafluoroéthylène par exemple). Ce procédé produit des iodures télomères, qui peuvent être oxydés pour produire un acide carboxylique -- par exemple, de l’APFO linéaire à plus de 99 % (Prevedouros et al., 2006) -- et réagir avec l’éthylène pour produire un autre iodure. On peut ensuite soumettre ces iodures à des réactions pour produire une multitude de matières fonctionnelles. La télomérisation donne généralement lieu à des mélanges de composés à chaîne d’atomes de carbone en nombre pair.
Le SAAPFO est utilisé principalement dans le procédé de polymérisation commerciale pour la production de polymères fluorés, tels que le polytétrafluoréthylène et le polyfluorure de vinylidène (Gouvernement des États-Unis, 2003; OCDE, 2006; Prevedouros et al., 2006), qui sont utilisés dans divers secteurs, comme les industries de l’aérospatiale, de la construction, de l’automobile et de l’électronique. Les polymères fluorés sont utilisés dans la fabrication de revêtements étanches et antitaches appliqués sur des tissus et tapis; de tuyaux, de câbles et de joints d’étanchéité; de revêtements antiadhésifs des batteries de cuisine; de produits de soins personnels (Gouvernement des États-Unis,, 2003). Le SAAPFO est également utilisé comme ingrédient dans les dispersions aqueuses de polymères fluorés, qui entrent dans la composition des peintures et des additifs pour pellicules photographiques et sont utilisées dans l’industrie de finition textile (OCDE, 2006). Les mousses extinctrices aqueuses peuvent également contenir du SAAPFO (OCDE, 2006; Prevedouros et al., 2006). Certains composés fluorés qui sont des précurseurs potentiels de l’APFO sont employés dans le traitement des matériaux d’emballage alimentaire et servent à accroître leur imperméabilité à l’humidité et aux graisses (Begley et al., 2005). Par conséquent, bien que le SAAPFO ne soit généralement pas destiné à demeurer dans les articles manufacturés, il peut être présent en quantités infimes sous forme de contaminant ou dans les produits de dégradation.
Il peut se produire des rejets dans l’environnement pendant les activités de fabrication et de traitement ainsi que tout au long de la vie utile et au moment de l’élimination des articles contenant de l’APFO. Les sources ponctuelles possibles de rejet sont donc les rejets directs des installations de fabrication ou de traitement. Les rejets indirects peuvent résulter, par exemple, de la dégradation ou de la transformation de précurseurs de l’APFO dans les usines de traitement des eaux usées et les sites d’enfouissement. Ces précurseurs peuvent comprendre des composés d’origine ou des produits chimiques contenant de l’APFO. Les précurseurs possibles comprennent également des composés fluorés apparentés qui sont détectables dans l’atmosphère (p. ex., l’alcool fluorotélomérique 8:2 [FTOH], qui a huit carbones fluorés et un groupe alcool éthylique à deux carbones) et peuvent se dégrader ou se transformer en APFO par des voies biotiques ou abiotiques.
Rejets directs
L’APFO et ses sels ne sont pas fabriqués au Canada (Environnement Canada, 2001). Il n’existe pas de données publiées sur les rejets directs dans l’air, l’eau ou le sol à partir d’installations industrielles au pays (Ellis et al., 2004b).
Muir et Scott (2003), Scott et al. (2003) et Boulanger et al. (2005) ont signalé la présence d’APFO dans les effluents d’usines de traitement des eaux usées (UTEU) rejetés dans les Grands Lacs. Les concentrations d’APFO mesurées dans les effluents traités provenant d’UTEU à Thunder Bay et à Sault Ste. Marie, en Ontario, étaient comprises entre 7,9 et 24 ng/L (Scott et al., 2003). La teneur en APFO de l’effluent d’une UTEU de North Toronto a également mesurée et attteignait 38 ng/L (Muir et Scott, 2003). Crozier et al. (2005) ont mesuré l’APFO dans les effluents (concentrations allant de 7 à 55 ng/L) et les biosolides (concentrations allant de 0,7 à 0,9 ng/g) d’usines de traitement des eaux usées en Ontario. Crozier et al.(2005) ont aussi décelé de l’APFO dans l’influent d’une UTEU à une concentration de 7 ng/L, puis dans l’effluent de la même UTEU, également à une concentration de 7 ng/L, ce qui indique que l’APFO n’a pas été éliminé par les procédés de l’usine de traitement des eaux usées. Des précurseurs comme les produits de dégradation des acides carboxyliques fluorotélomériques saturés (ACFT) et des FTOH ont été mesurés dans des influents et dans des échantillons d’eaux issues du traitement primaire, mais pas dans les eaux ayant subi un traitement secondaire (Sinclair et Kannan, 2006).
Boulanger et al. (2005) ont effectué une analyse du bilan massique de huit agents tensioactifs à base de perfluorooctane, y compris l’APFO, dans l’ensemble du lac Ontario. Boulanger et al. (2005) ont cité et utilisé une étude menée en 1999 par la Compagnie 3M qui comprenait l’analyse de trois composés perfluorés (PFC), dont l’APFO, dans les effluents finals de six UTEU. Quatre de ces UTEU se trouvaient dans des villes américaines où des PFC étaient produits ou étaient utilisés par l’industrie, et deux dans des villes américaines sans sources connues de ces composés. Des concentrations détectables d’APFO, variant entre 41,2 et 2 420 ng/L, ont été mesurées dans toutes les UTEU. Pour effectuer l’analyse du bilan massique, Boulanger et al.(2005) ont utilisé une concentration d’APFO dans un effluent d’UTEU de 549 ± 840 ng/L tirée de l’étude de la Compagnie 3M de 1999. Ils ont noté que cette valeur présentait une grande incertitude en raison du faible nombre d’échantillons étudiés, et l’étude ne portait pas sur les effluents réels rejetés dans le réseau des Grands Lacs. Selon les calculs du bilan massique réalisés par Boulanger et al. (2005), les eaux provenant du lac Érié et les rejets d’eaux usées étaient les principales sources, tandis que les eaux s’écoulant vers le fleuve Saint-Laurent constituaient le principal mécanisme de perte, ce qui indique que tous les rejets dans le lac Ontario ne sont pas pris en compte. Selon Boulanger et al. (2005), le nettoyage et l’entretien par les consommateurs de produits traités en surface et l’utilisation d’agents tensioactifs à base de perfluorooctane dans les procédés industriels peuvent entraîner la présence de ces substances dans les rejets d’UTEU. Ces auteurs étaient également d’avis que la présence d’objets traités dans des sites d’enfouissement et le traitement ultérieur des lixiviats provenant de ces sites par les UTEU municipales peuvent aussi faire entrer d’importantes quantités d’agents tensioactifs à base de perfluorooctane dans l’environnement. Tous les produits et matériaux fluorés étudiés par Dinglasan-Panlilio et Mabury (2006) contenaient des alcools télomériques fluorés libres ou non liés. Ces auteurs estiment que les alcools télomériques fluorés résiduels entrent pour une grande part dans la charge atmosphérique d’alcools télomériques fluorés et qu’ils pourraient en constituer la principale source, car le rejet de ces alcools télomériques fluorés résiduels peut se produire tout au long de la chaîne d’approvisionnement, depuis la production jusqu’à l’utilisation finale, en passant par les applications.
Il existe des données sur les rejets d’APFO à partir de sites d’enfouissement au Canada (p. ex., décharges publiques, dépotoirs avec brûlage et décharges de déchets métalliques) [Ikonomou, 2006]. On en a détecté dans les sédiments du site d’enfouissement de l’Arctique (de 22 à 1 083 ng/g) ainsi que dans les sédiments du site d’enfouissement de Kamloops, en Colombie-Britannique (jusqu’à 186 ng/g). L’APFO a également été détecté dans le lixiviat des sites d’enfouissement à Waterloo (458 ng/L), à Cambridge (1 144 ng/L) et à Toronto (880 ng/L), en Ontario, à Moncton, au Nouveau-Brunswick (88 ng/L), à Halifax, en Nouvelle-Écosse (2 040 ng/L), à Charlottetown, à l’île-du-Prince-Édouard (642 ng/L), à Kelowna, en Colombie-Britannique (146 ng/L), et à Calgary, en Alberta (238 ng/L). D’après la concentration moyenne d’APFO, la charge totale annuelle estimée dans le lixiviat est de 0,1 kg (Conestoga-Rovers & Associates, 2011). On a aussi détecté de l’APFOdans le lixiviat de sites d’enfouissement (91,3-516 ng/L) [Kallenborn et al., 2004] dans d’autres pays où, comme au Canada, on ne produit pas de composés perfluorés. Les FTOH 6:2, FTOH 8:2 et FTOH 10:2 (c.-à-d. les précurseurs de l’APFO) ont été mesurés dans l’air à deux sites d’enfouissement en Ontario; les concentrations étaient inférieures à 5 000 pg/m3 (en amont) et inférieures à 25 000 pg/m3 sur le site (Ahrens et al., 2010b).
Rejets indirects
Les causes possibles de la formation d’APFO, comme la dégradation ou la transformation de précurseurs, pourraient entraîner des rejets indirects et ainsi contribuer à la quantité totale d’APFO dans l’environnement.
D’Eon et al. (2007) ont établi que l’APFO pouvait se former à partir d’agents tensioactifs de phosphate de polyfluoroalkyle (PAPS), tels que le PAPS 8:2, par la rupture du lien ester phosphorique, libérant du FTOH 8:2, qui subit par la suite une biotransformation pour former de l’APFO. Lee et al.(2010) ont montré que les produits de la biodégradation par voie microbienne (c.-à-d., FTOH 8:2 et FTOH 10:2) provenant de PAPS monosubstitués 8:2 et 10:2 (qu’on peut retrouver dans des produits commerciaux) peuvent être présents dans les influents et les effluents des UTEU.
Wallington et al. (2006) ont utilisé un modèle tridimensionnel de la composition chimique de l’atmosphère du globe (IMPACT) pour montrer que le composé n-C8F17CH2CH2OH (c.-à-d., le FTOH 8:2) se transforme en APFO et en d’autres APFC par dégradation dans l’atmosphère. Schenker et al. (2008) ont utilisé un modèle plurispécifique à l’échelle mondiale (CliMoChem) pour montrer que, jusqu’en 2000, la contribution des flux atmosphériques de substances à base de fluorure de perfluorooctanesulfonyle aux dépôts atmosphériques d’APFO en Arctique était semblable à la contribution des flux de FTOH. On considère que, selon le lieu et la saison, les concentrations molaires d’APFO dans l’atmosphère sont d’un ordre de grandeur approprié pour expliquer les concentrations observées dans le biote de l’Arctique (Wallington et al., 2006). Les concentrations d’APFO dans cette région varient beaucoup suivant la saison : des quantités relativement élevées (> 1,5 × 103 molécules/cm3) sont mesurées sur tout ce territoire pendant l’été arctique, mais les concentrations sont inférieures à celles-ci d’un ordre de grandeur en hiver (Wallington et al., 2006).
Ellis et al. (2001, 2003) ont signalé la formation d’APFO par la thermolyse de polymères fluorés. Les résultats des études menées par ces auteurs indiquent que ce processus peut produire de l’APFO, mais vraisemblablement pas en quantités importantes dans l’environnement et pas suffisamment pour contribuer au transport à grande distance de cet acide (Ellis et al., 2001, 2003). La thermolyse des polymères fluorés s’enclenche à partir de 365 °C (température qu’on ne rencontre pas dans l’environnement). Cette température pourrait être atteinte dans des applications industrielles et domestiques, de sorte que la thermolyse des polymères fluorés pourrait être considérée comme une source d’APFO.
Il a été montré que les FTOH se métabolisent pour former de l’APFO chez le rat et la truite arc-en-ciel (Hagen et al., 1981; Butt et al., 2010b). Selon Hagen et al. (1981), la formation d’APFOchez les rats serait causée par une β-oxydation. Butt et al. (2010a) ont trouvé que l’exposition aux ACFT 7:3 ne résultait pas de la formation et de l’accumulation de l’APFOdans la truite arc-en-ciel; toutefois, l’APFO s’est formé dans les ACFT 8:2 et les acides carboxyliques fluorotélomériques insaturés (ACFTI) 8:2. Les auteurs ont proposé une voie par béta-oxydation qui suit le schéma suivant : ACFTI8:2 ? acide β-cétonique 7:3 ? cétone 7:2 ? APFO; ou encore, que l’APFOpourrait être formé directement par β-oxydation de l’acide cétonique 7:3. Butt et al. (2010b) ont exposé la truite arc-en-ciel à l’acrylate de fluorotélomère par voie alimentaire. Ils ont observé la formation d’ACFT 8:2, d’ACFTI8:2 et d’ACFT 7:3; toutefois, la formation et l’accumulation totales de l’APFO étaient faibles. Frömel et Knepper (2010) ont suggéré que l’ultime raccourcissement de la chaîne éthoxyle des éthoxylates de fluorotélomères peut produire des FTHO et donc contribuer en tant que source potentielle de composés perfluorés comme l’APFO.
Dinglasan et al. (2004) ont montré la biodégradation aérobie du FTOH 8:2 avec une demi-vie initiale de ~0,2 j/mg de la protéine de la biomasse initiale, suivie d’une seconde demi-vie de 0,8 j/mg dans une culture microbienne mixte obtenue à partir de sédiments et d’eau souterraine prélevés dans un lieu contaminé, culture enrichie sur du 1,2-dichloroéthane, puis maintenue avec de l’éthanol comme seule source de carbone. Cette culture mixte a été choisie parce qu’elle était acclimatée à la dégradation des alcanes et des alcools chlorés, et donc considérée comme active sur des alcools fluorés. La dégradation de l’alcool s’est produite surtout par un mécanisme produisant un acide télomérique, qui a ensuite subi une β-oxydation pour produire de l’APFO, qui représentait 3 % de la masse totale des FTOH initialement au jour 81. Toutefois, comme cette étude était limitée à l’identification et à la quantification de produits de transformation connus ou prévus, il se peut que d’autres produits de transformation soient demeurés inconnus. Les FTOHpouvaient se métaboliser pour former de l’APFO dans les boues d’UTEU municipales (Pace Analytical, 2001). Liu et al. (2007b) ont montré la dégradation microbienne du FTOH 8:2 en APFO dans des sols argileux et dans deux cultures bactériennes pures de sol (espèce Pseudomonas).
Wang et al. (2005) ont mené des études de biodégradation aérobie sur l’alcool télomérique 8:2 marqué au 14C dans des boues activées diluées d’une UTEU. Trois produits de transformation ont été identifiés : acides saturés 8:2, acides insaturés 8:2 et APFO, ceux-ci représentant respectivement 27 %, 6 % et 2,1 % de la masse initiale de l’alcool marqué au 14C après 28 jours. Selon les résultats obtenus, les métabolites d’acide perfluoré comme l’APFO ne constituent qu’une infime partie des produits de transformation observés durant la période considérée (Wang et al., 2005). Wang et al. (2005) ont également soutenu que le devenir biologique de l’alcool télomérique 8:2 était déterminé par de multiples voies de dégradation, ni la β-oxydation ni une autre réaction catalysée par des enzymes n’étant la cause dominante. Une étude réalisée par Dinglasan et al. (2005) a révélé que l’oxydation de FTOH 8:2 en acide télomérique s’était produite par l’intermédiaire de l’aldéhyde télomérique transitoire. L’acide télomérique subissait ensuite une transformation supplémentaire par β-oxydation pour former l’acide insaturé et l’APFO. Toutefois, un bilan massique complet n’a pas été établi, pour plusieurs raisons selon les auteurs : liaison des métabolites avec la biomasse et d’autres macromolécules biologiques, présence de métabolites non pris en compte, absorption d’intermédiaires (formation de liaisons covalentes) ou existence d’autres voies de dégradation (Dinglasan et al., 2005).
Les FTOH peuvent provenir de polymères ou de substances chimiques intégrant des FTOH ou de quantités résiduelles de FTOH qui n’ont pas établi de liaisons covalentes avec des polymères ou des substances chimiques pendant la production. Les FTOH entrent dans la fabrication de mousses extinctrices, de produits de soins personnels et de nettoyage, de revêtements antitaches, antigraisses, oléofuges et hydrofuges pour les tapis, les tissus, le cuir et le papier (US EPA, 2006a). Ils entrent également dans la fabrication d’une vaste gamme de produits : peintures, adhésifs, cires, polis, métaux, appareils électroniques, matériaux d’étanchéité, etc. De 2000 à 2002, ces composés ont été produits à raison d’environ 5 × 106 kg à l’échelle mondiale, dont 40 % en Amérique du Nord (Dinglasan et al., 2004). La fabrication des matières brutes et des produits à base de fluorotélomères comporte une suite d’étapes, le télomère A intervenant à la première étape. La production mondiale de télomère A de 2000 à 2002 était de 5 000 à 6 000 t/an (Prevedouros et al., 2006).
Yoo et al. (2010) ont mesuré les concentrations de FTOH dans le sol de champs (près de Decatur, en Alabama) sur lesquels on avait épandu des boues d’épuration. Des boues provenant d’une UTEU à Decatur, en Alabama, ont été épandues sur des champs agricoles pendant plus d’une décennie; cette UTEU recueillait les flux de déchets des industries qui utilisaient des composés fluorotélomériques (Washington et al., 2010). Yoo et al. (2010) ont constaté que les champs amendés par les boues présentaient des concentrations de FTOH dans le sol de surface de 5 à 73 ng/g poids sec. La concentration de FTOH la plus élevée était celle du FTOH 10:2, dont les concentrations variaient de moins de 5,6 à 166 ng/g poids sec. Les demi-vies des FTOH étaient comprises entre 0,85 et 1,8 année, ce qui laisse entendre que l’épandage des boues est une voie possible pour la dégradation des FTOH en APFO et autres APFC. Washington et al. (2010) ont également constaté que ces champs amendés par des boues présentent des concentrations élevées d’APFC, notamment d’APFO (moins de 320 ng/g poids sec).
La pression de vapeur mesurée des FTOH va de 140 à 990 Pa. Les constantes adimensionnelles de la loi de Henry calculées pour cette classe de composés (p. ex., 270 à 25 °C pour les FTOH 8:2) à partir de données limitées sur la solubilité dans l’eau et la pression de vapeur montrent la propension de ces composés à passer dans l’atmosphère (Dinglasan et al., 2004). Ellis et al. (2004a) ont montré le potentiel des FTOH à produire de l’APFO par réaction avec des radicaux hydroxyles dans l’atmosphère. Selon des études en chambre à smog, les FTOH peuvent produire une série homologue d’APFC par dégradation dans l’atmosphère (Ellis et al., 2004a). L’oxydation des FTOH dans l’atmosphère serait le fruit d’une réaction avec des radicaux hydroxyles (Dinglasan et al., 2004; Ellis et al., 2004a). Il a été démontré que les perfluorooctylsulfonamides réagissent avec des radicaux hydroxyles pour produire de l’APFO (Hatfield et al., 2002). Même si ces études ont été réalisées en présence de concentrations de radicaux hydroxyles plus fortes que ce qu’on observe dans l’environnement, et que leurs résultats étaient qualitatifs plutôt que quantitatifs, elles montrent la possibilité que des produits apparentés produisent de l’APFO en réagissant dans l’atmosphère.
Stock et al. (2004, 2007) ont montré que les FTOH étaient très répandus dans l’atmosphère en Amérique du Nord, et ce, à des concentrations importantes. Des échantillonnages d’air effectués récemment ont permis de déceler la présence de FTOH dans la troposphère à des concentrations comprises généralement entre 17 et 135 pg/m3 et plus élevées au-dessus des milieux urbains que des milieux ruraux (Martin et al., 2002; Stock et al., 2004). Loewen et al. (2008) ont étudié les concentrations de FTOH dans l’atmosphère et dans les eaux lacustres le long d’un transect altitudinal dans l’Ouest canadien. Les échantillons d’eau ont été prélevés au lac Cedar (petit lac situé près de Golden, en Colombie-Britannique), au lac Bow dans le parc national Banff (Banff, Alberta) et à un autre petit lac sans nom situé aussi dans ce parc. Des échantillonneurs d’air passifs ont été installés en différents points d’un transect altitudinal (800 à 2 740 m au-dessus du niveau de la mer) allant de Golden, en Colombie-Britannique, au parc national Banff. Loewen et al. (2008) ont noté que la quantité de FTOH 8:2 et 10:2 augmentait (< 2,0 ng/échantillonneur) en fonction de l’altitude. Les concentrations d’APFO dans l’eau prélevée dans les lacs le long du transect altitudinal étaient inférieures à 1 ng/L. Aucune tendance bien définie n’a pu être dégagée entre l’altitude et les concentrations d’APFO. Selon Ellis et al. (2004a) et Wallington et al.(2006), les alcools télomériques pourraient être en partie responsables de la présence d’APFC dans l’Arctique et dans d’autres régions non urbaines où les concentrations de radicaux peroxyles dépassent de beaucoup celles des oxydes d’azote (NOx). On a fait remarqué que comme la réaction du FTOH 8:2 avec l’oxyde nitrique entre en concurrence avec la réaction entraînant la formation d’APFO, la formation d’APFO devrait diminuer avec l’augmentation des concentrations de NOx. Dès lors, la production d’APFO est inhibée dans les régions sources où les concentrations de NOx sont généralement égales ou supérieures à 100 parties par billion.
De pair avec les mesures des alcools dans l’atmosphère effectuées par Martin et al. (2002) et Stock et al. (2004) et avec le profil des isomères linéaires et des isomères ramifiés observés dans des échantillons prélevés dans l’Arctique canadien (De Silva et Mabury, 2004), Ellis et al. (2004a) ont conclu que les alcools télomériques constituaient une source plausible d’une partie de l’APFOdétecté dans les régions éloignées. Cette conclusion est appuyée par Stock et al. (2007) qui ont mesuré des concentrations de FTOH dans l’air à l’île Cornwallis, au Nunavut, en 2004. Les concentrations moyennes de FTOH variaient entre 2,8 et 14 pg/m3. Cette conclusion est également appuyée par des mesures de l’APFO dans des échantillons d’eau de pluie prélevés aux États-Unis (Scott et al., 2003, 2006b). Ces résultats montrent que les FTOH sont très répandus dans la troposphère et qu’ils peuvent être transportés sur de grandes distances par voie atmosphérique. De plus, De Silva et al. (2009) ont décelé la présence d’isomères ramifiés d’APFOdans les sédiments et l’eau de surface du lac Ontario et en Arctique, dans le biote du lac Ontario et chez les humains. Ils n’ont toutefois pas mesuré d’isomères ramifiés dans des concentrations supérieures à la limite de détection (3,6 ng/g) chez l’ours blanc et le phoque annelé.
Gewurtz et al. (2009) ont décelé de l’APFO ainsi que des ACFTI8:2 et des ACFTI 10:2 dans la pellicule formée par les dépôts accumulés sur des fenêtres échantillonnées à l’intérieur et à l’extérieur, en ville, en banlieue, en campagne et dans des magasins de tapis à Toronto, en Ontario. Nilsson et al. (2010) ont décelé la présence de PFC, y compris d’APFO, dans le sang de techniciens de fartage de skis (les concentrations variaient de 4,8 à 535 ng/L). Nilsson et al. (2010) ont mentionné que des composés organiques fluorés sont ajoutés aux farts de glisse pour empêcher l’adhésion de la neige, de la glace et de la poussière. Les farts fluorés sont appliqués par chauffage à environ 130-220 °C, températures auxquelles des particules en suspension dans l’air et des émanations contenant un mélange de composés organochlorés gazeux sont émises. Cependant, les auteurs n’ont pas analysé les farts de glisse eux-mêmes pour déterminer la présence de PFC.
La grande solubilité dans l’eau de l’APFO ainsi que la volatilité négligeable des espèces ionisées indiquent que toutes les espèces d’APFO s’introduisent principalement dans les milieux aquatiques. La solubilité est fonction de la constante de dissociation acide (pKa) de la forme acide. Goss (2008) a également avancé que l’APFO devrait avoir une faible valeur de pKa, de sorte que plus de 99 % du composé se trouverait sous forme anionique (c.-à-d. PFO) dans la plupart des conditions environnementales. Ainsi, les résultats de modélisation présentés dans des publications évaluées par des pairs portant sur le devenir global, le transport, la répartition et la bioaccumulation devraient être examinés avec prudence, car ils n’ont peut-être pas tenu compte du pH du milieu naturel conjointement avec les valeurs de pKa du composé. Il est possible que le sel d’ammonium de l’APFO puisse se réintroduire dans la phase gazeuse à partir de l’eau (US EPA, 2002). Toutefois, des études ont montré que si cela se produit, c’est à un degré négligeable, à un pH proche de 8,5 (Oakes et al., 2004).
Une fois dans la phase aqueuse, l’APFO peut entrer dans des sédiments, comme l’a montré sa détection dans ce milieu (Giesy et Newsted, 2001; Stock et al., 2007). D’après une comparaison des concentrations mesurées dans la phase aqueuse et dans les sédiments, il est improbable que les sédiments soient un puits important pour l’APFO (Oakes et al., 2004; Masunaga et Odaka, 2005). Toutefois, les propriétés d’adsorption et de désorption du SAAPFO ont été étudiées avec un échantillon de boues activées et quatre échantillons de sol (Dekleva, 2003). Selon cette étude, le taux moyen d’adsorption du SAAPFO était de 40,8 à 81,8 %, tandis que les valeurs du coefficient d’adsorption (Kd) variaient entre 0,41 et 36,8 L/kg. Le coefficient d’adsorption sur le carbone organique (Kco) oscillait entre 48,8 et 229 L/kg et le coefficient d’adsorption sur la matière organique (Kmo), entre 28,4 et 133 L/kg. Ces valeurs montrent qu’il est plus probable que l’APFO soit adsorbé sur le carbone organique que sur les autres matières solides du sol. Moody et Field (1999) sont d’avis que, étant donné que l’APFO a pu être mesuré dans les eaux souterraines de zones où il n’est plus utilisé, une fraction du composé doit être liée au sol et libérée lentement dans l’eau. Toutefois, il est reconnu que sa présence dans les eaux souterraines pourrait simplement indiquer la lente migration de l’APFO plutôt que sa liaison avec le sol. Il est donc peu probable que l’APFO qui se dépose sur le sol soit transporté sur de grandes distances (Franklin, 2002).
Persistance
Selon les données disponibles, l’APFO ne subit pas de photodégradation importante dans des conditions environnementales normales (Todd, 1979; Nubbe et al., 1995; Scrano et al., 1999; Hatfield, 2001; Hori et al., 2004, 2005, 2008), ne s’hydrolyse pas (Ellis et al., 2004b) ou ne subit pas de dégradation biotique ou abiotique importante (Reiner, 1978; 3M Company, 1979, 1980b, 1985b; Pace Analytical, 1997; Oakes et al., 2004; Moriwaki et al., 2005; Cheng et al., 2008); il est également improbable que l’APFO subisse une fluoration réductrice par les communautés microbiennes anaérobies (Liou et al., 2010).
| Identité de l’APFO | Milieu | Étude | Demi-vie de dégradation | Références |
|---|---|---|---|---|
| Base conjuguée | Eau | Photolyse | > 349 jours | Todd, 1979; Hatfield, 2001 |
| Base conjuguée | Eau | Photolyse Hydrolyse Biodégradation Volatilité |
> 35 jours | Oakes et al., 2004 |
| Base conjuguée | Eau | Hydrolyse | ~235 ans | US EPA, 2002 |
| Base conjuguée | Air | Réaction avec des radicaux hydroxyles | ~90,1 jours | Hurley et al., 2004 |
| Base conjuguée | Boues résiduaires | Biodégradation | > 2,5 mois | Pace Analytical, 2001 |
| Base conjuguée | Sol/boues résiduaires | Fluoration réductrice microbienne anaérobie | > 110 jours | Liou et al., 2010 |
Les valeurs de la demi-vie de l’APFO et de ses sels sont estimées et demeurent hautement hypothétiques étant donné la brièveté des périodes d’étude. La valeur prévue de la durée de vie de l’APFO dans l’atmosphère par rapport aux radicaux hydroxyles a été établie à 130 jours (Hurley et al., 2004). Selon Franklin (2002), le temps de vie dans l’atmosphère se mesurerait en jours lorsque cet acide provient d’une source au sol, et il serait donc improbable qu’il soit transporté sur de grandes distances. Toutefois, si l’APFOprovient d’une source atmosphérique (c.-à-d. produit par l’intermédiaire de précurseurs) et que les pertes se produisent principalement par des dépôts humides ou secs, il aurait une durée de vie de 20 à 30 jours avant de se déposer (Ellis et al., 2004b). Cette durée serait suffisante pour que l’APFOsoit transporté sur des milliers de kilomètres, ce qui suggère l’existence d’un mécanisme de transport à grande distance. En outre, la présence d’APFO dans l’Arctique canadien peut constituer une preuve du transport à grande distance de l’APFO(par des courants océaniques, par exemple) [Caliebe et al., 2004; Yamashita et al., 2005] ou de précurseurs volatils de l’APFO par voie atmosphérique (Stock et al., 2007). Webster et Ellis (2010) ont proposé que les embruns pourraient être un mécanisme de production de l’APFO dans la phase gazeuse à partir de PFO dans un plan d’eau ayant le potentiel de fournir de grandes quantités d’APFOdans l’atmosphère et, donc, de fortement contribuer aux concentrations mesurées dans les régions éloignées.
Il est possible que la présence des PFC dans l’Arctique canadien puisse être due, en partie, à la présence d’anciennes bases militaires (Iqaluit, lac Sarcpa, île Resolution) ou aux stations du réseau d’alerte avancé [DEW] (côtes nord de l’Alaska jusqu’à Cape Dyer sur la côte de l’île de Baffin), qui ont pu utiliser des produits perfluorés (Stow et al., 2005; Poland et al., 2001). Ces sites sont considérés comme assainis, mais aucun PFC tel que l’APFO n’a été mesuré ou analysé, les publications disponibles (Stow et al., 2005; Poland et al., 2001) n’ayant déterminé que les concentrations de biphényles polychlorés (BPC) et de métaux pendant le processus d’assainissement. La présence d’APFO a été décelée dans les sites d’enfouissement de l’Arctique à des concentrations variant entre 22 et 1 083 ng/g (p. ex., décharges publiques, dépotoirs avec brûlage et décharges de déchets métalliques) [Ikonomou, 2006], ce qui semble indiquer qu’il existe des sources provenant d’activités locales de consommation ou de production. Néanmoins, l’APFO a été mesuré dans le biote et dans divers milieux naturels des régions éloignées de l’Arctique situées loin des sources locales ou régionales.
Une hypothèse a été avancée pour expliquer la présence d’APFOdans le biote de régions éloignées : un précurseur (p. ex., les FTOH) est émis dans l’atmosphère, puis se transforme en APFO par dégradation biotique et abiotique. Ellis et al. (2004a) ont montré que la durée de vie atmosphérique des FTOH à chaîne courte, sous l’effet d’une réaction avec des radicaux hydroxyles, était d’environ 20 jours. Piekarz et al. (2007) ont estimé que les temps de résidence dans l’atmosphère du FTOH 6:2, du FTOH 8:2 et du FTOH10:2 étaient respectivement de 50, 80 et 70 jours.
Shoeib et al. (2006) ont recueilli des échantillons d’air lorsqu’ils ont traversé l’Atlantique Nord et l’archipel de l’Arctique canadien en juillet 2005 pour étudier les concentrations des FTOH. Les concentrations les plus élevées de FTOH ont été mesurées pour le FTOH 8:2 (5,8 à 26 pg/m3), suivi par le FTOH 10:2 (1,9 à 17 pg/m3), puis le FTOH 6:2 (ND à 6,0 pg/m3). Ju et al. (2008) ont mesuré l’APFO dans la couche superficielle de la mer (interface eau-air) et les eaux subsuperficielles près des eaux côtières de Dalian, en Chine. Les concentrations d’APFO dans la couche superficielle variaient entre 0,26 et 1,19 ng/L. Dans les eaux subsuperficielles, les concentrations d’APFO allaient de 0,17 à 0,67 ng/L. La présence d’APFO dans les eaux océaniques indique un autre mécanisme possible pour le transport à grande distance jusque dans des régions éloignées comme l’Arctique canadien.
Des calculs de masse du transfert de PFO par le milieu marin vers l’Arctique ont donné un flux de 2 à 12 tonnes par année en utilisant un pKa variant de 2 à 3 à un pH de 4 et 7 (Prevedouros et al., 2006). Le flux net de PFO vers l’Arctique estimé par Armitage et al. (2006) était de 8 à 23 tonnes par année, calculé à l’aide d’un pKa variant de 2,5 à 2,8 à un pH de 5-8. L’APFO a été mesuré dans les calottes glaciaires polaires de trois régions dans l’Extrême Arctique (calotte glaciaire de Melville, Territoires du Nord-Ouest; calotte glaciaire d’Agassiz, Nunavut; calotte glaciaire de Devon, Nunavut) [Young et al., 2007]. Les concentrations variaient entre 0,012 et 0,147 ng/L, ce qui semble indiquer que la contamination pourrait résulter de l’apport atmosphérique. Aucune tendance significative n’a été observée pour les concentrations d’APFO entre 1996 et 2005 (analyse de régression, p = 0,140) [Young et al., 2007]. Les flux ont été calculés à l’aide de la concentration corrigée en fonction de la densité, multipliée par l’accumulation annuelle. Ces flux sont des estimations et pourraient ne pas être représentatifs des dépôts réels dans cette région, étant donné les variations importantes des taux de précipitation. Le flux de l’APFO était de 114 à 587 kg/an en 2005 (Young et al., 2007).
En résumé, l’APFO peut être transporté sur une grande distance et les données montrent qu’il est persistant, et des études indiquent l’absence de dégradation abiotique ou biotique dans l’environnement dans des conditions ambiantes normales. Par conséquent, d’après les données empiriques et les propriétés physiques et chimiques, l’APFO et ses sels répondent aux critères de persistance dans l’eau, le sol, les sédiments et l’air (demi-vie dans le sol et dans l’eau ≥ 182 jours et demi-vie dans les sédiments ≥ 365 jours; demi-vie dans l’air ≥ 2 jours ou preuve d’un transport atmosphérique vers des régions éloignées comme l’Arctique) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Bioaccumulation
Les APFC, y compris l’APFO, sont des molécules qui possèdent des portions oléophobes, des portions hydrophobes et des portions hydrophiles, et combinent donc toutes ces propriétés. Par exemple, le groupement carboxylate lié à la chaîne perfluorée rend la molécule polaire. Compte tenu de ces propriétés, l’hypothèse selon laquelle les interactions hydrophobes et lipophiles entre le composé et le substrat sont les principaux mécanismes qui régissent la répartition ne s’applique pas dans le cas de l’APFO. Bien que le coefficient de partage octanol-eau (Koe) ait été calculé ou modélisé pour la forme neutre de l’APFO et ses divers sels (voir tableau 2), la documentation actuelle laisse entendre que le Koe constitue un paramètre problématique dans le cas des agents tensioactifs ionisés, qui ont tendance à s’agréger à l’interface d’un système liquide-liquide. Par conséquent, le Koe n’a pas été considéré comme étant un indicateur fiable du potentiel de bioaccumulation des substances perfluorées. Toutefois, Webster et Ellis (2011) mentionnent que les APFC, y compris l’APFO, ne sont pas tensioactifs et que le Koe est une variable explicative de la répartition des lipides et des protéines dans le biote. Par conséquent, les auteurs affirment que les modèles de répartition à l’équilibre pour la répartition des molécules neutres hydrophobes des APFC, y compris l’APFO, sont applicables.
Des critères réglementaires (facteurs de bioconcentration [FBC] et facteurs de bioaccumulation [FBA]) définissant si une substance donnée doit ou non être considérée comme bioaccumulable ont été établis en application de la LCPE (1999) [Canada, 1999]. Cependant, ces critères sont fondés sur des connaissances accumulées au fil du temps sur des substances organiques neutres non métabolisées. Ces critères, fondés sur les critères de persistance et de bioaccumulation définis dans la Politique de gestion des substances toxiques (PGST) fédérale, ont été élaborés au milieu des années 1990 et officiellement publiés en 1995 (Canada, 1995b), et ils visent à identifier les substances lipophiles susceptibles de se bioaccumuler essentiellement dans les systèmes aquatiques d’eau douce (poissons). Les substances qui répondent aux critères définis (soit FBA ou FBC ≥ 5 000 ou log Koe≥ 5) sont fortement susceptibles de se bioaccumuler dans un organisme donné et de se bioamplifier à l’intérieur du réseau trophique. Toutefois, les FBA, les FBC ou le log Koe ne sont que quelques-uns des éléments formant le poids de la preuve qui détermine le potentiel général d’une substance à s’accumuler dans les organismes. En outre, une substance peut être jugée suffisamment bioaccumulable pour susciter des préoccupations même si les critères réglementaires ne sont pas atteints.
Étant donné le nombre d’études expérimentales disponibles, dans le cadre de la présente évaluation, l’accent a été placé sur les résultats des études expérimentales sur la bioaccumulation et la bioamplification.
Études sur la bioaccumulation, la bioconcentration et la bioamplification
L’APFO est absorbé dans les truites arc-en-ciel (Oncorhynchus mykiss) juvéniles, qui présentent un FBC de 4,0 (Martin et al., 2003b). L’exposition à l’APFO par voie alimentaire chez la même espèce n’a pas entraîné de bioaccumulation (FBA = 0,038) (Martin et al., 2003b). Des carpes (Cyprinus carpio) ont été exposées à deux concentrations d’APFO (5 et 50 µg/L) pendant 28 jours dans un système à recirculation d’eau (Kurume Laboratory, 2001). La substance chimique a été préparée en vue de l’exposition à l’aide d’un dispersant composé d’huile de ricin hydrogénée et mélangé dans de l’acétone. La qualité de l’eau a fait l’objet d’un suivi quotidien pendant la durée de l’expérience. Les FBC variaient de 3,1, à la plus faible concentration, à < 5,1-9,1, à la concentration élevée, ce qui révèle une faible bioaccumulation (Kurume Laboratory, 2001). Les expériences menées avec des poissons et d’autres espèces aquatiques montrent que la bioaccumulation de l’APFO est faible, mais il faut se garder d’extrapoler les résultats à d’autres animaux non aquatiques. Ainsi, les branchies des poissons peuvent être des véhicules d’élimination et d’absorption supplémentaires dont les organismes qui respirent dans l’air comme les oiseaux, les organismes terrestres et les mammifères marins ne sont pas dotés (Kelly et al., 2004). En raison de sa grande solubilité dans l’eau, l’APFO a tendance à se libérer assez facilement dans ce milieu par les branchies, alors qu’il lui est relativement difficile d’en faire autant dans l’air par la paroi alvéolaire des poumons, compte tenu de sa faible pression de vapeur et de sa charge négative. Par exemple, la demi-vie de l’APFO était de trois jours chez le poisson (Martin et al., 2003a), tandis qu’elle était de 11 jours chez le rat mâle (Ylinen et Auriola, 1990), et elle était de 4,37 ans (Kudo et Kawashima, 2003) et de 3,8 ans (Olsen et al., 2007) chez l’être humain.
On a calculé le FBC propre à deux espèces de tortues sauvages (tortue à oreilles rouges, Trachemys scripta elegans; chinémyde de Reeves, Chinemys reevesii). Au Japon, ces tortues occupent le sommet de la chaîne alimentaire dans l’écosystème fluvial et possèdent de petits territoires (Morikawa et al., 2006). Les concentrations d’APFO dans l’eau de surface étaient comprises entre 16,7 et 87 100 ng/L, et on a observé la présence de cet acide dans presque tous les échantillons de sérum (91 sur 94), où ses concentrations allaient de moins de 200 à 870 000 ng/L. Les valeurs calculées des FBC dans le sérum allaient de 0,8 à 15,8 (Morikawa et al., 2006). Les auteurs ont noté une relation inverse entre les valeurs du FBC et les concentrations de l’APFO dans l’eau de surface, ce qui semble indiquer que l’absorption d’APFO par l’intestin pourrait être un processus saturable. Toutefois, il convient de noter que le FBC est en réalité un FBA, vu que les tortues sauvages n’étaient probablement pas exposées à l’APFOseulement dans l’eau de surface.
Kannan et al. (2005a) ont mesuré les concentrations d’APFO dans une chaîne alimentaire en milieu benthique dans les Grands Lacs. Ils ont constaté que, malgré sa présence à des concentrations relativement fortes dans l’eau, cet acide était absent chez les invertébrés ou les poissons. Les résultats préliminaires (inédits) d’une étude menée dans l’Arctique canadien révèlent un facteur de bioamplification (FBM) de 8 entre le foie du phoque annelé (Pusa hispida) et le foie de l’ours blanc (Ursus maritimus) [Butt et Smithwick, 2004]. Dans le réseau trophique pélagique du lac Ontario, les concentrations d’APFO n’augmentaient pas en fonction du niveau trophique (déterminé par des isotopes stables de l’azote) [Martin et al., 2004b]. En fait, elles étaient moindres chez le touladi (Salvelinus namaycush), prédateur au sommet de la chaîne alimentaire, que chez la mysis (Mysis relicta), un invertébré (tableau 5). Par exemple, on a calculé un facteur d’amplification trophique (FAT) pour l’APFO de 0,37 pour la relation chabot visqueux (Cottus cognatus)-Diporeia hoyi, un amphipode fouisseur; alors qu’au sommet de la chaîne alimentaire, le FATétait de 0,58 pour la relation Mysis relicta-gaspareau (Alosa pseudoharengus)-éperlan (Osmerus mordax)-touladi (Martin et al., 2004b). Les différences entre les FAT aux deux extrémités du réseau pourraient indiquer des différences selon qu’il s’agit de relations en milieu benthique ou en milieu pélagique. Les FAT inférieurs à 1 correspondent à l’absence de bioamplification. Dans une autre étude, les FBM, corrigés en fonction du niveau trophique, ont été calculés pour plusieurs biotes de l’Arctique (Tomy et al., 2004). Les auteurs ont déterminé les FAT pour l’ensemble du réseau trophique en fonction de la relation entre le δ15 N et la concentration du contaminant. Les niveaux trophiques ont été déterminés par rapport à celui d’un mollusque bivalve, qu’on suppose être au deuxième niveau trophique (c.-à-d. herbivore primaire). Pour chaque échantillon de zooplancton, de poisson et de mammifère marin, le niveau trophique a été déterminé à l’aide de la formule suivante :
NT consommateur = 2 + (δ15 N consommateur – δ15 N bivalve) / 3,8
où NT consommateur est le niveau trophique de l’organisme étudié et 3,8, le facteur d’enrichissement isotopique. Et les facteurs de bioamplification (FBMNT) propres à chaque espèce, corrigés en fonction du niveau trophique, ont été déterminés à l’aide de la formule suivante :
FBMNT = [prédateur] / [proie] / (NT prédateur/NT proie)
où [prédateur] et [proie] sont les concentrations, en poids humide, de l’analyte chez les espèces prédatrices et les espèces proies respectivement, et NT, le niveau trophique basé sur δ15 N propre aux prédateurs et aux proies. Les valeurs du FBM de l’APFO étaient souvent supérieures à 1, ce qui porte à croire que cet acide peut subir une bioamplification dans les chaînes alimentaires suivantes : bivalves (Mya truncata; Serripes groenlandica)-morse (Odobenus rosmarus), morue polaire (Boreogadus saida)-narval (Monodon monoceros) et morue-beluga (Delphinapterus leucas) [tableau 5]. Ces résultats pourraient refléter des différences liées aux niveaux trophiques, et peut-être pas seulement le potentiel de bioaccumulation de l’APFO (p. ex., le prédateur au sommet d’un des réseaux trophiquesétait un poisson, tandis que dans l’autre, c’était un mammifère).
Martin et al. (2004a) ont constaté que l’ours blanc, qui est au sommet du réseau trophique dans l’Arctique canadien, avait une teneur en AFPO supérieure à celle mesurée dans tous les autres organismes de cette région qui ont été examinés. Butt et al. (2008) ont déterminé les valeurs du FBM de l’APFO par région pour la relation phoque annelé-ours blanc, et elles étaient comprises entre 45 et 125. Ces valeurs ont été calculées en regroupant les populations de phoques annelés avec les populations d’ours blancs correspondantes situées dans des régions similaires de l’Arctique canadien. Tomy et al.(2009) ont calculé les FAT de l’APFOpour un réseau trophique marin dans l’ouest de l’Arctique canadien (île Hendrickson et île Holman) composé des espèces suivantes : béluga de la mer de Beaufort (Delphinapterus leucas), phoque annelé (Phoca hispida), morue polaire (Boreogadus saida), hareng du Pacifique (Clupea pallasi), cisco arctique (Coregonus autumnalis), un amphipode pélagique (Themisto libellula) et un copépode arctique (Calanus hyperboreus). Les FAT variaient entre 0,1 (phoque annelé-morue polaire) et 2,2 (morue polaire-Calanus hyperboreus).
Houde et al. (2005) ont calculé des FBM de 1,8 à 13 à partir d’homogénats de proies entières et des concentrations de la base conjuguée dans le corps entier de dauphins à gros nez (Tursiops truncatus) dans le réseau trophique de cette espèce à Charleston, en Caroline du Sud. Kelly et al.(2009) ont calculé un FAT de 3,28 dans le réseau trophique marin (macroalgues, bivalves, poissons, canards marins et bélugas) de l’Arctique canadien (région de la baie d’Hudson). Martine van den Heuvel-Greve et al.(2009) ont établi des FBM de 3,8 et de 23, respectivement, pour les réseaux trophiques pélagique et benthique ayant comme prédateur dominant le phoque commun (Phoca vitulina). Les FBM d’autres espèces dans l’estuaire Westerschelde, aux Pays-Bas, étaient compris entre 0,03 et 31.
Jeon et al. (2010a) ont étudié les effets de la salinité sur la bioaccumulation dans le corps entier des PFC, y compris des APFO, chez l’huître creuse du Pacifique (Crassostrea gigas). Avec l’augmentation de la salinité (10-34 unités de salinité pratiques [USP]), on a pu observer une variation du FBC de 0,8 à 3,0, tandis que le FBA a augmenté de 9,6 à 19,4. Les auteurs laissent entendre que l’accumulation accrue est due principalement à une augmentation de l’absorption alimentaire provoquée par une possible modification de la physiologie des huîtres avec les changements de salinité. Les auteurs laissent également entendre qu’il y a une augmentation de la sorption des PFC sur les matières particulaires, ce qui peut accroître les risques pour les organismes benthiques et les mollusques bivalves filtreurs.
Jeon et al. (2010b) ont déterminé les FBC des PFC, y compris l’APFO, dans le sérum et dans le foie du sébaste noir (Sebastes schlegeli) à divers taux de salinité (10, 17,5, 25 et 34 USP). La bioconcentration des PCF (à l’exception de l’APFO) était plus grande à 34 USP qu’aux autres taux de salinité. Les FBC dans le sérum variaient de 578 (à 10 USP) à 357 (à 34 USP). Les FBC dans le foie variaient de 73 à 93.
Kwadijk et al. (2010) ont déterminé les FBA entre l’eau et l’anguille (Anguilla anguilla) [filets de 30 à 45 cm] provenant de 21 sites aux Pays-Bas. Le FBA eau-anguille calculé pour l’APFO était de à 1,09 et le FBA pour l’isomère linéaire de l’APFO était de 1,12.
Le tableau 5 fournit un résumé des données disponibles sur la bioaccumulation.
| Espèces (tissu)[1] | FBA | FBC | FBM | FAT | Références |
|---|---|---|---|---|---|
| [1] Nom des espèces non mentionné dans le texte : méné à grosse tête (Pimephales promelas); sébaste atlantique (Sebastes mentella); mouette tridactyle (Rissa tridactyla); goéland bourgmestre (Larus hyperboreus). | |||||
| Truite arc-en-ciel juvénile (carcasses) | 0,038 | 4,0 | Martin et al., 2003a, b |
||
| Truite arc-en-ciel juvénile (foie) | 8,0 | Martin et al., 2003b | |||
| Truite arc-en-ciel juvénile (sang) | 27 | Martin et al., 2003b | |||
| Carpe | 3,1-9,1 | Kurume Laboratory, 2001 | |||
| Tortues sauvages (sérum) | 0,8-15,8 | Morikawa et al., 2006 | |||
| Méné à grosse tête (corps entier) | 1,8 | 3M Company, 1995 | |||
| Ours blanc (foie) : phoque annelé (foie) | 8 | Butt et Smithwick, 2004 | |||
| Ours blanc (foie) : phoque annelé (foie) | 45-125 | Butt et al., 2008 | |||
| Morse (foie) : bivalve (corps entier) | 1,8 | Tomy et al., 2004 | |||
| Narval (foie) : morue (corps entier) | 1,6 | Tomy et al., 2004 | |||
| Béluga (foie) : morue (corps entier) | 2,7 | Tomy et al., 2004 | |||
| Béluga (foie) : sébaste atlantique (foie) | 0,8 | Tomy et al., 2004 | |||
| Mouette tridactyle (foie) : morue (corps entier) | 0,3 | Tomy et al., 2004 | |||
| Goéland bourgmestre (foie) : morue (corps entier) | 0,6 | Tomy et al., 2004 | |||
| Morue polaire (corps entier) : zooplancton (corps entier) | 0,04 | Tomy et al., 2004 | |||
| Mysis relicta : gaspareau : éperlan : touladi; homogénats de corps entiers | 0,37-0,58 | Martin et al., 2004b | |||
| Phoque annelé/morue polaire (foie) | 0,1 | Tomy et al., 2009 | |||
| Béluga/morue polaire (foie) | 0,9 | Tomy et al., 2009 | |||
| Béluga/hareng du Pacifique (foie) | 1,3 | Tomy et al., 2009 | |||
| Béluga/cisco arctique (foie) | 0,7 | Tomy et al., 2009 | |||
| Morue (foie)/Calanus hyperboreus (corps entier) | 2,2 | Tomy et al., 2009 | |||
| Morue (foie)/Themisto libellula (corps entier) | 0,8 | Tomy et al., 2009 | |||
| Touladi : gaspareau | 0,63 | Martin et al., 2004b | |||
| Touladi : éperlan | 0,5 | Martin et al., 2004b | |||
| Touladi : chabot | 0,02 | Martin et al., 2004b | |||
| Dauphin à gros nez (corps entier) : proies (corps entiers) | 1,8-13 | Houde et al., 2005 | |||
| Sédiments : macroalgues : bivalves : poisson : canard marin : béluga | 3,28 | Kelly et al., 2009 | |||
| Zooplancton/hareng | 1,6 | van den Heuvel-Greve et al., 2009 | |||
| Hareng/bar commun | 0,6 | van den Heuvel-Greve et al., 2009 | |||
| Hareng/phoque commun | 14 | van den Heuvel-Greve et al., 2009 | |||
| Bar commun/phoque commun (réseau trophique benthique pour le phoque commun) |
23 | 1,2 | van den Heuvel-Greve et al., 2009 | ||
| Scrobiculaire/flet | 31 | van den Heuvel-Greve et al., 2009 | |||
| Arénicole/flet | 0,03 | van den Heuvel-Greve et al., 2009 | |||
| Flet/phoque commun (réseau trophique pélagique pour le phoque commun) |
3,8 | 1,2 | van den Heuvel-Greve et al., 2009 | ||
| Chlorella ellipsoidea/huître creuse du Pacifique | 9,6-19,4 | 0,8-3,0 | Jeon et al., 2010a | ||
| Eau/sédiments/anguille | 1,09-1,12 | Kwadijk et al., 2010 | |||
| Eau de mer/sébaste noir (sérum) | 357-578 | Jeon et al., 2010b | |||
| Eau de mer/sébaste noir (foie) | 73-93 | Jeon et al., 2010b | |||
La concentration minimale d’une substance dans un organisme qui cause un effet nocif (charge corporelle critique) sert à évaluer le potentiel de toxicité directe. D’un point de vue physiologique, c’est la concentration d’une substance au site de l’action toxique dans l’organisme qui détermine si une réponse est observée, peu importe la concentration extérieure. Lors de la détermination du potentiel de toxicité d’une substance pour les organismes consommateurs, c’est aussi la concentration dans le corps entier d’une proie qui est pertinente, étant donné que le prédateur consomme souvent la proie entière (y compris les tissus et les organes comme le foie et le sang). Puisque les substances perfluorées se répartissent dans le foie et le sang, on estime souvent que le site de l’action toxique est le foie. Ainsi, d’un point de vue toxicologique, la bioaccumulation (FBC, FBA et FBM) basée sur les concentrations dans certains organes, comme le foie, pourrait être plus pertinente pour prévoir le potentiel de toxicité directe pour cet organe (p. ex., la toxicité hépatique).
La bioaccumulation peut également indiquer soit une exposition directe pour les organismes qui ont accumulé de l’APFO, soit une exposition indirecte pour les organismes qui se nourrissent de proies contenant de l’APFO (par transfert dans la chaîne trophique). Cela est particulièrement vrai dans le cas des organismes des niveaux trophiques supérieurs (p. ex., l’ours blanc), pour lesquels il est impossible d’analyser le corps entier. Bien qu’il soit possible de mesurer la bioaccumulation dans le corps entier pour les espèces de petite taille des niveaux trophiques inférieurs, le statut trophique inférieur de l’organisme signifie que la bioaccumulation totale estimée des substances perfluorées pourrait être sous-estimée. Les FBC et, particulièrement, les FBM basés sur les concentrations dans le corps entier pourraient constituer une mesure utile du potentiel général de transfert dans la chaîne trophique. Conder et al. (2008) ont observé que la concentration d’acides perfluorés exprimée en fonction de la masse du corps entier était estimée être de 2 à 10 fois inférieure aux concentrations d’acides perfluorés dans le sang et le foie de la truite.
Ainsi, on considère que, d’après les données sur le corps entier, le potentiel de l’APFO à s’accumuler dans les espèces aquatiques varie de faible à modéré. Toutefois, selon les données propres aux organes, on peut considérer que l’APFOs’accumule et se bioamplifie dans les mammifères terrestres et marins. Par conséquent, d’après les données empiriques disponibles, l’APFO et ses sels ne répondent pas aux critères de bioaccumulation (FBA ou FBC ≥ 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000a). Cependant, des données scientifiques indiquent que l’APFO et ses sels s’accumulent et se bioamplifient dans les mammifères terrestres et marins.
Évaluation de l’exposition environnementale
Air
Loewen et al. (2008) ont étudié les concentrations de FTOH dans l’atmosphère et dans les eaux lacustres le long d’un transect altitudinal dans l’Ouest canadien. Les échantillons d’eau ont été prélevés au lac Cedar (petit lac situé près de Golden, en Colombie-Britannique), au lac Bow dans le parc national Banff (Banff, Alberta) et à un autre petit lac sans nom situé aussi dans ce parc. Des échantillonneurs d’air passifs ont été installés en différents points d’un transect altitudinal (800 à 2 740 m au-dessus du niveau de la mer) allant de Golden, en Colombie-Britannique, jusqu’au parc national Banff. Loewen et al. (2008) ont noté que la quantité de FTOH 8:2 et 10:2 augmentait (< 2,0 ng/échantillonneur) avec l’altitude. Les concentrations d’APFO dans l’eau prélevée dans les lacs le long du transect altitudinal étaient inférieures à 0,001 ng/L. Aucune tendance bien définie n’a pu être dégagée entre l’altitude et les concentrations d’APFOdans l’eau des lacs.
Stock et al. (2007) ont recueilli des échantillons d’air sur l’île Cornwallis, au Nunavut, où les valeurs moyennes des concentrations totales de FTOH étaient comprises entre 2,8 (FTOH 10:2) et 14 pg/m3 (FTOH 8:2). Les auteurs ont également mesuré dans les particules une concentration moyenne d’APFO de 1,4 pg/m3.
Shoeib et al. (2006) ont recueilli 20 échantillons d’air à grand débit pendant une traversée de l’Atlantique Nord et de l’archipel de l’Arctique canadien en juillet 2005 (de Gothenburg, Suède, à Barrow, Alaska, en passant par l’Atlantique Nord et l’archipel canadien). Les concentrations les plus élevées (sommes des phases gazeuse et particulaire) de FTOH ont été mesurées pour le FTOH 8:2 (5,8 à 26 pg/m3), suivi par le FTOH 10:2 (1,9 à 17 pg/m3), puis le FTOH 6:2 (sous le seuil de détection à 6,0 pg/m3). Aux fins de comparaison, Shoeib et al. (2006) ont également recueilli des échantillons d’air en milieu semi-urbain à Toronto en mars 2006 et la concentration moyenne de FTOH 8:2 y était de 41 pg/m3. Dreyer et al. (2009) ont effectué un échantillonnage d’air à grand débit au-dessus de l’océan Atlantique, de l’océan Austral et de la mer Baltique. L’APFO a été détecté dans la fraction particulaire à une concentration maximale de 6 pg/m3. Le FTOH 6:2 et le FTOH 8:2 étaient les formes dominantes dans la fraction de la phase gazeuse. Les concentrations de FTOH 8:2 variaient entre 1,8 et 130 pg/m3. La somme de tous les FTOH (FTOH 4:2, FTOH 6:2, FTOH 8:2, FTOH 10:2 et FTOH 12:2) allait de 0,3 à 47 pg/m3.
Eau
Moody et al. (2002) ont mesuré les concentrations d’APFOdans les eaux de surface du ruisseau Etobicoke, un affluent du lac Ontario, à la suite d’un rejet accidentel de mousse extinctrice aqueuse. Le dysfonctionnement a provoqué le rejet de 22 000 L de mousse ignifuge et de 450 000 L d’eau provenant du système de gicleur dans les égouts pluviaux qui mènent au ruisseau Spring (distance de transport de 1,8 km environ), puis au ruisseau Etobicoke, qui se jette dans le lac Ontario. Ils ont également mesuré les concentrations de fond à un site en amont du lieu de rejet. Les résultats ont indiqué que les concentrations d’APFO en aval atteignaient 11,3 µg/L. La présence d’APFO a également été détectée au site en amont, en concentrations plus faibles (ND-0,033 µg/L).
Scott et al. (2009) ont échantillonné 38 rivières (en amont et en aval de zones peuplées) dans l’ensemble du Canada pour analyser les PFC au cours de la période de 2001 à 2008. Les concentrations d’APFO allaient de 4,4 × 10-5 à 0,0099 µg/L. Les concentrations maximales d’APFO ont été mesurées depuis les affluents du lac Érié jusqu’au fleuve Saint-Laurent. La plupart des sites en aval des zones urbaines présentaient des concentrations plus élevées que les sites en amont. Des sites de référence, tels que l’eau de fonte glaciaire en Colombie-Britannique, présentaient des concentrations d’APFOplus faibles.
Boulanger et al. (2004) ont mesuré les concentrations d’APFOdans les lacs Érié et Ontario, où ils ont prélevé des échantillons à une profondeur d’environ 4 m à quatre endroits dans chacun des lacs. Les sites d’échantillonnage ont été choisis de manière à prélever des eaux subissant l’influence de milieux urbains et des eaux dans des zones éloignées et à obtenir des échantillons dans les parties est, centrale et ouest de chaque lac. Les concentrations mesurées s’élevaient de 0,021à 0,047 µg/L dans le lac Érié et de 0,015 à 0,070 µg/L dans le lac Ontario. Cependant, l’étude ne précisait pas clairement quels échantillons avaient été prélevés dans des eaux subissant l’influence de milieux urbains et lesquels provenaient de zones éloignées. Muir et Scott (2003) ont mesuré les concentrations d’APFO dans les lacs Supérieur, Huron et Ontario (les lieux exacts des prélèvements n’étaient pas indiqués). Les concentrations étaient comprises entre 0,0015 et 0,0018 µg/L dans le lac Huron et entre < 0,00001 et 0,0007 µg/L dans le lac Supérieur. Dans le lac Ontario, à des profondeurs de 70 à 213 m, les concentrations allaient de 0,0023 à 0,011 µg/L, la concentration la plus élevée, soit 0,011 µg/L, a été mesurée à 213 m de profondeur. Dans une étude réalisée par Furdui et al.(2005), la mesure des concentrations d’APFO a été tentée dans les lacs Ontario, Érié et Huron et le chenal North (le long de la rive nord du lac Huron) à l’aide d’une méthode éliminant les étapes de l’extraction et de la concentration. Avec cette méthode, l’APFO a été mesuré seulement dans les lacs Ontario et Érié, à des concentrations allant de 0,002 à 0,007 µg/L. Scott et al. (2003, 2006b) ont montré la présence d’APFO dans les affluents des lacs Ontario et Érié. Dans six affluents du lac Ontario (le canal Welland et les rivières Trent, Black, Don, Genessee et Oswego), les concentrations d’APFO étaient comprises entre 0,0015 et 0,025 µg/L. Dans les quatre affluents du lac Érié (rivière Grand et ruisseaux Stoney, Sandusk et Talbot), elles variaient entre 0,0016 et 0,0093 µg/L. La concentration maximale d’APFO dans les eaux d’affluents du lac Ontario provenant de milieux urbains était de 0,02 µg/L (Myers et al., 2009).
En 2001, l’APFO a été mesuré dans les précipitations dans trois régions éloignées (lacs Turkey, en Ontario, Kejimkujik, en Nouvelle-Écosse, et Chapais, au Québec), où les concentrations allaient de < 0,0005 à 0,0031 µg/L (Scott et al., 2006b). Des échantillons d’eau de pluie ont été prélevés à Winnipeg, au Manitoba, mais aucun APFO n’a été détecté (la limite de détection de la méthode [LDM] était de 0,0072 µg/L) [Loewen et al., 2005]. Selon ces auteurs, cela pourrait être dû au fait que la LDM était relativement élevée et que les concentrations atmosphériques d’APFCétaient insuffisantes. Scott et al. (2006a) ont mesuré l’APFOdans les précipitations partout au Canada entre 2002 et 2004. En 2002, les concentrations d’APFO à Kejimkijik (site éloigné) variaient de < 0,0001 à 0,0031 µg/L. En 2002, à Algoma, en Ontario (site éloigné), les concentrations d’APFOallaient de < 0,0001 à 0,0061 µg/L. En 2003-2004, les concentrations d’APFO à deux sites urbains en Ontario (Egbert et North Toronto) étaient comprises entre 0,0007 et 0,0111 µg/L. En 2002, les concentrations d’APFO à l’île Saturna, en Colombie-Britannique (site rural), variaient de < 0,0001 à 0,002 µg/L.
Stock et al. (2007) ont analysé des échantillons d’eau prélevés de 2003 à 2005 dans trois lacs de l’Arctique (lacs Amituk, Resolute et Char) sur l’île Cornwallis, au Nunavut, et y ont mesuré des concentrations d’APFO variant entre 0,0009 et 0,014 µg/L. Ahrens et al. (2009) ont mesuré les quantités d’APFO le long du gradient longitudinal allant de Las Palmas (Espagne) à St. John’s, Terre-Neuve-et-Labrador, ainsi que le long du gradient latitudinal allant du golfe de Gascogne jusqu’au sud de l’océan Atlantique au printemps et à l’automne 2007. L’APFO n’a pas été détecté à des concentrations supérieures à la LDM, soit 0,0012 µg/L, dans la phase particulaire ni dans les échantillons d’eaux profondes prélevés à 200 m et à 3 800 m. Les concentrations d’APFO variaient entre 0,000 004 et 0,000 229 µg/L à 11 m, 2 m et directement à la surface. De plus, Ahrens et al. (2009) ont constaté qu’il existait une corrélation positive entre les concentrations d’APFO et d’acide perfluorononanoïque, ce qui indique un lien entre les sources des deux composés. Ahrens et al. (2010b) ont prélevé des échantillons d’eau de surface du 2 novembre au 30 décembre 2008 le long du gradient latitudinal allant de la mer du Nord (nord de l’Europe) à l’Antarctique. L’APFO a été trouvé dans 79 % des échantillons de la phase dissoute dont les concentrations variaient de < 5,2 × 10-6 à 0,000 223 µg/L. L’APFOn’a pas été détecté dans la phase particulaire. Del Vento et al. (2009) ont mesuré des concentrations d’APFOallant jusqu’à 0,000 448 µg/L dans l’eau de mer et variant de 3,4 × 10-5 à 0,002 282 µg/L dans la neige du golfe Amundsen.
L’APFOétait aussi le principal contaminant fluoré détecté dans les eaux des océans Pacifique et Atlantique et dans les eaux marines côtières de plusieurs endroits en Asie (Japon, Hong Kong, Chine et Corée) [Yamashita et al., 2005]. On a mesuré des concentrations d’APFO de 0,000 001 5 à 0,000 192 µg/L et des concentrations de PFOS de 1,1 × 10-6 à 0,0577 µg/L. Yamashita et al. (2005) ont également constaté que les échantillons d’eau de mer prélevés à des profondeurs supérieures à 1 000 m dans le Pacifique et la mer de Sulu contenaient de l’APFO à l’état de traces (valeurs non indiquées). La présence d’APFO a également été décelée dans la mer du Nord (dans les secteurs sud et est, dans l’estuaire de l’Elbe et dans la baie d’Helgoland) à des concentrations variant de 0,003 à 0,02 µg/L (Caliebe et al., 2004). En haute mer, cet acide a été détecté à une concentration de 0,0005 µg/L (Caliebe et al., 2004). On a également relevé la présence d’APFO dissous dans la baie de Tokyo, à des concentrations de 0,007 à 0,0182 µg/L (Masunaga et Odaka, 2005). Les concentrations d’APFO dans la saumure et la glace de mer se situaient dans la même plage de valeurs que les concentrations mesurées dans la neige.
Sédiments
Stock et al. (2007) ont mesuré l’APFO dans des carottes de sédiments prélevées dans trois lacs isolés de l’Arctique canadien (Amituk, Resolute et Char) sur l’île Cornwallis, au Nunavut, en 2003. Les concentrations d’APFO variaient entre 0,0023 et 0,00095 µg/g poids sec pour les carottes prélevées dans le lac Resolute et allaient jusqu’à 0,0017 µg/g poids sec pour celles prélevées dans le lac Char. Des échantillons de matières en suspension ont été prélevés dans la rivière Niagara, à Niagara-on-the-Lake, en vue du dosage de l’APFO. Les concentrations de cet acide ont augmenté légèrement entre 1980 et 2002, passant de < 0,0001 µg/g à < 0,0003 µg/g poids sec (Lucaciu et al., 2005). La concentration maximale de l’APFO mesurée dans les sédiments lacustres du lac Ontario était de 0,0066 µg/g (Myers et al., 2009).
Sols, eaux souterraines et végétation
Il n’existe pas actuellement de mesures des concentrations d’APFOdans les sols ou les eaux souterraines au Canada.
L’APFOa été mesuré à des concentrations allant de 0,055 à 0,174 µg/g dans des sols prélevés à Dalton, en Géorgie aux États-Unis (Ellington et al., 2005). De l’APFO a été détecté dans les eaux souterraines de sites où il y a eu des exercices militaires de lutte contre les incendies aux États-Unis (en Floride, au Nevada et au Missouri), où des mousses extinctrices à formation de pellicule aqueuse ont été utilisées (Schultz et al., 2004). Les concentrations allaient de ND à 6 570 µg/L. Le ministère de la Protection de l’environnement de la Virginie-Occidentale (West Virginia Department of Environmental Protection et al., 2003) a mesuré les concentrations d’APFO dans des échantillons d’eaux souterraines prélevés dans des puits d’eau potable, et celles-ci variaient de ND (< 0,01 µg/L) à 23,6 µg/L. Murakami et al. (2009) ont décelé la présence d’APFOdans des échantillons d’eaux souterrainex et d’eau de source prélevés de 0 à 33 m sous la surface du sol dans la région métropolitaine de Tokyo (Japon) de septembre à novembre 2006. Les concentrations allaient de 0,000 47 à 0,06 µg/L.
Biote
La base conjuguée de l’APFO a été détectée chez de nombreuses espèces sauvages dans le cadre d’études menées au Canada. Martin et al. (2004b) ont mesuré la présence d’APFO dans le corps entier de nombreuses espèces du lac Ontario, dont des invertébrés benthiques et pélagiques et diverses espèces de poissons. Dans le lac Ontario, les concentrations allaient de 0,001 à 0,09 µg/g poids humide, la concentration la plus élevée ayant été trouvée chez l’invertébré benthique Diporeia hoyi(Martin et al., 2004b). Ces données montrent que l’invertébré benthique Diporeia hoyi présentait les concentrations les plus élevées que tout autre organisme du lac Ontario (c.-à-d. 90 µg/kg) (y compris le touladi au sommet de la chaîne alimentaire) et indiquent que les sédiments pourraient être un réservoir d’APFO dans ce système (Martin et al., 2004b). Ces données ne signifient pas nécessairement que l’APFO se répartit fortement dans les sédiments aquatiques; il est plus probable que les précurseurs de l’APFO se répartissent dans les sédiments et libèrent ensuite de l’APFO à la suite de processus bactériens ou abiotiques (Martin et al., 2004b; Stock et al., 2007).
Après un déversement de mousse extinctrice dans le ruisseau Etobicoke, Moody et al. (2002) ont décelé la présence d’APFOdans le foie de ménés à nageoires rouges (Notropis cornutus), à des concentrations variant entre 0,006 et 0,091 µg/g en poids humide. Quarante-six homogénats de corps entiers de touladis prélevés dans les cinq Grands Lacs ont été analysés en 2001 (Furdui et al., 2007). Les concentrations d’APFOvariaient de 0,0007 µg/g poids humide, dans le lac Érié, à 0,0024 µg/g poids humide, dans le lac Michigan (Furdui et al., 2007).
Martin et al. (2004a) ont également montré la présence de l’APFO dans le foie d’ours blancs (0,0029 à 0,013 µg/g poids humide), tandis que les concentrations mesurées chez d’autres animaux de l’Arctique étaient inférieures à la limite de détection (c.-à-d. < 0,002 µg/g). Au Nunavut, cet acide a été détecté à l’état de traces dans le foie d’ombles chevaliers (Salvelinus alpinus) (ND), de lottes (Lota lota) [ND à 0,0265 µg/g poids humide], de caribous (Rangifer tarandus) [ND à 0,0122 µg/g poids humide], de phoques annelés (ND à 0,0087 µg/g poids humide) et de morses (ND à 0,0058 µg/g poids humide) (Ostertag et al., 2009). Powley et al. (2008) n’ont pas détecté d’APFO dans les échantillons de zooplancton (Calanis hyperboreus, Themisto libellula, Chaetognatha), de morue polaire (Boreogadus saida), de graisse, de sang ou de foie du phoque annelé (Phoca hispida) ni dans les échantillons de graisse, de sang ou de foie du phoque barbu (Erignathusbarbatus) prélevés près de l’île Banks (limite est de la mer de Beaufort dans les Territoires du Nord-Ouest). Il n’y avait toutefois qu’un petit nombre d’échantillons, soit entre 1 et 5. La limite de détection utilisée dans cette étude était de 0,0002 µg/g.
Des études menées aux États-Unis ont permis de détecter la base conjuguée de l’APFO dans une vaste gamme d’échantillons biotiques : poissons, myes, huîtres, oiseaux, visons et loutres. En général, les concentrations pouvaient être inférieures à la limite de détection (LD) ou supérieures à celle-ci jusqu’à 1,9345 µg/g poids humide, soit en plus grande quantité que dans la plupart des échantillons de biote prélevés au Canada. C’est à un exutoire de Guntersville, en Alabama, que la plus forte concentration a été mesurée, dans le foie d’une orphie (Giesy et Newsted, 2001). Des concentrations allant jusqu’à 0,450 µg/g poids humide ont été mesurées chez le grand cormoran (Phalacrocorax carbo) [Kannan et al., 2002]. Ces auteurs ont toutefois constaté que pour cette colonie de cormorans, le maximum (0,450 µg/g poids humide) semblait être une valeur aberrante étant donné qu’elle était 4,5 fois plus élevée que l’écart type de la moyenne. On n’a pas pu détecter la présence d’APFO dans les algues benthiques récoltées dans les rivières Raisin, Sainte-Claire et Calumet (limite de détection de 0,2 ng/g poids humide; Kannan et al., 2005a). L’APFO était l’un des principaux composés perfluorés présents (outre le PFOS) dans le plasma de tortues caouannes immatures (Caretta caretta) [0,000 493 à 0,008 14 µg/mL] et de tortues de Kemp immatures (Lepidochelys kempii) [0,002 77 à 0,004 25 µg/mL] capturées au large de la Caroline du Sud, de la Géorgie et de la Floride (Keller et al., 2005). La présence de PFC chez des tortues de mer juvéniles au stade pélagique peut indiquer la contamination d’un bassin océanique, car ces tortues s’alimentent à grande distance des influences continentales (Keller et al., 2005). Les mêmes auteurs ont aussi constaté qu’il n’y avait pas de différences significatives dans les concentrations d’APFO selon l’espèce, le sexe, l’âge ou le lieu. Toutefois, comme les sujets capturés étaient des juvéniles, il est normal qu’il n’y ait pas de différences en fonction du sexe et de l’âge.
Des études menées au Japon, en Chine, à Taiwan et en Corée ont permis de déceler la présence de la base conjuguée d’APFOdans un large éventail de biotes. Tseng et al. (2006) ont mesuré des concentrations d’APFO allant de 0,12 à 0,34 µg/g dans les huîtres (Crassostrea gigas), le bar du Japon (Lateolabrax japonicus) et le tilapia (Oreochromis sp.). Nakayama et al. (2008) n’ont pas détecté d’APFO (la limite de dosage était de 0,005 µg/g poids humide) dans le foie des grands cormorans sauvages du lac Biwa, au Japon. Des concentrations d’APFO ont été mesurées dans les jaunes d’œuf de l’aigrette garzette (Egretta garzetta), du pluvier petit-gravelot (Charadrius dubius) et du paradoxornis de Webb (Paradoxornis webbiana) recueillis autour du lac Shihwa, en Corée (Yoo et al., 2008). Les concentrations variaient de < 0,0008 à 0,0543 µg/g poids humide. Wang et al.(2008) ont mesuré des concentrations d’APFO dans les œufs d’oiseaux aquatiques (bihoreau gris [Nycticorax nycticorax], grande aigrette [Ardea alba] et aigrette garzette) dans le sud de la Chine, qui allaient de < 0,000 001 à 0,000 952 µg/g poids humide.
Des rats sauvages mâles (Rattus norvegicus) capturés au Japon, dans une UTEU, un port, deux zones industrielles, un port et un marché de fruits de mer, un marché et deux sites d’enfouissement (Yeung et al., 2009a), présentaient des concentrations d’APFO dans le sang entier variant entre 0,00006 et 0,00657 µg/mL. L’APFO a été trouvé dans le sérum sanguin de pandas géants (Ailuropoda melanoleuca) et de petits pandas (Ailurus fulgens) en captivité en Chine (Dai et al., 2006). Les concentrations sériques allaient de 0,00032 à 0,00156 µg/mL chez la première espèce et de 0,00033 à 0,00820 µg/mL chez la seconde. Des concentrations d’APFO, comprises entre 0,00004 et 0,00018 µg/mL, ont également été mesurées dans le sérum de tigres de Sibérie (Panthera tigris altaica) [Li et al., 2008b] du nord-est de la Chine, de l’extrême-est de la Russie et de la Corée du Nord. Dans une autre étude, le sérum de tigres du Bengale (Panthera tigris tigris) et de lions d’Afrique (Panthera leo) en captivité au parc Harbin Wildlife, en Chine, a été analysé (Li et al., 2008a). Les concentrations d’APFO mesurées étaient plus élevées chez le lion d’Afrique que chez le tigre du Bengale, ce qui semble indiquer qu’il existe des différences d’absorption de la substance à la suite d’une exposition ou de capacités métaboliques entre les deux espèces. Les concentrations d’APFO variaient entre ND et 0,000 097 8 µg/mL chez le tigre du Bengale et entre 0,000 286 et 0,001 04 µg/mL chez le lion d’Afrique.
Holmström et Berger (2008) n’ont trouvé aucun APFO dans le foie, les reins et les muscles des guillemots marmettes (Uria aalge) adultes, ni dans le foie des oisillons ou les œufs de cette espèce sur l’île Stora Karlsö dans la mer Baltique. De plus, aucun APFO n’a été décelé chez les harengs capturés à une distance de 150 km de Stora Karlsö (les harengs représentent une grande proportion de l’alimentation du guillemot marmette). L’APFO n’a pas été décelé dans le foie du fulmar boréal (Fulmarus glacialis) le long de la côte de Svalbard et de BjØrnØya dans la mer de Barents, dans l’Arctique norvégien (Knudsen et al., 2007). Les concentrations d’APFO dans le sang entier ont été mesurées chez des oiseaux aquatiques du golfe de Gdansk, en mer Baltique : macreuse noire (Melanitta nigra), eider à duvet (Somateria mollissima), plongeon catmarin (Gavia stellata), petit pingouin (Alca torda) et harelde kakawi (Clangula hyemalis). Les concentrations allaient de 0,00005 à 0,0018 µg/mL (Gulkowska et al., 2005). L’étude a également permis de mesurer des concentrations d’APFOdans le sang entier de la morue allant de 0,00005 à 0,0007 µg/mL. L’APFO a également été mesuré dans le foie de castors capturés en Pologne et les concentrations allaient de 0,000 28 à 0,000 29 µg/g poids humide (Taniyasu et al., 2005).
L’APFOn’était pas détectable chez le poisson, les oiseaux ou les mammifères marins au Groenland et dans les îles Féroé, sauf dans le foie de l’ours blanc (< 0,012 µg/g poids humide) et le foie du phoque annelé (< 0,012 µg/g poids humide); toutefois, ces valeurs étaient inférieures à la limite de dosage (Bossi et al., 2005). On a prélevé le foie de 35 ours blancs appartenant à deux sous-populations connues du nord et de l’ouest de l’Alaska (sous-population du sud de la mer de Beaufort, qui se répartit du cap Icy jusqu’à l’est de Paulatuk, au Canada, et sous-population des mers des Tchouktches et de Béring, qui vit près de la Russie et dans l’ouest de l’Alaska) de 1993 à 2002 (Kannan et al., 2005b). Les mâles adultes de la première et de la seconde de ces sous-populations affichaient respectivement des concentrations d’APFOoscillant entre 0,0013 et 0,013 µg/g poids humide et entre 0,001 et 0,0042 µg/g poids humide (Kannan et al., 2005b). Les auteurs ont également fait remarquer que l’analyse a été faite sur les données exprimées en fonction du poids humide, car la normalisation des concentrations en fonction des lipides ne réduisait pas la variabilité des données au sein d’une sous-population particulière. En outre, ils n’ont pas trouvé de différences significatives de concentrations d’APFO selon l’âge, le sexe ou la sous-population.
L’APFOn’a pas été décelé dans le foie, la graisse, les muscles ou les tissus de la rate chez le phoque commun (Phoca vitulina) dans la partie néerlandaise de la mer des Wadden (la limite de détection était de 0,062 µg/g poids humide) [Van de Vijver et al., 2005]. L’APFO a été mesuré dans le foie et le sérum des phoques du Baïkal (Pusa sibirica) du lac Baïkal, dans l’est de la Sibérie, en Russie (Ishibashi et al., 2008b). Les mâles et les femelles de cette espèce affichaient des concentrations d’APFOoscillant entre < 0,0015 et 0,0039 µg/g poids humide dans le foie, et entre < 0,000 33 et 0,0019 µg/g poids humide dans le sérum (Ishibashi et al., 2008b).
La présence d’APFO (0,0006 à 0,163 µg/g poids humide) a été détectée dans le plasma de dauphins à gros nez de la baie Delaware (Delaware), à Charleston (Caroline du Sud), dans la lagune d’Indian River (Floride) ainsi qu’aux Bermudes (Houde et al., 2005). Des interactions significatives entre l’âge et le lieu ont été observées pour les concentrations d’APFO dans le plasma, qui diminuaient de façon significative en fonction de l’âge chez les dauphins de Charleston et de la lagune d’Indian River. L’APFO a également été mesuré dans le plasma, le lait et l’urine de dauphins à gros nez sauvages dans la baie de Sarasota, en Floride (Houde et al., 2006). La concentration de cet acide variait de 0,0018 à 0,0068 µg/g poids humide dans le plasma, était de 0,0013 µg/g poids humide dans le lait et était inférieure à la LDM (0,000 06 µg/g poids humide) dans l’urine. La concentration d’APFO diminuait de façon significative en fonction de l’épaisseur de la couche de graisse (paramètre biologique lié à l’état corporel et à l’accumulation de contaminants). L’APFO a été trouvé dans des échantillons de foie de la sotalie de Chine (Sousa chinensis) et du marsouin aptère (Neophocaena phocaenoides) échoués à Hong Kong entre 2003 et 2007 (Yeung et al., 2009b). Les concentrations mesurées chez la première espèce étaient comprises entre 0,000 243 et 0,008 32 µg/g poids humide et, chez la deuxième espèce, elles variaient de < 0,000 25 à 0,000 859 µg/g poids humide. L’APFO a également été décelé à des concentrations inférieures à 0,0002 µg/gchez le dauphin de la Plata (Pontoporia blainvillei) et l’otarie à fourrure subantarctique (Arctocephalus tropicalis) capturés au sud du Brésil (Leonel et al., 2008). L’APFO et l’alcool télomérique 8:2 ont été trouvé dans l’urine de dauphins à gros nez appartenant à des populations situées au large de la Floride et de la Caroline du Sud (Houde et al., 2005). Les auteurs ont également constaté que la teneur en APFO du plasma diminuait en fonction de l’âge chez les dauphins des régions de Charleston (Caroline du Sud) et de la lagune d’Indian River (Floride).
Tendances temporelles et géographiques
Comme on n’a pas détecté d’APFO dans les œufs archivés de guillemots marmettes (Uria aalge) de la mer Baltique, de l’Islande, des îles Féroé, de la Suède et de la Norvège, aucune tendance temporelle des concentrations de cet acide n’a été établie (Holmström et al., 2005; Löfstrand et al., 2008). De même, il n’a pas été possible d’établir de tendances temporelles des concentrations d’APFOdans les œufs de faucon pèlerin (Falco peregrinus) archivés entre 1974 et 2007, car aucun APFO n’a été détecté. Il convient de noter qu’en raison du faible succès de reproduction au cours des 20 premières années, seuls quelques œufs ont été récoltés, et aucun œuf n’a été récolté entre 1987 et 1991. Par conséquent, tous les œufs récoltés jusqu’en 1999 ont été analysés individuellement, et les œufs ont été regroupés à partir de l’an 2000 (Holmström et al., 2010).
Toutefois, Verreault et al. (2007) ont examiné des œufs entiers fraîchement pondus dans deux colonies de goélands argentés (RØst et HØrnØya) au nord de la Norvège et ont constaté que les concentrations d’APFO avaient augmenté de façon significative de 1983 à 1993 dans la colonie de RØst, mais non dans la colonie de HØrnØya. Ils ont également observé une augmentation dans les deux colonies après 1993. Il a été constaté que les œufs de la colonie de RØst affichaient des concentrations d’APFO significativement plus élevées que ceux de la colonie de HØrnØya en 1993 et en 2003. Aucune tendance temporelle n’a été établie en ce qui concerne les échantillons de foie de guillemots de Brünnich (Uria lomvia) et de fulmars boréaux (Fulmaris glacialis) de l’île Prince Leopold dans l’Arctique canadien (Butt et al., 2007a). De même, aucune tendance temporelle des concentrations d’APFO n’a été établie pour le touladi capturé entre 1979 et 2004 dans le lac Ontario (Furdui et al., 2008) ni pour deux populations de phoques annelés (Phoca hispida) de l’Arctique canadien échantillonnées entre 1992 et 2005 (Butt et al., 2007b). O’Connell et al. (2010) ont analysé le plasma et le sérum de 163 tortues caouannes juvéniles (Caretta caretta) afin d’établir les tendances spatiales et temporelles des PFC. Les tortues ont été capturées sur une distance s’étendant jusqu’à 8,4 km de la rive la plus proche de Charleston (Caroline du Sud), du cap Canaveral (Floride), de Core Sound (Caroline du Nord), de la baie de Chesapeake (Maryland) et de la baie de Floride (Floride). Les concentrations d’APFOdans le plasma et le sérum variaient de < 7,6 × 10-5 à 0,000993 µg/g. Sur le plan spatial, les tortues de la baie de Floride ont accumulé plus d’APFO par rapport à d’autres APFC, ce qui indiquerait la présence de sources locales pour les tortues vivant dans la baie de Floride. Les tendances temporelles chez les tortues caouannes capturées près de Charleston ont été examinées sur une période de neuf ans; les concentrations d’APFO n’ont pas varié de façon significative dans le temps.
Cependant, des tendances temporelles des concentrations d’APFO ont été trouvées chez l’ours blanc de l’île de Baffin, au Canada, lequel présentait une augmentation de la contamination par cet acide dans le foie entre 1972 et 2002 (Smithwick et al., 2006). On a calculé que la teneur en APFO des tissus hépatiques avait doublé en 7,3 ± 2,8 ans chez l’ours blanc de l’île de Baffin et en 13,9 ± 14,2 ans chez l’ours blanc de Barrow, en Alaska. Smithwick et al. (2006) ont noté que le sexe et l’âge des ours blancs n’étaient pas corrélés de façon significative avec les concentrations d’APFO. Dietz et al.(2008) ont prélevé des sous-échantillons de tissus hépatiques chez 128 ours blancs subadultes (âgés de 3 à 5 ans) (provenant de la partie centrale de l’est du Groenland) pour 19 années d’échantillonnage au cours de la période 1984-2006, afin d’analyser les PFC, dont l’APFO. Les auteurs ont noté une augmentation annuelle de 2,3 % de la concentration d’APFO.
La teneur en APFO a été mesurée dans des tissus hépatiques prélevés chez 80 loutres de mer (Enhydra lutris) femelles adultes le long de la côte de la Californie. Au moment où ces animaux ont été trouvés sur les plages, ils étaient morts depuis peu. Les concentrations d’APFOdans le foie, comprises entre < 5 × 10-6 et 0,000147 µg/g poids humide, ont augmenté de 1992 à 2002 chez les femelles adultes (Kannan et al., 2006). En revanche, on n’a pas trouvé d’APFO chez les loutres de mer mâles adultes (limite de détection de 0,005 µg/g), et on ne connaît pas les raisons de cette absence de détection (Kannan et al., 2006).
Évaluation des effets sur l’environnement
Organismes aquatiques
L’algue d’eau douce Pseudokirchneriella subcapitataétait l’organisme pélagique le plus sensible. La concentration minimale avec effet observé (CMEO) [96 heures] fondée sur le taux de croissance et le nombre de cellules était de 2,0 mg/L (Ward et al., 1995b, 1995d).
L’algue d’eau douce Pseudokirchneriella subcapitataa fait l’objet de plusieurs essais de toxicité (Elnabarawy, 1981; Ward et al., 1995b, 1995d, 1996c, 1996e, 1996h; Boudreau, 2002; Thompson et al., 2004), et les valeurs estimées de la concentration efficace médiane (CE50) sur 96 heures allaient de 4,9 à plus de 3 330 mg/L (en fonction du taux de croissance) et de 2,9 à 1 980 mg/L (en fonction du nombre de cellules). Les valeurs de la concentration sans effet observé (CSEO; 96 heures) étaient de 1,0 à 500 mg/L et de 0,99 à 210 mg/L en fonction du taux de croissance et du nombre de cellules, respectivement. De même, la CMEO (96 heures) allait de 2,0 à 1 000 mg/L et de 2,0 à 430 mg/L en fonction du taux de croissance et du nombre de cellules, respectivement. Une valeur de CE50 (14 jours) a été établie à 43 mg/L pour cette algue (Elnabarawy, 1981). Les essais de toxicité sur cette algue comportaient l’utilisation de mélanges commerciaux des sels d’ammonium et de tétrabutylammonium de l’APFO et d’APFO de pureté élevée, ce qui peut expliquer l’étendue des gammes de valeurs enregistrées. Un autre essai de toxicité (Boudreau, 2002) sur l’algue d’eau douce Chlorella vulgaris réalisé avec de l’APFOde pureté élevée a donné une concentration inhibitrice médiane (CI50) après 96 heures (basée sur le taux de croissance) de 116 mg/L, ce qui montre qu’il pourrait y avoir de petites différences dans la sensibilité des deux espèces d’algues d’eau douce susmentionnées. Liu et al.(2008) ont effectué des mesures de cytométrie en flux pour étudier les effets de l’APFO sur les systèmes membraires de l’algue d’eau douce Scenedesmus obliquus. L’APFO n’a pas inhibé la croissance de l’algue à la concentration maximale de l’essai, soit 0,000 002 M (0,83 mg/L). Toutefois, on a observé des effets sur le potentiel de la membrane mitochondriale, et l’exposition à l’APFOà des concentrations allant de 0,000 001 M (0,41 mg/L) à 0,000 002 M (0,83 mg/L) a accru la perméabilité de la membrane. Ces résultats semblent indiquer que l’exposition à la concentration provoquant des perturbations de la fonction mitochondriale et de la perméabilité de la membrane ne provoque pas l’inhibition de la croissance de l’algue.
La bactérie Photobacterium phosphoreum a fait l’objet de six essais de toxicité Microtox avec des mélanges commerciaux des sels d’ammonium et de tétrabutylammonium de l’APFO (3M Company, 1987a, 1990a, 1996a, 1996b, 1996c; Beach, 1995a). La CE50 (30 minutes; basée sur le taux de bioluminescence) oscillait entre 260 et 3 150 mg/L. Il est difficile d’expliquer une telle amplitude; cela pourrait peut-être résulter du manque de caractérisation des mélanges commerciaux et de leurs impuretés.
Un essai de toxicité (Boudreau, 2002) sur le macrophyte aquatique Lemna gibba réalisé avec de l’APFO de pureté élevée a donné une CI50 sur 7 jours (basée sur le taux de croissance) de 80 mg/L.
La puce d’eau Daphnia magna a été soumise à plusieurs essais de toxicité avec des mélanges commerciaux à base d’APFO, les sels d’ammonium et de tétrabutylammonium de l’APFO et de l’APFO de pureté élevée (3M Company, 1982, 1984, 1987b; Ward et Boeri, 1990; Ward et al., 1995e, 1996a, 1996d, 1996g; CIT, 2003; Boudreau, 2002). La concentration létale médiane (CL50) [48 heures] (basée sur le taux de mortalité) était comprise entre 77 et 1550 mg/L, alors que la CE50(48 heures) [basée sur l’immobilisation des sujets], était entre 34 et 1 200 mg/L. Il est difficile d’expliquer une telle amplitude. Cela pourrait peut-être résulter du manque de caractérisation des mélanges commerciaux et de leurs impuretés ou, comme le laissent entendre Ward et al. (1996a), de la variabilité du régime alimentaire de l’organisme testé. La CSEO(48 heures) [basée sur l’immobilisation des sujets] était de 13 à 730 mg/L et la CSEO (21 jours) [basée sur le taux de survie, la capacité de reproduction ou la longueur du parent], de 13 à 89 mg/L. Une étude a donné une CE50 (21 jours) [basée sur la capacité de reproduction] de 39,6 mg/L (CIT, 2003). Une étude de toxicité (Boudreau, 2002) sur la puce d’eau Daphnia pulicariaeffectuée avec de l’APFO de pureté élevée a donné une CL50 (48 heures; basée sur le taux de mortalité) et une CE50 (48 heures; basée sur l’immobilisation des sujets) de 277 et 204 mg/L, respectivement. Ces résultats montrent qu’il pourrait y avoir de légères différences dans la sensibilité des deux espèces de Daphnia. Kim et al. (2009) ont réalisé des essais de toxicité aiguë, de reproduction et de développement embryonnaire sur Daphnia magna. La CE50 (48 heures) de l’APFO était de 253,5 mg/L et la CSEO, de 100 mg/L. L’APFO a causé une diminution de la fécondité à 10 mg/L ainsi qu’une létalité embryonnaire (interruption du développement des œufs) et des malformations chez les néonates (épine caudale recourbée ou non déployée et deuxième antenne non développée) à 125 mg/L.
Li (2008) a réalisé des essais de toxicité sur un planaire d’eau douce (Dugesia japonica), un gastéropode d’eau douce (Physa acuta), la puce d’eau (Daphnia magna) et la crevette cerise (Neocaridina denticulata). Pour le planaire d’eau douce, la CL50 (96 heures) était comprise entre 318 et 357 mg/L, et la CSEO était de 150 mg/L; pour le gastéropode d’eau douce, la CL50 (96 heures) était comprise entre 635 et 711 mg/L, et la CSEOétait de 250 mg/L. Pour Daphnia magna, la CL50(48 heures) était comprise entre 166 et 198 mg/L, et la CSEOétait de 125 mg/L; et pour la crevette cerise, la CL50(96 heures) allait de 418 à 494 mg/L, et la CSEO était de 250 mg/L.
Le méné à grosse tête a été soumis à plusieurs essais de toxicité avec des mélanges commerciaux à base d’APFO et des sels d’ammonium et de tétrabutylammonium de l’APFO (3M Company, 1977, 1985a, 1987c; Elnabarawy, 1980; Ward et al., 1995a, 1995c, 1996b, 1996f, 1996i, 1996j). La CL50 (96 heures) allait de 70 à 2 470 mg/L et la CSEO(96 heures) [basée sur le taux de mortalité], de 110 à 830 mg/L. Il est difficile d’expliquer une telle amplitude; cela pourrait toutefois résulter du manque de caractérisation des mélanges commerciaux et de leurs impuretés. Des études de la toxicité du sel d’ammonium sur le crapet arlequin ont été menées (3M Company, 1978a, 1978b); la gamme des valeurs de la CL50(96 heures) allait de > 420 à 569 mg/L.
Deux études de la toxicité du sel de sodium de l’APFO(pureté élevée) ont également été réalisées sur des communautés pélagiques entières, à l’aide de microcosmes constitués d’une communauté de zooplancton et mélangés avec de gros invertébrés sur une période de 35 jours (Sanderson et al., 2003, 2004). D’après les résultats de ces études, les valeurs de CMEO propres aux individus et aux communautés variaient entre 10 et 70 mg/L. Des mesures de la toxicité du sel de sodium de l’APFO sur les macrophytes aquatiques Myriophyllum sibiricum et M. spicatumont été réalisées dans des microcosmes extérieurs de 12 000 L sur une période de 35 jours (Hanson et al., 2005). Les doses appliquées étaient de 0,3, 1, 30 et 100 mg/L. Les paramètres mesurés étaient la croissance, la biomasse, le nombre de racines, la longueur des racines primaires et le nombre de nœuds. D’après les résultats, les deux espèces de Myriophyllum présentaient une sensibilité à l’APFOcomparable. Dans les deux cas, la CSEO était supérieure ou égale à 23,9 mg/L (Hanson et al., 2005).
Oiseaux
O’Brien et al. (2009) ont signalé que l’APFOlinéaire injecté dans l’alvéole d’œufs de poules Leghorn blanches n’avait pas d’effet sur le bêchage des embryons à des concentrations allant jusqu’à 10 mg/g de poids humide d’embryon, et que l’APFO s’accumulait dans le foie de ces embryons à des concentrations de 2,9 à 4,5 fois supérieures à celles présentes initialement dans les œufs entiers. Yeung et al. (2009c) ont exposé des poulets mâles âgés d’une journée à un mélange de PFOS, d’APFO et de perfluorodécanoate (PFDA) à des doses allant de 0,1 mg/kg poids corporel (p.c.) à 1,0 mg/kg p.c. pendant trois semaines. Il a été conclu que l’exposition à un mélange de PFOS, d’APFO et de PFDA à une dose de 1,0 mg/kg p.c. n’avait aucun effet nocif sur les poulets juvéniles. La demi-vie de l’APFO aux deux doses était de 3,9.
Organismes bactériens
Des essais de toxicité de l’APFO et de ses sels ont été effectués avec un mélange de boues activées et de liqueur mixte (obtenu d’une UTEU de St. Paul, au Minnesota). Il convient cependant de noter que les bactéries présentes dans les boues activées ont été choisies en fonction de leur capacité de se développer en présence de substances chimiques d’origine anthropique, de sorte que les essais utilisant de telles bactéries pourraient sous-estimer la toxicité. Au total, cinq essais de toxicité ont été effectués sur un mélange de boues activées et de liqueur mixte avec des mélanges commerciaux des sels d’ammonium et de tétrabutylammonium de l’APFO (3M Company, 1980a, 1990b, 1996d; Beach, 1995b). La CE50 (3 heures) [basée sur l’inhibition de la respiration] allait de > 1 000 à > 3 320 mg/L. De plus, la CSEO (7 minutes) [basée sur l’inhibition de la respiration] était de 1 000 mg/L (3M Company, 1980a).
Invertébrés benthiques
MacDonald et al. (2004) ont mesuré la toxicité de l’APFO de pureté élevée sur le chironomidé aquatique Chironomus tentans. Aucune toxicité n’a été observée aux concentrations d’essai. La CSEO sur 10 jours (basée sur les taux de survie et de croissance) a donc été établie à 100 mg/L.
Organismes endogés
D’après Tominaga et al. (2004), le nématode Caenorhabditis elegans – un invertébré endogé, c.-à-d. qui vit dans le sol – s’est révélé un organisme pouvant être soumis à des essais, car il présente des effets létaux et sublétaux au cours des évaluations écotoxicologiques de milieux liquides et de sols. Ces auteurs ont étudié la toxicité létale aiguë et la toxicité sublétale sur plusieurs générations (fécondité et reproduction) en utilisant des concentrations d’APFO de 0 mM (mmol/L) [0 mg/L], 0,01 mM (4,14 mg/L), 0,1 mM (41,4 mg/L), 0,5 mM (207 mg/L), 1,0 mM (414,07 mg/L) et 5,0 mM (2100 mg/L) pendant 48 heures. Toutes les concentrations jusqu’à 0,1 mM (41,4 mg/L) n’ont pas entraîné de létalité aiguë jusqu’à concurrence de 48 heures. La létalité aiguë s’est manifestée à des concentrations supérieures à 0,5 mM (207 mg/L) et elle ne dépendait pas de la durée d’incubation. La CE50 a été calculée après une heure (3,85 mM ou 1 590 mg/L), deux heures (2,80 mM ou 1 160 mg/L), trois heures (2,70 mM ou 1 120 mg/L), quatre heures (2,65 mM ou 1 100 mg/L), 24 heures (2,75 mM ou 1 140 mg/L) et 48 heures (2,35 mM ou 973 mg/L) [Tominaga et al., 2004]. L’essai de toxicité sur plusieurs générations n’a pas permis d’observer de relations génération-réponse et concentration-réponse dans le cas de l’APFO.
Plantes terrestres
Li (2008) a réalisé des essais de toxicité sur la germination des graines et sur l’élongation des racines sur 5 jours sur la laitue (Lactuca sativa), le concombre (Cucumis sativus) et le pak-choï (Brassica rapa chinensis). L’APFOn’a eu aucun effet sur la germination des graines de concombre, les valeurs de la CL50 et de la CSEO étant supérieures à 2 000 mg/L. La CL50 et la CSEOpour la germination des graines de laitue étaient de 1 734 et de 1 000 mg/L, respectivement. Pour la germination des graines de pak-choï, la CL50 était de 579 mg/L et la CSEO, de 250 mg/L. La CE50 pour l’élongation des racines de ces trois espèces variait entre 263 et 1 254 mg/L. L’APFO a inhibé presque entièrement la croissance des racines de la laitue et du pak-choï à des concentrations supérieures ou égales à 1 000 mg/L. La CSEO pour l’élongation des racines de ces trois espèces variait entre < 62,5 et 250 mg/L.
Stahl et al. (2009) ont étudié le transfert sol-plante d’un mélange d’APFO et de PFOS chez le blé de printemps, l’avoine, la pomme de terre, le maïs et l’ivraie vivace. Les concentrations étaient comprises entre 0,25 et 50 mg/kg d’APFO-PFOS sous forme de solution aqueuse. Les concentrations d’APFO étaient supérieures à celles de PFOS dans toutes les plantes, sauf dans la pomme de terre, qui affichait une absorption et une accumulation plus fortes dans la partie végétative que dans l’organe de réserve. Des anomalies visibles ont été observées à des concentrations supérieures à 10 mg/kg. On a observé, entre 25 et 50 mg/kg d’APFO-PFOS, des nécroses chez l’avoine et la pomme de terre, un jaunissement des feuilles de l’ivraie et une diminution de la croissance du blé de printemps.
Mammifères terrestres
Butenhoff et al. (2002) ont mené une étude par gavage d’une durée de 26 semaines sur des singes cynomolgus; la dose minimale avec effet nocif observé (DMENO) était de 3 mg/kg p.c. par jour chez les mâles pour des concentrations sériques présentant des effets réversibles sur le foie et des augmentations relatives du poids du foie sans effets histopathologiques. Une concentration moyenne d’APFO dans le foie de 15,8 µg/g a été mesurée à la 27e semaine chez les sujets du groupe recevant le traitement de 3 mg/kg p.c. par jour (c.-à-d. la DMENO). D’autres études sur les mammifères sont présentées dans la section sur l’évaluation des risques pour la santé humaine du présent ce document.
Autres effets
Liu et al. (2007a) ont utilisé le tilapia du Nil (Oreochromis niloticus) mâle comme modèle in vitro pour détecter l’induction de la vitellogénine. La vitellogénine est une protéine précurseur du vitellus exprimée chez les femelles de poissons, d’amphibiens, de reptiles (y compris les oiseaux), d’insectes et d’ornithorynque. En présence de substances qui ont un effet sur le système endocrinien, les mâles peuvent également exprimer le gène de la vitellogénine. Des hépatocytes de tilapia mâle en culture ont été exposés pendant 48 heures à l’APFO ainsi qu’aux FTOH 4:2, FTOH 6:2 et FTOH 8:2. Une induction de la vitellogénine proportionnelle à la dose a été observée dans les cellules traitées à l’APFO et au FTOH 6:2, alors que la vitellogénine est demeurée inchangée dans les cellules traitées au FTOH 4:2 et au FTOH8:2. Les valeurs estimées de la CE50 après 48 heures étaient de 2,9 × 10-5 M (12 mg/L) pour l’APFO et de 2,8 × 10-5 M (12,9 mg/L) pour le FTOH 6:2. Dans le cadre de l’étude, l’induction de la vitellogénine s’est produite en 48 heures (APFO), en 72 heures (FTOH 4:2), en 12 heures (FTOH 6:2) et en 72 heures (FTOH 8:2), puis s’est accrue après 96 heures d’exposition. La coexposition à un mélange de PFC et à l’estradiol pendant 48 heures a entraîné l’inhibition significative proportionnelle à la dose de la production de vitellogénine dans les cellules hépatiques induite par l’estradiol, sauf dans le cas du FTOH 4:2. Les valeurs estimées de la CI50 après 48 heures étaient de 5,1 × 10-7 M (0,21 mg/L) pour l’APFO, de 1,1 × 10-6 M (0,51 mg/L) pour le FTOH 6:2 et de 7,5 × 10-7 M (0,35 mg/L) pour le FTOH 8:2. Afin d’étudier le mécanisme œstrogénique de façon plus approfondie, les hépatocytes ont été coexposés pendant 48 heures à un mélange d’APFO et de FTOH 6:2, et au tamoxifène, inhibiteur connu du récepteur des œstrogènes. Les résultats généraux démontrent que l’APFO et les FTOH sont des substances ayant des activités œstrogéniques et que l’exposition à une combinaison d’estradiol et d’APFO ou de FTOH produit des effets antiœstrogéniques. Les résultats de l’essai sur l’inhibition du récepteur des œstrogènes semblent aussi indiquer que l’effet œstrogénique de l’APFO et des FTOH pourrait être induit par les voies de signalisation du récepteur des œstrogènes dans les hépatocytes de tilapia en culture primaire.
Wei et al. (2008a) ont examiné les effets de l’APFO sur des Gobiocypris rarus mâles et femelles en les exposant à des concentrations de 3, 10 et 30 mg/L de cette substance pendant 28 jours. Une exposition à des concentrations d’APFO de 3 mg/L a entraîné une hypertrophie hépatocellulaire modérée dans le foie des poissons mâles et femelles. Les mâles exposés à des concentrations de 10 mg/L d’APFO affichaient des gouttelettes hyalines éosinophiles dans le cytoplasme des hépatocytes; les femelles affichaient plus de gouttelettes hyalines éosinophiles dans le cytoplasme des hépatocytes, une hypertrophie hépatocellulaire et une dégénérescence vacuolaire. On a observé chez les poissons exposés à des concentrations de 30 mg/L d’APFO des changements histopathologiques hépatiques graves ainsi qu’une perturbation des fonctions mitochondriales. L’inhibition des gènes associés à la biosynthèse des hormones thyroïdiennes et l’induction des gènes sensibles à l’œstrogène pourraient indiquer que cet acide influe sur le système endocrinien. Wei et al.(2008b) ont précisé les biomarqueurs protéiques possibles de l’exposition du foie des Gobiocypris rarus à des concentrations de 3, 10 et 30 mg/L d’APFO pendant 28 jours, et ont trouvé 34 et 48 spots protéiques modifiés chez les mâles et les femelles, respectivement. Ces protéines contribuaient au transport intracellulaire des acides gras, au stress oxydatif, au catabolisme des macromolécules, au cycle cellulaire, au maintien de l’homéostasie intracellulaire du Ca2+ et à la fonction mitochondriale. Wei et al. (2007) ont étudié les effets in vivo de l’APFO d’origine hydrique sur l’expression des gènes hépatiques sensibles à l’œstrogène, la vitellogénine, les récepteurs des œstrogènes et le développement des gonades chez le cyprin d’eau douce Gobiocypris rarus. On a observé dans cette étude une dégénérescence des ovocytes au cours de la vitellogenèse (atrésie) dans les ovaires des femelles matures exposées à 3, 10 et 30 mg/L d’APFO pendant 28 jours. Chez les mâles exposés à 10 mg/L d’APFO, des ovocytes de premier ordre (ovocytes en prévitellogenèse) se sont développés dans des testicules. Chez les sujets exposés à des concentrations de 10 et 30 mg/L d’APFO, le nombre de spermatozoïdes et de cellules germinales à divers stades de la spermatogenèse était inférieur à celui observé chez les témoins mâles. L’APFO a provoqué une augmentation de la concentration de vitellogénine hépatique et le développement de gonades de type ovotestis chez les poissons mâles matures exposés à des concentrations de 10 et 30 mg/L de la substance pendant 28 jours. Wei et al. (2007) ont montré que l’APFO pouvait perturber l’activité de l’œstrogène en induisant les gènes hépatiques sensibles à l’œstrogène chez les mâles, bien que le mécanisme de développement des ovotestis chez le Gobiocypris rarus suivant une exposition à l’APFO ne soit pas connu.
Stevenson et al. (2006) ont étudié la toxicité de l’APFO pour le mécanisme de défense multixénobiotique chez la moule de Californie (Mytilus californianus). Ce mécanisme agit comme première ligne de défense des cellules contre les grandes classes de xénobiotiques en exportant des substances chimiques modérément hydrophobes à partir des cellules par l’intermédiaire de protéines de transport transmembranaires dépendantes de l’adénosine triphosphate (ATP). Le transporteur le plus étudié est la glycoprotéine P, qui est un mécanisme de défense fragile et peut être perturbé par certains xénobiotiques. L’accroissement de la sensibilité du sujet, appelé chimiosensibilisation, est dû à la capacité de la glycoprotéine P de reconnaître de multiples substrats xénobiotiques et de s’y lier, ce qui entraîne la saturation de la capacité de fixation. Même des substances non toxiques peuvent être des chimiosensibilisateurs et produire des effets néfastes sur des organismes vivants en permettant aux substances toxiques normalement exclues de s’accumuler dans la cellule. Stevenson et al. (2006) ont constaté que l’APFO, à une concentration de 50 µM (20 mg/L), était un important inhibiteur de la glycoprotéine P chez la moule de Californie et qu’il est donc un chimiosensibilisateur pour cet organisme. L’étude a également révélé que l’inhibition observée est réversible lorsque la moule est retirée du milieu contaminé, puis placée dans de l’eau de mer propre.
Ishibashi et al. (2008b) ont montré que l’APFO stimule le récepteur α activé par les proliférateurs des peroxysomes (PPARα) dans le foie des phoques du Baïkal; il s’agit de la première identification signalée de l’acide désoxyribonucléique (ADN) complémentaire du PPARαchez une espèce aquatique sauvage. Le PPAR fait partie de la superfamille des récepteurs nucléaires des hormones activés par des ligands. Le PPARαjoue un rôle physiologique essentiel comme détecteur de lipides et régulateur du métabolisme lipidique. La CMEO était de 62,5 µM (25,9 mg/L) pour l’APFO. Yang (2010) a exposé des medaka japonais (Oryzias latipes) mâles à 10, 50 et 100 mg/L d’APFO pendant sept jours. Il n’y a eu aucune incidence sur la survie, le poids relatif du foie et la taille des gonades, ainsi que sur le coefficient de condition, et ce, à toutes les concentrations. Toutefois, à de fortes doses, l’APFO a induit l’inhibition de l’activité de la catalase sans modification des activités de la superoxyde dismutase ou de la glutathion peroxydase dans le foie, ce qui laisse penser que l’APFO pourrait induire l’oxydation péroxysomale des acides gras et causer un stress oxydatif par l’altération de l’homéostasie oxydative cellulaire dans le foie. L’APFO a également augmenté les niveaux d’acide ribonucléique messager (ARNm) des cytokines pro-inflammatoires, ce qui laisse penser qu’il peut être impliqué dans l’inflammation et les dommages aux tissus. Les effets sur la prolifération des péroxysomes et l’expression de la cytokine indiquent qu’une exposition chronique à l’APFO peut être cancérogène chez le medaka japonais : la prolifération des péroxysomes est un mécanisme cancérogène déterminant et l’inflammation chronique est associée à un risque accru de cancer chez les rongeurs.
L’impact potentiel de l’exposition aux PFC sur les lésions hépatiques a été étudié chez les ours blancs de l’est du Groenland (Sonne et al., 2008). Cette étude portait sur les paramètres hépatiques suivants : infiltration des cellules mononucléaires, granulomes lipophagiques, stéatose, et hyperplasie des cellules de Ito et du canal cholédoque ou fibrose portale. La population était constituée de 28 femelles et de 29 mâles capturés par des chasseurs de la région entre 1999 et 2002. Des échantillons de foie ont été analysés aux fins de détection du PFOS, de l’acide perfluorononanoïque, de l’acide perfluoroundécanoïque, de l’acide perfluorodécanoïque, de l’acide perfluorotétradécanoïque, de l’APFO, du perfluorooctanesulfonamide, du perfluorodécanoate et du perfluorohexanesulfonate. Dans 23 cas, la concentration d’APFO était sous la limite de détection (0,0012 µg/g poids humide). Plusieurs composés perfluorés ont également été analysés dans les échantillons de foie, y compris les APFC en C9, C10, C11, C12 et C13. Soixante-cinq pour cent des ours blancs affichaient des concentrations totales de PFA supérieures à 1 µg/g poids humide. Les concentrations totales de PFA étaient comprises entre 0,256 et 2,77 µg/g poids humide chez les femelles et entre 0,114 et 3,052 µg/g en poids humide chez les mâles. Tous les composés PFA analysés ont été additionnés, de sorte qu’on ne peut déterminer de relation de cause à effet pour un composé perfluoré particulier, comme l’APFO. Les ours blancs de l’est du Groenland sont également contaminés par d’autres substances, comme les composés organochlorés (BPC, dichlorodiphényltrichloroéthane [DDT]) et le mercure, qui peuvent agir comme cofacteurs de confusion synergiques dans l’apparition des lésions. Les auteurs ont conclu que l’analyse statistique ne permettait pas de déterminer si l’exposition chronique aux PFC était associée aux lésions hépatiques chez les ours blancs. Toutefois, ces lésions étaient semblables à celles produites par les PFC dans des conditions de laboratoire (Sonne et al., 2008).
L’effet de l’APFO sur la fonction immunitaire et les paramètres sanguins cliniques a été étudié chez les dauphins à gros nez et les tortues marines de la Floride, de la Géorgie et de la Caroline du Sud. Il importe de noter qu’aucune relation directe de cause à effet ne peut être établie clairement, car d’autres contaminants pourraient produire des effets en même temps. Les résultats ont révélé qu’il pourrait y avoir augmentation des indicateurs d’inflammation et d’immunité dans les paramètres sanguins chez le dauphin à gros nez liée à l’APFO, ce qui semble indiquer que cet acide pourrait influer sur les biomarqueurs de la santé chez les mammifères marins (Peden-Adams et al., 2004a). Parmi les biomarqueurs analysés chez le dauphin à gros nez, on compte le nombre absolu de lymphocytes, la concentration de triglycérides sériques, la teneur en protéines sériques totales, le taux de sérumalbumine, le taux de cortisol sérique, le taux de protéines C-réactives, l’activité enzymatique (lysozyme) et la prolifération des cellules B (Peden-Adams et al., 2004a). La relation entre les triglycérides sériques et l’APFO était plus forte chez les femelles que chez les mâles. Il existait des corrélations positives, mais faibles, entre la prolifération des lymphocytes (des cellules B) induite par le lipopolysaccharide et l’APFO chez les dauphins à gros nez mâles, et une forte corrélation entre l’activité du lysozyme (mesure de l’immunité innée) et l’APFO chez la même espèce. Cependant, dans une autre étude de Flanary et al. (2010), aucune corrélation n’a été trouvée entre les composés perfluorés, y compris l’APFO, et les paramètres chimiques sanguins (p. ex., cholestérol, créatinine, albumine, concentration totale d’ions sériques) chez l’otarie à fourrure (Callorhinus ursinus).
De faibles concentrations de PFA peuvent aussi influer sur les biomarqueurs de la santé chez la tortue caouanne (Peden-Adams et al., 2004b). Parmi les biomarqueurs analysés chez cette espèce, mentionnons la teneur en protéines plasmatiques totales, les globulines du plasma, la prolifération des cellules T, l’activité du lysozyme dans le plasma et la prolifération des cellules B (Peden-Adams et al., 2004b).
Caractérisation des risques pour l’environnement
La démarche suivie dans cette évaluation écologique préalable consiste à examiner les renseignements scientifiques et techniques pertinents et à tirer des conclusions fondées sur de multiples éléments d’information, qui comprennent l’examen de la persistance, de l’exposition, des tendances, de la toxicité, de la bioaccumulation et de la présence répandue dans l’environnement.
Des organismes servant de paramètres d’évaluation ont été choisis en fonction de l’analyse des voies d’exposition. Pour chaque organisme paramètre, une concentration environnementale estimée (CEE) prudente (représentative de la pire éventualité raisonnable) et une concentration estimée sans effet (CESE) sont déterminées. On calcule la CESE en choisissant la plus faible valeur critique de la toxicité (VCT) pour le type d’organisme d’intérêt et en la divisant par un coefficient d’évaluation approprié au point de données. Un quotient de risque (CEE/CESE) est calculé pour chaque type de paramètre afin de déterminer s’il existe des risques pour l’environnement au Canada. Toutefois, il existe également des incertitudes quant aux risques que peut présenter l’APFO à l’heure actuelle ou à l’avenir. Les estimations quantitatives des risques (quotients de risque et analyses probabilistes) constituent généralement d’importants éléments d’information pour évaluer si une substance peut avoir des effets écologiques nocifs. Cependant, lorsque les risques que comportent les substances persistantes et bioaccumulables, comme l’APFO, sont estimés à l’aide de telles méthodes quantitatives, les résultats obtenus sont très incertains et les risques probablement sous-estimés. Étant donné qu’il n’est actuellement pas possible de prévoir de façon fiable les risques à long terme associés aux substances persistantes et bioaccumulables, la pertinence des estimations quantitatives des risques s’en trouve restreinte. Comme l’accumulation de ces substances peut être répandue et est difficilement réversible, il est justifié de réagir de façon prudente.
Faune mammalienne
Butenhoff et al. (2002) ont mené une étude par gavage d’une durée de 26 semaines sur des singes cynomolgus; la DMENO était de 3 mg/kg p.c. par jour chez les mâles pour des concentrations sériques présentant des effets réversibles sur le foie et des augmentations relatives du poids du foie sans effets histopathologiques. Une concentration moyenne d’APFO dans le foie de 15,8 µg/g a été mesurée à la 27e semaine chez les sujets du groupe recevant le traitement de 3 mg/kg p.c. par jour (c.-à-d. la DMENO). On a sélectionné cette valeur comme VCT. Cette VCT, divisée par un facteur d’évaluation de 100, a donné une CESEde 0,158 µg/g ou 158 µg/kg. On a utilisé ce facteur d’évaluation pour tenir compte de l’extrapolation des conditions de laboratoire à celles sur le terrain, de la variation intraspécifique et interspécifique, du fait que la substance est persistante et peut s’accumuler et se bioamplifier chez les mammifères terrestres et marins, et de l’extrapolation d’une DMENO à une DSENO (dose sans effet nocif observé). La valeur choisie comme CEE correspond à la plus forte concentration d’APFO dans le foie mesurée chez l’ours blanc, soit 13 µg/kg poids humide, à Sanikiluaq, au Nunavut (Canada) [Martin et al., 2004a].
Le quotient de risque (CEE/CESE) propre aux mammifères sauvages au Canada est de 0,08 (13/158). Comme il est inférieur à 1, l’exposition aux concentrations actuelles dans l’environnement ne présente qu’une faible probabilité de risque.
Organismes pélagiques
Les mesures des concentrations dans les eaux de surface au Canada comprennent celles réalisées dans le ruisseau Etobicoke (à Toronto, en Ontario), à la suite d’un déversement de mousse extinctrice aqueuse (Moody et al., 2002), et celles effectuées dans le lac Ontario (Boulanger et al., 2004). Ces données ont été choisies comme valeurs de CEE au Canada selon trois scénarios :
- dans des conditions de déversement (11,3 µg/L; en aval du point de déversement, sur 150 jours);
- dans un ruisseau situé dans une région densément peuplée (0,033 µg/L; en amont du point de déversement, sur 150 jours);
- dans un lac situé dans une région densément peuplée (la concentration de fond la plus élevée étant de 0,070 µg/L; lac Ontario).
Les conditions de déversement correspondent à une CEE de la pire éventualité extrême. Les conditions dans la partie en amont du ruisseau Etobicoke peuvent être considérées comme un scénario urbain à haute densité pour les eaux de surface en général au Canada, en raison de la densité de la population autour du ruisseau Etobicoke, des rejets d’eaux pluviales le long du ruisseau et du débit naturel plutôt faible du cours d’eau, si bien que les apports d’origine anthropique sont peu dilués. Toutefois, des concentrations plus élevées ont été mesurées dans le lac Ontario. La concentration maximale d’APFO mesurée dans chaque scénario a été choisie comme valeur de CEE :
- conditions de déversement (CEE = 11,3 µg/L);
- ruisseau récepteur (CEE = 0,033 µg/L);
- lac récepteur (CEE = 0,070 µg/L).
La plupart des données de toxicité existantes se rapportent à des organismes pélagiques d’eau douce, étant donné que l’APFOdevrait se répartir principalement dans le milieu aquatique. L’organisme le plus sensible aux effets de l’APFO selon les essais monospécifiques réalisés était l’algue d’eau douce Pseudokirchneriella subcapitata [CMEO (96 heures) en fonction du taux de croissance et du nombre de cellules = 2 mg/L] (Ward et al., 1995b, 1995d). Cette valeur a été retenue comme VCT pour les organismes pélagiques; elle est divisée par un facteur d’évaluation de 100 pour tenir compte de l’extrapolation du laboratoire au terrain, de l’extrapolation d’une DMENO à une DSENO et de la variation intra- et interspécifique, ce qui donne une CESE de 0,02 mg/L ou 20 µg/L. Les quotients de risque (CEE/CESE) propres aux organismes pélagiques sont les suivants :
- conditions de déversement = 0,56 (11,3/20);
- ruisseau récepteur = 0,002 (0,033/20);
- lac récepteur = 0,004 (0,07/20).
Ces quotients de risque indiquent que l’exposition aux concentrations actuelles dans l’environnement ne présente qu’une faible probabilité de risque pour les organismes pélagiques.
L’étude de Wei et al. (2007) a montré que les femelles du cyprin Gobiocypris rarus exposées à 3, 10 et 30 mg/L d’APFO pendant 28 jours affichaient une dégénérescence des ovocytes au cours de la vitellogenèse dans les ovaires. La valeur de 3 mg/L a été choisie comme VCT. Elle est divisée par un facteur d’évaluation de 100 pour tenir compte de l’extrapolation du laboratoire au terrain, de l’extrapolation d’une DMENO à une DSENO et de la variation intra- et interspécifique, ce qui donne une CESE de 0,03 mg/L ou 30 µg/L. Le quotient de risque pour les organismes pélagiques dans :
- un ruisseau récepteur est de 0,001 (0,033/30);
- un lac récepteur est de 0,002 (0,07/30).
Ces quotients de risque indiquent que l’exposition aux concentrations actuelles dans l’environnement ne présente qu’une faible probabilité de risque.
Les valeurs de quotients de risque calculées pour l’APFOsont résumées dans le tableau 6.
| Organisme | VCT | CESE | CEE | Scénario | Quotient de risque (CEE/ CESE) |
|---|---|---|---|---|---|
| (µg/L)[1] | |||||
| [1] Sauf indication contraire. [2] CMEO (96 heures; taux de croissance et nombre de cellules) chez une algue d’eau douce (Pseudokirchneriella subcapitata) [Ward et al., 1995a, 1995b]. [3] Facteur d’évaluation de 100 tenant compte de l’extrapolation laboratoire-terrain et des variations intra- et interspécifiques. [4] Concentration la plus élevée d’APFOmesurée en aval dans le ruisseau Etobicoke à la suite d’un déversement de mousse extinctrice aqueuse. [5] Concentration la plus élevée d’APFOmesurée en amont dans le ruisseau Etobicoke à la suite d’un déversement de mousse extinctrice aqueuse (représente la concentration de fond dans le cours d’eau, qui ne subit pas l’influence du déversement). [6] Concentration la plus élevée d’APFOmesurée dans le lac Ontario (Boulanger et al., 2004). [7] Concentration dans le foie à la DMENO mesurée dans une étude sur 26 semaines comportant l’administration d’APFO par gavage à des singes cynomolgus (Butenhoff et al., 2002). [8] Facteur d’évaluation de 100 tenant compte de l’extrapolation laboratoire-terrain, des effets pouvant être dus à la présence d’autres facteurs de stress, de la variation intra- et interspécifique et de l’extrapolation d’une DMENO à une DSENO. Aucune DSENO (ni aucune dose sans effet observé [DSEO]) n’a pu être déterminée dans l’étude de Butenhoff et al. (2002). La DSEO efficace était inférieure à 3 mg/kg p.c. par jour. La cause de la mort à la faible dose (3 mg/kg p.c. par jour) n’a pas pu être déterminée avec certitude (c.-à-d. que la mort peut ne pas être liée au traitement, ce qui peut révéler une importante variation intraspécifique), car les tumeurs chez les rongeurs seraient induites par la prolifération des peroxysomes (elles ne seraient pas de type génotoxique) et l’augmentation du poids du foie à ces faibles doses pourrait indiquer l’induction possible de tumeurs dans un scénario d’exposition chronique. [9] La concentration la plus forte d’APFOdans le foie mesurée chez l’ours blanc, à Sanikiluaq, au Nunavut (Canada) [Martin et al., 2004a]. [10] Concentration la plus faible entraînant l’induction de la vitellogénine dans le foie de Gobiocypris rarus mâles et femelles (Wei et al., 2007). |
|||||
| Algue d’eau douce | 2 000[2] | 20[3] | 11,3[4] | Pire éventualité extrême (conditions de déversement) | 0,6 |
| Algue d’eau douce (ruisseau en milieu urbain) | 2 000[2] | 20[3] | 0,033[5] | Scénario urbain à haute densité (ruisseau récepteur) | 0,002 |
| Algue d’eau douce (lac Ontario) |
2 000[2] | 20[3] | 0,07[6] | Scénario urbain à haute densité (lac récepteur) |
0,004 |
| Ours blanc de l’Arctique canadien (foie) | 15,8 mg/kg[7] | 158 µg/kg[8] |
13 µg/kg[9] | -- | 0,08 |
| Gobiocypris rarus mâles et femelles | 3 mg/L[10] | 0,03 mg/L[3] |
0,033-0,07[5], [6] | Lac et ruisseau récepteurs | 0,001-0,002 |
En résumé, les quotients de risque pour les organismes pélagiques indiquent que l’exposition aux concentration actuelles dans l’environnement aquatique ne présente qu’une faible probabilité de risque. Le quotient de risque pour les mammifères sauvages du Canada (ours blancs) est inférieur à 1; toutefois, en raison de la nature persistante de la substance, de sa tendance à s’accumuler et à se bioamplifier dans une variété de mammifères terrestres et marins, de son hépatotoxicité et de la tendance temporelle à la hausse des concentrations d’APFO chez les ours blancs et certaines autres espèces, les concentrations d’APFOobservées chez les ours blancs pourraient se rapprocher des expositions entraînant des effets néfastes.
Incertitudes dans l’évaluation des risques pour l’environnement
Malgré certaines lacunes et incertitudes, l’ensemble des données sur l’APFO et ses précurseurs est néanmoins substantiel. Par exemple, bien que le mécanisme de transport vers l’Arctique de l’APFO et de ses précurseurs ne soit pas clair, ces composés semblent avoir une certaine mobilité, étant donné qu’on a mesuré de l’APFO dans le biote dans tout l’Arctique canadien, loin des sources connues. Les voies environnementales du transfert de l’APFO au biote ne sont pas bien comprises en raison du peu de données de surveillance qui existent sur les concentrations de ses divers précurseurs dans l’air, l’eau, les effluents et les sédiments du Canada. De plus, bien que les mécanismes de toxicité de l’APFO soient peu connus, on a signalé toute une gamme d’effets toxicologiques chez diverses espèces, notamment l’induction de la vitellogénine, la féminisation des poissons mâles et la toxicité hépatique. Actuellement, on ne dispose que de renseignements limités sur la toxicologie des précurseurs de l’APFO, la possibilité d’effets combinés ou synergiques avec l’APFO ainsi que la toxicologie et le potentiel d’effets combinés ou synergiques de l’APFOavec d’autres acides perfluoroalkyliques. En outre, selon des études menées par van Leeuwen et al. (2006) révélant la variabilité des résultats analytiques obtenus par divers laboratoires, il est possible que les résultats des analyses effectuées par ces laboratoires ne soient pas directement comparables.
Évaluation de l’exposition
L’APFOa été détecté à différents endroits au Canada : dans la poussière domestique à Ottawa, en Ontario, à une concentration moyenne de 106 ng/g (n = 67; valeurs comprises entre 2,29 et 1 234 ng/g; médiane = 19,72 ng/g; Kubwabo et al., 2005); dans l’eau du robinet de Calgary, en Alberta, et de Vancouver, en Colombie-Britannique, à une concentration de 0,2 ng/L (un échantillon par ville; Lien et al., 2006); dans les eaux de surface à divers sites dans les lacs Ontario et Érié aux États-Unis et au Canada, à des concentrations comprises entre 13 et 50 ng/L (moyenne de 8 échantillons prélevés à 4 endroits dans le lac Ontario : 42,5 ng/L; moyenne de 8 échantillons prélevés à 4 endroits dans le lac Érié : 35,6 ng/L [Boulanger et al., 2004]; médiane de 13 échantillons prélevés dans le lac Ontario : 21 ng/L; médiane de 3 échantillons prélevés dans le lac Érié : 15 ng/L [Sinclair et al., 2006]); dans l’eau lacustre recueillie à 5 endroits en Arctique, à des concentrations moyennes allant de 0,9 à 14 ng/L (valeurs comprises entre 0,5 et 16 ng/L; Stock et al., 2007); et dans l’air intérieur et les résidus de sécheuse (Shoeib et al., 2011). On a également détecté une contamination par l’APFO des poissons et de l’eau à des sites aéroportuaires canadiens à la suite d’un déversement de mousse extinctrice (Moody et al., 2002; courriel de Transports Canada adressé au Bureau d’évaluation du risque de Santé Canada en 2008; source non citée).
De même, des FTOH ont été détectés à différents endroits au Canada : dans la poussière domestique à Ottawa, en Ontario (n = 59; moyenne du FTOH 8:2 : 55 ng/g; Shoeib et al., 2005), et dans l’air à des sites ruraux et urbains en Ontario et au Manitoba (total des FTOH à Toronto, en Ontario : valeurs comprises entre 113 et 213 pg/m3, moyenne = 165 pg/m3; Winnipeg, au Manitoba : valeurs inférieures à la LDM à 18 pg/m3, moyenne = 11 pg/m3; Long Point, en Ontario : valeurs inférieures à la LDM à 52 pg/m3, moyenne = 26 pg/m3; n = 3 échantillons par site [Stock et al., 2004]; FTOH 8:2 à Toronto, en Ontario : valeurs comprises entre 9 et 123 pg/m3, moyenne = 55 pg/m3; n = 4; Long Point, en Ontario : valeurs comprises entre 25 et 40 pg/m3, moyenne = 32 pg/m3; n = 2 [Martin et al., 2002]) et en Arctique (total des FTOH : moyenne = 28 pg/m3; valeurs du FTOH 8:2 inférieures à la limite de détection à 20 pg/m3 [Stock et al., 2007]; FTOH 8:2 : valeurs comprises entre 5,8 et 26 pg/m3; n = 20 [Shoeib et al., 2006]).
De l’APFO a été détecté dans 3 des 54 échantillons composites d’aliments recueillis dans le cadre de l’Étude canadienne sur l’alimentation totale menée de 1992 à 2004, la concentration quantifiable la plus élevée (3,6 ng/g) se retrouvant dans un échantillon de maïs à éclater au micro-ondes (Tittlemier et al., 2007). L’APFO a également été mesuré dans plusieurs espèces de poisson (dans des échantillons cuits et crus; concentration maximale détectée = 1,59 ng/g) achetés dans des marchés en Ontario en 2006 (Del Gobbo et al., 2008) et dans certains aliments autochtones (phoque, canard et caribou; concentration maximale détectée = 0,8 ng/g) prélevés au Nunavut en 1997-1998 (Ostertag et al., 2009).
L’APFOa été mesuré dans les matériaux d’emballage et dans les vapeurs produites par la cuisson au four à micro-ondes des deux marques de maïs à éclater au micro-ondes préemballé de l’essai, et le FTOH 8:2 a été mesuré dans l’emballage et les vapeurs de l’une des deux marques de maïs à éclater. Ni l’APFO ni le FTOH 8:2 n’a été détecté dans les matériaux d’emballage ou les vapeurs des grains de maïs à éclater nature cuits dans un sac en polyéthylène (Sinclair et al., 2007). Dans le cadre d’études portant sur l’analyse de produits achetés dans des magasins de détail aux États-Unis, l’APFO a été détecté dans des batteries de cuisine neuves traitées au polytétrafluoroéthylène après avoir été chauffées à des températures de cuisson normales (Begley et al., 2005) et dans de l’eau bouillie dans deux casseroles antiadhésives neuves sur quatre (Sinclair et al., 2007). La présence d’APFO et de FTOH 8:2 a été détectée dans le dégagement gazeux des quatre marques de casseroles antiadhésives neuves mises à l’essai chauffées à des températures de cuisson normales (Sinclair et al., 2007). Dans une étude menée en Italie, l’APFO a été détecté dans l’huile de cuisson après avoir été chauffée dans des casseroles antiadhésives neuves dans des conditions de cuisson normales (Bononi et Tateo, 2007). D’autres études ont signalé que des échantillons extraits de batteries de cuisine traitées neuves n’affichaient aucune concentration décelable d’APFO (Powley et al., 2005; Washburn et al., 2005; Bradley et al., 2007). Des échantillons extraits de certains articles traités aux composés fluorés (vêtements, tapis et tissus d’ameublement) contenaient de l’APFO (Washburn et al., 2005).
L’APFOa été détecté dans 44 des 45 échantillons de lait maternel humain prélevés au Massachusetts, à des concentrations allant de < 0,0301 à 0,161 µg/mL (Tao et al., 2008). De plus, la présence d’APFO a été décelée dans le sang du cordon ombilical de nouveau-nés au Canada dans le cadre de trois études (Tittlemeir et al., 2004; Monroy et al., 2008; Beesoon, 2011), ce qui indique une exposition possible à la substance in utero ainsi que par le lait maternel.
Les données disponibles semblent indiquer que les Canadiens sont exposés à l’APFO et à ses précurseurs présents dans l’environnement, notamment l’air, l’eau potable et la nourriture, et par l’utilisation de produits de consommation tels que les ustensiles antiadhésifs, ainsi que les vêtements et les matériaux traités avec des composés perfluorés, comme les tapis et les tissus d’ameublement. En général, les concentrations d’APFO observées dans l’air ambiant, les aliments et l’eau potable au Canada sont comparables à celles mesurées ailleurs, y compris aux États-Unis, en Europe et en Asie (Fromme et al., 2009). Toutefois, dans d’autres pays, des sources industrielles que l’on ne trouve pas au Canada produisent des concentrations ponctuelles d’APFO dans l’eau potable qui sont considérablement supérieures à celles signalées au Canada (p. ex., à Little Hocking, en Ohio : concentration moyenne de 3,5 µg/L; Emmett et al., 2006a).
Comme on disposait de données de biosurveillance, qui tiennent compte de toutes les sources d’exposition, on n’a pas calculé d’estimation quantitative de l’exposition à l’APFO fondée sur les concentrations dans les milieux naturels et l’utilisation de produits de consommation. De telles estimations de l’absorption quotidienne totale ont cependant été publiées récemment. Trudel et al. (2008) ont estimé l’exposition de la population générale en Amérique du Nord à l’APFOprovenant de l’air, de la nourriture, de l’eau potable, de la poussière et des produits de consommation. Les estimations de l’exposition pour des scénarios d’exposition à des concentrations faibles, intermédiaires et fortes variaient entre 1 et 130 ng/kg p.c. par jour pour tous les groupes d’âge. Le régime alimentaire constituait la principale source d’exposition dans les scénarios d’exposition à des concentrations faibles et intermédiaires, alors que les produits de consommation (exposition par voie orale au tapis traité et lors de la migration de la substance dans les aliments à partir du papier traité, et par inhalation lors du traitement par pulvérisation des vêtements par les particuliers) constituaient la principale source d’exposition dans les scénarios de forte exposition. Cette étude n’a pas abordé l’apport de l’exposition aux précurseurs de l’APFO. Dans une autre étude menée par Fromme et al. (2009), l’exposition de la population générale à l’APFO a été estimée à l’aide de données de l’Amérique du Nord, de l’Europe et du Japon. La limite supérieure de l’exposition a été estimée à 12,6 ng/kg p.c. par jour et résultait principalement de la consommation alimentaire. L’exposition aux FTOH comptait pour moins de 1 % de l’exposition à l’APFO. Cette étude ne portait pas particulièrement sur l’examen de scénarios d’exposition aux produits de consommation.
Les données de biosurveillance sont à la base de la présente évaluation de l’exposition à l’APFO, étant donné que les concentrations sanguines représentent l’exposition combinée de l’ensemble des sources et des voies, dont l’exposition aux précurseurs de l’APFO. L’APFO a été détecté dans les échantillons de sang de populations non exposées à cette substance au travail dans divers pays, y compris chez les adultes, les enfants et les nouveau-nés au Canada. La présence d’APFO dans une grande proportion des échantillons sanguins prélevés chez les humains indique que ces derniers sont exposés dans l’environnement à l’APFO ou à ses précurseurs qui se dégradent en APFO. Une fois dans l’organisme, cet acide peut se lier à certaines protéines (Han et al., 2003, 2005), mais aucune donnée n’indique qu’il est modifié par le métabolisme, la conjugaison ou la défluoration (Vanden Heuvel et al., 1991). La demi-vie de l’APFO est relativement longue chez l’humain, variant entre 2 et 4 ans (Olsen et al., 2007; Bartell et al., 2010; Brede et al., 2010).
Dans le cadre de plusieurs études, l’APFO a été mesuré dans le sang d’adultes non exposés à cette substance au travail, d’enfants et de nouveau-nés, à des concentrations variant de < 0,0001 µg/mL à 0,0561 µg/mL, qui sont présentées dans le tableau 7. Les données canadiennes de biosurveillance sont comparables à celles des États-Unis. Les concentrations sériques et plasmatiques d’APFO chez les enfants et les personnes âgées sont comparables à celles des adultes. Cependant, d’après les données d’une étude allemande, les nourrissons âgés de six mois semblent être le groupe d’âge le plus exposé. Dans le cadre de l’étude, les concentrations d’APFO ont été mesurées à deux occasions dans le sang maternel (n ~ 40 et 38), six mois après l’accouchement (n = 47), dans le sang du cordon ombilical (n = 33) et dans le sang des nourrissons à 6 mois (n = 40) et à 19 mois (n = 24), ainsi que tous les mois dans des échantillons de lait maternel. Les concentrations dans le sérum maternel allaient de 0,7 à 8,7 µg/L, alors que dans le sérum du cordon ombilical, elles variaient de 0,5 à 4,2 µg/L. Les résultats médians dans le sérum à 6 et 19 mois étaient de 6,9 et de 4,6 µg/L, respectivement. Dans le lait maternel, l’APFO n’a été détecté que dans quelques échantillons. Les auteurs laissent entendre que l’augmentation des concentrations d’APFO pendant les premiers mois de la vie d’un nourrisson est attribuable à l’allaitement, car le lait maternel contient des concentrations mesurables de cet acide (Fromme et al., 2010).
| Description de la population | n | MA, MG ou concentration médiane (µg/mL) | Fourchette (µg/mL) |
95e centile (µg/mL) |
Références |
|---|---|---|---|---|---|
| Abréviations : MA : moyenne arithmétique; MG : moyenne géométrique; LD : limite de détection; S.O. : sans objet. | |||||
| Données du Canada | |||||
| Plasma prélevé entre 2007 et 2009 chez des Canadiens âgés de 20 à 79 ans, dans le cadre de l’Enquête canadienne sur les mesures de la santé (ECMS) | 2 880 | 0,00252 (MG) | < LD (0,0003)- maximum non indiqué | 0,00550 | Santé Canada, 2010 |
| Plasma prélevé entre 2006 et 2008 chez des enfants inuits âgés de 12 à 54 mois, dans le cadre du Programme de lutte contre les contaminants dans le Nord | 86 | 0,00162 (MG) | 0,00046-0,01100 | S.O. | Turgeon-O’Brien et al., 2010 |
| Sérum mis en commun prélevé en 2005 chez des femmes enceintes en Alberta | 50 599 | (moyenne pondérée) 0,0026 µg/g (sérum) |
0,0017-0,0038 µg/g (sérum) |
S.O. | Alberta Health and Wellness, 2008 |
| Échantillons de sérum maternel et du cordon ombilical provenant de 152 femmes et de leur bébé à Vancouver (Colombie-Britannique), prélevés dans le cadre de l’étude ChirP (Chemicals, Health and Pregnancy Study), 2006-2008 | mères 152 | 0,0018 (MA) (maternel prélevé à la 15e semaine de grossesse) |
< LD (0,0005)-0,0046 (maternel) |
S.O. | Webster, 2011; Beesoon, 2011 (résultats inédits) |
| nourrissons 20 | 0,0011 (MA) (cordon) |
0,0005-0,0024 (cordon) |
|||
| Échantillons de sérum maternel et du cordon ombilical prélevés en 2004 et 2005 chez des femmes et leurs 105 bébés à Hamilton (Ontario) | mères 101 | 0,00254 (MA) (24 à 28 semaines de gestation) |
0,00133-0,00314 | S.O. | Monroy et al., 2008 |
| 0,00224 (MA) (à l’accouchement) |
|||||
| nourrissons 105 | 0,00194 (MA) (cordon) |
0,00109-0,00237 (cordon) |
|||
| Échantillons de plasma maternel et du cordon ombilical provenant de 23 échantillons de plasma combinés représentant 560 donneurs des populations du Nord de quatre régions géographiques de l’Arctique canadien, prélevés entre 1994 et 2001 | mères 10 échan-tillons combinés | 0,0022 (MA) (maternel) | 0,00048-0,00546 | S.O. | Tittlemier et al., 2004 |
| nourrissons 13 échan-tillons combinés |
0,0034 (MA) (cordon) |
||||
| Données des États-Unis et de l’Allemagne | |||||
| Sérum prélevé en 2007 et 2008 chez des Américains âgés de 12 ans et plus; National Health and Nutrition Examination Survey (NHANES) des États-Unis | 2 100 | 0,0041 (MG) | < LD (0,0001)- 0,0772 | 0,0097 | USCDC, 2011 |
| Sérum provenant de résidents de Seattle âgés de 65 à 96 ans | 238 | 0,0042 (MG) | < limite de dosage (0,0014)-0,0167 | 0,0097 | Olsen et al., 2004a |
| Sérum prélevé en 1994 et 1995 chez des enfants âgés de 2 à 12 ans provenant de 23 États | 598 | 0,0049 (MG) | < limite de dosage (0,0029)-0,0561 | 0,010 | Olsen et al., 2004b |
| Sérum provenant d’échantillons combinés prélevés chez des enfants âgés de 3 à 5 ans (21 enfants par groupe) et chez des enfants âgés de 6 à 11 ans (57 enfants par groupe), recueillis en 2001 et 2002 dans le cadre de l’étude NHANES | 12 échan-tillons combinés (3 à 5 ans) |
S.O. | 0,0058-0,0084 | S.O. | Kato et al., 2009 |
| 12 échan-tillons combinés (6 à 11 ans) |
0,0059-0,0082 | ||||
| Échantillons de sérum du cordon ombilical prélevés chez des nourrissons nés à Baltimore (Maryland), en 2004 et 2005 | 299 | 0,0016 (médiane) | 0,0003-0,0071 | 0,0034 | Apelberg et al., 2007a |
| Sérum prélevé en 2007 et 2008 chez des femmes allemandes au moment de l’accouchement et 6 mois plus tard, ainsi que chez leur nourrisson à la naissance (sang du cordon ombilical) et à 6 et 19 mois | mères 38 |
0,0019 (médiane) (à l’accouchement) |
0,0007-0,0087 | 0,0052 | Fromme et al., 2010 |
| mères 47 |
0,0015 (médiane) (après 6 mois) |
0,0039 | |||
| nourrissons 33 | 0,0014 (médiane) (cordon) |
0,0005-0,0042 (cordon) |
0,0037 | ||
| nourrissons 40 | 0,0069 (médiane) (à 6 mois) |
0,00096-0,0269 (à 6 mois) |
0,0195 | ||
| nourrissons 24 | 0,0046 (médiane) (à 19 mois) |
Non indiqué | 0,0114 | ||
Le niveau de confiance associé à la mesure de l’exposition (c.-à-d. les concentrations d’APFO dans le sang) est considéré comme élevé, car les données couvrent l’ensemble du Canada, tous les groupes d’âge, des nourrissons aux personnes âgées, et comprennent les populations vulnérables, comme les femmes enceintes, les nourrissons allaités et les personnes vivant dans le nord du Canada. Les concentrations chez les Canadiens, dont fait état l’Enquête canadienne sur les mesures de la santé (ECMS), sont comparables à celles mesurées aux États-Unis dans l’étude NHANES. L’utilisation des données de biosurveillance prend en compte les multiples sources d’exposition, il n’est donc pas nécessaire de calculer les estimations de la limite supérieure de l’exposition par l’entremise des milieux naturels, des produits de consommation et des matériaux domestiques.
Évaluation des effets sur la santé
La plupart des études de toxicité pertinentes effectuées sur des animaux de laboratoire portent sur le sel d’ammonium de l’APFO(SAAPFO). Des études sur l’anion (PFO) et le sel de sodium (APFO-Na) de l’APFO ainsi que sur l’APFO lui-même ont également été publiées. L’APFO et ses sels devraient se dissocier rapidement dans les tissus biologiques en perfluorooctanoate (PFO), l’anion de cet acide. Les effets toxicologiques associés à l’exposition à l’APFO, au SAAPFO et à l’APFO-Na sont similaires. L’APFO et ses sels sont donc considérés comme des équivalents biologiques dans le présent rapport. Les données toxicologiques propres à chaque précurseur de l’APFO n’ont pas été évaluées, car la démarche suivie dans cette évaluation consistait à examiner ces composés du point de vue de leur contribution à l’exposition totale à l’APFO. L’annexe 2 fournit un résumé de la base de données toxicologiques sur l’APFO et ses sels. Les études considérées comme critiques pour l’évaluation préalable étaient celles qui présentaient les plus faibles doses administrées et celles avec les plus faibles concentrations sériques d’APFO associées à des effets.
Une étude de toxicité à court terme (14 jours) par voie orale du SAAPFO sur les rats et les souris a obtenu une DMENO de 0,3 mg/kg p.c. par jour. Cette dose était associée à une concentration sérique moyenne d’APFO de 13 µg/mL et à une augmentation du poids du foie chez les souris mâles, ainsi qu’à une concentration sérique moyenne d’APFO de 20 µg/mL et à la modification des paramètres lipidiques chez les rats mâles. Il s’agissait de la dose la plus faible de l’essai, de sorte qu’aucune DSENO n’a été établie (Loveless et al., 2006).
Dans une étude de toxicité subchronique (13 semaines) par voie orale sur des rats mâles, aucun effet n’a été observé à la dose de 0,06 mg/kg p.c. par jour, ni même des changements histopathologiques dans le foie. Une augmentation du poids du foie ainsi qu’une hypertrophie hépatique ont été observées à la dose suivante, soit à 0,64 mg/kg p.c. par jour. Ces effets n’ont pas été observés après une période de rétablissement de 8 semaines. À la fin de la période d’exposition de 13 semaines, les concentrations sériques d’APFO correspondant à la DSENO et à la DMENO étaient respectivement de 7,1 et de 41,2 µg/mL (Palazzolo, 1993; Perkins et al., 2004).
Des effets sur le foie ont également été observés dans une étude d’exposition par inhalation de 14 jours sur des rats mâles. On a noté une augmentation du poids du foie réversible, des hausses réversibles de l’activité enzymatique sérique ainsi qu’une pathologie microscopique hépatique, dont une nécrose (non réversible), à des niveaux d’exposition de 8 mg/m3 et plus, mais pas à 1 mg/m3. Il a été calculé que ces niveaux d’exposition équivalaient respectivement à des doses de 2,48 et de 0,31 mg/kg p.c. par jour[3] (les concentrations sériques d’APFOcorrespondantes étaient respectivement de 47 et de 13 µg/mL, à la fin de la période d’exposition de 14 jours) (Haskell Laboratory, 1981a; Kennedy et al., 1986).
Dans une étude de toxicité subchronique de 26 semaines sur des singes mâles exposés par voie orale, la dose la plus faible de SAAPFO mise à l’essai de 3 mg/kg p.c. par jour a entraîné une augmentation du poids du foie (Thomford, 2001b; Butenhoff et al., 2002). D’après les mesures prises deux fois par semaine, la concentration sérique moyenne d’APFO était de 77 µg/mL.
Lors d’une étude de toxicité sur le développement des souris auxquelles on a administré des doses de 1 mg/kg p.c. par jour de SAAPFO par voie orale du 1er au 17e jour de gestation, on a observé une augmentation du poids du foie des souris mères, une ossification réduite des os des fœtus et une puberté précoce des souriceaux mâles. La concentration sérique moyenne d’APFO chez les mères recevant la DMENO de 1 mg/kg p.c. par jour était de 21,9 µg/mL. Comme il s’agissait de la dose la plus faible mise à l’essai, aucune DSENO n’a été établie (Lau et al., 2006). Pendant la préparation de la présente évaluation préalable finale, Macon et al. (2011) ont publié une étude portant sur les effets à faible dose de l’APFOchez les souris. L’étude a révélé des cotes de développement des glandes mammaires beaucoup plus faibles chez la progéniture des souris CD-1 au 21e jour après la naissance lorsque les mères ont été exposées par gavage à 0,01 mg/kg p.c. par jour du 10e au 17e jour de gestation; la concentration sérique d’APFO était de 16,5 ± 2,1 ng/mL. Les auteurs ont révélé une sensibilité des glandes mammaires à l’APFO chez les souris CD-1. Des recherches supplémentaires sont nécessaires pour déterminer si cette sensibilité est liée à la période d’exposition ou à la souche murine, ou encore si d’autres mécanismes sous-tendent la sensibilité apparente des souris CD-1. Il n’y a pas assez de renseignements pour déterminer si les effets sur les glandes mammaires sont permanents et, par conséquent, nocifs à de faibles doses.
Deux études de toxicité chronique sur des animaux de laboratoire ont été relevées. Dans la première étude de toxicité chronique, des rats CD ont été exposés au SAAPFO à des doses de 0, 30 ou 300 ppm (parties par million) dans leur alimentation pendant 2 ans (0, 1,3 ou 14,2 mg/kg p.c. par jour chez les mâles; 1, 1,6 ou 16,1 mg/kg p.c. par jour chez les femelles). Une DMENO de 1,3 mg/kg p.c. par jour a été établie d’après des augmentations significatives des paramètres sériques dans le foie (glutamate pyruvate transaminase, phosphatase alcaline et albumine) chez les mâles. Aucun signe de cancérogénicité n’a été rapporté chez les rats femelles, mais les mâles affichaient une augmentation des adénomes des cellules de Leydig. Cette augmentation était significative (p ≤ 0,05) chez le groupe exposé à la dose élevée, soit 14,2 mg/kg p.c. par jour (Sibinski, 1987). Dans la deuxième étude, des rats mâles CD ont été exposés à seulement une dose de SAAPFO dans leur alimentation, soit 300 ppm ou 13,6 mg/kg p.c. par jour, pendant 2 ans. L’incidence des adénomes du foie, de l’hyperplasie et des adénomes des cellules de Leydig ainsi que de l’hyperplasie et des adénomes dans les cellules acineuses du pancréas était significativement plus élevée chez les mâles exposés (Biegel et al., 2001). Aucune de ces études de toxicité chronique n’a indiqué les concentrations sériques d’APFO.
Afin de déterminer leur potentiel de génotoxicité, l’APFO ainsi que ses sels d’ammonium et de sodium ont été évalués à l’aide de trois tests du micronoyau in vivo sur la moelle osseuse de souris, de plusieurs tests d’Ames de mutation bactérienne et de trois tests d’aberration chromosomique in vitro (deux sur des cellules de hamster et un sur des cellules humaines); aucun de ces tests n’a produit de données probantes (voir l’annexe 2 pour les données détaillées sur chacun des composés et les références). Des résultats positifs ont été obtenus dans un essai de dommages chromosomiques sur des cellules de hamster et dans un test du micronoyau in vitro sur des cellules humaines. L’APFO a provoqué des dommages oxydatifs à l’ADN dans les cellules d’hépatomes humains en culture et dans le foie des rats exposés par voie orale ou intrapéritonéale. La base de données sur la génotoxicité indique que les composés d’APFO ne sont pas mutagènes.
Chez les rongeurs, l’APFO induit une prolifération des peroxysomes, par l’intermédiaire du PPARα. L’activation du PPARαprovoque des changements dans le foie, de même que des modifications du transport et du métabolisme des lipides ainsi que la modification d’autres processus biochimiques. La triade de tumeurs bénignes observées chez les rats mâles exposés à l’APFO (adénomes du foie, des cellules de Leydig et des cellules acineuses du pancréas) est typique des agonistes du PPAR, dont le clofibrate, le 2,2-dichloro-1,1,1-trifluoroéthane (HCFC 123) et l’acide pirinixique (WY-14643) [Cook et al., 1999; Kennedy et al., 2004]. Il a été proposé que l’activation du PPARα hépatique, et non la génotoxicité directe, était l’élément critique de l’induction de ces tumeurs. Le niveau de confiance envers le mode d’action du PPARα est élevé en ce qui concerne les tumeurs hépatiques, modéré pour les tumeurs à cellules de Leydig et faible pour les tumeurs des cellules acineuses du pancréas (recensé dans Klaunig et al., 2003).
Il a été montré que l’APFO stimule le PPARαin vitro et qu’il provoque la prolifération des peroxysomes dans le foie in vivo. Des données sur les relations dose-réponse et temporelles appuient le mode d’action du PPARα pour les tumeurs hépatiques chez le rat. Dans l’étude de toxicité chronique par voie alimentaire menée par Biegel et al. (2001), l’APFO a entraîné une augmentation du poids du foie et la prolifération des peroxysomes dans le foie des rats exposés tout au long de l’étude, et ce, dès un mois après le début du traitement, et la première apparition des tumeurs hépatiques a été observée 12 mois après le début du traitement. Dans une étude d’une durée de 14 jours sur des rats mâles, Liu et al. (1996) ont établi une DSEO de 0,2 mg/kg p.c. par jour et une DMEO de 2 mg/kg p.c. par jour pour l’augmentation du poids du foie et la prolifération des peroxysomes du foie (mesurée à l’aide de la β-oxydation hépatique), soit les principaux paramètres de l’initiation des tumeurs hépatiques. Des signes de cancérogénicité hépatique ont été observés à la dose de 13,6 mg/kg p.c. par jour dans l’étude de toxicité chronique menée par Biegel et al.(2001), mais aucun signe n’a été observé à la dose de 1,3 mg/kg p.c. par jour dans l’étude de toxicité chronique de Sibinski (1987), ce qui est conforme avec la relation dose-réponse établie pour les événements clés précoces. Dans une étude de toxicité subchronique sur des singes, aucune augmentation de la prolifération des peroxysomes n’a été observée après une exposition à l’APFO, bien que des effets hépatiques, dont une augmentation du poids du foie, aient été notés (Butenhoff et al., 2002).
Chez les rats mâles, l’APFO n’a pas induit de prolifération des peroxysomes ni de prolifération cellulaire dans les cellules de Leydig (Biegel et al., 2001), ce qui semble indiquer que ce n’est pas l’activation directe du PPAR qui provoque des tumeurs dans les testicules. Il a été proposé que les tumeurs à cellules de Leydig chez le rat mâle résultent d’une augmentation de l’estradiol sérique provoquée par l’activation du PPARα hépatique, suivie par des changements de l’activité des enzymes jouant un rôle dans la biosynthèse des stéroïdes. Les études montrent que l’exposition à l’APFO accroît l’activité de l’aromatase hépatique et augmente les concentrations d’estradiol dans le sérum (Liu et al., 1996; Biegel et al., 2001). Dans une étude d’une durée de 14 jours sur des rats mâles, Liu et al. (1996) ont démontré que l’activité de l’aromatase hépatique et les concentrations d’estradiol dans le sérum n’augmentaient qu’à des doses provoquant la prolifération des peroxysomes du foie. Une DSEO de 0,2 mg/kg p.c. par jour et une DMEO de 2 mg/kg p.c. par jour ont été établies selon l’augmentation de l’activité de l’aromatase hépatique et des concentrations d’estradiol dans le sérum. Dans l’étude de toxicité chronique menée par Sibinski (1987), une augmentation significative des tumeurs à cellules de Leydig a été observée à la dose élevée de 14,2 mg/kg p.c. par jour, mais non à la faible dose de 1,3 mg/kg p.c. par jour. Dans le cadre de l’étude de toxicité chronique par voie alimentaire réalisée par Biegel et al. (2001), l’APFO a provoqué une augmentation de la concentration d’estradiol dans le sérum des rats après 1, 3, 6, 9 et 12 mois d’exposition, avant la première apparition de tumeurs à cellules de Leydig. Le mode d’action du PPARαproposé concorde donc avec les relations dose-réponse et temporelles associées à l’augmentation de l’estradiol sérique. Dans les testicules, l’estradiol module l’expression du facteur de croissance, ce qui peut entraîner une hyperplasie et des adénomes (Biegel et al. 1995). Il a également été montré in vitro que l’APFO et d’autres agonistes du PPARα, dont le bézafibrate, le phtalate de monoéthylhexyle (MEHP) et le WY-14643, inhibent la production de testostérone dans les cellules de Leydig (Klaunig et al., 2003), bien qu’on n’ait noté aucune diminution des taux de testostérone sérique dans l’essai biologique d’une durée de deux ans sur l’exposition à l’APFO chez les rats (Biegel et al., 2001). Chez les primates non humains, une exposition à l’APFO n’a pas entraîné une augmentation de l’œstrogène sérique ni une diminution de la testostérone sérique, et aucune histopathologie anormale n’a été observée dans les testicules dans le cadre d’une étude d’une durée de 26 semaines (Butenhoff et al., 2002).
L’induction des tumeurs des cellules acineuses du pancréas chez les rats mâles peut également se faire par un mécanisme médié par le PPAR du foie, bien que le niveau de confiance à l’égard de ce mode d’action soit jugé plus élevé pour l’induction des tumeurs hépatiques ou des tumeurs à cellules de Leydig (recensé dans Klaunig et al., 2003). Les données sur les modes d’action in vivo sont principalement dérivées d’autres agonistes du PPAR, dont on a démontré l’induction de tumeurs des cellules acineuses du pancréas chez le rat. Chez cette espèce, les hormones stéroïdes, y compris l’estradiol et la cholécystokinine, ont un effet sur l’hyperplasie, les adénomes et l’hypertrophie des cellules acineuses du pancréas. L’exposition à l’APFO pourrait réduire l’écoulement de la bile ou changer sa composition en raison des effets en aval de l’activation du PPARα hépatique. Il peut alors s’ensuivre une augmentation des taux de cholécystokinine et une stimulation des cellules acineuses du pancréas. Bien qu’il n’existe aucune donnée mécaniste sur l’APFO lui-même, on a noté une réduction de l’écoulement de la bile et de la concentration d’acide biliaire ainsi qu’une augmentation continue de la cholécystokinine plasmatique chez les rats traités au WY-14643, un agoniste du PPARα. Ces changements ont été observés dès le troisième mois d’exposition, soit avant l’observation des premières tumeurs des cellules acineuses du pancréas. Dans l’étude de toxicité chronique par voie alimentaire menée par Biegel et al.(2001), les rats traités à l’APFO présentaient une prolifération accrue des cellules pancréatiques après 15, 18 et 21 mois d’exposition, ainsi qu’une augmentation significative de l’hyperplasie acineuse. Aucune histopathologie anormale dans le pancréas des singes exposés à l’APFO n’a été constatée dans une étude de 26 semaines (Butenhoff et al., 2002).
Dans une ébauche d’évaluation des risques, l’Environmental Protection Agency (EPA) des États-Unis a indiqué qu’il existait suffisamment de preuves pour conclure que la toxicité hépatique et les adénomes hépatiques observés chez les rats après une exposition à l’APFO résulteraient du mode d’action d’un agoniste du PPARα, ce qui est peu probable chez l’humain. L’EPA conclut également que les tumeurs à cellules de Leydig et les tumeurs des cellules acineuses du pancréas pourraient s’appliquer aux humains, mais qu’elles ne constituent probablement pas un risque de cancer important, en raison des différences quantitatives de l’expression des récepteurs et d’autres facteurs toxicodynamiques (US EPA, 2005). Toutefois, le Science Advisory Board a examiné l’évaluation des risques de l’EPA et a conclu qu’il pourrait exister d’autres modes d’action à l’origine des tumeurs hépatiques et que, comme les modes d’action induisant les tumeurs à cellules de Leydig et les tumeurs des cellules acineuses du pancréas demeurent inconnus, ils devraient être jugés applicables dans le cas des êtres humains (US EPA, 2006b).
Des études récentes réalisées sur des souris dont l’expression du gène PPARα a été inhibée (PPARα-KO) semblent indiquer que certains des effets associés à l’exposition à l’APFO se produisent indépendamment de la voie de prolifération des peroxysomes. Des effets sur le développement, tels qu’un retard dans l’ouverture des yeux, des déficits du gain de poids après la naissance et une réduction de la survie postnatale, ont été observés chez les souris de type sauvage, mais non chez les souris PPARα-KO, ce qui laisse supposer que ces effets dépendent de l’expression du PPARα. Des pertes en début de gestation ont été observées chez les deux souches de souris, ce qui indique l’intervention de voies autres que la prolifération des peroxysomes (Abbott et al., 2007). Yang et al. (2002) ont constaté que la diminution du poids de la rate et du nombre de splénocytes observée chez les souris de type sauvage exposées à l’APFO dans leur alimentation pendant sept jours ne se produisait pas chez les souris PPARα-KO exposées. Les souris exposées à l’APFO affichaient également une diminution du poids du thymus et du nombre de thymocytes, effets qui étaient atténués chez les souris PPARα-KO. Une augmentation significative du poids du foie a toutefois été notée tant chez les souris de type sauvage que chez les souris PPARα-KO. D’après des études du profil d’expression des gènes, l’APFO pourrait modifier les gènes du foie des souris indépendamment du PPARα (Rosen et al., 2008a, 2008b); on ne sait toutefois pas si ces données sont pertinentes du point de vue toxicologique.
Parmi les études épidémiologiques qui ont été réalisées sur les effets nocifs de l’exposition à l’APFO sur la santé, notons des études transversales sur l’exposition de la population générale, des études de populations exposées à des concentrations élevées d’APFO dans l’eau potable contaminée ainsi que des études d’exposition professionnelle. Selon deux études menées récemment (une étude transversale aux États-Unis et une étude de cohorte au Danemark), il pourrait exister une faible corrélation entre l’exposition à l’APFO pendant la grossesse et une insuffisance de poids à la naissance (Apelberg et al., 2007b; Fei et al., 2007). Toutefois, l’ampleur de cet effet était faible, compte tenu des variations normales des paramètres mesurés, et tous les enfants se situaient à l’intérieur de la plage normale. Aucune association entre les concentrations sériques de l’APFO chez les mères et le poids des nouveau-nés à la naissance n’a été relevée dans d’autres études d’exposition de la population générale menées au Canada (Monroy et al., 2008; Hamm et al., 2009), au Japon (Washino et al., 2009) ou dans une collectivité américaine qui affichait une concentration sérique moyenne d’APFO dix fois supérieure à celle observée au sein de la population générale (Stein et al., 2009).
Plusieurs études portant sur les personnes exposées au travail (Olsen et al., 2003; Sakr et al., 2007a, 2007b; Costa et al., 2009) et sur les résidents de collectivités très exposées (Steenland et al., 2009; Frisbee et al., 2010) ont observé une association positive entre l’APFO sérique et le cholestérol total ainsi que d’autres paramètres lipidiques. Une étude transversale portant sur la population générale des États-Unis est récemment arrivée à des résultats similaires (Nelson et al., 2010). À l’inverse, d’autres études épidémiologiques sur l’exposition au travail (Olsen et al., 2000; Olsen et Zobel, 2007) et sur les collectivités exposées (Emmett et al., 2006b) n’apportent aucune preuve d’une association significative entre l’APFO sérique et le cholestérol.
Le poids de la preuve global ne peut confirmer l’existence de relations causales entre l’exposition à l’APFO et les effets nocifs observés sur la santé, en raison des nombreux facteurs confusionnels, dont l’exposition à de multiples substances chimiques. Un examen récent des preuves épidémiologiques des effets sur la santé de l’APFO révèle également que les données épidémiologiques sont insuffisantes pour tirer des conclusions concernant le rôle de l’APFO dans les effets observés sur la santé (Steenland et al., 2010a).
Le niveau de confiance accordé à l’évaluation des effets de l’APFO est modéré à élevé, car la base de données toxicologiques couvre un large éventail de paramètres et de stades du cycle de vie, plusieurs espèces et les deux sexes.
Caractérisation des risques pour la santé humaine
Nous disposons de données suffisantes pour calculer des marges d’exposition fondées sur la comparaison entre les concentrations sériques d’APFO chez les animaux de laboratoire aux doses avec effet critique et les concentrations sériques ou plasmatiques d’APFO chez les humains tirées d’études de biosurveillance. Les marges d’exposition entre les concentrations sériques d’APFO associées aux effets les plus critiques chez les animaux de laboratoire et les concentrations plasmatiques d’APFO chez les Canadiens d’âge adulte sont comprises entre 5 100 et 30 600 environ pour la moyenne géométrique et entre 2 300 et 14 000 pour les valeurs du 95e centile. Pour les enfants inuits (12 à 54 mois), les marges d’exposition pour la moyenne géométrique et les valeurs maximales varient de 8 000 à 47 500 et de 1 200 à 7 000, respectivement. Pour les nourrissons allaités, les marges d’exposition pour la médiane et les valeurs du 95ecentile sont comprises entre 1 880 et 11 000 et entre 660 et 3 900, respectivement (tableau 8).
| Étude et effet critique (référence) |
Dose avec effet critique (mg/kg p.cpar jour) | Mesure de la dose d’APFO avec effet critique (concentra-tion sérique; µg/mL) | Exposition humaine à l’APFO (concentration sérique ou plasmatique; µg/mL) | Marge d’expo-sition[1] |
|---|---|---|---|---|
| [1] Les marges d’exposition ont été calculées selon le rapport entre les concentrations sériques d’APFO avec effet critique et les concentrations sériques d’APFO chez les humains. [2] Enquête canadienne sur les mesures de la santé (Santé Canada, 2010). [3] Programme de lutte contre les contaminants dans le Nord (Turgeon-O’Brien et al., 2010). Les valeurs du 95e centile n’étaient pas fournies; ainsi, les marges d’exposition sont basées sur les valeurs maximales. [4] Fromme et al., 2010. |
||||
| Augmentation du poids du foie des souris mâles auxquelles on a administré du SAAPFO par gavage pendant 14 jours (Loveless et al., 2006) |
DMENO = 0,3 |
13 | Canadiens âgés de 20 à 79 ans[2] 0,00252 (MG) |
5 159 |
| Canadiens âgés de 20 à 79 ans[2] 0,00550 (95ecentile[3]) |
2 364 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,00162 (MG) |
8 024 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,01100 (maximum) |
1 182 | |||
| Nourrissons de 6 mois, Allemagne[4] – 0,0069 (médiane) |
1 884 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0195 (95e centile) |
667 | |||
| Modifications des paramètres lipidiques chez les rats mâles auxquels on a administré du SAAPFO par gavage pendant 14 jours (Loveless et al., 2006) | DMENO = 0,3 |
20 | Canadiens âgés de 20 à 79 ans[2] 0,00252 (MG) |
7 937 |
| Canadiens âgés de 20 à 79 ans[2] 0,00550 (95e centile) |
3 636 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,00162 (MG) |
12 346 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,01100 (maximum) |
1 818 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0069 (médiane) |
2 899 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0195 (95e centile) |
1 026 | |||
| Augmentation du poids du foie des souris mères, ossification réduite des os des fœtus et puberté précoce des souriceaux mâles, à la suite de l’administration du SAAPFOpar gavage chez les souris mères du 1er au 17e jour de gestation (Lau et al., 2006) |
DMENO = 1 |
21,9 | Canadiens âgés de 20 à 79 ans[2] 0,00252 (MG) |
8 690 |
| Canadiens âgés de 20 à 79 ans[2] 0,00550 (95e centile) |
3 982 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,00162 (MG) |
13 519 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,01100 (maximum) |
1 991 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0069 (médiane) |
3 174 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0195 (95e centile) |
1 123 | |||
| Augmentation du poids du foie des singes mâles auxquels on a administré du SAAPFO par gavage pendant 26 semaines (Thomford, 2001b; Butenhoff et al., 2002) |
DMENO = 3 |
77 | Canadiens âgés de 20 à 79 ans[2] 0,00252 (MG) |
30 556 |
| Canadiens âgés de 20 à 79 ans[2] 0,00550 (95e centile) |
14 000 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,00162 (MG) |
47 531 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,01100 (maximum) |
7 000 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0069 (médiane) |
11 159 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0195 (95e centile) |
3 949 | |||
Les études sur des animaux de laboratoire qui ont servi à calculer les marges d’exposition étaient celles qui présentaient les plus faibles doses administrées et concentrations sériques d’APFO associées à des effets. Une étude de toxicité orale de 14 jours sur des rats et des souris (Loveless et al., 2006) a obtenu la plus faible des valeurs de DMENO (0,3 mg/kg p.c. par jour) déterminées dans les études critiques; les marges d’exposition ont été calculées en fonction des concentrations sériques d’APFOmesurées chez les rats et les souris associées à cette dose. Bien qu’aucune DSENO n’ait été établie dans cette étude critique, il existe des données probantes tirées d’autres études, telles qu’une étude d’exposition orale de 13 semaines sur le rat et une étude d’exposition par inhalation de 14 jours sur le rat, au cours desquelles aucun effet n’a été observé aux doses respectives de 0,06 et de 0,31 mg/kg p.c. par jour (Haskell Laboratory, 1981a; Kennedy et al., 1986; Palazzolo, 1993; Perkins et al., 2004).
Les marges d’exposition ont également été calculées en fonction des concentrations sériques chez les souris ayant reçu la DMENO associée à la toxicité pour le développement, soit 1 mg/kg p.c. par jour (Lau et al., 2006). Bien qu’aucune DSENO n’ait été établie dans cette étude, une DSENO associée à la toxicité pour le développement de 0,3 mg/kg p.c. par jour, fondée sur une diminution du taux de survie néonatale à la dose de 0,6 mg/kg p.c. par jour et un retard de l’ouverture des yeux à 1 mg/kg p.c. par jour, a été déterminée au cours d’une étude de suivi visant à examiner le mécanisme d’action des effets de l’APFO sur le développement. Comme les concentrations sériques d’APFO n’ont été mesurées qu’au 22e jour après la naissance, les doses avec effet tirées de cette étude n’ont pas été utilisées pour calculer une marge d’exposition (Abbott et al., 2007). Dans l’étude de Macon et al., 2011, des cotes de développement de la glande mammaire significativement plus faibles ont été observées chez la progéniture des souris CD-1 au 21e jour après la naissance, lorsque les mères étaient exposées à une dose de 0,01 mg/kg p.c. par jour. Cette étude n’a pas été jugée pertinente pour être utilisée dans la caractérisation des risques, en raison d’indications de la sensibilité de la souche, de l’absence de répétabilité du paramètre à des niveaux d’exposition faibles, d’un manque de compréhension du mode d’action et de la pertinence de ce paramètre pour les humains. De plus, cette étude ne présente pas suffisamment de données probantes indiquant que ces effets sont permanents et, par conséquent, nocifs.
Comme les primates sont jugés plus représentatifs des sujets humains que les rongeurs, une étude de toxicité chez les singes d’une durée de 26 semaines a aussi été choisie pour estimer des marges d’exposition (Thomford, 2001b; Butenhoff et al., 2002). La concentration sérique d’APFO à l’équilibre chez les singes recevant la DMENO de 3 mg/kg p.c. par jour a été utilisée pour faire ce calcul. Aucune DSENO n’a été établie dans le cadre de cette étude.
L’utilisation des concentrations sériques pour calculer les marges d’exposition permet de réduire de façon marquée le niveau d’incertitude associé aux différences pharmacocinétiques interspécifiques et intraspécifiques. Chez les animaux de laboratoire, l’APFO passe principalement dans le sérum et dans le foie (Vanden Heuvel et al., 1991; Butenhoff et al., 2004a; Hundley et al., 2006; Kudo et al., 2007). On dispose de peu de données sur la distribution tissulaire de l’APFO chez l’humain, mais on suppose qu’elle serait semblable à celle observée chez les animaux de laboratoire (notamment les rats mâles, les souris mâles et femelles et les primates non humains) [Hundley et al., 2006]. La présence d’APFO a été décelée dans des échantillons de foie humain prélevés post mortem dans le cadre de deux études (Olsen et al., 2003b; Maestri et al., 2006). Comme les données sur les concentrations d’APFO dans les tissus humains sont limitées, les données sur les concentrations d’APFO dans le sang (sérum ou plasma) constituent, en raison de leur disponibilité, la mesure de l’exposition interne la plus appropriée. Compte tenu de la longue demi-vie de l’APFO et de son absence de métabolisme, les concentrations sanguines d’APFO chez les humains d’âge adulte représentent l’exposition cumulative (à vie) à l’APFO ainsi qu’à tous ses précurseurs. Les concentrations sanguines d’APFO chez les enfants, les personnes âgées et les adultes sont comparables. Bien que les études de toxicologie critiques sur des animaux de laboratoire aient été menées sur des périodes d’exposition inférieures à la durée de vie, les données pharmacocinétiques indiquent que les concentrations sériques d’APFO mesurées représentent un état d’équilibre (Vanden Heuvel et al., 1991; Butenhoff et al., 2004a; Lau et al., 2006).
Il est important de tenir compte de la contribution possible de la prolifération des peroxysomes lorsqu’on estime une marge d’exposition fondée sur les effets d’une substance sur les rongeurs. Les rats et les souris sont sensibles aux effets des agents de prolifération peroxysomale, alors que les singes et les humains y sont relativement insensibles à des doses similaires (recensé dans Klaunig et al., 2003; Kennedy et al., 2004). De ce fait, les marges d’exposition fondées sur des effets liés à la prolifération des peroxysomes seraient prudentes. Comme les marges reposent sur les effets les plus critiques et les espèces les plus sensibles, elles sont considérées comme adéquates pour tenir compte à la fois des effets indépendants et dépendants du PPAR.
Le SAAPFO a induit des tumeurs chez les rats exposés à ce sel, mais les autres composés de l’APFO n’ont pas encore été mis à l’essai pour vérifier leur potentiel de cancérogénicité chez aucune autre espèce d’animaux de laboratoire. Il se peut que le mode d’action d’un agoniste du PPAR proposé pour les tumeurs du pancréas, des testicules et du foie du rat ne s’applique pas à l’humain, mais sa pertinence pour les humains n’a pas été établie de façon définitive selon les cadres établis (Meek et al., 2003; Boobis et al., 2006).
Il a été montré que l’APFO stimule le PPARαhumain en culture cellulaire in vitro (Takacs et Abbott, 2007; Wolf et al., 2008), mais pas les cellules de Leydig des rats mâles (Biegel et al., 2001). L’activation du PPARα provoque une large gamme d’effets, dont la régulation de l’expression des gènes qui participent à la survie et à la croissance des cellules. En fait, on sait que certains ligands du PPARα possèdent des propriétés anti-oncogènes, telles que la suppression de la croissance de plusieurs types de cellules cancéreuses humaines in vitro ainsi que l’inhibition de la cancérogénicité in vivo (recensé dans Pozzi et Capdevila, 2008). Le PPARα pourrait donc être une cible éventuelle pour un traitement contre le cancer. Il convient également de noter que d’autres ligands du PPARα, tels que les fibrates, qui provoquent une forte incidence de tumeurs chez les rongeurs, sont fréquemment utilisés à des fins thérapeutiques chez l’humain, et aucun signe de cancérogénicité n’a été constaté dans les études épidémiologiques (recensé dans Peters et al., 2005).
Bien que le mode d’action de l’induction de tumeurs n’ait pas été démontré de façon concluante et que la pertinence de la formation de tumeurs chez les rats soit incertaine pour ce qui est de l’évaluation de la cancérogénicité chez l’humain, la base de données sur la génotoxicité indique que l’APFOn’a pas d’effet mutagène direct. Par conséquent, étant donné que les tumeurs observées chez les rats mâles ne semblent pas être causées par une interaction directe avec le matériel génétique, une approche fondée sur le seuil d’innocuité est utilisée afin de caractériser les risques pour la santé humaine. Les marges d’exposition calculées pour les effets non néoplasiques sont suffisantes pour tenir compte de l’incidence accrue des tumeurs bénignes observées dans les études de toxicité chronique de l’APFO sur les rats, car : a) les tumeurs ont été observées seulement à des doses supérieures à celles qui ont induit des effets non néoplasiques; b) la base de données sur la génotoxicité indique que l’APFO n’a pas d’effet mutagène; c) les tumeurs hépatiques chez le rat sont vraisemblablement induites par un mode d’action qui ne s’applique pas à l’humain; d) aucun effet lié à l’APFOobservé chez les primates non humains n’a été associé à l’apparition de tumeurs du pancréas ou des testicules chez le rat.
Incertitudes dans l’évaluation des risques pour la santé humaine
L’utilisation des concentrations dans le sang (sérum ou plasma) permet de réduire le niveau d’incertitude associé à l’établissement de la limite supérieure estimée de l’absorption humaine d’APFO, étant donné les données limitées dont on dispose sur les concentrations d’APFO et de ses précurseurs dans l’air, les aliments, l’eau potable et le lait maternel et résultant du contact avec des matériaux domestiques traités avec des substances perfluorées. Qui plus est, les concentrations d’APFO dans le sang humain fournissent une mesure de l’exposition combinée à de multiples sources et voies d’exposition. L’utilisation des concentrations sanguines permet également de réduire de façon marquée le niveau d’incertitude associé aux différences pharmacocinétiques interspécifiques et intraspécifiques.
L’utilisation des valeurs du 95e centile des concentrations sériques ou plasmatiques s’avère prudente. En outre, des mesures ont été prises récemment afin de réduire les émissions des usines à l’échelle mondiale ainsi que la teneur des produits en APFO et en substances chimiques apparentées, y compris au Canada (US EPA, 2006c; EPE, 2009). Bien que deux études de biosurveillance plus anciennes menées aux États-Unis aient montré une diminution des concentrations sériques d’APFO par rapport à la période précédant l’instauration des mesures de réduction (Calafat et al., 2007, 2008), des données plus récentes tirées de l’étude NHANES montrent que les concentrations sériques d’APFO étaient stables pendant la période de 2003 à 2008 (USCDC, 2011). Des données canadiennes récentes affichent une tendance similaire, les concentrations étant demeurées stables pendant la période de 2004 à 2009 (voir le tableau 7). Les marges d’exposition présentées dans le tableau 8 sont fondées sur des concentrations sériques et plasmatiques mesurées de 1994 à 2009. Les concentrations d’APFO chez les Canadiens, dont fait état l’ECMS, sont comparables aux concentrations mesurées aux États-Unis, d’après les données de l’étude NHANES les plus récentes. Des lacunes subsistent dans les données de biosurveillance concernant les nourrissons et les enfants canadiens, de la naissance à l’âge de deux ans. Les données concernant les nourrissons allaités indiquent que ce groupe d’âge pourrait être la sous-population la plus exposée (Fromme et al., 2010).
Certaines incertitudes subsistent quant au mode d’action de l’induction de tumeurs; toutefois, comme la base de données sur la génotoxicité indique que l’APFO n’aurait pas d’effet mutagène, les marges d’exposition fondées sur les effets non néoplasiques chez les espèces les plus sensibles sont considérées comme suffisantes pour assurer une protection contre tout effet cancérogène chez l’humain.
Les effets de l’APFO à de faibles doses, y compris sur le développement des glandes mammaires, sont incertains; d’autres études sont requises pour explorer davantage ces premiers résultats.
L’évaluation est fondée sur une méthode du poids de la preuve en ce qui concerne la persistance, la bioaccumulation, les tendances temporelles chez certaines espèces (p. ex., l’ours blanc), le transport à grande distance, la présence répandue et les concentrations de l’APFO dans l’environnement et le biote (y compris les régions éloignées du Canada).
Selon l’information présentée dans la présente évaluation préalable, il est conclu que l’APFO, ses sels et ses précurseurs pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, il est conclu que l’APFO et ses sels sont extrêmement persistants et qu’ils répondent aux critères de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation. L’APFO et ses sels ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. Néanmoins, le poids de la preuve est suffisant pour conclure que l’APFO et ses sels s’accumulent et se bioamplifient chez les mammifères terrestres et marins.
D’après une comparaison entre la limite supérieure des concentrations de cet acide dans le sang (plasma ou sérum) chez les êtres humains et les concentrations sériques associées à l’apparition d’effets nocifs chez les animaux de laboratoire, on considère que les marges d’exposition calculées (tableau 8) sont adéquates pour protéger la santé humaine. Il est conclu que l’APFO et ses sels ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines. Les précurseurs de l’APFO pouvant se dégrader en APFO dans l’environnement n’ont pas été évalués de façon individuelle. La démarche suivie dans la présente évaluation prenait en compte leur contribution à l’exposition totale, qui correspond à la fraction préoccupante sur le plan toxicologique, étant donné qu’ils peuvent se dégrader en APFO dans l’environnement.
Il est donc conclu que l’APFO, ses sels et ses précurseurs répondent à au moins un des critères énoncés à l’article 64 de la LCPE (1999).
3M Company. 1977. Acute toxicity of FC-143 to fish (fathead minnow). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0498.
3M Company. 1978a. Acute toxicity of FC-143 to fish (bluegill sunfish). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0499.
3M Company. 1978b. Acute toxicity of FC-143 to fish (bluegill sunfish). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0500.
3M Company. 1979. Technical report summary--Final comprehensive report: FC-143. St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0528.
3M Company. 1980a. Activated sludge respiration inhibition (FC-143). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0505.
3M Company. 1980b. Ready biodegradation of FC-143 (BOD/COD). Lab Request No. 5625S. St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0492.
3M Company. 1982. Acute toxicity of FC-143 to aquatic invertebrates (Daphnia magna). St. Paul (MN): 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0507.
3M Company. 1984. Chronic toxicity to freshwater invertebrates (Daphnia magna). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0508.
3M Company. 1985a. Acute toxicity of FX-1001 to fish (fathead minnow). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0509.
3M Company. 1985b. Ready biodegradation of FX-1001 (BOD/COD). Lab Request No. C1006. St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0494.
3M Company. 1987a. Microbics Microtox toxicity test (FC-126). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0511.
3M Company. 1987b. Acute toxicity of FC-126 to aquatic invertebrates (Daphnia magna). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0512.
3M Company. 1987c. Acute toxicity of FC-126 to fish (fathead minnow). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, US Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0513.
3M Company. 1990a. Activated sludge respiration inhibition (FX-1003). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0514.
3M Company. 1990b. Microbics Microtox toxicity test (FX-1003). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0515.
3M Company. 1995. Technical report summary on assessment of the bioaccumulative properties of ammonium perfluorooctanoate: static fish test. St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0496.
3M Company. 1996a. Microbics Microtox toxicity test (FC-1015X). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0523.
3M Company. 1996b. Microbics Microtox toxicity test (FC-118). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0522.
3M Company. 1996c. Microbics Microtox toxicity test (FC-143). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0521.
3M Company. 1996d. Activated sludge respiration inhibition test (FC-1015X). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0524.
Abbott, B.D., Wolf, C.J., Schmid, J.E., Das, K.P., Zehr, R.D., Helfant, L., Nakayama, S., Lindstrom, A.B., Strynar, M.J., Lau, C.S. 2007. Perfluorooctanoic acid (PFOA)-induced developmental toxicity in the mouse is dependent on expression of peroxisome proliferator activated receptor-alpha (PPARα). Toxicol. Sci. 98(2):571-581.
Ahrens, L., Barber, J.L., Xie, Z., Ebinghaus, R. 2009. Longitudinal and latitudinal distribution of perfluoroalkyl compounds in the surface water of the Atlantic Ocean. Environ. Sci. Technol. 43(9):3122-3127.
Ahrens, L., Shoeib, M., Cheng, C., Lee, S.-C., Harner, T. 2010a. Wastewater Treatment Plant and Landfill Inputs of Polyfluoroalkyl Compounds and Siloxanes to the Atmosphere. Présentation dans le cadre de PFAA Day III: Recent Advances in Perfluoroalkyl Acid (PFAA) Research, tenu par l’Environmental Protection Agency des États-Unis, du 8 au 10 juin 2010, à Research Triangle Park (NC).
Ahrens, L., Xie, Z., Ebinghaus, R. 2010b. Distribution of perfluoroalkyl compounds in seawater from northern Europe, Atlantic Ocean and Southern Ocean. Chemosphere 78:1011-1016.
Alexander, B.H., Olsen, G.W., Burris, J.M., Mandel, J.H., Mandel, J.S. 2003. Mortality of employees of a perfluorooctanesulphonyl fluoride manufacturing facility. Occup. Environ. Med. 60(10):722-729.
Apelberg, B.J., Goldman, L.R., Calafat, A.M., Herbstman, J.B., Kuklenyik, Z., Heidler, J., Needham, L.L., Halden, R.U., Witter, F.R. 2007a. Determinants of fetal exposure to polyfluoroalkyl compounds in Baltimore, Maryland. Environ. Sci. Technol.41(11):3891-3897.
Apelberg, B.J., Witter, F.R., Herbstman, J.B., Calafat, A.M., Halden, R.U., Needham, L.L., Goldman, L.R. 2007b. Cord serum concentrations of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in relation to weight and size at birth. Environ. Health Perspect. 115(11):1670-1676.
Armitage, J., Cousins, I.T., Buck, R.C., Prevedouros, K., Russell, M.H., MacLeod, M., Korzeniowski, S.H. 2006. Modelling global-scale fate and transport of perfluorooctanoate emitted from direct sources. Environ. Sci. Technol.40(22):6969-6975.
Arp, H.P.H., Niederer, C., Goss, K.-U. 2006. Predicting the partitioning behaviour of highly fluorinated compounds. Environ. Sci. Technol.40(23):7298-7304.
Bartell, S.M., Calafat, A.M., Lyu, C., Kato, K., Ryan, P.B., Steenland, K. 2010. Rate of decline in serum PFOA concentrations after granular activated carbon filtration at two public water systems in Ohio and West Virginia. Environ. Health Perspect. 118:222-228.
Barton, C.A., Kaiser, M.A., Russell, M.H. 2007. Partitioning and removal of perfluorooctanoate during rain events: the importance of physical-chemical properties. J. Environ. Monit.9:839-846.
Beach, S.A. 1995a. Inhibitory effect of L-13492 to Microbics’ Microtox toxicity analyzer system. Document présenté à l’Office of Pollution Prevention and Toxics, U.S, Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 094.
Beach, S.A. 1995b. Inhibitory effects of L-13492 on activated sludge respiration. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 095.
Beesoon, S., Webster, G.M., Shoeib, M., Harner, T., Benskin, J.P., Martin, J.W. 2011. Isomer profiles of perfluorinated compounds in matching samples of pregnant women, cord serum and house dust: sources and transplacental transfer. [Inédit, soumis en décembre 2010].
Begley, T.H., White, K., Honigfort, P., Twaroski, M.L., Neches, R., Walker, R.A. 2005. Perfluorochemicals: potential sources of and migration from food packaging. Food Addit. Contam.22(10):1023-1031.
Biegel, L.B., Liu, R.C.M., Hurtt, M.E., Cook, J.C. 1995. Effects of ammonium perfluorooctanoate on Leydig cell function: in vitro, in vivo, and ex vivo studies. Toxicol. Appl. Pharmacol. 134(1):18-25.
Biegel, L.B., Hurtt, M.E., Frame, S.R., O’Connor, J., Cook, J.C. 2001. Mechanisms of extrahepatic tumor induction by peroxisome proliferators in male CD rats. Toxicol. Sci. 60(1):44-55.
Biosearch Inc. 1976. Acute oral toxicity--rats. Rapport inédit préparé pour la Compagnie 3M, St. Paul (MN).
Bononi, M., Tateo, F. 2007. Identification of perfluorooctanoic acid release from commercial coated cooking pans by liquid chromatography coupled to electrospray ionization tandem mass spectrometry. Am. J. Agric. Biol. Sci. 2(3):191-194.
Boobis, A.R., Cohen, S.M., Dellarco, V., McGregor, D., Meek, M.E., Vickers, C., Willcocks, D., Farland, W. 2006. IPCS framework for analyzing the relevance of a cancer mode of action for humans. Crit. Rev. Toxicol. 36(10):781-792.
Bossi, R., Riget, F.F., Dietz, R., Sonne, C., Fauser, P., Dam, M., Vorkamp, K. 2005. Preliminary screening of perfluorooctane sulfonate (PFOS) and other fluorochemicals in fish, birds, and marine mammals from Greenland and the Faroe Islands. Environ. Pollut. 136(2):323-329.
Boudreau, T.M. 2002. Toxicological evaluation of perfluorinated organic acids to selected freshwater primary and secondary trophic levels under laboratory and semi-natural field conditions [thèse de maîtrise]. Guelph (Ont.) : Université de Guelph, Département de biologie environnementale.
Boulanger, B., Vargo, J., Schnoor, J.L., Hornbuckle, K.C. 2004. Detection of perfluorooctane surfactants in Great Lakes water. Environ. Sci. Technol. 38(15):4064-4070.
Boulanger, B., Peck, A.M., Schnoor, J.L., Hornbuckle, K.C. 2005. Mass budget of perfluorooctane surfactants in Lake Ontario. Environ. Sci. Technol.39(1):74-79.
Bradley, E.L., Read, W.A., Church, L. 2007. Investigation into the migration potential of coating materials from cookware products. Food Addit. Contam. 24(3):326-335.
Brede, E., Wilhelm, M., Göen, T., Müller, J., Rauchfuss, K., Kraft, M., Hölzer, J. 2010. Two year follow-up biomonitoring pilot study of residents’ and controls’ PFC plasma levels after PFOA reduction in public water system in Arnsberg, Germany. Int. J. Hyg. Environ. Health213:217-223.
Burns, D.C., Ellis, D.A., Li, H., McMurdo, C.J., Webster, E. 2008. Experimental pKa determination for perfluorooctanoic acid (PFOA) and the potential impact of pKa concentration dependence on laboratory-measured partitioning phenomena and environmental modeling. Environ. Sci. Technol. 42(24):9283-9288.
Burris, J.M., Lundberg, J.K., Olsen, G., Simpson, C., Mandel, J. 2002. Determination of serum half-lives of several fluorochemicals. Interim Report No. 2. St. Paul (MN) : 3M Company, Medical Department.
Butenhoff, J., Costa, G., Elcombe, C., Farrar, D., Hansen, K., Iwai, H., Jung, R., Kennedy, G. Jr, Lieder, P., Olsen, G., Thomford, P. 2002. Toxicity of ammonium perfluorooctanoate in male cynomolgus monkeys after oral dosing for 6 months. Toxicol. Sci. 69(1):244-257.
Butenhoff, J.L., Kennedy, G.L. Jr, Hinderliter, P.M., Lieder, P.H., Jung, R., Hansen, K.J., Gorman, G.S., Noker, P.E., Thomford, P.J. 2004a. Pharmacokinetics of perfluorooctanoate in cynomolgus monkeys. Toxicol. Sci. 82(2):394-406.
Butenhoff, J.L., Kennedy, G.L. Jr, Frame, S.R., O’Connor, J.C., York, R.G. 2004b. The reproductive toxicology of ammonium perfluorooctanoate (APFO) in the rat. Toxicology 196(1-2):95-116.
Butenhoff, J.L., Gaylor, D.W., Moore, J.A., Olsen, G.W., Rodricks, J., Mandel, J.H., Zobel, L.R. 2004c. Characterization of risk for general population exposure to perfluorooctanoate. Regul. Toxicol. Pharmacol. 39(3):363-380.
Butt, C., Smithwick, M. 2004. Présentation lors du Workshop on the Environmental Fate of Fluorotelomer-Based Polymers, du 12 au 14 sept. 2004, Toronto (Ont.) Parrainé par le Canadian Environmental Modelling Network, Environnement Canada et DuPont Canada.
Butt, C.M., Mabury, S.A., Muir, D.C.G., Braune, B.M. 2007a. Prevalence of long-chained perfluorinated carboxylates in seabirds from the Canadian Arctic between 1975 and 2004. Environ. Sci. Technol. 41(10):3521-3528.
Butt, C.M., Muir, D.C.G., Stirling, I., Kwan, M., Mabury, S.A. 2007b. Rapid response of Arctic ringed seals to changes in perfluoroalkyl production. Environ. Sci. Technol.41(1):42-49.
Butt, C.M., Mabury, S.A., Kwan, M., Wang, X., Muir, D.C.G. 2008. Spatial trends of perfluoroalkyl compounds in ringed seals (Phoca hispida) from the Canadian Arctic. Environ. Toxicol. Chem. 27(3):542-553.
Butt, C.M., Muir, D.C.G., Mabury, S.A. 2010a. Elucidating the pathways of poly- and perfluorinated acid formation in rainbow trout. Environ. Sci. Technol. 44(13):4973-4980.
Butt, C.M., Muir, D.C.G., Mabury, S.A. 2010b. Biotransformation of the 8:2 fluorotelomer acrylate in rainbow trout. 1. in vivo dietary exposure. Environ. Toxicol. Chem.29(12):2726-2735.
Calafat, A.M., Wong, L.-Y., Kuklenyik, Z., Reidy, J.A., Needham, L.L. 2007. Polyfluoroalkyl chemicals in the U.S. population: data from the National Health and Nutrition Examination Survey (NHANES) 2003-2004 and comparisons to NHANES 1999-2000. Environ. Health Perspect. 115(11):1596-1602.
Caliebe, C., Gerwinski, W., Hühnerfuss, H., Theobald, N. 2004. Occurrence of perfluorinated organic acids in the water of the North Sea. Organohalogen Compd 66:4074-4078.
Canada. 1995a. Politique de gestion des substances toxiques. Ottawa (Ont.) : sa Majesté la Reine du chef du Canada (Environnement Canada). [réimpression en 2004]. Document disponible sur demande.
Canada. 1995b. Politique de gestion des substances toxiques : critères de persistance et de bioaccumulation. Ottawa (Ont.) : sa Majesté la Reine du chef du Canada (Environnement Canada). Document disponible sur demande.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33. Gazette du Canada, Partie III : vol. 22, n° 3.
Canada. 2000a. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada, Partie II : vol. 134, n° 7.
Canada. Ministère de l’Environnement. 2000b. Loi canadienne sur la protection de l’environnement (1999) :Avis concernant certaines substances perfluoroalkyliques et fluoroalkyliques ainsi que leurs dérivés et polymères. Gazette du Canada, Partie I : vol. 134, n° 24.
Canada. Ministère de l’Environnement. 2004. Loi canadienne sur la protection de l’environnement (1999) :Avis concernant certaines substances perfluoroalkyliques et fluoroalkyliques. Gazette du Canada, Partie I : vol. 139, n° 3.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique - OASIS Software]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry.
Cheng, J., Vecitis, C.D., Park, H., Mader, B.T., Hoffmann, M.R. 2008. Sonochemical degradation of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in landfill groundwater: environmental matrix effects. Environ. Sci. Technol.42(21):8057-8063.
Christopher, B., Marias, A.J. 1977. Report to 3M Company: 28-day oral toxicity study with FC-142 in albino mice. Northbrook (IL) : Industrial Bio-Test Laboratories Inc. IBT No. 8532-10655.
[CIT] Centre International de Toxicologie. 2003. Ammonium perfluorooctanoate (APFO): Daphnia magna reproduction test. Study No. 22658 ECD. Evreux (France) : CIT. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT-2003-0012-0180.
Conder, J.M., Hoke, R.A., de Wolf, W., Russell, M.H., Buck, R.C. 2008. Are PFCAs bioaccumulative? A critical review and comparison with regulatory criteria and persistent lipophilic compounds. Environ. Sci. Technol. 42(4):995-1003.
Conestoga-Rovers & Associates. 2011. Sampling for Chemicals Management Plan Challenge substances from the waste sector 2010 field sampling program. Document préparé pour Environnement Canada, Waterloo (Ont.)
Cook, J.C., Murray, S.M., Frame, S.R., Hurtt, M.E. 1992. Induction of Leydig cell adenomas by ammonium perfluorooctanoate: a possible endocrine-related mechanism. Toxicol. Appl.Pharmacol. 113(2):209-217.
Cook, J.C., Klinefelter, G.R., Hardisty, J.F., Sharpe, R.M., Foster, P.M. 1999. Rodent Leydig cell tumorigenesis: a review of the physiology, pathology, mechanisms and relevance to humans. Crit. Rev. Toxicol. 29(2):169-261.
Costa, G., Sartori, S., Consonni, D. 2009. Thirty years of medical surveillance in perfluooctanoic acid production workers. J. Occup. Environ. Med. 51(3):364-372.
Crozier, P., Furdui, V., Lucaciu, C., Stock, N., Mabury, S., Reiner, E. 2005. Detection of perfluoro-alkyl compounds (PFCs) in sewage treatment plant (STP) effluents and biosolids by liquid chromatography - tandem mass spectrometry. Toronto (Ont.) Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Dai, J., Li, M., Jin, Y., Saito, N., Xu, M., Wei, F. 2006. Perfluorooctanesulfonate and perfluorooctanoate in red panda and giant panda from China. Environ. Sci. Technol. 40(18):5647-5652.
Dekleva, L.A. 2003. Adsorption/desorption of ammonium perfluorooctanoate to soil (OCDE106). Document préparé pour E.I. du Pont de Nemours and Company et financé par PlasticsEurope (EMSER 17-03).
Del Gobbo, L., Tittlemier, S., Diamond, M., Pepper, K., Tague, B., Yeudall, F., Vanderlinden, L. 2008. Cooking decreases observed perfluorinated compound concentrations in fish. J. Agric.Food Chem. 56(16):7551-7559.
Del Vento, S., Codling, G., Ahrens, L., Ebinghuas, R., Jones, K.C., Halsall, C.J. 2009. Perfluoroalkylcompounds in the Arctic marine system: air, snow, water and sea-ice. Présentation lors de la SETAC North America, en novembre 2009, à la Nouvelle-Orléans (LA).
D’Eon, J., Mabury, S. 2007. Production of perfluorinated carboxylic acids (PFCAs) from the biotransformation of polyfluoroalkyl phosphate surfactants (PAPS): exploring routes of human contamination. Environ. Sci. Technol.41(1):4799-4805
De Silva, A.O., Mabury, S.A. 2004. Isolating isomers of perfluorocarboxylates in polar bears (Ursus maritimus) from two geographical locations. Environ. Sci. Technol. 38(24):6538-6545.
De Silva, A.O., Muir, D.C.G., Mabury, S.A. 2009. Distribution of perfluorocarboxylate isomers in select samples from the North American environment. Environ. Toxicol. Chem.28(9):1801-1814.
Dietz, R., Bossi, R., Rigét, F.F., Sonne, C., Born, E.W. 2008. Increasing perfluoroalkyl contaminants in East Greenland polar bears (Ursus maritimus): a new toxic threat to the Arctic bears. Environ. Sci. Technol. 42(7):2701-2707.
Dinglasan, M.J.A., Ye, Y., Edwards, E.A., Mabury, S.A. 2004. Fluorotelomer alcohol biodegradation yields poly- and perfluorinated acids. Environ. Sci. Technol.38(10):2857-2864.
Dinglasan, M.J.A., Ye, Y., Edwards, E.A., Mabury, S.A. 2005. Biodegradation of 8:2 telomer alcohol and 8:2 telomer acids under aerobic conditions. Toronto (Ont.) Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Dinglasan-Panlilio, M.J.A., Mabury, S. 2006. Significant residual fluorinated alcohols present in various fluorinated materials. Environ. Sci. Technol. 40(5):1447-1453.
Dreyer, A., Weinberg, I., Temme, C., Ebinghaus, R. 2009. Polyfluorinated compounds in the atmosphere of the Atlantic and Southern Oceans: evidence for a global distribution. Environ. Sci. Technol. 43(17):6507-6514
Ellington, J.J., Washington, J.W., Strynar, M.J., Evans, J.J., Jenkins, T.M., Henderson, W.M. 2005. Determination of perfluorinated chemicals (PFCs) in soils, sediments, and other matrices. Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Ellis, D.A., Mabury, S.A., Martin, J.W., Muir, D.C.G. 2001. Thermolysis of fluoropolymers as a potential source of halogenated organic acids in the environment. Nature 412:321-324.
Ellis, D.A., Martin, J.W., Muir, D.C.G., Mabury, S.A. 2003. The use of F-19 NMR and mass spectrometry for the elucidation of novel fluorinated acids and atmospheric fluoroacid precursors evolved in the thermolysis of fluoropolymers. Analyst128:756-764.
Ellis, D.A., Martin, J.W., De Silva, A.O., Mabury, S.A., Hurley, M.D., Andersen, M.P.S., Wallington, T.J. 2004a. Degradation of fluorotelomer alcohols: a likely atmospheric source of perfluorocarboxylic acids. Environ. Sci. Technol. 38(12):3316-3321.
Ellis, D.A., Mabury, S.A., Martin, J., Stock, N. 2004b. Environmental review of perfluorooctanoic acid (PFOA) and its salts. Document préparé en vertu d’un contrat pour Environnement Canada, Gatineau (Qc).
Elnabarawy, M.T. 1980. Aquatic toxicity testing: FC-143 (Lot-37) L.R. 5626S. Report No. 037. Document préparé pour l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0504.
Elnabarawy, M.T. 1981. Multi-phase exposure/recovery algal assay test method. Report No. 006. Document préparé pour l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0506.
Emmett, E.A., Shofer, F.S., Zhang, H., Freeman, D., Desai, C., Shaw, L.M. 2006a. Community exposure to perfluorooctanoate: relationships between serum concentrations and exposure sources. J. Occup. Environ. Med. 48(8):759-770.
Emmett, E.A., Zhang, H., Shofer, F.S., Freeman, D., Rodway, N.V., Desai, C., Shaw, L.M. 2006b. Community exposure to perfluorooctanoate: relationships between serum concentrations and certain health parameters. J. Occup. Environ. Med. 48(8):771-779.
Environnement Canada. 2001. Primary report on PFAs from section 71 survey. Préparé par la Section de l’utilisation des produits, Division du contrôle des produits chimiques, Direction de l’évaluation des produits chimiques commerciaux, Environnement Canada, Gatineau (Qc).
Environnement Canada. 2005. Report on PFCAs from Section 71 survey. Préparé par Environnement Canada, Gatineau (Qc).
[EPE] Entente sur la performance environnementale. 2009. Projet d’entente sur la performance environnementale (« Entente ») concernant la présence d’acides perfluorocarboxyliques (APFC) et de leurs précurseurs dans les produits chimiques perfluorés vendus au Canada entre Sa Majesté le Reine du chef du Canada, représentée par le ministre de l’Environnement et le ministre de la Santé, et les fabricants et importateurs participants de produits chimiques perfluorés tels qu’ils sont énumérés à l’annexe 1 (les « entreprises participantes »).
Eriksen, K.T., SØrensen, M., McLaughlin, J.K., Lipworth, L., TjØnneland, A., Overvad, K., Raaschou-Nielsen, O. 2009. Perfluorooctanoate and perfluorooctanesulfonate plasma levels and risk of cancer in the general Danish population. J. Natl Cancer Inst. 101(8):605-9.
Fei, C., McLaughlin, J.K., Tarone, R.E., Olsen, J. 2007. Perfluorinated chemicals and fetal growth: a study within the Danish National Birth Cohort. Environ. Health Perspect. 115(11):1677-1682.
Fei, C., McLaughlin, J.K., Lipworth, L., Olsen, J. 2008a. Prenatal exposure to perfluorooctanoate (PFOA) and perfluorooctanesulfonate (PFOS) and maternally reported developmental milestones in infancy. Environ. Health Perspect. 116(10):1391-1395.
Fei, C., McLaughlin, J.K., Tarone, R.E., Olsen, J. 2008b. Fetal growth indicators and perfluorinated chemicals: a study in the Danish National Birth Cohort. Am. J. Epidemiol.168(1):66-72.
Fei, C., McLaughlin, J.K., Lipworth, L., Olsen, J. 2009. Maternal levels of perfluorinated chemicals and subfecundity. Hum. Reprod. 24(5):1200-1205.
Flanary, J.R., Reiner, J.L., Helke, K.L., Kucklick, J.R., Gulland, F.M.D., Becker, P.R. 2010. Measurements of perfluorinated compounds in plasma of northern fur seals (Callorhinus ursinus) and a preliminary assessment of their relationship to peroxisome proliferation and blood chemistry parameters. Présentation dans le cadre de PFAA Day III: Recent Advances in Perfluoroalkyl Acid (PFAA) Research, tenu par l’Environmental Protection Agency des États-Unis, du 8 au 10 juin 2010, à Research Triangle Park (NC).
Franklin, J. 2002. Screening assessment for the potential for long-range atmospheric transport of perfluorooctanoic acid. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT-2003-0012-0183.
Frisbee, S.J., Shankar, A., Knox, S.S., Steenland, K., Fletcher, T., Savitz, D.A., Ducatman, A.M. 2010. The C8 Health Project: associations between perfluorooctanoic acid and perfluorooctanesulfonic acid and serum lipids in children. Arch. Pediatr. Adolesc. Med. 164(9):860-869.
Frömel, T., Knepper, T.P. 2010. Fluorotelomer ethoxylates: sources of highly fluorinated environmental contaminants, part I: biotransformation. Chemosphere 80:1387-1392.
Fromme, H., Tittlemier, S.A., Volkel, W., Wilhelm, M., Twardella, D. 2009. Perfluorinated compounds--exposure assessment for the general population in Western countries. Int. J. Hyg. Environ. Health 212(3):239-270.
Fromme, H., Mosch, C., Morovitz, M., Alba-Alejandre, I., Boehmer, S., Kiranoglu, M., Faber, F., Hannibal, I., Genzel-Boroviczény, O., Koletzko, B., Volkel, W. 2010. Pre- and postnatal exposure to perfluorinated compounds (PFCs). Environ. Sci. Technol. 44(18):7123-7129.
Furdui, V.I., Crozier, P., Reiner, E., Mabury, S.A. 2005. Direct measurement of perfluoroalkylated surfactants in the Great Lakes water samples. Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Furdui, V.I., Stock, N.L., Ellis, D.A., Butt, C.M., Whittle, D.M., Crozier, P.W., Reiner, E.J., Muir, D.C.G., Mabury, S.A. 2007. Spatial distribution of perfluoroalkyl contaminants in lake trout from the Great Lakes. Environ. Sci. Technol. 41(5):1554-1559.
Furdui, V.I., Helm, P.A., Crozier, P.W., Lucaciu, C., Reiner, E.J., Marvin, C.H., Whittle, D.M., Mabury, S.A., Tomy, G.T. 2008. Temporal trends of perfluoroalkyl compounds with isomer analysis in lake trout from Lake Ontario (1979-2004). Environ. Sci. Technol. 42(13):4739-4744.
Gewurtz. S.B., Bhavsar, S.P., Crozier, P.W., Diamond, M.L., Helm, P.A., Marvin, C.H., Reiner, E.J. 2009. Perfluoroalkyl contaminants in window film: indoor/outdoor, urban/rural, and winter/summer contamination and assessment of carpet as a possible source. Environ. Sci. Technol. 43(19):7317-7323.
Giesy, J.P., Newsted, J.L. 2001. Selected fluorochemicals in the Decatur, Alabama area. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a.
Glaza, S. 1990. Acute Oral Toxicity Study in Rats (OECD Guidelines). Étude inédite préparée par Hazleton Labs, HLA 91201739.
Glaza, S. 1995. Final Report: single-dose dermal absorption toxicity study of T-6067, T-6068, and T-6069 in rabbits. Rapport inédit rédigé par Hazleton Wisconsin, Inc., Madison (WI) pour 3M, rapport n° HWI 6329-152.
Glaza, S. 1997. Acute oral toxicity study of T-6669 in rats (OECD Guidelines). Document rédigé par Corning Hazleton Inc., Madison (WI). Project ID CHW 61001760.
Goldenthal, E.I. 1978a. Ninety day subacute rat toxicity study. Rapport rédigé par la International Research and Development Corporation, rapport n° 137-089.
Goldenthal, E.I. 1978b. Ninety day subacute rhesus monkey toxicity study. Rapport rédigé par la International Research and Development Corporation, rapport n° 137-090. Rapport sur le sérum préparé par le Central Analytical Laboratory, rapport n° 6919.
Gortner, E.G. 1981. Oral teratology study of T-2998CoC in rats. Experiment No. 0681TR0110. St. Paul (MN) : Safety Evaluation Laboratory and Riker Laboratories, Inc.
Gortner, E.G. 1982. Oral teratology study of T-3141C0C in rabbits. Experiment No. 0681TB0398. Rapport inédit préparé par Riker Laboratories, Inc., St. Paul (MN).
Goss, K.-U. 2008. The pKa values of PFOA and other highly fluorinated carboxylic acids. Environ. Sci. Technol.42(2):456-458.
Goss, K.-U., Arp, H.P.H. 2009. Comment on "Experimental pKa determination for perfluorooctanoic acid (PFOA) and the potential impact of pKa concentration dependence on laboratory-measured partitioning phenomena and environmental modeling." Environ. Sci. Technol. 43(1):5150-5151. [addenda à Arp, H.P.H., Goss, K.-U. 2009. Gas/particle partitioning behaviour of perfluorocarboxylic acids with terrestrial aerosols. Environ. Sci. Technol. 43:8542-8547.]
Gouvernement des États-Unis. 2003. Perfluorooctanoic acid (PFOA), fluorinated telomers; request for comment, solicitation of interested parties for enforceable consent agreement development, and notice of public meeting. Federal Register68(73):18626-18633.
Griffith, F.D., Long, J.E. 1980. Animal toxicity studies with ammonium perfluorooctanoate. Am. Ind. Hyg. Assoc. J. 41:576-583.
Gulkowska, A., Falandysz, J., Taniyasu, S., Bochentin, I., So, M.K., Yamashita, N. 2005. Perfluorinated chemicals in blood of fish and waterfowl from Gulf of Gdansk, Baltic Sea. Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Hagen, D.F., Belisle, J., Johnson, J.D., Venkateswarlu, P. 1981. Characterization of fluorinated metabolites by a gas chromatographic-helium microwave plasma detector--the biotransformation of 1h,1h,2h,2h-perfluorodecanol to perfluorooctanoate. Anal. Biochem. 118(2):336-343.
Hamm, M.P., Cherry, N.M., Chan, E., Martin, J.W., Burstyn, I. 2009. Maternal exposure to perfluorinated acids and fetal growth. Expo. Sci. Environ. Epidemiol.20(7):589-97.
Han, X., Snow, T.A., Kemper, R.A., Jepson, G.W. 2003. Binding of perfluorooctanoic acid to rat and human plasma proteins. Chem. Res. Toxicol. 16(6):775-781.
Han, X., Hinderliter, P.M., Snow, T.A., Jepson, G.W. 2004. Binding of perfluorooctanoic acid to rat liver-form and kidney-form α-globulins. Drug Chem. Toxicol. 27(4):341-360.
Han, X., Kemper, R.A., Jepson, G.W. 2005. Subcellular distribution and protein binding of perfluorooctanoic acid in rat liver and kidney. Drug Chem. Toxicol. 28(2):197-209.
Hanson, M.L., Sibley, P.K., Boudreau, T.M., Small, J., Brain, R.A., Mabury, S.M., Solomon, K.R. 2005. Microcosm evaluation of the toxicity and risk to aquatic macrophytes from perfluorooctanoic acid (PFOA) and perfluorooctane sulfonic acid (PFOS). Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Haskell Laboratory. 1969. Acute inhalation dust toxicity. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 160-69.
Haskell Laboratory. 1979a. Inhalation subacute. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 253-79.
Haskell Laboratory. 1979b. Skin absorption LD50 rabbit and rat. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 659-79.
Haskell Laboratory. 1980. Rat skin absorption subacute study with FC-143. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 589-80.
Haskell Laboratory. 1981a. Subacute inhalation toxicity of pentadecafluorooctanoic acid, ammonium salt. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 205-81.
Haskell Laboratory. 1981b. Oral LD50 test in rats. Newark (DE) : DuPont, Haskell Laboratory. N° du rapport : 295-81.
Hatfield, T. 2001. Screening studies on the aqueous photolytic degradation of perfluorooctanoic acid (PFOA). Lab Request No. E00-2192. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a.
Hatfield, T., Lange, C., Radford, P. 2002. Proposed photolysis and radical propagation scheme for sulphonamides of primary amines. Communication personnelle entre 3M et D. Ellis, Université de Toronto, le 11 novembre 2002, Toronto (Ont.)
Henwood, S. 1997. 5 daily dose oral toxicity study with T-6669 in rats. Madison (WI) : Corning Hazleton Inc. Project ID CHW 6329-197.
Higgins, C.P., Luthy, R.G. 2006. Sorption of perfluorinated surfactants on sediments. Environ. Sci. Technol.40:7251-7256.
Hines, E.P., White, S.S., Stanko, J.P., Gibbs-Flournoy, E.A., Lau, C., Fenton, S.E. 2009. Phenotypic dichotomy following developmental exposure to perfluorooctanoic acid (PFOA) in female CD-1 mice: Low doses induce elevated serum leptin and insulin, and overweight in mid-life. Mol. Cell. Endocrinol.304(1-2):97-105.
Holmström, K.E., Berger, U. 2008. Tissue distribution of perfluorinated surfactants in common guillemot (Uria aalge) from the Baltic Sea. Environ. Sci. Technol.42(16):5879-5884.
Holmström, K.E., Järnberg, U., Bignert, A. 2005. Temporal trends of PFOS and PFOA in guillemot eggs from the Baltic Sea, 1968-2003. Environ. Sci. Technol. 39(1):80-84.
Holmström, K.E., Johansson, A.-K., Bignert, A., Lindberg, P., Berger, U. 2010. Temporal trends of perfluorinated surfactants in Swedish peregrine falcon eggs (Falco peregrinus) 1974-2007. Environ. Sci. Technol. 44(11):4083-4088.
Hori, H., Hayakawa, E., Einaga, H., Kutsuna, S., Koike, K., Ibusuki, T., Kiatagawa, H., Arakawa, R. 2004. Decomposition of environmentally persistent perfluorooctanoic acid in water by photochemical approaches. Environ. Sci. Technol. 38(22):6118-6124.
Hori, H., Yamamoto, A., Hayakawa, E., Taniyasu, S., Yamashita, N., Kutsuna, S. 2005. Efficient decomposition of environmentally persistent perfluorocarboxylic acids by use of persulfate as a photochemical oxidant. Environ. Sci. Technol. 39(7):2383-2388.
Hori, H., Nagaoka, Y., Murayama, M., Kutsuna, S. 2008. Efficient decomposition of perfluorocarboxylic acids and alternative fluorochemical surfactants in hot water. Environ. Sci. Technol. 42(19):7238-7443.
Houde, M., Wells, R.S., Fair, P.A., Bossart, G.D., Hohn, A.A., Rowles, T.K., Sweeney, J.C., Solomon, K.R., Muir, D.C.G. 2005. Polyfluoroalkyl compounds in free-ranging bottlenose dolphins (Tursiops truncatus) from the Gulf of Mexico and the Atlantic Ocean. Environ. Sci. Technol.39(17):6591-6598.
Houde, M., Balmer, B.C., Brandsma, S., Wells, R.S., Rowles, T.K., Solomon, K.R., Muir, D.C.G. 2006. Perfluoroalkyl compounds in relation to life-history and reproductive parameters in bottlenose dolphins (Tursiops truncatus) from Sarasota Bay , Florida, USA. Environ. Toxicol. Chem. 25(9):2405-2412.
Hundley, S.G., Sarrif, A.M., Kennedy, G.L. Jr. 2006. Absorption, distribution, and excretion of ammonium perfluorooctanoate (APFO) after oral administration to various species. Drug Chem. Toxicol. 29(2):137-145.
Hurley, M.D., Andersen, M.P.S., Wallington, T.J., Ellis, D.A., Martin, J.W., Mabury, S.A. 2004. Atmospheric chemistry of perfluorinated carboxylic acids: reaction with OH radicals and atmospheric lifetimes. J. Phys. Chem. A108(4):615-620.
Ikonomou, M. 2006. Determination of perfluorinated compounds in biosolids, sediment, and leachate by ESI-LCMS/MS. Document préparé en vertu d’un contrat pour Environnement Canada, le 9 juin 2006.
[IRDC] International Research and Development Corporation. 1978. Acute oral toxicity (LD50) study in rats. Mattawan (MI) : IRDC. Rapport n° 137-091.
Ishibashi, H., Iwata, H., Kim, E.-Y., Tao, L., Kannan, K., Amano, M., Miyazaki, N., Tanabe, S., Batoev, V.B., Petrov, E. 2008a. Contamination and effects of perfluorochemicals in Baikal seal (Pusa sibirica). 1. Residue level, tissue distribution, and temporal trend. Environ. Sci. Technol. 42(7):2295-2301.
Ishibashi, H., Iwata, H., Kim, E.-Y., Tao, L., Kannan, K., Tanabe, S., Batoev, V.B., Petrov, E.A. 2008b. Contamination and effects of perfluorochemicals in Baikal seal (Pusa sibirica). 2. Molecular characterization, expression level, and transcriptional activation of peroxisome proliferator-activated receptor α. Environ. Sci. Technol. 42(7):2302-2308.
Jasinski, M., Ellis, D.A., Webster, E., McMurdo, C., Burns, D. 2009. The development of a 19F NMR technique for the simultaneous determination of the Kow and pKaof perfluorooctanoic acid (PFOA). Présentation lors de la 30e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) North America, du 19 au 23 novembre 2009, à la Nouvelle-Orléans (LA).
Jeon, J., Kannan, K., Lim, H.K., Moon, H.B., Ra, J.S., Kim, S.D. 2010a. Bioaccumulation of perfluorochemicals in Pacific oyster under different salinity gradients. Environ. Sci. Technol.44(7):2695-2701.
Jeon, J., Kannan, K., Lim, H.K., Moon, H.B., Kim, S.D. 2010b. Bioconcentration of perfluorinated compounds in blackrock fish, Sebastes schlegeli, at different salinity levels. Environ. Toxicol. Chem. 29(11):2529-2535.
Joensen, U.N., Bossi, R., Leffers, H., Jensen, A.A., Skakkebaek, N.E., Jorgensen, N. 2009. Do perfluoroalkyl compounds impair human semen quality? Environ. Health Perspect. 117(6):923-7.
Ju, X., Jin, Y., Sasaki, K., Saito, N. 2008. Perfluorinated surfactants in surface, subsurface water and microlayer from Dalian coastal waters in China. Environ. Sci. Technol.42(10):3538-3542.
Kallenborn, K., Berger, U., Järnberg, U. 2004. Perfluorinated alkylated substances (PFAS) in the Nordic environment. Copenhague (Danemark) : Conseil des ministres des pays nordiques.
Kannan, K., Corsolini, S., Falandysz, J., Oehme, G., Focardi, S., Giesy, J.P. 2002. Perfluorooctanesulfonate and related fluorinated hydrocarbons in marine mammals, fishes, and birds from coasts of the Baltic and the Mediterranean seas. Environ. Sci. Technol. 36(15):3210-3216.
Kannan, K., Tao, L., Pastva, S., Giesy, J.P. 2005a. Perfluorinated compounds in aquatic organisms at various trophic levels in a Great Lakes food chain. Arch. Environ. Contam. Toxicol. 48(4):559-566.
Kannan, K., Yun, S.H., Evans, T. 2005b. Chlorinated, brominated and perfluorinated contaminants in livers of polar bears from Alaska. Environ. Sci. Technol. 39(23):9057-9063.
Kannan, K., Perotta, E., Thomas, N.J. 2006. Association between perfluorinated compounds and pathological conditions in southern sea otters. Environ. Sci. Technol. 40:4943-4948.
Kato, K., Calafat, A.M., Wong, L.Y., Wanigatunga, A.A., Caudill, S.P., Needham, L.L. 2009. Polyfluoroalkyl compounds in pooled sera from children participating in the National Health and Nutrition Examination Survey 2001-2002. Environ. Sci. Technol. 43(7):2641-2647.
Kawashima, Y., Uy-Yu, N., Kozuka, H. 1989. Sex-related difference in the inductions by perfluoro-octanoic acid of peroxisomal beta-oxidation, microsomal 1-acylglycerophosphocholine acyltransferase and cytosolic long-chain acyl-CoA hydrolase in rat liver. Biochem. J. 261(2):595-600.
Keller, J.M., Kannan, K., Taniyasu, S., Yamashita, N., Day, R.D., Arendt, M.D., Segars, A.L., Kucklick, J.R. 2005. Perfluorinated compounds in the plasma of loggerhead and Kemp’s Ridley sea turtles from the southeastern coast of the United States. Environ. Sci. Technol. 39(23):9101-9108.
Kelly, B.C., Gobas, F.A.P.C., McLachlan, M.S. 2004. Intestinal absorption and biomagnification of organic contaminants in fish, wildlife and humans. Environ. Toxicol. Chem.23(10):2324-2336.
Kelly, B.C., Ikonomou, M.G., Blair, J.D., Surridge, B., Hoover, D., Grace, R., Gobas, F.A.P. 2009. Perfluoroalkyl contaminants in an Arctic marine food web: trophic magnification and wildlife exposure. Environ. Sci. Technol. 43(11):4037-4043.
Kennedy, G.L. Jr. 1976. Reverse mutation studies with T-1485 in five Salmonella strains and one Saccharomycesstrain. Northbrook (IL) : Industrial Bio-Test Laboratories Inc. Rapport n° 8540-09238.
Kennedy, G.L. Jr. 1985. Dermal toxicity of ammonium perfluorooctanoate. Toxicol. Appl. Pharmacol.81(2):348-355.
Kennedy, G.L. Jr. 1987. Increase in mouse liver weight following feeding of ammonium perfluorooctanoate and related fluorochemicals. Toxicol. Lett. 39(2-3):295-300.
Kennedy, G.L. Jr, Hall, G.T., Brittelli, M.R., Barnes, J.R., Chen, H.C. 1986. Inhalation toxicity of ammonium perfluorooctanoate. Food Chem. Toxicol. 24(12):1325-1329.
Kennedy, G.L. Jr, Butenhoff, J.L., Olsen, G.W., O’Connor, J.C., Seacat, A.M., Perkins, R.G., Biegel, L.B., Murphy, S.R., Farrar, D.G. 2004. The toxicology of perfluorooctanoate. Crit. Rev. Toxicol. 34(4):351-384.
Kim, K.-T., Ryu, T., Cho, J.-G., Joung, K.-E., Park, S., Choi, K., Han, J. 2009. The effects of perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) on acute toxicity, reproduction and embryo development in Daphnia magna. Présentation lors de la SETAC North America, en novembre 2009, à la Nouvelle-Orléans (LA).
Kissa, E. 1994. Fluorinated surfactants: synthesis, properties, applications. New York (NY) : Marcel Dekker, Inc.
Klaunig, J.E., Babich, M.A., Baetcke, K.P., Cook, J.C., Corton, J.C., David, R.M., DeLuca, J.G., Lai, D.Y., McKee, R.H., Peters, J.M., Roberts, R.A., Fenner-Crisp P.A. 2003. PPARαagonist-induced rodent tumours: modes of action and human relevance. Crit. Rev. Toxicol. 33(6):655-780.
Knudsen, L.B., Borgå, K., JØrgensen, E.H., van Bavel, B., Schlabach, M., Verreault, J., Gabrielsen, G.W. 2007. Halogenated organic contaminants and mercury in northern fulmars (Fulmarus glacialis): levels, relationships to dietary descriptors and blood to liver comparison. Environ. Pollut. 146(1):25-33.
Kojo, A., Hanhijärvi, H., Ylinen, M., Kosma, V.-M. 1986. Toxicity and kinetics of perfluoro-octanoic acid in the Wistar rat. Arch. Toxicol. Suppl. 9:465-468.
Kubwabo, C., Vais, N., Benoit, F.M. 2004. A pilot study on the determination of perfluorooctanesulfonate and other perfluorinated compounds in blood of Canadians. J. Environ. Monit.6(6):540-545.
Kubwabo, C., Stewart, B., Zhu, J., Marro, L. 2005. Occurrence of perfluorosulfonates and other perfluorochemicals in dust from selected homes in the city of Ottawa, Canada. J. Environ. Monit. 7(11):1074-1078.
Kudo, N., Kawashima, Y. 2003. Toxicity and toxicokinetics of perfluorooctanoic acid in humans and animals. J. Toxicol. Sci. 28(2):49-57.
Kudo, N., Mizuguchi, H., Yamamoto, A., Kawashima, Y. 1999. Alterations by perfluorooctanoic acid of glycerolipid metabolism in rat liver. Chem. Biol. Interact. 118(1):69-83.
Kudo, N., Sakai, A., Mitsumoto, A., Hibino, Y., Tsuda, T., Kawashima, Y. 2007. Tissue distribution and hepatic subcellular distribution of perfluorooctanoic acid at low dose are different from those at high dose in rats. Biol. Pharm. Bull.30(8):1535-1540.
Kurume Laboratory. 2001. Bioaccumulation test of perfluoroalkylcarboxylic acid (C=7-13) [this test is performed using perfluorooctanoic acid (Test substance number K-1519)] in carp. Test No. 51519. Chemicals Evaluation and Research Institute. [cité dans US EPA, 2002].
Kwadijk, C.J.A.F., Korytar, P., Koelmans, A.A. 2010. Distribution of perfluorinated compounds in aquatic systems in The Netherlands. Environ. Sci. Technol. 44(10):3746-3751.
Lau, C., Thibodeaux, J.R., Hanson, R.G., Narotsky, M.G., Rogers, J.M., Lindstrom, A.B., Strynar, M.J. 2006. Effects of perfluorooctanoic acid exposure during pregnancy in the mouse. Toxicol. Sci. 90(2):510-518.
Lawlor, T.E. 1995. Mutagenicity test with T-6342 in the Salmonella-Escherichia coli/mammalian-microsome reverse mutation assay. Study No. 17073-0-409. Vienna (VA) : Corning Hazleton.
Lawlor, T.E. 1996. Mutagenicity test with T-6564 in the Salmonella-Escherichia coli/mammalian-microsome reverse mutation assay with a confirmatory assay. Study No. 17750-0-409R. Vienna (VA) : Corning Hazleton.
Lee, H., D’Eon, J., Mabury, S.A. 2010. Biodegradation of polyfluoroalkyl phosphates as a source of perfluorinated acids to the environment. Environ. Sci. Technol.44(9):3305-3310.
Leonard, R.C., Kreckmann, K.H., Sakr, C.J., Symons, J.M. 2008. Retrospective cohort mortality study of workers in a polymer production plant including a reference population of regional workers. Ann. Epidemiol. 18(1):15-22.
Leonel, J., Kannan, K., Tao, L., Fillmann, G., Montone, R.C. 2008. A baseline study of perfluorochemicals in Franciscana dolphins and Subantarctic fur seal from coastal waters of southern Brazil. Mar. Pollut. Bull. 56(4):778-781.
Li, M.-H. 2008. Short communication: Toxicity of perfluorooctane sulfonate and perfluorooctanoic acid to plants and aquatic invertebrates. Environ. Toxicol. 24:95-101.
Li, X., Yeung, L.W.Y., Taniyasu, S., Lam, P.K.S., Yamashita, N., Xu, M., Dai, J. 2008a. Accumulation of perfluorinated compounds in captive Bengal tigers (Panthera tigris tigris) and African lions (Panthera leo Linnaeus) in China. Chemosphere 73(10):1649-1653.
Li, X., Yeung, L.W.Y., Taniyasu, S., Li, M., Zhang, H., Liu, D., Lam, P.K.S., Yamashita, N., Dai, J. 2008b. Perfluorooctanesulfonate and related fluorochemicals in the Amur tiger (Panthera tigris altaica) from China. Environ. Sci. Technol. 42(19):7078-7083.
Lien, N.P.H., Fujii, S., Tanaka, S., Nozoe, M., Wirojanagud, W., Anton, A., Lindström, G. 2006. Perfluorinated substances in tap water of Japan and several countries and their relationship to surface water contamination. Environ. Eng. Res.43:611-618.
Lin, C.Y., Lin, L.Y., Chiang, C.K., Wang, W.J., Su, Y.N., Hung, K.Y., Chen, P.C. 2010. Investigation of the associations between low-dose serum perfluorinated chemicals and liver enzymes in U.S. adults. Am. J. Gastroenterol. 105(6):1354-1363.
Liou, J.S.-C., Szostek, B., DeRito, C.M., Madsen, E.L. 2010. Investigating the biodegradability of perfluorooctanoic acid. Chemosphere 80:176-183.
Litton Bionetics Inc. 1978. Mutagenicity evaluation of T-2015CoC in the Ames Salmonella/microsome plate test. Project No. 20838. Rapport définitif présenté à la Compagnie 3M, St. Paul (MN).
Liu, C., Du, Y., Zhou, B. 2007a. Evaluation of estrogenic activities and mechanism of action of perfluorinated chemicals determined by vitellogenin induction in primary cultured tilapia hepatocytes. Aquat. Toxicol. 85(4):267-277.
Liu, J., Lee, L.S., Nies, L.F., Nakatsu, C.H., Turcot, R.F. 2007b. Biotransformation of 8:2 fluorotelomer alcohol in soil and by soil bacteria isolates. Environ. Sci. Technol.41(23):8024-8030.
Liu, R.C., Hurtt, M.E., Cook, J.C., Biegel, L.B. 1996. Effect of the peroxisome proliferator, ammonium perfluorooctanoate (C8), on hepatic aromatase activity in adult male Crl:CD BR (CD) rats. Fundam. Appl. Toxicol. 30(2):220-228.
Liu, W., Chen, S., Quan, X., Jin, Y.-H. 2008. Toxic effect of serial perfluorosulfonic and perfluorocarboxylic acids on the membrane system of a freshwater alga measured by flow cytometry. Environ. Toxicol. Chem. 27(7):1597-1604.
Loewen, M., Halldorson, T., Wang, F., Tomy, G. 2005. Fluorotelomer carboxylic acids and PFOS in rainwater from an urban centre in Canada. Environ. Sci. Technol. 39:2944-2951.
Loewen, M., Wania, F., Wang, F., Tomy, G. 2008. Altitudinal transect of atmospheric and aqueous fluorinated organic compounds in western Canada. Environ. Sci. Technol. 42(7):2374-2379.
Löfstrand, K., Jörundsdóttir, H., Tomy, G., Svavarsson, J., Weihe, P., Nygård, T., Bergman, Å. 2008. Spatial trends of polyfluorinated compounds in guillemot (Uria aalge) eggs from north-western Europe. Chemosphere72(10):1475-1480.
Loveless, S.E., Finlay, C., Everds, N.E., Frame, S.R., Gillies, P.J., O’Connor, J.C., Powley, C.R., Kennedy, G.L. 2006. Comparative responses of rats and mice exposed to linear/branched, linear, or branched ammonium perfluorooctanoate (APFO). Toxicology220(2-3):203-217.
Lucaciu, C.M., Furdui, V.I., Crozier, P.W., Reiner, E.J., Marvin, C.H., Wania, F., Mabury, S.A. 2005. Temporal study of perfluorinated alkyl surfactants in Niagara River sediments (1980-2002). Présentation lors de la 26e assemblée annuelle de la Society for Environmental Toxicology and Chemistry (SETAC) North America, du 13 au 17 novembre 2005, à Baltimore (MD).
Lundin, J.I., Alexander, B.H., Olsen, G.W., Church, T.R. 2009. Ammonium perfluorooctanoate production and occupational mortality. Epidemiology 20(6):921-928.
MacDonald, M.M., Warne, A.L., Stock, N.L., Mabury, S.A., Solomon, K.R., Sibley, P.K. 2004. Toxicity of perfluorooctane sulfonic acid (PFOS) and perfluorooctanoic acid (PFOA) to Chironomus tentans. Environ. Toxicol. Chem. 23:2116-2123.
Macon, M.B., Villanueva, L.R., Tatum-Gibbs, K., Zehr, R.D., Strynar, M.J., Stanko, J.P., White, S.S., Helfant, L., Fenton, S.E. 2011. Prenatal perfluorooctanoic acid exposure in CD-1 mice: low dose developmental effects and internal dosimetry. Toxicol. Sci. [numéro en ligne avant parution, le 11 avril 2011, doi:10.1093/toxsci/kfr076].
MacNeil, J., Steenland, N.K., Shankar, A., Ducatman, A. 2009. A cross-sectional analysis of type II diabetes in a community with exposure to perfluorooctanoic acid (PFOA). Environ. Res.109(8):997-1003.
Maestri, L., Negri, S., Ferrari, M., Ghittori, S., Fabris, F., Danesino, P., Imbriani, M. 2006. Determination of perfluorooctanoic acid and perfluorooctanesulfonate in human tissues by liquid chromatography/single quadrupole mass spectrometry. Rapid Commun. Mass Spectrom. 20(18):2728-2734.
Martin, J.W., Muir, D.C.G., Moody, C.A., Ellis, D.A., Kwan, W.C., Solomon, K.R., Mabury, S.A. 2002. Collection of airborne fluorinated organics and analysis by gas chromatography/chemical ionization mass spectrometry. Anal. Chem. 74(3):584-590.
Martin, J.W., Mabury, S.A., Solomon, K.R., Muir, D.C.G. 2003a. Dietary accumulation of perfluorinated acids in juvenile rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 22(1):189-195.
Martin, J.W., Mabury, S.A., Solomon, K.R., Muir, D.C.G. 2003b. Bioconcentration and tissue distribution of perfluorinated acids in rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 22(1):196-204.
Martin, J.W., Smithwick, M.M., Braune, B.M., Hoekstra, P.F., Muir, D.C.G., Mabury, S.A. 2004a. Identification of long-chain perfluorinated acids in biota from the Canadian Arctic. Environ. Sci. Technol. 38(2):373-380.
Martin, J.W., Whittle, M., Muir, D.C.G., Mabury, S.A. 2004b. Perfluoroalkyl contaminants in a food web from Lake Ontario. Environ. Sci. Technol. 38(20):5379-5385.
Masunaga, S., Odaka, R. 2005. Environmental behaviour and mass balance of perfluorinated surfactants in Tokyo Bay, Japan. Présentation lors de la 26e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) North America, du 13 au 17 novembre 2005, à Baltimore (MD).
McDonald, F. 1997. 5-daily dose dermal absorption/toxicity study of T-6564 in rabbits. Madison (WI) : Corning Hazleton Inc. Project ID 6329-185.
Meek, M.E., Bucher, J.R., Cohen, S.M., Dellarco, V., Hill, R.N., Lehman-McKeeman, L.D., Longfellow, D.G., Pastoor, T., Seed, J., Patton, D.E. 2003. A framework for human relevance analysis of information on carcinogenic modes of action. Crit. Rev. Toxicol. 33(6):591-653.
Melzer, D., Rice, N., Depledge, M.H., Henley, W.E., Galloway, T.S. 2010. Association between serum perfluorooctanoic acid (PFOA) and thyroid disease in the U.S. National Health and Nutrition Examination Survey. Environ. Health Perspect.118(5):686-92.
Mekenyan, O., Dimitrov, S., Temelkov, S. 2002. PFOS metabolic pathways and metabolic distributions: generated by catabolic simulator (2001-2002). Résultats compilés et révisés par P. Robinson, Direction des substances existantes, Environnement Canada, Gatineau (Qc).
Metrick, B., Marias, A.J. 1977. Report to 3M Company: 28-day oral toxicity study with FC-143 in albino rats. Northbrook (IL) : Industrial Bio-Test Laboratories, Inc., IBT No. 8532-10654.
Monroy, R., Morrison, K., Teo, K., Atkinson, S., Kubwabo, C., Stewart, B., Foster, W.G. 2008. Serum levels of perfluoroalkyl compounds in human maternal and umbilical cord blood samples. Environ. Res. 108(1):56-62.
Moody, C.A., Field, J.A. 1999. Determination of perfluorocarboxylates in groundwater impacted by fire-fighting activity. Environ. Sci. Technol. 33(16):2800-2806.
Moody, C.A., Martin, J.W., Kwan, W.C., Muir, D.C.G., Mabury, S.C. 2002. Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into Etobicoke Creek. Environ. Sci. Technol. 36(4):545-551.
Morikawa, A., Kamei, N., Harada, K., Inoue, K., Yoshinaga, T., Saito, N., Koizumi, A. 2006. The bioconcentration factor of perfluorooctane sulfonate is significantly larger than that of perfluorooctanoate in wild turtles (Trachemys scripta elegans and Chinemys reevesii): an Ai River ecological study in Japan. Ecotoxicol. Environ. Saf. 65(1):14-21.
Moriwaki, H., Takagi, Y., Tanaka, M., Tsuruho, K., Okitsu, K., Maeda, Y. 2005. Sonochemical decomposition of perfluorooctane sulfonate and perfluorooctanoic acid. Environ. Sci. Technol. 39:3388-3392.
Muir, D., Scott, B. 2003. Overview of recent studies/results at National Water Research Institute and Université de Toronto: chemistry on perfluorinated organics. Présentation à l’interne, Environnement Canada, Gatineau (Qc).
Murakami, M., Kuroda, K., Sato, N., Fukushi, T., Takizawa, S., Takada, H. 2009. Groundwater pollution by perfluorinated surfactants in Tokyo. Environ. Sci. Technol. 43(10):3480-3486.
Murli, H. 1995. Mutagenicity test on T-6342 in an in-vivo mouse micronucleus assay. Rapport définitif 17073-0-455 daté du 14 décembre 1995. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996a. Mutagenicity test on T6358 measuring chromosomal aberrations in Chinese hamster ovary (CHO) cells. Rapport définitif 17388-0-437 daté du 25 avril 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996b. Mutagenicity test on T-6358 in an in-vivo mouse micronucleus assay. Rapport définitif 17388-0-455 daté du 14 mai 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996c. Mutagenicity test on T-6342 measuring chromosomal aberrations in Chinese hamster ovary (CHO) cells: with a confirmatory assay with multiple harvests. Rapport définitif 17073-0-437CO daté du 16 septembre 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996d. Mutagenicity test on T6564 measuring chromosomal aberrations in Chinese hamster ovary (CHO) cells: with a confirmatory assay with multiple harvests. Rapport définitif 17750-0-437CO daté du 16 septembre 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996e. Mutagenicity test on T-6564 in an in-vivo mouse micronucleus assay. Rapport définitif 17750-0-455 daté du 1er novembre 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996f. Mutagenicity test on T-6342 measuring chromosomal aberrations in human whole blood lymphocytes with a confirmatory assay with multiple harvests. Rapport définitif 17073-0-449CO daté du 1er novembre 1996. Vienna (VA) : Corning Hazleton Inc.
Myers, A.L., Crozier, P.W., Helm, P.A., Reiner, E.J., Burniston, D., Marvin, C.H., McCarry, B.E. 2009. Spatial distribution and temporal trends of perfluorinated compounds in Great Lakes sediments and surface waters. Présentation lors de la SETAC North America, en novembre 2009, à la Nouvelle-Orléans (LA).
Mylchreest, E. 2003. PFOA: lactational and placental transport pharmacokinetic study in rats. Project DuPont-13309. Rapport préparé (19/12/2003) par Haskell Laboratory pour le compte de Health and Environmental Sciences, Newark (DE). Présenté par la Compagnie 3M à la Division de l’évaluation des produits chimiques, Environnement Canada.
Nakayama, K., Iwata, H., Tao, L., Kannan, K., Imoto, M., Kim, E.-Y., Tashiro, K., Tanabe, S. 2008. Potential effects of perfluorinated compounds in common cormorants from Lake Biwa, Japan: an implication from the hepatic gene expression profiles by microarray. Environ. Toxicol. Chem. 27(11):2378-2386.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2009. Issue 1. Columbus (OH) : American Chemical Society, Chemical Abstracts Service.
Nelson, J.W., Hatch, E.E., Webster, T.F. 2010. Exposure to polyfluoroalkyl chemicals and cholesterol, body weight, and insulin resistance in the general US population. Environ.Health Perspect. 118:197-202.
Nilsson, H., Kärrman, A., Westberg, H., Rotander, A., Van Bavel, B., Lindström, G. 2010. A time trend study of significantly elevated perfluorocarboxylate levels in humans after using fluorinated ski wax. Environ. Sci. Technol.44(6):2150-2155.
Nolan, L.A., Nolan, J.M., Shofer, F.S., Rodway, N.V., Emmett, E.A. 2009a. The relationship between birth weight, gestational age and perfluorooctanoic acid (PFOA)-contaminated public drinking water. Reprod. Toxicol. 27(3-4):231-238.
Nolan, L.A., Nolan, J.M., Shofer, F.S., Rodway, N.V., Emmett, E.A. 2009b. Congenital anomalies, labor/delivery complications, maternal risk factors and their relationship with perfluorooctanoic acid (PFOA)-contaminated public drinking water. Reprod. Toxicol. [numéro en ligne avant parution, le 6 novembre 2009; doi:10.1016/j.reprotox.2009.10.012].
Nubbe, M.E., Adams, V.D., Moore, W.M. 1995. The direct and sensitized photooxidation of hexachlorocyclopentadiene. Water Res. 29(5):1287-1293.
Oakes, K.D., Sibley, P.K., Solomon, K.R., Mabury, S.A., Van Der Kraak, G.J. 2004. Impact of perfluorooctanoic acid on fathead minnow (Pimephales promelas) fatty acyl-CoA oxidase activity, circulating steroids, and reproduction in outdoor microcosms. Environ. Toxicol. Chem. 23(8):1912-1919.
O’Brien, J.M., Crump, D., Mundy, L.J., Chu, S.G., McLaren, K.K., Vongpachan, V., Letcher, R.J., Kennedy, S.W. 2009. Pipping success and liver mRNA expression in chicken embryos exposed in ovo to C8 and C11 perfluorinated carboxylic acids and C10 perfluorinated sulfonate. Toxicol. Lett. 190(2):134-139.
O’Connell, S.G., Arendt, M., Segars, A., Kimmel, T., Braun-McNeil, J., Avens, L., Schroeder, B., Ngai, L., Kucklick, J.R., Keller, J. 2010. Temporal and spatial trends of perfluorinated compounds in juvenile loggerhead sea turtles (Caretta caretta) along the East Coast of the United States. Environ. Sci. Technol. 44(13):5202-5209.
[OCDE] Organisation de coopération et developpement économiques. 2006. Results of the 2006 survey on production and use of PFOS, PFAS, PFOA, PFCA, their related substances and products/mixtures containing these substances. ENV/JM/MONO (2006) 36. Paris (France) : OCDE. Environment, Health and Safety Publications, Series on Risk Management No. 22.
Olsen, G.W., Zobel, L.R. 2007. Assessment of lipid, hepatic, and thyroid parameters with serum
perfluorooctanoate (PFOA) concentrations in fluorochemical production workers. Int. Arch. Occup. Environ. Health81:231-46.
Olsen, G.W., Gilliland, F.D., Burlew, M.M., Burris, J.M., Mandel, J.S., Mandel, J.H. 1998. An epidemiologic investigation of reproductive hormones in men with occupational exposure to perfluorooctanoic acid. J. Occup. Environ. Med.40(7):614-622.
Olsen, G.W., Burris, J.M., Burlew, M.M., Mandel, J.H. 2000. Plasma cholecystokinin and hepatic enzymes, cholesterol and lipoproteins in ammonium perfluorooctanoate production workers. Drug Chem. Toxicol. 23(4):603-620.
Olsen, G.W., Burris, J.M., Burlew, M.M., Mandel, J.H. 2003a. Epidemiologic assessment of worker serum perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) concentrations and medical surveillance examinations. J. Occup. Environ. Med.45(3):260-270.
Olsen, G.W., Hansen, K.J., Stevenson, L.A., Burris, J.M., Mandel, J.H. 2003b. Human donor liver and serum concentrations of perfluorooctanesulfonate and other perfluorochemicals. Environ. Sci. Technol. 37(5):888-891.
Olsen, G.W., Logan, P.W., Hansen, K.J., Simpson, C.A., Burris, J.M., Burlew, M.M., Vorarath, P.P., Venkateswarlu, P., Schumpert, J.C., Mandel, J.H. 2003c An occupational exposure assessment of a perfluorooctanesulfonyl fluoride production site: biomonitoring. AIHI J. (Fairfax, VA) 64(5):651-659.
Olsen, G.W., Church, T.R., Larson, E.B., vanBelle, G., Lundberg, J.K., Hansen, K.J., Burris, J.M., Mandel, J.H., Zobel, L.R. 2004a. Serum concentrations of perfluorooctanesulfonate and other fluorochemicals in an elderly population from Seattle, Washington. Chemosphere 54(11):1599-1611.
Olsen, G.W., Church, T.R., Hansen, K.J., Burris, J.M., Butenhoff, J.L., Mandel, J.H., Zobel, L.R. 2004b. Quantitative evaluation of perfluorooctanesulfonate (PFOS) and other fluorochemicals in the serum of children. J. Child Health2(1):53-76.
Olsen, G.W., Burris, J.M., Ehresman, D.J., Froehlich, J.W., Seacat, A.M., Butenhoff, J.L., Zobel, L.R. 2007. Half-life of serum elimination of perfluorooctanesulfonate, perfluorohexanesulfonate, and perfluorooctanoate in retired fluorochemical production workers. Environ. Health Perspect. 115(9):1298-1305.
Olsen, G.W., Mair, D.C., Church, T.R., Ellefson, M.E., Reagen, W.K., Boyd, T.M., Herron, R.M., Medhdizadehkashi, Z., Nobiletti, J.B., Rios, J.A., Butenhoff, J.L., Zobel, L.R. 2008. Decline in perfluorooctanesulfonate and other polyfluoroalkyl chemicals in American Red Cross adult blood donors, 2000-2006. Environ. Sci. Technol. 42(13):4989-4995.
Ostertag, S.K., Tague, B.A., Humphries, M.M., Tittlemier, S.A., Chan, H.M. 2009. Estimated dietary exposure to fluorinated compounds from traditional foods among Inuit in Nunavut, Canada. Chemosphere 75(9):1165-1172.
Pace Analytical. 1997. Ready biodegradation of FC-126(BOD/COD). 3M Company Lab Request No. E1282. Document présenté à l’Office of Pollution Prevention and Toxics, US Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0495.
Pace Analytical. 2001. The 18-day aerobic biodegradation study of perfluorooctanesulfonyl-based chemistries. Contract Analytical Project ID: CA097. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 038.
Palazzolo, M.J. 1993. Final report, 13-week dietary toxicity study with T-5180, ammonium perfluorooctanoate (CAS No. 3825-26-1) in male rats. Rapport préparé par Hazleton Wisconsin Inc. Project HWI 6329-100.
Peden-Adams, M.M., Romano, T., Rice, C.D., Hesseman, L., EuDaly, J., Muir, D., Houde, M., Bossart, G., Fair, P. 2004a. Immune function and clinical blood parameters correlate with perfluorinated alkyl acid concentrations in bottlenose dolphins. Présentation lors de la 25e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) North America, du 14 au 18 novembre 2004, à Portland (OR).
Peden-Adams, M.M., Kannan, K., EuDaly, J.G., Hessemann, L.M., Kuckluck, J.R., Arendt, M.D., Maier, P.P., Segars, A.L. 2004b. Perfluorinated alkyl acids measured in sea turtle blood correlate to modulations in plasma chemistry values and immune function measurements. Présentation lors de la 25e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) North America, du 14 au 18 novembre 2004, à Portland (OR).
Perkins, R.G., Butenhoff, J.L., Kennedy, G.L. Jr, Palazzolo MJ. 2004. 13-week dietary toxicity study of ammonium perfluorooctanoate (APFO) in male rats. Drug Chem. Toxicol.27(4):361-378.
Permadi, H., Lundgren, B., Andersson, K., Sundberg, C., DePierre, J.W. 1993. Effects of perfluoro fatty acids on peroxisome proliferation and mitochondrial size in mouse liver: dose and time factors and effect of chain length. Xenobiotica23(7):761-770.
Peters, J.M., Cheung, C., Gonzalez, F.J. 2005. Peroxisome proliferator-activated receptor-alpha and liver cancer: where do we stand? J. Mol. Med. 83(10):774-785.
Piekarz, A.M., Primbs, T., Field, J.A., Barofsky, D.F., Simonich, S. 2007. Semivolatile fluorinated organic compounds in Asian and western U.S. air masses. Environ. Sci. Technol. 41(24):8248-8255.
Poland, J.S., Mitchell, S., Rutter, A. 2001. Remediation of former military bases in the Canadian Arctic. Cold Reg. Sci. Technol. 32:93-105.
Powley, C.R., Michalczyk, M.J., Kaiser, M.A., Buxton, L.W. 2005. Determination of perfluorooctanoic acid (PFOA) extractable from the surface of commercial cookware under simulated cooking conditions by LC/MS/MS. Analyst 130(9):1299-1302.
Powley, C.R., George, S.W., Russell, M.H., Hoke, R.A., Buck, R.C. 2008. Polyfluorinated chemicals in a spatially and temporally integrated food web in the western Arctic. Chemosphere70(4):664-672.
Pozzi, A., Capdevila, J.H. 2008. PPARαLigands as Antitumorigenic and Antiangiogenic Agents. PPAR Res 2008. Article ID 906542.
Prevedouros, K., Cousins, I.T., Buck, R.C., Korzeniowski, S.H. 2006. Sources, fate, and transport of perfluorocarboxylates. Environ. Sci. Technol. 40:32-44.
Reiner, E.A. 1978. Fate of fluorochemicals in the environment. Project No. 9970612613. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0489.
Riddell, N., Arsenault, G., Benskin, J.P., Chittim, B., Martin, J.W., McAlees, A., McCrindle, R. 2009. Branched perfluorooctane sulfonate isomer quantification and characterization in blood serum samples by HPLC/ESI-MS (/MS). Environ. Sci. Technol.43:7902-7908.
Riker Laboratories Inc. 1979. Repeat application 28 day percutaneous absorption study with T-2618CoC in albino rabbits, Experiment No. 09790AB0485. St. Paul (MN) : Riker Laboratories Inc.
Rosen, M.B., Abbott, B.D., Wolf, D.C., Corton, J.C., Wood, C.R., Schmid, J.E., Das, K.P., Zehr, R.D., Blair, E.T., Lau, C. 2008a. Gene profiling in the livers of wild-type and PPARα-null mice exposed to perfluorooctanoic acid. Toxicol. Pathol.36(4):592-607.
Rosen, M.B., Lee, J.S., Ren, H., Vallanat, B., Liu, J., Waalkes, M.P., Abbott, B.D., Lau, C., Corton, J.C. 2008b. Toxicogenomic dissection of the perfluorooctanoic acid transcript profile in mouse liver: evidence for the involvement of nuclear receptors PPAR alpha and CAR. Toxicol. Sci. 103(1):46-56.
Sakr, C.J., Kreckmann, K.H., Green, J.W., Gillies, P.J., Reynolds, J.L., Leonard, R.C. 2007a. Cross-sectional study of lipids and liver enzymes related to a serum biomarker of exposure (ammonium perfluorooctanoate or APFO) as part of a general health survey in a cohort of occupationally exposed workers. J. Occup. Environ. Med. 49(10):1086-1096.
Sakr, C.J., Leonard, R.C., Kreckmann, K.H., Slade, M.D., Cullen, M.R. 2007b. Longitudinal study of serum lipids and liver enzymes in workers with occupational exposure to ammonium perfluorooctanoate. J. Occup. Environ. Med. 49(8):872-879.
Sanderson, H., Boudreau, T.M., Mabury, S.A., Solomon, K.R. 2003. Impact of perfluorooctanoic acid on the structure of the zooplankton community in indoor microcosms. Aquat. Toxicol. 62(3):227-234.
Sanderson, H., Boudreau, T.M., Mabury, S.A., Solomon, K.R. 2004. Effects of perfluorooctane sulfonate and perfluorooctanoic acid on the zooplanktonic community. Ecotoxicol. Environ. Saf. 58(1):68-76.
Santé Canada. 1994. Loi canadienne sur la protection de l’environnement : L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Ottawa (Ont.) : Ministre des Approvisionnements et Services Canada.
Santé Canada. 2010. Rapport sur la biosurveillance humaine des substances chimiques de l’environnement au Canada. Ottawa (Ont.) : ministre de la Santé. ISBN : 978-1-100-94440-1.
Schenker, U., Scheringer, M., MacLeod, M., Martin, J.W., Cousins, I.T., Hungerbühler, K. 2008. Contribution of volatile precursor substances to the flux of perfluorooctanoate to the Arctic. Environ. Sci. Technol. 42:3710-3716.
Schultz, M.M., Barofsky, D.F., Field, J.A. 2004. Quantitative determination of fluorotelomer sulfonates in groundwater by LC MS/MS. Environ. Sci. Technol. 38(6):1828-1835.
Scott, B.F., Spencer, C., Moody, C.A., Martin, J.W., Mabury, S.A., Mactavish, D., Muir, D.C.G. 2003. Determination of perfluoroalkanoic acids in the aquatic environment. Présentation lors de la 23e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) Europe, du 27 avril au 1er mai 2003, à Hambourg (Allemagne).
Scott, B.F., Spencer, C., Mabury, S.A., Muir, D.C.G. 2006a. Poly and perfluorinated carboxylates in North American precipitation. Environ. Sci. Technol. 40(23):7167-7174.
Scott, B.F., Moody, C.A., Spencer, C., Small, J.M., Muir, D.C.G., Mabury, S.A. 2006b. Analysis of perfluorocarboxylic acids/anions in surface waters and precipitation using GC-MS and analysis of PFOA from large-volume samples. Environ. Sci. Technol. 40:6405-6410.
Scott, B.F., Spencer, C., Lopez, E., Muir, D.C.G. 2009. Perfluorinated alkyl acid concentrations in Canadian rivers and creeks. Water Qual. Res. J. Can. 44(3):263-277.
Scrano, L., Bufo, S.A., Perucci, P., Meallier, P., Mansour, M. 1999. Photolysis and hydrolysis of rimsulfuron. Pestic. Sci. 55:955-961.
Shoeib, M., Harner, T., Wilford, B.H., Jones, K.C., Zhu, J. 2005. Polyfluorinated compounds in the home: levels in air and dust and human exposure. Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, les 19 et 20 août 2005 à Toronto (Ont.). Fluoros Abstract Book.
Shoeib, M., Harner, T., Vlahos, P. 2006. Perfluorinated chemicals in the Arctic atmosphere. Environ. Sci. Technol. 40(24):7577-7583.
Shoeib, M., Harner, T., Webster, G.M., Lee, S.C. 2011. Indoor sources of poly- and perfluorinated compounds (PFCs) in Vancouver, Canada: implications for human exposure. Environ. Sci. Technol. 45(19):7999-8005.
Sibinski, L.J. 1987. Two-year oral (diet) toxicity/carcinogenicity study of fluorochemical FC-143 in rats. Riker Experiment No. 0281CR0012. Vol 1-4. St. Paul (MN) : Riker Laboratories Inc./3M Company.
Sinclair, E., Kannan, K. 2006. Mass loading and fate of perfluoroalkyl surfactants in wastewater treatment plants. Environ. Sci. Technol. 40(5):1408-1414.
Sinclair, E., Mayack, D.T., Roblee, K., Yamashita, N., Kannan, K. 2006. Occurrence of perfluoroalkyl surfactants in water, fish, and birds from New York State. Arch. Environ. Contam. Toxicol. 50(3):398-410.
Sinclair, E., Kim, S.K., Akinleye, H.B., Kannan, K. 2007. Quantitation of gas-phase perfluoroalkyl surfactants and fluorotelomer alcohols released from nonstick cookware and microwave popcorn bags. Environ. Sci. Technol. 41(4):1180-1185.
Smithwick, M., Norstrom, R.J., Mabury, S.A., Solomon, K., Evans, T.J., Stirling, I., Taylor, M.K., Muir, D.C.G. 2006. Temporal trends of perfluoroalkyl contaminants in polar bears (Ursus maritimus) from two locations in the North American Arctic, 1972-2002. Environ. Sci. Technol. 40(4):1139-1143.
Sohlenius, A.K., Andersson, K., DePierre, J.W. 1992. The effects of perfluoro-octanoic acid on hepatic peroxisome proliferation and related parameters show no sex-related differences in mice. Biochem. J. 285(Pt 3):779-783.
Sonne, C., Bossi, R., Dietz, R., Leiffson, P.S., Rigét, F.F., Born, E.W. 2008. Potential correlation between perfluorinated acids and liver morphology in East Greenland polar bears (Ursus maritimus). Toxicol. Environ. Chem.90(2):275-283.
Stahl, T., Heyn, J., Thiele, H., Huther, J., Failing, K., Georgii, S., Brunn, H. 2009. Carryover of perfluorooctanoic acid (PFOA) and perflurooctane sulfonate (PFOS) from soil to plants. Arch. Environ. Contam. Toxicol. 57(2):289-298
Staples, R.E., Burgess, B.A., Kerns, W.D. 1984. The embryo-fetal toxicity and teratogenic potential of ammonium perfluorooctanoate (APFO) in the rat. Fundam. Appl. Toxicol. 4(3 Pt 1):429-440.
Steenland, K., Fletcher, T., Savitz, D.A. 2010a. Epidemiologic evidence on the health effects of perfluorooctanoic acid (PFOA). Environ. Health Perspect. 118:1100-1108.
Steenland, K., Tinker, S., Shankar A., Ducatman, A. 2010b. Association of perfluorooctanoic acid (PFOA) and perfluorooctanesulfonate (PFOS) with uric acid among adults with elevated community exposure to PFOA. Environ. Health Perspect. 118:229-233.
Steenland, K., Tinker, S., Frisbee, S., Ducatman, A., Vaccarino, V. 2009. Association of perfluorooctanoic acid and perfluorooctane sulfonate with serum lipids among adults living near a chemical plant. Am. J. Epidemiol. 170(10):1268-1278.
Stein, C.R., Savitz, D.A., Dougan, M. 2009. Serum levels of perfluorooctanoic acid and perfluorooctane sulfonate and pregnancy outcome. Am. J. Epidemiol. 170(7):837-846.
Stevenson, C.N., MacManus-Spencer, L.A., Luckenbach, T., Luthy, R.G., Epel, D. 2006. New perspectives on perfluorochemical ecotoxicology: inhibition and induction of an efflux transporter in the marine mussel, Mytilus californianus. Environ. Sci. Technol. 40(17):5580-5585.
Stock, N.L., Lau, F.K., Ellis, D.A., Martin, J.W., Muir, D.C.G., Mabury, S.A. 2004. Polyfluorinated telomer alcohols and sulfonamides in the North American troposphere. Environ. Sci. Technol. 38(4):991-996.
Stock, N.L., Furdui, V.I., Muir, D.C.G., Mabury, S.A. 2007. Perfluoroalkyl contaminants in the Canadian Arctic: evidence of atmospheric transport and local contamination. Environ. Sci. Technol. 41(10):3529-3536.
Stow, J.P., Sova, J., Reimer, K.J. 2005. The relative influence of distant and local (DEW-line) PCB sources in the Canadian Arctic. Sci. Total Environ. 342:107-118.
Takacs, M.L., Abbott, B.D. 2007. Activation of mouse and human peroxisome proliferator-activated receptors (PPAR alpha, beta/delta, gamma) by perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS). Toxicol. Sci. 95(1):108-117.
Takagi, A., Sia, K., Umemura, T., Hasegawa, R., Kurokawa, Y. 1991. Short-term exposure to the peroxisome proliferators, perfluorooctanoic acid and perfluorodecanoic acid, causes significant increase of 8-hydroxydeoxyguanosine in liver DNA of rats. Cancer Lett. 57(1):55-60.
Taniyasu, S., Kannan, K., Ka So, M., Gulkowska, A., Sinclair, E., Okazawa, T., Yamashita, N. 2005. Analysis of fluorotelomer alcohols, fluorotelomer acids, and short- and long-chain perfluorinated acids in water and biota. J. Chromatogr. A1093(1-2):89-97.
Tao, L., Kannan, K., Wong, C.M., Arcaro, K.F., Butenhoff, J.L. 2008. Perfluorinated compounds in human milk from Massachusetts, U.S.A. Environ. Sci. Technol.42(8):3096-3101.
Thomford, P.J. 2001a. 4-week capsule toxicity study with ammonium perfluorooctanoate (APFO) in cynomolgus monkeys. Madison (WI) : Covance Laboratories Inc. Covance 6329-230; Sponsor’s study identification T-6889.2.
Thomford, P.J. 2001b. 26-week capsule toxicity study with ammonium perfluorooctanoate (APFO) in cynomolgus monkeys. Madison (WI) : Covance Laboratories Inc. Covance 6329-231; Sponsor’s study identification T-6889.3.
Thompson, R.S., Colombo, I., de Wolf, W., Farrar, D.G., Hoke, R.A., L’Haridon, J. 2004. Acute and chronic aquatic toxicity of ammonium perfluorooctanoate (APFO). Présentation lors de la 25e assemblée annuelle de la Society of Environmental Toxicology and Chemistry’s (SETAC) North America, du 14 au 18 novembre 2004, à Portland (OR).
Tittlemier, S., Ryan, J.J., VanOostdam, J. 2004. Presence of anionic perfluorinated organic compounds in serum collected from northern Canadian populations. Organohalogen Compd66:4009-4014.
Tittlemier, S.A., Pepper, K., Seymour, C., Moisey, J., Bronson, R., Cao, X.-L., Dabeka, R.W. 2007. Dietary exposure of Canadians to perfluorinated carboxylates and perfluorooctane sulfonate via consumption of meat, fish, fast foods, and food items prepared in their packaging. J. Agric. Food Chem. 55(8):3203-3210.
Todd, J.W. 1979. FC-143 photolysis study using simulated sunlight. Report No. 002. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0490.
Tominaga, N., Kohra, S., Iguchi, T., Arizono, K. 2004. Effects of perfluoro organic compound toxicity on nematode Caenorhabditis elegans fecundity. J. Health Sci.50(5):545-550.
Tomy, G.T., Budakowski, W., Halldorson, T., Helm, P.A., Stern, G.A., Friesen, K., Pepper, K., Tittlemier, S.A., Fisk, A.T. 2004. Fluorinated organic compounds in an eastern Arctic marine food web. Environ. Sci. Technol. 38(24):6475-6481.
Tomy, G.T., Pleskach, K., Ferguson, S.H., Hare, J., Stern, G., MacInnis, G., Marvin, C.H., Loseto, L. 2009. Trophodynamics of some PFCs and BFRs in a western Canadian Arctic marine food web. Environ. Sci. Technol. 43(11):4076-4081
Trudel, D., Horowitz, L., Wormuth, M., Scheringer, M., Cousins, I.T., Hungerbuhler, K. 2008. Estimating consumer exposure to PFOS and PFOA. Risk Anal. 28(2):251-269.
Tseng, C.-L., Liu, L.-L., Chen, C.-M., Ding, W.-H. 2006. Analysis of perfluorooctanesulfonate and related fluorochemicals in water and biological tissue samples by liquid-chromatography-ion trap mass spectrometry. J. Chromatogr. A1105(1-2):119-126.
Turgeon-O’Brien, H., Gagné, D., Vézina, C., Lauzière, J., Blanchet, R., Hamelin, A.-M., Ayotte, P., Déry, S.2010. Contaminant nutrient interaction issues as part of a public health intervention study of Inuit children in Nunavik: fourth year of data collection. In: Synopsis of research conducted under the 2009-2010 Northern Contaminants Program. Ottawa (Ont.) : ministère des Affaires autochtones et du Développement du Nord, 2010, p. 23-35.
[USCDC] U.S. Centers for Disease Control and Prevention. 2011. Fourth National Report on Human Exposure to Environmental Chemicals, Updated Tables, Février 2011. [consulté en mars 2011].
[US EPA] U.S. Environmental Protection Agency. 2002. Revised draft hazard assessment of perfluorooctanoic acid and its salts [and Annex]. November 4, 2002. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics, Risk Assessment Division.
[US EPA] U.S. Environmental Protection Agency. 2003. Preliminary risk assessment of the developmental toxicity associated with exposure to perfluorooctanoic acid and its salts. April 10, 2003. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics, Risk Assessment Division.
[US EPA] U.S. Environmental Protection Agency. 2005. Draft risk assessment of the potential human health effects associated with exposure to perfluorooctanoic acid and its salts. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics, Risk Assessment Division.
[US EPA] U.S. Environmental Protection Agency. 2006a. Perfluorooctanoic acid (PFOA) and fluorinated telomers - Basic Information. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics, Risk Assessment Division. [consulté le 17 octobre 2006].
[US EPA] U.S. Environmental Protection Agency. 2006b. SAB Review of EPA’s Draft Risk Assessment of Potential Human Health Effects Associated with PFOA and Its Salts. Washington (DC) : US EPA, Science Advisory Board. Report EPA-SAB-06-006.
[US EPA] U.S. Environmental Protection Agency. 2006c. 2010/2015 PFOA Stewardship Program [en ligne]. [consulté en décembre 2008].
van den Heuvel-Greve, M., Leonards, P., Brasseur, S., Kotterman, M., Zabel, A., Vethaak, D. 2009. Bioaccumulation of perfluorinated compounds in a Harbour seal food web of the Westerchelde, the Netherlands: a field study. Présentation dans le cadre de la SETAC North America, en novembre 2009, à la Nouvelle-Orléans (LA).
Vanden Heuvel, J.P., Kuslikis, B.I., Van Rafelghem, M.J., Peterson, R.E. 1991. Tissue distribution, metabolism, and elimination of perfluorooctanoic acid in male and female rats. J. Biochem. Toxicol. 6(2):83-92.
Van de Vijver, K.I., Hoff, P., Das, K., Brasseur, S., Van Dongen, W., Esmans, E., Reijnders, P., Blust, R., DeCoen, W. 2005. Tissue distribution of perfluorinated chemicals in harbor seals (Phoca vitulina) from the Dutch Wadden Sea. Environ. Sci. Technol. 39(18):6978-6984.
van Leeuwen, S.P.J., Kärrman, A., Van Bavel, B., De Boer, J., Lindstrom, G. 2006. Struggle for quality in determination of perfluorinated contaminants in environmental and human samples. Environ. Sci. Technol. 40(24):7854-7860.
van Zelm, R., Huijbregts, M.A.J., Russell, M.H., Jager, T., van de Meent, D. 2008. Modeling the environmental fate of perfluorooctanoate and its precursors from global fluorotelomer acrylate polymer use. Environ. Toxicol. Chem.27(11):2216-2223.
Verreault, J., Berger, U., Gabrielsen, G.W. 2007. Trends of perfluorinated alkyl substances in herring gull eggs from two coastal colonies in northern Norway: 1983-2003. Environ. Sci. Technol. 41(19):6671-6677.
Wallington, T.J., Hurley, M.D., Xia, J., Wuebbles, D.J., Sillman, S., Ito, A., Penner, E., Ellis, D.A., Martin, J., Mabury, S.A., Nielsen, O.J., Sulbaek Andersen, M.P. 2006. Formation of C7F15COOH (PFOA) and other perfluorocarboxylic acids during the atmospheric oxidation of 8:2 fluorotelomer alcohol. Environ. Sci. Technol. 40(3):924-930.
Wang, N., Szostek, B., Folsom, P., Sulecki, L.M., Capka, V., Buck, R., Berti, W.R., Gannon, J.T. 2005. Aerobic biotransformation of 14C-labeled 8-2 telomer B alcohol by activated sludge from a domestic sewage treatment plant. Environ. Sci. Technol. 39(2):531-538.
Wang, Y., Yeung, L.W.Y., Taniyasu, S., Yamashita, N., Lam, J.C.W., Lam, P.K.S. 2008. Perfluorooctane sulfonate and other fluorochemicals in waterbird eggs from South China. Environ. Sci. Technol. 42(21):8146-8151.
Ward, T., Boeri, R. 1990. Static acute toxicity of FX-1003 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0517.
Ward, T., Kowalski, P., Boeri, R. 1995a. Acute toxicity of N2803-2 to the fathead minnow, Pimephales promelas. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 097.
Ward, T., Kowalski, P., Boeri, R. 1995b. Acute toxicity of N2803-2 to the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a.
Ward, T., Magazu, J., Boeri, R. 1995c. Acute toxicity of L-13492 to the fathead minnow, Pimephales promelas. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 093.
Ward, T., Magazu, J., Boeri, R. 1995d. Growth and reproduction toxicity test with L-13492 and the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 096.
Ward, T., Magazu, J., Boeri, R. 1995e. Acute toxicity of L-13492 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 092.
Ward, T., Kawalski, P., Boeri, R. 1996a. Acute toxicity of N2803-2 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 099.
Ward, T., Kawalski, P., Boeri, R. 1996b. Acute toxicity of N2803-4 to the fathead minnow, Pimephales promelas. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 100.
Ward, T., Kawalski, P., Boeri, R. 1996c. Growth and reproduction toxicity test with N2803-4 and the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 101.
Ward, T., Kawalski, P., Boeri, R. 1996d. Acute toxicity of N2803-4 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 102.
Ward, T., Magazu, J., Boeri, R. 1996e. Growth and reproduction toxicity test with N2803-3 and the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0518.
Ward, T., Magazu, J., Boeri, R. 1996f. Acute toxicity of N2803-3 to the fathead minnow, Pimephales promelas. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0519.
Ward, T., Magazu, J., Boeri, R. 1996g. Acute toxicity of N2803-3 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0520.
Ward, T., Nevius, J.M., Boeri, R. 1996h. Growth and reproduction toxicity test with FC-1015 and the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0526.
Ward, T., Nevius, J.M., Boeri, R. 1996i. Acute toxicity of FC-1015 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0527.
Ward, T., Nevius, J.M., Boeri, R. 1996j. Acute toxicity of FC-1015 to the fathead minnow, Pimephales promelas. Document présenté à la Office of Pollution Prevention and Toxics, US Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0525.
Washburn, S.T., Bingman, T.S., Braithwaite, S.K., Buck, R.C., Buxton, W., Clewell, H.J., Haroun, L.A., Kester, J.E., Rickard, R.W., Shipp, A.M. 2005. Exposure assessment and risk characterization for perfluorooctanoate in selected consumer articles. Environ. Sci. Technol. 39(11):3904-3910.
Washington, J.W., Yoo, H., Ellington, J.J., Jenkins, T.M., Libelo, L. 2010. Concentrations, distribution and persistence of perfluoroalkylates in sludge-applied soils near Decatur, Alabama, USA. Environ. Sci. Technol. 44(22):8390-8396.
Washino, N., Saijo, Y., Sasaki, S., Kato, S., Ban, S., Konishi, K., Ito, R., Nakata, A., Iwasaki, Y., Saito, K., Nakazawa, H., Kishi, R. 2009. Correlations between prenatal exposure to perfluorinated chemicals and reduced fetal growth. Environ. Health Perspect. 117(4):660-667.
Webster, E., Ellis, D.A. 2010. Potential role of sea spray generation in the atmospheric transport of perfluorocarboxylic acids. Environ. Toxicol. Chem. 29(8):1703-1708.
Webster, E.M., Ellis, D.A. 2011. Equilibrium modelling: pathway to understanding observed perfluorocarboxylic and perfluorosulfonic acid behaviour. Environ. Toxicol. Chem. [publié en ligne le 27 juillet 2011].
Webster, G.M. 2011. Exposure sources and thyroid effects of perfluorinated compounds (PFCs) during pregnancy: results from the chemicals, health and pregnancy study (CHirP). Thèse de doctorat, School of Environmental Health, Université de la Colombie-Britannique.
Wei, Y., Dai, J., Liu, M., Wang, J., Xu, M., Zha, J., Wang, Z. 2007. Estrogen-like properties of perfluorooctanoic acid as revealed by expressing hepatic estrogen-responsive genes in rare minnows (Gobiocypris rarus). Environ. Toxicol. Chem. 26(11):2440-2447.
Wei, Y., Liu, Y., Wang, J., Tao, Y., Dai, J. 2008a. Toxicogenomic analysis of the hepatic effects of perfluorooctanoic acid on rare minnows (Gobiocypris rarus). Toxicol. Appl. Pharmacol. 226(3):285-297.
Wei, Y., Chan, L.L., Wang, D., Zhang, H., Wang, J., Dai, J. 2008b. Proteomic analysis of hepatic protein profiles in rare minnow (Gobiocypris rarus) exposed to perfluorooctanoic acid. J. Proteome Res. 7(4):1729-1739.
West Virginia Department of Environmental Protection, West Virginia Department of Health and Human Resources - Bureau for Public Health, DuPont. 2003. Ammonium Perfluorooctanoate (C-8) Ground Water Steering Team report. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT-2003-0012-0204.
White, S.S., Calafat, A.M., Kuklenyik, Z., Villanueva, L., Zehr, R.D., Helfant, L., Strynar, M.J., Lindstrom, A.B., Thibodeaux, J.R., Wood, C., Fenton, S.E. 2007. Gestational PFOA exposure of mice is associated with altered mammary gland development in dams and female offspring. Toxicol. Sci. 96(1):133-144.
Wolf, C.J., Fenton, S.E., Schmid, J.E., Calafat, A.M., Kuklenyik, Z., Bryant, X.A., Thibodeaux, J., Das, K.P., White, S.S., Lau, C.S., Abbott, B.D. 2007. Developmental toxicity of perfluorooctanoic acid in the CD-1 mouse after cross-foster and restricted gestational exposures. Toxicol. Sci. 95(2):462-473.
Wolf, C.J., Takacs, M.L., Schmid, J.E., Lau, C., Abbott, B.D. 2008. Activation of mouse and human peroxisome proliferator-activated receptor alpha by perfluoroalkyl acids of different functional groups and chain lengths. Toxicol. Sci. 106(1):162-171.
Yamashita, N., Kurunthachalam, K., Taniyasu, S., Horii, Y., Petrick, G., Gamo, T. 2005. A global survey of perfluorinated acids in oceans. Mar. Pollut. Bull. 51(8-12):658-668.
Yang, C., Tan, Y.S., Harkema, J.R., Haslam, S.Z. 2008. Differential effect of peripubertal exposure to perfluorooctanoic acid on mammary gland development in C57Bl/6 and Balb/c mouse strains. Reprod. Toxicol. 27(3-4):425-426.
Yang, J.-H. 2010. Perfluorooctanoic acid induces peroxisomal fatty acid oxidation and cytokine expression in the liver of male Japanese medaka (Oryzias latipes). Chemosphere81:548-552.
Yang, Q., Xie, Y., DePierre, J.W. 2000. Effects of peroxisome proliferators on the thymus and spleen of mice. Clin. Exp. Immunol. 122(2):219-226.
Yang, Q., Xie, Y., Eriksson, A.M., Nelson, B.D., DePierre, J.W. 2001. Further evidence for the involvement of inhibition of cell proliferation and development in thymic and splenic atrophy induced by the peroxisome proliferator perfluoroctanoic acid in mice. Biochem. Pharmacol. 62(8):1133-1140.
Yang, Q., Xie, Y., Alexson, S.E.H., Nelson, B.D., DePierre, J.W. 2002. Involvement of the peroxisome proliferator-activated receptor alpha in the immunomodulation caused by peroxisome proliferators in mice. Biochem. Pharmacol. 63(10):1893-1900.
Yao, X., Zhong, L. 2005. Genotoxic risk and oxidative DNA damage in HepG2 cells exposed to perfluorooctanoic acid. Mutat. Res. 587(1-2):38-44.
Yeung, L.W.Y., Miyake, Y., Peng, L., Taniyasu, S., Kannan, K., Guruge, K.S., Lam, P.K.S., Yamashita, N. 2009a. Comparison of total fluorine, extractable organic fluorine and perfluorinated compounds in the blood of wild and perfluorooctanoate (PFOA)-exposed rats: evidence for the presence of other organofluorine compounds. Anal. Chim. Acta 635(1):108-114.
Yeung, L.W.Y., Miyake, Y., Wang, Y., Taniyasu, S., Yamashita, N., Lam, P.K.S. 2009b. Total fluorine, extractable organic fluorine, perfluorooctane sulfonate and other related fluorochemicals in liver of Indo-Pacific humpback dolphins (Sousa chinensis) and finless porpoises (Neophocaena phocaenoides) from South China. Environ. Pollut. 157(1):17-23.
Yeung, L.W.Y., Loi, E.I.H., Wong, V.Y.Y., Guruge, K.S., Yamanaka, N., Tanimura, N., Hasegawa, J., Yamashita, N., Miyazaki, S., Lam, P.K.S. 2009c. Biochemical responses and accumulation properties of long-chain perfluorinated compounds (PFOS/PFDA/PFOA) in juvenile chickens (Gallus gallus). Arch. Environ. Contam. Toxicol. 57(2):377-386.
Ylinen, M., Auriola, S. 1990. Tissue distribution and elimination of perfluorodecanoic acid in the rat after single intraperitoneal administration. Pharmacol. Toxicol. 66(1):45-48.
Yoo, H., Kannan, K., Kim, S.K., Lee, K.T., Newsted, J.L., Giesy, J.P. 2008. Perfluoroalkyl acids in the egg yolk of birds from Lake Shihwa, Korea. Environ. Sci. Technol. 42(15):5821-5827.
York, R.G. 2002. Oral (gavage) two-generation (one litter per generation) reproduction study of ammonium perfluorooctanoate (APFO) in rats. Rapport préparé par Argus Research, Horsham (PA). Protocol 418-020; Sponsor’s Study No. T-6889.6.
Young, C.J., Furdui, V.I., Franklin, J., Koerner, R.M., Muir, D.C.G., Mabury, S.A. 2007. Perfluorinated acids in Arctic snow: new evidence for atmospheric formation. Environ. Sci. Technol.41(10):3455-3461.
| Paramètre | Doses ou concentrations minimales avec effet[1] / résultats | |||
|---|---|---|---|---|
| [1]CL50, concentration létale médiane; DL50, dose létale médiane; CMENO, concentration minimale avec effet nocif observé; DMENO, dose minimale avec effet nocif observé; CSENO, concentration sans effet nocif observé; DSENO, dose sans effet nocif observé. | ||||
Toxicité aiguë : par voie orale |
DL50 la plus faible, par voie orale (rat femelle) = 430 mg/kg p.c. [SAAPFO] (IRDC, 1978) [Autres études : Biosearch Inc., 1976 [APFO]; Griffith et Long, 1980 [SAAPFO]; Haskell Laboratory, 1981b [SAAPFO]; Glaza, 1990 [non précisé], 1997 [SAAPFO] |
|||
Toxicité aiguë : par voie cutanée |
DL50 la plus faible, par voie cutanée (lapin) = > 100 et < 1 000 mg/kg p.c. [SAAPFO, 24 h, application couverte] (Riker Laboratories Inc., 1979) [Autres études : Haskell Laboratory, 1979b [SAAPFO]; Kennedy, 1985 [SAAPFO]; Glaza, 1995 [APFO-Na]] |
|||
| Toxicité aiguë : par inhalation |
CL50 la plus faible, par inhalation (rat mâle) = 980 mg/m3 [SAAPFO, 4 h](Kennedy et al., 1986) [Autres études : Haskell Laboratory, 1969 [SAAPFO]; Griffith et Long, 1980 [SAAPFO]] |
|||
| Toxicité à court terme à doses répétées : par voie orale |
DMENO la plus faible, par voie orale = 0,3 mg/kg p.c. par jour d’après une augmentation marquée liée à la dose du poids du foie relatif chez les souris (concentration sérique d’APFO = 13 µg/mL) et la modification des paramètres lipidiques chez les rats (concentration sérique d’APFO = 20 µg/mL) (aucune DSENO). Des groupes de 10 rats et souris mâles recevaient des doses de SAAPFO de 0, 0,3, 1, 3, 10 ou 30 mg/kg p.c. par jour par gavage pendant 14 jours (Loveless et al., 2006). [Autres études : Christopher et Marias, 1977 [SAAPFO]; Metrick et Marias, 1977 [SAAPFO]; Griffith et Long, 1980 [SAAPFO]; Kojo et al., 1986 [PFOou APFO, imprécis]; Kennedy, 1987 [SAAPFO]; Kawashima et al., 1989 [APFO]; Cook et al., 1992 [SAAPFO]; Sohlenius et al., 1992 [PFO, sel non précisé]; Permadi et al., 1993 [APFO]; Biegel et al., 1995 [SAAPFO]; Henwood, 1997 [SAAPFO]; Kudo et al., 1999 [PFO ou APFO, imprécis]; Q. Yang et al., 2000 [APFO], 2001 [APFO]; Thomford, 2001a [SAAPFO]; Loveless et al., 2006 [SAAPFO]; C. Yang et al., 2008 [APFO]; Macon et al., 2011 [SAAPFO]] |
|||
| Toxicité à court terme à doses répétées : par inhalation |
CMENO la plus faible, par inhalation = 8 mg/m3 (2,48 mg/kg p.c. par jour, concentration sérique moyenne d’APFO = 47 µg/mL), d’après une hypertrophie cytoplasmique hépatique, une dégénérescence ou une nécrose, une augmentation du poids du foie et une augmentation de la phosphatase alcaline chez les rats (CSENO = 1 mg/m3, équivalant à 0,31 mg/kg p.c. par jour, concentration sérique d’APFO = 13 µg/mL). Des rats mâles ont été exposés au SAAPFO à des doses de 0, 1, 8 ou 84 mg/m3 à raison de 6 h/jour, 5 jours/semaine pendant 2 semaines (Haskell Laboratory, 1981a; Kennedy et al., 1986). [Autres études : Haskell Laboratory, 1979a [SAAPFO]] |
|||
| Toxicité à court terme à doses répétées : par voie cutanée |
DMENO la plus faible, par voie cutanée = 20 mg/kg p.c. par jour d’après une augmentation du poids du foie et de l’aspartate aminotransférase/glutamate pyruvate transaminase chez les rats (aucune DSENO). Des rats ont été exposés au SAAPFO à des doses de 0, 20, 200 ou 2 000 mg/kg p.c. par jour à raison de 6 h/jour (application couverte), 5 jours/semaine, pendant 2 semaines (Haskell Laboratory, 1980; Kennedy, 1985). [Autres études : Riker Laboratories Inc., 1979 [SAAPFO]; McDonald, 1997 [SAAPFO]] |
|||
| Toxicité subchronique : par voie orale (rongeurs) |
DMENO la plus faible, par voie orale = 0,64 mg/kg p.c. par jour (concentration sérique moyenne d’APFO = 41,2 µg/mL) d’après une augmentation du poids du foie transitoire, une hypertrophie et une activité accrue de l’oxydase palmitylcoenzyme A chez les rats (DSENO = 0,06 mg/kg p.c. par jour, concentration sérique d’APFO = 7,1 µg/mL). Des rats mâles ont reçu des doses de 0, 1, 10, 30 ou 100 ppm de SAAPFO dans leur alimentation pendant 13 semaines (0, 0,06, 0,64, 1,94 ou 6,5 mg/kg p.c. par jour) (Palazzolo, 1993; Perkins et al., 2004). [Autres études : Goldenthal, 1978a [SAAPFO]; Griffith et Long, 1980 [SAAPFO]] |
|||
| Toxicité subchronique : par voie orale (primates) |
DMENO la plus faible, par voie orale = 3 mg/kg p.c. par jour d’après une augmentation du poids du foie chez les singes cynomolgus mâles auxquels on a administré des doses de SAAPFO par gavage (capsule) 7 jours/semaine pendant 26 semaines (concentration sérique d’APFO = 77 µg/mL) (aucune DSENO). Des groupes de six singes cynomolgus mâles ont reçu initialement des doses de 0, 3, 10 ou 30 mg/kg p.c. par jour. On n’administrait pas de SAAPFO aux animaux recevant la dose élevée de la substance aux jours 12 à 21, puis le traitement recommençait au jour 22 à la dose de 20 mg/kg p.c. par jour (Thomford, 2001b; Butenhoff et al., 2002). Les données sur le poids du foie ont été modélisées par la suite (Butenhoff et al., 2004c) pour estimer la limite inférieure de l’intervalle de confiance à 95 % d’une dose de référence associée à une augmentation du poids du foie de 10 % (DRI10) et de la concentration sérique correspondante (CIDRI10) : DRI10 = 3,9 mg/kg p.c. par jour [SAAPFO] (CIDRI10 = 23 µg/mL) [Autres études : Goldenthal, 1978b [SAAPFO]; Griffith et Long, 1980 [SAAPFO]] |
|||
| Cancérogénicité/ toxicité chronique |
Effets non néoplasiques : DMENO la plus faible, par voie orale = 1,3 mg/kg p.c. par jour chez les rats mâles et 1,6 mg/kg p.c. par jour chez les rats femelles, d’après une augmentation liée à la dose des concentrations sériques de glutamate pyruvate transaminase, de phosphatase alcaline et d’albumine chez les mâles et les femelles; une ataxie et une légère augmentation de l’hyperplasie tubulaire de l’ovaire chez les femelles (aucune DSENO). Des rats CD (cinq par dose par sexe) ont été exposés au SAAPFO à 0, 30 ou 300 ppm dans leur alimentation pendant 2 ans (0, 1,3 ou 14,2 mg/kg p.c. par jour chez les mâles; 0, 1,6 ou 16,1 mg/kg p.c. par jour chez les femelles). Cancérogénicité : Aucun signe de cancérogénicité n’a été rapporté chez les femelles. Chez les mâles, on a observé une incidence accrue des adénomes des cellules de Leydig (0/49, 2/50, 7/50, respectivement chez le groupe témoin, le groupe exposé à la dose faible et le groupe exposé à la dose élevée), qui était significative (p ≤ 0,05) à la dose élevée (Sibinski, 1987). Autres études : DMENO, par voie orale = 13,6 mg/kg p.c. par jour d’après une incidence accrue des adénomes et de l’hyperplasie des cellules de Leydig, des adénomes hépatiques ainsi que des adénomes et de l’hyperplasie des cellules acineuses du pancréas chez les rats mâles (aucune DSENO). Des rats CD mâles ont reçu des doses de 0 ou 300 ppm de SAAPFO dans leur alimentation (0 ou 13,6 mg/kg p.c. par jour) pendant 2 ans (Biegel et al., 2001). (Voir Tableau de référence) |
|||
| Génotoxicité et paramètres connexes : in vitro | Résultats négatifs : Bactérie, mutation, avec et sans la fraction S9 [APFO-Na] (Lawlor, 1995) [Autres études : Kennedy, 1976 [non précisé]; Litton Bionetics Inc., 1978 [SAAPFO]; Lawlor, 1996 [SAAPFO]] Cellules de mammifères, aberrations chromosomiques, avec et sans la fraction S9 [SAAPFO] (Murli, 1996a) [Autres études : Murli, 1996c [SAAPFO], 1996f [APFO-Na]] |
|||
Résultats positifs : Cellules de mammifères (cellules d’ovaires de hamsters chinois [cellules CHO]), aberrations chromosomiques [APFO-Na] (Murli, 1996d) Cellules de mammifères (hépatomes humains), micronoyaux et dommages oxydatifs à l’ADN [APFO] (Yao et Zhong, 2005) |
||||
| Génotoxicité et paramètres connexes : in vivo | Résultats négatifs : Micronoyaux de moelle osseuse de souris (mâles/femelles) [APFO-Na], jusqu’à 5 g/kg p.c.; gavage aigu (Murli, 1995) [Autres études : Murli, 1996b [SAAPFO], 1996e [SAAPFO]] |
|||
Résultats positifs : Rat (mâles), dommages oxydatifs à l’ADN, augmentation de la 8-hydroxydésoxyguanosine dans l’ADN du foie, mais non dans l’ADN des reins [APFO]; 0,02 % dans l’alimentation pendant 2 semaines ou 100 mg/kg p.c. par une seule injection intrapéritonéale (Takagi et al., 1991) |
||||
Toxicité pour le développement : par voie orale |
DMENO, par voie orale = 1 mg/kg p.c. par jour(concentration sérique moyenne d’APFO de 21,9 µg/mL chez les mères) d’après la toxicité maternelle (augmentation du poids du foie) et la toxicité fœtale (ossification réduite, puberté précoce des mâles) chez les souris (aucune DSENO). Des souris CD-1 en gestation ont reçu des doses de 0, 1, 3, 5, 10, 20 ou 40 mg/kg p.c. de SAAPFO par gavage aux jours 1 à 17 de la gestation (Lau et al., 2006). [Autres études : Gortner, 1981 [SAAPFO], 1982 [SAAPFO]; Staples et al., 1984 [SAAPFO]; Mylchreest, 2003 [SAAPFO]; Abbott et al., 2007 [SAAPFO]; White et al., 2007 [SAAPFO]; Wolf et al., 2007 [SAAPFO]; Hines et al., 2009 [SAAPFO]; Macon et al., 2011 [SAAPFO]] |
|||
Toxicité pour le développement : par inhalation |
CMENO par inhalation = 10 mg/m3(équivalant à 3,1 mg/kg p.c. par jour) chez les rats, d’après la toxicité maternelle (apparence négligée, diminution du gain de poids corporel, augmentation du poids du foie) et la toxicité fœtale (poids corporel inférieur) (CSENO = 1 mg/m3). Des rates gravides ont été exposées au SAAPFO à des concentrations de 0, 0,1, 1 ou 10 mg/m3 à raison de 6 h/jour (exposition sur le corps entier) aux jours 6 à 15 de la gestation (Staples et al., 1984). | |||
| Toxicité pour la reproduction | DMENO, par voie orale = 1 mg/kg p.c. par jour chez les rats, d’après la toxicité chez les parents (augmentation du poids du foie et des reins), chez les mâles des générations F0 et F1 (DSENO pour les paramètres de la reproduction = 30 mg/kg p.c. par jour). Des rats Sprague-Dawley (60 rats par sexe par groupe) ont reçu des doses de 0, 1, 3, 10 ou 30 mg/kg p.c. par jour de SAAPFO par gavage. La génération F0 a été exposée de la cohabitation jusqu’à 6 semaines après le sevrage de la génération F1; la génération F1 a été exposée du sevrage jusqu’au sevrage de la génération F2 (York, 2002; Butenhoff et al., 2004a, 2004b). | |||
| Études épidémiologiques (exposition de la population générale) | Sélection au hasard de 1 400 femmes et de leur nouveau-né au sein de la cohorte de naissance nationale du Danemark. Les concentrations sériques d’APFO chez les mères étaient inversement proportionnelles au poids et à la grandeur à la naissance. Aucune corrélation n’a été établie entre les concentrations d’APFO chez la mère et les stades de développement critiques des jeunes enfants à 6 et à 18 mois. Chez 1 240 femmes dont la grossesse était prévue, une concentration sérique d’APFO plus élevée chez la mère en début de grossesse était associée à un temps de conception plus long (concentration sérique moyenne d’APFOchez la mère = 0,0056 µg/mL; quartile inférieur [référence] : APFO chez la mère ≤ 0,003 91 µg/mL) (Fei et al., 2007, 2008a, 2008b, 2009). Dans une étude transversale comptant 293 échantillons de sang de cordon ombilical de nouveau-nés menée à Baltimore, au Maryland, on a noté une faible association négative entre la concentration d’APFO dans le sang de cordon et le poids à la naissance (concentration sérique moyenne d’APFO du cordon = 0,0016 µg/mL) (Apelberg et al., 2007b). Dans une étude de 101 femmes enceintes et leur nouveau-né menée à Hamilton, en Ontario, on n’a établi aucune association entre les concentrations sériques d’APFO chez la mère ou du cordon ombilical et le poids à la naissance (concentration sérique moyenne d’APFO chez la mère = 0,002 54 µg/mL aux semaines 24 à 28 de la grossesse et 0,002 24 µg/mL à la naissance; concentration sérique moyenne d’APFO du cordon = 0,001 94 µg/mL) (Monroy et al., 2008). Dans une étude rétrospective de cohortes menée chez 428 femmes au Japon, on n’a établi aucune association entre les concentrations sériques d’APFO chez la mère et le poids à la naissance (concentration sérique moyenne d’APFOchez la mère = 0,0014 µg/mL) (Washino et al., 2009). Dans une étude menée auprès de 252 femmes enceintes et leur bébé en Alberta, on a établi aucune association entre la concentration sérique moyenne d’APFO chez la mère et le poids du fœtus (concentration sérique médiane d’APFOchez la mère = 0,0015 µg/mL) (Hamm et al., 2009). Dans une étude portant sur 105 Danois de la population générale, les hommes présentant une concentration sérique élevée de PFOS et d’APFO combinés avaient une concentration plus faible de spermatozoïdes (Joensen et al., 2009). Dans une étude transversale portant sur 860 adultes de la population générale des États-Unis, il existait une association positive entre l’APFO sérique, le cholestérol total et le cholestérol de faible densité (Nelson et al., 2010). Dans une étude transversale portant sur 860 adultes de la population générale des États-Unis, après ajustement pour les facteurs de confusion, il y avait une association entre l’APFOsérique et les enzymes hépatiques (Lin et al., 2010). Dans une étude transversale portant sur 3 974 adultes de la population générale des États-Unis, il existait une association positive entre l’APFO sérique et les maladies thyroïdiennes (Melzer et al., 2010). Dans le cadre d’une étude prospective de cohortes portant sur 713 Danois, aucun lien n’a été observé entre les concentrations plasmatiques d’APFO et le taux d’incidence de cancers de la prostate, de la vessie, du pancréas et du foie (Eriksen et al., 2009). |
|||
| Études épidémiologiques (populations présentant une plus grande exposition à l’APFO dans l’eau potable contaminée) | Dans une étude transversale portant sur 1 555 grossesses uniques en Ohio, un sous-ensemble de 380 mères vivaient dans un comté où l’eau potable était contaminée par l’APFO(concentration moyenne dans l’eau potable de 2002 à 2005 : 6,78 µg/L). Aucune différence n’a été observée quant au poids moyen à la naissance ou quant à l’incidence des poids insuffisants à la naissance entre le groupe exposé à de fortes doses et les femmes des autres comtés environnants où l’eau potable présentait des concentrations d’APFO d’environ 20 à 1 000 fois inférieures (Nolan et al., 2009a). Dans une étude de suivi, les chercheurs n’ont signalé aucune association entre une exposition élevée à l’APFO (personnes vivant dans une région raccordée à des services d’eau potable contaminée) et les anomalies congénitales (Nolan et al., 2009b). Les concentrations sériques d’APFO n’ont pas été mesurées au cours de ces études; toutefois, lors d’une étude antérieure menée chez une population située dans cette région, une concentration sérique médiane d’APFO de 0,354 µg/mL a été mesurée (Emmett et al., 2006b; voir plus haut). Dans une étude transversale portant sur 1 845 femmes enceintes vivant dans des collectivités en Ohio et en Virginie-Occidentale raccordées à des services d’eau potable contaminée par l’APFO, les concentrations sériques d’APFO ont été mesurées jusqu’à 5 ans après la naissance et les effets sur la santé étaient auto-déclarés. Aucune association entre la concentration sérique d’APFO chez la mère et le poids à la naissance n’a été établie (concentration sérique moyenne d’APFO : 0,048 µg/mL; concentration sérique médiane d’APFO : 0,0212 µg/mL) (Stein et al., 2009). Dans une étude transversale sur l’exposition de la population générale portant sur 371 sujets vivant en Ohio dans un comté où l’eau potable contenait de l’APFO à une concentration moyenne de 3,5 µg/L au cours des 3 années précédant l’étude, aucune corrélation significative entre la concentration sérique d’APFO et les tests mesurant la fonction hépatique et la fonction rénale, les taux de cholestérol et d’autres paramètres hématologiques n’a été observée (concentration sérique médiane d’APFO : 0,354 µg/mL) (Emmett et al., 2006b). Dans une étude transversale portant sur 54 468 adultes vivant dans des collectivités en Ohio et en Virginie-Occidentale raccordées à des services d’eau potable contaminée par l’APFO (C8 Health Project), la prévalence du diabète, ajustée selon l’âge, autodéclarée était comparable à celles observées dans ces États. Les rapports de cotes pour le diabète de type II étaient inférieurs à 1 pour toutes les concentrations sériques d’APFOplus élevées que celles du décile inférieur (référence), y compris lorsque l’analyse se limitait aux sujets qui avaient vécu depuis au moins 20 ans dans des districts où l’eau était contaminée et qui avaient été exposés pendant au moins 10 ans avant le diagnostic (concentration sérique moyenne d’APFO : 0,0868 µg/mL; concentration sérique médiane d’APFO : 0,0281 µg/mL; décile inférieur [référence] : concentration sérique d’APFO< 0,0079 µg/mL) (MacNeil et al., 2009). Dans une étude transversale portant sur 46 294 adultes vivant dans des collectivités en Ohio et en Virginie-Occidentale raccordées à des services d’eau potable contaminée par l’APFO (C8 Health Project), des tendances positives ont été observées entre l’augmentation des concentrations sériques d’APFO et les taux de cholestérol total, de cholestérol à lipoprotéines de basse densité (LDL) et de triglycérides. Le rapport de cotes pour un taux de cholestérol élevé augmentait dans chaque quartile, jusqu’à atteindre 1,4. Aucune association n’a été établie entre la concentration sérique d’APFO et le taux de cholestérol à lipoprotéine de haute densité (HDL) (concentration sérique moyenne d’APFO : 0,080 µg/mL; concentration sérique médiane d’APFO : 0,027 µg/mL; quartile inférieur [référence] : concentration sérique d’APFO< 0,0131 µg/mL; quartile supérieur ≥ 0,067 µg/mL) (Steenland et al., 2009). Dans une étude transversale portant sur 46 294 enfants et adolescents résidant dans la Mid-Ohio River Valley, raccordée à des services d’eau potable contaminée par l’APFO (C8 Health Project), une association positive significative a été établie entre l’APFOsérique et le cholestérol total et le cholestérol à lipoprotéines de basse densité (LDL) (Frisbee et al., 2010). Dans une étude transversale portant sur 54 951 adultes vivant en Ohio et en Virginie-Occidentale, exposées par l’intermédiaire de l’eau potable contaminée (C8 Health Project), une association positive significative a été établie entre l’APFO sérique et l’acide urique (hyperuricémie) (Steenland et al., 2010b). |
|||
| Études épidémiologiques (exposition professionnelle) | Enzymes hépatiques, hormones, lipides et autres paramètres sériques : Dans un examen transversal longitudinal (3 à 6 ans) de dossiers médicaux de 263 travailleurs à la production de substances fluorées, aucune corrélation significative n’a été constatée entre la concentration sérique d’APFO et les paramètres hématologiques, hépatiques ou de la thyroïde. On a toutefois observé des associations positives entre la concentration sérique d’APFO et le cholestérol total et les triglycérides (concentration sérique moyenne d’APFO : 1,78 µg/mL; plage : 0,04 à 12,7 µg/mL) (Olsen et al., 2003a). Dans deux études transversales limitées (111 et 80 travailleurs à la production d’APFO), les concentrations sériques d’APFO n’étaient pas associées de façon significative aux concentrations d’estradiol et de testostérone sériques (concentration sérique d’APFO : jusqu’à 115 µg/mL) (Olsen et al., 1998). Un programme de surveillance médicale annuelle a été mené auprès de 53 travailleurs mâles à la production d’APFO(exposés pendant 0,5 à 32,5 ans) et de 107 témoins non exposés. Sur une période de 30 ans, aucun signe clinique de maladie précise n’a été observé chez les travailleurs exposés et tous les paramètres biochimiques mesurés étaient compris dans la plage de valeurs normales. En 2007, le cholestérol total était significativement plus élevé chez 34 travailleurs exposés que chez les 34 témoins appariés selon l’âge et d’autres facteurs. Selon une analyse multivariable réalisée sur 56 sujets dont les concentrations sériques d’APFO ont été mesurées en même temps que les paramètres biochimiques au cours des 6 dernières années, il existait une corrélation faible mais significative entre le cholestérol total et les concentrations sériques d’APFO (concentrations sériques d’APFO analysées entre 2000 et 2007; en 2007, concentration sérique médiane d’APFOchez les travailleurs exposés à ce moment : 5,71 µg/mL; concentration médiane chez les travailleurs anciennement exposés : 4,43 µg/mL) (Costa et al., 2009). Les données de programmes de surveillance médicale menés auprès des travailleurs mâles participant à la production d’APFO en 1993 (n = 111), en 1995 (n = 80) et en 1997 (n = 74) (seulement 17 sujets ont participé aux programmes pendant les 3 années) indiquent une association négative entre les taux de cholécystokinine sérique et les concentrations sériques d’APFO. Aucune association n’a été établie entre la concentration sérique d’APFO et les lipides ou les enzymes hépatiques (concentrations sériques d’APFO : moyennes de chacune des années entre 5,0 et 6,8 µg/mL, plage globale jusqu’à 114,1 µg/mL) (Olsen et al., 2000). Dans une étude transversale de 1 025 travailleurs à la production de polymères fluorés, une analyse de régression linéaire multivariable a permis de constater une corrélation positive significative entre les concentrations sériques d’APFO et les taux de cholestérol, de cholestérol à lipoprotéine de très basse densité (VLDL), de cholestérol LDL et de gamma-glutamyl-aminotransférase (GGT) et, chez les hommes, les taux de testostérone et d’estradiol du sérum. On n’a constaté aucune association entre les concentrations sériques d’APFO et les taux de cholestérol HDL, de triglycérides, d’aspartate aminotransférase, de glutamate pyruvate transaminase ou de bilirubine (concentrations sériques d’APFO variant entre 0,0046 et 9,55 µg/mL; moyenne = 0,428 µg/mL) (Sakr et al., 2007a). Des données de surveillance médicale et des mesures de la concentration sérique d’APFO ont été recueillies pendant 25 ans chez 454 travailleurs à la production de polymères fluorés. Un modèle linéaire à effets mixtes a été utilisé et a montré que la concentration sérique d’APFO était corrélée de façon positive avec le cholestérol total et l’aspartate aminotransférase, et de façon négative avec la bilirubine totale. On n’a constaté aucune association entre les concentrations sériques d’APFO et de cholestérol HDL, de cholestérol LDL, de triglycérides, de gamma-glutamyl-aminotransférase, de glutamate pyruvate transaminase ou de phosphatase alcaline (concentrations sériques d’APFOvariant entre 0 et 22,66 µg/mL; moyenne = 1,13 µg/mL sur une période de 23 ans) (Sakr et al., 2007b). Mortalité et cancer : Une étude rétrospective de cohorte sur la mortalité a été réalisée chez 2 083 employés d’une usine de production de substances fluorées. Les données de biosurveillance sur les PFOS ont servi à grouper les membres de la cohorte selon leur exposition aux substances fluorées, soit non exposés, exposés à de faibles concentrations ou exposés à de fortes concentrations. Le taux de mortalité global était inférieur à celui prévu au sein de la population générale. On a constaté deux décès attribuables au cancer du foie dans les groupes exposés à de faibles et à de fortes concentrations (ratio standardisé de mortalité [RSM] de 3,08) et trois décès attribuables au cancer de la vessie, tous trois dans le groupe exposé à de fortes concentrations (RSM de 12,77) (Alexander et al., 2003). Cette usine ne fabriquait pas d’APFO, mais les travailleurs affichaient des concentrations sériques d’APFO et de six autres substances chimiques perfluorées liées à l’exposition professionnelle (concentration sérique d’APFO : moyenne géométrique de 0,899 µg/mL) (Olsen et al., 2003c). Une analyse rétrospective de cohorte sur la mortalité a été réalisée chez 6 027 travailleurs d’une usine de fabrication de polymères fluorés en Virginie-Occidentale. Les RSM ont été obtenus à partir de comparaisons avec la population américaine, la population de l’État et une population d’employés régionale. La majorité des valeurs de RSM étaient inférieures ou égales à 1. La seule hausse de mortalité statistiquement significative a été notée pour le diabète, comparativement à la population d’employés régionale (RSM = 1,97). Une hausse non significative de la mortalité attribuable aux cardiopathies ischémiques a également été constatée, comparativement à la population d’employés régionale (RSM = 1,09). Le nombre de décès attribuables aux cancers du foie, du pancréas et des testicules (8, 11 et 1, respectivement) était inférieur à celui prévu pour la population américaine (Leonard et al., 2008). La concentration sérique d’APFO chez les travailleurs avait été précédemment mesurée à cette usine, et la substance avait été détectée sans égard au poste occupé. Chez 1 025 travailleurs, les concentrations sériques d’APFO étaient comprises entre 0,0046 et 9,55 µg/mL (moyenne de 0,428 µg/mL) (Sakr et al., 2007a; voir plus haut). Une étude de mortalité menée sur une cohorte de 4 747 employés exposés au SAAPFO à l’usine de DuPont a permis de conclure que le risque de mortalité attribuable aux cardiopathies ischémiques n’était pas augmenté chez les travailleurs exposés au SAAPFO (Sakr et al., 2009). Une étude de mortalité a été réalisée sur une cohorte de 3 993 employés d’une usine de production de SAAPFO. Les postes ont été classés comme suit : exposition « probable » ou « certaine » au SAAPFO, ou sans exposition. Des données de concentrations sériques d’APFOrecueillies antérieurement dans diverses zones de l’usine ont été utilisées pour estimer l’exposition cumulative. Les RSM de la population générale du Minnesota étaient inférieurs ou égaux à 1 pour la plupart des causes de décès, y compris le cancer du foie, la cirrhose, le cancer du pancréas, la cardiopathie ischémique et toutes les cardiopathies. Aucun décès attribuable au cancer des testicules n’a été relevé (RSM non estimé). Les RSM des sujets qui occupaient des postes présentant une exposition certaine étaient supérieurs à 1 pour le cancer de la prostate et les maladies cérébrovasculaires (RSM de 2,1 et de 1,6, respectivement). Lorsqu’on compare la catégorie d’exposition cumulative la plus faible à celle la plus élevée, on obtient une augmentation du risque de cancer de la prostate et des maladies cérébrovasculaires (rapports des risques [RR] de 6,6 et de 4,6, respectivement). Le RSM des sujets qui occupaient des postes présentant une exposition probable était de 2,0 pour le diabète, et le RR comparé au groupe d’exposition faible était de 3,7. Aucun décès attribuable au diabète n’a été observé dans le groupe d’exposition certaine (Lundin et al., 2009). |
|||
| Cellule | Témoin (à volonté) |
Témoin (nourris ensemble) | Groupe exposé (300 ppm) |
|---|---|---|---|
| [*] p ≤ 0.05 | |||
| Hyperplasie des cellules de Leydig | 11/80 | 26/78 | 35/76[*] |
| Hyperplasie des cellules acineuses | 14/80 | 8/79 | 30/76[*] |
| Adénome des cellules de Leydig | 0/80 | 2/78 | 8/76[*] |
| Adénome des cellules acineuses | 0/80 | 1/79 | 7/76[*] |
| Adénome hépatique | 2/80 | 1/79 | 10/76[*] |
| Carcinome des cellules acineuses | 0/80 | 0/79 | 1/76 |
| Carcinome hépatique | 0/80 | 2/79 | 0/76 |
Notes de bas de page
[2] La détermination de la conformité à un ou plusieurs des critères énoncés à l’article 64 est basée sur une évaluation des risques potentiels pour l’environnement ou la santé humaine associés aux divers types d’exposition dans l’environnement en général. Pour les humains, cela inclut, sans toutefois s’y limiter, l’exposition par l’air ambiant et intérieur, l’eau potable, les produits alimentaires et l’utilisation de produits de consommation. Une conclusion établie en vertu de la LCPE(1999) portant sur les substances énumérées dans le Plan de gestion des produits chimiques (PGPC) n’est pas pertinente à une évaluation, qu’elle n’empêche pas non plus, par rapport aux critères de risque définis dans le Règlement sur les produits contrôlés, qui fait partie du cadre réglementaire pour le Système d’information sur les matières dangereuses au travail (SIMDUT) pour les produits destinés à être utilisés au travail. De même, une conclusion fondée sur les critères énoncés à l’article 64 de la LCPE(1999) n’empêche pas que des mesures soient prises en vertu d’autres articles de la LCPEou d’autres lois.
[3] Les doses ont été calculées à l’aide des valeurs de référence suivantes : taux d’inhalation chez le rat = 0,11 m3/jour; poids corporel du rat = 0,35 kg (Santé Canada, 1994).
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
Acide pentadécafluorooctanoïque, ses sels et ses précurseurs
Environnement Canada
Santé Canada
Août 2012
Table des matières
- Sommaire
- Introduction
- Identité de la substanceIdentité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l'environnement
- Devenir dans l'environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d'effets nocifs sur l'environnement
- Potentiel d'effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Résumé des renseignements relatifs aux effets de l'APFO sur la santé
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE(1999)], les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de l’acide pentadécafluorooctanoïque (APFO), dont le numéro de registre du Chemical Abstracts Service[1] est 335-67-1, ainsi que de ses sels et de ses précurseurs. Le sel d’ammonium de l’APFO et certains précurseurs de l’APFO, figurant sur la Liste intérieure des substances du Canada, ont été catégorisées en vertu de l’article 73 de la LCPE. Bien que l’APFO ne figure pas sur la Liste intérieure des substances, il peut se former dans l’environnement à la suite de la transformation ou dégradation d’une variété d’autres produits chimiques perfluorés. Il a été décidé d’effectuer une évaluation de l’APFO en raison de sa persistance, de sa présence répandue dans le biote, de sa présence dans l’Arctique canadien, étant donné qu’il peut être transporté sur de grandes distances, et de l’intérêt international suscité par les récentes données scientifiques indiquant que l’APFO et ses sels pourraient représenter un risque pour l’environnement et la santé humaine. De plus, les précurseurs de l’APFO ont été pris en compte dans la présente évaluation, compte tenu de leur contribution à la présence totale de l’APFO et de ses sels dans l’environnement.
L’APFOest une substance anthropique appartenant à la classe des acides perfluorocarboxyliques (les APFC), ces derniers faisant partie du grand groupe des substances perfluoroalkyliques (PFA). Dans la présente évaluation, l’abréviation « APFO » peut se rapporter à l’acide lui-même, à sa base conjuguée ou à ses principaux sels. Cet acide a fait l’objet de divers usages dans le passé, notamment dans des procédés industriels et dans la fabrication de produits commerciaux et de consommation. L’APFO et ses sels sont utilisés comme adjuvants de polymérisation dans la production de polymères fluorés et de fluoroélastomères. L’APFO lui-même n’est pas fabriqué au Canada; cependant, son sel d’ammonium est importé.
Environnement
L’APFOpeut être présent dans l’environnement en raison des rejets provenant des installations de fabrication ou de traitement de polymères fluorés et des usines de traitement des eaux usées, ainsi que du lixiviat des sites d’enfouissement, ou encore à la suite de la dégradation ou de la transformation de ses précurseurs. Dans le cadre de la présente évaluation, les précurseurs sont définis comme des substances contenant un groupement alkyle perfluoré dont la formule chimique est CnF2n+1 (où n = 7 ou 8), qui est directement lié à un groupement chimique autre qu’un atome de fluor, de chlore ou de brome. Ces précurseurs peuvent comprendre des composés d’origine, des produits chimiques contenant de l’APFO(dans des préparations ou sous forme de résidus produits de façon imprévue) ou des substances se transformant en intermédiaires qui se dégradent ultimement en APFO. Les précurseurs possibles comprennent également des composés fluorés (p. ex., des alcools, des iodures et des oléfines fluorotélomériques), dont certains sont actuellement présents dans des produits commerciaux et détectables dans l’atmosphère, et peuvent se dégrader ou se transformer en APFO par des voies biotiques ou abiotiques.
Une fois entré dans l’environnement, l’APFO est extrêmement persistent; il ne subirait aucune dégradation importante par voie biotique ou abiotique dans des conditions environnementales normales. Il est très soluble dans l’eau et, en solution, il est généralement présent sous forme d’anion (base conjuguée). Comme il présente une faible pression de vapeur, il est probable que le milieu aquatique sera son puits principal et qu’une fraction se retrouvera dans les sédiments. La présence d’APFOdans l’Arctique canadien est probablement attribuable au transport à longue distance de l’acide lui-même (p. ex., au gré des courants océaniques) ou de ses précurseurs volatils, notamment par voie atmosphérique.
L’APFOa été détecté à l’état de traces dans l’hémisphère Nord. En Amérique du Nord, les concentrations les plus élevées de cet acide ont été mesurées dans l’eau de surface près d’installations de production de polymères fluorés aux États-Unis (< 0,025 à 1 900 µg/L) et dans l’eau souterraine à proximité de bases militaires américaines (de non détecté [ND] à 6 570 µg/L). Il a également été détecté dans les effluents d’usines de traitement des eaux usées au Canada, à des concentrations de 0,007 à 0,055 µg/L, ainsi que dans les affluents d’usines de traitement des eaux usées aux États-Unis, à des concentrations de 0,0074 à 0,089 µg/L.
Au Canada, des concentrations traces d’APFO ont été mesurées dans les eaux douces (ND à 11,3 µg/L) et les sédiments (0,3 à 7,5 µg/kg). De plus, il a été détecté dans le biote canadien (ND à 90 µg/kg poids humide de tissu) du sud de l’Ontario et de l’Arctique canadien. La concentration d’APFO la plus élevée observée pour les organismes prélevés au Canada était de 90 µg/kg poids humide chez l’invertébré benthique Diporeia hoyi, suivie de 26,5 µg/kg poids humide dans le foie de turbots, de 13 µg/kg poids humide dans le foie d’ours blancs, de 12,2 µg/kg poids humide dans le foie de caribous, de 8,7 µg/kg poids humide dans le foie des phoques annelés et de 5,8 µg/kg poids humide dans le foie de morses. À la suite d’un rejet accidentel de mousse extinctrice dans le ruisseau Etobicoke, en Ontario, l’APFO a été mesuré dans le foie de ménés à nageoires rouges à une concentration maximale de 91 µg/kg poids humide Cependant, les concentrations actuelles d’APFO dans le biote canadien (pour un tissu en particulier et pour tout l’organisme) sont inférieures aux concentrations les plus élevées mesurées dans le biote aux États-Unis (jusqu’à 1 934,5 µg/kg poids humide dans le foie d’orphies).
Il n’a pas été possible d’établir de tendances temporelles ou spatiales relativement à la concentration d’APFOdans les œufs de guillemot ainsi que chez le touladi, le guillemot de Brünnich, le fulmar boréal ou le phoque annelé. Par contre, des tendances temporelles ont été observées chez l’ours blanc (de 1972 à 2002 et de 1984 à 2006) et la loutre de mer (de 1992 à 2002). La teneur en APFO des tissus hépatiques a doublé en 7,3 (± 2,8) ans chez l’ours blanc de l’île de Baffin et en 13,9 (± 14,2) ans chez l’ours blanc de Barrow, en Alaska. Elle s’est accrue de 2,3 % par année chez l’ours blanc de la partie centrale de l’est du Groenland. Les concentrations d’APFO ont également augmenté de façon significative en 10 ans chez les loutres de mer femelles adultes.
Contrairement à d’autres polluants organiques persistants que l’on retrouve dans le biote, l’APFO est présent principalement sous forme d’ions dans les milieux naturels. En raison de la perfluoration, les chaînes perfluorées sont oléophobes et hydrophobes. L’APFO se lie principalement aux protéines d’albumine dans le sang du biote et, par conséquent, est présent dans le sang et les tissus très perfusés comme le foie et les reins plutôt que dans les tissus lipidiques. Les critères numériques de bioaccumulation, prévus dans le Règlement sur la persistance et la bioaccumulation pris en application de la LCPE(1999), ont été calculés à partir des données sur la bioaccumulation chez les espèces aquatiques d’eau douce (poissons) seulement, et pour des substances dont la répartition se fait surtout dans les lipides. Par conséquent, les critères ne reflètent pas entièrement le potentiel de bioaccumulation de l’APFO qui se répartit surtout dans les protéines hépatiques, sanguines et rénales des mammifères terrestres et marins. Des expériences ont montré que l’APFO n’est pas très bioaccumulable chez les poissons; des facteurs de bioconcentration de 3,1 à 27 ont été observés en laboratoire, principalement chez la truite arc-en-ciel. Selon deux études portant sur le réseau trophique de la zone pélagique du lac Ontario, les concentrations d’APFO ne se bioamplifient pas d’un niveau trophique à l’autre. Il faut cependant éviter d’extrapoler ces résultats à des espèces non aquatiques, car les branchies des poissons constituent une voie supplémentaire d’élimination de l’APFO, ce dont sont dépourvus les organismes qui respirent dans l’air, comme les oiseaux et les mammifères terrestres et marins. Des études de terrain ayant permis de mesurer des facteurs de bioamplification supérieurs à 1,0 chez certaines espèces de mammifères arctique et d'auter mammifères (p. ex., le narval, le béluga, l’ours blanc, le morse, le dauphin à gros nez et le phoque commun), semblent indiquer un potentiel de bioaccumulation et de bioamplification de l’APFO chez les mammifères terrestres et marins. Des facteurs de bioamplification de 0,03 à 31 ont été observés pour ces mammifères. L’ours blanc, prédateur se situant au sommet du réseau trophique marin de l’Arctique, est l’espèce la plus contaminée par l’APFO, comparativement aux autres organismes terrestres de cette région.
Dans les études de toxicité traditionnelles, l’APFO présentait une toxicité aiguë faible à modérée pour les organismes pélagiques, notamment les poissons (70 à 2 470 mg/L). Par ailleurs, sa toxicité chronique était faible pour les organismes benthiques (> 100 mg/L). Une étude a été réalisée sur la toxicité de l’APFO et de ses sels pour les oiseaux. Celle-ci révèle que l’APFO n’a aucun effet sur le bêchage des embryons de poulets Leghorn blancs à des concentrations allant jusqu’à 10 µg/g d’embryon. Toutefois, l’APFOs’accumule dans le foie de ces embryons à des concentrations de 2,9 à 4,5 fois supérieures à la concentration initiale dans les œufs entiers.
Des études montrent que l’APFO peut avoir une incidence sur le système endocrinien, sans que les effets se manifestent avant que les organismes aient atteint l’âge adulte. Chez les Gobiocypris rarus mâles et femelles, des concentrations d’APFO de 3 à 30 mg/L ont entraîné une inhibition des gènes associés à la biosynthèse des hormones thyroïdiennes, induit l’expression de la vitellogénine chez les mâles, causé le développement d’ovocytes dans les testicules des poissons mâles et provoqué une dégénérescence des ovaires chez les femelles.
Il existe d’autres études qui démontrent une toxicité hépatique, une immunotoxicité et une chimiosensibilité. Par exemple, une concentration d’APFO de 20 mg/L a augmenté la chimiosensibilité des moules marines. À une concentration de 25,9 mg/L, l’APFO a stimulé le récepteur α activé par les proliférateurs des peroxysomes (PPARα) dans le foie des phoques du Baïkal. Ce récepteur joue un rôle physiologique essentiel en tant que détecteur de lipides et régulateur du métabolisme lipidique. Des données recueillies sur le terrain révèlent également une augmentation des indicateurs d’inflammation et d’immunité chez le dauphin à gros nez liée aux concentrations d’APFO, ce qui semble indiquer que cet acide pourrait entraîner une réponse auto-immune. Une autre étude de terrain porte aussi à croire que de faibles concentrations d’APFO peuvent influer sur les biomarqueurs de santé chez la tortue caouanne. Des essais biologiques d’une durée de deux ans sur la cancérogénicité de l’APFO chez les rats ont révélé que les mâles qui recevaient une dose élevée de sel d’ammonium de l’APFO (SAAPFO) dans leur nourriture présentaient une incidence significativement plus élevée d’adénomes des hépatocytes, des cellules de Leydig et des cellules acineuses du pancréas. Les tumeurs hépatiques chez les mâles pourraient être induites par la toxicité hépatique causée par la prolifération des peroxysomes induite par l’APFO. Par ailleurs, d’autres voies pourraient également contribuer à l’apparition de tumeurs dans d’autres tissus. Certaines données laissent croire que l’APFO pourrait provoquer des dommages oxydatifs indirects à l’ADN.
Santé humaine
Chez l’être humain, l’APFO est facilement absorbé quelle que soit la voie d’exposition; en outre, il ne semble pas être métabolisé et présente une demi-vie relativement longue. Les sels de l’APFO devraient se dissocier dans les tissus biologiques en perfluorooctanoate (PFO); par conséquent, on considère que leur toxicité est équivalente à celle de l’APFO. De faibles concentrations d’APFO ont été mesurées dans des échantillons sanguins prélevés chez des Canadiens n’y étant pas exposés au travail, y compris chez des nouveau-nés, ce qui indique une exposition environnementale à cet acide ou aux composés pouvant se dégrader en APFO. Les données disponibles indiquent que les Canadiens sont exposés à l’APFO et à ses précurseurs présents dans l’environnement, notamment l’air, l’eau potable et la nourriture, et par l’utilisation de produits de consommation tels que les ustensiles antiadhésifs, ainsi que de vêtements et de matériaux domestiques traités avec des composés perfluorés, par exemple les tapis et les tissus d’ameublement. Les Canadiens peuvent également être exposés à l’APFO in utero et pendant l’allaitement. La contribution relative de l’APFO, de ses sels et de ses précurseurs à l’exposition totale n’a pas été caractérisée; l’accent a plutôt été mis sur l’exposition globale à la fraction préoccupante sur le plan toxicologique, l’APFO.
Les études épidémiologiques réalisées chez l’être humain n’ont pas permis d’établir une relation causale entre l’exposition à l’APFO et des effets néfastes sur la santé. Des études de toxicité effectuées sur des animaux de laboratoire ont donc été utilisées pour déterminer les effets critiques et les concentrations sériques d’APFO correspondantes. À la suite de l’administration par voie orale du SAAPFO dans le cadre d’études de toxicité à court terme (14 jours), on a observé une augmentation du poids du foie chez les souris et une modification des paramètres lipidiques chez les rats. Une augmentation du poids du foie a également été relevée chez les singes dans une étude de toxicité de 26 semaines. Par ailleurs, une étude de toxicité sur le développement des souris a révélé une augmentation du poids du foie des souris mères, une ossification réduite des os des fœtus et une puberté précoce des souris mâles.
Des essais biologiques d’une durée de deux ans sur la cancérogénicité chez les rats ont révélé que les mâles qui recevaient une dose élevée de SAAPFO dans leur nourriture présentaient une incidence significativement plus élevée d’adénomes des hépatocytes, des cellules de Leydig et des cellules acineuses du pancréas. Aucun signe de cancérogénicité n’a cependant été observé chez les rats femelles. Les tumeurs hépatiques chez les mâles pourraient être induites par la toxicité hépatique causée par la prolifération des peroxysomes induite par l’APFO. Par ailleurs, d’autres voies pourraient également contribuer à l’apparition de tumeurs dans d’autres tissus. Étant donné que la prolifération des peroxysomes est beaucoup moins susceptible de survenir chez les primates que chez les rongeurs, les tumeurs induites par l’APFO chez les rats mâles ne sont pas considérées comme un effet pertinent dans le cas des êtres humains. Même si les concentrations sanguines d’APFO n’ont pas été mesurées dans le cadre d’études sur la toxicité chronique, la dose de SAAPFO administrée par voie orale était plusieurs fois supérieure à celles des études critiques de toxicité à court terme et subchronique. Par ailleurs, bien que certaines données laissent croire que l’APFO pourrait provoquer des dommages oxydatifs indirects à l’ADN, la base de données sur la génotoxicité indique que l’APFO n’est pas mutagène. Par conséquent, étant donné que les tumeurs observées chez les rats mâles ne semblent pas résulter d’une interaction directe avec le matériel génétique, une approche fondée sur le seuil d’innocuité est utilisée afin d’évaluer les risques pour la santé humaine.
L’évaluation de l’APFO repose sur une comparaison de la marge entre les concentrations de cet acide dans le sang (sérum ou plasma) chez les êtres humains et celles associées à l’apparition d’effets néfastes chez les animaux de laboratoire. Cette approche tient compte de toutes les sources d’exposition, notamment les rejets des installations de fabrication ou de traitement de polymères fluorés et les effluents des usines de traitement des eaux usées, ainsi que le lixiviat des sites d’enfouissement, ou encore la dégradation ou la transformation des précurseurs de l’APFO.
La comparaison des concentrations sériques de l’APFO associées à des effets néfastes chez les animaux de laboratoire (13 à 77 µg/mL) avec les concentrations sériques ou plasmatiques mesurées chez les adultes non exposés à cette substance au travail, chez les nourrissons et chez les enfants (0,00162 à 0,0195 µg/mL) donne des marges d’exposition supérieures à 660. Ces marges sont considérées comme suffisantes pour assurer une protection adéquate compte tenu des incertitudes présentes dans les bases de données sur l’exposition et le danger.
Conclusion
L’évaluation écologique est fondée sur une méthode du poids de la preuve en ce qui concerne la persistance, la bioaccumulation, les tendances temporelles chez certaines espèces (p. ex., l’ours blanc), le transport à grande distance, la présence répandue et les concentrations de l’APFO dans l’environnement et le biote (y compris les régions éloignées du Canada). Selon l’information disponible, il est conclu que l’APFO, ses sels et ses précurseurs pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, il est conclu que l’APFO et ses sels répondent aux critères de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation. L’APFO et ses sels ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. Néanmoins, le poids de la preuve est suffisant pour conclure que l’APFO et ses sels s’accumulent et se bioamplifient chez les mammifères terrestres et marins.
À la lumière des renseignements disponibles sur leur potentiel d’effets nocifs sur la santé humaine et les marges d’exposition en découlant, il est conclu que l’APFO et ses sels ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines. Les précurseurs de l’APFO n’ont pas été évalués de façon individuelle, mais ont été pris en compte du point de vue de leur contribution à l’exposition totale étant donné qu’ils peuvent se dégrader en APFO dans l’environnement.
Ainsi, d’après les renseignements disponibles en ce qui concerne les considérations liées à l’environnement et à la santé humaine, il est conclu que l’APFO, ses sels et ses précurseurs répondent à au moins un des critères énoncés à l’article 64 de la LCPE (1999).
Des activités de recherche et de surveillance viendront, s’il y a lieu, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, l’efficacité des mesures de contrôle possibles définies à l’étape de la gestion des risques.
La présente évaluation préalable a été effectuée conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l’environnement (1999) [LCPE(1999)] (Canada, 1999).
Une évaluation préalable a été réalisée pour l’acide pentadécafluorooctanoïque (APFO) [numéro 335-67-1 du registre du Chemical Abstracts Service (n° CAS)] et ses sels. De plus, les précurseurs de l’APFO ont été pris en compte selon leur contribution à la présence totale de l’APFO et de ses sels. Dans le cadre de cette évaluation, les précurseurs sont définis comme des substances contenant un groupement alkyle perfluoré dont la formule chimique est CnF2n+1 (où n = 7 ou 8), qui est directement lié à un groupement chimique autre qu’un atome de fluor, de chlore ou de brome.
Le sel d’ammonium (n° CAS 3825-26-1) et les précurseurs (nos CAS 53515-73-4, 678-39-7, 65530-61-2 et 70969-47-0) figurent sur la Liste intérieure des substances (LIS) et répondaient aux critères environnementaux de la catégorisation relatifs à la persistance, au potentiel de bioaccumulation ou à la toxicité intrinsèque pour les organismes non humains. Cependant, l’évaluation des risques que présentent toutes ces substances pour la santé humaine n’a pas été jugée hautement prioritaire à la lumière des résultats fournis par les outils simples de détermination du risque d’exposition et du risque pour la santé élaborés par Santé Canada aux fins de la catégorisation des substances de la LIS.
Les évaluations préalables mettent l’accent sur les renseignements jugés essentiels pour déterminer si une substance répond aux critères de l’article 64 de la LCPE (1999). Les évaluations préalables visent à examiner les renseignements scientifiques et à tirer des conclusions fondées sur la méthode du poids de la preuve et le principe de prudence.
La présente évaluation préalable contient des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition. Les données pertinentes pour l’évaluation préalable de ces substances sont tirées de publications originales, de rapports de synthèse et d’évaluation, de rapports de recherche de parties intéressées et d’autres documents consultés au cours de recherches documentaires menées récemment, jusqu’en février 2011 pour les sections traitant des aspects écologiques et jusqu’en avril 2011 pour les sections traitant des effets sur la santé humaine. De plus, une enquête a été menée auprès de l’industrie sur les composés perfluoroalkyliques et fluoroalkyliques pour les années 2000 et 2004 par l’intermédiaire d’avis publiés dans la Gazette du Canada conformément à l’article 71 de la LCPE (1999) [Canada, 1999; Canada, 2000b, 2004]. Ces enquêtes ont permis de recueillir des données sur la fabrication, l’importation, les utilisations et les rejets des composés perfluoroalkyliques et fluoroalkyliques au Canada. Des études toxicologiques ont également été soumises par l’industrie en application de l’article 70 de la LCPE (1999).
La démarche suivie dans cette évaluation écologique préalable consiste à examiner les renseignements scientifiques et techniques pertinents, et à tirer des conclusions fondées sur de multiples éléments d’information, tels que la persistance, l’exposition, les tendances, la toxicité, la bioaccumulation et la présence répandue dans l’environnement. Dans le cas de l’évaluation des risques pour la santé humaine, ces renseignements comprennent les données utiles à l’évaluation de l’exposition de la population générale (exposition non professionnelle) et l’information sur les dangers pour la santé. Les décisions concernant la santé humaine reposent sur la nature de l’effet critique retenu ou sur les marges entre les valeurs prudentes de concentration donnant lieu à des effets et les estimations de l’exposition, en tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, et ce, dans le contexte d’une évaluation préalable. L’évaluation préalable ne constitue pas un examen exhaustif ou critique de toutes les données disponibles. Elle fait plutôt état des études et des éléments d'information essentiels qui appuient les conclusions[2].
L’ébauche évaluation préalable a été préparée par le personnel du Programme des substances existantes de Santé Canada et d’Environnement Canada. L’ébauche d’évaluation écologique a fait l’objet d’un examen écrit par des pairs ou d’une consultation de ces derniers. L’ébauche d’évaluation préalable sur la santé humaine a été soumise à un examen externe réalisé par le personnel de Toxicology Advice and Consulting Limited, Sean Hayes, Ph. D. (Summit Toxicology), Greg Kedderis, Ph. D. (consultant privé), Kannan Krishan, Ph. D. (Université de Montréal) et Donna Vorhees, Ph. D. (Science Collaborative), afin de garantir le caractère adéquat de la couverture des données et les possibilités de défense des conclusions. Les énoncés formulés dans ce document ne reflètent pas nécessairement les opinions des examinateurs. De plus, l’ébauche de la présente évaluation préalable a fait l’objet d’une consultation publique de 60 jours. Bien que les commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu final et des résultats de l’évaluation préalable.
Les principales données et considérations sur lesquelles repose la présente évaluation sont résumées ci-après.
Les renseignements sur l’identité de l’APFO sont présentés au tableau 1. L’APFO est une substance d’origine anthropique à chaîne de huit atomes de carbone, dont sept sont perfluorés. Elle appartient à la classe générale des acides perfluorocarboxyliques (APFC), qui font partie du grand groupe des substances perfluoroalkyliques (PFA). Dans la présente évaluation, l’abréviation « APFO » peut se rapporter à l’acide lui-même, à sa base conjuguée ou à ses principaux sels (tableau 2). Elle ne désigne cependant pas les mélanges commerciaux contenant de l’APFO, car ceux-ci sont souvent mal caractérisés et pourraient comprendre n’importe quel produit qui contient même une infime quantité d’APFO. On désigne aussi l’APFO sous divers noms commerciaux et synonymes, dont C8. Ellis et al.(2004b) traitent plus en détail de l’identité, de la nomenclature et des noms commerciaux de l’APFO. Le sel de l’APFO le plus utilisé commercialement est le sel d’ammonium, appelé SAAPFO(voir la structure chimique dans le tableau 1).
| Numéro de registre du Chemical Abstracts Service (n° CAS) | 335-67-1 |
|---|---|
| Nom chimique | Acide pentadécafluorooctanoïque |
| [1] NCI 2009 : AICS (inventaire des substances chimiques de l’Australie); ASIA-PAC (listes des substances de l’Asie-Pacifique); ECL (liste des substances chimiques existantes de la Corée); EINECS (inventaire européen des substances chimiques commerciales existantes); ENCS (inventaire des substances chimiques existantes et nouvelles du Japon); LES (liste extérieure des substances [Canada]); NZIoC (inventaire des substances chimiques de la Nouvelle-Zélande); PICCS (inventaire des produits et substances chimiques des Philippines); REACH (enregistrement, évaluation, autorisation et restriction des produits chimiques [Commission européenne]); SWISS (Liste des toxiques 1 et inventaire des nouvelles substances notifiées de la Suisse); TSCA (inventaire des substances chimiques visées par la Toxic Substances Control Act des États-Unis). [2] Simplified Molecular Input Line Entry Specification. |
|
| Noms relevés dans les National Chemical Inventories (NCI)[1] | Octanoic acid, 2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-pentadecafluoro- (TSCA) Octanoic acid, pentadecafluoro- (AICS, ASIA-PAC, LES, NZloC, PICCS, SWISS) Pentadecafluorooctanoic acid (ECL, EINECS, PICCS, REACH) Perfluorooctanoic acid (ENCS) |
| Autres noms | EF 201; Eftop EF-201; NSC 95114; Pentadecafluoro-1-octanoic acid; Pentadecafluoro-n-octanoic acid; Perfluorocaprylic acid; Perfluoro-1-heptanecarboxylic acid; Perfluoroheptanecarboxylic acid; n-Perfluorooctanoic acid |
| Groupe chimique | Produits chimiques organiques définis |
| Principale classe chimique ou utilisation | Perfluoroalkyles |
| Principale sous-classe chimique | Acides perfluorocarboxyliques |
| Formule chimique | C8HF15O2 |
| Structure chimique (sel et forme acide) | Sel d’ammonium Acide |
| SMILES[2] | FC(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(F)(F)C(=O)O |
Environnement Canada a examiné les composés perfluoroalkyliques à partir d’avis d’experts, des structures chimiques et des estimations de la biodégradation obtenues à l’aide du modèle CATABOL (c2004-2008) [Mekenyan et al., 2002]. Ces approches ont été utilisées pour évaluer le potentiel de dégradation des structures en APFO. CATABOL (c2004-2008), qu’on a alimenté avec les résultats d’un essai de biodégradation du ministère du Commerce international et de l’Industrie du Japon (Ministry of International Trade and Industry, MITI), prévoit la biodégradation des composés sur une période de 28 jours (LD 301 C de l’OCDE). Les données sur la dégradation des composés perfluorés dans l’ensemble d’étalonnage étant limitées, il se peut que certains produits de dégradation générés par CATABOL (c2004-2008) soient d’une fiabilité restreinte. Il convient également de noter que, dans le cas des composés perfluorés, le temps de dégradation sera plus long, mais il est difficile d’estimer de combien, en particulier dans le cas des substances ayant une masse moléculaire élevée, comme les oligomères et les polymères.
Les précurseurs de l’APFO (tableau 2) ont été pris en compte dans la présente évaluation; toutefois, cette liste ne doit pas être considérée comme exhaustive. Une liste plus complète est présentée dans l’Avis concernant certaines substances perfluoroalkyliques et fluoroalkyliques, publié dans la Gazette du Canada, Partie I : vol. 139, n° 3. Il convient également de noter que certains précurseurs de l’APFOpeuvent aussi être considérés comme des précurseurs des APFC à longue chaîne (C9-C20). Dans le cadre de la présente évaluation, les précurseurs sont définis comme des substances contenant un groupement alkyle perfluoré dont la formule chimique est CnF2n+1 (où n = 7 ou 8), qui est directement lié à un groupement chimique autre qu’un atome de fluor, de chlore ou de brome.
| Nom | N° CAS | Formule moléculaire | Liste (LIS ou LES) |
|---|---|---|---|
| N° CAS : numéro de registre du Chemical Abstracts Service; LIS : Liste intérieure des substances; LES : Liste extérieure des substances; n.d. : non disponible. [1] Les précurseurs, dont la liste n’est pas exhaustive, sont ceux établis à partir de CATABOL (c2004-2008), de l’avis des experts et des ouvrages scientifiques. [2] van Zelm et al.(2008) [3] De Silva et al.(2009) [4] D’Eon et Mabury (2007) |
|||
| Acide libre de l’APFO (acide pentadécafluorooctanoïque) | 335-67-1 | C8HF15O2 | LES |
| Anion perfluorooctanoate (perfluorooctanoate [PFO], base conjuguée de l’acide libre) | 45285-51-6 | C8F15O2– | Non répertoriée |
| Acide pentadécafluorooctanoïque ramifié | 90480-55-0 | C8HF15O2 | Non répertoriée |
| Sels principaux | |||
| Sel d’ammonium de l’APFO (SAAPFO, pentadécafluorooctanoate d’ammonium) | 3825-26-1 | C8F15O2–NH4+ | LIS |
| Sel d’ammonium linéaire ou ramifié de l’acide pentadécafluorooctanoïque (sel d’ammonium ramifié de l’acide pentadécafluorooctanoïque) | 90480-56-1 | C8F15O2–NH4+ | Non répertoriée |
| Sel de sodium de l’APFO (pentadécafluorooctanoate de sodium) | 335-95-5 | C8F15O2–Na+ | LES |
| Sel de potassium de l’APFO (perfluorooctanoate de potassium) | 2395-00-8 | C8F15O2–K+ | Non répertoriée |
| Sel d’argent de l’APFO [perfluorooctanoate d’argent(1+)] | 335-93-3 | C8F15O2–Ag+ | LES |
| Précurseurs potentiels[1] | |||
| Méthacrylate de 2,2,3,3,4,4,5,5,6,6,7,7,8,8,8-pentadécafluorooctyle polymérisé avec l’acide acrylique | 53515-73-4 | (C15H11F15O4)x | LIS |
| 3-[(γ-ω-Perfluoro-C4-10-alkyl)thio]propionamides | 68187-42-8 | n.d. | LIS |
| Sulfate mixte d’α-fluoro-ω-{2-[2-(triméthylammonio)éthylthio]éthyl}poly (difluorométhylène) et de méthyle |
65530-57-6 | n.d. | LIS |
| α,α’-[Phosphinicobis (oxyéthylène)]bis[ω-fluoropoly(difluorométhylène)] | 65530-62-3 | n.d. | LIS |
| α-Fluoro-ω-[2- (phosphonooxy)éthyl]poly (difluorométhylène) |
65530-61-2 | n.d. | LIS |
| γ-ω-Perfluorothiols en C8-20télomérisés avec l’acrylamide | 70969-47-0 | n.d. | LIS |
| [2-(Sulfothio)éthyl]carbamate de C-(3,3,4,4,5,5,6,6,7,7,8,8,8-tridécafluorooctyle), sel monosodique | 82199-07-3 | n.d. | LIS |
| [2-(Sulfothio)éthyl]carbamate de C-(γ-ω-perfluoroalkyle) en C6-9, sels monosodiques | 95370-51-7 | n.d. | LIS |
| Phosphates de dérivés 2,2-bis{[(γ-ω-perfluoro-alkyl en C4-10)thio]méthyliques} de propane-1,3-diol, sels d’ammonium | 148240-85-1 | n.d. | LES |
| Propane-1,3-diol, dérivés 2,2-bis[[(γ-ω-perfluoro-alkyl en C6-12)thio]méthyliques], sels phosphatés et ammoniacaux | 148240-87-3 | n.d. | LES |
| γ-ω-Perfluorothiols en C4-20co-télomérisés avec l’acide acrylique et l’acrylamide | n.d. | n.d. | Non répertoriée |
| 3,3,4,4,5,5,6,6,7,7,8,8,9, 9,10,10,10-Heptadécafluorodécan-1-ol | 678-39-7 | C10F17H5O | LIS |
| Fluorure de pentadécafluorooctyle | 335-66-0 | C8F16O | LES |
| Perfluorooctanoate de méthyle | 376-27-2 | C9H3F15O2 | LES |
| Perfluorooctanoate d’éthyle | 3108-24-5 | C10H5F15O2 | LES |
| 8:2 Polymères d’acrylate de fluorotélomère[2] | n.d. | n.d. | n.d. |
| 1,1,1,2,2,3,3,4,4,5,5,6,6,7,7,8,8-Heptadécafluoro-10-iododécane | 2043-53-0 | n.d. | n.d. |
| Méthacrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-heptadécafluorodécyle | 1996-88-9 | n.d. | LIS |
| Acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-heptadécafluorodécyle | 27905-45-9 | n.d. | LIS |
| 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10-heptadécafluorodec-1-ène | 21652-58-4 | n.d. | n.d. |
| Agents tensioactifs d’acide phosphorique (p. ex. diester d’acide phosphorique de polyfluoroalkyle 8:2 ou diPAP 8:2)[4] | n.d. | x:2 diPAP (F(CF2)xCH2CH2O)2P(O)OH | n.d. |
| Perfluorooctylsulfonamides[3] | n.d. | F[CF2]8SO2NRR’ où R et R’ peuvent être CH2CH2OH, CH3, CH2CH3 ou H | n.d. |
| Propane-1,3-diol, dérivés 2,2-bis[[(γ-ω-perfluoro-alkyl en C10-20)thio]méthyliques], sels phosphatés et ammoniacaux | 148240-89-5 | n.d. | LES |
| Éthers mono{2-hydroxy-3-[(γ-ω-perfluoroalkyl C8-20)thio]propyliques} du polymère du 2-méthyloxirane avec l’oxirane | 183146-60-3 | n.d. | LES |
| α-Fluoro-ω-(2-sulfoéthyl)poly(difluorométhylène) | 80010-37-3 | n.d. | LES |
| Acrylate de 3,3,4,4,5,5,6, 6,7,7,8,8, 9,9,10,10,11,11,12,12,12- hénéicosafluorododécyle polymérisé avec l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10,10- héotadécafluorodécyle, l’α- (2-méthyl-1-oxoprop-2-ènyl)-ω-[(2-méthyl-1-oxoprop-2-ènyl)oxy]poly(oxyéthylène), l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10, 11,11,12,12,13,13,14,14,15,15,16,16,16-nonacosafluorohexadécyle, l’acrylate d’octadécyle, l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10, 10,11,11,12,12,13,13,14,14,14-pentacosafluorotétradécyle et l’acrylate de 3,3,4,4,5,5,6,6,7,7,8,8,9,9,10,10, 11,11,12,12,13,13,14,14,15,15,16, 16,17,17,18,18,18-tritriacontafluorooctadécyle |
116984-14-6 | n.d. | Non répertoriée |
| Acide valérique, dérivés 4,4-bis[(γ-ω-perfluoroalkyle en C8-20)thio], composés avec le 2,2’-iminodiéthanol | 71608-61-2 | n.d. | LES |
La solubilité dans l’eau est une propriété importante qui influe sur l’APFO et ses sels dans l’environnement. L’acide libre et le sel d’ammonium sont solides à 20 °C. L’acide libre se dissocie facilement en perfluorooctanoate (PFO), soit la base conjuguée qui est la forme qu’on mesure le plus souvent dans les milieux naturels et les échantillons biologiques. La base conjuguée de l’APFO et de ses sels est très soluble dans l’eau. On a constaté que les sels de l’APFO s’associent les uns aux autres à la surface, mais se dispersent par agitation et forment des micelles à des concentrations élevées (US EPA, 2003).
La solubilité est fonction de la constante de dissociation de la forme acide (pKa), et la valeur de pKa la plus fréquemment rapportée et utilisée est d’environ 2,5 (Kissa, 1994). Burns et al.(2008) ont cependant déterminé une valeur de pKa de 3,8 ± 0,1, ce qui laisse supposer que les espèces neutres peuvent exister dans l’environnement. Jasinski et al. (2009) ont déterminé une valeur de pKa de 3,3 ± 0.4. En se fondant sur des modèles moléculaires et des analogues, Goss et Arp (2009) ont indiqué que la valeur de pKa est comprise entre 0 et 4. Selon Goss (2008), l’APFO devrait avoir une faible valeur de pKa, de sorte que plus de 99 % du composé se trouverait sous forme anionique (c.-à-d. PFO) dans la plupart des conditions environnementales, laissant ainsi supposer que la forme prédominante de l’APFO dans l’environnement serait la forme anionique.
Les propriétés physiques et chimiques de l’APFO sont résumées dans le tableau 3.
| Propriété | Valeur[1] | Type | Référence |
|---|---|---|---|
| Abréviations : Koa, coefficient de partage octanol-air; Koe, coefficient de partage octanol-eau; Kco, coefficient de partage carbone organique-sédiments; pKa, constante de dissociation acide. [1] La valeur entre parenthèses est celle fournie dans la référence originale. |
|||
| Masse moléculaire (g/mol) | 414,0639 | – | – |
| Point de fusion (°C) | 52-54 | Barton et al., 2007 | |
| Pression de vapeur (Pa) | 2,2 (à 20 °C) | Calculé | Barton et al., 2007 |
| Constante de la loi de Henry (Pa·m3/mol) | 2,4 | Calculé | Barton et al., 2007 |
| Log Koe (sans dimension) | 5 ± 0,5 | Modélisé | Jasinski et al., 2009 |
| 3,62-6,30 | Modélisé | Arp et al., 2006 | |
| Log Koa (sans dimension) | 5,73-6,80 | Modélisé | Arp et al., 2006 |
| Log Kco (sans dimension) | 2,06 (sédiments, pH entre 5,7 et 7,6) |
Expérimental | Higgins et Luthy, 2006 |
| Solubilité dans l’eau (g/L) | 3,5 (pH neutre à alcalin) 0,0007 (pH acide) |
Barton et al., 2007 | |
| pKa (sans dimension) | 2,5 | Expérimental | Kissa, 1994 |
| 3,8 ± 0,1 | Expérimental | Burns et al., 2008 | |
| 0-4 | Modélisé et analogues | Goss et Arp, 2009 | |
L’APFOet ses sels sont d’origine anthropique; on n’en connaît pas de sources naturelles (Kissa, 1994). Des enquêtes menées auprès de l’industrie en 2000 et en 2004 en application de l’article 71 de la LCPE(1999) ont permis de recueillir des données sur la fabrication et l’importation au Canada de certaines substances perfluoroalkyliques et fluoroalkyliques, sur leurs dérivés et polymères, y compris l’APFO, et sur leur exportation à l’étranger (Canada, 2000b; Canada, 2004).
Les résultats de l’enquête de 2000 ont indiqué qu’on ne produit pas d’APFO ni de ses sels au Canada. Quelque 600 000 kg de PFA ont été importés au pays de 1997 à 2000. Une entreprise a déclaré avoir importé de l’APFO et de ses sels. L’APFO et ses sels représentaient une très petite proportion (< 1 000 kg) de la quantité de PFA importée; il s’agissait presque exclusivement de sel d’ammonium, qui servait à des applications industrielles. Les volumes déclarés n’incluent pas les quantités pouvant se trouver dans des articles manufacturés qui sont importés (Environnement Canada, 2001). Les utilisations de l’APFO et de ses sels, selon l’enquête, comprenaient l’emploi comme polymères ou comme ingrédients de préparations et d’autres usages, notamment pour la fabrication de batteries, de revêtements et de lubrifiants (Environnement Canada, 2001). À cause de ses propriétés physicochimiques, l’APFO peut remplacer le perfluorooctanesulfonate (PFOS) pour des applications dans lesquelles cet acide n’était pas utilisé auparavant (US EPA, 2002).
Des renseignements ont également été recueillis auprès de l’industrie pour l’année civile 2004 sur la fabrication et l’importation des substances perfluoroalkyliques et fluoroalkyliques au Canada, y compris les APFC, et sur leur exportation à l’étranger (Canada, 2004). Ces renseignements indiquaient qu’il n’y avait pas de fabrication connue de ces substances au Canada. Selon cette enquête, le sel d’ammonium de l’APFO était importé au Canada dans des quantités variant entre 100 et 100 000 kg (Environnement Canada, 2005) sous le code « grossistes de produits chimiques et de produits analogues » du Système de classification des industries de l’Amérique du Nord (SCIAN).
Il existe deux principaux procédés industriels de synthèse de l’APFO, soit le procédé de fluoration électrochimique de Simons et la télomérisation (US EPA, 2002). La première méthode comporte le passage d’un courant électrique dans une solution de fluorure d’hydrogène anhydre qui contient généralement un dérivé d’acide octanoïque. Tous les atomes d’hydrogène sont remplacés par du fluor, ce qui produit du fluorure de perfluorooctanoyle linéaire à 30-45 % ainsi qu’un mélange variable d’autres isomères, homologues et sous-produits (US EPA, 2002). Ensuite, le fluorure de perfluorooctanoyl est séparé et hydrolysé pour produire un mélange d’environ 70 % d’isomères linéaires et ramifiés variés de l’APFO (Riddell et al., 2009). La neutralisation par des bases de l’acide parent à l’aide de la base métallifère appropriée permet de produire les sels de l’APFO. La deuxième méthode, la télomérisation, est basée sur la réaction d’une molécule appelée télogène (de l’iodure de pentafluoroéthyle par exemple) avec au moins deux molécules appelées taxogènes (du tétrafluoroéthylène par exemple). Ce procédé produit des iodures télomères, qui peuvent être oxydés pour produire un acide carboxylique -- par exemple, de l’APFO linéaire à plus de 99 % (Prevedouros et al., 2006) -- et réagir avec l’éthylène pour produire un autre iodure. On peut ensuite soumettre ces iodures à des réactions pour produire une multitude de matières fonctionnelles. La télomérisation donne généralement lieu à des mélanges de composés à chaîne d’atomes de carbone en nombre pair.
Le SAAPFO est utilisé principalement dans le procédé de polymérisation commerciale pour la production de polymères fluorés, tels que le polytétrafluoréthylène et le polyfluorure de vinylidène (Gouvernement des États-Unis, 2003; OCDE, 2006; Prevedouros et al., 2006), qui sont utilisés dans divers secteurs, comme les industries de l’aérospatiale, de la construction, de l’automobile et de l’électronique. Les polymères fluorés sont utilisés dans la fabrication de revêtements étanches et antitaches appliqués sur des tissus et tapis; de tuyaux, de câbles et de joints d’étanchéité; de revêtements antiadhésifs des batteries de cuisine; de produits de soins personnels (Gouvernement des États-Unis,, 2003). Le SAAPFO est également utilisé comme ingrédient dans les dispersions aqueuses de polymères fluorés, qui entrent dans la composition des peintures et des additifs pour pellicules photographiques et sont utilisées dans l’industrie de finition textile (OCDE, 2006). Les mousses extinctrices aqueuses peuvent également contenir du SAAPFO (OCDE, 2006; Prevedouros et al., 2006). Certains composés fluorés qui sont des précurseurs potentiels de l’APFO sont employés dans le traitement des matériaux d’emballage alimentaire et servent à accroître leur imperméabilité à l’humidité et aux graisses (Begley et al., 2005). Par conséquent, bien que le SAAPFO ne soit généralement pas destiné à demeurer dans les articles manufacturés, il peut être présent en quantités infimes sous forme de contaminant ou dans les produits de dégradation.
Il peut se produire des rejets dans l’environnement pendant les activités de fabrication et de traitement ainsi que tout au long de la vie utile et au moment de l’élimination des articles contenant de l’APFO. Les sources ponctuelles possibles de rejet sont donc les rejets directs des installations de fabrication ou de traitement. Les rejets indirects peuvent résulter, par exemple, de la dégradation ou de la transformation de précurseurs de l’APFO dans les usines de traitement des eaux usées et les sites d’enfouissement. Ces précurseurs peuvent comprendre des composés d’origine ou des produits chimiques contenant de l’APFO. Les précurseurs possibles comprennent également des composés fluorés apparentés qui sont détectables dans l’atmosphère (p. ex., l’alcool fluorotélomérique 8:2 [FTOH], qui a huit carbones fluorés et un groupe alcool éthylique à deux carbones) et peuvent se dégrader ou se transformer en APFO par des voies biotiques ou abiotiques.
Rejets directs
L’APFO et ses sels ne sont pas fabriqués au Canada (Environnement Canada, 2001). Il n’existe pas de données publiées sur les rejets directs dans l’air, l’eau ou le sol à partir d’installations industrielles au pays (Ellis et al., 2004b).
Muir et Scott (2003), Scott et al. (2003) et Boulanger et al. (2005) ont signalé la présence d’APFO dans les effluents d’usines de traitement des eaux usées (UTEU) rejetés dans les Grands Lacs. Les concentrations d’APFO mesurées dans les effluents traités provenant d’UTEU à Thunder Bay et à Sault Ste. Marie, en Ontario, étaient comprises entre 7,9 et 24 ng/L (Scott et al., 2003). La teneur en APFO de l’effluent d’une UTEU de North Toronto a également mesurée et attteignait 38 ng/L (Muir et Scott, 2003). Crozier et al. (2005) ont mesuré l’APFO dans les effluents (concentrations allant de 7 à 55 ng/L) et les biosolides (concentrations allant de 0,7 à 0,9 ng/g) d’usines de traitement des eaux usées en Ontario. Crozier et al.(2005) ont aussi décelé de l’APFO dans l’influent d’une UTEU à une concentration de 7 ng/L, puis dans l’effluent de la même UTEU, également à une concentration de 7 ng/L, ce qui indique que l’APFO n’a pas été éliminé par les procédés de l’usine de traitement des eaux usées. Des précurseurs comme les produits de dégradation des acides carboxyliques fluorotélomériques saturés (ACFT) et des FTOH ont été mesurés dans des influents et dans des échantillons d’eaux issues du traitement primaire, mais pas dans les eaux ayant subi un traitement secondaire (Sinclair et Kannan, 2006).
Boulanger et al. (2005) ont effectué une analyse du bilan massique de huit agents tensioactifs à base de perfluorooctane, y compris l’APFO, dans l’ensemble du lac Ontario. Boulanger et al. (2005) ont cité et utilisé une étude menée en 1999 par la Compagnie 3M qui comprenait l’analyse de trois composés perfluorés (PFC), dont l’APFO, dans les effluents finals de six UTEU. Quatre de ces UTEU se trouvaient dans des villes américaines où des PFC étaient produits ou étaient utilisés par l’industrie, et deux dans des villes américaines sans sources connues de ces composés. Des concentrations détectables d’APFO, variant entre 41,2 et 2 420 ng/L, ont été mesurées dans toutes les UTEU. Pour effectuer l’analyse du bilan massique, Boulanger et al.(2005) ont utilisé une concentration d’APFO dans un effluent d’UTEU de 549 ± 840 ng/L tirée de l’étude de la Compagnie 3M de 1999. Ils ont noté que cette valeur présentait une grande incertitude en raison du faible nombre d’échantillons étudiés, et l’étude ne portait pas sur les effluents réels rejetés dans le réseau des Grands Lacs. Selon les calculs du bilan massique réalisés par Boulanger et al. (2005), les eaux provenant du lac Érié et les rejets d’eaux usées étaient les principales sources, tandis que les eaux s’écoulant vers le fleuve Saint-Laurent constituaient le principal mécanisme de perte, ce qui indique que tous les rejets dans le lac Ontario ne sont pas pris en compte. Selon Boulanger et al. (2005), le nettoyage et l’entretien par les consommateurs de produits traités en surface et l’utilisation d’agents tensioactifs à base de perfluorooctane dans les procédés industriels peuvent entraîner la présence de ces substances dans les rejets d’UTEU. Ces auteurs étaient également d’avis que la présence d’objets traités dans des sites d’enfouissement et le traitement ultérieur des lixiviats provenant de ces sites par les UTEU municipales peuvent aussi faire entrer d’importantes quantités d’agents tensioactifs à base de perfluorooctane dans l’environnement. Tous les produits et matériaux fluorés étudiés par Dinglasan-Panlilio et Mabury (2006) contenaient des alcools télomériques fluorés libres ou non liés. Ces auteurs estiment que les alcools télomériques fluorés résiduels entrent pour une grande part dans la charge atmosphérique d’alcools télomériques fluorés et qu’ils pourraient en constituer la principale source, car le rejet de ces alcools télomériques fluorés résiduels peut se produire tout au long de la chaîne d’approvisionnement, depuis la production jusqu’à l’utilisation finale, en passant par les applications.
Il existe des données sur les rejets d’APFO à partir de sites d’enfouissement au Canada (p. ex., décharges publiques, dépotoirs avec brûlage et décharges de déchets métalliques) [Ikonomou, 2006]. On en a détecté dans les sédiments du site d’enfouissement de l’Arctique (de 22 à 1 083 ng/g) ainsi que dans les sédiments du site d’enfouissement de Kamloops, en Colombie-Britannique (jusqu’à 186 ng/g). L’APFO a également été détecté dans le lixiviat des sites d’enfouissement à Waterloo (458 ng/L), à Cambridge (1 144 ng/L) et à Toronto (880 ng/L), en Ontario, à Moncton, au Nouveau-Brunswick (88 ng/L), à Halifax, en Nouvelle-Écosse (2 040 ng/L), à Charlottetown, à l’île-du-Prince-Édouard (642 ng/L), à Kelowna, en Colombie-Britannique (146 ng/L), et à Calgary, en Alberta (238 ng/L). D’après la concentration moyenne d’APFO, la charge totale annuelle estimée dans le lixiviat est de 0,1 kg (Conestoga-Rovers & Associates, 2011). On a aussi détecté de l’APFOdans le lixiviat de sites d’enfouissement (91,3-516 ng/L) [Kallenborn et al., 2004] dans d’autres pays où, comme au Canada, on ne produit pas de composés perfluorés. Les FTOH 6:2, FTOH 8:2 et FTOH 10:2 (c.-à-d. les précurseurs de l’APFO) ont été mesurés dans l’air à deux sites d’enfouissement en Ontario; les concentrations étaient inférieures à 5 000 pg/m3 (en amont) et inférieures à 25 000 pg/m3 sur le site (Ahrens et al., 2010b).
Rejets indirects
Les causes possibles de la formation d’APFO, comme la dégradation ou la transformation de précurseurs, pourraient entraîner des rejets indirects et ainsi contribuer à la quantité totale d’APFO dans l’environnement.
D’Eon et al. (2007) ont établi que l’APFO pouvait se former à partir d’agents tensioactifs de phosphate de polyfluoroalkyle (PAPS), tels que le PAPS 8:2, par la rupture du lien ester phosphorique, libérant du FTOH 8:2, qui subit par la suite une biotransformation pour former de l’APFO. Lee et al.(2010) ont montré que les produits de la biodégradation par voie microbienne (c.-à-d., FTOH 8:2 et FTOH 10:2) provenant de PAPS monosubstitués 8:2 et 10:2 (qu’on peut retrouver dans des produits commerciaux) peuvent être présents dans les influents et les effluents des UTEU.
Wallington et al. (2006) ont utilisé un modèle tridimensionnel de la composition chimique de l’atmosphère du globe (IMPACT) pour montrer que le composé n-C8F17CH2CH2OH (c.-à-d., le FTOH 8:2) se transforme en APFO et en d’autres APFC par dégradation dans l’atmosphère. Schenker et al. (2008) ont utilisé un modèle plurispécifique à l’échelle mondiale (CliMoChem) pour montrer que, jusqu’en 2000, la contribution des flux atmosphériques de substances à base de fluorure de perfluorooctanesulfonyle aux dépôts atmosphériques d’APFO en Arctique était semblable à la contribution des flux de FTOH. On considère que, selon le lieu et la saison, les concentrations molaires d’APFO dans l’atmosphère sont d’un ordre de grandeur approprié pour expliquer les concentrations observées dans le biote de l’Arctique (Wallington et al., 2006). Les concentrations d’APFO dans cette région varient beaucoup suivant la saison : des quantités relativement élevées (> 1,5 × 103 molécules/cm3) sont mesurées sur tout ce territoire pendant l’été arctique, mais les concentrations sont inférieures à celles-ci d’un ordre de grandeur en hiver (Wallington et al., 2006).
Ellis et al. (2001, 2003) ont signalé la formation d’APFO par la thermolyse de polymères fluorés. Les résultats des études menées par ces auteurs indiquent que ce processus peut produire de l’APFO, mais vraisemblablement pas en quantités importantes dans l’environnement et pas suffisamment pour contribuer au transport à grande distance de cet acide (Ellis et al., 2001, 2003). La thermolyse des polymères fluorés s’enclenche à partir de 365 °C (température qu’on ne rencontre pas dans l’environnement). Cette température pourrait être atteinte dans des applications industrielles et domestiques, de sorte que la thermolyse des polymères fluorés pourrait être considérée comme une source d’APFO.
Il a été montré que les FTOH se métabolisent pour former de l’APFO chez le rat et la truite arc-en-ciel (Hagen et al., 1981; Butt et al., 2010b). Selon Hagen et al. (1981), la formation d’APFOchez les rats serait causée par une β-oxydation. Butt et al. (2010a) ont trouvé que l’exposition aux ACFT 7:3 ne résultait pas de la formation et de l’accumulation de l’APFOdans la truite arc-en-ciel; toutefois, l’APFO s’est formé dans les ACFT 8:2 et les acides carboxyliques fluorotélomériques insaturés (ACFTI) 8:2. Les auteurs ont proposé une voie par béta-oxydation qui suit le schéma suivant : ACFTI8:2 ? acide β-cétonique 7:3 ? cétone 7:2 ? APFO; ou encore, que l’APFOpourrait être formé directement par β-oxydation de l’acide cétonique 7:3. Butt et al. (2010b) ont exposé la truite arc-en-ciel à l’acrylate de fluorotélomère par voie alimentaire. Ils ont observé la formation d’ACFT 8:2, d’ACFTI8:2 et d’ACFT 7:3; toutefois, la formation et l’accumulation totales de l’APFO étaient faibles. Frömel et Knepper (2010) ont suggéré que l’ultime raccourcissement de la chaîne éthoxyle des éthoxylates de fluorotélomères peut produire des FTHO et donc contribuer en tant que source potentielle de composés perfluorés comme l’APFO.
Dinglasan et al. (2004) ont montré la biodégradation aérobie du FTOH 8:2 avec une demi-vie initiale de ~0,2 j/mg de la protéine de la biomasse initiale, suivie d’une seconde demi-vie de 0,8 j/mg dans une culture microbienne mixte obtenue à partir de sédiments et d’eau souterraine prélevés dans un lieu contaminé, culture enrichie sur du 1,2-dichloroéthane, puis maintenue avec de l’éthanol comme seule source de carbone. Cette culture mixte a été choisie parce qu’elle était acclimatée à la dégradation des alcanes et des alcools chlorés, et donc considérée comme active sur des alcools fluorés. La dégradation de l’alcool s’est produite surtout par un mécanisme produisant un acide télomérique, qui a ensuite subi une β-oxydation pour produire de l’APFO, qui représentait 3 % de la masse totale des FTOH initialement au jour 81. Toutefois, comme cette étude était limitée à l’identification et à la quantification de produits de transformation connus ou prévus, il se peut que d’autres produits de transformation soient demeurés inconnus. Les FTOHpouvaient se métaboliser pour former de l’APFO dans les boues d’UTEU municipales (Pace Analytical, 2001). Liu et al. (2007b) ont montré la dégradation microbienne du FTOH 8:2 en APFO dans des sols argileux et dans deux cultures bactériennes pures de sol (espèce Pseudomonas).
Wang et al. (2005) ont mené des études de biodégradation aérobie sur l’alcool télomérique 8:2 marqué au 14C dans des boues activées diluées d’une UTEU. Trois produits de transformation ont été identifiés : acides saturés 8:2, acides insaturés 8:2 et APFO, ceux-ci représentant respectivement 27 %, 6 % et 2,1 % de la masse initiale de l’alcool marqué au 14C après 28 jours. Selon les résultats obtenus, les métabolites d’acide perfluoré comme l’APFO ne constituent qu’une infime partie des produits de transformation observés durant la période considérée (Wang et al., 2005). Wang et al. (2005) ont également soutenu que le devenir biologique de l’alcool télomérique 8:2 était déterminé par de multiples voies de dégradation, ni la β-oxydation ni une autre réaction catalysée par des enzymes n’étant la cause dominante. Une étude réalisée par Dinglasan et al. (2005) a révélé que l’oxydation de FTOH 8:2 en acide télomérique s’était produite par l’intermédiaire de l’aldéhyde télomérique transitoire. L’acide télomérique subissait ensuite une transformation supplémentaire par β-oxydation pour former l’acide insaturé et l’APFO. Toutefois, un bilan massique complet n’a pas été établi, pour plusieurs raisons selon les auteurs : liaison des métabolites avec la biomasse et d’autres macromolécules biologiques, présence de métabolites non pris en compte, absorption d’intermédiaires (formation de liaisons covalentes) ou existence d’autres voies de dégradation (Dinglasan et al., 2005).
Les FTOH peuvent provenir de polymères ou de substances chimiques intégrant des FTOH ou de quantités résiduelles de FTOH qui n’ont pas établi de liaisons covalentes avec des polymères ou des substances chimiques pendant la production. Les FTOH entrent dans la fabrication de mousses extinctrices, de produits de soins personnels et de nettoyage, de revêtements antitaches, antigraisses, oléofuges et hydrofuges pour les tapis, les tissus, le cuir et le papier (US EPA, 2006a). Ils entrent également dans la fabrication d’une vaste gamme de produits : peintures, adhésifs, cires, polis, métaux, appareils électroniques, matériaux d’étanchéité, etc. De 2000 à 2002, ces composés ont été produits à raison d’environ 5 × 106 kg à l’échelle mondiale, dont 40 % en Amérique du Nord (Dinglasan et al., 2004). La fabrication des matières brutes et des produits à base de fluorotélomères comporte une suite d’étapes, le télomère A intervenant à la première étape. La production mondiale de télomère A de 2000 à 2002 était de 5 000 à 6 000 t/an (Prevedouros et al., 2006).
Yoo et al. (2010) ont mesuré les concentrations de FTOH dans le sol de champs (près de Decatur, en Alabama) sur lesquels on avait épandu des boues d’épuration. Des boues provenant d’une UTEU à Decatur, en Alabama, ont été épandues sur des champs agricoles pendant plus d’une décennie; cette UTEU recueillait les flux de déchets des industries qui utilisaient des composés fluorotélomériques (Washington et al., 2010). Yoo et al. (2010) ont constaté que les champs amendés par les boues présentaient des concentrations de FTOH dans le sol de surface de 5 à 73 ng/g poids sec. La concentration de FTOH la plus élevée était celle du FTOH 10:2, dont les concentrations variaient de moins de 5,6 à 166 ng/g poids sec. Les demi-vies des FTOH étaient comprises entre 0,85 et 1,8 année, ce qui laisse entendre que l’épandage des boues est une voie possible pour la dégradation des FTOH en APFO et autres APFC. Washington et al. (2010) ont également constaté que ces champs amendés par des boues présentent des concentrations élevées d’APFC, notamment d’APFO (moins de 320 ng/g poids sec).
La pression de vapeur mesurée des FTOH va de 140 à 990 Pa. Les constantes adimensionnelles de la loi de Henry calculées pour cette classe de composés (p. ex., 270 à 25 °C pour les FTOH 8:2) à partir de données limitées sur la solubilité dans l’eau et la pression de vapeur montrent la propension de ces composés à passer dans l’atmosphère (Dinglasan et al., 2004). Ellis et al. (2004a) ont montré le potentiel des FTOH à produire de l’APFO par réaction avec des radicaux hydroxyles dans l’atmosphère. Selon des études en chambre à smog, les FTOH peuvent produire une série homologue d’APFC par dégradation dans l’atmosphère (Ellis et al., 2004a). L’oxydation des FTOH dans l’atmosphère serait le fruit d’une réaction avec des radicaux hydroxyles (Dinglasan et al., 2004; Ellis et al., 2004a). Il a été démontré que les perfluorooctylsulfonamides réagissent avec des radicaux hydroxyles pour produire de l’APFO (Hatfield et al., 2002). Même si ces études ont été réalisées en présence de concentrations de radicaux hydroxyles plus fortes que ce qu’on observe dans l’environnement, et que leurs résultats étaient qualitatifs plutôt que quantitatifs, elles montrent la possibilité que des produits apparentés produisent de l’APFO en réagissant dans l’atmosphère.
Stock et al. (2004, 2007) ont montré que les FTOH étaient très répandus dans l’atmosphère en Amérique du Nord, et ce, à des concentrations importantes. Des échantillonnages d’air effectués récemment ont permis de déceler la présence de FTOH dans la troposphère à des concentrations comprises généralement entre 17 et 135 pg/m3 et plus élevées au-dessus des milieux urbains que des milieux ruraux (Martin et al., 2002; Stock et al., 2004). Loewen et al. (2008) ont étudié les concentrations de FTOH dans l’atmosphère et dans les eaux lacustres le long d’un transect altitudinal dans l’Ouest canadien. Les échantillons d’eau ont été prélevés au lac Cedar (petit lac situé près de Golden, en Colombie-Britannique), au lac Bow dans le parc national Banff (Banff, Alberta) et à un autre petit lac sans nom situé aussi dans ce parc. Des échantillonneurs d’air passifs ont été installés en différents points d’un transect altitudinal (800 à 2 740 m au-dessus du niveau de la mer) allant de Golden, en Colombie-Britannique, au parc national Banff. Loewen et al. (2008) ont noté que la quantité de FTOH 8:2 et 10:2 augmentait (< 2,0 ng/échantillonneur) en fonction de l’altitude. Les concentrations d’APFO dans l’eau prélevée dans les lacs le long du transect altitudinal étaient inférieures à 1 ng/L. Aucune tendance bien définie n’a pu être dégagée entre l’altitude et les concentrations d’APFO. Selon Ellis et al. (2004a) et Wallington et al.(2006), les alcools télomériques pourraient être en partie responsables de la présence d’APFC dans l’Arctique et dans d’autres régions non urbaines où les concentrations de radicaux peroxyles dépassent de beaucoup celles des oxydes d’azote (NOx). On a fait remarqué que comme la réaction du FTOH 8:2 avec l’oxyde nitrique entre en concurrence avec la réaction entraînant la formation d’APFO, la formation d’APFO devrait diminuer avec l’augmentation des concentrations de NOx. Dès lors, la production d’APFO est inhibée dans les régions sources où les concentrations de NOx sont généralement égales ou supérieures à 100 parties par billion.
De pair avec les mesures des alcools dans l’atmosphère effectuées par Martin et al. (2002) et Stock et al. (2004) et avec le profil des isomères linéaires et des isomères ramifiés observés dans des échantillons prélevés dans l’Arctique canadien (De Silva et Mabury, 2004), Ellis et al. (2004a) ont conclu que les alcools télomériques constituaient une source plausible d’une partie de l’APFOdétecté dans les régions éloignées. Cette conclusion est appuyée par Stock et al. (2007) qui ont mesuré des concentrations de FTOH dans l’air à l’île Cornwallis, au Nunavut, en 2004. Les concentrations moyennes de FTOH variaient entre 2,8 et 14 pg/m3. Cette conclusion est également appuyée par des mesures de l’APFO dans des échantillons d’eau de pluie prélevés aux États-Unis (Scott et al., 2003, 2006b). Ces résultats montrent que les FTOH sont très répandus dans la troposphère et qu’ils peuvent être transportés sur de grandes distances par voie atmosphérique. De plus, De Silva et al. (2009) ont décelé la présence d’isomères ramifiés d’APFOdans les sédiments et l’eau de surface du lac Ontario et en Arctique, dans le biote du lac Ontario et chez les humains. Ils n’ont toutefois pas mesuré d’isomères ramifiés dans des concentrations supérieures à la limite de détection (3,6 ng/g) chez l’ours blanc et le phoque annelé.
Gewurtz et al. (2009) ont décelé de l’APFO ainsi que des ACFTI8:2 et des ACFTI 10:2 dans la pellicule formée par les dépôts accumulés sur des fenêtres échantillonnées à l’intérieur et à l’extérieur, en ville, en banlieue, en campagne et dans des magasins de tapis à Toronto, en Ontario. Nilsson et al. (2010) ont décelé la présence de PFC, y compris d’APFO, dans le sang de techniciens de fartage de skis (les concentrations variaient de 4,8 à 535 ng/L). Nilsson et al. (2010) ont mentionné que des composés organiques fluorés sont ajoutés aux farts de glisse pour empêcher l’adhésion de la neige, de la glace et de la poussière. Les farts fluorés sont appliqués par chauffage à environ 130-220 °C, températures auxquelles des particules en suspension dans l’air et des émanations contenant un mélange de composés organochlorés gazeux sont émises. Cependant, les auteurs n’ont pas analysé les farts de glisse eux-mêmes pour déterminer la présence de PFC.
La grande solubilité dans l’eau de l’APFO ainsi que la volatilité négligeable des espèces ionisées indiquent que toutes les espèces d’APFO s’introduisent principalement dans les milieux aquatiques. La solubilité est fonction de la constante de dissociation acide (pKa) de la forme acide. Goss (2008) a également avancé que l’APFO devrait avoir une faible valeur de pKa, de sorte que plus de 99 % du composé se trouverait sous forme anionique (c.-à-d. PFO) dans la plupart des conditions environnementales. Ainsi, les résultats de modélisation présentés dans des publications évaluées par des pairs portant sur le devenir global, le transport, la répartition et la bioaccumulation devraient être examinés avec prudence, car ils n’ont peut-être pas tenu compte du pH du milieu naturel conjointement avec les valeurs de pKa du composé. Il est possible que le sel d’ammonium de l’APFO puisse se réintroduire dans la phase gazeuse à partir de l’eau (US EPA, 2002). Toutefois, des études ont montré que si cela se produit, c’est à un degré négligeable, à un pH proche de 8,5 (Oakes et al., 2004).
Une fois dans la phase aqueuse, l’APFO peut entrer dans des sédiments, comme l’a montré sa détection dans ce milieu (Giesy et Newsted, 2001; Stock et al., 2007). D’après une comparaison des concentrations mesurées dans la phase aqueuse et dans les sédiments, il est improbable que les sédiments soient un puits important pour l’APFO (Oakes et al., 2004; Masunaga et Odaka, 2005). Toutefois, les propriétés d’adsorption et de désorption du SAAPFO ont été étudiées avec un échantillon de boues activées et quatre échantillons de sol (Dekleva, 2003). Selon cette étude, le taux moyen d’adsorption du SAAPFO était de 40,8 à 81,8 %, tandis que les valeurs du coefficient d’adsorption (Kd) variaient entre 0,41 et 36,8 L/kg. Le coefficient d’adsorption sur le carbone organique (Kco) oscillait entre 48,8 et 229 L/kg et le coefficient d’adsorption sur la matière organique (Kmo), entre 28,4 et 133 L/kg. Ces valeurs montrent qu’il est plus probable que l’APFO soit adsorbé sur le carbone organique que sur les autres matières solides du sol. Moody et Field (1999) sont d’avis que, étant donné que l’APFO a pu être mesuré dans les eaux souterraines de zones où il n’est plus utilisé, une fraction du composé doit être liée au sol et libérée lentement dans l’eau. Toutefois, il est reconnu que sa présence dans les eaux souterraines pourrait simplement indiquer la lente migration de l’APFO plutôt que sa liaison avec le sol. Il est donc peu probable que l’APFO qui se dépose sur le sol soit transporté sur de grandes distances (Franklin, 2002).
Persistance
Selon les données disponibles, l’APFO ne subit pas de photodégradation importante dans des conditions environnementales normales (Todd, 1979; Nubbe et al., 1995; Scrano et al., 1999; Hatfield, 2001; Hori et al., 2004, 2005, 2008), ne s’hydrolyse pas (Ellis et al., 2004b) ou ne subit pas de dégradation biotique ou abiotique importante (Reiner, 1978; 3M Company, 1979, 1980b, 1985b; Pace Analytical, 1997; Oakes et al., 2004; Moriwaki et al., 2005; Cheng et al., 2008); il est également improbable que l’APFO subisse une fluoration réductrice par les communautés microbiennes anaérobies (Liou et al., 2010).
| Identité de l’APFO | Milieu | Étude | Demi-vie de dégradation | Références |
|---|---|---|---|---|
| Base conjuguée | Eau | Photolyse | > 349 jours | Todd, 1979; Hatfield, 2001 |
| Base conjuguée | Eau | Photolyse Hydrolyse Biodégradation Volatilité |
> 35 jours | Oakes et al., 2004 |
| Base conjuguée | Eau | Hydrolyse | ~235 ans | US EPA, 2002 |
| Base conjuguée | Air | Réaction avec des radicaux hydroxyles | ~90,1 jours | Hurley et al., 2004 |
| Base conjuguée | Boues résiduaires | Biodégradation | > 2,5 mois | Pace Analytical, 2001 |
| Base conjuguée | Sol/boues résiduaires | Fluoration réductrice microbienne anaérobie | > 110 jours | Liou et al., 2010 |
Les valeurs de la demi-vie de l’APFO et de ses sels sont estimées et demeurent hautement hypothétiques étant donné la brièveté des périodes d’étude. La valeur prévue de la durée de vie de l’APFO dans l’atmosphère par rapport aux radicaux hydroxyles a été établie à 130 jours (Hurley et al., 2004). Selon Franklin (2002), le temps de vie dans l’atmosphère se mesurerait en jours lorsque cet acide provient d’une source au sol, et il serait donc improbable qu’il soit transporté sur de grandes distances. Toutefois, si l’APFOprovient d’une source atmosphérique (c.-à-d. produit par l’intermédiaire de précurseurs) et que les pertes se produisent principalement par des dépôts humides ou secs, il aurait une durée de vie de 20 à 30 jours avant de se déposer (Ellis et al., 2004b). Cette durée serait suffisante pour que l’APFOsoit transporté sur des milliers de kilomètres, ce qui suggère l’existence d’un mécanisme de transport à grande distance. En outre, la présence d’APFO dans l’Arctique canadien peut constituer une preuve du transport à grande distance de l’APFO(par des courants océaniques, par exemple) [Caliebe et al., 2004; Yamashita et al., 2005] ou de précurseurs volatils de l’APFO par voie atmosphérique (Stock et al., 2007). Webster et Ellis (2010) ont proposé que les embruns pourraient être un mécanisme de production de l’APFO dans la phase gazeuse à partir de PFO dans un plan d’eau ayant le potentiel de fournir de grandes quantités d’APFOdans l’atmosphère et, donc, de fortement contribuer aux concentrations mesurées dans les régions éloignées.
Il est possible que la présence des PFC dans l’Arctique canadien puisse être due, en partie, à la présence d’anciennes bases militaires (Iqaluit, lac Sarcpa, île Resolution) ou aux stations du réseau d’alerte avancé [DEW] (côtes nord de l’Alaska jusqu’à Cape Dyer sur la côte de l’île de Baffin), qui ont pu utiliser des produits perfluorés (Stow et al., 2005; Poland et al., 2001). Ces sites sont considérés comme assainis, mais aucun PFC tel que l’APFO n’a été mesuré ou analysé, les publications disponibles (Stow et al., 2005; Poland et al., 2001) n’ayant déterminé que les concentrations de biphényles polychlorés (BPC) et de métaux pendant le processus d’assainissement. La présence d’APFO a été décelée dans les sites d’enfouissement de l’Arctique à des concentrations variant entre 22 et 1 083 ng/g (p. ex., décharges publiques, dépotoirs avec brûlage et décharges de déchets métalliques) [Ikonomou, 2006], ce qui semble indiquer qu’il existe des sources provenant d’activités locales de consommation ou de production. Néanmoins, l’APFO a été mesuré dans le biote et dans divers milieux naturels des régions éloignées de l’Arctique situées loin des sources locales ou régionales.
Une hypothèse a été avancée pour expliquer la présence d’APFOdans le biote de régions éloignées : un précurseur (p. ex., les FTOH) est émis dans l’atmosphère, puis se transforme en APFO par dégradation biotique et abiotique. Ellis et al. (2004a) ont montré que la durée de vie atmosphérique des FTOH à chaîne courte, sous l’effet d’une réaction avec des radicaux hydroxyles, était d’environ 20 jours. Piekarz et al. (2007) ont estimé que les temps de résidence dans l’atmosphère du FTOH 6:2, du FTOH 8:2 et du FTOH10:2 étaient respectivement de 50, 80 et 70 jours.
Shoeib et al. (2006) ont recueilli des échantillons d’air lorsqu’ils ont traversé l’Atlantique Nord et l’archipel de l’Arctique canadien en juillet 2005 pour étudier les concentrations des FTOH. Les concentrations les plus élevées de FTOH ont été mesurées pour le FTOH 8:2 (5,8 à 26 pg/m3), suivi par le FTOH 10:2 (1,9 à 17 pg/m3), puis le FTOH 6:2 (ND à 6,0 pg/m3). Ju et al. (2008) ont mesuré l’APFO dans la couche superficielle de la mer (interface eau-air) et les eaux subsuperficielles près des eaux côtières de Dalian, en Chine. Les concentrations d’APFO dans la couche superficielle variaient entre 0,26 et 1,19 ng/L. Dans les eaux subsuperficielles, les concentrations d’APFO allaient de 0,17 à 0,67 ng/L. La présence d’APFO dans les eaux océaniques indique un autre mécanisme possible pour le transport à grande distance jusque dans des régions éloignées comme l’Arctique canadien.
Des calculs de masse du transfert de PFO par le milieu marin vers l’Arctique ont donné un flux de 2 à 12 tonnes par année en utilisant un pKa variant de 2 à 3 à un pH de 4 et 7 (Prevedouros et al., 2006). Le flux net de PFO vers l’Arctique estimé par Armitage et al. (2006) était de 8 à 23 tonnes par année, calculé à l’aide d’un pKa variant de 2,5 à 2,8 à un pH de 5-8. L’APFO a été mesuré dans les calottes glaciaires polaires de trois régions dans l’Extrême Arctique (calotte glaciaire de Melville, Territoires du Nord-Ouest; calotte glaciaire d’Agassiz, Nunavut; calotte glaciaire de Devon, Nunavut) [Young et al., 2007]. Les concentrations variaient entre 0,012 et 0,147 ng/L, ce qui semble indiquer que la contamination pourrait résulter de l’apport atmosphérique. Aucune tendance significative n’a été observée pour les concentrations d’APFO entre 1996 et 2005 (analyse de régression, p = 0,140) [Young et al., 2007]. Les flux ont été calculés à l’aide de la concentration corrigée en fonction de la densité, multipliée par l’accumulation annuelle. Ces flux sont des estimations et pourraient ne pas être représentatifs des dépôts réels dans cette région, étant donné les variations importantes des taux de précipitation. Le flux de l’APFO était de 114 à 587 kg/an en 2005 (Young et al., 2007).
En résumé, l’APFO peut être transporté sur une grande distance et les données montrent qu’il est persistant, et des études indiquent l’absence de dégradation abiotique ou biotique dans l’environnement dans des conditions ambiantes normales. Par conséquent, d’après les données empiriques et les propriétés physiques et chimiques, l’APFO et ses sels répondent aux critères de persistance dans l’eau, le sol, les sédiments et l’air (demi-vie dans le sol et dans l’eau ≥ 182 jours et demi-vie dans les sédiments ≥ 365 jours; demi-vie dans l’air ≥ 2 jours ou preuve d’un transport atmosphérique vers des régions éloignées comme l’Arctique) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Bioaccumulation
Les APFC, y compris l’APFO, sont des molécules qui possèdent des portions oléophobes, des portions hydrophobes et des portions hydrophiles, et combinent donc toutes ces propriétés. Par exemple, le groupement carboxylate lié à la chaîne perfluorée rend la molécule polaire. Compte tenu de ces propriétés, l’hypothèse selon laquelle les interactions hydrophobes et lipophiles entre le composé et le substrat sont les principaux mécanismes qui régissent la répartition ne s’applique pas dans le cas de l’APFO. Bien que le coefficient de partage octanol-eau (Koe) ait été calculé ou modélisé pour la forme neutre de l’APFO et ses divers sels (voir tableau 2), la documentation actuelle laisse entendre que le Koe constitue un paramètre problématique dans le cas des agents tensioactifs ionisés, qui ont tendance à s’agréger à l’interface d’un système liquide-liquide. Par conséquent, le Koe n’a pas été considéré comme étant un indicateur fiable du potentiel de bioaccumulation des substances perfluorées. Toutefois, Webster et Ellis (2011) mentionnent que les APFC, y compris l’APFO, ne sont pas tensioactifs et que le Koe est une variable explicative de la répartition des lipides et des protéines dans le biote. Par conséquent, les auteurs affirment que les modèles de répartition à l’équilibre pour la répartition des molécules neutres hydrophobes des APFC, y compris l’APFO, sont applicables.
Des critères réglementaires (facteurs de bioconcentration [FBC] et facteurs de bioaccumulation [FBA]) définissant si une substance donnée doit ou non être considérée comme bioaccumulable ont été établis en application de la LCPE (1999) [Canada, 1999]. Cependant, ces critères sont fondés sur des connaissances accumulées au fil du temps sur des substances organiques neutres non métabolisées. Ces critères, fondés sur les critères de persistance et de bioaccumulation définis dans la Politique de gestion des substances toxiques (PGST) fédérale, ont été élaborés au milieu des années 1990 et officiellement publiés en 1995 (Canada, 1995b), et ils visent à identifier les substances lipophiles susceptibles de se bioaccumuler essentiellement dans les systèmes aquatiques d’eau douce (poissons). Les substances qui répondent aux critères définis (soit FBA ou FBC ≥ 5 000 ou log Koe≥ 5) sont fortement susceptibles de se bioaccumuler dans un organisme donné et de se bioamplifier à l’intérieur du réseau trophique. Toutefois, les FBA, les FBC ou le log Koe ne sont que quelques-uns des éléments formant le poids de la preuve qui détermine le potentiel général d’une substance à s’accumuler dans les organismes. En outre, une substance peut être jugée suffisamment bioaccumulable pour susciter des préoccupations même si les critères réglementaires ne sont pas atteints.
Étant donné le nombre d’études expérimentales disponibles, dans le cadre de la présente évaluation, l’accent a été placé sur les résultats des études expérimentales sur la bioaccumulation et la bioamplification.
Études sur la bioaccumulation, la bioconcentration et la bioamplification
L’APFO est absorbé dans les truites arc-en-ciel (Oncorhynchus mykiss) juvéniles, qui présentent un FBC de 4,0 (Martin et al., 2003b). L’exposition à l’APFO par voie alimentaire chez la même espèce n’a pas entraîné de bioaccumulation (FBA = 0,038) (Martin et al., 2003b). Des carpes (Cyprinus carpio) ont été exposées à deux concentrations d’APFO (5 et 50 µg/L) pendant 28 jours dans un système à recirculation d’eau (Kurume Laboratory, 2001). La substance chimique a été préparée en vue de l’exposition à l’aide d’un dispersant composé d’huile de ricin hydrogénée et mélangé dans de l’acétone. La qualité de l’eau a fait l’objet d’un suivi quotidien pendant la durée de l’expérience. Les FBC variaient de 3,1, à la plus faible concentration, à < 5,1-9,1, à la concentration élevée, ce qui révèle une faible bioaccumulation (Kurume Laboratory, 2001). Les expériences menées avec des poissons et d’autres espèces aquatiques montrent que la bioaccumulation de l’APFO est faible, mais il faut se garder d’extrapoler les résultats à d’autres animaux non aquatiques. Ainsi, les branchies des poissons peuvent être des véhicules d’élimination et d’absorption supplémentaires dont les organismes qui respirent dans l’air comme les oiseaux, les organismes terrestres et les mammifères marins ne sont pas dotés (Kelly et al., 2004). En raison de sa grande solubilité dans l’eau, l’APFO a tendance à se libérer assez facilement dans ce milieu par les branchies, alors qu’il lui est relativement difficile d’en faire autant dans l’air par la paroi alvéolaire des poumons, compte tenu de sa faible pression de vapeur et de sa charge négative. Par exemple, la demi-vie de l’APFO était de trois jours chez le poisson (Martin et al., 2003a), tandis qu’elle était de 11 jours chez le rat mâle (Ylinen et Auriola, 1990), et elle était de 4,37 ans (Kudo et Kawashima, 2003) et de 3,8 ans (Olsen et al., 2007) chez l’être humain.
On a calculé le FBC propre à deux espèces de tortues sauvages (tortue à oreilles rouges, Trachemys scripta elegans; chinémyde de Reeves, Chinemys reevesii). Au Japon, ces tortues occupent le sommet de la chaîne alimentaire dans l’écosystème fluvial et possèdent de petits territoires (Morikawa et al., 2006). Les concentrations d’APFO dans l’eau de surface étaient comprises entre 16,7 et 87 100 ng/L, et on a observé la présence de cet acide dans presque tous les échantillons de sérum (91 sur 94), où ses concentrations allaient de moins de 200 à 870 000 ng/L. Les valeurs calculées des FBC dans le sérum allaient de 0,8 à 15,8 (Morikawa et al., 2006). Les auteurs ont noté une relation inverse entre les valeurs du FBC et les concentrations de l’APFO dans l’eau de surface, ce qui semble indiquer que l’absorption d’APFO par l’intestin pourrait être un processus saturable. Toutefois, il convient de noter que le FBC est en réalité un FBA, vu que les tortues sauvages n’étaient probablement pas exposées à l’APFOseulement dans l’eau de surface.
Kannan et al. (2005a) ont mesuré les concentrations d’APFO dans une chaîne alimentaire en milieu benthique dans les Grands Lacs. Ils ont constaté que, malgré sa présence à des concentrations relativement fortes dans l’eau, cet acide était absent chez les invertébrés ou les poissons. Les résultats préliminaires (inédits) d’une étude menée dans l’Arctique canadien révèlent un facteur de bioamplification (FBM) de 8 entre le foie du phoque annelé (Pusa hispida) et le foie de l’ours blanc (Ursus maritimus) [Butt et Smithwick, 2004]. Dans le réseau trophique pélagique du lac Ontario, les concentrations d’APFO n’augmentaient pas en fonction du niveau trophique (déterminé par des isotopes stables de l’azote) [Martin et al., 2004b]. En fait, elles étaient moindres chez le touladi (Salvelinus namaycush), prédateur au sommet de la chaîne alimentaire, que chez la mysis (Mysis relicta), un invertébré (tableau 5). Par exemple, on a calculé un facteur d’amplification trophique (FAT) pour l’APFO de 0,37 pour la relation chabot visqueux (Cottus cognatus)-Diporeia hoyi, un amphipode fouisseur; alors qu’au sommet de la chaîne alimentaire, le FATétait de 0,58 pour la relation Mysis relicta-gaspareau (Alosa pseudoharengus)-éperlan (Osmerus mordax)-touladi (Martin et al., 2004b). Les différences entre les FAT aux deux extrémités du réseau pourraient indiquer des différences selon qu’il s’agit de relations en milieu benthique ou en milieu pélagique. Les FAT inférieurs à 1 correspondent à l’absence de bioamplification. Dans une autre étude, les FBM, corrigés en fonction du niveau trophique, ont été calculés pour plusieurs biotes de l’Arctique (Tomy et al., 2004). Les auteurs ont déterminé les FAT pour l’ensemble du réseau trophique en fonction de la relation entre le δ15 N et la concentration du contaminant. Les niveaux trophiques ont été déterminés par rapport à celui d’un mollusque bivalve, qu’on suppose être au deuxième niveau trophique (c.-à-d. herbivore primaire). Pour chaque échantillon de zooplancton, de poisson et de mammifère marin, le niveau trophique a été déterminé à l’aide de la formule suivante :
NT consommateur = 2 + (δ15 N consommateur – δ15 N bivalve) / 3,8
où NT consommateur est le niveau trophique de l’organisme étudié et 3,8, le facteur d’enrichissement isotopique. Et les facteurs de bioamplification (FBMNT) propres à chaque espèce, corrigés en fonction du niveau trophique, ont été déterminés à l’aide de la formule suivante :
FBMNT = [prédateur] / [proie] / (NT prédateur/NT proie)
où [prédateur] et [proie] sont les concentrations, en poids humide, de l’analyte chez les espèces prédatrices et les espèces proies respectivement, et NT, le niveau trophique basé sur δ15 N propre aux prédateurs et aux proies. Les valeurs du FBM de l’APFO étaient souvent supérieures à 1, ce qui porte à croire que cet acide peut subir une bioamplification dans les chaînes alimentaires suivantes : bivalves (Mya truncata; Serripes groenlandica)-morse (Odobenus rosmarus), morue polaire (Boreogadus saida)-narval (Monodon monoceros) et morue-beluga (Delphinapterus leucas) [tableau 5]. Ces résultats pourraient refléter des différences liées aux niveaux trophiques, et peut-être pas seulement le potentiel de bioaccumulation de l’APFO (p. ex., le prédateur au sommet d’un des réseaux trophiquesétait un poisson, tandis que dans l’autre, c’était un mammifère).
Martin et al. (2004a) ont constaté que l’ours blanc, qui est au sommet du réseau trophique dans l’Arctique canadien, avait une teneur en AFPO supérieure à celle mesurée dans tous les autres organismes de cette région qui ont été examinés. Butt et al. (2008) ont déterminé les valeurs du FBM de l’APFO par région pour la relation phoque annelé-ours blanc, et elles étaient comprises entre 45 et 125. Ces valeurs ont été calculées en regroupant les populations de phoques annelés avec les populations d’ours blancs correspondantes situées dans des régions similaires de l’Arctique canadien. Tomy et al.(2009) ont calculé les FAT de l’APFOpour un réseau trophique marin dans l’ouest de l’Arctique canadien (île Hendrickson et île Holman) composé des espèces suivantes : béluga de la mer de Beaufort (Delphinapterus leucas), phoque annelé (Phoca hispida), morue polaire (Boreogadus saida), hareng du Pacifique (Clupea pallasi), cisco arctique (Coregonus autumnalis), un amphipode pélagique (Themisto libellula) et un copépode arctique (Calanus hyperboreus). Les FAT variaient entre 0,1 (phoque annelé-morue polaire) et 2,2 (morue polaire-Calanus hyperboreus).
Houde et al. (2005) ont calculé des FBM de 1,8 à 13 à partir d’homogénats de proies entières et des concentrations de la base conjuguée dans le corps entier de dauphins à gros nez (Tursiops truncatus) dans le réseau trophique de cette espèce à Charleston, en Caroline du Sud. Kelly et al.(2009) ont calculé un FAT de 3,28 dans le réseau trophique marin (macroalgues, bivalves, poissons, canards marins et bélugas) de l’Arctique canadien (région de la baie d’Hudson). Martine van den Heuvel-Greve et al.(2009) ont établi des FBM de 3,8 et de 23, respectivement, pour les réseaux trophiques pélagique et benthique ayant comme prédateur dominant le phoque commun (Phoca vitulina). Les FBM d’autres espèces dans l’estuaire Westerschelde, aux Pays-Bas, étaient compris entre 0,03 et 31.
Jeon et al. (2010a) ont étudié les effets de la salinité sur la bioaccumulation dans le corps entier des PFC, y compris des APFO, chez l’huître creuse du Pacifique (Crassostrea gigas). Avec l’augmentation de la salinité (10-34 unités de salinité pratiques [USP]), on a pu observer une variation du FBC de 0,8 à 3,0, tandis que le FBA a augmenté de 9,6 à 19,4. Les auteurs laissent entendre que l’accumulation accrue est due principalement à une augmentation de l’absorption alimentaire provoquée par une possible modification de la physiologie des huîtres avec les changements de salinité. Les auteurs laissent également entendre qu’il y a une augmentation de la sorption des PFC sur les matières particulaires, ce qui peut accroître les risques pour les organismes benthiques et les mollusques bivalves filtreurs.
Jeon et al. (2010b) ont déterminé les FBC des PFC, y compris l’APFO, dans le sérum et dans le foie du sébaste noir (Sebastes schlegeli) à divers taux de salinité (10, 17,5, 25 et 34 USP). La bioconcentration des PCF (à l’exception de l’APFO) était plus grande à 34 USP qu’aux autres taux de salinité. Les FBC dans le sérum variaient de 578 (à 10 USP) à 357 (à 34 USP). Les FBC dans le foie variaient de 73 à 93.
Kwadijk et al. (2010) ont déterminé les FBA entre l’eau et l’anguille (Anguilla anguilla) [filets de 30 à 45 cm] provenant de 21 sites aux Pays-Bas. Le FBA eau-anguille calculé pour l’APFO était de à 1,09 et le FBA pour l’isomère linéaire de l’APFO était de 1,12.
Le tableau 5 fournit un résumé des données disponibles sur la bioaccumulation.
| Espèces (tissu)[1] | FBA | FBC | FBM | FAT | Références |
|---|---|---|---|---|---|
| [1] Nom des espèces non mentionné dans le texte : méné à grosse tête (Pimephales promelas); sébaste atlantique (Sebastes mentella); mouette tridactyle (Rissa tridactyla); goéland bourgmestre (Larus hyperboreus). | |||||
| Truite arc-en-ciel juvénile (carcasses) | 0,038 | 4,0 | Martin et al., 2003a, b |
||
| Truite arc-en-ciel juvénile (foie) | 8,0 | Martin et al., 2003b | |||
| Truite arc-en-ciel juvénile (sang) | 27 | Martin et al., 2003b | |||
| Carpe | 3,1-9,1 | Kurume Laboratory, 2001 | |||
| Tortues sauvages (sérum) | 0,8-15,8 | Morikawa et al., 2006 | |||
| Méné à grosse tête (corps entier) | 1,8 | 3M Company, 1995 | |||
| Ours blanc (foie) : phoque annelé (foie) | 8 | Butt et Smithwick, 2004 | |||
| Ours blanc (foie) : phoque annelé (foie) | 45-125 | Butt et al., 2008 | |||
| Morse (foie) : bivalve (corps entier) | 1,8 | Tomy et al., 2004 | |||
| Narval (foie) : morue (corps entier) | 1,6 | Tomy et al., 2004 | |||
| Béluga (foie) : morue (corps entier) | 2,7 | Tomy et al., 2004 | |||
| Béluga (foie) : sébaste atlantique (foie) | 0,8 | Tomy et al., 2004 | |||
| Mouette tridactyle (foie) : morue (corps entier) | 0,3 | Tomy et al., 2004 | |||
| Goéland bourgmestre (foie) : morue (corps entier) | 0,6 | Tomy et al., 2004 | |||
| Morue polaire (corps entier) : zooplancton (corps entier) | 0,04 | Tomy et al., 2004 | |||
| Mysis relicta : gaspareau : éperlan : touladi; homogénats de corps entiers | 0,37-0,58 | Martin et al., 2004b | |||
| Phoque annelé/morue polaire (foie) | 0,1 | Tomy et al., 2009 | |||
| Béluga/morue polaire (foie) | 0,9 | Tomy et al., 2009 | |||
| Béluga/hareng du Pacifique (foie) | 1,3 | Tomy et al., 2009 | |||
| Béluga/cisco arctique (foie) | 0,7 | Tomy et al., 2009 | |||
| Morue (foie)/Calanus hyperboreus (corps entier) | 2,2 | Tomy et al., 2009 | |||
| Morue (foie)/Themisto libellula (corps entier) | 0,8 | Tomy et al., 2009 | |||
| Touladi : gaspareau | 0,63 | Martin et al., 2004b | |||
| Touladi : éperlan | 0,5 | Martin et al., 2004b | |||
| Touladi : chabot | 0,02 | Martin et al., 2004b | |||
| Dauphin à gros nez (corps entier) : proies (corps entiers) | 1,8-13 | Houde et al., 2005 | |||
| Sédiments : macroalgues : bivalves : poisson : canard marin : béluga | 3,28 | Kelly et al., 2009 | |||
| Zooplancton/hareng | 1,6 | van den Heuvel-Greve et al., 2009 | |||
| Hareng/bar commun | 0,6 | van den Heuvel-Greve et al., 2009 | |||
| Hareng/phoque commun | 14 | van den Heuvel-Greve et al., 2009 | |||
| Bar commun/phoque commun (réseau trophique benthique pour le phoque commun) |
23 | 1,2 | van den Heuvel-Greve et al., 2009 | ||
| Scrobiculaire/flet | 31 | van den Heuvel-Greve et al., 2009 | |||
| Arénicole/flet | 0,03 | van den Heuvel-Greve et al., 2009 | |||
| Flet/phoque commun (réseau trophique pélagique pour le phoque commun) |
3,8 | 1,2 | van den Heuvel-Greve et al., 2009 | ||
| Chlorella ellipsoidea/huître creuse du Pacifique | 9,6-19,4 | 0,8-3,0 | Jeon et al., 2010a | ||
| Eau/sédiments/anguille | 1,09-1,12 | Kwadijk et al., 2010 | |||
| Eau de mer/sébaste noir (sérum) | 357-578 | Jeon et al., 2010b | |||
| Eau de mer/sébaste noir (foie) | 73-93 | Jeon et al., 2010b | |||
La concentration minimale d’une substance dans un organisme qui cause un effet nocif (charge corporelle critique) sert à évaluer le potentiel de toxicité directe. D’un point de vue physiologique, c’est la concentration d’une substance au site de l’action toxique dans l’organisme qui détermine si une réponse est observée, peu importe la concentration extérieure. Lors de la détermination du potentiel de toxicité d’une substance pour les organismes consommateurs, c’est aussi la concentration dans le corps entier d’une proie qui est pertinente, étant donné que le prédateur consomme souvent la proie entière (y compris les tissus et les organes comme le foie et le sang). Puisque les substances perfluorées se répartissent dans le foie et le sang, on estime souvent que le site de l’action toxique est le foie. Ainsi, d’un point de vue toxicologique, la bioaccumulation (FBC, FBA et FBM) basée sur les concentrations dans certains organes, comme le foie, pourrait être plus pertinente pour prévoir le potentiel de toxicité directe pour cet organe (p. ex., la toxicité hépatique).
La bioaccumulation peut également indiquer soit une exposition directe pour les organismes qui ont accumulé de l’APFO, soit une exposition indirecte pour les organismes qui se nourrissent de proies contenant de l’APFO (par transfert dans la chaîne trophique). Cela est particulièrement vrai dans le cas des organismes des niveaux trophiques supérieurs (p. ex., l’ours blanc), pour lesquels il est impossible d’analyser le corps entier. Bien qu’il soit possible de mesurer la bioaccumulation dans le corps entier pour les espèces de petite taille des niveaux trophiques inférieurs, le statut trophique inférieur de l’organisme signifie que la bioaccumulation totale estimée des substances perfluorées pourrait être sous-estimée. Les FBC et, particulièrement, les FBM basés sur les concentrations dans le corps entier pourraient constituer une mesure utile du potentiel général de transfert dans la chaîne trophique. Conder et al. (2008) ont observé que la concentration d’acides perfluorés exprimée en fonction de la masse du corps entier était estimée être de 2 à 10 fois inférieure aux concentrations d’acides perfluorés dans le sang et le foie de la truite.
Ainsi, on considère que, d’après les données sur le corps entier, le potentiel de l’APFO à s’accumuler dans les espèces aquatiques varie de faible à modéré. Toutefois, selon les données propres aux organes, on peut considérer que l’APFOs’accumule et se bioamplifie dans les mammifères terrestres et marins. Par conséquent, d’après les données empiriques disponibles, l’APFO et ses sels ne répondent pas aux critères de bioaccumulation (FBA ou FBC ≥ 5 000) énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000a). Cependant, des données scientifiques indiquent que l’APFO et ses sels s’accumulent et se bioamplifient dans les mammifères terrestres et marins.
Évaluation de l’exposition environnementale
Air
Loewen et al. (2008) ont étudié les concentrations de FTOH dans l’atmosphère et dans les eaux lacustres le long d’un transect altitudinal dans l’Ouest canadien. Les échantillons d’eau ont été prélevés au lac Cedar (petit lac situé près de Golden, en Colombie-Britannique), au lac Bow dans le parc national Banff (Banff, Alberta) et à un autre petit lac sans nom situé aussi dans ce parc. Des échantillonneurs d’air passifs ont été installés en différents points d’un transect altitudinal (800 à 2 740 m au-dessus du niveau de la mer) allant de Golden, en Colombie-Britannique, jusqu’au parc national Banff. Loewen et al. (2008) ont noté que la quantité de FTOH 8:2 et 10:2 augmentait (< 2,0 ng/échantillonneur) avec l’altitude. Les concentrations d’APFO dans l’eau prélevée dans les lacs le long du transect altitudinal étaient inférieures à 0,001 ng/L. Aucune tendance bien définie n’a pu être dégagée entre l’altitude et les concentrations d’APFOdans l’eau des lacs.
Stock et al. (2007) ont recueilli des échantillons d’air sur l’île Cornwallis, au Nunavut, où les valeurs moyennes des concentrations totales de FTOH étaient comprises entre 2,8 (FTOH 10:2) et 14 pg/m3 (FTOH 8:2). Les auteurs ont également mesuré dans les particules une concentration moyenne d’APFO de 1,4 pg/m3.
Shoeib et al. (2006) ont recueilli 20 échantillons d’air à grand débit pendant une traversée de l’Atlantique Nord et de l’archipel de l’Arctique canadien en juillet 2005 (de Gothenburg, Suède, à Barrow, Alaska, en passant par l’Atlantique Nord et l’archipel canadien). Les concentrations les plus élevées (sommes des phases gazeuse et particulaire) de FTOH ont été mesurées pour le FTOH 8:2 (5,8 à 26 pg/m3), suivi par le FTOH 10:2 (1,9 à 17 pg/m3), puis le FTOH 6:2 (sous le seuil de détection à 6,0 pg/m3). Aux fins de comparaison, Shoeib et al. (2006) ont également recueilli des échantillons d’air en milieu semi-urbain à Toronto en mars 2006 et la concentration moyenne de FTOH 8:2 y était de 41 pg/m3. Dreyer et al. (2009) ont effectué un échantillonnage d’air à grand débit au-dessus de l’océan Atlantique, de l’océan Austral et de la mer Baltique. L’APFO a été détecté dans la fraction particulaire à une concentration maximale de 6 pg/m3. Le FTOH 6:2 et le FTOH 8:2 étaient les formes dominantes dans la fraction de la phase gazeuse. Les concentrations de FTOH 8:2 variaient entre 1,8 et 130 pg/m3. La somme de tous les FTOH (FTOH 4:2, FTOH 6:2, FTOH 8:2, FTOH 10:2 et FTOH 12:2) allait de 0,3 à 47 pg/m3.
Eau
Moody et al. (2002) ont mesuré les concentrations d’APFOdans les eaux de surface du ruisseau Etobicoke, un affluent du lac Ontario, à la suite d’un rejet accidentel de mousse extinctrice aqueuse. Le dysfonctionnement a provoqué le rejet de 22 000 L de mousse ignifuge et de 450 000 L d’eau provenant du système de gicleur dans les égouts pluviaux qui mènent au ruisseau Spring (distance de transport de 1,8 km environ), puis au ruisseau Etobicoke, qui se jette dans le lac Ontario. Ils ont également mesuré les concentrations de fond à un site en amont du lieu de rejet. Les résultats ont indiqué que les concentrations d’APFO en aval atteignaient 11,3 µg/L. La présence d’APFO a également été détectée au site en amont, en concentrations plus faibles (ND-0,033 µg/L).
Scott et al. (2009) ont échantillonné 38 rivières (en amont et en aval de zones peuplées) dans l’ensemble du Canada pour analyser les PFC au cours de la période de 2001 à 2008. Les concentrations d’APFO allaient de 4,4 × 10-5 à 0,0099 µg/L. Les concentrations maximales d’APFO ont été mesurées depuis les affluents du lac Érié jusqu’au fleuve Saint-Laurent. La plupart des sites en aval des zones urbaines présentaient des concentrations plus élevées que les sites en amont. Des sites de référence, tels que l’eau de fonte glaciaire en Colombie-Britannique, présentaient des concentrations d’APFOplus faibles.
Boulanger et al. (2004) ont mesuré les concentrations d’APFOdans les lacs Érié et Ontario, où ils ont prélevé des échantillons à une profondeur d’environ 4 m à quatre endroits dans chacun des lacs. Les sites d’échantillonnage ont été choisis de manière à prélever des eaux subissant l’influence de milieux urbains et des eaux dans des zones éloignées et à obtenir des échantillons dans les parties est, centrale et ouest de chaque lac. Les concentrations mesurées s’élevaient de 0,021à 0,047 µg/L dans le lac Érié et de 0,015 à 0,070 µg/L dans le lac Ontario. Cependant, l’étude ne précisait pas clairement quels échantillons avaient été prélevés dans des eaux subissant l’influence de milieux urbains et lesquels provenaient de zones éloignées. Muir et Scott (2003) ont mesuré les concentrations d’APFO dans les lacs Supérieur, Huron et Ontario (les lieux exacts des prélèvements n’étaient pas indiqués). Les concentrations étaient comprises entre 0,0015 et 0,0018 µg/L dans le lac Huron et entre < 0,00001 et 0,0007 µg/L dans le lac Supérieur. Dans le lac Ontario, à des profondeurs de 70 à 213 m, les concentrations allaient de 0,0023 à 0,011 µg/L, la concentration la plus élevée, soit 0,011 µg/L, a été mesurée à 213 m de profondeur. Dans une étude réalisée par Furdui et al.(2005), la mesure des concentrations d’APFO a été tentée dans les lacs Ontario, Érié et Huron et le chenal North (le long de la rive nord du lac Huron) à l’aide d’une méthode éliminant les étapes de l’extraction et de la concentration. Avec cette méthode, l’APFO a été mesuré seulement dans les lacs Ontario et Érié, à des concentrations allant de 0,002 à 0,007 µg/L. Scott et al. (2003, 2006b) ont montré la présence d’APFO dans les affluents des lacs Ontario et Érié. Dans six affluents du lac Ontario (le canal Welland et les rivières Trent, Black, Don, Genessee et Oswego), les concentrations d’APFO étaient comprises entre 0,0015 et 0,025 µg/L. Dans les quatre affluents du lac Érié (rivière Grand et ruisseaux Stoney, Sandusk et Talbot), elles variaient entre 0,0016 et 0,0093 µg/L. La concentration maximale d’APFO dans les eaux d’affluents du lac Ontario provenant de milieux urbains était de 0,02 µg/L (Myers et al., 2009).
En 2001, l’APFO a été mesuré dans les précipitations dans trois régions éloignées (lacs Turkey, en Ontario, Kejimkujik, en Nouvelle-Écosse, et Chapais, au Québec), où les concentrations allaient de < 0,0005 à 0,0031 µg/L (Scott et al., 2006b). Des échantillons d’eau de pluie ont été prélevés à Winnipeg, au Manitoba, mais aucun APFO n’a été détecté (la limite de détection de la méthode [LDM] était de 0,0072 µg/L) [Loewen et al., 2005]. Selon ces auteurs, cela pourrait être dû au fait que la LDM était relativement élevée et que les concentrations atmosphériques d’APFCétaient insuffisantes. Scott et al. (2006a) ont mesuré l’APFOdans les précipitations partout au Canada entre 2002 et 2004. En 2002, les concentrations d’APFO à Kejimkijik (site éloigné) variaient de < 0,0001 à 0,0031 µg/L. En 2002, à Algoma, en Ontario (site éloigné), les concentrations d’APFOallaient de < 0,0001 à 0,0061 µg/L. En 2003-2004, les concentrations d’APFO à deux sites urbains en Ontario (Egbert et North Toronto) étaient comprises entre 0,0007 et 0,0111 µg/L. En 2002, les concentrations d’APFO à l’île Saturna, en Colombie-Britannique (site rural), variaient de < 0,0001 à 0,002 µg/L.
Stock et al. (2007) ont analysé des échantillons d’eau prélevés de 2003 à 2005 dans trois lacs de l’Arctique (lacs Amituk, Resolute et Char) sur l’île Cornwallis, au Nunavut, et y ont mesuré des concentrations d’APFO variant entre 0,0009 et 0,014 µg/L. Ahrens et al. (2009) ont mesuré les quantités d’APFO le long du gradient longitudinal allant de Las Palmas (Espagne) à St. John’s, Terre-Neuve-et-Labrador, ainsi que le long du gradient latitudinal allant du golfe de Gascogne jusqu’au sud de l’océan Atlantique au printemps et à l’automne 2007. L’APFO n’a pas été détecté à des concentrations supérieures à la LDM, soit 0,0012 µg/L, dans la phase particulaire ni dans les échantillons d’eaux profondes prélevés à 200 m et à 3 800 m. Les concentrations d’APFO variaient entre 0,000 004 et 0,000 229 µg/L à 11 m, 2 m et directement à la surface. De plus, Ahrens et al. (2009) ont constaté qu’il existait une corrélation positive entre les concentrations d’APFO et d’acide perfluorononanoïque, ce qui indique un lien entre les sources des deux composés. Ahrens et al. (2010b) ont prélevé des échantillons d’eau de surface du 2 novembre au 30 décembre 2008 le long du gradient latitudinal allant de la mer du Nord (nord de l’Europe) à l’Antarctique. L’APFO a été trouvé dans 79 % des échantillons de la phase dissoute dont les concentrations variaient de < 5,2 × 10-6 à 0,000 223 µg/L. L’APFOn’a pas été détecté dans la phase particulaire. Del Vento et al. (2009) ont mesuré des concentrations d’APFOallant jusqu’à 0,000 448 µg/L dans l’eau de mer et variant de 3,4 × 10-5 à 0,002 282 µg/L dans la neige du golfe Amundsen.
L’APFOétait aussi le principal contaminant fluoré détecté dans les eaux des océans Pacifique et Atlantique et dans les eaux marines côtières de plusieurs endroits en Asie (Japon, Hong Kong, Chine et Corée) [Yamashita et al., 2005]. On a mesuré des concentrations d’APFO de 0,000 001 5 à 0,000 192 µg/L et des concentrations de PFOS de 1,1 × 10-6 à 0,0577 µg/L. Yamashita et al. (2005) ont également constaté que les échantillons d’eau de mer prélevés à des profondeurs supérieures à 1 000 m dans le Pacifique et la mer de Sulu contenaient de l’APFO à l’état de traces (valeurs non indiquées). La présence d’APFO a également été décelée dans la mer du Nord (dans les secteurs sud et est, dans l’estuaire de l’Elbe et dans la baie d’Helgoland) à des concentrations variant de 0,003 à 0,02 µg/L (Caliebe et al., 2004). En haute mer, cet acide a été détecté à une concentration de 0,0005 µg/L (Caliebe et al., 2004). On a également relevé la présence d’APFO dissous dans la baie de Tokyo, à des concentrations de 0,007 à 0,0182 µg/L (Masunaga et Odaka, 2005). Les concentrations d’APFO dans la saumure et la glace de mer se situaient dans la même plage de valeurs que les concentrations mesurées dans la neige.
Sédiments
Stock et al. (2007) ont mesuré l’APFO dans des carottes de sédiments prélevées dans trois lacs isolés de l’Arctique canadien (Amituk, Resolute et Char) sur l’île Cornwallis, au Nunavut, en 2003. Les concentrations d’APFO variaient entre 0,0023 et 0,00095 µg/g poids sec pour les carottes prélevées dans le lac Resolute et allaient jusqu’à 0,0017 µg/g poids sec pour celles prélevées dans le lac Char. Des échantillons de matières en suspension ont été prélevés dans la rivière Niagara, à Niagara-on-the-Lake, en vue du dosage de l’APFO. Les concentrations de cet acide ont augmenté légèrement entre 1980 et 2002, passant de < 0,0001 µg/g à < 0,0003 µg/g poids sec (Lucaciu et al., 2005). La concentration maximale de l’APFO mesurée dans les sédiments lacustres du lac Ontario était de 0,0066 µg/g (Myers et al., 2009).
Sols, eaux souterraines et végétation
Il n’existe pas actuellement de mesures des concentrations d’APFOdans les sols ou les eaux souterraines au Canada.
L’APFOa été mesuré à des concentrations allant de 0,055 à 0,174 µg/g dans des sols prélevés à Dalton, en Géorgie aux États-Unis (Ellington et al., 2005). De l’APFO a été détecté dans les eaux souterraines de sites où il y a eu des exercices militaires de lutte contre les incendies aux États-Unis (en Floride, au Nevada et au Missouri), où des mousses extinctrices à formation de pellicule aqueuse ont été utilisées (Schultz et al., 2004). Les concentrations allaient de ND à 6 570 µg/L. Le ministère de la Protection de l’environnement de la Virginie-Occidentale (West Virginia Department of Environmental Protection et al., 2003) a mesuré les concentrations d’APFO dans des échantillons d’eaux souterraines prélevés dans des puits d’eau potable, et celles-ci variaient de ND (< 0,01 µg/L) à 23,6 µg/L. Murakami et al. (2009) ont décelé la présence d’APFOdans des échantillons d’eaux souterrainex et d’eau de source prélevés de 0 à 33 m sous la surface du sol dans la région métropolitaine de Tokyo (Japon) de septembre à novembre 2006. Les concentrations allaient de 0,000 47 à 0,06 µg/L.
Biote
La base conjuguée de l’APFO a été détectée chez de nombreuses espèces sauvages dans le cadre d’études menées au Canada. Martin et al. (2004b) ont mesuré la présence d’APFO dans le corps entier de nombreuses espèces du lac Ontario, dont des invertébrés benthiques et pélagiques et diverses espèces de poissons. Dans le lac Ontario, les concentrations allaient de 0,001 à 0,09 µg/g poids humide, la concentration la plus élevée ayant été trouvée chez l’invertébré benthique Diporeia hoyi(Martin et al., 2004b). Ces données montrent que l’invertébré benthique Diporeia hoyi présentait les concentrations les plus élevées que tout autre organisme du lac Ontario (c.-à-d. 90 µg/kg) (y compris le touladi au sommet de la chaîne alimentaire) et indiquent que les sédiments pourraient être un réservoir d’APFO dans ce système (Martin et al., 2004b). Ces données ne signifient pas nécessairement que l’APFO se répartit fortement dans les sédiments aquatiques; il est plus probable que les précurseurs de l’APFO se répartissent dans les sédiments et libèrent ensuite de l’APFO à la suite de processus bactériens ou abiotiques (Martin et al., 2004b; Stock et al., 2007).
Après un déversement de mousse extinctrice dans le ruisseau Etobicoke, Moody et al. (2002) ont décelé la présence d’APFOdans le foie de ménés à nageoires rouges (Notropis cornutus), à des concentrations variant entre 0,006 et 0,091 µg/g en poids humide. Quarante-six homogénats de corps entiers de touladis prélevés dans les cinq Grands Lacs ont été analysés en 2001 (Furdui et al., 2007). Les concentrations d’APFOvariaient de 0,0007 µg/g poids humide, dans le lac Érié, à 0,0024 µg/g poids humide, dans le lac Michigan (Furdui et al., 2007).
Martin et al. (2004a) ont également montré la présence de l’APFO dans le foie d’ours blancs (0,0029 à 0,013 µg/g poids humide), tandis que les concentrations mesurées chez d’autres animaux de l’Arctique étaient inférieures à la limite de détection (c.-à-d. < 0,002 µg/g). Au Nunavut, cet acide a été détecté à l’état de traces dans le foie d’ombles chevaliers (Salvelinus alpinus) (ND), de lottes (Lota lota) [ND à 0,0265 µg/g poids humide], de caribous (Rangifer tarandus) [ND à 0,0122 µg/g poids humide], de phoques annelés (ND à 0,0087 µg/g poids humide) et de morses (ND à 0,0058 µg/g poids humide) (Ostertag et al., 2009). Powley et al. (2008) n’ont pas détecté d’APFO dans les échantillons de zooplancton (Calanis hyperboreus, Themisto libellula, Chaetognatha), de morue polaire (Boreogadus saida), de graisse, de sang ou de foie du phoque annelé (Phoca hispida) ni dans les échantillons de graisse, de sang ou de foie du phoque barbu (Erignathusbarbatus) prélevés près de l’île Banks (limite est de la mer de Beaufort dans les Territoires du Nord-Ouest). Il n’y avait toutefois qu’un petit nombre d’échantillons, soit entre 1 et 5. La limite de détection utilisée dans cette étude était de 0,0002 µg/g.
Des études menées aux États-Unis ont permis de détecter la base conjuguée de l’APFO dans une vaste gamme d’échantillons biotiques : poissons, myes, huîtres, oiseaux, visons et loutres. En général, les concentrations pouvaient être inférieures à la limite de détection (LD) ou supérieures à celle-ci jusqu’à 1,9345 µg/g poids humide, soit en plus grande quantité que dans la plupart des échantillons de biote prélevés au Canada. C’est à un exutoire de Guntersville, en Alabama, que la plus forte concentration a été mesurée, dans le foie d’une orphie (Giesy et Newsted, 2001). Des concentrations allant jusqu’à 0,450 µg/g poids humide ont été mesurées chez le grand cormoran (Phalacrocorax carbo) [Kannan et al., 2002]. Ces auteurs ont toutefois constaté que pour cette colonie de cormorans, le maximum (0,450 µg/g poids humide) semblait être une valeur aberrante étant donné qu’elle était 4,5 fois plus élevée que l’écart type de la moyenne. On n’a pas pu détecter la présence d’APFO dans les algues benthiques récoltées dans les rivières Raisin, Sainte-Claire et Calumet (limite de détection de 0,2 ng/g poids humide; Kannan et al., 2005a). L’APFO était l’un des principaux composés perfluorés présents (outre le PFOS) dans le plasma de tortues caouannes immatures (Caretta caretta) [0,000 493 à 0,008 14 µg/mL] et de tortues de Kemp immatures (Lepidochelys kempii) [0,002 77 à 0,004 25 µg/mL] capturées au large de la Caroline du Sud, de la Géorgie et de la Floride (Keller et al., 2005). La présence de PFC chez des tortues de mer juvéniles au stade pélagique peut indiquer la contamination d’un bassin océanique, car ces tortues s’alimentent à grande distance des influences continentales (Keller et al., 2005). Les mêmes auteurs ont aussi constaté qu’il n’y avait pas de différences significatives dans les concentrations d’APFO selon l’espèce, le sexe, l’âge ou le lieu. Toutefois, comme les sujets capturés étaient des juvéniles, il est normal qu’il n’y ait pas de différences en fonction du sexe et de l’âge.
Des études menées au Japon, en Chine, à Taiwan et en Corée ont permis de déceler la présence de la base conjuguée d’APFOdans un large éventail de biotes. Tseng et al. (2006) ont mesuré des concentrations d’APFO allant de 0,12 à 0,34 µg/g dans les huîtres (Crassostrea gigas), le bar du Japon (Lateolabrax japonicus) et le tilapia (Oreochromis sp.). Nakayama et al. (2008) n’ont pas détecté d’APFO (la limite de dosage était de 0,005 µg/g poids humide) dans le foie des grands cormorans sauvages du lac Biwa, au Japon. Des concentrations d’APFO ont été mesurées dans les jaunes d’œuf de l’aigrette garzette (Egretta garzetta), du pluvier petit-gravelot (Charadrius dubius) et du paradoxornis de Webb (Paradoxornis webbiana) recueillis autour du lac Shihwa, en Corée (Yoo et al., 2008). Les concentrations variaient de < 0,0008 à 0,0543 µg/g poids humide. Wang et al.(2008) ont mesuré des concentrations d’APFO dans les œufs d’oiseaux aquatiques (bihoreau gris [Nycticorax nycticorax], grande aigrette [Ardea alba] et aigrette garzette) dans le sud de la Chine, qui allaient de < 0,000 001 à 0,000 952 µg/g poids humide.
Des rats sauvages mâles (Rattus norvegicus) capturés au Japon, dans une UTEU, un port, deux zones industrielles, un port et un marché de fruits de mer, un marché et deux sites d’enfouissement (Yeung et al., 2009a), présentaient des concentrations d’APFO dans le sang entier variant entre 0,00006 et 0,00657 µg/mL. L’APFO a été trouvé dans le sérum sanguin de pandas géants (Ailuropoda melanoleuca) et de petits pandas (Ailurus fulgens) en captivité en Chine (Dai et al., 2006). Les concentrations sériques allaient de 0,00032 à 0,00156 µg/mL chez la première espèce et de 0,00033 à 0,00820 µg/mL chez la seconde. Des concentrations d’APFO, comprises entre 0,00004 et 0,00018 µg/mL, ont également été mesurées dans le sérum de tigres de Sibérie (Panthera tigris altaica) [Li et al., 2008b] du nord-est de la Chine, de l’extrême-est de la Russie et de la Corée du Nord. Dans une autre étude, le sérum de tigres du Bengale (Panthera tigris tigris) et de lions d’Afrique (Panthera leo) en captivité au parc Harbin Wildlife, en Chine, a été analysé (Li et al., 2008a). Les concentrations d’APFO mesurées étaient plus élevées chez le lion d’Afrique que chez le tigre du Bengale, ce qui semble indiquer qu’il existe des différences d’absorption de la substance à la suite d’une exposition ou de capacités métaboliques entre les deux espèces. Les concentrations d’APFO variaient entre ND et 0,000 097 8 µg/mL chez le tigre du Bengale et entre 0,000 286 et 0,001 04 µg/mL chez le lion d’Afrique.
Holmström et Berger (2008) n’ont trouvé aucun APFO dans le foie, les reins et les muscles des guillemots marmettes (Uria aalge) adultes, ni dans le foie des oisillons ou les œufs de cette espèce sur l’île Stora Karlsö dans la mer Baltique. De plus, aucun APFO n’a été décelé chez les harengs capturés à une distance de 150 km de Stora Karlsö (les harengs représentent une grande proportion de l’alimentation du guillemot marmette). L’APFO n’a pas été décelé dans le foie du fulmar boréal (Fulmarus glacialis) le long de la côte de Svalbard et de BjØrnØya dans la mer de Barents, dans l’Arctique norvégien (Knudsen et al., 2007). Les concentrations d’APFO dans le sang entier ont été mesurées chez des oiseaux aquatiques du golfe de Gdansk, en mer Baltique : macreuse noire (Melanitta nigra), eider à duvet (Somateria mollissima), plongeon catmarin (Gavia stellata), petit pingouin (Alca torda) et harelde kakawi (Clangula hyemalis). Les concentrations allaient de 0,00005 à 0,0018 µg/mL (Gulkowska et al., 2005). L’étude a également permis de mesurer des concentrations d’APFOdans le sang entier de la morue allant de 0,00005 à 0,0007 µg/mL. L’APFO a également été mesuré dans le foie de castors capturés en Pologne et les concentrations allaient de 0,000 28 à 0,000 29 µg/g poids humide (Taniyasu et al., 2005).
L’APFOn’était pas détectable chez le poisson, les oiseaux ou les mammifères marins au Groenland et dans les îles Féroé, sauf dans le foie de l’ours blanc (< 0,012 µg/g poids humide) et le foie du phoque annelé (< 0,012 µg/g poids humide); toutefois, ces valeurs étaient inférieures à la limite de dosage (Bossi et al., 2005). On a prélevé le foie de 35 ours blancs appartenant à deux sous-populations connues du nord et de l’ouest de l’Alaska (sous-population du sud de la mer de Beaufort, qui se répartit du cap Icy jusqu’à l’est de Paulatuk, au Canada, et sous-population des mers des Tchouktches et de Béring, qui vit près de la Russie et dans l’ouest de l’Alaska) de 1993 à 2002 (Kannan et al., 2005b). Les mâles adultes de la première et de la seconde de ces sous-populations affichaient respectivement des concentrations d’APFOoscillant entre 0,0013 et 0,013 µg/g poids humide et entre 0,001 et 0,0042 µg/g poids humide (Kannan et al., 2005b). Les auteurs ont également fait remarquer que l’analyse a été faite sur les données exprimées en fonction du poids humide, car la normalisation des concentrations en fonction des lipides ne réduisait pas la variabilité des données au sein d’une sous-population particulière. En outre, ils n’ont pas trouvé de différences significatives de concentrations d’APFO selon l’âge, le sexe ou la sous-population.
L’APFOn’a pas été décelé dans le foie, la graisse, les muscles ou les tissus de la rate chez le phoque commun (Phoca vitulina) dans la partie néerlandaise de la mer des Wadden (la limite de détection était de 0,062 µg/g poids humide) [Van de Vijver et al., 2005]. L’APFO a été mesuré dans le foie et le sérum des phoques du Baïkal (Pusa sibirica) du lac Baïkal, dans l’est de la Sibérie, en Russie (Ishibashi et al., 2008b). Les mâles et les femelles de cette espèce affichaient des concentrations d’APFOoscillant entre < 0,0015 et 0,0039 µg/g poids humide dans le foie, et entre < 0,000 33 et 0,0019 µg/g poids humide dans le sérum (Ishibashi et al., 2008b).
La présence d’APFO (0,0006 à 0,163 µg/g poids humide) a été détectée dans le plasma de dauphins à gros nez de la baie Delaware (Delaware), à Charleston (Caroline du Sud), dans la lagune d’Indian River (Floride) ainsi qu’aux Bermudes (Houde et al., 2005). Des interactions significatives entre l’âge et le lieu ont été observées pour les concentrations d’APFO dans le plasma, qui diminuaient de façon significative en fonction de l’âge chez les dauphins de Charleston et de la lagune d’Indian River. L’APFO a également été mesuré dans le plasma, le lait et l’urine de dauphins à gros nez sauvages dans la baie de Sarasota, en Floride (Houde et al., 2006). La concentration de cet acide variait de 0,0018 à 0,0068 µg/g poids humide dans le plasma, était de 0,0013 µg/g poids humide dans le lait et était inférieure à la LDM (0,000 06 µg/g poids humide) dans l’urine. La concentration d’APFO diminuait de façon significative en fonction de l’épaisseur de la couche de graisse (paramètre biologique lié à l’état corporel et à l’accumulation de contaminants). L’APFO a été trouvé dans des échantillons de foie de la sotalie de Chine (Sousa chinensis) et du marsouin aptère (Neophocaena phocaenoides) échoués à Hong Kong entre 2003 et 2007 (Yeung et al., 2009b). Les concentrations mesurées chez la première espèce étaient comprises entre 0,000 243 et 0,008 32 µg/g poids humide et, chez la deuxième espèce, elles variaient de < 0,000 25 à 0,000 859 µg/g poids humide. L’APFO a également été décelé à des concentrations inférieures à 0,0002 µg/gchez le dauphin de la Plata (Pontoporia blainvillei) et l’otarie à fourrure subantarctique (Arctocephalus tropicalis) capturés au sud du Brésil (Leonel et al., 2008). L’APFO et l’alcool télomérique 8:2 ont été trouvé dans l’urine de dauphins à gros nez appartenant à des populations situées au large de la Floride et de la Caroline du Sud (Houde et al., 2005). Les auteurs ont également constaté que la teneur en APFO du plasma diminuait en fonction de l’âge chez les dauphins des régions de Charleston (Caroline du Sud) et de la lagune d’Indian River (Floride).
Tendances temporelles et géographiques
Comme on n’a pas détecté d’APFO dans les œufs archivés de guillemots marmettes (Uria aalge) de la mer Baltique, de l’Islande, des îles Féroé, de la Suède et de la Norvège, aucune tendance temporelle des concentrations de cet acide n’a été établie (Holmström et al., 2005; Löfstrand et al., 2008). De même, il n’a pas été possible d’établir de tendances temporelles des concentrations d’APFOdans les œufs de faucon pèlerin (Falco peregrinus) archivés entre 1974 et 2007, car aucun APFO n’a été détecté. Il convient de noter qu’en raison du faible succès de reproduction au cours des 20 premières années, seuls quelques œufs ont été récoltés, et aucun œuf n’a été récolté entre 1987 et 1991. Par conséquent, tous les œufs récoltés jusqu’en 1999 ont été analysés individuellement, et les œufs ont été regroupés à partir de l’an 2000 (Holmström et al., 2010).
Toutefois, Verreault et al. (2007) ont examiné des œufs entiers fraîchement pondus dans deux colonies de goélands argentés (RØst et HØrnØya) au nord de la Norvège et ont constaté que les concentrations d’APFO avaient augmenté de façon significative de 1983 à 1993 dans la colonie de RØst, mais non dans la colonie de HØrnØya. Ils ont également observé une augmentation dans les deux colonies après 1993. Il a été constaté que les œufs de la colonie de RØst affichaient des concentrations d’APFO significativement plus élevées que ceux de la colonie de HØrnØya en 1993 et en 2003. Aucune tendance temporelle n’a été établie en ce qui concerne les échantillons de foie de guillemots de Brünnich (Uria lomvia) et de fulmars boréaux (Fulmaris glacialis) de l’île Prince Leopold dans l’Arctique canadien (Butt et al., 2007a). De même, aucune tendance temporelle des concentrations d’APFO n’a été établie pour le touladi capturé entre 1979 et 2004 dans le lac Ontario (Furdui et al., 2008) ni pour deux populations de phoques annelés (Phoca hispida) de l’Arctique canadien échantillonnées entre 1992 et 2005 (Butt et al., 2007b). O’Connell et al. (2010) ont analysé le plasma et le sérum de 163 tortues caouannes juvéniles (Caretta caretta) afin d’établir les tendances spatiales et temporelles des PFC. Les tortues ont été capturées sur une distance s’étendant jusqu’à 8,4 km de la rive la plus proche de Charleston (Caroline du Sud), du cap Canaveral (Floride), de Core Sound (Caroline du Nord), de la baie de Chesapeake (Maryland) et de la baie de Floride (Floride). Les concentrations d’APFOdans le plasma et le sérum variaient de < 7,6 × 10-5 à 0,000993 µg/g. Sur le plan spatial, les tortues de la baie de Floride ont accumulé plus d’APFO par rapport à d’autres APFC, ce qui indiquerait la présence de sources locales pour les tortues vivant dans la baie de Floride. Les tendances temporelles chez les tortues caouannes capturées près de Charleston ont été examinées sur une période de neuf ans; les concentrations d’APFO n’ont pas varié de façon significative dans le temps.
Cependant, des tendances temporelles des concentrations d’APFO ont été trouvées chez l’ours blanc de l’île de Baffin, au Canada, lequel présentait une augmentation de la contamination par cet acide dans le foie entre 1972 et 2002 (Smithwick et al., 2006). On a calculé que la teneur en APFO des tissus hépatiques avait doublé en 7,3 ± 2,8 ans chez l’ours blanc de l’île de Baffin et en 13,9 ± 14,2 ans chez l’ours blanc de Barrow, en Alaska. Smithwick et al. (2006) ont noté que le sexe et l’âge des ours blancs n’étaient pas corrélés de façon significative avec les concentrations d’APFO. Dietz et al.(2008) ont prélevé des sous-échantillons de tissus hépatiques chez 128 ours blancs subadultes (âgés de 3 à 5 ans) (provenant de la partie centrale de l’est du Groenland) pour 19 années d’échantillonnage au cours de la période 1984-2006, afin d’analyser les PFC, dont l’APFO. Les auteurs ont noté une augmentation annuelle de 2,3 % de la concentration d’APFO.
La teneur en APFO a été mesurée dans des tissus hépatiques prélevés chez 80 loutres de mer (Enhydra lutris) femelles adultes le long de la côte de la Californie. Au moment où ces animaux ont été trouvés sur les plages, ils étaient morts depuis peu. Les concentrations d’APFOdans le foie, comprises entre < 5 × 10-6 et 0,000147 µg/g poids humide, ont augmenté de 1992 à 2002 chez les femelles adultes (Kannan et al., 2006). En revanche, on n’a pas trouvé d’APFO chez les loutres de mer mâles adultes (limite de détection de 0,005 µg/g), et on ne connaît pas les raisons de cette absence de détection (Kannan et al., 2006).
Évaluation des effets sur l’environnement
Organismes aquatiques
L’algue d’eau douce Pseudokirchneriella subcapitataétait l’organisme pélagique le plus sensible. La concentration minimale avec effet observé (CMEO) [96 heures] fondée sur le taux de croissance et le nombre de cellules était de 2,0 mg/L (Ward et al., 1995b, 1995d).
L’algue d’eau douce Pseudokirchneriella subcapitataa fait l’objet de plusieurs essais de toxicité (Elnabarawy, 1981; Ward et al., 1995b, 1995d, 1996c, 1996e, 1996h; Boudreau, 2002; Thompson et al., 2004), et les valeurs estimées de la concentration efficace médiane (CE50) sur 96 heures allaient de 4,9 à plus de 3 330 mg/L (en fonction du taux de croissance) et de 2,9 à 1 980 mg/L (en fonction du nombre de cellules). Les valeurs de la concentration sans effet observé (CSEO; 96 heures) étaient de 1,0 à 500 mg/L et de 0,99 à 210 mg/L en fonction du taux de croissance et du nombre de cellules, respectivement. De même, la CMEO (96 heures) allait de 2,0 à 1 000 mg/L et de 2,0 à 430 mg/L en fonction du taux de croissance et du nombre de cellules, respectivement. Une valeur de CE50 (14 jours) a été établie à 43 mg/L pour cette algue (Elnabarawy, 1981). Les essais de toxicité sur cette algue comportaient l’utilisation de mélanges commerciaux des sels d’ammonium et de tétrabutylammonium de l’APFO et d’APFO de pureté élevée, ce qui peut expliquer l’étendue des gammes de valeurs enregistrées. Un autre essai de toxicité (Boudreau, 2002) sur l’algue d’eau douce Chlorella vulgaris réalisé avec de l’APFOde pureté élevée a donné une concentration inhibitrice médiane (CI50) après 96 heures (basée sur le taux de croissance) de 116 mg/L, ce qui montre qu’il pourrait y avoir de petites différences dans la sensibilité des deux espèces d’algues d’eau douce susmentionnées. Liu et al.(2008) ont effectué des mesures de cytométrie en flux pour étudier les effets de l’APFO sur les systèmes membraires de l’algue d’eau douce Scenedesmus obliquus. L’APFO n’a pas inhibé la croissance de l’algue à la concentration maximale de l’essai, soit 0,000 002 M (0,83 mg/L). Toutefois, on a observé des effets sur le potentiel de la membrane mitochondriale, et l’exposition à l’APFOà des concentrations allant de 0,000 001 M (0,41 mg/L) à 0,000 002 M (0,83 mg/L) a accru la perméabilité de la membrane. Ces résultats semblent indiquer que l’exposition à la concentration provoquant des perturbations de la fonction mitochondriale et de la perméabilité de la membrane ne provoque pas l’inhibition de la croissance de l’algue.
La bactérie Photobacterium phosphoreum a fait l’objet de six essais de toxicité Microtox avec des mélanges commerciaux des sels d’ammonium et de tétrabutylammonium de l’APFO (3M Company, 1987a, 1990a, 1996a, 1996b, 1996c; Beach, 1995a). La CE50 (30 minutes; basée sur le taux de bioluminescence) oscillait entre 260 et 3 150 mg/L. Il est difficile d’expliquer une telle amplitude; cela pourrait peut-être résulter du manque de caractérisation des mélanges commerciaux et de leurs impuretés.
Un essai de toxicité (Boudreau, 2002) sur le macrophyte aquatique Lemna gibba réalisé avec de l’APFO de pureté élevée a donné une CI50 sur 7 jours (basée sur le taux de croissance) de 80 mg/L.
La puce d’eau Daphnia magna a été soumise à plusieurs essais de toxicité avec des mélanges commerciaux à base d’APFO, les sels d’ammonium et de tétrabutylammonium de l’APFO et de l’APFO de pureté élevée (3M Company, 1982, 1984, 1987b; Ward et Boeri, 1990; Ward et al., 1995e, 1996a, 1996d, 1996g; CIT, 2003; Boudreau, 2002). La concentration létale médiane (CL50) [48 heures] (basée sur le taux de mortalité) était comprise entre 77 et 1550 mg/L, alors que la CE50(48 heures) [basée sur l’immobilisation des sujets], était entre 34 et 1 200 mg/L. Il est difficile d’expliquer une telle amplitude. Cela pourrait peut-être résulter du manque de caractérisation des mélanges commerciaux et de leurs impuretés ou, comme le laissent entendre Ward et al. (1996a), de la variabilité du régime alimentaire de l’organisme testé. La CSEO(48 heures) [basée sur l’immobilisation des sujets] était de 13 à 730 mg/L et la CSEO (21 jours) [basée sur le taux de survie, la capacité de reproduction ou la longueur du parent], de 13 à 89 mg/L. Une étude a donné une CE50 (21 jours) [basée sur la capacité de reproduction] de 39,6 mg/L (CIT, 2003). Une étude de toxicité (Boudreau, 2002) sur la puce d’eau Daphnia pulicariaeffectuée avec de l’APFO de pureté élevée a donné une CL50 (48 heures; basée sur le taux de mortalité) et une CE50 (48 heures; basée sur l’immobilisation des sujets) de 277 et 204 mg/L, respectivement. Ces résultats montrent qu’il pourrait y avoir de légères différences dans la sensibilité des deux espèces de Daphnia. Kim et al. (2009) ont réalisé des essais de toxicité aiguë, de reproduction et de développement embryonnaire sur Daphnia magna. La CE50 (48 heures) de l’APFO était de 253,5 mg/L et la CSEO, de 100 mg/L. L’APFO a causé une diminution de la fécondité à 10 mg/L ainsi qu’une létalité embryonnaire (interruption du développement des œufs) et des malformations chez les néonates (épine caudale recourbée ou non déployée et deuxième antenne non développée) à 125 mg/L.
Li (2008) a réalisé des essais de toxicité sur un planaire d’eau douce (Dugesia japonica), un gastéropode d’eau douce (Physa acuta), la puce d’eau (Daphnia magna) et la crevette cerise (Neocaridina denticulata). Pour le planaire d’eau douce, la CL50 (96 heures) était comprise entre 318 et 357 mg/L, et la CSEO était de 150 mg/L; pour le gastéropode d’eau douce, la CL50 (96 heures) était comprise entre 635 et 711 mg/L, et la CSEOétait de 250 mg/L. Pour Daphnia magna, la CL50(48 heures) était comprise entre 166 et 198 mg/L, et la CSEOétait de 125 mg/L; et pour la crevette cerise, la CL50(96 heures) allait de 418 à 494 mg/L, et la CSEO était de 250 mg/L.
Le méné à grosse tête a été soumis à plusieurs essais de toxicité avec des mélanges commerciaux à base d’APFO et des sels d’ammonium et de tétrabutylammonium de l’APFO (3M Company, 1977, 1985a, 1987c; Elnabarawy, 1980; Ward et al., 1995a, 1995c, 1996b, 1996f, 1996i, 1996j). La CL50 (96 heures) allait de 70 à 2 470 mg/L et la CSEO(96 heures) [basée sur le taux de mortalité], de 110 à 830 mg/L. Il est difficile d’expliquer une telle amplitude; cela pourrait toutefois résulter du manque de caractérisation des mélanges commerciaux et de leurs impuretés. Des études de la toxicité du sel d’ammonium sur le crapet arlequin ont été menées (3M Company, 1978a, 1978b); la gamme des valeurs de la CL50(96 heures) allait de > 420 à 569 mg/L.
Deux études de la toxicité du sel de sodium de l’APFO(pureté élevée) ont également été réalisées sur des communautés pélagiques entières, à l’aide de microcosmes constitués d’une communauté de zooplancton et mélangés avec de gros invertébrés sur une période de 35 jours (Sanderson et al., 2003, 2004). D’après les résultats de ces études, les valeurs de CMEO propres aux individus et aux communautés variaient entre 10 et 70 mg/L. Des mesures de la toxicité du sel de sodium de l’APFO sur les macrophytes aquatiques Myriophyllum sibiricum et M. spicatumont été réalisées dans des microcosmes extérieurs de 12 000 L sur une période de 35 jours (Hanson et al., 2005). Les doses appliquées étaient de 0,3, 1, 30 et 100 mg/L. Les paramètres mesurés étaient la croissance, la biomasse, le nombre de racines, la longueur des racines primaires et le nombre de nœuds. D’après les résultats, les deux espèces de Myriophyllum présentaient une sensibilité à l’APFOcomparable. Dans les deux cas, la CSEO était supérieure ou égale à 23,9 mg/L (Hanson et al., 2005).
Oiseaux
O’Brien et al. (2009) ont signalé que l’APFOlinéaire injecté dans l’alvéole d’œufs de poules Leghorn blanches n’avait pas d’effet sur le bêchage des embryons à des concentrations allant jusqu’à 10 mg/g de poids humide d’embryon, et que l’APFO s’accumulait dans le foie de ces embryons à des concentrations de 2,9 à 4,5 fois supérieures à celles présentes initialement dans les œufs entiers. Yeung et al. (2009c) ont exposé des poulets mâles âgés d’une journée à un mélange de PFOS, d’APFO et de perfluorodécanoate (PFDA) à des doses allant de 0,1 mg/kg poids corporel (p.c.) à 1,0 mg/kg p.c. pendant trois semaines. Il a été conclu que l’exposition à un mélange de PFOS, d’APFO et de PFDA à une dose de 1,0 mg/kg p.c. n’avait aucun effet nocif sur les poulets juvéniles. La demi-vie de l’APFO aux deux doses était de 3,9.
Organismes bactériens
Des essais de toxicité de l’APFO et de ses sels ont été effectués avec un mélange de boues activées et de liqueur mixte (obtenu d’une UTEU de St. Paul, au Minnesota). Il convient cependant de noter que les bactéries présentes dans les boues activées ont été choisies en fonction de leur capacité de se développer en présence de substances chimiques d’origine anthropique, de sorte que les essais utilisant de telles bactéries pourraient sous-estimer la toxicité. Au total, cinq essais de toxicité ont été effectués sur un mélange de boues activées et de liqueur mixte avec des mélanges commerciaux des sels d’ammonium et de tétrabutylammonium de l’APFO (3M Company, 1980a, 1990b, 1996d; Beach, 1995b). La CE50 (3 heures) [basée sur l’inhibition de la respiration] allait de > 1 000 à > 3 320 mg/L. De plus, la CSEO (7 minutes) [basée sur l’inhibition de la respiration] était de 1 000 mg/L (3M Company, 1980a).
Invertébrés benthiques
MacDonald et al. (2004) ont mesuré la toxicité de l’APFO de pureté élevée sur le chironomidé aquatique Chironomus tentans. Aucune toxicité n’a été observée aux concentrations d’essai. La CSEO sur 10 jours (basée sur les taux de survie et de croissance) a donc été établie à 100 mg/L.
Organismes endogés
D’après Tominaga et al. (2004), le nématode Caenorhabditis elegans – un invertébré endogé, c.-à-d. qui vit dans le sol – s’est révélé un organisme pouvant être soumis à des essais, car il présente des effets létaux et sublétaux au cours des évaluations écotoxicologiques de milieux liquides et de sols. Ces auteurs ont étudié la toxicité létale aiguë et la toxicité sublétale sur plusieurs générations (fécondité et reproduction) en utilisant des concentrations d’APFO de 0 mM (mmol/L) [0 mg/L], 0,01 mM (4,14 mg/L), 0,1 mM (41,4 mg/L), 0,5 mM (207 mg/L), 1,0 mM (414,07 mg/L) et 5,0 mM (2100 mg/L) pendant 48 heures. Toutes les concentrations jusqu’à 0,1 mM (41,4 mg/L) n’ont pas entraîné de létalité aiguë jusqu’à concurrence de 48 heures. La létalité aiguë s’est manifestée à des concentrations supérieures à 0,5 mM (207 mg/L) et elle ne dépendait pas de la durée d’incubation. La CE50 a été calculée après une heure (3,85 mM ou 1 590 mg/L), deux heures (2,80 mM ou 1 160 mg/L), trois heures (2,70 mM ou 1 120 mg/L), quatre heures (2,65 mM ou 1 100 mg/L), 24 heures (2,75 mM ou 1 140 mg/L) et 48 heures (2,35 mM ou 973 mg/L) [Tominaga et al., 2004]. L’essai de toxicité sur plusieurs générations n’a pas permis d’observer de relations génération-réponse et concentration-réponse dans le cas de l’APFO.
Plantes terrestres
Li (2008) a réalisé des essais de toxicité sur la germination des graines et sur l’élongation des racines sur 5 jours sur la laitue (Lactuca sativa), le concombre (Cucumis sativus) et le pak-choï (Brassica rapa chinensis). L’APFOn’a eu aucun effet sur la germination des graines de concombre, les valeurs de la CL50 et de la CSEO étant supérieures à 2 000 mg/L. La CL50 et la CSEOpour la germination des graines de laitue étaient de 1 734 et de 1 000 mg/L, respectivement. Pour la germination des graines de pak-choï, la CL50 était de 579 mg/L et la CSEO, de 250 mg/L. La CE50 pour l’élongation des racines de ces trois espèces variait entre 263 et 1 254 mg/L. L’APFO a inhibé presque entièrement la croissance des racines de la laitue et du pak-choï à des concentrations supérieures ou égales à 1 000 mg/L. La CSEO pour l’élongation des racines de ces trois espèces variait entre < 62,5 et 250 mg/L.
Stahl et al. (2009) ont étudié le transfert sol-plante d’un mélange d’APFO et de PFOS chez le blé de printemps, l’avoine, la pomme de terre, le maïs et l’ivraie vivace. Les concentrations étaient comprises entre 0,25 et 50 mg/kg d’APFO-PFOS sous forme de solution aqueuse. Les concentrations d’APFO étaient supérieures à celles de PFOS dans toutes les plantes, sauf dans la pomme de terre, qui affichait une absorption et une accumulation plus fortes dans la partie végétative que dans l’organe de réserve. Des anomalies visibles ont été observées à des concentrations supérieures à 10 mg/kg. On a observé, entre 25 et 50 mg/kg d’APFO-PFOS, des nécroses chez l’avoine et la pomme de terre, un jaunissement des feuilles de l’ivraie et une diminution de la croissance du blé de printemps.
Mammifères terrestres
Butenhoff et al. (2002) ont mené une étude par gavage d’une durée de 26 semaines sur des singes cynomolgus; la dose minimale avec effet nocif observé (DMENO) était de 3 mg/kg p.c. par jour chez les mâles pour des concentrations sériques présentant des effets réversibles sur le foie et des augmentations relatives du poids du foie sans effets histopathologiques. Une concentration moyenne d’APFO dans le foie de 15,8 µg/g a été mesurée à la 27e semaine chez les sujets du groupe recevant le traitement de 3 mg/kg p.c. par jour (c.-à-d. la DMENO). D’autres études sur les mammifères sont présentées dans la section sur l’évaluation des risques pour la santé humaine du présent ce document.
Autres effets
Liu et al. (2007a) ont utilisé le tilapia du Nil (Oreochromis niloticus) mâle comme modèle in vitro pour détecter l’induction de la vitellogénine. La vitellogénine est une protéine précurseur du vitellus exprimée chez les femelles de poissons, d’amphibiens, de reptiles (y compris les oiseaux), d’insectes et d’ornithorynque. En présence de substances qui ont un effet sur le système endocrinien, les mâles peuvent également exprimer le gène de la vitellogénine. Des hépatocytes de tilapia mâle en culture ont été exposés pendant 48 heures à l’APFO ainsi qu’aux FTOH 4:2, FTOH 6:2 et FTOH 8:2. Une induction de la vitellogénine proportionnelle à la dose a été observée dans les cellules traitées à l’APFO et au FTOH 6:2, alors que la vitellogénine est demeurée inchangée dans les cellules traitées au FTOH 4:2 et au FTOH8:2. Les valeurs estimées de la CE50 après 48 heures étaient de 2,9 × 10-5 M (12 mg/L) pour l’APFO et de 2,8 × 10-5 M (12,9 mg/L) pour le FTOH 6:2. Dans le cadre de l’étude, l’induction de la vitellogénine s’est produite en 48 heures (APFO), en 72 heures (FTOH 4:2), en 12 heures (FTOH 6:2) et en 72 heures (FTOH 8:2), puis s’est accrue après 96 heures d’exposition. La coexposition à un mélange de PFC et à l’estradiol pendant 48 heures a entraîné l’inhibition significative proportionnelle à la dose de la production de vitellogénine dans les cellules hépatiques induite par l’estradiol, sauf dans le cas du FTOH 4:2. Les valeurs estimées de la CI50 après 48 heures étaient de 5,1 × 10-7 M (0,21 mg/L) pour l’APFO, de 1,1 × 10-6 M (0,51 mg/L) pour le FTOH 6:2 et de 7,5 × 10-7 M (0,35 mg/L) pour le FTOH 8:2. Afin d’étudier le mécanisme œstrogénique de façon plus approfondie, les hépatocytes ont été coexposés pendant 48 heures à un mélange d’APFO et de FTOH 6:2, et au tamoxifène, inhibiteur connu du récepteur des œstrogènes. Les résultats généraux démontrent que l’APFO et les FTOH sont des substances ayant des activités œstrogéniques et que l’exposition à une combinaison d’estradiol et d’APFO ou de FTOH produit des effets antiœstrogéniques. Les résultats de l’essai sur l’inhibition du récepteur des œstrogènes semblent aussi indiquer que l’effet œstrogénique de l’APFO et des FTOH pourrait être induit par les voies de signalisation du récepteur des œstrogènes dans les hépatocytes de tilapia en culture primaire.
Wei et al. (2008a) ont examiné les effets de l’APFO sur des Gobiocypris rarus mâles et femelles en les exposant à des concentrations de 3, 10 et 30 mg/L de cette substance pendant 28 jours. Une exposition à des concentrations d’APFO de 3 mg/L a entraîné une hypertrophie hépatocellulaire modérée dans le foie des poissons mâles et femelles. Les mâles exposés à des concentrations de 10 mg/L d’APFO affichaient des gouttelettes hyalines éosinophiles dans le cytoplasme des hépatocytes; les femelles affichaient plus de gouttelettes hyalines éosinophiles dans le cytoplasme des hépatocytes, une hypertrophie hépatocellulaire et une dégénérescence vacuolaire. On a observé chez les poissons exposés à des concentrations de 30 mg/L d’APFO des changements histopathologiques hépatiques graves ainsi qu’une perturbation des fonctions mitochondriales. L’inhibition des gènes associés à la biosynthèse des hormones thyroïdiennes et l’induction des gènes sensibles à l’œstrogène pourraient indiquer que cet acide influe sur le système endocrinien. Wei et al.(2008b) ont précisé les biomarqueurs protéiques possibles de l’exposition du foie des Gobiocypris rarus à des concentrations de 3, 10 et 30 mg/L d’APFO pendant 28 jours, et ont trouvé 34 et 48 spots protéiques modifiés chez les mâles et les femelles, respectivement. Ces protéines contribuaient au transport intracellulaire des acides gras, au stress oxydatif, au catabolisme des macromolécules, au cycle cellulaire, au maintien de l’homéostasie intracellulaire du Ca2+ et à la fonction mitochondriale. Wei et al. (2007) ont étudié les effets in vivo de l’APFO d’origine hydrique sur l’expression des gènes hépatiques sensibles à l’œstrogène, la vitellogénine, les récepteurs des œstrogènes et le développement des gonades chez le cyprin d’eau douce Gobiocypris rarus. On a observé dans cette étude une dégénérescence des ovocytes au cours de la vitellogenèse (atrésie) dans les ovaires des femelles matures exposées à 3, 10 et 30 mg/L d’APFO pendant 28 jours. Chez les mâles exposés à 10 mg/L d’APFO, des ovocytes de premier ordre (ovocytes en prévitellogenèse) se sont développés dans des testicules. Chez les sujets exposés à des concentrations de 10 et 30 mg/L d’APFO, le nombre de spermatozoïdes et de cellules germinales à divers stades de la spermatogenèse était inférieur à celui observé chez les témoins mâles. L’APFO a provoqué une augmentation de la concentration de vitellogénine hépatique et le développement de gonades de type ovotestis chez les poissons mâles matures exposés à des concentrations de 10 et 30 mg/L de la substance pendant 28 jours. Wei et al. (2007) ont montré que l’APFO pouvait perturber l’activité de l’œstrogène en induisant les gènes hépatiques sensibles à l’œstrogène chez les mâles, bien que le mécanisme de développement des ovotestis chez le Gobiocypris rarus suivant une exposition à l’APFO ne soit pas connu.
Stevenson et al. (2006) ont étudié la toxicité de l’APFO pour le mécanisme de défense multixénobiotique chez la moule de Californie (Mytilus californianus). Ce mécanisme agit comme première ligne de défense des cellules contre les grandes classes de xénobiotiques en exportant des substances chimiques modérément hydrophobes à partir des cellules par l’intermédiaire de protéines de transport transmembranaires dépendantes de l’adénosine triphosphate (ATP). Le transporteur le plus étudié est la glycoprotéine P, qui est un mécanisme de défense fragile et peut être perturbé par certains xénobiotiques. L’accroissement de la sensibilité du sujet, appelé chimiosensibilisation, est dû à la capacité de la glycoprotéine P de reconnaître de multiples substrats xénobiotiques et de s’y lier, ce qui entraîne la saturation de la capacité de fixation. Même des substances non toxiques peuvent être des chimiosensibilisateurs et produire des effets néfastes sur des organismes vivants en permettant aux substances toxiques normalement exclues de s’accumuler dans la cellule. Stevenson et al. (2006) ont constaté que l’APFO, à une concentration de 50 µM (20 mg/L), était un important inhibiteur de la glycoprotéine P chez la moule de Californie et qu’il est donc un chimiosensibilisateur pour cet organisme. L’étude a également révélé que l’inhibition observée est réversible lorsque la moule est retirée du milieu contaminé, puis placée dans de l’eau de mer propre.
Ishibashi et al. (2008b) ont montré que l’APFO stimule le récepteur α activé par les proliférateurs des peroxysomes (PPARα) dans le foie des phoques du Baïkal; il s’agit de la première identification signalée de l’acide désoxyribonucléique (ADN) complémentaire du PPARαchez une espèce aquatique sauvage. Le PPAR fait partie de la superfamille des récepteurs nucléaires des hormones activés par des ligands. Le PPARαjoue un rôle physiologique essentiel comme détecteur de lipides et régulateur du métabolisme lipidique. La CMEO était de 62,5 µM (25,9 mg/L) pour l’APFO. Yang (2010) a exposé des medaka japonais (Oryzias latipes) mâles à 10, 50 et 100 mg/L d’APFO pendant sept jours. Il n’y a eu aucune incidence sur la survie, le poids relatif du foie et la taille des gonades, ainsi que sur le coefficient de condition, et ce, à toutes les concentrations. Toutefois, à de fortes doses, l’APFO a induit l’inhibition de l’activité de la catalase sans modification des activités de la superoxyde dismutase ou de la glutathion peroxydase dans le foie, ce qui laisse penser que l’APFO pourrait induire l’oxydation péroxysomale des acides gras et causer un stress oxydatif par l’altération de l’homéostasie oxydative cellulaire dans le foie. L’APFO a également augmenté les niveaux d’acide ribonucléique messager (ARNm) des cytokines pro-inflammatoires, ce qui laisse penser qu’il peut être impliqué dans l’inflammation et les dommages aux tissus. Les effets sur la prolifération des péroxysomes et l’expression de la cytokine indiquent qu’une exposition chronique à l’APFO peut être cancérogène chez le medaka japonais : la prolifération des péroxysomes est un mécanisme cancérogène déterminant et l’inflammation chronique est associée à un risque accru de cancer chez les rongeurs.
L’impact potentiel de l’exposition aux PFC sur les lésions hépatiques a été étudié chez les ours blancs de l’est du Groenland (Sonne et al., 2008). Cette étude portait sur les paramètres hépatiques suivants : infiltration des cellules mononucléaires, granulomes lipophagiques, stéatose, et hyperplasie des cellules de Ito et du canal cholédoque ou fibrose portale. La population était constituée de 28 femelles et de 29 mâles capturés par des chasseurs de la région entre 1999 et 2002. Des échantillons de foie ont été analysés aux fins de détection du PFOS, de l’acide perfluorononanoïque, de l’acide perfluoroundécanoïque, de l’acide perfluorodécanoïque, de l’acide perfluorotétradécanoïque, de l’APFO, du perfluorooctanesulfonamide, du perfluorodécanoate et du perfluorohexanesulfonate. Dans 23 cas, la concentration d’APFO était sous la limite de détection (0,0012 µg/g poids humide). Plusieurs composés perfluorés ont également été analysés dans les échantillons de foie, y compris les APFC en C9, C10, C11, C12 et C13. Soixante-cinq pour cent des ours blancs affichaient des concentrations totales de PFA supérieures à 1 µg/g poids humide. Les concentrations totales de PFA étaient comprises entre 0,256 et 2,77 µg/g poids humide chez les femelles et entre 0,114 et 3,052 µg/g en poids humide chez les mâles. Tous les composés PFA analysés ont été additionnés, de sorte qu’on ne peut déterminer de relation de cause à effet pour un composé perfluoré particulier, comme l’APFO. Les ours blancs de l’est du Groenland sont également contaminés par d’autres substances, comme les composés organochlorés (BPC, dichlorodiphényltrichloroéthane [DDT]) et le mercure, qui peuvent agir comme cofacteurs de confusion synergiques dans l’apparition des lésions. Les auteurs ont conclu que l’analyse statistique ne permettait pas de déterminer si l’exposition chronique aux PFC était associée aux lésions hépatiques chez les ours blancs. Toutefois, ces lésions étaient semblables à celles produites par les PFC dans des conditions de laboratoire (Sonne et al., 2008).
L’effet de l’APFO sur la fonction immunitaire et les paramètres sanguins cliniques a été étudié chez les dauphins à gros nez et les tortues marines de la Floride, de la Géorgie et de la Caroline du Sud. Il importe de noter qu’aucune relation directe de cause à effet ne peut être établie clairement, car d’autres contaminants pourraient produire des effets en même temps. Les résultats ont révélé qu’il pourrait y avoir augmentation des indicateurs d’inflammation et d’immunité dans les paramètres sanguins chez le dauphin à gros nez liée à l’APFO, ce qui semble indiquer que cet acide pourrait influer sur les biomarqueurs de la santé chez les mammifères marins (Peden-Adams et al., 2004a). Parmi les biomarqueurs analysés chez le dauphin à gros nez, on compte le nombre absolu de lymphocytes, la concentration de triglycérides sériques, la teneur en protéines sériques totales, le taux de sérumalbumine, le taux de cortisol sérique, le taux de protéines C-réactives, l’activité enzymatique (lysozyme) et la prolifération des cellules B (Peden-Adams et al., 2004a). La relation entre les triglycérides sériques et l’APFO était plus forte chez les femelles que chez les mâles. Il existait des corrélations positives, mais faibles, entre la prolifération des lymphocytes (des cellules B) induite par le lipopolysaccharide et l’APFO chez les dauphins à gros nez mâles, et une forte corrélation entre l’activité du lysozyme (mesure de l’immunité innée) et l’APFO chez la même espèce. Cependant, dans une autre étude de Flanary et al. (2010), aucune corrélation n’a été trouvée entre les composés perfluorés, y compris l’APFO, et les paramètres chimiques sanguins (p. ex., cholestérol, créatinine, albumine, concentration totale d’ions sériques) chez l’otarie à fourrure (Callorhinus ursinus).
De faibles concentrations de PFA peuvent aussi influer sur les biomarqueurs de la santé chez la tortue caouanne (Peden-Adams et al., 2004b). Parmi les biomarqueurs analysés chez cette espèce, mentionnons la teneur en protéines plasmatiques totales, les globulines du plasma, la prolifération des cellules T, l’activité du lysozyme dans le plasma et la prolifération des cellules B (Peden-Adams et al., 2004b).
Caractérisation des risques pour l’environnement
La démarche suivie dans cette évaluation écologique préalable consiste à examiner les renseignements scientifiques et techniques pertinents et à tirer des conclusions fondées sur de multiples éléments d’information, qui comprennent l’examen de la persistance, de l’exposition, des tendances, de la toxicité, de la bioaccumulation et de la présence répandue dans l’environnement.
Des organismes servant de paramètres d’évaluation ont été choisis en fonction de l’analyse des voies d’exposition. Pour chaque organisme paramètre, une concentration environnementale estimée (CEE) prudente (représentative de la pire éventualité raisonnable) et une concentration estimée sans effet (CESE) sont déterminées. On calcule la CESE en choisissant la plus faible valeur critique de la toxicité (VCT) pour le type d’organisme d’intérêt et en la divisant par un coefficient d’évaluation approprié au point de données. Un quotient de risque (CEE/CESE) est calculé pour chaque type de paramètre afin de déterminer s’il existe des risques pour l’environnement au Canada. Toutefois, il existe également des incertitudes quant aux risques que peut présenter l’APFO à l’heure actuelle ou à l’avenir. Les estimations quantitatives des risques (quotients de risque et analyses probabilistes) constituent généralement d’importants éléments d’information pour évaluer si une substance peut avoir des effets écologiques nocifs. Cependant, lorsque les risques que comportent les substances persistantes et bioaccumulables, comme l’APFO, sont estimés à l’aide de telles méthodes quantitatives, les résultats obtenus sont très incertains et les risques probablement sous-estimés. Étant donné qu’il n’est actuellement pas possible de prévoir de façon fiable les risques à long terme associés aux substances persistantes et bioaccumulables, la pertinence des estimations quantitatives des risques s’en trouve restreinte. Comme l’accumulation de ces substances peut être répandue et est difficilement réversible, il est justifié de réagir de façon prudente.
Faune mammalienne
Butenhoff et al. (2002) ont mené une étude par gavage d’une durée de 26 semaines sur des singes cynomolgus; la DMENO était de 3 mg/kg p.c. par jour chez les mâles pour des concentrations sériques présentant des effets réversibles sur le foie et des augmentations relatives du poids du foie sans effets histopathologiques. Une concentration moyenne d’APFO dans le foie de 15,8 µg/g a été mesurée à la 27e semaine chez les sujets du groupe recevant le traitement de 3 mg/kg p.c. par jour (c.-à-d. la DMENO). On a sélectionné cette valeur comme VCT. Cette VCT, divisée par un facteur d’évaluation de 100, a donné une CESEde 0,158 µg/g ou 158 µg/kg. On a utilisé ce facteur d’évaluation pour tenir compte de l’extrapolation des conditions de laboratoire à celles sur le terrain, de la variation intraspécifique et interspécifique, du fait que la substance est persistante et peut s’accumuler et se bioamplifier chez les mammifères terrestres et marins, et de l’extrapolation d’une DMENO à une DSENO (dose sans effet nocif observé). La valeur choisie comme CEE correspond à la plus forte concentration d’APFO dans le foie mesurée chez l’ours blanc, soit 13 µg/kg poids humide, à Sanikiluaq, au Nunavut (Canada) [Martin et al., 2004a].
Le quotient de risque (CEE/CESE) propre aux mammifères sauvages au Canada est de 0,08 (13/158). Comme il est inférieur à 1, l’exposition aux concentrations actuelles dans l’environnement ne présente qu’une faible probabilité de risque.
Organismes pélagiques
Les mesures des concentrations dans les eaux de surface au Canada comprennent celles réalisées dans le ruisseau Etobicoke (à Toronto, en Ontario), à la suite d’un déversement de mousse extinctrice aqueuse (Moody et al., 2002), et celles effectuées dans le lac Ontario (Boulanger et al., 2004). Ces données ont été choisies comme valeurs de CEE au Canada selon trois scénarios :
- dans des conditions de déversement (11,3 µg/L; en aval du point de déversement, sur 150 jours);
- dans un ruisseau situé dans une région densément peuplée (0,033 µg/L; en amont du point de déversement, sur 150 jours);
- dans un lac situé dans une région densément peuplée (la concentration de fond la plus élevée étant de 0,070 µg/L; lac Ontario).
Les conditions de déversement correspondent à une CEE de la pire éventualité extrême. Les conditions dans la partie en amont du ruisseau Etobicoke peuvent être considérées comme un scénario urbain à haute densité pour les eaux de surface en général au Canada, en raison de la densité de la population autour du ruisseau Etobicoke, des rejets d’eaux pluviales le long du ruisseau et du débit naturel plutôt faible du cours d’eau, si bien que les apports d’origine anthropique sont peu dilués. Toutefois, des concentrations plus élevées ont été mesurées dans le lac Ontario. La concentration maximale d’APFO mesurée dans chaque scénario a été choisie comme valeur de CEE :
- conditions de déversement (CEE = 11,3 µg/L);
- ruisseau récepteur (CEE = 0,033 µg/L);
- lac récepteur (CEE = 0,070 µg/L).
La plupart des données de toxicité existantes se rapportent à des organismes pélagiques d’eau douce, étant donné que l’APFOdevrait se répartir principalement dans le milieu aquatique. L’organisme le plus sensible aux effets de l’APFO selon les essais monospécifiques réalisés était l’algue d’eau douce Pseudokirchneriella subcapitata [CMEO (96 heures) en fonction du taux de croissance et du nombre de cellules = 2 mg/L] (Ward et al., 1995b, 1995d). Cette valeur a été retenue comme VCT pour les organismes pélagiques; elle est divisée par un facteur d’évaluation de 100 pour tenir compte de l’extrapolation du laboratoire au terrain, de l’extrapolation d’une DMENO à une DSENO et de la variation intra- et interspécifique, ce qui donne une CESE de 0,02 mg/L ou 20 µg/L. Les quotients de risque (CEE/CESE) propres aux organismes pélagiques sont les suivants :
- conditions de déversement = 0,56 (11,3/20);
- ruisseau récepteur = 0,002 (0,033/20);
- lac récepteur = 0,004 (0,07/20).
Ces quotients de risque indiquent que l’exposition aux concentrations actuelles dans l’environnement ne présente qu’une faible probabilité de risque pour les organismes pélagiques.
L’étude de Wei et al. (2007) a montré que les femelles du cyprin Gobiocypris rarus exposées à 3, 10 et 30 mg/L d’APFO pendant 28 jours affichaient une dégénérescence des ovocytes au cours de la vitellogenèse dans les ovaires. La valeur de 3 mg/L a été choisie comme VCT. Elle est divisée par un facteur d’évaluation de 100 pour tenir compte de l’extrapolation du laboratoire au terrain, de l’extrapolation d’une DMENO à une DSENO et de la variation intra- et interspécifique, ce qui donne une CESE de 0,03 mg/L ou 30 µg/L. Le quotient de risque pour les organismes pélagiques dans :
- un ruisseau récepteur est de 0,001 (0,033/30);
- un lac récepteur est de 0,002 (0,07/30).
Ces quotients de risque indiquent que l’exposition aux concentrations actuelles dans l’environnement ne présente qu’une faible probabilité de risque.
Les valeurs de quotients de risque calculées pour l’APFOsont résumées dans le tableau 6.
| Organisme | VCT | CESE | CEE | Scénario | Quotient de risque (CEE/ CESE) |
|---|---|---|---|---|---|
| (µg/L)[1] | |||||
| [1] Sauf indication contraire. [2] CMEO (96 heures; taux de croissance et nombre de cellules) chez une algue d’eau douce (Pseudokirchneriella subcapitata) [Ward et al., 1995a, 1995b]. [3] Facteur d’évaluation de 100 tenant compte de l’extrapolation laboratoire-terrain et des variations intra- et interspécifiques. [4] Concentration la plus élevée d’APFOmesurée en aval dans le ruisseau Etobicoke à la suite d’un déversement de mousse extinctrice aqueuse. [5] Concentration la plus élevée d’APFOmesurée en amont dans le ruisseau Etobicoke à la suite d’un déversement de mousse extinctrice aqueuse (représente la concentration de fond dans le cours d’eau, qui ne subit pas l’influence du déversement). [6] Concentration la plus élevée d’APFOmesurée dans le lac Ontario (Boulanger et al., 2004). [7] Concentration dans le foie à la DMENO mesurée dans une étude sur 26 semaines comportant l’administration d’APFO par gavage à des singes cynomolgus (Butenhoff et al., 2002). [8] Facteur d’évaluation de 100 tenant compte de l’extrapolation laboratoire-terrain, des effets pouvant être dus à la présence d’autres facteurs de stress, de la variation intra- et interspécifique et de l’extrapolation d’une DMENO à une DSENO. Aucune DSENO (ni aucune dose sans effet observé [DSEO]) n’a pu être déterminée dans l’étude de Butenhoff et al. (2002). La DSEO efficace était inférieure à 3 mg/kg p.c. par jour. La cause de la mort à la faible dose (3 mg/kg p.c. par jour) n’a pas pu être déterminée avec certitude (c.-à-d. que la mort peut ne pas être liée au traitement, ce qui peut révéler une importante variation intraspécifique), car les tumeurs chez les rongeurs seraient induites par la prolifération des peroxysomes (elles ne seraient pas de type génotoxique) et l’augmentation du poids du foie à ces faibles doses pourrait indiquer l’induction possible de tumeurs dans un scénario d’exposition chronique. [9] La concentration la plus forte d’APFOdans le foie mesurée chez l’ours blanc, à Sanikiluaq, au Nunavut (Canada) [Martin et al., 2004a]. [10] Concentration la plus faible entraînant l’induction de la vitellogénine dans le foie de Gobiocypris rarus mâles et femelles (Wei et al., 2007). |
|||||
| Algue d’eau douce | 2 000[2] | 20[3] | 11,3[4] | Pire éventualité extrême (conditions de déversement) | 0,6 |
| Algue d’eau douce (ruisseau en milieu urbain) | 2 000[2] | 20[3] | 0,033[5] | Scénario urbain à haute densité (ruisseau récepteur) | 0,002 |
| Algue d’eau douce (lac Ontario) |
2 000[2] | 20[3] | 0,07[6] | Scénario urbain à haute densité (lac récepteur) |
0,004 |
| Ours blanc de l’Arctique canadien (foie) | 15,8 mg/kg[7] | 158 µg/kg[8] |
13 µg/kg[9] | -- | 0,08 |
| Gobiocypris rarus mâles et femelles | 3 mg/L[10] | 0,03 mg/L[3] |
0,033-0,07[5], [6] | Lac et ruisseau récepteurs | 0,001-0,002 |
En résumé, les quotients de risque pour les organismes pélagiques indiquent que l’exposition aux concentration actuelles dans l’environnement aquatique ne présente qu’une faible probabilité de risque. Le quotient de risque pour les mammifères sauvages du Canada (ours blancs) est inférieur à 1; toutefois, en raison de la nature persistante de la substance, de sa tendance à s’accumuler et à se bioamplifier dans une variété de mammifères terrestres et marins, de son hépatotoxicité et de la tendance temporelle à la hausse des concentrations d’APFO chez les ours blancs et certaines autres espèces, les concentrations d’APFOobservées chez les ours blancs pourraient se rapprocher des expositions entraînant des effets néfastes.
Incertitudes dans l’évaluation des risques pour l’environnement
Malgré certaines lacunes et incertitudes, l’ensemble des données sur l’APFO et ses précurseurs est néanmoins substantiel. Par exemple, bien que le mécanisme de transport vers l’Arctique de l’APFO et de ses précurseurs ne soit pas clair, ces composés semblent avoir une certaine mobilité, étant donné qu’on a mesuré de l’APFO dans le biote dans tout l’Arctique canadien, loin des sources connues. Les voies environnementales du transfert de l’APFO au biote ne sont pas bien comprises en raison du peu de données de surveillance qui existent sur les concentrations de ses divers précurseurs dans l’air, l’eau, les effluents et les sédiments du Canada. De plus, bien que les mécanismes de toxicité de l’APFO soient peu connus, on a signalé toute une gamme d’effets toxicologiques chez diverses espèces, notamment l’induction de la vitellogénine, la féminisation des poissons mâles et la toxicité hépatique. Actuellement, on ne dispose que de renseignements limités sur la toxicologie des précurseurs de l’APFO, la possibilité d’effets combinés ou synergiques avec l’APFO ainsi que la toxicologie et le potentiel d’effets combinés ou synergiques de l’APFOavec d’autres acides perfluoroalkyliques. En outre, selon des études menées par van Leeuwen et al. (2006) révélant la variabilité des résultats analytiques obtenus par divers laboratoires, il est possible que les résultats des analyses effectuées par ces laboratoires ne soient pas directement comparables.
Évaluation de l’exposition
L’APFOa été détecté à différents endroits au Canada : dans la poussière domestique à Ottawa, en Ontario, à une concentration moyenne de 106 ng/g (n = 67; valeurs comprises entre 2,29 et 1 234 ng/g; médiane = 19,72 ng/g; Kubwabo et al., 2005); dans l’eau du robinet de Calgary, en Alberta, et de Vancouver, en Colombie-Britannique, à une concentration de 0,2 ng/L (un échantillon par ville; Lien et al., 2006); dans les eaux de surface à divers sites dans les lacs Ontario et Érié aux États-Unis et au Canada, à des concentrations comprises entre 13 et 50 ng/L (moyenne de 8 échantillons prélevés à 4 endroits dans le lac Ontario : 42,5 ng/L; moyenne de 8 échantillons prélevés à 4 endroits dans le lac Érié : 35,6 ng/L [Boulanger et al., 2004]; médiane de 13 échantillons prélevés dans le lac Ontario : 21 ng/L; médiane de 3 échantillons prélevés dans le lac Érié : 15 ng/L [Sinclair et al., 2006]); dans l’eau lacustre recueillie à 5 endroits en Arctique, à des concentrations moyennes allant de 0,9 à 14 ng/L (valeurs comprises entre 0,5 et 16 ng/L; Stock et al., 2007); et dans l’air intérieur et les résidus de sécheuse (Shoeib et al., 2011). On a également détecté une contamination par l’APFO des poissons et de l’eau à des sites aéroportuaires canadiens à la suite d’un déversement de mousse extinctrice (Moody et al., 2002; courriel de Transports Canada adressé au Bureau d’évaluation du risque de Santé Canada en 2008; source non citée).
De même, des FTOH ont été détectés à différents endroits au Canada : dans la poussière domestique à Ottawa, en Ontario (n = 59; moyenne du FTOH 8:2 : 55 ng/g; Shoeib et al., 2005), et dans l’air à des sites ruraux et urbains en Ontario et au Manitoba (total des FTOH à Toronto, en Ontario : valeurs comprises entre 113 et 213 pg/m3, moyenne = 165 pg/m3; Winnipeg, au Manitoba : valeurs inférieures à la LDM à 18 pg/m3, moyenne = 11 pg/m3; Long Point, en Ontario : valeurs inférieures à la LDM à 52 pg/m3, moyenne = 26 pg/m3; n = 3 échantillons par site [Stock et al., 2004]; FTOH 8:2 à Toronto, en Ontario : valeurs comprises entre 9 et 123 pg/m3, moyenne = 55 pg/m3; n = 4; Long Point, en Ontario : valeurs comprises entre 25 et 40 pg/m3, moyenne = 32 pg/m3; n = 2 [Martin et al., 2002]) et en Arctique (total des FTOH : moyenne = 28 pg/m3; valeurs du FTOH 8:2 inférieures à la limite de détection à 20 pg/m3 [Stock et al., 2007]; FTOH 8:2 : valeurs comprises entre 5,8 et 26 pg/m3; n = 20 [Shoeib et al., 2006]).
De l’APFO a été détecté dans 3 des 54 échantillons composites d’aliments recueillis dans le cadre de l’Étude canadienne sur l’alimentation totale menée de 1992 à 2004, la concentration quantifiable la plus élevée (3,6 ng/g) se retrouvant dans un échantillon de maïs à éclater au micro-ondes (Tittlemier et al., 2007). L’APFO a également été mesuré dans plusieurs espèces de poisson (dans des échantillons cuits et crus; concentration maximale détectée = 1,59 ng/g) achetés dans des marchés en Ontario en 2006 (Del Gobbo et al., 2008) et dans certains aliments autochtones (phoque, canard et caribou; concentration maximale détectée = 0,8 ng/g) prélevés au Nunavut en 1997-1998 (Ostertag et al., 2009).
L’APFOa été mesuré dans les matériaux d’emballage et dans les vapeurs produites par la cuisson au four à micro-ondes des deux marques de maïs à éclater au micro-ondes préemballé de l’essai, et le FTOH 8:2 a été mesuré dans l’emballage et les vapeurs de l’une des deux marques de maïs à éclater. Ni l’APFO ni le FTOH 8:2 n’a été détecté dans les matériaux d’emballage ou les vapeurs des grains de maïs à éclater nature cuits dans un sac en polyéthylène (Sinclair et al., 2007). Dans le cadre d’études portant sur l’analyse de produits achetés dans des magasins de détail aux États-Unis, l’APFO a été détecté dans des batteries de cuisine neuves traitées au polytétrafluoroéthylène après avoir été chauffées à des températures de cuisson normales (Begley et al., 2005) et dans de l’eau bouillie dans deux casseroles antiadhésives neuves sur quatre (Sinclair et al., 2007). La présence d’APFO et de FTOH 8:2 a été détectée dans le dégagement gazeux des quatre marques de casseroles antiadhésives neuves mises à l’essai chauffées à des températures de cuisson normales (Sinclair et al., 2007). Dans une étude menée en Italie, l’APFO a été détecté dans l’huile de cuisson après avoir été chauffée dans des casseroles antiadhésives neuves dans des conditions de cuisson normales (Bononi et Tateo, 2007). D’autres études ont signalé que des échantillons extraits de batteries de cuisine traitées neuves n’affichaient aucune concentration décelable d’APFO (Powley et al., 2005; Washburn et al., 2005; Bradley et al., 2007). Des échantillons extraits de certains articles traités aux composés fluorés (vêtements, tapis et tissus d’ameublement) contenaient de l’APFO (Washburn et al., 2005).
L’APFOa été détecté dans 44 des 45 échantillons de lait maternel humain prélevés au Massachusetts, à des concentrations allant de < 0,0301 à 0,161 µg/mL (Tao et al., 2008). De plus, la présence d’APFO a été décelée dans le sang du cordon ombilical de nouveau-nés au Canada dans le cadre de trois études (Tittlemeir et al., 2004; Monroy et al., 2008; Beesoon, 2011), ce qui indique une exposition possible à la substance in utero ainsi que par le lait maternel.
Les données disponibles semblent indiquer que les Canadiens sont exposés à l’APFO et à ses précurseurs présents dans l’environnement, notamment l’air, l’eau potable et la nourriture, et par l’utilisation de produits de consommation tels que les ustensiles antiadhésifs, ainsi que les vêtements et les matériaux traités avec des composés perfluorés, comme les tapis et les tissus d’ameublement. En général, les concentrations d’APFO observées dans l’air ambiant, les aliments et l’eau potable au Canada sont comparables à celles mesurées ailleurs, y compris aux États-Unis, en Europe et en Asie (Fromme et al., 2009). Toutefois, dans d’autres pays, des sources industrielles que l’on ne trouve pas au Canada produisent des concentrations ponctuelles d’APFO dans l’eau potable qui sont considérablement supérieures à celles signalées au Canada (p. ex., à Little Hocking, en Ohio : concentration moyenne de 3,5 µg/L; Emmett et al., 2006a).
Comme on disposait de données de biosurveillance, qui tiennent compte de toutes les sources d’exposition, on n’a pas calculé d’estimation quantitative de l’exposition à l’APFO fondée sur les concentrations dans les milieux naturels et l’utilisation de produits de consommation. De telles estimations de l’absorption quotidienne totale ont cependant été publiées récemment. Trudel et al. (2008) ont estimé l’exposition de la population générale en Amérique du Nord à l’APFOprovenant de l’air, de la nourriture, de l’eau potable, de la poussière et des produits de consommation. Les estimations de l’exposition pour des scénarios d’exposition à des concentrations faibles, intermédiaires et fortes variaient entre 1 et 130 ng/kg p.c. par jour pour tous les groupes d’âge. Le régime alimentaire constituait la principale source d’exposition dans les scénarios d’exposition à des concentrations faibles et intermédiaires, alors que les produits de consommation (exposition par voie orale au tapis traité et lors de la migration de la substance dans les aliments à partir du papier traité, et par inhalation lors du traitement par pulvérisation des vêtements par les particuliers) constituaient la principale source d’exposition dans les scénarios de forte exposition. Cette étude n’a pas abordé l’apport de l’exposition aux précurseurs de l’APFO. Dans une autre étude menée par Fromme et al. (2009), l’exposition de la population générale à l’APFO a été estimée à l’aide de données de l’Amérique du Nord, de l’Europe et du Japon. La limite supérieure de l’exposition a été estimée à 12,6 ng/kg p.c. par jour et résultait principalement de la consommation alimentaire. L’exposition aux FTOH comptait pour moins de 1 % de l’exposition à l’APFO. Cette étude ne portait pas particulièrement sur l’examen de scénarios d’exposition aux produits de consommation.
Les données de biosurveillance sont à la base de la présente évaluation de l’exposition à l’APFO, étant donné que les concentrations sanguines représentent l’exposition combinée de l’ensemble des sources et des voies, dont l’exposition aux précurseurs de l’APFO. L’APFO a été détecté dans les échantillons de sang de populations non exposées à cette substance au travail dans divers pays, y compris chez les adultes, les enfants et les nouveau-nés au Canada. La présence d’APFO dans une grande proportion des échantillons sanguins prélevés chez les humains indique que ces derniers sont exposés dans l’environnement à l’APFO ou à ses précurseurs qui se dégradent en APFO. Une fois dans l’organisme, cet acide peut se lier à certaines protéines (Han et al., 2003, 2005), mais aucune donnée n’indique qu’il est modifié par le métabolisme, la conjugaison ou la défluoration (Vanden Heuvel et al., 1991). La demi-vie de l’APFO est relativement longue chez l’humain, variant entre 2 et 4 ans (Olsen et al., 2007; Bartell et al., 2010; Brede et al., 2010).
Dans le cadre de plusieurs études, l’APFO a été mesuré dans le sang d’adultes non exposés à cette substance au travail, d’enfants et de nouveau-nés, à des concentrations variant de < 0,0001 µg/mL à 0,0561 µg/mL, qui sont présentées dans le tableau 7. Les données canadiennes de biosurveillance sont comparables à celles des États-Unis. Les concentrations sériques et plasmatiques d’APFO chez les enfants et les personnes âgées sont comparables à celles des adultes. Cependant, d’après les données d’une étude allemande, les nourrissons âgés de six mois semblent être le groupe d’âge le plus exposé. Dans le cadre de l’étude, les concentrations d’APFO ont été mesurées à deux occasions dans le sang maternel (n ~ 40 et 38), six mois après l’accouchement (n = 47), dans le sang du cordon ombilical (n = 33) et dans le sang des nourrissons à 6 mois (n = 40) et à 19 mois (n = 24), ainsi que tous les mois dans des échantillons de lait maternel. Les concentrations dans le sérum maternel allaient de 0,7 à 8,7 µg/L, alors que dans le sérum du cordon ombilical, elles variaient de 0,5 à 4,2 µg/L. Les résultats médians dans le sérum à 6 et 19 mois étaient de 6,9 et de 4,6 µg/L, respectivement. Dans le lait maternel, l’APFO n’a été détecté que dans quelques échantillons. Les auteurs laissent entendre que l’augmentation des concentrations d’APFO pendant les premiers mois de la vie d’un nourrisson est attribuable à l’allaitement, car le lait maternel contient des concentrations mesurables de cet acide (Fromme et al., 2010).
| Description de la population | n | MA, MG ou concentration médiane (µg/mL) | Fourchette (µg/mL) |
95e centile (µg/mL) |
Références |
|---|---|---|---|---|---|
| Abréviations : MA : moyenne arithmétique; MG : moyenne géométrique; LD : limite de détection; S.O. : sans objet. | |||||
| Données du Canada | |||||
| Plasma prélevé entre 2007 et 2009 chez des Canadiens âgés de 20 à 79 ans, dans le cadre de l’Enquête canadienne sur les mesures de la santé (ECMS) | 2 880 | 0,00252 (MG) | < LD (0,0003)- maximum non indiqué | 0,00550 | Santé Canada, 2010 |
| Plasma prélevé entre 2006 et 2008 chez des enfants inuits âgés de 12 à 54 mois, dans le cadre du Programme de lutte contre les contaminants dans le Nord | 86 | 0,00162 (MG) | 0,00046-0,01100 | S.O. | Turgeon-O’Brien et al., 2010 |
| Sérum mis en commun prélevé en 2005 chez des femmes enceintes en Alberta | 50 599 | (moyenne pondérée) 0,0026 µg/g (sérum) |
0,0017-0,0038 µg/g (sérum) |
S.O. | Alberta Health and Wellness, 2008 |
| Échantillons de sérum maternel et du cordon ombilical provenant de 152 femmes et de leur bébé à Vancouver (Colombie-Britannique), prélevés dans le cadre de l’étude ChirP (Chemicals, Health and Pregnancy Study), 2006-2008 | mères 152 | 0,0018 (MA) (maternel prélevé à la 15e semaine de grossesse) |
< LD (0,0005)-0,0046 (maternel) |
S.O. | Webster, 2011; Beesoon, 2011 (résultats inédits) |
| nourrissons 20 | 0,0011 (MA) (cordon) |
0,0005-0,0024 (cordon) |
|||
| Échantillons de sérum maternel et du cordon ombilical prélevés en 2004 et 2005 chez des femmes et leurs 105 bébés à Hamilton (Ontario) | mères 101 | 0,00254 (MA) (24 à 28 semaines de gestation) |
0,00133-0,00314 | S.O. | Monroy et al., 2008 |
| 0,00224 (MA) (à l’accouchement) |
|||||
| nourrissons 105 | 0,00194 (MA) (cordon) |
0,00109-0,00237 (cordon) |
|||
| Échantillons de plasma maternel et du cordon ombilical provenant de 23 échantillons de plasma combinés représentant 560 donneurs des populations du Nord de quatre régions géographiques de l’Arctique canadien, prélevés entre 1994 et 2001 | mères 10 échan-tillons combinés | 0,0022 (MA) (maternel) | 0,00048-0,00546 | S.O. | Tittlemier et al., 2004 |
| nourrissons 13 échan-tillons combinés |
0,0034 (MA) (cordon) |
||||
| Données des États-Unis et de l’Allemagne | |||||
| Sérum prélevé en 2007 et 2008 chez des Américains âgés de 12 ans et plus; National Health and Nutrition Examination Survey (NHANES) des États-Unis | 2 100 | 0,0041 (MG) | < LD (0,0001)- 0,0772 | 0,0097 | USCDC, 2011 |
| Sérum provenant de résidents de Seattle âgés de 65 à 96 ans | 238 | 0,0042 (MG) | < limite de dosage (0,0014)-0,0167 | 0,0097 | Olsen et al., 2004a |
| Sérum prélevé en 1994 et 1995 chez des enfants âgés de 2 à 12 ans provenant de 23 États | 598 | 0,0049 (MG) | < limite de dosage (0,0029)-0,0561 | 0,010 | Olsen et al., 2004b |
| Sérum provenant d’échantillons combinés prélevés chez des enfants âgés de 3 à 5 ans (21 enfants par groupe) et chez des enfants âgés de 6 à 11 ans (57 enfants par groupe), recueillis en 2001 et 2002 dans le cadre de l’étude NHANES | 12 échan-tillons combinés (3 à 5 ans) |
S.O. | 0,0058-0,0084 | S.O. | Kato et al., 2009 |
| 12 échan-tillons combinés (6 à 11 ans) |
0,0059-0,0082 | ||||
| Échantillons de sérum du cordon ombilical prélevés chez des nourrissons nés à Baltimore (Maryland), en 2004 et 2005 | 299 | 0,0016 (médiane) | 0,0003-0,0071 | 0,0034 | Apelberg et al., 2007a |
| Sérum prélevé en 2007 et 2008 chez des femmes allemandes au moment de l’accouchement et 6 mois plus tard, ainsi que chez leur nourrisson à la naissance (sang du cordon ombilical) et à 6 et 19 mois | mères 38 |
0,0019 (médiane) (à l’accouchement) |
0,0007-0,0087 | 0,0052 | Fromme et al., 2010 |
| mères 47 |
0,0015 (médiane) (après 6 mois) |
0,0039 | |||
| nourrissons 33 | 0,0014 (médiane) (cordon) |
0,0005-0,0042 (cordon) |
0,0037 | ||
| nourrissons 40 | 0,0069 (médiane) (à 6 mois) |
0,00096-0,0269 (à 6 mois) |
0,0195 | ||
| nourrissons 24 | 0,0046 (médiane) (à 19 mois) |
Non indiqué | 0,0114 | ||
Le niveau de confiance associé à la mesure de l’exposition (c.-à-d. les concentrations d’APFO dans le sang) est considéré comme élevé, car les données couvrent l’ensemble du Canada, tous les groupes d’âge, des nourrissons aux personnes âgées, et comprennent les populations vulnérables, comme les femmes enceintes, les nourrissons allaités et les personnes vivant dans le nord du Canada. Les concentrations chez les Canadiens, dont fait état l’Enquête canadienne sur les mesures de la santé (ECMS), sont comparables à celles mesurées aux États-Unis dans l’étude NHANES. L’utilisation des données de biosurveillance prend en compte les multiples sources d’exposition, il n’est donc pas nécessaire de calculer les estimations de la limite supérieure de l’exposition par l’entremise des milieux naturels, des produits de consommation et des matériaux domestiques.
Évaluation des effets sur la santé
La plupart des études de toxicité pertinentes effectuées sur des animaux de laboratoire portent sur le sel d’ammonium de l’APFO(SAAPFO). Des études sur l’anion (PFO) et le sel de sodium (APFO-Na) de l’APFO ainsi que sur l’APFO lui-même ont également été publiées. L’APFO et ses sels devraient se dissocier rapidement dans les tissus biologiques en perfluorooctanoate (PFO), l’anion de cet acide. Les effets toxicologiques associés à l’exposition à l’APFO, au SAAPFO et à l’APFO-Na sont similaires. L’APFO et ses sels sont donc considérés comme des équivalents biologiques dans le présent rapport. Les données toxicologiques propres à chaque précurseur de l’APFO n’ont pas été évaluées, car la démarche suivie dans cette évaluation consistait à examiner ces composés du point de vue de leur contribution à l’exposition totale à l’APFO. L’annexe 2 fournit un résumé de la base de données toxicologiques sur l’APFO et ses sels. Les études considérées comme critiques pour l’évaluation préalable étaient celles qui présentaient les plus faibles doses administrées et celles avec les plus faibles concentrations sériques d’APFO associées à des effets.
Une étude de toxicité à court terme (14 jours) par voie orale du SAAPFO sur les rats et les souris a obtenu une DMENO de 0,3 mg/kg p.c. par jour. Cette dose était associée à une concentration sérique moyenne d’APFO de 13 µg/mL et à une augmentation du poids du foie chez les souris mâles, ainsi qu’à une concentration sérique moyenne d’APFO de 20 µg/mL et à la modification des paramètres lipidiques chez les rats mâles. Il s’agissait de la dose la plus faible de l’essai, de sorte qu’aucune DSENO n’a été établie (Loveless et al., 2006).
Dans une étude de toxicité subchronique (13 semaines) par voie orale sur des rats mâles, aucun effet n’a été observé à la dose de 0,06 mg/kg p.c. par jour, ni même des changements histopathologiques dans le foie. Une augmentation du poids du foie ainsi qu’une hypertrophie hépatique ont été observées à la dose suivante, soit à 0,64 mg/kg p.c. par jour. Ces effets n’ont pas été observés après une période de rétablissement de 8 semaines. À la fin de la période d’exposition de 13 semaines, les concentrations sériques d’APFO correspondant à la DSENO et à la DMENO étaient respectivement de 7,1 et de 41,2 µg/mL (Palazzolo, 1993; Perkins et al., 2004).
Des effets sur le foie ont également été observés dans une étude d’exposition par inhalation de 14 jours sur des rats mâles. On a noté une augmentation du poids du foie réversible, des hausses réversibles de l’activité enzymatique sérique ainsi qu’une pathologie microscopique hépatique, dont une nécrose (non réversible), à des niveaux d’exposition de 8 mg/m3 et plus, mais pas à 1 mg/m3. Il a été calculé que ces niveaux d’exposition équivalaient respectivement à des doses de 2,48 et de 0,31 mg/kg p.c. par jour[3] (les concentrations sériques d’APFOcorrespondantes étaient respectivement de 47 et de 13 µg/mL, à la fin de la période d’exposition de 14 jours) (Haskell Laboratory, 1981a; Kennedy et al., 1986).
Dans une étude de toxicité subchronique de 26 semaines sur des singes mâles exposés par voie orale, la dose la plus faible de SAAPFO mise à l’essai de 3 mg/kg p.c. par jour a entraîné une augmentation du poids du foie (Thomford, 2001b; Butenhoff et al., 2002). D’après les mesures prises deux fois par semaine, la concentration sérique moyenne d’APFO était de 77 µg/mL.
Lors d’une étude de toxicité sur le développement des souris auxquelles on a administré des doses de 1 mg/kg p.c. par jour de SAAPFO par voie orale du 1er au 17e jour de gestation, on a observé une augmentation du poids du foie des souris mères, une ossification réduite des os des fœtus et une puberté précoce des souriceaux mâles. La concentration sérique moyenne d’APFO chez les mères recevant la DMENO de 1 mg/kg p.c. par jour était de 21,9 µg/mL. Comme il s’agissait de la dose la plus faible mise à l’essai, aucune DSENO n’a été établie (Lau et al., 2006). Pendant la préparation de la présente évaluation préalable finale, Macon et al. (2011) ont publié une étude portant sur les effets à faible dose de l’APFOchez les souris. L’étude a révélé des cotes de développement des glandes mammaires beaucoup plus faibles chez la progéniture des souris CD-1 au 21e jour après la naissance lorsque les mères ont été exposées par gavage à 0,01 mg/kg p.c. par jour du 10e au 17e jour de gestation; la concentration sérique d’APFO était de 16,5 ± 2,1 ng/mL. Les auteurs ont révélé une sensibilité des glandes mammaires à l’APFO chez les souris CD-1. Des recherches supplémentaires sont nécessaires pour déterminer si cette sensibilité est liée à la période d’exposition ou à la souche murine, ou encore si d’autres mécanismes sous-tendent la sensibilité apparente des souris CD-1. Il n’y a pas assez de renseignements pour déterminer si les effets sur les glandes mammaires sont permanents et, par conséquent, nocifs à de faibles doses.
Deux études de toxicité chronique sur des animaux de laboratoire ont été relevées. Dans la première étude de toxicité chronique, des rats CD ont été exposés au SAAPFO à des doses de 0, 30 ou 300 ppm (parties par million) dans leur alimentation pendant 2 ans (0, 1,3 ou 14,2 mg/kg p.c. par jour chez les mâles; 1, 1,6 ou 16,1 mg/kg p.c. par jour chez les femelles). Une DMENO de 1,3 mg/kg p.c. par jour a été établie d’après des augmentations significatives des paramètres sériques dans le foie (glutamate pyruvate transaminase, phosphatase alcaline et albumine) chez les mâles. Aucun signe de cancérogénicité n’a été rapporté chez les rats femelles, mais les mâles affichaient une augmentation des adénomes des cellules de Leydig. Cette augmentation était significative (p ≤ 0,05) chez le groupe exposé à la dose élevée, soit 14,2 mg/kg p.c. par jour (Sibinski, 1987). Dans la deuxième étude, des rats mâles CD ont été exposés à seulement une dose de SAAPFO dans leur alimentation, soit 300 ppm ou 13,6 mg/kg p.c. par jour, pendant 2 ans. L’incidence des adénomes du foie, de l’hyperplasie et des adénomes des cellules de Leydig ainsi que de l’hyperplasie et des adénomes dans les cellules acineuses du pancréas était significativement plus élevée chez les mâles exposés (Biegel et al., 2001). Aucune de ces études de toxicité chronique n’a indiqué les concentrations sériques d’APFO.
Afin de déterminer leur potentiel de génotoxicité, l’APFO ainsi que ses sels d’ammonium et de sodium ont été évalués à l’aide de trois tests du micronoyau in vivo sur la moelle osseuse de souris, de plusieurs tests d’Ames de mutation bactérienne et de trois tests d’aberration chromosomique in vitro (deux sur des cellules de hamster et un sur des cellules humaines); aucun de ces tests n’a produit de données probantes (voir l’annexe 2 pour les données détaillées sur chacun des composés et les références). Des résultats positifs ont été obtenus dans un essai de dommages chromosomiques sur des cellules de hamster et dans un test du micronoyau in vitro sur des cellules humaines. L’APFO a provoqué des dommages oxydatifs à l’ADN dans les cellules d’hépatomes humains en culture et dans le foie des rats exposés par voie orale ou intrapéritonéale. La base de données sur la génotoxicité indique que les composés d’APFO ne sont pas mutagènes.
Chez les rongeurs, l’APFO induit une prolifération des peroxysomes, par l’intermédiaire du PPARα. L’activation du PPARαprovoque des changements dans le foie, de même que des modifications du transport et du métabolisme des lipides ainsi que la modification d’autres processus biochimiques. La triade de tumeurs bénignes observées chez les rats mâles exposés à l’APFO (adénomes du foie, des cellules de Leydig et des cellules acineuses du pancréas) est typique des agonistes du PPAR, dont le clofibrate, le 2,2-dichloro-1,1,1-trifluoroéthane (HCFC 123) et l’acide pirinixique (WY-14643) [Cook et al., 1999; Kennedy et al., 2004]. Il a été proposé que l’activation du PPARα hépatique, et non la génotoxicité directe, était l’élément critique de l’induction de ces tumeurs. Le niveau de confiance envers le mode d’action du PPARα est élevé en ce qui concerne les tumeurs hépatiques, modéré pour les tumeurs à cellules de Leydig et faible pour les tumeurs des cellules acineuses du pancréas (recensé dans Klaunig et al., 2003).
Il a été montré que l’APFO stimule le PPARαin vitro et qu’il provoque la prolifération des peroxysomes dans le foie in vivo. Des données sur les relations dose-réponse et temporelles appuient le mode d’action du PPARα pour les tumeurs hépatiques chez le rat. Dans l’étude de toxicité chronique par voie alimentaire menée par Biegel et al. (2001), l’APFO a entraîné une augmentation du poids du foie et la prolifération des peroxysomes dans le foie des rats exposés tout au long de l’étude, et ce, dès un mois après le début du traitement, et la première apparition des tumeurs hépatiques a été observée 12 mois après le début du traitement. Dans une étude d’une durée de 14 jours sur des rats mâles, Liu et al. (1996) ont établi une DSEO de 0,2 mg/kg p.c. par jour et une DMEO de 2 mg/kg p.c. par jour pour l’augmentation du poids du foie et la prolifération des peroxysomes du foie (mesurée à l’aide de la β-oxydation hépatique), soit les principaux paramètres de l’initiation des tumeurs hépatiques. Des signes de cancérogénicité hépatique ont été observés à la dose de 13,6 mg/kg p.c. par jour dans l’étude de toxicité chronique menée par Biegel et al.(2001), mais aucun signe n’a été observé à la dose de 1,3 mg/kg p.c. par jour dans l’étude de toxicité chronique de Sibinski (1987), ce qui est conforme avec la relation dose-réponse établie pour les événements clés précoces. Dans une étude de toxicité subchronique sur des singes, aucune augmentation de la prolifération des peroxysomes n’a été observée après une exposition à l’APFO, bien que des effets hépatiques, dont une augmentation du poids du foie, aient été notés (Butenhoff et al., 2002).
Chez les rats mâles, l’APFO n’a pas induit de prolifération des peroxysomes ni de prolifération cellulaire dans les cellules de Leydig (Biegel et al., 2001), ce qui semble indiquer que ce n’est pas l’activation directe du PPAR qui provoque des tumeurs dans les testicules. Il a été proposé que les tumeurs à cellules de Leydig chez le rat mâle résultent d’une augmentation de l’estradiol sérique provoquée par l’activation du PPARα hépatique, suivie par des changements de l’activité des enzymes jouant un rôle dans la biosynthèse des stéroïdes. Les études montrent que l’exposition à l’APFO accroît l’activité de l’aromatase hépatique et augmente les concentrations d’estradiol dans le sérum (Liu et al., 1996; Biegel et al., 2001). Dans une étude d’une durée de 14 jours sur des rats mâles, Liu et al. (1996) ont démontré que l’activité de l’aromatase hépatique et les concentrations d’estradiol dans le sérum n’augmentaient qu’à des doses provoquant la prolifération des peroxysomes du foie. Une DSEO de 0,2 mg/kg p.c. par jour et une DMEO de 2 mg/kg p.c. par jour ont été établies selon l’augmentation de l’activité de l’aromatase hépatique et des concentrations d’estradiol dans le sérum. Dans l’étude de toxicité chronique menée par Sibinski (1987), une augmentation significative des tumeurs à cellules de Leydig a été observée à la dose élevée de 14,2 mg/kg p.c. par jour, mais non à la faible dose de 1,3 mg/kg p.c. par jour. Dans le cadre de l’étude de toxicité chronique par voie alimentaire réalisée par Biegel et al. (2001), l’APFO a provoqué une augmentation de la concentration d’estradiol dans le sérum des rats après 1, 3, 6, 9 et 12 mois d’exposition, avant la première apparition de tumeurs à cellules de Leydig. Le mode d’action du PPARαproposé concorde donc avec les relations dose-réponse et temporelles associées à l’augmentation de l’estradiol sérique. Dans les testicules, l’estradiol module l’expression du facteur de croissance, ce qui peut entraîner une hyperplasie et des adénomes (Biegel et al. 1995). Il a également été montré in vitro que l’APFO et d’autres agonistes du PPARα, dont le bézafibrate, le phtalate de monoéthylhexyle (MEHP) et le WY-14643, inhibent la production de testostérone dans les cellules de Leydig (Klaunig et al., 2003), bien qu’on n’ait noté aucune diminution des taux de testostérone sérique dans l’essai biologique d’une durée de deux ans sur l’exposition à l’APFO chez les rats (Biegel et al., 2001). Chez les primates non humains, une exposition à l’APFO n’a pas entraîné une augmentation de l’œstrogène sérique ni une diminution de la testostérone sérique, et aucune histopathologie anormale n’a été observée dans les testicules dans le cadre d’une étude d’une durée de 26 semaines (Butenhoff et al., 2002).
L’induction des tumeurs des cellules acineuses du pancréas chez les rats mâles peut également se faire par un mécanisme médié par le PPAR du foie, bien que le niveau de confiance à l’égard de ce mode d’action soit jugé plus élevé pour l’induction des tumeurs hépatiques ou des tumeurs à cellules de Leydig (recensé dans Klaunig et al., 2003). Les données sur les modes d’action in vivo sont principalement dérivées d’autres agonistes du PPAR, dont on a démontré l’induction de tumeurs des cellules acineuses du pancréas chez le rat. Chez cette espèce, les hormones stéroïdes, y compris l’estradiol et la cholécystokinine, ont un effet sur l’hyperplasie, les adénomes et l’hypertrophie des cellules acineuses du pancréas. L’exposition à l’APFO pourrait réduire l’écoulement de la bile ou changer sa composition en raison des effets en aval de l’activation du PPARα hépatique. Il peut alors s’ensuivre une augmentation des taux de cholécystokinine et une stimulation des cellules acineuses du pancréas. Bien qu’il n’existe aucune donnée mécaniste sur l’APFO lui-même, on a noté une réduction de l’écoulement de la bile et de la concentration d’acide biliaire ainsi qu’une augmentation continue de la cholécystokinine plasmatique chez les rats traités au WY-14643, un agoniste du PPARα. Ces changements ont été observés dès le troisième mois d’exposition, soit avant l’observation des premières tumeurs des cellules acineuses du pancréas. Dans l’étude de toxicité chronique par voie alimentaire menée par Biegel et al.(2001), les rats traités à l’APFO présentaient une prolifération accrue des cellules pancréatiques après 15, 18 et 21 mois d’exposition, ainsi qu’une augmentation significative de l’hyperplasie acineuse. Aucune histopathologie anormale dans le pancréas des singes exposés à l’APFO n’a été constatée dans une étude de 26 semaines (Butenhoff et al., 2002).
Dans une ébauche d’évaluation des risques, l’Environmental Protection Agency (EPA) des États-Unis a indiqué qu’il existait suffisamment de preuves pour conclure que la toxicité hépatique et les adénomes hépatiques observés chez les rats après une exposition à l’APFO résulteraient du mode d’action d’un agoniste du PPARα, ce qui est peu probable chez l’humain. L’EPA conclut également que les tumeurs à cellules de Leydig et les tumeurs des cellules acineuses du pancréas pourraient s’appliquer aux humains, mais qu’elles ne constituent probablement pas un risque de cancer important, en raison des différences quantitatives de l’expression des récepteurs et d’autres facteurs toxicodynamiques (US EPA, 2005). Toutefois, le Science Advisory Board a examiné l’évaluation des risques de l’EPA et a conclu qu’il pourrait exister d’autres modes d’action à l’origine des tumeurs hépatiques et que, comme les modes d’action induisant les tumeurs à cellules de Leydig et les tumeurs des cellules acineuses du pancréas demeurent inconnus, ils devraient être jugés applicables dans le cas des êtres humains (US EPA, 2006b).
Des études récentes réalisées sur des souris dont l’expression du gène PPARα a été inhibée (PPARα-KO) semblent indiquer que certains des effets associés à l’exposition à l’APFO se produisent indépendamment de la voie de prolifération des peroxysomes. Des effets sur le développement, tels qu’un retard dans l’ouverture des yeux, des déficits du gain de poids après la naissance et une réduction de la survie postnatale, ont été observés chez les souris de type sauvage, mais non chez les souris PPARα-KO, ce qui laisse supposer que ces effets dépendent de l’expression du PPARα. Des pertes en début de gestation ont été observées chez les deux souches de souris, ce qui indique l’intervention de voies autres que la prolifération des peroxysomes (Abbott et al., 2007). Yang et al. (2002) ont constaté que la diminution du poids de la rate et du nombre de splénocytes observée chez les souris de type sauvage exposées à l’APFO dans leur alimentation pendant sept jours ne se produisait pas chez les souris PPARα-KO exposées. Les souris exposées à l’APFO affichaient également une diminution du poids du thymus et du nombre de thymocytes, effets qui étaient atténués chez les souris PPARα-KO. Une augmentation significative du poids du foie a toutefois été notée tant chez les souris de type sauvage que chez les souris PPARα-KO. D’après des études du profil d’expression des gènes, l’APFO pourrait modifier les gènes du foie des souris indépendamment du PPARα (Rosen et al., 2008a, 2008b); on ne sait toutefois pas si ces données sont pertinentes du point de vue toxicologique.
Parmi les études épidémiologiques qui ont été réalisées sur les effets nocifs de l’exposition à l’APFO sur la santé, notons des études transversales sur l’exposition de la population générale, des études de populations exposées à des concentrations élevées d’APFO dans l’eau potable contaminée ainsi que des études d’exposition professionnelle. Selon deux études menées récemment (une étude transversale aux États-Unis et une étude de cohorte au Danemark), il pourrait exister une faible corrélation entre l’exposition à l’APFO pendant la grossesse et une insuffisance de poids à la naissance (Apelberg et al., 2007b; Fei et al., 2007). Toutefois, l’ampleur de cet effet était faible, compte tenu des variations normales des paramètres mesurés, et tous les enfants se situaient à l’intérieur de la plage normale. Aucune association entre les concentrations sériques de l’APFO chez les mères et le poids des nouveau-nés à la naissance n’a été relevée dans d’autres études d’exposition de la population générale menées au Canada (Monroy et al., 2008; Hamm et al., 2009), au Japon (Washino et al., 2009) ou dans une collectivité américaine qui affichait une concentration sérique moyenne d’APFO dix fois supérieure à celle observée au sein de la population générale (Stein et al., 2009).
Plusieurs études portant sur les personnes exposées au travail (Olsen et al., 2003; Sakr et al., 2007a, 2007b; Costa et al., 2009) et sur les résidents de collectivités très exposées (Steenland et al., 2009; Frisbee et al., 2010) ont observé une association positive entre l’APFO sérique et le cholestérol total ainsi que d’autres paramètres lipidiques. Une étude transversale portant sur la population générale des États-Unis est récemment arrivée à des résultats similaires (Nelson et al., 2010). À l’inverse, d’autres études épidémiologiques sur l’exposition au travail (Olsen et al., 2000; Olsen et Zobel, 2007) et sur les collectivités exposées (Emmett et al., 2006b) n’apportent aucune preuve d’une association significative entre l’APFO sérique et le cholestérol.
Le poids de la preuve global ne peut confirmer l’existence de relations causales entre l’exposition à l’APFO et les effets nocifs observés sur la santé, en raison des nombreux facteurs confusionnels, dont l’exposition à de multiples substances chimiques. Un examen récent des preuves épidémiologiques des effets sur la santé de l’APFO révèle également que les données épidémiologiques sont insuffisantes pour tirer des conclusions concernant le rôle de l’APFO dans les effets observés sur la santé (Steenland et al., 2010a).
Le niveau de confiance accordé à l’évaluation des effets de l’APFO est modéré à élevé, car la base de données toxicologiques couvre un large éventail de paramètres et de stades du cycle de vie, plusieurs espèces et les deux sexes.
Caractérisation des risques pour la santé humaine
Nous disposons de données suffisantes pour calculer des marges d’exposition fondées sur la comparaison entre les concentrations sériques d’APFO chez les animaux de laboratoire aux doses avec effet critique et les concentrations sériques ou plasmatiques d’APFO chez les humains tirées d’études de biosurveillance. Les marges d’exposition entre les concentrations sériques d’APFO associées aux effets les plus critiques chez les animaux de laboratoire et les concentrations plasmatiques d’APFO chez les Canadiens d’âge adulte sont comprises entre 5 100 et 30 600 environ pour la moyenne géométrique et entre 2 300 et 14 000 pour les valeurs du 95e centile. Pour les enfants inuits (12 à 54 mois), les marges d’exposition pour la moyenne géométrique et les valeurs maximales varient de 8 000 à 47 500 et de 1 200 à 7 000, respectivement. Pour les nourrissons allaités, les marges d’exposition pour la médiane et les valeurs du 95ecentile sont comprises entre 1 880 et 11 000 et entre 660 et 3 900, respectivement (tableau 8).
| Étude et effet critique (référence) |
Dose avec effet critique (mg/kg p.cpar jour) | Mesure de la dose d’APFO avec effet critique (concentra-tion sérique; µg/mL) | Exposition humaine à l’APFO (concentration sérique ou plasmatique; µg/mL) | Marge d’expo-sition[1] |
|---|---|---|---|---|
| [1] Les marges d’exposition ont été calculées selon le rapport entre les concentrations sériques d’APFO avec effet critique et les concentrations sériques d’APFO chez les humains. [2] Enquête canadienne sur les mesures de la santé (Santé Canada, 2010). [3] Programme de lutte contre les contaminants dans le Nord (Turgeon-O’Brien et al., 2010). Les valeurs du 95e centile n’étaient pas fournies; ainsi, les marges d’exposition sont basées sur les valeurs maximales. [4] Fromme et al., 2010. |
||||
| Augmentation du poids du foie des souris mâles auxquelles on a administré du SAAPFO par gavage pendant 14 jours (Loveless et al., 2006) |
DMENO = 0,3 |
13 | Canadiens âgés de 20 à 79 ans[2] 0,00252 (MG) |
5 159 |
| Canadiens âgés de 20 à 79 ans[2] 0,00550 (95ecentile[3]) |
2 364 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,00162 (MG) |
8 024 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,01100 (maximum) |
1 182 | |||
| Nourrissons de 6 mois, Allemagne[4] – 0,0069 (médiane) |
1 884 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0195 (95e centile) |
667 | |||
| Modifications des paramètres lipidiques chez les rats mâles auxquels on a administré du SAAPFO par gavage pendant 14 jours (Loveless et al., 2006) | DMENO = 0,3 |
20 | Canadiens âgés de 20 à 79 ans[2] 0,00252 (MG) |
7 937 |
| Canadiens âgés de 20 à 79 ans[2] 0,00550 (95e centile) |
3 636 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,00162 (MG) |
12 346 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,01100 (maximum) |
1 818 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0069 (médiane) |
2 899 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0195 (95e centile) |
1 026 | |||
| Augmentation du poids du foie des souris mères, ossification réduite des os des fœtus et puberté précoce des souriceaux mâles, à la suite de l’administration du SAAPFOpar gavage chez les souris mères du 1er au 17e jour de gestation (Lau et al., 2006) |
DMENO = 1 |
21,9 | Canadiens âgés de 20 à 79 ans[2] 0,00252 (MG) |
8 690 |
| Canadiens âgés de 20 à 79 ans[2] 0,00550 (95e centile) |
3 982 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,00162 (MG) |
13 519 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,01100 (maximum) |
1 991 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0069 (médiane) |
3 174 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0195 (95e centile) |
1 123 | |||
| Augmentation du poids du foie des singes mâles auxquels on a administré du SAAPFO par gavage pendant 26 semaines (Thomford, 2001b; Butenhoff et al., 2002) |
DMENO = 3 |
77 | Canadiens âgés de 20 à 79 ans[2] 0,00252 (MG) |
30 556 |
| Canadiens âgés de 20 à 79 ans[2] 0,00550 (95e centile) |
14 000 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,00162 (MG) |
47 531 | |||
| Enfants inuits âgés de 12 à 54 mois[3] 0,01100 (maximum) |
7 000 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0069 (médiane) |
11 159 | |||
| Nourrissons de 6 mois, Allemagne[4] 0,0195 (95e centile) |
3 949 | |||
Les études sur des animaux de laboratoire qui ont servi à calculer les marges d’exposition étaient celles qui présentaient les plus faibles doses administrées et concentrations sériques d’APFO associées à des effets. Une étude de toxicité orale de 14 jours sur des rats et des souris (Loveless et al., 2006) a obtenu la plus faible des valeurs de DMENO (0,3 mg/kg p.c. par jour) déterminées dans les études critiques; les marges d’exposition ont été calculées en fonction des concentrations sériques d’APFOmesurées chez les rats et les souris associées à cette dose. Bien qu’aucune DSENO n’ait été établie dans cette étude critique, il existe des données probantes tirées d’autres études, telles qu’une étude d’exposition orale de 13 semaines sur le rat et une étude d’exposition par inhalation de 14 jours sur le rat, au cours desquelles aucun effet n’a été observé aux doses respectives de 0,06 et de 0,31 mg/kg p.c. par jour (Haskell Laboratory, 1981a; Kennedy et al., 1986; Palazzolo, 1993; Perkins et al., 2004).
Les marges d’exposition ont également été calculées en fonction des concentrations sériques chez les souris ayant reçu la DMENO associée à la toxicité pour le développement, soit 1 mg/kg p.c. par jour (Lau et al., 2006). Bien qu’aucune DSENO n’ait été établie dans cette étude, une DSENO associée à la toxicité pour le développement de 0,3 mg/kg p.c. par jour, fondée sur une diminution du taux de survie néonatale à la dose de 0,6 mg/kg p.c. par jour et un retard de l’ouverture des yeux à 1 mg/kg p.c. par jour, a été déterminée au cours d’une étude de suivi visant à examiner le mécanisme d’action des effets de l’APFO sur le développement. Comme les concentrations sériques d’APFO n’ont été mesurées qu’au 22e jour après la naissance, les doses avec effet tirées de cette étude n’ont pas été utilisées pour calculer une marge d’exposition (Abbott et al., 2007). Dans l’étude de Macon et al., 2011, des cotes de développement de la glande mammaire significativement plus faibles ont été observées chez la progéniture des souris CD-1 au 21e jour après la naissance, lorsque les mères étaient exposées à une dose de 0,01 mg/kg p.c. par jour. Cette étude n’a pas été jugée pertinente pour être utilisée dans la caractérisation des risques, en raison d’indications de la sensibilité de la souche, de l’absence de répétabilité du paramètre à des niveaux d’exposition faibles, d’un manque de compréhension du mode d’action et de la pertinence de ce paramètre pour les humains. De plus, cette étude ne présente pas suffisamment de données probantes indiquant que ces effets sont permanents et, par conséquent, nocifs.
Comme les primates sont jugés plus représentatifs des sujets humains que les rongeurs, une étude de toxicité chez les singes d’une durée de 26 semaines a aussi été choisie pour estimer des marges d’exposition (Thomford, 2001b; Butenhoff et al., 2002). La concentration sérique d’APFO à l’équilibre chez les singes recevant la DMENO de 3 mg/kg p.c. par jour a été utilisée pour faire ce calcul. Aucune DSENO n’a été établie dans le cadre de cette étude.
L’utilisation des concentrations sériques pour calculer les marges d’exposition permet de réduire de façon marquée le niveau d’incertitude associé aux différences pharmacocinétiques interspécifiques et intraspécifiques. Chez les animaux de laboratoire, l’APFO passe principalement dans le sérum et dans le foie (Vanden Heuvel et al., 1991; Butenhoff et al., 2004a; Hundley et al., 2006; Kudo et al., 2007). On dispose de peu de données sur la distribution tissulaire de l’APFO chez l’humain, mais on suppose qu’elle serait semblable à celle observée chez les animaux de laboratoire (notamment les rats mâles, les souris mâles et femelles et les primates non humains) [Hundley et al., 2006]. La présence d’APFO a été décelée dans des échantillons de foie humain prélevés post mortem dans le cadre de deux études (Olsen et al., 2003b; Maestri et al., 2006). Comme les données sur les concentrations d’APFO dans les tissus humains sont limitées, les données sur les concentrations d’APFO dans le sang (sérum ou plasma) constituent, en raison de leur disponibilité, la mesure de l’exposition interne la plus appropriée. Compte tenu de la longue demi-vie de l’APFO et de son absence de métabolisme, les concentrations sanguines d’APFO chez les humains d’âge adulte représentent l’exposition cumulative (à vie) à l’APFO ainsi qu’à tous ses précurseurs. Les concentrations sanguines d’APFO chez les enfants, les personnes âgées et les adultes sont comparables. Bien que les études de toxicologie critiques sur des animaux de laboratoire aient été menées sur des périodes d’exposition inférieures à la durée de vie, les données pharmacocinétiques indiquent que les concentrations sériques d’APFO mesurées représentent un état d’équilibre (Vanden Heuvel et al., 1991; Butenhoff et al., 2004a; Lau et al., 2006).
Il est important de tenir compte de la contribution possible de la prolifération des peroxysomes lorsqu’on estime une marge d’exposition fondée sur les effets d’une substance sur les rongeurs. Les rats et les souris sont sensibles aux effets des agents de prolifération peroxysomale, alors que les singes et les humains y sont relativement insensibles à des doses similaires (recensé dans Klaunig et al., 2003; Kennedy et al., 2004). De ce fait, les marges d’exposition fondées sur des effets liés à la prolifération des peroxysomes seraient prudentes. Comme les marges reposent sur les effets les plus critiques et les espèces les plus sensibles, elles sont considérées comme adéquates pour tenir compte à la fois des effets indépendants et dépendants du PPAR.
Le SAAPFO a induit des tumeurs chez les rats exposés à ce sel, mais les autres composés de l’APFO n’ont pas encore été mis à l’essai pour vérifier leur potentiel de cancérogénicité chez aucune autre espèce d’animaux de laboratoire. Il se peut que le mode d’action d’un agoniste du PPAR proposé pour les tumeurs du pancréas, des testicules et du foie du rat ne s’applique pas à l’humain, mais sa pertinence pour les humains n’a pas été établie de façon définitive selon les cadres établis (Meek et al., 2003; Boobis et al., 2006).
Il a été montré que l’APFO stimule le PPARαhumain en culture cellulaire in vitro (Takacs et Abbott, 2007; Wolf et al., 2008), mais pas les cellules de Leydig des rats mâles (Biegel et al., 2001). L’activation du PPARα provoque une large gamme d’effets, dont la régulation de l’expression des gènes qui participent à la survie et à la croissance des cellules. En fait, on sait que certains ligands du PPARα possèdent des propriétés anti-oncogènes, telles que la suppression de la croissance de plusieurs types de cellules cancéreuses humaines in vitro ainsi que l’inhibition de la cancérogénicité in vivo (recensé dans Pozzi et Capdevila, 2008). Le PPARα pourrait donc être une cible éventuelle pour un traitement contre le cancer. Il convient également de noter que d’autres ligands du PPARα, tels que les fibrates, qui provoquent une forte incidence de tumeurs chez les rongeurs, sont fréquemment utilisés à des fins thérapeutiques chez l’humain, et aucun signe de cancérogénicité n’a été constaté dans les études épidémiologiques (recensé dans Peters et al., 2005).
Bien que le mode d’action de l’induction de tumeurs n’ait pas été démontré de façon concluante et que la pertinence de la formation de tumeurs chez les rats soit incertaine pour ce qui est de l’évaluation de la cancérogénicité chez l’humain, la base de données sur la génotoxicité indique que l’APFOn’a pas d’effet mutagène direct. Par conséquent, étant donné que les tumeurs observées chez les rats mâles ne semblent pas être causées par une interaction directe avec le matériel génétique, une approche fondée sur le seuil d’innocuité est utilisée afin de caractériser les risques pour la santé humaine. Les marges d’exposition calculées pour les effets non néoplasiques sont suffisantes pour tenir compte de l’incidence accrue des tumeurs bénignes observées dans les études de toxicité chronique de l’APFO sur les rats, car : a) les tumeurs ont été observées seulement à des doses supérieures à celles qui ont induit des effets non néoplasiques; b) la base de données sur la génotoxicité indique que l’APFO n’a pas d’effet mutagène; c) les tumeurs hépatiques chez le rat sont vraisemblablement induites par un mode d’action qui ne s’applique pas à l’humain; d) aucun effet lié à l’APFOobservé chez les primates non humains n’a été associé à l’apparition de tumeurs du pancréas ou des testicules chez le rat.
Incertitudes dans l’évaluation des risques pour la santé humaine
L’utilisation des concentrations dans le sang (sérum ou plasma) permet de réduire le niveau d’incertitude associé à l’établissement de la limite supérieure estimée de l’absorption humaine d’APFO, étant donné les données limitées dont on dispose sur les concentrations d’APFO et de ses précurseurs dans l’air, les aliments, l’eau potable et le lait maternel et résultant du contact avec des matériaux domestiques traités avec des substances perfluorées. Qui plus est, les concentrations d’APFO dans le sang humain fournissent une mesure de l’exposition combinée à de multiples sources et voies d’exposition. L’utilisation des concentrations sanguines permet également de réduire de façon marquée le niveau d’incertitude associé aux différences pharmacocinétiques interspécifiques et intraspécifiques.
L’utilisation des valeurs du 95e centile des concentrations sériques ou plasmatiques s’avère prudente. En outre, des mesures ont été prises récemment afin de réduire les émissions des usines à l’échelle mondiale ainsi que la teneur des produits en APFO et en substances chimiques apparentées, y compris au Canada (US EPA, 2006c; EPE, 2009). Bien que deux études de biosurveillance plus anciennes menées aux États-Unis aient montré une diminution des concentrations sériques d’APFO par rapport à la période précédant l’instauration des mesures de réduction (Calafat et al., 2007, 2008), des données plus récentes tirées de l’étude NHANES montrent que les concentrations sériques d’APFO étaient stables pendant la période de 2003 à 2008 (USCDC, 2011). Des données canadiennes récentes affichent une tendance similaire, les concentrations étant demeurées stables pendant la période de 2004 à 2009 (voir le tableau 7). Les marges d’exposition présentées dans le tableau 8 sont fondées sur des concentrations sériques et plasmatiques mesurées de 1994 à 2009. Les concentrations d’APFO chez les Canadiens, dont fait état l’ECMS, sont comparables aux concentrations mesurées aux États-Unis, d’après les données de l’étude NHANES les plus récentes. Des lacunes subsistent dans les données de biosurveillance concernant les nourrissons et les enfants canadiens, de la naissance à l’âge de deux ans. Les données concernant les nourrissons allaités indiquent que ce groupe d’âge pourrait être la sous-population la plus exposée (Fromme et al., 2010).
Certaines incertitudes subsistent quant au mode d’action de l’induction de tumeurs; toutefois, comme la base de données sur la génotoxicité indique que l’APFO n’aurait pas d’effet mutagène, les marges d’exposition fondées sur les effets non néoplasiques chez les espèces les plus sensibles sont considérées comme suffisantes pour assurer une protection contre tout effet cancérogène chez l’humain.
Les effets de l’APFO à de faibles doses, y compris sur le développement des glandes mammaires, sont incertains; d’autres études sont requises pour explorer davantage ces premiers résultats.
L’évaluation est fondée sur une méthode du poids de la preuve en ce qui concerne la persistance, la bioaccumulation, les tendances temporelles chez certaines espèces (p. ex., l’ours blanc), le transport à grande distance, la présence répandue et les concentrations de l’APFO dans l’environnement et le biote (y compris les régions éloignées du Canada).
Selon l’information présentée dans la présente évaluation préalable, il est conclu que l’APFO, ses sels et ses précurseurs pénètrent ou peuvent pénétrer dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique. De plus, il est conclu que l’APFO et ses sels sont extrêmement persistants et qu’ils répondent aux critères de persistance énoncés dans le Règlement sur la persistance et la bioaccumulation. L’APFO et ses sels ne répondent pas aux critères de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation. Néanmoins, le poids de la preuve est suffisant pour conclure que l’APFO et ses sels s’accumulent et se bioamplifient chez les mammifères terrestres et marins.
D’après une comparaison entre la limite supérieure des concentrations de cet acide dans le sang (plasma ou sérum) chez les êtres humains et les concentrations sériques associées à l’apparition d’effets nocifs chez les animaux de laboratoire, on considère que les marges d’exposition calculées (tableau 8) sont adéquates pour protéger la santé humaine. Il est conclu que l’APFO et ses sels ne pénètrent pas dans l’environnement en une quantité, à une concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines. Les précurseurs de l’APFO pouvant se dégrader en APFO dans l’environnement n’ont pas été évalués de façon individuelle. La démarche suivie dans la présente évaluation prenait en compte leur contribution à l’exposition totale, qui correspond à la fraction préoccupante sur le plan toxicologique, étant donné qu’ils peuvent se dégrader en APFO dans l’environnement.
Il est donc conclu que l’APFO, ses sels et ses précurseurs répondent à au moins un des critères énoncés à l’article 64 de la LCPE (1999).
3M Company. 1977. Acute toxicity of FC-143 to fish (fathead minnow). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0498.
3M Company. 1978a. Acute toxicity of FC-143 to fish (bluegill sunfish). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0499.
3M Company. 1978b. Acute toxicity of FC-143 to fish (bluegill sunfish). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0500.
3M Company. 1979. Technical report summary--Final comprehensive report: FC-143. St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0528.
3M Company. 1980a. Activated sludge respiration inhibition (FC-143). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0505.
3M Company. 1980b. Ready biodegradation of FC-143 (BOD/COD). Lab Request No. 5625S. St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0492.
3M Company. 1982. Acute toxicity of FC-143 to aquatic invertebrates (Daphnia magna). St. Paul (MN): 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0507.
3M Company. 1984. Chronic toxicity to freshwater invertebrates (Daphnia magna). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0508.
3M Company. 1985a. Acute toxicity of FX-1001 to fish (fathead minnow). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0509.
3M Company. 1985b. Ready biodegradation of FX-1001 (BOD/COD). Lab Request No. C1006. St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0494.
3M Company. 1987a. Microbics Microtox toxicity test (FC-126). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0511.
3M Company. 1987b. Acute toxicity of FC-126 to aquatic invertebrates (Daphnia magna). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0512.
3M Company. 1987c. Acute toxicity of FC-126 to fish (fathead minnow). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, US Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0513.
3M Company. 1990a. Activated sludge respiration inhibition (FX-1003). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0514.
3M Company. 1990b. Microbics Microtox toxicity test (FX-1003). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0515.
3M Company. 1995. Technical report summary on assessment of the bioaccumulative properties of ammonium perfluorooctanoate: static fish test. St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0496.
3M Company. 1996a. Microbics Microtox toxicity test (FC-1015X). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0523.
3M Company. 1996b. Microbics Microtox toxicity test (FC-118). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0522.
3M Company. 1996c. Microbics Microtox toxicity test (FC-143). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0521.
3M Company. 1996d. Activated sludge respiration inhibition test (FC-1015X). St. Paul (MN) : 3M Company. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0524.
Abbott, B.D., Wolf, C.J., Schmid, J.E., Das, K.P., Zehr, R.D., Helfant, L., Nakayama, S., Lindstrom, A.B., Strynar, M.J., Lau, C.S. 2007. Perfluorooctanoic acid (PFOA)-induced developmental toxicity in the mouse is dependent on expression of peroxisome proliferator activated receptor-alpha (PPARα). Toxicol. Sci. 98(2):571-581.
Ahrens, L., Barber, J.L., Xie, Z., Ebinghaus, R. 2009. Longitudinal and latitudinal distribution of perfluoroalkyl compounds in the surface water of the Atlantic Ocean. Environ. Sci. Technol. 43(9):3122-3127.
Ahrens, L., Shoeib, M., Cheng, C., Lee, S.-C., Harner, T. 2010a. Wastewater Treatment Plant and Landfill Inputs of Polyfluoroalkyl Compounds and Siloxanes to the Atmosphere. Présentation dans le cadre de PFAA Day III: Recent Advances in Perfluoroalkyl Acid (PFAA) Research, tenu par l’Environmental Protection Agency des États-Unis, du 8 au 10 juin 2010, à Research Triangle Park (NC).
Ahrens, L., Xie, Z., Ebinghaus, R. 2010b. Distribution of perfluoroalkyl compounds in seawater from northern Europe, Atlantic Ocean and Southern Ocean. Chemosphere 78:1011-1016.
Alexander, B.H., Olsen, G.W., Burris, J.M., Mandel, J.H., Mandel, J.S. 2003. Mortality of employees of a perfluorooctanesulphonyl fluoride manufacturing facility. Occup. Environ. Med. 60(10):722-729.
Apelberg, B.J., Goldman, L.R., Calafat, A.M., Herbstman, J.B., Kuklenyik, Z., Heidler, J., Needham, L.L., Halden, R.U., Witter, F.R. 2007a. Determinants of fetal exposure to polyfluoroalkyl compounds in Baltimore, Maryland. Environ. Sci. Technol.41(11):3891-3897.
Apelberg, B.J., Witter, F.R., Herbstman, J.B., Calafat, A.M., Halden, R.U., Needham, L.L., Goldman, L.R. 2007b. Cord serum concentrations of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in relation to weight and size at birth. Environ. Health Perspect. 115(11):1670-1676.
Armitage, J., Cousins, I.T., Buck, R.C., Prevedouros, K., Russell, M.H., MacLeod, M., Korzeniowski, S.H. 2006. Modelling global-scale fate and transport of perfluorooctanoate emitted from direct sources. Environ. Sci. Technol.40(22):6969-6975.
Arp, H.P.H., Niederer, C., Goss, K.-U. 2006. Predicting the partitioning behaviour of highly fluorinated compounds. Environ. Sci. Technol.40(23):7298-7304.
Bartell, S.M., Calafat, A.M., Lyu, C., Kato, K., Ryan, P.B., Steenland, K. 2010. Rate of decline in serum PFOA concentrations after granular activated carbon filtration at two public water systems in Ohio and West Virginia. Environ. Health Perspect. 118:222-228.
Barton, C.A., Kaiser, M.A., Russell, M.H. 2007. Partitioning and removal of perfluorooctanoate during rain events: the importance of physical-chemical properties. J. Environ. Monit.9:839-846.
Beach, S.A. 1995a. Inhibitory effect of L-13492 to Microbics’ Microtox toxicity analyzer system. Document présenté à l’Office of Pollution Prevention and Toxics, U.S, Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 094.
Beach, S.A. 1995b. Inhibitory effects of L-13492 on activated sludge respiration. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 095.
Beesoon, S., Webster, G.M., Shoeib, M., Harner, T., Benskin, J.P., Martin, J.W. 2011. Isomer profiles of perfluorinated compounds in matching samples of pregnant women, cord serum and house dust: sources and transplacental transfer. [Inédit, soumis en décembre 2010].
Begley, T.H., White, K., Honigfort, P., Twaroski, M.L., Neches, R., Walker, R.A. 2005. Perfluorochemicals: potential sources of and migration from food packaging. Food Addit. Contam.22(10):1023-1031.
Biegel, L.B., Liu, R.C.M., Hurtt, M.E., Cook, J.C. 1995. Effects of ammonium perfluorooctanoate on Leydig cell function: in vitro, in vivo, and ex vivo studies. Toxicol. Appl. Pharmacol. 134(1):18-25.
Biegel, L.B., Hurtt, M.E., Frame, S.R., O’Connor, J., Cook, J.C. 2001. Mechanisms of extrahepatic tumor induction by peroxisome proliferators in male CD rats. Toxicol. Sci. 60(1):44-55.
Biosearch Inc. 1976. Acute oral toxicity--rats. Rapport inédit préparé pour la Compagnie 3M, St. Paul (MN).
Bononi, M., Tateo, F. 2007. Identification of perfluorooctanoic acid release from commercial coated cooking pans by liquid chromatography coupled to electrospray ionization tandem mass spectrometry. Am. J. Agric. Biol. Sci. 2(3):191-194.
Boobis, A.R., Cohen, S.M., Dellarco, V., McGregor, D., Meek, M.E., Vickers, C., Willcocks, D., Farland, W. 2006. IPCS framework for analyzing the relevance of a cancer mode of action for humans. Crit. Rev. Toxicol. 36(10):781-792.
Bossi, R., Riget, F.F., Dietz, R., Sonne, C., Fauser, P., Dam, M., Vorkamp, K. 2005. Preliminary screening of perfluorooctane sulfonate (PFOS) and other fluorochemicals in fish, birds, and marine mammals from Greenland and the Faroe Islands. Environ. Pollut. 136(2):323-329.
Boudreau, T.M. 2002. Toxicological evaluation of perfluorinated organic acids to selected freshwater primary and secondary trophic levels under laboratory and semi-natural field conditions [thèse de maîtrise]. Guelph (Ont.) : Université de Guelph, Département de biologie environnementale.
Boulanger, B., Vargo, J., Schnoor, J.L., Hornbuckle, K.C. 2004. Detection of perfluorooctane surfactants in Great Lakes water. Environ. Sci. Technol. 38(15):4064-4070.
Boulanger, B., Peck, A.M., Schnoor, J.L., Hornbuckle, K.C. 2005. Mass budget of perfluorooctane surfactants in Lake Ontario. Environ. Sci. Technol.39(1):74-79.
Bradley, E.L., Read, W.A., Church, L. 2007. Investigation into the migration potential of coating materials from cookware products. Food Addit. Contam. 24(3):326-335.
Brede, E., Wilhelm, M., Göen, T., Müller, J., Rauchfuss, K., Kraft, M., Hölzer, J. 2010. Two year follow-up biomonitoring pilot study of residents’ and controls’ PFC plasma levels after PFOA reduction in public water system in Arnsberg, Germany. Int. J. Hyg. Environ. Health213:217-223.
Burns, D.C., Ellis, D.A., Li, H., McMurdo, C.J., Webster, E. 2008. Experimental pKa determination for perfluorooctanoic acid (PFOA) and the potential impact of pKa concentration dependence on laboratory-measured partitioning phenomena and environmental modeling. Environ. Sci. Technol. 42(24):9283-9288.
Burris, J.M., Lundberg, J.K., Olsen, G., Simpson, C., Mandel, J. 2002. Determination of serum half-lives of several fluorochemicals. Interim Report No. 2. St. Paul (MN) : 3M Company, Medical Department.
Butenhoff, J., Costa, G., Elcombe, C., Farrar, D., Hansen, K., Iwai, H., Jung, R., Kennedy, G. Jr, Lieder, P., Olsen, G., Thomford, P. 2002. Toxicity of ammonium perfluorooctanoate in male cynomolgus monkeys after oral dosing for 6 months. Toxicol. Sci. 69(1):244-257.
Butenhoff, J.L., Kennedy, G.L. Jr, Hinderliter, P.M., Lieder, P.H., Jung, R., Hansen, K.J., Gorman, G.S., Noker, P.E., Thomford, P.J. 2004a. Pharmacokinetics of perfluorooctanoate in cynomolgus monkeys. Toxicol. Sci. 82(2):394-406.
Butenhoff, J.L., Kennedy, G.L. Jr, Frame, S.R., O’Connor, J.C., York, R.G. 2004b. The reproductive toxicology of ammonium perfluorooctanoate (APFO) in the rat. Toxicology 196(1-2):95-116.
Butenhoff, J.L., Gaylor, D.W., Moore, J.A., Olsen, G.W., Rodricks, J., Mandel, J.H., Zobel, L.R. 2004c. Characterization of risk for general population exposure to perfluorooctanoate. Regul. Toxicol. Pharmacol. 39(3):363-380.
Butt, C., Smithwick, M. 2004. Présentation lors du Workshop on the Environmental Fate of Fluorotelomer-Based Polymers, du 12 au 14 sept. 2004, Toronto (Ont.) Parrainé par le Canadian Environmental Modelling Network, Environnement Canada et DuPont Canada.
Butt, C.M., Mabury, S.A., Muir, D.C.G., Braune, B.M. 2007a. Prevalence of long-chained perfluorinated carboxylates in seabirds from the Canadian Arctic between 1975 and 2004. Environ. Sci. Technol. 41(10):3521-3528.
Butt, C.M., Muir, D.C.G., Stirling, I., Kwan, M., Mabury, S.A. 2007b. Rapid response of Arctic ringed seals to changes in perfluoroalkyl production. Environ. Sci. Technol.41(1):42-49.
Butt, C.M., Mabury, S.A., Kwan, M., Wang, X., Muir, D.C.G. 2008. Spatial trends of perfluoroalkyl compounds in ringed seals (Phoca hispida) from the Canadian Arctic. Environ. Toxicol. Chem. 27(3):542-553.
Butt, C.M., Muir, D.C.G., Mabury, S.A. 2010a. Elucidating the pathways of poly- and perfluorinated acid formation in rainbow trout. Environ. Sci. Technol. 44(13):4973-4980.
Butt, C.M., Muir, D.C.G., Mabury, S.A. 2010b. Biotransformation of the 8:2 fluorotelomer acrylate in rainbow trout. 1. in vivo dietary exposure. Environ. Toxicol. Chem.29(12):2726-2735.
Calafat, A.M., Wong, L.-Y., Kuklenyik, Z., Reidy, J.A., Needham, L.L. 2007. Polyfluoroalkyl chemicals in the U.S. population: data from the National Health and Nutrition Examination Survey (NHANES) 2003-2004 and comparisons to NHANES 1999-2000. Environ. Health Perspect. 115(11):1596-1602.
Caliebe, C., Gerwinski, W., Hühnerfuss, H., Theobald, N. 2004. Occurrence of perfluorinated organic acids in the water of the North Sea. Organohalogen Compd 66:4074-4078.
Canada. 1995a. Politique de gestion des substances toxiques. Ottawa (Ont.) : sa Majesté la Reine du chef du Canada (Environnement Canada). [réimpression en 2004]. Document disponible sur demande.
Canada. 1995b. Politique de gestion des substances toxiques : critères de persistance et de bioaccumulation. Ottawa (Ont.) : sa Majesté la Reine du chef du Canada (Environnement Canada). Document disponible sur demande.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), L.C. 1999, ch. 33. Gazette du Canada, Partie III : vol. 22, n° 3.
Canada. 2000a. Loi canadienne sur la protection de l’environnement (1999) : Règlement sur la persistance et la bioaccumulation. C.P. 2000-348, 23 mars 2000, DORS/2000-107. Gazette du Canada, Partie II : vol. 134, n° 7.
Canada. Ministère de l’Environnement. 2000b. Loi canadienne sur la protection de l’environnement (1999) :Avis concernant certaines substances perfluoroalkyliques et fluoroalkyliques ainsi que leurs dérivés et polymères. Gazette du Canada, Partie I : vol. 134, n° 24.
Canada. Ministère de l’Environnement. 2004. Loi canadienne sur la protection de l’environnement (1999) :Avis concernant certaines substances perfluoroalkyliques et fluoroalkyliques. Gazette du Canada, Partie I : vol. 139, n° 3.
[CATABOL] Probabilistic assessment of biodegradability and metabolic pathways [modèle informatique - OASIS Software]. c2004-2008. Version 5.10.2. Bourgas (Bulgarie) : Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry.
Cheng, J., Vecitis, C.D., Park, H., Mader, B.T., Hoffmann, M.R. 2008. Sonochemical degradation of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in landfill groundwater: environmental matrix effects. Environ. Sci. Technol.42(21):8057-8063.
Christopher, B., Marias, A.J. 1977. Report to 3M Company: 28-day oral toxicity study with FC-142 in albino mice. Northbrook (IL) : Industrial Bio-Test Laboratories Inc. IBT No. 8532-10655.
[CIT] Centre International de Toxicologie. 2003. Ammonium perfluorooctanoate (APFO): Daphnia magna reproduction test. Study No. 22658 ECD. Evreux (France) : CIT. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT-2003-0012-0180.
Conder, J.M., Hoke, R.A., de Wolf, W., Russell, M.H., Buck, R.C. 2008. Are PFCAs bioaccumulative? A critical review and comparison with regulatory criteria and persistent lipophilic compounds. Environ. Sci. Technol. 42(4):995-1003.
Conestoga-Rovers & Associates. 2011. Sampling for Chemicals Management Plan Challenge substances from the waste sector 2010 field sampling program. Document préparé pour Environnement Canada, Waterloo (Ont.)
Cook, J.C., Murray, S.M., Frame, S.R., Hurtt, M.E. 1992. Induction of Leydig cell adenomas by ammonium perfluorooctanoate: a possible endocrine-related mechanism. Toxicol. Appl.Pharmacol. 113(2):209-217.
Cook, J.C., Klinefelter, G.R., Hardisty, J.F., Sharpe, R.M., Foster, P.M. 1999. Rodent Leydig cell tumorigenesis: a review of the physiology, pathology, mechanisms and relevance to humans. Crit. Rev. Toxicol. 29(2):169-261.
Costa, G., Sartori, S., Consonni, D. 2009. Thirty years of medical surveillance in perfluooctanoic acid production workers. J. Occup. Environ. Med. 51(3):364-372.
Crozier, P., Furdui, V., Lucaciu, C., Stock, N., Mabury, S., Reiner, E. 2005. Detection of perfluoro-alkyl compounds (PFCs) in sewage treatment plant (STP) effluents and biosolids by liquid chromatography - tandem mass spectrometry. Toronto (Ont.) Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Dai, J., Li, M., Jin, Y., Saito, N., Xu, M., Wei, F. 2006. Perfluorooctanesulfonate and perfluorooctanoate in red panda and giant panda from China. Environ. Sci. Technol. 40(18):5647-5652.
Dekleva, L.A. 2003. Adsorption/desorption of ammonium perfluorooctanoate to soil (OCDE106). Document préparé pour E.I. du Pont de Nemours and Company et financé par PlasticsEurope (EMSER 17-03).
Del Gobbo, L., Tittlemier, S., Diamond, M., Pepper, K., Tague, B., Yeudall, F., Vanderlinden, L. 2008. Cooking decreases observed perfluorinated compound concentrations in fish. J. Agric.Food Chem. 56(16):7551-7559.
Del Vento, S., Codling, G., Ahrens, L., Ebinghuas, R., Jones, K.C., Halsall, C.J. 2009. Perfluoroalkylcompounds in the Arctic marine system: air, snow, water and sea-ice. Présentation lors de la SETAC North America, en novembre 2009, à la Nouvelle-Orléans (LA).
D’Eon, J., Mabury, S. 2007. Production of perfluorinated carboxylic acids (PFCAs) from the biotransformation of polyfluoroalkyl phosphate surfactants (PAPS): exploring routes of human contamination. Environ. Sci. Technol.41(1):4799-4805
De Silva, A.O., Mabury, S.A. 2004. Isolating isomers of perfluorocarboxylates in polar bears (Ursus maritimus) from two geographical locations. Environ. Sci. Technol. 38(24):6538-6545.
De Silva, A.O., Muir, D.C.G., Mabury, S.A. 2009. Distribution of perfluorocarboxylate isomers in select samples from the North American environment. Environ. Toxicol. Chem.28(9):1801-1814.
Dietz, R., Bossi, R., Rigét, F.F., Sonne, C., Born, E.W. 2008. Increasing perfluoroalkyl contaminants in East Greenland polar bears (Ursus maritimus): a new toxic threat to the Arctic bears. Environ. Sci. Technol. 42(7):2701-2707.
Dinglasan, M.J.A., Ye, Y., Edwards, E.A., Mabury, S.A. 2004. Fluorotelomer alcohol biodegradation yields poly- and perfluorinated acids. Environ. Sci. Technol.38(10):2857-2864.
Dinglasan, M.J.A., Ye, Y., Edwards, E.A., Mabury, S.A. 2005. Biodegradation of 8:2 telomer alcohol and 8:2 telomer acids under aerobic conditions. Toronto (Ont.) Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Dinglasan-Panlilio, M.J.A., Mabury, S. 2006. Significant residual fluorinated alcohols present in various fluorinated materials. Environ. Sci. Technol. 40(5):1447-1453.
Dreyer, A., Weinberg, I., Temme, C., Ebinghaus, R. 2009. Polyfluorinated compounds in the atmosphere of the Atlantic and Southern Oceans: evidence for a global distribution. Environ. Sci. Technol. 43(17):6507-6514
Ellington, J.J., Washington, J.W., Strynar, M.J., Evans, J.J., Jenkins, T.M., Henderson, W.M. 2005. Determination of perfluorinated chemicals (PFCs) in soils, sediments, and other matrices. Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Ellis, D.A., Mabury, S.A., Martin, J.W., Muir, D.C.G. 2001. Thermolysis of fluoropolymers as a potential source of halogenated organic acids in the environment. Nature 412:321-324.
Ellis, D.A., Martin, J.W., Muir, D.C.G., Mabury, S.A. 2003. The use of F-19 NMR and mass spectrometry for the elucidation of novel fluorinated acids and atmospheric fluoroacid precursors evolved in the thermolysis of fluoropolymers. Analyst128:756-764.
Ellis, D.A., Martin, J.W., De Silva, A.O., Mabury, S.A., Hurley, M.D., Andersen, M.P.S., Wallington, T.J. 2004a. Degradation of fluorotelomer alcohols: a likely atmospheric source of perfluorocarboxylic acids. Environ. Sci. Technol. 38(12):3316-3321.
Ellis, D.A., Mabury, S.A., Martin, J., Stock, N. 2004b. Environmental review of perfluorooctanoic acid (PFOA) and its salts. Document préparé en vertu d’un contrat pour Environnement Canada, Gatineau (Qc).
Elnabarawy, M.T. 1980. Aquatic toxicity testing: FC-143 (Lot-37) L.R. 5626S. Report No. 037. Document préparé pour l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0504.
Elnabarawy, M.T. 1981. Multi-phase exposure/recovery algal assay test method. Report No. 006. Document préparé pour l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0506.
Emmett, E.A., Shofer, F.S., Zhang, H., Freeman, D., Desai, C., Shaw, L.M. 2006a. Community exposure to perfluorooctanoate: relationships between serum concentrations and exposure sources. J. Occup. Environ. Med. 48(8):759-770.
Emmett, E.A., Zhang, H., Shofer, F.S., Freeman, D., Rodway, N.V., Desai, C., Shaw, L.M. 2006b. Community exposure to perfluorooctanoate: relationships between serum concentrations and certain health parameters. J. Occup. Environ. Med. 48(8):771-779.
Environnement Canada. 2001. Primary report on PFAs from section 71 survey. Préparé par la Section de l’utilisation des produits, Division du contrôle des produits chimiques, Direction de l’évaluation des produits chimiques commerciaux, Environnement Canada, Gatineau (Qc).
Environnement Canada. 2005. Report on PFCAs from Section 71 survey. Préparé par Environnement Canada, Gatineau (Qc).
[EPE] Entente sur la performance environnementale. 2009. Projet d’entente sur la performance environnementale (« Entente ») concernant la présence d’acides perfluorocarboxyliques (APFC) et de leurs précurseurs dans les produits chimiques perfluorés vendus au Canada entre Sa Majesté le Reine du chef du Canada, représentée par le ministre de l’Environnement et le ministre de la Santé, et les fabricants et importateurs participants de produits chimiques perfluorés tels qu’ils sont énumérés à l’annexe 1 (les « entreprises participantes »).
Eriksen, K.T., SØrensen, M., McLaughlin, J.K., Lipworth, L., TjØnneland, A., Overvad, K., Raaschou-Nielsen, O. 2009. Perfluorooctanoate and perfluorooctanesulfonate plasma levels and risk of cancer in the general Danish population. J. Natl Cancer Inst. 101(8):605-9.
Fei, C., McLaughlin, J.K., Tarone, R.E., Olsen, J. 2007. Perfluorinated chemicals and fetal growth: a study within the Danish National Birth Cohort. Environ. Health Perspect. 115(11):1677-1682.
Fei, C., McLaughlin, J.K., Lipworth, L., Olsen, J. 2008a. Prenatal exposure to perfluorooctanoate (PFOA) and perfluorooctanesulfonate (PFOS) and maternally reported developmental milestones in infancy. Environ. Health Perspect. 116(10):1391-1395.
Fei, C., McLaughlin, J.K., Tarone, R.E., Olsen, J. 2008b. Fetal growth indicators and perfluorinated chemicals: a study in the Danish National Birth Cohort. Am. J. Epidemiol.168(1):66-72.
Fei, C., McLaughlin, J.K., Lipworth, L., Olsen, J. 2009. Maternal levels of perfluorinated chemicals and subfecundity. Hum. Reprod. 24(5):1200-1205.
Flanary, J.R., Reiner, J.L., Helke, K.L., Kucklick, J.R., Gulland, F.M.D., Becker, P.R. 2010. Measurements of perfluorinated compounds in plasma of northern fur seals (Callorhinus ursinus) and a preliminary assessment of their relationship to peroxisome proliferation and blood chemistry parameters. Présentation dans le cadre de PFAA Day III: Recent Advances in Perfluoroalkyl Acid (PFAA) Research, tenu par l’Environmental Protection Agency des États-Unis, du 8 au 10 juin 2010, à Research Triangle Park (NC).
Franklin, J. 2002. Screening assessment for the potential for long-range atmospheric transport of perfluorooctanoic acid. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT-2003-0012-0183.
Frisbee, S.J., Shankar, A., Knox, S.S., Steenland, K., Fletcher, T., Savitz, D.A., Ducatman, A.M. 2010. The C8 Health Project: associations between perfluorooctanoic acid and perfluorooctanesulfonic acid and serum lipids in children. Arch. Pediatr. Adolesc. Med. 164(9):860-869.
Frömel, T., Knepper, T.P. 2010. Fluorotelomer ethoxylates: sources of highly fluorinated environmental contaminants, part I: biotransformation. Chemosphere 80:1387-1392.
Fromme, H., Tittlemier, S.A., Volkel, W., Wilhelm, M., Twardella, D. 2009. Perfluorinated compounds--exposure assessment for the general population in Western countries. Int. J. Hyg. Environ. Health 212(3):239-270.
Fromme, H., Mosch, C., Morovitz, M., Alba-Alejandre, I., Boehmer, S., Kiranoglu, M., Faber, F., Hannibal, I., Genzel-Boroviczény, O., Koletzko, B., Volkel, W. 2010. Pre- and postnatal exposure to perfluorinated compounds (PFCs). Environ. Sci. Technol. 44(18):7123-7129.
Furdui, V.I., Crozier, P., Reiner, E., Mabury, S.A. 2005. Direct measurement of perfluoroalkylated surfactants in the Great Lakes water samples. Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Furdui, V.I., Stock, N.L., Ellis, D.A., Butt, C.M., Whittle, D.M., Crozier, P.W., Reiner, E.J., Muir, D.C.G., Mabury, S.A. 2007. Spatial distribution of perfluoroalkyl contaminants in lake trout from the Great Lakes. Environ. Sci. Technol. 41(5):1554-1559.
Furdui, V.I., Helm, P.A., Crozier, P.W., Lucaciu, C., Reiner, E.J., Marvin, C.H., Whittle, D.M., Mabury, S.A., Tomy, G.T. 2008. Temporal trends of perfluoroalkyl compounds with isomer analysis in lake trout from Lake Ontario (1979-2004). Environ. Sci. Technol. 42(13):4739-4744.
Gewurtz. S.B., Bhavsar, S.P., Crozier, P.W., Diamond, M.L., Helm, P.A., Marvin, C.H., Reiner, E.J. 2009. Perfluoroalkyl contaminants in window film: indoor/outdoor, urban/rural, and winter/summer contamination and assessment of carpet as a possible source. Environ. Sci. Technol. 43(19):7317-7323.
Giesy, J.P., Newsted, J.L. 2001. Selected fluorochemicals in the Decatur, Alabama area. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a.
Glaza, S. 1990. Acute Oral Toxicity Study in Rats (OECD Guidelines). Étude inédite préparée par Hazleton Labs, HLA 91201739.
Glaza, S. 1995. Final Report: single-dose dermal absorption toxicity study of T-6067, T-6068, and T-6069 in rabbits. Rapport inédit rédigé par Hazleton Wisconsin, Inc., Madison (WI) pour 3M, rapport n° HWI 6329-152.
Glaza, S. 1997. Acute oral toxicity study of T-6669 in rats (OECD Guidelines). Document rédigé par Corning Hazleton Inc., Madison (WI). Project ID CHW 61001760.
Goldenthal, E.I. 1978a. Ninety day subacute rat toxicity study. Rapport rédigé par la International Research and Development Corporation, rapport n° 137-089.
Goldenthal, E.I. 1978b. Ninety day subacute rhesus monkey toxicity study. Rapport rédigé par la International Research and Development Corporation, rapport n° 137-090. Rapport sur le sérum préparé par le Central Analytical Laboratory, rapport n° 6919.
Gortner, E.G. 1981. Oral teratology study of T-2998CoC in rats. Experiment No. 0681TR0110. St. Paul (MN) : Safety Evaluation Laboratory and Riker Laboratories, Inc.
Gortner, E.G. 1982. Oral teratology study of T-3141C0C in rabbits. Experiment No. 0681TB0398. Rapport inédit préparé par Riker Laboratories, Inc., St. Paul (MN).
Goss, K.-U. 2008. The pKa values of PFOA and other highly fluorinated carboxylic acids. Environ. Sci. Technol.42(2):456-458.
Goss, K.-U., Arp, H.P.H. 2009. Comment on "Experimental pKa determination for perfluorooctanoic acid (PFOA) and the potential impact of pKa concentration dependence on laboratory-measured partitioning phenomena and environmental modeling." Environ. Sci. Technol. 43(1):5150-5151. [addenda à Arp, H.P.H., Goss, K.-U. 2009. Gas/particle partitioning behaviour of perfluorocarboxylic acids with terrestrial aerosols. Environ. Sci. Technol. 43:8542-8547.]
Gouvernement des États-Unis. 2003. Perfluorooctanoic acid (PFOA), fluorinated telomers; request for comment, solicitation of interested parties for enforceable consent agreement development, and notice of public meeting. Federal Register68(73):18626-18633.
Griffith, F.D., Long, J.E. 1980. Animal toxicity studies with ammonium perfluorooctanoate. Am. Ind. Hyg. Assoc. J. 41:576-583.
Gulkowska, A., Falandysz, J., Taniyasu, S., Bochentin, I., So, M.K., Yamashita, N. 2005. Perfluorinated chemicals in blood of fish and waterfowl from Gulf of Gdansk, Baltic Sea. Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Hagen, D.F., Belisle, J., Johnson, J.D., Venkateswarlu, P. 1981. Characterization of fluorinated metabolites by a gas chromatographic-helium microwave plasma detector--the biotransformation of 1h,1h,2h,2h-perfluorodecanol to perfluorooctanoate. Anal. Biochem. 118(2):336-343.
Hamm, M.P., Cherry, N.M., Chan, E., Martin, J.W., Burstyn, I. 2009. Maternal exposure to perfluorinated acids and fetal growth. Expo. Sci. Environ. Epidemiol.20(7):589-97.
Han, X., Snow, T.A., Kemper, R.A., Jepson, G.W. 2003. Binding of perfluorooctanoic acid to rat and human plasma proteins. Chem. Res. Toxicol. 16(6):775-781.
Han, X., Hinderliter, P.M., Snow, T.A., Jepson, G.W. 2004. Binding of perfluorooctanoic acid to rat liver-form and kidney-form α-globulins. Drug Chem. Toxicol. 27(4):341-360.
Han, X., Kemper, R.A., Jepson, G.W. 2005. Subcellular distribution and protein binding of perfluorooctanoic acid in rat liver and kidney. Drug Chem. Toxicol. 28(2):197-209.
Hanson, M.L., Sibley, P.K., Boudreau, T.M., Small, J., Brain, R.A., Mabury, S.M., Solomon, K.R. 2005. Microcosm evaluation of the toxicity and risk to aquatic macrophytes from perfluorooctanoic acid (PFOA) and perfluorooctane sulfonic acid (PFOS). Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, du 18 au 20 août 2005, à Toronto (Ont.). Fluoros Abstract Book.
Haskell Laboratory. 1969. Acute inhalation dust toxicity. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 160-69.
Haskell Laboratory. 1979a. Inhalation subacute. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 253-79.
Haskell Laboratory. 1979b. Skin absorption LD50 rabbit and rat. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 659-79.
Haskell Laboratory. 1980. Rat skin absorption subacute study with FC-143. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 589-80.
Haskell Laboratory. 1981a. Subacute inhalation toxicity of pentadecafluorooctanoic acid, ammonium salt. Newark (DE) : DuPont, Haskell Laboratory, rapport n° 205-81.
Haskell Laboratory. 1981b. Oral LD50 test in rats. Newark (DE) : DuPont, Haskell Laboratory. N° du rapport : 295-81.
Hatfield, T. 2001. Screening studies on the aqueous photolytic degradation of perfluorooctanoic acid (PFOA). Lab Request No. E00-2192. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a.
Hatfield, T., Lange, C., Radford, P. 2002. Proposed photolysis and radical propagation scheme for sulphonamides of primary amines. Communication personnelle entre 3M et D. Ellis, Université de Toronto, le 11 novembre 2002, Toronto (Ont.)
Henwood, S. 1997. 5 daily dose oral toxicity study with T-6669 in rats. Madison (WI) : Corning Hazleton Inc. Project ID CHW 6329-197.
Higgins, C.P., Luthy, R.G. 2006. Sorption of perfluorinated surfactants on sediments. Environ. Sci. Technol.40:7251-7256.
Hines, E.P., White, S.S., Stanko, J.P., Gibbs-Flournoy, E.A., Lau, C., Fenton, S.E. 2009. Phenotypic dichotomy following developmental exposure to perfluorooctanoic acid (PFOA) in female CD-1 mice: Low doses induce elevated serum leptin and insulin, and overweight in mid-life. Mol. Cell. Endocrinol.304(1-2):97-105.
Holmström, K.E., Berger, U. 2008. Tissue distribution of perfluorinated surfactants in common guillemot (Uria aalge) from the Baltic Sea. Environ. Sci. Technol.42(16):5879-5884.
Holmström, K.E., Järnberg, U., Bignert, A. 2005. Temporal trends of PFOS and PFOA in guillemot eggs from the Baltic Sea, 1968-2003. Environ. Sci. Technol. 39(1):80-84.
Holmström, K.E., Johansson, A.-K., Bignert, A., Lindberg, P., Berger, U. 2010. Temporal trends of perfluorinated surfactants in Swedish peregrine falcon eggs (Falco peregrinus) 1974-2007. Environ. Sci. Technol. 44(11):4083-4088.
Hori, H., Hayakawa, E., Einaga, H., Kutsuna, S., Koike, K., Ibusuki, T., Kiatagawa, H., Arakawa, R. 2004. Decomposition of environmentally persistent perfluorooctanoic acid in water by photochemical approaches. Environ. Sci. Technol. 38(22):6118-6124.
Hori, H., Yamamoto, A., Hayakawa, E., Taniyasu, S., Yamashita, N., Kutsuna, S. 2005. Efficient decomposition of environmentally persistent perfluorocarboxylic acids by use of persulfate as a photochemical oxidant. Environ. Sci. Technol. 39(7):2383-2388.
Hori, H., Nagaoka, Y., Murayama, M., Kutsuna, S. 2008. Efficient decomposition of perfluorocarboxylic acids and alternative fluorochemical surfactants in hot water. Environ. Sci. Technol. 42(19):7238-7443.
Houde, M., Wells, R.S., Fair, P.A., Bossart, G.D., Hohn, A.A., Rowles, T.K., Sweeney, J.C., Solomon, K.R., Muir, D.C.G. 2005. Polyfluoroalkyl compounds in free-ranging bottlenose dolphins (Tursiops truncatus) from the Gulf of Mexico and the Atlantic Ocean. Environ. Sci. Technol.39(17):6591-6598.
Houde, M., Balmer, B.C., Brandsma, S., Wells, R.S., Rowles, T.K., Solomon, K.R., Muir, D.C.G. 2006. Perfluoroalkyl compounds in relation to life-history and reproductive parameters in bottlenose dolphins (Tursiops truncatus) from Sarasota Bay , Florida, USA. Environ. Toxicol. Chem. 25(9):2405-2412.
Hundley, S.G., Sarrif, A.M., Kennedy, G.L. Jr. 2006. Absorption, distribution, and excretion of ammonium perfluorooctanoate (APFO) after oral administration to various species. Drug Chem. Toxicol. 29(2):137-145.
Hurley, M.D., Andersen, M.P.S., Wallington, T.J., Ellis, D.A., Martin, J.W., Mabury, S.A. 2004. Atmospheric chemistry of perfluorinated carboxylic acids: reaction with OH radicals and atmospheric lifetimes. J. Phys. Chem. A108(4):615-620.
Ikonomou, M. 2006. Determination of perfluorinated compounds in biosolids, sediment, and leachate by ESI-LCMS/MS. Document préparé en vertu d’un contrat pour Environnement Canada, le 9 juin 2006.
[IRDC] International Research and Development Corporation. 1978. Acute oral toxicity (LD50) study in rats. Mattawan (MI) : IRDC. Rapport n° 137-091.
Ishibashi, H., Iwata, H., Kim, E.-Y., Tao, L., Kannan, K., Amano, M., Miyazaki, N., Tanabe, S., Batoev, V.B., Petrov, E. 2008a. Contamination and effects of perfluorochemicals in Baikal seal (Pusa sibirica). 1. Residue level, tissue distribution, and temporal trend. Environ. Sci. Technol. 42(7):2295-2301.
Ishibashi, H., Iwata, H., Kim, E.-Y., Tao, L., Kannan, K., Tanabe, S., Batoev, V.B., Petrov, E.A. 2008b. Contamination and effects of perfluorochemicals in Baikal seal (Pusa sibirica). 2. Molecular characterization, expression level, and transcriptional activation of peroxisome proliferator-activated receptor α. Environ. Sci. Technol. 42(7):2302-2308.
Jasinski, M., Ellis, D.A., Webster, E., McMurdo, C., Burns, D. 2009. The development of a 19F NMR technique for the simultaneous determination of the Kow and pKaof perfluorooctanoic acid (PFOA). Présentation lors de la 30e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) North America, du 19 au 23 novembre 2009, à la Nouvelle-Orléans (LA).
Jeon, J., Kannan, K., Lim, H.K., Moon, H.B., Ra, J.S., Kim, S.D. 2010a. Bioaccumulation of perfluorochemicals in Pacific oyster under different salinity gradients. Environ. Sci. Technol.44(7):2695-2701.
Jeon, J., Kannan, K., Lim, H.K., Moon, H.B., Kim, S.D. 2010b. Bioconcentration of perfluorinated compounds in blackrock fish, Sebastes schlegeli, at different salinity levels. Environ. Toxicol. Chem. 29(11):2529-2535.
Joensen, U.N., Bossi, R., Leffers, H., Jensen, A.A., Skakkebaek, N.E., Jorgensen, N. 2009. Do perfluoroalkyl compounds impair human semen quality? Environ. Health Perspect. 117(6):923-7.
Ju, X., Jin, Y., Sasaki, K., Saito, N. 2008. Perfluorinated surfactants in surface, subsurface water and microlayer from Dalian coastal waters in China. Environ. Sci. Technol.42(10):3538-3542.
Kallenborn, K., Berger, U., Järnberg, U. 2004. Perfluorinated alkylated substances (PFAS) in the Nordic environment. Copenhague (Danemark) : Conseil des ministres des pays nordiques.
Kannan, K., Corsolini, S., Falandysz, J., Oehme, G., Focardi, S., Giesy, J.P. 2002. Perfluorooctanesulfonate and related fluorinated hydrocarbons in marine mammals, fishes, and birds from coasts of the Baltic and the Mediterranean seas. Environ. Sci. Technol. 36(15):3210-3216.
Kannan, K., Tao, L., Pastva, S., Giesy, J.P. 2005a. Perfluorinated compounds in aquatic organisms at various trophic levels in a Great Lakes food chain. Arch. Environ. Contam. Toxicol. 48(4):559-566.
Kannan, K., Yun, S.H., Evans, T. 2005b. Chlorinated, brominated and perfluorinated contaminants in livers of polar bears from Alaska. Environ. Sci. Technol. 39(23):9057-9063.
Kannan, K., Perotta, E., Thomas, N.J. 2006. Association between perfluorinated compounds and pathological conditions in southern sea otters. Environ. Sci. Technol. 40:4943-4948.
Kato, K., Calafat, A.M., Wong, L.Y., Wanigatunga, A.A., Caudill, S.P., Needham, L.L. 2009. Polyfluoroalkyl compounds in pooled sera from children participating in the National Health and Nutrition Examination Survey 2001-2002. Environ. Sci. Technol. 43(7):2641-2647.
Kawashima, Y., Uy-Yu, N., Kozuka, H. 1989. Sex-related difference in the inductions by perfluoro-octanoic acid of peroxisomal beta-oxidation, microsomal 1-acylglycerophosphocholine acyltransferase and cytosolic long-chain acyl-CoA hydrolase in rat liver. Biochem. J. 261(2):595-600.
Keller, J.M., Kannan, K., Taniyasu, S., Yamashita, N., Day, R.D., Arendt, M.D., Segars, A.L., Kucklick, J.R. 2005. Perfluorinated compounds in the plasma of loggerhead and Kemp’s Ridley sea turtles from the southeastern coast of the United States. Environ. Sci. Technol. 39(23):9101-9108.
Kelly, B.C., Gobas, F.A.P.C., McLachlan, M.S. 2004. Intestinal absorption and biomagnification of organic contaminants in fish, wildlife and humans. Environ. Toxicol. Chem.23(10):2324-2336.
Kelly, B.C., Ikonomou, M.G., Blair, J.D., Surridge, B., Hoover, D., Grace, R., Gobas, F.A.P. 2009. Perfluoroalkyl contaminants in an Arctic marine food web: trophic magnification and wildlife exposure. Environ. Sci. Technol. 43(11):4037-4043.
Kennedy, G.L. Jr. 1976. Reverse mutation studies with T-1485 in five Salmonella strains and one Saccharomycesstrain. Northbrook (IL) : Industrial Bio-Test Laboratories Inc. Rapport n° 8540-09238.
Kennedy, G.L. Jr. 1985. Dermal toxicity of ammonium perfluorooctanoate. Toxicol. Appl. Pharmacol.81(2):348-355.
Kennedy, G.L. Jr. 1987. Increase in mouse liver weight following feeding of ammonium perfluorooctanoate and related fluorochemicals. Toxicol. Lett. 39(2-3):295-300.
Kennedy, G.L. Jr, Hall, G.T., Brittelli, M.R., Barnes, J.R., Chen, H.C. 1986. Inhalation toxicity of ammonium perfluorooctanoate. Food Chem. Toxicol. 24(12):1325-1329.
Kennedy, G.L. Jr, Butenhoff, J.L., Olsen, G.W., O’Connor, J.C., Seacat, A.M., Perkins, R.G., Biegel, L.B., Murphy, S.R., Farrar, D.G. 2004. The toxicology of perfluorooctanoate. Crit. Rev. Toxicol. 34(4):351-384.
Kim, K.-T., Ryu, T., Cho, J.-G., Joung, K.-E., Park, S., Choi, K., Han, J. 2009. The effects of perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) on acute toxicity, reproduction and embryo development in Daphnia magna. Présentation lors de la SETAC North America, en novembre 2009, à la Nouvelle-Orléans (LA).
Kissa, E. 1994. Fluorinated surfactants: synthesis, properties, applications. New York (NY) : Marcel Dekker, Inc.
Klaunig, J.E., Babich, M.A., Baetcke, K.P., Cook, J.C., Corton, J.C., David, R.M., DeLuca, J.G., Lai, D.Y., McKee, R.H., Peters, J.M., Roberts, R.A., Fenner-Crisp P.A. 2003. PPARαagonist-induced rodent tumours: modes of action and human relevance. Crit. Rev. Toxicol. 33(6):655-780.
Knudsen, L.B., Borgå, K., JØrgensen, E.H., van Bavel, B., Schlabach, M., Verreault, J., Gabrielsen, G.W. 2007. Halogenated organic contaminants and mercury in northern fulmars (Fulmarus glacialis): levels, relationships to dietary descriptors and blood to liver comparison. Environ. Pollut. 146(1):25-33.
Kojo, A., Hanhijärvi, H., Ylinen, M., Kosma, V.-M. 1986. Toxicity and kinetics of perfluoro-octanoic acid in the Wistar rat. Arch. Toxicol. Suppl. 9:465-468.
Kubwabo, C., Vais, N., Benoit, F.M. 2004. A pilot study on the determination of perfluorooctanesulfonate and other perfluorinated compounds in blood of Canadians. J. Environ. Monit.6(6):540-545.
Kubwabo, C., Stewart, B., Zhu, J., Marro, L. 2005. Occurrence of perfluorosulfonates and other perfluorochemicals in dust from selected homes in the city of Ottawa, Canada. J. Environ. Monit. 7(11):1074-1078.
Kudo, N., Kawashima, Y. 2003. Toxicity and toxicokinetics of perfluorooctanoic acid in humans and animals. J. Toxicol. Sci. 28(2):49-57.
Kudo, N., Mizuguchi, H., Yamamoto, A., Kawashima, Y. 1999. Alterations by perfluorooctanoic acid of glycerolipid metabolism in rat liver. Chem. Biol. Interact. 118(1):69-83.
Kudo, N., Sakai, A., Mitsumoto, A., Hibino, Y., Tsuda, T., Kawashima, Y. 2007. Tissue distribution and hepatic subcellular distribution of perfluorooctanoic acid at low dose are different from those at high dose in rats. Biol. Pharm. Bull.30(8):1535-1540.
Kurume Laboratory. 2001. Bioaccumulation test of perfluoroalkylcarboxylic acid (C=7-13) [this test is performed using perfluorooctanoic acid (Test substance number K-1519)] in carp. Test No. 51519. Chemicals Evaluation and Research Institute. [cité dans US EPA, 2002].
Kwadijk, C.J.A.F., Korytar, P., Koelmans, A.A. 2010. Distribution of perfluorinated compounds in aquatic systems in The Netherlands. Environ. Sci. Technol. 44(10):3746-3751.
Lau, C., Thibodeaux, J.R., Hanson, R.G., Narotsky, M.G., Rogers, J.M., Lindstrom, A.B., Strynar, M.J. 2006. Effects of perfluorooctanoic acid exposure during pregnancy in the mouse. Toxicol. Sci. 90(2):510-518.
Lawlor, T.E. 1995. Mutagenicity test with T-6342 in the Salmonella-Escherichia coli/mammalian-microsome reverse mutation assay. Study No. 17073-0-409. Vienna (VA) : Corning Hazleton.
Lawlor, T.E. 1996. Mutagenicity test with T-6564 in the Salmonella-Escherichia coli/mammalian-microsome reverse mutation assay with a confirmatory assay. Study No. 17750-0-409R. Vienna (VA) : Corning Hazleton.
Lee, H., D’Eon, J., Mabury, S.A. 2010. Biodegradation of polyfluoroalkyl phosphates as a source of perfluorinated acids to the environment. Environ. Sci. Technol.44(9):3305-3310.
Leonard, R.C., Kreckmann, K.H., Sakr, C.J., Symons, J.M. 2008. Retrospective cohort mortality study of workers in a polymer production plant including a reference population of regional workers. Ann. Epidemiol. 18(1):15-22.
Leonel, J., Kannan, K., Tao, L., Fillmann, G., Montone, R.C. 2008. A baseline study of perfluorochemicals in Franciscana dolphins and Subantarctic fur seal from coastal waters of southern Brazil. Mar. Pollut. Bull. 56(4):778-781.
Li, M.-H. 2008. Short communication: Toxicity of perfluorooctane sulfonate and perfluorooctanoic acid to plants and aquatic invertebrates. Environ. Toxicol. 24:95-101.
Li, X., Yeung, L.W.Y., Taniyasu, S., Lam, P.K.S., Yamashita, N., Xu, M., Dai, J. 2008a. Accumulation of perfluorinated compounds in captive Bengal tigers (Panthera tigris tigris) and African lions (Panthera leo Linnaeus) in China. Chemosphere 73(10):1649-1653.
Li, X., Yeung, L.W.Y., Taniyasu, S., Li, M., Zhang, H., Liu, D., Lam, P.K.S., Yamashita, N., Dai, J. 2008b. Perfluorooctanesulfonate and related fluorochemicals in the Amur tiger (Panthera tigris altaica) from China. Environ. Sci. Technol. 42(19):7078-7083.
Lien, N.P.H., Fujii, S., Tanaka, S., Nozoe, M., Wirojanagud, W., Anton, A., Lindström, G. 2006. Perfluorinated substances in tap water of Japan and several countries and their relationship to surface water contamination. Environ. Eng. Res.43:611-618.
Lin, C.Y., Lin, L.Y., Chiang, C.K., Wang, W.J., Su, Y.N., Hung, K.Y., Chen, P.C. 2010. Investigation of the associations between low-dose serum perfluorinated chemicals and liver enzymes in U.S. adults. Am. J. Gastroenterol. 105(6):1354-1363.
Liou, J.S.-C., Szostek, B., DeRito, C.M., Madsen, E.L. 2010. Investigating the biodegradability of perfluorooctanoic acid. Chemosphere 80:176-183.
Litton Bionetics Inc. 1978. Mutagenicity evaluation of T-2015CoC in the Ames Salmonella/microsome plate test. Project No. 20838. Rapport définitif présenté à la Compagnie 3M, St. Paul (MN).
Liu, C., Du, Y., Zhou, B. 2007a. Evaluation of estrogenic activities and mechanism of action of perfluorinated chemicals determined by vitellogenin induction in primary cultured tilapia hepatocytes. Aquat. Toxicol. 85(4):267-277.
Liu, J., Lee, L.S., Nies, L.F., Nakatsu, C.H., Turcot, R.F. 2007b. Biotransformation of 8:2 fluorotelomer alcohol in soil and by soil bacteria isolates. Environ. Sci. Technol.41(23):8024-8030.
Liu, R.C., Hurtt, M.E., Cook, J.C., Biegel, L.B. 1996. Effect of the peroxisome proliferator, ammonium perfluorooctanoate (C8), on hepatic aromatase activity in adult male Crl:CD BR (CD) rats. Fundam. Appl. Toxicol. 30(2):220-228.
Liu, W., Chen, S., Quan, X., Jin, Y.-H. 2008. Toxic effect of serial perfluorosulfonic and perfluorocarboxylic acids on the membrane system of a freshwater alga measured by flow cytometry. Environ. Toxicol. Chem. 27(7):1597-1604.
Loewen, M., Halldorson, T., Wang, F., Tomy, G. 2005. Fluorotelomer carboxylic acids and PFOS in rainwater from an urban centre in Canada. Environ. Sci. Technol. 39:2944-2951.
Loewen, M., Wania, F., Wang, F., Tomy, G. 2008. Altitudinal transect of atmospheric and aqueous fluorinated organic compounds in western Canada. Environ. Sci. Technol. 42(7):2374-2379.
Löfstrand, K., Jörundsdóttir, H., Tomy, G., Svavarsson, J., Weihe, P., Nygård, T., Bergman, Å. 2008. Spatial trends of polyfluorinated compounds in guillemot (Uria aalge) eggs from north-western Europe. Chemosphere72(10):1475-1480.
Loveless, S.E., Finlay, C., Everds, N.E., Frame, S.R., Gillies, P.J., O’Connor, J.C., Powley, C.R., Kennedy, G.L. 2006. Comparative responses of rats and mice exposed to linear/branched, linear, or branched ammonium perfluorooctanoate (APFO). Toxicology220(2-3):203-217.
Lucaciu, C.M., Furdui, V.I., Crozier, P.W., Reiner, E.J., Marvin, C.H., Wania, F., Mabury, S.A. 2005. Temporal study of perfluorinated alkyl surfactants in Niagara River sediments (1980-2002). Présentation lors de la 26e assemblée annuelle de la Society for Environmental Toxicology and Chemistry (SETAC) North America, du 13 au 17 novembre 2005, à Baltimore (MD).
Lundin, J.I., Alexander, B.H., Olsen, G.W., Church, T.R. 2009. Ammonium perfluorooctanoate production and occupational mortality. Epidemiology 20(6):921-928.
MacDonald, M.M., Warne, A.L., Stock, N.L., Mabury, S.A., Solomon, K.R., Sibley, P.K. 2004. Toxicity of perfluorooctane sulfonic acid (PFOS) and perfluorooctanoic acid (PFOA) to Chironomus tentans. Environ. Toxicol. Chem. 23:2116-2123.
Macon, M.B., Villanueva, L.R., Tatum-Gibbs, K., Zehr, R.D., Strynar, M.J., Stanko, J.P., White, S.S., Helfant, L., Fenton, S.E. 2011. Prenatal perfluorooctanoic acid exposure in CD-1 mice: low dose developmental effects and internal dosimetry. Toxicol. Sci. [numéro en ligne avant parution, le 11 avril 2011, doi:10.1093/toxsci/kfr076].
MacNeil, J., Steenland, N.K., Shankar, A., Ducatman, A. 2009. A cross-sectional analysis of type II diabetes in a community with exposure to perfluorooctanoic acid (PFOA). Environ. Res.109(8):997-1003.
Maestri, L., Negri, S., Ferrari, M., Ghittori, S., Fabris, F., Danesino, P., Imbriani, M. 2006. Determination of perfluorooctanoic acid and perfluorooctanesulfonate in human tissues by liquid chromatography/single quadrupole mass spectrometry. Rapid Commun. Mass Spectrom. 20(18):2728-2734.
Martin, J.W., Muir, D.C.G., Moody, C.A., Ellis, D.A., Kwan, W.C., Solomon, K.R., Mabury, S.A. 2002. Collection of airborne fluorinated organics and analysis by gas chromatography/chemical ionization mass spectrometry. Anal. Chem. 74(3):584-590.
Martin, J.W., Mabury, S.A., Solomon, K.R., Muir, D.C.G. 2003a. Dietary accumulation of perfluorinated acids in juvenile rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 22(1):189-195.
Martin, J.W., Mabury, S.A., Solomon, K.R., Muir, D.C.G. 2003b. Bioconcentration and tissue distribution of perfluorinated acids in rainbow trout (Oncorhynchus mykiss). Environ. Toxicol. Chem. 22(1):196-204.
Martin, J.W., Smithwick, M.M., Braune, B.M., Hoekstra, P.F., Muir, D.C.G., Mabury, S.A. 2004a. Identification of long-chain perfluorinated acids in biota from the Canadian Arctic. Environ. Sci. Technol. 38(2):373-380.
Martin, J.W., Whittle, M., Muir, D.C.G., Mabury, S.A. 2004b. Perfluoroalkyl contaminants in a food web from Lake Ontario. Environ. Sci. Technol. 38(20):5379-5385.
Masunaga, S., Odaka, R. 2005. Environmental behaviour and mass balance of perfluorinated surfactants in Tokyo Bay, Japan. Présentation lors de la 26e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) North America, du 13 au 17 novembre 2005, à Baltimore (MD).
McDonald, F. 1997. 5-daily dose dermal absorption/toxicity study of T-6564 in rabbits. Madison (WI) : Corning Hazleton Inc. Project ID 6329-185.
Meek, M.E., Bucher, J.R., Cohen, S.M., Dellarco, V., Hill, R.N., Lehman-McKeeman, L.D., Longfellow, D.G., Pastoor, T., Seed, J., Patton, D.E. 2003. A framework for human relevance analysis of information on carcinogenic modes of action. Crit. Rev. Toxicol. 33(6):591-653.
Melzer, D., Rice, N., Depledge, M.H., Henley, W.E., Galloway, T.S. 2010. Association between serum perfluorooctanoic acid (PFOA) and thyroid disease in the U.S. National Health and Nutrition Examination Survey. Environ. Health Perspect.118(5):686-92.
Mekenyan, O., Dimitrov, S., Temelkov, S. 2002. PFOS metabolic pathways and metabolic distributions: generated by catabolic simulator (2001-2002). Résultats compilés et révisés par P. Robinson, Direction des substances existantes, Environnement Canada, Gatineau (Qc).
Metrick, B., Marias, A.J. 1977. Report to 3M Company: 28-day oral toxicity study with FC-143 in albino rats. Northbrook (IL) : Industrial Bio-Test Laboratories, Inc., IBT No. 8532-10654.
Monroy, R., Morrison, K., Teo, K., Atkinson, S., Kubwabo, C., Stewart, B., Foster, W.G. 2008. Serum levels of perfluoroalkyl compounds in human maternal and umbilical cord blood samples. Environ. Res. 108(1):56-62.
Moody, C.A., Field, J.A. 1999. Determination of perfluorocarboxylates in groundwater impacted by fire-fighting activity. Environ. Sci. Technol. 33(16):2800-2806.
Moody, C.A., Martin, J.W., Kwan, W.C., Muir, D.C.G., Mabury, S.C. 2002. Monitoring perfluorinated surfactants in biota and surface water samples following an accidental release of fire-fighting foam into Etobicoke Creek. Environ. Sci. Technol. 36(4):545-551.
Morikawa, A., Kamei, N., Harada, K., Inoue, K., Yoshinaga, T., Saito, N., Koizumi, A. 2006. The bioconcentration factor of perfluorooctane sulfonate is significantly larger than that of perfluorooctanoate in wild turtles (Trachemys scripta elegans and Chinemys reevesii): an Ai River ecological study in Japan. Ecotoxicol. Environ. Saf. 65(1):14-21.
Moriwaki, H., Takagi, Y., Tanaka, M., Tsuruho, K., Okitsu, K., Maeda, Y. 2005. Sonochemical decomposition of perfluorooctane sulfonate and perfluorooctanoic acid. Environ. Sci. Technol. 39:3388-3392.
Muir, D., Scott, B. 2003. Overview of recent studies/results at National Water Research Institute and Université de Toronto: chemistry on perfluorinated organics. Présentation à l’interne, Environnement Canada, Gatineau (Qc).
Murakami, M., Kuroda, K., Sato, N., Fukushi, T., Takizawa, S., Takada, H. 2009. Groundwater pollution by perfluorinated surfactants in Tokyo. Environ. Sci. Technol. 43(10):3480-3486.
Murli, H. 1995. Mutagenicity test on T-6342 in an in-vivo mouse micronucleus assay. Rapport définitif 17073-0-455 daté du 14 décembre 1995. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996a. Mutagenicity test on T6358 measuring chromosomal aberrations in Chinese hamster ovary (CHO) cells. Rapport définitif 17388-0-437 daté du 25 avril 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996b. Mutagenicity test on T-6358 in an in-vivo mouse micronucleus assay. Rapport définitif 17388-0-455 daté du 14 mai 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996c. Mutagenicity test on T-6342 measuring chromosomal aberrations in Chinese hamster ovary (CHO) cells: with a confirmatory assay with multiple harvests. Rapport définitif 17073-0-437CO daté du 16 septembre 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996d. Mutagenicity test on T6564 measuring chromosomal aberrations in Chinese hamster ovary (CHO) cells: with a confirmatory assay with multiple harvests. Rapport définitif 17750-0-437CO daté du 16 septembre 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996e. Mutagenicity test on T-6564 in an in-vivo mouse micronucleus assay. Rapport définitif 17750-0-455 daté du 1er novembre 1996. Vienna (VA) : Corning Hazleton Inc.
Murli, H. 1996f. Mutagenicity test on T-6342 measuring chromosomal aberrations in human whole blood lymphocytes with a confirmatory assay with multiple harvests. Rapport définitif 17073-0-449CO daté du 1er novembre 1996. Vienna (VA) : Corning Hazleton Inc.
Myers, A.L., Crozier, P.W., Helm, P.A., Reiner, E.J., Burniston, D., Marvin, C.H., McCarry, B.E. 2009. Spatial distribution and temporal trends of perfluorinated compounds in Great Lakes sediments and surface waters. Présentation lors de la SETAC North America, en novembre 2009, à la Nouvelle-Orléans (LA).
Mylchreest, E. 2003. PFOA: lactational and placental transport pharmacokinetic study in rats. Project DuPont-13309. Rapport préparé (19/12/2003) par Haskell Laboratory pour le compte de Health and Environmental Sciences, Newark (DE). Présenté par la Compagnie 3M à la Division de l’évaluation des produits chimiques, Environnement Canada.
Nakayama, K., Iwata, H., Tao, L., Kannan, K., Imoto, M., Kim, E.-Y., Tashiro, K., Tanabe, S. 2008. Potential effects of perfluorinated compounds in common cormorants from Lake Biwa, Japan: an implication from the hepatic gene expression profiles by microarray. Environ. Toxicol. Chem. 27(11):2378-2386.
[NCI] National Chemical Inventories [base de données sur CD-ROM]. 2009. Issue 1. Columbus (OH) : American Chemical Society, Chemical Abstracts Service.
Nelson, J.W., Hatch, E.E., Webster, T.F. 2010. Exposure to polyfluoroalkyl chemicals and cholesterol, body weight, and insulin resistance in the general US population. Environ.Health Perspect. 118:197-202.
Nilsson, H., Kärrman, A., Westberg, H., Rotander, A., Van Bavel, B., Lindström, G. 2010. A time trend study of significantly elevated perfluorocarboxylate levels in humans after using fluorinated ski wax. Environ. Sci. Technol.44(6):2150-2155.
Nolan, L.A., Nolan, J.M., Shofer, F.S., Rodway, N.V., Emmett, E.A. 2009a. The relationship between birth weight, gestational age and perfluorooctanoic acid (PFOA)-contaminated public drinking water. Reprod. Toxicol. 27(3-4):231-238.
Nolan, L.A., Nolan, J.M., Shofer, F.S., Rodway, N.V., Emmett, E.A. 2009b. Congenital anomalies, labor/delivery complications, maternal risk factors and their relationship with perfluorooctanoic acid (PFOA)-contaminated public drinking water. Reprod. Toxicol. [numéro en ligne avant parution, le 6 novembre 2009; doi:10.1016/j.reprotox.2009.10.012].
Nubbe, M.E., Adams, V.D., Moore, W.M. 1995. The direct and sensitized photooxidation of hexachlorocyclopentadiene. Water Res. 29(5):1287-1293.
Oakes, K.D., Sibley, P.K., Solomon, K.R., Mabury, S.A., Van Der Kraak, G.J. 2004. Impact of perfluorooctanoic acid on fathead minnow (Pimephales promelas) fatty acyl-CoA oxidase activity, circulating steroids, and reproduction in outdoor microcosms. Environ. Toxicol. Chem. 23(8):1912-1919.
O’Brien, J.M., Crump, D., Mundy, L.J., Chu, S.G., McLaren, K.K., Vongpachan, V., Letcher, R.J., Kennedy, S.W. 2009. Pipping success and liver mRNA expression in chicken embryos exposed in ovo to C8 and C11 perfluorinated carboxylic acids and C10 perfluorinated sulfonate. Toxicol. Lett. 190(2):134-139.
O’Connell, S.G., Arendt, M., Segars, A., Kimmel, T., Braun-McNeil, J., Avens, L., Schroeder, B., Ngai, L., Kucklick, J.R., Keller, J. 2010. Temporal and spatial trends of perfluorinated compounds in juvenile loggerhead sea turtles (Caretta caretta) along the East Coast of the United States. Environ. Sci. Technol. 44(13):5202-5209.
[OCDE] Organisation de coopération et developpement économiques. 2006. Results of the 2006 survey on production and use of PFOS, PFAS, PFOA, PFCA, their related substances and products/mixtures containing these substances. ENV/JM/MONO (2006) 36. Paris (France) : OCDE. Environment, Health and Safety Publications, Series on Risk Management No. 22.
Olsen, G.W., Zobel, L.R. 2007. Assessment of lipid, hepatic, and thyroid parameters with serum
perfluorooctanoate (PFOA) concentrations in fluorochemical production workers. Int. Arch. Occup. Environ. Health81:231-46.
Olsen, G.W., Gilliland, F.D., Burlew, M.M., Burris, J.M., Mandel, J.S., Mandel, J.H. 1998. An epidemiologic investigation of reproductive hormones in men with occupational exposure to perfluorooctanoic acid. J. Occup. Environ. Med.40(7):614-622.
Olsen, G.W., Burris, J.M., Burlew, M.M., Mandel, J.H. 2000. Plasma cholecystokinin and hepatic enzymes, cholesterol and lipoproteins in ammonium perfluorooctanoate production workers. Drug Chem. Toxicol. 23(4):603-620.
Olsen, G.W., Burris, J.M., Burlew, M.M., Mandel, J.H. 2003a. Epidemiologic assessment of worker serum perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) concentrations and medical surveillance examinations. J. Occup. Environ. Med.45(3):260-270.
Olsen, G.W., Hansen, K.J., Stevenson, L.A., Burris, J.M., Mandel, J.H. 2003b. Human donor liver and serum concentrations of perfluorooctanesulfonate and other perfluorochemicals. Environ. Sci. Technol. 37(5):888-891.
Olsen, G.W., Logan, P.W., Hansen, K.J., Simpson, C.A., Burris, J.M., Burlew, M.M., Vorarath, P.P., Venkateswarlu, P., Schumpert, J.C., Mandel, J.H. 2003c An occupational exposure assessment of a perfluorooctanesulfonyl fluoride production site: biomonitoring. AIHI J. (Fairfax, VA) 64(5):651-659.
Olsen, G.W., Church, T.R., Larson, E.B., vanBelle, G., Lundberg, J.K., Hansen, K.J., Burris, J.M., Mandel, J.H., Zobel, L.R. 2004a. Serum concentrations of perfluorooctanesulfonate and other fluorochemicals in an elderly population from Seattle, Washington. Chemosphere 54(11):1599-1611.
Olsen, G.W., Church, T.R., Hansen, K.J., Burris, J.M., Butenhoff, J.L., Mandel, J.H., Zobel, L.R. 2004b. Quantitative evaluation of perfluorooctanesulfonate (PFOS) and other fluorochemicals in the serum of children. J. Child Health2(1):53-76.
Olsen, G.W., Burris, J.M., Ehresman, D.J., Froehlich, J.W., Seacat, A.M., Butenhoff, J.L., Zobel, L.R. 2007. Half-life of serum elimination of perfluorooctanesulfonate, perfluorohexanesulfonate, and perfluorooctanoate in retired fluorochemical production workers. Environ. Health Perspect. 115(9):1298-1305.
Olsen, G.W., Mair, D.C., Church, T.R., Ellefson, M.E., Reagen, W.K., Boyd, T.M., Herron, R.M., Medhdizadehkashi, Z., Nobiletti, J.B., Rios, J.A., Butenhoff, J.L., Zobel, L.R. 2008. Decline in perfluorooctanesulfonate and other polyfluoroalkyl chemicals in American Red Cross adult blood donors, 2000-2006. Environ. Sci. Technol. 42(13):4989-4995.
Ostertag, S.K., Tague, B.A., Humphries, M.M., Tittlemier, S.A., Chan, H.M. 2009. Estimated dietary exposure to fluorinated compounds from traditional foods among Inuit in Nunavut, Canada. Chemosphere 75(9):1165-1172.
Pace Analytical. 1997. Ready biodegradation of FC-126(BOD/COD). 3M Company Lab Request No. E1282. Document présenté à l’Office of Pollution Prevention and Toxics, US Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0495.
Pace Analytical. 2001. The 18-day aerobic biodegradation study of perfluorooctanesulfonyl-based chemistries. Contract Analytical Project ID: CA097. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 038.
Palazzolo, M.J. 1993. Final report, 13-week dietary toxicity study with T-5180, ammonium perfluorooctanoate (CAS No. 3825-26-1) in male rats. Rapport préparé par Hazleton Wisconsin Inc. Project HWI 6329-100.
Peden-Adams, M.M., Romano, T., Rice, C.D., Hesseman, L., EuDaly, J., Muir, D., Houde, M., Bossart, G., Fair, P. 2004a. Immune function and clinical blood parameters correlate with perfluorinated alkyl acid concentrations in bottlenose dolphins. Présentation lors de la 25e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) North America, du 14 au 18 novembre 2004, à Portland (OR).
Peden-Adams, M.M., Kannan, K., EuDaly, J.G., Hessemann, L.M., Kuckluck, J.R., Arendt, M.D., Maier, P.P., Segars, A.L. 2004b. Perfluorinated alkyl acids measured in sea turtle blood correlate to modulations in plasma chemistry values and immune function measurements. Présentation lors de la 25e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) North America, du 14 au 18 novembre 2004, à Portland (OR).
Perkins, R.G., Butenhoff, J.L., Kennedy, G.L. Jr, Palazzolo MJ. 2004. 13-week dietary toxicity study of ammonium perfluorooctanoate (APFO) in male rats. Drug Chem. Toxicol.27(4):361-378.
Permadi, H., Lundgren, B., Andersson, K., Sundberg, C., DePierre, J.W. 1993. Effects of perfluoro fatty acids on peroxisome proliferation and mitochondrial size in mouse liver: dose and time factors and effect of chain length. Xenobiotica23(7):761-770.
Peters, J.M., Cheung, C., Gonzalez, F.J. 2005. Peroxisome proliferator-activated receptor-alpha and liver cancer: where do we stand? J. Mol. Med. 83(10):774-785.
Piekarz, A.M., Primbs, T., Field, J.A., Barofsky, D.F., Simonich, S. 2007. Semivolatile fluorinated organic compounds in Asian and western U.S. air masses. Environ. Sci. Technol. 41(24):8248-8255.
Poland, J.S., Mitchell, S., Rutter, A. 2001. Remediation of former military bases in the Canadian Arctic. Cold Reg. Sci. Technol. 32:93-105.
Powley, C.R., Michalczyk, M.J., Kaiser, M.A., Buxton, L.W. 2005. Determination of perfluorooctanoic acid (PFOA) extractable from the surface of commercial cookware under simulated cooking conditions by LC/MS/MS. Analyst 130(9):1299-1302.
Powley, C.R., George, S.W., Russell, M.H., Hoke, R.A., Buck, R.C. 2008. Polyfluorinated chemicals in a spatially and temporally integrated food web in the western Arctic. Chemosphere70(4):664-672.
Pozzi, A., Capdevila, J.H. 2008. PPARαLigands as Antitumorigenic and Antiangiogenic Agents. PPAR Res 2008. Article ID 906542.
Prevedouros, K., Cousins, I.T., Buck, R.C., Korzeniowski, S.H. 2006. Sources, fate, and transport of perfluorocarboxylates. Environ. Sci. Technol. 40:32-44.
Reiner, E.A. 1978. Fate of fluorochemicals in the environment. Project No. 9970612613. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0489.
Riddell, N., Arsenault, G., Benskin, J.P., Chittim, B., Martin, J.W., McAlees, A., McCrindle, R. 2009. Branched perfluorooctane sulfonate isomer quantification and characterization in blood serum samples by HPLC/ESI-MS (/MS). Environ. Sci. Technol.43:7902-7908.
Riker Laboratories Inc. 1979. Repeat application 28 day percutaneous absorption study with T-2618CoC in albino rabbits, Experiment No. 09790AB0485. St. Paul (MN) : Riker Laboratories Inc.
Rosen, M.B., Abbott, B.D., Wolf, D.C., Corton, J.C., Wood, C.R., Schmid, J.E., Das, K.P., Zehr, R.D., Blair, E.T., Lau, C. 2008a. Gene profiling in the livers of wild-type and PPARα-null mice exposed to perfluorooctanoic acid. Toxicol. Pathol.36(4):592-607.
Rosen, M.B., Lee, J.S., Ren, H., Vallanat, B., Liu, J., Waalkes, M.P., Abbott, B.D., Lau, C., Corton, J.C. 2008b. Toxicogenomic dissection of the perfluorooctanoic acid transcript profile in mouse liver: evidence for the involvement of nuclear receptors PPAR alpha and CAR. Toxicol. Sci. 103(1):46-56.
Sakr, C.J., Kreckmann, K.H., Green, J.W., Gillies, P.J., Reynolds, J.L., Leonard, R.C. 2007a. Cross-sectional study of lipids and liver enzymes related to a serum biomarker of exposure (ammonium perfluorooctanoate or APFO) as part of a general health survey in a cohort of occupationally exposed workers. J. Occup. Environ. Med. 49(10):1086-1096.
Sakr, C.J., Leonard, R.C., Kreckmann, K.H., Slade, M.D., Cullen, M.R. 2007b. Longitudinal study of serum lipids and liver enzymes in workers with occupational exposure to ammonium perfluorooctanoate. J. Occup. Environ. Med. 49(8):872-879.
Sanderson, H., Boudreau, T.M., Mabury, S.A., Solomon, K.R. 2003. Impact of perfluorooctanoic acid on the structure of the zooplankton community in indoor microcosms. Aquat. Toxicol. 62(3):227-234.
Sanderson, H., Boudreau, T.M., Mabury, S.A., Solomon, K.R. 2004. Effects of perfluorooctane sulfonate and perfluorooctanoic acid on the zooplanktonic community. Ecotoxicol. Environ. Saf. 58(1):68-76.
Santé Canada. 1994. Loi canadienne sur la protection de l’environnement : L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Ottawa (Ont.) : Ministre des Approvisionnements et Services Canada.
Santé Canada. 2010. Rapport sur la biosurveillance humaine des substances chimiques de l’environnement au Canada. Ottawa (Ont.) : ministre de la Santé. ISBN : 978-1-100-94440-1.
Schenker, U., Scheringer, M., MacLeod, M., Martin, J.W., Cousins, I.T., Hungerbühler, K. 2008. Contribution of volatile precursor substances to the flux of perfluorooctanoate to the Arctic. Environ. Sci. Technol. 42:3710-3716.
Schultz, M.M., Barofsky, D.F., Field, J.A. 2004. Quantitative determination of fluorotelomer sulfonates in groundwater by LC MS/MS. Environ. Sci. Technol. 38(6):1828-1835.
Scott, B.F., Spencer, C., Moody, C.A., Martin, J.W., Mabury, S.A., Mactavish, D., Muir, D.C.G. 2003. Determination of perfluoroalkanoic acids in the aquatic environment. Présentation lors de la 23e assemblée annuelle de la Society of Environmental Toxicology and Chemistry (SETAC) Europe, du 27 avril au 1er mai 2003, à Hambourg (Allemagne).
Scott, B.F., Spencer, C., Mabury, S.A., Muir, D.C.G. 2006a. Poly and perfluorinated carboxylates in North American precipitation. Environ. Sci. Technol. 40(23):7167-7174.
Scott, B.F., Moody, C.A., Spencer, C., Small, J.M., Muir, D.C.G., Mabury, S.A. 2006b. Analysis of perfluorocarboxylic acids/anions in surface waters and precipitation using GC-MS and analysis of PFOA from large-volume samples. Environ. Sci. Technol. 40:6405-6410.
Scott, B.F., Spencer, C., Lopez, E., Muir, D.C.G. 2009. Perfluorinated alkyl acid concentrations in Canadian rivers and creeks. Water Qual. Res. J. Can. 44(3):263-277.
Scrano, L., Bufo, S.A., Perucci, P., Meallier, P., Mansour, M. 1999. Photolysis and hydrolysis of rimsulfuron. Pestic. Sci. 55:955-961.
Shoeib, M., Harner, T., Wilford, B.H., Jones, K.C., Zhu, J. 2005. Polyfluorinated compounds in the home: levels in air and dust and human exposure. Toronto (Ont.) : Université de Toronto. Présentation lors du symposium Fluoros, An International Symposium on Fluorinated Alkyl Organics in the Environment, les 19 et 20 août 2005 à Toronto (Ont.). Fluoros Abstract Book.
Shoeib, M., Harner, T., Vlahos, P. 2006. Perfluorinated chemicals in the Arctic atmosphere. Environ. Sci. Technol. 40(24):7577-7583.
Shoeib, M., Harner, T., Webster, G.M., Lee, S.C. 2011. Indoor sources of poly- and perfluorinated compounds (PFCs) in Vancouver, Canada: implications for human exposure. Environ. Sci. Technol. 45(19):7999-8005.
Sibinski, L.J. 1987. Two-year oral (diet) toxicity/carcinogenicity study of fluorochemical FC-143 in rats. Riker Experiment No. 0281CR0012. Vol 1-4. St. Paul (MN) : Riker Laboratories Inc./3M Company.
Sinclair, E., Kannan, K. 2006. Mass loading and fate of perfluoroalkyl surfactants in wastewater treatment plants. Environ. Sci. Technol. 40(5):1408-1414.
Sinclair, E., Mayack, D.T., Roblee, K., Yamashita, N., Kannan, K. 2006. Occurrence of perfluoroalkyl surfactants in water, fish, and birds from New York State. Arch. Environ. Contam. Toxicol. 50(3):398-410.
Sinclair, E., Kim, S.K., Akinleye, H.B., Kannan, K. 2007. Quantitation of gas-phase perfluoroalkyl surfactants and fluorotelomer alcohols released from nonstick cookware and microwave popcorn bags. Environ. Sci. Technol. 41(4):1180-1185.
Smithwick, M., Norstrom, R.J., Mabury, S.A., Solomon, K., Evans, T.J., Stirling, I., Taylor, M.K., Muir, D.C.G. 2006. Temporal trends of perfluoroalkyl contaminants in polar bears (Ursus maritimus) from two locations in the North American Arctic, 1972-2002. Environ. Sci. Technol. 40(4):1139-1143.
Sohlenius, A.K., Andersson, K., DePierre, J.W. 1992. The effects of perfluoro-octanoic acid on hepatic peroxisome proliferation and related parameters show no sex-related differences in mice. Biochem. J. 285(Pt 3):779-783.
Sonne, C., Bossi, R., Dietz, R., Leiffson, P.S., Rigét, F.F., Born, E.W. 2008. Potential correlation between perfluorinated acids and liver morphology in East Greenland polar bears (Ursus maritimus). Toxicol. Environ. Chem.90(2):275-283.
Stahl, T., Heyn, J., Thiele, H., Huther, J., Failing, K., Georgii, S., Brunn, H. 2009. Carryover of perfluorooctanoic acid (PFOA) and perflurooctane sulfonate (PFOS) from soil to plants. Arch. Environ. Contam. Toxicol. 57(2):289-298
Staples, R.E., Burgess, B.A., Kerns, W.D. 1984. The embryo-fetal toxicity and teratogenic potential of ammonium perfluorooctanoate (APFO) in the rat. Fundam. Appl. Toxicol. 4(3 Pt 1):429-440.
Steenland, K., Fletcher, T., Savitz, D.A. 2010a. Epidemiologic evidence on the health effects of perfluorooctanoic acid (PFOA). Environ. Health Perspect. 118:1100-1108.
Steenland, K., Tinker, S., Shankar A., Ducatman, A. 2010b. Association of perfluorooctanoic acid (PFOA) and perfluorooctanesulfonate (PFOS) with uric acid among adults with elevated community exposure to PFOA. Environ. Health Perspect. 118:229-233.
Steenland, K., Tinker, S., Frisbee, S., Ducatman, A., Vaccarino, V. 2009. Association of perfluorooctanoic acid and perfluorooctane sulfonate with serum lipids among adults living near a chemical plant. Am. J. Epidemiol. 170(10):1268-1278.
Stein, C.R., Savitz, D.A., Dougan, M. 2009. Serum levels of perfluorooctanoic acid and perfluorooctane sulfonate and pregnancy outcome. Am. J. Epidemiol. 170(7):837-846.
Stevenson, C.N., MacManus-Spencer, L.A., Luckenbach, T., Luthy, R.G., Epel, D. 2006. New perspectives on perfluorochemical ecotoxicology: inhibition and induction of an efflux transporter in the marine mussel, Mytilus californianus. Environ. Sci. Technol. 40(17):5580-5585.
Stock, N.L., Lau, F.K., Ellis, D.A., Martin, J.W., Muir, D.C.G., Mabury, S.A. 2004. Polyfluorinated telomer alcohols and sulfonamides in the North American troposphere. Environ. Sci. Technol. 38(4):991-996.
Stock, N.L., Furdui, V.I., Muir, D.C.G., Mabury, S.A. 2007. Perfluoroalkyl contaminants in the Canadian Arctic: evidence of atmospheric transport and local contamination. Environ. Sci. Technol. 41(10):3529-3536.
Stow, J.P., Sova, J., Reimer, K.J. 2005. The relative influence of distant and local (DEW-line) PCB sources in the Canadian Arctic. Sci. Total Environ. 342:107-118.
Takacs, M.L., Abbott, B.D. 2007. Activation of mouse and human peroxisome proliferator-activated receptors (PPAR alpha, beta/delta, gamma) by perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS). Toxicol. Sci. 95(1):108-117.
Takagi, A., Sia, K., Umemura, T., Hasegawa, R., Kurokawa, Y. 1991. Short-term exposure to the peroxisome proliferators, perfluorooctanoic acid and perfluorodecanoic acid, causes significant increase of 8-hydroxydeoxyguanosine in liver DNA of rats. Cancer Lett. 57(1):55-60.
Taniyasu, S., Kannan, K., Ka So, M., Gulkowska, A., Sinclair, E., Okazawa, T., Yamashita, N. 2005. Analysis of fluorotelomer alcohols, fluorotelomer acids, and short- and long-chain perfluorinated acids in water and biota. J. Chromatogr. A1093(1-2):89-97.
Tao, L., Kannan, K., Wong, C.M., Arcaro, K.F., Butenhoff, J.L. 2008. Perfluorinated compounds in human milk from Massachusetts, U.S.A. Environ. Sci. Technol.42(8):3096-3101.
Thomford, P.J. 2001a. 4-week capsule toxicity study with ammonium perfluorooctanoate (APFO) in cynomolgus monkeys. Madison (WI) : Covance Laboratories Inc. Covance 6329-230; Sponsor’s study identification T-6889.2.
Thomford, P.J. 2001b. 26-week capsule toxicity study with ammonium perfluorooctanoate (APFO) in cynomolgus monkeys. Madison (WI) : Covance Laboratories Inc. Covance 6329-231; Sponsor’s study identification T-6889.3.
Thompson, R.S., Colombo, I., de Wolf, W., Farrar, D.G., Hoke, R.A., L’Haridon, J. 2004. Acute and chronic aquatic toxicity of ammonium perfluorooctanoate (APFO). Présentation lors de la 25e assemblée annuelle de la Society of Environmental Toxicology and Chemistry’s (SETAC) North America, du 14 au 18 novembre 2004, à Portland (OR).
Tittlemier, S., Ryan, J.J., VanOostdam, J. 2004. Presence of anionic perfluorinated organic compounds in serum collected from northern Canadian populations. Organohalogen Compd66:4009-4014.
Tittlemier, S.A., Pepper, K., Seymour, C., Moisey, J., Bronson, R., Cao, X.-L., Dabeka, R.W. 2007. Dietary exposure of Canadians to perfluorinated carboxylates and perfluorooctane sulfonate via consumption of meat, fish, fast foods, and food items prepared in their packaging. J. Agric. Food Chem. 55(8):3203-3210.
Todd, J.W. 1979. FC-143 photolysis study using simulated sunlight. Report No. 002. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0490.
Tominaga, N., Kohra, S., Iguchi, T., Arizono, K. 2004. Effects of perfluoro organic compound toxicity on nematode Caenorhabditis elegans fecundity. J. Health Sci.50(5):545-550.
Tomy, G.T., Budakowski, W., Halldorson, T., Helm, P.A., Stern, G.A., Friesen, K., Pepper, K., Tittlemier, S.A., Fisk, A.T. 2004. Fluorinated organic compounds in an eastern Arctic marine food web. Environ. Sci. Technol. 38(24):6475-6481.
Tomy, G.T., Pleskach, K., Ferguson, S.H., Hare, J., Stern, G., MacInnis, G., Marvin, C.H., Loseto, L. 2009. Trophodynamics of some PFCs and BFRs in a western Canadian Arctic marine food web. Environ. Sci. Technol. 43(11):4076-4081
Trudel, D., Horowitz, L., Wormuth, M., Scheringer, M., Cousins, I.T., Hungerbuhler, K. 2008. Estimating consumer exposure to PFOS and PFOA. Risk Anal. 28(2):251-269.
Tseng, C.-L., Liu, L.-L., Chen, C.-M., Ding, W.-H. 2006. Analysis of perfluorooctanesulfonate and related fluorochemicals in water and biological tissue samples by liquid-chromatography-ion trap mass spectrometry. J. Chromatogr. A1105(1-2):119-126.
Turgeon-O’Brien, H., Gagné, D., Vézina, C., Lauzière, J., Blanchet, R., Hamelin, A.-M., Ayotte, P., Déry, S.2010. Contaminant nutrient interaction issues as part of a public health intervention study of Inuit children in Nunavik: fourth year of data collection. In: Synopsis of research conducted under the 2009-2010 Northern Contaminants Program. Ottawa (Ont.) : ministère des Affaires autochtones et du Développement du Nord, 2010, p. 23-35.
[USCDC] U.S. Centers for Disease Control and Prevention. 2011. Fourth National Report on Human Exposure to Environmental Chemicals, Updated Tables, Février 2011. [consulté en mars 2011].
[US EPA] U.S. Environmental Protection Agency. 2002. Revised draft hazard assessment of perfluorooctanoic acid and its salts [and Annex]. November 4, 2002. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics, Risk Assessment Division.
[US EPA] U.S. Environmental Protection Agency. 2003. Preliminary risk assessment of the developmental toxicity associated with exposure to perfluorooctanoic acid and its salts. April 10, 2003. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics, Risk Assessment Division.
[US EPA] U.S. Environmental Protection Agency. 2005. Draft risk assessment of the potential human health effects associated with exposure to perfluorooctanoic acid and its salts. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics, Risk Assessment Division.
[US EPA] U.S. Environmental Protection Agency. 2006a. Perfluorooctanoic acid (PFOA) and fluorinated telomers - Basic Information. Washington (DC) : US EPA, Office of Pollution Prevention and Toxics, Risk Assessment Division. [consulté le 17 octobre 2006].
[US EPA] U.S. Environmental Protection Agency. 2006b. SAB Review of EPA’s Draft Risk Assessment of Potential Human Health Effects Associated with PFOA and Its Salts. Washington (DC) : US EPA, Science Advisory Board. Report EPA-SAB-06-006.
[US EPA] U.S. Environmental Protection Agency. 2006c. 2010/2015 PFOA Stewardship Program [en ligne]. [consulté en décembre 2008].
van den Heuvel-Greve, M., Leonards, P., Brasseur, S., Kotterman, M., Zabel, A., Vethaak, D. 2009. Bioaccumulation of perfluorinated compounds in a Harbour seal food web of the Westerchelde, the Netherlands: a field study. Présentation dans le cadre de la SETAC North America, en novembre 2009, à la Nouvelle-Orléans (LA).
Vanden Heuvel, J.P., Kuslikis, B.I., Van Rafelghem, M.J., Peterson, R.E. 1991. Tissue distribution, metabolism, and elimination of perfluorooctanoic acid in male and female rats. J. Biochem. Toxicol. 6(2):83-92.
Van de Vijver, K.I., Hoff, P., Das, K., Brasseur, S., Van Dongen, W., Esmans, E., Reijnders, P., Blust, R., DeCoen, W. 2005. Tissue distribution of perfluorinated chemicals in harbor seals (Phoca vitulina) from the Dutch Wadden Sea. Environ. Sci. Technol. 39(18):6978-6984.
van Leeuwen, S.P.J., Kärrman, A., Van Bavel, B., De Boer, J., Lindstrom, G. 2006. Struggle for quality in determination of perfluorinated contaminants in environmental and human samples. Environ. Sci. Technol. 40(24):7854-7860.
van Zelm, R., Huijbregts, M.A.J., Russell, M.H., Jager, T., van de Meent, D. 2008. Modeling the environmental fate of perfluorooctanoate and its precursors from global fluorotelomer acrylate polymer use. Environ. Toxicol. Chem.27(11):2216-2223.
Verreault, J., Berger, U., Gabrielsen, G.W. 2007. Trends of perfluorinated alkyl substances in herring gull eggs from two coastal colonies in northern Norway: 1983-2003. Environ. Sci. Technol. 41(19):6671-6677.
Wallington, T.J., Hurley, M.D., Xia, J., Wuebbles, D.J., Sillman, S., Ito, A., Penner, E., Ellis, D.A., Martin, J., Mabury, S.A., Nielsen, O.J., Sulbaek Andersen, M.P. 2006. Formation of C7F15COOH (PFOA) and other perfluorocarboxylic acids during the atmospheric oxidation of 8:2 fluorotelomer alcohol. Environ. Sci. Technol. 40(3):924-930.
Wang, N., Szostek, B., Folsom, P., Sulecki, L.M., Capka, V., Buck, R., Berti, W.R., Gannon, J.T. 2005. Aerobic biotransformation of 14C-labeled 8-2 telomer B alcohol by activated sludge from a domestic sewage treatment plant. Environ. Sci. Technol. 39(2):531-538.
Wang, Y., Yeung, L.W.Y., Taniyasu, S., Yamashita, N., Lam, J.C.W., Lam, P.K.S. 2008. Perfluorooctane sulfonate and other fluorochemicals in waterbird eggs from South China. Environ. Sci. Technol. 42(21):8146-8151.
Ward, T., Boeri, R. 1990. Static acute toxicity of FX-1003 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0517.
Ward, T., Kowalski, P., Boeri, R. 1995a. Acute toxicity of N2803-2 to the fathead minnow, Pimephales promelas. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 097.
Ward, T., Kowalski, P., Boeri, R. 1995b. Acute toxicity of N2803-2 to the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a.
Ward, T., Magazu, J., Boeri, R. 1995c. Acute toxicity of L-13492 to the fathead minnow, Pimephales promelas. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 093.
Ward, T., Magazu, J., Boeri, R. 1995d. Growth and reproduction toxicity test with L-13492 and the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 096.
Ward, T., Magazu, J., Boeri, R. 1995e. Acute toxicity of L-13492 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 092.
Ward, T., Kawalski, P., Boeri, R. 1996a. Acute toxicity of N2803-2 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 099.
Ward, T., Kawalski, P., Boeri, R. 1996b. Acute toxicity of N2803-4 to the fathead minnow, Pimephales promelas. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 100.
Ward, T., Kawalski, P., Boeri, R. 1996c. Growth and reproduction toxicity test with N2803-4 and the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 101.
Ward, T., Kawalski, P., Boeri, R. 1996d. Acute toxicity of N2803-4 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-1030a 102.
Ward, T., Magazu, J., Boeri, R. 1996e. Growth and reproduction toxicity test with N2803-3 and the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0518.
Ward, T., Magazu, J., Boeri, R. 1996f. Acute toxicity of N2803-3 to the fathead minnow, Pimephales promelas. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0519.
Ward, T., Magazu, J., Boeri, R. 1996g. Acute toxicity of N2803-3 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0520.
Ward, T., Nevius, J.M., Boeri, R. 1996h. Growth and reproduction toxicity test with FC-1015 and the freshwater alga, Pseudokirchneriella subcapitata. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0526.
Ward, T., Nevius, J.M., Boeri, R. 1996i. Acute toxicity of FC-1015 to the daphnid, Daphnia magna. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0527.
Ward, T., Nevius, J.M., Boeri, R. 1996j. Acute toxicity of FC-1015 to the fathead minnow, Pimephales promelas. Document présenté à la Office of Pollution Prevention and Toxics, US Environmental Protection Agency, Washington (DC). OPPT Administrative Record AR226-0525.
Washburn, S.T., Bingman, T.S., Braithwaite, S.K., Buck, R.C., Buxton, W., Clewell, H.J., Haroun, L.A., Kester, J.E., Rickard, R.W., Shipp, A.M. 2005. Exposure assessment and risk characterization for perfluorooctanoate in selected consumer articles. Environ. Sci. Technol. 39(11):3904-3910.
Washington, J.W., Yoo, H., Ellington, J.J., Jenkins, T.M., Libelo, L. 2010. Concentrations, distribution and persistence of perfluoroalkylates in sludge-applied soils near Decatur, Alabama, USA. Environ. Sci. Technol. 44(22):8390-8396.
Washino, N., Saijo, Y., Sasaki, S., Kato, S., Ban, S., Konishi, K., Ito, R., Nakata, A., Iwasaki, Y., Saito, K., Nakazawa, H., Kishi, R. 2009. Correlations between prenatal exposure to perfluorinated chemicals and reduced fetal growth. Environ. Health Perspect. 117(4):660-667.
Webster, E., Ellis, D.A. 2010. Potential role of sea spray generation in the atmospheric transport of perfluorocarboxylic acids. Environ. Toxicol. Chem. 29(8):1703-1708.
Webster, E.M., Ellis, D.A. 2011. Equilibrium modelling: pathway to understanding observed perfluorocarboxylic and perfluorosulfonic acid behaviour. Environ. Toxicol. Chem. [publié en ligne le 27 juillet 2011].
Webster, G.M. 2011. Exposure sources and thyroid effects of perfluorinated compounds (PFCs) during pregnancy: results from the chemicals, health and pregnancy study (CHirP). Thèse de doctorat, School of Environmental Health, Université de la Colombie-Britannique.
Wei, Y., Dai, J., Liu, M., Wang, J., Xu, M., Zha, J., Wang, Z. 2007. Estrogen-like properties of perfluorooctanoic acid as revealed by expressing hepatic estrogen-responsive genes in rare minnows (Gobiocypris rarus). Environ. Toxicol. Chem. 26(11):2440-2447.
Wei, Y., Liu, Y., Wang, J., Tao, Y., Dai, J. 2008a. Toxicogenomic analysis of the hepatic effects of perfluorooctanoic acid on rare minnows (Gobiocypris rarus). Toxicol. Appl. Pharmacol. 226(3):285-297.
Wei, Y., Chan, L.L., Wang, D., Zhang, H., Wang, J., Dai, J. 2008b. Proteomic analysis of hepatic protein profiles in rare minnow (Gobiocypris rarus) exposed to perfluorooctanoic acid. J. Proteome Res. 7(4):1729-1739.
West Virginia Department of Environmental Protection, West Virginia Department of Health and Human Resources - Bureau for Public Health, DuPont. 2003. Ammonium Perfluorooctanoate (C-8) Ground Water Steering Team report. Document présenté à l’Office of Pollution Prevention and Toxics, U.S. Environmental Protection Agency, Washington (DC). OPPT-2003-0012-0204.
White, S.S., Calafat, A.M., Kuklenyik, Z., Villanueva, L., Zehr, R.D., Helfant, L., Strynar, M.J., Lindstrom, A.B., Thibodeaux, J.R., Wood, C., Fenton, S.E. 2007. Gestational PFOA exposure of mice is associated with altered mammary gland development in dams and female offspring. Toxicol. Sci. 96(1):133-144.
Wolf, C.J., Fenton, S.E., Schmid, J.E., Calafat, A.M., Kuklenyik, Z., Bryant, X.A., Thibodeaux, J., Das, K.P., White, S.S., Lau, C.S., Abbott, B.D. 2007. Developmental toxicity of perfluorooctanoic acid in the CD-1 mouse after cross-foster and restricted gestational exposures. Toxicol. Sci. 95(2):462-473.
Wolf, C.J., Takacs, M.L., Schmid, J.E., Lau, C., Abbott, B.D. 2008. Activation of mouse and human peroxisome proliferator-activated receptor alpha by perfluoroalkyl acids of different functional groups and chain lengths. Toxicol. Sci. 106(1):162-171.
Yamashita, N., Kurunthachalam, K., Taniyasu, S., Horii, Y., Petrick, G., Gamo, T. 2005. A global survey of perfluorinated acids in oceans. Mar. Pollut. Bull. 51(8-12):658-668.
Yang, C., Tan, Y.S., Harkema, J.R., Haslam, S.Z. 2008. Differential effect of peripubertal exposure to perfluorooctanoic acid on mammary gland development in C57Bl/6 and Balb/c mouse strains. Reprod. Toxicol. 27(3-4):425-426.
Yang, J.-H. 2010. Perfluorooctanoic acid induces peroxisomal fatty acid oxidation and cytokine expression in the liver of male Japanese medaka (Oryzias latipes). Chemosphere81:548-552.
Yang, Q., Xie, Y., DePierre, J.W. 2000. Effects of peroxisome proliferators on the thymus and spleen of mice. Clin. Exp. Immunol. 122(2):219-226.
Yang, Q., Xie, Y., Eriksson, A.M., Nelson, B.D., DePierre, J.W. 2001. Further evidence for the involvement of inhibition of cell proliferation and development in thymic and splenic atrophy induced by the peroxisome proliferator perfluoroctanoic acid in mice. Biochem. Pharmacol. 62(8):1133-1140.
Yang, Q., Xie, Y., Alexson, S.E.H., Nelson, B.D., DePierre, J.W. 2002. Involvement of the peroxisome proliferator-activated receptor alpha in the immunomodulation caused by peroxisome proliferators in mice. Biochem. Pharmacol. 63(10):1893-1900.
Yao, X., Zhong, L. 2005. Genotoxic risk and oxidative DNA damage in HepG2 cells exposed to perfluorooctanoic acid. Mutat. Res. 587(1-2):38-44.
Yeung, L.W.Y., Miyake, Y., Peng, L., Taniyasu, S., Kannan, K., Guruge, K.S., Lam, P.K.S., Yamashita, N. 2009a. Comparison of total fluorine, extractable organic fluorine and perfluorinated compounds in the blood of wild and perfluorooctanoate (PFOA)-exposed rats: evidence for the presence of other organofluorine compounds. Anal. Chim. Acta 635(1):108-114.
Yeung, L.W.Y., Miyake, Y., Wang, Y., Taniyasu, S., Yamashita, N., Lam, P.K.S. 2009b. Total fluorine, extractable organic fluorine, perfluorooctane sulfonate and other related fluorochemicals in liver of Indo-Pacific humpback dolphins (Sousa chinensis) and finless porpoises (Neophocaena phocaenoides) from South China. Environ. Pollut. 157(1):17-23.
Yeung, L.W.Y., Loi, E.I.H., Wong, V.Y.Y., Guruge, K.S., Yamanaka, N., Tanimura, N., Hasegawa, J., Yamashita, N., Miyazaki, S., Lam, P.K.S. 2009c. Biochemical responses and accumulation properties of long-chain perfluorinated compounds (PFOS/PFDA/PFOA) in juvenile chickens (Gallus gallus). Arch. Environ. Contam. Toxicol. 57(2):377-386.
Ylinen, M., Auriola, S. 1990. Tissue distribution and elimination of perfluorodecanoic acid in the rat after single intraperitoneal administration. Pharmacol. Toxicol. 66(1):45-48.
Yoo, H., Kannan, K., Kim, S.K., Lee, K.T., Newsted, J.L., Giesy, J.P. 2008. Perfluoroalkyl acids in the egg yolk of birds from Lake Shihwa, Korea. Environ. Sci. Technol. 42(15):5821-5827.
York, R.G. 2002. Oral (gavage) two-generation (one litter per generation) reproduction study of ammonium perfluorooctanoate (APFO) in rats. Rapport préparé par Argus Research, Horsham (PA). Protocol 418-020; Sponsor’s Study No. T-6889.6.
Young, C.J., Furdui, V.I., Franklin, J., Koerner, R.M., Muir, D.C.G., Mabury, S.A. 2007. Perfluorinated acids in Arctic snow: new evidence for atmospheric formation. Environ. Sci. Technol.41(10):3455-3461.
| Paramètre | Doses ou concentrations minimales avec effet[1] / résultats | |||
|---|---|---|---|---|
| [1]CL50, concentration létale médiane; DL50, dose létale médiane; CMENO, concentration minimale avec effet nocif observé; DMENO, dose minimale avec effet nocif observé; CSENO, concentration sans effet nocif observé; DSENO, dose sans effet nocif observé. | ||||
Toxicité aiguë : par voie orale |
DL50 la plus faible, par voie orale (rat femelle) = 430 mg/kg p.c. [SAAPFO] (IRDC, 1978) [Autres études : Biosearch Inc., 1976 [APFO]; Griffith et Long, 1980 [SAAPFO]; Haskell Laboratory, 1981b [SAAPFO]; Glaza, 1990 [non précisé], 1997 [SAAPFO] |
|||
Toxicité aiguë : par voie cutanée |
DL50 la plus faible, par voie cutanée (lapin) = > 100 et < 1 000 mg/kg p.c. [SAAPFO, 24 h, application couverte] (Riker Laboratories Inc., 1979) [Autres études : Haskell Laboratory, 1979b [SAAPFO]; Kennedy, 1985 [SAAPFO]; Glaza, 1995 [APFO-Na]] |
|||
| Toxicité aiguë : par inhalation |
CL50 la plus faible, par inhalation (rat mâle) = 980 mg/m3 [SAAPFO, 4 h](Kennedy et al., 1986) [Autres études : Haskell Laboratory, 1969 [SAAPFO]; Griffith et Long, 1980 [SAAPFO]] |
|||
| Toxicité à court terme à doses répétées : par voie orale |
DMENO la plus faible, par voie orale = 0,3 mg/kg p.c. par jour d’après une augmentation marquée liée à la dose du poids du foie relatif chez les souris (concentration sérique d’APFO = 13 µg/mL) et la modification des paramètres lipidiques chez les rats (concentration sérique d’APFO = 20 µg/mL) (aucune DSENO). Des groupes de 10 rats et souris mâles recevaient des doses de SAAPFO de 0, 0,3, 1, 3, 10 ou 30 mg/kg p.c. par jour par gavage pendant 14 jours (Loveless et al., 2006). [Autres études : Christopher et Marias, 1977 [SAAPFO]; Metrick et Marias, 1977 [SAAPFO]; Griffith et Long, 1980 [SAAPFO]; Kojo et al., 1986 [PFOou APFO, imprécis]; Kennedy, 1987 [SAAPFO]; Kawashima et al., 1989 [APFO]; Cook et al., 1992 [SAAPFO]; Sohlenius et al., 1992 [PFO, sel non précisé]; Permadi et al., 1993 [APFO]; Biegel et al., 1995 [SAAPFO]; Henwood, 1997 [SAAPFO]; Kudo et al., 1999 [PFO ou APFO, imprécis]; Q. Yang et al., 2000 [APFO], 2001 [APFO]; Thomford, 2001a [SAAPFO]; Loveless et al., 2006 [SAAPFO]; C. Yang et al., 2008 [APFO]; Macon et al., 2011 [SAAPFO]] |
|||
| Toxicité à court terme à doses répétées : par inhalation |
CMENO la plus faible, par inhalation = 8 mg/m3 (2,48 mg/kg p.c. par jour, concentration sérique moyenne d’APFO = 47 µg/mL), d’après une hypertrophie cytoplasmique hépatique, une dégénérescence ou une nécrose, une augmentation du poids du foie et une augmentation de la phosphatase alcaline chez les rats (CSENO = 1 mg/m3, équivalant à 0,31 mg/kg p.c. par jour, concentration sérique d’APFO = 13 µg/mL). Des rats mâles ont été exposés au SAAPFO à des doses de 0, 1, 8 ou 84 mg/m3 à raison de 6 h/jour, 5 jours/semaine pendant 2 semaines (Haskell Laboratory, 1981a; Kennedy et al., 1986). [Autres études : Haskell Laboratory, 1979a [SAAPFO]] |
|||
| Toxicité à court terme à doses répétées : par voie cutanée |
DMENO la plus faible, par voie cutanée = 20 mg/kg p.c. par jour d’après une augmentation du poids du foie et de l’aspartate aminotransférase/glutamate pyruvate transaminase chez les rats (aucune DSENO). Des rats ont été exposés au SAAPFO à des doses de 0, 20, 200 ou 2 000 mg/kg p.c. par jour à raison de 6 h/jour (application couverte), 5 jours/semaine, pendant 2 semaines (Haskell Laboratory, 1980; Kennedy, 1985). [Autres études : Riker Laboratories Inc., 1979 [SAAPFO]; McDonald, 1997 [SAAPFO]] |
|||
| Toxicité subchronique : par voie orale (rongeurs) |
DMENO la plus faible, par voie orale = 0,64 mg/kg p.c. par jour (concentration sérique moyenne d’APFO = 41,2 µg/mL) d’après une augmentation du poids du foie transitoire, une hypertrophie et une activité accrue de l’oxydase palmitylcoenzyme A chez les rats (DSENO = 0,06 mg/kg p.c. par jour, concentration sérique d’APFO = 7,1 µg/mL). Des rats mâles ont reçu des doses de 0, 1, 10, 30 ou 100 ppm de SAAPFO dans leur alimentation pendant 13 semaines (0, 0,06, 0,64, 1,94 ou 6,5 mg/kg p.c. par jour) (Palazzolo, 1993; Perkins et al., 2004). [Autres études : Goldenthal, 1978a [SAAPFO]; Griffith et Long, 1980 [SAAPFO]] |
|||
| Toxicité subchronique : par voie orale (primates) |
DMENO la plus faible, par voie orale = 3 mg/kg p.c. par jour d’après une augmentation du poids du foie chez les singes cynomolgus mâles auxquels on a administré des doses de SAAPFO par gavage (capsule) 7 jours/semaine pendant 26 semaines (concentration sérique d’APFO = 77 µg/mL) (aucune DSENO). Des groupes de six singes cynomolgus mâles ont reçu initialement des doses de 0, 3, 10 ou 30 mg/kg p.c. par jour. On n’administrait pas de SAAPFO aux animaux recevant la dose élevée de la substance aux jours 12 à 21, puis le traitement recommençait au jour 22 à la dose de 20 mg/kg p.c. par jour (Thomford, 2001b; Butenhoff et al., 2002). Les données sur le poids du foie ont été modélisées par la suite (Butenhoff et al., 2004c) pour estimer la limite inférieure de l’intervalle de confiance à 95 % d’une dose de référence associée à une augmentation du poids du foie de 10 % (DRI10) et de la concentration sérique correspondante (CIDRI10) : DRI10 = 3,9 mg/kg p.c. par jour [SAAPFO] (CIDRI10 = 23 µg/mL) [Autres études : Goldenthal, 1978b [SAAPFO]; Griffith et Long, 1980 [SAAPFO]] |
|||
| Cancérogénicité/ toxicité chronique |
Effets non néoplasiques : DMENO la plus faible, par voie orale = 1,3 mg/kg p.c. par jour chez les rats mâles et 1,6 mg/kg p.c. par jour chez les rats femelles, d’après une augmentation liée à la dose des concentrations sériques de glutamate pyruvate transaminase, de phosphatase alcaline et d’albumine chez les mâles et les femelles; une ataxie et une légère augmentation de l’hyperplasie tubulaire de l’ovaire chez les femelles (aucune DSENO). Des rats CD (cinq par dose par sexe) ont été exposés au SAAPFO à 0, 30 ou 300 ppm dans leur alimentation pendant 2 ans (0, 1,3 ou 14,2 mg/kg p.c. par jour chez les mâles; 0, 1,6 ou 16,1 mg/kg p.c. par jour chez les femelles). Cancérogénicité : Aucun signe de cancérogénicité n’a été rapporté chez les femelles. Chez les mâles, on a observé une incidence accrue des adénomes des cellules de Leydig (0/49, 2/50, 7/50, respectivement chez le groupe témoin, le groupe exposé à la dose faible et le groupe exposé à la dose élevée), qui était significative (p ≤ 0,05) à la dose élevée (Sibinski, 1987). Autres études : DMENO, par voie orale = 13,6 mg/kg p.c. par jour d’après une incidence accrue des adénomes et de l’hyperplasie des cellules de Leydig, des adénomes hépatiques ainsi que des adénomes et de l’hyperplasie des cellules acineuses du pancréas chez les rats mâles (aucune DSENO). Des rats CD mâles ont reçu des doses de 0 ou 300 ppm de SAAPFO dans leur alimentation (0 ou 13,6 mg/kg p.c. par jour) pendant 2 ans (Biegel et al., 2001). (Voir Tableau de référence) |
|||
| Génotoxicité et paramètres connexes : in vitro | Résultats négatifs : Bactérie, mutation, avec et sans la fraction S9 [APFO-Na] (Lawlor, 1995) [Autres études : Kennedy, 1976 [non précisé]; Litton Bionetics Inc., 1978 [SAAPFO]; Lawlor, 1996 [SAAPFO]] Cellules de mammifères, aberrations chromosomiques, avec et sans la fraction S9 [SAAPFO] (Murli, 1996a) [Autres études : Murli, 1996c [SAAPFO], 1996f [APFO-Na]] |
|||
Résultats positifs : Cellules de mammifères (cellules d’ovaires de hamsters chinois [cellules CHO]), aberrations chromosomiques [APFO-Na] (Murli, 1996d) Cellules de mammifères (hépatomes humains), micronoyaux et dommages oxydatifs à l’ADN [APFO] (Yao et Zhong, 2005) |
||||
| Génotoxicité et paramètres connexes : in vivo | Résultats négatifs : Micronoyaux de moelle osseuse de souris (mâles/femelles) [APFO-Na], jusqu’à 5 g/kg p.c.; gavage aigu (Murli, 1995) [Autres études : Murli, 1996b [SAAPFO], 1996e [SAAPFO]] |
|||
Résultats positifs : Rat (mâles), dommages oxydatifs à l’ADN, augmentation de la 8-hydroxydésoxyguanosine dans l’ADN du foie, mais non dans l’ADN des reins [APFO]; 0,02 % dans l’alimentation pendant 2 semaines ou 100 mg/kg p.c. par une seule injection intrapéritonéale (Takagi et al., 1991) |
||||
Toxicité pour le développement : par voie orale |
DMENO, par voie orale = 1 mg/kg p.c. par jour(concentration sérique moyenne d’APFO de 21,9 µg/mL chez les mères) d’après la toxicité maternelle (augmentation du poids du foie) et la toxicité fœtale (ossification réduite, puberté précoce des mâles) chez les souris (aucune DSENO). Des souris CD-1 en gestation ont reçu des doses de 0, 1, 3, 5, 10, 20 ou 40 mg/kg p.c. de SAAPFO par gavage aux jours 1 à 17 de la gestation (Lau et al., 2006). [Autres études : Gortner, 1981 [SAAPFO], 1982 [SAAPFO]; Staples et al., 1984 [SAAPFO]; Mylchreest, 2003 [SAAPFO]; Abbott et al., 2007 [SAAPFO]; White et al., 2007 [SAAPFO]; Wolf et al., 2007 [SAAPFO]; Hines et al., 2009 [SAAPFO]; Macon et al., 2011 [SAAPFO]] |
|||
Toxicité pour le développement : par inhalation |
CMENO par inhalation = 10 mg/m3(équivalant à 3,1 mg/kg p.c. par jour) chez les rats, d’après la toxicité maternelle (apparence négligée, diminution du gain de poids corporel, augmentation du poids du foie) et la toxicité fœtale (poids corporel inférieur) (CSENO = 1 mg/m3). Des rates gravides ont été exposées au SAAPFO à des concentrations de 0, 0,1, 1 ou 10 mg/m3 à raison de 6 h/jour (exposition sur le corps entier) aux jours 6 à 15 de la gestation (Staples et al., 1984). | |||
| Toxicité pour la reproduction | DMENO, par voie orale = 1 mg/kg p.c. par jour chez les rats, d’après la toxicité chez les parents (augmentation du poids du foie et des reins), chez les mâles des générations F0 et F1 (DSENO pour les paramètres de la reproduction = 30 mg/kg p.c. par jour). Des rats Sprague-Dawley (60 rats par sexe par groupe) ont reçu des doses de 0, 1, 3, 10 ou 30 mg/kg p.c. par jour de SAAPFO par gavage. La génération F0 a été exposée de la cohabitation jusqu’à 6 semaines après le sevrage de la génération F1; la génération F1 a été exposée du sevrage jusqu’au sevrage de la génération F2 (York, 2002; Butenhoff et al., 2004a, 2004b). | |||
| Études épidémiologiques (exposition de la population générale) | Sélection au hasard de 1 400 femmes et de leur nouveau-né au sein de la cohorte de naissance nationale du Danemark. Les concentrations sériques d’APFO chez les mères étaient inversement proportionnelles au poids et à la grandeur à la naissance. Aucune corrélation n’a été établie entre les concentrations d’APFO chez la mère et les stades de développement critiques des jeunes enfants à 6 et à 18 mois. Chez 1 240 femmes dont la grossesse était prévue, une concentration sérique d’APFO plus élevée chez la mère en début de grossesse était associée à un temps de conception plus long (concentration sérique moyenne d’APFOchez la mère = 0,0056 µg/mL; quartile inférieur [référence] : APFO chez la mère ≤ 0,003 91 µg/mL) (Fei et al., 2007, 2008a, 2008b, 2009). Dans une étude transversale comptant 293 échantillons de sang de cordon ombilical de nouveau-nés menée à Baltimore, au Maryland, on a noté une faible association négative entre la concentration d’APFO dans le sang de cordon et le poids à la naissance (concentration sérique moyenne d’APFO du cordon = 0,0016 µg/mL) (Apelberg et al., 2007b). Dans une étude de 101 femmes enceintes et leur nouveau-né menée à Hamilton, en Ontario, on n’a établi aucune association entre les concentrations sériques d’APFO chez la mère ou du cordon ombilical et le poids à la naissance (concentration sérique moyenne d’APFO chez la mère = 0,002 54 µg/mL aux semaines 24 à 28 de la grossesse et 0,002 24 µg/mL à la naissance; concentration sérique moyenne d’APFO du cordon = 0,001 94 µg/mL) (Monroy et al., 2008). Dans une étude rétrospective de cohortes menée chez 428 femmes au Japon, on n’a établi aucune association entre les concentrations sériques d’APFO chez la mère et le poids à la naissance (concentration sérique moyenne d’APFOchez la mère = 0,0014 µg/mL) (Washino et al., 2009). Dans une étude menée auprès de 252 femmes enceintes et leur bébé en Alberta, on a établi aucune association entre la concentration sérique moyenne d’APFO chez la mère et le poids du fœtus (concentration sérique médiane d’APFOchez la mère = 0,0015 µg/mL) (Hamm et al., 2009). Dans une étude portant sur 105 Danois de la population générale, les hommes présentant une concentration sérique élevée de PFOS et d’APFO combinés avaient une concentration plus faible de spermatozoïdes (Joensen et al., 2009). Dans une étude transversale portant sur 860 adultes de la population générale des États-Unis, il existait une association positive entre l’APFO sérique, le cholestérol total et le cholestérol de faible densité (Nelson et al., 2010). Dans une étude transversale portant sur 860 adultes de la population générale des États-Unis, après ajustement pour les facteurs de confusion, il y avait une association entre l’APFOsérique et les enzymes hépatiques (Lin et al., 2010). Dans une étude transversale portant sur 3 974 adultes de la population générale des États-Unis, il existait une association positive entre l’APFO sérique et les maladies thyroïdiennes (Melzer et al., 2010). Dans le cadre d’une étude prospective de cohortes portant sur 713 Danois, aucun lien n’a été observé entre les concentrations plasmatiques d’APFO et le taux d’incidence de cancers de la prostate, de la vessie, du pancréas et du foie (Eriksen et al., 2009). |
|||
| Études épidémiologiques (populations présentant une plus grande exposition à l’APFO dans l’eau potable contaminée) | Dans une étude transversale portant sur 1 555 grossesses uniques en Ohio, un sous-ensemble de 380 mères vivaient dans un comté où l’eau potable était contaminée par l’APFO(concentration moyenne dans l’eau potable de 2002 à 2005 : 6,78 µg/L). Aucune différence n’a été observée quant au poids moyen à la naissance ou quant à l’incidence des poids insuffisants à la naissance entre le groupe exposé à de fortes doses et les femmes des autres comtés environnants où l’eau potable présentait des concentrations d’APFO d’environ 20 à 1 000 fois inférieures (Nolan et al., 2009a). Dans une étude de suivi, les chercheurs n’ont signalé aucune association entre une exposition élevée à l’APFO (personnes vivant dans une région raccordée à des services d’eau potable contaminée) et les anomalies congénitales (Nolan et al., 2009b). Les concentrations sériques d’APFO n’ont pas été mesurées au cours de ces études; toutefois, lors d’une étude antérieure menée chez une population située dans cette région, une concentration sérique médiane d’APFO de 0,354 µg/mL a été mesurée (Emmett et al., 2006b; voir plus haut). Dans une étude transversale portant sur 1 845 femmes enceintes vivant dans des collectivités en Ohio et en Virginie-Occidentale raccordées à des services d’eau potable contaminée par l’APFO, les concentrations sériques d’APFO ont été mesurées jusqu’à 5 ans après la naissance et les effets sur la santé étaient auto-déclarés. Aucune association entre la concentration sérique d’APFO chez la mère et le poids à la naissance n’a été établie (concentration sérique moyenne d’APFO : 0,048 µg/mL; concentration sérique médiane d’APFO : 0,0212 µg/mL) (Stein et al., 2009). Dans une étude transversale sur l’exposition de la population générale portant sur 371 sujets vivant en Ohio dans un comté où l’eau potable contenait de l’APFO à une concentration moyenne de 3,5 µg/L au cours des 3 années précédant l’étude, aucune corrélation significative entre la concentration sérique d’APFO et les tests mesurant la fonction hépatique et la fonction rénale, les taux de cholestérol et d’autres paramètres hématologiques n’a été observée (concentration sérique médiane d’APFO : 0,354 µg/mL) (Emmett et al., 2006b). Dans une étude transversale portant sur 54 468 adultes vivant dans des collectivités en Ohio et en Virginie-Occidentale raccordées à des services d’eau potable contaminée par l’APFO (C8 Health Project), la prévalence du diabète, ajustée selon l’âge, autodéclarée était comparable à celles observées dans ces États. Les rapports de cotes pour le diabète de type II étaient inférieurs à 1 pour toutes les concentrations sériques d’APFOplus élevées que celles du décile inférieur (référence), y compris lorsque l’analyse se limitait aux sujets qui avaient vécu depuis au moins 20 ans dans des districts où l’eau était contaminée et qui avaient été exposés pendant au moins 10 ans avant le diagnostic (concentration sérique moyenne d’APFO : 0,0868 µg/mL; concentration sérique médiane d’APFO : 0,0281 µg/mL; décile inférieur [référence] : concentration sérique d’APFO< 0,0079 µg/mL) (MacNeil et al., 2009). Dans une étude transversale portant sur 46 294 adultes vivant dans des collectivités en Ohio et en Virginie-Occidentale raccordées à des services d’eau potable contaminée par l’APFO (C8 Health Project), des tendances positives ont été observées entre l’augmentation des concentrations sériques d’APFO et les taux de cholestérol total, de cholestérol à lipoprotéines de basse densité (LDL) et de triglycérides. Le rapport de cotes pour un taux de cholestérol élevé augmentait dans chaque quartile, jusqu’à atteindre 1,4. Aucune association n’a été établie entre la concentration sérique d’APFO et le taux de cholestérol à lipoprotéine de haute densité (HDL) (concentration sérique moyenne d’APFO : 0,080 µg/mL; concentration sérique médiane d’APFO : 0,027 µg/mL; quartile inférieur [référence] : concentration sérique d’APFO< 0,0131 µg/mL; quartile supérieur ≥ 0,067 µg/mL) (Steenland et al., 2009). Dans une étude transversale portant sur 46 294 enfants et adolescents résidant dans la Mid-Ohio River Valley, raccordée à des services d’eau potable contaminée par l’APFO (C8 Health Project), une association positive significative a été établie entre l’APFOsérique et le cholestérol total et le cholestérol à lipoprotéines de basse densité (LDL) (Frisbee et al., 2010). Dans une étude transversale portant sur 54 951 adultes vivant en Ohio et en Virginie-Occidentale, exposées par l’intermédiaire de l’eau potable contaminée (C8 Health Project), une association positive significative a été établie entre l’APFO sérique et l’acide urique (hyperuricémie) (Steenland et al., 2010b). |
|||
| Études épidémiologiques (exposition professionnelle) | Enzymes hépatiques, hormones, lipides et autres paramètres sériques : Dans un examen transversal longitudinal (3 à 6 ans) de dossiers médicaux de 263 travailleurs à la production de substances fluorées, aucune corrélation significative n’a été constatée entre la concentration sérique d’APFO et les paramètres hématologiques, hépatiques ou de la thyroïde. On a toutefois observé des associations positives entre la concentration sérique d’APFO et le cholestérol total et les triglycérides (concentration sérique moyenne d’APFO : 1,78 µg/mL; plage : 0,04 à 12,7 µg/mL) (Olsen et al., 2003a). Dans deux études transversales limitées (111 et 80 travailleurs à la production d’APFO), les concentrations sériques d’APFO n’étaient pas associées de façon significative aux concentrations d’estradiol et de testostérone sériques (concentration sérique d’APFO : jusqu’à 115 µg/mL) (Olsen et al., 1998). Un programme de surveillance médicale annuelle a été mené auprès de 53 travailleurs mâles à la production d’APFO(exposés pendant 0,5 à 32,5 ans) et de 107 témoins non exposés. Sur une période de 30 ans, aucun signe clinique de maladie précise n’a été observé chez les travailleurs exposés et tous les paramètres biochimiques mesurés étaient compris dans la plage de valeurs normales. En 2007, le cholestérol total était significativement plus élevé chez 34 travailleurs exposés que chez les 34 témoins appariés selon l’âge et d’autres facteurs. Selon une analyse multivariable réalisée sur 56 sujets dont les concentrations sériques d’APFO ont été mesurées en même temps que les paramètres biochimiques au cours des 6 dernières années, il existait une corrélation faible mais significative entre le cholestérol total et les concentrations sériques d’APFO (concentrations sériques d’APFO analysées entre 2000 et 2007; en 2007, concentration sérique médiane d’APFOchez les travailleurs exposés à ce moment : 5,71 µg/mL; concentration médiane chez les travailleurs anciennement exposés : 4,43 µg/mL) (Costa et al., 2009). Les données de programmes de surveillance médicale menés auprès des travailleurs mâles participant à la production d’APFO en 1993 (n = 111), en 1995 (n = 80) et en 1997 (n = 74) (seulement 17 sujets ont participé aux programmes pendant les 3 années) indiquent une association négative entre les taux de cholécystokinine sérique et les concentrations sériques d’APFO. Aucune association n’a été établie entre la concentration sérique d’APFO et les lipides ou les enzymes hépatiques (concentrations sériques d’APFO : moyennes de chacune des années entre 5,0 et 6,8 µg/mL, plage globale jusqu’à 114,1 µg/mL) (Olsen et al., 2000). Dans une étude transversale de 1 025 travailleurs à la production de polymères fluorés, une analyse de régression linéaire multivariable a permis de constater une corrélation positive significative entre les concentrations sériques d’APFO et les taux de cholestérol, de cholestérol à lipoprotéine de très basse densité (VLDL), de cholestérol LDL et de gamma-glutamyl-aminotransférase (GGT) et, chez les hommes, les taux de testostérone et d’estradiol du sérum. On n’a constaté aucune association entre les concentrations sériques d’APFO et les taux de cholestérol HDL, de triglycérides, d’aspartate aminotransférase, de glutamate pyruvate transaminase ou de bilirubine (concentrations sériques d’APFO variant entre 0,0046 et 9,55 µg/mL; moyenne = 0,428 µg/mL) (Sakr et al., 2007a). Des données de surveillance médicale et des mesures de la concentration sérique d’APFO ont été recueillies pendant 25 ans chez 454 travailleurs à la production de polymères fluorés. Un modèle linéaire à effets mixtes a été utilisé et a montré que la concentration sérique d’APFO était corrélée de façon positive avec le cholestérol total et l’aspartate aminotransférase, et de façon négative avec la bilirubine totale. On n’a constaté aucune association entre les concentrations sériques d’APFO et de cholestérol HDL, de cholestérol LDL, de triglycérides, de gamma-glutamyl-aminotransférase, de glutamate pyruvate transaminase ou de phosphatase alcaline (concentrations sériques d’APFOvariant entre 0 et 22,66 µg/mL; moyenne = 1,13 µg/mL sur une période de 23 ans) (Sakr et al., 2007b). Mortalité et cancer : Une étude rétrospective de cohorte sur la mortalité a été réalisée chez 2 083 employés d’une usine de production de substances fluorées. Les données de biosurveillance sur les PFOS ont servi à grouper les membres de la cohorte selon leur exposition aux substances fluorées, soit non exposés, exposés à de faibles concentrations ou exposés à de fortes concentrations. Le taux de mortalité global était inférieur à celui prévu au sein de la population générale. On a constaté deux décès attribuables au cancer du foie dans les groupes exposés à de faibles et à de fortes concentrations (ratio standardisé de mortalité [RSM] de 3,08) et trois décès attribuables au cancer de la vessie, tous trois dans le groupe exposé à de fortes concentrations (RSM de 12,77) (Alexander et al., 2003). Cette usine ne fabriquait pas d’APFO, mais les travailleurs affichaient des concentrations sériques d’APFO et de six autres substances chimiques perfluorées liées à l’exposition professionnelle (concentration sérique d’APFO : moyenne géométrique de 0,899 µg/mL) (Olsen et al., 2003c). Une analyse rétrospective de cohorte sur la mortalité a été réalisée chez 6 027 travailleurs d’une usine de fabrication de polymères fluorés en Virginie-Occidentale. Les RSM ont été obtenus à partir de comparaisons avec la population américaine, la population de l’État et une population d’employés régionale. La majorité des valeurs de RSM étaient inférieures ou égales à 1. La seule hausse de mortalité statistiquement significative a été notée pour le diabète, comparativement à la population d’employés régionale (RSM = 1,97). Une hausse non significative de la mortalité attribuable aux cardiopathies ischémiques a également été constatée, comparativement à la population d’employés régionale (RSM = 1,09). Le nombre de décès attribuables aux cancers du foie, du pancréas et des testicules (8, 11 et 1, respectivement) était inférieur à celui prévu pour la population américaine (Leonard et al., 2008). La concentration sérique d’APFO chez les travailleurs avait été précédemment mesurée à cette usine, et la substance avait été détectée sans égard au poste occupé. Chez 1 025 travailleurs, les concentrations sériques d’APFO étaient comprises entre 0,0046 et 9,55 µg/mL (moyenne de 0,428 µg/mL) (Sakr et al., 2007a; voir plus haut). Une étude de mortalité menée sur une cohorte de 4 747 employés exposés au SAAPFO à l’usine de DuPont a permis de conclure que le risque de mortalité attribuable aux cardiopathies ischémiques n’était pas augmenté chez les travailleurs exposés au SAAPFO (Sakr et al., 2009). Une étude de mortalité a été réalisée sur une cohorte de 3 993 employés d’une usine de production de SAAPFO. Les postes ont été classés comme suit : exposition « probable » ou « certaine » au SAAPFO, ou sans exposition. Des données de concentrations sériques d’APFOrecueillies antérieurement dans diverses zones de l’usine ont été utilisées pour estimer l’exposition cumulative. Les RSM de la population générale du Minnesota étaient inférieurs ou égaux à 1 pour la plupart des causes de décès, y compris le cancer du foie, la cirrhose, le cancer du pancréas, la cardiopathie ischémique et toutes les cardiopathies. Aucun décès attribuable au cancer des testicules n’a été relevé (RSM non estimé). Les RSM des sujets qui occupaient des postes présentant une exposition certaine étaient supérieurs à 1 pour le cancer de la prostate et les maladies cérébrovasculaires (RSM de 2,1 et de 1,6, respectivement). Lorsqu’on compare la catégorie d’exposition cumulative la plus faible à celle la plus élevée, on obtient une augmentation du risque de cancer de la prostate et des maladies cérébrovasculaires (rapports des risques [RR] de 6,6 et de 4,6, respectivement). Le RSM des sujets qui occupaient des postes présentant une exposition probable était de 2,0 pour le diabète, et le RR comparé au groupe d’exposition faible était de 3,7. Aucun décès attribuable au diabète n’a été observé dans le groupe d’exposition certaine (Lundin et al., 2009). |
|||
| Cellule | Témoin (à volonté) |
Témoin (nourris ensemble) | Groupe exposé (300 ppm) |
|---|---|---|---|
| [*] p ≤ 0.05 | |||
| Hyperplasie des cellules de Leydig | 11/80 | 26/78 | 35/76[*] |
| Hyperplasie des cellules acineuses | 14/80 | 8/79 | 30/76[*] |
| Adénome des cellules de Leydig | 0/80 | 2/78 | 8/76[*] |
| Adénome des cellules acineuses | 0/80 | 1/79 | 7/76[*] |
| Adénome hépatique | 2/80 | 1/79 | 10/76[*] |
| Carcinome des cellules acineuses | 0/80 | 0/79 | 1/76 |
| Carcinome hépatique | 0/80 | 2/79 | 0/76 |
Notes de bas de page
[2] La détermination de la conformité à un ou plusieurs des critères énoncés à l’article 64 est basée sur une évaluation des risques potentiels pour l’environnement ou la santé humaine associés aux divers types d’exposition dans l’environnement en général. Pour les humains, cela inclut, sans toutefois s’y limiter, l’exposition par l’air ambiant et intérieur, l’eau potable, les produits alimentaires et l’utilisation de produits de consommation. Une conclusion établie en vertu de la LCPE(1999) portant sur les substances énumérées dans le Plan de gestion des produits chimiques (PGPC) n’est pas pertinente à une évaluation, qu’elle n’empêche pas non plus, par rapport aux critères de risque définis dans le Règlement sur les produits contrôlés, qui fait partie du cadre réglementaire pour le Système d’information sur les matières dangereuses au travail (SIMDUT) pour les produits destinés à être utilisés au travail. De même, une conclusion fondée sur les critères énoncés à l’article 64 de la LCPE(1999) n’empêche pas que des mesures soient prises en vertu d’autres articles de la LCPEou d’autres lois.
[3] Les doses ont été calculées à l’aide des valeurs de référence suivantes : taux d’inhalation chez le rat = 0,11 m3/jour; poids corporel du rat = 0,35 kg (Santé Canada, 1994).