Rapport d'évaluation préalable pour le Défi
Archivée
Diisocyanate de toluène
Diisocyanate de 4-méthyl-m-phénylène
(2,4-TDI)
No CAS 584-84-9
Diisocyanate de 2-méthyl-m-phénylène
(2,6-TDI)
No CAS 91-08-7
Diisocyanate de m-tolylidène
(mélanges d’isomères du TDI)
No CAS 26471-62-5
Environnement Canada
Santé Canada
Juillet 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Sources
- Utilisations
- Rejets dans l’environnement
- Persistance et potentiel de bioaccumulation
- Devenir dans l’environnement
- Potentiel d’effets nocifs sur l’environnement
- Potentiel d’effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Limites supérieures estimées de l’absorption quotidienne du 2,4-diisocyanate de toluène et du 2,6- diisocyanate de toluène par la population générale au Canada
- Annexe 2 : Valeurs d’exposition estimées liées à l’utilisation de produits de consommation
- Annexe 3 : Sommaire des renseignements concernant les effets sur la santé des diisocyanates de toluène
Les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable des mélanges d’isomères du diisocyanate de toluène (TDI),numéro de registre du Chemical Abstracts Service (CAS) 26471-62-5, du Diisocyanate de 4-méthyl-m-phénylène (2,4-diisocyanate de toluène : 2,4-TDI), n° CAS 584-84-9 et du Diisocyanate de 2-méthyl-m-phénylène (2,6 diisocyanate de toluène : 2,6-TDI), n° CAS 91-08-7. Une priorité élevé a été accordée à la prise de mesure à l’égard de ces substances lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres. On estime que, pour les Canadiens, elles présentent le plus fort risque d’exposition (PFRE) dans le cas du n° CAS 26471-62-5, ou un risque d’exposition intermédiaire (REI) dans le cas des nos CAS 91-08-7 et 584-84-9; par ailleurs, elles ont été classées dans la catégorie des agents cancérogènes par d’autres organismes. étant donné que ces substances ne répondaient pas aux critères de la catégorisation écologique de la persistance, de la bioaccumulation ou de la toxicité intrinsèque visant les organismes aquatiques, cette évaluation est donc axée sur différents aspects relatifs à la santé humaine.
On a combiné les évaluations préalables du 2,4-TDI, du 2,6-TDI et des mélanges d’isomères du TDI car la plupart des données toxicologiques disponibles portent sur ce dernier groupe. Aussi, dans la présente évaluation, le terme « TDI » désigne indistinctement le 2,4-TDI, le 2,6-TDI et les mélanges d’isomères du TDI.
Le diisocyanate de toluène est un produit chimique industriel qui n’a été fabriqué au Canada par aucune entreprise en 2006, et ce, en quantité supérieure au seuil de déclaration de 100 kg, il y est cependant importé. Au cours de cette même année, plus de 85 p. 100 du diisocyanate de toluène importé au pays a servi à la fabrication de mousse de polyuréthane souple.
Au Canada, les rejets industriels de TDI se font surtout dans l’air et on croit que la plus grande partie du TDI qui y est rejeté devrait rester à l’état de vapeur et réagir principalement avec des radicaux hydroxyles produits par photolyse, ce qui correspond à une demi-vie inférieure à deux jours. Toutefois, le niveau d’exposition au TDI pourrait être élevé pendant l’utilisation de produits de consommation qui en contiennent.
En se fondant principalement sur les données concernant la cancérogénicité issues des évaluations de plusieurs organismes internationaux et nationaux, les données épidémiologiques chez l’humain et les données expérimentales chez les animaux sont équivoques et ne permettent donc pas de déterminer les risques de cancer associés à une exposition au TDI par inhalation chez l’humain. Le TDI est considéré comme une substance cancérogène, puisque les doses orales chez les animaux étaient associées à l’apparition de tumeurs à de nombreux endroits. Des résultats partagés on été obtenus pour des essais in vivo et in vitro sur la génotoxicité du TDI. Par conséquent, bien que le mode d’induction des tumeurs n’ait pas été complètement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez les animaux de laboratoire résultent de l’interaction directe avec le matériel génétique.
Les valeurs estimées de la limite supérieure de l’exposition par inhalation de la population générale ou lors de l’utilisation de l’utilisation de produits de consommation contenant du TDI peut presque atteindre ou dépasser les effets non cancérogènes critiques dans le système respiratoire, incluant l’hypersensibilité respiratoire. De plus, le TDI a été classé par l’Union européenne dans la catégorie des sensibilisants de la peau et des voies respiratoires.
Compte tenu de la cancérogénicité du TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène, pour lequel il pourrait exister une probabilité d’effets nocifs à tout niveau d’exposition, et de l’inadéquation possible des marges entre l’exposition estimée à partir des produits et du niveau critiques pour les effets non cancérogènes, il est conclu que le TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène sont des substances qui peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des dangers écologiques et des rejets déclarés de TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène, il est conclu que le TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ni à mettre en danger l'environnement essentiel pour la vie. De plus, le TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène ne répondent pas aux critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation.
Ces substances s'inscriront dans la mise à jour de l’inventaire de la Liste intérieure des substances, qui débutera en 2009. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, la performance des mesures de contrôle possibles déterminées à l'étape de la gestion des risques.
Compte tenu des renseignements disponibles, le TDI (mélanges d’isomère), le 2,4-diisocyanate de toluène et le 2,6-diisocyanate de toluène remplissent un ou plusieurs critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l’Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si ces substances présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine. À partir des résultats de l’évaluation préalable, les ministres peuvent proposer de ne rien faire à l’égard de la substance, de l’inscrire sur la Liste des substances d’intérêt prioritaire (LSIP) en vue d’une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l’annexe 1 de la Loi et, s’il y a lieu, la quasi-élimination de ses rejets dans l’environnement.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères de la catégorisation relatifs à l’environnement [persistance (P), potentiel de bioaccumulation (B) et toxicité intrinsèque (Ti) pour les organismes aquatiques] et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine à la lumière des classements effectués par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils mettent au défi l’industrie et les autres intervenants intéressés de fournir, selon un calendrier déterminé, des renseignements particuliers sur les substances qui pourraient servir à étayer l’évaluation des risques. Ces renseignements pourraient aussi servir à élaborer et à évaluer comparativement les meilleures pratiques de gestion des risques et de gérance des produits pour ces substances jugées hautement prioritaires.
Les isomères du diisocyanate de toluène ont été jugé hautement prioritaire pour l’évaluation des risques qu’ils comportent pour la santé humaine, car il a été considérée présenter un REI et a été classée par d’autres instances sur la base de leur cancérogénicité et de leur génotoxicité. Le volet du Défi portant sur cette substance a été lancé le 3 février 2007 au moyen d’un avis paru dans la Gazette du Canada (Canada, 2007a). Le profil de cette substance a été publié en même temps. Ce profil présentait l’information technique, obtenue avant décembre 2005, sur laquelle a reposé la catégorisation de cette substance. En réponse au Défi, on a reçu des documents présentant des renseignements.
Même si l’évaluation des risques des isomères du diisocyanate de toluène pour la santé humaine a été jugé hautement prioritaire, ces substances ne remplissent pas le critère de la catégorisation écologique du potentiel de bioaccumulation, de la persistance ou de la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée sur l’information pertinente à l’évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées en vertu de la LCPE (1999) portent sur les renseignements essentiels pour établir si une substance répond ou non aux critères de toxicité des substances chimiques énoncés dans l’article 64 de la Loi, qui se lit comme suit :
64. « ...est toxique toute substance qui pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à :
- avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique;
- mettre en danger l’environnement essentiel pour la vie;
- constituer un danger au Canada pour la vie ou la santé humaine. »
Les évaluations préalables mettent en lumière les renseignements scientifiques et présentent les conclusions que l’on peut dégager en incorporant la méthode du poids de la preuve et la prudence.
Cette évaluation préalable inclue l’examen des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, à l’inclusion des renseignements additionnels fournis dans le cadre du Défi. Des données pertinentes à l’évaluation préalable de cette substance ont été relevées dans des publications originales, des rapports de synthèse et d’évaluation, des rapports de recherche de parties intéressées et d’autres documents accessibles lors de recherches menées dernièrement, jusqu’en septembre 2007. Les études importantes ont fait l’objet d’évaluations critiques. Les études clés ont fait l’objet d’évaluation critique ; les résultats de la modélisation ont pu être utilisés dans la formulation de conclusions. L’évaluation des risques pour la santé humaine comprends l’examen de données pertinentes à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d’autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l’effet critique retenu ou sur l’écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l’exposition tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, cela dans le contexte d’une évaluation préalable. Les évaluations préalables ne sont pas le résultat d’examens critiques ou exhaustifs de toutes les données disponibles. Elles présentent plutôt les informations critiques selon lesquelles la conclusion est basée.
On a combiné les évaluations préalables du 2,4-TDI, du 2,6-TDI et des mélanges d’isomères du TDI parce que la plupart des données toxicologiques disponibles portent sur ce dernier groupe. Aussi, dans la présente évaluation, le terme « TDI » désigne indistinctement le 2,4-TDI, le 2,6-TDI ou les mélanges d’isomères du TDI.
La présente évaluation préalable a été effectuée par le personnel des Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre des résultats provenant d’autres programmes appliqués par ces ministères. Cette évaluation préalable a fait l’objet d’une consultation indépendante par des pairs. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus par Meridian Environmental Inc. et de Starodub & Associates. Bien que les commentaires externes aient été pris en considération, Santé Canada assume la responsabilité du contenu final de l’évaluation préalable pour tout ce qui concerne la santé humaine. De plus, une version provisoire de la présente évaluation préalable a fait l’objet d’une consultation publique de 60 jours. Les considérations et les renseignements importants à la base du présent rapport sont présentés ci-après.
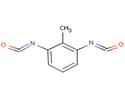
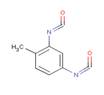
| No CAS et nom | N° CAS 584-84-9 : Diisocyanate de 4-méthyl-m-phénylène N° CAS 91-08-7 : Diisocyanate de 2-méthyl-m-phénylène (2,6-TDI) N° CAS 26471-62-5 : Diisocyanate de m-tolylidène (mélanges d’isomères du TDI) |
|---|---|
| Le TDI est habituellement vendu à l’état de mélange 80:20 des isomères 2,4- et 2,6-. On trouve également dans le commerce un mélange 65:35 et un mélange brut du TDI à rapport isomérique indéfini. De plus, on utilise le 2,4-TDI pur pour certaines applications spéciales. Le 2,6-TDI pur n’a pas d’application industrielle. | |
Synonymes No CAS 91-08-7 No CAS 26471-62-5 |
1,3-Diisocyanato-4-methylbenzene; 2,4-toluene diisocyanate (2,4-TDI); Isocyanic acid, 4-methyl- m -phenylene ester 1,3-Diisocyanato-2-methylbenzene; 2,6-toluene diisocyanate (2,6-TDI); Isocyanic acid, 2-methyl- m -phenylene ester Crude tolylene diisocyanate; 1,3-diisocyantomethylbenzene; toluene diisocyanate (80 % 2,4-TDI; 20 % 2,6-TDI) |
| Groupe chimique | Composés organiques |
| Sous-groupe chimique | Cyanates et leurs dérivés |
| Formule chimique | C9H6N2O2 |
| Structure chimique |
|
| Notation SMILES | 91-08-7: O=C=Nc(c(c(N=C=O)cc1)C)c1 584-84-9: O=C=Nc(c(ccc1N=C=O)C)c1 |
| Masse moléculaire | 174,16 |
| Propriété | Valeur | Type | Référence |
|---|---|---|---|
| exp.= données expérimentales | |||
| Point de fusion 2,4-TDI 2,6- TDI Mélanges d'isomères 2,4- et 2,6- du TDI |
22 °C 7,2 °C < 15 °C (mélange 80:20) < 8 °C (mélange 65:35) |
exp. exp. exp. exp. |
CIRC, 1986 CIRC, 1986 CIRC, 1986 CIRC, 1986 |
| Point d'ébullition 2,4-TDI 2,6- TDI Mélanges d'isomères 2,4- et 2,6- du TDI |
252,5-254 °C 252-254 °C |
exp. à 1 atm exp. à 0,98 atm exp. à 1 atm |
IUCLID, 2000 IUCLID, 2000 IUCLID, 2000 |
| Masse volumique | 1,22 g/cm3 | exp. à 20 °C | IUCLID, 2000 |
| Pression de vapeur 2,4-TDI 2,6- TDI Mélanges d'isomères 2,4- et 2,6- du TDI |
0,013-0,021 hPa 0,016 hPa 0,014-0,015 hPa |
toutes les val. d'exp. à 20 °C | IUCLID, 2000 IUCLID, 2000 IUCLID, 2000 |
| Constante de la loi de Henry (H) | Comme le TDI réagit avec l'eau, on n'a pas estimé H. | ||
| Solubilité dans l'eau | Comme le TDI réagit avec l'eau, on ne peut déterminer sa solubilité dans l'eau. | IUCLID, 2000 | |
| Log Koe | Comme le TDI réagit avec l'eau et avec l'octanol, on ne peut estimer Koe. | IUCLID, 2000 | |
| Log Kco | Comme le TDI réagit avec l'eau et avec l'octanol, on ne peut estimer Kco. | ||
Il n'y a pas de sources naturelles connues du TDI.
Le diisocyanate de toluène est un produit chimique industriel qui n’a été fabriqué au Canada en quantité supérieure au seuil de déclaration de 100 kg par aucune entreprise en 2006, mais qui y est importé. Pour cette même année, la demande industrielle en TDI au pays était estimée à 33,6 millions de kilogrammes (IAL Consultants, 2007). À partir des réponses à un avis publié en application de l’article 71 de la LCPE (1999), il a été établi que la quantité totale de TDI importée au Canada en 2006 dépassait les 10 millions de kilogrammes (Canada, 2007a). Cette valeur représente le total des isomères de diisocyanate de toluène définis par les trois numéros CAS ci-dessus et elle inclut le TDI importé dans des mélanges comportant d’autres substances chimiques et dans des produits de consommation si la quantité de TDI importée était égale ou supérieure à 100 kg en 2006.
Le diisocyanate de toluène peut être libéré dans l’environnement par des procédés industriels qui utilisent le TDI comme réactif intermédiaire, notamment pour la fabrication de la mousse de polyuréthane souple. Les rejets des activités industrielles sont surtout sous forme d’émissions atmosphériques. Une autre source possible d’émission de TDI dans l’environnement est l’incinération de polyuréthane résiduaire. Comme le TDI est une substance chimique réactive, on ne croit pas que le transport à grande distance de cette substance contribue notablement à l’exposition humaine au Canada.
Le diisocyanate de toluène est présent dans certains produits de consommation, qui peuvent libérer du TDI à l’usage. Ce sont, par exemple, des produits spécialisés à base de polyuréthane comme des peintures, des vernis, des revêtements, ou encore des adhésifs, des matériaux d’étanchéité et des mastics (CIRC, 1986; NTP, 2005). On signale la possibilité de rejets de mélanges d’isocyanates contenant notamment du TDI si des peintures à base d’isocyanate, qui sont utilisées à grande échelle comme couche de peinture primaire appliquée en usine sur les véhicules automobiles, sont chauffées pendant le meulage ou le ponçage des surfaces (Karlsson et al., 2000). On note des sources possibles de TDI dans les aliments à cause de l’utilisation de polyuréthanes dans les encres et les adhésifs appliqués à leurs emballages, ainsi que de l’emploi d’élastomères à base de polyuréthane dans des appareils de manutention des aliments comme les convoyeurs. Dans les cas où il n’y a pas de barrières fonctionnelles entre les encres ou les adhésifs et les aliments, Santé Canada utilise le jugement professionnel pour estimer les teneurs résiduelles en isomères du TDI et la migration possible de ceux-ci dans les aliments (selon un courriel de la Direction générale des aliments, Santé Canada, mai 2008, sans référence). Des garnitures de mousse de polyuréthane pouvant comporter du TDI ont été approuvées au Canada pour des utilisations restreintes où elles sont en contact avec des aliments (Damant et al., 1995; Ellendt et al., 2003; ACIA, 2007).
Dans l’industrie de la construction, l’utilisation de certains produits comme les matériaux d’étanchéité, les revêtements et les adhésifs, qui contiennent des quantités mesurables d’isocyanate libre, est réservée à des entrepreneurs qualifiés. On ignore cependant dans quelle mesure des personnes non qualifiées peuvent avoir accès à ces produits.
Les plus importantes utilisations industrielles du TDI sont celles des mélanges d'isomères 2,4- et 2,6- du diisocyanate de toluène. On utilise l'isomère 2,4- pur pour certains élastomères spéciaux. L'isomère 2,6- pur n'est pas un produit chimique industriel commercial (Allport et al., 2003).
Les profils des utilisations du TDI déclarées au Canada en 2006 sont présentés dans les tableaux 3 et 4.
Au Canada, environ 86 % du diisocyanate de toluène était utilisé pour la fabrication de mousse de polyuréthane souple (PUF) en 2006. En présence d’un surfactant, d’un catalyseur ou d’un agent gonflant ou grâce à d’autres processus chimiques, le TDI réagit avec un polyol de manière à former de la PUF. Sous sa forme souple, la PUF est utilisée à grande échelle pour le rembourrage dans l’industrie des meubles de maison et dans l’industrie automobile, ainsi que pour la fabrication de matelas, d’oreillers, d’emballages et de sous-tapis. Au Canada, l’utilisation du TDI qui lie les déchets de mousse pour fabriquer des sous-tapis consomme environ 1 % de tout le TDI (IAL Consultants, 2007). Dans d’autres pays, cette utilisation est remplacée par celle du diisocyanate de méthylènediphényle ou MDI (réunion avec le Groupe d’experts sur les isocyanates, American Chemistry Council – ACC, Ottawa, 2007-08-08). Les PUF semi-souples et semi-rigides sont utilisées pour la fabrication de panneaux, de capitonnage et de pare-chocs dans l’industrie automobile. Pour ce qui est de la production de PUF rigide destinée à l’isolation dans des applications comme la réfrigération et le calfeutrage par la pose de mousse, le TDI a été remplacé en grande partie par le MDI (réunion avec le Groupe d’experts sur les isocyanates, ACC, Ottawa, 2007 08 08).
En 2006, la demande en TDI du marché pour les revêtements et les adhésifs correspondait à environ 7 et 5 % de la demande totale, respectivement. Le TDI ou ses dérivés entrent dans la composition des peintures alkydes et des revêtements modifiés par le polyuréthane, utilisés notamment pour la fabrication de peintures automobiles et marines, de vernis pour bois, d’apprêt pour les planchers et de revêtements pour fils et poudres. Le TDI ou ses dérivés sont aussi utilisés pour la fabrication de matériaux d’étanchéité, d’adhésifs et d’élastomères. De plus, on peut employer des élastomères moulés de type poly(uréthane et urée) à base de TDI pour fabriquer des roues, des rouleaux, des convoyeurs et d’autres produits semblables. On utilise le TDI pour la production de revêtements de textiles afin de les rendre imperméables et durables, ainsi que pour d’autres applications textiles (Ulrich, 1996; CIRC, 1986; NTP, 2005). On utilise en outre des revêtements à base de TDI pour la production de papier (Canada, 2007a). Dans d’autres pays, on a déclaré des applications biomédicales pour plusieurs polyuréthanes à base de TDI. Au Canada, aucun produits constitués de polyuréthane à base de TDI n’ont obtenu de permis pour applications biomédicales. Deux utilisation historiques du TDI sont l’éponge contraceptive Today et les implants mammaires Même, qui étaient faits d’un noyau de silicone entouré d’une enveloppe de polyuréthane à base de TDI (Benoit, 1993).
| Type de produit | TDI (millions de kg) |
|---|---|
| Tiré de 2006 End-Use Market Survey on the Polyurethane Industry in the United States, Canada and Mexico, octobre 2007, par IAL Consultants pour le Center for the Polyurethanes Industry | |
| Blocs de mousse souple | 19,64 |
| Mousse souple moulée | 9,25 |
| Revêtements | 2,31 |
| Liants | 0,36 |
| élastomères | 0,45 |
| Adhésifs | 1,59 |
| Total | 33,6 |
| Utilisation finale | TDI (millions de kg) |
|---|---|
| Tiré de 2006 End-Use Market Survey on the Polyurethane Industry in the Unites States, Canada and Mexico, octobre 2007, par IAL Consultants pour le Center for the Polyurethane Industry | |
| Construction | 2,90 |
| Transport | 12,11 |
| Meubles | 9,53 |
| Déchets de mousse | 2,45 |
| Appareils électriques | 0,14 |
| Emballages | 0,41 |
| Matelas | 2,04 |
| Textiles et fibres | 0,36 |
| Utilisations industrielles | 0,32 |
| Fonderies | - |
| Industries marines | 0,09 |
| Machinerie | 0,18 |
| Composés électroniques | - |
| Roues et pneus | - |
| Chaussures | - |
| Arts décoratifs | - |
| Autres | 3,13 |
| Total | 33,6 |
Selon les déclarations faites en application de l’article 71 de la LCPE (1999), en 2006, on a importé au Canada plus de 10 millions de kilogrammes d’isomères de diisocyanate de toluène (Canada, 2007a). À cause des exigences relatives au caractère confidentiel des déclarations, on ne dispose pas de précisions supplémentaires sur les quantités de TDI correspondant à chacun des numéros CAS ci-dessus.
Au Canada, les installations industrielles qui fabriquent, traitent ou utilisent de toute autre façon plus de 10 tonnes de TDI par année, soit sous forme de mélanges d’isomères ou d’isomères définis, doivent déclarer à l’Inventaire national des rejets de polluants (INRP) l’ensemble de leurs rejets dans l’environnement et des autres transferts de cette substance. On présente au tableau 5 le sommaire des rejets de TDI des installations industrielles du Canada pour 2002 à 2006, selon l’INRP. On n’a déclaré aucun rejet dans les eaux de surface ou sur les terres pour cette période, mais on a fait état des transferts dans des installations d’élimination des déchets (INRP, 2008).
| Année | 2,4- TDI 584-84-9 |
2,6- TDI 91-08-7 |
Mélanges d'isomères du TDI 26471-62-5 |
Rejets totaux d'isomères du TDI |
|---|---|---|---|---|
| Tonnes | ||||
| 2006 | 0,005 | 0,0 | 2,022 | 2,027 |
| 2005 | 0,002 | 0,0 | 1,479 | 1,481 |
| 2004 | 0,003 | 0,0 | 1,096 | 1,099 |
| 2003 | 0,011 | 0,001 | 1,586 | 1,598 |
| 2002 | 0,106 | 0,001 | 1,232 | 1,339 |
Persistance
On a démontré que la dégradation photolytique indirecte due aux radicaux hydroxyles produits par la lumière dans l’air était une voie de dégradation significative pour le TDI (Pemberton et Tury, 2004). Bien que le TDI réagisse rapidement avec l’eau, Tury et al. (2003) ont observé que sa réaction (hydrolyse) avec l’eau atmosphérique n’était pas significative. Ils ont indiqué que la demi-vie du TDI était de 1,4 jour selon les vitesses de réaction expérimentales, laquelle se compare assez bien avec les valeurs prévues et calculées de 1,7 et de 1,5 jour (voir le tableau 6). On ne croit pas que le TDI réagisse avec d’autres espèces photo-oxydantes dans l’atmosphère, par exemple avec l’ozone (Tury et al., 2003). Selon les résultats disponibles, le TDI n’est pas jugé persistant dans l’air.
| Milieu | Processus du devenir | Valeur ou plage de dégradation | Paramètre de dégradation | Référence |
|---|---|---|---|---|
| [*] Pour une concentration de radicaux hydroxyles de 1,5 × 106radicaux OH/cm3(jour de 12 h). | ||||
| Air | Oxydation atm. par des radicaux OH[*] | 1,7 | demi-vie (jours) | AOPWIN, v. 1.91 (2000) |
| Air | Oxydation atm. par des radicaux OH | 1,5 | demi-vie (jours) | Atkinson (1989), valeur calculée |
| Air | Réaction avec l'ozone | négligeable | demi-vie (jours) | AOPWIN, v. 1.91 (2000) |
| Eau, sol et sédiments | Hydrolyse | moins de 10 min | demi-vie (jours) | HYDROWIN, v. 1.67 (2000) |
| Eau, sol et sédiments | Biodégradation | 15 - 60 | demi-vie (jours) | BIOWIN, v. 4.02 (2000) |
| Eau, sol et sédiments | Biodégradation | 0,002 - 0,2186 | probabilité de biodégradation rapide | BIOWIN v. 4.02 (2000); TOPKAT Aerobic Biodegradability (v.6.2, 2004) |
| Eau, sol et sédiments | Biodégradation (DBO) | plus de 15 | demi-vie (jours) | ASTER, 1999 |
Le modèle de transport et persistance de niveau III (TaPL3) (TaPL3, 2000) n’est pas considéré approprié pour l’estimation de la distance de transport caractéristique (DTC) pour le TDI puisque le domaine d’application du modèle ne couvre pas les substances qui réagissent dans l’eau ou le sol. La DTC est définie comme la distance minimale parcourue dans l’air par 63 % de la substance ou comme la distance que 37 % de celle-ci peut parcourir au-delà de cette distance. Néanmoins, on prévoit des DTC inférieures à 700 km pour les trois substances de TDI, en se basant sur deux facteurs. Le premier facteur est qu’un grand nombre de substances qui ne réagissent pas avec l’eau et le sol qui sont modélisées avec TaPL3 ont des DTC inférieures à 700 km si leur demi-vie dans l’atmosphère est de moins de deux jours (1,4 jour rapporté par Tury et al., 2003; 1,5 jours calculé selon Atkinson, 1989 et 1,7 jour prédit par AOPWIN, 2000). Le second facteur est que lorsqu’une substance comme le TDI se transforme en d’autres formes dans l’eau et le sol, la chance pour que la substance entre de nouveau dans l’atmosphère à partir de l’eau ou du sol est réduite et ceci se traduit par un potentiel de transport à grande distance réduit. En se fondant sur les critères proposés par Beyer et al. (2000), une DTC supérieure à 2000 km représente un potentiel de transport atmosphérique à grande distance (PTAGD) élevé, une DTC de 700 à 2000 km un PTAGD modéré et une DTC inférieure à 700 km un faible PTAGD. Le potentiel de transport sur longue distance pour le TDI est jugé faible (<700 km). Ceci indique qu’il n’est pas attendu que le TDI soit capable d’atteindre des aires loin de sa source d’émission.
Dans les milieux où de l'eau est présente (p. ex. les étendues d'eau, les sols humides, les sédiments), on estime que le TDI est un composé transitoire, avec une demi-vie inférieure à une minute (Yakabe et al., 1999). La réaction d'une amine avec un isocyanate est plus rapide que l'hydrolyse de l'eau en présence d'un isocyanate qui, dans le cas des diisocyanates semblables au TDI, produit surtout des polyurées (Yakabe et al., 1999; Pemberton et Tury, 2004).
Dans de nombreuses études, on a bien documenté l'hydrolyse des diisocyanates aromatiques et leur réaction rapide dans l'eau et le sol (Pemberton et Tury, 2004; Heimbach et al., 1996; Yakabe et al., 1999; Tury et al., 2003).
Si l’on applique la méthode du poids de la preuve aux données ci-dessus, le TDI ne répond aux critères de la persistance ni pour l’air (demi-vie supérieure ou égale à 2 jours), ni pour l’eau ou le sol (demi-vie supérieure ou égale à 182 jours), ni pour les sédiments (demi-vie supérieure ou égale à 365 jours), qui sont énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Bioaccumulation
Les données modélisées semblent indiquer que le TDI a un potentiel nul de bioaccumulation dans l'environnement (voir le tableau 7). étant donné le caractère fortement réactif des diisocyanates, les composés du TDI sont vraisemblablement métabolisés ou dégradés à des vitesses suffisamment élevées pour annuler tout potentiel de bioaccumulation ou de bioamplification. De plus, ils sont vraisemblablement hydrolysés dans les voies gastro-intestinales, ce qui réduit leur potentiel d'absorption dans les viscères (Yakabe et al., 1999; Pemberton et Tury, 2004; PISSC, 1987; PISSC, 1997).
| Organisme d'essai | Paramètre | Valeur en poids humide (L/kg) | Référence |
|---|---|---|---|
| Poisson | FBA | 380 | Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | FBC | 151-1 183 | Gobas BCF T2LTL (Arnot et Gobas, 2003); OASIS, v.1.20 (2005); BCFWIN, v.2.15 (2000) |
Les données expérimentales du facteur de bioconcentration (FBC) du 2,4-toluènediamine (un produit d’hydrolyse), qui vont de moins 5 à moins 50 (MITI, 1992), semblent indiquer que ce produit ne devrait pas non plus s’accumuler dans les organismes.
Selon la méthode du poids de la preuve, le TDI ne répond pas au critère de la bioaccumulation (FBC ou FBA [facteur de bioaccumulation] supérieur ou égal à 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
On prévoit que les rejets industriels de TDI se feront surtout dans l'air, dont la demi-vie devrait être inférieure à 2 jours à cause de sa dégradation photolytique (voir ci-dessus). À cause de son hydrolyse rapide, la durée du TDI est éphémère dans l'eau, les sols humides et les sédiments. Pour cette raison, on estime qu'il n'est pas utile de modéliser son devenir dans l'environnement afin d'estimer sa répartition dans les milieux naturels.
Comme il est indiqué précédemment, le TDI ne remplit pas les critères de persistance ou du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
À cause de l’existence transitoire du TDI dans le milieu aqueux, en incluant les sols humides, il est improbable que les effets sur l’environnement soient déclenchés par les composés d’origine du TDI. Des données écotoxicologiques expérimentales pour le TDI et ses produits de dégradation (CL50 et CE50 pour les daphnies, crevettes et algues > 1 mg/L; Tadokoro et al. 1997; Curtis et al. 1978; Agence de protection de l’environnement du Danemark, 1998; MITI, 1992) indiquent des toxicités faibles à modérées pour les organismes aquatiques. D’autres données de toxicité suggèrent une faible probabilité d’effets pour les biotes terrestres, comme les plantes, les vers de terre (CSEO, CE50 et CL50 >1000 mg/L; Van der Hoeven et al.,1992a,b) et les oiseaux (CL50 de ≥100 mg/kg de masse corporelle pour Agelaius phoenicens exposé au 2,4-TDI et au 2,6-TDI; tel que cité dans IUCLID 2000).
L’INRP a indiqué que 2 200 kg du mélange d’isomères étaient rejetés (92 % dans l’air et 8 % dans un milieu non spécifié) en 2006 (INRP, 2008). étant donné la nature dispersive de ces rejets, il est peu probable qu’ils résultent en une exposition significative pour les organismes dans l’environnement.
En se fondant sur les renseignements disponibles, il est peu probable que le TDI cause des dangers écologiques au Canada.
évaluation de l'exposition
Milieux naturels et régime alimentaire
On n’a pas trouvé de concentrations mesurées de diisocyanate de toluène pour les milieux naturels ni pour les sources alimentaires du Canada. Des rapports faisant état de concentrations de TDI dans l’air extérieur, près d’une usine de fabrication de la Caroline du Nord (états-Unis) fermée par la suite (Levine et al., 2001), n’ont pas été jugés représentatifs des valeurs d’exposition du Canada.
Plutôt que d’estimer la répartition du TDI dans les milieux naturels par modélisation, on a évalué sa concentration maximale dans l’air en amont d’une usine de fabrication du Canada. L’International Isocyanate Institute a estimé que, dans l’industrie européenne, 25 grammes de TDI sont rejetés dans l’atmosphère par tonne de TDI utilisée pour la production de mousse de polyuréthane souple (Chapman, 1994). La modélisation de sa concentration dans l’air ambiant à 100 mètres d’un bâtiment peu élevé sans cheminée à l’aide d’un modèle EUSES (European Union System for the Evaluation of Substances) prévoyait une concentration annuelle dans l’air de 6,7 × 10-3 µg/m3 pour une usine à rejet continu de TDI de 8,8 kg/an (Tury et al., 2003). Une usine canadienne a déclaré un rejet de 1 400 kg de mélanges d’isomères du TDI dans l’air pour 2006 (INRP, 2008. En extrapolant le résultat de Tury et al., la concentration moyenne annuelle estimée de TDI dans l’air à 100 mètres de l’usine est de 1,06 µg/m3. On s’attend à ce que les concentrations à court terme dans l’air varient par rapport à cette moyenne à cause des cycles de production, de la hauteur de la cheminée de l’usine, du vent, de la topographie locale et d’autres facteurs. En outre, cette concentration de TDI dans l’air est une estimation prudente qui ne s’applique qu’à la population du voisinage de l’usine. Les rejets industriels de TDI au Canada se font surtout dans l’air et on s’attend à ce que la plus grande partie du TDI qui y est rejeté y demeure à l’état de vapeur et réagisse principalement avec des radicaux hydroxyles produits par photolyse, ce qui se traduit par une demi-vie inférieure à deux jours (Tury et al., 2003; Atkinson, 1989).
Les limites supérieures estimées de l’exposition au TDI dans les milieux naturels étaient comprises entre 0,21 µg/kg-p. c. (kilogramme de poids corporel) par jour pour les personnes âgées de 60 ans et plus et 0,64 µg/kg-p. c. par jour pour les enfants âgés de 6 mois à 4 ans (voir l’annexe 1).
Produits de consommation
L’utilisation de produits de consommation peut contribuer à l’exposition de personnes au TDI. À l’aide d’un bloc à indicateur de couleur enduit de solvant, on a décelé la présence d’isocyanate libre sur la surface de mousse de polyuréthane durcie vieillie de 1 à 30 ans, mais cet essai n’était pas propre au TDI. . Les échantillons de PUF étaient déchiquetés et soumis à une extraction par solvant, et l’extrait était analysé. On a dosé le TDI et tous les groupes isocyanate du réactif dans les extraits (Krone et al., 2003). Au cours d’un autre essai, les isomères 2,4- et 2,6- du TDI ont été extraits par solvant de la mousse de polyuréthane, identifiés positivement et dosés avec une précision de l’ordre du nanogramme par gramme de mousse (Gagné et al., 2003). Les amines 2,4- et 2,6-toluènediamine, qui peuvent être présentes à cause de l’hydrolyse des isomères 2,4- et 2,6-diisocyanate de toluène, ont aussi été extraites de la mousse de polyuréthane (Marand et al., 2004). Ces expériences indiquent que le TDI et les amines qui en dérivent peuvent migrer de la mousse de produits de consommation et devenir ainsi disponibles pour l’absorption cutanée ou orale.
Il est impossible de quantifier la mesure dans laquelle l’utilisation de solvants peut contribuer à améliorer l’extraction du TDI de la PUF.
Selon un essai au cours duquel de l’air humidifié était aspiré à travers des pièces de mousse chargées de 1 ppm de TDI et laissées au repos pendant 3 jours, 99,9% du TDI était retenu dans la mousse (Hugo et al., 2000).
D’autres résultats expérimentaux indiquent que le TDI dans la mousse de polyuréthane ne se volatilise pas en quantités mesurables après une période initiale de durcissement de plusieurs jours (Kelly et al., 1999; Katsuyama et al., 2003). Kelly et al. (1999) ont examiné un certain nombre de produits de consommation à base de polyuréthane qui sont fabriqués avec le TDI, notamment les sous-tapis, le capitonnage des meubles, les feuilles de mousse, les vernis et les matériaux d’étanchéité, et ils n’ont mis en évidence aucune émission détectable d’isocyanate à un taux d’émission supérieur à 0,96 µg/m2/h pour des revêtements appliqués sur des surfaces ou pour la mousse de polyuréthane. De plus, Kelly et al. (1999) ont estimé la concentration à l’équilibre dans l’air des maisons, fondée sur la limite de détection de la méthode expérimentale utilisée pour la présente étude, et ils ont conclu que la plus forte concentration à l’équilibre dans l’air des maisons ne devrait pas dépasser 0,19 µg/m3 pour l’application d’un revêtement de polyuréthane.
Selon une étude des produits de consommation effectuée par Katsuyama et al. (2003), on n’a mesuré aucune émission de TDI supérieure aux limites de détection alors que des adhésifs, des peintures et des vernis à base d’uréthane étaient soumis à l’essai; toutefois, on a noté la présence de TDI si de la mousse de polyuréthane rigide était placée dans une atmosphère contenant des vapeurs d’acétone. Les chercheurs ont estimé le taux de rejet de TDI et, d’après les valeurs moyennes de volume et de débit de ventilation des maisons japonaises, ils ont obtenu une concentration à l’équilibre de 2,4-TDI de 4,28 x 10-2 ppm (305 µg/m3) pour ces maisons. étant donné que les feuilles de mousse de polyuréthane rigide ne sont pas un matériau de construction largement utilisé en construction domiciliaire au Canada et que la concentration d’acétone dans l’air utilisée pour cette expérience ne représente pas des conditions domestiques normales, les valeurs d’exposition décrites par Katsuyama et al. (2003) n’ont pas été jugées pertinentes.
On a démontré expérimentalement que les peintures à base d’isocyanate pour les planchers de béton et les scellants pour terrasse émettent des concentrations mesurables de 2,6-TDI dans l’air après l’application du revêtement (Kelly et al., 1999; Jarand et al., 2002). Bien que les concentrations de TDI dans l’air mesurées durant ces expériences dans des petites enceintes à milieu contrôlé ne puissent être extrapolées pour les expositions domestiques, on peut utiliser les concentrations de TDI dans les revêtements et le pourcentage de TDI rejeté dans l’air pour modéliser l’exposition.
On a utilisé les données de Jarand et al. (2002) pour estimer la concentration maximale de 2,6-TDI dans une pièce pendant et après (cinq heures après) l’application d’un scellant à base de polyuréthane à deux composants sur un plancher de béton, et on a obtenu une concentration estimée de TDI dans l’air de 24 µg/m3. La dose reçue par un adulte effectuant un travail léger pendant une heure était estimée à 0,44 µg/kg-p. c. par jour. Selon un second scénario utilisant les données sur les émissions de 2,6-TDI d’un scellant pour béton, mesurées par Kelly et al. (1999), on a obtenu une valeur d’absorption quotidienne estimée très supérieure pour une période d’une heure. Toutefois, les auteurs ont déclaré que le produit soumis à l’essai par Kelly et al. (1999) n’était commercialisé que par des entrepreneurs agréés. étant donné les incertitudes concernant la disponibilité de ce scellant à base de TDI dans le commerce de détail au Canada, on n’a retenu que le scénario fondé sur les résultats obtenus par Jarand et al. (2002). Il a été établi que le produit soumis à l’essai par Jarand et al.(2002) était disponible chez les détaillants canadiens en 2008. L’exposition cutanée, qui pourrait être due à l’utilisation du scellant pour béton, n’a pas été évaluée dans le cadre de ces scénarios; elle pourrait constituer une voie supplémentaire d’exposition.
Il faut aussi noter que cette valeur de dose estimée est une dose d’exposition d’une heure et que la fréquence de l’application de ce scellant est relativement faible (probablement moins d’une fois tous les 3 à 5 ans).
Si on élabore un scénario pour l’exposition des nourrissons qui mettent dans leur bouche des objets comportant de la mousse de polyuréthane (p. ex. des parties d’oreillers), avec une valeur de 7,8 ng de TDI libéré par gramme de mousse (Gagné et al., 2003), on obtient une valeur d’absorption estimée de 0,1 ng/kg-p. c. par jour. Il s’agit d’une surestimation de l’exposition, car les conditions d’extraction dans la bouche sont beaucoup plus douces que celles supposées par Gagné et al. (2003). Il faut aussi noter que cette valeur d’exposition estimée ne tient pas compte de la réactivité du TDI avec la salive. On croit que la quantité disponible de TDI pour l’ingestion est plus petite que la valeur de 0,1 ng/kg-p. c. par jour estimée pour ce scénario. L'absorption estimée de 0,1 ng/kg-p. c. par jour du scénario de mousse dans la bouche correspond à moins de 1 % de l’absorption estimée à partir de l’air ambiant et intérieur pour le groupe d’âge de 6 mois à 4 ans; on la juge donc négligeable.
On décrit les scénarios d'exposition dans l'annexe 2.
On estime que le niveau de confiance à l’égard de la base de données sur l’exposition est très faible. On n’a pas trouvé de données sur les concentrations de diisocyanate de toluène utilisées pour estimer l’exposition humaine dans aucun des milieux naturels. De même, le niveau de confiance relatif aux valeurs d’exposition estimées pour l’utilisation de produits de consommation est faible à cause de l’incertitude concernant l’accès des consommateurs à des revêtements de surface à base d’uréthane contenant du TDI.
évaluation des effets sur la santé
L'annexe 3 présente un sommaire des renseignements disponibles concernant les effets sur la santé du diisocyanate de toluène. La plus grande partie de ces données pour le TDI portent sur les mélanges d'isomères.
Le Centre international de recherche sur le cancer (CIRC) a classé le diisocyanate de toluène dans la catégorie des « cancérogènes possibles pour l’homme » (Groupe 2B pour la cancérogénicité), selon des résultats d’études de cancérogénicité des diisocyanates de toluène non concluants pour les humains, mais concluants pour des animaux de laboratoire (CIRC, 1986; CIRC, 1999). Le TDI a aussi été classé par la Commission européenne (CE) dans la catégorie 3 pour la cancérogénicité (« substances préoccupantes pour l’homme en raison d’effets cancérogènes possibles ») [Commission européenne, 1997, 2004; ESIS, v.4.50, 2006]; selon le National Toxicology Program (NTP) des états-Unis, il s’agit d’une substance dont on peut raisonnablement prévoir qu’elle est cancérogène pour les humains (NTP, 2005). Ces classements étaient fondés sur des accroissements notables de l’incidence des tumeurs dans de nombreux organes chez des souris et des rats exposés par gavage oral pendant deux ans. Les souris femelles exposées par voie orale à 60 ou à 120 mg TDI/kg-p. c./j présentaient un taux notablement supérieur d’adénomes hépatocellulaires et d’hémangiomes combinés (rate et tumeurs sous-cutanées), ainsi que d’hémangiosarcomes (foie, ovaires, péritoine) [NTP, 1983]. Des rates exposées par voie orale à 60 ou à 120 mg TDI/kg-p. c./j présentaient des taux notablement supérieurs de fibroadénomes des glandes mammaires et d’adénomes des cellules des îlots pancréatiques; chez des rats mâles exposés à 30 ou à 60 mg TDI/kg-p. c./j, on observait un accroissement des fibromes et des fibrosarcomes sous-cutanés (significatifs si on les combine), ainsi que des adénomes des cellules acinaires pancréatiques (significatifs à la dose la plus élevée) [NTP, 1983]. Pour chacune de ces études, on observait un accroissement des tumeurs à la plus faible concentration d’exposition soumise à l’essai. Les souris mâles exposées à une dose pouvant atteindre 240 mg TDI/kg-p. c./j n’ont pas développé de tumeurs liées à l’exposition (NTP, 1983).
On n’a pas observé de tumeurs liées à l’exposition chez les souris et les rats exposés à 0,36 et à 1,07 mg TDI /m3 par inhalation pendant 2 ans (Loeser, 1983). Le Programme international sur la sécurité des substances chimiques (PISSC, 1987) a noté qu’on n’a probablement pas administré aux animaux de cette étude la dose maximale tolérée; il se peut donc que la dose la plus élevée ait été insuffisante pour détecter une réponse. Toutefois, ce résultat était fondé sur des changements de poids corporel, et non sur d’autres effets. On a également noté un taux de mortalité élevé inexpliqué chez des animaux du groupe témoin et des groupes traités, ce qui réduisait la sensibilité de l’essai biologique. Bien que Loeser (1983) signale une augmentation significative de la mortalité des souris femelles aux deux doses, l’Environmental Protection Agency des états-Unis (US EPA, 1995) a conclu qu’on n’avait pas observé d’effets liés à l’exposition sur la mortalité, le poids des organes ou d’autres paramètres chimiques cliniques chez les rats ou les souris. Owen (1984) présente des résultats histopathologiques obtenus pour les voies nasales des rats de cette étude. La concentration minimale avec effet nocif observé (CMENO) était de 0,36 mg/m3 chez les rats, d’après une augmentation liée à la dose dans l’incidence et la gravité de la rhinite chronique et nécrotique chez les rates. On a également signalé des effets semblables chez les souris, mais le degré de précision était insuffisant pour l’établissement des concentrations efficaces.
Le CIRC (1999) a conclu que, chez les humains, il n’y avait aucune association marquée ou profil cohérent montrant la cancérogénicité de l’exposition au TDI par inhalation, selon trois études de cohortes industrielles et une étude cas-témoin de la population (Hagmar et al., 1993a et 1993b; Sorahan et Pope, 1993; Schnorr et al.,1996). Ces études peuvent être de valeur limitée à cause de la petite taille des échantillons, des périodes de suivi relativement courtes, de la jeunesse des cohortes et de la non-prise en compte de l’usage du tabac (Bolognesi et al., 2001). L’examen de Bolognesiet al. (2001) a conclu que les données expérimentales et les éléments probants disponibles concernant les humains sont inadéquats pour l’évaluation du risque de cancérogénicité du TDI pour ces derniers.
Bien que des études épidémiologiques plus récentes soient disponibles (Kerr et al., 2000; Mikoczy et al., 2004; Sorahan et Nichols, 2002; Clark et al., 2003), aucune évaluation internationale n’est disponible pour ces données mises à jour et des analyses complètes du poids de la preuve de l’ensemble des données épidémiologiques ne sont pas possibles dans le cadre de la présente évaluation préalable.
En se fondant sur l’étude de la cancérogénicité par voie orale chez des rats mâles qui est résumée ci-dessus (NTP, 1983 et 1986), l’EPA de la Californie a calculé, pour le TDI, un facteur d’estimation de risque du cancer par projection linéaire par voie orale et un facteur unitaire connexe de risque de cancer pour l’exposition par inhalation à l’aide de la méthode de l’extrapolation des voies comparées et de la méthode « Expedited Proposition 65 » de l’EPA de la Californie (California EPA, 1999).
On a obtenu des résultats contrastés pour le TDI d’après les épreuves de génotoxicité in vivo et in vitro (annexe 3). Selon des essais in vivo, le TDI provoquait des mutations liées au sexe chez les drosophiles (exposition par voie orale), mais non l’apparition de micronoyaux chez les souris ou d’érythrocytes chez les rats (exposition par inhalation). Selon une étude sur l’exposition humaine, les travailleurs exposés à un mélange d’isomères du TDI dans l’air présentaient une augmentation statistiquement significative d’aberrations structurelles des chromosomes, des échanges de chromatides soeurs et des micronoyaux dans les lymphocytes sanguins périphériques, par rapport aux témoins (Bilban, 2004). Toutefois, des échantillons de petite taille ayant servi à cette étude, les sujets peuvent avoir été soumis par exposition professionnelle à de nombreuses substances chimiques en plus du TDI; en outre, l’usage du tabac n’a pas été pris en compte. Des études faites avec des tailles d’échantillon plus petites ont donné des résultats négatifs pour les ruptures de brins d’ADN dans les lymphocytes des travailleurs (Marczynskiet al., 2003 et 2005). Certaines études in vitrodes mutations induites par le TDI font état de dommages de l’ADN, d’aberrations chromosomiques et d’échanges de chromatides sœurs, alors que d’autres n’en signalent pas. Bolognesi et al. (2001) ont indiqué que la stabilité du diisocyanate appliqué n’a pas été étudiée dans le cadre des études in vitro, et que les espèces réactives pourraient ne pas être les mêmes que celles des études in vivo. Toutefois, les auteurs ont conclu que le TDI était « probablement génotoxique » à cause de ses réactions possibles avec l’ADN.
Les principaux organes cibles pour les effets non néoplasiques de l’exposition au TDI par inhalation, par voie cutanée et par voie orale étaient les poumons et les voies respiratoires. L’exposition au TDI par inhalation et par voie cutanée entraîne une hypersensibilité respiratoire. Un examen de l’exposition cutanée aux isocyanates a permis d’établir que de nombreux éléments de preuve d’études sur les animaux et sur les humains, ainsi que d’études de biomarquage, indiquent que dans certains milieux d’exposition, la peau humaine est vraisemblablement une importante voie d’exposition à l’isocyanate, qui peut contribuer au développement de cas d’asthme causés par l’isocyanate (Bello et al., 2007). L’Union européenne (Commission européenne, 1997 et 2004; ESIS, 2006) a classé le TDI pour la sensibilisation par contact cutané et par inhalation (« substance qui peut causer la sensibilisation par inhalation ou par contact cutané »). Les concentrations et les conditions d’exposition exactes qui causent la sensibilisation n’ont pas été déterminées. Toutefois, chez des animaux de laboratoire, on a observé que des expositions simples à des concentrations aussi faibles que 0,3 mg/m3 induisaient une hypersensibilité respiratoire chez des cobayes déjà sensibilisés (Karol et al., 1981); dans le cas des humains, des expositions simples à 1 ppm 109 (0,007 mg/m3) induisaient une réponse asthmatique chez des personnes déjà sensibilisées (Lemièreet al., 2002; Ott et al., 2003). Cela a été observé chez des humains qui avaient déjà été exposés au TDI dans leur milieu de travail, alors que chez des humains souffrant d’asthme pour d’autres causes que leur milieu de travail, on a observé une sensibilisation au TDI au cours d’essais contrôlés à des concentrations aussi faibles que 10 ppb (0,07 mg/m³) (Ottet al., 2003). Ainsi, selon les données obtenues pour les humains et les données expérimentales sur les animaux, on estime, aux fins de la présente étude, que les concentrations comprises entre 0,007 et 0,07 mg/m³ sont des valeurs critiques pour l’exposition aiguë.
Il faut noter qu’on a signalé des cas d’asthme professionnel dus à une exposition excessive aux diisocyanates dans des usines de production de polyuréthane (Cragg, 2001). Aussi, des éléments de preuve indiquent que les symptômes de l’asthme peuvent persister chez la moitié des personnes souffrant d’asthme dû au TDI qui ont évité de s’exposer à cette substance en milieu de travail pendant plus de deux ans et qui ont pris des médicaments antiasthmatiques (Krone et Klingner, 2005).
La concentration minimale avec effet observé (CMEO) pour une exposition par inhalation répétée au TDI était de 1,9 ppm [concentration équivalente pour les humains de 0,014 mg/m3 calculée par l’US EPA (1995)], sur la base d’une diminution notable de la fonction pulmonaire chez les humains selon une étude prospective de cinq ans dans le secteur professionnel (Diem et al., 1982), qui est l’étude critique utilisée par l’EPA (1995) afin de déterminer la concentration de référence pour l’inhalation chronique (RfC). Dans cette évaluation, la valeur de 0,014 mg/m3 est considérée comme une dose à effet critique pour l’exposition chronique. L’EPA a examiné plusieurs autres études épidémiologiques à long terme, mais l’étude de Diem et al. (1982) a été sélectionnée car c’est la seule à partir de laquelle on pouvait établir une concentration sans effet observé (CSEO), soit 0,006 mg/m3, et une CMEO. L’EPA a noté des difficultés et des incertitudes associées à l’évaluation quantitative de l’exposition au TDI dans les études épidémiologiques. On a aussi observé des effets sur le système respiratoire chez des animaux de laboratoire exposés par inhalation à des concentrations de TDI de 5 à 26 fois supérieures à 0,014 mg/m3 (CMENO de 0,36 mg/m3 pour l’étude de toxicité chronique chez les rats; CMEO de 0,07 mg/m3 pour l’étude de 5 jours avec les cobayes).
La dose minimale avec effet observé (DMEO) pour l’exposition par voie orale au TDI était de 30 mg/kg-p. c./j, sur la base de cas de bronchopneumonie, de diminution du gain de poids corporel et de mortalité chez des rats exposés par gavage pendant deux ans (NTP, 1986). On a aussi observé des changements microscopiques dans les poumons et la trachée à cette dose d’exposition au cours d’une étude de 28 jours sur des rats (ministère de la Santé, du Travail et du Bien-être (MHLW) du Japon, 2005).
Le niveau de confiance à l’égard de la base de données sur la toxicité est moyen à cause de la disponibilité limitée des données sur la toxicité aiguë, la toxicité des doses répétées, la cancérogénicité, la génotoxicité, ainsi que sur la toxicité pour la reproduction et le développement.
Bien qu’une analyse exhaustive du mode d’action du TDI dépasse le cadre de cette évaluation préalable, on reconnaît que la voie d’exposition au TDI peut avoir une influence sur la tumorigenèse. Dans les cas d’une exposition par voie orale, le TDI hydrolysé dans l’estomac est converti en toluènediamine (TDA). Dans les cas d’une exposition par inhalation, le TDI est absorbé dans les voies respiratoires supérieures, ce qui entraîne la formation de conjugats labiles en milieu acide, ainsi que la formation d’un peu de diamine. La formation différentielle de TDA par ces deux voies d’exposition peut jouer un rôle dans le mécanisme selon lequel le TDI a une action cancérogène chez les souris et les rats par voie orale, mais non si l’exposition se fait par inhalation (Doe et Hoffman, 1995; CIRC, 1999; Collins, 2002). Toutefois, on ne peut écarter la possibilité d’occurrence de néoplasmes dus à l’exposition par inhalation, étant donné qu’on ne sait pas avec certitude si les doses tolérables maximales ont été atteintes au cours des études de toxicité chronique par inhalation.
Caractérisation des risques pour la santé humaine
Selon les évaluations de plusieurs organismes internationaux (le CIRC, l’UE et le NTP des é.-U.), ainsi que selon une étude indépendante effectuée par un groupe d’experts de plusieurs pays (Bolognesi et al., 2001), parce que les données épidémiologiques disponibles pour les humains et les données expérimentales de toxicité par inhalation pour les animaux sont équivoques, elles sont inadéquates pour déterminer le risque de cancérogénicité de l’exposition au TDI par inhalation chez les humains. Selon une approche fondée sur le principe de prudence, on estime que le TDI est cancérogène, étant donné que le dosage oral de cette substance a été associé à l’apparition de tumeurs dans plusieurs organes chez des animaux. Des épreuvesin vivo et in vitro de génotoxicité du TDIont donné des résultats très variables. Par conséquent, bien que le mode d’induction des tumeurs n’ait pas été complètement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez les animaux de laboratoire résultent de l’interaction directe avec le matériel génétique. L’EPA de la Californie a utilisé une approche semblable dans son évaluation, étant donné qu’on a extrapolé les résultats des données de l’étude de cancérogénicité orale chez des rats pour calculer le facteur unitaire de risque de cancer pour l’inhalation de TDI (EPA de la Californie, 1999).
Pour les effets non cancérogènes, le TDI a été classé par l’Union européenne dans la catégorie des sensibilisants de la peau et des voies respiratoires. Pour ce qui est des effets non cancérogènes, en comparant la dose à effet critique pour les effets chroniques non néoplasiques par inhalation chez les humains (14 µg/m3) et la limite supérieure prudente estimée de l’exposition par inhalation pour le TDI (1,06 µg/m3), on obtient une marge d’exposition d’environ 13 dans le voisinage d’une usine utilisant du TDI.
Dans la présente évaluation, on estime que les valeurs comprises entre 0,007 et 0,07 mg/m³ correspondent à la concentration à effet critique pour l’exposition aiguë. Aussi, la CMEO la plus faible déterminée pour les effets non néoplasiques subchroniques à court terme est de 0,07 à 0,14 mg/m³, selon les effets sur le système respiratoire observés au cours d’une étude de 5 jours chez les cobayes, d’une étude de 6 mois chez les rats et d’une étude de 10 mois chez les chiens. On doit utiliser cette même gamme de 0,07 à 0,14 mg/m³ pour la population humaine. Il faut noter que ces concentrations sont de 2,5 à 150 fois inférieures aux concentrations utilisées au cours des études d’inhalation à long terme chez les rats et les souris (0,36 et 1,07 mg/m3).
En comparant la dose à effet critique par inhalation pour les effets aigus non néoplasiques chez les humains sensibilisés (7 à 70 µg/m3) et la limite supérieure prudente estimée de l’exposition par inhalation pour le TDI dans les produits de consommation (24 µg/m3), on obtient des marges d’exposition de < 1 à 2,9.
En comparant la dose à effet critique par inhalation pour les effets subchroniques non néoplasiques à court terme chez le grand public (de 70 à 140 µg/m3) et la limite supérieure prudente estimée de l’exposition par inhalation pour le TDI dans les produits de consommation (24 µg/m3), on obtient des marges d’exposition de 2,9 à 5,8.
Par conséquent, la marge d’exposition pour les effets non néoplasiques et l’exposition du grand public par inhalation, ainsi que pour les scénarios d’exposition par les produits de consommation (même s’il s’agit d’évaluations prudentes), n’est pas utile pour tenir compte des incertitudes inhérentes aux bases de données relatives à l’exposition et aux effets.
Incertitudes relatives à l'évaluation des risques pour la santé humaine
L'estimation de l'exposition humaine aux isomères du diisocyanate de toluène est très incertaine. Les données sur les concentrations de TDI dans les milieux naturels n'étaient pas représentatives de l'exposition quotidienne au Canada ou dans d'autres pays. La modélisation de la répartition environnementale du TDI au Canada n'a pas été évaluée à cause du fort degré de réactivité de cette substance dans l'eau, les sédiments et les sols humides, et les résultats des études de modélisation de la fugacité pourraient ne pas être significatifs. On a utilisé la modélisation de la concentration du TDI à 100 mètres d'une usine de mousse de polyuréthane afin d'obtenir une limite supérieure estimée de la concentration de TDI dans l'air ambiant et intérieur pour une sous-population exposée. Dans ces conditions, la concentration de TDI dans l'air intérieur pourrait être inférieure à celle dans l'air ambiant. Ces simplifications pourraient contribuer à surestimer l'exposition quotidienne.
Les valeurs estimées de l’exposition due à l’utilisation de produits de consommation sont incertaines, car la concentration de TDI dans une gamme de ces produits de consommation n’est pas connue avec certitude, mais on a établi qu’un revêtement de surface contenant jusqu’à 3 % de TDI était disponible pour les consommateurs canadiens.
Cette évaluation préalable ne prend pas en compte l’analyse complète des mécanismes d’action du TDI. Le mécanisme de tumorigenèse déclenché par le TDI après l’exposition est source d’incertitude. Pour ce qui est des effets signalés pour les humains déjà sensibilisés, ils pourraient survenir à un niveau d’exposition inférieur à celui des effets déclarés pour les humains non sensibilisés. Toutefois, dans le cas des études à court terme portant sur des animaux de laboratoire non sensibilisés, on note des effets à des valeurs d’exposition qui ne dépassent que d’un ordre de grandeur celles rapportées pour des humains sensibilisés.
Compte tenu de l’information disponible, on conclut que le TDI ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique et à mettre en danger l'environnement essentiel pour la vie.
Compte tenu de la cancérogénicité du TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène, pour lequel il pourrait exister une probabilité d’effets nocifs à tout niveau d’exposition, et de l’inadéquation possible des marges entre l’exposition estimée à partir des produits et du niveau critiques pour les effets non cancérogènes, il est conclu que le TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène sont des substances qui peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que le TDI ne remplit pas les critères énoncés aux alinéas 64a) et b) de la LCPE (1999), mais qu’il remplit ceux énoncés à l’alinéa 64c) de la Loi. De plus, cette substance remplit le critère de la persistance, mais ne satisfait pas au critère du potentiel de bioaccumulation énoncé dans le Règlement sur la persistance et la bioaccumulation.
[ACIA] Agence canadienne d’inspection des aliments. 2007. Liste de référence pour les pièces de matériaux de construction, les matériaux d’emballage et les produits chimiques non alimentaires acceptés. Consulté en juillet 2007.
Allport D. C., Gilbert D. S., Outterside S. M., éditeurs. 2003. MDI and TDI: Safety, health and the environment: a source book and practical guide. Chichester (GB).
Andersen M., Binderup M.-L., Kiel P., Larsen H., Maxild J. 1980. Mutagenic action of isocyanates used in the production of polyurethanes. Scand. J. Work Environ. Health 6:221-226.
Anderson D., Styles J. A. 1978. The bacterial mutation test. Six tests for carcinogenicity. Br J Cancer 37(6):924-930.
[AOPWIN] Atmospheric Oxidation Program for Windows. 2000. Version 1.91. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Arnot J. A., Gobas FAPC. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci 22(3):337-345.
[ASTER] Assessment Tools for the Evaluation of Risk. 1999. Model developed by the Office of Research and Development, National Health and Environmental Effects Research Laboratory. Mid-Continent Ecology Division, US Environmental Protection Agency, Duluth, Minnesota.
Atkinson, R. 1989. Kinetics and mechanisms of the gas-phase reactions of the hydroxyl radical with organic compounds. J. Phys. Chem. Ref. Data Monograph No 1.
Ban M., Morel G., Longonne I., Huguet N., Pepin E. et Binet S. 2006. TDI can induce respiratory allergy with Th2-dominated response in mice. Toxicology 218: 39-47.
[BCFWIN] BioConcentration Factor Program for Windows. 2000. Version 2.15. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Benoit, F. 2004. Degradation of polyurethane foams used in the Même breast implant. J Biomedical Materials Res 27:1341-1348.
Bello D., Herrick C. A., Smith T. H., Woskie S. R., Streichner R. P., Cullen M. R., Liu Y. L. et Redlich C. A. 2006. Skin exposure to isocyanates: Reasons for concern. Environmental Health Perspectives 115: 328-335.
Beyer A., Mackay D., Matthies M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ Sci Technol 34(4): 699-703.
Bilban M. 2004. Mutagenic testing of workers exposed to toluene-diisocyanates during plastics production process. Am J Ind Med 45(5):468-474.
[BIOWIN] Biodegradation Probability Program for Windows. 2000. Version 4.02. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Bolognesi C., Baur X., Marczynski B., Norppa H., Sepai O., Sabbioni G. 2001. Carcinogenic risk of toluene diisocyanate and 4,4'-methylenediphenyl diisocyanate: epidemiological and experimental evidence. Crit. Rev. Toxicol. 31: 737-772.
[CalEPA] California Environmental Protection Agency. 1999. Air Toxics Hot Spots Program Risk Assessment Guidelines: Partie II. Technical Support Document for Describing Available Cancer Potency Factors. Berkley (CA): Office of Environmental Health Hazard Assessment.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). Lois du Canada. Ottawa, Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie III, vol. 22, n° 3.
Canada. 2000. Règlement sur la persistance et la bioaccumulation. Ottawa, Travaux publics et Services gouvernementaux Canada.Gazette du Canada Partie II, vol. 134, n° 7.
[Canada] Ministère de l’Environnement; ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999): Avis d’intention d’élaborer et de mettre en oeuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Ottawa, Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie I, vol. 140, n° 49.
[Canada] Ministère de l'Environnement; ministère de la Santé. 2007a. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances de la Liste intérieure des substances (LIS). Ottawa, Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie I, vol. 141, n° 5.
[Canada] Ministère de l'Environnement; ministère de la Santé. 2007b. Profil de substances pour le Défi - Diisocyanates de toluène ; No CAS 91-08-7, Diisocyanate de 2-méthyl-m-phénylène (2,6-diisocyanate de toluène); No CAS 584-84-9, Diisocyanate de 4-méthyl-m-phénylène (2,4-diisocyanate de toluène); No CAS 26471-62-5, Diisocyanate dem-tolylidène (mélanges d'isomères de diisocyanates de toluène).
Chapman J. F. 1994. European Emissions Project, Phase 1(A) - Gas Emissions Study - A rationale. Manchester (GB): Gilbert International Isocyanates. Rapport No 11157 (cité dans Tury et al., 2003).
Clark R. L., Bugler J., Paddle G. M., Chamberlain J. D. et Allport D. C. 2003. A 17-year epidemiological study on changes in lung function in toluene diisocyanate foam workers. Int Arch Occup Environ Health 76: 295-301.
ChemCAN. 2003. ChemCAN: level III fugacity model of regional fate of chemicals. Version 6.00. Peterborough (ON): Canadian Environmental Modelling Centre, Université Trent.
[CIRC] Centre international de recherche sur le cancer. 1986. Monographs on the evaluation of carcinogenic risk to humans. Volume 39. Some Chemicals Used in Plastics and Elastomers. p. 287-32.
[CIRC] Centre international de recherche sur le cancer. 1999. Monographs on the evaluation of carcinogenic risk to humans. Volume 71 (Part 2). Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. p. 865-879.
Collins M. A. 2002. Toxicology of toluene diisocyanate. Appl Occup Envir Hyg 17: 846-855.
Commission européenne. 1997. Summary Record - Toluene di-isocyanates. Commission Working Group on the Classification and Labelling of Dangerous Substances. Réunion de l’ECB-Ispra, du 15 au 21 octobre 1997. Rapport n° ECBI/51/97 - rév. 3.
Commission européenne. 2004. 2-methyl-m-phenylene diisocyanate. 4-methyl-m-phenylene diisocyanate.m-tolylidene diisocyanate. Directive de la Commission 2004/73/EC du 29 avril 2004. Annexe 1A. Journal officiel des Communautés européennes 16.6.2004. L 216/49.
Cragg, S. T. 2001. Polyurethanes, miscellaneous organic polymers, and silicones. In Allan, RE et al, éditors & contributors. Patty's industrial hygiene and toxicology [livre accessible sur Internet]. John Wiley and Sons.
Curtis, M.W., Copeland, T.L. and C.H. Ward. 1978. Aquatic toxicity of substances proposed for spill prevention regulation. In: Proc. Natl. Conf. Control of Hazardous Material Spills, Miami Beach, FL: 99-103.
Damant A. P., Jickells S. M., Castle L. 1995. Liquid chromatographic determination of residual isocyanate monomers in plastics intended for food contact use. J. of AOAC Int. 78(3): 711-719.
Danish Environmental Protection Agency. 1998. Immobilization test of aniline compounds with the crustacean Daphnia magna. Project no. 303587, Agence de protection de l’environnement du Danemark, Copenhague, Danemark. [Cité dans ACC, 2005].
Descotes, J. 1988. Identification of contact allergens: the mouse ear sensitization assay. J. Toxico.l-Cut. Ocular. Toxicol. 7:263-272.
Diem J. E., Jones R. N., Hendrick D. J., Glindmeyer H. W., Dharmarajan V., Butcher B. T., Salvaggio JE, Weill H. 1982. Five-year longitudinal study of workers employed in a new toluene diisocyanate manufacturing plant. Am. Rev. Respir. Dis. 126(3):420-428.
Doe J. E., Hoffman H. D. 1995. Toluene diisocyanate: An assessment of carcinogenic risk following oral and inhalation exposure. Toxicol. Ind. Health 11:13-32.
Duff P. B. 1983. The fate of TDI in the environment. Proceedings of the Society of the Plastic Industry's 6th International Technical Conference, San Diego, California. New York (NY): Society of Plastics Industry. p. 408-412.
Ebino K., Ueda H., Kawakatsu H., Shutoh Y., Kosaka T., Nagayoshi E., Lemus R., Karol M. H. 2001. Isolated airway exposure to toluene diisocyanate results in skin sensitization. Toxicol. Lett. 121: 79-85.
[ECB] Bureau européen des substances chimiques. 2004. Risk assessment report for Toluene-2,4-diamine (CAS #95-80-7). Ispra (IT): Bureau européen des substances chimiques. Commission européenne.
Ellendt K., Gutsche B., Steiner G. 2003. Analysis of Laminates - Determination of Isocyanate Residues and Primary Aromatic Amine Migration. Deutsches Lebensmittel-Rundschau 99(4):131-136.
Environ Corporation International. 2003. VCCEP Report - Tier 1 Assessment of the potential health risks to children associated with exposure to the commercial pentabromodiphenyl ether product. Préparé pour Great Lakes Chemical, états-Unis.
[EPIWIN] Estimation Programs Interface for Microsoft Windows. 2004. Version 3.12. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
[ESIS] Système européen d'information sur les substances chimiques[base de données sur Internet]. 2006. CAS No. 91-08-7. 2-methyl-m-phenylene diisocyanate. CAS No. 584-84-9. 4-methyl-m-phenylene diisocyanate. CAS No. 26471-62-5.m-tolylidene diisocyanate. Version 4.50. Bureau européen des substances chimiques (ECB). Commission européenne.
Estlander T., Keskinen H., Jolanki R., Kanerva L. 1992. Occupational dermatitis from exposure to polyurethane chemicals. Am. J. Contact. Dermat. 27:161-165.
Foureman P., Mason J. M., Valencia R., Zimmering S. 1994. Chemical mutagenesis testing in Drosophila. X. Results of 70 coded chemicals tested for the National Toxicology Program. Environ. Mol. Mutagen. 23(3):208-227.
Gad, S. C., Dunn B. J., Dobbs D. W., Reilly C., Walsh R. D. 1986. Development and validation of an alternative dermal sensitization test: the mouse ear swelling test (MEST). Toxic. Appl. Pharmac. 84:93-114.
Gagnaire F., Ban M., Cour C., Micillino J. C., Bonnet P., Hettich D. 1997. Role of tachykinins and neutral endopeptidase in toluene diisocyanate-induced bronchial hyperresponsiveness in guinea pigs. Toxicology 116(1-3):17-26.
Gagné S., Lesage J., Ostiguy C., Van T. H. 2003. Determination of unreacted 2,4-toluene diisocyanate (2,4TDI) and 2,6-toluene diisocyanate (2,6TDI) in foams at ultratrace level by using HPLC-CIS-MS-MS. Analyst 128:1447-51.
Goossens A., Detienne T., Bruze M. 2002. Occupational allergic contact dermatitis caused by isocyanates. Am. J. Contact Dermat. 47:304-308.
Gulati D. K., Witt K., Anderson B., Zeiger E., Shelby M. D. 1989. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. III. Results with 27 chemicals. Environ. Mol. Mutagen. 13(2):133-193.
Hagmar L., Welinder H., Mikoczy Z. 1993a. Cancer incidence and mortality in the Swedish polyurethane foam manufacturing industry. Br. J. Ind. Med. 50(6):537-543.
Hagmar L., Stromberg U., Welinder H., Mikoczy Z. 1993b. Incidence of cancer and exposure to toluene diisocyanate and methylene diphenyldiisocyanate: a cohort based case-referent study in the polyurethane foam manufacturing industry. Br. J. Ind. Med. 50(11):1003-1007.
Harton E.E. Jr, Rawl R. R. 1976. Toxicological and skin corrosion testing of selected hazardous materials. Springfield (VA): US Department of Commerce.
Heimbach F, Jaeger K., Sporenberg W. 1996. Fate and Biological Effects of Polymeric MDI (4,4-diphenylmethane diisocyanate and homologues) in small artificial ponds. Ecotox. Environ. Safety 33:143-153.
Henschler D., Assmann W., Meyer K.-O. 1962. Toxicology of toluene diisocyanate. Arch. Toxikol. 19:364-387.
Holdren M. W., Spicer C. W. et Riggin R. M. 1984. Gas Phase Reaction of Toluene Diisocyanate with Water Vapour. Am Ind Hyg Assoc J 45(9):626-633
Holness D. L., Nethercott J. R. 1997. Results of patch testing with a specialized collection of plastic and glue allergens. Am. J. Contact Derm. 8:121-124.
Huang J., Wang X. P., Ueda A., Aoyama K., Chen B. M., Matsushita T. 1991. Allergologic evaluation for workers exposed to toluene diisocyanate. Ind. Hlth 29:85-92.
Hugo J. M., Spence M. W. et Lickly T. D. 2000. The Determination of the Ability of Polyurethane Foam to Release Toluene Diisocyanate into Air. Appl. Occ Env Hygiene 15(6): 512-519.
[HYDROWIN] Hydrolysis Rates Program for Windows. 2000. Version 1.67. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
IAL Consultants. 2007. End-use market survey on the polyurethane industry in the US, Canada and Mexico. Alliance for the Polyurethanes Industry.
[INRP] Inventaire national des rejets de polluants [base de données sur Internet]. 2007. Gatineau (Québec): Environnement Canada [cité en 2007].
[IUCLID] Base de données internationale sur les informations chimiques unifiées. 2000. CAS RN. 26471-62-5. m-tolyidene diisocyanate. Commission européenne. Bureau européen des substances chimiques. Voir les données chimiques de Rhône-Poulenc. Date de création : 18 février 2000.
Jarand C. W., Akapo S. O., Swenson L. J., Kelman B. J. 2002. Diisocyanate emission from a paint product: a preliminary analysis. Appl. Occup. Environ. Hyg. 17(7):491-494.
Jeong Y. C., Kim D. H., Kim B. R., Park M. 1998. In vitro and in vivo reactions of 2,4-toluene diisocyanate with DNA and blood proteins. J. Toxicol. Sci. 23 Supp, l 4:660-661.
Kanerva L., Jolanki R., Alanko K., Estlander T. 1999. Patch-test reactions to plastic and glue allergens. Acta Derm.-Vener. Stockh. 79:296-300.
Kanerva L., Estlander T., Jolanki R., Keskinen H. 2001. Asthma from diisocyanates is not mediated through a Type IV, patch-test-positive mechanism. Am. J. Contact Dermat. 44:247-248.
Karlsson D., Spanne N., Dalene M., Skarping G. 2000. Airborne thermal degradation products of polyurethane coatings in car repair shops. J. Environ. Monit. 2:462-469.
Karol M. H., Hauth B. A., Riley E. J., Magreni C. M. 1981. Dermal contact with toluene diisocyanate (TDI) produces respiratory tract hypersensitivity in guinea-pigs. Toxicol. Appl. Pharmacol. 58: 221-230 [cité dans PISSC 1987].
Katsuyama Y., Shinohara N., Kumagai K., Fujii M., Yanagisawa Y. 2003. Emission of diisocyanates in indoor air. Proceedings of ISIAQ 7th International Conference, décembre 2003.
Kelly T. J., Myers J. D., Holdren M. W. 1999. Testing of household products and materials for emission of toluene diisocyanate. Indoor Air 9:117-124.
Kerr M. A., Nascav P. C., Mundt K. A., Michalek A. M., Baptiste, Mahoney M. C. 2000. Parental occupational exposures and risk of neuroblastoma: a case-control study (United States). Cancer Causes Control 11:635-643.
Krone CA, Ely JTA, Klingner T, Rando RJ. 2003. Isocyanates in flexible polyurethane foams. Bull Environ Contam Toxicol 70(2):328-335.
Krone C. A. et Klingner T. 2005. Isocyanates, polyurethane and childhood asthma (review article). Pediatr Allergy Immunol 16: 368-379.
Le Coz, C.-J., El Aboubi S., Ball C. 1999. Active sensitization to toluene di-isocyanate. Contact Dermatitis 41:104-105.
Lemière C., Romeo P., Chaboillez S., Tremblay C., Malo J. L. 2002. Airway inflammation and functional changes after exposure to different concentrations of isocyanates. J. Allergy Clin. Immunol. 110(4):641-646.
Levine S. P., Redinger C. F., Robert W. P. 2001. Community exposure assessment and intervention effectiveness at Trinity American Corporation, Glenola, Caroline du Nord. Amer. Ind. Hyg. Assoc. J. 62: 649-657.
Loeser E. 1983. Long-term toxicity and carcinogenicity studies with 2,4/2,6-toluene-diisocyanate (80/20) in rats and mice. Toxi col. Lett. 15(1):71-81.
Maestrelli P., Del Prete G. F., De Carli M., D'Elios M. M., Saetta M., Di Stefano A., Mapp C. E., Romagnani S., Fabbri L. M. 1994. CD8 T-cell clones producing interleukin-5 and interferon-gamma in bronchial mucosa of patients with asthma induced by toluene diisocyanate. Scand. J. Work Envir. Hlth. 20:376-381.
Maki-Paakkanen J., Norppa H. 1987. Chromosome aberrations and sister-chromatid exchanges induced by technical grade toluene diisocyanate and methylenediphenyl diisocyanate in cultured human lymphocytes. Toxicol. Lett. 36(1):37-43.
Marand Å., Karlsson D., Dalene M., Skarping G. 2004. Extractable organic compounds in polyurethane foam with special reference to aromatic amines and derivatives thereof. Anal. Chim. Acta. 510(1):109-119.
Marczynski B., Czuppon A. B., Marek W., Baur × . 1992. Indication of DNA strand breaks in human white blood cells after in vitro exposure to toluene diisocyanate (TDI). Toxicol. Ind. Health 8(3):157-69.
Marczynski B., Merget R., Teschner B., Korn M., Rabstein S. Bruning T. 2003. Changes in low molecular weight DNA fragmentation in white blood cells after diisocyanate exposure of workers. Archs Toxicol. 77: 470-476.
Marczynski B., Merget R., Mensing T., Rabstein S., Kappler M., Bracht A., Haufs M. G., Kafferlein H. U., Bruning T. 2005. DNA strand breaks in the lymphocytes of workers exposed to diisocyanates: indications of individual differences in susceptibility after low-dose and short-term exposure. Archs Toxicol. 79:355-362.
Marek W., Potthast J., Marczynski B., Mensing T., Baur X. 1999. Subchronic exposure to diisocyanates increases guinea pig tracheal smooth muscle responses to acetylcholine. Respiration 66(2):156-161.
McGregor D. B., Brown A. G., Howgate S., McBride D., Riach C., Caspary W. J. 1991. Responses of the L5178Y mouse Lymphoma cell forward mutation assay. V: 27 coded chemicals. Environ. Mol .Mutagen. 17(3):196-219.
Meredith S. K., Bugler J., Clark R. L. 2000. Isocyanate exposure and occupational asthma: a case-referent study. Occup. Envir. Med. 57:830-836.
[MHLW] Ministry of Health Labour and Welfare (JP). 2005. Safety examination of existing chemicals and safety programmes in Japan (en japonais avec résumé en anglais).
Mikoczy Z., Welinder H., Tinnerberg H., Hagmar L. 2004. Cancer incidence and mortality of isocyanate exposed workers from the Swedish polyurethane foam industry: updated findings 1959-98. Occup. Envir. Med. 61:432-437.
Militello G., Sasseville D., Ditre C., Brod B. A. 2004. Allergic contact dermatitis from isocyanates among sculptors. Dermatitis 15: p 150-153.
MITI. Ministry of International Trade & Industry. 1992. B iodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Japan : Chemical Products Safety Division Basic Industries Bureau, Ministry of International Trade & Industry. Chemicals Inspection & Testing Institute (JP), éditeur.
Moscato G., A. Dellabianca A., Corsico G., Biscaldi G., Gherson, Vinci G. 1993. Bronchial responsiveness to ultrasonic fog in occupational asthma due to toluene diisocyanate. Chest 104:1127-1132.
[NTP] National Toxicology Program. 1983. NTP technical report on the toxicology and carcinogenesis studies of commercial grade 2,4 (80%)- and 2,6 (20%)-toluene diisocyanate (CAS No. 26471) in F344/N rats and B6C3F1 mice (gavage studies). Rapport technique No 251 (provisoire).
[NTP] National Toxicology Program. 1986. NTP technical report on the toxicology and carcinogenesis studies of commercial grade 2,4 (80%)- and 2,6 (20%)-toluene diisocyanate (CAS No. 26471) in F344/N rats and B6C3F1 mice (gavage studies). Rapport technique No 251.
[NTP] National Toxicology Program. 2005. 11th report on carcinogens. Substance profile: toluene diisocyanate.
[OASIS] Optimized Approach based on Structural Indices Set. 2005. OASIS Forecast. Version 1.20. Bourgas, Bulgarie: Laboratory of Mathematical Chemistry.
Ott M. G., Diller W. F. et Jolly A. T. 2003, Respiratory effects of toluene diisocyanate in the workplace: A discussion of exposure-response relationships. Critical Reviews in Toxicology 33:1–59.
Owen P. E. 1984. The toxicity and carcinogenicity of toluene isocyanate vapour administered by inhalation for a period of 113 weeks. Addendum Report: Volume 2. Hazelton Laboratories Europe [cité dans US EPA, 1995].
Paggiaro, P.L., Vagaggini B., Dente F.L., Bacci E., Bancalari L., Carrara M., Di Franco A., Giannini D., Giuntini C. 1993. Bronchial hyperresponsiveness and toluene diisocyanate. Long-term change in sensitized asthmatic subjects. Chest 103:123-1128.
Park H.-S., Kim H. Y., Nahm D. H., Son J. W., Kim Y. Y. 1999. Specific IgG, but not specific IgE, antibodies to toluene diisocyanate-human serum albumin conjugate are associated with toluene diisocyanate bronchoprovocation test results. J. Allergy Clin. Immun. 104:847-851.
Patterson R., Zeiss C. R., Harris K. E. 1983. Immunologic and respiratory responses to airway challenges of dogs with toluene diisocyanate. J. Allergy Clin. Immunol. 71(6):604-611.
Peel M., Marczynski B., Baur X. 1997. Comparison of the binding potential of various diisocyanates on DNA in vitro. J. Toxicol. Environ. Health 52(6):517-526.
Pemberton D., Tury, B. 2004. TDI industry risk assessment: sections on physico-chemical properties, environmental exposures, and environmental effects. Rapport 2004/E. Manchester (R.-U.): Gilbert International Ltd.
Pisati F., Baruffini A., Zedda S. 1993. Toluene diisocyanate induced asthma: outcome according to persistence or cessation of exposure. Br. J. Ind. Med. 50:60-64.
[PISSC] Programme international sur la sécurité des substances chimiques. 1987. Critères d’hygiène de l’environnement 75. Toluene Diisocyanates. Genève (Suisse), Organisation mondiale de la santé. Sponsorisé de façon conjointe par le Programme des Nations Unies pour l’environnement, l’Organisation internationale du travail et l’Organisation mondiale de la santé.
[PISSC] Programme international sur la sécurité des substances chimiques. 1997. Monographie d’information sur les poisons : Toluene-2,4-diisocyanate.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (Ontario), Direction de l’hygiène du milieu, Santé Canada.
Schnorr T. M., Steenland K., Egeland G. M., Boeniger M., Egilman D. 1996. Mortality of workers exposed to toluene diisocyanate in the polyurethane foam industry. Occup. Environ. Med. 53(10): p.703-707.
Seel K., Walber U., Herbold B., Kopp.R. 1999. Chemical behaviour of seven aromatic diisocyanates (toluenediisocyanates and diphenylmethanediisocyanates) under in vitro conditions in relationship to their results in the Salmonella/microsome test. Mutat. Res. 438(2):109-123.
Shaddock J. G., Robinson B.Y., Casciano D. A. 1990. Effect of pretreatment with hepatic mixed-function oxidase inducers on the genotoxicity of four rat carcinogens in the hepatocyte/DNA repair assay. Mutagenesis 5(4):387-391.
Shiotsuka R. N., Warren D. L., Halliburton A. T., Sturdivant D. W. 2000. A comparative respiratory sensitization study of 2,4- and 2,6-toluene diisocyanate using guinea pigs. Inhal. Toxicol. 12:605-615.
Sorahan T., Pope D. 1993. Mortality and cancer morbidity of production workers in the United Kingdom flexible polyurethane foam industry. Br. J. Ind. Med. 50(6):528-536.
Tadokora H, et al. 1997. Ecotoxicities of TDI and TDA to fish, algae and aquatic invertebrates. IN: Chemicals Inspection and Research Institute, Japan. III Report No. 11217
[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (ON): Université Trent, Canadian Environmental Modelling Centre.
Thorne, P. S., Hillebrand J. A., Lewis G. R., Karol M. H. 1987. Contact sensitivity by diisocyanates: potencies and cross-reactivities. Toxic. Appl. Pharmac. 87:155-165.
[TOPKAT] Toxicity Prediction Program [Internet]. 2004. Version 6.2. San Diego (CA): Accelrys Software Inc.
Tury B., Pemberton D., Bailey R. E. 2003. Fate and potential environmental effects of methylenediphenyl diisocyanate and toluene diisocyanate released into the atmosphere. J. Air Waste Manage. Assoc. 53:61-66.
Tyl R. W. 1988. Developmental toxicity study of inhaled toluene diisocyanate vapor in CD (Sprague-Dawley) rats. Union Carbide, Bushy Run Research Center. Projet révisé No50-592.
Tyl R. W., Fisher L. C., Dodd D. E., Pritts I. M., Kubena M. F., Losco P. E., Troup C. M., Lyon J. P., Landry T. D. 1999a. Developmental toxicity evaluation of inhaled toluene diisocyanate vapor in CD rats. Toxicol. Sci. 52(2):248-257.
Tyl R. W., Neeper-Bradley T. L. 1989. Two-generation reproductive study of inhaled toluene diisocyanate in CD (Sprague-Dawley) rats. Union Carbide, Bushy Run Research Center. No de projet 86-33-90704.
Tyl R. W., Neeper-Bradley T. L., Fisher L. C., Dodd D. E., Pritts I. M., Losco P. E., Lyon J. P., Landry T. D. 1999b. Two-generation reproductive toxicity study of inhaled toluene diisocyanate vapor in CD rats. Toxicol. Sci. 52(2):258-268.
Ulrich H. 1996. Chemistry and Technology of Isocyanates. Chichester (GB): John Wiley & Sons, Ltd.
[US EPA] Environmental Protection Agency. 1995. Integrated Risk Information System (IRIS). 2,4-/2,6-Toluene Diisocyanate mixture (TDI).
[US EPA] Environmental Protection Agency. 2002. Child-specific exposure factors handbook. Rapport provisoire.Washington (DC): National Center for Environmental Assessment, Office of Research and Development.
Vandenplas O., Cartier A., Ghezzo H., Cloutier Y., Malo J. L. 1993. Response to isocyanates: Effect of concentration, duration of exposure, and dose. Am. Rev. Resp. Dis. 147:1287-1290.
Van der Hoeven N, Roza P, Henzen L. 1992a. Determination of the effect of TDI, TDA, MDI, and MDA on the emergence and growth of the plant species Avena sativa and Lactuca sativaaccording to OECD Guideline no. 208. TNO. III Report no. 11024. [Cited in Pemberton and Tury 2004].
Van der Hoeven N, Roza P, Henzen L. 1992b. Determination of the LC50 (14 days) of TDI, TDA, MDI, and MDA to the earthwormEisenia fetida according to OECD guideline no. 207. TNO. III Report no. 11025. [Cité dans Pemberton et Tury 2004].
Vanoirbeek, J. A., Tarkowski J. M., Ceuppens J. L., Verbeken E. K., Nemery B., Hoet P. H. 2004. Respiratory response to toluene diisocyanate depends on prior frequency and concentration of dermal sensitization in mice. Toxic. Sci. 80:310-321.
Yakabe Y., Henderson K. M., Thompson W. C., Pemberton D., Tury B., Bailey R. E. 1999. Fate of methylenediphenyl diisocyanate and toluene diisocyanate in the aquatic environment. Environ. Sci. Technol. 33(15):2579-2583.
Zapp J. A. Jr. 1957. Hazards of isocyanates in polyurethane foam plastic production. Arch. Ind. Hlth 15(4):324-330.
Zissu D., Binet S., Limasset J. C. 1998. Cutaneous sensitization to some polyisocyanate prepolymers in guinea pigs. Contact Dermatitis 39:248-251.
| Voie d' exposition | Absorption estimée (μg/kg-p. c. par jour) de TDI par divers groupes d’âge | |||||||
|---|---|---|---|---|---|---|---|---|
| 0 à 6 mois [1] | 0,5 à 4 ans[3] | 5 à 11 ans[4] | 12 à 19 ans[5] | 20 à 59 ans[6] | 60 ans et plus[7] | |||
| Allaitement artificiel[2] | Allaitement naturel | |||||||
| [1] Hypothèses : poids, 7,5 kg, respiration, 2,1 m3 d'air par jour, consommation d'eau, 0,8 L par jour (allaitement artificiel) ou 0,3 L par jour (allaitement naturel) et ingestion de sol, 30 mg par jour (Santé Canada, 1998). [2] Dans le cas des nourrissons allaités artificiellement (lait maternisé), l'absorption à partir de l' eau équivaut à l'absorption à partir des aliments. On n'a pas trouvé de données sur les concentrations de TDI dans les laits maternisés au Canada. [3] Hypothèses : poids, 15,5 kg; respiration, 9,3 m3 d'air par jour, consommation d'eau, 0,7 L par jour et ingestion de sol, 100 mg par jour (Santé Canada, 1998). [4] Hypothèses : poids, 31,0 kg; respiration, 14,5 m3 d'air par jour, consommation d'eau, 1,1 L par jour et ingestion de sol, 65 mg par jour (Santé Canada, 1998). [5] Hypothèses : poids, 59,4 kg; respiration, 15,8 m3 d'air par jour, consommation d'eau, 1,2 L par jour et ingestion de sol, 30 mg par jour (Santé Canada, 1998). [6] Hypothèses : poids, 70,9 kg; respiration, 16,2 m3 d'air par jour, consommation d'eau, 1,5 L par jour et ingestion de sol, 30 mg par jour (Santé Canada, 1998). [7] Hypothèses : poids, 72,0 kg, respiration 14,3 m3 d'air par jour, consommation d'eau, 1,6 L par jour et ingestion de sol, 30 mg par jour (Santé Canada, 1998). [8] On a obtenu une concentration annuelle moyenne calculée de 1,06 µg/m3 à 100 mètres d'une usine de mousse de polyuréthane (voir l' évaluation de l'exposition dans ce rapport). On a supposé que l' air ambiant était représentatif de l' exposition à l' air intérieur, bien que l' utilisation de certains produits de consommation puisse être à l'origine du rejet de diisocyanate de toluène dans l' air intérieur. [9] On n'a pas trouvé de rapports sur les mesures de diisocyanate de toluène dans l' eau potable. On estime que la demi-vie du diisocyanate de toluène dans l' eau, avec un degré moyen de mélange, est de une à trois heures (Yakabe et al., 1999). On suppose donc que le diisocyanate de toluène n' est pas présent dans l' eau potable. [10] On n'a pas trouvé de rapports sur les mesures de diisocyanate de toluène dans les aliments ou dans les boissons, mais on en a trouvé pour la migration d u diisocyanate de toluène des emballages d' aliments; toutefois, ils ne permettaient pas de déterminer la concentration de TDI dans les aliments et les boissons. [11] On n'a pas trouvé de rapports sur les mesures de diisocyanate de toluène dans le sol. On a établi expérimentalement que la demi-vie du diisocyanate de toluène dans le sol humide était inférieure à une heure (Duff, 1983). Le TDI n' est pas considéré comme une substance persistante et sauf dans le cas des sites de déversements industriels, il ne devrait pas être présent à la surface du sol. |
||||||||
| Air [8] | 0,30 | 0,64 | 0,50 | 0,28 | 0,24 | 0,21 | ||
| Eau potable [9] | _ | _ | _ | _ | _ | _ | _ | |
| Aliments et boissons [10] | _ | _ | _ | _ | _ | _ | ||
| Sol [11] | _ | _ | _ | _ | _ | _ | ||
| Absorption totale | 0,30 | 0,30 | 0,64 | 0,50 | 0,28 | 0,24 | 0,21 | |
| Paramètre | Concentrations à effet le plus faible / Résultats |
|---|---|
| [*] Sauf indication contraire, ces données représentent le mélange d'isomères. | |
| Animaux de laboratoire et essais in vitro | |
| Toxicité aiguë | DL50 orale la plus faible,(rats) : 3 060 mg/kg (Harton et Rawl, 1976, cité dans PISSC, 1987) études supplémentaires : Woolrich, 1982, cité dans PISSC, 1987 CL50 la plus faible, par inhalation (rats) : 57 mg/m3 (Harton et Rawl 1976, cité dans PISSC, 1987) études supplémentaires : Duncan et al.,1962, Bungeet al., 1977, cités dans PISSC, 1987. DL50 la plus faible, absorption cutanée (lapins) : 10 000 mg/kg (Harton et Rawl, 1976, cité dans PISSC, 1987) |
| Dose toxique à court terme pour l'exposition répétée | DMEO orale (rats, 28 jours) : 30 mg/kg-p. c./j, à cause de changements microscopiques dans les poumons et la trachée (MHLW du Japon, 2005, étude sommaire seulement). études supplémentaires : Zapp, 1957, cité dans PISSC, 1987; NTP, 1986. CMEO la plus faible par inhalation (cobayes, 5 j) : 0,07mg/m3, à cause d'une plus forte réponse des muscles lisses de la trachée (Marek et al., 1999). Il y a de nombreuses autres études. |
| Toxicité subchronique | DMEO orale (rats, souris, 13 sem.) : 120 mg/kg-p. c./j, à cause de cas de bronchopneumonie et de diminution du poids corporel chez les rats, ainsi que de cas d'inflammation et de nécrose du foie chez les souris (NTP, 1986). CMEO par inhalation (rats, 27 sem.; chiens, 10 mois) : 0,14 mg/m3, à cause de changements histologiques dans les fosses nasales et dans les voies respiratoires supérieures de rats de la génération F 1 (Tyl et Neeper-Bradley, 1989, cité dans US EPA, 1995; publié sous la signature de Tyl et al., 1999b); forts titres d'anticorps, fonction pulmonaire diminuée et réaction cutanée immédiate chez les chiens (Patterson et al., 1983, cité dans PISSC, 1987). études supplémentaires : Gagnaire et al., 1997; Henschler et al.,1962, cité dans PISSC, 1987; Friebel, 1955, cité dans PISSC, 1987; Zapp, 1957, cité dans PISSC, 1987. |
| Toxicité chronique/ cancéro-génicité | Essai biologique de détection du cancer, par voie orale, rats Essai biologique de détection du cancer, par voie orale, souris Essai biologique de détection du cancer, par inhalation, souris et rats Des rats ont été exposés à raison de 6 h/j et de 5 j/sem. pendant 104 semaines, à 0, 0,36 ou 1,07 mg/m3 pendant 108 semaines (mâles) ou pendant 110 semaines (femelles). Il n'y avait pas de différence significative pour l'incidence ou les types de tumeurs entre les groupes traités et le groupe témoin (Loeser, 1983, cité dans CIRC, 1986). On a noté des augmentations liées à la dose dans l'incidence et la gravité des rhinites chroniques et nécrotiques chez les rates. DMEO, effets non néoplasiques, par voie orale, par gavage : (rats, de 105 à 106 semaines) : 30 mg/kg-p. c./j (dose la plus faible testée), fondée sur les cas de bronchopneumonie aiguë, de diminution du gain de poids corporel et de mortalité (NTP, 1986, cité dans PISSC, 1987). CMENO, effets non néoplasiques, par inhalation : 0,36 mg/m3, fondée sur un accroissement notable des rhinites chroniques et nécrotiques chez les rates. |
| Toxicité pour le dévelop-pement | CMEO par inhalation : 0,5 ppb (3,57mg/m3), fondée sur une seule variation au niveau du squelette, qui a été signalée comme une variation commune et peut-être non significative compte tenu des données historiques obtenues pour les groupes témoins. Dans cette étude, on a exposé des rates gravides à des vapeurs de TDI à raison de 6 h/j pendant les jours de gestation 6 à 15. (Tyl, 1988, cité par l'US EPA, 1995; publié sous la signature de Tyl et al., 1999a) |
| Toxicité pour la reproduction | CSEO par inhalation : Aucun effet dû à l'exposition pour aucun des organes reproducteurs ou des paramètres de la reproduction à la plus forte dose de 0,3 ppm (2,14 mg/m3). Dans cette étude, les rats mâles et femelles ont été exposés à des vapeurs de TDI à raison de 6 h/j, 5 j/sem., puis de 7 j/sem., pendant une période de 3 semaines de reproduction, de gestation et de lactation pour les deux générations d'une étude de reproduction à deux générations. (Tyl et Neeper-Bradley, 1989, cité dans US EPA, 1995; publié sous la signature de Tyl et al., 1999b). |
| Génotoxicité et paramètres connexes (in vivo) | Essai de létalité récessive liée au sexe Essai du micronoyau |
| Génotoxicité et paramètres connexes (in vitro) | Mutagénicité, Salmonella typhimurium Mutagénicité, lignées de cellules de rongeurs Aberrations chromosomiques Synthèse d'ADN non programmée échange de chromatides sœurs Ruptures de brins d'ADN Formation de liens avec l'ADN |
| Sensibi-lisation | De nombreuses études qualitatives (p. ex. épidermotests chez les humains, tests Buehler chez les cobayes, tests d'enflure des oreilles chez les souris) indiquent que le TDI est un sensibilisant cutané. De plus, l'exposition cutanée au TDI peut induire une sensibilisation respiratoire (Descotes, 1988; Estlander et al., 1992; Gad et al., 1986; Goossens et al., 2002; Holness et Nethercott, 1997; Huang et al., 1991; Kanerva et al., 1999, 2001; Le Coz et al., 1999; Maestrelli et al., 1994; Mandervelt et al., 1997; Meredith et al., 2000; Militello et al., 2004 : Moscato et al., 1993; Paggiaro et al., 1993; Park et al., 1999; Pisati et al., 1993; Shiotsuka et al., 2000; Thorne et al., 1987; Vandenplas et al., 1993; Vanoirbeek et al., 2004; Zissu et al., 1998). Une étude semble indiquer que l'exposition par inhalation peut aussi être à l'origine d'une sensibilisation de la peau (Ebino et al., 2001). Une seule exposition peut aussi causer une réaction asthmatique immédiate ou différée chez des personnes déjà exposées. Des expositions simples à des concentrations aussi faibles que 0,03mg/m3 ont induit une hypersensibilité respiratoire chez des cobayes déjà sensibilisés (Karol et al., 1981). |
| Études épidémiologiques | |
| Toxicité chronique/ cancérogé-nicité | Chez les humains, on n'a observé ni association forte, ni profil cohérent (cancer) pour trois études de cohortes industrielles et une étude cas-témoin de la population (Sorahan et Pope, 1993, Hagmar et al., 19 93(a et b), Schnorret al., 19 96; tous cités dans CIRC, 1999) CMEO, effets non néoplasiques, par inhalation(humains, 5 ans) : 1,9 ppb (0,014 mg/m3), fondée sur une diminution de la fonction pulmonaire selon une étude prospective des maladies professionnelles (Diem et al., 1982, cité dans US EPA, 1995). La diminution de la fonction pulmonaire a pris la forme de déclins annuels significatifs du volume expiratoire maximal par seconde (VEMS) et du débit respiratoire forcé à 25-75 % (DRF 25-75). études épidémiologiques professionnelles études de sensibilisation |
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
Diisocyanate de toluène
Diisocyanate de 4-méthyl-m-phénylène
(2,4-TDI)
No CAS 584-84-9
Diisocyanate de 2-méthyl-m-phénylène
(2,6-TDI)
No CAS 91-08-7
Diisocyanate de m-tolylidène
(mélanges d’isomères du TDI)
No CAS 26471-62-5
Environnement Canada
Santé Canada
Juillet 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Sources
- Utilisations
- Rejets dans l’environnement
- Persistance et potentiel de bioaccumulation
- Devenir dans l’environnement
- Potentiel d’effets nocifs sur l’environnement
- Potentiel d’effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Limites supérieures estimées de l’absorption quotidienne du 2,4-diisocyanate de toluène et du 2,6- diisocyanate de toluène par la population générale au Canada
- Annexe 2 : Valeurs d’exposition estimées liées à l’utilisation de produits de consommation
- Annexe 3 : Sommaire des renseignements concernant les effets sur la santé des diisocyanates de toluène
Les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable des mélanges d’isomères du diisocyanate de toluène (TDI),numéro de registre du Chemical Abstracts Service (CAS) 26471-62-5, du Diisocyanate de 4-méthyl-m-phénylène (2,4-diisocyanate de toluène : 2,4-TDI), n° CAS 584-84-9 et du Diisocyanate de 2-méthyl-m-phénylène (2,6 diisocyanate de toluène : 2,6-TDI), n° CAS 91-08-7. Une priorité élevé a été accordée à la prise de mesure à l’égard de ces substances lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres. On estime que, pour les Canadiens, elles présentent le plus fort risque d’exposition (PFRE) dans le cas du n° CAS 26471-62-5, ou un risque d’exposition intermédiaire (REI) dans le cas des nos CAS 91-08-7 et 584-84-9; par ailleurs, elles ont été classées dans la catégorie des agents cancérogènes par d’autres organismes. étant donné que ces substances ne répondaient pas aux critères de la catégorisation écologique de la persistance, de la bioaccumulation ou de la toxicité intrinsèque visant les organismes aquatiques, cette évaluation est donc axée sur différents aspects relatifs à la santé humaine.
On a combiné les évaluations préalables du 2,4-TDI, du 2,6-TDI et des mélanges d’isomères du TDI car la plupart des données toxicologiques disponibles portent sur ce dernier groupe. Aussi, dans la présente évaluation, le terme « TDI » désigne indistinctement le 2,4-TDI, le 2,6-TDI et les mélanges d’isomères du TDI.
Le diisocyanate de toluène est un produit chimique industriel qui n’a été fabriqué au Canada par aucune entreprise en 2006, et ce, en quantité supérieure au seuil de déclaration de 100 kg, il y est cependant importé. Au cours de cette même année, plus de 85 p. 100 du diisocyanate de toluène importé au pays a servi à la fabrication de mousse de polyuréthane souple.
Au Canada, les rejets industriels de TDI se font surtout dans l’air et on croit que la plus grande partie du TDI qui y est rejeté devrait rester à l’état de vapeur et réagir principalement avec des radicaux hydroxyles produits par photolyse, ce qui correspond à une demi-vie inférieure à deux jours. Toutefois, le niveau d’exposition au TDI pourrait être élevé pendant l’utilisation de produits de consommation qui en contiennent.
En se fondant principalement sur les données concernant la cancérogénicité issues des évaluations de plusieurs organismes internationaux et nationaux, les données épidémiologiques chez l’humain et les données expérimentales chez les animaux sont équivoques et ne permettent donc pas de déterminer les risques de cancer associés à une exposition au TDI par inhalation chez l’humain. Le TDI est considéré comme une substance cancérogène, puisque les doses orales chez les animaux étaient associées à l’apparition de tumeurs à de nombreux endroits. Des résultats partagés on été obtenus pour des essais in vivo et in vitro sur la génotoxicité du TDI. Par conséquent, bien que le mode d’induction des tumeurs n’ait pas été complètement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez les animaux de laboratoire résultent de l’interaction directe avec le matériel génétique.
Les valeurs estimées de la limite supérieure de l’exposition par inhalation de la population générale ou lors de l’utilisation de l’utilisation de produits de consommation contenant du TDI peut presque atteindre ou dépasser les effets non cancérogènes critiques dans le système respiratoire, incluant l’hypersensibilité respiratoire. De plus, le TDI a été classé par l’Union européenne dans la catégorie des sensibilisants de la peau et des voies respiratoires.
Compte tenu de la cancérogénicité du TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène, pour lequel il pourrait exister une probabilité d’effets nocifs à tout niveau d’exposition, et de l’inadéquation possible des marges entre l’exposition estimée à partir des produits et du niveau critiques pour les effets non cancérogènes, il est conclu que le TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène sont des substances qui peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
À la lumière des dangers écologiques et des rejets déclarés de TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène, il est conclu que le TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène ne pénètrent pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ni à mettre en danger l'environnement essentiel pour la vie. De plus, le TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène ne répondent pas aux critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation.
Ces substances s'inscriront dans la mise à jour de l’inventaire de la Liste intérieure des substances, qui débutera en 2009. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, la performance des mesures de contrôle possibles déterminées à l'étape de la gestion des risques.
Compte tenu des renseignements disponibles, le TDI (mélanges d’isomère), le 2,4-diisocyanate de toluène et le 2,6-diisocyanate de toluène remplissent un ou plusieurs critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l’Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si ces substances présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine. À partir des résultats de l’évaluation préalable, les ministres peuvent proposer de ne rien faire à l’égard de la substance, de l’inscrire sur la Liste des substances d’intérêt prioritaire (LSIP) en vue d’une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l’annexe 1 de la Loi et, s’il y a lieu, la quasi-élimination de ses rejets dans l’environnement.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères de la catégorisation relatifs à l’environnement [persistance (P), potentiel de bioaccumulation (B) et toxicité intrinsèque (Ti) pour les organismes aquatiques] et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine à la lumière des classements effectués par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils mettent au défi l’industrie et les autres intervenants intéressés de fournir, selon un calendrier déterminé, des renseignements particuliers sur les substances qui pourraient servir à étayer l’évaluation des risques. Ces renseignements pourraient aussi servir à élaborer et à évaluer comparativement les meilleures pratiques de gestion des risques et de gérance des produits pour ces substances jugées hautement prioritaires.
Les isomères du diisocyanate de toluène ont été jugé hautement prioritaire pour l’évaluation des risques qu’ils comportent pour la santé humaine, car il a été considérée présenter un REI et a été classée par d’autres instances sur la base de leur cancérogénicité et de leur génotoxicité. Le volet du Défi portant sur cette substance a été lancé le 3 février 2007 au moyen d’un avis paru dans la Gazette du Canada (Canada, 2007a). Le profil de cette substance a été publié en même temps. Ce profil présentait l’information technique, obtenue avant décembre 2005, sur laquelle a reposé la catégorisation de cette substance. En réponse au Défi, on a reçu des documents présentant des renseignements.
Même si l’évaluation des risques des isomères du diisocyanate de toluène pour la santé humaine a été jugé hautement prioritaire, ces substances ne remplissent pas le critère de la catégorisation écologique du potentiel de bioaccumulation, de la persistance ou de la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée sur l’information pertinente à l’évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées en vertu de la LCPE (1999) portent sur les renseignements essentiels pour établir si une substance répond ou non aux critères de toxicité des substances chimiques énoncés dans l’article 64 de la Loi, qui se lit comme suit :
64. « ...est toxique toute substance qui pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à :
- avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique;
- mettre en danger l’environnement essentiel pour la vie;
- constituer un danger au Canada pour la vie ou la santé humaine. »
Les évaluations préalables mettent en lumière les renseignements scientifiques et présentent les conclusions que l’on peut dégager en incorporant la méthode du poids de la preuve et la prudence.
Cette évaluation préalable inclue l’examen des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, à l’inclusion des renseignements additionnels fournis dans le cadre du Défi. Des données pertinentes à l’évaluation préalable de cette substance ont été relevées dans des publications originales, des rapports de synthèse et d’évaluation, des rapports de recherche de parties intéressées et d’autres documents accessibles lors de recherches menées dernièrement, jusqu’en septembre 2007. Les études importantes ont fait l’objet d’évaluations critiques. Les études clés ont fait l’objet d’évaluation critique ; les résultats de la modélisation ont pu être utilisés dans la formulation de conclusions. L’évaluation des risques pour la santé humaine comprends l’examen de données pertinentes à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d’autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l’effet critique retenu ou sur l’écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l’exposition tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, cela dans le contexte d’une évaluation préalable. Les évaluations préalables ne sont pas le résultat d’examens critiques ou exhaustifs de toutes les données disponibles. Elles présentent plutôt les informations critiques selon lesquelles la conclusion est basée.
On a combiné les évaluations préalables du 2,4-TDI, du 2,6-TDI et des mélanges d’isomères du TDI parce que la plupart des données toxicologiques disponibles portent sur ce dernier groupe. Aussi, dans la présente évaluation, le terme « TDI » désigne indistinctement le 2,4-TDI, le 2,6-TDI ou les mélanges d’isomères du TDI.
La présente évaluation préalable a été effectuée par le personnel des Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre des résultats provenant d’autres programmes appliqués par ces ministères. Cette évaluation préalable a fait l’objet d’une consultation indépendante par des pairs. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus par Meridian Environmental Inc. et de Starodub & Associates. Bien que les commentaires externes aient été pris en considération, Santé Canada assume la responsabilité du contenu final de l’évaluation préalable pour tout ce qui concerne la santé humaine. De plus, une version provisoire de la présente évaluation préalable a fait l’objet d’une consultation publique de 60 jours. Les considérations et les renseignements importants à la base du présent rapport sont présentés ci-après.
| No CAS et nom | N° CAS 584-84-9 : Diisocyanate de 4-méthyl-m-phénylène N° CAS 91-08-7 : Diisocyanate de 2-méthyl-m-phénylène (2,6-TDI) N° CAS 26471-62-5 : Diisocyanate de m-tolylidène (mélanges d’isomères du TDI) |
|---|---|
| Le TDI est habituellement vendu à l’état de mélange 80:20 des isomères 2,4- et 2,6-. On trouve également dans le commerce un mélange 65:35 et un mélange brut du TDI à rapport isomérique indéfini. De plus, on utilise le 2,4-TDI pur pour certaines applications spéciales. Le 2,6-TDI pur n’a pas d’application industrielle. | |
Synonymes No CAS 91-08-7 No CAS 26471-62-5 |
1,3-Diisocyanato-4-methylbenzene; 2,4-toluene diisocyanate (2,4-TDI); Isocyanic acid, 4-methyl- m -phenylene ester 1,3-Diisocyanato-2-methylbenzene; 2,6-toluene diisocyanate (2,6-TDI); Isocyanic acid, 2-methyl- m -phenylene ester Crude tolylene diisocyanate; 1,3-diisocyantomethylbenzene; toluene diisocyanate (80 % 2,4-TDI; 20 % 2,6-TDI) |
| Groupe chimique | Composés organiques |
| Sous-groupe chimique | Cyanates et leurs dérivés |
| Formule chimique | C9H6N2O2 |
| Structure chimique |
|
| Notation SMILES | 91-08-7: O=C=Nc(c(c(N=C=O)cc1)C)c1 584-84-9: O=C=Nc(c(ccc1N=C=O)C)c1 |
| Masse moléculaire | 174,16 |
| Propriété | Valeur | Type | Référence |
|---|---|---|---|
| exp.= données expérimentales | |||
| Point de fusion 2,4-TDI 2,6- TDI Mélanges d'isomères 2,4- et 2,6- du TDI |
22 °C 7,2 °C < 15 °C (mélange 80:20) < 8 °C (mélange 65:35) |
exp. exp. exp. exp. |
CIRC, 1986 CIRC, 1986 CIRC, 1986 CIRC, 1986 |
| Point d'ébullition 2,4-TDI 2,6- TDI Mélanges d'isomères 2,4- et 2,6- du TDI |
252,5-254 °C 252-254 °C |
exp. à 1 atm exp. à 0,98 atm exp. à 1 atm |
IUCLID, 2000 IUCLID, 2000 IUCLID, 2000 |
| Masse volumique | 1,22 g/cm3 | exp. à 20 °C | IUCLID, 2000 |
| Pression de vapeur 2,4-TDI 2,6- TDI Mélanges d'isomères 2,4- et 2,6- du TDI |
0,013-0,021 hPa 0,016 hPa 0,014-0,015 hPa |
toutes les val. d'exp. à 20 °C | IUCLID, 2000 IUCLID, 2000 IUCLID, 2000 |
| Constante de la loi de Henry (H) | Comme le TDI réagit avec l'eau, on n'a pas estimé H. | ||
| Solubilité dans l'eau | Comme le TDI réagit avec l'eau, on ne peut déterminer sa solubilité dans l'eau. | IUCLID, 2000 | |
| Log Koe | Comme le TDI réagit avec l'eau et avec l'octanol, on ne peut estimer Koe. | IUCLID, 2000 | |
| Log Kco | Comme le TDI réagit avec l'eau et avec l'octanol, on ne peut estimer Kco. | ||
Il n'y a pas de sources naturelles connues du TDI.
Le diisocyanate de toluène est un produit chimique industriel qui n’a été fabriqué au Canada en quantité supérieure au seuil de déclaration de 100 kg par aucune entreprise en 2006, mais qui y est importé. Pour cette même année, la demande industrielle en TDI au pays était estimée à 33,6 millions de kilogrammes (IAL Consultants, 2007). À partir des réponses à un avis publié en application de l’article 71 de la LCPE (1999), il a été établi que la quantité totale de TDI importée au Canada en 2006 dépassait les 10 millions de kilogrammes (Canada, 2007a). Cette valeur représente le total des isomères de diisocyanate de toluène définis par les trois numéros CAS ci-dessus et elle inclut le TDI importé dans des mélanges comportant d’autres substances chimiques et dans des produits de consommation si la quantité de TDI importée était égale ou supérieure à 100 kg en 2006.
Le diisocyanate de toluène peut être libéré dans l’environnement par des procédés industriels qui utilisent le TDI comme réactif intermédiaire, notamment pour la fabrication de la mousse de polyuréthane souple. Les rejets des activités industrielles sont surtout sous forme d’émissions atmosphériques. Une autre source possible d’émission de TDI dans l’environnement est l’incinération de polyuréthane résiduaire. Comme le TDI est une substance chimique réactive, on ne croit pas que le transport à grande distance de cette substance contribue notablement à l’exposition humaine au Canada.
Le diisocyanate de toluène est présent dans certains produits de consommation, qui peuvent libérer du TDI à l’usage. Ce sont, par exemple, des produits spécialisés à base de polyuréthane comme des peintures, des vernis, des revêtements, ou encore des adhésifs, des matériaux d’étanchéité et des mastics (CIRC, 1986; NTP, 2005). On signale la possibilité de rejets de mélanges d’isocyanates contenant notamment du TDI si des peintures à base d’isocyanate, qui sont utilisées à grande échelle comme couche de peinture primaire appliquée en usine sur les véhicules automobiles, sont chauffées pendant le meulage ou le ponçage des surfaces (Karlsson et al., 2000). On note des sources possibles de TDI dans les aliments à cause de l’utilisation de polyuréthanes dans les encres et les adhésifs appliqués à leurs emballages, ainsi que de l’emploi d’élastomères à base de polyuréthane dans des appareils de manutention des aliments comme les convoyeurs. Dans les cas où il n’y a pas de barrières fonctionnelles entre les encres ou les adhésifs et les aliments, Santé Canada utilise le jugement professionnel pour estimer les teneurs résiduelles en isomères du TDI et la migration possible de ceux-ci dans les aliments (selon un courriel de la Direction générale des aliments, Santé Canada, mai 2008, sans référence). Des garnitures de mousse de polyuréthane pouvant comporter du TDI ont été approuvées au Canada pour des utilisations restreintes où elles sont en contact avec des aliments (Damant et al., 1995; Ellendt et al., 2003; ACIA, 2007).
Dans l’industrie de la construction, l’utilisation de certains produits comme les matériaux d’étanchéité, les revêtements et les adhésifs, qui contiennent des quantités mesurables d’isocyanate libre, est réservée à des entrepreneurs qualifiés. On ignore cependant dans quelle mesure des personnes non qualifiées peuvent avoir accès à ces produits.
Les plus importantes utilisations industrielles du TDI sont celles des mélanges d'isomères 2,4- et 2,6- du diisocyanate de toluène. On utilise l'isomère 2,4- pur pour certains élastomères spéciaux. L'isomère 2,6- pur n'est pas un produit chimique industriel commercial (Allport et al., 2003).
Les profils des utilisations du TDI déclarées au Canada en 2006 sont présentés dans les tableaux 3 et 4.
Au Canada, environ 86 % du diisocyanate de toluène était utilisé pour la fabrication de mousse de polyuréthane souple (PUF) en 2006. En présence d’un surfactant, d’un catalyseur ou d’un agent gonflant ou grâce à d’autres processus chimiques, le TDI réagit avec un polyol de manière à former de la PUF. Sous sa forme souple, la PUF est utilisée à grande échelle pour le rembourrage dans l’industrie des meubles de maison et dans l’industrie automobile, ainsi que pour la fabrication de matelas, d’oreillers, d’emballages et de sous-tapis. Au Canada, l’utilisation du TDI qui lie les déchets de mousse pour fabriquer des sous-tapis consomme environ 1 % de tout le TDI (IAL Consultants, 2007). Dans d’autres pays, cette utilisation est remplacée par celle du diisocyanate de méthylènediphényle ou MDI (réunion avec le Groupe d’experts sur les isocyanates, American Chemistry Council – ACC, Ottawa, 2007-08-08). Les PUF semi-souples et semi-rigides sont utilisées pour la fabrication de panneaux, de capitonnage et de pare-chocs dans l’industrie automobile. Pour ce qui est de la production de PUF rigide destinée à l’isolation dans des applications comme la réfrigération et le calfeutrage par la pose de mousse, le TDI a été remplacé en grande partie par le MDI (réunion avec le Groupe d’experts sur les isocyanates, ACC, Ottawa, 2007 08 08).
En 2006, la demande en TDI du marché pour les revêtements et les adhésifs correspondait à environ 7 et 5 % de la demande totale, respectivement. Le TDI ou ses dérivés entrent dans la composition des peintures alkydes et des revêtements modifiés par le polyuréthane, utilisés notamment pour la fabrication de peintures automobiles et marines, de vernis pour bois, d’apprêt pour les planchers et de revêtements pour fils et poudres. Le TDI ou ses dérivés sont aussi utilisés pour la fabrication de matériaux d’étanchéité, d’adhésifs et d’élastomères. De plus, on peut employer des élastomères moulés de type poly(uréthane et urée) à base de TDI pour fabriquer des roues, des rouleaux, des convoyeurs et d’autres produits semblables. On utilise le TDI pour la production de revêtements de textiles afin de les rendre imperméables et durables, ainsi que pour d’autres applications textiles (Ulrich, 1996; CIRC, 1986; NTP, 2005). On utilise en outre des revêtements à base de TDI pour la production de papier (Canada, 2007a). Dans d’autres pays, on a déclaré des applications biomédicales pour plusieurs polyuréthanes à base de TDI. Au Canada, aucun produits constitués de polyuréthane à base de TDI n’ont obtenu de permis pour applications biomédicales. Deux utilisation historiques du TDI sont l’éponge contraceptive Today et les implants mammaires Même, qui étaient faits d’un noyau de silicone entouré d’une enveloppe de polyuréthane à base de TDI (Benoit, 1993).
| Type de produit | TDI (millions de kg) |
|---|---|
| Tiré de 2006 End-Use Market Survey on the Polyurethane Industry in the United States, Canada and Mexico, octobre 2007, par IAL Consultants pour le Center for the Polyurethanes Industry | |
| Blocs de mousse souple | 19,64 |
| Mousse souple moulée | 9,25 |
| Revêtements | 2,31 |
| Liants | 0,36 |
| élastomères | 0,45 |
| Adhésifs | 1,59 |
| Total | 33,6 |
| Utilisation finale | TDI (millions de kg) |
|---|---|
| Tiré de 2006 End-Use Market Survey on the Polyurethane Industry in the Unites States, Canada and Mexico, octobre 2007, par IAL Consultants pour le Center for the Polyurethane Industry | |
| Construction | 2,90 |
| Transport | 12,11 |
| Meubles | 9,53 |
| Déchets de mousse | 2,45 |
| Appareils électriques | 0,14 |
| Emballages | 0,41 |
| Matelas | 2,04 |
| Textiles et fibres | 0,36 |
| Utilisations industrielles | 0,32 |
| Fonderies | - |
| Industries marines | 0,09 |
| Machinerie | 0,18 |
| Composés électroniques | - |
| Roues et pneus | - |
| Chaussures | - |
| Arts décoratifs | - |
| Autres | 3,13 |
| Total | 33,6 |
Selon les déclarations faites en application de l’article 71 de la LCPE (1999), en 2006, on a importé au Canada plus de 10 millions de kilogrammes d’isomères de diisocyanate de toluène (Canada, 2007a). À cause des exigences relatives au caractère confidentiel des déclarations, on ne dispose pas de précisions supplémentaires sur les quantités de TDI correspondant à chacun des numéros CAS ci-dessus.
Au Canada, les installations industrielles qui fabriquent, traitent ou utilisent de toute autre façon plus de 10 tonnes de TDI par année, soit sous forme de mélanges d’isomères ou d’isomères définis, doivent déclarer à l’Inventaire national des rejets de polluants (INRP) l’ensemble de leurs rejets dans l’environnement et des autres transferts de cette substance. On présente au tableau 5 le sommaire des rejets de TDI des installations industrielles du Canada pour 2002 à 2006, selon l’INRP. On n’a déclaré aucun rejet dans les eaux de surface ou sur les terres pour cette période, mais on a fait état des transferts dans des installations d’élimination des déchets (INRP, 2008).
| Année | 2,4- TDI 584-84-9 |
2,6- TDI 91-08-7 |
Mélanges d'isomères du TDI 26471-62-5 |
Rejets totaux d'isomères du TDI |
|---|---|---|---|---|
| Tonnes | ||||
| 2006 | 0,005 | 0,0 | 2,022 | 2,027 |
| 2005 | 0,002 | 0,0 | 1,479 | 1,481 |
| 2004 | 0,003 | 0,0 | 1,096 | 1,099 |
| 2003 | 0,011 | 0,001 | 1,586 | 1,598 |
| 2002 | 0,106 | 0,001 | 1,232 | 1,339 |
Persistance
On a démontré que la dégradation photolytique indirecte due aux radicaux hydroxyles produits par la lumière dans l’air était une voie de dégradation significative pour le TDI (Pemberton et Tury, 2004). Bien que le TDI réagisse rapidement avec l’eau, Tury et al. (2003) ont observé que sa réaction (hydrolyse) avec l’eau atmosphérique n’était pas significative. Ils ont indiqué que la demi-vie du TDI était de 1,4 jour selon les vitesses de réaction expérimentales, laquelle se compare assez bien avec les valeurs prévues et calculées de 1,7 et de 1,5 jour (voir le tableau 6). On ne croit pas que le TDI réagisse avec d’autres espèces photo-oxydantes dans l’atmosphère, par exemple avec l’ozone (Tury et al., 2003). Selon les résultats disponibles, le TDI n’est pas jugé persistant dans l’air.
| Milieu | Processus du devenir | Valeur ou plage de dégradation | Paramètre de dégradation | Référence |
|---|---|---|---|---|
| [*] Pour une concentration de radicaux hydroxyles de 1,5 × 106radicaux OH/cm3(jour de 12 h). | ||||
| Air | Oxydation atm. par des radicaux OH[*] | 1,7 | demi-vie (jours) | AOPWIN, v. 1.91 (2000) |
| Air | Oxydation atm. par des radicaux OH | 1,5 | demi-vie (jours) | Atkinson (1989), valeur calculée |
| Air | Réaction avec l'ozone | négligeable | demi-vie (jours) | AOPWIN, v. 1.91 (2000) |
| Eau, sol et sédiments | Hydrolyse | moins de 10 min | demi-vie (jours) | HYDROWIN, v. 1.67 (2000) |
| Eau, sol et sédiments | Biodégradation | 15 - 60 | demi-vie (jours) | BIOWIN, v. 4.02 (2000) |
| Eau, sol et sédiments | Biodégradation | 0,002 - 0,2186 | probabilité de biodégradation rapide | BIOWIN v. 4.02 (2000); TOPKAT Aerobic Biodegradability (v.6.2, 2004) |
| Eau, sol et sédiments | Biodégradation (DBO) | plus de 15 | demi-vie (jours) | ASTER, 1999 |
Le modèle de transport et persistance de niveau III (TaPL3) (TaPL3, 2000) n’est pas considéré approprié pour l’estimation de la distance de transport caractéristique (DTC) pour le TDI puisque le domaine d’application du modèle ne couvre pas les substances qui réagissent dans l’eau ou le sol. La DTC est définie comme la distance minimale parcourue dans l’air par 63 % de la substance ou comme la distance que 37 % de celle-ci peut parcourir au-delà de cette distance. Néanmoins, on prévoit des DTC inférieures à 700 km pour les trois substances de TDI, en se basant sur deux facteurs. Le premier facteur est qu’un grand nombre de substances qui ne réagissent pas avec l’eau et le sol qui sont modélisées avec TaPL3 ont des DTC inférieures à 700 km si leur demi-vie dans l’atmosphère est de moins de deux jours (1,4 jour rapporté par Tury et al., 2003; 1,5 jours calculé selon Atkinson, 1989 et 1,7 jour prédit par AOPWIN, 2000). Le second facteur est que lorsqu’une substance comme le TDI se transforme en d’autres formes dans l’eau et le sol, la chance pour que la substance entre de nouveau dans l’atmosphère à partir de l’eau ou du sol est réduite et ceci se traduit par un potentiel de transport à grande distance réduit. En se fondant sur les critères proposés par Beyer et al. (2000), une DTC supérieure à 2000 km représente un potentiel de transport atmosphérique à grande distance (PTAGD) élevé, une DTC de 700 à 2000 km un PTAGD modéré et une DTC inférieure à 700 km un faible PTAGD. Le potentiel de transport sur longue distance pour le TDI est jugé faible (<700 km). Ceci indique qu’il n’est pas attendu que le TDI soit capable d’atteindre des aires loin de sa source d’émission.
Dans les milieux où de l'eau est présente (p. ex. les étendues d'eau, les sols humides, les sédiments), on estime que le TDI est un composé transitoire, avec une demi-vie inférieure à une minute (Yakabe et al., 1999). La réaction d'une amine avec un isocyanate est plus rapide que l'hydrolyse de l'eau en présence d'un isocyanate qui, dans le cas des diisocyanates semblables au TDI, produit surtout des polyurées (Yakabe et al., 1999; Pemberton et Tury, 2004).
Dans de nombreuses études, on a bien documenté l'hydrolyse des diisocyanates aromatiques et leur réaction rapide dans l'eau et le sol (Pemberton et Tury, 2004; Heimbach et al., 1996; Yakabe et al., 1999; Tury et al., 2003).
Si l’on applique la méthode du poids de la preuve aux données ci-dessus, le TDI ne répond aux critères de la persistance ni pour l’air (demi-vie supérieure ou égale à 2 jours), ni pour l’eau ou le sol (demi-vie supérieure ou égale à 182 jours), ni pour les sédiments (demi-vie supérieure ou égale à 365 jours), qui sont énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Bioaccumulation
Les données modélisées semblent indiquer que le TDI a un potentiel nul de bioaccumulation dans l'environnement (voir le tableau 7). étant donné le caractère fortement réactif des diisocyanates, les composés du TDI sont vraisemblablement métabolisés ou dégradés à des vitesses suffisamment élevées pour annuler tout potentiel de bioaccumulation ou de bioamplification. De plus, ils sont vraisemblablement hydrolysés dans les voies gastro-intestinales, ce qui réduit leur potentiel d'absorption dans les viscères (Yakabe et al., 1999; Pemberton et Tury, 2004; PISSC, 1987; PISSC, 1997).
| Organisme d'essai | Paramètre | Valeur en poids humide (L/kg) | Référence |
|---|---|---|---|
| Poisson | FBA | 380 | Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | FBC | 151-1 183 | Gobas BCF T2LTL (Arnot et Gobas, 2003); OASIS, v.1.20 (2005); BCFWIN, v.2.15 (2000) |
Les données expérimentales du facteur de bioconcentration (FBC) du 2,4-toluènediamine (un produit d’hydrolyse), qui vont de moins 5 à moins 50 (MITI, 1992), semblent indiquer que ce produit ne devrait pas non plus s’accumuler dans les organismes.
Selon la méthode du poids de la preuve, le TDI ne répond pas au critère de la bioaccumulation (FBC ou FBA [facteur de bioaccumulation] supérieur ou égal à 5 000) énoncé dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
On prévoit que les rejets industriels de TDI se feront surtout dans l'air, dont la demi-vie devrait être inférieure à 2 jours à cause de sa dégradation photolytique (voir ci-dessus). À cause de son hydrolyse rapide, la durée du TDI est éphémère dans l'eau, les sols humides et les sédiments. Pour cette raison, on estime qu'il n'est pas utile de modéliser son devenir dans l'environnement afin d'estimer sa répartition dans les milieux naturels.
Comme il est indiqué précédemment, le TDI ne remplit pas les critères de persistance ou du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
À cause de l’existence transitoire du TDI dans le milieu aqueux, en incluant les sols humides, il est improbable que les effets sur l’environnement soient déclenchés par les composés d’origine du TDI. Des données écotoxicologiques expérimentales pour le TDI et ses produits de dégradation (CL50 et CE50 pour les daphnies, crevettes et algues > 1 mg/L; Tadokoro et al. 1997; Curtis et al. 1978; Agence de protection de l’environnement du Danemark, 1998; MITI, 1992) indiquent des toxicités faibles à modérées pour les organismes aquatiques. D’autres données de toxicité suggèrent une faible probabilité d’effets pour les biotes terrestres, comme les plantes, les vers de terre (CSEO, CE50 et CL50 >1000 mg/L; Van der Hoeven et al.,1992a,b) et les oiseaux (CL50 de ≥100 mg/kg de masse corporelle pour Agelaius phoenicens exposé au 2,4-TDI et au 2,6-TDI; tel que cité dans IUCLID 2000).
L’INRP a indiqué que 2 200 kg du mélange d’isomères étaient rejetés (92 % dans l’air et 8 % dans un milieu non spécifié) en 2006 (INRP, 2008). étant donné la nature dispersive de ces rejets, il est peu probable qu’ils résultent en une exposition significative pour les organismes dans l’environnement.
En se fondant sur les renseignements disponibles, il est peu probable que le TDI cause des dangers écologiques au Canada.
évaluation de l'exposition
Milieux naturels et régime alimentaire
On n’a pas trouvé de concentrations mesurées de diisocyanate de toluène pour les milieux naturels ni pour les sources alimentaires du Canada. Des rapports faisant état de concentrations de TDI dans l’air extérieur, près d’une usine de fabrication de la Caroline du Nord (états-Unis) fermée par la suite (Levine et al., 2001), n’ont pas été jugés représentatifs des valeurs d’exposition du Canada.
Plutôt que d’estimer la répartition du TDI dans les milieux naturels par modélisation, on a évalué sa concentration maximale dans l’air en amont d’une usine de fabrication du Canada. L’International Isocyanate Institute a estimé que, dans l’industrie européenne, 25 grammes de TDI sont rejetés dans l’atmosphère par tonne de TDI utilisée pour la production de mousse de polyuréthane souple (Chapman, 1994). La modélisation de sa concentration dans l’air ambiant à 100 mètres d’un bâtiment peu élevé sans cheminée à l’aide d’un modèle EUSES (European Union System for the Evaluation of Substances) prévoyait une concentration annuelle dans l’air de 6,7 × 10-3 µg/m3 pour une usine à rejet continu de TDI de 8,8 kg/an (Tury et al., 2003). Une usine canadienne a déclaré un rejet de 1 400 kg de mélanges d’isomères du TDI dans l’air pour 2006 (INRP, 2008. En extrapolant le résultat de Tury et al., la concentration moyenne annuelle estimée de TDI dans l’air à 100 mètres de l’usine est de 1,06 µg/m3. On s’attend à ce que les concentrations à court terme dans l’air varient par rapport à cette moyenne à cause des cycles de production, de la hauteur de la cheminée de l’usine, du vent, de la topographie locale et d’autres facteurs. En outre, cette concentration de TDI dans l’air est une estimation prudente qui ne s’applique qu’à la population du voisinage de l’usine. Les rejets industriels de TDI au Canada se font surtout dans l’air et on s’attend à ce que la plus grande partie du TDI qui y est rejeté y demeure à l’état de vapeur et réagisse principalement avec des radicaux hydroxyles produits par photolyse, ce qui se traduit par une demi-vie inférieure à deux jours (Tury et al., 2003; Atkinson, 1989).
Les limites supérieures estimées de l’exposition au TDI dans les milieux naturels étaient comprises entre 0,21 µg/kg-p. c. (kilogramme de poids corporel) par jour pour les personnes âgées de 60 ans et plus et 0,64 µg/kg-p. c. par jour pour les enfants âgés de 6 mois à 4 ans (voir l’annexe 1).
Produits de consommation
L’utilisation de produits de consommation peut contribuer à l’exposition de personnes au TDI. À l’aide d’un bloc à indicateur de couleur enduit de solvant, on a décelé la présence d’isocyanate libre sur la surface de mousse de polyuréthane durcie vieillie de 1 à 30 ans, mais cet essai n’était pas propre au TDI. . Les échantillons de PUF étaient déchiquetés et soumis à une extraction par solvant, et l’extrait était analysé. On a dosé le TDI et tous les groupes isocyanate du réactif dans les extraits (Krone et al., 2003). Au cours d’un autre essai, les isomères 2,4- et 2,6- du TDI ont été extraits par solvant de la mousse de polyuréthane, identifiés positivement et dosés avec une précision de l’ordre du nanogramme par gramme de mousse (Gagné et al., 2003). Les amines 2,4- et 2,6-toluènediamine, qui peuvent être présentes à cause de l’hydrolyse des isomères 2,4- et 2,6-diisocyanate de toluène, ont aussi été extraites de la mousse de polyuréthane (Marand et al., 2004). Ces expériences indiquent que le TDI et les amines qui en dérivent peuvent migrer de la mousse de produits de consommation et devenir ainsi disponibles pour l’absorption cutanée ou orale.
Il est impossible de quantifier la mesure dans laquelle l’utilisation de solvants peut contribuer à améliorer l’extraction du TDI de la PUF.
Selon un essai au cours duquel de l’air humidifié était aspiré à travers des pièces de mousse chargées de 1 ppm de TDI et laissées au repos pendant 3 jours, 99,9% du TDI était retenu dans la mousse (Hugo et al., 2000).
D’autres résultats expérimentaux indiquent que le TDI dans la mousse de polyuréthane ne se volatilise pas en quantités mesurables après une période initiale de durcissement de plusieurs jours (Kelly et al., 1999; Katsuyama et al., 2003). Kelly et al. (1999) ont examiné un certain nombre de produits de consommation à base de polyuréthane qui sont fabriqués avec le TDI, notamment les sous-tapis, le capitonnage des meubles, les feuilles de mousse, les vernis et les matériaux d’étanchéité, et ils n’ont mis en évidence aucune émission détectable d’isocyanate à un taux d’émission supérieur à 0,96 µg/m2/h pour des revêtements appliqués sur des surfaces ou pour la mousse de polyuréthane. De plus, Kelly et al. (1999) ont estimé la concentration à l’équilibre dans l’air des maisons, fondée sur la limite de détection de la méthode expérimentale utilisée pour la présente étude, et ils ont conclu que la plus forte concentration à l’équilibre dans l’air des maisons ne devrait pas dépasser 0,19 µg/m3 pour l’application d’un revêtement de polyuréthane.
Selon une étude des produits de consommation effectuée par Katsuyama et al. (2003), on n’a mesuré aucune émission de TDI supérieure aux limites de détection alors que des adhésifs, des peintures et des vernis à base d’uréthane étaient soumis à l’essai; toutefois, on a noté la présence de TDI si de la mousse de polyuréthane rigide était placée dans une atmosphère contenant des vapeurs d’acétone. Les chercheurs ont estimé le taux de rejet de TDI et, d’après les valeurs moyennes de volume et de débit de ventilation des maisons japonaises, ils ont obtenu une concentration à l’équilibre de 2,4-TDI de 4,28 x 10-2 ppm (305 µg/m3) pour ces maisons. étant donné que les feuilles de mousse de polyuréthane rigide ne sont pas un matériau de construction largement utilisé en construction domiciliaire au Canada et que la concentration d’acétone dans l’air utilisée pour cette expérience ne représente pas des conditions domestiques normales, les valeurs d’exposition décrites par Katsuyama et al. (2003) n’ont pas été jugées pertinentes.
On a démontré expérimentalement que les peintures à base d’isocyanate pour les planchers de béton et les scellants pour terrasse émettent des concentrations mesurables de 2,6-TDI dans l’air après l’application du revêtement (Kelly et al., 1999; Jarand et al., 2002). Bien que les concentrations de TDI dans l’air mesurées durant ces expériences dans des petites enceintes à milieu contrôlé ne puissent être extrapolées pour les expositions domestiques, on peut utiliser les concentrations de TDI dans les revêtements et le pourcentage de TDI rejeté dans l’air pour modéliser l’exposition.
On a utilisé les données de Jarand et al. (2002) pour estimer la concentration maximale de 2,6-TDI dans une pièce pendant et après (cinq heures après) l’application d’un scellant à base de polyuréthane à deux composants sur un plancher de béton, et on a obtenu une concentration estimée de TDI dans l’air de 24 µg/m3. La dose reçue par un adulte effectuant un travail léger pendant une heure était estimée à 0,44 µg/kg-p. c. par jour. Selon un second scénario utilisant les données sur les émissions de 2,6-TDI d’un scellant pour béton, mesurées par Kelly et al. (1999), on a obtenu une valeur d’absorption quotidienne estimée très supérieure pour une période d’une heure. Toutefois, les auteurs ont déclaré que le produit soumis à l’essai par Kelly et al. (1999) n’était commercialisé que par des entrepreneurs agréés. étant donné les incertitudes concernant la disponibilité de ce scellant à base de TDI dans le commerce de détail au Canada, on n’a retenu que le scénario fondé sur les résultats obtenus par Jarand et al. (2002). Il a été établi que le produit soumis à l’essai par Jarand et al.(2002) était disponible chez les détaillants canadiens en 2008. L’exposition cutanée, qui pourrait être due à l’utilisation du scellant pour béton, n’a pas été évaluée dans le cadre de ces scénarios; elle pourrait constituer une voie supplémentaire d’exposition.
Il faut aussi noter que cette valeur de dose estimée est une dose d’exposition d’une heure et que la fréquence de l’application de ce scellant est relativement faible (probablement moins d’une fois tous les 3 à 5 ans).
Si on élabore un scénario pour l’exposition des nourrissons qui mettent dans leur bouche des objets comportant de la mousse de polyuréthane (p. ex. des parties d’oreillers), avec une valeur de 7,8 ng de TDI libéré par gramme de mousse (Gagné et al., 2003), on obtient une valeur d’absorption estimée de 0,1 ng/kg-p. c. par jour. Il s’agit d’une surestimation de l’exposition, car les conditions d’extraction dans la bouche sont beaucoup plus douces que celles supposées par Gagné et al. (2003). Il faut aussi noter que cette valeur d’exposition estimée ne tient pas compte de la réactivité du TDI avec la salive. On croit que la quantité disponible de TDI pour l’ingestion est plus petite que la valeur de 0,1 ng/kg-p. c. par jour estimée pour ce scénario. L'absorption estimée de 0,1 ng/kg-p. c. par jour du scénario de mousse dans la bouche correspond à moins de 1 % de l’absorption estimée à partir de l’air ambiant et intérieur pour le groupe d’âge de 6 mois à 4 ans; on la juge donc négligeable.
On décrit les scénarios d'exposition dans l'annexe 2.
On estime que le niveau de confiance à l’égard de la base de données sur l’exposition est très faible. On n’a pas trouvé de données sur les concentrations de diisocyanate de toluène utilisées pour estimer l’exposition humaine dans aucun des milieux naturels. De même, le niveau de confiance relatif aux valeurs d’exposition estimées pour l’utilisation de produits de consommation est faible à cause de l’incertitude concernant l’accès des consommateurs à des revêtements de surface à base d’uréthane contenant du TDI.
évaluation des effets sur la santé
L'annexe 3 présente un sommaire des renseignements disponibles concernant les effets sur la santé du diisocyanate de toluène. La plus grande partie de ces données pour le TDI portent sur les mélanges d'isomères.
Le Centre international de recherche sur le cancer (CIRC) a classé le diisocyanate de toluène dans la catégorie des « cancérogènes possibles pour l’homme » (Groupe 2B pour la cancérogénicité), selon des résultats d’études de cancérogénicité des diisocyanates de toluène non concluants pour les humains, mais concluants pour des animaux de laboratoire (CIRC, 1986; CIRC, 1999). Le TDI a aussi été classé par la Commission européenne (CE) dans la catégorie 3 pour la cancérogénicité (« substances préoccupantes pour l’homme en raison d’effets cancérogènes possibles ») [Commission européenne, 1997, 2004; ESIS, v.4.50, 2006]; selon le National Toxicology Program (NTP) des états-Unis, il s’agit d’une substance dont on peut raisonnablement prévoir qu’elle est cancérogène pour les humains (NTP, 2005). Ces classements étaient fondés sur des accroissements notables de l’incidence des tumeurs dans de nombreux organes chez des souris et des rats exposés par gavage oral pendant deux ans. Les souris femelles exposées par voie orale à 60 ou à 120 mg TDI/kg-p. c./j présentaient un taux notablement supérieur d’adénomes hépatocellulaires et d’hémangiomes combinés (rate et tumeurs sous-cutanées), ainsi que d’hémangiosarcomes (foie, ovaires, péritoine) [NTP, 1983]. Des rates exposées par voie orale à 60 ou à 120 mg TDI/kg-p. c./j présentaient des taux notablement supérieurs de fibroadénomes des glandes mammaires et d’adénomes des cellules des îlots pancréatiques; chez des rats mâles exposés à 30 ou à 60 mg TDI/kg-p. c./j, on observait un accroissement des fibromes et des fibrosarcomes sous-cutanés (significatifs si on les combine), ainsi que des adénomes des cellules acinaires pancréatiques (significatifs à la dose la plus élevée) [NTP, 1983]. Pour chacune de ces études, on observait un accroissement des tumeurs à la plus faible concentration d’exposition soumise à l’essai. Les souris mâles exposées à une dose pouvant atteindre 240 mg TDI/kg-p. c./j n’ont pas développé de tumeurs liées à l’exposition (NTP, 1983).
On n’a pas observé de tumeurs liées à l’exposition chez les souris et les rats exposés à 0,36 et à 1,07 mg TDI /m3 par inhalation pendant 2 ans (Loeser, 1983). Le Programme international sur la sécurité des substances chimiques (PISSC, 1987) a noté qu’on n’a probablement pas administré aux animaux de cette étude la dose maximale tolérée; il se peut donc que la dose la plus élevée ait été insuffisante pour détecter une réponse. Toutefois, ce résultat était fondé sur des changements de poids corporel, et non sur d’autres effets. On a également noté un taux de mortalité élevé inexpliqué chez des animaux du groupe témoin et des groupes traités, ce qui réduisait la sensibilité de l’essai biologique. Bien que Loeser (1983) signale une augmentation significative de la mortalité des souris femelles aux deux doses, l’Environmental Protection Agency des états-Unis (US EPA, 1995) a conclu qu’on n’avait pas observé d’effets liés à l’exposition sur la mortalité, le poids des organes ou d’autres paramètres chimiques cliniques chez les rats ou les souris. Owen (1984) présente des résultats histopathologiques obtenus pour les voies nasales des rats de cette étude. La concentration minimale avec effet nocif observé (CMENO) était de 0,36 mg/m3 chez les rats, d’après une augmentation liée à la dose dans l’incidence et la gravité de la rhinite chronique et nécrotique chez les rates. On a également signalé des effets semblables chez les souris, mais le degré de précision était insuffisant pour l’établissement des concentrations efficaces.
Le CIRC (1999) a conclu que, chez les humains, il n’y avait aucune association marquée ou profil cohérent montrant la cancérogénicité de l’exposition au TDI par inhalation, selon trois études de cohortes industrielles et une étude cas-témoin de la population (Hagmar et al., 1993a et 1993b; Sorahan et Pope, 1993; Schnorr et al.,1996). Ces études peuvent être de valeur limitée à cause de la petite taille des échantillons, des périodes de suivi relativement courtes, de la jeunesse des cohortes et de la non-prise en compte de l’usage du tabac (Bolognesi et al., 2001). L’examen de Bolognesiet al. (2001) a conclu que les données expérimentales et les éléments probants disponibles concernant les humains sont inadéquats pour l’évaluation du risque de cancérogénicité du TDI pour ces derniers.
Bien que des études épidémiologiques plus récentes soient disponibles (Kerr et al., 2000; Mikoczy et al., 2004; Sorahan et Nichols, 2002; Clark et al., 2003), aucune évaluation internationale n’est disponible pour ces données mises à jour et des analyses complètes du poids de la preuve de l’ensemble des données épidémiologiques ne sont pas possibles dans le cadre de la présente évaluation préalable.
En se fondant sur l’étude de la cancérogénicité par voie orale chez des rats mâles qui est résumée ci-dessus (NTP, 1983 et 1986), l’EPA de la Californie a calculé, pour le TDI, un facteur d’estimation de risque du cancer par projection linéaire par voie orale et un facteur unitaire connexe de risque de cancer pour l’exposition par inhalation à l’aide de la méthode de l’extrapolation des voies comparées et de la méthode « Expedited Proposition 65 » de l’EPA de la Californie (California EPA, 1999).
On a obtenu des résultats contrastés pour le TDI d’après les épreuves de génotoxicité in vivo et in vitro (annexe 3). Selon des essais in vivo, le TDI provoquait des mutations liées au sexe chez les drosophiles (exposition par voie orale), mais non l’apparition de micronoyaux chez les souris ou d’érythrocytes chez les rats (exposition par inhalation). Selon une étude sur l’exposition humaine, les travailleurs exposés à un mélange d’isomères du TDI dans l’air présentaient une augmentation statistiquement significative d’aberrations structurelles des chromosomes, des échanges de chromatides soeurs et des micronoyaux dans les lymphocytes sanguins périphériques, par rapport aux témoins (Bilban, 2004). Toutefois, des échantillons de petite taille ayant servi à cette étude, les sujets peuvent avoir été soumis par exposition professionnelle à de nombreuses substances chimiques en plus du TDI; en outre, l’usage du tabac n’a pas été pris en compte. Des études faites avec des tailles d’échantillon plus petites ont donné des résultats négatifs pour les ruptures de brins d’ADN dans les lymphocytes des travailleurs (Marczynskiet al., 2003 et 2005). Certaines études in vitrodes mutations induites par le TDI font état de dommages de l’ADN, d’aberrations chromosomiques et d’échanges de chromatides sœurs, alors que d’autres n’en signalent pas. Bolognesi et al. (2001) ont indiqué que la stabilité du diisocyanate appliqué n’a pas été étudiée dans le cadre des études in vitro, et que les espèces réactives pourraient ne pas être les mêmes que celles des études in vivo. Toutefois, les auteurs ont conclu que le TDI était « probablement génotoxique » à cause de ses réactions possibles avec l’ADN.
Les principaux organes cibles pour les effets non néoplasiques de l’exposition au TDI par inhalation, par voie cutanée et par voie orale étaient les poumons et les voies respiratoires. L’exposition au TDI par inhalation et par voie cutanée entraîne une hypersensibilité respiratoire. Un examen de l’exposition cutanée aux isocyanates a permis d’établir que de nombreux éléments de preuve d’études sur les animaux et sur les humains, ainsi que d’études de biomarquage, indiquent que dans certains milieux d’exposition, la peau humaine est vraisemblablement une importante voie d’exposition à l’isocyanate, qui peut contribuer au développement de cas d’asthme causés par l’isocyanate (Bello et al., 2007). L’Union européenne (Commission européenne, 1997 et 2004; ESIS, 2006) a classé le TDI pour la sensibilisation par contact cutané et par inhalation (« substance qui peut causer la sensibilisation par inhalation ou par contact cutané »). Les concentrations et les conditions d’exposition exactes qui causent la sensibilisation n’ont pas été déterminées. Toutefois, chez des animaux de laboratoire, on a observé que des expositions simples à des concentrations aussi faibles que 0,3 mg/m3 induisaient une hypersensibilité respiratoire chez des cobayes déjà sensibilisés (Karol et al., 1981); dans le cas des humains, des expositions simples à 1 ppm 109 (0,007 mg/m3) induisaient une réponse asthmatique chez des personnes déjà sensibilisées (Lemièreet al., 2002; Ott et al., 2003). Cela a été observé chez des humains qui avaient déjà été exposés au TDI dans leur milieu de travail, alors que chez des humains souffrant d’asthme pour d’autres causes que leur milieu de travail, on a observé une sensibilisation au TDI au cours d’essais contrôlés à des concentrations aussi faibles que 10 ppb (0,07 mg/m³) (Ottet al., 2003). Ainsi, selon les données obtenues pour les humains et les données expérimentales sur les animaux, on estime, aux fins de la présente étude, que les concentrations comprises entre 0,007 et 0,07 mg/m³ sont des valeurs critiques pour l’exposition aiguë.
Il faut noter qu’on a signalé des cas d’asthme professionnel dus à une exposition excessive aux diisocyanates dans des usines de production de polyuréthane (Cragg, 2001). Aussi, des éléments de preuve indiquent que les symptômes de l’asthme peuvent persister chez la moitié des personnes souffrant d’asthme dû au TDI qui ont évité de s’exposer à cette substance en milieu de travail pendant plus de deux ans et qui ont pris des médicaments antiasthmatiques (Krone et Klingner, 2005).
La concentration minimale avec effet observé (CMEO) pour une exposition par inhalation répétée au TDI était de 1,9 ppm [concentration équivalente pour les humains de 0,014 mg/m3 calculée par l’US EPA (1995)], sur la base d’une diminution notable de la fonction pulmonaire chez les humains selon une étude prospective de cinq ans dans le secteur professionnel (Diem et al., 1982), qui est l’étude critique utilisée par l’EPA (1995) afin de déterminer la concentration de référence pour l’inhalation chronique (RfC). Dans cette évaluation, la valeur de 0,014 mg/m3 est considérée comme une dose à effet critique pour l’exposition chronique. L’EPA a examiné plusieurs autres études épidémiologiques à long terme, mais l’étude de Diem et al. (1982) a été sélectionnée car c’est la seule à partir de laquelle on pouvait établir une concentration sans effet observé (CSEO), soit 0,006 mg/m3, et une CMEO. L’EPA a noté des difficultés et des incertitudes associées à l’évaluation quantitative de l’exposition au TDI dans les études épidémiologiques. On a aussi observé des effets sur le système respiratoire chez des animaux de laboratoire exposés par inhalation à des concentrations de TDI de 5 à 26 fois supérieures à 0,014 mg/m3 (CMENO de 0,36 mg/m3 pour l’étude de toxicité chronique chez les rats; CMEO de 0,07 mg/m3 pour l’étude de 5 jours avec les cobayes).
La dose minimale avec effet observé (DMEO) pour l’exposition par voie orale au TDI était de 30 mg/kg-p. c./j, sur la base de cas de bronchopneumonie, de diminution du gain de poids corporel et de mortalité chez des rats exposés par gavage pendant deux ans (NTP, 1986). On a aussi observé des changements microscopiques dans les poumons et la trachée à cette dose d’exposition au cours d’une étude de 28 jours sur des rats (ministère de la Santé, du Travail et du Bien-être (MHLW) du Japon, 2005).
Le niveau de confiance à l’égard de la base de données sur la toxicité est moyen à cause de la disponibilité limitée des données sur la toxicité aiguë, la toxicité des doses répétées, la cancérogénicité, la génotoxicité, ainsi que sur la toxicité pour la reproduction et le développement.
Bien qu’une analyse exhaustive du mode d’action du TDI dépasse le cadre de cette évaluation préalable, on reconnaît que la voie d’exposition au TDI peut avoir une influence sur la tumorigenèse. Dans les cas d’une exposition par voie orale, le TDI hydrolysé dans l’estomac est converti en toluènediamine (TDA). Dans les cas d’une exposition par inhalation, le TDI est absorbé dans les voies respiratoires supérieures, ce qui entraîne la formation de conjugats labiles en milieu acide, ainsi que la formation d’un peu de diamine. La formation différentielle de TDA par ces deux voies d’exposition peut jouer un rôle dans le mécanisme selon lequel le TDI a une action cancérogène chez les souris et les rats par voie orale, mais non si l’exposition se fait par inhalation (Doe et Hoffman, 1995; CIRC, 1999; Collins, 2002). Toutefois, on ne peut écarter la possibilité d’occurrence de néoplasmes dus à l’exposition par inhalation, étant donné qu’on ne sait pas avec certitude si les doses tolérables maximales ont été atteintes au cours des études de toxicité chronique par inhalation.
Caractérisation des risques pour la santé humaine
Selon les évaluations de plusieurs organismes internationaux (le CIRC, l’UE et le NTP des é.-U.), ainsi que selon une étude indépendante effectuée par un groupe d’experts de plusieurs pays (Bolognesi et al., 2001), parce que les données épidémiologiques disponibles pour les humains et les données expérimentales de toxicité par inhalation pour les animaux sont équivoques, elles sont inadéquates pour déterminer le risque de cancérogénicité de l’exposition au TDI par inhalation chez les humains. Selon une approche fondée sur le principe de prudence, on estime que le TDI est cancérogène, étant donné que le dosage oral de cette substance a été associé à l’apparition de tumeurs dans plusieurs organes chez des animaux. Des épreuvesin vivo et in vitro de génotoxicité du TDIont donné des résultats très variables. Par conséquent, bien que le mode d’induction des tumeurs n’ait pas été complètement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez les animaux de laboratoire résultent de l’interaction directe avec le matériel génétique. L’EPA de la Californie a utilisé une approche semblable dans son évaluation, étant donné qu’on a extrapolé les résultats des données de l’étude de cancérogénicité orale chez des rats pour calculer le facteur unitaire de risque de cancer pour l’inhalation de TDI (EPA de la Californie, 1999).
Pour les effets non cancérogènes, le TDI a été classé par l’Union européenne dans la catégorie des sensibilisants de la peau et des voies respiratoires. Pour ce qui est des effets non cancérogènes, en comparant la dose à effet critique pour les effets chroniques non néoplasiques par inhalation chez les humains (14 µg/m3) et la limite supérieure prudente estimée de l’exposition par inhalation pour le TDI (1,06 µg/m3), on obtient une marge d’exposition d’environ 13 dans le voisinage d’une usine utilisant du TDI.
Dans la présente évaluation, on estime que les valeurs comprises entre 0,007 et 0,07 mg/m³ correspondent à la concentration à effet critique pour l’exposition aiguë. Aussi, la CMEO la plus faible déterminée pour les effets non néoplasiques subchroniques à court terme est de 0,07 à 0,14 mg/m³, selon les effets sur le système respiratoire observés au cours d’une étude de 5 jours chez les cobayes, d’une étude de 6 mois chez les rats et d’une étude de 10 mois chez les chiens. On doit utiliser cette même gamme de 0,07 à 0,14 mg/m³ pour la population humaine. Il faut noter que ces concentrations sont de 2,5 à 150 fois inférieures aux concentrations utilisées au cours des études d’inhalation à long terme chez les rats et les souris (0,36 et 1,07 mg/m3).
En comparant la dose à effet critique par inhalation pour les effets aigus non néoplasiques chez les humains sensibilisés (7 à 70 µg/m3) et la limite supérieure prudente estimée de l’exposition par inhalation pour le TDI dans les produits de consommation (24 µg/m3), on obtient des marges d’exposition de < 1 à 2,9.
En comparant la dose à effet critique par inhalation pour les effets subchroniques non néoplasiques à court terme chez le grand public (de 70 à 140 µg/m3) et la limite supérieure prudente estimée de l’exposition par inhalation pour le TDI dans les produits de consommation (24 µg/m3), on obtient des marges d’exposition de 2,9 à 5,8.
Par conséquent, la marge d’exposition pour les effets non néoplasiques et l’exposition du grand public par inhalation, ainsi que pour les scénarios d’exposition par les produits de consommation (même s’il s’agit d’évaluations prudentes), n’est pas utile pour tenir compte des incertitudes inhérentes aux bases de données relatives à l’exposition et aux effets.
Incertitudes relatives à l'évaluation des risques pour la santé humaine
L'estimation de l'exposition humaine aux isomères du diisocyanate de toluène est très incertaine. Les données sur les concentrations de TDI dans les milieux naturels n'étaient pas représentatives de l'exposition quotidienne au Canada ou dans d'autres pays. La modélisation de la répartition environnementale du TDI au Canada n'a pas été évaluée à cause du fort degré de réactivité de cette substance dans l'eau, les sédiments et les sols humides, et les résultats des études de modélisation de la fugacité pourraient ne pas être significatifs. On a utilisé la modélisation de la concentration du TDI à 100 mètres d'une usine de mousse de polyuréthane afin d'obtenir une limite supérieure estimée de la concentration de TDI dans l'air ambiant et intérieur pour une sous-population exposée. Dans ces conditions, la concentration de TDI dans l'air intérieur pourrait être inférieure à celle dans l'air ambiant. Ces simplifications pourraient contribuer à surestimer l'exposition quotidienne.
Les valeurs estimées de l’exposition due à l’utilisation de produits de consommation sont incertaines, car la concentration de TDI dans une gamme de ces produits de consommation n’est pas connue avec certitude, mais on a établi qu’un revêtement de surface contenant jusqu’à 3 % de TDI était disponible pour les consommateurs canadiens.
Cette évaluation préalable ne prend pas en compte l’analyse complète des mécanismes d’action du TDI. Le mécanisme de tumorigenèse déclenché par le TDI après l’exposition est source d’incertitude. Pour ce qui est des effets signalés pour les humains déjà sensibilisés, ils pourraient survenir à un niveau d’exposition inférieur à celui des effets déclarés pour les humains non sensibilisés. Toutefois, dans le cas des études à court terme portant sur des animaux de laboratoire non sensibilisés, on note des effets à des valeurs d’exposition qui ne dépassent que d’un ordre de grandeur celles rapportées pour des humains sensibilisés.
Compte tenu de l’information disponible, on conclut que le TDI ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique et à mettre en danger l'environnement essentiel pour la vie.
Compte tenu de la cancérogénicité du TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène, pour lequel il pourrait exister une probabilité d’effets nocifs à tout niveau d’exposition, et de l’inadéquation possible des marges entre l’exposition estimée à partir des produits et du niveau critiques pour les effets non cancérogènes, il est conclu que le TDI (mélange d’isomères), du 2,4-diisocyanate de toluène et du 2,6-diisocyanate de toluène sont des substances qui peuvent pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaines.
Il est donc proposé de conclure que le TDI ne remplit pas les critères énoncés aux alinéas 64a) et b) de la LCPE (1999), mais qu’il remplit ceux énoncés à l’alinéa 64c) de la Loi. De plus, cette substance remplit le critère de la persistance, mais ne satisfait pas au critère du potentiel de bioaccumulation énoncé dans le Règlement sur la persistance et la bioaccumulation.
[ACIA] Agence canadienne d’inspection des aliments. 2007. Liste de référence pour les pièces de matériaux de construction, les matériaux d’emballage et les produits chimiques non alimentaires acceptés. Consulté en juillet 2007.
Allport D. C., Gilbert D. S., Outterside S. M., éditeurs. 2003. MDI and TDI: Safety, health and the environment: a source book and practical guide. Chichester (GB).
Andersen M., Binderup M.-L., Kiel P., Larsen H., Maxild J. 1980. Mutagenic action of isocyanates used in the production of polyurethanes. Scand. J. Work Environ. Health 6:221-226.
Anderson D., Styles J. A. 1978. The bacterial mutation test. Six tests for carcinogenicity. Br J Cancer 37(6):924-930.
[AOPWIN] Atmospheric Oxidation Program for Windows. 2000. Version 1.91. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Arnot J. A., Gobas FAPC. 2003. A generic QSAR for assessing the bioaccumulation potential of organic chemicals in aquatic food webs. QSAR Comb Sci 22(3):337-345.
[ASTER] Assessment Tools for the Evaluation of Risk. 1999. Model developed by the Office of Research and Development, National Health and Environmental Effects Research Laboratory. Mid-Continent Ecology Division, US Environmental Protection Agency, Duluth, Minnesota.
Atkinson, R. 1989. Kinetics and mechanisms of the gas-phase reactions of the hydroxyl radical with organic compounds. J. Phys. Chem. Ref. Data Monograph No 1.
Ban M., Morel G., Longonne I., Huguet N., Pepin E. et Binet S. 2006. TDI can induce respiratory allergy with Th2-dominated response in mice. Toxicology 218: 39-47.
[BCFWIN] BioConcentration Factor Program for Windows. 2000. Version 2.15. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Benoit, F. 2004. Degradation of polyurethane foams used in the Même breast implant. J Biomedical Materials Res 27:1341-1348.
Bello D., Herrick C. A., Smith T. H., Woskie S. R., Streichner R. P., Cullen M. R., Liu Y. L. et Redlich C. A. 2006. Skin exposure to isocyanates: Reasons for concern. Environmental Health Perspectives 115: 328-335.
Beyer A., Mackay D., Matthies M., Wania, F., Webster, E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ Sci Technol 34(4): 699-703.
Bilban M. 2004. Mutagenic testing of workers exposed to toluene-diisocyanates during plastics production process. Am J Ind Med 45(5):468-474.
[BIOWIN] Biodegradation Probability Program for Windows. 2000. Version 4.02. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
Bolognesi C., Baur X., Marczynski B., Norppa H., Sepai O., Sabbioni G. 2001. Carcinogenic risk of toluene diisocyanate and 4,4'-methylenediphenyl diisocyanate: epidemiological and experimental evidence. Crit. Rev. Toxicol. 31: 737-772.
[CalEPA] California Environmental Protection Agency. 1999. Air Toxics Hot Spots Program Risk Assessment Guidelines: Partie II. Technical Support Document for Describing Available Cancer Potency Factors. Berkley (CA): Office of Environmental Health Hazard Assessment.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999). Lois du Canada. Ottawa, Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie III, vol. 22, n° 3.
Canada. 2000. Règlement sur la persistance et la bioaccumulation. Ottawa, Travaux publics et Services gouvernementaux Canada.Gazette du Canada Partie II, vol. 134, n° 7.
[Canada] Ministère de l’Environnement; ministère de la Santé. 2006. Loi canadienne sur la protection de l’environnement (1999): Avis d’intention d’élaborer et de mettre en oeuvre des mesures d’évaluation et de gestion des risques que certaines substances présentent pour la santé des Canadiens et leur environnement. Ottawa, Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie I, vol. 140, n° 49.
[Canada] Ministère de l'Environnement; ministère de la Santé. 2007a. Loi canadienne sur la protection de l'environnement (1999) : Avis concernant certaines substances de la Liste intérieure des substances (LIS). Ottawa, Travaux publics et Services gouvernementaux Canada. Gazette du Canada Partie I, vol. 141, n° 5.
[Canada] Ministère de l'Environnement; ministère de la Santé. 2007b. Profil de substances pour le Défi - Diisocyanates de toluène ; No CAS 91-08-7, Diisocyanate de 2-méthyl-m-phénylène (2,6-diisocyanate de toluène); No CAS 584-84-9, Diisocyanate de 4-méthyl-m-phénylène (2,4-diisocyanate de toluène); No CAS 26471-62-5, Diisocyanate dem-tolylidène (mélanges d'isomères de diisocyanates de toluène).
Chapman J. F. 1994. European Emissions Project, Phase 1(A) - Gas Emissions Study - A rationale. Manchester (GB): Gilbert International Isocyanates. Rapport No 11157 (cité dans Tury et al., 2003).
Clark R. L., Bugler J., Paddle G. M., Chamberlain J. D. et Allport D. C. 2003. A 17-year epidemiological study on changes in lung function in toluene diisocyanate foam workers. Int Arch Occup Environ Health 76: 295-301.
ChemCAN. 2003. ChemCAN: level III fugacity model of regional fate of chemicals. Version 6.00. Peterborough (ON): Canadian Environmental Modelling Centre, Université Trent.
[CIRC] Centre international de recherche sur le cancer. 1986. Monographs on the evaluation of carcinogenic risk to humans. Volume 39. Some Chemicals Used in Plastics and Elastomers. p. 287-32.
[CIRC] Centre international de recherche sur le cancer. 1999. Monographs on the evaluation of carcinogenic risk to humans. Volume 71 (Part 2). Re-evaluation of some organic chemicals, hydrazine and hydrogen peroxide. p. 865-879.
Collins M. A. 2002. Toxicology of toluene diisocyanate. Appl Occup Envir Hyg 17: 846-855.
Commission européenne. 1997. Summary Record - Toluene di-isocyanates. Commission Working Group on the Classification and Labelling of Dangerous Substances. Réunion de l’ECB-Ispra, du 15 au 21 octobre 1997. Rapport n° ECBI/51/97 - rév. 3.
Commission européenne. 2004. 2-methyl-m-phenylene diisocyanate. 4-methyl-m-phenylene diisocyanate.m-tolylidene diisocyanate. Directive de la Commission 2004/73/EC du 29 avril 2004. Annexe 1A. Journal officiel des Communautés européennes 16.6.2004. L 216/49.
Cragg, S. T. 2001. Polyurethanes, miscellaneous organic polymers, and silicones. In Allan, RE et al, éditors & contributors. Patty's industrial hygiene and toxicology [livre accessible sur Internet]. John Wiley and Sons.
Curtis, M.W., Copeland, T.L. and C.H. Ward. 1978. Aquatic toxicity of substances proposed for spill prevention regulation. In: Proc. Natl. Conf. Control of Hazardous Material Spills, Miami Beach, FL: 99-103.
Damant A. P., Jickells S. M., Castle L. 1995. Liquid chromatographic determination of residual isocyanate monomers in plastics intended for food contact use. J. of AOAC Int. 78(3): 711-719.
Danish Environmental Protection Agency. 1998. Immobilization test of aniline compounds with the crustacean Daphnia magna. Project no. 303587, Agence de protection de l’environnement du Danemark, Copenhague, Danemark. [Cité dans ACC, 2005].
Descotes, J. 1988. Identification of contact allergens: the mouse ear sensitization assay. J. Toxico.l-Cut. Ocular. Toxicol. 7:263-272.
Diem J. E., Jones R. N., Hendrick D. J., Glindmeyer H. W., Dharmarajan V., Butcher B. T., Salvaggio JE, Weill H. 1982. Five-year longitudinal study of workers employed in a new toluene diisocyanate manufacturing plant. Am. Rev. Respir. Dis. 126(3):420-428.
Doe J. E., Hoffman H. D. 1995. Toluene diisocyanate: An assessment of carcinogenic risk following oral and inhalation exposure. Toxicol. Ind. Health 11:13-32.
Duff P. B. 1983. The fate of TDI in the environment. Proceedings of the Society of the Plastic Industry's 6th International Technical Conference, San Diego, California. New York (NY): Society of Plastics Industry. p. 408-412.
Ebino K., Ueda H., Kawakatsu H., Shutoh Y., Kosaka T., Nagayoshi E., Lemus R., Karol M. H. 2001. Isolated airway exposure to toluene diisocyanate results in skin sensitization. Toxicol. Lett. 121: 79-85.
[ECB] Bureau européen des substances chimiques. 2004. Risk assessment report for Toluene-2,4-diamine (CAS #95-80-7). Ispra (IT): Bureau européen des substances chimiques. Commission européenne.
Ellendt K., Gutsche B., Steiner G. 2003. Analysis of Laminates - Determination of Isocyanate Residues and Primary Aromatic Amine Migration. Deutsches Lebensmittel-Rundschau 99(4):131-136.
Environ Corporation International. 2003. VCCEP Report - Tier 1 Assessment of the potential health risks to children associated with exposure to the commercial pentabromodiphenyl ether product. Préparé pour Great Lakes Chemical, états-Unis.
[EPIWIN] Estimation Programs Interface for Microsoft Windows. 2004. Version 3.12. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
[ESIS] Système européen d'information sur les substances chimiques[base de données sur Internet]. 2006. CAS No. 91-08-7. 2-methyl-m-phenylene diisocyanate. CAS No. 584-84-9. 4-methyl-m-phenylene diisocyanate. CAS No. 26471-62-5.m-tolylidene diisocyanate. Version 4.50. Bureau européen des substances chimiques (ECB). Commission européenne.
Estlander T., Keskinen H., Jolanki R., Kanerva L. 1992. Occupational dermatitis from exposure to polyurethane chemicals. Am. J. Contact. Dermat. 27:161-165.
Foureman P., Mason J. M., Valencia R., Zimmering S. 1994. Chemical mutagenesis testing in Drosophila. X. Results of 70 coded chemicals tested for the National Toxicology Program. Environ. Mol. Mutagen. 23(3):208-227.
Gad, S. C., Dunn B. J., Dobbs D. W., Reilly C., Walsh R. D. 1986. Development and validation of an alternative dermal sensitization test: the mouse ear swelling test (MEST). Toxic. Appl. Pharmac. 84:93-114.
Gagnaire F., Ban M., Cour C., Micillino J. C., Bonnet P., Hettich D. 1997. Role of tachykinins and neutral endopeptidase in toluene diisocyanate-induced bronchial hyperresponsiveness in guinea pigs. Toxicology 116(1-3):17-26.
Gagné S., Lesage J., Ostiguy C., Van T. H. 2003. Determination of unreacted 2,4-toluene diisocyanate (2,4TDI) and 2,6-toluene diisocyanate (2,6TDI) in foams at ultratrace level by using HPLC-CIS-MS-MS. Analyst 128:1447-51.
Goossens A., Detienne T., Bruze M. 2002. Occupational allergic contact dermatitis caused by isocyanates. Am. J. Contact Dermat. 47:304-308.
Gulati D. K., Witt K., Anderson B., Zeiger E., Shelby M. D. 1989. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. III. Results with 27 chemicals. Environ. Mol. Mutagen. 13(2):133-193.
Hagmar L., Welinder H., Mikoczy Z. 1993a. Cancer incidence and mortality in the Swedish polyurethane foam manufacturing industry. Br. J. Ind. Med. 50(6):537-543.
Hagmar L., Stromberg U., Welinder H., Mikoczy Z. 1993b. Incidence of cancer and exposure to toluene diisocyanate and methylene diphenyldiisocyanate: a cohort based case-referent study in the polyurethane foam manufacturing industry. Br. J. Ind. Med. 50(11):1003-1007.
Harton E.E. Jr, Rawl R. R. 1976. Toxicological and skin corrosion testing of selected hazardous materials. Springfield (VA): US Department of Commerce.
Heimbach F, Jaeger K., Sporenberg W. 1996. Fate and Biological Effects of Polymeric MDI (4,4-diphenylmethane diisocyanate and homologues) in small artificial ponds. Ecotox. Environ. Safety 33:143-153.
Henschler D., Assmann W., Meyer K.-O. 1962. Toxicology of toluene diisocyanate. Arch. Toxikol. 19:364-387.
Holdren M. W., Spicer C. W. et Riggin R. M. 1984. Gas Phase Reaction of Toluene Diisocyanate with Water Vapour. Am Ind Hyg Assoc J 45(9):626-633
Holness D. L., Nethercott J. R. 1997. Results of patch testing with a specialized collection of plastic and glue allergens. Am. J. Contact Derm. 8:121-124.
Huang J., Wang X. P., Ueda A., Aoyama K., Chen B. M., Matsushita T. 1991. Allergologic evaluation for workers exposed to toluene diisocyanate. Ind. Hlth 29:85-92.
Hugo J. M., Spence M. W. et Lickly T. D. 2000. The Determination of the Ability of Polyurethane Foam to Release Toluene Diisocyanate into Air. Appl. Occ Env Hygiene 15(6): 512-519.
[HYDROWIN] Hydrolysis Rates Program for Windows. 2000. Version 1.67. Washington (DC): U.S. Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation.
IAL Consultants. 2007. End-use market survey on the polyurethane industry in the US, Canada and Mexico. Alliance for the Polyurethanes Industry.
[INRP] Inventaire national des rejets de polluants [base de données sur Internet]. 2007. Gatineau (Québec): Environnement Canada [cité en 2007].
[IUCLID] Base de données internationale sur les informations chimiques unifiées. 2000. CAS RN. 26471-62-5. m-tolyidene diisocyanate. Commission européenne. Bureau européen des substances chimiques. Voir les données chimiques de Rhône-Poulenc. Date de création : 18 février 2000.
Jarand C. W., Akapo S. O., Swenson L. J., Kelman B. J. 2002. Diisocyanate emission from a paint product: a preliminary analysis. Appl. Occup. Environ. Hyg. 17(7):491-494.
Jeong Y. C., Kim D. H., Kim B. R., Park M. 1998. In vitro and in vivo reactions of 2,4-toluene diisocyanate with DNA and blood proteins. J. Toxicol. Sci. 23 Supp, l 4:660-661.
Kanerva L., Jolanki R., Alanko K., Estlander T. 1999. Patch-test reactions to plastic and glue allergens. Acta Derm.-Vener. Stockh. 79:296-300.
Kanerva L., Estlander T., Jolanki R., Keskinen H. 2001. Asthma from diisocyanates is not mediated through a Type IV, patch-test-positive mechanism. Am. J. Contact Dermat. 44:247-248.
Karlsson D., Spanne N., Dalene M., Skarping G. 2000. Airborne thermal degradation products of polyurethane coatings in car repair shops. J. Environ. Monit. 2:462-469.
Karol M. H., Hauth B. A., Riley E. J., Magreni C. M. 1981. Dermal contact with toluene diisocyanate (TDI) produces respiratory tract hypersensitivity in guinea-pigs. Toxicol. Appl. Pharmacol. 58: 221-230 [cité dans PISSC 1987].
Katsuyama Y., Shinohara N., Kumagai K., Fujii M., Yanagisawa Y. 2003. Emission of diisocyanates in indoor air. Proceedings of ISIAQ 7th International Conference, décembre 2003.
Kelly T. J., Myers J. D., Holdren M. W. 1999. Testing of household products and materials for emission of toluene diisocyanate. Indoor Air 9:117-124.
Kerr M. A., Nascav P. C., Mundt K. A., Michalek A. M., Baptiste, Mahoney M. C. 2000. Parental occupational exposures and risk of neuroblastoma: a case-control study (United States). Cancer Causes Control 11:635-643.
Krone CA, Ely JTA, Klingner T, Rando RJ. 2003. Isocyanates in flexible polyurethane foams. Bull Environ Contam Toxicol 70(2):328-335.
Krone C. A. et Klingner T. 2005. Isocyanates, polyurethane and childhood asthma (review article). Pediatr Allergy Immunol 16: 368-379.
Le Coz, C.-J., El Aboubi S., Ball C. 1999. Active sensitization to toluene di-isocyanate. Contact Dermatitis 41:104-105.
Lemière C., Romeo P., Chaboillez S., Tremblay C., Malo J. L. 2002. Airway inflammation and functional changes after exposure to different concentrations of isocyanates. J. Allergy Clin. Immunol. 110(4):641-646.
Levine S. P., Redinger C. F., Robert W. P. 2001. Community exposure assessment and intervention effectiveness at Trinity American Corporation, Glenola, Caroline du Nord. Amer. Ind. Hyg. Assoc. J. 62: 649-657.
Loeser E. 1983. Long-term toxicity and carcinogenicity studies with 2,4/2,6-toluene-diisocyanate (80/20) in rats and mice. Toxi col. Lett. 15(1):71-81.
Maestrelli P., Del Prete G. F., De Carli M., D'Elios M. M., Saetta M., Di Stefano A., Mapp C. E., Romagnani S., Fabbri L. M. 1994. CD8 T-cell clones producing interleukin-5 and interferon-gamma in bronchial mucosa of patients with asthma induced by toluene diisocyanate. Scand. J. Work Envir. Hlth. 20:376-381.
Maki-Paakkanen J., Norppa H. 1987. Chromosome aberrations and sister-chromatid exchanges induced by technical grade toluene diisocyanate and methylenediphenyl diisocyanate in cultured human lymphocytes. Toxicol. Lett. 36(1):37-43.
Marand Å., Karlsson D., Dalene M., Skarping G. 2004. Extractable organic compounds in polyurethane foam with special reference to aromatic amines and derivatives thereof. Anal. Chim. Acta. 510(1):109-119.
Marczynski B., Czuppon A. B., Marek W., Baur × . 1992. Indication of DNA strand breaks in human white blood cells after in vitro exposure to toluene diisocyanate (TDI). Toxicol. Ind. Health 8(3):157-69.
Marczynski B., Merget R., Teschner B., Korn M., Rabstein S. Bruning T. 2003. Changes in low molecular weight DNA fragmentation in white blood cells after diisocyanate exposure of workers. Archs Toxicol. 77: 470-476.
Marczynski B., Merget R., Mensing T., Rabstein S., Kappler M., Bracht A., Haufs M. G., Kafferlein H. U., Bruning T. 2005. DNA strand breaks in the lymphocytes of workers exposed to diisocyanates: indications of individual differences in susceptibility after low-dose and short-term exposure. Archs Toxicol. 79:355-362.
Marek W., Potthast J., Marczynski B., Mensing T., Baur X. 1999. Subchronic exposure to diisocyanates increases guinea pig tracheal smooth muscle responses to acetylcholine. Respiration 66(2):156-161.
McGregor D. B., Brown A. G., Howgate S., McBride D., Riach C., Caspary W. J. 1991. Responses of the L5178Y mouse Lymphoma cell forward mutation assay. V: 27 coded chemicals. Environ. Mol .Mutagen. 17(3):196-219.
Meredith S. K., Bugler J., Clark R. L. 2000. Isocyanate exposure and occupational asthma: a case-referent study. Occup. Envir. Med. 57:830-836.
[MHLW] Ministry of Health Labour and Welfare (JP). 2005. Safety examination of existing chemicals and safety programmes in Japan (en japonais avec résumé en anglais).
Mikoczy Z., Welinder H., Tinnerberg H., Hagmar L. 2004. Cancer incidence and mortality of isocyanate exposed workers from the Swedish polyurethane foam industry: updated findings 1959-98. Occup. Envir. Med. 61:432-437.
Militello G., Sasseville D., Ditre C., Brod B. A. 2004. Allergic contact dermatitis from isocyanates among sculptors. Dermatitis 15: p 150-153.
MITI. Ministry of International Trade & Industry. 1992. B iodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Japan : Chemical Products Safety Division Basic Industries Bureau, Ministry of International Trade & Industry. Chemicals Inspection & Testing Institute (JP), éditeur.
Moscato G., A. Dellabianca A., Corsico G., Biscaldi G., Gherson, Vinci G. 1993. Bronchial responsiveness to ultrasonic fog in occupational asthma due to toluene diisocyanate. Chest 104:1127-1132.
[NTP] National Toxicology Program. 1983. NTP technical report on the toxicology and carcinogenesis studies of commercial grade 2,4 (80%)- and 2,6 (20%)-toluene diisocyanate (CAS No. 26471) in F344/N rats and B6C3F1 mice (gavage studies). Rapport technique No 251 (provisoire).
[NTP] National Toxicology Program. 1986. NTP technical report on the toxicology and carcinogenesis studies of commercial grade 2,4 (80%)- and 2,6 (20%)-toluene diisocyanate (CAS No. 26471) in F344/N rats and B6C3F1 mice (gavage studies). Rapport technique No 251.
[NTP] National Toxicology Program. 2005. 11th report on carcinogens. Substance profile: toluene diisocyanate.
[OASIS] Optimized Approach based on Structural Indices Set. 2005. OASIS Forecast. Version 1.20. Bourgas, Bulgarie: Laboratory of Mathematical Chemistry.
Ott M. G., Diller W. F. et Jolly A. T. 2003, Respiratory effects of toluene diisocyanate in the workplace: A discussion of exposure-response relationships. Critical Reviews in Toxicology 33:1–59.
Owen P. E. 1984. The toxicity and carcinogenicity of toluene isocyanate vapour administered by inhalation for a period of 113 weeks. Addendum Report: Volume 2. Hazelton Laboratories Europe [cité dans US EPA, 1995].
Paggiaro, P.L., Vagaggini B., Dente F.L., Bacci E., Bancalari L., Carrara M., Di Franco A., Giannini D., Giuntini C. 1993. Bronchial hyperresponsiveness and toluene diisocyanate. Long-term change in sensitized asthmatic subjects. Chest 103:123-1128.
Park H.-S., Kim H. Y., Nahm D. H., Son J. W., Kim Y. Y. 1999. Specific IgG, but not specific IgE, antibodies to toluene diisocyanate-human serum albumin conjugate are associated with toluene diisocyanate bronchoprovocation test results. J. Allergy Clin. Immun. 104:847-851.
Patterson R., Zeiss C. R., Harris K. E. 1983. Immunologic and respiratory responses to airway challenges of dogs with toluene diisocyanate. J. Allergy Clin. Immunol. 71(6):604-611.
Peel M., Marczynski B., Baur X. 1997. Comparison of the binding potential of various diisocyanates on DNA in vitro. J. Toxicol. Environ. Health 52(6):517-526.
Pemberton D., Tury, B. 2004. TDI industry risk assessment: sections on physico-chemical properties, environmental exposures, and environmental effects. Rapport 2004/E. Manchester (R.-U.): Gilbert International Ltd.
Pisati F., Baruffini A., Zedda S. 1993. Toluene diisocyanate induced asthma: outcome according to persistence or cessation of exposure. Br. J. Ind. Med. 50:60-64.
[PISSC] Programme international sur la sécurité des substances chimiques. 1987. Critères d’hygiène de l’environnement 75. Toluene Diisocyanates. Genève (Suisse), Organisation mondiale de la santé. Sponsorisé de façon conjointe par le Programme des Nations Unies pour l’environnement, l’Organisation internationale du travail et l’Organisation mondiale de la santé.
[PISSC] Programme international sur la sécurité des substances chimiques. 1997. Monographie d’information sur les poisons : Toluene-2,4-diisocyanate.
Santé Canada. 1998. Exposure factors for assessing total daily intake of priority substances by the general population of Canada. Rapport non publié. Ottawa (Ontario), Direction de l’hygiène du milieu, Santé Canada.
Schnorr T. M., Steenland K., Egeland G. M., Boeniger M., Egilman D. 1996. Mortality of workers exposed to toluene diisocyanate in the polyurethane foam industry. Occup. Environ. Med. 53(10): p.703-707.
Seel K., Walber U., Herbold B., Kopp.R. 1999. Chemical behaviour of seven aromatic diisocyanates (toluenediisocyanates and diphenylmethanediisocyanates) under in vitro conditions in relationship to their results in the Salmonella/microsome test. Mutat. Res. 438(2):109-123.
Shaddock J. G., Robinson B.Y., Casciano D. A. 1990. Effect of pretreatment with hepatic mixed-function oxidase inducers on the genotoxicity of four rat carcinogens in the hepatocyte/DNA repair assay. Mutagenesis 5(4):387-391.
Shiotsuka R. N., Warren D. L., Halliburton A. T., Sturdivant D. W. 2000. A comparative respiratory sensitization study of 2,4- and 2,6-toluene diisocyanate using guinea pigs. Inhal. Toxicol. 12:605-615.
Sorahan T., Pope D. 1993. Mortality and cancer morbidity of production workers in the United Kingdom flexible polyurethane foam industry. Br. J. Ind. Med. 50(6):528-536.
Tadokora H, et al. 1997. Ecotoxicities of TDI and TDA to fish, algae and aquatic invertebrates. IN: Chemicals Inspection and Research Institute, Japan. III Report No. 11217
[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (ON): Université Trent, Canadian Environmental Modelling Centre.
Thorne, P. S., Hillebrand J. A., Lewis G. R., Karol M. H. 1987. Contact sensitivity by diisocyanates: potencies and cross-reactivities. Toxic. Appl. Pharmac. 87:155-165.
[TOPKAT] Toxicity Prediction Program [Internet]. 2004. Version 6.2. San Diego (CA): Accelrys Software Inc.
Tury B., Pemberton D., Bailey R. E. 2003. Fate and potential environmental effects of methylenediphenyl diisocyanate and toluene diisocyanate released into the atmosphere. J. Air Waste Manage. Assoc. 53:61-66.
Tyl R. W. 1988. Developmental toxicity study of inhaled toluene diisocyanate vapor in CD (Sprague-Dawley) rats. Union Carbide, Bushy Run Research Center. Projet révisé No50-592.
Tyl R. W., Fisher L. C., Dodd D. E., Pritts I. M., Kubena M. F., Losco P. E., Troup C. M., Lyon J. P., Landry T. D. 1999a. Developmental toxicity evaluation of inhaled toluene diisocyanate vapor in CD rats. Toxicol. Sci. 52(2):248-257.
Tyl R. W., Neeper-Bradley T. L. 1989. Two-generation reproductive study of inhaled toluene diisocyanate in CD (Sprague-Dawley) rats. Union Carbide, Bushy Run Research Center. No de projet 86-33-90704.
Tyl R. W., Neeper-Bradley T. L., Fisher L. C., Dodd D. E., Pritts I. M., Losco P. E., Lyon J. P., Landry T. D. 1999b. Two-generation reproductive toxicity study of inhaled toluene diisocyanate vapor in CD rats. Toxicol. Sci. 52(2):258-268.
Ulrich H. 1996. Chemistry and Technology of Isocyanates. Chichester (GB): John Wiley & Sons, Ltd.
[US EPA] Environmental Protection Agency. 1995. Integrated Risk Information System (IRIS). 2,4-/2,6-Toluene Diisocyanate mixture (TDI).
[US EPA] Environmental Protection Agency. 2002. Child-specific exposure factors handbook. Rapport provisoire.Washington (DC): National Center for Environmental Assessment, Office of Research and Development.
Vandenplas O., Cartier A., Ghezzo H., Cloutier Y., Malo J. L. 1993. Response to isocyanates: Effect of concentration, duration of exposure, and dose. Am. Rev. Resp. Dis. 147:1287-1290.
Van der Hoeven N, Roza P, Henzen L. 1992a. Determination of the effect of TDI, TDA, MDI, and MDA on the emergence and growth of the plant species Avena sativa and Lactuca sativaaccording to OECD Guideline no. 208. TNO. III Report no. 11024. [Cited in Pemberton and Tury 2004].
Van der Hoeven N, Roza P, Henzen L. 1992b. Determination of the LC50 (14 days) of TDI, TDA, MDI, and MDA to the earthwormEisenia fetida according to OECD guideline no. 207. TNO. III Report no. 11025. [Cité dans Pemberton et Tury 2004].
Vanoirbeek, J. A., Tarkowski J. M., Ceuppens J. L., Verbeken E. K., Nemery B., Hoet P. H. 2004. Respiratory response to toluene diisocyanate depends on prior frequency and concentration of dermal sensitization in mice. Toxic. Sci. 80:310-321.
Yakabe Y., Henderson K. M., Thompson W. C., Pemberton D., Tury B., Bailey R. E. 1999. Fate of methylenediphenyl diisocyanate and toluene diisocyanate in the aquatic environment. Environ. Sci. Technol. 33(15):2579-2583.
Zapp J. A. Jr. 1957. Hazards of isocyanates in polyurethane foam plastic production. Arch. Ind. Hlth 15(4):324-330.
Zissu D., Binet S., Limasset J. C. 1998. Cutaneous sensitization to some polyisocyanate prepolymers in guinea pigs. Contact Dermatitis 39:248-251.
| Voie d' exposition | Absorption estimée (μg/kg-p. c. par jour) de TDI par divers groupes d’âge | |||||||
|---|---|---|---|---|---|---|---|---|
| 0 à 6 mois [1] | 0,5 à 4 ans[3] | 5 à 11 ans[4] | 12 à 19 ans[5] | 20 à 59 ans[6] | 60 ans et plus[7] | |||
| Allaitement artificiel[2] | Allaitement naturel | |||||||
| [1] Hypothèses : poids, 7,5 kg, respiration, 2,1 m3 d'air par jour, consommation d'eau, 0,8 L par jour (allaitement artificiel) ou 0,3 L par jour (allaitement naturel) et ingestion de sol, 30 mg par jour (Santé Canada, 1998). [2] Dans le cas des nourrissons allaités artificiellement (lait maternisé), l'absorption à partir de l' eau équivaut à l'absorption à partir des aliments. On n'a pas trouvé de données sur les concentrations de TDI dans les laits maternisés au Canada. [3] Hypothèses : poids, 15,5 kg; respiration, 9,3 m3 d'air par jour, consommation d'eau, 0,7 L par jour et ingestion de sol, 100 mg par jour (Santé Canada, 1998). [4] Hypothèses : poids, 31,0 kg; respiration, 14,5 m3 d'air par jour, consommation d'eau, 1,1 L par jour et ingestion de sol, 65 mg par jour (Santé Canada, 1998). [5] Hypothèses : poids, 59,4 kg; respiration, 15,8 m3 d'air par jour, consommation d'eau, 1,2 L par jour et ingestion de sol, 30 mg par jour (Santé Canada, 1998). [6] Hypothèses : poids, 70,9 kg; respiration, 16,2 m3 d'air par jour, consommation d'eau, 1,5 L par jour et ingestion de sol, 30 mg par jour (Santé Canada, 1998). [7] Hypothèses : poids, 72,0 kg, respiration 14,3 m3 d'air par jour, consommation d'eau, 1,6 L par jour et ingestion de sol, 30 mg par jour (Santé Canada, 1998). [8] On a obtenu une concentration annuelle moyenne calculée de 1,06 µg/m3 à 100 mètres d'une usine de mousse de polyuréthane (voir l' évaluation de l'exposition dans ce rapport). On a supposé que l' air ambiant était représentatif de l' exposition à l' air intérieur, bien que l' utilisation de certains produits de consommation puisse être à l'origine du rejet de diisocyanate de toluène dans l' air intérieur. [9] On n'a pas trouvé de rapports sur les mesures de diisocyanate de toluène dans l' eau potable. On estime que la demi-vie du diisocyanate de toluène dans l' eau, avec un degré moyen de mélange, est de une à trois heures (Yakabe et al., 1999). On suppose donc que le diisocyanate de toluène n' est pas présent dans l' eau potable. [10] On n'a pas trouvé de rapports sur les mesures de diisocyanate de toluène dans les aliments ou dans les boissons, mais on en a trouvé pour la migration d u diisocyanate de toluène des emballages d' aliments; toutefois, ils ne permettaient pas de déterminer la concentration de TDI dans les aliments et les boissons. [11] On n'a pas trouvé de rapports sur les mesures de diisocyanate de toluène dans le sol. On a établi expérimentalement que la demi-vie du diisocyanate de toluène dans le sol humide était inférieure à une heure (Duff, 1983). Le TDI n' est pas considéré comme une substance persistante et sauf dans le cas des sites de déversements industriels, il ne devrait pas être présent à la surface du sol. |
||||||||
| Air [8] | 0,30 | 0,64 | 0,50 | 0,28 | 0,24 | 0,21 | ||
| Eau potable [9] | _ | _ | _ | _ | _ | _ | _ | |
| Aliments et boissons [10] | _ | _ | _ | _ | _ | _ | ||
| Sol [11] | _ | _ | _ | _ | _ | _ | ||
| Absorption totale | 0,30 | 0,30 | 0,64 | 0,50 | 0,28 | 0,24 | 0,21 | |
| Paramètre | Concentrations à effet le plus faible / Résultats |
|---|---|
| [*] Sauf indication contraire, ces données représentent le mélange d'isomères. | |
| Animaux de laboratoire et essais in vitro | |
| Toxicité aiguë | DL50 orale la plus faible,(rats) : 3 060 mg/kg (Harton et Rawl, 1976, cité dans PISSC, 1987) études supplémentaires : Woolrich, 1982, cité dans PISSC, 1987 CL50 la plus faible, par inhalation (rats) : 57 mg/m3 (Harton et Rawl 1976, cité dans PISSC, 1987) études supplémentaires : Duncan et al.,1962, Bungeet al., 1977, cités dans PISSC, 1987. DL50 la plus faible, absorption cutanée (lapins) : 10 000 mg/kg (Harton et Rawl, 1976, cité dans PISSC, 1987) |
| Dose toxique à court terme pour l'exposition répétée | DMEO orale (rats, 28 jours) : 30 mg/kg-p. c./j, à cause de changements microscopiques dans les poumons et la trachée (MHLW du Japon, 2005, étude sommaire seulement). études supplémentaires : Zapp, 1957, cité dans PISSC, 1987; NTP, 1986. CMEO la plus faible par inhalation (cobayes, 5 j) : 0,07mg/m3, à cause d'une plus forte réponse des muscles lisses de la trachée (Marek et al., 1999). Il y a de nombreuses autres études. |
| Toxicité subchronique | DMEO orale (rats, souris, 13 sem.) : 120 mg/kg-p. c./j, à cause de cas de bronchopneumonie et de diminution du poids corporel chez les rats, ainsi que de cas d'inflammation et de nécrose du foie chez les souris (NTP, 1986). CMEO par inhalation (rats, 27 sem.; chiens, 10 mois) : 0,14 mg/m3, à cause de changements histologiques dans les fosses nasales et dans les voies respiratoires supérieures de rats de la génération F 1 (Tyl et Neeper-Bradley, 1989, cité dans US EPA, 1995; publié sous la signature de Tyl et al., 1999b); forts titres d'anticorps, fonction pulmonaire diminuée et réaction cutanée immédiate chez les chiens (Patterson et al., 1983, cité dans PISSC, 1987). études supplémentaires : Gagnaire et al., 1997; Henschler et al.,1962, cité dans PISSC, 1987; Friebel, 1955, cité dans PISSC, 1987; Zapp, 1957, cité dans PISSC, 1987. |
| Toxicité chronique/ cancéro-génicité | Essai biologique de détection du cancer, par voie orale, rats Essai biologique de détection du cancer, par voie orale, souris Essai biologique de détection du cancer, par inhalation, souris et rats Des rats ont été exposés à raison de 6 h/j et de 5 j/sem. pendant 104 semaines, à 0, 0,36 ou 1,07 mg/m3 pendant 108 semaines (mâles) ou pendant 110 semaines (femelles). Il n'y avait pas de différence significative pour l'incidence ou les types de tumeurs entre les groupes traités et le groupe témoin (Loeser, 1983, cité dans CIRC, 1986). On a noté des augmentations liées à la dose dans l'incidence et la gravité des rhinites chroniques et nécrotiques chez les rates. DMEO, effets non néoplasiques, par voie orale, par gavage : (rats, de 105 à 106 semaines) : 30 mg/kg-p. c./j (dose la plus faible testée), fondée sur les cas de bronchopneumonie aiguë, de diminution du gain de poids corporel et de mortalité (NTP, 1986, cité dans PISSC, 1987). CMENO, effets non néoplasiques, par inhalation : 0,36 mg/m3, fondée sur un accroissement notable des rhinites chroniques et nécrotiques chez les rates. |
| Toxicité pour le dévelop-pement | CMEO par inhalation : 0,5 ppb (3,57mg/m3), fondée sur une seule variation au niveau du squelette, qui a été signalée comme une variation commune et peut-être non significative compte tenu des données historiques obtenues pour les groupes témoins. Dans cette étude, on a exposé des rates gravides à des vapeurs de TDI à raison de 6 h/j pendant les jours de gestation 6 à 15. (Tyl, 1988, cité par l'US EPA, 1995; publié sous la signature de Tyl et al., 1999a) |
| Toxicité pour la reproduction | CSEO par inhalation : Aucun effet dû à l'exposition pour aucun des organes reproducteurs ou des paramètres de la reproduction à la plus forte dose de 0,3 ppm (2,14 mg/m3). Dans cette étude, les rats mâles et femelles ont été exposés à des vapeurs de TDI à raison de 6 h/j, 5 j/sem., puis de 7 j/sem., pendant une période de 3 semaines de reproduction, de gestation et de lactation pour les deux générations d'une étude de reproduction à deux générations. (Tyl et Neeper-Bradley, 1989, cité dans US EPA, 1995; publié sous la signature de Tyl et al., 1999b). |
| Génotoxicité et paramètres connexes (in vivo) | Essai de létalité récessive liée au sexe Essai du micronoyau |
| Génotoxicité et paramètres connexes (in vitro) | Mutagénicité, Salmonella typhimurium Mutagénicité, lignées de cellules de rongeurs Aberrations chromosomiques Synthèse d'ADN non programmée échange de chromatides sœurs Ruptures de brins d'ADN Formation de liens avec l'ADN |
| Sensibi-lisation | De nombreuses études qualitatives (p. ex. épidermotests chez les humains, tests Buehler chez les cobayes, tests d'enflure des oreilles chez les souris) indiquent que le TDI est un sensibilisant cutané. De plus, l'exposition cutanée au TDI peut induire une sensibilisation respiratoire (Descotes, 1988; Estlander et al., 1992; Gad et al., 1986; Goossens et al., 2002; Holness et Nethercott, 1997; Huang et al., 1991; Kanerva et al., 1999, 2001; Le Coz et al., 1999; Maestrelli et al., 1994; Mandervelt et al., 1997; Meredith et al., 2000; Militello et al., 2004 : Moscato et al., 1993; Paggiaro et al., 1993; Park et al., 1999; Pisati et al., 1993; Shiotsuka et al., 2000; Thorne et al., 1987; Vandenplas et al., 1993; Vanoirbeek et al., 2004; Zissu et al., 1998). Une étude semble indiquer que l'exposition par inhalation peut aussi être à l'origine d'une sensibilisation de la peau (Ebino et al., 2001). Une seule exposition peut aussi causer une réaction asthmatique immédiate ou différée chez des personnes déjà exposées. Des expositions simples à des concentrations aussi faibles que 0,03mg/m3 ont induit une hypersensibilité respiratoire chez des cobayes déjà sensibilisés (Karol et al., 1981). |
| Études épidémiologiques | |
| Toxicité chronique/ cancérogé-nicité | Chez les humains, on n'a observé ni association forte, ni profil cohérent (cancer) pour trois études de cohortes industrielles et une étude cas-témoin de la population (Sorahan et Pope, 1993, Hagmar et al., 19 93(a et b), Schnorret al., 19 96; tous cités dans CIRC, 1999) CMEO, effets non néoplasiques, par inhalation(humains, 5 ans) : 1,9 ppb (0,014 mg/m3), fondée sur une diminution de la fonction pulmonaire selon une étude prospective des maladies professionnelles (Diem et al., 1982, cité dans US EPA, 1995). La diminution de la fonction pulmonaire a pris la forme de déclins annuels significatifs du volume expiratoire maximal par seconde (VEMS) et du débit respiratoire forcé à 25-75 % (DRF 25-75). études épidémiologiques professionnelles études de sensibilisation |