Rapport d'évaluation préalable pour le Défi
Archivée
Benzène-1,4-diol
(hydroquinone)
Numéro de registre du Chemical Abstracts Service
123-31-9
Environnement Canada
Santé Canada
Juillet 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l’environnement
- Devenir dans l’environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d’effets nocifs sur l’environnement
- Potentiel d’effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Valeurs estimées de la limite supérieure d’absorption quotidienne d’hydroquinone par la population générale au Canada
- Annexe 2 : Estimations de l'exposition cutanée des adultes canadiens à l'hydroquinone contenue dans les produits de consommation
- Annexe 3 : Résumé des renseignements sur les effets de l’hydroquinone sur la santé
- Annexe 4 : Survol des effets signalés de l'hydroquinone sur la santé humaine
Les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de l’hydroquinone, dont le numéro de registre du Chemical Abstracts Service (CAS) est 123-31-9. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres, car on considère qu’elle présente le plus fort risque d’exposition (PFRE) pour les Canadiens et que son pouvoir cancérogène et sa génotoxicité ont conduit d’autres agences à l’évaluer en priorité. Comme cette substance répond au critère de catégorisation écologique de la toxicité intrinsèque pour les organismes aquatiques, mais non aux critères de la persistance ou de la bioaccumulation, la présente évaluation est donc axée sur les aspects relatifs à la santé humaine.
Selon les renseignements communiqués en vertu de l’article 71 de la LCPE (1999), l’hydroquinone aurait été importée au Canada, en 2006, en une quantité totale située entre 100 000 kg et 1 000 000 kg. Au Canada, l’hydroquinone sert notamment d’inhibiteur de la polymérisation des monomères utilisés pour la préparation de résines de méthacrylate et de polyesters insaturés, ainsi que de stabilisateur de colorants et de divers types d’adhésifs industriels et de grande consommation, d’adhésifs frein-filet et de pâtes d’étanchéité pour raccords filetés. Elle est aussi employée comme additif pour les tubes thermorétrécissables, les produits d’obturation dentaire, les bandes adhésives, les rubans de collage, les pansements liquides; elle sert d’additif dans les encres thermoséchantes pour améliorer la performance de l’impression à alimentation par feuilles, et aussi d’agent réducteur dans les révélateurs photographiques. L’hydroquinone est produite naturellement et on le retrouve notamment dans divers aliments.
On estime que sa présence à l’état naturel, ou encore celle de son conjugué glucosique, le 4 hydroxyphényl-ß-D-glucopyranoside (arbutine), dans différents aliments et différentes boissons, constitue la principale source d’exposition de la population. En comparaison, l’exposition associée à d’autres milieux (air ambiant ou intérieur, eau ou particules du sol) est jugée négligeable.
Il existe des possibilités d’exposition par la voie cutanée à l’hydroquinone car elle est retrouvée dans des produits de consommation comme les révélateurs photographiques, les adhésifs et certains produits cosmétiques comme les colorants capillaires et diverses crèmes autorisée pour l’éclaircissement de la peau.
Sur la base essentiellement des évaluations de la Commission européenne fondées sur la méthode du poids de la preuve, le pouvoir cancérogène est l’effet critique appliqué à la caractérisation des risques pour la santé humaine. Les éléments retenus sont l’observation de tumeurs, notamment rénales, chez des rats et des souris exposés chroniquement à l’hydroquinone (exposition orale). En outre, l’hydroquinone était génotoxique dans plusieurs essais in vitro et in vivo. Même si le mécanisme de formation des tumeurs n’a pas été encore parfaitement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez des animaux de laboratoire résultent de l’action directe de la substance avec le matériel génétique.
Compte tenu de la cancérogénicité de l’hydroquinone, pour lequel il peut exister une probabilité d’effets nocifs à tout niveau d’exposition, il est conclu que l’hydroquinone est une substance qui peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
À la lumière des dangers écologiques et des rejets déclarés d’hydroquinone, il est conclu que cette substance ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ni à mettre en danger l'environnement essentiel pour la vie. De plus, l’hydroquinone ne répond pas les critères potentiels de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation.
Cette substance s'inscrira dans la mise à jour de l’inventaire de la Liste intérieure des substances, qui débutera en 2009. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, la performance des mesures de contrôle possibles déterminées à l'étape de la gestion des risques.
Compte tenu des renseignements disponibles, l’hydroquinone remplit un ou plusieurs critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l’Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si ces substances présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine. À partir des résultats de l’évaluation préalable, les ministres peuvent proposer de ne rien faire à l’égard de la substance, de l’inscrire sur la Liste des substances d’intérêt prioritaire (LSIP) en vue d’une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l’annexe 1 de la Loi et, s’il y a lieu, la quasi-élimination de ses rejets dans l’environnement.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères de la catégorisation relatifs à l’environnement [persistance (P), potentiel de bioaccumulation (B) et toxicité intrinsèque (Ti) pour les organismes aquatiques] et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine à la lumière des classements effectués par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils mettent au défi l’industrie et les autres intervenants intéressés de fournir, selon un calendrier déterminé, des renseignements particuliers sur les substances qui pourraient servir à étayer l’évaluation des risques. Ces renseignements pourraient aussi servir à élaborer et à évaluer comparativement les meilleures pratiques de gestion des risques et de gérance des produits pour ces substances jugées hautement prioritaires.
L’hydroquinone a été jugée hautement prioritaire pour l’évaluation des risques qu’elle pose pour la santé humaine, car elle a été jugée présenter un PFRE et a été classée par une autre instance sur la base de son potentiel de cancérogénicité et de génotoxicité. Le volet du Défi portant sur cette substance a été lancé le 3 février 2007 au moyen d’un avis paru dans la Gazette du Canada (Canada, 2007a). Le profil de cette substance a été publié en même temps. Ce profil présentait l’information technique, obtenue avant décembre 2005, sur laquelle a reposé la catégorisation de cette substance. En réponse au Défi, on a reçu des documents présentant des renseignements.
Même si l’évaluation des risques de l’hydroquinone pour la santé humaine a été jugé hautement prioritaire et que la substance remplit le critère de la catégorisation écologique de la persistance, elle ne remplit pas celui du potentiel de bioaccumulation ou de la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée sur l’information pertinente à l’évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées en vertu de la LCPE (1999) portent sur les renseignements essentiels pour établir si une substance répond ou non aux critères de toxicité des substances chimiques énoncés dans l’article 64 de la Loi, qui se lit comme suit :
64. « ...est toxique toute substance qui pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à :
a) avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique;
b) mettre en danger l’environnement essentiel pour la vie;
c) constituer un danger au Canada pour la vie ou la santé humaine.»
Les évaluations préalables mettent en lumière les renseignements scientifiques et présentent les conclusions que l’on peut dégager en incorporant la méthode du poids de la preuve et la prudence.
Cette évaluation préalable inclue l’examen des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, à l’inclusion des renseignements additionnels fournis dans le cadre du Défi. Des données pertinentes à l’évaluation préalable de cette substance ont été relevées dans des publications originales, des rapports de synthèse et d’évaluation, des rapports de recherche de parties intéressées et d’autres documents accessibles lors de recherches menées dernièrement, jusqu’en septembre 2007. Les études importantes ont fait l’objet d’évaluations critiques. Les études clés ont fait l’objet d’évaluation critique ; les résultats de la modélisation ont pu être utilisés dans la formulation de conclusions. L’évaluation des risques pour la santé humaine comprends l’examen de données pertinentes à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d’autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l’effet critique retenu ou sur l’écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l’exposition tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, cela dans le contexte d’une évaluation préalable. Les évaluations préalables ne sont pas le résultat d’examens critiques ou exhaustifs de toutes les données disponibles. Elles présentent plutôt les informations critiques selon lesquelles la conclusion est basée.
La présente évaluation préalable a été effectuée par le personnel des Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre des résultats provenant d’autres programmes appliqués par ces ministères. Cette évaluation préalable a fait l’objet d’une consultation indépendante par des pairs. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus par des experts scientifiques désignés et dirigés par la corporation Toxicology Excellence for Risk Assessment (TERA). Ce sont notamment John Christopher (California Department of Toxic Substances Control), Michael Jayjock (The Lifeline Group), Donna Vorhees (The Science Collaborative) et Joan Strawson (TERA). Exponent a également transmis des commentaires sur ces sections. Bien que les commentaires externes aient été pris en considération, Santé Canada assume la responsabilité du contenu final de l’évaluation préalable pour tout ce qui concerne la santé humaine. De plus, une version provisoire de la présente évaluation préalable a fait l’objet d’une consultation publique de 60 jours. Les considérations et les renseignements importants à la base du présent rapport sont présentés ci-après.
Tableau 1. Identité de la substance
| Numéro de registre CAS | 123-31-9 |
| Nom dans la LIS | hydroquinone |
| Noms dans les inventaires [1] | 1,4-Benzenediol (TSCA, DSL, ENCS, AICS, ECL, SWISS, PICCS, ASIA-PAC, NZIoC) Hydroquinone (DSL, EINECS, PICCS) Hydrochinon (EINECS, SWISS, PICCS) Benzène, 1,4-Dihydroxy- (PICCS) P-Dihydroxybenzene (PICCS) P-Hydroxyphenol (PICCS) |
| Autres noms | Hydroquinone; 1,4-Benzoquinol; 1,4-Dihydroxybenzene; 4-Hydroxyphenol; Aida; Arctuvin; Benzohydroquinone; Benzoquinol; Black & White Bleaching Cream; BQ(H); Diak 5; Dihydroquinone; Eldopacque; Eldopaque; Eldopaque Forte; Eldoquin; Eldoquin Forte; HE 5; Hydroquinol; NSC 9247; p-Benzenediol; p-Dihydroquinone; p-Dioxybenzene; p-Hydroquinone; p-Phenylenediol; p-Quinol; Phiaquin; Quinol; Solaquin Forte; Tecquinol; Tenox HQ; UN 2662; UN 2662 (DOT) |
| Groupe chimique | produits chimiques organiques définis |
| Sous-groupe chimique | phénols |
| Formule chimique | C6H6O2 |
| Structure chimique |  |
| SMILES | Oc(ccc(O)c1)c1 |
| Masse moléculaire | 110,11 g/mole |
Tableau 2. Propriétés physiques et chimiques de l'hydroquinone
| Propriétés | Type | Valeur | Température (°C) |
Référence |
|---|---|---|---|---|
| Point de fusion (°C) |
expérimental | 169 | SIDS OCDE, 2002 | |
| Point d'ébullition (°C) |
expérimental | 286 | SIDS OCDE, 2002 | |
| Masse volumique (kg/m3) |
expérimental | 1,341 | SIDS OCDE, 2002 | |
| Pression de vapeur (Pa) |
expérimental | 2,34 × 10-3 | 25 | SIDS OCDE, 2002 |
| Constante de la loi de Henry (Pa·m3/mole) |
expérimental | 3,84 × 10-11 | SIDS OCDE, 2002 (Meylan et Howard, 1991) |
|
| Constante de dissociation | expérimental | pK1= 9,9 | SIDS OCDE, 2002 | |
| Log Koe | expérimental | 0,59 | Hansch et al., 1995 | |
| Log Kco | modélisé | 2,64 | PCKOCWIN, v. 1.66 | |
| Solubilité dans l'eau (mg/L) | expérimental | 73 000 | SIDS OCDE, 2002 (Sterner et. al., 1947) |
L’hydroquinone est produite naturellement sous forme conjuguée avec le bêta-D-glucopyranoside dans les feuilles, l’écorce et les fruits de nombreuses plantes, notamment les éricacées arbustives comme l’airelle canneberge, l’airelle vigne-d’Ida, l’arctostaphyle raisin-d’ours et l’airelle à feuilles étroites (Varagnat, 1982; Harbison et Belly, 1982; Hudnall, 1987). Cette substance a été décelée en faibles concentrations dans le café, le thé, le vin rouge, la bière, le cola, le lait à 2 p. 100 de matières grasses, le jus d’orange, les céréales de maïs, de blé et de riz, le germe de blé et différents fruits, notamment la poire, l’orange, le melon brodé, la cerise, l’asperge, la pomme, le bleuet et la canneberge (Deisinger et al., 1996). L’hydroquinone participe aux mécanismes de défense de certaines classes de coléoptères (Aneshansley et al., 1969). On la trouve également dans les particules de la fumée de cigarette (CIRC, 1985).
Cette substance est produite par l’oxydation de l’aniline en quinone et par réduction subséquente de la quinone en hydroquinone (Kirk-Othmer, 1966). Le clivage oxydatif du diisopropylbenzène et l’hydroxylation de phénols sont d’autres voies d’obtention de l’hydroquinone (SIDS OCDE, 2002). En vertu d’un avis publié en application de l’article 71 de la LCPE (1999) concernant l’hydroquinone, 17 entreprises canadiennes et 2 entreprises étrangères ont déclaré avoir importé cette substance (seule, dans un mélange, dans un produit ou présente dans un article manufacturé), en 2006, en une quantité égale ou supérieure au seuil de déclaration de 100 kg. En outre, 10 autres entreprises canadiennes ont déclaré avoir importé de l’hydroquinone (seule, dans un mélange, dans un produit ou présente dans un article manufacturé), en 2006, en une quantité inférieure au seuil de 100 kg. Aucune entreprise canadienne n’a fabriqué d’hydroquinone dans une quantité supérieure à 100 kg au Canada en 2006 (Environnement Canada, 2007; Chemical Economics Handbook, 2006). La quantité totale d’hydroquinone importée se situe entre 100 000 et 1 000 000 kg (Environnement Canada, 2007).
Les déclarations obtenues en application de l'article 71 de la LCPE (1999) indiquent qu'actuellement au Canada, l'hydroquinone sert d'inhibiteur de la polymérisation des monomères utilisés pour la préparation de résines de méthacrylate et de polyesters insaturés, ainsi que de stabilisateur de colorants et de divers types d'adhésifs industriels et commerciaux, d'adhésifs frein-filet et de pâtes d'étanchéité pour raccords filetés. Elle est aussi employée comme additif pour les tubes thermorétrécissables, les produits d'obturation dentaire, les bandes adhésives, les rubans de collage, les pansements liquides, etc.; elle sert d'additif dans les encres thermoséchantes pour améliorer la performance de l'impression à alimentation par feuilles, et aussi d'agent réducteur dans les révélateurs photographiques (Environnement Canada, 2007).
Il existe beaucoup d’autres utilisations de l’hydroquinone au Canada. Même s’il est interdit de l’utiliser dans les produits cosmétiques appliqués sur la peau ou les muqueuses, notamment dans les produits d’éclaircissement de la peau (Santé Canada, 2007a), Santé Canada a reçu, en vertu du Règlement sur les cosmétiques de la Loi sur les aliments et drogues, 110 déclarations concernant des produits cosmétiques contenant de l’hydroquinone. Il s’agit principalement de préparations pour manucure et de colorants capillaires qui peuvent en contenir jusqu’à 3 p. 100 (Santé Canada, 2007b). La base de données de Santé Canada sur les produits pharmaceutiques énumère 90 préparations en vente libre qui en contiennent à des concentrations de < 2 p. 100 à 4 p. 100. Ces produits ont un numéro DIN. À l’échelle provinciale, la National Association of Pharmacy Regulatory Authorities (NAPRA) classe les préparations topiques qui contiennent de l’hydroquinone avec les drogues de l’annexe II. Bien que les produits pharmaceutiques de l’annexe II soient davantage considérés comme des médicaments d’ordonnance plutôt que comme des produits en vente libre, ils sont réglementés de façon moins stricte et, si leur vente ne nécessite pas d’ordonnance, le pharmacien doit néanmoins intervenir professionnellement, quitte même à diriger la personne vers son médecin. À la pharmacie, le public ne doit pas avoir accès à ces produits et il ne doit pas avoir la possibilité de s’en procurer sans consulter le pharmacien (Santé Canada, 2007c). L’hydroquinone est employée à raison d’une concentration de 0,3 p. 100 comme stabilisateur dans deux pesticides homologués en vertu de la Loi sur les produits antiparasitaires. Le premier est un herbicide à utilisation restreinte pour lutter contre les végétaux dans les canaux d’irrigation, l’autre est un microbiocide commercial qui est employé dans l’extraction pétrolière (ARLA, 2007).
L’hydroquinone est également un intermédiaire chimique de la synthèse des types suivants de composés chimiques : antioxydants et antiozone employés pour le traitement du caoutchouc, antioxydants pour les aliments et les graisses et huiles d’usage industriel, et stabilisateurs dans les peintures, les vernis, les huiles à moteur et les carburants. L’hydroquinone trouve des applications dans le développement des pellicules photo en noir et blanc et des pellicules utilisées en radiographie, ainsi qu’en lithographie. Elle entre également dans la fabrication de mélanges de coulage et elle peut servir d’inhibiteur de la corrosion dans les chaudières et les tours de refroidissement (SIDS OCDE, 2002).
Il peut se produire des rejets anthropiques d’hydroquinone au moment de sa fabrication et au cours de son emploi en photographie, dans les antioxydants, dans les inhibiteurs de la polymérisation de monomères, dans les colorants et les pigments, dans les composés à usage agricole et dans les stabilisateurs de peintures et de vernis, de carburants et d’huiles. Cette substance peut être rejetée dans l’environnement avec les effluents produits par les procédés de développement photographique (HSDB, 2006). Le tableau 3 présente les rejets sur place par des installations industrielles et l’élimination hors site de l’hydroquinone (et de ses sels) dans des milieux non précisés, au Canada entre 2001 et 2006 (Source : Inventaire national des rejets de polluants – INRP, 2007).
Tableau 3. Rejets d'hydroquinone entre 2001 et 2006
| Année | Rejets sur place | élimination hors site |
Unités |
|---|---|---|---|
| 2006 | 2 | 0 | kg |
| 2005 | 2 | 1 | kg |
| 2004 | 2 | 49 | kg |
| 2003 | 2 | 1 | kg |
| 2002 | 0 | 1 | kg |
| 2001 | 1 | 1 | kg |
Selon les déclarations obtenues en application de l’article 71 de la LCPE (1999), trois entreprises canadiennes ont signalé des rejets d’hydroquinone (seule, dans un mélange, dans un produit ou présente dans un article manufacturé) en une quantité totale de 103 kg au cours de l’année civile 2006 (Environnement Canada, 2007).
Comme on le voit au tableau 2, la solubilité dans l’eau de l’hydroquinone est très élevée et son coefficient d’adsorption par le sol est modéré, ce qui indique qu’il se produirait peu d’adsorption de l’hydroquinone par les sédiments et les matières organiques en suspension si cette substance était rejetée dans l’eau. En cas de rejet dans le sol, la majeure partie de l’hydroquinone ne devrait pas s’en échapper, sinon en une petite quantité susceptible de passer dans l’eau. En cas de rejet atmosphérique, l’hydroquinone devrait se photodégrader directement (tableaux 5a et b). Cette substance pourrait aussi être extraite de l’air par dépôt humide car elle est très soluble dans l’eau (HSDB, 2006). Le tableau 4 présente la répartition de l’hydroquinone dans l’environnement, prévue au moyen d’un modèle de fugacité de niveau III, à la suite de son rejet dans divers milieux naturels.
Tableau 4. Résultats de la modélisation de la fugacité de niveau III de l'hydroquinone (EPIWIN, v. 3.12)
| Substance rejetée dans | Fraction de la substance se répartissant dans chaque milieu (%) |
|||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 0,00 | 24,1 | 75,9 | 0,05 |
| l'eau (100 %) | 0,00 | 99,8 | 0,00 | 0,19 |
| le sol (100 %) | 0,00 | 20,2 | 79,8 | 0,04 |
| l'air, l'eau et le sol (33,3 % chacun) | 0,00 | 37,1 | 62,9 | 0,07 |
Persistance
étant donné ses propriétés physiques et chimiques (tableau 2) et compte tenu des données empiriques et modélisées présentées ci-dessous (tableaux 5a et 5b), l’hydroquinone ne répond pas aux critères de la persistance (demi-vie dans le sol et l’eau ≥ 182 jours; demi-vie dans les sédiments ≥ 365 jours; demi-vie dans l’air ≥ 2 jours) définis dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Tableau 5a. Données empiriques sur la persistance de l'hydroquinone
| Milieu | Processus du devenir | Valeur de la dégradation | Paramètre de la dégradation/unité | Durée des essais | Référence |
|---|---|---|---|---|---|
| Air | photolyse | 57 | photominéralisation (%) | 17 h | Freitag et al., 1985 |
| Eau | biodégradation | 70 | biodégradation (%) | 28 j | Chemicals Inspection and Testing Institute, 1992 |
Tableau 5b. Données modélisées sur la persistance de l'hydroquinone
| Milieu | Processus du devenir | Valeur de la dégradation | Paramètre de la dégradation/unité | Référence |
|---|---|---|---|---|
| Air | oxydation atm. | 0,4606 | demi-vie (jours) | AOPWIN, v. 1.91 |
| Air | réaction avec l'ozone | non réactif | demi-vie (jours) | AOPWIN, v. 1.91 |
| Eau/sol | biodégradation | 15 | demi-vie (jours) | BIOWIN, v. 4.02, Ultimate survey |
| Eau/sol | biodégradation | 0,691 | probabilité | BIOWIN, v. 4.02, MITI Non linear Probability |
| Eau/sol | biodégradation | 0,546 | probabilité | BIOWIN, v. 4.02, MITI Non linear Probability |
| Eau/sol | biodégradation | 0,918 | probabilité | Topkat, v. 6.1 |
Bioaccumulation
Les données expérimentales et modélisées (tableaux 6a et 6b) indiquent que l’hydroquinone ne répond pas aux critères de la bioaccumulation (facteur de bioconcentration [FBC]/facteur de bioaccumulation [FBA] ≥ 5 000), définis dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Tableau 6a. Données expérimentales sur la bioaccumulation de l'hydroquinone
| Organisme d'essai | Paramètre | Valeur (poids humide) (L/kg) |
Référence (base de données ECOTOX) |
|---|---|---|---|
| Algue verte (Chlorella fusca) | FBC | 35–65 | 306; 11 297; 17 318 |
| Poisson (Leuciscus idus; Leuciscus idus melanotus) | FBC | 40 | 3 781; 17 318 |
Tableau 6b. Données modélisées sur la bioaccumulation de l'hydroquinone
| Organisme d'essai | Paramètre | Valeur (poids humide) (L/kg) |
Référence |
|---|---|---|---|
| Poisson | FBA | 1 | Modified Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | FBC | 1 – 19 | OASIS; Modified Gobas BCF 5 % T2LTL (Arnot et Gobas, 2003); BCFWIN, v. 2.15 |
Comme il est indiqué précédemment, l’hydroquinone ne remplit pas les critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Les données écotoxicologiques expérimentales (base de données ECOTOX) sur l’hydroquinone dénotent une toxicité élevée pour les organismes aquatiques. Les valeurs de la toxicité aiguë (CL50 et CE50) pour le poisson et la daphnie sont inférieures à 1 mg/L tandis que d’autres sont encore plus faibles, soit 0,044 mg/L pour le poisson. L’algue verte et la crevette des salines seraient les espèces les moins sensibles (CL50 et CE50aiguës de 17-31 mg/L). Aucune donnée sur la toxicité pour les organismes non aquatiques autres que des mammifères n’a été relevée.
L’Inventaire national des rejets de polluants (INRP) signale des rejets allant jusqu’à 2 kg par année vers un milieu non spécifié pour les années 2001 à 2006 (INRP, 2007). Selon les renseignements récemment obtenus en vertu de l’article 71 de la LCPE (1999), une quantité totale légèrement au-dessus de 100 kg d’hydroquinone a été rejetée en 2006 par trois entreprises canadiennes (Environnement Canada, 2007). étant donné la quantité et la nature de ces rejets, il est peu probable que ces derniers deviennent une source d’exposition importante pour les organismes dans l’environnement.
Selon l’information disponible, l’hydroquinone n’aurait pas le potentiel de causer des dommages écologiques au Canada.
Évaluation de l'exposition
L’annexe 1 présente des valeurs estimées de la limite supérieure d’absorption d’hydroquinone en fonction de différents groupes d’âge au sein de la population canadienne. Les estimations sont fondées sur la concentration maximale déterminée dans les milieux naturels et dans les aliments. Pour l’ensemble de la population, l’estimation de la limite supérieure d’exposition à l’hydroquinone varie de 91,32 µg/kg de masse corporelle (m.c.) par jour pour la cohorte des 60 ans et plus à 393,45 µg/kg-m.c. par jour chez les sujets de la cohorte des 0 à 6 mois (non nourris au lait maternisé). Selon ces estimations, l’absorption par les aliments et les boissons constitue la principale source d’exposition à l’hydroquinone de l’ensemble de la population au Canada. Elle équivaut à plus de 99,9 p. 100 de l’exposition totale, tous groupes d’âge confondus. Comme on l’a indiqué plus tôt, l’hydroquinone et son conjugué glucosé, le 4-hydroxyphényl-β-D-glucopyranoside (arbutine), sont présents naturellement dans un grand nombre d’aliments et de boissons. S’hydrolysant facilement en solution acide diluée pour produire le D-glucose et l’hydroquinone, l’arbutine devrait se convertir en hydroquinone libre dans l’estomac (Deisinger et al., 1996). C’est pourquoi nous tenons compte des concentrations mesurées d’hydroquinone et d’arbutine dans les aliments et les boissons dans le calcul des estimations. L’apport en provenance d’autres sources (air ambiant, air intérieur, eau et sol) devrait être négligeable en comparaison de son absorption par les aliments et les boissons.
L’exposition cutanée attribuable à l’emploi de divers produits de consommation contenant de l’hydroquinone peut aussi ajouter à l’exposition totale de l’ensemble de la population. L’annexe 2 présente différents scénarios correspondant à des limites supérieures d’exposition à différents produits contenant de l’hydroquinone. Ce sont notamment son absorption au cours de l’emploi de révélateurs pour photos noir et blanc (7,9 × 10-4 µg/kg-m.c. par jour), l’emploi d’adhésifs à usage domestique (7,2 × 10-5 µg/kg-m.c. par jour), les préparations pour manucure (3,0 × 10-4 µg/kg-m.c. par jour) et l’emploi de colorants capillaires oxydants (7,5 × 10-2 µg/kg-m.c. par jour)kg-m.c.. Sa pression de vapeur étant faible, il existe peu de risques d’exposition importante par inhalation de l’hydroquinone dégagée au moment de l’utilisation d’un de ces produits. Quant à l’exposition attribuable à l’emploi des révélateurs photographiques, les résultats d’une récente étude réalisée au Royaume-Uni, au cours de laquelle des travailleurs professionnels en chambre noire ont fait l’objet d’une surveillance biologique, n’ont révélé aucune hausse de l’excrétion urinaire de l’hydroquinone chez ces travailleurs. Cela signifie que même chez cette sous-population susceptible d’être fortement exposée, l’absorption d’hydroquinone associée à l’emploi de révélateurs risque peu d’être une source de préoccupation (UKHSE, 1993).
À cause de la grande diversité d’utilisations cliniques possibles, aucune valeur estimée de l’exposition n’a été calculée pour les produits en vente libre d’éclaircissement de la peau qui contiennent de l’hydroquinone et qui sont réglementés en vertu de la Loi sur les aliments et drogues. En outre, la vente de ces produits est régie par des dispositions imposées par la National Association of Pharmacy Regulatory Authorities.
Les particules de la fumée de cigarette contiennent de l’hydroquinone (CIRC, 1985). Elles sont donc une autre source d’exposition.
La confiance relative à l’estimation des limites supérieures d’absorption de l’hydroquinone par exposition dans les milieux naturels est modérée puisque les mesures de concentration effectuées étaient limitées. Il faut accorder une confiance limitée aux valeurs estimées de l’exposition à l’hydroquinone par l’utilisation de produits de consommation qui en contiennent puisqu’elles sont fondées sur des hypothèses. Toutefois, on juge que ces dernières surévaluent l’exposition réelle.
Évaluation des effets sur la santé humaine
L’annexe 3 fait le résumé de l’information sur les effets de l’hydroquinone sur la santé d’animaux de laboratoire. L’annexe 4 fait le survol des effets sur la santé humaine qui ont été signalés.
La Commission européenne (CE) a classé l’hydroquinone à titre de cancérogène de catégorie 3 (« substances préoccupantes pour les humains en raison d’effets cancérogènes possibles ») (CE, 1997a; IUCLID, 2000). À l’origine, on avait proposé de classer l’hydroquinone dans le groupe 2 des substances cancérogènes à cause de données sur l’apparition d’adénomes rénaux et de leucémie monocytaire chez le rat, ainsi que d’adénomes hépatiques chez la souris (annexe 3). Toutefois, la majorité des experts de la CE se sont entendus pour classer cette substance dans le groupe 3 puisque seulement des tumeurs bénignes ont été observées après l’exposition d’animaux de laboratoire à cette substance (CE, 1997a, 1997b). Le Centre international de recherche sur le cancer (CIRC) a placé l’hydroquinone dans le groupe 3 (« non classable en tant que substance cancérogène pour les humains »), à cause d’un manque d’indications suffisantes de cancérogénicité chez l’humain et d’indications limitées chez les animaux de laboratoire (CIRC, 1999).
L’exposition à long terme (2 ans) de rats mâles et femelles de la souche F344 par gavage (5 jours par semaine) à l’hydroquinone aux doses de 0, 25 ou 50 mg/kg donne lieu à une hausse proportionnelle à la dose des adénomes des cellules des tubules rénaux chez les mâles. Chez les femelles, l’incidence de la leucémie monocytaire s’élève de façon proportionnelle à la dose, mais la néphropathie est moins prononcée chez les femelles que chez les mâles. Chez des souris mâles et femelles de la souche B6C3F1 soumises à un même schéma de traitement à des doses de 0, 50 ou 100 mg/kg d’hydroquinone, le poids relatif du foie a augmenté chez les mâles traités et chez les femelles exposées à la dose la plus élevée. Chez les souris mâles, les lésions hépatiques associées à la substance testée sont l’altération des tissus adipeux, la cytomégalie et l’altération des cellules syncitiales. L’incidence combinée des carcinomes et des adénomes hépatocellulaires n’est pas statistiquement significative. Toutefois, on a observé une hausse marquée de l’incidence des adénomes hépatocellulaires chez les souris femelles traitées, en comparaison des témoins (NTP, 1989).
L’exposition de rats et de souris par voie alimentaire à l’hydroquinone à une dose de 0,8 p. 100 pendant 104 ou 96 semaines, respectivement, a provoqué l’hyperplasie des cellules des tubules rénaux et de l’épithélium des papilles rénales, ainsi que des adénomes, surtout chez les mâles des deux espèces. Ce traitement a été associé à une néphropathie chronique chez les rats mâles. Les rates présentaient des signes de néphropathie bénigne. L’absorption quotidienne moyenne a été estimée à 351 ou à 368 mg/kg-m.c. par jour chez les rats mâles et femelles, respectivement, et à 1 046 et 1 486 mg/kg-m.c. par jour chez les souris mâles et femelles, respectivement. Chez le rat, l’incidence des cas d’hyperplasie des cellules épithéliales des papilles rénales, d’hyperplasie des cellules des tubules rénaux et d’adénomes tubulaires était nettement plus élevée chez les mâles, alors que les femelles présentaient des signes de néphropathie bénigne. Chez la souris, les chercheurs ont observé une hausse marquée des cas d’hyperplasie de l’épithélium du préestomac (cellules de l’épithélium pavimenteux) tant chez les mâles que chez les femelles. Cependant, le nombre de cas d’hyperplasie des cellules des tubules rénaux et d’adénomes s’est accru uniquement chez les mâles. En outre, une incidence accrue d’adénomes hépatocellulaires a été observée chez les souris mâles (Shibata et al., 1991).
La Commission européenne (CE) a classé l’hydroquinone à titre de mutagène de catégorie 3 (« substance préoccupante pour l’homme en raison d’effets mutagènes possibles ») (CE, 1997a; OJEC, 2001). Les spécialistes de la CE s’entendent pour reconnaître que l’hydroquinone est clairement mutagène in vitro et qu’elle est un mutagène somatique in vivo(CE, 1997a). Les essais sur la génotoxicité ont donné des résultats positifs dans de nombreux systèmes d’essai in vivo et in vitro. Le CIRC (1999) est parvenu à la conclusion que l’hydroquinone avait un effet mutagène dans de nombreux systèmes in vitro et qu’elle était à l’origine d’aberrations chromosomiques structurales sur des cellules de la moelle osseuse de souris après injection intrapéritonéale.
L’analyse des modes d’action échappe à la portée du présent rapport, mais des mécanismes non génotoxiques ont été avancés pour expliquer la cancérogénicité de l’hydroquinone. On a avancé que les adénomes au niveau des tubules rénaux auraient pu être induits chez le rat par un mécanisme indirect qui aurait eu pour effet d’intensifier une maladie courante chez les rats vieillissants (néphropathie chronique évolutive) suivant l’exposition à l’hydroquinone ou à son métabolite (McGregor, 2007). Cependant, on ne peut pas écarter d’emblée les liens possibles entre des dommages génétiques et la cancérogénicité de cette substance. Il se peut que cette substance agisse indirectement par un mécanisme de génotoxicité (comme l’hétéroploïdie, le stress oxydatif, l’inhibition de la synthèse d’ADN ou la cytotoxicité) qui pourrait avoir un seuil d’action (Pratt et Barron, 2003). Il existe des indications montrant que les liaisons macromoléculaires et que l’endommagement oxydatif de l’hydroquinone sont associés à sa génotoxicité (Tsutsui et al., 1997; do Ceu Silvaet al., 2003, 2004). Des chercheurs ont aussi proposé l’existence d’un lien entre la réaction des métabolites de l’hydroquinone avec le glutathion ainsi que la manifestation de dommages épigénétiques causés par l’hydroquinone, et la leucémie ou des troubles rénaux (English et al., 1994; Whysner et al., 1995; McDonald et al., 2001). De surcroît, l’hydroquinone est un métabolite du benzène, un cancérogène du groupe 1 chez les humains, selon le CIRC (CIRC, 1987).
Quant aux effets autres que cancérogènes, la plus faible dose sans effet observé (DSEO) orale relevée dans la base de données est de 15 mg/kg-m.c. par jour. Dans une étude sur la reproduction portant sur deux générations, des chercheurs ont administré par gavage une dose d’hydroquinone de 0, 15, 50 ou 150 mg/kg-m.c. par jour à des rats mâles et femelles. Aucun effet marqué sur la reproduction n’a été observé chez les animaux de la génération F0 ou F1 aux deux doses les plus faibles. Des tremblements ont été signalés chez 1 des 30 animaux exposés à la dose de 50 mg/kg-m.c. par jour. La DSEO chez les animaux de la génération F0 (toxicité générale) était de 15 mg/kg-m.c. par jour. La DSEO associée à la toxicité pour la reproduction s’est chiffrée à 150 mg/kg-m.c. par jour chez les animaux des deux générations (Blacker et al., 1993). Au cours d’une étude de 90 jours portant sur l’exposition de rats par voie cutanée , David (1994) a établi à 73,9 mg/kg-m.c. par jour la dose sans effet nocif observé (DSENO) chez les mâles en prenant pour paramètre les effets topiques. Aucun effet systémique n’a été signalé.
La confiance accordée à la base de données toxicologiques est de faible à modérée. La base de données sur les effets sur la santé ne traite pas complètement des principales voies et durées d’exposition.
Caractérisation des risques pour la santé humaine
Selon l’évaluation de la Commission européenne, la cancérogénicité est l’effet critique à considérer en vue de la caractérisation des risques pour la santé humaine; on ne peut donc pas exclure la possibilité d’un mode d’induction comportant une interaction directe avec le matériel génétique.
Pour ce qui est des effets autres que cancérogènes, la plus faible DSEO orale relevée (15 mg/kg-m.c. par jour) provient de l’étude sur la reproduction de deux générations de rats. Elle est fondée sur la toxicité pour les parents. Mais comme l’exposition de la population générale est associée en très grande partie à la présence naturelle d’hydroquinone dans les aliments et les boissons, il serait inutile de déterminer la marge d’exposition entre des doses avec effet mesurées dans le cadre d’études où l’exposition d’animaux de laboratoire se fait par le régime alimentaire et des estimations de la limite supérieure de l’exposition. Lorsqu’il s’agit des effets autres que le cancer, on estime que l’exposition additionnelle dans les milieux naturels à l’hydroquinone attribuable à sa fabrication et à ses utilisations industrielles et les risques qui en découlent sont négligeables.
Il peut se produire une exposition cutanée à l’hydroquinone contenue dans des produits de consommation (annexe 2). Le contact avec des colorants capillaires oxydants contenant cette substance (7,5 × 10-3 µg/kg-m.c. par jour) correspond au scénario de la plus forte exposition cutanée par des produits de consommation. La marge d’exposition entre cette valeur et la DSENO associée à l’exposition par voie cutanée dans l’étude de 90 jours chez le rat (73,9 mg/kg-m.c. par jour) est bien au-delà de 1 000 000. On estime par ailleurs que, relativement aux effets autres que cancérogènes par exposition cutanée, la marge obtenue suffit pour tenir compte de l’incertitude associée à la base de données sur l’exposition et les effets.
Il faut jauger les risques présentés par les produits d’éclaircissement de la peau contenant de l’hydroquinone qui sont en vente libre et qui sont réglementés en vertu de laLoi sur les aliments et drogues, au regard des avantages cliniques qu’ils procurent aux utilisateurs. Cette évaluation échappe au cadre du présent rapport. Toutefois, Santé Canada a reçu 10 rapports (entre le 1er janvier 1965 et le 30 novembre 2007) faisant état de réactions négatives sans doute associées à l’utilisation de crèmes liquides pour la peau en vente libre (Santé Canada, 2007d).
Incertitudes associées à l'évaluation des risques pour la santé humaine
Il subsiste des incertitudes relativement à des différences de sensibilité à l’hydroquinone entre les espèces. La présente évaluation préalable ne porte pas sur l’analyse du mode d’action appliquée à la cancérogénicité de l’hydroquinone.
Il existe peu de données sur les concentrations d'hydroquinone dans les milieux naturels. Il y a aussi des incertitudes concernant les estimations de l'exposition associée à l'utilisation de produits de consommation puisqu'elles sont fondées sur des hypothèses prudentes.
Compte tenu de la cancérogénicité de l’hydroquinone, pour laquelle il existe une probabilité d’effets nocifs à toute concentration d’exposition, il est conclu que l’hydroquinone est une substance qui peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Compte tenu de l’information disponible, il est conclu que l’hydroquinone ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique et à mettre en danger l'environnement essentiel pour la vie.
Il est donc conclu que l’hydroquinone ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE (1999), mais qu’il remplit ceux énoncés à l’alinéa 64c) de la Loi. De plus, cette substance ne satisfait pas aux critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation.
Alder, I.D. et U. Kliesch. 1990. Comparison of single and multiple treatment regimens in the mouse bone marrow micronucleus assay for hydroquinone (HQ) and cyclophosphamide (CP). Mutat. Res. 234:115-23.
Aneshansley, D.J., T. Eisner, J.M. Widom et B.Widom. 1969. Biochemistry at 100{degrees}C: Explosive Secretory Discharge of Bombardier Beetles (Brachinus). Science, 165(3888):61-3.
AOPWIN, v. 1.91. 2000. U.S. Environmental Protection Agency.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Liste des produits de formulation de l’ARLA. Ottawa (ON) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. (cité le 10 juillet 2007)
Arnot, J.A. et F.P.A.C. Gobas. 2003. A Generic QSAR for Assessing the Bioaccumulation Potential of Organic Chemicals in Aquatic Food Webs. QSAR Comb. Sci. 22(3): 337-345.
Asan, A.et I. Isildak. 2003. Determination of major phenolic compounds in water by reversed-phase liquid chromatography after pre-column derivatization with benzoyl chloride. J. Chromatography A. 988: 145-149
Barber, E.D., T. Hill et D.B. Schum. 1995. The percutaneous absorption of hydroquinone (HQ) through rat and human skin in vitro. Toxicology Letters 80:167-172
BCFWIN. 2000. v. 2.15. U.S. Environmental Protection Agency.
Bentley-Phillips B. et M.A. Bayles. 1975. Cutaneous reactions to topical application of hydroquinone. Results of a 6-year investigation. S. Afr. Med. J. 49(34):1391-5.
Bernard, L.G. 1988. Subchronic oral toxicity of hydroquinone in rats utilizing a functional-observational battery and neuropathology to detect neurotoxicity (rapport non publié TX-88-78). Eastman Kodak.
Bio/dynamics Inc.1989. A developmental toxicity study in rabbits with hydroquinone (No projet 87-3220) : Rapport définitif rédigé pour le compte de la Chemical Manufacturers Association. East Millstone, New Jersey.
BIOWIN 2000, v. 4.02. U.S. Environmental Protection Agency.
Blacker, A.M., R. E. Schroeder, J.C. English, S.J. Murphy, W.J. Krasavage et G.S. Simon. 1993. A two-generation reproduction study with hydroquinone in rats. Fundam. Appl. Toxicol. 21(4):420-424.
Blacker, A.M., R. E. Schroeder, J.C. English, S.J. Murphy, W.J. Krasavage et G.S. Simon. 1993a. A two-generation reproduction study with hydroquinone in rats. Fundam. Appl. Toxicol. 21(4):420-4.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), Lois du Canada, Ottawa, Imprimeur de la Reine, chap. 33. Loi sanctionnée le 14 septembre 1999. Publiée dans la Gazette du Canada Partie III, vol. 22, n° 3.
Canada. 2000. Règlement sur la persistance et la bioaccumulation. Ottawa : Travaux publics et Services gouvernementaux Canada. Publié dans la Gazette du Canada Partie II, vol. 134, n° 7.
Canada, 2007a. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inscrites sur la Liste intérieure des substances (LIS).Ottawa. Travaux publics et Services gouvernementaux. Gazette du Canada Partie I, vol. 141, n° 5.
Canada. 2007b. Ministère de l’Environnement, ministère de la Santé. Profil de substance pour le Défi, pyrocathécol (cathécol), No CAS 120-80-9.
Carlson, A.J. et N.R. Brewer. 1953b. Toxicity studies on hydroquinone. Proc. Soc. Exp. Biol. Med. 84(3):684-8:684-8.[CE] Commission européenne. 1997a. Summary Record. Commission Working Group of Specialised Experts in the fields of Carcinogenicity, Mutagenicity and Reprotoxicity. Meeting at Belgirate (4-6 juin).
[CE] Commission européenne. 1997b. Draft Summary Record Commission Working Group on the Classification and Labeling of Dangerous Substances. Réunion de l’ECB à Ispra (4-6 juin).
[Chemical Economics Handbook]. 2006. SRI Consulting. CEH Data Summary for Hydroquinone, June 2006. p. 1-20.
Journal officiel des Communautés européennes, 2001. Commission Directive 2001/59/EC of 6 August 2001 adapting to technical progress for the 28th time Council Directive 67/548/EEC on the approximation of the laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances. L225 (21 août). Vol. 44 (Annex 6).
Chemicals Inspection and Testing Institute. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Japon : Chemical Industry Ecology- Toxicology and Information Centre. ISBN 4-89074-101-1.
[CIRC] Centre international de recherche sur le cancer. 1985. Tobacco Smoking. IARC Monogr.Eval.Carcinogen. Risk Chem.Hum. 38:86. Lyon, France. IARC Monogr. Eval. Carcinogen.
[CIRC] Centre international de recherche sur le cancer. 1987. Benzene. Summary and Evaluation Supplement 7. Lyon, France.
[CIRC] Centre international de recherche sur le cancer. 1999. Hydroquinone. Monographs on the Evaluation of Carcinogenic Risks to Humans. Re-evaluation of Some Organic Chemicals, Hydrazine and Hydrogen peroxide. Lyon, France. 71 (Partie 2):691-719.
David, R. 1994. NDMA high HQ formulation cream: a thirteen-week dermal toxicity and cell proliferation study in the rat. Rapport non publié. Nonprescription Drug Manufacturers Association.
Deisinger, P.J., T.S. Hill et J.C. English. 1996. Human exposure to naturally occurring hydroquinone. J. Toxicol. Environ. Health, 47: 31-46.
DHM (Direction de l’hygiène du milieu). 1998. Exposure factors for assessing total daily intake of Priority Substances by the general population of Canada. Rapport non publié. Décembre 1998. Section des substances d’intérêt prioritaire, Direction de l’hygiène du milieu, Santé Canada.
do Ceu Silva, M., J. Gaspar, I. Duarte Silva, A. Faber et J.Rueff. 2004. GSTM1, GSTT1, and GSTP1 genotypes and the genotoxicity of hydroquinone in human lymphocytes. Environ. Mol. Mutagen. 2004;43(4):258-64:258-64.
do Ceu Silva, M., J. Gaspar, I. Duarte Silva, D. Leao et J.Rueff. 2003. Mechanisms of induction of chromosomal aberrations by hydroquinone in V79 cells. Mutagenesis. Nov. 2003; 18(6):491-6.
ECOTOX. Base de données.
English, J.C., L.G. Perry, M. Vlaovic, C.Moyer et J.L. O'donoghue. 1994. Measurement of cell proliferation in the kidneys of Fischer 344 and Sprague-Dawley rats after gavage administration of hydroquinone. Fundam. Appl. Toxicol. 1994 Oct; 23(3):397-406:397-406.
Environnement Canada. 2007. Loi canadienne sur la protection de l’environnement (1999). Avis concernant certaines substances identifiées dans la Liste intérieure des substances (LIS). Gazette du Canada Partie I, vol. 141, n° 5.
EPIWIN, 2000. v. 3.12. U.S. Environmental Protection Agency.
Erexson, G.L., J.L. Wilmer et A.D. Kligerman. 1985. Sister chromatid exchange induction in human lymphocytes exposed to benzene and its metabolites in vitro. Cancer Res. 45(6):2471-2477.
Fahrig, R. 1984. Genetic mode of action of cocarcinogens and tumor promoters in yeast and mice. Mol. Gen. Genet. 194(1-2):7-14.
Findlay, G.H. et H.A. De Beer. 1980. Chronic hydroquinone poisoning of the skin from skin-lightening cosmetics. A South African epidemic of ochronosis of the face in dark-skinned individuals. S. Afr. Med. J. 57(6):187-90.
Findlay, G.H., J.G. Morrison et I.W. Simson. 1975. Exogenous ochronosis and pigmented colloid milium from hydroquinone bleaching creams. Br. J. Dermatol. 3(6):613-22.
Freitag, D., L. Ballhorn, H. Geyer et F. Korte. 1985. Environmental hazard profile of organic chemicals. Chemosphere, 14: 1589-1616.
Galloway, S.M., M.J. Armstrong, C.Reuben, S. Colman, B. Brown, C.Cannon, A.D. Bloom, F. Nakamura, M. Ahmed, S. Duk et al. 1987. Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: evaluations of 108 chemicals. Environ. Mol. Mutagen. Suppl. 10:1-175.
Glatt, H., I. Gemperlein, F. Setiabudi, K.L. Platt et F. Oesch. 1990. Expression of xenobiotic-metabolizing enzymes in propagatable cell cultures and induction of micronuclei by 13 compounds. Mutagenesis 5(3):241-9.
Hakura, A., Y. Tsutsui, H. Mochida, Y. Sugihara, T. Mikami et F. Sagami. 1996. Mutagenicity of dihydroxybenzenes and dihydroxynaphthalenes for Ames Salmonella tester strains. Mutat. Res. 371(3-4):293-9.
Hansch, C., A. Leo et D. Hoekman. 1995. Exploring QSAR: Hydrophobic, Electronic, and Steric Constants. American Chemical Society, Washington, DC, USA.
Harbison, K.G. et R.T. Belly. 1982. The biodegradation of hydroquinone. Environ. Toxicol. Chem. 1(1): 9–15
Haworth, S., T. Lawlor, K. Mortelmans, W. Speck et E. Zeiger. 1983. Salmonella mutagenicity test results for 250 chemicals. Environ. Mutagen. Suppl. 1:1-142.
[HSDB] Hazardous Substances Databank [base de données sur Internet]. 2006. Bethesda (MD): U.S Department of Health and Human Services, National Institutes of Health, National Library of Medicine, Toxicology Data Network. [cité en mars 2006].
Hudnall, P.M. 1987. Hydroquinone. In : Gerhartz ,W., R. Pfefferkorn, F.T. Campbell, J.F. Rounsaville et S.Y. Yamamoto. 1987. Ullman's Encyclopedia of Industrial Chemistry. 5e éd. New York: VCH Publishers. p. A13: 499-505.
[IUCLID] International Uniform Chemical Information Database. 2000. Hydroquinone (CAS 123-31-9). Commission européenne, Bureau européen des substances chimiques.
Krasavage, W.J. 1984. Hydroquinone: a dominant lethal assay in male rats: Report No. TX-84-23. Rochester (NY): Eastman Kodak Company, Health and Environment Laboratories.
Krasavage, W.J., A.M. Blacker, J.C. English et S.J. Murphy. 1992. Hydroquinone: a developmental toxicity study in rats. Fundam. Appl. Toxicol. 18(3):370-5.
Laboratory of Industrial Medicine, Eastman Kodak Company. 1971. Toxicity Report. (rapport non publié).
Levitt, J. 2007. The safety of hydroquinone: A dermatologist’s response to the 2006 federal Register. J Am Acad Dermatol. 57(5):854-872.
McDonald, T.A., N.T. Holland, C. Skibola, P. Duramad et M.T. Smith. 2001. Hypothesis: phenol and hydroquinone derived mainly from diet and gastrointestinal flora activity are causal factors in leukemia 1. Leukemia 15(1):10-20.
McGregor D. 2007. Hydroquinone: An evaluation of the human risks from its carcinogenic and mutagenic properties. Critic Rev Toxicol 37. 887-914.
Meylan, W.M. et P.H. Howard. (1991). Bond contribution method for estimating Henry's law constants. Environmental Toxicology and Chemistry 10:1283-1293.
Miller, B.M. et I.D. Adler. 1989. Suspect spindle poisons: analysis of c-mitotic effects in mouse bone marrow cells. Mutagenesis 4(3):208-15.
Morimoto, K. et S. Wolff. 1980. Cell cycle kinetics in human lymphocyte cultures. Nature 288(5791):604-6.
Murphy, S.J., R.E. Schroeder, A.M. Blacker, W.J. Krasavage et J.C.English. 1992. A study of developmental toxicity of hydroquinone in the rabbit. Fundam. Appl. Toxicol. 19(2):214-221.
Nielsen, H., L. Henriksen et J.H. Olsen. 1996. Melignant melanoma among lithographers. Scan J Work Environ Health Apr 22(2):108-111.
[NTP] National Toxicology Program. 1989. Toxicology and carcinogenesis studies of hydroquinone in F344/N rats and B6C3F1 mice (études par gavage). Research Triangle Park (Caroline du Nord): National Toxicology Program. Rapport technique no 366.
OASIS Forecast. 2004. Version 1.14. Laboratoire de chimie mathématique, Université "Prof. Assen Zlatarov". Bourgas, Bulgarie.
Pacchierotti, F., B. Bassani, P. Leopardi et A. Zijno. 1991. Origin of aneuploidy in relation to disturbances of cell-cycle progression. II: Cytogenetic analysis of various parameters in mouse bone marrow cells after colchicine or hydroquinone treatment. Mutagenesis 6(4):307-11.
Painter, R.B. et R. Howard. 1982. The Hela DNA-synthesis inhibition test as a rapid screen for mutagenic carcinogens. Mutat. Res. 92(1-2):427-37.
PCKOCWIN. 2000. v. 1.66. U.S. Environmental Protection Agency.
[PISSC] Programme international sur la sécurité des substances chimiques.1994. Environmental Health Criteria (EHC) 157. Hydroquinone.
Pratt, I.S. et T. Barron. 2003. Regulatory recognition of indirect genotoxicity mechanisms in the European Union. Toxicology Letters 140-141:53-62.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo) Model [Internet]. Version 4.1. Pays-Bas : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
Sakai, M., D.Yoshida et S. Mizusaki. 1985. Mutagenicity of polycyclic aromatic hydrocarbons and quinones on Salmonella typhimurium TA97. Mutat. Res. 156(1-2):61-7.
Santé Canada. 2007a. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques au Canada
Santé Canada. 2007b. Rapport provisoire sur l’hydroquinone. Division des cosmétiques de Santé Canada. Septembre 2007.
Santé Canada. 2007c. Communication personnelle. Robin Marles. Direction des produits thérapeutiques. 22 novembre 2007.
Santé Canada. 2007d. Communication personnelle., Jenna Griffiths, Direction des produits de santé commercialisés, Direction générale des produits de santé et des aliments, 8 janvier 2008.
Schauer, J.J. et G.R. Cass. 2000. Source Apportionment of Wintertime Gas-Phase and Particle-Phase Air Pollutants Using Organic Compounds as Tracers. Environmental Science and Technology, 34(9).1821-1832.
Shibata, M.A., M. Hirose, H. Tanaka, E. Asakawa, T. Shirai et N. Ito. 1991c. Induction of renal cell tumors in rats and mice, and enhancement of hepatocellular tumor development in mice after long-term hydroquinone treatment. Jpn J. Cancer Res. 2(11):1211-9.
Shibata, M.A., M. Hirose, H. Tanaka, E. Asakawa, T. Shirai et N. Ito. 1991c. Induction of renal cell tumors in rats and mice, and enhancement of hepatocellular tumor development in mice after long-term hydroquinone treatment. Jpn J. Cancer Res. 2(11):1211-1219.
Shibata, M.A., M. Hirose, H. Tanaka, E. Asakawa, T. Shirai et N. Ito. 1991a. Induction of renal cell tumors in rats and mice, and enhancement of hepatocellular tumor development in mice after long-term hydroquinone treatment. Jpn J. Cancer Res. 2(11):1211-9.
SIDS OCDE, 2002. Screening Information Data Set. CAS RN 123-31-9, 1,4-Benzenediol. Publications du PNUE. Juin 2002.
Sterner, J.H., F.L. Oglesby et B. Anderson. 1947. Quinone vapors and their harmful effects. The Journal of Industrial Hygiene and Toxicology 29:60-73.
Topkat, 2004. v. 6.1. Accelrys Software Inc.
Tsutsui, T., N. Hayashi, H. Maizumi, J. Huff et J.C. Barrett. 1997. Benzene-, catechol hydroquinone- and phenol-induced cell transformation, gene mutations, chromosome aberrations, aneuploidy, sister chromatid exchanges and unscheduled DNA synthesis in Syrian hamster embryo cells. Mutat. Res. 373(1):113-123.
UKHSE, 1993. United Kingdom Health and Safety Executive. Renseignements non publiés. Tel qu’indiqué dans le SIDS de l’OCDE, 2002.
Varagnat, J. 1982. Kirk-Othmer Encyclopedia of Chemical Technology 3e éd. New York: Wiley Publishing Co. 39-69.
Versar Inc. 1986. Standard Scenarios for Estimating Exposure to Chemical Substances During Use of Consumer Products, Vol. I. Rédigé pour le compte de l’U.S. Environmental Protection Agency.
Woodard , G.D.L. 1951. The toxicity, mechanism of action, and metabolism of hydroquinone. [dissertation]. Université George Washington.
Whysner, J., L. Verna, J.C. English et G.M. Williams. 1995. Analysis of studies related to tumorigenicity induced by hydroquinone. Regul. Toxicol. Pharmacol. Février 1995. 21(1):158-76.
Xu, W. et I.D. Adler. 1990. Clastogenic effects of known and suspect spindle poisons studied by chromosome analysis in mouse bone marrow cells. Mutagenesis 5(4):371-374.
Zeidman, I. et R. Deuit. 1945. Poisoning by hydroquinone and mono-methylparamenohenol sulphate: Report of 2 cases with autopsy findings. Am J Med Sci 210:328-332.
Annexe 1 : Valeurs estimées de la limite supérieure d’absorption quotidienne d’hydroquinone par la population générale au Canada
| Voie d'exposition | Estimation de l'absorption (μg/kg-m.c. par jour) d'hydroquinone par groupe d'âge |
|||||||
|---|---|---|---|---|---|---|---|---|
| 0-6 mois [1, 2, 3] | 0,5-4 ans[4] | 5-11 ans[5] | 12-19 ans[6] | 20-59 ans[7] | 60+ ans[8] | |||
| Nourris au lait maternisé | Nourris autrement | |||||||
| Air [9] | 0,01 | 0,03 | 0,05 | 0,05 | 0,06 | 0,05 | ||
| Eau potable [10] | 0,00 | 0,20 | 0,10 | 0,10 | 0,05 | 0,04 | 0,04 | |
| Aliments et boissons [11] | 393,24 | 366,35 | 242,46 | 127,65 | 105,19 | 91,27 | ||
| Sol [12] | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | ||
| Absorption totale | 0,00 | 393,45 | 366,45 | 242,56 | 127,71 | 105,23 | 91,32 | |
[1] Aucune donnée n’a été signalée sur les concentrations d’hydroquinone dans le lait maternel.
[2] Par hypothèse, poids de 7,5 kg, absorption d'air de 2,1 m 3 par jour, absorption d'eau de 0,8 L par jour (lait maternisé) ou de 0,3 L/jour (autres que lait maternisé), ingestion de 30 mg de particules de sol par jour (DHM, 1998).
[3] Pour les poupons nourris avec du lait maternisé, l'absorption d'eau est synonyme de l'absorption d'aliments. On n'a relevé aucune donnée connue sur les concentrations d'hydroquinone dans le lait maternisé au Canada.
[4] Par hypothèse, poids de 15,5 kg, absorption d'air de 9,3 m 3 par jour, absorption d'eau de 0,7 L par jour, ingestion de 100 mg de particules de sol par jour (DHM, 1998).
[5] Par hypothèse, poids de 31,0 kg, absorption d'air de 14,5 m 3 par jour, absorption d'eau de 1,1 L par jour, ingestion de 65 mg de particules de sol par jour (DHM, 1998).
[6] Par hypothèse, poids de 59,4 kg, absorption d'air de 15,8 m 3 par jour, absorption d'eau de 1,2 L par jour, ingestion de 30 mg de particules de sol par jour (DHM, 1998).
[7] Par hypothèse, poids de 70,9 kg, absorption d'air de 16,2 m 3 par jour, absorption d'eau de 1,5 L par jour, ingestion de 30 mg de particules de sol par jour (DHM, 1998).
[8] Par hypothèse, poids de 72,0 kg, absorption d'air de 14,3 m 3 par jour, absorption d'eau de 1,6 L par jour, ingestion de 30 mg de particules de sol par jour (DHM, 1998).
[9] Aucune donnée canadienne n’a été relevée. En guise de remplacement, une concentration de 0,00346 µg/m3 d’hydroquinone dans les particules fines lors d’une étude de surveillance de l’air ambiant à Fresno, Californie, a été appliquée au calcul de la limite supérieure d’exposition estimée (Schauer et Cass, 2000). Aucune donnée sur la concentration dans l’air intérieur n’a été relevée. Par hypothèse, elle est égale à la concentration dans l’air ambiant mentionnée ci-dessus, et la population canadienne y est exposée jour et nuit.
[10] On a relevé aucune donnée canadienne. En guise de remplacement, la concentration moyenne de 7,6 µg/L mesurée dans un échantillon d’eau prélevé dans la rivière Mert, Turquie, a été appliquée au calcul de la limite supérieure d’exposition estimée (Asan et Isildak, 2003). Chez les poupons nourris au lait maternisé, la concentration d’hydroquinone dans l’eau de surface ayant servi à la préparation du lait correspond à la dose absorbée dans les aliments
[11] La concentration maximale d'hydroquinone dans les aliments mesurée dans d'autres pays est employée à titre de donnée de remplacement lorsqu'il n'existe pas de données canadiennes. Les estimations de l'absorption d'hydroquinone dans les aliments sont calculées à partir des concentrations dans les aliments représentatifs de douze groupes d'aliments dont on tient compte pour calculer l'absorption (DHM, 1998):
Produits laitiers : 30 µg/kg; concentration moyenne (total d'hydroquinone) dans le yogourt (Deisinger et al., 1996);
Matières grasses : aucune donnée;
Fruits : 15,090 µg/kg; concentration moyenne (total d'hydroquinone) dans la poire d'Anjou (Deisinger et al., 1996);
Légumes : 480 µ g/kg; concentration moyenne (total d'hydroquinone) dans l'oignon (Deisinger et al., 1996);
Produits céréaliers : 10 650 µ g/kg; concentration moyenne (total d'hydroquinone) dans le germe de blé (Deisinger et al., 1996);
Viande et volaille : aucune donnée ;
Poisson : aucune donnée;
œufs : aucune donnée;
Aliments surtout à base de sucre : aucune donnée;
Plats préparés et potages : aucune donnée ;
Noix et graines : aucune donnée ;
Boissons gazeuses, alcool, café, thé : 430 µ g/kg; concentration moyenne (total d'hydroquinone) dans le vin rouge (Deisinger et al., 1996).
[12] La quantit é d’aliments consommée quotidiennement par chaque groupe d’âge est établie par Santé Canada (DHM, 1998). À noter que toutes les concentrations d’hydroquinone signalées dans les aliments sont d’origine naturelle.
Annexe 2 : Estimations de l'exposition cutanée des adultes canadiens à l'hydroquinone contenue dans les produits de consommation
| Type de produit de consommation | Hypothèses | Estimation de l'exposition |
|---|---|---|
| Révélateur pour photos en noir et blanc[1] | Par hypothèse, le coefficient de perméabilité est de 9,3 x 10-6 cm/h (Barber et al., 1995). Par hypothèse, la superficie exposée est de 20 cm2. Il s’agit d’une évaluation basée sur le choix d’une superficie d’exposition de 200 cm2 (Versar Inc., 1986) et d’un commentaire reçu lors de la consultation publique indiquant que seul le bout des doigts d’une main est sans doute exposé pendant le procédé de développement. Par hypothèse, la fréquence d’utilisation est de 12 fois par an, la masse volumique de la solution est de ~1,0 g/cm3et la fraction en poids de l’hydroquinone en solution dans un bain de révélateur est de 0,037 (Versar Inc., 1986). Même si cette fraction en poids, selon les renseignements communiqués en vertu de l’article 71, est d’environ 0,22 à 0,14 dans les différents produits de développement commerciaux et de grande consommation (Environnement Canada, 2007), la valeur mentionnée par Versar est jugée davantage représentative des concentrations de travail employées par les amateurs. Par hypothèse, l’exposition totale est d’une durée de 15 minutes. Il s’agit d’une évaluation qui repose sur une durée moyenne de travail en chambre noire de 8 h (Versar Inc., 1986) et qui, selon les commentaires reçus du public, montre la brièveté du contact avec le révélateur au cours du développement, car on suppose que les personnes s’essuient les mains après les avoir trempées dans le révélateur afin de réduire la contamination par ce dernier des autres solutions employées par la suite. Cette valeur serait surestimée si les personnes devaient appliquer les méthodes recommandées de manipulation des révélateurs en portant des gants ou aussi en utilisant des pinces plutôt que le bout des doigts pour déposer et pour retirer le papier. Par hypothèse, la masse corporelle est de 70,9 kg (DHM, 1998). Dose = (coefficient de perméabilité) x (fraction en poids) x (masse volumique du produit) x (durée d’exposition) x (superficie exposée) x (facteur de conversion/masse corporelle) Dose = (9,3 x 10-6 cm/h) x (0,037) x (1,0 g/cm3) x (0,25 h) x (20 cm2) x (12 fois/an /365 jours/an) x (1 x 10-6 µg/g)/(70,9 kg-m.c.)kg-m.c.
|
7,9 x 10-4 |
| Constituant de colles à usage domestique [1, 2] | Par hypothèse, , le coefficient de perméabilité est de 9,3 x 10-6 cm/h (Barber et al., 1995). Par hypothèse, la fréquence d’utilisation est de 12 fois par an, la superficie exposée est de 2 cm2 et la durée d’exposition (c.-à-d. de l’application) est de 0,083 h (RIVM, 2006); Par hypothèse, la fraction en poids de l’hydroquinone dans l’adhésif est de 0,01 (Environnement Canada, 2007). Par hypothèse, la masse volumique du produit est de ~1,0 g/cm3 (Versar, 1986). Par hypothèse, la masse corporelle est de 70,9 kg (DHM, 1998). Dose = (coefficient de perméabilité) x (fraction en poids) x (masse volumique du produit) x (durée d’exposition) x (superficie exposée) x (facteur de conversion/masse corporelle) Dose = (9,3 x 10-6 cm/h) x (0,01) x (1,0 g/cm3) x (0,083 h) x (2 cm2) x (12 fois/an /365 jours/an) x (1 x 10-6 µg/g)/(70,9 kg-m.c.) |
7,2 x 10-5 |
| Préparations pour manucure[3, 4] | Par hypothèse, un taux d’absorption cutanée de 0,52 ± 0,13 μg/cm2 par heure (Barber et al., 1995). Par hypothèse, la fréquence d’utilisation est de 0,035 fois par jour, la durée d’exposition est de 0,25 h et la masse corporelle est de 60 kg (Santé Canada, 2007b). Par hypothèse, la superficie exposée moyenne est de 4 cm2 (RIVM, 2006). Dose = (taux d’absorption cutanée) x (superficie exposée) x (fréquence d’utilisation) x (durée d’exposition) / (m.c.) Dose = (0,52 μg/cm2 par heure) x (4 cm2) x (0,035 fois/jour) x (0,25 h) / (60 kg-m.c.) |
3,0 x 10-4
|
| Colorants capillaires oxydants [5] | Par hypothèse, un taux d’absorption cutanée de 0,52 ± 0,13 μg/cm2 par heure (Barber et al., 1995). Par hypothèse, la fréquence d’utilisation est de 0,03 fois/jour, la masse corporelle est de 60 kg, la superficie exposée moyenne est de 580 cm2 et la durée d’exposition est de 0,5 heure (Santé Canada, 2007b). Dose = (taux d’absorption cutanée) x (superficie exposée) x (fréquence d’utilisation) x (durée d’exposition)/ (m.c.) Dose = (0,52 μg/cm2 par heure) x (580 cm2) x (0,03 fois/jour) x (0,5 h) / (60 kg-m.c.) Les colorants capillaires sont de type oxydant et la concentration d’hydroquinone qu’ils contiennent, ordinairement de 0,1 à 0,3 %, s’abaisse lorsque du peroxyde d’hydrogène est mélangé au colorant avant le traitement. |
7,5 x 10-2
|
[2] Adhésif de type cyanoacrylate (p.ex., colle à base de cyanoacétate.
[3] Une masse corporelle moyenne de 60 kg pour les femmes adultes canadiennes a été appliquée aux calculs (Santé Canada, 2007b).
[4] Lorsqu'il s'agit de préparations pour ongles artificiels, l'exposition à l'hydroquinone résulte principalement de l'application de la résine liquide sur l'ongle. Du fait que l'hydroquinone est rapidement épuisée au cours de la réaction de polymérisation et que tout résidu reste captif de la matrice durcie de polyacrylate, toute exposition subséquente à l'application initiale est sans doute négligeable.
[5] Par hypothèse, taux d'absorption à partir d'une solution aqueuse.
| Paramètre | Plus faibles concentrations avec effet / résultats |
|---|---|
| Toxicité aiguë | Plus faible DL50 orale = 298 mg/kg m.c. (rat - Wistar – jeûne) Plus faible DL50 orale = 390 mg/kg-m.c. (souris Swiss nourries) (Woodard, 1951), [cité dans OCDE (2002)]. Plus faible DL50 cutanée = > 1 000 mg/kg-m.c. (cobaye) (Rapport sur la toxicité, 1971), [cité dans OCDE (2002)]. |
| Toxicité à court terme de doses répétées | Exposition pendant 14 jours : Plus faible DSEO orale = 250 mg/kg m.c. par jour (rat - F344) (NTP, 1989). Plus faible DSEO orale = 125 mg/kg m.c. par jour (souris mâles – B6C3F1) (NTP, 1989). Plus faible DSEO orale = 250 mg/kg m.c. par jour (souris femelles – B6C3F1). Plus faible DSEO cutanée = 1 920 mg/kg-m.c. par jour (rats mâles et femelles – F344), cité dans {OCDE n o 1081, 2002 } . étude originale : (NTP, 1989). [cité dans OCDE (2002)]. Plus faible DSEO cutanée = 4 800 mg/kg-m.c. par jour (souris mâles et femelles – B6C3F1) (NTP, 1989). [cité dans OCDE (2002)]. |
| Toxicité subchronique | Exposition pendant 13 semaines : Plus faible DSEO orale = 20 mg/kg-m.c. par jour (rats Sprague-Dawley) (Bernard, 1988) [cité dans OCDE (2002)]. [Autres études : NTP, 1989] kg-m.c.kg-m.c.kg-m.c.kg-m.c.kg-m.c. Plus faible DSENO cutanée = Administration topique à des rats mâles et femelles (dos rasé) d’hydroquinone à raison de 0, 2,0, 3,5 ou 5,0 % (73,9 mg/kg-m.c. par jour chez les mâles et 109,6 mg/kg-m.c. par jour chez les femelles de rats F344) pendant 13 semaines (5 jours/semaine, 6 h par jour). Les chercheurs signalent des effets topiques tels que peau sèche, taches brunâtres ou érythèmes. DSENO fondée sur l’absence d’effets systémiques ou histopathologiques (David, 1994) [cité dans OCDE (2002)]. kg-m.c.kg-m.c. kg-m.c.kg-m.c.kg-m.c.kg-m.c.kg-m.c. kg-m.c.kg-m.c. |
| Toxicité pour la reproduction ou le développement | étude sur la reproduction portant sur 2 générations : administration par gavage d'hydroquinone à des rats mâles et femelles (Sprague-Dawley) de F0 et de F1 (15, 50 ou 150 mg/kg m.c. par jour (Blacker et al., 1993a)3). DSEO = 15 mg/kg m.c. par jour (toxicité générale pour les parents). DSEO = 150 mg/kg m.c. par jour (toxicité pour la reproduction chez les 2 générations). Un mâle de la F0 du groupe exposé à 50 mg/kg a souffert de tremblements après le traitement. À 150 mg/kg, les auteurs signalent des tremblements chez plusieurs parents des 2 sexes (F0 et F1). Une analyse des tendances a indiqué un ralentissement significatif et proportionnel à la dose du gain pondéral des mâles de la F1, mais non chez ceux de la F0. [Autres renseignements : Krasavage et al. 1992; Bio/dynamics Inc., 1989; Murphy et al., 1992]kg-m.c. |
| Toxicité chronique/ cancérogénicité | Administration par gavage d’hydroquinone (0, 25 ou 50 mg/kg-m.c. par jour) à des rats mâles et femelles F344 pendant 103 semaines (5 fois/semaine). Premier sacrifice d’animaux à 15 mois (NTP, 1989). Premier sacrifice d’animaux à 15 mois :rat – néphropathie liée à la substance observée chez les mâles exposés à 25 ou à 50 mg/kg-m.c. par jour. Poids relatif des reins significativement plus élevé et incidence accrue des cas de néphropathie chez les mâles accompagnée d’une baisse de l’hématocrite, et numération érythrocytaire à la baisse (anémie régénérative bénigne) chez les femelles exposées à la dose la plus forte (50 mg/kg m.c.). |
Administration par gavage d’hydroquinone à des souris mâles et femelles B6C3F1 pendant 103 semaines (5 fois par semaine) aux doses de 0, 50 ou 100 mg/kg-m.c. par jour. Premier sacrifice d’animaux à 15 mois (NTP, 1989). Premier sacrifice d’animaux à 15 mois :poids relatif du foie élevé chez les mâles et les femelles du groupe exposé à 100 mg/kg-m.c. par jour. Poids relatif supérieur des reins et du cerveau chez les femelles. Lésions hépatiques associées à la substance uniquement chez les mâles traités avec la substance (50 ou 100 mg/kg-m.c. par jour). étude de 2 ans : hausse associée à la substance du poids relatif du foie chez les mâles (50 ou 100 mg/kg-m.c. par jour) et chez les femelles exposées à la dose la plus élevée seulement. Incidence accrue d’adénomes hépatocellulaires uniquement chez les souris femelles traitées. Hyperplasie des cellules folliculaires de la thyroïde chez les souris mâles et femelles traitées. |
|
Administration par le régime alimentaire d’hydroquinone à des rats mâles et femelles F344 pendant 104 semaines (351 ou 368 mg/kg-m.c. par jour) (Shibata et al., 1991) Les auteurs ne signalent aucune mortalité ni aucun signe clinique de toxicité. Chez les mâles, hausse du poids absolu ou relatif du foie et des reins et hyperplasie accrue des cellules des tubules rénaux, et présence d’adénomes microscopiques chez les sujets traités. Néphropathie chronique chez les sujets traités et chez les témoins, mais plus grave dans le cas des sujets traités. Chez les femelles, hausse du poids absolu ou relatif des reins.. |
|
Administration par le régime alimentaire d’hydroquinone à des souris mâles et femelles B6C3F1 pendant 96 semaines (1 046 ou 1 486 mg/kg-m.c. par jour) (Shibata et al., 1991). Les auteurs ne signalent aucune mortalité ni aucun signe clinique de toxicité. Chez les mâles, hyperplasie accrue des cellules des tubules rénaux, adénomes hépatocellulaires et foyers au niveau du foie. Hyperplasie des cellules épithéliales du préestomac chez les sujets des deux sexes et hausse du poids relatif du foie et des reins chez les femelles uniquement.Signes possibles de cancérogénicité. |
|
| Génotoxicité in vivo |
Positif : aberrations chromosomiques, effets d'inhibition de la mitose induits par la colchicine, formation de micronoyaux et échanges entre chromatides sœurs (cellules de la moelle osseuse) (Miller et Adler, 1989; Xu et Adler, 1990; Alder et Kliesch, 1990; Pacchierotti et al., 1991)1), [cité dans PISSC (1994) et OCDE (2002)]. Hydroquinone administrée par voie intrapéritonéale. Négatif : mutations létales d’allèles dominants (rats mâles Sprague-Dawley mâles). (Krasavage, 1984), [cité dans PISSC (1994) et CIRC (1999)] |
| In vitro | Négatif : test d'Ames sur S. typhimurium TA97, 98, 100, 1535, 1537 et 1538. (Haworth et al., 1983; Fahrig, 1984; Sakai et al., 1985; Hakuraet al., 1996), [cité dans PISSC (1994) et CIRC (1999)]. Positif : aberrations chromosomiques (cellules ovariennes de hamsters chinois), échanges entre chromatides sœurs (cellules V79 de hamsters chinois, lymphocytes humains), induction de la formation de micronoyaux (lymphocytes humains, cellules des poumons de hamsters chinois), endommagement de l'ADN (cellules HeLa). (Morimoto et Wolff, 1980; Painter et Howard, 1982; Erexsonet al., 1985; Galloway et al., 1987; Glatt et al., 1990), cité dans PISSC (1994). |
Il existe très peu de données portant sur les humains. L’ingestion d’hydroquinone à des concentrations allant jusqu’à 500 mg/jour pendant 20 semaines n’a donné lieu à aucun changement pathologique observable dans le sang et l’urine des sujets volontaires. L’ingestion en grande quantité d’hydroquinone peut causer des tremblements, des vomissements, des convulsions, la dyspnée, la cyanose et le coma; des décès ont été signalés après l’ingestion de 3 000 à 12 000 mg d’hydroquinone contenue dans des révélateurs photographiques (Zeidman et Deuit, 1945; PISSC, 1994). L’exposition cutanée pendant 3 ans à > 5 p. 100 d’hydroquinone dans des crèmes éclaircissantes a provoqué l’ochronose et le milium colloïde pigmenté chez des Sud-Africaines (Findlay et al., 1975; Findlay et De Beer, 1980). Une étude sur 840 sujets volontaires de sexe masculin d’origines ethniques différentes a montré qu’à moins de 3 p. 100, l’hydroquinone provoquait des effets négligeables sur la peau des utilisateurs (Bentley-Phillips et Bayles, 1975). L’ochronose est rare en Amérique du Nord. L’abus d’utilisation de crèmes éclaircissantes et l’utilisation de produits avec des concentrations plus élevées que celles indiquées sur les étiquettes, d’agents blanchissants autres que l’hydroquinone, et l’utilisation d’antipaludiques sont quelques facteurs ayant entraîné de plus fortes incidences d’ochronose avant les changements réglementaires en Afrique (Levitt, 2006). Le CIRC (1999) est parvenu à la conclusion qu’il n’existe pas de preuves suffisantes de la cancérogénicité de l’hydroquinone chez l’humain. Dans le cadre d’une étude par cohorte, aucun changement proportionnel à la dose n’a été observé dans le taux de mortalité ou les cas de cancer (cancer des reins ou du foie, ou encore leucémie) chez des travailleurs des deux sexes exposés à une dose moyenne de 0,1 à 6,0 mg/m3 de poussière d’hydroquinone pendant 8 h (Piferet al., 1995). Dans une autre étude par cohorte, il pourrait exister un lien entre cinq cas de mélanome malin et l’exposition de lithographes à l’hydroquinone (Nielsen et al., 1996).
Cette page Web a été archivée dans le Web
L'information dont il est indiqué qu'elle est archivée est fournie à des fins de référence, de recherche ou de tenue de documents. Elle n'est pas assujettie aux normes Web du gouvernement du Canada et elle n'a pas été modifiée ou mise à jour depuis son archivage. Pour obtenir cette information dans un autre format, veuillez communiquer avec nous.
Archivée
Benzène-1,4-diol
(hydroquinone)
Numéro de registre du Chemical Abstracts Service
123-31-9
Environnement Canada
Santé Canada
Juillet 2008
Table des matières
- Synopsis
- Introduction
- Identité de la substance
- Propriétés physiques et chimiques
- Sources
- Utilisations
- Rejets dans l’environnement
- Devenir dans l’environnement
- Persistance et potentiel de bioaccumulation
- Potentiel d’effets nocifs sur l’environnement
- Potentiel d’effets nocifs sur la santé humaine
- Conclusion
- Références
- Annexe 1 : Valeurs estimées de la limite supérieure d’absorption quotidienne d’hydroquinone par la population générale au Canada
- Annexe 2 : Estimations de l'exposition cutanée des adultes canadiens à l'hydroquinone contenue dans les produits de consommation
- Annexe 3 : Résumé des renseignements sur les effets de l’hydroquinone sur la santé
- Annexe 4 : Survol des effets signalés de l'hydroquinone sur la santé humaine
Les ministres de l’Environnement et de la Santé ont effectué une évaluation préalable de l’hydroquinone, dont le numéro de registre du Chemical Abstracts Service (CAS) est 123-31-9. Une priorité élevée a été accordée à la prise de mesures à l’égard de cette substance lors de la catégorisation visant la Liste intérieure des substances dans le cadre du Défi lancé par les ministres, car on considère qu’elle présente le plus fort risque d’exposition (PFRE) pour les Canadiens et que son pouvoir cancérogène et sa génotoxicité ont conduit d’autres agences à l’évaluer en priorité. Comme cette substance répond au critère de catégorisation écologique de la toxicité intrinsèque pour les organismes aquatiques, mais non aux critères de la persistance ou de la bioaccumulation, la présente évaluation est donc axée sur les aspects relatifs à la santé humaine.
Selon les renseignements communiqués en vertu de l’article 71 de la LCPE (1999), l’hydroquinone aurait été importée au Canada, en 2006, en une quantité totale située entre 100 000 kg et 1 000 000 kg. Au Canada, l’hydroquinone sert notamment d’inhibiteur de la polymérisation des monomères utilisés pour la préparation de résines de méthacrylate et de polyesters insaturés, ainsi que de stabilisateur de colorants et de divers types d’adhésifs industriels et de grande consommation, d’adhésifs frein-filet et de pâtes d’étanchéité pour raccords filetés. Elle est aussi employée comme additif pour les tubes thermorétrécissables, les produits d’obturation dentaire, les bandes adhésives, les rubans de collage, les pansements liquides; elle sert d’additif dans les encres thermoséchantes pour améliorer la performance de l’impression à alimentation par feuilles, et aussi d’agent réducteur dans les révélateurs photographiques. L’hydroquinone est produite naturellement et on le retrouve notamment dans divers aliments.
On estime que sa présence à l’état naturel, ou encore celle de son conjugué glucosique, le 4 hydroxyphényl-ß-D-glucopyranoside (arbutine), dans différents aliments et différentes boissons, constitue la principale source d’exposition de la population. En comparaison, l’exposition associée à d’autres milieux (air ambiant ou intérieur, eau ou particules du sol) est jugée négligeable.
Il existe des possibilités d’exposition par la voie cutanée à l’hydroquinone car elle est retrouvée dans des produits de consommation comme les révélateurs photographiques, les adhésifs et certains produits cosmétiques comme les colorants capillaires et diverses crèmes autorisée pour l’éclaircissement de la peau.
Sur la base essentiellement des évaluations de la Commission européenne fondées sur la méthode du poids de la preuve, le pouvoir cancérogène est l’effet critique appliqué à la caractérisation des risques pour la santé humaine. Les éléments retenus sont l’observation de tumeurs, notamment rénales, chez des rats et des souris exposés chroniquement à l’hydroquinone (exposition orale). En outre, l’hydroquinone était génotoxique dans plusieurs essais in vitro et in vivo. Même si le mécanisme de formation des tumeurs n’a pas été encore parfaitement élucidé, on ne peut exclure la possibilité que les tumeurs observées chez des animaux de laboratoire résultent de l’action directe de la substance avec le matériel génétique.
Compte tenu de la cancérogénicité de l’hydroquinone, pour lequel il peut exister une probabilité d’effets nocifs à tout niveau d’exposition, il est conclu que l’hydroquinone est une substance qui peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
À la lumière des dangers écologiques et des rejets déclarés d’hydroquinone, il est conclu que cette substance ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique ni à mettre en danger l'environnement essentiel pour la vie. De plus, l’hydroquinone ne répond pas les critères potentiels de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation.
Cette substance s'inscrira dans la mise à jour de l’inventaire de la Liste intérieure des substances, qui débutera en 2009. De plus, des activités de recherche et de surveillance viendront, le cas échéant, appuyer la vérification des hypothèses formulées au cours de l’évaluation préalable et, le cas échéant, la performance des mesures de contrôle possibles déterminées à l'étape de la gestion des risques.
Compte tenu des renseignements disponibles, l’hydroquinone remplit un ou plusieurs critères de l’article 64 de la Loi canadienne sur la protection de l’environnement (1999).
La Loi canadienne sur la protection de l’environnement (1999) [LCPE (1999)] (Canada, 1999) impose aux ministres de l’Environnement et de la Santé de faire une évaluation préalable des substances qui répondent aux critères de la catégorisation énoncés dans la Loi, afin de déterminer si ces substances présentent ou sont susceptibles de présenter un risque pour l’environnement ou la santé humaine. À partir des résultats de l’évaluation préalable, les ministres peuvent proposer de ne rien faire à l’égard de la substance, de l’inscrire sur la Liste des substances d’intérêt prioritaire (LSIP) en vue d’une évaluation plus détaillée ou de recommander son inscription sur la Liste des substances toxiques de l’annexe 1 de la Loi et, s’il y a lieu, la quasi-élimination de ses rejets dans l’environnement.
En se fondant sur l’information obtenue dans le cadre de la catégorisation, les ministres ont jugé qu’une attention hautement prioritaire devait être accordée à un certain nombre de substances, à savoir :
- celles qui répondent à tous les critères de la catégorisation relatifs à l’environnement [persistance (P), potentiel de bioaccumulation (B) et toxicité intrinsèque (Ti) pour les organismes aquatiques] et que l’on croit être commercialisées au Canada;
- celles qui répondent aux critères de la catégorisation pour le plus fort risque d’exposition (PFRE) ou qui présentent un risque d’exposition intermédiaire (REI) et qui ont été jugées particulièrement dangereuses pour la santé humaine à la lumière des classements effectués par d’autres organismes nationaux ou internationaux concernant leur cancérogénicité, leur génotoxicité ou leur toxicité pour le développement ou la reproduction.
Le 9 décembre 2006, les ministres ont publié un avis d’intention dans la Partie I de la Gazette du Canada (Canada, 2006), dans lequel ils mettent au défi l’industrie et les autres intervenants intéressés de fournir, selon un calendrier déterminé, des renseignements particuliers sur les substances qui pourraient servir à étayer l’évaluation des risques. Ces renseignements pourraient aussi servir à élaborer et à évaluer comparativement les meilleures pratiques de gestion des risques et de gérance des produits pour ces substances jugées hautement prioritaires.
L’hydroquinone a été jugée hautement prioritaire pour l’évaluation des risques qu’elle pose pour la santé humaine, car elle a été jugée présenter un PFRE et a été classée par une autre instance sur la base de son potentiel de cancérogénicité et de génotoxicité. Le volet du Défi portant sur cette substance a été lancé le 3 février 2007 au moyen d’un avis paru dans la Gazette du Canada (Canada, 2007a). Le profil de cette substance a été publié en même temps. Ce profil présentait l’information technique, obtenue avant décembre 2005, sur laquelle a reposé la catégorisation de cette substance. En réponse au Défi, on a reçu des documents présentant des renseignements.
Même si l’évaluation des risques de l’hydroquinone pour la santé humaine a été jugé hautement prioritaire et que la substance remplit le critère de la catégorisation écologique de la persistance, elle ne remplit pas celui du potentiel de bioaccumulation ou de la toxicité intrinsèque pour les organismes aquatiques. La présente évaluation est donc axée sur l’information pertinente à l’évaluation des risques pour la santé humaine.
Les évaluations préalables effectuées en vertu de la LCPE (1999) portent sur les renseignements essentiels pour établir si une substance répond ou non aux critères de toxicité des substances chimiques énoncés dans l’article 64 de la Loi, qui se lit comme suit :
64. « ...est toxique toute substance qui pénètre ou peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à :
a) avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique;
b) mettre en danger l’environnement essentiel pour la vie;
c) constituer un danger au Canada pour la vie ou la santé humaine.»
Les évaluations préalables mettent en lumière les renseignements scientifiques et présentent les conclusions que l’on peut dégager en incorporant la méthode du poids de la preuve et la prudence.
Cette évaluation préalable inclue l’examen des renseignements sur les propriétés chimiques, les dangers, les utilisations et l’exposition, à l’inclusion des renseignements additionnels fournis dans le cadre du Défi. Des données pertinentes à l’évaluation préalable de cette substance ont été relevées dans des publications originales, des rapports de synthèse et d’évaluation, des rapports de recherche de parties intéressées et d’autres documents accessibles lors de recherches menées dernièrement, jusqu’en septembre 2007. Les études importantes ont fait l’objet d’évaluations critiques. Les études clés ont fait l’objet d’évaluation critique ; les résultats de la modélisation ont pu être utilisés dans la formulation de conclusions. L’évaluation des risques pour la santé humaine comprends l’examen de données pertinentes à l’évaluation de l’exposition (non professionnelle) de la population dans son ensemble et de l’information sur les dangers pour la santé (surtout fondée sur des évaluations réalisées par d’autres organismes selon la méthode du poids de la preuve et ayant servi à déterminer le caractère prioritaire de la substance). Les décisions reposent sur la nature de l’effet critique retenu ou sur l’écart entre les valeurs prudentes donnant lieu à des effets et les estimations de l’exposition tenant compte de la confiance accordée au caractère exhaustif des bases de données sur l’exposition et les effets, cela dans le contexte d’une évaluation préalable. Les évaluations préalables ne sont pas le résultat d’examens critiques ou exhaustifs de toutes les données disponibles. Elles présentent plutôt les informations critiques selon lesquelles la conclusion est basée.
La présente évaluation préalable a été effectuée par le personnel des Programme des substances existantes de Santé Canada et d’Environnement Canada et elle intègre des résultats provenant d’autres programmes appliqués par ces ministères. Cette évaluation préalable a fait l’objet d’une consultation indépendante par des pairs. Des commentaires sur les portions techniques concernant la santé humaine ont été reçus par des experts scientifiques désignés et dirigés par la corporation Toxicology Excellence for Risk Assessment (TERA). Ce sont notamment John Christopher (California Department of Toxic Substances Control), Michael Jayjock (The Lifeline Group), Donna Vorhees (The Science Collaborative) et Joan Strawson (TERA). Exponent a également transmis des commentaires sur ces sections. Bien que les commentaires externes aient été pris en considération, Santé Canada assume la responsabilité du contenu final de l’évaluation préalable pour tout ce qui concerne la santé humaine. De plus, une version provisoire de la présente évaluation préalable a fait l’objet d’une consultation publique de 60 jours. Les considérations et les renseignements importants à la base du présent rapport sont présentés ci-après.
Tableau 1. Identité de la substance
| Numéro de registre CAS | 123-31-9 |
| Nom dans la LIS | hydroquinone |
| Noms dans les inventaires [1] | 1,4-Benzenediol (TSCA, DSL, ENCS, AICS, ECL, SWISS, PICCS, ASIA-PAC, NZIoC) Hydroquinone (DSL, EINECS, PICCS) Hydrochinon (EINECS, SWISS, PICCS) Benzène, 1,4-Dihydroxy- (PICCS) P-Dihydroxybenzene (PICCS) P-Hydroxyphenol (PICCS) |
| Autres noms | Hydroquinone; 1,4-Benzoquinol; 1,4-Dihydroxybenzene; 4-Hydroxyphenol; Aida; Arctuvin; Benzohydroquinone; Benzoquinol; Black & White Bleaching Cream; BQ(H); Diak 5; Dihydroquinone; Eldopacque; Eldopaque; Eldopaque Forte; Eldoquin; Eldoquin Forte; HE 5; Hydroquinol; NSC 9247; p-Benzenediol; p-Dihydroquinone; p-Dioxybenzene; p-Hydroquinone; p-Phenylenediol; p-Quinol; Phiaquin; Quinol; Solaquin Forte; Tecquinol; Tenox HQ; UN 2662; UN 2662 (DOT) |
| Groupe chimique | produits chimiques organiques définis |
| Sous-groupe chimique | phénols |
| Formule chimique | C6H6O2 |
| Structure chimique | 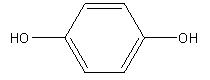 |
| SMILES | Oc(ccc(O)c1)c1 |
| Masse moléculaire | 110,11 g/mole |
Tableau 2. Propriétés physiques et chimiques de l'hydroquinone
| Propriétés | Type | Valeur | Température (°C) |
Référence |
|---|---|---|---|---|
| Point de fusion (°C) |
expérimental | 169 | SIDS OCDE, 2002 | |
| Point d'ébullition (°C) |
expérimental | 286 | SIDS OCDE, 2002 | |
| Masse volumique (kg/m3) |
expérimental | 1,341 | SIDS OCDE, 2002 | |
| Pression de vapeur (Pa) |
expérimental | 2,34 × 10-3 | 25 | SIDS OCDE, 2002 |
| Constante de la loi de Henry (Pa·m3/mole) |
expérimental | 3,84 × 10-11 | SIDS OCDE, 2002 (Meylan et Howard, 1991) |
|
| Constante de dissociation | expérimental | pK1= 9,9 | SIDS OCDE, 2002 | |
| Log Koe | expérimental | 0,59 | Hansch et al., 1995 | |
| Log Kco | modélisé | 2,64 | PCKOCWIN, v. 1.66 | |
| Solubilité dans l'eau (mg/L) | expérimental | 73 000 | SIDS OCDE, 2002 (Sterner et. al., 1947) |
L’hydroquinone est produite naturellement sous forme conjuguée avec le bêta-D-glucopyranoside dans les feuilles, l’écorce et les fruits de nombreuses plantes, notamment les éricacées arbustives comme l’airelle canneberge, l’airelle vigne-d’Ida, l’arctostaphyle raisin-d’ours et l’airelle à feuilles étroites (Varagnat, 1982; Harbison et Belly, 1982; Hudnall, 1987). Cette substance a été décelée en faibles concentrations dans le café, le thé, le vin rouge, la bière, le cola, le lait à 2 p. 100 de matières grasses, le jus d’orange, les céréales de maïs, de blé et de riz, le germe de blé et différents fruits, notamment la poire, l’orange, le melon brodé, la cerise, l’asperge, la pomme, le bleuet et la canneberge (Deisinger et al., 1996). L’hydroquinone participe aux mécanismes de défense de certaines classes de coléoptères (Aneshansley et al., 1969). On la trouve également dans les particules de la fumée de cigarette (CIRC, 1985).
Cette substance est produite par l’oxydation de l’aniline en quinone et par réduction subséquente de la quinone en hydroquinone (Kirk-Othmer, 1966). Le clivage oxydatif du diisopropylbenzène et l’hydroxylation de phénols sont d’autres voies d’obtention de l’hydroquinone (SIDS OCDE, 2002). En vertu d’un avis publié en application de l’article 71 de la LCPE (1999) concernant l’hydroquinone, 17 entreprises canadiennes et 2 entreprises étrangères ont déclaré avoir importé cette substance (seule, dans un mélange, dans un produit ou présente dans un article manufacturé), en 2006, en une quantité égale ou supérieure au seuil de déclaration de 100 kg. En outre, 10 autres entreprises canadiennes ont déclaré avoir importé de l’hydroquinone (seule, dans un mélange, dans un produit ou présente dans un article manufacturé), en 2006, en une quantité inférieure au seuil de 100 kg. Aucune entreprise canadienne n’a fabriqué d’hydroquinone dans une quantité supérieure à 100 kg au Canada en 2006 (Environnement Canada, 2007; Chemical Economics Handbook, 2006). La quantité totale d’hydroquinone importée se situe entre 100 000 et 1 000 000 kg (Environnement Canada, 2007).
Les déclarations obtenues en application de l'article 71 de la LCPE (1999) indiquent qu'actuellement au Canada, l'hydroquinone sert d'inhibiteur de la polymérisation des monomères utilisés pour la préparation de résines de méthacrylate et de polyesters insaturés, ainsi que de stabilisateur de colorants et de divers types d'adhésifs industriels et commerciaux, d'adhésifs frein-filet et de pâtes d'étanchéité pour raccords filetés. Elle est aussi employée comme additif pour les tubes thermorétrécissables, les produits d'obturation dentaire, les bandes adhésives, les rubans de collage, les pansements liquides, etc.; elle sert d'additif dans les encres thermoséchantes pour améliorer la performance de l'impression à alimentation par feuilles, et aussi d'agent réducteur dans les révélateurs photographiques (Environnement Canada, 2007).
Il existe beaucoup d’autres utilisations de l’hydroquinone au Canada. Même s’il est interdit de l’utiliser dans les produits cosmétiques appliqués sur la peau ou les muqueuses, notamment dans les produits d’éclaircissement de la peau (Santé Canada, 2007a), Santé Canada a reçu, en vertu du Règlement sur les cosmétiques de la Loi sur les aliments et drogues, 110 déclarations concernant des produits cosmétiques contenant de l’hydroquinone. Il s’agit principalement de préparations pour manucure et de colorants capillaires qui peuvent en contenir jusqu’à 3 p. 100 (Santé Canada, 2007b). La base de données de Santé Canada sur les produits pharmaceutiques énumère 90 préparations en vente libre qui en contiennent à des concentrations de < 2 p. 100 à 4 p. 100. Ces produits ont un numéro DIN. À l’échelle provinciale, la National Association of Pharmacy Regulatory Authorities (NAPRA) classe les préparations topiques qui contiennent de l’hydroquinone avec les drogues de l’annexe II. Bien que les produits pharmaceutiques de l’annexe II soient davantage considérés comme des médicaments d’ordonnance plutôt que comme des produits en vente libre, ils sont réglementés de façon moins stricte et, si leur vente ne nécessite pas d’ordonnance, le pharmacien doit néanmoins intervenir professionnellement, quitte même à diriger la personne vers son médecin. À la pharmacie, le public ne doit pas avoir accès à ces produits et il ne doit pas avoir la possibilité de s’en procurer sans consulter le pharmacien (Santé Canada, 2007c). L’hydroquinone est employée à raison d’une concentration de 0,3 p. 100 comme stabilisateur dans deux pesticides homologués en vertu de la Loi sur les produits antiparasitaires. Le premier est un herbicide à utilisation restreinte pour lutter contre les végétaux dans les canaux d’irrigation, l’autre est un microbiocide commercial qui est employé dans l’extraction pétrolière (ARLA, 2007).
L’hydroquinone est également un intermédiaire chimique de la synthèse des types suivants de composés chimiques : antioxydants et antiozone employés pour le traitement du caoutchouc, antioxydants pour les aliments et les graisses et huiles d’usage industriel, et stabilisateurs dans les peintures, les vernis, les huiles à moteur et les carburants. L’hydroquinone trouve des applications dans le développement des pellicules photo en noir et blanc et des pellicules utilisées en radiographie, ainsi qu’en lithographie. Elle entre également dans la fabrication de mélanges de coulage et elle peut servir d’inhibiteur de la corrosion dans les chaudières et les tours de refroidissement (SIDS OCDE, 2002).
Il peut se produire des rejets anthropiques d’hydroquinone au moment de sa fabrication et au cours de son emploi en photographie, dans les antioxydants, dans les inhibiteurs de la polymérisation de monomères, dans les colorants et les pigments, dans les composés à usage agricole et dans les stabilisateurs de peintures et de vernis, de carburants et d’huiles. Cette substance peut être rejetée dans l’environnement avec les effluents produits par les procédés de développement photographique (HSDB, 2006). Le tableau 3 présente les rejets sur place par des installations industrielles et l’élimination hors site de l’hydroquinone (et de ses sels) dans des milieux non précisés, au Canada entre 2001 et 2006 (Source : Inventaire national des rejets de polluants – INRP, 2007).
Tableau 3. Rejets d'hydroquinone entre 2001 et 2006
| Année | Rejets sur place | élimination hors site |
Unités |
|---|---|---|---|
| 2006 | 2 | 0 | kg |
| 2005 | 2 | 1 | kg |
| 2004 | 2 | 49 | kg |
| 2003 | 2 | 1 | kg |
| 2002 | 0 | 1 | kg |
| 2001 | 1 | 1 | kg |
Selon les déclarations obtenues en application de l’article 71 de la LCPE (1999), trois entreprises canadiennes ont signalé des rejets d’hydroquinone (seule, dans un mélange, dans un produit ou présente dans un article manufacturé) en une quantité totale de 103 kg au cours de l’année civile 2006 (Environnement Canada, 2007).
Comme on le voit au tableau 2, la solubilité dans l’eau de l’hydroquinone est très élevée et son coefficient d’adsorption par le sol est modéré, ce qui indique qu’il se produirait peu d’adsorption de l’hydroquinone par les sédiments et les matières organiques en suspension si cette substance était rejetée dans l’eau. En cas de rejet dans le sol, la majeure partie de l’hydroquinone ne devrait pas s’en échapper, sinon en une petite quantité susceptible de passer dans l’eau. En cas de rejet atmosphérique, l’hydroquinone devrait se photodégrader directement (tableaux 5a et b). Cette substance pourrait aussi être extraite de l’air par dépôt humide car elle est très soluble dans l’eau (HSDB, 2006). Le tableau 4 présente la répartition de l’hydroquinone dans l’environnement, prévue au moyen d’un modèle de fugacité de niveau III, à la suite de son rejet dans divers milieux naturels.
Tableau 4. Résultats de la modélisation de la fugacité de niveau III de l'hydroquinone (EPIWIN, v. 3.12)
| Substance rejetée dans | Fraction de la substance se répartissant dans chaque milieu (%) |
|||
|---|---|---|---|---|
| Air | Eau | Sol | Sédiments | |
| l'air (100 %) | 0,00 | 24,1 | 75,9 | 0,05 |
| l'eau (100 %) | 0,00 | 99,8 | 0,00 | 0,19 |
| le sol (100 %) | 0,00 | 20,2 | 79,8 | 0,04 |
| l'air, l'eau et le sol (33,3 % chacun) | 0,00 | 37,1 | 62,9 | 0,07 |
Persistance
étant donné ses propriétés physiques et chimiques (tableau 2) et compte tenu des données empiriques et modélisées présentées ci-dessous (tableaux 5a et 5b), l’hydroquinone ne répond pas aux critères de la persistance (demi-vie dans le sol et l’eau ≥ 182 jours; demi-vie dans les sédiments ≥ 365 jours; demi-vie dans l’air ≥ 2 jours) définis dans le Règlement sur la persistance et la bioaccumulation(Canada, 2000).
Tableau 5a. Données empiriques sur la persistance de l'hydroquinone
| Milieu | Processus du devenir | Valeur de la dégradation | Paramètre de la dégradation/unité | Durée des essais | Référence |
|---|---|---|---|---|---|
| Air | photolyse | 57 | photominéralisation (%) | 17 h | Freitag et al., 1985 |
| Eau | biodégradation | 70 | biodégradation (%) | 28 j | Chemicals Inspection and Testing Institute, 1992 |
Tableau 5b. Données modélisées sur la persistance de l'hydroquinone
| Milieu | Processus du devenir | Valeur de la dégradation | Paramètre de la dégradation/unité | Référence |
|---|---|---|---|---|
| Air | oxydation atm. | 0,4606 | demi-vie (jours) | AOPWIN, v. 1.91 |
| Air | réaction avec l'ozone | non réactif | demi-vie (jours) | AOPWIN, v. 1.91 |
| Eau/sol | biodégradation | 15 | demi-vie (jours) | BIOWIN, v. 4.02, Ultimate survey |
| Eau/sol | biodégradation | 0,691 | probabilité | BIOWIN, v. 4.02, MITI Non linear Probability |
| Eau/sol | biodégradation | 0,546 | probabilité | BIOWIN, v. 4.02, MITI Non linear Probability |
| Eau/sol | biodégradation | 0,918 | probabilité | Topkat, v. 6.1 |
Bioaccumulation
Les données expérimentales et modélisées (tableaux 6a et 6b) indiquent que l’hydroquinone ne répond pas aux critères de la bioaccumulation (facteur de bioconcentration [FBC]/facteur de bioaccumulation [FBA] ≥ 5 000), définis dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Tableau 6a. Données expérimentales sur la bioaccumulation de l'hydroquinone
| Organisme d'essai | Paramètre | Valeur (poids humide) (L/kg) |
Référence (base de données ECOTOX) |
|---|---|---|---|
| Algue verte (Chlorella fusca) | FBC | 35–65 | 306; 11 297; 17 318 |
| Poisson (Leuciscus idus; Leuciscus idus melanotus) | FBC | 40 | 3 781; 17 318 |
Tableau 6b. Données modélisées sur la bioaccumulation de l'hydroquinone
| Organisme d'essai | Paramètre | Valeur (poids humide) (L/kg) |
Référence |
|---|---|---|---|
| Poisson | FBA | 1 | Modified Gobas BAF T2MTL (Arnot et Gobas, 2003) |
| Poisson | FBC | 1 – 19 | OASIS; Modified Gobas BCF 5 % T2LTL (Arnot et Gobas, 2003); BCFWIN, v. 2.15 |
Comme il est indiqué précédemment, l’hydroquinone ne remplit pas les critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation (Canada, 2000).
Les données écotoxicologiques expérimentales (base de données ECOTOX) sur l’hydroquinone dénotent une toxicité élevée pour les organismes aquatiques. Les valeurs de la toxicité aiguë (CL50 et CE50) pour le poisson et la daphnie sont inférieures à 1 mg/L tandis que d’autres sont encore plus faibles, soit 0,044 mg/L pour le poisson. L’algue verte et la crevette des salines seraient les espèces les moins sensibles (CL50 et CE50aiguës de 17-31 mg/L). Aucune donnée sur la toxicité pour les organismes non aquatiques autres que des mammifères n’a été relevée.
L’Inventaire national des rejets de polluants (INRP) signale des rejets allant jusqu’à 2 kg par année vers un milieu non spécifié pour les années 2001 à 2006 (INRP, 2007). Selon les renseignements récemment obtenus en vertu de l’article 71 de la LCPE (1999), une quantité totale légèrement au-dessus de 100 kg d’hydroquinone a été rejetée en 2006 par trois entreprises canadiennes (Environnement Canada, 2007). étant donné la quantité et la nature de ces rejets, il est peu probable que ces derniers deviennent une source d’exposition importante pour les organismes dans l’environnement.
Selon l’information disponible, l’hydroquinone n’aurait pas le potentiel de causer des dommages écologiques au Canada.
Évaluation de l'exposition
L’annexe 1 présente des valeurs estimées de la limite supérieure d’absorption d’hydroquinone en fonction de différents groupes d’âge au sein de la population canadienne. Les estimations sont fondées sur la concentration maximale déterminée dans les milieux naturels et dans les aliments. Pour l’ensemble de la population, l’estimation de la limite supérieure d’exposition à l’hydroquinone varie de 91,32 µg/kg de masse corporelle (m.c.) par jour pour la cohorte des 60 ans et plus à 393,45 µg/kg-m.c. par jour chez les sujets de la cohorte des 0 à 6 mois (non nourris au lait maternisé). Selon ces estimations, l’absorption par les aliments et les boissons constitue la principale source d’exposition à l’hydroquinone de l’ensemble de la population au Canada. Elle équivaut à plus de 99,9 p. 100 de l’exposition totale, tous groupes d’âge confondus. Comme on l’a indiqué plus tôt, l’hydroquinone et son conjugué glucosé, le 4-hydroxyphényl-β-D-glucopyranoside (arbutine), sont présents naturellement dans un grand nombre d’aliments et de boissons. S’hydrolysant facilement en solution acide diluée pour produire le D-glucose et l’hydroquinone, l’arbutine devrait se convertir en hydroquinone libre dans l’estomac (Deisinger et al., 1996). C’est pourquoi nous tenons compte des concentrations mesurées d’hydroquinone et d’arbutine dans les aliments et les boissons dans le calcul des estimations. L’apport en provenance d’autres sources (air ambiant, air intérieur, eau et sol) devrait être négligeable en comparaison de son absorption par les aliments et les boissons.
L’exposition cutanée attribuable à l’emploi de divers produits de consommation contenant de l’hydroquinone peut aussi ajouter à l’exposition totale de l’ensemble de la population. L’annexe 2 présente différents scénarios correspondant à des limites supérieures d’exposition à différents produits contenant de l’hydroquinone. Ce sont notamment son absorption au cours de l’emploi de révélateurs pour photos noir et blanc (7,9 × 10-4 µg/kg-m.c. par jour), l’emploi d’adhésifs à usage domestique (7,2 × 10-5 µg/kg-m.c. par jour), les préparations pour manucure (3,0 × 10-4 µg/kg-m.c. par jour) et l’emploi de colorants capillaires oxydants (7,5 × 10-2 µg/kg-m.c. par jour)kg-m.c.. Sa pression de vapeur étant faible, il existe peu de risques d’exposition importante par inhalation de l’hydroquinone dégagée au moment de l’utilisation d’un de ces produits. Quant à l’exposition attribuable à l’emploi des révélateurs photographiques, les résultats d’une récente étude réalisée au Royaume-Uni, au cours de laquelle des travailleurs professionnels en chambre noire ont fait l’objet d’une surveillance biologique, n’ont révélé aucune hausse de l’excrétion urinaire de l’hydroquinone chez ces travailleurs. Cela signifie que même chez cette sous-population susceptible d’être fortement exposée, l’absorption d’hydroquinone associée à l’emploi de révélateurs risque peu d’être une source de préoccupation (UKHSE, 1993).
À cause de la grande diversité d’utilisations cliniques possibles, aucune valeur estimée de l’exposition n’a été calculée pour les produits en vente libre d’éclaircissement de la peau qui contiennent de l’hydroquinone et qui sont réglementés en vertu de la Loi sur les aliments et drogues. En outre, la vente de ces produits est régie par des dispositions imposées par la National Association of Pharmacy Regulatory Authorities.
Les particules de la fumée de cigarette contiennent de l’hydroquinone (CIRC, 1985). Elles sont donc une autre source d’exposition.
La confiance relative à l’estimation des limites supérieures d’absorption de l’hydroquinone par exposition dans les milieux naturels est modérée puisque les mesures de concentration effectuées étaient limitées. Il faut accorder une confiance limitée aux valeurs estimées de l’exposition à l’hydroquinone par l’utilisation de produits de consommation qui en contiennent puisqu’elles sont fondées sur des hypothèses. Toutefois, on juge que ces dernières surévaluent l’exposition réelle.
Évaluation des effets sur la santé humaine
L’annexe 3 fait le résumé de l’information sur les effets de l’hydroquinone sur la santé d’animaux de laboratoire. L’annexe 4 fait le survol des effets sur la santé humaine qui ont été signalés.
La Commission européenne (CE) a classé l’hydroquinone à titre de cancérogène de catégorie 3 (« substances préoccupantes pour les humains en raison d’effets cancérogènes possibles ») (CE, 1997a; IUCLID, 2000). À l’origine, on avait proposé de classer l’hydroquinone dans le groupe 2 des substances cancérogènes à cause de données sur l’apparition d’adénomes rénaux et de leucémie monocytaire chez le rat, ainsi que d’adénomes hépatiques chez la souris (annexe 3). Toutefois, la majorité des experts de la CE se sont entendus pour classer cette substance dans le groupe 3 puisque seulement des tumeurs bénignes ont été observées après l’exposition d’animaux de laboratoire à cette substance (CE, 1997a, 1997b). Le Centre international de recherche sur le cancer (CIRC) a placé l’hydroquinone dans le groupe 3 (« non classable en tant que substance cancérogène pour les humains »), à cause d’un manque d’indications suffisantes de cancérogénicité chez l’humain et d’indications limitées chez les animaux de laboratoire (CIRC, 1999).
L’exposition à long terme (2 ans) de rats mâles et femelles de la souche F344 par gavage (5 jours par semaine) à l’hydroquinone aux doses de 0, 25 ou 50 mg/kg donne lieu à une hausse proportionnelle à la dose des adénomes des cellules des tubules rénaux chez les mâles. Chez les femelles, l’incidence de la leucémie monocytaire s’élève de façon proportionnelle à la dose, mais la néphropathie est moins prononcée chez les femelles que chez les mâles. Chez des souris mâles et femelles de la souche B6C3F1 soumises à un même schéma de traitement à des doses de 0, 50 ou 100 mg/kg d’hydroquinone, le poids relatif du foie a augmenté chez les mâles traités et chez les femelles exposées à la dose la plus élevée. Chez les souris mâles, les lésions hépatiques associées à la substance testée sont l’altération des tissus adipeux, la cytomégalie et l’altération des cellules syncitiales. L’incidence combinée des carcinomes et des adénomes hépatocellulaires n’est pas statistiquement significative. Toutefois, on a observé une hausse marquée de l’incidence des adénomes hépatocellulaires chez les souris femelles traitées, en comparaison des témoins (NTP, 1989).
L’exposition de rats et de souris par voie alimentaire à l’hydroquinone à une dose de 0,8 p. 100 pendant 104 ou 96 semaines, respectivement, a provoqué l’hyperplasie des cellules des tubules rénaux et de l’épithélium des papilles rénales, ainsi que des adénomes, surtout chez les mâles des deux espèces. Ce traitement a été associé à une néphropathie chronique chez les rats mâles. Les rates présentaient des signes de néphropathie bénigne. L’absorption quotidienne moyenne a été estimée à 351 ou à 368 mg/kg-m.c. par jour chez les rats mâles et femelles, respectivement, et à 1 046 et 1 486 mg/kg-m.c. par jour chez les souris mâles et femelles, respectivement. Chez le rat, l’incidence des cas d’hyperplasie des cellules épithéliales des papilles rénales, d’hyperplasie des cellules des tubules rénaux et d’adénomes tubulaires était nettement plus élevée chez les mâles, alors que les femelles présentaient des signes de néphropathie bénigne. Chez la souris, les chercheurs ont observé une hausse marquée des cas d’hyperplasie de l’épithélium du préestomac (cellules de l’épithélium pavimenteux) tant chez les mâles que chez les femelles. Cependant, le nombre de cas d’hyperplasie des cellules des tubules rénaux et d’adénomes s’est accru uniquement chez les mâles. En outre, une incidence accrue d’adénomes hépatocellulaires a été observée chez les souris mâles (Shibata et al., 1991).
La Commission européenne (CE) a classé l’hydroquinone à titre de mutagène de catégorie 3 (« substance préoccupante pour l’homme en raison d’effets mutagènes possibles ») (CE, 1997a; OJEC, 2001). Les spécialistes de la CE s’entendent pour reconnaître que l’hydroquinone est clairement mutagène in vitro et qu’elle est un mutagène somatique in vivo(CE, 1997a). Les essais sur la génotoxicité ont donné des résultats positifs dans de nombreux systèmes d’essai in vivo et in vitro. Le CIRC (1999) est parvenu à la conclusion que l’hydroquinone avait un effet mutagène dans de nombreux systèmes in vitro et qu’elle était à l’origine d’aberrations chromosomiques structurales sur des cellules de la moelle osseuse de souris après injection intrapéritonéale.
L’analyse des modes d’action échappe à la portée du présent rapport, mais des mécanismes non génotoxiques ont été avancés pour expliquer la cancérogénicité de l’hydroquinone. On a avancé que les adénomes au niveau des tubules rénaux auraient pu être induits chez le rat par un mécanisme indirect qui aurait eu pour effet d’intensifier une maladie courante chez les rats vieillissants (néphropathie chronique évolutive) suivant l’exposition à l’hydroquinone ou à son métabolite (McGregor, 2007). Cependant, on ne peut pas écarter d’emblée les liens possibles entre des dommages génétiques et la cancérogénicité de cette substance. Il se peut que cette substance agisse indirectement par un mécanisme de génotoxicité (comme l’hétéroploïdie, le stress oxydatif, l’inhibition de la synthèse d’ADN ou la cytotoxicité) qui pourrait avoir un seuil d’action (Pratt et Barron, 2003). Il existe des indications montrant que les liaisons macromoléculaires et que l’endommagement oxydatif de l’hydroquinone sont associés à sa génotoxicité (Tsutsui et al., 1997; do Ceu Silvaet al., 2003, 2004). Des chercheurs ont aussi proposé l’existence d’un lien entre la réaction des métabolites de l’hydroquinone avec le glutathion ainsi que la manifestation de dommages épigénétiques causés par l’hydroquinone, et la leucémie ou des troubles rénaux (English et al., 1994; Whysner et al., 1995; McDonald et al., 2001). De surcroît, l’hydroquinone est un métabolite du benzène, un cancérogène du groupe 1 chez les humains, selon le CIRC (CIRC, 1987).
Quant aux effets autres que cancérogènes, la plus faible dose sans effet observé (DSEO) orale relevée dans la base de données est de 15 mg/kg-m.c. par jour. Dans une étude sur la reproduction portant sur deux générations, des chercheurs ont administré par gavage une dose d’hydroquinone de 0, 15, 50 ou 150 mg/kg-m.c. par jour à des rats mâles et femelles. Aucun effet marqué sur la reproduction n’a été observé chez les animaux de la génération F0 ou F1 aux deux doses les plus faibles. Des tremblements ont été signalés chez 1 des 30 animaux exposés à la dose de 50 mg/kg-m.c. par jour. La DSEO chez les animaux de la génération F0 (toxicité générale) était de 15 mg/kg-m.c. par jour. La DSEO associée à la toxicité pour la reproduction s’est chiffrée à 150 mg/kg-m.c. par jour chez les animaux des deux générations (Blacker et al., 1993). Au cours d’une étude de 90 jours portant sur l’exposition de rats par voie cutanée , David (1994) a établi à 73,9 mg/kg-m.c. par jour la dose sans effet nocif observé (DSENO) chez les mâles en prenant pour paramètre les effets topiques. Aucun effet systémique n’a été signalé.
La confiance accordée à la base de données toxicologiques est de faible à modérée. La base de données sur les effets sur la santé ne traite pas complètement des principales voies et durées d’exposition.
Caractérisation des risques pour la santé humaine
Selon l’évaluation de la Commission européenne, la cancérogénicité est l’effet critique à considérer en vue de la caractérisation des risques pour la santé humaine; on ne peut donc pas exclure la possibilité d’un mode d’induction comportant une interaction directe avec le matériel génétique.
Pour ce qui est des effets autres que cancérogènes, la plus faible DSEO orale relevée (15 mg/kg-m.c. par jour) provient de l’étude sur la reproduction de deux générations de rats. Elle est fondée sur la toxicité pour les parents. Mais comme l’exposition de la population générale est associée en très grande partie à la présence naturelle d’hydroquinone dans les aliments et les boissons, il serait inutile de déterminer la marge d’exposition entre des doses avec effet mesurées dans le cadre d’études où l’exposition d’animaux de laboratoire se fait par le régime alimentaire et des estimations de la limite supérieure de l’exposition. Lorsqu’il s’agit des effets autres que le cancer, on estime que l’exposition additionnelle dans les milieux naturels à l’hydroquinone attribuable à sa fabrication et à ses utilisations industrielles et les risques qui en découlent sont négligeables.
Il peut se produire une exposition cutanée à l’hydroquinone contenue dans des produits de consommation (annexe 2). Le contact avec des colorants capillaires oxydants contenant cette substance (7,5 × 10-3 µg/kg-m.c. par jour) correspond au scénario de la plus forte exposition cutanée par des produits de consommation. La marge d’exposition entre cette valeur et la DSENO associée à l’exposition par voie cutanée dans l’étude de 90 jours chez le rat (73,9 mg/kg-m.c. par jour) est bien au-delà de 1 000 000. On estime par ailleurs que, relativement aux effets autres que cancérogènes par exposition cutanée, la marge obtenue suffit pour tenir compte de l’incertitude associée à la base de données sur l’exposition et les effets.
Il faut jauger les risques présentés par les produits d’éclaircissement de la peau contenant de l’hydroquinone qui sont en vente libre et qui sont réglementés en vertu de laLoi sur les aliments et drogues, au regard des avantages cliniques qu’ils procurent aux utilisateurs. Cette évaluation échappe au cadre du présent rapport. Toutefois, Santé Canada a reçu 10 rapports (entre le 1er janvier 1965 et le 30 novembre 2007) faisant état de réactions négatives sans doute associées à l’utilisation de crèmes liquides pour la peau en vente libre (Santé Canada, 2007d).
Incertitudes associées à l'évaluation des risques pour la santé humaine
Il subsiste des incertitudes relativement à des différences de sensibilité à l’hydroquinone entre les espèces. La présente évaluation préalable ne porte pas sur l’analyse du mode d’action appliquée à la cancérogénicité de l’hydroquinone.
Il existe peu de données sur les concentrations d'hydroquinone dans les milieux naturels. Il y a aussi des incertitudes concernant les estimations de l'exposition associée à l'utilisation de produits de consommation puisqu'elles sont fondées sur des hypothèses prudentes.
Compte tenu de la cancérogénicité de l’hydroquinone, pour laquelle il existe une probabilité d’effets nocifs à toute concentration d’exposition, il est conclu que l’hydroquinone est une substance qui peut pénétrer dans l’environnement en une quantité ou concentration ou dans des conditions de nature à constituer un danger au Canada pour la vie ou la santé humaine.
Compte tenu de l’information disponible, il est conclu que l’hydroquinone ne pénètre pas dans l’environnement en une quantité ou concentration ou dans des conditions de nature à avoir, immédiatement ou à long terme, un effet nocif sur l’environnement ou sur la diversité biologique et à mettre en danger l'environnement essentiel pour la vie.
Il est donc conclu que l’hydroquinone ne satisfait pas aux critères énoncés aux alinéas 64a) et b) de la LCPE (1999), mais qu’il remplit ceux énoncés à l’alinéa 64c) de la Loi. De plus, cette substance ne satisfait pas aux critères de la persistance et du potentiel de bioaccumulation énoncés dans le Règlement sur la persistance et la bioaccumulation.
Alder, I.D. et U. Kliesch. 1990. Comparison of single and multiple treatment regimens in the mouse bone marrow micronucleus assay for hydroquinone (HQ) and cyclophosphamide (CP). Mutat. Res. 234:115-23.
Aneshansley, D.J., T. Eisner, J.M. Widom et B.Widom. 1969. Biochemistry at 100{degrees}C: Explosive Secretory Discharge of Bombardier Beetles (Brachinus). Science, 165(3888):61-3.
AOPWIN, v. 1.91. 2000. U.S. Environmental Protection Agency.
[ARLA] Agence de réglementation de la lutte antiparasitaire. 2007. Liste des produits de formulation de l’ARLA. Ottawa (ON) : Santé Canada, Agence de réglementation de la lutte antiparasitaire. (cité le 10 juillet 2007)
Arnot, J.A. et F.P.A.C. Gobas. 2003. A Generic QSAR for Assessing the Bioaccumulation Potential of Organic Chemicals in Aquatic Food Webs. QSAR Comb. Sci. 22(3): 337-345.
Asan, A.et I. Isildak. 2003. Determination of major phenolic compounds in water by reversed-phase liquid chromatography after pre-column derivatization with benzoyl chloride. J. Chromatography A. 988: 145-149
Barber, E.D., T. Hill et D.B. Schum. 1995. The percutaneous absorption of hydroquinone (HQ) through rat and human skin in vitro. Toxicology Letters 80:167-172
BCFWIN. 2000. v. 2.15. U.S. Environmental Protection Agency.
Bentley-Phillips B. et M.A. Bayles. 1975. Cutaneous reactions to topical application of hydroquinone. Results of a 6-year investigation. S. Afr. Med. J. 49(34):1391-5.
Bernard, L.G. 1988. Subchronic oral toxicity of hydroquinone in rats utilizing a functional-observational battery and neuropathology to detect neurotoxicity (rapport non publié TX-88-78). Eastman Kodak.
Bio/dynamics Inc.1989. A developmental toxicity study in rabbits with hydroquinone (No projet 87-3220) : Rapport définitif rédigé pour le compte de la Chemical Manufacturers Association. East Millstone, New Jersey.
BIOWIN 2000, v. 4.02. U.S. Environmental Protection Agency.
Blacker, A.M., R. E. Schroeder, J.C. English, S.J. Murphy, W.J. Krasavage et G.S. Simon. 1993. A two-generation reproduction study with hydroquinone in rats. Fundam. Appl. Toxicol. 21(4):420-424.
Blacker, A.M., R. E. Schroeder, J.C. English, S.J. Murphy, W.J. Krasavage et G.S. Simon. 1993a. A two-generation reproduction study with hydroquinone in rats. Fundam. Appl. Toxicol. 21(4):420-4.
Canada. 1999. Loi canadienne sur la protection de l’environnement (1999), Lois du Canada, Ottawa, Imprimeur de la Reine, chap. 33. Loi sanctionnée le 14 septembre 1999. Publiée dans la Gazette du Canada Partie III, vol. 22, n° 3.
Canada. 2000. Règlement sur la persistance et la bioaccumulation. Ottawa : Travaux publics et Services gouvernementaux Canada. Publié dans la Gazette du Canada Partie II, vol. 134, n° 7.
Canada, 2007a. Loi canadienne sur la protection de l’environnement (1999) : Avis concernant certaines substances inscrites sur la Liste intérieure des substances (LIS).Ottawa. Travaux publics et Services gouvernementaux. Gazette du Canada Partie I, vol. 141, n° 5.
Canada. 2007b. Ministère de l’Environnement, ministère de la Santé. Profil de substance pour le Défi, pyrocathécol (cathécol), No CAS 120-80-9.
Carlson, A.J. et N.R. Brewer. 1953b. Toxicity studies on hydroquinone. Proc. Soc. Exp. Biol. Med. 84(3):684-8:684-8.[CE] Commission européenne. 1997a. Summary Record. Commission Working Group of Specialised Experts in the fields of Carcinogenicity, Mutagenicity and Reprotoxicity. Meeting at Belgirate (4-6 juin).
[CE] Commission européenne. 1997b. Draft Summary Record Commission Working Group on the Classification and Labeling of Dangerous Substances. Réunion de l’ECB à Ispra (4-6 juin).
[Chemical Economics Handbook]. 2006. SRI Consulting. CEH Data Summary for Hydroquinone, June 2006. p. 1-20.
Journal officiel des Communautés européennes, 2001. Commission Directive 2001/59/EC of 6 August 2001 adapting to technical progress for the 28th time Council Directive 67/548/EEC on the approximation of the laws, regulations and administrative provisions relating to the classification, packaging and labelling of dangerous substances. L225 (21 août). Vol. 44 (Annex 6).
Chemicals Inspection and Testing Institute. 1992. Biodegradation and bioaccumulation data of existing chemicals based on the CSCL Japan. Japon : Chemical Industry Ecology- Toxicology and Information Centre. ISBN 4-89074-101-1.
[CIRC] Centre international de recherche sur le cancer. 1985. Tobacco Smoking. IARC Monogr.Eval.Carcinogen. Risk Chem.Hum. 38:86. Lyon, France. IARC Monogr. Eval. Carcinogen.
[CIRC] Centre international de recherche sur le cancer. 1987. Benzene. Summary and Evaluation Supplement 7. Lyon, France.
[CIRC] Centre international de recherche sur le cancer. 1999. Hydroquinone. Monographs on the Evaluation of Carcinogenic Risks to Humans. Re-evaluation of Some Organic Chemicals, Hydrazine and Hydrogen peroxide. Lyon, France. 71 (Partie 2):691-719.
David, R. 1994. NDMA high HQ formulation cream: a thirteen-week dermal toxicity and cell proliferation study in the rat. Rapport non publié. Nonprescription Drug Manufacturers Association.
Deisinger, P.J., T.S. Hill et J.C. English. 1996. Human exposure to naturally occurring hydroquinone. J. Toxicol. Environ. Health, 47: 31-46.
DHM (Direction de l’hygiène du milieu). 1998. Exposure factors for assessing total daily intake of Priority Substances by the general population of Canada. Rapport non publié. Décembre 1998. Section des substances d’intérêt prioritaire, Direction de l’hygiène du milieu, Santé Canada.
do Ceu Silva, M., J. Gaspar, I. Duarte Silva, A. Faber et J.Rueff. 2004. GSTM1, GSTT1, and GSTP1 genotypes and the genotoxicity of hydroquinone in human lymphocytes. Environ. Mol. Mutagen. 2004;43(4):258-64:258-64.
do Ceu Silva, M., J. Gaspar, I. Duarte Silva, D. Leao et J.Rueff. 2003. Mechanisms of induction of chromosomal aberrations by hydroquinone in V79 cells. Mutagenesis. Nov. 2003; 18(6):491-6.
ECOTOX. Base de données.
English, J.C., L.G. Perry, M. Vlaovic, C.Moyer et J.L. O'donoghue. 1994. Measurement of cell proliferation in the kidneys of Fischer 344 and Sprague-Dawley rats after gavage administration of hydroquinone. Fundam. Appl. Toxicol. 1994 Oct; 23(3):397-406:397-406.
Environnement Canada. 2007. Loi canadienne sur la protection de l’environnement (1999). Avis concernant certaines substances identifiées dans la Liste intérieure des substances (LIS). Gazette du Canada Partie I, vol. 141, n° 5.
EPIWIN, 2000. v. 3.12. U.S. Environmental Protection Agency.
Erexson, G.L., J.L. Wilmer et A.D. Kligerman. 1985. Sister chromatid exchange induction in human lymphocytes exposed to benzene and its metabolites in vitro. Cancer Res. 45(6):2471-2477.
Fahrig, R. 1984. Genetic mode of action of cocarcinogens and tumor promoters in yeast and mice. Mol. Gen. Genet. 194(1-2):7-14.
Findlay, G.H. et H.A. De Beer. 1980. Chronic hydroquinone poisoning of the skin from skin-lightening cosmetics. A South African epidemic of ochronosis of the face in dark-skinned individuals. S. Afr. Med. J. 57(6):187-90.
Findlay, G.H., J.G. Morrison et I.W. Simson. 1975. Exogenous ochronosis and pigmented colloid milium from hydroquinone bleaching creams. Br. J. Dermatol. 3(6):613-22.
Freitag, D., L. Ballhorn, H. Geyer et F. Korte. 1985. Environmental hazard profile of organic chemicals. Chemosphere, 14: 1589-1616.
Galloway, S.M., M.J. Armstrong, C.Reuben, S. Colman, B. Brown, C.Cannon, A.D. Bloom, F. Nakamura, M. Ahmed, S. Duk et al. 1987. Chromosome aberrations and sister chromatid exchanges in Chinese hamster ovary cells: evaluations of 108 chemicals. Environ. Mol. Mutagen. Suppl. 10:1-175.
Glatt, H., I. Gemperlein, F. Setiabudi, K.L. Platt et F. Oesch. 1990. Expression of xenobiotic-metabolizing enzymes in propagatable cell cultures and induction of micronuclei by 13 compounds. Mutagenesis 5(3):241-9.
Hakura, A., Y. Tsutsui, H. Mochida, Y. Sugihara, T. Mikami et F. Sagami. 1996. Mutagenicity of dihydroxybenzenes and dihydroxynaphthalenes for Ames Salmonella tester strains. Mutat. Res. 371(3-4):293-9.
Hansch, C., A. Leo et D. Hoekman. 1995. Exploring QSAR: Hydrophobic, Electronic, and Steric Constants. American Chemical Society, Washington, DC, USA.
Harbison, K.G. et R.T. Belly. 1982. The biodegradation of hydroquinone. Environ. Toxicol. Chem. 1(1): 9–15
Haworth, S., T. Lawlor, K. Mortelmans, W. Speck et E. Zeiger. 1983. Salmonella mutagenicity test results for 250 chemicals. Environ. Mutagen. Suppl. 1:1-142.
[HSDB] Hazardous Substances Databank [base de données sur Internet]. 2006. Bethesda (MD): U.S Department of Health and Human Services, National Institutes of Health, National Library of Medicine, Toxicology Data Network. [cité en mars 2006].
Hudnall, P.M. 1987. Hydroquinone. In : Gerhartz ,W., R. Pfefferkorn, F.T. Campbell, J.F. Rounsaville et S.Y. Yamamoto. 1987. Ullman's Encyclopedia of Industrial Chemistry. 5e éd. New York: VCH Publishers. p. A13: 499-505.
[IUCLID] International Uniform Chemical Information Database. 2000. Hydroquinone (CAS 123-31-9). Commission européenne, Bureau européen des substances chimiques.
Krasavage, W.J. 1984. Hydroquinone: a dominant lethal assay in male rats: Report No. TX-84-23. Rochester (NY): Eastman Kodak Company, Health and Environment Laboratories.
Krasavage, W.J., A.M. Blacker, J.C. English et S.J. Murphy. 1992. Hydroquinone: a developmental toxicity study in rats. Fundam. Appl. Toxicol. 18(3):370-5.
Laboratory of Industrial Medicine, Eastman Kodak Company. 1971. Toxicity Report. (rapport non publié).
Levitt, J. 2007. The safety of hydroquinone: A dermatologist’s response to the 2006 federal Register. J Am Acad Dermatol. 57(5):854-872.
McDonald, T.A., N.T. Holland, C. Skibola, P. Duramad et M.T. Smith. 2001. Hypothesis: phenol and hydroquinone derived mainly from diet and gastrointestinal flora activity are causal factors in leukemia 1. Leukemia 15(1):10-20.
McGregor D. 2007. Hydroquinone: An evaluation of the human risks from its carcinogenic and mutagenic properties. Critic Rev Toxicol 37. 887-914.
Meylan, W.M. et P.H. Howard. (1991). Bond contribution method for estimating Henry's law constants. Environmental Toxicology and Chemistry 10:1283-1293.
Miller, B.M. et I.D. Adler. 1989. Suspect spindle poisons: analysis of c-mitotic effects in mouse bone marrow cells. Mutagenesis 4(3):208-15.
Morimoto, K. et S. Wolff. 1980. Cell cycle kinetics in human lymphocyte cultures. Nature 288(5791):604-6.
Murphy, S.J., R.E. Schroeder, A.M. Blacker, W.J. Krasavage et J.C.English. 1992. A study of developmental toxicity of hydroquinone in the rabbit. Fundam. Appl. Toxicol. 19(2):214-221.
Nielsen, H., L. Henriksen et J.H. Olsen. 1996. Melignant melanoma among lithographers. Scan J Work Environ Health Apr 22(2):108-111.
[NTP] National Toxicology Program. 1989. Toxicology and carcinogenesis studies of hydroquinone in F344/N rats and B6C3F1 mice (études par gavage). Research Triangle Park (Caroline du Nord): National Toxicology Program. Rapport technique no 366.
OASIS Forecast. 2004. Version 1.14. Laboratoire de chimie mathématique, Université "Prof. Assen Zlatarov". Bourgas, Bulgarie.
Pacchierotti, F., B. Bassani, P. Leopardi et A. Zijno. 1991. Origin of aneuploidy in relation to disturbances of cell-cycle progression. II: Cytogenetic analysis of various parameters in mouse bone marrow cells after colchicine or hydroquinone treatment. Mutagenesis 6(4):307-11.
Painter, R.B. et R. Howard. 1982. The Hela DNA-synthesis inhibition test as a rapid screen for mutagenic carcinogens. Mutat. Res. 92(1-2):427-37.
PCKOCWIN. 2000. v. 1.66. U.S. Environmental Protection Agency.
[PISSC] Programme international sur la sécurité des substances chimiques.1994. Environmental Health Criteria (EHC) 157. Hydroquinone.
Pratt, I.S. et T. Barron. 2003. Regulatory recognition of indirect genotoxicity mechanisms in the European Union. Toxicology Letters 140-141:53-62.
[RIVM] Rijksinstituut voor Volksgezondheid en Milieu. 2006. Consumer Exposure (ConsExpo) Model [Internet]. Version 4.1. Pays-Bas : The National Institute for Public Health and the Environment (Rijksinstituut voor Volksgezondheid en Milieu).
Sakai, M., D.Yoshida et S. Mizusaki. 1985. Mutagenicity of polycyclic aromatic hydrocarbons and quinones on Salmonella typhimurium TA97. Mutat. Res. 156(1-2):61-7.
Santé Canada. 2007a. Liste critique des ingrédients dont l'utilisation est restreinte ou interdite dans les cosmétiques au Canada
Santé Canada. 2007b. Rapport provisoire sur l’hydroquinone. Division des cosmétiques de Santé Canada. Septembre 2007.
Santé Canada. 2007c. Communication personnelle. Robin Marles. Direction des produits thérapeutiques. 22 novembre 2007.
Santé Canada. 2007d. Communication personnelle., Jenna Griffiths, Direction des produits de santé commercialisés, Direction générale des produits de santé et des aliments, 8 janvier 2008.
Schauer, J.J. et G.R. Cass. 2000. Source Apportionment of Wintertime Gas-Phase and Particle-Phase Air Pollutants Using Organic Compounds as Tracers. Environmental Science and Technology, 34(9).1821-1832.
Shibata, M.A., M. Hirose, H. Tanaka, E. Asakawa, T. Shirai et N. Ito. 1991c. Induction of renal cell tumors in rats and mice, and enhancement of hepatocellular tumor development in mice after long-term hydroquinone treatment. Jpn J. Cancer Res. 2(11):1211-9.
Shibata, M.A., M. Hirose, H. Tanaka, E. Asakawa, T. Shirai et N. Ito. 1991c. Induction of renal cell tumors in rats and mice, and enhancement of hepatocellular tumor development in mice after long-term hydroquinone treatment. Jpn J. Cancer Res. 2(11):1211-1219.
Shibata, M.A., M. Hirose, H. Tanaka, E. Asakawa, T. Shirai et N. Ito. 1991a. Induction of renal cell tumors in rats and mice, and enhancement of hepatocellular tumor development in mice after long-term hydroquinone treatment. Jpn J. Cancer Res. 2(11):1211-9.
SIDS OCDE, 2002. Screening Information Data Set. CAS RN 123-31-9, 1,4-Benzenediol. Publications du PNUE. Juin 2002.
Sterner, J.H., F.L. Oglesby et B. Anderson. 1947. Quinone vapors and their harmful effects. The Journal of Industrial Hygiene and Toxicology 29:60-73.
Topkat, 2004. v. 6.1. Accelrys Software Inc.
Tsutsui, T., N. Hayashi, H. Maizumi, J. Huff et J.C. Barrett. 1997. Benzene-, catechol hydroquinone- and phenol-induced cell transformation, gene mutations, chromosome aberrations, aneuploidy, sister chromatid exchanges and unscheduled DNA synthesis in Syrian hamster embryo cells. Mutat. Res. 373(1):113-123.
UKHSE, 1993. United Kingdom Health and Safety Executive. Renseignements non publiés. Tel qu’indiqué dans le SIDS de l’OCDE, 2002.
Varagnat, J. 1982. Kirk-Othmer Encyclopedia of Chemical Technology 3e éd. New York: Wiley Publishing Co. 39-69.
Versar Inc. 1986. Standard Scenarios for Estimating Exposure to Chemical Substances During Use of Consumer Products, Vol. I. Rédigé pour le compte de l’U.S. Environmental Protection Agency.
Woodard , G.D.L. 1951. The toxicity, mechanism of action, and metabolism of hydroquinone. [dissertation]. Université George Washington.
Whysner, J., L. Verna, J.C. English et G.M. Williams. 1995. Analysis of studies related to tumorigenicity induced by hydroquinone. Regul. Toxicol. Pharmacol. Février 1995. 21(1):158-76.
Xu, W. et I.D. Adler. 1990. Clastogenic effects of known and suspect spindle poisons studied by chromosome analysis in mouse bone marrow cells. Mutagenesis 5(4):371-374.
Zeidman, I. et R. Deuit. 1945. Poisoning by hydroquinone and mono-methylparamenohenol sulphate: Report of 2 cases with autopsy findings. Am J Med Sci 210:328-332.
Annexe 1 : Valeurs estimées de la limite supérieure d’absorption quotidienne d’hydroquinone par la population générale au Canada
| Voie d'exposition | Estimation de l'absorption (μg/kg-m.c. par jour) d'hydroquinone par groupe d'âge |
|||||||
|---|---|---|---|---|---|---|---|---|
| 0-6 mois [1, 2, 3] | 0,5-4 ans[4] | 5-11 ans[5] | 12-19 ans[6] | 20-59 ans[7] | 60+ ans[8] | |||
| Nourris au lait maternisé | Nourris autrement | |||||||
| Air [9] | 0,01 | 0,03 | 0,05 | 0,05 | 0,06 | 0,05 | ||
| Eau potable [10] | 0,00 | 0,20 | 0,10 | 0,10 | 0,05 | 0,04 | 0,04 | |
| Aliments et boissons [11] | 393,24 | 366,35 | 242,46 | 127,65 | 105,19 | 91,27 | ||
| Sol [12] | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | 0,00 | ||
| Absorption totale | 0,00 | 393,45 | 366,45 | 242,56 | 127,71 | 105,23 | 91,32 | |
[1] Aucune donnée n’a été signalée sur les concentrations d’hydroquinone dans le lait maternel.
[2] Par hypothèse, poids de 7,5 kg, absorption d'air de 2,1 m 3 par jour, absorption d'eau de 0,8 L par jour (lait maternisé) ou de 0,3 L/jour (autres que lait maternisé), ingestion de 30 mg de particules de sol par jour (DHM, 1998).
[3] Pour les poupons nourris avec du lait maternisé, l'absorption d'eau est synonyme de l'absorption d'aliments. On n'a relevé aucune donnée connue sur les concentrations d'hydroquinone dans le lait maternisé au Canada.
[4] Par hypothèse, poids de 15,5 kg, absorption d'air de 9,3 m 3 par jour, absorption d'eau de 0,7 L par jour, ingestion de 100 mg de particules de sol par jour (DHM, 1998).
[5] Par hypothèse, poids de 31,0 kg, absorption d'air de 14,5 m 3 par jour, absorption d'eau de 1,1 L par jour, ingestion de 65 mg de particules de sol par jour (DHM, 1998).
[6] Par hypothèse, poids de 59,4 kg, absorption d'air de 15,8 m 3 par jour, absorption d'eau de 1,2 L par jour, ingestion de 30 mg de particules de sol par jour (DHM, 1998).
[7] Par hypothèse, poids de 70,9 kg, absorption d'air de 16,2 m 3 par jour, absorption d'eau de 1,5 L par jour, ingestion de 30 mg de particules de sol par jour (DHM, 1998).
[8] Par hypothèse, poids de 72,0 kg, absorption d'air de 14,3 m 3 par jour, absorption d'eau de 1,6 L par jour, ingestion de 30 mg de particules de sol par jour (DHM, 1998).
[9] Aucune donnée canadienne n’a été relevée. En guise de remplacement, une concentration de 0,00346 µg/m3 d’hydroquinone dans les particules fines lors d’une étude de surveillance de l’air ambiant à Fresno, Californie, a été appliquée au calcul de la limite supérieure d’exposition estimée (Schauer et Cass, 2000). Aucune donnée sur la concentration dans l’air intérieur n’a été relevée. Par hypothèse, elle est égale à la concentration dans l’air ambiant mentionnée ci-dessus, et la population canadienne y est exposée jour et nuit.
[10] On a relevé aucune donnée canadienne. En guise de remplacement, la concentration moyenne de 7,6 µg/L mesurée dans un échantillon d’eau prélevé dans la rivière Mert, Turquie, a été appliquée au calcul de la limite supérieure d’exposition estimée (Asan et Isildak, 2003). Chez les poupons nourris au lait maternisé, la concentration d’hydroquinone dans l’eau de surface ayant servi à la préparation du lait correspond à la dose absorbée dans les aliments
[11] La concentration maximale d'hydroquinone dans les aliments mesurée dans d'autres pays est employée à titre de donnée de remplacement lorsqu'il n'existe pas de données canadiennes. Les estimations de l'absorption d'hydroquinone dans les aliments sont calculées à partir des concentrations dans les aliments représentatifs de douze groupes d'aliments dont on tient compte pour calculer l'absorption (DHM, 1998):
Produits laitiers : 30 µg/kg; concentration moyenne (total d'hydroquinone) dans le yogourt (Deisinger et al., 1996);
Matières grasses : aucune donnée;
Fruits : 15,090 µg/kg; concentration moyenne (total d'hydroquinone) dans la poire d'Anjou (Deisinger et al., 1996);
Légumes : 480 µ g/kg; concentration moyenne (total d'hydroquinone) dans l'oignon (Deisinger et al., 1996);
Produits céréaliers : 10 650 µ g/kg; concentration moyenne (total d'hydroquinone) dans le germe de blé (Deisinger et al., 1996);
Viande et volaille : aucune donnée ;
Poisson : aucune donnée;
œufs : aucune donnée;
Aliments surtout à base de sucre : aucune donnée;
Plats préparés et potages : aucune donnée ;
Noix et graines : aucune donnée ;
Boissons gazeuses, alcool, café, thé : 430 µ g/kg; concentration moyenne (total d'hydroquinone) dans le vin rouge (Deisinger et al., 1996).
[12] La quantit é d’aliments consommée quotidiennement par chaque groupe d’âge est établie par Santé Canada (DHM, 1998). À noter que toutes les concentrations d’hydroquinone signalées dans les aliments sont d’origine naturelle.
Annexe 2 : Estimations de l'exposition cutanée des adultes canadiens à l'hydroquinone contenue dans les produits de consommation
| Type de produit de consommation | Hypothèses | Estimation de l'exposition |
|---|---|---|
| Révélateur pour photos en noir et blanc[1] | Par hypothèse, le coefficient de perméabilité est de 9,3 x 10-6 cm/h (Barber et al., 1995). Par hypothèse, la superficie exposée est de 20 cm2. Il s’agit d’une évaluation basée sur le choix d’une superficie d’exposition de 200 cm2 (Versar Inc., 1986) et d’un commentaire reçu lors de la consultation publique indiquant que seul le bout des doigts d’une main est sans doute exposé pendant le procédé de développement. Par hypothèse, la fréquence d’utilisation est de 12 fois par an, la masse volumique de la solution est de ~1,0 g/cm3et la fraction en poids de l’hydroquinone en solution dans un bain de révélateur est de 0,037 (Versar Inc., 1986). Même si cette fraction en poids, selon les renseignements communiqués en vertu de l’article 71, est d’environ 0,22 à 0,14 dans les différents produits de développement commerciaux et de grande consommation (Environnement Canada, 2007), la valeur mentionnée par Versar est jugée davantage représentative des concentrations de travail employées par les amateurs. Par hypothèse, l’exposition totale est d’une durée de 15 minutes. Il s’agit d’une évaluation qui repose sur une durée moyenne de travail en chambre noire de 8 h (Versar Inc., 1986) et qui, selon les commentaires reçus du public, montre la brièveté du contact avec le révélateur au cours du développement, car on suppose que les personnes s’essuient les mains après les avoir trempées dans le révélateur afin de réduire la contamination par ce dernier des autres solutions employées par la suite. Cette valeur serait surestimée si les personnes devaient appliquer les méthodes recommandées de manipulation des révélateurs en portant des gants ou aussi en utilisant des pinces plutôt que le bout des doigts pour déposer et pour retirer le papier. Par hypothèse, la masse corporelle est de 70,9 kg (DHM, 1998). Dose = (coefficient de perméabilité) x (fraction en poids) x (masse volumique du produit) x (durée d’exposition) x (superficie exposée) x (facteur de conversion/masse corporelle) Dose = (9,3 x 10-6 cm/h) x (0,037) x (1,0 g/cm3) x (0,25 h) x (20 cm2) x (12 fois/an /365 jours/an) x (1 x 10-6 µg/g)/(70,9 kg-m.c.)kg-m.c.
|
7,9 x 10-4 |
| Constituant de colles à usage domestique [1, 2] | Par hypothèse, , le coefficient de perméabilité est de 9,3 x 10-6 cm/h (Barber et al., 1995). Par hypothèse, la fréquence d’utilisation est de 12 fois par an, la superficie exposée est de 2 cm2 et la durée d’exposition (c.-à-d. de l’application) est de 0,083 h (RIVM, 2006); Par hypothèse, la fraction en poids de l’hydroquinone dans l’adhésif est de 0,01 (Environnement Canada, 2007). Par hypothèse, la masse volumique du produit est de ~1,0 g/cm3 (Versar, 1986). Par hypothèse, la masse corporelle est de 70,9 kg (DHM, 1998). Dose = (coefficient de perméabilité) x (fraction en poids) x (masse volumique du produit) x (durée d’exposition) x (superficie exposée) x (facteur de conversion/masse corporelle) Dose = (9,3 x 10-6 cm/h) x (0,01) x (1,0 g/cm3) x (0,083 h) x (2 cm2) x (12 fois/an /365 jours/an) x (1 x 10-6 µg/g)/(70,9 kg-m.c.) |
7,2 x 10-5 |
| Préparations pour manucure[3, 4] | Par hypothèse, un taux d’absorption cutanée de 0,52 ± 0,13 μg/cm2 par heure (Barber et al., 1995). Par hypothèse, la fréquence d’utilisation est de 0,035 fois par jour, la durée d’exposition est de 0,25 h et la masse corporelle est de 60 kg (Santé Canada, 2007b). Par hypothèse, la superficie exposée moyenne est de 4 cm2 (RIVM, 2006). Dose = (taux d’absorption cutanée) x (superficie exposée) x (fréquence d’utilisation) x (durée d’exposition) / (m.c.) Dose = (0,52 μg/cm2 par heure) x (4 cm2) x (0,035 fois/jour) x (0,25 h) / (60 kg-m.c.) |
3,0 x 10-4
|
| Colorants capillaires oxydants [5] | Par hypothèse, un taux d’absorption cutanée de 0,52 ± 0,13 μg/cm2 par heure (Barber et al., 1995). Par hypothèse, la fréquence d’utilisation est de 0,03 fois/jour, la masse corporelle est de 60 kg, la superficie exposée moyenne est de 580 cm2 et la durée d’exposition est de 0,5 heure (Santé Canada, 2007b). Dose = (taux d’absorption cutanée) x (superficie exposée) x (fréquence d’utilisation) x (durée d’exposition)/ (m.c.) Dose = (0,52 μg/cm2 par heure) x (580 cm2) x (0,03 fois/jour) x (0,5 h) / (60 kg-m.c.) Les colorants capillaires sont de type oxydant et la concentration d’hydroquinone qu’ils contiennent, ordinairement de 0,1 à 0,3 %, s’abaisse lorsque du peroxyde d’hydrogène est mélangé au colorant avant le traitement. |
7,5 x 10-2
|
[2] Adhésif de type cyanoacrylate (p.ex., colle à base de cyanoacétate.
[3] Une masse corporelle moyenne de 60 kg pour les femmes adultes canadiennes a été appliquée aux calculs (Santé Canada, 2007b).
[4] Lorsqu'il s'agit de préparations pour ongles artificiels, l'exposition à l'hydroquinone résulte principalement de l'application de la résine liquide sur l'ongle. Du fait que l'hydroquinone est rapidement épuisée au cours de la réaction de polymérisation et que tout résidu reste captif de la matrice durcie de polyacrylate, toute exposition subséquente à l'application initiale est sans doute négligeable.
[5] Par hypothèse, taux d'absorption à partir d'une solution aqueuse.
| Paramètre | Plus faibles concentrations avec effet / résultats |
|---|---|
| Toxicité aiguë | Plus faible DL50 orale = 298 mg/kg m.c. (rat - Wistar – jeûne) Plus faible DL50 orale = 390 mg/kg-m.c. (souris Swiss nourries) (Woodard, 1951), [cité dans OCDE (2002)]. Plus faible DL50 cutanée = > 1 000 mg/kg-m.c. (cobaye) (Rapport sur la toxicité, 1971), [cité dans OCDE (2002)]. |
| Toxicité à court terme de doses répétées | Exposition pendant 14 jours : Plus faible DSEO orale = 250 mg/kg m.c. par jour (rat - F344) (NTP, 1989). Plus faible DSEO orale = 125 mg/kg m.c. par jour (souris mâles – B6C3F1) (NTP, 1989). Plus faible DSEO orale = 250 mg/kg m.c. par jour (souris femelles – B6C3F1). Plus faible DSEO cutanée = 1 920 mg/kg-m.c. par jour (rats mâles et femelles – F344), cité dans {OCDE n o 1081, 2002 } . étude originale : (NTP, 1989). [cité dans OCDE (2002)]. Plus faible DSEO cutanée = 4 800 mg/kg-m.c. par jour (souris mâles et femelles – B6C3F1) (NTP, 1989). [cité dans OCDE (2002)]. |
| Toxicité subchronique | Exposition pendant 13 semaines : Plus faible DSEO orale = 20 mg/kg-m.c. par jour (rats Sprague-Dawley) (Bernard, 1988) [cité dans OCDE (2002)]. [Autres études : NTP, 1989] kg-m.c.kg-m.c.kg-m.c.kg-m.c.kg-m.c. Plus faible DSENO cutanée = Administration topique à des rats mâles et femelles (dos rasé) d’hydroquinone à raison de 0, 2,0, 3,5 ou 5,0 % (73,9 mg/kg-m.c. par jour chez les mâles et 109,6 mg/kg-m.c. par jour chez les femelles de rats F344) pendant 13 semaines (5 jours/semaine, 6 h par jour). Les chercheurs signalent des effets topiques tels que peau sèche, taches brunâtres ou érythèmes. DSENO fondée sur l’absence d’effets systémiques ou histopathologiques (David, 1994) [cité dans OCDE (2002)]. kg-m.c.kg-m.c. kg-m.c.kg-m.c.kg-m.c.kg-m.c.kg-m.c. kg-m.c.kg-m.c. |
| Toxicité pour la reproduction ou le développement | étude sur la reproduction portant sur 2 générations : administration par gavage d'hydroquinone à des rats mâles et femelles (Sprague-Dawley) de F0 et de F1 (15, 50 ou 150 mg/kg m.c. par jour (Blacker et al., 1993a)3). DSEO = 15 mg/kg m.c. par jour (toxicité générale pour les parents). DSEO = 150 mg/kg m.c. par jour (toxicité pour la reproduction chez les 2 générations). Un mâle de la F0 du groupe exposé à 50 mg/kg a souffert de tremblements après le traitement. À 150 mg/kg, les auteurs signalent des tremblements chez plusieurs parents des 2 sexes (F0 et F1). Une analyse des tendances a indiqué un ralentissement significatif et proportionnel à la dose du gain pondéral des mâles de la F1, mais non chez ceux de la F0. [Autres renseignements : Krasavage et al. 1992; Bio/dynamics Inc., 1989; Murphy et al., 1992]kg-m.c. |
| Toxicité chronique/ cancérogénicité | Administration par gavage d’hydroquinone (0, 25 ou 50 mg/kg-m.c. par jour) à des rats mâles et femelles F344 pendant 103 semaines (5 fois/semaine). Premier sacrifice d’animaux à 15 mois (NTP, 1989). Premier sacrifice d’animaux à 15 mois :rat – néphropathie liée à la substance observée chez les mâles exposés à 25 ou à 50 mg/kg-m.c. par jour. Poids relatif des reins significativement plus élevé et incidence accrue des cas de néphropathie chez les mâles accompagnée d’une baisse de l’hématocrite, et numération érythrocytaire à la baisse (anémie régénérative bénigne) chez les femelles exposées à la dose la plus forte (50 mg/kg m.c.). |
Administration par gavage d’hydroquinone à des souris mâles et femelles B6C3F1 pendant 103 semaines (5 fois par semaine) aux doses de 0, 50 ou 100 mg/kg-m.c. par jour. Premier sacrifice d’animaux à 15 mois (NTP, 1989). Premier sacrifice d’animaux à 15 mois :poids relatif du foie élevé chez les mâles et les femelles du groupe exposé à 100 mg/kg-m.c. par jour. Poids relatif supérieur des reins et du cerveau chez les femelles. Lésions hépatiques associées à la substance uniquement chez les mâles traités avec la substance (50 ou 100 mg/kg-m.c. par jour). étude de 2 ans : hausse associée à la substance du poids relatif du foie chez les mâles (50 ou 100 mg/kg-m.c. par jour) et chez les femelles exposées à la dose la plus élevée seulement. Incidence accrue d’adénomes hépatocellulaires uniquement chez les souris femelles traitées. Hyperplasie des cellules folliculaires de la thyroïde chez les souris mâles et femelles traitées. |
|
Administration par le régime alimentaire d’hydroquinone à des rats mâles et femelles F344 pendant 104 semaines (351 ou 368 mg/kg-m.c. par jour) (Shibata et al., 1991) Les auteurs ne signalent aucune mortalité ni aucun signe clinique de toxicité. Chez les mâles, hausse du poids absolu ou relatif du foie et des reins et hyperplasie accrue des cellules des tubules rénaux, et présence d’adénomes microscopiques chez les sujets traités. Néphropathie chronique chez les sujets traités et chez les témoins, mais plus grave dans le cas des sujets traités. Chez les femelles, hausse du poids absolu ou relatif des reins.. |
|
Administration par le régime alimentaire d’hydroquinone à des souris mâles et femelles B6C3F1 pendant 96 semaines (1 046 ou 1 486 mg/kg-m.c. par jour) (Shibata et al., 1991). Les auteurs ne signalent aucune mortalité ni aucun signe clinique de toxicité. Chez les mâles, hyperplasie accrue des cellules des tubules rénaux, adénomes hépatocellulaires et foyers au niveau du foie. Hyperplasie des cellules épithéliales du préestomac chez les sujets des deux sexes et hausse du poids relatif du foie et des reins chez les femelles uniquement.Signes possibles de cancérogénicité. |
|
| Génotoxicité in vivo |
Positif : aberrations chromosomiques, effets d'inhibition de la mitose induits par la colchicine, formation de micronoyaux et échanges entre chromatides sœurs (cellules de la moelle osseuse) (Miller et Adler, 1989; Xu et Adler, 1990; Alder et Kliesch, 1990; Pacchierotti et al., 1991)1), [cité dans PISSC (1994) et OCDE (2002)]. Hydroquinone administrée par voie intrapéritonéale. Négatif : mutations létales d’allèles dominants (rats mâles Sprague-Dawley mâles). (Krasavage, 1984), [cité dans PISSC (1994) et CIRC (1999)] |
| In vitro | Négatif : test d'Ames sur S. typhimurium TA97, 98, 100, 1535, 1537 et 1538. (Haworth et al., 1983; Fahrig, 1984; Sakai et al., 1985; Hakuraet al., 1996), [cité dans PISSC (1994) et CIRC (1999)]. Positif : aberrations chromosomiques (cellules ovariennes de hamsters chinois), échanges entre chromatides sœurs (cellules V79 de hamsters chinois, lymphocytes humains), induction de la formation de micronoyaux (lymphocytes humains, cellules des poumons de hamsters chinois), endommagement de l'ADN (cellules HeLa). (Morimoto et Wolff, 1980; Painter et Howard, 1982; Erexsonet al., 1985; Galloway et al., 1987; Glatt et al., 1990), cité dans PISSC (1994). |
Il existe très peu de données portant sur les humains. L’ingestion d’hydroquinone à des concentrations allant jusqu’à 500 mg/jour pendant 20 semaines n’a donné lieu à aucun changement pathologique observable dans le sang et l’urine des sujets volontaires. L’ingestion en grande quantité d’hydroquinone peut causer des tremblements, des vomissements, des convulsions, la dyspnée, la cyanose et le coma; des décès ont été signalés après l’ingestion de 3 000 à 12 000 mg d’hydroquinone contenue dans des révélateurs photographiques (Zeidman et Deuit, 1945; PISSC, 1994). L’exposition cutanée pendant 3 ans à > 5 p. 100 d’hydroquinone dans des crèmes éclaircissantes a provoqué l’ochronose et le milium colloïde pigmenté chez des Sud-Africaines (Findlay et al., 1975; Findlay et De Beer, 1980). Une étude sur 840 sujets volontaires de sexe masculin d’origines ethniques différentes a montré qu’à moins de 3 p. 100, l’hydroquinone provoquait des effets négligeables sur la peau des utilisateurs (Bentley-Phillips et Bayles, 1975). L’ochronose est rare en Amérique du Nord. L’abus d’utilisation de crèmes éclaircissantes et l’utilisation de produits avec des concentrations plus élevées que celles indiquées sur les étiquettes, d’agents blanchissants autres que l’hydroquinone, et l’utilisation d’antipaludiques sont quelques facteurs ayant entraîné de plus fortes incidences d’ochronose avant les changements réglementaires en Afrique (Levitt, 2006). Le CIRC (1999) est parvenu à la conclusion qu’il n’existe pas de preuves suffisantes de la cancérogénicité de l’hydroquinone chez l’humain. Dans le cadre d’une étude par cohorte, aucun changement proportionnel à la dose n’a été observé dans le taux de mortalité ou les cas de cancer (cancer des reins ou du foie, ou encore leucémie) chez des travailleurs des deux sexes exposés à une dose moyenne de 0,1 à 6,0 mg/m3 de poussière d’hydroquinone pendant 8 h (Piferet al., 1995). Dans une autre étude par cohorte, il pourrait exister un lien entre cinq cas de mélanome malin et l’exposition de lithographes à l’hydroquinone (Nielsen et al., 1996).