Rapport sur l'état des connaissances scientifiques Groupe des phtalates Esters phtaliques à chaîne courte
Acide benzènedicarboxylique-1,2 ester de diméthyle
(phtalate de diméthyle [DMP])
Numéro de registre du Chemical Abstracts Service
131-11-3
Environnement Canada
Santé Canada
Août 2015
Table des matières
- Sommaire
- 1. Introduction
- 2. Identité des substances
- 3. Propriétés physiques et chimiques
- 4. Sources
- 5. Utilisations
- 6. Rejets
- 7. Devenir et comportement dans l'environnement
- 8. Potentiel d'effets nocifs sur l'environnement
- 9. Potentiel d'effets nocifs pour la santé humaine
- 10. Références
- Annexe A : Données empiriques et modélisées de la biodégradation du DMP
- Annexe B : Données empiriques de la toxicité aquatique du DMP
- Annexe C : Estimations de la dose journalière admissible pour le groupement à chaîne courte
- Annexe D : Dérivation de l'absorption par voie alimentaire
- Annexe E : Estimations de l'exposition chronique par voie cutanée aux cosmétiques et produits de soins personnels
- Annexe F : Dérivation des absorptions quotidiennes de DMP à partir des données de biosurveillance MIREC-CD Plus
- Annexe G :. Description et application du système de notation Downs and Black et directives pour calculer la force de l'association statistique
Tableaux et figures
- Tableau 2-1. Identité de la substance – DMP
- Tableau 2-2. Identité de la substance – DEP
- Tableau 3-1. Propriétés physiques et chimiques expérimentales et prédites du DMP
- Tableau 7-1. Sommaire de la modélisation de la fugacité de niveau III (EQC, 2003) du DMP montrant le pourcentage de répartition dans chaque milieu pour trois scénarios de rejet
- Tableau 8-1. Résumé des entrées utilisées dans le cadre du scénario prudent de niveau 1 visant à estimer les concentrations aquatiques à la suite du rejet industriel de DMP dans des sites génériques d'application d'enduits
- Tableau 8-2. Entrées et résumé des résultats du modèle SCREEN3
- Tableau 8-3. Résumé des quotients de risque associés au DMP pour différents milieux et scénarios d'exposition
- Tableau 9-1. Concentrations de DMP dans l'air intérieur
- Tableau 9-2. Concentrations de DMP dans les poussières domestiques
- Tableau 9-3. Les concentrations de DMP mesurées dans les cosmétiques par Guo et Kannan 2013
- Tableau 9-4. Estimations de l'exposition cutanée chronique liée à l'utilisation de cosmétiques
- Tableau 9-5. Estimations de l'exposition cutanée aiguë liée à l'utilisation de cosmétiques
- Tableau 9-6. Absorption journalière (µg/kg/jour) par les mâles (méthode de correction par la créatinine) selon le NHANES (2009-2010)a
- Tableau 9-7. Absorption journalière (µg/kg/jour) par les femelles (méthode de correction par la créatinine) selon le NHANES (2009-2010)a
- Tableau 9-8. Absorption journalière (µg/kg/jour) par les enfants âgés de 2 à 3 ans (données provisoires), selon MIREC-CD Plusa
- Tableau 9-9. Résumé des métabolites de DMP et de DEP détectés dans l'urine suivant l'administration orale in vivo
- Tableau 9-10. Résumé des pourcentages d'absorption par voie cutanée et des taux de phtalates à chaîne courte obtenus in vivo
- Tableau 9-11. Sommaire des taux d'absorption cutanée des phtalates à chaîne courte obtenus in vitro (systèmes de cellules de diffusion)
- Tableau 9-12. Doses minimales avec effet (nocif) observé (DME[N]O) sur la progéniture mâle exposée au DMP pendant la gestation (mg/kg de p.c./jour)
- Tableau 9-13. Doses minimales avec effet (nocif) observé (DME[N]O) sur les mâles prépubères et pubertaires exposés au DMP et au DEP (mg/kg de p.c./jour)
- Tableau 9-14. Doses minimales avec effet observé (DMEO) sur les mâles adultes exposés au DEP (mg/kg de p.c./jour)
- Tableau 9-15. Sommaire des résultats pour les effets sur la reproduction ou le développement en fonction d'une exposition orale au DMP
- Tableau 9-16. Sommaire des résultats des études pour les effets sur la reproduction ou le développement en fonction d'une exposition orale au DMP
- Tableau 9-17. Sommaire des effets critiques après une exposition cutanée au DMP
- Tableau 9-18. Sommaire des marges d'exposition au DMP pour les sous-populations avec l'exposition la plus élevée
- Tableau A-1. Résumé des données empiriques clés sur la biodégradation du DMP
- Tableau A-2. Résumé des données modélisées clés sur la biodégradation ultime du DMP
- Tableau B-1. Valeur de toxicité des organismes
- Tableau C-1. Tendance centrale (limite supérieure des estimations de la dose quotidienne de DMP absorbée par la population générale. Estimation de l'apport (µg/kg/jour) de DMP par divers groupes d'âge
- Tableau C-2. Estimations probabilistes de l'exposition alimentaire au DMP (ng/kg/jour)
- Tableau E-1. Estimations de l'exposition par voie cutanée aux cosmétiques et produits de soins personnels
- Figure 1. Structure générale des ortho-phtalates
- Figure G-1. Répartition des notes de Downs and Black, en fonction du plan d'étude
Sommaire
Le ministre de l'Environnement et le ministre de la Santé ont préparé un rapport sur l'état des connaissances scientifiques concernant l'acide benzènedicarboxylique-1,2, ester de diméthyle (DMP), substance portant le numéro de registre du Chemical Abstracts Service (numéro CASNote de bas de page[1]) 131-11-3. Ce rapport vise à passer en revue les connaissances scientifiques actuelles sur le DMP afin de permettre au grand public de se pencher sur celles-ci, de les commenter et de fournir des renseignements supplémentaires à des fins d'examen, et ce, avant que des conclusions soient proposées dans une ébauche d'évaluation préalable qui sera publiée. Une approche pour l'évaluation des risques cumulatifs associés aux phtalates a aussi été proposée aux fins d'examen et de commentaires par le grand public et elle sera utilisée pour la rédaction de l'ébauche d'évaluation préalable.
Le DMP est un des 14 esters phtaliques (ou phtalates) qui doit faire l'objet d'une évaluation préalable dans le cadre de l'Initiative des groupes de substances du Plan de gestion des produits chimiques (PGPC). Les principaux critères de sélection pour ce groupe étaient fondés sur la possibilité d'effets préoccupants similaires sur la santé; pour certains phtalates, sur la possibilité d'effets préoccupants sur l'environnement; sur la possibilité d'exposition des consommateurs et des enfants; sur la possibilité de tirer parti des activités internationales et de les harmoniser; et sur la possibilité de gains d'efficacité en matière d'évaluation et de gestion des risques.
Bien qu'un grand nombre de phtalates présentent des caractéristiques structurales communes et des utilisations fonctionnelles semblables, les différences quant aux risques possibles sur la santé, ainsi qu'à leur devenir et à leur comportement dans l'environnement ont été prises en considération dans l'établissement des sous-groupes. Du point de vue des dangers pour la santé, les sous-groupes se fondent d'abord et avant tout sur une analyse des rapports structure-activité (RSA). Cette analyse repose sur des études ayant trait à des événements importants touchant le mode d'action lié à l'insuffisance androgénique causée par les phtalates durant le développement de l'appareil reproducteur masculin chez les rats. Les effets des esters phtaliques sur ces événements importants semblent dépendre de la structure et être fortement associés à la longueur et à la nature de la chaîne alkyle. L'approche qui a permis de diviser les substances faisant partie du groupe des phtalates en trois sous-groupes en fonction des dangers qu'ils posent pour la santé est présentée plus en détail dans le document préparé par Santé Canada (2015a). Du point de vue écologique, l'établissement des sous-groupes était principalement fondé sur les différences dans le coefficient de partage octanol-eau (log Koe) et l'hydrosolubilité, ainsi que sur leurs répercussions sur la bioaccumulation et l'écotoxicité. D'autres points de vue portant sur une proposition d'approche d'évaluation des risques cumulés pour certains phtalates sont présentés dans un document d'accompagnement (Environnement Canada et Santé Canada, 2015a). Le DMP appartient au sous-groupe des esters phtaliques à chaîne courte.
Le DMP n'est pas présent dans l'environnement à l'état naturel. Au cours de l'année civile 2012, le DMP a été importé au Canada dans des quantités inférieures à 100 000 kg, et les applications déclarées de la substance comprennent la production de peintures, de revêtements, d'adhésifs et de produits d'étanchéité (Environnement Canada, 2014a). Le DMP a également des applications comme plastifiant dans la fabrication de matériaux de construction et la production des produits de soins personnelsNote de bas de page[2] (Environnement Canada, 2014a).
Les rejets de DMP sont plus susceptibles de se produire dans l'air et dans l'eau. Lorsqu'il est rejeté dans l'air, le DMP devrait se répartir principalement dans le sol. Lorsqu'il est rejeté dans l'eau ou le sol, il devrait rester en majeure partie dans ces milieux respectifs. Les données limitées sur la concentration environnementale dans les milieux canadiens indiquent des concentrations maximales, qui ne sont toutefois pas nécessairement représentatives, de 5,46 ng/l dans l'eau de surface, de 2 600 ng/l dans l'effluent des usines de traitement des eaux usées municipales et de 853 ng/g dans les sédiments. Les données de surveillance canadiennes existantes pour le DMP dans l'air et dans le sol révèlent que les concentrations sont toutes inférieures aux seuils de détection. Le DMP est persistant dans l'air, mais pas dans l'eau, le sol ou les sédiments. Le DMP a un très faible potentiel de bioaccumulation dans les organismes aquatiques. Les données expérimentales sur la toxicité aiguë et chronique indiquent toutes que le DMP ne représente pas un risque élevé pour les organismes aquatiques. Des scénarios d'exposition ont été élaborés afin d'estimer les rejets de DMP dans l'air et dans l'eau en provenance des installations où il est utilisé comme additif de revêtement. Des données de surveillance ont également été utilisées pour estimer les concentrations d'exposition potentielles. Les quotients de risque (QR) calculés pour les scénarios d'exposition dans l'air et dans l'eau montrent que les effets néfastes pour les organismes aquatiques et terrestres sont peu probables.
En ce qui concerne la santé humaine, on s'attend à ce que la principale source d'exposition au DMP pour la population générale soit le lait maternel et la nourriture, en plus de l'air intérieur et de la poussière qui agissent comme facteurs contributif. L'exposition cutanée et par inhalation (aérosol) à des cosmétiques et à des produits de soins personnels a également été évaluée pour les adultes (plus de 20 ans) et les enfants en bas âge (de 0 à 6 mois). La base de données des effets sur la santé des esters phtaliques à chaîne courte ne présente aucune preuve d'effets nocifs sur le développement, les organes reproducteurs ou les organes des autres systèmes par suite d'une exposition au DMP. Les renseignements existants montrent que les niveaux critiques sélectionnés pour la caractérisation du risque étaient principalement associés aux doses sans effet observé (DSEO) et à la dose minimale avec effet observé (DMEO) fondée sur les changements légers dans le poids du cerveau après une exposition cutanée chronique.
La comparaison de l'exposition estimée au DMP par l'environnement, les aliments et les produits de soins personnels de même que les niveaux de biosurveillance pour tous les groupes d'âge selon les seuils d'effets critiques appropriés, ont révélé des marges d'exposition jugées adéquates pour que les incertitudes relevées dans les bases de données sur l'exposition et les effets sur la santé soient dissipées.
1. Introduction
Conformément aux articles 68 et 74 de la Loi canadienne sur la protection de l'environnement (1999) [LCPE (1999)] (Canada, 1999), le ministre de l'Environnement et le ministre de la Santé évaluent des substances pour déterminer si elles présentent ou sont susceptibles de présenter un risque pour l'environnement ou pour la santé humaine.
L'Initiative des groupes de substances constitue un volet clé du Plan de gestion des produits chimiques (PGPC) du gouvernement du Canada. Le groupe des phtalates comprend 14 substances dont l'évaluation a été jugée essentielle, car elles respectent les critères de catégorisation définis à l'article 73 de la LCPE (1999) ou encore, elles constituent des substances prioritaires en raison des préoccupations que suscitent leurs effets sur la santé humaine (Environnement Canada, Santé Canada, 2013). Certaines substances appartenant à ce groupe ont été jugées préoccupantes par d'autres autorités en raison de leurs effets potentiels sur la reproduction et le développement chez les humains. De plus, certains phtalates sont susceptibles d'avoir des effets écologiques préoccupants. Une étude réalisée dans le cadre de la première phase de la mise à jour de la Liste intérieure des substances (LIS) a révélé qu'un sous-ensemble de phtalates présentait un vaste éventail d'applications commerciales qui pourraient entraîner une exposition chez les humains, y compris les enfants (Environnement Canada, 2012). Le fait de se pencher sur ces substances en tant que groupe permet de tenir compte de leurs risques cumulés, lorsque cela est justifié.
Le présent rapport sur l'état des connaissances scientifiques (ECS) contient une synthèse et une évaluation des renseignements scientifiques actuels. Il servira de base à une ébauche d'évaluation préalable. Le gouvernement du Canada a élaboré un ensemble de rapports sur l'ECS visant le groupe des phtalates afin de permettre au grand public de formuler des commentaires sur une proposition d'approche d'évaluation des risques cumulés associés à certains phtalates (Environnement Canada et Santé Canada, 2015), et ce, avant que cette approche soit mise en œuvre en vue de rendre des conclusions sur les substances de ce groupe dans une ébauche de rapport d'évaluation préalable qui sera publié.
Le présent rapport sur l'ECS porte essentiellement sur l'acide benzènedicarboxique-1,2, ester de diméthyle ou DMP (noCAS Note de bas de page[3] 131-11-3). L'évaluation de cette substance est jugée prioritaire en vertu du paragraphe 73(1) de la LCPE (1999). Cette substance satisfait également aux critères de catégorisation relatifs à la persistance, mais pas à ceux se rapportant à la bioaccumulation ni à la toxicité intrinsèque pour les organismes non humains.
Bien que les phtalates présentent des caractéristiques structurales communes et des usages fonctionnels semblables, les différences quant aux risques possibles sur la santé, à leur devenir et à leur comportement dans l'environnement ont été prises en considération pour l'établissement des sous-groupes. Du point de vue des dangers pour la santé, les sous-groupes se fondent d'abord et avant tout sur une analyse des rapports structure-activité (RSA). Cette analyse repose sur des études ayant trait à des événements importants touchant le mode d'action lié à l'insuffisance androgénique causée par les phtalates durant le développement de l'appareil reproducteur masculin chez les rats. Les effets des esters phtaliques sur ces événements importants semblent dépendre de la structure et être fortement associés à la longueur et à la nature de la chaîne alkyle (Santé Canada, 2015a). L'approche qui a permis de diviser les substances faisant partie du groupe des phtalates en trois sous-groupes en fonction des dangers qu'ils posent pour la santé est présentée plus en détail dans le document préparé par Santé Canada (2015a). Du point de vue écologique, l'établissement des sous-groupes était principalement fondé sur les différences dans le coefficient de partage octanol-eau (log Koe) et l'hydrosolubilité, ainsi que sur leurs répercussions sur la bioaccumulation et l'écotoxicité (Environnement Canada et Santé Canada, 2015a).
Le DMP appartient au sous-groupe des esters phtaliques à chaîne courte (Santé Canada, 2015a).
Ce rapport sur l'ECS évalue les renseignements sur les propriétés chimiques, le devenir dans l'environnement, les dangers, les usages et l'exposition, y compris les renseignements additionnels présentés par les intervenants. Des données pertinentes ont été recueillies jusqu'en octobre 2014 pour le volet écologique, et jusqu'en août 2014 pour le volet sanitaire de l'évaluation. Lorsqu'elle était disponible et pertinente, l'information présentée dans les évaluations réalisées par d'autres autorités a été prise en considération.
Ce rapport sur l'ECS ne constitue pas un examen exhaustif ni critique de toutes les données disponibles. Il fait plutôt état des études les plus importantes et fiables sur le sujet, ainsi que des sources de données les plus pertinentes pour appuyer l'élaboration ultérieure d'une évaluation préalable.
Les volets de ce rapport portant sur l'écologie et la santé humaine ont fait l'objet d'une évaluation écrite par des pairs ou d'une consultation de ces derniers. Les chercheurs suivants ont fourni des commentaires sur les volets techniques relatifs à l'environnement : Frank Gobas (Frank Gobas Environmental Consulting), Chris Metcalfe (Ambient Environmental Consulting, Inc.), Thomas Parkerton (ExxonMobil Biomedical Sciences, Inc.) et Charles Staples (Assessment Technologies, Inc.). Les chercheurs suivants ont fourni des commentaires sur les volets techniques relatifs à la santé humaine : Jack Dempsey (EnRisks), Michael Jayjock (The Lifeline Group) et Bernard Gadagbui (Toxicology Excellence for Risk Assessment). Bien que des commentaires externes aient été pris en considération, Santé Canada et Environnement Canada assument la responsabilité du contenu et des résultats finaux de ce rapport.
2. Identité des substances
Les esters phtaliques sont synthétisés par l'estérification de l'anhydride phtalique (anhydride de l'acide 1,2-benzènedicarboxylique, no CAS 85-44-9) avec divers alcools (ACC, 2001). Les esters phtaliques produits sont des diesters de l'acide benzènedicarboxylique composés d'un cycle benzénique avec deux groupes ester à chaîne latérale. Les phtalates ont la structure générale présentée à la figure 1, où R1 et R2 représentent des chaînes ester latérales dont la longueur et la structure peuvent varier (ACC, 2001). Les groupes ester latéraux peuvent être identiques ou différents, et la nature des groupes latéraux détermine l'identité du phtalate particulier de même que ses propriétés physiques et toxicologiques. Toutes les substances appartenant au groupe des phtalates sont des ortho-phtalates (o-phtalates) dont les chaînes ester latérales sont adjacentes l'une de l'autre aux positions 1 et 2 du cycle benzénique (voir la figure 1; US EPA, 2012).
La formule développée des esters phtaliques est tirée de la composition isomérique de l'alcool utilisé dans leur fabrication (Parkerton and Winkelmann, 2004). Les phtalates de dialkylés ont des groupes ester à chaîne alkyle ramifiée ou linéaire contenant de un à treize carbones, alors que les phtalates de benzyle contiennent généralement, à titre de groupe ester, un groupe phénylméthyle et une chaîne alkyle, et les phtalates de cyclohexyle, un cycle benzénique saturé (Parkerton and Winkelmann, 2004).
Figure 1. Structure générale des ortho-phtalates

Longue description pour la figure 1
Représentation bidimensionnelle de la structure moléculaire générale des phtalates d'intérêt.
La figure comporte deux éléments :
1) La structure moléculaire générale des phtalates d'intérêt est présentée à gauche. La structure moléculaire générale consiste en un cycle benzénique avec substitutions d'esters en positions 1 et 2. Les chaînes sur les liens esters sont représentées par les lettres « R1 » et « R2 ».
2) La définition des groupes R est indiquée à la droite de la figure. R1 et R2 peuvent être des chaînes alkyles saturées, linéaires ou ramifiées. R1 et R2 peuvent également être un groupement phényle ou un cycle cyclohexyle.
Le phtalate de diméthyle (DMP) est un des 14 esters phtaliques du groupe des phtalates. Des renseignements à propos de la structure et de l'identité chimiques sont fournis au tableau 2-1. Le DMP, qui a un groupement méthyle dans chaque chaîne ester latérale, se classe dans le sous-groupe à chaîne courte. Le DMP est une substance chimique organique définie.
| No CAS Acronyme |
Nom LIS et nom commun |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 131-11-3 DMP |
Acide benzènedicarboxylique-1,2, ester de diméthyle Phtalate de diméthyle |
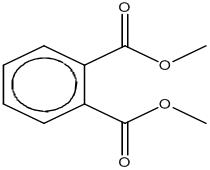 C10H10O4 |
194,19 |
2.1 Sélection des analogues pour l'évaluation de l'impact écologique
Différentes organisations, comme l'Organisation de coopération et de développement économiques (OCDE), ont préparé des directives sur l'utilisation d'une approche de lecture croisée et des modèles de relations quantitatives structure-activité, ou QSAR, pour combler le manque des données. Ces méthodes ont été appliquées dans le cadre de différents programmes d'application de la réglementation, y compris le Programme des substances existantes de l'Union européenne (UE). Dans cette évaluation, une approche de lecture croisée ayant recours aux données des analogues et aux résultats des modèles QSAR, si nécessaire, a été utilisée pour documenter les évaluations de l'impact écologique et sur la santé humaine.
Pour l'évaluation de l'impact écologique, un analogue a été sélectionné parce qu'il est structuralement semblable et/ou fonctionnellement semblable à la substance de ce sous-groupe (p. ex., en fonction des propriétés physiques et chimiques, de la toxicocinétique) et qu'il présentait des données empiriques pertinentes pouvant être utilisées pour la lecture croisée visant à combler le manque des données. L'analogue sélectionné, le phtalate de diéthyle (DEP), a été spécifiquement choisi pour combler le manque de données à propos de la toxicité pour le sol et les organismes vivant dans les sédiments et de la toxicité pour les organismes terrestres liée à l'inhalation. Ce choix d'analogue est justifiable parce que les valeurs de propriété physique et chimique du DEP sont comparables à celles du DMP (c.-à-dire, valeurs du log Koe de 1,47 pour le DMP et de 2,51 pour le DEP), et les deux substances ont le même mode d'action non spécifique (narcotique). D'autres renseignements à propos de la justification écologique de la sélection de cet analogue sont fournis dans une annexe de l'approche visant à prendre en considération les risques cumulés des phtalates (Environnement Canada et Santé Canada, 2015). L'identité de la substance DEP est indiquée ci-dessous.
| No CAS Acronyme |
Nom LIS et nom commun |
Structure chimique et formule moléculaire | Masse moléculaire (g/mol) |
|---|---|---|---|
| 84-66-2 DEP |
Acide benzènedicarboxylique-1,2, ester de diéthyle Phtalate de diéthyle |
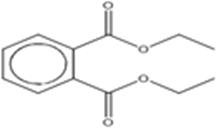 C12H14O4 |
222,24 |
L'applicabilité des modèles QSAR a été déterminée au cas par cas.
Dans le cas de l'évaluation des effets sur la santé humaine, le même analogue (DEP) a été sélectionné pour la lecture croisée. Les renseignements sur la sélection de cet analogue se trouvent dans l'étude de Santé Canada (2015a).
3. Propriétés physiques et chimiques
Les propriétés physiques et chimiques déterminent les caractéristiques globales d'une substance et sont utilisées pour établir si une substance donnée convient à un type d'application particulier. Ces propriétés jouent un rôle clé dans la détermination du devenir des substances dans l'environnement (y compris leur potentiel de transport sur une grande distance), ainsi que dans leur toxicité pour les organismes humains et non humains.
Un résumé des propriétés physiques et chimiques du DMP est présenté dans le tableau 3-1. Lorsque les renseignements expérimentaux sur une propriété étaient limités ou inexistants, les données des modèles QSAR ont été utilisées pour générer les valeurs prédites pour la substance. On a examiné des études expérimentales clés d'un œil critique afin d'en évaluer la validité, et ces évaluations (sommaires de rigueur d'étude) sont disponibles dans un document d'Environnement Canada (2015).
| Propriété | Valeur ou plageNote de bas de page[a]Tableau 3-1[a] | Type de données | Référence clé |
|---|---|---|---|
| État physique | Liquide (huileux, à la température ambiante) |
Expérimentales | Commission européenne, 2000 |
| Point de fusion (°C) | 5,5Note de bas de page Tableau 3-1[f] | Expérimentales | Haynes et Lide, 2010 |
| Point d'ébullition (°C) | 283,7 (à 1 013 hPa) |
Expérimentales | Haynes et Lide, 2010 |
| Densité (kg/m3) | 1 190 | Expérimentales | Haynes et Lide, 2010 |
| Tension de vapeur (Pa) | 0,22 (1,65 x 10-3 mmHg) |
Expérimentales | Howard et al., 1985 |
| Tension de vapeur (Pa) | 0,24 (1,8 x 10-3 mmHg) |
Expérimentales | Stephenson et Malanowski, 1987 |
| Tension de vapeur (Pa) | 0,72 (5,4 x 10-3 mmHg) |
Expérimentales | Cowen et Baynes, 1980 |
| Tension de vapeur (Pa) | 0,411f | Expérimentales | Daubert et Danner, 1989 |
| Hydrosolubilité (mg/l) | 4 290Note de bas de page Tableau 3-1[d] | Expérimentales | Leyder et Boulanger, 1983 |
| Hydrosolubilité (mg/l) | 4 000f | Expérimentales | Yalkowsky et al., 2010 |
| Constante de la loi de Henry (Pa·m3/mol) | 2,27 × 10-2 | Modélisées | HENRYWIN, 2011 Estimation fondée sur les liaisons |
| Constante de la loi de Henry (Pa·m3/mol) | 6,23 × 10-3 | Modélisées | HENRYWIN, 2011 Estimation fondée sur les groupes |
| Constante de la loi de Henry (Pa·m3/mol) | 5,94 × 10-2 | Modélisées | HENRYWIN, 2011 Estimation fondée sur PV/HSNote de bas de page[b]Tableau 3-1[b] |
| Constante de la loi de Henry (Pa·m3/mol) | 1,99 × 10-2 | Modélisées | HENRYWIN, 2011 Estimation fondée sur PV/HSNote de bas de page[c]Tableau 3-1[c] |
| Log Koe (adimensionnel) | 1,60 | Expérimentales | Ellington et Floyd, 1996 |
| Log Koe (adimensionnel) | 1,47 | Expérimentales | Howard et al., 1985 |
| Log Koe (adimensionnel) | 1,61f | Expérimentales | Renberg et al. 1985 |
| Log Koe (adimensionnel) | 1,80Note de bas de page Tableau 3-1[e] | Expérimentales | Macintosh et al., 2006 |
| Log Koe (adimensionnel) | 1,53 | Expérimentales | Leyder et Boulanger, 1983 |
| Log Kco (adimensionnel) | 1,90 - 2,56 | Expérimentales | Banerjee et al., 1985 |
| Log Kco (adimensionnel) | 1,68 | Modélisées | Kocwin, 2010 (Estimation fondée sur le Koe) |
| Log Koa (adimensionnel) | 6,69 | Modélisées | Koawin, 2010 |
| Log Koa (adimensionnel) | 7,01 | Modélisées | Cousins et Mackay, 2000 |
Des modèles fondés sur les relations quantitatives structure-activité (QSAR) ont été utilisés afin de générer des données sur certaines des propriétés physiques et chimiques du DMP, notamment la constante de la loi de Henry. Ces modèles sont principalement fondés sur des méthodes d'addition de fragments, c'est-à-dire qu'ils additionnent les contributions des fragments sous-structuraux d'une molécule pour faire des prédictions concernant une propriété ou un indicateur de résultat. La plupart de ces modèles s'appuient sur la forme neutre d'un produit chimique comme donnée d'entrée, et cette approche convient aux phtalates puisqu'ils existent sous forme de substances neutres (non ionisées) dans l'environnement.
D'après les valeurs des propriétés physiochimiques expérimentales et modélisées, le DMP est un liquide huileux à la température ambiante et il possède une forte hydrosolubilité, une pression de vapeur modérée, un faible coefficient de partage octanol-eau (Koe) et un faible rapport de distribution carbone organique-eau (Kco).
4. Sources
Le DMP n'est pas présent dans l'environnement à l'état naturel. Dans certaines conditions, des phtalates de masse moléculaire élevée, lorsqu'ils sont métabolisés ou biodégradés, peuvent être une source de DMP dans l'environnement. L'étude de Hashizume et al. (2002) s'est penchée sur la biodégradation des phtalates dans l'eau de rivière, et par des microbes isolés de l'eau des rivières, et ont observé qu'à mesure que le DEP et le DEHP se dégradaient, du DMP était produit. Du DMP était également produit à partir du DBP dans la solution d'enzyme brute utilisée par les auteurs. Par contre, il est généralement reconnu que la déméthylation des chaînes alkyle pour dégrader les phtalates à chaîne longue en phtalates à chaîne courte n'est pas une voie de dégradation importante dans le milieu naturel.
Une enquête sur l'industrie, faite conformément à l'article 71 de la LCPE 1999, a été menée en 2013 afin d'obtenir des données sur les quantités commerciales des substances du groupe des phtalates au Canada (Canada, 2013). Les résultats de l'enquête sur l'industrie réalisée en 2012 en vertu de l'article 71 indiquent que le DMP a été importé au Canada en quantités allant de 10 000 à 100 000 kg en 2012 (Environnement Canada, 2014). En raison de la nature ciblée de l'enquête, il est possible que les quantités utilisées déclarées ne représentent pas toutes les utilisations au Canada.
Aux États-Unis, les volumes de production nationale combinés de DMP étaient déclarés par l'intermédiaire du Inventory Update Reporting (IUR) entre 1986 et 2002 (US EPA, 2014ab). D'après les renseignements non confidentiels, l'utilisation du DMP oscillait entre plus de 4 536 tonnes et 22 680 tonnes en 2002. En 2006, la plage rapportée était également de 4 536 tonnes à moins de 22 680 tonnes (US EPA, 2014ab).
Des volumes de production/d'utilisation de 10 000 à 100 000 tonnes par année ont été signalées par les inscrits en vertu de l'initiative REACH de l'Union européenne (Agence européenne des produits chimiques, 2014). De plus, on a établi que le DMP était un produit chimique à volume de production élevé en Europe (ESIS, 2014).
5. Utilisations
D’après les résultats d’une enquête sur le secteur réalisée conformément à l’article 71 de la LCPE 1999, le DMP a des applications dans la production de peintures, de revêtements, d’adhésifs et de scellants (Environnement Canada, 2014a). Il sert également de plastifiant dans la fabrication de matériaux de construction (Environnement Canada, 2014a). Selon les documents présentés en réaction à l’enquête relative à l’article 71, moins de 1 000 kg de DMP ont été utilisés au Canada en 2012.
Le DMP peut être utilisé en tant que solvant ou plastifiant pour des compositions de nitrate de cellulose, d'acétate de cellulose et d'acétobutyrate de cellulose (NICNAS, 2008). Il s'agit également d'un plastifiant pour les revêtements et les mélanges à mouler de cellulose, et on a déclaré l'avoir utilisé comme plastifiant auxiliaire pour les revêtements de surface (Valspar, 2011). Il peut également avoir des applications comme inhibiteur et stabilisateur dans le peroxyde (Cheminfo, 2013; Agence européenne des produits chimiques, 2014). Il se peut qu'il soit utilisé dans des explosifs ou en tant que produit chimique de laboratoire (Cheminfo, 2013; NICNAS, 2008; Agence européenne des produits chimiques, 2014).
Le DMP figure dans la Compilation of Ingredients Used in Cosmetics in the United States et est réputé pour avoir des utilisations en tant que solvant, plastifiant et ingrédient de parfum dans les cosmétiques (Cheminfo, 2013; Bailey, 2011). Plus particulièrement, il est possible que le DMP soit utilisé dans des crèmes, des parfums, des vernis à ongles, des déodorants, des poudres pour le visage et des fonds de teint, des savons de bain et des détergents, des lotions après-rasage, des laques pour les cheveux et des shampoings (Versar et SRC, 2011; Ash and Ash, 2003; Cheminfo, 2013). Parmi les produits de soins pour les cheveux contenant du DMP, on compte les laques (laques en aérosol), les produits capillaires, les vaporisateurs de colorant capillaire en aérosol, les revitalisants, les toniques, les cires, les gels coiffants, les produits de soins personnels/pour les cheveux et les produits de rinçage avec colorant (Comité d'experts du CIR, 2003; Liebert, 1985; Agence européenne des produits chimiques, 2014). Le DMP peut également être utilisé en tant que base de parfum pour les produits de nettoyage de la maison (NICNAS, 2008; Comité scientifique des produits de consommation, 2007).
Le DMP peut aussi être utilisé dans des peintures, des revêtements, des diluants, des enduits de décapant, des mastics, des plâtres, de l'argile à modeler, des peintures au doigt, des scellants, des polis, des mélanges de cire, des vernis et des adhésifs (NICNAS, 2008; Versar et SRC, 2011; Ash and Ash, 2003; Agence européenne des produits chimiques, 2014). De plus, on retrouve du DMP dans des peintures et des revêtements qui ne sont pas conçus pour des produits destinés aux enfants (US EPA IUR, 2014).
Pour ce qui est des articles fabriqués, le DMP peut être utilisé pour produire des articles/produits de mousse plastique, des produits de caoutchouc et de plastique (destinés aux enfants), des articles de papier, des articles de bois, des piles électriques, des accumulateurs, des appareils mécaniques et des articles électriques/électroniques (US EPA IUR, 2014; Agence européenne des produits chimiques, 2014). Le DMP a aussi des utilisations dans les tissus, les textiles et les vêtements (Agence européenne des produits chimiques, 2014). De plus, du DMP a été détecté dans des casques d'écoute ainsi que dans des jouets et produits pour enfants fabriqués avec de la mousse de plastique (Agence de protection environnementale du Danemark, 2006e, 2008d).
Dans le secteur alimentaire, le DMP est un solvant pour des adjuvants dans les polyesters à chaînes transversales en contact avec les aliments et un adhésif d'emballage alimentaire, en plus de se trouver dans les emballages alimentaires en acrylique (Ash and Ash, 2003). Aussi, le DMP peut avoir des applications dans la production de produits pharmaceutiques (Agence européenne des produits chimiques, 2014).
Le DMP peut également avoir des applications dans des insecticides et des pesticides (NICNAS, 2008; Ash and Ash, 2003; Versar et SRC, 2011). Le DMP est enregistré comme formulant dans des produits de lutte antiparasitaire enregistrés au Canada (courriel de janvier 2015 de l'ARLA, Santé Canada au Bureau d'évaluation du risque des substances existantes, Santé Canada, sans référence).
Finalement, le DMP peut être utilisé en tant qu'excipient dans des produits pharmaceutiques et figure dans la liste des ingrédients inactifs de la US Food and Drug Administration (FDA) (FDA, 2014). Le DMP ne figure pas dans la Base de données sur les produits pharmaceutiques, la base de données interne des ingrédients non médicinaux de la Direction des produits thérapeutiques ou la Base de données des produits de santé naturels homologués à titre d'ingrédient médicinal ou non médicinal présent dans des produits pharmaceutiques finaux, des médicaments vétérinaires ou des produits de santé naturelle au Canada (BDPP, 2014; BDIPSN, 2014; BDPSNH, 2014; courriel de septembre 2014 de la Direction des produits thérapeutiques, Santé Canada au Bureau de la gestion du risque, Santé Canada).
Le DMP figure sur la liste des ingrédients interdits et d'usage restreint (mieux connus sous le nom de Liste critique des ingrédients des cosmétiques ou simplement la Liste critique), un outil administratif que Santé Canada utilise pour communiquer aux fabricants et aux autres parties intéressées que certaines substances, lorsqu'elles sont présentes dans un produit cosmétique, peuvent contrevenir à l'interdiction générale se trouvant à l'article 16 de la Loi sur les aliments et drogues ou à une disposition du Règlement sur les cosmétiques (Santé Canada, 2011). Selon les avis présentés en vertu du Règlement sur les cosmétiques de Santé Canada, la présence du DMP a été déclarée dans trois produits, mais tous les avis ont été faits avant 2008 (courriel de septembre 2014 de la Direction de la Sécurité des produits de consommation [DSPC], Santé Canada au Bureau d'évaluation du risque des substances existantes, Santé Canada).
Finalement, on a signalé que le DMP est utilisé dans les emballages alimentaires, où il est un plastifiant dans la fabrication de réservoirs de fibre de verre destinés à contenir l'eau à des fins de nettoyage et de lavage des plantes alimentaires (courriel de septembre 2014 de la Direction des aliments, Santé Canada au Bureau de la gestion du risque, Santé Canada, sans référence).
6. Rejets
En réaction à l'enquête relative à l'article 71 pour 2012, une entreprise du secteur de la peinture et des revêtements a signalé des rejets de DMP de 2 kg dans l'air (Environnement Canada, 2014). La fabrication et l'utilisation de revêtements industriels et de matériaux d'étanchéité peuvent donner lieu à des rejets dans l'eau et, éventuellement, dans l'air, par la pulvérisation de revêtements. De nombreuses déclarations produites en vertu de l'article 71 indiquent qu'il n'y a pas de rejets, que les rejets sont indéterminés ou que des déchets sont transportés à des installations hors site aux fins d'élimination. Cependant, comme la majorité des entreprises ne semblent pas mesurer les rejets, ceux qui proviennent d'installations industrielles ne sont pas bien quantifiés. Il est possible que les rejets soient traités par des systèmes de traitement des eaux usées sur place ou hors site.Note de bas de page[4] En vertu du programme de l'Inventaire national de rejets de polluants (INRP), une entreprise de Toronto qui utilise des peintures et des revêtements a déclaré des rejets de DMP de 1 300 kg dans l'atmosphère en air 2013 (NPRI 1995-).
Compte tenu des utilisations du DMP énoncées ci-dessus, d'autres situations de rejets sont possibles. Par exemple, l'élimination des produits de soins personnels et des cosmétiques contenant du DMP dans des tuyaux d'évacuation entraînerait probablement des rejets dans les systèmes de traitement des eaux usées.
Des rejets de DMP pourraient se produire dans les effluents des systèmes de traitement des eaux usées sur place et hors site. Lors du traitement d'eaux usées contenant des phtalates, l'absorption et la biotransformation sont les processus clés de l'élimination/la dégradation responsables de la réduction des phtalates dans les effluents des systèmes de traitement. L'importance de l'absorption et, par conséquent, de l'élimination par sorption des boues, s'accroît avec l'augmentation de la masse moléculaire et du caractère lipophile de la substance (Clara et al., 2010). Comme le coefficient de partage octanol-eau (log Koe) du DMP est faible, on pourrait s'attendre à une absorption limitée par sorption des boues. De fait, dans l'un des systèmes de traitement des eaux usées inspectés (Clara et al., 2010), le taux d'absorption n'était que de 3,4 %. Le processus d'élimination clé du DMP, durant le traitement des eaux usées, est la biotransformation. Des études montrent que des taux d'élimination élevés (biotransformation) du DMP peuvent être atteints durant le traitement des eaux usées. Par exemple, selon une étude de l'efficacité des processus d'élimination dans des usines de traitement des eaux usées aux États-Unis (Deblonde et al., 2011), la concentration moyenne du DMP dans l'influent était de 1,5 µg/l, la concentration moyenne dans l'effluent était de 0,038 µg/l, et le taux d'élimination était de 97,5 %. Selon ces études, on peut donc s'attendre à de faible taux de rejets de DMP dans le plan d'eau récepteur en provenance de l'effluent du système de traitement des eaux usées.
D'autres rejets possibles de DMP pourraient découler du reconditionnement des conteneurs et des camions de transport, de la migration de produits de plastique ainsi que du lavage de planchers et de revêtements muraux contenant des phtalates. Le lessivage du DMP provenant de produits de plastique dans des sites d'enfouissement pourrait survenir, mais ce scénario n'a pas été évalué dans le présent rapport.
7. Devenir et comportement dans l'environnement
7.1 Distribution dans l'environnement
Le tableau 7-1 ci-dessous présente une synthèse du modèle de fugacité de niveau III, c'est-à-dire de la distribution masse-fraction du DMP selon les émissions constantes individuelles dans l'air, l'eau et le sol. Les résultats figurant dans le tableau 7-1 mettent en lumière les effets nets du partage chimique, du transport entre divers milieux et de la perte tant par le processus d'advection (hors de la région modélisée) que par celui de la dégradation ou de la transformation. Dans l'ensemble, les résultats de la modélisation de la fugacité de niveau III semblent indiquer que le DMP devrait se répartir principalement dans l'eau, le sol et l'air, selon le milieu dans lequel la substance est rejetée (tableau 7-1). La substance ne devrait pas se répartir considérablement dans le sédiment.
| Rejet de la substance dans : | Air (%) | Eau (%) | Sol (%) | Sédiments (%) |
|---|---|---|---|---|
| Air (100%) | 13,6 | 16,7 | 69,7 | négligeable |
| Eau (100%) | négligeable | 99,8 | négligeable | 0,2 |
| Sol (100%) | 0,2 | 11,1 | 88,7 | négligeable |
Lorsqu'il est rejeté dans l'air, le DMP devrait principalement se déposer au sol par l'entremise de retombées humides (69,7 %) et être présents en proportions moindres dans l'eau (16,7 %) et dans l'air (13,6 %). La demi-vie relativement longue du DMP dans l'air (9,32 jours) indique que le DMP rejeté dans l'air est susceptible d'être transporté sur de grandes distances (voir ci-dessous, sous-section 7.1.1) dans la phase gazeuse.
7.1.1 Potentiel de transport à grande distance
La demi-vie estimée du DMP dans l'air est de 9,32 jours (voir Persistance dans l'environnement, section 7.2). Cette demi-vie relativement longue, conjuguée à la répartition de la substance dans l'air lorsqu'elle est rejetée dans ce milieu (tableau 7-1), porte à croire que le DMP présente un potentiel de transport sur de grandes distances (PTGD) vers des régions éloignées de la source des rejets.
On a utilisé le modèle de transport et de persistance de niveau III (TaPL3, 2000) pour estimer la distance de transport caractéristique (DTC) du DMP, définie comme la distance maximale parcourue dans l'air par 63 % de la substance. Beyer et al. (2000) ont proposé que des DTC de plus de 2 000 km représentent un PTGD élevé, une distance comprise entre 700 et 2 000 km correspondrait à un PTGD modéré et une distance de moins de 700 km correspondrait à un faible PTGD. Selon l'estimation de la DTC de 668 km, le PTGD du DMP est jugé faible, à la limite de modéré. Ainsi, on ne prévoit pas que le DMP soit transporté dans l'atmosphère sur de grandes distances de la source d'émission.
Le modèle de dépistage des polluants organiques persistants (POP) de l'OCDE peut également être utilisé pour identifier les produits chimiques à fort potentiel de persistance et de transport sur de grandes distances (Scheringer et al., 2006). Le modèle de l'OCDE est un modèle mondial qui compartimente la Terre en air, eau et sol. Ce modèle est « axé sur le transport » plutôt que sur une « cible », car il établit simplement la DTC sans préciser l'endroit où une substance peut être transportée (Fenner et al., 2005). Klasmeier et al., (2006) ont laissé entendre qu'un seuil de 5 098 km, fondé sur l'estimation de la DTC du modèle pour le PCB-180, permettrait d'identifier des substances ayant un fort potentiel de transport sur de grandes distances. On sait de façon empirique que l'on trouve du PCB-180 dans des régions éloignées. La DTC calculée pour le DMP à l'aide du modèle de l'OCDE est de 1 670 km, ce qui indique que le DMP présente un certain potentiel de transport dans l'air, même s'il se situe sous la limite suggérée pour les polluants mondiaux par Klasmeier et al., (2006). Le modèle de dépistage des POP de l'OCDE permet également de calculer l'efficacité du transfert (ET), qui correspond au pourcentage du flux des émissions vers l'atmosphère déposé à la surface (eau et sol) dans une région éloignée (% ET = D/E × 100, où E est le flux des émissions vers l'atmosphère et D, le flux du dépôt sur les milieux en surface dans une région cible). L'ET calculée pour le DMP était de 4,75 %, ce qui est supérieur à la limite de 2,248 % (PCB-28) établie pour les substances de référence du modèle dont on sait de manière empirique qu'elles sont déposées. Une ET élevée signifie que le DMP présente un potentiel élevé de se déposer de l'air à l'eau ou au sol dans des régions éloignées de la source des rejets. Ce résultat est conforme à la modélisation de la fugacité de niveau III (EQC, 2003) qui prévoit qu'environ 86 % du DMP rejeté dans l'air seront ensuite répartis dans l'eau et le sol (voir tableau 7-1).
En outre, les valeurs log Koa et log Kaemodélisées pour le DMP, soit 6,69 (KOAWIN, 2010) et -5,1 (selon HENRYWIN, 2011), respectivement, portent également à croire que le DMP présente un faible potentiel de contamination de l'Arctique (PCA) s'il est examiné à l'aide des parcelles de partage chimique décrites par Wania (2003, 2006).
Les concentrations de DMP mesurées dans le biote de la baie d'Hudson (Morin, 2003) ainsi que dans l'air et l'eau de l'Arctique norvégien laissent entendre que la possibilité de transport à grande distance des DMP existe (voir ci-dessous, sous-section 9.1).
7.2 Persistance dans l'environnement
Le DMP est persistant dans l'air, mais il ne l'est pas dans l'eau, le sol et les sédiments. La tension de vapeur modérée et le coefficient de partage à l'équilibre (PE) du DMP laissent croire qu'un pourcentage significatif de DMP rejeté sera réparti dans l'air. L'hydrosolubilité relativement élevée du DMP, comparativement aux phtalates à chaîne moyenne et à longue chaîne, et le coefficient PE indiquent que le DMP rejeté dans l'eau demeurera en grande partie dans ce milieu.
Quelques mécanismes de biodégradation des phtalates ont été proposés, dont la déestérification et la déméthylation. Les mécanismes semblent liés à l'organisme précis qui est présent. Par exemple, Babu et Wu (2010) ont constaté que les mécanismes de dégradation dans les cyanobactéries diffèrent de ceux dans les microbes dans le sol. Une discussion approfondie des mécanismes de biodégradation pour les phtalates se trouve sur un document d'Environnement Canada (2015a).
7.2.1 Dégradation abiotique
Selon les résultats de la modélisation, le DMP est persistant dans l'air, avec une demi-vie prévue de 9,32 jours pour l'oxydation atmosphérique (AOPWIN, 2010).
La demi-vie dans l'environnement pour l'hydrolyse du DMP est de 2,8 ans (HYDROWIN, 2008) à un pH de 7. On peut conclure que l'hydrolyse dans l'environnement est peu susceptible de constituer un mécanisme de dégradation important pour le DMP dans des conditions environnementales ordinaires. Il faut cependant souligner que le DMP est hydrolysé rapidement au sein d'organismes (Lake et al. 1977; Rowland et al. 1977, White et al. 1980).
7.2.2 Biodégradation
Des données empiriques concernant la biodégradation du DMP sont présentées à l'annexe A. Des études ont révélé que les phtalates sont biodégradés par les bactéries, les champignons et les algues (Zeng et al. 2004).
La biodégradabilité immédiate du DMP a été déterminée par un test similaire à la technique de dépistage dans un flacon de culture statique de Bunch et Chambers (1967), utilisant une eau de dilution avec demande biochimique d'oxygène (BOD) comme milieu synthétique. Dans cette étude (Tabak et al., 1981), les auteurs ont utilisé la chromatographie gazeuse (CG) ainsi que les techniques d'analyse du carbone organique dissous (COD) et du carbone organique total (COT) pour déterminer l'étendue de la biodégradation. Ils ont observé une biodégradation complète (100 %) du DMP après 7 jours dans les trois sous-cultures et pour les deux concentrations de DMP analysées (5 et 10 mg/l).
Les résultats de test de biodégradation du DMP dans des eaux fluviales sont partagés. Furtmann (1994) signale que le DMP présent dans des échantillons prélevés dans le Rhin et la rivière Emscher, en Allemagne, ont fait l'objet d'une biodégradation primaire rapide à une température de 20 °C. À 4 °C, la dégradation a été retardée de trois à quatre jours. L'ajout d'azoture de sodium (un poison bactériostatique pour la cytochrome oxydase dans les mitochondries) a eu pour effet d'interrompre les processus de dégradation. Hashizume et al. (2002), cependant, ont obtenu des résultats quelque peu différents lors d'une étude de la biodégradation des phtalates, dont le DMP, dans des eaux de surface de rivières situées dans des régions urbaines du Japon. Ils ont constaté des dégradations du DMP de 49,3 % et de 100 % après 7 jours dans des échantillons de la rivière Tempaku prélevés à deux endroits différents, et ont constaté que les isolats des eaux de rivière ne dégradaient aucunement le DMP en 7 jours. La biodégradation dans les eaux de surface peut varier d'un plan d'eau à l'autre pour une même substance, en partie en raison des différences de concentrations de matière en suspension (Banerjee et al., 1984). Cette variation pourrait également être due aux différences d'efficacité de l'inoculum. Il est peu probable que les différences de concentrations de matière en suspension produisent un effet sur la biodégradation du DMP dans l'eau de surface, car le coefficient de partage carbone organique-eau (Kco) du DMP est faible et parce que la substance ne devrait pas s'agglomérer avec la matière en suspension de façon significative.
Des demi-vies relativement courtes (de 1,9 à 2,5 jours) ont été signalées pour le DMP avec des organismes adaptés au sédiment/à l'eau (Kickham et al., 2012; Sugatt et al., 1984), mais des périodes de dégradation plus longues ont été signalées pour le DMP dans les sédiments marins (11,8 jours) (Peng et Li, 2012).
Les données concernant la biodégradation du DMP dans le sol dans des conditions aérobies indiquent que la bactérie Pseudomonas fluorescens FS1 a un effet manifeste sur les vitesses de biodégradation; la demi-vie du DMP varie entre 6 et 10 heures (Zeng et al., 2004). Wang et al., (2004) ont constaté que le DMP se dégradait rapidement dans le sol bioaugmenté avec de la boue activée acclimatée, et qu'il affichait une demi-vie de 2,29 jours et une élimination complète (100 %) en moins de 15 jours. Ce n'est pas explicité dans ces études, mais les demi-vies et la vitesse d'élimination citées sont probablement celles de la dégradation primaire.
Wang et al., (1996) ont constaté que l'utilisation de boues d'épuration activées acclimatées avait entraîné l'élimination rapide du DMP, avec une demi-vie de 21 heures. Lors d'un essai de dégagement de CO2 par agitation en flacon, Sugatt et al., (1984) ont constaté une biodégradation de 86 % après 28 jours, ce qui indique que le DMP peut être biodégradé rapidement. Les auteurs de l'étude ont également observé une biodégradation primaire supérieure à 99 % et une demi-vie de 1,9 jour. L'extrapolation des résultats d'un tel essai à des systèmes d'eau naturelle requiert la prise en compte de facteurs comme l'effet des conditions environnementales sur le processus d'acclimatation.
Babu et Wu (2010) ont constaté que certains phtalates, dont le DMP, stimulent la croissance de la cyanobactérie Anabaena flos-aquae. Les auteurs indiquent que, comparativement aux algues vertes étudiées par Hai et Yun-zia (1998), la cyanobactérie évaluée dans leur étude a grandement accéléré le processus de biodégradation du DMP.
La cinétique de la biodégradation du DMP a été évaluée à l'aide de la bactérie Pseudomonas fluorescens FS1 et des boues activées dans une usine pétrochimique (Zeng et al., 2004). Les auteurs ont constaté que la biodégradation était conforme à la cinétique de premier ordre et que la demi-vie de la biodégradation était de 6,38 heures à une concentration initiale de 100 mg/l et à une température comprise entre 20 et 35 °C. Ils ont également constaté un ralentissement considérable de la vitesse de la biodégradation à des températures plus basses (p. ex., 10 °C) et à des températures au-dessus de 35 °C. Battersby et Wilson (1989) ont étudié le potentiel final de dégradation de 77 produits chimiques organiques, dont le DMP, avec des boues digérées par voie anaérobie provenant du Royaume-Uni. La dégradation a été évaluée du point de vue de la production de gaz nette (PGN) (CH4 et CO2), exprimée en pourcentage de la production de gaz théorique (PGTh). La mesure de la PGN constitue une évaluation du potentiel de biodégradation anaérobie dans des conditions méthanogènes. Les auteurs ont observé que, après une période de latence (adaptation) de 16 jours, la PGN du DMP était de 41 ± 8,3 % de la PGTh, ce qui signifie que le DMP sera probablement biodégradé dans un milieu de digestion anaérobie. Wang et al., (2000) ont également étudié la biodégradation du DMP dans des conditions anaérobies et ont observé une dégradation rapide du DMP (une élimination supérieure à 90 % en moins de 4 jours).
Même s'il existe des preuves de la biodégradation rapide du DMP, des questions demeurent concernant la minéralisation complète de certains esters phtaliques dialcoylés (DPE) dans l'environnement, et ce, principalement parce que les recherches ont été limitées à la réduction de la concentration chimique initiale et ne portaient pas sur la minéralisation complète des esters phtaliques dialcoylés.
Les données empiriques sur la biodégradation, qu'il s'agisse de la biodégradation immédiate ou d'autres essais, montrent que la biodégradation du DMP varie de 0 à 100 % au cours d'un certain nombre d'heures. Les données empiriques sont résumées à l'annexe A. Le poids des preuves expérimentales et modélisées indique que le DMP est facilement dégradable.
7.2.3 Métabolites
McConnell (2007) a étudié la présence, la répartition et le potentiel de bioaccumulation des esters phtaliques monoalkyles (MPE) dans les organismes des réseaux trophiques marins. Une étude sur le terrain a été menée dans la baie de False Creek, à Vancouver; des sédiments, de l'eau de mer et sept organismes ont été recueillis. Les concentrations de MPE (200 µg/kg) les plus élevées ont été observées pour les phtalates de mono-n-butyle (MnBP) chez les moules. Les MPE ne semblaient pas bioamplifier les réseaux trophiques marins. On pourrait conclure que les MPE sont éliminés assez rapidement, peut-être à cause de l'échange d'eau par les branchies ou d'une transformation métabolique. L'étude de McConnell (2007) porte aussi à croire que la principale source de MPE dans l'environnement aquatique est l'absorption alimentaire de DPE et la métabolisation subséquente dans le biote, mais ce scénario est moins probable avec le DMP en raison de l'exposition alimentaire réduite à cette substance comparativement à d'autres phtalates dont le log KoeS plus élevé.
7.3 Potentiel de bioaccumulation
Les facteurs de bioconcentration (FBC) et de bioaccumulation (FBA) pour le DMP sont similaires et se situent généralement dans la portion inférieure de la plage des facteurs de bioaccumulation pour des substances organiques définies. Comme le log Koe du DMP est faible, une accumulation significative dans les tissus est peu probable. Cependant, les facteurs de bioconcentration dans les poissons sont plus bas que prévu (lorsqu'on tient compte du faible log Koe), ce qui est probablement lié à la grande capacité de métabolisation du DMP par ces espèces (van Wezel et al., 2000). Le log Koe peu élevé signifie également que le DMP possède un faible potentiel de migration de l'eau vers les tissus adipeux (p. ex., le foie) des organismes aquatiques.
7.3.1 Facteur de bioconcentration (FBC)
Il n'existe pas beaucoup de données sur la bioconcentration du DMP. Dans Barrows et al. 1980, un BCF de 57 a été signalé pour le crapet arlequin. Bien que la période d'exposition était de 28 jours, l'équilibre a été obtenu au bout de 7 jours.
La fiabilité de certaines études de FBC est douteuse. Par exemple, Wofford et al., (1981) font part d'un FBC de 6,0 pour le mené tête-de-mouton, mais la période d'exposition n'était que de 24 heures et le tissu pris en compte pour la bioaccumulation n'est pas mentionné.
Un FBC maximal de 162 l/kg a été atteint pour l'algue Chlorella pyrenoidosa en 24 heures (Yan et al., 1995). Les algues ont été cultivées à 24 °C dans des flacons de 100 ml contenant 25 ml d'une solution de milieu de culture avec phtalates, et la concentration de DMP mise à l'essai était de 100 mg/l. La biodégradation du DMP a eu une incidence sur les taux de bioconcentration, tandis que la densité des cellules algaires et le rythme de croissance des cellules ont eu une incidence sur la biodégradation du DMP. La fiabilité de cette étude est douteuse, car ni la source ni le degré de pureté du DMP utilisé n'ont été mentionnés.
Les données concernant la bioconcentration du DMP dans des organismes aquatiques sont présentées dans un document d'Environnement Canada (2015a).
7.3.2 Facteur de bioaccumulation (FBA)
Les données expérimentales sur le FBA indiquent que le DMP possède un potentiel de bioaccumulation très faible. Dans une étude réalisée par Ge et al. (2011), des tilapias (Oreochromis spp.) ont reçu une dose unique de 20 mg de DMP par kg de poids corporel par voie orale pour que l'on évalue l'absorption et les résidus dans les tissus à deux températures d'eau différentes (18 et 28 °C). Les concentrations de DMP dans les divers tissus ont été indiquées. On a calculé les facteurs de bioaccumulation (Intrinsik, 2013) en divisant les concentrations dans les tissus par la dose administrée (20 mg/kg). Dans l'étude, les concentrations ont été mesurées à différents intervalles de temps, mais, aux fins du calcul des FBA, ce sont les concentrations mesurées lors du dernier échantillonnage (360 h) qui ont été utilisées. Les FBA calculés dans l'étude pour chacun des types de tissus étaient tous inférieurs à 1, ce qui semblerait indiquer un potentiel d'accumulation limité.
Selon les études sur le terrain, le DMP a un potentiel de bioaccumulation plus élevé que son log Koe semble indiquer. Par exemple, le FBA estimé pour le chabot (exprimé en par rapport à la teneur en lipides), si on se base sur un log Koe de 1,78, est de 70,4, alors que le FBA observé (exprimé par rapport à la teneur en lipides) est de 19 000 (Gobas et al., 2003). Le FBA élevé du DMP pourrait s'expliquer par le grand déséquilibre entre les sédiments et l'eau surjacente; le contact entre les organismes et les sédiments (p. ex., les chabots qui s'enfouissent dans les sédiments) pourrait élever leur charge corporelle de DMP au-delà du taux d'absorption dans l'eau surjacente. De plus, la capacité d'absorption par les branchies pourrait être plus élevée que ce que prédit le modèle, ou les taux métaboliques et les poids lipidiques pourraient être très différents de ceux du modèle.
7.3.3 Facteur d'accumulation biote-sédiments (FABS) et facteur d'accumulation biote-air (FABA)
Le FABS est un paramètre qui décrit la bioaccumulation de composés associés aux sédiments dans les tissus de récepteurs écologiques (Burkhard, 2009). Étant donné les capacités d'absorption différentes des lipides et du carbone organique, le point d'équilibre est représenté par une valeur de trois, puisque la capacité d'absorption du carbone organique est 0,35 fois celle de l'octanol (lipides). Un FABS supérieur à trois indique par conséquent une concentration chimique plus grande dans le biote que dans les sédiments (Morin, 2003). Par ailleurs, l'American Society for Testing and Materials ([ASTM], 1997) recommande un seuil de 1,7 pour représenter les conditions d'équilibre. Un FABS dépassant des valeurs approximatives de 1,7 à 3 (sur une base normalisée) semble indiquer que la bioamplification augmente et que les concentrations chimiques des organismes se situent au-delà des conditions d'équilibre (un processus de bioaccumulation se produit).
Dans le cadre d'un examen de la bioaccumulation des esters phtaliques dans les réseaux trophiques marins, Gobas et al. (2003) décrivent le déséquilibre qui se produit à des degrés variables pour les esters phtaliques entre l'eau interstitielle des sédiments et l'eau surjacente. Ils ont constaté que les concentrations dans l'eau interstitielle des sédiments étaient supérieures à celles dans l'eau surjacente, ce qui entraînerait un niveau d'exposition directe plus élevé pour les organismes invertébrés vivant dans les sédiments que pour les organismes épibenthiques présents dans l'épilimnion. Mackintosh (2004) a calculé les valeurs du FABS des esters phtaliques dans huit organismes au sein du réseau trophique marin en divisant la concentration moyenne normalisée des lipides dans le biote par la concentration moyenne normalisée de carbone organique dans les sédiments. Le FABS calculé du DMP était de 0,77.
Dans le cadre d'une étude portant sur la distribution des esters phtaliques (dont le DMP) dans les mammifères, les poissons, les sédiments et l'air du côté est de la baie d'Hudson, Morin (2003) a calculé des valeurs du FABS des esters phtaliques chez le béluga (Delphinapterus leucas) et la morue polaire (Boreogadus saida). Les sédiments sont considérés comme une source d'exposition alimentaire pour le béluga, puisqu'il a recours à la succion dans sa recherche d'organismes benthiques et qu'il peut alors en ingérer (Morin, 2003). Les valeurs du FABS (normalisées pour les lipides et corrigées pour le carbone organique) ont été établies à 1,37 kg carbone organique/kg lipides pour la morue polaire et à 2,29 kg carbone organique/kg lipides dans le béluga. La valeur pour le béluga indique une capacité de bioaccumulation du DMP. Cependant, les valeurs du FABS pour la morue polaire, qui sont près de l'unité, donnent à penser que l'exposition par l'alimentation ne contribue pas de façon importante au transfert trophique du DMP et à l'accumulation dans l'environnement par la chaîne trophique.
Les valeurs du FABS ont été calculées d'après les concentrations dans des poissons et des échantillons de sédiments provenant de 17 rivières à Taïwan. Les valeurs du FABS pour le DMP ont été présentées sous forme de graphique et variaient entre 0,05 et 1,2 dans quatre espèces de poissons (Huang et al., 2008), ce qui indique également de faibles niveaux d'accumulation.
Le modèle FBCFBA (EPI Suite 2000-2008) prédit, pour la biotransformation se rapportant au niveau trophique intermédiaire, un FBC et un FBA de 2 065 pour les poissons.
Aucune donnée empirique n'était disponible pour l'absorption du DMP présent dans l'air, l'eau ou le sol par les plantes ou les autres organismes terrestres. Cependant, Morin (2003) a trouvé un facteur de bioaccumulation air-biote (par rapport à la teneur en lipides) pour les bélugas de 7,66, ce qui indique que l'exposition à l'air contribue davantage à la bioaccumulation du DMP que l'exposition alimentaire.
7.3.4 Bioamplification
Il y a peu d'études dans lesquelles on trouve des mesures de la bioamplification du DMP.
Dans des systèmes aquatiques (le côté est de la baie d'Hudson), Morin (2003) a trouvé un facteur de bioamplification en poids humide de 12,3 pour les bélugas et un facteur de bioamplification par rapport à la teneur en lipides de 1,67. Toutefois, il a été déterminé que le résultat du facteur de bioamplification par rapport à la teneur en lipides n'était pas statistiquement différent de 1,0, ce qui indique que le potentiel de bioamplification dans les bélugas est faible. Ces conclusions s'expliquent par : la similitude des positions dans la chaîne trophique de la proie (morue : 3,6) et du prédateur (béluga : 3,9), la transformation métabolique et les habitudes alimentaires des bélugas échantillonnés.
Aucune donnée mesurée n'était disponible pour la bioamplification des phtalates dans les écosystèmes terrestres. Toute l'information disponible indique que la bioaccumulation dans les réseaux trophiques, c'est-à-dire la bioamplification, des phtalates ne se produit pas (Gobas et al., 2003).
Sommaire du devenir et du comportement dans l'environnement
Du DMP pourrait être rejeté dans le cours d'activités industrielles et, éventuellement, par le biais d'une utilisation par les consommateurs, et ce, principalement dans l'air et dans des systèmes de prétraitement d'eaux usées. Les phtalates comme le DMP ne sont pas chimiquement liés à la matrice polymère. Ils peuvent donc migrer lentement vers la surface des produits, et, ensuite, entrer dans l'environnement. Le DMP rejeté dans l'air se déposera au sol et, dans une moindre proportion, demeurera dans l'air pour ensuite se déposer dans l'eau. Le DMP rejeté dans des systèmes de prétraitement des eaux usées subira probablement le traitement appliqué aux eaux usées dans des installations sur place ou hors site. Le DMP se biodégrade rapidement et ne devrait pas être récalcitrant dans l'environnement. La dégradation peut être légèrement ralentie dans des conditions anaérobies, ce qui augmente la durée d'exposition des organismes. De plus, l'utilisation de quantités modérées de DMP, y compris dans des produits de consommation, indique que les rejets dans l'environnement et, par conséquent, l'exposition se produit de manière continue. D'après l'information concernant les rejets et la répartition prévue dans l'environnement, c'est chez les organismes vivant dans les sols et les organismes aquatiques que l'exposition au DMP devrait être la plus élevée. La biodégradation rapide du DMP indique que l'exposition sera plus importante pour les organismes vivant près des sites de rejet; les concentrations dans l'environnement devraient diminuer avec la distance du point de rejet, bien que la possibilité de transport sur de grandes distances existe. L'hydrosolubilité relativement élevée du DMP indique que l'exposition se produira principalement par un contact direct avec le milieu environnant plutôt que par l'alimentation. Les données empiriques et modélisées montrent que le DMP possède un potentiel de bioaccumulation et de bioamplification faible, principalement en raison de la haute capacité de biotransformation.
8. Potentiel d'effets nocifs sur l'environnement
8.1 Effets sur l'environnement
Les données empiriques concernant la toxicité en milieu aquatique pour le DMP sont résumées à l'annexe B. Le DMP présente une faible toxicité pour les organismes aquatiques, ce qui concorde avec son faible potentiel de bioaccumulation. Les poissons sont plus sensibles que les algues, tandis que la réponse toxicologique est plus variée chez les invertébrés. Dans de nombreux cas, aucune donnée sur la concentration minimale avec effet observé (CMEO) n'était disponible en raison de l'absence de toxicité aux doses d'essai les plus élevées. Les données sur la toxicité aiguë pour les poissons, les invertébrés et les plantes indiquent que le DMP présente une faible toxicité pour les organismes aquatiques et terrestres (CL50 ou CE50 supérieur(e) u égal(e) à 1 mg/l ou supérieur(e) u égal(e) à 500 mg/kg p.c., respectivement). Les données sur la toxicité chronique pour les poissons, les plantes et les invertébrés aquatiques indiquent également que la toxicité du DMP est relativement faible (CSEO supérieur(e) u égal(e) à 0,1 mg/l).
La faible toxicité du DMP s'explique en partie par le partage à l'équilibre et le métabolisme, ce qui signifie que les niveaux de résidu corporel critique (RCC) ne peuvent être atteints. De plus, une comparaison des relations quantitatives structure-activité (QSAR) spécifiques des espèces renforce l'hypothèse voulant que la biotransformation soit importante pour expliquer les différents niveaux de toxicité entre les espèces. Une étude menée en 1995 (Jaworska et al.) indique une forte corrélation positive entre la toxicité excessive et le taux d'hydrolyse, ce qui explique pourquoi les poissons, qui affichent des taux d'hydrolyse in vivo plus élevés que les algues, sont plus sensibles au DMP que les algues.
Oehlmann et al. (2009) laissent entendre que les phtalates à faible masse moléculaire (p. ex., le DMP) utilisent probablement la narcose non polaire comme mode d'action. Cette hypothèse repose sur la corrélation positive qui existe entre les données sur la toxicité et les valeurs log Koe. Cependant, Adams et al. (1995) affirment que les phtalates à faible masse moléculaire, comme le DMP, semblent avoir un niveau de toxicité supérieur par rapport aux narcotiques organiques neutres non spécifiques. Ils seraient ainsi classés comme des narcotiques polaires ou des composés ayant un mode d'action reposant sur une « réactivité indéterminée » comme le mode d'action des esters. Les deux sont légèrement supérieurs à la référence non polaire, mais ils se chevauchent également. De plus, Parkerton et Konkel (2000) indiquent que le mode d'action principal des phtalates, dont le DMP, serait la narcose polaire. Les auteurs énoncent également que les résidus corporels critiques (RCC) estimés pour la substance d'origine et les métabolites se situaient dans la plage des narcotiques non polaires (c.-à-d. la toxicité de référence), ce qui laisse croire que les métabolites des esters phtaliques joueraient un rôle dans la réponse toxique (Parkerton and Konkel, 2000). Si les métabolites formés sont composés d'un phénol et d'un acide, le premier contribue au mode d'action polaire, tandis que le deuxième contribue au mode d'action non polaire.
8.1.1 Eau
Le DMP est peu toxique pour les algues vertes (Desmodesmus subspicatus et Pseudokirchneriella subcapitata), avec une CE50 (taux de croissance) de 260 mg/l après 72 heures pour Desmodesmus subspicatus (ECHA, c2007-2013). La faible toxicité du DMP pour les algues peut également être observée chez d'autres espèces : une CE50 (diminution du nombre de cellules) de 142 mg/l après 96 heures a été signalée pour Pseudokirchneriella subcapitata (Adams et al., 1996), et une CE50 (croissance) de 313 mg/l après 96 heures pour Chlorella pyrenoidosa (Yan et al., 1995).
Un des programmes d'essai les plus complets pour la toxicité aiguë des phtalates a été mené par Adams et al.(1995). Ces chercheurs ont réalisé des études de la toxicité statique au cours desquelles la puce d'eau (Daphnia magna), le moucheron (Paratanytarsus parthenogenetica) et le mysidacé (Americamysis bahia) ont été exposés à 14 esters phtaliques commerciaux, dont le DMP. Si l'Agence européenne des produits chimiques (ECHA) a qualifié l'étude de fiable sans restriction, il est bon de noter que les tests étaient statiques et que le DMP présente un potentiel élevé de biodégradation dans l'eau. Les calculs des valeurs CE50 ou CL50 ont été effectués pour le DMP pour diverses espèces d'invertébrés, et les résultats varient entre une CE50 pour l'immobilisation de 45,9 mg/l (D. magna) après 48 heures et des CL50 de 68,6 mg/l (mysidacé) et de 377 mg/l (moucheron) après 96 heures (Adams et al., 1995). Les valeurs CSEO indiquées pour l'immobilisation chez ces trois espèces étaient de inférieur(e) à 23,5 mg/l, 22,2 mg/l et inférieur(e) à 100 mg/l, respectivement, ce qui semble indiquer un niveau de toxicité relativement faible associé à ce composé chez toutes les espèces étudiées (les valeurs CMEO n'ont pas été déclarées en raison d'une toxicité insuffisante). En ce qui a trait aux études de l'exposition chronique, Rhodes et al. (1995) ont exposé D. magna lors d'un essai dynamique de 21 jours à divers phtalates afin d'examiner le potentiel de survie et les effets sur la reproduction. Les valeurs CSEO et CMEO pour la survie de D. magna après 21 jours étaient de 9,6 mg/l et de 23 mg/l, respectivement. D'autres études de l'exposition chronique au DMP ont été réalisées. Par exemple, Call et al. (2001) ont rapporté une CL50 après 10 jours de 246 mg/l de DMP pour Lumbriculus variegatus, une CL50 après 10 jours de 68,2 mg/l de DMP pour Chironomus tentans et une CL50 après 10 jours de 28,1 mg/l de DMP pour Hyalella azteca. Des CMEO de 1,94 mg/l pour la diminution de la fertilité et de 0,0194 mg/l pour la séparation chromosomique des ovocytes au cours de l'anaphase ont été rapportés pour le ver polychète (Pomatoceros lamarckii) exposé au DMP (Dixon et al., 1999; Wilson et al., 2002).
En plus des essais de toxicité standard, quelques études ont examiné les effets du DMP sur le développement d'une univalve marine, l'ormeau (Haliotis diversicolor supertexta). Liu et al. (2009) ont étudié la toxicité du DMP pour l'embryogenèse et le développement larvaire de cette espèce au moyen d'un test de toxicité sur l'embryon à deux stades de développement. Au stade de la blastula, la CE50 pour le développement réduit de la blastula était de 55,71 mg/l après 9 heures. Après 96 heures, le CSEO (réduction de la métamorphose larvaire) était de 0,020 mg/l (le CMEO n'a pas été rapporté). Yang et al. (2009) ont étudié les effets toxiques du DMP et de trois autres phtalates sur l'embryogenèse et le développement larvaire des mêmes espèces que celles étudiées par Liu et al. (2009), et ont observé des CE50 de 40 mg/l (anomalies larvaires) et de 0,05 mg/l (fixation larvaire). Zhou et al. (2011) ont étudié l'effet du DMP sur la fécondation et l'embryogenèse de l'ormeau. Ils ont constaté que les spermatozoïdes traités au DMP affichaient des diminutions de l'efficacité de la fécondation, de la morphogenèse et de l'éclosion proportionnelles à la dose administrée.
Les données présentées par Call et al. (2001), Dixon et al. (1999), Wilson et al. (2002), Liu et al. (2009) et Yang et al. (2009) soutiennent globalement la conclusion selon laquelle le DMP présente un potentiel d'effets nocifs sur les organismes aquatiques peu élevé, selon les essais de toxicité standard.
Quelques études ont fait état de CL50 de DMP après 96 heures pour le méné tête-de-boule (29 mg/l; Adams et al., 1995), le crapet arlequin (38 mg/l; ECHA, c2007-2013), la truite arc-en-ciel (56 mg/l; Adams et al., 1995) et le méné tête-de-mouton (56 mg/l; Adams et al., 1995). Une CL50 de 121 mg/l après 96 heures a aussi été signalée par Adams et al. (1995) pour l'essai statique effectué sur le méné tête-de-boule; cependant, la CL50 après 96 heures pour l'essai dynamique réalisé sur la même espèce était de 39 mg/l. Les essais dynamiques sont considérés comme étant plus fiables pour les évaluations toxicologiques. La CL50 de 39 mg/l concorde avec les résultats obtenus par l'US EPA (2010) pour la tête-de-boule (56 mg/l) après une période d'exposition de 96 heures. Cette valeur indique également que l'activité chimique du DMP se trouve dans les limites de celle de la narcose. Cet auteur a également observé des CSEO (96 heures; survie) de 3,2 mg/l (méné tête-de-mouton) à 38 mg/l (truite arc-en-ciel) lors de l'exposition de ces espèces au DMP (Adams et al., 1995; CMEO non indiquées). D'autres études (Heitmuller et al. 1981, Linden et al. 1979) appuient l'hypothèse selon laquelle le DMP présente une faible toxicité pour les organismes aquatiques (CL50 ou CE50 supérieur(e) u égal(e) à 1 mg/l).
Les données disponibles sur la toxicité chronique chez les poissons étaient plus limitées. Une étude a évalué les effets chroniques liés au DMP (Rhodes et al., 1995). Pour le DMP, des CMEO et CSEO (survie, croissance et éclosivité) de 24 mg/l et 11 mg/l, respectivement, ont été observées à la suite d'une période d'exposition de 102 jours.
Afin d'élargir la portée de leur étude, Staples et al. (2000) ont eu recours à deux méthodes pour calculer la concentration estimée sans effet (CESE) de DMP : une méthode de l'US EPA et une méthode des Pays-Bas. Celles-ci ont révélé des concentrations chroniques sans effet de 4,7 mg/l (valeur chronique finale; méthode de l'US EPA) et de 3,2 mg/l (HC5; méthode des Pays-Bas) dans l'eau de surface. Ces deux méthodes nécessitent l'évaluation de multiples espèces aquatiques et niveaux trophiques.
8.1.1.1 Dérivation de la concentration estimée sans effet (CESE) pour l'eau
La valeur critique de toxicité (VCT) choisie pour représenter les effets chez les organismes aquatiques est une CL50 aiguë de 28,1 mg/l pour une exposition de 10 jours chez l'amphipode Hyallela azteca, tirée de Call et al. (2001). Cette étude s'est montrée fiable (voir le sommaire de rigueur d'étude dans Environnement Canada, 2015b). Un facteur d'application (FA) de 10 a été retenu puisqu'il s'agit d'une valeur aiguë et qu'il y avait des données disponibles pour plus de sept espèces d'au moins trois groupes taxonomiques. La CESE est donc de 2,81 mg/l.
Plusieurs études révèlent des concentrations effectives inférieures à la VCT choisie. Rhodes et al., ont observé une CMEO de 24 mg/l (exposition de 102 jours) pour la diminution de la survie, de la croissance et de l'éclosion chez les truites arc-en-ciel. L'étude menée par Rhodes et al. (1995) est considérée comme fiable parce que les auteurs ont respecté les procédures d'essai normalisées et les règles de bonne pratique en laboratoire. Par contre, comme cette CMEO chronique n'est que légèrement inférieure à la CL50 aiguë de Call et al. (2001), l'application du facteur d'évaluation diminue la précision de la CESE. Cette valeur n'a donc pas été choisie comme VCT. L'utilisation d'un critère d'évaluation basé sur la régression (c.-à-d. CL50) au lieu d'un critère basé sur des essais hypothétiques (c.-à-d. CSEO ou CMEO) augmente également la certitude en matière de seuil pour les effets. De plus, chez les ormeaux, les valeurs correspondant aux effets secondaires sont inférieures (Zhou et al.2011), mais.
8.1.2 Sédiments
Très peu de données sur la toxicité des sédiments ont été trouvées pour le DMP. Une étude (Call et al. 2001) a révélé les effets sur l'annélide, Lumbriculus variegatus : une CL50 de 256 mg/l pour une période de 10 jours a été observée. Ni le DMP ni le DEP analogue ne devraient se loger dans les solides ou les sédiments en suspension. Une CESE n'a donc pas été calculée pour les sédiments.
8.1.3 Sol
Les données portant sur la toxicité terrestre du DMP ont été regroupées dans un document d'Environnement Canada (2015b). Les données se rapportent uniquement à quelques espèces.
Le DMP a fait l'objet de plusieurs études montrant de faibles niveaux de toxicité chez les organismes endogés. Par exemple, Neuhauser et al. (1985) ont obtenu une CL50 de 3 160 mg/kg pour une exposition de 14 jours au DMP chez le ver de terre (endogé). Neuhauser et al. (1986) ont obtenu des CL50 variant entre 1 064 et 3 335 mg/kg pour une période de 14 jours chez quatre espèces de ver (Allolobophora tuberculata, Eisenia fetida, Eudrilus eugeniae et Perionyx excavates). De plus, pour une période d'exposition au DMP de 56 jours dans le fumier de cheval, les CL100, CMEO et CSEO mesurées pour la croissance et la reproduction chez le ver de terre (Eisenia fetida) étaient de 94 400 mg/kg, 70 800 mg/kg et 47 200 mg/kg, respectivement (Neuhauser et al., 1985). Ces études indiquent qu'il est peu probable que le DMP soit toxique chez les vers de terre, et ce, même lorsque les concentrations dans le sol sont très élevées. Aucune donnée sur la toxicité des plantes n'a été trouvée pour le DMP.
8.1.4 Faune sauvage
Il n'existe aucune donnée d'essai de toxicité sur la faune sauvage pour le DMP. Il ne devrait pas y avoir d'exposition de la faune par voie aquatique parce que le DMP n'est pas susceptible de subir une bioamplification et le taux d'absorption par l'eau potable est très peu élevé.
Il existe cependant des études qui montrent la toxicité du DMP chez les mammifères tels que les rats et les souris. Au cours d'une étude de deux ans menée chez des rats (Lehman, 1955), des effets sur la croissance et sur les reins ont été observés. Les résultats de cette étude sont présentés de façon plus détaillée ci-dessous (section 9.2.3.2). (Lehman, 1955 dans NICNAS, 2008). Ces genres d'effet sont tout aussi importants pour la faune sauvage, notamment pour les mustélidés comme la loutre et le vison. Des facteurs d'échelle pour le poids corporel sont utilisés afin d'adapter les données toxicologiques aux espèces de la faune sauvage (p. ex., le vison). Le facteur d'échelle de 5,77 est utilisé pour convertir le poids corporel d'un rat en celui d'un vison (Sample et al. 1996).
Suivant l'administration orale chez les rats, le métabolite primaire du DMP détecté dans l'urine était le monométhyl phtalate (MMP) (78 %). L'urine contenait également de l'acide phtalique libre (14,4 %) et du DMP inchangé (8,1 %) (Albro et Moore, 1974, dans NICNAS, 2008). Le méthanol et le formaldéhyde ont également été identifiés comme métabolites in vivo et in vitro.
Un nombre limité d'études se sont penchées sur la cancérogénicité potentielle du DMP chez les mammifères. Les résultats sont abordés ci-dessous (section 9.2.3.2).
8.1.5 Air
Considérant le temps de séjour relativement élevé du DMP dans l'air, il est possible que la faune subisse des effets liés à l'inhalation. Aucune étude sur la toxicité par inhalation n'a été trouvée pour la faune. Cependant, il existe un certain nombre d'études sur l'inhalation menées chez des animaux d'expérience.
Dans une étude de quatre mois sur la toxicité par inhalation menée chez des rats exposés à des doses de 0,68 et 1,84 mg/m3 de DMP à raison de 4 h/j a révélé, avec la dose élevée, des changements dans la fréquence respiratoire, une baisse de l'hémoglobine, un changement dans le nombre de globules rouges, une diminution du gain pondéral, une diurèse perturbée, une concentration urinaire de chlorure altérée et une clairance d'acide hippurique accrue (Timofievskaya et al., 1974, dans NICNAS, 2008). Les résultats de cette étude sur l'exposition par inhalation ne permettent pas de formuler des conclusions au sujet de la toxicité de l'inhalation régulière.
8.1.5.2 Dérivation de la concentration estimée sans effet (CESE) pour l'air
Une évaluation de la toxicité du DEP (SCCNFP, 2002) démontre des effets liés à l'inhalation de DEP chez les souris. La toxicité aiguë par inhalation correspond à une CL50de 4,9 g/m3 (4 900 mg/m3). Cette valeur a été choisie comme VCT pour les effets de l'exposition atmosphérique sur la faune. Un coefficient d'évaluation de 100 a été choisi puisqu'il s'agit d'une valeur aiguë et pour tenir compte des variations interespèces, considérant qu'aucune donnée n'était disponible pour les autres espèces. La CESE est donc de 49 mg/m3.
8.1.6 Effets secondaires y compris les effets sur le système endocrinien
Les effets secondaires à la suite de l'exposition à des produits chimiques incluent des réactions moléculaires, biochimiques, cellulaires ou histologiques. Ils comprennent des effets sur la régulation génique. Les effets secondaires peuvent être utiles pour comprendre le mode d'action toxicologique ou pour agir à titre de biomarqueurs d'exposition.
Certaines données indiquent que le DMP cause des effets secondaires chez les organismes aquatiques. Par exemple, Zhou et al. (2011) ont démontré que l'exposition de gamètes d'ormeaux (Haliotis diversicolor supertexta) au DMP entraîne des changements dans les profils d'expression des gènes liés à la physiologie (p. ex., 17B-HSD-11) dans les embryogenèses subséquentes. En revanche, Staples et al.(2011) ont conclu que les effets secondaires liés aux phtalates ne semblent pas prédire les effets liés aux paramêtres primaires de la survie, de la croissance et du développement, ou de l'adaptation du système de reproduction. Par contre, leur conclusion est basée sur des études portant sur des phtalates autres que le DMP, comme le phtalate de dioctyle (DEHP) à chaîne moyenne.
Certaines études, utilisant des essais de toxicité normalisés, indiquent que le DMP ne produit aucun effet sur le système endocrinien. Par exemple, il a été démontré que le DMP ne présente aucune affinité de liaison pour le récepteur des œstrogènes et n'a pu prévenir la liaison à l'œstradiol in vitro dans l'utérus de rats (NCTR:SDN) ou le récepteur des œstrogènes α ou ß chez les humains ([Nakai et al., 1999; Toda et al., 2004; Blair et al., 2000) dans NICNAS, 2008). De plus, le phtalate monométhylique (MMP, le principal métabolite du DMP) n'a produit aucun effet sur la production d'œstradiol (concentrations allant jusqu'à 400 μM) dans les cellules de la granulosa de l'ovaire (de culture) chez les rats (Lovekamp et Davies, 2001 dans NICNAS, 2008). Par contre, des études toxicologiques non normalisées révèlent la possibilité d'effets sur le processus de fertilisation et sur les embryogenèses subséquentes, et ce, à des concentrations bien inférieures, ce qui porterait à croire qu'il existe des effets des perturbateurs endocriniens. Ces études montrent une CMEO de 0,0194 mg/l liée à une diminution de la fertilisation (il s'agit d'une référence secondaire qui ne peut être validée), une CE50 (fixation des larves) inférieur(e) ou égal(e) à 0,05 mg/l (Yang et al., 2009) et les résultats de Zhou et al. (2011), présentés ci-dessus. La fiabilité de ces études n'a pas été confirmée.
8.2 Exposition environnementale
8.2.1 Concentrations environnementales mesurées
Les médias canadiens offrent peu de données au sujet des concentrations environnementales récentes de DMP. Cependant, les données historiques existantes (1998-2012) indiquent des concentrations maximales, mais pas forcément représentatives, de 5,46 ng/l (eau de surface), 2 600 ng/l (effluent d'eaux usées) et 853 ng/g (sédiments). Il n'y a aucune donnée au sujet de la concentration de DMP dans l'air. Les concentrations de DMP dans le sol, au Canada, seraient toutes en deçà de la limite de détection pour la méthode analytique utilisée. La plupart des concentrations de DMP mesurées dans les boues d'épuration sont inférieures à la limite de détection. La concentration la plus élevée observée est de 900 ng/g (poids à sec) (Webber et Nichols, 1995).
Les données disponibles en matière de concentrations de DMP dans l'environnement canadien, y compris les effluents d'eaux usées, sont présentées dans un document d'Environnement Canada (2015a).
8.2.2 Air
Le taux de DMP a été mesuré dans des échantillons d'air prélevés dans des régions considérées comme étant éloignées de sources potentielles. Par exemple, les concentrations de DMP étaient de 0,040 - 0,223 ng/m3 (phase gazeuse) et de 0,001 - 0,008 ng/m3 (particules) dans six échantillons d'air prélevés dans l'Arctique norvégien en 2004 (Xie et al., 2007). Morin (2003) a trouvé du DMP dans l'air de l'est de la baie d'Hudson à des concentrations variant entre 1,12 et 2,31 ng/g.
8.2.3 Eau de surface
Les données canadiennes au sujet de la concentration de DMP dans l'eau de surface sont limitées. Des échantillons ont été prélevés au lac Wabamun, Alberta, à la suite d'un déversement pétrolier, puis des analyses ont été réalisées dans cinq cours d'eau récepteurs d'effluents d'installations d'épuration des eaux usées en Alberta. Alberta Environment (2006) a observé des concentrations non détectables (inférieur(e) à 0,1 µg/l) de DMP au lac Wabamun, ce qui constitue une limite de détection relativement élevée pour ces types de composés. Alberta Environment affirme que, dans le cadre de son programme échantillonnage, certains phtalates étaient parfois détectés dans les blancs de terrain et de transport, ce qui laisse croire qu'une contamination aurait eu lieu lors de l'échantillonnage. Les cours d'eau récepteurs d'effluents d'installations d'épuration des eaux usées étaient les suivants : les rivières Saskatchewan Nord, Bow, Oldman, Saskatchewan Sud et Red Deer. Les concentrations de DMP variaient entre des concentrations non détectées et des concentrations de 3,2 ng/l (les limites de détection spécifiques de chaque phtalate n'étaient pas précisées; Alberta Environment, 2005). Les données au sujet des concentrations de DMP dans la rivière Niagara (en amont [source]/en aval [embouchure]) ont été recueillies dans le cadre de l'initiative canado-américaine du comité de surveillance de la Niagara (Data Interprétation Group, 1999). Les concentrations en amont (Fort Erie) variaient entre 0,93 ng/l et 6,38 ng/l, alors que celles en aval (Niagara-on-the-Lake) variaient entre 0,49 ng/l et 4,39 ng/l. Une concentration de DMP de 0,08 µg/l a été mesurée dans un échantillon d'eau du robinet au Japon en 1998 (Hashizume et al., 2002).
Dans le cadre de l'étude menée sur des échantillons prélevés dans l'Arctique norvégien en 2004 (Xie et al., 2007), les auteurs ont noté une concentration moyenne de 0,033 ng/l de DMP dissous dans 8 échantillons d'eau sur les 16 prélevés. Une autre étude (Mackintosh et al., 2006) révèle que les concentrations de DMP dans l'eau de mer ne représentaient qu'une très petite fraction de la solubilité du DMP dans l'eau (6,7 × 10-8 %).
Le scénario (voir ci-dessous, section 8.2.8) de l'exposition des organismes aquatiques comporte le calcul de la concentration environnementale estimée (CEE) pour le site donné (industriel). À des fins de comparaison, une CEE basée sur une concentration environnementale de DMP mesuré dans l'eau de surface a également été retenue. La concentration choisie est de 4,39 ng/l (0,004 µg/l), mesurée à Niagara-on-the-Lake en 1997 (Data Interprétation Group, 1999).
8.2.4 Eau de mer
Les données canadiennes au sujet de la concentration de DMP dans l'eau de mer se limitent aux études menées dans la région de False Creek à Vancouver, Colombie-Britannique (ancienne zone industrialisée en milieu urbain). Les concentrations de DMP dans cette zone étaient d'environ 3 à 3,7 ng/l (Blair et al., 2009; Mackintosh et al., 2004, 2006).
8.2.5 Effluent d'eaux usées
Une étude menée par Alberta Environment (2005) a révélé des concentrations de phtalates dans les eaux usées épurées en Alberta. Les concentrations de DMP étaient très basses, variant entre des concentrations non détectables et des concentrations de 3,9 ng/l. Le rapport indique que ces échantillons ont été corrigés par soustraction des concentrations de composés trouvés dans les blancs de laboratoire de celles provenant des échantillons. Cette correction a été effectuée afin de tenir compte de la contamination fortuite d'échantillons due à la grande utilisation de phtalates dans la fabrication de plastiques dont l'utilisation est répandue dans les laboratoires.
8.2.6 Sédiments
Il existe des données au sujet des concentrations de DMP dans les sédiments au Canada, principalement en Colombie-Britannique. Les concentrations varient entre 0,04 ng/g (poids à sec, baie d'Hudson, 2002 [Morin, 2003]) et 853 ng/g (poids à sec, Vancouver, 2003 [Mackintosh et al., 2006]).
8.2.7 Biotes
Seulement quelques études font état des concentrations de phtalates au sein de biotes au Canada. Les données recueillies dans l'est de la baie d'Hudson entre 2000 et 2002 ont révélé des concentrations de DMP dans de nombreux tissus biologiques (Morin, 2003). Les concentrations de DMP observées dans le lichen, les tissus de béluga et la morue polaire étaient de 0,325 ng/g (poids à sec), 2,39 ng/g (poids humide) et 0,346 ng/g (poids humide), respectivement. Les sédiments et les biotes de False Creek Harbour ont été analysés (Lin et al., 2003). Les résultats indiquent une prédominance de phtalates à faible masse moléculaire, dont le DMP, dans les tissus de poissons. Ces concentrations varient entre 0,1 et 1 ng/g, soit des résultats comparables à ceux obtenus dans l'est de la baie d'Hudson (Morin, 2003). Dans une étude portant sur les biotes de False Creek Harbour, les concentrations de DMP chez les sourcils à taches blanches et les perches-ménés variaient entre 0,26 et 0,71 ng/g (poids humide), et les concentrations chez les aiguillats communs étaient inférieures à la limite de détection (McConnell, 2007). Les concentrations de DMP chez les divers invertébrés variaient entre 0,051 et 0,47 ng/g (poids humide) (Blair et al., 2009; McConnell, 2007), alors que les concentrations algales étaient de 0,33 ng/g (poids humide) (McConnell, 2007).
8.2.8 Scénarios d'exposition et concentrations environnementales estimées
Selon les renseignements présentés dans l'article 71 au sujet du DMP (Environnement Canada, 2014), le composé est principalement importé au Canada sous la forme d'enduits prêts à l'emploi. Au Canada, ce phtalate s'utilise principalement dans le cadre de l'application d'enduits spécialisés. À l'avenir, la préparation de ces enduits spécialisés pourrait peut-être se faire au Canada, car les sites de fabrication d'enduits des principaux importateurs d'enduits de DMP (Environnement Canada, 2014) se trouvent eux aussi au Canada. Cependant, on s'attend à ce que les rejets de DMP provenant de la préparation d'enduits au Canada ne dépassent pas les estimations prudentes de rejets de DMP pour l'application d'enduits présentée ci-dessous.
Le DMP est utilisé, notamment comme solvant dans les préparations d'enduit extérieur de fluoropolymère appliquées sur les surfaces de métal (p. ex., rouleau de tuiles de couverture en aluminium). Ces enduits extérieurs portent également le nom d'enduits de polyfluorure de vinylidène. Ces enduits se composent normalement de solides (50 à 60 %) et de solvants (40 à 50 %) (OECD ESD, 2009). Le DMP se trouverait dans le solvant. Les fiches signalétiques trouvées pour deux enduits de fluoropolymère indiquent que les concentrations de DMP dans ces produits varient de 1 à 5 % (Valspar, 2011) et de 5 à 10 % (PPG Industries Inc Coatings et Resins Group, 1991). En vue de l'élaboration d'un scénario d'exposition prudent et générique de niveau 1, on a supposé que la concentration de DMP dans la préparation d'enduit était de 10 %. Comme il a été mentionné précédemment, l'activité ayant nécessité les plus grandes quantités de DMP au Canada en 2012, selon l'enquête menée conformément à l'article 71, a été l'importation d'enduits prêts à l'emploi. L'importateur en question a identifié dix utilisateurs en aval qui appliquent les enduits spécialisés à leurs sites au Canada. Les quatre utilisateurs en aval affichant les plus grandes quantités d'utilisation ont été étudiés et les renseignements relatifs à leurs sites accessibles au public (ministère de l'Environnement de l'Ontario, autorisation environnementale) ont été analysés. Il y avait peu de renseignements utiles à l'élaboration d'un scénario d'exposition générique. Par contre, le taux d'utilisation quotidien maximal pour les enduits de fluoropolymère (fourni pour l'un des sites) a été utilisé dans le cadre de l'évaluation de l'exposition pour le calcul des rejets de DMP dans l'eau et l'air à la suite de l'application d'enduits en milieu industriel au Canada.
Milieu aquatique – scénario d'exposition locale d'origine industrielle
Selon ce scénario de niveau 1, il devrait y avoir une exposition aquatique au DMP lorsque la substance est rejetée des applications d'enduits de fluoropolymère, dans un site industriel d'application d'enduits générique, vers un réseau d'assainissement. La concentration de la substance dans les eaux réceptrices près du point de rejet peut être utilisée pour évaluer le risque aquatique lié à la substance. Elle peut être calculée au moyen de l'équation suivante :
Caquatic-ind = [1000 × Q × L × (1-R)] / [F × D]
où
- C aquatic-ind :
- concentrations aquatiques à la suite de rejets industriels, mg/l
- Q :
- quantité totale de la substance utilisée quotidiennement dans un site industriel, kg/j
- L :
- pertes dans les eaux usées, fraction
- R :
- taux d'élimination du système d'assainissement, fraction
- F :
- débit des effluents du système d'assainissement, m 3/d
- D :
- facteur de dilution des eaux réceptrices, sans dimension
Comme il est indiqué ci-dessus, la quantité de substance utilisée quotidiennement au site générique est calculée d'après le taux d'utilisation maximal sur 24 heures de peintures à base de fluoropolymère acrylique chez l'un des utilisateurs en aval et la densité des enduits à base de solvant appliqués sur les rouleaux (Crechem, 2003). Une perte de 100 % dans les eaux usées a été retenue pour ce scénario d'exposition de niveau 1. Cette hypothèse est irréaliste et très prudente. Les enduits sont appliqués dans des cabines de pulvérisation. Même si l'efficacité de transfert d'enduit dans les cabines de pulvérisation est faible, la perte d'enduit serait tout de même inférieure à 100 %. Aucun renseignement ne permet de déterminer si les utilisateurs en aval procèdent au traitement sur place de leurs eaux usées. Aux fins de la présente évaluation, nous supposons donc que le site générique rejette ses effluents vers un réseau d'assainissement hors site.
Les taux d'élimination potentiels de DMP dans les systèmes d'assainissement des eaux usées primaire et secondaire ont été calculés à l'aide des trois modèles informatiques suivants : SimpleTreat 3.0 (1997), STP Model 2.1 (2006) et ASTreat 1.0 (2006). Les taux d'élimination de DMP dans les étangs aérés et mixtes ont été calculés par STP-EX (2011). Les estimations les plus prudentes issues des quatre modèles ont été sélectionnées pour estimer les rejets aquatiques. Le résultat du processus d'élimination primaire, obtenu à l'aide du modèle ASTreat 1.0 (2006), est utilisé lorsque l'on présume que les effluents de ce site d'application d'enduit industriel sont rejetés dans un système d'assainissement des eaux usées qui effectue uniquement un traitement primaire. En revanche, les taux d'élimination primaire et secondaire (combinés), obtenus à l'aide du modèle ASTreat 1.0 (2006) sont utilisés lorsque l'on considère que les effluents sont rejetés dans un système d'assainissement secondaire à boues activées. Les taux d'élimination prévus par les étangs n'ont pas été utilisés dans le cadre de ce calcul, puisque le modèle STP-EX a prédit un taux d'élimination du DMP par les étangs plus élevé par comparaison au modèle ASTreat 1.0 (2006) en ce qui concerne l'élimination secondaire. L'estimation plus prudente est donc retenue. Les quatre sites sélectionnés parmi les utilisateurs en aval d'enduits contenant du DMP se situent dans le même grand secteur industriel et dirigent leurs eaux usées vers d'importants systèmes d'assainissement secondaires dotés de la technologie à boues activées. L'un des sites qui dirigent ses rejets vers un système d'assainissement secondaire est utilisé pour la détermination du débit des effluents et du facteur de dilution du scénario générique, alors que le système d'assainissement primaire de Montréal a été sélectionné pour les données relatives au débit des effluents et au facteur de dilution de ses eaux réceptrices. Montréal a été sélectionné, puisqu'il s'agit d'un bon exemple d'un grand secteur industriel comptant un système d'assainissement primaire.
Toutes les entrées utilisées pour calculer l'exposition aquatique sont présentées dans le tableau 8-1 ci-dessous.
| Entrée | Valeur | Justification et référence |
|---|---|---|
| Quantité utilisée par site par jour (kg/j) | 104,5 | Selon le taux d'utilisation d'enduits de l'un des utilisateurs en aval (ministère de l'Environnement de l'Ontario), avec une concentration de solvant présumée de 10 % pour les enduits de fluorure (OECD ESD, 2009) et une densité de 0,950 kg/l pour les enduits à base de solvant appliqués sur les rouleaux (Crechem, 2003) |
| Perte dans les eaux usées (%) | 100 | Hypothèse irréaliste dans le cadre de l'approche prudente de niveau 1 |
| Taux d'efficacité de l'élimination dans les systèmes d'assainissement primaire et secondaire (%) | 4 et 81 | Valeurs prévues par le modèle ASTreat 1.0 (2006) pour les traitements primaire et secondaire |
| Débit des effluents du système d'assainissement primaire (m3/d) | 2,2 x 106 | Volume moyen de l'effluent quotidien du système d'assainissement des eaux usées |
| Débit des effluents du système d'assainissement secondaire (m3/d) | 171,1 x 103 | Données propres au site du système d'assainissement des eaux usées, provenant de la base de données interne d'Environnement Canada |
| Facteur de dilution (-) | 10 | Rapport propre au site entre le débit des masses d'eau réceptrices et le débit du système d'assainissement des eaux usées. Une valeur par défaut maximale de 10 est utilisée lorsque le facteur de dilution est supérieur à 10. |
Selon les calculs, les concentrations totales dans l'eau près du point de rejet dans les systèmes d'assainissement primaire et secondaire sont de 4,56 µg/l (0,00456 mg/l) et 11,6 µg/l (0,0116 mg/l), respectivement. La CEE retenue pour la caractérisation du risque pour les organismes aquatiques est de 0,0116 mg/l.
Milieu atmosphérique – scénario d'exposition locale d'origine industrielle
Étant donné que le DMP affiche un temps de séjour atmosphérique relativement élevé, un scénario d'exposition atmosphérique a été élaboré.
Dans le cadre du scénario d'exposition de niveau 1, le modèle SCREEN3 de USEPA a été retenu pour estimer la concentration maximale générique de DMP sur une heure autour d'un site industriel représentatif où se fait l'application d'enduits (SCREEN3, 1995). Le modèle SCREEN3 est un outil qui nécessite moins d'entrées et des entrées moins précises que les autres modèles plus complexes. Le scénario sélectionné est conçu pour fournir une estimation fondée sur des hypothèses prudentes concernant la quantité de substance utilisée et rejetée par l'installation, ainsi que les conditions d'installation et environnementales au point de rejet. Toutes les entrées utilisées pour le calcul de la concentration atmosphérique autour de l'installation et le résultat du modèle sont présentés dans le tableau 8-2. Si la perte atmosphérique est de 100 % et le taux de rejet est de 6,05 g/s, SCREEN3 estime que la concentration maximale sur une heure de 28 420 µg/m3 est obtenue à 30 m de la source. La concentration maximale sur une heure à 100 m est de 6 020 µg/m3, puis de 380,7 µg/m3 à 1 000 m. La concentration à 100 m est utilisée comme concentration environnementale estimée représentative (CEEatmosphérique) dans le cadre de cette évaluation, puisque la distance correspond à la distance moyenne entre la source de rejet et la délimitation d'un site industriel (Commission européenne, 2003).
| Paramètres | Valeur | Remarques |
|---|---|---|
| Taux de rejet (g/s) | 6,05 | Cette estimation est fondée sur le taux d'utilisation maximal de peinture sur une heure de l'un des utilisateurs en aval, sur une perte atmosphérique de 100 % et une densité de 0,950 kg/l d'enduits à base de solvant appliqués sur les rouleaux (Crechem, 2003) |
| Hauteur de la cheminée (m) | 10 | Par défaut; médiane pour 1 085 590 cheminées aux É.-U. (US EPA, 2004) |
| Diamètre de la cheminée (m) | 0,6 | Par défaut; médiane pour 9 706 cheminées du Système d'inventaire des déversements résiduels (base de données du Système d'inventaire des déversements résiduels). |
| Vitesse d'échappement des gaz de la cheminée (m/s) | 9 | Par défaut; médiane pour 1 085 590 cheminées aux É.-U. (US EPA, 2004) |
| Température des gaz d'échappement de la cheminée (K) | 316 | Par défaut; médiane pour 9 706 cheminées du Système d'inventaire des déversements résiduels (base de données du Système d'inventaire des déversements résiduels). |
| Température ambiante (K) | 293 | Par défaut |
| Hauteur du récepteur au-dessus du sol (m) | 2,5 | Par défaut; représente la hauteur de petits organismes terrestres arboricoles. |
| Urbain/rural | Urbain | Par défaut; l'installation se trouve en milieu urbain. |
| Option de rabattement de panaches | Sélectionnée | Par défaut; fournit un scénario plus prudent (US EPA, 1995). |
| Hauteur de l'édifice (m) | 10 | Par défaut; représente la hauteur de l'édifice où se font la production, le traitement ou l'utilisation (Commission européenne, 2003). |
| Dimension horizontale minimum (m) | 20 | Par défaut; représente les installations industrielles typiques de faible hauteur (Law et al., 2004). |
| Dimension horizontale maximum (m) | 100 | Par défaut; représente les installations industrielles typiques de faible hauteur (Law et al., 2004). |
| Terrain simple | Sélectionné | Par défaut; fournit un scénario plus prudent qu'un terrain complexe (US EPA, 1995). |
| Conditions météorologiques complètes | Sélectionnées | Par défaut; définit les conditions les plus défavorables (US EPA, 1995). |
| Altitude du terrain (m) | 5 | Par défaut; correspond à la moitié de la hauteur de la cheminée. |
| Concentration maximum (mg/m3) | 28,4 | À 30 m |
| Concentration à 100 m (mg/m3) | 6,02 | À 100 m, cela correspond à la distance moyenne entre la source de rejet et la délimitation d'un site industriel |
| Concentration à 1 000 m (mg/m3) | 0,38 |
8.3 Caractérisation des risques pour l'environnement
8.3.1 Évaluation des données
Une analyse du quotient de risque, intégrant les estimations prudentes de l'exposition aux renseignements toxicologiques, a été effectuée pour le milieu aquatique afin de déterminer s'il existe des risques d'effets nocifs pour l'environnement au Canada. Le scénario industriel spécifique du site (considérant la masse d'eau réceptrice réelle) présenté ci-dessus a révélé une concentration environnementale estimée (CEE) de 0,0116 mg/l (Environnement Canada, 2015a). Une concentration estimée sans effet (CESE) a été calculée à partir de la valeur de toxicité aiguë de 28,1 mg/l (voir la section « Effets sur l'environnement »). Le quotient de risque correspondant (CEE/CESE) est de 0,004. Les effets nocifs pour les organismes aquatiques à ce site sont donc peu probables. Une analyse du quotient de risque en milieu aquatique a également été effectuée à partir de la concentration environnementale mesurée (voir le tableau 8-3 ci-dessous); le quotient de risque correspondant est de 0,0000014.
Une analyse du quotient de risque atmosphérique a également été effectuée. Le scénario industriel spécifique du site (considérant le site industriel représentatif d'application d'enduits) présenté ci-dessus affichait une concentration environnementale estimée (CEE) de 6,02 mg/m3 à 100 mètres du site. Une concentration estimée sans effet (CESE) a été calculée à partir de la CL50 de toxicité aiguë par inhalation de 4,9 g/m3(4 900 mg/m3, voir la Section « Effets sur l'environnement »). Le quotient de risque correspondant (CEE/CESE) est de 0,12. Les effets nocifs pour la faune sauvage sont donc peu probables à ce site.
Une analyse du quotient de risque n'a pas été effectuée pour les sédiments.
| Milieu | Scénario | CESE | CEE | Quotien de risque |
|---|---|---|---|---|
| Aquatique | Rejet industriel | 2,81 mg/L | 0,0116 mg/L | 0,004 |
| Aquatique (concentration environnementale mesurée) | Concentration environnementale mesurée | 2,81 mg/L | 0,0000044 mg/L | 0,0000014 |
| Atmosphérique | Rejet industriel | 49 mg/m3 | 6,02 mg/m3 | 0,12 |
On s'attend à ce que le DMP persiste dans l'air, mais pas dans l'eau, le sol ou les sédiments. Le DMP devrait également avoir un faible potentiel de bioaccumulation. Les quantités modérées de DMP importées au Canada, ainsi que les renseignements au sujet de son utilisation, indiquent que des rejets à grande échelle pourraient se produire dans l'environnement canadien. Une fois rejeté, le DMP se trouvera principalement dans l'air, dans l'eau et dans le sol. Les données de surveillance disponibles indiquent la présence de faibles concentrations de DMP dans la plupart des milieux (air, eau, sédiments). Le potentiel de toxicité du DMP chez les organismes aquatiques est faible. Les analyses du quotient de risque indiquent qu'il est peu probable que le rejet de DMP des installations où la substance est utilisée comme additif pour enduit ait des effets nocifs pour les organismes aquatiques. De même, il est peu probable que le DMP rejeté dans l'air à la suite d'une utilisation industrielle cause des effets nocifs par inhalation à la faune terrestre.
8.3.2 Incertitudes
Le DMP est un composé chimique ayant fait l'objet de nombreuses études. Il y a toutefois des données manquantes. Les données expérimentales concernant les effets sur la faune ainsi que sur les organismes vivant dans le sol et dans les sédiments sont limitées. Les mises en garde résident dans le fait que le DMP ne devrait persister dans aucun milieu, sauf le milieu atmosphérique, et qu'il ne devrait pas se disperser de manière significative dans les sédiments. En conséquence, il ne devrait pas y avoir d'effet significatif sur la faune ou sur les organismes vivant dans le sol ou les sédiments. Des données de surveillance, qui sont également rares pour ces milieux, seraient utiles pour confirmer la nature peu préoccupante des effets environnants. Les données reliées aux activités endocrines possibles du DMP ne sont pas définitives. D'autres études à ce sujet seraient donc utiles. Ces données manquantes engendrent de l'incertitude en matière de caractérisation des risques.
9. Potentiel d'effets nocifs pour la santé humaine
9.1 Exposition
Milieux environnementaux et aliments
Air ambiant, eau potable et sol
Aucune donnée de surveillance canadienne n'a été trouvée au sujet de la présence de DMP dans l'air ambiant. Le DMP a été détecté dans l'air ambiant de la mer du Nord, dans l'Arctique (Xie et al., 2005, 2007), et de la baie d'Hudson (voir la section 8.2.2, Xie et al., 2005, 2007; Morin, 2003). Il est à noter que les études réalisées par Xie et al., en 2005 et 2007 indiquent des concentrations plus élevées en phase de vapeur qu'en phase gazeuse.
Un résumé des données concernant la présence de DMP dans l'eau de surface canadienne est présenté dans la section 8.2.3. De plus, en France et en Chine, le DMP a fait l'objet d'une surveillance dans des échantillons d'eau de surface (Teil et al., 2007; Shao et al., 2013, Liu et al., 2014; He et al., 2011; Zhang et al., 2012), mais il n'a pas été détecté dans les échantillons d'eau de surface prélevés dans des pays d'Afrique (Adeniyi et al., 2011; Fatoki et al., 2010).
Aucune donnée de surveillance canadienne n'a été trouvée au sujet de la présence de DMP dans l'eau potable. Par contre, le DMP a été détecté dans un des 15 échantillons d'eau potable provenant de la Californie (0,54 µg/l) (Loraine et Pettigrove, 2006), mais n'a pas été détecté ou mesuré dans les échantillons d'eau potable provenant de l'Espagne et de la Chine (Bono-Blay et al., 2012, Shao et al., 2013).
Le DMP n'a pas été détecté dans les échantillons d'eau embouteillée examinés dans le cadre de l'Étude sur l'alimentation totale par Santé Canada (Cao 2008). En outre, les concentrations de DMP étaient inférieures soit à la limite de détection, soit à la limite de quantification dans les études menées sur de l'eau embouteillée en France, en Grèce et en Chine (Devier et al., 2013; Diana et Dimitra, 2011; Guo et al., 2012).
D'autres études internationales ont détecté la présence de DMP dans l'eau embouteillée en Thaïlande, en Arabie Saoudite et en Italie (Prapatpong et Kanchanamayoon, 2010; Kanchanamayoon et al., 2012; Al-Saleh et al., 2011; Montuori et al., 2008).
Selon les données disponibles, le DMP a été détecté dans une petite portion des échantillons d'eau embouteillée, mais pas dans les échantillons d'eau embouteillée au Canada. L'exposition au DMP par la consommation d'eau embouteillée serait donc négligeable.
Le DMP a été détecté, mais pas mesuré, dans six échantillons de sol agricole sur dix provenant de cinq provinces canadiennes (limite de détection, 0,03 mg/kg poids à sec) (Webber et Wang, 1995). De plus, Zeng et al. (2009) ont fait état des concentrations moyennes de DMP dans les échantillons de sol prélevés dans des milieux résidentiels (0,074 µg/g poids à sec) et des forêts-parcs (0,067 µg/g poids à sec) dans la ville de Guangzhou, en Chine.
En raison de la quantité limitée de données au sujet de la présence de DMP dans l'air ambiant, l'eau potable, l'eau embouteillée et le sol, les estimations liées à l'exposition n'ont pas été calculées à partir de ces sources.
Air intérieur et poussières
Une étude a mesuré la concentration de DMP dans l'air intérieur de résidences canadiennes. Tous les échantillons affichaient des concentrations inférieures à la limite de détection (Zhu et al., 2007). Un résumé des données au sujet de la présence de DMP dans l'air intérieur est présenté ci-dessous.
| Emplacement | Fréquence de détection | Concentration (µg/m3) | Référence |
|---|---|---|---|
| Canada | 0 % de 73 résidences | inférieur(e) à LD (LD non indiquée) | Zhu et al., 2007 |
| Allemagne | 100 % de 59 appartements | Médiane : 0,436 Moyenne : 1,182 95e centile : 4,648 Maximum : 13,907 |
Fromme et al., 2004 |
| Allemagne | 100 % de 74 maternelles | Médiane : 0,331 Moyenne : 1,034 95e centile : 6,249 Maximum : 13,233 |
Fromme et al., 2004 |
| Suède | 100 % de 10 résidences | Médiane : 0,015 Moyenne : 0,018 Plage : 0,0074 - 0,047 |
Bergh et al., 2011a |
| Suède | 100 % de 10 garderies | Médiane : 0,0047 Moyenne : 0,0062 Plage : 0,0023 - 0,014 |
Bergh et al., 2011a |
| Suède | 100 % de 10 lieux de travail | Médiane : 0,0044 Moyenne : 0,0046 Plage : 0,0028 - 0,0079 |
Bergh et al., 2011a |
| Suède | FD non indiquée : 169 appartements | Médiane : 0,016 Moyenne : 0,027 Plage : ND - 0,380 |
Bergh et al., 2011b |
| Chine | 100 % de 10 appartements | Moyenne : 1,299 Plage : ND - 6,578 |
Pei et al., 2013 |
Given that DMP is of moderate volatility (DMP vapour pressure: 0.23 Pascals), exposure from air is expected to occur and is expected to be predominantly from indoor air. The recent Swedish surveys (survey of DMP in apartments and homes) were used for exposure characterization and data from apartments were used specifically as these reported higher concentrations than other homes surveyed (Bergh et al. 2011a,b). DMP concentrations reported in Bergh et al. (2011b) are lower than surveys conducted in Germany and China (Fromme et al. 2004; Pei et al. 2013), but this survey has a higher sample size (n=169 apartments vs. n= 10 apartments vs. 59 homes) and is more recent (when compared to Fromme et al. 2004).
Therefore, mean (0.027 µg/m3) and maximum (0.380 µg/m3) concentrations were used to estimate exposure to the Canadian general population from DMP presence in indoor air; the highest estimates, from this source, were 0.014 and 0.21 µg/kg/day (children aged 0.5 to 4 years old) for central tendency and upper-bounding concentrations, respectively (see Appendix C).
DMP has been detected in numerous surveys of house dust and a summary of the results is provided in Table 9-2 below.
| Emplacement | Fréquence de détection | Concentration (µg/g) | Référence |
|---|---|---|---|
| Canada | 90 % de 126 résidences | Médiane : 0,12 95e centile : 1,4 Plage : ND - 22 |
Kubwabo et al., 2013 |
| États-Unis | 94 % de 33 résidences | Médiane : 0,08 Plage : ND - 3,3 |
Guo et al., 2011 |
| Allemagne | 97 % de 30 appartements | Médiane : 1,5 Moyenne : 10,8 95e centile : 46,4 Maximum : 157,9 |
Fromme et al., 2004 |
| Bulgarie | 92 % de 177 résidences | Moyenne géométrique : 260 Médiane : 280 |
Kolarik et al., 2008a |
| Chine | 99 % de 75 résidences | Médiane : 0,2 Plage : ND* - 8,2 |
Guo et al., 2011 |
| Suède | 100 % de 10 résidences | Médiane : 0,04 Moyenne : 0,1 Plage : 0,03 - 0,1 |
Bergh et al., 2011a |
| Suède | 100 % de 10 garderies | Médiane : 0,1 Moyenne : 0,3 Plage : 0,01 - 1,5 |
Bergh et al., 2011a |
| Suède | 100 % de 10 lieux de travail | Médiane : 0,2 Moyenne : 0,2 Plage : 0,05 - 1,2 |
Bergh et al., 2011a |
| Koweït | 62 % de 21 résidences | Médiane : 0,03 Moyenne géométrique : 0,01 Plage : ND - 0,1 |
Gevao et al., 2013 |
L'enquête sur les poussières domestiques au Canada (Kubwabo et al., 2013) a été retenue comme étant la plus pertinente pour le calcul des estimations de l'exposition de la population canadienne à la poussière. Les estimations les plus élevées étaient ˂ 0,001 et 0,007 µg/kg/jour (enfants de 0 à 6 mois) selon la concentration médiane (0,12 µg/g) et le 95e centile (1,4 µg/g) (voir l'annexe C pour plus de détails).
Aliments et boissons
Les phtalates pourraient être présents dans les aliments et les boissons en raison de leur utilisation potentielle dans les tuyaux et les gants en PVC, les pellicules d'emballage d'aliments, les joints en PVC des récipients en verre, l'encre d'imprimerie dans les emballages d'aliments et ainsi de suite (Fasano et al., 2012). Par conséquent, ils ont été détectés dans divers articles d'emballage alimentaire et de transformation des aliments et on sait qu'ils migrent dans les aliments et les boissons (Alin et al., 2011; Barros et al., 2010; Bradley et al., 2007; Gartner et al., 2009; Page et Lacroix 1992; Fierens et al., 2012; Petersen et Jensen et al., 2010; Xu et al., 2010; Xue et al., 2010).
Au Canada, les phtalates ont été contrôlés lors d'une enquête ciblant le beurre, la margarine et leurs emballages dans le cadre de l'Étude sur l'alimentation globale de Santé Canada (Page et Lacroix, 1992, 1995). Le DMP n'a été détecté dans aucune des des deux enquêtes (Page et Lacroix, 1992, limite de détection [LD] : 1 000 ppb, Page et Lacroix, 1995, LD non indiquée). De même, dans le cadre d'une récente enquête ciblée menée par Santé Canada au sujet de la présence de phtalates dans la viande, le poisson et le fromage, le DMP n'a pas été détecté (limite de détection moyenne [LD] : 2,5 ppb) (Cao et al., 2014)Note de bas de page[5].
La présence de DMP a été surveillée dans le cadre d'études sur l'alimentation totale au Royaume-Uni (LD : 2,0 – 11,5 ppb), aux États-Unis (LD : 0,1 ppb), en Belgique (limite de quantification [LQ] : 0,01 – 5 ppb), en Allemagne (0,2 – 5 ppb), en Chine (LQ : 2 ppb) et à Taïwan (25 – 50 ppb); le DMP a été détecté dans toutes les enquêtes. Notamment, le DMP a été détecté dans 32 % de 400 échantillons alimentaires en Belgique, dans 37 % de 65 échantillons alimentaires aux États-Unis, dans 4 % de 261 échantillons d'aliments vendus au détail au Royaume-Uni, dans 18 % de 350 et 58 % de 171 échantillons alimentaires répétés en Allemagne, dans plus de 60 % de 70 échantillons alimentaires en Chine, puis dans une certaine proportion (fréquence de détection non indiquée) de 1 200 échantillons alimentaires à Taïwan (Fierens et al., 2012; Schecter et al., 2013; Bradley et al., 2013a; Bradley et al., 2013b; Fromme et al., 2007; Fromme et al., 2011; Guo et al., 2012; Chang et al., 2014).
L'étude nord-américaine sur l'alimentation totale (Schecter et al., 2013) a servi d'étude critique pour la caractérisation de l'exposition (l'analyse a montré que l'étude englobait suffisamment d'aliments pour que l'exposition puisse être quantifiée, et l'emplacement géographique visé par l'étude est celui qui est le plus près du Canada), et les données provenant de Bradley et al. 2013a, 2013b ont complété les données manquantes (p. ex., la présence de DMP dans un type de produit alimentaire absent dans l'étude de Schecter et al., 2013).
Les absorptions probabilistes ont été calculées pour le DMP d'après des enquêtes nutritionnelles. Un résumé des résultats et de la méthodologie est présenté dans le tableau C2 de l'annexe C ainsi que dans l'annexe DNote de bas de page[6].
Le groupe affichant la plus importante exposition était celui des enfants de 1 à 3 ans : une absorption de 0,0029 et 0,010 µg/kg/jour pour les concentrations médianes et le 90e centile, respectivement. Chez les adultes, le groupe affichant la plus importante exposition était celui des hommes de 19 à 30 ans : une absorption de 0,0018 et 0,0046 µg/kg/jour pour les concentrations médianes et le 90e centile, respectivement.
Lait maternel
Récemment, dans le cadre de l'Étude mère-enfant sur les composés chimiques de l'environnement (étude MIREC), Santé Canada a surveillé la présence de DMP dans le lait maternel. Le DMP n'a été détecté dans aucun échantillon de lait maternel (n = 305; LD = 1 ng/g; communication personnelle entre la Direction des aliments, Santé Canada et le Bureau d'évaluation du risque des substances existantes, Santé Canada, novembre 2014). Dans une étude précédente menée par Santé Canada, la présence de DMP a été contrôlée dans le lait maternel (21 mères, 86 échantillons) et le DMP n'a été détecté (limite de détection de 0,63 ng/g) dans aucun échantillon (Zhu et al., 2006). Par contre, le DMP devrait être rapidement métabolisé en monométhyle phtalate (MMP) (Koch et Calafat et al., 2009), ce qui pourrait expliquer la non-détection du DMP dans les études susmentionnées.
Dernièrement, l'analyse d'échantillons de lait maternel provenant de 56 femmes dans le cadre de l'étude de cohorte Plastics and Personal-care Product Use in Pregnancy (P4) a révélé un taux de détection du MMP de 100 % (LD : 0,03 µg/l, moyenne géométrique : 0,55 µg/l, médiane : 0,56 µg/l, maximum : 2,8 µg/l) (communication personnelle entre le BSRSE et le BERSE, septembre 2013). Cependant, le dosage de ce métabolite dans le lait maternel a été perturbé par les concentrations élevées dans les échantillons-témoins (contamination possible) et n'a donc pas été retenu pour quantifier l'absorption.
Mortensen et al. (2005) ont recueilli 36 échantillons de lait maternel provenant de mères en bonne santé au Danemark et ont obtenu des concentrations de MMP (fréquence de détection : 89 % des 36 échantillons) allant de inférieur(e) à 0,01 à 1,49 µg/l (médiane : 0,11 µg/l; moyenne : 0,17 µg/l). De plus, Main et al. (2006) ont recueilli des échantillons de lait maternel provenant d'une étude de cohorte longitudinale conjointe menée en Finlande et au Danemark (n = 65 pour chaque pays). Les concentrations médianes de MMP étaient de 0,10 et 0,09 µg/l, au Danemark et en Finlande, respectivement.
En conséquence, l'étude de Mortensen et al., 2005 a été utilisée pour la caractérisation de l'exposition, puis un coefficient de correction de la masse moléculaire a été utilisé afin de convertir l'absorption de MMP en estimation de l'absorption de DMP. L'absorption de DMP par la consommation de lait maternel (nourrissons de 0 à 6 mois) a été estimée à 0,012 et 0,16 µg/kg/jour, d'après les concentrations médiane (0,11 µg/l) et maximum (1,49 µg/l), respectivement (voir l'annexe C pour plus de détails).
Produits utilisés par les consommateurs
Cosmétiques et produits de soins personnels
Selon les avis publiés en vertu du Règlement sur les cosmétiques de Santé Canada, le DMP était présent dans trois produits. Cependant, les déclarations avaient toutes été faites avant 2008 (courriel datant de septembre 2014 de la Direction de la Sécurité des produits de consommation [DSPC], Santé Canada au Bureau d'évaluation du risque des substances existantes [BERSE], Santé Canada). Il est indiqué que le DMP est présent dans trois produits, et ce, à des concentrations entre 1 et 3 %. Les trois produits sont une préparation pour manucure au gel, un colorant capillaire en gel et un produit de coiffure en atomiseur.
Santé Canada (Koniecki et al., 2011) a également mené une étude nationale sur la présence de 18 phtalates dans les cosmétiques et les produits de soins personnels offerts sur le marché canadien. Au total, 18 phtalates ont été contrôlés dans 252 produits (dont 98 produits de soins pour bébés) recueillis dans plusieurs provinces canadiennes (régions de l'Atlantique, de l'Ontario, de l'Alberta, du Manitoba/de la Saskatchewan) de décembre 2007 à avril 2008. Ces produits incluent des parfums, des produits de soins capillaires, des déodorants et des vernis à ongles (Koniecki et al., 2011). Seulement 5 des 18 phtalates ciblés ont été détectés. Le DMP a été détecté dans 1 des 252 produits analysés, et il était présent à une concentration de 72 µg/g dans 1 des 18 déodorants. La limite de détection était de 0,5 µg/g.
Hubinger et Havery (2006) ont acheté 48 produits de soins personnels à Washington DC et ont détecté le DMP dans 3 des 48 échantillons prélevés (LD : 10 µ/g). Dans le vernis à ongles, les concentrations de DMP variaient de valeurs inférieures à la LD jusqu'à 15 395 µg/g. Une étude subséquente réalisée par les mêmes auteurs à Washington DC n'a pas permis de détecter de DMP (LD : 10 µg/g) dans les produits échantillonnés (Hubinger, 2010).
Guo et al. (2013) ont également détecté le DMP dans des échantillons de produits (17 % de 52 produits, limite de détection de 0,1 µg/g) provenant de la Chine. Notamment, le DMP a été détecté dans une lotion pour les mains et le corps (médiane : 0,1 µg/g, moyenne : 0,2 µg/g, maximum : 4,4 µg/g), un shampoing (médiane : ND, moyenne : 0,1 µg/g, maximum : 0,7 µg/g) et un nettoyant pour le corps (médiane : ND, moyenne : 0,1 µg/g, maximum : 0,8 µg/g).
Enfin, Guo et Kannan (2013) ont également contrôlé la présence de DMP dans 170 produits de soins personnels à Albany, New York (LD : 0,01 µg/g, 50 fois inférieure aux résultats de Koniecki et al., [2011]) et ont détecté le DMP dans 11 % des 170 produits. Les résultats de leurs analyses sont présentés dans le tableau 9-3 ci-dessous).
| Produit (nombre d'unités) | Concentration de DMP (µg/g) |
|---|---|
| Nettoyant pour le corps (n = 11) | Moyenne : 0,01 Maximum : 0,09 |
| Shampoing (n = 9) | Moyenne : 0,07 Maximum : 0,32 |
| Revitalisant capillaire (n = 7) | Moyenne : ND Maximum : ND |
| Nettoyant pour le visage (n = 9) | Moyenne : 0,01 Maximum : 0,06 |
| Gel de rasage (n = 5) | Moyenne : ND Maximum : ND |
| Lotion pour la peau (n = 23) | Moyenne : 0,39 Maximum : 5,68 |
| Produit de soins capillaires (n = 6) | Moyenne : 3,71 Maximum : 12,1 |
| Parfum (n = 12) | Moyenne : ND Maximum : ND |
| Lotion tonique (n = 9) | Moyenne : 0,03 Maximum : 0,28 |
| Déodorant (n = 14) | Moyenne : 1,51 Maximum : 20,6 |
| Crème pour le visage (n = 21) | Moyenne : 0,52 Maximum : 10,7 |
| Ligneur en crème (n = 4) | Moyenne : ND Maximum : ND |
| Crème pour les mains (n = 3) | Moyenne : ND Maximum : ND |
| Écran solaire (n = 5) | Moyenne : ND Maximum : ND |
| Rouge à lèvres (n = 4) | Moyenne : 0,04 Maximum : 0,18 |
| Vernis à ongles (n = 8) | Moyenne : 0,03 Maximum : 0,22 |
| Shampoing (n = 4) | Moyenne : 0,17 Maximum : 0,68 |
| Lotion et huile (n = 4) | Moyenne : ND Maximum : ND |
| Écran solaire (n = 6) | Moyenne : ND Maximum : ND |
| Crème contre l'érythème (n = 3) | Moyenne : 0,17 Maximum : 0,51 |
| Poudre (n = 1) | ND |
À partir des concentrations mentionnées dans les publications de GuoNote de bas de page[7] et de Koniecki et al. (2011), ainsi que les avis communiqués de Santé Canada, en vertu du Règlement sur les cosmétiques, nous avons estimé pour la population canadienne l'absorption quotidienne de DMP découlant de l'utilisation de cosmétiques et de produits de soins personnels (annexe E). Cette absorption a été estimée à l'aide du logiciel ConsExpo 4.1 (RIVM 2007).
Nous avons sélectionné des produits représentatifs pour évaluer l'absorption cutanée quotidienne de DMP chez les adultes (20 ans et plus) et les nourrissons (0 à 0,5 mois), ces groupes d'âge correspondant aux applications sans rinçage, à la plus haute fréquence d'utilisation et aux concentrations les plus élevées de DMP (tableaux 9-4 et 9-5).
| Produit sentinelleNotes de bas de page Tableau 9-4[a].1,Notes de[b].1bas de page Tableau 9-4[b].1 | Concentration (µg/g) | Absorption (µg/kg/jour) | Référence |
|---|---|---|---|
| Laque (adulte) | Minimum : 10 000 Maximum : 30 000 |
Minimum : 6,6 Maximum : 20 |
Avis en vertu du Règlement sur les cosmétiques, DSPC |
| Vernis à ongles (adulte) |
Minimum : 10 000 Maximum : 30 000 |
Minimum : 0,30 Maximum : 0,90 |
Avis en vertu du Règlement sur les cosmétiques, DSPC |
| Déodorant solide (adulte) |
Moyenne : 1,51 Maximum : 72 |
Moyenne : 0,0017 Maximum : 0,079 |
Guo et Kannan, 2013; Koniecki et al., 2011 |
| Lotion pour le corps (adulte) | Moyenne : 0,39 Maximum : 5,68 |
Moyenne : 0,0027 Maximum : 0,039 |
Guo et Kannan, 2013 |
| Crème pour le visage (adulte) | Moyenne : 0,52 Maximum : 10,7 |
Moyenne : 0,0016 Maximum : 0,033 |
Guo et Kannan, 2013 |
| Déodorant solide (adulte) | Moyenne : 1,51 Maximum : 20,6 |
Moyenne : 0,0017 Maximum : 0,023 |
Guo et Kannan, 2013 |
| Mousse coiffante | Moyenne : 3,71 Maximum : 12,1 |
Moyenne : inférieur(e) à 0,001 Maximum : 0,0031 |
Guo et Kannan, 2013 |
| Lotion pour le corpsNotes de bas de page Tableau 9-4[c].1 (nourrisson) |
Moyenne : 0,1 Maximum : 4,4 |
Moyenne : 0,0032 Maximum : 0,14 |
Guo et al., 2013 |
| Crème contre l'érythème (nourrisson)Notes de bas de page[d].1Tableau 9-4[d].1 | Moyenne : 0,17 Maximum : 0,51 |
Moyenne : 2,7 Maximum : 8,2 |
Guo et Kannan, 2013 |
| Produit sentinelleFootnote Table 9-5[a].2 | Concentration (µg/g) | Absorption (µg/kg/jour) | Référence |
|---|---|---|---|
| Colorant capillaire (adulte)Footnote Table 9-5[b].2 | Minimum : 10 000 Maximum : 30 000 |
Minimum : 140 Maximum : 420 |
Avis en vertu du Règlement sur les cosmétiques, DSPC |
Chez les adultes, les produits affichant le plus fort potentiel d'exposition cutanée chronique au DMP sont la laque et la mousse coiffante (selon les concentrations élevées du produit). Chez les nourrissons (âgés de 0 à 6 mois), la crème contre l'érythème constitue le produit ayant le plus fort potentiel d'exposition cutanée chronique au DMP. En ce qui concerne la voie orale, l'exposition au DMP causée par la présence de DMP dans le rouge à lèvres est estimée à moins de 1 ng/kg/jour.
Considérant que le DMP est peu volatil (pression de vapeur : 0,23 pascal), l'absorption par inhalation, lors de l'utilisation de produits de soins personnels, devrait découler principalement des aérosols plutôt que de la vapeur. Il en résulte que l'exposition au DMP par inhalation de laque (1 – 3 %, le seul produit aérosol où l'on a détecté du DMP) a été modélisée. Il est estimé que l'utilisation de laque (1,5/jour) contenant 1 – 3 % de DMP donne lieu à des concentrations moyennes de 0,27 à 0,82 mg/m3 et une absorption de 0,76 à 2,3 µg/kg/jour, selon les concentrations minimum et maximum, respectivement. En matière d'exposition par inhalation de vapeur, en raison de la faible volatilité de la vapeur, l'exposition au DMP par cette voie ne devrait pas être importante.
Biosurveillance
Dans le cadre des cycles 1 et 2 de l'Enquête canadienne sur les mesures de la santé (ECMS), on a mesuré le MMP (le monoester du DMP) dans l'urine (Santé Canada, 2013). Les deux cycles présentent une limite de détection de 5 µg/l pour le MMP. Le MMP étant rarement détecté, et ce, uniquement à des centiles plus élevés (58 – 74 % en deçà de la limite de détection : cycles 1 et 2, détection au 95e centile et plus).
Santé Canada a également surveillé la présence de MMP dans l'urine dans le cadre de l'Initiative de biosurveillance de l'Assemblée des Premières Nations (APN 2013) et de deux études de cohorte : l'Étude concernant l'utilisation de plastiques et de produits de soins personnels durant la grossesse (P4, n = 31 femmes, 542 échantillons ponctuels d'urine; les femmes ont donné de nombreux échantillons d'urine au cours de deux visites) et l'Étude mère-enfant sur les composés chimiques de l'environnement – Child Development Plus (étude MIREC-CD Plus, 194 enfants, 2 – 3 ans, 1 échantillon ponctuel par individu). (Communication personnelle de la Direction des sciences de la santé environnementale et de la radioprotection [DSSER] au Bureau d'évaluation du risque des substances existantes [BERSE], octobre 2013, 2014). Par contre, les limites de détection de ces trois études étaient également de 5 µg/l, et la présence de MMP a été détectée à de faibles fréquences et aux centiles les plus élevés.
Dernièrement, une méthode plus sensible (LD de 0,2 µg/l) a été élaborée pour les enfants participant à l'étude MIREC (données non publiées, de la DSSER au BERSE, octobre 2014). Le MMP a été détecté dans tous les échantillons. Une autre méthode présentant une limite de détection plus basse (0,1 µg/l, soit une limite de détection 50 fois plus basse que la LD mentionnée plus haut) a également été utilisée par les Centers for Disease Control and Protection (CDC, 2013).
Compte tenu des obstacles méthodologiques présentés ci-dessus, les données de l'étude NHANES ont été utilisées comme substitut pour estimer l'exposition de la population du Canada (6 ans et plus), alors que les données de l'étude MIREC-CD Plus ont été utilisées pour estimer l'exposition des enfants âgés de 2 à 3 ans (voir les tableaux 9-6 à 9-8.
La fraction d'excrétion urinaire (FEU) d'une substance est définie comme étant le rapport moléculaire entre la quantité de métabolites excrétés dans l'urine (après 24 heures) et la quantité totale de la molécule mère ingérée. Comme il n'existe aucune étude pharmacocinétique sur l'humain pour le DMP, une approche en lecture croisée a été adoptée pour estimer la FEU pour le DMP. Koch et Calafat et al. (2009) ont recommandé l'utilisation de DnBP (FEU : MnBP, monoester = 0,69, Anderson et al., 2001) pour le DEP. Le DEP est un phtalate semblable au DMP et il possède un profil métabolique similaire, c.-à-d. les deux phtalates devraient se métaboliser en leurs monoesters respectifs. Cette hypothèse est soutenue par les données provenant d'études pharmacocinétiques menées chez les rongeurs pour ces deux composésNote de bas de page[8].
Considérant ces données, la FEU de 0,69 pour le DnBPNote de bas de page[9] a également été utilisée pour le DMP. L'absorption a été corrigée pour la dilution dans l'urine à l'aide d'une méthode de correction par la créatinine; une méthode couramment utilisée dans le cadre de la biosurveillance des phtalates (Fromme, 2007, Christensen et al., 2014, US CPSC CHAP 2014, Frederiksen et al., 2014). Les taux d'excrétion journalière de créatinine chez les participants ont été estimés à l'aide de l'équation de Mage et les taux d'absorption mesurés en biosurveillance présentés aux tableaux 9-6, 9-7 et 9-8 ci-dessous (voir l'Annexe F pour plus de renseignements au sujet de la méthodologie).
| Groupe d'âge | n | Moyenne géométrique | 50e | 75e | 95e |
|---|---|---|---|---|---|
| 6-11 | 209 | 0,082 | 0,092 | 0,16 | 0,66Note de bas de page Tableau 9-6[b].3 |
| 12-19 | 225 | 0,039 | 0,042 | 0,087 | 0,29 |
| 20+ | 949 | 0,026 | 0,026 | 0,064 | 0,24 |
| Groupe d'âge | n | Moyenne géométrique | 50e | 75e | 95e |
|---|---|---|---|---|---|
| 6-11 | 204 | 0,076 | 0,087 | 0,16 | 0,52 |
| 12-19 | 189 | 0,029 | 0,032 | 0,057 | 0,19 |
| 20+ | 948 | 0,027 | 0,027 | 0,060 | 0,26 |
| Groupe d'âge | n | Moyenne arithmétique | 50e | 75e | 95e, 95% CI |
|---|---|---|---|---|---|
| 2 - 3 | 197 | 0,27 | 0,19 | 0,33 | 0,66 |
Le groupe présentant la plus forte exposition (toutes les sources, MIREC-CD Plus) est celui des garçons de 2 à 3 ans pour lequel les concentrations médianes et celles du 95e centile étaient respectivement de 0,27 et 0,66 µg/kg/jour. Chez les humains plus âgés, le groupe présentant la plus forte exposition (toutes les sources, NHANES) est celui des adolescents de 12 à 19 ans pour lequel les concentrations médianes et celles du 95e centile étaient respectivement de 0,42 et 0,29 µg/kg/jour.
9.2 Effets sur la santé
9.2.1 Modèles toxicocinétiques
Cette section examine les modèles toxicocinétiques du DMP et du phtalate analogue DEP.
9.2.1.1 Voie orale
Chez le rat, le DMP est absorbé rapidement et abondamment dans le tractus gastro-intestinal. Après l'administration orale à cet animal, les métabolites primaires de ce phtalate mesuré dans l'urine étaient les phtalates monométhyliques (MMP) (78 %). L'urine contenait également de l'acide phtalique libre (14,4 %) et du DMP inchangé (8,1 %) [tableau 9-9 ci-dessous] (NICNAS, 2008; US CPSC, 2010a).
De même, les données portant sur le DEP indiquent qu'à la suite de l'administration d'une dose orale, ce phtalate est rapidement absorbé, réparti, métabolisé et excrété dans l'urine, et ce, principalement sous la forme de phtalate monoéthylique (MEP) [tableau 9-9 ci-dessous]. Dans une étude dans laquelle du DEP marqué au 14C a été administré par voie orale à des rats et des souris, la radioactivité a été observée dans les tissus, l'urine et les selles, 48 heures après la prise de la dose. Les concentrations maximales de radioactivité ont été observées après 20 minutes et étaient plus élevées dans les reins et le foie, puis dans le sang, la rate et la graisse. Après 24 heures, seules des traces de radioactivité ont été détectables. Les taux d'excrétion urinaire et fécale ont atteint 90 et 2,7 %, respectivement, 48 heures suivant l'administration (Loku et al., 1976). Chez des rats Wistar auxquels 10 mg ou 100 mg de DEP avait été administré par gavage, les échantillons urinaires journaliers ont révélé un taux d'excrétion urinaire sous les 75 % dans les 24 premières heures, et ce, pour les deux doses. Ces excrétions se composaient du monoester MEP (67 – 70 %), d'acide phtalique (8 – 9 %) et de la molécule mère (0,1 – 0,4 %). De 83 à 90 % de la dose administrée fut excrétée dans l'urine après une semaine (Kawano 1980). Lors d'une expérience d'administration orale de DEP à des chiens juvéniles, la quantité de MEP détecté dans le plasma et l'urine représentait la majorité de la dose de DEP (~ 1,2 mg) administrée par voie orale (Kao et al., 2012). Au cours de cette étude, environ 90 à 96 % de la dose administrée fut excrétée dans l'urine en 72 heures.
L'hydrolyse de DMP en MMP et de DEP en MEP a été démontrée in vitro dans les broyats de foie et les préparations de cellules muqueuses intestinales provenant de rats, de babouins et de furets, ainsi que dans les préparations de cellules muqueuses intestinales provenant d'humains (Lake et al., 1977; Rowland et al., 1977;White et al., 1980). L'hydrolyse de DEP en MEP a également été démontrée dans les reins et les poumons de rats (Kayano et al., 1997), puis dans la peau de rats et d'humains (Mint et Hotchkiss, 1994).
| Phtalate | Abrév. | Métabolite détecté dans l'urine après l'administration orale | Abrév. | Référence (espèce) |
|---|---|---|---|---|
| Phtalate de diméthyle 131-11-3 |
DMP | Phtalate de diméthyle | DMP | Albro et Moore 1974 (rat); Suzuki et al., 2012 (human)Note de bas[a].6de page Tableau 9-9[a].6; Kasper-Sonnenberg et al., 2012 (humain)a |
| Phtalate de diméthyle 131-11-3 |
DMP | Phtalate monométhylique | MMP | Albro et Moore 1974 (rat) |
| Phtalate de diméthyle 131-11-3 |
DMP | Acide phtalique | PA | Albro et Moore 1974 (rat) |
| Diisocyanate de 2,2,4-triméthylhe-xaméthylène 84-66-2 |
DEP | Diisocyanate de 2,2,4-triméthylhexaméthylène | DEP | Kawano, 1980 (rat) |
| Diisocyanate de 2,2,4-triméthylhe-xaméthylène 84-66-2 |
DEP | Acide phtalique | PA | Kawano, 1980 (rat) |
| Diisocyanate de 2,2,4-triméthylhe-xaméthylène 84-66-2 |
DEP | Phtalate monoéthylique | MEP | Suzuki et al., 2012 (human)a; Kasper-Sonnenberg et al., 2012 (human)a; Kao et al., 2012 (chein); Kawano 1980 (rat) |
Grossesse et allaitement
Certaines études menées auprès de femmes enceintes ont porté sur la teneur en MMP ou en MEP du liquide amniotique. En général, ces métabolites sont indétectables, mais s'ils sont présents, ils ne sont détectés que sous forme de traces (Silva et al., 2004; Huang et al., 2009).
Des études montrent qu'il existe des différences sur le plan de la concentration des différents phtalates présents dans les testicules du fœtus, à la suite d'une exposition durant la grossesse. Les concentrations les plus élevées détectées dans les testicules de fœtus à la suite d'une exposition maternelle correspondaient aux métabolites de plus petits phtalates comme le DMP et le DEP. Les concentrations les moins élevées détectées correspondaient aux métabolites de DEHP (Clewell et al., 2010).
Une revue des études sur la présence de phtalates dans le lait maternel humain indique la présence de DEP et de son monoester MEP (Frederiksen et al., 2007).
9.2.1.2 Inhalation
Nous n'avons recensé aucune étude toxicocinétique pour le DMP ou le DEP.
9.2.1.3 Voie cutanée
Dans le cadre d'une étude, on a appliqué des diesters de phtalate marqués au 14C sur le dos de rats (du DMP et du DEP 5-8 mg/cm2; la peau non nettoyée après l'application et le site été recouvert d'une calotte perforée), et on a observé qu'une grande partie de la dose restait au site de l'application (dans la peau), et ce, pour toutes les substances testées. Selon les taux d'excrétion urinaire et fécale, environ 40 % des doses de DMP et 50 % de celles de DEP ont été absorbées en sept jours. Pour la plupart des diesters, la répartition dans les tissus après sept jours était généralement peu élevée (de 0,5 à 1,5 % de la dose appliquée a été trouvée dans les tissus). Approximativement 0,6 % et 0,3 % de la dose appliquée de DMP, et 0,14 % et 0,03 % de la dose appliquée de DEP ont été détectés respectivement dans les muscles et dans les tissus adipeux. De plus, dans les deux cas, moins de 0,5 % de la dose appliquée a été retrouvée dans d'autres tissus examinés (cerveau, moelle épinière et testicules) (Elsisi et al.,1989). Dans les quatre jours suivant l'application, de DEP (dose non spécifiée) sur la peau de lapins, approximativement 49 % et 1 % de la dose a été respectivement détectée dans l'urine et les selles. Moins de 1 % de la radioactivité a été détectée dans le foie, les reins et le sang (RIFM 1973; NICNAS, 2008; US CPSC, 2010a) ce qui implique que les phtalates à chaîne courte absorbés par les animaux se répartissent et s'éliminent rapidement et que l'accumulation est limitée.
Elsisi et al., (1989) ont fait état d'une relation entre la longueur des chaînes latérales et l'excrétion fécale : 24 heures après l'exposition par voie cutanée aux diesters (chaînes alkyles de 1 à 10 C), le taux d'excrétion fécale augmente en fonction de la longueur des chaînes latérales. Les auteurs ont signalé que l'excrétion fécale constituait moins de 16 % de l'excrétion totale pour les diesters ayant une chaîne latérale de 6 C ou moins, et qu'elle constituait seulement 0,1 % de l'excrétion totale pour le DMP, et 1 % pour le DEP.
Au cours d'une étude de deux semaines menées auprès d'un groupe de 26 hommes de race blanche et en bonne santé, les participants ont reçu des applications topiques sur le corps entier d'une crème de contrôle (posologie : 2 mg/cm2), une fois par jour pendant cinq jours consécutifs, puis cinq fois par jour de la même crème contenant 2 % (par volume) de DEP (ainsi que 2 % de phtalate de dibutyle et 2 % de butylparabène). Des échantillons de sang et d'urine ont été recueillis et analysés au cours de l'étude pour déterminer les niveaux de MEP. Deux heures après la première application de la crème contenant le DEP, la concentration sérique de MEP s'est élevée à 1001 µg/l (soit 6,9 mg) et est retombée à 23 µg/l après 24 heures, juste avant la deuxième application. En ce qui concerne les concentrations de MEP dans le sang, le pourcentage total absorbé est estimé à 10 % de la dose appliquée. Dans l'urine, la majorité du MEP a été excrété dans les huit premières heures suivant l'application. L'absorption cutanée moyenne de DEP, estimée à partir des taux d'excrétion urinaire journalière de MEP, était de 5,8 % (Janjua et al., 2007, 2008; NICNAS, 2011).
L'absorption et la rétention dermiques de DBP dans la peau de rats et d'humains ont également été étudiées in vitro. Des diesters de phtalates (20 mg/cm2) ont été appliqués sur l'épiderme de peau pectorale humaine ou de peau dorsale de rat pleine épaisseur placée sur les cellules de diffusion (le liquide de Hanks a servi de fluide récepteur) (Mint et Hotchkiss 1993; Mint et al., 1994). Les résultats ont montré que la rétention de la peau était 3 à 6 fois plus élevée chez le rat que chez l'humain. Mint et Hotchkiss (1993) ont constaté que, après 72 h, la moitié du phtalate de diméthyle, ou DMP (52 %) appliquée était encore présente sur la surface de la peau humaine, comparativement à 27 % sur la surface de la peau de rat, et la fraction présente à l'intérieur de la peau était de 5 % chez l'humain et de 30 % chez le rat. Quant au DEP, un peu moins de la moitié de la dose appliquée (44 % à 46 %) était toujours présente sur la surface de la peau humaine, comparativement à 20 % sur la peau de rat, et la fraction présente à l'intérieur de la peau était de 10 % chez l'humain et de 35 % chez le rat (Mint et al., 1994). Ces résultats indiquent que la peau de rat est plus perméable aux phtalates à chaîne courte que la peau humaine. Une autre étude a indiqué que l'absorption de DMP par voie cutanée était environ 10 à 20 fois plus élevée chez le rat que chez l'humain (Scott et al., 1987; 1989 [erratum]). Les auteurs de cette étude ont également indiqué que, bien que le taux d'absorption de la peau de rat soit comparable, le taux d'absorption de DMP in vitro a été trois fois plus élevé que le taux d'absorption du phtalate de diéthyle, ou DEP, chez l'humain.
Les tableaux 9-10 et 9-11 résument les valeurs d'absorption de DMP et DEP (en pourcentage) par voie cutanée obtenues in vivo et in vitro.
Concernant l'absorption par voie cutanée, bien que les études in vivo menées chez les animaux indiquent une absorption par voie cutanée d'environ 40 % à 50 % de phtalates à chaîne courte, de récentes études in vivo et in vitro montrent, en général, que l'absorption de DMP et DEP chez l'humain est très inférieure à celle enregistrée chez les animaux. Cette différence pourrait s'expliquer par les différences entre espèces, notamment les différences de perméabilité de la peau, comme le montrent les études in vitro et (ou) divers facteurs liés aux diverses méthodes employées dans les différentes études. Compte tenu de cela et des résultats de Janjua et al., (2008) indiquant une absorption cutanée moyenne du DEP de 5,8 % chez les humains, comme décrit plus haut, la biodisponibilité cutanée des phtalates à chaîne courte chez les humains ne devrait pas dépasser 10 %. Ce chiffre concorde avec la biodisponibilité cutanée du DEP observée par NICNAS dans le rapport d'analyse des substances prioritaires existantes (NICNAS, 2011) et dans la récente analyse du DMP dans laquelle on affirme que « la biodisponibilité cutanée du DMP chez les humains ne serait pas inférieure à celle du DEP, c'est-à-dire 10 % » (NICNAS, 2014).
| Substance | Espèce | Dose | Base | Absorption (% de la dose et/ou d'absorption) | Référence |
|---|---|---|---|---|---|
| DEP | Humains | 5x 2 mg/cm2 | Urine | Au moins 5,8 % par jour pendant 5 jours | Janjua, et al., (2008) |
| DEP | Humains | 5x 2 mg/cm2 | Sang | 700-1 000 μg/l/h pendant 8 h après une première application; 10 % | Janjua, et al., (2007) |
| DEP | Rats | 1x 30-40 mg/kg | Urine et tissus | 50 % pendant 7 jours | Elsisi, et al., (1989) |
| DMP | Rats | 1x 30-40 mg/kg | Urine et tissus | 40 % pendant 7 jours | Elsisi, et al., (1989) |
| Substance | Espèce | Échan-tillon de peau | Dose | Durée de l'exposition | Fluide récepteur | Absorption (% de la dose, taux d'absorption et/ou constante de perméabilité [Kp]) | Référence |
|---|---|---|---|---|---|---|---|
| DEP | Humains | Peau pectorale pleine épaisseur | 16,3-20,6 mg/cm2 Non recouverte |
72 h | Liquide de Hanks | 4,2 % pendant 72 h État stationnaire : 14 μg/cm2/h (12-72 h) |
Mint et al., (1994) |
| DEP | Rats | Peau dorsale pleine épaisseur | 16,3-20,6 mg/cm2 Non recouverte |
72 h | Liquide de Hanks | 35% pendant 72 h, État stationnaire : 103 μg/cm2/h (12-72 h) |
Mint et al., (1994) |
| DEP | Humains | Épiderme (peau abdomi-nale) | 0,5 ml | 30 h | Éthanol à 50 % | État stationnaire : 1,27 μg/cm2/h Kp=1.14 x 10-5 cm/h |
Scott et al., (1987) |
| DEP | Rats | Épiderme (peau dorsale) | 0,5 ml | 8 h | Éthanol à 50 % | État stationnaire : 41,37 μg/cm2/h Kp=37,0 x 10-5 cm/h |
Scott et al., (1987) |
| DMP | Humains | Peau pectorale pleine épaisseur | 20 mg/cm2 | 72 h | Liquide de Hanks | 3 % pendant 72 h État stationnaire 9,4 μg/cm2/h |
Mint et Hotchkiss (1993) |
| DMP | Rats | Peau dorsale pleine épaisseur | 20 mg/cm2 | 72 h | Liquide de Hanks | 20,8 % pendant 72 h État stationnaire 66,8 μg/cm2/h |
Mint et Hotchkiss (1993) |
| DMP | Humains | Épiderme (peau abdomi-nale) | 0,5 ml | 30 h | Éthanol à 50 % | 3,95 μg/cm2/h Kp=3,33 x 10-5 cm/h |
Scott et al., (1987) |
| DMP | Rats | Épiderme (peau dorsale) | 0,5 ml | 8 h | Éthanol à 50 % | 41,6 μg/cm2/h Kp=34,5 x 10-5 cm/h |
Scott et al., (1987) |
9.2.2 Effets sur la reproduction et sur le développement
Les trois premiers segments de cette section traitent des effets sur la reproduction et le développement des sujets de sexe masculin à trois stades de leur vie (exposition gestationnelle [0 à 21 jours de gestation], prépubère/pubertaire [1 à 55 jours après la naissance] et adulte [plus de 55 jours après la naissance]), tout particulièrement chez les individus du sexe masculin, car le DMP fait partie d'un plus grand groupe de substances auxquelles on attribue des effets antiandrogènes spécifiques chez les mâles (syndrome des phtalates chez les rats (SPR), voir Santé Canada [2015a] pour plus de détails). Les effets nocifs observés à la suite d'une exposition au DMP pendant la gestation sont organisés et présentés en détail : 1) variation des taux hormonaux (sérique ou testiculaire); 2) effets de féminisation; 3) malformations de l'appareil génital et (ou) effets sur la fertilité; et 4) divers effets sur le développementNote de bas de page[10]. La description des effets à chaque stade vital est structurée de façon à présenter en premier les effets découlant des doses les plus faibles. Les effets possibles du DMP sur la reproduction et le développement chez les animaux femelles sont présentés ci-dessous de façon analogue, tout en tenant compte du stade vital et de la sensibilité de l'espèce. Lorsqu'aucune étude sur le DMP n'était disponible pour un stade de vie donné ou une période d'exposition particulière, une analyse des effets du DEP analogue de sur la santé a été réalisée (Santé Canada 2015a). Les derniers segments traitent surtout des études du système endocrinien et des effets sur la reproduction et le développement chez l'humain.
9.2.2.1 Développement fœtal : Exposition in utero
Nous avons recensé dans les publications scientifiques, six études sur la toxicité potentielle du DMP pendant la gestation des rattes, dont deux études seulement traitaient des effets sur la fonction reproductive des mâles au cours de la période de masculinisation (entre 15 et 17 jours de gestation) alors que d'éventuels effets antiandrogènes pourraient être observés. Les sommaires de ces études sont présentés au tableau 9-12 ci-dessous.
En général, quel que soit le moment de l'exposition pendant la gestation, aucun effet sur le développement des fœtus n'a été observé aux doses les plus élevées. De plus, aucune toxicité importante chez la mère n'a été constatée. L'observation plus attentive de la faible réaction des gènes de la stéroïdogenèse appuie l'hypothèse que le DMP n'est pas un facteur actif de la toxicité pour l'appareil reproducteur du rat mâle au cours de la gestation (Liu et al., 2005). L'exposition par voie cutanée des rattes au DMP pendant la gestation (1 à 20 jours de gestation) n'a pas eu d'incidence sur le développement de la progéniture jusqu'à des doses de 2380 mg/kg de p.c./jour, mais elle a causé une légère diminution du gain de poids corporel chez les rattes gestantes (Hansen et Meyer 1989).
Des résultats semblables ont été observés lors d'essais sur les souris de la toxicité du DMP sur le développement (tableau 9-12). Il convient toutefois de souligner que les paramètres de la reproduction touchant directement le système reproducteur mâle, associés à certains phtalates tributaires du SPR n'ont pour la plupart pas été mesurés chez la souris. Par conséquent, aucune conclusion ne peut être tirée concernant le potentiel spécifique du DMP à induire ce syndrome chez les souris.
| Souche et espèce; Dose (mg/kg de p.c./jour); Voie d'exposition; Durée (référence) |
Taux de testosté-roneNotes de[a].7bas de page[a].7Tableau 9-12[a].7 (T, S) |
Para-mètres de la fémini-sationNotes de[b].4bas de page Tableau[b].49-12[b].4 | Malfor¬mations du tractus génital et (ou) fertilitéNotesde bas de page Tableau 9-12[c].2 | Autres para-mètres pour le développementNotes de bas de page[d].2Tableau 9-12[d].2 | Effets maternels |
|---|---|---|---|---|---|
| Rats SD Harlan; 0, 750; 14 à 18 jours de gestation (Furr et al., 2014). |
SE (T) NM (S) |
NM | NM | NM (p.c.) NM (POR) SE (Viabilité du foetus [FV]) NM (Embryotoxicité [EMB]) NM (ESV) |
750 (↓du gain de p.c.) |
| Rats SD; 0, 750; Gavage; du 14e jour de gestation au 3e jour après la naissance (Gray et al., 2000). |
SE (T) SE (S) |
SE (DAG) SE (RT) SE (SPP) |
SE (CRY) SE (HYP) NM (FER) |
SE | SE |
| Rats SD; 0, 500; Gavage; 12 à 19 jours de gestation (Liu et al., 2005) |
NM | SE (DAG) NM (RT) NM (SPP) |
NM | NM | SE |
| Rats CD; 0, 0,25, 1,0, 5,0 %, est. 0, 200, 840, 3570; Régime alimentaire; 6 à 15 jours de gestation (NTP 1989; Field et al., 1993). |
NM | NM | NP | SE | DMEO = 3570 (variations transitoires du poids corporel, ↑du poids relatif du foie) |
| Souris CD-1; 0, 3500; gavage; 7 à 14 jours de gestation (NTP 1983; Plasterer et al., 1985). | NM | NM | NM | SE | SE |
| Souris CD-1; 0, 3500, 5000, gavage; 6 à 13 jours de gestation (Hardin et al., 1987). |
NM | NM | NM | SE | DMENO = 5000 (28 % de décès maternels) |
| Rats Wist. : mol. chez les exogames; 0, 0,5, 1,0, 2,0 ml/kg de p.c./jour, est. 0, 595, 1190, 2380; voie cutanée; 6 à 15 jours de gestation, 1 à 20 jours de gestation [dose élevée uniquement] (Hansen et Meyer 1989) |
NM | NM | NM | SE | DMEO = 2380 (légère diminution du poids corporel) |
Effets observés d'autres phtalates à chaîne de longueur/taille similaire
Le phtalate de diéthyle [DEP] (acide 1,2-benzènedicarboxylique, Ester de diéthyle : numéro CAS 84-66-2) a été jugé comme phtalate analogue le plus proche du DMP de cette sous-catégorie en raison de la similitude de la longueur et de la nature des chaînes d'ester (Section2.3.2; Santé Canada, 2015a). Les résultats de ces mêmes études utilisant le DMP (longueur et taille de chaîne similaire) semblent être comparables (Gray et al., 2002). 2000; Liu et al., 2005). La seule exception est une étude du régime alimentaire multigénérationnel chez les rats où on a observé une augmentation de la fréquence de spermatozoïdes anormaux et sans flagelle chez les générations F0 et F1, sans aucun effet sur la fertilité chez l'une ou l'autre génération, de même qu'aucun effet sur les testicules de la progéniture ou sur les divers paramètres, dont la DAG (Fujii et al., 2005). Le gain de poids corporel avant le sevrage chez les générations F1 et F2 a cessé à la dose maximale (1016 mg/kg de p.c./jour) et de nombreuses variations du poids d'organes ont été observées, mais aucune anomalie histopathologique n'a été constatée (Fujii et al., 2005). Une étude par Howdeshell et ses collègues (2008) a permis de constater une faible réaction des taux de testostérone testiculaire à des doses aussi élevées que 900 mg/kg de p.c./jour, bien que les taux de testostérone sérique n'aient pas été mesurés.
Les résultats d'études menées à l'aide du DEP chez les souris semblent être également semblables aux résultats d'études du DMP sur cette espèce; où les effets ont été observés sur la viabilité et sur la fertilité des nouveau-nés à la dose maximale d'essai du DEP (3640 mg/kg de p.c./jour; Lamb, 1987). Lors d'une autre étude, aucun effet n'a été observé chez la progéniture après une exposition à dose élevée (4500 mg/kg de p.c./jour) au DEP des mères entre 6 et 13 jours de gestation (Hardin 1987). Comme avec le DMP, la plupart des paramètres de la reproduction touchant directement le système reproducteur mâle, en ce qui a trait au syndrome des phtalates chez les rats, n'ont pas été mesurés à l'aide du DEP administré chez les souris.
Aucune étude sur le développement portant sur l'exposition gestationnelle au DMP ou au DEP chez d'autres espèces n'a été recensée.
En général, la dose maximale sans effet nocif observé (DSENO) lors d'études de la toxicité du DMP sur le développement a été de 750 mg/kg de pc/jour lors des études menées au cours de la masculinisation du développement du système reproducteur (Gray et al., 2000; Furr et al., 2014). Cette même dose avec effets a été établie par le Chronic Hazard Advisory Panel (CHAP) de la US CSPC (2014). La DMENO d'exposition par voie orale la plus faible associée à la toxicité maternelle était de 3750 mg/kg de p.c./jour sur la base d'une diminution transitoire du gain de poids corporel lors d'une étude du régime alimentaire à court terme chez des rats entre 6 et 15 jours de gestation, accompagnée d'une augmentation légère, mais significative du poids du foie dès le 20e jour de gestation (DSENO de 840 mg/kg de p.c./jour; Field 1993). La DSENO la plus élevée de DMP administrée par voie cutanée pour étudier sa toxicité pour le développement était de 2380 mg/kg de p.c./jour et affichait une légère toxicité maternelle chez les rats (Hansen et Meyer 1989).
9.2.2.2 Exposition aux stades prépubère et pubertaire
Les résultats des études de l'exposition par voie orale à dose répétée chez les rats dont l'appareil reproducteur est encore immature (pendant les 55 premiers jours après la naissance) ont prouvé que le DMP n'est pas un agent aussi toxique pour les organes reproducteurs des rats mâles que certains esters phtaliques (p. ex., le DEHP et les autres phtalates à chaîne moyenne). Les sommaires de ces études sont présentés dans le tableau 9-13 ci-dessous.
Oishi et Hiraga (1980) ont constaté une diminution significative des concentrations de la testostérone et de la dihydrotestostérone sériques et testiculaires (p inférieur(e) à 0,05) chez les animaux traités. Toutefois, la nocivité sous-tendue par ces résultats est incertaine, car ils n'ont constaté aucun effet sur les testicules (aucune modification du poids des testicules, aucune inhibition de la spermatogenèse et aucune atrophie testiculaire). Nous n'avons pas trouvé d'autres études portant sur d'autres modes d'exposition.
| Souche et espèce; Dose (mg/kg de p.c./jour); Voie d'exposition; Durée (référence) |
Stade vital au début du traitement (âge) | Taux de testosté-roneNotes de bas de page[a].8Tableau 9-13[a].8 (T, S, LH) |
FertilitéNotes de bas de[b].5page Tableau 9-13[b].5 | Pathologie de l'appareil génitalNotes de bas de page[c].3Tableau 9-13[c].3 | Effets diversNotes de bas de[d].3page Tableau 9-13[d].3 |
|---|---|---|---|---|---|
| Rats Wistar; 0,2 %, est. 0, 1862 de DMP (US CPSC, 2010a); régime; 7 jours (Oishi et Hiraga 1980) |
Prépubères (35 jours après la naissance) | DMENO = 1862 (↓T) 1862 (↓S) |
SE | SE |
|
| Souche? Rats; 0, 1400 de DMP; Gavage; 4 jours (Foster et al., 1980) |
Prépubères d'après le poids (« non mature » NR; 70 g) | NM | NM | SE |
|
| Rats SD; 0, 500 de DMP; Gavage; 4 sem. (Kwack et al., 2009) |
Prépubert-pubertaire (35 jours après la naissance) | NM | SE | NM |
|
| Rats F344/N; 0, 37,5, 75, 150 ou 300 μL, est. 0, 282, 559, 1332, 2278 DEP; voie cutanée; 4 sem. (National Toxicology Program [NTP] 1995) |
Pubertaire (6 sem.) |
NM | NM | SE |
|
| Souris B6C3F1; 0, 12,5, 25, 50 ou 100 μL; est. 0, 630, 1314, 2594, 5212 de DEP; voie cutanée; 4 sem. (National Toxicology Program [NTP] 1995) |
Pubertaire (6 sem.) |
NM | NM | SE |
|
Effets observés d'autres phtalates à chaîne de longueur ou taille similaire
Les résultats d'études menées à l'aide du DMP semblent comparables à ceux d'études effectuées au moyen d'un autre phtalate de longueur ou taille de chaîne similaire, le DEP. Le DEP a également causé une réduction des taux des testostérones sérique et testiculaire chez les rats prépubères après une exposition orale à court terme à des doses très élevées [2000 mg/kg de p.c./jour, seule dose évaluée] (Oishi et Hiraga 1980). Certains signes indiquent une légère linéarité des spermatozoïdes lors d'une autre étude à une dose de 500 mg/kg de p.c./jour (Kwack et al., 2009). On a aussi observé des effets subtils dans les testicules (altérations dans l'ultrastructure cytoplasmique des cellules de Leydig, gonflement des mitochondries et des effets dans le réticulum endoplasmique lisse) chez les rats pubertaires aussi à de très fortes doses, mais ces modifications n'ont pu être reproduites in vitro avec le métabolite du DEP, le phtalate de monoéthyle (MEP) (2000 mg/kg de p.c./jour; Jones et al., 1993). Les autres études n'ont pas permis d'observer d'effets chez les mâles à des doses pouvant atteindre 1600 mg/kg de p.c./jour (Foster 1980; Gray et Gangiolli 1986; Li et al., 2000).
En raison du manque d'études de l'exposition au DMP par voie cutanée disponibles, nous avons utilisé les résultats d'une étude de quatre semaines à l'aide du DEP chez les souris et les rats pour examiner les effets possibles de l'exposition cutanée à ces phtalates de faible masse moléculaire sur la reproduction à ce stade de la vie. Aucun effet n'a été observé sur les organes reproducteurs ou le poids corporel des rongeurs pubertaires (6 semaines), à l'exception de l'augmentation du poids des reins et du foie chez les rats mâles, mais sans changement histopathologique dans ces organes (voir le tableau 9-12; NTP 1995).
Globalement, la seule DMENO du DMP concernant la toxicité pour la reproduction à ce stade vital après exposition par voie orale était de 1862 mg/kg de p.c./jour, se traduisant par la diminution significative des concentrations de testostérone et de dihydrotestostérone sériques et testiculaires chez les jeunes rats mâles exposés à la substance. La DMEO de toxicité systémique était de 1862 mg/kg de p.c./jour d'après l'augmentation significative des poids absolu et relatif du foie chez les rats traités au cours de la même étude (Oishi et Hiraga 1980).
En ce qui concerne l'exposition cutanée, nous n'avons pas découvert d'informations disponibles sur le DMP. La DSENO la plus faible quant à la toxicité du DEP en tant que substance analogue pour la reproduction chez les rats dont l'appareil reproducteur est encore immature après exposition cutanée est de 2278 mg/kg de p.c./jour, cette substance ayant causé une augmentation du poids des reins à des doses de 1332 mg/kg de p.c./jour (DMEO) ainsi qu'une légère augmentation du poids du foie à des doses 2278 mg/kg de p.c./jour, sans histopathologie chez les jeunes rats (NTP 1995). Nous n'avons recensé aucune étude traitant des effets possibles du DMP sur la reproduction d'autres espèces par d'autres voies d'exposition à ce stade de la vie.
9.2.2.3 Exposition par voie orale des mâles adultes matures
Nous n'avons recensé aucune étude, quelle que soit la voie d'exposition au DMP chez les rongeurs mâles adultes (55 et plus après la naissance), dans laquelle on aurait mesuré les paramètres de la fonction reproductive. Comme nous le mentionnions plus haut, le DEP a été jugé comme le phtalate analogue « le plus proche » du DMP dans cette sous-catégorie pour une « lecture croisée du risque potentiel qu'il cause. Ces résumés d'études sont reproduits au tableau 9-14 ci-dessous.
Une étude relativement récente, conforme aux lignes directrices de l'OCDE et aux bonnes pratiques de laboratoire (BPL) et conçue pour dépister les effets liés à la fonction endocrinienne n'a révélé aucun effet sur les paramètres de la testostérone, des testicules ou des spermatozoïdes chez les rats mâles adultes exposés au DEP (tableau 9-14; Shiraishi et al., 2006). Il faut souligner que les doses administrées pour cette étude étaient les mêmes que celle de pour l'étude multigénérationnelle décrite plus haut (Fujii et al., 2005) dont les auteurs ont observé une diminution des taux de testostérone sérique chez les mâles F0 dès 197 mg/kg de p.c./jour. Les auteurs de cette étude n'ont pas jugé que ces résultats révèlent un effet nocif parce que la diminution observée était trop légère pour nuire à la capacité de reproduction, parce que le degré de cette diminution était plus marqué à la dose moyenne qu'à la dose élevée et parce que les taux étaient tous dans la plage des valeurs du groupe témoin historique pour cette souche de rats. On a aussi observé une augmentation significative de l'incidence des spermatozoïdes anormaux et sans flagelle à la dose moyenne (197 mg/kg de p.c./jour) et non à une dose élevée chez les mâles F0 et aux doses moyenne et élevée chez les F1 mâles, mais encore une fois, ces légères diminutions n'avaient pas nui à la capacité de reproduction des mâles F1 adultes (Fujii et al., 2005). De plus, les proportions de spermatozoïdes anormaux et sans flagelle (1 à 1,5 %) ont été assez faibles en comparaison avec les proportions trouvées par d'autres études menées chez la même souche de rats où ces taux chez les rats non traités du groupe témoin se situaient entre 0 et 3,5 % (Ateşşahin et al., 2006; Kato et al., 2006; Turk et al., 2008; Matsumoto et al., 2008).
Lors d'une étude du NTP (NTP 1995), aucun effet de la fertilité chez les deux générations n'a été observé après l'exposition chronique par voie cutanée au DEP (104 semaines), chez les rats et les souris, bien que les effets systémiques aient compris des variations de poids des reins, du foie et du cerveau pour les doses d'essai les plus élevées (voir le tableau 9-14).
| Souche et espèce; Dose (mg/kg de p.c./jour); Voie d'exposition; Durée (référence) |
Stade vital au début du traitement (âge) | Taux de testosté-roneNotes de bas de page[a].9Tableau 9-14[a].9 (T, S, LH) |
FertilitéNotes de[b].6bas de page Tableau 9-14[b].6 | Pathologie de l'appareil génitalNotes de bas de page[c].4Tableau 9-14[c].4 | Effets diversNotes de[d].4bas de page Tableau 9-14[d].4 |
|---|---|---|---|---|---|
| Rats SD; 0, 40, 200, 1000; gavage; 28 jours (Shiraishi et al., 2006). |
8 sem. |
|
SE | SE |
|
| Rats SD IGS Crj:CD; 0, 600, 3000, 15 000 ppm; est. 0, 40, 197, 1016 de DEP (mâles) F0; régime; 15 à 17 sem. (Fujii et al., 2005). |
F0 : 8 sem. |
|
197NDR (spermatozoïdes anormaux, sans flagelle) | SE |
|
| Rats SD; 0, 0,2, 1,0, 5,0 %, est. 0, 100, 500, 2500 (SC 1994); Régime; 16 semaines (Brown et al., 1978) |
Non spécifié | NM | NM | SE |
|
| Rats Wistar; 0, 0,57, 1,43, 2,85 de DEP; Régime; 150 jours (Pereira et al., 2006Notes de bas de page Tableau 9-14[f].1) |
7 à 8 sem. | NM (T) 0.57 (S) |
NM | NM |
|
| Rats N/F344; 0, 100, 300 μL, est. 0, 230, 743 de DEP (d'après la conversion posologique selon la U.S CPSC en 2011); voie cutanée; 104 sem. (NTP 1995) |
6 sem. | NM | NM | SE |
|
| Souris B6C3F1; 0, 7,5, 15 ou 30 μL, est. 0, 191, 387, 775 de DEP (d'après une conversion de dose par la U.S CPSC en 2011); voie cutanée; 104 sem. (NTP 1995) |
6 sem. | NM | NM | SE |
|
Puisque l'on ne dispose pas d'études traitant des effets possibles du DMP sur la reproduction au stade adulte, des études menées avec le DEP ont servi pour une lecture croisée. La DMEO par voie orale la plus faible observée concernant la toxicité pour la reproduction était de 1016 mg/kg de p.c./jour d'après les légers effets enregistrés chez les parents F0 mâles, soit la diminution du taux de testostérone sérique et l'augmentation transitoires des spermatozoïdes anormaux et sans flagelle à la dose moyenne (et non à la dose élevée), ainsi que les faibles diminutions du poids absolu de l'épididyme et du poids absolu des surrénales enregistrées pour cette dose chez les mâles F0 (Fujii et al., 2005). La DSENO la plus faible pour la toxicité systémique du DEP était de 1016 mg/kg de p.c./jour (l'augmentation du poids relatif du foie chez les parents F0 mâles à cette dose n'a pas été jugée nocive) (Fujii et al., 2005).
On n'a observé aucun effet du DEP sur la reproduction de rats mâles adultes après une exposition chronique par voie cutanée (DSENO sur la reproduction de 743 mg/kg de p.c./jour) accompagnée d'effets systémiques, dont une diminution légère, mais significative du poids absolu du cerveau à 743 mg/kg de p.c./jour (DSENO de 230 mg/kg de p.c./jour; NTP 1995).
9.2.2.4 Exposition des femelles par voie orale
On a recensé six études des effets du DMP sur la reproduction et le développement chez les femelles. Ces études ont été menées sur des rats et des souris exposés au DMP au cours de la gestation (principalement entre 6 et 15 jours de gestation, mais aussi entre 1 et 20 jours de gestation et le 14e jour de gestation et 3 jours après la naissance) par l'intermédiaire de leurs aliments, par gavage ou par voie cutanée. Aucune étude portant sur deux générations n'était disponible.
On n'a observé aucun effet sur le développement dans les études analysées, même aux doses toxiques pour les mères (la DMENO associée à la toxicité maternelle variait de 200 à 5 000 mg/kg de p.c./jour). Les DSENO de toxicité pour le développement variaient de 2 380 mg/kg de p.c./jour (voie cutanée) à 5 000 mg/kg de p.c./jour (gavage) chez les rats et les souris, respectivement.
Aucun effet sur la reproduction n'a été observé dans les études analysées. Les DSENO de toxicité pour la reproduction variaient de 750 à 5 000 mg/kg de p.c./jour (gavage) chez les rats et les souris.
Globalement, ces études ne révèlent aucun effet nocif pour les paramètres de la reproduction et du développement chez les femelles après une exposition à des fortes doses de DMP (750 mg/kg de p.c./jour ou plus).
Effets observés d'autres phtalates à chaîne de longueur/taille similaire (DEP)
On a recensé neuf études des effets du DEP sur la reproduction ou sur le développement chez les femelles. Ces études ont été menées sur des rats et des souris exposés pendant la gestation à du DEP administré par voie orale, percutanée ou sous-cutanée, et comprennent deux études réalisées sur deux générations (l'une chez les rats et l'autre chez les souris). En outre, une étude visait à déterminer l'activité œstrogénique du DEP au moyen d'un essai biologique in vitro sur la liaison des récepteurs des œstrogènes ainsi que d'un essai biologique utérotrophique in vivo effectués chez des rats dont l'appareil reproducteur n'est pas mature et qui ont été exposés par injection sous-cutanée. Dans l'ensemble, les résultats des études disponibles indiquent que, à des doses élevées (721 à 2 191 mg/kg de p.c./jour), le DEP peut être toxique pour le développement des femelles et causer l'altération de la croissance (organes, poids corporel), la létalité, la tératogénicité (variations : côtes surnuméraires et rudimentaires) et des déficits fonctionnels (foie). Or, tous ces effets nocifs pour le développement observés chez les femelles étaient présents seulement à des doses induisant une toxicité maternelle et étaient essentiellement les mêmes que ceux observés chez les mâles.
L'une des deux études sur deux générations indiquait une toxicité pour la reproduction chez les femelles. On a enregistré une toxicité pour la reproduction (effets sur le développement de l'appareil reproducteur, l'issue de la gestation et le poids des organes liés à la reproduction) chez les parents F1 seulement (après l'exposition in utero et les expositions subséquentes).
9.2.2.5 Études du système endocrinien
Une étude ciblée, menée par Clewell et al. (2010), a porté sur les effets du monoester de DMP, le MMP, sur la synthèse de la progestérone et de la testostérone dans le système d'essai biologique de la tumeur des cellules de Leydig immortalisées chez la souris (MA-10). On a noté pour le MMP une inhibition faible ou nulle de la synthèse de la testostérone (c.-à-d. aucun changement de l'expression des gènes participant à ce processus) à des concentrations pouvant atteindre 100 µM. Au cours de la même étude, les auteurs ont administré des doses d'essai de DMP (et de quatre autres phtalates) chez des rattes en gestation (500 mg/kg de p.c./jour, entre 12 et 19 jours de gestation) et ont analysé les testicules fœtaux pour vérifier la présence des monoesters correspondants; ils ont constaté que les concentrations de MMP étaient 2 à 40 fois plus élevées dans les testicules que celles des monoesters plus actifs examinés. Une étude plus récente du même groupe à l'aide d'une lignée cellulaire de Leydig (R2C) et de l'administration de MMP (et du monoester du DEP, le MEP) a démontré que les monoesters avaient légèrement réduit la production de testostérone à des concentrations égales ou supérieures à 100 µM (Balbuena et al., 2013). Les auteurs ont conclu qu'il faudrait que les concentrations testiculaires in vivocomparables de ces phtalates de faible masse moléculaire soient très élevées pour inhiber la testostérone dans un testicule fœtal (supérieures à 500 mg/kg de p.c./jour).
Lors d'une étude menée par Yuan et al. (2012), les microsomes des testicules des humains et des rats ont été utilisés pour l'évaluation de la capacité de 14 phtalates à inhiber l'activité de la 3β-hydroxystéroοde déshydrogénase (3βHSD) et de la 17β-hydroxystéroοde déshydrogénase 3 (17β-HSD3), des enzymes participant à la biosynthèse des androgènes. Le DMP et le DEP n'ont présenté aucune activité microsomique chez les rats et n'ont présenté qu'une activité microsomique faible chez les humains; ils n'ont pas inhibé les activités dans une proportion allant jusqu'à 50 % aux concentrations d'essai maximales (1 mM).
Un essai biologique in vitro sur la liaison des récepteurs des œstrogènes et un essai biologique utérotrophique in vivo indiquent que le DEP ne s'est pas fixé aux récepteurs d'œstrogènes et n'a pas eu d'effet sur l'activité œstrogénique ou anti-œstrogénique (Akahori et al., 2008).
9.2.2.6 Toxicité pour la reproduction et le développement : données probantes chez les humains
Les informations disponibles sur les effets possibles des phtalates sur les humains ont été analysées. La recherche effectuée dans les publications scientifiques a permis de recenser des études menées chez les humains, qui étaient axées sur l'aspect épidémiologique et qui ont fait l'objet d'un examen. Cet examen comportait des études transversales, des études cas-témoins et études de cohorte qui portaient sur 14 phtalates d'origine et leurs métabolites. Étant donné le grand nombre d'études existantes chez les humains et les divers résultats enregistrés pour ce groupe de substances, toutes les études recueillies ont été cotées d'après leur qualité à l'aide de critères d'évaluation cohérentsNote de bas de page[11](Downs et Black, 1988). On a ainsi disposé d'un outil d'évaluation fiable et objectif qui a permis de prendre en compte les différents aspects de la qualité des études menées selon diverses méthodologies. Voir Annexe G pour une description de la méthode d'évaluation de Downs and Black pour les études épidémiologiques et les définitions des niveaux d'association. On a analysé les cas d'associations statistiquement significatives entre l'exposition et la réaction pour chaque effet sur la santé. De cette analyse, on a conclu par rapport au niveau de preuve qu'une association d'un phtalate avec chaque effet sur la santé était fondée sur la force et sur la cohérence de cette relation ainsi que sur la qualité des études épidémiologiques, d'après les critères de cotation de Downs et Black. En fonction de la cote globale obtenue avec la méthode d'évaluation, le niveau de preuve pour une association a été qualifié de suffisant, limité, inadéquat ou preuve ne suggérant pas d'association. Les études qui ont été cotées dans le quartile le plus bas (quartile 1) sur la base de l'évaluation ne sont pas incluses dans le présent rapport. Cette évaluation n'a pas examiné la plausibilité biologique de la relation, ce qui revient à dire qu'aucune inférence causale n'a été établie. Il est possible d'obtenir de plus amples renseignements sur demande auprès de Santé Canada (2015 b).
Plusieurs études menées chez les humains ont fait état de résultats pour le DMP et son métabolite, le monométhyl phtalate (MMP) (voir la section 9.2.1), et ces résultats ont été évalués en conséquence. Il y avait des preuves insuffisantes pour une association d'exposition néonatale au MMP par le lait maternel et le rapport d'hormone lutéïnisante (LH)/testostérone chez le les garçons nouveau-nés (Main et al., 2006). Aucune association n'a été rapportée, entre l'exposition au MMP et l'âge de la gestation, les mesures à la naissance (c.-à-d., le poids et la taille à la naissance et la circonférence crânienne), l'âge gestationnel (Wolff et al., 2008; Suzuki et al., 2010) ou les malformations des organes génitaux chez les nouveau-nés mâles (Main et al., 2006.
Aucune association n'a été observée entre les MMP dans l'urine et les taux sériques d'hormones de reproduction chez l'homme (Duty et al., 2005) ou dans les paramètres du sperme. On n'a trouvé aucune association significative entre les concentrations de MMP dans l'urine et les paramètres du sperme (c.-à-d. intégrité, concentration, mobilité et morphologie) (Duty et al., 2003a; Duty et al., 2003 b). Buck Louis et al. (2014) ont trouvé une association entre le MMP et un temps plus long avant le début d'une grossesse et la concentration de MMP chez le partenaire masculin, bien que la preuve de cette association était inadéquate comme une seule étude était disponible).
No associations were observed between urinary MMP and serum levels of reproductive hormones in men (Duty et al. 2005) or in semen parameters (e.g. DNA integrity in sperm, sperm concentration, motility and morphology) (Duty et al.2003a; Duty et al. 2003b). Buck Louis et al.(2014) found association between MMP and longer time to pregnancy based on MMP concentrations in male partners, although the evidence for this association was inadequate as only one study was available.
Rozati et al. (2008) ont mis en évidence des taux de DMP sérique sensiblement supérieurs dans les cas d'endométriose par rapport au groupe témoin. Toutefois, l'absence d'ajustement pour les facteurs de confusion limite la validité de cette étude.
Il y avait des preuves insuffisantes de l'association entre MMP et certains aspects du fonctionnement comportemental et cognitif chez les enfants (par exemple, des problèmes d'attention, contrôle émotionnel, etc.) (Engel et al. 2010), et aucune association n'a été observée pour MMP avec le fonctionnement social (Miodovnik et al., 2011); tandis que dans certaines études, l'association pour les métabolites individuels tels que MMP n'a pas été signalé (Engel et al., 2009).
Des études plus récentes se sont penchées sur l'associations entre le DMP et événements cibles, mais elles n'ont pas encore été évaluées à l'aide de la méthode de Downs et Black. D'après les conclusions des auteurs, aucune association n'a été trouvée entre le MMP et la kisspeptine-54 chez les filles (Chen et al., 2013) et un retard de croissance intra-utérine (Zhao et al., 2014) et la testosterone chez les deux sexes (Meeker and Ferguson 2014), et le moment de la puberté féminine (Chen et al. 2013).
9.2.3 Autres effets systémiquesNote de bas de page[12]
L'exposition aux phtalates est couramment associée à des effets indésirables sur le développement de l'appareil reproducteur chez les animaux de laboratoire, elle est également associée à une série d'effets systémiques. L'exposition à court et long termes à doses répétées de phtalates a également été associée à des effets sur le foie et d'autres organes comme les reins et les testicules.
On a démontré que les phtalates induisaient la prolifération de peroxysomes dans le foie, de même qu'une augmentation du poids du foie chez les rats et les souris, et que ces effets détectés étaient considérés comme les plus sensibles dans plusieurs études sur les rongeurs réalisées au cours des dernières décennies. Dans certains cas, une administration par voie orale à long terme s'est traduite par l'observation d'un cancer du foie. Il est prouvé que le récepteur alpha activé par les proliférateurs des peroxysomes (PPARα) joue un rôle dans les effets sur le foie induits par la prolifération des peroxysomes (Corton et Lapinskas, 2005). Toutefois, il est difficile d'établir la pertinence des effets hépatotoxiques des phtalates observés chez les rongeurs en raison des différences spécifiques aux espèces dans la réponse à la prolifération des peroxysomes. Les rongeurs sont notablement plus sensibles que les humaine à la prolifération des peroxysomes médiée par l'induction du PPARα (ECB, 2008; NICNAS, 2010; CPSC américain, 2010b). Plusieurs études laissent penser que les mécanismes de l'hépatotoxicité des proliférateurs des peroxysomes ne sont pas encore complètement élucidés et que diverses voies existent, dont certaines sont probablement indépendantes des PPARα (Ito et al., 2007; Yang et al., 2007; Eveillard et al., 2009; Ren et al., 2010; CIRC, 2012). Une évaluation détaillée de la toxicité systémique potentielle (mode d'action) de l'exposition aux phtalates peut être obtenue auprès de Santé Canada (2015c).
La présente section contient une analyse des études portant sur les paramètres de toxicité non reproductive.
9.2.3.1 Études avec administration répétée
La base de données sur la toxicité de l'administration répétée du DMP se limite à quelques études subchroniques à court terme par voie orale ou cutanée qui ont été recensées dans la recherche documentaire relative aux effets du DMP sur les rats, les souris et les lapins. Un sommaire des données relatives aux effets du DMP sur la santé suit.
Lors d'une étude sur l'établissement des doses, conçue pour détecter la dose maximale tolérée (DMT) pour le DMP, on a administré à des souris CD-1 femelles du DMP par gavage à des doses de 0, 875, 1 750, 3 500, 7 000 et 11 890 mg/kg p.c./jour durant 8 jours. On n'a observé aucun effet sur le poids corporel, quelle que soit la dose. On a constaté une mortalité à partir de 3 500 mg/kg p.c./jour avec un taux de létalité de 10 % à ce niveau de dose, une létalité de 50 % à 7 000 mg/kg p.c./jour et une létalité de 100 % à la plus forte dose testée. La DMT a donc été fixée à 3 500 mg/kg p.c./jour (NTP, 1983). Dans une autre étude, aucun effet n'a été signalé lors de l'administration de DMP à des rats par gavage durant 14 jours, et ce, jusqu'à 1 000 mg/kg p.c./jour (Lake et al., 1978). Toutefois, lors d'une seconde étude d'administration orale à des rats, on a observé des changements dans le métabolisme des lipides (une réduction significative du cholestérol hépatique total et des lipides totaux chez les animaux traités, 31 % et 9 %, respectivement) lors d'une exposition à 0,5 % de DMP dans la nourriture durant 21 jours (l'équivalent de 250 mg/kg p.c./jour, selon une conversion de dose basée sur Santé Canada, 1994). Cependant, le taux de cholestérol sérique était similaire chez les animaux exposés et les témoins (Bell et al., 1978).
La DEMO pour une exposition à court terme par voie orale était de 250 mg/kg p.c./jour, basée sur des modifications du métabolisme des lipides chez les rats, et la DMENO était de 3 500 mg/kg p.c./jour (DSENO de 1 750 mg/kg p.c./jour) basée sur l'augmentation de la mortalité chez les souris femelles traitées.
Dans une étude d'exposition cutanée à court terme, une DEMO de 4 800 mg/kg p.c./jour a été rapportée chez des lapins à qui on appliquait du DMP durant 33 jours, fondée sur une légère réduction des hématocrites et du poids des testicules à ce niveau de dose. Aucun changement histologique n'a été signalé à la fin de l'étude (Dow Chemical, 1946). Lors d'une étude d'exposition cutanée chez les lapins à qui on appliquait 0; 0,5; 1,0; 2,0 ou 4,0 ml/kg (0, 600, 1 200, 2 400, 4 800 mg/kg p.c./jour) de DMP pendant 90 jours, on a observé un œdème pulmonaire et des lésions rénales (néphrite) chez les animaux à des doses égales ou supérieures à 2 400 mg/kg p.c./jour (Draize et al., 1948). Lors d'une exposition cutanée de rats mâles à 0, 200, 1 250, 2 000 mg/kg p.c./jour de DMP durant 90 jours, des altérations du système nerveux et de la fonction rénale ont été signalées aux deux doses les plus élevées (on ne dispose d'aucun autre détail sur ces effets) (Timofieyskaya, 1976).
Lors de ces études, la DMENO la plus faible pour les expositions à des doses répétées était de 1 250 mg/kg p.c./jour (DSENO de 200 mg/kg p.c./jour) en fonction des altérations du système nerveux et de la fonction rénale chez les rats mâles.
9.2.3.2 Cancérogénicité
Le DMP n'a pas été classé pour sa cancérogénicité potentielle par d'autres organismes internationaux, et les études de toxicité chronique ou de cancérogénicité pour ce phtalate sont limitées.
Lors d'une étude de deux ans sur les rattes exposées à 0; 2,0 %; 4,0 % et 8,0 % de DMP dans le régime alimentaire (l'équivalent de 0, 1 000, 2 000, 4 000 mg/kg p.c./jour en fonction d'une conversion de dose basée sur Santé Canada, 1994), on n'a relevé aucune preuve de cancérogénicité. Les effets non néoplasiques observés comprenaient des effets sur la croissance et les reins. Le taux de croissance (gain de poids corporel) dans les groupes de doses de 4 % et de 8 % était légèrement, mais statistiquement, diminué par rapport aux témoins (l'amplitude du changement n'a pas été rapportée). Aux doses les plus élevées, on a observé des lésions aux reins (Lehman, 1955). En raison de l'ancienneté de l'étude et du peu de détails qu'elle comporte, on ne peut que lui accorder une confiance limitée.
Le National Toxicology Program (NTP) en 1995 a également réalisé une étude sur l'initiation et la promotion de tumeurs lors de l'application de DMP non dilué chez les souris mâles. Le DMP a été testé comme un initiateur, avec et sans le promoteur de tumeur de la peau connu sous le nom de TPA (12-O-tétradécanoylphorbol -13-acétate), et en tant que promoteur, avec ou sans l'initiateur de tumeurs de la peau connu sous le nom de DMBA (7,12-dimethylbenzanthrancène). Dans l'étude d'initiation, on administrait 0,1 ml de DMP aux souris sur la peau durant la semaine 1, puis on appliquait 0,005 mg de TPA, 3 fois/semaine durant 8 semaines, puis 0,0025 de TPA 2 fois/semaine pendant 44 semaines pour un total de 52 semaines de promotion. Dans l'étude de promoteur, on traitait les souris une fois pendant la semaine 1 avec 0,05 mg de DMBA, suivi par les applications de 0,1 ml de DMP, 5 fois/semaine pour un total de 52 semaines. On n'a observé aucune preuve de promotion de carcinogenèse cutanée. L'incidence du papillome ou carcinome spinocellulaire dans le groupe d'initiation du DMP (0/50) comme dans le groupe de promotion du DMP (1/50, papillome spinocellulaire) était similaire aux témoins (0/50).
Les données dont on dispose laissent penser que le DMP n'est pas susceptible d'induire de tumeurs chez les animaux de laboratoire exposés par voie orale ou cutanée.
Études de cancérogénicité réalisées avec les autres phtalates ayant une longueur de chaîne similaire (DEP)
Aucune organisation n'a classé le DEP pour sa cancérogénicité.
Outre une étude de toxicité cutanée d'une durée d'un an chez les souris mâles dans lequel DEP n'a démontré aucune activité comme initiateur ou promoteur, à l'instar du DMP (NTP, 1995); le NTP a également mené des études de cancérogénicité à long terme par voie cutanée avec le DEP chez les rats et les souris.
Lors de l'étude sur le rat, le DEP non dilué était appliqué sur la peau rasée de rats F344/N mâles et femelles à des doses de 0, 100 ou 300 μL/animal par jour (équivalentes à 0, 230 et 743 mg/kg p.c./jour chez les mâles et 0, 379 et 1 170 mg/kg p.c./jour chez les femelles (calculé avec le facteur de conversion de dose de la CPSC des États-Unis, 2011), cinq fois par semaine pendant 104 semaines (NTP, 1995). On n'a rapporté aucune preuve de cancérogénicité quel que soit le sexe. Néanmoins, les auteurs ont noté la sensibilité réduite de l'étude chez les mâles puisqu'au moment du sacrifice final, la survie était réduite de manière significative chez tous les groupes (survie chez les mâles : 8 %, 12 % et 12 %, à des doses de 0 µl, 100 µl et de 300 µl, respectivement). Une augmentation de l'acanthose épidermique, minimale à légère, due au traitement a été remarquée chez les deux sexes au point d'application, et fut interprétée comme une réaction adaptative à l'irritation. Durant une évaluation réalisée après 15 mois d'exposition (sacrifice en cours d'étude), on a signalé une diminution faible, mais significative, du poids absolu du cerveau chez les mâles à la plus forte dose testée (environ 5 à 6 % plus petit que les témoins, sans changements histopatologiques signalés) (NTP, 1995). La DSENO pour les effets non cancérogènes lors de cette étude a été établie à 230 et 1170 mg/kg p.c./jour pour les rats mâles et femelles, respectivement.
Dans une étude sur la souris, le DEP dissous dans l'acétone était appliqué sur la peau rasée de la région intrascapulaire des souris B6C3F1 mâles et femelles à 0; 7,5; 15 ou 30 μL/animal par jour (l'équivalent de 0, 191, 387 ou 775 mg/kg/jour chez les mâles et 0, 209, 415 ou 834 mg/kg/jour chez les femelles; selon une conversion de dose de la CPSC des États-Unis, 2011), cinq jours par semaine durant 103 semaines. Lors du sacrifice à la fin de l'étude, la survie et le poids corporel moyen des souris exposées étaient similaires à ceux des témoins. Même si le point d'application ne montrait pas de signe de toxicité ou de néoplasie, une augmentation significative de l'incidence des lésions prolifératives non néoplasiques (foyers basophiles) a été observée dans le foie des mâles à dose moyenne. Une augmentation importante de l'adénome ou du carcinome hépatocellulaire combinée a également été observée chez les mâles à forte dose, même si elle se retrouvait dans la gamme des témoins historiques. Les augmentations de l'incidence de l'adénome ou du carcinome hépatocellulaire combiné étaient également observées chez les femelles exposées à des doses faibles et moyennes, mais pas à la dose supérieure. En raison cette absence de tendance dans la dose-réponse chez les femelles et parce que le taux d'incidence chez les mâles à haute dose se situait dans la gamme des témoins historiques, le NTP a indiqué que les augmentations marginales des néoplasmes hépatocellulaires chez les souris ont été considérées comme des conclusions incertaines, car elles ne fournissent qu'une preuve ambivalente de l'activité cancérogène (NTP, 1995). Lors du sacrifice en cours d'étude à 15 mois, une réduction du poids corporel moyen (8 % inférieur à celui des témoins) a été signalée chez les femelles à la plus forte dose, ainsi qu'une augmentation significative du poids relatif des reins chez les femelles aux deux plus fortes doses. La DSENO pour les effets non néoplasiques dans cette étude correspondait respectivement à 775 et 415 mg/kg p.c./jour pour les mâles et pour les femelles.
En conclusion, les informations dont on dispose indiquent que le DEP n'est probablement pas cancérogène.
9.2.3.3 Génotoxicité
Les essais sur la génotoxicité du DMP obtenus in vitro et in vivo donnent des résultats contradictoires.
Lors des essais in vitro, on a observé des résultats contradictoires avec le DMP lors du test de mutation bactérienne sur les souches de Salmonella typhimurium TA98, TA 100, TA 1535 et TA 1537, avec et sans activation métabolique. Dans certaines études, le DMP n'était pas mutagène (Zeiger et al., 1985; Kozumbo et Rubin, 1991; Kubo et al., 2002). Lors de certains tests, le DMP induisait des mutations dans les souches de Salmonella typhimuriumTA100 ou TA 1535 en l'absence, mais pas en présence, d'activation métabolique (Kozumbo et al., 1982; Seed, 1982; Argawal et al., 1985). Dans un essai de résistance à la 8-azaguanine, le DMP n'était pas non plus mutagène à la fois en présence et en absence d'activation métabolique (Seed, 1982). Dans les tests de mutation sur cellules de lymphome de la souris et l'essai d'échange de chromatides sœurs provenant des ovaires de hamsters chinois [OHC], des résultats négatifs ont été signalés sans activation métabolique, mais des résultats positifs ont été observés en présence d'activation métabolique (Chemical Manufacturers Association,1986; Loveday et al., 1990; Barber et al., 2000). Des résultats négatifs ont été observés dans un essai de transformation cellulaire dans les cellules BALB/3T3, et dans les tests d'aberration chromosomique dans les cellules OHC et les leucocytes humains, avec ou sans activation métabolique, respectivement (Tsuchiya et Hattori, 1976; Loveday et al., 1990; Barber et al., 2000).
Certaines études in vivo où le DMP était administré sur la peau ou par voie intrapéritonale (IP) ont été recensées dans les revues scientifiques. Le DMP a produit des résultats négatifs aux essais de létalité dominante à la suite d'une administration cutanée et par IP (Timofieyskaya, 1976; Yurchenko et Gleiberman, 1980). De la même manière, aucune lésion chromosomique n'a été observée dans la moelle osseuse des souris lors d'un essai d'aberration chromosomique réalisé avec une injection IP de DMP. Toutefois, une augmentation faible, mais significative, dans les aberrations chromosomiques a été observée dans le foie des rats à la suite d'une exposition cutanée pendant un mois au cours de cette étude (Yurchenko, 1977).
9.2.3.4 Preuve de toxicité systémique chez l'humain
Une analyse de l'information disponible sur les effets systémiques potentiels des phtalates chez l'humain a été réalisée (Santé Canada, 2015b). Voir l'annexe G pour une description de l'approche d'évaluation de Downs et Black pour les études épidémiologiques et les définitions des niveaux d'association.
Il y avait de preuve insuffisante sur les association du MMP et le diabète (Lind et al., 2012a) et la fonction cardiovasculaire (Lind et Lind, 2011; Olsen et al., 2012; Shiue 2013; Trasande et al, 2014) et l'obésité chez les femmes âgées (Lind et al., 2012b). Il y avait de preuve insuffisante pour une association inverse entre le MMP et le tour de taille chez les enfants (Wang et al. 2013).
Les taux de DMP dans la poussière intérieure et les métabolites urinaires correspondant au MMP n'étaient pas associés aux symptômes allergiques (asthme, rhinite allergique, eczéma, etc.) (Kolarik et al., 2008b; Hsu et al., 2012, Hoppin et al. 2013).
Des études plus récentes ont mis en évidence des associations entre le DMP et divers événements cibles, mais elles n'ont pas encore été évaluées à l'aide de la méthode de Downs et Black. Des associations significatives entre le DMP et la rhinite allergique chez l'enfant (Bamai et al., 2014) ont été signalées dans la poussière intérieures, et la rhinite allergique chez les enfants ( Bamai et al . 2014), mais aucune association significative n'a été trouvée pour d'autres résultats connexes et dans la poussière multi-surface. Des associations significatives ont été signalées entre MMP et la pression artérielle considérant les deux sexes ensemble (Shiue 2014a,b; Shiue et Hristova 2014) et chez les hommes uniquement (Shiue et Hristova 2014). Cependant, aucune association statistiquement significative n'a été observée chez les femmes de façon unique (Shiue et Hristova 2014).
9.3 Caractérisation des risques pour la santé humaine
9.3.1 DMP
Le DMP n'a pas été classé pour sa cancérogénicité possible par d'autres organismes internationaux. Même si les études de toxicité chronique et de cancérogénicité sur le DMP restent limitées, les données dont on dispose laissent penser que ce phtalate n'induit probablement pas de tumeurs chez les animaux de laboratoire exposés par voie orale ou cutanée.
La réflexion sur l'information existante sur la génotoxicité fait apparaître des résultats mitigés par les essais in vitro et in vivo. Toutefois, les phtalates sont généralement considérés comme des substances non génotoxiques.
La base de données des effets sur la santé du DMP ne montre aucune preuve d'effets indésirables sur le développement, la fonction reproductrice et les autres organes après une exposition. Aucun effet n'a été observé sur le mâle en développement en ce qui concerne le syndrome des phtalates chez le rat (RPS) à des doses allant jusqu'à 750 mg/kg p.c./jour, ni aucun autre effet sur les autres paramètres du développement, hormis ce syndrome, à des doses aussi élevées que 3 570 mg/kg p.c./jour. Il est impossible d'exclure la probabilité d'effets à des doses supérieures, similaires à ceux observés à des stades ultérieurs de la vie où les diminutions des taux de testostérone sérique et testiculaire sont apparues chez les rats pubères (1 000 mg/kg p.c./jour), même si ces niveaux de doses n'ont aucune pertinence chez l'humain. On n'a également observé aucun effet pour la reproduction chez les mâles adultes lors d'une exposition au DEP, un analogue du DMP, et il semble qu'il n'y ait pas eu des différences dans les effets en fonction des diverses voies d'exposition (orale versus cutanée). En se fondant sur l'information dont on dispose à l'heure actuelle, il ne semble pas qu'un stade de la vie soit plus sensible qu'un autre.
Il est impossible de tirer des conclusions sur une sensibilité plus grande de la souris rap rapport au rat, car on ne dispose d'aucune étude examinant les paramètres utilisés pour mesurer le RPS dans cette espèce avec le DMP ou le DEP (voir les tableaux 9-15 et 9-16 pour le sommaire des effets critiques du DMP [ou du DEP] servant à la caractérisation des risques).
Un examen de la toxicité potentielle du DMP pour le développement a montré que ce phtalate à courte chaîne n'a pas non plus d'effet sur la femelle en développement ou la capacité de reproduction des femelles adultes à des doses relativement élevées.
| Stade vital | Espèces | Effet (mg/kg p.c./jour) |
DMEO (mg/kg p.c./jour) |
DSEO (mg/kg p.c./jour) |
Référence |
|---|---|---|---|---|---|
| Lopez-Carrillo, 2007. | Rat | Aucun effet observé sur le développement. Aucun effet sur les paramètres RPS (JG 14 à JPN 3) |
S.O. | 750 | Gray et al. (2000); Furr et al. (2014) |
| Lopez-Carrillo, 2007. | Rat | DEMO (maternelle) = 3 750 changements temporaires du poids corporel, ↑ du poids relatif foie (JG 6 à 15) |
S.O. | 3750 | NTP (1989) [NICNAS et CPSC américaine] |
| Pré-pubère | Rat (7 j) |
Diminution significative du taux de testostérone sérique et testiculaireNote de bas de page Tableau 9-15[a].10, concentration de dihydrotestostérone et ↑ du poids absolu et relatif du foie | 1862 (DMENO) |
S.O. | Oishi et Hiraga (1980) |
| Adulte | Rat DEP (F0, 8 sem.) |
↓ de la testostérone sérique, augmentations temporaires des spermatozoïdes anormaux et sans flagelle à mi-dose (pas élevée), ↓ du poids absolu de l'épididyme et des surrénales | 1 016 | 197 | Fujii et al. (2005) |
| Stade vital | Espèces | Effet (mg/kg p.c./jour) |
DMEO (mg/kg p.c./jour) |
DSEO (mg/kg p.c./jour) |
Référence |
|---|---|---|---|---|---|
| in utero | Rat (JG 1 à 20) |
DEMO (maternelle) = 2380 (légère ↓ du poids corporel). Aucun effet sur les petits | S.O. | 2380 | Hansen et Meyer (1989) |
| Pré-pubère | Rat DEP (4 sem.) |
DEMO systémique = 1332 ↑ du poids relatif des reins et du foie (2 278), aucune pathologie testiculaire observée |
S.O. | 2278 | NTP (1995) |
| Adulte | Rat DEP (2 ans) |
DMENO systémique = 743 ↓ du poids abs. cerveau, aucune pathologie testiculaire observée |
S.O. | 743 | NTP (1995) |
À la suite d'une exposition à doses répétées, la DMENO la plus faible pour l'exposition cutanée subchronique était de 1 250 mg/kg p.c./jour (DSENO de 200 mg/kg p.c./jour), basée sur les altérations du système nerveux et de la fonction rénale chez les rats mâles exposés durant 90 jours. La DMENO la plus faible pour l'exposition cutanée chronique recensée dans une étude de deux ans sur des rats avec l'analogue du DEP était de 743 mg/kg p.c./jour (DSENO de 230 mg/kg p.c./jour), basée sur une diminution légère, mais significative du poids absolu du cerveau chez les mâles. Dans une étude correspondante sur la souris, la DMENO la plus faible pour une exposition chronique était recensée à 834 mg/kg p.c./jour (DSENO de 415 mg/kg p.c./jour), basée sur une réduction du poids corporel moyen chez les femelles.
Voir le tableau 9-17 pour un sommaire des effets critiques du DMP qui seront utilisés pour la caractérisation des risques.
| Critère d'effet toxicologique | Espèces | Effet | DMENO (mg/kg p.c./jour) |
MAQT (mg/kg p.c./jour) |
Référence |
|---|---|---|---|---|---|
| Subchronique | Rat (90 jours) |
Altérations du système nerveux et de la fonction rénale chez les mâles | 1 250 | 200 | Timofieyskaya (1976) |
| Chronique | Rats DEP (2 ans) |
Diminutions faible, mais significative du poids absolu du cerveau chez les mâles | 743 | 230 | NTP (1995) |
| Chronique | Souris DEP (2 ans) |
Diminution du poids corporel moyen chez les femelles | 834 | 415 | NTP (1995) |
Pour la population canadienne, la source prédominante d'exposition au DMP se trouve dans le lait maternel et la nourriture, mais l'air intérieur et la poussière peuvent également y contribuer. L'exposition aux produits cosmétiques et d'hygiène, par voie cutanée et inhalation (aérosol), peut être également évaluée pour les adultes (20 ans et plus) et les nouveau-nés (0 à 6 mois). Enfin, on a évalué les concentrations métabolites de DMP dans l'urine humaine et utilisé la dosimétrie inverse pour convertir ces concentrations en estimations de l'absorption de DMP afin d'obtenir une estimation de l'exposition systémique à partir de toutes les sources. Le tableau 9-18 présente la tendance centrale, les limites supérieures de la consommation et les marges d'exposition respectives pour les populations et les sources pertinentes.
| Groupe d'âge et scénario d'exposition | Estimation de la tendance centrale (limites supérieures) pour l'exposition (µg/kg par jour) | Niveau et base de la DSENO (mg/kg p.c./jour) | Marge d'exposition (ME)Note de bas de[d].5page Tableau 9-18[d].5 |
|---|---|---|---|
| Enfants (mâles) 2 à 3 ans : biosurveillance, MIREC CD Plus | 0,19 (0,66) | DSENO = 230 (cutanée chronique, DEP) Diminution du poids absolu du cerveau chez les mâles |
Plus d'un million (348 485) |
| Nouveau-nés 0 à 6 mois, nourris au lait maternel : milieu naturel et nourriture, voie orale et inhalation | 0,019 (0,26) | LOAEL = 1862 (développement pubertaire, 7 jours voie orale, DMP) ↓ de la testostérone sérique et testiculaire, concentrations de dihydrotestostérone et ↑ du poids relatif et absolu du cerveau (pas de DSENO) |
Plus d'un million |
| Nouveau-nés 0 à 6 mois : crème anti-érythème, cutanée | 2,7a (8,2)Note de bas de page Tableau 9-18[a].11 | DSENO = 200 (cutanée subchronique, DMP) Altérations du système nerveux et de la fonction rénale chez les mâles |
74 074 (24 390) |
| Adultes (femmes) 20+ ans : biosurveillance, NHANES | 0,027 (0,26) | DSENO = 415 (cutanée chronique, DEP) Diminution du P.C. de 8 % chez les femelles |
Plus d'un million |
| Adolescents (garçons) 12 à 19 ans : biosurveillance, NHANES | 0,042 (0,29) | DSENO = 230 (cutanée chronique, DEP) Diminution du poids absolu du cerveau chez les mâles |
Plus d'un million (793 103) |
| Adolescents 12 à 19 ans : milieu naturel et nourriture, voie orale et inhalation | 0,0085 (0,091) |
DSENO = 750 (in utero par voie orale DMP) La plus forte dose testée pour les effets potentiels du RPS |
Plus d'un millionNote de bas de page[b].7Tableau 9-18[b].7 |
| Adultes 20 + ans : fixatif, cutanée | 66aNote de bas de page Tableau 9-18[c].5 (200)a |
NOEL = 230 (cutanée chronique, DEP) Diminution du poids absolu du cerveau chez les mâles |
3 485 (1150) |
| Adultes 20 + ans : colorant cheveux, cutanée | 1400ac (4200)a |
DSENO = 2380 (cutanée à court terme, DMP) légère ↓ du poids corporel des mères |
1 700 (567) |
Les ME susmentionnées sont considérées comme adéquates pour prendre en compte des incertitudes relatives à l'exposition et aux effets systémiques potentiels du DMP, mais aussi aux effets légers sur le système reproducteur à des doses supérieures à celles qui servent à la caractérisation des risques. Par ailleurs, la sélection d'une DSENO de 750 mg/kg p.c./jour, spécifique au RPS, pour les effets potentiels sur le développement a été choisie comme point de départ prudent et conservateur alors que d'autres études disponibles avec des DSENO supérieures n'ont pas examiné les paramètres indicateurs du mode d'action préoccupant de ce groupe de substances.
9.3.2 Considérations
Pour le DMP, la source d'exposition prédominante est le lait maternel et la nourriture, avec la contribution de l'air intérieur et de la poussière. Les produits d'hygiène et les cosmétiques constituent des sources supplémentaires d'exposition.
En ce qui concerne l'utilisation des adhésifs, des mastics et des revêtements qui contiennent du DMP, l'exposition ne semble pas poser de problème pour la santé humaine pour les raisons suivantes :
L'absorption cutanée des phtalates à chaîne courte chez le rat est faible (10 %), et il est prouvé que la peau humaine est moins perméable que celle des rats aux diesters des phtalates. De plus, la rétention dans la peau du rat est de trois à six fois supérieure à celle de l'humain (Mint et Hotchkiss, 1993; Mint et al., 1994). La distribution dans les tissus des rats s'effectue généralement lentement et ne montre aucune accumulation, alors que l'excrétion se produit rapidement en quelques heures ou en quelques jours.
L'exposition découlant de l'utilisation de ces produits serait de très courte durée (aiguë) par voie cutanée.
Les phtalates, en général, ne sont pas considérés comme ayant une toxicité aiguë, puisque les niveaux de DL50 de l'exposition cutanée se situent à un minimum de deux à cinq fois supérieur aux valeurs orales (Draize et al., 1948; Eastman Kodak, 1978; David et al., 2001; Monsanto Company, 1970 cité dans EPA des États-Unis, 2006, 2010).
L'information sur la toxicocinétique cutanée aiguë indique que les organes reproducteurs constituent une cible et que la durée d'exposition et de présence du DEP et du DMP dans d'autres tissus (adipeux et musculaires) est extrêmement faible après 7 jours (0,3 à 0,6 % de la dose appliquée; Elsisi et al., 1989).
De telles indications corroborent les évaluations d'autres organismes centrées sur des expositions répétées (AEPC, 2013a; CPSC américaine CHAP, 2014).
9.4 Incertitudes dans l'évaluation des risques pour la santé humaine
Des incertitudes sont associées à l'utilisation du DEP pour caractériser les effets du DMP sur la santé humaine, lorsqu'on ne dispose pas de données toxicologiques pour un stade particulier de la vie ou une voie ou une durée d'exposition.
Il n'existe aucune étude sur la toxicité pour le développement neurologique par une quelconque voie d'administration, de même qu'aucune étude sur deux générations pour le DMP. Les autres études restantes concernant le DMP et sa toxicité sur le développement de l'appareil reproducteur se limitent généralement à une espèce (le rat), à une dose et, la plupart du temps, elles portent sur les mâles. Certaines incertitudes sont associées avec la signification biologique potentielle des effets, mais également avec la sensibilité des effets après l'exposition à ce groupe de substances à la fois chez les hommes et les femmes, mais l'information existante ne permet pas de tirer un autre type de conclusion.
Il manque d'études sur le DMP à doses répétées à court et long terme par inhalation de même que des études de cancérogénicité limitées par voie orale ou cutanée. Par conséquent, l'incertitude demeure en ce qui a trait à la cancérogénicité potentielle et la toxicité chronique de ce phtalate. Toutefois, on dispose d'études de cancérogénicité pour l'analogue, le DEP afin de traiter ce critère d'effet toxicologique.
Même si une évaluation rigoureuse a été menée sur les données épidémiologiques humaines, il existe toujours des incertitudes sur la pertinence des études portant sur le risque potentiel de certains phtalates pour les humains. Des études épidémiologiques rigoureusement menées et démontrant des associations cohérentes et robustes entre un facteur d'exposition et un résultat pourraient démontrer solidement une inférence causale. Toutefois, les études observationnelles sur diverses populations présentent des difficultés, tant pour la mesure de l'exposition que pour la mesure du résultat, les biais et les facteurs de confusion qui leur sont inhérents (Lucas et McMichael, 2005). La majorité des études épidémiologiques examinées étaient transversales et il n'était donc pas possible d'établir une séquence temporelle où l'exposition précédait les conséquences. Qui plus est, plusieurs résultats associés avec l'exposition humaine aux phtalates dans les études épidémiologiques présentent de très longues latences (comme le cancer, le diabète, l'obésité, les maladies cardiovasculaires) et des étiologies multifactorielles (localisation géographique, statut socio-économique, facteurs liés au mode de vie, propension génétique, facteurs de stress non chimiques) et sont par nature chroniques, alors que les phtalates ont des demi-vies biologiques courtes et que leur mesure correspond donc à un aperçu de l'exposition récente. En outre, les données de biosurveillance indiquent que l'exposition à certains phtalates est omniprésente et ne peut donc pas être dichotomisée comme présente ou absente, mais qu'il s'agit plutôt d'une variable continue, souvent avec une gamme limitée.
Il est possible d'argumenter que même en l'absence de méthodes cohérentes, une association robuste devrait aboutir à des résultats cohérents (La Kind et al., 2012), les études épidémiologiques concernant les phtalates continuent de se caractériser par leur reproductibilité médiocre. Pour ajouter à ce manque de clarté, il faut mentionner l'exposition simultanée des humains à de multiples phtalates issus de multiples sources et de multiples voies, de même qu'à d'autres agents environnementaux susceptibles de présenter des effets qui coïncident, entre autres, le bisphénol A et certains métaux et composés organochlorés, comme les biphényles polychlorés (BPC) les dioxines et les divers pesticides organiques persistants. Dans son rapport final sur les phtalates de 2014, le Chronic Hazard Advisory Panel (CHAP) des États-Unis a conclu que malgré l'existence d'un nombre croissant d'études ayant rapporté des associations entre l'exposition aux phtalates et la santé humaine, et le signalement de la plupart des effets sur la santé, compatibles avec un syndrome de dysgénésie testiculaire chez l'homme, de telles études présentent des limitations reconnues et similaires à celles décrites ci-dessus. Elles n'ont donc pas servi pour la caractérisation des risques (US CPSC CHAP, 2014). Un autre examen récent a également mis en évidence des preuves épidémiologiques, minimales à faibles, pour les associations des effets des phtalates sur la reproduction et le développement dans la plupart des cas (Kay et al., 2014).
L'estimation des absorptions de DMP depuis le milieu naturel est entachée d'incertitudes en raison du peu de données de surveillance dont on dispose pour l'air, l'eau potable et le sol. Les estimations sur les absorptions provenant de la poussière domestique suscitent une confiance modérée à élevée, puisqu'elles sont représentatives de l'exposition potentielle de la population canadienne en général, étant donné que les estimations d'exposition se fondent sur une étude canadienne de surveillance de la poussière intérieure.
Pour quantifier l'exposition par voie orale découlant de la présence de DMP dans la nourriture, nous avons utilisé pour l'analyse des études réalisées aux États-Unis et en Grande-Bretagne. Par conséquent, une incertitude demeure puisque ces absorptions étaient ensuite extrapolées pour la population canadienne en général. Une incertitude est également associée aux estimations sur l'exposition calculée découlant de la présence du monoester de DMP (MMP) dans le lait maternel et les préparations pour nourrissons. Cette incertitude découle de la quantification de l'exposition (conversion de l'exposition au métabolite en exposition de la mère au phtalate) et de l'évaluation des marges d'exposition entre les absorptions dérivées de l'exposition au métabolite (pour les nourrissons ingérant du lait maternel ou des préparations contenant du MMP) des études toxicologiques évaluant les effets de l'exposition de la mère au phtalate.
Pour déduire les estimations des doses absorbées à partir des données de la biosurveillance qui comportent des incertitudes, il a fallu faire un certain nombre d'hypothèses. Autrement dit, présumer que les échantillons ponctuels d'urine sont représentatifs d'une concentration quotidienne à l'état d'équilibre ou faire des suppositions sur l'utilisation des concentrations corrigées de créatinine. Il est toutefois possible de considérer ces hypothèses sur la déduction de l'absorption comme fiables, car elles sont appropriées et prudentes.
De plus, il existe des incertitudes liées à l'utilisation des chiffres dérivés de le National Health and Nutrition Examination Survey (NHANES) pour l'absorption de DMP comme substituts pour la population canadienne et l'utilisation de références croisées (excrétion fractionnelle du MnBP au lieu du MMP) pour dériver les estimations d'exposition. Cependant, la base de données de biosurveillance pour DMP inspire une grande confiance, car elle représente un grand nombre de données recueillies récemment chez les individus en Amérique du Nord.
Les marges d'exposition par inhalation de fixatif en aérosol n'ont pas été évaluées en raison de l'insuffisance de données de toxicité par inhalation et de l'absence d'études de toxicité robustes pour évaluer l'exposition chronique par voie orale (empêchant les extrapolations d'une voie à l'autre).
Il existe également une incertitude concernant l'utilisation d'une dose cutanée en tant que paramètre pour évaluer le risque associé à des absorptions internes dans les données de biosurveillance (toutes sources et voies d'exposition), lorsqu'il est prévu que l'absorption cutanée de cette substance est inférieure à 100 % chez les rats (inférieur(e) à 10 %, voir la section 9.2.2). Toutefois, l'ampleur des marges d'exposition (348 485 à supérieur(e) à 1 million) est considérée comme adéquate pour prendre en compte cette incertitude. De plus, puisque la peau des rats est plus perméable que celle des humains pour un phtalate similaire (DEP), on peut vraisemblablement en déduire des doses systémiques plus faibles chez l'humain (voir la section 9.2.2).
L'absence de données, ou leur caractère limité, sur les effets pour la santé par toutes les voies et durées d'exposition pertinentes exige de faire une extrapolation d'une voie à l'autre ou l'utilisation de seuils d'effets à partir d'études dont la durée d'exposition est plus ou moins longue que les scénarios d'exposition. En cas d'incohérences dans les scénarios de durée, à condition que l'exposition quotidienne soit comparée aux seuils des effets sur la santé provenant d'études animales de plus longue durée, on peut faire confiance aux marges d'exposition dérivées qui sont prudentes.
L'incertitude est reconnue en matière de biodisponibilité orale potentielle du DMP après l'administration et, par conséquent, l'estimation de l'exposition systémique à laquelle des effets ont été observés dans les études sur l'animal. Néanmoins, l'information limitée sur l'absorption orale de phtalates à chaîne courte qui avoisinerait 100 % (voir la section 9.2.1) incite à considérer que les marges d'exposition sont adéquates lors de prise en compte de cette incertitude.
10. Références
[ACC] American Chemistry Council, 2001. High production volume (HPV) chemical challenge program test plan for the phthalate esters category. 10 décembre 2001. Préparé par ExxonMobil Biomedical Sciences, Inc. pour le Phthalate Esters Panel HPV Testing Group of the American Chemistry Council. Washington (D.C.) : American Chemistry Council.
Adams WJ, Biddinger GR, Robillard KA et Gorsuch JW. 1995. A summary of the acute toxicity of 14 phthalate-esters to representative aquatic organisms. Environ Toxicol Chem 14(9) : 1569-1574.
Adeniyi A., Okedeyi O et Yusuf K, 2011. Flame ionization gas chromatographic determination of phthalate esters in water, surface sediments and fish species in the Ogun river catchments, Ketu, Lagos, Nigeria. Environ. Monit. Assess. 172 561-569.
L'Assemblée des Premières Nations (APN) 2013. Initiative de biosurveillance des Premières Nations. Résultats Nationaux (2011). Juin 2013. Téléchargé le 26 février 2014.
http://www.afn.ca/uploads/files/afn_fnib_en_-_2013-06-26.pdf
Agarwal DK, Lawrence WH, Nunez LJ, Autian J. 1985. Mutagenicity evaluation of phthalic acid esters and metabolites in Salmonella typhimurium cultures. J Toxicol Environ Health 16(1) : 61-9.
Akahori Y, Nakai M, Yamasaki K, Takatsuki M, Shimohigashi Y, Ohtaki M. 2008. Relationship between the results of in vitro receptor binding assay to human estrogen receptor α and in vivo uterotrophic assay: Comparative study with 65 selected chemicals. Toxicol in Vitro22(1):225-231.
Alberta Environment. 2005. A preliminary survey of pharmaceuticals and endocrine disrupting compounds in treated municipal wastewaters and receiving rivers of Alberta. Rapport préparé par Al Sosiak, M. Sc., P.Biol. and Thorsten Hebben, M. Sc., P.Biol. Environmental Monitoring and Evaluation Branch. Accessible sur le web : http://environment.gov.ab.ca/info/library/7604.pdf
Alberta Environment. 2006. Wabamun Lake Spill Août 2005. Rapport de données sur la superficie du lac en eau libre (4 au 5 août au 15 septembre 2005). Rapport rédigé par Anne-Marie Anderson, Ph. D., P.Biol. Environmental Monitoring and Evaluation Branch Accessible sur le web : http://environment.gov.ab.ca/info/home.asp
Albro PW et Moore B. 1974. Identification of the metabolites of simple phthalate diesters in rat urine. J Chromatogr 94:0-209.
Albro PW et Moore B. 1974. Identification of the metabolites of simple phthalate diesters in rat urine. J Chromatogr 94(0):209-18. [cité dans NICNAS, 2008].
Alin J, Hakkarainen M. 2011. Microwave heating causes rapid degradation of antioxidants in polypropylene packaging, leading to greatly increased specific migration to food simulants as shown by ESI-MS and GC-MS. J Agr Food Chem 59:5418-27.
Al-Saleh I., Shinwari N et Alsabbaheen A, 2011. Phthalates residues in plastic bottled waters. J. Toxicol. Sci. 36(4) 469-478.
Amir S, Hafidi M, Merlina G, Hamdi H, Jouraiphy A, El Gharous M, et Revel JC. 2005. Fate of phthalic acid esters during composting of both lagooning and activated sludges. Process Biochemistry 40(6) : 2183-2190.
Anderson W., Castle L, Scotter L, Massey R. 2001. A biomarker approach in measuring human dietary exposure to certain phthalate esters. Food Addit.Contam. 18: 1068-1074.
[AOPWIN] Atmospheric Oxidation Program for Windows [modèle d'estimation]. 2010. Version 1.92a. Washington (D.C.) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [cité le 18/07/2014]. Accessible sur le Web à : www.epa.gov/oppt/exposure/pubs/episuite.html
Api AM. 2001. Toxicological profile of diethyl phthalate: a vehicle for fragrance and cosmetic ingredients. Food and Chemical Toxicology 39:97-108.
Ash M, Ash I. 2003. Paint and Coating Raw Materials - Manuel électronique, seconde édition. Endicott (NY) : Synapse Information Resources, Inc.
ASTM. 1997. Standard guide for determination of bioaccumulationof sediment-associated contaminants by benthic invertebrates. E1688-97a. In ASTM annual book of standards, Vol. 11.05, American Society for Testing and Materials, Philadelphia, PA, pp. 1072-1121. [cité ASTreat Model [modèle d'élimination des plantes dans le traitement des eaux usées]. 2006. Version 1.0. Cincinnati (US) : Procter & Gamble Company. [cité le 20/02/2015]. Disponible auprès de Procter & Gamble Company, P.O. Box 538707, Cincinnati, O.H. 45253-8707, États-Unis.
Ateşşahin A, ürk GT, Karahan İ, Yılmaz S, Çeribaşı AO, Bulmuş Ö. 2006. Lycopene prevents adriamycin-induced testicular toxicity in rats. Fertil Steril 85:1216-1222.
Babu B, Wu JT. 2010. Biodegradation of phthalate esters by cyanobacteria. Journal of Phycology46(6) : 1106-1113.
Bailey, J.E., editor. 2011. Compilation of Ingredients Used in Cosmetics in the United States. Première édition. Washington D.C. : Personal Care Products Council.
Balbuena P, Campbell JL, Clewell III HJ, Clewell RA. 2013. Evaluation of a predictive in vitro Leydig cell assay for anti-androgenicity of phthalate esters in the rat. Toxicol in Vitro 27(6):1711-1718.
Bamai YA, Shibata E, Saito I, Araki A, Kanazawa A, Morimoto K, Nakayama K, Tanaka M, Takigawa T, Yoshimura T, Chikara H, Saijo Y, Kishi R. 2014. Exposure to house dust phthalates in relation to asthma and allergies in both children and adults. Sci Total Environ. 485-486:153-63.
Banerjee S, Howard PH, Rosenberd AM, Dombrowski AE, S H, Tullis DL. 1984. Development of a general kinetic model for biodegradation and its application to chlorophenols and related compounds. Environ Sci Technol 18 : 416-422.
Banerjee P, Piwoni MD, Ebeid K. 1985. Sorption of organic contaminants to a low carbon subsurface core. Chemosphere 14(8):1057-1067.
Barber ED, Cifone M, Rundell J, Przygoda R, Astill BD, Moran E, Mulholland A, Robinson E, Schneider B. 2000. Results of the L5178Y Mouse Lymphoma Assay and the Balb/3T3 Cell In Vitro Transformation Assay for Eight Phthalate Esters. J Appl Toxicol 20 : 69-80.
Barros HD, Zamith HPdS, Bazilio FS, Carvalho LJ, Abrantes S. 2011. Identification of fatty foods with contamination possibilities by plasticizers when stored in PVC film packaging. Cienc Tecnol Aliment Campinas 31:547-52.
Barrows ME, Petrocelli SR, Macek KJ, Carroll JJ. 1980. Bioconcentration and elimination of selected water pollutants by bluegill sunfish (Lepomis macrochirus). Dans : Haque R, rédacteur. Dynamics, exposure and hazard assessment of toxic chemicals. Ann Arbor, Michigan, États-Unis : American Chemical Society. p. 379-392.
Battersby NS, Wilson V. 1989. Survey of the anaerobic biogdegradation potential of organic chemicals in digesting sludge. Appl Environ Microbiol 55(2) : 433-439.
Bell FP, Patt CS, Brundage B, Gillies P, Phillips WA. 1978. Studies on lipid biosynthesis and cholesterol content of liver and serum lipoproteins in rats fed various phthalate esters. Lipids 13:66-74.
Bergh C., Torgrip R, Emenius G Ostman C. 2011a. Organophosphate and phthalate esters in air and settled dust - a multi-location indoor study. Indoor Air 21: 67-76
Bergh C, Aberg K, Svartengren M, Emenius G, Ostman C. 2011b. Organophosphate and phthalate esters in indoor air: a comparison between multi-storey buildings with high and low prevalence of sick building symptoms. J. Environ. Monit. 13: 2001-2009
Beyer A, Mackay D, Matthies M, Wania F, Webster E. 2000. Assessing long-range transport potential of persistent organic pollutants. Environ Sci Technol34(4):699-703
Blair RM, Fang H, Branham WS, Hass BS, Dial SL, Moland CL, Tong W, Shi L, Perkins R, Sheehan DM. 2000. The oestrogenic receptor relative binding affinities of 188 natural and xenochemicals: structural diversity of ligands. Toxicol. Sci., 54 : 138-153.
Blair JD, Ikonomou MG, Kelly BC, Surridge B, et Gobas FAPC. 2009. Ultra-trace determination of phthalate ester metabolites in seawater, sediments, and biota from an urbanized marine inlet by LC/ESI-MS/MS. Sci. Technol.43(16):1344-1351. 6262-6268.
Buck Louis GM, Sundaram R, Sweeney AM, Schisterman EF, Maisog J, Kannan K. 2014. Urinary bisphenol A, phthalates, and couple fecundity: the Longitudinal Investigation of Fertility and the Environment (LIFE) study. Fertil Steril101(5):1359-1366.
Bono-Blay F., Guart A, de la Fuente B, Pedemonte M, Pastor M, Borrell A, Lacorte S. 2012. Survey of phthalates, alkylphenols, bisphenol A and herbicides in Spanish source waters intended for bottling. Environ. Sci. Pollut. Res. 19: 3339-3349.
Bradley EL, Burden RA, Leon I, Mortimer DN, Speck DR, Castle L. 2013a. Determination of phthalate diesters in foods. Food Addit Contam Part A Chem Anal Control Expo Risk Assess 30(4):722-34.
Bradley EL, Burden RA, Bentayeb K, Driffield M, Harmer N, Mortimer DN, Speck DR, Ticha J, Castle L, (2013). Exposure to phthalic acid, phthalate diesters and phthalate monoesters from food stuff: UK total diet study results. Food Additives and Contaminants : Part A, 30(4);735-742.
Bradley EL, Read WA, Castle L. 2007. Investigation into the migration potential of coating materials from cookware products. Food Addit Contam 24(3):326-35.
Brown D, Butterworth KR, Gaunt IF, Grasso P, Gangolli SD. 1978. Short-term oral toxicity study of diethyl phthalate in the rat. Fd Cosmet Toxicol 16:415-422 [tel que cité dans IPCS, 2003; NICNAS, 2011; US CPSC, 2011].
Buck Louis GM, Peterson CM, Chen Z, et al., 2013. Bisphenol A and phthalates and endometriosis: the Endometriosis: Natural History, Diagnosis and Outcomes Study. Fertil Steril. 100(1):162-9.e1-2.
Buck Louis GM, Sundaram R, Sweeney AM, Schisterman EF, Maisog J, Kannan K. 2014. Urinary bisphenol A, phthalates, and couple fecundity: the Longitudinal Investigation of Fertility and the Environment (LIFE) study. Fertil Steril.101(5):1359-1366.
Bunch RL, Chambers CW. 1967. A biodegradability test for organic compounds. Jour. Water Poll. Control Fed.39:181.
Burkhard L. 2009. Estimation of biota sediment accumulation factor (BSAF) from paired observations of chemical concentrations in biota and sediment. U.S. Environmental Protection Agency, Ecological Risk Assessment Support Center, Cincinnati, OH. EPA/600/R-06/047.
Call DJ, Markee TP, Geiger DL, Brooke LT, VandeVenter FA, Cox DA, Genisot KI, Robillard KA, Gorsuch JW, Parkerton TF, Reiley MC, Ankley GT, et Mount DR. 2001. An assessment of the toxicity of phthalate esters to freshwater benthos. 1. Aqueous exposures. Environ Toxicol Chem 20(8) : 1798-1804.
Canada. 1999. Loi canadienne sur la protection de l'environnement (1999). L.C., 1999, ch. 33. Partie III, vol. 22, no 3. Accessible sur le Web à : http://laws-lois.justice.gc.ca/PDF/C-15.31.pdf
Canada, ministère de l'Environnement. 2013. Loi canadienne sur la protection de l'environnement (1999). Avis concernant certaines substances de phtalates. Gazette du Canada, Partie I, vol. 147, no 28, p. 1801-1823. Accessible sur le Web à : http://gazette.gc.ca/rp-pr/p1/2013/2013-07-13/html/notice-avis-fra.html#archived
Cao, X. 2008. Determination of phthalates and adipate in bottled water by headspace solid-phase microextraction and gas chromatography/mass spectrometry. Journal of Chromatography A 1178(1-2): 231-238.
Cao X-L, Zhao W, Churchill R, Hilts C. 2014. Occurrence of Di-(2-Ethylhexyl) Adipate and Phthalate Plasticizers in Samples of Meat, Fist, and Cheese and Their Packaging Films. Journal of Food Protection77:610-620.
CARB (California Air Resources Board). Toxic Air Contaminant (TAC) Identification List. Dernière révision de la liste 16 août 2010. Téléchargé le 17 juillet 2014
CATALOGIC [Computer Model]. 2012. Version 5.11.15. Bourgas (BG) : Bourgas Prof. Assen Zlatarov University, Laboratory of Mathematical Chemistry. Accessible sur le Web à : www.oasis-lmc.org/?section=software&swid=1
CDC (Centres for Disease Control and Prevention. 2013). Fourth National Report on Human Exposure to Environmental Chemicals. Updated Tables, March 2013www.cdc.gov/exposeuereport/pdf/FourthReport_UpdatedTables_Mar2013.pdf
Chemical Manufacturers Association. 1986. Mutagenicity of 1C (di-n- butyl phthalate) in a mouse lymphoma mutation assay (final report). Submitted to Hazleton Biotechnologies Company. HB Project No. 20989 [tel que cité dans IRIS 2009].
Cheminfo Services Inc. 2013a. Chemical Management Plan 2 (CMP2) scoping project for substance information. Draft final report on phtalates. Markham (Ont.) : Cheminfo Services Inc.
Chen CY, Chou YY, Wu YM, Lin CC, Lin SJ, Lee CC. 2013. Phthalates may promote female puberty by increasing kisspeptin activity. Human Reproduction. 28 (10):2765-2773.
Cheung JKH, Lam RKW, Shi MY, et Gu JD. 2007. Environmental fate of endocrine-disrupting dimethyl phthalate esters (DMPE) under sulfate-reducing condition. Sci Total Environ 381(1-3) : 126-133.
Christensen KLY, Makris SL, Lorber M. Generation of hazard indices for cumulative exposure to phthalates for use in cumulative risk assessment. Regulatory Toxicology and Pharmacology 2014: 69(3) 380 - 389
CIR Expert Panel. 2003. Dibutyl Phthalate, Diethyl Phthalate, and Dimethyl Phthalate Re-review Summary. Accessible sur le Web à : http://www.national-toxic-encephalopathy-foundation.org/wp-content/uploads/2012/01/phthalatessafe.pdf.
Clara M, Windhofer G, Hartl W, Braun K, Simon M, Gans O, Scheffknecht C, Chovanec A. 2010. Occurrence of phthalates in surface runoff, untreated and treated wastewater and fate during wastewater treatment. Chemosphere78:1078-1084.
Clewell RA, Campbell JL, Ross SM, Gaido KW, Clewell III HJ, Andersen ME. 2010. Assessing the relevance of in vitro measures of phthalate inhibition of steroidogenesis for in vivo response. Toxicol in Vitro 24(1):327-334.
CMA.1984. Toxicity of fourteen phthalate esters to the freswater green alga Selenastrum capricornutum.Chemical Manufacturers Association (CMA), CMA Contract Nr PE 16.PET-EGG, Report BP-84-1-4.263. [tel que cité dans : EURAR 2003a et EURAR 2003b].
CMA. 1984f. Summary Report Environmental Studies - Phase I: Generation of Chemical Manufacturers Association (CMA), Phthalate Esters Program Panel: Generation of Environmental Fate and Effects Data Base on 14 Phthalate Esters.
Corton JC, Lapinskas PJ. 2005. Peroxisome proliferator-activated receptors: mediators of phthalate ester-induced effects in the male reproductive tract?Toxicol Sci 83(1):4-17.
Cousins I, Mackay D. 2000. Correlating the physical-chemical properties of phthalate esters using the 'three solubility' approach. Chemosphere 41:1389-1399.
Cowen WF, Baynes ILK. 1980. Estimated application of gas chromatographic headspace analysis to priority pollutants. Environ. Sci. Health A15(5) : 413--427.
Crechem, 2003. Release scenarios for Canadian coatings facilities. Rapport préparé pour Environnement Canada. Ottawa (Ont.) : par Crechem Technologies Inc. 31 mars 2003.
Data Interpretation Group. 1999. Joint evaluation of upstream/downstream Niagara River data 1996-97. Prepared by Data Interpretation Group, River Monitoring Committee. A joint publication of Environment Canada, US Environmental Protection Agency, Ontario Ministry of the Environment, NY State Department of Environmental Conservation.
[APE du Danemark]. Agence de la protection de l'environnement du Danemark. 2006. Survey, migration and health evaluation of chemical substances in toys and childcare products produced from foam plastic (Survey of Chemical Substances in Consumer Products No. 70). Accessible sur le Web à : http://www2.mst.dk/common/Udgivramme/Frame.asp?http://www2.mst.dk/udgiv/Publications/2006/87-7052-098-4/html/helepubl_eng.htm. Copenhagen (DK) : Agence de la protection de l'environnement du Danemark, ministère de l'Environnement du Danemark.
[APE du Danemark]. Agence de la protection de l'environnement du Danemark. 2008. Survey of chemical substances in headphones and hearing protection aids (Survey of Chemical Substances in Consumer Products No. 91). Accessible sur le Web à : http://www2.mst.dk/common/Udgivramme/Frame.asp?http://www2.mst.dk/udgiv/publications/2008/978-87-7052-733-0/html/helepubl_eng.htm. Copenhague (DK) : Agence de la protection de l'environnement du Danemark, ministère de l'Environnement du Danemark.
Daubert TE, Danner RP. 1989. Physical and thermodynamic properties of pure chemicals data compilation. Washington (D.C.) : Taylor and Francis [tel que cité dans HSDB 2010].
David RM. 2000. Exposure to phthalate esters. Environ Health Perspect 108:A440.
Deblonde T, Cossu-Leguille C, et Hartemann P. 2011 Emerging pollutants in wastewater: A review of the literature. Int J Hygiene Environ Health 214: 442-448.
Devier M, LeMenach K, Viglino L, DiGioia L, Lachassagne P, Budzinski H. 2013. Ultra-trace analysis of hormones, pharmaceutical substances, alkylphenols and phthalates in two French natural mineral waters. Sci. Total Environ. 443 : 621-632.
Devier M, LeMenach K, Viglino L, DiGioia L, Lachassagne P, Budzinski H. 2013. Ultra-trace analysis of hormones, pharmaceutical substances, alkylphenols and phthalates in two French natural mineral waters. Sci. Total Environ. 443 621-632.
Diana A, Dimitra V. 2011. Alkylphenols and phthalates in bottled waters. Journal of Hazardous Materials185: 281-286. Dixon DR, Wilson JT, Pascoe PL, Parry J.M. 1999. Anaphase aberrations in the embryos of the marine tubeworm Pomatoceros lamarckii (Polychaeta: Serpulidae): a new in vivo test assay for detecting aneugens and clastogens in the marine environment. Mutagenesis 14 : 375-383. (doi:10,1093/mutage/14.4.375). [tel que cité dans : Oehlmann et al., 2009].
[BDPP] Base de données sur les produits pharmaceutiques [base de données sur Internet]. 2010. Ottawa (Ont.) : Santé Canada. Base de données des médicaments.
[DS TOPKAT] Discovery Studio Toxicity Prediction by computer Assisted Technology [Prediction Module]. c2005-2009. Version 2,5.0,9164. San Diego (CA) : Accelrys Software Inc. [cité année, mois, date]. Accessible sur le Web à : http://accelrys.com/products/discovery-studio/qsar-admet-and-predictive-toxicology.html
Dow Chemical. 1946. TSCAT OTS0206677, Doc ID 878214827, N, 09,10.1946 [tel que cité dans NICNAS, 2008].
Downs SH, Black N. The feasibility of creating a checklist for the assessment of the methodological quality both of randomised and non-randomised studies of health care interventions. J Epidemiol Community Health 1998; 52:377-84.
Draize JH, Alvarez E, Whitesell MF, Woodward G, Conway Hagan E, Nelson AA. 1948. Toxicological investigations of compounds proposed for use as insect repellants; A. Local and systemic effects following topical skin application; B. Acute oral toxicity; C. Pathological examination. J Pharmacol Exp Ther 93:26-39.
Duty SM, Calafat AM, Silva MJ, Ryan L, Hauser R. 2005. Phthalate exposure and reproductive hormones in adult men. Hum Reprod 20(3):604-10.
Duty SM, Singh NP, Silva MJ. 2003a. The relationship between environmental exposures to phthalates and DNA damage in human sperm using the neutral comet assay. Environ Health Perspect 111(9):1164-9.
Duty SM, Silva MJ, Barr DB. 2003 b. Phthalate exposure and human semen parameters. Epidemiology14:269-77.
Eastman Kodak. 1978. Toxicity and Health Hazard Summary. Fourni dans la TSCA Section 8D. Document No 878214402; OTS 0206525.
Bureau européen des substances chimiques [BESC] 2008. Rapport d'évaluation des risques de l'Union européenne; numéro de CAS : 117-81-7; numéro EINECS : 204-211-0; bis(2-ethylhexyl)phthalate (DEHP). 2nd Priority List, Volume 80. Institut pour la santé et la protection des consommateurs Numéro de rapport 23 384 EUR EN. pp. 588. http://publications.jrc.ec.europa.eu/repository/bitstream/111111111/5648/1/dehpreport042.pdf.
[ECHA] Agence européenne des produits chimiques. 2014. Base de données des substances enregistrées. Résultats de la recherche pour le numéro de CAS [3648-20-2]. Helsinki (FI) : ECHA [consulté le 28 février 2014]. Accessible sur le Web à : www.echa.europa.eu/information-on-chemicals/registered-substances
[ECHA] Agence européenne des produits chimiques. c2007-2013. Base de données des substances enregistrées. Résultats de la recherche pour le numéro de CAS 1330-78-5. Helsinki (FI) : ECHA. [tel que cité en juillet 2013]. Accessible sur le Web à : www.echa.europa.eu/information-on-chemicals/registered-substances
Elsisi AE, Carter DE, Sipes IG. 1989. Dermal absorption of phthalate diesters in rats. Fundam Appl Toxicol 12(1):70-7.
Engel SM. 2009. Prenatal phthalate exposure and performance on the Neonatal Behavioral Assessment Scale in a multiethnic birth cohort. Neurotoxicology30:522-528.
Engel SM. 2010. Prenatal phthalate exposure is associated with childhood behavior and executive functioning. Environ Health Perspect 118:565-571.
Ellington JJ, Floyd TF. 1996. Octanol water partition coefficients for eight phthalate esters. EPA/600/S-96/006. Athens (GA): U.S. Environmental Protection Agency.
Environnement Canada. 2012. Final Results from Phase One of the Domestic Substances ListInventory Update Rapid Screening Assessment of Substances of Lower Ecological Concern -Detailed Spreadsheet. Gatineau (Qué.) : Division des évaluations écologiques, Environnement Canada,
Environnement Canada. 2014. Data for phthalate substances collected under the Loi canadienne sur la protection de l'environnement (1999), article 71 : Avis concernant certaines substances de phtalates. Données compilées par : Environnement Canada, Division de la mobilisation et de l'élaboration des programmes.
Environnement Canada. 2015a. Documents d'appui : Groupe de substances des phtalates Information in support of the State of the Science Reports for Phthalates: Short-, Medium-, Long-Chain, and DINP. Gatineau (Qué.) : Environnement Canada. Disponible sur demande : substances@ec.gc.ca
Environnement Canada. 2015a. Documents d'appui : Groupe de substances des phtalates Robust Study Summaries in support of the State of the Science Reports for Phthalates: Short-, Medium-, Long-Chain, and DINP. Gatineau (Qué.) : Environnement Canada. Disponible sur demande : substances@ec.gc.ca
Environnement Canada, Santé Canada. 2013. Substances chimiques : Catégorisation [Internet]. Ottawa (Ont.) : Gouvernement du Canada [mis à jour le 20 avril 2007; cité le 10 juin 2014]. Accessible sur le Web à : http://www.chemicalsubstanceschimiques.gc.ca/approach-approche/categor-fra.php
Environnement Canada et Santé Canada. 2015. Approche proposée pour la prise en compte des risques cumulatifs de certains phtalates en vertu du Plan de gestion des produits chimiques. Gatineau (Qué.) : Environnement Canada, Santé Canada, Programme des substances existantes. Disponible sur demande : substances@ec.gc.ca
[EPI Suite] Estimation Programs Interface Suite for Microsoft Windows [Modèle d'estimation]. 2000-2008. Version 4.1. Washington (D.C.) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [cité le 18/07/2014]. Accessible sur le Web : www.epa.gov/oppt/exposure/pubs/episuitedl.htm
[EQC] Equilibrium Criterion Model. 2011. Version 1.00. Peterborough (Ont.) : Trent University, Canadian Environmental Modelling Centre.[cité le 18/07/2014]. Accessible sur le Web à : http://www.trentu.ca/academic/aminss/envmodel/models/EQC2.html
[ESIS] système européen d'information sur les substances chimiques. Accessible sur le Web à : http://esis.jrc.ec.europa.eu/. Joint Research Centre (JRC). [cité le 23 juin 2014].
Commission européenne. 2000. IUCLID Dataset. Ispra (IT) : Commission européenne, Centre commun de recherche, Institut pour la santé et la protection des consommateurs, Bureau européen des substances chimiques. Accessible sur le Web à : http://esis.jrc.ec.europa.eu/.
Commission européenne. 2003. Document technique d'orientation pour l'évaluation des risques : Partie II. Ispra (IT) : Commission européenne, Centre commun de recherche, Institut pour la santé et la protection des consommateurs. Numéro de rapport : EUR 20418 EN/2. 328p. Luxembourg, Office des publications officielles des Communautés européennes. Accessible sur le Web à : http://ecb.jrc.it/Documents/TECHNICAL_GUIDANCE_DOCUMENT/EDITION_2/tgdpart2_2ed.pdf
Eveillard A, Mselli-Lakhal L, Mogha A, Lasserre F, Polizzi A, Pascussi JM, Guillou H, Martin PG, Pineau T. 2009. Di-(2-ethylhexyl)-phthalate (DEHP) activates the constitutive androstane receptor (CAR): a novel signalling pathway sensitive to phthalates. Biochem Pharmacol 77:1735-1746.
Fatoki O, Bornman M, Ravandhalala L, Chimuka L, Genthe B, Adeniyi A. 2010. Phthalate ester plasticizers in freshwater systems of Venda. South Africa and potential health effects. Water SA 36: 117-125.
Fenner K, Scheringer M, MacLeod M, Matthies M, McKone TE, Stroebe M, Beyer A, Bonnell M, Le Gall A, Klasmeier J, Mackay D, Pennington DW, Scharenberg B, Wania F. 2005. Comparing estimates of persistence and long-range transport potential among multimedia models. Environ Sci Technol 39:1932-1942.
Field EA, Price, CJ, Sleet RB, George JD, Marr MC, Myers CB, Schwetz BA, Morrissey RE. 1993. Developmental toxicity evaluation of diethyl and di methyl phthalate in rats. Teratology 48:33-44.
Fierens T, Servaes K, Van Holderbeke M, Geerts L, De Henauw S, Sioen I, Vanerman G. 2012. Analysis of phthalates in food products and packaging materials sold on the Belgian market. Food and Chemical Toxicology 50: 2575-2583.
Foster PMD, Thomas LV, Cook MW, Gangolli SD. 1980. Study of the Testicular Effects and Changes in Zinc Excretion Produced by Some n-Alkyl Phthalates in the Rat. Toxicol Appl Pharmacol 54:392-398.
Frederiksen H, Hanninen TK, Main KM, Dunkel L, Sankilampi. A longitudinal study of urinary phthalate excretion in 58 full-term and 67 preterm infants from birth through 14 months. Environmental Health Perspectives. 2014 Sept : 122(9) 998 - 1005
Frederiksen H, Skakkebaek NE, Andersson AM. 2007. Metabolism of phthalates in humans. Mol Nutr Food Res 51(7):899-911.
Fromme H, Lahrz T, Piloty M, Gebhart H, Oddoy A, Ruden H. 2004. Occurrence of phthalates and musk fragrances in indoor air and dust from apartments and kindergartens in Berlin (Germany). Indoor Air 14: 188-195.
Fromme H, Gruber L, Schlummer M, Wolz G, Böhmer S, Angerer J, Mayer R, Liebl B, Bolte G. 2007. Intake of phthalates and di (2-ethylhexyl) adipate: Results of the Integrated Exposure Assessment Survey based on duplicate diet samples and biomonitoring data. Environ Int33(8):1012-1020.
Fromme H, Gruber L, Seckin E, Raab U, Zimmermann S, Kiranoglu M, Völkel W. 2011. Phthalates and their metabolites in breast milk - results from the Bavarian Monitoring of Breast Milk (BAMBI). Environ Int 37(4):715-722.
Fujii S, Yabe K, Furukawa M, Hirata M, Kiguchi M, Ikka T. 2005. A two-generation reproductive toxicity study of diethyl phthalate (DEP) in rats. J Toxicol Sci 30:97-116.
Furr J, Lambright C, Wilson V, Foster P, Gray, Jr L.2014. A short-term in vivo screen using fetal testosterone production, a key event in the phthalate adverse outcome pathway, to predict disruption of sexual differentiation. Toxicological Sciences, 140(2), 403-432.
Furtmann K. 1994. Phthalates in surface water - a method for routine trace level analysis. Fresenius J Anal Chem 348:291-296.
Gartner S, Balski M, Koch M, Nehls I. 2009. Analysis and migration of phthalates in infant food packed in recycled paperboard. J Agric Food Chem 57:10675-81.
Ge J, Li MK, Lin F, Zhao J, et Dai XJ. 2011. Comparative studies on toxicokinetics and residues of dimethyl phthalate (DMP) in tilapia (Oreoehromis niloticus x 0. aureus) at different water temperatures. Turkish Journal of Fisheries and Aquatic Sciences 11(2) : 253-259.
Gevao B, Al-Ghadban A, Bahloul M, Uddin S, Zafar J. 2013. Phthalates in indoor dust in Kuwait: implications for non-dietary human exposure. Indoor Air 23: 126-133.
Gobas FACP, Mackintosh CE, Webster G, Ikonomou M, Parkerton TF, Robillard K. 2003. Bioaccumulation of phthalate esters in aquatic food webs. The Handbook of Environmental Chemistry, Vol. 3, Part Q : 201-225.
Gouvernement du Canada 2015. Le « Défi » du gouvernement du Canada relatif aux substances chimiques dont le suivi est de priorité élevée. Accessible sur le Web à : http://www.chemicalsubstanceschimiques.gc.ca/challenge-defi/index-fra.php
Gray TJB, Gangolli S. 1986. Aspects of the Testicular Toxicity of Phthalate Esters. Environ Health Perspect 65:229-235.
Gray LE, Ostby J, Furr J, Price M, Veeramachaneni DNR, Parks L. 2000. Perinatal exposure to the phthalates DEHP, BBP, and DINP but not DEP, DMP or DOTP alters sexual differentiation of the male rat. Toxicol Sci 58:350-365.
Guo Y, Kannan K. 2011. Comparative assessment of human exposure to phthalate esters from house dust in China and the United States. Environ. Sci. Technol. 45: 3788-3794.
Guo Y, Kannan K. 2013. A survey of phthalates and parabens in personal care products from the United States and its implications for human exposure. Environ. Sci. Technol. 47: 14442-14449.
Guo Y, Wang L, Kannan K. 2013. Phthalates and Parabens in personal care products from China : Concentrations and Human Exposure. Arch Environ Contam Toxicol: 66(1):113-9
Guo Y, Zhang Z, Liu L, Li Y, Ren N, Kannan K. 2012. Occurrence and profiles of phthalates in foodstuffs from China and their implications for human exposure. J. Agric. Food Chem. 60: 6913-6919.
Hansen E, Meyer O. 1989. No embryotoxic or teratogenic effect of dimethyl phthalate in rats after epicutaneous application. Short Communications. Pharmacol & Toxicol 64:237-238.
Hardin BD, Schuler RL, Burg JR, Booth GM, Hazleden KP, Mackenzie KM, Piccirillo VJ, and Smith KN. 1987. Evaluaton of 60 chemicals in a preliminary developmental toxicity test. Teratog Carcinog Mutagen 7:29-48.
Hashizume K, Nanya J, Toda C, Yasui T, Nagano H, et Kojima N. 2002. Phthalate esters detected in various water samples and biodegradation of the phthalates by microbes isolated from river water. Biological & Pharmaceutical Bulletin 25(2) : 209-214.
Haynes WM, Lide DR. 2010.CRC Handbook of Chemistry and Physics. 91 st edition. 2010-2011. Boca Raton (FL) : CRC Press, Taylor & Francis Group.
[HSDB] Hazardous Substances Data Bank[base de données sur Internet]. 2010. Bethesda (MD) : U.S. National Library of Medicine. [cité le 26 jan 2012]. Accessible sur le Web à : http://toxnet.nlm.nih.gov/cgi-bin/sis/htmlgen?HSDB
He H, Hu G, Sun C, Chen S, Yang M, Li J, Zhao Y, Wang H. 2011. Trace analysis of persistent toxic substances in the main stream of Jiangsu section of the Yangtse River, China. Environ Sci Pollut Res 18: 638-648.
Santé Canada. 1994. L'évaluation du risque à la santé humaine des substances d'intérêt prioritaire. Ottawa (Ont.), Santé Canada, Direction de l'hygiène du milieu. Accessible sur le Web à : http://www.hc-sc.gc.ca/ewh-semt/pubs/contaminants/approach/index-fra.php
Santé Canada. 2013. Deuxième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada Résultats de l'Enquête canadienne sur les mesures de la santé Cycle 2 (2009-2011). ISBN : 978-0-660-20754-4.http://publications.gc.ca/site/fra/442162/publication.html Téléchargé le 27 novembre 2013.
Santé Canada. 2015a. Document technique : Draft Approach for Using Chemical Categories and Read-Across to Address Data Gaps for Effects on the Developing Male Reproductive System : Groupe de substances des phtalates : Accessible sur le Web à : http://www.chemicalsubstanceschimiques.gc.ca/approach-approche/index-fra.php
Santé Canada. 2015 b. Documents d'appui : Evaluation of epidemiologic studies on phthalate compounds and their metabolites. Ottawa (Ont.) : Santé Canada. Disponible sur demande : substances@ec.gc.ca
Santé Canada. 2015c. Documents d'appui : Reproductive/developmental effects of selected phthalates in females animals. Ottawa (Ont.) : Santé Canada. Disponible sur demande : substances@ec.gc.ca
Santé Canada. 2015d. Documents d'appui : Carcinogenicity of phthalates - Common MOA by tumor types. Ottawa (Ont.) : Santé Canada. Disponible sur demande : substances@ec.gc.ca
Heitmuller PT, Hollister TA, Parrish PR. 1981. Acute toxicity of 54 industrial chemicals to Sheepshead Minnows (Cyprinodon variegatus). Bull.Environm. Contam. Toxicol. 27 : 596-604.
[HENRYWIN] Henry's Law Constant Program for Microsoft Windows [modèle d'estimation]. 2011. Version 3.20. Washington (D.C.) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [cité le 18/07/2014]. Accessible sur le Web : www.epa.gov/oppt/exposure/pubs/episuite.htm
Hoppin JA, Jaramillo R, London SJ, Bertelsen RJ, Salo PM, Sandler DP, Zeldin DC. 2013. Phthalate exposure and allergy in the U.S. population: results from NHANES 2005-2006. Environ Health Perspect 121:1129-34.
Howard PH, Banerjee S, Robillard KH. 1985. Measurement of water solubilities, octanol/water partition coefficients and vapor pressures of commercial phthalate esters. Environ Toxicol Chem 4:653-661.
Howdeshell KL, Wilson VS, Furr J, Lambright CR, Rider CV, Blystone CR, Hotchkiss AK, Gray LE. 2008. A mixture of five phthalate esters inhibits fetal testicular testosterone production in the Sprague-Dawley Rat in a cumulative, dose-additive manner. Toxicol Sci 105(1):153-165.
Hsu N, Lee C, Wang J, Li Y, Chang H, Chen C, Bornehag C, Wu P, Sundell J, Su H. 2012. Predicted risk of childhood allergy, asthma, and reported symptoms using measured phthalate exposure in dust and urine. Indoor Air 22(3): 186-199.
Huang PC, Kuo PL, Chou YY, Lin SJ, Lee CC. 2009. Association between prenatal exposure to phthalates and the health of newborns. Environ Int 35:14-20. Huang Y, Li J, Garcia JM, et al. Phthalate levels in cord blood are associated with preterm delivery and fetal growth parameters in Chinese women. PLOS ONE 2014;9(2):e87430.
Huber DR, Blount BC, Mage DT, Letkiewicz FJ, Kumar A, Allen RH. Estimating perchlorate exposure from food and tap water based on US biomonitoring and occurrence data. Journal of Exposure Science and Environmental Epidemiology2010;21(4):395-407.
Hubinger J. 2010. A survey of phthalate esters in consumer cosmetic products. J. Cosmet. Sci. 61: 457-465.
Hubinger J, Havery D. 2006. Analysis of consumer cosmetic products for phthalate esters. J. Cosmet. Sci. 57: 127-137.
[Hydrowin] Aqueous Hydrolysis Rate Program for Microsoft Windows s [modèle d'estimation]. 2008. Version 2.00. Washington (D.C.) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [cité le 18/07/2014]. Accessible sur le Web à : www.epa.gov/oppt/exposure/pubs/episuite.htm
Centre International de Recherche sur le Cancer (CIRC). 2012. Di(2-ethylhexyl) phthalate. CIRC Monographies sur l'évaluation des risques de cancérogénicité pour l'homme. Volume 101 - Some Chemicals Present in Industrial and Consumer Products, Food and Drinking-water. Pp. 149-284. Disponible à l'adresse suivante : http://monographs.iarc.fr/ENG/Monographs/vol101/mono101-006.pdf.
Ioku T, Mukaide A, Kitanaka H, Sakagami Y, Kamevama T. 1976. In vitro distribution of drugs. Labelled compounds. Yakuri To Chiryo 4:510-514.
Intrinsik Environmental Sciences, Inc. 2013. Comprehensive literature search, data evaluation and summary of the environmental fate, concentrations, persistence, bioaccumulation and ecotoxicity of phthalates subject to CMP assessment. Numéro du contrat : K8A43-12-0018.
[PISC] Programme international sur la sécurité des substances chimiques. 2003. Diethyl phthalate. http://www.inchem.org/documents/cicads/cicads/cicad52.htm
Genève (CH) : Organisation mondiale de la Santé (Résumé succinct international no 52 sur l'évaluation des risques chimiques) Parrainé conjointement par le Programme des Nations Unies pour l'environnement, l'Organisation internationale du Travail et l'Organisation mondiale de la Santé, et produit dans le cadre du Programme interorganisations pour la gestion rationnelle des produits chimiques. Disponible à l'adresse suivante : http://www.inchem.org/documents/cicads/cicads/cicad52.htm
Integrated Risk Information System (IRIS) 2009
Ito Y, Yamanoshita O, Asaeda N, Tagawa Y, Lee CH, Aoyama T, Ichihara G, Furuhashi K, Kamijima M, Gonzalez FJ, Nakajima T. 2007. Di(2-ethylhexyl)phthalate induces hepatic tumorigenesis through a peroxisome proliferator-activated receptor alpha-independent pathway. J Health Sci 49, p.172-182.
Janjua NR, Mortensen GK, Andersson AM, Kongshoj B, Skakkebaek NE, Wulf HC. 2007. Systemic uptake of diethyl phthalate, dibutyl phthalate, and butyl paraben following whole-body topical application and reproductive and thyroid hormone levels in humans. Sci. Technol. 41, p. 5564-5570.
Janjua NR, Frederiksen H, Skakkebaek NE, Wulf HC, Andersson AM. 2008. Urinary excretion of phthalates and paraben after repeated whole-body topical application in humans. Int J Androl 31(2), p.118-30.
Jaworska JS, Hunter RS, Schultz TW. 1995. Quantitative structure-toxicity relationships and volume fraction analyses forselected esters. Arch Environ Contam Toxicol. 29, p. 86-93
Jones HB, Garside DA, Liu R, Roberts JC. 1993. The Influence of Phthalate Esters on Leydig Cell Structure and Function in Vitro and in Vivo. Exp Mol Pathol 58, p.179-193.
Jonsson and Baun. 2003. Toxicity of mono- and diesters of o-phthalic esters to a crustacean, a green alga, and a bacterium. Environmental Toxicology and Chemistry 22: 3037-3043.
Kanchanamayoon W, Prapatpong P, Chumwangwapee S, Chaithongrat S. 2012. Analysis of phthalate esters contamination in drinking water samples. African Journal of Biotechnology 11: 16263-16269.
Kang Y, Man Y, Cheung K, Wong M. 2012. Risk assessment of human exposure to bioaccessible phthalate esters via indoor dust around the Pearl River Delta. Environ. Sci. Technol. 46: 8422-8430.
Kao ML, Ruoff B, Bower N, Aoki T, Smart C, Mannens G. 2012. Pharmacokinetics, metabolism and excretion of 14C-monoethyl phthalate (MEP) and 14C-diethyl phthalate (DEP) after single oral and IV administration in the juvenile dog. Xenobiotica 42(4), p.389-397.
Kasper-Sonnenberg M, Koch HM, Wittsiepe J, Wilhelm M. 2012. Levels of phthalate metabolites in urine among mother-child-pairs - results from the Duisburg birth cohort study, Germany. Int J Hyg Environ Health 215(3), p. 373-382.
Kato H, Furuhashi T, Tanaka M, Katsu Y, Watanabe H, Ohta Y, Iguchi T. 2006. Effects of bisphenol A given neonatally on reproductive functions of male rats. Reprod Toxicol 22(1), p. 20-29.
Kawano M. 1980. [Toxicological studies on phthalate esters. 2. Metabolism, accumulation and excretion of phthalate esters in rats (author's transl)]. Nihon eiseigaku zasshi. Jpn J Hyg 35(4) : p. 693-701.
Kayano Y, Watanabe K, Matsunaga T, Yamamoto I, Yoshimura H. 1997. Involvement of a novel mouse hepatic microsomal esterase, ES46.5K, in the hydrolysis of phthalate esters. Biol Pharm Bull 20(7), p. 749-751.
Kickham P, Otton SV, Moore MM, Ikonomou MG et Gobas FAPC. 2012. Relationship between biodegradation and sorption of phthalate esters and their metabolites in natural sediments. Environmental Toxicology and Chemistry 31(8), p. 1730-1737.
Klasmeier J, Matthies M, MacLeod M, Fenner K, Scheringer M, Stroebe M, Le Gall AC, McKone TE, van de Meent D, Wania F. 2006. Application of multimedia models for screening assessment of long-range transport potential and overall persistence. Sci. Technol. 40:53-60.
[KOAWIN] Octanol Air Partition Coefficient Program for Microsoft Windows [Estimation Model]. 2010. Version 1.10. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [source citée le 2014 07 18]. Disponible à l'adresse suivante : www.epa.gov/oppt/exposure/pubs/episuite.htm. Référence dans le texte (PCKOCWIN, 2000)
Koch HM, and Calafat AM. 2009. Human body burdens of chemicals used in plastic manufacture. Philos.Trans. R. Soc. Lond. B: Biol. Sci. 364 (1526), 2063-2078
Koch HM, Becker K, Wittassek M, Seiwert M, Angerer J, Kolossa-Gehring M. 2007 Di-n-butylphthalate and butylbenzylphthalate--urinary metabolite levels and estimated daily intakes: pilot study for the German Environmental Survey on children. Journal of Exposure Science and Environmental Epidemiology 17:378-387.
[KOCWIN] The Soil Adsorption Coefficient Program [Estimation Model]. 2010. Version 2.00. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation. [source citée le 2014 07 18]. Disponible à l'adresse suivante : www.epa.gov/oppt/exposure/pubs/episuite.htm. Référence dans le texte (PCKOCWIN, 2000)
Kolarik B, Bornehag C, Naydenov K, Sundell J, Stavova P, Nielsen O. 2008a. The concentrations of phthalates in settled dust in Bulgarian homes in relation to building characteristics and cleaning habits in the family. Atmospheric Environment 42: 8553-8559.
Kolarik B, Naydenov K, Larsson M, Bornehag C, Sundell J. 2008b. The association between phthalates in dust and allergic diseases among Bulgarian children. Environ Health Perspect. 116: 98-103.
Koniecki D, Wang R, Moody R, Zhu J. 2011. Phthalates in cosmetic and personal care products: Concentrations and possible dermal exposure. Environ. Res. 111: 329-336.
[KOWWIN] Octanol-Water Partition Coefficient Program for Microsoft Windows [Estimation Model]. 2010. Version 1.68. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.[source citée le 2014 07 18]. Disponible à l'adresse suivante : www.epa.gov/oppt/exposure/pubs/episuite.htm
Kozumbo WJ et Rubin RJ. 1991. Mutagenicity and metabolism of dimethyl phthalate and its binding to epidermal and hepatic macromolecules. J Toxicol Environ Health 33(1), p. 29-46.
Kozumbo WJ, Kroll R, Rubin RJ. 1982. Assessment of the mutagenicity of phthalate esters. Environ Health Perspect 45, p. 103-109.
Kubwabo C, Rasmussen P, Fan X, Kosarac I, Wu F, Zidek A, Kuchta S. 2013. Analysis of selected phthalates in Canadian indoor dust collected using household vacuum and standardized sampling techniques. Indoor Air 23: 506-514.
Kwack SJ, Kim KB, Kim HS, Lee BM. 2009. Comparative toxicological evaluation of phthalate diesters and metabolites in Sprague-Dawley male rats for risk assessment. J Toxicol Environ Health 72, p.1446-1454.
Lake BG, Phillips JC, Linnell JC, Gangolli SD. 1977. The in vitro hydrolysis of some phthalate diesters by hepatic and intestinal preparations from various species. Toxicol Appl Pharmacol. Feb; 39(2), p. 239-48.
Lake BG et al. 1978. Abstract 215. 19th Annual Meeting of the Society of Toxicology, Washington DC [source citée dans NICNAS 2008].
Lamb JC, Chapin RE, Teague J, Lawton AD, Reel JR. 1987. Reproductive effects of four phthalic acid esters in the mouse. Toxicol Appl Pharmacol 88, p. 255-269.
Law AWK, Choi, ECC, Britter, RE. 2004. Re-entrainment around a low-rise industrial building: 2D versus 3D wind tunnel study. Atmos Environ 38(23), p. 3817-3825.
Lehman AJ. 1955. Insect repellents. Quart Bull Assoc Food Drug Officials US 19, p. 87-99.
LeBlanc GA. 1980. Acute Toxicity of Priority Pollutants to Water Flea (Daphnia magna). Bull. Environm. Contain. Toxicol. 24, p. 684-691. Lertsirisopon R, Soda S, Sei K et Ike M. 2009. Abiotic degradation of four phthalic acid esters in aqueous phase under natural sunlight irradiation. Journal of Environmental Sciences-China 21(3), p. 285-290.
Lehman AJ. 1955. Insect repellants. Assoc. Food and Drug Officials US Quart Bull, 19, p. 87-99. [source citée dans NICNAS 2008]
Leyder F, Boulanger P. 1983. Ultraviolet absorption, aqueous solubility, and octanol-water partition for several phthalates. Bull Environ Contam Toxicol 30, p.152-157.
Li LH, Jester Jr WF, Laslett AL, Orth JM. 2000. A single dose of Di-(2-ethylhexyl) phthalate in neonatal rats alters gonocytes, reduces sertoli cell proliferation, and decreases cyclin D2 expression. Toxicol Appl Pharmacol 166(3), p. 222-229.
Lin Z-P, Ikonomou MG, Jing H, Mackintosh C, Gobas FAPC. 2003. Determination of Phthalate Ester Congeners and Mixtures by LC/ESI-MS in Sediments and Biota of an Urbanized Marine Inlet. Environ Sci Technol 37 : p. 2100-2108.
Lind PM, Lind L. 2011. Circulating levels of bisphenol A and phthalates are related to carotid atherosclerosis in the elderly. Atherosclerosis 218:207-213.
Lind PM, Roos V, Ronn M. 2012b. Serum concentrations of phthalate metabolites are related to abdominal fat distribution two years later in elderly women. Environ Health 11 h 21.
Linden E, Bengtsson BE, Svanberd O, Sundstrom G. 1979. The acute toxicity of 78 chemicals and pesticide formulations against two brackish water organisms, the bleak (alburnus alburnus) and the harpacticoid(nitocrqa spinipes). Chemosphere 11(12), p. 843-851.
Liu K, Lehmann KP, Sar M, Young SS, Gaido KW. 2005. Gene expression profiling following in utero exposure to phthalate esters reveals new gene targets in the etiology of testicular dysgenesis. Biol Reprod 73, p.180-192.
Liu Y, Guan YT, Yang ZH, Cai ZH, Mizuno T, Tsuno H, Zhu WP et Zhang XH. 2009. Toxicity of seven phthalate esters to embryonic development of the abalone Haliotis diversicolor supertexta. Ecotoxicology 18(3), p. 293-303.
Liu, X., J. Shi, T. Bo, H. Zhang, W. Wu, Q. Chen et X. Zhan. 2014. Occurrence of phthalic acid esters is source waters: a nationwide survey in China during the period of 2009-2012. Environmental Pollution 184, p. 262-270.
[BDPSNH] Base de données des produits de santé naturels homologués [base de données sur Internet]. 2010. Ottawa, ON : Santé Canada (Dernière date de modification le 8 mai 2009). Ottawa, ON : Santé Canada
Loraine G, Pettigrove M. 2006. Seasonal variations in concentrations of pharmaceuticals and personal care products in drinking water and reclaimed wastewater in Southern California. Environ. Sci. Technol. 40: 687-695.
Loveday KS, Anderson BE, Resnick MA, Zeiger E. 1990. Chromosome aberration and sister chromatid exchange tests in Chinese hamster ovary cells in vitro. V : results with 46 chemicals. Environ Mol Mutagen 16, p. 272-303.
Lovekamp TN et Davis BJ. 2001. Mono-(2-ethylhexyl) phthalate suppresses aromatase transcript levels and estradiol production in cultured rat granulosa cells. Toxicol. Appl. Pharmacol., 172, p. 217-224. [source citée dans le NICNAS 2008]
Mackintosh CE, Maldonado J, Hongwu J, Hoover N, Chong A, Ikonomou MG, Gobas FAPC. 2004. Distribution of phthalate esters in a marine aquatic food web: Comparison to polychlorinated biphenyls. Environ Sci Technol 38, p. 2011-2020.
Mackintosh CE, Maldonado JA, Ikonomou MG, Gobas FAPC. 2006. Sorption of phthalate esters and PCBs in a marine ecosystem. Sci. Technol. 40 (11), p. 3481-3488.
Main K, Mortensen G, Kaleva M, Boisen K, Damgaard I, Chellakooty M, Schmidt I, Suomi A, Virtanen H, Petersen J, Andersson A, Toppari J, Skakkebaek N. 2006. Human breast milk contamination with phthalates and alterations of endogenous reproductive hormones in infants three months of age. Environ Health Perspect. 114: 270-276.
Matsumoto M, Furuhashi T, Poncipe C, Ema M. 2008. Combined repeated dose and reproductive/developmental toxicity screening test of the nitrophenolic herbicide Dinoseb, 2-sec-Butyl-4,6-Dinitrophenol, in rats. Environ Toxicol 23(2), p.169-183.
Mint A et Hotchkiss SA. 1993. Percutaneous absorption of dimethyl phthalate and di-n-butyl phthalate through rat and human skin in vitro. In : Prediction of percutaneous penetration. Brain KR, J. V., Hadgraft J et Walters KA, éditeur. Cardiff. STS Publishing. 646-657 [source citée dans ECB 2003].
Mint A, Hotchkiss SA, Caldwell J. 1994.Percutaneous absorption of diethyl phthalate through rat and human skin in vitro. Toxicol in Vitro 8(2), p. 251-6.
Miodovnik A. 2011. Endocrine disruptors and childhood social impairment. Neurotoxicology 32, p. 261-267.
Montuori P, Jover E, Morgantini M, Bayona J, Triassi M. 2008. Assessing human exposure to phthalic acid and phthalate esters from mineral water stored in polyethylene terephthalate and glass bottles. Food Addit. Contamin. 25: 511-518.
Morin A. 2003. Distribution of phthalate esters in a marine mammal food chain from Canada's eastern Arctic. School of Resource and Environmental Management Master of Resource Management Thesis Project Report No. 338. August 2003. Burnaby (BC): Simon Fraser University.
Mortensen G, Main K, Andersson A, Leffers H, Skakkebaek N. 2005. Determination of phthalate monoesters in human milk, consumer milk, and infant formula by tandem mass spectrometry (LC-MS-MS). Anal.Bioanal.Chem. 382: 1084-1092.
[MPBPVPWIN] Melting Point Boiling Point Program for Microsoft Windows [modèle d'estimation]. 2010. Version 1.43. Washington (DC) : US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY) : Syracuse Research Corporation.[source citée le 2014 07 18]. Disponible à l'adresse suivante : www.epa.gov/oppt/exposure/pubs/episuite.htm. Référence dans le texte (PCKOCWIN, 2000)
National Library of Medicine Hazardous Substance Databank (HSDB). (2013). Diisobutyl phthalate CASRN : 84-69-5. http://toxnet.nlm.nih.gov/cgi-bin/sis/search/a?dbs+hsdb:@term+@DOCNO+5247. Date d'accès : 21 octobre 2013
Neuhauser EF, Durkin PR, Malecki MR Anatra M. 1986. Comparative toxicity of ten organic chemicals to four earthworm species. Comp Biochem Physiol 83: 197-200. (doi:10.1016/0742-8413(86)90036-8). [cited in: Oehlmann et al. 2009].
Neuhauser EF, Loehr RC, Malecki MR, Milligan DL et Durkin PR. 1985. The toxicity of selected organic chemicals to the earthworm Eisenia feotida. J Environ Qual 14, p. 383-388. [source citée dans : EU RAR 2008].
[BDIPSN] Base de données d'ingrédients de produits de santé naturels [base de données sur Internet]. 2010. Ottawa, ON : Santé Canada
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2008. Dimethyl phthalate. Existing Chemical Hazard Assessment Report. Sydney (Nouvelle-Galles du Sud) Gouvernement australien. Deparment of Health and Ageing. Disponible à l'adresse suivante : http://www.nicnas.gov.au/__data/assets/pdf_file/0009/4977/DMP-hazard-asssessment.pdf
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2010. Diethylhexyl Phthalate. Priority Existing Chemical Assessment Report No.32. Sydney (Nouvelle-Galles du Sud) Gouvernement australien. Deparment of Health and Ageing. Disponible à l'adresse suivante : http://www.nicnas.gov.au/chemical-information/pec-assessments
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2011. Diethyl phthalate. Priority Existing Chemical Assessment Report No.33. Sydney (Nouvelle-Galles du Sud) Gouvernement australien. Deparment of Health and Ageing. Disponible à l'adresse suivante : http://www.nicnas.gov.au/chemical-information/pec-assessments
[NICNAS] National Industrial Chemicals Notification and Assessment Scheme. 2014. Dimethyl phthalate. Priority Existing Chemical Assessment Report No.37. Gouvernement australien, ministère de la Santé. Disponible à l'adresse suivante : http://www.nicnas.gov.au/chemical-information/pec-assessments
[INRP] Inventaire national des rejets de polluants [base de données sur Internet]. 1995. Gatineau, QC : Environnement Canada. [source citée le 2014 08 04]. Disponible à l'adresse suivante : http://www.ec.gc.ca/pdb/querysite/query_f.cfm
[NTP] National Toxicology Program. 1983. Screening of priority chemicals for potential reproductive hazard. U. S. Department of Health, education, and Welfare, Public Health Service Center for Disease Control, National Institute for Occupational Safety and Health.
[NTP] National Toxicology Program. 1989. Developmental toxicity evaluation of dimethyl phthalate(CAS No. 131-11-3) administered to CD rats on gestational days 6 through 15. National Institute of Environmental Health Sciences NTP-89-034.
[NTP] National Toxicology Program. 1995. Toxicology and carcinogenesis studies of diethylphthalate(CAS no. 84-66-2) in F344/N rats and B6C3F1 mice (dermal studies) with dermal initiation/promotion study of diethylphthalate and dimethylphthalate (CAS no. 131-11-3) in male Swiss (CD-1) mice. Technical report series No. 429, p. 1-286.
[OCDE] Organisation de coopération et de développement économiques. 2009. Emission Scenario Document on Coating Industry (Paints, Lacquers and Varnishes). Paris (FR) : Direction de l'environnement de l'OCDE. Series on Emission Scenario Documents No. 22. Report No. ENV/JM/MONO(2009)24, JT03267833.
Oehlmann J, Schulte-Oehlmann U, Kloas W, Jagnytsch O, Lutz I, Kusk KO, Wollenberger L, Santos EM, Paull GC, Van Look KJW, et Tyler CR. 2009. A critical analysis of the biological impacts of plasticizers on wildlife. Philosophical Transactions of the Royal Society B-Biological Sciences364(1526) : p. 2047-2062.
Oishi S et Hiraga K. 1980. Testicular atrophy induced by phthalic acid esters: effect on testosterone and zinc concentrations. Toxicol Appl Pharmacol 53, p. 35-41.
Olsen L, Lind L, Lind PM. 2012. Associations between circulating levels of bisphenol A and phthalate metabolites and coronary risk in the elderly. Ecotoxicol Environ Saf 80, p.179-83.
Orecchio S, Indelicato R, Barreca S. 2013. The distribution of phthalate esters in indoor dust of Palermo(Italy). Environ. Geochem.Health 35: 613-624.
[OMOE] Ministère de l'Environnement de l'Ontario. 1988. Thirty-seven municipal water pollution control plants. Pilot monitoring study. Décembre 1988 Rapport préparé par Canviro Consultants pour la Direction des ressources en eau du ministère de l'Environnement de l'Ontario.
Page BD, Lacroix GM. 1992. Studies into the transfer and migration of phthalate esters from aluminium foil-paper laminates to butter and margarine. Food Addit Contam 9(3):197-212.
Page BD, Lacroix GM. 1995. The occurrence of phthalate ester and di-2-ethylhexyl adipate plasticizers in Canadian packaging and food sampled in 1985-1989: A survey. Food Addit Contam 12(1):129-51.
Parkerton TF, Konkel WJ. 2000. Application of quantitative structure-activity relationships for assessing the aquatic toxicity of phthalate esters. Ecotoxicology and Environmental Safety 45, p. 61-78.
Parkerton TF, Winkelmann D. 2004. An assessment of the persistence, bioaccumulation, and inherent toxicity of selected phthalates, trimellitates, adipates, and related monoesters on the Canadian Domestic Substance List (DSL). Préparé pour le Phthalate Esters Panel of the American Chemistry Council. 9 août 2004 Annandale (NJ) : ExxonMobil Biomedical Sciences Inc.
Pei X, Song M, Guo M, Mo FF, Shen XY. 2013. Concentration and risk assessment of phthalates present in indoor air from newly decorated apartments. Atmospheric Environment 68: 17-23.
Peng XW and Li XG. 2012. Compound-specific isotope analysis for aerobic biodegradation of phthalate acid esters. Talanta 97: 445-449.
Petersen JH, Jensen LK. 2010. Phthalates and food-contact materials: enforcing the 2008 European Union plastics legislation. Food Addit Contam Part A Chem Anal Control Expo Risk Assess 27(11):1608-16.
[PhysProp] Interactive PhysProp Database [base de données en ligne]. 2006. Syracuse (NY) : Syracuse Research Corporation.[source citée le 17 févr. 2012]. Disponible à l'adresse suivante : http://www.syrres.com/esc/physdemo.htm
Plasterer MR, Bradshaw WS, Booth GM, Carter MW, Schuler RL, Hardin BD. 1985. Developmental toxicity of 9 selected compounds following prenatal exposure in the mouse. J Toxicol Environ Health 15, p. 25-38.
PPG Industries Inc Coatings and Resins Group. 1991. Material Safety Data Sheet: UC56600 (041691S) DURANAR. Allison Park, PA 15101-5000 US. Disponible à l'adresse suivante :
http://msdsreport.com/ds.cfm?msds=BYLBR&name=UC56600%20(041691S)%20DURANAR&mfg=PPG%20INDUSTRIES%20INC%20COATINGS%20AND%20RESINS%20GROUP
Prapatpong P, Kanchanamayoon W. 2010. Determination of phthalate esters in drinking water using solid-phase extraction and gas chromatography. Journal of Applied Sciences 10(17): 1987-1990.
Rasmussen P, Levesque C, Chenier M, Gardner H, Jones-Otazo H, Petrovic S. 2013. Canadian House Dust Study: Population-based concentrations, loads and loading rates of arsenic, cadmium, chromium, copper, nickel, lead, and zinc inside urban homes. Sci. Total Environ. 443: 520-529.
Ren H, Aleksunes LM, Wood C, Vallanat B, George MH, Klaassen CD, Corton JC. 2010. Characterization of peroxisome proliferator-activated receptor alpha-independent effects of PPARalpha activators in the rodent liver: di- (2-ethylhexyl) phthalate also activates the constitutive-activated receptor. Toxicol Sci 113:45-59.
Renberg LO, Sundström SG, Rosen-Olofsson AC. 1985. The determination of partition coefficients of organiccompounds in technical products and waste waters for the estimation of their bioaccumulation potential using reverse-phase thin layer chromatography. Environ. Toxicol. Chem. 10:333-349.
Rhodes JE, Adams WJ, Biddinger GR, Robillard KA et Gorsuch JW. 1995. Chronic toxicity of 14 phthalate-esters to Daphnia-magna and rainbow-trout (Oncorhynchus-mykiss). Environmental Toxicology and Chemistry 14(11), p. 1967-1976.
RIFM. 1973. Report on the primary irritation potential of DEP on human volunteers. Numéro de rapport 1802 du RIFM [source citée dans API 2001].
Rozati R, Simha B, Bendi N, Sekhar C. 2008. Evaluation of the phthalate esters in South Indian women with endometriosis. IJFS 1(4), p. 165-70.
Rowland IR, Cottrell RC et Phillips JC. 1977. Hydrolysis of phthalate esters by the gastro-intestinal contents of the rat. Food Cosmet.Toxicol. 15, p. 17-21.
SampleBE, Opresko DM, Suter II GW. 1996. Toxicological Benchmarks for Wildlife. Risk Assessment Program Health Sciences Research Division. Oak Ridge, Tennessee 37831.
Schecter A, Lorber M, Guo Y, Wu Q, Yun S, Kannan K, Hommel M, Imram N, Hynan L, Cheng D, Colacino J, Birnbaum L. 2013. Phthalate concentrations and dietary exposure from food purchased in New York State. Environ. Health Perspect. 121: 473-479.
Scheringer M, MacLeod M, Wegmann F. 2006. The OECD POV and LRTP Screening Tool [Internet]. Version 2.0. Organisation de coopération et de développement économiques; Zurich (CH) : École Polytechnique Fédérale de Zurich. Distribué lors de l'atelier OCDE-PNUE sur l'utilisation de modèles multimédias pour déterminer les polluants organiques persistants, tenu à Ottawa (Canada), du 31 mai au 2 juin 2006. [source citée le 2015 02 20]. Disponible à l'adresse suivante : www.sust-chem.ethz.ch/downloads/Tool2_0_Manual.pdf
Scholz N. 2003. Ecotoxicity and biodegradation of phthalate monoesters. Chemosphere 53, p. 921-926.
[SCCNFP] Scientific Committee on Cosmetic Products and Non-food Products Intended for Consumers(organe consultatif scientifique de la Commission européenne). 2002. Opinion of the scientific committee on cosmetic products and non-food products intended for consumers concerning diethyl phthalate (SCCNFP/0411/01). Adoptée par le SCCNFP lors de la 20e réunion plénière du 4 juin 2002
[CSPC]. Comité scientifique des produits de consommation. 2007. Opinion on Phthalates In Cosmetic Products. Disponible à l'adresse suivante : http://ec.europa.eu/health/ph_risk/committees/04_sccp/docs/sccp_o_106.pdf. Bruxelles (Belgique) : Commission européenne -- Direction générale de la santé et des consommateurs
SciFinder [base de données sur l'Internet]. 2013. Columbus (OH) : American Chemical Society [source citée le 11 oct. 2013]. Accès restreint. Disponible à l'adresse suivante : https://scifinder.cas.org/scifinder/
SCREEN3 [modèle informatique]. 20111995. Version 3.5.096043. Research Triangle Park (NC): US Environmental Protection Agency, Office of Air Quality Planning and Standards, Emissions, Monitoring, and Analysis Division. Disponible à l'adresse suivante : http://www.epa.gov/scram001/dispersion_screening.htm
Scott RC, Dugard PH, Ramsey JD, Rhodes C. 1987. In vitro absorption of some o-phthalate diesters through human and rat skin. Environ Health Perspect 74, p. 223-7.
Seed JL. 1982. Mutagenic Activity of Phthalate Esters in Bacterial Liquid Suspension Assays. Environ Health Perspect 45, p. 111-114.
Shao X, Zou Y, Wang F, Zhang Z, Wang S, Han S, Wang S, Chen Y, Wu X, Chen Z. 2013. Determination of phthalate acid esters in water and sediment samples by GC-MS. Advanced Materials Research 610-613: 157-162.
Shelton DR, Boyd SA et Tiedje JM. 1984. Anaerobic biodegradation of phthalic acid esters in sludge. Environmental Science & Technology 18(2), p. 93-97.
Shiraishi K, Miyata K, Houshuyama S, Imatanaka N, Umano T, Minobe Y, Yamasaki K. 2006. Subacute oral toxicity study of diethylphthalate based on the draft protocol for "Enhanced OECD Test Guideline no. 407". Arch Toxicol 80(1), p. 10-16.
Shiue I. 2013. Urine phthalate concentrations are higher in people with stroke: United States National Health and Nutrition Examination Surveys (NHANES), 2001-2004. Eur J Neurol 20(4), p. 728-31.
Shiue I. 2014a. Higher urinary heavy metal, arsenic, and phthalate concentrations in people with high blood pressure: US NHANES, 2009-2010. Blood Press 23(6): 363-369.
Shiue I. 2014b. Higher urinary heavy metal, phthalate, and arsenic but not parabens concentrations in people with high blood pressure, U.S. NHANES, 2011-2012. Int J Environ Res Public Health 11(6):5989-99.
Shiue I, Hristova K. 2014. Higher urinary heavy metal, phthalate and arsenic concentrations accounted for 3-19% of the population attributable risk for high blood pressure: US NHANES, 2009-2012. Hypertens Res 37(12):1075-81.
Silva MJ, Reidy JA, Herbert AR, Preau JL, Needham LL, Calafat AM. 2004. Detection of phthalate metabolites in human amniotic fluid. Bull Environ Contam Toxicol 72 : p. 1226-1231.
SimpleTreat [sewage treatment plant removal model] 1997. Version 3.0. Bilthoven (NL) : Institut national de la santé publique et de l'environnement (RIVM). Disponible à l'adresse suivante : National Institute for Public Health and the Environment (RIVM), Laboratory for Ecological Risk Assessment, PO Box 1, 3720 BA Bilthoven, The Netherlands.
SRC (1994). Syracuse Research Corporation, (Q)SAR programs, LOGKOW, WS/KOW, AOP. [source citée dans le EU RAR 2003b].
SRC. 2000. Estimation programs interface for Microsoft Windows, Version 3.04. EPIWIN, Syracuse Research Corporation, North Syracuse, NY. [source citée dans Gill et al. 2001].
Statistique Canada, 2004 Enquête sur la santé dans les collectivités canadiennes - Nutrition (ESCC). Renseignements détaillés pour 2004 (Cycle 2.2). Ottawa, ON : Statistique Canada. Disponible à l'adresse suivante : http://www23.statcan.gc.ca/imdb/p2SV_f.pl?Function=getSurvey&SDDS=5049&lang=en&db=imdb&adm=8&dis
Staples CA, Parkerton TF et Peterson DR. 2000. A risk assessment of selected phthalate esters in North American and Western European surface waters. Chemosphere 40(8), p. 885-891.
Staples CA, Guinn R, Kramarz K, Lampi M. 2011. Assessing the chronic aquatic toxicity of phthalate ester plasticizers. Human and Ecological Risk Assessment, 17, p. 1057-1076.
Stephenson R.M., Malanowski S, 1987. Handbook of the Thermodynamics of O~anic Compounds. Elsevier Science [STORET] STORage and RETrieval database [database on the Internet]. 2014. Washington (DC) : U.S. Environmental Protection Agency, Office of Water[consulté le 13 mars 2014, 18]. Disponible à l'adresse suivante : http://www.epa.gov/storet/dw_home.html
[STP Model] Fugacity-based Sewage Treatment Plant Model. 2006. Version 2.11. Peterborough (ON) : Centre canadien de modélisation environnementale de l'Université Trent [Modèle fondé sur Clark et al. 1995].
Sugatt RH, O'Grady DP, Banerjee S, Howard PH et Gledhill WE. 1984. Shake flask biodegradation of 14 commercial phthalate esters. Applied and Environmental Microbiology47(4) : p. 601-606.
Suzuki Y, Niwa M, Yoshinaga J, Mizumoto Y, Serizawa S, Shiraishi H. 2010. Prenatal exposure to phthalate esters and PAHs and birth outcomes. Environ Int 36(7), p. 699-704.
Suzuki Y, Yoshinaga J, Mizumoto Y, Serizawa S, Shiraishi H. 2012. Foetal exposure to phthalate esters and anogenital distance in male newborns. Int J Androl 35(3), p.236-244.
Swan SH, Main KM, Liu F, Stewart SL, Kruse RL, Calafat AM, Mao CS, Redmon JB, Ternand CL, Sullivan S, Teague JL. 2005. Decrease in anogenital distance among male infants with prenatal phthalate exposure. Environ Health Perspect 113, p. 105-61.
Swan S. 2008. Environmental phthalate exposure in relation to reproductive outcomes and other health endpoints in humans. Environ Res 108(2), p. 177-184.
Tabak HH, Quave SA, Mashni CI et Barth EF.1981. Biodegradability studies with organic priority pollutant compounds. Journal of the Water Pollution Control Federation. 53 (10), 1503-1518.[TaPL3] Long Range Transport and Persistence Level III model [Internet]. 2000. Version 2.10. Peterborough (ON) : Centre canadien de modélisation environnementale de l'Université Trent [source citée le 2014 07 18]. Disponible à l'adresse suivante : http://www.trentu.ca/academic/aminss/envmodel/models/TaPL3.html.
Teil M, Blanchard M, Dargnat C, Larcher-Tipphagne K, Chevreuil M. 2007. Occurrence of phthalate diesters in rivers of the Paris district (France). Hydrological Processes 21: 2515-2525.
Timofievskaya LA, Aldyreva, MV, & Kazbekov IM (1974) Experimental studies on the effect of phthalate plasticisers on the organism. Gigiena i sanitarija, 12, p. 26-28. [source citée dans le NICNAS 2008]
Timofieyskaya LA. 1976. In : Major Problems of Remote After-Effects of Exposure to Occupational Poisons. Collected scientific works (Plyasunov, A. K. und Pahkova, G. A. (eds.), Seite 40-43 [source citée dans l'IUCLID 2000].
Toda C, Okamoto Y, Ueda K, Hashizume K, Itoh K et Kojima N. 2004. Unequivocal oestrogen receptor-binding affinity of phthalate esters featured with ring hydroxylation and proper alkyl chain size. Archives of Biochemistry and Biophysics, 431, p. 16-21. [source citée dans le NICNAS 2014]
[TOXNET] Toxicology Data Network [base de données sur l'Internet]. 2012. Bethesda (MD) : U.S. National Library of Medicine [source citée le 22 oct. 2013]. Disponible à l'adresse suivante : http://toxnet.nlm.nih.gov/index.html
Trasande L, Sathyanarayana S, Trachtman H. 2014. Dietary phthalates and low-grade albuminuria in US children and adolescents. Clin J Am Soc Nephrol. 9(1), p. 100-9.
Türk G, Ateşşahin A, Sönmez M, Çeribaşı AO, Yüce A. 2008. Improvement of cisplatin-indiced injuries to sperm quality, the oxidant-antioxidant system, and the histologic structure of the rat testis by ellagic acid. Fertil Steril 89, p. 1474-1481.
Tsuchiya K et Hattori K. 1976. Chromosomal study on human leukocyte cultures treated with phthalic acid esters [Japanais]. Hokkaidoritsu Eisei Kenkyusho Ho 26:114 [source citée dans le NICNAS 2008].
[US CPSC] United States Consumer Product Safety Commission. 2010a. Toxicity review of dimethyl phthalate. Bethesda (MD). Contract No. CPSC-D-06-0006, Task Order 012. Préparé par : Versar Inc., 6850 Versar Center, Springfield (VA) and SRC, Inc., 7502 Round Pond Road, North Syracuse (NY). Disponible à l'adresse suivante : http://www.cpsc.gov/PageFiles/125767/dmp.pdf
[US CPSC] United States Consumer Product Safety Commission. 2010 b. Toxicity Review of Di(2-ethylhexyl) Phthalate (DEHP). Bethesda (MD). Disponible à l'adresse suivante : http://oehha.ca.gov/PageFiles/126533/toxicityDEHP.pdf
[US CPSC] United States Consumer Product Safety Commission. 2011. Final toxicity review for diethyl phthalate (DEP). Bethesda (MD). Contract No. CPSC-D-06-0006, Task Order 012. Préparé par : Versar Inc., 6850 Versar Center, Springfield (VA) and SRC, Inc., 7502 Round Pond Road, North Syracuse (NY). Disponible à l'adresse suivante : http://www.cpsc.gov/PageFiles/125770/dep.pdf
[US CPSC CHAP]. United States Consumer Product Safety Commission, Chronic Hazard Advisory Panel. 2014. Chronic Hazard Advisory Panel on Phthalates and Phthalate Alternatives Final Report. Disponible à l'adresse suivante : http://oehha.ca.gov/PageFiles/169902/CHAP-REPORT-With-Appendices.pdf
[US EPA] United States Environmental Protection Agency. 2012. Phthalates action plan. Révisé le 03/14/2012. Washington (DC) : United States Environmental Protection Agency.
US EPA (United States Environmental Protection Agency). 2011. Exposure Factors Handbook: 2011 Edition. Office of Research and Development, National Center for Environmental Assessment. EPA/600/R-090/052F
[US EPA] United States Environmental Protection Agency. 2010. Screening-level hazard characterization phthalate esters category. Avril 2010. http://www.epa.gov/chemrtk/ hpvis/hazchar/Category_%20Phthalate%20Esters_March%202010.pdf
[US EPA] United States Environmental Protection Agency. 2012. Phthalates action plan. Révisé le 03/14/2012. Washington (DC) : United States Environmental Protection Agency.
US EPA EPI Suite. 2012. Ecological structure activity relationships (ECOSAR) Modeling Software. v. 1.11.
[US EPAa] US Environmental Protection Agency. 2014. Non-confidential IUR Production Volume Information. Disponible à l'adresse suivante : http://www.epa.gov/oppt/cdr/tools/data/2002-vol.html Washington (DC) : US EPA. (consulté en 2014)
[US EPAb] US Environmental Protection Agency. 2014 Non-confidential 2006 IUR Company/Chemical Records. Disponible à l'adresse suivante : http://cfpub.epa.gov/iursearch/index.cfm. Washington (DC) : US EPA. (consulté en 2014)
The Valspar Corporation. Material Safety Data Sheet: Fluropon A/D. Minneapolis MN 55440 US. Disponible à l'adresse suivante : http://www.valsparcoilextrusion.com/en/insight-center/samples.html?code=VAL-5006C&fullName=Fluropon+Hardcoat&family =coil&submit =add#orderSampleLitFormWrap
van Wezel AP, van Vlaardingen P, Posthumus R, Crommentuijn GH, Sijm DTHM. 2000. Environmental risk limits for two phthalates, with special emphasis on endocrine disruptive properties. Ecotoxicol. Environ. Saf. 46, 305-321. [cited in Oehlmann et al. 2008].
[Versar et SRC]. Versar Inc. et SRC, Inc. 2011. Final Toxicity Review for Dimethyl Phthalate (DMP, CASRN 131-11-3). Disponible à l'adresse suivante : http://oehha.ca.gov/PageFiles/125767/dmp.pdf Springfield (VA) : Versar Inc. North Syracuse (NY) : SRC, Inc.
Wang H, Zhou Y, Tang C, He Y, Wu J, Chen Y, Jiang Q. 2013. Urinary phthalate metabolites are associated with body mass index and waist circumference in Chinese school children. PLoS One 8(2): e56800
Wang JL, Chen LJ, Shi HC et Qian Y. 2000. Microbial degradation of phthalic acid esters under anaerobic digestion of sludge. Chemosphere 41(8), p. 1245-1248.
Wang JL, Ping L et Yi Q. 1996. Biodegradation of phthalic acid esters by acclimated activated sludge. Environment International 22:506, p. 737-741.
Wang JL, Xuan Z et Wu WZ. 2004. Biodegradation of phthalic acid esters (PAEs) in soil bioaugmented with acclimated activated sludge. Process Biochemistry 39(12), p. 1837-1841.
Wang Z, Heymsfield SB, Chen Z, Zhu S, Pierson RN. 2010. Estimation of percentage body fat by dual-energy x-ray absorptiometry: evaluation by in vivo human elemental composition. Phys Med Biol 55(9), p. 2619-35.
Wania F. 2003. Assessing the potential of persistent organic chemicals for long-range transport and accumulation in polar regions. Environ. Environ Sci Technol 37, p. 1344-1351.
Wania F. 2006. Potential of degradable organic chemicals for absolute and relative enrichment in the Arctic. Environ Sci Technol 40, p. 569-577.
Webber MD, Nichols JA. 1995. Organic and metal contaminants in Canadian municipal sludges and a sludge compost. Février 1995 Burlington (ON) : Wastewater Technology Centre, exploité par Rockcliffe Research Management Inc.
Webber, M. et C. Wang.1995. Industrial organic compounds in selected Canadian Canadian soils. Canadian Journal of Soil Science 75 (4), p. 513-524.
Werner AC. 1952. Vapor pressures of phthalate esters. Ind. Eng. Chem. 2736-40 [source citée dans MPBPVPWIN 2010].
White RD, Carter DE, Earnest D et Mueller J. 1980. Absorption and metabolism of three phthalate diesters by the rat small intestine. Food Cosmet. Toxicol. 18, p. 383-6.
Wilson JT, Dixon DR et Dixon LRJ. 2002. Numerical chromosomal aberrations in the early life-history stages of a marine tubeworm, Pomatoceros lamarckii(Polychaeta : Serpulidae). Aquatic Toxicology 59(3-4), p. 163-175.
Wilson R, Jones-Otazo H, Petrovic S, Mitchell I, Bonvalot Y, Williams D, Richardson GM. 2013. Revisiting dust and soil ingestion rates based on hand-to-mouth transfer. Hum Ecol Risk Assess 19(1):158-188.
Wilson WB, Giam CS, Goodwin TE, Aldrich A, Carpenter V, Hrung YC. 1978. The toxicity of phthalates of the marine dinoflagellate Gymnodinium breve. Bull. Environm.Contam.Toxicol. 20, p. 149-154.
Wofford HW, WilseyCD, Neff GS, Giam CS et Neff JM. 1981. Bioaccumulation and metabolism of phthalate esters byoysters, brown shrimp, and sheepshead minnows. Ecotoxicology and Environmental Safety 5, p. 202-210.
[WSKOWWIN] Water Solubility for Organic Compounds Program for Microsoft Windows [Estimation Model]. 2010. Version 1.42. Washington (DC): US Environmental Protection Agency, Office of Pollution Prevention and Toxics; Syracuse (NY): Syracuse Research Corporation. [cited 2014 07 18].Available from: www.epa.gov/oppt/exposure/pubs/episuite.htm
Xie Z, Ebinghaus R, Temme C, Caba A, Ruck W. 2005. Atmospheric concentrations and air-sea exchanges of phthalates in the North Sea (German Bight). Atmospheric Environment 39: 3209-3219.
Xie Z, Ebinghaus R, Temme C, Lohmann R, Caba A, Ruck W. 2007. Occurrence and air-sea exchange of phthalates in the Arctic. Environ Sci Technol 41(13):4555-4560.
Xu Q, Yin X, Wang M, Wang H, Zhang N, Shen Y, Xu S, Zhang L, Zhongze G. 2010. Analysis of phthalate migration from plastic containers to packaged cooking oil and mineral water. J Agric Food Chem 58:11311-7.
Xue MG, Wang SF, Huang CX, Xia NN. 2010. The analysis of organic contaminants in printing paper food packaging materials. Proceedings of the 17th IAPRI World Conference on Packaging. ISSN: 978-1-935068-36-5.
Yalkowsky SH, He Y, Jain P. 2010. Handbook of aqueous solubility data. 2e édition. Boca Raton (FL) : CRC Press, Taylor et Francis Group.
Yan H, Ye CM et Yin CQ. 1995. Kinetics of phthalate Epester biodegradation by Chlorella-pyrenoidosa. Environmental Toxicology and Chemistry 14(6), p. 931-938.
Yan H, Ye CM et Yin CQ. 1995. Kinetics of phthalate Epester biodegradation by Chlorella-pyrenoidosa. Environmental Toxicology and Chemistry 14(6), p. 931-938.
Yang Q, Nagano T, Shah Y, Cheung C, Ito S, Gonzalez FJ. 2007. The PPARα-Humanized Mouse: A Model to Investigate Species Differences in Liver Toxicity Mediated by PPARα. Toxicol Sci 101(1), p. 132-139.
Yang ZH, Zhang XJ et Cai ZH. 2009. Toxic effects of several phthalate esters on the embryos and larvae of abalone Haliotis diversicolor supertexta. Chinese Journal of Oceanology and Limnology 27(2), p. 395-399.
Yuan K, Zhao B, Li XW, Hu GX, Su Y, Chu Y, Akingbemi BT, Lian QQ, Ge RS. 2012. Effects of phthalates on 3β-hydroxysteroid dehydrogenase and 17β-hydroxysteroid dehydrogenase 3 activities in human and rat testes. Chem Biol Interact 195(3), p.180-188.
Yurchenko VV. 1977. Cytogenetic investigation of mutagenic properties common to the repellents dimethylphthalate and N, N-diethylamide of phenoxyacetic acid [Russian]. Farmacol Toksikol 40:454-457 [résumé].
Yurchenko VV et Gleiberman S. 1980. Study of long-term effects of repellent use. Partie III Study of mutagenic properties of dimethyl phthalate and phenoxyacetic acid N, N-dimethylamide by dominate lethal mutations [Russian]. Meditsinskuya Parazitologiya i Parazitarnye Bolezni 4958-61 [résumé].
Zeiger E, Haworth S, Mortelmans K, Speck W. 1985. Mutagenicity testing of di (2- ethylhexy1) phthalate and related chemicals in salmonella. Environ Mutagen 7:213-232.
Zeng F, Cui KY, Li XD, Fu JA et Sheng GY. 2004. Biodegradation kinetics of phthalate esters by Pseudomonas fluoresences FS1. Process Biochemistry 39(9), p. 1125-1129.
Zeng F, Cui K, Xie Z, Wu L, Luo D, Chen L, Lin Y, Liu M, Sun G. 2009. Distribution of phthalate esters in urban soils of subtropical city, Guangzhou, China. Journal of Hazardous Materials 164: 1171-1178.
Zhang M, Liu S, Zhuang H. 2012. Determination of dimethyl phthalate in environment water samples by a highly sensitive indirect competitive ELISA. Appl. Biochem. Biotechnol. 166: 436-445.
Zhang Q, Lu X, Zhang X, Sun Y, Zhu D, Wang B, Zhao R, Zhang Z. 2013. Levels of phthalate esters in settled house dust from urban dwellings with young children in Nanjing, China. Atmospheric Environment 69: 258-264.
Zhao Y, Chen L, Li L, Xie C, Li D, Shi H, Zhang Y. 2014. Gender-specific relationship between prenatal exposure to phthalates and intrauterine growth restriction. Pediatric Research 76(4): 401-408.
Zhang Q, Lu X, Zhang X, Sun Y, Zhu D, Wang B, Zhao R, Zhang Z. 2013. Levels of phthalate esters in settled house dust from urban dwellings with young children in Nanjing, China. Atmospheric Environment 69: 258-264.
Zhou J, Zhu XS, and Cai ZH. 2011. Influences of DMP on the fertilization process and subsequent embryogenesis of abalone (Haliotis diversicolor supertexta) by Gametes Exposure. Plos One 6(10)
Zhu J, Harner H, Kubwabo C, White P, Shoeib M, Wilford, BH, Feng YL. Semi-volatile organic pollutants in indoor air and indoor dust in Ottawa residences and their implication for human exposure. Proceedings of the 6th International Conference on Indoor Air Quality, Ventilation & Energy Conservation in Buildings, Sendai, Japan, October 28-31, 2007. Vol 2, 115-120.
Zhu J, Phillips S, Feng Y, Yang X. 2006. Phthalate esters in human milk: concentration variations over a 6-month postpartum time. Environ. Sci. Technol. 40: 5276-5281.
Annexe A : Données empiriques et modélisées de la biodégradation du DMP
| Type de milieu | Milieu | Processus du devenir | Valeur de dégradation | Paramètre de la dégradation et unités (méthode) | Référence |
|---|---|---|---|---|---|
| Eau de surface | Eau de rivière urbaine au Japon | Biodégradation aérobie (méthode de Handai) | 49,3 % de biodégradation par l'eau de la rivière | Dégradation primaire (isolats microbiens cultivés); phtalate retrouvé dans l'eau ou ajouté. 100 µg dans 5 ml d'eau de rivière, 25 °C; Incubation 7 j | Hashizume et al., 2002 |
| Eau/sédiments | Sédiments d'eau douce (rapport eau de rivière/sédiments de 9 à 1) | Biodégradation aérobie; 12-14 °C dans l'obscurité | t½(j) = 2,5 j | Dégradation primaire (OCDE 301) | Kickham et al., 2012 |
| Eau/sédiments | Sédiments d'eau douce (rapport eau de la rivière/sédiments de 9 à 1) | Biodégradation aérobie; 12-14 °C dans l'obscurité | taux = 0,28 (± 0,07) j-1 | Dégradation primaire (OCDE 301) | Kickham et al., 2012 |
| Eau/sédiments | Sédiments boueux sous la surface | Milieu réducteur de sulfate; isolement/ enrichissement des espèces bactériennes (Thauera sp.) | Dégradation de 22 % du DMP en 60 j dans des conditions réductrices de sulfate | Thauera sp. Ralentissement des rendements des isolats purs et dégradation incomplète dans des conditions réductrices de sulfate. | Cheung et al., 2007 |
| Eau/sédiments | Organismes sédimentaires acclimatés | Biodégradation aérobie, flacon d'agitation | 86 % ± 12 % (28 j) [supérieur(e) à 99 %] | Primaire [ultime] | Sugatt et al., 1984 |
| Eau/sédiments | Organismes sédimentaires acclimatés | Biodégradation aérobie, flacon d'agitation | t½(j) = 1,9 | demi-vie | Sugatt et al., 1984 |
| Eau/sédiments | Organismes sédimentaires acclimatés | Biodégradation aérobie, flacon d'agitation | 0,364 (écart type = 0,015) | Taux constant par jour | Sugatt et al., 1984 |
| Eau/sédiments | Sédiments marins (microbes enrichis) | Biodégradation aérobie primaire | supérieur(e) à 85 % (74 j); K = 0,0587 j-1 , t½ = 11,8 |
% de dégradation (74 j); 18 °C | Peng et Li 2012 |
| Eau/sédiments | Sédiments et cyanobactéries d'eau douce | Taux de dégradation primaire par rapport au témoin | A. flos-aquae (souche) : 4,89 ± 0,16 /69,63 ± 1,49; | Sédiments et cyanobactéries d'eau douce | Taux de dégradation primaire par rapport au témoin |
| Sols | Microbes du sol (enrichi) | Dégradation aérobie en culture par Pseudomonas fluorescens FS1 | Demi-vie de la concentration initiale de 25 à 400 mg/l. = 6,17 à 10,39 h. | Taux de biodégradation en fonction de la concentration | Zeng et al., 2004 |
| Sols | Microbes du sol (enrichi) | Dégradation aérobie en culture par Pseudomonas fluorescens FS1 | Concentration initiale inférieur(e) à 200 mg/l, incubation de 7 j à 30 °C, t½ = 6,48 h | Taux de biodégradation en fonction de la concentration | Zeng et al., 2004 |
| Boues résiduaires | Boues (activées) | Biodégradation aérobie (compostage) | 75 % (entre 75 et 90 j), 100 % (135 j) | Amir et al., 2005 | |
| Boues résiduaires | Boues (lagune) | Biodégradation aérobie (compostage) | 180 j. | non dégradées | Amir et al., 2005 |
| Boues résiduaires | Digesteur anaérobie des boues (trait. des eaux usées) | Biodégradation anaérobie (37 °C) | supérieur(e) à 90 % | Dégradation primaire (4 j) | Wang et al., 2000 |
| Boues résiduaires | Digesteur anaérobie des boues (trait. des eaux usées) | Biodégradation anaérobie (37 °C) | supérieur(e) à 78 % | Méthane (% théorique) | Wang et al., 2000 |
| Boues résiduaires | Digesteur anaérobie des boues (trait. des eaux usées) | Biodégradation anaérobie (37 °C) | 23,9 | demi-vie (h) | Wang et al., 2000 |
| Boues résiduaires | Boues (trait. des eaux usées) | Dégradation anaérobie (35 °C) | supérieur(e) à 90 % (LD = 0,5 ppm) | Dégradation primaire (40 j) | Shelton et al., 1984 |
| Boues résiduaires | Boues (trait. des eaux usées) | Dégradation anaérobie (35 °C) | supérieur(e) à 82 % | Méthane (% théorique) | Shelton et al., 1984 |
| Boues résiduaires | Boues activées | Biodégradation anaérobie (25 °C) | 90 % (3 j); 100 % (5 j) 100 mg/l; t½ = 21 h; taux constant = 0,033 h-1 | Dégradation primaire | Wang et al., 1996 |
| Boues résiduaires | Boues activées | Biodégradation aérobie | inférieur(e) à 0,1 % adsorbé; 93 % dégradé par les microbes, taux = 0,031 kg/j (DMP) | Biodégradation primaire, solubilité et adsorption aux particules. | Roslev et al., 2007 |
| Boues résiduaires | Acclimatés, boues activées | Biodégradation aérobie | supérieur(e) à 90 % (10 j); K = 0,3028 j-1; t½ = 2,29 j | Biodégradation primaire,% après la période des jours, taux et t½. | Wang et al., 2004 |
| Autre | Milieu défini | Essai biologique d'algues : Densité initiale de cellules d'algues de 106 ml-1 pour les expériences de biodégradation/ accumulation | Perte de 85 % due à la fraction aqueuse. Conc. fin. = 13,4 mg/L; taux constant = 0,484 h-1 (second ordre). |
DMP = 100 mg/L (2 % de dégradation abiotique). Combinaison de bioaccumulation et biodégradation mesurée par la perte de DMP dans une solution aqueuse. Après 24 h, l'accumulation diminue, et la biodégradation maximale obtenue d'ici 72 h. Taux fourni. | Yan et al., 1995 |
| Critère d'évaluation de la dégradation ou la prédiction | Méthode d'essai ou base du modèle | Demi-vie extrapolée (t½ en jours) |
Référence |
|---|---|---|---|
| 3,05Note de bas de page Tableau A-2[a].12 « biodégradation rapide » |
Sous-modèle 3 : Enquête d'experts (qualitative) | inférieur(e) à 180 | BIOWIN, 2010 |
| 0,86Note de bas de page Tableau A-2[b].8 « biodégradation rapide » |
Sous-modèle 5 : MITI probabilité linéaire | inférieur(e) à 180 | BIOWIN, 2010 |
| 0,91b « biodégradation rapide » |
Sous-modèle 6 : Probabilité non linéaire MITI |
inférieur(e) à 180 | BIOWIN, 2010 |
| 1b « biodégradation rapide » |
Probabilité | inférieur(e) à 180 | DS TOPKAT, 2004 |
| 0,86 « biodégradation rapide » |
DBO, % (demande biologique d'oxygène) |
inférieur(e) à 180 | CATALOGIC, 2012 |
Annexe B : Données empiriques de la toxicité aquatique du DMP
| Type de organisme | Organisme | Type d'essai | Critère d'effet toxicologique | Valeur (mg/l) | Référence |
|---|---|---|---|---|---|
| Poisson | Truite arc-en-ciel, Oncorhynchus mykiss | Toxicité aiguë (96 h) | CL50 | 56 (38-83) | CMA 1984f |
| Poisson | Truite arc-en-ciel, Oncorhynchus mykiss | Toxicité aiguë (96 h) | CL50 | 56 | Adams et al., 1995Footnote Table B-1[a].13 |
| Poisson | Crapet arlequin, Lepomis macrochirus | Toxicité aiguë (96 h) juvénile | CL50 | 50 (statique) | Adams et al., 1995a |
| Poisson | Crapet arlequin, Lepomis macrochirus | Toxicité aiguë (96 h) juvénile | CSEO, survie | 15,3 (statique) | Adams et al., 1995a |
| Poisson | Crapet arlequin, Lepomis macrochirus | Toxicité aiguë (96 h) juvénile | CL50 | 67 (statique) | CMA 1984f |
| Poisson | Ablette, Alburnus alburnus | Toxicité aiguë (96 h) | CL(I)50 | 100-115 | Linden et al., 1979 |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) juvénile | CL50 | 121 (statique) | Adams et al., 1995a |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) juvénile | CL50 | 39 (en écoulement continu) | Adams et al., 1995a |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (120 h) | CL50 | 38 (32 - 45) | AEPC c2007-2013 |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (144 h) | CL50 | 38 (32 - 45) | AEPC c2007-2013 |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) | CL50 | 56 | US EPA 2010 |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) juvénile | CSEO, survie | 66 (statique) | Adams et al., 1995a |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) juvénile | CSEO, survie | 16 (en écoulement continu) | Adams et al., 1995a |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) juvénile | CL50 | 29 (statique) | Adams et al., 1995a |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) juvénile | CL50 | 120 (statique) 68-210 |
CMA 1984f |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) juvénile | CL50 | 39 (en écoulement continu) 33-46 |
CMA 1984f |
| Poisson | Tête-de-boule, Pimephales promelas | Toxicité aiguë (96 h) juvénile | CL50 | 39 (en écoulement continu) | Référence? |
| Poisson | Méné tête-de-mouton, Cyprinodon variegatus | Toxicité aiguë (96 h) juvénile | CSEO, survie | 3,2 (en écoulement continu) | Adams et al., 1995a |
| Poisson | Méné tête-de-mouton, Cyprinodon variegatus | Toxicité aiguë (96 h) juvénile | CL50 | 56 (en écoulement continu) | Adams et al., 1995a |
| Poisson | Méné tête-de-mouton, Cyprinodon variegatus | Toxicité aiguë (96 h) juvénile | CSEO, survie | 38 (en écoulement continu) | Adams et al., 1995a |
| Poisson | Méné tête-de-mouton, Cyprinodon variegatus | Toxicité aiguë (96 h) | CL50 | 29 (en écoulement continu) | CMA 1984e |
| Poisson | Méné tête-de-mouton, Cyprinodon variegatus | Toxicité aiguë (96 h) | CL50 | 58 (47-68) | Heitmuller et. al., 1981 |
| Poisson | Truite arc-en-ciel, Oncorhynchus mykiss | Toxicité chronique (102 j) | CSEO, éclosabilité, survie ou croissance | 11 | Rhodes et al., 1995a |
| Poisson | Truite arc-en-ciel, Oncorhynchus mykiss | Toxicité chronique (102 j) | CMEO, éclosabilité, survie ou croissance | 24 | Rhodes et al., 1995a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (9 h) | CE50 (toxicité embryonnaire, phase de la blastula) | 55,71 | Yang Z. et al., 2009a. |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | (96 h) | CSEO (96 h); métamorphose réduite des larves | 0,02 | Liu et al., 2009a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | (96 h) | CMEO, anomalies de l'embryon | 40 | Yang et al., 2009a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | (96 h) | CMEO, fixation larvaire | 0,05 | Yang et al., 2009a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CMEO, diminution des activités ATPase (spermatozoïdes) | 0,01 (10 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CSEO, diminution des activités ATPase (spermatozoïdes) | 0,001 (1 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CMEO, morphologie des spermatozoïdes | 0,1 (100 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CSEO, total des niveaux d'œufs liquides | 0,1 (100 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CSEO, morphologie de l'œuf | 0,001 (1 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CMEO, capacités de fertilisation T2 et T3 | 0,01 (10 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CSEO, capacités de fertilisation T1 | 0,001 (1 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CMEO, anomalies de l'embryon T2 et T3 | 0,001 (1 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CSEO, anomalies de l'embryon T1 | 0,1 (100 ppb) | Zhou et al., 2011a |
| Invertébrés | Ormeau, Haliotis diversicolor supertexta | Toxicité aiguë (96 min) | CMEO; taux de réussite d'éclosion (T1, T2, T3, respectivement) | 0,1 (100 ppb; T1); 0,01 (10 ppb, T2); 0,01 (10 ppb; T3) | Zhou et al., 2011a |
| Invertébrés | Crevette mysidacé, Americamysis bahia | Toxicité aiguë (96 h) | CL50 | 68,6 (statique) | Adams et al., 1995a |
| Invertébrés | Crevettte mysidacé, Americamysis bahia | Toxicité aiguë (96 h) | CSEO, immobilité | 22,2 (statique) | Adams et al., 1995a |
| Invertébrés | Cervette mysidacé, Americamysis bahia | Toxicité aiguë (48 h) | CE50 | 76 (statique) 54-130 |
CMA 1984e |
| Invertébrés | Daphnie, Daphnia magna | Toxicité aiguë (48 h) | CL50 | inférieur(e) à 52 | AEPC c2007-2013 |
| Invertébrés | Daphnie, Daphnia magna | Toxicité aiguë (48 h) | CE50, immobilité | 45,9 (statique) | Adams et al., 1995a |
| Invertébrés | Daphnie, Daphnia magna | Toxicité aiguë (48 h) | CSEO, immobilité | 23,5 (statique) | Adams et al., 1995a |
| Invertébrés | Daphnie, Daphnia magna | Toxicité aiguë (48 h) | CL50, immobilité | 284 | Oehlmann et al., 2009 (Jonsson et Baun 2003)a |
| Invertébrés | Daphnie, Daphnia magna | Toxicité aiguë (48 h) | CE50 | 33 | LeBlanc 1980 |
| Invertébrés | Ver fragile, Lumbriculus variegatus | Aiguë (10 jours) | CL50 | 246 | Call et al., 2001a |
| Invertébrés | Crustacé amphipode, Hyalella azteca | Aiguë (10 jours) | CL50 | 28,1 | Call et al., 2001a |
| Invertébrés | Chironome, Chironomus tentans | Aiguë (10 jours) | CL50 | 68,2 | Call et al., 2001 |
| Invertébrés | Polychète, Pomatoceros lamarckii | NS | CMEO; diminution de la fécondation | 1,94 | Dixon et al., 1999a |
| Invertébrés | Polychète, Pomatoceros lamarckii | NS | CMEO; séparation des chromosomes dans des ovocytes à l'anaphase | 0,0194 (19,4 µg/l) | Wilson et al., 2002a |
| Invertébrés | Moucheron, Paratany-tarsus parthenogenetica | Toxicité aiguë (96 h) | CL50, immobilité | 377 (statique) | Adams et al., 1995a |
| Invertébrés | Moucheron, Paratany-tarsus parthenogenetica | Toxicité aiguë (96 h) | CSEO, immobilité | inférieur(e) à 100 (statique) | Adams et al., 1995a |
| Invertébrés | Moucheron | Toxicité aiguë (48 h) | CE50 | 390 (statique) 330-450 |
CMA 1984e |
| Invertébrés | Harpacticoïde, Nitocra spinipes | Toxicité aiguë (96 h) | CL(I)50 | 53-72 | Linden et al., 1979 |
| Invertébrés | Daphnie, Daphnia magna | Toxicité chronique (21 j) | CSEO, survie et reproduction | 9,6 | Rhodes et al., 1995a |
| Invertébrés | Daphnie, Daphnia magna | Toxicité chronique (21 j) | CMEO, survie et reproduction | 23 | Rhodes et al., 1995a |
| Algue | Algue verte, Desmodesmus subspicatus | Toxicité chronique (72 h) | CE10, biomasse | 116 | AEPC c2007-2013 |
| Algue | Algue verte, Desmodesmus subspicatus | Toxicité chronique (72 h) | CE50, biomasse | 204 | AEPC c2007-2013 |
| Algue | Algue verte, Desmodesmus subspicatus | Toxicité chronique (72 h) | CE90, biomasse | 358 | AEPC c2007-2013 |
| Algue | Algue verte, Desmodesmus subspicatus | Toxicité chronique (72 h) | CE10, taux de croissance | 193,09 | AEPC c2007-2013 |
| Algue | Algue verte, Desmodesmus subspicatus | Toxicité chronique (72 h) | CE50, taux de croissance | 259,76 | AEPC c2007-2013 |
| Algue | Algue verte, Desmodesmus subspicatus | Toxicité chronique (72 h) | CE90, taux de croissance | 349,43 | AEPC c2007-2013 |
| Algue | Algues vertes, Pseudokirchneriella subcapitata | Chronique (96 h) | CE50, diminution de la numération cellulaire | 142 | Adams et al., 1995a |
| Algue | Algues vertes, Pseudokirchneriella subcapitata | Chronique (96 h) | CSEO, diminution de la numération cellulaire | inférieur(e) à 64,7 (statique) | Adams et al., 1995a |
| Algue | Algues vertes, Chlorella pyrenoidosa | Chronique (96 h) | CE50, croissance | 313 | Yan et al., 1995a |
| Algue | Algue | Toxicité chronique (96 h) | CE50 | 145,6 (statique) 95,4-240,2 |
CMA 1984e |
| Autre | Microorganismes | (30 minutes) | CE20, taux de respiration | 400 (calculé) | AEPC c2007-2013 |
| Autre | Gymnodinium brève | TLm de 96 h Note de bas de page Tableau[c].6B-1[c].6 | 125, 185 (2 essais) | Wilson et al., 1978Note de bas de page Tableau B-1[b].9 | |
| Autre | Gymnodinium brève | 96 h CE50 (croissance médiane concentration limite) | 96, 54 (2 essais) | Wilson et al., 1978b |
Annexe C : Estimations de la dose journalière admissible pour le groupement à chaîne courte
| Voie d'exposition | 0 à 6 moisNote de[a].14bas de page Tableau C-1[a].14 Nourri au lait humainNote de bas[b].10de page Tableau C-1[b].10 |
0 à 6 moisa Nourri de préparationNote[c].7de bas de page Tableau[c].7C-1[c].7 |
0 à 6 moisa Non nourris de préparation |
6 mois à 4 ansNote de[d].6bas de page[d].6Tableau C-1[d].6 | 5 à 11 ansNote de bas de[e].2page Tableau C-1[e].2 | 12 à 19 ansNote de bas de page Tableau C-1[f] | 20 à 59 ansNote de bas de[g]page Tableau C-1[g] | 60 ans et plusNote de[h]bas de page[h]Tableau C-1[h] |
|---|---|---|---|---|---|---|---|---|
| Air ambiantNote[i]de bas de page Tableau[i]C-1[i] | - | - | - | - | - | - | - | - |
| Air intérieurNote[k]de bas de page Tableau[k]C-1[k] | 0,0066 (0,093)Note de bas de page[j]Tableau C-1[j] | 0,0066 (0,093) | 0,0066 (0,093) | 0,014 (0,21) | 0,011 (0,16) | 0,0063 (0,084) | 0,0054 (0,076) | 0,0047 (0,066) |
| Eau potableNote[l]de bas de page Tableau[l]C-1[l] | - | - | - | - | - | - | - | - |
| Aliments et boissonsNote de[m]bas de page Tableau C-1[m] | 0,012 (0,16) | 0 | 0 | 0,0029 (0,010) | 0,0028 (0,0076) | 0,0022 (0,0061) | 0,0018 (0,0046) | 0,0011 (0,0034) |
| SolNote de bas de[n]page Tableau C-1[n] | - | - | - | - | - | - | - | - |
| PoussièreNote de[o]bas de page Tableau C-1[o] | inférieur(e) à 0,001 (0,0070) | inférieur(e) à 0,001 (0,0070) | inférieur(e) à 0,001 (0,0070) | inférieur(e) à 0,001 (0,0050) | inférieur(e) à 0,001 (0,0023) | inférieur(e) à 0,001 | inférieur(e) à 0,001 | inférieur(e) à 0,001 |
| Total par voie orale | 0,019 (0,26) | 0,0066 (0,10) | 0,0066 (0,10) | 0,017 (0,23) | 0,014 (0,17) | 0,0085 (0,090) | 0,0072 (0,081) | 0,0058 (0,069) |
| Groupe DRI | Médian | 90e centile |
|---|---|---|
| inférieur(e) à 6 mois | 0 | 0 |
| 6 moin-1 an | F | F |
| 1 - 3 yrs | 2,9 | 10,02 |
| 4 - 8 yrs | 2,82 | 7,57 |
| M: 9 -13 yrs | 2,14 | 5,9 |
| F: 9 -13 yrs | 1,7 | 4,93 |
| M: 14 - 18 yrs | 2,21 | 6,11 |
| F: 14 - 18 yrs | 1,55 | 4,42 |
| M: 19 - 30 yrs | 1,81 | 4,64 |
| F: 19 - 30 yrs | 1,29 | 4,09 |
| M: 31 - 50 yrs | 1,42 | 4,14 |
| F: 31 - 50 yrs | 1,14 | 3,53 |
| M: 51 - 70 yrs | 1,09 | 3,4 |
| F: 51 - 70 yrs | 0,82 | 2,88 |
| M: supérieur(e) à 71 yrs | 0,73 | 2,59 |
| F: supérieur(e) à 71 yrs | 0,67 | 2,32 |
Annexe D : Dérivation de l’absorption par voie alimentaire
Données de présence – DMP
Les données sur la présence de DMP ont été obtenues d'une étude américaine de l'alimentation totale (Schecter et al., 2013) et les données manquantes ont été complétées par des données d'une étude anglaise de l'alimentation totale (Bradley et al., 2013b).
On a attribué une valeur de ½LD aux données sur la présence de DMP dans les aliments qui était inférieure à la LD (limite de détection) analytique. Une valeur de zéro a toutefois été attribuée à tous les échantillons au sein d'une vaste catégorie d'aliments, si aucun échantillon de la catégorie ne contenait des concentrations de phtalates mesurables au-dessus de la LD.
Données de consommation alimentaire et données de présence concordantes
Les concentrations DMP dans les aliments individuels ont été mises en correspondance avec les chiffres de consommation de ces aliments qui ont été révélés par l'Enquête sur la santé dans les collectivités canadiennes (ESCC) - Cycle 2.2 sur la nutrition (Statistiques Canada 2004), afin de générer des distributions de l'exposition aux phtalates pour divers groupes d'âge-sexe. L'ESCC comportait un volet sur le rappel des aliments consommés au cours de 24 heures par plus de 35 000 répondants de tous les âges partout au Canada.
Si un élément d'une gamme de produits alimentaires figure dans une recette qui a été mise en correspondance avec un ensemble d'aliments analysés, les niveaux de phtalates associés à la recette ont été attribués à l'ingrédient. Si un élément d'une gamme de produits correspondait à un ensemble d'aliments analysés, on a attribué les niveaux de phtalates de l'élément. Pour le DMP, 989 aliments et 23 recettes ont été jumelés à la liste des aliments analysés.
Renseignements sur le poids corporel
Pour estimer le niveau d'exposition par kilogramme de poids corporel, les poids corporels des nourrissons ont été fixés en fonction des poids corporels moyens obtenus des données de poids corporel de l'enquête Continuing Survey of Food Intake by Individuals (CSFII) du United States Department of Agriculture (CSFII; 1994-1996, 1998). Pour tous les groupes d'âge, on a utilisé les poids corporels disponibles dans l'ESCC, qui ont été mesurés ou autodéclarés. S'il manquait des données, on les a imputées par la médiane pour le groupe âge-sexe correspondant et le quintile de l'apport énergétique.
Évaluation probabiliste de l'exposition
Pour chaque aliment consommé par un répondant à l'enquête de l'ESCC, les concentrations de phtalates ont été choisies au hasard dans la liste correspondante de valeurs dosées. Pour chaque répondant, les estimations de l'exposition de chaque aliment ont été additionnées, afin de générer une distribution de l'exposition pour tous les répondants. On a répété cela 500 fois (500 itérations) pour modéliser la variabilité de la distribution des expositions et corriger la variabilité des niveaux de phtalates. Pour chaque groupe d'âge-sexe, les expositions médianes et au 90e percentile ont été calculées à partir de la distribution empirique générée par les 500 itérations
Annexe E : Estimations de l'exposition chronique par voie cutanée aux cosmétiques et produits de soins personnels
| Type de produit | % min./moy. - % max. | Exposition chronique min. (mg/kg/jour) |
Exposition chronique max. (mg/kg/jour) |
Référence |
|---|---|---|---|---|
| Laque pour les cheveux (adulte) | 1 - 3 | 0,0066 | 0,020 | Notifications en vertu du Règlement sur les cosmétiques |
| Vernis à ongles (adulte) | 1 - 3 | 3,00 × 10-4 | 9,0 × 10-4 | Notifications en vertu du Règlement sur les cosmétiques |
| Crème pour le corps, lotion, crème hydratante (infantile) | 0,00001 - 0,00044 | 3,2 × 10-6 | 1,4 × 10-4 | Guo et al., 2013 |
| Désodorisant/antisudorifique solide (adulte) | ND - 0,0072 | - | 7,9 × 10-5 | Guo et Kannan, 2013 |
| Crème pour le corps, lotion, crème hydratante (adulte) | 0,000039 - 0,000568 | 2,7 × 10-6 | 3,9 × 10-5 | Guo et Kannan, 2013 |
| Crème pour le visage, lotion, crème hydratante (adulte) | 0,000052 - 0,00107 | 1,6 × 10-6 | 3,3 × 10-5 | Guo et Kannan, 2013 |
| Crème pour le corps, lotion, crème hydratante (adulte) | 0,00001 - 0,00044 | 6,8 × 10-7 | 3,0 × 10-5 | Guo et Kannan, 2013 |
| Désodorisant/antisudorifique solide (adulte) | 0,000151 - 0,00206 | 1,7 × 10-6 | 2,3 × 10-5 | Guo et Kannan, 2013 |
| Crème pour le corps, lotion, crème hydratante (infantile) | 0,000017 - 0,000051 | 5,4 × 10-6 | 1,6 × 10-5 | Guo et Kannan, 2013 |
| Mousse cheveux (adulte) | 0,000371 - 0,00121 | 9,4 × 10-7 | 3,1 × 10-6 | Guo et Kannan, 2013 |
| Tonifiant pour le visage (adulte) | 0,000003 - 0,000028 | 2,1 × 10-8 | 2,0 × 10-7 | Guo et Kannan, 2013 |
| Shampoing (adulte) | 0,00001 - 0,00007 | 1,8 × 10-8 | 1,3 × 10-7 | Guo et al., 2013 |
| Shampoing (adulte) | 0,000007 - 0,000032 | 1,3 × 10-8 | 5,9 × 10-8 | Guo et Kannan, 2013 |
| Savon de douche liquide (adulte) | 0,00001 - 0,00008 | 3,7 × 10-9 | 2,9 × 10-8 | Guo et al., 2013 |
| Vernis à ongles (adulte) | 0,000003 - 0,000022 | 9,0 × 10-10 | 6,6 × 10-9 | Guo et Kannan, 2013 |
| Shampoing (nourrisson) | 0,00001 - 0,00007 | 9,3 × 10-10 | 6,5 × 10-9 | Guo et Kannan, 2013 |
| Shampoing (nourrisson) | 0,000017 - 0,000068 | 1,6 × 10-9 | 6,3 × 10-9 | Guo et Kannan, 2013 |
| Nettoyant visage (adulte) | 0,000001 - 0,000006 | 5,9 × 10-10 | 3,5 × 10-9 | Guo et Kannan, 2013 |
| Savon de douche liquide (adulte) | 0,000001 - 0,000009 | 3,7 × 10-10 | 3,3 × 10-9 | Guo et Kannan, 2013 |
Annexe F : Dérivation des absorptions quotidiennes de DMP à partir des données de biosurveillance
MIREC-CD Plus
Équation 1 :
Absorptions quotideinnes (µg/kg mc•day) = [Cmétabolite (mole/g Cr) × TEC (g/jour) × MMparent (g/mole)] / [EUF × MC (kg)]
où :
- C métabolite :
- concentration molaire du métabolite
- TEC :
- taux d’excrétion de créatinine, d'après l'équation de Mage
- MM :
- masse molaire du DMP, 194 g/mole
- EUF :
- valeur d’élimination urinaire fractionnaire de MMP : 0,69
- MC :
- masse corporelle du participant
Étape 1: Convertir les concentrations de métabolites urinaires en mole/g Cr
Équation 2 :
Cmétabolite (mole/g Cr) = [Cmétabolite Cr (µg/g Cr)] / [MMmétabolite (g/mole)]
A. Conversion des concentrations urinaires de MMP (estimation de l'absorption quotidienne de DEP)
CMMP (mole/g Cr) = [CMMP Cr (µg/g Cr)] / 180 (g/mole)
Étape 2 : Calculer le TEC pour chaque participant individuel à l’aide de l’équation de Mage
Étape 3 : Estimer l’absorption quotidienne moyenne à l’aide de l’équation 1.
NHANES
Analyse statistique : Les données ont été analysées avec les logiciels SAS 9.2 (SAS Institute Inc., USA) et SUDAAN 10.0.1 (RTI International, USA). Les estimations de variance ont été produites en utilisant l'approche de linéarisation de Taylor, telle que recommandée dans les directives d'analyse de la NHANES. Toutes les analyses ont été pondérées en utilisant les poids de l'enquête NHANES (sous-échantillon de l'environnement), afin d'être représentatives de la population américaine. Nous avons attribué une valeur de LD/2 aux concentrations de phtalates qui étaient sous la limite de détection (LD).
Estimation du taux d'excrétion de créatinine : Nous avons calculé le taux d'excrétion de la créatinine de chaque participant à l'étude à l'aide des équations de Mage (Huber et al., 2010). Nous avons appliqué pour tous les participants l'ajustement pour l'adiposité. décrit dans l'information supplémentaire (Huber et al., 2010) et, pour les enfants de moins de 18 ans, l'ajustement de la surface du corps. Nous avons calculé l'IMC selon l'âge pour l'ajustement pour l'adiposité en utilisant la totalité de l'échantillon du National Health Ann Nutrition Examination Survey (NHANES). Les ensembles de données sur les phtalates des NHANES de 2009-2010 et de 2011-2012 comportaient 58 garçons et 49 filles qui excédaient les limites de taille corporelle des équations de Mage (186 cm pour les garçons et 172 cm pour les filles). Les équations de Mage ont été appliquées directement aux tailles observées, afin d'extrapoler les taux d'excrétion de créatinine de ces participants. Les taux d'excrétion prévus pour ces personnes semblaient être raisonnables malgré l'extrapolation.
Estimation de l'ingestion : Nous avons estimé la dose journalière de chaque phtalate absorbée par chaque participant, à l'aide de l'équation suivante (David et al., 2000; Koch et al., 2007) :
Équation 1 :
Absorptions quotideinnes (µg/kg mc•day) = [UCCr(µg/g Cr) / MMM] × [(CER (g/jour) × MMD) / (MC (kg) × EUF)]
Le UCCr est la concentration de monoester dans l'urine ajustée pour la créatine. MC désigne la masse corporelle. MMD et MMM sont respectivement la masse moléculaire du monoester et du diester. Chaque DMP a un seul métabolite de monoester mesuré par le NHANES (MMP). Les masses moléculaires sont respectivement de 194,19 et 180,16 g/mole pour les DMP et MMP.
L'excrétion urinaire fractionnelle (UEF) est définie comme la fraction de la dose de l'exposition au diester excrétée sous forme de monoester dans l'urine, calculée sur une base de molaire (0,69 pour MMP).
Pour chaque diester de phtalate sélectionné, l'apport quotidien pour chaque participant à l'étude a été calculé à l'aide de l'équation 1. On a calculé les moyennes arithmétiques et géométriques de l'apport quotidien, ainsi que les centiles choisis avec un intervalle de confiance à 95 %, pour la population américaine par groupe d'âge et le sexe. Les statistiques descriptives ont été calculées en utilisant la procédure DESCRIPT du logiciel SUDAAN.
Annexe G : Description et application du système de notation de Downs et Black et directives pour calculer le niveau de la preuve de l'association statistique
Évaluation de la qualité de l'étude
Nous avons recensé et évalué un certain nombre d'approches systématiques permettant d'évaluer la qualité des études épidémiologiques. La méthode Downs Ann Black a été sélectionnée en raison (1) de son applicabilité à la base de données sur les phtalates, (2) de son applicabilité à plusieurs plans d'étude, (3) de sa validité et fiabilité avérées, (4) de sa simplicité, (5) du petit nombre de composantes et (6) de sa portée épidémiologique. La méthode Downs et Black comporte 27 questions réparties dans les cinq domaines suivants : 1) rapports, 2) validité externe, 3) biais de l'étude de la validité interne, 4) biais de confusion et de sélection de la validité interne, 5) la puissance de l'étude. La qualité globale de l'étude est évaluée sur échelle numérique pour chacune des cinq catégories. La fourchette de l'échelle permet une plus grande variabilité dans la qualité des études. Les 27 questions sont applicables à des études d'observation, y compris les études cas-témoins, les études de cohorte et les études transversales et les essais contrôlés randomisés.
A l''aide de l'outil de Downs et Black, nous avons attribué une note de qualité aux études retenues pour une évaluation.. Comme préalablement mentionné, cet outil de Downs et Black permet d'établir une note sur une échelle de 27 questions. Il existe une note maximale attribuable à chaque plan d'étude épidémiologique (elle est de 21 pour les études de cohorte, 18 pour les études cas-témoins et 17 pour les études transversales). Nous avons réparti les études en quartiles en fonction de la répartition de la notation pour chaque plan d'étude. La figure G-1 montre la répartition de la notation pour les études de cohorte, cas-témoins et transversales. Les études transversales moyennes et les études cas-témoins étaient de 13.1 alors que les études de cohorte, leur note moyenne était la plus élevée que toutes les autres, soit de 14,4.
Figure G-1. Répartition des notes de Downs et Black, en fonction du plan d'étude

Longue description pour la figure G-1
La figure est un diagramme à barres décrivant la plage et la fréquence des cotes de Downs et Black données aux études de différentes conceptions.
Sur le diagramme à barres, l’axe des x représente la cote de Downs et Black comprise entre 7 et 19, et l’axe des y représente la fréquence des cotes, jusqu’à une valeur de 15. La figure présente la fréquence des types d’étude suivants : études par cohorte, études cas/témoin et études transversales.
1) Pour les études par cohorte, 2 études ont reçu une cote de 12, 6 études ont reçu une cote de 13, 8 études ont reçu une cote de 14, 6 études ont reçu une cote de 15, 3 études ont reçu une cote de 16, 3 études ont reçu une cote de 17 et 1 étude a reçu une cote de 19.
2) Pour les études cas/témoin, 1 étude a reçu une cote de 8, 3 études ont reçu une cote de 9, 4 études ont reçu une cote de 10, 4 études ont reçu une cote de 11, 1 étude a reçu une cote de 12, 2 études ont reçu une cote de 13, 6 études ont reçu une cote de 14, 3 études ont reçu une cote de 15 et 2 études ont reçu une cote de 16.
3) Pour les études transversales, 1 étude a reçu une cote de 7, 4 études ont reçu une cote de 11, 12 études ont reçu une cote de 12, 15 études ont reçu une cote de 13, 14 études ont reçu une cote de 14, 2 études ont reçu une cote de 15, 2 études ont reçu une cote de 16 et 1 étude a reçu une cote de 17.
Orientation pour le niveau de preuve d'une association
Nous avons évalué l'association potentielle entre l'exposition aux phtalates et chaque résultat de santé en fonction de la force et de la cohérence, ainsi que la qualité des études épidémiologiques qui a été déterminée en fonction de la note du système de Downs et Black. Les descriptions des niveaux de preuve d'association sont les suivantes :
- Preuve suffisante d'une association : la preuve est suffisante pour conclure qu'il y a une association. C'est-à-dire une association entre l'exposition à un phtalate ou à son métabolite et une répercussion sur la santé a été observée dans quel cas où pour établir une implication de causalité, on doit observer un lien positif dont on peut exclure avec une confiance raisonnable qu'il est le fruit du hasard, de biais et de facteurs de confusion connus. Pour conclure à une association causale, il faut faire un examen complet de la biologie et de la toxicologie sous-jacente, ce qui dépasse la portée de la présente étude.
- Preuve limitée d'une association : la preuve suggère ici une association entre l'exposition à un phtalate ou à son métabolite et une répercussion sur la santé. Toutefois, on ne pouvait pas exclure avec une certitude raisonnable que c'est le fruit du hasard, de biais ou de la confusion.
- Preuve suggérant aucune association : La qualité, la cohérence et la puissance statistique de l'étude disponible ne permettent pas de tirer une conclusion relative à la présence d'un lien de causalité ou à son absence.
- La preuve suggérant aucune association : Les études disponibles sont mutuellement compatibles en ne montrant pas d'association entre le phtalate d'intérêt et les résultats mesurés sur la santé.


