Évaluation et rapport de situation du COSEPAC sur la Chimaphile maculée (Chimaphila maculata) au Canada, 2017
Chimaphile maculée

- Table des matières
- COSEPAC Sommaire de l’évaluation
- COSEPAC Résumé
- Résumé technique
- Préface
- Description et importance de l’espèce sauvage
- Répartition
- Habitat
- Biologie
- Taille et tendances des populations
- Menaces et facteurs limitatifs
- Menaces
- Activités récréatives (6.1)
- Espèces indigènes problématiques (8.2)
- Incendies et suppression des incendies (7.1)
- Développement résidentiel et commercial (1)
- Exploitation forestière et récolte du bois (5.3)
- Espèces exotiques (non indigènes) envahissantes (8.1)
- Déchets solides et ordures (9.4)
- Autres modifications de l’écosystème (7.3)
- Changements climatiques et phénomènes météorologiques violents (11)
- Menaces potentielles et hypothétiques
- Facteurs limitatifs
- Nombre de localités
- Menaces
- Protection, statuts et classements
- Remerciements et experts contactés
- Sources d’information
- Sommaire biographique des rédacteurs du rapport
- Collections examinées
- Tableau 1. Dénombrement des sous-populations de chimaphile maculée
- Annexe 1. Tableau de classification des menaces pesant sur la chimaphile maculée
Évaluation et rapport de situation du COSEPAC sur la Chimaphile maculée (Chimaphila maculata) au Canada, 2017

COSEPAC
Comité sur la situation
des espèces en péril
au Canada

COSEWIC
Committee on the Status
of Endangered Wildlife
in Canada
Les rapports de situation du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages que l’on croit en péril. On peut citer le présent rapport de la façon suivante :
COSEPAC. 2017. Évaluation et Rapport de situation du COSEPAC sur la chimaphile maculée (Chimaphila maculata) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xiv + 42 p. (Registre public des espèces en péril site Web).
Rapport(s) précédent(s) :
COSEPAC. 2000. Évaluation et Rapport de situation du COSEPAC sur la chimaphile maculée (Chimaphila maculata) au Canada. - Mise à jour. Comité sur la situation des espèces en péril au Canada. Ottawa. vi + 7 p.
WHITE, D.J. 1998. Rapport de situation du COSEPAC sur la chimaphile maculée (Chimaphila maculata) au Canada – Mise à jour. Comité sur la situation des espèces en péril au Canada. Ottawa. Pages 1-7.
KIRK, D.A. 1987. COSEWIC status report on the spotted wintergreen Chimaphila maculata in Canada. Comité sur le statut des espèces menacées de disparition au Canada. Ottawa. 36 p.
Le COSEPAC remercie Holly Bickerton et Melinda Thompson d’avoir rédigé le rapport de situation sur la chimaphile maculée (Chimaphila maculata)auCanada,aux termes d’un marché conclu avec Environnement et Changement climatique Canada. La supervision et la révision du rapport ont été assurées par Del Meidinger, coprésident du Sous-comité de spécialistes des plantes vasculaires du COSEPAC.
Pour obtenir des exemplaires supplémentaires, s’adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-938-4125
Téléc. : 819-938-3984
Courriel : COSEPAC courriel
Site Web du COSEPAC
Also available n English under the title COSEWIC Assessment and status report on the Spotted Wintergreen (Chimaphila maculata) in Canada, 2017
Chimaphile maculée - Photo de Jenny McCune, utilisation autorisée.
Chimaphile maculée
Chimaphila maculata
La chimaphile maculée (Chimaphila maculata) est une petite plante vivace basse à feuilles persistantes qui est ligneuse à la base et se propage à l’aide de rhizomes pour former des colonies. Chaque tige porte des feuilles vert-bleu épaisses et dentées qui sont disposées en verticilles et dont la nervation est panachée de blanc. Le verticille de feuilles est surmonté d’une tige portant une à cinq fleurs blanches ou rosâtres à port retombant. Pour une année donnée, seules certaines tiges d’une sous-population produisent des fleurs. Les capsules arrondies se redressent après la floraison et contiennent de nombreuses graines minuscules.
La chimaphile maculée est présente dans l’est de l’Amérique du Nord, au Mexique et en Amérique centrale. Dans l’est de l’Amérique du Nord, on la trouve depuis le sud du Michigan et de l’Ontario jusqu’au sud du New Hampshire et du Maine, vers l’est, et jusqu’au Mississippi et au nord de la Floride, vers le sud. Par le passé, la chimaphile maculée était plus répandue dans le sud de l’Ontario et dans le sud-ouest du Québec. Aujourd’hui, il subsiste quelques sous-populations dans le sud de l’Ontario, et on la considère disparue du Québec.
La chimaphile maculée est une espèce du sous-étage typiquement associée aux forêts et aux boisés mixtes de chênes ou de chênes et de pins sur sol sec à frais. La plante pousse généralement dans un sol sableux bien drainé, exempt de gros fragments, pauvre en nutriments et dont la teneur en matière organique est faible.
La floraison de la chimaphile maculée se produit à la fin du mois de juillet et au début du mois d’août. Elle se reproduit par voie clonale ou à partir de graines. Comme les tiges proviennent de rhizomes traçants, les touffes ou les groupes contigus de tiges constituent probablement des ramets plutôt que des individus génétiquement distincts. Les graines minuscules de cette famille de plantes, semblables à des grains de poussière, sont surtout dispersées par le vent.
Au Canada, on compte actuellement cinq sous-populations existantes. Selon les relevés effectués entre 2011 et 2014, la population totale au Canada serait d’au moins 3 587 (~3 600) tiges. Le nombre d’individus génétiquement distincts n’est pas connu, mais on présume qu’il est inférieur à ce chiffre. Les populations déclarées antérieurement s’élevaient à quelques centaines de tiges, mais deux des sous-populations existantes (et plusieurs sites plus petits) ont été découvertes après la diffusion du dernier rapport de situation et sont toutes deux assez isolées des autres sites existants. Il ne s’agit probablement pas de sous-populations nouvellement établies; cette découverte pourrait découler de l’intensification des activités de recherche et de communication des observations. La plupart des sites connus depuis environ l’an 2000 sont demeurés au minimum stables, mais certains présentent une abondance et une étendue accrues, comme l’indique le suivi effectué régulièrement.
On compte en outre deux sous-populations historiques et six sous-populations disparues. Il est possible que des individus aient persisté à l’un ou l’autre des sites historiques. La plupart des mentions d’individus disparus n’ont été obtenues qu’à partir de données vagues sur leur localisation ou leur population et les individus n’ont jamais été retrouvés. Une petite sous-population découverte près de Montréal en 1992 pourrait avoir été plantée, et on croit aujourd’hui qu’elle a disparu.
Les activités récréatives représentent probablement la principale menace pesant sur les sous-populations existantes de chimaphile maculée, mais les incendies risquent d’avoir le plus de conséquences, car cette espèce ne semble pas persister après un feu. La plupart des sites existants sont de propriété publique et sont protégés des pertes attribuables au développement, mais de nombreux sites sont accessibles à la population, et il se peut que certains d’entre eux soient vulnérables aux dommages occasionnés par les VTT et au compactage du sol dans les sentiers pédestres adjacents. Beaucoup de sites ne semblent pas être menacés dans l’immédiat, bien que leur petite taille et leur étendue géographique les rendent vulnérables à des perturbations localisées. Des espèces envahissantes sont présentes sur quelques sites ou à proximité de ces derniers, mais ne semblent pas nuire au nombre de ramets (ou tiges) de ces sous-populations. La dégradation de l’habitat (p. ex. par le déversement de déchets) pourrait aussi avoir des effets limités sur certaines sous-populations de chimaphile maculée. Il se peut que cette espèce soit restreinte dans une certaine mesure en raison de sa dépendance aux champignons mycorhiziens du sol et de la biologie de sa reproduction.
La chimaphile maculée a été désignée « en voie de disparition » pour la première fois par le COSEPAC en 1987. Ce statut a été revu et confirmé en 1998 et en 2000. L’espèce est actuellement désignée « en voie de disparition » aux termes de la Loi sur les espèces en péril (LEP) et de la Loi sur les espèces en voie de disparition (LEVD) de l’Ontario.En Ontario, l’espèce et son habitat sont protégés en vertu de la LEVD. La cote de conservation mondiale de la chimaphile maculée est G5, soit « non en péril ». Au Canada, la chimaphile maculée est classée N2 (en péril). En Ontario, elle est classée S2 et au Québec, SX. La chimaphile maculée est considérée comme étant non en péril (N5) aux États-Unis, mais au sein même de ce pays, elle est désignée gravement en péril (S1) en Illinois, et en péril (S2) au Vermont, au Maine et au Mississippi. L’espèce est aussi protégée par la loi en Illinois, où elle a été désignée comme espèce en voie de disparition.
| Sujet | Information |
|---|---|
Durée d’une génération (généralement, âge moyen des parents dans la population; indiquez si une méthode d’estimation de la durée d’une génération autre que celle qui est présentée dans les lignes directrices de l’UICN (2011) est utilisée) L’âge minimum à la floraison est estimé à au moins 2 à 3 ans. Toutefois, la capacité de l’espèce à se reproduire par voie végétative semble indiquer que l’âge moyen des individus matures est probablement d’au moins 10 ans, et possiblement beaucoup plus. |
Inconnue, mais probablement d’au moins 10 ans, et possiblement plus |
Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d’individus matures? Une comparaison de toutes les sous-populations à deux points temporels laisse croire que depuis 2000, le nombre d’individus matures (nombre approximatif obtenu par dénombrement des tiges) est certainement stable et est probablement en hausse. Deux nouvelles sous-populations (et plusieurs sites d’autres sous-populations) ont été découvertes dans la dernière décennie, bien que cette découverte découle probablement de l’intensification des activités de recherche. Depuis le dernier rapport de situation (~15 ans ou 1,5 génération), une sous-population a disparu et deux autres sont maintenant considérées comme historiques, mais ces sous-populations représentent très peu d’individus matures par rapport à la population totale. |
Non |
| Pourcentage estimé de déclin continu du nombre total d’individus matures sur [cinq ans ou deux générations] | Inconnu |
Pourcentage [observé, estimé, inféré ou présumé] d’augmentation du nombre total d’individus matures au cours des [dix dernières années ou trois dernières générations]. Deux nouvelles sous-populations ont été répertoriées, mais il pourrait ne pas s’agir de nouveaux sites. Dans plusieurs sites connus et surveillés, on assiste à une hausse notable du nombre de tiges et de la superficie occupée depuis 2000. Au cours des dix dernières années, deux sous-populations ont été considérées comme historiques, mais elles pourraient encore exister, et une autre a probablement disparu. |
Population stable ou en hausse |
Pourcentage [prévu ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix prochaines années ou trois prochaines générations]. Si les relevés et la gestion planifiée de l’habitat se poursuivent à Turkey Point et à la forêt St. Williams, le nombre total de tiges pourrait continuer à s’accroître. |
Possiblement en hausse |
| Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours de toute période de [dix ans ou trois générations] commençant dans le passé et se terminant dans le futur. | Inconnu |
| Est-ce que les causes du déclin sont a) clairement réversibles, b) comprises et c) ont effectivement cessé? | S.O. |
| Y a-t-il des fluctuations extrêmes du nombre d’individus matures? | No |
| Sujet | Information |
|---|---|
| Superficie estimée de la zone d’occurrence – actuelle | 1 952 km2 |
| Indice de zone d’occupation (IZO) (Fournissez toujours une valeur établie à partir d’une grille à carrés de 2 km de côté). | 28 km2 |
| La population totale est-elle « gravement fragmentée », c.-à-d. que plus de 50 % de sa zone d’occupation totale se trouvent dans des parcelles d’habitat qui sont a) plus petites que la superficie nécessaire au maintien d’une population viable et b) séparées d’autres parcelles d’habitat par une distance supérieure à la distance de dispersion maximale présumée pour l’espèce? | Inconnu |
Nombre de localités? On compte cinq sous-populations existantes; il y a plusieurs menaces, mais les incendies constituent probablement la menace la plus importante pesant sur la majorité de la population et risquent de varier en intensité et en étendue, ce qui explique la fourchette plausible du nombre de localités. |
7-9 |
Y a-t-il un déclin continu [observé, inféré ou prévu] de la zone d’occurrence? Déclin important causé par la perte de certaines localités. Voir le rapport pour une analyse des méthodes de calcul des zones d’occurrence antérieure et actuelle. |
Oui |
Y a-t-il un déclin continu [observé, inféré ou prévu] de l’indice de zone d’occupation? Voir le rapport pour une analyse des méthodes de calcul des indices de zone d’occupation antérieur et actuel. |
Oui, déclin de 22 % observé depuis 2000. |
Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de sous-populations? Deux sous-populations sont considérées comme « historiques », mais il se peut qu’elles existent toujours. La sous-population du Québec n’est pas incluse, car on juge qu’elle a été introduite. |
Oui |
| Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de localités? Voir « Définitions et abréviations » sur le Site Web du site web du COSEPAC et IUCN (février 2014; en anglais seulement) pour obtenir des précisions sur ce terme.? |
Oui |
| Y a-t-il un déclin continu [observé, inféré ou prévu] de [la superficie, l’étendue ou la qualité] de l’habitat? | Inconnu |
| Y a-t-il des fluctuations extrêmes du nombre de sous-populations? | Non |
| Y a-t-il des fluctuations extrêmes du nombre de localités? Voir « Définitions et abréviations » sur le Site Web du site web du COSEPAC et IUCN (février 2014; en anglais seulement) pour obtenir des précisions sur ce terme.? |
Non |
| Y a-t-il des fluctuations extrêmes de la zone d’occurrence? | Non |
| Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation? | Non |
| Sujet | Information |
|---|---|
| Sous-population 1 – Forêt St. Williams (2012) | 2 065 tigesa |
| Sous-population 2 – Secteur de Turkey Point (2012) | 928 tiges |
| Sous-population 3 – Secteur de Fishers Glen (2012, 2013) | 579 tiges |
| Sous-population 4 – Chemin Perry, Wainfleet (2012) | 5 tiges |
| Sous-population 5 – Parc Ojibway, Windsor (2014) | 10 tiges |
| Total | ~3 600b tiges |
a Le dénombrement des tiges est un indice de l’abondance de la population. Le nombre d’individus matures n’est pas connu, mais on présume qu’il est inférieur au nombre de tiges chez cette plante clonale. Dans le cas de la sous-population de la forêt St. Williams, le nombre 2 065 est une estimation minimale, car de nouvelles colonies ont été recensées à la suite de la remise en état de l’habitat en 2014, en 2015 et en 2016. Le dénombrement révisé n’est pas encore connu, mais il est probable qu’il a augmenté (Heagy, comm. pers., 2016).
b Arrondi pour tenir compte de l’incertitude des estimations relatives aux colonies plus importantes.
| Sujet | Information |
|---|---|
| La probabilité de disparition de l’espèce à l’état sauvage est d’au moins [20 % sur 20 ans ou 5 générations, ou 10 % sur 100 ans] | Non réalisée |
| Sujet | Information |
|---|---|
Un calculateur des menaces a-t-il été rempli pour l’espèce? En mars 2016. Voir l’annexe 1. |
Participants : Del Meidinger (coprésident), Kristiina Ovaska (animatrice), Holly Bickerton (rédactrice), Karen Timm et Joanna James (Secrétariat), Sean Blaney, Andy MacKinnon, Joyce Gould, Melinda Thompson, Audrey Heagy, Mike Oldham, Jenny McCune
|
| Sujet | Information |
|---|---|
Situation des populations de l’extérieur les plus susceptibles de fournir des individus immigrants au Canada Dans les États septentrionaux adjacents que sont le Maine et le Vermont, les populations semblent être en hausse selon les rapports les plus récents; cependant, la chimaphile maculée pourrait aussi ne pas avoir été signalée systématiquement dans le passé (Cameron, comm. pers., 2015; Popp, comm. pers., 2015). La chimaphile maculée est une plante commune des boisés secs de chênes et de pins du sud de la Nouvelle-Angleterre et est particulièrement abondante le long de la plaine côtière de l’Atlantique dans le sud de la Nouvelle-Angleterre (voir l’Atlas of the Flora of New England, Angelo et Boufford, 2016). |
Stable, et possiblement en hausse |
| Une immigration a-t-elle été constatée ou est-elle possible? | Possible, mais faible probabilité globale |
| Des individus immigrants seraient-ils adaptés pour survivre au Canada? | Probablement |
| Y a-t-il suffisamment d’habitat disponible au Canada pour les individus immigrants? | Oui |
Les conditions se détériorent-elles au Canada? Les deux plus grands sites se trouvent sur des terres publiques et sont actuellement l’objet d’une remise en état de l’habitat qui se traduit par l’observation d’une augmentation de population. Trois autres sous-populations ont été récemment découvertes ou redécouvertes. On estime que le site Fishers Glen et celui du chemin Perry (Wainfleet) sont associés à une viabilité faible et à un habitat possiblement en détérioration. |
Globalement non, mais certains déclins locaux |
| Les conditions de la population source se détériorent-elles? | Stable et possiblement en hausse |
| La population canadienne est-elle considérée comme un puits? | Non |
La possibilité d’une immigration depuis des populations externes existe-t-elle? La recolonisation à partir de populations hors du Canada est possible, car la chimaphile maculée est présente dans les États du Michigan et de New York, qui sont adjacents, et ses graines, semblables à des grains de poussière, peuvent être transportées sur de grandes distances. Il se peut que l’établissement de l’espèce soit limité par la disponibilité de champignons mycorhiziens compatibles dans le sol. |
Possible |
| Sujet | Information |
|---|---|
| L’information concernant l’espèce est-elle de nature délicate? | Non |
| Sujet | Information |
|---|---|
| COSEPAC : Espèce désignée « en voie de disparition » en avril 1987. | Réexamen et confirmation du statut en avril 1998 et en mai 2000. Réexamen du statut : l’espèce a été désignée « menacée » en avril 2017. |
| Sujet | Information |
|---|---|
| Statut recommandé | Menacée |
| Codes alpha-numériques | B1ab (i, ii, iv) et 2ab (i, ii, iv) |
| Justification de la désignation | Cette plante vivace basse est restreinte aux sols sablonneux dans le sud de l’Ontario. Depuis la dernière évaluation, cette espèce a été découverte dans deux nouveaux sites et est disparue de deux autres sites. L’ensemble de la population est demeuré relativement stable, mais les cinq sous-populations sont menacées par les activités récréatives et la possibilité de feu de friches. |
| Sujet | Information |
|---|---|
| Critère A (déclin du nombre total d’individus matures) | Non satisfait. Le nombre d’individus matures (calculé approximativement par le dénombrement des tiges) est stable. |
| Critère B (petite aire de répartition, et déclin ou fluctuation) | Correspond au critère de la catégorie « menacée », B1ab (i, ii, iv) et 2ab (i, ii, iv); la zone d’occurrence (1 952 km2) et l’IZO (28 km2) respectent le seuil établi pour la catégorie « en voie de disparition », mais le nombre de localités plausible (7-9) correspond au seuil établi pour la catégorie « menacée ». Le déclin observé de la zone d’occurrence, de l’indice de zone d’occupation et du nombre de localités/sous-populations est attribuable à la perte des petites occurrences historiques. Il est possible que les pertes se poursuivent à cause des activités récréatives et du risque d’incendie. La population n’est pas gravement fragmentée et ne subit pas de fluctuations extrêmes. |
| Critère C (nombre d’individus matures peu élevé et en déclin) | Non satisfait. La petite taille de la population (3 600 tiges) correspond au seuil établi pour la catégorie « menacée », mais on ne peut inférer de déclin futur de 10 % d’après les données de population les plus récentes. Le critère C1 ne s’applique donc pas. La taille des sous-populations et le nombre d’individus matures ne satisfont pas aux seuils établis pour le critère C2 – une sous-population existante comprend plus de 1 000 individus matures, et aucune sous-population ne constitue toute la population. On ne note aucune fluctuation extrême du nombre d’individus matures. |
| Critère D (très petite population totale ou répartition restreinte) | Non satisfait. |
| Critère E (analyse quantitative) | Analyse non réalisée. |
La chimaphile maculée (Chimaphila maculata) a été désignée « en voie de disparition » en 1987, car on n’en connaissait que très peu d’occurrences au Canada (Kirk, 1987). On croyait alors que les principales menaces pesant sur la chimaphile maculée étaient le piétinement et les activités récréatives (COSEWIC, 2000). Depuis la dernière évaluation de cette plante par le COSEPAC en 2000, plusieurs sites ont été redécouverts et deux nouvelles sous-populations ont été localisées. D’après les relevés réalisés de 2011 à 2014, l’abondance de la chimaphile maculée, obtenue par un dénombrement des tiges, est sans doute stable, et peut-être même en hausse. La taille de l’ensemble de la population et les tendances touchant celle-ci sont quelque peu difficiles à déterminer compte tenu des différentes méthodes de recherche et de dénombrement utilisées au cours des deux dernières décennies.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d’une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d’une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d’être évaluées selon un processus scientifique rigoureux et indépendant.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Le COSEPAC est composé de membres de chacun des organismes responsables des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l’Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d’information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous-comités de spécialistes des espèces et du sous-comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Remarque : Catégorie « DSIDD » (données insuffisantes pour donner une désignation) jusqu’en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d’Environnement et Changement climatique Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Nom scientifique : Chimaphila maculata (L.) Pursh
Synonymes : Chimaphila maculata (L.) Pursh var. maculata
Pyrola maculata L.
Chimaphila maculata var. dasystemma (Torrey ex Rydberg) Kearney & Peebles
Nom français : Chimaphile maculée
Noms anglais : Spotted Wintergreen, Mottled Pipsissewa,
Striped Wintergreen, Striped Prince's Pine
Grand groupe végétal : Eudicotylédones
Famille : Éricacées
La chimaphile maculée, Chimaphila maculata, est l’une des cinq espèces du genre Chimaphila, dont trois sont présentes au Canada. L’aire de répartition de la chimaphile à ombelles, Chimaphila umbellata, chevauche celle de la chimaphile maculée, mais l’espèce est bien distincte et aucun hybride n’a été signalé.
La chimaphile maculée est une petite vivace basse à feuilles persistantes qui est ligneuse à la base et se propage à l’aide de rhizomes (figure 1). Les plantes atteignent rarement une hauteur de 50 cm (Freeman, 2009), mais la taille de celles de l’Ontario est généralement inférieure à 20 cm de hauteur. Chaque tige porte plusieurs verticilles de feuilles vert-bleu lisses, lancéolées ou ovées-lancéolées, bordées de dents pointues. Les feuilles mesurent de 2,5 à 7 cm de longueur et présentent une nervation blanche bien marquée comprenant une bande centrale blanche. Les tiges individuelles portent une inflorescence terminale formée d’une à cinq fleurs blanches ou rosâtres à port retombant dont le diamètre peut atteindre 2 cm (Kirk, 1987; Standley et al., 1988). Le fruit est une capsule arrondie mesurant jusqu’à 1 cm de diamètre (Freeman, 2009). Les graines sont petites (0,4 à 0,6 mm de longueur et 0,1 à 0,2 mm de largeur) et non ailées (Kirk, 1987). On croit que les graines de la chimaphile maculée sont dispersées par le vent et possiblement par l’eau (Amador et al., 2013).
Comme les individus génétiquement distincts (genets) peuvent se propager à l’aide de rhizomes, un regroupement de tiges peut être composé d’un ou de plusieurs individus génétiquement distincts. Standley et al. (1988) ont présumé que les touffes de tiges représentaient des clones distincts et ont établi qu’une touffe moyenne comportait 16 tiges (intervalle : 1 à 90 tiges) dans deux populations du sud du Massachusetts.
La chimaphile maculée est semblable à la chimaphile à ombelles; les deux espèces semblent avoir des exigences similaires pour ce qui est de l’habitat et coexistent souvent là où leur aire de répartition se chevauche. Ces deux espèces se distinguent par le fait que la chimaphile à ombelles possède des feuilles oblancéolées entièrement vertes et très lustrées, qui ne présentent pas la bande médiane blanche et la nervation blanche caractéristiques de la face supérieure des feuilles de la chimaphile maculée. Des techniques de codage à barres de l’ADN permettent de distinguer efficacement les cinq espèces de Chimaphila existantes dans le monde (Liu et al., 2013).

Description longue de la figure 1
Photo de chimaphiles maculées qui montre les tiges portant plusieurs verticilles de feuilles vert bleu, lisses, lancéolées ou ovées-lancéolées, bordées de dents pointues. Les feuilles présentent une nervation blanche bien marquée comprenant une bande centrale blanche. Une des tiges porte à son extrémité deux capsules (fruits) arrondies.
Toutes les sous-populations existantes se rencontrent dans le sud-ouest de l’Ontario, et la plupart des individus se trouvent dans le comté de Norfolk. Deux sous-populations récemment découvertes dans la région de Niagara et dans la ville de Windsor sont séparées des autres sites existants du comté de Norfolk par 75 km et 200 km, respectivement. Aucune étude génétique n’a encore été réalisée, mais on peut émettre l’hypothèse que la fragmentation de l’habitat peut contribuer à restreindre le flux génétique et la diversité génétique. Cependant, les données sur la biologie de la population de l’espèce sont insuffisantes pour que soient déterminés la taille minimale de la parcelle d’habitat ou le nombre d’individus nécessaires à la viabilité à long terme de la population, et on ignore si la population canadienne est gravement fragmentée.
Une seule unité désignable est reconnue au Canada. La population canadienne se limite à l’aire écologique nationale des Plaines des Grands Lacs (COSEWIC, 2014). Rien n’indique qu’il existe des différences génétiques ou morphologiques chez cette espèce, et aucune différence de cet ordre n’est reconnue. La chimaphile maculée présente des variations morphologiques considérables dans l’ensemble de son aire de répartition de l’Amérique du Nord, mais ces variations ne semblent pas être corrélées avec son emplacement (Freeman, 2009).
Des études ethnobotaniques ont fait état d’un certain nombre d’usages alimentaires et médicinaux du genre Chimaphila chez de nombreux peuples autochtones de l’Amérique du Nord ainsi que chez les premiers colons européens (Moerman, 1998; Pengelly et Bennett, 2011).
La chimaphile maculée est l’une des cinq espèces du genre Chimaphila dans le monde. Les espèces de Chimaphila sont des mycohétérotrophes partiels, ce qui signifie que leurs graines ont besoin d’un champignon hôte pour germer et se développer, et que les plantes matures font de la photosynthèse, mais peuvent aussi recevoir un apport nutritionnel supplémentaire provenant des champignons mycorhiziens (Massicotte et al., 2008; Hynson et al., 2009; Johannson et Eriksson, 2013).
La chimaphile maculée est une espèce indigène de l’est de l’Amérique du Nord, du Mexique et de l’Amérique centrale. Son aire de répartition dans l’est de l’Amérique du Nord s’étend depuis le centre du Michigan et le sud de l’Ontario jusqu’au sud du New Hampshire et du Maine, vers l’est, et jusqu’au Mississippi et au nord de la Floride, vers le sud. L’ouest du Kentucky et du Tennessee et l’est de l’Illinois semblent constituer les limites ouest de l’aire de répartition. L’aire de répartition de la chimaphile maculée comprend aussi l’Amérique centrale, le Mexique et le sud de l’Arizona (figure 2).
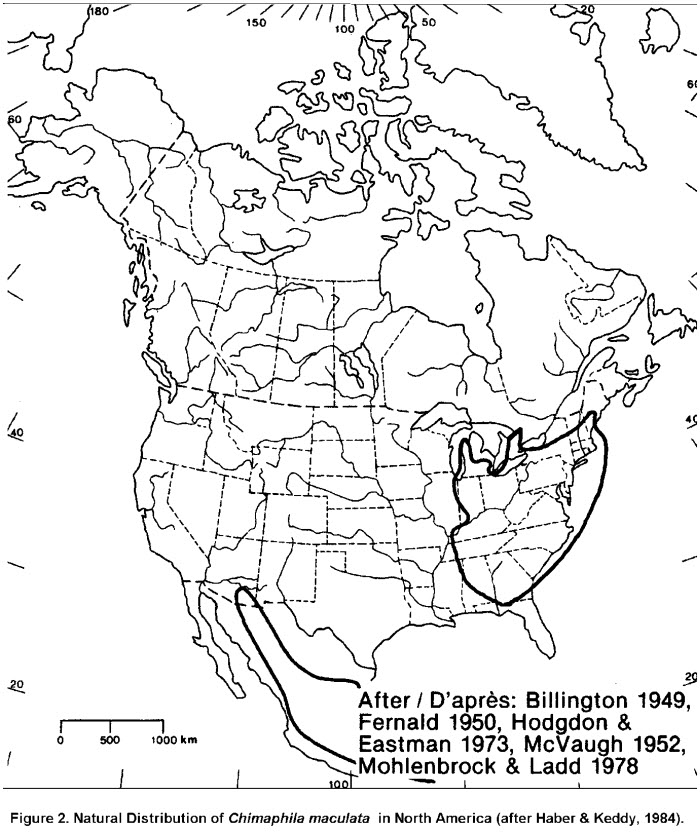
Description longue de la figure 2
Carte montrant l’aire de répartition mondiale de la chimaphile maculée. Dans l’est de l’Amérique du Nord, l’aire de répartition s’étend depuis le centre du Michigan et le sud de l’Ontario jusqu’au sud du New Hampshire et du Maine, vers l’est, et jusqu’au Mississippi et au nord de la Floride, vers le sud. L’ouest du Kentucky et du Tennessee et l’est de l’Illinois semblent constituer les limites ouest de l’aire de répartition. La chimaphile maculée est également présente en Amérique centrale, au Mexique et dans le sud de l’Arizona.
Les sous-populations Note1 canadiennes se situent dans le sud de l’Ontario, à la limite septentrionale de l’aire de répartition de la chimaphile maculée. L’aire de répartition totale au Canada représente probablement moins de 1 % de l’aire de répartition mondiale de l’espèce. Une seule sous-population isolée a été découverte près de Montréal, au Québec, et on estime qu’elle a probablement été introduite. Toutes les cinq sous-populations existantes se trouvent en Ontario, et le comté de Norfolk renferme presque toute la population canadienne (figure 3).
Dans le passé, la chimaphile maculéeétait probablement plus largement distribuée dans le sud-ouest et dans le centre-sud de l’Ontario. On la considère comme disparue de cinq sites dans les régions de Niagara et de Muskoka (NHIC, 2015; voir le tableau 1). On en sait peu sur ces sous-populations, qui ne sont connues que d’après de vieux spécimens dont l’emplacement est vague.
La sous-population maintenant disparue du Québec est considérée comme étant probablement introduite. On a relevé la présence de deux tiges à Deux-Montagnes, dans le sud-ouest du Québec, en 1992; comme aucune plante n’a été repérée depuis 2000, on juge que l’espèce a disparu (Jacobs, 2001). Cette sous-population a probablement été introduite, car le site était autrefois utilisé par les Mohawks, et la chimaphile maculée est considérée comme une plante médicinale importante par de nombreux peuples autochtones (Labrecque, comm. pers., 2015; Sabourin, comm. pers., 2015). Cette sous-population est aussi séparée par plusieurs centaines de kilomètres des autres sous-populations indigènes.
| Type de population | Nom du site | Propriété | Mentions antérieures (pour la plupart) | Année de la plus récente observation | Abondance en 2011-2014 (nbre de tiges) | Commentaires |
|---|---|---|---|---|---|---|
| Sous-populations existantes | FORÊT ST. WILLIAMS (OE 5501) | cellule vide | cellule vide | cellule vide | 2 065 tiges | cellule vide |
| Sous-populations existantes | Parcelle Manester A | Terres de la Couronne provinciale | 1986 – 14 plantes (D. Sutherland) 2007 – 25 tiges (R. Gould) 2009 – 25 tiges (R. Gould) 2012 – non observé (M. Thompson) |
2009 | 25 tiges | Compris dans le total, car la population persiste probablement (Gould, comm. pers., 2015). |
| Sous-populations existantes | Parcelle Manester B | Terres de la Couronne provinciale | 1988 – 2-3 plantes (P. Carson) 2001 – 23 plantes (D. Jacobs, M. Thompson) 2002 – 5 tiges (R. Gould) 2005 – 36 tiges (R. Gould) 2007 – 5 tiges (R. Gould) 2009 – 36 tiges (R. Gould) 2012 – 23 tiges (M. Thompson) |
2012 | 23 tiges | cellule vide |
| Sous-populations existantes | Parcelle Manester C | Terres de la Couronne provinciale | 1994 – 3 plantes (M. Gartshore) 1997 – 3 plantes (M. Gartshore) 2000 – 9 plantes (1 florifère, M. Thompson, D. Jacobs). 2001 – 8 tiges (M. Thompson, D. Jacobs) 2004 – 12 tiges (R. Gould) 2007 – 25 tiges (R. Gould) 2009 – 25 tiges (R. Gould) 2012 – 1 tige (M. Thompson) |
2012 | 1 tige | En 2012, impossible de relever d’autres plantes dans le voisinage. Possible qu’on ait manqué une grande colonie, et que celle-ci représente une tige solitaire d’une nouvelle sous-population. |
| Sous-populations existantes | Parcelle de la pépinière | Terres de la Couronne provinciale | 1985 – < 20 plantes (M. Gartshore). 1985 – 41 plantes (12 florifères, D. Kirk). 1989 – 36 plantes (M. Oldham). 1997 – 100 plantes (est.) (M. Gartshore) 1997 – 87 plantes (15 florifères, D. White) 2000 – 406 plantes (~203 florifères, M. Thompson et al.) 2001 – ~500 plantes (D. Jacobs, M. Thompson). 2003 – 948 tiges (R. Gould) 2005 – 1 893 tiges (R. Gould) 2012 – ~2 000 tiges (M. Thompson) |
2012 | ~2 000 tiges | cellule vide |
| Sous-populations existantes | Forêt St. Williams (nouveau site) | Terres de la Couronne provinciale | 2014 – 16 tiges (J. McCune) | 2014 | 16 | cellule vide |
| Sous-populations existantes | SECTEUR DE TURKEY POINT (OE 5502) | cellule vide | cellule vide | cellule vide | 928 tiges | cellule vide |
| Sous-populations existantes | Parcelle Turkey Point A | Terres de la Couronne provinciale | 2009 – 7 tiges (R. Gould) 2012 – 9 tiges (M. Thompson) |
2012 | 9 tiges | cellule vide |
| Sous-populations existantes | Parcelle Turkey Point B | Terres de la Couronne provinciale | 2004 – 7 tiges (R. Gould) 2007 – 8 tiges (R. Gould, A. Woodliffe) 2012 – 7 tiges (M. Thompson) |
2012 | 7 tiges | cellule vide |
| Sous-populations existantes | Parcelle Turkey Point C | Terres de la Couronne provinciale | 2004 – 3 tiges (R. Gould) 2007 – 13 tiges (R. Gould, A. Woodliffe) 2012 – 4 tiges (M. Thompson) 2014 – 42 tiges (M. Gartshore, J. Chambers) |
2012 | 4 tiges | cellule vide |
| Sous-populations existantes | Parcelle Turkey Point D | Terres de la Couronne provinciale | 2007 – 2 tiges (R. Gould) 2010 – 13 tiges (R. Gould) 2010 – 22 tiges (D. White) |
2010 | - | Non retrouvée en 2012, signes de circulation en VTT. Possiblement disparue. |
| Sous-populations existantes | Parcelle Turkey Point E | Terres de la Couronne provinciale | 2010 – 500 tiges (D. White) 2012 – espèce non observée (M. Thompson) 2014 – au moins 500 tiges (M. Gartshore) |
2014 | 500 tiges | Espèce non retrouvée en 2012, mais en 2014 Mary Gartshore a réalisé un dénombrement partiel de 256 tiges de cette « très grande » population. D’après une conversation avec Audrey Heagy, elle est présumée être stable (possiblement en hausse); le dénombrement antérieur est indiqué. |
| Sous-populations existantes | Parcelle Turkey Point F | Terres de la Couronne provinciale | 2012 – 34 tiges (R. Gould et al.) | 2012 | 34 tiges | cellule vide |
| Sous-populations existantes | Parc provincial Turkey Point A | Parc provincial | 2011 – 1 tige (S. Brinker et M. Oldham) | 2011 | 1 tige | cellule vide |
| Sous-populations existantes | Parc provincial Turkey Point B | Parc provincial | 2012 – 200 tiges (R. Gould) | 2012 | 200 tiges | cellule vide |
| Sous-populations existantes | Parc provincial Turkey Point C | Parc provincial | 2012 – 6 tiges (R. Gould) | 2012 | 6 tiges | cellule vide |
| Sous-populations existantes | Normandale | Terres privées (camp religieux) | 1996 – 10-15 tiges (M. Gartshore) 2000 – 80 plantes (D. Jacobs et al.) 2001 – 130 plantes (M.Thompson et al.) 2005 – 165 tiges (R. Gould) 2012 – 163 tiges (M. Thompson) |
2012 | 163 tiges | cellule vide |
| Sous-populations existantes | Normandale – nouveau site | Terres privées (Camp religieux) | 2014 – 4 plantes (2 florifères, J. McCune) | 2014 | 4 tiges | cellule vide |
| Sous-populations existantes | SECTEUR DE FISHERS GLEN (OE 5503) | cellule vide | cellule vide | cellule vide | 579 tiges | cellule vide |
| Sous-populations existantes | Aire de conservation de Fishers Glen | Office de protection de la nature de la région de Long Point | 1921 (T. Ivey) 2000 – 23 plantes (D. Leadbeater, K. Ursic) 2001 – 12 plantes (M. Thompson) 2002 – 14 tiges (inconnu) 2003 – 20 tiges (inconnu) 2005 – 16 tiges (inconnu) 2006 – 7 tiges (R. Gould) 2007 – 51 tiges (R. Gould) 2012 – 166 tiges (M. Thompson) 2013 – « au moins » 529 tiges (B. Draper, R. Gould; comptes combinés) |
2013 | 529 tiges | cellule vide |
| Sous-populations existantes | ZINS de Spooky Hollow | Hamilton Naturalists' Club | 1968 (F.H. Montgomery) 1984 – espèce non observée (D. Kirk) 2011 – environ 50 tiges (M. Thompson) |
2013 | 50 tiges | Observateurs inconnus |
| Sous-populations existantes | BOISÉ DU CHEMIN PERRY (WAINFLEET) (OE 92678) | cellule vide | cellule vide | cellule vide | 5 tiges | cellule vide |
| Sous-populations existantes | Boisé du chemin Perry, secteur de Wainfleet, Région de Niagara | Terres privées | 2007 – 7 tiges (T. Staton, S. Brinker, M. Oldham) 2012 – 5 tiges (M. Thompson) |
2012 | 5 tiges | Sur l’emprise municipale, propriété incertaine. |
| Sous-populations existantes | PARC OJIBWAY (OE 115386) | cellule vide | cellule vide | cellule vide | 10 tiges | cellule vide |
| Sous-populations existantes | Parc Ojibway | Ville de Windsor | 2014 – 10 tiges (M. Oldham) | 2014 | 10 tiges (M. Oldham) | cellule vide |
| Populations historiques | Ruisseau Trout (OE 13044) | Inconnue | 1991 – 3 tiges (D. Sutherland) 1997 – espèce non observée (D. White) |
1991 | - | L’espèce a peut-être échappé à l’attention de l’observateur en 1997 (COSEWIC, 2000). |
| Populations historiques | Parc provincial Wasaga Beach (OE 5506) | Parc provincial | 1975 – 6 plantes (Van Stam et T. Reznicek) 1989 – espèce non observée (D. Brunton) 1991 – espèce non observée (B. Bowles et al.) 1992 – espèce non observée (B. Bowles et al.) 1995 – espèce observée (base de données du CIPN) 1995 – espèce non observée (M. Oldham et al.) 2000 – espèce non observée (B. Bowles et al.) 2001 – espèce non observée (B. Bowles et al.) |
1995 | - | Les avis divergent quant à la probabilité de retrouver l’espèce dans ce site. |
| Sous-populations disparues | Regroupement des parcs du Niagara (OE 92208) | Inconnue | Aucune | 1895 | - | Observation; emplacement exact inconnu. |
| Sous-populations disparues | Simcoe (OE 5504) | Inconnue | Aucune | 1949 | cellule vide | Collecte; emplacement exact inconnu. |
| Sous-populations disparues | Fort Erie (OE 5505) | Inconnue | Aucune | 1863 | cellule vide | Collecte; emplacement exact inconnu. |
| Sous-populations disparues | Hamilton (OE 5507) | Inconnue | Aucune | 1886 | cellule vide | Collecte; emplacement exact inconnu. |
| Sous-populations disparues | Baysville, District de Muskoka (ZO 5511) | Inconnue | Aucune | 1904 | - | Collecte; emplacement exact inconnu. |
| Sous-populations disparues | Parc national d'Oka, Québec (OE 5702) | Parc provincial | 1992 – 2 tiges (Sabourin et al.) 2000 – 1 tige 2002 – espèce non observée 2006 – espèce non observée |
2000 | - | Considérée comme probablement introduite. Considérée comme disparue en raison de son absence en dépit de recherches. L’habitat est présent et les raisons de la disparition sont inconnues. |
a Le terme « sous-population » utilisé dans le présent rapport, conformément à la terminologie du COSEPAC, est équivalent à « population » dans le programme de rétablissement fédéral de 2015.
L’indice de zone d’occupation (IZO) et la zone d’occurrence n’ont pas été calculés dans le précédent rapport de situation (COSEWIC, 2000). Par conséquent, le secrétariat du COSEPAC a procédé au calcul des valeurs antérieures et actuelles dans le présent rapport en se fondant sur les meilleures données existantes fournies par les centres de données sur la conservation provinciaux. L’IZO a été mesuré à l’aide d’une grille à carrés de 2 km de côté.
Pour calculer l’IZO et la zone d’occurrence actuels, on n’a tenu compte que des sous-populations existantes (2012-2014) (voir le tableau 1).
Dans le cas de l’IZO et de la zone d’occurrence de 2000, les deux sous-populations maintenant historiques (plage Wasaga et ruisseau Trout) ont été prises en compte, car elles étaient considérées comme existantes en 2000, selon les normes de NatureServe. La sous-population du Québec n’a pas été incluse, puisqu’on a présumé qu’elle était introduite. Enfin, toutes les sous-populations répertoriées et les observations réalisées depuis 2000 (p. ex. parc Ojibway, Wainfleet) ont aussi été incluses dans les calculs de 2000, même si elles n’avaient pas été répertoriées à l’époque. On émet ainsi l’hypothèse qu’elles étaient existantes en 2000, mais non encore découvertes. Il est impossible de savoir si cela est vrai, mais il s’agit là d’une approche prudente.
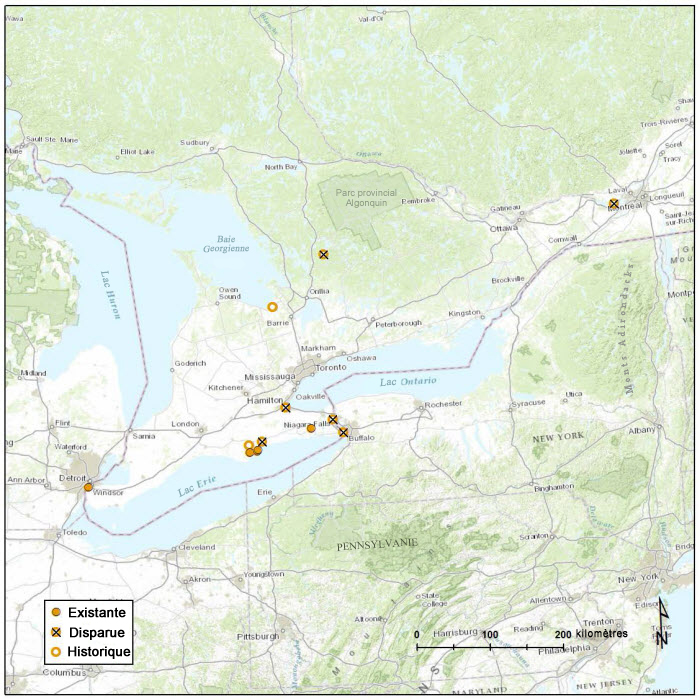
Description longue de la figure 3
Carte montrant la répartition des sous populations de chimaphiles maculées au Canada, où l’espèce est présente dans le sud de l’Ontario. Presque toute la population de l’espèce au Canada se trouve dans le comté de Norfolk. Des symboles distinguent les sous populations existantes, disparues et historiques.
Selon ces hypothèses, l’IZO actuel (2012-2014) de la chimaphile maculée au Canada est de 28 km2. L’IZO de la chimaphile maculée de 2000 est de 36 km2. Ces valeurs indiquent un déclin de 22 %.
La zone d’occurrence actuelle (2012-2014) est de 1 952 km2. La zone d’occurrence de la chimaphile maculée de 2000 est de 29 340 km2. On a donc assisté à un déclin de la superficie de 93 %. Ce déclin considérable de la zone d’occurrence correspond à la perte (ou à la perte probable) de la sous-population isolée de la plage Wasaga (voir la figure 3, cercle avec un x à l’est de la baie Georgienne).
En préparation du présent rapport de situation, Melinda Thompson a visité 12 sites de quatre des sous-populations connues (tableau 1) entre août et octobre 2012. Chaque site a été l’objet de recherches durant au moins une heure, parfois avec l’aide de plusieurs observateurs. Ron Gould a effectué un relevé dans trois autres sites des sous-populations de Turkey Point et de Fishers Glen en 2012. Les données sur la population d’un site de Turkey Point (relevé de 2011) ont été fournies par Sam Brinker et Mike Oldham. Les données de relevé de la zone d’intérêt naturel et scientifique (ZINS) de Spooky Hollow (2011, 2013) proviennent du Hamilton Naturalists’ Club. On estime que les activités de recherche de 2011-2013 liées à cette espèce représentent au moins 25 heures-personnes. La sous-population de Windsor a été découverte par Paul Pratt en juin 2014.
Le présent rapport de situation fait état de plusieurs nouveaux sites, en particulier à l’intérieur du secteur de Turkey Point, dont la découverte découle de l’intensification des activités de recherche menées au cours de la dernière décennie. Depuis le dernier rapport de situation, l’habitat de la chimaphile maculée dans les secteurs de Turkey Point et de St. Williams a fait l’objet de relevés dans le cadre d’initiatives de conservation locales (p. ex. White, 2012). Il est impossible de quantifier cette activité de recherche, qui ne portait pas uniquement sur la chimaphile maculée.
Au cours du dernier siècle, la flore de beaucoup des zones naturelles résiduelles du sud-ouest de l’Ontario, dont le secteur du parc Ojibway, a été l’objet de relevés rigoureux. La découverte récente de deux sous-populations à des sites où on n’avait jamais observé la chimaphile maculée est quelque peu inattendue.
En vue de la rédaction du présent rapport de situation, les sites historiques (plage Wasaga et ruisseau Trout) n’ont pas fait l’objet d’un relevé, en raison de contraintes de temps et du fait que ces sites avaient précédemment été explorés par d’autres, en vain. Dan Brunton en 1988 (Brunton, 1989) ainsi que Bob Bowles et d’autres en 1991, en 1992, en 2000 et en 2001 (Bowles, 2001) ont cherché la chimaphile maculée dans le secteur de la plage Wasaga. Heather Stewart a fait une observation en 1995 dans le parc Wasaga Beach, mais les individus n’ont pas été retrouvés par Mike Oldham, Wasyl Bakowsky et Don Sutherland. Au cours de la saison de 2001, Bowles (2001) et plusieurs autres botanistes ont recherché l’espèce de façon exhaustive dans trois sites du secteur de la plage Wasaga et ont conclu à son absence. Depuis 2001, des employés de Parcs Ontario ont à l’occasion fouillé le secteur, mais n’ont pas localisé l’espèce (Chambers, comm. pers., 2015). Néanmoins, de l’habitat existe probablement dans les deux sites historiques, et la présence d’individus de l’espèce est possible à ces endroits (Oldham, comm. pers., 2015). Comme la sous-population du ruisseau Trout n’a pas été observée depuis 1997, on ne sait rien de son statut. Compte tenu de la période de temps écoulée, cette sous-population est considérée comme « disparue » par le Centre d’information sur le patrimoine naturel (CIPN) et dans le programme de rétablissement du gouvernement fédéral sur l’espèce (Environment Canada, 2015). C’est peut-être le cas. Dans le présent rapport, on la considère toutefois comme étant « historique », car l’habitat n’a pas été récemment exploré.
Compte tenu de la large répartition de toutes les mentions répertoriées entre Windsor et Muskoka et possiblement dans l’ouest du Québec, il se peut que d’autres habitats convenables, mais non explorés, existent, surtout dans le centre-sud de l’Ontario.
Dans l’ensemble de son aire de répartition, la chimaphile maculée est généralement présente dans des habitats de boisés et de forêts mixtes de pins ou de chênes et de pins (NatureServe, 2015). Au Canada, des observations sur le terrain réalisées récemment ont permis de confirmer que la chimaphile maculée est une espèce du sous-étage typiquement associée aux forêts et aux boisés mixtes de chênes ou de chênes et de pins, sur sol sec à frais (Ursic et al., 2010). Dans ces communautés, les conditions typiques sont un couvert forestier semi-fermé, caractérisé par un étage supérieur constitué de pin blanc (Pinus strobus), de chêne rouge (Quercus rubra), de chêne des teinturiers (Quercus velutina) et de hêtre à grandes feuilles (Fagus grandifolia) et d’un tapis végétal composé de la chimaphile à ombelles, du pain-de-perdrix (Mitchella repens), du maïanthème du Canada (Maianthemum canadense), de la fougère-aigle (Pteridium aquilinum) et de l’aralie à tige nue (Aralia nudicaulis). Plusieurs colonies se trouvent à l’intérieur ou en bordure de plantations abandonnées de pin rouge (Pinus resinosa) ou de pin blanc, en particulier dans la réserve de conservation St. Williams (Thompson, obs. pers., 2012; Heagy, comm. pers., 2015).
Les sous-populations de chimaphile maculée semblent être présentes dans des sites ayant un pH dont l’intervalle est relativement étroit (et acide), mais on ne dispose pas de données sur le pH de chacun des sites. L’espèce préfère un sol ayant un pH moyen inférieur à 6 (Eastman, 1976; Kirk, 1987).
Selon les données existantes (Ursic et al., 2010), les principales caractéristiques de l’habitat de la chimaphile maculéesont les suivantes :
- Association avec des forêts ou des boisés naturels ou artificiels (c.-à.d., des plantations) dominés par des chênes ou par des chênes et des pins, sur sol sec à frais
- Présence limitée d’autres espèces du tapis végétal
- Conditions partiellement ombragées
- Conditions acides à la surface du sol (pH du sol = 4,2 à 6,0)
- Sols et sites bien drainés
- Sols pauvres en nutriments
La chimaphile maculée semble préférer les conditions partiellement ombragées. En Caroline du Nord, Fraver (1994) a établi que le pourcentage de couverture de C. maculata augmentait en lisière de parcelles de 10 m sur 10 m, en suivant un gradient allant de la lisière vers l’intérieur, dans les forêts de feuillus. L’espèce apparentée qu’est la chimaphile à ombelles persisterait dans un environnement très ombragé, mais avec une floraison et une production de fruits réduites et une propagation clonale accrue (Lundell et al., 2015). Contrairement aux plantes situées en milieu très ombragé, celles qui sont en conditions partiellement ombragées semblent porter un plus grand nombre de fleurs (Heagy, comm. pers., 2015). Selon certaines hypothèses, la fermeture du couvert forestier pourrait avoir contribué au déclin de l’un des sites de la sous-population de la forêt St. Williams, bien que le seuil auquel le déclin peut se produire soit inconnu. Une étude plus approfondie de la tolérance à la lumière sera menée dans la réserve de conservation St. Williams en 2016 (Heagy, comm. pers., 2015).
Il est probable que la chimaphile maculée ne tolère pas bien les incendies, bien qu’elle puisse bénéficier de leurs effets. Dans une étude menée au Tennessee, Zimmerman (2006) a montré que le C. maculata ne persistait pas à la suite de brûlages dirigés dans les six sites de l’étude. Deux espèces de pyroloïdes apparentées (Chimaphila menziesii, Pyrola picta) auraient disparu des parcelles après des brûlages dirigés dans une forêt mixte de conifères en Californie (Rocca, 2009). Des études réalisées aux États-Unis indiquent que le C. menziesii etle C. umbellata sont associés à une probabilité modérée ou élevée de mortalité après un incendie (Matthews, 1994a, b). Jusqu’à maintenant, la chimaphile maculée a été protégée avec succès des brûlages dirigés ayant eu lieu à Turkey Point et à la réserve de conservation St. Williams. Dans les zones faisant l’objet d’une remise en état dans le comté de Norfolk (p. ex. parc provincial Turkey Point et St. Williams), la méthode de gestion adoptée consiste à protéger la chimaphile maculée des brûlages dirigés (Gould, comm. pers., 2015).
La chimaphile maculée est un mycohétérotrophe partiel, ce qui signifie qu’elle dépend de la présence des champignons mycorhiziens du sol pour germer, se développer et possiblement persister dans les conditions ombragées (voir la section Physiologie et adaptabilité, plus loin).
Les sous-populations canadiennes de la chimaphile maculée sont situées dans des zones où il y a suffisamment d’habitat pour permettre une expansion naturelle dans l’environnement adjacent. Les forêts et les boisés mixtes de chênes ou de chênes et de pins sur sol sec à frais ne sont pas inhabituels dans l’aire de répartition de l’espèce en Ontario, mais plusieurs secteurs ayant un substrat sableux convenable ont été transformés en terres agricoles ou en plantations. Une sous-population (parc Ojibway) est entourée de zones urbaines, et son expansion est donc limitée.
Plusieurs aspects de la biologie de la chimaphile maculée demeurent obscurs, notamment la contribution relative de la propagation par voie clonale et du recrutement à partir de graines. L’association avec les champignons mycorhiziens semble aussi être importante pour cette espèce, comme c’est le cas d’un grand nombre de membres de la famille des Éricacées (Massicotte et al., 2008; Johansson et Eriksson, 2013).
Dans le Sud de l’Ontario, la chimaphile maculée fleurit de la mi-juillet durant environ 17 jours. La fructification a généralement lieu en août, après quoi la capsule s’ouvre et libère ses nombreuses graines, dont beaucoup demeurent dans la capsule jusqu’au prochain printemps (Kirk, 1987; Ursic et al., 2010).
Comme c’est le cas pour de nombreuses espèces clonales du sous-étage forestier, il n’existe aucune information sur la durée d’une génération pour la chimaphile maculée ou pour des taxons apparentés. Au minimum, les individus florifères ont probablement au moins 2 à 3 ans. Cependant, chez les plantes clonales, les genets produisent continuellement de nouveaux ramets à partir de rhizomes souterrains, et les vieux ramets meurent. À l’aide de méthodes de biologie moléculaire récentes, on a établi que la longévité des genets de nombreuses espèces d’arbres ou d’arbustes était considérablement plus longue qu’on le croyait. Chez certains arbustes clonaux, l’âge des genets peut varier de quelques décennies à des milliers d’années (de Witte et Stöcklin, 2010). La durée moyenne d’une génération, ou l’âge moyen d’un individu mature capable de se reproduire, peut être calculée pour un taxon clonal compte tenu à la fois des individus de la population qui se reproduisent par voie asexuée et de ceux qui se reproduisent par voie sexuée (IUCN, 2010). On estime de manière prudente que la durée d’une génération de la chimaphile maculée est d’une décennie, mais elle pourrait être considérablement plus longue.
La biologie de la pollinisation de la chimaphile maculée a été examinée par Standley et al. (1988), qui ont étudié des populations sympatriques de chimaphile maculée et de chimaphile à ombelles dans une forêt de feuillus du Massachusetts. D’après cette étude, la période de floraison de ces espèces se chevauche partiellement (mais le maximum de la floraison est distinct et survient entre le début et la mi-juillet), et elles reçoivent toutes deux en majorité la visite de bourdons (espèces de Bombus). Dans cette étude, la chimaphile maculée était surtout visitée par le bourdon trompeur (Bombus perplexus), tandis que la chimaphile à ombelles a été visitée par le bourdon à deux taches (B. bimaculatus), le bourdon mi-noir (B. vagans) et le bourdon trompeur. Bon nombre des Pyrolacées du l’Europe du Nord sont surtout pollinisées par vibration par des espèces de Bombus, mais les données sont contradictoires à savoir si les plantes du genre Chimaphila figurent parmi celles-ci (Knudsen et Oleson, 1993). On n’a relevé aucune étude qui portait sur cette question.
Selon Standley et al. (1988), la chimaphile maculée est autocompatible, mais des études avec exclos de pollinisateurs ont révélé qu’elle nécessite des pollinisateurs pour produire des graines (c.-à-d. qu’elle ne s’autoféconde pas régulièrement).
Les graines des espèces faisant partie de la tribu des Pyrolées (famille des Éricacées) sont semblables à des grains de poussière et contiennent des réserves minimales d’éléments nutritifs. Comme dans le cas des orchidées, ces graines dépendent de symbiontes fongiques pour la germination et le développement (Johansson et Eriksson, 2013). Des signes de colonisation des racines par des champignons mycorhiziens ont été observés chez plusieurs autres membres de cette tribu, et on sait que des espèces de champignons ectomycorhiziens coloniseraient plusieurs pyroloïdes, dont la chimaphile à ombelles, qui appartient au même genre (Zimmer et al., 2007; Massicotte et al., 2008). On peut présumer que la chimaphile maculée est aussi l’hôte de champignons mycorhiziens, mais l’identité des espèces en cause demeure inconnue.
Les symbiontes fongiques contribuent probablement à assurer un apport d’éléments nutritifs à l’embryon en développement et fournissent aussi une source supplémentaire d’éléments nutritifs aux plantes vertes matures faisant de la photosynthèse. Il a été montré que plusieurs espèces de pyroloïdes d’Amérique du Nord et d’Europe peuvent capter l’azote et, dans une moindre mesure, le carbone à l’aide de champignons mycorhiziens (Tedersoo et al., 2007; Zimmer et al., 2007). La capacité à obtenir de l’azote et du carbone d’origine organique à l’aide des symbiontes semble permettre à ces espèces d’obtenir une source d’énergie supplémentaire, autre que celle de la photosynthèse, et c’est pourquoi elles peuvent tolérer le faible éclairement du sous-étage forestier, qui est ombragé (Zimmer et al., 2007). Il a été proposé que les champignons colonisant les racines, en particulier les champignons ectomycorhiziens, pouvaient aussi relier ces espèces au flux de carbone provenant des arbres environnants (Tedersoo et al., 2007).
En dépit des avantages possibles conférés par cette stratégie de mycotrophie partielle, les pyroloïdes pourraient être vulnérables à des perturbations comme l’exploitation forestière, le dépôt d’azote anthropique ou l’envahissement par des vers de terre non indigènes, qui peuvent modifier la composition du sol en champignons mycorhiziens (Hale et al., 2006; Zimmer et al., 2007). Il a été établi que les organismes mycotrophes sont généralement sensibles aux perturbations, notamment parce qu’ils dépendent de caractéristiques précises du microhabitat, par exemple la présence de couches épaisses de litière et le taux d’humidité (Halpern et Spies, 1995; Lindh et Muir, 2004).
La chimaphile maculée et la chimaphile à ombelles, qui lui est apparentée, sont toutes deux connues pour être difficiles à multiplier à partir de graines (Cullina, 2000; Pengelly et Bennett, 2011), peut-être en raison de leur association avec des champignons mycorhiziens.
La chimaphile maculéeest capable de se reproduire par voie végétative ou à partir de graines (Standley et al., 1988). Pour déterminer le nombre précis de clones ou d’individus dans une sous-population, il faudrait creuser le sol ou procéder à une analyse génétique, ce qui n’a pas encore été fait pour cette espèce. Les touffes sont constituées de quelques tiges à plusieurs centaines de tiges, de sorte qu’une sous-population de plusieurs centaines de tiges se compose d’un nombre inconnu d’individus génétiques (Standley et al., 1988).
Les minuscules graines des pyroloïdes sont probablement dispersées par le vent et possiblement par la pluie, car la forme des capsules en déhiscence facilite la dispersion des graines grâce à la fragmentation des gouttes d’eau qui y tombent (Amador et al., 2013). Bien que la population canadienne fleurisse et produise des graines régulièrement, on a émis l’hypothèse que la faible viabilité et dispersion des graines étaient des facteurs intrinsèques limitant la croissance de la population, car la plupart des sites existants comportent de l’habitat inoccupé (Kirk, 1987). Il est aussi possible que d’autres facteurs mal connus (p. ex. la présence de champignons mycorhiziens) restreignent la germination et l’établissement.
Comme il a été décrit ci-dessus, la chimaphile maculée dépend probablement de champignons mycorhiziens, mais les espèces en jeu et la nature de cette association demeurent floues (Boullard et Ferchau, 1962; Largent et al., 1980; Massicotte et al., 2008).
La chimaphile maculée est vraisemblablement pollinisée en majorité par des bourdons (Standley et al., 1988). Récemment, on a observé un déclin généralisé de l’abondance d’espèces communes de bourdons partout en Amérique du Nord (Williams et al., 2014). Les effets possibles de ce déclin sur la pollinisation de la chimaphile maculée ne sont pas connus.
On sait que l’aire de répartition et l’habitat de la chimaphile à ombelles et de la chimaphile maculée se chevauchent, mais même à l’échelle du microhabitat, les deux espèces ne s’hybrident pas entre elles. Il est difficile de savoir si l’espèce la plus commune est capable d’exclure la chimaphile maculée par compétition (Standley et al., 1988). Il n’existe aucun prédateur herbivore ou prédateur de graines connu de la chimaphile maculée, mais on en a suggéré quelques-uns (Ursic et al., 2010).
Chaque sous-population a été l’objet d’une visite d’au moins une heure en vue de la préparation du présent rapport. Lorsqu’il était impossible de localiser des individus de l’espèce recensés antérieurement, on s’est appliqué à les rechercher une autre journée pendant une autre heure. On a compté les tiges de toutes les sous-populations. Aucune information n’a été recueillie sur le nombre ni la proportion de tiges florifères; beaucoup de sites ont été examinés en dehors de la période de floraison. À l’heure actuelle, on ne dispose d’aucune information permettant d’estimer le nombre d’individus matures.
On manquait auparavant de données de relevé fiables, précises, exhaustives et à jour sur les sous-populations de chimaphile maculée. Il était impossible de réaliser des analyses comparatives de tendances, car les méthodes de relevé ainsi que la désignation et le géoréférencement des sous-populations n’étaient pas uniformes. L’amélioration récente de la qualité et de la fréquence des recherches a permis d’accroître les connaissances sur l’espèce et de mieux cerner les tendances touchant la population de chaque localité existante.
L’aire de répartition actuelle connue de la chimaphile maculée au Canada comprend les cinq sous-populations existantes de l’Ontario (figure 3), qui représentent au moins 3 600 Note2 tiges (tableau 1). Le nombre total d’individus matures n’est pas connu, mais on estime qu’il est probablement inférieur à ce nombre d’un facteur que l’on ignore. Beaucoup de ces tiges (ramets), mais pas toutes, peuvent fleurir et devenir reproductives Note3, mais il se peut aussi qu’elles proviennent du même individu génétiquement distinct. Aucune donnée n’existe sur le pourcentage de tiges reproductives recensées au cours des relevés de 2012-2013. Le nombre moyen de tiges par individu génétiquement distinct n’a pas été estimé pour la chimaphile maculée.
Les individus de l’espèce récemment (2010-2016) découverts à la réserve de conservation St. Williams augmenteront vraisemblablement ce chiffre. En effet, plusieurs nouveaux sites ont été repérés à St. Williams durant des recherches sur le terrain menées en 2014 et en 2015 (Heagy, comm. pers., 2015, 2016). Ces sites sont considérés comme de nouveaux sites à l’intérieur des sous-populations existantes à St. Williams et à Turkey Point. En 2016, la plupart des colonies déjà connues ont été retrouvées, et de nouvelles colonies continuent d’être localisées (Heagy, comm. pers., 2016).
Sur les cinq sous-populations existantes (zones d’occurrence), les trois sous-populations trouvées dans le comté de Norfolk (forêt St. Williams, secteurs de Turkey Point et de Fishers Glen) constituent presque l’ensemble de la population canadienne. Seules 15 tiges ont été recensées parmi les deux autres sous-populations existantes (c.-à-d., boisé du chemin Perry, dans la région de Niagara, et le parc Ojibway, à Windsor).
Après avoir réalisé des travaux exhaustifs sur le terrain, Bowles (2001) a conclu que la sous-population de la plage Wasaga, dont un site bien documenté et deux mentions crédibles, a probablement disparu. Il suggère que cette disparition pourrait être attribuable à la succession végétale de l’habitat. Les avis sont partagés quant à la probabilité de redécouvrir la chimaphile maculée à la plage Wasaga. De l’habitat est présent aux emplacements des deux sous-populations historiques, mais des individus de l’espèce n’y ont été observés qu’en petit nombre (c-.à-d., moins de 10 plantes pour chacune); dans l’éventualité d’une redécouverte, l’abondance totale au Canada risque de ne pas être modifiée considérablement.
Il est difficile de quantifier avec certitude les tendances touchant l’abondance. La plupart des premiers dénombrements (avant 2000) concernaient des « plantes » plutôt que des « tiges », et il se peut qu’on ne puisse les comparer aux relevés ultérieurs. Les activités de recherche sont aussi plus nombreuses aujourd’hui, surtout dans le comté de Norfolk.
Le dénombrement total des sous-populations canadiennes n’a pas été rapporté dans les rapports de situation antérieurs (Kirk, 1987; COSEWIC, 2000) en raison des données de relevé limitées, mais les chiffres étaient certainement très inférieurs (c.-à-d., quelques centaines de « plantes »). Dans un programme de rétablissement plus récent de l’Ontario, Ursic et al. (2010) ont fait état d’environ 2 700 tiges, d’après des relevés de 2007 réalisés sur un nombre de sous-populations semblable (à l’exception de la sous-population du parc provincial Turkey Point et de celle de Windsor).
Un examen du compte de tiges de toutes les sous-populations (voir le tableau 1) laisse aussi penser que la population canadienne s’est accrue quelque peu depuis autour de l’an 2000, lorsque le dénombrement est devenu plus détaillé et plus normalisé. Bien que certains sites n’aient pas été retrouvés lors des relevés récents, l’abondance à d’autres sites, par exemple dans la parcelle de la pépinière de la forêt St. Williams, semble avoir considérablement augmenté depuis 2000. Les raisons qui expliquent cette hausse ne sont pas claires, mais pourraient être liées à une plus grande pénétration de la lumière dans certains sites. Cet apport supplémentaire de lumière pourrait être le résultat de plusieurs facteurs, dont l’éclaircissement du couvert forestier, les brûlages dirigés, une défoliation attribuable à la spongieuse européenne (Lymantria dispar dispar) et l’établissement de l’agrile du frêne (Agrilis planipennis) (Gould, comm. pers., 2015). Une hausse importante du nombre de tiges à un site (parcelle de la pépinière) a suivi la fermeture des sentiers de VTT et des pistes équestres de ce secteur.
Deux sous-populations et plusieurs nouveaux sites dans les trois autres sous-populations ont été découverts depuis le rapport de situation de 2000. Toutefois, il convient d’interpréter ces découvertes avec prudence. Il se peut que la chimaphile maculée se soit établie dans ces sites et que la population soit en hausse, mais la plupart des découvertes récentes résultent probablement d’activités accrues de recherche et de communication, surtout dans le comté de Norfolk. Certaines correspondent probablement à des mentions anciennes d’individus de l’espèce que l’on croyait disparus. La découverte récente de la sous-population du parc Ojibway à Windsor est une exception. La flore de cette zone naturelle bien connue est étudiée en détail depuis de nombreuses décennies, et la découverte, près d’un sentier, de la chimaphile maculée, une espèce plutôt visible, était inattendue. Il est possible que cette sous-population se soit récemment établie (Oldham, comm. pers., 2015).
Le parc national d’Oka au Québec est un nouvel ajout dans le présent rapport de situation. Cette sous-population comprenait une plante (deux tiges) lorsqu’elle a été découverte en 1992. À la suite de relevés infructueux menés en 2002 et en 2006, on suppose aujourd’hui qu’elle a disparu. La cause de la disparition est inconnue, car les zones d’habitat demeurent convenables, et les menaces sont considérées comme faibles (Centre de données sur le patrimoine naturel du Québec, 2015). Il s’agit probablement d’une introduction qui a échoué.
La population canadienne de chimaphile maculée ne subit pas de « fluctuations extrêmes » de son effectif.
Dans toute l’aire de répartition de l’espèce aux États-Unis, les populations semblent être relativement stables, et aucun déclin majeur n’a été signalé (NatureServe, 2015). Dans les États septentrionaux adjacents que sont le Maine et le Vermont, les populations semblent être en hausse selon les derniers rapports; cependant, la chimaphile maculée pourrait aussi ne pas avoir été signalée systématiquement dans le passé (Cameron, comm. pers., 2015; Popp, comm. pers., 2015).
La probabilité d’une colonisation naturelle de chimaphile maculée provenant des États-Unis est possible, surtout dans l’extrême sud-ouest de l’Ontario. L’espèce a été signalée dans trois comtés de l’État voisin qu’est le Michigan (Reznicek et al., 2011), peut-être à une distance de 50 à 100 km du site nouvellement découvert de Windsor. Bien que les graines semblables à des grains de poussière puissent demeurer en suspension dans l’air pendant de longues périodes et parcourir de grandes distances, la vaste majorité se déposent à quelques mètres de leur source (Arditti et Ghani, 2000; Johansson et al., 2014). Il est plausible que la sous-population de Windsor établie récemment soit issue des États-Unis.
Les autres populations des États-Unis sont plus éloignées vers le sud, au-delà des lacs Érié et Ontario. La chimaphile maculée a été signalée dans le nord de l’Ohio (SNR, non classée) et dans l’État de New York (S4, apparemment non en péril) (NatureServe, 2015). Les sites du Vermont et du Maine se limitent à la portion méridionale de ces États, et se situent à au moins 200 km du Québec (Kartesz 2015; Popp, comm. pers., 2015).
Le calculateur des menaces de l’UICN (Master et al., 2012) a servi à évaluer les menaces pesant sur la chimaphile maculée (annexe 1). La méthode du calculateur des menaces consiste à donner une valeur à la portée, à la gravité et à l’immédiateté des menaces pour chacune des catégories de menaces standards, l’impact global des menaces étant ensuite calculé à partir de ces valeurs.
L’impact global des menaces attribué à la chimaphile maculée est moyen à faible. La combinaison de deux menaces distinctes ayant un impact faible et de deux menaces ayant un impact moyen à faible a donné un impact global calculé élevé à moyen. Or, comme on a jugé que chaque impact correspondait au minimum de la plage de valeurs, l’impact calculé a été ajusté pour être moyen à faible (annexe 1).
Les rubriques qui suivent correspondent aux catégories et aux sous-catégories de menaces du calculateur des menaces, et sont présentées en ordre décroissant approximatif de leur importance perçue.
La perturbation découlant des activités récréatives constitue probablement la principale menace pesant sur la chimaphile maculée. Elle comprend les effets de la circulation des VTT et des vélos de montagne, de l’équitation et de la randonnée pédestre. La majorité des sites sont situés sur des terres publiques. Plusieurs de ces sites (p. ex. dans la réserve de conservation St. Williams et dans le parc provincial Turkey Point) sont accessibles aux VTT et/ou aux vélos de montagne, et plusieurs colonies se trouvent à proximité des pistes et des sentiers (Gould, comm. pers., 2015). Des rapports antérieurs ont fait état de menaces semblables attribuables à la circulation des VTT (Kirk, 1987; COSEWIC, 2000; White, 2010). Kirk (1987) a observé que la circulation en VTT pourrait avoir causé la disparition de la sous-population de Simcoe. L’un des sites de Turkey Point n’a pas été retrouvé en 2012 et pourrait avoir disparu à cause des VTT (Thompson, obs. pers., 2012).
Le risque couru par la chimaphile maculée et d’autres espèces en péril dans la réserve de conservation St. Williams et dans le parc provincial Turkey Point diminue, car les pistes et sentiers non autorisés sont fermés et sont remis en état, et le suivi est plus serré (Gould, comm. pers., 2015; Heagy, comm. pers., 2015). Cependant, il est difficile de surveiller et de faire appliquer la réglementation dans les pistes d’une si grande zone largement utilisée à des fins récréatives, et la fermeture des pistes s’est avérée difficile (Gould, comm. pers., 2015). De nombreux sites (p. ex. à St. Williams, à Turkey Point, dans le parc Ojibway) avoisinent des sentiers pédestres et pourraient subir un piétinement ou un compactage du sol.
Les espèces indigènes abondantes comme le cerf de Virginie (Odocoileus virginianus) et le Dindon sauvage (Meleagris gallopavo), qui a été réintroduit, peuvent brouter ou déterrer les populations de chimaphile maculée. Récemment, une colonie de chimaphile maculée a disparu en une nuit au site de Spooky Hollow et aurait été broutée par des cerfs de Virginie. Depuis, on a installé un exclos par-dessus la parcelle, lequel a efficacement protégé la petite population (Beck, comm. pers., 2016). Des Dindons sauvages à la recherche de nourriture ont perturbé le tapis forestier du site de St. Williams (Gould, 2001). Le grattage du sol et le déracinement occasionnés par les Dindons sauvages pourraient endommager les rhizomes de la chimaphile maculée (Gould, comm. pers., 2015), mais on n’a pas observé de preuves directes de cette perturbation.
La suppression des incendies et la succession naturelle résultante, qui donne lieu à des conditions ombragées, pourraient menacer la chimaphile maculée. Les sites plus ombragés semblent être corrélés à une diminution de la floraison de la chimaphile à ombelles, et la succession naturelle joue un rôle dans son déclin en Europe (Lundell et al., 2015). Dans certains sites ontariens se trouvant à un stade de succession plus tardif (p. ex. Fishers Glen), la chimaphile maculée pourrait ne pas prospérer; des observations réalisées sur 15 ans en Ontario semblent indiquer que les colonies de chimaphile maculée tirent souvent profit d’un meilleur éclairement, par exemple à la suite d’un chablis localisé ou d’une défoliation du couvert forestier (Gould, comm. pers., 2015). Cependant, des colonies de chimaphile maculée semblent persister pendant de longues périodes dans des sites plus ombragés et sont capables de se reproduire par voie végétative. Les effets de la quantité de lumière et/ou de la succession naturelle sur la chimaphile maculée n’ont pas été étudiés.
En raison de l’accumulation d’une épaisse couche de feuilles mortes, des feux de friches d’origine naturelle très intenses peuvent survenir dans les zones où des incendies ont été antérieurement supprimés. Ces feux très intenses pourraient aussi menacer cette espèce, car on la croit intolérante aux incendies (Zimmerman, 2006; Gould, comm. pers., 2015).
Bien qu’il y ait eu de grands défrichements dans l’aire de répartition de cette espèce dans le passé, la perte d’habitat causée par l’aménagement du territoire ou l’agriculture est probablement une menace mineure aujourd’hui. La plupart des sites existants se trouvent sur des terres de propriété publique ou appartenant à des organismes de conservation, et bénéficient de plans de gestion. Ces sites sont protégés à divers degrés du développement. Deux sites semblent être de propriété privée (tableau 1). Ces deux sites pourraient être détruits par accident, surtout si les propriétaires ne sont pas au courant de la présence de l’espèce sur leur propriété.
L’exploitation forestière était probablement une grande menace autrefois. En Nouvelle-Angleterre, Duguid et al. (2013) ont montré que l’abondance du C. maculata a décliné à la suite d’une récolte de bois d’œuvre et d’une scarification du sol dans les parcelles à l’étude. Il a été établi que la fréquence de la chimaphile à ombelles, une espèce apparentée, et de deux autres mycotrophes diminuait après un éclaircissement de la forêt (Davis et Puettman, 2015). L’un des deux sites privés a été l’objet d’une exploitation forestière il y a environ dix ans, et des employés du bureau de district du ministère des Richesses naturelles et des Forêts de l’Ontario ont été consultés pour assurer la protection de la population de chimaphile maculée (Gould, comm. pers., 2015). Aucun suivi officiel n’a eu lieu, mais le nombre de tiges observées à ce site semble être demeuré constant.
qOn a recensé peu d’espèces végétales envahissantes dans l’habitat de la chimaphile maculée (Thompson, obs. pers., 2012; Oldham, comm. pers., 2015). L’un des sites nouvellement découverts à la réserve de conservation St. Williams est situé sous un grand peuplement de tilleul à petites feuilles (Tilia cordata) en expansion. Parmi les autres espèces envahissantes avoisinant certains sites du comté de Norfolk, citons la centaurée maculée (Centaurea stoebe ssp. micranthos), le rosier multiflore (Rosa multiflora) et l’alliaire officinale (Alliaria petiolata), mais, jusqu’à maintenant, ces espèces n’ont pas envahi l’habitat occupé par la chimaphile maculée (Gould, comm. pers., 2015; Heagy, comm. pers., 2015).
Des insectes non indigènes envahissants pourraient avoir des conséquences sur la chimaphile maculée, bien qu’il ne soit pas clair s’ils constituent une menace. Les variations d’éclairement dans la forêt, causées par le dépérissement des frênes attaqués par l’agrile et la défoliation par la spongieuse européenne, pourraient être bénéfiques dans certains sites ombragés, mais être nuisibles dans d’autres sites (Gould, comm. pers., 2015). Le puceron lanigère de la pruche (Adelges tsugae) s’est aussi avéré préjudiciable à la chimaphile maculée en Caroline du Nord (Ford et al., 2012). Ce puceron n’est pas encore présent dans l’aire de répartition de la chimaphile maculée, mais il a été détecté dans le sud de l’Ontario et devrait se propager (Canadian Forest Service, 2013).
Un rejet de déchets a été observé au site de Wainfleet (Ursic et al., 2010), et a parfois lieu le long des sentiers et en bordure des routes de la réserve de conservation St. Williams (Heagy, comm. pers., 2016). Le rejet non autorisé de déchets peut survenir dans n’importe quel site, peu importe le propriétaire. Cette dégradation peut être localisée, mais comme plusieurs sous-populations n’occupent que quelques mètres carrés, l’élimination de l’ensemble d’une sous-population est possible.
Presque tous les sites de la chimaphile maculée se trouvent aujourd’hui sur des terres gérées à des fins de conservation. En particulier, l’ancienne pépinière provinciale de St. Williams, largement constituée d’une plantation de pins, est maintenant gérée comme une réserve de conservation, et est restaurée à l’état de savane à chênes et à pins au moyen d’un traitement d’éclaircissement de la plantation de pins. Les travaux de remise en état sont pilotés par des biologistes spécialisés en gestion de la végétation qui suivent un plan de gestion, et la préservation et/ou la remise en état de l’habitat des espèces en péril est la priorité absolue (White, 2010). Actuellement, l’éclaircissement n’a pas lieu dans un rayon de 30 m de l’habitat de la chimaphile maculée. En 2016, des relevés des sites existants de la chimaphile maculée seront utilisés pour formuler des recommandations en matière de gestion afin d’orienter les futures activités d’éclaircissement des plantations et de remise en état de la savane à chênes (Heagy, comm. pers., 2015). Contrairement à l’exploitation forestière, à la récolte du bois et aux feux de friches, les techniques de gestion de l’habitat comme l’éclaircissement du couvert forestier et les brûlages dirigés ne devraient pas menacer la chimaphile maculée, car leur utilisation est soigneusement contrôlée et surveillée.
Le réchauffement climatique peut avoir une incidence sur la chimaphile maculée, mais on ignore si cette incidence sera positive ou négative. Dans une étude expérimentale menée en Caroline du Nord, Marchin (2014) a établi qu’une hausse de 2 °C en été avait entraîné un échec de la reproduction. Les effets probables des changements climatiques, comme une augmentation de la concentration de CO2, la sécheresse et une augmentation des températures, peuvent aussi avoir différentes retombées sur l’abondance des champignons mycorhiziens et leurs interactions avec les plantes hôtes (Drigo et al., 2008; Compant et al., 2010). Or, on trouve aussi la chimaphile maculée en Amérique centrale. Plusieurs nouvelles mentions de l’espèce en Ontario, au Vermont et au Maine laissent supposer qu’elle n’est pas actuellement en déclin à la limite septentrionale de son aire de répartition et pourrait même être en hausse (Cameron, comm. pers., 2015; Popp, comm. pers., 2015).
Comme les champignons mycorhiziens semblent être des associés obligatoires des pyroloïdes, les agents polluants qui modifient la composition en champignons et leur abondance pourraient avoir des répercussions sur les plantes vasculaires qui leur sont associées. Les pyroloïdes sont des végétaux dont on sait qu’ils sont vulnérables à une hausse du dépôt d’azote atmosphérique, laquelle entraîne une réduction de la diversité fongique (Wallenda et Kotke, 1998). D’autres formes de pollution se sont avérées nuisibles pour la diversité et la composition en champignons mycorhiziens des forêts (Arnolds, 1991; Peter et al., 2001). On ignore toutefois si ce phénomène a des effets sur les sous-populations canadiennes.
Dans tout l’est de l’Amérique du Nord, les vers de terre non indigènes sont considérés comme envahissants et se sont avérés très dommageables pour le sous-étage forestier et la composition en espèces végétales (Hale et al., 2006, 2008). Il se peut que des vers de terre soient présents dans les habitats de forêt et de boisé sur sol sec occupés par la chimaphile maculée.
On a constaté des signes de collecte de l’espèce dans le passé (White, 1998 cité dans Ursic et al., 2010), mais on considère qu’il ne s’agit pas d’une menace importante actuellement (Gould, comm. pers., 2015). Aucun signe de collecte n’a été observé depuis de nombreuses années, malgré le travail approfondi effectué sur l’espèce, et la valeur sur le marché de l’espèce en tant que plante médicinale serait faible (NatureServe, 2015).
La dépendance de la chimaphile maculée envers des champignons hôtes pour germer et se développer peut limiter le nombre de populations, en particulier l’établissement de nouvelles colonies. Dans le cas de la chimaphile à ombelles et de plusieurs autres pyroloïdes, il a été établi que la disponibilité de microhabitats était un important facteur limitatif de la colonisation (Johannson et Eriksson, 2012).
Plusieurs menaces pèsent sur la région occupée par cette espèce, mais la menace touchant la plus grande proportion de la population est probablement celle des feux de friches. Les activités récréatives et les effets des cerfs et des Dindons sauvages sont localisés, et il est peu probable qu’ils affectent rapidement une grande proportion de la population. L’impact global est faible d’après l’évaluation des menaces, mais les incendies semblent être la menace plausible la plus importante. Le nombre de parcelles de forêt occupées par cette espèce est faible, mais toutes les parcelles occupées sont situées en milieu rural, dont certaines dans des parcs provinciaux ou des aires de conservation. Les interventions de lutte contre les incendies risquent donc d’être rapides. Il semble raisonnable de présumer que le secteur ravagé par un incendie, le cas échéant, serait restreint, mais la superficie d’un tel secteur est inconnue. Compte tenu des incertitudes, il convient probablement de décrire le nombre de localités à l’aide d’un intervalle de valeurs.
Aux fins du présent rapport, les « sous-populations » canadiennes sont considérées comme étant des occurrences d’élément (OE) Note4. En Ontario, les occurrences d’élément ont été récemment réanalysées (Craig, comm. pers., 2015), et des sous-populations qui étaient autrefois distinctes (p. ex. plusieurs du comté de Norfolk, en particulier dans la forêt St. Williams et à Turkey Point) ont été regroupées. On compte actuellement cinq occurrences d’élément existantes distribuées dans environ 19 sites connus. Soulignons que cette répartition des occurrences d’élément et des sous-populations a été mise à jour à partir de celles qui ont été précédemment publiées dans les programmes de rétablissement (Ursic et al., 2011; Environnement Canada, 2015).
Deux des occurrences d’élément, celles du parc Ojibway et du chemin Perry, chacune composée d’une seule colonie ayant un petit nombre d’individus, correspondent à deux localités. Les trois autres occurrences d’élément comportent plusieurs sites. Les sites connus de l’occurrence d’élément de la forêt St. Williams font environ 1,3 km du nord au sud et environ 600 m d’est en ouest, et la majorité de la sous-population est concentrée dans un site. On pourrait considérer que cette occurrence d’élément correspond à une ou deux localités, car les feux de friches qui s’étendent au-delà d’un kilomètre sont possibles, mais peu probables. Les sites connus de Turkey Point couvrent une superficie de plus de 3 km d’est en ouest et d’environ 2 km du nord au sud. Comme l’un des sites est séparé des autres par plus d’un kilomètre (parcelle F à Turkey Point), il pourrait s’agir d’une localité. En supposant qu’un incendie est peu susceptible de se propager sur plusieurs kilomètres, la partie résiduelle de cette occurrence d’élément correspond à au moins deux localités. Pour l’ensemble du secteur de Turkey Point, on peut supposer qu’il y a deux localités à Turkey Point et une à la parcelle F de Turkey Point, ce qui donne 2 à 3 localités. L’occurrence d’élément de Fishers Glen s’étend sur plus de 2,7 km d’est en ouest, et une distance de 1,7 km sépare les deux sites connus. Il semble raisonnable d’envisager deux localités dans ce secteur, compte tenu de la distance entre les sites. La fourchette plausible du nombre de localités de la chimaphile maculée au Canada serait alors de 7 à 9, si on présume que les feux de friches sont la menace plausible la plus importante et que les incendies sont supprimés.
La chimaphile maculée a été évaluée pour la première fois par le COSEPAC en 1987 comme étant « en voie de disparition ». Ce statut a été réexaminé, puis a été confirmé en 1998 et en 2000. L’espèce a été inscrite à l’annexe 1 de la Loi sur les espèces en péril (LEP)en tant qu’espèce en voie de disparition en 2004. En Ontario, l’espèce a aussi été désignée « espèce en voie de disparition » en vertu de la Loi de 2007 sur les espèces en voie de disparition, et un programme de rétablissement provincial a été rédigé (Ursic et al., 2010). En vertu de la LEVD, l’espèce et son habitat en Ontario sont protégés. Dans l’addition du gouvernement fédéral qui complète le programme de rétablissement provincial, on a aussi désigné l’habitat essentiel de cette espèce en vertu de la LEP (Environment Canada, 2015).
NatureServe (2015) attribue à la chimaphile maculée la cote G5 (non en péril; dernier examen en 2001). L’espèce est classée N5 (non en péril) aux États-Unis, N2 (en péril) au Canada, S2 (en péril) en Ontario et SX (vraisemblablement disparue) au Québec. Aux États-Unis, les cotes de conservation infranationales suivantes ont été attribuées à la chimaphile maculée : S1 – gravement en péril (Illinois), S2 – en péril (Maine, Vermont et Mississippi), S3 – vulnérable (Indiana et Arizona), S4 – apparemment non en péril (New York), et S5 – non en péril (New Jersey, Delaware, District de Columbia, Virginie, Virginie-Occidentale, Kentucky et Caroline du Nord). L’espèce n’a pas été cotée dans les 13 autres États où elle est présente.
Parmi les cinq sous-populations existantes, quatre se trouvent entièrement ou en majorité sur des terres publiques (c.-à-d., terres de la Couronne, parcs provinciaux ou aires de conservation). Ces zones sont protégées du développement, mais elles peuvent subir de nombreuses perturbations, dont la circulation de véhicules tout-terrain et le piétinement. Une partie de la sous-population de Turkey Point (site de Normandale) est sur une propriété privée qui tient lieu de camp d’été pour enfants. La sous-population de la région de Niagara, située sur un terrain privé, pourrait subir les effets d’un aménagement.
Nous souhaitons remercier Del Meidinger (coprésident du Sous-comité de spécialistes des plantes vasculaires du COSEPAC), le Sous-comité de spécialistes des plantes vasculaires du COSEPAC et de nombreux représentants des administrations concernées pour leurs commentaires sur les ébauches. Nous sommes aussi reconnaissants à Alain Filion du secrétariat du COSEPAC pour avoir créé des cartes et avoir calculé l’IZO et la zone d’occurrence. Robert Craig du CIPN de l’Ontario a fourni les données à jour sur les occurrences d’élément et des explications.
Nous voulons aussi remercier les personnes suivantes pour nous avoir procuré des renseignements utiles à la préparation du présent document :
- Secrétariat du COSEPAC, pour les renseignements sur les sources de connaissances traditionnelles autochtones, Service canadien de la faune
- Karine Beriault, biologiste des espèces en péril, ministère des Richesses naturelles et des Forêts de l’Ontario
- Gregor Beck, gestionnaire de programmes intérimaire de l’Ontario, Études d’oiseaux Canada
- Audrey Heagy, coordonnatrice de projet, réserve de conservation St. Williams
- Ron Gould, intendant des ressources, Parcs Ontario
- Jacques Labrecque, botaniste, ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques, Québec
- Mike Oldham, botaniste, Centre d’information sur le patrimoine naturel, ministère des Richesses naturelles et des Forêts de l’Ontario
- Wasyl Bakowsky, écologiste communautaire, Centre d’information sur le patrimoine naturel, ministère des Richesses naturelles et des Forêts de l’Ontario
- Bob Popp, Department Botanist, Natural Heritage Inventory, Vermont Department of Fish and Wildlife
- Don Cameron, botaniste/écologiste, Maine Natural Areas Program
- Ken Ursic, écologiste principal, Beacon Environmental, Guelph, Ontario
- Dan Brunton, botaniste, Brunton Consulting, Ottawa, Ontario
- Steve Young, botaniste, New York Natural Heritage Program
- Tara Kieninger, Database Program Manager, Illinois Natural Heritage Database
- Jennifer Chambers, écologiste adjointe, zone du Sud-Ouest, Parcs Ontario
- André Sabourin, consultant en botanique, Québec
Amador, G.J., Y. Yamada, M. McCurley et D.L. Hu. 2013. Splash-cup plants accelerate raindrops to disperse seeds (Disponible an anglais seulement). Journal of the Royal Society Interface 10:20120880
Angelo, D. et D.E. Boufford. 2016. Atlas of the Flora of New England [Disponible an anglais seulement, consulté le 5 novembre 2016].
Arditti, J., et A.K.A. Ghani. 2000. Numerical and physical properties of orchid seeds and their biological implications, Tansley Review No. 110, New Phytologist 145:367-421.
Arnolds, E. 1991. Decline of ectomycorrhizal fungi in Europe. Agriculture, Ecosystems and Environment 35:209–244.
Barrett, S.C.H., et K. Helenurm. 1987. The reproductive biology of boreal forest herbs: I. Breeding systems and pollination, Canadian Journal of Botany 65(10):2036-2046.
Beck, G., comm. pers. 2016. Correspondance par courriel adressée à H. Bickerton, mars 2016. Gestionnaire de programmes intérimaire de l’Ontario, Études d’oiseaux Canada, Port Rowan (Ontario).
Boullard, B. et H.A. Ferchau. 1962. Endotrophic mycorrhizae of plants collected in some eastern American and Canadian white pine communities. Phyton, Vincente Lopez 19:65-71.
Bowles, B. 2001. Field Survey Report on the Status of Spotted Wintergreen (Chimaphila maculata) at three Wasaga Beach Provincial Park Sites. Bowles Environmental. Produced for Ontario Parks, 7 pp.
Brunton, D. F. 1989. Biological Inventory and Evaluation Of Wasaga Beach Provincial Park and Adjacent Natural Areas, Simcoe County, Ontario. Ontario Ministry of Natural Resources, Central Region, Richmond Hill. OFER 8905. ix + 166 pp. + maps.
Cameron, D.S., comm. pers. 2015. Correspondance par courriel adressée à H. Bickerton, septembre 2015. Botaniste/écologiste, Maine Natural Areas Program, Augusta (Maine).
Canadian Forest Service. 2014. Alien, invasive hemlock woolly adelgid found in Ontario (PDF Version; 475 KB) (Disponible an anglais seulement). Frontline : Forestry Research Applications. Technical Note No. 114.
Centre de données sur le patrimoine naturel du Québec (CDPPNG). 2015. Chimaphila maculata occurrence report. 5 pp.
Chambers, Jennifer, comm. pers. 2015. Correspondance par courriel adressée à H. Bickerton, septembre 2015. Écologiste adjointe, Parcs Ontario, zone du Sud-Ouest, ministère des Richesses naturelles et des Forêts de l’Ontario, London (Ontario).
Compant, S., M.G. Van Der Heijden et A. Sessitsch. 2010. Climate change effects on beneficial plant–microorganism interactions, FEMS Microbiology Ecology 73:197-214.
COSEWIC 2000. COSEWIC assessment and update status report on the spotted wintergreen Chimaphila maculata in Canada, Committee on the Status of Endangered Wildlife in Canada, Ottawa. vi + 6 pp. (Également disponible en français : COSEPAC. 2000. Évaluation et rapport de situation du COSEPAC sur la chimaphile maculée (Chimaphila maculata) au Canada − Mise à jour, Comité sur la situation des espèces en péril au Canada. Ottawa. vi + 7 p.)
COSEWIC. 2014. Guidelines for recognizing designatable units. [consulté le 10 novembre 2015]. (Également disponible en français : COSEPAC. 2014. Lignes directrices pour reconnaître les unités désignables.
Craig, R., comm. pers. 2015. Correspondance par courriel adressée à H. Bickerton, novembre 1999. Analyste des espèces en péril, Centre d’information sur le patrimoine naturel du ministère des Richesses naturelles et des Forêts de l’Ontario, Peterborough (Ontario).
Cullina, W. 2000. New England Wildflower Society Guide to Growing and Propagating Wildflowers of the United States and Canada. Houghton Mifflin, New York, NY.
Davis, L.R. et K.J. Puettmann. 2009. Initial response of understory vegetation to three alternative thinning treatments. Journal of Sustainable Forestry 28(8):904-934.
de Witte, L. C. et J. Stöcklin. 2010. Longevity of clonal plants: why it matters and how to measure it. Annals of Botany 106:859-870.
Drigo, B., G.A. Kowalchuk et J.A. van Veen. 2008. Climate change goes underground: effects of elevated atmospheric CO2 on microbial community structure and activities in the rhizosphere. Biology and Fertility of Soils 44:667-679.
Duguid, M.C., B.R. Frey, D.S. Ellum, M. Kelty et M.S. Ashton. 2013.The influence of ground disturbance and gap position on understory plant diversity in upland forests of southern New England. Forest Ecology and Management 303:148-159.
Eastman, L.M. 1976. Spotted Wintergreen, Chimaphila maculata (L.) Pursh in Maine and its Relevance to the Critical Areas Program. Planning Report No. 21, State Planning Office, Maine Critical Areas Planning Program, Augusta, Maine.
Environment Canada. 2015. Recovery Strategy for the Spotted Wintergreen (Chimaphila maculata) in Canada. Species at Risk Act Recovery Strategy Series. Environment Canada, Ottawa. 24 pp. + Appendix. (Également disponible en français : Environnement Canada. 2015. Programme de rétablissement de la chimaphile maculée (Chimaphila maculata) au Canada, série de Programmes de rétablissement de la Loi sur les espèces en péril, Environnement Canada, Ottawa. 25 p. + annexe.)
Ford, C.R., K.J. Elliott, B.D. Clinton, B.D. Kloeppel et J.M. Vose. 2012. Forest dynamics following eastern hemlock mortality in the southern Appalachians. Oikos 121:523-336.
Fraver, S. 1994. Vegetation Responses along Edge-to-Interior Gradients in the Mixed Hardwood Forests of the Roanoke River Basin, North Carolina. Conservation Biology 8(3):822-832.
Freeman, C.C. 2009. Chimaphila In: Ericaceae. Flora of North America North of Mexico: Volume 8 Magnoliophyta: Paeoniaceae to Ericaceae. Oxford University Press, New York. Pp. 385-387.
Gould, R. 2001. Spotted Wintergreen (Chimaphila maculata) 2001 Survey Report. rapport inédit.
Gould, R., comm. pers. 2015. Correspondance par courriel adressée à H. Bickerton, septembre 2015. Intendant des ressources, Parcs Ontario, zone du Sud-Ouest, ministère des Ressources naturelles de l’Ontario, London (Ontario).
Haber, E., et C.J. Keddy. 1984. Chimaphila maculata (L.) Pursh. A page in the Atlas of the Rare Vascular Plants of Ontario, Part 3, Eds. G. W. Argus and C. J. Keddy, National Museum of Canada, Ottawa.
Hale, C.M., L.E. Frelich et P.B. Reich. 2006. Changes in hardwood forest understory plant communities in response to European earthworm invasions. Ecology 87:1637-1649.
Hale, C.M., L.E. Frelich, P.B. Reich et J.Pastor. 2008. Exotic earthworm effects on hardwood forest floor, nutrient availability and native plants: a mesocosm study. Oecologia 155:509-518.
Halpern, C.B. et T.A. Spies. 1995. Plant species diversity in natural and managed forests of the Pacific Northwest. Ecological Applications 5:913–934.
Heagy, A., comm. pers. 2015. Correspondance par courriel et conversation téléphonique avec H. Bickerton, septembre 2015. Président, Conseil communautaire de la réserve de conservation St. Williams (Ontario).
Heagy, A., comm. pers. 2016. Correspondance par courriel adressée à H. Bickerton, novembre 2016. Président, Conseil communautaire de la réserve de conservation St. Williams (Ontario).
Hynson, N.A., K. Preiss, G. Gebauer et T.D. Bruns. 2009. Isotopic evidence of full and partial myco-heterotrophy in the plant tribe Pyroleae (Ericaceae). New Phytologist 182:719-726.
IUCN 2010. Guidelines for Using the IUCN Red List Categories and Criteria (PDF Version) (Disponible an anglais seulement)
Jacobs, D. 2001. Spotted Wintergreen: Chimaphila maculata at Parc D’Oka, Québec. Rapport inédit.
Johansson, V.A. et O. Eriksson. 2013. Recruitment limitation, germination of dust seeds, and early development of underground seedlings in six Pyroleae species. Botany 91:17-24.
Johansson, V.A., G. Müller et O. Eriksson. 2014. Dust seed production and dispersal in Swedish Pyroleae species. Nordic Journal of Botany 32:209-214.
Kartesz, J.T. 2015. The Biota of North America Program (BONAP). North American Plant Atlas. Chapel Hill, N.C. [maps generated from Kartesz, J.T. 2015, Floristic Synthesis of North America, Version 1.0. Biota of North America Program (BONAP). (sous presse). [Disponible an anglais seulement, consulté le 18 septembre 2015].
Kirk, D. 1987. COSEWIC status report on the Spotted Wintergreen Chimaphila maculata in Canada, Committee on the Status of Endangered Wildlife in Canada. Ottawa, 36 pp.
Knudsen, J. T. et J. M. Oleson. 1993. Buzz-pollination and patterns in sexual traits in north European Pyrolaceae. American Journal of Botany 80(8):900-913.
Labrecque, J., comm. pers. 2015. Correspondance par courriel adressée à H. Bickerton, avril et novembre 2015. Botaniste, ministère du Développement durable, de l'Environnement et de la Lutte contre les changements climatiques (Québec).
Largent, D.L., N. Sugihara et C. Wishner. 1980. Occurrence of mycorrhizae on ericaceous and pyrolaceous plants in northern California. Canadian Journal of Botany 58:2274-2279.
Lindh, B.C., et P.S Muir. 2004. Understory vegetation in young Douglas-fir forests: Does thinning help restore old-growth composition? Forest Ecology and Management 192:285–296.
Liu, Z.W., Q.R. Zhao et J. Zhou. 2013. A test of four candidate barcoding markers for the identification of geographically widespread Chimaphila species (Pyroleae, Ericaceae). Acta Botanica Gallica 160(1):11-17.
Lundell, A., S.A. Cousins et O. Eriksson. 2015. Population size and reproduction in the declining en voie de disparition forest plant Chimaphila umbellata in Sweden. Folia Geobotanica 1-11.
Marchin, R.M. 2013. Using a physiological approach to improve predictions of climate change effects on temperate forests. North Carolina State University.
Massicotte, H., L. Melville, L. Tackaberry et R. Peterson. 2008. A comparative study of mycorrhizas in several genera of Pyroleae (Ericaceae) from western Canada. Botany 86:610-622.
Master, L.L., D. Faber-Langendoen, R. Bittman, G.A. Hammerson, B. Heidel, L. Ramsay, K. Snow, A. Teucher et A. Tomaino. 2012. NatureServe conservation status assessments: factors for evaluating species and ecosystems at risk. NatureServe, Arlington, VA.
Matthews, Robin F. 1994a. Chimaphila menziesii. In: Fire Effects Information System, [Online]. U.S. Department of Agriculture, Forest Service, Rocky Mountain Research Station, Fire Sciences Laboratory (Producer). [Disponible an anglais seulement, consulté le 4 novembre 2016M].
Matthews, Robin F. 1994b. Chimaphila umbellata. In: Fire Effects Information System, [Online]. U.S. Department of Agriculture, Forest Service, Rocky Mountain Research Station, Fire Sciences Laboratory (Producer). [consulté le 4 novembre 2016].
Moerman, D.E. 2009. Native American medicinal plants: an ethnobotanical dictionary. Timber Press, Portland, Oregon.
Natural Heritage Information Centre. 2015. Element Occurrence Database.
NatureServe. 2015. NatureServe Explorer: An online encyclopedia of life [application Web]. Version 7.1. NatureServe, Arlington (Virginie). [Disponible an anglais seulement,consulté le 21 novembre 2015].
Oldham, M.J., comm. pers. 2015. Correspondance par courriel adressée à H. Bickerton, septembre 2015. Botaniste, Centre d’information sur le patrimoine naturel, MRNFO.
Pengelly, A. et K. Bennett. 2011. Appalachian plant monographs: Chimaphila umbellata (L.) Nutt. Pipsissewa. [consulté le 18 septembre 2015].
Peter, M., F. Ayer et S. Egli. 2001. Nitrogen addition in a Norway spruce stand altered macromycete sporocarp production and below-ground ectomycorrhizal species composition. New Phytologist 149(2):311-325.
Popp, B., comm. pers. 2015. Correspondance par courriel adressée à H. Bickerton, août 2015. Department Botanist, Vermont Department of Fish and Wildlife, Natural Heritage Inventory.
Reznicek, A.A, E.G. Voss et B.S. Walters. 2011. Michigan Flora Online - Chimaphila maculata. University of Michigan. [anglais seulement, consulté le 18 septembre 2015].
Rocca, M. 2009. Fine-scale patchiness in fuel load can influence initial post-fire understory composition in a mixed conifer forest, Sequoia National Park, California. Natural Areas Journal 29(2):126-132.
Sabourin, André, comm. pers. 2015. Correspondance par courriel adressée à H. Bickerton, novembre 2015. Botaniste consultant, Québec.
Standley, L.A., S. S.-H. Kim et I.M. Hjersted. 1988. Reproductive biology of two sympatric species of Chimaphila. Rhodora 90:233-244.
Tedersoo, L., P. Pellet, U. Koljalg et M.-A. Selosse. 2007. Parallel evolutionary paths to mycoheterotrophy in understorey Ericaceae and Orchidaceae: ecological evidence for mixotrophy in Pyroleae. Oecologia 151:206-217.
Ursic, K., T. Farrell, M. Ursic et M. Stalker. 2010. Recovery strategy for the Spotted Wintergreen (Chimaphila maculata) in Ontario. Ontario Recovery Strategy Series. Prepared for the Ontario Ministry of Natural Resources, Peterborough, Ontario. vi + 28 pp.
Wallenda, T. et I. Kottke. 1998. Nitrogen deposition and ectomycorrhizas. New Phytologist 139:169–187.
White, D.J. 1998. Update COSEWIC status report on spotted wintergreen Chimaphila maculata in Canada. Committee on the Status of Endangered Wildlife in Canada. Ottawa. 1-6 pp. (Également disponible en français : White, D.J. 1998. Rapport de situation du COSEPAC sur la chimaphile maculée (Chimaphila maculata) au Canada – Mise à jour, Comité sur la situation des espèces en péril au Canada, Ottawa, pages 1-7.
White, D.J. 2010. Species at Risk Survey at the St. Williams Conservation Reserve. Rapport inédit destiné au Conseil communautaire de la réserve de conservation St. Williams, décembre 2010.
Williams, P.H., R.W. Thorp, L.L. Richardson et S.R. Colla. 2014. Bumble Bees of North America: An Identification Guide. Princeton: Princeton University Press, 208 pp.
Zimmer, K., N.A. Hynson, G. Gebauer, E.B. Allen, M.F. Allen et D.J. Read. 2007. Wide geographical and ecological distribution of nitrogen and carbon gains from fungi in pyroloids and monotropoids (Ericaceae) and in orchids. New Phytologist 175:166-175.
Zimmerman, M.L. 2006. The Effects of Prescribed Fire on the Herbaceous Layer in the MSouthern Appalachian Mountains. Mémoire de maîtrise, Department of Biological Sciences, East Tennessee State University.
Holly Bickerton est une biologiste ayant plus de 15 ans d’expérience dans le sud de l’Ontario. Holly a obtenu un baccalauréat en sciences de l’Université McMaster (McMaster University) et une maîtrise en études environnementales de l’Université York (York University). Elle a travaillé dans les domaines de l’écologie et des espèces en péril pour le ministère des Richesses naturelles de l’Ontario et le Department of Environment and Heritage en Australie-Méridionale. Depuis 2005, elle travaille à son compte comme consultante en écologie. Holly réalise les tâches suivantes : inventaire de la faune et de la flore, cartographie des végétaux, évaluation des espèces envahissantes, suivi écologique et recherches sur les politiques. Elle a été l’auteur de deux rapports de situation du COSEPAC et de nombreux autres documents sur les espèces rares ou en péril.
Melinda Thompson a rédigé une thèse de maîtrise sur la violette pédalée (Viola pedata L.), et a plus particulièrement examiné les caractéristiques optimales du microhabitat dans les vestiges de prairie à herbes hautes de l’Ontario. En plus d’avoir travaillé sur son projet de maîtrise, elle a participé, en tant que biologiste des espèces en péril, à de nombreux projets sur ces espèces avec le ministère des Richesses naturelles de l’Ontario. Au cours des 13 dernières années, elle a été l’auteur ou a collaboré à la rédaction de rapports sur la gestion et le rétablissement de neuf espèces végétales différentes en Ontario et au Canada. Elle est membre de plusieurs équipes de rétablissement et a une vaste expérience sur les espèces rares de l’Ontario.
Aucune collection n’a été examinée lors de la préparation du présent rapport.
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de niveau 1 selon l’intensité de leur impact : Maximum de la plage d’intensité |
Comptes des menaces de niveau 1 selon l’intensité de leur impact : Minimum de la plage d’intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 0 | 0 |
| C | Moyen | 2 | 0 |
| D | Faible | 2 | 4 |
| - | Impact global des menaces calculé : | Élevé | Moyen |
| Menace | Description de menace | Impact (calculé) | Impact description (calculé) | Portée (10 prochaines années) | Gravité (10 ans ou 3 gén.) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | D | Faible | Petite (1 %-10 %) | Élevée - Légère (1 %-70 %) | Modérée (possiblement à court terme, < 10 ans) | cellule vide |
| 1.1 | Zones résidentielles et urbaines | D | Faible | Petite (1 %-10 %) | Élevée - Légère (1 %-70 %) | Modérée (possiblement à court terme, < 10 ans) | Deux sites privés contiennent 4,8 % de la population. La gravité est variable, selon l’activité. Pour ce qui est de l’immédiateté, la menace serait possible, mais pas nécessairement continue. La majorité des sites sont ruraux et le seul site situé près d’un développement est un camp utilisé à l’occasion. Si le camp est vendu, le terrain pourrait faire l’objet d’un développement, en particulier le long des berges du lac. Remarque : la portée a une valeur située plus près de 1 % dans la plage de l’estimation. |
| 1.2 | Zones commerciales et industrielles | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 1.3 | Zones touristiques et récréatives | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2 | Agriculture et aquaculture | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.1 | Cultures annuelles et pérennes de produits autres que le bois | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.2 | Plantations pour la production de bois et de pâte | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.3 | Élevage de bétail | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 2.4 | Aquaculture en mer et en eau douce | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 3 | Production d’énergie et exploitation minière | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 3.1 | Forage pétrolier et gazier | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 3.2 | Exploitation de mines et de carrières | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 3.3 | Énergie renouvelable | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4 | Corridors de transport et de service | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4.1 | Routes et voies ferrées | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4.2 | Lignes de services publics | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4.3 | Voies de transport par eau | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 4.4 | Corridors aériens | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 5 | Utilisation des ressources biologiques | cellule vide | Négligeable | Négligeable (< 1 %) | Élevée - Légère (1 %-70 %) | Modérée (possiblement à court terme, < 10 ans) | cellule vide |
| 5.1 | Chasse et capture d’animaux terrestres | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 5.2 | Cueillette de plantes terrestres | cellule vide | Négligeable | Négligeable (< 1 %) | Élevée - Légère (1 %-70 %) | Modérée (possiblement à court terme, < 10 ans) | Signes de collecte dans le passé; non considérée comme une menace actuelle. Plante attrayante, mais difficile à cultiver. |
| 5.3 | Exploitation forestière et récolte du bois | cellule vide | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (continue) | La portée est peut-être négligeable, car < 5 % de la population se trouve sur des terres privées, mais un site a été l’objet d’une exploitation forestière dans les dix dernières années. Les répercussions de l’exploitation forestière effectuée il y a dix ans sont négligeables. Il est possible que la récolte sélective ne soit pas une menace, mais contribue en fait à ouvrir le couvert forestier et à stimuler la floraison. Cela n’a pas été démontré, et c’est la raison pour laquelle la réserve de conservation St. Williams suit la recommandation qui est de ne pas éclaircir dans un rayon de 30 m de l’espèce. Peut être bénéfique et favoriser la floraison (toutes les espèces de l’ouest présentent un autre mode et n’en bénéficieront pas nécessairement). Selon une étude menée par Jenny McCune, qui a examiné des sites prévus pour voir si la chimaphile maculée était présente, les sites inoccupés étaient associés à un couvert arbustif important composé d’espèces réagissant à une plus grande quantité de lumière (benjoin et Sambucus). Les trouées du couvert forestier créées par l’exploitation forestière peuvent avoir des effets nuisibles, en favorisant une augmentation du couvert arbustif, mais cela est hypothétique pour l’instant. L’un des sites est un boisé; le déboisement peut aussi survenir sur des terres privées. Pour ce qui est du site du camp religieux, le propriétaire est au courant de la présence de l’espèce et ne prévoit pas de déboiser à l’été 2016. Le propriétaire du site de Wainfleet sait aussi que la plante est présente sur ses terres. Remarque : Un éclaircissement à des fins de conservation au site de St. Williams sera envisagé en vertu de la menace 7.3. D’autres brûlages dirigés à cet endroit seront envisagés en vertu de la menace 7 également. |
| 5.4 | Pêche et récolte de ressources aquatiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6 | Intrusions et perturbations humaines | CD | Moyen - Faible | Restreinte (11 %-30 %) | Modérée - Légère (1 %-30%) | Élevée (continue) | cellule vide |
| 6.1 | Activités récréatives | CD | Moyen - Faible | Restreinte (11 %-30 %) | Modérée - Légère (1 %-30 %) | Élevée (continue) | Effets de la circulation en VTT, en vélo de montagne, à cheval et à pied. L’espèce est petite; elle risque de ne pas survivre à certaines de ces activités, même si de nombreux sites sont éloignés des sentiers et des pistes. Les risques diminuent là où des sentiers non autorisés ont été fermés et remis en état, mais la fermeture ne se traduit pas toujours par une réussite. La portée est possiblement grande, mais la gravité est inconnue – aire de répartition utilisée. St Williams : certains individus de l’espèce sont près des sentiers dans certains sites. L’un des sites du parc Ojibway est situé à moins de 1 m du sentier. S’il y a fauchage ou modification du sentier (p. ex. élargissement), l’espèce subira des répercussions. |
| 6.2 | Guerre, troubles civils et exercices militaires | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 6.3 | Travail et autres activités | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | On a discuté des activités de recherche, mais comme l’impact global est très faible ou neutre, la menace n’a pas été calculée. |
| 7 | Modifications des systèmes naturels | D | Faible | Restreinte - Petite (1 %-30 %) | Modérée - Légère (1 %-30 %) | Élevée (continue) | cellule vide |
| 7.1 | Incendies et suppression des incendies | D | Faible | Restreinte - Petite (1 %-30 %) | Modérée - Légère (1 %-30 %) | Élevée (continue) | Les incendies et la suppression des incendies, ainsi que l’ombrage accru subséquent, peuvent avoir des conséquences sur les colonies, mais la reproduction par voie végétative peut permettre aux sous-populations de persister. Des observations indiquent que les colonies pourraient bénéficier d’une lumière accrue, p. ex. en cas de défoliation ou de chablis localisé. Incertitude quant à la proportion de population potentiellement touchée. La suppression des incendies est continue, mais des incendies ont été signalés chaque année (ont été rapidement maîtrisés dans le passé – les parcelles de forêt sont situées près de zones habitées). Turkey Point et St. Williams font tous deux l’objet de brûlages dirigés. Cette espèce n’est pas très résistante aux incendies. Commentaire de Ron Gould (MRNFO) : il faudrait aussi prendre en considération le fait qu’un dégagement trop important résultant d’incendies de forte intensité ou trop fréquents n’entraînerait généralement pas la création d’un habitat de prédilection dans l’aire de répartition, et pourrait favoriser la croissance d’herbacées qui exercent une compétition. |
| 7.2 | Gestion et utilisation de l’eau et exploitation de barrages | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 7.3 | Autres modifications de l’écosystème | cellule vide | Pas une menace | Grande (31 %-70 %) | Neutre ou avantage potentiel | Élevée (continue) | La remise en état de l’habitat, c.-à-d. éclaircissement et brûlage dirigé à des fins de conservation à St. Williams et à Turkey Point. Cette espèce est prise en compte dans les activités de remise en état de l’habitat aux deux sites. Les effets possibles des vers de terre introduits sur les conditions du sol ont été analysés, mais on estime que la majorité des sites sont peut-être trop secs – l’impact peut être inconnu, mais potentiellement négatif. |
| 8 | Espèces et gènes envahissants ou autrement problématiques | CD | Moyen - Faible | Généralisée - Grande (31 %-100 %) | Modérée - Légère (1 %-30 %) | Élevée (continue) | cellule vide |
| 8.1 | Espèces exotiques (non indigènes) envahissantes | cellule vide | Inconnu | Petite (1 %-10 %) | Inconnue | Élevée (continue) | Menace restreinte dans la zone et aucun signe réel d’impact. Plantes envahissantes présentes dans les secteurs, mais très faible incidence dans les sites recensés; envahissement difficile dans les sols secs et sablonneux; les pistes de vélos de montagne dans certains sites peuvent favoriser les espèces envahissantes; portée probablement > 1 %. |
| 8.2 | Espèces indigènes problématiques | CD | Moyen - Faible | Généralisée - Grande (31 %-100 %) | Modérée - Légère (1 %-30 %) | Élevée (continue) | Les Dindons sauvages (récemment réintroduits) ont nui au tapis forestier dans les secteurs avoisinants, mais jusqu’à maintenant, il n’y a aucun signe d’impact direct sur la chimaphile maculée. Les Dindons sauvages sont considérés comme une menace, car les populations ont augmenté en raison des activités humaines. À Spooky Hollow, certains individus de l’espèce ont disparu en une nuit à cause du broutage des cerfs; les exclos sont efficaces – des caméras ont enregistré la présence de Dindons sauvages et de cerfs (impacts inconnus). Les exclos à Spooky Hollow ont permis au site de se rétablir après le broutage des cerfs. |
| 8.3 | Matériel génétique introduit | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9 | Pollution | cellule vide | Négligeable | Négligeable (< 1 %) | Extrême - Élevée (31 %-100 %) | Élevée (continue) | cellule vide |
| 9.1 | Eaux usées domestiques et urbaines | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.2 | Effluents industriels et militaires | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.3 | Effluents agricoles et sylvicoles | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 9.4 | Déchets solides et ordures | cellule vide | Négligeable | Négligeable (< 1 %) | Extrême - Élevée (31 %-100 %) | Élevée (continue) | Un rejet de déchets a été signalé à au moins un site; le rejet de déchets en bordure des routes est fréquent, et une population se trouvant sur le bord d’un chemin est vulnérable. |
| 9.5 | Polluants atmosphériques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | La pollution (concentration d’azote accrue) peut avoir une incidence sur les champignons mycorhiziens associés à l’espèce, mais on ignore s’il y a un impact. Très hypothétique et peu d’éléments probants pour le moment, donc la pollution n’est pas considérée une menace. On ignore si la fermeture de la centrale électrique de Nanticoke en 2013 a eu un impact potentiellement négatif ou positif. |
| 9.6 | Apports excessifs d’énergie | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10 | Phénomènes géologiques | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.1 | Volcans | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.2 | Tremblements de terre et tsunamis | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 10.3 | Avalanches et glissements de terrain | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11 | Changements climatiques et phénomènes météorologiques violents | cellule vide | Non calculé (en dehors de la période d’évaluation) | Généralisée (71 %-100%) | Inconnue | Faible (possiblement à long terme, > 10 ans) | Impact potentiel inconnu, car l’espèce est présente dans un large éventail de conditions climatiques. |
| 11.1 | Déplacement et altération de l'habitat | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11.2 | Sécheresses | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11.3 | Températures extrêmes | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |
| 11.4 | Tempêtes et inondations | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide | cellule vide |