Évaluation et Rapport de situation du COSEPAC sur le L’hermine de la sous-espèce haidarum Mustela erminea haidarum au Canada - 2015

Photo : Hermine de la sous-espèce haidarum © Janet Gifford, 2015
Description longue pour la figure
Photo d’un Mustela erminea haidarumen pelage d’hiver. Le M. e. haidarum a la forme typique d’une belette, avec un petit visage, de petites oreilles ovales et un corps long et mince ainsi qu’une queue recouverte de fourrure dont la pointe est noire. En été, l’espèce a un pelage brun rougeâtre avec un ventre blanc crème; en hiver, le pelage passe au blanc.
- Table des matières
- Sommaire de l’évaluation
- Résumé
- Résumé technique
- Préface
- Description et importance de l’espèce sauvage
- Répartition
- Habitat
- Biologie
- Taille et tendances de la population
- Menaces et facteurs limitatifs
- Protection, statuts et classements
- Remerciements et experts contactés
- Sources d’information
- Sommaire biographique des rédactrices du rapport
- Figure 1. Photographie d’un M. e. haidarum en captivité, avec son pelage d’hiver, à Sewall (île Graham), 1981. Source : Janet Gifford
- Figure 2. Emplacement du clade insulaire de l’hermine (Mustela erminea) à Haida Gwaii et sur l’île Prince of Wales, en rouge. Trois des quatre clades génétiques (lignées) relevés à l’échelle de la planète se trouvent dans la région de Haida Gwaii et de l’archipel Alexander (Flemming et Cook, 2002; Dawson et al., 2014). Aucun échantillon génétique n’est disponible pour les îles où la lignée est indéterminée. La figure provient de Cook et al. (2006) et précise que les hermines de Haida Gwaii et de l’île Prince of Wales forment une même sous-espèce, mais la taxonomie actuelle indique que le M. e. haidarum est présent à Haida Gwaii, tandis que le M. e. celenda occupe l’île Prince of Wales. Source : Cook et al. (2006)
- Figure 3. Emplacement des mentions vérifiées et non vérifiées du M. e. haidarum à Haida Gwaii, en Colombie-Britannique, depuis 1898. L’archipel est dominé par l’île Graham au nord, et par l’île Moresby au sud. Les zones biogéoclimatiques sont décrites par Banner et al. (2014); la majeure partie de l’archipel est située dans la variante hypermaritime humide sous-montagnarde de la zone côtière à pruche de l’Ouest (CMAwh) et dans la variante hypermaritime très humide de Haida Gwaii de la zone côtière à pruche de l’Ouest (CWHvh3). Carte produite par Jenny Wu, Secrétariat du COSEPAC
- Figure 4. Emplacement approximatif des relevés du M. e. haidarum effectués à Haida Gwaii, en Colombie-Britannique, depuis 1960. Les recherches ont été réalisées à l’aide de pièges, de pièges photographiques, de chiens renifleurs, de pièges à traces, de pièges à poils dans la forêt et de relevés des traces le long des routes (voir Activités de recherche). Voir la figure 3 pour une description des zones biogéoclimatiques. Carte produite par Jenny Wu, Secrétariat du COSEPAC
- Figure 5. Photographies montrant la différence dans la végétation du sousétage entre une zone où les cerfs de Sitka n’ont pas été introduits (île Low; à gauche) et une zone touchée par le broutage des cerfs (île East Limestone; à droite). Source : Martin (2001)
- Tableau 1. Méthodes utilisées et efforts déployés pour déceler la présence du M. e. haidarum de 1992 à 2013
- Tableau 2. Emplacement des pièges photographiques utilisés pour déceler la présence du M. e. haidarum en 2013 et en 2014 (données ajustées en fonction de l’effort). L’espèce a été détectée à trois endroits, mais cette information est omise. (Source : B. Wijdeven, données inédites, 2014)
COSEPAC
Comité sur la situation
des espèces en péril
au Cananda

COSEWIC
Committee on the Status
of Endangered Wildlife
in Canada
Les rapports de situation du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages que l’on croit en péril. On peut citer le présent rapport de la façon suivante :
COSEPAC. 2015. Évaluation et Rapport de situation du COSEPAC sur l’hermine de la sous-espèce haidarum (Mustela erminea haidarum) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. ix + 42 p.
COSEPAC. 2001. . Comité sur la situation des espèces en péril au Canada. Ottawa. vii + 46 p. Évaluation et Rapport de situation sur l’hermine de la sous-espèce haidarum (Mustela erminea haidarum) au Canada – Mise à jour.
EDIE, A. 2001. Rapport de situation du COSEPAC sur l’hermine de la sous-espèce haidarum(Mustela erminea haidarum) au Canada – Mise à jour, in Évaluation et Rapport de situation sur l’hermine de la sous-espèce haidarum (Mustela erminea haidarum) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. Pages 1-46.
YOUNGMAN, P. 1984. COSEWIC status report on the Ermine Mustela erminea haidarum (Queen Charlotte Islands population) in Canada. Comité sur le statut des espèces menacées de disparition au Canada. Ottawa. 14 p.
Le COSEPAC aimerait remercier David Kirk qui a rédigé le rapport de situation sur l’hermine de la sous-espèce haidarum (Mustela erminea haidarum), en vertu d’un contrat avec Environnement Canada. Les modifications apportées au rapport de situation après l’acceptation du rapport provisoire ont été supervisées par Graham Forbes, coprésident du Sous-comité de spécialistes des mammifères terrestres (SCS MT) du COSEPAC, d’après les commentaires des administrations, des experts de l’extérieur, du SCS MT et des membres du COSEPAC.
Pour obtenir des exemplaires supplémentaires, s’adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-938-4125
Téléc. : 819-938-3984
Courriel : COSEPAC courriel
Site Web : COSEPAC
Also available in English under the title COSEWIC Assessment and Status Report on the Ermine haidarum subspecies Mustela erminea haidarum in Canada.
Hermine de la sous-espèce haidarum -- source : Janet Gifford.
L’hermine de la sous-espèce haidarum (Mustela erminea haidarum; ci-après le M. e. haidarum) a la forme typique d’une belette, avec un petit visage, de petites oreilles ovales et un corps long et mince ainsi qu’une queue recouverte de fourrure dont la pointe est noire. En été, l’espèce a un pelage brun rougeâtre avec un ventre blanc crème; en hiver, le pelage passe au blanc. Le statut subspécifique du M. e. haidarum est fondé sur des caractéristiques morphométriques uniques, et soutenu par des analyses génétiques. Le M. e. haidarum a été isolé du continent pendant quelque 11 000 ans, et constitue un indicateur important de l’existence d’un refuge glaciaire sur la côte du Pacifique Nord. Il s’agit de l’un de quatre clades génétiques de l’hermine à l’échelle de la planète.
D’après la taxonomie actuelle, le M. e. haidarum n’est présent que dans l’archipel Haida Gwaii (îles de la Reine-Charlotte), en Colombie-Britannique. L’espèce est définitivement présente sur les îles Graham, Moresby, Louise et Burnaby, et il est possible qu’elle occupe aussi d’autres petites îles de l’archipel.
Les mentions du M. e. haidarum ont été relevées entre le niveau de la mer et 800 m au-dessus du niveau de la mer, mais la plupart des mentions sont à 350 m, dans des forêts de conifères de la sous-zone biogéoclimatique hypermaritime humide sous-montagnarde. Il est possible que le M. e. haidarum soit plus rare dans les zones de l’ouest et de haute altitude à Haida Gwaii.
On en sait relativement peu sur la biologie du M. e. haidarum. D’après la biologie des hermines du continent, qui devrait être semblable chez toutes les sous-espèces, le M. e. haidarums’accouple probablement à l’été/automne, et produit une portée de 4 à 6 petits le printemps suivant. La durée de vie de la plupart des individus est de moins de deux ans. Le M. e. haidarum est un prédateur opportuniste qui s’alimente de petits mammifères, d’oiseaux et d’invertébrés. Il se nourrit aussi de carcasses de cerf de Sitka (Odocoileus hemionus sitkensis).
On en sait relativement peu sur la biologie du M. e. haidarum. D’après la biologie des hermines du continent, qui devrait être semblable chez toutes les sous-espèces, le M. e. haidarums’accouple probablement à l’été/automne, et produit une portée de 4 à 6 petits le printemps suivant. La durée de vie de la plupart des individus est de moins de deux ans. Le M. e. haidarum est un prédateur opportuniste qui s’alimente de petits mammifères, d’oiseaux et d’invertébrés. Il se nourrit aussi de carcasses de cerf de Sitka (Odocoileus hemionus sitkensis).
Par le passé, la taille de la population du M. e. haidarum a probablement toujours été naturellement faible en raison d’un bassin de proies limité, et il est probable qu’elle baisse dans le futur à cause de diverses menaces. Les principales menaces qui pèsent sur le M. e. haidarum sont les changements de l’habitat résultant de la compétition et de la prédation accrues associées à l’introduction de diverses espèces sauvages à Haida Gwaii. En effet, les cerfs introduits ont gravement réduit la végétation du sous-étage dans la majeure partie de l’aire de répartition du M. e. haidarum, ce qui a vraisemblablement accru le taux de mortalité lié à la prédation, et réduit les populations des proies préférées par l’espèce. La population de la martre du Pacifique (Martes caurina), une espèce indigène, a augmenté, probablement à la suite de l’introduction du cerf (source de charogne) et de l’écureuil roux (Tamiasciurus hudsonicus). La martre du Pacifique entre en compétition avec le M. e. haidarum sur le plan de l’alimentation, et pourrait aussi constituer un prédateur pour l’espèce. Contrairement à la martre du Pacifique, il est peu probable que le M. e. haidarumtire avantage de l’introduction des écureuils roux et des rats.
Il arrive que le M. e. haidarum soit pris accidentellement dans des pièges destinés à la martre du Pacifique. La faible population de M. e. haidarum pourrait être affectée par le piégeage, mais cette menace est difficile à quantifier puisque l’ampleur des activités de piégeage est inconnue. En outre, il est peu probable que les programmes d’éradication des rats sur plusieurs îles de la réserve de parc national Gwaii Haanas aient touché le M. e. haidarum.
Par le passé, la taille de la population du M. e. haidarum a probablement toujours été naturellement faible en raison d’un bassin de proies limité, et il est probable qu’elle baisse dans le futur à cause de diverses menaces. Les principales menaces qui pèsent sur le M. e. haidarum sont les changements de l’habitat résultant de la compétition et de la prédation accrues associées à l’introduction de diverses espèces sauvages à Haida Gwaii. En effet, les cerfs introduits ont gravement réduit la végétation du sous-étage dans la majeure partie de l’aire de répartition du M. e. haidarum, ce qui a vraisemblablement accru le taux de mortalité lié à la prédation, et réduit les populations des proies préférées par l’espèce. La population de la martre du Pacifique (Martes caurina), une espèce indigène, a augmenté, probablement à la suite de l’introduction du cerf (source de charogne) et de l’écureuil roux (Tamiasciurus hudsonicus). La martre du Pacifique entre en compétition avec le M. e. haidarum sur le plan de l’alimentation, et pourrait aussi constituer un prédateur pour l’espèce. Contrairement à la martre du Pacifique, il est peu probable que le M. e. haidarumtire avantage de l’introduction des écureuils roux et des rats.
Il arrive que le M. e. haidarum soit pris accidentellement dans des pièges destinés à la martre du Pacifique. La faible population de M. e. haidarum pourrait être affectée par le piégeage, mais cette menace est difficile à quantifier puisque l’ampleur des activités de piégeage est inconnue. En outre, il est peu probable que les programmes d’éradication des rats sur plusieurs îles de la réserve de parc national Gwaii Haanas aient touché le M. e. haidarum.
Durée d’une génération.
2 à 3 ans
- La plage indiquée incorpore les taux de mortalité très variables de la première année de vie qui ont été constatés ailleurs, chez d’autres espèces d’hermines.
Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d’individus matures?
Oui
- La baisse de la population se poursuivra probablement, puisque les conséquences du broutage excessif par les cerfs augmentent avec le temps, et parce que les populations de cerfs persisteront vraisemblablement. La compétition sur le plan alimentaire avec la martre du Pacifique devrait aussi se poursuivre.
Pourcentage estimé de déclin continu du nombre total d’individus matures sur [cinq ans ou deux générations] (52-60 ans).
Inconnu
Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix dernières années ou trois dernières générations] (78-90 ans).
Inconnu
Pourcentage [prévu ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours des [dix prochaines années ou trois prochaines générations] (78-90 ans).
Inconnu
Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d’augmentation] du nombre total d’individus matures au cours de toute période de [dix ans ou trois générations] commençant dans le passé et se terminant dans le futur.
Inconnu
Est-ce que les causes du déclin sont clairement réversibles et comprises et ont effectivement cessé?
Non
- La baisse de la population se poursuivra probablement, puisque les conséquences du broutage excessif par les cerfs augmentent avec le temps, et parce que les populations de cerfs persisteront vraisemblablement. La compétition sur le plan alimentaire avec la martre du Pacifique devrait aussi se poursuivre.
Y a-t-il des fluctuations extrêmes du nombre d’individus matures?
On ne sait pas
Superficie estimée de la zone d’occurrence Tirée de COSEPAC (2004)
10 816 km²
Indice de zone d’occupation (IZO; valeurs d’une grille à carrés de 2 km de côté)
1 052 km²
- Fondé sur l’ensemble des mentions. Si l’on ne tient pas compte des archives de musées (d’avant 1990), l’IZO est de 1 032 km²
La population totale est-elle gravement fragmentée?
On ne sait pas
- Les déplacements entre les îles varient probablement en fonction de la distance couverte par les eaux permanentes.
Nombre de localités
Nombreuse
- La présence de l’espèce est confirmée sur quatre îles, mais elle s’étend probablement à d’autres. Le nombre de localités dépend de la distance entre les îles et la probabilité (inconnue) des déplacements entre les îles. Compte tenu de la grande superficie des deux îles et de la variabilité des menaces entre les îles, il y a probablement de nombreuses localités.
Y a-t-il un déclin continu observé de la zone d’occurrence?
On ne sait pas
Y a-t-il un déclin continu observé de l’indice de zone d’occupation?(La zone d’occupation actuelle représente 65 % de la zone d’occupation historique; voir la figure 4.)
On ne sait pas
Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de populations?
Possiblement
- Compte tenu de la faible population, il existe un risque de déclin à l'échelle locale relié à de nombreuses menaces, mais l'impact sur les sous populations potentielles est inconnu.
Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de localités?
Possiblement
- Compte tenu de la faible population, il existe un risque de déclin à l’échelle locale relié à de nombreuses menaces.
Y a-t-il un déclin continu [observé, inféré ou prévu] de [la superficie, l’étendue ou la qualité] de l’habitat?
Oui
- Le broutage excessif par les cerfs se poursuit et réduit la densité de la végétation du sous-étage, qui permet à l’espèce de s’alimenter et de s’abriter des prédateurs.
Y a-t-il des fluctuations extrêmes du nombre de populations?
Probablement pas
Y a-t-il des fluctuations extrêmes du nombre de localités?
Probablement pas
Y a-t-il des fluctuations extrêmes de la zone d’occurrence?
Probablement pas
Y a-t-il des fluctuations extrêmes de l’indice de zone d’occupation?
Probablement pas
Population de l’estuaire du Saint-Laurent totale :
Inconnu
- On ignore la taille de la population, mais des relevés intensifs ont permis de documenter moins de 40 individus au cours des 20 dernières années; il y a probablement moins de 1 000 individus matures.
La probabilité de disparition de l’espèce à l’état sauvage est d’au moins [20 % sur 20 ans ou 5 générations, ou 10 % sur 100 ans].
Inconnu
- Aucune AVP n'a été effectuée.
Les principales menaces qui pèsent sur le M. e. haidarum sont : 1) la compétition par interférence pour une source de nourriture limitée par une population de martres du Pacifique en expansion, soutenue par; 2) l’introduction des cerfs de Sitka, qui ont éliminé la majeure partie de la végétation du sous-étage à Haida Gwaii, ce qui a réduit le nombre d’espèces proies (oiseaux, rongeurs) et a vraisemblablement accru la vulnérabilité du M. e. haidarum à la prédation; 3) la mortalité accidentelle (prises accessoires) dans le cadre du piégeage de la martre du Pacifique, qui pourrait agir sur la viabilité du M. e. haidarum.
- Situation des populations de l’extérieur?
S.O.
Une immigration a-t-elle été constatée ou est-elle possible?
Nom
- Des individus immigrants seraient-ils adaptés pour survivre au Canada?
S.O.
Y a-t-il suffisamment d’habitat disponible au Canada pour les individus immigrants dans l’estuaire du Saint-Laurent?
S.O.
- La possibilité d’une immigration depuis des populations externes existe-t-elle?
Non
L’information concernant l’espèce est-elle de nature délicate?
Non
Espèce désignée « préoccupante » en avril 1984. Réexamen du statut : l’espèce a été désignée « menacée » en mai 2001 et en mai 2015.
L’hermine de la sous-espèce haidarum (Mustela erminea haidarum) a été désignée comme espèce préoccupante en avril 1984, puis comme espèce menacée en 2001, et a finalement reçu la désignation « menacée » en vertu de la Loi sur les espèces en péril. Cette désignation a été fondée sur la faible taille de la population et sur un déclin inféré. Depuis, des efforts de recherche considérables ont été déployés pour documenter la répartition et l’abondance de l’espèce. Le Programme de rétablissement de l’hermine de la sous-espèce haidarum (Mustela erminea haidarum) au Canada (2009; ci-après nommé le programme de rétablissement de 2009) a été produit avec un rapport fédéral supplémentaire sur l’habitat essentiel achevé en 2011 (Parks Canada Agency, 2011). Le nom scientifique « M. e. haidarum » est utilisé pour désigner l’hermine de la sous-espèce haidarum dans le présent rapport; le terme « hermine » est réservé aux autres sous-espèces.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d’une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d’une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril(LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d’être évaluées selon un processus scientifique rigoureux et indépendant.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Remarque : Catégorie « DSIDD » (données insuffisantes pour donner une désignation) jusqu’en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d’Environnement Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Nom scientifique : Mustela erminea haidarum
Noms communs : Hermine de la sous-espèce haidarum; hermine de Haida Gwaii; Haida Ermine; Ermine, haidarum subspecies; Queen Charlotte Ermine; Short-tailed Weasel; Tllga (Skidegate/Masset).
Classe : Mammifères
Ordre : Carnivores
Famille : Mustélidés
Genre : Mustela
Espèce : erminea
Sous-espèce : haidarum Preble (1898)
Le M. e. haidarum (Mustela erminea haidarum) est une petite hermine au corps allongé et mince, dont la queue est recouverte de fourrure et comporte une pointe noire, et dont le visage est petit et les oreilles sont courtes et ovales (figure 1). En été, le pelage est brun rougeâtre avec un ventre blanc crème. En hiver, il devient entièrement blanc.
Figure 1. Photographie d'un M. e. haidarum en captivité, avec son pelage d'hiver, à Sewall (île Graham), 1981. Source : Janet Gifford

Photo : Hermine de la sous-espèce haidarum © Janet Gifford, 2015
Description longue pour la figure 1
Photo d’un Mustela erminea haidarumen pelage d’hiver. Le M. e. haidarum a la forme typique d’une belette, avec un petit visage, de petites oreilles ovales et un corps long et mince ainsi qu’une queue recouverte de fourrure dont la pointe est noire. En été, l’espèce a un pelage brun rougeâtre avec un ventre blanc crème; en hiver, le pelage passe au blanc.
Le M. e. haidarum ressemble aux autres hermines (Mustela erminea Linnaeus 1758), mais il s’agit de la sous-espèce la plus distincte sur le plan morphologique en raison des caractéristiques structurelles uniques de son crâne (région préorbitale relativement grande) et de son faible dimorphisme sexuel (Hall, 1951; Foster, 1965; Cowan, 1989; Reimchen et Byun, 2005). Une analyse en composantes principales de 13 mesures des dimensions du crâne de 76 M. erminea mâles d’Amérique du Nord a permis d’établir que le M. e. haidarum est distinct des autres hermines (Eger, 1990). Le M. e. haidarum est une hermine relativement petite, dont les mâles (n = 3) atteignent entre 275 et 290 mm de longueur. Par comparaison, la longueur du mâle des sous-espèces d’hermines de la région continentale de la Colombie-Britannique(M. e. richardsonii; n = 10) varie entre 301 et 367 mm (Cowan et Guiguet, 1960). On observe aussi chez le M. e. haidarum un moins grand dimorphisme sexuel que chez les autres hermines : le crâne des femelles ne pèse que 29 % de moins que celui des mâles, par rapport à un poids d’au moins 42 % plus faible chez les femelles d’autres sous-espèces, et de 52 % pour le M. e. richardsoni, la sous-espèce d’hermine la plus répandue au Canada (Hall, 1951; Foster, 1965).
Au départ, le M. e. haidaruma été classé comme une espèce distincte, le Putorius [Mustela] haidarum, d’après sa morphologie unique que l’on croyait attribuable à son isolation des populations du continent (Preble, 1898). Hall (1944, 1945) a classé le M. e. haidarum comme une sous-espèce du M. erminea parce que les différences morphologiques observées entre les populations des îles et celles de la côte ouest seraient insuffisantes pour empêcher la reproduction. Dans le cadre d’un examen taxonomique exhaustif, Hall (1951) a conclu que le M. e. haidarum pourrait mériter le statut d’espèce distincte, mais l’a quand même retenu comme l’une de 20 sous-espèces d’hermines nord-américaines, dont 7 occupent des îles côtières de la Colombie-Britannique et de l’Alaska.
Le caractère distinct du M. e. haidarum a aussi été établi par des analyses génétiques. Le M. e. haidarumest isolé des lignées continentale et béringienne de l’hermine depuis la glaciation du Wisconsin, qui a pris fin il y a quelque 11 000 ans (Byun, 1999; Fleming et Cook, 2002; Dawson et al., 2014). Le point le plus haut à Haida Gwaii se trouve actuellement à 1 148 m au-dessus du niveau de la mer, et des données géologiques indiquent que les terres situées à plus de 900 m n’ont pas été touchées par la glaciation (Banner et al., 2014). D’autres refuges possibles ont été relevés dans le détroit d’Hécate et dans l’archipel Alexander (Burles et al., 2004).
Fleming et Cook (2002) ont relevé une variation géographique significative dans le gène mitochondrial codant le cytochrome b de 210 spécimens de Mustela erminea provenant d’Amérique du Nord, d’Irlande, de Russie et du Japon, et ont conclu qu’il existait trois lignées de l’hermine dont l’une, le « clade insulaire », est centrée sur le M. e. haidarumet deux sous-espèces étroitement apparentées des îles avoisinantes de l’Alaska : le M. e. celenda sur l’île Prince of Wales et le M. e. seclusa sur les îles Suemez et Heceta (figure 2). Byun (1999) est arrivé à une conclusion semblable en détectant trois lignées à l’échelle de la planète. Une évaluation plus approfondie, fondée sur le gène mitochondrial codant le cytochrome b, la région de contrôle et quatre loci nucléaires de 237 spécimens de M. erminea provenant de partout sur la planète (échantillons de Haida Gwaii = 7; échantillons des îles voisines de l’Alaska = 8), a permis d’établir 4 clades (insulaire [Haida Gwaii/île Prince of Wales], holarctique, continental, occidental) et a réaffirmé le caractère unique du clade insulaire (Dawson et al., 2014).
La délimitation de l’aire de répartition des sous-espèces d’hermines dans l’ouest de l’Amérique du Nord exige davantage de recherche, mais le M. e. haidarum est présentement reconnu comme une sous-espèce confinée à Haida Gwaii (Hall, 1981; King, 1983; Wilson et Reeder, 2005).
La diversité génétique de l’hermine est abordée à la section Description morphologique. La diversité génétique du clade insulaire (M. e. haidarum, M. e. celenda, M. e. seclusa) est considérée comme faible (Dawson et al., 2014). La structure spatiale et la variabilité génétique au sein de la population du M. e. haidarum sont inconnues, mais elles sont probablement limitées puisque cette sous-espèce n’occupe qu’une petite région.
Le M. e. haidarum est considéré comme une seule unité désignable au Canada, car on ne dispose d’aucune indication de divisions génétiques chez cette sous-espèce.
Figure 2. Emplacement du clade insulaire de l’hermine (Mustela erminea) à Haida Gwaii et sur l’île Prince of Wales, en rouge. Trois des quatre clades génétiques (lignées) relevés à l’échelle de la planète se trouvent dans la région de Haida Gwaii et de l’archipel Alexander (Flemming et Cook, 2002; Dawson et al., 2014). Aucun échantillon génétique n’est disponible pour les îles où la lignée est indéterminée. La figure provient de Cook et al. (2006) et précise que les hermines de Haida Gwaii et de l’île Prince of Wales forment une même sous-espèce, mais la taxonomie actuelle indique que le M. e. haidarum est présent à Haida Gwaii, tandis que le M. e. celenda occupe l’île Prince of Wales. Source : Cook et al. (2006).

Description longue pour la figure 2
Carte montrant la répartition du clade insulaire de l’hermine (Mustela erminea) à Haida Gwaii et dans la région de l’archipel Alexander de l’Alaska. La carte montre que le Mustela e. haidarum occupe Haida Gwaii et l’île Prince of Wales, même si la taxonomie actuelle indique que le M. e. haidarum est présent à Haida Gwaii, et le M. e. celenda, sur l’île Prince of Wales.
Le M. e. haidarum constitue l’une de seulement sept espèces de mammifères terrestres indigènes encore existants dans l’archipel de Haida Gwaii (Foster, 1965; Nagorsen, 1990; Reid et al., 1999, 2000). De nombreux clans de la Première Nation Haïda ont choisi l’hermine comme élément de leur emblème (p. ex. les Ninstints du clan du Corbeau, les Stawaas xaad iagaii, les Naay yu aans xaada gaay (Gens de la grande maison), les Na saga xaada gaay (Gens de la maison pourrie) et les Qaay llnagaay (Gens du village de l’otarie) du clan de l’Aigle (Burles et al., 2004). Les connaissances traditionnelles autochtones sur le M. e. haidarum sont aujourd’hui assez limitées (Collison, 2004 in Parks Canada Agency, 2011). On ignore si les fourrures d’hermine qui décorent les objets de cérémonie locaux proviennent du commerce avec les nations du continent, ou de M. e. haidarumpiégés à Haida Gwaii (Parks Canada Agency, 2011).
Le M. e. haidarum est particulièrement important à titre d’espèce relique d’une aire glaciaire, dont la lignée est unique (Byun, 1999; Fleming et Cook, 2002). On ne compte que quatre clades génétiques d’hermines, même si celles-ci se trouvent partout dans la majeure partie de l’hémisphère nord (voir Description morphologique). L’ensemble de l’Eurasie est donc représenté par un seul clade, mais la population de Gwaii Hanaas et de l’île Prince of Wales voisine, en Alaska, est assez unique pour mériter son propre clade. Le M. e. haidarum (avec le M. e. celenda et le M. e. seclusa) est considéré comme le mammifère constituant la meilleure preuve de l’existence du refuge glaciaire du Pacifique Nord (Fleming et Cook, 2002). La population de Haida Gwaii pourrait être encore plus importante, car les îles situées à proximité de l’île Prince of Wales ont récemment été colonisées par les clades continental et holarctique, ce qui soulève des préoccupations quant au maintien de la diversité génétique, de l’hybridation et de l’échange de parasites au sein du clade insulaire, faisant possiblement du M. e. haidarum le seul représentant de cette diversité génétique unique (Dawson et al., 2014).
D’après la taxonomie existante, le M. e. haidarum est endémique à l’archipel Haida Gwaii (îles de la Reine-Charlotte), situé à quelque 80 km au nord de la côte centrale de la Colombie-Britannique (Hall, 1951; Foster, 1965; Cowan, 1989; Reid et al., 2000). Deux sous-espèces étroitement apparentées sont présentes sur l’île Prince of Wales et dans les îles Suemez et Heceta adjacentes de l’archipel Alexander, en Alaska, à environ 80 km de distance (Fleming et Cook, 2002; figure 2). Il est possible que les hermines présentes sur l’île Prince of Wales et à proximité soient aussi des M. e. haidarum (Cook et al., 2006) mais, à l’heure actuelle, ces individus sont considérés comme appartenant à une sous-espèce différente (voir Description morphologique).
Le nombre de sous-populations est inconnu, mais il semble que la plupart des M. e. haidarumvivent sur les deux principales îles (Graham, Moresby); on ne compte aucune mention de l’espèce sur les îles situées à plus de 250 m de distance d’une autre île ou sa présence est confirmée. Les autres îles qui comportent des mentions (Louise, Burnaby) sont reliées, lorsque la marée est extrêmement basse, aux grandes îles qui abritent le M. e. haidarum par des distances de moins de 100 m (Louise à Moresby, Burnaby à Moresby) et de 250 m (Graham et Burnaby). Les îles Moresby et Graham ne sont séparées que par une distance de 250 m, et sont presque reliées à marée basse (Burles et al., 2004). Même si les hermines sont capables de nager sur de longues distances (voir Dispersion et migration), il semble que les déplacements entre les îles plus éloignées les unes des autres soient limités. Compte tenu de la similarité de l’habitat dans la majeure partie de Haida Gwaii, il est possible que le M. e. haidarum soit présent sur d’autres îles situées près de la côte, mais aucun n’a été observé malgré les nombreux relevés effectués (voir Activités de recherche).
La plupart des observations non vérifiées mentionnées par Reid et al. (2001) ont été faites autour des établissements humains qui avaient la plus forte population (Masset, Port Clements, Tlell, Skidegate, Queen Charlotte City, Alliford Bay et Moresby Camp). Sur l’île Graham, Reid et al. (2001) ont constaté que les observations étaient concentrées autour : de Delkatla et de la base des Forces canadiennes Masset; de la baie Masset près de l’embouchure de la rivière Watun; du ruisseau Kumdis; des affluents de la partie sud du lac Mayer; de la rivière Mayer; du cours inférieur de la rivière Yakoun; de la jonction du ruisseau Gold et de la rivière Yakoun; du cours inférieur du ruisseau Phantom et de la rivière Yakoun; du ruisseau Lawn et de la côte de Lawnhill; du ruisseau Tarundl et du cours inférieur de la rivière Honna. Sur l’île Moresby, les observations proviennent : du cours inférieur du ruisseau Sachs et de la baie Alliford; du cours d’eau alimentant l’inlet Skidegate le long de la route South Main; du lac et du ruisseau Mosquito; du ruisseau Copper et de la baie Copper.
Figure 3. Emplacement des mentions vérifiées et non vérifiées du M. e. haidarum à Haida Gwaii, en Colombie-Britannique, depuis 1898. L’archipel est dominé par l’île Graham au nord, et par l’île Moresby au sud. Les zones biogéoclimatiques sont décrites par Banner et al. (2014); la majeure partie de l’archipel est située dans la variante hypermaritime humide sous-montagnarde de la zone côtière à pruche de l’Ouest (CMAwh) et dans la variante hypermaritime très humide de Haida Gwaii de la zone côtière à pruche de l’Ouest (CWHvh3). Carte produite par Jenny Wu, Secrétariat du COSEPAC.
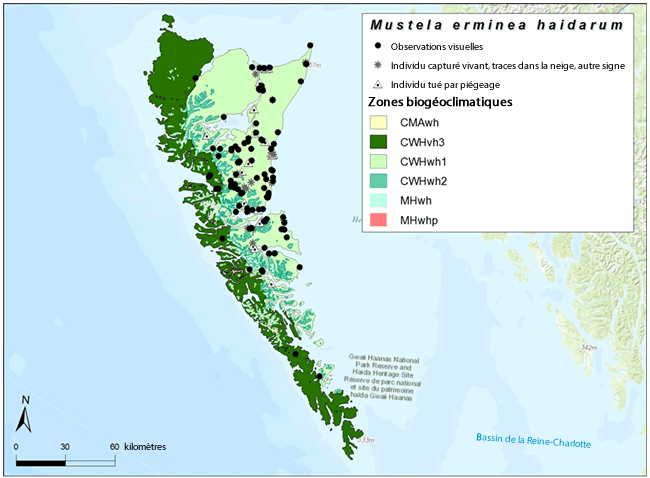
Description longue pour la figure 3
Carte montrant les observations vérifiées et non vérifiées du M. e. haidarum à Haida Gwaii depuis 1898 ainsi que les zones biogéoclimatiques connexes. La majeure partie des mentions est située du côté est de l’archipel, dans la zone biogéoclimatique CWHwh1.
La zone d’occurrence a été établie à 10 816 km², d’après le plus petit polygone convexe tracé autour de l’ensemble des observations vérifiées et non vérifiées (sauf à l’île SGaang) (voir Aire de répartition canadienne). Le fait d’exclure les mentions historiques de musées (de 1900 à 1991) de ce calcul n’a pas changé la superficie de la zone d’occurrence, parce que toutes les mentions de musées provenaient de la zone d’occurrence actuelle. L’indice de zone d’occupation (IZO, fondé sur une grille de 2 km x 2 km) a été établi à 1 052 km² (263 carrés) d’après les données du Conservation Data Centre de la Colombie-Britannique ainsi que des observations et des mentions de musées du M. e. haidarum. L’IZO est de 1 032 km² si l’on exclut les mentions de musées.
Les sections Activités de recherche et Activités et méthodes d’échantillonnage du présent rapport sont combinées, car les méthodes utilisées pour déterminer la répartition, l’utilisation de l’habitat et la tendance de la population du M. e. haidarum sont les mêmes.
Haida Gwaii se compose de diverses îles, et l’accès à de nombreuses de ces îles est difficile. De plus, des parties des grandes îles (Graham et Moresby) sont inaccessibles en hiver. La majeure partie des recherches a été effectuée dans les zones de faible altitude de l’est des îles Graham et Moresby, mais d’autres sections des grandes îles, ainsi que de plus petites îles, ont aussi fait l’objet de relevés; environ 20 % de la zone a été examinée (figure 4). La partie ouest des îles comporte généralement moins de routes. Le paysage y est accidenté et en grande partie inaccessible, particulièrement durant l’hiver, lorsque de nombreuses routes sont fermées (Wijdeven, comm. pers., 2014). Des relevés ont été effectués sur bon nombre d’autres îles et dans les zones de l’ouest, et chaque relevé a donné des résultats semblables, soit très peu de mentions de M. e. haidarum. Comme l’espèce est généraliste sur le plan de l’habitat (voir Besoins en matière d’habitat), et comme la plupart des menaces existent probablement à des degrés similaires dans la majeure partie de son aire de répartition (voir Menaces et facteurs limitatifs), il est peu probable que les zones peu examinées abritent plus de M. e. haidarum que les zones bien examinées. Elles pourraient même abriter moins d’individus (voir Besoins en matière d’habitat). Habituellement, même si la densité des hermines est très faible, leur présence dans une région est rapidement établie : elles sont faciles à capturer dans des pièges (létaux ou non), ne sont pas particulièrement discrètes, et sont facilement identifiées par le public (King et Powell, 2007).
Figure 4. Emplacement approximatif des relevés du M. e. haidarum effectués à Haida Gwaii, en Colombie-Britannique, depuis 1960. Les recherches ont été réalisées à l’aide de pièges, de pièges photographiques, de chiens renifleurs, de pièges à traces, de pièges à poils dans la forêt et de relevés des traces le long des routes (voir Activités de recherche). Voir la figure 3 pour une description des zones biogéoclimatiques. Carte produite par Jenny Wu, Secrétariat du COSEPAC.

Description longue pour la figure 4
Carte montrant l’emplacement approximatif des relevés du M. e. haidarum à Haida Gwaii depuis 1960, ainsi que les zones biogéoclimatiques.
Les activités de recherche ont été les suivantes :
Quatre expéditions de collecte ont été effectuées entre 1900 et 1920 en vue de recueillir des spécimens de musée (voir Fluctuations et tendances). Foster (1965) a réalisé des relevés des mammifères sur 45 îles de 1960 à 1961, dans le but de documenter les mammifères endémiques, dont le M. e. haidarum.
Les relevés entrepris de 1992 à 2014 sont résumés aux tableaux 1 et 2. Durant les années 1990, un échantillonnage intensif du M. e. haidarum a été effectué par Reid et al. (2000). Ceux-ci ont utilisé diverses méthodes d’inventaire dans un éventail de types de milieux, y compris : des pièges de Sherman permettant de capturer des individus vivants (50 pièges-nuits à l’été 1992; 2 301 pièges-nuits à l’automne 1993; 3 000 pièges-nuits au printemps 1995; 1 414 pièges-nuits au printemps 1997), des relevés des pistes dans la neige (22 km à pied et 900 km sur la route) et des pièges à traces (2 692 pièges-nuits en 1997 et 1998).
En 2004-2005, Burles et al. (2008) ont effectué un échantillonnage du M. e. haidarum dans des zones où des observations avaient été faites précédemment (p. ex. est de l’île Graham, île Burnaby, anse Ikeda). Ils ont utilisé des pièges à poils (32 emplacements, 871 pièges-nuits), des boîtes-gîtes ayant été utilisées avec succès dans le cadre de relevés des hermines en Nouvelle-Zélande (22 emplacements, 3 460 pièges-nuits), des pièges photographiques (31 emplacements, 481 pièges-nuits) et des relevés des traces dans la neige (70 km, 4 nuits hors route).
L’estomac de 152 martres du Pacifique (Martes caurina; Carr et Hicks, 1997) piégées à Haida Gwaii dans les années 1990 a été examiné en vue d’y déceler la présence de poils ou d’os de M. e. haidarum (Nagorsen, 2006).
La majeure partie des activités de recherche est fondée sur du travail de terrain, mais des connaissances locales proviennent aussi d’habitants de Haida Gwaii. Reid et al. (2000) ont mené 325 entrevues après du public, y compris auprès de trappeurs, entre 1997 et 1998. Une observation était considérée comme une mention par les auteurs si l’animal observé avait au moins une des caractéristiques suivantes : un corps allongé avec une longue queue et des pattes courtes, de couleur brun rougeâtre ou blanc, une tache noire à l’extrémité de la queue et une démarche bondissante. Des 162 mentions, 75 % (121) étaient des observations visuelles, et 57 % de celles-ci faisaient état du pelage blanc typique de l’espèce. Les individus piégés ont constitué 15 % des 162 mentions. Les autres mentions provenaient de traces dans la neige (4 %; la plupart relevées par des trappeurs d’expérience) et de diverses sources (6 % étaient des individus gardés comme animaux de compagnie, tués par des chats ou identifiés d’après les blessures infligées à des poulets tués (Reid et al., 2000). Même si ces mentions sont considérées comme non vérifiées en raison de l’absence de photo ou de spécimen, les critères pour l’acceptation des mentions de Reid et al. (2000) et la facilité d’identification des hermines laissent croire qu’elles sont valides.
Au total, 21 îles de l’extrémité nord à l’extrémité sud de Haida Gwaii ont été surveillées au moyen de pièges photographiques (1 643 pièges-nuits) de 2010 à 2011 dans le cadre de la surveillance des effets de la prédation par les espèces envahissantes sur les oiseaux nicheurs (Bergman, 2012). Depuis, 47 autres îles ont fait l’objet d’activités de surveillance d’une même intensité. La superficie de ces 68 îles varie entre 0,01 et 20 km² (Bergman, comm. pers., 2014).
Le programme de rétablissement de 2009 du M. e. haidarum recommande de faire en priorité l’essai sur le terrain des méthodes de détection nouvelles et existantes en vue de déterminer la taille, la densité et la répartition de la population. Les nouvelles activités comprennent la mise en place d’autres pièges photographiques numériques, tant de manière systématique qu’opportuniste (suivi d’observations signalées) sur un certain nombre d’années. En 2013 et 2014, 339 km de terrain ont fait l’objet d’un relevé effectué sur l’île Graham à l’aide d’un chien entraîné à localiser les excréments d’hermines (Wijdeven, comm. pers., 2014; tableau 2). Les chercheurs étaient sûrs que des excréments seraient trouvés s’ils étaient présents, car le chien a été capable d’en repérer un échantillon durant le relevé (Wijdeven, comm. pers., 2014).
Les associations végétales de l’habitat, ainsi que les caractéristiques naturelles d’importance capitale pour le M. e. haidarum,sont largement inconnues (Parks Canada Agency, 2011). Certaines déductions peuvent toutefois être faites d’après les études sur les associations de l’habitat d’autres sous-espèces d’hermines. On considère que ces dernières sont des généralistes sur le plan de l’habitat, puisqu’elles sont présentes dans un grand éventail de types de végétation, comme la toundra ouverte et les forêts matures très denses (King, 1983; Fagerstone, 1987; King et Powell, 2007). L’espèce est présente toute l’année dans les hautes régions alpines (Fitzgerald, 1977) ainsi que le long des côtes.
Certains renseignements proviennent de données d’observation du M. e. haidarum issues d’entrevues menées auprès du public par Reid et al. (2000). La plupart des 130 observations (94 %) ont été faites dans la zone biogéoclimatique hypermaritime humide sous-montagnarde (Banner et al., 2014), et toutes sauf une ont été faites à une altitude inférieure à 350 m le long du côté est de l’archipel Haida Gwaii. Seules six mentions proviennent de la variante CWHvh2, qui se trouve dans les régions de faible altitude très humides, du côté ouest des monts Windward; deux autres proviennent de la variante CWHwh2 (au-dessus de 350 m d’altitude, du côté est des îles Windward). Aucune mention ne provient de la zone de toundra alpine (Reid et al., 2000).
La plupart (87 %) des 130 observations proviennent de paysages forestiers; de celles-ci, 69 % proviennent de forêts de conifères. Le M. e. haidarum a été observé dans des forêts matures très denses, mais aussi fréquemment (57 % des observations) dans des forêts de seconde venue ou dans des zones non boisées, ce qui indique que l’espèce n’a pas nécessairement besoin de forêts matures (Reid et al., 2000). Dans les forêts semblables à ce que l’on trouve à Haida Gwaii sur la péninsule Olympic, dans l’État de Washington, les hermines sont surtout présentes dans les peuplements éclaircis de douglas de Menzies (Pseudotsuga menziesii) de seconde venue, à végétation de sous-étage dense (Wilson et Carey, 1996). La même tendance existe dans différents types de forêts, comme la forêt boréale de l’Ontario, où les hermines ne semblent pas choisir de classes d’âge en particulier et sont communes dans les zones forestières exploitées et non exploitées (Thompson et al., 1989).
Reid et al. (2000) ont avancé que le M. e. haidarum préférait les zones riveraines. La plupart des observations ont été faites à basse altitude (<50 m) et à moins de 100 m d’un plan d’eau (océan, rivière ou ruisseau; Reid et al., 2000), quoique la précision de ces observations demeure incertaine (Parks Canada Agency, 2011). À des altitudes semblables à Haida Gwaii, en Oregon, les hermines sont plus nombreuses dans les sites riverains par rapport aux sites de l’intérieur des terres, probablement en raison de la plus forte densité du sous-étage dans les zones riveraines (Doyle, 1990). Les hermines sont aussi plus nombreuses dans les zones riveraines que dans les hautes terres dans le nord de l’île de Vancouver (Mowat et al., 2000) et dans la vallée de l’Okanagan (Gyug, 1994).
S’il est vrai que la plupart des mentions du M. e. haidarum proviennent de l’est de l’archipel, qui est habité, ces résultats ne sont pas nécessairement biaisés. À Haida Gwaii, de nombreux chemins forestiers atteignent de hautes altitudes et ont fait l’objet de relevés, mais peu (12 %) d’observations ont été faites par Reid et al. (2000) à plus de 50 m au-dessus du niveau de la mer. En outre, certaines données montrent que les forêts de basse altitude du côté est des îles représentent un habitat de qualité; les observations d’une sous-espèce d’hermine de taille similaire dans le nord-ouest de l’île de Vancouver (M. e. anguinae), dans un milieu très semblable à ce que l’on trouve à Haida Gwaii, ont aussi été faites dans les arbustaies ouvertes et sèches de l’est de l’île, et non dans les zones accidentées plus élevées et humides de l’ouest (Mowat et al., 2000).
Le grand éventail d’écosystèmes utilisés par l’hermine laisse croire que le choix de l’habitat est surtout relié à l’emplacement des proies ainsi qu’aux conditions qui régissent l’abondance des proies, comme la productivité des sites (Mowat et Poole, 2005). Les campagnols constituent une source importante de nourriture pour les hermines (voir Alimentation), mais ils ne sont pas présents à Haida Gwaii, et on présume que d’autres espèces de petits mammifères et d’oiseaux influent sur l’utilisation de l’habitat du M. e. haidarum. Bien que les hermines soient capables de grimper aux arbres pour atteindre les nids, la majeure partie de la prédation par les hermines a lieu au niveau du sol (King et Powell, 2007), et les structures qui influent sur les proies à ce niveau ont probablement une incidence sur les lieux d’alimentation du M. e. haidarum. Une couverture végétale dense au sol et au niveau du sous-étage (<2 m) est souvent associée avec un grand nombre de petits mammifères proies (Miller et Getz, 1977; Carey et Harrington, 2001). Doyle (1990) a constaté que les proies et les hermines étaient surtout présentes dans les régions de l’Oregon où le sous-étage est dense. Il est difficile d’établir une distinction entre la fonction de sécurité et la fonction d’alimentation, mais la densité de la couverture végétale pourrait aussi être importante sur le plan de la protection contre les prédateurs. La présence de débris ligneux grossiers est corrélée au degré de protection des hermines contre les prédateurs (Samson et Raymond, 1998), ainsi qu’à un nombre accru de petits mammifères (Carey et Harrington, 2001; Fauteux et al., 2012).
En résumé, la présence du M. e. haidarum a été constatée dans divers milieux ouverts et fermés mais, dans la forêt, où la plupart des mentions ont été obtenues, il semble que les ressources alimentaires et la sécurité associées à la végétation du sous-étage soient très importantes. D’après l’habitat aux endroits où le M. e. haidarum a été observé, les caractéristiques importantes sont un sous-étage bien structuré, un tapis végétal étendu, des débris ligneux grossiers, une faible altitude et des forêts riveraines (Burles et al., 2004; Recovery Team, 2009).
Des changements importants ont eu lieu dans les milieux forestiers à Haida Gwaii, mais leurs conséquences directes pour le M. e. haidarum n’ont pas été quantifiées. Les coupes à blanc ont déjà été intensives dans les régions des basses terres de Haida Gwaii (Golumbia, 2000; Martin et Baltzinger, 2002). L’exploitation forestière a lieu dans environ 25 % des forêts CWHwh1, la variante de zone biogéoclimatique qui contient la plupart des mentions du M. e. haidarum (Parks Canada Agency, 2011). Comme les hermines utilisent un grand éventail de milieux, la transformation des forêts anciennes en forêts aux premiers stades successionnels n’a probablement pas d’effet direct sur l’utilisation de l’habitat par le M. e. haidarum (voir Besoins en matière d’habitat). Toutefois, si la population de cerfs augmente en raison de l’existence de forêts aux premiers stades successionnels, il pourrait y avoir une perte de tapis végétal dans les forêts non exploitées et, donc, un risque accru pour le M. e. haidarum.
Les principales tendances en matière d’habitat sont les changements causés à la structure végétale par le cerf de Sitka (Odocoileus hemionus sitkensis; appelé ci-après « cerf »). Introduits en 1878, les cerfs ont colonisé la totalité de l’aire de répartition connue du M. e. haidarum, et toutes les îles de l’archipel sauf 11 (Daufresne et Martin, 1997; Parks Canada Agency, 2012). Les cerfs ont de fortes répercussions sur la végétation du sous-étage des forêts depuis au moins les années 1980 (Pojar et al., 1980; Golumbia, 2000) (figure 5). Dans le cadre d’une comparaison entre des parcelles végétales de 40 m² situées sur des îles occupées par les cerfs (33 cerfs/km²; n = 150 parcelles) et des parcelles situées sur des îles non occupées par les cerfs (n = 16 parcelles), Daufresne et Martin (1997) ont documenté l’absence totale de ronce remarquable (Rubus spectabilis), de salal (Gaultheria shallon), de fougère-aigle (Pteridium aquilinum) et de maïanthème du Canada (Maianthemum dilatatum), ainsi qu’un feuillage fortement réduit chez l’airelle à petites feuilles (Vaccinium parvifolium) et le thuya géant (Thuja plicata). Les quatre premières espèces étaient les espèces du sous-étage les plus abondantes dans les régions non occupées par les cerfs, ce qui indique que le broutage a considérablement réduit l’abondance des espèces végétales les plus communes. Dans le cadre d’une étude en exclos (Bennett, 1996 in Baltzinger et Martin, 1998), une parcelle clôturée de 6 250 m² présentait 750 jeunes thuyas géants par hectare (>1,5 m de haut) comparativement à zéro dans les endroits où les cerfs pouvaient brouter. Les très jeunes arbres de moins de 0,5 m étaient abondants. De même, Stockton et al. (2005) ont constaté que les îles qui abritaient des cerfs depuis plus de 50 ans présentaient moins de 10 % de couverture végétale, par rapport à plus de 80 % pour les îles exemptes de cerfs. La perte d’espèces communes a donné lieu à des forêts très différentes, où la couche arbustive dense a été remplacée par un sol dénudé et des mousses (Pojar et al., 1980; Stockton, 2003).
Figure 5. Photographies montrant la différence dans la végétation du sous-étage entre une zone où les cerfs de Sitka n’ont pas été introduits (île Low; à gauche) et une zone touchée par le broutage des cerfs (île East Limestone; à droite). Source : Martin (2001).

Description longue pour la figure 5
Deux photos illustrant l’impact du broutage par les cerfs sur la végétation du sous-étage. Une photo montre une dense couche arbustive située dans une zone exempte de cerfs de Sitka introduits. L’autre photo montre le sol dénudé et les mousses que l’on trouve habituellement dans les zones touchées par le broutage des cerfs.
On pense que le broutage par les cerfs pourrait avoir un double effet sur le M. e. haidarum : premièrement, la réduction de la végétation du sous-étage a réduit le couvert disponible pour l’espèce, et a probablement accentué la vulnérabilité de celle-ci aux prédateurs aériens et terrestres; deuxièmement, la réduction de la végétation du sous-étage a altéré les populations de proies du M. e. haidarum. Par exemple, la perte d’espèces à petits fruits (salal, Gaylussacia) agirait sur les populations de proies, tandis que la réduction de la maïanthème du Canada et des fougères représenterait une perte de couvert. Allombert et al. (2005a) ont constaté que les îles de Haida Gwaii abritant des cerfs avaient affiché une baisse de l’ordre de 55 à 70 % de la densité des oiseaux chanteurs, par rapport aux îles exemptes de cerfs. La plus grande baisse (93 %) a été constatée dans l’abondance des espèces d’oiseaux les plus dépendantes du sous-étage. Par exemple, le Bruant fauve (Passerella iliaca), le Bruant chanteur (Melospiza melodia), la Paruline verdâtre (Vermivora celata) et le Troglodyte de Baird (Troglodytes pacificus) sont des espèces communes qui nichent au sol ou dans la couche arbustive, et font probablement partie de l’alimentation du M. e. haidarum. Ces espèces étaient toutefois absentes ou considérablement plus rares dans les endroits touchés par le broutage des cerfs depuis plus de 50 ans. La communauté avienne est passée d’une communauté dominée par les espèces du sous-étage à une communauté où la plupart des espèces vivent à la cime des arbres (Allombert et al., 2005a). En outre, la végétation située à un niveau inférieur à la limite du broutage (p. ex. <150 cm) sur les îles abritant des cerfs depuis plus de 50 ans présentait 8 fois moins d’insectes et une densité 6 fois plus faible que sur les îles exemptes de cerfs (Allombert et al., 2005b).
De manière générale, le broutage par les cerfs a réduit la qualité de l’habitat forestier dans la majeure partie de l’aire de répartition du M. e. haidarum, et a vraisemblablement eu des effets considérables sur les populations de l’espèce en raison du risque accru de prédation et de la réduction du nombre de proies. Les graines, les fruits et les insectes associés à la végétation forestière sont consommés par des petits mammifères et des oiseaux, qui constituent à leur tour des éléments de l’alimentation du M. e. haidarum (voir Alimentation); bien qu’elles n’aient pas fait l’objet d’études, il est probable que les petites populations de mammifères aient été touchées par le broutage par les cerfs.
Même si peu d’études ont été effectuées sur la biologie du M. e. haidarum, il est probable que les comportements de reproduction et d’alimentation soient semblables entre les sous-espèces d’hermines, et on peut raisonnablement extrapoler à partir de ces dernières.
Toutes les sous-espèces d’hermines sont polygames, et le domaine vital d’un mâle recouvre celui de plusieurs femelles (Erlinge, 1977). Il est donc très probable que le M. e. haidarum présente le même système de reproduction. Les hermines s’accouplent à l’été ou à l’automne et l’implantation du zygote a lieu printemps suivant (Fagerstone, 1987); la femelle donne naissance 4 semaines plus tard (King, 1983). La taille des portées varie entre 4 et 13 petits, et dépend fortement de l’abondance des proies. En effet, lorsque la densité des proies est très faible, aucun petit n’est produit (Erlinge, 1983; King, 1983; Jedrzejewski et. al., 1998; Korpimaki et al., 1991). Le rapport des sexes à la naissance est de 1:1 (King et Powell, 2007). Les femelles et les mâles atteignent la taille adulte à 4 à 6 mois et à 10 mois, respectivement. Les femelles peuvent être fécondées à l’âge de 3 mois mais, en raison de l’implantation retardée du zygote, l’âge de la première reproduction et de 1 an (Fagerstone, 1987).
Les hermines se reproduisent tôt, ont une courte durée de vie, et leur population varie considérablement d’une année à l’autre en raison des fluctuations des ressources alimentaires (Raymond et Bergeron, 1982; King et Powell, 2007). En Suède, Erlinge (1983) a enregistré un taux de mortalité de 40 % chez les mâles au cours de la première année et de 68 % au cours de la deuxième année, et de 54 % au cours de la première année et de 73 % au cours de la deuxième année chez les femelles. La survie des hermines âgées de 1 an dépend fortement des ressources alimentaires; le taux de mortalité des individus de 1 an est supérieur à 90 % lorsque les populations de proies commencent à diminuer, par rapport à 73 % lorsque davantage de ressources sont disponibles (King et Powell, 2007). La longévité maximale de l’espèce est estimée à 7 ans (Fagerstone, 1987), mais il est très rare d’observer une hermine de 4 ans (1 individu sur 47; 2 %), et la longévité moyenne (après l’indépendance des parents à 3 ou 4 mois) est de 1,4 an chez les mâles et de 1,1 an chez les femelles (Erlinge, 1983). La variable la plus importante qui agit sur la survie est la compétition pour la nourriture par d’autres espèces prédatrices (Erlinge, 1983). Les changements rapides entre des taux de croissance positifs et négatifs qui se produisent sur des périodes de 1 à 2 ans signifient que les populations locales d’hermines sont considérées comme instables (King et Powell, 2007). L’impact d’une telle variabilité sur la faible densité du M. e. haidarum est inconnu, mais on se préoccupe du fait que des épisodes de mortalité stochastiques pourraient avoir des effets considérables sur les sous-populations.
Les données démographiques sur les hermines présentes dans d’autres régions sont utilisées ici, car la durée d’une génération chez le M. e. haidarum est inconnue. Le calcul est le suivant : [1/taux de mortalité annuel estimé des adultes] + âge estimé de la première reproduction. Deux estimations sont produites, car les taux de mortalité des hermines varient considérablement. À un taux de mortalité de 47 % (moyenne entre 40 % chez les mâles et 54 % chez les femelles durant la première année; Erlinge, 1983), et à un âge de la première reproduction de 1 an (voir Cycle vital et reproduction), on estime la durée d’une génération à 3,1 ans. À un taux de mortalité de 90 % (King et Powell, 2007), la durée d’une génération est estimée à 2,1 ans. La durée d’une génération est donc de 2 à 3 ans.
On en sait peu sur les habitudes alimentaires du M. e. haidarum. La seule analyse quantitative de l’alimentation (n = 9) effectuée durant l’examen de l’estomac, des intestins et des excréments a permis de déceler des restes de souris de Keen (Peromyscus keeni) (auparavant le Peromyscus maniculatus keenii et le P. m. sitkensis;Allard et Greenbaum 1988), de musaraigne sombre (Sorex monitcolus elassodon), d’un grand oiseau non identifié (probablement un Larus spp.), de troglodyte de Baird et d’un petit poisson (espèce inconnue) (D. Nagorsen, données inédites in Recovery Team, 2009). On pense aussi que le M. e. haidarum se nourrit d’invertébrés marins dans la zone intertidale. L’espèce s’alimente probablement de carcasses de poisson (p. ex. saumons morts après la fraie [Oncorhynchus spp.] et abandonnés par des ours noirs [Ursus americana]; Reid et al., 2000) et de cerf. On compte six mentions (jusqu’à 1997) de M. e. haidarum pourchassant ou tuant des poulets, et une seule observation d’un M. e. haidarum pourchassant un rat noir (Rattus rattus) et tuant des hirondelles (Hirundo sp.) (Reid et al., 2000). En outre, on compte des cas d’individus s’alimentant de carcasses de rat musqué (Ondatra zibethicus), d’appâts de pièges et d’aliments dans une cuisine (Reid et al., 2000).
En Amérique du Nord, les hermines consomment une grande variété d’espèces (oiseaux, œufs, volaille domestique, mammifères; y compris des carcasses), mais la majeure partie de leur alimentation, de la dynamique de leur population et de leur morphologie est associée à de petits mammifères tels que des musaraignes, des souris et des campagnols (King et Powell, 2007). Le groupe le plus important semble être celui des campagnols, vraisemblablement en raison de leur taille et de leur abondance. Les habitudes de consommation et d’utilisation de l’habitat des hermines sont surtout associées à l’abondance des campagnols, toutes espèces confondues, comme le Microtus oeconomus sur l’île Kodiak, en Alaska (Clark, 1958), le M. montanus dans le Nevada (Fitzgerald, 1977), le Clethrionomys rutilus dans le sud-ouest du Yukon (O’Donoghue et al., 2001) et le M. pennsylvanicus dans les terres agricoles de l’Ontario (Simms, 1979). Les campagnols sont absents de l’archipel Haida Gwaii (Burles et al., 2004), ce qui a soulevé des questions quant aux ressources alimentaires essentielles pour le M. e. haidarum. En effet, il est possible que les populations de M. e. haidarum aient toujours été très faibles vu l’absence d’une ressource alimentaire aussi importante (Reid et al., 2000; Edie, 2001).
Les seules espèces de petits mammifères indigènes à Haida Gwaii qui constituent des proies pour le M. e. haidarum sont la souris de Keen et la musaraigne sombre (Reid et al., 1999, 2000; Burles et al., 2004). La souris de Keen se nourrit de fruits et de graines, et occupe un grand éventail de milieux, du littoral aux régions alpines (Cowan et Guiguet, 1965; Foster, 1965). Des études effectuées sur des sites côtiers de l’Alaska indiquent que l’abondance relative de la souris de Keen est liée à la variabilité annuelle des ressources alimentaires (Hanley et Barnard, 1999a), qui entraîne des fluctuations annuelles considérables de la densité des populations (Hanley et Barnard, 1999b). La musaraigne sombre à Haida Gwaii est quant à elle probablement très dispersée (Foster, 1965). Des individus ont été capturés dans la couverture herbacée au-dessus de la ligne des arbres et le long du littoral rocheux (Burles et al., 2004), mais on considère que l’espèce est moins commune que la souris de Keen (Burles et al., 2004). Par exemple, des pièges photographiques installés sur 21 îles ont permis de documenter 37 souris par rapport à 18 musaraignes (Bergman, 2012). On ignore la taille des populations et les tendances des petits mammifères à Haida Gwaii.
Le M. e. haidarum peut aussi se nourrir d’espèces introduites, soit le rat noir, le rat surmulot (Rattus norvegicus) et l’écureuil roux. Cependant, la faible taille du M. e. haidarum limite vraisemblablement son efficacité à titre de prédateur des écureuils roux ou des rats. En Alberta, l’écureuil roux représente une grande proportion de l’alimentation des hermines, mais les hermines mâles dans cette région pèsent 150 g (n = 10), tandis que les M. e. haidarum mâles ne pèsent que 110 g (n = 4) (Lisgo, 1999) et sont probablement inefficaces comme prédateurs de l’écureuil roux. Les hermines femelles en Alberta pèsent 52 g et s’attaquent rarement aux écureuils roux; les M. e. haidarum femelles pèsent 69 g (n = 2), ce qui laisse croire qu’elles ne s’alimentent pas non plus d’écureuils roux (Burles et al., 2004). Les rats et les rats musqués sont plus gros que l’écureuil roux, et il semble probable que les seuls mammifères proies, outre les carcasses, du M. e. haidarum soient la souris de Keen et la musaraigne sombre.
Les hermines s’alimentent aussi d’oiseaux et d’œufs d’espèces qui nichent au sol ou dans la végétation du sous-étage, ainsi que d’une grande variété d’invertébrés et de fruits (King et Powell, 2007).
Les seuls cas confirmés de prédation du M. e. haidarum proviennent d’une mention de trois individus tués par des chats domestiques (Felis catus; 2 % de toutes les sources de mortalité connues – Reid et al., 2000). La prédation par les ratons laveurs (Procyon lotor) a aussi été avancée comme facteur de déclin. En effet, d’après des observations anecdotiques, on a relevé moins de M. e. haidarum sur l’île Graham (inlet Masset) après que des ratons laveurs aient été introduits dans l’archipel Haida Gwaii (Parks Canada Agency, 2011). Plusieurs espèces d’oiseaux de proie sont présentes à Haida Gwaii, dont l’Autour des palombes de la sous-espèce laingi (Accipiter gentilis laingi), l’Épervier brun (A. striatus), la Buse à queue rousse (Buteo jamaicensis), le Faucon pèlerin de la sous-espèce pealei (Falco peregrinus pealei), le Pygargue à tête blanche (Haliaeetus leucocephalus) et la Petite Nyctale de la sous-espèce brooksi (Aegolius acadicus brooksi). Les autours sont relativement rares; c’est pourquoi le prédateur le plus probable du M. e. haidarum est la Buse à queue rousse. On ignore quelles sont les habitudes alimentaires de ces espèces à Haida Gwaii, mais la modélisation ciblant les oiseaux de proie et les hermines à d’autres endroits indique que les oiseaux de proie peuvent limiter les populations d’hermines, même si celles-ci ne représentent que 1 % de leur alimentation (Powell, 1973).
Des cas de martres d’Amérique (Martes americana) tuant des hermines ont été relevés ailleurs (Weckwerth et Hawley, 1962; Thompson et Colgan, 1990; Jędrzejewski et al., 1995); c’est pourquoi la martre du Pacifique, une espèce très semblable, constitue un prédateur potentiel du M. e. haidarum. L’analyse du contenu stomacal de 152 martres du Pacifique provenant de Haida Gwaii n’a permis de déceler aucun reste de M. e. haidarum (Nagorsen et al., 1991; Nagorsen, 2006), mais des trappeurs ont constaté que des martres du Pacifique se nourrissaient de M. e. haidarum piégés (Burles et al., 2004), et Edie (2001) avance qu’un échantillon beaucoup plus grand d’estomacs de martres du Pacifique serait nécessaire pour révéler la présence d’hermines, et que la prédation d’un faible nombre d’individus seulement serait significative pour la population.
Les hermines ont un métabolisme rapide, et elles doivent consommer de la nourriture pour maintenir leur température corporelle. Les hermines s’alimentent de 5 à 10 fois par jour, et meurent sans apport fréquent d’énergie. Elles consomment environ de 19 à 32 % de leur poids corporel chaque jour (King et Powell, 2007), et il est probable que le M. e. haidarum, de petite taille, ait encore plus besoin de s’alimenter. Les hermines conservent leur chaleur en se mettant à l’abri dans des endroits isolés (p. ex. terriers, sous la neige) plutôt qu’en accumulant des graisses (King et Powell, 2007).
Aucun M. e. haidarum n’a été pisté individuellement, et on ne dispose d’aucune donnée sur les déplacements quotidiens ou sur le domaine vital des individus. Chez les hermines, les mâles comme les femelles sont territoriaux, et le domaine vital du mâle est plus grand. Dans une région forestière et agricole du sud du Québec, le domaine vital des mâles s’étend en moyenne sur 0,2 km² (n = 11), soit une superficie quatre fois plus grande que celle du domaine vital des femelles (0,05 km²; n = 12) (Robitaille et Raymond, 1995). Des domaines vitaux pouvant atteindre 0,25 km² (mâles) et 0,15 km² (femelles) ont été enregistrés dans un milieu semblable du sud de l’Ontario (Simms, 1979). Dans la forêt boréale mixte de l’est de l’Alberta, Lisgo (1999) a constaté une superficie moyenne du domaine vital de 1,5 km² pour les mâles (n = 4) et de 0,8 km² (n = 4) pour les femelles. La disponibilité réduite des ressources alimentaires entraîne l’expansion du domaine vital, puisque les individus doivent se déplacer plus loin pour trouver de la nourriture (King et Powell, 2007).
La densité des hermines est positivement associée aux ressources alimentaires (King et Powell, 2007). En Amérique du Nord, les densités varient entre 4 et 11 individus par kilomètre carré (Fagerstone, 1987). En outre, on a constaté des distances de déplacement quotidiennes (sur 24 h) de 500 m (Robitaille et Raymond, 1995) et de 600 m (Simms, 1979), ainsi que des distances de 6 km sur des périodes de chasse de plusieurs jours (Simms, 1979).
Les jeunes hermines quittent leur mère à environ 3 ou 4 mois, et quittent habituellement leur lieu de naissance à l’automne (Fagerstone, 1997; King et Powell, 2007). La distance de dispersion peut être très grande; un individu en Alaska a parcouru 35 km entre août et mars (Burns, 1964). La densité des mâles adultes territoriaux influe vraisemblablement sur la distance parcourue par les jeunes pour trouver un territoire disponible (King et Powell, 2007).
Selon certains, le M. e. haidarum ne serait pas capable de nager sur plus de 100 m, car la présence de l’espèce n’a pas été constatée sur des îles séparées des îles colonisées par plus de 100 m d’eaux permanentes (Recovery Team, 2009). Toutefois, on sait que des hermines ont pu nager sur une distance de 1,6 km (et peut-être même 2,2 km) pour atteindre des îles de l’Arctique abritant des oiseaux de mer en migration (Cairns, 1985). De plus, un M. e. haidarum a été observé en 1980 sur une estacade à Skaat Harbour, sur l’île Moresby (Reid et al., 2000), ce qui indique que des déplacements encore plus grands sur des débris flottants sont possibles.
Il pourrait y avoir une relation négative entre la martre du Pacifique et le M. e. haidarum. Même si les deux espèces ont vécu ensemble pendant des milliers d’années (Burles et al., 2004), l’augmentation de la population de la martre du Pacifique coïncide avec une baisse de celle du M. e. haidarum. D’après l’expérience de trappeurs enregistrés et certaines observations anecdotiques, on pense que les populations de martres du Pacifique seraient de cinq à dix fois plus grandes à Haida Gwaii par rapport aux années 1940 (Edie, 2001; Reid et al., 2000). En outre, des baisses du nombre de M. e. haidarum piégés ont été constatées après les années 1950 (Reid et al., 2000). Des trappeurs locaux avaient aussi remarqué que le M. e. haidarum était devenu temporairement abondant dans les années 1960, lorsque les populations de martres du Pacifique étaient réduites à la suite d’une grave infestation de tiques (espèce inconnue; Edie, 2001).
On pense que la principale raison de la hausse du nombre de martres de Pacifique serait l’augmentation des populations de mammifères introduits, comme l’écureuil roux, mais surtout la disponibilité des cerfs, introduits à la fin du XIXesiècle (Golumbia, 2000). Avant l’introduction des cerfs, aucune autre source de carcasses d’ongulés n’existait à Haida Gwaii, sauf le caribou de Dawson (Rangifer tarandus dawsoni), une espèce indigène aujourd’hui disparue. Parmi les autres mammifères introduits, on compte le rat noir, le castor (Castor canadensis), le rat musqué, le raton laveur et l’écureuil roux, qui ont été introduits dans l’archipel entre les années 1940 et 1950 (Golumbia, 2000).
La fréquence des mammifères introduits dans les estomacs de martres du Pacifique était de 50 %, tandis que les mammifères indigènes (souris de Keen et musaraigne sombre) représentaient 7 % (Nagorsen, 2006); la présence de poils de cerfs était aussi évidente (à une fréquence de 35 %; Nagorsen et al., 1991). Les écureuils roux introduits représentent quant à eux un faible pourcentage de l’alimentation de la martre du Pacifique (fréquence de 5 %; Nagorsen et al., 1991).
La hausse du nombre de martres du Pacifique pourrait accroître la compétition pour les ressources alimentaires limitées entre cette espèce et le M. e. haidarum. Par exemple, 10 nids de perdrix dotés de caméras de surveillance sur 20 ont été attaqués par des martres du Pacifique en 2013 (Wijdeven, comm. pers., 2014). L’espèce semble être bien adaptée à Haida Gwaii. D’après des trappeurs, les populations sont en hausse, et le contenu en graisse de 85 carcasses de martres du Pacifique fournies par des trappeurs était élevé, même si ces individus avaient été piégés durant les mois de décembre et janvier, lorsque les animaux à fourrure sont généralement moins en santé (Wijdeven, comm. pers., 2014). La prédation directe du M. e. haidarum par la martre du Pacifique est aussi possible (voir Prédation).
Le M. e. haidarum ne semble pas avoir tiré avantage des nouvelles ressources alimentaires disponibles aussi bien que la martre du Pacifique. Il pourrait se nourrir de carcasses de cerf, mais il ne s’agit pas d’un prédateur important pour les rats et l’écureuil roux (voir Alimentation). Il est aussi possible que des espèces introduites consomment les petites proies nécessaires au M. e. haidarum; les populations de souris de Keen et de musaraignes sombres ont diminué sur les îles de Haida Gwaii qui abritent des rats non indigènes (Foster, 1965; Burles et al., 2004), et on sait que les écureuils roux sont des prédateurs de petits mammifères et d’oiseaux nicheurs (Steele, 1998).
Les parasites et les maladies n’ont pas été évalués chez le M. e. haidarum, sauf chez un seul spécimen qui contenait de nombreux strongles pulmonaires (vraisemblablement une espèce d’Aleurostrongylus) (Coates, 2004). De manière générale, les hermines ne sont pas considérées comme vulnérables aux épisodes épizootiques qui entraînent une forte mortalité, mais elles sont vulnérables à la tularémie, à la maladie de Carré, à la maladie aléoutienne du vison (Neovison vison) et aux infections bactériennes, par exemple au Borrelia burgdorferi(King et Powell, 2007). De nombreux parasites helminthes ont été constatés chez les hermines, ainsi que des espèces de pou (Trichodectes ermineae) et de tique (Ixodes gregsoni) qu’on ne trouve que chez les hermines (Jennings et al., 1982; Lindquist et al., 1999).
Voir la section Activités de recherche.
On estime à 263 le nombre de mentions du M. e. haidarum depuis 1898. En 1999, il existait 32 mentions vérifiées dans des archives de musées et au Conservation Data Centre de la Colombie-Britannique (Reid et al., 2000). Des entrevues menées auprès du public ont permis de recueillir 162 autres mentions faites entre 1920 et 1997 (75 % étaient des observations visuelles), y compris des mentions pour les îles Louise (en 1983, 1986, 1993) et Burnaby (1985). Depuis 2001, 23 autres mentions du M. e. haidarum ont été vérifiées d’après des individus piégés, photographiés ou pris par des trappeurs. Environ 1 622 pièges-nuits ont produit des preuves photographiques de la présence de M. e. haidarum à trois sites (deux photographies et une vidéo). En plus des mentions confirmées, des relevés effectués par chien renifleur ont permis de trouver 12 crottes d’hermine (présumées) sur l’île Graham en 2013, et de 4 à 6 en 2014 (Wijdeven, comm. pers., 2014), ce qui représente un nombre inconnu d’individus. Les relevés photographiques menés par le personnel de Parcs Canada sur 68 îles n’ont cependant pas permis de déceler la présence du M. e. haidarum (Bergman, 2012; comm. pers., 2014).
Dans les derniers 20 ans, le plus grand nombre d’individus trouvés en une seule année a été 5 (Reid et al., 2000; Wijdeven et Cober, données inédites), et le plus grand nombre d’individus signalés par le public en une seule année a été 8, en 2007 (Parks Canada Agency, 2011).
En résumé, la taille de la population du M. e. haidarum est inconnue, mais il est probable qu’il existe très peu d’individus, probablement moins de 1 000 adultes. On ignore également quelle est la taille de la population sur chacune des deux principales îles de l’archipel, mais il est possible qu’elle dépasse le seuil de 250 individus matures utilisé par le COSEPAC pour déterminer la situation de l’espèce. Des relevés intensifs ont été effectués selon diverses méthodes, et peu d’observations ont été faites. Les activités de recherche ont été moins nombreuses à haute altitude et dans l’ouest des îles mais, si l’espèce y est présente, il est peu probable que la densité des individus y soit plus élevée que dans les régions ciblées par davantage de relevés; il est même probable qu’elle y soit moins élevée (voir Besoins en matière d’habitat).
On présume qu’il s’est produit une baisse historique de la population du M. e. haidarum, car l’espèce était facilement capturée par le passé.Le premier spécimen trouvé date de 1898 (Preble, 1898), et des collectes de spécimens destinées à des musées ont été accomplies dans le cadre de quatre expéditions (Hall, 1951). D’après Burles et al. (2008), ces premières collectes étaient caractérisées par un faible effort de recherche, mais le taux de piégeage était élevé, ce qui laisse croire que le M. e. haidarum était probablement plus commun au début du XXe siècle qu’aujourd’hui. Osgood (1901) a piégé 4 M. e. haidarum sur une période de 1 mois en 1900; W. Brown en a piégé 3 en 2 semaines en 1914; J. Munro en a pris 4 en 1918; A. Brooks en a pris 5 en 1920 (Nagorsen, données inédites in Edie, 2001). Par contre, des activités de piégeage fondées sur des méthodes semblables et effectuées dans la même région que les premiers relevés, sur une période de 5 ans (1992 à 1997) et plus intensément Activités de recherche (plus de 6 600 pièges-nuits), n’ont permis de repérer que 2 individus (voir; tableau 1). Des méthodes encore plus variées et intensives (relevés routiers, pièges photographiques, chiens renifleurs, etc.) ont été utilisées au cours des derniers 10 ans, et auraient permis de documenter le M. e. haidarum si l’espèce était commune. Plutôt, on ne compte que trois mentions vérifiées ou probables (et peut-être 16 crottes d’un nombre inconnu d’individus) obtenues à partir de 2 319 pièges-nuits avec pièges photographiques, de 7 023 pièges-nuits avec pièges à traces, boîtes-gîtes et pièges à poils, et de 339 km de pistage par chien renifleur, surtout dans des régions où le M. e. haidarum était situé par le passé (tableau 1). Dans les derniers 10 ans, 12 autres individus ont été pris accidentellement par des trappeurs, mais l’ampleur des activités de piégeage est inconnue (Cober, données inédites).
| Activité | Années | Pièges-nuitsNotea | Résultats | Source |
|---|---|---|---|---|
| Piégeage de capture vivante | 1992-1997 | >6 700 | 2 hermines | Reid et al. (2000) |
| Pièges à traces | 1997-1998 | 2 692 | 0 trace d’hermine | Reid et al. (2000) |
| Relevé des traces sur la neige (forêt) | 1997-1998 | - | 0 trace d’hermine sur 23 km | Reid et al. (2000) |
| Relevé des traces sur la neige (route) | 1997-1998 | - | 0 trace d’hermine sur 900 km | Reid et al. (2000) |
| Carcasses de martres du Pacifique | 1983-1986; 2003 |
- | 0 hermine – 152 estomacs | Nagorsen et al. (1991); Nagorsen (2006). |
| Essai de divers types de pièges | Mai 2004 | - | 0 hermine | Burles et al. (2008) |
| Pièges à poils | Mai 2004 | 871 | 0 hermine | Burles et al. (2008) |
| Boîtes-gîtes | Juin 2004 | 3 460 | 2 hermines (probables) | Burles et al. (2008) |
| Relevé des traces sur la neige | 2004 | - | 0 hermine sur 70 km | Burles et al. (2008) |
| Photographie (pellicule) | Juillet 2004 | 99 | 0 hermine | Burles et al. (2008) |
| Photographie (numérique) | Juillet 2005 | 598 | 0 hermine | Burles et al. (2008) |
| Photographie | 2007-2013 | 1 622 | 3 hermines | B. Wijdeven, données inédites (2014) |
| Chien renifleur | 2013 | - | 12 crottes d’hermine (probables) sur 225 km; nombre d’individus inconnu | B. Wijdeven, données inédites (2014) |
| Chien renifleur | 2014 | - | 4 à 6 crottes d’hermine (probables) sur 114 km; nombre d’individus inconnu | B. Wijdeven, données inédites (2014) |
| Emplacement | Pièges-nuits (pièges photographiques x nuits) |
|---|---|
| Ruisseau Crush – autoroute 16 | 84 |
| SPCA – autoroute 16 | 10 |
| Misty Meadows – Tlell | 24 |
| QC Mainline – tronçon 311 | 58 |
| QC Mainline – divers emplacements | 822 |
| QC Mainline – divers emplacements | 168 |
| QC Mainline – divers emplacements | 84 |
| QC Mainline – km 17 | 72 |
| Ruisseau Honna | 120 |
| Réserve écologique Tow Hil | 22 |
| Chemin Chinikundl | 86 |
| Queen Charlotte – autoroute | 28 |
| Queen Charlotte – autoroute | 18 |
| Sentier du lac Spirit | 26 |
| Total | 1 622 |
On pense que la baisse de la population a eu lieu autour des années 1950. Bien qu’on ignore l’ampleur des activités de piégeage, des 161 observations faites par le public, la proportion issue du piégeage a été plus élevée de 1920 à 1950 (n = 12; 34 %) qu’après 1950 (n = 13, 10 %) (Reid et al., 2000). Un relevé intensif des mammifères effectué en 1960-1961 a permis d’obtenir 1 136 spécimens de mammifères de tailles variant entre l’ours noir et la musaraigne sombre sur 39 îles, mais le M. e. haidarum ne fait pas partie des espèces trouvées (Foster, 1965). Les baisses apparentes correspondent à une augmentation des populations de martres du Pacifique et à l’introduction de l’écureuil roux et du raton laveur (voir Relations interspécifiques).
L’absence de nouvelles mentions dans les régions ayant fait l’objet de nouveaux relevés pourrait indiquer que l’espèce a disparu ou que celle-ci persiste sans avoir été détectée par l’échantillonnage. Les activités de relevé ont été intensives dans la région où les mentions sont les plus concentrées, et plus importantes que les activités entreprises antérieurement, lorsque les mentions étaient moins rares. De manière générale, une baisse historique semble évidente. Les menaces varient en intensité, mais sont semblables dans l’ensemble de l’aire de répartition connue de l’espèce. Une baisse de la qualité de l’habitat et de la population est donc inférée (voir Menaces et facteurs limitatifs).
On pense que la baisse de la population a eu lieu autour des années 1950. Bien qu’on ignore l’ampleur des activités de piégeage, des 161 observations faites par le public, la proportion issue du piégeage a été plus élevée de 1920 à 1950 (n = 12; 34 %) qu’après 1950 (n = 13, 10 %) (Reid et al., 2000). Un relevé intensif des mammifères effectué en 1960-1961 a permis d’obtenir 1 136 spécimens de mammifères de tailles variant entre l’ours noir et la musaraigne sombre sur 39 îles, mais le M. e. haidarum ne fait pas partie des espèces trouvées (Foster, 1965). Les baisses apparentes correspondent à une augmentation des populations de martres du Pacifique et à l’introduction de l’écureuil roux et du raton laveur (voir Relations interspécifiques).
L’absence de nouvelles mentions dans les régions ayant fait l’objet de nouveaux relevés pourrait indiquer que l’espèce a disparu ou que celle-ci persiste sans avoir été détectée par l’échantillonnage. Les activités de relevé ont été intensives dans la région où les mentions sont les plus concentrées, et plus importantes que les activités entreprises antérieurement, lorsque les mentions étaient moins rares. De manière générale, une baisse historique semble évidente. Les menaces varient en intensité, mais sont semblables dans l’ensemble de l’aire de répartition connue de l’espèce. Une baisse de la qualité de l’habitat et de la population est donc inférée (voir Menaces et facteurs limitatifs).
Les principales menaces relevées dans le Programme de rétablissement de 2009 sont : les modifications de l’habitat par des espèces introduites (impact élevé); la petite aire de répartition et la faible abondance (impact élevé); la prédation par les espèces indigènes (impact moyen); la compétition pour la nourriture (impact moyen); le piégeage (impact moyen); l’exploitation forestière (impact faible) (Recovery Team, 2009). On pense que trois principales menaces pèsent sur le M. e. haidarum, et leurs effets pourraient être cumulatifs. Ces menaces sont : 1) les changements de la végétation (particulièrement la perte de végétation dans le sous-étage) causés par le broutage des cerfs introduits, qui ont réduit la quantité de couvert permettant au M. e. haidarum de se mettre à l’abri des prédateurs, et probablement aussi le nombre de mammifères et d’oiseaux dont l’espèce se nourrit; 2) la compétition interspécifique et la prédation intraguilde par une population accrue de martres du Pacifique; 3) la mortalité accidentelle dans le cadre d’activités de piégeage visant la martre du Pacifique. Les données sont circonstancielles, et aucune étude inductive n’a été effectuée.
L’impact global des menaces déterminé à partir du tableau d’évaluation des menaces pour le M. e. haidarum est de « moyen » à « faible » (annexe 1). Certaines menaces pourraient être significatives pour le M. e. haidarum, mais elles ont reçu la cote « impact inconnu » en raison du manque de données.
Les effets des cerfs sur la structure des forêts sont documentés à la section Tendances en matière d’habitat. Le broutage par les cerfs (modification du système naturel; autres modifications de l’écosystème) a été évalué comme une menace à impact moyen-faible dans le tableau d’évaluation des menaces (annexe 1). Les cerfs ont réduit le couvert végétal utilisé par le M. e. haidarum pour s’abriter des prédateurs, et ont probablement indirectement causé des baisses des populations d’oiseaux, d’invertébrés et peut-être de petits prédateurs dont se nourrit l’espèce.
Le piégeage du M. e. haidarum est interdit depuis 1985, mais l’espèce est parfois tuée accidentellement dans le cadre des activités de piégeage de la martre du Pacifique. On ignore quels sont les taux de mortalité accidentelle du M. e. haidarum, car les taux de déclaration volontaire sont inconnus. Vingt-cinq M. e. haidarum (15 % des 162 nouvelles mentions obtenues auprès du public) ont été piégés sans être déclarés, et quatre de ceux-ci l’ont été après l’entrée en vigueur de l’interdiction du piégeage (Reid et al., 2000; Edie, 2001). En 2004, plusieurs trappeurs rencontrés étaient d’avis que les prises accessoires étaient minimes (Parks Canada Agency, 2011). L’introduction de pièges à martre du Pacifique certifiés sans cruauté en 2007 a coïncidé avec la mort de cinq M. e. haidarum, ce qui laisse croire que la mortalité associée au piégeage se poursuit, et pourrait même représenter une menace accrue (Parks Canada Agency, 2011). Le piégeage de la martre du Pacifique est autorisé dans les aires protégées provinciales, et il est permis aux membres des Premières Nations dans les aires protégées nationales. Dans la réserve de parc national Gwaii Haanas, la Première Nation Haïda possède 12 lignes de pièges autorisées, mais aucune n’est utilisée activement pour le moment. Ces lignes existaient avant l’établissement de Gwaii Haanas, et aucun nouveau permis de ligne de piège ne sera délivré à l’intérieur des limites de la réserve (Argument, comm. pers., 2014). De manière générale, la gravité de la menace est difficile à déterminer. Il est possible que la superficie occupée par le M. e. haidarum qui est exposée à des activités soutenues de piégeage soit faible (p. ex. 5 % de la zone d’occurrence; Wijdeven, comm. pers., 2014), mais la majeure partie du piégeage a lieu dans la même zone que la plus grande concentration de mentions du M. e. haidarum et, si les effectifs de l’espèce sont aussi faibles que l’on croit, même un faible taux de mortalité par piégeage pourrait être significatif. L’impact de la menace est considéré comme faible dans le tableau d’évaluation des menaces, surtout en raison du faible pourcentage de l’aire de répartition qui fait l’objet du piégeage. Cependant, on se préoccupe du fait que le M. e. haidarum pourrait être menacé si l’intensité du piégeage de la martre du Pacifique augmente; en 2012-2013, cinq M. e. haidarum ont été pris par un seul trappeur (Cober, données inédites).
Des programmes d’éradication des rats ont été mis en œuvre sur plusieurs îles de Haida Gwaii dans le cadre d’un plan visant à accroître la viabilité des oiseaux de mer nicheurs. Les îles visées sont les îles Langara, Lucy et Cox au nord et l’île St. James au sud, et on prévoit étendre l’éradication à 10 autres îles (Golumbia, 2000), dont les îles Bischof, Arichika, Murchison et Faraday (Parks Canada Agency, 2012). On utilise du poison pour éradiquer les rats, ce qui soulève des préoccupations quant à la mortalité possible des M. e. haidarum qui pourraient consommer les appâts ou se nourrir de carcasses d’animaux empoisonnés. On pense que le M. e. haidarumn’a pas été touché par ce programme, car les îles ciblées sont éloignées de l’aire de répartition connue de l’espèce et abritent peu de souris et de musaraignes. En outre, le M. e. haidarum n’y a pas été trouvé dans le cadre de relevés photographiques intensifs effectués avant l’éradication des rats (Bergman, 2012; Parks Canada Agency, 2012). On considère que la menace que représente le programme d’éradication actuel des rats pour le M. e. haidarum est faible.
L’impact de l’exploitation forestière est inconnu, mais on pense qu’il est minime : les coupes touchent environ 25 % des forêts CWHwh1 de l’archipel Haida Gwaii (Parks Canada Agency, 2011), et le M. e. haidarum ne semble pas éviter les zones exploitées. Toutefois, le broutage excessif des cerfs dans les zones de coupe pourrait réduire la couverture végétale dans les blocs de coupe, et accroître la vulnérabilité du M. e. haidarum à la prédation (Parks Canada Agency, 2011).
L’impact des espèces indigènes problématiques sur le M. e. haidarum est documenté dans la section Relations interspécifiques. Certains signes indiquent que le nombre de martres du Pacifique a considérablement augmenté à Haida Gwaii, et on présume qu’il y a un impact pour le M. e. haidarum. Le pelage du M. e. haidarum passe au blanc en hiver, mais la neige est absente de la majeure partie des régions de basse altitude dans l’aire de répartition de l’espèce (Banner et al., 2014), ce qui pourrait accroître la vulnérabilité de celle-ci à la prédation. Bien que la martre du Pacifique soit certainement capable de tuer le M. e. haidarum, et puisse le faire de manière opportuniste, on ne sait pas si la prédation directe par la martre du Pacifique constitue un facteur limitatif pour le M. e. haidarum. Il semble plus probable que la compétition entre les populations grandissantes de martres du Pacifique et le M. e. haidarumpour les ressources alimentaires limitées à Haida Gwaii joue un rôle dans les déclins présumés.
On ne dispose d’aucune preuve d’effet direct des changements climatiques sur le M. e. haidarum; c’est pourquoi l’impact de cette menace est considéré comme inconnu. Il est possible que l’augmentation de la chaleur et de l’humidité au printemps (Doyle, 2008) agisse sur la quantité des graines et des fruits consommés par les proies du M. e. haidarum ou sur le moment où ceux-ci sont disponibles. Même si on ne dispose pas de données sur l’impact de cette menace sur le M. e. haidarum, d’autres prédateurs des petits mammifères à Haida Gwaii, comme les autours, ont connu des échecs de reproduction sur une longue période (Doyle, 2008).
Le nombre de localités est inconnu, mais il est probablement élevé en raison de la variabilité de l’intensité des menaces dans l’ensemble de l’aire de répartition de l’espèce. En effet, on observe des variations de l’effort de piégeage de la martre du Pacifique et de l’intensité du broutage par les cerfs, ainsi que de la disponibilité des proies et de l’abondance des martres du Pacifique sur les quatre îles où la présence du M. e. haidarum a été constatée.
Même si la cote de conservation mondiale de l’hermine est G5 (non en péril), la cote mondiale du M. e. haidarum est G5T2 (en péril; NatureServe, 2014; dernière évaluation en 1996). Le M. e. haidarum s’est vu attribuer la cote nationale N2 (en péril). En raison de la faible taille de la population et de son déclin continu, l’espèce est passée d’espèce préoccupante à espèce menacée selon le COSEPAC (Edie, 2001). Le M. e. haidarum a reçu la cote S2 (en péril) à l’échelle provinciale. Il figure aussi sur la liste rouge de la Colombie-Britannique (ce qui signifie qu’il s’agit d’une espèce menacée ou en voie de disparition).
Environ 52 % de la superficie terrestre de l’archipel Haida Gwaii fait actuellement l’objet d’une protection fédérale ou provinciale contre l’exploitation forestière et minière (Banner et al., 2014). Par exemple, la réserve de parc national Gwaii Haanas et le site du patrimoine haïda (15 % de Haida Gwaii) sont protégés par Parcs Canada en vertu de la Loi sur les parcs nationaux du Canada. Cependant, il est difficile de déterminer la valeur de ces sites, parce qu’on y compte une seule mention du M. e. haidarum, sur l’île Burnaby (BCCDC, 2010). Divers autres sites font l’objet d’une désignation provinciale, comme le parc provincial Naikoon, la réserve écologique Vladimir-Krajina et 11 nouvelles aires de conservation. D’autres parcelles d’habitat convenant au M. e. haidarum pourraient exister dans des aires patrimoniales haïda ou dans des réserves fauniques établies pour plusieurs espèces d’oiseaux nichant dans les milieux forestiers. En dehors des zones protégées, une approche de gestion écosystémique est adoptée pour encadrer les pratiques d’exploitation forestière et pour protéger les zones riveraines dans le cadre du Haida Gwaii Strategic Land Use Agreement (Accord sur l’aménagement stratégique des terres de Haida Gwaii).
Le rédacteur remercie particulièrement Berry Wijdeven d’avoir fourni de l’information aux fins du présent rapport. Frank Doyle a aussi fourni de l’information sur les menaces pesant possiblement sur le M. e. haidarum. Doug Burles a fourni un rapport sur les activités de recherche visant le M. e. haidarum dans les années 2000. Graham Forbes, Dave Fraser, Richard Weir, Patrick Nantel, Louise Waterhouse, Berry Wijdeven et Jenny Wu ont participé à l’exercice d’évaluation des menaces. Berry Wijdeven a fourni des détails approfondis sur les activités de recherche, et Doug Burles a présenté un rapport sur les relevés effectués en 2004-2005. Merci à Jenny Wu qui a préparé plusieurs figures, en plus de calculer la zone d’occupation et l’IZO. Enfin, Graham Forbes et Berry Wijdeven ont fourni des commentaires extrêmement utiles sur une ébauche antérieure du rapport.
Allard, M. et I. Greenbaum. 1988. Morphological variation and taxonomy of chromosomally differentiated Peromyscus from the Pacific Northwest. Canadian Journal of Zoology 66:2734-2739.
Allombert, S., A. Gaston et J-L. Martin. 2005a. A natural experiment on the impact of overabundant deer on songbird populations. Biological Conservation 126:1-13.
Allombert, S., S. Stockton et J-L. Martin. 2005b. A natural experiment on the impact of overabundant deer on forest invertebrates. Conservation Biology 19:1917-1929.
Argument, D. 2014. Resource Conservation Manager, Gwaii Haanas National Park Reserve, National Marine Conservation Area Reserve, and Haida Heritage Site, Parks Canada. Skidegate BC. Correspondance par courriel adressée à Graham Forbes, mai 2014.
B.C. Conservation Data Centre (BCCDC). 2010. Conservation Status Report – Mustela erminea haidarum. B.C. Ministry of Environment. Victoria, BC. [Consulté le 23 mai 2014].
Baltzinger, C. et J-L. Martin. 1998. The effect of browsing by deer on the regeneration of western redcedar in Haida Gwaii. Laseek Bay Research 8:42-65.
Banner, A. (et 5 coauteurs). 2014. A Field Guide to Ecosystem Classification and Identification for Haida Gwaii. Land Management Handbook 68. Province of Brirish Columbia, Victoria, BC. 258 p.
Bennett, J. 1996. The effect of deer browsing on shrub, herbaceous plant growth and cedar regeneration in Sewell Inlet, Queen Charlotte Islands. Western Forest Products. Rapport inédit.
Bergman, C. 2012. Cost Savings in Gwaii Haanas Invasive Species Management: Replacing Raccoon and Rat Surveys with Camera Trapping. Technical Report. Gwaii Haanas archive. Skidegate, BC. Rapport inédit. 18 p.
Bergman, C. 2012. Terrestrial Ecologist, Gwaii Haanas National Park Reserve, National Marine Conservation Area Reserve, and Haida Heritage Site, Parks Canada. Correspondance par courriel adressée à Graham Forbes, juin 2014.
Burles, D., A. Edie et P. Bartier. 2004. Native Land Mammals and Amphibians of Haida Gwaii with Management Implications for Gwaii Haanas National Park Reserve and Haida Heritage Site. Parks Canada Technical Reports in Ecosystem Science Report # 40. 119 p.
Burles, D.W., J. Stuart-Smith, B. Wijdeven, D.W. Nagorsen et T. Husband. 2008. Summary of research activities related to the recovery of Haida Ermine, Mustela erminea haidarum, on Haida Gwaii. Gwaii Haanas National Park Reserve and Haida Heritage Site Technical Report.
Burns, J. 1964. Movements of a tagged weasel in Alaska. Murrelet 45:10.
Byun, S. 1999. Quaternary biogeography of western North America: insights from mtDNA phylogeography of endemic vertebrates from Haida Gwaii. Thèse de doctorat. University of Victoria. Victoria, BC.
Cairns, D. 1985. Ermine visitation to Black Guillemot colonies in northeastern Hudson Bay. The Condor 87:144-145.
Carey, A. et C. Harrington 2001. Small mammals in young forests: implications for management for sustainability. Forest Ecology and Management 154:289-309.
Carr, S.M. et S. Hicks. 1997. Are there two species of Marten in North America? Genetic and evolutionary relationships within Martes. p. 15-28 in Proulx, G., Bryant, H.N., Woodard, P.M. (Eds.), Martes: Taxonomy, Ecology, Techniques, and Management. The Provincial Museum of Alberta, Edmonton.
Clark, W. 1958. The land mammals of the Kodiak Islands. Journal of Mammalogy 39:574-577.
Coates, J. 2004. Pathology report on QC Island Ermine, cat. 2004.03426. October 26, 2004, Abbotsford, BC.
Cober, A. Données inédites sur des spécimens morts d’hermines appartenant au gouvernement provincial. Fournies à B. Wijdeven. Juillet 2014.
Collison, V. 2004. Haida Ermine – Traditional Knowledge. Rapport inédit, Masset BC. 3 p.
Cook, J., N. Dawson et S. MacDonald. 2006. Conservation of highly fragmented systems: The north temperate Alexander Archipelago. Biological Conservation 133:1-15.
Cowan, I.M. 1989. Birds and mammals on the Queen Charlotte Islands. p. 175-186 inG. Scudder and N. Gessler, (Eds.). The Outer Shores: Queen Charlotte Islands Museum Press. Queen Charlotte, BC.
Cowan, I.M. et C. Guiguet. 1960. The Mammals of British Columbia. British Columbia Provincial Museum, Victoria, BC. 413 p.
Daufresne, T. et J-L. Martin. 1997. Changes in vegetation structure and diversity as a result of browsing by a large herbivore: the impact of introduced black tail deer in the primary forest of Haida Gwaii. Laskeek Bay Report on Scientific Activities 7:2-26.
Dawson, N., A. Hope, S. Talbot et J. Cook. 2014. A multilocus evaluation of ermine (Mustela erminea) across the Holarctic, testing hypotheses of Pleistocene diversification in response to climate change. Journal of Biogeography 41:464-475.
Doyle, A. 1990. Use of riparian and upland habitats by small mammals. Journal of Mammalogy 71:14-23.
Doyle, F. 2008. Breeding success of the goshawk (A. g. laingii) on Haida Gwaii/Queen Charlotte Islands, 2008. Report to Gwaii Forest Society and Western Forest Products Inc. Report by Wildlife Dynamics Consulting, Inc., Telkwa, BC.
Doyle, Frank. Communication personnelle. 2014. Biologist, Wildlife Dynamics Consulting, Telkwa, British Columbia. Correspondance par courriel adressée à D. A. Kirk, février 2014.
Edie, A. 2001. Update COSEWIC status report on Queen Charlotte Islands Ermine (Mustela erminea haidarum L.). COSEWIC Secretariat, Ottawa.
Eger, J.L. 1990. Patterns of geographic variation in the skull of Nearctic Ermine (Mustela erminea). Canadian Journal of Zoology 68:1241-1249.
Erlinge, S. 1977. Spacing strategy in the stoat Mustela erminea. Oikos 28:32-42.
Erlinge, S. 1983. Demography and dynamics of a stoat Mustela erminea population in a diverse community of invertebrates. Journal of Animal Ecology 52:705-726.
Fagerstone, K.A. 1987. Black-footed ferret, long-tailed weasel, short-tailed weasel and least weasel. p. 549-573 inM. Novak, J.A. Baker, M.E. Obbard and M. Malloch (editors). Wild Furbearer Management and Conservation in North America. Ontario Fur Managers Federation and Ontario Ministry of Natural Resources. Queen’s Printer, Toronto, ON.
Fauteux, D., L. Imbeau, P. Drapeau et M. Mazerolle. 2012. Small mammal response to coarse woody debris distribution at different spatial scales in managed and unmanaged boreal forest. Forest Ecology and Management 266:194-205.
Fitzgerald, B. 1977. Weasel predation on a cyclic population of the montane vole (Microtus montanus) in California. Journal of Animal Ecology 46:367-397.
Fleming, M.A. et J.A. Cook. 2002. Phylogeography of endemic Ermine (Mustela erminea) in southeast Alaska. Molecular Ecology 11:795-807.
Foster, J.B. 1965. The evolution of the mammals of the Queen Charlotte Islands, British Columbia. Number 14. Occasional Papers of the British Columbia Provincial Museum. Victoria, BC.
Golumbia, T.E. 2000. Introduced species management in Haida Gwaii (Queen Charlotte Islands). Proceedings of Biology and Management of Species and Habitats at Risk, Kamloops, BC, 15-19 Feb.
Gyug, L, 1994. Wildlife use of logging debris piles in clearcuts. Technical Report to British Columbia Ministry of the Environment. Penticton, BC. 45 p.
Hall, E.R. 1944. Four new Ermines from the islands of southeastern Alaska. Proceedings Biological Society of Washington. 57:34-41.
Hall, E.R. 1981. The Mammals of North America. Vol. 2. John Wiley and Sons, NY, USA. 1181 p.
Hall, E.R., 1945. A revised classification of the American Ermines with a description of a new subspecies from the western Great Lakes region. Journal of Mammalogy 26:175-182.
Hall. E.R., 1951. American Weasels. University of Kansas Publication of the Museum of Natural History 4:1-466.
Hanley, T. et J. Barnard. 1999a. Food resources and diet composition in riparian and upland habitats for Sitka mice, Peromyscus keeni sitkensis. Canadian Field-Naturalist 113:401-407.
Hanley, T. et J. Barnard. 1999b. Spatial variation in the population dynamics of Sitka mice in floodplain forests. Journal of Mammalogy 80:866-879.
Jędrzejewski, W., B. Jędrzejewska et L. Szymura. 1995. Weasel population response, home range and predation on rodents in a deciduous forest in Poland. Ecology 76:179-195.
Jennings, D., W. Threlfall et D. Dodds. 1982. Metazoan parasites and food of short-tailed weasels and mink in Newfoundland, Canada. Canadian Journal of Zoology 60:180-183.
King, C. et R. Powell. 2007. The Natural History of Weasels and Stoats: Ecology, Behavior, and Management. Oxford University Press, New York, NY. 446 p.
King, C.M. 1983. Mustela erminea. Mammalian Species No. 195. American Society of Mammalogists.
Korpimäki, E., K. Norrdahl et T. Rinta-Jaskari. 1991. Responses of stoats and least weasels to fluctuating food abundances: is the low phase of the vole cycle due to mustelid predation? Oecologia 88:552-561.
Lindquist, E., K. Wu et J. Redner. 1999. A new species of tick genus Ixodes (Acari:Ixodidae) parasitic on mustelids (Mammalia:Carnivora) in Canada. Canadian Entomologist 131:151-170.
Lisgo, K. 1999. Ecology of the short-tailed weasel (Mustela erminea) in the mixedwood boreal forest of Alberta. Mémoire de maîtrise. University of British Columbia, Vancouver, BC; 65 p.
Martin, J.L. 2001. Reef, low, and limestone. Spruce Roots Magazine. [Consulté en octobre 2014].
Martin, J-L. et C. Baltzinger. 2002. Interaction among deer browsing, hunting, and tree regeneration. Canadian Journal of Forest Research 32:1254-1264.
Miller, D. et L. Getz. 1977. Factors influencing local diversity and species diversity of small mammals in New England. Canadian Journal of Zoology 55:806-814.
Mowat, G. et Poole, K.G. 2005. Habitat associations of short-tailed weasels in winter. Northwest Science 79: 28-36.
Mowat, G., C. Surgot et K.G. Poole. 2000. Using track plates and remote cameras to detect marten and short-tailed weasels in coastal cedar hemlock forests. Northwestern Naturalist 81:113-121.
Nagorsen, D.W. 1990. The Mammals of British Columbia. Royal British Columbia Museum, Victoria, BC. 140 p.
Nagorsen, D.W. 2006. Haida Gwaii American Marten (Martes americana) study. Final report 28 June 2006. Mammalia Biological Consulting, Victoria, BC.
Nagorsen, D.W., R.W. Campbell et G.R. Giannico. 1991. Winter food habits of Marten, Martes americana in Haida Gwaii. Canadian Field-Naturalist 105:55-59.
O’Donaghue, M., S. Boutin, E. Hofer et R. Boonstra. 2001. Other mammalian predators. p. 324-336 in C. Krebs, S. Boutin et R. Boonstra (eds.). Ecosystem Dynamics of the Boreal Forest: The Kluane Project. Oxford University Press, NY. 511 p.
Osgood, W. 1901. Natural history of the Queen Charlotte Islands, British Columbia; Natural History of the Cook Inlet Region, Alaska. North American Fauna 21:1-87.
Parks Canada Agency. 2011. Recovery Strategy for the Ermine, haidarum subspecies (Mustela erminea haidarum), in Canada. Species at Risk Act Recovery Strategy Series. Parks Canada Agency. Ottawa iv + 3 p + Appendices. (Également disponible en français : Agence Parcs Canada. 2011.
Programme de rétablissement de l’hermine de la sous-espèce haidarum (Mustela erminea haidarum) au Canada. Loi sur les espèces en péril. Série de Programmes de rétablissement. Agence Parcs Canada, Ottawa iv + 3 p. + annexes.)
Parks Canada Agency. 2012. Night Birds Returning: Feasibility Study for Removal of Black Rats from Murchison and Faraday Islands. Gwaii Haanas National Park Reserve, National Marine Conservation Reserve and Haida Heritage Site, Skidegate, BC. Rapport inédit. 70 p.
Pojar, J., Lewis, T., Roemer, H. et J. Wilford 1980. Relationships between Introduced Black-tailed Deer and the Plant Life in the Queen Charlotte Islands, British Columbia. BC Ministry of Forest, Smithers, BC.
Powell, R. 1973. A model for raptor predation on weasels. Journal of Mammalogy 54:259-263.
Preble, E.A., 1898. Description of a new weasel for the Queen Charlotte Islands, British Columbia. Proceedings Biological Society of Washington 12:169-170.
Raymond, M. et J-M. Bergeron. 1982. Résponse numérique de l’hermine aux fluctuations d’abondance de Microtus pennsylvanicus. Canadian Journal of Zoology 60:542-549.
Recovery Team. 2009. (Ermine, haidarum subspecies Recovery Team. 2009). Recovery Strategy for the Ermine, haidarumsubspecies (Mustela erminea haidarum) in British Columbia. Prepared for the British Columbia Ministry of Environment, Victoria, BC. 23 p.
Reid (et 6 coauteurs). 1999. Status and management of ermine on the Queen Charlotte Islands, British Columbia. Forest Research Extension Note EN-001 March 1999. BC Ministry of Forests. 4 p.
Reid, D., L. Waterhouse, P. Buck, A. Derocher, R. Bettner et C. French. 2000. Inventory of the Queen Charlotte Islands Ermine. p. 393-406 inL.M. Darling, editor. Proceedings of a Conference on the Biology and Management of Species and Habitats at Risk. B.C. Ministry of Environment, Lands & Parks, Victoria, BC and University College of the Cariboo, Kamloops, BC.
Reimchen, T. et A. Byun. 2005. p. 77-95 inD.W. Fedje and R.W. Mathewes (eds.). Haida Gwaii: Human History and Environment from the Time of the Loon to the Time of the Iron People. UBC Press, Vancouver, BC.
Robitaille, J-F. et M. Raymond. 1995. Spacing patterns of Ermine, Mustela erminea L., in a Quebec agrosystem. Canadian Journal of Zoology 73:1827-1834.
Samson, C. et M. Raymond. 1998. Movement and habitat preference of radio tracked stoats, Mustela erminea, during summer in southern Quebec. Mammalia 62:165-174.
Simms, D. 1979. Studies of an ermine population in southern Ontario. Canadian Journal of Zoology 57:824-832.
Steele, M. 1998. Tamiasciurus hudsonicus. Mammalian Species. 586:1-9.
Stockton, S. 2003. The Effect of Introduced Sitka Black-tailed Deer, Odocoileus hemionus sitkensis on the Forest Understorey Plant Communities of Haida Gwaii, British Columbia: Pattern, Process and Recovery. Thèse de doctorat. University of Ottawa, Ottawa, ON. 235 p.
Stockton, S., S. Allombert, A. Gaston et J-L Martin. 2005. A natural experiment on the effects of high deer densities on the native flora of coastal temperate rain forests. Biological Conservation 126:118-128.
Thompson, I.D., I.J. Davidson, S. O’Donnell et F. Brazeau. 1989. Use of track transects to measure the relative occurrence of some boreal mammals in uncut forest and regeneration stands. Canadian Journal of Zoology 67:1816-1823.
Weckworth, R. et V. Harley. 1962. Marten food habits and population fluctuations in Montana. Journal of Wildlife Management 26:55-74.
Wijdeven, Berry. 2014. Biologist, Government of British Columbia. Correspondance par courriel adressée à D. A. Kirk et à Graham Forbes, janvier, février et mai 2014.
Wilson, D. et D. Reeder. 2005. Mammal Species of the World. Vol. 1. Johns Hopkins Press, Baltimore, USA. 743 p.
Wilson, T. et A. Carey. 1996. Observations of weasels in second-growth Douglas-fir forests in the Puget Trough, Washington. Northwestern Naturalist 77:35-39.
David Anthony Kirk est un chercheur en écologie et un consultant qui a travaillé pendant 25 ans pour les gouvernements fédéral et provinciaux du Canada ainsi que pour des organismes de conservation non gouvernementaux. David a rédigé et corédigé plus de 35 articles scientifiques et chapitres d’ouvrage dans les 20 dernières années, y compris 26 rapports de situation et mises à jour du COSEPAC, ainsi que 9 ébauches de programmes de rétablissement, 6 plans d’action et 9 plans de gestion d’espèces en péril. Il a aussi rédigé un plan d’action préliminaire visant de multiples espèces des prairies dans le sud-est de la Saskatchewan.
Aucune collection n'a été examinée dans le cadre de la préparation du présent rapport de situation du COSEPAC.
Espèce: Mustela erminea haidarum
Date : 12/02/2014
Évaluateurs : David Kirk (rédacteur du rapport), Graham Forbes (coprésident du SCS MT), Dave Fraser (C.-B.), Patrick Nantel (Parcs Canada), Berry Wijdeven (président de l’équipe de rétablissement), Louise Waterhouse (équipe de rétablissement)
| Impact des menaces | Maximum de la plage d'intensité | Minimum de la plage d'intensité |
|---|---|---|
| A - Très élevé | 0 | 0 |
| B - Élevé | 0 | 0 |
| C - Moyen | 1 | 0 |
| D - Faible |
1 | 2 |
| Impact global des menaces calculé : | Moyen | Faible |
Valeur de l'impact global attribuée :
Ajustement de la valeur de l'impact – justification :
Impact global des menaces – commentaires : La durée d'une génération est faible; 3 ans maximum.
| [No.] | Menace | [Impact des menaces] | Impact (calculé) | Portée (10 prochaines années) | Gravité (10 ans ou 3 générations) | Immédiateté | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial | - | Négligeable | Négligeable (<1 %) | Négligeable (<1 %) | Élevée (Constante) | - |
| 1.1 | Habitations et zones urbaines | - | Négligeable | Négligeable (<1 %) | Négligeable (<1 %) | Élevée (Constante) | On sait que les chats domestiques peuvent tuer l’espèce en région urbaine, mais l’impact est négligeable. Menace mineure. |
| 1.2 | Zones commerciales et industrielles | - | Négligeable | Négligeable (<1 %) | Négligeable (<1 %) | Élevée (Constante) | - |
| 1.3 | Tourisme et espaces récréatifs | - | - | - | - | - | Non problématique |
| 2 | Agriculture et aquaculture | - | - | - | - | - | - |
| 2.1 | Cultures annuelles et pluriannuelles de produits autres que le bois | - | - | - | - | - | Non problématique |
| 2.2 | Plantations pour la production de bois et de pâte | - | - | - | - | - | Non problématique |
| 2.3 | Élevage et élevage à grande échelle | - | - | - | - | - | Non problématique |
| 2.4 | Aquaculture en mer et en eau douce | - | - | - | - | - | Non problématique |
| 3 | Production d’énergie et exploitation minière | - | Pas une menace | Négligeable (<1 %) | Neutre ou avantage possible | Élevée (Constante) | - |
| 3.1 | Forage pétrolier et gazier | - | - | - | - | - | Non problématique |
| 3.2 | Exploitation de mines et de carrières | - | Pas une menace | Négligeable (<1 %) | Neutre ou avantage possible | Élevée (Constante) | Il y a un certain nombre de carrières, mais elles ne posent pas de problème; les hermines utilisent les amas de roches. |
| 3.3 | Énergie renouvelable | - | - | - | - | - | Non problématique |
| 4 | Corridors de transport et de service | - | Négligeable | Négligeable (<1 %) | Négligeable (<1 %) | Élevée (Constante) | - |
| 4.1 | Routes et voies ferrées | - | Négligeable | Négligeable (<1 %) | Négligeable (<1 %) | Élevée (Constante) | Aucune voie ferrée et seulement une grande autoroute. La mortalité routière existe, mais elle est probablement négligeable. Moins de 1 % de la population traverserait des routes, et la majorité réussirait; on ne compte que 1 ou 2 cas de mortalité routière confirmée. |
| 4.2 | Lignes de services publics | - | Négligeable | Négligeable (<1 %) | Négligeable (<1 %) | Élevée (Constante) | Menace encore plus faible que 4.1. |
| 4.3 | Transport par eau | - | - | - | - | - | Non problématique |
| 4.4 | Trajectoires de vol | - | - | - | - | - | Non problématique |
| 5 | Utilisation des ressources biologiques | D | Faible | Petite (1-10 %) | Modérée – légère (1-30 %) |
Élevée (Constante) | - |
| 5.1 | Chasse et prélèvement d’animaux terrestres | D | Faible | Petite (1-10 %) | Modérée – légère (1-30 %) |
Élevée (Constante) | Quelle proportion de la population est visée par la chasse ou le piégeage? * Chasse = Zéro. * Piégeage = devrait être zéro, mais des prises accidentelles ont lieu. Quelle proportion n’est pas exposée? * 95 %; zone de piégeage restreinte. * La Portée devrait être petite. Quelle proportion de la baisse de la population est attribuable au piégeage? * Les données indiquent que de 4 à 6 individus ont été trouvés dans la même aire de piégeage. * Le piégeage est peu fréquent, mais pourrait être plus important puisque le nombre d’individus est faible. * Les trappeurs disent voir davantage d’hermines prises accidentellement. * Pour la population touchée, la Gravité se situerait dans la limite supérieure de la plage de modérée à légère (entre 10 et 30 %) |
| 5.2 | Cueillette de plantes terrestres | - | - | - | - | - | Non problématique |
| 5.3 | Exploitation forestière et récolte du bois | - | Inconnu | Petite (1-10 %) | Inconnue | Élevée (Constante) | Quel pourcentage de la population est touché par l’exploitation forestière? * 1 à 10 %. Les coupes sont-elles mauvaises pour l’espèce? Un déclin est-il prévu? * On ne sait pas, mais les hermines sont généralistes; des données indiquent qu’elles utilisent les zones de coupe. Gravité = inconnue. * Pourrait avoir un impact à court terme, mais probablement pas à long terme, sauf si les populations de cerfs augmentent davantage (broutage accru). |
| 5.4 | Pêche et récolte de ressources aquatiques | - | - | - | - | - | Non problématique |
| 6 | Intrusions et perturbations humaines | - | - | - | - | - | Inconnu. |
| 7 | Modification du système naturel | CD | Moyen - faible | Généralisée (71-100 %) | Modérée – légère (1-30 %) |
Élevée (Constante) | - |
| 7.1 | Incendies et lutte contre les incendies | - | - | - | - | - | Pas de lutte contre les incendies – les incendies sont rares, et il n’y en a pas eu depuis longtemps. Quelle superficie des îles de la Reine-Charlotte devrait brûler dans les 10 prochaines années? * 3 feux l’an dernier ont couvert 3 hectares. |
| 7.2 | Barrages, gestion et utilisation de l’eau | - | - | - | - | - | Non problématique |
| 7.3 | Autres modifications de l’écosystème | CD | Moyen - faible | Généralisée (71-100 %) | Modérée – légère (1-30 %) |
Élevée (Constante) | L’impact n’est pas connu de manière explicite, mais les cerfs éliminent le sous-étage forestier et, donc, la capacité des hermines de s’abriter des prédateurs. * Certaines îles n’ont pas été touchées. * Des études montrent que des oiseaux ont été touchés, mais l’impact pour les mammifères est difficile à estimer; baisse de 40 à 60 % chez les oiseaux touchés. Les petits mammifères se limitent à des souris et à des musaraignes. * Peu d’analyses du contenu stomacal ont été effectuées, mais des restes d’oiseaux ont été trouvés. Gravité : On considère qu’une gravité modérée à légère (11 à 30 %) est appropriée. |
| 8 | Espèces et gènes envahissants ou problématiques | - | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (Constante) | - |
| 8.1 | Espèces exotiques/non indigènes envahissantes | - | Négligeable | Négligeable (<1 %) | Légère (1-10 %) | Élevée (Constante) | Les hermines sont attirées par les poulaillers et les garages dans les zones peuplées, mais les sites urbains sont plutôt petits; c’est pourquoi, en pourcentage, l’impact est faible. Moins de 1 %. Chats * 2 individus ont été tués par des chats en milieu urbain; probablement plus ailleurs. Ratons laveurs et rats * Impact inconnu, mais les rats ont réduit le nombre de proies pour l’espèce. |
| 8.2 | Espèces indigènes problématiques | - | Inconnu | Généralisée (71-100 %) | Inconnue | Élevée (Constante) | Martre du Pacifique * La martre du Pacifique est un compétiteur important des hermines pour la nourriture. * Une martre du Pacifique peut manger une hermine. * Les connaissances locales indiquent que les martres du Pacifique ont augmenté (en raison de la diminution du piégeage), et comblent la niche. Prédateurs aériens * Autours; menace peu probable en raison de leur rareté. On prévoit une baisse soutenue du nombre d’hermines (3 à 30 %) dans les prochains 10 ans, mais ce n’est pas sûr. |
| 8.3 | Introduction de matériel génétique | - | - | - | - | - | Non problématique |
| 9 | Pollution | - | - | - | - | - | Non problématique |
| 10 | Phénomènes géologiques | - | Pas une menace | Négligeable (<1 %) | Neutre ou avantage possible | Élevée (Constante) | - |
| 10.1 | Volcans | - | - | - | - | - | Les volcans sont inactifs depuis des milliers d’années. |
| 10.2 | Tremblements de terre et tsunamis | - | - | - | - | - | Des tremblements de terre et des tsunamis sont possibles. La zone touchée serait grande, mais l’impact serait faible si la majeure partie de la population se trouve dans l’est des îles. |
| 10.3 | Avalanches et glissements de terrain | - | Pas une menace | Négligeable (<1 %) | Neutre ou avantage possible | Élevée (Constante) | Les zones vulnérables aux glissements de terrain sont petites. Menace négligeable. |
| 11 | Changements climatiques et phénomènes météorologiques violents | - | - | - | - | - | Haida Gwaii augmente en humidité mais, pour les prochains 10 ans, cet impact est négligeable. Il s’agit plutôt d’une préoccupation à long terme sur le plan des ressources alimentaires. |