Évaluation et Rapport de situation du COSEPAC sur le pin flexible (Pinus flexilis) au Canada -2014

Photo: C. Smith.
Description longue de la bannière
Photo d'un pin flexible (Pinus flexilis) mature, dont le houppier est arrondi et fortement ramifié.
- Table des matières
- COSEPAC Sommaire de l'évaluation
- Sommaire de l'évaluation – novembre 2014
- COSEPAC Résumé
- Résumé technique
- Données démographiques
- Information sur la répartition
- Number of Mature Individuals
- Analyse quantitative
- Menaces (réelles ou imminentes pour les sous-populations ou leur habitat)
- Immigration de source externe (immigration de l'extérieur du Canada)
- Historique du statut
- Statut et justification de la désignation :
- Applicabilité des critères
- Historique du COSEPAC
- Mandat du COSEPAC
- Composition du COSEPAC
- Définitions (2014)
- Description et importance de l'espèce sauvage
- Répartition
- Habitat
- Biologie
- Taille et tendances de la population
- Menaces et facteurs limitatifs
- Protection, statuts et classements
- Remerciements et experts contactés
- Sources d'information
- Sommaire biographique du rédacteurs du rapport
- Collections Examinées
- Tableau 1. Taux de mortalité du pin flexible dans les Rocheuses canadiennes (d'après Smith et al., 2011a).
- Tableau 2. Évaluation des menaces pesant sur le pin flexible (IUCN et CMP, 2006).
- Tableau 3. Déclin estimé de la population de pin flexible au Canada sur 100 ans, avec plage de taux de mortalité probables.
COSEWIC
Committee on the Status
of Endangered Wildlife
in Canada

COSEPAC
Comité sur la situation
des espèces en péril
au Canada
Les rapports de situation du COSEPAC sont des documents de travail servant à déterminer le statut des espèces sauvages que l'on croit en péril. On peut citer le présent rapport de la façon suivante :
COSEPAC. 2014. Évaluation et Rapport de situation du COSEPAC sur le pin flexible (Pinus flexilis) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xi + 55 p.
Le COSEPAC remercie Peter L. Achuff d'avoir rédigé le rapport de situation sur le pin flexible (Pinus flexilis) au Canada, avec le soutien financier de Parcs Canada. La supervision et la révision du rapport ont été assurées par Patrick Nantel, représentant de Parcs Canada au COSEPAC, avec l'appui de Bruce Bennett, coprésident du Sous-comité de spécialistes des plantes vasculaires.
Pour obtenir des exemplaires supplémentaires, s'adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-938-4125
Téléc. : 819-938-3984
Courriel : COSEPAC courriel
Site web : COSEPAC
Also available in English under the title COSEWIC Assessment and Status Report on the Limber Pine Pinus flexilis in Canada.
Pin flexible -- Photo: C. Smith.


Pin flexible
Pinus flexilis
Le pin flexible mesure généralement 3 à 15 m de hauteur et possède un houppier arrondi et très ramifié. Ses aiguilles sont réunies en faisceaux de cinq. Les cônes femelles sont ovoïdes, brun clair à brun verdâtre, longs de 7 à 15 cm et larges de 4 à 6 cm. Ils s'ouvrent pour libérer les graines, puis tombent au sol. Les graines sont grosses, brunes, longues de 10 à 15 mm et généralement dépourvues d'ailes.
Les cernes de croissance annuelle du pin flexible peuvent fournir des renseignements sur le climat et le débit des cours d'eau des 500 à 1000 dernières années, alors que les données historiques ne sont généralement disponibles que pour les 100 dernières années, tout au plus. Ces renseignements sont importants, car ils nous permettent de comprendre et prévoir le changement climatique, y compris les sécheresses et le débit des cours d'eau. En outre, le pin flexible est une espèce clé, car il joue un rôle d'abri pour d'autres espèces, et ses graines constituent une importante source de nourriture pour les ours, les petits mammifères et les oiseaux.
Le pin flexible est naturellement limité à l'ouest de l'Amérique du Nord et se rencontre depuis le sud-est de la Colombie-Britannique et le sud-ouest de l'Alberta jusque dans le nord de l'Arizona, le Nouveau-Mexique et le sud de la Californie. Au Canada, il se rencontre dans le sud-est de la Colombie-Britannique, le long du côté est du sillon des Rocheuses, depuis les environs de la ville de Field jusque près de la frontière avec les États-Unis, ainsi que dans le sud-ouest de l'Alberta, dans les Rocheuses et leurs contreforts, depuis les environs des plaines Kootenay jusqu'à la frontière avec les États-Unis.
Au Canada, le pin flexible se rencontre généralement dans des sites chauds et secs, dans les portions inférieures des montagnes et des contreforts, à une altitude de 850 à 1900 m. Certains individus peuvent pousser à une altitude d'environ 2000 m, où ils peuvent former des peuplements mixtes avec le pin à écorce blanche. Le pin flexible peut se rencontrer dans des sites d'altitude relativement haute ou basse, à la limite des arbres. Il pousse sur des versants peu inclinés à escarpés généralement exposés au sud ou à l'ouest. En Colombie-Britannique, la majeure partie des peuplements de pin flexible se trouvent sur des falaises et des crêtes escarpées, alors qu'en Alberta certains peuplements se trouvent dans des terrains, des crêtes rocheuses et des affleurements rocheux à pente douce. Les sites occupés par le pin flexible sont souvent exposés aux forts vents, en plus de présenter un sol peu profond à drainage bon à rapide et de se situer sur les versants où les températures sont élevées, ce qui créée des conditions de sécheresse.
Le pin flexible est longévif et vit fréquemment plusieurs centaines d'années, et des individus âgés de plus de 1000 ans ont déjà été observés. Les individus commencent à produire des cônes vers l'âge de 50 ans, mais parfois à un âge plus avancé, et atteignent leur pic de production seulement des dizaines d'années plus tard. La production de cônes est irrégulière, et la production de graines est très faible certaines années. Les graines sont principalement dispersées par les oiseaux, mais aussi par de petits mammifères. Cependant, la plupart des semis sont issus des graines dispersées par les oiseaux, de sorte que la dispersion par les petits mammifères contribue peu au recrutement. Les caractéristiques physiologiques des semis et des individus plus âgés leur permettent de tolérer les conditions environnementales difficiles, particulièrement la sécheresse.
Le pin flexible dépend des champignons mycorhiziens, car ceux-ci permettent aux racines de prélever les éléments nutritifs et participent à la protection des racines contre les agents pathogènes. Toutefois, d'autres types de champignons peuvent endommager les graines, les tiges et les racines de l'espèce. En outre, les chenilles d'un petit papillon rare au Canada se nourrissent exclusivement des aiguilles du pin flexible.
Au Canada, le nombre d'individus matures s'élèverait à environ 44,4 millions. La population canadienne diminue à un taux annuel moyen d'environ 1 % et pourrait donc avoir diminué de 66 % en 100 ans. Il est irréaliste de penser que l'effectif canadien pourrait être rétabli à partir des populations des États-Unis, car ces populations sont soumises aux mêmes menaces que celles observées au Canada, et plusieurs sont également en déclin.
Dans toute son aire canadienne, le pin flexible est menacé de manière grave et imminente par la rouille vésiculeuse du pin blanc (causée par une espèce introduite), le dendroctone du pin ponderosa et le changement climatique. Chacune de ces trois menaces pèse gravement sur l'espèce, et elles interagissent d'une manière qui accentue la gravité de leurs répercussions. On prévoit que le changement climatique causera une augmentation de la fréquence, de l'intensité et de la durée des sécheresses ainsi que de la fréquence et de la gravité des incendies. En outre, les individus soumis au stress sont probablement plus vulnérables aux agents pathogènes et aux insectes.
Le pin flexible figure sur la liste des espèces en voie de disparition (« endangered ») de la Wildlife Act de l'Alberta, mais cette loi ne prévoit aucune disposition offrant une protection générale aux individus et à leur habitat. Un programme de rétablissement provincial est en préparation. En Colombie-Britannique, le pin flexible ne bénéficie d'aucune protection juridique, mais il figure sur la liste bleue (espèces préoccupantes). Dans les deux provinces, de petites populations bénéficient d'une certaine protection dans les aires protégées provinciales. En outre, le pin flexible est présent dans certains parcs nationaux en Alberta et en Colombie-Britannique, où les individus et leur habitat sont protégés.
NatureServe a attribué au pin flexible les cotes de conservation S2 (en péril) en Alberta et S3 (vulnérable) en Colombie-Britannique.
Durée d'une génération :
(1/taux de mortalité des individus matures + âge à la première reproduction). Voir la section « Cycle vital et reproduction ».
- 150 à 250 ans
Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre total d'individus matures?
- Oui, un déclin continu est observé et prévu.
Pourcentage estimé de déclin continu du nombre total d'individus matures sur [cinq ans ou deux générations] (52-60 ans).
- Les pourcentages observés et estimés sur une période de 100 ans sont de 51 à 76 % (moyenne = 66 %)
Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d'augmentation] du nombre total d'individus matures au cours des [dix dernières années ou trois dernières générations] (78-90 ans).
- Inconnu
Pourcentage prévu de réduction du nombre total d'individus matures au cours des 100 prochaines années.
- 51-76 % (moyenne = 66 %)
Pourcentage [observé, estimé, inféré ou présumé] [de réduction ou d'augmentation] du nombre total d'individus matures au cours de toute période de [dix ans ou trois générations] commençant dans le passé et se terminant dans le futur.
- Les pourcentages observés et estimés sur une période de 100 ans sont de 51 à 76 % (moyenne = 66 %)
Est-ce que les causes du déclin sont clairement réversibles et comprises et ont effectivement cessé?
Certaines causes (rouille vésiculeuse du pin blanc, dendroctone du pin ponderosa) sont comprises dans une certaine mesure, mais elles n'ont pas cessé et, bien que leurs répercussions puissent être atténuées en partie, elles ne sont essentiellement pas réversibles.
- Non
Y a-t-il des fluctuations extrêmes du nombre d'individus matures?
- Non
Superficie estimée de la zone d'occurrence Tirée de COSEPAC (2004)
- 44 460 km2
Indice de zone d'occupation (IZO)
grille à carrés de 2 km de côté, zone d'occupation biologique beaucoup plus petite
- 1480 km2
La population totale est-elle gravement fragmentée?
Plus de 50 % de la population totale se présente sous forme de colonies suffisamment grandes pour être considérées comme viables.
- Non
Nombre de localités Table Footnotea
- 1
Y a-t-il un déclin continu [observé, inféré ou prévu] de la zone d'occurrence?
Le changement climatique aura une incidence sur la zone d'occurrence, mais on ignore quels seront ses effets exacts, car il entraînera un déplacement des aires propices.
- Inconnu, mais probable
Y a-t-il un déclin continu [observé, inféré ou prévu] de l'indice de zone d'occupation?
Des sous-populations disparaîtront probablement à l'échelle locale, en raison de la rouille, du dendroctone et du changement climatique.
- Oui
Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de sous-populations?
- Oui
Y a-t-il un déclin continu [observé, inféré ou prévu] du nombre de localités Table Footnotea?
- Non
Y a-t-il un déclin continu [observé, inféré ou prévu] de [la superficie, l'étendue ou la qualité] de l'habitat?
On sait que la qualité de l'habitat continuera de diminuer, mais on ignore dans quelle mesure les répercussions du changement climatique auront une incidence sur la superficie et l'étendue de l'habitat.
- Oui
Y a-t-il des fluctuations extrêmes du nombre de sous-populations?
- Non
Y a-t-il des fluctuations extrêmes du nombre de localités Table Footnotea?
- Non
Y a-t-il des fluctuations extrêmes de la zone d'occurrence?
- Non
Y a-t-il des fluctuations extrêmes de l'indice de zone d'occupation?
- Non
Sous-population:
Information insuffisante pour la délimitation.
- Nbre d'individus matures: -
Total
Évalué en fonction de l'IZO (1480 km2) et de la densité moyenne d'individus dans les parcelles de suivi (300 individus/ha).
- 44,4 million
La probabilité de disparition de l'espèce à l'état sauvage est d'au moins [20 % sur 20 ans ou 5 générations, ou 10 % sur 100 ans].
- Aucune n'a été faite
Rouille vésiculeuse du pin blanc, dendroctone du pin ponderosa, changement climatique.
- Situation des populations de l'extérieur?
Les populations des États-Unis sont soumises aux mêmes menaces que celles du Canada et sont également en déclin.
Une immigration a-t-elle été constatée ou est-elle possible?
- Possible
Des individus immigrants seraient-ils adaptés pour survivre au Canada?
Ils seraient adaptés au climat actuel, mais ne seraient pas moins vulnérables à la rouille vésiculeuse du pin blanc et au dendroctone du pin ponderosa.
- Peut-être
Y a-t-il suffisamment d'habitat disponible au Canada pour les individus immigrants dans l'estuaire du Saint-Laurent?
- Probablement pas
- La possibilité d'une immigration depuis des populations externes existe-t-elle vraisemblable?
Elle est possible mais peu probable en raison de la capacité de dispersion limitée.
- Non
COSEPAC : espèce désignée « en voie de disparition » en novembre 2014.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d'une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d'une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d'être évaluées selon un processus scientifique rigoureux et indépendant.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d'autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Le COSEPAC est composé de membres de chacun des organismes responsables des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l'Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d'information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous-comités de spécialistes des espèces et du sous-comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Remarque : Catégorie « DSIDD » (données insuffisantes pour donner une désignation) jusqu'en 1994, puis « indéterminé » de 1994 à 1999. Définition de la catégorie (DI) révisée en 2006.
Le Service canadien de la faune d'Environnement Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Nom scientifique : Pinus flexilis E. James
Synonymes : Apinus flexilis (E. James) Rydberg
Nom français : Pin flexible
Noms anglais : Limber Pine
Famille : Pinacées
Grand groupe végétal : Gymnospermes (conifères)
Selon de récentes analyses phylogénétiques fondées sur l'ADN (Liston et al., 1999; Liston et al., 2007; Gernandt et al., 2005; Syring et al., 2005; Syring et al., 2007; Eckert et Hall, 2006, etc.), le pin flexible appartient au sous-genre Strobus, à la section Quinquefolia et à la sous-section Strobus, qui comprend 22 espèces de pin dans le monde entier.
Le pin flexible est le plus étroitement apparenté au pin nayar (P. strobiformis) et au pin du Mexique (P. ayacahuite) (Earle, 2010) et semble s'hybrider avec le pin nayar dans les régions où les deux espèces sont cooccurrentes, dans le sud-ouest des États-Unis (Andresen et Steinhoff, 1971). Cette forme intermédiaire sur le plan morphologique est décrite sous le nom de P. flexilis var. reflexa et est limitée au sud-ouest des États-Unis. La taxonomie du pin flexible, du pin nayar et du pin du Mexique ainsi que la relation qui unit ces espèces font actuellement l'objet de débats, mais la population canadienne de pin flexible n'est pas concernée par ceux-ci. En effet, le pin flexible est la seule de ces trois espèces à être présente au Canada.
Au Canada, les individus matures mesurent généralement 3 à 15 m de hauteur et possèdent un houppier arrondi très ramifié (Figure 1). Dans les sites exposés, ils peuvent être rabougris et façonnés par le vent. Dans les sites mésiques abrités, les individus sont généralement plus hauts (jusqu'à 20 m) et présentent un tronc droit et un houppier conique (Douglas et al., 1998). L'écorce est grise et presque lisse chez les jeunes arbres et devient avec le temps brun foncé à noirâtre et découpée en plaques écailleuses (Kral, 1993; Douglas et al., 1998).
Les aiguilles sont réunies par 5 et mesurent 3 à 7 cm de longueur et 1 à 1,5 mm d'épaisseur (Kral, 1993). Les cônes femelles sont ovoïdes, brun clair à brun verdâtre, longs de 7 à 15 cm et larges de 4 à 6 cm. Ils s'ouvrent pour libérer les graines, puis tombent au sol. Les graines sont obovoïdes, brunes, longues de 10 à 15 mm et généralement dépourvues d'ailes. Les cônes mâles mesurent environ 15 mm de longueur et sont jaunâtres (Kral, 1993).

Photo: C. Smith.
Description longue pour la figure 1
Photo d'un pin flexible mature poussant dans un site rocheux exposé. Son houppier est arrondi et fortement ramifié.
Le pin flexible peut être confondu avec le pin à écorce blanche (P. albicaulis) dans les régions où les aires des deux espèces se chevauchent, dans le sud-ouest de l'Alberta et le sud-est de la Colombie-Britannique. Les deux espèces possèdent des feuilles fasciculées par 5 et des houppiers pouvant être de forme semblable et poussent souvent dans des sites rocheux exposés. Les cônes femelles du sont généralement plus longs chez le pin flexible (7 à 15 cm) que chez le pin à écorce blanche (5 à 8 cm) et sont havane chez le pin flexible et violets chez le pin à écorce blanche. En outre, chez le pin flexible, ils s'ouvrent pour libérer les graines, puis tombent au sol, alors que chez le pin à écorce blanche ils demeurent fermés et accrochés à l'arbre jusqu'à ce qu'un animal les ramasse (Kral, 1993). La présence de cônes au sol est souvent le signe permettant le plus facilement de distinguer le pin flexible du pin à écorce blanche. De plus, les cônes mâles sont généralement jaunâtres chez le pin flexible, alors qu'ils sont écarlates chez le pin à écorce blanche.
Au Canada, en plus du pin à écorce blanche, le pin argenté (Pinus monticola) est la seule autre espèce de pin dont les aiguilles sont regroupées par 5 qu'on rencontre dans l'aire de répartition du pin flexible. Il pousse généralement dans des milieux plus mésiques que le pin flexible, et il est rare que les deux espèces soient présentes dans un même peuplement. Le pin argenté se distingue du pin flexible par ses cônes plus larges (10 à 25 cm) et plus longs, ses aiguilles plus minces (4 à 10 cm sur 0,7 à 1 mm, comparativement à 3 à 7 cm sur 1 à 1,5 mm pour le pin flexible et le pin à écorce blanche).
La structure génétique du pin flexible a été évaluée par analyse des allozymes et de l'ADN (Schuster et al., 1989; Latta et Mitton, 1997; Mitton et al., 2000; Schuster et Mitton, 2000; Jorgensen et al., 2002; Bower et al., 2011). Certaines populations canadiennes ont été incluses dans ces études; les similitudes observées entre les populations du Canada et celles du nord des Rocheuses, aux États-Unis, donnent à penser que les résultats obtenus dans le cadre des études visant les populations des États-Unis peuvent s'appliquer aux populations canadiennes.
Dans l'ensemble, la plus grande partie de la diversité génétique est observable à l'intérieur des populations locales plutôt qu'entre les populations. La répartition et l'ampleur de la diversité observée chez le pin flexible sont semblables à celles observées chez d'autres espèces de pin de l'ouest de l'Amérique du Nord dont les graines sont dispersées par les oiseaux (Jorgensen et al., 2002; Bower et al., 2011). Cependant, la diversité correspond à environ le tiers de celle généralement observée chez les espèces de pin dont les graines sont dispersées par le vent (Bower et al., 2011). En outre, cette répartition de la diversité génétique reflète l'origine des populations de pin flexible actuelles, qui sont issues de multiples refuges du Pléistocène et de flux génétiques récents entre les populations (Mitton et al., 2000; Jorgensen et al., 2002). Le flux génétique semble être attribuable à la fois aux échanges de pollen et à la dispersion des graines (Schuster et al., 1989; Schuster et Mitton, 2000), de sorte que les populations isolées et marginales présentent une diversité génétique presque équivalente à celle des grandes populations centrales (Mitton et al., 2000). Même si la population est naturellement fragmentée, on estime que le flux génétique, principalement assuré par le pollen, est suffisant pour empêcher la dérive génétique (Schuster et al., 1989; Jorgensen et al., 2002; Richardson et al., 2010).
Le pin flexible est l'espèce du groupe des pins blancs la plus répandue en Amérique du Nord, mais on observe seulement de faibles tendances, principalement nord-sud, en ce qui a trait aux caractères quantitatifs, notamment la grosseur des cônes, le poids des graines et la croissance des semis (Steinhoff et Andresen, 1971).
Il n'y a actuellement aucune sous-espèce ou variété reconnue pour l'espèce, et rien n'indique que les populations canadiennes présentent une structure génétique particulière ou qu'il y ait des barrières au flux génétique entre ces populations. Ainsi, une seule unité désignable, qui comprend l'espèce dans son ensemble, est reconnue.
Dans une bonne partie de son aire de répartition, le pin flexible pousse le long ou à proximité de la limite des arbres qui marque, à une altitude relativement basse, le début des prairies sèches de terrain élevé. Ces arbres sont soumis à un stress hydrique, et leurs cernes de croissance annuelle peuvent fournir de l'information sur les précipitations et d'autres variables hydrologiques pour les 500 à 1000 dernières années, alors qu'on dispose de données historiques et instrumentales seulement pour les 100 dernières années environ (Case et MacDonald, 1995; Case et MacDonald, 2003; MacDonald et Case 2005; Perez-Valdivia et al., 2010; Vanstone et al., 2010). Cette information est importante pour l'analyse de la portée économique et sociale de la fréquence et de la gravité des sécheresses. Par exemple, la sécheresse connue de 1918 à 1922 dans le sud de l'Alberta, qui a causé de grandes perturbations économiques et sociales, n'était ni inhabituelle ni la plus grave observée au cours des 500 dernières années (Case et MacDonald, 1995). Cette information a aussi révélé que les données actuellement utilisées pour évaluer les débits fluviaux dans les provinces des Prairies sont fondées sur une période inhabituellement stable et humide (Sauchyn et al., 2002; Case et MacDonald, 2003). En outre, elle est importante pour la compréhension de phénomènes climatiques de vaste échelle (El Niño-oscillation australe, oscillation décennale du Pacifique, etc.) et l'évaluation de modèles de prédiction du changement climatique (St Jacques et al., 2011).
Le pin flexible est souvent la seule espèce d'arbre capable de pousser dans les terrains escarpés et venteux du haut des bassins versants, et il joue un rôle important pour la rétention de la neige, le ralentissement de la fonte de la neige et la prévention de l'érosion (Schoettle, 2004). Dans les sites plus humides, le pin flexible est une espèce de début de succession et favorise l'établissement d'autres espèces de conifères ainsi que le phénomène de succession (Rebertus et al., 1991; Donnegan et Rebertus, 1999).
Le pin flexible atteint la limite nord de son aire de répartition au Canada, de sorte qu'il est important pour l'étude des processus génétiques et évolutifs associés au changement climatique et des effets des espèces introduites, notamment le Cronartium ribicola, agent de la rouille vésiculeuse du pin blanc (Franks et al., 2014). Il est essentiel de comprendre ces processus pour la modélisation des changements climatiques et l'adaptation à ces changements.
En outre, le pin flexible est une « espèce mutualiste clé » (Mills et al., 1993), c'est-à-dire qu'elle est si étroitement associée à d'autres organismes que sa disparition ou la grave diminution de ses populations aurait des répercussions sur l'ensemble de son écosystème (Lanner, 1996) – voir la section « Relations interspécifiques ». Le pin à écorce blanche a un rôle écologique semblable. Cependant, il est lui aussi considéré comme « en voie de disparition » au Canada (COSEWIC, 2010) et est en déclin à cause de plusieurs des menaces qui touchent le pin flexible. En outre, il y a peu de chevauchements entre l'aire de répartition et l'habitat des deux espèces. Ainsi, il est peu probable que le pin à écorce blanche puisse remplir le rôle écologique du pin flexible à la place de ce dernier.
Plusieurs cultivars de pin flexible ont été mis au point à partir de sources diverses provenant de partout dans l'aire de répartition de l'espèce et sont produits par certaines pépinières. L'espèce est attrayante pour les plantations brise-vent et le paysagement, en raison de sa résistance à la sécheresse. Elle est cultivée avec succès à l'extérieur de son aire de répartition naturelle (NDSU, 2013).
Le pin flexible pousse uniquement dans l'ouest de l'Amérique du Nord (Figure 2), le long des Rocheuses, depuis l'Alberta et la Colombie-Britannique jusque dans le sud du Montana, puis jusqu'au Nouveau-Mexique, ainsi que dans le Grand Bassin, jusque dans le sud de la Californie (Kral, 1993; Tomback et Achuff, 2010). On trouve aussi des occurrences isolées plus à l'est, dans l'ouest du Dakota du Nord, l'ouest du Dakota du Sud (Black Hills) et l'ouest du Nebraska; l'occurrence la plus orientale de l'espèce a été signalée dans le nord-est de l'Oregon (Wallowa Mountains). Des fossiles montrent que l'aire de répartition de l'espèce était plus vaste durant le Pléistocène et s'étendait plus loin vers le sud et vers l'est dans le Grand Bassin des États-Unis ainsi que jusque dans le nord du Mexique, le centre du Nebraska, le Kansas et le Texas (Wells, 1983; Wells et Stewart, 1987; Betancourt, 1990; Rhode et Madsen, 1998). Les mentions du pin flexible au Mexique semblent être attribuables à une classification taxonomique différente de celle utilisée ici (par exemple, Earle, 2010; IUCN, 2010 b).
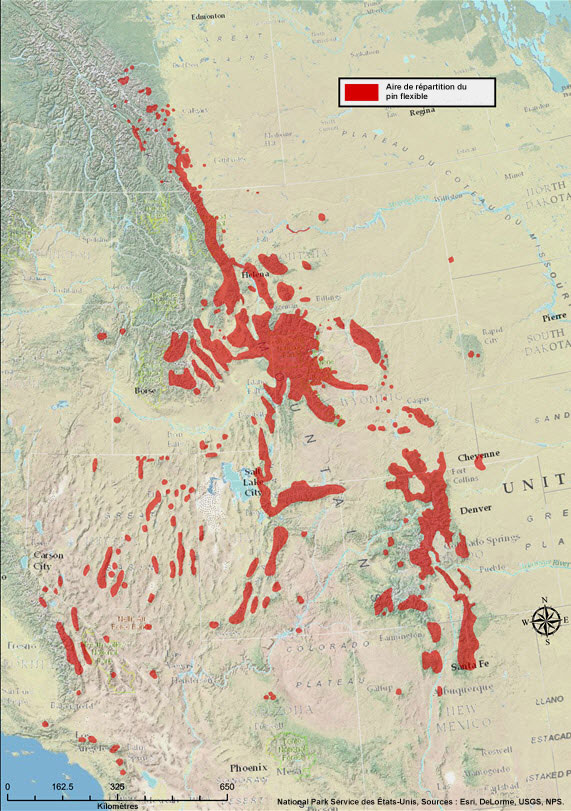
Photo: C. Smith.
Description longue pour la figure 2
Carte montrant l'aire de répartition mondiale du pin flexible, dans l'ouest de l'Amérique du Nord. L'espèce est présente le long des Rocheuses, depuis l'Alberta et la Colombie-Britannique jusque dans le sud du Montana, puis jusqu'au Nouveau-Mexique, ainsi que dans le Grand bassin, jusque dans le sud de la Californie. On trouve également des occurrences isolées plus à l'est, dans l'ouest du Dakota du Nord, l'ouest du Dakota du Sud, l'ouest du Nebraska ainsi que le nord-est de l'Oregon, cette dernière constituant l'occurrence la plus orientale de l'espèce.
L'aire de répartition canadienne du pin flexible (Figure 3) s'étend le long du côté est du sillon des Rocheuses, depuis le sud-est de la Colombie-Britannique (près de Field, coordonnées approximatives 51°26'N) jusque près de la frontière avec les États-Unis, ainsi que dans les Rocheuses et leurs contreforts, depuis le sud-ouest de l'Alberta (près des plaines Kootenay, coordonnées approximatives 52°16'N) jusqu'à la frontière avec les États-Unis. L'aire de répartition de l'espèce comprend en Alberta des portions des sous-régions naturelles montagnarde, subalpine, de la prairie-parc du piémont et de la prairie à fétuques du piémont (Downing et Pettapiece, 2006) et, en Colombie-Britannique, des zones biogéoclimatiques intérieure à douglas, montagnarde à épinette et à épinette d'Engelmann et à sapin subalpin (Meidinger et Pojar, 1991).
Environ 10 % de l'aire mondiale de l'espèce se trouvent au Canada. L'aire de répartition est en général fragmentée et compte de petites populations isolées, particulièrement près de sa limite nord.
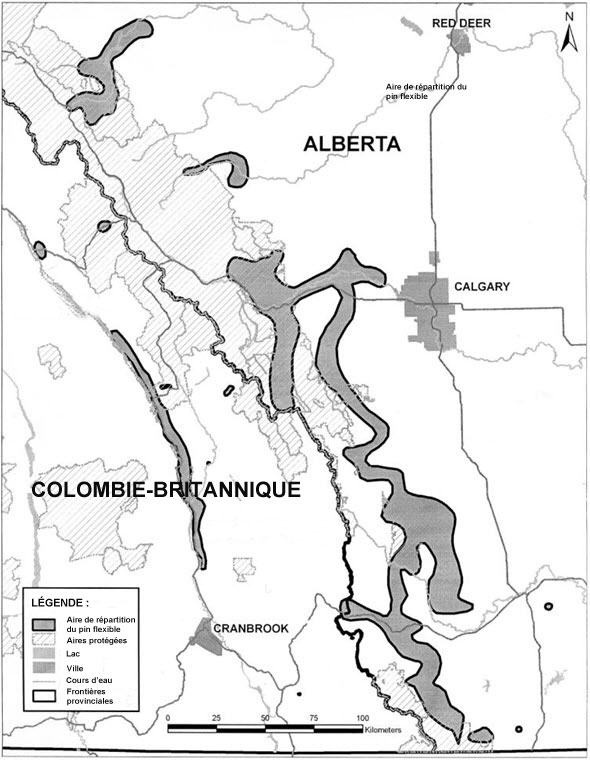
Photo: C. Smith.
Description longue pour la figure 3
Carte montrant l'aire de répartition actuelle du pin flexible au Canada. Celle-ci s'étend le long du côté est du sillon des Rocheuses, depuis le sud-est de la Colombie-Britannique (environs de la ville de Field) jusque près de la frontière avec les États-Unis, ainsi que dans les Rocheuses et leurs contreforts, depuis le sud-ouest de l'Alberta (environs des plaines Kootenay) jusqu'à la frontière avec les États-Unis.
La superficie de la zone d'occurrence (EO) du pin flexible au Canada est évaluée à 44 460 km2, dont environ 80 % se trouvent en Alberta et 20 % en Colombie-Britannique.
La superficie de l'indice de zone d'occupation (IZO), estimée à l'aide d'une grille à carrés de 2 km de côté et des données d'occurrence d'élément (ACIMS, 2011; BC-CDC, 2011; Moody, comm. pers., 2011; Achuff, obs. pers.), est de 1480 km2, dont 1420 km2 en Alberta et 60 km2 en Colombie-Britannique. Il est fort probable que les données d'occurrence d'élément ne représentaient pas toutes les populations locales, de sorte que l'IZO présenté ici est une sous-estimation. Cependant, plusieurs populations de pin flexible occupent des zones de moins de 1 km2; l'utilisation d'une grille à carrés de 2 km de côté entraîne donc une surestimation par rapport à la zone d'occupation biologique.
La plus grande partie de l'information dont on dispose sur la répartition du pin flexible au Canada est issue d'inventaires des ressources naturelles et d'activités de suivi opérationnel réalisés en Alberta (Holland et Coen, 1982; Achuff et al., 2002; ACIMS, 2011; ESIS, 2011; FIAS, 2011; WLIS, 2011, etc.) et en Colombie-Britannique (Achuff et al., 1984; Lea, 1984; Achuff et al., 1993; BC-CDC, 2011; BEC, 2011; E-flora BC, 2011). En outre, des renseignements ont été tirés des étiquettes de spécimens déposés dans les herbiers d'universités et d'organismes gouvernementaux par les Centres de données sur la conservation de ces deux provinces ainsi que de projets de recherche universitaires. Au total, des centaines, voire des milliers de jours-personnes de recherche ont été consacrés au pin flexible dans son aire de répartition canadienne.
En outre, des recherches ciblées (environ 35 jours-personnes) ont été réalisées récemment dans le sud-est de la Colombie-Britannique, et la documentation scientifique concernant la présence du pin flexible au Canada a été consultée.
Grâce à toutes ces activités de recherche, un degré de confiance élevé est associé à la répartition (zone d'occurrence) connue du pin flexible au Canada. Toutefois, on dispose de renseignements moins détaillés sur l'emplacement des sous-populations locales (utilisé pour le calcul de l'IZO). Il a donc été impossible de délimiter les sous-populations et d'en déterminer le nombre.
Dans son aire de répartition canadienne, le pin flexible se rencontre généralement dans des sites chauds et secs, dans la sous-région naturelle montagnarde et la portion inférieure de la sous-région naturelle subalpine d'Alberta (Downing et Pettapiece, 2006) ainsi que dans les zones biogéoclimatiques intérieure à douglas, montagnarde à épinette et à épinette d'Engelmann et sapin subalpin (portion inférieure) de Colombie-Britannique (Meidinger et Pojar, 1991). L'espèce pousse généralement à des altitudes d'environ 850 m à 1900 m. Toutefois, certaines occurrences se trouvent dans la partie supérieure de la région subalpine, à une altitude de jusqu'à environ 2000 m, où l'espèce peut former des peuplements mixtes avec le pin à écorce blanche. Des occurrences situées en haute altitude, jusqu'à 3800 m (Steele 1990; Millar et al., 2007), sont plus couramment observées aux États-Unis. Le pin flexible peut donc se rencontrer dans des sites d'altitude relativement haute ou basse, à la limite des arbres. Il pousse sur des versants peu inclinés à escarpés (angle de 20 à 80 %) généralement exposés au sud ou à l'ouest. En Colombie-Britannique, la majeure partie des peuplements de pin flexible se trouve sur des falaises et des crêtes escarpées, alors qu'en Alberta certains peuplements se trouvent dans des terrains, des crêtes rocheuses et des affleurements rocheux à pente douce. Les sites occupés par le pin flexible sont souvent exposés aux forts vents, en plus de présenter un sol peu profond à drainage bon à rapide et de se situer sur les versants où les températures sont élevées, ce qui favorise la création d'un déficit hydrique considérable et nuit à la croissance des individus.
Le pin flexible pousse dans une variété de substrats rocheux, notamment le calcaire et le grès, ainsi que dans les substrats morainiques et les graviers fluviatiles, dans les sols régosoliques ou brunisoliques à drainage bon à rapide (Timoney, 1999; Achuff et al., 2002).
Le pin flexible forme généralement des peuplements clairsemés ou pousse de façon éparse, entouré d'un sous-étage herbeux ou arbustif. Au Canada, on le rencontre souvent aux côtés des espèces suivantes : douglas de Menzies (Pseudotsuga menziesii), pin tordu (Pinus contorta), genévrier des Rocheuses (Juniperus scopulorum), genévrier commun (J. communis), genévrier horizontal (J. horizontalis), potentille frutescente (Dasiphora fruticosa), shépherdie du Canada (Shepherdia canadensis), fétuque scabre (Festuca campestris) et koelérie à crêtes (Koeleria macrantha) (Timoney, 1999; Achuff et al., 2002; ACIMS, 2011).
Le pin flexible est une composante importante de six communautés écologiques préoccupantes du point de vue de la conservation (qui font l'objet d'un suivi) en Alberta (Allen, 2010), dont la plupart sont classées dans la catégorie « en péril » (S2). En Colombie-Britannique, les communautés de pin flexible ont été décrites mais n'ont pas été classées (Utzig et al., 1977; BC-CDC, 2011).
Le pin flexible est considéré comme intolérant à l'ombre, et des études sur la dynamique des peuplements réalisées à haute et à basse altitudes ont montré qu'il est une espèce pionnière des sites perturbés par les incendies (Rebertus et al., 1991; Webster et Johnson, 2000). Une fois qu'il est établi, le pin flexible favorise souvent l'établissement d'autres espèces végétales, notamment des espèces d'arbres qui peuvent finir par le remplacer (Rebertus et al., 1991; Baumeister et Callaway, 2006). Dans les peuplements mixtes, en milieux mésiques, il peut être remplacé par d'autres espèces de conifères, dont le douglas de Menzies, l'épinette d'Engelmann (Picea engelmannii), le sapin subalpin (Abies lasiocarpa) et le pin tordu (Steele, 1990; Rebertus et al., 1991; Donnegan et Rebertus, 1999; Coop et Schoettle, 2009). Sa persistance dans ces milieux où il est soumis à une forte concurrence exercée par d'autres espèces de conifères semble dépendre des incendies de forêt périodiques de forte intensité (Coop et Schoettle, 2009).
Dans les communautés de pin flexible, l'intervalle entre les incendies varie grandement, allant de 2 à 30 ans dans les sites en faible altitude (Wright et Bailey, 1982) à plusieurs centaines d'années dans certains peuplements situés en altitude élevée (Veblen, 1986; Rebertus et al., 1991; Coop et Schoettle, 2009; Coop et al., 2010). La dynamique de métapopulations est bien illustrée par certains peuplements qui ont été détruits par le feu, puis se sont rétablis grâce aux graines provenant de sous-populations adjacentes (Webster et Johnson, 2000; Coop et Schoettle, 2009). Dans la même région, d'autres peuplements ont subi des incendies périodiques, qui ne les ont toutefois pas détruits, et d'autres n'ont subi aucun incendie depuis des centaines d'années (Webster et Johnson, 2000; Sherriff et al., 2001). Dans les peuplements incendiés, des épisodes de recrutement accru ont été observés après les incendies (Donnegan et Rebertus, 1999; Webster et Johnson, 2000; Coop et Schoettle, 2009). Dans le cas de certains peuplements de pin flexible qui sont situés à la limite de l'aire de l'espèce et sont entourés de prairies, les incendies fréquents semblent avoir limité la régénération de l'espèce. La récente suppression des incendies a permis à l'espèce de se propager dans les prairies adjacentes et aux peuplements de se densifier (Keane et al., 2002; Brown et Schoettle, 2008).
Certains peuplements de pin flexible, souvent ceux situés dans les sites où les conditions sont extrêmes et sèches, forment des communautés stables et persistantes (Webster et Johnson, 2000; Tomback et al., 2005), ce qui est probablement attribuable à la tolérance physiologique du pin flexible, supérieure à celles d'autres espèces d'arbres.
Au Canada, l'habitat du pin flexible n'a probablement diminué de façon considérable au cours des cent dernières années. Cependant, la prévention et la suppression des incendies pourraient avoir causé une diminution de la qualité de l'habitat de l'espèce, en entraînant une hausse de la compétition, une accélération de la succession végétale et une hausse de la force des incendies. En outre, on s'attend à ce que le changement climatique cause une diminution de la qualité de l'habitat de l'espèce dans le futur, comme il est expliqué plus bas, ainsi qu'une modification de la superficie et de l'étendue de l'habitat. Cependant, la rapidité et l'ampleur de ces changements sont incertaines. Des tendances semblables en ce qui a trait à la qualité et à la superficie de l'habitat sont prévues aux États-Unis.
Le pin flexible est longévif et vit fréquemment plusieurs centaines d'années (McCune, 1988). Des individus âgés de plus de 1000 ans ont déjà été signalés (Schuster et al., 1995; Keeley et Zedler, 1998). En général, l'âge maximal augmente avec l'augmentation de l'altitude, en raison de la diminution de la fréquence des incendies (Schuster et al., 1995). L'espèce se reproduit uniquement par ses graines (Steele, 1990). La production de cônes commence généralement vers l'âge de 50 ans, voire parfois uniquement vers l'âge de 200 ans (Schoettle, 2004), et peut se poursuivre pendant plusieurs centaines d'années.
Le cycle de reproduction du pin flexible est semblable à celui d'autres espèces de pin, et il s'écoule deux ans entre la production des cônes et l'arrivée à maturité des graines. Le pollen est dispersé par le vent, principalement en juin et en juillet (Steele, 1990) et surtout à l'échelle locale, mais il arrive qu'il soit dispersé sur des distances de plus de 100 km (Schuster et al., 1989; Schuster et Mitton, 2000). La fécondation se produit au printemps ou au début de l'été de l'année suivante, environ 13 mois après la pollinisation, et les cônes arrivent généralement à maturité en août et en septembre (Schmidt et Lotan, 1980). Les semences sont grosses (10 à 15 mm) et généralement dépourvues d'ailes, mais certaines présentent une aile vestigiale qui n'est pour ainsi dire pas fonctionnelle pour la dispersion par le vent (Lanner, 1985; Kral, 1993). Des semis apparaissent en masse tous les 4 ou 5 ans, mais ce phénomène varie grandement sur le plan spatial et temporel (Steele, 1990; Keane et Schoettle, 2011).
Lorsque les cônes s'ouvrent à la fin de l'été, les graines sont récoltées, dispersées et cachées par des animaux, principalement le Cassenoix d'Amérique et l'écureuil roux (Benkman et al., 1984; Tomback et Linhart, 1990; Tomback et al., 2005). Après la dispersion, les graines qui ne sont pas retrouvées ou consommées par les oiseaux ou les rongeurs germent généralement en deux ans (Webster et Johnson 2000). Le taux de survie des semis semble principalement déterminé par le stress hydrique (Keuppers, 2010) et augmente lorsque les semis sont abrités par des « objets-mères » qui créent une microtopographie favorable (Coop et Schoettle, 2009). Les semis du pin flexible soutiennent difficilement la concurrence exercée par les autres plantes, l'espèce ayant adopté une stratégie axée sur la persistance associée à la tolérance aux conditions ne convenant pas aux autres espèces plutôt qu'à la capacité de compétition (Schoettle et Rochelle, 2000; Schoettle, 2004).
La durée d'une génération est difficile à évaluer, car l'espèce est longévive, et on dispose de peu de données démographiques sur elle. En supposant que le taux de mortalité annuel des individus mature (1 %) est actuellement environ le double du taux « normal » et que l'âge à la première reproduction est d'environ 50 ans et en utilisant la formule « 1/taux de mortalité + âge à la première reproduction », on obtient une durée approximative de 250 ans (1/0,005 + 50 ans = 250 ans ; IUCN, 2013 – équation 2). Ces résultats concordent avec ceux obtenus par Field et al. (2012) pour les pins flexibles matures sains : un taux de survie moyen de 0,9950 (0,9840 à 1,000). Si on utilise le taux de mortalité actuel, on obtient une durée d'environ 150 ans (1/0,01 + 50 = 150).
Des études physiologiques sur le pin flexible ont révélé la capacité de l'espèce à composer avec le stress hydrique et à optimiser la photosynthèse (Schoettle et Rochelle, 2000; Letts et al., 2009). En plus de posséder les caractères structuraux et physiologiques associés à la résistance au stress hydrique et communs aux conifères en général (Gao et al., 2002), le pin flexible présente des caractères qui lui permettent de maintenir un taux annuel positif de photosynthèse nette, c'est-à-dire des aiguilles à longue durée de vie (4,4 à 9,6 ans; Barrick et Schoettle, 1996), une surface foliaire spécifique faible (Letts et al., 2009) et une densité stomatique faible (Schoettle et Rochelle, 2000). Les espèces qui présentent une densité stomatique faible possèdent généralement une efficacité d'utilisation de l'eau élevée durant la photosynthèse (Letts et al., 2009).
Les taux de photosynthèse nette sont plus élevés durant le printemps et le début de l'automne, périodes où le stress hydrique est faible, qu'en juillet et en août (Letts et al., 2009), ce qui indique que l'espèce a besoin d'un taux d'humidité atmosphérique élevé. Les résultats des études sont contradictoires quant à l'effet de la température sur la croissance du pin flexible; selon certaines études, la température de l'air n'a pas d'effet particulier sur la croissance de l'espèce (Schoettle et Rochelle, 2000), alors que selon certaines autres études l'interaction entre la température et les précipitations entraîne une réaction complexe chez l'espèce (Millar et al., 2007). L'établissement et la croissance des semis semblent plus étroitement liés à la disponibilité d'eau qu'à la température (Kueppers, 2010; Moyes et al., 2013).
Les individus matures sont assez résistants au stress hydrique, comme en témoigne la longue durée de vie de certains (plus de 1000 ans; Case et MacDonald, 2003), qui ont survécu à de nombreuses sécheresses. Une étroite corrélation a été observée entre la croissance et les précipitations annuelles totales, et les arbres âgés sont moins sensibles aux variables climatiques que les plus jeunes (Case et MacDonald, 1995; Millar et al., 2007).
Dans l'ensemble, le pin flexible semble présenter une large tolérance ou plasticité physiologique au stress hydrique (Schoettle et Rochelle, 2000) et être limité par le stress hydrique à la limite inférieure de sa répartition altitudinale. Certaines études donnent à penser que le stress hydrique ne constitue pas un facteur limitatif pour la propagation potentielle de l'espèce en altitude élevée (Schoettle et Rochelle, 2000; Letts et al., 2009; Reinhardt et al., 2011), mais selon une autre étude (Moyes et al., 2013) il constitue aussi une contrainte pour l'établissement des semis à la limite des arbres.
Des individus de l'espèce ont été cultivés avec succès à partir de graines et transplantés en milieu naturel (Asebrook et al., 2011; Casper et al., 2011; Smith et al., 2011 b), et des lignes directrices sur le transfert de semence, fondées sur les profils de diversité génétique, ont été mises au point (Mahalovich, 2006).
L'effet des incendies sur le pin flexible dépend largement de l'intensité des feux et de l'intervalle entre les incendies. L'écorce du pin flexible est mince et ne résiste pas au feu, de sorte que les individus de l'espèce peuvent facilement être tués par les incendies graves. Cependant, le pin flexible se rencontre souvent dans des sites secs et dégagés où les matières combustibles peuvent être clairsemées et discontinues; les incendies peuvent donc avoir une répartition irrégulière et être de faible intensité dans ces milieux, entraînant la mort de seulement une partie de la sous-population de pin flexible (Webster et Johnson, 2000; Brown et Schoettle, 2008). Après les incendies de grande intensité entraînant le remplacement des peuplements, le pin flexible peut disparaître dans une région, puis une sous-population locale peut y être rétablie rapidement grâce aux semences apportées depuis les populations adjacentes par le Cassenoix d'Amérique (Rebertus et al., 1991; Donnegan et Rebertus, 1999; Webster et Johnson, 2000; Brown et Schoettle, 2008; Cooop et Schoettle, 2009). Le pin flexible, grâce à ses caractères physiologiques lui permettant de résister à la sécheresse, peut s'établir dans les sites secs qui sont peu propices à d'autres espèces de conifères (Coop et Schoettle, 2009).
Le pin flexible dépend grandement du Cassenoix d'Amérique pour la dispersion de ses graines et sa régénération (Tomback et Kramer, 1980; Lanner, 1988; Tomback et Linhart, 1990; Tomback et al., 2005). Le Cassenoix d'Amérique prélève les graines dans les cônes fixés aux arbres et les disperse sur des distances allant généralement de quelques mètres à plusieurs km (jusqu'à 22 km), puis cache les graines par groupes de 1 à 5 (Vander Wall et Balda, 1977; Carsey et Tomback, 1994; Tomback et al., 2005). Il peut transporter jusqu'à 125 graines à la fois dans sa poche sublinguale et peut cacher plus de 30 000 graines par ha au cours d'une année (Lanner et Vander Wall, 1980). Le Geai de Steller (Cyanocitta stelleri) récolte lui aussi les graines dans les cônes ouverts et les cache dans le sol ou dans d'autres endroits (Tomback et al., 2011). Cependant, cette espèce est absente de la plus grande partie de l'aire de répartition du pin flexible en Alberta (FAN, 2007), et son rôle semble beaucoup moins important que celui du Cassenoix d'Amérique.
Après l'ouverture des cônes, certaines graines restent prises dans la résine (Tomback et Kramer, 1980), alors que d'autres tombent au sol, où elles peuvent être ramassées et cachées par de petits rongeurs, qui les dispersent sur de courtes distances. Toutefois, ces graines ne semblent pas être d'une grande importance pour la régénération de l'espèce (Schoettle et Rochelle, 2000; Tomback et al., 2005; Tomback et al., 2011).
Le pollen dispersé par le vent et les graines dispersées par les animaux, principalement le Cassenoix d'Amérique, assurent un flux génétique entre les populations. La population de l'espèce est naturellement fragmentée, mais on croit que ce flux génétique est suffisant pour que la dérive génétique soit évitée (Schuster et al., 1989; Schuster et Mitton, 2000; Jorgensen et al., 2002), et on ne considère pas que la population de pin flexible est gravement fragmentée au Canada.
La migration potentielle de l'espèce sous l'effet du changement climatique est examinée ci-dessous, dans la section « Changement climatique ».
La forte dépendance du pin flexible envers le Cassenoix d'Amérique pour la dispersion et la reproduction est décrite plus bas, dans la section « Dispersion ». Les interactions de l'espèce avec la rouille vésiculeuse du pin blanc et le dendroctone du pin ponderosa (Dendroctonus ponderosae) sont décrites ci-après, dans la section « Menaces et facteurs limitatifs ».
En outre, le pin flexible est lié à d'autres espèces, principalement à cause de ses graines, qui constituent une importante source de nourriture pour de nombreux animaux, dont l'écureuil roux (Tamiasciurus hudsonicus) et d'autres petits mammifères, l'ours noir (Ursus americanus), le grizzli (U. arctos) ainsi qu'un certain nombre d'oiseaux, plus particulièrement le Cassenoix d'Amérique (Nucifraga columbiana; Smith et Balda, 1979; Kendall, 1983; Benkman et al., 1984; Tomback et Linhart, 1990; Benkman, 1995; McCutchen, 1996; Tomback, 2001; Peters, 2011; Tomback et al., 2011).
Il arrive que les écureuils récoltent une grande partie des cônes avant que ceux-ci aient libéré leurs graines. Cette prédation semble avoir créé une pression de sélection qui a entraîné une certaine réaffectation de l'énergie et des ressources servant à la production de graines vers la création de caractères morphologiques de défense chez les cônes (Smith, 1970; Benkman, 1995; Siepielski et Benkman, 2007; Siepielski et Benkman, 2008).
Le pin flexible interagit souvent avec d'autres espèces de végétaux, notamment des arbres. En effet, il favorise l'établissement de ces végétaux, particulièrement dans les sites où les conditions sont rigoureuses, en créant des microsites protégés constituant des abris (Rebertus et al., 1991; Baumeister et Callaway, 2006). Plus tard dans la succession, ces espèces peuvent entrer en compétition avec le pin flexible et créer des conditions qui sont défavorables à sa persistance (par exemple, le douglas de Menzies) ou causer une augmentation de la fréquence et de la gravité de la rouille vésiculeuse du pin blanc (espèces du genre Ribes).
En outre, l'espèce a des interactions avec certains champignons, positives dans certains cas et négatives dans d'autres. Comme toutes les autres espèces de pin, le pin flexible dépend des champignons mycorhiziens pour sa croissance et sa survie; ces champignons favorisent le prélèvement des nutriments, en plus d'offrir une protection contre les agents pathogènes, les organismes terricoles nuisibles, les métaux lourds et la sécheresse (Smith et Read, 1997). Plus de 26 espèces de champignons mycorhiziens ont été signalés en association avec le pin flexible, et des recherches plus approfondies sur le sujet sont en cours (Cripps et Antibus, 2011). Certaines espèces de champignons mycorhiziens sont associées uniquement aux espèces de pin possédant des fascicules à cinq aiguilles, et des données de plus en plus nombreuses indiquent que les champignons mycorhiziens présentent une spécificité à l'égard de l'espèce et de l'âge des arbres hôtes ainsi que des conditions locales (Tedersoo et al., 2009). Ces interactions pourraient être essentielles à l'établissement des semis dans les peuplements décimés ou dans les nouveaux sites où des graines arrivent par dispersion naturelle ou assistée (Desprez-Loustau et al., 2007).
Cependant, certains champignons non mycorhiziens peuvent causer la mort des graines et endommager les aiguilles, les tiges et les racines (Burns et Honkala, 1990). Le champignon causant les dommages les plus considérables est sans doute le Dothistroma septosporum (Jackson et Lockman, 2003; Woods et al., 2005), qui s'attaque aux aiguilles; il a récemment causé une mortalité importante au Montana (Schwandt et al., 2010), et sa répartition semble s'étendre (Watt et al., 2009; Sturrock et al., 2011). Un autre champignon, le Cronartium comandrae (responsable de la rouille-tumeur oblongue), s'hybride naturellement avec le champignon responsable de la rouille vésiculeuse du pin blanc et a récemment été signalé chez le pin flexible (Joly et al., 2006). On ignore encore quelles pourraient être les conséquences de ce phénomène pour le pin flexible.
De plus, le pin flexible est touché par d'autres parasites, notamment l'Arceuthobium cyanocarpum, plante qui n'a pas encore été signalée au Canada mais s'attaque aux espèces du genre Pinus dans certaines régions du Montana. Dans l'ouest des États-Unis, elle est considérée pour le pin flexible comme le deuxième organisme nuisible en importance, après l'agent de la rouille vésiculeuse du pin blanc (Taylor et Mathiasen, 1999). Avec le changement climatique, cette plante parasite pourrait se propager jusqu'au Canada.
En outre, il faut mentionner la relation potentiellement importante entre le pin flexible et l'Argyresthia flexilis, papillon nocturne dont la chenille se nourrit exclusivement des aiguilles du pin flexible (Freeman, 1972). Ce papillon est apparemment extrêmement rare au Canada et figure sur la liste des espèces candidates aux fins d'une évaluation par le Sous-comité de spécialistes des arthropodes du COSEPAC (COSEWIC, 2013). Le déclin des populations de pin flexible pourrait avoir des répercussions sur cet insecte, notamment la disparition concomitante de populations locales des deux espèces (Colwell et al., 2012). Toutefois, étant donné que cette relation n'est pas réciproque, c'est-à-dire que le papillon dépend du pin flexible, mais non l'inverse, le risque est sans doute plus élevé pour le papillon. De même, l'Ips woodi, scolyte, est fortement ou peut-être entièrement limité au pin flexible au Canada, même s'il a déjà été observé chez le pin à écorce blanche en Colombie-Britannique (une seule mention, par Valemount; Bright, 1976) et dans l'État de Washington (Furniss et Johnson, 1995)
L'information sur les tendances des populations est fondée sur des études de suivi réalisées par Parcs Canada, le Service canadien des forêts, le U.S. National Parks Service, Alberta Environment and Sustainable Resource Development et Alberta Parks. Des parcelles de suivi ont été délimitées partout dans l'aire de répartition du pin flexible, en Alberta et en Colombie-Britannique (Smith et al., 2011a). En 2003 et 2004, 12 parcelles qui avaient fait l'objet de relevés pour la dernière fois en 1996 ont été revisitées, et 73 nouvelles parcelles ont été délimitées dans les Rocheuses canadiennes; ces 85 parcelles ont été visitées de nouveau en 2009 (Smith et al., 2011a; Smith et al., 2013). À chaque visite, on a dénombré les arbres vivants et les arbres morts.
Le nombre d'individus matures de l'espèce a été évalué au moyen de l'indice de zone d'occupation et de la densité moyenne des peuplements (nombre d'arbres matures/ha). Les individus ayant un diamètre à hauteur de poitrine (dhp) d'au moins 10 cm ont été considérés comme matures. Selon les données recueillies dans les parcelles en Alberta et en Colombie-Britannique (Smith et al., 2013), la densité moyenne est de 300 individus matures par ha (ha). L'effectif total au Canada est donc évalué à 44,4 millions d'individus matures (300 individus matures/ha × 148 000 ha). Cette estimation comporte une certaine part d'incertitudes, car il est possible que les individus qui présentent des chancres causés par la rouille vésiculeuse du pin blanc ne puissent pas être considérés comme des « individus matures » (capables de se reproduire). En effet, ces chancres peuvent tuer les portions du houppier où les cônes sont produits, ce qui signifie que le nombre d'individus matures pourrait être surestimé. Par contre, dans certains milieux, les individus peuvent être rabougris (krummholz) et avoir un dhp de moins de 10 cm, mais tout de même produire des cônes, de sorte qu'ils pourraient être considérés comme des individus matures. Toutefois, on ne dispose d'aucune estimation fiable de la proportion d'individus dont le houppier a été tué par les chancres et d'individus rabougris matures.
Au Canada, les populations de pin flexible sont actuellement en déclin, et on s'attend à ce que ce déclin se poursuivre en raison des effets combinés de la rouille vésiculeuse du pin blanc, du dendroctone du pin ponderosa et du changement climatique. Aucune fluctuation rapide ou extrême (de plus d'un ordre de grandeur) de l'effectif des populations de pin flexible n'a été observée.
La rouille vésiculeuse du pin blanc est actuellement la principale cause de déclin de la population de pin flexible (Smith et al., 2011a; Smith et al., 2013). Au Canada, le taux de maladie est passé de 33 % durant la période 2003-2004 à 43 % en 2009 (Smith et al., 2011a; Smith et al., 2013). Les populations de dendroctone du pin ponderosa sont actuellement faibles dans l'habitat du pin flexible au Canada et ne causent pas un taux de mortalité élevé chez l'espèce. En effet, seulement 4 % des individus qui sont morts entre la période 2003-2004 et 2009 ont été tués par le dendroctone du pin ponderosa (Smith et al., 2013). Il est actuellement impossible d'évaluer les effets du changement climatique sur le taux de mortalité de l'espèce; toutefois, on s'attend à ce qu'il entraîne initialement une hausse des effets de la rouille vésiculeuse du pin blanc et du dendroctone du pin ponderosa. Ainsi, les tendances des populations présentées ci-dessous sont essentiellement attribuables uniquement aux effets de la rouille vésiculeuse du pin blanc.
Aux fins de la présente évaluation, les taux de mortalité annuelle moyens ont été estimés pour chacune des 85 parcelles de suivi de Smith et al. (2011a). Deux formules ont été utilisées, selon que le site avait été visité deux ou trois fois (tableau 1; annexe 1). Dans le cas des sites visités deux fois, le taux de mortalité annuelle a été calculé en soustrayant le pourcentage d'arbres morts observé en 2003-2004 à celui observé en 2009, puis en divisant le résultat obtenu par 5,5 (intervalle moyen, en années, entre la période 2003-2004 et 2009). Dans le cas des sites visités trois fois, le taux de mortalité annuelle a été calculé au moyen de la pente de la droite de régression linéaire représentant le pourcentage d'arbres morts au fil du temps.
| Zone | Emplacement | Taux de mortalité moyen (1996) |
Taux de mortalité moyen (2003-04) |
Taux de mortalité moyen (2009) |
Taux de mortalité annuelle Table Footnotef (Toutes les années) |
|---|---|---|---|---|---|
| Nord | Vallée de la Bow jusqu'aux plaines Kootenay | - | 12 | 13 | 0,18 |
| Centre | Route 3 jusqu'à la vallée de la Bow | - | 32 | 37 | 0,91 |
| Centre | Whaleback | 15 | 43 | 32 | 1,45 |
| Sud | Route3 jusqu'au parc national des Lacs-Waterton | - | 45 | 52 | 1,27 |
| Sud | Parc national des Lacs-Waterton | 40 | 56 | 52 | 0,99 |
| Moyenne ± écart-type | - | - | - | - | 0,96 ± 0,44 |
| Ensemble complet de données (n = 85 parcelles) Table Footnoteg | - | - | - | - | - |
| Moyenne | - | 32,04 | 28,85 | 33,02 | 1,06 |
| Écart-type | - | 15,87 | 19,40 | 21,76 | 1,61 |
| Intervalle de confiance à 95 % | - | 9,00 | 4,12 | 4,63 | 0,34 |
Selon cette estimation, les taux de mortalité annuelle variaient d'une région à l'autre, allant de 0,18 % à 1,45 %. Le taux moyen général est de 1,06 %, et l'intervalle de confiance à 95 % est de 0,34 % (tableau 1). En projetant le taux de mortalité annuelle moyen sur 100 ans, le taux de déclin estimé du pin flexible au Canada est de 66 % [1 - (1 - 0,0106)100 = 0,66; (tableau 3)]. Content Footnote1Si on utilise les valeurs supérieure et inférieure de l'intervalle de confiance à ± 95 %, le déclin projeté sur 100 ans va de 51 à 76 % (tableau 3).
| Niveau de la menace | Portée | Gravité | Immédiateté | Impact |
|---|---|---|---|---|
| Rouille vésiculeuse du pin blanc (8.1. Espèces exotiques envahissantes) | Généralisée | Extrême | Élevée | Très élevé |
| Dendroctone du pin ponderosa (8.2. Espèces indigènes problématiques) | Généralisée | Extrême | Élevée | Très élevé |
| Changement climatique (11. Changement climatique) | Généralisée | Extrême | Élevée | Très élevé |
| Année | Taux de mortalité annuelle Table Footnoteh 1,06% Nbre d'individus matures |
Taux de mortalité annuelle Table Footnoteh 1,06% Déclin |
Taux de mortalité annuelle Table Footnoteh 1,40% Nbre d'individus matures |
Taux de mortalité annuelle Table Footnoteh 1,40% Déclin |
Taux de mortalité annuelle Table Footnoteh 0,72% Nbre d'individus matures |
Taux de mortalité annuelle Table Footnoteh 0,72% Déclin |
|---|---|---|---|---|---|---|
| 0 | 44 400 000 | 0 % | 44 400 000 | 0 % | 44 400 000 | 0 % |
| 10 | 39 911 866 | 10 % | 38 561 340 | 13 % | 41 304 812 | 7 % |
| 20 | 35 877 411 | 19 % | 33 490 472 | 25 % | 38 425 395 | 13 % |
| 30 | 32 250 775 | 27 % | 29 086 430 | 34 % | 35 746 706 | 19 % |
| 40 | 28 990 734 | 35 % | 25 261 525 | 43 % | 33 254 752 | 25 % |
| 50 | 26 060 232 | 41 % | 21 939 601 | 51 % | 30 936 515 | 30 % |
| 60 | 23 425 956 | 47 % | 19 054 514 | 57 % | 28 779 887 | 35 % |
| 70 | 21 057 965 | 53 % | 16 548 819 | 63 % | 26 773 600 | 40 % |
| 80 | 18 929 339 | 57 % | 14 372 627 | 68 % | 24 907 174 | 44 % |
| 90 | 17 015 884 | 62 % | 12 482 607 | 72 % | 23 170 859 | 48 % |
| 100 | 15 295 848 | 66 % | 10 841 128 | 76 % | 21 555 585 | 51 % |
Pour diverses raisons, les projections sur 100 ans demeurent incertaines, comme c'est le cas de toutes les projections démographiques. Dans le cas présent, les sources d'incertitude sont notamment : le fait que le nombre d'années (5 à 13) pour lesquelles on dispose de données est faible par rapport à la portée temporelle de la projection; les variations géographique et temporelle et la variation liée à la taille en ce qui a trait aux taux de maladie et de mortalité; la contribution future inconnue du recrutement à la croissance de la population; la possibilité qu'une résistance naturelle apparaisse au cours de la période de 100 ans.
Il est probable que les taux de mortalité annuelle et de fécondité changeront à court terme. Un nombre élevé d'individus présentent des chancres actifs sur le tronc ou sur les branches, à moins de 15 cm du tronc (ceux-ci risquent de croître jusqu'au tronc et de tuer l'arbre en moins de 10 ans; Kearnes et al., 2009), ce qui donne à penser qu'une augmentation du nombre d'individus dont le haut du houppier est mort pourrait bientôt être observée (Smith et al., 2013). Il est à signaler qu'il est moins fréquent d'observer chez le pin flexible que chez le pin à écorce blanche le phénomène où la rouille vésiculeuse du pin blanc tue seulement la partie supérieure du houppier, qui sert à la reproduction; le pin flexible peut produire des cônes dans la partie inférieure de son houppier, mais la production de cônes s'en trouve tout de même réduite.
Actuellement, on considère que le taux de croissance de la population est déterminé uniquement par la mortalité des individus matures, car le recrutement d'individus matures issus de semis semble être très faible, voire probablement négligeable (Smith, comm. pers., 2013). On dispose de peu de renseignements sur le taux de recrutement. Les semis meurent 1 à 3 années après l'infection (Schoettle et Sniezko, 2007) et se décomposent rapidement, ce qui rend difficile l'évaluation du taux de mortalité des semis (Field et al., 2012). Smith et al. (2013) ont observé, au cours d'une période de 5 ou 6 ans, que le taux de parcelles où des semis étaient présents avait légèrement augmenté, passant de 76 % à 85 %, et que le taux de semis infectés par la rouille avait diminué, passant de 8 % à 4 %. Cependant, ils ont également observé une hausse du taux d'infection des semis les plus hauts et les plus âgés dans le cas des deux périodes de collecte de données, ce qui donne à penser que le taux d'infection pourrait augmenter de façon épisodique dans le temps, fort probablement au cours des années où les conditions environnementales sont favorables à la propagation de la rouille vésiculeuse du pin blanc. La diminution de la proportion de semis appartenant à la catégorie de taille supérieure laisse croire qu'il est probable que peu de semis parviennent à maturité. Selon des études en serre, le taux d'infection est trois fois plus élevé chez les semis du pin flexible que chez ceux du pin à écorce blanche (Hoff et McDonald, 1993). Selon les estimations, si on tient compte uniquement de la mortalité causée par la rouille, seulement environ 3 % des semis de pin à écorce blanche atteignent l'âge de 100 ans (taux calculé en fonction des taux de survie par classes d'âge de Ettl et Cotone, 2004, et de Keane et al., 1990). Ainsi, on peut supposer que le taux de recrutement des semis du pin flexible est très faible.
En outre, d'autres facteurs entraînent une diminution du recrutement, notamment la diminution de la dispersion des graines (la proportion des graines consommée par les animaux augmente du fait que la production de graines est moins abondante; Peters, 2012) et la répartition fragmentée du pin flexible, qui diminue la probabilité de dispersion des graines entre les peuplements. Par conséquent, le recrutement d'individus matures issus de semis est considéré comme négligeable.
Le taux de mortalité projeté suppose que le taux d'infection par la rouille vésiculeuse du pin blanc demeurera constant au cours des 100 prochaines années. On peut réalistement s'attendre à ce que ce taux se maintienne ou augmente dans le futur, étant donné qu'une tendance à la hausse des taux d'infection et de mortalité a été observée en Amérique du Nord (Schwandt et al., 2010; Burns et al., 2011; Smith et al., 2011a). En outre, on peut s'attendre à ce qu'il y ait des infestations de dendroctone du pin ponderosa au cours de cette période de 100 ans, car au moins deux infestations se sont produites au Canada au cours du 20e siècle (AFLW, 1986; Wood et Unger, 1996; Langor, 2007; CFS, 2008; Raffa et al., 2008). Les taux de mortalité dépendent d'une combinaison de facteurs interreliés, de sorte que les déclins projetés uniquement en fonction du taux de mortalité associé à la rouille vésiculeuse du pin blanc (principale menace actuelle) constituent probablement des sous-estimations.
Certaines populations de pin flexible des États-Unis sont situées à proximité de populations canadiennes d'Alberta ou même presque continues avec ces populations. La dispersion de graines par le Cassenoix d'Amérique depuis les populations des États-Unis jusqu'à des milieux propices au Canada est en théorie possible. Cependant, les populations de pin flexible des États-Unis ont elles aussi subi des déclins associés aux mêmes facteurs que ceux mentionnés pour le Canada (Kearnes et Jacobi, 2007; Asebrook et al., 2011; Burns et al., 2011; Klutsch et al., 2011). On ignore quels sont les effets de ce déclin sur le Cassenoix d'Amérique, mais on peut s'attendre à ce que l'effectif de l'espèce diminue, en raison de sa relation avec le pin flexible et le pin à écorce blanche, qui est également en déclin; il en résulterait ainsi une diminution de la dispersion des graines. On ne prévoit pas que les effets du changement climatique seront moindres aux États-Unis (Warwell et al., 2007) qu'au Canada. Par conséquent, la probabilité d'une immigration depuis les populations des États-Unis en cas de disparition ou de déclin de l'espèce au Canada est extrêmement faible.
De plus, il est possible que les gènes de résistance à la rouille vésiculeuse du pin blanc soient puissent être transférés naturellement, par dispersion du pollen, depuis les populations des États-Unis à celles du Canada, mais ce phénomène n'a jamais été signalé. Aucune immigration de source externe ne semble actuellement possible.
La rouille vésiculeuse du pin blanc provient d'Eurasie et a été introduite accidentellement en Amérique du Nord (McDonald et Hoff 2001; Geils et al.,2010). La maladie a été initialement découverte sur l'île de Vancouver en 1921, puis s'est propagée dans l'aire de répartition du pin flexible (Geils et al., 2010). En 1952, elle avait atteint les occurrences de pin flexible d'Alberta (Gautreau, 1963) et s'est par la suite propagée dans presque toute l'aire nord-américaine de l'espèce (Tomback et Achuff, 2010). Le pin flexible a été gravement touché par la maladie. En effet, dans l'ensemble de son aire de répartition, seulement quelques peuplements ne présentent pas de signes d'infection (Schwandt et al., 2010). Dans plusieurs peuplements du Canada, le taux d'infection est supérieur à 60 %, et le taux de mortalité associé à la maladie est de plus de 50 % (Smith et al., 2011a). Dans l'ensemble, au Canada, les taux d'infection par la rouille vésiculeuse du pin blanc et de mortalité sont en hausse (Smith et al., 2011a). Ces taux sont les plus élevés dans le sud-ouest de l'Alberta et diminuent vers le nord, mais la maladie est présente dans l'ensemble de l'aire de répartition canadienne.
La propagation de la maladie dépend non seulement de la présence du pin flexible, mais aussi de celle de ses hôtes intermédiaires, principalement les arbustes indigènes du genre Ribes, qui sont répandus dans l'ouest de l'Amérique du Nord (Zambino, 2010). Selon des recherches récentes, la castilléjie rougeâtre (Castilleja miniata), la pédiculaire à fleurs bractéolées (Pedicularis bracteosa) et la pédiculaire à fleurs en grappes (P. racemosa), espèces indigènes, pourraient aussi servir d'hôtes intermédiaires (McDonald et al., 2006; Zambino et al., 2007).
Le champignon produit sur ses hôtes intermédiaires des basidiospores qui sont transportées par le vent jusqu'aux pins, dont ils attaquent les aiguilles, généralement à la fin de l'été (McDonald et Hoff, 2001). Une fois que le champignon a infecté les aiguilles, ses hyphes s'enfoncent dans le faisceau vasculaire et pénètrent dans le phloème de la branche ou du tronc. À mesure que le champignon envahit le phloème, le transport d'éléments nutritifs vers les branches et la partie supérieure du tronc se fait de plus en plus difficilement. Deux à quatre années après l'infection, le champignon cause l'apparition de chancres, qui brisent la surface de l'écorce. Les semis et les gaules sont particulièrement sensibles et sont souvent tués en 1 à 3 ans (Schoettle et Sniezko, 2007). Le faible taux d'infection des semis observé dans certains peuplements n'est pas attribuable à une faible probabilité d'infection. Plutôt, une combinaison des effets négatifs du champignon, de la mortalité naturelle et du bref temps de séjour font en sorte qu'il est difficile de recenser les semis infectés avec certitude (Field et al., 2012). Même si les chancres peuvent finir par anneler les tiges infectées, la maladie n'est pas nécessairement la cause directe de la mort des individus. Les concentrations élevées de nutriments présentes dans les chancres attirent les rongeurs; ceux-ci grignotent les chancres et, du même coup, les tissus vasculaires du pin et annèlent souvent la tige. La blessure causée par le prélèvement des tissus vasculaires constitue une voie d'entrée pour les agents pathogènes secondaires, qui constituent la principale cause de mortalité chez toutes les classes d'âge.
En plus de causer une mortalité directe, la rouille vésiculeuse du pin blanc peut entraîner une diminution considérable du recrutement, par divers mécanismes. En effet, elle peut réduire ou éliminer la production de graines, en causant la mort de la partie terminale des branches, où les cônes sont généralement produits. La maladie peut entraîner une diminution de la production de cônes, du taux de survie des graines avant le stade de la dispersion et de la probabilité que les graines soient dispersées par le Cassenoix d'Amérique (voir la section « Immigration de source externe » ci-dessus). Une telle diminution de la fécondité et de la dispersion des graines pourrait entraîner une suppression presque complète de la régénération dans de grandes parties de l'aire de répartition du pin flexible.
En outre, la rouille pourrait avoir un effet sur les infestations de dendroctone du pin ponderosa, en rendant les arbres plus vulnérables à l'insecte (Schwandt et al., 2010).
Des individus à phénotype résistant à la rouille vésiculeuse du pin blanc ont été observés en forêt naturelle, mais ceux-ci sont peu fréquents (Hoff et al.,1980). Cette résistance pourrait être d'origine génétique, comme chez d'autres espèces de pin (pin argenté, pin à écorce blanche, etc.; King et al., 2010). La résistance génétique et les mécanismes de résistance ont fait l'objet d'études (Burns et al., 2008; ASRD, 2009; Schoettle et al., 2011); il y a peu de temps, un important gène de résistance (nommé Cr4)a été trouvé chez des populations saines et récemment infestées dans le sud des Rocheuses (Schoettle et al., 2014). Des enquêtes destinées à trouver d'autres sources de résistance à la rouille vésiculeuse du pin blanc chez le pin flexible sont actuellement en cours.
Une fois que les gènes de résistance auront été identifiés, un programme d'amélioration visant la résistance à la rouille vésiculeuse du pin blanc pourrait être créé, en vue de mettre au point des arbres résistants destinés à la plantation. Cependant, ce processus s'échelonnera sur au moins plusieurs dizaines d'années (Hoff et al., 2001), et il est possible que la variation génétique de la virulence de l'agent pathogène neutralise la résistance du pin flexible (McDonald et Hoff, 2001).
Le dendroctone du pin ponderosa est une espèce indigène qui coexiste avec le pin flexible depuis plus de 8500 ans (Brunelle et al., 2008) et se rencontre dans la majeure partie de l'aire canadienne de celui-ci, mais l'Alberta et la Colombie-Britannique sont actuellement aux prises avec des infestations du ravageur (CFS, 2008). Il a été montré que des facteurs anthropiques (suppression des incendies, changement climatique associé aux émissions de gaz à effet de serre, etc.) jouent un rôle considérable dans ces infestations (Carroll et al., 2003; Taylor et al., 2006; Logan et Powell, 2008; Raffa et al., 2008).
Le réchauffement climatique entraîne un adoucissement des températures hivernales et une hausse des températures estivales ainsi qu'un prolongement de la saison de croissance, facteurs qui favorisent tous la survie, le développement et la reproduction du dendroctone du pin ponderosa (Carroll et al., 2003; Taylor et al., 2006; Logan et Powell, 2008). Autrefois, le dendroctone mettait souvent 2 ou 3 ans pour accomplir son cycle vital dans les peuplements de pin flexible (Amman et al., 1997). Avec le réchauffement, il est de plus en plus courant d'observer des cycles de 1 an (Logan et al., 2010), et certaines populations comptent 2 couvains par année (Mitton et Ferrenberg, 2012). Cette accélération du cycle vital permet une hausse de la croissance de la population et une réduction des risques de mortalité liés au froid, à la prédation par les oiseaux et aux champignons pathogènes (Bentz et al., 2011). Si la tendance au réchauffement se maintient, les niveaux d'infestation risquent d'augmenter (Logan et Powell, 2008).
La suppression des incendies a entraîné une hausse dans le paysage de la proportion occupée par des pins, y compris le pin tordu et le pin ponderosa (P. ponderosa), de la classe d'âge la plus vulnérable au dendroctone du pin ponderosa. Les conditions sont ainsi devenues propices à des pullulations du dendroctone sur de vastes étendues, ce qui augmente le risque d'infestation des peuplements de pin flexible (AFLW, 1986; Raffa et al., 2008).
Dans les années 1980, dans le sud-ouest de l'Alberta, de vastes superficies de la population de pin flexible ont été touchées par une infestation de dendroctone du pin ponderosa. Près de 40 000 individus ont été coupés dans le cadre des mesures de lutte (AFLW, 1986), et plusieurs milliers d'autres ont été tués directement par l'insecte (Langor, 2007).
Le pin flexible est plutôt vulnérable aux attaques du dendroctone du pin ponderosa, et le couvain est proportionnellement plus nombreux chez le pin flexible que chez la plupart des autres espèces de pin (Amman, 1982; Langor, 1989; Langor et al., 1990). En outre, l'interaction entre le dendroctone du pin ponderosa et la rouille vésiculeuse du pin blanc est très préoccupante : non seulement les arbres affaiblis par la rouille sont-ils plus susceptibles d'être infestés par le dendroctone (Schwandt et al., 2010), mais le dendroctone risque d'infester et de tuer les arbres qui n'ont pas été tués ou rendus stériles par la rouille.
Actuellement, les populations de pin flexible du Canada ne sont pas touchées par des infestations de dendroctone du pin ponderosa. Les données de surveillance indiquent que peu d'arbres (4 % des arbres morts entre la période 2003-2004 et 2009) ont été tués par le dendroctone du pin ponderosa (Smith et al., 2013). Cependant, au Canada, le dendroctone du pin ponderosa est encore présent dans le paysage entourant le pin flexible, et on peut s'attendre à ce que les populations de dendroctone atteignent de nouveau des niveaux épidémiques comme ceux observés dans l'Ouest canadien dans les années 1890, à la fin des années 1930 et au début des années 1940, au milieu des années 1980 ainsi qu'à la fin des années 1990 et au début des années 2000 (AFLW, 1986; Alfaro et al., 2007; Safranyik et al., 2010). L'infestation des années 1980 a causé un taux de mortalité élevé chez le pin flexible dans le sud-ouest de l'Alberta (AFLW, 1986; Langor et al., 1990; Langor 2007).
On prévoit que le changement climatique aura une incidence sur le pin flexible dans les parties de son aire de répartition situées en Alberta et en Colombie-Britannique, mais il persiste des incertitudes considérables quant à ses effets. Selon les modèles, dans ces régions, une augmentation de 2 à 6 °C des températures moyennes annuelles est prévue d'ici les années 2080, et ces hausses seront les plus marquées à l'hiver et au printemps. En Alberta, on prévoit de légères hausses des précipitations annuelles moyennes, qui seront plus marquées à l'hiver et au printemps (Barrow et Yue, 2005; Sauchyn et Kulshreshtha, 2008). Dans le sud-est de la Colombie-Britannique, une diminution des précipitations annuelles moyennes est prévue; une augmentation des précipitations est prévue en hiver et au printemps, mais celle-ci sera compensée par une diminution des précipitations estivales (Spittlehouse, 2008; Walker et Sydneysmith, 2008; Utzig, 2012). Dans l'ensemble de l'aire de répartition de l'espèce, l'effet net prévu est une hausse de l'évapotranspiration et une diminution de 20 à 30 % du taux d'humidité du sol durant la saison de croissance (Rweyongeza et al., 2010; Schindler et Donahue, 2012).
Les effets de ces changements seront les plus marqués le long de l'écotone entre les forêts des piémonts et les prairies adjacentes (MacDonald, 1989; Henderson et al., 2002; Sauchyn et Kulshreshtha, 2008), qui est la principale région où on rencontre l'espèce. On prévoit une hausse de la fréquence, de l'intensité et de la durée des sécheresses (Gillett et al., 2004; Sauchyn et Kulshreshtha, 2008; Utzig, 2012) ainsi que de la fréquence et de la gravité des incendies (de Groot et al., 2002; Flannigan et al., 2005; Utzig et al., 2012). En outre, les individus soumis au stress sont probablement plus sensibles aux agents pathogènes (Saporta et al., 1998; Logan et Powell, 2008).
Ces facteurs entraîneront probablement une croissance réduite des arbres, une absence de régénération les années sèches, la mort d'individus associée à la sécheresse et aux agents pathogènes ainsi qu'une diminution graduelle de la taille des populations. Chez le pin flexible, la durée d'une génération est considérable, et la tolérance au stress est élevée, de sorte que les individus matures pourraient résister aux changements liés au climat pendant des dizaines d'années (Roberts et Hamman, 2011). Cependant, le taux de diminution de la population pourrait augmenter, car la réaction de l'espèce pourrait être non linéaire en raison d'une « inertie écologique ». En effet, les individus matures ont la capacité de tolérer le stress accru pendant une certaine période, mais une fois qu'un certain seuil a été atteint, ils dépérissent rapidement, et un rapide déclin de la population est observé (Saporta et al., 1998; Burkett et al., 2005).
On s'attend à ce qu'il y ait un décalage considérable dans l'adaptation in situ du pin flexible au changement climatique, car les populations sont relativement petites et éparses, le taux de fécondité est faible et la production de graines commence à un âge tardif (Dullinger et al., 2004; Savolainen et al., 2007; Aitken et al., 2008). Selon des études portant sur d'autres espèces de pin qu'on rencontre dans l'hémisphère Nord mais dont les caractéristiques du cycle vital sont plus favorables, la sélection sur une génération serait insuffisante pour qu'une espèce puisse s'adapter au changement climatique, et cette adaptation pourrait nécessiter 10 générations, ou plus de 1000 ans (Rehfeldt et al., 1999; Rehfeldt et al., 2001; Rehfeldt et al., 2002). En outre, il y a probablement des limites génétiques à l'adaptation (Jump et Penuelas, 2005).
Au cours des 75 à 100 prochaines années, on prévoit que la plus grande partie de l'aire de répartition canadienne actuelle du pin flexible pourrait ne plus convenir à l'espèce, en raison du changement climatique (Henderson et al., 2002; Hamman et Wang, 2006). Toutefois, des individus matures sains pourraient être capables de persister pendant une certaine période dans des conditions où la régénération ne serait plus possible. Selon des modèles « d'enveloppe climatique », qui prédisent les modifications de l'aire de répartition d'une espèce en fonction de variables climatiques déterminant les régions propices, l'espèce devrait progresser en altitude et vers le nord en Alberta et en Colombie-Britannique (Hamann et Wang, 2006; Rweyongeza et al., 2010). Cependant, ce type de modèle a une relativement faible valeur prédictive pour le pin flexible en Colombie-Britannique, et les statistiques sur la perte d'habitat ne sont pas valables (Hamann et Wang, 2006).
Aucune prédiction n'a été faite quant à la superficie de l'habitat du pin flexible en Alberta, mais on s'attend à ce que des tendances semblables à celles prévues pour la Colombie-Britannique soient observées dans cette province (Henderson et al., 2002; Rweyongeza et al., 2010). Toutefois, on ignore quelle sera la superficie rendue propice à l'espèce par le changement climatique, particulièrement parce que les compositions physiographiques des deux provinces diffèrent.
Selon les modèles, l'aire de répartition mondiale du pin flexible augmentera d'environ 8 % d'ici 2100 (McKenney et al., 2007), si on tient compte de tous les nouveaux milieux qui deviendront propices à l'espèce; si on ne tient pas compte de la capacité de l'espèce d'occuper de nouveaux milieux, l'aire diminuerait alors d'environ 56 %. Cependant, l'aire de répartition actuelle du pin flexible était surestimée dans cette étude, de sorte que l'expansion de l'aire est probablement elle aussi surestimée. Les modèles d'enveloppe climatique surestiment probablement la capacité des espèces d'occuper de nouveaux milieux, comme on l'explique plus bas, et on ignore si le pin flexible sera capable de s'établir dans les milieux qui lui seront devenus propices.
Dans le passé, les végétaux ont généralement migré vers des milieux propices lorsque des changements climatiques se sont produits (MacDonald, 1989; Bradshaw et McNeilly, 1991; Huntley, 1991; Jackson et Overpeck, 2000). Toutefois, vu la rapidité prévue des changements (IPCC, 2007; Barrow et Yu, 2005; Sauchyn et Kulshreshtha, 2008; Walker et Sydneysmith, 2008; Schneider et al., 2009), il est peu probable que le pin flexible soit capable de migrer ainsi dans la majeure partie de son aire de répartition. Selon des observations faites dans le passé, la vitesse de migration latitudinale du pin flexible est estimée à environ 100 mètres/an, alors que dans l'éventualité où la concentration de CO2 doublerait, il faudrait que l'espèce se déplace d'environ 1 km/an pour gagner les milieux favorables (Malcolm et al., 2002; Aitken et al., 2008; Van der Putten, 2012). Il sera probablement plus facile pour le pin flexible de migrer en altitude qu'en latitude (Bertrand et al., 2011), car la distance à parcourir est moindre; toutefois, dans plusieurs régions, la migration en altitude pourrait être limitée par l'absence de substrat propice ou de terrains propices se prolongeant en altitude (Romme et Turner, 1991; Bartlein et al., 1997; Hamman et Wang, 2006; Lenoir et al., 2008). En outre, la migration pourrait être freinée par d'autres facteurs, par exemple, l'absence de champignons mycorhiziens spécifiques au pin flexible (Cripps et Antibus, 2011), les effets de la fragmentation de l'habitat et la dispersion par les oiseaux limitée (Van der Putten, 2012).
La prédiction de l'effet du changement climatique sur le pin flexible comporte une part considérable d'incertitudes. Les processus déterminés par des variables climatiques sont relativement bien compris, mais il est beaucoup plus complexe de prédire les réactions biologiques de l'espèce. Les modèles d'enveloppe climatique, destinés à prédire la future répartition d'une espèce (milieux propices), reposent sur une approche simplifiée; cette approche est fondée sur des variables climatiques et ne tient compte d'aucun facteur biologique, par exemple, les caractéristiques liées à la dispersion et au cycle vital, les régimes de perturbations et les interactions biotiques (Hamman et Wang, 2006; Rehfeldt et al., 2006; Aitken et al., 2008; Leniham et al., 2008; Litell et al., 2010; Buckley et Kingsolver, 2012). Les facteurs biotiques sont particulièrement importants dans le cas du pin flexible, car il est essentiel de tenir compte de ses interactions avec les champignons mycorhiziens, la rouille vésiculeuse du pin blanc et le dendroctone du pin ponderosa. La dispersion sur de longues distances peut permettre à une espèce de s'établir dans des milieux où certains de ses agents pathogènes sont absents (Van Grunsven et al., 2007), mais des analyses historiques plurispécifiques donnent à penser que ce phénomène avantageux serait peu fréquent ou de courte durée (Moorcroft et al., 2006). Bref, il est probable que les prédictions sur les aires de répartition obtenues au moyen des modèles d'enveloppe climatique constituent des surestimations, car la plupart des facteurs biologiques entraîneront un ralentissement de la migration et nuiront à l'établissement.
Chacun des trois facteurs liés à l'activité humaine (rouille vésiculeuse du pin blanc, dendroctone du pin ponderosa, changement climatique) constitue une menace considérable pour le pin flexible, et ces menaces interagissent d'une manière qui accentue la gravité de leurs répercussions. Le changement climatique accentuera le stress subi par les individus de l'espèce, les rendant plus vulnérables à la rouille vésiculeuse du pin blanc et au dendroctone du pin ponderosa. En outre, le changement climatique entraînera probablement une augmentation du risque de pullulations du dendroctone du pin ponderosa et de la gravité des infestations, et l'insecte pourrait tuer les derniers arbres encore vivants dans les peuplements déjà décimés par la rouille vésiculeuse du pin blanc. On s'attend à ce que la rouille vésiculeuse du pin blanc et le dendroctone du pin ponderosa se dispersent au même rythme que le pin flexible, de sorte qu'il semble impossible que la migration permette à l'espèce d'échapper à ces menaces.
La prise de mesures adéquates et opportunes pour atténuer les menaces décrites serait, sinon impossible, à tout le moins extrêmement difficile (Keane et Schoettle, 2011). La mise au point d'individus résistants à la rouille vésiculeuse du pin blanc et l'établissement de populations viables à long terme dans une aire aussi vaste que celle du pin flexible prendrait plusieurs décennies et nécessiterait des ressources considérables. La réduction des changements climatiques ou l'adaptation à ces changements prendrait également des décennies, et les moyens pour y parvenir sont source de beaucoup d'incertitude pour l'élaboration des politiques gouvernementales. En outre, il peut être difficile d'obtenir des ressources pour une espèce qui n'est pas exploitée commercialement, comme le pin flexible. On pense donc que les facteurs qui menacent le pin flexible persisteront pendant encore au moins plusieurs décennies et que peu de mesures seront prises pour les atténuer.
En outre, le niveau de menace a été évalué au moyen d'un système international (IUCN et CMP, 2006) qui prend en compte la portée, la gravité, la durée et l'impact des menaces actuelles et futures. L'impact des principales menaces pesant sur le pin flexible (rouille vésiculeuse du pin blanc, dendroctone du pin ponderosa, changement climatique) est considéré comme très élevé (tableau 2). Ce système ne tient pas compte des interactions entre les menaces de façon explicite, mais, comme il l'est indiqué plus haut, ces menaces interagissent, et la gravité de leurs impacts s'en trouve accentuée.
Le nombre de localités (COSEWIC, 2012) est déterminé en fonction de la menace plausible la plus grave. La localité est une zone dans laquelle un seul phénomène menaçant peut affecter rapidement tous les individus du taxon présent. Elle peut comprendre une partie d'une population ou plusieurs populations. Il n'a pas été possible de délimiter les populations de pin flexible au Canada, car on dispose d'information limitée quant aux peuplements locaux; la totalité de la population canadienne est donc considérée comme une seule entité. En outre, la menace plausible la plus grave est la même pour l'ensemble de la population canadienne de pin flexible.
Le dendroctone du pin ponderosa est la menace qui pourrait le plus rapidement toucher toutes les populations de pin flexible. Il a été observé à l'intérieur ou à proximité de toutes les parties de l'aire du pin flexible au Canada et a entraîné la mort de dizaines de milliers d'arbres dans le sud-ouest de l'Alberta durant les années 1980 (AFLW, 1986; Langor, 2007). La portée et la rapidité des récentes infestations observées dans le centre de la Colombie-Britannique montrent que le dendroctone a la capacité de rapidement causer un déclin des populations sur de vastes superficies. Comme il est expliqué plus haut, le dendroctone du pin ponderosa ne touche actuellement pas toutes les populations de pin flexible au Canada, mais il le pourrait, particulièrement vu les tendances actuelles de propagation des coléoptères et le changement climatique. Ainsi, on peut en conclure que l'ensemble des populations de pin flexible du Canada constitue une seule localité si le dendroctone du pin ponderosa est considéré comme la menace principale.
Les effets de la rouille vésiculeuse du pin blanc se font sentir plus lentement que ceux du dendroctone du pin ponderosa, mais la maladie se propage de façon inexorable et tue des individus de tous les âges partout dans l'aire canadienne de l'espèce depuis les 60 dernières années. L'agent de cette maladie, qui n'est pas indigène, a probablement causé la mort d'un plus grand nombre d'individus que le dendroctone du pin ponderosa et est présent dans toute l'aire de répartition canadienne du pin flexible. Le taux de maladie est proportionnellement faible dans certaines parties de l'aire du pin flexible, mais on peut s'attendre à que la gravité de celle-ci augmente au cours des prochaines décennies. Si on tient compte de la longévité du pin flexible, qui est de plusieurs centaines d'années, et des répercussions qu'a eues la rouille vésiculeuse du pin blanc au cours des 60 dernières années, on peut considérer que les effets de cette maladie sont « rapides ». En outre, la maladie peut certainement toucher tous les individus de l'espèce. Ainsi, on peut considérer qu'il y a une seule localité si on considère la rouille vésiculeuse du pin blanc comme la menace principale.
Le dendroctone du pin ponderosa et la rouille vésiculeuse du pin blanc sont deux graves menaces plausibles qui peuvent toucher le pin flexible dans toute son aire de répartition canadienne. Il est toutefois difficile de déterminer laquelle des deux menaces est la plus plausible. Étant donné l'interaction entre les deux menaces, où la rouille vésiculeuse du pin blanc tue les individus de plusieurs groupes d'âge et réduit la production de graines et la régénération de l'espèce et où le dendroctone du pin ponderosa peut tuer les individus matures restants (qui sont peut-être résistants à la rouille), il est plus réaliste de considérer les effets combinés des deux menaces comme un seul phénomène menaçant.
Le pin flexible ne jouit d'aucune protection juridique au Canada (voir précisions ci-dessous).
Le pin flexible figure sur la liste des espèces en voie de disparition (« endangered ») de la Wildlife Act de l'Alberta (Government of Alberta, 2010). Cependant, cette loi ne prévoit actuellement aucune disposition protégeant les espèces végétales en Alberta. Une équipe de rétablissement provinciale a été créée en décembre 2008, et elle prépare actuellement un programme de rétablissement pour l'espèce. Pour l'heure, les services provinciaux d'aménagement du territoire ont recours aux mécanismes existants pour protéger l'espèce et son habitat.
En Colombie-Britannique, le pin flexible ne bénéficie d'aucune protection juridique, mais il figure sur la liste bleue (BC-CDC, 2011). Les espèces figurant sur cette liste sont considérées comme des espèces sauvages désignées (« Identified Wildlife Species ») aux termes du Forest Practices Code; toutefois, aucun document énonçant les lignes directrices pour la gestion de l'habitat (« Accounts and Measures ») n'a été préparé pour le pin flexible.
Au niveau international, le pin flexible a été classé en 1998 dans la catégorie « préoccupation mineure » (« Least Concern ») de la liste rouge de l'UICN (IUCN, 2010b). Cependant, il est mentionné que l'évaluation de l'espèce nécessite une mise à jour. En effet, beaucoup de nouveaux renseignements sur le pin flexible ont été récoltés depuis 1998.
NatureServe (2011) a attribué au pin flexible la cote G4 (apparemment non en péril) à l'échelle mondiale. Toutefois, il est indiqué dans la justification de la cote que les forêts de pin flexible sont aux prises avec des combinaisons complexes de facteurs de stress associés au climat, aux plantes parasites du genre Arceuthobium, à la rouille vésiculeuse du pin blanc et aux insectes forestiers, qui ont causé des taux de mortalité élevés dans plusieurs régions. En outre, il est mentionné que la modification du régime d'incendies, la faible capacité de compétition de l'espèce et le faible taux de régénération causé par la rouille vésiculeuse du pin blanc sont d'autres sources de préoccupation.
NatureServe (2011) a attribué au pin flexible les cotes N3 (vulnérable) au Canada et N4 (apparemment non en péril) aux États-Unis. En Alberta, le pin flexible est actuellement coté S2 (en péril; ACIMS, 2011). En Colombie-Britannique, l'espèce est cotée S3 (vulnérable; BC-CDC, 2011).
Aux États-Unis (NatureServe, 2011), le pin flexible est coté S1 (gravement en péri) dans quatre États (ND, NE, NM, SD), S4 (apparemment non en péril) en Oregon, S5 (non en péril) dans deux États (MT, WY) et SNR (espèce non classée, généralement en raison d'un manque d'information) dans six États (AZ, CA, CO, ID, NV, UT). Cette diversité de cotes est probablement attribuable aux dates des évaluations et à la quantité de renseignements disponibles plutôt qu'à des divergences de la situation actuelle de l'espèce.
En Alberta et en Colombie-Britannique, le pin flexible se rencontre sur des terres de la Couronne fédérales et provinciales ainsi que sur des terrains privés. On ignore quelles proportions de l'aire de l'espèce se trouvent sur des terrains privés et publics.
Parmi les terres de la Couronne fédérales qui hébergent l'espèce, on compte le parc national Banff et le parc national des Lacs-Waterton, en Alberta, et les parcs nationaux Kootenay et Yoho, en Colombie-Britannique. À l'intérieur des parcs nationaux, l'habitat de l'espèce est protégé en vertu de la Loi sur les parcs nationaux du Canada ainsi que par des plans et activités d'aménagement visant la conservation et le rétablissement de l'intégrité écologique. En Alberta et en Colombie-Britannique, les gestionnaires des parcs nationaux sont conscients du besoin de protéger l'habitat du pin flexible et ont mis en place des mesures à cette fin dans le cadre des activités de gestion du parc.
En outre, le pin flexible pousse dans les réserves indiennes Blood, Peigan, Eden Valley et Stoney, en Alberta.
En Alberta, le pin flexible est présent dans diverses aires protégées gérées par Alberta Parks, notamment des parcs provinciaux, des parcs sauvages provinciaux et des réserves écologiques. Alberta Parks a commencé à évaluer la situation du pin flexible dans les aires protégées et prend en considération la conservation de l'espèce dans ses plans de gestion (Gould, comm. pers., 2008). En outre, le pin flexible se rencontre dans des terres de la Couronne de l'Alberta gérées par Alberta Environment and Sustainable Resource Development. Ce ministère a pris des mesures destinées à gérer l'habitat du pin flexible dans le cadre de ses activités de planification de l'exploitation forestière, de lutte contre les incendies, de lutte contre le dendroctone du pin ponderosa et d'exploitation pétrolière (Dhir et al., 2003; AESRD, 2013). De plus, le pin flexible est présent dans le Black Creek Heritage Rangeland, géré par plusieurs organismes gouvernementaux. Un programme provincial de rétablissement du pin flexible est en cours de préparation et tient compte de la protection de l'habitat de l'espèce (Jones, comm. pers., 2012).
En Colombie-Britannique, le pin flexible est présent dans des terres de la couronne provinciales et des forêts provinciales ainsi que dans les réserves écologiques Columbia Lake et Mount Sabine.
Le présent rapport a été préparé avec l'appui de Parcs Canada. Le rédacteur remercie les personnes suivantes pour leur aide : B. Bennett, J. Bogart, R. Boles, S. Cannings, J. Gould, R. Gutsell, K. Kendall, B. Jones, E. Lamb, D. Langor, R. Moody, M. Murray, P. Nantel, D. Pigott, C. Smith, J. Stuart-Smith, D. Tomback et J. Whitton.
Gordon Court, Alberta Environment and Sustainable Resource Development,
Edmonton, Alberta
David Fraser, British Columbia Environment, Victoria, Colombie-Britannique
Lynn Gillespie, Musée canadien de la nature, Ottawa, Ontario
Joyce Gould, Alberta Tourism, Parks and Recreation, Edmonton, Alberta
Patrick Nantel, Parcs Canada, Gatineau (Québec)
Jenifer Penny, British Columbia Conservation Data Centre, Victoria, Colombie-Britannique
Kella Sadler, Canadian Wildlife Service, Delta, Colombie-Britannique
Dean Trumbley, Sous-comité des connaissances traditionnelles autochtones, Salmon Arm, Colombie-Britannique
Achuff, P.L., W.D. Holland, G.M. Coen et K. Van Tighem. 1984. Ecological land classification of Kootenay National Park, British Columbia. Volume I: Integrated resource description. Alberta Institute of Pedology Publication M-84-10: 373 pp.
Achuff, P.L., W.S. Taylor et L.J. Knapik. 1993. Ecological land classification of Yoho National Park, British Columbia. Yoho National Park, Field, British Columbia. 283 pp.
Achuff, P.L., R.L. McNeill, M.L. Coleman, C. Wallis et C. Wershler. 2002. Ecological land classification of Waterton Lakes National Park, Alberta. Volume I: Integrated resource description. Parks Canada, Waterton Park, Alberta. 226 pp.
ACIMS (Alberta Conservation Information Management System). 2011. Element occurrence file: Pinus flexilis. Alberta Tourism, Parks and Recreation, Alberta Parks, Edmonton, Alberta.
AESRD (Alberta Environment and Sustainable Resource Development). 2013. Enhanced Approvals Process. [consulté le 27 novembre 2013].
AFLW (Alberta Forestry, Lands and Wildlife). 1986. Mountain pine beetle control program 1980-1986. Alberta Forestry, Lands and Wildlife, Forest Service, Edmonton, Alberta, Publication I/43: 14 pp.
Aitken, S.N., S. Yeaman, J.A. Holliday, T. Wang et S. Curtis-McLane. 2008. Adaptation, migration or extirpation: climate change outcomes for tree populations. Evolutionary Applications 1:95-111.
Alfaro, R., B. Hawkes et J. Axelson. 2007. Stand dynamics in even-aged lodgepole pine stands following mountain pine beetle outbreaks. Presentation at 15th Alberta-British Columbia Intermountain Forest Health Workshop, Hinton, Alberta.
Allen, L. 2010. Alberta Natural Heritage Information Centre Preliminary Ecological Community Tracking List. Alberta Tourism, Parks and Recreation, Alberta Parks, Edmonton, Alberta.
Amman, G.D. 1982. Characteristics of mountain pine beetles reared on four different pine hosts. Environmental Entomology 11: 590-593.
Amman, G.D., M.D. McGregor et R.E. Dolph. 1997. Mountain pine beetle. Forest Insect & Disease Leaflet 2. USDA Forest Service. Site Web : http://www.na.fs.fed.us/spfo/pubs/fidls/mt_pine_beetle/mt_pine.htm(Forest Service) [consulté en février 2003].
Andresen, J.W. et R.J. Steinhoff. 1971. The taxonomy of Pinus flexilis and P. strobiformis. Phytologia 22:57-70.
Asebrook, J.M., J. Lapp et T. Carolin. 2011. Whitebark and limber pine restoration and monitoring in Glacier National Park. pp. 335-337, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
ASRD (Alberta Sustainable Resource Development). 2009. Gene conservation plan for native trees in Alberta. Technical Publication T-1141: 108 pp.
Barrack, K.A. et A.W. Schoettle. 1996. A comparison of the foliar nutrient status of elfinwood and symmetrically formed tall trees, Colorado Front Range, USA. Canadian Journal of Botany 74: 1461-1475.
Barrow, E. et G. Yu. 2005. Climate scenarios for Alberta: report prepared for the Prairie Adaptation Research Collaborative, Regina, Saskatchewan in cooperation with Alberta Environment. 73 pp.
Bartlein, P.J., C. Whitlock et S.L. Shafer. 1997. Future climate in the
Yellowstone National Park region and its potential impact on vegetation. Conservation Biology 11: 782-792.
Baumeister, D. et R.M. Callaway. 2006. Facilitation by Pinus flexilis during succession: a hierarchy of mechanisms benefits other plant species. Ecology 87: 1816-1830.
BC-CDC (British Columbia Conservation Data Centre). 2011. Conservation status report: Pinus flexilis. BC Species and Ecosystems Explorer. British Columbia Ministry of Environment, Victoria, British Columbia. [consulté le 18 avril 2011].
BEC (Biogeoclimatic Ecosystem Classification). 2011. Plot database.[consulté le 24 février 2011].
Benkman, C.W. 1995. The impact of tree squirrels (Tamiasciurus) on limber pine seed dispersal adaptations. Evolution 49: 585-591.
Benkman, C.W., R.P. Balda et C.C. Smith. 1984. Adaptations for seed dispersal and the compromises due to seed predation in limber pine. Ecology 65: 632-642.
Bentz, B., E. Campbell, K. Gibson, S. Kegley, J. Logan et D. Six. 2011. Mountain pine beetle in high-elevation five-needle white pine ecosystems. pp. 78-84, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Bertrand, R., L. Lenoir, C. Piedallu, G. Riofrio-Dillon et P. de Ruffray. 2011. Changes in plant community composition lag behind climate warming in lowland forests. Nature 479:517-520.
Betancourt, J.L. 1990. Late Quaternary biogeography of the Colorado Plateau. pp. 259-292, in J.L. Betancourt, T.R. Van Devender et P.S. Martin (eds.), Packrat middens: the last 40,000 years of biotic change. University of Arizona Press, Tucson, Arizona.
Bower, A.D., S.C. McLane, A. Eckert, S. Jorgensen, A. Schoettle et S. Aitken. 2011. Conservation genetics of high-elevation five-needle white pines. pp. 98-117 in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Bradshaw, A.D. et T. McNeilly. 1991. Evolutionary response to global climatic change. Annals of Botany 67:5-14.
Bright, D.E. 1976. The insects and arachnids of Canada and Alaska. Part 2. The Bark Beetles of Canada and Alaska: Coleoptera, Scolytidae. Canada Department of Agriculture, Ottawa. 241 pp.
Brown, P.M. et A.W. Schoettle. 2008. Fire and stand history in two limber pine (Pinus flexilis) and Rocky Mountain bristlecone pine (Pinus aristata) stands in Colorado. International Journal of Wildland Fire 17:339-347.
Brunelle, A., G.E. Rehfeldt, B. Bentz et A.S. Munson. 2008. Holocene records of Dendroctonus bark beetles in high elevation pine forests of Idaho and Montana, USA. Forest Ecology and Management 255:836-846.
Buckley, L.B. et J.G. Kingsolver. 2012. Functional and phylogenetic approaches to forecasting species' response to climate change. Annual Review of Ecology and Systematics 43:205-226.
Burkett, V.R., D.A. Wilcox, R. Stottlemyer, W. Barrow, D. Fagre, J. Baron, J. Price, J.L. Neilson, C.D. Allen, D.L. Peterson, G. Ruggerone et T. Doyle. 2005. Nonlinear dynamics in ecosystem response to climatic change: case studies and policy implications. Ecological Complexity 2: 357-394.
Burns, K.S., A.W. Schoettle, W.R. Jacobi et M.F. Mahalovich. 2008. Options for the management of white pine blister rust in the Rocky Mountain Region. USDA Forest Service General Technical Report RMRS-GTR-206: 26 pp.
Burns, K.S., J. Blodgett, M. Jackson, B. Howell, W. Jacobi, A. Schoettle, A.M. Casper et J. Klutsch. 2011. Monitoring limber pine health in the Rocky Mountains and North Dakota. pp. 47-50, in R.E. Keane, D.F. Tomback, M.P. Murray and C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Burns, R.M. et B.H. Honkala. 1990. Pinus flexilis. pp. 348-354 in Silvics of North America, volume 1, Conifers. USDA Forest Service, Agriculture Handbook 654.
Carroll, A.L., S.W. Taylor, J. Regnière et L. Safranyik. 2003. Effects of climate change on range expansion by the mountain pine beetle in British Columbia. pp. 223-232, in T.L. Shore, J.E. Brooks et J.E. Stone (eds.), Mountain pine beetle symposium: challenges and solutions. Canadian Forest Service, Pacific Forestry Centre, Information Report BC-X-399.
Carsey, K.S. et D.F. Tomback. 1994. Growth form distribution and genetic relationships of tree clusters of Pinus flexilis, a bird-dispersed pine. Oecologia 98: 402-411.
Case, R.A. et G.M. MacDonald. 1995. A dendroclimatic reconstruction of annual precipitation on the western Canadian prairies since A.D. 1505 from Pinus flexilis James. Quaternary Research 44: 267-275.
Case, R.A. et G.M. MacDonald. 2003. Tree ring reconstructions of streamflow for three Canadian prairie rivers. Journal of the American Water Resources Association 39: 703-716.
Casper, A.M., W.R. Jacobi, A.W. Schoettle et K.S. Burns. 2011, Restoration planting options for limber pines in the southern Rocky Mountains. p. 375, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
CFS (Canadian Forest Service). 2008. Meet the mountain pine beetle. Canadian Forest Service, Natural Resources Canada. Site Web : http://mpb.cfs.nrcan.gc.ca/biology/introduction_e.html [consulté le 19 décembre 2008]. (Également disponible en français : SCF [Service canadien des forêts]. 2008. Rencontrez le dendroctone du pin. Service canadien des forêts, Ressources naturelles Canada. Site Web : http://mpb.cfs.nrcan.gc.ca/biology/introduction_f.html)
Colwell, R.K., R.R. Dunn et N.C. Harris. 2012. Coextinction and persistence of dependent species in a changing world. Annual Review of Ecology and Systematics 43: 183-203.
Coop, J.D. et A.W. Schoettle. 2009. Regeneration of Rocky Mountain bristlecone pine (Pinus aristata) and limber pine (Pinus flexilis) three decades after stand-replacing fires. Forest Ecology and Management 257: 893-903.
Coop, J.D., R.T. Massati et A.W. Schoettle. 2010. Subalpine vegetation pattern three decades after stand-replacing fire: effects of landscape context and topography on plant community composition, tree regeneration, and diversity. Journal of Vegetation Science 21: 1-16.
COSEWIC (Canada. Committee on the Status of Endangered Wildlife in Canada). 2010. COSEWIC assessment and status report on the Whitebark Pine Pinus albicaulis in Canada. Ottawa. x + 44 pp. (COSEWIC). (Également disponible en français : COSEPAC. 2010. Évaluation et Rapport de situation du COSEPAC sur le pin à écorce blanche (Pinus albicaulis) au Canada. Ottawa. x + 48 p. http://www.registrelep.gc.ca/Status/Status_f.cfm.)
COSEWIC (Committee on the Status of Endangered Wildlife in Canada). 2012. COSEWIC Operations and Procedures Manual, Appendix C: Definitions and Abbreviations (November 2011). Site Web : http://www.cosewic.gc.ca/538n1sc001/plants/index.cfm [consulté en octobre 2012]. (Également disponible en français : COSEPAC. 2012. Manuel des opérations et des procédures du COSEPAC, Annexe C : Définitions et abréviations (novembre 2011). Site Web: http://www.cosewic.gc.ca/538n1sc001/plants/index.cfm.)
COSEWIC (Committee on the Status of Endangered Wildlife in Canada). 2013. The Species Specialist Subcommittees' Candidate Lists: Arthropods. [consulté le 8 janvier 2013]. (Également disponible en français : COSEPAC. 2013. Les listes des espèces candidates des sous-comités de spécialistes des espèces : Arthropodes.)
Cripps, C.L. et R.K. Antibus. 2011. Native ectomycorrhizal fungi of limber and whitebark pine: necessity for forest sustainability? pp. 37-44, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
de Groot, W., P. Bothwell, D. Carlsson, K. Logan, R. Wein et C. Li. 2002. Forest fire management adaptation to climate change in the Prairies. Canadian Forest Service, University of Alberta, and Prairie Adaptation Research Collaborative, Regina, SK. 97 pp.
Desprez-Loustau, M-L., C. Robin, M. Buee, R. Courtecuisse, J. Garbaye, F. Suffert, I. Sache et D.M. Rizzo. 2007. The fungal dimension of biological invasions. TRENDS in Ecology and Evolution 22: 472-480.
Dhir, N., L. Allan et K. Vujnovic. 2003. Limber pine and whitebark pine management in Alberta. pp. 10-11, in Parks Canada (ed.). Whitebark and limber pine workshop proceedings, 28-29 February 2003, Calgary, Alberta. Site Web : PDF file [consulté en 2006].
Donnegan, J.A. et A.J. Rebertus. 1999. Rates and mechanisms of subalpine forest succession along an environmental gradient. Ecology 80: 1370-1384.
Douglas, G.D., G.B. Straley, D. Meidinger et J. Polar. 1998. Pinus. pp. 20-23, in Illustrated flora of British Columbia, volume 1: Gymnosperms and Dicotyledons (Aceraceae through Asteraceae). Ministry of Forests. Victoria, British Columbia, Canada.
Downing, D.J. et W.W. Pettapiece (comps.). 2006. Natural regions and subregions of Alberta. Natural Regions Committee, Alberta Government Publication T/852: 254 pp.
Dullinger, S., T. Dirnbock et G. Grabherr. 2004. Modelling climate change-driven treeline shifts: relative effects of temperature increase, dispersal and invasibility. Journal of Ecology 92: 241-252.
Earle, C.J. 2010. Pinus flexilis. The Gymnosperm Database. [consulté le 21 avril 2011].
Eckert, A.J. et B.D. Hall. 2006. Phylogeny, historical biogeography, and patterns of diversification for Pinus (Pinaceae): phylogenetic tests of fossil-based hypotheses. Molecular Phylogenetics and Evolution 40: 166-182.
E-flora BC. 2011. Electronic atlas of the flora of British Columbia. Site Web : http://www.geog.ubc.ca/atlas/atlas.aspx?sciname=Pinus%20flexilis [consulté le 3 mars 2011].
ESIS. 2011. Alberta Ecological Site Information System. Site Web : http://www.srd.gov.ab.ca/lands/geographicinformation/resourcedataproductcatalogue/esis.aspx. [consulté le 9 janvier 2011].
Ettl, G.J. et N. Cottone. 2004. Whitebark pine (Pinus albicaulis) in Mt Rainier National Park, Washington, USA. pp. 36-47, in H.R. Akçakaya, M. Burgman, O. Kindvall, C.C. Wood, P. Sjögren-Gulve, J.S. Hatfield et M.A. McCarthy (eds.). Species Conservation and Management: Case Studies. Oxford University Press. Oxford, United Kingdom.
FAN (Federation of Alberta Naturalists). 2007. The atlas of breeding birds of Alberta: a second look. Federation of Alberta Naturalists, Edmonton, Alberta. 626 pp.
FIAS (Forest Invasive Alien Species). 2011. Canadian Forest Alien Species database: Pinus flexilis records 1921-2010. Site Web : https://afc-fr.cfsnet.nfis.org/fiaslib/index.jsp?query=pinus+flexilis [consulté le 2 mai 2011].
Field, S.G., A.W. Schoettle, J.G. Klutsch, S.J. Tavener et M.F. Antolin. 2012. Demographic projection of high-elevation white pines infected with white pine blister rust: a nonlinear disease model. Ecological Applications 22: 166-183.
Flannigan, M.D., K.A. Logan, B.D. Amiro, W.R. Skinner et B.J. Stocks. 2005. Future area burned in Canada. Climate Change 72: 1-16.
Franks, S.J., J.J. Weber et S.N. Aitken. 2014. Evolutionary and plastic responses to climate change in terrestrial plant populations. Evolutionary Applications 7: 123–139.
Freeman, T.N. 1972. The coniferous feeding species of Argyresthia in Canada (Lepidoptera: Yponomeutidae). Canadian Entomologist 104: 687-697.
Furniss, M.M. et J. B. Johnson. 1995. New records of Scolytidae from Washington State. Great Basin Naturalist 55: 335-341.
Gao, Q., P. Zhao, X. Zheng, X. Cai et W. Shen. 2002. A model of stomatal conductance to quantify the relationship between leaf transpiration, microclimate and soil water stress. Plant, Cell and Environment 25: 1373-1381.
Gautreau, E. 1963. Effects of white pine blister rust in limber pine stands in Alberta. 1963. Canada Department of Forestry, Forest Entomology and Pathology Branch, Ottawa, Ontario. Bi-Monthly Progress Report 19 (4): 3.
Geils, B.W., K.L. Hummer et R.S. Hunt. 2010. White pines, Ribes and blister rust: a review and synthesis. Forest Pathology 40: 147-185.
Gernandt, D.S., G.G. Geada Lopez, S. Ortiz Garcia et A. Liston. 2005. Phylogeny and classification of Pinus. Taxon 54: 29-42.
Gillett, N.P., A.J. Weaver, F.W. Zweirs et M.D. Flannigan. 2004. Detecting the effect of climate change on Canadian forest fires. Geophysical Research Letters 31: L18211.
Gould, J. comm. pers. 2008. Compte rendu verbal fait à la réunion de l'équipe du pin à écorce blanche et du pin flexible, 15 décembre 2008, Edmonton, Alberta. Science Coordinator, Parks Division, Alberta Tourism, Parks and Recreation, Edmonton, Alberta.
Government of Alberta. 2010. Species assessed by Alberta's Endangered Species Conservation Committee: short list. Site Web : (http://www.srd.ab.ca/FishWildlife/SpeciesAtRisk/SpeciesSummaries/SpeciesAtRiskFactSheets.aspx) [consulté le 9 janvier 2013].
Hamman, A. et T. Wang. 2006. Potential effects of climate change on ecosystem and tree species distribution in British Columbia. Ecology 87:2772-2786.
Henderson, N, T. Hogg, E. Barrow et B. Dolter. 2002. Climate change impacts on the island forests of the Great Plains and the implications for conservation policy. Prairie Adaptation Research Collaborative, Regina, Saskatchewan. 116 pp.
Hoff, R.J. et G.I. McDonald. 1993. Variation of virulence of white pine blister rust. European Journal of Forest Pathology 23: 103-109.
Hoff, R.J., D.F. Ferguson, G.I. McDonald et R.E. Keane. 2001. Strategies for managing whitebark pine in the presence of white pine blister rust. pp. 346-366, in D.F. Tomback, S.F. Arno et R.E. Keane (eds.). Whitebark pine communities: ecology and restoration. Island Press. Washington, District of Columbia, USA.
Hoff, R.J., R. Bingham et G. MacDonald. 1980. Relative blister rust resistance of white pines. European Journal of Forest Pathology 10: 307-316.
Holland, W.D. et G.M. Coen (eds.). 1982. Ecological (biophysical) land classification of Banff and Jasper national parks. Volume 2: soil and vegetation resources. SS-82-44. Alberta Institute of Pedology, University of Alberta, Edmonton, Alberta. 540 pp.
Huntley, B. 1991. How plants respond to climate change: migration rates, individualism and the consequences for plant communities. Annals of Botany 67: 15-22.
IPCC (Intergovernmental Panel on Climate Change). 2007. Climate Change 2007: contributions of Working Groups I, II, and III to the Fourth Assessment Report of the Intergovernmental Panel on Climate Change. IPCC, Geneva, Switzerland. 104 pp. (Également disponible en français : GIEC. 2007. Changements climatiques 2007 : rapport de synthèse : contribution du Groupe de travail I, II, III au quatrième Rapport d'évaluation du GIEC. GIEC, Genève, Suisse. 104 p.)
IUCN (International Union for Conservation of Nature). 2010a. Guidelines for using IUCN Red List categories and criteria. IUCN Standards and Petitions Subcommittee, March 2010. 85 pp. Site Web : http://intranet.iucn.org/webfiles/doc/SSC/Redlist/RedListGuidelines.pdf">(PDF file) [consulté en novembre 2010].
IUCN (International Union for Conservation of Nature). 2010b. Pinus flexilis. 2010 IUCN Red List of Threatened Species. [consulté le 18 avril 2011].
IUCN et CMP (International Union for Conservation of Nature and Conservation Measures Partnership). 2006. IUCN-CMP unified classification of direct threats, ver. 1.0 – June 2006. Gland, Switzerland. 17 pp.
Jackson, M. et B. Lockman. 2003. Update on limber pine decline and mortality on the Lewis and Clark National Forest, Montana. USDA Forest Service, Forest Health Protection Report 03-4: 8 pp.
Jackson, S.T. et J.T. Overpeck. 2000. Responses of plant populations and communities to environmental changes of the late Quaternary. Paleobiology 26 (Supplement No. 4): 194-220.
Joly, D.L., D.W. Langor et R.C. Hamelin. 2006. Interspecific hybridization between Cronartium ribicola and C. comandrae on Pinus flexilis in southwestern Alberta. Plant Disease 90: 1552.
Jones, B. comm. pers. 2012. Conversation tenue en septembre 2012. Coprésident, Alberta Whitebark and Limber Pine Recovery Team. Alberta Environment and Sustainable Resource Development, Calgary, Alberta.
Jorgensen, S., J.L. Hamrick et P.V. Wells. 2002. Regional patterns of genetic diversity in Pinus flexilis (Pinaceae) reveal complex species history. American Journal of Botany 89: 792-800.
Jump, A.S. et J. Penuelas. 2005. Running to stand still: adaptation and the response of plants to rapid climate change. Ecological Letters 8: 1010-1020.
Keane, R.E., S.F. Arno, J.K. Brown et D.F. Tomback. 1990. Stand dynamics in whitebark pine (Pinus albicaulis) forests. Ecological Modelling 51: 73-96.
Keane, R.E., K.C. Ryan, T.T. Veblen, C.D. Allen, J. Logan et B. Hawkes. 2002. Cascading effects of fire exclusion in Rocky Mountain ecosystems: a literature review. USDA Forest Service, General Technical Report RMRS-GR-91: 24 pp.
Keane, R.E. et A.W Schoettle. 2011. Strategies, tools, and challenges for sustaining and restoring high-elevation five-needle white pine forests in western North America. pp. 276-294, in R.E. Keane, D.F. Tomback, M.P. Murray and C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Kearnes, H.S.J. et W.R. Jacobi. 2007. The distribution and incidence of white pine blister rust in central and southeastern Wyoming and northern Colorado. Canadian Journal of Forest Research 37: 462-472.
Kearnes, H.S.J., W.R. Jacobi et B.W. Geils. 2009. A method for estimating white pine blister rust canker age on limber pine in the central Rocky Mountains. Forest Pathology 39: 177-191.
Keeley, J.E. et P.H. Zedler. 1998. Evolution of life histories in Pinus. pp. 219-250 in D.M. Richardson (ed.), Ecology and biogeography of Pinus. Cambridge University Press, Cambridge, UK.
Kendall, K.C. 1983. Use of pine nuts by grizzly and black bears in the Yellowstone area. International Conference on Bear Research and Management 5: 166-173.
King, J.N., A. David, D. Noshad et J. Smith. 2010. A review of genetic approaches to the management of blister rust in white pines. Forest Pathology 40: 292-313.
Klutsch, J.G., B.A. Goodrich et A.W. Schoettle. 2011. Limber pine forests on the leading edge of white pine blister rust distribution in northern Colorado. pp. 222-225, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Kral, R. 1993. Pinus. pp. 373-398, in Flora of North America Editorial Committee (eds.), Flora of North America, volume 2. Pteridophytes and Gymnosperms. Oxford University Press, New York, New York, USA.
Kueppers, L.M. 2010. Sensitivity of subalpine tree seedlings and alpine plants to natural and manipulated climate variation: initial results from an Alpine Treeline Warming Experiment. Abstract GC53A-04 presented at American Geophysical Union, Fall Meeting 2010, San Francisco, California, 13-17 December.
Langor, D.W. 1989. Host effects on the phenology, development, and mortality of field populations of the mountain pine beetle, Dendroctonus ponderosae Hopkins (Coleoptera: Scolytidae). Canadian Entomologist 121: 149-157.
Langor, D.W. 2007. Status of limber pine (Pinus flexilis) in Alberta. Alberta Sustainable Resource Development, Wildlife Status Report No. 62: 17 pp.
Langor, D.W., J.R. Spence et G.R. Pohl. 1990. Host effects on fertility and reproductive success of Dendroctonus ponderosae Hopkins) (Coleoptera: Scolytidae). Evolution 44: 609-618.
Lanner, R.M. 1985. Effectiveness of the seed wing of Pinus flexilis in wind dispersal. Great Basin Naturalist 45: 318-320.
Lanner, R.M. 1996. Made for each other: a symbiosis of birds and pines. Oxford University Press, New York, New York, USA. 160 pp.
Lanner, R.M. 1998. Seed dispersal in Pinus. pp. 281-295, in D.M. Richardson (ed.), Ecology and biogeography of Pinus. Cambridge University Press, Cambridge, United Kingdom.
Lanner, R.M. et S.B. Vander Wall. 1980. Dispersal of limber pine seed by Clark's nutcracker. Journal of Forestry 78: 637-639.
Latta, R.G. et J.B. Mitton. 1997. A comparison of population differentiation across four classes of gene markers in limber pine (Pinus flexilis James). Genetics 146: 1153-1163.
Lea, E.C. 1984. Biophysical resources of the East Kootenay area: Volume 1 – Vegetation. British Columbia Ministry of Environment, Victoria, British Columbia, Technical Report 5: 75 pp.
Lenihan, J.M., D. Bachelet, R.P. Neilson et R.J. Drapek. 2008. Simulated response of conterminous United States ecosystems to climate change at different levels of fire suppression, CO2 emission rate and growth response to CO2. Global Planet Change 64: 16-25.
Lenoir, J., J.V. Gegout, P.A. Marquet, P. de Ruffray et H. Brisse. 2008. A significant upward shift in plant species optimum elevation during the 20th century. Science 320: 1768-1771.
Letts, M.G., K.N. Nakonechny, K.E. Van Gaalen et C.M. Smith. 2009. Physiological acclimation of Pinus flexilis to drought stress on contrasting slope aspects in Waterton Lakes National Park, Alberta, Canada. Canadian Journal of Forest Research 39: 629-641.
Liston, A., W.A. Robinson, D. Pinero et E.R. Alvarez-Buylla. 1999. Phylogenetics of Pinus (Pinaceae) based on nuclear ribosomal DNA internal transcribed spacer sequences. Molecular Phylogenetics and Evolution 11: 95-109.
Liston, A., M. Parker-Defeniks, J.V. Syring, A. Willyard et R. Cronn. 2007. Interspecific phylogenetic analysis enhances intraspecific phylogeographical inference: a case study in Pinus lambertiana. Molecular Ecology 16: 3926-3937.
Litell, J.S., E.E. Oneill, D. McKenzie, J.A. Hicke, J.A. Lutz, R.A. Norheim et M.M. Eisner. 2010. Forest ecosystems, disturbance and climatic change in Washington State, USA. Climatic Change 102: 129-158.
Logan, J.A. et J.A. Powell. 2008. Ecological consequences of climatic change – altered forest insect disturbance regimes. 33 pp., in F.H. Wagner (ed.). Climate Change in western North America: evidence and environmental effects. Allen Press (en révision). Site Web : http://www.usu.edu/beetle/publications_bark_beetle.htm [consulté le 18 décembre 2008].
Logan, J.A., W.W. McFarlane et L. Willcox. 2010. Whitebark pine vulnerability in climate-driven mountain pine beetle disturbance in the Greater Yellowstone ecosystem. Ecological Applications 20: 895-902.
MacDonald, G.M. 1989. Postglacial palaeoecology of the subalpine forest-grassland ecotone of southwestern Alberta: new insights on vegetation and climate change in the Canadian Rocky Mountains and adjacent foothills. Palaeogeography, Palaeoclimatology and Palaeoecology 73: 156-173.
MacDonald, G.M. et R.A. Case. 2005. Variations in the Pacific Decadal Oscillation over the past millennium. Geophysical Research Letters 32: L08703, 4 pp.
Mahalovich, M.F. 2006. Limber pine seed transfer guidelines. USDA Forest Service, Regions1-4, internal report. 4 pp.
Malcolm, J.R., A. Markham, R.P. Neilson et M. Garaci. 2002. Estimated migration rates under scenarios of global climate change. Journal of Biogeography 29: 835-849.
McCune, B. 1988. Ecological diversity in North American pines. American Journal of Botany 75: 353-368.
McCutchen, H.E. 1996. Limber pines and black bears. Great Basin Naturalist 56: 90-92.
McDonald, G.I. et R.J. Hoff. 2001. Blister rust: an introduced plague. pp. 193-220, in D.F. Tomback, S.F. Arno et R.E. Keane (eds.). Whitebark pine communities: ecology and restoration. Island Press. Washington, DC, USA.
McDonald, G.I., B.A. Richardson, P.J. Zambino, N.B. Klopfenstein et M.S. Kim. 2006. Pedicularis and Castilleja are natural hosts of Cronartium ribicola in North America: a first report. Forest Pathology 36: 73-82.
McKenney, D.W., J.H. Pedlar, K. Lawrence, K. Campbell et M.F. Hutchinson. 2007. Potential impacts of climate change on the distribution of North American trees. BioScience 57: 939-948.
McKinney, S.T., C.E. Fiedler et D.F. Tomback. 2009. Invasive pathogen threatens bird-pine mutualism: implications for sustaining a high-elevation ecosystem. Ecological Applications 19: 597-607.
Meidinger, D. et J. Pojar (eds.). 1991. Ecosystems of British Columbia. British Columbia Ministry of Forests, Victoria British Columbia, Special Report Series 6: 330 pp.
Millar, C.I., R.D. Westfall et D.L. Delany. 2007. Response of high-elevation limber pine (Pinus flexilis) to multiyear droughts and 20th –century warming, Sierra Nevada, California, USA. Canadian Journal of Forest Research 37: 2508-2520.
Mills, L.S., M.E. Soule et D.F. Doak. 1993. The keystone-species concept in ecology and conservation. Bioscience 43: 219-224.
Mitton, J.B., B.R. Kreiser et R.G. Latta. 2000. Glacial refugia of limber pine (Pinus flexilis James) inferred from the population structure of mitochondrial DNA. Molecular Ecology 9: 91-97.
Mitton, J.B. et S.M. Ferenberg. 2012. Mountain pine beetle develops an unprecedented summer generation in response to climate warming. American Naturalist 179: E163-E171.
Moody, R. comm. pers. 2011. Courriel adressé à P. Achuff, septembre 2011. Écologiste, Keefer Ecological Services, Cranbrook, British Columbia.
Moorcroft, P.R., S.W. Pacala et M.A. Lewis. 2006. Potential role of natural enemies during tree range expansions following climate change. Journal of Theoretical Biology 241: 601-616.
Moyes, A.B., C. Castanha, M.J. Germino et L.M. Kueppers. 2013. Warming and the dependence of limber pine (Pinus flexilis) establishment on summer moisture within and above its current range. Oecologia 171: 271-282.
NatureServe. 2011. Pinus flexilis. NatureServe Explorer: An online encyclopedia of life [application Web]. Version 7.1. NatureServe, Arlington, Virginia. Nature Serve Explorer [consulté le 18 avril 2011].
NDSU (North Dakota State University). 2013. Limber Pine (Pinus flexilis). PDF file [consulté le 12 juillet 2013].
Perez-Valdivia, C. J.R. Vanstone et D. Sauchyn. 2010. Tree-ring reconstruction of 700 years flow at the Oldman River, southwestern Alberta, Canada. Poster presented at American Geophysical Union, 2010 Fall Meeting, San Francisco, California, 13-17 December.
Peters, V.S. 2011. Pre-dispersal seed predation dynamics at the northern limit of limber pine. p. 74 in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Peters, V. 2012. Limber pine seed mutualisms: between the devil and the deep blue sea. Nutcracker Notes 22: 11-13.
Raffa, K.F., B.H. Aukema, B.J. Bentz, A.L. Carroll, J.A. Hicke, M.G. Turner et W.H. Romme. 2008. Cross-scale drivers of natural disturbances prone to anthropogenic amplification: the dynamics of bark beetle eruptions. BioScience 58: 501-517.
Rebertus, A.J., B.R. Burns et T.T. Veblen. 1991. Stand dynamics of Pinus flexilis-dominated subalpine forests in the Colorado Front Range. Journal of Vegetation Science 2: 445-458.
Rehfeldt, G.E., C.C. Ying, D.L Spittlehouse et D.A. Hamilton. 1999. Genetic responses to climate in Pinus contorta: niche breadth, climate change, and reforestation. Ecological Monographs 69: 375-407.
Rehfeldt, G.E., R.A. Wykoff et C.C. Ying. 2001. Physiologic plasticity, evolution, and impacts of a changing climate on Pinus contorta. Climate Change 50: 355-376.
Rehfeldt, G.E., N.M. Tchebakova, Y.I. Parfenova, R.A. Wykoff. N.A. Kuzmina et L.I. Milyutin. 2002. Intraspecific responses to climate in Pinus sylvestris. Global Change Biology 8: 912-929.
Rehfeldt, G.E., N.L. Crookston, M.V. Warwell et J.S. Evans. 2006. Empirical analyses of plant-climate relationships for the western United States. International Journal of Plant Science 167: 1123-1150.
Reinhardt, K., C. Castanha, M.J. Germino et L.M. Kueppers. 2011. Leapfrogging of tree species provenances: interaction of microclimates and genetics on upward shifts in tree species' range limits. Abstract B13D-0601 presented at American Geophysical Union, Fall Meeting 2011, San Francisco, California, 5-9 December.
Rhode, D. et D.B. Madsen. 1998. Pine nut use in the Early Holocene and beyond: the Danger Cave archaeobotanical record. Journal of Archaeological Science 25: 1199-1210.
Richardson, B.A., A.K.M. Ekramoddoulah, J.J. Liu, M.S. Kim et N.B. Klopfenstein. 2010. Current and future molecular approaches to investigate the white pine blister rust pathosystem. Forest Pathology 40: 314-331.
Roberts, D.R. et A. Hamman. 2011. Predicting potential climate change impacts with bioclimate envelope models: a palaeoecological perspective. Global Ecology and Biogeography 21: 121-133.
Romme, W.H. et M.G. Turner. 1991. Implications of global change for biogeographic patterns in the Greater Yellowstone Ecosystem. Conservation Biology 5: 373-396.
Rweyongeza, D., L. Barnhardt et C. Hansen. 2010. Climate change adaptation by Alberta Sustainable Resource Development. Site Web : http://www.afex.ca/afex-events/22-forest-tree-provenance-application-to-reforestation-reclamation-and-adaptation-to-climate-change [consulté le 2 avril 2012].
Safranyik, L., A.L. Carroll, J. Regnière, D.W. Langor, W.G. Riel, T.L. Shore, B. Peter, B.J. Cooke, V.G. Nealis et S.W. Taylor. 2010. Potential for range expansion of mountain pine beetle into the boreal forest of North America. Canadian Entomologist 142: 415-422.
Saporta, R., J. Malcolm et D. Martell. 1998. The impact of climate change on Canadian forests. Chapter 6, in G. Koshida et A. Avis (eds.), The Canada Country Study: climate impact and adaptation. Volume 7, National Sectoral Volume. Environment Canada, Ottawa, Ontario. (Également disponible en français : Saporta, R., J. Malcolm et D. Martell. 1998. Impacts du changement climatique sur les forêts canadiennes. chapitre 6, dans G. Koshida, et A. Avis (sous la dir. de), L'étude pan-canadienne sur les impacts et l'adaptation à la variabilité et au changement climatique. volume 7, Questions sectorielles. Environnement Canada, Ottawa, Ontario.)
Sauchyn, D. J., E. Barrow, R.F. Hopkinson et P. Leavitt. 2002. Aridity on the Canadian plains. Geographie physique et Quaternaire 56: 247-259.
Sauchyn, D. et S. Kulshreshtha. 2008. Prairies. pp. 275-328, in D.S. Lemmon, F.J. Warren, J. Lacroix et E. Bush (eds.), From impacts to adaptation: Canada in a changing climate. Government of Canada, Ottawa, Ontario. (Également disponible en frnaçais : Sauchyn, D. et S. Kulshreshtha. 2008. Prairies. p. 275-328, in D.S. Lemmon, F.J. Warren, J. Lacroix et E. Bush (sous la dir. de), Vivre avec les changements climatiques au Canada. Gouvernement du Canada, Ottawa, Ontario.)
Savolainen, O., T. Pyhajarvi et T. Knurr. 2007. Gene flow and adaptation in trees. Annual Review of Ecology and Systematics 38: 595-619.
Schindler, D. et B. Donahue. 2012. The impacts of climate change on water in Alberta. Environmental Research and Studies Centre, University of Alberta, Edmonton. [consulté le 26 mars 2012].
Schmidt, W.C. et J.E. Lotan. 1980. Phenology of common forest flora of the northern Rockies – 1928-1937. USDA Forest Service, Research Paper INT-259.
Schneider, R.R., A. Hamman, D. Farr, X. Wang et S. Boutin. 2009. Potential effects of climate change on ecosystem distribution in Alberta. Canadian Journal of Forest Research 39: 1001-1010.
Schoettle, A.W. 2004. Ecological roles of five-needle pines in Colorado: potential consequences of their loss, pp. 124-135, in R.A. Sniezko, S. Samman, S.E. Schlarbaum et B.E. Howard (eds.), Breeding and genetic resources of five-needle pines: growth, adaptability and pest resistance. USDA Forest Service Proceedings RMRS-P-32.
Schoettle, A.W. et S.G. Rochelle. 2000. Morphological variation of Pinus flexilis (Pinaceae), a bird-dispersed pine, across a range of elevation. American Journal of Botany 87: 1797-1806.
Schoettle, A.W. et R.A. Sniezko. 2007. Proactive intervention to sustain high-elevation pine ecosystems threatened by white pine blister rust. Journal of Forest Research 12: 327-336.
Schoettle, A.W., R.A. Sniezko, A. Kegley et K.S. Burns. 2011. Preliminary overview of the first extensive rust resistance screening tests of Pinus flexilis and Pinus aristata. pp. 265-269, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Schoettle, A.W., R.A. Sniezko, A. Kegley et K.S. Burns. 2014. White Pine Blister Rust Resistance in Limber Pine: Evidence for a major gene. Phytopathology 104:163-173.
Schuster, W.S., D.L. Alles et J.B. Mitton. 1989. Gene flow in limber pine: evidence from pollination phenology and genetic differentiation along an elevational transect. American Journal of Botany 76: 1395-1403.
Schuster, W.S. et J.B. Mitton. 2000. Paternity and gene dispersal in limber pine (Pinus flexilis James). Heredity 84: 348-361.
Schuster, W.S., J.B. Mitton, D.K. Yamaguchi et C.A. Woodhouse. 1995. A comparison of limber pine (Pinus flexilis) ages at lower and upper treeline sites of the Continental Divide in Colorado. American Midland Naturalist 133: 101-111.
Schwandt, J.W., I.B. Lockman, J.T. Kliejunas et J.A. Muir. 2010. Current health issues and management strategies for white pines in the western United States and Canada. Forest Pathology 40: 226-250.
Sherriff, R.L., T.T. Veblen et J.S. Sibold. 2001. Fire history in high elevation subalpine forests in the Colorado Front Range. Ecoscience 8: 369-380.
Siepielski, A.M. et C.W. Benkman. 2007. Selection by a predispersal seed predator constrains the evolution of avian seed dispersal in pines. Functional Ecology 21: 611-618.
Siepielski, A.M. et C.W. Benkman. 2008. Seed predation and selection exerted by a seed predator influence subalpine tree densities. Ecology 89: 2960-2966.
Smith, C.C. 1970. The coevolution of pine squirrels (Tamiasciurus) and conifers. Ecological Monographs 40: 349-371.
Smith, C.C. et R.P. Balda. 1979. Competition among insects, birds and mammals for conifer seeds. American Zoologist 19: 1065-1083.
Smith, C.M. comm. pers. 2013. Scientist Emeritus, Waterton Lakes National Park, Waterton Park, Alberta.
Smith, C.M., D. Langor, C. Myrholm, J. Weber, C. Gillies et J. Stuart-Smith. 2011a. Limber Pine health in the Canadian Rockies. pp. 63-65, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Smith, C.M., G. Poll, C. Gillies, C. Praymak, E. Miranda et J. Hill. 2011 b. Limber pine seed and seedling planting experiment in Waterton Lakes National Park, Canada. pp. 365-374, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Smith, C.M., D. Langor, C. Myrholm, J. Weber, C. Gillies et J. Stuart-Smith. 2013. Changes in blister rust infection and mortality in limber pine over time. Canadian Journal of Forest Research: 43: 919–928
Smith, S.E. et D.J. Read. 1997. Mycorrhizal symbiosis. Academic Press, San Diego, California, USA.
Spittlehouse, D.L. 2008. Climate Change, impacts, and adaptation scenarios: climate change and forest and range management in British Columbia. B.C. Min. For. Range, Res. Br., Victoria, B.C. Tech. Rep. 045.
St. Jacques, J-M., A.Y. Huang, Y. Zhao, S.L. Lapp et D.J. Sauchyn. 2011. Understanding hydrologic change: analyses of regional streamflow records. Abstract H42H-08 presented at American Geophysical Union, Fall Meeting 2011, San Francisco, CA, 5-9 December.
Steele, R. 1990. Pinus flexilis James – Limber Pine. pp. 348-354, in R.M. Burns et B.H. Honkala (tech. coords.), Silvics of North America: 1. Conifers. Agriculture Handbook 654, USDA Forest Service, Washington, District of Columbia. 675 pp.
Steinhoff, R.J. et J.W. Andresen. 1971. Geographic variation in Pinus flexilis and Pinus strobiformis and its bearing on their taxonomic status. Silvae Genetica 20: 159-167.
Sturrock, R.N., S.J. Frankel, A.V. Brown, P.E. Hennon, J.T. Kliejunas, K.J. Lewis, J.J. Worrall et A.J. Woods. 2011. Climate change and forest disease. Plant Pathology 60: 133-149.
Syring, J., A. Willyard, R. Cronn et A. Liston. 2005. Evolutionary relationships among Pinus (Pinaceae) subsections inferred from multiple low-copy nuclear loci. American Journal of Botany 92: 2086-2100.
Syring, J. K. Farrell, R. Businsky, R. Cronn et A. Liston. 2007. Widespread genealogical nonmonophyly in species of Pinus subgenus Strobus. Systematic Botany 56: 163-181.
Taylor, S.W., A.L. Carroll, R.I. Alfaro et L. Safranyik. 2006. Forest, climate and mountain pine beetle outbreak dynamics in western Canada. pp. 67-94, in L. Safranyik et W.R. Wilson (eds.), The Mountain Pine Beetle: a synthesis of biology, management, and impacts on lodgepole pine. Canadian Forest Service, Pacific Forestry Centre, Victoria, British Columbia.
Taylor, J.E. et R.L. Mathiason. 1999. Limber pine dwarf mistletoe (FIDL). USDA Forest Service, Northern Region, Forest Health Protection, Forest Insect and Disease Leaflet 171.
Tedersoo, L., T.W. May et M.E. Smith. 2009. Ectomycorrhizal lifestyle in fungi: global diversity, distribution and evolution of phylogenetic lineages. Mycorrhiza 20: 217-263.
Timoney, K. 1999. Limber pine, whitebark pine, alpine heath and terricolous alpine lichen vegetation alliances in Alberta. Alberta Environmental Protection, Edmonton, Alberta. 196 pp.
Tomback, D.F. 2001. Clark's nutcracker: agent of regeneration. pp. 89-104, in D.F. Tomback, S.F. Arno et R.E. Keane (eds.). Whitebark pine communities: ecology and restoration. Island Press. Washington, District of Columbia, USA.
Tomback, D.F. et P.L. Achuff. 2010. Blister rust and western forest biodiversity: ecology, values and outlook for white pines. Forest Pathology 40: 186-225.
Tomback, D.F. et K.A. Kramer. 1980. Limber pine seed harvest by Clark's nutcracker in the Sierra Nevada: timing and foraging behavior. Condor 82: 467-468.
Tomback, D.F. et Y.B. Linhart. 1990. The evolution of bird-dispersed pines. Evolutionary Ecology 4: 185-219.
Tomback, D.F., A.W Schoettle, K.E. Chevalier et C.A. Jones. 2005. Life on the edge for limber pine: seed dispersal within a peripheral population. Ecoscience 12: 519-529.
Tomback, D.F., P.L. Achuff, A.W. Schoettle, J.W. Schwandt et R.J. Mastrogiuseppe. 2011. The magnificent high-elevation five-needle white pines: ecological roles and future outlook. pp. 2-28, in R.E. Keane, D.F. Tomback, M.P. Murray et C.M. Smith (eds.), The future of high-elevation, five-needle white pines in western North America. USDA Forest Service, Proceedings RMRS-P-63.
Utzig, G. 2012. Ecosystem and tree species bioclimate envelope modeling for the West Kootenays. West Kootenay Climate Vulnerability and Resilience Project, Report 5: 44 pp. [consulté le 15 avril 2012].
Utzig, G., J. Boulanger et R.F. Holt. 2012. Climate change and area burned: projections for the West Kootenays. West Kootenay Climate Vulnerability and Resilience Project, Report 4. [consulté le 15 avril 2012].
Utzig, G., D. Macdonald, D. Ailman et J. Pojar. 1977 Kicking Horse River Limber Pines ecological reserve proposal #295.
Van der Putten, W.H. 2012. Climate change, aboveground-belowground interactions and species' range shifts. Annual Review of Ecology and Systematics 43: 365-383.
Vander Wall, S.B. et R.P. Balda. 1977. Coadaptations of the Clark's nutcracker and the pinon pine for efficient seed harvest and dispersal. Ecological Monographs 47: 89-111.
Van Grunsven, R.H.A., W.H. Van der Putten, T.M. Bezemer, W.L.M. Tamis, F. Berendse et E.M. Veenendaal. 2007. Reduced plant-soil feedback of plant species expanding their range as compared to natives. Journal of Ecology 95: 1050-1057.
Vanstone, J.R., C.A. Perez-Valdivia et D. Sauchyn. 2010. Tree ring reconstruction of streamflow using early and latewood chronologies as proxies in the North Saskatchewan River Basin, Alberta, Canada. Poster presented at American Geophysical Union, 2010 Fall Meeting, San Francisco, California, 13-17 December.
Veblen, T.T. 1986. Age and size structure of subalpine forests in the Colorado Front Range. Bulletin of the Torrey Botanical Club 113: 225-240.
Walker, I.J. et R. Sydneysmith. 2008. British Columbia. pp. 329-386, in D.S. Lemmon, F.J. Warren, J. Lacroix et E. Bush (eds.), From impacts to adaptation: Canada in a changing climate. Government of Canada, Ottawa, Ontario. (Également disponible en français: Walker, I.J. et R. Sydneysmith. 2008. Colombie-Britannique. p. 329-386, in D.S. Lemmon, F.J. Warren, J. Lacroix et E. Bush (sous la dir. de), Vivre avec les changements climatiques au Canada. Gouvernement du Canada, Ottawa, Ontario.)
Warwell, M.V., G.E. Rehfeldt et N.L. Crookston. 2007. Modelling contemporary climate profiles of whitebark pine (Pinus albicaulis) and predicting responses to global warming. pp. 139-142, in E. Goheen (ed.). Proceedings of a conference – Whitebark Pine: a Pacific Coast perspective. USDA Forest Service R6-NR-FHP-2007-01.
Watt, M.S., D.J. Kriticos, A. Alcaraz, A.V. Brown et A. Leriche. 2009. The hosts and potential geographic range of Dothistroma needle blight. Forest Ecology and Management 257: 1505-1519.
Webster, K.L. et E.A. Johnson. 2000. The importance of regional dynamics in local populations of limber pine (Pinus flexilis). Ecoscience 7: 175-182.
Wells, P.V. 1983. Paleobiogeography of montane islands in the Great Basin since the last glaciopluvial. Ecological Monographs 53: 341-382.
Wells, P.V. et J.D. Stewart. 1987. Cordilleran-boreal taiga and fauna on the central Great Plains of North America, 14,000-18,000 years ago. American Midland Naturalist 118: 94-106.
WLIS. 2011. Whitebark and Limber Pine Information System. USDA Forest Service, Northern and Intermountain Regions, Missoula, MT. Site Web : http://www.fs.fed.us/r1-r4/spf/fhp/prog/program2.html [consulté le 8 février 2011].
Wood, C.S. et L. Unger. 1996. Mountain pine beetle - a history of outbreaks in pine forests in British Columbia, 1910 to 1995. Pacific Forestry Centre, Victoria, British Columbia.
Woods, A., K.D. Coates et A. Hamman. 2005. Is an unprecedented Dothistroma needle blight epidemic related to climate change? BioScience 55: 761-769.
Wright, H.A. et A.W. Bailey. 1982. Fire ecology. John Wiley and Sons, New York, New York, USA. 501 pp.
Zambino, P.J. 2010. Biology and pathology of Ribes and their implications for management of white pine blister rust. Forest Pathology 40: 264-291.
Zambino, P.J., B.A. Richardson et G.I. McDonald. 2007. First report of the white pine blister rust fungus, Cronartium ribicola, on Pedicularis bracteosa. Plant Disease 91: 467.
Peter L. Achuff est scientifique émérite au parc national des Lacs-Waterton et membre du sous-comité des plantes vasculaires et était auparavant membre du COSEPAC. Il détient des grades universitaires en botanique (systématique et écologie végétales) de l'Université du Montana, du Jardin botanique de New York (Université Columbia) ainsi que de l'Université d'Alberta. Au cours des 40 dernières années, il a principalement travaillé dans l'ouest et le nord de l'Amérique du Nord, à une variété de projets ayant trait à l'inventaire et à la surveillance des ressources naturelles, à la gestion des zones protégées, aux espèces rares et à la conservation des plantes.
Aucune collection n'a été examinée durant la préparation du présent rapport.
| Code du transect | 1996 Table Footnotei | 2003 - 2004 | 2009 | Taux de mortalité annuelle (%) Table Footnotej |
|---|---|---|---|---|
| L1001 | - | 44,44 | 61,11 | 3,03 |
| L1002 | - | 42,00 | 57,14 | 2,75 |
| L1003 | - | 23,53 | 33,33 | 1,78 |
| L1004 | - | 38,00 | 57,14 | 3,48 |
| L1005 | - | 46,55 | 65,52 | 3,45 |
| L1006 | - | 38,00 | 52,00 | 2,55 |
| L1007 | - | 40,00 | 44,00 | 0,73 |
| L1008 | - | 44,44 | 53,70 | 1,68 |
| L1009 | - | 37,25 | 43,14 | 1,07 |
| L1010 | - | 38,00 | 50,00 | 2,18 |
| L1011 | - | 55,22 | 68,66 | 2,44 |
| L1012 | - | 45,61 | 50,88 | 0,96 |
| L1013 | - | 35,85 | 49,06 | 2,40 |
| L1014 | - | 1,82 | 3,64 | 0,33 |
| L1015 | - | 30,00 | 38,00 | 1,45 |
| L1016 | - | 0,00 | 0,00 | 0,00 |
| L1017 | - | 6,00 | 9,62 | 0,66 |
| L1018 | - | 8,00 | 10,00 | 0,36 |
| L1019 | - | 6,00 | 12,00 | 1,09 |
| L1020 | - | 10,00 | 22,00 | 2,18 |
| L1021 | - | 12,00 | 14,29 | 0,42 |
| L1022 | - | 11,11 | 22,22 | 2,02 |
| L1023 | - | 42,00 | 48,98 | 1,27 |
| L1024 | - | 10,00 | 10,00 | 0,00 |
| L1025 | - | 4,00 | 4,00 | 0,00 |
| L1026 | - | 4,00 | 3,70 | -0,05 |
| L1027 | - | 8,00 | 7,41 | -0,11 |
| L1028 | - | 0,00 | 0,00 | 0,00 |
| L1029 | - | 8,00 | 8,00 | 0,00 |
| L1030 | - | 22,00 | 22,00 | 0,00 |
| L1031 | - | 16,00 | 16,00 | 0,00 |
| L1032 | - | 6,25 | 6,25 | 0,00 |
| L1033 | - | 5,77 | 7,69 | 0,35 |
| L1034 | - | 12,00 | 12,00 | 0,00 |
| L2001 | 34,38 | 60,47 | 66,15 | 2,51 |
| L2002 | 22,39 | 38,71 | 44,36 | 1,72 |
| L2003 | 40,91 | 53,57 | 58,20 | 1,35 |
| L2004 | 46,03 | 59,21 | 46,36 | 0,13 |
| L2005 | 40,91 | 62,16 | 59,55 | 1,52 |
| L2006 | 50,00 | 41,18 | 56,67 | 0,41 |
| L2007 | 56,52 | 86,54 | 63,64 | 0,75 |
| L2008 | 34,04 | 42,17 | 23,81 | -0,68 |
| L2009 | - | 33,87 | 40,00 | 1,11 |
| L2010 | - | 30,91 | 46,27 | 2,79 |
| L2011 | - | 25,00 | 41,86 | 3,07 |
| L2012 | - | 22,00 | 28,00 | 1,09 |
| L2013 | - | 58,57 | 60,00 | 0,26 |
| L2014 | - | 60,29 | 59,42 | -0,16 |
| L2015 | - | 44,90 | 50,98 | 1,11 |
| L2016 | - | 45,90 | 49,18 | 0,60 |
| L2017 | - | 19,23 | 34,62 | 2,80 |
| L2018 | - | 32,81 | 37,50 | 0,85 |
| L2019 | - | 40,00 | 46,30 | 1,14 |
| L2020 | - | 19,23 | 21,57 | 0,43 |
| L2021 | - | 44,74 | 46,75 | 0,37 |
| L2022 | 19,23 | 42,31 | 30,23 | 0,98 |
| L2023 | 11,11 | 40,70 | 27,54 | 1,42 |
| L2024 | - | 14,58 | 16,67 | 0,38 |
| L2025 | 23,91 | 50,00 | 37,74 | 1,21 |
| L2026 | 5,10 | 37,38 | 33,67 | 2,32 |
| L2027 | - | 26,00 | 39,71 | 2,49 |
| L2028 | - | 51,02 | 48,15 | -0,52 |
| L2029 | - | 45,90 | 60,66 | 2,68 |
| L2030 | - | 25,00 | 32,69 | 1,40 |
| L2031 | - | 58,18 | 73,21 | 2,73 |
| L2032 | - | 22,45 | 38,78 | 2,97 |
| L2033 | - | 39,13 | 79,59 | 7,36 |
| L2034 | - | 28,00 | 60,98 | 6,00 |
| L2035 | - | 13,73 | 23,53 | 1,78 |
| L2036 | - | 18,92 | 21,05 | 0,39 |
| L2037 | - | 18,75 | 30,61 | 2,16 |
| L2038 | - | 0,00 | 0,00 | 0,00 |
| L2039 | - | 8,11 | 11,36 | 0,59 |
| L2040 | - | 26,47 | 26,47 | 0,00 |
| L2041 | - | 37,50 | 45,83 | 1,52 |
| L2042 | - | 29,79 | 8,33 | -3,90 |
| L2043 | - | 15,63 | 15,15 | -0,09 |
| L2044 | - | 10,42 | 12,00 | 0,29 |
| L2045 | - | 7,89 | 7,69 | -0,04 |
| L2046 | - | 12,70 | 14,29 | 0,29 |
| L2047 | - | 0,00 | 0,00 | 0,00 |
| L2048 | - | 2,33 | 0,00 | -0,42 |
| L2049 | - | 0,00 | 0,00 | 0,00 |
| L2050 | - | 66,67 | 62,22 | -0,81 |
| L2051 | - | 29,41 | 4,00 | -4,62 |
| Moyenne | 32,00 | 28,85 | 33,02 | 1,06 |
| Écart-type | 15,87 | 19,40 | 21,76 | 1,61 |