Évaluation et Rapport de situation du COSEPAC sur Psithyre bohémien (Bombus bohemicus) au Canada - 2014
- Description et importance de l’espèce sauvage
- Répartition
- Habitat
- Biologie
- Taille et tendances des populations
- Menaces et facteurs limitatifs
- Protection, statuts et classements
- Remerciements et experts contactés
- Sources d’information
- Sommaire biographique des rédacteurs du rapport
- Collections examinées
- Figure 1. Vue latérale d’un psithyre bohémien femelle (Bombus bohemicus) conservé dans la Packer Collection, York University, Toronto (Ontario). Photographie : Sheila Colla.
- Figure 2. Patrons de coloration chez le psithyre bohémien (reproduction autorisée de Colla, 2012).
- Figure 3. Répartition du psithyre bohémien en Amérique du Nord, établie par modélisation de la qualité de l’habitat à l’aide du logiciel MaxEnt (Phillips et al., 2006) d’après les données de collecte de spécimens de musée (cercles rouges) (reproduction autorisée de Williams et al., 2014).
- Figure 4. Mentions du psithyre bohémien (n = 844) au Canada, et activités de recherche récentes (2000-2012) montrant les mentions de collecte pour tous les spécimens de Bombus (reproduction autorisée à partir de la base de données de Williams et al., 2014).
- Figure 5. Points de collecte de bourdons (tous les points = 236 260 spécimens) en Amérique du Nord de 1892 à 2013. Les points rouges représentent le bourdon de l’Ouest, et les points bleus, le bourdon terricole (voir Description et importance de l’espèce sauvage). Aucune donnée n’existe pour les zones sans points. En raison des incertitudes entourant le statut taxinomique du bourdon de l’Ouest et du bourdon terricole, il n’est pas certain que tous les spécimens représentés sur cette carte aient été correctement identifiés. Cette carte doit être interprétée comme une carte de répartition générale comportant un certain nombre d’observations aberrantes à vérifier. Carte compilée par Leif Richardson en novembre 2013 et reproduite avec l’autorisation de Sheffield et al. (en prép.).
- Figure 6. Phénologie du développement du psithyre bohémien dans le sud de l’Ontario (d’après les spécimens récoltés de 1883 à 2008). La mention la plus hâtive a été enregistrée le 21 avril (n = 275 [à noter que des mentions historiques additionnelles ont été ajoutées aux mentions de l’Ontario depuis la production de ce graphique, voir le tableau 2]) (reproduction autorisée de Colla, 2012).
- Figure 7. Comparaison de l’abondance relative de chaque espèce de bourdon capturée entre 1971 et 1973 (noir) et entre 2004 et 2006 (gris) à Guelph et à Belwood, en Ontario (* = P < 0,0001) (reproduction autorisée de Colla, 2012).
- Figure 8. Abondance relative du psithyre bohémien (PB) au Yukon, dans les Territoires du Nord-Ouest, en Colombie-Britannique, en Alberta et en Saskatchewan, d’après toutes les mentions de Bombus compilées au Canada de 1882 à 2011. L’axe des Y de gauche (portions ombrées des barres) indique le nombre de spécimens de PB, tandis que l’axe des Y de droite (triangles) indique la proportion de spécimens de PB pour chaque intervalle de dix ans considéré. Une analyse de régression a permis d’examiner l’évolution de l’abondance relative du PB dans le temps; la ligne représente le meilleur ajustement des données. Voir également le tableau 3. Les graphiques ont été produits à l’aide du logiciel Minitab ®.
- Figure 9. Abondance relative du psithyre bohémien (PB) au Manitoba, en Ontario, au Québec, au Nouveau-Brunswick et en Nouvelle-Écosse, d’après toutes les mentions de Bombus compilées au Canada de 1882 à 2011. L’axe des Y de gauche (portions ombrées des barres) indique le nombre de spécimens de PB, tandis que l’axe des Y de droite (triangles) indique la proportion de spécimens de PB pour chaque intervalle de dix ans considéré. Une analyse de régression a permis d’examiner l’évolution de l’abondance relative du PB dans le temps; la ligne représente le meilleur ajustement des données. Voir également le tableau 3. Les graphiques ont été produits à l’aide du logiciel Minitab ®.
- Figure 10. Abondance relative du psithyre bohémien (PB) à l’île du Prince-Édouard et à Terre-Neuve-et-Labrador, d’après toutes les mentions de Bombus compilées au Canada de 1882 à 2011. L’axe des Y de gauche (portions ombrées des barres) indique le nombre de spécimens de PB, tandis que l’axe des Y de droite (triangles) indique la proportion de spécimens de PB pour chaque intervalle de dix ans considéré. Une analyse de régression a permis d’examiner l’évolution de l’abondance relative du PB dans le temps; la ligne représente le meilleur ajustement des données. Voir également le tableau 3. Les graphiques ont été produits à l’aide du logiciel Minitab ®.
- Figure 11. Nombre total de spécimens de bourdons capturés au Canada répertoriés dans la base de données (1882 2011), par province et territoire; les triangles indiquent le nombre de spécimens de psithyres bohémiens (PB). Les pourcentages au-dessus de chaque barre correspondent à l’abondance relative du PB. Voir également le tableau 3. Les graphiques ont été produits à l’aide du logiciel Minitab ®.
- Tableau 1. Nombre de mentions nord-américaines d’espèces choisies du genre Bombus par période et résultats d’une analyse de régression logistique de l’abondance relative [la présence d’un astérisque indique que l’espèce est un parasite social (psithyre); les caractères gras et le soulignement indiquent un changement significatif de l’abondance relative de l’espèce considérée dans le temps] (données tirées de Colla et al., 2012).
- Tableau 2. Nombre de mentions du psithyre bohémien par province. Les mentions compilées pour le présent rapport se trouvent dans une base de données qui est constamment mise à jour. Plus de 70 personnes et établissements ont contribué à enrichir cette base de données (voir la liste à l’adresse : www.leifrichardson.org/bbna.html).
- Tableau 3. Abondance relative du psithyre bohémien (PB) et de deux de ses hôtes, le bourdon de l’Ouest (BO) et le bourdon terricole (BT), établie à partir des données de collecte canadiennes de Bombus versées dans une base de données (1882–2011). À noter le déclin de l’abondance relative du PB survenu au cours des périodes 1991–2001 et 2002–2011 (en rouge). Voir les figures 8 à 12 pour une représentation graphique de ces données. Plus de 70 personnes et établissements ont contribué à enrichir cette base de données (voir la liste à l’adresse : www.leifrichardson.org/bbna.html). Données compilées dans une base de données en vue de la publication de Williams et al., 2014.
- Tableau 4. La classification des menaces présentée ci-dessous est fondée sur le système unifié de classification des menaces proposé par l’Union internationale pour la conservation de la nature (UICN) et le Partenariat pour les mesures de conservation (Conservation Measures Partnership, ou CMP) (IUCN–CMP). Pour obtenir de plus amples renseignements sur le système de classification des menaces, consulter le site Web du Partenariat pour les mesures de conservation (CMP, 2010). Pour de plus amples informations sur les modalités d’assignation des valeurs, voir Master et al. (2009) et les notes de bas de tableau. Les menaces pesant sur le psithyre bohémien ont été évaluées à l’échelle de l’aire de répartition de l’espèce au Canada. Le tableau de classification des menaces a été rempli par Jennifer Heron, Sheila Colla, Cory Sheffield et Dave Fraser (novembre 2013). Pour de plus amples informations sur les menaces, voir la section Menaces.

Les rapports de situation du Comité sur la situation des espèces en péril au Canada (COSEPAC) sont des documents de travail servant à déterminer le statut des espèces sauvages que l’on croit en péril. On peut citer le présent rapport de la façon suivante :
COSEPAC. 2014. Évaluation et Rapport de situation du COSEPAC sur le Psithyre bohémien (Bombus bohemicus) au Canada. Comité sur la situation des espèces en péril au Canada. Ottawa. xi + 64 p. (Registre public des espèces en péril site Web).
Le COSEPAC remercie Sheila Colla, Cory Sheffield et Leif Richardson d’avoir rédigé le rapport de situation sur le Psithyre bohémien (Bombus bohemicus) au Canada, aux termes d’un marché conclu avec Environnement Canada. La supervision et la révision du rapport ont été assurées par Jennifer Heron, coprésidente du Sous-comité de spécialistes des arthropodes du COSEPAC.
Pour obtenir des exemplaires supplémentaires, s’adresser au :
Secrétariat du COSEPAC
a/s Service canadien de la faune
Environnement Canada
Ottawa (Ontario)
K1A 0H3
Tél. : 819-953-3215
Téléc. : 819-994-3684
COSEPAC Courriel
COSEPAC site Web
Also available in English under the title COSEWIC Assessment and Status Report on the Gypsy Cuckoo Bumble Bee Bombus bohemicus in Canada.
Illustration/photo de la couverture :
Psithyre bohémien - Fournie par les auteurs.
© Sa Majesté la Reine du chef du Canada, 2014.
No de catalogue CW69-14/692-2014F-PDF
ISBN 978-0-660-22196-0

Sommaire de l’évaluation - mai 2014
Le Psithyre bohémien (Bombus bohemicus) est l’une des six espèces de psithyres (sous-genre Psithyrus) présentes en Amérique du Nord. Les deux sexes sont de taille moyenne (longueur :12–18 mm) et présentent un patron de coloration similaire, avec l’extrémité de l’abdomen blanche. En Amérique du Nord, le psithyre bohémien est un parasite social obligatoire de diverses espèces de bourdons du sous-genre Bombus, dont le bourdon à tache rousse (B. affinis) (désigné en voie de disparition par le COSEPAC), le bourdon terricole (B. terricola) et le bourdon de l’Ouest (B. occidentalis) (la situation de ces deux espèces est en cours d’évaluation par le COSEPAC). Le B. cryptarum est peut-être également un hôte du psithyre bohémien. Une analyse récente des codes-barres ADN et de données morphologiques a confirmé la conspécificité du Bombus ashtoni, anciennement reconnu comme une espèce distincte, avec le Bombus bohemicus, largement réparti dans l’Ancien Monde.
Le psithyre bohémien est une espèce holarctique qui est présente dans la plupart des régions d’Europe (à l’exception de l’Islande) et dans l’extrême sud-ouest de l’Europe et certaines régions du nord et du centre de l’Asie. Au Canada, il a été observé dans toutes les provinces et tous les territoires à l’exception du Nunavut. Les mentions canadiennes sont réparties de 1883 à 2008, les plus récentes provenant du parc provincial Pinery en Ontario (2008) et du parc national des Monts-Valin, au Québec (2008). Depuis 1991, ce bourdon a été observé dans seulement trois provinces : Ontario (67 spécimens), Québec (39 spécimens) et Nouvelle-Écosse (18 spécimens). Malgré l’ampleur des recherches ciblées menées au cours des dernières années (2001–2013), seulement 42 individus ont été trouvés. La répartition de l’espèce est partiellement dictée par la répartition et l’abondance des espèces hôtes.
Le psithyre bohémien fréquente divers types de milieux allant des prés ouverts et des terres agricoles mixtes aux zones urbaines, à la forêt boréale et aux prés montagnards. Il se nourrit du pollen et du nectar de divers genres de plantes. Le psithyre bohémien émerge peu de temps après les reines des espèces hôtes et parasitent les nids de ses hôtes au printemps. Les espèces hôtes aménagent leur nid dans des terriers souterrains abandonnés de rongeurs ou des grumes pourries.
Le psithyre bohémien est un parasite social. Il ne forme donc pas de colonies eusociales et ne produit pas d’ouvrières comme les autres bourdons. Les femelles accouplées émergent au printemps et partent à la recherche d’un nid d’une espèce hôte. Après s’y être introduites, elles tuent ou neutralisent la reine fondatrice et pondent leurs œufs, confiant aux ouvrières de la colonie hôte le soin d’élever leur descendance. À la fin de l’été et en automne, les femelles et les mâles issus de cette ponte émergent du nid et quittent la colonie pour s’accoupler. Une fois accouplées, les femelles entreprennent de trouver un site d’hibernation. Comme chez les autres espèces de bourdons, les mâles de cette nouvelle génération et les femelles qui se sont déjà reproduites plus tôt au cours de l’année meurent à l’arrivée du temps froid.
Les relevés effectués récemment aux sites anciennement occupés par le psithyre bohémien se sont révélés infructueux. On dispose de données sur l’abondance historique de l’espèce uniquement pour une fraction de l’aire de répartition de l’espèce au Canada (principalement le sud de l’Ontario et du Manitoba). Le psithyre bohémien n’a pas été observé à de nombreux sites inventoriés au cours des quatre dernières décennies, même là où ses hôtes sont encore présents.
La principale menace pesant sur le psithyre bohémien est le déclin des populations de deux de ses hôtes, le bourdon à tache rousse dans l’est du Canada et le bourdon de l’Ouest dans l’ouest du pays. Le troisième hôte, le bourdon terricole, est encore largement réparti, mais il semble en déclin dans certaines portions de son aire de répartition. À l’échelle régionale, l’utilisation de pesticides, la dissémination de pathogènes et la perte d’habitat constituent probablement des menaces.
Aucune loi provinciale ou fédérale ne protège actuellement le psithyre bohémien au Canada. Aucune cote de conservation générale ne lui a été attribuée dans le cadre du Programme de surveillance de la situation des espèces sauvages au Canada, mais l’espèce est cotée « possiblement en péril » en Ontario, au Québec, en Nouvelle Écosse, au Nouveau-Brunswick et à Terre-Neuve. À l’échelle mondiale, l’espèce est cotée possiblement disparue (GH).
L’aire de répartition du psithyre bohémien au Canada est très vaste, et de nombreuses parcelles d’habitat propice se trouvent à l’intérieur d’aires protégées.
Bombus bohemicus (anciennement Bombus ashtoni)
Psithyre bohémien
Gypsy Cuckoo Bumble Bee
Données démographiques
Information sur la répartition
| Population | Nombre d’individus matures |
|---|---|
| Total | Inconnu. |
Analyse quantitative
Menaces (réelles ou imminentes pour les populations ou leur habitat)
La nature des menaces qui pèsent sur l’espèce à l’échelle de son aire de répartition est incertaine. À l’échelle régionale, les principales menaces sont l’utilisation des pesticides et la dissémination de pathogènes. Les populations des espèces hôtes ont décliné dans certaines régions comprises dans l’aire de répartition du psithyre bohémien. Le bourdon à tache rousse (B. affinis) a disparu du sud de l’Ontario et du Québec, tandis que le bourdon terricole (B. terricola) est en déclin dans les portions méridionales de son aire de répartition dans le centre et l’est du Canada et les populations de la sous-espèce occidentalis du bourdon de l’Ouest (B. occidentalis occidentalis) ont décliné dans le sud des provinces de l’Ouest.
Immigration de source externe (immigration de l’extérieur du Canada)
Statut actuel
COSEPAC : aucun
Statut et justification de la désignation
Applicabilité des critères

Le Comité sur la situation des espèces en péril au Canada (COSEPAC) a été créé en 1977, à la suite d’une recommandation faite en 1976 lors de la Conférence fédérale-provinciale sur la faune. Le Comité a été créé pour satisfaire au besoin d’une classification nationale des espèces sauvages en péril qui soit unique et officielle et qui repose sur un fondement scientifique solide. En 1978, le COSEPAC (alors appelé Comité sur le statut des espèces menacées de disparition au Canada) désignait ses premières espèces et produisait sa première liste des espèces en péril au Canada. En vertu de la Loi sur les espèces en péril (LEP) promulguée le 5 juin 2003, le COSEPAC est un comité consultatif qui doit faire en sorte que les espèces continuent d’être évaluées selon un processus scientifique rigoureux et indépendant.
Le Comité sur la situation des espèces en péril au Canada (COSEPAC) évalue la situation, au niveau national, des espèces, des sous-espèces, des variétés ou d’autres unités désignables qui sont considérées comme étant en péril au Canada. Les désignations peuvent être attribuées aux espèces indigènes comprises dans les groupes taxinomiques suivants : mammifères, oiseaux, reptiles, amphibiens, poissons, arthropodes, mollusques, plantes vasculaires, mousses et lichens.
Le COSEPAC est composé de membres de chacun des organismes responsable des espèces sauvages des gouvernements provinciaux et territoriaux, de quatre organismes fédéraux (le Service canadien de la faune, l’Agence Parcs Canada, le ministère des Pêches et des Océans et le Partenariat fédéral d’information sur la biodiversité, lequel est présidé par le Musée canadien de la nature), de trois membres scientifiques non gouvernementaux et des coprésidents des sous-comités de spécialistes des espèces et du sous-comité des connaissances traditionnelles autochtones. Le Comité se réunit au moins une fois par année pour étudier les rapports de situation des espèces candidates.
Espèce, sous-espèce, variété ou population géographiquement ou génétiquement distincte d’animal, de plante ou d’un autre organisme d’origine sauvage (sauf une bactérie ou un virus) qui est soit indigène du Canada ou qui s’est propagée au Canada sans intervention humaine et y est présente depuis au moins cinquante ans.
Le Service canadien de la faune d’Environnement Canada assure un appui administratif et financier complet au Secrétariat du COSEPAC.
Le Bombus bohemicus a été décrit par Seidl en 1837 et est depuis considéré comme une espèce valide dans l’Ancien Monde. En Amérique du Nord, Cresson (1864) a décrit l’Apathus ashtoni et, jusqu’à tout récemment, le Bombus ashtoni (Cresson) était le nom scientifique reconnu pour ce taxon. Williams (1991) a toutefois mis en doute le statut spécifique du B. ashtoni sur la base de divers critères morphologiques. Subséquemment, Cameron et al. (2007), se fondant sur des données moléculaires (ADN), se sont dit d’avis que le B. ashtoni était conspécifique avec le B. bohemicus, de l’Ancien Monde. Plus récemment, sur la base de données génétiques additionnelles (analyse des séquences de la COI de l’ADN mitochondrial), le taxon nord-américain B. ashtoni a été synonymisé avec le B. bohemicus, et ce nom est maintenant appliqué à cette espèce holarctique (Williams, 2013; Williams et al., 2014).
La description morphologique du psithyre bohémien présentée ci-après est fondée sur les informations fournies par Plath (1934), Mitchell (1962), Colla et al., (2011) (sous le nom B. ashtoni) et Williams et al. (2014).
Femelle : Longueur du corps : 17-18 mm; largeur de l’abdomen : 8-8,5 mm. Face externe des métatibias convexe, garnie d’une pilosité dense, sans corbicule (ou corbeille à pollen). Face et sommet de la tête garnis de poils noirs, avec parfois des poils jaunes sur la partie postérieure du sommet de la tête. Pilosité du thorax principalement noire sur les côtés, jaune sur sa portion antérieure (c.-à-d. entre les ailes), jaune à noir sur le reste de sa face dorsale. Segments abdominaux 1 et 2 avec des poils noirs, segments abdominaux 3 à 5 variables, blanc jaunâtre sur les côtés, habituellement blanc au moins dans la portion médio-postérieure du segment 4 (figure 2). Comme chez tous les psithyres, l’extrémité de l’abdomen est fortement recourbée (figure 1) et fortement bicarénée ventralement.
Mâle : Longueur du corps : 12-16 mm; largeur de l’abdomen : 5-7 mm. Antennes de longueur moyenne, flagelle trois fois plus long que le scape. Poils de la frange postérieure du basitarse des pattes postérieures en majorité noirs. Pilosité du segment abdominal 1 jaune, fortement mêlée de poils noirs; segment 2 entièrement noirs, segments 3, 5 et 6 principalement jaunes avec des poils noirs au milieu, segment 4 principalement jaune, segment 7 entièrement noir (figure 2).
Le psithyre bohémien est fréquemment confondu avec l’une ou l’autre des trois autres espèces du genre Psithyrus avec lesquelles il cohabite, à savoir le B. insularis, le B. flavidus et le B. suckleyi. Chez les psithyres bohémiens femelles, les poils sur le sommet de la tête sont majoritairement foncés, alors qu’ils sont pâles chez les autres espèces. Chez les femelles, les pleures noires et la carène sur le sternite 6 sont également des caractères fiables qui permettent de distinguer les psithyres bohémiens femelles du B. insularis, du B. flavidus et de la plupart des spécimens de B. suckleyi. Enfin, chez les psithyres bohémiens femelles, la pilosité sur les tergites (T) 3 et 4 est habituellement blanche, au moins dans la portion médio-postérieure du T4. L’examen des genitalia peut être nécessaire pour départager les mâles de ces espèces (Williams et al., 2014).

Photo : S. Colla © Environnement Canada
Description longue pour la figure 1
Photo (vue latérale) d’un psithyre bohémien femelle. Pour une description complète des patrons de coloration et des caractères diagnostiques, voir la section « Description morphologique » du rapport.
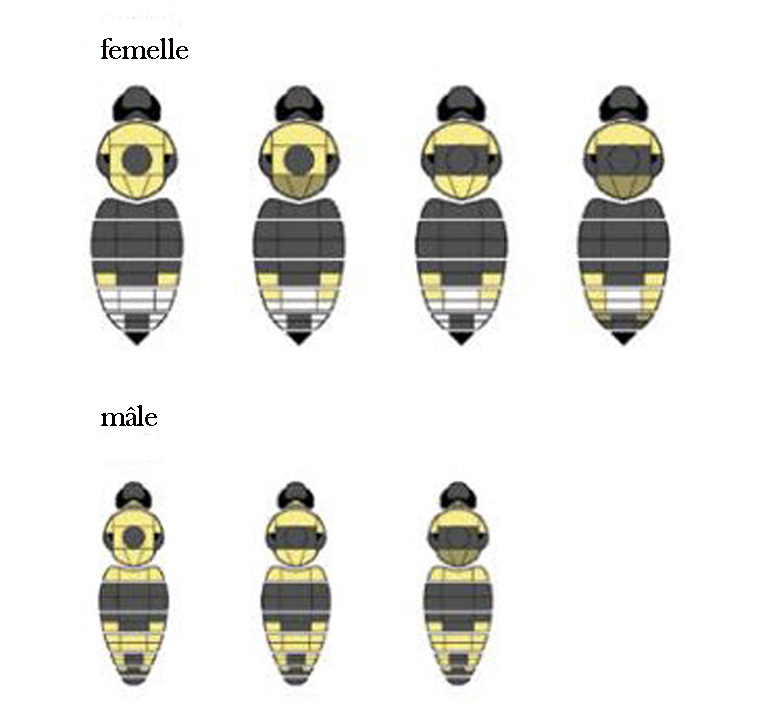
Photo : S. Colla © Environnement Canada
Description longue pour la figure 2
Illustrations des divers patrons de coloration chez les psithyres bohémiens femelles (quatre images du haut) et mâles (trois images du bas).
Femelles : La pilosité de la face et du sommet de la tête est entièrement noire. La pilosité du thorax est principalement noire sur les côtés, jaune sur la portion antérieure (en avant des ailes) et jaune à noire sur le reste du dessus du thorax. Les segments abdominaux 1 et 2 sont recouverts de poils noirs, tandis que les segments 3 à 5 montrent une quantité variable de poils blanc jaunâtre sur les côtés, avec le milieu du segment 4 garni de poils blancs.
Mâles : La pilosité est jaune sur le segment abdominal 1, entièrement noire sur le segment 2, principalement jaune mais avec du noir au milieu sur les segments 3, 5 et 6, principalement jaune sur le segment 4 et entièrement noire sur le segment 7.
La structure et la variabilité génétique de la population n’ont pas été étudiées chez le psithyre bohémien. La Barcode of Life database (BOLD) (www.barcodeoflife.org) contient les codes-barres de huit spécimens issus de quatre sites au Canada (Colombie-Britannique et Nouvelle-Écosse) et des États-Unis (Alaska) (Packer, comm. pers., 2011). Toutes les séquences sont pratiquement identiques et ne diffèrent pas significativement de celles d’un échantillon de psithyre bohémien d’Allemagne (Cameron et al., 2011; Williams et al., 2012). Le psithyre bohémien est aujourd’hui considéré comme une espèce holarctique, et le nom B. ashtoni est traité comme un synonyme plus récent.
En l’absence d’information sur le caractère distinct et important du point de vue évolutif des populations, le psithyre bohémien est considéré comme une seule unité désignable aux fins de la présente évaluation. L’espèce est présente dans toutes les zones écologiques du COSEPAC (2011), à l’exception de la frange est du Pacifique (tout juste à l’ouest des Rocheuses) et de l’Arctique (où sa présence n’a pas été signalée).
Le psithyre bohémien est un parasite social qui vit dans les colonies d’autres espèces de bourdons. Il joue probablement un rôle écologique important en raison de son impact sur la dynamique des populations et la répartition de ses hôtes (Antonovics et Edwards, 2011). Ses hôtes sont le bourdon à tache rousse (B. affinis), le bourdon de l’Ouest (les deux sous-espèces du B. occidentalis), le bourdon terricole (B. terricola) et, possiblement, le B. cryptarum, une espèce holarctique (Owen et al., 2012).
La biologie du psithyre bohémien a déjà été étudiée (voir par exemple Fisher, 1983, sous le nom B. ashtoni). L’intérêt de cette espèce réside principalement dans sa sensibilité à la dégradation environnementale. En effet, les abeilles, de façon générale, et tout particulièrement les psithyres et les abeilles sociales, sont sensibles aux impacts de la faible taille des populations (Williams et al., 2010) en raison des mécanismes qui régissent la détermination des sexes (Zayed et Packer, 2005) (voir Facteurs limitatifs).
Le psithyre bohémien est une espèce holarctique. En Amérique du Nord, il est présent dans toutes les provinces et tous les territoires du Canada (à l’exception du Nunavut) et dans plusieurs États du nord des États-Unis (Alaska, Connecticut, Dakota du Nord, Indiana, Massachusetts, Minnesota, New Hampshire, New Jersey, New York, Ohio, Pennsylvanie, Virginie, Virginie-Occidentale, Wisconsin) (figure 3). Dans l’Ancien Monde, il est présent dans la plupart des pays d’Europe (à l’exception de l’Islande et de l’extrême sud-ouest de l’Europe) et est largement réparti en Asie.
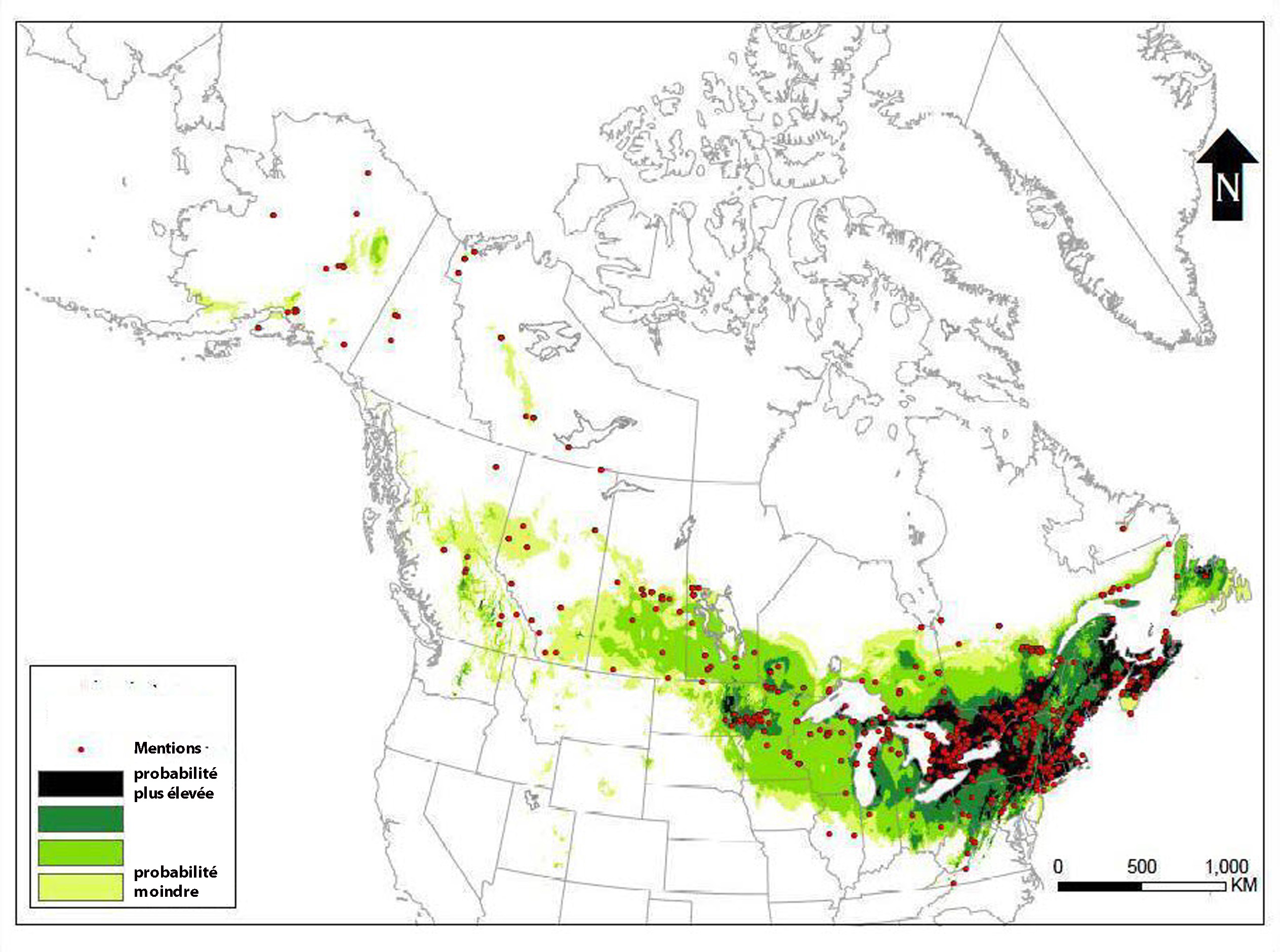
Photo : S. Colla © Environnement Canada
Description longue pour la figure 3
Carte illustrant la répartition du psithyre bohémien en Amérique du Nord, établie d’après les données de collecte de spécimens de musée. Les zones comportant des parcelles d’habitat jugé propice sont également indiquées. Quatre catégories de qualité d’habitat sont distinguées, allant de particulièrement propice (probabilité plus élevée de rencontrer l’espèce) à moins propice (probabilité moindre). L’espèce est présente dans toutes les provinces et tous les territoires du Canada à l’exception du Nunavut et dans diverses régions du nord des États-Unis (Alaska, Connecticut, Dakota du Nord, Indiana, Massachusetts, Minnesota, New Hampshire, New Jersey, New York, Ohio, Pennsylvanie, Virginie, Virginie-Occidentale et Wisconsin).
Au Canada, le psithyre bohémien a été observé dans toutes les provinces et tous les territoires à l’exception du Nunavut (Colla et Sheffield, 2010) (figure 4). Les mentions canadiennes sont échelonnées de 1883 à 2008. Depuis 1991, il a été observé dans seulement trois provinces : Ontario (67 spécimens), Québec (39 spécimens) et Nouvelle-Écosse (18 spécimens) (annexe 1). Les mentions les plus récentes proviennent du parc provincial Pinery en Ontario (2008) et du parc national des Monts-Valin, au Québec (2008). Bien que l’espèce soit largement répartie, une modélisation de l’adéquation climatique fondée sur les données de collecte (mentions de collecte et spécimens de musée) semble indiquer que c’est dans le sud et le centre de l’Ontario et du Québec qu’elle trouve des conditions optimales (figure 3). C’est d’ailleurs dans ces régions que les mentions les plus récentes ont été enregistrées au Canada (2008).

Image : © Environnement Canada
Description longue pour la figure 4
Carte illustrant la répartition du psithyre bohémien au Canada durant trois périodes (2002 à 2012, 1992 à 2001 et 1883 à 1991) ainsi que les mentions de collecte (tous les spécimens de Bombus) enregistrées dans le cadre des recherches effectuées récemment (2000 à 2012). Le psithyre bohémien a été observé dans toutes les provinces et tous les territoires du Canada à l’exception du Nunavut.
Chaque province et territoire sont mentionnés ci-dessous (tableau 2) (mentions présentées par ordre chronologique, les plus récentes en premier). Des informations sur la répartition des espèces hôtes dans chaque province et territoire sont également présentées lorsque ces données sont disponibles. L’aire de répartition des espèces hôtes au Canada sont les suivantes :
- Bourdon à tache rousse : sud de l’Ontario et du Québec;
- Bourdon de l’Ouest (sous-espèces du Nord et du Sud) (figure 5) : Colombie-Britannique, Alberta, sud de la Saskatchewan, Yukon et ouest des Territoires du Nord-Ouest;
- Bourdon terricole (figure 5) : zone boréale, des Rocheuses dans l’est de la Colombie-Britannique jusque dans l’est du pays, sud des Territoires du Nord-Ouest et moitié méridionale du Canada jusqu’à Terre-Neuve;
- Bombus cryptarum (espèce holarctique considérée comme un hôte potentiel) : Yukon, Territoires du Nord-Ouest, Colombie-Britannique, Alberta et Saskatchewan, et quelques mentions non confirmées provenant du Nunavut et de l’extrême-nord de l’Ontario (Colla, comm. pers., 2013).
Une des mentions les plus récentes du psithyre bohémien au Canada provient du parc provincial Pinery (2008). Hôtes en Ontario : le bourdon terricole est présent dans les écozones des Plaines à forêts mixtes et du Bouclier canadien dans le sud de l’Ontario ainsi que dans certaines des basses-terres de la baie d’Hudson autour de la baie James. Cette espèce hôte a été récoltée pour la dernière fois dans le sud de l’Ontario en 2013 (notamment à Toronto, Barrie et Ottawa) (Colla, comm. pers., 2014). Le bourdon à tache rousse est beaucoup plus rare et a été observé pour la dernière fois dans la province en 2009, dans le parc provincial Pinery (COSEPAC, 2010).

Image : © Environnement Canada
Description longue pour la figure 5
Carte montrant tous les points de collecte de bourdons en Amérique du Nord entre 1892 et 2013. Les points de collecte du bourdon de l’Ouest et du bourdon terricole (deux espèces hôtes) et de toutes les espèces de Bombus confondues sont distingués les uns des autres par un code couleur. Au Canada, le bourdon de l’Ouest (sous-espèces du Nord et du Sud) se rencontre en Colombie-Britannique, en Alberta, dans le sud de la Saskatchewan, au Yukon et dans l’ouest des Territoires du Nord-Ouest. Le bourdon terricole est présent dans les Rocheuses de l’est de la Colombie-Britannique jusqu’au sud des Territoires du Nord-Ouest dans la zone boréale et jusqu’à Terre-Neuve-et-Labrador dans la moitié méridionale du Canada.
Les mentions les plus récentes du psithyre bohémien au Canada ont été enregistrées au Québec, dans le parc national des Monts-Valin – Chalet La Courtepointe (4 juillet 2008) (Savard, 2012) et Pied-du-Mont (29 juillet 2007) (Savard, 2012) et à l’île d’Anticosti – Jupiter, dans le golfe du Saint-Laurent (16 au 30 juin 2007) (Brousseau, 2011; Savard, comm. pers., 2012). De nombreux individus ont été capturés lors de relevés réalisés en 2000-2001 à Magpie, Aguanish, Baie-Johan-Beetz et Rivière-Saint-Jean (Buidin, comm. pers., 2011) (voir l’annexe 1). Des mentions plus anciennes proviennent du sud et du centre de la province, et des mentions non confirmées ont été enregistrées dans le nord de la province (Laverty et Harder, 1988). Hôtes au Québec : le bourdon terricole est encore présent en populations éparses dans le sud du Québec. Cette espèce hôte était autrefois commune dans les écozones des Plaines à forêts mixtes et du Bouclier canadien du sud de la province et a été capturé dans des localités éparses dans l’écozone de la taïga du Bouclier, aussi loin au nord que Schefferville, à près de 55° N. Plus récemment, en 2013, des individus ont été capturés par M. Chagnon en milieu agricole au sud de Montréal et de Québec (Sheffield, comm. pers., 2014). Le bourdon à tache rousse n’a pas été observé au Québec depuis les années 1970 (COSEPAC, 2010).
Les mentions les plus récentes du psithyre bohémien proviennent de la région de Middleton (2002). L’espèce a été observée dans de nombreux sites au cours des années 1990; certains des spécimens capturés à l’époque sont conservés dans la collection de la Cape Breton University (les captures les plus récentes datent de 2001) (McCorquodale, comm. pers., 2012). Hôte : le bourdon terricole a été observé dans la plupart des régions de la province, et des individus ont été capturés en 2013 au cours de relevés effectués dans d’anciens sites de collecte, à Lockeport, Greenfield et New Germany (Colla, comm. pers., 2014).
La capture la plus récente date de 1983 (Curley, comm. pers., 2011). La collection de l’University of Prince Edward Island [Entomology] Museum contient des spécimens capturés au cours des années 1970 et 1980 à Riverdale, Charlottetown, Cornwall et Vernon River. Hôte : le bourdon terricole est commun aux mêmes sites de relevés à Riverdale, Charlottetown, Cornwall et Vernon River (Giberson, comm. pers., 2011) et a été observé encore tout récemment en 2013 (Colla, comm. pers., 2014).
Le psithyre bohémien a été capturé pour la dernière fois dans la province en 1988, à 40 km au sud de Quesnel. Le centre intérieur de la province constitue la limite occidentale de son aire de répartition. Ce bourdon n’a été observé ni le long de la côte ni dans la portion sud-ouest de la province (figure 3). Hôtes : les hôtes incluent le bourdon de l’Ouest et le bourdon terricole, deux espèces qui semblent en déclin dans la province. Des relevés ciblant le bourdon de l’Ouest et totalisant au moins 281 heures de recherche réparties dans plus de 104 sites (d’autres échantillons n’ont pas encore été traités) ont été effectués dans la province en 2013 (Sheffield et al.; les données sont présentées dans un manuscrit en préparation). Quelque 6 447 spécimens de Bombus ont alors été capturés, dont 115 bourdons de l’Ouest (ou 1,7 % du nombre total de spécimens examinés) (à 36 des 104 sites inventoriés) et 295 bourdons terricoles (ou 4 % du nombre total de spécimens examinés) (Sheffield et al., en prép.). Aucun psithyre bohémien n’a été capturé durant ces relevés, malgré la présence des deux espèces hôtes.
Le psithyre bohémien n’a été observé que dans le centre et le sud de la province. La capture la plus récente date de 1986 (voir également Turnock et al. [2007] à la section Taille et tendances des populations). Hôte : la plupart des captures anciennes de bourdons terricoles ont été effectuées dans les écozones des Plaines boréales et des Prairies, dans le tiers méridional de la province, mais quelques individus ont été trouvés aussi loin au nord que la baie d’Hudson. Les captures les plus récentes ont été réalisées à Gillam et à York Factory, en 2010 (Colla, comm. pers., 2014).
La mention la plus récente du psithyre bohémien provient de Lethbridge et date de 1983. Hôtes : le bourdon terricole est présent partout dans la province et a été capturé dans toutes les écozones, y compris dans le sud des Prairies, le centre des Plaines boréales, les montagnes de l’Ouest et le nord de la taïga des Plaines. Il a été observé à Edmonton et à Slave Lake en 2013, lors de nouveaux relevés menés dans d’anciennes localités de collecte (Rowe, comm. pers., 2013). D’autres individus ont été capturés dans un rayon de 200 km autour d’Edmonton par G. Anweiler (Sheffield, comm. pers., 2014). Les relevés effectués en 2013 ont mené à la capture d’un faible nombre de bourdons de l’Ouest et de bourdons terricoles près du parc provincial Dinosaur (près de Red Deer) et dans les régions de Red Cliff (au sud de Medicine Hat) et des collines du Cyprès (Sheffield, comm. pers., 2014).
La dernière capture d’un psithyre bohémien date de 1979 et été effectuée au parc national du Gros-Morne. D’autres individus ont été capturés à Goose Bay, Codroy Valley et Grand Falls. Hôte : le bourdon terricole a été capturé principalement dans les régions côtières, en particulier le long du golfe du Saint-Laurent. La Collection nationale canadienne contient quelques spécimens sans date de capture (mais vraisemblablement capturés avant 2004) provenant de Cartwright et de St. Anthony, au Labrador. Les captures les plus récentes de bourdons terricoles dans la province datent de 2010. L’espèce y est encore commune (Sheffield, comm. pers., 2014).
Le psithyre bohémien a été capturé dans la moitié occidentale de ce territoire. La capture la plus récente a été réalisée à « 3 milles au sud-est » de Fort Simpson en 1972. Hôtes : le bourdon terricole se rencontre dans le centre de l’écozone de la taïga des Plaines dans les Territoires du Nord-Ouest, mais pas dans les portions montagneuses situées à l’ouest. Les captures les plus récentes ont été effectuées dans les régions de Hay River (2005) et de Fort Simpson (2011). Le bourdon de l’Ouest (sous-espèce du Nord) n’a été observé qu’à quelques reprises dans les Territoires du Nord-Ouest, dans l’extrême-ouest des territoires. Une seule mention date d’avant 2011 (4 août 1944 – localité de collecte exacte non précisée). Les huit autres spécimens ont été capturés à des dates différentes en août 2011, à divers endroits le long de la rivière South Nahanni (Stotyn, 2012; Sheffield, comm. pers., 2014).
La capture la plus récente du psithyre bohémien a été effectuée à Meadow Lake en 1972. L’espèce a été observée dans le sud et le centre de la province, notamment à Val Marie. Hôtes : le bourdon terricole se rencontre dans les écozones des Plaines boréales et des Prairies dans le tiers méridional de la province. Curry (1984) considérait le bourdon terricole comme commun et largement réparti dans la province, des prairies aux forêts conifériennes dans le nord de la province. En 2013, des individus ont été capturés à Killaly et à Prince Albert (Colla, comm. pers., 2014), et d’autres captures donnent à croire que le bourdon terricole est l’une des espèces de bourdons les plus communes dans les régions de Prince Albert et de Birch Hills et aussi loin au sud que Regina (Sheffield, comm. pers., 2014). En Saskatchewan, le bourdon de l’Ouest est peu représenté dans les mentions historiques de relevés ou de collecte. Récemment (2012-2013), sa présence a été signalée à de nombreux endroits dans le tiers méridional de la province (parc national des Prairies, parc provincial Landing de la Saskatchewan, Great Sand Hills, vallée de la Big Muddy et parc provincial Cypress Hills, Eastend, Swift Current, et aussi loin vers l’est que Regina) [le traitement des échantillons se poursuit, Sheffield et al. (en prép.)]. Le bourdon de l’Ouest semble relativement peu commun en comparaison des autres espèces de bourdons. Avant ces relevés, peu de mentions historiques avaient été enregistrées dans ces régions (Sheffield, comm. pers., 2014).
La capture la plus récente d’un psithyre bohémien a été enregistrée à « 15 milles à l’est de Dawson » en 1962. Hôte : bien que le bourdon de l’Ouest ait été observé à de nombreux sites au cours des trois dernières années, aucun psithyre bohémien n’a été trouvé (Cannings, comm. pers., 2013; Sheffield, comm. pers., 2014). Le bourdon de l’Ouest était présent à de nombreux sites inventoriés en 2009, 2010 et 2013 (Cannings comm. pers., 2013; Sheffield, comm. pers., 2014). La sous-espèce du Nord est encore considérée comme commune dans les régions adjacentes de l’Alaska, où elle représentait plus de 30 % de tous les bourdons observés (Koch et Strange, 2012).
La mention la plus récente du psithyre bohémien provient de Coldbrook (1961), près de Saint John. Hôtes : le bourdon terricole est présent partout dans la province (Laverty et Harder, 1988). L’espèce était un pollinisateur commun du bleuet au cours des années 1970 et au début des années 1990 (Sheffield, comm. pers., 2014). Les captures les plus récentes ont été enregistrées lors de relevés effectués en 2013 dans des sites anciennement occupés, à Springfield et à Norton (Colla, comm. pers., 2014). La présence du bourdon à tache rousse dans la province est attestée par une mention confirmée de la capture d’un individu au cours des années 1940 (Klymko, comm. pers., 2014).
Une somme considérable de temps et d’efforts a été consacrée récemment et historiquement à la conduite de relevés ciblant les bourdons, dont le psithyre bohémien. En conséquence, nous disposons de beaucoup plus de données sur les bourdons sauvages que sur la plupart des autres groupes d’insectes d’Amérique du Nord. Une base de données récemment compilée (Williams et al., 2014) contenant les données de collecte d’environ 236 260 spécimens de bourdons (figure 5) conservés dans des collections de musées au Canada et aux États-Unis montre que le nombre de bourdons récoltés a augmenté, en particulier au cours de la dernière décennie. Cette hausse est due à la prolifération récente d’études aux États-Unis (voir par exemple Cameron et al., 2011; Grixti et al., 2009) et au Canada (voir par exemple Colla et Packer, 2008; Sheffield, données personnelles, 2013; Williams et al., 2014) comportant un effort d’échantillonnage important, des centaines d’heures-personnes ayant été consacrées à la recherche des populations de bourdons sauvages au cours de chaque décennie.
En outre, aucun des nombreux relevés de bourdons récents réalisés à l’échelle de l’aire de répartition du psithyre bohémien, mais ciblant le bourdon à tache rousse et le bourdon de l’Ouest n’a permis de confirmer la présence du psithyre. Deux méthodes d’échantillonnage ont été utilisées dans le cadre de ces relevés : recherche opportuniste et capture à l’aide d’un filet des bourdons butinant les fleurs et lâcher ou montage des individus capturés, et utilisation de pièges à eau colorés. Les relevés de bourdons effectués récemment au Yukon, en Colombie-Britannique, en Alberta et en Saskatchewan (dans le cadre des travaux préparatoires au rapport de situation du COSEPAC sur le bourdon de l’Ouest) et au Nouveau-Brunswick et en Ontario (voir COSEPAC, 2010) sont décrits brièvement ci-après.
Un certain nombre de lacunes ont limité la portée des relevés effectués. De façon générale, les relevés n’ont pas été menés de façon systématique ou exhaustive dans le temps et l’espace à l’échelle de l’aire de répartition du psithyre bohémien. En conséquence, de vastes régions (p. ex. moitié septentrionale de la plupart des provinces et territoires) n’ont pas été inventoriées, principalement en raison de leur inaccessibilité, et aucune donnée n’est disponible pour ces régions ou pour certaines périodes. La plupart des relevés ont été menés dans la portion méridionale de l’aire de répartition du psithyre bohémien, mais de nombreux sites anciennement occupés se trouvent dans le biome de la forêt boréale et n’ont pas été réinventoriés (figure 4). En outre, les observateurs ont souvent omis de documenter le temps et l’effort consacrés aux recherches, ce qui complique la quantification et la comparaison de l’effort de recherche. Pour toutes ces raisons, il est difficile d’interpréter les tendances spatio-temporelles associées aux mentions du psithyre bohémien (voir Taille et tendances des populations).
Lors des relevés effectués durant la préparation du présent rapport, des recherches ciblant le psithyre bohémien ont été effectuées de façon opportuniste à l’aide d’un filet entomologique entre juin et octobre 2011 dans les sites historiques suivants (Colla, données pers., 2011) : Toronto (5 jours), parc provincial Pinery (8 jours), Beamsville (1 jour) et Guelph (1 jour), en Ontario, et Sainte-Anne-de-Bellevue (2 jours), au Québec. Un relevé (1 jour) a également été réalisé en Ontario au parc provincial Presqu’ile en juin 2012. Aucun psithyre bohémien n’a été trouvé durant ces relevés
Les activités de recherche menées dans chaque province et territoire sont brièvement décrites ci-dessous, et l’emplacement de tous les sites où des Bombus spp. (toutes espèces confondues) ont été récoltés est indiqué à la figure 4.
Une grande partie des Territoires du Nord-Ouest n’a fait l’objet d’aucun relevé ciblant les bourdons. Plus récemment (juillet 2011), des relevés ont été effectués à 19 sites répartis le long des rives de la rivière South Nahanni, de Moose Ponds à la rivière Liard (Stotyn, 2012). La présence du bourdon de l’Ouest a été notée parmi les quelque 78 Bombus spp. capturés, mais pas celle du psithyre bohémien (Stotyn, 2012).
Aucun psithyre bohémien n’a été récolté durant les nombreux relevés réalisés dans la région de Churchill et les secteurs avoisinants. Patenaude (2007) n’a observé aucun psithyre bohémien parmi les quelque 600 bourdons capturés dans des prairies du sud-ouest de la province (mai à septembre 2005 et 2006).
Des recherches intensives de bourdons (n > 4 000 Bombus spp. capturés) ont été menées dans le sud de l’Ontario de 2004 à 2012 (figure 4). Une des mentions les plus récentes du psithyre bohémien au Canada a été enregistrée au parc provincial Pinery en 2008, au même site où les dernières populations connues du bourdon à tache rousse (espèce hôte) ont été observées en 2009. Des recherches intensives ciblant le psithyre bohémien ont été menées au parc provincial Pinery de 2008 à 2011, mais sans succès. Les relevés récents réalisés à divers endroits dans le centre et le nord de la province se sont également révélés infructueux (p. ex. parc provincial Mississagi, 13 au 16 juin 2011).
Laverty et Harder (1988) font état d’un certain nombre de mentions non confirmées dans le nord de la province. De nombreux individus ont été capturés durant des relevés menés entre 2000 et 2008 à Magpie, Aguanish, Baie-Johan-Beetz et Rivière-Saint-Jean (Buidin, comm. pers., 2011; Savard, 2012) (voir l’annexe 1).
Aucun psithyre bohémien n’a été observé lors des relevés menés au cours de l’été 2008 près de Moncton, au parc national Fundy et à Saint John (S. Colla a vainement tenté de trouver des bourdons à tache rousse lors d’un relevé de bourdons d’une durée de 4 jours) (COSEPAC, 2010). De la même façon, aucun psithyre bohémien n’a été trouvé parmi les quelque 219 bourdons récoltés lors de relevés menés en 2010 et en 2011 (Klymko, comm. pers., 2012).
Au cours des dix dernières années, de nombreux relevés ont été réalisés à l’échelle de la province par des étudiants et d’autres observateurs (Sheffield, comm. pers., 2012). La présence du psithyre bohémien a été observée à de nombreux sites au cours des années 1990. La collection de la Cape Breton University contient quelques spécimens capturés entre 1986 et 1998, la capture la plus récente datant de 2001 (McCorquodale, comm. pers., 2012). Aucun psithyre bohémien n’a été récolté au cours des relevés menés en 2010 et en 2011 (Klymko, comm. pers., 2012).
Aucune recherche ciblant cette espèce n’a été effectuée à Terre-Neuve au cours des dix dernières années.
Des relevés intensifs ont été réalisés à plus de 57 sites depuis 2000, mais aucun psithyre bohémien n’a été trouvé parmi les 266 spécimens de bourdons récoltés; le bourdon terricole était cependant commun à ces sites (Giberson, comm. pers., 2011). La présence du psithyre bohémien n’a pas été observée lors des travaux de terrain effectués en 2004–2005 (MacPhail, 2011).
Au moins 2 000 bourdons ont été récoltés à de nombreux sites au cours des trois dernières années, mais aucun psithyre bohémien n’a été observé même si deux de ses hôtes potentiels, le bourdon de l’Ouest et le B. cryptarum, sont encore communs (Cannings, comm. pers., 2013).
Des relevés de bourdons ont été effectués à de nombreux sites par des biologistes affiliés à des universités ou à des organismes gouvernementaux, mais aucun psithyre bohémien n’a été trouvé (figure 4). Les recherches intensives (plusieurs centaines d’heures) menées au cours des dix dernières années ont mené à la capture de plusieurs milliers de bourdons. Par exemple, 4 221 bourdons ont été capturés dans le cadre d’une étude réalisée dans la vallée du Fraser en 2003 et en 2004; ce lot ne contenait toutefois aucun psithyre bohémien (Ratti, 2006). Des relevés récents totalisant au moins 281 heures cumulées de recherche à environ 104 sites (un certain nombre d’échantillons n’ont pas encore été traités) ont été réalisés dans la province en 2013 (Sheffield et al.; données présentées dans un manuscrit en préparation). Dans le cadre de ces relevés intensifs, les observateurs ont consacré au moins 30 à 60 minutes à la recherche des bourdons à chaque site, et tous les individus présents ont été capturés. Aucun psithyre bohémien n’a été trouvé parmi les 104 échantillons traités jusqu’à maintenant (Sheffield et al., en prép.).
Des relevés de bourdons ont été effectués à de nombreux sites par des biologistes affiliés à des universités ou à des organismes gouvernementaux, mais aucun psithyre bohémien n’a été trouvé (voir par exemple Colla, données personnelles, 2010; Owen et al., 2012; figure 4). Les recherches intensives (plusieurs centaines d’heures) menées au cours des dix dernières années ont mené à la capture de plusieurs milliers de bourdons. De la même façon, aucun psithyre bohémien n’a été trouvé parmi un lot de 775 bourdons capturés en 2010 dans le sud de l’Alberta (Colla, données personnelles, 2010). Les recherches de l’espèce entreprises dans les collines du Cyprès (en 2007 et en 2013), au parc provincial Dinosaur, à Red Cliff (au sud de Medicine Hat), à Edmonton et dans les régions avoisinantes se sont toutes révélées vaines (Sheffield, comm. pers., 2014). Les relevés menés par G. Anweiler à au moins 20 sites (minimum de 30 minutes par site) dans un rayon de 200 km autour d’Edmonton se sont également révélées infructueux (Sheffield et al., en prép.).
La présence du psithyre bohémien n’a pas été détectée lors de relevés récents (2011-2013) effectués au parc national des Prairies, au parc provincial Landing de la Saskatchewan, dans les Great Sand Hills, dans la vallée de la Big Muddy, à Eastend, à Leader, à Swift Current, à Prince Albert, au parc provincial Cypress Hills et à d’autres endroits aussi loin vers l’est que Regina et dans d’autres régions (le traitement des échantillons est en cours, Sheffield et al. (en prép.). En 2011, d’autres recherches d’une durée d’une semaine menées à l’aide de pièges intercepteurs Note de bas de page1.1 par A. Crosby dans les collines du Cyprès se sont également révélées infructueuses (Colla, comm. pers., 2013).
À l’extérieur du Canada, aucun psithyre bohémien n’a été capturé dans le cadre de relevés effectués de 2007 à 2009 à 382 sites (n = 16 788 Bombus capturés) dans diverses régions de la portion continentale des États-Unis. Ces relevés ont également mis en évidence d’importants déclins chez les trois espèces hôtes, soit le bourdon terricole, le bourdon de l’Ouest et le bourdon à tache rousse (Cameron et al., 2011).
Le psithyre bohémien est un parasite social qui vit dans les nids de bourdons du sous-genre Bombus sensu stricto. Les espèces hôtes nichent dans des terriers de rongeurs abandonnés (Plath, 1934) et ont été récoltées dans divers types de milieux tels que des prés montagnards, des friches, des terres agricoles mixtes, des zones urbaines et des boisés clairsemés.
Le psithyre bohémien est un butineur généraliste qui se nourrit principalement de nectar (voir par exemple Colla et Dumesh, 2010) et qui est associé à des espèces végétales poussant près des zones boisées (Colla et Dumesh, 2010) et des bleuetières (Vaccinium spp.) (Sheffield, comm. pers., 2011).
Les besoins en matière de l’habitat d’hibernation du B. bohemicus sont inconnus, mais de façon générale, les bourdons hibernent dans le sol, dans les paillis ou d’autres types de matière végétale en décomposition ou dans des grumes pourries à proximité des sites de nidification (Macfarlane, 1974).
Le psithyre bohémien est l’une des espèces de bourdons les plus largement réparties au Canada. Il est peu probable que les tendances liées à l’habitat aient pu entraîner son déclin à une échelle aussi vaste, mais la perte d’habitat causée par l’urbanisation ou l’agriculture intensive constitue une menace potentielle pour cette espèce (en raison de ses effets sur ses hôtes) dans les portions méridionales de son aire de répartition le long de la frontière canado-états-unienne. La fragmentation de l’habitat, les nouveaux projets agricoles, en particulier le remplacement des cultures pollinisées par les insectes par des cultures pollinisées par le vent ou par des cultures en serre, et/ou l’intensification des activités agricoles, possiblement en combinaison avec une augmentation des taux d’infection par des pathogènes, ont probablement contribué au déclin de la qualité de l’habitat du psithyre bohémien.
Les altérations de l’habitat induites par les changements climatiques pourraient également avoir un impact négatif sur cette espèce en affectant ses hôtes, mais cet impact demeure à évaluer plus à fond.
Le psithyre bohémien est un parasite social dont le cycle vital est étroitement associé à celui de ses hôtes. La durée d’une génération est d’une année. Au printemps, les femelles des espèces du sous-genre Psithyrus (psithyres) envahissent les nids des espèces de Bombus sociaux (bourdons vrais), y délogent la reine fondatrice résidente (en la tuant ou en la blessant) et, au moyen de divers stimuli chimiques, confient aux filles (ouvrières) de la reine hôte le soin d’élever leur progéniture (Michener, 2000) en utilisant des stimuli chimiques (Zimma et al., 2003). Les œufs éclosent environ quatre jours après la ponte, et les jeunes larves commencent aussitôt à se nourrir à même les réserves de pollen et de nectar. La vie larvaire comporte quatre stades et dure presque deux semaines. Leur développement achevé, les larves se tissent un cocon et s’y nymphosent. Les adultes émergent deux semaines plus tard. Le développement de l’œuf à l’adulte dure environ cinq semaines, mais sa durée exacte varie selon la température et la quantité de nourriture disponible (Alford, 1975). Après l’accouplement, les mâles meurent, tandis que les femelles partent à recherche d’un site en vue d’y passer l’hiver.
Une colonie de bourdons à tache rousse excavée par Plath (1934) le 9 août contenait la reine fondatrice et cent ouvrières de même que neuf psithyres bohémiens (trois femelles et six mâles). La colonie, dont l’observation s’est poursuivie jusqu’à la fin de septembre, a produit 90 psithyres bohémiens, soit 29 mâles et 61 femelles. Bien que la reine fondatrice, blessée, ait eu l’abdomen distendu et ait pondu des œufs, la colonie n’a produit aucun descendant (mâle, ouvrière ou nouvelle reine). Selon Fisher (1983), la présence d’une reine vivante de bourdon à tache rousse hôte est nécessaire pour inhiber le développement ovarien des ouvrières, mais la femelle du psithyre bohémien dévore les œufs produits par la reine fondatrice pour réduire la compétition avec sa propre descendance. On ne connaît pas les détails de la cohabitation du psithyre bohémien avec les autres hôtes avérés ou potentiels au Canada, à savoir le bourdon de l’Ouest, le bourdon terricole et le Bombus cryptarum.
On sait très peu de choses sur le comportement d’accouplement du psithyre bohémien. Les adultes butinent les fleurs, après leur émergence quelque part en automne et, dans le cas des femelles, avant l’invasion du nid de l’hôte au printemps (Antonovics et Edwards, 2011). La phénologie du cycle vital varie selon la latitude et l’altitude, mais en général, les femelles émergent environ un mois après l’espèce hôte (Plath, 1934) et sont actives jusqu’à la fin de l’été. Les mâles émergent au début de l’été et sont actifs jusqu’à la fin de l’automne. La figure 6 montre la phénologie du développement de l’espèce dans le sud de l’Ontario, une des régions les mieux échantillonnées au Canada. La phénologie du développement du psithyre bohémien varie probablement légèrement selon la latitude, l’altitude et le moment de l’émergence de l’hôte, mais on manque de détails sur la phénologie de son cycle dans les autres portions de son aire de répartition.
![Figure 6. Phénologie du développement du psithyre bohémien dans le sud de l’Ontario (d’après les spécimens récoltés de 1883 à 2008). La mention la plus hâtive a été enregistrée le 21 avril (n = 275 [à noter que des mentions historiques additionnelles ont été ajoutées aux mentions de l’Ontario depuis la production de ce graphique, voir le tableau 2]) (reproduction autorisée de Colla, 2012). La description de cette image suit Image : © Environnement Canada](/content/dam/eccc/migration/sara/2022/a6df8d16-d937-443d-b9ff-ca03aa594c57/gypsy_bee_fig_6_fra.jpg)
| Espèce | Nombre total de mentions en Amérique du Nord | Avant 1931 | 1931-1960 | 1961-1990 | 1991-2009 | Pente (le signe indique la direction du changement) | Χ2 | Valeur de P |
|---|---|---|---|---|---|---|---|---|
| Bourdon à tache rousse B. affinis | 1 563 | 355 | 303 | 812 | 93 | -0,2779 | 0,5281 | 0,4674 |
| Psithyre bohémien B. bohemicus* | 941 | 311 | 280 | 267 | 83 | -0,5166 | 13,7488 | 0,0002 |
| B. citrinus* | 1 202 | 222 | 217 | 178 | 585 | 0,1750 | 0,4106 | 0,5217 |
| B. fernaldae* | 474 | 77 | 277 | 97 | 23 | -0,5064 | 1,0955 | 0,2952 |
| Bourdon fébrile B. impatiens | 9 111 | 1 141 | 851 | 2 709 | 4 410 | 0,3984 | 6,7176 | 0,0095 |
| B. insularis* | 1 025 | 159 | 361 | 470 | 35 | -0,3099 | 0,5251 | 0,4687 |
| Bourdon terricole B. terricola | 3 724 | 963 | 456 | 1 632 | 673 | -0,1723 | 0,4516 | 0,5016 |
| B. variabilis* | 94 | 76 | 11 | 7 | 0 | -1,7406 | 39,2118 | 0,0000 |
| Total (toutes les espèces) |
69 600 | 12 375 | 16 093 | 21 386 | 19 746 | -0,0682 | 1,2002 | 0,2733 |
| Province | Mention la plus ancienne | Mention la plus récente | Nombre de mentions Footnotea.1 | Sites de collecte |
|---|---|---|---|---|
| Alberta | 1953 | 1983 | 15 | McMurray, Calais, Beaverlodge, Delburne, Fairview, Lethbridge, Jasper |
| Colombie-Britannique | 1915 | 1988 | 11 | Revelstoke, Golden, Fort Nelson, lac Peters, barrage Kenney, 40 km au sud de Quesnel |
| Manitoba | 1924 | 1986 | 84 | Teulon, Aweme, lac Cormorant, Winnipeg, Carberry, plage Victoria, The Pas, Wanless, Erickson, Bowsman et spécimens mentionnés in Turnock et al. 1986. |
| Nouveau-Brunswick | 1914 | 1961 | 8 | Painsec, Fredericton, St. Andrews, Coldbrook |
| Terre-Neuve-et-Labrador | 1925 | 1979 | 5 | Grand Falls, Goose Bay, Codroy Valley |
| Nouvelle-Écosse | 1910 | 2002 | 45 | Barrington Passage, Digby, Antigonish, Jimtown, Ottawa, Thession, Halifax, South Maitland, lac Shubernacadie, Truro, baie Merigomish, rivière Pleasant, McNabs Island, Meat Cove, Pleasant Bay, Debert, Belaps Cove, West Dover, Greenfield, mont Uniacke, Armdale, Whycocomagh, West Black Rock, Middleton, Cheticamp (île du Cap-Breton) |
| Territoires du Nord-Ouest | 1948 | 1972 | 38 | Reindeer Depot, Norman Wells, Fort Smith, Fort Simpson, Hay River, Aklavik, Fort McPherson, ruisseau No Name |
| Yukon | 1916 | 1962 | 4 | Dawson, et sites non localisés. |
| Saskatchewan | 1938 | 1972 | 34 | Saskatoon, Waskesiu Lake, Love, White Fox, Hudson Bay, Torch River, Estevan, Candle Lake, Greenwater Lake, Emma Lake, Meadow Lake, Val Marie, Melfort, Indian Head |
| Ontario | 1883 | 2008 | 352 | Nombreux sites dans le sud de l’Ontario, dont Toronto, Guelph, London, baie Mica, Merivale, Ottawa, Parc provincial Pinery, Port Franks, parc provincial Presqu’île, Speedside, Sudbury. |
| Québec | 1913 | 2008 | 121 | Nombreux sites dans le sud du Québec, dont Lakeside, Saint-Hilaire, Shawbridge, Montréal, lac Jean-Venne, Luskville Falls, Gaspé, Hull, Lanoraie. |
| Île du Prince-Édouard | 1970 | 1983 | 5 | Riverdale, Vernon River, Charlottetown, Cornwall |
| Total | 722 |
Les psithyres femelles sont bien adaptés à la vie parasitaire et, en comparaison des femelles hôtes, possèdent un exosquelette plus épais et plus résistant, des mandibules plus fortes, un plus grand nombre d’ovarioles et une glande à venin plus longue (Fisher et Sampson, 1992). Leurs pattes postérieures sont dépourvues de corbicule (elles ne récoltent donc pas de pollen), et la pilosité de leur abdomen est généralement moins dense.
Dans une étude, les femelles ont émergé environ un mois après leur hôte, le bourdon à tache rousse (Plath, 1934). Cette espèce hôte n’occupe qu’une faible portion de l’aire de répartition du psithyre bohémien au Canada, mais la phénologie de l’émergence est probablement similaire des autres espèces hôtes occupant d’autres portions de l’aire de répartition du parasite.
De façon générale, on dispose de très peu d’information sur les taux de dispersion naturelle des bourdons. La capacité et la rapidité de dispersion du psithyre bohémien dépendent de la dynamique et de la répartition de ses hôtes. La dispersion du psithyre bohémien est assurée par les individus reproducteurs, principalement les femelles à la recherche d’un site de nidification approprié (Goulson, 2003). La dispersion joue vraisemblablement un impact important dans la survie des bourdons si l’on considère la répartition agrégée de l’habitat du psithyre bohémien (voir par exemple Hatfield et LeBuhn, 2007) et les problèmes grandissants associés aux faibles tailles effectives des populations chez les insectes haplodiploïdes (Zayed et Packer, 2005) (voir Facteurs limitatifs).
Certaines observations semblent indiquer que les bourdons peuvent se disperser sur de grandes distances. On estime que les mâles du bourdon terrestre (B. terrestris), hôte du psithyre bohémien dans l’Ancien Monde qui a été largement étudié, se dispersent sur des distances de 2,2 à 9,9 km à partir de leur colonie d’origine (Kraus et al., 2008). Le bourdon terrestre a été introduit en Tasmanie au début des années 1990 et s’y est depuis dispersé à raison d’environ 10 km par année (Stout et Goulson, 2000).
Le psithyre bohémien est un parasite social obligatoire de diverses espèces de bourdons du sous-genre Bombus sensu stricto qui détecte ses hôtes à l’aide de stimuli chimiques (Fisher et al., 1993). Dans la portion est de l’aire de répartition du psithyre bohémien, le bourdon à tache rousse était plus communément parasité que le bourdon terricole (au moins en Nouvelle-Angleterre, où les deux espèces cohabitent) (Plath, 1934). Dans l’Ouest, les hôtes du psithyre bohémien sont inconnus, mais le B. cryptarum, le bourdon terricole et le bourdon de l’Ouest font probablement partie de la gamme d’hôtes du parasite. Dans l’Ancien Monde, le psithyre bohémien parasite des espèces du même sous-genre (p. ex. B. lucorum et B. terrestris), et possiblement le B. cryptarum, une espèce holarctique.
Le déclin de l’abondance relative du psithyre bohémien est attesté par quatre analyses différentes. L’abondance relative correspond au rapport du nombre d’individus d’une espèce (le psithyre bohémien dans le cas présent) au nombre total d’individus (p. ex. Bombus, toutes espèces confondues) capturés. L’abondance relative d’une espèce est souvent utilisée comme une approximation de son abondance lorsque les données ne prêtent pas à d’autres analyses. L’abondance relative peut également être utilisée comme un indice de l’effort de recherche ciblant une espèce, et l’on suppose que si l’espèce est présente dans une région donnée durant un épisode de collecte, elle devrait normalement être capturée. Il convient de noter que la valeur d’abondance relative d’une espèce ne reflète pas nécessairement son abondance réelle dans une région donnée. Anciennement, l’abondance relative estimée du psithyre bohémien par rapport à toutes les espèces de bourdons capturées s’élevait à 1 à 2 % (Colla et al., 2012). Malgré l’augmentation du nombre de relevés de bourdons effectués dans certaines régions au cours de la dernière décennie, très peu de psithyres bohémiens ont été observés. Pour faciliter les renvois aux prochaines sections, ces études sont numérotées.
- La première étude utilise une base de données sur les bourdons capturés (spécimens de musée) ou observés au Canada entre 1882 à 2011 (44 706 entrées). Cette base de données ne contient aucune donnée pour les années 2012 et 2013 (Sheffield et al., en prép.). Les données sur l’abondance relative du psithyre bohémien, du bourdon de l’Ouest (espèce hôte dans l’Ouest) et du bourdon terricole (une des espèces hôtes dans l’Est) ont été analysées par tranches de dix ans et pour chaque province ou territoire où chacune de ces espèces a été observée (tableau 3; figure 8 [Yukon, Territoires du Nord-Ouest, Colombie-Britannique, Alberta et Saskatchewan], figure 9 [Manitoba, Ontario, Québec, Nouveau-Brunswick et Nouvelle-Écosse] et figure 10 [Île du Prince-Édouard et Terre-Neuve-et-Labrador] et figure 11 [toutes espèces confondues].
- Les valeurs historiques d’abondance relative du psithyre bohémien en Amérique du Nord ont été comparées par périodes de 30 ans, soit 1864-1930, 1931-1960, 1961 1990 et 1991-2009 (tableau 1).
- Les résultats indirects d’une étude menée au Manitoba (voir Turnock et al., 2007) permettent de suivre les fluctuations des populations du psithyre bohémien au fil des ans. Durant cette étude, des pièges ciblant la légionnaire bertha (Mamestra configurata Wlk.) ont été déployés dans un champ de canola (Brassica rapa L.). Tous les ans, de 1986 à 1993, quatorze sites répartis dans quatre régions du sud du Manitoba (vallée de la rivière Swan, hautes terres de l’ouest, basses terres du Manitoba et vallée de la rivière Rouge) ont fait l’objet d’un échantillonnage toutes les deux semaines du milieu de juin au début d’août (Turnock et al., 2007).
- Les auteurs d’une deuxième étude réalisée à Guelph et dans les régions avoisinantes dans le sud de l’Ontario ont répété les relevés déjà effectués dans la région entre 1971 et 1973 (Macfarlane, 1974) et entre 2004 et 2006 (Colla et Packer, 2008; COSEPAC, 2010). Durant les relevés, qui se sont poursuivis sur une base régulière d’avril à octobre, ils ont capturé de façon opportuniste à l’aide d’un filet entomologique tous les bourdons détectés.
- Le statut de conservation (attribué selon la méthode proposée par IUCN [2001] d’après les mentions enregistrées uniquement au cours des 20 dernières années) de 21 espèces de bourdons indigènes à l’échelle de leur aire de répartition en Amérique du Nord a été évalué sur la base de plus de 69 000 mentions géoréférencées remontant jusqu’à 1864 (Colla et al., 2012). Des carrés à côté de 50 km anciennement occupés ont été rééchantillonnés dans le cadre de relevés étendus à l’ensemble de ces espèces.
| Espèce | 1882-1891 | 1892-1901 | 1902-1911 | 1912-1921 | 1922-1931 | 1932-1941 | 1942-1951 | 1952-1961 | 1962-1971 | 1972-1981 | 1982-1991 | 1992-2001 | 2002-2011 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Yn | PB | - | - | - | 0,048 | - | - | 0,013 | - | 0,003 | - | - | - | - |
| Yn | BO | - | - | 0,50 | 0,38 | 0,67 | - | 0,18 | 0,12 | 0,69 | 0,36 | 0,35 | 0,50 | 0,63 |
| Yn | BT | - | - | - | - | - | - | - | - | - | - | - | - | - |
| T.N.O. | PB | - | - | - | - | - | - | 0,06 | 0,25 | 0,005 | 0,03; 1 spécimen |
- | - | - |
| T.N.O. | BO | - | - | - | - | - | - | - | - | - | - | - | - | 0,09 |
| T.N.O. | BT | - | - | - | - | 0,900 | - | 0,004 | 0,250 | 0,000 | 0,182 | - | 0,167 | 0,221 |
| Nt | PB | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Nt | BO | - | - | - | - | - | - | - | - | - | - | - | - | - |
| Nt | BT | - | - | - | - | - | - | - | - | - | - | - | - | - |
| C.-B. | PB | - | - | - | 0,003 | - | - | 0,006 | - | 0,01 | - | 0,0044; 1 spécimen |
- | - |
| C.-B. | BO | 0,40 | 0,17 | 0,30 | 0,22 | 0,24 | 0,31 | 0,30 | 0,36 | 0,50 | 0,44 | 0,45 | 0,43 | 0,03 |
| C.-B. | BT | - | - | 0,006 | - | 0,003 | - | 0,029 | 0,008 | 0,015 | 0,138 | 0,020 | 0,086 | 0,002 |
| Alb. | PB | - | - | 0,017 | 0,012 | - | - | 0,007 | 0,024 | 0,02 | 0,008; 1 spécimen |
0,034; 2 spécimens |
- | - |
| Alb. | BO | 0,18 | 0,09 | 0,09 | 0,14 | 0,20 | 0,15 | 0,30 | 0,18 | 0,16 | 0,13 | 0,02 | 0,83 | 0,07 |
| Alb. | BT | 0,077 | - | 0,017 | 0,012 | 0,247 | 0,051 | 0,000 | 0,043 | 0,060 | 0,008 | - | - | 0,135 |
| Sask. | PB | - | - | - | - | - | 0,057 | - | - | 0,03 | 0,56; 5 spécimens |
- | - | - |
| Sask. | BO | - | - | - | - | - | 0,06 | 0,02 | - | 0,01 | - | - | 0,09 | 0,03 |
| Sask. | BT | 0,500 | - | - | 0,065 | - | 0,071 | 0,107 | 0,500 | 0,284 | - | - | 0,364 | - |
| Man. | PB | - | - | - | 0,018 | 0,045 | - | - | 0,09 | - | 0,32; 6 spécimens |
0,035; 5 spécimens |
0,14; 1 spécimen |
- |
| Man. | BO | - | - | - | - | - | 0,46 | - | - | - | - | 0,01 | - | - |
| Man. | BT | - | - | 0,200 | 0,464 | 0,727 | 0,224 | 0,795 | 0,351 | 0,256 | 0,316 | 0,716 | 0,429 | 0,019 |
| Ont. | PB | 0,1; 3 spécimens |
0,075; 4 spécimens |
0,036 | 0,04 | 0,13 | 0,09 | 0,06 | 0,09 | 0,02 | 0,02; 46 spécimens |
0,012; 23 spécimens |
0,045; 65 spécimens |
0,00027; 1 spécimen |
| Ont. | BO | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o |
| Ont. | BT | 0,100 | 0,170 | 0,325 | 0,028 | 0,292 | 0,148 | 0,113 | 0,078 | 0,393 | 0,416 | 0,542 | 0,310 | 0,009 |
| Qc | PB | - | - | - | 0,29 | 0,09 | 0,08 | 0,04 | - | 0,12 | 0,34; 12 spécimens |
0,47; 45 spécimens |
0,28; 29 spécimens |
0,0066; 10 spécimens |
| Qc | BO | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o |
| Qc | BT | - | - | 0,077 | 0,018 | 0,233 | 0,032 | 0,115 | 0,725 | 0,207 | 0,171 | 0,292 | 0,288 | 0,021 |
| N.-B. | PB | - | - | - | 0,038 | - | - | - | 0,33 | - | 0,02; 7 spécimens |
- | - | - |
| N.-B. | BO | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o |
| N.-B. | BT | - | - | - | 0,038 | - | 0,400 | - | 0,667 | 0,391 | 0,356 | 0,818 | 0,399 | 0,200 |
| N.-É. | PB | - | - | - | 0,052 | 0,04 | - | - | 0,15 | 0,29 | 0,006; 1 spécimen |
0,035; 4 spécimens |
0,07; 16 spécimens |
0,02; 2 spécimens |
| N.-É. | BO | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o |
| N.-É. | BT | - | - | 0,169 | 0,247 | 0,654 | 0,184 | - | 0,135 | 0,419 | 0,479 | 0,281 | 0,158 | 0,173 |
| Î.-P.-É. | PB | - | - | - | - | - | - | - | - | 0,15 | 0,02; 2 spécimens |
2 0,04; spécimens |
- | - |
| Î.-P.-É. | BO | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o |
| Î.-P.-É. | BT | - | - | - | - | - | 0,600 | - | 1,000 | 0,208 | 0,384 | 0,064 | 1,000 | 0,037 |
| T.-N.-L. | PB | - | - | - | - | 0,042 | - | 0,07 | - | - | 0,09; 3 spécimens |
- | - | - |
| T.-N.-L. | BO | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o | s/o |
| T.-N.-L. | BT | - | - | 0,750 | 0,222 | 0,083 | 0,333 | 0,250 | - | - | 0,594 | 0,000 | 0,416 | 0,050 |
| Global | PB | 0,034 | 0,026 | 0,01 | 0,044 | 0,035 | 0,035 | 0,029 | 0,06 | 0,02 | 0,024 | 0,03 | 0,05 | 0,00089 |
| Global | BO | 0,15 | 0,08 | 0,13 | 0,09 | 0,14 | 0,12 | 0,10 | 0,09 | 0,13 | 0,05 | 0,05 | 0,02 | 0,02 |
| Global | BT | 0,080 | 0,058 | 0,113 | 0,041 | 0,201 | 0,097 | 0,105 | 0,143 | 0,249 | 0,355 | 0,448 | 0,297 | 0,033 |
| Impact des menaces | Impact des menaces (descriptions) | Comptes des menaces de nniveau 1 selon l’intensité de leur impact Maximum de la plage d’intensité |
Minimum de la plage d’intensité |
|---|---|---|---|
| A | Très élevé | 0 | 0 |
| B | Élevé | 0 | 0 |
| C | Moyen | 0 | 0 |
| D | Faible | 2 | 2 |
| Impact global des menaces calculée : | Faible | Faible |
| # | Menace | Impact Note de bas dedéfinitiona.2 (calculé) Critère |
Impact (calculé) |
Portée Noteb.1de bas deb.1définitionb.1 (10 prochaines années) |
Gravité Notec.1de bas dec.1définitionc.1 (10 années ou 3 générations) |
Immédiateté Note de bas de définitiond.1 | Commentaires |
|---|---|---|---|---|---|---|---|
| 1 | Développement résidentiel et commercial (en anglais seulement) | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (continue) | Portée : négligeable parce que de vastes étendues d’habitat naturel ne sont pas menacées par le développement. Gravité : légère, parce que les impacts cumulatifs des projets de développement résidentiel et industriel autour des centres urbains de l’ouest du Canada, en particulier dans les régions situées à environ 200 km de la frontière canado-états-unienne, se traduisent souvent par la perte totale d’habitat. Immédiateté : élevée, parce que la pratique se poursuit. | |
| 1.1 | Habitations et zones urbaines | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (constante) | La perte d’habitat due à l’intensification de l’agriculture et à l’urbanisation croissante est une autre menace présumée pour les espèces hôtes. Tant le psithyre bohémien que ses hôtes ont besoin d’importantes quantités de pollen durant une longue période, car les individus reproducteurs qui assureront la pérennité de l’espèce n’apparaissent que vers la fin du cycle de la colonie. | |
| 1.2 | Zones commerciales et industrielles | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (constante) | La perte d’habitat due à l’intensification de l’agriculture et à l’urbanisation croissante est une autre menace présumée pour les espèces hôtes. | |
| 1.3 | Tourisme et espaces récréatifs | S/O; certains projets de développement récréatif peuvent entraîner une perte d’habitat, mais de façon globale, d’autres impacts tangentiels peuvent avoir un impact sur l’habitat des bourdons (p. ex. épandages de pesticides sur les terrains de golf, dérivation de cours d’eau, etc.) et peuvent être regroupés sous d’autres menaces. | |||||
| 2 | Agriculture et aquaculture (en anglais seulement) | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (constante) | Portée : négligeable parce que de vastes étendues d’habitat naturel ne sont pas menacées par les pratiques agricoles; gravité : légère, parce qu’il existe des régions agricoles où les bourdons sont abondants et largement répartis; Immédiateté : élevée, parce que la pratique se poursuit. | |
| 2.1 | Cultures annuelles et pluriannuelles de produits autres que le bois | Négligeable | Négligeable (< 1 %) | Légère (1-10 %) | Élevée (continue) | La perte d’habitat due à l’intensification de l’agriculture est une autre menace présumée pour les espèces hôtes. Tant le psithyre bohémien que ses hôtes ont besoin d’importantes quantités de pollen durant une longue période, car les individus reproducteurs qui assureront la pérennité de l’espèce n’apparaissent que vers la fin du cycle de la colonie. La dépendance accrue des humains à l’agriculture intensive au cours des dernières décennies s’est traduite mondialement par une réduction de la qualité de l’habitat d’alimentation des bourdons (voir par exemple Williams [1989]; Kosior et al. [2007]). De petites portions de l’aire de répartition canadienne du psithyre bohémien contiennent certaines des régions les plus urbanisées et les plus intensivement cultivées au pays (et potentiellement les plus propices aux bourdons) (p. ex. sud de l’Ontario, de la Saskatchewan et du Manitoba). L’habitat propice au psithyre bohémien et à ses hôtes est probablement peu abondant et difficile à trouver dans ces régions. | |
| 4 | Corridors de transport et de service (en anglais seulement) | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (constante) | Portée : négligeable parce que de vastes étendues d’habitat naturel ne sont pas menacées par des projets de construction de routes ou d’aménagement de corridors de service. Gravité : négligeable parce que dans de nombreux cas, les corridors de transport peuvent contribuer à créer des milieux ouverts propices aux bourdons (à condition que ces corridors ne soient pas pavés). Immédiateté : élevée, parce que la pratique se poursuit. | |
| 4.1 | Routes et voies ferrées | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (constante) | S/O; la quantité d’habitat propice peut temporairement augmenter à proximité immédiate des routes et voies ferrées. | |
| 4.2 | Lignes de services publics | Négligeable | Négligeable (< 1 %) | Inconnue | Élevée (constante) | S/O; la quantité d’habitat propice peut temporairement augmenter à proximité immédiate des routes et voies ferrées. | |
| 5 | Utilisation des ressources biologiques (en anglais seulement) | Pas une menace | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (constante) | S.O. | |
| 5.3 | Exploitation forestière et récolte du bois | Pas une menace | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (constante) | Menace considérée négligeable. L’exploitation forestière peut continuer à accroître temporairement la quantité d’habitat propice si les milieux exploités sont connectés entre eux. | |
| 6 | Intrusions et perturbations humaines (en anglais seulement) | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (constante) | Portée : négligeable parce que de vastes étendues d’habitat naturel ne sont pas menacées par des activités récréatives. Gravité : négligeable parce que les activités récréatives peuvent entraîner le piétinement ou une réduction des sites de nidification (les sites de psithyre ne constitueraient toutefois qu’un faible pourcentage des sites touchés). Immédiateté : élevée, parce que la pratique se poursuit. | |
| 6.1 | Activités récréatives | Négligeable | Négligeable (< 1 %) | Négligeable (< 1 %) | Élevée (constante) | S/O; certaines activités récréatives peuvent entraîner la disparition locale de nids; de façon globale, cette menace est considérée comme mineure. | |
| 8 | Espèces et gènes envahissants ou problématiques (en anglais seulement) | Moyen | Petite (1-10 %) | Extrême (71-100 %) | Élevée (constante) | Portée : petite, car la propagation d’espèces envahissantes se produit principalement dans les régions urbaines et agricoles du Canada. Aucune abeille non indigène ne semble présente dans les milieux naturels abritant le psithyre bohémien ou ses hôtes. La dissémination de pathogènes et ses impacts ont été très peu étudiés dans une bonne partie de l’aire de répartition de l’espèce. Gravité : extrême parce que ces pratiques ont un impact sur les bourdons. Immédiateté : élevée, parce que ces pratiques se poursuivent. | |
| 8.1 | Espèces exotiques/non indigènes envahissantes | Moyen | Petite (1-10 %) | Extrême (71-100 %) | Élevée (constante) | L’introduction et l’utilisation du bourdon fébrile (B. impatiens) pour la pollinisation des cultures dans l’Ouest canadien pourraient exacerber encore davantage les déclins des populations hôtes du bourdon de l’Ouest et du bourdon terricole. Le bourdon fébrile pourrait livrer à certaines espèces de bourdons indigènes une compétition agressive pour l’habitat de nidification et les ressources nutritives et contribuer à la propagation de pathogènes et de maladies. L’ampleur de la menace que représente la dissémination de pathogènes pour les bourdons est incertaine. L’utilisation pour la pollinisation des cultures sous serre d’espèces de bourdons commerciales infectées (p. ex. bourdon fébrile) au Canada a été incriminée dans la propagation de pathogènes aux populations de bourdons sauvages se nourrissant à proximité des exploitations serricoles (Colla et al., 2006; Otterstatter et Thomson, 2008). Des études en laboratoire ont montré que les parasites Crithidia bombi et Nosema bombi (probablement) ont des effets dévastateurs chez les reines fondatrices, les ouvrières butineuses et l’ensemble des colonies de Bombus spp. (Brown et al., 2000, 2003; Otterstatter et al., 2005). Un lien a été établi entre l’utilisation accrue de colonies de bourdons commerciales par les serriculteurs au cours des dernières décennies et le déclin de certaines espèces du sous-genre Bombus. |
|
| 9 | Pollution (en anglais seulement) | Moyen | Petite (1-10 %) | Grave (31-70 %) | Élevée (constante) | Portée : petite, parce qu’aucun pesticide n’est appliqué sur de vastes étendues d’habitat naturel. Gravité : grave à cause des impacts connus des pesticides. Immédiateté : élevée, parce que la pratique se poursuit. | |
| 9.3 | Effluents agricoles et forestiers | Moyen | Petite (1-10 %) | Grave (31-70 %) | Élevée (constante) | L’imidaclopride (un néonicotinoïde) représente une menace particulière pour les bourdons (en comparaison avec d’autres pesticides) parce qu’il est toxique même à des concentrations de l’ordre de quelques parties par milliard (ppb) (Environmental Protection Agency [EPA], 1994; Marletto et al., 2003). Les néonicotinoïdes sont des pesticides systémiques qui circulent dans toute la plante. | |
| 11 | Changement climatique et phénomènes météorologiques extrêmes (en anglais seulement) | Non calculé | Généralisée (71-10 %) | Inconnue | Élevée (constante) | Portée : généralisée parce que les changements climatiques touchent l’ensemble de l’aire de répartition de l’espèce. Gravité : inconnue, car les impacts n’ont pas été étudiés à grande échelle. Immédiateté : élevée, parce que la menace continue de s’exercer. | |
| 11.2 | Sécheresses | Généralisée (71-100 %) | Inconnue | Élevée (constante) | Les changements climatiques constituent une autre menace potentielle (Williams et Osborne, 2009). Il a été démontré que les bourdons ont des tolérances climatiques étroites et sont plus vulnérables aux menaces extrinsèques (Williams et al., 2009). On ne connaît pas les tolérances climatiques du psithyre bohémien, mais il semble que les changements climatiques aient des effets négatifs chez au moins une de ses espèces hôtes (bourdon à tache rousse) en entraînant une augmentation de la variabilité des précipitations dans le temps (Kerr et al., en cours de révision). |
Classification des menaces d’après l’IUCN-CMP (International Union for Conservation of Nature - Conservation Measures Partnership), Salafsky et al. (2008).
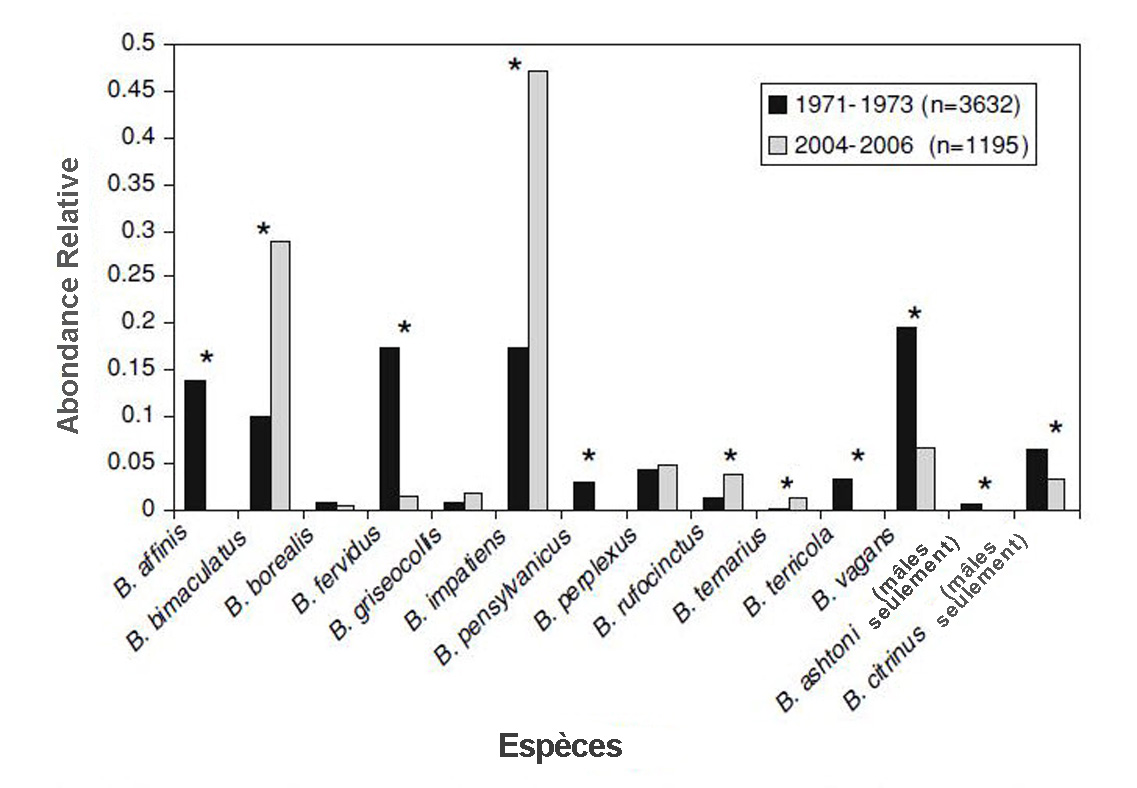
Image : © Environnement Canada
Description longue pour la figure 7
Histogramme comparant l’abondance relative de chacune des 14 espèces de bourdons capturées entre 1971 et 1973 et entre 2004 et 2006 à Guelph et à Belwood, en Ontario. Les valeurs de p inférieures à 0,0001 sont identifiées par un astérisque. Pour de plus amples renseignements, voir le point 4 de la section « Abondance » du rapport.
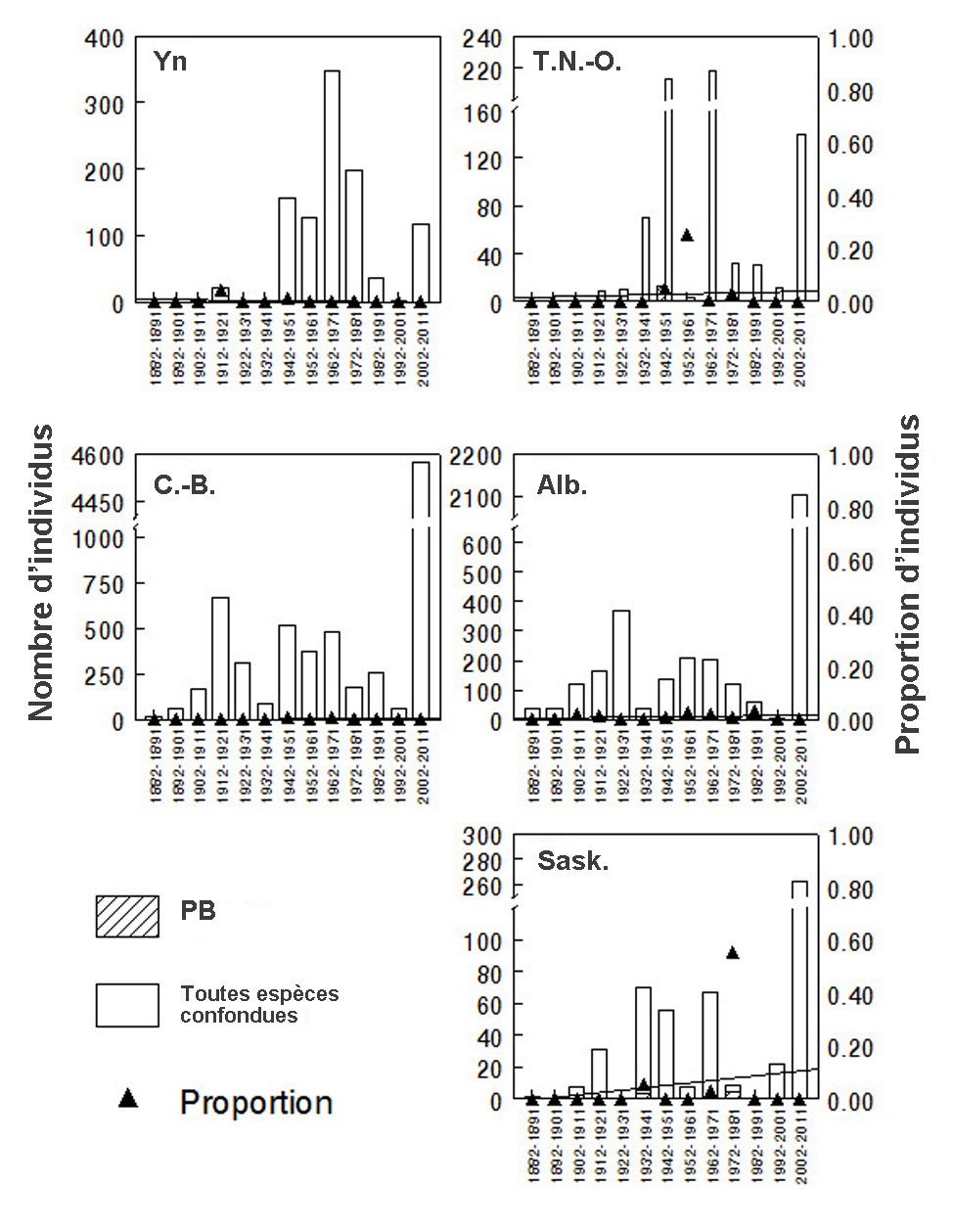
Image : © Environnement Canada
Description longue pour la figure 8
Diagrammes illustrant l’abondance relative du psithyre bohémien d’après les mentions de Bombus compilées dans cinq provinces et territoires de l’ouest du Canada (1882 à 2011). Les cinq diagrammes représentent le Yukon, les Territoires du Nord-Ouest, la Colombie-Britannique, l’Alberta et la Saskatchewan. L’axe des Y de gauche indique le nombre de spécimens de psithyres bohémiens, et l’axe des Y de droite, la proportion de spécimens par intervalle de 10 ans. L’évolution de l’abondance relative de l’espèce dans le temps a été examinée au moyen d’une analyse de régression linéaire; la ligne représente le meilleur ajustement des données. Pour de plus amples renseignements, voir la section « Abondance » du présent rapport.
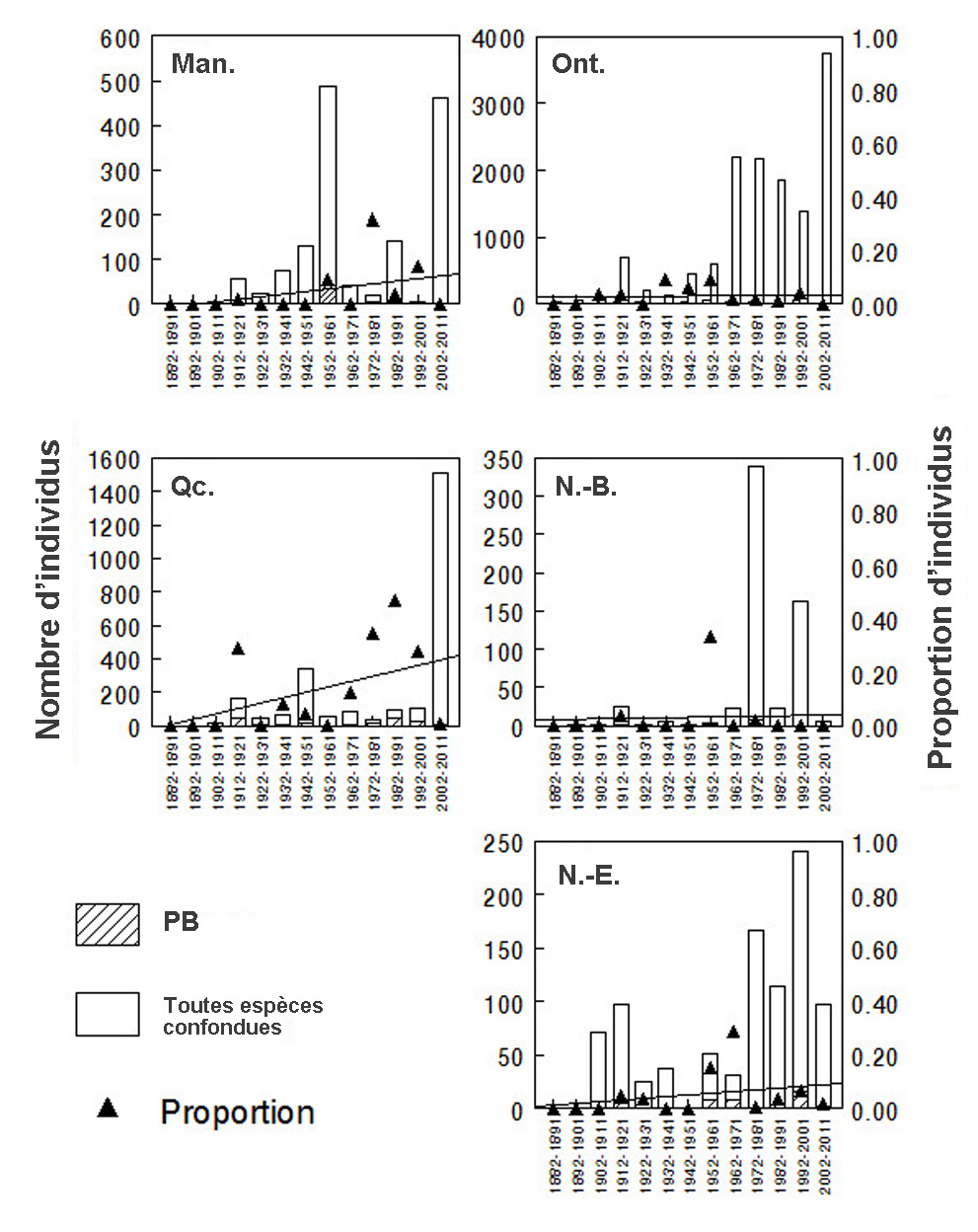
Image : © Environnement Canada
Description longue pour la figure 9
Diagrammes illustrant l’abondance relative du psithyre bohémien d’après les mentions de Bombus compilées dans cinq provinces du centre et de l’est du Canada (1882 à 2011). Les cinq diagrammes représentent le Manitoba, l’Ontario, le Québec, le Nouveau-Brunswick et la Nouvelle-Écosse. L’axe des Y de gauche indique le nombre de spécimens de psithyres bohémiens, et l’axe des Y de droite, la proportion de spécimens par intervalle de 10 ans. L’évolution de l’abondance relative de l’espèce dans le temps a été examinée au moyen d’une analyse de régression linéaire; la ligne représente le meilleur ajustement des données. Pour de plus amples renseignements, voir la section « Abondance » du présent rapport.
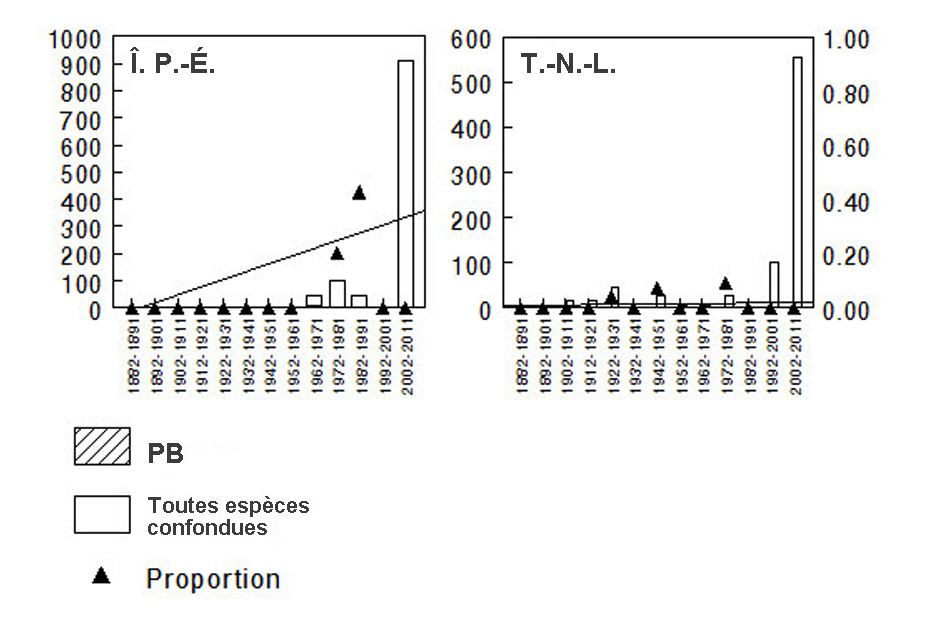
Image : © Environnement Canada
Description longue pour la figure 10
Deux diagrammes illustrant l’abondance relative du psithyre bohémien d’après les mentions de Bombus enregistrées à l’Île du Prince-Édouard et à Terre-Neuve-et-Labrador. L’axe des Y de gauche indique le nombre de spécimens de psithyres bohémiens, et l’axe des Y de droite, la proportion de spécimens par intervalle de 10 ans. L’évolution de l’abondance relative de l’espèce dans le temps a été examinée au moyen d’une analyse de régression linéaire; la ligne représente le meilleur ajustement des données. Pour de plus amples renseignements, voir la section « Abondance » du présent rapport.
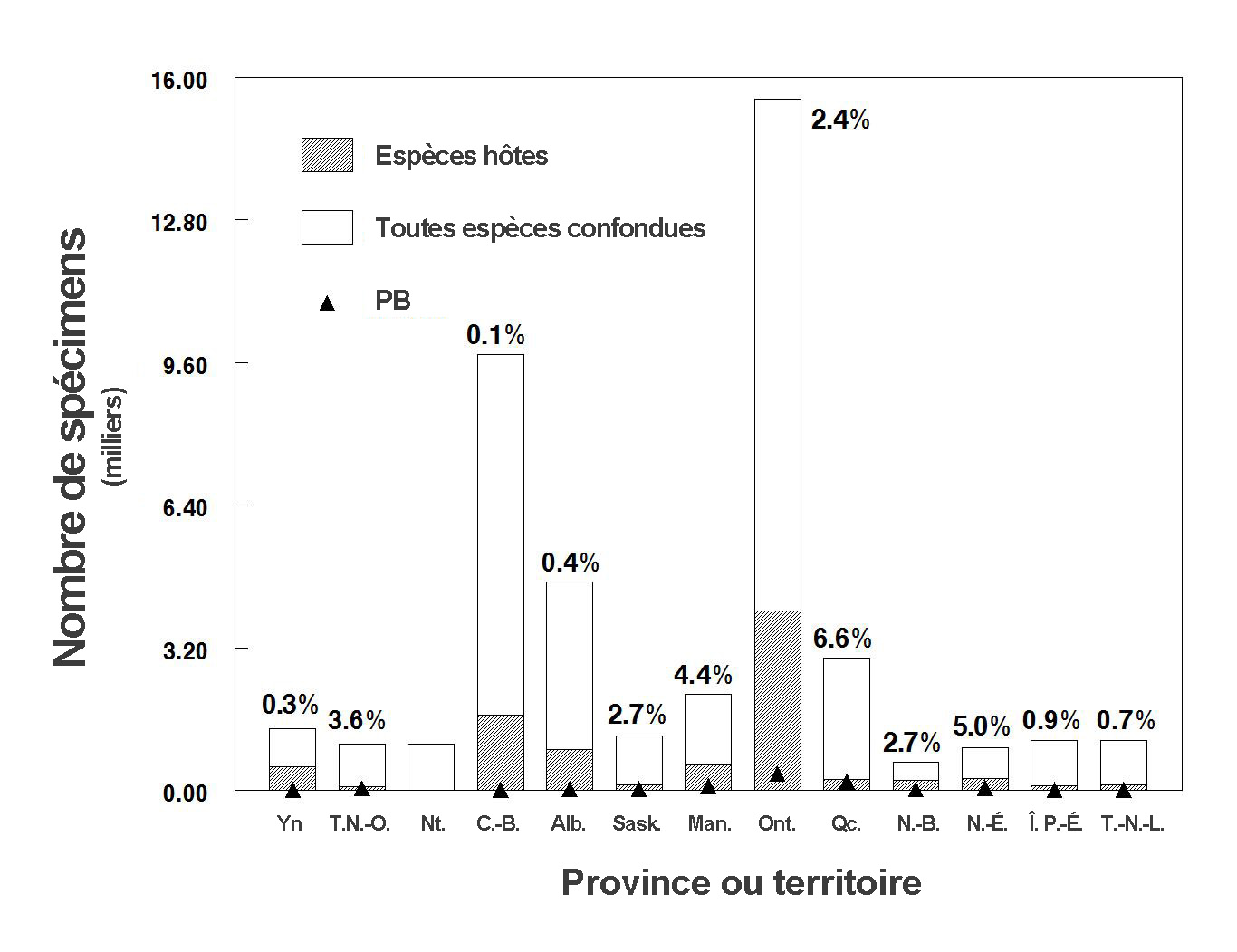
Image : © Environnement Canada
Description longue pour la figure 11
Histogramme indiquant le nombre total de bourdons capturés au Canada répertoriés dans la base de données (1882-2011), par province et territoire. Les symboles dans les barres indiquent le nombre de spécimens de psithyres bohémiens (PB). Les pourcentages au-dessus de chaque barre correspondent à l’abondance relative du psithyre bohémien.
- L’abondance relative du psithyre bohémien a décliné de plus de 90 % entre les périodes 1992–2001 (0,5) et 2002–2011 (0,00089) (tableau 3; figures 8-10).
L’abondance relative des espèces hôtes a également décliné au cours des dix dernières années. L’abondance relative du bourdon de l’Ouest a chuté d’environ 40 % (1992–2001) à environ 3 % au cours de la dernière période de dix ans considérée (2002 – 2011) en Colombie-Britannique, et de plus de 80 % (1992–2001) à moins de 10 % (2002–2011) en Alberta. Dans l’est du pays, le bourdon terricole n’a pas connu les mêmes déclins que l’hôte exploité par le psithyre bohémien dans l’Ouest. - L’abondance relative du psithyre bohémien en Amérique du Nord a décliné (Colla et al. 2010), passant de 2,5 % durant la période 1864-1930 à 7 % en 1931-1960, à 1,2 % en 1961-1990 et à 0,4 % en 1991-2009 (n = 69 600 Bombus) (tableau 1). Le déclin survenu au cours de ces périodes est statistiquement significatif (X2 = 13,7488, p = 0,0002) (Colla et al., 2012).
- Au cours de l’étude menée au Manitoba, 47 psithyres bohémiens ont été capturés entre 1986 et 1993 dans toutes les régions inventoriées à l’exception de la vallée de la rivière Rouge en 1986 (Turnock et al., 2007). En 1986, 398 bourdons ont été capturés, et l’abondance relative du psithyre bohémien s’établissait à seulement 1,1 % (Turnock et al., 2007). Aucun psithyre bohémien n’a été trouvé parmi les quelque 1 891 bourdons capturés au cours des années subséquentes (1987-1993) (Turnock et al., 2007).
- L’étude ontarienne (Guelph et Belwood) révèle qu’entre 1971 et 1973, l’abondance relative du B. bohemicus s’établissait à 1 % (n = 3 632 spécimens), et celle de ses deux espèces hôtes, le bourdon à tache rousse et le bourdon terricole, à 14 % et à 4 %, respectivement (figure 7; Colla et Packer, 2008). Aucun psithyre bohémien ni bourdon à tache rousse n’a été observé durant les relevés effectués dans ces deux régions entre 2004 et 2006 (n = 1 195), et seulement deux bourdons terricoles ont été capturés (Colla et Packer, 2008).
- La proportion de carrés historiques (1864-1990) à 50 km de côté rééchantillonnés et occupés par le psithyre bohémien au cours de la période la plus récente (1991 - 2010) était de 0,347 (Colla et al. 2012). En d’autres mots, le psithyre bohémien a été observé dans seulement 35 % des portions de son aire de répartition historiques (209 carrés de grille) rééchantillonnées au moins une fois entre 1991 et 2010. Ce psithyre a subi un déclin significatif à l’échelle de son aire de répartition, contrairement à d’autres espèces de psithyres (p. ex. B. citrinus – cette espèce a toutefois des hôtes différents) [tableau 1] (Colla et al., 2012).
- Le déclin de l’espèce est attesté par de nombreux autres travaux, dont une analyse récente des données de collecte de plus de 30 000 spécimens de musée d’abeilles répartis en 438 espèces (incluant des bourdons) présentes dans le nord-est de l’Amérique du Nord. Selon cette étude, le psithyre bohémien compte parmi les trois espèces ayant subi le déclin le plus abrupt au cours des dernières années dans la région considérée (Bartomeus et al., 2013). Les deux autres espèces sont également des bourdons, et l’une d’entre elles est le bourdon à tache rousse (Bartomeus et al., 2013).
On sait peu de choses sur les fluctuations naturelles et les tendances des populations de bourdons. Bien que de vastes régions du Canada aient été inventoriées (voir par exemple Colla et al. 2012; Cameron et al., 2011; Colla et Packer, 2008), peu de sites ont été échantillonnés de façon répétée durant toute une saison ou au cours de plusieurs années successives. Dans le cas des bourdons (voir par exemple Colla et Packer, 2008), certaines régions peuvent abriter trois ou quatre espèces communes et quelques espèces relativement rares. Les populations des espèces communes sont relativement stables dans le temps (p. ex. taille efficace des populations élevée), mais celles des populations rares fluctuent et sont exposées à un risque de disparition stochastique locale (p. ex. faible taille efficace des populations). Ces espèces plus rares peuvent être des éléments peu communs de la faune de bourdons locale ou présenter des besoins plus spécifiques en matière d’habitat. La situation est encore plus complexe dans le cas des psithyres, car ces derniers dépendent de la présence et de l’abondance de leurs hôtes et de la dynamique de leurs populations.
Compte tenu de sa faible abondance et du déclin possible de ses hôtes, il semble exclu qu’une immigration de source externe permette au psithyre bohémien de recoloniser son aire de répartition historique dans le sud du Canada. Au cours de la dernière décennie, seulement quelques mentions confirmées de l’espèce ont été enregistrées aux États-Unis, toutes en Alaska (Williams et al., 2014). Une immigration en provenance de l’Alaska pourrait se produire si les populations des espèces hôtes étaient suffisamment élevées au Yukon. Des relevés effectués récemment au Yukon y ont révélé la présence d’espèces hôtes potentielles (voir Activités de recherche) (Cannings, comm. pers., 2013).
La classification des menaces pesant sur le psithyre bohémien (Salafsky et al., 2008; Master et al., 2009) a été réalisée à l’aide du système de classification des menaces proposé par l’Union internationale pour la conservation de la nature (UICN) et le Partenariat pour les mesures de conservation (Conservation Measures Partnership, ou CMP) (2006) (IUCN–CMP). L’impact global calculé des menaces est faible (tableau 3). La portée de la plupart des menaces est difficile à quantifier, principalement parce que la majeure partie de l’aire de répartition de l’espèce n’a pas été inventoriée et qu’il ne semble pas y avoir une menace commune à l’échelle de l’aire de répartition de l’espèce. Quoi qu’il en soit, l’espèce n’a pas été récoltée depuis 2008 dans les portions de son aire de répartition où les populations de ses hôtes sont également en déclin (sud du Canada) ou sont encore présentes et non en déclin (Yukon, Territoires du Nord-Ouest).
La principale menace pesant sur le psithyre bohémien est le déclin des populations de ses espèces hôtes (principalement le bourdon à tache rousse, le bourdon de l’Ouest et le bourdon terricole) dans le sud du Canada. En cas de déclin important des populations des espèces hôtes, le psithyre bohémien pourrait disparaître localement.
Le déclin rapide des espèces du sous-genre Bombus sensu stricto semble s’être amorcé au milieu des années 1990 (National Research Council [NRC], 2007). Les facteurs responsables de ces déclins demeurent inconnus, mais d’après le moment où ces déclins sont survenus, diverses hypothèses ont été formulées concernant les menaces potentielles, et leur impact potentiel est examiné ci-dessous (NRC, 2007; Evans et al., 2008). Une espèce du sous-genre Bombus, le B. cryptarum, semble étendre son aire de répartition et devenir plus abondante (Owen et al., 2012). On ignore toutefois si cette espèce fait partie de la gamme d’hôtes du psithyre bohémien.
L’introduction et l’utilisation du très prolifique bourdon fébrile (B. impatiens) à titre d’agent pollinisateur au Canada pourraient exacerber encore davantage les déclins des populations hôtes du bourdon de l’Ouest et du bourdon terricole dans les portions méridionales de l’aire de répartition respective de ces deux espèces. Le bourdon fébrile pourrait livrer à certaines espèces de bourdons indigènes une compétition agressive pour l’habitat de nidification et les ressources nutritives et contribuer à la propagation de pathogènes et de maladies. On ignore dans quelle mesure des populations sauvages du bourdon fébrile sont parvenues à s’établir dans l’ouest du Canada, mais si l’on en juge par ce qui s’est produit dans d’autres régions du monde (Williams et Osborne, 2009), ces populations auront vraisemblablement un impact négatif sur celles des espèces indigènes.
La dissémination de pathogènes a causé des déclins importants chez de nombreuses espèces animales (voir par exemple Morton et al., 2004; Power et Mitchell, 2004), mais l’ampleur de cette menace pour les bourdons demeure à évaluer. Ce phénomène survient lorsqu’un agent pathogène est transmis d’une population hôte réservoir gravement infectée à une population hôte sympatrique non réservoir (Power et Mitchell, 2004). L’utilisation pour la pollinisation des cultures sous serre d’espèces de bourdons commerciales infectées (p. ex. bourdon fébrile) au Canada a été incriminée dans la propagation de pathogènes aux populations de bourdons sauvages se nourrissant à proximité des exploitations serricoles (Colla et al., 2006; Otterstatter et Thomson, 2008).
Des études en laboratoire ont montré que les parasites Crithidia bombi et Nosema bombi (probablement) ont des effets dévastateurs chez les reines fondatrices, les ouvrières butineuses et l’ensemble des colonies de Bombus spp. (Brown et al., 2000, 2003; Otterstatter et al., 2005). Ces parasites attaquent diverses espèces de bourdons (Macfarlane, 1974; Macfarlane et al., 1995; Colla et al., 2006), mais l’ampleur de leur impact chez les espèces de bourdons sauvages demeure inconnue. Quoi qu’il en soit, un lien a été établi entre l’utilisation accrue de colonies de bourdons commerciales par les serriculteurs au cours des dernières décennies et le déclin de certaines espèces du sous-genre Bombus, dont le bourdon à tache rousse, le bourdon terricole et le bourdon de l’Ouest dans le sud du Canada (Thorp et Shepherd, 2005; NRC, 2007; Evans et al., 2008; COSEPAC, 2010; Szabo et al., 2012). Cette pratique ne semble toutefois pas avoir eu d’impact sur les espèces des autres sous-genres. Ces espèces sont peut-être les principaux hôtes du psithyre bohémien dans ces régions (voir la figure 3), mais elles sont peut-être encore relativement communes ailleurs.
Il est établi depuis longtemps que les produits chimiques utilisés à des fins agricoles (pesticides) peuvent avoir des impacts néfastes pour les bourdons (voir par exemple Johansen et Mayer, 1990; NRC, 2007). À peu près au moment où les déclins des espèces du sous-genre Bombus sensu stricto ont été constatés en Amérique du Nord, l’utilisation d’un nouveau pesticide, l’imidaclopride (un néonicotinoïde) a été homologuée aux États-Unis et au Canada, en 1994 et en 1995, respectivement (Cox, 2001; Agence de réglementation de la lutte antiparasitaire [ARLA], 2001). Les néonicotinoïdes peuvent constituer une grave menace pour les bourdons parce qu’ils sont toxiques même à des concentrations de l’ordre de quelques parties par milliard (ppb) (Environmental Protection Agency [EPA], 1994; Marletto et al., 2003). Les néonicotinoïdes sont des pesticides systémiques qui circulent dans toute la plante et qui contaminent le pollen et le nectar; ils sont couramment utilisés sur les terrains de golf et les terres cultivées (Sur et Stork, 2003). L’imidaclopride est non létal pour les bourdons s’il est utilisé conformément au mode d’emploi (voir par exemple Tasei et al., 2001). En Amérique du Nord, ses effets sur les bourdons n’ont toutefois été évalués que chez une seule espèce, le bourdon fébrile, largement utilisé à des fins commerciales et jugé représentatif de toutes les espèces nord-américaines (voir par exemple Gels et al., 2002; Morandin et Winston, 2003). On ignore toutefois si le bourdon fébrile constitue effectivement un modèle représentatif juste de toutes ces espèces. En outre, les insectes coloniaux (p. ex. insectes produisant des individus reproducteurs à la fin du cycle de la colonie) peuvent être affectés par les effets sublétaux cumulatifs de l’imidaclopride et d’autres pesticides. Les effets létaux et sublétaux de ce groupe de pesticides sur d’autres espèces de bourdons sauvages demeurent à évaluer.
Une autre menace présumée pour les populations des espèces hôtes est la perte d’habitat occasionnée par l’intensification de l’agriculture et l’urbanisation croissante. Tant le psithyre bohémien que ses hôtes ont besoin d’importantes quantités de pollen durant une longue période, car les individus reproducteurs qui assureront la pérennité de l’espèce n’apparaissent que vers la fin du cycle de la colonie. L’essor de l’agriculture intensive au cours des dernières décennies a entraîné une réduction de la qualité et de la disponibilité de l’habitat d’alimentation des bourdons à l’échelle mondiale (voir par exemple Williams, 1989; Kosior et al., 2007). L’impact est probablement similaire au Canada, car une bonne partie du territoire anciennement occupé par le psithyre bohémien et ses hôtes a subi d’importantes transformations (Grant et Javorek, 2011). La portion de l’aire de répartition canadienne du psithyre bohémien adjacente à la frontière canado-états-unienne, considérée comme la plus propice pour les espèces sauvages, contient certaines des régions les plus urbanisées et les plus intensivement cultivées au pays (p. ex. sud de l’Ontario et régions du sud de la Saskatchewan et du Manitoba).
Les changements climatiques constituent mondialement une autre menace potentielle pour les bourdons (Williams et Osborne, 2009). Il a été démontré que les espèces de bourdons sténothermes (ne tolérant que des variations de température de faible amplitude) sont plus vulnérables aux menaces extrinsèques (Williams et al., 2009). On ne connaît pas les tolérances climatiques du psithyre bohémien, mais il semble que les changements climatiques aient des effets négatifs chez au moins une de ses espèces hôtes (bourdon à tache rousse) en entraînant une augmentation de la variabilité des précipitations dans le temps (Kerr et al., en cours de révision). Toutefois, les autres espèces hôtes connues (du sous-genre Bombus sensu stricto) sont plus largement réparties au Canada, mais on ne connaît pas plus leurs tolérances climatiques. En général, les psithyres femelles émergent environ un mois après leurs hôtes (Plath, 1934). Les impacts des changements climatiques sur la synchronisation de l’émergence du parasite et de ses hôtes demeurent incertains pour l’instant.
Les bourdons ont besoin d’une source constante et diversifiée de ressources florales pour assurer la croissance de leur colonie, et l’approvisionnement en pollen et en nectar doit être constant durant toute la saison de végétation. Sans ces ressources, la viabilité des reines et des ouvrières et la croissance de la colonie sont limitées. Seules les femelles fécondées hibernent, et si les ressources florales ne sont pas disponibles en quantité suffisante en début de saison, les colonies dépérissent et meurent et les reines nouvellement émergées se dispersent. À l’inverse, l’accès à des sources de nourriture abondantes durant toute la période de croissance de la colonie assure le maintien de la colonie.
Les bourdons des organismes haplodiploïdes chez qui le déterminisme complémentaire du sexe accroît considérablement le risque de disparition lorsque la taille efficace de la population diminue (Zayed et Packer, 2005). Cette situation est le fait d’une spirale d’extinction induite par les mâles diploïdes (Zayed et Packer, 2005). Chez les abeilles et la plupart des autres organismes haplodiploïdes, le sexe est déterminé par le génotype à locus unique : les hémizygotes (haploïdes) sont des mâles, les hétérozygotes sont des femelles et les homozygotes sont des mâles diploïdes. Les mâles diploïdes sont habituellement stériles ou inviables. Le nombre d’allèles codeurs du sexe chez une population détermine la proportion d’individus diploïdes qui sont des mâles et dépend lui-même principalement de la taille efficace de la population. En d’autres mots, lorsque la taille d’une population de bourdons s’amenuise, la fréquence des mâles diploïdes augmente. Comme les mâles diploïdes sont des tentatives de production de femelles, leur production accrue dans une population de plus petite taille a pour effet d’en accélérer le déclin et détermine du coup une forme spéciale de spirale d’extinction induite par les mâles diploïdes. Ce type spécial de fardeau génétique est le plus lourd connu (Hedrick et al., 2006). En pratique, une population d’abeilles qui décline au point de ne plus compter que quelques individus reproducteurs est inévitablement vouée à disparaître localement même si les conditions environnementales demeurent stables, à moins qu’elle augmente subitement en l’espace de quelques générations.
Aucune loi fédérale ou provinciale ne protège le psithyre bohémien ou ses sites de nidification ou son habitat ni n’atténue les menaces compromettant la viabilité de ses populations.
- Rangs de conservation selon Espèces sauvages 2010 : La situation générale des espèces au Canada (Conseil canadien pour la conservation des espèces en péril, 2011) :
- Espèce non classée au Yukon, en Colombie-Britannique, en Alberta, en Saskatchewan, dans les Territoires du Nord-Ouest et au Manitoba.
- Espèce possiblement en péril en Ontario, au Québec, en Nouvelle-Écosse, au Nouveau-Brunswick, à l’Île-du-Prince-Édouard, à Terre-Neuve-et-Labrador.
- Statut indéterminé à l’échelle canadienne.
- Rang de conservation mondial : GH (espèce possiblement disparue) (NatureServe, 2012).
- Liste rouge de l’Union internationale pour la conservation de la nature (UICN) : Espèce non classée.
- Rangs de conservation infranationaux (provinces et territoires) :
- Yukon (espèce non classée [SNR]);
- Alberta (statut indéterminé);
- Ontario (S4, apparemment non en péril);
- Centre de données sur la conservation du Canada atlantique (SNR);
- Cette espèce n’est pas classée au Québec et n’y figure pas sur la Liste des espèces susceptibles d’être désignées menacées ou vulnérables : http://www.mddep.gouv.qc.ca/faune/especes/menacees/liste.asp#insectes.
- Espèce non classée dans les autres territoires ou provinces.
La plupart des mentions du psithyre bohémien proviennent de terres provinciales ou gérées par les provinces. Environ 44 mentions du psithyre bohémien ont été enregistrées à ce jour dans des aires protégées au Canada. Aucune mention n’a été enregistrée dans des aires protégées en Colombie-Britannique, en Alberta, en Saskatchewan, au Nouveau-Brunswick, à l’île du Prince-Édouard, dans les Territoires du Nord-Ouest, au Yukon et au Nunavut. En Ontario, le psithyre bohémien a été observé au Parc provincial Algonquin, au parc provincial Presqu’île, au parc provincial Awenda, au parc provincial McGregor Point et au parc provincial Pinery. Au Québec, il a été observé au parc national Forillon, au parc national des Monts-Valin, à Queens Park et à Aylmer. En Nouvelle-Écosse, l’espèce a été observée au parc national des Hautes-Terres-du-Cap-Breton, et à Terre-Neuve, au parc national du Gros-Morne.
Les rédacteurs du présent rapport remercient tout particulièrement Leif Richardson d’avoir produit les cartes SIG et MaxEnt et les figures de gestion des données. Ils remercient également Syd Cannings, Jennifer Heron, Andrew Hebda, Elizabeth Elle, Michel Savard, Nathalie Desrosiers, Peter Hallett, Ray Poulin, Matthias Buck, Donna Giberson, Christophe Buidin-Yann Rochepault, Jeffery Ogden, Cory Sheffield, Laurence Packer et de nombreux autres observateurs et collectionneurs de leur avoir fourni de précieux renseignements sur des spécimens de bourdons et divers relevés.
- Anderson, Robert. 2011. Scientifique chercheur, Musée canadien de la nature, Ottawa (Ontario).
- Amirault, Diane. 2011. Biologiste, Environnement Canada, Sainte-Foy (Québec).
- Bélanger, Luc. 2011. Biologiste, Environnement Canada, Sainte-Foy (Québec).
- Blaney, Sean. 2011. Botaniste, Centre de données sur la conservation du Canada atlantique, Sackville (Nouveau-Brunswick).
- Boates, Sherman. 2011. Gestionnaire, Biodiversity Wildlife Division, Department of Natural Resources, gouvernement de la Nouvelle-Écosse, Kentville (Nouvelle-Écosse).
- Bromwell, Vivian. 2011. Senior Species at Risk Biologist, ministère des Richesses naturelles de l’Ontario, Peterborough (Ontario).
- Bucknell, Shelagh. 2011. Centre de recherche sur la faune du Pacifique, Environnement Canada, Delta (Colombie-Britannique).
- Carrière, Suzanne. 2011. Biologiste, Department of Environment and Natural Resources (ENR), gouvernement des Territoires du Nord-Ouest, Yellowknife (Territoires du Nord-Ouest).
- Charlwood, Vanessa. 2011. Environnement Canada, Yellowknife (Territoires du Nord-Ouest).
- Court, Gord. 2011. Provincial Wildlife Status Biologist, Department of Sustainable Resource Development, Edmonton (Alberta).
- Curley, Rosemary. 2011. Conservation Biologist, Department of Agriculture and Forestry, Charlottetown (Île-du-Prince-Édouard).
- Desmet, Ken. 2011. Species at Risk Biologist, Centre de données sur la conservation du Manitoba, Winnipeg (Manitoba).
- Duncan, Dave. 2011. Biologiste, Environnement Canada, Edmonton (Alberta).
- Elder, K.M.F. 2011. Species at Risk Biologist, Department of Natural Resources, Kentville (Nouvelle-Écosse).
- Fournier, François. 2011. Direction de la conservation de l'environnement, Environnement Canada, Sainte-Foy (Québec).
- Fraser, Dave. 2011. Unit Head Scientific Authority Assessment, Ministry of Environment de la Colombie-Britannique, Ecosystems Branch, Victoria (Colombie-Britannique).
- Gauthier, Isabelle. 2014. Biologiste, coordonnatrice provinciale, espèces fauniques menacées et vulnérables, ministère des Forêts, de la Faune et des Parcs, Québec (Québec).
- Giasson, Pascal. 2011. Gestionnaire, Programme des espèces en péril, Direction du poisson et de la faune, ministère des Ressources naturelles, Fredericton (Nouveau-Brunswick).
- Gravel, Mike. 2011. Provincial Species at Risk Biologist, Department of Natural Resources, Kentville (Nouvelle-Écosse).
- Howes, Briar. 2011. Direction de l’intégrité écologique, Agence Parcs Canada, Gatineau (Québec).
- Ingstrup, David. 2011. Biologiste, Environnement Canada, Edmonton (Alberta).
- Jung, Thomas. 2011. Senior Wildlife Biologist, Environment Yukon, Whitehorse (Yukon).
- Levesque, Annie. 2011. Biologiste, coordonnatrice provinciale, Espèces fauniques menacées et vulnérables, ministère des Forêts, de la Faune et des Parcs, Québec (Québec).
- MacDonald, Bruce. 2011. Biologiste, Environnement Canada, Yellowknife (Territoires du Nord-Ouest).
- McConnell, Angela. 2011. Biologiste, Environnement Canada, Toronto (Ontario).
- Millikin, Rhonda. 2011. Chef par intérim, Évaluation des populations, Centre de recherche sur la faune du Pacifique, Environnement Canada, Delta (Colombie-Britannique).
- Nantel, Patrick. 2011. Biologiste de la conservation, Agence Parcs Canada, Vancouver (Colombie-Britannique).
- Oldman, Michael. 2011. Botaniste, Centre d'information sur le patrimoine naturel de l'Ontario, Perterborough (Ontario).
- Paquet, Annie. 2011. Biologiste, coordonnatrice provinciale, Espèces fauniques menacées et vulnérables, ministère des Forêts, de la Faune et des Parcs, Québec (Québec).
- Pardy, Shelley. 2011. Gestionnaire principal, Department of Environment and Conservation, (T.-N.-L.).
- Pepper, Jeanette. 2011. Science Panning Section, Saskatoon (Saskatchewan).
- Pittoello, Gigi. 2011. Habitat Ecologist, Saskatchewan Ministry of Environment, Regina (Saskatchewan).
- Quinlan, Richard. 2011. Biologiste, Alberta Fish and Wildlife, Lethbridge (Alberta).
- Raillard, Martin. 2011. Gestionnaire, Environnement Canada, Sackville (Nouveau-Brunswick).
- Sabine, Mary. 2011. Biologiste, ministère des Ressources naturelles, Department of Environment and Conservation, Fredericton (Nouveau-Brunswick).
- Squires, Susan. 2011. Ecosystem Management Ecologist, Corner Brook (T.-N.-L.)
- Stipec, Katrina. 2011. Spécialiste de la gestion des données, Conservation Data Centre de la Colombie-Britannique, Victoria (Colombie-Britannique).
- Tuininga, Ken. 2011. Biologiste, Environnement Canada, Toronto (Ontario).
- Watkins, William. 2011. Direction de la protection des écosystèmes et des espèces sauvages, ministère de la Conservation du Manitoba, Winnipeg (Manitoba).
- Agence de réglementation de la lutte antiparasitaire (ARLA). 2001. Imidacloprid, Note réglementaire REG2001-11, Santé Canada, Agence de réglementation de la lutte antiparasitaire, Ottawa, (consulté le 22 janvier 2013).
- Alford, DV. 1975. Bumblebees. London: Davis-Poynter. Xii + 352 p.
- Antonovics, J., et M. Edwards. 2011. Spatio-temporal dynamics of Bumble Bee nest parasites (Bombus subgenus Psithyrus ssp.) and their hosts (Bombus spp.), Journal of Animal Ecology 80: 999-1011.
- Bartomeus, I., J.S. Ascher, J. Gibbs, B.N. Danforth, D.L. Wagner, S. Hedtke et R. Winfree. 2013. Historical changes in northeastern US bee pollinators related to shared ecological traits, Proceedings of the National Academy of Sciences, (en anglais seulement), consulté le 21 février 2014.
- Brousseau, P.-M. 2011. Impact de la densité de cerfs de Virginie sur les communautés d'insectes de l'île d'Anticosti, mémoire de maîtrise, Université Laval, Québec, 92 p.
- Brown, M.J.F., R. Loosli et P. Schmid-Hempel. 2000. Condition-dependent expression of virulence in a trypanosome infecting Bumble Bees, Oikos 91: 421–427.
- Brown, M.J.F., R. Schmid-Hempel et P. Schmid-Hempel. 2003. Strong context-dependent virulence in a host-parasite system: reconciling genetic evidence with theory, Journal of Animal Ecology 72: 994–1002.
- Buidin, C., comm. pers. 2011. Correspondance par courriel adressée à S. Colla. 2011. Association Le Balbuzard de la Minganie, Rivière-Saint-Jean (Québec).
- Cameron, S.A., H.M. Hines et P.H. Williams. 2007. A comprehensive phylogeny of the Bumble Bees (Bombus), Biological Journal of the Linnean Society 91, 161-188.
- Cameron, S.A., J.D. Lozier, J.P. Strange, J.B. Koch, N. Cordes, L.F. Solter et T. Griswold. 2011. Patterns of widespread decline in North American Bumble Bees, Proceedings of the National Academy of Science 108: 662-667.
- Cannings, S., comm. pers. 2011-2013. Correspondance par courriel adressée à S. Colla et J. Heron. Biologiste, Environnement Canada, Whitehorse (Yukon).
- Colla, S.R. 2012. The Ecology and Conservation of Eastern North American Bumblebees (Bombus spp.), thèse de doctorat, York University, Toronto (Ontario), 214 p.
- Colla, S.R., et S. Dumesh. 2010. Natural history notes for the Bumble Bees of southern Ontario, Journal of the Entomological Society of Ontario 141: 38-67.
- Colla, S.R., F. Gadallah, L. Richardson, D. Wagner et L. Gall. 2012. Assessing declines of North American Bumble Bees (Bombus spp.) using museum specimens, Biodiversity and Conservation 21: 3585-3595.
- Colla, S.R., M.C. Otterstatter, R.J. Gegear et J.D. Thomson. 2006. Plight of the Bumble Bee: Pathogen spillover from commercial to wild populations, Biological Conservation 129: 461-467.
- Colla, S.R., et L. Packer. 2008. Evidence for decline in eastern North American Bumble Bees (Hymenoptera: Apidae), with special focus on Bombus affinis Cresson, Biodiversity and Conservation 17:1379-1391.
- Colla, S.R, L. Richardson et P. Williams. 2011. Bumble Bees of the Eastern United States, USDA Forest Service Publication, (en anglais seulement) consulté le 24 septembre 2011.
- Conseil canadien de conservation des espèces en péril (CCCEP). 2011. Espèces sauvages 2010 : la situation générale des espèces au Canada, Groupe de travail national sur la situation générale, 323 p.
- Conservation Measures Partnership (CMP), 2010, (en anglais seulement). consulté le 27 février 2013.
- COSEPAC 2010. Évaluation et Rapport de situation du COSEPAC sur le bourdon à tache rousse (Bombus affinis) au Canada, (Format PDF), Comité sur la situation des espèces en péril au Canada, Ottawa, vi + 36 p.
- COSEPAC. 2011. Lignes directrices pour reconnaître les unités désignables, (consulté le 27 février 2013).
- Cox, C. 2001. Insecticide factsheet: Imidacloprid, Journal of Pesticide Reform 21:15-22.
- Cresson, E.T. 1864. Descriptions of several new species of North American Apidae, Proceedings of the Entomological Society of Philadelphia 3: 38 43.
- Curley, R., comm. pers., 2011. Correspondance par courriel adressée à S. Colla, 2011. Conservation Biologist, Forests Fish and Wildlife Division, Department of Environment, Energy and Forestry de l’Île-du-Prince-Édouard, Charlottetown (Île-du-Prince-Édouard).
- Environmental Protection Agency (EPA), U.S.A. 1994. Pesticide fact sheet: Imidacloprid, Washington D.C., Mar. 18.
- Evans, E., R. Thorp, S. Jepsen et S.H. Black. 2008. Status Review of Three Formerly Common Species of Bumble Bee in the Subgenus Bombus, The Xerces Society for Invertebrate Conservation, Portland (Oregon).
- Fisher, R.M. 1983. Inability of the social parasite Psithyrus ashtoni to suppress ovarian development in workers of Bombus affinis (Hymenoptera: Apidae), Journal of the Kansas Entomological Society 56: 69-73.
- Fisher, R.M., D.R. Greenwood et G.J. Shaw. 1993. Host recognition and the study of a chemical basis for attraction by cuckoo Bumble Bees (Hymenoptera: Apidae), Journal of Chemical Ecology 19: 771-786.
- Fisher, R.M., et B.J. Sampson. 1992. Morphological specializations of the Bumble Bee social parasite Psithyrus- Ashtoni (Cresson) (Hymenoptera, Apidae), Canadian Entomologist 124:69-77.
- Gels, J.A., D.W. Held et D.A. Potter. 2002. Hazards of insecticides to the Bumble Bees Bombus impatiens (Hymenoptera: Apidae) foraging on flowering white clover in turf, Journal of Economic Entomology 95: 722-728.
- Giberson, D., comm. pers. 2011. Correspondance par courriel via L. Packer, 2011, professeur à la University of Prince Edward Island, Charlottetown (Île-du-Prince-Édouard).
- Goulson, D. 2003. Bumblebees, Their Behaviour and Ecology, Oxford University Press, Oxford, 235 p.
- Grixti, J. C., L.T. Wong, S.A. Cameron et C. Favret. 2009. Decline of Bumble Bees (Bombus) in the North American Midwest, Biological Conservation 142: 75-84.
- Hatfield, R.G., et G. LeBuhn. 2007. Patch and landscape factors shape community assemblages of Bumble Bees, Bombus spp. (Hymenoptera: Apidae), in montane meadows. Biological Conservation 139: 150-158.
- IUCN (International Union for Conservation of Nature). 2001. IUCN red list categories and criteria: Version 3.1, IUCN Species Survival Commission, IUCN, Gland (SUISSE) et Cambridge (ROYAUME-UNI), ii + 30 p.
- Javorek, S.K., et M.C. Grant. 2011. Tendances de la capacité d’habitat faunique des terres agricoles du Canada, de 1986 à 2006, Biodiversité canadienne : état et tendances des écosystèmes en 2010, Rapport technique thématique nº 14, Conseils canadiens des ministres des ressources, Ottawa (Ontario), vi + 51 p.
- Johansen, C.A., et D.F. Mayer. 1990. Pollinator Protection. A Bee and Pesticide Handbook, Cheshire (Connecticut), Wicwas Press.
- Kerr, J., N. Szabo, S.R. Colla, L. Richardson et L. Packer (en révision). Strongly increasing climatic variation and concurrent near extinction of a historically abundant pollinator.
- Klymko, J. 2012. Comm. pers. à S. Colla. Centre de données sur la conservation du Canada atlantique, Cornerbrook (Terre-Neuve-et-Labrador).
- Klymko, J. 2014. Comm. pers. à C. Sheffield. Centre de données sur la conservation du Canada atlantique, Cornerbrook (Terre-Neuve-et-Labrador).
- Kosoir, A., W. Celary, P. Olejniczak, J. Fijal, W. Krol, W. Solarz et P. Plonka. 2007. The decline of the Bumble Bees and cuckoo bees (Hymenoptera: Apidae: Bombini) of Western and Central Europe, Oryx 41: 79-88.
- Laverty, T.M., et L. Harder. 1988. The Bumble Bees of Eastern Canada, Canadian Entomologist 120: 965-987.
- Macfarlane, R. 1974. Ecology of Bombinae (Hymenoptera: Apidae) of Southern Ontario, with emphasis on their natural enemies and relationships with flowers, thèse de doctorat, University of Guelph, Guelph (Ontario).
- Macfarlane, R.P., J.J. Lipa et H.J. Liu. 1995. Bumble Bee pathogens and internal enemies, Bee World 76: 130-148.
- Macfarlane, R.P., et K.D. Patten. 1997. Food sources in the management of Bumble Bee populations around cranberry marshes, in Proceedings of the 7th International Symposium on Pollination, K.W. Richards (éd.), Acta Horticulturae: 239-244.
- MacPhail, V.J. 2007. Pollination Biology of Wild Roses (Rosa spp.) in Eastern Canada, mémoire de maîtrise ès sciences, University of Guelph (Ontario), 174 p.
- Marletto, F., A. Patetta et A. Manino. 2003. Laboratory assessment of pesticide toxicity to Bumble Bees, Bulletin of Insectology 56:155-158.
- Master, L., D. Faber-Langendoen, R. Bittman, G.A. Hammerson, B. Heidel, J. Nichols, L. Ramsay et A. Tomaino. 2009. NatureServe conservation status assessments: factors for assessing extinction risk, (en anglais seulement), consulté le 15 juin 2012; NatureServe, Arlington (Virginie), ÉTATS-UNIS.
- McCorquodale, D., comm. pers. 2012. Correspondance par courriel adressée à S. Colla. 2012. Cape Breton University, Sydney (Nouvelle Écosse).
- Michener, C.S. 2000. The Bees of the World, The Johns Hopkins University Press, Baltimore, 952 p.
- Mitchell, T.B. 1962. Bees of the Eastern United States, North Carolina Agricultural Experiment Station Technical Bulletin No. 152.
- Morandin, L.A., et M.L. Winston. 2003. Effects of novel pesticides on bumble bee (Hymenoptera: Apidae) colony health and foraging ability, Community and Ecosystem Ecology 32: 555-563.
- Morton, A., R. Routledge, C. Peet et A. Ladwig. 2004. Sea lice infection rates on juvenile pink and chum salmon in the nearshore environment of British Columbia, Canada, Canadian Journal of Fish and Aquatic Sciences 61:147-158.
- National Research Council (NRC). 2007. Status of Pollinators in North America, The National Academies Press, Washington D.C.
- National Research Council (NRC) 2007. Status of pollinators in North America, Committee on the Status of Pollinators in North America, The National Academies Press, Washington D.C., 312 p.
- NatureServe 2012., (en anglais seulement). consulté le 22 janvier 2013.
- Otterstatter, M.C., R.J. Gegear, S.R. Colla et J.D. Thomson. 2005. Effects of parasitic mites and protozoa on the flower constancy and foraging rate of Bumble Bees, Behavioral Ecology and Sociobiology 58: 383-389.
- Otterstatter, M.C., et J.D. Thomson. 2008. Does Pathogen Spillover from Commercially Reared Bumble Bees Threaten Wild Pollinators? PLoS One 3: e2771.
- Owen, R., M.C. Otterstatter, R.V. Cartar, A. Farmer, S.R. Colla et N. O’Toole. 2012. Significant expansion of the distribution of the Bumble Bee Bombus moderatus (Hymenoptera: Apidae) over twenty years, Canadian Journal of Zoology 90:133-138.
- Packer, L., comm. pers. 2011. Correspondance par courriel adressée à S. Colla. 2011. Professeur à la York University, Toronto (Ontario).
- Patenaude, A. 2007. Diversity, composition and seasonality of wild bees (Hymenoptera: Apoidea) in a northern mixed-grass prairie preserve, mémoire de maîtrise ès sciences, University of Manitoba, 235 p.
- Phillips, S.J., M. Dudik et R.E. Shapire. 2006. Maximum entropy modeling of species geographic distributions, Ecological Modelling 190: 231-259.
- Plath, O.E. 1934. Bumblebees and their ways, Macmillan, New York, ÉTATS UNIS, 201 p.
- Power, A. G., et C.E. Mitchell. 2004. Pathogen Spillover in Disease Epidemics, American Naturalist 164: S79-S89.
- Ratti, C.M. 2006. Bee abundance and diversity in berry agriculture, mémoire de maîtrise ès sciences, Simon Fraser University.
- Salafsky, N., D. Salzer, A.J. Stattersfield, C. Hilton-Taylor, R. Neugarten, S.H.M. Butchart, B. Collen, N. Cox, L.L. Master, S. O’Connor et D. Wilkie. 2008. A standard lexicon for biodiversity conservation: unified classifications of threats and actions, Conservation Biology 22: 897–911.
- Savard, M. 2012. Données inédites sur la présence historique du Bombus (Psithyrus) ashtoni au sud du Québec, au Saguenay-Lac-Saint-Jean et en Minganie, rapport déposé au ministère des Ressources naturelles et de la Faune du Québec, 17 mai 2012, 8 p.
- Sheffield, C.S., comm. pers. 2011. Correspondance par courriel adressée à S. Colla. 2011. Associé de recherche à la York University, Toronto (Ontario).
- Stotyn, S. 2012. Wild Bumble Bees of the Nahanni River Region, NT, Final Report, Environnement Canada, 10 p.
- Stout, J.C., et D. Goulson. 2000. Bumble Bees in Tasmania: their distribution and potential impact on Australian flora and fauna, Bee World 81: 80-86.
- Sur, R., et A. Stork. 2003. Uptake, translocation and metabolism of imidacloprid in plants, Bulletin of Insectology 1: 35-40.
- Szabo, N., S.R. Colla, D. Wagner, L.F. Gall et J.T. Kerr. 2012. Is pathogen spillover from commercial bumble bees responsible for North American wild Bumble Bee declines? Conservation Letters 5: 232-239.
- Tasei, J. N., G. Ripault et E. Rivault. 2001. Hazards of Imidacloprid seed coating to Bombus terrestris (Hymenoptera: Apidae) when applied to Sunflower, Journal of Economic Entomology 94: 623-627.
- Thorp, R.W., M.D. Shepherd. 2005. Profile: subgenus Bombus, in Shepherd M.D., D.M. Vaughan et S.H. Black (éd.), Red list of pollinator insects of North America, The Xerces Society for Invertebrate Conservation, Portland (Oregon).
- Turnock, W.J., P.G. Kevan, T.M. Laverty, et L. Dumouchel. 2007. Abundance and species of Bumble Bees in fields of canola, Brassica rapa, in Manitoba: an 8 year study, Journal of the Entomological Society of Ontario 137: 31-41.
- Williams, P.H. 1991. The bumble bees of the Kashmir Himalaya (Hymenoptera: Apidae, Bombinae), Bulletin of the British Museum of Natural History (Entomology) 60: 1-204 (page 46).
- Williams, P.H. 2011. Bombus of the World, (en anglais seulement), consulté le 22 janvier 2013.
- Williams, P.H., M.J.F. Brown, J.C. Carolan, D. Goulson, Jiandong An, S.M. Aytekin, L.R. Best, A.M. Byvaltsev, B. Cederberg, R. Dawson, J. Huang, M. Ito, A. Monfared, R.H. Raina, P. Schmid-Hempel, C.S. Sheffield, P. Šima et Z. Xie. 2012. Assessing cryptic species of the bumblebee subgenus Bombus s. str. world-wide with COI barcodes (Hymenoptera: Apidae), Systematics and Biodiversity 10: 21-56.
- Williams, P.H. 2013. Bombus: Species world-wide listed by old and new subgenera, (en anglais seulement), consulté le 22 janvier 2013; Natural History Museum, London, ROYAUME-UNI.
- Williams, P.H., R.W. Thorp, L.L. Richardson et S.R. Colla. 2014. The Bumble Bees of North America: an identification guide, Princeton University Press, New York, ÉTATS-UNIS, 208 p.
- Williams, P.H., et J.L. Osborne. 2009. Bumble Bee vulnerability and conservation worldwide, Apidologie 40:367-387.
- Williams, P.H., S.R. Colla et Z. Xie. 2009. Bumble Bee vulnerability: common correlates of winners and losers across three continents, Conservation Biology 23: 931-940.
- Williams, P.H. 1989. Bumble Bees - and their decline in Britain, (en anglais seulement), consulté le 22 janvier 2013; Ilford: Central Association of Bee-Keepers, 15 p.
- Zayed, A., et L. Packer. 2005. Complementary sex determination substantially increases extinction proneness of haplodiploid populations, Proceedings of the National Academy of Sciences 102: 10742-10746.
- Zimma, B.O., M. Ayasse, J. Tengo, F. Ibarra, C. Schulz et W. Francke. 2003. Do social parasitic Bumble Bees use chemical weapons? (Hymenoptera, Apidae), Journal of Comparative Physiology 189: 769-775.
Sheila R. Colla a commencé à étudier les espèces de bourdons indigènes d’Amérique du Nord en 2003, alors qu’elle poursuivait ses études de premier cycle à l’université de Toronto (University of Toronto). Titulaire d’une bourse d’études supérieures du Canada Alexander-Graham-Bell du CRSNG, elle a ensuite obtenu un diplôme de doctorat à l’université York (York University), à Toronto, en Ontario, sous la direction de Laurence Packer (Ph.D.). Sa thèse portait sur l’évolution des communautés de bourdons au cours des cent dernières années et sur certaines des causes des déclins observés. Elle est la cocoordonnatrice pour l’Amérique du Nord du groupe de spécialistes des bourdons participant à la Commission sur la survie des espèces de l’UICN. Les résultats de ses travaux ont été publiés dans les quotidiens et revues The Washington Post, Canadian Gardening, The Toronto Star et BioScience et ont été présentés aux émissions CBC’s Quirks and Quarks et The Daily Planet de Discovery Channel Canada.
Leif L. Richardson est candidat au doctorat au Dartmouth College, à Hanover, au New Hampshire. Ses travaux portent sur les effets de la chimie du nectar des fleurs sur les abeilles et leurs parasites. Il analyse également les données des relevés et les données de collecte des spécimens de musée afin de documenter les changements touchant la répartition des espèces de bourdons d’Amérique du Nord. Avec Sheila R. Colla et deux autres chercheurs, il a corédigé un guide d’identification des bourdons d’Amérique du Nord publié par Princeton University Press en 2014.
Cory S. Sheffield s’intéresse aux abeilles et à la pollinisation depuis 1993, alors qu’il était étudiant au baccalauréat spécialisé à l’Université Acadia (Acadia University), à Wolfville, en Nouvelle-Écosse. Il a ensuite poursuivi des études supérieures (M.Sc.) sur les interactions entre les insectes et les plantes à l’Université Acadia, ainsi qu’à Agriculture et Agroalimentaire Canada (AAC), à Kentville, en Nouvelle-Écosse, de 1994 à 2006. Il a ensuite entrepris des études doctorales à l’université de Guelph (University of Guelph), tout en continuant de travailler à AAC. Ses travaux portaient sur la diversité des abeilles de la Nouvelle-Écosse et sur leur contribution à la pollinisation des cultures. Durant cette période, il a publié, en collaboration avec plusieurs coauteurs, des articles portant sur la redécouverte en Nouvelle-Écosse d’un insecte que l’on croyait disparu, l’Epeoloides pilosulus. Il a ensuite entrepris des études postdoctorales à l’Université York (York University), en Ontario, consacrant ses recherches à la taxinomie des abeilles et à l’utilisation du codage à barres, avant d’accepter un poste d’associé de recherche en taxinomie des abeilles au sein de l’Initiative canadienne sur la pollinisation (CANPOLIN). Il œuvre aujourd’hui à titre de chercheur scientifique et de conservateur en zoologie des invertébrés au musée royal de la Saskatchewan (Royal Saskatchewan Museum), à Regina, en Saskatchewan. Son intérêt pour les abeilles demeure toujours aussi vif, et il a publié des articles sur la taxinomie des abeilles du Canada et de l’Amérique du Nord, sur l’utilité du codage à barres pour l’identification des abeilles, sur la physiologie des abeilles, sur la contribution des abeilles à la pollinisation et sur la diversité des abeilles canadiennes.
- University of Guelph Insect Collection, Guelph (Ontario)
- Collection nationale canadienne, Ottawa (Ontario)
- Musée Lyman, Université McGill, Sainte-Anne-de-Bellevue (Québec)
- Musée royal de l’Ontario, Toronto (Ontario)
- Packer Collection, York University, Toronto (Ontario)
- Royal British Columbia Museum, Victoria (Colombie-Britannique)
- Royal Saskatchewan Museum, Regina (Saskatchewan)
- Illinois Natural History Survey, Champaign (Illinois)
- Kansas State University Insect Collection, Manhattan (Kansas)
- Nova Scotia Museum, Halifax (Nouvelle-Écosse)
- Ohio State University Columbus Collection, Columbus (Ohio)
- American Museum of Natural History, New York (New York)
- University of Massachusetts, Amherst (Massachusetts)
- University of New Hampshire, Durham (New Hampshire)
- New York State Museum, Albany, New York
- Connecticut Agricultural Experiment Station, New Haven (Connecticut)
- University of Prince Edward Island, Charlottetown (Île-du-Prince-Édouard)
- Collection André Francœur (Université du Québec), Chicoutimi (Québec)
- Collection Michel Savard, Saguenay (Québec)
- Collection Christophe Buidin-Yann Rochepault (Association Le Balbuzard de la Minganie), Rivière-Saint-Jean (Québec), Musée canadien de la nature, Ottawa (Ontario)
- Cape Breton University, Sydney (Nouvelle-Écosse)
| Province | Région ou site | Jour | Mois | Année |
|---|---|---|---|---|
| Nouvelle-Écosse | Comté de Colchester, Debert | 27 | 6 | 1995 |
| Nouvelle-Écosse | Comté de Colchester, Debert | 5 | 6 | 1995 |
| Nouvelle-Écosse | Comté de Colchester, Debert | 6 | 6 | 1995 |
| Nouvelle-Écosse | Comté de Digby, Delaps Cove. | 19 | 6 | 1995 |
| Nouvelle-Écosse | Comté de Colchester, Debert | 19 | 7 | 1996 |
| Nouvelle-Écosse | Comté de Colchester, Debert | 6 | 6 | 1996 |
| Nouvelle-Écosse | Comté de Halifax, West Dover | 6 | 8 | 1998 |
| Nouvelle-Écosse | Comté de Colchester, Shubenacadie | 20 | 5 | 1998 |
| Nouvelle-Écosse | Comté de Halifax, Armdale | 11 | 8 | 1999 |
| Nouvelle-Écosse | Comté de Colchester, Greeenfield | 5 | 8 | 1999 |
| Nouvelle-Écosse | Comté de Hants, Mount Uniacke | 11 | 8 | 1999 |
| Nouvelle-Écosse | Comté de Hants, Mount Uniacke | 11 | 8 | 1999 |
| Nouvelle-Écosse | West Black Rock, comté de Kings | 16 | 8 | 2001 |
| Nouvelle-Écosse | Whycocomagh, comté d’Inverness | 3 | 8 | 2001 |
| Nouvelle-Écosse | 3 | 8 | 2001 | |
| Nouvelle-Écosse | 16 | 8 | 2001 | |
| Nouvelle-Écosse | Middleton, comté d’Annapolis | 12 | 6 | 2002 |
| Nouvelle-Écosse | 12 | 6 | 2002 | |
| Ontario | Flesherton | 12 | 5 | 1991 |
| Ontario | Canton de Blue | 29 | 5 | 1992 |
| Ontario | Canton de Worthington | 11 | 6 | 1992 |
| Ontario | Canton de Worthington | 9 | 6 | 1992 |
| Ontario | Canton de Chapple | 17 | 8 | 1992 |
| Ontario | Canton de Chapple | 4 | 8 | 1992 |
| Ontario | Canton d’Atwood | 15 | 6 | 1992 |
| Ontario | Canton d’Atwood | 22 | 6 | 1992 |
| Ontario | Canton d’Atwood | 26 | 7 | 1992 |
| Ontario | Canton d’Atwood | 26 | 7 | 1992 |
| Ontario | Canton d’Atwood | 27 | 7 | 1992 |
| Ontario | Canton d’Atwood | 18 | 8 | 1992 |
| Ontario | Canton de Blue | 14 | 8 | 1992 |
| Ontario | Canton de Chapple | 22 | 7 | 1992 |
| Ontario | Canton de Chapple | 17 | 8 | 1992 |
| Ontario | Canton de Morley | 15 | 6 | 1992 |
| Ontario | Parc provincial Pinery, comté de Lambton | 8 | 6 | 1992 |
| Ontario | Canton de Worthington | 8 | 6 | 1992 |
| Ontario | Parc provincial Macgregor Point | 21 | 5 | 1993 |
| Ontario | Shallow Lake | 15 | 7 | 1993 |
| Ontario | Spencer Gorge, Escarpement du Niagara | 18 | 8 | 1993 |
| Ontario | Hepworth, comté de Grey | 16 | 7 | 1994 |
| Ontario | Luther Marsh, comté de Wellington | 20 | 8 | 1994 |
| Ontario | Parc provincial Pinery, comté de Lambton | 1 | 6 | 1994 |
| Ontario | Parc provincial Pinery, comté de Lambton | 15 | 6 | 1994 |
| Ontario | Parc provincial Pinery, comté de Lambton | 24 | 6 | 1994 |
| Ontario | Spencer Gorge, Escarpement du Niagara | 31 | 7 | 1994 |
| Ontario | St.Williams tract, comté de Norfolk | 5 | 6 | 1994 |
| Ontario | St.Williams tract, comté de Norfolk | 5 | 6 | 1994 |
| Ontario | Lac Jean-Venne | 5 | 6 | 1995 |
| Ontario | Parc provincial Pinery, comté de Lambton | 27 | 6 | 1995 |
| Ontario | Parc provincial Pinery, comté de Lambton | 17 | 6 | 1995 |
| Ontario | Parc provincial Pinery, comté de Lambton | 17 | 6 | 1995 |
| Ontario | Lac Matchedash, comté de Simcoe | 12 | 8 | 1996 |
| Ontario | Port Franks, comté de Lambton | 15 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 20 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 27 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 9 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 9 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 9 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 12 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 14 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 14 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 14 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 16 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 16 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 16 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 15 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 15 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 23 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 23 | 6 | 1996 |
| Ontario | Port Franks, comté de Lambton | 14 | 8 | 1996 |
| Ontario | Port Franks, comté de Lambton | 29 | 8 | 1996 |
| Ontario | Elmira, Salem Creek | 18 | 5 | 1997 |
| Ontario | Rivière Crane, comté de Bruce | 27 | 9 | 1997 |
| Ontario | Hope Bay, comté de Bruce | 1 | 6 | 1997 |
| Ontario | Huntsville | 18 | 8 | 1997 |
| Ontario | Orillia, comté de Simcoe | 13 | 8 | 1998 |
| Ontario | Lac Cameron, comté de Bruce | 16 | 6 | 1999 |
| Ontario | Baie Dorcas, comté de Bruce | 19 | 6 | 1999 |
| Ontario | Baie Dorcas, comté de Bruce | 19 | 6 | 1999 |
| Ontario | Toronto, rivière Humber près d’Old Mill, | 9 | 5 | 1999 |
| Ontario | Baie Dunks, comté de Bruce | 5 | 7 | 2000 |
| Ontario | Tourbière Oliphant, comté de Bruce | 5 | 7 | 2000 |
| Ontario | Parc provincial Presqu'Ile | 28 | 4 | 2000 |
| Ontario | Parc provincial Presqu'Ile | 17 | 6 | 2000 |
| Ontario | Pinery | 6 | 8 | 2008 |
| Québec | Lac Jean-Venne | 24 | 8 | 1995 |
| Québec | Lac Jean-Venne | 4 | 6 | 1995 |
| Québec | Magpie | 17 | 6 | 2000 |
| Québec | Aguanish | 16 | 6 | 2001 |
| Québec | Baie-Johan-Beetz | 16 | 6 | 2001 |
| Québec | Rivière-Saint-Jean | 12 | 8 | 2001 |
| Québec | Rivière-Saint-Jean | 15 | 7 | 2001 |
| Québec | Rivière-Saint-Jean | 13 | 7 | 2001 |
| Québec | Rivière-Saint-Jean | 16 | 7 | 2001 |
| Québec | Rivière-Saint-Jean | 9 | 6 | 2001 |
| Québec | Rivière-Saint-Jean | 17 | 6 | 2001 |
| Québec | Rivière-Saint-Jean | 16 | 6 | 2001 |
| Québec | Rivière-Saint-Jean | 28 | 5 | 2001 |
| Québec | Havre-Saint-Pierre | 22 | 6 | 2001 |
| Québec | Chemin du Grand-Ruisseau ou ch. du Grand-Ruisseau | 22 | 5 | 2001 |
| Québec | Chemin du Grand-Ruisseau ou ch. du Grand-Ruisseau | 28 | 5 | 2001 |
| Québec | Chemin du Grand-Ruisseau ou ch. du Grand-Ruisseau | 9 | 6 | 2001 |
| Québec | Sentier Val-Menaud, Saint-Charles-de-Bourget | 9 | 6 | 2001 |
| Québec | Baie-à-Forest, Saint-Gédéon | 10 | 6 | 2001 |
| Québec | Chemin du Grand-Ruisseau ou ch. du Grand-Ruisseau | 16 | 6 | 2001 |
| Québec | Chemin du Grand-Ruisseau ou ch. du Grand-Ruisseau | 17 | 6 | 2001 |
| Québec | Havre-Saint-Pierre | 19 | 6 | 2001 |
| Québec | Baie-à-Forest, Saint-Gédéon | 24 | 6 | 2001 |
| Québec | Camp Patmos, L'Ascension | 25 | 6 | 2001 |
| Québec | Havre-Saint-Pierre | 26 | 6 | 2001 |
| Québec | Bout-du-Banc, space Rivière-Saint-Jean | 13 | 7 | 2001 |
| Québec | Berge de la rivière Saint-Jean, Longue-Pointe-de-Mingan | 15 | 7 | 2001 |
| Québec | Chemin du Grand-Ruisseau ou ch. du Grand-Ruisseau | 16 | 7 | 2001 |
| Québec | Bout-du-Banc, Rivière-Saint-Jean | 18 | 7 | 2001 |
| Québec | Parc Rivière-du-Moulin, Chicoutimi | 6 | 6 | 2002 |
| Québec | Parc Rivière-du-Moulin, Chicoutimi | 8 | 6 | 2002 |
| Québec | Chicoutimi (réservoir d'eau au quartier des Oiseaux), Chicoutimi | 13 | 6 | 2002 |
| Québec | Baie-à-Forest, Saint-Gédéon | 1 | 7 | 2002 |
| Québec | Route Fillion, Saint-Honoré | 7 | 6 | 2003 |
| Québec | Camp Patmos, L'Ascension-de-Notre-Seigneur | 28 | 6 | 2003 |
| Québec | Baie-à-Forest, Saint-Gédéon | 1 | 7 | 2003 |
| Québec | Pied-du-Mont, Parc national du Mont-Orford | 29 | 7 | 2007 |
| Québec | Île d’Anticosti | 2007 | ||
| Québec | Chalet La Courtepointe, Parc national du Mont-Orford | 4 | 7 | 2008 |