Séances d’information sur les Lignes directrices pour le personnel du CEPMB
Direction de la réglementation et de la liaison auprès des brevetés
18 novembre 2025
Introduction
- Mot de bienvenue, Guillaume Couillard, Directeur général, Conseil d’examen du prix des médicaments brevetés
- Anie Perrault, Présidente par intérim, Conseil d’examen du prix des médicaments brevetés
Aperçu
- Dépôt
- Processus d’examen
- Examen initial
- Examen annuel
- Information additionnelle
- Examen approfondi
- Communications et échéanciers
- Période de questions
Dépôt
Dépôt – Outil de dépôt en ligne
- L’outil de dépôt en ligne (ODL) est un portail en ligne conçu pour faciliter les titulaires de droits dans leurs obligations en matière de présentation des renseignements selon la loi qui encadre le CEPMB.
- Principalement :
- Formulaire 1 – Identification du médicament, du titulaire de droits et des brevets (dès le début et après toute modification)
- Formulaire 2 – Données sur les prix et les ventes (dès le début et deux fois par an) jusqu’à la section 4 (ventes au Canada) et section 5 (prix départ usine accessibles pour Canada et les pays du CEPMB11)
- Formulaire 3 – Recettes et dépenses de recherche et développement
- Il incombe au titulaire de droits de s’assurer que tous les renseignements demandés sont fournis dans les délais impartis et qu’ils sont exacts.
- Plus de détails sur le moment et la manière de déposer les renseignements se trouvent sur notre site Web.
Exigences en matière de fourniture des renseignements relatifs aux examens de prix
Formulaire 1 : Renseignements sur le titulaire de droits et sur le médicament
| Renseignements | Date d'échéance | Loi sur les brevets | Règlement | Formulaire |
|---|---|---|---|---|
| Identification du médicament, du titulaire de droits et des brevets | La première des dates suivantes : Sept (7) jours après la date d'émission du premier Avis de conformité Sept (7) jours après la date de première vente du médicament au Canada |
80(1)a) 80(2)a) |
3(1) 3(2) 3(3) |
1 |
| Mise à jour des renseignements identifiant le médicament ou le titulaire de droits | Dans les (30) jours suivant toute modification des renseignements | 3(4) | 1 |
Formulaire 2 : Données sur les prix et les ventes
| Renseignements | Date d'échéance | Loi sur les brevets | Règlement | Formulaire |
|---|---|---|---|---|
Données sur les prix et la valeur des ventes du médicament pour chaque catégorie de client par province ou territoire au Canada Prix départ-usine publiquement disponibles pratiqués en Australie, en Belgique, en France, en Allemagne, en Italie, au Japon, aux Pays-Bas, en Norvège, en Espagne, en Suède et au Royaume-Uni |
Lorsqu'un médicament est lancé sur le marché canadien, au plus tard trente (30) jours après la date de première vente Au plus tard le 30 juillet (période de rapport du 1er janvier au 30 juin) Au plus tard le 30 janvier (période de rapport du 1er juillet au 31 décembre) |
80(1)b) 80(2)b) |
4(1) 4(2) |
2 |
Formulaire 3 : Recettes tirées des ventes et dépenses de R-D
| Renseignements | Date d'échéance | Loi sur les brevets | Règlement | Formulaire |
|---|---|---|---|---|
| Recettes tirées des ventes et dépenses de R–D | Au plus tard le 1er mars chaque année | 88(1) 88(2) | 5, 6 | 3 |
Dépôt – Renseignements sur les sections 4 et 5 du formulaire 2
- Environ 6 semaines avant la date limite du dépôt semestriel, le personnel envoie à tous les titulaires de droits des renseignements sur le dépôt à venir, y compris une liste de médicaments déclarés au CEPMB.
- Vous devez signaler toute anomalie et vous assurer que tous les renseignements demandés se trouvent dans le rapport.
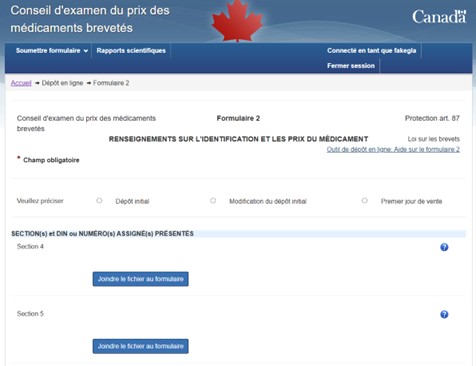
Description de la figure
Cette image est une capture d'écran de la page de soumission du « Formulaire 2 - Informations sur l'identification et les prix du médicament » sur l'Outil de dépôt en ligne. Ce formulaire comprend des champs à remplir pour la Section 1 (période de déclaration), ainsi qu'une section pour joindre des fichiers afin de soumettre les informations des Sections 4 et 5.

Description de la figure
Cette image est un exemple d'un document Excel fourni par le CEPMB aux titulaires de droits pour soumettre les informations de la Section 4. Il s'agit d'un tableau comprenant des colonnes permettant de noter les informations sur les ventes au Canada, y compris le numéro DIN, la concentration/unité, la forme posologique, le format d’emballage, le nombre d’emballages vendus, s'il s'agit des recettes nettes ou du prix moyen par emballage, et la province/territoire.
- Le CEPMB utilise les renseignements fournis par le titulaire de droits pour réaliser l’examen des prix. Selon le nouveau cadre, les renseignements déclarés dans la section 5 sont particulièrement importants pour l’examen initial et annuel.
- Le personnel peut faire un suivi si des renseignements semblent manquants ou s’il semble y avoir une erreur administrative.
- Par exemple, s’il manque le prix courant au Canada, si l’unité indiquée a changé (c.-à-d. le format d’emballage) ou si le prix courant a changé de manière à laisser penser qu’il s’agit d’une erreur (p. ex. passe de 1,35 $ à 135 $).
- Le but est d’éviter les situations où un examen approfondi est amorcé alors que ce n’était pas nécessaire. Il est donc important de communiquer avec le personnel du CEPMB le plus tôt possible si une question a été posée ou si le titulaire de droits réalise qu’il y a une erreur dans le rapport.
- On rappelle que les renseignements suivants doivent être fournis pour chaque période de référence, pour chaque médicament visé par le Règlement :
- Renseignements sur les ventes au Canada
- Prix courant canadien
- Prix courant pratiqué dans les pays du CEPMB11 où le médicament est vendu
- Advenant le cas où aucun prix départ usine n’est accessible au Canada, les titulaires de droits doivent donner une justification pour permettre au personnel du CEPMB de conserver les dossiers appropriés.
Processus d’examen
Examen initial – Printemps 2026
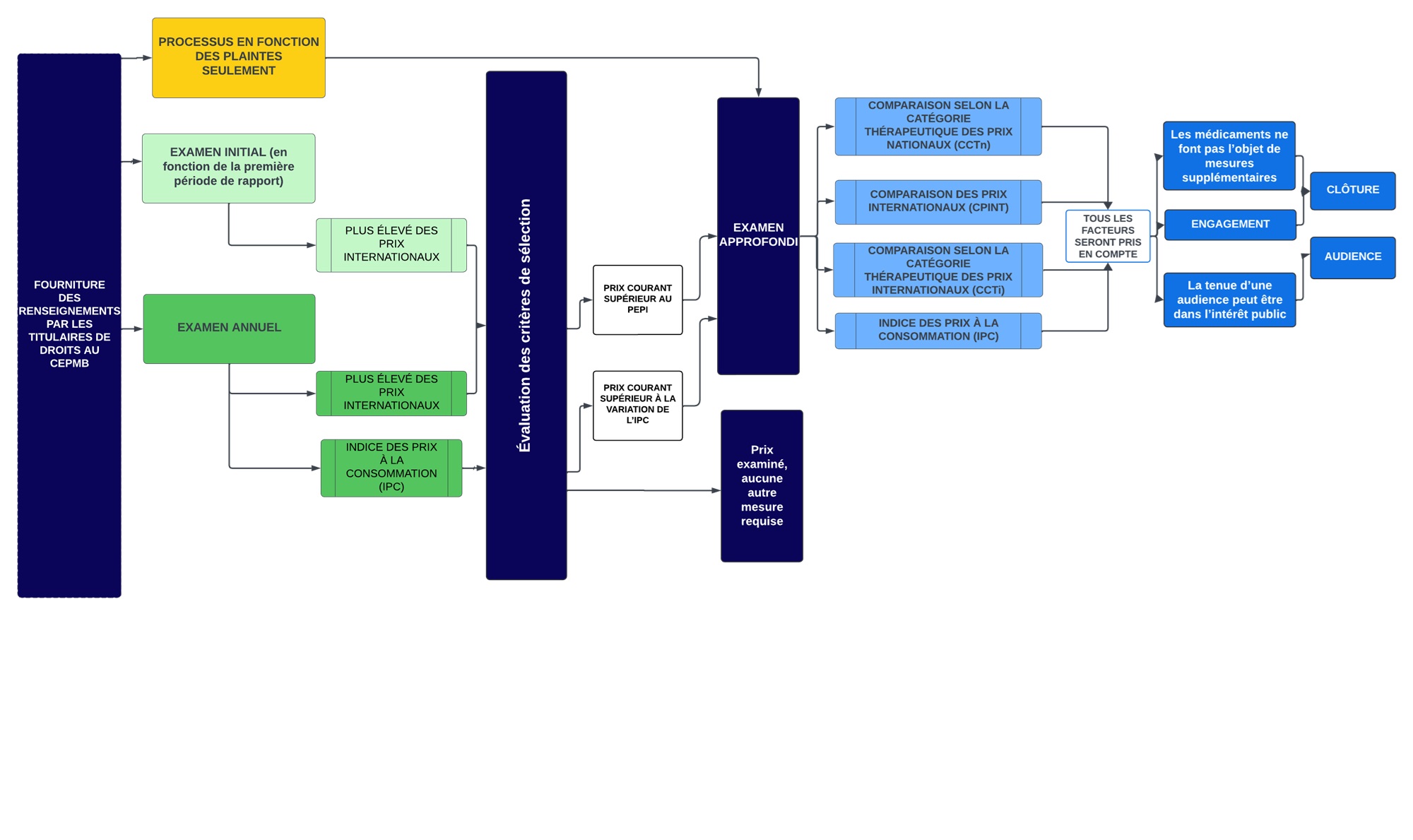
Description de la figure
Ce diagramme présente les processus généraux d’examen des médicaments brevetés qui sont envisagés dans les Lignes directrices. Il est divisé en plusieurs sections pour mettre en évidence les différentes étapes du processus.
Voici la description de la procédure :
- La première étape est un examen initial (vert pâle) ou un examen annuel (vert foncé). Tous les médicaments brevetés vendus au Canada y sont soumis, à quelques exceptions près (voir ci-dessous la rubrique « Dispositions particulières relatives aux plaintes »).
- Les plaintes (jaune) sont un processus distinct permettant de recenser les médicaments devant faire l’objet d’un examen approfondi.
- Examen initial (encadré vert pâle) :
- Le personnel procède à un examen initial en fonction du plus élevé des prix internationaux (PEPI) dans les pays inscrits à l’annexe, en se fondant sur le premier rapport semestriel que fournit le titulaire de droits au sujet du prix d’un médicament.
- Les médicaments brevetés dont le prix est supérieur au PEPI font l’objet d’un examen approfondi.
- Examen annuel (encadré vert foncé) :
- Le personnel procède à un examen annuel des prix courants de tous les médicaments brevetés relevant de la compétence du CEPMB.
- En ce qui concerne la CPINT, l’examen annuel et l’examen initial emploient les mêmes critères de sélection (le PEPI).
- Le personnel compare également la variation du prix de chaque médicament breveté aux variations de l’indice des prix à la consommation (IPC). Il s’agit de l’un des critères de sélection en fonction desquels les médicaments feront l’objet d’un examen approfondi.
- À l’issue de l’examen initial ou de l’examen annuel, deux résultats sont possibles : a) aucun autre examen; b) examen approfondi.
- L’examen approfondi (bleu pâle) est une démarche au cours de laquelle le personnel analyse et soupèse tous les renseignements se rapportant aux facteurs de l’article 85, afin de formuler une recommandation au président quant à la tenue d’une audience. L’examen approfondi aboutira à l’une ou l’autre des recommandations suivantes : a) recommandation de la clôture de l’examen approfondi; b) recommandation d’une tenue d’une audience.
Examen initial
- La période d’examen initial d’un médicament s’étend de la date de la première vente à la fin de la période de référence, c.-à-d. soit le 30 juin ou le 31 décembre.
- À l’aide de la méthode des taux de change décrite précédemment, le personnel comparera le prix courant le plus élevé au Canada du médicament déclaré pour la période d’examen initial, tel que déclaré par le titulaire de droits, au plus élevé des prix internationaux (PEPI) du CEPMB11.
- Ce processus est appelé « comparaison des prix internationaux » (CPINT)
- Si le prix courant canadien le plus élevé est supérieur au PEPI, le médicament fera l’objet d’un examen approfondi.
- L’examen approfondi comprendra le DIN qui a mené à l’examen approfondi ainsi que tous les DIN associés (selon les renseignements transmis par les titulaires de droits).
- Si le prix courant canadien le plus élevé est inférieur au PEPI, on considérera que le médicament aura été examiné.
- S’il est impossible de procéder à une CPINT pendant l’examen initial parce qu’aucun prix courant n’a été communiqué pour le médicament dans l’un des pays de comparaison du CEPMB11, on considérera également que le médicament aura été examiné.
Examen initial – Printemps 2026
- Aux termes des nouvelles Lignes directrices, un nouveau médicament est un médicament breveté vendu pour la première fois le 1er juillet 2022 ou après cette date.
- Les examens initiaux ayant lieu au printemps 2026 engloberont tous les nouveaux médicaments vendus pour la première fois entre le 1er juillet 2022 et le 31 décembre 2025. Ces examens initiaux seront effectués à partir :
- des renseignements transmis par les titulaires de droits dans la section 5 du formulaire 2 de juillet à décembre 2025;
- de la moyenne des taux de change de la période de 36 mois se terminant en février 2025.
- Les résultats des examens initiaux seront communiqués aux titulaires de droits dans les 60 jours suivant la date de dépôt du rapport semestriel.
- Après ce premier exercice, les examens initiaux seront effectués après chaque rapport semestriel pour chaque nouveau médicament déclaré.
Processus d’examen – Taux de change
- Le CEPMB a ajusté sa moyenne de taux de change de la période de 36 mois utilisée lors des examens initiaux et annuels pour assurer une meilleure uniformité et améliorer la prévisibilité et la transparence pour les titulaires de droits.
- Au cours de l’examen initial, les taux de change utilisés seront la moyenne de la période de 36 mois se terminant au deuxième mois de la période de référence précédant la période de référence de l’examen initial. Exemples :
- Pour tout médicament dont la période de référence de l’examen initial est de janvier à juin 2040, on utilisera la moyenne de taux de change pour la période de 36 mois se terminant en août 2039.
- Pour tout médicament dont la période de référence de l’examen initial est de juillet à décembre 2040, on utilisera la moyenne de taux de change pour la période de 36 mois se terminant en février 2040.
- Au cours des examens annuels, les taux de change utilisés seront la moyenne de la période de 36 mois se terminant le deuxième mois de la période de référence à l’étude. Exemple :
- Lors de l’examen annuel des prix de juillet à décembre 2035, on utilisera la moyenne des taux de change pour la période de 36 mois se terminant en août 2035.
- Les titulaires de droits connaîtront les taux de change utilisés par le personnel du CEPMB au moins cinq mois avant la date limite du dépôt de leur rapport.
Résumé des critères – Examen initial
Exemples d’examens initiaux selon la date de la première vente :
| Date de la première vente | Examen initial | Période de référence à l’examen | Taux de change utilisé** | PEPI s’applique? | IPC s’applique? | Premier examen annuel | Période de référence utilisée |
|---|---|---|---|---|---|---|---|
1er juillet 2022* |
Janv./févr. 2026 |
2025-2 |
03/22 - 02/25 |
Oui |
Non |
Janv./févr. 2027 |
2026-2 |
5 mars 2024 |
Janv./févr. 2026 |
2025-2 |
03/22 - 02/25 |
Oui |
Non |
Janv./févr. 2027 |
2026-2 |
9 sept. 2025 |
Janv./févr. 2026 |
2025-2 |
03/22 - 02/25 |
Oui |
Non |
Janv./févr. 2027 |
2026-2 |
12 mai 2027 |
Juil./août 2027 |
2027-1 |
09/23 - 08/26 |
Oui |
Non |
Janv./févr. 2028 |
2027-2 |
26 oct. 2028 |
Janv./févr. 2029 |
2028-2 |
03/25 - 02/28 |
Oui |
Non |
Janv./févr. 2030 |
2029-2 |
*Première date de la première vente d’un médicament considéré comme un nouveau médicament. Les médicaments vendus pour la première fois avant cette date sont considérés comme étant des médicaments existants suivant les nouvelles Lignes directrices.
** Moyenne simple des 36 taux de change moyens au comptant à midi, tels que publiés par la Banque du Canada pour chaque pays, comme expliqué précédemment.
Examen annuel
Examen annuel – Processus
- Le personnel procédera à un examen annuel des prix courants de tous les médicaments brevetés relevant de la compétence du CEPMB à compter du mois de janvier de chaque année.
- L’examen annuel emploiera deux critères de sélection :
- La comparaison des prix internationaux (CPINT)
- L’indice des prix à la consommation (IPC)
- Comparaison des prix internationaux :
- Lors de l’examen annuel, le personnel comparera le prix courant canadien le plus élevé du médicament au PEPI du CEPMB11.
- Le personnel utilisera les données de la section 5 du formulaire 2 déclarées par le titulaire de droits pour la période de référence de juillet à décembre.
- Si le prix courant canadien le plus élevé est supérieur au PEPI, le médicament (ainsi que tous les DIN associés déclarés par les titulaires de droits) feront l’objet d’un examen approfondi.
Examen annuel – IPC
- Indice des prix à la consommation :
- Pour le deuxième critère de sélection, le personnel compare la variation du prix courant d’un médicament à la variation de l’IPC.
- Le personnel utilisera les facteurs de l’IPC retardé d’un an pour cette évaluation.
- Exemple : lors de l’examen annuel des prix des médicaments brevetés en février 2028, le personnel comparera les augmentations des prix courants en 2027 aux facteurs de l’IPC de 2026, publiés par Statistique Canada en janvier 2027.
- Les titulaires de droits connaîtront les facteurs de l’IPC utilisés par le personnel avant l’examen annuel.
- Pour calculer l’IPC, le personnel emploie l’« Indice des prix à la consommation mensuel, non désaisonnalisé » publié par Statistique Canada.
- Si un titulaire de droits augmente le prix courant d’un médicament breveté d’un montant supérieur à la variation de l’IPC au cours d’une année donnée, le personnel entreprendra un examen approfondi à moins que :
- le titulaire de droits n’ait pas augmenté le prix courant au cours de l’année précédente; et
- l’augmentation de la deuxième année n’excède pas la variation totale de l’IPC sur ces deux années.
Examen annuel – Schéma de l’IPC
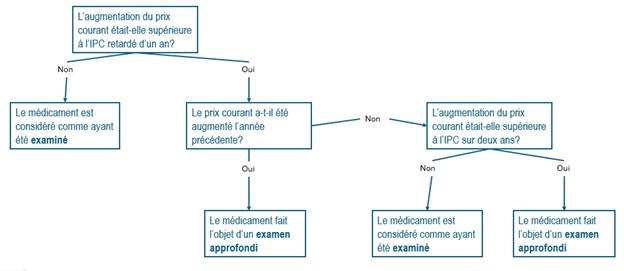
Description de la figure
Cette image représente la matrice de décision pour déterminer comment appliquer le critère de l'indice des prix à la consommation (IPC) à une augmentation du prix courant.
La première question est « L'augmentation du prix courant était-elle supérieure à l'IPC retardé d’un an ? » Si la réponse est non, alors le médicament est considéré comme ayant été examiné.
Si la réponse est oui, la question suivante est « Le prix courant a-t-il été augmenté l'année précédente ? » Si la réponse est oui, alors le médicament fait l'objet d'un examen approfondi.
Si la réponse est non, la question suivante est « L'augmentation du prix courant était-elle supérieure à l'IPC sur deux ans ? » Si la réponse est non, alors le médicament est considéré comme ayant été examiné.
Si la réponse est oui, alors le médicament fait l'objet d'un examen approfondi.
Remarque : Ce schéma représente uniquement le critère de l’IPC, et on suppose que le prix courant est inférieur au PEPI.
Examen annuel – Exemples d’IPC
- Exemple 1 : (Date de la première vente : 2 février 2029)
| Période réglementaire | Prix courant le plus élevé | Variation du prix courant | IPC sur un an |
|---|---|---|---|
29 janv. – 29 déc. |
11,00 $ |
-- |
-- |
30 janv. – 30 déc. |
11,20 $ |
1,8 % |
2,3 % |
- En 2030, le prix courant canadien le plus élevé a augmenté de 1,8 %.
- Puisque l’augmentation du prix courant est inférieure à l’IPC d’un an (2,3 %), elle ne mène pas à un examen approfondi.
- Exemple 2 : (Date de la première vente : 2 février 2029)
| Période réglementaire | Prix courant le plus élevé | Variation du prix courant | IPC sur un an |
|---|---|---|---|
29 janv. – 29 déc. |
11,00 $ |
-- |
-- |
30 janv. – 30 déc. |
11,35 $ |
3,2 % |
2,3 % |
- En 2030, le prix courant canadien le plus élevé a augmenté de 3,2 %.
- On ne peut pas considérer l’IPC sur deux ans, car le médicament n’en est qu’à sa deuxième année de commercialisation au Canada
- Puisque l’augmentation du prix courant est supérieure à l’IPC d’un an (2,3 %), elle mène à un examen approfondi.
- Exemple 3 : (Date de la première vente : 2 février 2029)
| Période réglementaire | Prix courant le plus élevé | Variation du prix courant | IPC sur un an | IPC sur deux ans |
|---|---|---|---|---|
29 janv. – 29 déc. |
11,00 $ |
-- |
-- |
-- |
30 janv. – 30 déc. |
11,00 $ |
0,0 % |
2,3 % |
-- |
31 janv. – 31 déc. |
11,35 $ |
3,2 % |
2,1 % |
4,4 % |
- In 2031, the highest Canadian list price increased by 3.2%. This increase is greater than one-year CPI (2.1%).
- No list price increase was taken in 2030; therefore, Staff compare the increase to two-year CPI.
- As this increase is less than two-year CPI (4.4%), the list price increase does not trigger an In-Depth Review.
- Exemple 4 : (Date de la première vente : 2 février 2029)
| Période réglementaire | Prix courant le plus élevé | Variation du prix courant | IPC sur un an | IPC sur deux ans |
|---|---|---|---|---|
29 janv. – 29 déc. |
11,00 $ |
-- |
-- |
-- |
30 janv. – 30 déc. |
11,22 $ |
2,0 % |
2,3 % |
-- |
31 janv. – 31 déc. |
11,48 $ |
2,3 % |
2,1 % |
4,4 % |
- En 2030, le prix courant canadien le plus élevé a augmenté de 2,0 %. Cette augmentation est inférieure à l’IPC sur un an (2,3 %).
- En 2031, le prix courant canadien le plus élevé a augmenté de 2,3 %. Cette augmentation est supérieure à l’IPC sur un an (2,1 %).
- Bien que l’augmentation sur deux ans (4,36 %) soit inférieure à l’IPC sur deux ans (4,4 %), on ne peut pas considérer l’IPC sur deux ans, car il y a eu une augmentation du prix courant l’année précédente.
- Puisque l’augmentation du prix courant de 2031 est supérieure à l’IPC sur un an, elle mène à un examen approfondi.
Examen annuel
- Un examen approfondi sera déclenché si le prix courant d’un médicament répond à l’un des critères de sélection.
- On considère qu’un médicament a été examiné si son prix ne remplit aucun des critères de sélection.
- Les résultats des examens annuels seront communiqués par courrier aux titulaires de droits dans les 60 jours suivant la date limite de dépôt du rapport semestriel en janvier.
Information additionnelle
Période transitoire – Médicaments nouveaux et existants
- Des mesures ont été mises en place pour tenir compte de la période de transition avec le cadre précédent, ainsi que du nouveau groupe de pays de comparaison établi le 1er juillet 2022. Ces mesures s’appliquent surtout aux médicaments existants.
- Médicaments nouveaux et médicaments existants :
- Médicament nouveau – médicament breveté vendu pour la première fois le 1er juillet 2022 ou après cette date.
- Médicament existant – médicament breveté vendu pour la première fois avant le 1er juillet 2022.
- Première période de référence aux fins d’examen :
- Les Lignes directrices pour le personnel entreront en vigueur en janvier 2026. Ainsi, la période de référence de 2025-2 sera la première qui fera l’objet d’un examen conformément à la première étape du nouveau cadre.
- Cette situation n’empêche pas le personnel d’utiliser des données précédentes dans le cas d’un examen approfondi ou d’une audience.
Période transitoire – Médicaments existants
- Les médicaments existants ont une période transitoire de deux ans à compter de la date d’entrée en vigueur des Lignes directrices avant que le personnel effectue l’examen des prix pour la première fois.
- Janvier 2026 – Aucun examen des données de 2025-2
- Janvier 2027 – Aucun examen des données de 2026-2
- Janvier 2028 – Examen annuel des données de 2027-2
- Le premier examen (janvier 2028) ne constituera pas un examen initial, mais plutôt un examen annuel « abrégé », au cours duquel seul le critère de sélection du CPINT (comparaison des prix internationaux) sera appliqué.
- Le personnel effectuera le premier examen annuel « standard » des médicaments existants, où l’on appliquera les deux critères de sélection, en 2029.
Résumé des critères – Examen annuel
Exemples d’examens annuels en fonction des mesures transitoires :
| Examen annuel | Période de référence à l’examen | Médicaments couverts | Taux de change utilisé* | PEPI s’applique? | IPC s’applique? |
|---|---|---|---|---|---|
Janv./févr. 2026 |
s. o. |
s. o. |
|||
Janv./févr. 2027 |
2026-2 |
Nouveaux médicaments |
09/23 - 08/26 |
Oui |
Oui |
Janv./févr. 2028 |
2027-2 |
Médicaments existants |
09/24 - 08/27 |
Oui |
Non |
Nouveaux méd. ayant fait l’objet d’un examen initial |
09/24 - 08/27 |
Oui |
Oui |
||
Janv./févr. 2029 |
2028-2 |
Tous les méd. ayant fait l’objet d’un examen initial |
09/25 - 08/28 |
Oui |
Oui |
Janv./févr. 2030 |
2029-2 |
Tous les méd. ayant fait l’objet d’un examen initial |
09/26 - 08/29 |
Oui |
Oui |
*Moyenne simple des 36 taux de change moyens au comptant à midi, tels que publiés par la Banque du Canada pour chaque pays, comme expliqué précédemment.
Médicaments existants – Rapports informatifs
- Afin d’éviter des lacunes en matière de communications avec les titulaires de droits au sujet des prix de leurs médicaments existants, le personnel enverra des rapports informatifs après la réception de chaque dépôt semestriel entraînant leur premier examen annuel.
- Les données se trouvant dans les rapports informatifs s’appuient sur les renseignements de la section 5 du formulaire 2 et résument le prix courant canadien le plus élevé pour chaque médicament, le PEPI et le pays pratiquant le PEPI.
- Ces rapports informatifs seront similaires à ceux envoyés aux titulaires de droits cet automne, mais traiteront seulement des médicaments existants, puisque les nouveaux médicaments feront l’objet d’examens initiaux et annuels, comme le décrivent les nouvelles Lignes directrices.
- Un médicament existant sera seulement soumis à l’examen approfondi lors de cette période transitoire de deux ans si :
- il est visé par une plainte;
- il est un DIN associé à un médicament soumis à un examen approfondi.
Médicaments existants – Rapports d’information

Description de la figure
Cette image montre un exemple de rapports d'informations qui sont envoyés aux titulaires de droits. Le titre est « Rapport d'information sur le prix courant et international (mois/mois année) Période de référence ».
La partie supérieure fournit des informations sur le nom du titulaire de droits. Ensuite, nous voyons un tableau avec 5 colonnes :
- Colonne 1 - Nom commercial
- Colonne 2 - DIN
- Colonne 3 - Prix courant le plus élevé au Canada
- Colonne 4 – Plus élevé des prix internationaux (PEPI)
- Colonne 5 - Pays de comparaison où le PEPI est fixé.
Communications à la suite d’examens initiaux et annuels
Communications prévues avec les titulaires de droits :
| Date | Médicaments existants (vendus pour la première fois avant le 1er juillet 2022) | Nouveaux médicaments (vendus pour la première fois entre le 1er juillet 2022 et le 31 décembre 2025) | Par la suite, exemple : Médicament vendu pour la première fois entre le 1er janvier 2026 et le 30 juin 2026 | Par la suite, exemple : Médicament vendu pour la première fois entre le 1er juillet 2026 et le 31 décembre 2026 |
|---|---|---|---|---|
Mars 2026 |
Rapport d’information |
Examen initial |
s. o. |
s. o. |
Sept. 2026 |
Rapport d’information |
s. o. |
Examen initial |
s. o. |
Mars 2027 |
Rapport d’information |
Examen annuel |
Examen annuel |
Examen initial |
Sept. 2027 |
Rapport d’information |
s. o. |
s. o. |
s. o. |
Mars 2028 |
Examen annuel (sans IPC) |
Examen annuel |
Examen annuel |
Examen annuel |
Sept. 2028 |
s. o. |
s. o. |
s. o. |
s.o. |
Mars 2029 |
Examen annuel |
Examen annuel |
Examen annuel |
Examen annuel |
Considérations spéciales – Plaintes
- En plus des critères de sélection du PEPI et de l’IPC, un examen approfondi peut avoir lieu en tout temps si une personne (ou organisation) approuvée dépose une plainte.
- Le ministre fédéral de la Santé ou l’un de ses homologues provinciaux ou territoriaux.
- Les cadres supérieurs autorisés à représenter les programmes publics d’assurance médicaments canadiens.
- Les renseignements de base devront être confirmés avant le début d’un examen approfondi. Après la réception d’une plainte, le personnel :
- confirmera que le plaignant est l’une des personnes approuvées mentionnées ci-dessus;
- confirmera que l’objet de la plainte concerne un médicament breveté relevant de la compétence du CEPMB.
- Le CEPMB accusera réception de toutes les plaintes. Cependant, le plaignant ne sera pas informé du déclenchement d’un examen approfondi ni du résultat de celui-ci.
- Les processus d’examen scientifique et d’examen des prix lors d’un examen approfondi déclenché à la suite d’une plainte sont les mêmes que ceux d’un examen approfondi déclenché à la suite d’examens initiaux ou annuels.
Examen approfondi
Examen approfondi – Début
- On procédera à un examen approfondi en fonction du résultat d’un examen initial ou annuel, ou à la suite d’une plainte.
- Au titre des Lignes directrices :
- Le personnel n’établit pas de prix plafond chaque année pour chaque médicament.
- Le personnel utilise plutôt des critères pour cibler les médicaments nécessitant un examen plus rigoureux.
- Il ne faut pas confondre ces critères avec les plafonds, et ceux-ci n’agissent pas à titre d’arbitre qui peut déterminer si le prix d’un médicament est excessif ou non : seul le Conseil peut prendre cette décision dans le cadre d’une audience sur les prix.
- En conséquence, le personnel ne calcule pas les recettes excédentaires potentielles.
- Ce processus permet une transparence accrue : les critères sont fondés sur les renseignements fournis par les titulaires de droits concernant les prix courants canadiens et le PEPI, ainsi que les taux de change et les facteurs de l’IPC accessibles au préalable. Un titulaire de droits saura, au moment du dépôt du rapport, si leurs médicaments feront l’objet d’un examen approfondi.
Examen approfondi – Examen scientifique
- On procède à l’examen scientifique dès le tout début du processus d’examen approfondi.
- Cet examen vise à déterminer les médicaments de comparaison ainsi que les schémas posologiques comparables et à attribuer un degré de similitude au médicament à l’étude. Ce processus éclairera l’analyse de la comparaison selon la catégorie thérapeutique (CCT).
- Le personnel de l’équipe scientifique est responsable de l’examen scientifique. L’équipe est composée de professionnels de la santé ayant une formation, un parcours et une expérience considérable dans divers domaines de la pratique clinique, de l’évaluation des médicaments et de l’utilisation des médicaments.
- Cet exercice se fait à l’aide de diverses sources telles que la littérature médicale disponible, des évaluations cliniques réalisées par les organisations des technologies de la santé, de la recherche menée par un centre d’information sur les médicaments, une présentation soumise par le titulaire de droits, etc.
- Une liste des sources potentielles se trouve dans le paragraphe 91 des Lignes directrices.
- Le Groupe consultatif sur les médicaments pour usage humain (GCMUH) peut être consulté pour aider avec les évaluations scientifiques, au besoin. Plus d’informations sur le GCMUH se trouvent sur notre site Web.
- L’examen scientifique permet de déterminer des médicaments de comparaison pour chaque indication approuvée ou utilisation au moment de l’examen.
- Chaque médicament de comparaison se voit attribuer un degré de similitude et un schéma posologique comparable. On utilisera ces renseignements pour l’analyse de la CCT, qui éclairera l’examen des prix.

Description de la figure
Ce tableau illustre le spectre de la comparabilité, qui varie de « plus comparable » (en haut à gauche) à « moins comparable » (en bas à droite). L’axe horizontal représente la catégorie qualitative (A, B, C, D), tandis que l’axe vertical indique les groupes (1, 2, 3, 4). La figure montre efficacement comment la comparabilité diminue progressivement d’une catégorie qualitative à l’autre (de gauche à droite) et d’un groupe à l’autre (de haut en bas).
La comparabilité se distingue visuellement par la couleur :
- Vert : comparabilité élevée (p. ex. : A1, A2 et B1)
- Bleu : comparabilité moyenne (p. ex. : A3, A4, B2, B3, C1, C2, D1)
- Jaune, orange et rose : comparabilité basse (p. ex. : B4, C3, C4, D2, D3 et D4)
- Il faut noter que :
- le niveau d’amélioration thérapeutique n’est plus un facteur (p. ex. découverte)
- on ne tient compte des prix à aucun moment de l’examen scientifique
- Les titulaires de droits peuvent décider de soumettre des renseignements écrits concernant l’examen scientifique.
- Les documents doivent être envoyés par l’intermédiaire de l’outil de dépôt en ligne du CEPMB, conformément à la pratique antérieure.
- Après avoir reçu un avis d’examen approfondi, les titulaires de droits devront aviser le personnel s’ils comptent fournir des renseignements scientifiques. Le cas échéant, la présentation des renseignements devrait être envoyée dans les plus brefs délais afin de garantir qu’elle soit prise en compte dans l’examen scientifique.
- Le site Web du CEPMB fournit des directives concernant le format et le contenu suggérés dans les rapports scientifiques.
- Le contenu devrait cadrer avec les renseignements fournis précédemment. Pour chaque indication approuvée :
- Un résumé du point de vue du titulaire de droit concernant la place qu’occupe le médicament dans la thérapie
- Des médicaments de comparaison
- Des schémas posologiques comparables
- De la littérature scientifique à l’appui
Examen approfondi – Résultats de l’examen scientifique
- L’examen scientifique sera généralement terminé dans les huit mois suivant le début de l’examen approfondi.
- Ce délai peut être plus long si on consulte le Groupe consultatif sur les médicaments pour usage humain (GCMUH).
- Une fois l’examen scientifique terminé, les titulaires de droits recevront un document qui résume :
- les médicaments de comparaison définis
- les schémas posologiques comparables du médicament à l’étude et de tous les comparateurs définis
- la cote de comparabilité de chaque comparateur
- Ce résumé comprendra également :
- les grandes lignes des justifications par comparateur évalué;
- une liste des références examinées au cours du processus d’examen scientifique.
Examen approfondi – Examen des prix
- Au moment où l’examen scientifique est commencé, le personnel effectuera un examen préliminaire des prix.
- La première annexe des Lignes directrices donne un aperçu du type d’analyse qui sera effectuée. À ce moment, sans l’examen scientifique, l’accent est mis sur les alinéas 85(1)a), 85(1)c) et 85(1)d), comme :
- l’examen des prix courants actuels et dans le passé
- les variations des prix courants actuels et dans le passé comparativement à l’IPC
- le nombre de pays du CEPMB11 dont des données ont été déclarées, actuellement et dans le passé
- la répartition des prix des médicaments établis dans les pays du CEPMB11
- les variations des prix dans la monnaie locale et des taux de change dans les pays du CEPMB11
- Une fois l’examen scientifique terminé, l’examen des prix se poursuit avec l’analyse de la comparaison selon la catégorie thérapeutique des prix nationaux (CCTn) et de la comparaison selon la catégorie thérapeutique des prix internationaux (CCTi).
- Concernant les alinéas 85(1)b) and 85(1)c), respectivement.
- Les analyses de la CCTn et de la CCTi ne sont pas des « tests ». Ils ne permettent pas d’obtenir un seul résultat indiquant une réussite ou un échec. Le personnel examine le coût de traitement de tous les médicaments de comparaison et détermine la pondération des deux analyses de CCT à attribuer en fonction des cotes de comparabilité établies lors l’examen scientifique.
- L’image montre comment la CCT peut être utilisée pour évaluer les coûts de traitement lors de la composante de l’examen des prix de l’examen approfondi.
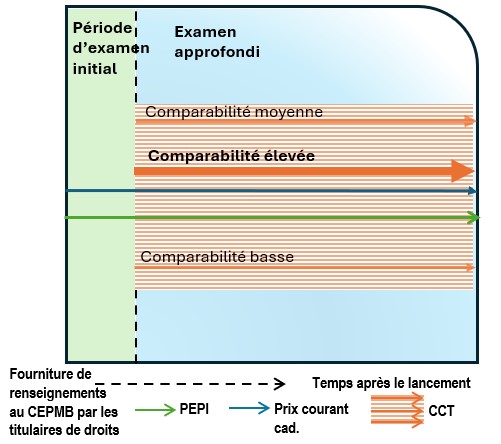
Description de la figure
Ce diagramme illustre l’exemple dans lequel, lors de l’examen initial, le prix courant canadien est supérieur au PEPI. Il en résulte un examen approfondi. Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue aussi le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude. Le diagramme est divisé en deux sections : la section verte représente la période d’examen initial, tandis que la section bleue représente la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente le PEPI et les lignes orange représentent les comparateurs de la CCT. Il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est supérieur au prix courant canadien et au PEPI.
Examen approfondi – Recommandation
- À la fin de l’examen des prix, le personnel se fonde sur l’analyse effectuée de chaque facteur individuel énuméré au paragraphe 85(1) pour déterminer s’il faut une recommandation à l’issue de l’examen approfondi.
- On estime que le processus au complet, y compris l’examen scientifique, prend de 12 à 18 mois, selon sa complexité.
- Le résultat d’un examen approfondi sera la recommandation à la présidente :
- de publier un avis d’audience;
- de clore le dossier (avec ou sans un engagement accepté).
- Les annexes des Lignes directrices décrivent des situations qui peuvent mener à la recommandation de la tenue d’une audience comparativement à celles qui peuvent mener à la recommandation d’une clôture.
- Si le Président décide de clôturer un examen approfondi, les Lignes directrices prévoient une période de grâce d’au moins deux périodes de dépôt pendant laquelle le médicament ne sera pas soumis à un autre examen approfondi.
Communications et échéanciers
- Renseignements sur les facteurs relatifs aux prix
- Présentation écrite dans les trois mois suivant le début de l’examen approfondi, envoyée par courriel.
- Agent principal de réglementation désigné tout au long de l’examen approfondi.
- Renseignements sur les facteurs scientifiques
- Dès que possible, suivant le début de l’examen approfondi.
- Envoyés au moyen de l’outil de dépôt en ligne, avec un courriel envoyé à l’adresse de dépôt.
- Deuxième occasion de répondre après la réception des résultats de l’examen scientifique.
- Engagements
- Les titulaires de droits peuvent soumettre un engagement à tout moment pendant l’examen approfondi et jusqu’à deux mois après avoir été avisés que le personnel a recommandé la publication d’un avis d’audience à la présidente.
- Le personnel analysera tous les engagements reçus et les présentera à la présidente pour examen.
- Si le personnel compte recommander la tenue d’une audience, il en informe le titulaire de droits lorsque la recommandation est envoyée à la présidente. La décision définitive de la présidente sera rendue trois mois après la réception de la recommandation du personnel.

Description de la figure
Cette image présente deux lignes de temps illustrant les échéances et dates butoirs envisagés selon l’ébauche des lignes directrices.
La première ligne de temps décrit le processus interne du CEPMB du dépôt de renseignements par le titulaire de droits jusqu’à la décision du président.
Voici la description de ce processus :
- La première étape (première boite bleue) est un examen initial ou un examen annuel. Celui-ci serait complété en soixante jours. A la fin de cette période, les titulaires de droits seraient avisés de l’examen approfondi.
- La deuxième étape (deuxième boite bleue) est l’examen approfondi, qui peut prendre entre douze et vingt-huit mois. Cet examen est divisé en trois sections :
- La première section (boite verte) est l’examen scientifique, qui peut durer jusqu’à huit mois, et même plus longtemps si le GCMUH est consulté.
- La deuxième section (boite mauve) est l’examen des prix. Elle débute en même temps que l’examen scientifique, mais s’échelonne jusqu’à trois mois avant la fin du processus.
- La troisième section (boite jaune) est la décision du président, qui peut prendre jusqu’à trois mois, et au minimum un mois après la soumission d’un engagement.
La deuxième ligne de temps (ligne de temps bleue) décrit les interactions entre les titulaires de droits et le CEPMB tout au long du processus.
Voici la description de ces interactions :
- Premièrement, à la suite de l’examen initial ou annuel, le titulaire de droit est avisé du début d’un examen approfondi.
- À partir de ce moment, le titulaire de droits a trois mois pour soumettre des renseignements relatifs aux facteurs énumérés au paragraphe 85(1) et autre que la CCT.
- Toujours à partir du moment où le titulaire de droits est avisé du début d’un examen approfondi, il est maintenant possible de soumettre un engagement pour la considération du président. La date butoir pour qu’un titulaire de droits soumette un engagement est deux mois après que le personnel du CEPMB recommande au président la tenue d’une audience.
Période de questions
- Période de questions techniques
- Les questions seront posées en direct
- Les participants qui souhaitent poser une question doivent lever la main virtuellement
- Seules les questions techniques sur la mise en œuvre des Lignes directrices seront répondues aujourd’hui
- Puisque cette séance vise à mieux comprendre l’application générale du nouveau cadre, les questions ne devraient pas porter sur des cas précis. Il est possible de discuter des problèmes propres à l’entreprise après la séance en communiquant avec la Direction de la réglementation et de la liaison auprès des brevetés du CEPMB.
- Vous avez d’autres questions?
- Contactez la Direction de la réglementation et de la liaison auprès des brevetés :
Stéphanie Plouffe, directrice principale, Réglementation et liaison auprès des brevetés
stephanie.plouffe@pmprb-cepmb.gc.ca