Lignes directrices pour le personnel du CEPMB
Table des matières
- Rôle des présentes Lignes directrices
- Présentation du CEPMB et des lois applicables
- Processus d’examen
- Première étape
- Deuxième étape
- Examen approfondi
- Examen scientifique : sélection et analyse de la comparaison selon la catégorie thérapeutique
- Comparaison selon la catégorie thérapeutique des prix nationaux (CCTn)
- Comparaison selon la catégorie thérapeutique des prix internationaux (CCTi)
- Groupe consultatif sur les médicaments pour usage humain (GCMUH)
- Examen des prix
- Examen approfondi
- Recommandations
- Glossaire et liste des acronymes et des abréviations
- Annexes
Rôle des présentes Lignes directrices
- Le Conseil d’examen du prix des médicaments brevetés (« CEPMB ») a été créé en 1987 en vertu de modifications à la Loi sur les brevets (la « Loi ») à la suite d’une série de réformes importantes de la Loi qui ont renforcé la protection des brevets des médicaments au Canada. Le CEPMB est un organisme indépendant établi par la loi et qui détient des pouvoirs quasi judiciaires. Il a le mandat de surveiller les prix des médicaments brevetés vendus au Canada pour s’assurer qu’ils ne sont pas excessifs. Il remplit son mandat en tenant des audiences publiques pour déterminer si les prix de certains médicaments brevetés sont excessifs. Il est également autorisé à publier des Lignes directrices non contraignantes sur des questions relevant de sa compétence.
- En 2019, le gouvernement a proposé de modifier le Règlement sur les médicaments brevetés (le « Règlement ») afin d’introduire de nouveaux facteurs d’examen des prix (valeur pharmacoéconomique, taille du marché et produit intérieur brut) que le CEPMB devrait prendre en compte lors de la surveillance de la pratique de prix excessifs. Il a modifié l’annexe des pays de comparaison pour lesquels les titulaires de droits doivent fournir des renseignements sur les prix au CEPMB et a également exigé des titulaires de droits qu’ils présentent des renseignements sur tous les rajustements de prix (en valeurs nettes), y compris les rabais consentis dans le cadre d’ententes d’inscription de produits.
- Les modifications proposées ont été contestées devant les tribunaux provinciaux et fédéraux, ce qui a donné lieu à une nouvelle jurisprudence résultant de deux procédures judiciaires – Merck Canada inc. c. Procureur général du Canada et Médicaments Novateurs Canada c. Canada (Procureur général) Note de bas de page 1 – portant sur la portée du mandat du CEPMB et des pouvoirs qui lui sont conférés. Par la suite, le gouverneur en conseil a décidé de ne pas procéder aux modifications relatives aux nouveaux facteurs d’examen des prix et à la fourniture de renseignements sur les prix nets. Le gouvernement a plutôt décidé de ne mettre en œuvre que l’annexe actualisée de 11 pays (« CEPMB11 ») et de réduire les exigences en matière de fourniture de renseignements pour les médicaments considérés comme posant un risque moindre de se vendre à des prix excessifs. Ces changements ont été confirmés comme étant à la fois constitutionnels et conformes à la Loi dans les instances judiciaires. Ces deux modifications réglementaires sont entrées en vigueur le 1er juillet 2022.
- Les présentes Lignes directrices non contraignantes ont été élaborées pour répondre aux modifications du Règlement et pour refléter les indications données par la jurisprudence. Destinées au personnel du CEPMB (« personnel »), elles visent à assurer une transparence auprès des parties intéressées quant au processus utilisé pour cibler les cas potentiels à recommander au président pour la tenue d’une audience. Les présentes Lignes directrices sont conçues pour garantir une équité procédurale et une cohérence, de sorte que tous les titulaires de droits placés dans des conditions similaires fassent l’objet de la même procédure et des mêmes délais. Le processus établi dans les présentes Lignes directrices consiste en deux étapes de « sélection » destinées à prioriser les cas qui seront recommandés au président pour la tenue d’une audience. L’objectif de ce processus est de permettre au CEPMB de concentrer efficacement ses ressources limitées relatives aux audiences. La première étape de sélection – l’examen initial et l’examen annuel – permet de sélectionner les cas qui nécessitent un examen approfondi. La deuxième étape – l’examen approfondi –, quant à elle, permet de prioriser les cas qui seront recommandés au président pour la tenue d’une audience. Le personnel ne détermine dans aucune des deux étapes si un prix est excessif ou non. Ces deux étapes permettent seulement de sélectionner les cas que le personnel recommandera au président pour la tenue d’une audience. Dans tous les cas, c’est le président, et non le personnel, qui a le pouvoir discrétionnaire d’émettre ou non un avis d’audience. C’est toujours au groupe de membres du Conseil chargés de l’audience sur un prix excessif (le « panel d’audience ») qu’il appartient de déterminer si un prix est excessif.
- Les présentes Lignes directrices ne constituent pas un cadre de fixation des prix. Elles ne s’adressent pas aux titulaires de droits et n’ont pas pour objectif d’offrir une certitude quant aux résultats finaux de cas particuliers, de suggérer ou de fixer des prix au Canada, ni d’encourager la « conformité » à des tests ou à des prix plafonds . Les présentes Lignes directrices ne servent pas à calculer de « prix plafonds », de « prix non excessifs » ou de « recettes excédentaires potentielles », que ce soit lors de l’introduction d’un médicament ou à un moment ultérieur. Elles ne permettent pas de considérer ni de présumer non plus qu’un prix ou qu’un seuil de prix est excessif ou non excessif.
- Le CEPMB ne peut définir le terme « excessif » ni décider si le prix d’un médicament breveté est excessif ou non au moyen de Lignes directrices générales. C’est uniquement au cas par cas, dans le contexte d’une audience publique, qu’un panel d’audience du Conseil peut établir que les prix sont excessifs, selon les facteurs énumérés dans la Loi, et exiger des baisses de prix à un plafond maximum ou le paiement de recettes excédentaires. Les Lignes directrices ne restreignent d’aucune façon le pouvoir discrétionnaire d’un panel d’audience du Conseil au cours des audiences, notamment en matière de calcul du montant des recettes excédentaires ou d’établissement de la période pendant laquelle le prix d’un médicament peut avoir été excessif.
- Le Conseil reconnaît que l’approche exposée dans les présentes Lignes directrices s’écarte de la méthode qu’il privilégiait jusqu’ici, à savoir la publication de lignes directrices destinées aux titulaires de droits comme moyen d’encourager leur « conformité volontaire » aux prix plafonds qui y étaient énoncés. Le Conseil a défini sa nouvelle approche à la lumière des litiges récents et de la jurisprudence concernant son mandat et ses pouvoirs, ainsi que des commentaires formulés par les parties intéressées lors des consultations que le Conseil a menées ces dernières années au sujet des Lignes directrices.
- Selon la Loi, les titulaires de droits fixent comme bon leur semble les prix de leurs médicaments brevetés au Canada, sauf s’ils font l’objet d’une ordonnance du Conseil à la suite d’une audience concernant le prix d’un médicament breveté. Les titulaires de droits n’ont pas besoin de l’« approbation » du CEPMB ni de se « conformer » aux Lignes directrices pour vendre leurs médicaments brevetés au Canada. Le CEPMB ne peut pas autoriser ou approuver les prix et s’abstient donc de le faire.
- Le CEPMB pourrait réexaminer certains aspects des présentes Lignes directrices en fonction de l’évolution des circonstances. S’il envisage des modifications aux Lignes directrices à la suite d’un examen interne, le CEPMB consultera les parties intéressées conformément au paragraphe 96(5) de la Loi.
Présentation du CEPMB et des lois applicables
Mandat
- Le mandat et le champ de compétence du CEPMB sont définis aux articles 79 à 103 de la Loi. Le CEPMB a pour mandat principal de s’assurer que les médicaments brevetés ne sont pas vendus à des prix excessifs au Canada. Pour ce faire, le CEPMB surveille et examine le prix des médicaments brevetés, et il tient des audiences au terme desquelles il peut, par ordonnance, exiger que les prix soient ramenés à un niveau non excessif.
- La Loi ne définit pas ce qu’est un prix « excessif ». On y trouve plutôt, au paragraphe 85(1), les facteurs dont un panel d’audience du Conseil doit tenir compte dans ses audiences pour déterminer si un titulaire de droits ou un ancien titulaire de droits vend ou a vendu un médicament breveté à un prix excessif « sur un marché canadien ». Ces facteurs sont les suivants :
- Le prix de vente du médicament sur un tel marché;
- Le prix de vente de médicaments de la même catégorie thérapeutique sur un tel marché;
- Le prix de vente du médicament et d’autres médicaments de la même catégorie thérapeutique à l’étranger;
- Les variations de l’indice des prix à la consommation;
- Tous les autres facteurs précisés par les règlements d’application du présent paragrapheNote de bas de page 2.
- Si, après avoir tenu compte de ces facteurs, le Conseil est incapable de décider si un prix est excessif, le Conseil peut, selon le paragraphe 85(2) de la Loi, tenir compte des coûts de réalisation et de mise en marché, ainsi que de tous les autres facteurs précisés par les règlementsNote de bas de page 3 ou qu’il estime pertinents.
- En plus de s’assurer que les médicaments brevetés ne sont pas vendus à des prix excessifs au Canada, le CEPMB doit présenter dans un rapport annuel des renseignements sur les tendances des prix dans l’industrie pharmaceutique. Également, comme le prévoit l’article 90 de la Loi, le CEPMB produit les rapports que lui demande le ministre de la Santé sur divers sujets liés aux prix et à l’utilisation des produits pharmaceutiques. Ces publications, les rapports du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), peuvent être consultées sur le site Web du CEPMB. Les renseignements que les titulaires de droits transmettent au CEPMB ne servent pas à la production de ces rapports au ministre.
Structure et fonctionnement
- Le CEPMB se compose d’au plus cinq membres nommés par le gouverneur en conseil en vertu du paragraphe 91(1) de la Loi. L’un des membres est désigné président du Conseil et, à ce titre, agit comme premier dirigeant du CEPMB. En plus de son rôle de membre, le président est responsable de la supervision administrative et de l’orientation des travaux du Conseil, ce qui inclut la publication des avis d’audience, la nomination de membres du Conseil à titre de membres d’un panel d’audience, ainsi que la gestion des affaires internes du Conseil et de son personnel. Un autre membre est désigné vice-président. Le vice-président assume la présidence en cas d’absence ou d’empêchement du président, ou de vacance de son poste.
- La publication des Lignes directrices et des rapports du CEPMB est une responsabilité collective des membres du Conseil. De plus, les membres affectés à un panel d’audience constituent le Conseil aux fins de l’audience. Seuls les membres affectés à un panel d’audience peuvent, à leur discrétion, exercer les pouvoirs du CEPMB de tenir des audiences et de rendre des ordonnances exécutoires, y compris de juger si un prix est excessif au titre de l’article 85 de la Loi et d’ordonner la prise des mesures correctives prévues par la Loi. À l’exception de l’adoption de Lignes directrices et de règlements administratifs, les membres du Conseil, autres que le président, ne dirigent pas et ne donnent pas d’instructions au personnel quant à leur travail quotidien.
- Les ordonnances rendues par les panels d’audience du CEPMB sont exécutoires de la même manière que les ordonnances de la Cour fédérale ou de toute cour supérieure au Canada, et elles peuvent être exécutées par le CEPMB ou par la Cour fédérale. Les décisions contenues dans les ordonnances du CEPMB peuvent faire l’objet d’un contrôle judiciaire par la Cour fédérale, conformément aux principes de droit administratif et à la Loi sur les Cours fédérales.
- Le personnel du CEPMB est composé de fonctionnaires nommés selon les dispositions du paragraphe 94(1) de la Loi. Le personnel aide le CEPMB dans l’exercice de ses activités. À la tête du personnel se trouve un directeur général, qui relève du président du CEPMB. Le personnel n’est pas habilité à formuler des lignes directrices, à entamer des audiences, à décider si le prix d’un médicament breveté est excessif, à émettre des ordonnances ou des directives exécutoires ou à obliger les titulaires de droits à se conformer à la loi. Ces pouvoirs discrétionnaires appartiennent au Conseil en entier, au président ou aux membres qui siègent à un panel d’audience, conformément aux dispositions applicables de la Loi.
- Parce que le CEPMB est constitué au titre de la Loi en tant qu’organisme indépendant aux pouvoirs quasi judiciaires, il n’a aucun lien de dépendance avec le reste du gouvernement fédéral dans l’exercice de son mandat, y compris avec le ministre de la Santé (qui est responsable des articles de la Loi applicables au CEPMB) et avec le ministre de l’Innovation, des Sciences et du Développement économique (qui est responsable de la Loi dans son ensemble). En vertu de la Loi, le CEPMB n’a pas d’autorité précise ni d’obligation de s’aligner sur toute autre politique gouvernementale relative aux produits pharmaceutiques ou à l’écosystème des sciences de la vie au Canada. De même, la Loi ne confère aucun pouvoir exprès ou implicite qui permettrait à Santé Canada ou à toute autre entité gouvernementale de diriger le CEPMB dans l’exercice de ses fonctions de surveillance des prix. Cela dit, le CEPMB fait partie du gouvernement fédéral, et il relève du ministre de la Santé aux fins de la Loi sur la gestion des finances publiques. De plus, la Loi définit un ensemble limité de fonctions et de pouvoirs qu’exerce le ministre de la Santé vis-à-vis du CEPMB.
- À l’interne, la structure du CEPMB maintient une séparation entre les activités et les fonctions du personnel, du président et des membres du Conseil. Les fonctions décisionnelles incombent aux seuls membres qui siègent à un panel d’audience. Les fonctions administratives internes, y compris l’examen des renseignements fournis par les titulaires de droits, sont exécutées par le personnel sous la direction du président en tant que premier dirigeant. Le Secrétariat du Conseil assume ses activités de manière indépendante, séparément du reste du personnel, en ce qui concerne les audiences et les autres questions confidentielles liées au fonctionnement du Conseil. Le Secrétariat gère les activités du Conseil, y compris les réunions du Conseil, les consultations, les audiences et les processus connexes.
- Afin de préserver l’impartialité des membres du Conseil, aucun membre, à l’exception du président, ne reçoit d’information détaillée sur l’examen interne des renseignements présentés par les titulaires de droits ou sur les recommandations faites au président, et cela tant qu’un cas n’a pas été porté devant un panel d’audience lors d’une audience publique. Une fois l’audience entamée, le personnel représente l’intérêt public en tant que partie opposée au titulaire de droits à l’audience publique. Par conséquent, le personnel ne prend part à aucune communication ex parte avec les membres du panel d’audience au sujet de l’audience. Les interactions entre le personnel et les membres du panel d’audience se déroulent selon les Règles de pratique et de procédure du CEPMB aux fins des audiencesNote de bas de page 4. De même, les membres qui ne siègent pas au panel d’audience ne discutent pas de l’audience avec les membres du panel d’audience.
Rôle général des Lignes directrices
- En vertu du paragraphe 96(4) de la Loi sur les brevets, le CEPMB peut, s’il le souhaite, formuler des lignes directrices non contraignantes (les « Lignes directrices ») sur des questions relevant de sa compétence.
- Le Conseil n’a pas la capacité ou les ressources administratives de tenir des audiences sur chaque médicament breveté relevant de sa compétence. Par conséquent, le Conseil a besoin d’un mécanisme pour établir l’ordre de priorité des cas que le personnel recommande au président en vue de la tenue d’une audience.
- Ainsi, comme il a été décrit dans l’introduction, le Conseil a rédigé les présentes Lignes directrices à titre de guide pour le personnel et pour définir, par souci de transparence envers les parties intéressées, le processus par lequel le personnel détermine les cas qui pourraient faire l’objet d’une recommandation d’audience au président. Les Lignes directrices visent à garantir une équité procédurale et une cohérence, de sorte que la procédure et les délais soient les mêmes pour tous les titulaires de droits qui se trouvent dans une situation similaire.
- Puisque la Loi prévoit que le Conseil ne doit prendre en compte les facteurs énoncés au paragraphe 85(2) que s’il est incapable de déterminer si le médicament est vendu ou a été vendu à un prix excessif après avoir pris en compte les facteurs du paragraphe 85(1), les présentes Lignes directrices ne portent que sur les facteurs du paragraphe 85(1) et n’abordent pas les considérations qui pourraient être soulevées qu’en vertu du paragraphe 85(2).
- Une fois que le personnel a suivi les processus décrits dans les présentes Lignes directrices, il informe le président s’il recommande la tenue d’une audience sur le prix d’un médicament breveté et lui fournit les renseignements pertinents. Le président décide par la suite s’il convient ou non de publier un avis d’audience.
- Lorsque le président décide s’il convient de publier un avis d’audience, sa décision relève exclusivement du rôle de direction qui lui est confié, à titre de premier dirigeant du CEPMB, au paragraphe 93(2) de la Loi. Cette décision reflète l’intérêt public de tenir une audience, et non le caractère excessif du prix d’un médicament breveté.
Compétence du CEPMB
- La Loi investit le CEPMB du pouvoir de déterminer si un titulaire de droits ou un ancien titulaire de droits d’une invention liée à un médicament vend ou a vendu son médicament à un prix excessif sur un marché canadien lorsque les critères énoncés ci-dessous s’appliquentNote de bas de page 5.
Titulaire de droits ou ancien titulaire de droits
- Selon la définition fournie au paragraphe 79(1) de la Loi, le « titulaire de droits » est « le titulaire d’un brevet et la personne ayant pour le moment droit à l’avantage d’un certificat de protection supplémentaire délivré à l’égard du brevet, ainsi que quiconque peut exercer tout droit d’un titulaire relativement à ce certificat ».
- Le CEPMB a également compétence sur l’ancien titulaire de droits d’une invention pour la période durant laquelle il était titulaire de droits (voir notamment les paragraphes 80(2) et 83(3)].
Invention du brevet liée au médicament
- Selon la jurisprudence actuelle, les principes suivants permettent de déterminer si une invention est liée à un médicament :
- L’invention brevetée est liée à un médicament si « elle est destinée à des médicaments ou à la préparation ou la production de médicaments, ou susceptible d’être utilisée à de telles fins »;
- De prime abord, il doit exister un rapport ou un lien logique entre l’invention présentée dans le brevet et le médicament, et ce lien peut être le médicament lui-mêmeNote de bas de page 6.
Médicament
- Un « médicament », aux termes du paragraphe 79(1) de la Loi, « s’entend notamment d’une drogue au sens de l’article 104 et d’un ingrédient médicinal ».
- L’article 104 de la Loi donne la définition suivante de « drogue » : « substance ou mélange de substances qui est fabriqué, vendu ou présenté comme pouvant servir à l’une des fins suivantes : a) le diagnostic, le traitement, l’atténuation, la prévention d’une maladie, d’un désordre, d’un état physique anormal ou de leurs symptômes, chez l’être humain ou les animaux; b) la restauration, la correction ou la modification des fonctions organiques chez l’être humain ou les animaux ».
- Le CEPMB a toujours considéré que ces définitions excluaient les instruments médicaux en soi (par opposition aux substances actives utilisées dans les instruments médicaux), les produits de diagnostic in vitro et les désinfectants qui ne sont pas utilisés in vivo.
Invention/brevet
- Selon le paragraphe 79(2) de la Loi, « une invention est liée à un médicament si elle est destinée à des médicaments ou à la préparation ou à la production de médicaments, ou susceptible d’être utilisée à de telles fins ».
- Les types d’inventions brevetées visant, entre autres, les éléments suivants peuvent être liées à un médicament :
- Des ingrédients actifs;
- Des procédés de fabrication;
- Un mode d’administration ou une forme posologique faisant partie intégrante de l’administration du médicament;
- Des indications ou utilisations;
- Des formulations.
Vente sur un marché canadien
- Le titulaire de droits ou l’ancien titulaire de droits doit vendre ou avoir vendu le médicament breveté « sur un marché canadien » (voir par exemple le paragraphe 83(1)].
- Le CEPMB examine le prix des médicaments brevetés vendus sans lien de dépendance par les titulaires de droit. Les ventes au Canada peuvent comprendre notamment les médicaments brevetés pour lesquels un avis de conformité (AC) ou un avis de conformité avec conditions (AC-C) a été délivré, les médicaments obtenus par l’entremise du Programme d’accès spécial et les médicaments figurant sur la Liste des médicaments utilisés pour des besoins urgents en matière de santé publiqueNote de bas de page 7. Le CEPMB n’a aucun pouvoir sur les prix demandés par des parties autres que les titulaires de droits, comme les prix pratiqués par les grossistes ou les détaillants, ou sur les honoraires des pharmaciens.
Présentation et protection des renseignements
- Le Règlement sur les médicaments brevetés (le « Règlement ») définit les renseignements que les titulaires de droits doivent présenter au CEPMB et les délais dans lesquels ils doivent être fournis. Ces renseignements portent notamment sur l’identification, le prix et les ventes des médicaments.
- La présentation des renseignements réglementés est obligatoire, et ni le Conseil ni son personnel ne peuvent modifier les exigences, accorder des exceptions ou prolonger les délais fixés par le Règlement.
- S’il apparaît que certains renseignements n’ont pas été fournis de la manière prescrite par le Règlement, le cas peut être porté à l’attention du président. Ce dernier peut recommander la formation d’un panel du Conseil qui, dans le cadre d’une audience, déterminera si la présentation de ces renseignements sera exigée au moyen d’une ordonnance.
- Autrement ou en plus, le cas peut être renvoyé au procureur général du Canada afin qu’il détermine si une procédure sommaire devrait être entamée au titre du paragraphe 76.1(1) de la Loi.
- Aux termes du paragraphe 87(1) de la Loi, les renseignements ou les documents fournis au CEPMB en application des articles 80, 81 ou 82 de la Loi, ou lors d’une procédure au titre de l’article 83, sont protégés et ne peuvent être communiqués sans l’autorisation de la personne qui les a fournis, sauf s’ils ont été divulgués dans le cadre d’une audience publique tenue en vertu de l’article 83. D’autres mesures de protection énoncées dans la Loi sur l’accès à l’information ou la Loi sur la protection des renseignements personnels peuvent s’appliquer.
- La réception de renseignements ou de documents fournis par les titulaires de droits ne signifie pas que le personnel ou les membres du Conseil en ont accepté, vérifié ou approuvé le contenu.
Processus d’examen
- Le diagramme suivant présente les processus généraux d’examen qui sont envisagés dans les Lignes directrices. Il est divisé en deux étapes ou rondes d’examen. La première étape est un examen initial ou un examen annuel. Tous les médicaments brevetés vendus au Canada y sont soumis, à quelques exceptions près (voir ci-dessous la rubrique « Dispositions particulières relatives aux plaintes »). À l’issue de la première étape, deux résultats sont possibles : a) aucun autre examen; b) examen approfondi. La deuxième étape s’applique uniquement aux médicaments brevetés ayant passé la première étape (examen initial ou examen annuel) et ayant été sélectionnés pour un examen approfondi. Le résultat de la deuxième étape sera soit : a) une recommandation de clôture de l’examen approfondi; b) une recommandation pour la tenue d’une audience.
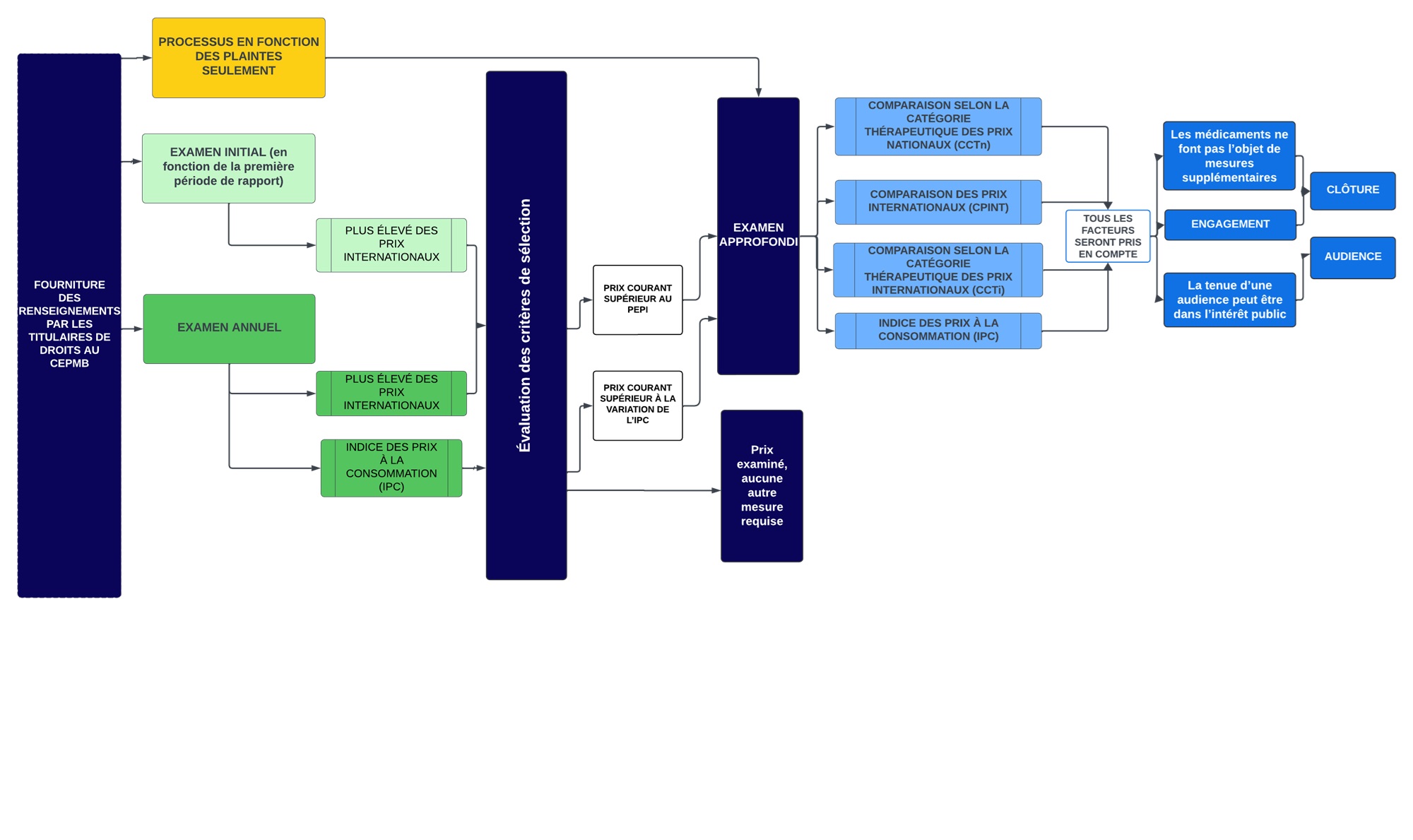
Description de la figure
Ce diagramme présente les processus généraux d’examen des médicaments brevetés qui sont envisagés dans les Lignes directrices. Il est divisé en plusieurs sections pour mettre en évidence les différentes étapes du processus.
Voici la description de la procédure :
- La première étape est un examen initial (vert pâle) ou un examen annuel (vert foncé). Tous les médicaments brevetés vendus au Canada y sont soumis, à quelques exceptions près (voir ci-dessous la rubrique « Dispositions particulières relatives aux plaintes »).
- Les plaintes (jaune) sont un processus distinct permettant de recenser les médicaments devant faire l’objet d’un examen approfondi.
- Examen initial (encadré vert pâle) :
- Le personnel procède à un examen initial en fonction du plus élevé des prix internationaux (PEPI) dans les pays inscrits à l’annexe, en se fondant sur le premier rapport semestriel que fournit le titulaire de droits au sujet du prix d’un médicament.
- Les médicaments brevetés dont le prix est supérieur au PEPI font l’objet d’un examen approfondi.
- Examen annuel (encadré vert foncé) :
- Le personnel procède à un examen annuel des prix courants de tous les médicaments brevetés relevant de la compétence du CEPMB.
- En ce qui concerne la CPINT, l’examen annuel et l’examen initial emploient les mêmes critères de sélection (le PEPI).
- Le personnel compare également la variation du prix de chaque médicament breveté aux variations de l’indice des prix à la consommation (IPC). Il s’agit de l’un des critères de sélection en fonction desquels les médicaments feront l’objet d’un examen approfondi.
- À l’issue de l’examen initial ou de l’examen annuel, deux résultats sont possibles : a) aucun autre examen; b) examen approfondi.
- L’examen approfondi (bleu pâle) est une démarche au cours de laquelle le personnel analyse et soupèse tous les renseignements se rapportant aux facteurs de l’article 85, afin de formuler une recommandation au président quant à la tenue d’une audience. L’examen approfondi aboutira à l’une ou l’autre des recommandations suivantes : a) recommandation de la clôture de l’examen approfondi; b) recommandation d’une tenue d’une audience.
- Lors de l’examen initial et des examens annuels, le personnel examine les médicaments brevetés en fonction des DIN. Si un DIN répond aux critères pour un examen approfondi, tous les DIN associésNote de bas de page 8 vendus par le titulaire de droits seront soumis à l’examen approfondi. Si plusieurs prix courants sont déclarés pour un médicament breveté au Canada ou dans un pays inscrit à l’annexe, le personnel retient le prix courant le plus élevé sur le marché visé, du moment que les prix déclarés par le titulaire de droits respectent les exigences du Règlement. S’il y a lieu de croire qu’un prix déclaré par le titulaire de droits n’est pas conforme au Règlement (p. ex. le prix indiqué semble être un prix de vente public plutôt que le prix départ-usine exigé par le Règlement, ou on soupçonne une erreur de typographie), le personnel peut communiquer avec le titulaire de droits au sujet d’une éventuelle correction des données.
- Lorsqu’il détermine le prix courant des médicaments de comparaison de même catégorie thérapeutique, le personnel retient le prix courant le plus élevé par comparateur. Les renseignements qu’utilise le personnel proviennent de sources publiques, et non des titulaires de droits, en ce qui a trait aux prix des médicaments de comparaison. Les prix canadiens sont normalement établis en fonction des listes provinciales de médicaments, tandis que les listes officielles des pays inscrits à l’annexe (lorsqu’elles sont disponibles) servent normalement à l’établissement des prix internationaux. Toutefois, dans le contexte d’une audience, le panel d’audience peut examiner tous les prix du médicament breveté et des comparateurs sans se limiter aux prix les plus élevés.
- Pour comparer les prix déclarés par les titulaires de droits dans les pays inscrits à l’annexe, le personnel convertit la monnaie locale en dollars canadiens en utilisant un taux de change correspondant à la moyenne simple des 36 taux de change mensuels moyens au comptant à midi, tels que publiés par la Banque du Canada pour chaque pays. Lors de l’examen initial d’un médicament breveté, on utilise généralement une période de 36 mois se terminant au deuxième mois de la période de référence précédente (c.-à-d. février ou août). Au cours des examens annuels, la période de 36 mois se terminant au deuxième mois de la période de référence à l’étude sert généralement à la conversion des prix déclarés par les titulaires de droits.
- Lorsqu’on détermine si un médicament breveté fera l’objet d’un examen approfondi, aucune « marge » n’est prévue pour les fluctuations du taux de change ou d’autres fluctuations temporaires des prix. Toutefois, le personnel peut examiner les fluctuations des taux de change dans le cadre de l’examen approfondi.
Première étape
Examen initial
- Le personnel procède à un examen initial en fonction du plus élevé des prix internationaux (PEPI) dans les pays inscrits à l’annexe, suivant l’alinéa 85(1)c) de la Loi, en se fondant sur le premier rapport semestriel que fournit le titulaire de droits au sujet du prix d’un médicament breveté. Lors de cet examen, le ou les prix courants d’un médicament breveté au Canada sont comparés aux renseignements fournis par le titulaire de droits au sujet du ou des prix courants du médicament dans les pays inscrits à l’annexe. Les nouveaux médicamentsNote de bas de page 9 seront examinés dès l’entrée en vigueur des Lignes directrices. Les médicaments existantsNote de bas de page 10 feront l’objet de mesures transitoires décrites dans le processus d’examen annuel (voir les paragraphes 53 et 54).
- Les médicaments brevetés dont le prix est supérieur au PEPI feront l’objet d’un examen approfondi. Comme il a été mentionné ci-dessus, lorsque le personnel examine les médicaments brevetés en fonction des DIN, si un DIN répond aux critères de réalisation d’un examen approfondi, les DIN associés seront soumis à l’examen approfondi.
- S’il est impossible de procéder à une comparaison des prix internationaux (CPINT) pendant l’examen initial parce qu’aucun prix courant n’a été communiqué pour le médicament dans l’un ou l’autre des pays inscrits à l’annexe, on considère que le prix courant a été examiné aux fins de l’examen initial, et ce prix ne sera pas réexaminé avant l’examen annuel. Autrement dit, une CPINT est effectuée si au moins un prix courant a été communiqué pour le médicament dans un pays inscrit à l’annexe.
- Selon la norme de service relative aux examens initiaux, le personnel dispose de 60 jours, après la date limite de dépôt du premier rapport semestriel, pour informer les titulaires de droits si leurs médicaments brevetés feront l’objet d’un examen approfondi.
Examen annuel
- Le personnel procède à un examen annuel des prix de tous les médicaments brevetés relevant de la compétence du CEPMB, à compter du mois de janvier de chaque année. Cet examen vise à déterminer si un examen approfondi est requis. Les « nouveaux médicaments » et les « médicaments existants » sont assujettis au même processus d’examen annuel, à la différence que l’examen des médicaments existants débutera deux ans après l’entrée en vigueur des présentes Lignes directrices.
- Mesures transitoires : Le personnel appliquera seulement le critère de sélection du CPINT (le PEPI) lors du premier examen annuel des médicaments existants, qui aura lieu deux (2) ans après la date d’entrée en vigueur des présentes Lignes directrices. Le critère de sélection de l’indice des prix à la consommation (IPC) sera appliqué lors de l’examen annuel suivant. Les médicaments existants seront seulement soumis à l’examen approfondi lors de cette période de deux ans s’ils sont visés par une plainte (dont le processus est décrit ci-dessous, dans la section « Dispositions particulières relatives aux plaintes ») ou s’ils sont un DIN associé à un médicament soumis à un examen approfondi.
- La norme de service est la même que pour les examens initiaux : le personnel dispose de 60 jours, après la date limite de dépôt du rapport semestriel en janvier, pour informer les titulaires de droits si leurs médicaments brevetés feront l’objet d’un examen approfondi. En ce qui concerne la CPINT, l’examen annuel et l’examen initial emploient les mêmes critères de sélection (le PEPI) et la même méthodologie (p. ex. taux de change, sélection du prix lorsque plusieurs prix sont fournis pour un pays, etc.). Toutefois, l’examen annuel porte sur les plus récentes données fournies au sujet des prix au pays et à l’étranger.
- Il convient de noter que, puisque lors de l’examen annuel, le personnel comparera le ou les prix courants d’un médicament breveté avec le PEPI en fonction des prix courants en vigueur dans les pays inscrits à l’annexe, des changements dans le PEPI pourraient rendre le seuil applicable plus bas ou plus élevé dans les années suivantes par rapport à son niveau initial, en fonction de l’évolution du contexte international. Par exemple, si un médicament breveté, auparavant répertorié uniquement dans certains des pays inscrits à l’annexe, est ensuite répertorié dans un autre pays de l’annexe à un prix plus élevé que dans les pays d’origine, le seuil de prix pour initier un examen approfondi augmentera en conséquence. De même, si le prix le plus élevé dans les autres pays de l’annexe où le médicament est disponible baisse, cela signifie que le seuil deviendra plus bas au fil du temps. Ces changements sont pris en compte dans le cadre de l’examen approfondi.
- Au cours d’un examen annuel, le personnel compare également la variation du prix de chaque médicament breveté aux variations de l’IPC. Il s’agit de l’un des critères de sélection en fonction desquels les médicaments feront l’objet d’un examen approfondi.
- Si la CPINT s’avère impossible à effectuer parce qu’aucun prix courant n’est déclaré pour le médicament breveté dans les pays inscrits à l’annexe, seules une variation de l’IPC ou la réception d’une plainte pourront motiver la réalisation d’un examen approfondi.
- Si l’examen approfondi d’un médicament breveté n’est pas terminé au début d’une période subséquente d’examen annuel, le nouvel examen annuel du médicament n’aura pas lieu.
- Après la clôture de l’examen approfondi d’un médicament breveté, ce médicament ne fait l’objet d’aucun autre examen approfondi pendant les deux périodes subséquentes de rapport.
Variations de l’indice des prix à la consommation (IPC)
- Les prix courants sont évalués en fonction de la variation de l’IPC chaque année, à l’aide de l’IPC retardé d’un an (p. ex. : pour les médicaments brevetés examinés en 2028, le personnel comparera les augmentations des prix courants en 2027 aux facteurs de l’IPC de 2026, publiés par Statistique Canada en janvier 2027). Si un titulaire de droits augmente le prix courant d’un médicament breveté d’un montant supérieur à la variation de l’IPC au cours d’une année donnée, le personnel entreprendra un examen approfondi du médicament, à moins que le titulaire de droits n’ait pas augmenté le prix courant au cours de l’année précédente et que l’augmentation de la deuxième année n’excède pas la variation totale de l’IPC sur ces deux années. Quand il établit s’il faut procéder à un examen approfondi, le personnel ne tient pas compte des variations que l’IPC a subies avant les deux dernières années. Toutefois, la variation totale de l’IPC sur plus de deux ans peut être prise en compte dans l’examen approfondi.
- Pour calculer l’IPC, le personnel emploie l’« Indice des prix à la consommation mensuel, non désaisonnalisé » publié par Statistique CanadaNote de bas de page 11.
- Tous les examens approfondis se déroulent ensuite de la même façon, y compris ceux motivés par des augmentations du prix courant supérieures aux variations de l’IPC.
Dispositions particulières relatives aux plaintes
- Le processus relatif aux plaintes est une mesure administrative de surveillance et de protection dont le but est de tenir compte de situations qui n’auraient pas été signalées lors du processus d’examen habituel. Le CEPMB se sert de ce mécanisme pour remplacer les examens approfondis périodiques réalisés sur des médicaments sélectionnés au hasard.
- Les médicaments génériques, les médicaments en vente libre et les médicaments à usage vétérinaire brevetés ne font l’objet d’un examen approfondi que si une plainte est reçue d’une personne ou d’une organisation approuvée (voir le paragraphe 68).
- De plus, pour tous les autres médicaments brevetés, un examen approfondi aura automatiquement lieu si une personne ou une organisation approuvée (voir le paragraphe 68) dépose une plainte concernant le prix excessif d’un médicament breveté sur un marché canadien. Cette condition s’applique indépendamment de la satisfaction des critères de l’examen initial ou annuel, pourvu qu’il ait été déterminé que le médicament relève de la compétence du CEPMB.
- Le processus relatif aux plaintes sera mis en œuvre une fois que les Lignes directrices seront entrées en vigueur et s’appliquera aux nouveaux médicaments et aux médicaments existants. Plus précisément, les médicaments visés par une plainte reçue avant qu’ils fassent l’objet d’un examen annuel (voir le paragraphe 53 ci-dessus) seront soumis à un examen approfondi, pourvu que le médicament relève de la compétence du CEPMB.
- Un examen approfondi sera mené à la réception d’une plainte par les personnes ou organisations approuvées, à savoir :
- le ministre fédéral de la Santé ou l’un de ses homologues provinciaux ou territoriaux;
- les cadres supérieurs autorisés à représenter les programmes publics d’assurance médicaments canadiens.
- Le ministre fédéral de la Santé et ses homologues provinciaux sont des personnes autorisées à déposer une plainte conformément à leur statut spécial au titre des paragraphes 86(2 ) et 87(2) de la Loi. Les programmes publics d’assurance médicaments canadiens relèvent habituellement de leur ministre de la Santé respectif ou de son équivalent.
- Les plaintes d’autres parties ne donnent pas lieu à des examens approfondis. Les autres parties qui souhaitent soulever des préoccupations au sujet du prix courant d’un médicament breveté peuvent s’adresser au ministre de la Santé ou au programme public d’assurance médicaments canadien concernés, qui pourront déposer une plainte en leur nom auprès du CEPMB.
- Les personnes et les organisations approuvées peuvent déposer une plainte en suivant le processus indiqué sur la page « Comment déposer une plainte » du site Web du CEPMB. Aucun renseignement relatif au plaignant n’est transmis au titulaire de droits du médicament breveté visé par la plainte, à moins que la loi ne l’exige . Le CEPMB ne rend publics ni les renseignements sur le plaignant ni le nom du médicament breveté faisant l’objet de la plainte et de son titulaire de droits, sauf si la plainte donne lieu à une audience ou si la loi l’exige. Le plaignant n’est pas tenu de fournir des documents ou des éléments de preuve au CEPMB et, s’il choisit de le faire, le personnel ne tient compte que des renseignements qui se rapportent aux facteurs énoncés au paragraphe 85(1).
- En raison des restrictions prévues aux articles 87 et 88 de la Loi sur les brevets et dans la Loi sur l’accès à l’information, l’information communiquée au plaignant se limite à un accusé de réception de sa plainte. Le résultat de l’examen approfondi ne lui sera communiqué que si le processus mène à un engagement ou à un avis d’audience. Plus précisément, en raison de ces obligations de confidentialité, si aucune mesure n’est prise à la suite d’un examen approfondi (c.-à-d. que le président clôt l’examen), le titulaire de droits est avisé, mais pas le plaignant.
- Tous les examens approfondis se déroulent ensuite de la même façon, y compris ceux qui sont motivés par une plainte.
Deuxième étape
Examen approfondi
- L’examen approfondi est une démarche au cours de laquelle le personnel analyse et soupèse tous les renseignements se rapportant aux facteurs de l’article 85, afin de formuler une recommandation au président quant à la tenue d’une audience. L’examen approfondi est abordé plus en détail dans la présente section et les suivantes (« Examen scientifique : sélection et analyse de la comparaison selon la catégorie thérapeutique » et « Examen des prix »).
- Il convient de noter que l’emploi du PEPI comme critère de sélection pour l’examen initial et l’examen annuel repose sur des considérations liées à l’efficacité administrative et à la bonne répartition des ressources. Ce choix ne présuppose d’aucune façon que les prix supérieurs ou inférieurs au PEPI sont excessifs ou non. Le Conseil reconnaît que seuls les panels d’audience peuvent déterminer, dans le cadre d’une audience, si le prix d’un médicament est excessif, d’après l’ensemble des facteurs énoncés au paragraphe 85(1) de la Loi. Par conséquent, il est possible qu’un prix supérieur ou inférieur au PEPI soit jugé excessif ou non, selon la façon dont le panel d’audience analyse les facteurs et les renseignements propres au cas examinéNote de bas de page 12. Ces principes guident le travail du personnel lorsqu’il effectue un examen approfondi. Aussi, tous les prix fournis dans les pays inscrits à l’annexe sont pris en compte dans un examen approfondi.
Lettres de report
- Si les ressources sont limitées, le personnel priorisera les médicaments brevetés dont le prix est nettement supérieur au PEPI ou dont l’augmentation du prix courant dépasse largement l’IPC. Ainsi, selon les ressources internes dont dispose le CEPMB, les autres médicaments brevetés peuvent faire l’objet de lettres de report. Il est possible que certains médicaments brevetés dont le prix courant dépasse le PEPI puissent faire l’objet de plusieurs reports, en fonction des ressources internes du CEPMB. Les lettres de report ne modifient pas le calcul des recettes excédentaires effectué par un panel d’audience, et les recettes éventuellement accumulées pendant la période de report sont prises en compte, car seul un panel d’audience peut déterminer, à la suite d’une audience, le montant et la période utilisés dans le calcul de recettes excédentaires.
Examen scientifique : sélection et analyse de la comparaison selon la catégorie thérapeutique
- Le personnel de l’équipe scientifique se compose de professionnels de la santé ayant une formation, un parcours et une expérience considérables dans divers domaines de la pratique clinique, de l’évaluation des médicaments et de l’utilisation des médicaments. Quand un examen approfondi est déclenché, le personnel de l’équipe scientifique détermine les médicaments de comparaison qui serviront à la comparaison selon la catégorie thérapeutique (CCT). Des comparateurs sont déterminés au début de l’examen approfondi pour chaque indication ou utilisation approuvée du médicament breveté visé. Afin de répartir le mieux possible les ressources de l’équipe scientifique, seules les indications ou les utilisations approuvées du médicament breveté à l’étude seront prises en compte dans la CCT pendant les examens approfondis. S’il est établi que le médicament breveté est employé à d’autres fins que les indications approuvées, ces autres indications pourraient être prises en compte lors d’une audience.
- Tous les produits ayant la même indication ou la même utilisation que le médicament à l’étude seront recensés en vue de la CCT. Les évaluations de la CCT sont menées pour chaque indication en fonction de l’ensemble de la population traitée, plutôt qu’en fonction des besoins de patients particuliers. Elles ne visent pas à prendre en compte l’ensemble des situations ou des besoins propres à certains patients. Les évaluations de la CCT sont réalisées aux seules fins des examens internes du CEPMB en vertu des Lignes directrices; elles ne sont pas destinées à l’utilisation dans les audiences du CEPMB ni à l’utilisation par des tiers dans un contexte clinique ou médical ou pour l’évaluation de médicaments. Les évaluations de la CCT restent confidentielles pour le titulaire de droits et ne sont pas communiquées à des tiers par le CEPMB, sauf si la loi l’exige.
- Chaque médicament de comparaison se voit attribuer un degré de similitude avec le médicament breveté sur lequel porte l’examen approfondi, conformément à la procédure en deux étapes énoncée ci-dessous. Un degré de comparabilité est attribué à chaque comparateur trouvé par indication. Les formes posologiques comparables sont également établies à cette étape. La concentration du produit pharmaceutique est déterminée en fonction du schéma posologique à l’étude. En règle générale, le schéma posologique correspond à une période de traitement pour les indications aiguës, tandis qu’un schéma quotidien (correspondant à la dose d’entretien) est utilisé pour les indications chroniques.
Étape 1 : Évaluation qualitative
| Catégorie qualitative | Exemple de justificationNote de bas de page 13 |
|---|---|
A |
Médicament comparable : L’innocuité et l’efficacité sont comparables et ont été établies au moyen d’essais de comparaison directe ou de méta-analyses de grande qualité. Mêmes recommandations ou utilisations thérapeutiques que le médicament breveté à l’étude. |
B |
Comparabilité partielle : Selon la littérature scientifique, l’efficacité, l’innocuité ou les résultats évalués par les patients diffèrent sensiblement de ceux du médicament breveté à l’étude (ils peuvent être supérieurs ou inférieurs). Recommandations ou utilisations thérapeutiques similaires à celles du médicament breveté à l’étude. |
C |
Comparabilité incertaine : Le médicament pourrait être utilisé à la place du médicament breveté à l’étude dans bon nombre de situations, mais la littérature disponible ne permet pas d’établir avec certitude la comparabilité. |
D |
Aucune donnée : Il est impossible d’évaluer la comparabilité avec le médicament breveté à l’étude, faute de données publiées de qualité. |
X |
Aucun comparateur. Ne pas effectuer l’étape 2*. |
*Remarque : La catégorie qualitative X est attribuée si, au cours de la CCT, un médicament breveté se révèle être le seul traitement efficace vendu au Canada pour une maladie ou une indication particulière. Ce médicament n’a donc pas de comparateurs.
Étape 2 : Évaluation du groupe
| Groupe | Description du médicament de comparaison |
|---|---|
1 |
Même classification ATC au 4e niveau†; indication ou utilisation sensiblement similaire à celle du médicament breveté à l’étude selon Santé Canada. |
2 |
Classification ATC différente au 4e niveau; indication sensiblement similaire à celle du médicament breveté à l’étude selon Santé Canada. |
3 |
Même classification ATC au 4e niveau; indication ou utilisation au Canada sensiblement similaire à celle du médicament breveté à l’étude selon la littérature, mais cette indication ou utilisation n’est pas attestée par Santé Canada. |
4 |
Classification ATC différente au 4e niveau; indication ou utilisation au Canada sensiblement semblable à celle du médicament breveté à l’étude selon la littérature, mais cette indication ou utilisation n’est pas attestée par Santé Canada. |
† Système de classification anatomique, thérapeutique et chimique publié par l’Organisation mondiale de la Santé |
|
- À titre d’exemple, si un médicament breveté a trois médicaments de comparaison, ceux-ci pourraient appartenir respectivement aux catégories B2, A1 et D2.
- Les titulaires de droits sont généralement informés de la sélection des médicaments de comparaison pour chaque indication ou utilisation approuvée dans les huit mois suivant le début de l’examen approfondi. Ce délai peut être plus long si le personnel décide de consulter le Groupe consultatif sur les médicaments pour usage humain (GCMUH).
- Au cours de l’examen scientifique, cette évaluation ne tient pas compte du prix du médicament breveté à l’étude ni de celui des médicaments de comparaison. L’analyse vise plutôt à déterminer dans quelle mesure les médicaments de la même catégorie thérapeutique sont comparables au médicament breveté soumis à l’examen approfondi. Ces renseignements serviront ensuite à la réalisation de la CCT prévue à l’alinéa 85(1)b).

Description de la figure
Ce tableau illustre le spectre de la comparabilité, qui varie de « plus comparable » (en haut à gauche) à « moins comparable » (en bas à droite). L’axe horizontal représente la catégorie qualitative (A, B, C, D), tandis que l’axe vertical indique les groupes (1, 2, 3, 4). La figure montre efficacement comment la comparabilité diminue progressivement d’une catégorie qualitative à l’autre (de gauche à droite) et d’un groupe à l’autre (de haut en bas).
La comparabilité se distingue visuellement par la couleur :
- Vert : comparabilité élevée (p. ex. : A1, A2 et B1)
- Bleu : comparabilité moyenne (p. ex. : A3, A4, B2, B3, C1, C2, D1)
- Jaune, orange et rose : comparabilité basse (p. ex. : B4, C3, C4, D2, D3 et D4)
| Comparabilité élevée | Comparabilité moyenne | Comparabilité basse |
|---|---|---|
|
|
|
Description de la figure
Ce tableau est constitué de trois colonnes, chacune montrant des exemples de caractéristiques dans les catégories de comparabilité. La première colonne est axée sur la catégorie de comparabilité élevée, la deuxième sur la catégorie de comparabilité moyenne et la troisième sur la catégorie de comparabilité basse.
Comparaison selon la catégorie thérapeutique des prix nationaux (CCTn)
- L’examen scientifique de la CCTn comprend une évaluation distincte des indications ou utilisations approuvées actuelles du médicament breveté sur lequel porte l’examen approfondi. Si les indications ou les utilisations approuvées au Canada venaient à changer, ces changements seraient pris en compte dans un examen approfondi subséquent. Une évaluation distincte de la CCTn est préparée pour chaque indication ou utilisation approuvée. Les médicaments employés pour la même indication thérapeutique que celle à l’étude peuvent être inclus dans la CCTn d’un médicament breveté, quelles que soient les indications ou utilisations approuvées de ces médicaments, si leur inclusion est justifiée. Autrement dit, la CCTn peut comprendre comme médicaments de comparaison des produits génériques ou biosimilaires (brevetés ou autres) si les données montrent qu’il est pertinent de les inclure.
Comparaison selon la catégorie thérapeutique des prix internationaux (CCTi)
- En général, le personnel de l’équipe scientifique utilise les médicaments de comparaison inclus dans la CCTn pour effectuer la CCTi. Cette façon de procéder est la plus rapide et la plus facile à mettre en œuvre, ce qui favorise une répartition optimale des ressources du Conseil. Toutefois, elle ne reflète pas nécessairement les comparateurs thérapeutiques qui sont disponibles dans chacun des pays inscrits à l’annexe.
- Dans certains cas, le personnel de l’équipe scientifique peut également effectuer une CCTi qui comprend des listes de comparateurs par pays inscrit à l’annexe. Certaines circonstances peuvent inciter le personnel de l’équipe scientifique à analyser séparément les médicaments de comparaison dans chacun des pays inscrits à l’annexe, par exemple si les notions scientifiques sont particulièrement complexes; si la catégorie thérapeutique risque de différer considérablement d’un pays à l’autre en raison des indications du médicament breveté visé par l’examen approfondi; ou si l’étude des autres facteurs énumérés au paragraphe 85(1) montre qu’une audience pourrait être indiquée et qu’il est judicieux de consacrer des ressources supplémentaires à l’analyse.
Communication d’information sur la comparabilité aux titulaires de droits
- Quand le personnel de l’équipe scientifique a fini d’évaluer les médicaments de comparaison, les titulaires de droits reçoivent la liste des comparateurs ayant des schémas posologiques comparables (CCTn ou CCTi), la cote de comparabilité de chaque comparateur, une liste des références examinées et un résumé des justifications par comparateur évalué.
- Les titulaires de droits peuvent, à leur discrétion, fournir des renseignements que le personnel pourra évaluer aux fins de la CCT. Ces renseignements peuvent être transmis au début de l’examen scientifique et après la réception de l’évaluation. Toutefois, si les titulaires de droits souhaitent soumettre des renseignements, ils sont encouragés à le faire dans les plus brefs délais après la réception d’un avis d’examen approfondi. Les titulaires de droits n’ont pas de contraintes particulières à respecter lorsqu’ils soumettent des documents écrits pour un examen scientifique ou qu’ils réagissent à la CCT proposée, et ils peuvent fournir tous les renseignements qu’ils jugent utiles. L’information transmise pourrait éventuellement comprendre des commentaires et une analyse du médicament breveté provenant de sources pertinentes. Il serait particulièrement utile pour le personnel de l’équipe scientifique que le titulaire de droits expose clairement, dans les documents transmis, la raison d’être de ses propositions concernant le degré de comparabilité, les médicaments pouvant faire l’objet de comparaisons et les schémas posologiques comparables. Ces renseignements pourraient comprendre des données concernant les indications du médicament breveté à l’étude et ses comparateurs potentiels, une courte description du médicament breveté et de ses utilisations thérapeutiques, ainsi qu’un résumé des données cliniques disponibles. Les données cliniques de haut niveau peuvent comprendre des essais de phase III (ou des essais de phase II, si l’on ne dispose pas encore d’essais de phase III), des méta-analyses ou des revues systématiques de grande qualité et des comparaisons directes avec les médicaments de comparaison utilisés pour chaque indication à l’étude.
Groupe consultatif sur les médicaments pour usage humain (GCMUH)
- Le GCMUH est un organisme consultatif consistant en un ensemble défini de professionnels de la santé indépendants auxquels le CEPMB fait appel dans ses évaluations scientifiques, au besoin, en raison de leurs vastes connaissances générales de la pharmacothérapie, de l’évaluation des médicaments, de l’utilisation des médicaments et des méthodes de recherche clinique.
- Le personnel peut consulter de manière ponctuelle le GCMUH, en totalité ou en partie, lorsque le personnel a besoin d’un avis supplémentaire sur des sujets particuliers. Le GCMUH n’est pas un organisme décisionnel, et les titulaires de droits ne peuvent pas demander que le GCMUH examine leur médicament breveté. Si le personnel décide de consulter le GCMUH, les renseignements fournis par le titulaire de droits en vue de l’examen scientifique seront transmis au GCMUH s’ils ont été reçus avant que le GCMUH examine le médicament breveté. Le personnel peut aussi, sans y être obligé, demander l’avis d’experts ou spécialistes contractuels autres que ceux du GCMUH, s’il le juge nécessaire.
- Le rôle du GCMUH n’est pas de trancher les différends entre le personnel et les titulaires de droits au sujet de la sélection ou de l’importance relative des médicaments de comparaison, et il n’est pas prévu que le GCMUH soit consulté plus d’une fois au sujet d’un médicament breveté au cours d’un examen approfondi. Le rôle du GCMUH consiste plutôt à formuler des recommandations sur les comparateurs et les schémas posologiques comparables afin d’offrir une aide ponctuelle au personnel scientifique du CEPMB.
Sources
- Quand il établit la cote de comparabilité des médicaments inclus dans la CCT, le personnel de l’équipe scientifique consulte les sources suivantes :
- Classification ATC;
- Indications ou utilisations approuvées, ou indications proposées, le cas échéant;
- Littérature médicale disponible;
- Évaluations cliniques réalisées par des organismes reconnus d’évaluation des technologies de la santé (p. ex. Agence des médicaments du Canada, INESSS, OMS, NICE, etc.);
- Renseignements fournis par écrit par le titulaire de droits (le cas échéant);
- Recherches menées par un centre d’information sur les médicaments (CIM). Le personnel peut faire appel aux services de divers CIM pour obtenir des renseignements scientifiques, notamment des renseignements sur les essais cliniques et les directives de pratique clinique. La base de l’examen du CIM est la monographie du produit (ou des renseignements similaires à ceux contenus dans une monographie de produit si un AC n’a pas été accordé). Les titulaires de droits fournissent les monographies de produits (et les renseignements similaires) conformément au Règlement;
- Recherches menées par le personnel. Le personnel peut mettre à jour les recherches et compléter les données et les éléments de preuve du titulaire de droits et du CIM en utilisant d’autres sources;
- Groupe consultatif sur les médicaments pour usage humain (GCMUH) du CEPMB. Le personnel peut, de façon ponctuelle, consulter le GCMUH quant aux aspects cliniques des renseignements scientifiques à I’étude;
- Lignes directrices ou déclarations consensuelles de groupes cliniques canadiens ou étrangers reconnus concernant le traitement à l’aide du médicament breveté à l’étude pour l’indication approuvée par Santé Canada.
Examen des prix
- Parallèlement à l’examen scientifique, le personnel entame l’examen du prix du médicament breveté en attendant les résultats de l’examen scientifique. S’ils le souhaitent, les titulaires de droits peuvent fournir à l’équipe d’examen des prix des renseignements qui concernent les facteurs autres que la CCT énumérés au paragraphe 85(1). Ces renseignements doivent être présentés dans les trois mois suivant la communication d’un avis d’un examen approfondi. Comme pour l’examen scientifique, les titulaires de droits sont libres de choisir les renseignements complémentaires qu’ils fournissent et que le personnel pourra considérer dans l’examen des facteurs énumérés au paragraphe 85(1). Le personnel peut exclure de son examen approfondi certains renseignements ou documents fournis par les titulaires de droits s’ils ne s’appliquent qu’à l’analyse prévue au paragraphe 85(2) ou qu’ils ne concernent pas les facteurs énumérés au paragraphe 85(1) de la Loi. Le personnel peut inclure dans sa recommandation au président tous les renseignements complémentaires pertinents que lui ont fournis les titulaires.
- Une fois l’examen scientifique terminé, le personnel ajoute les renseignements sur les prix à l’analyse de la CCT. Dans la CCT, le prix des médicaments tient compte des schémas thérapeutiques de chaque médicament et de l’indication figurant dans l’examen scientifique.
- Le personnel examine et analyse tous les renseignements relatifs au médicament breveté et à son prix qui sont fournis conformément aux articles 3 et 4 du Règlement, de même que les renseignements recueillis par le personnel en lien avec les facteurs énumérés à l’article 85 de la Loi. Ces renseignements concernent :
- le prix du médicament au Canada;
- le prix du médicament dans les pays inscrits à l’annexe;
- la sélection et l’analyse de la CCT;
- les variations de l’lPC au cours de la période à l’étude.
- Le personnel examine tous les renseignements recueillis et recommande au président soit la clôture de l’examen approfondi (avec ou sans engagement), soit la tenue d’une audience. L’annexe « Évaluation individuelle des facteurs énumérés au paragraphe 85(1) » présente des exemples de la façon dont le personnel entreprend son évaluation des renseignements recueillis en tenant d’abord compte de chacun des facteurs individuellement. L’annexe « Pondération individuelle des facteurs dans l’examen approfondi » contient des exemples de la façon habituelle dont le personnel établit l’importance relative des facteurs du paragraphe 85(1) lorsqu’il prépare sa recommandation. Il est à noter que l’analyse ne fournit pas de prix plafond, de prix recommandé ou de décision quant au caractère excessif ou probablement excessif d’un prix; elle aboutit plutôt à une recommandation sur la pertinence de tenir une audience.
- En plus des renseignements ci-dessus, la recommandation comprend la documentation transmise par le titulaire de droits et toute proposition d’engagement. Chaque recommandation est examinée par le directeur principal, Réglementation et liaison auprès des brevetés et par le directeur général du CEPMB, de façon à garantir la cohérence des analyses et de la recommandation subséquente.
- En général, un examen approfondi prend de 12 à 28 mois, selon sa complexité (p. ex. nombre de médicaments de comparaison lors de l’examen scientifique, calculs relatifs à la CPINT).
- Les titulaires de droits dont les médicaments brevetés sont soumis à un examen approfondi ne peuvent pas se soustraire ou mettre fin à cet examen en modifiant unilatéralement leurs prix courants une fois qu’il est lancé. Toutefois, les titulaires de droits peuvent en tout temps proposer des engagements au président entre le moment où ils apprennent que leur médicament breveté fait l’objet d’un examen approfondi et jusqu’à deux mois après le moment où ils sont informés que le personnel recommande la tenue d’une audience. Si un titulaire de droits soumet une proposition d’engagement au début de l’examen approfondi, le personnel peut interrompre l’examen pour gérer les ressources pendant que le président étudie l’engagement.
Recommandations
- Si, au terme d’un examen approfondi, il est recommandé au président de publier un avis d’audience, le personnel informe le titulaire de droits de cette recommandation quand il la présente au président. En ce qui concerne les analyses d’examen des prix faites par le personnel, l’information transmise aux titulaires de droits se limite aux éléments fournis dans le cadre de l’examen scientifique (voir le paragraphe 86 ci-dessus). Avec les renseignements fournis au sujet de l’examen scientifique, la variation de l’IPC (une donnée accessible au public) et les prix du médicament breveté dans les pays inscrits à l’annexe (qui sont communiqués par le titulaire de droits), le titulaire de droits devrait pouvoir cerner les raisons pour lesquelles le personnel recommande la tenue d’une audience sur son médicament breveté. Les titulaires de droits ont deux mois, à partir du moment où la recommandation leur est communiquée, pour présenter une proposition d’engagement au président. Le président examinera la proposition d’engagement et rendra sa décision dans un délai d’un mois après l’avoir reçue ou au plus tard trois mois après la réception de la recommandation du personnel.
- Si le président décide de clore un examen approfondi, le personnel en avise le titulaire de droits.
- Si le président décide qu’il est dans l’intérêt public de tenir une audience, le titulaire de droits en est avisé. Si un titulaire de droits visé par un avis d’audience souhaite régler l’affaire avant la fin de l’audience, le titulaire de droits peut négocier une entente de règlement avec le panel d’audience.
Engagements et propositions de règlement
- Les engagements sont des promesses unilatérales faites par les titulaires de droits et non des ententes exécutoires. Par conséquent, les engagements et les discussions qui s’y rapportent ne sont pas couverts par le privilège relatif aux règlements et la règle des communications faites « sous toutes réserves » ne s’applique pas.
- Les titulaires de droits sont avisés lorsqu’un examen approfondi est entrepris. Les titulaires de droits peuvent soumettre un engagement à tout moment pendant l’examen approfondi et jusqu’à deux mois après avoir été avisés que le personnel recommande une audience au président. Tout engagement présenté est soumis au président.
- Puisque les engagements sont unilatéraux et que les Lignes directrices ne portent pas sur la conformité des prix, ni le personnel ni le président ne conseillent les titulaires de droits quant au contenu d’une proposition d’engagement, et ils n’en négocient pas les modalités. Le président tient compte de tous les engagements reçus, et s’il estime, au vu des modalités de l’engagement, qu’il ne serait pas dans l’intérêt public de tenir l’audience recommandée, il demande au personnel de clore l’examen approfondi, et aucun avis d’audience n’est délivré. Les engagements acceptés par le président visent la résolution d’un examen approfondi particulier et n’offrent pas de garantie quant aux prix futurs. Le médicament breveté restera soumis aux examens des prix prévus dans les Lignes directrices tant qu’il relèvera de la compétence du Conseil.
- Il faut préciser que le personnel ne calcule pas les recettes excédentaires potentielles au cours de l’examen approfondi, et ce calcul n’entre pas en ligne de compte dans la recommandation au président, laquelle est fondée uniquement sur le prix courant. Si un titulaire de droits propose un engagement qui prévoit le remboursement des recettes excédentaires potentielles, le personnel examine le calcul des recettes excédentaires indiqué par le titulaire de droits en fonction non pas des prix courants, mais des renseignements communiqués par le titulaire de droits, conformément au Règlement, au sujet du prix de vente moyen par emballage et/ou des recettes nettes (prix de transaction moyen).
- Après la publication d’un avis d’audience, l’affaire peut seulement être réglée par la fin de la procédure devant le panel d’audience ou un règlement. Les engagements ne sont plus une option. Quand un avis d’audience a été publié, il reste au titulaire de droits la possibilité d’obtenir l’approbation d’un règlement officiel par le panel d’audience. Toutes les propositions de règlement doivent être présentées au panel d’audience et nécessitent son approbation. Une requête en abandon de procédure est habituellement employée dans ces situations, sur la base du règlement proposé. Après la délivrance d’un avis d’audience, les négociations et les discussions avec le personnel au sujet d’une proposition de règlement peuvent se dérouler « sous toutes réserves » et sont assujetties au privilège relatif aux règlements (voir l’analyse détaillée des processus d’audience à la section « Audiences sur les prix » ci-dessous).
- Le CEPMB rend publics tous les engagements acceptés par le président et tous les règlements acceptés par les panels d’audience. Les renseignements communiqués comprennent habituellement le nom du médicament breveté et/ou du titulaire de droits, ainsi que toute autre information utile. Ces renseignements figurent dans le Rapport annuel du CEPMB et sont publiés sur le site Web du CEPMB. Ils peuvent également se retrouver dans La Nouvelle ou d’autres publications.
Audiences sur les prix
- Les audiences du CEPMB débutent par la publication d’un avis d’audience, transmis aux parties intéressées selon les dispositions de la Loi.
- Les audiences du CEPMB sont publiques et ont un caractère « de novo », ce qui signifie que le panel d’audience reprend du début l’examen de la Loi et de la preuve. Les audiences du CEPMB ne visent pas à examiner l’application des Lignes directrices ou les mesures prises par le personnel avant la publication de l’avis. Lors d’une audience, un panel d’audience, composé d’au moins deux membres du Conseil, entend les observations et les éléments de preuve des parties. Le panel d’audience détermine si un médicament breveté est ou a été vendu à un prix excessif sur un marché canadien en tenant compte des renseignements disponibles concernant les facteurs énumérés à l’article 85 de la Loi. Les Lignes directrices ou leur application au médicament breveté visé par l’audience ne restreignent d’aucune façon le pouvoir discrétionnaire du panel d’audienceNote de bas de page 14.
- De plus amples renseignements sur les audiences se trouvent dans les Règles de pratique et de procédure du CEPMBNote de bas de page 15, l’ensemble des procédures établies publié à l’intention de toutes les parties participant à des audiences devant le CEPMB. Les procédures établies dans ces Règles suivent les exigences de la Loi, à savoir que dans la mesure où les circonstances et l’équité le permettent, le CEPMB tranche les questions soumises à son attention sans formalisme, en procédure expéditive. Les instructions relatives à la pratique et d’autres renseignements au sujet des audiences en cours ou passées sont à la disposition du public sur le site Web du CEPMB.
- Conformément à l’article 83 de la Loi, lorsque, à la suite d’une audience, le Conseil estime que le titulaire de droits vend le médicament breveté à un prix excessif sur un marché canadien, le Conseil peut, par ordonnance, lui enjoindre de baisser le prix de vente maximal du médicament dans ce marché.
- De plus, si, à la suite d’une audience, le Conseil estime que le titulaire de droits ou l’ancien titulaire de droits a vendu, alors qu’il était titulaire des droits, le médicament breveté sur un marché canadien à un prix excessif, le Conseil peut, par ordonnance, lui enjoindre de compenser, selon lui, les recettes excédentaires qu’aurait procurées au titulaire de droits la vente du médicament au prix excessif. Bien que les présentes Lignes directrices exigent que le personnel évalue le prix courant d’un médicament breveté en fonction de certains critères, dans les cas antérieurs où le Conseil a rendu une ordonnance exigeant le remboursement de recettes excédentaires, ce calcul a tenu compte du prix de transaction net ou moyen du médicament.
- Si, à la suite d’une audience, le Conseil estime que le titulaire de droits ou l’ancien titulaire de droits s’est livré à une politique de vente du médicament breveté à un prix excessif, « compte tenu de l’envergure et de la durée des ventes à un tel prix » (voir le paragraphe 83(4) de la Loi), le Conseil peut, par ordonnance, lui enjoindre de compenser, selon lui, au plus le double de l’excédent procuré par la vente au prix excessif. Comme mentionné précédemment, ces calculs tiennent compte du prix de transaction net ou moyen du médicament breveté.
- Le Conseil peut exiger qu’un titulaire de droits ou un ancien titulaire de droits prenne l’une ou plusieurs des mesures suivantes pour compenser les recettes excédentaires :
- Baisser, dans un marché canadien, le prix de vente du médicament;
- Baisser, dans un marché canadien, le prix de vente de tout autre médicament breveté du titulaire de droits;
- Payer à Sa Majesté du chef du Canada la somme précisée.
Glossaire et liste des acronymes et des abréviations
Ces définitions sont fournies à titre indicatif seulement et n’incluent que les termes qui ne sont pas déjà définis à l’article 79 de la Loi; elles n’ont aucune valeur juridique et doivent être lues conjointement avec les dispositions législatives en vigueur.
ATC : Classification anatomique, thérapeutique et chimique décrite par l’Organisation mondiale de la Santé.
CCT : comparaison selon la catégorie thérapeutique.
CCTi : comparaison selon la catégorie thérapeutique des prix internationaux.
CCTn : comparaison selon la catégorie thérapeutique des prix nationaux.
CEPMB11 : Allemagne, Australie, Belgique, Espagne, France, Italie, Japon, Norvège, Pays-Bas, Royaume-Uni et Suède.
CPINT : comparaison des prix internationaux.
DIN : numéro d’identification du médicament attribué par Santé Canada.
DIN associés : tous les DIN déclarés au CEPMB par le titulaire de droits comme étant liés à la ou les mêmes inventions brevetées que le DIN soumis à l’examen approfondi (voir le Règlement sur les médicaments brevetés, alinéas 3(1)g), h) et i)).
GCMUH : Groupe consultatif sur les médicaments pour usage humain.
IPC : indice des prix à la consommation.
Médicament existant : médicament breveté vendu pour la première fois avant le 1er juillet 2022.
Nouveau médicament : médicament breveté vendu pour la première fois le 1er juillet 2022 ou après cette date.
Pays inscrits à l’annexe : pays figurant actuellement à l’annexe du Règlement sur les médicaments brevetés.
PEPI : plus élevé des prix internationaux, pour la même concentration et la même forme posologique du médicament breveté, parmi les pays inscrits à l’annexe.
Prix courant : prix départ-usine brut (avant tout rabais ou escompte) fourni par le titulaire de droits conformément aux sous-alinéas 4(1)f)(i) ou (ii) du Règlement.
Annexes
Évaluation individuelle des facteurs énumérés au paragraphe 85(1)
L’annexe « Évaluation individuelle des facteurs énumérés au paragraphe 85(1) » et l’annexe « Pondération individuelle des facteurs lors de l’examen approfondi » ont pour objet de fournir un certain degré de transparence et de prévisibilité quant au processus, de façon à garantir la cohérence des examens approfondis. Elle n’a pas pour objet de traiter des résultats des examens approfondis.
Lorsqu’il entreprend un examen approfondi, le personnel commence par examiner séparément chacun des facteurs énumérés au paragraphe 85(1). Pendant cette phase de l’examen, le personnel prend notamment en compte les renseignements suivants :
85(1)a) le prix de vente du médicament sur un tel marché
- Combien de prix courants différents ont été déclarés par le titulaire de droits du médicament?
- Y a-t-il des différences de prix d’un marché à l’autre? Quelle est l’ampleur de la différence?
- Comment les prix ont-ils évolué au fil du temps? Ont-ils augmenté? Diminué?
- Ce médicament est-il offert en d’autres concentrations au Canada? Leurs prix sont-ils égaux? Proportionnels? Linéaires?
- Comment le prix moyen par emballage (ou les recettes nettes) déclaré par le titulaire de droits se compare-t-il au prix courant? Des avantages ont-ils été déclarés?
- Le médicament a-t-il été soumis à un processus d’appel d’offres? Le titulaire de droits a-t-il déclaré des ventes contractuelles?
- Le médicament a-t-il été généricisé? La version générique est-elle « autorisée » par le titulaire de droits? Comment son prix se compare-t-il à celui de la version générique?
- Le médicament fait-il l’objet d’un engagement (ou un engagement de conformité volontaire suivant les anciennes Lignes directrices)? Si oui, le prix est-il conforme aux termes de cet engagement?
- Le médicament fait-il l’objet d’une ordonnance émise par un panel du Conseil? Si oui, est-il conforme à cette ordonnance?
85(1)b) le prix de vente de médicaments de la même catégorie thérapeutique sur un tel marché
- Le médicament est-il un produit d’extension de gamme? Un produit mixte? Un biosimilaire? Un générique breveté?
- Combien d’indications approuvées ce médicament compte-t-il?
- Combien de médicaments de comparaison ont été recensés au cours de l’examen scientifique?
- Les comparateurs ont-ils la même indication que le médicament? Sont-ils plutôt utilisés de la même façon sans avoir une même indication approuvée?
- Quel est le degré de similitude entre les médicaments de comparaison?
- Quel est l’écart entre les coûts de traitement? Est-il étroit ou faible?
- Y a-t-il des valeurs aberrantes élevées ou faibles parmi les coûts de traitement?
- Certains médicaments de comparaison ont-ils été généricisés?
- Si le médicament est un médicament biologique breveté, existe-t-il des comparateurs biosimilaires?
- Le titulaire a-t-il exprimé son désaccord sur un aspect quelconque de l’examen scientifique? Si oui, pour quels motifs?
85(1)c) le prix de vente du médicament et d’autres médicaments de la même catégorie thérapeutique à l’étranger
- Si l’examen approfondi a été entrepris parce que le prix courant dépassait le PEPI, de combien le dépassait-il?
- Quel est le nombre de pays de comparaison déclarés pour le médicament?
- Quel est l’écart entre les prix du médicament dans les pays inscrits à l’annexe? Est-il étroit ou faible?
- Comment le prix du médicament au Canada se compare-t-il aux prix dans les autres pays inscrits à l’annexe en général?
- Le nombre de pays de comparaison a-t-il changé au fil du temps? Si oui, de quelle façon?
- Prévoit-on que les renseignements d’autres pays s’ajouteront à ceux communiqués? Si oui, pourquoi?
- Une baisse de prix (dans la monnaie locale) a-t-elle été déclarée pour l’un des pays de comparaison?
- Une hausse de prix (dans la monnaie locale) a-t-elle été déclarée pour l’un des pays de comparaison?
- Les taux de change ont-ils eu une incidence sur le PEPI?
- Les médicaments de comparaison établis lors de l’examen scientifique sont-ils offerts dans l’ensemble des pays inscrits à l’annexe?
- Comment les coûts de traitement du médicament se comparent-ils aux coûts de traitement des comparateurs dans l’ensemble des pays de comparaison?
- Si le prix du médicament est constamment plus élevé ou plus bas que celui des médicaments de comparaison à l’échelle internationale, en est-il de même dans la CCTn?
85(1)d) les variations de l’indice des prix à la consommation
- Si l’examen approfondi a été entrepris parce que la hausse du prix courant dépassait celle de l’IPC, de combien la dépassait-elle?
- Y a-t-il une différence entre la valeur de l’IPC retardé d’un an utilisée comme critère de déclenchement et l’IPC de l’année où la hausse du prix courant s’est produite? Si oui, comment la hausse du prix courant se compare-t-elle aux deux mesures de l’IPC?
- Combien y a-t-il eu de hausses du prix courant de ce médicament, et comment chacune de ces hausses de prix se compare-t-elle à l’IPC?
- Comment la hausse cumulative, calculée depuis le lancement, se compare-t-elle à la variation cumulative de l’IPC sur la même période?
Autres questions possibles à examiner
- Comment la variation de l’IPC et la hausse correspondante du prix courant se comparent-elles aux variations des prix courants dans les pays inscrits à l’annexe?
- Ce médicament a-t-il déjà fait l’objet d’un examen approfondi? Si oui, quel en a été le résultat? Le contexte était-il différent ou identique?
- À quel moment le dernier brevet déclaré pour ce médicament arrive-t-il à échéance?
- Le titulaire de droits a-t-il un certificat de protection supplémentaire pour ce médicament? Si oui, quelle est sa date d’expiration?
- A-t-on reçu une plainte concernant le prix de ce médicament?
- Le titulaire de droits a-t-il communiqué des renseignements supplémentaires que devrait connaître le président en lien avec les facteurs examinés?
Pondération individuelle des facteurs lors de l’examen approfondi
L’objet de la présente annexe, « Pondération individuelle des facteurs lors de l’examen approfondi », est de fournir des renseignements généraux sur la façon dont le personnel peut établir l’importance relative des facteurs énumérés au paragraphe 85(1) lorsqu’il effectue un examen approfondi.
Toutes les recommandations découlant des examens approfondis sont vérifiées, à des fins de cohérence, par le directeur principal, Réglementation et liaison auprès des brevetés et par le directeur général avant la présentation au président pour examen.
Le personnel, en se fondant sur son analyse du cas (voir les exemples de questions à l’annexe « Évaluation individuelle des facteurs énumérés au paragraphe 85(1) »), recommande au président soit de publier un avis d’audience, soit de clore l’examen approfondi. Pour parvenir à cette recommandation, le personnel met en balance les renseignements relatifs aux facteurs énumérés au paragraphe 85(1), obtenus pendant l’examen approfondi. La recommandation du personnel au président n’est qu’un avis, et le président conserve sa pleine discrétion quant à la décision finale de publier un avis d’audience ou de clore l’examen approfondi.
Les examens approfondis étant menés au cas par cas, il est impossible de prévoir tous les scénarios d’examen possibles. Certaines dérogations peuvent aussi survenir par rapport à l’approche générale.
L’annexe « Exemples de cas » illustre au moyen d’exemples l’approche générale employée dans la présente annexe.
Recommandation d’audience
Certains scénarios feront probablement pencher la balance en faveur d’une recommandation d’audience :
- Le ou les prix courants canadiens sont supérieurs aux prix de référence de la CPINT et de la CCT.
- Certaines indications permettent de croire à l’existence d’« une politique de vente du médicament à un prix excessif » aux termes du paragraphe 83(4) de la Loi sur les brevets.
- Le ou les prix courants canadiens se situent entre ceux de la CPINT et de la CCT, et il y a un écart important entre le prix du ou des médicaments de comparaison les plus similaires et le prix de référence de la CPINT, surtout si les médicaments de comparaison sont très similaires et leurs prix sont inférieurs au prix de référence de la CPINT.
- La CCT s’avère impossible (aucun médicament de comparaison), le ou les prix courants canadiens sont supérieurs au prix de référence de la CPINT, et il y a un écart important entre le prix de référence de la CPINT et le ou les prix courants canadiens, surtout si l’écart ne semble pas être lié aux variations du taux de change.
- La CPINT s’avère impossible (aucun prix international), mais une CCT est possible (il existe des médicaments de comparaison), le ou les prix courants canadiens sont supérieurs aux prix de la CCT, et il y a un écart important entre le prix du ou des médicaments de comparaison les plus similaires et le ou les prix courants canadiens, surtout si le ou les médicaments de comparaison sont très similaires.
Recommandation de clôture
Certains scénarios feront probablement pencher la balance en faveur d’une recommandation de clôture :
- Le ou les prix courants canadiens sont inférieurs aux prix de référence de la CPINT et de la CCT.
- Le ou les prix courants canadiens se situent entre ceux de la CPINT et de la CCT, et il y a un écart négligeable entre le prix du ou des médicaments de comparaison les plus similaires et le prix de référence de la CPINT.
- La CCT s’avère impossible (aucun médicament de comparaison), le ou les prix courants canadiens sont supérieurs au prix de référence de la CPINT, et il y a un écart négligeable entre le prix de référence de la CPINT et le ou les prix courants canadiens, surtout si l’écart semble être lié aux variations du taux de change.
- La CPINT s’avère impossible (aucun prix international), mais une CCT est possible (il existe des médicaments de comparaison), le ou les prix courants canadiens sont supérieurs aux prix de la CCT, et il y a un écart négligeable entre le prix du ou des médicaments de comparaison les plus similaires et le ou les prix courants canadiens.
- La CPINT s’avère impossible (aucun prix international), mais une CCT est possible (il existe des médicaments de comparaison), et le ou les médicaments de comparaison les plus similaires présentent un degré de comparabilité plutôt faible par rapport au médicament à l’étude.
- Il semble que des erreurs de communication des données ou d’autres circonstances inhabituelles entraînent une fluctuation des prix temporaire, qui sera probablement résolue en l’espace d’une période de rapport.
- Le titulaire de droits a soumis un engagement qui entraînerait l’une des situations précédentes.
Exemples de cas
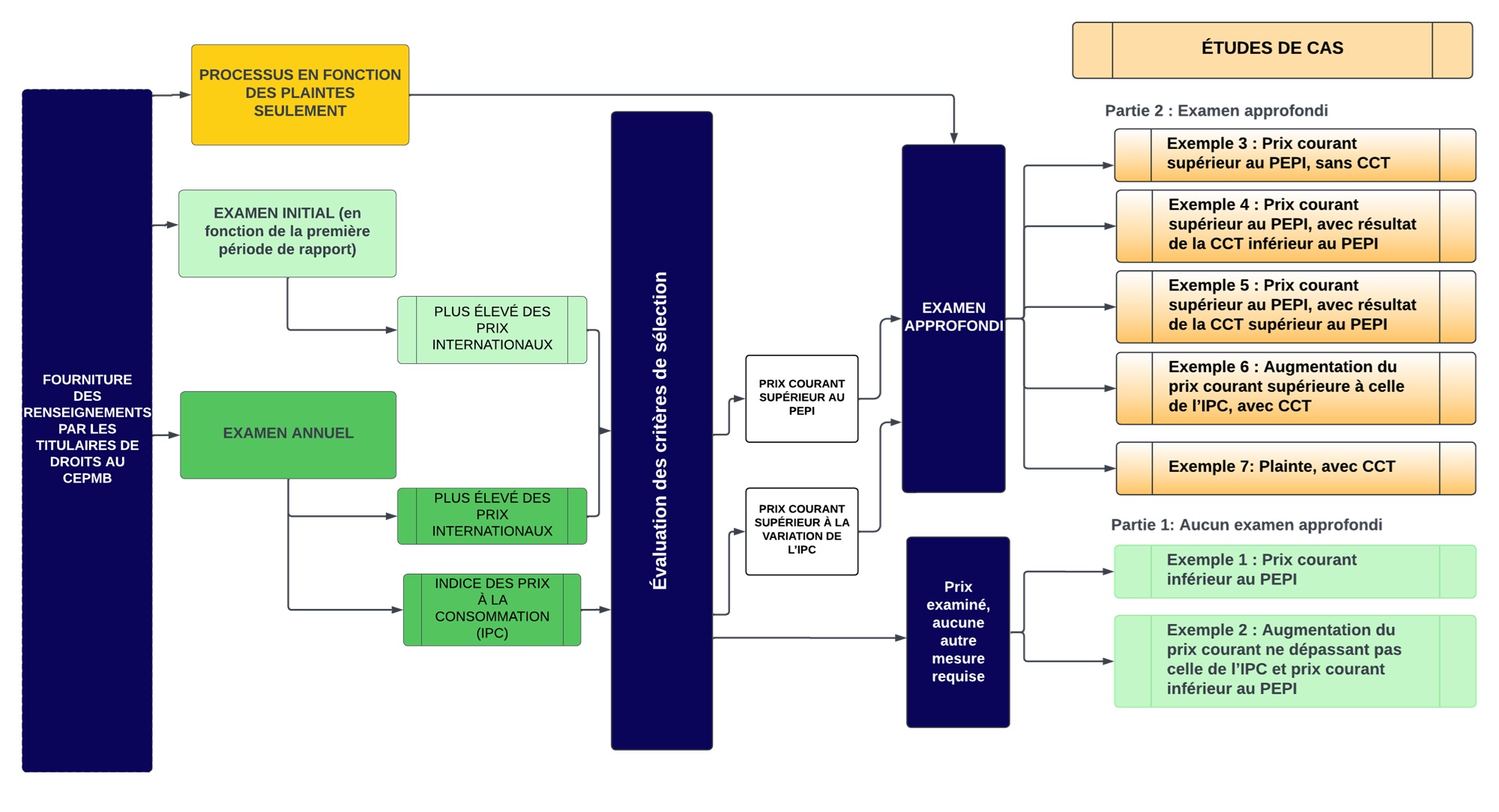
Description de la figure
Cet organigramme représente les processus généraux d’examen des médicaments brevetés qui sont envisagés dans les Lignes directrices. Il met en évidence les exemples visant à démontrer la façon dont le personnel peut évaluer les facteurs au cours du processus d’examen approfondi afin d’arriver à une recommandation au président. Les exemples sont divisés en deux parties. La partie 1 comprend des scénarios dans lesquels les critères de sélection ne sont pas remplis et il n’y a donc pas lieu de procéder à un examen approfondi. La partie 2 comprend des scénarios dans lesquels un examen approfondi est déclenché.
Aucun examen approfondi :
- Exemple no 1 : Prix courant inférieur au PEPI
- Exemple no 2 : Augmentation du prix courant ne dépassant pas celle de l’IPC et prix courant inférieur au PEPI
Examen approfondi :
- Exemple no 3 : Prix courant supérieur au PEPI, sans CCT
- Exemple no 4 : Prix courant supérieur au PEPI, avec résultat de la CCT inférieur au PEPI
- Exemple no 5 : Prix courant supérieur au PEPI, avec résultat de la CCT supérieur au PEPI
- Exemple no 6 : Augmentation du prix courant supérieure à celle de l’IPC, avec CCT
- Exemple no 7 : Plainte, avec CCT
Les exemples qui suivent, préparés à l’intention des parties intéressées, illustrent la façon dont le personnel peut évaluer les facteurs au cours du processus d’examen approfondi afin d’arriver à une recommandation au président.
Les exemples sont divisés en deux parties. La partie 1 comprend des scénarios dans lesquels les critères de sélection ne sont pas remplis et il n’y a donc pas lieu de procéder à un examen approfondi. La partie 2 comprend des scénarios dans lesquels un examen approfondi est déclenché. Les exemples correspondants illustrent le cadre décisionnel en fonction duquel le personnel du CEPMB pourrait formuler sa recommandation au président, selon son évaluation des renseignements disponibles sur les facteurs énoncés au paragraphe 85(1).
Ces exemples de cas ne sont pas exhaustifs et ne visent pas à couvrir tous les scénarios susceptibles de se présenter dans le cadre d’examens approfondis. Ils sont fournis à titre indicatif seulement. En particulier, il ne faut pas tenir compte de l’ampleur de l’écart entre les lignes et de la distance qui les sépare : les exemples ne visent qu’à représenter les positions relatives des lignes, et non la distance qui les sépare ou le poids précis.
| Partie | Exemples de cas |
|---|---|
|
1. Aucun examen approfondi |
Exemple no 1 : Prix courant inférieur au PEPI |
Exemple no 2 : Augmentation du prix courant ne dépassant pas celle de l’IPC et prix courant inférieur au PEPI |
|
|
2. Examen approfondi |
Exemple no 3 : Prix courant supérieur au PEPI, sans CCT |
Exemple no 4 : Prix courant supérieur au PEPI, avec résultat de la CCT inférieur au PEPI |
|
Exemple no 5 : Prix courant supérieur au PEPI, avec résultat de la CCT supérieur au PEPI |
|
Exemple no 6 : Augmentation du prix courant supérieure à celle de l’IPC, avec CCT |
|
Exemple no 7 : Plainte, avec CCT |
Vu l’importance accordée à la CCT dans les exemples de la partie 2, il est important de bien connaître le processus décrit dans la section « Examen scientifique : sélection et analyse de la comparaison selon la catégorie thérapeutique ». Au cours d’un examen, plusieurs médicaments de comparaison sont définis et classés par degré de comparabilité. Les exemples représentent des scénarios simplifiés.
La présentation de ces exemples n’entraîne aucune obligation pour le personnel ou le Conseil quant à la réalisation d’examens approfondis ou à la tenue d’audiences, et la méthode d’analyse peut être modifiée en fonction des circonstances de l’examen. Toutes les recommandations du personnel et les décisions du président et du Conseil dépendent des circonstances particulières du cas en question.
Partie 1 (Aucun examen approfondi)
Exemple no 1 : Prix courant inférieur au PEPI
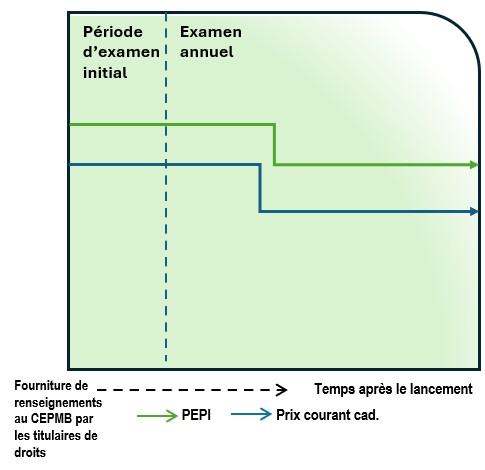
Description de la figure
Ce diagramme illustre l’exemple dans lequel, lors de l’examen initial, le prix courant canadien est inférieur au PEPI. Lors de la période d’examen annuel, le prix courant canadien et le PEPI diminuent avec le temps. Le prix courant canadien reste inférieur au PEPI. Ainsi, l’examen approfondi n’aura pas lieu. Le diagramme est divisé en deux sections, séparées par une ligne pointillée : la section de gauche représente la période d’examen initial, tandis que la section de droite représente la période d’examen annuel. La ligne bleue représente le prix courant canadien, et la ligne verte représente le PEPI.
Situation
- Lors de l’examen initial, le prix courant au Canada est inférieur au PEPI.
- Le PEPI tend à diminuer avec le temps, mais le prix courant au Canada diminue lui aussi.
- En l’absence d’augmentation du prix courant, les variations de l’IPC ne sont pas à prendre en compte.
- Aucune plainte n’est reçue concernant ce médicament.
Analyse
- Aucune analyse supplémentaire n’est nécessaire, car le médicament ne requiert pas d’examen approfondi.
Recommandation potentielle
- S.O. – Le médicament ne requiert pas un examen approfondi.
Exemple no 2 : Augmentation du prix courant ne dépassant pas celle de l’IPC et prix courant inférieur au PEPI
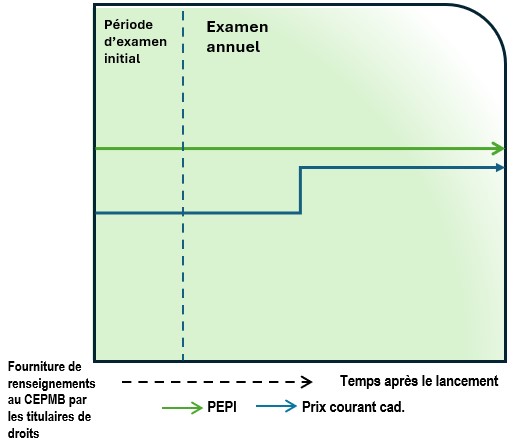
Description de la figure
Ce diagramme illustre l’exemple dans lequel, lors de l’examen initial, le prix courant canadien est inférieur au PEPI. Lors de la période d’examen annuel, l’augmentation du prix courant canadien est inférieure à celle de l’IPC. Ainsi, l’examen approfondi n’aura pas lieu. Le diagramme est divisé en deux sections, séparées par une ligne pointillée : la section de gauche représente la période d’examen initial, tandis que la section de droite représente la période d’examen annuel. La ligne bleue représente le prix courant canadien, et la ligne verte représente le PEPI.
Situation
- Lors de l’examen initial, le prix courant au Canada est inférieur au PEPI.
- Le PEPI ne fluctue pas dans le temps, mais le prix courant au Canada augmente.
- L’augmentation du prix courant est inférieure à celle de l’IPC.
- Aucune plainte n’est reçue concernant ce médicament.
Analyse
- Aucune analyse supplémentaire n’est nécessaire, car le médicament ne requiert pas d’examen approfondi.
Recommandation potentielle
- S.O. – Le médicament ne requiert pas un examen approfondi.
Partie 2 (Examen approfondi)
Exemple no 3 : Prix courant supérieur au PEPI, sans CCT
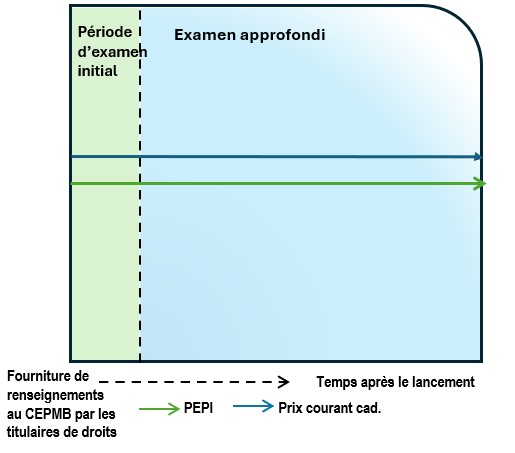
Description de la figure
Ce diagramme illustre l’exemple dans lequel, lors de l’examen initial, le prix courant canadien est supérieur au PEPI. Il en résulte un examen approfondi. Le diagramme est divisé en deux sections : la section verte représente la période d’examen initial, tandis que la section bleue représente la période d’examen approfondi. La ligne bleue représente le prix courant canadien, et la ligne verte représente le PEPI.
Situation
- Lors de l’examen initial, le prix courant au Canada est supérieur au PEPI. Il en résulte un examen approfondi.
Analyse
- Le déclenchement d’un examen approfondi donne lieu à un examen scientifique; cependant, il n’y a pas de comparateur de même catégorie thérapeutique, et il n’est pas possible d’effectuer une CCT.
- Au cours de l’examen approfondi, il est observé que le prix courant au Canada reste supérieur au PEPI, mais qu’aucune augmentation du prix courant n’est appliquée par le titulaire de droits.
- En l’absence de CCT et d’augmentation du prix courant à comparer à l’IPC, le seul facteur prévu au paragraphe 85(1) est le PEPI. Le personnel du CEPMB peut tenir compte de la différence entre le prix courant au Canada et le PEPI, du nombre de pays pour lesquels le prix du médicament a été déclaré, ainsi que de la fourchette des prix établis dans les pays du CEPMB11.
Recommandation potentielle
- Ce cas pourrait donner lieu à une recommandation de clôture de l’examen approfondi ou à un avis d’audience, en fonction du positionnement du prix courant au Canada par rapport à l’analyse plus complète du marché international.
Exemple no 4 : Prix courant supérieur au PEPI, avec résultat de la CCT inférieur au PEPI
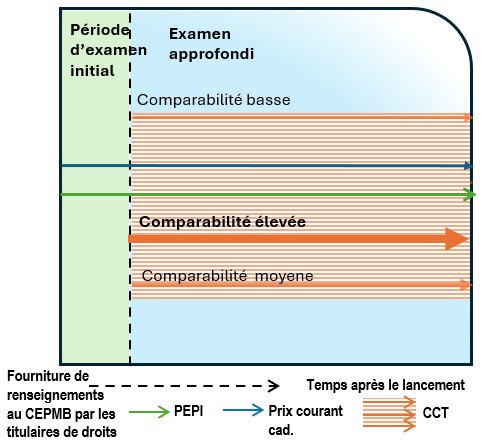
Description de la figure
Ce diagramme illustre l’exemple dans lequel, lors de l’examen initial, le prix courant canadien est supérieur au PEPI. Il en résulte un examen approfondi. Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue aussi le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude. Le diagramme est divisé en deux sections : la section verte représente la période d’examen initial, tandis que la section bleue représente la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente le PEPI et les lignes orange représentent les comparateurs de la CCT. Il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est inférieur au prix courant canadien et au PEPI.
Situation
- Lors de l’examen initial, le prix courant au Canada est supérieur au PEPI. Il en résulte un examen approfondi.
Analyse
- Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude.
- Bien qu’aucune augmentation du prix courant n’ait été appliquée par le titulaire de droits, l’analyse suggère que le prix courant au Canada est supérieur à la fois au PEPI et aux prix de la CCT.
- Le personnel du CEPMB peut tenir compte de la pertinence de la CCT ainsi que de la différence entre le prix courant au Canada et le PEPI, du nombre de pays où le prix du médicament a été déclaré et de la fourchette des prix établis dans les pays du CEPMB11.
Recommandation potentielle
- Le prix courant au Canada étant supérieur au PEPI et au prix de certains médicaments de comparaison de la CCT, il faudrait que le contexte particulier justifie le prix du médicament pour que le personnel du CEPMB recommande la clôture de l’examen approfondi. Il est plus probable qu’une recommandation d’avis d’audience soit émise dans ce cas, étant donné l’existence d’un médicament de comparaison dont la comparabilité est élevée et dont le prix est inférieur au prix courant au Canada et au PEPI.
Exemple no 5 : Prix courant supérieur au PEPI, avec résultat de la CCT supérieur au PEPI
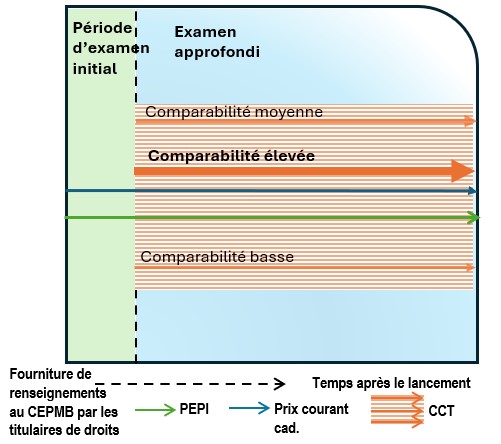
Description de la figure
Ce diagramme illustre l’exemple dans lequel, lors de l’examen initial, le prix courant canadien est supérieur au PEPI. Il en résulte un examen approfondi. Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue aussi le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude. Le diagramme est divisé en deux sections : la section verte représente la période d’examen initial, tandis que la section bleue représente la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente le PEPI et les lignes orange représentent les comparateurs de la CCT. Il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est supérieur au prix courant canadien et au PEPI.
Situation
- Lors de l’examen initial, le prix courant au Canada est supérieur au PEPI. Il en résulte un examen approfondi.
Analyse
- Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude. Il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est supérieur au prix courant canadien et au PEPI.
- Aucune augmentation du prix courant n’a été appliquée par le titulaire de droits, de sorte que le facteur de l’IPC n’est pas pris en compte.
- Le personnel du CEPMB peut tenir compte de la pertinence de la CCT ainsi que de la différence entre le prix courant au Canada et le PEPI, du nombre de pays où le prix du médicament a été déclaré et de la fourchette des prix établis dans les pays du CEPMB11.
Recommandation potentielle
Le prix courant au Canada étant supérieur au PEPI, mais inférieur au prix de certains médicaments de comparaison de la CCT, il faudrait que le contexte particulier justifie le prix du médicament pour que le personnel du CEPMB recommande la clôture de l’examen approfondi. Vu l’existence d’un médicament de comparaison dont la comparabilité est élevée et dont le prix est supérieur au prix courant canadien et au PEPI, le personnel recommandera probablement la clôture de l’examen approfondi.
Exemple no 6 : Augmentation du prix courant supérieure à celle de l’IPC, avec résultat de la CCT inférieur au PEPI
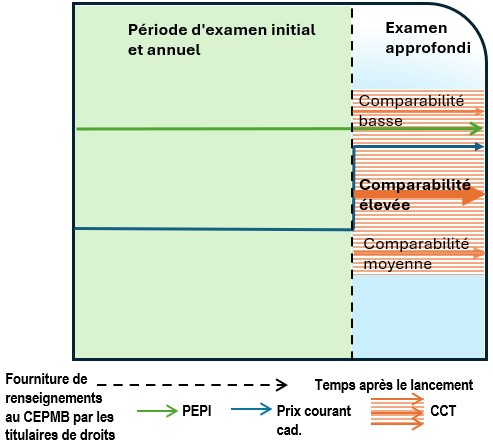
Description de la figure
Ce diagramme illustre l’exemple dans lequel, après une certaine période de commercialisation, le prix courant augmente plus que l’IPC. Il en résulte un examen approfondi. Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue aussi le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude. Le diagramme est divisé en deux sections : la section verte représente la période d’examen initial et la période d’examen annuel avant l’augmentation du prix, tandis que la section bleue représente la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente le PEPI et les lignes orange représentent les comparateurs de la CCT. Il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est supérieur au prix courant canadien et inférieur au PEPI.
Situation
- Après une certaine période de commercialisation, le prix courant augmente plus que l’IPC.
Analyse
- Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude. Il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est inférieur au prix courant canadien et au PEPI.
- Le personnel du CEPMB peut tenir compte de la pertinence de la CCT ainsi que de la différence entre le prix courant au Canada et le PEPI, du nombre de pays où le prix du médicament a été déclaré et de la fourchette des prix établis dans les pays du CEPMB11.
Recommandation potentielle
- Le prix courant au Canada est inférieur au PEPI. Vu l’augmentation supérieure à celle de l’IPC et le résultat inférieur de la CCT, il faudrait tenir compte du contexte particulier, y compris de la différence entre le prix courant au Canada et le PEPI, de l’ampleur de l’augmentation des prix et de la comparabilité relative de la CCT. Il est probable qu’une recommandation d’avis d’audience soit émise dans ce cas, étant donné l’existence d’un médicament de comparaison dont la comparabilité est élevée et dont le prix est inférieur au prix courant au Canada et au PEPI.
Exemple no 7 : Plainte, avec CCT
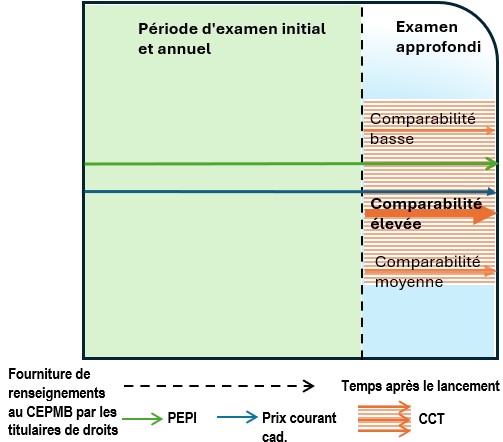
Description de la figure
Ce diagramme illustre l’exemple dans lequel le prix courant canadien est inférieur au PEPI et demeure inchangé. Après une certaine période de commercialisation, une plainte est reçue. Il en résulte un examen approfondi. Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue aussi le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude. Le diagramme est divisé en deux sections : la section verte représente la période d’examen initial et la période d’examen annuel avant la réception de la plainte, tandis que la section bleue représente la période d’examen approfondi. La ligne bleue représente le prix courant canadien, la ligne verte représente le PEPI et les lignes orange représentent les comparateurs de la CCT. Il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est inférieur au prix courant canadien et au PEPI.
Situation
- Au fil du temps sur le marché, le prix courant au Canada et le PEPI demeurent inchangés.
- Une plainte est reçue. Il en résulte un examen approfondi.
Analyse
- Le déclenchement de l’examen approfondi donne lieu à un examen scientifique. Cet examen permet de définir une catégorie thérapeutique contenant plusieurs comparateurs dont les prix se situent au-dessus et en dessous du prix courant au Canada et du PEPI. Au cours de l’examen scientifique, on évalue le degré de comparabilité des médicaments de comparaison avec le médicament à l’étude. Il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est inférieur au prix courant canadien et au PEPI.
- Le personnel doit prendre en compte la CCT, et la mettre en balance avec le PEPI et avec le fait que le prix courant n’a pas changé au Canada. La recommandation du personnel dépendra fortement du contexte de la CCT et de l’ampleur de l’écart de prix.
Recommandation potentielle
- Dans ce cas, il existe un médicament de comparaison dont la comparabilité est élevée et dont le prix est inférieur au prix courant au Canada et au PEPI. Il faudra soupeser l’importance de ces éléments en regard du fait que le prix courant au Canada est inférieur au PEPI. Dans une situation où le PEPI a beaucoup plus de poids que la CCT compte tenu du contexte, le personnel peut recommander que l’examen approfondi soit clos. Dans le cas contraire, le personnel peut recommander un avis d’audience.
Formes posologiques comparables
La présente annexe indique les formes posologiques comparables pour l’examen scientifique des médicaments brevetés. Les formulations d’un même groupe sont considérées comme étant comparables, mais les formes posologiques de groupes différents ne le sont pas.
Le CEPMB examine périodiquement la liste des formes posologiques comparables pour s’assurer qu’elle reste actuelle.
| Voie topique | Voie nasale (N) ou pulmonaire (P) | Solide administré par voie orale (S) |
|---|---|---|
Aérosol |
Aérosol
|
Bandelette
|
| Liquide administré par voie orale (L) | Voie vaginale (V) | Voie parentérale (J) |
Émulsion
|
Anneau à libération lente
|
Bolus
|
| Otique (E) ou ophtalmique (Y) | Voie rectale (R) | Voie dentaire, sublinguale ou buccale (M) |
Dispositif oculaire à libération modifiée
|
Bâtonnet
|
Bandelette
|