Lignes directrices pour l’analyse de l’incidence du prix d’un médicament
Lignes directrices pour l’analyse de l’incidence du prix d’un médicament sur les budgets des régimes d’assurance-médicaments

Juin 2020
ISBN : 978-0-660-34572-7
No. cat. : H82-49/2020F-PDF
Table des matières
- 1.0 Résumé
- 2.0 Objet
- 3.0 Contexte
- 4.0 Méthodologie : Révisions des Lignes directrices de 2007
- 5.0 Introduction
- 6.0 Recommandations concernant le cadre d’analyse
- 7.0 Recommandations relatives aux données et aux sources
- 7.1 Estimation de la taille actuelle du marché
- 7.2 Sélection des médicaments de comparaison pertinents
- 7.3 Prévision du marché : scénario de référence
- 7.4 Prévision du marché : scénario du nouveau médicament
- 7.5 Estimation des coûts en médicaments
- 7.5.1 Estimation du coût unitaire des médicaments actuellement admissibles à un remboursement
- 7.5.2 Estimation du coût unitaire des médicaments non remboursés par les régimes d’assurance-médicaments
- 7.5.3 Estimation des équivalences thérapeutiques
- 7.5.4 Inclusion des marges bénéficiaires, des honoraires du pharmacien et des co-paiements
- 7.6 Calcul de l’incidence sur le budget
- 8.0 Recommandations relatives au format du rapport
- 9.0 Modèle d’AIPMB interactif
- 10.0 Expressions et abréviations
- 11.0 Références
- Annexe A : Sommaire des lignes directrices sur l’AIPMB examinées
- Annexe B : Sommaire des modifications aux Lignes directrices pour l’AIPMB du CEPMB
- Annexe C : Liste de contrôle
Remerciements
La mise à jour de la version 2007 des Lignes directrices pour l’analyse de l’incidence du prix d’un médicament sur les budgets des régimes d’assurance-médicaments a été effectuée par le CEPMB, sous la surveillance et suivant les directives du Comité consultatif du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) et avec les conseils éclairés de EVERSANAMC (anciennement Cornerstone Research Group Inc.).
Le CEPMB tient à remercier les personnes suivantes d’avoir mis à profit leurs connaissances et leur expertise dans le cadre de l’élaboration et de la préparation du présent document.
Le personnel du CEPMB responsable de la gestion du projet – donner une orientation aux consultants externes, collaborer avec les intervenants clés et mettre à jour le contenu d’analyse et du texte d’accompagnement :
Direction du projet et analyse
Nevzeta Bosnic, analyste économique principal, SNIUMP
Yvonne Zhang, analyste économique principale, SNIUMP
Naghmeh Foroutan, Recherche et gestion des données, Élaboration de politiques
Surveillance
Tanya Potashnik, directrice, Direction des politiques et de l’analyse économique
Elena Lungu, gestionnaire, Élaboration de politiques
Jeffrey Menzies, gestionnaire, SNIUMP
Matthew Kellison, directeur, Direction de la réglementation et de la liaison auprès des brevetés
Publication et traduction
Carol McKinley, conseillère en publications, SNIUMP
Sarah Parker, agente de la publication, SNIUMP
Shirin Paynter, traduction, CEPMB
L’entreprise EVERSANAMC pour sa contribution à l’élaboration des Lignes directrices et du modèle d’analyse :
EVERSANAMC
Chris Cameron, vice-président principal
Heather Cameron, directrice principale
Diana Tran, directrice
Les participants et collègues du Comité consultatif du SNIUMP pour leur rétroaction utile et leurs commentaires sur la version provisoire des Lignes directrices :
Colombie-Britannique
Christine Voggenreiter (membre), directrice, Economic Analysis, Pharmaceutical Services Division (Analyses économiques, Division des services pharmaceutiques), ministère de la Santé de la Colombie-Britannique
Beverly Wan, directrice, Pharmaceutical Analytics, Integrated Analytics, Community & Cross Sector Branch, Health Sector Information, Analysis & Reporting Division (Analyses pharmaceutiques, Direction générale des analyses intégrées, des collectivités et des secteurs), ministère de la Santé de la Colombie-Britannique
Alberta
Sandra Rees (membre), conseillère en politiques sur les produits pharmaceutiques, Pharmaceuticals and Health Benefits (Produits pharmaceutiques et services de santé complémentaires), ministère de la Santé de l’Alberta
Jocelyn Milburn, directeur, Professional and Industry Relations, Pharmaceuticals and Supplementary Health Benefits (Relations professionnelles et industrielles, Produits pharmaceutiques et services de santé complémentaires), ministère de la Santé de l’Alberta
Saskatchewan
Erin Jennings (membre), gestionnaire, Strategic Financial Planning and Analysis, Drug Plan and Extended Benefits Branch (Planification et analyse stratégiques des finances, Direction de l’assurance-médicaments et des prestations d’assurance-maladie complémentaires), ministère de la Santé de la Saskatchewan
Rachel Cheruvallath, directrice, Pharmaceutical Policy and Appropriateness, Drug Plan and Extended Benefits Branch (Politiques et rectitude des produits pharmaceutiques, Direction de l’assurance-médicaments et des prestations d’assurance-maladie complémentaires), ministère de la Santé de la Saskatchewan
Mehdee Araee, économiste principal en santé, Pharmaceutical Policy and Appropriateness, Drug Plan and Extended Benefits Branch (Politiques et rectitude des produits pharmaceutiques, Direction de l’assurance-médicaments et des prestations d’assurance-maladie complémentaires), ministère de la Santé de la Saskatchewan
Manitoba
Patricia Caetano (membre), directrice exécutive, Provincial Drug Programs (Programme provincial d’assurance-médicaments), ministère de la Santé du Manitoba
Ontario
Angie Wong (membre), directrice, Direction des politiques et stratégies relatives aux programmes de médicaments, Division des médicaments et des appareils et accessoires fonctionnels, Programmes publics de médicaments de l’Ontario
Vivian Leong, gestionnaire principale, Direction des politiques et stratégies relatives aux programmes de médicaments, Unité de l'intégration et des politiques, Division des médicaments et des appareils et accessoires fonctionnels, Programmes publics de médicaments de l’Ontario
Vivian Ng, chef d'équipe, Direction des politiques et stratégies relatives aux programmes de médicaments, Unité de l'intégration et des politiques, Division des médicaments et des appareils et accessoires fonctionnels, Programmes publics de médicaments de l’Ontario
Mofakhar Hussain, économiste principal, Direction des politiques et stratégies relatives aux programmes de médicaments, Unité de l'intégration et des politiques, Division des médicaments et des appareils et accessoires fonctionnels, Programmes publics de médicaments de l’Ontario
Nouveau-Brunswick
Kevin Pothier (membre), directeur, Gestion des affaires, Services pharmaceutiques, ministère de la Santé du Nouveau-Brunswick
Nouvelle-Écosse
Holly Chisholm (membre), économiste principale, ministère de la Santé de la Nouvelle-Écosse
Lara Grant, gestionnaire, Programmes pharmaceutiques assurés
Kathleen Coleman, directrice, Formulary and Clinical Practice (Formulaires et pratique clinique)
Île-du-Prince-Édouard
Bonnie Corish (membre), pharmacienne consultante, Programme d’assurance-médicaments de l’Île-du-Prince-Édouard
Terre-Neuve-et-Labrador
Patricia Clark (membre), gestionnaire, Politique de programme et services professionnels, ministère de la Santé et des Services communautaires de Terre-Neuve-et-Labrador
Yukon
Jodi Giesbrecht (membre), gestionnaire intérimaire, Stratégies de gestion des prestations d’assurance-maladie complémentaires et des produits pharmaceutiques, ministère de la Santé et des Services sociaux du Yukon
SSNA
Susan Pierce (membre), gestionnaire, Groupe pharmaceutique, Division de la gestion des prestations, Programme des services de santé non assurés
ACMTS
Tarry Ahuja (observateur), gestionnaire, Élaboration de politiques et de programmes, Agence canadienne des médicaments et des technologies de la santé
Alexander Haines, gestionnaire, Économie de la santé, Agence canadienne des médicaments et des technologies de la santé
Bernice Tsoi, gestionnaire, Économie de la santé, Agence canadienne des médicaments et des technologies de la santé
Justin Reimer, économiste en santé, Agence canadienne des médicaments et des technologies de la santé
Karen Lee, directrice, Économie de la santé, Agence canadienne des médicaments et des technologies de la santé
ICIS
Jordan Hunt (observateur), gestionnaire, Pharmaceutique, Institut canadien d’information sur la santé
Québec
Dominic Bélanger (observateur), directeur intérimaire, Direction des affaires pharmaceutiques et du médicament, ministère de la Santé et des Services sociaux du Québec
Santé Canada
Nelson Millar (observateur), analyste principal des politiques, Bureau des stratégies de gestion des produits pharmaceutiques, Santé Canada
APP
Daniel Sperber (observateur), économiste principal, Bureau de l’Alliance pancanadienne pharmaceutique
Le CEPMB souhaite aussi souligner la contribution des membres de l’Institut national d’excellence en santé et en services sociaux (INESSS) Patrick Dufort, Marie-Ève Brouard et Thomas Mortier, qui ont discuté des Lignes directrices et en ont examiné la version révisée.
Avis de non-responsabilité
Ces lignes directrices sont fournies aux fins d’information uniquement. Toute utilisation ou interprétation de ces pratiques exemplaires sont uniquement et exclusivement à la discrétion de l’utilisateur. Sauf indication contraire formulée dans une entente écrite, le Conseil d’examen du prix des médicaments brevetés ne garantit ni n’affirme aucunement, d’une façon explicite ou autrement, que l’information présentée dans ces lignes directrices est exacte, pertinente et complète pour toute fin recherchée. Le Conseil d’examen du prix des médicaments brevetés n’assume aucune responsabilité à l’égard des mesures prises ni de l’inaction suite à la consultation des présentes lignes directrices.
Le SNIUMP est une initiative de recherche indépendante des activités réglementaires du Conseil du CEPMB. Les priorités de recherche, les données, les déclarations et les opinions présentées ou reproduites dans les rapports du SNIUMP ne représentent pas la position du CEPMB au sujet des questions réglementaires. Les rapports du SNIUMP ne contiennent pas d’information confidentielle ou protégée en vertu des articles 87 et 88 de la Loi sur les brevets, et la mention d’un médicament dans un rapport du SNIUMP ne revient pas à reconnaître ou à nier que le médicament fait l’objet d’une demande de brevet en vertu des articles 80, 81 ou 82 de la Loi sur les brevets ou que son prix est ou n’est pas excessif au sens de l’article 85 de la Loi sur les brevets.
Conflit d’intérêts
EVERSANAMC (anciennement Cornerstone Research Group Inc.) a fourni de l’information et des conseils au CEPMB dans le cadre de l’élaboration des Lignes directrices et du modèle. EVERSANAMC est une organisation de recherche et de services-conseils en économie de la santé travaillant aux termes d’un contrat d’envergure mondiale et ayant pignon sur rue au Canada. Entre autres activités, l’organisation élabore, pour le compte de ses clients, des analyses de l’incidence sur les budgets (AIP) au Canada devant être présentées aux régimes d’assurance-médicaments des gouvernements fédéral, provinciaux et territoriaux.
Renseignements connexes
Conseil d’examen du prix des médicaments brevetés
Centre Standard Life
C.P. L40, 333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Tél. : 1-877-861-2350
ATS : 613-288-9654
Courriel : PMPRB.Information-Renseignements.CEPMB@pmprb-cepmb.gc.ca
Lignes directrices pour l’analyse de l’incidence du prix d’un médicament : Sommaire des versions
Voir à l’annexe B la description détaillée des mises à jour effectuées aux Lignes directrices de 2007.
| Date de publication | Remarques et mises à jour |
|---|---|
Mai 2007 |
La première édition des Lignes directrices pour l’analyse de l’incidence du prix d’un médicament (AIPMB) sur les budgets des régimes d’assurance-médicaments au Canada est conçue à titre de première ressource pour l’élaboration d’AIPMP pharmaceutiques. |
Juin 2020 |
La deuxième édition des Lignes directrices pour l’AIPMB se fonde sur la première et comprend une méthodologie améliorée afin d’accroître la transparence et la cohérence des AIPMB présentées aux régimes publics d’assurance-médicaments canadiens. |
1.0 Résumé
1.1 Introduction
Les analyses de l’incidence du prix d’un médicament sur les budgets des régimes d’assurance-médicaments au Canada (AIPMB) servent à prédire et à comprendre l’impact financier éventuel du lancement de nouveaux produits pharmaceutiques sur un régime de remboursement des médicaments dont les ressources financières sont limitées [Référence 1]. Alors qu’une AIPMB porte sur l’impact financier d’un nouveau médicament, la valeur de ce dernier pour le système de soins de santé dans son ensemble est plutôt examinée au moyen d’autres analyses économiques, comme une analyse du rapport coût-efficacité (ARCE).
Au Canada, on utilise les AIPMB pour prendre des décisions éclairées en matière de remboursement. Les présentes lignes directrices fournissent une approche normalisée et des recommandations détaillées en ce qui concerne l’élaboration d’une AIPMB devant être soumise à l’Agence canadienne des médicaments et des technologies de la santé (ACMTS) ou à un régime fédéral, provincial ou territorial (FPT) d’assurance-médicaments.
Elles remplacent les lignes directrices publiées en mai 2007 par le Conseil d’examen du prix des médicaments brevetés (CEPMB). Bien que ces dernières étaient considérées comme une ressource de première importante pour la préparation d’AIPMB au Canada, elles ne reflètent plus les pratiques exemplaires actuelles. Les Lignes directrices de 2007 devaient être mises à jour afin de suivre les avancées dans les méthodes d’AIPMB exigées par les régimes publics d’assurance-médicaments canadiens, ainsi que les lignes directrices internationales en matière d’AIPMB.
1.2 Recommandations relatives aux AIPMB
Recommandations concernant le cadre d’analyse
Perspective
L’AIPMB doit être effectuée en adoptant comme perspective celle du régime d’assurance-médicaments concerné et elle doit porter sur les coûts liés aux médicaments qui ont un impact direct sur le budget de ce régime. Les coûts non liés aux médicaments sont généralement exclus de l’analyse principale; ils peuvent toutefois y être mentionnés ou y être présentés dans une analyse des scénarios.
Horizon prévisionnel
Les données servant à prévoir l’incidence d’un nouveau médicament sur le budget d’un régime d’assurance-médicaments doivent couvrir un horizon prévisionnel de quatre ans, plus précisément une période initiale d’un an ainsi qu’une période prévisionnelle de trois ans. Il arrive toutefois qu’il soit préférable d’adopter un horizon prévisionnel plus long. On recommande d’ailleurs une certaine souplesse à cet égard. Il est important que les prévisions et les résultats couvrent des périodes de 12 mois. Le modèle doit également donner une certaine marge de manœuvre quant aux cycles choisis.
Population
La population sous examen doit être définie à la lumière des données inscrites sur l’étiquette du médicament ou dans la monographie du médicament, des critères d’admissibilité ou de participation au régime et de tout autre critère limitant l’accès au médicament. La croissance du marché au fil des ans sera établie en fonction de la croissance prévue de la population cible, en rajustant comme il convient lorsque la disponibilité du médicament est susceptible d’avoir une incidence sur la taille du marché. L’analyse principale de l’AIPMB ne doit pas porter sur une indication non inscrite sur l’étiquette d’un nouveau médicament. Cette indication doit toutefois être évaluée dans une analyse de scénarios.
Scénarios de comparaison
Pour bien évaluer l’incidence budgétaire de l’inscription d’un médicament sur la liste des médicaments assurés, deux scénarios doivent être comparés, à savoir le scénario de référence, qui est établi en fonction du contexte actuel, et le scénario suivant lequel le nouveau médicament serait inscrit sur la liste des médicaments assurés d’un régime d’assurance-médicaments donné. Toutes les hypothèses associées à chaque scénario doivent être énoncées clairement et les données de référence à l’appui doivent être fournies.
Coûts en médicaments
Pour calculer le coût que sous-tend le remboursement d’un médicament pour un régime d’assurance-médicaments, il faut tenir compte du prix auquel le nouveau médicament serait remboursé, du montant du remboursement de tous les médicaments de comparaison et de tous les médicaments administrés en concomitance qui sont déjà remboursés par le régime en question. Les régimes d’assurance-médicaments exigent que les coûts des médicaments comprennent les marges bénéficiaires, les honoraires du pharmacien et la partie du paiement assumée par le patient qu’on appelle dans le jargon « co-paiement ». Par contre, les montants des primes et des franchises ne doivent pas être calculés dans le prix, sauf si le régime d’assurance-médicaments concerné l’exige.
Actualisation à la hausse ou à la baisse
Les résultats ne doivent pas être actualisés à la hausse ou à la baisse. Le modèle d’AIPMB peut permettre une modification des taux, si désiré.
Conception du modèle
Pour qu’il soit aussi transparent et facile d’accès que possible, le modèle d’AIPMB et le rapport qui l’accompagne doivent être conçus de manière à satisfaire les besoins des utilisateurs finaux et à aider ces derniers à comprendre comment le modèle fonctionne. Il faut retenir le modèle qui utilise la structure la plus simple possible, fournit des résultats exacts et répétitifs et est conçu au moyen d’un logiciel facilement accessible, comme Microsoft Excel. Les choix et les hypothèses examinés lors de l’élaboration du modèle seront expliqués en détail.
Caractérisation de l’incertitude
Il faut joindre au rapport d’AIPMB les analyses déterministes de la sensibilité et les analyses de scénarios afin d’informer les décideurs du degré de sensibilité du modèle face à certaines hypothèses. Des analyses probabilistes de sensibilité peuvent être ajoutées, sans toutefois être exigées.
Validation
La validité du modèle doit être évaluée et documentée.
Recommandations relatives aux données et aux sources
Estimation de la taille actuelle du marché
Pour estimer la taille du marché, les analystes peuvent concevoir leurs propres modèles en utilisant les données sur la population (épidémiologiques) ou les données sur les demandes de remboursement, ou encore les deux. Les données sur la population conviennent mieux lorsqu’il s’agit d’un nouveau médicament pénétrant un nouveau marché, alors que les données sur les demandes de remboursement sont généralement utilisées lorsqu’il s’agit d’un nouveau médicament lancé sur un marché établi. Par souci de transparence et d’exhaustivité, les modèles fondés sur les demandes de remboursement devraient fournir une estimation du nombre de bénéficiaires actifs, suivant le nombre de demandes pour le scénario de référence ainsi que le scénario associé à l’inscription d’un nouveau médicament.
Sélection des médicaments de comparaison pertinents
Les médicaments de comparaison utilisés pour le modèle d’AIPMB doivent refléter les stratégies de traitement médicamenteux employées pour traiter les mêmes indications que le nouveau médicament. Par souci de transparence, les coûts de la médication concomitante doivent être indiqués séparément. Les traitements non médicamenteux ne doivent pas être pris en compte dans l’analyse principale, mais ils doivent être inclus dans le rapport et possiblement dans l’analyse des scénarios, si on s’attend à ce qu’ils aient une incidence marquée. Les stratégies de traitement seront choisies à la lumière de celles employées dans l’évaluation économique jointe au rapport d’AIPMB, si possible.
Prévision du marché : scénario de référence
Les analystes doivent utiliser les prévisions pour prévoir les changements sur le marché. Les prévisions doivent tenir compte des changements devant survenir sur l’horizon prévisionnel et utiliser à cette fin les données disponibles. La croissance prévue du marché et la répartition des parts de marché entre les stratégies de traitement qui devraient être disponibles figurent au nombre de ces changements.
Prévision du marché : scénario du nouveau médicament
Les analystes doivent prévoir les changements à l’aide de données vérifiables sur l’incidence qu’aura le remboursement du nouveau médicament sur le marché. À cette fin, ils prendront en considération les données sur les marchés où le nouveau médicament est admissible à un remboursement. Ils estimeront le taux de croissance du marché, la part du marché que devrait alors accaparer le nouveau médicament, l’effet des restrictions imposées à son accès sur la taille ou sur la part du marché et, enfin, l’influence qu’aura le nouveau médicament sur la part de marché des différentes stratégies de traitement. Ces facteurs doivent être pris en compte pour l’ensemble de l’horizon prévisionnel et des données à l’appui de ces estimations doivent être fournies et expliquées.
Estimation des coûts en médicaments
Les analystes doivent estimer le prix de chaque stratégie de traitement en consultant les meilleures sources disponibles des prix auxquels les médicaments sont remboursés. Ces sources sont, entre autres, la liste des médicaments assurés du régime d’assurance-médicaments, les bases de données des régimes publics d’assurance-médicaments et les données des grossistes. Les analystes tiendront aussi compte des marges bénéficiaires, des honoraires du pharmacien et des co-paiements selon les spécifications du régime d’assurance-médicaments directement concerné. Lorsqu’ils comparent le coût quotidien des différentes stratégies de traitement, ils prendront en compte les équivalences thérapeutiques (c.-à-d. la fréquence d’administration du médicament) et le gaspillage (c.-à-d. le nombre d’unités du médicament délivrés par ordonnance, plutôt que le nombre d’unités consommées). Les analystes examineront l’incidence de la conformité et de la constance de la thérapie sur le coût du traitement, s’il y a lieu, selon les meilleures données probantes disponibles. Ils détermineront enfin si d’autres hypothèses employées dans l’évaluation économique connexe s’avèrent pertinentes pour l’estimation des coûts en médicaments.
Recommandations relatives au format du rapport
Les AIPMB soumises aux régimes d’assurance-médicaments doivent contenir les rubriques suivantes : introduction; technologie; plan et méthodologie de l’étude; résultats; limites et hypothèses; analyse de sensibilité et analyse des scénarios; conclusions; références et annexes. L’information doit être suffisamment détaillée pour qu’une tierce partie qui fait la même analyse arrive aux mêmes résultats. Le rapport doit également contenir des tableaux et des graphiques pour lui donner encore plus de clarté.
Enfin, l’analyste doit, à l’aide de la liste de contrôle incluse à l’annexe C, vérifier que son analyse a été correctement effectuée.
Formulaire électronique d’analyse de l’incidence sur le budget
Le modèle interactif d’analyse de l’incidence sur le budget utilisé pour produire les résultats doit être joint au rapport de l’AIPMB. Ce modèle doit être assez souple pour permettre aux examinateurs d’en modifier les paramètres de manière à tenir compte des différences provinciales sur le plan de la réglementation du prix des médicaments (p. ex. prix des médicaments, marges bénéficiaires, honoraires professionnels et co-paiements) ou à évaluer l’impact de possibles réductions de prix.
2.0 Objet
Les présentes lignes directrices fournissent une approche normalisée et des recommandations détaillées en ce qui concerne l’élaboration d’une AIPMB devant être soumise à l’ACMTS ou à un régime FPT d’assurance-médicaments.
Elles visent précisément à aider les personnes qui élaborent, soumettent ou évaluent les AIPMB à déterminer l’impact financier et l’accessibilité sur le plan financier de l’inscription d’un nouveau médicament sur la liste des médicaments assurés d’un régime public d’assurance-médicaments canadien.
Toutes les administrations devant soumettre des AIPMB à l’ACMTS ont contribué à l’élaboration du présent document :
- Colombie-Britannique
- Alberta
- Saskatchewan
- Manitoba
- Ontario
- Nouveau-Brunswick
- Nouvelle-Écosse
- Île-du-Prince-Édouard
- Terre-Neuve-et-Labrador
- Services de santé non assurés (SSNA)
Les présentes lignes directrices et le modèle qui les accompagne pourraient aussi être utiles à d’autres administrations (p. ex. le QuébecFootnote i, le Yukon, les Territoires-du-Nord-Ouest, le Nunavut, Service correctionnel du Canada, la Gendarmerie royale du Canada, le ministère des Anciens Combattants et le ministère de la Défense nationale), ainsi qu’à des payeurs privés canadiens et à des organismes internationaux.
Le présent document constitue un guide des pratiques exemplaires pour l’élaboration d’AIPMB au Canada; il ne figure pas au nombre des exigences de déclaration réglementaires du CEPMB. Il importe de consulter directement le CEPMB et l’ACMTS pour tout renseignement concernant les exigences en matière de déclaration et de présentation.
3.0 Contexte
Lorsque Santé Canada approuve l’utilisation d’un médicament au Canada, chaque province et territoire doit déterminer si ce médicament sera admissible à un remboursement en vertu de son régime public d’assurance-médicaments.
Avant de lancer le processus de prise de décisions concernant le remboursement d’un nouveau médicament, d’une nouvelle indication pour un médicament ou d’un nouveau produit mixte, le fabricant doit soumettre un rapport à l’ACMTS. Celle-ci mène alors une évaluation approfondie et objective des données cliniques et économiques et des données sur les patients concernant le médicament, et elle utilise cette évaluation pour formuler des recommandations et des conseils relatifs au remboursement aux régimes publics d’assurance-médicaments participants. Bien que le dossier soumis comprenne des AIPMB, l’ACMTS n’évalue les AIPMB pancanadiennes que dans le cadre du processus du Programme pancanadien d’évaluation des anticancéreux (PPEA), s’il s’agit de médicaments oncologiques, et du processus du Programme commun d’évaluation des médicaments (PCEM), s’il s’agit de médicaments non oncologiques.
L’ACMTS agit à titre de secrétariat pour la réception de l’information relative au rapport pour les régimes publics d’assurance-médicaments participants. Si le fabricant souhaite élargir les critères de remboursement d’un médicament qui est déjà inscrit à la liste des médicaments assurés d’un régime public d’assurance-médicaments, l’AIPMB doit être soumise directement au régime en question.
4.0 Méthodologie : Révisions des Lignes directrices de 2007
Les présentes Lignes directrices remplacent les Lignes directrices publiées en mai 2007 par le CEPMB, qui étaient considérées comme une ressource de première importance pour la préparation d’AIPMB au Canada. Il fallait que les Lignes directrices de 2007 soient mises à jour afin d’appuyer le travail continu des participants du Comité consultatif du SNIUMP et de suivre les avancées dans les méthodes d’AIPMB exigées par les régimes publics d’assurance-médicaments canadiens, ainsi que les lignes directrices internationales en matière d’AIPMB.
En janvier 2018, le CEPMB a confié à EVERSANAMC (anciennement Cornerstone Research Group Inc.) le mandat de fournir des conseils menant à l’établissement d’une méthodologie améliorée, d’aider à l’élaboration de celle-ci, ainsi que d’examiner le modèle d’AIPMB. L’entreprise a tout d’abord procédé à un examen de la documentation des Lignes directrices [Référence 2] , en examinant notamment les normes de pratiques internationales en matière d’AIPMB de plusieurs pays, comme le Canada [Référence 1], l’Australie [Référence 3], l’Angleterre et les Pays de Galles [Référence 4], la Belgique [Référence 5], l’Irlande [Référence 6], la France [Référence 7], la Pologne [Référence 8] et les Pays-Bas [Référence 9], ainsi que les lignes directrices de l’International Society for Pharmacoeconomics and Outcomes (ISPOR) [Référence 10] . Elle a aussi examiné les modèles des régimes provinciaux d’assurance-médicaments de l’Alberta [Référence 11], de l’Ontario [Référence 12] et du Manitoba [Référence 13], de même que les directives pertinentes du Québec [Référence 14] et de l’ACMTS (PPEA) [Référence 15].
Une ébauche de la mise à jour proposée a alors été distribuée aux membres et aux observateurs du Comité consultatif du SNIUMP. Leurs commentaires, parallèlement à une recherche documentaire mieux ciblée, ont servi à mettre au point un questionnaire structuré devant permettre de recueillir des renseignements supplémentaires.
Entre avril et septembre 2019, ce questionnaire a été envoyé aux participants du Comité consultatif ou à leurs collègues afin de recueillir leurs observations et leurs recommandations quant aux modifications apportées. La discussion a notamment porté sur les sujets suivants : l’horizon prévisionnel; les éléments liés aux coûts des médicaments; la sélection des médicaments de comparaison et les indications multiples; les lacunes relevées dans les Lignes directrices. Tous les commentaires reçus ont été pris en compte dans le cadre de l’examen des Lignes directrices. En outre, la mise à jour des documents de l’ACMTS Procédures relatives au Programme commun d’évaluation des médicaments et au Processus intérimaire d’examen des protéines plasmatiques de l’ACMTS (en anglais seulement) et Procédures relatives au Programme pancanadien d’évaluation des anticancéreux de l’ACMTS (en anglais seulement) a été également considérée lors de la révision des Lignes directrices.
Grâce à la méthodologie améliorée ayant découlé de ce processus de révision, ainsi qu’à la transparence et à l’uniformité accrues des lignes directrices révisées, on dispose maintenant d’un outil complet pour l’exécution d’AIPMB au Canada.
La mise à jour des Lignes directrices de 2007 repose sur un examen approfondi des normes et des pratiques exemplaires nationales et internationales (voir l’annexe A), ainsi que sur les commentaires formulés par les régimes publics d’assurance-médicaments canadiens participants.
Voir l’annexe B pour une liste détaillée des révisions apportées aux Lignes directrices de 2007.
5.0 Introduction
L’AIPMB permet de mieux prévoir et de mieux comprendre l’incidence que peut avoir une nouvelle intervention en santé (p. ex. un nouveau médicament) sur le budget d’un régime de soins de santé dont les ressources financières sont limitées [Référence 10] . Une des questions importantes à laquelle l’AIPMB permet de répondre est la capacité du régime sous examen d’assumer les coûts de remboursement d’un nouveau médicament [Référence 1].
Au Canada, on utilise l’AIPMB pour prendre des décisions éclairées en matière de remboursement. Cette analyse vise essentiellement à évaluer l’impact financier du remboursement d’un nouveau médicament sur une certaine période en comparant deux scénarios : un scénario de référence, qui est fondé sur le marché actuel, et un scénario de nouveau médicament, qui tient compte du remboursement de ce nouveau médicament. Les deux scénarios tiennent compte de divers facteurs, comme la taille du marché, le nombre de médicaments de comparaison et la part de marché de ces derniers, ainsi que le prix du médicament et des médicaments de comparaison.
Alors qu’une AIPMB porte sur l’impact financier d’un nouveau médicament, la valeur de ce dernier pour le système de soins de santé dans son ensemble est plutôt examinée au moyen d’analyses économiques, comme une analyse du rapport coût-efficacité (ARCE). L’ARCE mesure la valeur d’un nouveau médicament en termes d’unités monétaires par unité supplémentaire de bienfaits pour la santé (p. ex. nombre de dollars par jour sans symptôme, ou encore par année de vie ajustée en fonction de la qualité [AVAQ] obtenue). Ensemble, l’AIPMB et les analyses économiques comme l’ARCE servent à prendre des décisions en ce qui concerne le remboursement d’un nouveau médicament à un prix donné pour une population donnée. Les caractéristiques de ces deux analyses sont comparées plus en détail dans le tableau 5.0.
Tableau 5.0 : Comparaison entre l’analyse de l’incidence du prix d’un médicament sur les budgets d’assurance médicaments (AIPMB) et l’analyse du rapport coût efficacité (ARCE)
| AIPMB [Référence 1, Référence 5, Référence 16] | ARCE [Référence 17] | |
|---|---|---|
| Perspective | Payeur | Concorde avec le problème faisant l’objet d’une décision. Le scénario de référence canadien est celui d’un payeur public de soins de santé. |
| Population | Population admissible pour un régime donné | Concorde avec le problème faisant l’objet d’une décision (p. ex. population sous-examen ou un sous-groupe de celle-ci). |
| Horizon prévisionnel | De court à moyen terme | Suffisamment longtemps pour saisir toutes les différences pertinentes sur le plan des coûts et des résultats à venir (p. ex. pourrait être toute la vie durant). |
| Résultat du modèle | Incidence sur les coûts du régime d’assurance-médicaments | Coûts supplémentaires par AVAQ obtenue; possiblement coûts supplémentaires par année de vie obtenue. |
| Actualisation | Non | Oui |
| Analyse de sensibilité | Déterministe | Probabiliste |
Le présent document explique en détail les facteurs qui doivent absolument être pris en compte lors de l’élaboration d’une AIPMB, précise les sources de données et la manière de les utiliser, et donne un aperçu du format du rapport.
On peut obtenir un modèle Excel de l’AIPMB directement auprès du CEPMB à pmprb.npduis-sniump.cepmb@pmprb-cepmb.gc.ca. Il importe de noter qu’il s’agit d’un modèle de base à partir duquel les analystes doivent établir leur propre modèle détaillé.
6.0 Recommandations concernant le cadre d’analyse
Les analystes utilisent généralement les modèles interactifs conçus par les fabricants pour mener une AIPMB. Ces modèles permettent aux décideurs de prévoir l’incidence qu’auront ultérieurement les décisions prises aujourd’hui. L’utilité et la fiabilité de ces modèles dépendent de leur conception, des données utilisées pour faire les prévisions autant que de la démonstration de l’incertitude associée à la conception du modèle et aux données utilisées. Considérant ces facteurs limitatifs, les analystes élaboreront des modèles qui s’inscrivent dans un cadre analytique solide.
La présente section donne un aperçu des éléments qui doivent absolument être pris en compte lors de l’élaboration d’une AIPMB, à savoir la perspective, l’horizon prévisionnel, la population, les scénarios de comparaison, les coûts, les taux d’actualisation à la hausse ou à la baisse, la conception du modèle, les caractéristiques de l’incertitude et la validation.
La section 7.0 : Recommandations relatives aux données et aux sources contient des renseignements plus détaillés sur les exigences relatives aux données.
6.1 Perspective
L’AIPMB doit être préparée selon la perspective d’un régime d’assurance-médicaments. Elle doit porter sur les coûts liés au médicament ayant une incidence directe sur le budget de ce régime. Ces coûts sont le prix remboursé du médicament, les marges bénéficiaires du grossiste et de la pharmacie et les honoraires du pharmacien, selon les exigences du régime en question. Dans certains cas, il peut être nécessaire de rajuster les coûts afin de tenir compte des co-paiements effectués par les bénéficiaires du régime.
Les coûts afférents s’inscrivant dans la perspective plus vaste d’un régime de soins de santé, comme les actes médicaux (p. ex. chirurgies), les visites à l’urgence, les visites du médecin, les procédures de diagnostic, les hospitalisations et les dispositifs médicaux, ne sont généralement pas pris en compte dans les AIPMB préparées à l’intention des régimes FPT d’assurance-médicaments. Ils peuvent toutefois être mentionnés dans le corps de l’AIPMB, fournie en guise d’analyse complémentaire ou présentée dans une analyse des scénarios. Les analystes peuvent consulter les procédures et gabarits du PCEM et du PPEA de l’ACMTS afin de déterminer les technologies qui requièrent une analyse de scénarios qui tienne compte d’une perspective plus vaste. Dans certains cas exceptionnels, ces coûts peuvent être inclus dans l’analyse principale, selon les exigences du régime public d’assurance-médicaments en question.
On considère pertinent d’utiliser, pour les AIPMB canadiennes, une perspective du régime d’assurance-médicaments qui ne tienne pas compte des coûts en soins de santé, puisque ces coûts ont une incidence sur le budget global du système de soins de santé, plutôt que d’avoir une incidence directe sur le budget du régime d’assurance-médicaments en soi. Les coûts en soins de santé sont dits « coûts compensateurs », en ce sens qu’ils compensent le prix élevé d’un nouveau médicament et donnent parfois lieu en aval à des économies importantes pour les budgets en médicaments et pour l’ensemble du système de soins de santé. Les coûts compensateurs médicaux sont pris en compte dans les évaluations économiques canadiennes (p. ex. dans les ARCE). On invite donc les décideurs des régimes d’assurance-médicaments à prendre en compte les résultats des évaluations économiques et des AIPMB lorsqu’ils sont appelés à se prononcer sur la pertinence d’ajouter ou non un nouveau médicament sur leur liste de médicaments assurés. Pour qu’ils soient utilisés de façon significative, les paramètres qui sont inclus à la fois dans les évaluations économiques et les AIPMB doivent autant que possible concorder.
Les coûts non liés aux soins de santé, comme la perte de productivité, le transport et les coûts associés aux aidants ne sont pas pris en compte dans les AIPMB, puisqu’ils ne sont généralement pas pertinents pour le détenteur de budget. Ici encore, ils peuvent être mentionnés dans le corps de l’AIPMB s’ils sont susceptibles d’avoir une incidence importante.
Les changements sur le plan de la dynamique du marché des régimes publics qui découlent de facteurs externes, comme les traitements non médicamenteux ou une autre couverture d’assurance-médicaments (publique ou privée), doivent être pris en compte dans les prévisions de l’AIPMB. Entre autres exemples, l’incidence de traitements non médicamenteux serait incluse dans les prévisions de la taille de la population.
Bref, l’AIPMB devrait emprunter la perspective suivante :
- Tous les coûts liés aux médicaments qui sont remboursés par un régime d’assurance-médicaments doivent être inclus dans l’analyse;
- Les autres coûts liés aux soins de santé devraient généralement être exclus de l’AIPMB, mais peuvent être inclus en guise d’analyse complémentaire ou être mentionnés dans le corps du rapport s’ils sont susceptibles d’avoir une incidence importante sur le budget. Dans de rares cas, ils peuvent être inclus dans l’analyse principale, selon les circonstances et les exigences du régime d’assurance-médicaments;
- Les coûts non liés aux soins de santé ne devraient pas être inclus dans l’AIPMB, mais ils peuvent être mentionnés dans le rapport s’ils sont susceptibles d’avoir une incidence importante;
- Les changements non liés aux médicaments qui surviennent dans la pratique clinique et les autres facteurs externes qui sont susceptibles de changer la dynamique du marché du régime d’assurance-médicaments devraient être pris en compte dans l’AIPMB.
6.2 Horizon prévisionnel
Les données servant à prévoir l’incidence d’un nouveau médicament sur le budget d’un régime d’assurance-médicaments doivent couvrir un horizon prévisionnel de quatre ans, plus précisément une période de référence d’un an ainsi qu’une période prévisionnelle de trois ans. Il arrive toutefois qu’il soit préférable d’adopter un horizon prévisionnel plus long. On recommande d’ailleurs une certaine souplesse à cet égard. Entre autres exemples, si un nouveau médicament est associé à des coûts à plus long terme (économies ou dépenses) ou s’il est nécessaire d’attendre plusieurs années avant d’atteindre un niveau stable, il faudra adopter un horizon prévisionnel plus long, tout en reconnaissant que l’incertitude entourant les résultats sera accrue.
Les prévisions relatives au marché doivent être fondées sur plusieurs années de données historiques. Le nombre d’années de données historiques est généralement équivalent au nombre d’années de la période prévisionnelle (p. ex. trois ans). Les unités temporelles qui sont utilisées pour établir les prévisions (mois, trimestre, etc.) doivent être clairement indiquées.
Les données et les résultats estimés doivent être présentés par périodes de 12 mois commençant à la date proposée d’inscription du médicament sur la liste des médicaments assurés. Si, par exemple, la date d’inscription proposée est le 1er avril 2021, la première période de l’horizon prévisionnel ira du 1er avril 2021 au 31 mars 2022. Les données pour l’année de référence doivent également être présentées pour les 12 mois précédant la date d’inscription proposée.
Les modèles d’AIPMB doivent être conçus de manière à ce que les résultats puissent être fondés sur la période du contrat (c.-à-d. liés à la date de la première décision de financement) ou sur l’année financière ou civile. Cela est essentiel, puisqu’il peut être nécessaire, dans le secteur public, de faire des calculs budgétaires à la fois en fonction des années du contrat (pour la facturation d’actualisation) et des années financières (pour la budgétisation).
Bref, les données utilisées pour prévoir l’incidence d’un nouveau médicament sur le budget doivent être les suivantes :
- Une année de référence et un horizon prévisionnel de trois ans doivent être établis, avec la possibilité d’ajouter des années;
- Les prévisions relatives au marché doivent être fondées sur plusieurs années de données historiques;
- Les données estimées et les résultats doivent être présentés par périodes de 12 mois, et le modèle doit offrir une certaine souplesse quant aux cycles prévisionnels sélectionnés.
6.3 Population
Tous les bénéficiaires d’un régime d’assurance-médicaments qui sont susceptibles d’obtenir un diagnostic et un traitement pour le problème de santé d’intérêt et d’utiliser le nouveau médicament doivent être pris en compte dans l’AIPMB. L’admissibilité à un médicament doit être déterminée en fonction de la population précisée sur l’étiquette du médicament ou la monographie du médicament et de toute condition visant à en limiter l’accès.
Comme les caractéristiques des bénéficiaires et l’étendue de la couverture varient considérablement d’une administration à une autre, il importe de s’assurer que les données utilisées dans l’AIPMB reflètent fidèlement la population de chaque régime public d’assurance-médicaments. Entre autres exemples, le Régime d’assurance-médicaments du Manitoba est un programme universel fondé sur le revenu qui s’adresse à tous les Manitobains admissibles, quel que soit leur âge ou leur profil de santé. Il est donc raisonnable de supposer que l’âge, le sexe et la prévalence de la maladie des bénéficiaires seront à l’image de ceux de la population dans son ensemble. Par conséquent, on ne s’attend pas à ce que le Programme de médicaments de l’Ontario (PMO), qui s’adresse aux personnes âgées de 65 ans et plus, aux personnes sur l’aide sociale, aux enfants et aux jeunes âgés de 24 ans et moins qui ne sont pas couverts par une assurance privée et à d’autres groupes particuliers, reflète les caractéristiques de la population générale. Certaines comparaisons sont toutefois possibles entre des sous-populations, comme la population de personnes âgées en Ontario et les personnes âgées qui bénéficient du PMO.
Dans certains cas, l’AIPMB peut être conçue de manière à limiter la population admissible au remboursement du nouveau médicament aux patients pour lesquels les autres thérapies n’ont pas donné les résultats escomptés ou qui satisfont à des critères bien précis. Cela doit être pris en compte dans l’estimation de la population admissible. Entre autres exemples, si seuls les patients pour qui un traitement initial (thérapie de première ligne) n’a pas donné les résultats escomptés étaient admissibles au remboursement d’un médicament récemment inscrit sur la liste des médicaments assurés, le pourcentage de cette population devra être pris en compte dans le calcul de la population admissible au remboursement. Tous les critères limitant l’accès au médicament doivent être clairement énoncés dans le rapport de l’AIPMB.
En général, le modèle devrait supposer une population ouverte, soit la possibilité d’ajouter ou de retirer des patients de l’analyse au fil de l’horizon prévisionnel. Cela est tout particulièrement important lorsque l’accès au remboursement du nouveau médicament a une incidence sur la taille de la population traitée (p. ex. lorsqu’une baisse de la mortalité associée à l’affectation donne lieu à un plus grand nombre de patients traités ou lorsqu’un traitement curatif donne lieu à un moins grand nombre de patients traités). La mortalité et la progression de la maladie (p. ex. pour la chimiothérapie) sont aussi des facteurs importants à prendre en compte lors de la modélisation d’une AIPMB, ici encore afin de refléter la nature ouverte de la population admissible. Dans certains cas, comme lorsque le nouveau médicament s’adresse à un groupe particulier de patients qui n’est pas susceptible de changer au fil du temps (p. ex. un traitement pour une grave maladie génétique), il pourrait être préférable d’utiliser une population fermée pour le modèle.
Les estimations de la croissance du marché doivent reposer sur la croissance prévue de la population cible, ainsi que sur la croissance découlant de l’accès au nouveau médicament, s’il y a lieu (p. ex. si le médicament a un impact sur l’incidence ou la prévalence de la maladie ou encore sur le passage d’un traitement à un autre). Dans un modèle fondé sur les demandes de remboursement, la croissance du marché doit reposer sur la croissance prévue du nombre de demandes et de demandeurs.
Comme il est mentionné dans la section 6.1 : Perspective, les facteurs externes qui sont susceptibles d’avoir une incidence sur la dynamique du marché des régimes publics, comme les traitements non médicamenteux ou d’autres régimes d’assurance-médicaments (publics ou privés), doivent être pris en compte dans les prévisions. Entre autres exemples, si le recours à une chirurgie visant à corriger une maladie qui est généralement traitée avec des médicaments devait augmenter dans un marché donné, le nombre de personnes recevant le traitement médicamenteux diminuerait, d’où une réduction de la taille du marché.
Les indications non mentionnées sur l’étiquette doivent être incluses dans les analyses de sensibilité et de scénarios, plutôt que dans l’analyse principale. Cette recommandation concorde avec d’autres lignes directrices internationales, comme les lignes directrices sur l’AIPMB de l’ISPOR [Référence 10] , qui proposent de considérer les indications non mentionnées sur l’étiquette comme étant complémentaires à l’analyse principale, surtout en raison du manque de données sur l’innocuité et l’efficacité.
Pour déterminer la taille de la population sous examen, il faut adopter une approche fondée sur la taille de la population, sur le nombre de demandes de remboursement, ou sur les deux dans certains cas, suivant en cela les exigences du régime d’assurance-médicaments et la disponibilité des données. Consulter la section 7.1 : Estimation de la taille actuelle du marché pour des renseignements plus précis sur les exigences relatives aux données et des recommandations sur l’estimation de la taille du marché.
Bref, voici comment définir la population d’intérêt dans une AIPMB :- La population doit être définie en fonction des indications mentionnées sur l’étiquette ou dans la monographie du médicament, de l’admissibilité ou de la participation au régime d’assurance-médicaments et de toute autre restriction à l’accès au médicament;
- La population doit être considérée comme étant ouverte, c’est-à-dire qu’on peut ajouter ou retirer des patients de l’analyse si, au fil de l’horizon prévisionnel, ils répondent ou non aux critères d’inclusion;
- Les estimations de la croissance du marché doivent reposer sur la croissance prévue de la population cible, ainsi que sur la croissance découlant de l’accès au nouveau médicament, ou dans le cas d’une approche fondée sur les demandes de remboursement, sur la croissance prévue du nombre de demandeurs;
- Les indications non mentionnées sur l’étiquette ne doivent pas être prises en compte dans l’analyse du scénario de référence;
- Pour déterminer la taille de la population cible, on peut adopter une approche fondée sur la population, une approche fondée sur les demandes de remboursement ou une approche combinée.
6.4 Scénarios de comparaison
Pour bien évaluer l’incidence budgétaire de l’inscription d’un médicament sur la liste des médicaments assurés, deux scénarios doivent être comparés, à savoir le scénario de référence, qui est établi en fonction du contexte actuel, et le scénario du nouveau médicament suivant lequel le nouveau médicament serait inscrit sur la liste des médicaments assurés d’un régime d’assurance-médicaments donné.
Afin que les décideurs puissent évaluer le caractère raisonnable des scénarios présentés, toutes les hypothèses doivent être explicitement formulées, la source des données à l’appui doit être fournie et les données qui ont une incidence sur ces hypothèses doivent être présentées d’une manière intuitive. L’information sur laquelle s’appuie l’AIPMB doit être la meilleure information disponible, ce qui peut comprendre les données historiques des autres marchés, les prévisions publiées autant que l’opinion des experts.
6.4.1 Scénario de référence
Sous ce scénario, la composition du marché prévu à l’horizon prévisionnel repose sur le paysage concurrentiel du marché actuel ainsi que sur les données et sur les hypothèses justifiables concernant l’abandon ou l’adoption de nouvelles options thérapeutiques.
6.4.2 Scénario du nouveau médicament
Sous ce scénario, la composition du marché prévu à l’horizon prévisionnel repose sur le paysage concurrentiel du marché actuel, ainsi que sur les données et sur les hypothèses justifiables concernant la façon dont le nouveau médicament changera le marché, ce qui comprend l’abandon ou l’adoption de nouvelles options thérapeutiques.
Les indications changeantes doivent être prises en compte dans le rapport d’AIPMB. Entre autres exemples, un médicament couramment utilisé en guise de thérapie de deuxième ligne pour une catégorie de maladie en particulier qui dans la nouvelle utilisation deviendrait un traitement de première ligne pourrait ne plus être remboursé en tant que thérapie de deuxième ligne.
Bref, pour évaluer l’incidence de l’inscription d’un nouveau médicament sur la liste des médicaments assurés :
- Il faut comparer deux scénarios, à savoir un scénario de référence (avec des prévisions établies en fonction du contexte actuel) et un scénario du nouveau médicament (avec des prévisions établies en supposant que le nouveau médicament est inscrit sur la liste des médicaments assurés);
- Les données sont obtenues auprès des meilleures sources disponibles, toutes les hypothèses formulées pour élaborer un quelconque scénario sont explicitement énoncées et la source des données à l’appui est fournie.
6.5 Coûts en médicaments
Pour évaluer l’incidence d’un nouveau médicament sur le budget d’un régime d’assurance-médicaments, l’AIPMB doit comprendre le prix de remboursement prévu (c.-à-d. le prix courant hors effet d’actualisation) du nouveau médicament et de tous les médicaments de comparaison, ainsi que de tous les médicaments administrés en concomitance qui sont remboursés par le régime. Les coûts en médicaments doivent refléter les marges bénéficiaires, les honoraires du pharmacien et les co-paiements exigés par le régime d’assurance-médicaments en question. Le coût des essais diagnostiques complémentaires ou des instruments médicaux couverts par le régime doit aussi être pris en compte.
Le nombre de fois que le médicament est administré (fréquence de dosage) doit être pris en compte dans le calcul du coût annuel. Dans le cas des médicaments administrés au besoin ou, encore, périodiquement au cours de l’année, il faut utiliser le nombre moyen de traitements. Les hypothèses concernant le nombre de traitements doivent être fournies et devraient correspondre aux données établies dans l’évaluation économique (p. ex. ARCE) qui accompagne l’AIPMB.
L’analyste doit tenir compte de l’incidence de la conformité et de la constance de la thérapie sur le coût des traitements, si cela est exigé par le régime d’assurance-médicaments. Comme l’AIPMB adopte une perspective d’un régime d’assurance-médicaments, l’analyste doit déterminer si le régime assume ce coût. Entre autres exemples, un patient peut ne pas prendre un médicament que le régime a déjà payé. Toute hypothèse concernant les taux de conformité et la constance de la thérapie doit reposer sur les meilleures données probantes disponibles, lesquelles peuvent provenir d’études de bases de données, être recueillies de manière ciblée ou encore découler de l’opinion d’un expert. Les taux de conformité et de constance relatifs doivent être calculés à divers intervalles [Référence 18].
Seuls les prix de remboursement, les coûts et les ajustements de coûts les plus récents doivent être utilisés. L’incidence du remboursement du nouveau médicament pourrait autrement être sous-évaluée.
Des détails concernant le calcul des coûts en médicaments sont présentés dans les sections suivantes et dans la section 7.5 : Estimation des coûts en médicaments.
6.5.1 Prix des médicaments
Pour établir les prix des médicaments qui seront pris en compte dans l’AIPMB, il faut utiliser les prix de vente au régime d’assurance-médicaments en question. Chaque prix doit être présenté clairement et doit correspondre à l’ingrédient médicinal et à la dose d’intérêt.
6.5.2 Médicaments administrés en concomitance
Les médicaments administrés en concomitance peuvent avoir un effet pharmacologique plus fort ou réduire les effets secondaires d’un traitement. Entre autres exemples, un antiémétique est souvent pris lors des infusions intraveineuses afin de soulager la nausée et les vomissements associés à la chimiothérapie.
Si la nouvelle thérapie médicamenteuse requiert l’utilisation d’un ou de plusieurs médicaments concomitants qui sont remboursés par le régime public d’assurance-médicaments, ceux-ci devraient être inclus dans l’AIPMB. L’analyste doit donc calculer le coût des « stratégies de traitement » plutôt que simplement le coût de chaque médicament, bien que chaque coût doive apparaître séparément dans le modèle. Seuls les médicaments liés aux substances pharmacologiques actives du nouveau médicament doivent être pris en considération (selon les lignes directrices sur le traitement existant, l’indication du nouveau médicament et les critères de restriction de l’accès suggérés par le fabricant).
Si tout semble indiquer qu’un autre nouveau médicament sera inscrit sur la liste des médicaments assurés au cours de l’horizon prévisionnel du modèle et qu’il aura une incidence sur les hypothèses formulées concernant l’utilisation de médicaments concomitants, ces derniers médicaments doivent alors être pris en compte dans l’AIPMB et leur incidence doit être étudiée au moyen d’analyses de scénarios.
6.5.3 Primes et franchises
Les primes et les franchises ne doivent pas être prises en compte dans le calcul des coûts, sauf si cela est exigé par le régime d’assurance-médicaments en question (p. ex. dans le cas d’un plan fondé sur le revenu qui offre une protection universelle). Les primes et les franchises doivent plutôt être réparties sur l’ensemble des pharmacothérapies suivies par un patient au cours d’une année civile.
6.5.4 Marges bénéficiaires, honoraires du pharmacien et co-paiements
La nécessité de prendre en compte des frais particuliers tels que les marges bénéficiaires du grossiste, les marges bénéficiaires de la pharmacie, les honoraires du pharmacien et les co-paiements, varient considérablement. L’analyste doit donc soigneusement examiner les exigences de chaque régime public d’assurance-médicaments.
Lorsque l’on s’attend à ce que le nouveau médicament ait une incidence marquée sur le montant remboursé pour les marges bénéficiaires ou les honoraires du pharmacien (p. ex. l’introduction d’une polythérapie à dose fixe qui a pour effet de réduire le nombre d’honoraires payés chaque année aux pharmaciens), la valeur réelle des montants payés par le régime peut être prise en compte dans l’AIPMB. Les méthodes utilisées pour calculer les marges bénéficiaires et les honoraires du pharmacien doivent répondre aux exigences de chaque régime public d’assurance-médicaments. Lorsque plusieurs régimes d’assurance-médicaments d’une même province remboursent le médicament (p. ex. le régime d’assurance-médicaments de l’aide sociale, le régime d’assurance-médicaments pour les aînés), les marges bénéficiaires et les honoraires du pharmacien doivent correspondre à leur moyenne pondérée, sauf indication contraire donnée par le régime d’assurance-médicaments.
Dans certains cas, les régimes d’assurance-médicaments peuvent exiger que les fabricants tiennent compte des co-paiements dans leur modèle d’AIPMB ainsi que de l’incidence nette pour le payeur.
Bref, pour calculer les coûts en médicaments assumés par le régime public d’assurance-médicaments, il faut :
- Inclure le prix du nouveau médicament et celui de tous les médicaments concomitants qui sont remboursés par le régime d’assurance-médicaments, en tant qu’éléments distincts;
- Inclure le prix de tous les médicaments de comparaison et de leurs médicaments concomitants qui sont remboursés par le régime d’assurance-médicaments;
- Tenir compte de l’incidence de la conformité et de la constance de la thérapie sur le coût des traitements, s’il y a lieu;
- Réviser tous les coûts en médicaments conformément aux exigences établies par le régime d’assurance-médicaments en ce qui concerne les AIPMB;
- Déterminer si certains frais qui s’ajoutent au prix des médicaments doivent être pris en compte et utiliser les valeurs les plus récentes pour les marges bénéficiaires, les honoraires du pharmacien et les co-paiements;
- Exclure les primes et les franchises, à moins que le régime d’assurance-médicaments demande leur inclusion.
6.6 Actualisation à la hausse ou à la baisse
À la différence des évaluations économiques, les AIPMB ne doivent pas être actualisées à la hausse ni à la baisse, à moins de circonstances particulières. Il en est ainsi parce que les décideurs des régimes d’assurance-médicaments s’intéressent davantage aux coûts supplémentaires (ou aux économies) sur leurs budgets annuels qu’à la valeur en dollars constants des coûts supplémentaires (ou des économies) qui découlent du remboursement d’une nouvelle thérapie. Même si les coûts des années ultérieures pourraient en théorie être majorés au taux d’inflation prévu, cette mesure n’est pas recommandée.
Une actualisation peut être effectuée si elle est fondée sur des arguments solides (p. ex. suivant l’information confirmée concernant une politique d’établissement des prix, la mise en œuvre prochaine d’une nouvelle politique approuvée ou une modification des prix après expiration du brevet).
Bref, en ce qui concerne l’actualisation :
- Les résultats de l’AIPMB ne doivent pas être actualisés à la hausse ou à la baisse.
6.7 Conception du modèle
Le modèle d’AIPMB et le rapport qui l’accompagne doivent être aussi transparents et faciles à comprendre que possible. Ils doivent être conçus de manière à satisfaire les besoins des utilisateurs finaux et à aider ces derniers à comprendre comment le modèle fonctionne.
Il faut retenir le modèle qui utilise la structure la plus simple possible, qui fournit des résultats exacts et reproductibles et qui est conçu au moyen d’un logiciel facilement accessible, comme Microsoft Excel. Les choix et les hypothèses examinés lors de l’élaboration du modèle doivent être expliqués en détail.
Comme l’impact clinique du traitement n’est pas pris en compte, aucun modèle de maladies employant des techniques de modélisation plus complexes, comme le modèle de Markov, n’est requis. Il pourrait toutefois être nécessaire d’effectuer des calculs plus complexes afin de tenir compte de la dynamique des maladies de la population traitée.
Pour être aussi transparents et faciles à comprendre que possible, le modèle d’AIPMB et le rapport qui l’accompagne doivent :
- Être conçus avec l’objectif de satisfaire aux besoins des utilisateurs finaux;
- Expliquer clairement toutes les hypothèses et tous les choix faits par les analystes;
- Avoir recours à la structure la plus simple possible;
- Utiliser un logiciel facilment accessible (p. ex. Excel).
6.8 Caractérisation de l’incertitude
Par souci de transparence, l’AIPMB doit toujours comporter une analyse d’incertitude. Les décideurs doivent être informés du degré de sensibilité du modèle à l’égard d’hypothèses précises, puisqu’ils sauront ainsi quelle est la fourchette de valeurs que les régimes d’assurance-médicaments peuvent s’attendre à payer s’ils décidaient de rendre le nouveau médicament admissible à un remboursement.
Une AIPMB comporte deux types d’incertitudes : l’incertitude relative aux paramètres des valeurs saisies; l’incertitude structurale qui découle des hypothèses formulées lors de la définition du cadre d’analyse. Les analyses déterministes de la sensibilité (ADS) servent à évaluer les incertitudes entourant les paramètres, alors que l’analyse de scénarios sert à déterminer l’incertitude structurale. Dans l’analyse de scénarios, les valeurs de certains paramètres d’entrée et certaines hypothèses structurales sont modifiées afin de produire d’autres scénarios plausibles [Référence 10] (p. ex. l’introduction de médicaments génériques ou biosimilaires au cours de l’horizon prévisionnel).
Les ADS peuvent comprendre des analyses à un seul critère de classification, des analyses à plusieurs critères de classification et des analyses des extrêmes.
- Les analyses à un seul critère de classification vérifient différentes valeurs en utilisant un paramètre à la fois. Entre autres exemples, la variation du prix d’un médicament de comparaison qui devrait être admissible à un remboursement lorsque le nouveau médicament sera inscrit sur la liste des médicaments assurés constitue une analyse à un seul critère de classification.
- Les analyses à plusieurs critères de classification sont faites en changeant simultanément plusieurs paramètres du modèle, p. ex. les hypothèses concernant la part et le taux de croissance du marché pourraient être changées simultanément afin d’illustrer leur effet conjoint sur le budget du régime d’assurance-médicaments.
- Les analyses des extrêmes représentent un cas spécial d’analyse de la sensibilité à plusieurs critères où tous les paramètres d’un modèle sont vérifiés à leur plus basse et à leur plus haute valeur (de manière à étudier les conditions les plus pessimistes et les plus optimistes). Ces analyses révéleront les résultats qui pourraient être obtenus avec le modèle et des hypothèses raisonnables.
L’analyse probabiliste de sensibilité (APS) est un autre type d’analyse de la sensibilité à plusieurs paramètres. Pour effectuer une APS, une distribution de probabilité est assignée à chaque paramètre et une valeur est tirée d’une façon aléatoire de la distribution, et ce, pour chaque simulation de modèle. Ce processus est répété plusieurs fois afin de tirer des estimations moyennes. Même si l’APS peut s’avérer utile en guise d’analyse exploratoire, conformément aux lignes directrices de l’ISPOR [Référence 10] , elle n’est pas recommandée pour l’instant. Les données pour nombre des paramètres étant limitées, on ne peut quantifier de manière significative l’incertitude de ces derniers. Toute approche standard, telle qu’une analyse à un seul critère de sélection ou une APS, ne saurait donc être complète. Qui plus est, une bonne part de l’incertitude est de nature structurale et ne peut être aisément paramétrée. Une analyse de scénarios doit donc être réalisée en changeant la valeur de certains paramètres d’entrée et certaines hypothèses structurales de manière à produire d’autres scénarios plausibles [Référence 10, Référence 16] .
Les valeurs utilisées dans les analyses de sensibilité et des scénarios doivent être étoffées par des sources de données reconnues, p. ex. lorsqu’une utilisation non mentionnée sur l’étiquette d’un nouveau médicament a été observée sur un marché étranger, cette utilisation doit être évaluée au moyen d’une analyse des scénarios faite à l’aide des données relatives à ce marché étranger. Lorsque les intervalles de confiance n’ont pas été établis pour une valeur donnée, les changements importants de la valeur du paramètre doivent être testés. La valeur utilisée doit être justifiée dans le corps du rapport définitif.
Les paramètres ou les hypothèses associés à l’incertitude dans l’évaluation économique à l’appui doivent aussi être mis à l’essai dans l’AIPMB au moyen d’une analyse de sensibilité. À tout le moins, les paramètres suivants doivent être mise à l’essai de manière à démontrer l’incidence des hypothèses formulées durant le processus d’élaboration du modèle puisqu’elles représentent les principales composantes de l’estimation de la valeur du scénario de référence et du scénario du nouveau médicament :
- Les variations de la taille du marché sur l’horizon prévisionnel;
- La distribution des parts de marché entre le nouveau médicament et ses médicaments de comparaison;
- Le prix du nouveau médicament, en supposant différents niveaux de prix;
- Le prix des médicaments de comparaison ou des médicaments concomitants assujettis à un certain niveau d’incertitude.
L’exclusion de l’une ou de l’autre des analyses de sensibilité susmentionnées doit être justifiée dans l’AIPMB.
Les analystes devraient inclure des analyses de scénarios qui permettraient de mieux saisir l’incidence des hypothèses formulées lors de l’élaboration du modèle. Ces analyses de scénarios peuvent comprendre, entre autres, les tests suivants :
- Hypothèses du modèle relativement au pourcentage de bénéficiaires admissibles qui ont le problème de santé sous examen et qui devraient être diagnostiqués et traités;
- Hypothèses relativement à l’ajout de nouveaux traitements de comparaison à la liste des médicaments assurés au cours de l’horizon prévisionnel;
- Coûts directs en soins de santé, s’il y a lieu et si cela est pertinent.
Bref, l’analyse de l’incertitude jointe à l’AIPMB doit faire ce qui suit :
- Contenir des ADS (c.-à-d. des analyses à un seul critère de classification, des analyses à plusieurs critères de classification ou des analyses des extrêmes) et des analyses de scénarios qui informent les décideurs du degré de sensibilité des données saisies et de la structure du modèle par rapport aux hypothèses formulées;
- Utiliser des analyses de scénarios afin d’évaluer d’autres situations, comme l’introduction de médicaments génériques ou biosimilaires, la conformité et la constance du patient, les restrictions à l’accès et les indications non mentionnées sur l’étiquette au cours de l’horizon prévisionnel;
- Fournir de l’information reconnue concernant la marge d’incertitude associée à chaque hypothèse;
- Fournir un sommaire des analyses de sensibilité effectuées au regard, à tout le moins, des paramètres suivants : le prix du nouveau médicament, la part et la taille du marché, ainsi que le prix des médicaments de comparaison ou de la stratégie de traitement.
6.9 Validation
La validité et la transparence du modèle doivent être évaluées et documentées dans l’AIPMB. L’analyste doit vérifier et mettre à l’essai rigoureusement les équations, les paramètres et le code de programmation afin de s’assurer que le modèle est techniquement adéquat. Toute la documentation doit être disponible sur demande.
L’analyste peut à cette fin utiliser les recommandations formulées dans le rapport du groupe de travail de l’ISPOR-SMDM (Society for Medical Decision Making) [Référence 19] en guise de référence pour le processus d’évaluation. Les modèles doivent reposer sur la meilleure information raisonnablement accessible (c.-à-d. validation interne et externe). Il doit tenir compte de la valeur de toute information supplémentaire (le coût par opposition à une plus grande exactitude du modèle) afin d’évaluer ce qui constitue la meilleure information disponible.
Les points suivants doivent être pris en considération au moment de valider le modèle de l’incidence sur le budget :
- La validité du modèle d’AIPMB doit être évaluée et documentée;
- Le modèle doit être mis à l’essai avec rigueur pour assurer sa validité technique (p. ex. les calculs mathématiques sont correctement mis en œuvre et exécutés) et des preuves de cette validation doivent être disponibles sur demande;
- Les équations et les paramètres du modèle doivent être vérifiés par rapport à leur source;
- Le code de programmation doit être documenté, annoté et soumis à des mesures d’assurance et de contrôle de la qualité sur le plan du génie logiciel;
- Le programme utilisé pour effectuer l’analyse (code source) doit être soumis à l’examen (sous réserve du respect des droits de propriété intellectuelle).
7.0 Recommandations relatives aux données et aux sources
Tous les résultats générés par le modèle d’AIPMB sont déterminés en fonction des valeurs et de la méthodologie utilisées pour effectuer les calculs. Il est donc extrêmement important de choisir les meilleures hypothèses et les meilleures données possible. Même si les résultats finaux ne prédisent pas avec exactitude ce qui se passera dans l’avenir, on peut quand même s’attendre à ce qu’ils fournissent une image fidèle de ce qui pourrait se passer à la lumière de la dynamique du marché actuel.
La présente section donne aux analystes des sources et des exemples concrets de données qui peuvent être utilisés pour élaborer, remplir et évaluer leur modèle d’AIPMB.
7.1 Estimation de la taille actuelle du marché
Pour estimer la taille du marché, les analystes peuvent concevoir des modèles en utilisant les données sur la population (épidémiologiques) ou les données sur les demandes de remboursement, ou encore les deux, dans certains cas. Ces approches, dont le schéma est présenté dans le diagramme 7.1, démontrent ce qui suit :
- Des modèles fondés sur la population (épidémiologiques) illustrent comment une population donnée répondra à la disponibilité des options thérapeutiques;
- Des modèles fondés sur les demandes de remboursement reposent sur l’historique d’achat du médicament.

Figure description
Des diagrammes à deux niveaux, en forme de pyramide, illustrent le processus d’estimation de la taille du marché au moyen d’un modèle basé sur la population et d’un modèle basé sur les données sur les demandes de remboursement.
Modèle fondé sur la population
Le marché d’intérêt est déterminé d’abord par l’évaluation de la taille de la population fédérale, provinciale ou territoriale. Au sein de cette population, le champ d’application est ramené au nombre de bénéficiaires admissibles qui présentent le problème de santé visé. Le nombre de bénéficiaires admissibles chez qui le problème de santé a été diagnostiqué doit ensuite être déterminé. Enfin, parmi ce groupe, le marché d’intérêt est composé du nombre de bénéficiaires admissibles ayant reçu un diagnostic et un traitement pour le problème de santé visé.
Modèle fondé sur les demandes de remboursement
À partir des données sur les demandes de remboursement, il est possible de définir le marché d’intérêt en déterminant le nombre annuel de demandes de remboursement soumises pour le problème de santé visé (bénéficiaires actifs).
Les modèles fondés sur les données sur la population permettent d’estimer d’une façon efficace le nombre de personnes admissibles à la protection d’un régime d’assurance-médicaments (bénéficiaires admissibles) sur une période donnée, alors que les modèles fondés sur les demandes de remboursement permettent d’estimer le nombre de participants admissibles qui soumettront une demande de remboursement au cours d’une année donnée et qui recevront un traitement (bénéficiaires actifs).
En ce qui concerne le modèle fondé sur la population, on utilise des données sur la population et des données épidémiologiques pour évaluer le nombre de personnes sur un territoire donné qui sont susceptibles d’avoir les problèmes de santé sous examen, le nombre de personnes qui pourraient devenir des bénéficiaires actifs en soumettant une demande de remboursement pour le traitement des problèmes de santé, ainsi que le nombre de bénéficiaires actifs dans chaque régime d’assurance-médicaments spécialisé (p. ex. assistance sociale, aînés) qui reçoivent un traitement pour ces problèmes de santé. Les modèles fondés sur la population se prêtent tout particulièrement aux situations dans lesquelles le nouveau médicament pourrait avoir une incidence sur le nombre de personnes traitées au fil du temps, comme un tout nouveau médicament qui entre sur un nouveau marché ou un nouveau traitement qui est, sur le plan thérapeutique, plus efficace que les médicaments existants. Alors que les données sur la population et les données épidémiologiques servent à évaluer la taille de la population admissible, l’analyste peut avoir besoin d’autres données, comme les données sur l’utilisation, pour évaluer l’adoption ou la part de marché du nouveau médicament.
Les données fondées sur les demandes de remboursement sont généralement utilisées lorsqu’il s’agit d’un nouveau médicament qui pénètre un marché mieux établi. Suivant cette approche, l’analyste peut, à l’aide d’une série d’hypothèses (p. ex. l’introduction d’un nouveau médicament ne devrait pas faire augmenter le nombre de personnes traitées), évaluer la taille des populations de patients admissibles à un remboursement.
Par souci de transparence et d’exhaustivité, les modèles fondés sur les demandes de remboursement devraient fournir une estimation du nombre de bénéficiaires actifs, suivant le nombre de demandes pour le scénario de référence ainsi que le scénario associé à l’inscription d’un nouveau médicament. Le choix de la méthodologie doit être clairement énoncé et étayé, et les données doivent être entièrement documentées. En outre, l’analyste doit permettre la comparaison des valeurs estimées avec les données historiques afin de s’assurer que le modèle permet la formulation d’une estimation adéquate de la taille du marché.
Les méthodes recommandées pour évaluer la taille du marché au moyen des données sur la population et des données sur les demandes de remboursement sont précisées dans les sections suivantes.
7.1.1 Détermination de la taille du marché à l’aide du modèle fondé sur la population
Suivant l’approche fondée sur la population, l’analyste peut utiliser diverses sources de données et hypothèses afin de déterminer la taille de la population cible.
Il doit en premier lieu déterminer le nombre de bénéficiaires admissibles au moyen des données publiées du régime d’assurance-médicaments. Si cette information ne peut être obtenue directement auprès du régime d’assurance-médicaments, elle peut l’être auprès d’autres sources fiables. On peut aussi en faire une estimation en tenant compte des données sur les bénéficiaires actifs. Toutes les sources des données utilisées doivent être citées dans le rapport et dans le modèle. Dans les rares cas où aucune donnée concernant le régime d’assurance-médicaments n’est disponible, l’analyste doit utiliser les données d’une administration canadienne voisine qui possède un régime d’assurance-médicaments semblable et les rajuster en fonction de la taille relative de la population générale.
Bien que plusieurs administrations diffusent des statistiques sur le nombre de bénéficiaires actifs de leur régime d’assurance-médicaments, ces données ne reflètent pas nécessairement la prévalence des maladies dans la population générale à laquelle le régime s’adresse. Faute de données plus exactes, il faut se contenter des données sur les bénéficiaires actifs. Toutefois, toutes les hypothèses sur l’épidémiologie de la maladie, sur le diagnostic et sur le traitement doivent être minutieusement mises à l’essai pour bien en démontrer l’effet sur le résultat définitif.
Des données détaillées sur la population admissible peuvent être obtenues auprès du régime d’assurance-médicaments ou auprès d’autres sources publiques ou commerciales. Si aucune donnée sur l’âge n’est disponible ou si les données ne sont pas suffisamment détaillées, l’analyste doit faire une estimation de la répartition selon l’âge. S’il ne dispose d’aucune autre information, il peut tenir compte des données sur les bénéficiaires actifs pour faire une estimation de la population admissible.
Pour faire une telle estimation sur une période de 12 mois, l’analyste doit utiliser la taille de la population au milieu de la période visée. On tient alors compte du fait que la population au début de la période visée peut différer de celle à la fin de la période et on suppose que les variations de la taille de la population sur une période de 12 mois sont de nature linéaire.
Après avoir déterminé le nombre de bénéficiaires admissibles, l’analyste doit utiliser les statistiques sur l’incidence ou la prévalence de la maladie ainsi que les données disponibles concernant le pourcentage de personnes qui ont reçu un diagnostic et un traitement afin d’évaluer le nombre de bénéficiaires admissibles qui recevraient le traitement. Ces détails devraient être tirés d’une source publiée, d’une base de données d’un régime public ou même d’une opinion d’expert.
Bien des facteurs, comme la nature du problème de santé visé et son traitement, doivent être pris en compte pour déterminer s’il faut ou non utiliser les données sur l’incidence ou la prévalence afin de définir la population admissible. Les données sur l’incidence se prêtent mieux à l’évaluation des problèmes de santé pour lesquels le traitement est de courte durée, alors que les données sur la prévalence peuvent être plus utiles dans le cas de traitements de longue durée. Dans certains cas, ces deux types de données peuvent être nécessaires. Il importe de noter que les caractéristiques des populations visées par les données sur l’incidence ou la prévalence peuvent varier, ce qui pourrait avoir une incidence sur l’adoption du nouveau médicament [Référence 20]. L’analyste doit tenir compte de cette distinction lors de l’élaboration du modèle d’AIPMB.
Si aucune information valide concernant le pourcentage de personnes ayant obtenu un diagnostic et un traitement n’est disponible, des hypothèses raisonnables doivent être formulées. À défaut de données pertinentes, l’analyste doit présumer que tous les bénéficiaires admissibles atteints de la maladie obtiendront un diagnostic et un traitement. Les hypothèses doivent être mises à l’essai à l’aide de l’analyse de sensibilité afin de déterminer leur incidence sur les résultats définitifs.
Les méthodes de détermination de la population admissible ayant le problème de santé visé sont précisées dans le diagramme 7.1.1, par ordre de fiabilité.

Figure description
Ce diagramme échelonné énumère les méthodes permettant de déterminer la population admissible ayant le problème de santé visé, de la plus fiable à la moins fiable.
| Source de données | Description |
|---|---|
Données publiées sur l’incidence ou la prévalence de la maladie au sein de la population admissible |
Ces données facilitent tout particulièrement l’élaboration d’un modèle d’analyse de l’incidence sur le budget en ce sens qu’elles fournissent des données plus objectives et réelles. |
Données sur l’incidence ou la prévalence pour l’administration ou la population d’intérêt |
Statistiques sur la taille et sur la composition démographique de la population admissible (p. ex. âge, sexe) ou données sur l’incidence ou la prévalence pour la province ou le territoire utilisées pour déterminer le nombre de personnes couvertes par le régime public d’assurance-médicaments qui auraient le problème de santé d’intérêt. Il s’agit de la meilleure utilisation pouvant être faite des données réelles sur la prévalence pour le régime d’assurance-médicaments. |
Données sur l’incidence ou la prévalence pour un territoire ou une population qui est semblable à la population d’intérêt |
Statistiques sur la taille et sur la composition démographique de la population admissible ou données sur l’incidence ou la prévalence pour un territoire semblable utilisées pour déterminer le nombre de personnes couvertes par le régime public d’assurance‑médicaments qui auraient le problème de santé sous examen (p. ex. utilisation des données sur la prévalence et les statistiques de la population de la Nouvelle‑Écosse pour déterminer le nombre de personnes admissibles à un remboursement en vertu du Programme d’aide financière des médicaments de l’Île-du-Prince-Édouard). Cette option moins qu’idéale ne devrait être utilisée que lorsque les données appropriées ne sont pas disponibles. |
Utilisation des données nationales sur l’incidence ou la prévalence |
Statistiques sur la taille et sur la composition démographique de la population admissible et données canadiennes sur l’incidence ou la prévalence utilisées pour déterminer le nombre de personnes couvertes par le régime public d’assurance‑médicaments qui auraient le problème de santé d’intérêt. Cette option moins qu’idéale ne devrait être utilisée que lorsque les données appropriées ne sont pas disponibles. |
Comme un nouveau médicament peut être inscrit sur la liste des médicaments assurés avec certaines restrictions, il importe d’inclure des prévisions budgétaires qui tiennent compte de ce scénario. La taille du marché doit alors être réduite en fonction des données disponibles. Entre autres exemples, si l’analyse ne considère que les femmes du troisième âge ayant déjà subi une fracture, seules les données sur la population qui correspond à ce profil démographique (p. ex. femmes de plus de 65 ans) doivent être prises en compte dans l’analyse. Ce sous-groupe pourra encore être réduit à des patientes ayant déjà subi une fracture. Pour calculer l’incidence d’un référencement restreint sur la liste des médicaments assurés, l’analyste peut utiliser des sources de données semblables à celles utilisées pour estimer la taille et la croissance du marché, ainsi que des études portant sur la maladie et d’autres données vérifiables pertinentes.
7.1.2 Détermination de la taille du marché à l’aide du modèle fondé sur les demandes de remboursement
Le nombre de demandes de remboursement pour une indication donnée doit être évalué au moyen d’une base de données qui contient des renseignements détaillés sur les demandes de remboursement du régime public d’assurance-médicaments.
Pour l’année de référence, ce nombre doit comprendre les demandes de remboursement pour tous les médicaments de comparaison pour la même indication. Si le nouveau médicament ou les médicaments de comparaison sont utilisés pour plusieurs indications, l’analyste ne devrait utiliser les données fondées sur les demandes de remboursement que s’il dispose du nombre de demandes par indication pour chaque médicament. Si ce n’est pas le cas, il devra plutôt utiliser le modèle fondé sur la population.
L’analyste doit utiliser un modèle fondé sur les demandes de remboursement pour calculer le nombre de bénéficiaires indiqué dans l’AIPMB, pour valider les estimations du nombre de demandes et pour fournir au régime d’assurance-médicaments le nombre approximatif de bénéficiaires qui sont actuellement traités pour une indication donnée. S’il ne connaît pas le nombre de bénéficiaires actifs, il peut l’évaluer en divisant le nombre de demandes de remboursement traitées chaque année pour chaque traitement primaire par le nombre moyen de demandes de remboursement par personne qui auront été soumises au cours de la même année. Puisqu’à chaque demande est associé à un patient en particulier, il ne devrait y avoir aucun double comptage des bénéficiaires actifs. Le choix de la méthodologie doit être clairement énoncé et étayé, et les données doivent être bien décrites et validées.
Il peut néanmoins arriver qu’on ne puisse pas subdiviser par âge ou par sexe les estimations établies au moyen de cette approche. L’analyste ne pourra pas alors utiliser les données sur la prévalence selon l’âge et le sexe à des fins prévisionnelles.
Comme pour l’approche fondée sur la population, les modèles fondés sur les demandes de remboursement doivent prendre en compte toute restriction relative à l’inscription du nouveau médicament sur la liste des médicaments assurés, ainsi que des médicaments concurrents.
Bref, pour estimer la taille du marché, les analystes doivent faire ce qui suit :
- Produire des estimations en se servant d’une approche fondée sur la population ou d’une approche fondée sur les demandes de remboursement, ou les deux, s’il y a lieu;
- Fournir des estimations de la population lors de l’utilisation d’un modèle fondé sur les demandes de remboursement.
7.2 Sélection des médicaments de comparaison pertinents
Au moment de choisir les médicaments de comparaison qui seront pris en compte dans l’AIPMB, l’analyste doit examiner les options thérapeutiques existantes pour les mêmes indications que le nouveau médicament. Les médicaments retenus doivent être les mêmes que ceux qui figurent dans l’évaluation économique connexe, à moins d’indication contraire (p. ex. dans le cas d’options pharmacologiques ou chirurgicales).
Les médicaments de comparaison doivent être classés et évalués selon leur indication de manière à donner aux décideurs du régime d’assurance-médicaments une idée de l’incidence générale du remboursement du nouveau médicament et de l’incidence par indication, puisque la dynamique du marché peut varier selon le sous-groupe (p. ex. il peut exister des médicaments de comparaison propres au sous-groupe).
Dans le cas de thérapies concomitantes, chaque thérapie de comparaison et ses médicaments concomitants doivent être pris en compte comme une seule stratégie de traitement (p. ex. utilisation d’un antiémétique et d’un médicament utilisé en chimiothérapie), bien que le coût de chaque médicament doive, par souci de transparence, apparaître séparément dans le modèle.
Le coût des polythérapies fixes doit être établi comme une seule stratégie de traitement. On ne doit pas utiliser des coûts partiels pour représenter la proportion du médicament en association qui est un médicament de comparaison direct.
Les options non médicamenteuses sont généralement exclues de l’analyse principale, sauf lorsque le régime d’assurance-médicaments l’exige (p. ex. lorsqu’un comprimé remplace une demande de chirurgie), ce qui arrive rarement. Elles doivent toutefois être mentionnées dans le rapport, et elles peuvent être incluses dans l’analyse des scénarios si elles sont susceptibles d’avoir une incidence marquée. Dans tous les cas, l’approche doit être étayée et les données doivent être bien décrites et validées.
Pour déterminer quels médicaments existants sont susceptibles d’être remplacés par le nouveau médicament, il faut utiliser les données concernant les autres marchés (p. ex. données réelles, études publiées). À défaut d’avoir accès à de telles données, une opinion d’expert pourra être utile.
Si un nouveau médicament de comparaison risque fort d’être ajouté à la liste des médicaments assurés avant que le soit le nouveau médicament, il peut être inclus dans l’analyse de base ou dans l’analyse des scénarios, selon le bien-fondé de son ajout et suivant les exigences du régime d’assurance-médicaments. Si les données suggèrent l’inscription possible d’un nouveau médicament de comparaison, celui-ci doit être inclus dans l’analyse des scénarios, s’il y a lieu.
Les médicaments qui sont couramment utilisés pour les mêmes indications que le nouveau médicament, bien que cette utilisation ne soit pas mentionnée sur l’étiquette, et qui figurent sur la liste des médicaments assurés peuvent être inclus dans l’analyse du scénario de référence ou dans l’analyse des scénarios, suivant les exigences du régime public d’assurance-médicaments. Les médicaments génériques à prévoir peuvent être pris en compte dans l’analyse des scénarios s’ils sont à l’étude par Santé Canada ou s’ils doivent être mis en marché au cours de l’horizon prévisionnel.
S’il n’y a aucun médicament de comparaison pour le nouveau médicament, l’analyste doit élaborer un modèle fondé sur la population afin d’explorer l’évolution du nouveau marché.
Bref, avant de choisir les médicaments de comparaison pour une AIPMB, les analystes doivent faire ce qui suit :
- Regrouper les médicaments de comparaison par indication et les faire cadrer avec l’évaluation économique, si possible;
- Déterminer les stratégies de traitement qui se prêtent à une comparaison avec le nouveau médicament;
- Chercher des données adéquates (p. ex. expérience postcommercialisation dans d’autres administrations ou études publiées et opinion d’expert, si nécessaire) pour déterminer les médicaments de comparaison et leur utilisation;
- Inclure, dans l’analyse des scénarios, les produits de comparaison non médicinaux dont l’incidence pourrait être notable;
- Inclure, dans l’analyse des scénarios, tout médicament de comparaison susceptible d’être inscrit sur la liste des médicaments assurés au cours de l’horizon prévisionnel. Si cela est justifié, l’inclure dans l’analyse principale;
- Inclure, dans l’analyse des scénarios, les médicaments génériques à venir, s’il y a lieu.
7.3 Prévision du marché : scénario de référence
Une fois les données établies pour l’année de référence, l’analyste doit prévoir les données du modèle sur l’horizon prévisionnel. Il ne doit inclure que les outils qui font partie du progiciel de base utilisé pour élaborer le modèle (généralement Microsoft Excel). Toute macro définie par l’utilisateur doit être clairement indiquée et étoffée, de sorte que les décideurs du régime d’assurance-médicaments puissent facilement utiliser, comprendre et évaluer le modèle.
Les changements attendus sur le marché au fil du temps, y compris la croissance estimative du marché et la distribution des parts du marché entre les médicaments de comparaison, doivent être pris en compte dans les prévisions. Toutes les sources d’information (p. ex. bases de données, études publiées et opinions d’experts) doivent être citées en référence dans l’AIPMB, et le choix des données pour l’ensemble des prévisions et des hypothèses doit être expliqué en détail.
7.3.1 Estimation de la croissance du marché
La croissance estimative du marché est le produit de deux facteurs : la croissance de la population générale et les changements propres à une maladie.
Pour intégrer dans le modèle des statistiques sur la croissance de la population, il est recommandé d’utiliser des prévisions publiées et rendues publiques. Statistique Canada possède la plus grande collection de données et de prévisions pertinentes sur la population. Si l’analyste ne dispose d’aucune prévision fiable concernant la population cible, il peut produire des estimations à partir de données provenant d’une source publiée ou fiable (p. ex. une base de données fondée sur les données du régime d’assurance-médicaments).
Le nombre de patients traités pour un problème donné peut varier au cours de l’horizon prévisionnel, entre autres, en raison des changements sur le plan des normes des soins de santé ou des régimes d’assurance-médicaments. Tout changement prévu sur le marché doit être repris dans les estimations de la croissance du marché. L’information concernant les changements possibles peut être obtenue auprès de diverses sources, notamment le site Web et les publications du régime d’assurance-médicaments et de l’ACMTS, d’autres documents publiés, les opinions d’experts, l’évaluation de données historiques et l’information commerciale vérifiable. En l’absence de ces éléments d’information, le marché sera considéré comme stable et le taux de croissance sera présumé être de 0 %.
7.3.2 Estimation de la répartition des parts du marché
Après avoir établi les prévisions du marché, l’analyste doit évaluer les parts du marché des différentes stratégies de traitement sur l’horizon prévisionnel. Ces estimations seront utilisées pour le scénario de référence selon lequel le nouveau médicament n’est pas inscrit sur la liste des médicaments assurés et pour le scénario du nouveau médicament selon lequel le nouveau médicament est inscrit sur la liste des médicaments assurés.
Pour le marché actuel, il faut utiliser les données du régime public d’assurance-médicaments pour déterminer la répartition des patients (ou des demandes de remboursement) entre les différents traitements offerts. Les tendances annuelles doivent être calculées pour chaque médicament de comparaison et les valeurs obtenues doivent être utilisées pour prévoir les variations des parts de marché sur l’horizon prévisionnel, suivant les tendances prévisibles. Si le marché est jugé stable, la répartition des parts du marché des médicaments de comparaison peut être constante pour tout l’horizon prévisionnel.
Dans certains cas, il faudra évaluer un ou plusieurs médicaments de comparaison qui peuvent être indiqués et utilisés pour plusieurs problèmes de santé. Selon leur source, les données peuvent ne pas être ventilées par indication ou par utilisation. Il faudra alors consulter les études publiées afin de déterminer le pourcentage de patients traités avec les médicaments de comparaison pour l’indication (ou les indications) visée. En l’absence d’études publiées, on peut s’en remettre à l’opinion d’un expert. Si l’on s’attend à ce que de nouveaux traitements soient ajoutés à la liste des médicaments assurés ou à ce que des traitements existants soient retirés au cours de l’horizon prévisionnel (p. ex. retrait d’un médicament du marché, inscription d’un médicament concurrent sur la liste des médicaments assurés, disponibilité d’équivalents génériques), les estimations tenant compte de ces éventualités doivent être prises en compte dans une analyse des scénarios. Les données historiques du même marché pour des médicaments semblables doivent être utilisées pour déterminer comment les perturbations du marché peuvent influer sur la distribution des traitements disponibles. Par ailleurs, les données historiques d’un marché privé ou étranger qui ressemble au marché modélisé peuvent être utilisées pour prévoir les variations du marché. En l’absence d’autres éléments d’information, les stratégies suivantes peuvent être suivies :
- Inscription sur la liste d’un nouveau traitement concurrent
La croissance de la part du marché du nouveau traitement concurrent doit refléter celle du nouveau médicament proposé.
- Médicament retiré du marché
La part du marché occupée par le médicament retiré du marché doit être répartie entre les traitements qui demeurent accessibles au prorata de la part du marché occupée par chaque médicament de comparaison, p. ex. un traitement qui accapare 80 % du marché devrait obtenir 80 % de la part du marché que détenait le traitement qui a été retiré.
S’il n’existe aucun médicament de comparaison pour le nouveau médicament, le scénario de référence ne devrait comprendre aucun médicament, alors que le scénario du nouveau médicament ne devrait comprendre que le nouveau médicament. Il s’agit du format le plus simple de l’AIPMB où l’incidence sur le budget correspond au coût total du médicament lancé sur le marché.
Bref, pour prévoir les changements dans le scénario de référence, les analystes doivent faire ce qui suit :
- Utiliser des outils qui font partie du progiciel de base utilisé pour produire le modèle;
- Tirer les statistiques sur la croissance de la population des prévisions publiées;
- Consulter les bases de données disponibles pour déterminer la distribution actuelle des parts de marché des stratégies de traitement;
- Établir des prévisions qui tiennent compte des variations prévues du marché au cours de l’horizon prévisionnel (p. ex. inscription d’un nouveau traitement concurrent, retrait d’un traitement du marché ou mise en marché de médicaments génériques).
7.4 Prévision du marché : scénario du nouveau médicament
Lorsqu’un nouveau médicament est inscrit sur la liste des médicaments assurés, la dynamique actuelle du marché peut devenir chose du passé. En effet, le taux de croissance du marché, l’utilisation faite des traitements disponibles et même le montant payé annuellement par le régime d’assurance-médicaments peuvent changer après l’ajout d’un nouveau médicament. Les analystes procédant à l’AIPMB doivent donc tenir compte de ces facteurs lorsqu’ils établissent des prévisions quant aux variations du marché au cours de l’horizon prévisionnel.
L’éventail de nouvelles stratégies de traitement prises en compte dans l’AIPMB doit démontrer les changements que devrait subir le marché suite à l’ajout du nouveau médicament à la liste des médicaments assurés. Il faudra également expliquer le changement de la répartition des parts de marché. Le taux auquel le nouveau traitement accaparera les parts de marché de ses médicaments de comparaison doit être clairement documenté et être présenté d’une manière qui reflète la part du marché de l’année précédente.
À cette fin, les marchés où le nouveau médicament est admissible à un remboursement doivent être pris en compte lors de l’établissement du processus prévisionnel. Ces éléments d’information devraient être mentionnés dans le corps du rapport ou en annexe au rapport. Il faut également y joindre une brève évaluation à savoir si les données présentées ou les tendances dégagées traduisent les variations attendues sur les marchés des régimes d’assurance-médicaments.
Les prévisions de la part de marché du nouveau médicament doivent être établies à la lumière de sa croissance sur le marché au sein d’autres régimes publics d’assurance-médicaments au Canada, sur les marchés de payeurs privés canadiens ou, dans des circonstances exceptionnelles, sur des marchés étrangers. Les analystes ne devraient toutefois utiliser des marchés de payeurs privés ou des marchés étrangers que s’ils sont semblables au marché du régime public d’assurance-médicaments visé ou si leur relation est bien comprise. Si le nouveau médicament n’a pas été inscrit sur d’autres listes des médicaments assurés, les prévisions peuvent reposer sur la part de marché d’un produit semblable sur un marché de payeur privé ou sur un marché étranger. Cette méthode ne doit être utilisée que s’il est clair qu’on obtiendra des résultats raisonnables et pertinents.
Si aucune des méthodes susmentionnées ne se prête à l’estimation de la part de marché du nouveau médicament, la part de marché prévue peut être fondée sur les données présentées dans des publications, sur une opinion d’expert, sur une expérience passée ou sur toute autre source de données fiables sur l’utilisation escomptée du médicament.
Au nombre des facteurs qui peuvent être pris en compte dans le calcul de la part de marché du nouveau médicament, citons les suivants :
- Pourcentage d’utilisateurs d’autres traitements qui peuvent utiliser le nouveau médicament;
- Pourcentage de médecins qui connaissent le nouveau médicament;
- Pourcentage de médecins qui acceptent de prescrire le nouveau médicament;
- Pourcentage d’utilisateurs d’autres traitements qui connaissent le nouveau médicament;
- Pourcentage d’utilisateurs d’autres traitements qui sont susceptibles d’adopter le nouveau médicament;
- Pourcentage d’utilisateurs qui mettent le nouveau médicament à l’essai, mais qui n’obtiennent pas les résultats escomptés.
D’autres critères pourront au besoin être ajoutés à cette liste, suivant les besoins du régime public d’assurance-médicaments. La somme de tous les pourcentages représente la part du marché que devrait accaparer le nouveau médicament pour chaque année du modèle.
7.4.1 Estimation de la croissance du marché
Lorsque le nouveau médicament est susceptible de donner lieu à un changement sur le plan du nombre de patients traités pour une indication donnée, ce fait doit être reflété dans les prévisions utilisées. L’incidence de ce changement peut être évaluée en tenant compte de l’expérience vécue sur des marchés de payeurs privés ou des marchés étrangers, en utilisant les données de médicaments semblables qui ont été mis en marché ou l’opinion d’un expert. Les analyses de sensibilité doivent être effectuées pour toutes les estimations de la croissance du marché. Lorsqu’il est impossible de générer des estimations faibles et élevées fondées sur les données, il faut alors utiliser des estimations faibles et élevées raisonnables du taux de croissance. Le recours à de telles estimations doit alors être décrit et étayé.
À défaut de données permettant d’extrapoler les variations de la croissance du marché, le taux de croissance du marché attribuable au lancement du nouveau médicament doit être établi à 0 %. Cette hypothèse doit être présentée d’une façon explicite et être vérifiée à l’aide d’analyses de sensibilité mesurant l’effet des augmentations ou des diminutions annuelles et raisonnables de la taille du marché (p. ex. augmentation de 5 %). L’utilisation d’une valeur particulière dans les analyses de sensibilité doit aussi être justifiée.
Lorsque tout indique (ou que l’opinion fiable d’un expert indique) que l’introduction d’un nouveau traitement ne devrait pas donner lieu à une croissance du marché, il n’est alors pas nécessaire d’effectuer des analyses de sensibilité pour étudier les variations de la croissance du marché. Il faut plutôt fournir les éléments d’information à l’appui de cette conclusion.
Dans tous les cas, les prévisions doivent couvrir tout l’horizon prévisionnel et être accompagnées d’un commentaire concernant les données sur lesquelles sont fondées les estimations.
7.4.2 Estimation de la part de marché du nouveau médicament
L’utilisation possible du nouveau médicament sur le marché aura une incidence marquée sur les résultats de l’AIPMB. Pour le scénario du nouveau médicament, l’analyste doit utiliser les données historiques des marchés des payeurs privés canadiens ou des marchés étrangers pour évaluer la répartition des parts de marché des médicaments de comparaison. Bien ce que soit là la meilleure façon d’évaluer la part du marché, cette méthode est limitée par les variations entre les marchés, puisque l’information provenant d’un marché n’est pas nécessairement directement transférable à un autre marché.
On pourrait également concevoir un modèle pour prévoir la part de marché du nouveau médicament à l’aide de données telles que le nombre prévu de patients qui connaissent le nouveau médicament, le nombre de médecins qui connaissent le nouveau médicament, le taux probable de délaissement d’un médicament existant en faveur du nouveau médicament et tous autres facteurs du genre. Suivant cette approche, les changements éventuels du marché serviront à évaluer les coûts supplémentaires que devra assumer le régime d’assurance-médicaments ou, encore, les économies qu’il réalisera. Une opinion d’expert devrait être utilisée pour évaluer la justesse de ces estimations.
Il importe de décrire de façon aussi détaillée que possible les hypothèses et les calculs qui portent sur l’estimation de la part de marché.
7.4.3 Estimation du taux de délaissement des thérapies existantes
Le taux auquel le nouveau médicament accaparera une part du marché doit être évalué à l’aide d’une série d’hypothèses soigneusement pesées. Ces hypothèses doivent reposer sur toute l’information commerciale vérifiable disponible et être entièrement étayées.
Pour calculer la part du marché, les prévisions du nouveau marché doivent être établies à la lumière des prévisions de l’année précédente. Si on prévoit, par exemple, que le nouveau médicament accaparera au cours de la première année 100 % de la part du marché d’un médicament de comparaison, la valeur de la part du marché qui reviendra au nouveau médicament la deuxième année sera de 0 %.
Lorsque les données disponibles ne permettent pas d’améliorer la qualité des prévisions des parts de marché de chaque médicament de comparaison ou, encore, si on s’attend à ce que le nouveau médicament donne lieu à une augmentation de la taille du marché indépendamment du fait que les patients optent ou non pour le nouveau médicament, on doit présumer que le taux auquel le nouveau médicament accaparera le marché d’un médicament de comparaison sera proportionnel à la part de marché occupée par ce médicament. Si, par exemple, le médicament de comparaison A détient 75 % du marché et le médicament de comparaison B 25 %, on peut présumer que le nouveau médicament prendra 75 % de la part du marché du médicament A et 25 % du médicament B.
Bref, pour prévoir les changements du marché relatif au scénario du nouveau médicament, les analystes doivent faire ce qui suit :
- Établir les prévisions sous le scénario de référence à l’aide des règles générales détaillées;
- Consulter les données relatives au médicament sur les marchés où le nouveau médicament est actuellement remboursé;
- Considérer l’information commerciale vérifiable actuelle quant à l’incidence qu’aura le remboursement du nouveau médicament sur le marché et y faire référence.
7.5 Estimation des coûts en médicaments
Les prix des médicaments constituent une composante importante de l’AIPMB et ils devraient être estimés avec soin. Des facteurs tels que le prix unitaire du médicament, les équivalences thérapeutiques et les rajustements de prix sous forme de marges bénéficiaires, d’honoraires du pharmacien et de co-paiements sont autant d’éléments qui doivent être pris en compte pour évaluer les coûts supplémentaires que devra assumer le régime ou les économies qu’il pourra réaliser si le nouveau médicament est inscrit sur la liste des médicaments assurés. Dans les sections qui suivent, on explique comment évaluer ces facteurs et comment les utiliser dans les modèles d’AIPMB en tenant compte des hypothèses relatives au coût unitaire et au traitement utilisées dans l’évaluation économique.
7.5.1 Estimation du coût unitaire des médicaments actuellement admissibles à un remboursement
Pour évaluer le coût de chaque médicament, ou d’une stratégie de traitement, il faut obtenir les prix de remboursement auprès des meilleures sources disponibles, telles que la liste des médicaments assurés du régime d’assurance-médicaments, le fabricant, le grossiste ou les fournisseurs de données du régime public d’assurance-médicaments.
Il faut consulter les versions les plus récentes des listes de prix des médicaments inscrits sur la liste des médicaments assurés des régimes d’assurance-médicaments. Il convient de préciser que des frais additionnels, comme des marges bénéficiaires, peuvent avoir été ajoutés au prix figurant sur les listes des régimes provinciaux d’assurance-médicaments. Le document intitulé Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) – Document d’information sur les régimes de l’ICIS donne de l’information contextuelle sur les frais additionnels que chaque régime public d’assurance-médicaments au Canada utilise.
Les prix utilisés dans l’AIPMB doivent être les prix les plus appropriés pour chaque médicament de comparaison. Il peut s’agir du prix le plus bas remboursé pour un ingrédient médicinal, du prix le plus bas remboursé pour un type de thérapie, du prix réel du médicament ou d’un autre prix. Le prix qu’il y a lieu d’utiliser sera, dans la plupart des cas, indiqué sur la liste des médicaments assurés.
Lorsque le prix remboursé est le prix départ-usine, le prix du médicament peut être demandé directement au fabricant du médicament. Le prix du nouveau médicament et celui du médicament de comparaison devraient concorder sur le plan des marges bénéficiaires applicables.
Lorsque le prix unitaire ne peut être obtenu en consultant la liste des médicaments assurés ou en s’adressant au fabricant, l’analyste peut utiliser l’information tirée des catalogues des grossistes ou d’autres sources de données du régime public d’assurance-médicaments. La source de données doit être la plus récente possible. Idéalement, elle devrait être de la même année civile que les sources des autres prix utilisés dans le modèle.
Dans tous les cas, les prix utilisés dans l’AIPMB doivent être tirés de sources propres au régime d’assurance-médicaments sous examen. Entre autres exemples, une AIPMB pour la province de l’Ontario doit utiliser les coûts de l’Ontario et non pas les coûts de l’Alberta. Toutes les sources des coûts doivent aussi être clairement étayés dans le rapport.
7.5.2 Estimation du coût unitaire des médicaments non remboursés par les régimes d’assurance-médicaments
Le prix des médicaments qui ne sont pas actuellement remboursés, mais qui devraient être inscrits sur la liste des médicaments assurés au cours de l’horizon prévisionnel, doivent être évalués au moyen des données disponibles.
Si le nouveau médicament représente une concentration plus faible d’un traitement existant, c’est le prix de ce traitement qui doit être utilisé. Si le nouveau médicament représente une catégorie de médicaments, il faut utiliser comme base d’établissement du prix le médicament de cette catégorie dont le prix est le plus bas.
Lorsque l’information concernant le prix du médicament de comparaison non inscrit sur la liste des médicaments assurés est limitée, le prix de ce médicament doit être le même que celui du nouveau médicament à l’étude afin de minimiser l’effet de distorsion.
Toute hypothèse concernant le prix des médicaments de comparaison doit être formulée dans le rapport et être vérifiée au moyen de l’ADS.
7.5.3 Estimation des équivalences thérapeutiques
Pour déterminer dans l’AIPMB le coût par ordonnance ou le coût par patient par année, il est important d’évaluer avec précision les équivalences thérapeutiques. Dans l’AIPMB, on entend par « équivalence thérapeutique » l’équivalence de l’utilisation et non pas l’équivalence de l’efficacité thérapeutique, par exemple, un traitement prescrit pour être administré une fois par mois ne peut en toute équité être comparé sur la seule base de son prix unitaire à un traitement prescrit pour être administré une fois par jour. La fréquence de l’administration du médicament doit également être prise en compte dans la comparaison des deux traitements.
Pour assurer une comparaison équitable, le nombre d’unités utilisées par jour et le nombre de jours d’administration du médicament par année doivent être présentés clairement dans l’AIPMB. Sous le modèle fondé sur les demandes de remboursement, il faut normaliser les demandes de remboursement rattachées à chaque médicament afin de représenter la même période de traitement. Comme ces estimations reflètent la quantité de médicaments remise et non la quantité de médicaments consommée, la quantité remboursée par le régime d’assurance-médicaments reflétera le nombre d’unités remises par demande de remboursement. Le gaspillage et le partage d’unités devraient donc déjà être pris en compte dans le coût du médicament et ne requérir aucun rajustement supplémentaire. Au besoin, ces éléments peuvent être pris en considération dans l’analyse des scénarios.
Tous les traitements modélisés dans l ’AIPMB doivent être tirés de la monographie du produit ou de la base de données du régime public d’assurance-médicaments, ou encore d’autres données applicables du régime. Si on dispose de données du monde réel, il faut tenir compte de la constance du patient dans l’estimation de la durée du traitement. Les données devraient fournir une indication claire du nombre d’unités administrées par jour ou par année pour chaque traitement. Lorsque la stratégie de traitement comprend plus d’un médicament, les données du monde réel peuvent fournir de l’information sur l’utilisation des médicaments concomitants. Il faut dans tous les cas démontrer la validité de la source des données.
7.5.4 Inclusion des marges bénéficiaires, des honoraires du pharmacien et des co-paiements
Chaque régime d’assurance-médicaments participant a sa propre politique de remboursement des marges bénéficiaires, des honoraires du pharmacien et des co-paiements. Si le régime l’exige, ces rajustements doivent être inclus dans les coûts des médicaments utilisés dans le modèle et les calculs doivent respecter les exigences de chaque régime d’assurance-médicaments. Une liste mise à jour des rajustements de prix doit être obtenue directement du site Web du régime d’assurance-médicaments visé. L’ICIS et le CEPMB offrent aussi sur leur site Web de l’information sur les frais propres aux divers régimes.
Lorsque l’AIPMB couvre une polythérapie, les honoraires du pharmacien doivent être inclus dans le calcul de l’incidence du nouveau traitement sur le budget du régime d’assurance-médicaments. L’utilisation d’une polythérapie réduit en effet le nombre de demandes de remboursement soumises et donc le montant que le régime d’assurance-médicaments rembourse en honoraires du pharmacien. La marge bénéficiaire du grossiste et la marge bénéficiaire de la pharmacie doivent aussi être prises en compte lorsqu’elles ont une incidence directe sur le calcul des honoraires du pharmacien remboursés par le régime d’assurance-médicaments. Les co-paiements ne doivent être inclus que si le régime d’assurance-médicaments l’exige. Les analystes doivent consulter le document intitulé Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP) – Document d’information sur les régimes de l’ICIS pour en savoir plus sur les co-paiements.
Bref, pour établir le prix de chaque stratégie de traitement, les analystes doivent faire ce qui suit :
- Obtenir le prix du remboursement des meilleures sources disponibles, comme la liste des médicaments assurés du régime d’assurance-médicaments, les bases de données des régimes d’assurance-médicaments et l’information sur les prix du grossiste;
- Établir une estimation du nombre de jours de traitement pour chaque stratégie de traitement (c.-à-d. tenir compte des équivalences thérapeutiques et du gaspillage);
- Inclure les rajustements de prix en tenant compte des exigences du régime d’assurance-médicaments.
7.6 Calcul de l’incidence sur le budget
L’analyste doit utiliser les estimations établies dans le scénario de référence et dans le scénario du nouveau médicament pour déterminer les coûts supplémentaires que devra assumer le régime ou les économies qu’il pourra réaliser. Le processus visant à calculer l’incidence sur le budget est illustré dans le diagramme 7.6.
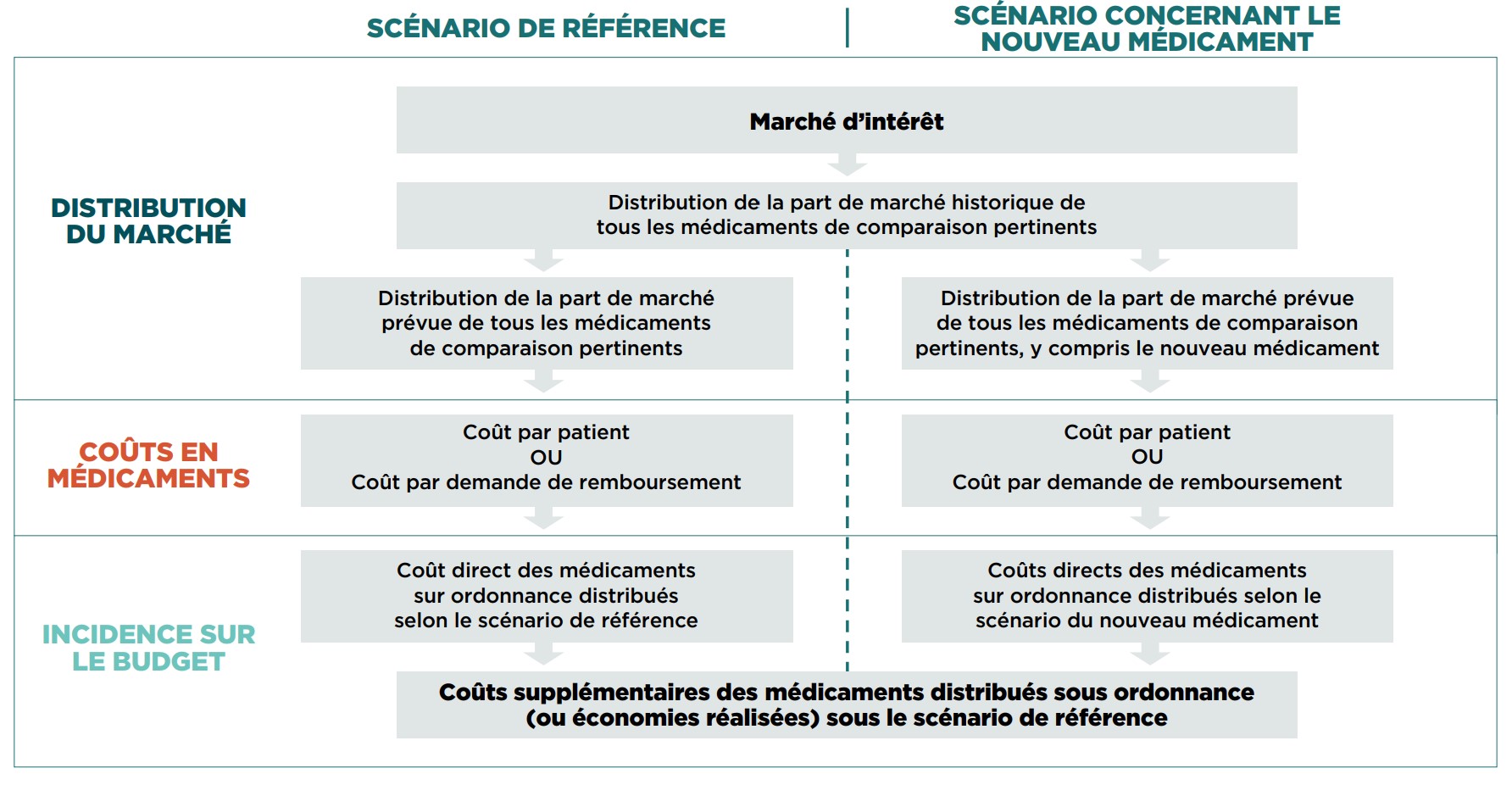
Figure description
Le diagramme illustre le processus à suivre pour déterminer l’incidence du médicament analysé sur le budget. Le diagramme permet de comparer le processus pour le scénario de référence et le scénario du nouveau médicament suivant les trois sections principales de l’analyse : distribution du marché, coût en médicaments et incidence sur le budget.
Le processus à suivre pour le scénario de référence est le suivant :
Distribution du marché
- Marché d’intérêt
- Distribution de la part de marché historique de tous les médicaments de comparaison pertinents
- Distribution de la part de marché prévue de tous les médicaments de comparaison pertinents
Ensuite
Coûts en médicaments
- Coût par patient ou coût par demande de remboursement
Ensuite
Incidence sur le budget
- Coût direct des médicaments sur ordonnance distribués selon le scénario de référence
Le processus à suivre pour le scénario du nouveau médicament est le même, sauf que le nouveau médicament est inclus dans la distribution de la part de marché prévue de tous les médicaments de comparaison pertinents.
L’incidence ultime sur le budget est déterminée au moyen du calcul des coûts supplémentaires des médicaments sur ordonnance (économies) résultant de la différence entre les scénarios.
La valeur de chaque scénario est égale au coût total de chaque stratégie de traitement. L’estimation du coût annuel d’une stratégie de traitement dépend du modèle. Lorsque le modèle utilisé est fondé sur la population, le coût annuel d’une stratégie de traitement est égal à ce qui suit :
Nombre de patients par année x Part de marché de la stratégie de traitement pour l’année x Coût du médicament par patient par année
Lorsque le modèle utilisé est fondé sur les demandes de remboursement, le coût annuel d’une stratégie de traitement est égal à ce qui suit :
Nombre de demandes de remboursement par année x Part de marché de la stratégie de traitement pour l’année x Coût du médicament par patient par demande de remboursement
L’incidence sur le budget est égale à la différence entre la valeur du scénario du nouveau médicament et celle du scénario de référence. Une incidence positive sur le budget indique que l’introduction du nouveau médicament donnera lieu à une augmentation des dépenses pour le régime d’assurance-médicaments, alors qu’une incidence négative indique que le régime d’assurance-médicaments économisera de l’argent en inscrivant le nouveau médicament sur sa liste des médicaments assurés.
Les coûts supplémentaires des médicaments distribués sous ordonnance doivent être calculés pour chaque année de l’horizon prévisionnel. Les coûts supplémentaires cumulatifs au cours de l’horizon prévisionnel des médicaments distribués sous ordonnance doivent aussi être évalués. Le sommaire des calculs du total des coûts directs pour chaque année (année 1, année 2 et année 3) et pour toutes les années (années 1 à 3) doit être présenté par scénario afin que les vérificateurs comprennent bien comment a été évaluée l’incidence sur le budget.
8.0 Recommandations relatives au format du rapport
Le format de rapport recommandé est fondé sur la structure que privilégie l’ISPOR pour le rapport de l’AIPMB [Référence 10] . L’information doit être présentée de manière à optimiser la cohérence et la transparence. Les choix faits au moment d’élaborer l’AIPMB doivent être pleinement documentés et décrits d’une façon claire afin que les décideurs puissent aisément comprendre la méthodologie sur laquelle repose le modèle d’analyse de l’incidence sur le budget.
La Liste de contrôle de l’AIPMB (annexe C) doit être utilisée pour vérifier l’exhaustivité de l’AIPMB.
8.1 Contenu du rapport
Introduction
L’introduction doit contenir l’objectif et la perspective de l’analyse, ainsi qu’un sommaire de tous les éléments d’information épidémiologique, clinique et économique se rapportant à la population admissible et à l’indication visées. Plus précisément, les éléments à inclure sont les suivants :
Objectif
L’objectif de l’AIPMB doit être clairement énoncé et lié à la population qui serait admissible à un remboursement, à l’horizon prévisionnel et à la perspective employée dans le rapport.
Épidémiologie et prise en charge du problème de santé
L’introduction doit contenir des détails selon l’âge et le sexe concernant la prévalence et l’incidence de la maladie en question, la pathologie, la gravité et le pronostic de la maladie, les cas non diagnostiqués ou non traités, ainsi que les facteurs de risque qui permettront d’évaluer l’incidence sur le budget.
Information clinique
L’information clinique concernant la population admissible et les options de prise en charge existantes (les options de traitement pharmacologiques et non pharmacologiques) qui influent sur la conception de l’AIPMB, ainsi que l’efficacité et l’innocuité de ces options, doit être résumée. Si des options thérapeutiques additionnelles devaient devenir disponibles avant la fin de l’horizon prévisionnel, il faudrait aussi les décrire.
Incidence économique
Les études qui traitent des indications et des traitements visés doivent être passées en revue. Au nombre de telles études, citons les suivantes :
- AIPMB antérieures traitant de la condition visée pour un autre médicament
- Études sur le fardeau de la maladie et le coût des soins
- Études sur le rapport coût-efficacité ou sur le rapport coût-utilité
Technologie
Il faut décrire sous la présente rubrique les caractéristiques du nouveau médicament, y compris les détails concernant la façon dont la nouvelle technologie se compare aux traitements existants. Plus précisément, les caractéristiques dont il faut faire état sont les suivantes :
- Indication (selon la monographie du médicament)
- Formulation
- Amorce de l’action
- Efficacité
- Effets secondaires
- Effets indésirables graves
- Résultats intermédiaires
- Respect et conformité
Un sommaire des essais cliniques doit aussi être fourni, dont l’information sur la conception, la population visée par à l’étude, la période de suivi et les résultats cliniques. Ce sommaire peut être présenté sous forme de tableau.
Plan et méthodologie de l’étude
Dans le rapport, on doit fournir sous la rubrique « Méthodes » suffisamment de détails pour permettre à une tierce partie de reproduire l’analyse. Les caractéristiques suivantes doivent toutes être traitées sous cette rubrique :
Population de patients
La population de patients visée (population admissible ayant le problème de santé en question) doit être décrite d’une façon claire et succincte sous la présente rubrique. Il convient d’y noter les détails concernant la restriction posée à l’accès au nouveau médicament après que celui-ci ait été inscrit sur la liste des médicaments assurés.
Éventail de stratégies de traitement
Les hypothèses formulées dans le modèle concernant l’éventail de stratégies de traitement pour le scénario de référence et pour le scénario du nouveau médicament doivent être décrites et justifiées. Les stratégies de traitement sélectionnées doivent refléter les stratégies de traitement et les lignes directrices cliniques de l’administration visée. Les caractéristiques pertinentes de chaque stratégie de traitement doivent aussi être fournies. Cela comprend l’indication approuvée, le dosage, l’efficacité, les effets indésirables et les questions relatives au respect du traitement.
Perspective
L’AIPMB porte exclusivement sur l’incidence qu’aura sur le budget des régimes publics d’assurance-médicaments l’inscription d’un nouveau médicament sur la liste des médicaments assurés. Cette perspective sera confirmée dans le rapport et le régime d’assurance-médicaments pour lequel l’AIPMB est préparée y sera mentionné.
Horizon prévisionnel
Règle générale, l’horizon prévisionnel du rapport doit être de trois ans à compter de la date prévue de l’inscription du nouveau traitement sur la liste des médicaments assurés. Un horizon prévisionnel plus long peut être utilisé, avec justification à l’appui.
Description du modèle
Un schéma du modèle d’AIPMB et une description détaillée et complète de sa structure doivent être présentés dans le rapport.
Données et leurs sources
Afin qu’il soit possible de reproduire l’analyse et d’arriver aux mêmes résultats, toutes les valeurs utilisées dans l’AIPMB pour produire les résultats d’analyse, y compris les autres scénarios plausibles, doivent être présentées dans le rapport. Les transformations et calculs de données doivent être décrits de manière suffisamment détaillée pour qu’il soit possible de les reproduire. Selon la structure du modèle d’AIPMB, les paramètres étudiés peuvent inclure le coût, les données épidémiologiques ou les données sur l’utilisation des médicaments.
Chaque valeur de paramètre doit être décrite et présentée en référence afin que le lecteur puisse évaluer de lui-même la validation des données utilisées. Les critères de sélection des études et des bases de données doivent être expliqués pour bien situer le processus d’évaluation. En outre, la direction et l’ampleur de toute distorsion des sources de données utilisées seront précisées.
Collecte des données
Les méthodes et les processus employés pour l’abstraction des données (p. ex. des bases de données) ou pour la collecte des données primaires (p. ex. opinion d’expert) doivent être décrits dans le rapport. Les données, les rapports sommaires et les formulaires de collecte de données/questions doivent aussi être joints sous forme d’annexes.
Analyse
Une description des méthodes utilisées pour calculer le budget requis pour lancer le nouveau médicament ainsi que pour calculer les coûts supplémentaires de remboursement des médicaments d’ordonnance par rapport au scénario de référence doit être donnée dans l’analyse principale. Elle doit être suffisamment détaillée et claire pour que le lecteur puisse de lui-même effectuer la même analyse et arriver aux mêmes résultats. Le choix de tous les scénarios présentés dans les résultats doit être documenté et justifié.
Incertitude
Les méthodes d’analyse de l’incertitude doivent être décrites et justifiées.
Résultats
Pour le rapport des résultats du modèle, l’incidence sur le budget total et sur le budget supplémentaire doit être présentée pour chaque année de l’horizon prévisionnel. Il faut également inclure dans le rapport les tableaux montrant les coûts en médicaments globaux et les coûts ventilés, et ce, avant et après avoir appliqué l’information sur les coûts (p. ex. marge bénéficiaire, honoraires du pharmacien, co-paiements) propre au régime d’assurance-médicaments. Une explication des résultats doit être jointe aux tableaux. Les résultats des analyses d’incertitude et les scénarios étudiés doivent être décrits et présentés sous forme de diagrammes ou de tableaux.
Analyses de sensibilité et analyse des scénarios
Les résultats des analyses de sensibilité doivent être décrits et les choix posés concernant les modifications apportées aux données utilisées dans le scénario de référence doivent être justifiés. Un tableau sommaire des résultats des analyses de sensibilité ainsi qu’une présentation graphique des résultats (p. ex. graphique en tornade) doivent également figurer dans cette section du rapport.
Les analyses de sensibilité et l’analyse des scénarios doivent être présentées dans le corps du rapport. Les résultats des analyses de sensibilité connexes doivent être présentés ensemble et de façon explicite (p. ex. les analyses de sensibilité portant sur la taille du marché et l’éventail des analyses de sensibilité les concernant).
Les limites ou les hypothèses se rapportant directement aux analyses de sensibilité et à l’analyse des scénarios doivent être présentées sous forme de sous-section de la présente section et d’une matière semblable à celle utilisée dans la section « Limites et hypothèses ».
Limites et hypothèses
Le rapport doit contenir une section clairement identifiée dans laquelle sont ventilées les limites et les hypothèses formulées au moment de la préparation du modèle ou du rapport (concernant les principales questions relatives à la conception, comme une utilisation non mentionnée sur l’étiquette et les hypothèses sur le respect du traitement, ainsi que l’exhaustivité et la qualité des entrées et des sources de données). Une brève explication de la raison de chaque limite ou hypothèse doit y être donnée. Pour faciliter l’accès à l’information, le rapport doit également contenir un tableau sommaire. La section Limites et hypothèses doit contenir au moins les sous-sections suivantes :
- Limites et hypothèses : Structure du modèle
- Limites et hypothèses : Données et leurs sources
Conclusions
Le rapport sur l’AIPMB doit enfin comprendre une conclusion dans laquelle sont résumés les principaux éléments d’information présentés. C’est dans cette section du rapport que doit être présentée l’incidence sur le budget supplémentaire pour chacune des années sur lesquelles portent les prévisions ainsi que pour l’horizon prévisionnel de l’analyse.
Références et annexes
Les références doivent être présentées en fin de rapport. Il est également fortement recommandé d’ajouter des annexes afin de donner aux rapports d’AIPMB soumis le plus de transparence possible. En effet, l’inclusion d’éléments d’information sur les données utilisées dans le modèle et dans le rapport facilitera l’évaluation de la validité de chaque dossier.
9.0 Modèle d’AIPMB interactif
Les modèles d’AIPMB doivent être présentés comme une série d’étapes clairement définies qui en facilitent l’examen. Tous les calculs effectués doivent être décrits en détail et être justifiés. L’analyste doit concevoir un modèle d’AIPMB qui soit interactif sur le plan fonctionnel afin que l’examinateur puisse aisément changer les divers paramètres en tenant compte des différences provinciales dans la réglementation sur l’établissement du prix des médicaments (p. ex. prix des médicaments, marges bénéficiaires, honoraires du pharmacien et co-paiements) ou puisse tester l’incidence d’une réduction de prix. Toute macro définie par l’utilisateur doit être clairement présentée et étoffée.
9.1 Détails supplémentaires sur le dossier d’AIPMB
Utilisation de tableaux et de graphiques
L’utilisation de graphiques ou de tableaux pour représenter la structure du modèle, les données et les résultats donnera aux décideurs du régime d’assurance-médicaments une vision plus claire de la structure et de la fonction du modèle d’AIPMB.
Tous les rapports doivent contenir les éléments suivants :
Représentation schématique du modèle
Le rapport doit contenir un diagramme qui illustre clairement la fonction du modèle, accompagné d’un texte descriptif. Ce diagramme peut être une adaptation pour un médicament en particulier du diagramme 9.1.
Tableaux des intrants et des extrants
Les tableaux énumérant les intrants (et leurs références) et les extrants donnent aux examinateurs un sommaire du modèle qu’ils peuvent facilement comprendre. Ces tableaux doivent être intégrés dans la section « Données et leurs sources » du rapport.
Tableau des limites et des hypothèses
Une liste des limites et des hypothèses du modèle contribue à en améliorer la transparence. Cette liste doit donc être intégrée dans la section « Limites et hypothèses » du rapport.
Représentation schématique de l’incertitude
Des graphiques (tel que des graphiques en tornade) doivent être utilisés pour présenter les variables qui ont la plus grande incidence sur les résultats du modèle. Ces graphiques doivent être intégrés dans la section « Analyses de sensibilité et analyse des scénarios » du rapport.
Lorsque des graphiques sont utilisés pour démontrer l’incertitude inhérente à un modèle donné, les résultats sommaires de l’incidence nette sur le budget doivent être présentés pour au moins trois années (c.-à-d. années 1 à 3) après l’inscription du médicament sur la liste des médicaments assurés. L’incidence nette pour chaque année (année 1, année 2 et année 3) ne doit être présentée que si elle permet de jeter un éclairage supplémentaire.
Un exemple de graphique en tornade est présenté ci-dessous (diagramme 9.1). Dans cet exemple, six catégories d’analyses de sensibilité ont été effectuées et les intervalles obtenus ont été présentés au moyen d’un graphique. Les valeurs considérées représentent l’incidence sur le budget pour l’horizon prévisionnel de trois ans. Estimée à 20 000 $, la valeur de l’incidence sur le budget qui est tirée de l’analyse principale est présentée dans le graphique au moyen d’une ligne coupant l’axe des abscisses (x). Les six analyses de sensibilité ont été placées sur l’axe des ordonnées (y) par ordre décroissant de leur intervalle. Ainsi, le graphique en tornade permet aux décideurs de reconnaître rapidement les hypothèses ayant la plus grande incidence sur le modèle d’AIPMB ainsi que les intervalles des coûts supplémentaires que le régime d’assurance-médicaments devra assumer (ou des économies qu’il réalisera) si le nouveau médicament était ajouté à la liste des médicaments assurés.
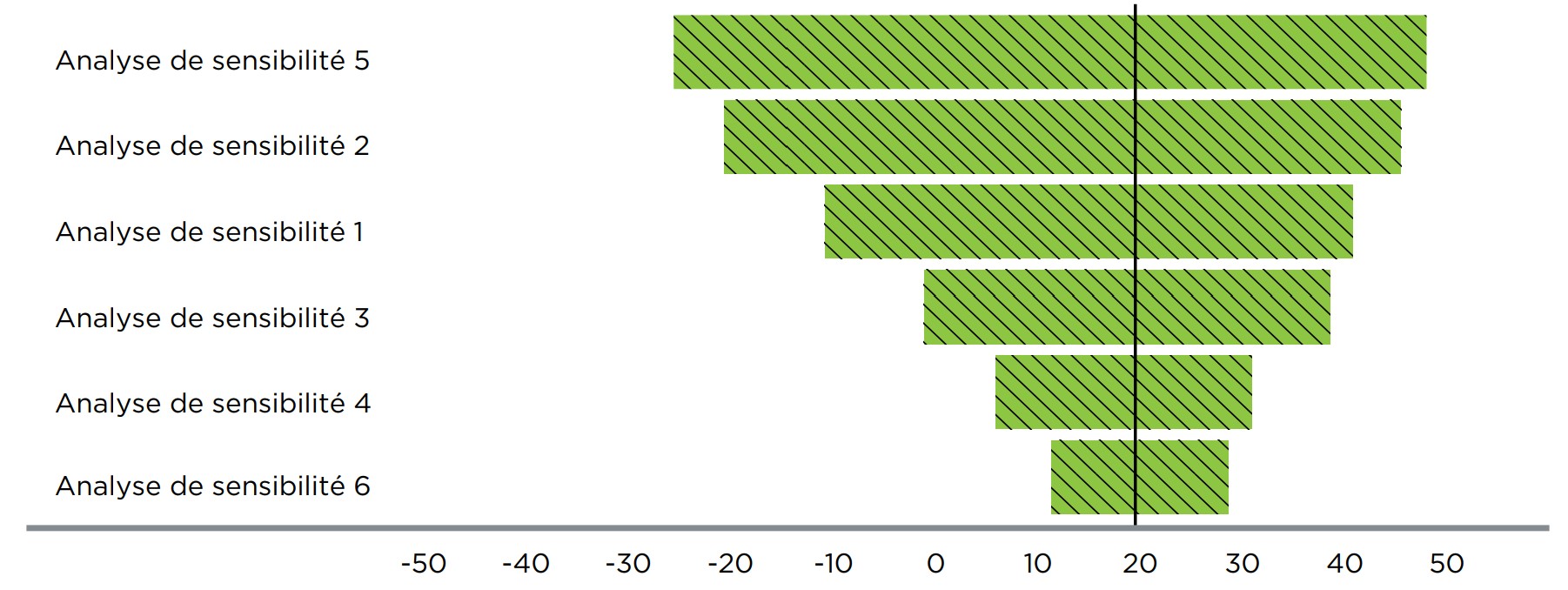
Figure description
Un exemple de graphique en tornade est fourni pour illustrer la présentation idéale des résultats des analyses de sensibilité dans le cadre d’une analyse de l’incidence sur le budget.
10.0 Expressions et abréviations
ACMTS |
Agence canadienne des médicaments et des technologies de la santé |
AIPMB |
Analyse de l’incidence du prix d’un médicament sur les budgets des régimes d’assurance-médicaments |
APP |
Alliance pancanadienne pharmaceutique |
APS |
Analyse probabiliste de sensibilité |
ARCE |
Analyse du rapport coût-efficacité |
Bénéficiaire actif |
Bénéficiaire admissible qui soumet une demande de remboursement |
Bénéficiaire admissible |
Personne admissible à la protection d’un régime d’assurance-médicaments donné |
CEPMB |
Conseil d’examen du prix des médicaments brevetés |
Conformité |
Mesure dans laquelle un patient respecte l’intervalle et le dosage d’un schéma posologique |
Constance |
Période de temps entre l’initiation et l’arrêt de la thérapie |
Coût du médicament |
Le coût d’un médicament comprend le prix remboursé, ainsi que les marges bénéficiaires du grossiste et les marges bénéficiaires et honoraires du pharmacien. Cette définition peut varier selon l’administration. |
FPT |
Fédéral, provincial ou territorial |
ISPOR |
International Society for Pharmacoeconomics and Outcomes Research |
Liste des médicaments assurés |
Liste des médicaments assurés par un régime d’assurance-médicaments donné |
Médicament |
Substance active considérée comme étant un médicament à usage humain en vertu de la Loi sur les aliments et drogues et de son règlement d’application |
PCEM |
Programme commun d’évaluation des médicaments |
PPEA |
Programme pancanadien d’évaluation des anticancéreux |
Prix départ-usine |
Prix auquel le fabricant vend un médicament |
Prix de remboursement prévu |
Prix courant du médicament excluant tout rabais |
SNIUMP |
Système national d’information sur l’utilisation des médicaments prescrits |
Stratégie de traitement |
Une ou plusieurs substances actives utilisées ensemble pour traiter un problème médical |
Taux d’actualisation |
Rajustement des coûts futurs en médicaments et des prestations pour faciliter la comparaison des coûts et des prestations sur différentes années |
Taux d’inflation |
Taux moyen de variation des prix des biens et des services sur une période donnée |
Annexe A : Sommaire des lignes directrices sur l’AIPMB examinées
| Pays | Système de financement | Année | Organisation | Titre |
|---|---|---|---|---|
Irlande |
Système public de santé et de services sociaux (HSE) |
2018 |
Health Information and Quality Authority |
Guidelines for the Budget Impact Analysis of Health Technologies in Ireland 2018 |
France |
Système de sécurité sociale |
2017 |
Haute Autorité de Santé (HAS) |
Le guide d’analyse d’impact budgétaire de la HAS : un nouvel outil d’aide à la décision |
Royaume-Uni |
Système de santé national (NHS) |
2017 |
National Institute for Health and Care Excellence (NICE) |
Proposals for changes to the arrangements for evaluating and funding drugs and other health technologies appraised through NICE’s Technology Appraisal and Highly Specialized Technologies programmes (évaluation de l’incidence sur les ressources) |
Australie |
Régime d’assurance-médicaments (PBS) |
2016 |
Pharmaceutical Benefits Advisory Committee (PBAC) |
Guidelines for preparing a submission to the Pharmaceutical Benefits Advisory Committee (Version 5.0) |
Pologne |
Fonds national de santé (NFZ) |
2016 |
Agence pour l’évaluation des technologies de la santé et le système tarifaire (AOTMiT) |
Health Technology Assessment Guidelines |
Belgique |
Gouvernement fédéral, collectivités, patients |
2015 |
Centre fédéral d’expertise des soins de santé (KCE) |
Guidelines for Budget Impact Analysis |
ISPOR |
S.O. |
2014 |
International Society for Pharmacoeco-nomics and Outcomes Research |
Rapport du groupe de travail de l’ISPOR : Budget Impact Analysis—Principles of good practice: Report of the ISPOR 2012 Budget Impact Analysis good practice II task force |
Canada |
Régimes d’assurance-médicaments fédéral, provinciaux et territoriaux, payeurs privés, patients |
2007 |
Conseil d’examen du prix des médicaments brevetés (CEPMB) |
Lignes directrices pour l’analyse de l’incidence du prix d’un médicament sur les budgets des régimes d’assurance-médicaments au Canada |
| Lignes directrices canadiennes sur l’AIPMB | Année | Modèle ou lignes directrices |
|---|---|---|
Agence canadienne des médicaments et des technologies de la santé (ACMTS) |
2020 |
Procédures du Programme pancanadien d’évaluation des anticancéreux et du Programme commun d'évaluation des médicaments de l’ACMTS (en anglais) |
Alberta (Plan de médicaments sur ordonnance) |
2018 |
Budget Impact Assessment for the Alberta Drug Benefit List (version 9, mai 2018) |
Québec (Régime d’assurance-médicaments) |
2018 |
Guide de soumission d’une demande à l’INESSS (2018) |
Manitoba (Liste des médicaments admissibles et interchangeables du Manitoba) |
2017 |
Budget Impact Analysis for Manitoba Health, Seniors and Active Living (avril 2017) |
Ontario (Programme de médicaments de l’Ontario) |
2016 |
Ontario Guidelines for Drug Submission and Evaluation (2016) |
Annexe B : Sommaire des modifications aux Lignes directrices pour l’AIPMB du CEPMB
Ce tableau montre les modifications qui ont été apportées à la précédente version des Lignes directrices pour l’AIPMB du CEPMB publiées en mai 2007.
| Section | Description de la modification | Ajout/Modification |
|---|---|---|
| Cadre d’analyse | ||
Perspective |
Les coûts associés à une plus vaste perspective du système de santé et les coûts non liés aux soins de santé sont généralement exclus des AIPMB. Ils peuvent toutefois être inclus dans une analyse complémentaire ou être mentionnés dans le corps du rapport d’AIPMB s’ils sont susceptibles d’avoir une incidence considérable sur le budget. Dans certains cas exceptionnels, les coûts liés au système de santé peuvent être inclus dans l’analyse du scénario de référence. |
Modification |
Horizon prévisionnel |
On recommande encore généralement un horizon prévisionnel comprenant une période de référence d’un an et une période prévisionnelle de trois ans, mais on peut maintenant ajouter des années, s’il y a lieu. |
Modification |
Population |
Il faut, s’il y a lieu, utiliser une population ouverte dans l’évaluation de la population cible (p. ex. le taux de mortalité et la progression de la maladie doivent être pris en compte dans l’AIPMB). |
Nouveau |
On donne autant de poids à l’approche fondée sur la population qu’à l’approche fondée sur les demandes de remboursement. L’approche à privilégier dépend des données accessibles et des caractéristiques du marché. On donne des orientations plus claires sur la manière de choisir la meilleure approche. |
Modification |
|
On note que la croissance du marché doit, sous l’approche fondée sur les demandes de remboursement, reposer sur la croissance prévue du nombre de demandes de remboursement et de demandeurs, lorsqu’on dispose de données sur le nombre unique de demandeurs. |
Modification |
|
Scénarios de comparaison |
On note que les indications changeantes doivent être prises en compte dans le rapport d’AIPMB. |
Ajout |
Coûts en médicaments |
On note que le coût des essais diagnostiques complémentaires ou des instruments médicaux couverts par le régime d’assurance-médicaments doit être pris en compte dans l’AIPMB. |
Ajout |
On explique que l’analyste doit tenir compte de l’incidence de la conformité et de la constance de la thérapie sur le coût des traitements, si cela est exigé par le régime d’assurance-médicaments. |
Ajout |
|
On donne plus de souplesse sur le plan des primes et des franchises. Ainsi, bien que ces éléments ne soient généralement pas pris en compte dans le calcul des coûts, ils doivent être inclus si le régime d’assurance-médicaments l’exige (p. ex. dans le cas d’un régime fondé sur le revenu à couverture universelle). |
Modification |
|
Caractérisation de l’incertitude |
De l’information est ajoutée à l’analyse des scénarios afin d’aviser les décideurs du degré de sensibilité de la structure du modèle par rapport aux hypothèses formulées. |
Modification |
Il est établi que même si une APS peut s’avérer utile en guise d’analyse exploratoire, elle n’est pas actuellement exigée puisqu’on ne peut quantifier de manière significative l’incertitude entourant certains paramètres de l’AIPMB. |
Modification |
|
On insiste sur la nécessité de fournir de l’information reconnue concernant la marge d’incertitude associée à chaque hypothèse. |
Modification |
|
| Recommandations relatives aux données et aux sources pour l’AIPMB | ||
Sélection des médicaments de comparaison pertinents |
On élargit les critères utilisés pour choisir les médicaments de comparaison afin d’accroître la cohérence avec l’évaluation économique (p. ex. étude coût-efficacité), sauf s’il est clairement démontré que cela n’est pas pertinent. |
Modification |
On donne des précisions sur l’approche de sélection des médicaments de comparaison pertinents :
|
Modification |
|
|
Ajout |
|
Estimation des équivalences thérapeutiques |
Le gaspillage et le partage d’unités devraient déjà être pris en compte dans le coût du médicament et ne requièrent aucun rajustement supplémentaire. Au besoin, ces éléments peuvent être pris en considération dans l’analyse des scénarios. |
Modification |
Accès restreint |
Les modèles fondés sur les demandes de remboursement doivent prendre en compte toute restriction relative à l’inscription du nouveau médicament sur la liste des médicaments assurés, ainsi que des médicaments concurrents. |
Modification |
Généralités |
On précise que les prévisions d’un fabricant qui n’ont pas été validées ni étoffées ne peuvent être considérées comme une source de données fiable. |
Modification |
| Rapports | ||
Contenu du rapport |
On note qu’il faudrait déclarer les résultats cumulatifs et ventilés de l’incidence budgétaire pour chaque année. |
Modification |
| Autres modifications | ||
Modèle Excel |
Le modèle Excel fourni en exemple a été simplifié et mis à jour. |
Modification |
Révisions et réorganisation |
Révisions générales
|
Modification |
Annexe C : Liste de contrôle
Une fois l’analyse de l’incidence du prix d’un médicament terminée, cette liste de contrôle doit être remplie et signée.
❏ Les données utilisées portent spécifiquement sur chaque régime d’assurance-médicaments.
❏ De l’information sur la prévalence de la maladie, propre au régime d’assurance-médicaments, est présentée.
❏ Une justification est fournie lorsque les données propres à un régime d’assurance-médicaments n’ont pas été utilisées.
❏ Les prévisions portent sur un horizon prévisionnel de trois ans.
❏ Tous les médicaments de comparaison pertinents sont mentionnés, y compris les options non médicamenteuses.
❏ Toutes les indications approuvées sont mentionnées, avec les concentrations recommandées et la durée du traitement.
❏ Les prévisions établies dans l’analyse du scénario de référence reposent exclusivement sur des médicaments de comparaison pertinents.
❏ Le coût total de la stratégie de traitement par patient par année (ou coût total de la stratégie de traitement par demande de remboursement par année) est calculé pour chaque indication à l’aide de la dose recommandée et des données à partir desquelles sont rajustés les prix courants pour l’AIPMB (marges bénéficiaires, honoraires du pharmacien et co-paiements).
❏ Les prévisions sur la part de marché sont présentées au moyen du nombre total de patients (ou de demandes de remboursement) et du pourcentage du marché total.
❏ Les prévisions de la part du marché sont établies pour une période de 12 mois à partir de la date d’inscription sur la liste des médicaments assurés proposée.
❏ Les sources à partir desquelles ont été évaluées la part de marché et la proportion de la part de marché sont présentées.
❏ Les coûts totaux en médicaments sont fournis pour chaque régime d’assurance-médicaments.
❏ S’il y a lieu, le médicament dont le prix est le moins élevé est utilisé comme médicament de substitution.
❏ Les prévisions sont établies à l’aide des données sur la prévalence, sur la part de marché et sur les coûts de l’ordonnance.
❏ Toutes les hypothèses sont énoncées et toutes les références sont citées.
❏ L’incidence nette sur le budget est présentée pour les régimes d’assurance-médicaments.
❏ Toutes les hypothèses sont énoncées et toutes les références sont citées.
❏ Des analyses déterministes de la sensibilité et une analyse des scénarios (s’il y a lieu) ont été effectuées. Celles-ci comprennent notamment :
❏ Les variations de la taille du marché sur l’horizon prévisionnel (p. ex. sous-groupes, indications élargies);
❏ La distribution des parts de marché entre le nouveau médicament et ses médicaments de comparaison;
❏ Le prix du nouveau médicament et le prix des médicaments de comparaison ou des stratégies de traitement pour lesquels il existe un certain niveau d’incertitude.
❏ Une explication des méthodes d’analyse de sensibilité et d’analyse des scénarios est fournie.
❏ Toutes les hypothèses sont énoncées et toutes les références sont citées.
❏ Les conclusions de l’AIPMB sont clairement énoncées.
❏ Le formulaire de calcul de l’incidence du prix a été rempli et joint au rapport.
Information optionnelle
❏ Autre information pertinents jointes au rapport :
❏ Utilisation par les autres administration;
❏ Lignes directrices concernant le traitement ou la posologie;
❏ Commentaire concernant l’inscription du nouveau médicament sur la liste des médicaments assurés et sur son incidence marquée sur les dépenses en soins de santé.
❏ Autres AIPMB jointes, mais dont le format de présentation est différent (s’il y a lieu).
Signature :
Date: