L’Observateur des médicaments émergents 2019

Avril 2020
ISSN 2292-3144
No cat. : H79-5F-PDF
Version PDF (2,7 Mo)
Liste complète des études analytiques
Table des matières
Renseignements connexes
Conseil d’examen du prix des médicaments brevetés
Centre Standard Life
Case postale L40
333, avenue Laurier Ouest
Bureau 1400
Ottawa (Ontario) K1P 1C1
Téléphone : 1-877-861-2350
ATS : 613-288-9654
Courriel : PMPRB.Information-Renseignements.CEPMB@pmprb-cepmb.gc.ca
Remerciements
Le présent rapport a été rédigé par le CEPMB au titre de l’initiative du SNIUMP.
Le CEPMB tient à remercier les membres du Comité consultatif du SNIUMP pour leur supervision spécialisée et leur orientation dans le cadre de la rédaction du présent rapport. Veuillez noter que les énoncés et les constatations du présent rapport ne reflètent pas nécessairement ceux des membres ou de leurs organisations.
Nous remercions sincèrement Patricia Carruthers‑Czyzewski, B. Sc. (phm.), M. Sc., Sintera Inc. pour son expertise du domaine pharmaceutique et sa contribution à l’évaluation scientifique.
Nous remercions Allison Carey d’avoir dirigé le projet, ainsi que Tanya Potashnik et Jeffrey Menzies d’avoir supervisé la rédaction du rapport. Le CEPMB tient également à souligner la contribution de Carol McKinley, de Sarah Parker et de Shirin Paynter, membres de l’équipe rédactionnelle.
Avertissement
Le SNIUMP est une initiative de recherche indépendante des activités réglementaires du Conseil du CEPMB. Les priorités de recherche, les données, les déclarations et les opinions présentées ou reproduites dans les rapports du SNIUMP ne représentent pas la position du CEPMB au sujet des questions réglementaires. Les rapports du SNIUMP ne contiennent pas d’information confidentielle ou protégée en vertu des articles 87 et 88 de la Loi sur les brevets, et la mention d’un médicament dans un rapport du SNIUMP ne revient pas à reconnaître ou à nier que le médicament fait l’objet d’une demande de brevet en vertu des articles 80, 81 ou 82 de la Loi sur les brevets ou que son prix est ou n’est pas excessif au sens de l’article 85 de la Loi sur les brevets.
Bien qu’ils soient en partie fondés sur des données obtenues avec l’autorisation de GlobalData et à partir de la base de données MIDASMC d’IQVIA, les énoncés, les résultats, les conclusions, les points de vue et les opinions exprimés dans le présent rapport sont exclusivement ceux du CEPMB et ne sont pas imputables à GlobalData Plc ou à IQVIA.
Sommaire
L’Observateur des médicaments émergents (OMÉ) est un rapport d’analyse prospective qui présente une sélection de nouveaux médicaments qui en sont aux dernières étapes de l’évaluation clinique et qui pourraient avoir une incidence importante sur la pratique clinique future ou sur les dépenses en médicaments au Canada.
Les médicaments en essais cliniques de phase III ou en attente d’homologation par la Food and Drug Administration (FDA) des États-Unis sont considérés pour la sélection s’ils peuvent répondre à un besoin thérapeutique non comblé, offrir un mécanisme nouveau ou un avantage thérapeutique par rapport aux traitements existants, ou traiter une affection grave. La sélection finale présente des médicaments provenant d’un large éventail de domaines thérapeutiques. En plus de désigner les nouveaux médicaments à inclure dans la liste, la présente édition fait le suivi des médicaments figurant dans l’OMÉ 2018 pour rendre compte des changements de leur état d’émergence. Une nouvelle section axée sur le Canada met en évidence les médicaments potentiellement importants actuellement examinés par Santé Canada.
Le rapport rassemble des données provenant de deux sources principales : la base de données GlobalData Healthcare est utilisée pour relever les médicaments actuellement en essais cliniques, tandis que la liste de présentations de médicaments et de produits de santé en cours d’examen (PCE) de Santé Canada fournit de l’information sur les nouveaux médicaments en cours d’évaluation au Canada.
Avec sa publication complémentaire, la Veille des médicaments mis en marché, cette série de rapports assure une surveillance des médicaments nouveaux ou émergents au Canada et à l’étranger et fournit des renseignements clés aux décideurs, aux chercheurs, aux patients, aux cliniciens et aux autres intervenants.
Faits saillants relatifs aux médicaments émergents en 2019
- En 2019, les médicaments émergents comprenaient plus de 5 584 nouveaux médicaments à différentes étapes de l’évaluation.
- L’oncologie a dominé la combinaison thérapeutique, les traitements contre le cancer représentant plus d’un tiers (35 %) des médicaments à toutes les phases des essais cliniques. Des traitements contre les maladies du système nerveux central, comme l’Alzheimer et la dépression, représentaient 14 % des médicaments en essais cliniques.
- Les traitements du système nerveux représentaient la plus grande part (19 %) des médicaments en attente d’homologation par la FDA en 2019, dépassant les 15 % de l’oncologie.
- Sur les 5 584 nouveaux médicaments, 697 (12 %) étaient en essais cliniques de phase III ou en attente d’homologation par la FDA, représentant un large éventail de domaines thérapeutiques. Un tiers de ces médicaments aux dernières étapes avaient une désignation rapide de médicament orphelin approuvée par la FDA ou l’Agence européenne des médicaments, ce qui concorde avec la tendance à la hausse de la prévalence des médicaments orphelins entrant sur le marché pharmaceutique.
- Huit nouveaux médicaments aux dernières étapes, dont deux produits de thérapie génique, ont été sélectionnés pour être ajoutés à la liste de l’OMÉ 2019 en raison de leur incidence potentielle sur le système de soins de santé au Canada. Certains de ces médicaments peuvent offrir des percées en ce qui concerne la réponse à des besoins auparavant non comblés ou pourraient traiter de grandes populations de patients.
- Sur les 30 nouveaux médicaments présentés dans l’édition 2018 de l’OMÉ, 16 ont été conservés sur la liste, car ils correspondent toujours aux critères de sélection. Cinq médicaments, dont le traitement contre l’amyotrophie spinale Zolgensma, désigné comme découverte par la FDA, ont reçu une autorisation de mise en marché de la FDA aux États-Unis, de l’Agence européenne des médicaments ou de Santé Canada avant janvier 2020.
- Le rapport met également en évidence neuf nouveaux médicaments actuellement à l’étude par Santé Canada. Plus de la moitié d’entre eux devraient générer des revenus mondiaux approchant ou dépassant le milliard de dollars d’ici 2025.
Liste de termes
Les termes suivants et leurs définitions s’appliquent aux fins du présent rapport.
- Autorisation de mise en marché :
- Processus d’approbation de la commercialisation d’un médicament dans un pays donné. Au Canada, l’approbation de la commercialisation est accordée à la suite d’une évaluation scientifique approfondie de l’innocuité, de l’efficacité et de la qualité d’un produit, comme l’exigent la Loi sur les aliments et drogues et son RèglementNote de bas de page i.
- Efficacité clinique :
- Réponse maximale possible d’un médicament en contexte de recherche médicale et capacité d’avoir un effet thérapeutique suffisant en contexte cliniqueNote de bas de page ii.
- En attente d’homologation :
- Un médicament est en attente d’homologation une fois que tous les essais cliniques nécessaires sont terminés et qu’il attend l’homologation ou l’approbation de son utilisation par un organisme de réglementationNote de bas de page iii.
- Essai clinique de phase III :
- Essai, contrôlé ou non, effectué après que des données préliminaires qui permettent de penser que le médicament est efficace ont été obtenues. L’objectif est de recueillir des données supplémentaires afin de confirmer l’efficacité clinique et l’innocuité du médicament dans les conditions d’utilisation proposées. Les essais de phase III sont habituellement des essais randomisés à double insu menés auprès de plusieurs centaines ou de plusieurs milliers de patients.
- Ingrédient médicinal :
- Substance chimique ou biologique responsable de l’effet pharmacologique d’un produit médicamenteux. Parfois appelé molécule, substance active ou ingrédient actifNote de bas de page iv.
- Médicament :
- Terme général englobant à la fois le produit médicamenteux final et les ingrédients médicinaux, notamment les substances actives et les produits biologiques fabriqués chimiquement, ainsi que les thérapies géniques. Les médicaments sont déclarés au niveau des ingrédients médicinaux et peuvent faire référence à un seul ingrédient ou à une combinaison unique d’ingrédients.
- Médicaments émergents :
- Ensemble de nouveaux médicaments candidats qui font l’objet de recherches actives et de mises au point par une société de biotechnologie ou de produits pharmaceutiques.
- Nouveau médicament :
- Ingrédient médicinal dont la mise en marché n’a pas encore été autorisée par un organisme de réglementation.
- Thérapie génique :
- Technique utilisée pour traiter des maladies génétiques qui consiste à remplacer un gène absent ou défectueux par un gène sain, selon la définition de Santé CanadaNote de bas de page v.
Introduction
La neuvième édition de l’Observateur des médicaments émergents (OMÉ) est la suite de la recherche d’analyse prospective qui a été publiée par les années passées sous un titre différent en anglais (New Drug Pipeline Monitor), mais sous le même titre en français. Il présente une sélection de médicaments qui en sont à l’étape des essais cliniques de phase III ou en attente d’homologation par la FDA des États-Unis et qui peuvent avoir une incidence importante sur la pratique clinique ou les dépenses en médicaments au Canada. La présente édition comprend également la nouvelle section « Faits saillants au Canada » qui met en évidence les nouveaux médicaments potentiellement importants actuellement examinés par Santé Canada.
La méthodologie, qui est décrite en détail dans la section suivante, utilise un ensemble précis de critères pour dresser la liste des médicaments candidats tirés de la base de données GlobalData Healthcare, ainsi que la liste des candidats en cours d’examen au Canada selon la liste des PCE de Santé Canada. Les médicaments mentionnés dans l’édition précédente sont également passés en revue dans la présente édition, qu’il s’agisse de ceux qui continuent à figurer sur la liste des candidats ou de ceux qui ont entre-temps reçu une autorisation de mise en marché. De même, les nouveaux médicaments figurant dans le présent rapport feront l’objet d’un suivi dans les prochaines éditions de l’OMÉ afin de relever ceux qui réussissent à faire leur entrée sur le marché.
Pour mettre en contexte la sélection des médicaments, l’OMÉ comprend un aperçu de l’ensemble des médicaments émergents, qui met l’accent sur la ventilation thérapeutique de chaque phase d’essais cliniques. Il décrit également les tendances observées par rapport à l’ensemble des médicaments émergents en 2019.
L’OMÉ est une publication complémentaire à la Veille des médicaments mis en marché, qui analyse la dynamique du marché des médicaments nouvellement approuvés au Canada et à l’étranger. Ensemble, ces deux rapports du CEPMB permettent de surveiller le continuum post-commercialisation des médicaments émergents aux dernières étapes de développement et des nouveaux médicaments approuvés, en plus de fournir de l’information sur les médicaments émergents et les pressions changeantes sur les coûts aux décideurs, aux chercheurs, aux patients, aux cliniciens et à d’autres intervenants.
Méthodologie
Aperçu des médicaments émergents
L’aperçu des médicaments émergents permet de saisir la composition des médicaments aux diverses étapes des essais cliniques à un moment donné. Aux fins de l’analyse, une liste complète des médicaments émergents a été extraite de la base de données de GlobalData Healthcare en septembre 2019.
Les nouveaux ingrédients médicinaux sont ceux qui n’ont pas été approuvés antérieurement par la FDA des États-Unis, l’Agence européenne des médicaments ou Santé Canada, tandis que les ingrédients médicinaux existants comprennent les médicaments déjà approuvés qui sont en cours d’évaluation pour des indications supplémentaires.
La répartition thérapeutique des médicaments émergents correspond à l’indication en cours d’évaluation, selon l’information fournie par GlobalData. Prendre note qu’un même nouveau médicament peut faire l’objet de plusieurs essais cliniques liés à des indications distinctes.
L’Observateur des médicaments émergents
L’OMÉ met l’accent sur les nouveaux médicaments qui font l’objet d’essais cliniques de phase III au Canada, aux États‑Unis et en Europe, ou qui sont en attente d’homologation par la FDA. La sélection des médicaments émergents à inclure repose sur un processus en deux étapes (figure 1). À l’étape de la sélection initiale, les médicaments choisis en sont aux dernières étapes de l’évaluation clinique, tandis qu’à l’étape de l’examen analytique, une évaluation plus rigoureuse de chaque médicament potentiel est effectuée afin de déterminer les médicaments qui peuvent avoir une incidence clinique ou budgétaire importante. La deuxième étape tient compte d’un ensemble précis de critères et des résultats d’un examen approfondi des données cliniques et des publications scientifiques.
La méthodologie est examinée annuellement et perfectionnée au besoin.

Figure description
Cet organigramme décrit la procédure de sélection des nouveaux médicaments inscrits. Le schéma comprend deux étapes :
1. Sélection initiale
Cette étape comprend d’abord tous les médicaments faisant l’objet d’essais cliniques de phase III ou en attente d’homologation par la Food and Drug Administration des États-Unis. À l’étape suivante, les seuls médicaments retenus sont ceux dont la date de fin prévue des essais cliniques est comprise dans les trois années suivant l’analyse, dans les régions du Canada, des États-Unis et de l’Europe. Pour qu’un médicament satisfasse au critère géographique, des essais cliniques de phase III doivent être menés au Canada, aux États-Unis ou sur le continent européen (à l’exclusion de la Russie et de la Turquie).
2. Examen analytique
L’étape d’examen analytique comprend deux parties : une voie pour les nouveaux médicaments et une autre pour les thérapies géniques.
- Les nouveaux médicaments doivent satisfaire au moins l’une des exigences suivantes pour figurer dans la liste :
- Preuves d’une innocuité et d’une efficacité supérieure
- Nouveau mécanisme ou premier agent de sa classe, avec au moins une désignation parmi les suivantes : découverte, traitement accéléré ou évaluation prioritaire
- Les thérapies géniques doivent présenter une preuve d’efficacité clinique et un profil d’innocuité acceptable pour figurer dans la liste.
* En attente d’homologation par la FDA des États-Unis.
† Essais cliniques de phase III menés au Canada, aux États-Unis ou sur le continent européen (à l’exclusion de la Russie et de la Turquie).
Étape 1. Sélection initiale
La base de données GlobalData Healthcare est utilisée pour dresser une liste des médicaments en essais cliniques de phase III ou en attente d’homologation par la FDA. Ces médicaments servent de base pour l’étape de la sélection initiale.
La géographie des médicaments, qui s’entend de la région géographique ou du pays où le médicament est commercialisé ou en développement, est limitée au Canada et à d’autres pays ayant des processus de réglementation et d’approbation semblables, soit les États-Unis et le continent européen (à l’exclusion de la Russie et de la Turquie). Seuls les nouveaux ingrédients médicinaux dont l’innocuité et l’efficacité accrues démontrées dans les essais cliniques sont établies par des données adéquates peuvent être considérés pour la sélection.
Les médicaments approuvés ou vendus au Canada, aux États-Unis ou en Europe pour toute autre indication ou dans toute autre concentration ou formulation sont exclus pendant le processus de sélection, tout comme les médicaments dont les essais cliniques sont inactifs, suspendus, retirés ou terminés.
Le processus de sélection regroupe les médicaments candidats en deux catégories : (a) les nouveaux médicaments et (b) les nouvelles thérapies géniques. Comme l’illustre la figure 1, le processus de sélection initiale est le même pour les deux catégories, mais l’examen analytique est légèrement différent, car les données accessibles pour les thérapies géniques sont limitées.
Étape 2. Examen analytique
Critères de sélection
La seconde étape du processus tient compte d’un certain nombre de critères de sélection pour déterminer la liste finale des médicaments candidats. Ces critères sont présentés dans le tableau 1.
Les thérapies géniques sont sélectionnées selon une approche plus générale, étant donné que les données cliniques accessibles sur ce groupe sont relativement limitées. Pour rester sur la liste, une thérapie génique doit présenter des résultats préliminaires (ou définitifs) des essais de phase III indiquant qu’il y a des données probantes sur l’efficacité clinique de la thérapie et un profil d’innocuité acceptable.
| Critères de sélection |
|---|
| Amélioration de l’innocuité ou de l’efficacité démontrée dans les essais cliniques : médicament qui démontre une innocuité accrue, de nouvelles mesures des résultats, une espérance de vie accrue ou une meilleure qualité de vie. |
|
Nouveau mécanisme ou premier de sa classe : médicament qui utilise un nouveau mécanisme d’interaction biochimique pour produire un effet médical, ou médicament qui est le premier de sa classe thérapeutique. De plus, le médicament doit correspondre à l’une ou à plusieurs des trois désignations suivantes de la FDA pour le développement et l’examen accélérés :
Thérapie génique : Technique utilisée pour traiter des maladies génétiques qui consiste à remplacer un gène absent ou défectueux par un gène sain, selon la définition de Santé Canada. |
Renseignements descriptifs supplémentaires
Le profil de chaque médicament candidat retenu est fourni, ce qui comprend un aperçu de l’indication et du mécanisme d’action, ainsi qu’un résumé des résultats publiés pertinents des essais cliniques. Les attributs particuliers qui peuvent influer sur l’adoption éventuelle ou le coût de chaque médicament sont également énoncés. Le tableau 2 fournit une description détaillée des principaux attributs.
| Attribut | Pertinence | Source de données |
|---|---|---|
| Essais cliniques de phase III au Canada | Les médicaments mis à l’essai au Canada sont susceptibles d’intéresser les Canadiens. |
GlobalData Healthcare; |
| Désignation de médicament rare ou orphelin | Les médicaments utilisés dans le traitement des maladies ou des problèmes de santé rares ont généralement des coûts de traitement élevés et peuvent entraîner des dépenses importantes. | GlobalData Healthcare |
| Médicament biologique | Ces molécules complexes produites par des organismes vivants devraient avoir des coûts élevés et entraîner ainsi des dépenses importantes. | |
| Traitement d’appoint | Les médicaments conçus pour être utilisés en association avec des médicaments existants peuvent augmenter les coûts de traitement et contribuer à une augmentation des dépenses. |
Le profil précise également les répercussions possibles sur les coûts, le cas échéant, y compris les revenus mondiaux prévus déclarés par GlobalData.
Les indications et les domaines thérapeutiques des médicaments présentés correspondent à leur stade d’essai clinique de phase III ou d’attente d’homologation. Un seul essai clinique peut évaluer plusieurs indications du même domaine thérapeutique. Ces médicaments peuvent avoir des indications supplémentaires à diverses étapes de l’évaluation clinique qui ne sont pas mentionnées dans le présent rapport. La description scientifique fournie s’applique directement à l’indication précisée pour les médicaments sélectionnés.
Faits saillants au Canada
Les PCE de Santé Canada sont évaluées selon une approche modifiée des critères de sélection afin d’établir une liste de médicaments susceptibles d’avoir une incidence importante sur les dépenses en médicaments au Canada.
Les médicaments de la liste des PCE comprennent les nouveaux médicaments contenant des ingrédients médicinaux qui n’ont pas été approuvés au Canada pour toute indication ou dans toute concentration ou formulation. Contrairement aux médicaments sélectionnés dans les listes de médicaments émergents, ceux-ci peuvent avoir déjà reçu une autorisation de mise en marché par la FDA des États-Unis, l’Agence européenne des médicaments.
Critères de sélection
Après la sélection initiale, le médicament doit satisfaire à au moins un des deux critères de sélection pour figurer dans le rapport. Ces critères sont présentés dans le tableau 3.
Les thérapies géniques sont sélectionnées selon une approche plus générale, en fonction des données cliniques accessibles sur ce groupe. Pour rester sur la liste, une thérapie génique doit présenter des résultats préliminaires (ou définitifs) des essais de phase III indiquant qu’il y a des données probantes sur l’efficacité clinique de la thérapie et un profil d’innocuité acceptable.
| Critères de sélection |
|---|
| Amélioration de l’innocuité ou de l’efficacité démontrée dans les essais cliniques : médicament qui démontre une innocuité accrue, de nouvelles mesures des résultats, une espérance de vie accrue ou une meilleure qualité de vie. |
| Nouveau mécanisme ou premier de sa classe : médicament qui utilise un nouveau mécanisme d’interaction biochimique pour produire un effet médical, ou médicament qui est le premier de sa classe thérapeutique. |
| Thérapie génique : Technique utilisée pour traiter des maladies génétiques qui consiste à remplacer un gène absent ou défectueux par un gène sain, selon la définition de Santé Canada. |
Renseignements descriptifs supplémentaires
Comme dans le cas des listes de médicaments émergents, le profil de chaque médicament en cours d’examen comprend les principaux attributs énoncés au tableau 2 et un aperçu de l’indication et du mécanisme d’action, ainsi qu’un résumé des résultats publiés pertinents des essais cliniques. Les attributs particuliers qui peuvent influer sur l’adoption éventuelle ou le coût de chaque médicament sont également énoncés, tout comme les répercussions possibles sur les coûts, le cas échéant, y compris les revenus mondiaux prévus déclarés par GlobalData.
Bien que les désignations de la FDA pour le développement et l’examen accélérés ne constituent pas des critères de sélection pour cette liste, les désignations pertinentes (découverte, désignation accélérée et examen prioritaire) sont mentionnées lorsqu’elles sont disponibes. Ces désignations sont décrites au tableau 1.
Les indications et les domaines thérapeutiques correspondent aux renseignements fournis par GlobalData. La description scientifique fournie s’applique directement à l’indication précisée pour le médicament sélectionné. Dans le cas des médicaments examinés pour plusieurs indications, c’est l’indication principale qui est retenue.
Sources de données
La base de données GlobalData Healthcare est la principale source de données pour la désignation des médicaments émergents et la consignation des renseignements cliniques correspondants, y compris la date de fin des essais cliniques. GlobalData Healthcare fait le suivi des médicaments depuis leur découverte préclinique, en passant par les essais cliniques, jusqu’au lancement sur le marché et aux ventes subséquentes. La base de données est une ressource complète de médicaments à divers stades de développement clinique. Les capacités de recherche permettent une sélection contrôlée d’attributs particuliers, notamment la phase de développement clinique, le domaine thérapeutique, le type de molécule, l’indication, la géographie du médicament, le mécanisme d’action et les désignations de la FDA.
Les listes des PCE de Santé Canada sont utilisées pour déterminer la sélection présentée des nouveaux médicaments en cours d’examen par Santé Canada. Les PCE constituent un ensemble de listes accessibles au public énumérant les présentations de produits pharmaceutiques et biologiques qui contiennent de nouveaux ingrédients médicinaux, lesquels n’ont pas encore été approuvés au Canada, et qui ont été acceptés pour examen. Cela s’applique aux présentations acceptées au plus tôt le 1er avril 2015.
Étant donné que la sélection se limite aux nouveaux médicaments, d’autres sources d’information sont comparées pour confirmer que les médicaments candidats n’ont pas été approuvés ou vendus auparavant. Ces sources comprennent les données de vente enregistrées de la base de données MIDASMD d’IQVIA (tous droits réservés), les dossiers d’approbation réglementaire du National Institute of Health, de la FDA des États-Unis, de l’Agence européenne des médicaments et de Santé Canada, et des renseignements issus de la base de données sur les essais cliniques de Santé Canada et de ClinicalTrials.org.
Limites
La présente analyse donne un aperçu des médicaments émergents pour une période donnée. Bien qu’il soit censé être représentatif de la composition des médicaments au cours de l’année complète, l’ensemble des médicaments émergents est assez dynamique, et la part des médicaments dans un domaine thérapeutique particulier peut varier.
L’évaluation se limite aux médicaments en développement destinés à la commercialisation au Canada et dans d’autres pays ayant des processus de réglementation et d’approbation semblables, soit les États-Unis et l’Europe (à l’exclusion de la Russie et de la Turquie). Les médicaments qui n’ont pas encore reçu d’autorisation de mise en marché dans ces pays ont été considérés comme des médicaments candidats potentiels, même s’ils ont été approuvés ailleurs dans le monde.
Certains des médicaments sélectionnés peuvent faire l’objet d’essais cliniques pour des indications supplémentaires; la présente analyse ne fait état que des indications aux derniers stades de développement, c’est-à-dire lors des essais cliniques de phase III ou en attente d’homologation par la FDA des États-Unis, qui répondent aux critères de sélection énoncés dans la méthodologie.
Pour chaque médicament émergent sélectionné, les principaux fabricants et le nom commercial, le cas échéant, sont précisés avec l’indication. Dans certains cas, d’autres fabricants, y compris des filiales, peuvent également participer au développement du médicament avec les principales entreprises, ou d’autres fabricants peuvent mettre au point le même médicament pour d’autres indications.
Bien que le présent rapport tente de définir les médicaments émergents les plus importants, la sélection n’est pas exhaustive, et certains médicaments qui ne sont pas inclus dans cette sélection peuvent avoir une incidence importante sur la pratique clinique future ou les dépenses en médicaments au Canada.
Les listes présentées rendent compte de la composition des médicaments émergents à partir de septembre 2019 et elles sont valides dès la fin janvier 2020. En raison de la nature imprévisible et rapide de l’entrée sur le marché des médicaments émergents, certains des médicaments énumérés dans la présente édition peuvent avoir été approuvés ou commercialisés au Canada, aux États-Unis ou en Europe après cette date. Les médicaments émergents qui n’ont pas été inclus dans le rapport en raison du calendrier de sélection peuvent actuellement répondre aux critères de sélection et ceux-ci, ainsi que le reste de la liste des médicaments émergents, seront pris en considération pour la prochaine édition du rapport.
Aperçu des médicaments émergents en 2019
L’innovation pharmaceutique transforme le développement et l’application des traitements médicaux dans le monde entier. En 2019, plus de 5 500 nouveaux médicaments étaient en évaluation clinique ou en attente d’homologation par la FDA, soit 88 % des médicaments émergents.
La figure 2 donne un aperçu des médicaments émergents en 2019, y compris du nombre de nouveaux ingrédients médicinaux pour chaque phase de l’évaluation clinique. Sur les 5 584 nouveaux médicaments, 697 (12 %) étaient en essais cliniques de phase III ou en attente d’homologation par la FDA.
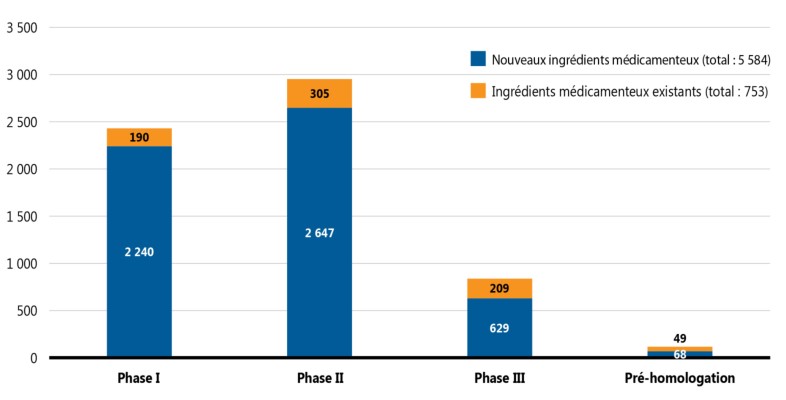
Figure description
Ce graphique à barres empilées illustre le nombre de médicaments distincts pour chaque phase des essais cliniques en 2019, c’est-à-dire le nombre de nouveaux ingrédients médicamenteux et le nombre d’ingrédients médicamenteux existants. En tout, 5 584 nouveaux ingrédients médicamenteux et 753 ingrédients médicamenteux existants étaient en développement.
| Phase I | Phase II | Phase III | Pré-homologation | |
|---|---|---|---|---|
| Nouveaux ingrédients médicamenteux | 2 240 | 2 647 | 629 | 68 |
| Ingrédients médicamenteux existants | 190 | 305 | 209 | 49 |
Sources de données : Base de données GlobalData Healthcare (consultée en septembre 2019).
La figure 3 représente la répartition des nouveaux médicaments par domaine thérapeutique, de la phase I à l’attente d’homologation. Bien que les résultats montrent que les médicaments émergents correspondent à un large éventail de domaines thérapeutiques en 2019, les traitements contre le cancer dominent la combinaison thérapeutique dans l’ensemble, représentant plus d’un tiers (35 %) des médicaments à toutes les phases de l’évaluation clinique. D’autres domaines thérapeutiques importants comprenaient les traitements contre les maladies du système nerveux central, comme l’Alzheimer et la dépression.
La part des médicaments en attente d’homologation que représentent les traitements contre les maladies du système nerveux central est passée à 19 % en 2019, dépassant ainsi la part de 15 % correspondant à l’oncologie. Cette augmentation reflète principalement les récents développements innovants liés aux médicaments contre la maladie d’Alzheimer. Les nouveaux traitements contre la maladie d’Alzheimer qui ciblent soit l’accumulation de protéines amyloïdes dans le cerveau, soit l’activité des neurotransmetteurs, sont de plus en plus présents dans toutes les phases des médicaments émergents en raison des besoins croissants non satisfaits et en dépit des échecs d’essais cliniques antérieurs. En 2019, il y a 128 médicaments émergents contre la maladie d’Alzheimer, dont 16 % en phase III et en attente d’homologation.
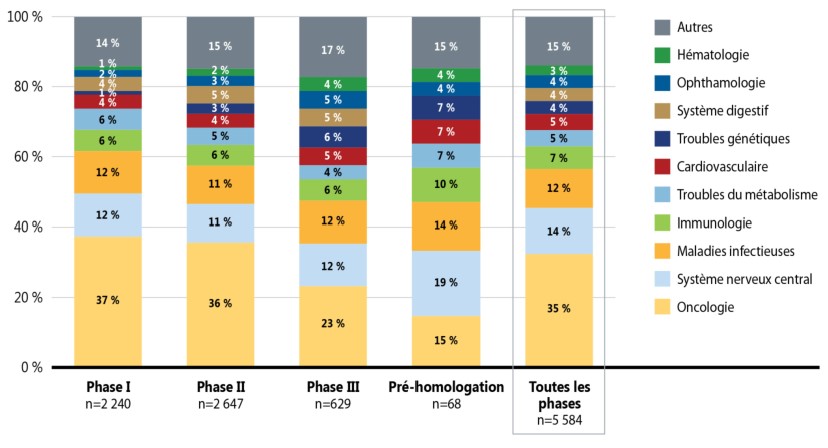
Figure description
Cette figure comprend deux diagrammes à barres qui montrent la répartition de tous les nouveaux médicaments en cours de développement selon le domaine thérapeutique. La répartition est fournie sous forme de pourcentage de l’ensemble des médicaments par phase de développement, ainsi qu’en fonction du pourcentage total pour toutes les phases.
| Domaine thérapeutique | Phase I | Phase II | Phase III | Pré-homologation | Toutes les phases |
|---|---|---|---|---|---|
| Oncologie | 37 % | 36 % | 23 % | 15 % | 35 % |
| Système nerveux central | 12 % | 11 % | 12 % | 19 % | 14 % |
| Maladies infectieuses | 12 % | 11 % | 12 % | 14 % | 12 % |
| Immunologie | 6 % | 6 % | 6 % | 10 % | 7 % |
| Troubles du métabolisme | 6 % | 5 % | 4 % | 7 % | 5 % |
| Cardiovasculaire | 4 % | 4 % | 5 % | 7 % | 5 % |
| Troubles génétique | 1 % | 3 % | 6 % | 7 % | 4 % |
| Système digestif | 4 % | 5 % | 5 % | 0 % | 4 % |
| Ophthamologie | 2 % | 3 % | 5 % | 4 % | 4 % |
| Hématologie | 1 % | 2 % | 4 % | 4 % | 3 % |
| Autres | 14 % | 15 % | 17 % | 15 % | 15 % |
| Nombre total de médicaments | 2 240 | 2 647 | 629 | 68 | 5 584 |
Sources de données : Base de données GlobalData Healthcare (consultée en septembre 2019).
L’Observateur des médicaments émergents 2019
Les tableaux suivants présentent la sélection des nouveaux médicaments émergents en 2019 et ceux conservés de l’édition 2018 de l’OMÉ, ainsi que les médicaments qui y figurent et qui ont depuis reçu une autorisation de mise en marché. Ces médicaments feront l’objet d’un suivi dans les prochaines éditions du rapport.
En appliquant les critères de sélection décrits dans la section « Méthodologie », 8 des 697 médicaments émergents aux dernières étapes de l’évaluation clinique, dont 2 thérapies géniques, ont été sélectionnés pour figurer dans la liste des nouveaux médicaments de 2019 (tableau 4). De même, 16 médicaments aux dernières étapes ont été conservés parmi ceux de la liste de 2018, car ils continuent à répondre aux mêmes critères (tableau 5).
Cinq médicaments figurant dans l’édition 2018 de l’OMÉ, dont deux de la liste des thérapies géniques, ont reçu une autorisation de mise en marché aux États-Unis, en Europe ou au Canada avant janvier 2020. Les médicaments figurent au tableau 6.
| Médicament (nom commercial) Entreprise | Indications* | Description et principaux attributs |
|---|---|---|
Cardiovasculaire |
||
Acide bempédoïque
|
Hyperlipidémie |
|
Système nerveux central |
||
Ganténérumab
|
Maladie d’Alzheimer |
|
Chlorhydrate de gépirone ER
|
Trouble dépressif majeur (TDM) |
|
Endocrinologie |
||
Donaperminogène seltoplasmide (VM202)
|
Douleur neuropathique diabétique |
|
Immunologie |
||
Imlifidase (Idefirix [Europe])
|
Rejet d’une greffe de rein |
|
Oncologie |
||
Nadofaragène firadénovec (Instiladrine [États-Unis])
|
Cancer de la vessie non invasif sur le plan musculaire (CVNIM) |
|
Plitidepsine (Aplidin)
|
Myélome multiple récidivant ou réfractaire |
|
Ophtalmologie |
||
Abicipar pégol
|
Dégénérescence maculaire humide (néovasculaire/exsudative) |
|
* Les données sur les prévisions consensuelles pour les revenus globaux ont été recueillies auprès de GlobalData, T4-2019, et sont présentées en dollars américains.
Sources de données : base de données GlobalData Healthcare. Les résultats de la recherche dans la base de données quant aux nouveaux médicaments ajoutés à l’OMÉ ont été recueillis en septembre 2019.
| Médicament (nom commercial) Entreprise | Indications* | Description et principaux attributs |
|---|---|---|
Troubles gastro-intestinaux et métaboliques |
||
Cénicriviroc
|
Fibrose hépatique; stéatohépatite non alcoolique (SHNA) |
|
Setmélanotide
|
Troubles génétiques; obésité |
|
Troubles génétiques |
||
Elivaldogene tavalentivec (Lenti-D)
|
Leucodystrophie avec insuffisance surrénale |
|
Hématologie |
||
Fitusiran
|
Hémophilie A; hémophilie B |
|
Vadadustat
|
Anémie dans la maladie rénale chronique (MRC); anémie rénale |
|
Maladies infectieuses |
||
Cabotégravir
|
Infections à VIH (sida) |
|
Fostemsavir trométhamine
|
Infections à VIH (sida) |
|
Troubles musculosquelettiques |
||
Palovarotène
|
Myosite ossifiante progressive; Fibrodysplasie ossifiante progressive (FOP) |
|
Oncologie |
||
Ipatasertib
|
Cancer de la prostate métastatique hormono-résistant (résistant à la castration, androgéno-indépendant) |
|
Chlorhydrate de melphalan flufénamide (Melflufen, Ygalo)
|
Myélome multiple réfractaire; myélome multiple récidivant |
|
Dichlorhydrate de quizartinib (Vanflyta)
|
Leucémie myéloïde aiguë (LMA) réfractaire; LMA récidivante |
|
Tavokinogène telséplasmide (ImmunoPulse, Tavo)
|
Mélanome métastatique |
|
Ublituximab (Utuxin)
|
Leucémie lymphoïde chronique (LLC) réfractaire; LLC récurrente; sclérose en plaques cyclique |
|
Ophtalmologie |
||
Lénadogène nolparvovec (Lumevoq [Europe])
|
Neuropathie optique héréditaire de Leber (NOHL) |
|
Timrépigène emparvovec [AAV2-REP1, NSR-REP-1]
|
Choroïdérémie |
|
Acétate de zurétinol
|
Amaurose congénitale de Leber; rétinite |
|
* Les données sur les prévisions consensuelles pour les revenus globaux ont été recueillies auprès de GlobalData, T4-2019, et sont présentées en dollars américains.
Sources de données : base de données GlobalData Healthcare.
| Médicament (nom commercial) Entreprise | Indications* | Description et principaux attributs |
|---|---|---|
Système nerveux central |
||
Onasemnogène abéparvovec (Zolgensma)
|
Amyotrophie spinale |
|
Ubrogépant (Ubrelvy [États-Unis])
|
Migraines |
|
Maladies infectieuses |
||
Léfamuline (Xenleta)
|
Pneumonie bactérienne acquise dans la collectivité |
|
Oncologie |
||
Sélinexor (Xpovio)
|
Myélome multiple récidivant ou réfractaire |
|
Hématologie |
||
LentiGlobine BB305 (Zynteglo)
|
Bêta-thalassémie majeure |
|
* Les données sur les prévisions consensuelles pour les revenus globaux ont été recueillies auprès de GlobalData, T4-2019, et sont présentées en dollars américains.
Sources de données : base de données GlobalData Healthcare.
Faits saillants au Canada
Cette nouvelle section comprend une liste de certains médicaments en cours d’examen par Santé Canada qui pourraient avoir une incidence importante sur la pratique clinique et les dépenses en médicaments à l’avenir. Les médicaments figurant sur cette liste sont nouveaux au Canada, mais peuvent avoir été approuvés dans d’autres pays.
Le tableau 7 présente neuf nouveaux médicaments actuellement inscrits sur la liste des PCE de Santé Canada et qui ont un nouveau mécanisme d’action ou dont l’innocuité et l’efficacité ont été améliorées pendant des essais cliniques. Les PCE constituent un ensemble de documents accessibles au public énumérant les présentations de produits pharmaceutiques et biologiques qui contiennent de nouveaux ingrédients médicinaux et qui ont été acceptés pour examen au Canada.
| Médicament (nom commercial) Entreprise | Indications* | Description et principaux attributs |
|---|---|---|
Système nerveux central |
||
Frémanézumab (Ajovy)
|
Prévention de la migraine |
|
Dermatologie |
||
Tildrakizumab (Ilumetri)
|
Psoriasis en plaques |
|
Système digestif |
||
Ténapanor (Ibsrela)
|
Syndrome de l’intestin irritable (SII) |
|
Système génito-urinaire et hormones sexuelles |
||
Ospémifène (Osphena, Senshio)
|
Ménopause |
|
Maladies infectieuses |
||
Baloxavir marboxil (Xofluza)
|
Infections par le virus de la grippe A ou B |
|
Cabotégravir
|
Infections à VIH (sida) |
|
Neurologie |
||
Fumarate de siponimod (Mayzent)
|
Sclérose en plaques (SP) |
|
Oncologie |
||
Darolutamide (Nubeqa)
|
Cancer de la prostate |
|
Entrectinib (Rozlytrek)
|
Cancer du poumon non à petites cellules (CPNPC); |
|
* Les données sur les prévisions consensuelles pour les revenus globaux ont été recueillies auprès de GlobalData, T4-2019, et sont présentées en dollars américains.
Sources de données : base de données GlobalData Healthcare.
Références
- Bilen O, Ballantyne CM. 2016. Bempedoic Acid (ETC-1002): an Investigational Inhibitor of ATP Citrate Lyase. Curr Atheroscler Rep. 18(10):61.
- Ballantyne CM, Laufs U, Ray KK, et al. 2019. Bempedoic acid plus ezetimibe fixed-dose combination in patients with hypercholesterolemia and high CVD risk treated with maximally tolerated statin therapy. Eur J Prev Cardiol. 29:2047487319864671. doi: 10.1177/2047487319864671. [Publication électronique avant l’impression].
- Laufs U, Banach M, Mancini GBJ, et al. 2019. Efficacy and Safety of Bempedoic Acid in Patients With Hypercholesterolemia and Statin Intolerance. J Am Heart Assoc. 8(7):e011662. doi: 10.1161/JAHA.118.011662.
- Penson P, McGowan M, Banach M. 2017. Evaluating bempedoic acid for the treatment of hyperlipidaemia. Expert Opin Investig Drugs. 26(2):251-259. doi: 10.1080/13543784.2017.1280458.
- Ray KK, Bays HE, Catapano AL, et al.; CLEAR Harmony Trial. 2019. Safety and Efficacy of Bempedoic Acid to Reduce LDL Cholesterol. N Engl J Med. 380(11):1022-1032. doi: 10.1056/NEJMoa1803917.
- A Phase III, Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Efficacy, and Safety Study of Gantenerumab in Patients With Early (Prodromal to Mild) Alzheimer's Disease. ClinicalTrial.gov : NCT03443973. https://www.clinicaltrials.gov/ct2/show/NCT03443973?term=Gantenerumab&rank=2
- A Phase III, Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Efficacy, and Safety Study of Gantenerumab in Patients With Early (Prodromal to Mild) Alzheimer's Disease. ClinicalTrial.gov : NCT03444870. https://www.clinicaltrials.gov/ct2/show/NCT03444870?term=Gantenerumab&rank=3
- A Phase III, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Multicenter, Efficacy and Safety Study of Gantenerumab in Patients With Mild Alzheimer's Disease; Part II: Open-Label Extension For Participating Patients. ClinicalTrial.gov : NCT02051608. https://www.clinicaltrials.gov/ct2/show/NCT02051608?term=Gantenerumab&rank=6
- Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group Two Year Study to Evaluate the Effect of Subcutaneous RO4909832 on Cognition and Function in Prodromal Alzheimer's Disease With Option for up to an Additional Two Years of Treatment and an Open-Label Extension With Active Study Treatment. ClinicalTrial.gov : NCT01224106. https://www.clinicaltrials.gov/ct2/show/NCT01224106?term=Gantenerumab&rank=8
- A Phase II/III Randomized, Double-Blind, Placebo-Controlled, Cognitive Endpoint, Multi-Center Study of Potential Disease Modifying Therapies in Individuals at Risk for and With Dominantly Inherited Alzheimer's Disease. ClinicalTrial.gov : NCT01760005. https://www.clinicaltrials.gov/ct2/show/NCT01760005?term=Gantenerumab&rank=12
- A Phase II/III Randomized, Double-Blind, Placebo-Controlled Multi-Center Study of 2 Potential Disease Modifying Therapies in Individuals at Risk for and with Dominantly Inherited Alzheimer's Disease (ADAD). Washington University. Base de données sur les essais cliniques de Santé Canada : 168399. https://produits-sante.canada.ca/ctdb-bdec/index-fra.jsp
- A Phase III, Multicenter, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Efficacy, and Safety Study of Gantenerumab in Patients with Early (Prodromal to Mild) Alzheimer’s Disease. Hoffmann La Roche Limited. Base de données sur les essais cliniques de Santé Canada : 216415. https://produits-sante.canada.ca/ctdb-bdec/index-fra.jsp
- A Phase III, Randomized, Double-Blind, Placebo-Controlled, Parallel-Group, Multicenter, Efficacy, and Safety Study of Gantenerumab in Patients with Mild Alzheimer's Disease. Hoffmann La Roche Limited. Base de données sur les essais cliniques de Santé Canada : 171314. https://produits-sante.canada.ca/ctdb-bdec/index-fra.jsp
- Fabre LF, Clayton AH, Smith LC, Goldstein I, Derogatis LR. 2012. The effect of gepirone-ER in the treatment of sexual dysfunction in depressed men. J Sex Med. 9(3):821-829. doi: 10.1111/j.1743-6109.2011.02624.x.
- Kaur Gill A, Bansal Y, Bhandari R, et al. 2019. Gepirone hydrochloride: a novel antidepressant with 5-HT1A agonistic properties. Drugs Today (Barc). 55(7):423-437. doi: 10.1358/dot.2019.55.7.2958474.
- Flavell L. VM202. ALS News Today. https://alsnewstoday.com/vm202/
- Phase 3 Gene Therapy for Painful Diabetic Neuropathy. WCG CentreWatch : NCT02427464 https://www.centerwatch.com/clinical-trials/listings/72339/painful-diabetic-neuropathy-phase-3-gene-therapy/
- A Phase III, Double-Blind, Randomized, Placebo-Controlled, Multicenter Study to Assess the Safety and Efficacy of VM202 in Subjects With Painful Diabetic Peripheral Neuropathy. ClinicalTrial.gov : NCT02427464. https://clinicaltrials.gov/ct2/show/study/NCT02427464
- Kessler JA, Smith AG, Cha BS, et al. 2015. Double-blind, placebo-controlled study of HGF gene therapy in diabetic neuropathy. Ann Clin Transl Neurol. 2(5):465-478. doi: 10.1002/acn3.186.
- A Phase III, Double-Blind, Randomized, Placebo-controlled, Multicenter Study to Asses the Safety and Efficacy of VM202 to Treat Chronic Nonhealing Foot Ulcers in Diabetic Patients With Concomitant Peripheral Arterial Disease (PAD). ClinicalTrial.gov : NCT02563522. https://clinicaltrials.gov/ct2/show/NCT02563522
- Lonze BE, Tatapudi VS, Weldon EP, et al. 2018. IdeS (Imlifidase): A Novel Agent That Cleaves Human IgG and Permits Successful Kidney Transplantation Across High-strength Donor-specific Antibody. Ann Surg. 268(3):488-496. doi: 10.1097/SLA.0000000000002924.
- National Institute for Health Research. 2018. Axalimogene filolisbac for cervical cancer – beyond first line treatment. http://www.io.nihr.ac.uk/report/axalimogene-filolisbac-for-cervical-cancer-beyond-first-line-treatment/
- A Phase III, Open Label Study to Evaluate the Safety and Efficacy of INSTILADRIN® (rAd-IFN)/Syn3) Administered Intravesically to Patients With High Grade, BCG Unresponsive Non-Muscle Invasive Bladder Cancer (NMIBC). ClinicalTrials.gov : NCT02773849. https://clinicaltrials.gov/ct2/show/NCT02773849
- Alonso-Álvarez S, Pardal E, Sánchez-Nieto D, et al. 2017. Plitidepsin: design, development, and potential place in therapy. Drug Des Devel Ther. 11:253-264. doi: 10.2147/DDDT.S94165.
- Delgado-Calle J, Kurihara N, Atkinson EG, et al. 2019. Aplidin (plitidepsin) is a novel anti-myeloma agent with potent anti-resorptive activity mediated by direct effects on osteoclasts. Oncotarget. 10(28):2709-2721. doi: 10.18632/oncotarget.26831.
- Leisch M, Egle A, Greil R. 2019. Plitidepsin: a potential new treatment for relapsed/refractory multiple myeloma. Future Oncol. 15(2):109-120. doi: 10.2217/fon-2018-0492.
- Spicka I, Ocio EM, Oakervee HE, et al. 2019. Randomized phase III study (ADMYRE) of plitidepsin in combination with dexamethasone vs. dexamethasone alone in patients with relapsed/refractory multiple myeloma. Ann Hematol. 98(9):2139-2150. doi: 10.1007/s00277-019-03739-2.
- Kunimoto D, Ohji M, Maturi RK, et al.; BAMBOO and CYPRESS Study Groups. 2019. Evaluation of Abicipar Pegol (an Anti-VEGF DARPin Therapeutic) in Patients With Neovascular Age-Related Macular Degeneration: Studies in Japan and the United States. Ophthalmic Surg Lasers Imaging Retina. 50(2):e10-e22. doi: 10.3928/23258160-20190129-13.
- Hussain RM, Ciulla TA. 2017. Emerging vascular endothelial growth factor antagonists to treat neovascular age-related macular degeneration. Expert Opin Emerg Drugs. 22(3):235-246. doi:10.1080/14728214.2017.1362390.
- Al-Khersan H, Hussain RM, Ciulla TA, Dugel PU. 2019. Innovative therapies for neovascular age-related macular degeneration. Expert Opin Pharmacother. 12:1-13. doi: 10.1080/14656566.2019.1636031. [Publication électronique avant l’impression].
- Rodrigues GA, Mason M, Christie LA, et al. 2018. Functional Characterization of Abicipar-Pegol, an Anti-VEGF DARPin Therapeutic That Potently Inhibits Angiogenesis and Vascular Permeability. Invest Ophthalmol Vis Sci. 59(15):5836-5846. doi:10.1167/iovs.18-25307.
- DʼAntoni ML, Paul RH, Mitchell BI, et al. 2018. Improved Cognitive Performance and Reduced Monocyte Activation in Virally Suppressed Chronic HIV After Dual CCR2 and CCR5 Antagonism. J Acquir Immune Defic Syndr. 79(1):108-116. doi:10.1097/QAI.0000000000001752.
- Friedman SL, Ratziu V, Harrison SA, et al. 2018. A randomized, placebo-controlled trial of cenicriviroc for treatment of nonalcoholic steatohepatitis with fibrosis. Hepatology. 67(5):1754-1767. doi: 10.1002/hep.29477.
- Tacke F. 2018. Cenicriviroc for the treatment of non-alcoholic steatohepatitis and liver fibrosis. Expert Opin Investig Drugs. 27(3):301-311. doi:10.1080/13543784.2018.1442436.
- AURORA: A Phase 3 Study to Evaluate the Efficacy and Safety of Cenicriviroc for the Treatment of Liver Fibrosis in Adult Subjects With Nonalcoholic Steatohepatitis. ClinicalTrials.gov : NCT03028740. https://www.clinicaltrials.gov/ct2/show/NCT03028740?term=Cenicriviroc&draw=2&rank=12
- Collet TH, Dubern B, Mokrosinski J, et al. 2017. Evaluation of a melanocortin-4 receptor (MC4R) agonist (Setmelanotide) in MC4R deficiency. Mol Metab. 6(10):1321-1329. doi: 10.1016/j.molmet.2017.06.015.
- A Phase 3 Trial of Setmelanotide (RM-493), a Melanocortin-4 Receptor (MC4R) Agonist, in Bardet-Biedl Syndrome (BBS) and Alström Syndrome (AS) Patients With Moderate to Severe Obesity. ClinicalTrials.gov : NCT03746522. https://www.clinicaltrials.gov/ct2/show/NCT03746522?term=Setmelanotide&draw=2&rank=3
- An Open Label, 1-Year Trial, Including a Double-Blind Placebo-Controlled Withdrawal Period, of Setmelanotide (RM-493), a Melanocortin 4 Receptor (MC4R) Agonist, in Early Onset Leptin Receptor (LEPR) Deficiency Obesity Due to Bi-Allelic Loss-of-Function LEPR Genetic Mutation. ClinicalTrials.gov : NCT03287960. https://www.clinicaltrials.gov/ct2/show/NCT03287960?term=Setmelanotide&draw=2&rank=4
- Eichler F, Duncan C, Musolino PL, et al. 2017. Hematopoietic Stem-Cell Gene Therapy for Cerebral Adrenoleukodystrophy. N Engl J Med. 377(17):1630-8.
- Pasi KJ, Rangarajan S, Georgiev P, et al. 2017. Targeting of Antithrombin in Hemophilia A or B with RNAi Therapy. N Engl J Med. 377(9):819-828. doi: 10.1056/NEJMoa1616569.
- ATLAS-PPX: An Open-label, Multinational, Switching Study to Describe the Efficacy and Safety of Fitusiran Prophylaxis in Patients With Hemophilia A and B Previously Receiving Factor or Bypassing Agent Prophylaxis. ClinicalTrials.gov : NCT03549871. https://www.clinicaltrials.gov/ct2/show/NCT03549871?term=fitusiran&draw=2&rank=1
- An Open-label, Long-term Safety and Efficacy Study of Fitusiran in Patients With Hemophilia A or B, With or Without Inhibitory Antibodies to Factor VIII or IX. ClinicalTrials.gov : NCT03754790. https://www.clinicaltrials.gov/ct2/show/NCT03754790?term=fitusiran&draw=2&rank=3
- ATLAS-INH: A Phase 3 Study to Evaluate the Efficacy and Safety of Fitusiran in Patients With Hemophilia A or B, With Inhibitory Antibodies to Factor VIII or IX. ClinicalTrials.gov : NCT03417102. https://www.clinicaltrials.gov/ct2/show/NCT03417102?term=fitusiran&draw=2&rank=5
- ATLAS-A/B: A Phase 3 Study to Evaluate the Efficacy and Safety of Fitusiran in Patients With Hemophilia A or B, Without Inhibitory Antibodies to Factor VIII or IX. ClinicalTrials.gov : NCT03417245. https://www.clinicaltrials.gov/ct2/show/NCT03417245?term=fitusiran&draw=2&rank=6
- Martin ER, Smith MT, Maroni BJ, Zuraw QC, deGoma EM. 2017. Clinical Trial of Vadadustat in Patients With Anemia Secondary to Stage 3 or 4 Chronic Kidney Disease. Am J Nephrol. 45(5):380-388. doi: 10.1159/000464476.
- Haase VH, Chertow GM, Block GA, et al. 2018. Effects of vadadustat on hemoglobin concentrations in patients receiving hemodialysis previously treated with erythropoiesis-stimulating agents. Nephrol Dial Transplant. doi: 10.1093/ndt/gfy055. [Publication électronique avant l’impression].
- Phase 3, Randomized, Open-Label, Active-Controlled Study Evaluating the Efficacy and Safety of Oral Vadadustat for the Correction or Maintenance Treatment of Anemia in Subjects With Incident Dialysis-Dependent Chronic Kidney Disease (DD-CKD) (INNO2VATE - CORRECTION/CONVERSION). ClinicalTrials.gov : NCT02865850. https://www.clinicaltrials.gov/ct2/show/NCT02865850?term=vadadustat&recrs=d&phase=2&draw=2&rank=1
- Whitfield T, Torkington A, van Halsema C. 2016. Profile of cabotegravir and its potential in the treatment and prevention of HIV-1 infection: evidence to date. HIV AIDS (Auckl). 8:157-164.
- Trezza C, Ford SL, Spreen W, Pan R, Piscitelli S. 2015. Formulation and pharmacology of long-acting cabotegravir. Curr Opin HIV AIDS. 10(4):239-45. doi:10.1097/COH.0000000000000168.
- Margolis DA, Brinson CC, Smith GHR, et al. 2015. Cabotegravir plus rilpivirine, once a day, after induction with cabotegravir plus nucleoside reverse transcriptase inhibitors in antiretroviral-naive adults with HIV-1 infection (LATTE): a randomised, phase 2b, dose-ranging trial. Lancet Infect Dis. 15(10):1145-1155. doi: 10.1016/S1473-3099(15)00152-8.
- Andrews CD, Heneine W. 2015. Cabotegravir long-acting for HIV-1 prevention. Curr Opin HIV AIDS. 10(4):258-263. doi:10.1097/COH.0000000000000161.
- Cahn P, Fink V, Patterson P. 2018. Fostemsavir: a new CD4 attachment inhibitor. Curr Opin HIV AIDS. 13(4):341-345. doi: 10.1097/COH.0000000000000469.
- Hind M, Stinchcombe S. 2009. Palovarotene, a novel retinoic acid receptor gamma agonist for the treatment of emphysema. Curr Opin Investig Drugs. 10(11):1243-50.
- MOVE TRIAL: A Phase 3, Efficacy and Safety Study of Oral Palovarotene for the Treatment of Fibrodysplasia Ossificans Progressiva (FOP). ClinicalTrials.gov : NCT03312634. https://www.clinicaltrials.gov/ct2/show/NCT03312634?term=Palovarotene&draw=2&rank=3
- de Bono JS, De Giorgi U, Nava Rodrigues D, et al. 2018. Randomized Phase II Study of Akt Blockade With or Without Ipatasertib in Abiraterone-Treated Patients With Metastatic Prostate Cancer With and Without PTEN Loss. Clin Cancer Res. doi:10.1158/1078-0432.CCR-18-0981. [Publication électronique avant l’impression].
- Costa RLB, Han HS, Gradishar WJ. 2018. Targeting the PI3K/AKT/mTOR pathway in triple-negative breast cancer: a review. Breast Cancer Res Treat. 169(3):397-406. doi: 10.1007/s10549-018-4697-y.
- Kim SB, Dent R, Im SA, et al. 2017. Ipatasertib plus paclitaxel versus placebo plus paclitaxel as first-line therapy for metastatic triple-negative breast cancer (LOTUS): a multicentre, randomised, double-blind, placebo-controlled, phase 2 trial. Lancet Oncol. 18(10):1360-1372. doi: 10.1016/S1470-2045(17)30450-3.
- A Phase Ib/III Study of Ipatasertib Plus Palbociclib and Fulvestrant Versus Placebo Plus Palbociclib and Fulvestrant in Hormone Receptor Positive and HER2 Negative Locally Advanced Unresectable or Metastatic Breast Cancer. ClinicalTrials.gov : NCT04060862. https://www.clinicaltrials.gov/ct2/show/NCT04060862?term=Ipatasertib&draw=2&rank=15
- A Phase III, Double-blind, Placebo-controlled, Randomized Study Of Ipatasertib in Combination With Atezolizumab and Paclitaxel as a Treatment for Participants With Locally Advanced Unresectable or Metastatic Triple-Negative Breast Cancer. ClinicalTrials.gov : NCT04177108. https://www.clinicaltrials.gov/ct2/show/NCT04177108?term=Ipatasertib&draw=2&rank=17
- A Phase III, Randomized, Double-Blind, Placebo-Controlled, Multicenter Trial Testing Ipatasertib Plus Abiraterone Plus Prednisone/Prednisolone, Relative to Placebo Plus Abiraterone Plus Prednisone/Prednisolone in Adult Male Patients With Asymptomatic or Mildly Symptomatic, Previously Untreated, Metastatic Castrate-Resistant Prostate Cancer. ClinicalTrials.gov : NCT03072238. https://www.clinicaltrials.gov/ct2/show/NCT03072238?term=Ipatasertib&draw=2&rank=9
- Chauhan D, Ray A, Viktorsson K, et al. 2013. In vitro and in vivo antitumor activity of a novel alkylating agent, melphalan-flufenamide, against multiple myeloma cells. Clin Cancer Res. 19(11):3019-31. doi: 10.1158/1078-0432.CCR-12-3752.
- A Randomized, Controlled, Open-label, Phase 3 Study of Melflufen/Dexamethasone Compared With Pomalidomide/Dexamethasone for Patients With Relapsed Refractory Multiple Myeloma Who Are Refractory to Lenalidomide. ClinicalTrials.gov : NCT03151811. https://www.clinicaltrials.gov/ct2/show/NCT03151811?term=melflufen&draw=2&rank=4
- A Phase 3, Double-Blind, Placebo-controlled Study of Quizartinib Administered in Combination With Induction and Consolidation Chemotherapy, and Administered as Continuation Therapy in Subjects 18 to 75 Years Old With Newly Diagnosed FLT3-ITD (+) Acute Myeloid Leukemia (QuANTUM First). ClinicalTrials.gov : NCT02668653. https://www.clinicaltrials.gov/ct2/show/NCT02668653?term=Quizartinib&draw=2&rank=12
- A Multicenter Phase 2, Open Label Study of Intratumoral Tavo Plus Electroporation in Combination With Intravenous Pembrolizumab in Patients With Stage III/IV Melanoma Who Are Progressing on Either Pembrolizumab or Nivolumab Treatment. ClinicalTrials.gov : NCT03132675. https://clinicaltrials.gov/ct2/show/NCT03132675
- Burkart C, Mukhopadhyay A, Shirley SA, et al. 2018. Improving therapeutic efficacy of IL-12 intratumoral gene electrotransfer through novel plasmid design and modified parameters. Gene Ther. 25(2):93-103.
- Babiker HM, Glode AE, Cooke LS, Mahadevan D. 2018. Ublituximab for the treatment of CD20 positive B-cell malignancies. Expert Opin Investig Drugs. 27(4):407-412. doi:10.1080/13543784.2018.1459560.
- Sharman JP, Farber CM, Mahadevan D, et al. 2017. Ublituximab (TG-1101), a novel glycoengineered anti-CD20 antibody, in combination with ibrutinib is safe and highly active in patients with relapsed and/or refractory chronic lymphocytic leukaemia: results of a phase 2 trial. Br J Haematol. 176(3):412-420. doi: 10.1111/bjh.14447.
- UbLiTuximab in Multiple Sclerosis Treatment Effects (ULTIMATE I STUDY). ClinicalTrials.gov : NCT03277261. https://www.clinicaltrials.gov/ct2/show/NCT03277261?term=Ublituximab&draw=2&rank=5
- Randomized, Double-Masked, Sham-Controlled Clinical Trial [phase 3] to Evaluate the Efficacy of a Single Intravitreal Injection of GS010 in Subjects Affected for 6 Months or Less by LHON Due to the G11778A Mutation in the Mitochondrial ND4 Gene. ClinicalTrials.gov : NCT02652767. www.clinicaltrials.gov/ct2/show/NCT02652767?term=NCT02652767&rank=1
- Randomized, Double-Masked, Sham-Controlled Clinical Trial to Evaluate the Efficacy of a Single Intravitreal Injection of GS010 in Subjects Affected for More Than 6 Months and To 12 Months by LHON Due to the G11778A Mutation in the ND4 Gene. ClinicalTrials.gov : NCT02652780. https://www.clinicaltrials.gov/ct2/show/NCT02652780?term=lenadogene+nolparvovec&rank=1
- Mitsios A, Dubis AM, Moosajee M. 2018. Choroideremia: from genetic and clinical phenotyping to gene therapy and future treatments. Ther Adv Ophthalmol. 10:1-18.
- Ong T, Pennesi ME, Birch DG, Lam BL, Tsang SH. 2019. Adeno-Associated Viral Gene Therapy for Inherited Retinal Disease. Pharm Res. 36(2):34.
- Fischer MD, Ochakovski GA, Beier B, et al. 2019. Efficacy and Safety of Retinal Gene Therapy Using Adeno-Associated Virus Vector for Patients With Choroideremia: A Randomized Clinical Trial. JAMA Ophthalmol. doi: 10.1001/jamaophthalmol.2019.3278. [Publication électronique avant l’impression].
- A Randomised, Open Label, Outcomes-Assessor Masked, Prospective, Parallel Controlled Group, Phase 3 Clinical Trial Of Retinal Gene Therapy For Choroideremia Using An Adeno-Associated Viral Vector (AAV2) Encoding Rab Escort Protein 1 (REP1). ClinicalTrials.gov : NCT03496012. https://www.clinicaltrials.gov/ct2/show/NCT03496012?term=NSR-REP1&rank=3
- A Single-Masked, Randomized, Controlled, Parallel Group, Phase 3 Clinical Trial Of Retinal Gene Therapy for Choroideremia Using an Adeno-Associated Viral Vector (AAV2) Encoding Rab Escort Protein 1 (REP1). Base de données sur les essais cliniques de Santé Canada : 193958. https://produits-sante.canada.ca/ctdb-bdec/index-fra.jsp
- Osborne R. Merged companies QLT, Aegerion eyeball Zuretinol, ultra-orphan phase III bid. BioWorld. http://www.bioworld.com/content/merged-companies-qlt-aegerion-eyeball-zuretinol-ultra-orphan-phase-iii-bid
- Mendell JR, Al-Zaidy S, Shell R, et al. 2017. Single-Dose Gene-Replacement Therapy for Spinal Muscular Atrophy. N Engl J Med. 377:1713-22. doi: 10.1056/NEJMoa1706198.
- A Global Study of a Single, One-Time Dose of AVXS-101 Delivered to Infants With Genetically Diagnosed and Pre-symptomatic Spinal Muscular Atrophy With Multiple Copies of SMN2. ClinicalTrials.gov : NCT03505099. www.clinicaltrials.gov/ct2/show/NCT03505099?term=AVXS-101&draw=1&rank=1
- European, Phase 3, Open-Label, Single-Arm, Single-Dose Gene Replacement Therapy Clinical Trial for Patients With Spinal Muscular Atrophy Type 1 With One or Two SMN2 Copies Delivering AVXS-101 by Intravenous Infusion. ClinicalTrials.gov : NCT03461289. www.clinicaltrials.gov/ct2/show/NCT03461289?term=AVXS-101&draw=1&rank=4
- Phase 3, Open-Label, Single-Arm, Single-Dose Gene Replacement Therapy Clinical Trial for Patients With Spinal Muscular Atrophy Type 1 With One or Two SMN2 Copies Delivering AVXS-101 by Intravenous Infusion. ClinicalTrials.gov : NCT03306277. www.clinicaltrials.gov/ct2/show/NCT03306277?term=AVXS-101&draw=1&rank=5
- A Long Term Follow up Safety Study of Patients in the AVXS-101-CL-101 Gene Replacement Therapy Clinical Trial for Spinal Muscular Atrophy Type 1 Delivering AVXS 101. ClinicalTrials.gov : NCT03421977. https://www.clinicaltrials.gov/ct2/show/NCT03421977?term=Onasemnogene+abeparvovec&draw=2&rank=7
- Lipton RB, Dodick DW, Ailani J, et al. 2019. Effect of Ubrogepant vs Placebo on Pain and the Most Bothersome Associated Symptom in the Acute Treatment of Migraine: The ACHIEVE II Randomized Clinical Trial. JAMA. 322(19):1887-98.
- Veve MP, Wagner JL. 2018. Lefamulin: Review of a Promising Novel Pleuromutilin Antibiotic. Pharmacotherapy. 38(9):935-946.
- Lee YR, Jacobs KL. 2019. Leave it to Lefamulin: A Pleuromutilin Treatment Option in Community-Acquired Bacterial Pneumonia. Drugs. 79(17):1867-76.
- File TM, Goldberg L, Das A, et al. 2019. Efficacy and Safety of Intravenous-to-oral Lefamulin, a Pleuromutilin Antibiotic, for the Treatment of Community-acquired Bacterial Pneumonia: The Phase III Lefamulin Evaluation Against Pneumonia (LEAP 1) Trial. Clin Infect Dis. 69(11):1856-67.
- Chari A, Vogl DT, Gavriatopoulou M, et al. 2019. Oral Selinexor-Dexamethasone for Triple-Class Refractory Multiple Myeloma. N Engl J Med. 381(8):727-738.
- Cavazzana-Calvo M, Payen E, Negre O, et al. 2010. Transfusion independence and HMGA2 activation after gene therapy of human β-thalassaemia. Nature. 467(7313):318-322. doi: 10.1038/nature09328.
- A Phase 3 Single Arm Study Evaluating the Efficacy and Safety of Gene Therapy in Subjects With Transfusion-dependent β-Thalassemia, Who Have a β0/β0 Genotype by Transplantation of Autologous CD34+ Stem Cells Transduced Ex Vivo With a Lentiviral βA-T87Q-Globin Vector in Subjects ≤50 Years of Age. ClinicalTrials.gov : NCT03207009. www.clinicaltrials.gov/ct2/show/NCT03207009?term=lentiglobin&rank=4
- A Phase 3 Single Arm Study Evaluating the Efficacy and Safety of Gene Therapy in Subjects With Transfusion-dependent β-Thalassemia, Who Do Not Have a β0/β0 Genotype by Transplantation of Autologous CD34+ Stem Cells Transduced Ex Vivo With a Lentiviral βA-T87Q-Globin Vector in Subjects ≤50 Years of Age. ClinicalTrials.gov : NCT02906202. https://www.clinicaltrials.gov/ct2/show/NCT02906202?term=LentiGlobin&rank=4
- Melo-Carrillo A, Strassman AM, Nir RR, et al. 2017. Fremanezumab-A Humanized Monoclonal Anti-CGRP Antibody-Inhibits Thinly Myelinated (Aδ) But Not Unmyelinated (C) Meningeal Nociceptors. J Neurosci. 37(44):10587-10596. doi: 10.1523/JNEUROSCI.2211-17.2017.
- Ferrari MD, Diener HC, Ning X, et al. 2019. Fremanezumab versus placebo for migraine prevention in patients with documented failure to up to four migraine preventive medication classes (FOCUS): a randomised, double-blind, placebo-controlled, phase 3b trial. Lancet. doi:10.1016/S0140-6736(19)31946-4. [Publication électronique avant l’impression].
- Lionetto L, Curto M, Cisale GY, et al. 2019. Fremanezumab for the preventive treatment of migraine in adults. Expert Rev Clin Pharmacol. 12(8):741-748. doi:10.1080/17512433.2019.1635452.
- Reich K, Papp KA, Blauvelt A, et al. 2017. Tildrakizumab versus placebo or etanercept for chronic plaque psoriasis (reSURFACE 1 and reSURFACE 2): results from two randomised controlled, phase 3 trials. Lancet. 390(10091):276-288. doi: 10.1016/S0140-6736(17)31279-5.
- Bangert C, Kopp T. 2018. Tildrakizumab for the treatment of psoriasis. Immunotherapy. 10(13):1105-1122. doi: 10.2217/imt-2018-0028.
- Pithadia DJ, Reynolds KA, Lee EB, et al. 2019. Tildrakizumab in the treatment of psoriasis: latest evidence and place in therapy. Ther Adv Chronic Dis. 10:2040622319865658. doi:10.1177/2040622319865658.
- Chey WD, Lembo AJ, Rosenbaum DP. 2017. Tenapanor Treatment of Patients With Constipation-Predominant Irritable Bowel Syndrome: A Phase 2, Randomized, Placebo-Controlled Efficacy and Safety Trial. Am J Gastroenterol. 112(5):763-774. doi: 10.1038/ajg.2017.41.
- Block GA, Rosenbaum DP, Yan A, Chertow GM. 2019. Efficacy and Safety of Tenapanor in Patients ith Hyperphosphatemia Receiving Maintenance Hemodialysis: A Randomized Phase 3 Trial. J Am Soc Nephrol. 30(4):641-652. doi: 10.1681/ASN.2018080832.
- Simon JA, Altomare C, Cort S, et al. 2018. Overall Safety of Ospemifene in Postmenopausal Women from Placebo-Controlled Phase 2 and 3 Trials. J Womens Health (Larchmt). 27(1):14-23. doi: 10.1089/jwh.2017.6385.
- Shin JJ, Kim SK, Lee JR, Suh CS. 2017. Ospemifene: A Novel Option for the Treatment of Vulvovaginal Atrophy. J Menopausal Med. 23(2):79-84. doi: 10.6118/jmm.2017.23.2.79.
- Bruyniks N, Biglia N, Palacios S, Mueck AO. 2017. Systematic indirect comparison of ospemifene versus local estrogens for vulvar and vaginal atrophy. Climacteric. 20(3):195-204. doi: 10.1080/13697137.2017.1284780.
- Faught BM, Soulban G, Yeaw J, et al. 2019. Ospemifene versus local estrogen: adherence and costs in postmenopausal dyspareunia. J Comp Eff Res. doi: 10.2217/cer-2019-0091. [Publication électronique avant l’impression].
- Szollosi DE, Bill A. 2019. Potential Role of Endonuclease Inhibition and Other Targets in the Treatment of Influenza. Curr Drug Targets. doi: 10.2174/1389450120666190801115130. [Publication électronique avant l’impression].
- Hayden FG, Sugaya N, Hirotsu N, et al.; Baloxavir Marboxil Investigators Group. 2018. Baloxavir Marboxil for Uncomplicated Influenza in Adults and Adolescents. N Engl J Med. 379(10):913-923. doi: 10.1056/NEJMoa1716197.
- Al-Salama ZT. 2019. Siponimod: First Global Approval. Drugs. 79(9):1009-1015. doi: 10.1007/s40265-019-01140-x.
- Gajofatto A. 2017. Spotlight on siponimod and its potential in the treatment of secondary progressive multiple sclerosis: the evidence to date. Drug Des Devel Ther. 11:3153-3157. doi: 10.2147/DDDT.S122249.
- Shore ND. 2017. Darolutamide (ODM-201) for the treatment of prostate cancer. Expert Opin Pharmacother. 18(9):945-952. doi: 10.1080/14656566.2017.1329820.
- Sugawara T, Baumgart SJ, Nevedomskaya E, et al. 2019. Darolutamide is a potent androgen receptor antagonist with strong efficacy in prostate cancer models. Int J Cancer. 145(5):1382-1394. doi: 10.1002/ijc.32242.
- [Aucun auteur indiqué]. 2019. Darolutamide Slows Metastasis in Prostate Cancer. Cancer Discov. 9(4):OF6. doi: 10.1158/2159-8290.CD-NB2019-029.
- Fizazi K, Shore N, Tammela TL, et al; ARAMIS Investigators. 2019. Darolutamide in Nonmetastatic, Castration-Resistant Prostate Cancer. N Engl J Med. 380(13):1235-1246. doi: 10.1056/NEJMoa1815671.
- Smith KM, Fagan PC, Pomari E, et al. 2018. Antitumor Activity of Entrectinib, a Pan-TRK, ROS1, and ALK Inhibitor, in ETV6-NTRK3-Positive Acute Myeloid Leukemia. Mol Cancer Ther. 17(2):455-463. doi: 10.1158/1535-7163.MCT-17-0419.
- Rolfo C, Ruiz R, Giovannetti E, et al. 2015. Entrectinib: a potent new TRK, ROS1, and ALK inhibitor. Expert Opin Investig Drugs. 24(11):1493-1500. doi:10.1517/13543784.2015.1096344.