Rapport Annuel 2018

ISSN: 1495-0561
Cat. no.: H78E-PDF
Version PDF (2 Mo)
Table des matières
- Aperçu statistique de 2018
- Lettre à la Ministre
- Message du président
- À propos du Conseil d’examen du prix des médicaments brevetés : agir dans l’intérêt des Canadiens
- Réglementation des prix des médicaments brevetés : une vigilance continue nécessaire
- Principales tendances relatives aux produits pharmaceutiques : les médicaments plus coûteux continuent d’influer sur les ventes
- Le système national d’information sur l’utilisation des médicaments prescrits : à l’appui des décisions relatives aux soins de santé au Canada
- Analyse des dépenses de recherche et développement : l’investissement en R-D n’atteint pas la cible
- Annexe 1 : Glossaire
- Annexe 2 : Médicaments brevetés ayant fait l’objet d’un premier rapport au CEPMB en 2018
- Annexe 3 : Tendances relatives aux produits pharmaceutiques – ventes
- Annexe 4 : Recherche et développement
Aperçu statistique de 2018
Mandat de réglementation
- 1 403 médicaments brevetés pour usage humain ont fait l’objet d’un rapport au CEPMB, dont 108 nouveaux médicaments.
- En date du 31 décembre 2017, 7 engagements de conformité volontaire ont été acceptés.
- Des recettes excédentaires totalisant 315 milliards de dollars ont été remboursées au moyen de paiements au gouvernement du Canada, en plus de réductions de prix.
Mandat de rapport
Tendances observées Au niveau des ventes :
- Les ventes de médicaments brevetés au Canada ont atteint 16,7 milliards de dollars en 2018, reculant très légèrement (0,6 %) par rapport à l’année précédente.
- Les médicaments brevetés représentaient 59,0 % du total des ventes de médicaments au Canada, soit une diminution par rapport à 61,5 % en 2017.
Tendances observées au niveau des prix :
- Les prix des médicaments brevetés existants sont demeurés stables, alors que l’indice des prix à la consommation (IPC) a augmenté de 2,3 %.
- Les prix au Canada se situaient au quatrième rang des prix les plus élevés parmi les sept pays de comparaison du CEPMB, étant inférieurs aux prix en Suisse, en Allemagne et aux États-Unis.
Recherche et développement :
Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes a diminué en 2018 :
- 4,0 % pour tous les brevetés, une diminution légère par rapport à 4,1 % en 2017.
- 4,3 % pour tous les brevetés membres de Médicaments novateurs Canada, une diminution par rapport à 4,6 % en 2017.
Dépenses de R-D :
- Les brevetés ont fait rapport de dépenses de R-D totalisant 892,6 millions de dollars, soit une augmentation de 2,4 par rapport à 2017.
- Les brevetés membres de Médicaments novateurs Canada ont fait rapport de dépenses de R-D totalisant 723,0 millions de dollars, soit une diminution de 4,3 % par rapport à 2017.
Lettre à la Ministre
Le 28 février 2020
L’honorable Patty Hajdu, C.P., députée
Ministre de la Santé
Chambre des communes
Ottawa (Ontario)
K1A 0A6
Madame la Ministre,
J’ai le plaisir de vous présenter, conformément aux articles 89 et 100 de la Loi sur les brevets, le Rapport annuel du Conseil d’examen du prix des médicaments brevetés pour l’exercice terminé le 31 décembre 2018.
Veuillez agréer, Madame, l’expression de mes sentiments les meilleurs.
Dr Mitchell Levine
Président
Message du président
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme quasi‑judiciaire indépendant établi par le Parlement en 1987 en application de la Loi sur les brevets (la Loi). Le mandat du CEPMB consiste à protéger et à informer les Canadiens en veillant à ce que les prix des médicaments brevetés vendus au Canada ne soient pas excessifs et en faisant rapport sur les tendances pharmaceutiques.
En 2018, le CEPMB a mis l’accent sur l’achèvement des dernières étapes visant à moderniser sa réglementation et ses lignes directrices. À cette fin, le CEPMB a mis sur pied un comité directeur composé d’intervenants clés afin d’obtenir des observations de haut niveau sur un nouveau cadre réglementaire proposé visant à protéger les consommateurs contre les médicaments brevetés vendus à des prix excessifs. Pour aider le comité, le CEPMB a également mis sur pied un groupe de travail composé d’experts pour examiner certaines facettes du nouveau cadre proposé plus exigeantes sur le plan technique et pour donner des conseils connexes. Le résultat des délibérations du comité directeur et du groupe de travail technique a été présenté au Conseil pour examen avant la publication des nouvelles lignes directrices provisoires à des fins de consultation publique plus vaste à l’automne 2019. Jusqu’à ce que la nouvelle réglementation et les nouvelles lignes directrices soient achevées et en vigueur, le CEPMB continuera de gérer son mandat réglementaire conformément aux règles existantes afin de produire les meilleurs résultats possible pour les Canadiens.
En plus des progrès accomplis relativement aux objectifs d’élaboration des politiques du CEPMB pour la nouvelle réglementation et les nouvelles lignes directrices, 2018 a également vu les fondements législatifs de ces deux instruments renforcés davantage par la décision de la Cour suprême du Canada de refuser à Alexion le droit de porter le jugement de la Cour d’appel fédérale en appel dans l’affaire Soliris. Ce faisant, la Cour suprême du Canada fait bien comprendre que tout doute concernant la validité constitutionnelle du régime législatif du CEPMB devrait être solidement dissipé.
En ce qui a trait aux tendances pharmaceutiques, la conclusion la plus marquante du rapport annuel de cette année est la diminution sans précédent de 0,6 % des dépenses totales pour des médicaments brevetés. Cela s’explique par le fait que certains médicaments clés les plus vendus ont cessé d’être déclarés au CEPMB en 2018, y compris Remicade, le médicament d’ordonnance le plus vendu au Canada. En 2018, les médicaments qui étaient déclarés au CEPMB représentaient des ventes estimatives de 3,3 milliards de dollars ou 11,6 % de toutes les ventes. Il s’agit d’une nette augmentation comparativement à l’année précédente et une augmentation considérable par rapport à la décennie passée, quand les médicaments qui étaient officiellement déclarés au CEPMB représentaient 0,7 milliard de dollars en vente ou 3,2 % de toutes les ventes. Historiquement, la part de marché des médicaments brevetés a connu une baisse importante au moment de la perte de protection conférée par les brevets. Toutefois, ce même effet n’a pas été récemment observé pour un certain nombre de médicaments biologiques très coûteux qui ne sont plus protégés par des brevets. Vu l’importance de ce phénomène, le CEPMB a ajouté du nouveau contenu à son rapport annuel afin de suivre l’incidence de cette tendance à mesure que le marché pour ces médicaments évolue.
Dr Mitchell Levine
Président
À propos du conseil d’examen du prix des médicaments brevetés : agir dans l’intérêt des canadiens
Le Conseil d’examen du prix des médicaments brevetés (CEPMB) est un organisme quasi judiciaire indépendant, créé par le Parlement en 1987 en vertu de la Loi sur les brevets (la Loi).
Le CEPMB est un organisme administratif quasi judiciaire qui exécute un double mandat de réglementation et de production de rapports. Dans le cadre de son mandat de réglementation, il s’assure que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs. Le Conseil fait également rapport sur les tendances observées au niveau des ventes de produits pharmaceutiques et de l’établissement des prix pour tous les médicaments, ainsi que les dépenses de recherche-développement (R-D) des brevetés. De plus, à la demande du ministre de la Santé en vertu de l’article 90 de la Loi sur les brevets, le CEPMB effectue des analyses critiques sur les tendances en matière de prix, d’utilisation et de coûts des médicaments sur ordonnance brevetés et non brevetés au moyen de l'initiative du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). Son mandat de rapport fournit aux payeurs de produits pharmaceutiques et aux décideurs les renseignements nécessaires pour prendre des décisions rationnelles et fondées sur des données probantes concernant le remboursement et l’établissement des prix.
Le CEPMB fait partie du portefeuille de la Santé, qui comprend également Santé Canada, l’Agence de la santé publique du Canada, les Instituts de recherche en santé du Canada et l’Agence canadienne d’inspection des aliments. Le portefeuille de la Santé aide le ministre de la Santé à maintenir et à améliorer la santé des Canadiens.
Notre mission
Le CEPMB est un organisme public respecté qui contribue de façon unique et précieuse à la durabilité des dépenses en produits pharmaceutiques au Canada au moyen des mesures suivantes :
- fournir aux intervenants des renseignements sur les prix, les coûts et l’utilisation pour les aider à prendre en temps opportun des décisions éclairées en matière de prix, d’achat et de remboursement;
- exercer un contrôle efficace sur les prix des médicaments brevetés grâce à l’exercice responsable et efficient de ses pouvoirs en matière de protection des consommateurs.
La protection des consommateurs dans un marché complexe
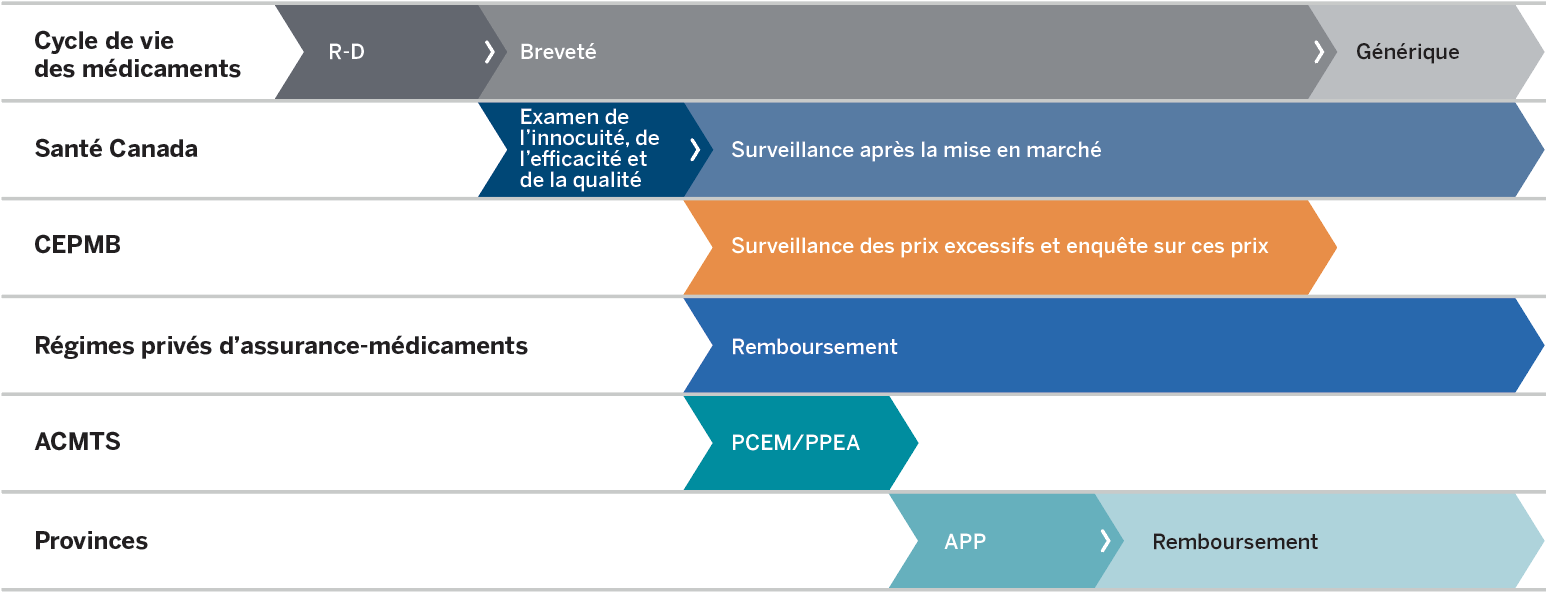
Description de la figure
Cet organigramme illustre le rôle des organismes de réglementation canadiens au cours du cycle de vie d’un médicament, soit pendant les périodes de recherche et développement, d’application du brevet et de commercialisation des génériques après l’expiration du brevet. Santé Canada examine l’innocuité, l’efficacité et la qualité au début de la période du brevet et assume ensuite la surveillance après la mise en marché. Le CEPMB effectue la surveillance des prix et mène des enquêtes sur ces prix pendant la période du brevet, après l’examen de Santé Canada. Les régimes privés d’assurance-médicaments procèdent au remboursent pendant et après la période du brevet, après l’examen de Santé Canada. L’ACMTS applique les processus du Programme commun d’évaluation des médicaments et du Programme pancanadien d’évaluation des anticancéreux après l’examen de Santé Canada. Pour les provinces et les territoires, les négociations de l’Alliance pancanadienne pharmaceutique débutent après les examens de l’ACMTS, et le remboursement suit ces négociations.
Agence canadienne des médicaments et des technologies de la santé (ACMTS); Programme commun d’évaluation des médicaments (PCEM); Programme pancanadien d’évaluation des anticancéreux (PPEA); et Alliance pancanadienne pharmaceutique (APP)
Source: CEPMB
Même s’il fait partie du portefeuille de la Santé, le CEPMB, en raison de ses responsabilités quasi judiciaires, exerce son mandat en toute indépendance du ministre de la Santé, qui est responsable de l’application des articles de la Loi se rapportant au CEPMB. Le CEPMB fonctionne également d’une façon indépendante d’autres organismes liés à la santé, comme :
- Santé Canada, qui autorise la commercialisation des médicaments au Canada après avoir vérifié leur innocuité, leur efficacité et leur qualité;
- les régimes publics fédéral, provinciaux et territoriaux d’assurance-médicaments, qui travaillent ensemble dans le cadre de l’APP et autorisent l’inscription des médicaments sur leurs formulaires de médicaments admissibles à un remboursement;
- le Programme commun d’examen des médicaments et le Programme pancanadien d’évaluation des anticancéreux (PPEA), gérés par l’Association canadienne des médicaments et des technologies de la santé (ACMTS), qui présente des recommandations quant aux nouveaux médicaments qui devraient être admissibles au remboursement par l’APP.
Le CEPMB se compose de fonctionnaires (le personnel du Conseil) responsables des activités quotidiennes de l’organisme, et de membres du Conseil nommés par le gouverneur en conseil qui agiront à titre de membres du panel d’audience en cas de conflit entre le personnel du Conseil et un breveté au sujet du prix d’un médicament breveté.
Compétence
Réglementation
Le CEPMB réglemente le prix maximum auquel les brevetés (entreprises) peuvent vendre leurs produits aux grossistes, aux hôpitaux, aux pharmacies et aux autres grands distributeurs. Ce prix est parfois appelé prix « départ usine ». Le CEPMB ne réglemente pas les prix des médicaments non brevetés.
La compétence du CEPMB ne se limite pas aux médicaments pour lesquels le brevet vise l’ingrédient actif ou les formulations ou utilisations précises pour lesquelles le breveté vend le médicament au Canada. Sa compétence couvre plutôt les médicaments visés par un brevet, y compris les brevets pour les procédés de fabrication, les systèmes de livraison ou les formes posologiques, les indications ou utilisations et toute formulation.
La Loi exige que les brevetés (y compris toutes les parties qui bénéficient d’un brevet, qu’elles soient détentrices du brevet ou titulaires d’une licence délivrée en vertu du brevet, peu importe si leurs activités commerciales concernent un médicament de marque ou un médicament générique) informent le CEPMB de leur intention de vendre un nouveau médicament breveté. Les brevetés doivent présenter des renseignements relatifs au prix et à la vente après l’introduction de leur médicament breveté, et ce, jusqu’à ce que tous les brevets soient expirés. Les brevetés ne sont pas tenus de faire approuver au préalable les prix de vente pour être en mesure de commercialiser leurs produits.
Notre mission :
Un système pharmaceutique durable dans le cadre duquel les payeurs obtiennent l’information dont ils ont besoin pour faire de bons choix en matière de remboursement et les Canadiens peuvent avoir les moyens de se payer les médicaments brevetés dont ils ont besoin pour avoir une vie saine et productive.
Cependant, la Loi exige que le CEPMB s’assure que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs.
Le personnel du Conseil examine les prix demandés par les brevetés pour chaque concentration et forme d’un médicament breveté. S’il détermine qu’un prix semble peut-être excessif, le personnel du Conseil tâche d’abord de régler le différend sur une base volontaire avec le breveté. À défaut d’y parvenir, le président peut décider de renvoyer l’affaire à une audience. Lors de cette dernière, un comité, se composant des membres du Conseil, agira à titre d’arbitre neutre entre le personnel du Conseil et le breveté. Si ce comité conclut que le prix du médicament breveté est excessif, il peut rendre une ordonnance demandant la réduction du prix. Il peut également exiger que le breveté verse un montant au gouvernement du Canada pour compenser les recettes excessives qu’il a encaissées et, dans les cas où le comité conclut à la présence d’une politique de prix excessifs, il peut doubler le montant des recettes excessives à rembourser.
Production de rapports
Comme l’exige la Loi, le CEPMB fait rapport chaque année au Parlement, par l’entremise du ministre de la Santé, de ses activités d’examen des prix et des prix des médicaments brevetés et des tendances des prix de tous les médicaments sur ordonnance et des dépenses de R-D déclarées par les titulaires de brevets pharmaceutiques.
De plus, conformément à une entente conclue entre les ministres fédéral, provinciaux et territoriaux de la Santé en 2001, et à la demande du ministre de la Santé en vertu de l’article 90 de la Loi, le CEPMB effectue des analyses critiques des tendances des prix, de l’utilisation et des coûts des médicaments sur ordonnance brevetés et non brevetés au moyen du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP). Le CEPMB publie les résultats des analyses du SNIUMP sous forme de rapports de recherche, d’affiches, de présentations et de résumés. Cette initiative permet aux gouvernements fédéral, provinciaux et territoriaux et aux autres intervenants intéressés d’accéder à une source centrale, impartiale et fiable de renseignements sur les tendances concernant les produits pharmaceutiques.
Entre autres initiatives relevant de son mandat, le CEPMB organise également divers forums comme des webinaires, des forums de recherche et des séances d’information avec des universitaires et des experts en matière de politiques afin de discuter de la recherche concernant les domaines émergents pour les études sur les tendances pharmaceutiques au Canada et à l’étranger, et d’en diffuser les résultats.
1,403 médicaments brevetés
1,403 médicaments brevetés ont fait l’objet d’un rapport au CEPMB en 2018.
Communications et sensibilisation
Le CEPMB adopte une approche proactive et un langage clair à l’égard de ses activités de communication externes. Il s’agit notamment de campagnes ciblées sur les médias sociaux et de mobilisation plus conventionnelle (p. ex. courriel et téléphone) auprès de médias d’information nationaux, internationaux et spécialisés. Le CEPMB recherche activement d’autres possibilités de tirer parti des nouveaux médias pour communiquer avec les Canadiens et ses intervenants.
Le CEPMB reconnaît l’importance de l’ouverture et de la transparence alors que nous continuons de travailler à la modernisation de la manière dont nous nous acquittons de notre mandat. Nous communiquons régulièrement, au moyen de différents canaux, de l’information sur nos progrès, notamment les échéanciers prévus et les jalons clés. La mobilisation des intervenants demeure au coeur de notre démarche de communication à volets multiples. Rendre compte de nos progrès nous permet de demeurer concentrés sur l’obtention de résultats.
Gouvernance
Le Conseil est composé d’au plus cinq membres siégeant à temps partiel. Les membres du Conseil, y compris un président et un vice-président, sont nommés par le gouverneur en conseil. Le président du Conseil, nommé chef de la direction du CEPMB en vertu de la Loi, est chargé de la gouverne et de la supervision des activités du CEPMB. Selon la Loi, le vice-président, en cas d’absence ou d’empêchement du président, ou de vacance de son poste, assume la présidence.
Les membres du Conseil, y compris le président, sont collectivement responsables de la mise en oeuvre des dispositions applicables de la Loi. Ensemble, ils établissent les lignes directrices, les règles, les règlements administratifs et les autres politiques du CEPMB comme le prévoit la Loi (article 96) et consultent, au besoin, les intervenants concernés, dont les ministres de la santé provinciaux et territoriaux, les représentants des groupes de consommateurs, l’industrie pharmaceutique et d’autres intervenants.
Membres du Conseil
Président
Dr Mitchell Levine,
B. Sc., M. Sc., M. D., FRCPC, FISPE, FACP

Le Dr Mitchell Levine a été nommé président du Conseil le 13 février 2018.
Le Dr Levine est professeur au sein du département des méthodes, des données et de l’impact de la recherche en santé et du département de médecine, Division de pharmacologie et toxicologie clinique, de l’Université McMaster à Hamilton, en Ontario. Il est également vice-doyen de la faculté des sciences de la santé et membre du personnel enseignant du Centre for Health Economics and Policy Analysis de l’Université McMaster.
Le Dr Levine a obtenu son diplôme en médecine de l’Université de Calgary en 1979 et a fait des études supérieures en médecine interne (FRCPC) et en pharmacologie clinique à l’Université de Toronto (1981-1987). Il a obtenu un diplôme de maîtrise ès sciences en épidémiologie clinique de l’Université McMaster en 1988.
Avant sa nomination au Conseil, le Dr Levine était membre du Groupe consultatif sur les médicaments pour usage humain du CEPMB. Il agit actuellement comme consultant spécial en pharmacologie clinique aux ministères de la Santé et des Soins de longue durée de l’Ontario. De plus, il est rédacteur en chef adjoint de l’ACP Journal Club : Evidence-Based Medicine.
Il s’agit du deuxième mandat du Dr Levine en tant que membre du Conseil. Il a d’abord été nommé vice-président en 2011.
Vice-président
Poste vacant
Membres
Carolyn Kobernick,
B.C.L., LL. B.

Carolyn Kobernick a été nommée membre du Conseil le 13 juin 2014.
Mme Kobernick est avocate et ancienne fonctionnaire. Avant sa retraite en 2013, elle occupait le poste de sous-ministre adjointe du droit public au sein du ministère de la Justice. En tant qu’avocate principale du ministre de la Justice et du procureur général du Canada, Mme Kobernick a joué un rôle clé dans l’élaboration et la mise en oeuvre de politiques du secteur du droit public. En plus de cerner les grandes questions stratégiques, juridiques et opérationnelles, elle s’est attaquée à des questions intersectorielles nationales à titre d’agente de liaison entre le ministère de la Justice et les autres organismes gouvernementaux.
Mme Kobernick s’est jointe au ministère de la Justice en 1980, où elle a pratiqué le droit litigieux et fiscal au bureau régional de Toronto. En 1991, elle a été nommée avocate générale principale et chef adjointe du portefeuille du droit des affaires et du droit réglementaire après avoir travaillé pendant plus de dix ans au sein de l’unité des services juridiques de Service correctionnel du Canada. En tant qu’avocate principale générale, Mme Kobernick a participé à des dossiers stratégiques et opérationnels complexes du gouvernement fédéral, comme les projets de pipeline de l’Alaska et de pipeline de la vallée du Mackenzie ainsi que le dossier des commandites.
Pendant sa carrière au sein de la fonction publique, Mme Kobernick a activement participé à de nombreuses initiatives de haut niveau. Elle a été présidente du Comité national de conseils juridiques et championne ministérielle des Autochtones et de l’égalité entre les sexes. Elle a aussi agi à titre de haute fonctionnaire du ministère de la Justice au Comité du Cabinet chargé des affaires intérieures et a été nommée conseillère juridique principale auprès du gouvernement du Canada dans le cadre de l’enquête de la commission Gomery de 2004.
Mme Kobernick possède un B.C.L. et un LL.B. de l’Université McGill et a été reçue au barreau de l’Ontario. En 2012, elle a obtenu un certificat en arbitrage auprès des conseils d’administration et des tribunaux de l’Osgoode Hall Law School et de la Society of Ontario Adjudicators and Regulators.
Dre Ingrid Sketris,
BSc(Pharm), Pharm.D., MPA(HSA), Résidence en toxicologie clinique

La Dre Ingrid Sketris a été nommée membre du Conseil le 29 juin 2018.
La Dre Sketris est pharmacienne autorisée et professeure au College of Pharmacy de l’Université Dalhousie, avec nomination conjointe en médecine et en administration des services de santé.
Après l’obtention de son doctorat en pharmacie de l’Université du Minnesota en 1979, la Dre Sketris a complété un programme de résidence en toxicologie clinique au centre des sciences de la santé de l’Université du Tennessee. Elle est également détentrice d’une maîtrise en administration publique et des services de santé de l’Université Dalhousie.
Chef de file en pharmacie, elle a été présidente de l’Association des facultés de pharmacie du Canada et membre du conseil d’administration du Conseil canadien d’agrément des programmes de pharmacie.
La Dre Sketris est membre de la Société canadienne des pharmaciens d’hôpitaux, du American College of Clinical Pharmacy et de l’Académie canadienne des sciences de la santé. Elle a antérieurement été élue aux National Academies of Practice des États-Unis.
Matthew Herder,
B.Sc. (avec mention), LL.B., LL.M., J.S.M.

Matthew Herder a été nommé membre du Conseil le 29 juin 2018.
M. Herder est directeur du Health Law Institute de l’Université Dalhousie et professeur agrégé au Département de pharmacologie de la Faculté de médecine, avec nomination conjointe auprès de l’École de droit Schulich.
Ses travaux de recherche portent sur les politiques d’innovation biomédicale, en particulier sur le droit de la propriété intellectuelle et la réglementation des interventions biopharmaceutiques. Le travail de M. Herder est souvent interdisciplinaire et axé sur les politiques. M. Herder a obtenu des subventions des Instituts de recherche en santé du Canada et de la Société royale du Canada. Il a aussi comparu devant plusieurs comités parlementaires comme expert de la réglementation et de la politique pharmaceutique.
Avant d’arriver à l’Université Dalhousie, M. Herder a reçu une bourse de recherche en droit de l’Ewing Marion Kauffman Foundation à l’École de droit de l’Université de New York. Il a été stagiaire en droit à la Cour fédérale du Canada et a été admis au Barreau de l’Ontario. M. Herder possède une maîtrise en sciences juridiques de l’École de droit de Stanford ainsi que deux diplômes en droit de l’Université Dalhousie.
Structure organisationnelle et personnel
Organigramme du CEPMB
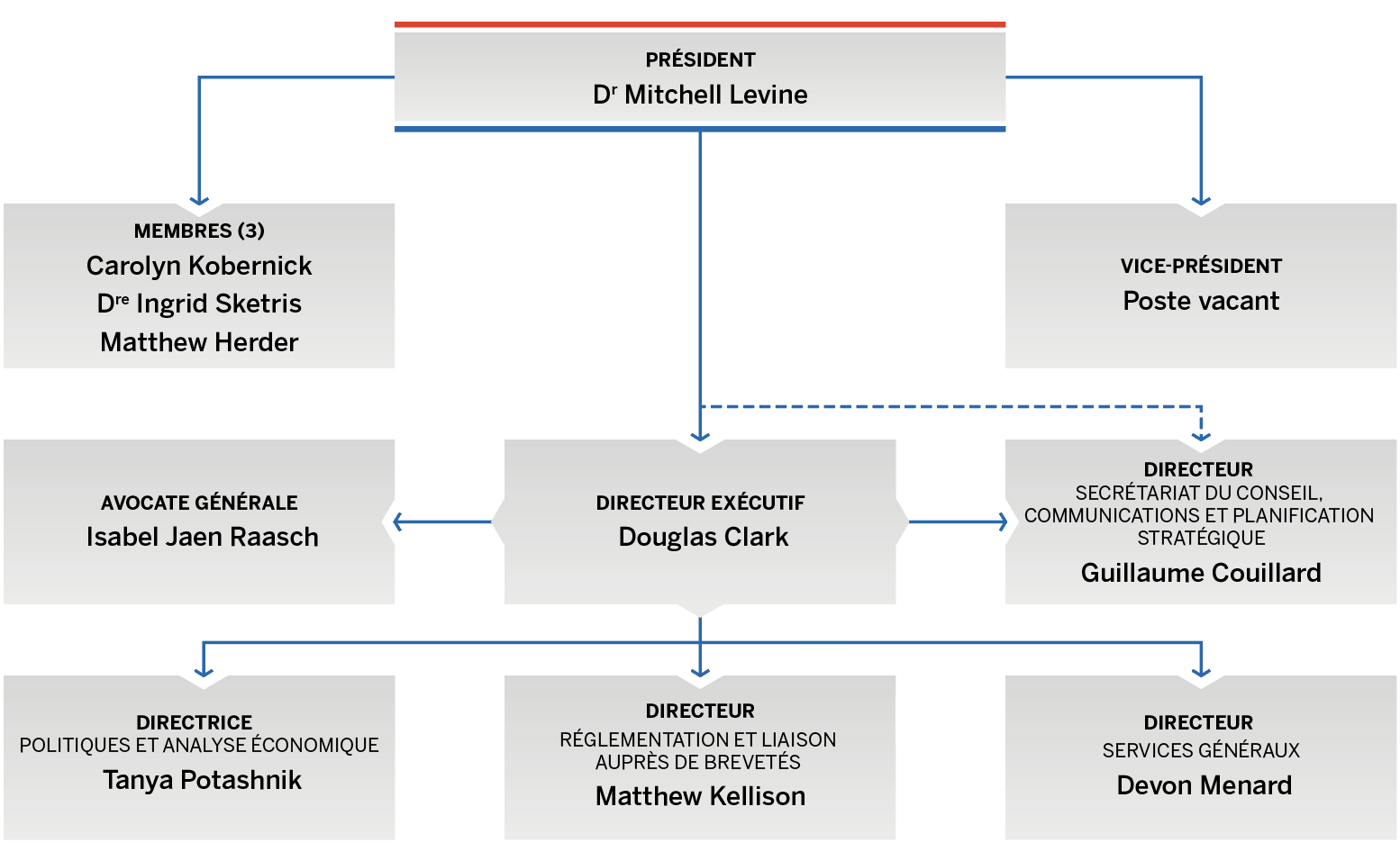
Description des figure
L’organigramme illustre la structure hiérarchique de haut niveau au sein du CEPMB, et nomme les membres actuels du Conseil et de la haute direction. Conseil : Président — Dr Mitchell Levine; Vice-président — Poste vacant; Membres — Carolyn Kobernick, Ingrid Sketris, Matthew Herder. Haute direction : Directeur exécutif — Douglas Clark; Avocate générale — Isabel Jaen Raasch; Directeur, Secrétariat du Conseil, communications et planification stratégique — Guillaume Couillard; Directrice, Politiques et analyse économique — Tanya Potashnik; Directeur, Réglementation et liaison auprès des brevetés — Matthew Kellison; Directeur, Services généraux — Devon Menard.
Directeur exécutif
Le directeur exécutif avise le Conseil, supervise le travail du personnel et en assume le leadership.
Réglementation et liaison auprès des brevetés
La Direction de la réglementation et de la liaison auprès des brevetés fait l’examen des prix des médicaments brevetés vendus au Canada pour s’assurer qu’ils ne sont pas excessifs, s’assure que les brevetés respectent leurs obligations en matière de présentation de rapports, encourage les brevetés à se conformer volontairement aux Lignes directrices du CEPMB, veille à la bonne application des politiques de conformité et fait enquête sur les plaintes reçues concernant les prix de certains médicaments brevetés.
Politiques et analyse économique
La Direction des politiques et de l’analyse économique formule des avis politiques et stratégiques, dirige des consultations auprès des intervenants et présente des recommandations concernant des modifications possibles aux Lignes directrices du CEPMB, effectue des recherches et des analyses sur les prix des médicaments, les évolutions sur le marché pharmaceutique et les tendances en matière de R-D et publie des études visant à fournir aux gouvernements fédéral, provinciaux et territoriaux et à d’autres intervenants de l’information crédible, impartiale et centralisée à l’appui de politiques fondées sur des données probantes.
Services généraux
La Direction des services généraux offre des conseils et des services en matière de gestion des ressources humaines, des installations, de l’approvisionnement, de la santé et sécurité au travail, de la technologie et de la gestion de l’information. Elle s’occupe également de la planification financière de même que des rapports, de la comptabilité, des vérifications, de l’évaluation et de la liaison auprès des agences centrales fédérales relativement à ces questions.
Secrétariat du Conseil, communications et planification stratégique
La Direction du Secrétariat du Conseil, communications et planification stratégique planifie et orchestre le programme des communications du CEPMB, les relations avec les médias et les demandes de renseignements du public. Elle gère les réunions et les audiences du Conseil, y compris les comptes rendus officiels des délibérations. Elle coordonne les activités du Conseil relatives à l’application de la Loi sur l’accès à l’information et de la Loi sur la protection des renseignements personnels. Elle est également responsable du processus de planification stratégique et de production de rapports.
Avocate générale
L’avocate générale fournit des opinions juridiques au CEPMB et dirige l’équipe des services juridiques qui représente les membres du personnel du Conseil au cours des audiences devant le Conseil.
Budget
En 2018-2019, le CEPMB disposait d’un budget de 14 872 millions de dollars et d’un effectif approuvé de 72 équivalents temps plein (ETP).
| 2017-2018 | 2018-2019 | 2019-2020 | |
|---|---|---|---|
| Budget* | 10 866 321 | 14 871 872 | 16 612 511 |
| Salaires et avantages sociaux | 6 896 051 | 8 373 171 | 9 636 550 |
| Opérations | 1 532 270 | 3 079 220 | 2 699 395 |
| Affectation à but spécial** | 2 438 000 | 3 419 481 | 4 276 566 |
| Équivalents temps plein (ETP) | 66 | 72 | 82 |
* Les montants du budget sont fondés sur le Budget principal des dépenses
** L’affectation à but spécial est réservée aux coûts externes liés à la tenue d’audiences publiques (conseillers juridiques, témoins experts, etc.). Les fonds non dépensés sont retournés au Trésor.
Réglementation des prix des médicaments brevetés : une vigilance continue nécessaire
Les avancées médicales ont permis d’offrir sur le marché canadien de nombreux nouveaux médicaments novateurs afin d’améliorer les traitements existants et de traiter des conditions pour lesquelles il n’existait auparavant aucun traitement pharmaceutique. Cependant, bon nombre de ces nouveaux médicaments coûtent très cher. Depuis 1987, les coûts des produits pharmaceutiques au Canada ont augmenté à un taux annuel moyen de 7,2 %Note de bas de page 1, dépassant tous les autres coûts des soins de santé et augmentant bien plus que trois fois le rythme de l’inflation. À 15,7 % des dépenses totales en soins de santé, les produits pharmaceutiques se classent maintenant au-dessus des dépenses consacrées aux médecinsNote de bas de page 2 Environ un Canadien sur cinq déclare ne pas avoir de couverture pour les médicaments sur ordonnance et beaucoup d’autres sont sous-assurés ou font face à des franchises ou à des quotes-parts élevées. Presque un Canadien sur dix a dû renoncer à se procurer un médicament sur ordonnance au cours de la dernière année pour des raisons liées au coûtNote de bas de page 3
Le CEPMB protège les intérêts des consommateurs canadiens en s’assurant que les médicaments brevetés ne sont pas vendus au Canada à des prix excessifs. Il le fait en examinant les prix auxquels les brevetés vendent chaque médicament breveté et en veillant à ce que les brevetés réduisent leurs prix et remboursent leurs recettes excédentaires, le cas échéant.
Exigences en matière de rapport
Les brevetés sont tenus par la loi de produire des renseignements sur la vente de leurs médicaments au Canada. La Loi et le Règlement sur les médicaments brevetés (le Règlement) établissent les renseignements requis et le personnel du Conseil examine de façon continue les renseignements sur les prix jusqu’à échéance de tous les brevets pertinents.
Il existe divers facteurs servant à déterminer si le prix d’un médicament est excessif, comme l’énonce l’article 85 de la Loi.
Le Compendium des politiques, des Lignes directrices et des procédures (les Lignes directrices) fournit des 10 CONSEIL D’EXAMEN DU PRIX DES MÉDICAMENTS BREVETÉS renseignements sur les tests appliqués aux prix par le personnel du Conseil lors de l’examen des prix des médicaments brevetés. Les Lignes directrices ne sont pas contraignantes et ont été élaborées en collaboration avec les intervenants, dont les ministres de la Santé provinciaux et territoriaux, les associations de consommateurs et l’industrie pharmaceutique. Lorsque, à l’issue d’une enquête, on juge que le prix d’un médicament breveté semble excessif, on offre au breveté la possibilité de réduire volontairement son prix ou de rembourser ses recettes excédentaires aux termes des modalités d’un engagement de conformité volontaire (ECV). Si le breveté ne souscrit pas aux résultats de l’enquête et choisit de ne pas présenter un tel engagement, le président peut émettre un avis d’audience. Après l’audition de la preuve, si le Conseil conclut que le prix est excessif, il peut rendre une ordonnance obligeant le breveté à réduire le prix de son produit ou à rembourser les recettes excédentaires. Des copies de la Loi, du Règlement, des Lignes directrices et du Guide du breveté sont disponibles sur le site Web du CEPMB.
Défaut de présenter ses rapports
Le CEPMB compte sur la ponctualité des brevetés en ce qui a trait à la présentation de leurs rapports sur tous les médicaments brevetés qu’ils vendent au Canada auxquels un brevet s’applique. En 2018, 5 médicaments ont été déclarés au CEPMB pour la première fois, même s’ils étaient brevetés et vendus avant 2018. (Voir le tableau 2, Défaut de présenter ses rapports sur les ventes de médicaments brevetés)
Défaut de soumettre les données sur les prix et sur les ventes (Formulaire 2)
Le défaut de soumettre ses rapports fait référence au défaut partiel ou complet d’un breveté de soumettre les rapports requis au CEPMB en vertu de la Loi et du Règlement. Le Conseil n’a pas été appelé à rendre des ordonnances pour défaut de présenter ses rapports en 2018.
| Breveté | Nom de marque | Ingrédient médicinal | Année où le médicament a été déclaré au CEPMB comme relevant de la compétence du CEPMB |
Année où le médicament a été déclaré au CEPMB en vertu d’un brevet subséquent |
|---|---|---|---|---|
| Alkermes Inc. | Vivitrol | naltrexone | 2016 | blank |
| Avir Pharma Inc. | Cresemba | isavuconazole | 2016 | blank |
| Shire Pharma Canada Inc. | Xiidra | lifitegrast | 2018 | blank |
| Cipher Pharmaceuticals Inc. | Xydalba | Dalbavancin | 2018 | blank |
| Taiho Oncology Inc. | Lonsurf (2 DINs) | Trifluridine/tipiracil | 2017 | blank |
Source : CEPMB
Examen scientifique
Groupe consultatif sur les médicaments pour usage humain
Tous les nouveaux médicaments brevetés sont soumis à une évaluation scientifique dans le cadre du processus d’examen du prix. Le CEPMB a créé le Groupe consultatif sur les médicaments pour usage humain (GCMUH) dans le but d’offrir une expertise et des conseils indépendants au personnel du Conseil. Le GCMUH entreprend un examen lorsqu’un breveté allègue que le nouveau médicament offre une amélioration thérapeutique. Les membres du GCMUH examinent et évaluent les renseignements scientifiques pertinents et disponibles, notamment toute preuve présentée par le breveté sur le niveau d’amélioration thérapeutique proposé, le choix de médicaments de comparaison et les posologies comparables.
Le GCMUH évalue l’avantage thérapeutique des nouveaux médicaments brevetés selon les définitions suivantes :
- Découverte : premier médicament de sa catégorie disponible sur le marché canadien qui traite avec efficacité une maladie ou une condition particulière.
- Amélioration importante : médicament qui offre des bienfaits thérapeutiques largement plus importants à ceux des médicaments existants offerts sur le marché canadien.
- Amélioration modérée : médicament qui offre une amélioration modérée des bienfaits thérapeutiques par rapport à ceux des médicaments existants offerts sur le marché canadien.
- Amélioration minime ou nulle : médicament qui offre une amélioration minime ou nulle des bienfaits thérapeutiques par rapport à ceux des médicaments existants offerts sur le marché canadien.
* Évaluation en date du 31 mars 2019
Source : CEPMB
Description de la figure
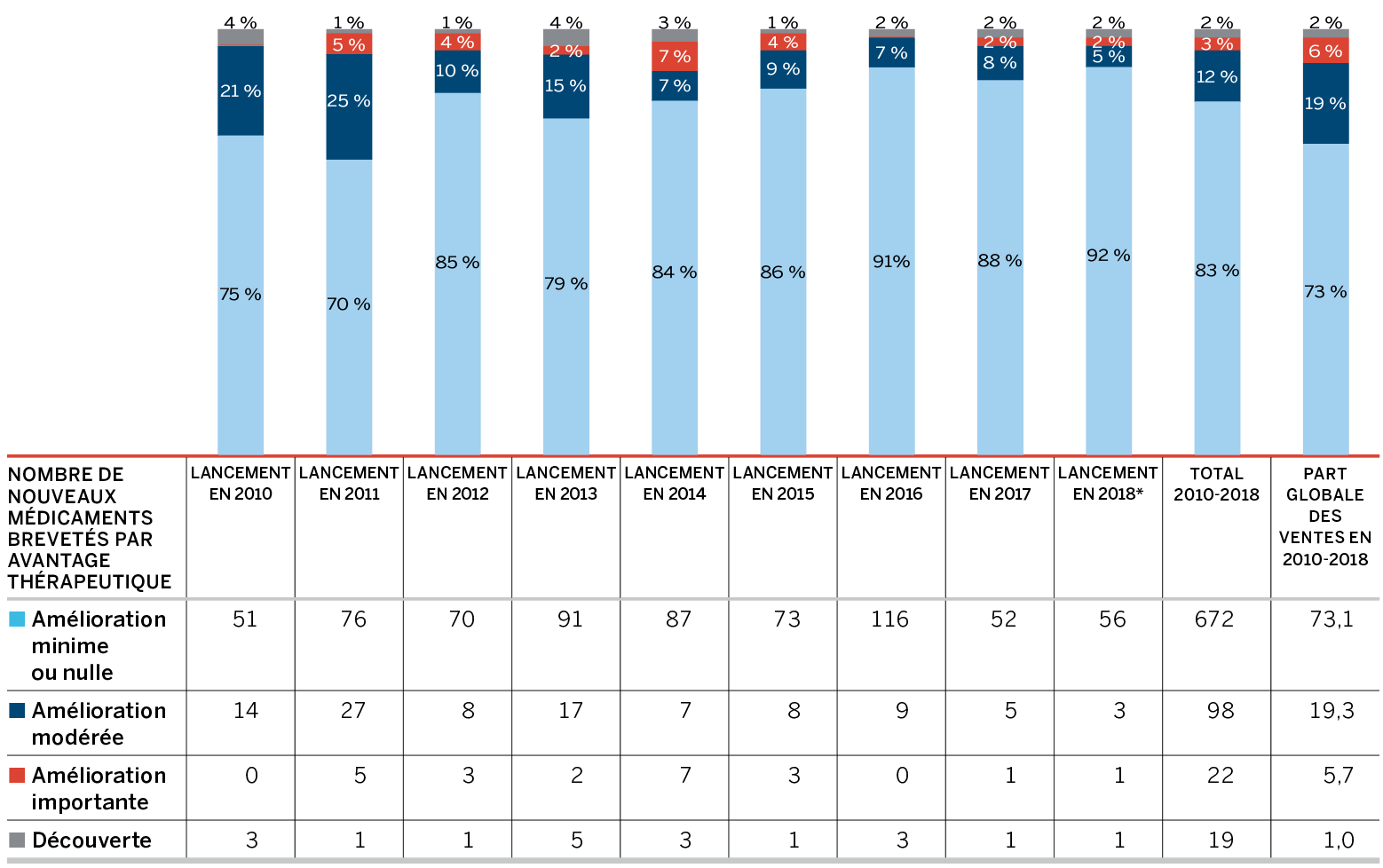
Ce diagramme à barres montre la ventilation en pourcentage des nouveaux médicaments brevetés par niveau d’amélioration thérapeutique par rapport aux médicaments existants selon l’année de lancement pour la période de 2010 à 2018. En 2010, 75 % des nouveaux médicaments brevetés ont procuré une amélioration minime ou nulle, 21 % ont procuré une amélioration modeste, aucun n’a procuré d’amélioration importante et 4 % comptaient parmi les découvertes; en 2011, 70 % des nouveaux médicaments brevetés ont procuré une amélioration minime ou nulle, 25 % ont procuré une amélioration modeste, 5 % ont procuré une amélioration importante et 1 % comptaient parmi les découvertes; en 2012, 85 % des nouveaux médicaments brevetés ont procuré une amélioration minime ou nulle, 10 % ont procuré une amélioration modeste, 4 % ont procuré une amélioration importante et 1 % comptaient parmi les découvertes; en 2013, 79 % des nouveaux produits médicamenteux brevetés ont procuré une amélioration minime ou nulle, 15 % ont procuré une amélioration modeste, 2 % ont procuré une amélioration importante et 4 % comptaient parmi les découvertes; en 2014, 84 % des nouveaux médicaments brevetés ont procuré une amélioration minime ou nulle, 7 % ont procuré une amélioration modeste, 7 % ont procuré une amélioration importante et 3 % comptaient parmi les découvertes; en 2015, 86 % des nouveaux médicaments brevetés ont procuré une amélioration minime ou nulle, 9 % ont procuré une amélioration modeste, 4 % ont procuré une amélioration importante et 1 % comptaient parmi les découvertes; en 2016, 91 % des nouveaux médicaments brevetés ont procuré une amélioration minime ou nulle, 7 % ont procuré une amélioration modeste, aucun pourcentage n’a procuré d’amélioration importante et 2 % comptaient parmi les découvertes; en 2017, 88 % des nouveaux produits médicamenteux brevetés ont procuré une amélioration minime ou nulle, 8 % ont procuré une amélioration modeste, 2 % ont procuré une amélioration importante et 2 % comptaient parmi les découvertes; en 2018, 92 % des nouveaux produits médicamenteux brevetés ont procuré une amélioration minime ou nulle, 5 % ont procuré une amélioration modeste, 2 % ont procuré une amélioration importante et 2 % comptaient parmi les découvertes. La bande « Total 2010-2018 » représente la ventilation de l’avantage thérapeutique pour l’ensemble des nouveaux médicaments brevetés lancés entre 2010 et 2018. Entre 2010 et 2018 : 83 % des nouveaux médicaments brevetés apportaient une amélioration minime ou nulle, 12 % apportaient une amélioration modeste; 3 % apportaient une amélioration importante; 2 % étaient des découvertes. La bande « Part globale des ventes en 2010-2018 » donne la ventilation des parts des recettes tirées des ventes selon l’avantage thérapeutique : 73 % des ventes étaient représentées par des médicaments apportant une amélioration minime ou nulle; 19 %, des médicaments apportant une amélioration modeste; 6 %, des médicaments apportant une amélioration importante; 2 %, des découvertes.
La figure 1 présente la ventilation des nouveaux médicaments brevetés au cours de l’année de lancement par avantage thérapeutique pour la période de 2010 à 2018. La grande majorité (82,9 %) des médicaments brevetés lancés depuis 2010 ont été classés « Amélioration minime ou nulle » au chapitre des avantages thérapeutiques par rapport aux traitements existantsNote de bas de page 4.
La bande « Total 2010-2018 » représente la ventilation de l’avantage thérapeutique pour l’ensemble des nouveaux médicaments brevetés lancés entre 2010 et 2018. La bande « Part globale des ventes 2010-2018 » donne la part des recettes tirées des ventes selon l’avantage thérapeutique pour l’ensemble des nouveaux médicaments brevetés lancés entre 2010 et 2018.
Notre devise

Protéger, habiliter, s’adapter.
Examen du prix
Le CEPMB examine le prix moyen de chaque concentration de chaque forme posologique d’un médicament breveté. Dans la plupart des cas, cette unité est conforme aux numéros d’identification du médicament (DIN) attribués par Santé Canada au moment où la vente au Canada du médicament est approuvée.
Nouveaux médicaments brevetés déclarés au CEPMB en 2018
Aux fins du présent rapport, tout médicament breveté lancé ou vendu sur le marché canadien avant l’attribution de son premier brevet entre le 1er décembre 2017 et le 30 novembre 2018 est réputé avoir été breveté en 2018.
Il y a eu 108 nouveaux médicaments brevetés pour usage humain déclarés comme vendus en 2018. Certains constituent une ou plusieurs concentrations d’une nouvelle substance active et d’autres sont de nouvelles présentations de médicaments existants. Douze (11,1 %) des 108 nouveaux médicaments brevetés ont été commercialisés au Canada avant d’avoir obtenu le brevet canadien qui l’a assujetti à la compétence du CEPMB. Le tableau 3 indique l’année de la première commercialisation de ces médicaments.
| Année de la première vente | Nombre de médicaments |
|---|---|
| 2014 | 2 |
| 2015 | 2 |
| 2016 | 7 |
| 2017 | 1 |
| 2018 | 96 |
| Total | 108 |
Source : CEPMB
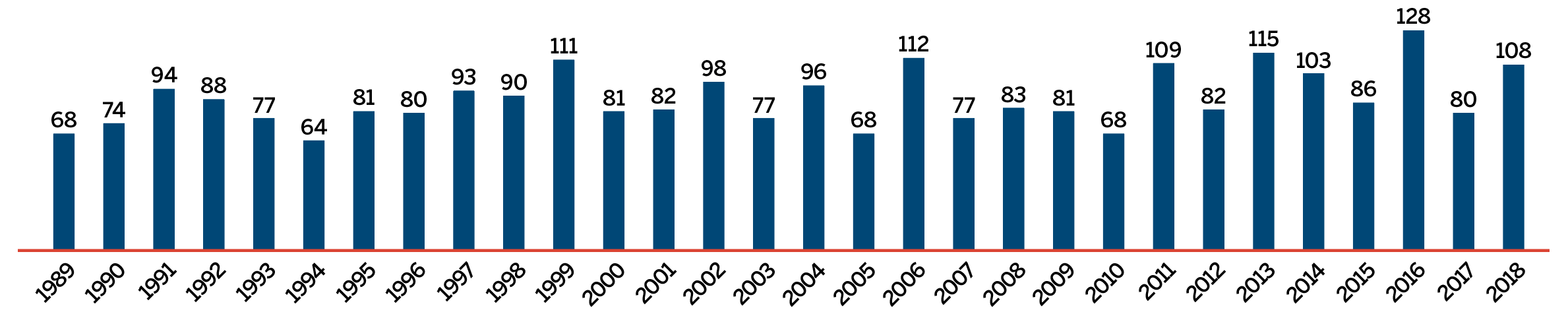
La liste des nouveaux médicaments brevetés déclarés au CEPMB est affichée sur le site Web du CEPMB sous la rubrique « Réglementation des prix ». Cette liste présente de l’information sur le statut de l’examen (c.-à-d. la question de savoir si le médicament est sous examen, conforme aux Lignes directrices, sous enquête ou assujetti à un engagement de conformité volontaire ou à un avis d’audience). La figure 2 illustre le nombre de nouveaux médicaments brevetés pour usage humain déclarés au CEPMB de 1989 à 2018.
Source : CEPMB
Description de la figure
Il s’agit d’un diagramme à barres présentant le nombre de nouveaux médicaments brevetés à usage humain déclarés au CEPMB selon l’année. En 1989, 68 médicaments brevetés à usage humain ont été déclarés au CEPMB. En 1989, 68 médicaments brevetés à usage humain ont été déclarés au CEPMB.
En 1990 : 74; 1991 : 94; 1992 : 88; 1993 : 77; 1994 : 64; 1995 : 81; 1996 : 80; 1997 : 93; 1998 : 90; 1999 : 111; 2000 : 81; 2001 : 82; 2002 : 98; 2003 : 77; 2004 : 96; 2005 : 68; 2006 : 112; 2007 : 77; 2008 : 83; 2009 : 81; 2010 : 68; 2011 : 109; 2012 : 82; 2013 : 115; 2014 : 103; 2015 : 86; 2016 : 128; 2017 : 80; 2018 : 108.
Des 108 nouveaux médicaments brevetés, les prix de 61 d’entre eux avaient été soumis à un examen en date du 31 mars 2019 :
- les prix de 39 médicaments brevetés ont été jugés conformes aux seuils établis dans les Lignes directrices;
- les prix de 6 médicaments brevetés semblaient dépasser les seuils établis dans les Lignes directrices d’un montant ne justifiant pas d’enquête;
- les prix de 16 médicaments brevetés semblaient dépasser les seuils établis dans les Lignes directrices; ainsi, des enquêtes ont été lancées.
- 8 des 16 enquêtes ont été résolues par des engagements de conformité volontaire.
Pour la liste complète des 108 nouveaux médicaments brevetés et du statut de l’examen des prix, veuillez consulter l’annexe 2.
Examen des prix des médicaments brevetés existants pour usage humain en 2018
Aux fins du présent rapport, l’expression « médicaments brevetés existants » désigne tous les médicaments brevetés vendus sur le marché canadien et déclarés au CEPMB avant le 1er décembre 2017.
Au moment de la rédaction du présent rapport, il y avait 1 295 médicaments brevetés existants :
- les prix de 929 médicaments brevetés étaient conformes aux seuils établis dans les Lignes directrices;
- les prix de 226 médicaments brevetés semblaient dépasser les seuils établis dans les Lignes directrices d’un montant ne justifiant pas d’enquête;
- les prix de 120 médicaments brevetés faisaient l’objet d’une enquête;
- les prix de 4 médicaments étaient sous examen;
- les prix de 13 médicaments ont fait l’objet d’un engagement de conformité volontaire;
- les prix de 2 médicaments font l’objet d’une audience;
- le prix d’un médicament est assujetti à une ordonnance de baisse de prix et de remboursement des recettes excédentaires au moyen d’un paiement (actuellement partiellement suspendue).
Table 4 provides a summary of the status of the price review of the new and existing patented medicines for human use in 2018.
| Nouveaux médicaments lancés sur le marché en 2018 | Médicaments existants | Total | |
|---|---|---|---|
| Total | 108 | 1 295 | 1 403 |
| Conformes aux seuils des Lignes directrices | 39 | 929 | 968 |
| Sous examens | 47 | 4 | 51 |
| Ne justifie pas une enquête | 6 | 226 | 232 |
| Sous enquête | 8 | 120 | 128 |
| Assujettis à un engagement de conformité volontaire | 8 | 13 | 211 |
| Audience sur le prix | 0 | 2 | 2 |
| Assujetti à une ordonnance de baisse de prix (suspendue) | 0 | 1 | 1 |
1Les modalités des engagements de conformité volontaire des années précédentes reportées en 2018 ne sont pas comprises dans ce nombre.
Source : CEPMB
Mise à jour du rapport annuel 2017
- À une exception près, l’examen de l’ensemble des médicaments pour usage humain déclarés comme étant « sous examen » dans le rapport annuel de 2017 est terminé.
- Des 122 enquêtes mentionnées dans le rapport annuel de 2017, 98 d’entre elles se sont soldées par les résultats suivants :
- la fermeture de l’enquête lorsqu’il apparaît que le prix est conforme aux seuils établis dans les Lignes directrices;
- un engagement de conformité volontaire par lequel le breveté s’engage à réduire le prix de son médicament et à rembourser les recettes excédentaires au moyen d’un paiement ou d’une réduction du prix d’un autre médicament breveté (voir la section Engagements de conformité volontaire);
- une audience publique dont l’objet est de déterminer si le prix du médicament est ou non excessif, y compris une ordonnance corrective rendue par le Conseil (voir la section Audiences).
Médicaments brevetés en vente libre, médicaments génériques brevetés et médicaments brevetés pour usage vétérinaire
Le personnel du Conseil procède à l’examen des prix des médicaments brevetés en vente libre, des médicaments génériques brevetés et des médicaments brevetés pour usage vétérinaire seulement à la suite de la réception d’une plainte. Aucune plainte n’a été reçue en 2018.
Engagements de conformité volontaire et audiences
Engagements de conformité volontaire
L’engagement de conformité volontaire est un engagement écrit par lequel le breveté s’engage à ajuster son prix afin de respecter les Lignes directrices du Conseil. Les Lignes directrices établissent les procédures que les brevetés doivent suivre pour soumettre un engagement de conformité volontaire lorsque le personnel du Conseil détermine, à la suite d’une enquête, que le prix d’un médicament breveté vendu au Canada semble dépasser les seuils établis dans les Lignes directrices. Un engagement de conformité volontaire représente la promesse d’un breveté envers la résolution satisfaisante d’une enquête lancée par le personnel, conformément aux Lignes directrices. L’engagement de conformité volontaire tient compte des faits précis et du contexte d’un cas particulier. Les engagements de conformité volontaire n’ont donc pas de valeur de précédent.
En 2018, sept engagements de conformité volontaire ont été finalisés. En plus de la réduction du prix de certains médicaments, des recettes excédentaires totalisant 315 070,73 $ ont été remboursées au moyen de paiements au gouvernement du Canada.
En 2019, au 31 mai 2019, le président a approuvé l’examen de cinq autres engagements de conformité volontaire totalisant 2,2 millions de dollars, portant le total des paiements au gouvernement du Canada en 2018 au 31 mai 2019 à 2,5 millions de dollars.
| Nom de marque du médicament breveté | Usage thérapeutique | Breveté | Date d’approbation | Remboursement des recettes excédentaires | |
|---|---|---|---|---|---|
| Réduction de prix | Paiement au gouvernement | ||||
| Engagements de conformité volontaire en 2018 | |||||
| Solution ophtalmique travoprost et timolol (vendu sous le nom commercial DuoTrav®PQ) (1 DIN) | Réduction de la pression intraoculaire élevée (PIO) chez les patients présentant un glaucome à angle ouvert ou une hypertension oculaire, qui ne répondent pas suffisamment aux bêtabloquants, aux prostaglandines ou à d’autres agents abaissant la PIO et quand le recours à DuoTrav® PQ (association fixe) est considéré approprié. | Novartis Pharmaceuticals Canada Inc. | Janvier | ✓ | 275 000,00 $ |
| Méthotrexate (vendu sous le nom commercial Metoject® sous-cutané) (4 DIN) | Un antirhumatismal modificateur de la maladie (« ARMM ») pour les maladies suivantes, lorsque les interventions thérapeutiques standards échouent :
|
Medexus Inc. | Janvier | ✓ | |
| Gel de brimonidine (vendu sous le nom commercial Onreltea) (1 DIN) | Traitement topique de l’érythème facial associé à la rosacée chez les adultes de 18 ans et plus. | Galderma Canada Inc. | Février | ✓ | |
| Panitumumab (vendu sous le nom commercial Vectibix) (1 DIN) | Traitement de patients préalablement non traités ayant un carcinome colorectal métastatique RAS non muté (type sauvage) en combinaison avec FOLFOX (5-fluoro-uracile infusionnel, leucovorine et oxaliplatine). Aussi, sous forme de monothérapie pour le traitement de patients atteints de cancer colorectal métastatique TAS non muté (type sauvage) après l’échec des protocoles de chimiothérapie comprenant de la fluoropyrimidine, de l’oxaliplatine et de l’irinotécan. | Amgen Canada Inc. | Février | ✓ | |
| Évolocumab (vendu sous le nom commercial Repatha) (1 DIN) | Traitement d’appoint au régime alimentaire et à la dose maximale tolérée d’une statine chez les patients adultes atteints d’hypercholestérolémie familiale (HF) hétérozygote ou de maladie cardiovasculaire athéroscléreuse cliniquement manifeste qui ont besoin d’une réduction supplémentaire de leur taux de cholestérol des lipoprotéines de faible densité (C-LDL). | Amgen Canada Inc. | Mai | ✓ | 40 070,73 $ |
| Lévofloxacin (vendu sous le nom commercial Quinsair) (1 DIN) | Traitement de la fibrose kystique (FK) chez des patients âgés de 18 ans et plus atteints d’infections pulmonaires chroniques à Pseudomonas aeruginosa (P. aeruginosa). | HZNP Canada Limited | Juin | ✓ | |
| Olaparib (vendu sous le nom commercial Lynparza) (3 DIN) | Monothérapie pour le traitement d’entretien de patientes adultes atteintes d’un cancer épithélial séreux de haut grade de l’ovaire ou de la trompe de Fallope ou d’un cancer péritonéal primitif porteur de mutations (germinales ou somatiques) d’un gène BRCA, sensible au platine et récidivant qui ont répondu (réponse complète ou partielle) à une chimiothérapie à base de platine. Traitement du cancer du sein métastatique HER2 négatif (absence de récepteurs 2 du facteur de croissance épidermique) avec mutation germinale délétère ou présumée délétère d’un gène BRCA (mgBRCA) chez les patientes adultes ayant déjà reçu une chimiothérapie comme traitement néoadjuvant ou adjuvant ou comme traitement de la maladie métastatique. |
AstraZeneca Canada Inc. | Novembre | ✓ | |
| Total en date du 31 décembre 2018 | 315 070,73 $ | ||||
| Triptoréline (vendu sous le nom commercial Trelstar) (1 DIN) | Traitement palliatif du cancer de la prostate hormono dépendant à un stade avancé (stade D2). | Paladin Labs Inc. | Janvier 2019 | ✓ | 157 159,70 $ |
| Belimumab (vendu sous le nom commercial Benlysta) (2 DIN) | Traitement d’appoint au traitement standard pour réduire l’activité pathologique chez les patients adultes atteints de lupus érythémateux disséminé (LED) évolutif avec expression d’anticorps. | GlaxoSmithKline Inc. | Mars 2019 | ✓ | |
| Dupilumab (vendu sous le nom commercial Dupixent) (1 DIN) | Traitement des patients adultes atteints de dermatite atopique modérée à sévère chez qui la maladie n’est pas adéquatement contrôlée par des traitements topiques sous ordonnance ou quand ces traitements ne sont pas appropriés. | Sanofi-aventis Canada Inc. | Avril 2019 | ✓ | 1 654 520,73 $ |
| Alirocumab (vendu sous le nom commercial Praluent) (4 DIN) | Traitement d’appoint au régime alimentaire et aux statines à la dose maximale tolérée chez les adultes atteints d’hypercholestérolémie familiale hétérozygote ou de maladie cardiovasculaire athéroscléroseuse cliniquement manifeste qui ont besoin d’abaisser davantage leur taux de cholestérol associé aux lipoprotéines de faible densité (C-LDL). | Sanofi-aventis Canada Inc. | Avril 2019 | ✕ | 426 955,62 $ |
| Darunavir/cobicistat/emtricitabine/ténofovir alafénamide (vendu sous le nom commercial Symtuza (1 DIN) | Agent antirétroviral indiqué comme schéma complet dans le traitement de l’infection au virus de l’immunodéficience humaine de type 1 chez des adultes et des adolescents (âgés de 12 ans ou plus, pesant au moins 40 kg) qui ne présentent pas de mutations connues associées à une résistance à l’un des composants de Symtuza. | Janssen Inc. | Avril 2019 | ✕ | 4 590,73 $ |
| Total en date du 31 mai 2019 | 2 558 297,51 $ | ||||
Audiences
Le CEPMB tient des audiences dans deux types d’instances :
- prix excessifs;
- défaut de soumettre ses rapports — questions relatives à la compétence du Conseil.
Prix excessifs
Si le prix d’un médicament breveté semble excessif, le président peut tenir une audience publique. Si le panel d’audience détermine que le prix du médicament est excessif, il peut rendre une ordonnance visant à réduire le prix du médicament breveté en question (ou d’un autre médicament breveté du breveté) ou à rembourser les recettes excédentaires obtenues en raison d’un prix excessif. On peut demander une révision judiciaire des décisions du Conseil devant la Cour fédérale du Canada.
En janvier 2019, le CEPMB a annoncé qu’il entamerait une audience publique dans l’affaire du prix du médicament breveté bitartrate de cystéamine vendu sous l’appellation commerciale Procysbi par Horizon Therapeutics Canada. Le but de cette audience est de déterminer si le médicament a été ou est vendu sur le marché canadien à un prix qui, de l’avis du Conseil, est ou était excessif et, le cas échéant, de déterminer l’ordonnance qui doit être délivrée, s’il le faut, pour corriger le prix excessif. L’affaire suit son cours.
Défaut de soumettre ses rapports – questions relatives à la compétence du Conseil
Si le personnel du Conseil estime qu’un breveté a omis ou a refusé de fournir au CEPMB les renseignements sur les prix et les ventes exigés par la loi, il recommande au président de convoquer une audience publique pour déterminer si le breveté a bel et bien enfreint les exigences en matière de présentation de renseignements prévues par la Loi et le Règlement. Si le panel d’audience conclut, à la suite d’une audience publique, que le breveté n’a pas respecté les exigences en matière production de rapports, il peut ordonner au breveté de fournir les renseignements requis sur les prix et les ventes.
Il n’y a eu aucune audience sur le défaut de présenter ses rapports en date du 31 mars 2019.
Sommaire
En 2018 et jusqu’au 31 mai 2019, des recettes excédentaires totalisant 6 803 627,11 $ ont été remboursées au moyen de paiements versés au gouvernement du Canada en vertu d’engagements de conformité volontaire et d’ordonnances du Conseil.
Depuis 1993, 145 engagements de conformité volontaire ont été approuvés et 30 audiences publiques ont été entamées. Ces mesures ont donné lieu à des réductions de prix et au remboursement des recettes excessives au moyen de réductions supplémentaires de prix ou de paiements versés au gouvernement du Canada. Plus de 209 millions de dollars ont été recueillis en vertu d’engagements de conformité volontaire, de règlements négociés et d’ordonnances du Conseil par l’entremise de paiements versés au gouvernement du Canada ou aux clients, dont les hôpitaux et les cliniques médicales.
Affaires devant la Cour fédérale, la Cour d’appel fédérale et la Cour suprême du Canada
Le 20 octobre 2017, Alexion Pharmaceuticals Inc. a déposé une demande de révision judiciaire de la décision du Conseil datée du 20 septembre 2017 selon laquelle le médicament breveté éculizumab vendu sous l’appellation commerciale Soliris était vendu à un prix excessif au Canada et par laquelle le Conseil a ordonné à Alexion d’en baisser le prix (actuellement suspendue) et de rembourser les recettes excédentaires au moyen d’un paiement de 4 245 329,60 $. La décision du Conseil a été jugée raisonnable par la Cour fédérale dans une décision datée du 23 mai 2019. Alexion a déposé un appel de la décision de la Cour fédérale devant la Cour d’appel fédérale.
Le 18 janvier 2017, Galderma Canada Inc. a déposé une demande de révision judiciaire de la décision du Conseil datée du 19 décembre 2016 selon laquelle le brevet canadien no 2 478 237 a trait au médicament breveté éculizumab vendu sous l’appellation commerciale Differin et par laquelle le Conseil ordonne à Galderma de déposer les renseignements exigés pour la période allant du 1er janvier 2010 au 14 mars 2016. La Cour fédérale a accueilli la demande de révision judiciaire de Galderma le 9 novembre 2017 et a annulé la décision du Conseil. Le 21 novembre 2017, le procureur général a interjeté appel de l’acceptation de la demande de révision judiciaire par la Cour fédérale. Le 28 juin 2019, la Cour d’appel fédérale a accueilli l’appel et a rendu sa décision renvoyant l’affaire au Conseil pour qu’elle fasse l’objet d’un réexamen. La décision du Conseil concernant le réexamen est en instance.
Il n’y a aucune affaire devant la Cour suprême du Canada.
| Médicament | Indication/utilisation | Breveté | Date de l’avis d’audience | Statut |
|---|---|---|---|---|
| Eculizumab (vendu sous le nom commercial Soliris) | Hémoglobinurie paroxystique nocturne Syndrome hémolytique et urémique atypique |
Alexion Pharmaceuticals Inc. | 20 janvier 2015 | Ordonnance du Conseil : 27 septembre 2017 A conclu que le prix de Soliris était et demeure excessif aux termes des articles 83 et 85 de la Loi Remboursement des recettes excédentaires : 4 245 329,60 $ |
| Bitartrate de cystéamine (vendu sous le nom commercial Procysbi) | Nephropathic cystinosis | Horizon Thearpeutics Canada | 14 janvier 2019 | En cours |
| Médicament | Indication/utilisation | Breveté | Date de l’avis d’audience | Statut |
|---|---|---|---|---|
| Aucun |
| Médicament | Indication/utilisation | Breveté | Date de l’avis d’audience | Statut |
|---|---|---|---|---|
| Éculizumab (vendu sous le nom commercial Soliris) | Hémoglobinurie paroxystique nocturne Syndrome hémolytique et urémique atypique |
Alexion Pharmaceuticals Inc. | Allégations de prix excessifs | Avis d’appel (Cour d’appel fédérale) déposé le 21 juin 2019. Dossier de la Cour A-237-19, En suspens Avis de demande de contrôle judiciaire – 20 octobre 2017 Dossier de la Cour T-1596-17 (concernant la décision du panel du Conseil du 20 septembre 2017) : audience tenue les 15 et 16 novembre 2018 Décision rendue le 23 mai 2019. |
| Adapalene (vendu sous le nom commercial Differin et Differin XP) | Acné | Galderma Canada Inc. | Défaut de soumettre ses rapports (questions relatives à la compétence du Conseil) | Avis d’appel –21 novembre 2017 Dossier de la Cour A-385-17 : audience tenue le 17 janvier 2019. Décision rendue le 28 juin 2019. Affaire renvoyée pour ré-examen par le Conseil. Ré-examen – en attente de la décision. Dossier de la Cour T-83-17 concernant la décision du panel du Conseil du 19 décembre 2016) : décision rendue le 9 novembre 2017 annulant en partie la décision du panel du Conseil (porté en appel – voir ci-dessus) |
Principales tendances relatives aux produits pharmaceutiques : les médicaments plus coûteux continuent d’influer sur les ventes
De nombreux facteurs influent sur les dépenses totales en produits pharmaceutiques, notamment les prix, l’utilisation, l’arrivée sur le marché de nouveaux médicaments plus coûteux et la perte d’exclusivité du marché d’anciens médicaments brevetés. En 2018, le volume des ventes de médicaments brevetés a connu une augmentation appréciable; les ventes de médicaments plus coûteux ont également connu une hausse. Parallèlement, les ventes de certains médicaments essentiels les plus vendus ont cessé d’être déclarées au CEPMB, si bien que les dépenses totales en médicaments brevetés ont enregistré un léger recul de 0,6 %. Les prix courants au Canada des médicaments brevetés sont demeurés parmi les plus élevés de les pays de l’Organisation de coopération et de développement économiques (OCED) (au quatrième rang), loin derrière les É.-U., et légèrement inférieurs à l’Allemagne et la Suisse.
Le CEPMB fait rapport des tendances observées au chapitre des ventes de produits pharmaceutiques et des prix de tous les médicaments, ainsi que des dépenses de recherche-développement des brevetés.
En vertu du Règlement, les brevetés doivent faire rapport en détail de leurs ventes de médicaments brevetés, à savoir les quantités vendues, les prix bruts et nets et les recettes nettes. Le CEPMB utilise ces renseignements dans ses analyses des tendances au niveau des ventes, des prixNote de bas de page 5, et de l’utilisation faite des médicaments brevetésNote de bas de page 6. La présente section fournit les principales tendances ainsi que des analyses des marchés national, public et privé au Canada pour tous les médicaments. Il convient de noter que tout renvoi aux ventes à la présente section doit être interprété comme des recettes, à moins d’indication contraire.
16,7 Milliards de $ en ventes de médicaments brevetés en 2018
Les ventes de médicaments brevetés ont augmenté en moyenne de 4,9 % par an au cours des cinq dernières années.
Avis de non-responsabilité
- Bien que certaines statistiques déclarées à la section PRINCIPALES TENDANCES RELATIVES AUX PRODUITS PHARMACEUTIQUES se fondent, en partie, sur des données obtenues sous licence à partir de la base de données MIDAS® et de la base de données sur les régimes privés d’assurance-médicaments d’IQVIA, les déclarations, les conclusions, les opinions et les avis exprimés dans le présent Rapport annuel sont exclusivement ceux du CEPMB et ne peuvent être attribués à IQVIA.
- Afin de brosser un portrait plus juste des tendances relatives aux produits pharmaceutiques au Canada, des sommaires des résultats des analyses du SNIUMP ont été inclus sous forme d’« aperçus » à la section des tendances relatives aux produits pharmaceutiques au Canada du Rapport annuel. Diverses sources de données publiques et sous licence sont utilisées pour mener les études analytiques du SNIUMP. Bon nombre de ces sources ne distinguent pas les médicaments génériques brevetés des médicaments génériques non brevetés. Aussi, dans de tels cas, le terme « générique » englobe ces deux notions. Le SNIUMP est une initiative de recherche indépendante des activités réglementaires du CEPMB.
Tendances relatives aux ventes de médicaments brevetés
Les Canadiens dépensent beaucoup plus en médicaments brevetés aujourd’hui qu’il y a dix ans. Au cours des cinq dernières années, les ventes de médicaments brevetés ont augmenté en moyenne de 4,9 % par année, pour atteindre 16,7 milliards $ en 2018. La présente section se penche sur les facteurs les plus importants qui déterminent l’évolution des recettes tirées des ventes de 2017 à 2018 et les compare aux tendances des dernières années.
Tendances relatives aux recettes tirées de ventes
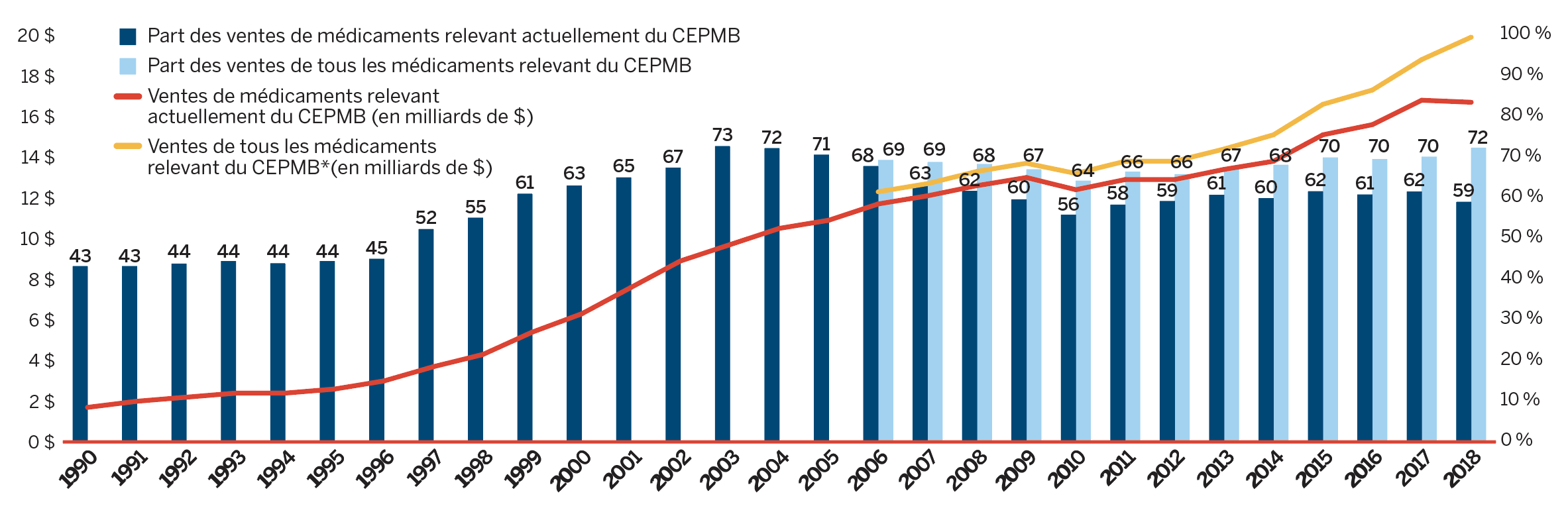
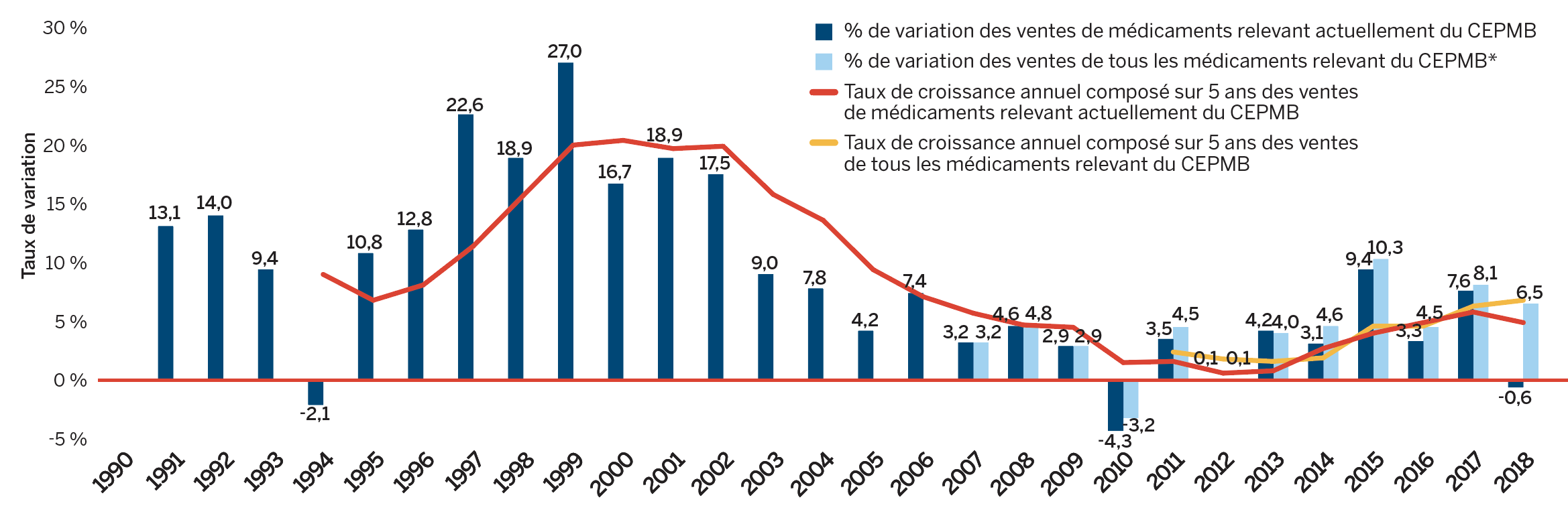
En 2018, les ventes de médicaments brevetés sont demeurées relativement inchangées, reculant très légèrement (0,6 %) par rapport à l’année précédente. La figure 3 fait état des tendances relatives aux ventes de médicaments brevetés pour les années 1990 à 2018. Bien que les ventes annuelles soient environ dix fois supérieures à ce qu’elles étaient en 1990, le taux de variation d’une année à l’autre au cours de cette période variait. Cette tendance est mise en évidence par le taux de croissance annuel composé sur cinq ans fourni à la figure 3 (b).
La figure 3 (a) exprime la valeur des ventes de médicaments brevetés en pourcentage des ventes totales de médicaments. Cette part, qui a culminé à 72,7 % en 2003, a diminué entre 2004 et 2010. Depuis, les médicaments brevetés comptent pour environ 60 % de toutes les ventes de médicaments au Canada.
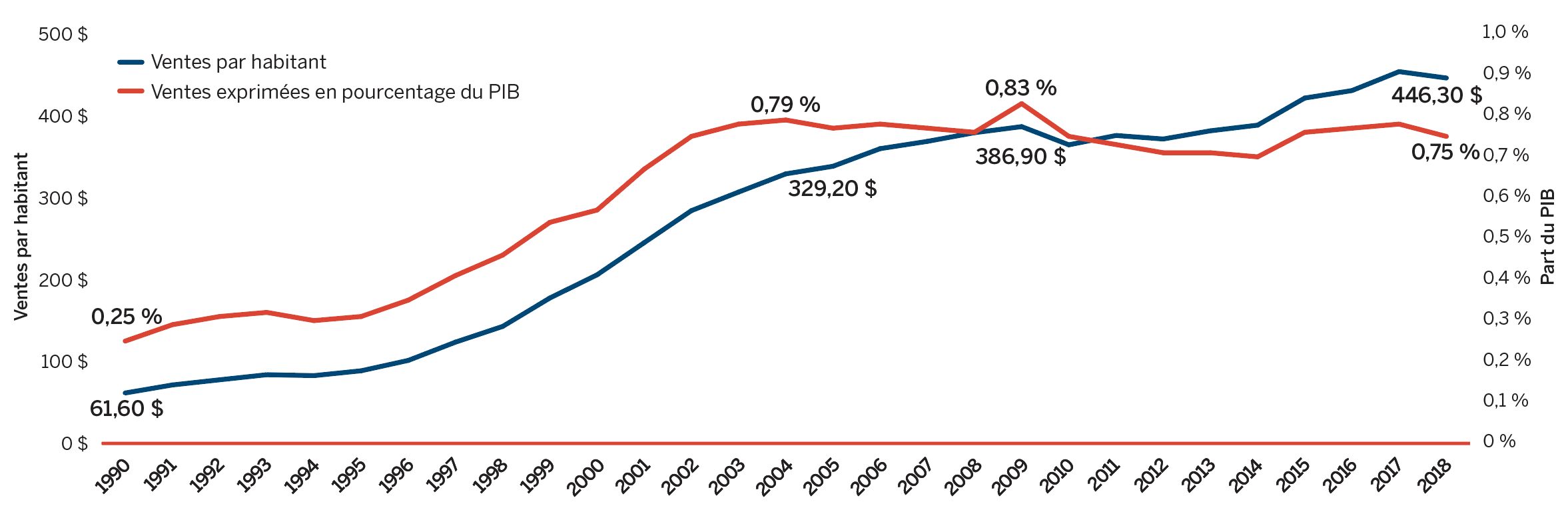
Les tendances relatives aux ventes par habitant et aux ventes exprimées en pourcentage du produit intérieur brut (PIB) démontrent l’importance croissante des médicaments brevetés pour l’économie canadienne. Dans l’ensemble, les ventes de médicaments brevetés par habitant sont passées de 61,60 $ en 1990 à 446,30 $ en 2018, alors que les ventes exprimées en pourcentage du PIB ont augmenté, passant de 0,25 % en 1990 à 0,75 % en 2018 [figure 3(a)].
Pour mettre en évidence l’incidence persistante des médicaments brevetés, les figures 3(a) et 3(b) fournissent également les résultats pour « Tous les médicaments du CEPMB ». Cette catégorie plus vaste englobe tous les médicaments, actuels et anciens, pour lesquels des ventes ont été rapportées au CEPMB (depuis sa création).
En 2018, les médicaments qui étaient déclarés au CEPMB représentaient des ventes estimatives de 3,3 milliards de dollars ou 11,6 % de toutes les ventes. Il s’agit d’une nette augmentation comparativement à l’année précédente et une augmentation considérable par rapport à la décennie passée, quand les médicaments qui étaient officiellement déclarés au CEPMB représentaient 0,7 milliard de dollars en vente ou 3,2 % de toutes les ventes.
On y note que les ventes de « Tous les médicaments du CEPMB » ont augmenté de 6,5 % en 2018, comparativement au recul de 0,6 % observé pour les médicaments actuellement brevetés. Cela est attribuable au fait qu’une poignée de médicaments ont cessé d’être déclarés au CEPMB en 2018, notamment Remicade, le médicament sur ordonnance le plus vendu RAPPORT ANNUEL 2018-2021 au Canada. Depuis toujours, les médicaments brevetés subissent une érosion considérable de leur part de marché en raison de la perte de protection conférée par brevet. Or, récemment, ce même effet n’a pas été observé pour certains médicaments biologiques fort coûteux dont les brevets sont arrivés à échéance.
Un tableau complet des données présentées à la figure 3 relativement aux médicaments brevetés actuellement déclarés au CEPMB est présenté à l’annexe 3.
Figure 3. Tendances relatives aux ventes de médicaments brevetés, de 1990 à 2018
* Inclut les ventes de médicaments actuellement brevetés et de médicaments qui étaient déclarés au CEPMB, mais qui ne sont plus déclarés comme brevetés.
Source de données CEPMB; base de données MIDAS®, 1990-2018, IQVIA (tous droits réservés)
Description de la figure
Figure 3 (a) – Part des médicaments brevetés de toutes les ventes de médicaments : Médicaments actuellement déclarés au CEPMB et tous les médicaments déclarés au CEPMB
Ce diagramme linéaire à barres illustre les ventes annuelles des médicaments brevetés actuellement déclarés au CEPMB et des médicaments qui étaient déclarés au CEPMB, mais qui ne sont plus déclarés comme brevetés, pour la période de 1990 à 2018. Le diagramme montre la part des médicaments brevetés de toutes les ventes de médicaments, pour les médicaments actuellement déclarés au CEPMB et tous les médicaments déclarés au CEPMB. En 1990, les ventes de médicaments brevetés actuellement déclarés au CEPMB totalisaient 1,7 milliard de dollars, ce qui correspondait à 43,2 % de toutes les ventes de médicaments brevetés.
En 1991 : 2,0 milliards de dollars, 43,2 %; 1992 : 2,2 milliards de dollars, 43,8 %; 1993 : 2,4 milliards de dollars, 44,4 %; 1994 : 2,4 milliards de dollars, 43,9 %; 1995 : 2,6 milliards de dollars, 44,4 %; 1996 : 3,0 milliards de dollars, 45,0 %; 1997 : 3,7 milliards de dollars, 52,3 %; 1998 : 4,3 milliards de dollars, 55,1 %; 1999 : 5,4 milliards de dollars, 61,0 %; 2000 : 6,3 milliards de dollars, 63,0 %; 2001 : 7,6 milliards de dollars, 65,0 %; 2002 : 8,9 milliards de dollars, 67,4 %; 2003 : 9,7 milliards de dollars, 72,7 %; 2004 : 10,5 milliards de dollars, 72,2 %; 2005 : 10,9 milliards de dollars, 70,6 %;
En 2006 : les ventes de médicaments brevetés actuellement déclarés au CEPMB totalisaient 11,7 milliards de dollars; la part des médicaments brevetés actuellement déclarés au CEPMB, sur toutes les ventes de médicaments, était de 67,8 %; les ventes de tous les médicaments déclarés au CEPMB totalisaient 12,3 milliards de dollars; la part de tous les médicaments déclarés au CEPMB, sur toutes les ventes de médicaments, était de 69,9 %;
2007 : 12,1 milliards de dollars; 63,2 %; 12,7 milliards de dollars; 67,9 %;
2008 : 12,6 milliards de dollars; 61,7 %; 13,3 milliards de dollars;65,5 %;
2009 : 13,0 milliards de dollars; 59,6 %; 13,7 milliards de dollars; 63,1 %;
2010 : 12,4 milliards de dollars; 55,8 %; 13,2 milliards de dollars; 59,2 %;
2011 : 12,9 milliards de dollars; 58,3 %; 13,8 milliards de dollars; 63,6%;
2012 : 12,9 milliards de dollars; 59,2 %; 13,8 milliards de dollars;63,0 %;
2013 : 13,4 milliards de dollars; 60,7 %; 14,4 milliards de dollars; 64,6 %;
2014 : 13,8 milliards de dollars; 59,9 %; 15,1 milliards de dollars;64,3 %;
2015 : 15,1 milliards de dollars; 61,6 %; 16,6 milliards de dollars;66,9%;
2016 : 15,6 milliards de dollars; 60,8 %; 17,3 milliards de dollars; 66,8 %;
2017 : 16,8 milliards de dollars; 61,5 %; 18,8 milliards de dollars; 68,6 %;
2018 : 16,7 milliards de dollars; 59,0 %; 19,9 milliards de dollars; 69,8 %.
* Inclut les ventes de médicaments actuellement brevetés et de médicaments qui étaient déclarés au CEPMB, mais qui ne sont plus déclarés comme brevetés.
Source de données CEPMB; base de données MIDAS®, 1990-2018, IQVIA (tous droits réservés)
Description de la figure
Ce diagramme linéaire à barres illustre le taux de variation annuel des ventes de médicaments brevetés et le taux de croissance annuel composé sur cinq ans pour la période de 1990 à 2018, pour les médicaments brevetés actuellement déclarés au CEPMB et les médicaments qui étaient déclarés au CEPMB, mais qui ne sont plus déclarés comme brevetés. En 1991, le taux de variation des ventes de médicaments brevetés actuellement déclarés au CEPMB était de 13,1 %. En 1992 : 14,0 %; 1993 : 9,4 %.
En 1994, le taux de variation des ventes de médicaments brevetés actuellement déclarés au CEPMB était de -2,1 % et le taux de croissance annuel composé sur cinq ans des ventes de médicaments brevetés actuellement déclarés au CEPMB était de 9,0 %.
En 1995 : 10,8 %, 6,8 %;
1996 : 12,8 %, 8,1 %;
1997 : 22,6 %, 11,4 %;
1998 : 18,9 %, 15,7 %;
1999 : 27,0 %, 20,0 %;
2000 : 16,7 %, 20,4 %;
2001 : 18,9 %, 19,7 %;
2002 : 17,5 %, 19,9 %;
2003 : 9,0 %, 15,8 %;
2004 : 7,8 %, 13,6 %;
2005 : 4,2 %, 9,4 %;
2006 : 7,4 %, 7,1 %;
En 2007, le taux de variation des ventes de médicaments actuellement déclarés au CEPMB était de 3,2 %, le taux de croissance annuel composé sur cinq ans des ventes de médicaments actuellement déclarés au CEPMB était de 5,7 %, et le taux de variation des ventes de tous les médicaments déclarés au CEPMB était de 3,2 %.
2008 : 4,6 %, 4,7 %, 4,8 %;
2009 : 2,9 %, 4,5 %, 2,9 %;
2010 : -4,3 %, 1,5 %, -3,2 %;
En 2011, le taux de variation des ventes de médicaments actuellement déclarés au CEPMB était de 3,5 %, le taux de croissance annuel composé sur cinq ans des ventes de médicaments actuellement déclarés au CEPMB était de 1,6 %, le taux de variation des ventes de tous les médicaments déclarés au CEPMB était de 4,5 %, et le taux de croissance annuel composé sur cinq ans des ventes de tous les médicaments déclarés au CEPMB était de 2,4 %.
2012 : 0,1 %, 0,6 %, 0,1 %, 1,8 %;
2013 : 4,2 %, 0,8 %, 4,0 %, 1,6 %;
2014 : 3,1 %, 2,7 %, 4,6 %, 1,9 %;
2015 : 9,4 %, 4,0 %, 10,3 %, 4,6 %;
2016 : 3,3 %, 4,9 %, 4,5 %, 4,6 %;
2017 : 7,6 %, 5,8 %, 8,1 %, 6,3 %;
2018 : -0,6 %, 4,9 %, 6,5 %, 6,8 %.
Source de données CEPMB; Statistique Canada; OCDE
Description de la figure
Ce diagramme linéaire illustre les ventes de médicaments actuellement déclarés au CEPMB par habitant et sous forme de pourcentage du PIB de 1990 à 2018. En 1990, les ventes de médicaments actuellement déclarés au CEPMB par habitant étaient de 61,60 $ et, sous forme de pourcentage du PIB, de 0,25. En 1991 : 71,40 $, 0,29; 1992 : 77,70 $, 0,31; 1993 : 83,90 $, 0,32; 1994 : 82,80 $, 0,30; 1995 : 88,70 $, 0,31;
1996 : 101,40 $, 0,35; 1997 : 123,70 $, 0,41; 1998 : 142,0 $, 0,46; 1999 : 177,60 $, 0,54;
2000 : 205,90 $, 0,57; 2001 : 245,20 $, 0,67; 2002 : 284,30 $, 0,75; 2003 : 307,00 $, 0,78;
2004 : 329,20 $, 0,79; 2005 : 338,50 $, 0,77; 2006 : 360,00 $, 0,78; 2007 : 368,90 $, 0,77;
2008 : 379,50 $, 0,76; 2009 : 386,90 $, 0,83; 2010 : 364,70 $, 0,75; 2011 : 376,10 $, 0,73;
2012 : 371,80 $, 0,71; 2013 : 381,80 $, 0,71; 2014 : 388,70 $, 0,70; 2015 : 421,80 $, 0,76;
2016 : 430,94 $, 0,77; 2017 : 454,09 $, 0,78; 2018 : 446,30 $, 0,75.
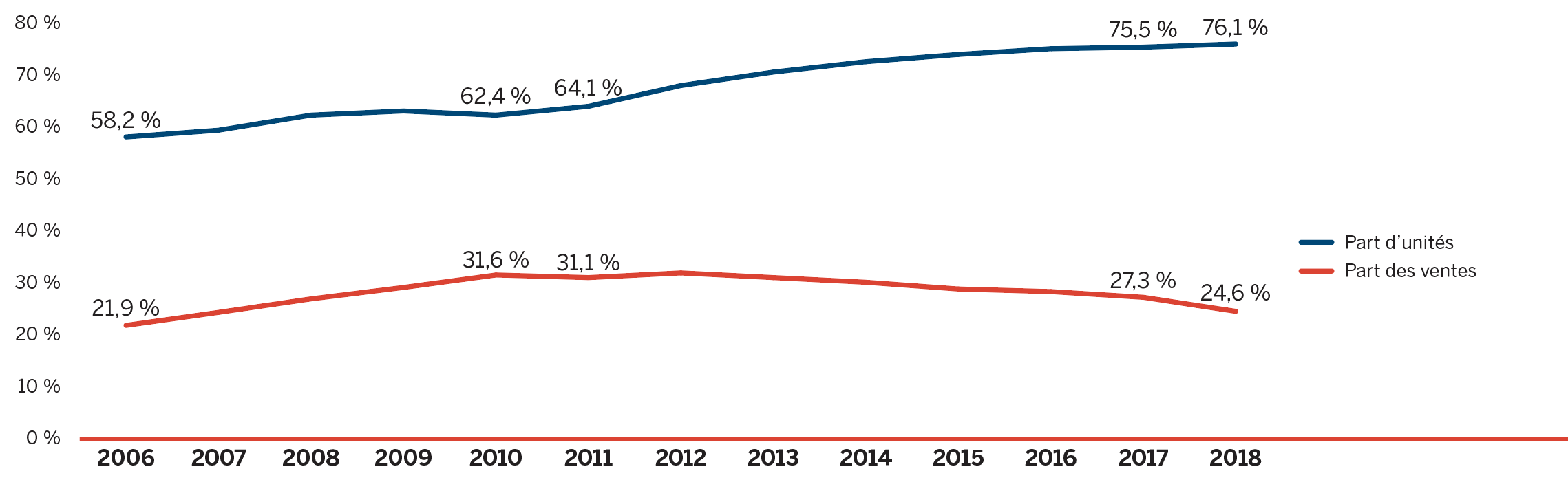
Aperçu : tendances relatives aux ventes de médicaments génériques
Bien que les ventes de médicaments brevetés aient connu un léger recul de 0,6 % en 2018, les ventes de médicaments génériques ont diminué de façon beaucoup plus importante, soit de 7 %. Les ventes de médicaments génériques ont connu des taux de variation faibles ou négatifs depuis 2010, en grande partie attribuable à la mise en place de politiques relatives à l’établissement des prix par les gouvernements provinciaux et par l’intermédiaire de l’Alliance pancanadienne pharmaceutique (APP).
En 2018, la conclusion d’une entente conjointe d’une durée de cinq ans entre l’APP et l’Association canadienne du médicament générique (ACMG) a permis de réduire les prix de 67 médicaments génériques à 10 % ou à 18 % du prix de référence du médicament de marque, ce qui a ramené les dépenses à peu près à leur niveau de 2010, malgré la hausse continue de l’utilisation des médicaments génériques.
Remarque : Les résultats témoignent des ventes de médicaments sur ordonnance sur le marché de détail national selon les prix départ-usine des fabricants.
Source de données : Base de données MIDAS®, IQVIA (tous droits réservés)
[Rapport du SNIUMP : Génériques360, 2018]
Description de la figure
Ce diagramme linéaire montre la part des produits génériques sur le marché de détail des produits pharmaceutiques au Canada, de 2006 à 2018, en fonction des dépenses (ventes) et du nombre d’unités vendues.
| 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Part des unités |
58,2 % | 59,5 % | 62,4 % | 63,2 % | 62,4 % | 64,1 % | 68,1 % | 70,7 % | 72,7 % | 74,1 % | 75,2 % | 75,5 % | 76,1 % |
| Part des ventes | 21,9 % | 24,4 % | 27,0 % | 29,2 % | 31,6 % | 31,1 % | 32,0 % | 31,1 % | 30,2 % | 28,9 % | 28,4 % | 27.3% | 24.6% |
Facteurs influant sur la croissance des recettes tirées des ventes
L’évolution de plusieurs facteurs clés influe sur la croissance des recettes tirées des ventes de médicaments brevetés.
- Effet de volume : Variations de la quantité de médicaments brevetés vendus. Cet effet porte sur les médicaments établis qui étaient offerts sur le marché pendant toute la période. Les augmentations de la population, les variations de la répartition démographique (p. ex. des changements dans la répartition selon l’âge), les hausses de l’incidence de maladies, et les changements dans les habitudes de prescription sont parmi les facteurs qui peuvent contribuer à cet effet.
- Effet de la combinaison de médicaments : évolution de la quantité de médicaments brevetés moins coûteux et plus coûteux consommés. Cet effet s’applique à la fois aux nouveaux médicaments et à ceux qui étaient déjà sur le marché. L’adoption de nouveaux médicaments plus coûteux, le recours à de nouveaux médicaments pour traiter des conditions pour lesquelles il n’existait pas encore un traitement efficace, et les changements dans les habitudes de prescription des médecins sont parmi les facteurs qui peuvent contribuer à ce changement.
- Effet du retrait : médicaments précédemment brevetés pour lesquels des recettes tirées de ventes ne sont plus déclarées au CEPMB, ou qui ne sont plus vendus au Canada.
- Effet de la perte d’exclusivité : médicaments ayant perdu l’exclusivité du marché et qui sont ouverts à un certain degré de concurrence générique, mais qui demeurent brevetés.
- Effet de prix : changements de prix de médicaments brevetés actuels. Cet effet s’applique autant aux hausses qu’aux baisses de prix des médicaments brevetés au cours de la période examinée.
Certains facteurs, comme l’effet de combinaison de médicaments, exercent généralement une pression à la hausse sur les ventes, tandis que d’autres, comme l’effet de perte d’exclusivité, peuvent avoir l’effet opposé. Le résultat net de tous les effets combinés correspond à la variation annuelle des ventes.
À l’occasion, l’arrivée d’un nouveau médicament à grand succès commercial influe considérablement sur les ventes et est surveillée en tant qu’effet distinct. Par exemple, l’arrivée des médicaments antiviraux à action directe (AAD) pour le traitement de l’hépatite C a eu un effet notable sur les ventes de médicaments brevetés au cours des dernières années. C’est en 2015 que cela a eu l’effet le plus important, alors que ces médicaments ont fait augmenter le total des ventes de près de 5 %. Bien que leur contribution à la croissance des ventes ait été modeste en 2018, ces médicaments pourraient continuer à avoir une incidence au cours des prochaines années, avec l’arrivée sur le marché de nouveaux AAD et dans la foulée de l’augmentation de la protection offerte par les assureurs.
La figure 5 examine les principaux facteurs responsables de la croissance annuelle des ventes de médicaments brevetésNote de bas de page 7 entre 2014 et 2018 (a) en valeur absolue en dollars, et (b) exprimées en proportion de la variation annuelle globale des ventes.
Les variations de prix des médicaments brevetés ont joué un rôle très mineur dans la croissance des ventes de médicaments brevetés au cours des cinq dernières années, ce qui donne à penser qu’en moyenne les prix des médicaments brevetés actuels sont plutôt stables. Cependant, cela ne tient pas compte des hausses globales des coûts de traitement attribuables à l’arrivée sur le marché de nouveaux médicaments brevetés plus coûteux (représenté par l’effet de combinaison de médicaments).
Les résultats indiquent que la vigueur des ventes de nouveaux médicaments brevetés et de médicaments brevetés plus coûteux établis a le plus contribué à la croissance des ventes sur cinq ans. En 2018, la hausse globale du recours aux médicaments brevetés et les médicaments brevetés plus coûteux ont exercé une pression à la hausse plus importante sur les ventes que les années précédentes. Ces facteurs seront examinés de façon plus détaillée dans les sections qui suivent.
Figure 5. Principaux moteurs de changement des ventes de médicaments brevetés, de 2014 à 2018
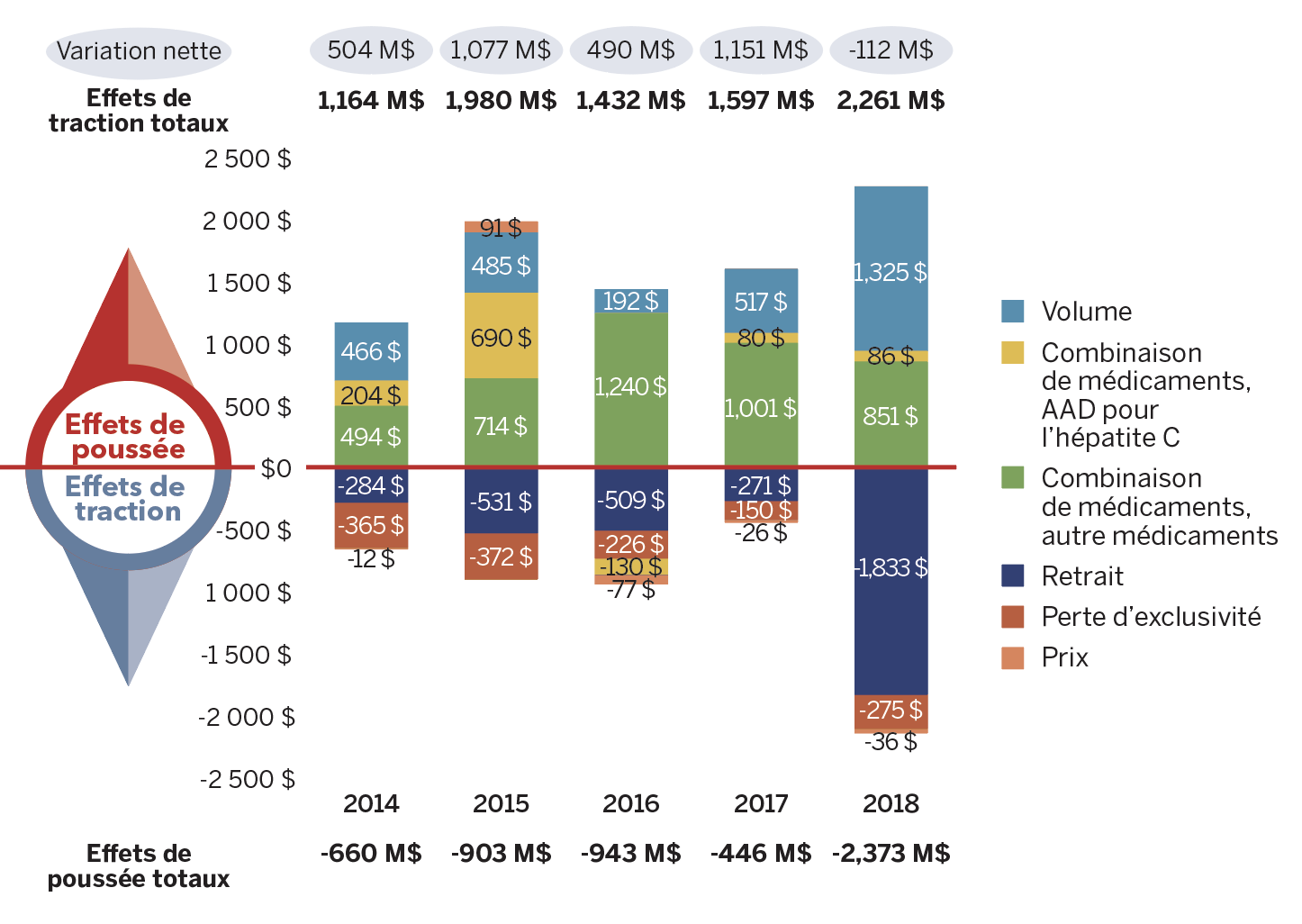
Remarque : Lorsque plusieurs facteurs évoluent simultanément, cela crée un effet résiduel ou croisé, qui n’est pas déclaré séparément dans cette
analyse, mais qui est comptabilisé dans la variation de coût total.
Les valeurs peuvent ne pas correspondre à la variation nette, car elles ont été arrondies et subissent un effet croisé.
Source de données : CEPMB
Description de la figure
Ces deux diagrammes à barres illustrent les facteurs qui ont influé sur les taux de variation annuels au chapitre des ventes de médicaments brevetés de 2014 à 2018. Le premier diagramme présente le taux de variation en dollars absolus pour chacun de facteurs contributifs ainsi que les effets de poussée (positifs) et de traction (négatifs) totaux. Les antiviraux à action directe (AAD) pour l’hépatite C sont présentés de façon distincte de l’ensemble de l’effet de combinaison de médicaments en raison de leur haute incidence.
(a) Variation absolue en millions de dollars
| Retrait | Perte d’exclusivité | Combinaison, autres médicaments | Combinaison, AAD pour l’hépatite C | Volume | Prix | |
|---|---|---|---|---|---|---|
2014 |
-284 000 000 $ |
-365 000 000 $ |
494 000 000 $ |
204 000 000 $ |
466 000 000 $ |
12 000 000 $ |
2015 |
-531 000 000 $ |
-372 000 000 $ |
714 000 000 $ |
690 000 000 $ |
485 000 000 $ |
91 000 000 $ |
2016 |
-509 000 000 $ |
-226 000 000 $ |
1 240 000 000 $ |
-130 000 000 $ |
192 000 000 $ |
-77 000 000 $ |
2017 |
-271 000 000 $ |
-150 000 000 $ |
1 001 000 000 $ |
80 000 000 $ |
517 000 000 $ |
-26 000 000 $ |
2018 |
-1 833 240 954 $ |
275 094 724 $ |
851 146 902 $ |
85 642 876 $ |
1 324 601 290 $ |
35 545 747 $ |
| Variation absolue (millions de dollars) | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|
Effets de poussée totaux |
1 164 $ |
1 980 $ |
1 432 $ |
1 597 $ |
2 261 $ |
Effets de traction totaux |
-660 $ |
-903 $ |
-943 $ |
-446 $ |
2 373 $ |
Variation nette |
504 $ |
1 077 $ |
490 $ |
1 151 $ |
112 $ |
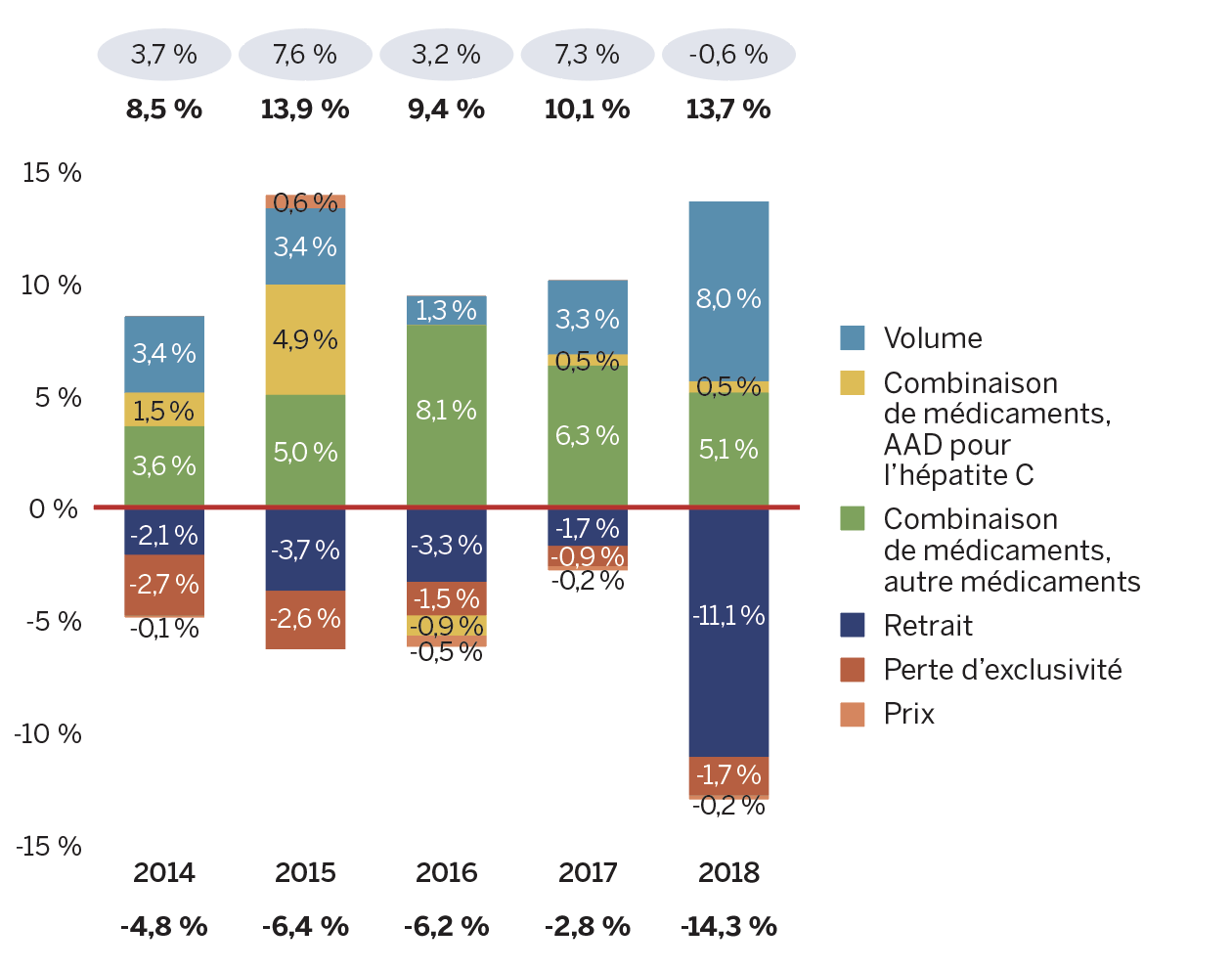
Remarque : Lorsque plusieurs facteurs évoluent simultanément, cela crée un effet résiduel ou croisé, qui n’est pas déclaré séparément dans cette analyse, mais qui est comptabilisé dans la variation de coût total.
Les valeurs peuvent ne pas correspondre à la variation nette, car elles ont été arrondies et subissent un effet croisé.
Source de données : CEPMB
Description de la figure
(b) Variation relative en pourcentage
| Retrait | Perte d’exclusivité | Combinaison, autres médicaments | Combinaison, AAD pour l’hépatite C | Volume | Prix | |
|---|---|---|---|---|---|---|
| 2014 | -2,1 % | -2,7 % | 3,6 % | 1,5 % | 3,4 % | -1,0 % |
| 2015 | -3,7 % | -2,6 % | 5,0 % | 4,9 % | 3,4 % | 0,6 % |
| 2016 | -3,3 % | -1,5 % | 8,1 % | -0,9 % | 1,3 % | -0,5 % |
| 2017 | -1,7 % | -0,9 % | 6,3 % | 0,5 % | 3,3 % | -0,2 % |
| 2018 | -11,1 % | -1,7 % | 5,1 % | 0,5 % | 8,0 % | -0,2 % |
| Variation absolue (millions de dollars) | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|
| Effets de traction totaux | -4,8 % | -6,4 % | -6,2 % | -2,8 % | -14,3 % |
| Effets de poussée totaux | 8,5 % | 13,9 % | 9,4 % | 10,1 % | 13,7 % |
| Variation nette | 3,7 % | 7,6 % | 3,2 % | 7,3 % | -0,6% |
En 2018, les ventes d’un certain nombre de médicaments les plus vendus ont cessé d’être déclarées au CEPMB, une réorientation importante de segment de marché qui est venue limiter cette pression à la hausse. Cela englobait les médicaments coûteux ou les médicaments à taux d’utilisation élevé. Au total, des médicaments représentant 1,8 milliard de dollars de dépenses ont été retirés de l’espace des ventes de médicaments brevetés, Remicade comptant à lui seul pour la moitié de ce total.
L’effet de retrait était considérablement plus marqué en 2018 que lors des années précédentes, ce qui est venu compenser les hausses des ventes déclarées et a entraîné une légère baisse de la croissance globale des ventes. La figure 6 illustre l’évolution de l’incidence de l’effet de retrait au cours des cinq dernières années et recense les médicaments les plus vendus qui ont cessé d’être déclarés au CEPMB en 2018.
Figure 6. Perte des ventes de médicaments brevetés due à l’effet de retrait, de 2014 à 2018
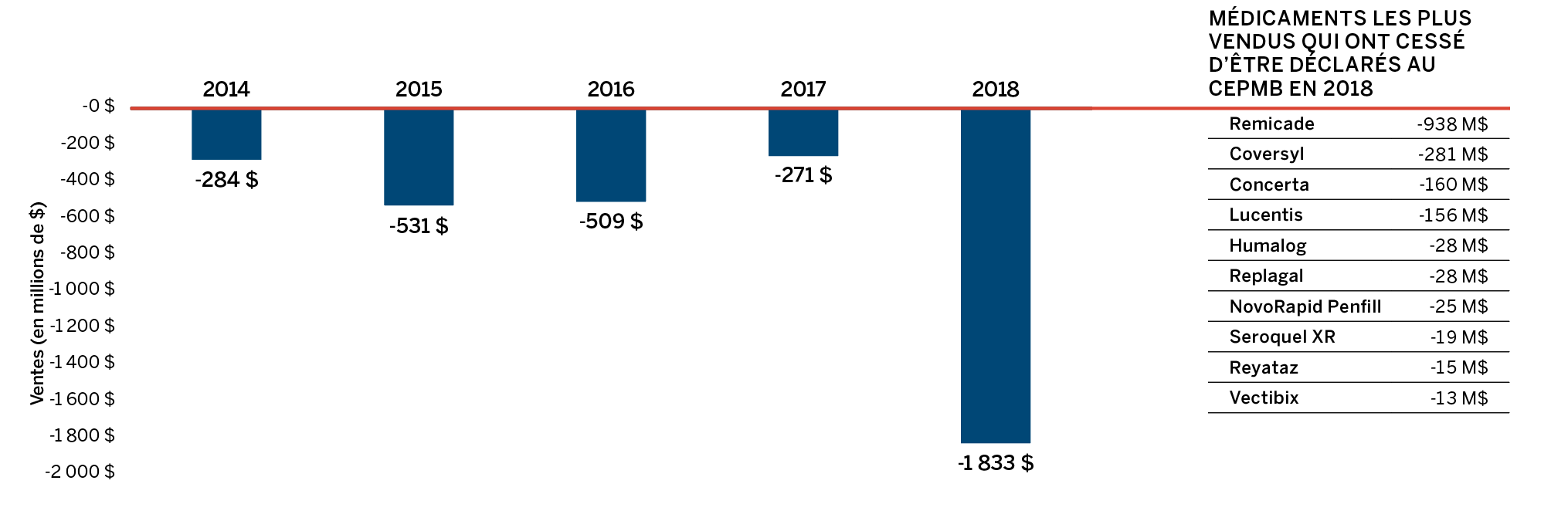
Source de données : CEPMB
Description de la figure
Ce diagramme à barres décrit la variation des ventes de médicaments brevetés attribuable aux médicaments qui ont cessé de faire l’objet d’une déclaration comme médicaments brevetés entre 2014 et 2018. Un tableau complémentaire montre la variation des ventes des médicaments les plus vendus qui ont cessé d’être déclarés à titre de médicaments brevetés en 2018.
| Année | Variation des ventes (millions de dollars) |
|---|---|
| 2014 | -284 $ |
| 2015 | -531 $ |
| 2016 | -509 $ |
| 2017 | -271 $ |
| 2018 | -1 833 $ |
| Médicaments les plus vendus qui ont cessé d’être déclarés au CEPMB en 2018 |
Variation des ventes (millions de dollars) |
|---|---|
| Remicade | -938 $ |
| Coversyl | -281 $ |
| Concerta | -160 $ |
| Lucentis | -156 $ |
| Humalog | -28 $ |
| Replagal | -28 $ |
| NovoRapid Penfill | -25 $ |
| Seroquel XR | -19 $ |
| Reyataz | -$15 $ |
| Vectibix | -13 $ |
Aperçu : facteurs de coût des régimes publics et privés d’assurance-médicaments au canada
Les médicaments plus coûteux (autres que les AAD pour l’hépatite C) sont le principal facteur de coût relativement aux dépenses des régimes d’assurance-médicaments publics et privés canadiens. Au cours des six dernières années, ces médicaments ont exercé une pression à la hausse constante de 4 % à 5 % sur les coûts des médicaments. Inversement, les économies attribuables à la substitution par un médicament générique et aux réductions de prix ont diminué au cours de cette même période. Une nouvelle politique d’établissement des prix des médicaments génériques mise en place en 2018 a permis de réduire la hausse des coûts pour cette année. Toutefois, l’incidence globale d’une telle politique sur les coûts ne devrait pas être soutenue pendant plusieurs années, car les interventions entraînent une réduction ponctuelle des dépenses, sans éliminer la croissance annuelle sous-jacente.
Outre l’utilisation de médicaments plus coûteux, les changements de conception des régimes peuvent contribuer de manière importante à la croissance, comme ce fut le cas en 2018 dans la foulée de la mise en oeuvre de l’Assurance-santé Plus, qui assure la fourniture d’une assurance-médicaments aux résidents de l’Ontario âgés de moins de 24 ans.
(a) Régimes publics d’assurance-médicaments du SNIUMP*

Remarque : Rapport sur les régimes publics par exercice financier, et régimes privés par année civile. Cela a une incidence sur l’ampleur des effets de politiques,
comme l’Assurance-santé Plus ou l’initiative de tarification des médicaments génériques lancée en 2018. Par exemple, pour les régimes publics,
les répercussions seront ressenties au prochain exercice.
Lorsque plusieurs facteurs évoluent simultanément, cela crée un effet résiduel ou croisé, qui n’est pas déclaré séparément dans cette analyse, mais
qui est comptabilisé dans la variation de coût total.
Les valeurs peuvent ne pas correspondre à la variation nette, parce qu’elles ont été arrondies et qu’elles subissent un effet croisé.
* Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard,
Terre-Neuve-et-Labrador, Yukon et le Programme des services de santé non assurés
Source de données : Base de données du SNIUMP, ICIS; base de données des régimes privés d’assurance-médicaments à paiement direct d’IQVIA
Rapport du SNIUMP : CompasRx, 2017-2018; Affiche du SNIUMP : Pressions à l’origine de la hausse des coûts des régimes privés d’assurancemédicaments au Canada, 2018
Description de la figure
Ces deux diagrammes à barres illustrent les facteurs qui ont influé sur les taux de variation annuels des coûts de médicaments au sein des régimes publics et privés. Le premier diagramme présente le total combiné pour les régimes publics d’assurance-médicaments du SNIUMP de l’exercice 2012-2013 à 2017-2018, tandis que le deuxième représente les régimes privés d’assurance-médicaments de l’année civile 2013 à 2018. Pour chaque année, on présente sous la barre le total des effets de poussée (positifs), de traction (négatifs) et la variation nette. Les antiviraux à action directe (AAD) pour l’hépatite C sont présentés de façon distincte de l’ensemble de l’effet de combinaison de médicaments en raison de leur haute incidence. Les effets de la mise en œuvre du programme Assurance-santé Plus en Ontario sont également indiqués séparément pour 2017-2018 dans le tableau des régimes publics d’assurance-médicaments du SNIUMP et pour 2018 dans le tableau des régimes privés d’assurance-médicaments.
| 2012-2013 | 2013-2014 | 2014-2015 | 2015-2016 | 2016-2017 | 2017-2018 | |
|---|---|---|---|---|---|---|
| Assurance-santé Plus | – | – | – | – | – | – |
| Combinaison de médicaments, AAD pour l’hépatite C | 0,0 % | 0,0 % | 0,0 % | 8,0 % | -2,3 % | 2,4 % |
| Combinaison de médicaments, autres médicaments | 4,1 % | 5,4 % | 4,9 % | 4,1 % | 4,4 % | 4,7 % |
| Volume | 1,7 % | 2,2 % | 0,3 % | 1,3 % | 1,0 % | 1,0 % |
| Démographie | 2,7 % | 2,1 % | 2,7 % | 3,0 % | 1,8 % | 1,4 % |
| Variation de prix | -2,0 % | -6,0 % | -3,0 % | -1,8 % | -1,0 % | -1,1 % |
| Substitution par un générique | -7,2 % | -1,5 % | -3,2 % | -2,3 % | -1,8 % | -1,3 % |
| Effets de traction totaux | -9,2 % | -7,5 % | -6,2 % | -4,1 % | -5,1 % | -2,3 % |
| Effets de poussée totaux | 8,5 % | 9,7 % | 7,9 % | 16,2 % | 7,2 % | 11,0 % |
| Variation nette | -0,8 % | 2,0 % | 2,5 % | 12,0 % | 2,0 % | 8,3 % |
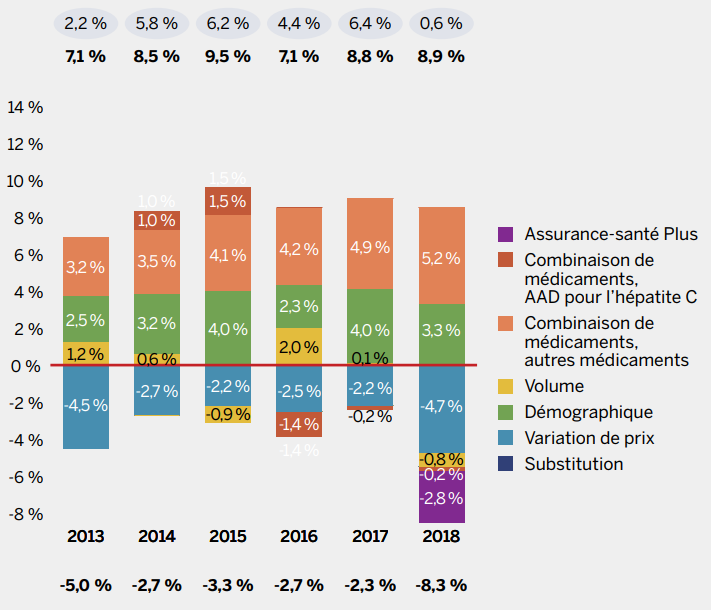
Remarque : Rapport sur les régimes publics par exercice financier, et régimes privés par année civile. Cela a une incidence sur l’ampleur des effets de politiques,
comme l’Assurance-santé Plus ou l’initiative de tarification des médicaments génériques lancée en 2018. Par exemple, pour les régimes publics,
les répercussions seront ressenties au prochain exercice.
Lorsque plusieurs facteurs évoluent simultanément, cela crée un effet résiduel ou croisé, qui n’est pas déclaré séparément dans cette analyse, mais
qui est comptabilisé dans la variation de coût total.
Les valeurs peuvent ne pas correspondre à la variation nette, parce qu’elles ont été arrondies et qu’elles subissent un effet croisé.
* Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard,
Terre-Neuve-et-Labrador, Yukon et le Programme des services de santé non assurés
Source de données : Base de données du SNIUMP, ICIS; base de données des régimes privés d’assurance-médicaments à paiement direct d’IQVIA
Rapport du SNIUMP : CompasRx, 2017-2018; Affiche du SNIUMP : Pressions à l’origine de la hausse des coûts des régimes privés d’assurancemédicaments au Canada, 2018
Description de la figure
| 2012-2013 | 2013-2014 | 2014-2015 | 2015-2016 | 2016-2017 | 2017-2018 | |
|---|---|---|---|---|---|---|
| Assurance-santé Plus | – | – | – | – | – | -2,8 % |
| Combinaison de médicaments, AAD pour l’hépatite C | 0,0 % | 1,0 % | 1,5 % | -1,4 % | -0,2 % | -0,2 % |
| Combinaison de médicaments, autres médicaments | 3,5 % | 3,2 % | 4,1 % | 4,2 % | 4,9 % | 5,2 % |
| Volume | 1,2 % | 0,6 % | -0,9 % | 2,0 % | 0,1 % | -0,8 % |
| Démographie | 2,5 % | 3,2 % | 4,0 % | 2,3 % | 4,0 % | 3,3 % |
| Variation de prix | -4,5 % | -2,7 % | -2,2 % | -2,5 % | -2,2 % | -4,7 % |
| Substitution par un générique | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % | 0,0 % |
| Effets de traction totaux | -5,0 % | -2,7 % | -3,3 % | -2,7 % | -2,3 % | -8,3 % |
| Effets de poussée totaux | 7,1 % | 8,5 % | 9,5 % | 7,1 % | 8,8 % | 8,9 % |
| Variation nette | 2,2 % | 5,8 % | 6,2 % | 4,4 % | 6,4 % | 0,6 % |
Nouveaux médicaments exerçant une influence sur les recettes tirées de ventes
La figure 8 présente pour 2018 une ventilation des ventes de médicaments brevetés selon l’année où ils ont reçu leur premier avis de conformité (AC) de Santé Canada et où leur vente a été autorisée au Canada. Au cours de la dernière partie des années 1990 et du début des années 2000, la croissance des ventes a été grandement associée à une succession de nouveaux médicaments « vedettes » qui ont donné lieu à des volumes de ventes très élevés. À mesure que les brevets de ces médicaments expiraient, leur part des ventes diminuait progressivement. Les nouveaux médicaments plus coûteux, comme les produits biologiques, les médicaments oncologiques et les traitements pour l’hépatite C, représentent une part grandissante des ventes.
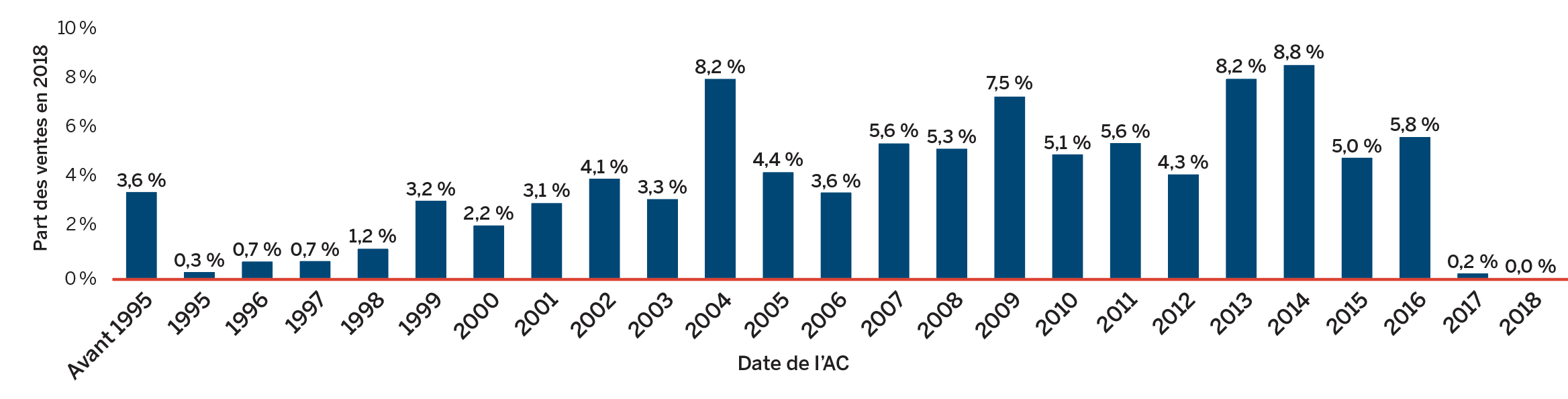
Source de données : CEPMB
Description de la figure
Ce diagramme à barres présente le pourcentage des ventes de médicaments brevetés en fonction de l’année à laquelle le médicament a reçu son premier AC de Santé Canada et a été autorisé pour la vente au Canada. Les médicaments commercialisés avant 1995 représentaient 3,6 % des ventes de 2018.
1995 : 0,3 %; 1996 : 0,7 %; 1997 : 0,7 %; 1998 : 1,2 %; 1999 : 3,2 %; 2000 : 2,2 %; 2001 : 3,1 %; 2002 : 4,1 %; 2003 : 3,3 %; 2004 : 8,2 %; 2005 : 4,4 %; 2006 : 3,6 %; 2007 : 5,6 %; 2008 : 5,3 %; 2009 : 7,5 %; 2010 : 5,1 %; 2011 : 5,6 %; 2012 : 4,3 %; 2013 : 8,2 %; 2014 : 8,8 %; 2015 : 5,0 %; 2016 : 5,8 %; 2017 : 0,2 %; 2018 : 0,0 %.
Aperçu : nouveaux médicaments arrivant sur les marchés canadiens et internationaux
Les nouveaux médicaments lancés entre 2009 et 2017 comptaient pour le tiers du total des produits pharmaceutiques de marque au Canada au quatrième trimestre 2018. Environ 50 nouveaux médicaments ont reçu une approbation de mise en marché par la US Food and Drug Administration (FDA), l’Agence européenne des médicaments (EMA) ou Santé Canada en 2017 et en 2018, dont la plupart étaient des thérapies spécialisées onéreuses. Cela représente une forte augmentation par rapport à la moyenne annuelle de 36 approbations par an enregistrée entre 2009 et 2016.
Source de données : base de données MIDAS®, 2009−2018, IQVIA (tous droits réservés)
[Affiche du SNIUMP : Premier aperçu des lancements de nouveaux médicaments sur les marchés canadien et international]
Description de la figure
Ce graphique en aires illustre la part cumulée des nouveaux médicaments par rapport au total des ventes de médicaments de marque au Canada, selon l’année de la première approbation. Les ventes annuelles de médicaments approuvés entre 2009 et 2017 sont présentées jusqu’au quatrième trimestre de 2018. On présente aussi la part totale des ventes des nouveaux médicaments pour chaque année.
| Année de la première approbation | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | Q4-2018 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| 2009 | 0,1 % | 0,6 % | 1,4 % | 2,2 % | 2,7 % | 3,1 % | 3,8 % | 4,1 % | 4,1 % | 4,2 % | 4,3 % |
| 2010 | – | 0,1 % | 0,5 % | 0,9 % | 1,2 % | 1,4 % | 1,7 % | 1,8 % | 1,8 % | 1,9 % | 1,8 % |
| 2011 | – | – | 0,5 % | 1,4 % | 1,9 % | 2,3 % | 3,0 % | 3,8 % | 3,9 % | 4,1 % | 4,2 % |
| 2012 | – | – | – | 0,01 % | 0,7 % | 1,5 % | 2,6 % | 3,6 % | 3,5 % | 3,7 % | 3,8 % |
| 2013 | – | – | – | – | 0,2 % | 4,1 % | 3,4 % | 4,2 % | 3,6 % | 3,1 % | 3,1 % |
| 2014 | – | – | – | – | – | 0,2 % | 5,8 % | 6,4 % | 6,0 % | 6,3 % | 6,7 % |
| 2015 | – | – | – | – | – | – | 0,3 % | 2,1 % | 3,8 % | 4,3 % | 4,6 % |
| 2016 | – | – | – | – | – | – | – | – | 1,9 % | 2,3 % | 2,3 % |
| 2017 | – | – | – | – | – | – | – | – | – | 2,3 % | 2,8 % |
| Part des ventes des nouveaux médicaments | 0,1 % | 0,7 % | 2,4 % | 4,6 % | 6,8 % | 12,6 % | 20,6 % | 26,1 % | 28,7 % | 32,2 % | 33,5 % |
Médicaments plus coûteux exerçant une influence sur les recettes tirées de ventes
Au cours de la dernière décennie, on a constaté une importante réorientation de l’industrie pharmaceutique vers la fabrication de médicaments plus spécialisés, ainsi qu’une augmentation du nombre de médicaments à prix plus élevé arrivant sur le marché puis accaparant une part de marché notable.
En 2018, le passage aux nouveaux médicaments ou aux médicaments plus coûteux a exercé une poussée vers le haut des ventes globales de médicaments brevetés. Les dix principaux médicaments contribuant à cette croissance ont fait augmenter les ventes de médicaments brevetés de plus de 900 millions de dollars entre 2017 et 2018 (tableau 7). Pour la plupart de ces médicaments, le coût annuel moyen de traitement était supérieur à 10 000 $.
| Ingrédient médicinal (nom commercial) | ATC | Ventes (millions de $) 2017 |
Ventes (millions de $) 2018 |
Variation absolue des ventes (millions de $) 2017-2018 |
Coût moyen du traitement annuel ($) 2018 |
|---|---|---|---|---|---|
| Pembrolizumab (Keytruda) | L01 | 74,8 | 206,3 | 131,4 | 37 637 |
| Empagliflozin (Jardiance) | A10 | 67,9 | 194,9 | 127,0 | 663 |
| Sofosbuvir/velpatasvir (Epclusa) | J05 | 518,2 | 645,2 | 126,9 | 43 563 |
| Aflibercept (Eylea) | S01 | 397,1 | 506,9 | 109,7 | 9 207 |
| Adalimumab (Humira) | L04 | 701,9 | 791,0 | 89,1 | 17 092 |
| Palbociclib (Ibrance) | L01 | 44,6 | 118,4 | 73,8 | 40 265 |
| Ibrutinib (Imbruvica) | L01 | 133,5 | 205,7 | 72,2 | 53 790 |
| Lenalidomide (Revlimid) | L04 | 338,5 | 408,4 | 69,9 | 60 312 |
| Apixaban (Eliquis) | B01 | 195,0 | 256,6 | 61,6 | 720 |
| Ustekinumab (Stelara) | L04 | 206,0 | 263,4 | 57,3 | 21 179 |
| Total des dix principaux médicaments* | 2 677,5 | 3 596,8 | 918,9 |
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source de données : CEPMB, base de données des régimes privés d’assurance-médicaments à paiement direct d’IQVIA, 2018
Bien que le tableau 7 présente les dix principaux médicaments contribuant à la croissance des ventes de médicaments brevetés, le tableau 8 compare les médicaments brevetés les plus vendus en 2006 et en 2018, ainsi que les coûts de traitement pour ces médicaments. En 2006, Remicade a été le seul médicament biologique à faire partie de la liste des dix principaux médicaments, avec un coût de traitement annuel moyen de 17 759 $. Ce coût était beaucoup plus élevé que le reste des dix principaux médicaments, dont aucun ne dépassait 1 000 $ par année. En 2018, toutefois, la moitié des dix médicaments les plus vendus étaient des produits biologiques dont les coûts annuels allaient de 9 207 $ à 37 637 $. Parmi les autres médicaments de cette liste, seuls trois représentaient un coût annuel inférieur à 1 000 $, alors que le plus coûteux dépassait les 60 000 $ par an. Avec des ventes annuelles collectives d’environ 3,8 milliards de dollars, ces dix médicaments représentaient près du quart des ventes totales de tous les médicaments brevetés en 2018.
| 2006 | 2018 | ||||||
|---|---|---|---|---|---|---|---|
| Ingrédient médicamenteux (nom commercial) |
ATC | Coût moyen du traitement annuel | Ingrédient médicamenteux (nom commercial) | ATC | Coût moyen du traitement annuel | Ventes (millions de $) | Part des ventes de médicaments brevetés (%) |
| 1. Atorvastatine calcique (Lipitor) | C10A | 511 $ | 1. Adalimumab (Humira) | L04A | 17 092 $ | 791,0 $ | 4,8 |
| 2. Bésylate d’amlodipine (Norvasc) | C08C | 417 $ | 2. Sofosbuvir / velpatasvir (Epclusa) | J05A | 43 563 $ | 645,2 $ | 3,9 |
| 3. Ramipril (Altace) | C09A | 271 $ | 3. Aflibercept (Eylea) | S01L | 9 207 $ | 506,9 $ | 3,0 |
| 4. Chlorhydrate de venlafaxine (Effexor) | N06A | 446 $ | 4. Lenalidomide (Revlimid) | L04A | 60 312 $ | 408,4 $ | 2,5 |
| 5. Pantoprazole sodique (Pantoloc) | A02B | 330 $ | 5. Etanercept (Enbrel) | L04A | 13 654 $ | 292,3 $ | 1,8 |
| 6. Bisulfate de clopidogrel (Plavix) | B01A | 607 $ | 6. Ustekinumab (Stelara) | L04A | 21 179 $ | 263,4 $ | 1,6 |
| 7. Rosuvastatine calcique (Crestor) | C10A | 341 $ | 7. Apixaban (Eliquis) | B01A | 720 $ | 256,6 $ | 1,5 |
| 8. Olanzapine (Zyprexa) | N05A | 977 $ | 8. Rivaroxaban (Xarelto) | B01A | 586 $ | 241,6 $ | 1,5 |
| 9. Xinafoate de salmétérol/propionate de fluticasone (Advair) | R03A | 343 $ | 9. Budesonide / formoterol fumarate (Symbicort) | R03A | 291 $ | 209,1 $ | 1,3 |
| 10. Infliximab (Remicade) | L04A | 17 759 $ | 10. Pembrolizumab (Keytruda) | L01X | 37 637 $ | 206,3 $ | 1,2 |
| Total des dix principaux médicaments* | 3 820,6 $ | 23,0 | |||||
| Total des médicaments brevetés | 16 653,1 $ | ||||||
Remarque : Les médicaments biologiques ont été mis en surbrillance jaune.
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source de données : CEPMB, base de données des régimes privés d’assurance-médicaments à paiement direct d’IQVIA, 2018
La figure 10 présente les détails des tendances relatives aux coûts de traitement des médicaments brevetés au cours de la dernière décennie. Pendant bon nombre d’années, la majorité des 20 médicaments brevetés les plus vendus présentaient des coûts de traitement annuels de moins de 1 000 $; cependant, l’année 2015 a marqué un tournant, puisque la plupart des médicaments les plus vendus coûtent désormais des milliers, voire des dizaines de milliers de dollars par an. Ce changement se reflète dans la croissance exceptionnelle multipliée par dix du coût de traitement annuel médian entre 2006 et 2015, lequel a atteint 5 163 $ en 2018 après avoir atteint un sommet de 8 584 $ en 2016. Outre le coût élevé de ces médicaments, l’utilisation de ces derniers a augmenté de façon considérable, ce qui a entraîné un coût de traitement annuel moyen pondéré de 18 414 $ pour les 20 médicaments brevetés les plus vendus en 2018. Ce montant est légèrement inférieur au coût annuel moyen maximal du traitement il y a une décennie.
Source de données : CEPMB, base de données des régimes privés d’assurance-médicaments à paiement direct d’IQVIA, 2006-2018
Description de la figure
Ce diagramme illustre le coût de traitement annuel minimum, maximum, médian et moyen pondéré des 20 médicaments brevetés les plus vendus au Canada, de 2006 à 2018.
| Coût de traitement | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Coût maximum | 17 759 $ | 18 669 $ | 19 974 $ | 22 716 $ | 22 361 $ | 23 507 $ | 49 022 $ | 52 227 $ | 58 800 $ | 58 830 $ | 60 249 $ | 57 928 $ | 60 313 $ |
| Coût moyen pondéré | 1 797 $ | 2 576 $ | 2 892 $ | 4 114 $ | 5 228 $ | 6 009 $ | 7 960 $ | 10 156 $ | 12 491 $ | 18 860 $ | 17 770 $ | 16 359 $ | 18 414 $ |
| Coût médian | 409 $ | 479 $ | 420 $ | 584 $ | 704 $ | 675 $ | 731 $ | 803 $ | 828 $ | 4 626 $ | 8 584 $ | 5 728 $ | 5 163 $ |
| Coût minimum | 86 $ | 89 $ | 86 $ | 88 $ | 88 $ | 87 $ | 173 $ | 181 $ | 136 $ | 254 $ | 260 $ | 260 $ | 291 $ |
Comme le montre la figure 11, la part des ventes totales de médicaments brevetés détenue par les médicaments à coût élevé n’a cessé d’augmenter, passant de 5,0 % en 2006 à 42,1 % en 2018. Cette croissance soutenue est évidente dans toutes les fourchettes de coût (10 000 $ à 20 000 $; 20 000 $ à 50 000 $ et 50 000 $ et plus), l’augmentation la plus forte se manifestant dans la catégorie des médicaments les plus coûteux. Malgré l’augmentation importante dans la part des coûts, le nombre de personnes prenant ces médicaments est demeuré à moins de 1 % de la population.
Entre 2006 et 2018, le nombre de médicaments brevetés au Canada ayant un coût de traitement annuel moyen d’au moins
10 000 $ a plus que triplé, si bien que les médicaments à prix élevé accaparent maintenant plus de 40 % des ventes de médicaments brevetés comparativement à 5 % en 2006.
Remarque : La méthodologie de cette analyse a été révisée et, par conséquent, les résultats historiques pourraient ne pas correspondre à ceux des éditions précédentes.
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source de données : CEPMB, base de données des régimes privés d’assurance-médicaments à paiement direct d’IQVIA, 2006-2018
Description de la figure
Ce diagramme à barres montre la part en pourcentage des ventes totales de médicaments brevetés détenue par les médicaments à coût élevé, selon le coût annuel du traitement, pour la période de 2006 à 2018. Les barres sont subdivisées selon trois catégories correspondant au coût annuel moyen de traitement : de 10 000 à 20 000 dollars; de 20 000 à 50 000 dollars; et 50 000 dollars et plus.
| Année | Part des ventes de médicaments dont le coût est de 10 000 à 20 000 $ | Part des ventes de médicaments dont le coût est de 20 000 à 50 000 $ | Part des ventes de médicaments dont le coût est supérieur à 50 000 $ | Part totale des ventes de médicaments à coût élevé |
|---|---|---|---|---|
| 2006 | 3,2 % | 1,7 % | 0,1 % | 5,0 % |
| 2007 | 3,0 % | 2,0 % | 0,3 % | 5,3 % |
| 2008 | 4,0 % | 2,3 % | 0,4 % | 6,7 % |
| 2009 | 5,1 % | 2,9 % | 0,6 % | 8,6 % |
| 2010 | 5,8 % | 3,3 % | 1,0 % | 10,1 % |
| 2011 | 7,0 % | 5,5 % | 1,3 % | 13,8 % |
| 2012 | 7,9 % | 7,7 % | 1,7 % | 17,3 % |
| 2013 | 9,1 % | 10,5 % | 2,2 % | 21,8 % |
| 2014 | 9,8 % | 11,7 % | 4,2 % | 25,7 % |
| 2015 | 11,0 % | 13,4 % | 8,9 % | 33,3 % |
| 2016 | 12,9 % | 15,6 % | 8,3 % | 36,8 % |
| 2017 | 14,4 % | 20,2 % | 6,7 % | 41,3 % |
| 2018 | 15,1 % | 19,4 % | 7,6 % | 42,1 % |
Le tableau qui suit le graphique fournit des renseignements additionnels, notamment le coût des médicaments, le nombre de médicaments, le coût de traitement annuel moyen, la population traitée estimée et la part de la population canadienne totale.
| 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Coût des médicaments (millions de dollars) | 849 $ | 884 $ | 1 119 $ | 1 413 $ | 1 681 $ | 2 303 $ | 2 882 $ | 3 624 $ | 4 284 $ | 5 549 $ | 6 141 $ | 6 864 $ | 6 996 $ |
| Nombre total de médicaments | 40 | 48 | 56 | 62 | 68 | 85 | 92 | 105 | 116 | 129 | 143 | 150 | 162 |
| Nombre de médicaments dont le coût est de 10 000 à 20 000 $ | 20 | 24 | 26 | 28 | 30 | 37 | 37 | 39 | 40 | 42 | 44 | 47 | 49 |
| Nombre de médicaments dont le coût est de 20 000 à 50 000 $ | 16 | 17 | 21 | 25 | 17 | 35 | 40 | 45 | 50 | 58 | 68 | 69 | 73 |
| Nombre de médicaments dont le coût est supérieur à 50 000 $ | 4 | 7 | 9 | 9 | 11 | 13 | 15 | 21 | 26 | 29 | 31 | 34 | 40 |
| Coût annuel moyen du traitement par patient | 34 561 $ | 42 022 $ | 37 561 $ | 32 191 $ | 38 636 $ | 37 930 $ | 38 130 $ | 37 842 $ | 41 447 $ | 44 804 $ | 43 520 $ | 42 691 $ | 45 843 $ |
| Population traitée estimée | 48 077 | 46 526 | 60 277 | 75 130 | 86 229 | 112 761 | 136 862 | 167 164 | 186 895 | 222 382 | 254 089 | 284 838 | 285 798 |
| Part de la population canadienne totale | 0,15 % | 0,14 % | 0,18 % | 0,22 % | 0,25 % | 0,33 % | 0,39 % | 0,48 % | 0,53 % | 0,62 % | 0,70 % | 0,77 % | 0,78 % |
Le virage en faveur des traitements à coût élevé est particulièrement apparent du côté des médicaments oncologiques. La figure 12 présente la part des ventes totales des médicaments oncologiques brevetés selon le coût du traitement et un protocole de traitement de 28 jours.
De 2006 à 2018, le coût moyen de traitement des médicaments oncologiques a plus que doublé, passant de 3 555 $ à 7 152 $. Bon nombre de protocoles de traitement combinent de multiples médicaments, ce qui se traduit par des coûts de traitement encore plus élevés par bénéficiaire. Il peut y avoir un certain chevauchement dans les médicaments indiqués aux figures 11 et 12, car les médicaments oncologiques dont le coût annuel de traitement dépasse 10 000 $ sont présentés dans les deux graphiques.
La double pression de la hausse des coûts moyens de traitement et de l’utilisation croissante signifie que ce domaine thérapeutique continuera probablement de croître en proportion des ventes de médicaments brevetés.

Remarque : Ces résultats traduisent les ventes totales de médicaments brevetés utilisés dans le traitement du cancer. Bien que certains de ces médicaments puissent également être utilisés pour traiter d’autres conditions, les données utilisées pour cette analyse ne font pas de distinction entre les indications, de sorte que les ventes déclarées peuvent refléter une certaine utilisation non liée au cancer.
* Coûts de traitement non disponibles pour ces médicaments.
† Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source de données : CEPMB; ACMTS; PPEA
Description de la figure
Ce diagramme à barres illustre la part des ventes de médicaments oncologiques brevetés à coût élevé en pourcentage des ventes totales de médicaments brevetés, selon le coût d’un traitement de 28 jours, pour la période de 2006 à 2018. Les barres sont subdivisées en sept sections correspondant au coût d’un traitement de 28 jours : médicaments dont le coût n’est pas connu; médicaments coûtant moins de 2 500 $; 2 500 $ à 3 500 $; 3 500 $ à 5 000 $; 5 000 $ à 7 500 $; 7 500 $ à 10 000 $; plus de 10 000 $.
| Année | Part des ventes de médicaments oncologiques brevetés dont le coût n’est pas connu | Part des ventes de médicaments oncologiques brevetés dont le coût est moins de 2500 $ | Part des ventes de médicaments oncologiques brevetés dont le coût est de 2 500 $ à 3 500 $ | Part des ventes de médicaments oncologiques brevetés dont le coût est de 3 500 $ à 5 000 $ | Part des ventes de médicaments oncologiques brevetés dont le coût est de 5 000 $ à 7 500 $ | Part des ventes de médicaments oncologiques brevetés dont le coût est de 7 500 $ à 10 000 $ | Part des ventes de médicaments oncologiques brevetés dont le coût est de plus de 10 000 $ | Part totale des ventes de médicaments oncologiques brevetés |
|---|---|---|---|---|---|---|---|---|
| 2006 | 1,4 % | 0,5 % | 1,2 % | 0,7 % | 0,1 % | 0,1 % | 0,0 % | 4,0 % |
| 2007 | 1,5 % | 0,4 % | 1,3 % | 0,5 % | 0,2 % | 0,2 % | 0,0 % | 4,1 % |
| 2008 | 1,5 % | 0,8 % | 1,4 % | 1,0 % | 0,2 % | 0,5 % | 0,0 % | 5,4 % |
| 2009 | 1,6 % | 0,8 % | 1,5 % | 1,2 % | 0,3 % | 0,7 % | 0,3 % | 6,4 % |
| 2010 | 1,4 % | 0,9 % | 1,5 % | 1,3 % | 0,4 % | 0,8 % | 0,5 % | 6,8 % |
| 2011 | 1,4 % | 1,0 % | 1,6 % | 1,6 % | 0,6 % | 0,8 % | 0,7 % | 7,7 % |
| 2012 | 1,1 % | 1,0 % | 1,8 % | 2,0 % | 0,6 % | 0,9 % | 1,0 % | 8,4 % |
| 2013 | 0,8 % | 1,0 % | 1,7 % | 2,4 % | 0,9 % | 0,9 % | 1,3 % | 9,0 % |
| 2014 | 0,7 % | 1,0 % | 1,6 % | 2,9 % | 1,0 % | 1,3 % | 1,7 % | 10,2 % |
| 2015 | 0,7 % | 1,0 % | 2,2 % | 3,2 % | 0,8 % | 1,9 % | 2,3 % | 12,1 % |
| 2016 | 0,7 % | 0,5 % | 3,3 % | 3,3 % | 0,8 % | 2,7 % | 2,6 % | 13,9 % |
| 2017 | 0,7 % | 0,4 % | 4,3 % | 3,2 % | 0,9 % | 3,3 % | 3,4 % | 16,2 % |
| 2018 | 0,9 % | 0,4 % | 4,9 % | 3,2 % | 1,5 % | 3,8 % | 6,0 % | 20,7 % |
Le tableau situé sous le diagramme contient de l’information supplémentaire, comme le coût des médicaments, le nombre de médicaments, le coût moyen d’un traitement de 28 jours, ainsi que la population traitée estimée et la part correspondante de la population canadienne totale.
| 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Coût des médicaments | 670M $ | 698M $ | 895M $ | 1 045M $ | 1 150M $ | 1 262M $ | 1 379M $ | 1 520M $ | 1 700M $ | 1 999M $ | 1 2,299M $ | 2 720M $ | 3 446M $ |
| Nombre total de médicaments | 35 | 35 | 40 | 43 | 46 | 53 | 56 | 60 | 68 | 72 | 76 | 80 | 83 |
| Nombre de médicaments dont le coût n’est pas connu | 13 | 12 | 13 | 10 | 11 | 10 | 9 | 9 | 10 | 9 | 8 | 9 | 9 |
| Nombre de médicaments dont le coût est moins de 2 500 $ | 11 | 11 | 13 | 14 | 14 | 16 | 16 | 13 | 14 | 13 | 11 | 11 | 10 |
| Nombre de médicaments dont le coût est de 2 500 $ à 3 500 $ | 2 | 2 | 2 | 3 | 3 | 4 | 4 | 4 | 5 | 6 | 6 | 6 | 7 |
| Nombre de médicaments dont le coût est de 3 500 $ à 5 000 $ | 3 | 3 | 4 | 6 | 6 | 10 | 10 | 11 | 11 | 12 | 12 | 12 | 12 |
| Nombre de médicaments dont le coût est de 5 000 $ à 7 500 $ | 3 | 4 | 4 | 4 | 5 | 5 | 7 | 8 | 9 | 10 | 12 | 11 | 13 |
| Nombre de médicaments dont le coût est de 7 500 $ à 10 000 $ | 3 | 3 | 3 | 4 | 4 | 4 | 5 | 7 | 8 | 9 | 12 | 14 | 17 |
| Nombre de médicaments dont le coût est de plus de 10 000 $ | 0 | 0 | 1 | 2 | 3 | 4 | 5 | 8 | 11 | 13 | 15 | 17 | 24 |
| Coût moyen d’un traitement de 28 jours | 3 555 $ | 3 785 $ | 3 867 $ | 4 492 $ | 4 803 $ | 4 888 $ | 5 090 $ | 5 564 $ | 6 011 $ | 6 293 $ | 6 270 $ | 6 445 $ | 7 152 $ |
| Population traitée estimée | 167 070 | 169 712 | 371 137 | 393 209 | 466 689 | 538 561 | 578 748 | 589 003 | 615 358 | 635 842 | 552 606 | 608 244 | 681 758 |
| Part de la population | 0,51 % | 0,52 % | 1,12 % | 1,17 % | 1,37 % | 1,57 % | 1,67 % | 1,68 % | 1,73 % | 1,78 % | 1,53 % | 1,65 % | 1,83 % |
Aperçu : médicaments à coût élevé dans les régimes publics et privés d’assurance-médicaments
Les médicaments à coût élevé comptent pour environ 30 % des dépenses des régimes publics et privés d’assurancemédicaments. Or, ce taux est inférieur à la part des médicaments brevetés rapportée à la figure 11, puisque les coûts des régimes publics et privés comprennent également les médicaments génériques non brevetés et non brevetés de source unique.
En 2018, les régimes privés d’assurance-médicaments couvraient 189 médicaments à coût élevé, alors que les régimes publics couvraient 99 médicaments à coût élevé à l’exercice 2017-2018. Il convient de noter que les médicaments oncologiques et autres médicaments à coût élevé couverts par les régimes publics peuvent être sous-estimés, car certains sont remboursés dans le cadre de programmes spécialisés, notamment les soins oncologiques, et ne sont pas pris en compte dans les données.
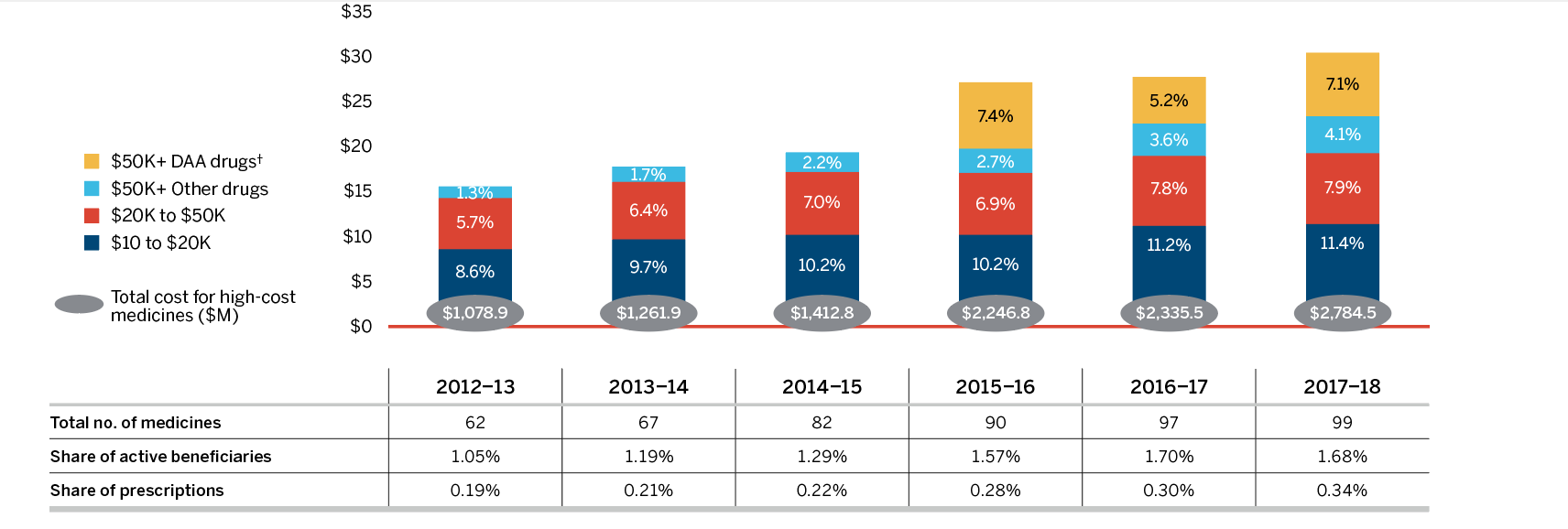
Remarque : Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
* Colombie-Britannique, Alberta, Saskatchewan, Manitoba, Ontario, Nouveau-Brunswick, Nouvelle-Écosse, Île-du-Prince-Édouard, Terre-Neuve-et-Labrador, Yukon et le Programme des services de santé non assurés
† AAD : Antiviraux à action directe pour le traitement de l’hépatite C, lancés en 2014-2015
Source de données : Base de données du SNIUMP, ICIS (données de l’exercice)
[Rapport du SNIUMP : CompasRx, 2017-2018]
Description de la figure
Ce graphique à colonnes empilées et le tableau qui l’accompagne montrent les tendances relatives aux médicaments à coût élevé de 2012-2013 à 2017-2018. Les colonnes sont divisées en sections en fonction des coûts annuels moyens par bénéficiaire actif : 10 000 $ à 20 000 $; 20 000 $ à 50 000 $; et plus de 50 000 $. La part des nouveaux antiviraux à action directe (AAD) pour l’hépatite C est donnée séparément. Le tableau complémentaire indique le nombre total de médicaments à coût élevé, la part des bénéficiaires utilisant ces médicaments et la part des ordonnances qu’ils représentent.
Part du coût total des médicaments attribuable aux médicaments à coût élevé
| 2012-2013 | 2013-2014 | 2014-2015 | 2015-2016 | 2016-2017 | 2017-2018 | |
|---|---|---|---|---|---|---|
| Coût des médicaments en millions de dollars | 1 078,9 $ | 1 261,9 $ | 1 412,8 $ | 2 246,8 $ | 2 335,5 $ | 2 784,5 $ |
| Nombre total de médicaments | 62 | 67 | 82 | 90 | 97 | 99 |
| Coût moyen de 10 000 $ à 20 000 $ par bénéficiaire actif : part du coût total des médicaments | 8,6 % | 9,7 % | 10,2 % | 10,2 % | 11,2 % | 11,4 % |
| Coût moyen de 20 000 $ à 50 000 $ par bénéficiaire actif : part du coût total des médicaments | 5,7 % | 6,4 % | 7,0 % | 6,9 % | 7,8 % | 7,9 % |
| Coût moyen de plus de 50 000 $ par bénéficiaire actif : part du coût total des médicaments pour les médicaments autres que les AAD pour l’hépatite C | 1,3 % | 1,7 % | 2,25 | 2,7 % | 3,6 % | 4,1 % |
| Coût moyen de plus de 50 000 $ par bénéficiaire actif : part du coût total des médicaments pour les AAD | 0 % | 0 % | 0 % | 7,4 % | 5,2 % | 7,1 % |
| Médicaments à coût élevé : part des bénéficiaires actifs | 1,05 % | 1,19 % | 1,29 % | 1,57 % | 1,70 % | 1,68 % |
| Médicaments à coût élevé : part des ordonnances totales | 0,19 % | 0,21 % | 0,22 % | 0,28 % | 0,30 % | 0,34 % |
Principales classes thérapeutiques exerçant une influence sur les recettes tirées de ventes
Les « agents antinéoplasiques et immunomodulateurs », les « anti-infectieux généraux pour usage systémique et produits antiparasitaires » et les « produits agissant sur le tube digestif et le métabolisme » étaient les trois classes thérapeutiques les plus vendus en 2018, comptant pour 60 % du total de ventes de médicaments brevetés. Après avoir connu une croissance des ventes se situant dans les deux chiffres en 2017, les ventes d’« agents antinéoplasiques et immunomodulateurs » les plus vendus ont diminué en 2018, car les ventes de certains médicaments importants ont cessé d’être déclarées au CEPMB.
En 2018, les coûts de traitement annuels pour six des dix
médicaments les plus vendus dépassaient 10 000 $.
La figure 14 ventile les ventes de médicaments brevetés au Canada par classe thérapeutique à l’aide du niveau 1 du Système de classification anatomique, thérapeutique, chimique (ATC) de l’Organisation mondiale de la Santé (OMS)Note de bas de page 8. Les deux graphiques en beignes comparent la part des ventes totales pour chaque classe thérapeutique en 2018 à la part en 2008. Les tableaux correspondants indiquent les ventes de 2018 pour chaque classe et le taux de croissance des ventes de 2017 à 2018.
La catégorie des agents antinéoplasiques et immunomodulateurs représentait une part beaucoup plus importante des ventes en 2018 (33,7 %) qu’en 2008 (15,6 %), car plus de médicaments coûteux sont entrés sur le marché au cours de la dernière décennie. En revanche, la part des ventes de médicaments pour le système cardiovasculaire a diminué considérablement, passant de 24,5 % à 3,8 %.
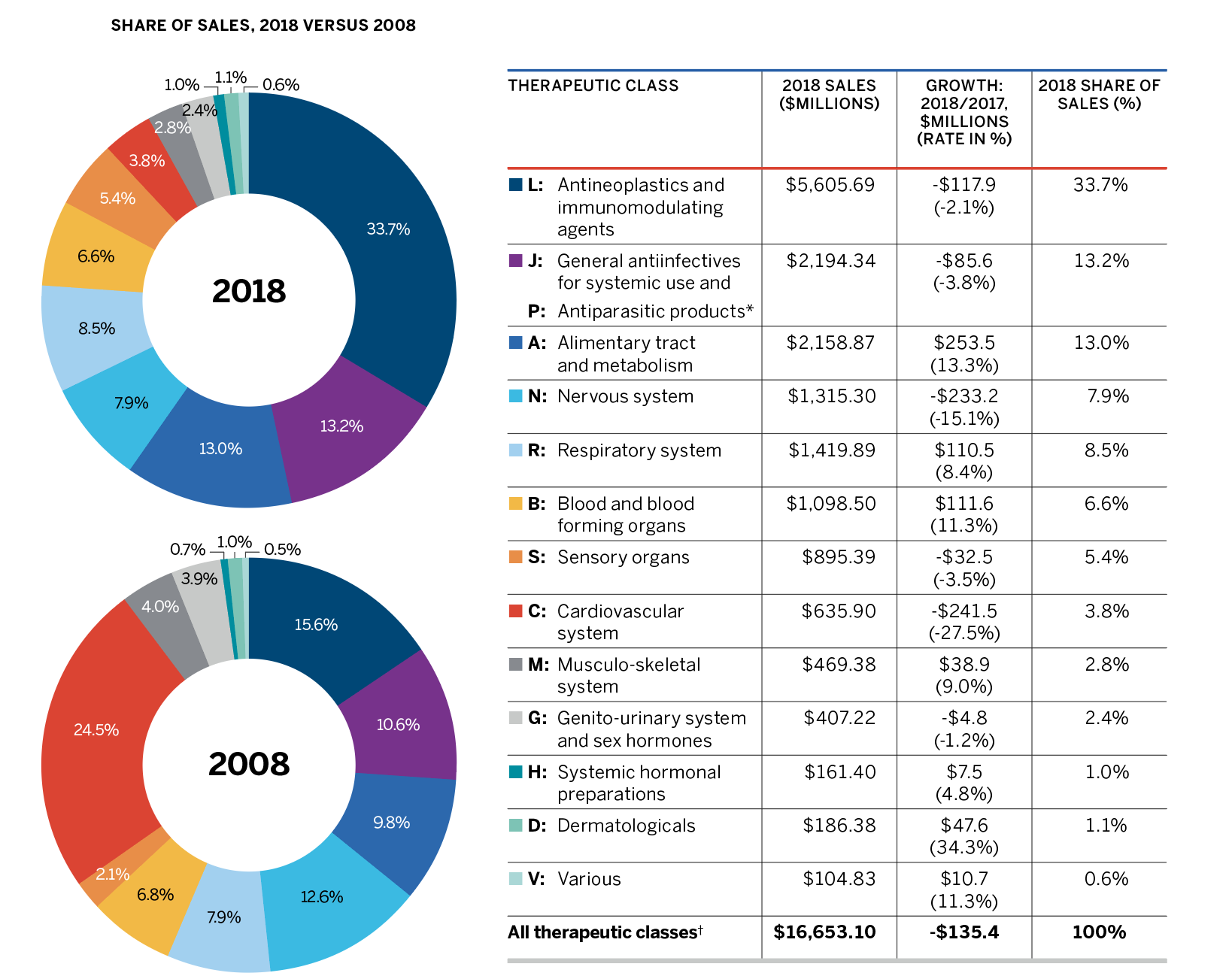
* Pour des raisons de confidentialité, les données sur ces groupes ont été combinées.
† Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source de données : CEPMB
Description de la figure
Ces diagrammes circulaires montrent les ventes de médicaments brevetés en pourcentage de toutes les ventes de médicaments par classe thérapeutique, en 2018 et en 2008
| Classe thérapeutique | Part des ventes (%) 2018 | Part des ventes (%) 2008 |
|---|---|---|
| L : Antinéoplasiques et immunomodulateurs | 33,7 | 15,6 |
| J : Anti-infectieux généraux pour usage systémique et P : Produits antiparasitaires | 13,2 | 10,6 |
| A : Tube digestif et métabolisme alimentaire | 13,0 | 9,8 |
| N : Système nerveux | 7,9 | 12,6 |
| R : Appareil respiratoire | 8,5 | 7,9 |
| B : Sang et organes hématopoïétiques | 6,6 | 6,8 |
| S : Organes sensoriels | 5,4 | 2,1 |
| C : Système cardiovasculaire | 3,8 | 24,5 |
| M : Système musculosquelettique | 2,8 | 4,0 |
| G : Système génito-urinaire et hormones sexuelles | 2,4 | 3,9 |
| H : Préparations hormonales systémiques | 1,0 | 0,7 |
| D : Médicaments dermatologiques | 1,1 | 1,0 |
| V : Divers | 0,6 | 0,5 |
Le tableau complémentaire indique les ventes totales de 2018 par classe thérapeutique, la croissance des ventes (en millions de dollars) et le taux de croissance (en pourcentage) de 2017 à 2018, et la part des ventes de 2018.
| Classe thérapeutique | Ventes 2018 (millions de dollars) |
Croissance : 2017-2018, M$ (taux en %) | Répercussion sur la variation des dépenses (%) | Part des ventes de 2018 (%) |
|---|---|---|---|---|
| L : Antinéoplasiques et immunomodulateurs | 5 605,69 $ | -117,9 $ (-2,1 %) |
33,7 % | |
| J : Anti-infectieux généraux pour usage systémique et P : Produits antiparasitaires | 2 194,34 $ | -85,6 $ (-3,8 %) |
13,2 % | |
| A : Tube digestif et métabolisme alimentaire | 2 158,87 $ | 253,5 $ (13,3 %) |
13,0 % | |
| N : Système nerveux | 1 315,30 $ | -233,2 $ (-15,1 %) |
7,9 % | |
| R : Appareil respiratoire | 1 419,89 $ | 110,5 $ (8,4 %) |
8,5 % | |
| B : Sang et organes hématopoïétiques | 1 098,50 $ | 111,6 $ (11,3 %) |
6,6 % | |
| S : Organes sensoriels | 895,39 $ | -32,5 $ (-3,5 %) |
5,4 % | |
| C : Système cardiovasculaire | 635,90 $ | -241,5 $ (-27,5 %) |
3,8 % | |
| M : Système musculosquelettique | 469,38 $ | 38,9 $ (9,0 %) |
2,8 % | |
| G : Système génito-urinaire et hormones sexuelles | 407,22 $ | -4,8 $ (-1,2 %) |
2,4 % | |
| G : Système génito-urinaire et hormones sexuelles | 161,40 $ | 7,5 $ (4,8 %) |
1,0 % | |
| D : Médicaments dermatologiques | 186,38 $ | 47,6 $ (34,3 %) |
1,1 % | |
| V : Divers | 104,83 $ | 10,7 $ (11,3 %) |
0,6 % | |
| Toutes les classes thérapeutiques | 16 653,10 $ | -134,4 $ | 100 % |
Médicaments biologiques
Les médicaments biologiques, dont la majorité fait partie de la catégorie des médicaments à coût élevé, occupent une part croissante du marché canadien, ayant passé de 16 % des ventes de médicaments brevetés en 2008 à 39 % en 2018. En 2018, Humira, Eylea, et Enbrel étaient les médicaments biologiques les plus vendus, représentant collectivement près de 10 % du total des ventes de médicaments brevetés. La figure 15 présente une ventilation de la croissance annuelle des ventes de médicaments biologiques brevetés par classe thérapeutique principale.
Bien que la croissance de la part des ventes de médicaments biologiques touche nombre de groupes thérapeutiques, les immunosuppresseurs ont connu l’augmentation la plus élevée au cours de la dernière décennie, passant de 4 % du total des ventes de médicaments brevetés en 2008 à 17 % en 2017, principalement sous l’impulsion de la vente de trois médicaments : Remicade, Humira, et Enbrel.
Cependant, en 2018, la part des ventes des immunosuppresseurs parmi l’ensemble des médicaments brevetés est passée de 17 % à 13 %, car le médicament le plus vendu Remicade n’était plus déclaré au CEPMB. Bien que les ventes de ces médicaments aient continué d’avoir une incidence notable sur le marché pharmaceutique canadien, elles n’étaient plus prises en compte dans les données du CEPMB. En 2018, la part globale des médicaments biologiques a reculé de 42 % à 39 % en raison de l’effet de retrait de ces importants médicaments. La part de tous les autres groupes de médicaments biologiques est demeurée la même qu’en 2017, à l’éxception des médicaments oncologiques, qui représentent une part sans cesse croissante du marché.
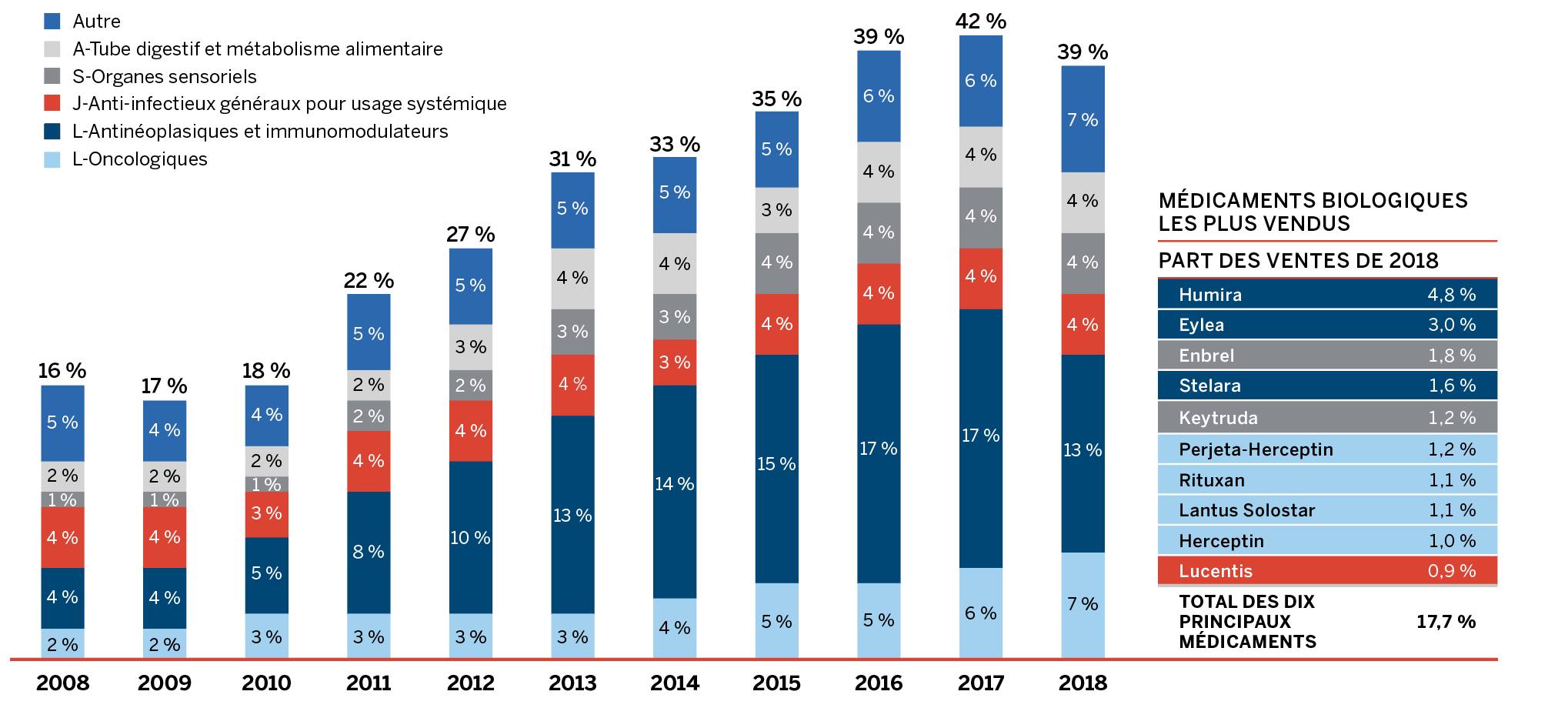
Source de données : CEPMB
Description de la figure
Ce diagramme à barres illustre la part des médicaments biologiques des ventes totales de médicaments brevetés par classe thérapeutique de 2008 à 2018. Chaque barre est subdivisée en fonction des différentes classes thérapeutiques : autre; tube digestif et métabolisme alimentaire; organes sensoriels; anti-infectieux généraux pour usage systémique; agents immunomodulateurs – autres qu’oncologiques; et oncologie. Les ventes totales en milliards de dollars sont indiquées pour chaque année.
| Classe thérapeutique | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|---|---|---|---|---|---|
Autre |
5 % |
4 % |
4 % |
5 % |
5 % |
5 % |
5 % |
5 % |
6 % |
6 % |
7 % |
A : Tube digestif et métabolisme alimentaire |
2 % |
2 % |
2 % |
2 % |
3 % |
4 % |
4 % |
3 % |
4 % |
4 % |
4 % |
S : Organes sensoriels |
1 % |
1 % |
1 % |
2 % |
2 % |
3 % |
3 % |
4 % |
4 % |
4 % |
4 % |
J : Anti-infectieux généraux pour usage systémique |
4 % |
4 % |
3 % |
4 % |
4 % |
4 % |
3 % |
4 % |
4 % |
4 % |
4 % |
L : Agents immunomodulateurs – autres qu’oncologiques |
4 % |
4 % |
5 % |
8 % |
10 % |
13 % |
14 % |
15 % |
17 % |
17 % |
13 % |
L : Oncologie |
2 % |
2 % |
3 % |
3 % |
3 % |
3 % |
4 % |
5 % |
5 % |
6 % |
7 % |
Le tableau complémentaire montre la part des ventes de 2018 des dix médicaments biologiques les plus vendus, ainsi que leur classe thérapeutique.
| Médicament | Classe thérapeutique | Part des ventes de 2018 |
|---|---|---|
Humira |
L : Agents immunomodulateurs – autres qu’oncologiques |
4,8 % |
Eylea |
S : Organes sensoriels |
3,0 % |
Enbrel |
L : Agents immunomodulateurs – autres qu’oncologiques |
1,8 % |
Stelara |
L : Agents immunomodulateurs – autres qu’oncologiques |
1,6 % |
Keytruda |
L : Oncologie |
1,2 % |
Perjeta-Herceptin |
L : Oncologie |
1,2 % |
Rituxan |
L : Oncologie |
1,1 % |
Lantus Solostar |
A : Tube digestif et métabolisme alimentaire |
1,1 % |
Herceptin |
L : Oncologie |
1,0 % |
Lucentis |
S : Organes sensoriels: |
0,9 % |
Total des 10 principaux médicaments biologiques |
17,7 % |
|
Aperçu : adoption des biosimilaires
En raison de l’utilisation et du coût élevés des médicaments biologiques au Canada, les biosimilaires offrent l’occasion de réaliser des économies de coûts importantes. Cependant, contrairement aux médicaments génériques, les biosimilaires ne sont pas identiques à leurs médicaments d’origine; il s’agit plutôt de versions fort similaires. L’autorisation d’un biosimilaire par Santé Canada n’est pas une déclaration d’équivalence au médicament biologique d’origine, ce qui est l’une des exigences des autorités provinciales et territoriales pour en juger le caractère interchangeable. Cela complexifie la substitution d’un médicament par un autre, et peut rendre les nouveaux patients et les prescripteurs plus hésitants à recourir à un biosimilaire. De plus, une perte d’exclusivité ne se traduit pas nécessairement par une baisse des ventes des médicaments biologiques d’origine.
Les prix des biosimilaires sont généralement plus élevés au Canada que dans d’autres pays, si bien que leur adoption est plus faible. De plus, lorsque des biosimilaires deviennent disponibles, les nouveaux patients peuvent être plus susceptibles de commencer à prendre d’autres médicaments biologiques d’origine plutôt que la solution de rechange biosimilaire.
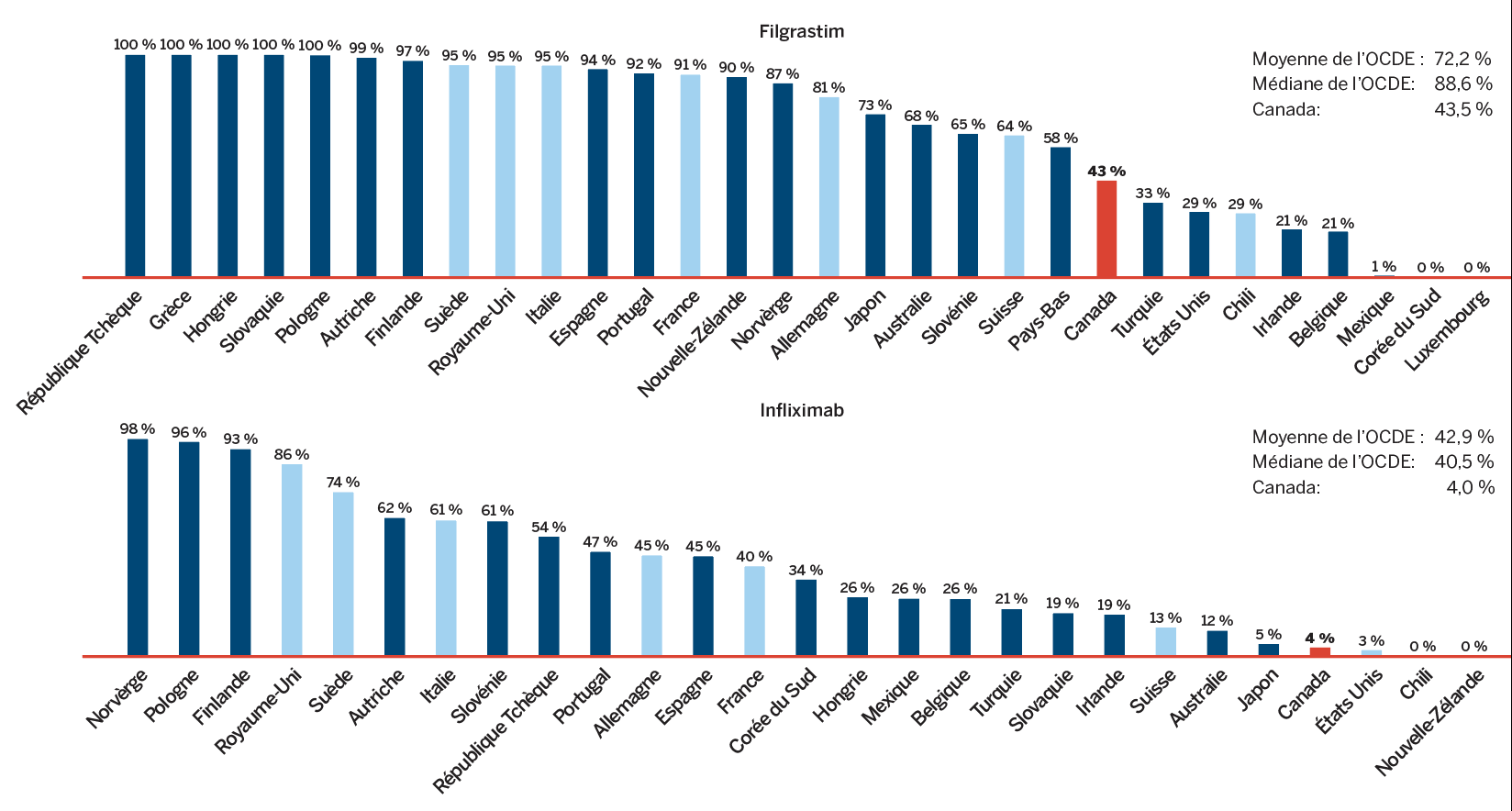
Remarque : Les pays sans ventes de biosimilaires consignées dans la base de données MIDAS® sont exclus du calcul des moyennes de l’OCDE.
Source de données : Politiques internationales sur l’utilisation adéquate des médicaments biosimilaires (Association canadienne des médicaments
et des technologies de la santé, 2018); base de données MIDAS®, 2017, IQVIA (tous droits réservés)
[Rapport du SNIUMP : Veille des médicaments mis en marché, 2017]]
Description de la figure
Ces deux diagrammes à barres illustrent l’adoption de deux médicaments biologiques : le filgrastim et l’infliximab. La part des unités vendues est donnée pour chaque pays de l’Organisation de coopération et de développement économiques (OCDE) au dernier trimestre de 2017. La moyenne et la médiane de l’OCDE sont aussi indiquées.
| Pays de l’OCDE | Part des unités vendues pour le filgrastim |
|---|---|
| Estonie | |
| République tchèque | 100 % |
| Grèce | 100 % |
| Hongrie | 100 % |
| Slovaquie | 100 % |
| Pologne | 100 % |
| Autriche | 99 % |
| Finlande | 97 % |
| Suède | 95 % |
| Royaume-Uni | 95 % |
| Italie | 95 % |
| Espagne | 94 % |
| Portugal | 92 % |
| France | 91 % |
| Nouvelle-Zélande | 90 % |
| Norvège | 87 % |
| Allemagne | 81 % |
| Japon | 73 % |
| Australie | 69 % |
| Slovénie | 65 % |
| Suisse | 64 % |
| Pays-Bas | 59 % |
| Canada | 44 % |
| Turquie | 34 % |
| États-Unis | 29 % |
| Chili | 29 % |
| Irlande | 22 % |
| Belgique | 21 % |
| Mexique | 1 % |
| Corée | 0 % |
| Luxembourg | 0 % |
| Moyenne de l’OCDE | 72,2 % |
| Médiane de l’OCDE | 88,6 % |
| Pays de l’OCDE | Part des unités vendues pour l’infliximab |
|---|---|
| Estonie | |
| Grèce | S.O. |
| Norvège | 98 % |
| Pologne | 96 % |
| Finlande | 93 % |
| Royaume-Uni | 86 % |
| Suède | 74 % |
| Autriche | 62 % |
| Italie | 61 % |
| Slovénie | 61 % |
| République tchèque | 54 % |
| Portugal | 47 % |
| Allemagne | 45 % |
| Espagne | 45 % |
| France | 41 % |
| Corée | 35 % |
| Hongrie | 27 % |
| Mexique | 26 % |
| Belgique | 26 % |
| Turquie | 21 % |
| Slovaquie | 19 % |
| Irlande | 19 % |
| Suisse | 13 % |
| Australie | 12 % |
| Japon | 6 % |
| Canada | 4 % |
| États-Unis | 3 % |
| Chili | 0 % |
| Nouvelle-Zélande | 0 % |
| Moyenne de l’OCDE | 42.9 % |
| Médiane de l’OCDE | 40.5 % |
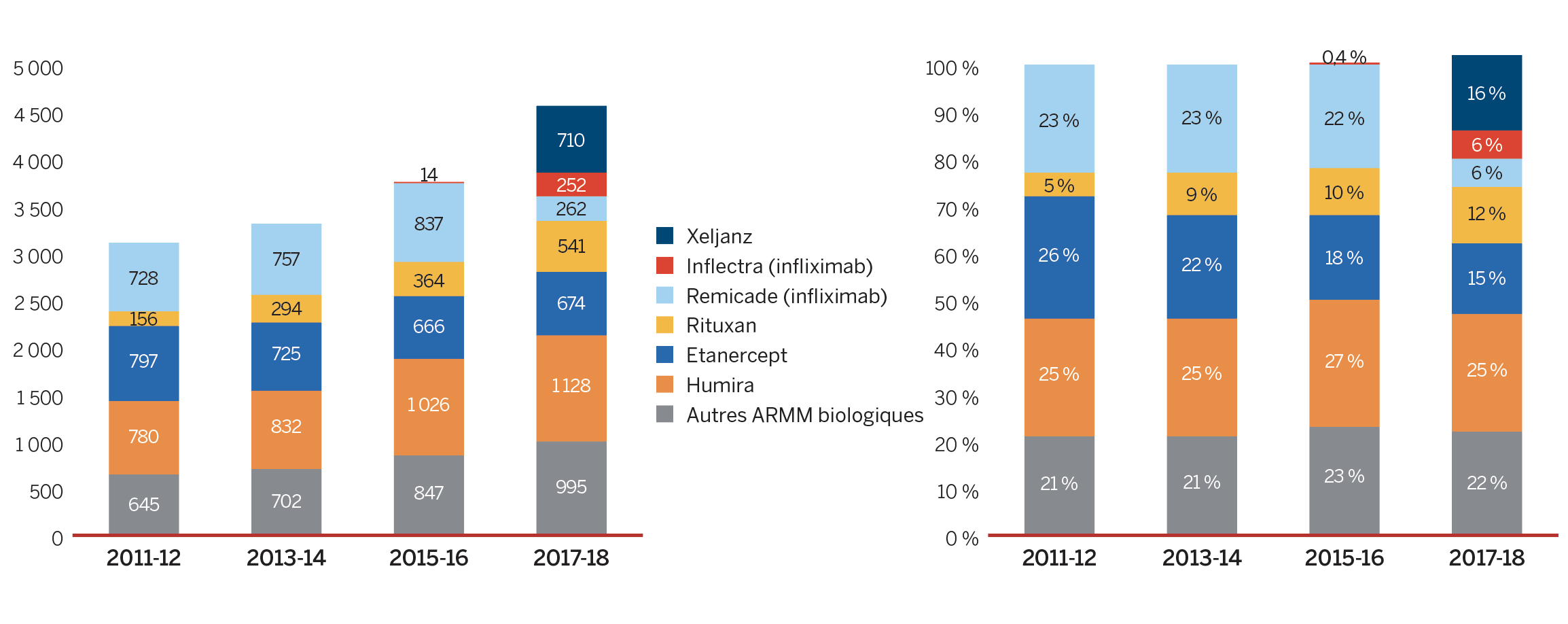
Remarque : Les autres ARMM biologiques comprennent Simponi, Orencia, Actemra et Cimzia. Les résultats ne font pas de distinction entre l’utilisation pour la polyarthrite rhumatoïde et d’autres indications.
Source de données : Base de données du SNIUMP, ICIS
[Rapport du SNIUMP : CompassRx, 2017-2018]
Description de la figure
Ces deux diagrammes à colonnes empilées montrent la répartition des nouveaux patients ayant commencé à prendre certains médicaments antirhumatismaux modificateurs de la maladie, par médicament, en 2011-2012, puis une année sur deux jusqu’en 2017-2018. Le premier diagramme donne le nombre de nouveaux patients qui ont commencé à prendre chaque médicament, alors que le deuxième indique la répartition en pourcentage des nouveaux patients entre les différents antirhumatismaux modificateurs de la maladie retenus.
| Autres ARMM biologiques | Humira | Étanercept | Rituxan | Remicade (infliximab) | Inflectra (infliximab) | Xeljanz | |
|---|---|---|---|---|---|---|---|
| 2011-2012 | 645 | 780 | 797 | 156 | 728 | – | – |
| 2013-2014 | 702 | 832 | 725 | 294 | 757 | – | – |
| 2015-2016 | 847 | 1 026 | 666 | 364 | 837 | 14 | – |
| 2017-2018 | 995 | 1 128 | 674 | 541 | 262 | 252 | 710 |
| Autres ARMM biologiques | Humira | Étanercept | Rituxan | Remicade (infliximab) | Inflectra (infliximab) | Xeljanz | |
|---|---|---|---|---|---|---|---|
| 2011-2012 | 21 % | 25 % | 26 % | 5 % | 23 % | – | – |
| 2013-2014 | 21 % | 25 % | 22 % | 9 % | 23 % | – | – |
| 2015-2016 | 23 % | 27 % | 18 % | 10 % | 22 % | 0,4 % | – |
| 2017-2018 | 22 % | 25 % | 15 % | 12 % | 6 % | 6 % | 16 % |
Médicaments oncologiques
La figure 18 illustre la croissance des ventes de tous les médicaments oncologiques (biologiques et autres) au cours de la dernière décennie. Les médicaments oncologiques comptent maintenant pour 20,7 % du total des ventes de médicaments brevetés, une hausse substantielle par rapport à 2008, où cette part n’était que de 5,4 %. Les traitements contre le cancer administrés par voie orale sont un segment émergent, augmentant leur part du marché des médicaments brevetés de 1,7 % à 9,2 % pendant la même période. Revlimid était le médicament oncologique le plus vendu, représentant 2,5 % du total des ventes de médicaments brevetésNote de bas de page 9.
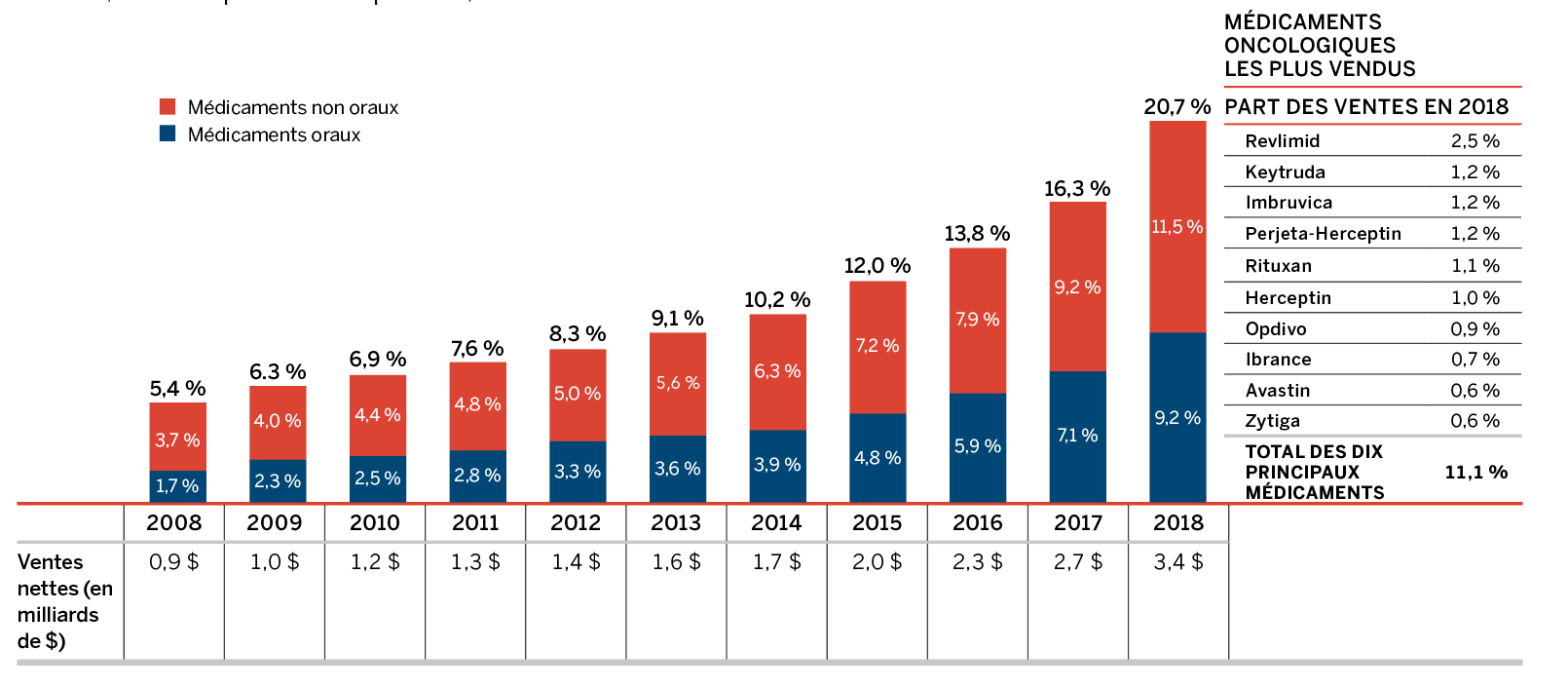
Remarque : Ces résultats traduisent les ventes totales de médicaments brevetés utilisés dans le traitement du cancer. Bien que certains de ces médicaments puissent également être utilisés pour traiter d'autres maladies, les données utilisées pour cette analyse ne font pas de distinction entre les indications, de sorte que les ventes déclarées peuvent refléter une certaine utilisation non liée au cancer.
Source de données : CEPMB
Description de la figure
Ce diagramme à barres empilées représente la part des médicaments oncologiques des ventes de médicaments brevetés par formulation de 2008 à 2018. Chaque barre est divisée entre les médicaments non oraux et les médicaments oraux. La part totale combinée des médicaments oncologiques, en fonction des ventes de médicaments brevetés, et les ventes nettes en milliards de dollars sont aussi indiquées.
| Formulation | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 |
|---|---|---|---|---|---|---|---|---|---|---|---|
| Médicaments non oraux | 3,7 % | 4,0 % | 4,4 % | 4,8 % | 5,0 % | 5,6 % | 6,3 % | 7,2 % | 7,9 % | 9,2 % | 11,5 % |
| Médicaments oraux | 1,7 % | 2,3 % | 2,5 % | 2,8 % | 3,3 % | 3,6 % | 3,9 % | 4,8 % | 5,9 % | 7,1 % | 9,2 % |
| Part totale des médicaments oncologiques | 5,4 % | 6,3 % | 6,9 % | 7,6 % | 8,3 % | 9,1 % | ,2 % | 12,0 % | 13,8 % | 16,3 % | 20,7 % |
| Ventes (en milliards de dollars) | 0,9 $ | 1,0 $ | 1,2 $ | 1,3 $ | 1,4 $ | 1,5 $ | 1,7 $ | 2,0 $ | 2,3 $ | 2,7 $ | 3,4 $ |
Le tableau complémentaire fournit la part des ventes de 2018 correspondant aux 10 médicaments oncologiques les plus vendus.
| Médicament oncologique | Part des ventes en 2018 |
|---|---|
| Revlimid | 2,5 % |
| Keytruda | 1,2 % |
| Imbruvica | 1,2 % |
| Perjeta-Herceptin | 1,2 % |
| Rituxan | 1,1 % |
| Herceptin | 1,0 % |
| Opdivo | 0,9 % |
| Ibrance | 0,7 % |
| Avastin | 0,6 % |
| Zytiga | 0,6 % |
| Total des dix principaux médicaments | 11,1 % |
Tendances observées au niveau des prix
Le CEPMB utilise l’indice des prix des médicaments brevetés (IPMB) pour assurer le suivi des tendances des prix des médicaments brevetés. L’IPMB mesure la variation annuelle moyenne des prix départ usine des médicaments brevetés pratiqués sur le marché canadien. L’indice est calculé à l’aide de la moyenne de la variation des prix au niveau du médicament pondérée en fonction des ventesNote de bas de page 10. La méthodologie utilisée rappelle celle qu’utilise Statistique Canada pour compiler l’indice des prix à la consommation (IPC). L’IPMB est fondé sur les données rapportées par les brevetés sur les prix moyens par transaction et sur les ventes pour une période de six mois.
L’IPMB ne mesure que la croissance des ventes attribuables aux variations de prix des médicaments brevetés. Il ne mesure pas les variations au niveau de l’utilisation de médicaments brevetés, laquelle est calculée selon l’indice de volume, ou IVVMB (voir la section intitulée « Utilisation faite des médicaments brevetés »). L’IPMB ne mesure pas non plus l’incidence sur les coûts des nouvelles habitudes de prescription des médecins ou de l’arrivée sur le marché de nouveaux médicaments.
La Loi sur les brevets exige que le CEPMB tienne compte des variations de l’IPC, entre autres facteurs, lorsqu’il est appelé à déterminer si le prix d’un médicament breveté est excessif ou non. La figure 19 compare les variations annuelles de l’IPMB par rapport aux variations correspondantes de l’IPC pour les années 2003 à 2018. L’IPMB est présenté en fonction de deux mesures : le prix de transaction moyen national (prix net comprenant les remises et les rabais) et le prix courant national, soit un prix « brut ». Ces deux mesures sont déclarées au CEPMB par les brevetés. L’inflation générale des prix, mesurée au moyen de l’IPC, a été supérieure à l’augmentation moyenne des prix des médicaments brevetés presque chaque année depuis 2003. En 2018, l’IPC a augmenté de 2,3 %, alors que l’IPMB a augmenté de 0,1 %.
Il n’est pas surprenant que l’IPMB ait rarement augmenté au même rythme que l’IPC. Les Lignes directrices du CEPMB prévoient que le prix d’un médicament breveté ne devrait pas dépasser l’IPC sur une période de trois ansNote de bas de page 11. (Les Lignes directrices envisagent également un plafond des hausses de prix d’une année sur l’autre équivalant à une fois et demie le taux annuel actuel d’inflation de l’IPC.) Cette exigence a pour effet de limiter les augmentations des prix des médicaments à celles de l’IPC sur une période de trois ans. En général, les variations de l’IPMB n’atteignent jamais cette limite étant donné qu’un grand nombre de brevetés n’augmentent pas les prix de leurs médicaments dans toute la mesure envisagée par les Lignes directrices.
L’augmentation des prix des médicaments brevetés était inférieure à l’IPC
En 2018, l’augmentation moyenne des prix des médicaments brevetés était, en moyenne, inférieure au taux d’inflation, telle que mesurée par l’indice des prix à la consommation (IPC) et, par conséquent, n’a pas contribué à la croissance des ventes.
Source de données : CEPMB; Statistique Canada
Description de la figure
Ce diagramme linéaire montre le pourcentage de variation de l’IPMB et de l’IPC d’une année à l’autre pour la période de 2003 à 2018. L’IPMB est représenté par deux lignes : l’une se fonde sur le prix de transaction moyen national et l’autre, sur le prix courant national.
| 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Variation de l’IPC | 2,8 | 1,8 | 2,2 | 2,0 | 2,2 | 2,3 | 0,3 | 1,8 | 2,9 | 1,5 | 0,9 | 2,0 | 1,1 | 1,4 | 1,6 | 2,3 |
| Variation de l’IPMB (prix courant national) | 0,6 | 1,0 | 1,2 | 0,1 | 1,4 | 2,9 | 1,3 | 2,4 | 1,4 | 1,2 | 1,4 | 0,8 | 0,2 | 0,3 | 0,8 | 0,1 |
| Variation de l’IPMB (prix de transaction moyen national) | 0,1 | 0,7 | 0,5 | -0,2 | 0.0 | -0,1 | 0,2 | -0,5 | -0,1 | 0,3 | -0,1 | 0,0 | 0,0 | 0,7 | -0,2 | -0,4 |
Variation du prix après le lancement
Le prix du médicament breveté type varie-t-il beaucoup au cours des années qui suivent son lancement sur le marché canadien? La figure 20 répond à cette question en présentant le ratio moyen des prix de vente des médicaments en 2018 par rapport aux prix de lancement (prix auxquels ils ont été vendus à leur première année sur le marché canadien).
Les résultats présentés à la figure 20 indiquent une tendance uniforme selon laquelle les prix demeurent stables tôt dans le cycle de vie, puis augmentent graduellement d’un petit montant au cours des années subséquentes. Cela s’harmonise avec l’effet de la méthodologie de l’IPC du CEPMBNote de bas de page 12 Par exemple, les prix moyens des médicaments lancés il y a une décennie sont toujours au même niveau en 2018.
Source de données : CEPMB
Description de la figure
Il s’agit d’un diagramme à barres présentant le ratio moyen du prix de 2018 d’un médicament breveté type, par rapport à son prix de lancement (prix de vente du médicament l’année de son lancement sur le marché canadien). Le diagramme comprend les médicaments lancés entre 1995 et 2017. Une ligne située au niveau 1,00 correspond au prix de 2018.
En ce qui concerne les médicaments lancés en 1995, le ratio moyen entre le prix de 2018 et le prix de lancement est de 1,07. En 1996, 1,16;
1997, 1,12; 1998, 1,05; 1999, 1,09; 2000, 1,09; 2001, 1,07; 2002, 1,04; 2003, 1,03; 2004, 1,04;
2005, 1,02; 2006, 1,02; 2007, 1,01; 2008, 1,00; 2009, 0,99; 2010, 0,99; 2011, 0,99; 2012, 0,98;
2013, 0,99; 2014, 0,98; 2015, 0,99; 2016, 0,98; 2017, 0,98.
Variation des prix selon le pays
La Loi et son Règlement obligent les brevetés à faire rapport des prix de leurs médicaments brevetés accessibles au public qu’ils pratiquent dans les sept pays de comparaison (CEPMB7) : France, Allemagne, Italie, Suède, Suisse, Royaume-Uni et États-Unis.
Le CEPMB utilise ces données aux fins suivantes :
- effectuer des comparaisons des prix à l’étranger;
- comparer les prix des médicaments brevetés pratiqués au Canada avec les prix pratiqués dans d’autres pays.
La figure 21 présente les taux moyens annuels de variation des prix pour le Canada et chacun des pays du CEPMB7. Ces valeurs ont été obtenues en appliquant la méthodologie de l’IPMB (avec pondération pour tenir compte des tendances des ventes au Canada) aux données sur les prix pratiqués dans les différents pays de comparaison soumises par les brevetés au CEPMB. Il convient de noter que les résultats pour les États-Unis sont fondés sur des prix qui tiennent compte des prix de la Classification fédérale des approvisionnements (US Federal Supply Schedule ou FSS)Note de bas de page 13.
En 2018, les prix aux États-Unis ont augmenté, en moyenne, de 5,9 %, alors qu’ils ont reculé dans tous les autres pays. L’Allemagne a connu la plus forte baisse, soit de 10,5 %. Ces résultats concordent avec la tendance observée à long terme selon laquelle les prix des médicaments brevetés baissent graduellement au fil du temps dans la plupart des pays de comparaison (à l’exception des États-Unis).
Les résultats s’appliquant au marché étranger s’appuient sur des données relatives au prix brut, notamment le prix départ usine, accessibles au public (généralement dans la catégorie des clients de la vente au détail) qui sont soumises par les brevetés au CEPMB. Toutefois, pour le Canada, le taux de variation se fonde sur les prix nets, notamment les prix moyens réels par transaction, et ne tient pas compte des remises et des rabais accordés par les fabricants directement à leurs clients.
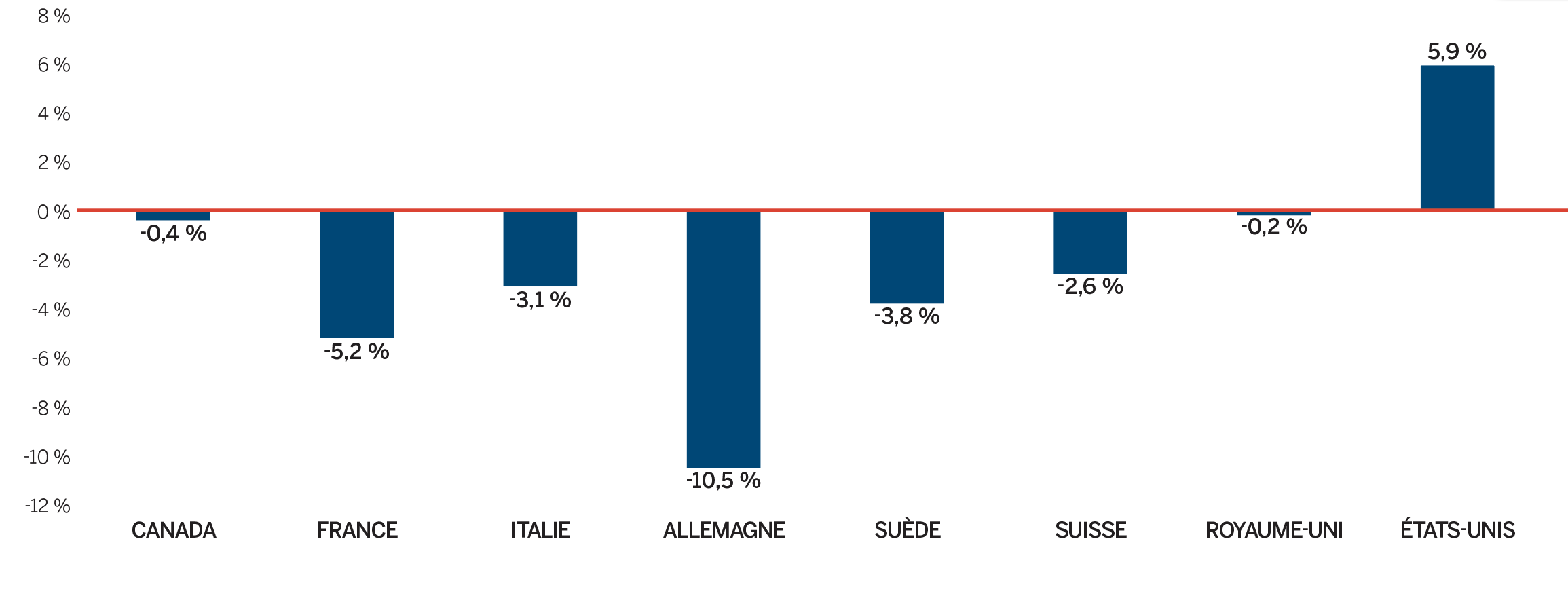
Data source: CEPMB
Description de la figure
Il s’agit d’un diagramme à barres présentant les taux moyens annuels de variation des prix au Canada et dans chacun des sept pays de comparaison du CEPMB en 2018. Au Canada, le taux moyen annuel de variation des prix était de -0,4 %. France : -5,2 %; Italie : -3,1 %; Allemagne : -10,5 %; Suède : -3,8 %; Suisse : -2,6 %; Royaume-Uni : -0,2 %; États-Unis : 5,9 %.
Comparaison des prix pratiqués au Canada avec ceux pratiqués à l’étranger
Les tableaux 9 et 10 présentent des statistiques détaillées qui permettent de comparer les prix des médicaments brevetés pratiqués à l’étranger avec ceux pratiqués au Canada. Chaque tableau présente deux séries de ratios de prix moyens. Les tableaux sont différents selon la méthode de conversion en équivalents dollars canadiens des prix exprimés dans la devise des différents pays. Les tableaux présentent aussi le nombre de concentrations et de formes posologiques des médicaments (DIN) ainsi que le volume des ventes couvertes par chaque ratio de prix déclaréNote de bas de page 14.
Les ratios moyens de prix donnés aux tableaux 9 et 10 sont des moyennes arithmétiques pondérées des ventes de ratios de prix obtenues pour des médicaments individuels, dont la pondération est fondée sur les tendances des ventes au Canada. Les ratios moyens de prix interprétés de cette façon répondent à des questions comme celle-ci :
Combien les Canadiens auraient-ils payé, en plus ou en moins, leurs médicaments brevetés en 2018 s’ils les avaient achetés aux prix pratiqués dans le pays X?
Par exemple, on peut voir dans le tableau 9 que le ratio moyen de prix en France par rapport au prix moyen au Canada était de 0,74 pour 2018. Cela signifie que les Canadiens auraient payé leurs médicaments brevetés 26 % moins cher en 2018 s’ils avaient pu les acheter aux prix pratiqués en France.
Depuis plusieurs années, le CEPMB a fait rapport des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada après avoir converti les prix en équivalents dollars canadiens à l’aide des moyennes des taux de change du marché. (Plus précisément, les moyennes mobiles des taux de change sur une période de 36 mois que le CEPMB utilise généralement lorsqu’il applique ses Lignes directrices). Les tableaux 9 et 10 comparent également les ratios des prix dans les pays de comparaison par rapport à leurs prix au Canada, après avoir converti la devise à l’aide de la parité des pouvoirs d’achat (PPA). Le taux de parité des pouvoirs d’achat représente le coût de la vie relatif dans ces deux pays exprimé dans leurs devises respectives. En pratique, le coût de la vie est calculé à l’aide d’un « panier » de produits et de services aux prix courants dans chaque pays.
Étant donné que les taux de parité des pouvoirs d’achat représentent le coût relatif de la vie dans chacun des pays, ils constituent un moyen simple de rajuster les prix pour tenir compte des différences de prix, de revenus et d’autres valeurs monétaires dans la comparaison des prix pratiqués dans les différents pays. Appliqués au calcul des ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, les taux de parité des pouvoirs d’achat fournissent des statistiques qui nous permettent de répondre à des questions comme celle-ci :
Quel montant, en plus ou en moins, les Canadiens auraient-ils dû payer pour les médicaments brevetés achetés en 2018 s’ils avaient dû payer les prix du pays X au lieu des prix pratiqués au Canada?
On ne peut répondre à une telle question en limitant la comparaison aux prix des médicaments. Il faut plutôt calculer ce que chaque prix représente en termes de biens et de services sacrifiés. C’est précisément ce que permettent de faire les parités des pouvoirs d’achat.
Comparaisons bilatérales des prix
Le tableau 9 fournit des comparaisons bilatérales des prix dans chacun des pays du CEPMB7 par rapport aux prix correspondants pratiqués au Canada. D’après les résultats de la conversion des différentes devises aux taux de change du marché, il semble que, comme lors des années antérieures, les prix pratiqués au Canada se situaient en général dans la gamme des prix observés parmi les pays de comparaison. Les prix en France étaient sensiblement inférieurs aux prix au Canada, suivis par la Suède et l’Italie. Les prix au Royaume-Uni étaient équivalents à ceux du Canada, alors que les prix pratiqués en Allemagne et en Suisse étaient plus élevés. Comme lors des années antérieures, les prix déclarés étaient beaucoup plus élevés aux États-Unis qu’au Canada et que dans tous les autres pays de comparaison.
Tableau 9. Ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, comparaisons bilatérales, 2018
| Canada | France | Italie | Allemagne | Suède | Suisse | Royaume-uni | États-Unis | |
|---|---|---|---|---|---|---|---|---|
| Ratio moyen des prix en 2018 | 1,00 | 0,74 | 0,97 | 1,09 | 0,94 | 1,08 | 1,00 | 3,59 |
| Ratio moyen des prix en 2017 | 1,00 | 0,75 | 0,95 | 1,12 | 0,93 | 1,12 | 0,94 | 3,36 |
| Canada | France | Italie | Allemagne | Suède | Suisse | Royaume-uni | États-Unis | |
|---|---|---|---|---|---|---|---|---|
| Ratio moyen des prix en 2018 | 1,00 | 0,76 | 1,09 | 1,13 | 0,82 | 0,82 | 0,99 | 3,07 |
| Ratio moyen des prix en 2017 | 1,00 | 0,79 | 1,12 | 1,20 | 0,83 | 0,88 | 0,98 | 3,25 |
| Nombre de médicaments brevetés en 2018 | 1 392 | 662 | 812 | 1 015 | 820 | 863 | 976 | 1 074 |
| Ventes (en millions de $) | 16 325,7 | 10 767,8 | 12 700,9 | 14 200,9 | 12 362,0 | 13 868,6 | 13 213,86 | 14 758,5 |
Source de données : CEPMB
Il importe de noter qu’il n’est pas toujours possible de trouver un prix correspondant dans chaque pays de comparaison pour chacune des concentrations et des formes posologiques des médicaments brevetés vendus au Canada. Le tableau 9 illustre la fréquence de disponibilité d’un prix de comparaison pratiqué dans chacun des pays de comparaison. Par exemple, parmi les 1392 médicaments brevetés déclarés comme relevant de la compétence du CEPMB en 2018, un prix départ usine accessible au public n’était disponible pour la France que dans 48 % des cas, alors que le même chiffre pour les États-Unis s’élevait à 77 %. Vu le caractère intégré de la chaîne d’approvisionnement du Canada et des États-Unis, il arrive souvent que les États-Unis soient le seul autre pays pour lequel un prix de comparaison est disponible relativement à une concentration et à une forme posologique vendues au Canada. Dans un tel cas, ce prix est considéré comme étant le prix international médian pour les fins de la méthodologie du CEPMB.
Les ratios moyens de prix obtenus à la suite de la conversion des devises aux taux de parité des pouvoirs d’achat permettent de tirer les mêmes conclusions. Si l’on tient compte des différences internationales du coût de la vie, le Canada se présente comme le pays où les coûts de consommation pour les médicaments brevetés étaient les plus élevés en 2018 que pour les résidents de la France, la Suède, la Suisse et le Royaume-Uni.
La figure 22 présente ces résultats dans une perspective historique. En 2008, les prix canadiens étaient, en moyenne, légèrement supérieurs à ceux de l’Italie, de la France, de la Suède et du Royaume-Uni, et à peu près identiques à ceux de la Suisse. En 2018, l’écart entre les prix au Canada et les prix en France et en Suède avait légèrement augmenté puisque les prix relatifs dans ces pays avaient diminué, tandis que les prix en Italie et au Royaume-Uni en 2018 étaient plus conformes aux niveaux canadiens. Les prix en Suisse, en Allemagne et aux États-Unis ont tous dépassé ceux au Canada en 2018.
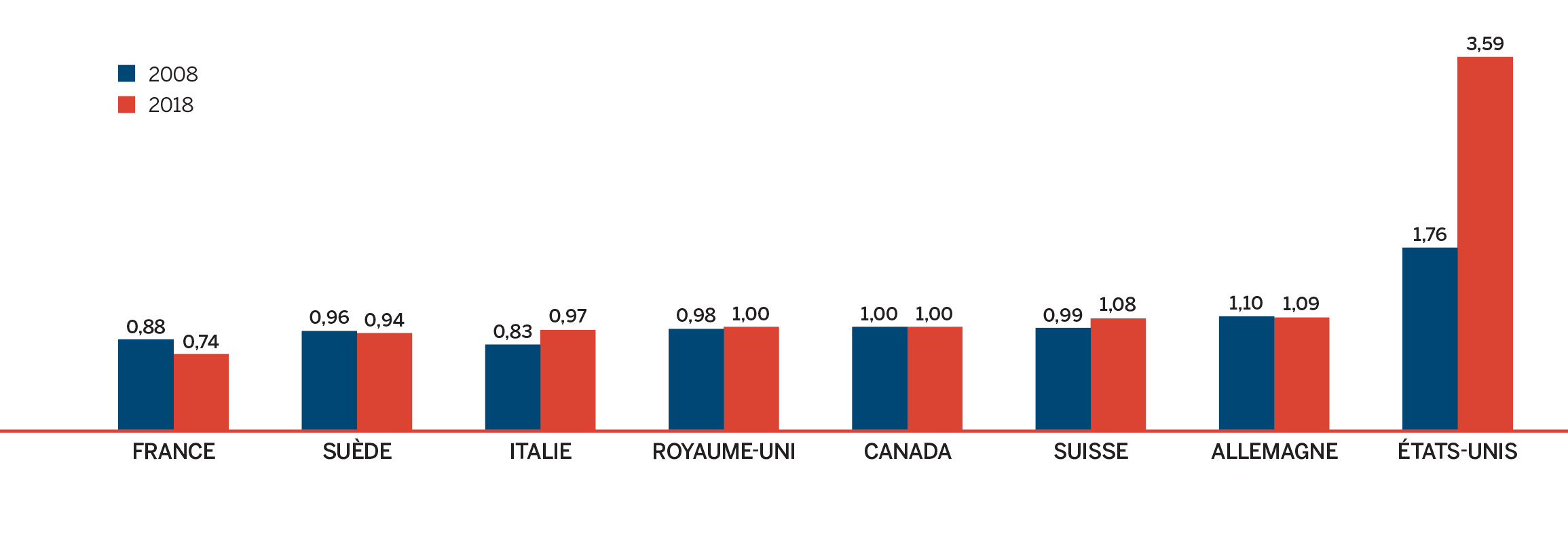
Source de données : CEPMB
Description de la figure
Il s’agit d’un diagramme à barres présentant les ratios moyens des prix étrangers par rapport aux prix canadiens en 2008 et en 2018 pour les sept pays de comparaison du CEPMB.
- France — 2008 : 0,88, 2018 : 0,74
- Suède – 2008 : 0,96, 2018 : 0,94
- Italie – 2008 : 0,83, 2018 : 0,97
- Royaume-Uni – 2008 : 0,98, 2018 : 1,00
- Canada – 2008 : 1,00, 2018 : 1,00
- Suisse – 2008 : 0,99, 2018 : 1,08
- Allemagne – 2008 : 1,10, 2018 : 1,09
- États-Unis – 2008 : 1,76, 2018 : 3,59
Si le médicament breveté est vendu dans un ou plusieurs des pays du CEPMB7, le breveté doit soumettre les prix départ usine accessibles au public au CEPMB pour chaque type de client.Note de bas de page 15 Pour évaluer comment se situe le Canada par rapport à un ensemble de pays plus large que le CEPMB7, la figure 23 utilise les prix pratiqués au Canada et à l’étranger consignés dans la base de données MIDAS® d’IQVIA au niveau du prix du fabricant départ usine de manière à tenir compte de toutes les ventes dans les pharmacies et les hôpitaux.
Les comparaisons de prix pratiqués à l’étranger consignées à la figure 23 permettent de faire une comparaison bilatérale des prix en se servant de tous les pays de l’OCDE avec les données MIDAS® disponibles. Les ratios moyens des prix pratiqués dans les prix de comparaison par rapport aux prix pratiqués au Canada sont calculés en se servant de la même approche que celle utilisée pour produire les ratios présentés à la figure 22. Ce sont des moyennes arithmétiques, pondérées en fonction des ventes canadiennes, pour les ratios du prix international correspondant par rapport au prix canadien pour des médicaments pris individuellement.Note de bas de page 16 Comme indiqué à la figure 23, les prix médians de l’OCDE sont en moyenne 17 % sous les prix du Canada, qui se situent au troisième rang parmi les 31 pays de comparaison. En particulier, les trois pays où les prix sont les plus élevés sont les États-Unis, l’Allemagne et la Suisse.
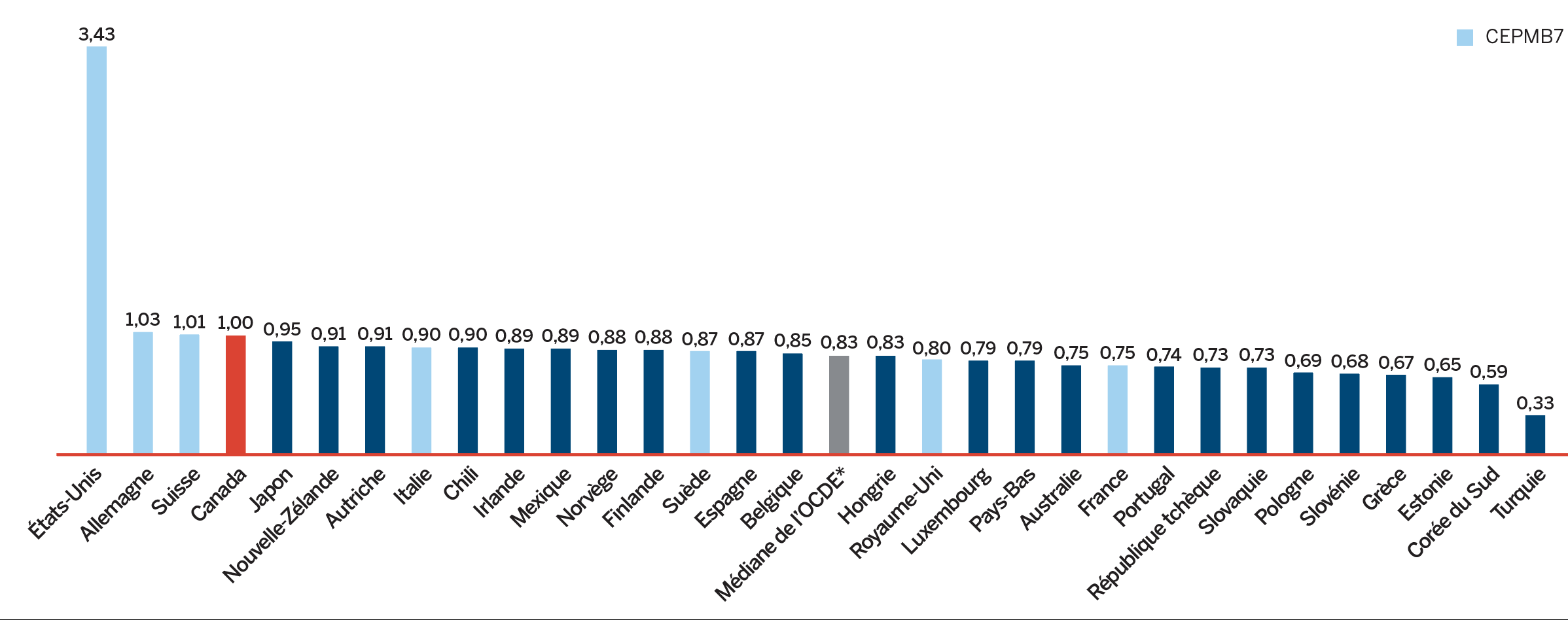
* Calculé en fonction des prix des médicaments disponibles dans au moins trois marchés étrangers.
Source de données : MIDAS® Base de données MIDAS®, 2018, IQVIA (tous droits réservés)
Description de la figure
Ce diagramme à barres présentant le ratio moyen du prix des médicaments brevetés dans les pays de l’OCDE par rapport au prix du Canada en 2018. La comparaison a été réalisée au moyen des prix canadiens et internationaux au départ de l’usine figurant dans la base de données MIDASMC d’IQVIA. La médiane de l’OCDE est calculée en fonction des médicaments dont les prix sont connus sur au moins trois marchés étrangers.
États-Unis : 3,43; Allemagne : 1,03; Suisse : 1,01; Canada : 1,00; Japon : 0,95; Nouvelle-Zélande : 0,91; Autriche : 0,91; Italie : 0,90; Chili : 0,90; Irlande : 0,89; Mexique : 0,89; Norvège : 0,88; Finlande : 0,88; Suède : 0,87; Espagne : 0,87; Belgique : 0,85; médiane de l’OCDE* : 0,83; Hongrie : 0,83; Royaume-Uni : 0,83; Luxembourg : 0,79; Pays-Bas : 0,79; Australie : 0,75; France : 0,75; Portugal : 0,74; République tchèque : 0,73; Slovaquie : 0,73; Pologne : 0,69; Slovénie : 0,68; Grèce : 0,67; Estonie : 0,65; Corée du Sud : 0,59; Turquie : 0,33.
Aperçu : Tendances relatives aux prix des médicaments génériques
Les prix moyens des médicaments génériques vendus au Canada ont reculé considérablement, soit de 59 % par rapport à leurs prix d’il y a dix ans (figure 24). Cela dépassait les diminutions de prix globales observées dans tous les marchés des pays du CEPMB7, car les diminutions des prix des médicaments génériques, associées à la dépréciation du dollar canadien, ont graduellement réduit l’écart traditionnel important entre les prix des médicaments génériques pratiqués au Canada et ceux pratiqués à l’étranger. La politique canadienne d’établissement des prix des médicaments génériques mise en place en 2018 a permis d’harmoniser les prix des médicaments génériques pratiqués au Canada avec ceux de l’Italie, des États-Unis et de la France. Cependant, les prix demeurent inférieurs en Allemagne et considérablement plus bas au Royaume-Uni et en Suède, alors que la moyenne des prix pour tous les pays de l’OCDE est de 15 % inférieure aux prix pratiqués au Canada (figure 25).
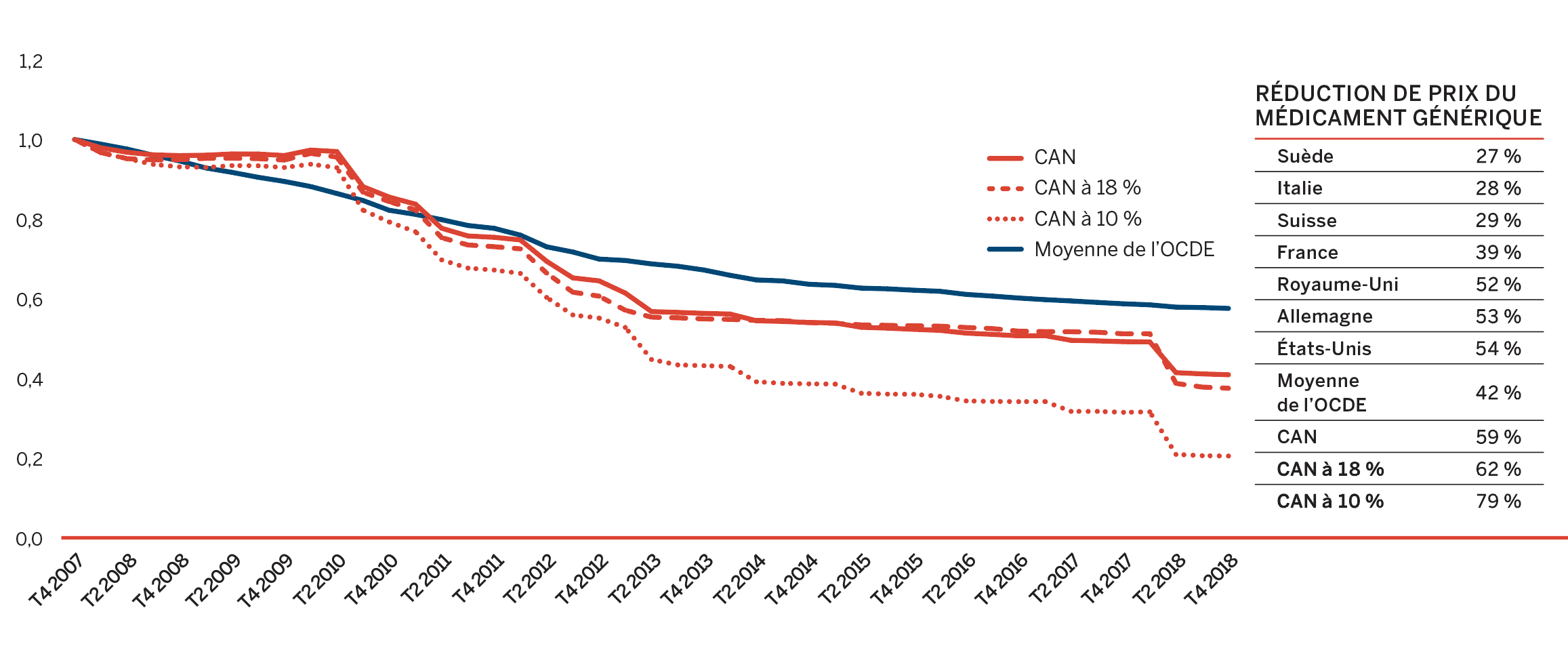
Remarque : Le terme « générique » utilisé dans la présente analyse comprend les médicaments brevetés et les médicaments non brevetés. Les résultats se fondent sur les prix départ usine des fabricants sur les marchés de détail nationaux. L’analyse se limitait aux médicaments génériques solides oraux sur le marché depuis au moins un an.
Les lignes CAN à 18 % et à 10 % se rapportent aux 67 médicaments génériques réduits à 18 % et à 10 % du prix de référence des médicaments de marque dans la foulée de l’adoption des politiques en matière d’établissement des prix des médicaments génériques en avril 2018.
Source de données : Base de données MIDAS®, octobre à décembre 2007 à octobre à décembre 2018, IQVIA (tous droits réservés) [Rapport du SNIUMP : Génériques360, 2018]
Description de la figure
Ce graphique linéaire et le tableau qui l’accompagne portent sur les réductions de prix des médicaments génériques du quatrième trimestre de 2007 au quatrième trimestre de 2018. Le graphique linéaire donne les indices de prix de tous les médicaments génériques au Canada ainsi que de ceux dont le prix représente 18 % et 10 % du prix de référence du médicament de marque, et les compare à la moyenne des pays de l’Organisation de coopération et de développement économiques (OCDE) au cours de la même période. Remarque : Dans cette analyse, le terme « médicament générique » englobe les médicaments génériques brevetés et non brevetés.
| Année et trimestre | Canada | Canada : médicaments à 18 % |
Canada : médicaments à 10 % |
Moyenne de l’OCDE |
|---|---|---|---|---|
| 2007 : quatrième trimestre | 1,00 | 1,00 | 1,00 | 1,00 |
| 2008 : premier trimestre | 0,98 | 0,97 | 0,97 | 0,99 |
| 2008 : deuxième trimestre | 0,97 | 0,95 | 0,95 | 0,98 |
| 2008 : troisième trimestre | 0,96 | 0,95 | 0,94 | 0,96 |
| 2008 : quatrième trimestre | 0,96 | 0,95 | 0,93 | 0,95 |
| 2009 : premier trimestre | 0,96 | 0,95 | 0,93 | 0,93 |
| 2009 : deuxième trimestre | 0,96 | 0,95 | 0,93 | 0,92 |
| 2009 : troisième trimestre | 0,96 | 0,95 | 0,93 | 0,91 |
| 2009 : quatrième trimestre | 0,96 | 0,95 | 0,93 | 0,89 |
| 2010 : premier trimestre | 0,97 | 0,96 | 0,94 | 0,88 |
| 2010 : deuxième trimestre | 0,97 | 0,96 | 0,93 | 0,86 |
| 2010 : troisième trimestre | 0,88 | 0,87 | 0,82 | 0,85 |
| 2010 : quatrième trimestre | 0,86 | 0,84 | 0,79 | 0,82 |
| 2011 : premier trimestre | 0,84 | 0,82 | 0,77 | 0.,81 |
| 2011 : deuxième trimestre | 0,78 | 0,75 | 0,70 | 0,80 |
| 2011 : troisième trimestre | 0,76 | 0,74 | 0,68 | 0,78 |
| 2011 : quatrième trimestre | 0,75 | 0,73 | 0,67 | 0,78 |
| 2012 : premier trimestre | 0,75 | 0,73 | 0,66 | 0,76 |
| 2012 : deuxième trimestre | 0,69 | 0,66 | 0,60 | 0,73 |
| 2012 : troisième trimestre | 0,65 | 0,62 | 0,56 | 0,72 |
| 2012 : quatrième trimestre | 0,65 | 0,61 | 0,55 | 0,70 |
| 2013 : premier trimestre | 0,61 | 0,57 | 0,53 | 0,70 |
| 2013 : deuxième trimestre | 0,57 | 0,55 | 0,45 | 0,69 |
| 2013 : troisième trimestre | 0,57 | 0,55 | 0,43 | 0,68 |
| 2013 : quatrième trimestre | 0,56 | 0,55 | 0,43 | 0,67 |
| 2014 : premier trimestre | 0,56 | 0,55 | 0,43 | 0,66 |
| 2014 : deuxième trimestre | 0,55 | 0,55 | 0,39 | 0,65 |
| 2014 : troisième trimestre | 0,54 | 0,55 | 0,39 | 0,65 |
| 2014 : quatrième trimestre | 0,54 | 0,54 | 0,39 | 0,64 |
| 2015 : premier trimestre | 0,54 | 0,54 | 0,39 | 0,63 |
| 2015 : deuxième trimestre | 0,53 | 0,53 | 0,36 | 0,63 |
| 2015 : troisième trimestre | 0,53 | 0,53 | 0,36 | 0,63 |
| 2015 : quatrième trimestre | 0,52 | 0,53 | 0,36 | 0,62 |
| 2016 : premier trimestre | 0,52 | 0,53 | 0,36 | 0,62 |
| 2016 : deuxième trimestre | 0,51 | 0,53 | 0,34 | 0,61 |
| 2016 : troisième trimestre | 0,51 | 0,53 | 0,34 | 0,61 |
| 2016 : quatrième trimestre | 0,51 | 0,53 | 0,34 | 0,61 |
| 2017 : premier trimestre | 0,51 | 0,52 | 0,34 | 0,60 |
| 2017 : deuxième trimestre | 0,50 | 0,52 | 0,32 | 0,59 |
| 2017 : troisième trimestre | 0,50 | 0,52 | 0,32 | 0,59 |
| 2017 : quatrième trimestre | 0,49 | 0,51 | 0,32 | 0,59 |
| 2018 : premier trimestre | 0,49 | 0,51 | 0,32 | 0,58 |
| 2018 : deuxième trimestre | 0,41 | 0,39 | 0,21 | 0,58 |
| 2018 : troisième trimestre | 0,41 | 0,38 | 0,21 | 0,58 |
| 2018 : quatrième trimestre | 0,41 | 0,38 | 0,21 | 0,58 |
Le tableau complémentaire indique les réductions correspondantes du prix des médicaments génériques entre le quatrième trimestre de 2007 et le quatrième trimestre de 2018 pour les marchés canadiens et chaque pays du CEPMB7, ainsi que la moyenne de l’OCDE.
| Pays | Réduction de prix des médicaments génériques |
|---|---|
| Suède | 27 % |
| Italie | 28 % |
| Suisse | 29 % |
| France | 39 % |
| Royaume-Uni | 52 % |
| Allemagne | 53 % |
| États-Unis | 54 % |
| Moyenne de l’OCDE | 42 % |
| Canada, tous les médicaments génériques | 59 % |
| Canada, médicaments génériques à 18 % du prix | 62 % |
| Canada, médicaments génériques à 10 % du prix | 79 % |
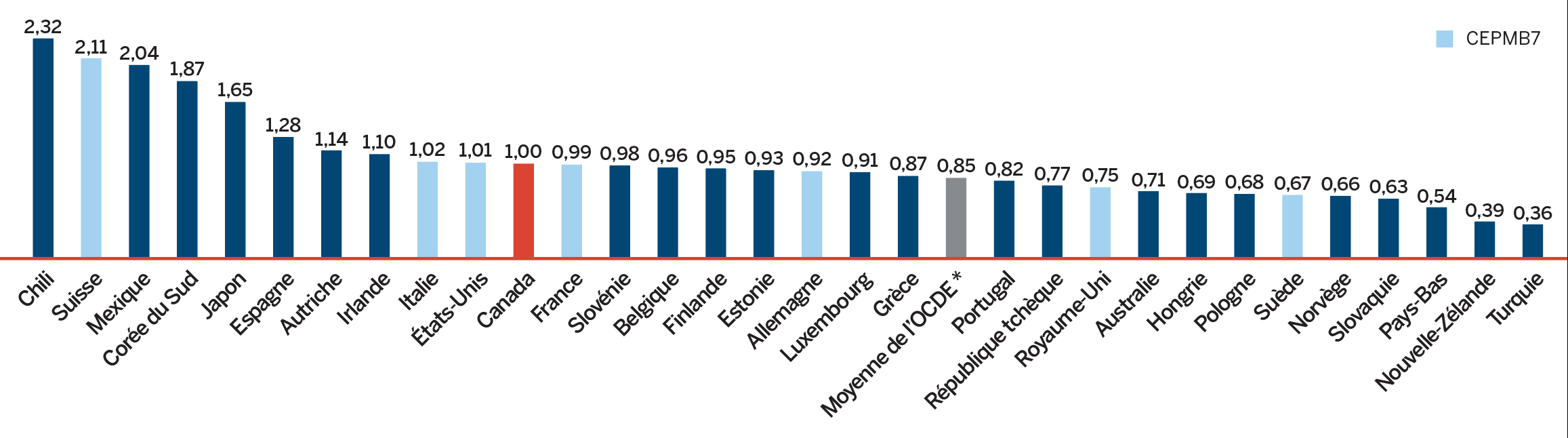
Remarque : Le terme « générique » utilisé dans la présente analyse comprend les médicaments brevetés et non brevetés. Les résultats sont fondés sur les prix départ usine des fabricants sur les marchés de détail nationaux. L’analyse se limitait aux médicaments génériques solides oraux sur le marché depuis au moins un an.
Les résultats ont été calculés selon les médicaments pour lesquels des prix disponibles dans au moins trois marchés étrangers.
Source de données : Base de données MIDAS®, octobre à décembre 2018, IQVIA (tous droits réservés) [Rapport du SNIUMP : Génériques360, 2018]
Description de la figure
Ce graphique à colonnes présente les ratios bilatéraux des prix à l’étranger par rapport aux prix au Canada pour les pays de l’OCDE au quatrième trimestre de 2018. Une valeur médiane pour l’OCDE est également fournie et a été calculée en fonction des médicaments dont les prix sont connus dans au moins trois marchés étrangers.
Remarque : Dans cette analyse, le terme « médicament générique » englobe les médicaments génériques brevetés et non brevetés. Les résultats sont fondés sur les prix départ-usine des fabricants sur les marchés de détail nationaux. L’analyse se limitait aux médicaments génériques solides oraux sur le marché depuis au moins un an.
| Pays | Ratio des prix étrangers par rapport aux prix canadiens |
|---|---|
| Chili | 2,32 |
| Suisse | 2,11 |
| Mexique | 2,04 |
| Corée du Sud | 1,87 |
| Japon | 1,65 |
| Espagne | 1,28 |
| Autriche | 1,14 |
| Irlande | 1,10 |
| Italie | 1,02 |
| États-Unis | 1,01 |
| Canada | 1,00 |
| France | 0,99 |
| Slovénie | 0,98 |
| Belgique | 0,96 |
| Finlande | 0,95 |
| Estonie | 0,93 |
| Allemagne | 0,92 |
| Luxembourg | 0,91 |
| Grèce | 0,87 |
| Médiane de l’OCDE | 0,85 |
| Portugal | 0,82 |
| République tchèque | 0,77 |
| Royaume-Uni | 0,75 |
| Australie | 0,71 |
| Hongrie | 0,69 |
| Pologne | 0,68 |
| Suède | 0,67 |
| Norvège | 0,66 |
| Slovaquie | 0,63 |
| Pays-Bas | 0,54 |
| Nouvelle-Zélande | 0,39 |
| Turquie | 0,36 |
Comparaisons multilatérales des prix
Le tableau 10 présente les ratios moyens des prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada, et ce, pour plusieurs mesures multilatérales des prix pratiqués dans les pays de comparaison. Le prix international médian (PIM) correspond à la médiane des prix observés dans les pays du CEPMB7. D’autres ratios de prix multilatéraux comparent la moyenne minimale, maximale et simple des prix pratiqués dans les pays de comparaison par rapport aux prix au Canada.
Une fois de plus sous l’angle des résultats obtenus avec les taux de change du marché, le ratio du prix international médian par rapport aux prix pratiqués au Canada s’est maintenu à 1,20 en 2018, une baisse par rapport au ratio de 2017, soit 1,26 (figure 26). Il convient de noter que la moyenne des prix pratiqués dans les pays de comparaison produit des ratios prix pratiqués dans les pays de comparaison par rapport aux prix pratiqués au Canada plus élevés que les PIM. Cette situation s’explique par l’influence des prix pratiqués aux États- Unis, où les prix sont habituellement beaucoup plus élevés que dans tous les autres pays. Même si les prix pratiqués aux États-Unis sont presque toujours pris en compte dans la détermination du prix moyen pratiqué dans les pays de comparaison, leur impact est moindre en ce qui concerne les prix internationaux médians. Néanmoins, les États-Unis exercent une influence majeure sur le ratio moyen des prix internationaux médians comparativement aux prix canadiens, puisqu’ils constituent parfois le seul pays pour lequel un prix départ usine est disponible pour un médicament breveté vendu au Canada.
| Médiane | Minimum | Maximum | Moyenne | |
|---|---|---|---|---|
| Ratio moyen des prix aux taux de change du marché | 1,20 | 0,91 | 3,50 | 1,53 |
| Ratio moyen des prix aux parités de pouvoir d’achat | 1,24 | 0,94 | 3,51 | 1,59 |
| Nombre de médicaments brevetés | 1 287 | 1 287 | 1 287 | 1 287 |
| Ventes (en millions de $) | 15 843,19 | 15 843,19 | 15 843,19 | 15 843,19 |
Source de données : CEPMB
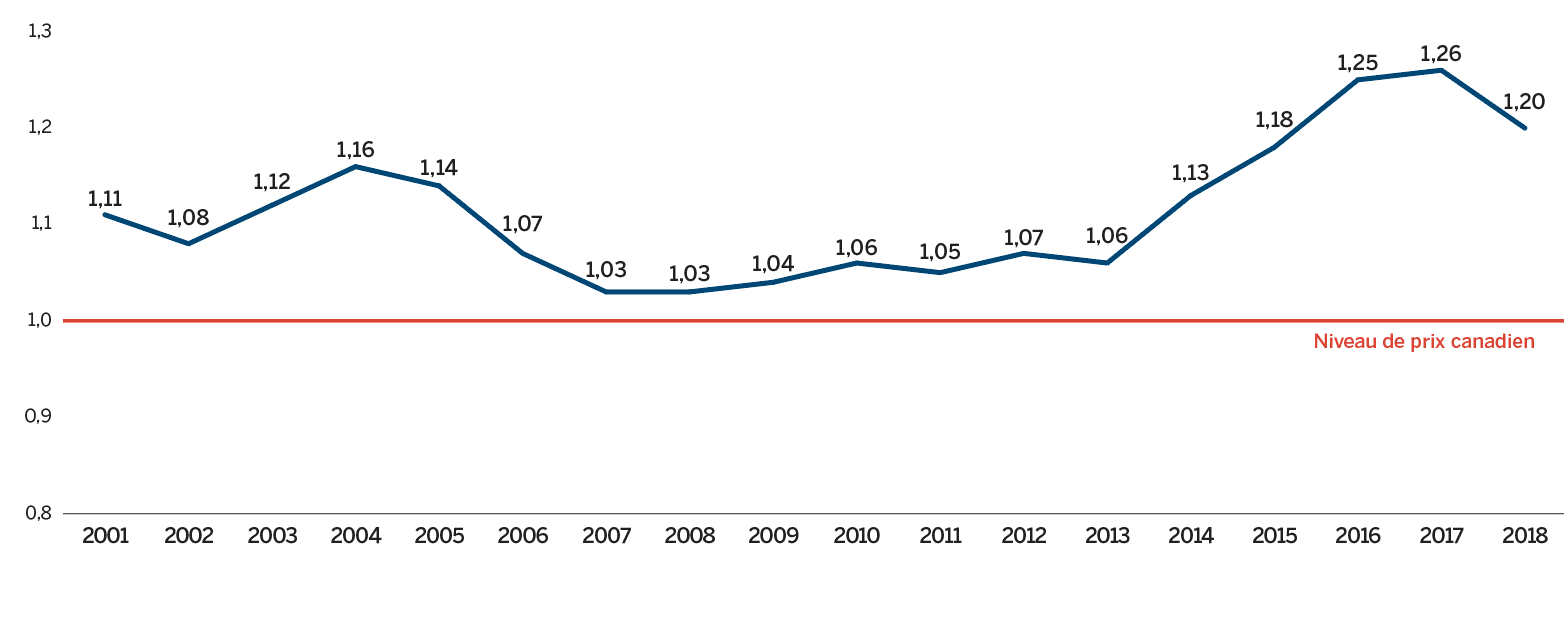
Source de données : CEPMB
Description de la figure
Ce diagramme linéaire présente les ratios moyens des prix internationaux médians par rapport aux prix canadiens de 2001 à 2018. En 2001, le ratio moyen du prix international médian (PIM) par rapport au prix de transaction moyen (PTM) au Canada, aux taux de change du marché, était de 1,11. En 2002 : 1,08; 2003 : 1,12; 2004 : 1,16; 2005 : 1,14; 2006 : 1,07; 2007 : 1,03; 2008 : 1,03; 2009 : 1,04; 2010 : 1,06; 2011 : 1,05; 2012 : 1,07; 2013 : 1,06; 2014 : 1,13; 2015 : 1,18; 2016 : 1,25; 2017 : 1,26; 2018 : 1,20.
La figure 27 présente d’autres résultats concernant le ratio moyen du prix international médian par rapport aux prix canadiens aux taux de change du marché en 2018. Afin de se pencher sur la question selon laquelle les prix canadiens sont des prix de vente moyens nationaux tandis que les prix pratiqués à l’étranger sont des prix courants, on calcule également un ratio prix courant-prix courant. Suivant cette méthode, le ratio moyen diminue de 1,20 à 1,07. Il importe de garder à l’esprit que les remises confidentielles accordées directement aux payeurs ne sont présentement pas consignées dans ces données.
Afin de tenir compte de la grande incidence des prix américains dans l’établissement du prix étranger médian, on fournit aussi à la figure 27 un ratio qui exclut les États-Unis et un ratio qui inclut au moins cinq pays dans le calcul de la valeur médiane. En tenant compte de ces restrictions, le ratio moyen du prix international médian par rapport aux prix canadiens diminue à 0,87 et à 0,91, respectivement, ce qui donne à penser que les prix courants étrangers médians sont en moyenne de 13 % à 9 % inférieurs aux prix courants canadiens. Dans bon nombre des pays de comparaison, des rabais sur les prix courants sont offerts à tous les payeurs publics et privés. En revanche, une grande proportion du marché canadien paie le prix courant ou près du prix courant. De plus, il convient de noter qu’il s’agit de ratios moyens – certains brevetés imposent aux consommateurs canadiens un prix moins élevé que les prix internationaux médians, alors que d’autres imposent des prix plus élevés. Pour voir les ratios médians par rapport aux prix canadiens par breveté, consultez le tableau 21 à l’annexe 4 du présent rapport.
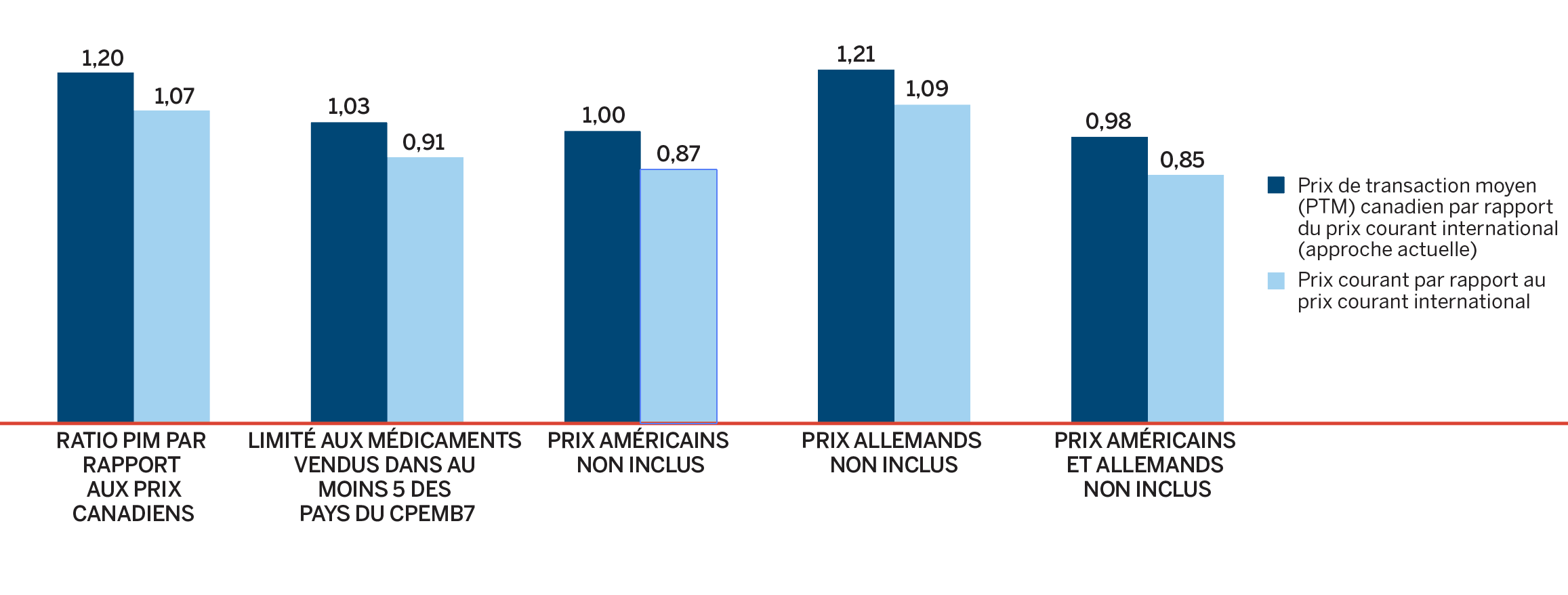
Source de données : CEPMB
Description de la figure
Ce diagramme linéaire présente les ratios moyens du prix international médian par rapport au prix canadien en 2018, d’après 1) le prix de transaction moyen (PTM) au Canada en comparaison du prix courant international dans les pays du CEPMB7, et 2) le prix courant canadien en comparaison du prix courant international.
| Comparaison entre le prix de transaction moyen (PTM) et le prix courant international | Comparaison entre le prix courant canadien et le prix courant international | |
|---|---|---|
| PIM par rapport au prix canadien | 1,20 | 1,07 |
| Médiane correspondant aux médicaments vendus dans au moins 5 pays du CPEMB7 | 1,03 | 0,91 |
| Prix américains non inclus | 1,00 | 0,87 |
| Prix allemands non inclus | 1,21 | 1,09 |
| Prix américains et allemands non inclus | 0,98 | 0,85 |
La figure 28 présente encore plus de détails sur les ratios des prix internationaux médians par rapport aux prix pratiqués au Canada au niveau des médicaments qui sous-tendent les moyennes présentées dans le tableau 10. Cette figure ventile les ventes de chaque médicament breveté réalisées en 2018 selon la valeur de son ratio PIM par rapport aux prix pratiqués au Canada (ou, pour être plus précis, selon la fourchette dans laquelle s’inscrit le ratio)Note de bas de page 17. Ces résultats révèlent une dispersion importante des ratios de prix au niveau du médicament : alors que les médicaments brevetés dont les ratios PIM par rapport aux prix pratiqués au Canada se situent entre 0,90 et 1,10 représentaient 32,5 % des ventes, ceux dont les ratios se situent sous 0,90 en représentaient 37,1 % et ceux dont les ratios dépassaient 1,10 en représentaient 30,4 %.
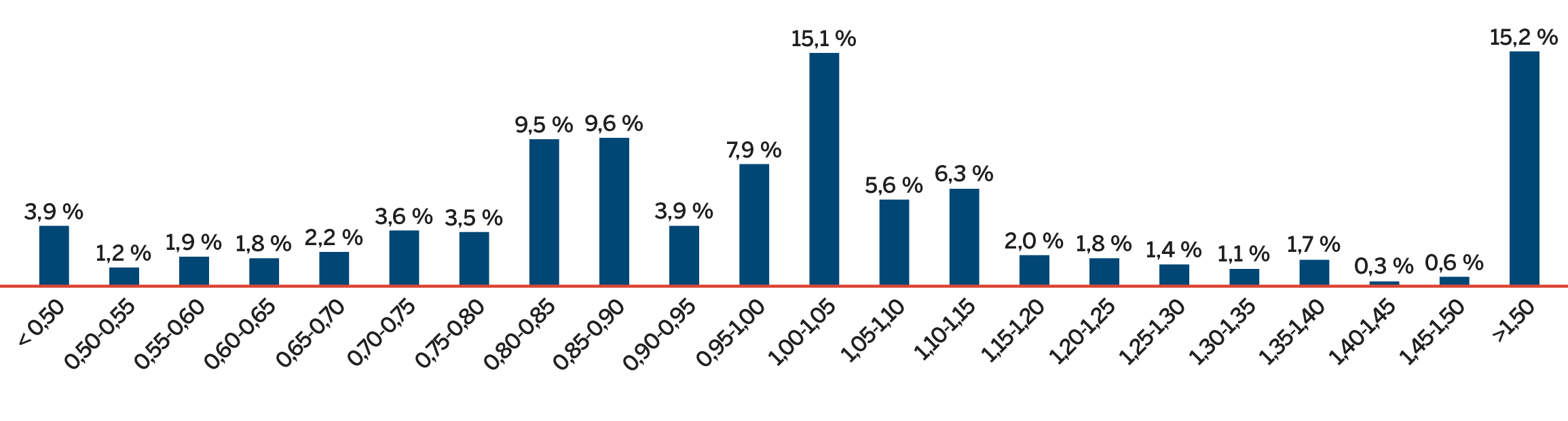
Source de données : CEPMB
Description de la figure
Ce diagramme à barres présente la distribution des ventes de médicaments brevetés en 2018, selon l’intervalle dans lequel se trouve le ratio du prix international médian par rapport au prix canadien. En deçà de 0,50 et au-delà de 1,50, les ratios sont indiqués par tranches de 0,05.
Les médicaments brevetés ayant un ratio de prix inférieur à 0,50 représentaient 3,2 % des ventes. De 0,50 à 0,55 : 0,5 %; 0,55 à 0,60 : 1,8 %; 0,60 à 0,65 : 4,4 %; 0.65 à 0,70 : 1,9 %; 0,70 à 0,75 : 3,3 %; 0,75 à 0,80 : 3,9 %; 0,80 à 0,85 : 3,0 %; 0,85 à 0,90 : 8,5 %; 0,90 à 0,95 : 7,0 %; 0,95 à 1,00 : 10,7 %; 1,00 à 1,05 : 8,2 %; 1,05 à 1,10 : 8,8 %; 1,10 à 1,15 : 8,7 %; 1,15 à 1,20 : 3,7 %; 1,20 à 1,25 : 1,0 %; 1,25 à 1,30 : 0,5 %; 1,30 à 1,35 : 1,3 %; 1,35 à 1,40 : 3,3 %; 1,40 à 1,45 : 1,2 %; 1,45 à 1,50 : 2,2 %; >1,50 : 12,8 %.
En 2018, environ 50 % des médicaments brevetés au Canada affichaient un prix supérieur aux niveaux médians internationauxNote de bas de page 18. Le tableau 11 illustre les classes thérapeutiques dont les prix sont supérieurs aux niveaux médians internationaux au Canada. Les médicaments qui s’inscrivent dans le quatrième niveau ATC (« ATC4 »)Note de bas de page 19 sont regroupés afin de dresser la liste des sous-groupes chimiques, pharmacologiques et thérapeutiques distincts et de permettre le calcul des ratios moyens des PIM par rapport au prix canadien pour les médicaments qui peuvent être utilisés pour traiter les mêmes maladies. Le tableau 11 présente les 10 principaux ATC4 de 2018 pour lesquels l’écart entre les prix canadiens et les prix médians a eu la plus grande incidence sur les dépenses en médicaments brevetés au Canada. Par exemple, si les prix canadiens avaient été semblables aux prix médians internationaux pour ces classes de médicaments en 2018, les ventes au Canada auraient diminué de plus d’un milliard de dollars (une diminution moyenne de 22 % pour ces ATC4). Parmi les 149 DIN se classant dans ces 10 ATC4, le prix de plus de 63 % d’entre eux était plus élevé que le prix médian international.
| Description | ATC4 | Nombre d’entreprises | Nombre de produits chimiques dans la catégorie ATC4 (nombre breveté)Note de bas de page 20 | Total de din brevetés | Din brevetés supérieurs au prix médian | Revenu net en 2018 pour les din brevetés (en millions de $) | Part des revenus de 2018 attribuable aux din brevetés de la catégorie ATC4 | Ratio des prix internationaux médians par rapport aux prix pratiqués au Canada (min. 5) des din brevetés | Répercussion de l’écart sur les médicaments brevetés en 2018 |
|---|---|---|---|---|---|---|---|---|---|
| Anti-infectieux pour usage systémique | J05AX | 6 | 14 (14) | 20 | 9 | 982,3 $ | 5,90 % | 91 % | 273,5 $ |
| Adrénergiques en association avec des corticostéroïdes ou autres médicaments, sauf les anticholinergiques | R03AK | 3 | 4 (4) | 11 | 9 | 568,0 $ | 3,41 % | 59 % | 231,8 $ |
| Inhibiteurs de la DPP-4 | A10BH | 4 | 4 (4) | 9 | 9 | 349,0 $ | 2,10 % | 75 % | 89,7 $ |
| Glucocorticoïdes | R03BA | 7 | 9 (6) | 17 | 11 | 211,1 $ | 1,27 % | 65 % | 81,6 $ |
| Combinaison d’hypoglycémiants oraux | A10BD | 7 | 12 (12) | 36 | 22 | 356,6 $ | 2,14 % | 69 % | 78,9 $ |
| Agents antinéovascularisation | S01LA | 2 | 2 (1) | 1 | 1 | 506,8 $ | 3,04 % | 80 % | 77,1 $ |
| Autres hypoglycémiants, à l’exclusion des insulines | A10BX | 6 | 8 (7) | 13 | 11 | 547,7 $ | 3,29 % | 87 % | 73,6 $ |
| Insulines et analogues de l’insuline, à action prolongée | A10AE | 3 | 5 (3) | 5 | 4 | 282,3 $ | 1,70 % | 80 % | 55,5 $ |
| Inhibiteurs de la pompe à protons | A02BC | 5 | 8 (7) | 13 | 10 | 186,3 $ | 1,12 % | 45 % | 54,3 $ |
| Autres agents antinéoplasiques | L01XC | 11 | 19 (17) | 24 | 8 | 967,9 $ | 5,81 % | 99 % | 53,2 $ |
Source de données : CEPMB
Le Canada est parmi les 10 premiers marchés dans le monde
Le Canada est un marché important pour les produits pharmaceutiques et accapare 2,1 % des ventes mondiales. Même s’il compte une population deux fois inférieure, le Canada dépense environ le même montant que le Royaume-Uni en produits pharmaceutiques.
Utilisation des médicaments brevetés
Les données sur les prix et sur la valeur des ventes utilisées pour calculer l’IPMB servent également à déterminer les tendances dans les quantités de médicaments brevetés vendus au Canada. Le CEPMB calcule à cette fin l’indice du volume des ventes de médicaments brevetés (IVVMB). La figure 29 présente, pour les années 1988 à 2018, les taux moyens de croissance de l’utilisation des médicaments brevetés, mesurée à l’aide de l’IVVMB. Les résultats obtenus confirment que, dans les dernières années, la croissance de l’utilisation faite des médicaments brevetés est le principal facteur d’augmentation de la valeur des ventes.
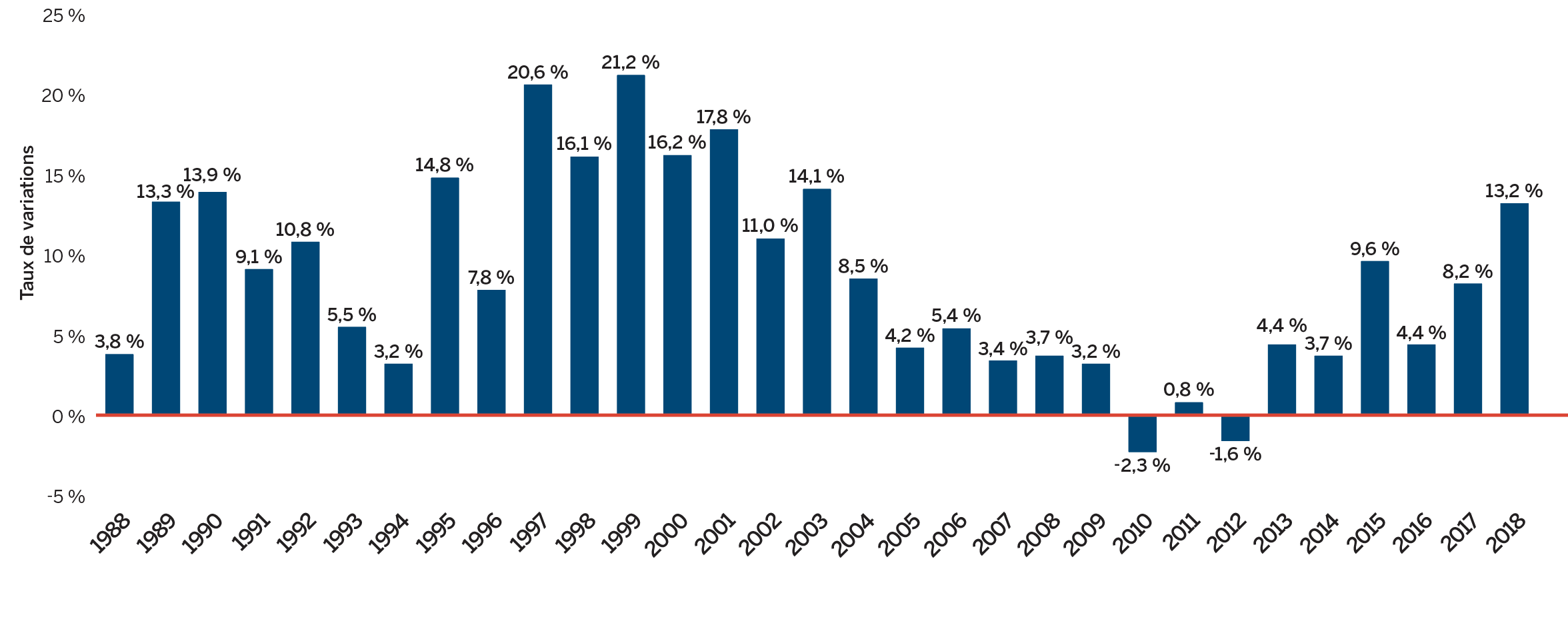
Source de données : CEPMB
Description de la figure
Il s’agit d’un diagramme à barres présentant les taux annuels moyens de croissance de l’utilisation, mesurés par l’indice du volume des ventes de médicaments brevetés (IVVMB), de 1998 à 2018.
Taux de variation (en pourcentage) en 1988 : 3,8; 1989 : 13,3; 1990 : 13,9; 1991 : 9,1; 1992 : 10,8; 1993 : 5,5; 1994 : 3,2; 1995 : 14,8; 1996 : 7,8; 1997 : 20,6; 1998 : 16,1; 1999 : 21,2; 2000 : 16,2; 2001 : 17,8; 2002 : 11,0; 2003 : 14,1; 2004 : 8,5; 2005 : 4,2; 2006 : 5,4; 2007 : 3,4; 2008 : 3,7; 2009 : 3,2; 2010 : -2,3; 2011 : 0,8; 2012 : -1,6; 2013 : 4,4; 2014 : 3,7; 2015 : 9,6; 2016 : 4,4; 2017 : 8,2; 2018 : 13,2.
Dépenses en médicaments au Canada par rapport aux marchés mondiaux
IQVIANote de bas de page 21 fait régulièrement rapport des ventes de médicaments dans un grand nombre de pays. Selon les données sur les ventes provenant de cette source, la figure 30 illustre la répartition de ces ventes globales pour le Canada et d’autres marchés nationaux d’envergure, notamment les pays du CEPMB7Note de bas de page 22. En 2018, le marché canadien a représenté 2,1 % du marché mondial.
Source de données : Base de données MIDAS®, 2018, IQVIA (tous droits réservés)
Description de la figure
Il s’agit d’un diagramme circulaire présentant la distribution des ventes des médicaments parmi les principaux marchés mondiaux en 2018.
Le marché des États-Unis comptait pour 44,5 % du marché mondial en 2018. Japon : 7,1 %; Allemagne : 4,4 %; France : 3,4 %; Italie : 3,1 %; Royaume-Uni : 2,4 %; Espagne : 2,2 %; Canada : 2,1 %; Suisse : 0,6 %; Suède : 0,4 %; reste du monde : 29,8 %.
La figure 31 présente la part des ventes du Canada sur les principaux marchés mondiaux de 2005 à 2018. Pendant toute cette période, la part des ventes du Canada s’est maintenue entre 1,9 % et 2,7 %. Bien que 2,1 % soit à l’extrémité inférieure de la part moyenne canadienne des ventes mondiales au cours des dernières années, la part américaine est passée de 40,4 % en 2014 à 44,5 % en 2018, ce qui a entraîné une baisse des parts pour tous les autres grands pays.
1,8 % Dépenses en médicaments au Canada
En 2016, les Canadiens ont dépensé 1,8 % du produit intérieur brut en médicaments. Il s’agit de la deuxième part la plus élevée du CEPMB7, seulement derrière les États-Unis.
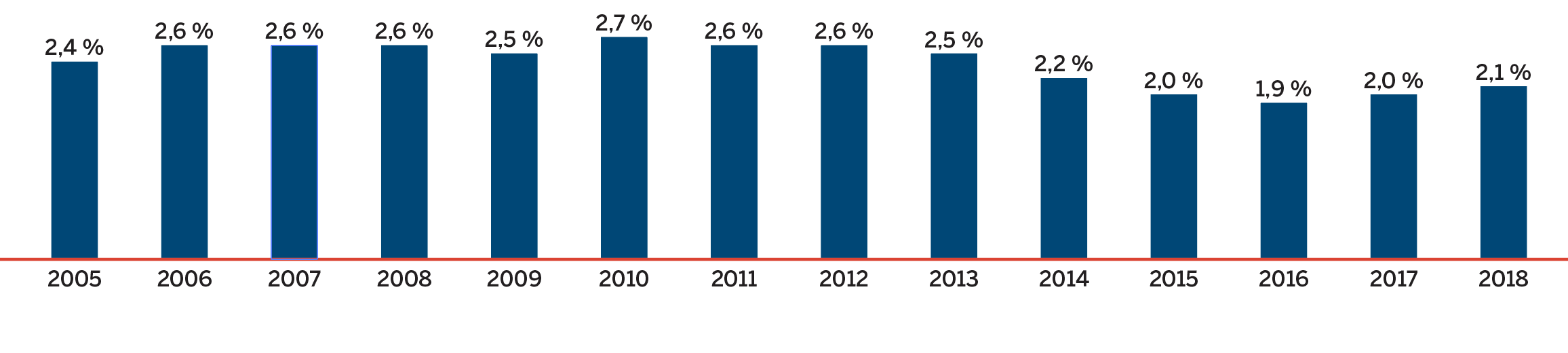
Source de données : Base de données MIDAS®, 2005-2018, IQVIA (tous droits réservés)
Description de la figure
Ce diagramme à barres présente les ventes au Canada exprimées en pourcentage des ventes mondiales de médicaments, de 2005 à 2018.
En 2005, les ventes au Canada représentaient 2,4 % des ventes mondiales; 2006 : 2,6 %; 2007 : 2,6 %; 2008 : 2,6 %; 2009 : 2,5 %; 2010 : 2,7 %; 2011 : 2,6 %; 2012 : 2,6 %; 2013 : 2,5 %; 2014 : 2,2 %; 2015 : 2,0 %; 2016 : 1,9 %; 2017 : 2,0 %; 2018 : 2,1 %.
La figure 32 compare la croissance annuelle des ventes de médicaments au Canada à celle des pays du CEPMB7, ensemble et séparément. Entre 2005 et 2018, les ventes de médicaments au Canada ont augmenté à un taux annuel moyen d’environ 4,6 %. Ce taux est inférieur au taux moyen de croissance des ventes de médicaments dans les pays du CEPMB7 pour la même période; cependant, comme l’indique clairement la figure, ce taux de croissance est grandement faussé par l’influence des ventes aux États-Unis.
Source de données : Base de données MIDAS®, 2005-2018, IQVIA (tous droits réservés)
Description de la figure
Ce diagramme à barres présente, en pourcentage, la croissance annuelle moyenne des ventes totales de médicaments pour le Canada et les sept pays de comparaison de CEMPB, de 2005 à 2018.
En France, le taux de croissance moyen a été de 1,4 %; Suisse : 3,0 %; Allemagne : 3,7 %; Suède : 4,3 %; Canada : 4,6 %; Italie : 4,7 %; Royaume-Uni : 4,7 %; CEPMB7 : 4,9 %; États-Unis : 5,4 %.
La figure 33 compare les taux annuels de croissance des ventes de médicaments dans l’ensemble du marché pharmaceutique au Canada et dans l’ensemble des pays du CEPMB7. En 2018, les ventes ont augmenté à un rythme légèrement plus rapide au Canada que dans les autres pays du CEPMB7. Cette croissance englobe les médicaments qui ne sont plus déclarés au CEPMB, comme Remicade.
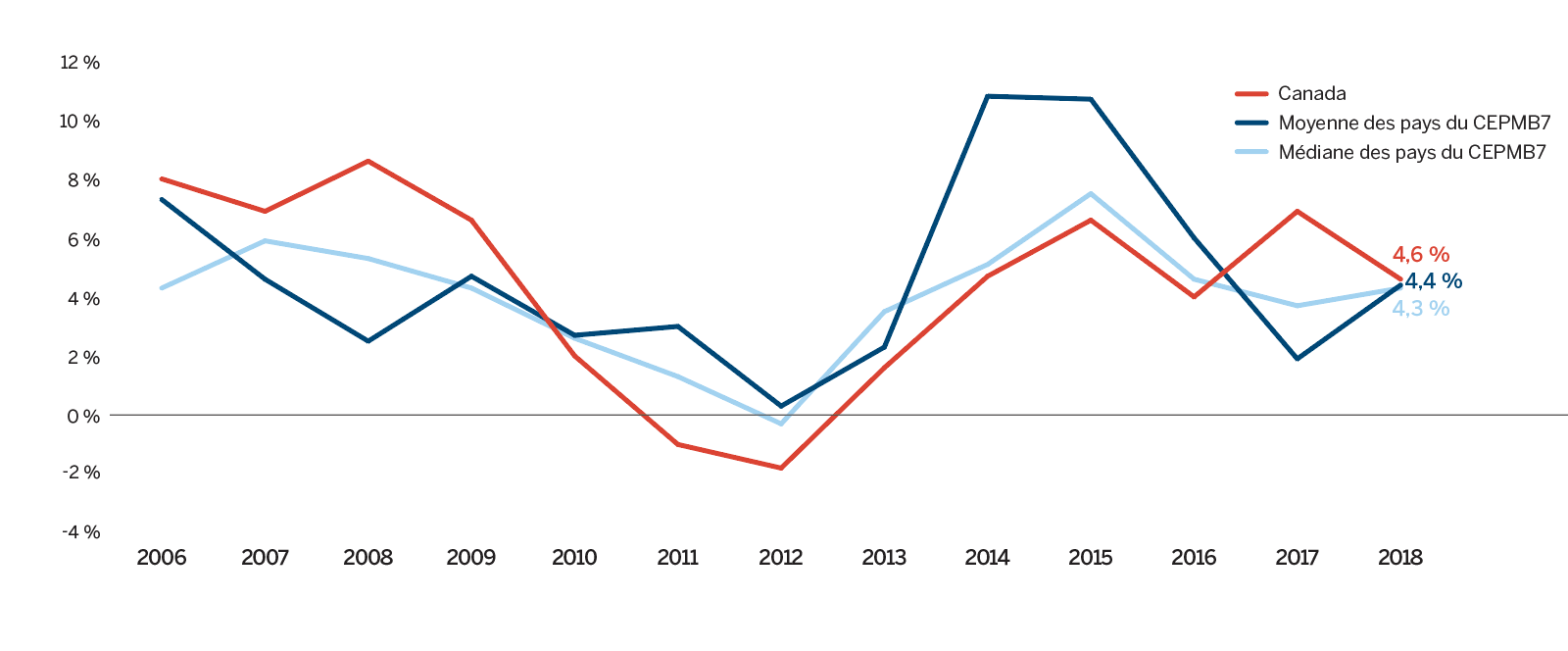
Source de données : Base de données MIDAS®, 2005-2018, IQVIA (tous droits réservés)
Description de la figure
Il s’agit d’un diagramme linéaire qui compare le taux moyen annuel de variation des ventes de médicaments, aux taux de change constants du marché de 2018. On y trouve les taux du Canada, ainsi que les taux moyens et médians pour les pays du CEPMB7 entre 2006 et 2018.
| Année | Canada | Moyenne du CEPMB7 | Médiane du CEPMB7 |
|---|---|---|---|
| 2006 | 8,0 | 7,3 | 4,3 |
| 2007 | 6,9 | 4,6 | 5,9 |
| 2008 | 8,6 | 2,5 | 5,3 |
| 2009 | 6,6 | 4,7 | 4,3 |
| 2010 | 2,0 | 2,7 | 2,6 |
| 2011 | -1,0 | 3,0 | 1,3 |
| 2012 | -1,8 | 0,3 | -0,3 |
| 2013 | 1,6 | 2,3 | 3,5 |
| 2014 | 4,7 | 10,8 | 5,1 |
| 2015 | 6,6 | 10,7 | 7,5 |
| 2016 | 4,0 | 6,0 | 4,6 |
| 2017 | 6,9 | 1,9 | 3,7 |
| 2018 | 4,6 | 4,4 | 4,3 |
La comparaison des dépenses en médicaments entre les pays peut aussi être faite à l’aide de la proportion du revenu national consacrée à l’achat de médicamentsNote de bas de page 23. La figure 34 présente les dépenses en médicaments exprimées en pourcentage du produit intérieur brut (PIB) du Canada et des pays du CEPMB7 (selon des données de 2016). Dans les pays du CEPMB7, les dépenses en médicaments ont accaparé entre 1,1 % et 2,1 % du PIB. La valeur canadienne (1,8 %) arrivait tout juste derrière les États-Unis.
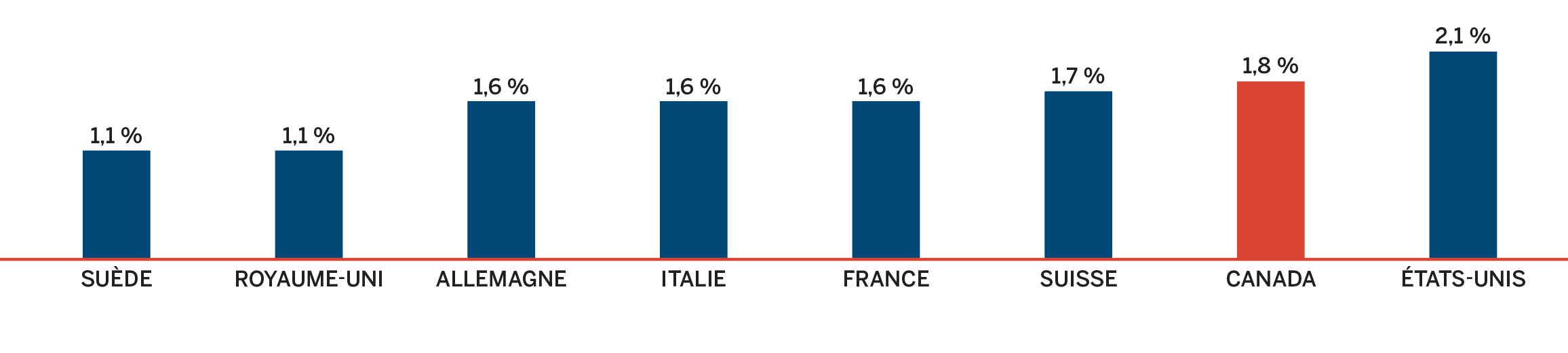
Source de données : OCDE
Description de la figure
Ce diagramme à barres présente les dépenses en médicaments en pourcentage du produit intérieur brut (PIB) pour le Canada et les sept pays de comparaison du CEPMB, selon les données de 2016.
En Suède, les dépenses en médicaments représentaient 1,1 % du PIB; Royaume-Uni : 1,1 %; Allemagne : 1,6 %; Italie : 1,6 %; France : 1,6 %; Suisse : 1,7 %; Canada : 1,8 %; États-Unis : 2,1 %.
Le tableau 12 présente une perspective historique du ratio des dépenses par rapport au PIBNote de bas de page 24. En 2005, le ratio du Canada était le quatrième plus élevé des pays du CEPMB7. Depuis, le ratio du Canada a augmenté, alors que les ratios de trois autres pays (la France, l’Italie et la Suède) ont diminué. En 2016, le Canada est arrivé troisième en ce qui concerne les dépenses les plus élevées en médicaments par habitant parmi les pays du CEPMB7, soit 26 % au-dessus de la médiane de ces pays.
| Part : dépenses en médicaments/PIB 2016 (en %) | Part : dépenses en médicaments/PIB 2005 (en %) | Croissance : PIB 2005-2016 (en %) | Dépenses en médicaments par habitant, 2005 (PPA en $ us) | Dépenses en médicaments par habitant, 2016 (PPA en $ us) | |
|---|---|---|---|---|---|
| Canada | 1,84 | 1,64 | 39,8 | 593 | 833 |
| France | 1,60 | 1,79 | 46,1 | 545 | 663 |
| Allemagne | 1,59 | 1,58 | 54,9 | 509 | 777 |
| Italie | 1,59 | 1,70 | 37,7 | 505 | 607 |
| Suède | 1,07 | 1,15 | 57,1 | 396 | 524 |
| Suisse | 1,68 | 1,09 | 84,8 | 427 | 1 080 |
| United Royaume-Uni | 1,12 | 1,00 | 34,8 | NA | 476 |
| États-Unis | 2,10 | 1,88 | 42,0 | 832 | 1 208 |
Source de données : OCDE
Le tableau 13 présente la distribution des ventes par les brevetés selon la classe thérapeutique pour le Canada et les pays du CEPMB, individuellement par pays et ensembleNote de bas de page 25. Les résultats font ressortir un degré de similitude remarquable entre les différents pays.
| Groupe thérapeutique | Canada | PMPRB7 | France | Italie | Allemagne | Suède | Suisse | United Royaume-Uni | États-Unis |
|---|---|---|---|---|---|---|---|---|---|
| A: Tube digestif et métabolisme alimentaire | 13,1 | 15,2 | 9,5 | 10,0 | 10,7 | 10,1 | 10,4 | 10,8 | 16,8 |
| B: Sang et organes hématopoïétiques | 4,6 | 6,1 | 8,4 | 8,9 | 8,1 | 9,1 | 6,3 | 6,3 | 5,5 |
| C: Système cardiovasculaire | 7,4 | 4,7 | 7,1 | 8,5 | 6,9 | 4,2 | 8,7 | 6,0 | 3,9 |
| D: Médicaments dermatologiques | 2,9 | 2,4 | 2,1 | 1,7 | 2,6 | 2,2 | 2,9 | 2,1 | 2,5 |
| G: Système génito-urinaire et hormones sexuelles | 4,3 | 3,6 | 2,7 | 2,9 | 2,6 | 3,5 | 3,8 | 3,3 | 3,9 |
| H: Préparations hormonales systémiques | 1,3 | 2,6 | 2,2 | 1,8 | 2,0 | 2,1 | 1,3 | 2,0 | 2,9 |
| J: Anti-infectieux généraux pour usage systémique | 10,0 | 11,5 | 12,4 | 19,0 | 9,1 | 12,9 | 10,7 | 12,2 | 11,1 |
| L: Agents antineoplasiques et immunomodulateurs | 21,6 | 22,4 | 23,9 | 20,7 | 24,3 | 24,4 | 23,4 | 23,9 | 22,1 |
| M: Système musculo-squelettique | 3,0 | 3,3 | 2,7 | 3,0 | 4,0 | 3,7 | 5,0 | 2,6 | 3,3 |
| N: Système nerveux | 16,2 | 15,6 | 13,9 | 12,1 | 15,2 | 15,8 | 16,5 | 14,9 | 16,0 |
| P: Médicaments antiparasitaires | 0,2 | 0,2 | 0,2 | 0,0 | 0,2 | 0,1 | 0,1 | 0,1 | 0,2 |
| R: Système respiratoire | 7,2 | 7,0 | 5,9 | 5,2 | 6,6 | 6,7 | 5,8 | 7,7 | 7,2 |
| S: Organes sensoriels | 4,7 | 2,6 | 3,7 | 2,1 | 2,9 | 2,8 | 4,4 | 4,7 | 2,4 |
| V: Divers | 3,4 | 2,8 | 5,3 | 4,1 | 4,8 | 2,3 | 0,6 | 3,3 | 2,3 |
| Toutes les classes thérapeutiques* | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 | 100,0 |
* Les chiffres AYANT été arrondi, il est possible que valeurs ne totalisent pas 100.
Source de données : Base de données MIDAS®, 2018, IQVIA (tous droits réservés)
Le système national d’information sur l’utilisation des médicaments prescrits : à l’appui des décisions relatives aux soins de santé au Canada
La façon dont les médicaments sont utilisés — où, par qui et dans quel but — influe sur les dépenses en matière de médicaments. Le CEPMB permet au Canada de mieux comprendre l’utilisation des médicaments par l’entremise du Système national d’information sur l’utilisation des médicaments prescrits (SNIUMP), qui produit des renseignements complets et exacts permettant d’orienter le processus décisionnel et de favoriser la viabilité soutenue de notre système pharmaceutique.
Contexte
Le SNIUMP est une initiative de recherche mise sur pied par les ministres fédéral, provinciaux et territoriaux de la Santé en septembre 2001. Il s’agit d’un partenariat entre le CEPMB et l’Institut canadien d’information sur la santé (ICIS).
À la demande du ministre de la Santé en vertu de l’article 90 de la Loi sur les brevets, le CEPMB a pour mandat d’effectuer des analyses qui fournissent aux décideurs de l’information et des renseignements critiques sur les tendances en matière de prix, d’utilisation et de coûts des médicaments sur ordonnance brevetés et non brevetés. Cela permet de s’assurer que le système canadien des soins de santé a accès à des renseignements plus exhaustifs et précis sur l’utilisation des médicaments et les facteurs à l’origine des contraintes financières.
Les priorités et méthodes de recherche propres au SNIUMP sont établies avec l’aide du Comité consultatif du SNIUMP et reflètent les priorités des administrations participantes. Le Comité consultatif est constitué de représentants des régimes publics d’assurance-médicaments de la Colombie-Britannique, de l’Alberta, de la Saskatchewan, du Manitoba, de l’Ontario, du Nouveau-Brunswick, de la Nouvelle-Écosse, de l’Île-du-Prince-Édouard, de Terre-Neuve-et-Labrador et du Yukon, du Programme 54 CONSEIL D’EXAMEN DU PRIX DES MÉDICAMENTS BREVETÉS des services de santé non assurés (SSNA) et de Santé Canada. Il comprend également des observateurs de l’ICIS, de l’Agence canadienne des médicaments et des technologies de la santé (ACMTS), du ministère de la Santé et des Services sociaux du Québec (MSSS) et de l’Alliance pancanadienne pharmaceutique (APP).
Le SNIUMP est une initiative de recherche indépendante des activités réglementaires du CEPMB. Les rapports du SNIUMP ne contiennent pas de renseignements confidentiels ou privilégiés en vertu des articles 87 et 88 de la Loi sur les brevets.
Faits saillants
Depuis la publication du dernier rapport annuel, le CEPMB a publié huit rapports d’analyse, un recueil de graphiques et six affiches sous la bannière du SNIUMP.
Rapports publiés :
- Génériques360 : Médicaments génériques au Canada, 2016 (février 2018)
- Veille des médicaments mis en marché, 2016 (juin 2018)
- CompasRx, 4e édition, 2016-2017 (septembre 2018)
- Rapport sur la situation du marché : Médicaments inhibiteurs du facteur de croissance vasculaire endothéliale (anti-VEGF) indiqués dans le traitement de troubles rétiniens, 2017 (décembre 2018)
- Veille des médicaments mis en marché, 2017 (février 2019)
- L’Observateur des médicaments émergents 2018 (mai 2019) [anciennement New Drug Pipeline Monitor en anglais, mais même titre en français]
- Génériques360 : Médicaments génériques au Canada, 2018 (août 2019)
- CompasRx, 5e édition, 2017-2018 (septembre 2019)
Recueil de graphiques :
- Le marché des opioïdes d’ordonnance sous forme orale solide, de 2010 à 2017 (janvier 2019)
Présentations d’affiches :
- Le prix des médicaments génériques au Canada : combler l’écart
- Découvrir les facteurs de coûts des régimes publics d’assurance-médicaments du Canada, 2017-2018
- Le marché des médicaments oncologiques : un domaine thérapeutique à forte croissance et à prix élevé
- Inhalateurs combinés contre l’asthme au Canada : des prix toujours élevés
- Harmonisation de la couverture des anticancéreux au Canada
- Pressions à l’origine de la hausse des coûts des régimes privés d’assurance-médicaments au Canada, 2018
Le SNIUMP a également mené un certain nombre d’études spéciales à la demande des administrations participantes du SNIUMP.
Le CEPMB a continué de soutenir et de renforcer ses activités d’engagement liées au SNIUMP en consultant régulièrement le Comité consultatif du SNIUMP, en participant à des conférences et des comités d’intervenants et en organisant des séances d’information avec des intervenants souhaitant partager les résultats des études analytiques.
Programme de recherche
En 2018, le CEPMB a lancé une série de courtes analyses présentées sous forme de graphiques appelées Recueils de graphiques. Le premier recueil de graphiques, publié en janvier 2019, portait sur le marché des opioïdes d’ordonnance sous forme orale solide au Canada et aux États-Unis. Parmi les sujets de prochaines analyses, on compte un aperçu des marchés des biosimilaires, des médicaments onéreux pour maladies rares (MOMR) et des médicaments oncologiques au Canada et à l’étranger.
Le programme de recherche du SNIUMP pour le prochain exercice financier comprend également la publication des études analytiques suivantes :
- Veille des médicaments mis en marché, 2018
- L’Observateur des médicaments émergents, 2019, Rapports sur la situation du marché sur 1) les inhalateurs combinés contre l’asthme, 2018; et 2) les nouveaux médicaments antidiabétiques, 2018
- Concordance des listes de médicaments des régimes publics au Canada, Partie 2 : Les médicaments oncologiques évalués dans le cadre du Programme d’examen conjoint des médicaments oncologiques (PECMO).
- Les régimes privés d’assurance-médicaments au Canada Partie 2 : Principaux facteurs qui déterminent les coûts des médicaments et les frais d’exécution des ordonnances dans les régimes privés
D’autres sujets de recherche peuvent être traités après consultation du Comité consultatif du SNIUMP.
Analyse des dépenses de recherche et développement : l’investissement en R-D n’atteint pas la cible
L’innovation est cruciale pour la promotion des soins de santé. La Loi sur les brevets du Canada vise, en partie, à créer un climat d’investissement propice à la recherche et au développement (R-D) dans le domaine pharmaceutique au Canada. Toutefois, le ratio des dépenses effectuées en R-D par rapport aux recettes tirées des ventes chez les titulaires de brevets pharmaceutiques au Canada diminue depuis la fin des années 1990 et se situe sous l’objectif convenu de 10 % depuis 2003. En 2018, ce pourcentage équivalait à 4,0 % pour tous les titulaires de brevets, et à 4,3 % pour les membres de Médicaments novateurs Canada.
Analyse des dépenses de recherche-développement
La Loi confère au CEPMB le mandat de faire le suivi des dépenses en recherche-développement (R-D) dans le domaine pharmaceutique et de faire rapport sur celles-ci. Le présent chapitre fournit des statistiques clés sur la situation actuelle des investissements dans la R-D dans le domaine pharmaceutique au Canada.
4,0 % Ratio des dépenses de R-D
Ratio de dépenses de R-D par rapport
aux recettes tirées des ventes pour
tous les brevetés était de 4,0 %.
Cela représente une diminution de 66 %
par rapport au sommet de 11,7 % en 1995.
Sources de données
Les résultats statistiques du présent rapport proviennent entièrement des données soumises au CEPMB par les brevetés.
La Loi oblige les brevetés à faire rapport au CEPMB des recettes brutes totales qu’ils tirent des ventes de tous leurs médicaments pour usage humain et pour usage vétérinaire (y compris les recettes tirées des ventes de médicaments non brevetés et les recettes découlant d’ententes de vente sous licence) ainsi que de leurs dépenses de R-D au Canada pour leurs différents médicaments (brevetés et non brevetés, pour usage humain et pour usage vétérinaire). Les brevetés transmettent ces renseignements au CEPMB au moyen de son Formulaire 3 (Recettes et dépenses en recherche et développement fournies en application du paragraphe 88(1) de la Loi sur les brevets).
Le Règlement sur les médicaments brevetés (le Règlement) exige que chaque Formulaire 3 déposé soit accompagné d’un document certifiant l’exactitude et la conformité des données fournies. Le CEPMB ne vérifie pas systématiquement l’information qui lui est présentée sur le Formulaire 3, mais cherche plutôt les anomalies et les contradictions et, lorsqu’il y a lieu, demande aux brevetés de corriger leurs données ou de les étoffer. Pour garantir la juste interprétation des données de la part du personnel du CEPMB, chaque breveté est invité à vérifier et à confirmer, avant la publication du ratio, l’exactitude du ratio de ses dépenses de R-D par rapport aux recettes tirées des ventes.
Défaut de soumettre ses rapports (Formulaire 3)
Les brevetés sont tenus de soumettre un Formulaire 3 complet et exact dans les délais mentionnés dans le Règlement. Si un breveté omet de respecter les exigences en matière de présentation de rapport, le Conseil peut rendre une ordonnance exigeant le respect de ces exigences. Aucune ordonnance n’a été rendue pour la période de déclaration de 2018.
Couverture
Notons que les entreprises qui n’ont fait aucune vente de médicaments brevetés ne sont pas tenues de présenter un rapport sur leurs dépenses de R-D au CEPMB. Cela a deux conséquences.
D’abord, les résultats statistiques indiqués ici ne devraient pas être utilisés afin de couvrir toute la recherche pharmaceutique réalisée au Canada. Par exemple, une entreprise peut vendre uniquement des médicaments non brevetés, mais effectuer quand même beaucoup de recherche au Canada. De même, une entreprise peut effectuer de la recherche et ne vendre aucun médicamentNote de bas de page 26. Les résultats présentés ci-dessous ne tiennent pas compte des dépenses de R-D des entreprises dans l’une ou l’autre de ces situations.
Ensuite, comme de nouveaux médicaments brevetés sont entrés sur le marché canadien et que des brevets existants expirent, le nombre et l’identité des entreprises devant soumettre un rapport sur leurs données de R-D peuvent varier d’une année à l’autre. En 2018, 93 entreprises ont déclaré leurs activités de R-D. Parmi celles-ci, 32 étaient membres de Médicaments novateurs Canada.
Définition de recettes tirées des ventes
Aux fins du présent rapport, les recettes tirées des ventes s’entendent du produit brut total des ventes au Canada de tous les médicaments ainsi que des recettes découlant d’ententes de vente sous licence (p. ex. redevances et droits versés au breveté liés aux ventes effectuées au Canada par des titulaires de licence).
Définition de dépenses de R-D
En vertu de l’article 6 du Règlement, les brevetés doivent inclure dans leurs rapports leurs dépenses de R-D qui auraient été admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental (RS-DE) aux termes de la Loi de l’impôt sur le revenu qui est entrée en vigueur le 1er décembre 1987Note de bas de page 27. Ainsi, les dépenses de R-D peuvent inclure les dépenses courantes, les coûts d’immobilisation et l’amortissement autorisé. Les frais engagés pour les études de marché, la promotion des ventes, le contrôle de la qualité ou les essais systématiques de matériel, de dispositifs ou de produits ainsi que pour la collecte de données de routine n’étant pas admissibles au crédit d’impôt à l’investissement, ils ne doivent pas figurer dans les dépenses de R-D déclarées par les brevetés.
Recettes tirées des ventes et dépenses de R-D totales
Le tableau 14 donne un aperçu des recettes tirées des ventes et des dépenses de R-D déclarées au cours de la période de 1988 à 2018.
La valeur des recettes totales tirées des ventes déclarées par les brevetés a totalisé 22,7 milliards de dollars en 2018, ce qui représente une augmentation de 7,2 % par rapport à 2017. Les recettes tirées des ventes déclarées par les membres de Médicaments novateurs Canada ont totalisé 16,8 milliards de dollars, soit 74 % de l’ensemble des recettes. (De ce montant, moins de 1 % des recettes découlent d’ententes de vente sous licence.)
Les dépenses de R-D déclarées par les brevetés ont totalisé 892,6 millions de dollars en 2018, ce qui représente une hausse de 2,4 % par rapport à 2017. Les dépenses de R-D déclarées par les brevetés membres de Médicaments novateurs Canada ont totalisé 723,0 millions de dollars en 2018, soit une baisse de 4,3 % par rapport à l’année précédente. Les brevetés membres de Médicaments novateurs Canada ont effectué 81,0 % de toutes les dépenses de R-D déclarées pour 2018.
Ratios des dépenses de R-D par rapport aux recettes tirées des ventes
Le tableau 14 et la figure 35 présentent également les ratios des dépenses de R-D par rapport aux recettes tirées des ventes. Il convient de noter que, en contrepartie de l’adoption des modifications apportées à la Loi en 1987, Médicaments novateurs Canada s’était engagé publiquement à augmenter les dépenses annuelles de R-D de ses membres pour qu’elles totalisent avant 1996 10 % des recettes tirées des ventesNote de bas de page 28. Ce niveau de dépenses de R-D a été atteint en 1993, le taux ayant même dépassé 10 % certaines années.
Le ratio de 2018 des dépenses de R-D par rapport aux recettes tirées des ventes de tous les brevetés était de 4,0 %, ce qui représente une légère baisse par rapport au ratio de 4,1 % en 2017. Le ratio global des dépenses de R-D par rapport aux recettes tirées des ventes a été inférieur à 10 % au cours des 18 dernières années.
Le ratio correspondant des dépenses de R-D par rapport aux recettes tirées des ventes des brevetés membres de Médicaments novateurs Canada était de 4,3 % en 2018, une baisse par rapport au 4,6 % en 2017Note de bas de page 29. Le ratio des brevetés membres de Médicaments novateurs Canada a été inférieur à 10 % au cours des 16 dernières années.
Le tableau 20 à l’annexe 4 présente en détail la fourchette des ratios des dépenses de R‑D par rapport aux recettes tirées des ventes de 2018. Des 93 entreprises ayant présenté des rapports en 2018, 82,8 % ont présenté un ratio de R‑D par rapport aux recettes tirées des ventes de moins de 10 %.
| Année | Tous les brevetés | Brevetés membres de médicaments novateurs Canada | Ratio des dépenses de R-D par rapport aux recettes tirées des ventes : tous les brevetés (en %) |
Ratio des dépenses de R-D par rapport aux recettes tirées des ventes : brevetés membres de médicaments novateurs Canada (en %) |
|||||||
|---|---|---|---|---|---|---|---|---|---|---|---|
| Nombre d’entreprises faisant rapport | Dépenses de R-D de tous les brevetés (m$) | Variation par rapport à l’année précédente (en %) |
Recettes tirées des ventes (m$) | Variation par rapport à l’année précédente (en %) |
Dépenses de R-D de tous les brevetés membres de médicaments novateurs Canada (m$) |
Variation par rapport à l’année précédente (en %) |
Recettes tirées des ventes (m$) | Variation par rapport à l’année précédente (en %) |
|||
| 2018 | 93 | 892,6 | 2,4 | 22 663,4 | 7,2 | 723,0 | -4,3 | 16 789,7 | 2,7 | 4,0 | 4,3 |
| 2017 | 85 | 871,4 | -5,1 | 21 147,2 | 1,4 | 755,8 | -1.8 | 16 349,8 | 4,8 | 4,1 | 4,6 |
| 2016 | 78 | 918,2 | 5,7 | 20 855,7 | 5,9 | 769,9 | 0,3 | 15 599,9 | 0,2 | 4,4 | 4,9 |
| 2015 | 77 | 869,1 | 9,7 | 19 693,3 | 6,7 | 767,4 | 7.8 | 15 565,1 | 4,7 | 4,4 | 4,9 |
| 2014 | 75 | 792,2 | -0,8 | 18 455,1 | 1,0 | 711,7 | 2,0 | 14 861,1 | 9,2 | 4,3 | 4,8 |
| 2013 | 81 | 798,3 | -14,7 | 18 268,1 | 1,4 | 697,5 | -15,4 | 13 614,8 | 3,4 | 4,4 | 5,1 |
| 2012 | 85 | 936,1 | -5,6 | 18 021,1 | 1,3 | 824,1 | -8,6 | 13 162,8 | -2,1 | 5,2 | 6,3 |
| 2011 | 79 | 991,7 | -15,8 | 17 798,8 | 4,7 | 901,2 | -9,9 | 13 446,1 | 10,7 | 5,6 | 6,7 |
| 2010 | 82 | 1,178,2 | -7.4 | 17 000,0 | -0,3 | 1,000,2 | -11,7 | 12 149,0 | -11,8 | 6,9 | 8,2 |
| 2009 | 81 | 1,272,0 | -2,9 | 17 051,9 | 4,5 | 1,132,9 | -3,4 | 13 780,0 | 4,6 | 7,5 | 8,2 |
| 2008 | 82 | 1 310,7 | -1.1 | 16 316,7 | 2,0 | 1 172,2 | -1,0 | 13 178,2 | -1,4 | 8,1 | 8,9 |
| 2007 | 82 | 1 325,0 | 9,5 | 15 991,0 | 7,3 | 1 184,4 | 24,8 | 13 359,8 | 20,0 | 8,3 | 8,9 |
| 2006 | 72 | 1 210,0 | -1,9 | 14 902,0 | 4,7 | 949,0 | -8,8 | 11 131,2 | -5,8 | 8,1 | 8,5 |
| 2005 | 80 | 1 234,3 | 5,5 | 14 231,3 | 0,5 | 1 040,1 | 3,9 | 11 821,4 | 0,0 | 8,7 | 8,8 |
| 2004 | 84 | 1 170,0 | -2,0 | 14 168,3 | 4,0 | 1 000,8 | 0,8 | 11 819,0 | 8,8 | 8,3 | 8,5 |
| 2003 | 83 | 1 194,3 | -0,4 | 13 631,1 | 12,8 | 992,9 | -3,6 | 10 865,7 | 5,2 | 8,8 | 9,1 |
| 2002 | 79 | 1 198,7 | 13,0 | 12 081,2 | 12,5 | 1 029,6 | 10,1 | 10 323,8 | 16,8 | 9,9 | 10,0 |
| 2001 | 74 | 1 060,1 | 12,6 | 10 732,1 | 15,3 | 935,2 | 14,7 | 8 835,4 | 14,3 | 9,9 | 10,6 |
| 2000 | 79 | 941,8 | 5,3 | 9 309,6 | 12,0 | 815,5 | 4.0 | 7 728,8 | 11,6 | 10,1 | 10,6 |
| 1999 | 78 | 894,6 | 12,0 | 8 315,5 | 19,2 | 784,3 | 9,9 | 6 923,4 | 22,8 | 10,8 | 11,3 |
| 1998 | 74 | 798,9 | 10,2 | 6 975,2 | 10,9 | 713,7 | 8,6 | 5 640,2 | 10,6 | 11,5 | 12,7 |
| 1997 | 75 | 725,1 | 9,0 | 6 288,4 | 7,4 | 657,4 | 10,3 | 5 098,2 | 4,9 | 11,5 | 12,9 |
| 1996 | 72 | 665,3 | 6,4 | 5 857,4 | 9,9 | 595,8 | 6,5 | 4 859,5 | 8,7 | 11,4 | 12,3 |
| 1995 | 71 | 625,5 | 11,5 | 5 330,2 | 7,5 | 559,5 | 9,8 | 4 468,8 | 1,4 | 11,7 | 12,5 |
| 1994 | 73 | 561,1 | 11,4 | 4 957,4 | 4,4 | 509,5 | 10,4 | 4 407,2 | 2,0 | 11,3 | 11,6 |
| 1993 | 70 | 503,5 | 22,1 | 4 747,6 | 14,0 | 461,4 | 24,0 | 4 321,4 | 14,4 | 10,6 | 10,7 |
| 1992 | 71 | 412,4 | 9,6 | 4 164,4 | 6,9 | 372,1 | 9,0 | 3 778,4 | 6,5 | 9,9 | 9,8 |
| 1991 | 65 | 376,4 | 23,2 | 3 894,8 | 18,1 | 341,4 | 24,7 | 3 546,9 | 19,5 | 9,7 | 9,6 |
| 1990 | 65 | 305,5 | 24,8 | 3 298,8 | 11,0 | 273,8 | 25,8 | 2 967,9 | 10,5 | 9,3 | 9,2 |
| 1989 | 66 | 244,8 | 47,4 | 2 973,0 | 9,4 | 217,6 | 34,7 | 2 685,5 | 7,3 | 8,2 | 8,1 |
| 1988 | 66 | 165,7 | — | 2 718,0 | — | 161,5 | — | 2 502,3 | — | 6,1 | 6,5 |
Source : CEPMB
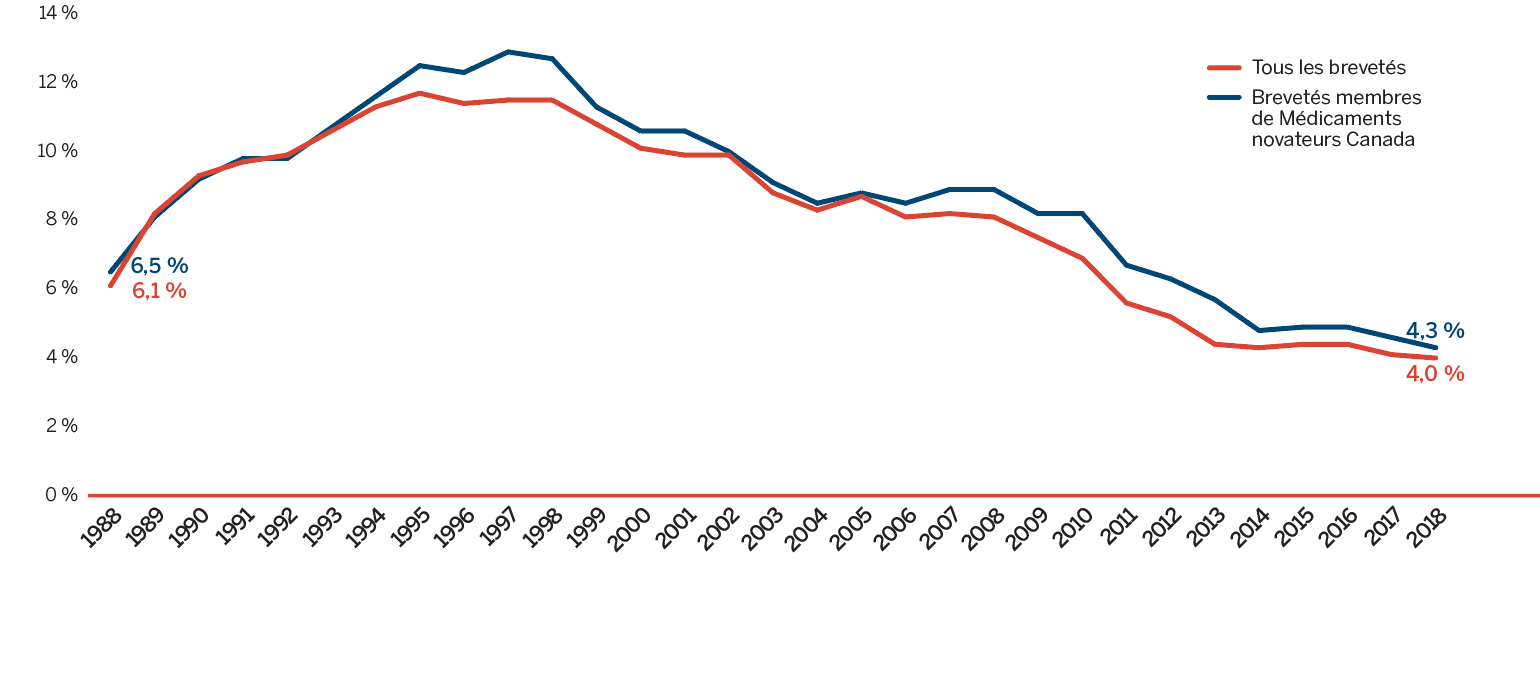
Source : CEPMB
Description de la figure
Il s’agit d’un diagramme linéaire comparant le ratio des dépenses de R-D par rapport aux ventes parmi tous les titulaires de brevets et les membres de Médicaments novateurs Canada, selon les données recueillies de 1988 à 2018.
Brevetés membres de Médicaments novateurs Canada : 1988, 6,5 %; 1989, 8,1 %; 1990, 9,2 %; 1991, 9,8 %; 1992, 9,8 %; 1993, 10,7 %; 1994, 11,6 %; 1995, 12,5 %; 1996, 12,3 %; 1997, 12,9 %; 1998, 12,7 %; 1999, 11,3 %; 2000, 10,6 %; 2001, 10,6 %; 2002, 10,0 %; 2003, 9,1 %; 2004, 8,5 %; 2005, 8,8 %; 2006, 8,5 %; 2007, 8,9 %; 2008, 8,9 %; 2009, 8,2 %; 2010, 8,2 %; 2011, 6,7 %; 2012, 6,3 %; 2013, 5,7 %; 2014, 4,8 %; 2015, 4,9 %; 2016, 4,9 %; 2017, 4,6 %; 2018, 4,3 %.
Tous les brevetés : 1988, 6,1 %; 1989, 8,2 %; 1990, 9,3 %; 1991, 9,7 %; 1992, 9,9 %; 1993, 10,6 %; 1994, 11,3 %; 1995, 11,7 %; 1996, 11,4 %; 1997, 11,5 %; 1998, 11,5 %; 1999, 10,8 %; 2000, 10,1 %; 2001, 9,9 %; 2002, 9,9 %; 2003, 8,8 %; 2004, 8,3 %; 2005, 8,7 %; 2006, 8,1 %; 2007, 8,2 %; 2008, 8,1 %; 2009, 7,5 %; 2010, 6,9 %; 2011, 5,6 %; 2012, 5,2 %; 2013, 4,4 %; 2014, 4,3 %; 2015, 4,4 %; 2016, 4,4 %; 2017, 4,1 %; 2018, 4,0 %.
Dépenses courantes de R-D selon le type de recherche
Le tableau 15 et la figure 36 (ainsi que la figure 38 à l’annexe 4) présentent des données sur la ventilation des dépenses courantes de R-D engagées en 2018Note de bas de page 30 selon le type de recherche, à savoir la recherche fondamentale, la recherche appliquée et autres types de R-D admissiblesNote de bas de page 31. Pour 2018, les brevetés ont fait état de dépenses de recherche fondamentale totalisant 106,9 millions de dollars ou 12,3 % du total des dépenses courantes de R-D, soit une baisse de 2,0 % par rapport à l’année précédente. Les brevetés ont déclaré des dépenses de recherche appliquée totalisant 517,1 millions de dollars, ou, encore, 59,2 % des dépenses courantes de R-D. Les essais cliniques représentaient 77,3 % des dépenses de recherche appliquée.
| Type de recherche | Dépenses : 2018 (m$) | Part : 2018 (en %) | Dépenses : 2017 (m$) | Part : 2017 (en %) | Variation annuelle des dépenses (en %) |
|---|---|---|---|---|---|
| Fondamentale | 106,9 | 12,3 | 109,0 | 13,1 | -2,0 |
| Chimique | 69,5 | 8,0 | 61,4 | 7,4 | 13,2 |
| Biologique | 37,4 | 4,3 | 47,6 | 5,7 | -21,4 |
| Appliquée | 517,1 | 59,2 | 501,9 | 60,3 | 3,0 |
| Processus de fabrication | 71,0 | 8,1 | 72,9 | 8,8 | -2,6 |
| Essais précliniques I | 19,8 | 2,3 | 31,6 | 3,8 | -37,3 |
| Essais précliniques II | 26,8 | 3,1 | 34,6 | 4,2 | -29,8 |
| Essais cliniques de phase I | 50,5 | 5,8 | 41,2 | 4,9 | 22,6 |
| Essais cliniques de phase II | 83,1 | 9,5 | 58,7 | 7,0 | 41,6 |
| Essais cliniques de phase III | 265,9 | 30,4 | 262,9 | 31,6 | 1,1 |
| Autre R-D admissible | 250,2 | 28,6 | 222,2 | 26,7 | 12,6 |
| Total* | 874,1 | 100 | 833,1 | 100 | 4,9 |
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source : CEPMB
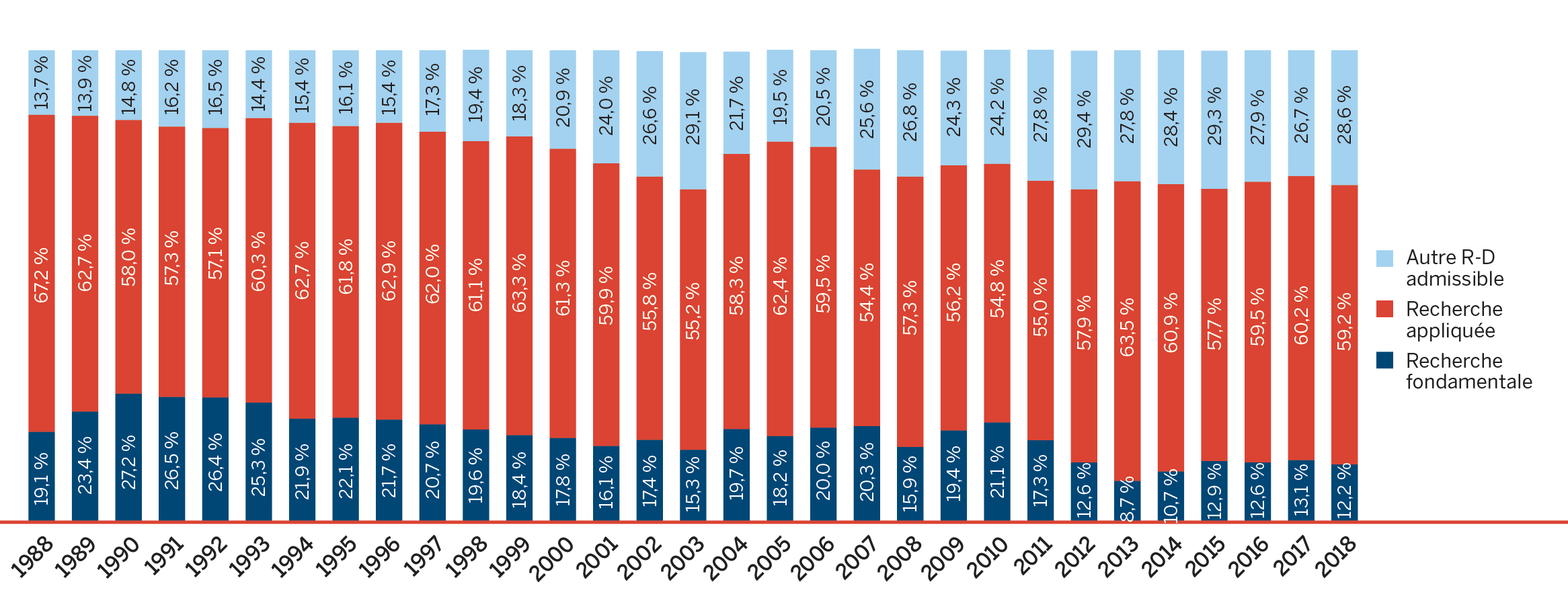
Source : CEPMB
Description de la figure
Ce diagramme à colonnes empilées présente la part des dépenses courantes de R-D, de 1988 à 2018, par type de recherche : fondamentale, appliquée et autre R-D admissible.
| Année | Recherche fondamentale (%) | Recherche appliquée (%) | Autre R-D admissible (%) |
|---|---|---|---|
| 1988 | 19,1 | 67,2 | 13.7 |
| 1989 | 23,4 | 62,7 | 13,9 |
| 1990 | 27,2 | 58,0 | 14,8 |
| 1991 | 26,5 | 57,3 | 16,2 |
| 1992 | 26,4 | 57,1 | 16,5 |
| 1993 | 25,3 | 60,3 | 14,4 |
| 1994 | 21,9 | 62,7 | 15,4 |
| 1995 | 22,1 | 61,8 | 16,1 |
| 1996 | 21,7 | 62,9 | 15,4 |
| 1997 | 20,7 | 62,0 | 17,3 |
| 1998 | 19,6 | 61,1 | 19,4 |
| 1999 | 18,4 | 63,3 | 18,3 |
| 2000 | 17,8 | 61,3 | 20,9 |
| 2001 | 16,1 | 59,9 | 24,0 |
| 2002 | 17,4 | 55,8 | 26,6 |
| 2003 | 15,3 | 55,2 | 29,1 |
| 2004 | 19,7 | 58,3 | 21,7 |
| 2005 | 18,2 | 62,4 | 19,5 |
| 2006 | 20,0 | 59,5 | 20,5 |
| 2007 | 20,3 | 54,4 | 25,6 |
| 2008 | 15,9 | 57,3 | 26,8 |
| 2009 | 19,4 | 56,2 | 24,3 |
| 2010 | 21,1 | 54,8 | 24,2 |
| 2011 | 17,3 | 55,0 | 27,8 |
| 2012 | 12,6 | 57,9 | 29,4 |
| 2013 | 8,7 | 63,5 | 27,8 |
| 2014 | 10,7 | 60,9 | 28,4 |
| 2015 | 12,9 | 57,7 | 29,3 |
| 2016 | 12,6 | 59,5 | 27,9 |
| 2017 | 13,1 | 60,2 | 26,7 |
| 2018 | 12,2 | 59,2 | 28,6 |
Dépenses courantes de R-D selon le milieu de recherche
Les brevetés peuvent inclure dans leurs dépenses de R-D la recherche qu’ils effectuent eux-mêmes à l’interne ainsi que la recherche qu’ils font faire à l’externe, notamment par des universités, des hôpitaux et d’autres fabricants. Le tableau 16 révèle que, en 2018, 49,2 % des dépenses courantes de recherche ont été effectuées à l’interne. La proportion de la R-D effectuée par d’autres entreprises pour le compte des brevetés a représenté 23,7 % de l’ensemble des dépenses courantes, tandis que la recherche effectuée par les universités et par les hôpitaux a représenté 18,5 % des dépenses courantes.
| Milieu de recherche | Dépenses : 2018 (m$) | Part : 2018 (en %) | Dépenses : 2017 (m$) | Part : 2017 (en %) | Variation annuelle des dépenses (en %) |
|---|---|---|---|---|---|
| À l’interne | |||||
| Brevetés | 429,7 | 49,2 | 375,3 | 45,1 | 14,5 |
| À l’externe | |||||
| Universités et hôpitaux | 162,4 | 18,5 | 148,7 | 17,9 | 9,2 |
| tres entreprises | 207,0 | 23,7 | 222,6 | 26,7 | -7,0 |
| Autres | 75,1 | 8,6 | 86,5 | 10,4 | -13,2 |
| Total* | 874,1 | 100,0 | 833,1 | 100,0 | 4,9 |
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source: CEPMB
Le ratio moyen des dépenses de R-D par rapport aux recettes tirées des ventes du CEPMB7 est cinq fois supérieur à celui du Canada
Le ratio des dépenses de R-D par rapport aux recettes tirées des ventes obtenu par agrégation des dépenses de R-D et des ventes dans l’ensemble des sept pays de comparaison était 23,5 %, soit plus de cinq fois celui du Canada.
Dépenses courantes de R-D selon la région géographique
Le tableau 17 (ainsi que le tableau 22 et le tableau 23 de l’annexe 4) ventile les dépenses courantes de R-D selon la région géographique. Cette année encore, les dépenses ont été surtout engagées en Ontario et au Québec en 2018, qui ont accaparé 80,1 % de la valeur totale des dépenses courantes de R-D. Cependant, tandis que la valeur des dépenses courantes de R-D a augmenté d’un modeste taux annuel de 1,2 % en Ontario et de 1,0 % au Québec, elle a augmenté de 23,0 % dans l’ouest du pays et de 26,6 % dans les provinces de l’Atlantique.
| Région | Dépenses : 2018 (m$) | Part : 2018 (en %) | Dépenses : 2017 (m$) | Part : 2017 (en %) | Variation annuelle des dépenses (en %) |
|---|---|---|---|---|---|
| Provinces de l’Atlantique | 19,8 | 2,3 | 15,7 | 1,9 | 26,6 |
| Québec | 285,8 | 32,7 | 283,1 | 34,0 | 1,0 |
| Ontario | 414,5 | 47,4 | 409,5 | 49,1 | 1,2 |
| Provinces de l’Ouest | 153,6 | 17,6 | 124,9 | 15,0 | 23,0 |
| Territoires | 0,4 | 0,0 | 0,0 | 0,0 | 0,0 |
| Total* | 874,1 | 100,0 | 833,1 | 100,0 | 4,9 |
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source : CEPMB
Dépenses totales de R-D selon la provenance des fonds
Le tableau 18 présente des renseignements sur la provenance des fonds utilisés par les brevetés pour financer leurs activités de R-D. En 2018, les brevetés ont financé à même leurs propres fonds la majeure partie de leur R-D (91,0 % des dépenses totales). Les fonds provenant du gouvernement ont servi à financer 0,5 % des dépenses totales.
| Provenance des fonds | Dépenses : 2018 (m$) | Part : 2018 (en %) | Dépenses : 2017 (m$) | Part : 2017 (en %) | Variation annuelle des dépenses (en%) |
|---|---|---|---|---|---|
| Fonds de l’entreprise | 812,1 | 91,0 | 791,1 | 90,8 | 2,7 |
| Gouvernements fédéral et provinciaux | 4,5 | 0,5 | 6,0 | 0,7 | -25,0 |
| Autres | 75,9 | 8,5 | 74,3 | 8,5 | 2,2 |
| Total* | 892,6 | 100,0 | 871,4 | 100,0 | 2,4 |
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source : CEPMB
Contexte mondial
Contexte mondial La figure 37 compare les ratios des dépenses de R-D par rapport aux recettes tirées des ventes des produits pharmaceutiques canadiens pour les années 2000 et 2016 à ceux du CEPMB7Note de bas de page 32. En 2000, le Canada affichait un ratio des dépenses de R-D par rapport aux recettes tirées des ventes de 10,1 %, ce qui est inférieur à celui de tous les autres pays du CEPMB7, à l’exception de l’Italie, à 6,2 %. Le ratio le plus élevé de la Suisse était de 102,5 %.
En 2016, le ratio des dépenses de R-D par rapport aux recettes tirées des ventes du Canada était le plus faible parmi les pays de comparaison, soit 4,4 %. L’Italie affichait un ratio légèrement plus élevé de 5,7 %, tandis que tous les autres pays du CEPMB7 sont demeurés bien au-dessus du Canada. Le ratio obtenu avec l’ensemble des dépenses de R-D et des ventes de tous les pays du CEPMB7 était de 23,5 %, soit plus de cinq fois celui du Canada.
On peut comparer les ratios des dépenses de R-D par rapport aux recettes tirées des ventes présentés à la figure 37 avec les ratios moyens des prix bilatéraux mentionnés au tableau 9 (voir la section Comparaison des prix pratiqués au Canada avec ceux pratiqués à l’étranger). Un certain nombre de pays de comparaison, dont les prix des médicaments brevetés sont, en moyenne, moins élevés qu’au Canada, ont obtenu des ratios des dépenses de R-D par rapport aux recettes tirées des ventes beaucoup plus élevés.
Tel que mentionné dans les rapports annuels précédents, la région géographique où se produit la R-D pharmaceutique dépend de plusieurs facteurs. Parmi les facteurs dont tiennent compte les entreprises, il y a notamment la présence, la qualité et la rentabilité des meilleures institutions scientifiques et l’accès aisé à une infrastructure de haute qualité pour les essais cliniques. Bien qu’on cite souvent les niveaux de prix et la protection de la propriété intellectuelle comme importants leviers politiques pour attirer la R-D, les données n’appuient pas une telle corrélation au niveau national ou international.
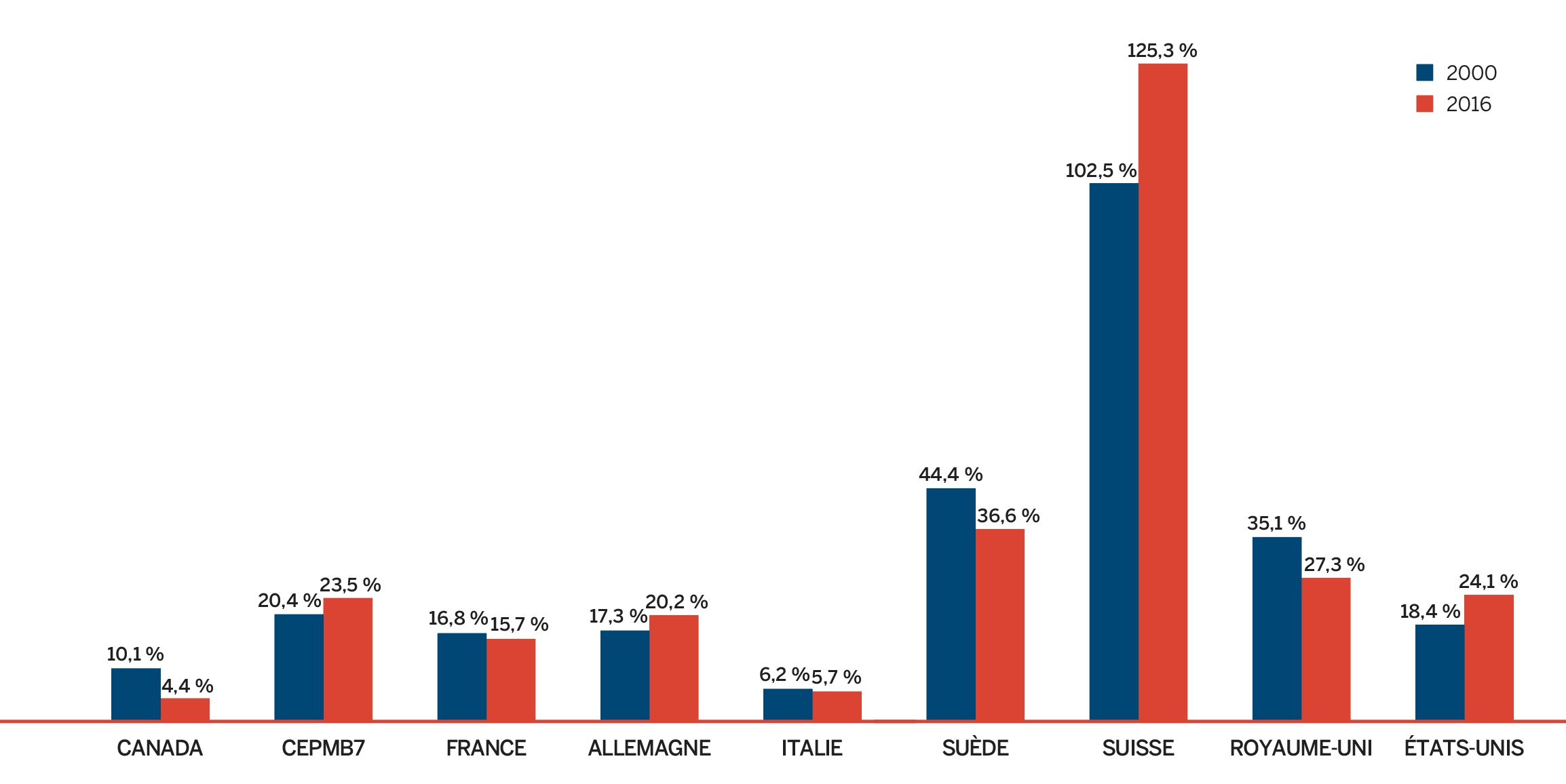
Source : CEPMB; Fédération européenne des associations de l’industrie pharmaceutique (FEAIP) : L’industrie pharmaceutique dans les figures 2018; profil PhRMA 2018
Description de la figure
Le diagramme à barres présente le ratio des dépenses de R-D par rapport aux ventes au Canada et dans les pays de comparaison, en 2000 et en 2016.
2000 : Canada, 10,1 %; CEPMB7, 20,4 %; France, 16,8 %; Allemagne, 17,3 %; Italie, 6,2 %; Suède, 44,4 %; Suisse, 102,5 %; Royaume-Uni, 35,1 %; États-Unis, 18,4 %.
2016 : Canada, 4,4 %; CEPMB7, 23,5 %; France, 15,7 %; Allemagne, 20,2 %; Italie, 5,7 %; Suède, 36,6 %; Suisse, 125,3 %; Royaume-Uni, 27,3 %; États-Unis, 24,1 %.
Annexe 1 : Glossaire
Ces définitions sont fournies à des fins d’aide générale seulement; elles n’ont pas force de loi et doivent être lues conjointement avec les lois applicables.
ATC: Système de classification anatomique, thérapeutique et chimique (ATC), conçu et tenu à jour par le Centre collaborateur de l’OMS pour la méthodologie sur l’établissement des statistiques concernant les médicaments de l’Organisation mondiale de la Santé (OMS). Ce système distingue les médicaments selon leur site d’action et leurs caractéristiques thérapeutiques et chimiques. Le CEPMB utilise ce système pour sélectionner les médicaments qui seront utilisés dans les comparaisons des prix conformément aux Lignes directrices.
Avis de conformité (AC) : Avis donné en vertu de l’article C.08.004.01 ou C.08.004.01 du Règlement sur les aliments et drogues. Cet avis confirme que le produit médicamenteux respecte les normes prescrites par Santé Canada pour une administration à des humains ou à des animaux, selon le cas, et que le fabricant du produit est autorisé à commercialiser le produit au Canada.
Brevet : Instrument émis par le Commissaire aux brevets sous forme de lettres patentes pour une invention.
Breveté : Aux termes du paragraphe 79(1) de la Loi sur les brevets : « La personne ayant pour le moment droit à l’avantage d’un brevet pour une invention liée à un médicament, ainsi que quiconque était titulaire d’un brevet pour une telle invention ou exerce ou a exercé les droits d’un titulaire dans un cadre autre qu’une licence prorogée en vertu du paragraphe 11(1) de la Loi de 1992 modifiant la Loi sur les brevets ».
CEPMB7 : La France, l’Allemagne, l’Italie, la Suède, la Suisse, le Royaume-Uni et les États-Unis.
Défaut de présenter ses rapports : Défaut complet d’un breveté de déclarer un médicament breveté vendu conformément aux exigences réglementaires en matière de présentation de rapport prévues à la Loi sur les brevets et au Règlement sur les médicaments brevetés.
Défaut de soumettre ses rapports : Défaut partiel ou complet d’un breveté de respecter ses exigences réglementaires en matière de soumission de rapport prévues à la Loi sur les brevets et au Règlement sur les médicaments brevetés.
Dépenses courantes de recherche et développement : Désignent les dépenses autres qu’en capital directement liées à la recherche, dont : a) salaires; b) matériel direct; c) entrepreneurs et sous‑traitants; d) autres coûts directs tels que les frais généraux de production; e) paiements aux institutions désignées; f) paiements aux organismes subventionnaires; g) paiements aux autres organismes. Ces éléments sont décrits plus amplement dans le Formulaire 3 présenté dans le Guide du breveté qui se trouve dans le site Web du CEPMB sous « Rapports réglementaires ».
Dépenses de recherche et développement : Aux termes du Règlement sur les médicaments brevetés, et plus particulièrement de ses articles 5 et 6, la recherche et développement s’entend des activités qui auraient été considérées admissibles au crédit d’impôt à l’investissement pour la recherche scientifique et le développement expérimental en vertu de la Loi de l’impôt sur le revenu dans sa version du 1er décembre 1987.
Engagement de conformité volontaire (ECV) : Engagement écrit pris par le breveté de rajuster le prix de son médicament pour le rendre conforme aux Lignes directrices du Conseil. Un engagement de conformité volontaire représente la promesse d’un breveté envers la résolution satisfaisante d’une enquête lancée par le personnel du Conseil, conformément aux Lignes directrices. L’engagement de conformité volontaire tient compte des faits précis et du contexte d’un cas particulier. Par conséquent, l’engagement de conformité volontaire n’a aucune valeur de précédent.
Indice des Prix des médicaments brevetés (IPMB) : Indice établi par le CEPMB pour mesurer la variation annuelle des prix de transaction des médicaments brevetés vendus au Canada. Cet indice est établi à partir des données sur les prix et sur les ventes déclarées par les brevetés.
Ingrédient actif ou Ingrédient médicamenteux : Substance chimique ou biologique responsable de l’effet pharmacologique revendiqué d’un médicament.
Licence volontaire : Engagement contractuel entre un breveté et un titulaire de licence permettant à ce dernier de bénéficier des retombées d’un brevet ou d’exercer des droits à l’égard de celui-ci moyennant une contrepartie financière (comme des redevances sous forme de part des recettes tirées des ventes).
Médicament : une substance ou un ingrédient médicamenteux ou un mélange de substances fabriqué, vendu ou présenté comme pouvant servir au diagnostic, au traitement, à l’atténuation ou à la prévention d’une maladie, d’un trouble, d’un état physique anormal ou de leurs symptômes, chez l’être humain ou les animaux, ou à la restauration, à la correction ou à la modification des fonctions organiques chez l’être humain ou les animaux.
Numéro d’identification du médicament (DIN) : Numéro d’identification que la Direction générale des produits de santé et des aliments de Santé Canada attribue à chaque produit médicamenteux vendu sous ordonnance ou en vente libre et commercialisé en vertu du Règlement sur les aliments et drogues. Le DIN identifie les éléments suivants comme étant uniques au produit : le fabricant, le ou les ingrédients actifs, la concentration du ou des ingrédients actifs, la forme posologique et le mode d’administration. Des DIN différents peuvent être attribués à des concentrations et des formes posologiques différentes d’un même médicament.
Produit médicamenteux : Présentation d’un médicament qui se distingue par sa forme pharmaceutique et la concentration de son ingrédient actif (voir « médicament »).
Programme d’accès spécial (PAS) : Programme en vertu duquel Santé Canada permet à des praticiens d’avoir accès à des produits médicamenteux n’ayant pas encore été approuvés ou qui ne seraient autrement pas disponibles sur le marché canadien.
Recherche et développement (R-D) : Recherche fondamentale ou appliquée visant à créer de nouveaux matériaux, dispositifs, produits ou procédés ou à améliorer ceux qui existent (par exemple, les procédés de fabrication).
Recherche et développement – Autres R-D admissibles : Comprend les dépenses de recherche et développement admissibles qui ne correspondent à aucune des catégories de R-D susmentionnées. Elle comprend les présentations réglementaires, les études de biodisponibilité ainsi que les essais cliniques de phase IV.
Recherche et développement – Recherche appliquée : Activités de recherche et développement entreprises avec une application pratique en vue, notamment la recherche qui vise à améliorer les procédés de fabrication, les études précliniques ou les essais cliniques.
Recherche et développement – Recherche fondamentale : R-D désignant les travaux qui contribuent à faire avancer la connaissance scientifique et qui sont entrepris sans aucune application précise en vue.
Annexe 2 : Médicaments brevetés ayant fait l’objet d’un premier rapport au CEPMB en 2018
| Nom de marque | Entreprise | DIN | Statut (année 2018 entière) | Niveau d’amélioration thérapeutique/catégorie* | |
|---|---|---|---|---|---|
| 1 | Addyi – 100 mg/comprimé | Sprout Pharmaceuticals, Inc. | 2473550 | Sous examen | Sous examen |
| 2 | Alecensaro –150 mg/capsule | Hoffmann-La Roche Limited, Canada | 2458136 | Conforme aux lignes directrices | MN |
| 3 | Alunbrig – 30 mg/comprimé | Takeda Canada Inc. | 2479206 | Sous examen | Sous examen |
| 4 | Alunbrig – 90 mg/comprimé | Takeda Canada Inc. | 2479214 | Sous examen | Sous examen |
| 5 | Alunbrig – 180 mg/comprimé | Takeda Canada Inc. | 2479222 | Sous examen | Sous examen |
| 6 | Alunbrig 90/180 – emballage de 270 mg | Takeda Canada Inc. | 2479230 | Sous examen | Sous examen |
| 7 | ARZERRA – 100 mg/mL | Novartis Pharmaceuticals Canada Inc. | 2381559 | Sous examen | Sous examen |
| 8 | ARZERRA – 1000 mg/mL | Novartis Pharmaceuticals Canada Inc. | 2381567 | Sous examen | Sous examen |
| 9 | Bavencio – 20 mg/mL | EMD Serono Canada Inc | 2469723 | Conforme aux lignes directrices | MN |
| 10 | Belbuca – pellicule de 75 mcg | Purdue Pharma | 2465221 | Conforme aux lignes directrices | MN |
| 11 | Belbuca – pellicule de 150 mcg | Purdue Pharma | 2465248 | Conforme aux lignes directrices | MN |
| 12 | Belbuca – pellicule de 300 mcg | Purdue Pharma | 2465256 | Conforme aux lignes directrices | MN |
| 13 | Belbuca – pellicule de 450 mcg | Purdue Pharma | 2465264 | Conforme aux lignes directrices | MN |
| 14 | Beleodaq – 500 mg/flacon | Servier Canada Inc. | -374 | Sous examen | Sous examen |
| 15 | Benlysta – 200 mg /mL | GlaxoSmithKline Inc. | 2470489 | Sous examen | Sous examen |
| 16 | Besponsa – 0.9 mg/flacon | Pfizer Canada Inc. | 2473909 | Conforme aux lignes directrices | MI-S |
| 17 | Biktarvy 25/50/200 – 275 mg/comprimé | Gilead Sciences, Inc. | 2478579 | Sous examen | Sous examen |
| 18 | Brinavess – 20 mg/mL | Cipher Pharmaceuticals Inc. | 2462400 | Ne justifie pas une enquête | MN |
| 19 | Cabometyx – 20 mg/comprimé | Ipsen Biopharmaceuticals Canada Inc. | 2480824 | Sous examen | Sous examen |
| 20 | Cabometyx – 40 mg/comprimé | Ipsen Biopharmaceuticals Canada Inc. | 2480832 | Sous examen | Sous examen |
| 21 | Cabometyx – 60 mg/comprimé | Ipsen Biopharmaceuticals Canada Inc. | 2480840 | Sous examen | Sous examen |
| 22 | Constella – 72 mcg/capsule | Allergan Inc | 2469510 | Conforme aux lignes directrices | MN |
| 23 | Contrave 8/90 – 98 mg/comprimé | Bausch Health, Canada Inc. | 2472945 | Conforme aux lignes directrices | MN |
| 24 | Cresemba – 200 mg/flacon | Avir Pharma Inc. | 2483998 | Sous examen | Sous examen |
| 25 | Cubicin RF – 500 mg/flacon | Sunovion Pharmaceuticals Inc. | 2465493 | Ne justifie pas une enquête | MN |
| 26 | Darazalex – 100 mg/flacon | Janssen Inc. | 2455951 | Sous examen | Sous examen |
| 27 | Darazalex – 400 mg/flacon | Janssen Inc. | 2455978 | Sous examen | Sous examen |
| 28 | Dupixent – 150mg/mL | Sanofi-aventis Canada Inc. | 2470365 | ECV | MN |
| 29 | Erleada – 60 mg/comprimé | Janssen Inc. | 2478374 | Sous examen | Sous examen |
| 30 | Eucrisa – 20 mg/gram | Pfizer Canada Inc. | 2476991 | Sous examen | Sous examen |
| 31 | Fasenra – 30 mg/dose | AstraZeneca Canada Inc. | 2473232 | Conforme aux lignes directrices | MN |
| 32 | Folotyn – 20 mg/mL | Servier Canada Inc. | 2481820 | Sous examen | Sous examen |
| 33 | Foquest – 25 mg/capsule | Purdue Pharma | 2470292 | Conforme aux lignes directrices | MN |
| 34 | Foquest – 35 mg/capsule | Purdue Pharma | 2470306 | Conforme aux lignes directrices | MN |
| 35 | Foquest – 45 mg/capsule | Purdue Pharma | 2470314 | Conforme aux lignes directrices | MN |
| 36 | Foquest –55 mg/capsule | Purdue Pharma | 2470322 | Conforme aux lignes directrices | MN |
| 37 | Foquest – 70 mg/capsule | Purdue Pharma | 2470330 | Conforme aux lignes directrices | MN |
| 38 | Foquest – 85 mg/capsule | Purdue Pharma | 2470349 | Conforme aux lignes directrices | MN |
| 39 | Foquest – 100 mg/capsule | Purdue Pharma | 2470357 | Conforme aux lignes directrices | MN |
| 40 | Galafold – 123 mg/capsule | Amicus Therapeutics | 2468042 | Sous enquête | MI-S |
| 41 | Herceptin SC – 600 mg/flacon | Hoffmann-La Roche Limited, Canada | 2480697 | Sous examen | Sous examen |
| 42 | Imfinzi – 50 mg/mL | AstraZeneca Canada Inc. | 2468816 | Conforme aux lignes directrices | MN |
| 43 | Juluca 50/25 – 75 mg/comprimé | ViiV HealthCare ULC | 2475774 | Sous examen | Sous examen |
| 44 | Kadcyla – 160 mg/flacon | Hoffmann-La Roche Limited, Canada | 2473224 | Sous examen | Sous examen |
| 45 | Kanuma – 2 mg/mL | Alexion Pharmaceuticals, Inc. | 2469596 | Conforme aux lignes directrices | B |
| 46 | Kevzara – 150 mg/stylo | Sanofi-aventis Canada Inc. | 2472961 | Sous examen | Sous examen |
| 47 | Kevzara – 200 mg/stylo | Sanofi-aventis Canada Inc. | 2472988 | Sous examen | Sous examen |
| 48 | Kisqali – 200 mg/comprimé | Novartis Pharmaceuticals Canada Inc. | 2473569 | Ne justifie pas une enquête | MN |
| 49 | Lartruvo 500 mg/flacon | Eli Lilly Canada Inc. | 2469227 | Sous enquête | MI-P |
| 50 | Lenvima – 8 mg/jour | Eisai Limited | 2468220 | Conforme aux lignes directrices | MN |
| 51 | Lenvima – 18 mg/jour | Eisai Limited | 2468239 | Conforme aux lignes directrices | MN |
| 52 | Lynparza – 100 mg/comprimé | AstraZeneca Canada Inc. | 2475200 | ECV | MN |
| 53 | Lynparza – 150 mg/comprimé | AstraZeneca Canada Inc. | 2475219 | ECV | MN |
| 54 | Metoject Subcutaneous – 15 mg/seringue | Medexus Inc. | 2454858 | Sous examen | Sous examen |
| 55 | Monoprost – 50 mcg/mL | Labtician Théa | 2456230 | Ne justifie pas une enquête | MN |
| 56 | Nuwiq – 3000 IU/flacon | Octapharma Canada Inc. | 2474050 | Sous examen | Sous examen |
| 57 | Nuwiq – 4000 IU/flacon | Otsuka Canada Pharmaceutical Inc. | 2474069 | Sous examen | Sous examen |
| 58 | Ofirmev – 10 mg/mL | Mallinckrodt Canada Inc. | 2408066 | Sous examen | Sous examen |
| 59 | Olumiant – 2 mg/comprimé | Eli Lilly Canada Inc. | 2480018 | Sous examen | Sous examen |
| 60 | Opdivo – 40 mg/flacon | Bristol-Myers Squibb Canada Co. | 2446626 | Sous examen | Sous examen |
| 61 | Opdivo – 100 mg/flacon | Bristol-Myers Squibb Canada Co. | 2446634 | Sous examen | Sous examen |
| 62 | Orilissa – 150 mg/comprimé | Abbvie | 2481332 | Sous examen | Sous examen |
| 63 | Ozanex – 10 mg/gram | Cipher Pharmaceuticals Inc. | 2463504 | Conforme aux lignes directrices | MN |
| 64 | Ozempic – 1 mg/dose | Novo Nordisk Canada Inc. | 2471469 | Conforme aux lignes directrices | MN |
| 65 | Ozempic – 1 N.A./dose | Novo Nordisk Canada Inc. | 2471477 | Conforme aux lignes directrices | MN |
| 66 | Pazeo – 7 mg/mL | Novartis Pharmaceuticals Canada Inc. | 2458551 | Conforme aux lignes directrices | MN |
| 67 | Pifeltro – 100 mg/comprimé | Merck Canada Inc. | 2481545 | Sous examen | Sous examen |
| 68 | Praluent – 75 mg/mL | Sanofi-aventis Canada Inc. | 2453754 | ECV | MN |
| 69 | Praluent – 150 mg/mL | Sanofi-aventis Canada Inc. | 2453762 | ECV | MN |
| 70 | Praluent – 75 mg/mL | Sanofi-aventis Canada Inc. | 2453819 | ECV | MN |
| 71 | Praluent – 150 mg/mL | Sanofi-aventis Canada Inc. | 2453835 | ECV | MN |
| 72 | Prevymis – 20 mg/mL | Merck Canada Inc. | 2469367 | Sous enquête | MN |
| 73 | Prevymis – 240 mg/comprimé | Merck Canada Inc. | 2469375 | Sous enquête | MN |
| 74 | Prevymis – 480 mg/comprimé | Merck Canada Inc. | 2469383 | Sous enquête | MN |
| 75 | Prevymis – 20 mg/mL | Merck Canada Inc. | 2469405 | Sous enquête | MN |
| 76 | Probuphine – 80 mg/implant | Knight Therapeutics Inc. | 2474921 | Sous examen | Sous examen |
| 77 | Rebinyn – 500 | Novo Nordisk Canada Inc. | 2470187 | Conforme aux lignes directrices | MN |
| 78 | Rebinyn – 1000 | Novo Nordisk Canada Inc. | 2470268 | Conforme aux lignes directrices | MN |
| 79 | Rebinyn – 2000 | Novo Nordisk Canada Inc. | 2470276 | Conforme aux lignes directrices | MN |
| 80 | Restasis MultiDose – 0.5 mg/mL | Allergan Inc | 2476835 | Sous examen | Sous examen |
| 81 | Rhopressa – 0.2 mg/mL | Aerie Pharmaceuticals, Inc | Sous examen | Sous examen | |
| 82 | Rituxan SC – 120 mg/mL | Hoffmann-La Roche Limited, Canada | 2473976 | Conforme aux lignes directrices | MN |
| 83 | Rixubis – 3000 unit/flacon | Baxalta Canada Corporation | 2431963 | Sous enquête | MN |
| 84 | Segluromet 2.5/1000 – 1002.5 mg/comprimé | Merck Canada Inc. | 2476223 | Sous examen | Sous examen |
| 85 | Segluromet 2.5/500 – 502.5 mg/comprimé | Merck Canada Inc. | 2476215 | Sous examen | Sous examen |
| 86 | Segluromet 7.5/1000 – 1007.5 mg/comprimé | Merck Canada Inc. | 2476258 | Sous examen | Sous examen |
| 87 | Segluromet 7.5/1000 – 507.5 mg/comprimé | Merck Canada Inc. | 2476231 | Sous examen | Sous examen |
| 88 | Shingrix – 50 mcg/dose | GlaxoSmithKline Inc. | 2468425 | Sous enquête | SI |
| 89 | Siliq – 210 mg/seringue | Bausch Health, Canada Inc. | 2473623 | Sous examen | Sous examen |
| 90 | Soliqua – 3 mL/stylo | Sanofi-aventis Canada Inc. | 2478293 | Sous examen | Sous examen |
| 91 | Steglatro – 5 mg/comprimé | Merck Canada Inc. | 2475510 | Conforme aux lignes directrices | MN |
| 92 | Steglatro – 15 mg/comprimé | Merck Canada Inc. | 2475529 | Conforme aux lignes directrices | MN |
| 93 | Steglujan 5/100 – 105 mg/comprimé | Merck Canada Inc. | 2475928 | Sous examen | Sous examen |
| 94 | Steglujan 15/100 – 115 mg/comprimé | Merck Canada Inc. | 2475901 | Sous examen | Sous examen |
| 95 | Strensiq – 40 mg/mL | Alexion Pharmaceuticals, Inc. | 2444631 | Ne justifie pas une enquête | MN |
| 96 | Symdeko 100/150/150 – 400 mg/comprimé | Vertex Pharmaceuticals Canada Inc. | 2478080 | Sous examen | Sous examen |
| 97 | Symtuza 800/150/200/10 – 1160 mg/comprimé | Janssen Inc. | 2473720 | ECV | MN |
| 98 | Takhzyro – 150 mg/mL | Shire Pharma Canada Inc. | 2480948 | Sous examen | Sous examen |
| 99 | Trelegy Ellipta 100/62.5/25 – 187 mcg/dose | GlaxoSmithKline Inc. | 2474522 | Conforme aux lignes directrices | MN |
| 100 | Trumenba – 1 N.A./dose | Pfizer Canada Inc. | 2468751 | Conforme aux lignes directrices | MN |
| 101 | Xarelto – 2.5 mg/comprimé | Bayer Inc. | 2480808 | Sous examen | Sous examen |
| 102 | Xeljanz XR – 11 mg/comprimé | Pfizer Canada Inc. | 2470608 | Ne justifie pas une enquête | MN |
| 103 | Zevtera – 500 mg/flacon | Avir Pharma Inc. | 2446685 | Conforme aux lignes directrices | MN |
| 104 | Zonovate – 250 | Novo Nordisk Canada Inc. | 2435187 | Conforme aux lignes directrices | MN |
| 105 | Zonovate – 500 | Novo Nordisk Canada Inc. | 2435195 | Conforme aux lignes directrices | MN |
| 106 | Zonovate – 1000 | Novo Nordisk Canada Inc. | 2435209 | Conforme aux lignes directrices | MN |
| 107 | Zonovate – 2000 | Novo Nordisk Canada Inc. | 2435225 | Conforme aux lignes directrices | MN |
| 108 | Zonovate – 3000 | Novo Nordisk Canada Inc. | 2435233 | Conforme aux lignes directrices | MN |
* État de conformité à la fin de la période visée de janvier à décembre 2018. Les médicaments faisant l’objet d’un examen sont en date du 31 mars 2019.
- MN Amélioration minime ou nulle
- AM-S Amélioration modeste – facteurs secondaires
- AM-P Amélioration modeste – facteurs principaux
- AI Amélioration importante
- D Découverte
Annexe 3 : Tendances relatives aux produits pharmaceutiques – ventes
| Année | Médicaments brevetés | Taux de croissance annuel composé sur cinq ans | Ventes de médicaments brevetés exprimées sous forme de part des ventes de tous les médicaments (en %)* |
Ventes de médicaments brevetés par habitant | Variation (en %) | Ventes de médicaments brevetés exprimées par rapport au PIB (en %) | |
|---|---|---|---|---|---|---|---|
| Ventes (en milliards de $) | Variation (en %) | ||||||
| 2018 | 16,7 | -0,6 | 4,9 | 59.0 | 446,30 $ | -1,7 | 0,751 |
| 2017 | 16,8 | 7,6 | 5,8 | 61,5 | 454,1 $ | 5,4 | 0,783 |
| 2016 | 15,6 | 3,3 | 4,9 | 60.8 | 430,9 $ | 2.2 | 0.770 |
| 2015 | 15,1 | 9,4 | 4,0 | 61,6 | 421,8 $ | 8,5 | 0,760 |
| 2014 | 13,8 | 3,1 | 2,7 | 59,9 | 388,7 $ | 1,8 | 0,696 |
| 2013 | 13,4 | 4,2 | 0,8 | 60,7 | 381,8 $ | 2,7 | 0,706 |
| 2012 | 12,9 | 0,1 | 0,6 | 59,2 | 371,8 $ | -1,2 | 0,708 |
| 2011 | 12,9 | 3,5 | 1,6 | 58,3 | 376,1 $ | 3,1 | 0,729 |
| 2010 | 12,4 | -4,3 | 1,5 | 55,8 | 364,7 $ | -5,7 | 0,746 |
| 2009 | 13,0 | 2,9 | 4,5 | 59,6 | 386,9 $ | 1,9 | 0,829 |
| 2008 | 12,6 | 4,6 | 4,7 | 61,7 | 379,5 $ | 2,9 | 0,762 |
| 2007 | 12,1 | 3,2 | 5,7 | 63,2 | 368,9 $ | 2,5 | 0,769 |
| 2006 | 11,7 | 7,4 | 7,1 | 67,8 | 360,0 $ | 6,3 | 0,784 |
| 2005 | 10,9 | 4,2 | 9,4 | 70,6 | 338,5 $ | 2,8 | 0,769 |
| 2004 | 10,5 | 7,8 | 13,6 | 72,2 | 329,2 $ | 7,2 | 0,789 |
| 2003 | 9,7 | 9,0 | 15,8 | 72,7 | 307,0 $ | 8,0 | 0,776 |
| 2002 | 8,9 | 17,5 | 19,9 | 67,4 | 284,3 $ | 16,0 | 0,748 |
| 2001 | 7,6 | 18,9 | 19,7 | 65,0 | 245,2 $ | 19,1 | 0,666 |
| 2000 | 6,3 | 16,7 | 20,4 | 63,0 | 205,9 $ | 15,9 | 0,571 |
| 1999 | 5,4 | 27,0 | 20,0 | 61,0 | 177,6 $ | 24,3 | 0,538 |
| 1998 | 4,3 | 18,9 | 15,7 | 55,1 | $142,9 | 15,4 | 0,459 |
| 1997 | 3,7 | 22,6 | 11,4 | 52,3 | 123,7 $ | 22,1 | 0,409 |
| 1996 | 3,0 | 12,8 | 8,1 | 45,0 | 101,4 $ | 14,2 | 0,350 |
| 1995 | 2,6 | 10,8 | 6,8 | 43,9 | 88,7 $ | 7,2 | 0,314 |
| 1994 | 2,4 | -2,1 | 9,0 | 40,7 | 82,8 $ | -1,4 | 0,304 |
| 1993 | 2,4 | 9,4 | — | 44,4 | 83,9 $ | 7,9 | 0,322 |
| 1992 | 2,2 | 14,0 | — | 43,8 | 77,7 $ | 8,8 | 0,307 |
| 1991 | 2,0 | 13,1 | — | 43,2 | 71,4 $ | 16,0 | 0,286 |
| 1990 | 1,7 | — | — | 43,2 | 61,6 $ | — | 0,245 |
* Le dénominateur dans ce ratio comprend les ventes de médicaments de marque brevetés, de médicaments de marque non brevetés et de médicaments génériques brevetés et non brevetés. L’estimation de la valeur totale des ventes utilisée pour calculer le ratio à compter de 2005 se fonde sur les données tirées de la base de données MIDAS® d’IQVIA. Pour les années antérieures, les données d’IQVIA n’ont été utilisées que pour calculer la valeur des ventes des médicaments génériques, tandis que l’estimation des ventes de produits de marque non brevetés s’appuyait sur les données soumises par les brevetés. Pour mettre un terme aux anomalies attribuables aux variations annuelles de la liste des entreprises faisant rapport au CEPMB, le CEPMB n’utilise plus cette approche. Les ratios rapportés pour les années avant 2005 gonflaient probablement la part des médicaments brevetés, mais seulement dans une faible proportion. Ce léger écart n’invalide toutefois pas la forte tendance à la hausse observée pour les années 1990 à 2003. Les ratios depuis 2009 ont également été légèrement révisés à la suite de la mise à jour des données d’IQVIA – aucun de ces rajustements n’a entraîné de changement supérieur à 0,4 %.
Source de données CEPMB; base de données MIDAS®, 2005−2018, IQVIA (tous droits réservés)
Annexe 4 : recherche et développement
| Portée : ratio des dépenses de R-D par rapport aux recettes tirées des ventes |
Nombre d’entreprises ayant fourni des données : 2018 |
Recettes tirées des ventes : 2018 (en millions de $) |
Part : 2018 (en %) | Nombre d’entreprises ayant fourni des données : 2017 |
Recettes tirées des ventes : 2017 (en millions de $) |
Part : 2017 (en %) |
|---|---|---|---|---|---|---|
| 0 % | 38 | 2 764,4 | 12,2 | 33 | 1 662,1 | 7,8 |
| ≤10 % | 39 | 17 682,7 | 78,0 | 41 | 17 566,3 | 83,1 |
| > 10 % | 16 | 2 216,3 | 9,8 | 11 | 1 918,8 | 9,1 |
| Total* | 93 | 22 663,4 | 100,0 | 85 | 21 147,2 | 100,0 |
* Les chiffres ayant été arrondis, leur somme peut ne pas correspondre aux totaux indiqués.
Source de données : CEPMB
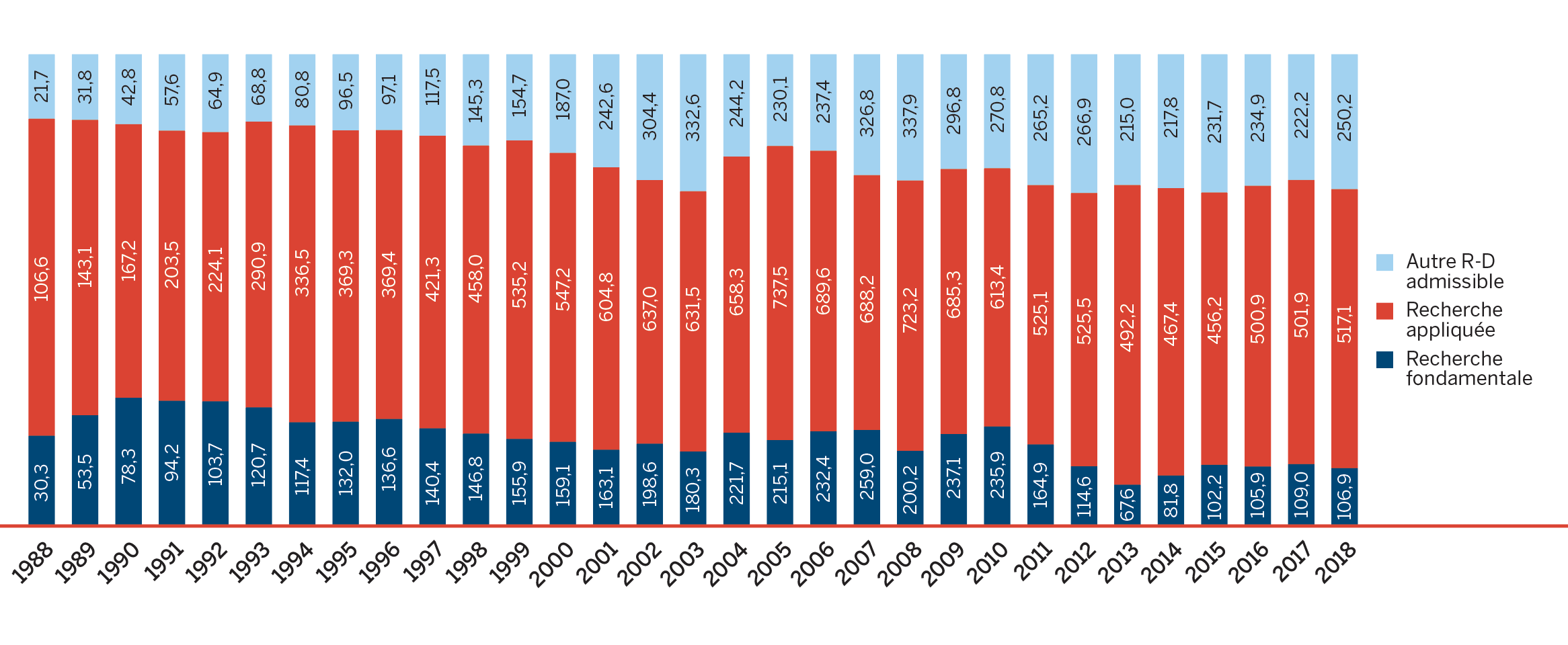
Source de données : CEPMB
Description de la figure
Ce diagramme à colonnes empilées présente les dépenses courantes de R-D en millions de dollars, de 1988 à 2018, par type de recherche : fondamentale, appliquée et autre R-D admissible.
| Année | Recherche fondamentale (millions de dollars) | Recherche appliquée (millions de dollars) | Autre R-D admissible (millions de dollars) |
|---|---|---|---|
| 1988 | 30,3 | 106,6 | 21,7 |
| 1989 | 53,5 | 143,1 | 31,8 |
| 1990 | 78,3 | 167,2 | 42,8 |
| 1991 | 94,2 | 203,5 | 57,6 |
| 1992 | 103,7 | 224,1 | 64,9 |
| 1993 | 120,7 | 290,9 | 68,8 |
| 1994 | 117,4 | 336,5 | 80,8 |
| 1995 | 132,0 | 369,3 | 96,5 |
| 1996 | 136,6 | 369,4 | 97,1 |
| 1997 | 140,4 | 421,3 | 117,5 |
| 1998 | 146,8 | 458,0 | 145,3 |
| 1999 | 155,9 | 535,2 | 154,7 |
| 2000 | 159,1 | 547,2 | 187,0 |
| 2001 | 163,1 | 604,8 | 242,6 |
| 2002 | 198,6 | 637,0 | 304,4 |
| 2003 | 180,3 | 631,5 | 332,6 |
| 2004 | 221,7 | 658,3 | 244,2 |
| 2005 | 215,1 | 737,5 | 230,1 |
| 2006 | 232,4 | 689,6 | 237,4 |
| 2007 | 259,0 | 688,2 | 326,8 |
| 2008 | 200,2 | 723,2 | 337,9 |
| 2009 | 237,1 | 685,3 | 296,8 |
| 2010 | 235,9 | 613,4 | 270,8 |
| 2011 | 164,9 | 525,1 | 265,2 |
| 2012 | 114,6 | 525,5 | 266,9 |
| 2013 | 67,6 | 492,2 | 215,0 |
| 2014 | 81,8 | 467,4 | 217,8 |
| 2015 | 102,2 | 456,2 | 231,7 |
| 2016 | 105,9 | 500,9 | 234,9 |
| 2017 | 109,0 | 501,9 | 222,2 |
| 2018 | 106,9 | 517,1 | 250,2 |
| Entreprise | Ratio des dépenses de R-D par rapport aux recettes tirées des ventes (en %) 2018 | Ratio des dépenses de R-D par rapport aux recettes tirées des ventes (en %) 2017 | Ratio des prix des PIM par rapport au prix au canada (en %) – limite de cinq pays | Part canadienne des ventes par rapport aux pays du CEPMB7 (2018) | Part Canadienne des ventes par rapport à l’OCDE (2018) |
|---|---|---|---|---|---|
| AbbVie Corporation2,3 | 2,7 | 2,2 | – | 2,6 | 2,2 |
| Acerus Pharmaceuticals | 0,0 | 0,0 | – | – | – |
| Actelion Pharmaceuticals Canada Inc.2 | 2,9 | 4,2 | 103 | 4,0 | 2,5 |
| Aerie Pharmaceuticals Inc.4 | 0,0 | – | – | – | – |
| Alexion Pharmaceuticals Inc.3 | 0,0 | 0,0 | 97 | – | – |
| ALK-Abelló A/S | 0,3 | 0,0 | 119 | 3,3 | 2,6 |
| Alkermes Inc.4 | 10 732,8 | – | – | – | – |
| Allergan Inc. | 1,4 | 1,1 | 79 | 1,0 | 1,0 |
| Altius Healthcare Inc. | 17,8 | 0,0 | – | – | – |
| Amgen Canada Inc.2,3 | 3,6 | 3,7 | 154 | 2,5 | 2,2 |
| Amicus Therapeutics UK Ltd4 | 0,0 | – | 242 | – | – |
| Aralez Pharmaceuticals Inc.4 | 0,0 | – | 101 | 8,1 | 7,5 |
| Aspen Pharmacare Canada Inc. | 0,0 | 0,0 | 96 | 3,7 | 1,1 |
| Astellas Pharma Canada Inc.2 | 1,1 | 1,8 | 148 | 3,2 | 2,0 |
| AstraZeneca Canada Inc.2,3 | 7,7 | 7,5 | 81 | 4,9 | 3,9 |
| Avir Pharma Inc.3,4 | 0,0 | – | 102 | – | – |
| Bausch Health Canada Inc.4 | 0,6 | – | 66 | 23,0 | 8,3 |
| Baxalta Canada Corp. | 0,0 | 0,0 | 299 | – | – |
| Baxter Corporation | 0,0 | 0,02 | 136 | 0,5 | 0,3 |
| Bayer Inc.2,3 | 5,4 | 6,8 | 102 | 13,9 | 6,2 |
| BGP Pharma ULC | 0,0 | 0,0 | 52 | 910,4 | 55,5 |
| Biogen Idec Canada Inc.3 | 16,5 | 11,9 | 109 | 1,7 | 1,4 |
| BioMarin Canada Inc.3 | 7,6 | 11,2 | 100 | – | – |
| BioSyent Pharma Inc. | 0,0 | 0,0 | – | – | – |
| Bioverativ Canada Inc.3 | 1,7 | 0,7 | 173 | – | – |
| Boehringer Ingelheim (Canada) Ltd.2 | 2,2 | 3,8 | 101 | 3,5 | 2,8 |
| Bracco Diagnostics Canada Inc. | 0,0 | 0,0 | – | – | – |
| Bristol-Myers Squibb Canada2 | 10,4 | 10,3 | 106 | 32,8 | 24,7 |
| BTG International Ltd.5 | 0,0 | 0,0 | – | – | – |
| Celgene Inc.3 | 1,9 | 1,1 | 104 | 0,5 | 0,4 |
| Cheplapharm Arzneimittel GmbH. | 0,0 | 0,0 | 72 | – | – |
| Cipher Pharmaceuticals Inc. | 1,3 | 2,1 | – | – | – |
| CSL Behring Canada Inc. | 0,2 | 0,5 | 526 | – | – |
| Duchesnay Inc. | 0,7 | 0,7 | – | 10,8 | 9,8 |
| Eisai Limited3 | 3,2 | 7,4 | 97 | 1,3 | 0,6 |
| Eli Lilly Canada Inc. (includes Provel Animal Health Division)2,3 | 7,3 | 9,5 | 91 | 1,4 | 1,3 |
| EMD Serono Canada Inc.2 | 0,0 | 0,0 | 78 | 3,5 | 3,4 |
| Ferring Pharmaceuticals Inc.3 | 0,0 | 0,0 | 87 | 3,8 | 2,6 |
| Galderma Canada Inc. | 0,0 | 0,0 | 50 | 5,4 | 4,5 |
| GE Healthcare Inc.4 | 0,0 | – | – | – | – |
| Gilead Sciences Canada, Inc.2 | 10,3 | 11,1 | 95 | 3,5 | 2,8 |
| GlaxoSmithKline Inc.2 | 5,4 | 5,9 | 63 | 66,9 | 14,4 |
| Grifols Canada Ltd. (Talecris Biotherapeutics Ltd.)3 | 0,0 | 0,0 | – | – | – |
| Hoffmann-La Roche Ltd. Canada2,3 | 6,8 | 5,9 | 96 | 15,1 | 7,1 |
| Horizon Pharma PLC. 2,3 | 0,0 | 0,0 | 110 | – | – |
| Intercept Pharmaceuticals Inc. | 13,4 | 27,4 | – | 0,2 | 0,2 |
| Ipsen Biopharmaceuticals Inc.2,3 | 0,2 | 0,3 | 105 | 0,7 | 0,5 |
| Janssen Inc.2,3 | 2,4 | 2,6 | 112 | 7,4 | 5,8 |
| Jazz Pharmaceuticals3 | 9,3 | 11,9 | – | 0,4 | 0,4 |
| Johnson & Johnson Medical Products | 0,9 | 0,4 | – | 2,4 | 1,4 |
| Knight Therapeutics Inc.2 | 18,2 | 24,8 | 58 | – | – |
| Labtician Théa.4 | 37,1 | – | 84 | – | – |
| Lantheus MI Canada Inc. | 0,0 | 0,0 | – | – | – |
| LEO Pharma Inc.2 | 0,1 | 0,04 | 66 | 10,2 | 6,9 |
| Lundbeck Canada Inc.2 | 0,5 | 1,1 | 75 | 5,1 | 3,9 |
| Lupin Pharma Canada Limited | 0,0 | 0,0 | 101 | 0,2 | 0,2 |
| Medexus Inc. | 0,0 | 0,0 | 76 | – | – |
| Merck Canada Inc.2,3 | 4,3 | 3,8 | 97 | 5,2 | 4,0 |
| Merus Labs | 0,0 | 0,0 | 98 | 24,1 | 13,8 |
| Merz Pharma Canada Ltd. | 0,0 | 1,9 | 97 | 1,9 | 1,3 |
| Novartis Pharmaceuticals Canada Inc.2,3 | 3,4 | 3,9 | 89 | 5,6 | 3,8 |
| Novo Nordisk Canada Inc.2,3 | 1,6 | 1,6 | 95 | 1,8 | 1,6 |
| Octapharma Canada Inc. | 0,5 | 20,6 | 500 | – | – |
| Otsuka Canada Pharmaceutical Inc. (OCPI)2 | 0,2 | 1,0 | 93 | 6,0 | 3,0 |
| Paladin Labs Inc.2 | 0,2 | 0,3 | 90 | – | – |
| Partner Therapeutics Inc.4 | 519,6 | – | – | – | – |
| Pediapharm Inc. | 0,0 | 0,0 | – | – | – |
| Pfizer Canada Inc.2,3 | 0,3 | 0,6 | 110 | 3,6 | 3,0 |
| Pharmascience Inc. | 12,4 | 9,2 | – | – | – |
| Pierre Fabre Dermo-CosmétiquIe Canada Inc. | 0,0 | 0,0 | 103 | – | – |
| Purdue Pharma2 | 2,1 | 3,6 | 140 | 13,6 | 12,0 |
| PTC Therapeutics International Ltd. | 637,0 | 149,6 | – | – | – |
| Sandoz Canada Inc.4 | 0,0 | – | – | 10,9 | 7,2 |
| Sanofi Canada Inc.2,3 | 1,5 | 1,7 | 84 | 28,5 | 11,6 |
| Sanofi Pasteur Ltd.2,3 | 51,7 | 72,1 | – | – | – |
| Seattle Genetics Inc. | 16,6 | 5,7 | 108 | – | – |
| Seqirus Canada Inc.3 | 870,2 | 20,8 | 165 | – | – |
| Servier Canada Inc.2,3 | 4,4 | 1,8 | 114 | 61,9 | 11,0 |
| Shire Canada Inc.3 | 0,0 | 0,0 | 113 | 3,8 | 3,2 |
| Shire Rare Disease Business Unit3 | 0,0 | 0,0 | 134 | – | – |
| Sprout Pharmaceuticals Inc.4 | 0,0 | – | – | – | – |
| Sunovion Pharmaceuticals Canada Inc.2 | 0,0 | 0,0 | 99 | 1,0 | 0,9 |
| Swedish Orphan Biovitrum AB (Sobi)3 | 0,0 | 0,0 | 90 | 0,03 | 0,01 |
| Taiho Oncology Inc.3,4 | 0,0 | – | 61 | 2,4 | 0,4 |
| Takeda Canada Inc.2,3 | 0,2 | 0,9 | 68 | 3,3 | 1,8 |
| Theratechnologies Inc. | 0,0 | 0,0 | – | – | – |
| Teva Canada Innovation3 | 0,1 | 0,1 | 100 | 4,8 | 3,8 |
| ThromboGenics N.V.4 | 359,7 | – | 102 | – | – |
| UCB Canada Inc.3 | 41,5 | 9,9 | 95 | 1,6 | 1,2 |
| Valneva Austria GmbH.3 | 0,0 | 0,0 | – | 92,4 | 43,1 |
| Vertex Pharma Canada Inc.3 | 0,0 | 5,5 | 106 | – | – |
| VIIV Healthcare ULC2 | 0,0 | 0,0 | 118 | 2,8 | 2,3 |
1 Pour éviter la double comptabilisation des recettes tirées des ventes, les recettes tirées des redevances sont incluses dans le calcul du ratio de chaque entreprise, mais non dans le calcul du ratio à l’échelle de l’industrie. Les subventions des gouvernements fédéral et provinciaux ne sont pas comptabilisées dans les dépenses utilisées pour le calcul des ratios individuels des dépenses de R-D, mais elles le sont dans les statistiques pour l’ensemble de l’industrie. La liste des entreprises ayant soumis un rapport sur les prix n’est pas identique à celle des entreprises ayant soumis un rapport sur leurs activités de R-D en raison des différences des modalités de rapport entre les brevetés et leurs entreprises affiliées ou les détenteurs d’une licence d’exploitation. Il convient également de noter que certains titulaires d’un brevet pour un médicament vétérinaire (soit les brevetés qui ne tirent aucun revenu de la vente de produits pour un usage humain) sont tenus de présenter un rapport sur leurs dépenses de R-D, mais pas nécessairement sur les prix qu’ils pratiquent et sur la valeur de leurs ventes.
2 Membre de Médicaments novateurs Canada.
3 Membre de BIOTECanada.
4 N’était pas un breveté en 2017.
Source des données : CEPMB
| Province | Dépenses : tous les brevetés (en milliers de dollars) | Part régionale (en %) | Dépenses : médicaments novateurs canada (en milliers de dollars) | Part régionale (en %) |
|---|---|---|---|---|
| Terre-Neuve-et-Labrador | 2 039,74 | 0,234 | 1 507,73 | 0,213 |
| Île-du-Prince-Édouard | 4 435,29 | 0,507 | 0,00 | 0,000 |
| Nouvelle-Écosse | 9 770,95 | 1,118 | 7 166,03 | 1,015 |
| Nouveau-Brunswick | 3 574,56 | 0,409 | 2 590,46 | 0,367 |
| Québec | 285 832,53 | 32,699 | 196 068,21 | 27,762 |
| Ontario | 414 466,33 | 47,415 | 369 334,50 | 52,296 |
| Manitoba | 12 438,87 | 1,423 | 10 272,08 | 1,454 |
| Saskatchewan | 3 022,70 | 0,346 | 1 136,07 | 0,161 |
| Alberta | 97 189,93 | 11,119 | 89 641,24 | 12,693 |
| Colombie-Britannique | 40 991,48 | 4,689 | 28 280,09 | 4,004 |
| Territoires | 365,69 | 0,042 | 246,25 | 0,035 |
| Canada* | 874 128,06 | 100,0 | 706 242,66 | 100,0 |
* Les chiffres des provinces et territoires ayant été arrondis, leur somme peut ne pas correspondre aux totaux pour le Canada.
Source de données : CEPMB
| Province | blank | Brevetes | Autres entreprises | Universités | Hôpitaux | Autres |
|---|---|---|---|---|---|---|
| Terre-Neuveet-Labrador | 000 $ | 1 019,39 | 356,59 | 131,4 | 143,35 | 388,97 |
| % | 49,9 | 17,5 | 6,4 | 7,0 | 19,1 | |
| Île-du-Prince-Édouard | 000 $ | 443,48 | 3 991,81 | 0,00 | 0,00 | 0,00 |
| % | 10,0 | 90,0 | 0,0 | 0,0 | 0,0 | |
| Nouvelle-Écosse | 000 $ | 1 575,44 | 3 266,45 | 1 212,53 | 643,83 | 3 072,70 |
| % | 16,1 | 33,4 | 12,4 | 6,6 | 31,4 | |
| Nouveau-Brunswick | 000 $ | 1 160,96 | 645,33 | 859,20 | 293,63 | 615,44 |
| % | 32,5 | 18,1 | 24,0 | 8,2 | 17,2 | |
| Québec | 000 $ | 103 984,05 | 102 585,91 | 16 665,01 | 26 109,23 | 36 488,33 |
| % | 36,4 | 35,9 | 5,8 | 9,1 | 12,8 | |
| Ontario | 000 $ | 217 892,16 | 72 693,18 | 40 878,55 | 57 033,53 | 25 966,91 |
| % | 52,6 | 17,5 | 9,9 | 13,8 | 6,2 | |
| Manitoba | 000 $ | 9 838,65 | 968,01 | 239,18 | 440,33 | 952,70 |
| % | 79,1 | 7,8 | 1,9 | 3,5 | 7,7 | |
| Saskatchewan | 000 $ | 1 142,95 | 643,59 | 1 081,51 | 0,00 | 154,65 |
| % | 37,8 | 21,3 | 35,8 | 0,0 | 5,1 | |
| Alberta | 000 $ | 74 003,39 | 9 147,54 | 5 714,28 | 4 246,96 | 4 077,75 |
| % | 76,1 | 9,4 | 5,8 | 4,3 | 4,2 | |
| Colombie-Britannique | 000 $ | 18 476,99 | 12 695,15 | 4 756,68 | 1 710,52 | 3 352,13 |
| % | 45,1 | 30,9 | 11,6 | 4,1 | 8,2 | |
| Territoires | 000 $ | 119,44 | 11,00 | 235,25 | 0,00 | 0,00 |
| % | 32,7 | 3,0 | 64,3 | 0,0 | 0,0 | |
| Canada | 000 $ | 429 656,89 | 207 004,56 | 71 773,65 | 90 623,38 | 75 069,58 |
| % | 49,1 | 23,7 | 8,2 | 10,4 | 8,6 |
Remarques :
- Le pourcentage figurant sous chaque catégorie de R-D correspond au pourcentage de toutes les dépenses engagées dans cette catégorie dans la province.
- Les dépenses présentées sous forme de pourcentage du total correspondent au pourcentage des dépenses de R-D dans cette province par rapport à l’ensemble des dépenses de R-D faites au Canada.
- Le total des colonnes et des rangs ne correspond pas nécessairement, car certains chiffres ont été arrondis.
- Dépenses courantes plus dépenses en immobilisations (équipement + amortissement) = total des dépenses de R-D.
Source de donnéess : CEPMB