Aperçu des approbations, de la commercialisation et des prix des nouveaux médicaments sur les marchés canadien et international
Contexte et objectif
Les médicaments spécialisés onéreux dominent de plus en plus le marché des nouveaux médicaments lancés au Canada et à l’étranger. Une part croissante de ces médicaments, qui comprennent les produits biologiques, les médicaments orphelins et les produits oncologiques, ont des coûts de traitement qui se chiffrent dans les dizaines ou les centaines de milliers de dollars par année, même si, dans certains cas, il existe peu de données à l’appui de leur efficacité thérapeutique. Cette présentation donne un aperçu des nouveaux médicaments approuvés, et présente les données sur les ventes, les prix et les caractéristiques de ces produits ainsi que sur l’accès à ceux-ci au Canada et à l’étranger.
Méthode
Cette étude explore la dynamique de mise en marché des nouveaux médicaments approuvés par Santé Canada, la Food and Drug Administration (FDA) des États-Unis ou l’Agence européenne des médicaments (AEM) de 2015 à 2020. Un nouveau médicament est sélectionné pour l’analyse s’il a reçu une autorisation de mise en marché de l’un ou l’autre de ces organismes de réglementation pour la première fois pendant l’année civile. L’analyse étudie la disponibilité, le coût du traitement et les ventes de ces médicaments dans l’année civile suivant leur première approbation à l’échelle internationale, et surveille l’évolution de ces indicateurs d’une année à l’autre. La base de données MIDAS d’IQVIA représente la principale source de données pour cette analyse, et des données supplémentaires sont tirées des bases de données en ligne sur les médicaments de Santé Canada, de la FDA des États-Unis et de l’AEM.
Résultats
Section 1 : Tendances relatives aux approbations et aux ventes
En moyenne, 45 nouveaux médicaments ont été approuvés chaque année entre 2015 et 2020, même si le nombre de nouveaux médicaments approuvés depuis 2017 a dépassé la moyenne. Les médicaments orphelins et oncologiques représentent toujours une part importante des nouvelles approbations.
En 2020, 50 nouveaux médicaments ont été approuvés, avec notamment une part plus importante de médicaments orphelins et oncologiques : les médicaments orphelins représentaient 58 % des nouvelles approbations, tandis que la part des médicaments oncologiques atteignait 34 %, soit la part la plus élevée depuis 2015.
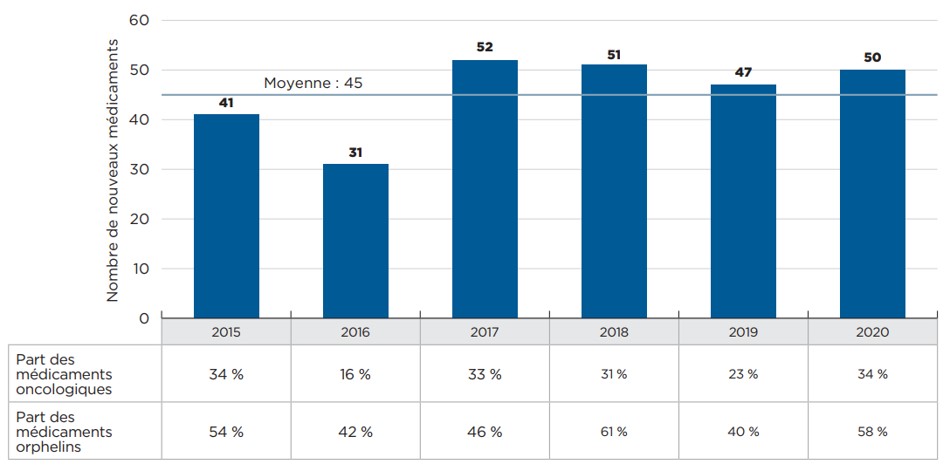
Description de la figure
Ce diagramme à barres représente le nombre de nouveaux médicaments approuvés par la Food and Drug Administration des États-Unis, l’Agence européenne des médicaments ou Santé Canada de 2015 à 2020. Le tableau montre la part des médicaments orphelins et oncologiques dans chaque total annuel. Le nombre moyen d’approbations annuelles pour la période était de 45.
| 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|---|
Nombre de nouveaux médicaments |
41 |
31 |
52 |
51 |
47 |
50 |
Part des médicaments orphelins |
54 % |
42 % |
46 % |
61 % |
40 % |
58 % |
Part des médicaments oncologiques |
34 % |
16 % |
33 % |
31 % |
23 % |
34 % |
Collectivement, les médicaments approuvés entre 2015 et 2019 représentaient environ 15 % des ventes de produits pharmaceutiques en 2020.
La figure 2 représente la progression, d’une année à l’autre, des ventes de médicaments approuvés pour la première fois entre 2015 et 2019. Au T4 2020, ces médicaments représentaient 15,5 % de l’ensemble du marché des médicaments de marque au Canada. Au cours d’une année donnée, l’incidence des nouveaux médicaments sur les ventes de produits pharmaceutiques dépend de leur nombre, de leur utilité thérapeutique et des coûts de traitement. Au cours de cette période de cinq ans, les antiviraux à action directe approuvés en 2016 pour le traitement de l’hépatite C ont rapidement gagné d’importantes parts de marché en 2018, mais les ventes de ces produits ont ensuite commencé à baisser, en raison notamment de la nature curative des traitements. Au T4 2020, les nouveaux médicaments les plus vendus au Canada étaient le sémaglutide, un médicament contre le diabète mis en marché en 2017, ainsi que le palbociclib et le daratumumab, deux médicaments contre le cancer mis en marché en 2015.
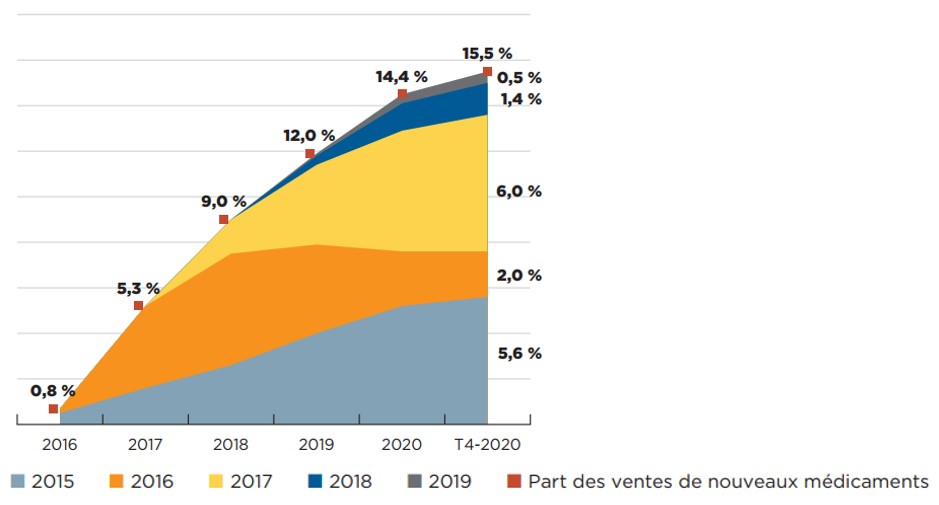
Description de la figure
Le graphique représente la part cumulative des nouveaux médicaments par rapport à la valeur totale des ventes de médicaments de marque, par année d'approbation entre 2015 et 2019, pour les onze pays de comparaison du CEPMB et le second pour le Canada uniquement. Le graphique suit le pourcentage des nouveaux médicaments dans les ventes annuelles jusqu'au quatrième trimestre de 2020. La part des ventes de nouveaux médicaments pour chaque année est également indiquée. Pour les onze pays de comparaison du CEPMB et pour le Canada seulement.
| Année d’approbation | 2016 | 2017 | 2018 | 2019 | 2020 | T4 2020 |
|---|---|---|---|---|---|---|
2015 |
0,5 % |
1,6 % |
2,6 % |
4,0 % |
5,2 % |
5,6 % |
2016 |
0,2 % |
3,6 % |
4,9 % |
3,9 % |
2,4 % |
2,0 % |
2017 |
0,0 % |
0,0 % |
1,5 % |
3,5 % |
5,3 % |
6,0 % |
2018 |
0,0 % |
0,0 % |
0,0 % |
0,4 % |
1,2 % |
1,4 % |
2019 |
0,0 % |
0,0 % |
0,0 % |
0,1 % |
0,4 % |
0,5 % |
Part des ventes de nouveaux médicaments |
0,8 % |
5,3 % |
9,0 % |
12,0 % |
14,4 % |
15,5 % |
Section 2 : Médicaments onéreux et spécialisés
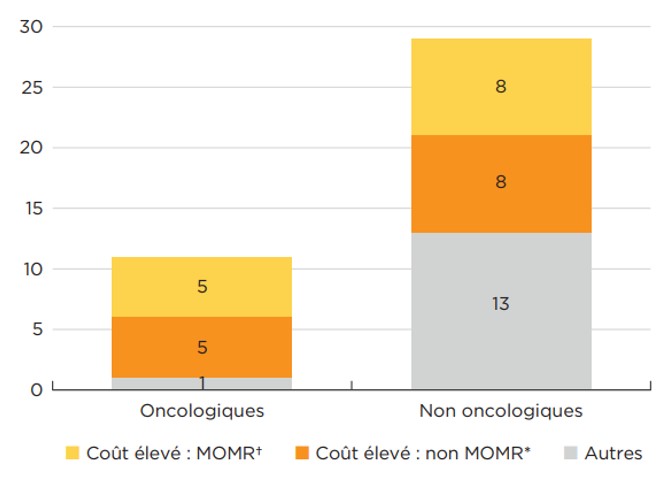
Soixante-cinq pour cent des nouveaux médicaments de 2019 avaient un coût de traitement élevé, c’est-à-dire un coût dépassant 10 000 $ par année ou 5 000 $ par cycle de 28 jours.
Parmi les 11 nouveaux médicaments oncologiques, 10 appartenaient à cette catégorie de médicament « onéreux », ainsi que plus de la moitié des médicaments non oncologiques. Huit (8) médicaments non oncologiques et 5 médicaments oncologiques sont considérés comme des médicaments onéreux pour maladies rares (MOMR), à savoir des traitements ayant obtenu la désignation de médicament orphelin dont le coût annuel du traitement dépasse 100 000 $, ou 7 500 $ par cycle de 28 jours. Au total, ces 13 MOMR représentaient plus de 36 % des ventes de nouveaux médicaments en 2019. Ces caractéristiques ne représentent plus une année exceptionnelle pour ce qui est du prix des nouveaux médicaments. Les éditions précédentes de Veille des médicaments mis en marché montraient que plus de la moitié des nouveaux médicaments approuvés à l’échelle internationale entre 2017 et 2019 avaient des coûts de traitement supérieurs à 10 000 $ par année, et que, pour une part considérable de ceux-ci, ces coûts atteignaient les six chiffres.
* Les médicaments onéreux sont définis comme ceux dont les coûts de traitement dépassent 10 000 $ par an ou 5000 $ par cycle de 28 jours.
† Les médicaments onéreux pour maladies rares (MOMR) sont définis comme ceux ayant une
désignation de médicament orphelin attribuée par la FDA ou l’AEM et dont les coûts de traitement dépassent 7500 $ par cycle de 28 jours ou 100 000 $ par an.
Description de la figure
Cet histogramme empilé représente la répartition des 40 nouveaux médicaments approuvés en 2019 dont les coûts de traitement étaient connus, en fonction de la catégorie des médicaments onéreux. La première bande montre la répartition des nouveaux médicaments oncologiques, tandis que la deuxième indique les totaux pour les médicaments non oncologiques. Chaque bande est ventilée en fonction du nombre de nouveaux médicaments étant des médicaments onéreux pour maladies rares (MOMR), des médicaments onéreux mais non destinés à des maladies rares et des médicaments non onéreux. Les médicaments onéreux dépassent 10 000 $ de coût annuel de traitement ou 5000 $ par cycle de 28 jours. Les médicaments onéreux pour maladies rares sont définis comme ayant des coûts de traitement supérieurs à 100 000 $ par année ou supérieurs à 7500 $ par cycle de 28 jours; le terme s’applique également aux produits désignés comme médicaments orphelins par la Food and Drug Administration des États-Unis ou l’Agence européenne des médicaments.
| Médicaments onéreux pour les maladies rares† | Médicaments onéreux, non destinés à des maladies rares* | Autres | Total | |
|---|---|---|---|---|
Médicaments oncologiques |
5 |
5 |
1 |
11 |
Médicaments non oncologiques |
8 |
8 |
13 |
29 |
Quarante pour cent des nouveaux médicaments approuvés en 2019 avaient reçu une désignation de médicament orphelin par la FDA et/ou l’AEM. Environ 23 % (11) des nouveaux médicaments étaient destinés au traitement du cancer et 30 % (14) étaient des médicaments biologiques. Comme le montre la figure 4, il y a un chevauchement notable entre ces catégories, où plus de la moitié des médicaments ayant reçu une désignation de médicament orphelin étaient soit un produit biologique, soit un produit indiqué dans le traitement du cancer, soit les deux. La figure 1 indique que le nombre de médicaments ayant reçu la désignation de médicament orphelin était légèrement inférieur en 2019, les taux observés en 2018 et en 2020 se situant à près de 60 %.
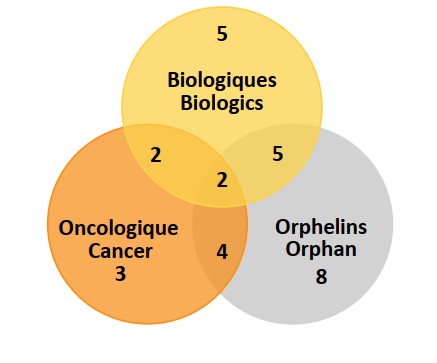
Description de la figure
Il s’agit d’un diagramme de Venn illustrant le chevauchement entre les médicaments orphelins, biologiques et oncologiques parmi les nouveaux médicaments approuvés en 2019. Parmi les 47 nouvelles approbations, 14 médicaments étaient biologiques, 19 avaient la désignation de médicament orphelin et 11 étaient des médicaments oncologiques. Parmi tous les nouveaux médicaments, 5 étaient à la fois biologiques et orphelins, 2 étaient à la fois biologiques et oncologiques, 4 étaient orphelins et oncologiques, et 2 étaient des médicaments biologiques et oncologiques ayant également une désignation de médicament orphelin.
Section 3 : Lancements sur le marché
Trente pour cent des nouveaux médicaments avaient enregistré des ventes au Canada de 2015 à 2019 au cours de l’année civile suivant la première approbation à l’échelle internationale, ce qui place le Canada au cinquième rang parmi les pays du CEPMB11. Prenant appui sur une analyse rétrospective, la figure 5 indique le nombre de nouveaux médicaments ayant été approuvés et commercialisés au Canada et dans les pays de comparaison à la fin de l’année civile suivant leur première autorisation dans un pays ou un autre du monde. Le Canada avait enregistré des ventes pour 66 (30 %) des 222 médicaments approuvés pour la première fois entre 2015 et 2019 dans un pays ou un autre du monde, dans l’année suivant leur première approbation. Le Canada dépasse ainsi la médiane du CEPMB11 de 62 médicaments, et se classe mieux que la France, l’Italie, le Japon, les Pays-Bas, l’Espagne, la Belgique et l’Australie. Les États-Unis représentaient l’exception parmi les pays présentés, ayant enregistré des ventes pour 182 (82 %) des nouveaux médicaments au cours d’une période d’un an. Parmi les pays du CEPMB11, seule l’Allemagne a commercialisé plus de 100 nouveaux médicaments au cours d’une période d’un an.
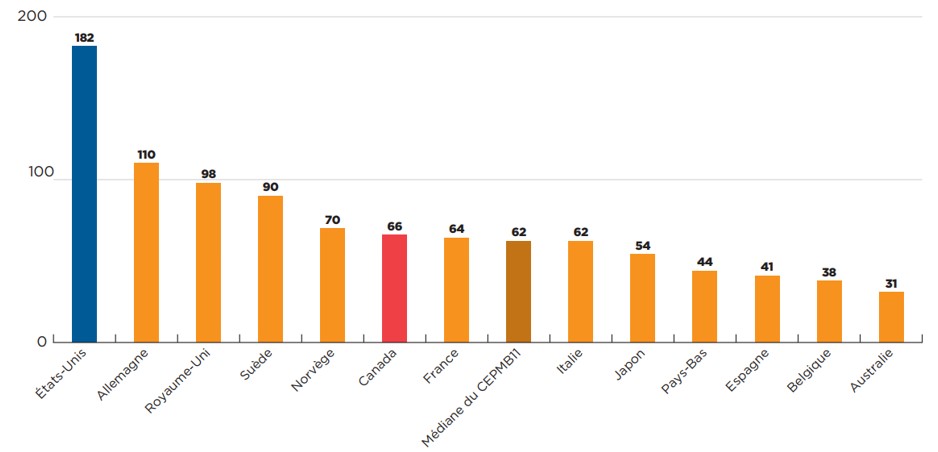
Description de la figure
Ce graphique à barres représente le nombre de nouveaux médicaments ayant enregistré des ventes au Canada, aux États-Unis et dans chacun des 11 pays de comparaison du CEPMB (CEPMB11) dans l’année suivant leur première approbation dans un pays ou un autre du monde. La médiane du CEPMB11 était de 62. Aux fins de cette analyse, les nouveaux médicaments ont été définis comme étant ceux ayant obtenu leur première autorisation de mise en marché par l’entremise de la Food and Drug Administration (FDA) des États-Unis, de l’Agence européenne des médicaments (AEM) ou de Santé Canada entre 2015 et 2019. Un médicament a été considéré comme commercialisé dans un délai d’un an s’il a enregistré des ventes avant la fin de l’année civile suivant sa première approbation dans un pays ou un autre du monde.
| Pays | Nombre de nouveaux médicaments avec ventes dans un délai d’un an |
|---|---|
États-Unis |
182 |
Allemagne |
110 |
Royaume-Uni |
98 |
Suède |
90 |
Norvège |
70 |
Canada |
66 |
France |
64 |
Italie |
62 |
Japon |
54 |
Pays-Bas |
44 |
Espagne |
41 |
Belgique |
38 |
Australie |
31 |
Le taux d’approbation des nouveaux médicaments au Canada était de 40 % à 50 % et le taux de vente, de 22 % à 38 %, au cours de l’année civile suivant leur première approbation à l’échelle internationale. La figure 6 représente le pourcentage de nouveaux médicaments approuvés et vendus au Canada dans l’année suivant leur première approbation dans un autre pays, pour chaque année, de 2015 à 2019. Les résultats montrent que, pour la période de 2015 à 2017, Santé Canada a approuvé environ la moitié des nouveaux médicaments dans l’année suivant leur autorisation dans un autre pays, et près de 40 % des médicaments pour la période de 2018 à de 2019. Les éditions précédentes de Veille des médicaments mis en marché montraient une baisse similaire de la proportion de médicaments approuvés au cours d’une année civile par l’AEM pendant la même période. La part des nouveaux médicaments vendus au Canada au cours de la même période était inférieure d’environ 15 points à celle des approbations, la part de nouveaux médicaments vendus s’établissant à 22 % à son point le plus bas (2018) et à 38 % à son point le plus haut (2017).
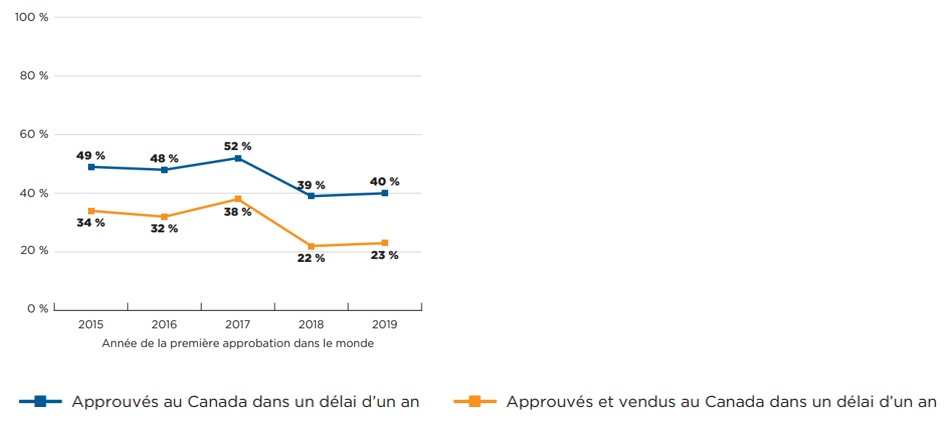
* Les nouveaux médicaments de la figure 6 ont été définis comme ceux qui ont reçu une première autorisation de mise sur le marché par le biais de la FDA, AEM, ou de Santé Canada entre 2015 et 2019
Description de la figure
Les graphiques linéaires représentent le pourcentage de nouveaux médicaments approuvés et vendus au Canada dans l'année qui suit leur première approbation dans n'importe quel pays du monde.
Les résultats sont présentés par année, en fonction de l'année au cours de laquelle le médicament a reçu sa première autorisation de mise sur le marché par la Food and Drug Administration (FDA) des États-Unis, l'Agence européenne des médicaments (EMA) ou Santé Canada entre 2015 et 2019. Un médicament a été considéré comme approuvé ou commercialisé dans l'année si sa date d'approbation ou sa première date de commercialisation était antérieure à la fin de l'année civile suivant sa première approbation dans un autre pays.
| Année d’approbation | Approuvés au Canada dans un délai d’un an | Approuvés et vendus au Canada dans un délai d’un an |
|---|---|---|
2015 |
49 % |
34 % |
2016 |
48 % |
32 % |
2017 |
52 % |
38 % |
2018 |
39 % |
22 % |
2019 |
40 % |
23 % |
Conclusion
Conformément à la tendance observée au cours des dernières années, cette affiche souligne que les médicaments onéreux et les médicaments contre les maladies rares représentent une part importante des nouveaux médicaments approuvés. Un plus grand nombre de ces nouveaux médicaments atteignent les patients canadiens que dans la plupart des pays de l’Organisation de coopération et de développement économiques (OCDE), bien que le Canada accuse un retard par rapport à certains marchés clés où les prix moyens des médicaments brevetés sont moins élevés. Tandis que le Canada met tout en œuvre pour suivre le rythme des taux d’approbation des nouveaux médicaments dans les pays de comparaison, il importe d’obtenir plus de renseignements sur les répercussions des nouvelles approbations sur les payeurs et les patients.
Sources de données
La base de données MIDAS d’IQVIA représente la principale source de données pour ce rapport, et des données supplémentaires sont tirées de la base de données des avis de conformité et de la base de données sur les produits pharmaceutiques (BDPP) de Santé Canada, ainsi que de l’AEM et de la FDA des États-Unis.
Limites
Comme le présent rapport se concentre sur trois organismes d’approbation, il est possible que certains nouveaux médicaments qui y sont mentionnés aient été approuvés plus tôt par d’autres instances. De la même façon, il est possible que certains médicaments ayant fait l’objet d’une première approbation dans un autre pays en 2019 et en 2020 ne soient pas présentés dans le rapport.
Les données sur les ventes ne tiennent pas compte des remises de prix, des ententes ni des régimes d’accès des patients. Il est possible que certains médicaments ayant été vendus ne soient pas déclarés dans la base de données MIDAS, ce qui pourrait entraîner une sous-déclaration des ventes de nouveaux médicaments dans un pays donné.