Comprendre le marché des médicaments pour maladies rares au Canada
Jihong Yang, Tuhin Rahman et Shirin Rizzardo
Présentation à la 29e conférence annuelle de l’ACPT, les 22 et 23 septembre 2025
Objectif
L’arrivée d’un nombre croissant de médicaments onéreux pour le traitement de maladies rares (MOMR) offre de nouvelles possibilités de traitement, tout en suscitant des préoccupations quant à leur coût et à leur accessibilité. Dans le cadre de la présente étude, les MOMR mis sur le marché au Canada au cours des deux dernières décennies sont analysés au moyen de données quantitatives permettant d’évaluer les tendances des MOMR en ce qui concerne leur approbation, leur prix et leurs revenus de vente au Canada.
Démarche
S’appuyant sur les informations relatives aux ventes et aux prix fournies par la base de données MIDASMD d’IQVIA et sur les informations relatives aux coûts du traitement fournies par l’Agence des médicaments du Canada (AMC), on examine, dans le cadre de l’étude, 159 MOMR approuvés au Canada entre 2005 et 2024. Dans le cadre de l’étude, on explore les tendances d’approbation et la croissance du marché au cours des dernières décennies, on compare les coûts des traitements dans le cadre desquels les MOMR oncologiques sont utilisés avec les coûts des traitements dans le cadre desquels les MOMR non oncologiques sont utilisés, et on compare les prix courants au Canada en 2024 avec ceux des 11 pays de comparaison du Conseil d’examen du prix des médicaments brevetés (CEPMB) (les pays du CEPMB11). Ces pays sont l’Australie, la Belgique, la France, l’Allemagne, l’Italie, le Japon, les Pays-Bas, la Norvège, l’Espagne, la Suède et le Royaume‑Uni.
Définition des MOMR : Pour l’étude, il s’agit de médicaments ayant obtenu au moins une désignation de médicament orphelin (maladie rare) de la Food and Drug Administration américaine ou de l’Agence européenne des médicaments, et dont le coût est estimé à plus de 100 000 dollars canadiens par année pour les médicaments qui ne sont pas anticancéreux, ou à plus de 7 500 dollars canadiens par période de 28 jours pour les médicaments anticancéreux/oncologiques.
Résultats
1. Comment le nombre de MOMR approuvés a-t-il évolué au fil du temps au Canada?
- Le nombre de MOMR approuvés chaque année au Canada a augmenté de manière importante depuis 2005 (Figure 1).
- 2005 à 2008 : Les approbations ont été faibles et relativement stables (1 à 2 approbations par année).
- 2009 à 2014 : Croissance modérée, mais régulière, atteignant 6 approbations en 2014.
- 2015 à 2023 : Accélération marquée des approbations, avec régulièrement plus de 10 MOMR par année et un sommet de 17 en 2023, tandis que les approbations en 2024 sont tombées à 10, ce qui pourrait indiquer une baisse temporaire.
- Dans l’ensemble, la tendance montre une augmentation significative des approbations réglementaires pour les MOMR au cours de la dernière décennie.
Figure 1. Nombre de médicaments onéreux pour les maladies rares (MOMR) approuvés au Canada par année d’avis de conformité (AC), de 2005 à 2024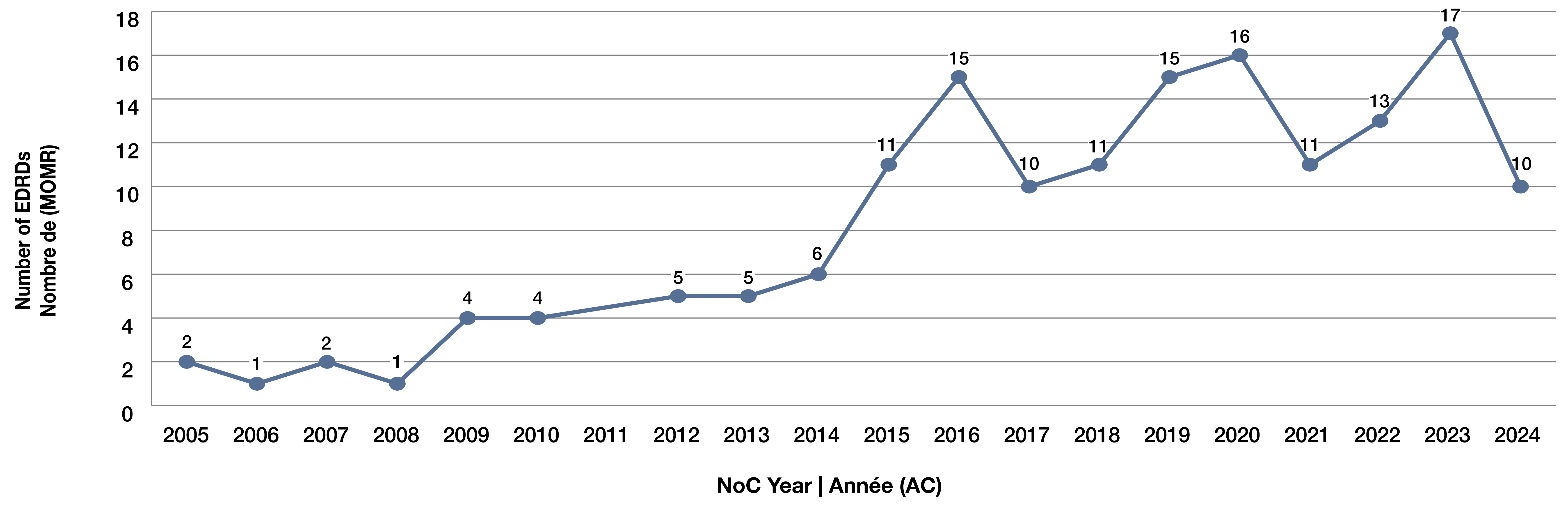
Figure - Version texte
| Année de l’avis de conformité | Nombre de médicaments onéreux pour les maladies rares |
|---|---|
2005 |
2 |
2006 |
1 |
2007 |
2 |
2008 |
1 |
2009 |
4 |
2010 |
4 |
2012 |
5 |
2013 |
5 |
2014 |
6 |
2015 |
11 |
2016 |
15 |
2017 |
10 |
2018 |
11 |
2019 |
15 |
2020 |
16 |
2021 |
11 |
2022 |
13 |
2023 |
17 |
2024 |
10 |
Sources : Base de données des avis de conformité (AC) de Santé Canada; Base de données sur les produits pharmaceutiques de Santé Canada; Agence des médicaments du Canada.
2. Comment la part des MOMR a-t-elle évolué au fil du temps sur le marché canadien des produits pharmaceutiques de marque?
- De 2006 à 2016, la part de marché des MOMR dans le secteur canadien des produits pharmaceutiques de marque est demeurée faible. Elle a augmenté lentement, passant de 0,4 % en 2006 à 3,8 % en 2016 (Figure 2).
- Croissance rapide : La part de marché des MOMR dans le secteur canadien des produits pharmaceutiques de marque a augmenté régulièrement. Cette part connaît une croissance particulièrement forte depuis 2017.
- Accélération soutenue (2018-2024) : À partir de 2018, la part de marché des MOMR a augmenté fortement chaque année pour atteindre 28 % en 2024, alors qu’elle n’était que de 0,4 % moins de deux décennies auparavant.
- De 2006 à 2024, les ventes de MOMR ont augmenté à un taux de croissance annuel composé (TCAC) de 32,4 %, dépassant de loin la croissance de 3,9 % pour l’ensemble des médicaments de marque.
Figure 2. Part de marché des médicaments onéreux pour les maladies rares (MOMR) sur le marché canadien des produits pharmaceutiques de marque, 2006-2024 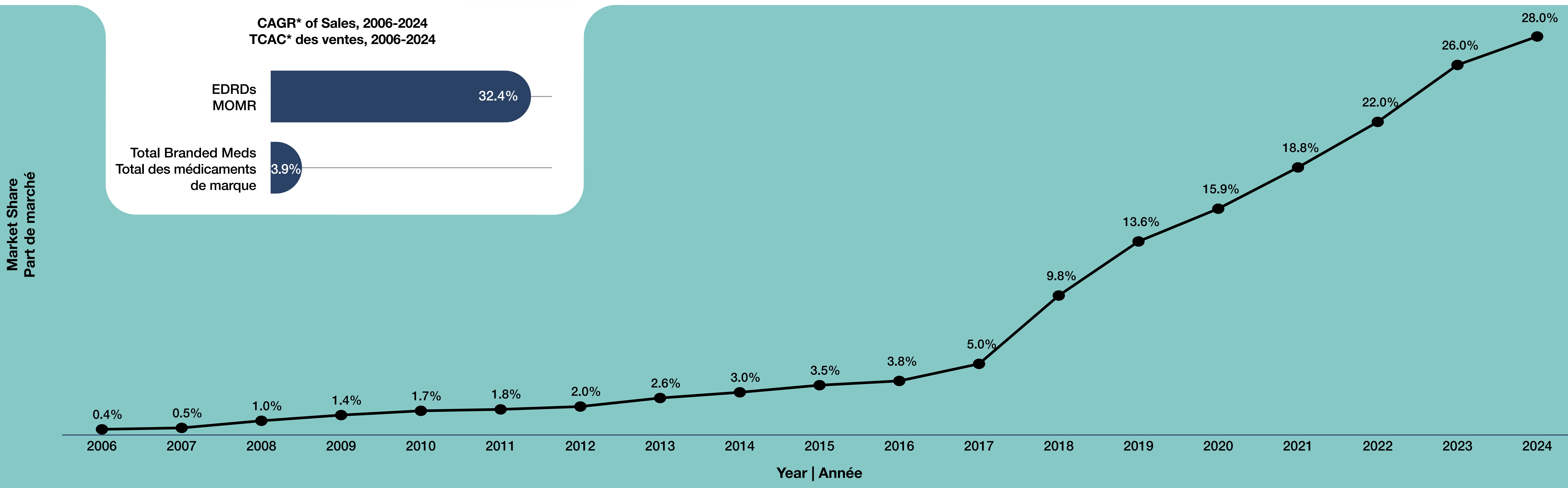
Figure - Version texte
| Année | Part de marché |
|---|---|
2006 |
0,4 % |
2007 |
0,5 % |
2008 |
1,0 % |
2009 |
1,4 % |
2010 |
1,7 % |
2011 |
1,8 % |
2012 |
2,0 % |
2013 |
2,6 % |
2014 |
3,0 % |
2015 |
3,5 % |
2016 |
3,8 % |
2017 |
5,0 % |
2018 |
9,8 % |
2019 |
13,6 % |
2020 |
15,9 % |
2021 |
18,8 % |
2022 |
22,0 % |
2023 |
26,0 % |
2024 |
28,0 % |
| Taux de croissance annuel composé | |
|---|---|
Médicaments onéreux pour les maladies rares |
32,4 % |
Total des médicaments de marque |
3,9 % |
Remarque : TCAC=Taux de croissance annuel composé
Source : base de données MIDASMD d’IQVIA.
3. Comment les MOMR sont-ils répartis en fonction du coût annuel du traitement, et comment cela varie-t-il entre les médicaments oncologiques et les médicaments non oncologiques?
- Des 159 MOMR approuvés au Canada au cours des deux dernières décennies, 88 (55 %) sont des médicaments oncologiques et 71 (45 %) sont des médicaments non oncologiques (Figure 3).
- Les MOMR oncologiques se situent dans les catégories les moins coûteuses. En effet, 56 % ont des coûts de traitement annuels inférieurs à 200 000 $, alors que seulement 20 % des MOMR non oncologiques ont des coûts de traitement annuels inférieurs à 200 000 $.
- Les MOMR non oncologiques sont plus susceptibles d’appartenir à la catégorie dont les coûts sont les plus élevés. En effet, 23 % dépassent 1 M$ annuellement, alors que c’est le cas pour seulement 1 % des MOMR oncologiques.
- Les coûts moyens (de 200 000 $ à 1 M$) représentent une part importante dans les deux groupes. En effet, 43 % des MOMR oncologiques et 58 % MOMR non oncologiques se situent dans cette fourchette.
Figure 3. Part des médicaments onéreux pour le traitement de maladies rares (MOMR) par coût de traitement annuel : comparaison entre les MOMR oncologiques et les MOMR non oncologiques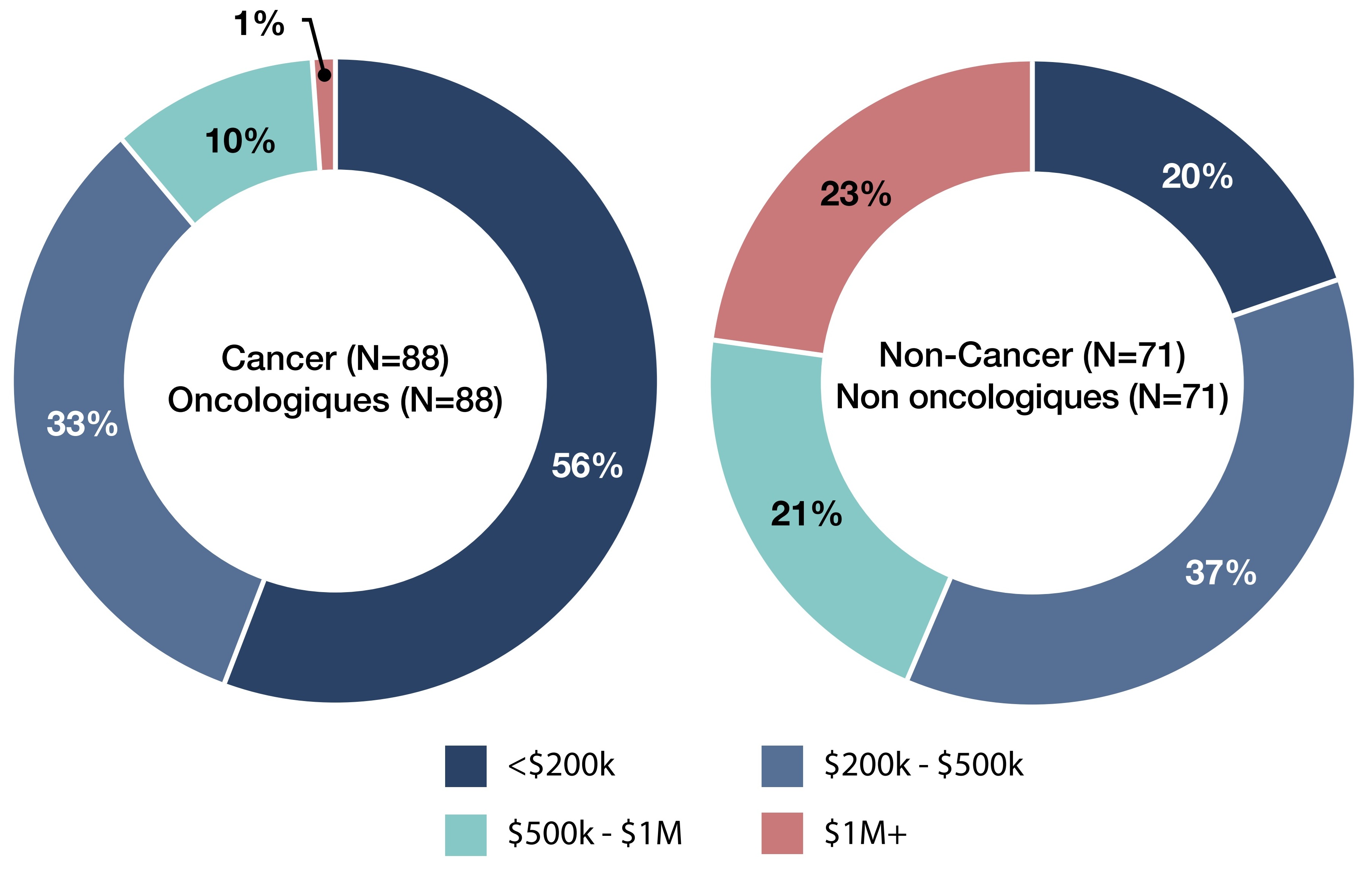
Figure - Version texte
Oncologiques
| Coût du traitement | Part |
|---|---|
<200 000 $ |
56 % |
200 000 $-500 000 $ |
33 % |
500 000 $ - 1 M$ |
10 % |
1 M$ + |
1 % |
Non oncologiques
| Coût du traitement | Part |
|---|---|
<200 000 $ |
20 % |
200 000 $-500 000 $ |
37 % |
500 000 $ - 1 M$ |
21 % |
M$ |
23 % |
Sources : Base de données des avis de conformité de Santé Canada; Base de données sur les produits pharmaceutiques de Santé Canada; Agence des médicaments du Canada.
4. Comment les prix courants des MOMR au Canada se comparent-ils à ceux des 11 pays de comparaison utilisés par le Conseil d’examen du prix des médicaments brevetés (CEPMB11) en 2024?
- En 2024, les prix canadiens des MOMR étaient les troisièmes plus élevés par rapport aux pays du CEPMB11. En effet, les prix en Espagne et en Italie sont supérieurs de 15 % et de 3 %, respectivement, aux prix canadiens (Figure 4).
- Les prix internationaux les plus élevés (PIPE) étaient supérieurs de 19 % aux prix canadiens, tandis que la médiane des prix internationaux (MPI) était inférieure de 15 % aux prix canadiens pour les MOMR.
- La plupart des pays affichaient des prix inférieurs à ceux du Canada, le Japon (-40 %), l’Australie (-20 %) et la France (-19 %) présentant les écarts les plus importants. L’Allemagne, la Norvège, la Suède et les Pays-Bas affichaient tous des prix inférieurs d’environ 17 ou 18 %.
Figure 4. Comparaisons bilatérales des prix courants entre les pays étrangers et le Canada en 2024, médicaments coûteux pour les maladies rares, pays du CEPMB11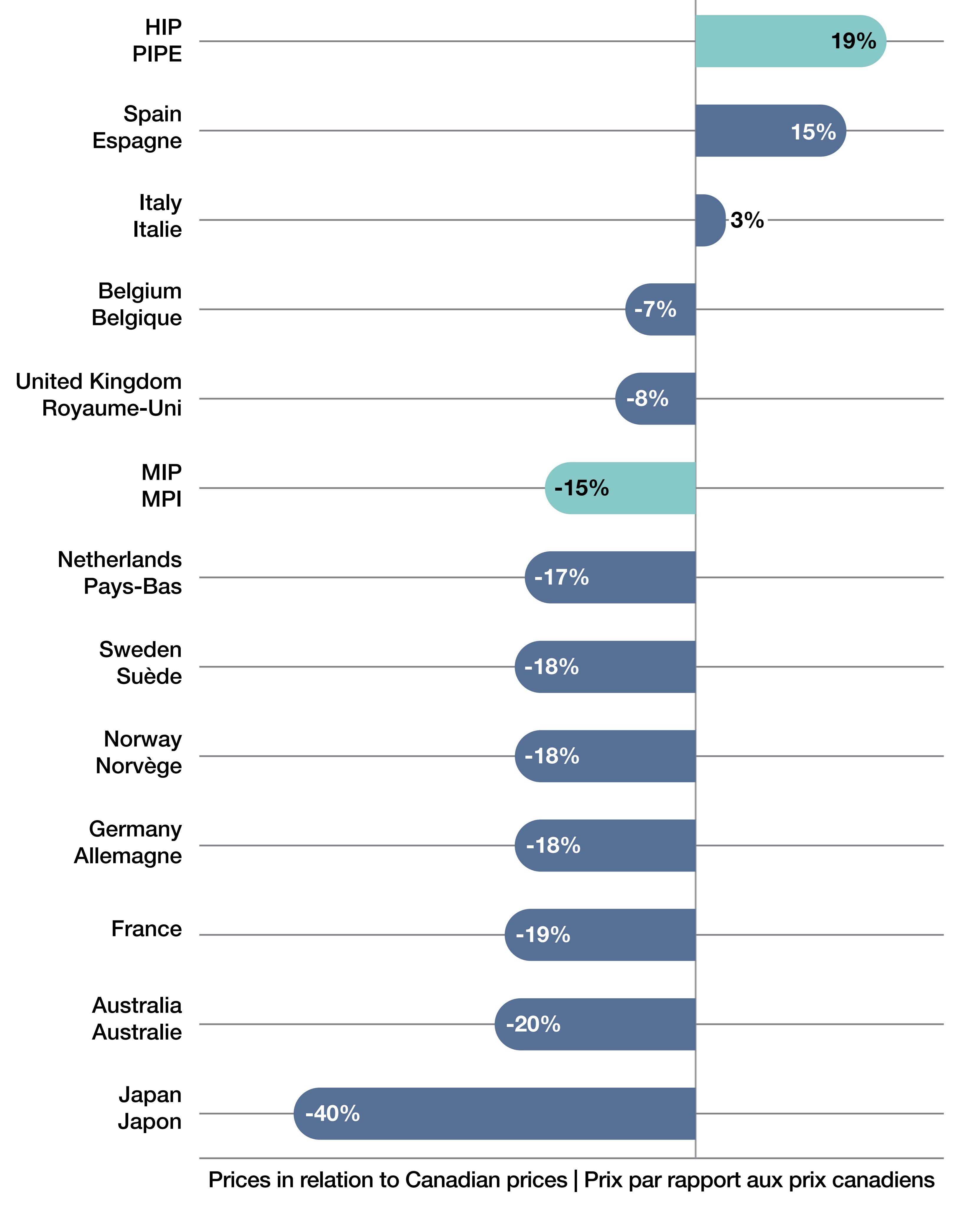
Figure - Version texte
Prix à l’étranger par rapport aux prix canadiens |
|
Le plus élevé des prix internationaux |
19 % |
Espagne |
15 % |
Italie |
3 % |
Belgique |
-7 % |
Royaume-Uni |
-8 % |
La médiane des prix internationaux |
-15 % |
Pays-Bas |
-17 % |
Suède |
-18 % |
Norvège |
-18 % |
Allemagne |
-18 % |
France |
-19 % |
Australie |
-20 % |
Japon |
-40 % |
Remarque : MPI = Médiane des prix internationaux; PIPE = Prix international le plus élevé;
Sources : MIDASMD d’IQVIA.
Conclusion
L’étude met en évidence la réalité économique du nombre croissant de médicaments onéreux pour les maladies rares (MOMR) au Canada et de leurs coûts en hausse. L’augmentation du nombre d’autorisations des MOMR, la présence croissante des MOMR sur le marché et leurs prix relativement plus élevés que dans d’autres pays soulignent la nécessité de mettre en place des politiques efficaces qui soutiennent les personnes atteintes de maladies rares, tout en garantissant la viabilité du système de soins de santé.
Quelques réserves
La gamme de médicaments utilisés pour les comparaisons bilatérales entre les prix à l’étranger et les prix au Canada a été différente selon le pays. Des dollars non indexés ont été utilisés pour identifier les MOMR approuvés toutes les années.
Avis de non‑responsabilité
Bien que ces informations soient en partie fondées sur des données obtenues sous licence venant de la base de données MIDASMD appartenant à IQVIA Solutions Canada Inc. et/ou à ses sociétés affiliées (« IQVIA »), les déclarations, les résultats, les conclusions, les points de vue et les opinions présentés dans le présent rapport sont exclusivement ceux du CEPMB et ne peuvent être attribués à IQVIA.