L’évolution du marché des biosimilaires au Canada et ce qu’elle signifie pour les payeurs
Introduction
Les économies potentielles liées aux médicaments biosimilaires suscitent un vif intérêt au niveau international, et ont un intérêt particulier pour les Canadiens. En effet, étant donné le grand usage et le coût élevé des médicaments biologiques au Canada, l’utilisation accrue des biosimilaires offre aux payeurs canadiens une occasion importante de réaliser des économies.
Contrairement aux médicaments à petites molécules, qui connaissent assez rapidement un ajustement de marché à l’arrivée des médicaments génériques, la plupart des médicaments biologiques d’origine au Canada continuent de dominer le marché après l’introduction d’un biosimilaire. La faible part de marché des biosimilaires limite ainsi les économies réalisables par les payeurs canadiens et leur capacité potentielle à financer les nouveaux traitements, qui entrent par conséquent sur le marché à des prix de plus en plus élevés.
Les récents changements apportés aux politiques visant à promouvoir une transition vers les biosimilaires devraient se traduire par d’importantes réductions de coûts pour les catégories visées de médicaments biologiques au Canada, ce qui contribuera à compenser la pression exercée par les nouveaux médicaments plus coûteux dans les années à venir.
L’analyse qui suit compare le marché canadien émergent des biosimilaires avec celui de ses homologues internationaux, elle évalue l’incidence des initiatives récentes visant à remplacer certains médicaments biologiques par leurs versions biosimilaires et elle met en évidence le potentiel de réduction des coûts au Canada. La base de données MIDAS® d’IQVIA (2020) a été utilisée pour comparer la disponibilité, l’adoption et les ventes de biosimilaires au Canada par rapport à la situation dans les pays de l’Organisation de coopération et de développement économiques (OCDE). Les données sur la dynamique du marché des biosimilaires au Canada en 2020 et 2021 et sur le potentiel de réduction des coûts ont été tirées de l’Audit des achats des pharmacies et des hôpitaux canadiens d’IQVIA.
Résultats
Tendances du marché des médicaments biologiques au Canada et comparaisons avec d’autres pays
Les ventes de médicaments biologiques au Canada ont triplé au cours de la dernière décennie, passant d’une valeur de 3,3 milliards de dollars en 2011 à 10 milliards de dollars en 2020. Cela représente un taux de croissance annuel composé (TCAC) sur 10 ans de 13,2 %, ainsi qu’une augmentation de 14,6 % pour cette seule dernière année 2020.
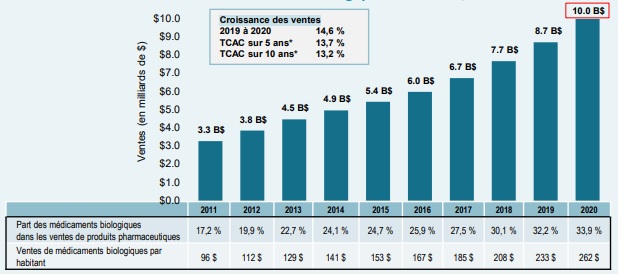
Description de la figure
Le diagramme en barres illustre la croissance des ventes de médicaments biologiques au Canada. Les ventes annuelles sont exprimées en milliards de dollars pour chaque année, de 2011 à 2020. Le tableau ci-dessous présente la part des ventes de médicaments biologiques en pourcentage du marché total des médicaments d’ordonnance pour chaque année, ainsi que les ventes annuelles de médicaments biologiques par habitant. Le taux de croissance des ventes de 2019 à 2020 (14,6 %), ainsi que les taux de croissance annuels composés sur 5 ans (13,7 %) et 10 ans (13,2 %), sont également indiqués.
| 2011 | 2012 | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | |
|---|---|---|---|---|---|---|---|---|---|---|
Ventes au Canada en milliards de dollars |
3,3 $ |
3,8 $ |
4,4 $ |
4,9 $ |
5,4 $ |
6,0 $ |
6,7 $ |
7,7 $ |
8,7 $ |
10,0 $ |
Part des médicaments biologiques dans les ventes de produits pharmaceutiques |
17,2 % |
19,9 % |
22,7 % |
24,1 % |
24,7 % |
25,9 % |
27,5 % |
30,1 % |
32,2 % |
33,9 % |
Ventes de médicaments biologiques par habitant |
96 $ |
112 $ |
129 $ |
141 $ |
153 $ |
167 $ |
185 $ |
208 $ |
233 $ |
262 $ |
Le Canada dépense plus en médicaments biologiques par habitant que presque tous les autres pays industrialisés. En 2020, les médicaments biologiques représentaient 33,9 % des ventes de produits pharmaceutiques au Canada, soit la troisième part la plus élevée de l’OCDE et une part supérieure à la médiane, qui est de 27,4 %. Les Canadiens ont dépensé en moyenne 262 $ par personne pour des médicaments biologiques au cours de la même année, ce qui est bien supérieur à la médiane internationale de 156 $. Cela a placé le Canada au quatrième rang des pays de l’OCDE au chapitre des ventes par habitant.
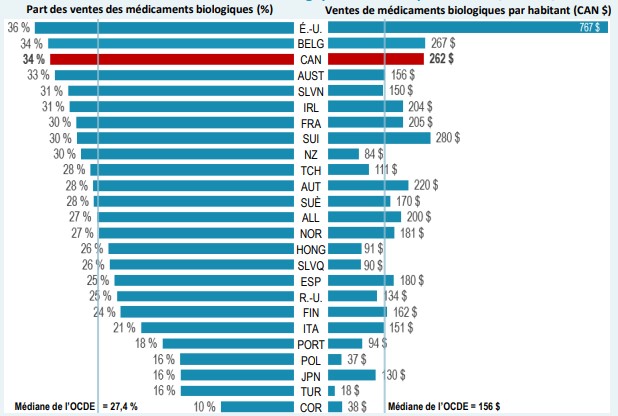
* Les pays pour lesquels les données sur les ventes sont limitées ont été exclus de cette analyse.
Description de la figure
Un diagramme en barres fractionnées illustre la part des médicaments biologiques dans les ventes totales de produits pharmaceutiques et les ventes de médicaments biologiques par habitant pour chaque pays de l’Organisation de coopération et de développement économiques en 2020. Toutes les ventes sont exprimées en dollars canadiens. La médiane de la part des médicaments biologiques pour tous les pays était de 27,4 %, tandis que la médiane des ventes de médicaments biologiques par habitant était de 156 $.
| Pays | Part des ventes de médicaments biologiques | Ventes de médicaments biologiques par habitant |
|---|---|---|
États-Unis |
36,0 % |
767 $ |
Belgique |
34,2 % |
267 $ |
Canada |
33,9 % |
262 $ |
Australie |
33,3 % |
156 $ |
Slovénie |
31,4 % |
150 $ |
Irlande |
31,2 % |
204 $ |
France |
30,3 % |
205 $ |
Suisse |
30,2 % |
280 $ |
Nouvelle-Zélande |
29,6 % |
84 $ |
République tchèque |
28,3 % |
111 $ |
Autriche |
27,9 % |
220 $ |
Suède |
27,8 % |
170 $ |
Allemagne |
27,4 % |
200 $ |
Norvège |
27,1 % |
181 $ |
Hongrie |
25,8 % |
91 $ |
Slovaquie |
25,6 % |
90 $ |
Espagne |
25,0 % |
180 $ |
Royaume-Uni |
24,6 % |
134 $ |
Finlande |
24,1 % |
162 $ |
Italie |
21,3 % |
151 $ |
Portugal |
18,3 % |
94 $ |
Pologne |
15,8 % |
37 $ |
Japon |
15,8 % |
130 $ |
Turquie |
15,7 % |
18 $ |
Corée du Sud |
10,1 % |
38 $ |
Disponibilité et adoption des médicaments biosimilaires au Canada et dans d’autres pays de l’OCDE
Malgré une augmentation du nombre d’approbations de biosimilaires au Canada ces dernières années, l’Europe reste en tête avec le plus grand nombre d’approbations de biosimilaires. À la fin de 2020, des versions biosimilaires de 14 médicaments biologiques distincts avaient été autorisées par Santé Canada, contre 17 par l’Agence européenne des médicaments (EMA) et 12 par la Food and Drug Administration (FDA) des États-Unis.
Pour les molécules biologiques distinctes dont les biosimilaires sont approuvés et vendus dans l’ensemble de l’OCDE, l’adoption des biosimilaires au Canada est modérée par rapport aux marchés internationaux, en particulier pour les produits les plus vendus. L’infliximab, le médicament biologique le plus vendu et l’un des premiers à être disponible au Canada sous forme de biosimilaire, ne représentait que 20 % de la part des biosimilaires au Canada en 2020, ce qui est bien inférieur à la médiane de 73 % de l’OCDE. L’adalimumab, le deuxième médicament biologique le plus vendu, ne compte aucune vente de biosimilaires au Canada en 2020 et son utilisation médiane est de 28 % dans l’OCDE.
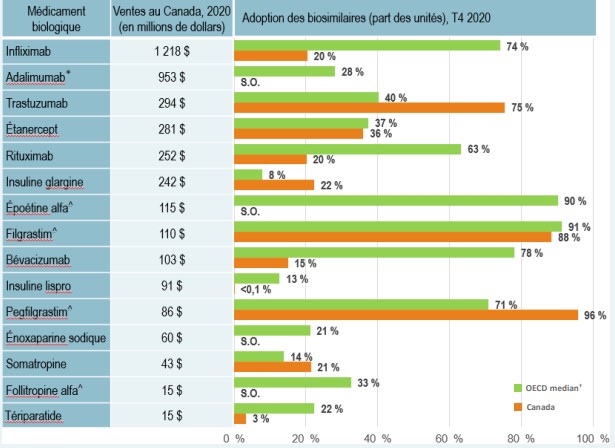
* En 2018, un produit d’adalimumab biosimilaire a été autorisé au Canada, mais les ventes n’ont débuté qu’en février 2021. Par conséquent, aucune donnée sur l’adoption n’est communiquée dans la figure.
^ Médicaments biologiques prescrits pour des pathologies aiguës.
† Le Canada est exclu du calcul de la médiane.
Description de la figure
Un diagramme en barres illustre l’adoption des biosimilaires, en part des unités vendues, pour le Canada et l’Organisation de coopération et de développement économiques (OCDE) au quatrième trimestre de 2020. Le graphique compare l’adoption de médicaments biologiques à la disponibilité de biosimilaires au Canada. Les résultats pour l’OCDE correspondent à la médiane pour tous les pays, à l’exclusion du Canada. La valeur totale des ventes au Canada en 2020 pour chaque médicament est également indiquée.
| Médicament biologique | Ventes au Canada en 2020, en millions de dollars | Adoption des biosimilaires, T4 2020, part des unités | |
|---|---|---|---|
| Médiane de l’OCDE | Canada | ||
Infliximab |
1 218 $ |
74 % |
20 % |
Adalimumab |
953 $ |
28 % |
— |
Trastuzumab |
294 $ |
40 % |
75 % |
Étanercept |
281 $ |
37 % |
36 % |
Rituximab |
252 $ |
63 % |
20 % |
Insuline glargine |
242 $ |
8 % |
22 % |
Époétine alfa* |
115 $ |
90 % |
— |
Filgrastim* |
110 $ |
91 % |
88 % |
Bévacizumab |
103 $ |
78 % |
15 % |
Insuline lispro |
91 $ |
13 % |
<0,1 % |
Pegfilgrastim* |
86 $ |
71 % |
96 % |
Énoxaparine sodique |
60 $ |
21 % |
— |
Somatropine |
43 $ |
14 % |
21 % |
Follitropine alfa* |
15 $ |
33 % |
— |
Tériparatide |
15 $ |
22 % |
3 % |
Défis liés à l’adoption des médicaments biosimilaires et politiques actuelles
Au Canada, plusieurs facteurs clés peuvent avoir une incidence sur l’adoption des biosimilaires :
- Interchangeabilité : Comme dans la plupart des pays, les biosimilaires ne sont pas interchangeables avec le médicament biologique d’origine.
- Substitution pour les patients : La substitution n’est pas obligatoire partout. Il est recommandé que la décision de faire passer un patient d’un médicament biologique d’origine à un biosimilaire soit prise par le médecin traitant, en consultation avec le patient, et qu’elle tienne compte de toutes les politiques en vigueur dans l’administration concernée.
- Maintien des parts de marché : Les stratégies et initiatives entreprises par le fabricant du produit biologique d’origine peuvent limiter l’adoption des biosimilaires.
Depuis le mois de mai 2019, plusieurs payeurs canadiens ont entrepris un certain nombre d’initiatives visant à encourager la transition des médicaments biologiques vers les biosimilaires dans le but d’accroître l’adoption des biosimilaires, comme indiqué dans le tableau ci-dessous.
| Payeur | Initiative | |
|---|---|---|
Payeurs publics |
Colombie-Britannique |
En 2019, la Colombie-Britannique est devenue la première province canadienne à amorcer une transition vers les biosimilaires pour les patients couverts par le Régime d’assurance-médicaments. Dans le cadre des initiatives des phases 1 et 2 de son programme, les patients qui étaient sous Enbrel, Remicade ou Lantus pour des indications particulières devaient obligatoirement passer à une version biosimilaire. La politique de substitution a été étendue aux phases 3 et 4 en 2020 et 2021 pour inclure les médicaments Rituxan et Humira. |
Alberta |
En janvier 2021, l’Alberta a annoncé que tous les patients sous Enbrel, Remicade, Lantus, Neupogen, Neulasta, Rituxan ou Copaxone pour des indications allant de la polyarthrite rhumatoïde au diabète et à la sclérose en plaques devaient en changer pour un biosimilaire. Cette politique a depuis été élargie pour inclure les médicaments Humira, Lovenox et Hamlog. |
|
Nouveau-Brunswick |
Depuis avril 2021, le Nouveau-Brunswick ne rembourse que les versions biosimilaires pour les indications approuvées des médicaments Humira, Enbrel, Remicade, Lantus, Humalog, Rituxan, Copaxone et Lovenox. |
|
Québec |
En avril 2021, le gouvernement du Québec a annoncé une politique de substitution pour des raisons non médicales : les patients couverts par le régime public d’assurance-médicaments du Québec qui sont traités avec des médicaments biologiques sont tenus de passer de façon permanente à des versions biosimilaires dès lors que celles-ci sont sur le marché. |
|
MB, ON, N.-É., Î.-P.-É., T.-N. et Labrador, YK, services de santé non assurés (SSNA) |
Planification de la mise en œuvre de stratégies de remplacement de certains médicaments biologiques par des versions biosimilaires. |
|
Payeurs privés |
Green Shield Canada (GSC), la Sun Life et la Pacific Blue Cross (PBC) ont lancé des initiatives stratégiques pour promouvoir l’utilisation de médicaments biosimilaires. |
|
Ces politiques de transition des payeurs vers les biosimilaires ont favorisé une plus grande adoption des biosimilaires dans leur province ou leur territoire respectif. L’infliximab, qui représente l’une des premières ventes de biosimilaires au Canada, faisait partie des médicaments visés par l’Initiative sur les biosimilaires du Régime d’assurance-médicaments de la Colombie-Britannique. Grâce à cette initiative, les biosimilaires représentent maintenant 94 % du marché de l’infliximab en Colombie-Britannique, comparativement à seulement 30 % des unités d’infliximab vendues à l’échelle nationale.
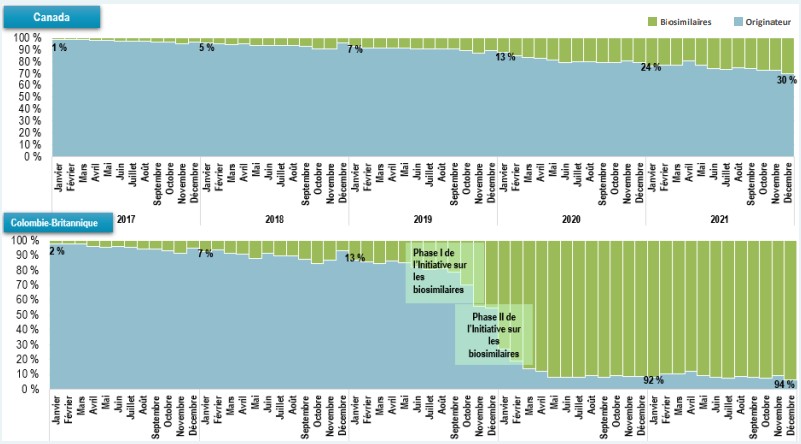
Description de la figure
Canada
Un diagramme en barres empilées illustre l’adoption des produits d’infliximab biosimilaires en tant que part de toutes les unités d’infliximab vendues au Canada de janvier 2017 à décembre 2021. Les résultats sont présentés mensuellement pour cette période.
| Année | Mois | Part du médicament d’origine dans les unités vendues | Part des médicaments biosimilaires dans les unités vendues |
|---|---|---|---|
2017 |
Janvier |
99 % |
1 % |
Février |
99 % |
1 % |
|
Mars |
98 % |
2 % |
|
Avril |
98 % |
2 % |
|
Mai |
98 % |
2 % |
|
Juin |
97 % |
3 % |
|
Juillet |
97 % |
3 % |
|
Août |
97 % |
3 % |
|
Septembre |
97 % |
3 % |
|
Octobre |
96 % |
4 % |
|
Novembre |
95 % |
5 % |
|
Décembre |
96 % |
4 % |
|
2018 |
Janvier |
95 % |
5 % |
Février |
95 % |
5 % |
|
Mars |
94 % |
6 % |
|
Avril |
95 % |
5 % |
|
Mai |
93 % |
7 % |
|
Juin |
94 % |
6 % |
|
Juillet |
94 % |
6 % |
|
Août |
93 % |
7 % |
|
Septembre |
93 % |
7 % |
|
Octobre |
90 % |
10 % |
|
Novembre |
91 % |
9 % |
|
Décembre |
95 % |
5 % |
|
2019 |
Janvier |
93 % |
7 % |
Février |
92 % |
8 % |
|
Mars |
92 % |
8 % |
|
Avril |
91 % |
9 % |
|
Mai |
91 % |
9 % |
|
Juin |
91 % |
9 % |
|
Juillet |
90 % |
10 % |
|
Août |
91 % |
9 % |
|
Septembre |
91 % |
9 % |
|
Octobre |
89 % |
11 % |
|
Novembre |
87 % |
13 % |
|
Décembre |
89 % |
11 % |
|
2020 |
Janvier |
87 % |
13 % |
Février |
85 % |
15 % |
|
Mars |
83 % |
17 % |
|
Avril |
82 % |
18 % |
|
Mai |
81 % |
19 % |
|
Juin |
79 % |
21 % |
|
Juillet |
80 % |
20 % |
|
Août |
80 % |
20 % |
|
Septembre |
79 % |
21 % |
|
Octobre |
79 % |
21 % |
|
Novembre |
80 % |
20 % |
|
Décembre |
79 % |
21 % |
|
2021 |
Janvier |
76 % |
24 % |
Février |
77 % |
23 % |
|
Mars |
77 % |
23 % |
|
Avril |
80 % |
20 % |
|
Mai |
77 % |
23 % |
|
Juin |
74 % |
26 % |
|
Juillet |
73 % |
27 % |
|
Août |
74 % |
26 % |
|
Septembre |
74 % |
26 % |
|
Octobre |
73 % |
27 % |
|
Novembre |
73 % |
27 % |
|
Décembre |
70 % |
30 % |
Colombie-Britannique
Un diagramme en barres empilées illustre l’adoption des produits d’infliximab biosimilaires en tant que part de toutes les unités d’infliximab vendues en Colombie-Britannique de janvier 2017 à décembre 2021. Les résultats sont présentés mensuellement pour cette période. La Phase I de l’Initiative sur les biosimilaires a débuté en mai 2019 et la Phase II a débuté en septembre 2019.
| Année | Mois | Part du médicament d’origine dans les unités vendues | Part des médicaments biosimilaires dans les unités vendues |
|---|---|---|---|
2017 |
Janvier |
98 % |
2 % |
Février |
98 % |
2 % |
|
Mars |
97 % |
3 % |
|
Avril |
96 % |
4 % |
|
Mai |
96 % |
4 % |
|
Juin |
96 % |
4 % |
|
Juillet |
95 % |
5 % |
|
Août |
94 % |
6 % |
|
Septembre |
94 % |
6 % |
|
Octobre |
93 % |
7 % |
|
Novembre |
92 % |
8 % |
|
Décembre |
95 % |
5 % |
|
2018 |
Janvier |
93 % |
7 % |
Février |
94 % |
6 % |
|
Mars |
91 % |
9 % |
|
Avril |
91 % |
9 % |
|
Mai |
88 % |
12 % |
|
Juin |
91 % |
9 % |
|
Juillet |
90 % |
10 % |
|
Août |
89 % |
11 % |
|
Septembre |
87 % |
13 % |
|
Octobre |
84 % |
16 % |
|
Novembre |
87 % |
13 % |
|
Décembre |
93 % |
7 % |
|
2019 |
Janvier |
87 % |
13 % |
Février |
85 % |
15 % |
|
Mars |
84 % |
16 % |
|
Avril |
86 % |
14 % |
|
Mai |
85 % |
15 % |
|
Juin |
82 % |
18 % |
|
Juillet |
80 % |
20 % |
|
Août |
81 % |
19 % |
|
Septembre |
78 % |
22 % |
|
Octobre |
70 % |
30 % |
|
Novembre |
56 % |
44 % |
|
Décembre |
54 % |
46 % |
|
2020 |
Janvier |
27 % |
73 % |
Février |
19 % |
81 % |
|
Mars |
14 % |
86 % |
|
Avril |
12 % |
88 % |
|
Mai |
8 % |
92 % |
|
Juin |
8 % |
92 % |
|
Juillet |
8 % |
92 % |
|
Août |
9 % |
91 % |
|
Septembre |
8 % |
92 % |
|
Octobre |
9 % |
91 % |
|
Novembre |
9 % |
91 % |
|
Décembre |
8 % |
92 % |
|
2021 |
Janvier |
8 % |
92 % |
Février |
11 % |
89 % |
|
Mars |
10 % |
90 % |
|
Avril |
12 % |
88 % |
|
Mai |
9 % |
91 % |
|
Juin |
8 % |
92 % |
|
Juillet |
7 % |
93 % |
|
Août |
9 % |
91 % |
|
Septembre |
8 % |
92 % |
|
Octobre |
7 % |
93 % |
|
Novembre |
9 % |
91 % |
|
Décembre |
6 % |
94 % |
Possibilités de réduction des coûts grâce aux biosimilaires
Dans la mesure où les économies autrefois réalisées grâce aux génériques (baisse des prix et substitutions) commencent à faiblir, les économies réalisées grâce aux biosimilaires pourraient jouer un rôle croissant dans la compensation de l’augmentation des coûts des médicaments. Étant donné que ces initiatives de substitution sont mises en œuvre au niveau de l’administration et par le payeur, le Canada offre un modèle unique, qui permet d’observer l’incidence des différentes approches, selon la province ou le territoire, et l’adoption des biosimilaires au fil du temps.
Une pénétration du marché national conforme aux résultats observés en Colombie-Britannique pourrait avoir des répercussions importantes sur les coûts pour les payeurs canadiens, comme en témoigne l’utilisation accrue de trois biosimilaires visés par l’Initiative sur les biosimilaires du Régime d’assurance-médicaments de la Colombie-Britannique : infliximab, étanercept et insuline glargine 100 UI. Ces biosimilaires ont permis aux Canadiens d’économiser environ 168 millions et 232 millions de dollars en 2020 et 2021, respectivement. Si l’adoption de ces biosimilaires à l’échelle nationale avait suivi les tendances observées en Colombie-Britannique, des économies supplémentaires de près de 1,1 milliard de dollars auraient été réalisées pour 2020 et 2021. À la fin de l’année 2021, les Canadiens n’avaient réalisé qu’une fraction (30 %) des économies potentielles qu’il aurait été possible de réaliser grâce aux biosimilaires; on aurait pu réaliser jusqu’à 70 % d’économies annuelles supplémentaires si des initiatives favorisant la transition vers les biosimilaires avaient été mises en œuvre à l’échelle nationale chez tous les payeurs.
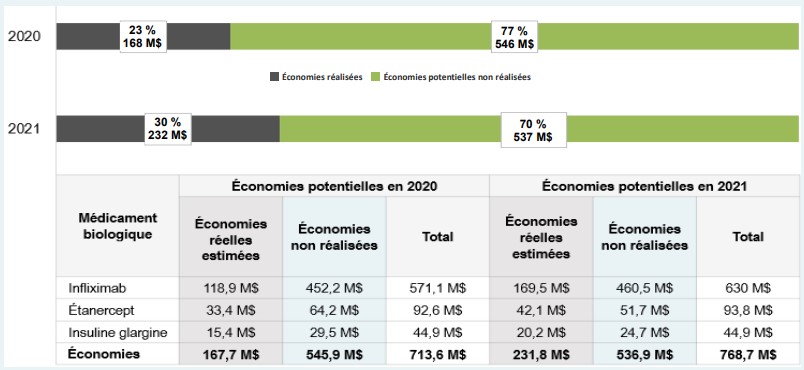
Description de la figure
Un diagramme à barres horizontales illustre la différence entre les économies potentielles réalisées et non réalisées résultant d’une plus grande adoption des biosimilaires et/ou d’une baisse des prix au Canada en 2020 et 2021. Les résultats sont exprimés en pourcentage du total des économies potentielles et en dollars.
En 2020, les économies réalisées s’élevaient à 168 millions de dollars (soit 23 % des économies potentielles totales), laissant 546 millions de dollars (77 %) d’économies potentielles non réalisées.
En 2021, les économies réalisées s’élevaient à 232 millions de dollars (soit 30 % des économies potentielles totales), laissant 537 millions de dollars (70 %) d’économies potentielles non réalisées.
Un tableau situé sous le graphique ventile ces résultats par médicament biologique.
| Médicament biologique | Économies potentielles en 2020, en millions de dollars | Économies potentielles en 2021, en millions de dollars | ||||
|---|---|---|---|---|---|---|
| Économies réelles estimées | Économies non réalisées | Total | Économies réelles estimées | Économies non réalisées | Total | |
Infliximab |
118,9 $ |
452,2 $ |
571,1 $ |
169,5 $ |
460,5 $ |
630,0 $ |
Étanercept |
33,4 $ |
64,2 $ |
97,6 $ |
42,1 $ |
51,7 $ |
93,8 $ |
Insuline glargine |
15,4 $ |
29,5 $ |
44,9 $ |
20,2 $ |
24,7 $ |
44,9 $ |
Économies |
167,7 $ |
545,9 $ |
713,6 $ |
231,8 $ |
536,9 $ |
768,7 $ |
Remarques
Source de données : Base de données MIDASMD d’IQVIA 2020 (tous droits réservés); Audit des achats des pharmacies et des hôpitaux canadiens d’IQVIA de 2020 à 2021; bases de données de la Food and Drug Administration (FDA) des États-Unis, de l’Agence européenne des médicaments (EMA) et de Santé Canada; Banque mondiale.
Limites
L’analyse ci-dessus porte sur les médicaments biologiques ayant connu des ventes sur le marché canadien. Les médicaments biologiques sélectionnés sont ceux qui, dans la Base de données sur les produits pharmaceutiques (BDPP) de Santé Canada, sont classés à l’annexe Médicaments sur ordonnance et à l’Annexe D; ils comprennent les médicaments biologiques à base d’insuline. Le modèle de réduction des coûts ne tient pas compte de l’incidence des changements apportés aux politiques sur les gammes de prix des biosimilaires; ce sont les prix des biosimilaires au cours de la période visée par l’étude qui ont été utilisés pour calculer les répercussions sur les coûts et les économies.
Clause de non-responsabilité
Bien qu’ils s’appuient en partie sur des données obtenues sous licence provenant des bases de données MIDAS® et de l’Audit des achats des pharmacies et des hôpitaux canadiens appartenant à IQVIA Solutions Canada Inc. et/ou ses sociétés affiliées (« IQVIA »), les énoncés, les résultats, les conclusions, les points de vue et les opinions présentés dans le présent document sont exclusivement ceux du Conseil d’examen du prix des médicaments brevetés (CEPMB) et ne sont pas attribuables à IQVIA.