Le bromate dans l'eau potable
Organisation : Santé Canada
Type : Consultation
Date publiée : 2015-11-27
Sujets connexes
Table des matières
- Objet de la consultation
- Partie I. Vue d'ensemble et application
- Partie II. Science et considérations techniques
- 4.0 Désignations, utilisations et sources dans l'environnement
- 5.0 Exposition
- 6.0 Méthodes d'analyse
- 7.0 Considérations relatives aux techniques de traitement
- 7.1 Formation de bromate
- 7.2 Prévention de la formation de bromate
- 7.3 Facteurs influant sur la formation de bromate pendant l'ozonation
- 7.4 Traitement à l'ozone à l'échelle municipale
- 7.5 Échelle résidentielle
- 8.0 Cinétique et métabolisme
- 9.0 Effets sur la santé
- 9.1 Effets chez les humains
- 9.2 Effets chez les animaux de laboratoire
- 9.3 Modes d'action
- 9.3.1 Stress oxydatif
- 9.3.2 Néphropathie induite par l'α2µ-globuline
- 9.3.2.1 Accumulation de gouttelettes hyalines dans les tubules proximaux
- 9.3.2.2 Surcharge de protéines rénales provoquant des lésions aux cellules rénales
- 9.3.2.3 Prolifération cellulaire
- 9.3.2.4 Analyse quantitative des événements clés pour le mode d'action de la néphropathie induite par l'α2µ-globuline
- 9.3.2.5 Synthèse du mode d'action de la néphropathie induite par l'α2µ-globuline.
- 9.3.3 Mutagénèse à action directe
- 9.3.4 Autres modes d'action
- 9.3.5 Conclusions et conséquences de l'analyse des modes d'action
- 10.0 Classification et évaluation
- 11.0 Justification
- 12.0 Références
- Annexe A. Liste des acronymes
- Annexe B. Recommandations pour la manutention et l'entreposage des solutions d'hypochlorite
- Annexe C. Estimations des coûts par province et territoire
Objet de la consultation
Le Comité fédéral-provincial-territorial sur l'eau potable (CEP) a évalué l'information disponible sur le bromate dans le but de mettre à jour la recommandation pour la qualité de l'eau potable actuelle. La présente consultation vise à recueillir des commentaires sur la recommandation proposée, la démarche suivie pour l'élaborer et les coûts possibles de sa mise en œuvre, ainsi que pour déterminer la disponibilité d'autres données sur l'exposition.
La recommandation actuelle, dont la dernière mise à jour remonte à 1998, fixe la concentration maximale acceptable (CMA) de bromate à 0,01 mg/L (10 µg/L) en fonction des tumeurs rénales chez les rats, compte tenu des limites des méthodes d'analyse et des techniques de traitement. Dans le présent document, les tumeurs mésothéliales constituent le critère d'effet critique sur lequel la recommandation est établie, compte tenu des études scientifiques les plus récentes et de la connaissance du mode d'action. Le document fournit des données et des renseignements à jour sur l'exposition au bromate au Canada, sur les méthodes d'analyse et les méthodes de traitement aux niveaux municipal et résidentiel. À la lumière de toutes ces informations, le CEP propose de réaffirmer la CMA de 0,01 mg/L (10 µg/L) pour le bromate dans l'eau potable.
Le CEP a demandé que le document soit rendu public aux fins de consultation. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. On peut les faire parvenir par courriel au Secrétariat du CEP, à l'adresse water_eau@hc-sc.gc.ca. Sinon, on peut les envoyer par la poste au Secrétariat du CEP, Bureau de la qualité de l'eau et de l'air, Santé Canada, 3e étage, 269, avenue Laurier Ouest, localisateur d'adresse 4903D, Ottawa (Ontario) K1A 0K9. Les commentaires doivent être reçus avant le 5 février 2016.
Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres concernés du CEP. Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent fournir une déclaration à cet effet avec leurs commentaires.
Il est à noter que le présent document technique sur le bromate dans l'eau potable sera révisé après l'analyse des commentaires reçus et qu'une recommandation pour l'eau potable sera établie s'il y a lieu. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Juillet 2015
Bromate
Partie I. Vue d'ensemble et application
1.0 Recommandation proposée
Une concentration maximale acceptable (CMA) de 0,01 mg/L (10 µg/L) est proposée pour le bromate dans l'eau potable, sur la base d'une moyenne courante annuelle par emplacement calculée à l'aide d'échantillons au moins trimestriels.
2.0 Sommaire
La présence de bromate dans l'eau potable découle habituellement du traitement de l'eau, plutôt que de la contamination de l'eau d'alimentation. Elle est principalement liée à la réaction entre l'ozone et le bromure naturellement présent dans l'eau d'alimentation, et à la formation du bromate pendant la production de solutions d'hypochlorite utilisées pour désinfecter l'eau.
Ce document technique passe en revue et évalue tous les risques connus pour la santé qui sont associés à la présence de bromate dans l'eau potable. Il tient compte des nouvelles études et approches, ainsi que des limites des méthodes d'analyse et des techniques de traitement. D'après cet examen, la recommandation proposée pour le bromate dans l'eau potable est une concentration maximale acceptable de 0,01 mg/L (10 µg/L).
À sa réunion de l'automne 2014, le Comité fédéral-provincial-territorial sur l'eau potable a examiné le document technique sur le bromate dans l'eau potable et en a autorisé la diffusion à des fins de consultation publique.
2.1 Effets sur la santé
Le bromate de potassium est classé comme cancérogène possible pour l'humain, d'après des preuves suffisantes de cancérogénicité chez des animaux de laboratoire, mais des preuves insuffisantes chez l'humain. Cependant, il est manifeste que la toxicité du bromate de potassium est associée à l'anion bromate et n'est pas tributaire du sel utilisé dans une étude toxicologique donnée.
Les études sur des animaux de laboratoire ont révélé des liens entre l'ingestion de bromate dans l'eau potable et divers types de tumeurs chez les rats et les souris, y compris les tumeurs du rein, de la thyroïde et du mésothéliome testiculaire. Des effets non cancérogènes sur la santé associés à l'exposition au bromate ont été également observés chez les rongeurs. Aucune étude ne rapportait d'effets sur la santé humaine résultant de l'exposition à long terme au bromate.
Les évaluations des risques de cancer et des risques autres que le cancer ont été prises en compte dans le calcul de la CMA proposée. L'évaluation du risque de cancer amène à proposer une CMA qui assure la protection de la santé humaine contre les effets cancérogènes et non cancérogènes.
2.2 Exposition
Les Canadiens sont surtout exposés au bromate en raison de sa présence dans l'eau potable. Le bromate a aussi été détecté dans l'eau embouteillée ozonée. Le bromate de sodium et le bromate de potassium sont utilisés dans la production de certains produits de consommation, notamment des cosmétiques. On trouverait peu de bromate dans l'air ou le sol.
2.3 Analyse et traitement
Lorsqu'on établit une recommandation concernant la présence d'un contaminant dans l'eau potable, on doit prendre en considération la capacité de le mesurer et de l'éliminer des approvisionnements d'eau potable. Il existe plusieurs méthodes pour analyser la présence du bromate dans l'eau potable. Vu les moyens des laboratoires commerciaux, on dispose de méthodes d'analyse permettant de mesurer avec fiabilité le bromate dans l'eau potable, à la CMA proposée.
Il est difficile de retirer le bromate de l'eau potable une fois qu'il s'est formé. Dans le cas du bromate produit en cours d'ozonation, il est recommandé de contrôler le procédé d'ozonation, car il n'est pas rentable d'éliminer le bromure dans l'eau d'alimentation. Dans le cas de la contamination par le bromate associée à l'emploi de solutions d'hypochlorite, la meilleure approche consiste à empêcher sa formation en privilégiant l'emploi de produits chimiques de traitement certifiés, y compris quand les solutions d'hypochlorite sont produites sur place, ainsi que les mesures appropriées de manutention et d'entreposage. La CMA proposée tient compte également des exigences de certification des produits chimiques de traitement de l'eau, et de la nécessité d'assurer la sécurité microbiologique de l'eau potable.
Au niveau résidentiel, on estime que les dispositifs utilisant l'osmose inverse, la distillation ou l'échange d'ion sont des moyens efficaces pour réduire les concentrations de bromate dans l'eau potable. Cependant, comme l'eau produite par les dispositifs utilisant l'osmose inverse et la distillation peut être corrosive pour les éléments de plomberie, on devrait installer ces dispositifs seulement au point d'utilisation (sur un seul robinet).
3.0 Application de la recommandation
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable dans le secteur de compétence concerné.
Il convient de limiter le plus possible l'exposition au bromate, qui est un cancérogène possible pour l'humain. Cependant, le bromate se forme dans l'eau potable par suite de divers procédés de traitement, et il ne peut en être efficacement éliminé une fois présent.
La recommandation pour une substance cancérogène est habituellement établie de sorte qu'une personne qui serait exposée toute sa vie à cette concentration dans l'eau potable aurait un risque accru de cancer « essentiellement négligeable ». Santé Canada situe l'accroissement « essentiellement négligeable » du risque de cancer par rapport au niveau de fond entre un nouveau cas de plus par 100 000 personnes et un nouveau cancer de plus par 1 million de personnes (c.-à-d. entre 10−5 et 10−6). Le risque à vie estimé découlant de l'ingestion d'eau contenant du bromate à la CMA proposée est légèrement supérieur à la plage de valeurs représentant un risque accru « essentiellement négligeable », puisque la CMA proposée est une valeur basée sur la gestion du rique afin de tenir compte de la faisabilité analytique.
L'approche visant à réduire l'exposition au bromate privilégie habituellement les pratiques exemplaires pour l'ozonation et l'emploi de solutions d'hypochlorite.
Dans les installations qui utilisent l'ozonation, des fluctuations de la qualité de l'eau exigent parfois d'ajuster les processus de traitement afin de minimiser la formation de bromate. Les services publics de l'eau devraient savoir comment leurs processus réagissent aux changements de qualité de l'eau, et ajuster en conséquence leurs objectifs de traitement afin d'optimiser leur processus et de minimiser la formation de bromate.
Dans les installations qui utilisent des solutions d'hypochlorite, on peut minimiser les concentrations de bromate dans l'eau potable en appliquant les pratiques exemplaires suivantes :
- Utiliser des produits chimiques de traitement qui sont certifiés selon la norme 60 de la NSF International (NSF)/American National Standards Institute (ANSI).
- Dans les systèmes de production sur place d'hypochlorite, utiliser un sel à faible teneur en bromure.
- Observer les recommandations de manutention et d'entreposage décrites à l'annexe B.
- Établir un programme de contrôle de la qualité pour vérifier la qualité du produit et gérer le stockage des solutions.
3.1 Surveillance
Il est recommandé que les installations qui utilisent de l'ozone ou des solutions d'hypochlorite procèdent au minimum à une surveillance trimestrielle de l'eau traitée provenant des sources d'eau de surface et d'eau souterraine afin de détecter la présence de bromate. Les échantillons devraient être prélevés après le traitement de l'eau dans l'usine de traitement ou le puits, et avant sa distribution. Dans les réseaux dotés de stations de rechloration qui utilisent des solutions d'hypochlorite, des échantillons trimestriels devraient aussi être prélevés à l'endroit où l'eau rechlorée entre dans le réseau de distribution. La valeur de la recommandation devrait être comparée avec la moyenne courante annuelle par emplacement des échantillons trimestriels, puisque les concentrations de bromate peuvent varier grandement avec le temps, notamment au cours des saisons, en raison de facteurs comme la concentration de matières organiques dans l'eau brute, la température ainsi que la manutention et le stockage des solutions d'hypochlorite. Bien que les mesures individuelles puissent dépasser la valeur recommandée, la situation ne devient préoccupante que si la moyenne courante des échantillons trimestriels par emplacement dépasse la valeur de la recommandation.
Dans le cas des installations qui emploient de l'ozone, les services publics d'eau devraient bien comprendre les sources et la concentration du bromure dans leur eau d'alimentation, ainsi que la variabilité saisonnière des paramètres de qualité de l'eau qui peuvent influer sur la formation de bromate (p. ex., pH, alcalinité, matières organiques, ammoniac). La surveillance trimestrielle du bromure dans l'eau brute est recommandée, de concert avec la surveillance du bromate dans l'eau traitée, mais on peut réduire la fréquence si la surveillance du bromate dans l'eau potable ne montre pas de concentrations élevées.
Partie II. Science et considérations techniques
4.0 Désignations, utilisations et sources dans l'environnement
L'ion bromate (BrO3−; numéro du Chemical Abstracts Service [CAS] 15541-45-4) a une masse moléculaire de 127,9 Da. Il est présent dans un certain nombre de sels, le plus courant étant le bromate de potassium. Les études qui portent sur les effets possibles du bromate sur la santé des humains et des animaux de laboratoire sont pour la plupart réalisées avec du sel de bromate de potassium, bien qu'on ait également étudié le bromate de sodium. Le bromate de potassium (numéro CAS 7758-01-2) est un cristal incolore et inodore qui est soluble dans l'eau et qui se dissocie en ion bromate et en métal. Sa masse moléculaire est de 167,0 Da, sa solubilité dans l'eau est de 75 g/L à 25 °C et sa pression de vapeur est négligeable, tout comme sa constante de la loi d'Henry (Environnement Canada et Santé Canada, 2010). Le bromate ne se volatilise pas et ne s'adsorbe que légèrement sur les sols ou les sédiments.
La présence du bromate dans l'eau potable est habituellement imputable au traitement de l'eau potable, et non à sa présence dans l'eau d'alimentation.
Les sels de bromate sont utilisés à des fins commerciales. Il est impossible de divulguer toutes les utilisations du bromate de potassium au Canada pour des motifs de confidentialité des renseignements commerciaux, mais la nature en est surtout industrielle et commerciale. Le bromate de potassium est aussi présent sous forme d'impureté dans un adjuvant de traitement pour l'emballage des aliments sous papier (Environnement Canada et Santé Canada, 2010).
Le bromate de potassium est un oxydant puissant et par le passé il était couramment utilisé dans la cuisson. Toutefois, son utilisation dans la nourriture n'est plus permise au Canada. Aux États-Unis, la Food and Drug Administration a demandé aux entreprises de cesser d'utiliser le bromate de potassium dans leurs produits alimentaires, car ce composé peut être nocif s'il est consommé à des doses suffisantes (Environnement Canada et Santé Canada, 2010).
4.1 Devenir dans l'environnement
D'après ses propriétés physiques et chimiques, le bromate dans l'eau est peu susceptible de se volatiliser, et son adsorption sur les sols ou les sédiments est minime. D'après les données thermodynamiques disponibles, la production de complexe du bromate est probablement négligeable dans la plupart des eaux naturelles. Cependant, l'eau de mer et des eaux plus minéralisées devraient occasionner une complexation faible du bromate, en raison de l'intensité ionique accrue de ces eaux. On s'attend à ce qu'une proportion relativement faible de bromate se retrouve dans les sédiments et les sols. La réduction du bromate naturel en ion bromure peut survenir dans les eaux ayant de faibles concentrations d'oxygène (Environnement Canada et Santé Canada, 2010).
5.0 Exposition
On s'attend à ce que l'exposition au bromate provenant des divers milieux ambiants (eau, air, sol) et des aliments soit négligeable (Environnement Canada et Santé Canada, 2010). Dans la présente évaluation, l'eau potable est considérée comme étant la source principale d'exposition.
5.1 Eau
Rien n'indique que le bromate soit présent à l'état naturel dans les sources d'eau (U.S. EPA, 2001a; OMS, 2005). La présence de bromate dans l'eau potable est habituellement imputable au traitement de l'eau, plutôt qu'à sa présence dans l'eau à la source. De façon générale, tous les approvisionnements d'eau potable devraient être désinfectés. Lorsqu'il y a lieu, une concentration résiduelle appropriée de désinfectant devrait être maintenue en tout temps d'un bout à l'autre du réseau de distribution. Le désinfectant le plus couramment utilisé pour les désinfections primaire et secondaire est le chlore, et l'hypochlorite en est la forme la plus commune.
La présence de bromate dans l'eau potable peut être associée à la réaction entre le bromure naturellement présent dans l'eau d'alimentation et l'ozone (Haag et Hoigné, 1983), à sa formation pendant la production de solutions d'hypochlorite utilisées pour désinfecter l'eau (Bolyard et coll., 1992), lorsque le dioxyde de chlore est photolysé en présence de l'ion bromure (Gordon et Emmert, 1996) ou pendant la chloration d'eau contenant du bromure en présence de cuivre (Liu et coll., 2012, 2013). À l'heure actuelle, les éléments probants font supposer que l'ozonation de l'eau contenant du bromure et l'emploi des solutions d'hypochlorite sont les principales sources d'exposition au bromate dans l'eau potable.
Au Canada, le bromate a rarement été détecté dans l'eau brute. Entre 2002 et 2011, le bromate n'a été détecté dans aucun des 69 échantillons d'eau brute prélevés en Nouvelle-Écosse (limite de détection de la méthode [LDM] = 0,01-0,001 mg/L; Nova Scotia Environment, 2011). Au Nouveau-Brunswick, aucun bromate n'a été détecté dans deux échantillons d'eau brute prélevés en 2008 (LDM = 0,003 mg/L; ministère de la Santé du Nouveau-Brunswick, 2011). En Ontario, du bromate a été détecté à une concentration de 1,7 µg/L dans un de huit échantillons d'eau brute prélevés entre 2005 et 2011 (LDM = 0,2 µg/L) (ministère de l'Environnement de l'Ontario, 2011).
Au Royaume-Uni, on a signalé la contamination d'eau souterraine par du bromate provenant d'une usine de produits chimiques, les concentrations de bromate dans les zones du panache dépassant 2 mg/L (Butler et coll., 2005). Legube (1996) a rapporté que les concentrations de bromate dans 36 sources d'eau brute, y compris l'eau de rivière, l'eau close et l'eau souterraine, toutes situées en Europe, étaient inférieures à la limite de détection de 2 µg/L et que des niveaux trace (2 et 3 µg/L) avaient été trouvés dans deux sources d'eau brute. Lefebvre et coll. (1995) ont trouvé des concentrations de bromate dans trois eaux souterraines, trois eaux closes et trois eaux de rivière/canal en France, qui étaient inférieures à la limite de détection (2 µg/L). Kruithof et Meijers (1995) ont rapporté des concentrations de bromate comprises entre 4 et 8 µg/L dans quatre des 36 échantillons d'eau de surface, potentiellement à la suite de procédés d'oxydation ou de désinfection industriels.
Le bromate a été détecté dans l'eau potable traitée partout au Canada. En Nouvelle-Écosse, on a détecté du bromate dans 7 des 136 échantillons d'eau traitée prélevés entre 2002 et 2011 dans des usines de traitement de l'eau utilisant de l'hypochlorite. Les concentrations de bromate allaient de 0,0012 à 0,060 mg/L (LDM = 0,01-0,001 mg/L); quatre échantillons présentaient des concentrations de bromate inférieures à 0,010 mg/L, et trois échantillons présentaient des concentrations de bromate de 0,060 mg/L (Nova Scotia Environment, 2011). La province de Terre-Neuve-et-Labrador a réalisé un programme spécial de surveillance en 2008 afin de mesurer les concentrations de bromate dans 10 collectivités qui utilisaient de l'ozone. Les concentrations de bromure et de bromate étaient inférieures aux valeurs LDM (LDM pour le bromure = 0,05 mg/L; LDM pour le bromate = 0,003 mg/L) dans tous les échantillons (n = 10; Newfoundland and Labrador Department of Environment and Conservation, 2011). Au Québec, entre 2001 et 2011, on a détecté du bromate dans 61 des 472 échantillons soumis par les installations municipales d'approvisionnement d'eau utilisant de l'ozone; les concentrations allaient de 0,0005 à 0,008 mg/L (LDM = 0,0005-0,01 mg/L), avec une valeur médiane de 0,0014 mg/L et une valeur moyenne de 0,002 mg/L (ministère du Développement durable, de l'Environnement et des Parcs du Québec, 2011). En Ontario, entre 2005 et 2011, on a détecté du bromate dans 343 des 849 échantillons (LDM = 0,2 µg/L); les concentrations allaient de 0,3 à 11,6 µg/L, avec une valeur médiane de 1,1 µg/L et une valeur moyenne de 2,0 µg/L. Aucune information sur les procédés de traitement n'accompagnait les données de l'Ontario. Cependant, les concentrations maximales avaient été trouvées dans des usines de traitement de l'eau où l'emploi d'ozone était connu; les concentrations moyennes dans ces usines allaient de 2,0 à 5,1 µg/L. Au Manitoba, du bromate a été détecté à une concentration de 0,038 mg/L dans un des quatre échantillons d'eau traitée prélevés en 2011 (LDM = 0,01 mg/L); aucune information n'a été fournie sur les procédés de traitement (Conservation et Gestion des ressources hydriques Manitoba, 2011).
Santé Canada a commandé deux rapports en 2012 pour déterminer l'apport possible de bromate dans l'eau potable imputable à des solutions commerciales d'hypochlorite de sodium et de calcium certifiées selon la norme 60 de la NSF International (NSF)/American National Standards Institute (ANSI), entre 2004 et 2011 (NSF, 2012; Underwriters Laboratories LLC, 2012). Les concentrations de bromate mesurées dans des solutions non diluées d'hypochlorite de sodium et de calcium sont résumées dans le tableau 1 ci-dessous. D'après ces résultats, on peut calculer (c.-à-d. normaliser) la quantité estimative de bromate ajoutée à l'eau potable à la niveau maximal d'utilisation (NMU) de 10 mg de chlore (Cl2) par litre. Ces résultats normalisés sont résumés dans le tableau 2 et indiquent que les solutions d'hypochlorite de sodium pourraient ajouter, en moyenne, 2,5 µg de bromate par litre d'eau potable traitée, dans une plage de 0,1 à 26 µg/L, avec des concentrations plus faibles pour l'hypochlorite de calcium.
| Organisme de certification (type de solution) |
Années analysées |
Nombre d'échantillons |
Concentration de bromate dans le produit non dilué (mg/kg) | ||
|---|---|---|---|---|---|
| Moyenne | Minimale | Maximale | |||
| NSF - hypochlorite de sodium (NaOCl) | 2004 à 2011 | 886 | 31 | 2,0 | 313 |
| NSF - hypochlorite de calcium (Ca(OCl)2) | 2004 à 2011 | 73 | 119 | 2,0 | 370 |
| Organisme de certification (type de solution) |
Années analysées | Nombre d'échantillons | Contibution estimée de bromate dans l'eau potable au NMU (µg/L) | ||
|---|---|---|---|---|---|
| Moyenne | Minimale | Maximale | |||
| NSF - hypochlorite de sodium (NaOCl) | 2004 à 2011 | 886 | 2,5 | 0,10 | 26 |
| NSF - hypochlorite de calcium (Ca(OCl)2) | 2004 à 2011 | 73 | 1,8 | 0,005 | 4,5 |
| UL - NaOCl et Ca(OCl)2 | 2006 à 2011 | 147Tableau 2 note de bas de page * | 2,5 | 0,3 | 8 |
|
|||||
D'après les propriétés physicochimiques du bromate, l'exposition par inhalation ou absorption cutanée pendant le bain ou la douche est jugée négligeable.
5.2 Aliments
Le bromate a été mesuré dans l'eau embouteillée à des concentrations allant de < 0,2 à 37,3 µg/L, avec des concentrations moyennes de 3,72 µg/L pour l'eau embouteillée non ozonée et de 18,14 µg/L pour l'eau ozonée (Dabeka et coll., 2002). Plus récemment, la présence de bromate dans 288 échantillons d'eau embouteillée a été étudiée par l'Agence canadienne d'inspection des aliments (ACIA, 2012). On a indiqué que 87 % des échantillons ne contenaient pas de concentrations détectables de bromate et que dans les échantillons restants, les concentrations de bromate allaient de 1,2 à 21 ppb (1,2 à 21 µg/L). Seulement 2 % des échantillons contenaient du bromate à des concentrations supérieures à 10 ppb (10 µg/L).
Le bromate de potassium a déjà été un additif alimentaire au Canada, mais il n'est plus autorisé dans les aliments vendus au Canada (Environnement Canada et Santé Canada, 2010).
5.3 Air
On ne s'attend pas à ce que le bromate de potassium se retrouve dans l'air, car sa pression de vapeur est négligeable. Cependant, de petites quantités de bromate peuvent être associées à des aérosols. Dans une étude, on a fait état d'une petite quantité de bromate dans les particules de l'air arctique mesurée par chromatographie par échange d'ions. Les concentrations de bromate allaient d'en deçà de la limite de détection (< 0,01 nmol m−3) à 0,19 nmol m−3 (Hara et coll., 2002; Environnement Canada et Santé Canada, 2010).
5.4 Sols
Très peu de bromate devrait se retrouver dans les sédiments et les sols. On ne dispose d'aucune donnée empirique sur la présence de bromate dans les sols.
5.5 Produits de consommation
Le bromate de potassium est utilisé comme adjuvant de traitement pour l'emballage (Environnement Canada et Santé Canada, 2010). Le bromate de sodium et le bromate de potassium sont utilisés dans l'industrie cosmétique pour les produits de défrisement et de permanente des cheveux (Environnement Canada et Santé Canada, 2010; Suzuta et coll., 2012). Le bromate de potassium peut également être utilisé comme réactif oxydant dans les laboratoires et pour la teinture des textiles (Environnement Canada et Santé Canada, 2010).
6.0 Méthodes d'analyse
L'United States Environmental Protection Agency (U.S. EPA) a approuvé sept méthodes pour l'analyse du bromate dans l'eau potable. Ces méthodes d'analyse sont basées sur la chromatographie par échange d'ions, assortie de diverses techniques de détection. Leur LDM variera selon le laboratoire qui réalise l'analyse, la nature des interférences dans la matrice de l'échantillon et l'instrumentation spécifique utilisée. Les échantillons devraient être prélevés dans des bouteilles de verre ambre ou en plastique opaque, nettoyées au préalable, et contenant l'agent d'inactivation approprié pour la méthode d'analyse. Des conditions de température peuvent également être appliquées pendant le transport et l'entreposage des échantillons. Les méthodes de prétraitement des échantillons devraient permettre l'élimination des concentrations élevées de chlorure, qui peuvent interférer avec la mesure du bromate.
Le tableau 3 présente un aperçu des méthodes approuvées, des techniques utilisées, des valeurs LDM applicables et d'autres analytes qui peuvent être mesurés par chaque méthode (le cas échéant). Les valeurs LDM doivent être établies au moyen de critères de contrôle de la qualité spécifiques. Elles représentent la concentration minimale qui peut être identifiée, mesurée et rapportée avec un niveau de confiance de 99 % que la concentration de l'analyte est supérieure à zéro (U.S. EPA, 1997a, 1997b, 2001b, 2002, 2009a, 2009b). Dans la pratique, ces valeurs sont calculées à partir de la précision absolue des échantillons en double. Certains laboratoires ne divulguent plus leurs valeurs LDM, mais fournissent plutôt le seuil minimal de niveau à rapporter (SMNR). Les SMNR représentent les concentrations minimales que les laboratoires estiment pouvoir présenter avec confiance aux utilisateurs des données (Symons et coll., 2000). Les SMNR ne peuvent être inférieures à la concentration du plus petit étalon utilisé par le laboratoire pour étalonner les instruments spécifiques utilisés pour l'analyse des échantillons. Les SMNR peuvent être utilisées seulement si des critères de contrôle de la qualité acceptables sont respectés (U.S. EPA, 1997a, 1997b, 2001b, 2002, 2009a, 2009b).
Les services d'eau devraient discuter des exigences en matière d'échantillonnage avec le laboratoire accrédité qui réalise l'analyse, afin de s'assurer que les procédures de contrôle de la qualité sont respectées et que les valeurs LDM/SMNR sont suffisamment faibles pour assurer une surveillance exacte aux concentrations proches de la CMA proposée.
À l'occasion du deuxième examen sur six ans du règlement américain existant National Primary Drinking Water Regulations, l'U.S. EPA a maintenu le niveau pratique d'évaluation quantitative (NPEQ) pour le bromate à 10 µg/L, en raison du taux de succès variable des laboratoires et de l'absence de données sous 10 µg/L (U.S. EPA, 2009c). Le rapport constatait également la disponibilité de deux nouvelles méthodes approuvées : la méthode 317.0 Révision 2.0 (plage de LDM = 0,12-0,98 µg/L) et la méthode 326.0 Révision 1.0 (plage de LDM = 0,17-1,2 µg/L). Ces méthodes pourraient mener à une amélioration globale de la performance des analyses et potentiellement justifier une réduction du NPEQ. Depuis la publication du rapport d'examen sur six ans de l'U.S. EPA en 2009, les méthodes 302.0 et 557 de l'U.S. EPA ont été approuvées, avec des valeurs LDM de 0,12 et 0,020 µg/L, respectivement (U.S. EPA, 2014). Snyder et coll. (2004) ont signalé que la chromatographie par échange d'ions avec des méthodes de détection de la conductivité avait habituellement un SMNR de 5 µg/L.
| Méthode (référence) | Technique | LDM (µg/L) | Autres analytes d'intérêt |
|---|---|---|---|
| EPA 300.1 Révision 1.0 (U.S. EPA, 1997a) |
Chromatographie par échange d'ions avec détecteur de conductivité | 1,32Note de bas de page a-1,44Note de bas de page b | Partie A : Bromure, chlorure, fluorure, nitrate, nitrite, orthophosphate, sulfate Partie B : Bromure, chlorate, chlorite |
| EPA 321.8 Révision 1.0 (U.S. EPA, 1997b) |
Chromatographie par échange d'ions avec détection par spectrométrie de masse avec plasma à couplage inductif (ICP-MS) | 0,3 | Sans objet |
| EPA 317.0 Révision 2.0 (U.S. EPA, 2001) |
Chromatographie par échange d'ions avec réactif postcolonne (PCR) et détection de l'absorbance dans l'ultraviolet/visible (UV/VIS) pour l'analyse du bromate à l'état trace | 0,12Note de bas de page c-0,98Note de bas de page d | Bromure, chlorate, chlorite |
| EPA 326.0 Révision 1.0 (U.S. EPA, 2002) |
Chromatographie par échange d'ions avec PCR acidifiée supprimée et détection de l'absorbance UV/VIS pour l'analyse du bromate à l'état trace | 0,17Note de bas de page e-1,2Note de bas de page f | Bromure, chlorate, chlorite |
| EPA 302.0 (U.S. EPA, 2009a) |
Chromatographie par échange d'ions avec détection de conductivité supprimée | 0,12 | Sans objet |
| EPA 557 (U.S. EPA, 2009b) |
Chromatographie par échange d'ions avec spectrométrie de masse en tandem avec ionisation par électronébulisation | 0,020 | Acides haloacétiques (neuf), dalapon |
| ASTM D6581-12 (ASTM, 2012; approuvé à l'origine en 2000) |
Chromatographie par échange d'ions avec détection de conductivité supprimée | 0,4214Note de bas de page g-2,73Note de bas de page h | Bromure, chlorate, chlorite |
|
|||
Certains laboratoires peuvent atteindre des niveaux de quantification plus faibles. Par exemple, les valeurs LDM fournies par les provinces vont de 0,0002 à 0,01 mg/L, bien que les méthodes d'analyse associées à ces valeurs LDM n'aient pas été indiquées. En outre, plusieurs laboratoires commerciaux ont été contactés afin de déterminer quels SMNR ils peuvent atteindre pour l'analyse du bromate. Les SMNR allaient de 0,0003 mg/L à l'aide de la méthode 6850 de l'U.S. EPA (modifiée pour analyse du bromate) à 0,003 mg/L à l'aide de la méthode 317.0 de l'U.S. EPA, et à 0,010 mg/L à l'aide de la méthode standard 4110 (AGAT Laboratories, 2014; ALS Environmental, 2014; Maxxam Analytics, 2014; SGS Environmental Services, 2014; SRC Environmental Analytical Laboratories, 2014). D'après cette information, il semble possible d'obtenir un SMNR de 0,003 mg/L ou moins. Ce SMNR assurerait la surveillance précise à des concentrations près de la CMA proposée.
D'après les renseignements ci-dessus, la concentration de bromate qui est jugée mesurable par les laboratoires à l'intérieur des limites raisonnables de précision et d'exactitude est de 0,005 mg/L au moyen des méthodes approuvées par l'U.S. EPA. Les services d'eau devraient établir des mesures du rendement qui indiquent quelles méthodes analytiques doivent être utilisées (p. ex. le volume de l'échantillon, les exigences en matière d'échantillonnage, la préservation et le stockage des échantillons, les valeurs LDM).
7.0 Considérations relatives aux techniques de traitement
De façon générale, tous les approvisionnements d'eau potable devraient être désinfectés, et une concentration résiduelle appropriée de désinfectant devrait être maintenue en tout temps d'un bout à l'autre du réseau de distribution. Le désinfectant le plus couramment utilisé pour les désinfections primaire et secondaire est le chlore, et l'hypochlorite en est la forme la plus commune.
La formation du bromate pendant l'ozonation est un processus complexe en plusieurs étapes mettant en cause l'ion bromure, l'ozone moléculaire, les radicaux hydroxyles (un produit de décomposition de l'ozone) et d'autres paramètres de la qualité de l'eau (Haag et Hoigné, 1983; Krasner et coll., 1991, 1993; von Gunten et Hoigné, 1992, 1994; Siddiqui et Amy, 1993; Kruithof et Meijers, 1995; Siddiqui et coll., 1995; Song et coll., 1996, 1997; Amy et coll., 1997; Westerhoff et coll., 1998, 1999; Elovitz et von Gunten, 1999; Elovitz et coll., 2000; Gillogly et coll., 2001; Hofmann et Andrews, 2001, 2006; Pinkernell et von Gunten, 2001; Hofmann et coll., 2002; Chao et Westerhoff, 2003; von Gunten, 2003; Williams et coll., 2003; Legube et coll., 2004; Naumov et von Sonntag, 2008; Heeb et coll., 2014).
Lorsque le bromure est oxydé, des espèces de « brome réactif » sont formées. Dans des conditions normales de traitement de l'eau potable, les espèces de brome réactif importantes comprennent la paire acide base acide hypobromeux (HOBr) et ion hypobromite (OBr−). Avec une constante de dissociation d'acide (pKa) de 8,8, la dépendance au pH de l'équilibre du HOBr et de l'OBr− fait en sorte qu'au-dessus d'un pH de 8,8, l'ion OBr− est prédominant, tandis qu'à un pH plus bas, c'est le HOBr qui est prédominant (figure 1). La formation requise de HOBr/OBr− est une étape cruciale pour contrôler le bromate et les sous-produits de désinfection (SPD) bromés (p. ex. certains trihalométhanes [THM] et acides haloacétiques [AHA]), car la spéciation de la paire HOBr/OBr−, qui dépend du pH, influe sur l'efficacité des stratégies utilisées pour minimiser leurs concentrations. Outre le pH, les facteurs suivants sont importants et peuvent influer sur la formation de bromate : concentration de bromure, dose d'ozone, température, alcalinité, matière organique, ammoniac et peroxyde d'hydrogène (H2O2). Tous ces paramètres sont traités à la section 7.3.
L'ozone et le chlore peuvent tous deux oxyder le bromure en brome réactif (c.-à-d. HOBr/OBr−). L'oxydation supplémentaire en bromate dépend du mode d'action du désinfectant spécifique. Bien que le dioxyde de chlore soit un oxydant efficace pour la désinfection, il n'oxyde pas le bromure. Par conséquent, le brome réactif et le bromate ne sont pas produits lorsqu'il est utilisé (Hoigné et Bader, 1994). Le peroxyde d'hydrogène avec désinfection à l'ultraviolet (H2O2/UV) est une méthode d'oxydation avancée qui ne produit pas non plus de bromate (Symons et Zheng, 1997; Ikehata et Gamel El-Din, 2006).
La formation de bromate par chloration n'est pas jugée importante dans des conditions habituelles de traitement de l'eau potable (von Gunten, 2003). Cependant, dans le cas des solutions d'hypochlorite, le bromate peut être formé lorsque le bromure, qui est présent naturellement dans le sel de chlorure, est oxydé pendant le procédé de fabrication (Weinberg et coll., 2003; Stanford et coll., 2013). Le bromate n'est pas formé pendant la fabrication du chlore gazeux (Stanford et coll., 2011).
Comme l'ozone et le chlore peuvent oxyder le bromure en HOBr/OBr−, il y a lieu de noter que le HOBr peut réagir avec la matière organique présente dans l'eau pour former des SPD bromés (Cooper et coll., 1985; Krasner et coll., 1989; Glaze et coll., 1993; Siddiqui et Amy, 1993). Ce phénomène est bien connu pour la chloration, mais il l'est moins pour ce qui est de l'ozonation. On trouvera plus d'information dans les documents techniques relatifs aux recommandations visant les THM et les HAA (Santé Canada, 2006, 2008).
Il importe que les services d'eau comprennent bien les sources et les concentrations de bromure dans leur eau d'alimentation ainsi que la variabilité saisonnière des paramètres de qualité de l'eau qui peuvent influer sur la formation de bromate ou d'autres SPD. Bien que les services d'eau doivent trouver un juste équilibre entre la désinfection efficace et la création de SPD, il est crucial que l'efficacité de la désinfection ne soit pas compromise par la méthode utilisée, quelle qu'elle soit, pour gérer les concentrations de SPD dans l'eau potable.
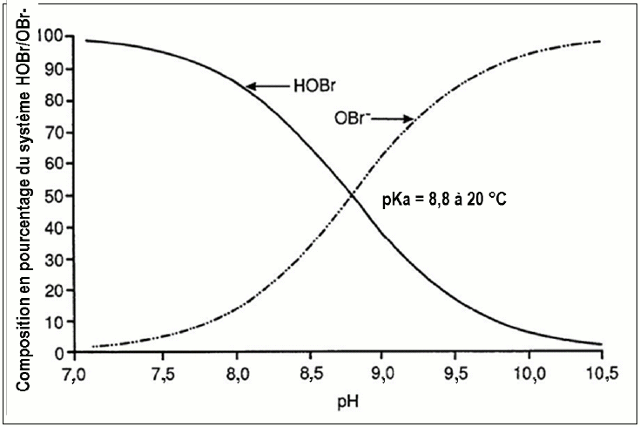
Figure 1 - Equivalent Textuel
La répartition du système HOBr/OBr− en solution aqueuse, divisé en pourcentage de 0 à 100, se trouve sur l'axe vertical, alors que l'axe horizontal indique les valeurs de pH allant de 7,0 à 10,5. Le graphique comporte deux courbes. À un pH près de 7,0, la première courbe montre la composition de HOBr commençant à environ 100 %, alors que l'autre montre la composition de OBr− approchant 0 %. Lorsque le pH augmente, la composition de HOBr diminue pendant que celle de OBr− augmente. À un pH de 8,8 et une composition de 50 % pour chacun des composés, les deux lignes se croisent, indiquant un pKa de 8,8 à une température de 20 °C. Lorsque le pH continue d'augmenter, la courbe montre que la composition de HOBr diminue et s'approche de 0 % à un pH de 10,5, alors que la composition de OBr− augmente et s'approche de 100 % à un pH de 10,5.
7.1 Formation de bromate
7.1.1 Ozonation
Des travaux de recherche considérables ont été réalisés pour déterminer les mécanismes de formation du bromate dans l'eau ozonée (Haag et Hoigné, 1983; von Gunten et Hoigné, 1992, 1994; Krasner et coll., 1993; Siddiqui et Amy, 1993; Kruithof et Meijers, 1995; Siddiqui et coll., 1995; Song et coll., 1996, 1997; Amy et coll., 1997; Elovitz et von Gunten, 1999; Elovitz et coll., 2000; Gillogly et coll., 2001; Pinkernell et von Gunten, 2001; Chao et Westerhoff, 2003; von Gunten, 2003; Legube et coll., 2004; Naumov et von Sonntag, 2008; Heeb et coll., 2014).
Pour ce qui est des eaux naturelles, il est généralement reconnu que l'ozone (O3) réagit avec le bromure de trois façons, comme il est illustré à la figure 2. Dans la première voie, dite « directe », l'O3 et le bromure réagissent pour former du HOBr/OBr−; l'oxydation additionnelle de l'OBr− par l'O3 forme en fin de compte du bromate. Dans la deuxième voie, dite « directe/indirecte », l'O3 et le bromure réagissent pour former du HOBr/OBr−; l'oxydation additionnelle par les radicaux hydroxyles (OH•) et l'O3 forme en définitive du bromate. Dans la troisième voie, dite « indirecte/directe », le bromure est oxydé par l'OH• pour former des radicaux de brome; une oxydation additionnelle par l'O3 forme en fin de compte du bromate.
Les réactions en cause sont extrêmement complexes et non linéaires, car l'O3 et l'OH• contribuent au processus d'oxydation. Les deux sont de puissants oxydants dont les potentiels d'oxydation sont de 2,70 électrons volts (eV), respectivement, par rapport au chlore qui est de 1,49 eV (Dorfman et Adams, 1973). Bien que l'OH• soit un oxydant extrêmement puissant, il joue un rôle mineur dans la désinfection par rapport à l'O3, en raison de sa forte réactivité avec les composés organiques et inorganiques dans l'eau d'alimentation (Peyton et coll., 1998; Acero et von Gunten, 2001).
La connaissance des voies de réaction peut aider les services d'eau à sélectionner la stratégie de réduction la plus appropriée. Si les voies dominantes sont bloquées, on peut minimiser la formation de bromate.
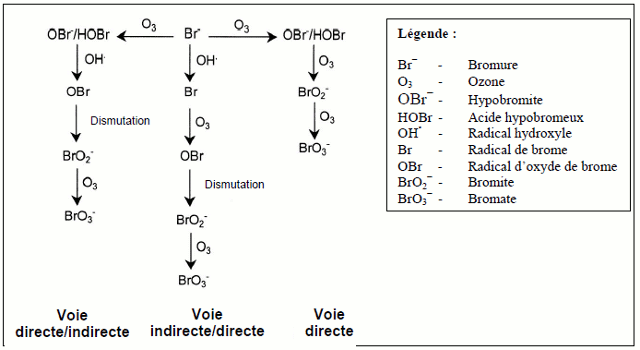
Figure 2 - Equivalent Textuel
La figure 2 montre les trois principals voies de formation du bromate, commençant avec le bromure (Br−) et utilisant des flèches vers la gauche, la droite et le bas pour montrer les transformations. À la droite de l'ion bromure se trouve la voie directe, dans laquelle l'ozone (O3) et le bromure (Br−) réagissent pour former OBr−/HOBr qui sont ensuite oxydés par l'ozone (O3) pour produire du bromite (BrO2−), celui-ci étant enfin oxydé par l'ozone (O3) pour former du bromate (BrO3−). La flèche allant vers la gauche illustre une voie indirecte/directe qui comporte aussi la réaction entre l'ozone (O3) et le bromure (Br−) pour former OBr−/HOBr, suivie de leur réaction avec les radicaux hydroxyles (OH•) qui est une dismutation produisant un radical d'oxyde de brome (OBr) et du bromite (BrO2−) qui sont ensuite oxydés par l'ozone (O3) pour produire du bromate (BrO3−). La troisième voie, qui va vers le bas, est aussi une voie indirecte/directe; dans celle-ci, le bromure (Br−) est oxydé par les radicaux hydroxyles (OH•) pour former des radicaux de brome (Br) qui réagissent ensuite avec l'ozone (O3) par dimutation, formant des radicaux d'oxyde de brome, puis, par dismutation, du bromite (BrO2−) qui est ensuite oxydé en bromate (BrO3−) par l'ozone (O3).
7.1.2 Produits chimiques de traitement contenant de l'hypochlorite
Les solutions d'hypochlorite sont produites par électrolyse de saumures de chlorure de sodium ou de calcium. Le bromure coexiste naturellement avec le chlorure dans les saumures et il est oxydé en bromate pendant la fabrication ou le procédé de production sur place. La quantité de contamination par le bromate dépendra des sources du sel utilisé pour produire les saumures en vue de leur électrolyse pour la production commerciale d'hypochlorite en vrac ou la production d'hypochlorite sur place. Le type de cellules électrolytiques qui sont utilisées pour la fabrication commerciale d'hypochlorite en vrac influe également sur le procédé.
Le bromure est présent en diverses concentrations dans les différentes sources du sel utilisé pour la fabrication des solutions d'hypochlorite. Par conséquent, la teneur en bromure dans la saumure a un effet important sur la teneur en bromate dans la solution d'hypochlorite (Chlorine Institute, 1999) et c'est un aspect important dont les services publics doivent tenir compte pour produire leur propre hypochlorite avec de l'équipement sur place (Stanford et coll., 2013).
Les types de cellules électrolytiques utilisées pour la fabrication commerciale d'hypochlorite en vrac comprennent les cellules à diaphragme, à mercure et à membrane. Les études ont montré que lorsqu'on utilise une cellule à diaphragme, 60 % du bromure se trouvant dans la saumure d'origine se retrouvera dans l'hydroxyde de sodium ou de calcium, et 40 % dans le chlore. Lorsqu'une cellule électrolytique au mercure ou à membrane est utilisée, 20 % du bromure se retrouvera dans l'hydroxyde de sodium ou de calcium, et 80 % dans le chlore. Lorsque l'hydroxyde de sodium ou de calcium et le chlore sont combinés pour produire de l'hypochlorite, 100 % de l'ion bromure dans le produit hydroxyde est converti en bromate (NSF/ANSI, 2013).
7.2 Prévention de la formation de bromate
7.2.1 Ozonation
L'emploi de l'ozone pour le traitement de l'eau potable est bien connu et se pratique au Canada depuis 1954 (Larocque, 1999). On peut recourir à l'ozonation pour atteindre plusieurs objectifs touchant la qualité de l'eau, notamment la désinfection, la réduction des concentrations de SPD chlorés, le contrôle des goûts et des odeurs, l'élimination de la couleur, la transformation du carbone organique, l'élimination accrue des particules et l'oxydation des composés inorganiques (c.-à-d. sulfure d'hydrogène, fer, manganèse) et organiques (c.-à-d. toxines algales, pesticides, produits pharmaceutiques et produits d'hygiène personnelle) (Langlois et coll., 1991). On doit souligner que l'emploi de l'ozone peut accroître le contenu organique biologiquement disponible dans l'eau traitée. Par conséquent, il peut être nécessaire de recourir à la filtration biologiquement active. La production d'une eau biologiquement stable est importante pour stabiliser les SPD de l'ozonation, optimiser le procédé de désinfection secondaire et empêcher la croissance biologique dans le réseau de distribution de l'eau (GLUMRB, 2012). Une croissance biologique excessive dans le réseau de distribution peut causer des goûts et des odeurs indésirables, ainsi que la corrosion (LeChevallier et coll., 1993).
L'U.S. EPA reconnaît le contrôle du procédé d'ozonation comme la meilleure technique existante (MTE) pour minimiser la formation de bromate (U.S. EPA, 1998, 2006). On reconnaît ainsi que le bromate est difficile à éliminer une fois formé, et que le bromure n'est pas éliminé de manière rentable de l'eau d'alimentation. Aux États-Unis, la surveillance du bromate est limitée aux services qui utilisent de l'O3. La conformité est établie d'après une moyenne mobile annuelle, calculée chaque trimestre, d'échantillons de bromate prélevés mensuellement à l'entrée du réseau de distribution (U.S. EPA, 1998, 2006). L'U.S. EPA n'a pas recommandé la surveillance des systèmes qui utilisent l'hypochlorite, car elle estimait que l'apport des solutions d'hypochlorite représentait une moyenne de 0,001 mg/L de bromate (U.S. EPA, 2003). Cependant, il a été établi que l'apport peut dépasser cette concentration (Bolyard et coll., 1992; Weinberg, 2003; Snyder et coll., 2009; Stanford et coll., 2011, 2013; NSF, 2012; Underwriters Laboratories LLC, 2012).
L'optimisation des procédés dépendra de nombreux facteurs, y compris la source et les caractéristiques de l'eau brute, les conditions opérationnelles et les objectifs de traitement du service d'eau. L'optimisation des procédés afin de réduire la formation de SPD, y compris le bromate, ne doit pas compromettre l'efficacité de la désinfection. Des informations additionnelles au sujet des facteurs qui influent sur la formation de bromate figurent à la section 7.3.
7.2.2 Solutions d'hypochlorite
La manutention et le stockage des solutions d'hypochlorite sont des aspects importants pour la possibilité d'ajout de bromate dans l'eau potable (Snyder et coll., 2009; Stanford et coll., 2011). Plusieurs facteurs - la lumière, les températures tièdes, la matière organique et certains cations de métaux lourds comme le cuivre, le nickel et le cobalt - accélèrent la décomposition du chlore dans la solution d'hypochlorite (ANSI/AWWA, 2010). Cependant, la concentration de bromate ne diminue pas (ni n'augmente) pendant le stockage. Par conséquent, une diminution de la concentration de chlore dans la solution d'hypochlorite se traduira par une augmentation de la dose de chlore pour maintenir les objectifs de désinfection; la dose de chlore accrue se traduira par une concentration de bromate accrue dans l'eau traitée (Bouland et coll., 2005). Snyder et coll. (2009) ont formulé des recommandations au sujet de la manutention et du stockage des solutions d'hypochlorite pour aider les services d'eau à minimiser les concentrations de contaminants dans les solutions d'hypochlorite. Ces recommandations figurent à l'annexe B.
La norme 60 de la NSF/ANSI établit des concentrations maximales pour les impuretés, comme le bromate, que peuvent contenir les produits chimiques ajoutés directement à l'eau potable dans le cadre du procédé de traitement. La concentration maximale, appelée concentration permissible par produit individuel (CPPI), représente la concentration maximale qui peut être apportée à l'eau potable lorsque l'hypochlorite est dosé à son NMU, habituellement basée sur une dose atteignant 10 mg Cl2/L. La CPPI actuelle pour le bromate, selon la norme 60 de la NSF/ANSI, est de 0,0033 mg/L (3,3 µg/L) et est basée sur les critères pour l'eau potable harmonisés entre le Canada et les États-Unis. Un changement dans les critères pour l'eau potable aurait probablement un effet proportionnel sur la valeur de la CPPI. Les fabricants de produits chimiques de traitement certifiés contenant de l'hypochlorite sont tenus de respecter cette CPPI pour protéger la qualité de l'eau potable. Les services d'eau devraient indiquer dans leurs documents d'achat que les produits chimiques de traitement contenant de l'hypochlorite doivent être certifiés selon la norme 60 de la NSF/ANSI (NSF/ANSI, 2014).
L'ajout de bromate à l'eau potable pendant la chloration dépendra donc des concentrations de bromate et de chlore dans la solution d'hypochlorite de sodium et de la dose de chlore appliquée, comme le résume le tableau 4 ci-dessous. Par exemple, l'emploi d'une solution d'hypochlorite de sodium de 12 % (c.-à-d. 120 g Cl2/L) contenant un contaminant de bromate en concentration de 30 mg/L et l'application d'une dose de 1 mg Cl2/L donneraient lieu à une concentration de bromate de 0,25 µg/L dans l'eau traitée. Si la concentration du contaminant de bromate dans la solution d'hypochlorite augmente à 100 mg/L, l'eau traitée aurait une concentration de bromate d'environ 0,8 µg/L. Toutefois, il y a lieu de noter qu'au NMU, cette solution ne respecterait pas la CPPI pour le bromate.
Pour ce qui est des générateurs d'hypochlorite de sodium sur place, la norme 60 de la NSF/ANSI précise que le bromure ne doit pas dépasser 54 mg/kg dans le NaCl à une concentration d'alimentation maximale de chlore de 10 mg/L, pourvu qu'il n'y ait pas de bromure dans l'eau utilisée pour la saumure. S'il y a 0,5 mg/L de bromure dans l'eau utilisée pour la saumure, la quantité maximale de bromure permise dans le sel fléchit à 36 mg/kg, comme le montre le tableau 5 ci-dessous. La norme 60 de la NSF/ANSI permet une concentration supérieure de bromure pour les générateurs qui fournissent des concentrations d'alimentation de chlore maximales qui sont moindres, mais la concentration totale de bromate ne doit pas dépasser 0,003 mg/L (NSF/ANSI, 2013).
| Dose de chlore appliquéeNote de bas de page * (mg/L) |
Solution de NaOCl avec 15 mg/L de bromate | Solution de NaOCl avec 30 mg/L de bromate | Solution de NaOCl avec 60 mg/L de bromate | Solution de NaOCl avec 100 mg/L de bromate |
|---|---|---|---|---|
| Concentration de bromate dans l'eau traitée (µg/L) | ||||
| 0,7 | 0,09 | 0,18 | 0,35 | 0,58 |
| 1,0 | 0,13 | 0,25 | 0,50 | 0,83 |
| 1,3 | 0,16 | 0,33 | 0,65 | 1,08 |
| 2,0 | 0,25 | 0,50 | 1,00 | 1,67 |
| 2,5 | 0,31 | 0,63 | 1,25 | 2,08 |
| 10,0 (NMU) | 1,25 | 2,50 | 5,0 | 8,33 |
|
||||
| Bromure dans l'eau utilisée pour la saumure (mg/L) |
Apport de bromate provenant de l'eau de saumure (µg/L) |
Bromate dans l'eau traitée provenant du sel (µg/L) |
Concentration maximale acceptable de bromure dans le sel (ppm) |
|---|---|---|---|
| 0,0 | 0,0 | 3,0 | 54 |
| 0,05 | 0,1 | 2,9 | 52 |
| 0,5 | 1,0 | 2,0 | 36 |
| 1,0 | 2,0 | 1,0 | 18 |
|
|||
Il est recommandé que les services d'eau établissent un programme de contrôle de la qualité pour vérifier la qualité des produits et gérer le stockage des solutions. La norme B300 de l'AWWA recommande également qu'on instaure un programme de vérification pour confirmer que les produits chimiques de traitement contenant de l'hypochlorite répondent aux spécifications (ANSI/AWWA, 2010).
En guise de conclusion, pour minimiser les concentrations de bromate dans l'eau potable lorsqu'on utilise des solutions d'hypochlorite, les services d'eau devraient :
- spécifier dans leurs documents d'achat que les produits chimiques de traitement contenant de l'hypochlorite sont conformes à la norme 60 de la NSF/ANSI;
- dans le cas des services d'eau utilisant des systèmes de production sur place de l'hypochlorite, utiliser un sel à faible teneur en bromure;
- suivre les recommandations de manutention et de stockage décrites à l'annexe B;
- établir un programme de contrôle de la qualité pour vérifier la qualité des produits et gérer le stockage des solutions.
7.3 Facteurs influant sur la formation de bromate pendant l'ozonation
7.3.1 Concentration de bromure
Un ion bromure peut être présent naturellement en raison d'intrusions d'eau de mer et par la dissolution de formations géologiques, ou il peut pénétrer dans les sources d'eau en raison des activités humaines, par exemple l'épandage de bromure de méthyle sur les cultures, l'épandage de sel sur les routes en hiver ou encore les rejets d'égouts ou d'effluents industriels (Siddiqui et coll., 1995). Les activités humaines spécifiques qui ont des impacts répertoriés sur les concentrations de SPD, en raison de rejets de bromure dans l'environnement, comprennent l'exploitation minière du sel (Carrasco-Turigas et coll., 2013), les activités de fracturation hydraulique et la purge des déchets par les centrales au charbon (Cornwell, 2014), ainsi que la fabrication des textiles (Greune et Knappe, 2014).
Il y a relativement peu d'information disponible sur l'occurrence du bromure dans les plans d'eau canadiens. Des concentrations de bromure ont été mesurées en mars et en août 1993 dans 53 sources d'eau potable au Canada, y compris des rivières (n = 28), des lacs (n = 19), des bassins (n = 1), des puits (n = 3) et un mélange de ces sources (n = 2) (Santé Canada, 1995). Du bromure a été détecté dans seulement deux des 52 échantillons d'eau brute prélevés en mars (0,2 et 0,5 mg/L), probablement en raison de la LDM élevée de 0,01 mg/L; les deux sources étaient une rivière. Du bromure a été détecté dans 10 des 37 échantillons d'eau brute prélevés en août (LDM = 0,002 mg/L); ces échantillons provenaient de cinq lacs et cinq rivières. Les concentrations de bromure allaient de 0,006 à 0,070 mg/L (moyenne = 0,030 mg/L). Le bromure a été détecté plus fréquemment dans les échantillons provenant des réseaux de distribution et d'eau traitée, soit 24 sur 51 et 25 sur 50 échantillons, respectivement, car les échantillons d'eau brute n'étaient pas prélevés pour toutes les sources lors de l'échantillonnage réalisé au mois d'août. Les concentrations allaient de 0,002 à 0,32 mg/L (moyenne = 0,023 mg/L) et de 0,002 à 0,49 mg/L (moyenne = 0,030 mg/L) pour les échantillons d'eau traitée et de réseaux de distribution, respectivement. Les résultats publiés les plus récents du Programme de surveillance de l'eau potable (ministère de l'Environnement de l'Ontario, 2009) indiquaient que les concentrations de bromure allaient de 0,0002 à 1,09 mg/L en 2009, avec une médiane de 0,028 mg/L et une moyenne de 0,060 mg/L (n = 70). Santé Canada a réalisé un relevé de l'eau potable contenant des sources élevées de bromure au Canada à l'hiver 2012 et à l'été 2013. Du bromure a été détecté dans 22 des 23 échantillons d'eau brute (LDM = 0,006 mg/L); les concentrations allaient de 0,034 à 2,55 mg/L, avec une médiane de 0,505 mg/L et une moyenne de 0,62 mg/L (Santé Canada, 2014a). Dans une étude réalisée dans 23 villes aux États-Unis et au Canada, les concentrations de bromure allaient de 0,024 à 1,12 mg/L (médiane de 0,109 mg/L) dans de l'eau d'alimentation (Richardson et coll., 2008). Aux États-Unis, la concentration moyenne de bromure dans l'eau brute était d'environ 0,1 mg/L, dans une étude réalisée afin d'évaluer la présence nationale de bromure, en préparation d'un nouveau règlement sur les SPD (Amy et coll., 1994).
Hem (1985) a rapporté des concentrations de bromure dans l'eau de pluie et la neige allant d'environ 5 µg/L à > 150 µg/L. Les sources d'eau qui sont très tributaires de l'eau de pluie ou de la fonte de la neige devraient également faire l'objet d'essais afin de déterminer la concentration de bromure dans l'eau brute, particulièrement si l'eau potable est désinfectée par ozonation ou chloration, en raison du potentiel de formation de bromate ou de SPD de chloration, respectivement.
En règle générale, la plupart des chercheurs signalent que l'augmentation de la concentration de bromure a tendance à se traduire par une formation accrue de bromate pendant l'ozonation. Cependant, comme d'autres paramètres de la qualité de l'eau influent sur le processus d'oxydation, il est difficile de prévoir au jugé le risque de formation de bromate. Par exemple, le risque de formation de bromate a été évalué par Gillogly et coll. (2001) pour trois eaux d'alimentation présentant des concentrations de bromure similaires (concentration de bromure = 145, 170, 200 µg/L; dose d'O3 = 1 mg/L par milligramme de carbone organique dissous [COD]); les concentrations mesurées de bromate étaient de 23, 4,2 et 35 µg/L, respectivement. La source contenant la plus faible concentration de bromate (4,2 µg/L) contenait également de l'ammoniac naturel, qui inhibe la formation de bromate (voir la section 7.3.7).
Les services d'eau devraient avoir une bonne compréhension des concentrations de bromure dans leur eau d'alimentation afin de contrôler la formation de bromate et d'autres SPD bromés. Par exemple, si l'on détermine que 100 % du bromure est converti en bromate, on pourrait calculer la quantité maximale de bromate. Cela pourrait constituer un outil de contrôle de la qualité utile pour les services d'eau (Westerhoff, 2014). Plusieurs laboratoires commerciaux ont été contactés afin de déterminer quels SMNR ils peuvent atteindre pour l'analyse du bromure. Les SMNR allaient de 0,001 mg/L à l'aide de la méthode 317.0 de l'U.S. EPA à 0,3 mg/L à l'aide de la méthode 4110 de l'U.S. EPA (AGAT Laboratories, 2014; ALS Environmental, 2014; Maxxam Analytics, 2014; SGS Environmental Services, 2014). Les services d'eau devraient s'assurer que le SMNR est suffisamment faible pour leurs activités lorsqu'ils précisent quelle méthode d'analyse doit être utilisée. Les laboratoires peuvent offrir un SMNR plus faible sur demande. Une valeur LDM minimale de 0,01 mg/L (10 µg/L) est recommandée pour le bromure (Westerhoff, 2014).
7.3.2 Dose d'ozone
La dose d'ozone joue un rôle important dans la formation du bromate. En règle générale, l'application d'une dose d'O3 plus élevée aboutit à une formation de bromate plus grande (Krasner et coll., 1993; von Gunten et Hoigné, 1994). La dose d'O3 requise dépendra des objectifs de traitement du service d'eau et des caractéristiques de qualité de l'eau, et pourrait varier en raison du changement saisonnier de température et des fluctuations dans la matière organique naturelle (MON) et des autres caractéristiques de qualité de l'eau. De plus, on devrait déterminer l'endroit où le dosage de l'O3 sera effectué, par rapport aux objectifs de traitement (c.-à-d. préozonation ou ozonation intermédiaire). Krasner et coll. (1993) ont signalé que la dose d'O3 requise pour répondre à la demande d'O3 était proportionnelle aux concentrations de COD. Habituellement, les ratios dose O3/COD publiés dans la littérature vont de 0,5 à 1,0 mg O3/mg COD. Westerhoff et coll. (2005) ont signalé que les concentrations et les doses d'O3 pertinentes pour l'industrie de l'eau potable vont habituellement de 0,1 à 5 mg/L, bien que des doses atteignant 16-20 mg/L afin d'éliminer la couleur (carbone organique total [COT] = 8,3 mg/L) aient été publiées (Loveland et coll., 2004).
Les services d'eau devraient tenir compte des variations saisonnières afin d'optimiser la dose d'O3 appliquée, et ce, en tout temps tout en minimisant la formation de bromate et autres SPD. Le but de l'optimisation du système devrait être d'atteindre les objectifs de traitement avec la plus petite dose possible d'O3 (Rakness et coll., 1996). Pour optimiser le procédé, il y a lieu de déterminer la demande et la dispersion d'O3. On devrait surveiller la qualité de l'eau, la consommation d'O3 et la consommation d'énergie pour s'assurer que les objectifs du traitement sont atteints.
Il est crucial que l'efficacité de la désinfection ne soit pas compromise par la méthode utilisée, quelle qu'elle soit, pour contrôler les concentrations de SPD dans l'eau potable.
7.3.3 Température
Les effets de la température sur la formation du bromate sont triples : 1) l'O3 dissous est plus stable à basse température; 2) les taux d'oxydation augmentent avec la température; 3) le pKa du système HOBr/OBr− diminue lorsque la température augmente (Krasner et coll., 1991; Siddiqui et coll., 1995). En outre, l'inactivation des pathogènes dépend de la température. Elovitz et coll. (2000) ont étudié l'influence de la température sur les taux de réaction de l'O3 et de l'OH•. Ces auteurs ont signalé une augmentation des taux de décomposition d'O3 lorsque la température augmentait de 5 °C à 35 °C (pH 8,0); par contre, les réactions de l'OH• n'étaient pas influencées par la température. Ces données étayent la compréhension générale selon laquelle les réactions d'O3 dépendent grandement de la température, alors que les réactions d'OH• sont très peu dépendantes de la température. Par conséquent, les voies de réaction mettant en cause l'O3 seront plus touchées par la température que celles mettant en cause l'OH• (voir la figure 2).
Siddiqui et Amy (1993) ont observé une augmentation de 20 % de la formation de bromate lorsque la température augmentait de 20 °C à 30 °C (O3/COD = 3; pH 7,5; bromure = 1,0 mg/L). Kruithof et Meijers (1995) ont indiqué qu'il y avait une augmentation importante de la formation de bromate lorsque la température augmentait de 5 °C à 20 °C à un pH 7,8-8,0 (les données sur le bromate et le bromure n'ont pas été présentées). Gillogly et coll. (2001) ont réalisé des expériences d'ozonation en lot afin d'évaluer l'effet de la température sur cinq eaux d'alimentation (pH 7,0; plage de bromure = 17-200 µg/L). En moyenne, 46 % moins de bromate était formé à 10 °C par rapport à 20 °C (plage de 29 à 54 %), même si l'exposition à l'O3 était augmentée afin d'obtenir le même niveau d'inactivation à plus faible température. Legube et coll. (2004) ont signalé une augmentation de 50 % de la formation de bromate lorsque la température augmentait de 5 °C à 21 °C (temps de contact = 5 mg O3·min/L; pH 7,6; COD = 2,6 mg/L; ammoniac < 10 µg/L).
Des résultats contradictoires ont également été publiés dans la littérature. Krasner et coll. (1991) ont observé que les concentrations de bromate diminuaient de 41 à 28 µg/L (réduction d'environ 32 %) lorsque la température augmentait de 13 °C à 23 °C dans un contacteur d'O3 à écoulement continu de laboratoire. Gillogly et coll. (2001) ont trouvé que dans un réacteur à débit continu de laboratoire (par rapport aux expériences en lot indiquées ci-dessus), l'augmentation de température de 5 °C à 25 °C se traduisait par une réduction de 28 à 85 % de la formation de bromate pour sept des huit approvisionnements en eau; dans le cas d'un des approvisionnements, on a constaté une augmentation de 113 % de la formation du bromate pour une même augmentation de température (pH 7; exposition à l'O3 = inactivation (2 log) du Cryptosporidium). On a présumé que les caractéristiques hydrauliques du système contrôlant l'exposition à l'O3 contribuaient à ces résultats.
L'effet de la température de l'eau pendant le traitement sur l'inactivation des pathogènes est important. L'inactivation est habituellement plus difficile à réaliser à faible température. L'effet est aussi important sur la formation des SPD, qui augmente habituellement aux températures plus élevées, bien que les résultats varient, tout particulièrement pour le bromate. Comme les services d'eau ne peuvent ajuster la température pendant le traitement de l'eau, ils devraient tenir compte des changements saisonniers et de la façon dont leur procédé répond à la formation de bromate et autres SPD, afin de pouvoir ajuster en conséquence leurs objectifs de qualité de l'eau (Gillogly et coll., 2001).
7.3.4 pH
L'influence du pH sur la formation de bromate a été étudiée en détail (Haag et Hoigné, 1983; von Gunten et Hoigné, 1992, 1994; Krasner et coll., 1993; Siddiqui et Amy, 1993; Kruithof et Meijers, 1995; Siddiqui et coll., 1995; Song et coll., 1996, 1997; Amy et coll., 1997; Gillogly et coll., 2001; Pinkernell et von Gunten, 2001; Chao et Westerhoff, 2003; Haidri et coll., 2003; von Gunten, 2003; Williams et coll., 2003; Legube et coll., 2004; Bonacquisti, 2006; Heeb et coll., 2014).
Comme le montre la figure 1 ci-dessus, le pH est important pour déterminer l'équilibre du système HOBr/OBr−. Un pH élevé favorise l'équilibre vers OBr−, qui réagit rapidement avec l'O3 et l'OH• pour former du bromate, tandis qu'un pH plus faible pousse l'équilibre vers le HOBr, qui est moins susceptible de former du bromate. À un pH plus faible, le taux de décomposition de l'O3 est également plus lent, et moins d'O3 est requis pour réaliser les objectifs de la désinfection.
Les chercheurs mentionnent invariablement que la formation du bromate est réduite lorsque le pH est abaissé. Cela se produit parce que les espèces de HOBr, prédominantes à des pH inférieurs à 8,8, sont moins aisément oxydées par l'O3 ou l'OH•. Il est généralement reconnu qu'une réduction de 30 à 50 % peut être obtenue par diminution unitaire de pH, lorsque le pH initial est supérieur à 7,5. Par conséquent, la diminution du pH est une stratégie de réduction que les services d'eau peuvent envisager pour minimiser la formation de bromate, particulièrement dans le cas de l'eau faiblement alcaline ou de l'eau nécessitant l'ajout d'acide avant un traitement par coagulation accentuée (Song et coll., 1997).
On doit envisager plusieurs compromis quand on se propose de diminuer le pH comme stratégie de contrôle du bromate : 1) un faible pH est indésirable pour la protection contre la corrosion; par conséquent, un ajustement supplémentaire du pH peut s'avérer nécessaire; 2) un pH plus faible accroît la formation de HOBr, lequel peut réagir avec la matière organique pour former des SPD bromés (Glaze et Weinberg, 1993; Glaze et coll., 1993); 3) l'ajustement du pH accroît la concentration de matières dissoutes totales (MDT) dans l'eau; 4) la faisabilité d'une diminution du pH peut être limitée dans le cas des eaux fortement alcalines en raison de la quantité d'acide qui peut raisonnablement être ajoutée.
En outre, les produits chimiques couramment utilisés pour diminuer le pH comprennent le dioxyde de carbone (CO2) et l'acide sulfurique (H2SO4). Le dioxyde de carbone peut être une méthode plus sécuritaire que le H2SO4 parce qu'il stabilise davantage l'O3. Toutefois, il s'agit d'un acide plus faible, et les coûts peuvent être prohibitifs s'il faut modifier considérablement le pH (Haidri et coll., 2003; Williams et coll., 2003).
7.3.5 Alcalinité
L'alcalinité est un important paramètre de la qualité de l'eau, dont on sait qu'il influe sur la formation de bromate (Krasner et coll., 1993; Siddiqui et coll., 1995; von Gunten et coll., 1995; Song et coll., 1996; Peyton et coll., 1998; Elovitz et coll., 2000; Hofmann et coll., 2002; Chao et Westerhoff, 2003; Legube et coll., 2004; Hofmann et Andrews, 2006). La principale source d'alcalinité est le système carbonate, qu'on présume être à l'équilibre dans les procédés de traitement de l'eau.
On sait que le bicarbonate (HCO3−) et le carbonate (CO32−) sont des piégeurs d'OH•; par conséquent, l'augmentation de l'alcalinité devrait diminuer la formation de bromate en bloquant les voies « directes/indirectes » et « indirectes/directes ». Cependant, l'alcalinité piège l'OH• selon les réactions chimiques suivantes et produit un radical carbonate (CO3•−), qui est un oxydant doux (von Gunten et coll., 1995) :

Figure 3 - Equivalent Textuel
La première équation montre comment le radical hydroxyle (OH•) réagit avec le carbonate (CO32-) pour produire de l'hydroxyde (HO−) et un radical carbonate (CO3•−). La deuxième équation montre la réaction entre le radical hydroxyle et le bicarbonate (HCO3−) pour produire de l'eau (H2O) et un radical carbonate.
Par conséquent, lorsque l'alcalinité piège l'OH•, les voies de formation du bromate peuvent être bloquées ou la décomposition d'O3 peut être réduite, ce qui permet à plus de bromate de se former par la voie « directe », ou encore, l'OBr− peut être oxydé par le CO3•− pour en fin de compte former du bromate. La cinétique des réactions est complexe, et la littérature confirme que l'alcalinité peut soit inhiber, soit promouvoir la formation de bromate.
Krasner et coll. (1993) ont trouvé qu'à un pH de 7, une alcalinité accrue réduisait la formation de bromate, tandis qu'à un pH de 8, elle augmentait la formation de bromate. Von Gunten et coll. (1995) n'ont fait état d'aucune tendance significative dans la formation de bromate avec la variation de l'alcalinité (pH 8; bromure = 1 mg/L; alcalinité = 1, 2,5, 10 mM sous forme de HCO3−). Song et coll. (1996) ont indiqué qu'une augmentation de l'alcalinité se traduisait par une formation accrue de bromate, en raison de l'oxydation de l'OBr− par le CO3•− (données non indiquées). Chao et Westerhoff (2003) ont également mentionné que la formation de bromate augmentait avec l'accroissement de l'alcalinité (O3 = 3 mg/L; bromure = 170 µg/L; pH 7,5; température = 24 °C; COD = 3 mg/L; alcalinité = 20, 50, 100, 200 mg/L sous forme de carbonate de calcium [CaCO3]). Hofmann et coll. (2002) ont indiqué que lorsque l'ammoniac était présent à raison de 0,4 mg/L, la formation de bromate diminuait lorsque l'alcalinité augmentait (O3 = 2 mg/L; bromure = 0,2 mg/L; pH 7,5; température = 20 °C; alcalinité = 50, 120, 357 mg/L sous forme de CaCO3). Williams et coll. (2003) ont fait état de conclusions similaires au sujet de la présence d'ammoniac dans les eaux d'alcalinité faible et élevée (60 et 130 mg/L sous forme de CaCO3, respectivement), mais ils ont attribué le résultat à des modifications du pH (voir la section 7.3.7). Hofmann et Andrews (2006) ont observé une réduction de 30 à 50 % dans la formation du bromate lorsque l'alcalinité augmentait de 50 à 119 mg/L sous forme de CaCO3 en présence d'ammoniac excédentaire (pH 7,5; température = 22 °C); des augmentations additionnelles d'alcalinité ne donnaient aucun avantage supplémentaire. Les auteurs ont indiqué que les effets confusionnels de la MONs n'ont pas été considérés dans le cadre de cette étude.
Les réactions dominantes liées à l'alcalinité seront assujetties aux caractéristiques de l'eau d'alimentation et peuvent varier selon les saisons. Les services d'eau devraient savoir comment leurs procédés réagissent au bromate et à la formation d'autres SPD, afin d'ajuster en conséquence leurs objectifs de qualité de l'eau.
7.3.6 Matière organique
La matière organique naturelle (MON) constitue un autre paramètre important de la qualité de l'eau qui influe sur la formation de bromate (Song et coll., 1996; Westerhoff et coll., 1998, 1999; Acero et von Gunten, 2001; Gillogly et coll., 2001; Chiang et coll., 2002; Hofmann et coll., 2002; Legube et coll., 2004; Grefte et coll., 2013). Le terme MON est utilisé pour capturer la composition complexe des matières organiques présentes dans les eaux d'alimentation. Les méthodes les plus couramment utilisées pour mesurer la réactivité de la MON dans l'eau sont le COT, le COD et l'absorbance du rayonnement ultraviolet à une longueur d'onde de 254 nanomètres (UV254). L'absorbance spécifique UV254 (ASUV) peut être utilisée pour évaluer le potentiel de formation des SPD (ASUV = UV254/COD). On peut également mesurer les fractions chimiques de la MON afin d'évaluer leurs caractéristiques d'hydrophobicité et de traitabilité par chromatographie en phase liquide avec détection du carbone organique. La réactivité de la MON est tributaire des caractéristiques du bassin hydrographique ou de l'aquifère et peut changer avec les saisons, pendant les événements de précipitations ou la prolifération d'algues, ou encore, s'il se produit des changements dans la zone de provenance de l'eau (p. ex. incendie, aménagement du territoire).
La présence de la MON est importante pour plusieurs raisons. En premier lieu, elle exerce une demande d'O3, ce qui peut affecter le rendement de la désinfection. En deuxième lieu, la MON réagit avec le HOBr/OBr−; pour produire des SPD, comme du bromoforme et des acides bromoacétiques. En troisième lieu, elle piège l'OH•, ce qui peut bloquer les voies de formation du bromate « directes/indirectes » et « indirectes/directes ». En quatrième lieu, lorsque la MON réagit avec l'O3, elle forme de l'OH•, du peroxyde d'hydrogène (H2O2) et du superoxyde (O2−), lesquels accélèrent tous la décomposition de l'O3 (Amy et coll., 1997; Westerhoff et coll., 1999).
En présence de MON, les concentrations de bromate ont tendance à être plus faibles, parce que la MON réagit avec l'O3 et l'OH•, ce qui réduit la quantité d'oxydant disponible pour oxyder le bromure. La quantité de bromate qui est formée dépend de la nature et de la quantité de MON. L'ozone réagit de préférence avec certaines fractions de MON, tandis que l'OH• réagit de façon plutôt non sélective (Westerhoff et coll., 1998). Legube et coll. (2004) ont indiqué également que la fraction hydrophobe de la MON est moins efficace pour piéger l'OH•.
L'effet de la MON sur la formation du bromate a été étudié pour plusieurs eaux d'alimentation et diverses compositions de MON. Amy et coll. (1997) ont étudié cinq eaux de surface (plage de COD = 1,95-5,05 mg/L) et une eau souterraine (COD = 3,00 mg/L) et ils ont constaté que la présence de la fraction hydrophobe se traduisait par une formation moindre de bromate. Gillogly et coll. (2001) ont étudié 14 eaux d'alimentation (eaux de surface, eaux souterraines, mélange d'eaux de surface et d'eaux souterraines) et ils ont également constaté que la présence de la fraction hydrophobe inhibe la formation de bromate. Les auteurs ont conclu que la MON a des effets confusionnels sur la demande en O3, la décomposition de l'O3 et la désinfection, et ils ont suggéré qu'il serait avantageux d'éliminer la MON avant de procéder à l'ozonation. Cela laisserait entendre que l'ozonation intermédiaire est préférable à la préozonation. Grefte et coll. (2013) ont évalué une eau de surface à différentes étapes de traitement avec des concentrations de COD variées (COD = 1,1, 3,1, 5,1 mg/L). Les auteurs ont observé que la demande en O3 était spécifique selon la composition de la MON et qu'elle était surtout déterminée par la fraction hydrophobe, laquelle était hautement réactive avec l'O3, l'OH• et le HOBr/OBr−. La conclusion était que la production de bromate augmente lorsque le ratio O3/COD augmente, ce qui laisse entendre qu'on devrait maintenir un faible ratio O3/COD pour minimiser la formation de bromate. On peut y parvenir en réduisant la fraction de MON qui consomme l'O3, et ainsi abaisser la dose d'ozone.
Les services d'eau devraient bien connaître leur eau d'alimentation, ainsi que la nature et la production de la MON, sa variabilité saisonnière et sa façon d'interagir avec la demande en O3 et la formation de bromate. Le calcul de l'ASUV peut fournir aux services d'eau une bonne mesure de la réactivité de la MON et être un indicateur des changements dans la qualité de l'eau d'alimentation; à cette fin, les services d'eau devraient surveiller les paramètres COD et UV254 (Westerhoff et coll., 1999). Le calcul de l'ASUV est suggéré comme outil de contrôle des procédés, mais non comme stratégie de réduction des bromates.
7.3.7 Ammoniac
L'effet de l'ammoniac sur la formation de bromate a fait l'objet de nombreuses études (Haag et Hoigné, 1983; Haag et coll., 1984; von Gunten et Hoigné, 1992, 1994; Krasner et coll., 1993; Siddiqui et Amy, 1993; Kruithof et Meijers, 1995; Siddiqui et coll., 1995; Song et coll., 1996, 1997; Amy et coll., 1997; Amy et Siddiqui, 1999; Gillogly et coll., 2001; Hofmann et Andrews, 2001, 2006, 2007; Pinkernell et von Gunten, 2001; Hofmann et coll., 2002; Chao et Westerhoff, 2003; von Gunten, 2003; Williams et coll., 2003; Legube et coll., 2004; Heeb et coll., 2014).
L'ammoniac réagit rapidement avec le HOBr/OBr− pour former de la monobromamine et bloque efficacement les voies de formation de bromate « directes » et « directes/indirectes » illustrées à la figure 2. Tant que le bromure est séquestré sous forme de monobromamine pendant l'ozonation, il ne peut être converti en bromate. Cependant, une fois l'ammoniac entièrement oxydé, la capacité de piéger le HOBr/OBr− sous forme de bromamines est épuisée, et la formation de bromate reprend par les voies « directes » et « directes/indirectes ». En d'autres mots, la présence d'ammoniac retarde la formation de bromate. Comme l'ammoniac ne bloque pas la voie « indirecte/directe », une certaine partie du bromate continuera de se former par cette voie. L'ajout d'ammoniac est reconnu comme stratégie de réduction que les services d'eau peuvent envisager pour minimiser la formation de bromate, bien que son efficacité varie, en fonction des caractéristiques de qualité de l'eau.
Siddiqui et Amy (1993) ont indiqué que la formation de bromate était réduite de 36 % lorsque de l'ammoniac était ajouté avant l'ozonation (ammoniac: O3 = 0,25 mg/mg; pH 7,5). Krasner et coll. (1993) ont conclu que l'ajout d'ammoniac ne semblait pas être efficace à un pH de 8 ou inférieur. Amy et Siddiqui (1999) ont signalé une réduction de 20 à 84 % de la formation de bromate lorsque 1 mg/L d'ammoniac était ajouté à de l'eau exempte de MON dans une plage de pH de 6,5 à 8,5. Pinkernell et von Gunten (2001) ont rapporté que l'ajout d'ammoniac à une concentration de 200 µg/L réduisait la formation de bromate de 50 %, mais que l'ajout d'ammoniac au-delà de 200 µg/L ne produisait pas de réduction additionnelle. Williams et coll. (2003) ont observé que la formation de bromate était réduite de 67 et de 70 % lorsque 0,2 et 0,9 mg/L d'ammoniac, respectivement, étaient ajoutés à de l'eau fortement alcaline (130 mg/L sous forme de CaCO3; pH 8). Dans une eau faiblement alcaline (60 mg/L sous forme de CaCO3; pH 8), la formation de bromate était réduite de 40 et de 60 % par l'ajout de 0,2 mg/L et 0,9 mg/L d'ammoniac, respectivement. L'efficacité réduite dans l'eau faiblement alcaline a été attribuée au pH accru qui résultait de l'ajout d'ammoniac (c.-à-d. la formation de bromate augmente lorsque le pH augmente; voir la section 7.3.4). À un pH de 7, Williams et coll. (2003) ont constaté que la formation de bromate n'était pas réduite de façon appréciable, peu importe la dose d'ammoniac.
Les résultats variables observés par les chercheurs peuvent être attribués aux mécanismes complexes de formation du bromate. Hofmann et Andrews (2001) ont indiqué que la réaction entre l'ammoniac et le HOBr/OBr− est la plus efficace à un pH de 9, puisque c'est le point milieu des valeurs pKa pour l'ammonium (pKa = 9,3) et le système HOBr/OBr− (pKa = 8,8). Aux valeurs de pH comprises entre 6 et 8, la réaction ralentit, ce qui permet à davantage de bromate de se former par la voie « indirecte/directe ». Hofmann et coll. (2002) ont indiqué qu'une concentration initiale élevée d'ammoniac prolongeait le délai de formation du bromate, mais qu'on obtenait peu d'avantages additionnels lorsque le ratio ammoniac/bromure dépassait 3/1 (ratio molaire).
Des recherches ont également été réalisées sur les avantages que pourrait avoir la modification de cette stratégie de réduction dans un procédé chlore-ammoniac (Buffle et coll., 2004; Neemann et coll., 2004; Wert et Benotti, 2010; Benotti et coll., 2011; Ikehata et coll., 2013). Le chlore convertit le bromure en HOBr/OBr−, et l'ajout subséquent d'ammoniac (avant l'O3) piège le HOBr/OBr− sous forme de bromamines, qui empêchent la formation de bromate pendant l'ozonation. Un brevet sous le titre Water Treatment Using Ozone and Having a Reduced Likelihood of Bromate Formation from Bromures Formed in the Water (« traitement de l'eau au moyen de l'ozone avec probabilité réduite de formation de bromate à partir des bromures formés dans l'eau ») (US 6,602,426,B2) a été émis le 5 août 2003 en prévision de cette approche novatrice, et il a été versé dans le domaine public, ce qui permet aux services d'eau de l'utiliser gratuitement (Neemann et coll., 2004).
Buffle et coll. (2004) ont observé une réduction de 86 % de la formation de bromate dans une eau dopée au bromure, en utilisant une dose de chlore de 1,12 mg/L suivie d'un ajout de 400 µg/L d'ammoniac (bromure = 560 µg/L; exposition à l'O3 = 6 mg/L·min; pH 8; température = 20 °C). Neemann et coll. (2004) ont indiqué que l'ajout de chlore à raison de 0,5 mg/L puis d'ammoniac à 0,1 mg/L réduisait la formation de bromate de 75 à 80 % (bromure = 60-120 µg/L; pH 7,5-8,2; alcalinité = 130 mg/L sous forme de CaCO3; COT = 2,5-3,5 mg/L). L'emploi de l'ammoniac seul a permis d'obtenir des résultats similaires, mais la demande en chlore requise pour consommer l'ammoniac résiduel était très élevée, de telle sorte que le procédé combiné chlore-ammoniac représentait les doses chimiques et les coûts d'exploitation les plus faibles. Wert et Benotti (2010) ont indiqué que le procédé chlore-ammoniac formait moins de bromate que l'ammoniac seul. Ces réductions allaient de 20 à 90 %, selon la dose de produits chimiques (bromure = 73-98 µg/L; O3 = 1-2 mg/L; chlore = 0-1,5 mg/L; ammoniac = 0-0,43 mg/L), la réduction la plus importante ayant eu lieu aux doses de chlore et d'ammoniac les plus élevées. Les auteurs ont également indiqué que la séquence d'ajout chimique pouvait être remplacée par ammoniac-chlore sans compromettre la performance, bien que la désinfection à l'O3 semble plus efficace lorsqu'on ajoutait le chlore en premier. Benotti et coll. (2011) ont indiqué que le procédé chlore-ammoniac piège l'OH• plus efficacement que l'ammoniac seul, ce qui réduit la formation de bromate. Toutefois, les auteurs ont fait une mise en garde : cet effet accru de piégeage de l'OH• pourrait avoir un effet négatif si les réactions avec l'OH• sont requises pour oxyder les composés qui produisent les goûts et les odeurs, ou les produits pharmaceutiques. Ikehata et coll. (2013) ont comparé la formation de bromate pendant l'ozonation d'une eau souterraine colorée à teneur élevée en bromure en utilisant de l'ammoniac seul et un procédé chlore-ammoniac (bromure = 240 µg/L; pH 8,2; COT = 4 mg/L; température = 24,3 °C). La formation de bromate a été réduite de 67 % et 83 % en utilisant des concentrations d'ammoniac de 0,3 mg/L et 0,6 mg/L, respectivement. Lorsque du chlore était ajouté à raison de 1,0 mg/L, suivi de l'ammoniac à 0,2 mg/L, la formation de bromate était réduite de 68 %; elle augmentait à 92 % lorsque le chlore était ajouté à raison de 2,0 mg/L, suivi de l'ammoniac à 0,5 mg/L. Cette dernière procédure était la seule qui réduisait suffisamment le bromate à une concentration inférieure à 0,01 mg/L.
Plusieurs préoccupations ont été soulevées pour ce qui est de l'ajout d'ammoniac par les services d'eau pour contrôler le bromate. Comme la monobromamine est oxydée par l'O3 en bromure et en nitrate, le bromure devient de nouveau disponible pour former du bromate et générer une demande en O3. Hofmann et Andrews (2006) ont indiqué qu'il est peu probable que l'ajout d'ammoniac favorise la nitrification pourvu que le système soit correctement conçu et que les services d'eau évitent d'ajouter des quantités excessives d'ammoniac. En outre, l'ammoniac résiduel pourrait causer des ennuis pour les services d'eau qui utilisent du chlore libre pour la désinfection secondaire, dans la mesure où il exercerait une demande de chlore, comme l'ont signalé Neemann et coll. (2004). Wert et coll. (2008) ont étudié la possibilité de mettre au point des filtres nitrifiants biologiquement actifs après l'ozonation, afin de convertir l'ammoniac résiduel en nitrite/nitrate. Ces auteurs concluaient que l'eau de lavage à contre-courant déchlorée était requise pour la mise au point de filtres de nitrification biologiquement actifs avec des temps de contact en fût vide (TCFV) de 3,2 à 8,3 minutes. Le rendement de la nitrification était réduit de 60 % lorsque le taux de filtration augmentait de 4,8 à 14,6 m/h. Enfin, on a craint que l'ajout d'ammoniac accroisse le pH dans des eaux faiblement alcalines. Comme un pH accru a un effet sur les objectifs de désinfection, les services d'eau doivent tenir compte des caractéristiques de qualité de l'eau lorsqu'ils emploient l'ajout d'ammoniac comme stratégie de réduction.
7.3.8 Peroxyde d'hydrogène
Le peroxyde d'hydrogène (H2O2) accélère la décomposition de l'O3 dans l'OH•, qui est un oxydant extrêmement puissant. L'ajout de H2O2 de concert avec l'O3 est donc un processus d'oxydation avancé (POA) reconnu qui est employé pour oxyder les composés ayant un goût et une odeur, ainsi que les micropolluants, comme les pesticides et les produits pharmaceutiques. L'ajout de H2O2 a également été évalué comme stratégie de réduction pour minimiser la formation de bromate (Song et coll., 1997; Amy et Siddiqui, 1999; Speitel et coll., 1999; Acero et von Gunten, 2001; Hofmann et coll., 2002, 2006).
Voici les réactions chimiques qui se produisent (Staehelin et Hoigné, 1982; Westerhoff, 1995; von Gunten et Oliveras, 1997) :
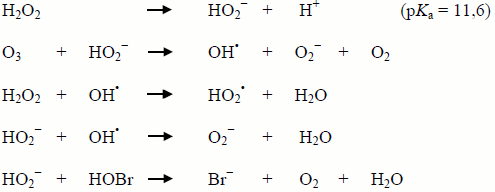
Figure 4 - Equivalent Textuel
L'image montre cinq réactions chimiques. La première d'entre elles montre la dissociation du peroxyde d'hydrogène en HO2− et en H+ à un pKa de 11,6. La deuxième équation montre la réaction entre l'ozone (O3) et HO2− pour produire les espèces OH•, O2− and O2. La troisième équation montre le peroxyde d'hydrogène réagissant avec OH• pour former HO2• et de l'eau (H2O). La quatrième équation montre le HO2− réagissant avec OH• pour produire du O2− et de l'eau. La cinquième équation montre le HO2− réagissant avec de l'acide hypobromeux (HOBr) pour produire les espèces bromure (Br-), O2 et de l'eau.
La dernière étape est la réaction critique pour le bromate et comporte la réduction chimique du HOBr en bromure (Br−). Comme le peroxyde d'hydrogène (pKa = 11,6) et le brome (pKa = 8,8) sont tributaires du pH, la dépendance au pH est forte lorsque le H2O2 est choisi pour réduire le bromate, la réaction étant la plus efficace aux valeurs moyennes de pKa (˜ pH 10,2). Par conséquent, l'interprétation des résultats contradictoires indiqués dans la littérature devrait prendre en compte les effets du pH.
Song et coll. (1997) ont présenté des résultats mitigés au sujet de l'effet de l'ajout de H2O2 sur la formation de bromate dans quatre eaux d'alimentation (pH 7,5; O3 = 6 mg/L; bromure = 400 µg/L; COD = 3 mg/L; H2O2 = 0,35 mg/mg O3). La formation de bromate a augmenté de 30 à 36 % dans deux eaux d'alimentation, mais diminué de 30 à 64 % dans les deux autres. Amy et Siddiqui (1999) ont observé que l'ajout de H2O2 augmentait la formation de bromate à un pH de 6,5, mais la diminuait à un pH de 8,5 (bromure = 500 µg/L; O3 = 3 mg/L; H2O2 = 0, 0,2, 0,3, 0,5 mg/L). Speitel et coll. (1999) ont évalué deux eaux d'alimentation présentant des caractéristiques différentes de qualité de l'eau. Dans la première eau d'alimentation, le bromate était réduit de > 80 % à une dose d'O3 de 1 mg/mg COT et avec l'ajout de H2O2 à 0,4 mg/mg O3; dans l'autre eau d'alimentation, aucun avantage n'a été observé.
Acero et von Gunten (2001) ont trouvé que l'ajout de H2O2 accélérait grandement la décomposition de l'O3 dans une eau à faible teneur en COD et fortement alcaline (COD = 1 mg/L; alcalinité = 5,2 mM HCO3−), tandis qu'en présence d'une teneur élevée en COD et d'une faible alcalinité (COD = 3,2 mg/L; alcalinité = 3,8 mM HCO3−), l'ajout de H2O2 ne modifiait pas grandement les modes de décomposition de l'O3. Cela peut également expliquer les résultats contradictoires présentés par les chercheurs pour diverses eaux d'alimentation.
Les services d'eau qui envisagent l'ajout de H2O2 pour réduire la formation de bromate devraient savoir que cette méthode mène à une décomposition rapide de l'O3, ce qui pourrait rendre la désinfection inadéquate. Si les objectifs de traitement comprennent à la fois une oxydation poussée et la désinfection, l'ajout de H2O2 n'est pas recommandé (Hofmann, 2014). Comme avec les autres paramètres, les services d'eau devraient savoir comment leurs procédés réagissent, de sorte qu'ils puissent faire les ajustements nécessaires (Amy et Siddiqui, 1999; Speitel et coll., 1999).
7.4 Traitement à l'ozone à l'échelle municipale
7.4.1 Minimisation de la formation de bromate
Les services d'eau peuvent prendre un certain nombre de mesures afin de minimiser la formation de bromate. D'abord, ils doivent bien comprendre les caractéristiques de leur eau d'alimentation (p. ex. bromure, température, pH, alcalinité, MON et ammoniac), ainsi que leur variation saisonnière. Ensuite, la dose nominale d'O3 devrait être déterminée par rapport aux objectifs de traitement (p. ex. désinfection, réduction des goûts et des odeurs, élimination de la couleur, etc.) et des caractéristiques saisonnières de l'eau d'alimentation. L'endroit où l'O3 sera injecté (préozonation ou ozonation intermédiaire) devrait également être établi en fonction des objectifs de traitement. Comme les paramètres de la qualité de l'eau peuvent fluctuer au fil de l'année, on peut devoir également varier la dose d'O3 pour minimiser la formation de bromate.
Si on ne peut atteindre la CMA du bromate en optimisant la conception du système et les procédures opérationnelles, la stratégie de réduction la plus couramment utilisée consiste à diminuer le pH (voir la section 7.3.4) et à ajouter de l'ammoniac ou du chlore-ammoniac (voir la section 7.3.7). Ces stratégies peuvent à elles seules réduire de 50 % la formation de bromate, voire plus si on les combine (Pinkernell et von Gunten, 2001; Hofmann et coll., 2002). Les services d'eau doivent envisager des compromis lorsqu'ils mettent en œuvre ces stratégies de réduction, comme il est décrit aux sections 7.3.4 et 7.3.7. L'ajout de H2O2 peut également être une option pour certaines eaux d'alimentation, bien que son efficacité varie, compte tenu d'autres caractéristiques de qualité de l'eau. Cette stratégie de réduction n'est pas recommandée si on utilise l'O3 pour la désinfection, comme il est décrit à la section 7.3.8.
Avant de choisir une méthode d'ozonation, il est recommandé de procéder à des essais en laboratoire ou à l'échelle pilote pour s'assurer qu'il s'agit de la solution la plus appropriée, compte tenu des caractéristiques de qualité de l'eau, des objectifs de traitement et de la formation du bromate.
7.4.2 Enlèvement du bromate après sa formation
Bien que la MTE reconnue soit le contrôle du procédé d'ozonation pour minimiser la formation de bromate, il est techniquement possible d'enlever le bromate après sa formation en utilisant plusieurs méthodes de traitement, dont le charbon actif, l'ajout de fer ferreux, l'irradiation par les ultraviolets, les membranes et les résines échangeuses d'anions. Cependant, ces méthodes ont surtout été évaluées en laboratoire et à l'échelle pilote, et on dispose de peu d'information sur leur application à pleine échelle (Siddiqui et coll., 1994; Amy et Siddiqui, 1999). Bien qu'il soit techniquement possible d'enlever le bromate de l'eau traitée, il est peu probable que ce soit rentable.
7.4.2.1 Adsorption par le charbon activé
Legube (1996) a signalé des concentrations de bromate similaires dans l'eau avant et après son traitement par filtres de charbon actif en grains (CAG) utilisés par des services d'eau en Europe qui employaient de l'O3, ce qui indique une élimination inefficace du bromate à pleine échelle (plage d'influent ≤ 2-19,6 µg/L; plage d'eau traitée ≤ 2-21,2 µg/L). Amy et Siddiqui (1999) ont réalisé des études en laboratoire et à l'échelle pilote et ils ont constaté que l'élimination du bromate dépendait du pH de l'eau d'alimentation, du type de charbon activé et du temps de contact; les concentrations de bromate atteignaient habituellement 10 µg/L dans moins de 1 000 volumes de lit (VL). On a indiqué que le charbon actif en poudre (CAP) était inefficace pour plusieurs raisons (p. ex. effets confusionnels avec le pH, les MON et le sulfate, nécessité d'utiliser du charbon chargé positivement). Asami et coll. (1999) ont indiqué que du CAG neuf pouvait faire passer le bromate dans un influent d'une concentration de 50 µg/L à environ 10 µg/L pendant 50 jours, après quoi la performance était réduite, car le filtre commençait à devenir biologiquement actif; presque aucune élimination n'était constatée après 3 mois. Bao et coll. (1999) ont réalisé des expériences en laboratoire et à l'échelle pilote et ont indiqué que l'élimination du bromate était spécifique selon le charbon, dépendait de la qualité de l'eau d'alimentation et était négativement affectée par la présence de MON et d'anions comme le bromure, le nitrate et le sulfate. Dans une colonne CAG à l'échelle pilote (TCFV = 20 minutes; taux de chargement = 3,9 m/h) utilisant de l'eau de rivière prétraitée par préchloration, adsorption de CAP, floculation-sédimentation et filtration par du sable, on obtenait un taux d'élimination du bromate allant de 57 à 92 % pendant au moins 98 jours (concentrations de bromate dans l'influent = 30 et 109 µg/L; concentrations de bromate dans l'eau traitée = 13 et 9 µg/L); la plus faible concentration mesurée de bromate était de 6 µg/L (concentration de bromate dans l'influent = 17 µg/L). Kirisits et coll. (2000) ont indiqué que le débordement de bromate se produisait très rapidement dans l'eau naturelle en raison de la présence des MON et d'autres anions (p. ex. chlorure, sulfate, bromure et nitrate). Kirisits et coll. (2001) ont trouvé que le charbon biologiquement actif (CBA) pouvait réduire la concentration de bromate dans un influent de 20 µg/L jusqu'à 40 %, mais que la concentration d'oxygène dissous (OD) devait être inférieure à 2 mg/L pour soutenir la biomasse réductrice de bromate. Par conséquent, il est peu probable qu'on observe, dans des installations utilisant le procédé O3-CBA à pleine échelle, une réduction biologique du bromate, parce que la concentration d'OD est trop élevée. Huang et coll. (2004) ont constaté que la filtration par CAG pouvait réduire la concentration de bromate de 50 à 80 % (la concentration de bromate dans l'influent allait de 18 à 163 µg/L), mais pour seulement 3 mois de fonctionnement; après 9 mois, on ne constatait presque plus d'élimination.
7.4.2.2 Ajout de fer ferreux
La réduction chimique du bromate en bromure est possible grâce à l'emploi d'un agent réducteur comme du fer ferreux (Fe2+). Amy et Siddiqui (1999) ont réalisé des essais en laboratoire avec du Fe2+ et ils ont constaté que les concentrations de bromate pouvaient être réduites de 40 à 80 %, tout dépendant de la dose, du pH et de la température. Le processus était presque 50 % moins efficace à 10 °C qu'à 20 °C. Le processus dépendait également de l'alcalinité et de la MON, et son efficacité diminuait lorsque l'alcalinité et la MON augmentaient. Des doses de Fe2+ de 10 à 20 mg/L étaient requises à un pH de 7 à 8 avant quelque élimination du bromate que ce soit.
Krasner et Yates (1996) ont réalisé des essais à l'échelle pilote pour évaluer l'efficacité de l'ajout de Fe2+ visant à réduire la formation de bromate (concentration de bromate = 15 µg/L; température = 19 °C; pH = 6, 6,2, 6,5; concentration de Fe2+ = 5, 10 mg/L). Après environ 30 minutes, l'élimination du bromate allait de 4 à 14 % et de 18 à 41 % aux doses faible et élevée, respectivement. Après un temps de contact additionnel (2 heures), l'élimination du bromate augmentait à 36-40 % et à 59-70 % pour les doses faible et élevée, respectivement. Les auteurs ont indiqué qu'un résidu de Fe2+ d'au moins 1 mg/L était requis pour assurer une bonne élimination du bromate; cette concentration de Fe2+ était jugée inacceptable pour la qualité de l'eau traitée. En outre, l'augmentation du nombre de particules posait problème. Les auteurs ont conclu que le processus nécessitait un équilibre délicat et n'était pas pratique à toutes les températures.
7.4.2.3 Irradiation par les ultraviolets
Les études de l'élimination du bromate par irradiation par les ultraviolets en laboratoire et à l'échelle pilote ont démontré que son efficacité varie grandement, en fonction de la qualité de l'eau, de la fluence et de la longueur d'onde des UV (Amy et Siddiqui, 1999; Peldszus et coll., 2004; Chen et coll., 2013). Amy et Siddiqui (1999) ont indiqué que des lampes à moyenne pression (200-600 nm) étaient plus efficaces que les lampes à basse pression (254 nm) pour détruire le bromate, en raison d'un apport énergétique plus élevé et d'une plus large plage de rayonnements émis. Une élimination de 31 à 46 % de la concentration initiale de bromate a été observée au moyen de lampes à moyenne pression, avec un temps de contact de 6 secondes et une dose d'UV de 550 mJ/cm2 (concentration initiale de bromate = 11-19 µg/L). Toutefois, les auteurs ont noté qu'une lampe à basse pression émettant un rayonnement à des longueurs d'onde inférieures à 200 nm était plus efficace qu'une lampe à moyenne pression, pour des doses similaires. Environ 40 % du bromate était détruit, pour une concentration initiale de 50 µg/L, au moyen d'une lampe à basse pression et avec une dose de 250 mJ/cm2.
À l'opposé, des essais à l'échelle pilote réalisés par Peldszus et coll. (2004) au moyen de lampes UV à moyenne pression ont démontré une élimination limitée du bromate (c.-à-d. élimination de 0-19 %). Deux sources d'eau différentes ont été dopées au bromate à raison de 20 µg/L et irradiées à des fluences UV atteignant 718 mJ/cm2. L'eau d'alimentation contenant 4 mg/L de nitrate-azote et 4,1 mg/L de COD ne présentait aucun signe d'élimination du bromate, ce qui a été attribué à l'absorption compétitive par le nitrate et possiblement par le COD. Les auteurs ont conclu qu'un traitement avec lampe UV à moyenne pression, aux fluences habituellement utilisées pour la désinfection de l'eau potable, se traduirait par une élimination négligeable du bromate.
7.4.2.4 Techniques membranaires
Les techniques membranaires présentées dans la littérature pour l'élimination du bromate comprennent l'osmose inverse, l'électrodialyse inversée (EDI) et les membranes échangeuses d'anions. Ces méthodes ont été évaluées surtout en laboratoire et à l'échelle pilote et il y a peu d'information sur leur application à pleine échelle.
- Osmose inverse
- L'osmose inverse (OI) est un procédé sous pression dans lequel l'eau est forcée de traverser une membrane semi-perméable, ce qui retire les contaminants organiques et les sels. van der Hoek et coll. (1998) ont réalisé des expériences à l'échelle pilote et ils ont indiqué que des membranes OI présentaient un taux de rejet du bromate de 96 %. La concentration de bromate dans l'eau d'alimentation a atteint 125 µg/L, et la concentration cible de 5 µg/L a été obtenue dans le filtrat. La performance de la membrane n'était pas affectée par la température.
- Électrodialyse inversée
- L'électrodialyse (ED) utilise un courant continu pour transférer des espèces ioniques au travers de paires de cellules de membranes de charge opposée, ce qui permet de les retirer de l'eau d'alimentation. La technique EDI est une modification du procédé ED, dans lequel la polarité des électrodes est inversée pendant le traitement pour réduire l'entartrage et nettoyer la surface des membranes (Watson et coll., 2012). van der Hoek et coll. (1998) ont réalisé des expériences à l'échelle pilote et ils ont constaté que les membranes EDI étaient moins efficaces que l'OI et que leur performance diminuait aux températures plus faibles. On a indiqué que le bromate était rejeté à raison de 64 % à 2,4 °C par la technique EDI, et qu'on ne pouvait atteindre l'objectif de concentration de 5 µg/L dans le filtrat. Les auteurs ont indiqué que l'OI était préférable, car cette méthode permettait d'atteindre plusieurs objectifs de traitement, notamment la désinfection, ainsi que l'élimination des sels, de la dureté et des composés organiques. La technique EDI ne retire pas les composés organiques, et n'agit pas comme désinfectant.
- Membranes échangeuses d'ions
- Le procédé par membrane échangeuse d'ions est similaire à l'électrodialyse, mais il met à profit le gradient de potentiel chimique entre l'eau d'alimentation et la solution d'échange pour transférer les ions de part et d'autre de la membrane. Wiśniewski et Kabsh-Korbutowicz (2010) ont réalisé des essais en lot et ont indiqué que les membranes échangeuses d'ions permettaient d'atteindre des taux d'élimination de l'ordre de 90 % lorsque le bromate était le seul anion à éliminer, peu importe que la concentration initiale de bromate soit faible (50 µg/L) ou élevée (200 µg/L). En présence d'autres anions, comme le nitrate et le bicarbonate, le taux d'élimination diminuait à environ 60 %, et les concentrations de bromate ne pouvaient être réduites sous 20 µg/L. À l'opposé, Wiśniewski et coll. (2011) ont indiqué que dans des eaux naturelles dopées avec du bromate à 50 µg/L, on parvenait à éliminer 100 % du bromate après 2 heures (concentration de chlorure de sodium = 100 mM dans la solution d'échange). Wiśniewski et coll. (2011) ont également réalisé des essais ED en débit continu sur de l'eau contenant du bromate et ils ont rapporté un taux d'élimination du bromate de 83 % (la concentration dans l'eau traitée était de 8,8 µg/L). Une membrane sélective mono-anion a été utilisée afin d'accroître le taux d'élimination du bromate à 93 % (concentration dans l'eau traitée = 3,3 µg/L). Les auteurs ont indiqué que la membrane sélective mono-anion a un effet favorable sur l'élimination du bromate, tout en minimisant l'échange des anions connexes, comme le sulfate et le bicarbonate.
7.4.2.5 Résines échangeuses d'anions
On dispose de peu de renseignements sur l'élimination du bromate des solutions aqueuses au moyen des résines échangeuses d'ions. Chen et coll. (2014) ont réalisé des expériences en lot afin d'évaluer la performance de l'élimination du bromate au moyen d'une résine macroporeuse échangeuse d'anions fortement basiques avec une matrice de polystyrène, des groupes fonctionnels d'amine quaternaire et du chlorure comme ion d'échange. La sorption de la résine était fortement tributaire du pH. Les auteurs ont indiqué que les concentrations de bromate allant de 200 à 600 µg/L pouvaient être réduites à < 10 µg/L à un pH entre 4,5 et 10, et à < 5 µg/L à un pH entre 5 et 8,5. La capacité maximale de sorption de la résine était obtenue avec un pH de 7,07 (concentration de bromate = 0 µg/L, d'après l'interprétation des graphiques). La présence d'autres anions, comme le nitrate, le sulfate et le chlorure, réduisait la capacité de sorption de la résine de 28 %, 27 % et 23 %, respectivement.
7.4.3 Enlèvement du bromure
Plusieurs techniques, dont la filtration sur membrane, les procédés électrochimiques et l'échange d'ions, constituent des méthodes potentielles de traitement pour enlever le bromure des sources d'eau potable afin de réduire la formation de bromate. Cependant, ces méthodes ont été évaluées surtout en laboratoire et à l'échelle pilote, et on dispose de peu de renseignements sur les applications à pleine échelle (Amy et Siddiqui, 1999; Watson et coll., 2012). En outre, même s'il est techniquement possible d'enlever le bromure de l'eau d'alimentation, il est peu probable que cette option soit rentable pour réduire les concentrations de bromate dans l'eau traitée.
7.4.3.1 Osmose inverse
Un examen récent des techniques de traitement pour l'élimination du bromure a déterminé que l'OI est la technique la plus efficace actuellement disponible. Watson et coll. (2012) ont résumé les résultats de plusieurs études sur l'élimination du bromure dans l'eau douce et l'eau de mer. Les taux de rejet allaient de 90 à 100 %, selon la membrane utilisée et les conditions opérationnelles. Bartels et coll. (2009) ont indiqué un taux d'élimination du bromure > 99 % dans des installations d'OI à l'échelle pilote et à pleine échelle, avec de l'eau de mer. Les concentrations initiales de bromure allaient de 64 à 71 mg/L, les pressions de service allaient de 5 065 à 6 480 kPa, et le débit était de 11 000 L/min. Amy et Siddiqui (1999) ont signalé que les membranes de nanofiltration avec un seuil de poids moléculaire de 150 à 300 Da pouvaient rejeter jusqu'à 50 % du bromure. Harrison et coll. (2007) ont réalisé des essais en laboratoire sur l'élimination du bromure par nanofiltration. Une membrane ayant un seuil de poids moléculaire de 200 Da a rejeté de 94 à 97 % du bromure, à une concentration initiale de 1 030 mg/L. Les données ci-dessus proviennent d'études de dessalement de l'eau de mer, et la rentabilité de l'emploi des membranes expressément pour éliminer le bromure n'avait pas été évaluée (Amy et Siddiqui, 1999).
7.4.3.2 Électrodialyse
Les techniques ED et EDI se sont avérées efficaces pour l'élimination du bromure. Valero et Arbos (2010) ont réalisé des études à l'échelle pilote et à pleine échelle de l'emploi de la technique EDI pour la réduction des THM dans de l'eau de rivière contenant du bromure et d'autres sels. Un système EDI à deux étages, chacun comportant neuf modules, avec 32 cellules par module, et ayant une capacité de production totale de 2,3 m3/s, a permis d'éliminer plus de 80 % du bromure dans l'eau d'alimentation, à des concentrations atteignant 1,2 mg/L.
Quelques procédés électrochimiques se sont récemment révélés prometteurs pour l'élimination du bromure par volatilisation électrolytique. Kimbrough et coll. (2013) ont réalisé une étude à l'échelle pilote afin d'évaluer l'efficacité de l'électrolyse pour éliminer le bromure dans les sources d'eau potable. Le réacteur fonctionnait à un débit de 10 L/min et dans diverses conditions de courant/puissance (0-98 A; 0-65 W·h). Les cellules comportaient des anodes de titane et des cathodes de carbone, pour une surface anodique totale de 72 310 cm2. Des taux d'élimination allant de 23 à 82 % ont été observés pour des concentrations initiales de bromure allant de 0,04 à 0,21 mg/L. Les auteurs ont également réalisé une analyse des coûts et ils ont déterminé que les coûts associés à l'emploi de l'électrolyse sont comparables à ceux de l'osmose inverse.
7.4.3.3 Échange d'ions
Grefte et coll. (2013) ont étudié l'influence de l'élimination du bromure et du COD par échange anionique sur la demande d'ozone et la formation de bromate. Les résultats de l'essai à l'échelle pilote d'un système d'échange d'ions fluidisé, consistant en trois colonnes de résine en gel fortement basique fonctionnant en parallèle avec un débit de 4 m3/h, un TCFV de 2,3 minutes et un temps de fonctionnement de 15 000 VL, ont démontré qu'une concentration initiale de bromure de 90 µg/L pouvait être réduite jusqu'à 60 %, mais il avait fallu seulement 1 000 VL pour que le débordement se produise.
7.5 Échelle résidentielle
Le traitement de l'eau potable dans les installations municipales vise à diminuer les niveaux de contaminants pour qu'ils soient conformes, ou en-dessous de la valeur de la recommandation. Par conséquent, l'utilisation de dispositifs de traitement d'eau potable résidentiels pour traiter de l'eau déjà traitée par une usine de traitement municipale n'est habituellement pas nécessaire, mais le résultat d'un choix individuel. Tous les approvisionnements d'eau potable devraient être désinfectés, y compris lorsque l'eau potable d'une résidence provient d'un approvisionnement privé. Lorsque des solutions d'hypochlorite sont utilisées comme sources de chlore pour désinfecter l'eau de ces résidences, les mesures de précaution décrites à la section 7.2.2 devraient être observées. Lorsque l'ozone est utilisé comme désinfectant primaire, on devrait faire analyser l'eau pour en déterminer les concentrations de bromure et ses autres caractéristiques de qualité. Si l'eau contient du bromure en présence d'autres caractéristiques de qualité favorisant la formation de bromate, il peut s'avérer plus approprié d'utiliser d'autres méthodes de désinfection (p. ex. les rayons UV).
Santé Canada ne recommande pas de marques particulières de dispositifs de traitement de l'eau potable, mais encourage fortement les consommateurs à utiliser des dispositifs qui ont été certifiés par un organisme de certification accrédité comme étant conformes aux normes appropriées de NSF/ANSI pour les dispositifs de traitement de l'eau potable. Ces normes visent à protéger la qualité de l'eau potable en aidant à garantir l'innocuité des matériaux et le rendement des produits qui entrent en contact avec l'eau potable. Les organismes de certification garantissent qu'un produit est conforme aux normes en vigueur et doivent être accrédités par le Conseil canadien des normes (CCN). Au Canada, le CCN a accrédité les organismes suivants, qu'il autorise ainsi à certifier les dispositifs de traitement et les produits liés à l'eau potable qui respectent les normes NSF/ANSI (CCN, 2014) :
- CSA Group (www.csagroup.org - disponible en anglais seulement);
- NSF International (www.nsf.org - disponible en anglais seulement);
- Water Quality Association (www.wqa.org - disponible en anglais seulement);
- UL LLC (www.ul.com - disponible en anglais seulement);
- International Association of Plumbing and Mechanical Officials (www.iapmo.org - disponible en anglais seulement).
Une liste à jour des organismes de certification accrédités peut être obtenue auprès du CCN (2014).
D'après les données publiées dans la littérature, les appareils à osmose inverse pour utilisation résidentielle sont censés réduire efficacement les concentrations de bromate dans l'eau potable (van der Hoek et coll., 1998; Carrasco-Turigas et coll., 2013). Bien qu'il y ait peu de publications sur l'emploi de la distillation pour éliminer le bromate dans l'eau potable, on estime que la distillation peut être adéquate, parce qu'elle réduit efficacement les contaminants inorganiques. Cependant, le procédé nécessite une alimentation électrique. L'échange d'ions peut également éliminer efficacement le bromate dans l'eau potable, d'après les résultats obtenus dans les installations municipales et présentés à la section 7.4.2.5.
Bien qu'aucun dispositif de traitement résidentiel ne soit certifié pour l'élimination du bromate, il est recommandé que les dispositifs de traitement de l'eau potable soient certifié selon la norme 58 de NSF/ANSI (pour les systèmes utilisant l'osmose inverse), la norme 62 de NSF/ANSI (pour les systèmes utilisant la distillation) ou la norme 53 de NSF/ANSI (concernant les effets à la santé des dispositifs de traitement). L'eau qui a été traitée par osmose inverse ou distillation peut être corrosive pour l'intérieur des éléments de plomberie. Ces dispositifs devraient donc être installés uniquement au point d'utilisation. En outre, ces deux types de systèmes de traitement de l'eau potable sont conçus pour être installés uniquement au point d'utilisation, car il faut de grandes quantités d'eau pour obtenir le volume requis d'eau traitée, ce qui n'est généralement pas pratique si on les installe au point d'entrée de l'eau d'une résidence.
Des essais de contrôle périodiques devraient être effectués par un laboratoire accrédité sur l'eau qui pénètre dans le dispositif de traitement et l'eau traitée pour s'assurer de l'efficacité du dispositif de traitement. Les dispositifs de traitement peuvent perdre leur capacité d'élimination avec l'usage au fil du temps, et doivent être entretenus ou remplacé. Les consommateurs devraient vérifier la longévité prévue des composants de leur dispositif de traitement, conformément aux recommandations du fabricant, et veiller à leur entretien au besoin.
8.0 Cinétique et métabolisme
La cinétique et le métabolisme du bromate ont été étudiés surtout chez les animaux de laboratoire.
8.1 Absorption
Le bromate administré par intubation gastrique à des rats Wistar mâles (0,625-100 mg/kg de poids corporel [p.c.]) était rapidement absorbé et partiellement excrété, sous forme inchangée, dans l'urine, la concentration maximale dans le plasma étant atteinte après 15 minutes et dans l'urine après 2 heures (Fujii et coll., 1984). Les auteurs ont indiqué que le bromate avait également été partiellement réduit en bromure.
L'absorption du bromate par intubation gastrique chez les rats a été mesurée au moyen de bromate marqué au 18O par Delker et coll. (2006). Les concentrations les plus élevées ont été détectées dans les reins et le foie, indiquant une absorption par le système digestif au profit de la grande circulation. Des recherches additionnelles réalisées au National Health and Environmental Effects Research Laboratory de l'U.S. EPA ont été résumées dans un rapport de la Water Research Foundation (Cotruvo et Bull, 2012), et on y indiquait que la pente d'absorption de 18O dérivée du bromate marqué dans les reins changeait de façon spectaculaire lorsque la dose augmentait de 0,5 à 5 mg/kg p.c., et au-delà.
Plus récemment, l'absorption et l'élimination du bromate chez des rats F344 ont été étudiées par Bull et coll. (2012), qui ont caractérisé la biodisponibilité systémique du bromate par voie orale. Les rats avaient été exposés à du bromate par gavage ou par voie intraveineuse. Les résultats semblaient indiquer une saturation de la dégradation du bromate aux doses élevées, et on a avancé qu'à une dose faible (≤ 0,077 mg/kg p.c.), la dégradation gastrique et plasmatique pourrait réduire la biodisponibilité systémique du bromate administré par voie orale (Keith et coll., 2006).
8.2 Distribution
L'administration de bromate à des rats Wistar mâles à une dose de 100 mg/kg p.c. par gavage oral s'est traduite par une large distribution, comme l'ont indiqué les augmentations importantes de concentrations de bromure dans les reins, le pancréas, l'estomac, les globules rouges et le plasma, 24 heures après l'administration (Fujii et coll., 1984).
Bull et coll. (2012) ont signalé que les concentrations plasmatiques maximales (Cmax) et l'aire sous la courbe (ASC) concentration plasmatique-temps étaient reliées linéairement avec la dose intraveineuse chez des rats F344 à qui on avait administré jusqu'à 0,77 mg/kg p.c. Toutefois, aux doses plus élevées (1,9 et 3,8 mg/kg p.c.), on constatait une augmentation disproportionnée de ces paramètres et une importante diminution du volume de distribution. On a proposé qu'une fraction importante du bromate était distribuée dans l'espace intracellulaire des tissus aux doses plus élevées, car les thiols plasmatiques s'épuisent et sont moins disponibles pour réduire le bromate en bromure (Bull et coll., 2012). Cette hypothèse corrobore les constatations de Delker et coll. (2006), qui ont fait état d'une augmentation importante des concentrations de 18O dans le rein et le foie du rat à des doses de bromate marqué au 18O de 10 mg/kg p.c. et plus élevées, après administration par gavage. La capacité moindre d'éliminer les métabolites du bromate marqué au 18O peut être attribuable à la saturation de la réponse des antioxydants.
On a également observé une relation linéaire pour l'ASC et Cmax chez les rats ayant reçu des doses orales de bromate atteignant 15,3 mg/kg p.c. Aux doses plus élevées (c.-à-d. les doses qui deviennent cancérogènes chez les rats), une proportion plus élevée de bromate peut être acheminée aux tissus sous une forme inchangée, en raison d'une saturation des réducteurs. Bull et coll. (2012) ont fait l'analyse des concentrations plasmatiques maximales obtenues par administration intraveineuse ou orale du bromate et de leurs conséquences possibles sur l'acheminement du bromate vers les tissus cibles. Une perte initiale différentielle de bromate a été observée à la suite de sa réduction en Br−. Une faible fraction du bromate administré atteindrait la grande circulation aux doses faibles. Toutefois, les composés organiques bromés sont produits dans cette plage de doses. Les sous-produits pourraient contribuer à la toxicité (Bull et coll., 2012).
8.3 Métabolisme
La dégradation du bromate a été étudiée suite à son ajout à du sang de rat frais (Bull et coll., 2012). Une perte initiale rapide et disproportionnée de bromate (réduit en bromure) s'est produite aux concentrations inférieures à 320 µM, et elle a été suivie d'une perte de taux secondaire qui semblait correspondre à la perte observée dans des échantillons soumis à des concentrations initiales plus élevées de bromate.
Le temps d'absorption du bromate dans le plasma a également été étudié in vivo. La demi-vie terminale moyenne du bromate administré par voie orale était de 37 minutes. Les auteurs ont proposé que le déficit de brome total récupéré après l'excrétion pouvait être attribuable à la production de substances biochimiques bromées in vivo, qui sont métabolisées et éliminées plus lentement (Bull et coll., 2012).
Fujii et coll. (1984) ont également fait état de la dégradation rapide et en peu de temps du bromate administré par voie orale à des rats, et aucun bromate n'avait été détecté dans les organes corporels ou le sang 24 heures après l'administration. Les concentrations de bromure dans plusieurs organes, le plasma et l'urine avaient toutefois augmenté après l'administration du bromate.
8.4 Excrétion
Le bromate administré par voie orale est absorbé et partiellement excrété dans l'urine, sous une forme inchangée. Une partie du bromate restant est réduite en bromure et est également excrétée dans l'urine ou, dans une moindre mesure, dans les selles (Fujii et coll., 1984). Les concentrations de bromate liées à la dose ont été détectées dans l'urine de rats ayant reçu des doses orales de 5 mg/kg p.c. et plus, mais non à des doses de 2,5 mg/kg p.c. ou moins.
De même, Bull et coll. (2012) ont observé une réduction chimique de la majeure partie du bromate administré (0,077-15,3 mg/kg p.c.) par voie orale (gavage) ou par voie intraveineuse à des rats en brome. Une augmentation de l'excrétion de brome, liée à la dose, a également été signalée. Un déficit de la récupération du brome a été observé, car environ 75 % du brome a été récupéré chez les rats mâles à toutes les doses (mais moins chez les femelles), et le brome organique total ne compensait pas la perte. Cela pourrait suggérer une rétention des composés bromés dans le corps. Toutefois, il est à noter que la rétention du brome organique dans les tissus n'a pas été quantifiée, et que seule son élimination par voie urinaire a été mesurée. D'autres études seraient requises pour conclure que la formation de sous-produits explique le déficit dans l'élimination du brome.
La demi-vie du bromate dans du suc gastrique réel a été établie à 144 minutes, et la demi-vie du suc gastrique de synthèse a été établie à 90 minutes. Toutefois, il faut préciser que la dégradation du suc gastrique a été déterminée dans une culture statique qui ne tenait pas compte du fait que l'absorption dans le système circulatoire entrerait en compétition avec le processus de dégradation (Keith et coll., 2006; Campbell, 2013). Les données sur le temps d'absorption in vivo,publiées par Bull et coll. (2012), indiquent une clairance initiale rapide du bromate dans le plasma chez le rat ainsi qu'une faible biodisponibilité (Campbell, 2013).
8.5 Modèles PBPK
Les résultats publiés dans la littérature ont souligné l'importance d'utiliser un modèle pharmacocinétique à base physiologique (PBPK) pour l'évaluation du risque lié au bromate (Bull et Cotruvo, 2006, 2013). Selon un modèle préliminaire, les concentrations maximales de bromate provenant de l'eau potable et se retrouvant dans le plasma du rat étaient inférieures à celles qu'on obtenait avec des doses administrées en bolus par intubation gastrique, car la consommation d'eau potable était répartie pendant la journée (Bull et Cotruvo, 2013).
Santé Canada a utilisé le modèle PBPK dans son évaluation du risque actuel afin de calculer des concentrations équivalentes pour l'humain qui seraient représentatives des données d'absorption, d'élimination et de clairance du bromate chez le rat (Campbell, 2013). Ce modèle était basé sur les modèles précédemment publiés pour le perchlorate (Clewell et coll., 2003; Merrill et coll., 2005) et le modèle préliminaire pour le bromate (Fisher et Bull, 2006). Ce modèle comporte plusieurs compartiments : globules rouges, tube digestif, foie, peau et « reste du corps ». Les voies d'acheminement des doses comprenaient les voies intraveineuse, orale (bolus et eau potable), cutanée et l'inhalation. Les ensembles de données utilisés dans le modèle provenaient d'études chez la rate, qui semblent représenter davantage les risques de cancérogénicité chez l'humain, selon les données publiées par Bull et coll. (2012).
L'élaboration du modèle a comporté trois phases. Au cours de la première phase, les paramètres de distribution et de clairance ont été estimés d'après l'ensemble de données sur le temps d'absorption dans le plasma, par voie intraveineuse (Bull et coll., 2012). La deuxième phase du modèle a consisté à estimer les vitesses d'absorption par voie orale et la dégradation présystémique dans l'intestin. Au cours de la troisième phase, on a estimé la clairance urinaire d'après les données publiées par Bull et coll. (2012) et Fujii et coll. (1984). Le modèle final a ensuite été extrapolé aux humains, au moyen d'une paramétrisation propre à l'espèce tenant compte de la physiologie et des pratiques standards de mise à l'échelle pour les constantes de vitesse, car il n'y a pas de données publiées sur le bromate dans l'urine ou le plasma humain. De manière plus précise, les débits (c.-à-d. clairance urinaire) ont été échelonnés à PC¾, et les constantes de vitesse de premier ordre (c.-à-d. vitesse d'absorption par voie orale) ont été échelonnées à PC−¼. Les vitesses de réaction comme la dégradation gastro-intestinale et la réduction du glutathion (GSH) n'ont pas changé. Les paramètres de dose dérivés à partir de ce modèle ont été calculés après que le modèle ait accumulé des données pendant 7 jours, et comprenaient l'aire sous la courbe temps d'absorption pour le plasma quotidien (AUCq) et la concentration plasmatique moyenne (CPlmoy).
Le modèle montre une linéarité distincte pour les valeurs ASCj dans le plasma, Cmoy et Cmax sur toute la plage des doses utilisées (10 à 500 ppm dans l'eau potable), même si plusieurs processus non linéaires ont été incorporés (réaction avec le plasma GSH/thiol, absorption à diffusion limitée dans les compartiments tissulaires, clairance du plasma et clairance des compartiments tissulaires). On a également constaté que ce modèle était compatible avec les ensembles de données obtenus par voie intraveineuse et orale, publiés par Bull et coll. (2012).
Les concentrations équivalentes dans l'eau potable chez l'humain correspondant aux paramètres de dose pour le bromate dans le plasma, provenant d'essais biologiques chez les rongeurs, ont été calculées d'après un taux d'ingestion de 1,5 L/jour chez un humain de 70 kg pendant 24 heures. Les concentrations calculées d'après l'ASC étaient presque identiques à celles qui étaient basées sur la CPlmoy. Les concentrations basées sur l'ASC ont été utilisées pour la présente évaluation du risque, car elles étaient légèrement plus conservatrices. Les concentrations équivalentes chez l'humain utilisées dans l'évaluation du risque et correspondant aux doses de 0,02, 0,1, 0,2 et 0,4 g/L chez les rats (DeAngelo et coll., 1998) sont de 54,2, 240, 493 et 1 088 ppm (mg/L) dans l'eau potable, respectivement.
Il y a lieu de noter que le modèle PBPK ne tenait pas compte de la perte initiale rapide de bromate qui avait été constatée dans l'essai in vitro sur le sang total, ce qui pourrait indiquer que très peu de bromate serait disponible pour une distribution systémique en dessous d'un certain niveau. Ces données in vitro n'étaient pas compatibles avec les données sur le temps d'absorption dans le plasma in vivo. Il faudra pousser plus à fond l'élaboration d'une méthode in vivo afin d'incorporer cette perte initiale dans le modèle du bromate (Campbell, 2013). De plus, il y a une certaine incertitude dans les concentrations de bromate de fond mesurées chez des rats non exposés, lorsque les prévisions du modèle sont en deçà des valeurs de fond (10 µg/L). Une incertitude additionnelle dans le modèle a été relevée, car il n'existe pas de données chez l'humain qui seraient utilisables pour valider le modèle pour l'extrapolation des données par voie orale des animaux de laboratoire à l'humain. On a mis à l'échelle les constantes de vitesse de premier ordre à PC−¼, ce qui donne un taux plus faible chez l'humain, et également une fraction plus faible de la dose absorbée par gavage oral.
Le modèle PBPK pour le bromate appliqué au rat a reproduit les données obtenues in vivo chez le rat. Bien que le modèle prévoie de manière adéquate la cinétique du plasma et l'excrétion urinaire chez le rat, on ne disposait pas de concentrations chez l'humain pour la validation du modèle (Campbell, 2013), ce qui est une limitation importante de celui-ci. Comme les différences de la cinétique du bromate chez le rat et l'humain ne sont pas connues, l'évaluation du bromate faite par Santé Canada tient compte de l'incertitude associée à ces différences en maintenant un facteur d'ajustement allométrique (pour l'approche de risques de cancer) et une valeur de 10 pour le facteur d'incertitude intraespèces (pour l'approche de risques autres que le cancer). En règle générale, les résultats du modèle PBPK, avec l'application d'un facteur d'ajustement allométrique pour tenir compte des différences interespèces, et les résultats de l'approche par défaut utilisant un facteur d'attribution étaient presque identiques pour l'évaluation du risque de cancer et variaient d'un facteur inférieur à trois pour l'évaluation de risques autres que le cancer. Les résultats du modèle PBPK sont présentés à la section 10, en parallèle avec les résultats obtenus par une approche d'évaluation basée sur le risque par défaut (c.-à-d. qui n'utilise pas le modèle PBPK).
9.0 Effets sur la santé
9.1 Effets chez les humains
9.1.1 Toxicité aiguë
Les effets aigus du bromate chez les humains ont été signalés après des empoisonnements qui résultaient surtout de l'ingestion de produits capillaires contenant du bromate. La dose ingérée a été estimée entre 12 et 50 g, et des décès ont été signalés chez 9 des 24 adultes touchés (Kurokawa et coll., 1990).
Les premiers effets suivant une exposition orale aiguë au bromate comprennent le vomissement, la diarrhée et les douleurs abdominales. Par la suite, les effets peuvent comprendre l'oligurie, l'anurie, la surdité, le vertige, l'hypotension, la dépression du système nerveux central, la thrombocytopénie et la défaillance rénale (Campbell, 2006).
L'ingestion du bromate a été associée à une perte irréversible de l'ouïe (ototoxicité) à des doses élevées (Campbell, 2006). L'apparition de l'ototoxicité suivant une exposition à une dose élevée est rapide (4 à 16 heures). Toutefois, la possibilité de perte retardée ou progressive de l'ouïe n'a pas été étudiée dans la littérature.
9.1.2 Toxicité subchronique et chronique et cancérogénicité
On ne dispose d'aucune étude faisant état d'effets sur la santé des humains à la suite de l'exposition à long terme au bromate. Le bromate a été classifié comme cancérogène possible pour l'humain (groupe 2B) par le Centre international de recherche sur le cancer (CIRC, 1999) en raison de preuves insuffisantes chez les humains, mais de preuves suffisantes chez les animaux de laboratoire.
9.1.3 Toxicité pour la reproduction et le développement
La toxicité pour la reproduction et le développement associée à l'exposition au bromate n'a pas été documentée chez les humains. Cependant, certaines préoccupations ont été soulevées dans la littérature au sujet de l'absence d'études sur la neurotoxicité du bromate pour le développement (Campbell, 2006; Crofton, 2006). La marge d'exposition entre les faibles concentrations de bromate trouvées dans l'eau potable et les doses aiguës élevées qui ont causé l'ototoxicité rapportée chez les humains est très large.
9.2 Effets chez les animaux de laboratoire
9.2.1 Toxicité aiguë
Les valeurs de dose létale (DL50) orale ont été obtenues pour le bromate de potassium par Kurokawa et coll. (1990), qui utilisaient une seule dose par intubation intragastrique et observaient les animaux pendant 7 jours. On a souligné que les valeurs étaient plus grandes chez les femelles que chez les mâles, pour toutes les espèces testées. Les auteurs ont rapporté des valeurs DL50 de 388 mg/kg p.c. (mâles) et de 460 mg/kg p.c. (femelles) chez le hamster doré de Syrie. La même étude indiquait des valeurs DL50 de 280 mg/kg p.c. (mâles) et de 355 mg/kg p.c. (femelles) chez la souris B6C3F1 et de 400 mg/kg p.c. (mâles) et de 495 mg/kg p.c. (femelles) chez le rat F344. Les auteurs ont également cité une communication personnelle selon laquelle on avait trouvé des valeurs DL50 pour le rat Wistar de 160-180 mg/kg p.c. On a également publié des valeurs DL50 orales de 223-363 mg/kg p.c. pour le bromate de potassium administré par voie orale chez la souris (Nakajima et coll., 1989). Kawana et coll. (1991) ont signalé une DL50 orale chez le rat Wistar de 159 mg/kg p.c., ce qui est compatible avec ces résultats.
Les valeurs DL50 pour le bromate de sodium publiées par Sax et coll. (1979) étaient de 140 mg/kg p.c. (voie intrapéritonéale) pour la souris et de 250 mg/kg p.c. (voie orale) pour le lapin.
Les effets aigus signalés de l'administration du bromate de potassium aux rats Wistar comprenaient l'hémochromatose dans les reins, le foie et la rate (Kawana et coll., 1991). Des rats Long-Evans mâles qui avaient reçu une dose unique de bromate de potassium à raison de 0, 129, 192, 257 ou 385 mg/kg p.c. par gavage présentaient des symptômes de diarrhée et des signes de sédation après une exposition de 6 heures au niveau de dose le plus élevé (Fujie et coll., 1988). Dans une étude dans laquelle un nombre non indiqué de rats avaient reçu une dose orale unique de bromate de potassium de 100 mg/kg p.c. et avaient été sacrifiés de 12 à 168 heures après le traitement, les auteurs ont signalé des dommages oxydatifs réversibles aux reins, l'effet maximal ayant été constaté 48 heures après l'administration (Ahmad et coll., 2012). Une étude subséquente a également indiqué que le bromate de potassium provoquait un stress oxydatif dans le sang du rat, comme le démontraient l'augmentation de peroxydation lipidique, d'oxydation des protéines et des niveaux de peroxyde d'hydrogène, et la diminution de la teneur en GSH. Les auteurs ont également mentionné une déficience du pouvoir antioxydant (Ahmad et Mahmood, 2012).
9.2.2 Exposition à court terme
Dodd et coll. (2013) ont étudié la toxicité subchronique du bromate administré à des rats F344 dans l'eau potable, après des expositions de 2 et 13 semaines. Des concentrations de bromate de potassium dans l'eau potable de 0, 5, 20, 100, 200 et 400 mg/L ont été étudiées, avec 10 rats par groupe de dose. Des gouttelettes hyalines ont été observées dans les tubules rénaux des rats exposés au bromate de potassium dans de l'eau potable à des concentrations de 200 et 400 mg/L (aucune modification microscopique n'a été observée dans les poumons, le foie, la thyroïde ou la tunique vaginale). Une dose sans effet observé (NOEL) pour le bromate de potassium de 100 mg/L (8,1 mg/kg p.c. par jour) a été établie, d'après l'absence d'altérations microscopiques dans les reins. Une étude ultérieure par Umemura et coll. (2004) a permis d'observer une accumulation importante d'α2µ-globuline dans les tubules proximaux rénaux chez le rat mâle, après 4 semaines d'exposition à du bromate de potassium dans de l'eau potable à des concentrations de 125, 250 et 500 mg/L.
La toxicité rénale a également été constatée chez la souris SPF-ddy mâle par Kawana et coll. (1991). Les souris (9 par groupe) ont ingéré du bromate de potassium dans l'eau potable à des concentrations de 0, 100, 500, 1 000, 2 500 ou 5 000 ppm (0, 10,8, 54, 108, 270 et 540 mg BrO3/kg-jour, respectivement) pendant 2 semaines. Le groupe ayant reçu la dose élevée a manifesté une inhibition de la prise de poids corporel. L'autopsie des reins, des poumons et du foie a démontré une augmentation importante du poids des organes au-dessus de celle des témoins. Cependant, ces modifications ne semblaient pas liées à la dose. Les concentrations de phosphatase alcaline, de gamma-glutamyltranspeptidase et d'α- fœtoprotéine dans les groupes ayant reçu 270 et 540 mg/kg p.c. par jour avaient grandement augmenté par rapport aux témoins. D'après ces changements, une dose sans effet nocif observé (NOAEL) pour le bromate dans cette étude a été établie à 108 mg/kg p.c. par jour.
Guo et coll. (2001) ont évalué la toxicité du bromate de sodium chez la souris B6C3F1 femelle. Du bromate de sodium dans de l'eau potable a été administré à ces souris à des concentrations de 0, 20, 80, 400, 600 ou 800 ppm pendant 28 jours. Dans l'ensemble, on n'a constaté aucune différence entre les groupes traités et les témoins pour ce qui est du poids corporel, de la prise de poids corporel ou encore du poids du thymus, du foie et des poumons. On a observé une augmentation du poids de la rate. Seules des modifications minimes ont été observées (légère augmentation des lymphocytes B à une dose de 600 ppm et diminution de l'effet suppresseur des macrophages sur la prolifération des cellules cancéreuses B16F10) parmi un grand nombre de paramètres immunologiques testés. Globalement, les auteurs ont indiqué que l'exposition au bromate de sodium par l'entremise de l'eau potable produisait des effets toxicologiques et immunologiques minimes aux concentrations utilisées.
Dans une étude sur la toxicité pour la reproduction et le développement à court terme, on a administré du bromate de sodium dans de l'eau potable (concentrations de 0, 25, 80 et 250 ppm) à des rats Sprague-Dawley pendant 35 jours. On n'a observé aucun changement dans les paramètres de reproduction chez les femelles. Toutefois, les mâles démontraient une diminution de la densité du sperme épididymal. On a estimé que le bromate de sodium était une substance toxique sélective pour les mâles, et on a déduit des résultats une dose minimale avec effet nocif observé (LOAEL) de 16,1 mg/kg p.c. par jour et une NOAEL de 5,5 mg/kg p.c. par jour (NTP, 1996).
On a constaté des effets sur les systèmes auditif et vestibulaire chez les cobayes qui avaient reçu par voie sous-cutanée du bromate de potassium à 20 ou 50 mg/kg p.c. par jour pendant 14 jours (Chuu et coll., 2000; Young et coll., 2001). Cette ototoxicité a été comparée aux effets constatés chez les coiffeurs exposés dans leur travail au bromate de potassium dans les solutions capillaires de frisage, ce qui permet de croire que cet effet est pertinent pour l'humain.
9.2.3 Exposition à long terme et cancérogénicité
On a signalé que le bromate de potassium est cancérogène chez le rat et la souris, provoquant diverses tumeurs, y compris des tumeurs rénales (adénomes et adénocarcinomes), des adénomes et des adénocarcinomes de la thyroïde ainsi que des mésothéliomes dans la tunique vaginale. On a déterminé que l'animal le plus sensible est le rat mâle.
Kurokawa et coll. (1983) ont examiné la cancérogénicité du bromate de potassium administré à des rats F344 à une concentration de 250 ou 500 mg/L dans de l'eau potable pendant 110 semaines. Les auteurs ont indiqué que le temps moyen de survie était raccourci chez les rats mâles exposés à la dose élevée, et ils ont mentionné une incidence beaucoup plus grande de tumeurs rénales par rapport aux témoins chez les mâles et les femelles dans les deux groupes de dose.
Dans une étude ultérieure, Kurokawa et coll. (1986a) ont examiné la relation dose-réponse pour le bromate de potassium chez des rats F344 mâles. Des groupes de 20 à 24 rats ont été exposés à du bromate de potassium dans de l'eau potable à des concentrations allant de 15 à 500 ppm pendant 104 semaines. On a observé que les tumeurs rénales (adénomes et adénocarcinomes combinés) et les adénomes rénaux avaient augmenté par rapport aux témoins dans les groupes exposés à du bromate de potassium à raison de 125, 250 ou 500 ppm. En outre, on a constaté une augmentation importante de l'incidence des foyers de dysplasie rénale à des concentrations de bromate de potassium de 30 ppm et plus. Des mésothéliomes péritonéaux ont été relevés à des concentrations de bromate de potassium aussi faibles que 30 ppm, et cette augmentation devenait importante à 500 ppm. L'incidence combinée d'adénocarcinomes de la thyroïde et d'adénomes folliculaires était également importante à 500 ppm. Les auteurs ont également constaté une augmentation importante des tumeurs rénales et des adénomes rénaux, combinés, dans le cadre d'une étude séparée dans laquelle on avait exposé des rats F344 mâles et femelles à du bromate de potassium dans de l'eau potable à une concentration de 250 ou 500 ppm (Kurokawa et coll., 1986b). L'examen de la durée du traitement dans ces études a permis de conclure qu'une durée de 13 semaines est suffisante pour induire la cancérogénicité chez les rats qui ingèrent du bromate de potassium dans leur eau potable à une concentration de 500 ppm (dose totale de 4 g/kg p.c.) (Kurokawa et coll., 1987).
L'incidence des tumeurs rénales, des tumeurs thyroïdiennes et des mésothéliomes chez le rat a également affiché une augmentation avec la dose de bromate de potassium, dans le cadre d'une étude réalisée par DeAngelo et coll. (1998). On avait administré à des rats F344 (50 rats par groupe) du bromate de potassium à de faibles doses de 0,02, 0,1, 0,2 et 0,4 g/L dans leur eau potable, pendant des périodes atteignant 100 semaines. D'après les concentrations dans l'eau potable, on a calculé que les doses équivalentes chez les rats avaient été de 1,1, 6,1, 12,9 et 28,7 mg/kg p.c. par jour (Campbell, 2013). Tous les animaux qui avaient survécu jusqu'à la fin de l'étude ont été complètement autopsiés, et un examen macroscopique de tous leurs tissus a été effectué. Les rats mâles ayant reçu du bromate de potassium dans l'eau potable à une concentration de 0,4 g/L présentaient une augmentation des tumeurs rénales, surtout localisées dans le cortex rénal, mais quelques-unes s'étendaient à la région médullaire. Les tumeurs rénales (adénomes et carcinomes combinés) se sont développées à des concentrations ≥ 0,1 g/L, mais augmentaient de façon appréciable à la dose élevée. Bien qu'il ne s'agisse pas d'un effet cancérogène, une incidence accrue de l'hyperplasie urothéliale du bassinet du rein (caractérisée par une augmentation du nombre de couches de cellules urothéliales qui recouvrent le bassinet rénal et les papilles) chez les rats traités au bromate de potassium a été signalée à une concentration de 0,1 g/L (6,1 mg/kg p.c. par jour), avec une NOAEL de 0,02 g/L (0,1 mg/kg p.c. par jour). Les auteurs ont également fait état d'une augmentation, en fonction de la dose, de l'incidence des tumeurs thyroïdiennes et des mésothéliomes se manifestant sur la tunique vaginale des testicules des rats mâles aux faibles doses, et qui devenait importante aux concentrations de 0,2 g/L et 0,1 g/L, respectivement (DeAngelo et coll., 1998; Crosby et coll., 2000).
La relation entre la dose et le temps pour les tumeurs induites par le bromate a été étudiée chez les rats F344 mâles (Wolf et coll., 1998). Du bromate de potassium a été administré aux rats dans l'eau potable à des concentrations de 0, 0,02, 0,1, 0,2 ou 0,4 g/L pour 12, 26, 52, 78 ou 100 semaines. Des tumeurs étaient présentes dans les cellules rénales après 52 semaines de traitement seulement dans le groupe ayant reçu la dose élevée. Des mésothéliomes se sont développés sur la tunique vaginale après 52 semaines de traitement, et on les a retrouvés à d'autres endroits que les testicules après 78 semaines, ce qui permet de supposer que leur origine était la tunique vaginale des testicules. Les tumeurs de la vésicule thyroïdienne étaient présentes après 26 semaines seulement chez les groupes traités à raison de 0,1 et 0,2 g/L.
DeAngelo et coll. (1998) ont également étudié l'effet du bromate de potassium chez des souris ayant consommé de l'eau potable contenant le composé à une concentration de 0,08, 0,4 et 0,8 g/L. Les auteurs ont constaté une augmentation, dépendante du traitement mais non de la dose, de l'incidence des tumeurs rénales chez les souris exposées au bromate de potassium à une concentration de 0,08 g/L pendant 100 semaines (DeAngelo et coll., 1998). Par conséquent, on a trouvé que les souris étaient moins sensibles que les rats à la cancérogénicité induite par le bromate de potassium.
L'injection sous-cutanée, chez des souris nouveau-nées, d'une dose cumulative de 400-800 mg/kg p.c. de bromate de potassium par jour pendant 4 semaines a donné lieu à une augmentation de l'incidence combinée de lymphomes et de leucémies chez les souris mâles (8/20) par rapport aux témoins (1/15). Aucune cancérogénicité accrue n'a été observée après une injection sous-cutanée de bromate de potassium (jusqu'à 100 mg/kg p.c. une fois par semaine pendant 4 semaines) chez des rats nouveau-nés (Matsushima et coll., 1986; CIRC, 1999).
Le bromate de potassium semblait moins puissant chez le hamster doré de Syrie mâle après une administration à long terme, par le truchement de l'eau potable, à une concentration de 0, 125, 250, 500 ou 2 000 mg/L pendant 89 semaines (équivalant à 0, 5,6, 12, 20 et 84 g/kg p.c. par jour, respectivement). L'incidence des tumeurs tubulaires rénales avait également augmenté chez tous les groupes traités, même si les résultats n'étaient pas statistiquement significatifs, et on n'a pas observé de relation de dépendance avec la dose (Takamura et coll., 1985; CIRC, 1999).
Les propriétés du bromate de potassium comme initiateur de tumeur ont été étudiées chez des rats F344/NCr auxquels on avait administré une seule dose de bromate de potassium de 300 mg/kg p.c., correspondant à la dose tolérée maximale, par voie intragastrique. Des groupes de 39 rats avaient reçu 4 000 ppm de barbital sodique (BBNa), 2 semaines après avoir commencé un traitement au bromate de potassium, comme régime promoteur, pendant jusqu'à 104 semaines. Par la suite, on a cherché à voir s'il y avait des signes de néphropathie chez les rats. On n'a pas observé de néphropathie chez les rats ayant reçu du bromate de potassium seul, sans BBNa, mais on a constaté son incidence chez les groupes qui avaient reçu l'agent promoteur. L'incidence et la multiplicité des foyers de cellules tubulaires rénales dysplasiques et des tumeurs des cellules tubulaires rénales, observées entre les semaines 31 et 104, n'ont pas révélé un effet initiateur attribuable au traitement par le bromate de potassium. On a conclu que la dose de 300 mg/kg p.c. ne provoque pas de cancérogénèse rénale (Kurata et coll., 1992).
Un groupe d'études réalisées dans le cadre du National Toxicology Program (NTP) aux États-Unis a porté sur les effets du bromate de sodium sur des souris génétiquement modifiées. Le but de cette recherche était d'évaluer l'emploi des modèles de souris hemizygote Tg.AC et à haploïde semi-dominant p53 pour détecter la cancérogénèse des SPD et d'autres contaminants de l'environnement. On a administré aux souris du bromate de potassium par voie cutanée (64-256 mg/kg p.c. par jour pendant 26 semaines; chez les souris Tg.AC seulement) et dans leur eau potable (80-800 ppm, correspondant à environ 13-148 mg/kg p.c. par jour pendant 27-48 semaines). Malgré une diminution du poids corporel des animaux traités, on n'a pas observé d'effets néoplasiques résultant du traitement. La conclusion était que les modèles de souris n'étaient pas un moyen sensible ni rapide pour évaluer la cancérogénicité et la toxicité potentielle résultant de l'exposition au bromate de sodium (NTP, 2007).
9.2.4 Génotoxicité
Le bromate de potassium peut causer des dommages génétiques in vitro et in vivo. Comme l'indiquent les sections suivantes, plusieurs études ont signalé une plage d'effets allant des mutations ponctuelles aux mutations chromosomiques.
9.2.4.1 Résultats in vitro
On a signalé que le bromate de potassium est génotoxique, d'après des résultats positifs obtenus avec les essais d'Ames, d'aberration chromosomique et de micronoyaux. Toutefois, les essais d'Ames n'ont pas tous donné des résultats positifs. Il ressort de l'analyse des mutants que le stress oxydatif et la perte d'hétérozygotie sont des mécanismes possibles de mutagénicité.
On a obtenu des résultats positifs de mutagénicité avec l'essai d'Ames en utilisant la souche TA100 de Salmonella typhimurium à une concentration de 3 mg de bromate de potassium par plaque, après activation métabolique (Ishidate et coll., 1984; Kurokawa et coll., 1990). Des résultats négatifs, avec et sans S9, ont été obtenus dans d'autres souches de S. typhimurium (TA98, TA1535, TA1537 et TA1538) (1-10 mg/plaque), dans Escherichia coli WP2try (1-10 mg/plaque) et dans Bacillus subtilis (2-4 mg/plaque) (Kawachi et coll., 1980; Kurokawa et coll., 1990; Moore et Chen, 2006).
Le test des comètes a indiqué une mutation dépendante de la dose dans le gène Hprt des cellules V79 du hamster chinois, après une exposition au bromate de potassium à une concentration de 5, 10 ou 20 mM. Quarante pour cent des mutations dans le groupe traité étaient d'importantes suppressions, tandis qu'aucune suppression n'a été trouvée chez les témoins. En outre, seulement quatre des 28 mutations étaient des mutations ponctuelles (Speit et coll., 1999). L'analyse par chromatographie liquide à haute performance (CLHP) a révélé une augmentation importante de la concentration de la 8-oxodéoxyguanosine (8-oxodG) dans les cellules traitées au bromate de potassium. Des résultats positifs indiquant la cassure de l'acide désoxyribonucléique (ADN), à la suite du test des comètes, ont été confirmés dans les cellules ovariennes du hamster chinois (2,5-10 mM) et les cellules rénales primaires chez le rat et l'humain (0,56-1,8 mM) (Robbiano et coll., 1999; Plewa et coll., 2002; Poul et coll., 2004; Moore et Chen, 2006).
On a constaté que le bromate de potassium et le bromate de sodium augmentent la fréquence de mutation génique Tk dans les cellules de lymphome chez la souris (0,6-3 mM). Des analyses postérieures ont révélé une perte d'hétérozygotie chez presque tous les mutants, ce qui permet de supposer un mécanisme clastogène (Harrington-Brock et coll., 2003). Platel et coll.(2009, 2011) ont également étudié l'effet du bromate de potassium chez les cellules lymphoblastoïdes humaines TK6 en utilisant l'essai de mutation génique Tk, le test des comètes et l'essai de micronoyaux. Les résultats positifs laissaient supposer une relation dose-réponse seuil et des concentrations sans effet génotoxique observé, qui variaient selon l'essai réalisé. Des résultats génotoxiques positifs ont également été signalés chez les cellules L5178Y du lymphome de la souris pour les micronoyaux, des mutations du locus Tk et la cassure double brin au niveau chromosomique, bien que peu de dommages à l'ADN aient été signalés après le test des comètes (Priestley et coll., 2010). Globalement, les auteurs de cette étude ont proposé que des facteurs en sus de la génération de la 8-hydroxydéoxyguanosine (8-OHdG) prennent part à la génotoxicité du bromate de potassium dans ces cellules, et probablement dans d'autres systèmes in vitro et in vivo.De la même manière, on a obtenu des résultats positifs dans une étude des effets du bromate de potassium sur les cellules lymphoblastoïdes humaines TK6 au moyen du test des comètes, de l'essai de micronoyaux et de l'essai de mutation génique Tk (Luan et coll., 2007). Des cassures double brin ont été signalées avec le test des comètes, et des mutations des micronoyaux et du gène Tk ont été induites selon une relation dépendante de la dose. Une analyse moléculaire postérieure a révélé que 90 % des mutations comportaient une perte d'hétérozygotie sur le locus Tk. On a suggéré que la génotoxicité induite par le bromate de potassium était attribuable à de grandes suppressions, plutôt qu'à l'accumulation, précédemment proposée, d'adduits de la 8-OHdG qui mène aux transversions de GC en TA (Ballmaier et Epe, 2006). Les auteurs ont réalisé une analyse de l'expression qui indiquait une régulation à la hausse des gènes en cause dans l'apoptose, la réparation de l'ADN et la régulation à la hausse du stress.
Une étude réalisée par Umemura et coll. (2006) a donné peu de preuves de transversions de GC en TA à des doses de bromate de potassium inférieures à 500 mg/L.
Le bromate de potassium a également donné des résultats positifs dans les essais d'aberration chromosomique, se soldant par des cassures et des échanges de chromatides (Ishidate et coll., 1984; Speit et coll., 1999).
De nombreux effets génotoxiques ont été signalés après l'exposition de cellules humaines au bromate de potassium. Un examen de la génotoxicité des lymphocytes du sang périphérique chez les humains, traités au bromate de potassium à raison de 400-550 µg/mL pendant 24 et 48 heures, comportait un échange de chromatides sœurs, des essais d'aberration chromosomique et des essais de micronoyaux (Kaya et Topaktas, 2007). Des résultats positifs ont été obtenus dans tous ces essais. Cependant, les doses et les temps qui donnaient des résultats statistiquement significatifs étaient variables.
On a signalé que le bromate de potassium induisait des cassures de brin d'ADN dans des cellules humaines cultivées (HL-60, HL-100) et dans des cellules de lymphome de la souris (L1210) (Ballmaier et Epe, 2006; Kawanishi et Murata, 2006). On a indiqué que les radicaux de bromure formés en présence de thiols étaient responsables des dommages à l'ADN. La formation de la 8-déoxyguanosine était induite.
9.2.4.2 Résultats in vivo
On a obtenu des résultats positifs dans une étude portant sur les effets aigus du bromate sur les cellules de la moelle osseuse chez des rats Long-Evans mâles après l'administration par voie orale (334,0 mg/kg) ou intrapéritonéale (250,5 mg/kg) de doses élevées de bromate. Dans les deux cas, le nombre de cellules aberrantes augmentait de manière progressive, avec une valeur maximale de 10,5 % atteinte 12 heures après l'administration par voie intrapéritonéale, et une valeur maximale de 10,8 % atteinte 18 heures après l'administration par voie orale (Fujie et coll., 1988; Kurokawa et coll., 1990).
L'administration de bromate de potassium à des souris et à des rats a donné des résultats positifs dans l'essai de micronoyaux. Sur des souris CD-1 et Ms/Ae ayant reçu du bromate de potassium par voie intrapéritonéale (18,8-150 mg/kg p.c.) ou par gavage (37,5-300 mg/kg p.c.), les résultats ont été positifs, avec des réponses dépendantes de la dose dans l'essai des micronoyaux chez les souris, en utilisant des érythrocytes polychromatiques de la moelle osseuse fémorale (Nakajima et coll., 1989). Des résultats similaires ont été obtenus chez la souris ddY mâle pour deux voies d'exposition : gavage oral (plus de 100 mg/kg p.c.) et voie intrapéritonéale (plus de 25 mg/kg p.c.), alors que l'essai de micronoyaux a donné des résultats positifs dans les érythrocytes de la moelle osseuse (Hayashi et coll., 1988). Dans le même ordre d'idées, la fréquence des érythrocytes polychromatiques micronucléés avait augmenté d'une manière dépendante de la dose chez les souris CD-1 et MS/Ae (Hayashi et coll., 1989). On a également signalé des résultats positifs chez la souris CD-1 en utilisant les réticulocytes du sang périphérique avec administration par voie intrapéritonéale de doses de 18,8-212 mg/kg p.c. (Awogi et coll., 1992). Les résultats chez le rat F344 mâle ont également montré des micronoyaux significativement plus nombreux dans les réticulocytes du sang périphérique après l'administration par voie intrapéritonéale de bromate de potassium à 16 mg/kg p.c. Cette augmentation était inhibée par un cotraitement avec le GSH ou la cystéine, et un traitement quotidien avec de la vitamine C produisait également un effet protecteur (Sai et coll., 1992a). Il ressort de ces résultats que les espèces réactives de l'oxygène peuvent jouer un rôle important dans la clastogénicité induite par le bromate.
La mutagénicité in vivo du bromate a également été étudiée par Allen et coll. (2000), qui ont caractérisé la clastogénicité des érythrocytes chez des souris B6C3F1 chroniquement exposées au bromate dans de l'eau potable à des concentrations de 0,08, 0,4 et 0,8 g/L pendant 8 semaines. En outre, les auteurs ont échantillonné des souris issues de la même cohorte que celle utilisée dans l'étude de tumorigénicité réalisée par DeAngelo et coll. (1998), et ils ont indiqué des niveaux de dommages chromosomiques pour divers groupes de doses après 78 semaines d'exposition aux mêmes doses. Dans l'ensemble, les résultats indiquent que le bromate induit la formation de micronoyaux dans les érythrocytes d'une manière dépendante de la dose, bien que cette relation dose-réponse ne se fasse pas en parallèle à celle de la cancérogénèse, pour laquelle une importante incidence de tumeurs avait été observée seulement dans le groupe ayant reçu la plus faible dose. On a proposé que la fragmentation chromosomique et la perte de fragments jouent un rôle dans le mécanisme, ce qui est compatible avec le métabolisme mettant en cause la peroxydation lipidique et les radicaux qui s'attachent à l'ADN, plutôt qu'aux protéines cibles. Les auteurs ont également examiné les effets du bromate de potassium sur les cellules germinales de souris exposées aux doses susmentionnées pendant 8 semaines, en examinant les spermatides au moyen de l'essai de micronoyaux. Le bromate ne semblait pas être clastogène pour les cellules germinales, et on n'a observé aucun effet apparent sur les spermatides (Allen et coll., 2000).
Umemura et coll. (2004) ont administré du bromate de potassium à des rates (300 mg/kg p.c. par intubation intragastrique unique, ou 80 mg/kg p.c. par injection intrapéritonéale unique) et ils ont mesuré les concentrations de substances réagissant avec l'acide thiobarbiturique (SRATB) et la 8-oxodG dans les reins. Les deux mesures étaient relativement élevées par rapport aux témoins. On doit cependant souligner que de plus faibles doses dans l'eau potable (15-300 ppm) n'ont pas donné de résultats positifs pour l'essai SRATB, malgré la présence de la 8-oxodG, ce qui permet de croire que le stress oxydatif peut se produire indépendamment de la peroxydation lipidique.
Des études ont permis de constater une augmentation des mutations dans le foie et les reins de la souris et du rat in vivo, associée à une accumulation de 8-oxodG. On a formulé l'hypothèse selon laquelle ces mutations étaient probablement attribuables, entre autres, aux suppressions et aux transversions de GC en TA (Moore et Chen, 2006; Umemura et coll., 2006). L'analyse de l'expression a permis d'étayer davantage la présence de la 8-oxodG comme mécanisme potentiel de la mutagénicité causée par le bromate (Delker et coll., 2006). Une augmentation des concentrations de 8-oxodG, un indicateur de dommages de l'ADN promutagènes, a été observée dans les reins de rats mâles et femelles après 4 semaines d'exposition à du bromate de potassium dans de l'eau potable (Geter et coll., 2006; Umemura et coll., 2004).
Un essai de mutagénicité in vivo a été réalisé chez les rats gpt delta mâles qui avaient ingéré du bromate de potassium dans l'eau potable à une concentration de 0 ou 500 ppm pendant 12 semaines. L'analyse subséquente des reins a révélé une augmentation des fréquences de la mutation Spi− par rapport aux témoins, ce qui représente des mutations par suppression. Aucune modification de la fréquence de mutation de gpt n'a été observée après un traitement au bromate de potassium (Umemura et Kurokawa, 2006). Subséquemment, les rats gpt delta ont été traités avec du bromate de potassium dans de l'eau potable à des concentrations de 0, 60, 125, 250 ou 500 ppm. On a signalé que la fréquence de mutation augmentait d'une manière dépendante de la dose à partir de 250 ppm, et que la dépendance était statistiquement significative à 500 ppm.
Le spectre de mutation chez les rats gpt delta mâles et femelles ayant reçu du bromate de potassium a été examiné par Umemura et coll. (2009). L'analyse des mutations chez les rats ayant reçu du bromate de potassium dans de l'eau potable à une concentration de 500 ppm pendant 9 semaines n'a pas démontré une préférence pour les transversions de GC en TA. Ce sont plutôt les mutations par suppression qui étaient les plus prévalentes, comme d'autres études l'avaient constaté (Harrington-Brock et coll., 2003; Umemura et coll., 2006; Luan et coll., 2007).
L'étude du rat Big Blue mâle a laissé entrevoir la présence d'une concentration sans effet pour la mutagénicité (Yamaguchi et coll., 2008). Dans le cadre d'une expérience, on a trouvé qu'un traitement à raison de 500 ppm de bromate de potassium augmentait de manière appréciable la fréquence des mutations, ainsi que la fréquence des transversions de GC en TA du gène lacI dans les reins par rapport aux témoins. Les doses plus faibles examinées (125 ppm et moins) ne causaient pas ces transversions. On a avancé des preuves pour indiquer que cet effet mutagène était dû à la présence de 8-OHdG causée par le stress oxydatif. Les auteurs ont constaté que des modifications rénales histopathologiques étaient observées chez les groupes exposés à des concentrations de bromate de potassium de 30 ppm et plus, d'une manière dépendante de la dose. On a avancé qu'une augmentation de la prolifération cellulaire observée chez les rats mâles à des concentrations de 125 ppm et moins serait attribuable à la cytotoxicité causée par un mécanisme différent, notamment une accumulation d'α2-microglobuline.
Bien que la recherche ait porté sur les effets toxiques du bromate de potassium, il est intéressant de noter que le bromate de sodium a également donné des résultats positifs dans un essai de mutagénicité in vivo chez les souris hémizygotes Tg.AC mâles et femelles et les souris à haploïde semi-dominant p53 (NTP, 2007). Les souris (15 de chaque sexe) exposées à du bromate de sodium dans de l'eau potable à des concentrations allant de 80 à 800 ppm pendant 27 semaines ont manifesté une relation claire dose-réponse lors des essais de micronoyaux. Des résultats similaires ont été obtenus pour l'exposition par voie cutanée, des souris ayant été exposées à du bromate de sodium dans de l'eau avec éthanol à une dose de 64-256 mg/kg p.c. par jour, 5 jours par semaine, pendant 26 semaines.
Le caractère promotionnel du bromate de potassium a été examiné après son administration à des rats à une concentration de 500 ppm dans de l'eau potable pendant 1 à 13 semaines, avec marquage par bromodéoxyuridine (BrdU), un indicateur de prolifération cellulaire. Une augmentation importante de l'indice de marquage par BrdU a été constatée dans les tubules contournés proximaux des rats mâles traités par rapport aux témoins, pendant toute la période d'expérience. L'augmentation de l'indice de marquage par BrdU a été observée après 13 semaines d'exposition chez les femelles (Umemura et coll., 1998). Une expérience subséquente a établi une relation dépendante de la dose entre l'administration de bromate dans de l'eau potable à des concentrations allant de 30 à 500 ppm chez les rats F344 mâles et des concentrations de 250 ppm et plus chez les femelles (Umemura et coll., 2004).
L'effet promoteur du bromate de potassium sur la cancérogénicité des reins causée par la N-éthyl-N-hydroxyéthylnitrosamine (EHEN) chez les rats Wistar a été étudié par Wei et coll. (2009). Les rats avaient reçu du bromate de potassium dans de l'eau potable à des concentrations allant de 0,02 ppm à 500 ppm. On a constaté qu'une cancérogénèse accrue du rein augmentait au-delà de 250 ppm, mais pas à 125 ppm et moins. En outre, les dommages oxydatifs aux reins augmentaient à 125 ppm et au-delà, mais non à 30 ppm et moins. Les auteurs ont suggéré qu'il existe une dose seuil pour les effets promoteurs du bromate de potassium sur la cancérogénèse du rein.
9.2.5 Toxicité pour la reproduction et le développement
Dans un essai de toxicité à court terme pour la reproduction et le développement, on a administré du bromate de sodium à des rats Sprague-Dawley dans l'eau potable à 0, 0,25, 80 ou 250 ppm (0, 2,6, mg/kg-jour), 80 ppm (9,0 ou 25,6 mg/kg p.c. par jour) ou 250 ppm pendant 35 jours. De nombreux critères d'effet ont été évalués chez les mâles, y compris la pathologie clinique, le poids des organes, l'analyse du sperme et l'histopathologie. Deux groupes de femelles ont été exposés; le premier a reçu du bromate de sodium dans l'eau entre les jours 1 et 34 de l'étude afin d'examiner les effets pendant la conception et le début de la gestation, tandis que le deuxième groupe a été exposé à partir du jour de gestation 6 jusqu'au jour postnatal 1 afin d'examiner les effets pendant la fin de la gestation et la naissance. Les mesures ont porté sur le poids corporel maternel, le nombre d'implantations utérines, le nombre et le poids des ratons. On n'a observé aucun changement dans les données de reproduction chez les femelles. Toutefois, les mâles ont démontré une diminution de la densité spermatique épididymale. Le bromate de sodium a été considéré comme une substance toxique sélective pour les mâles, et une LOAEL de 250 ppm et une NOAEL de 80 ppm ont été obtenues (NTP, 1996).
Dans un rapport du NTP de 2007 sur la toxicité du bromate de sodium, on résumait les résultats d'une étude multigénérationnelle et de reproduction continue chez les rats (NTP, 2001, 2007). Des rats Sprague-Dawley mâles et femelles avaient reçu du bromate de sodium dans de l'eau potable à des concentrations de 0, 30, 100 ou 300 mg/L; la durée de l'exposition n'était pas indiquée dans le sommaire disponible. On a observé une toxicité généralisée chez les deux sexes à 100 et 300 mg/L, comme le démontraient les gouttelettes hyalines et la néphropathie progressive et chronique chez les mâles, et les changements prolifératifs des cellules rénales chez les femelles. Bien que les auteurs n'aient pas fait état de changement important dans les données sur les portées, on a constaté une diminution de 16 % de la densité du sperme chez la génération F0, et une diminution de 8 % (non significative) chez la génération F1 (NTP, 2001, 2007). La diminution de 16 % de la densité du sperme était compatible avec la diminution initiale de 18 % observée dans une étude préliminaire, même si aucun effet sur la fertilité mâle n'avait été observé (NTP, 2007).
9.3 Modes d'action
Même si on a réalisé de nombreuses études mécanistiques au sujet du bromate, le mode d'action de la toxicité du bromate n'est pas encore bien compris. Afin de mieux faire la synthèse des données et de tirer peut-être des conclusions à partir du corpus d'études mécanistiques, Santé Canada a réalisé une analyse des modes d'action (Santé Canada, 2014) en utilisant l'approche décrite dans le cadre de l'Institut international des sciences de la vie (IISC)/Programme international sur la sécurité des substances chimiques (PISSC) (PISSC, 2007; Meek et coll., 2014a), laquelle a été mise à jour par les critères évolués de Bradford-Hill (Meek et coll., 2014b). L'analyse de chacun des modes d'action potentiels et les conclusions énoncées d'après la synthèse sont résumées dans la présente section. Comme la plupart des recherches mécanistiques ont porté sur les cancers (surtout les tumeurs rénales, mais également les tumeurs des cellules thyroïdiennes et les mésothéliomes de la tunique vaginale testiculaire), cette analyse des modes d'action a porté elle aussi sur cet aspect. De plus, comme ces effets ont été observés chez les rats, la majeure partie des données analysées provenaient d'études sur les rats, ainsi que d'autres espèces, mais uniquement pour assurer la concordance entre les espèces. Dans la mesure du possible, on a réalisé une analyse quantitative des principaux événements, on a estimé la limite de confiance inférieure à 95 % à l'égard de la concentration d'exposition à laquelle on pourrait s'attendre à une augmentation de 10 % de l'incidence (par rapport au niveau naturel) dans la population étudiée (c.-à-d. une valeur représentant la limite inférieure de l'intervalle de confiance à 95 % de la BMD10 [valeur BMDL10]; ces valeurs ont été calculées à l'aide du logiciel de l'U.S. EPA « Benchmark Dose Software », BMDS version 2.4 R70). Sauf indication contraire, les expositions mentionnées dans la présente section consistaient en bromate de potassium dans de l'eau potable.
9.3.1 Stress oxydatif
Les données portant sur le mode d'action du stress oxydatif ont été étudiées surtout pour les tumeurs rénales. Les données corroborent grandement ce mode d'action pour les tumeurs rénales, mais il existe d'importantes lacunes dans les données corroborantes pour les autres types de cancer. Les principaux événements dans ce mode d'action ont été proposés comme suit : 1) épuisement du GSH et surplus d'espèces oxydatives; 2) dommages à l'ADN, aux protéines et aux lipides; 3) prolifération cellulaire, ce qui mène à la propagation des mutations génétiques spontanées ou causées par le bromate. On a formulé l'hypothèse voulant que ces événements clés mènent au développement de tumeurs. Les données corroborant ou invalidant chacun de ces événements clés sont présentées aux sections 9.3.1.1 à 9.3.1.3; l'analyse quantitative des événements clés et la synthèse du mode d'action sont présentées aux sections 9.3.1.4 et 9.3.1.5, respectivement.
9.3.1.1 Épuisement du GSH et surplus d'espèces oxydatives
Le stress oxydatif était le plus souvent mesuré sous forme de changements dans les concentrations d'adduits de 8-OHdG, et des concentrations accrues du marqueur dans les reins ont été observées à ≥ 250 mg/L chez les rats mâles et femelles dans plusieurs études (Umemura et coll., 1998, 2004, 2006; McDorman et coll., 2005; Yamaguchi et coll., 2008; Cotruvo et Bull, 2012; Kolisetty et coll., 2013a). Lorsque les rats co-ingéraient des antioxydants avec le bromate de potassium, l'augmentation des concentrations de 8-OHdG diminuait (Umemura et coll., 2009). Qui plus est, lorsque les rats exposés au bromate par gavage étaient également exposés à des composés suppresseurs de GSH (diéthylmaléate), une augmentation de la 8-OHdG se produisait à des concentrations plus faibles (Sai et coll., 1992b). Le développement de gouttelettes éosinophiliques (qui sont différentes des gouttelettes hyalines causées par l'α2µ-globuline), une indication manifeste des dommages oxydatifs, a été observé à ≥ 400 mg/L dans des études chroniques (Kurokawa et coll., 1987; DeAngelo et coll., 1998); l'effet semblait être réversible, car on ne l'a pas observé chez des rats qui avaient été gardés en vie après que l'exposition eut cessé (Kurokawa et coll., 1987). Bien que les gènes associés au stress oxydatif se soient exprimés de manière différentielle à des doses plus faibles que celles auxquelles les autres mesures de l'oxydation ont été observées (c.-à-d. ≥ 20 mg/L) (Delker et coll., 2006; Geter et coll., 2006; Ahlborn et coll., 2009), ces résultats sont corroborants et ne sont pas considérés comme quantitativement définitifs pour cet événement clé.
Aucune donnée n'a été trouvée au sujet du stress oxydatif dans l'urothélium. Dans la thyroïde, on n'a observé aucune augmentation de l'expression d'Ogg1 - l'acide ribonucléique messager pour une enzyme qui répare l'ADN endommagé par le stress oxydatif, et qui fait l'objet d'une régulation à la hausse dans les reins (Delker et coll., 2006); aucune autre étude sur le stress oxydatif dans la thyroïde n'a été réalisée.
La seule mesure de dommages oxydatifs chez la souris a été constatée à une très forte concentration (2 000 mg/L). Dans cette étude, l'accumulation de 8-OHdG se produisait seulement chez la souris transgénique, sans le gène Ogg1, et non chez la souris de type sauvage (c.-à-d. avec un système fonctionnel de réparation des dommages oxydatifs) (Arai et coll., 2002).
9.3.1.2 Dommages à l'ADN, aux protéines et aux lipides
Les données pour cet événement clé portaient sur les dommages à l'ADN sous forme de mutations, qui se produisaient à ≥ 250 mg/L; ces effets sont décrits plus à fond à la section 9.3.3.2.
9.3.1.3 Prolifération cellulaire
Des différences associées au sexe dans la prolifération cellulaire ont été observées dans les reins des rats. On a constaté cet effet (mesuré par l'indice de marquage par BrdU ou l'essai d'antigène nucléaire des cellules proliférantes) à ≥ 30 mg/L chez des mâles (Umemura et coll., 2004; Yamaguchi et coll., 2008; Cotruvo et Bull, 2012; Kolisetty et coll., 2013b); chez les femelles, l'effet a été observé à ≥ 250 mg/L dans une étude (Umemura et coll., 2004), mais non à des concentrations atteignant 400 mg/L dans une autre étude (Cotruvo et Bull, 2012; Kolisetty et coll., 2013b). De plus, l'effet se produisait plus tôt chez les mâles que chez les femelles, la prolifération cellulaire se manifestant après ≥ 1 semaine chez les rats mâles exposés à 500 mg/L, et seulement après 13 semaines chez les femelles soumises à un même régime de dosage (Umemura et coll., 1993, 1998). La coexposition à des substances antioxydantes s'est traduite par une diminution de la prolifération cellulaire chez les femelles, mais non chez les mâles (Umemura et coll., 2009).
Des preuves histologiques de l'hyperplasie rénale ont également été observées chez les rats mâles coexposés à du bromate de potassium à ≥ 30 mg/L et à l'EHEN, un initiateur connu (Kurokawa et coll., 1985; Umemura et coll., 1995), mais non chez les rats exposés uniquement au bromate de potassium à des concentrations atteignant 500 mg/L (Umemura et coll., 1995; DeAngelo et coll., 1998).
On dispose de très peu de données sur la prolifération cellulaire pour le mésothélium testiculaire et la thyroïde. On a constaté une augmentation de l'indice de marquage par BrdU dans les tissus des rats à une concentration de 125 mg/L (la dose la plus faible testée) et plus (Cotruvo et Bull, 2012). L'hyperplasie urothéliale a également été observée à ≥ 100 mg/L chez des rats dans le cadre d'études chroniques (Kurokawa et coll., 1983; DeAngelo et coll., 1998; Wolf et coll., 1998). Bien que les auteurs n'aient pas indiqué si l'hyperplasie avait expressément affecté le mésothélium de la tunique vaginale, une nouvelle analyse des tissus provenant d'un essai biologique (DeAngelo et coll., 1998; Wolf et coll., 1998) a indiqué que des lésions hyperplasiques et prénéoplasiques avaient été observées dans le mésorchium de la tunique vaginale (Crosby et coll., 2000). Une seule étude chronique a traité de l'hyperplasie des cellules folliculaires (Wolf et coll., 1998). Dans cette étude, on a observé une hyperplasie, mais les incidences étaient peu nombreuses (et non significatives) et moindres que pour les tumeurs des cellules folliculaires.
9.3.1.4 Analyse quantitative des événements clés pour le mode d'action du stress oxydatif
Les valeurs BMDL10 pour la prolifération cellulaire et le stress oxydatif des reins ont été estimées à partir des données publiées par Umemura et coll. (2004) et ces concentrations de bromate de potassium sont de 78 mg/L et 75 mg/L, respectivement. Ces valeurs ont été calculées pour les rates, tandis que les données présentaient une piètre adéquation avec les modèles dose-réponse pour les rats mâles. Une BMDL10 de 229 mg/L pour les dommages à l'ADN a été observée chez les rats mâles, mais il n'y a pas eu d'étude menée sur les rates (valeurs calculées à partir des données de Yamaguchi et coll. [2008], mais les résultats étaient similaires à ceux calculés à l'aide des données d'Umemura et coll. [2006]). Bien que la prolifération cellulaire semble se produire plus tôt et à des doses plus faibles que pour les mutations causées par le bromate, la prolifération cellulaire propagera toute mutation non réparée (c.-à-d. les mutations spontanées), et non seulement celles qui résultent de l'exposition au bromate. Les valeurs BMDL10 pour les tumeurs rénales étaient toutes d'environ 50 mg/L chez les rats mâles (Kurokawa et coll., 1986a; Wolf et coll., 1998). Les valeurs BMDL10 sont plus faibles pour les tumeurs rénales que pour le stress oxydatif et la prolifération cellulaire. Toutefois, cette observation ne contredit pas nécessairement le mode d'action, car l'évaluation quantitative des tumeurs rénales pouvait être réalisée seulement chez les mâles (les tumeurs rénales chez les mâles sont potentiellement exacerbées par la production d'α2µ-globuline).
Dans le cas des tumeurs urothéliales, le seul événement clé précoce qui pouvait être évalué quantitativement était l'hyperplasie urothéliale; la BMDL10 pour cet événement clé était une concentration de bromate de potassium de 19,6 mg/L chez les rats mâles (d'après les données de Wolf et coll. [1998]), ce qui était plus faible que pour les mésothéliomes urothéliaux (concentrations de bromate de potassium de 34 mg/L et de 141 mg/L, d'après les données de Wolf et coll. [1998] et de Kurokawa et coll. [1986a], respectivement). Même si les auteurs n'avaient pas indiqué si l'hyperplasie touchait expressément le mésothélium de la tunique vaginale, une nouvelle analyse des tissus provenant d'un essai biologique (DeAngelo et coll., 1998; Wolf et coll., 1998) indiquait que les lésions hyperplasiques et prénéoplasiques avaient été observées dans le mésorchium de la tunique vaginale (Crosby et coll., 2000a). Une seule étude avait porté sur la mesure directe de la réplication des cellules mésothéliales testiculaires (Cotruvo et Bull, 2012), mais on avait identifié des effets à la plus faible concentration (125 mg/L); par conséquent, ce résultat ne peut être employé comme indicateur quantitatif pour l'événement clé.
On ne possède pas suffisamment de données pour procéder à une analyse quantitative des tumeurs de la vésicule thyroïdienne chez les rats ou dans tout tissu cible chez les espèces autres que le rat.
9.3.1.5 Synthèse du mode d'action du stress oxydatif
On dispose de données robustes corroborant l'existence de ce mode d'action, car le stress oxydatif et la réplication cellulaire se produisent dans les reins du rat à des concentrations de bromate de potassium inférieures à celles auxquelles les mutations surviennent. Qui plus est, on constate une réduction de la production d'adduits oxydatifs, de la réplication cellulaire et des mutations lorsqu'il y a une co-exposition avec le GSH ou la cystéine (un précurseur du GSH). Dans le même ordre d'idées, des études qui avaient provoqué l'épuisement artificiel des concentrations de GSH ont montré qu'il y avait un stress oxydatif à des concentrations plus faibles que celles auxquelles cela se serait normalement produit. Ces études, ainsi que celles qui indiquent un niveau d'exposition inférieur à celui où il n'y a pas d'augmentation de la 8-oxodG, semblent corroborer l'existence de doses auxquelles le développement tumoral est contrecarré chez les espèces pertinentes.
La preuve la plus importante qui contredit l'hypothèse selon laquelle le mode d'action concerne les tumeurs causées par le bromate est que les valeurs de BMDL10 pour les tumeurs (chez les mâles) sont plus faibles que celles pour le stress oxydatif (chez les mâles et les femelles) ou la prolifération cellulaire (chez les femelles). Cependant, on pourrait expliquer cette observation par les différences de production d'α2µ-globuline chez les deux sexes. Les concentrations de 8-oxodG augmentent à des concentrations similaires de bromate de potassium chez les rats mâles et femelles, tandis que les mâles sont plus sensibles à la prolifération cellulaire et au développement de tumeurs rénales. La prolifération cellulaire étant associée à la production d'α2µ-globuline, qui se produit avec l'exposition au bromate, ces derniers événements clés sont probablement exacerbés chez les mâles, en raison de ce processus additionnel. Comme les données sur l'incidence des tumeurs utilisables pour l'analyse dose-réponse existent seulement pour les mâles, on ne peut réaliser des comparaisons quantitatives fiables entre les événements clés précoces et l'apparition de tumeurs rénales.
En guise de conclusion, le mode d'action du stress oxydatif pour les tumeurs rénales semble être plausible, mais des données additionnelles sont requises pour le confirmer. Les données obtenues pour deux autres critères d'effet tumoral (mésothéliomes de la tunique vaginale et tumeurs thyroïdiennes) sont insuffisantes pour évaluer le mode d'action du stress oxydatif. Bien qu'on dispose de données limitées propres au bromate pour ce mode d'action chez les humains, le stress oxydatif se produit chez les humains. Par conséquent, on présume actuellement que cet effet s'applique aux humains.
9.3.2 Néphropathie induite par l'α2µ-globuline
Les données portant sur le mode d'action de l'α2µ-globuline ne s'appliquent qu'aux tumeurs rénales. On dispose de preuves concernant le rôle contributif du mode d'action chez les rats mâles. Toutefois, ce mode d'action ne semble pas être la cause principale des tumeurs rénales. Les événements clés suivants ont été proposés pour ce mode d'action : 1) l'accumulation de gouttelettes hyalines dans les tubules proximaux; 2) une surcharge de protéines rénales, provoquant des lésions aux cellules rénales; 3) une prolifération cellulaire compensatoire soutenue, donnant lieu à la propagation de mutations génétiques spontanées ou causées par le bromate. On suppose que ces événements clés mènent au développement des tumeurs rénales. Les données corroborant ou invalidant chacun de ces événements clés sont présentées aux sections 9.3.2.1 à 9.3.2.3; une analyse quantitative des événements clés et la synthèse du mode d'action sont présentées aux sections 9.3.2.4 et 9.3.2.5, respectivement.
9.3.2.1 Accumulation de gouttelettes hyalines dans les tubules proximaux
L'augmentation des gouttelettes hyalines rénales ou des concentrations d'α2µ-globuline chez les rats mâles a été constatée dans de nombreuses études portant sur l'eau potable, avec des concentrations de bromate de potassium aussi faibles que 30 mg/L (Kurokawa et coll., 1983; Umemura et coll., 1993, 1998, 2004, 2009; NTP, 2001; Yamaguchi et coll., 2008; Dodd et coll., 2013). Comme il était prévu, les effets chez les rates étaient non existants (Umemura et coll., 1993, 1998) ou se produisaient à des concentrations beaucoup plus faibles que chez les mâles et n'étaient pas associés au traitement par le bromate (Umemura et coll., 2004). On n'a trouvé aucune étude de l'α2µ-globuline chez d'autres espèces, mais il semble que l'effet soit un phénomène propre aux rats mâles.
9.3.2.2 Surcharge de protéines rénales provoquant des lésions aux cellules rénales
Une dégénérescence dépendante de la dose a été observée dans les tubules proximaux chez des rats mâles à ≥ 60 mg/L (Kurokawa et coll., 1983; Umemura et coll., 2004; Yamaguchi et coll., 2008); aucune augmentation n'a été observée chez des femelles à des concentrations atteignant 500 mg/L (Umemura et coll., 2004). On a également mesuré des indicateurs de la déficience de la fonction rénale, avec une augmentation des concentrations de créatinine sérique à des concentrations ≥ 250 mg/L chez les mâles, mais non chez les femelles (Umemura et coll., 2004), ainsi qu'une légère augmentation de l'azote uréique du sang tant chez les mâles que chez les femelles à ≥ 250 mg/L (Kurokawa et coll., 1983).
9.3.2.3 Prolifération cellulaire
Comme il a été indiqué à la section 9.3.1.3, la prolifération cellulaire rénale se produit après une exposition à de plus faibles concentrations et pour de plus courtes durées chez les rats mâles que chez les rates.
9.3.2.4 Analyse quantitative des événements clés pour le mode d'action de la néphropathie induite par l'α2µ-globuline
Une BMDL10 pour l'accumulation de gouttelettes hyalines a été estimée à 7,5 mg/L chez les rats mâles (Yamaguchi et coll., 2008), et une NOAEL de 60 mg/L (les valeurs pour les doses de référence [BMD] n'ayant pu être calculées en raison d'un manque d'adéquation avec les modèles) a été constatée pour les concentrations hépatiques d'α2µ-globuline chez les rats mâles (Umemura et coll., 2004). La NOAEL pour la dégénérescence des tubules proximaux rénaux était de 30 mg/L (Umemura et coll., 2004). Aucune valeur BMD n'a pu être calculée pour la prolifération cellulaire chez les rats mâles, mais la NOAEL pour cet effet était de 15 mg/L (Umemura et coll., 2004). Les tumeurs rénales présentaient une BMDL10 d'environ 50 mg/L dans deux études (Kurokawa et coll., 1986a; Wolf et coll., 1998). L'absence de données a empêché le calcul des valeurs BMD pour les événements clés précoces chez les rates ou d'autres espèces.
9.3.2.5 Synthèse du mode d'action de la néphropathie induite par l'α2µ-globuline
La progression de la néphropathie induite par l'α2µ-globuline dans les tumeurs rénales semble être pertinente dans le cas des rats mâles. Cependant, comme on a démontré que ce mode d'action est propre aux rats mâles et comme des tumeurs rénales ont été observées chez des rates (ainsi que chez des souris et des hamsters), ce mode d'action ne semble pas être le plus pertinent pour ce qui est des tumeurs rénales.
Comme il a été indiqué au sujet du mode d'action du stress oxydatif, les rats mâles sont plus sensibles à la prolifération cellulaire et aux tumeurs rénales, tandis que les preuves de dommages oxydatifs sont quantitativement similaires chez les rats mâles et femelles. Par conséquent, même si l'accumulation de gouttelettes hyalines ne semble pas être le mode d'action responsable des tumeurs rénales causées par le bromate, elle semble jouer un rôle dans la sensibilité accrue des rats mâles, probablement en favorisant l'accroissement de la prolifération cellulaire. L'incidence des tumeurs rénales chez les rats mâles n'est donc probablement pas pertinente, d'un point de vue quantitatif, pour les humains.
9.3.3 Mutagénèse à action directe
Les données existantes corroborent fortement la mutagénicité du bromate. Toutefois, comme il existe moins de preuves au sujet de son occurrence aux doses données aux rats et pertinentes pour ce qui est des tumeurs, le rôle de ce mode d'action dans le développement tumoral est sujet à caution. Pour ce mode d'action, les événements clés suivants ont été proposés : 1) formation directe d'adduits à l'ADN; 2) mutagénèse (dans les gènes critiques); 3) expansion clonale menant à des lésions prénéoplasiques. Ces événements clés ont été étudiés afin de déterminer leur rôle dans les tumeurs rénales, les tumeurs de la vésicule thyroïdienne et les mésothéliomes de la tunique vaginale testiculaire. Les données corroborant ou invalidant chacun de ces événements clés sont présentées aux sections 9.3.3.1 à 9.3.3.3; une analyse quantitative des événements clés et la synthèse du mode d'action sont présentées aux sections 9.3.3.4 et 9.3.3.5, respectivement.
9.3.3.1 Formation directe d'adduits à l'ADN
Il n'y a pas eu d'études de la formation directe d'adduits à l'ADN après l'exposition au bromate. La formation des adduits de la 8-OHdG n'est pas pertinente pour l'analyse de la mutagénèse directe, car les adduits sont le résultat du stress oxydatif causé par le bromate, plutôt que par des activités à action directe.
9.3.3.2 Mutagénèse
On dispose de données limitées au sujet des mutations dans les tissus cibles, qui ont tous été retrouvés dans les reins. Les mutations dans les systèmes Spi−, gpt et Lac ont été observées chez les rats mâles et femelles exposés à du bromate de potassium seulement à 500 mg/L, et non à des concentrations plus faibles (Umemura et coll., 2006, 2009; Yamaguchi et coll., 2008). La co-exposition avec des antioxydants s'est traduite par une atténuation de la mutagénicité chez les femelles, mais non chez les rats mâles (Umemura et coll., 2009).
Chez la souris, on n'a trouvé aucune donnée portant expressément sur les tissus cibles, mais la formation de micronoyaux dans les érythrocytes a été examinée dans deux études sur l'eau potable. Comme la mutagénicité est bien conservée parmi les tissus, ces données ont été incorporées dans l'analyse. L'induction dépendante de la dose de micronoyaux a été observée chez la souris. La concentration de 80 mg/L représentait la LOAEL après une exposition de 8 semaines (Allen et coll., 2000) et la NOAEL après 78 semaines (Allen et coll., 2000) ou 27 semaines d'exposition au bromate de sodium (NTP, 2007).
Peu d'études sur la nature des mutations observées ont été réalisées in vivo. Yamaguchi et coll. (2008) ont établi un spectre d'effets mutagènes, parmi lesquels seules les transversions de GC en TA - qu'on pense généralement être associées aux adduits oxydatifs (c.-à-d. indirects) - étaient importantes (à 500 mg/L).
9.3.3.3 Expansion clonale menant aux lésions prénéoplasiques
La prolifération cellulaire dans les reins, l'urothélium et la thyroïde est décrite à la section 9.3.1.3.
9.3.3.4 Analyse quantitative des événements clés pour le mode d'action de la mutagénicité
En l'absence de données sur la formation directe d'adduits à l'ADN, on ne peut réaliser une analyse dose-réponse de l'événement clé précoce pour ce mode d'action. Les valeurs BMDL10 pour la mutagénicité dans les reins du rat étaient d'environ 230 mg/L dans deux études différentes (Umemura et coll., 2006; Yamaguchi et coll., 2008). Les points de départ pour les micronoyaux dans les érythrocytes de la souris étaient beaucoup plus bas, soit une BMDL10 de 2,4 mg/L pour le critère d'effet le plus prudent. On ne disposait de données sur l'expansion clonale que pour les rats; on a établi une BMDL10 de 75,1 mg/L pour la prolifération des cellules rénales chez les femelles (les données ne pouvaient être mises en adéquation avec les modèles chez les mâles) (Umemura et coll., 2004) et une BMDL10 de 19,6 mg/L pour l'hyperplasie urothéliale (Wolf et coll., 1998). Des valeurs BMDL10 ont été calculées pour les tumeurs dans le rein (environ 50 mg/L par Wolf et coll. [1998] et Kurokawa et coll. [1986a]), l'urothélium (34 mg/L dans Wolf et coll. [1998]; 141 mg/L dans Kurokawa et coll. [1996b]) et la thyroïde (79 mg/L dans Wolf et coll. [1998]; 137 mg/L dans Kurokawa et coll. [1986a]) chez les rats mâles. Chez les souris mâles, il n'a pas été possible d'utiliser les données sur les tumeurs rénales dans le modèle BMD, parce qu'une augmentation importante n'a été observée que dans le groupe ayant été exposé à la plus faible dose (80 mg/L) (DeAngelo et coll., 1998).
9.3.3.5 Synthèse du mode d'action de la mutagénicité par action directe
Le bromate a été identifié comme cause de mutations chez les souris et les rats in vivo ainsi que dans les cellules humaines in vitro. Toutefois, la mutagénicité causée directement par le bromate ou ses métabolites n'a pas été examinée. Bien qu'on ait étudié la mutagénicité dans des tissus pertinents pour les tumeurs seulement dans le rein du rat, le processus de mutagénicité à action directe semble être uniforme parmi les tissus et les espèces. Pour que la mutagénicité se manifeste dans un tissu donné, le bromate devrait atteindre ce tissu; on a démontré que le bromate atteint les reins, la thyroïde et les testicules (Delker et coll., 2006).
Les données indiquent que les concentrations de bromate qui provoquent des tumeurs rénales chez les rats sont plus faibles que celles qui provoquent la mutagénèse chez la même espèce, ce qui donne à penser que ce mode d'action ne participe pas au développement tumoral causé par le bromate chez les rats. Les souris semblent être plus sensibles que les rats à la mutagénicité (dans les érythrocytes; aucune étude de mutagénicité dans les tissus pertinents pour les tumeurs), ce qui démontre également la non-pertinence du mode d'action de la mutagénèse à action directe, car les rats sont plus sensibles aux tumeurs causées par le bromate. Toutefois, il convient de noter que même si les tumeurs précèdent la mutagénicité chez les espèces clés (c.-à-d. les rats), la formation de micronoyaux dans les érythrocytes des souris se produisait à des doses similaires auxquelles les tumeurs rénales étaient apparues (et une BMDL10 plus faible pour l'induction de micronoyaux a été calculée pour un critère d'effet).
Une lacune importante dans les données est l'absence d'essais de mutagénicité in vivo dans les tissus rénaux de la souris. Si cette lacune était comblée, on pourrait mieux comprendre la mutagénicité du bromate. De plus, si on disposait de données expérimentales additionnelles démontrant le mode d'action du stress oxydatif ou les seuils reliés à la pharmacocinétique (p. ex. en établissant que le développement tumoral est empêché par la co-exposition aux antioxydants ou au GSH, respectivement), on pourrait avoir une preuve suffisante qu'un mode d'action de mutagénèse à action non directe est à la source de la cancérogénicité provoquée par le bromate.
En guise de conclusion, les données semblent indiquer que le bromate est mutagène. Toutefois, aucune étude in vivo portant sur l'événement clé précoce (c.-à-d. la mutagénèse à action directe) n'a été réalisée, et la mutagénèse ne semble pas être un mode d'action pertinent pour le bromate chez les espèces clés (c.-à-d. les rats). On ne peut cependant rejeter ce mode d'action pour les espèces moins sensibles (c.-à-d. les souris). Toutefois, les tumeurs rénales chez cette espèce ne se manifestent pas avec une relation dose-réponse constante. Même si les données propres au bromate pour ce mode d'action chez les humains sont limitées, la mutagénèse se produit chez les humains. Par conséquent, on suppose que ce critère d'effet a une pertinence pour les humains.
9.3.4 Autres modes d'action
Il existe d'autres modes d'action potentiels qui pourraient contribuer aux tumeurs provoquées par le bromate, mais les données sont insuffisantes pour qu'on en fasse l'analyse. Ces modes d'action comprennent le déséquilibre de l'hormone thyroïdienne, le déséquilibre des hormones sexuelles et l'immunosuppression ainsi qu'un événement clé proposé impliquant l'altération de l'apoptose. Comme ces modes d'action n'ont pu faire l'objet d'une analyse plus détaillée, nous en présentons ci-dessous un aperçu seulement.
9.3.4.1 Altération de l'apoptose
Un événement clé additionnel qui a récemment été proposé pour le bromate est l'altération de l'apoptose dans les cellules rénales. L'événement clé proposé consiste en un accroissement de l'apoptose, qui est suivi d'une suppression compensatoire de l'apoptose. La suppression de l'apoptose permet la survie et la réplication des cellules dont l'ADN est endommagé, ce qui accroît la probabilité d'un développement de tumeurs rénales (Bull et Cotruvo, 2013). On dispose de données limitées au sujet de cet événement clé; des études ultérieures permettront de mieux déterminer si l'événement clé devrait être incorporé dans les modes d'action proposés et existants, et/ou dans d'autres modes d'action. Les seules données portant sur l'apoptose faisaient état d'un accroissement de l'apoptose, mesuré par le marquage de l'extrémité dUTP de la désoxyribonucléotidyle-transférase terminale (technique TUNEL) sur les tubules proximaux rénaux chez les rats (à ≥ 15 mg/L chez les femelles et à ≥ 60 mg/L chez les mâles) (Kolisetty et coll., 2013a). Cet accroissement de l'apoptose était accompagné d'une expression des protéines qui suppriment l'apoptose, y compris la p21 et la clustérine (Kolisetty et coll., 2013a, 2013b).
Si l'apoptose est un événement clé pour le bromate, l'augmentation de la 8-oxodG et le développement de micronoyaux pourraient être secondaires par rapport à l'apoptose, plutôt que représenter des événements clés dans d'autres modes d'action. Pendant que la rupture cellulaire provoquée par l'apoptose se produit, l'ADN pourrait être davantage exposé aux radicaux libres générés, donnant lieu au développement de la 8-oxodG (Kolisetty et coll., 2013a). De plus, le développement de micronoyaux, qui est l'effet mutagène observé aux plus faibles concentrations, pourrait être influencé par l'apoptose, car les corps apoptotiques s'apparentent aux micronoyaux (Bull et Cotruvo, 2013). Cependant, comme les données actuelles sont limitées pour corroborer l'altération de l'apoptose et comme l'apoptose provoquée par le bromate n'a pas été étudiée chez la souris (l'espèce chez qui des micronoyaux ont été observés in vivo), il reste à déterminer si ces effets sont pertinents pour d'autres modes d'action.
9.3.4.2 Déséquilibre de l'hormone thyroïdienne
La perturbation de l'hormone thyroïdienne pourrait être le résultat de tumeurs thyroïdiennes causées par le bromate chez les rats s'il y a une diminution de la triiodothyronine (T3) ou de la thyroxine (T4) associée au bromate, laquelle pourrait mener à une augmentation compensatoire de la thyréostimuline (TSH) et à une hyperplasie subséquente des cellules thyroïdiennes. Les seules données disponibles sur des événements clés précoces présumés chez les rats mâles exposés au bromate comprennent des preuves de diminution de la T3 aux faibles doses, y compris celles menant à des tumeurs thyroïdiennes (DeAngelo et coll., 1998; Wolf et coll., 1998) ainsi qu'à des taux accrus de réplication des cellules thyroïdiennes chez des rats exposés au bromate à des concentrations plus élevées que les doses les plus faibles génératrices de tumeurs (Cotruvo et Bull, 2012). Des effets qui contrent ce mode d'action ont été observés par Dodd et coll. (2013), y compris une diminution de la TSH (mais sans relation dose-réponse), avec une absence d'effet sur la T3 et la T4 à des doses pertinentes pour les tumeurs chez les rats.
Afin de mieux évaluer ce mode d'action proposé, on devrait disposer d'études qui mesurent les concentrations d'hormones thyroïdiennes, de TSH et la réplication/hyperplasie cellulaire à des concentrations inférieures à celles qui contribuent au développement tumoral (c.-à-d. 20 mg/L dans de l'eau potable) chez les rats mâles et femelles. Si ces études pouvaient tenter en quelque sorte de prévenir l'épuisement de l'hormone thyroïdienne provoqué par le bromate (et/ou l'augmentation compensatoire de la TSH, si cela se produit avec le bromate) et démontrer l'effet résultant sur la prolifération cellulaire, les données seraient extrêmement utiles pour les analyses ultérieures des modes d'action du bromate. S'il était possible de réaliser des études portant sur l'exposition au bromate et ses effets sur les concentrations d'hormone thyroïdienne et de TSH chez les humains d'une manière éthique, ces données seraient également pertinentes pour l'analyse de concordance des espèces.
Les humains sont beaucoup moins sensibles que les rongeurs au développement des tumeurs thyroïdiennes causé par la perturbation de l'axe hypothalamus-hypophyse-adrénale. Par conséquent, si la pertinence de ce mode d'action était confirmée pour les tumeurs thyroïdiennes associées au bromate, la pertinence de ces tumeurs pour les humains pourrait être exclue, d'après les différences quantitatives entre les espèces (Meek et coll., 2003; Crofton, 2008). Toutefois, comme la perturbation thyroïdienne peut néanmoins affecter le neurodéveloppement des rongeurs et des humains (Crofton, 2008), on devrait étudier plus à fond, si cela est possible, ces effets chez diverses espèces.
9.3.4.3 Déséquilibre des hormones sexuelles
Le déséquilibre des hormones sexuelles pourrait être un promoteur tumoral. On n'a trouvé aucune étude de l'effet du bromate sur la dopamine, la prolactine, l'hormone lutéinisante, la testostérone, la gonadolibérine ou d'autres aspects de l'axe hypothalamus-hypophyse-testicules. L'observation d'une diminution de la densité du sperme épididymal dans une étude sur la reproduction (NTP, 1996) pourrait être une preuve indirecte d'un déséquilibre des hormones sexuelles. L'hyperplasie à cellules de Leydig pourrait également être une preuve de faibles concentrations de testostérone, mais aucune étude ne traite de cet effet. On a observé des tumeurs à cellules de Leydig chez des rats exposés au bromate de potassium, mais on les a également observées à des concentrations élevées chez des animaux témoins dans le cadre des mêmes études.
9.3.4.4 Immunosuppression
Dans une étude qui portait sur l'immunosuppression du bromate de sodium chez des souris B6C3F1 femelles exposées à 80, 200, 400, 600 ou 800 mg/L pendant 28 jours (Guo et coll., 2001), on a relevé une absence de l'immunosuppression pour la plupart des critères d'effet. Cependant, on a également observé une diminution de la capacité des macrophages de supprimer la prolifération des cellules de mélanomes. L'effet était bénin et ne se manifestait pas d'une manière associée à la dose (suppression à 200 et 800 mg/L en l'absence de stimulation, et à 200, 400 et 800 mg/L avec stimulation par l'interféron-γ et les lipopolysaccharides). Cette étude pourrait indiquer que l'exposition au bromate pourrait supprimer les défenses immunologiques contre les cellules tumorales. Toutefois, aucune autre étude pouvant corroborer ce mode d'action potentiel n'a été trouvée.
9.3.5 Conclusions et conséquences de l'analyse des modes d'action
Les données sur le bromate sont insuffisantes pour qu'on puisse écarter la possibilité d'un mode d'action mutagène. Dans le même ordre d'idées, le poids de la preuve actuel n'est pas suffisant pour étayer l'un ou l'autre des modes d'action non mutagènes proposés. Vu cette limitation touchant les données, il faut procéder à une extrapolation linéaire des faibles doses pour évaluer de manière quantitative les risques de cancer que présente le bromate, ce qui est fait à la section 10.1 ci-dessous. Si de nouvelles études permettent d'étayer davantage les éléments probants pour ce qui est des modes d'action pour les risques autres que le cancer, ou pour un mode d'action mutagène, on devrait envisager une approche avec seuil pour les futures évaluations du risque associé au bromate.
10.0 Classification et évaluation
Santé Canada a élaboré des valeurs basées sur la santé (VBS) pour les effets associés au risque de cancer et ceux associés aux risques autres que les risques de cancer, qui sont présentées aux sections 10.1 et 10.2, respectivement. Ces valeurs sont présentées avec et sans l'application des concentrations équivalentes pour les humains, dérivées du modèle PBPK décrit à la section 8.5.
10.1 Évaluation du risque de cancer
Le bromate de potassium a été classé par le CIRC (1999) comme un cancérogène possible pour les humains (groupe 2B), compte tenu des preuves suffisantes de sa cancérogénicité pour les animaux de laboratoire, mais des preuves inadéquates pour les humains.
Les études de Kurokawa et coll. (1986a) et de DeAngelo et coll. (1998) ont été prises en compte pour l'évaluation du risque de cancer associé à l'ingestion de bromate dans l'eau potable. Dans ces deux études, on avait administré du bromate à des rats mâles dans leur eau potable pendant une période chronique d'exposition. L'étude de DeAngelo et coll. (1998) a été choisie comme l'étude principale pour évaluer le risque de cancer associé à l'ingestion de bromate dans l'eau potable. Comme il est décrit dans les sections précédentes, les chercheurs de cette étude avaient administré du bromate à des rats mâles dans leur eau potable à différentes concentrations à faible dose. On a également utilisé un grand nombre d'animaux et inclus plusieurs groupes exposés à de faibles doses. En outre, des données sur les tumeurs chez des animaux individuels étaient disponibles et utilisables ultérieurement afin de mieux éclairer l'analyse du risque. Cette étude comportait également de multiples périodes de sacrifice, ce qui a permis de réaliser une analyse du temps d'apparition des tumeurs afin d'établir un facteur de pente pour chaque site de cancer, en tenant compte des morts précoces.
Selon les résultats de cette étude, des tumeurs surviennent dans les reins, la thyroïde et les mésothéliomes de la tunique vaginale. Ces trois tissus ont été évalués indépendamment dans l'analyse, car on avait indiqué que chaque site répondait à des modes d'action différents. L'approche de Santé Canada a tenu compte de tous les critères d'effet cancérogène possibles et a utilisé le plus prudent d'entre eux qui pourrait être pertinent pour les humains.
Il est à noter que l'extrapolation des données provenant des études de cancérogénicité sur les reins des rats mâles n'est pas nécessairement représentative du risque réel d'exposition à l'eau potable contenant de faibles concentrations de bromate. Comme la néphropathie induite par l'α2µ-globuline est propre au rat mâle et qu'elle explique probablement sa sensibilité accrue à la tumorigénèse provoquée par le bromate, des études réalisées sur les rates seraient probablement plus représentatives pour une évaluation du risque pour les humains. L'apport de l'α2µ-globuline à la cancérogénèse provoquée par le bromate peut donner lieu à un risque calculé accru de cancérogénicité pour les reins, en laissant supposer que la cancérogénicité survient à des doses plus faibles que ce qu'on retrouverait chez les humains. Bien que les tumeurs induites par l'α2µ-globuline ne soient pas pertinentes pour les humains, on ne peut rejeter d'emblée les études de cancérogénicité réalisées chez les rats mâles, car l'ensemble des effets cancérogènes n'est pas seulement attribuable à l'α2µ-globuline, mais également à d'autres modes d'action qui sont pertinents pour les humains.
Même si les modes d'action pour le bromate ne sont pas encore tout à fait élucidés, les effets mutagènes à action directe constatés in vivo se sont manifestés seulement à des concentrations qui dépassent les doses auxquelles les occurrences de cancer étaient régulièrement observées. Plusieurs études ont proposé l'existence d'un seuil pour la cancérogénicité du bromate dans les reins. La section 9.3 décrit en détail l'analyse dose-réponse et les modes d'action possibles pour le bromate. Malgré la suggestion d'un mode d'action seuil présentée dans certaines études, l'analyse des données disponibles sur les modes d'action ne permet pas de conclure qu'il y a suffisamment de données probantes dans la littérature publiée pour s'écarter d'une approche sans seuil linéaire par défaut pour quantifier le risque de cancer à l'heure actuelle.
Bien que la littérature scientifique ait porté sur les effets cancérogènes sur les reins et leurs mécanismes connexes, les évaluations du risque actuellement publiées s'appuient sur une approche multisite afin d'inclure tous les effets cancérogènes rapportés (c.-à-d. les tumeurs des reins, de la thyroïde et de la tunique vaginale) (OEHHA, 2009). L'approche de Santé Canada tient compte également de tous les effets cancérogènes - y compris les événements clés précoces dans les modes d'action les plus probables - en modélisant le risque pour chaque tissu indépendamment, et en choisissant le critère d'effet le plus prudent comme base d'évaluation du risque de cancer.
Le modèle PBPK décrit à la section 8.5 a été appliqué afin d'estimer les concentrations de bromate pour les humains qui seraient équivalentes aux doses administrées aux rats dans l'étude de DeAngelo et coll. (1998). Il faut souligner que les limites du modèle, notamment l'absence de données sur la pharmacocinétique humaine aux fins de validation, ont été relevées. Comme on ignore les différences dans la cinétique du bromate entre les rats et les humains, un ajustement allométrique est appliqué afin de tenir compte de ces différences potentielles, même si le modèle PBPK est utilisé. Les résultats d'une approche par défaut (c.-à-d. n'utilisant pas le modèle PBPK, et utilisant un facteur d'ajustement allométrique pour extrapoler les données des animaux aux humains) sont également présentés aux fins de comparaison.
Les doses de référence (BMD10) et leurs limites inférieures (BMDL10) pour les rats mâles ont été calculées pour chaque tissu. Les valeurs individuelles pour chaque tissu ont été déterminées selon un modèle du temps d'apparition des tumeurs pour tenir compte de l'occurrence des tumeurs fortuites et fatales. Dans le cas des reins et de la thyroïde, un modèle de degré polynomial a été utilisé pour l'analyse des tumeurs fortuites et mortelles, qui a donné les mêmes résultats pour la modélisation des cas fortuits par rapport aux cas mortels; un ajustement linéaire a été appliqué aux reins, et un ajustement quadratique a été appliqué à la thyroïde. Un modèle des incidences mortelles (polynomial, deuxième ordre) a été choisi pour les mésothéliomes, car il fournissait une estimation de puissance plus prudente que l'analyse utilisant les tumeurs fortuites. L'analyse a été réalisée à l'aide du modèle Weibull multi-étapes du temps d'apparition des tumeurs (modèle de l'U.S. EPA [U.S. EPA, 2009d]) et des logiciels Tox Risk. Les valeurs BMD10 et BMDL10 ont ensuite été extrapolées aux concentrations équivalentes chez les humains dans de l'eau potable à l'aide du modèle PBPK (section 8.5). Ces valeurs sont présentées au tableau 6.
| Tissu | BMD10 (mg/L) | BMDL10 (mg/L) |
|---|---|---|
| Rein | 64 | 48 |
| Thyroïde | 122 | 73 |
| Tunique vaginale | 71 | 38 |
10.1.1 Approche avec seuil utilisant les tumeurs
Il n'y a pas suffisamment d'information pour déterminer de manière concluante le mode d'action pour chacun des critères d'effet cancérogène. On a trouvé que le bromate est mutagène, mais les concentrations auxquelles cela a été observé in vivo sont plus élevées que celles auxquelles on a observé les tumeurs (voir la section 9.3). Cette preuve concernant le bromate pourrait étayer l'hypothèse d'un mécanisme non mutagène favorisant le développement tumoral, ainsi qu'une approche possible basée sur l'apport quotidien tolérable (AQT) pour l'évaluation du risque. Bien que certaines données probantes pointent vers un mode d'action seuil pour le bromate, la preuve existante publiée dans la littérature jusqu'à ce jour n'est pas concluante.
10.1.2 Approche sans seuil
Comme on ne peut rejeter entièrement la mutagénicité, et comme on n'a pas entièrement élucidé le mode d'action du bromate, on a appliqué l'approche par défaut basée sur l'extrapolation linéaire afin d'estimer les doses d'exposition qui entraîneraient des niveaux de risques de cancer excédentaires dans la plage de 10-5 à 10-6 (1 sur 100 000 à 1 sur 1 000 000). On a utilisé une approximation linéaire (c.-à-d. en divisant la dose de référence de 10 % par la valeur BMDL10 pour chaque type de tissu) afin d'obtenir des risques unitaires, qui ont été ensuite utilisés pour calculer les concentrations de bromate dans l'eau potable associées aux risques de cancer excédentaires de 10-4, 10-5 et 10-6 (tableau 7).
| Tissu | Facteur de pente du cancer [(mg/L)-1] |
Concentration de bromate (mg/L) | ||
|---|---|---|---|---|
| Risque de 10-4 | Risque de 10-5 | Risque de 10-6 | ||
| Approche par défaut (sans modélisation PBPK, ajustement allométrique) | ||||
| Rein | 2,2 × 10-3 | 0,046 | 0,004 6 | 0,000 46 |
| Thyroïde | 1,3 × 10-3 | 0,077 | 0,007 7 | 0,000 77 |
| Tunique vaginale | 3,0 × 10-3 | 0,034 | 0,003 4 | 0,000 34 |
| Approche PBPK, avec ajustement allométrique | ||||
| Rein | 2,1 × 10-3 | 0,048 | 0,004 8 | 0,000 48 |
| Thyroïde | 1,4 × 10-3 | 0,073 | 0,007 3 | 0,000 73 |
| Tunique vaginale | 2,6 × 10-3 | 0,038 | 0,003 8 | 0,000 38 |
Sur les trois types de tissu, les mésothéliomes de la tunique vaginale offrent l'estimation la plus prudente du risque de cancer, et ils sont donc utilisés pour estimer la VBS pour l'évaluation du risque de cancer au moyen de l'approche sans seuil. Ainsi, la VBS pour le bromate dans l'eau potable associée à un excès de risque de cancer à vie de 10-5 est de 0,004 mg/L (4 µg/L).
10.2 Évaluation des risques autres que les risques de cancer
En plus d'évaluer le potentiel cancérogène du bromate de potassium chez les rats mâles, DeAngelo et coll. (1998) et Wolf et coll. (1998) ont également évalué le critère d'effet non néoplasique associé à l'accroissement de l'hyperplasie urothéliale du bassinet rénal. Comme on l'a précédemment décrit, des rats F344 et des souris B6C3F1 ont ingéré du bromate de potassium dans de l'eau potable à une concentration de 0, 0,02, 0,1, 0,2 ou 0,4 g/L pour des périodes atteignant 100 semaines. L'hyperplasie urothéliale, observée chez les rats seulement, était caractérisée par une augmentation du nombre de couches de cellules urothéliales qui recouvrent le bassinet rénal et les papilles. Cette augmentation a été signalée à une concentration de 0,1 g/L (6,1 mg/kg p.c. par jour), avec une NOAEL de 0,02 g/L (0,1 mg/kg p.c. par jour). Cette étude a présenté la plus faible valeur NOAEL publiée pour les effets non cancérogènes résultant de l'exposition à du bromate, et elle a donc été choisie pour calculer une VBS.
Santé Canada a utilisé les données sur l'hyperplasie urothéliale publiées dans les études de DeAngelo et coll. (1998) et de Wolf et coll. (1998) pour calculer les valeurs BMD en utilisant les concentrations équivalentes pour les humains d'après le modèle PBPK décrit à la section 8.5 et une approche par défaut (c.-à-d. sans modèle PBPK).
En utilisant le modèle PBPK, on a obtenu une BMD10 de 92,2 mg/L, ce qui représente une incidence accrue de 10 % des effets nocifs par rapport aux taux de fond. Une limite inférieure de l'intervalle de confiance à 95 % (BMDL10) de 49,7 mg/L, correspondant à la BMD10 pour ce critère d'effet, a été calculée. Les valeurs BMD10 et BMDL10 ont été calculées d'après des données obtenues sur les animaux seulement après le sacrifice final; toutefois, en utilisant les résultats pour tous les animaux présentés dans l'étude de Wolf et coll. (1998), y compris les sacrifices précoces et finaux, on obtient des résultats similaires. L'analyse a été réalisée à l'aide du logiciel BMDS (version 2.4 R70) de l'U.S. EPA, et un modèle log-logistique a été choisi, car c'est celui qui offre le meilleur ajustement pour l'analyse (U.S. EPA, 2013).
Pour calculer la VBS pour le bromate, on a sélectionné la dose à laquelle l'effet critique a été observé à une faible incidence (c.-à-d. 10 %) et on a appliqué des facteurs d'incertitude afin de tenir compte des différences entre les conditions des études et celles de l'exposition environnementale des humains. Comme l'analyse PBPK donne des concentrations équivalentes pour les humains en milligrammes par litre, et que ces concentrations tiennent déjà compte de l'exposition pour un adulte d'un poids corporel moyen de 70 kg et consommant 1,5 L/jour d'eau potable, la VBS pour l'hyperplasie urothéliale induite par le bromate se calcule comme suit :
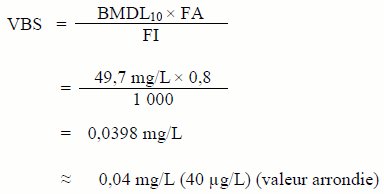
Figure 5 - Equivalent Textuel
La valeur basée sur la santé (VBS) pour le bromate est d'environ 0,04 mg/L (arrondie). Cette valeur est calculée en multipliant la BMDL10 de 49,7 mg/L par le facteur d'attribution (FA) de 0,8, puis en divisant le résultat par le facteur d'incertitude combiné de 1000.
où :
- BMDL10 (49,7 mg/L) est la limite inférieure de l'intervalle de confiance à 95 % de la dose de référence (BMD10) calculée;
- FI est le facteur d'incertitude combiné ×10 pour la variation interespèces (compte tenu de l'incertitude dans le modèle PBPK - particulièrement en l'absence d'un modèle humain validé -, le volet toxicocinétique du facteur d'incertitude par défaut a déjà été appliqué), ×10 pour la variation intra-espèces et ×10 pour les lacunes dans la base de données au sujet de la toxicité développementale (absence d'étude à long terme sur la neurotoxicité pour le développement, absence d'une étude de toxicité développementale chez une seconde espèce et prédominance d'études chroniques chez les rongeurs mâles, les études chroniques chez les femelles étant limitées à une étude sur des rates et avec seulement deux groupes de doses [Kurokawa et coll., 1983] et absence complète d'études chroniques chez des femelles d'autres espèces);
- FA (facteur d'attribution) désigne la proportion d'absorption journalière de bromate attribuée à l'eau potable. Une valeur de 0,8 a été utilisée, car l'eau potable est la principale source d'exposition au bromate, et on trouve peu de bromate dans l'eau embouteillée (Krishnan et Carrier, 2013).
Par conséquent, on obtient une VBS de 0,04 mg/L (40 µg/L) pour les effets autres que le cancer résultant de l'exposition au bromate dans l'eau potable en appliquant le modèle PBPK.
Aux fins de comparaison, l'approche par défaut, qui consiste à ne pas appliquer le modèle PBPK, a également été utilisée pour déterminer une VBS basée sur un critère d'effet autre que le cancer sous forme d'hyperplasie urothéliale :
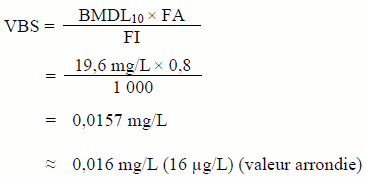
Figure 6 - Equivalent Textuel
La valeur basée sur la santé (VBS) pour le bromate est d'environ 0,016 mg/L (arrondie), si une approche sans PBPK est utilisée. Cette valeur est calculée en multipliant la BMDL10 de 19,6 mg/L par le facteur d'attribution (FA) de 0,8, puis en divisant le résultat par le facteur d'incertitude combiné de 1000.
où :
- BMDL10 (19,6 mg/L) est la limite inférieure de l'intervalle de confiance à 95 % associée à la dose de référence (BMD10) calculée;
- FI est le facteur d'incertitude combiné ×10 pour la variation interespèces, ×10 pour la variation intra-espèces et ×10 pour les lacunes dans la base de données au sujet de la toxicité développementale (absence d'étude à long terme sur la neurotoxicité pour le développement, absence d'une étude de toxicité développementale chez une seconde espèce et prédominance d'études chroniques chez les rongeurs mâles, les études chroniques chez les femelles étant limitées à une étude sur des rates et avec seulement deux groupes de doses [Kurokawa et coll., 1983] et absence complète d'études chroniques chez des femelles d'autres espèces);
- FA (facteur d'attribution) désigne la proportion d'absorption journalière de bromate attribuée à l'eau potable. Une valeur de 0,8 a été utilisée, car l'eau potable est la principale source d'exposition au bromate, et on trouve peu de bromate dans l'eau embouteillée (Krishnan et Carrier, 2013).
Par conséquent, on obtient une VBS de 0,016 mg/L (16 µg/L) pour les effets autres que le cancer résultant de l'exposition au bromate dans l'eau potable.
10.3 Comparaison des évaluations des risques de cancer et des risques autres que le cancer
À la section 10.1, il a été établi que la concentration de bromate associée à un excès de risque de mésothéliomes de la tunique vaginale de 10−5 sur toute la durée de vie est de 0,004 mg/L (4 µg/L). L'évaluation des risques autres que les risques de cancer, basée sur l'hyperplasie urothéliale comme il est décrit à la section 10.2, a donné des VBS de 0,04 mg/L (40 µg/L) et de 0,016 mg/L (16 µg/L), calculées à l'aide du modèle PBPK et de l'approche par défaut, respectivement. Comme l'évaluation du risque basée sur le cancer établit une valeur plus prudente pour le bromate dans l'eau potable, par rapport aux valeurs obtenues par les approches non basées sur le cancer, on considère que l'évaluation du risque basée sur le cancer est la démarche la plus appropriée pour établir une CMA dans l'eau potable.
10.4 Considérations internationales
Diverses organisations ont évalué le risque associé à l'ingestion de bromate dans l'eau potable. La cancérogénicité était le principal critère d'effet préoccupant et, dans la plupart des cas, on a utilisé l'extrapolation linéaire selon une approche sans seuil. Vu les faibles VBS obtenues au moyen de cette approche, la gestion du risque a été nécessaire afin d'assurer que les recommandations établies sont réalisables, compte tenu des techniques de traitement et d'analyse disponibles.
La plupart des évaluations du risque actuelles sont basées sur l'étude de DeAngelo et coll. (1998), qui a fait état d'une incidence accrue de tumeurs rénales, thyroïdiennes et mésothéliales chez les rats après une exposition à du bromate dans l'eau potable. En 2005, l'OMS a formulé une recommandation provisoire de 10 µg/L pour le bromate dans l'eau potable, dans une optique de gestion du risque basée sur une VBS de 2 µg/L. De même, l'U.S. EPA s'est basée sur cette étude pour établir sa norme de 2006 pour le bromate dans l'eau potable : un objectif de dose maximale de contaminant de 0 et une dose maximale de contaminant de 10 ppb ont été établis (U.S. EPA, 2006). L'Agence de protection de l'environnement de la Californie s'est également appuyée sur cette étude pour établir un objectif de santé publique de 0,1 ppb en 2009; l'Agence a adopté la dose maximale de contaminant de l'U.S. EPA de 10 ppb (OEHHA, 2009).
En Australie, le National Health and Medical Research Council a établi une ligne directrice pour l'eau potable de 0,02 mg/L pour le bromate en 1996 (NHMRC, 2011). L'évaluation du risque était basée sur une étude japonaise réalisée par Nakano et coll. (1989), dans laquelle on utilisait les changements rénaux chez le rat comme critère d'effet préoccupant.
11.0 Justification
Le bromate de potassium est classé par le CIRC comme cancérogène possible pour l'humain (groupe 2B) d'après des preuves suffisantes de cancérogénicité chez des animaux de laboratoire, mais des preuves insuffisantes chez les humains. La toxicité du bromate de potassium est associée à l'ion bromate, et non au sel lui-même. Le bromate n'est pas préoccupant dans l'eau d'alimentation; on le trouve dans l'eau potable à la suite du traitement de l'eau. Les plus importantes sources de bromate dans l'eau potable sont sa formation par le truchement de la réaction du bromure présent à l'état naturel et de l'ozone, et comme contaminant dans les solutions d'hypochlorite utilisées pour chlorer l'eau potable.
Les effets du bromate ont été étudiés chez les rongeurs dont l'eau potable contenait du bromate à diverses concentrations, et l'incidence de tumeurs dans les reins, la thyroïde et le mésothélium de la tunique vaginale a été observée. À l'aide du modèle PBPK et de l'ajustement allométrique, des doses de référence ont été calculées pour ces trois critères d'effet. L'étude des mésothéliomes de la tunique vaginale offre l'approche la plus prudente, qui a été utilisée pour le calcul d'une valeur basée sur la santé pour le bromate dans l'eau potable.
Une CMA de 0,01 mg/L (10 µg/L) est proposée pour le bromate dans l'eau potable, sur la base des considérations suivantes :
- Les concentrations représentant un risque à vie « essentiellement négligeable » de mésothéliomes de la tunique vaginale de 10−6 et 10−5 ont été établies à 0,0004 et 0,004 mg/L (0,4 et 4 µg/L), respectivement. Santé Canada a défini le risque « essentiellement négligeable » comme étant une plage allant d'un nouveau cas de cancer au-dessus des niveaux de fond par 100 000 personnes à un nouveau cas de cancer au-dessus des niveaux de fond par 1 million de personnes (c.-à-d. de 10−5 à 10−6). Comme l'eau potable est la source la plus importante d'exposition au bromate, la VBS pour le bromate dans l'eau potable est établie à 0,004 mg/L (4 µg/L), d'après un risque de cancer excédentaire à vie de 10−5. Cette concentration assure la protection à la fois contre le risque de cancer et les risques autres que le cancer résultant de l'exposition au bromate dans l'eau potable.
- D'après la capacité des laboratoires commerciaux, il existe des méthodes d'analyse permettant de mesurer avec fiabilité le bromate dans l'eau potable à la CMA proposée.
- Il est difficile de retirer le bromate une fois qu'il s'est formé dans l'eau potable. Les stratégies recommandées pour les systèmes municipaux consistent à empêcher sa formation en contrôlant le processus d'ozonation ou en s'assurant de la qualité des produits chimiques de traitement, par l'emploi de produits certifiés selon les normes appropriées de la NSF/ANSI. Les dispositifs de traitement résidentiels basés sur l'osmose inverse, la distillation ou l'échange d'ions devraient réduire la concentration de bromate à des niveaux inférieurs à la CMA proposée.
- Les efforts visant à réduire les concentrations de bromate ne doivent pas compromettre l'efficacité de la désinfection.
- La CMA proposée tient compte de la nécessité de s'assurer que la CPPI pour les solutions d'hypochlorite peut être atteinte par les fabricants et les services publics.
Santé Canada continuera, dans le cadre de son processus continu de révision des recommandations, de suivre les nouvelles recherches à ce sujet, et recommandera au besoin toute modification jugée appropriée.
12.0 Références
- Acero, J.L et von Gunten, U. (2001). Characterization of oxidation processes: ozonation and the AOP O3/H2O2. J. Am. Water Works Assoc., 93(10): 90-100.
- ACIA (2012). 2010-2011 Bromate dans l'eau embouteillée - Sommaire [en ligne]. Agence canadienne d'inspection des aliments. Disponible à : www.inspection.gc.ca/aliments/residus-chimiques-microbiologie/residus-chimiques/bromate/fra/1347981862898/1347982103854
- AGAT Laboratories (2014). Communications personnelles avec D. Desmarais (Burnaby, C.-B.), A. Al-Sakaf (Calgary, Alberta) et P. Reyno (Dartmouth, Nouvelle-Écosse).
- Ahlborn, G.J., Delker, D.A., Roop, B.C., Geter, D.R., Allen, J.W., DeAngelo, A.B. et Winnik, W.M. (2009). Early alterations in protein and gene expression in rat kidney following bromate exposure. Food Chem. Toxicol., 47: 1154-1160.
- Ahmad, M.K. et Mahmood, R. (2012). Oral administration of potassium bromate, a major water disinfection by-product, induces oxidative stress and impairs the antioxidant power of rat blood. Chemosphere, 87(7): 750-756.
- Ahmad, M.K., Naqshbandi, A., Fareed, M. et Mahmood, R. (2012). Oral administration of a nephrotoxic dose of potassium bromate, a food additive, alters renal redox and metabolic status and inhibits brush border membrane enzymes in rats. Food Chem., 134(2): 980-985.
- Allen, J.W., Collins, B.W., Lori, A., Afshari, A.J., George, M.H., DeAngelo, A.B. et Fuscoe, J.C. (2000). Erythrocyte and spermatid micronucleus analyses in mice chronically exposed to potassium bromate in drinking water. Environ. Mol. Mutagen., 36(3): 250-253.
- ALS Environmental (2014). Communication personnelle avec L. Neimor.
- Amy, G.L. et Siddiqui, M.S. (1999). Strategies to control bromate and bromide. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- Amy, G., Siddiqui, M., Zhai, W., Debroux, J. and Odem, W. (1994). Survey of bromide in drinking water and impacts on DBP formation. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- Amy, G.L., Westerhoff, P., Minear, R.A. et Song, R. (1997). Formation and control of brominated ozone by-products. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- ANSI/AWWA (2010). ANSI/AWWA B300-10 - Hypochlorites. American Water Works Association, Denver, Colorado.
- Arai, T., Kelly, V.P., Minowa, O., Noda, T. et Nishimura, S. (2002). High accumulation of oxidative DNA damage, 8-hydroxyguanine, in Mmh/Ogg1 deficient mice by chronic oxidative stress. Carcinogenesis, 23(12): 2005-2010.
- Asami, M., Aizawa, T., Morioka, T., Nishijima, W., Tabata, A. et Magara, Y. (1999). Bromate removal during transition from new granular activated carbon (GAC) to biological activated carbon (BAC). Water Res., 33(12): 2797-2804.
- ASTM (2012). Standard test methods for bromate, bromide, chlorate, and chlorite in drinking water by suppressed ion chromatography. ASTM International, West Conshohocken, Pennsylvania.
- Awogi, T., Murata, K., Uejima, M., Kuwahara, T., Asanami, S., Shimono, K. et Morita, T. (1992). Induction of micronucleated reticulocytes by potassium bromate and potassium chromate in CD-1 male mice. Mutat. Res., 278(2-3): 181-185.
- Ballmaier, D. et Epe, B. (2006). DNA damage by bromate: mechanism and consequences. Toxicology, 221(2-3): 166-171.
- Bao, M.L., Griffini, O., Santianni, D., Barbieri, K., Burrini, D. et Pantani, F. (1999). Removal of bromate ion from water using granular activated carbon. Water Res., 33(13): 2959-2970.
- Bartels, C.R., Rybar, S., Andes, K. et Franks, R. (2009). Optimized removal of boron and other specific contaminants by SWRO membranes. Dans : Proceedings of the International Desalination Association World Congress, Dubai, United Arab Emirates. International Desalination Association, Topsfield, MA.
- Benotti, M.J., Wert, E.C., Snyder, S.A., Owen, C. et Cheng, R. (2011). Role of bromamines on DBP formation and impact on chloramination and ozonation. Water Research Foundation, Denver, Colorado.
- Bolyard, M., Snyder Fair, P. et Hautman, D.P. (1992). Occurrence of chlorate in hypochlorite solutions used for drinking water disinfection. Environ. Sci. Technol., 26(8): 1663-1665.
- Bonacquisti, T.P. (2006). A drinking water utility's perspective on bromide, bromate, and ozonation. Toxicology, 221(2-3): 145-148.
- Bouland, S., Duguet, J.-P. et Montiel, A. (2005). Evaluation of bromate ions level introduced by sodium hypochlorite during post-disinfection of drinking water. Environ. Technol., 26(2): 121-125.
- Buffle, M.-O., Galli, S. et von Gunten, U. (2004). Enhanced bromate control during ozonation: the chlorine-ammonia process. Environ. Sci. Technol., 38(19): 5187-5195.
- Bull, R.J. et Cotruvo, J.A. (2006). Research strategy for developing key information on bromate's mode of action. Toxicology, 221(2-3):135-144.
- Bull, R.J. et Cotruvo, J.A. (2013). Nongenotoxic mechanisms involved in bromate-induced cancer in rats. J. Am. Water Works Assoc., 105(12): E709-E720.
- Bull, R.J., Kolisetty, N., Zhang, X., Muralidhara, S., Quiñones, O., Lim, K.Y., Guo, Z., Cotruvo, J.A., Fisher, J.W., Yang, X., Delker, D., Snyder, S.A. et Cummings, B.S. (2012). Absorption and disposition of bromate in F344 rats. Toxicology, 300(1-2): 83-91.
- Butler, R., Godley, A., Lytton, L. et Cartmell, E. (2005). Bromate environmental contamination: review of impact and possible treatment. Crit. Rev. Environ. Sci. Technol., 35(3): 193-217.
- Campbell, K.C. (2006). Bromate-induced ototoxicity. Toxicology, 221(2-3): 205-211.
- Campbell, J.L., Jr. (2013). Development of a rat and human PBPK model for bromate and estimation of human equivalent concentrations. Rapport établi pour Santé Canada.
- Carrasco-Turigas, G., Villanueva, C.M., Goñi, F., Rantakokko, P. et Nieuwenhuijsen, M.J. (2013). The effect of different boiling and filtering devices on the concentration of disinfection by-products in tap water. J. Environ. Public Health, 2013: 1-8.
- Chao, P. et Westerhoff, P. (2003). Water quality factors affecting hydroxyl radicals and bromate formation during ozonation. Dans : Water Quality Technology Conference and Exposition (WQTC) Conference Proceedings. American Water Works Association, Denver, Colorado.
- Chen, S., Zhu, Q., Liu, D., Cui, F., Fang, L. et Ma, D. (2013). Bromate control by UVC and UVA treatment in drinking water. Adv. Mater. Res., 807-809: 1455-1458.
- Chen, R., Yang, Q., Zhong, Y., Li, X., Li, X.-M., Du, W.-X. et Zeng, G.-M. (2014). Sorption of trace levels of bromate by macroporous strong base anion exchange resin: influencing factors, equilibrium isotherms and thermodynamic studies. Desalination, 344: 306-312.
- Chiang, P.C., Chang, E.E. et Liang, C.H. (2002). NOM characteristics and treatabilities of ozonation processes. Chemosphere, 46(6): 929-936.
- Chlorine Institute (1999). Bromate in sodium hypochlorite solutions - a progress report. Chlorine Institute, Washington, DC.
- Chuu, J.J., Hsu, C.J. et Lin-Shiau, S.Y. (2000). The detrimental effects of potassium bromate and thioglycolate on auditory brainstem response of guinea pigs. Chin. J. Physiol., 43(2): 91-96.
- CIRC (1999). Potassium bromate. Centre International de Recherches sur le Cancer. IARC Monogr. Eval. Carcinog. Risks Hum., 73: 481-496. Disponible à : http://monographs.iarc.fr/ENG/Monographs/vol73/mono73-22.pdf.
- Clewell, R.A., Merrill, E.A., Yu, K.O., Mahle, D.A., Sterner, T.R., Fisher, J.W. et Gearhart, J.M. (2003). Predicting neonatal perchlorate dose and inhibition of iodide uptake in the rat during lactation using physiologically-based pharmacokinetic modeling. Toxicol. Sci., 74(2): 416-436.
- Conservation et Gestion des ressources hydriques Manitoba (2011). Communication personnelle avec K. Philip.
- Cooper, W.J., Zika, R.G. et Steinhauer, M.S. (1985). Bromide-oxidant interactions and THM formation: a literature review. J. Am. Water Works Assoc., 77(4): 116-121.
- Cornwell, D. (2014). Impact of increased bromide in water sources on drinking water DBPs. Dans : American Water Works Association Annual Conference and Exposition (ACE) Conference Proceedings. American Water Works Association, Denver, Colorado.
- Cotruvo, J., Bull, R.J., Cummings, B.S., Delker, D, Zhongxian, G., Fisher, J., Quinones, O., Snyder, S.A. et Ong, C.N. (2012). Bromate disposition and mechanisms of toxicity at high and low doses. Water Research Foundation and International Ozone Association (Web Report No. 4042).
- Crofton, K.M. (2006). Bromate: concern for developmental neurotoxicity? Toxicology, 221(2-3): 212-216.
- Crofton, K.M. (2008). Thyroid disrupting chemicals: mechanisms and mixtures. Int. J. Androl., 31(2): 209-223.
- Crosby, L.M., Morgan, K.T., Gaskill, B., Wolf, D.C. et DeAngelo, A.B. (2000). Origin and distribution of potassium bromate-induced testicular and peritoneal mesotheliomas in rats. Toxicol. Pathol., 28(2): 253-266.
- Dabeka, R.W., Conacher, H.B.S., Lawrence, J.F., Newsome, W.H., McKenzie, A., Wagner, H.P., Chadha, R.K.H. et Pepper, K. (2002). Survey of bottled drinking waters sold in Canada for chlorate, bromide, bromate, lead, cadmium and other trace elements. Food Addit. Contam., 19(8): 721-732.
- DeAngelo, A.B., George, M.H., Kilburn, S.R., Moore, T.M. et Wolf, D.C. (1998). Carcinogenicity of potassium bromate administered in the drinking water to male B6C3F1 mice and F344/N rats. Toxicol. Pathol., 26(5): 587-594.
- Delker, D., Hatch, G., Allen, J., Crissman, B., George, M., Geter, D., Kilburn, S., Moore, T., Nelson, G., Roop, B., Slade, R., Swank, A., Ward, W. et DeAngelo, A. (2006). Molecular biomarkers of oxidative stress associated with bromate carcinogenicity. Toxicology, 221(2-3): 158-165.
- Dodd, D.E., Layko, D.K., Cantwell, K.E., Willson, G.A. et Thomas, R.S. (2013). Subchronic toxicity evaluation of potassium bromate in Fischer 344 rats. Environ. Toxicol. Pharmacol., 36(3): 1227-1234.
- Dorfman, L.M. et Adams, G.E. (1973). Reactivity of the hydroxyl radical in aqueous solutions. National Standard Reference Data System, U.S. National Bureau of Standards, U.S. Department of Commerce. Disponible à : http://permanent.access.gpo.gov/LPS112864/NSRDS-NBS-46.pdf
- Elovitz, M.S. et von Gunten, U. (1999). Hydroxyl radical/ozone ratios during ozonation processes. I. The Rct concept. Ozone Sci. Eng., 21(3): 239-260.
- Elovitz, M.S., von Gunten, U. et Kaiser, H.-P. (2000). Hydroxyl radical/ozone ratios during ozonation processes. II. The effect of temperature, pH, alkalinity, and DOM properties. Ozone Sci. Eng., 22(2): 123-150.
- Environnement Canada et Santé Canada (2010). Évaluation préalable pour le Défi concernant le Bromate de potassium. Numéro de registre du Chemical Abstracts Service : 7758-01-2. Disponible à : www.ec.gc.ca/ese-ees/47CCC26F-88C5-40E4-8C3D-FE88049DC9C7/batch9_7758-01-2_fr.pdf
- Fisher, J. et Bull, R.J. (2006). Development of a rat dosimetry model for bromate. Toxicology, 221(2-3): 235-240.
- Fujie, K., Shimazu, H., Matsuda, M. et Sugiyama, T. (1988). Acute cytogenetic effects of potassium bromate on rat bone marrow cells in vivo. Mutat. Res., 206(4): 455-458.
- Fujii, M., Oikawa, K., Saito, H., Fukuhara, C., Onosaka, S. et Tanaka, K. (1984). Metabolism of potassium bromate in rats. I. In vivo studies. Chemosphere, 13(11): 1207-1212.
- Geter, D.R., Ward, W.O., Knapp, G.W., DeAngelo, A.B., Rubis, J.A., Owen, R.D., Allen, J.W. et Delker, D.A. (2006). Kidney toxicogenomics of chronic potassium bromate exposure in F344 male rats. Transl. Oncogenomics, 1: 33-52.
- Gillogly, T., Najm, I., Minear, R., Mariñas, B., Urban, M., Kim, J.H., Echigo, S., Amy, G., Douville, C., Daw, B., Andrews, R., Hofmann, R. et Croué, J.-P. (2001). Bromate formation and control during ozonation of low bromide waters. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- Glaze, W.H. et Weinberg, H.S. (1993). Identification and occurrence of ozonation by-products in drinking water. AWWA Research Foundation and American Water Works Association, Denver, Colorado
- Glaze, W.H., Weinberg, H.S. et Cavanagh, J.E. (1993). Evaluating the formation of brominated DBPs during ozonation. J. Am. Water Works Assoc., 85(1): 96-103.
- GLUMRB (2012). Recommended standards for water works. Health Education Services, Great Lakes - Upper Mississippi River Board of State and Provincial Public Health and Environmental Managers, Albany, New York.
- Gordon, G. et Emmert, G.L. (1996). Bromate ion formation in water when chlorine dioxide is photolyzed in the presence of bromide ion. Dans : Water Quality Technology Conference and Exposition (WQTC) Conference Proceedings. American Water Works Association, Denver, Colorado.
- Grefte, A., Ross, P.S., Dignum, M., Cornelissen, E.R. et Rietveld, L.C. (2013). The influence of the removal of specific NOM compounds by anion exchange on ozone demand, disinfection capacity, and bromate formation. Ozone Sci. Eng., 35(4): 283-294.
- Greune, A. et Knappe, D. (2014). Uncovering the trends of increasing bromide in North Carolina's surface waters: sources and impacts on brominated DBPs throughout the state. ACE Conference Proceedings. American Water Works Association, Denver, Colorado.
- Guo, T.L., McCay, J.A., Karrow, N.A., Brown, R.D., Musgrove, D.L., Luebke, R.W., Germolec, D.R. et White, K.L., Jr. (2001). Immunotoxicity of sodium bromate in female B6C3F1 mice: a 28-day drinking water study. Drug Chem. Toxicol., 24(2): 129-149.
- Haag, W.R. et Hoigné, J. (1983). Ozonation of bromide-containing waters: kinetics of formation of hypobromous acid and bromate. Environ. Sci. Technol., 17(5): 261-267.
- Haag, W.R., Hoigné, J. et Bader, H. (1984). Improved ammonia oxidation by ozone in the presence of bromide ion during water treatment. Water Res., 18(9): 1125-1128.
- Haidri, S.F., Adu-Sarkodie, K. et Mariñas, B.J. (2003). Strategies for bromate control in drinking water ozonation. Dans : Water Quality Technology Conference and Exposition (WQTC) Conference Proceedings. American Water Works Association, Denver, Colorado.
- Hara, K., Osada, K., Matsunaga, K., Iwasaka, Y., Shibata, T. et Furuya, K. (2002). Atmospheric inorganic chlorine and bromine species in Arctic boundary layer of the winter/spring. J. Geophys. Res., 107(D18): AAC 4-1-AAC 4-15.
- Harrington-Brock, K., Collard, D.D. et Chen, T. (2003). Bromate induces loss of heterozygosity in the thymidine kinase gene of L5178Y/Tk+/−−3.7.2C mouse lymphoma cells. Mutat. Res., 537(1): 21-28.
- Harrison, C.J., Le Gouellec, Y.A., Cheng, R.C. et Childress, A.E. (2007). Bench-scale testing of nanofiltration for seawater desalination. J. Environ. Eng., 133(11): 1004-1014.
- Hayashi, M., Kishi, M., Sofuni, T. et Ishidate, M., Jr. (1988). Micronucleus tests in mice on 39 food additives and eight miscellaneous chemicals. Food Chem. Toxicol., 26(6): 487-500.
- Hayashi, M., Sutou, S., Shimada, H., Sato, S., Sasaki, Y.F. et Wakata, A. (1989). Difference between intraperitoneal and oral gavage application in the micronucleus test. The 3rd collaborative study by CSGMT/JEMS.MMS. Collaborative Study Group for the Micronucleus Test/Mammalian Mutagenesis Study Group of the Environmental Mutagen Society of Japan. Mutat. Res., 223(4): 329-344.
- Heeb, M.B., Criquet, J., Zimmermann-Steffens, S. et von Gunten, U. (2014). Oxidative treatment of bromide-containing water: formation of bromine and its reactions with inorganic and organic compounds - A critical review. Water Res., 48(1): 15-42.
- Hem, J.D. (1985). Study and interpretation of the chemical characteristics of natural water. 3rd edition. U.S. Geological Survey Water-Supply Paper 2254.
- Hofmann, R. (2014). Communication personnelle.
- Hofmann, R. et Andrews, R. (2001). Ammoniacal bromamines: a review of their influence on bromate formation during ozonation. Water Res., 35(3): 599-604.
- Hofmann, R. et Andrews, R. (2006). Impact of H2O2 and (bi)carbonate alkalinity on ammonia's inhibition of bromate formation. Water Res., 40(18): 3343-3348.
- Hofmann, R. et Andrews, R. (2007). Potential side effects of using ammonia to inhibit bromate formation during ozonation of drinking water. Rev. Gén. Sci. Env. / J. Environ. Eng. Sci., 6(6): 739-743. Comprend un résumé en français.
- Hofmann, R., Larcher, S. et Andrews, R. (2002). Effect of several natural water constituents on bromate formation during ozonation. Water Sci. Technol., 2(5-6): 501-507.
- Hoigné, J. et Bader, H. (1994). Kinetics of reactions of chlorine dioxide (OClO) in water - I. Rate constants for inorganic and organic compounds. Water Res., 28(1): 45-55.
- Huang, W., Peng, H., Peng, M. et Chen, L. (2004). Removal of bromate and assimilable organic carbon from drinking water using granular activated carbon. Water Sci. Technol., 50(8): 73-80.
- Ikehata, K. et Gamal El-Din, M. (2006). Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type advanced oxidation processes: a review. Rev. Gén. Sci. Env. / J. Environ. Eng. Sci., 5(2): 81-135. Comprend un résumé en français.
- Ikehata, K., Wang, L., Nessl, M.B., Komor, A.T., Cooper, W.J. et McVicker, R.R. (2013). Effect of ammonia and chloramine pretreatment during the ozonation of a colored groundwater with elevated bromide. Ozone Sci. Eng., 35(6): 438-447.
- Ishidate, M., Jr., Sofuni, T., Yoshikawa, K., Hayashi, M., Nohmi, T., Sawada, M. et Matsuoka, A. (1984). Primary mutagenicity screening of food additives currently used in Japan. Food Chem. Toxicol., 22(8): 623-636.
- Kawachi, T., Yahagi, T., Kada, T., Tazima, Y., Ishidate, M., Sasaki, M. et Sugiyama, T. (1980). Cooperative programme on short-term assays for carcinogenicity in Japan. IARC Sci. Publ., 27: 323-330 [cité dans Moore et Chen, 2006].
- Kawana, K., Nakaoka, T., Horiguchi, Y., Watanabe, S. et Kawauchi, S. (1991). [Toxicological study of potassium bromate: 2. Hepatotoxic effects of the potassium bromate and benzo[a]pyrene simultaneous administration in mice.] Jpn. J. Toxicol. Environ. Health, 37(4): 266-275 (en japonais) [cité dans Environnement Canada et Santé Canada, 2010].
- Kawanishi, S. et Murata, M. (2006). Mechanism of DNA damage induced by bromate differs from general types of oxidative stress. Toxicology, 221(2-3): 172-178.
- Kaya, F.F. et Topaktaş, M. (2007). Genotoxic effects of potassium bromate on human peripheral lymphocytes in vitro. Mutat. Res., 626(1-2): 48-52.
- Keith, J.D., Pacey, G.E., Cotruvo, J.A. et Gordon, G. (2006). Experimental results from the reaction of bromate ion with synthetic and real gastric juices. Toxicology, 221(2-3): 225-228.
- Kimbrough, E., Boulos, L., Surawanvijit, S., Zacheis, A. et Cohen, Y. (2013). Pilot-testing of electrolysis for bromide removal from drinking water. J. Am. Water Works Assoc, 105(6): E299-E309.
- Kirisits, M.J., Snoeyink, V.L. et Kruithof, J.C. (2000). The reduction of bromate by granular activated carbon. Water Res., 34(17): 4250-4260.
- Kirisits, M., Snoeyink, V., Inan, H., Chee-Sanford, J., Raskin, L. et Brown, J. (2001). Water quality factors affecting bromate reduction in biologically active carbon filters. Water Res., 35(4): 891-900.
- Kolisetty, N., Bull, R.J., Muralidhara, S., Costyn, L.J., Delker, D.A., Guo, Z., Cotruvo, J.A., Fisher, J.W. et Cummings, B.S. (2013a). Association of brominated proteins and changes in protein expression in the rat kidney with subcarcinogenic to carcinogenic doses of bromate. Toxicol. Appl. Pharmacol., 272(2): 391-398.
- Kolisetty, N., Delker, D.A., Muralidhara, S., Bull, R.J., Cotruvo, J.A., Fisher, J.W. et Cummings, B.S. (2013b). Changes in mRNA and protein expression in the renal cortex of male and female F344 rats treated with bromate. Arch. Toxicol., 87(11): 1911-1925.
- Krasner, S.W. et Yates, R.S. (1996). Use of ferrous and ferric coagulants to reduce bromate and particulate levels. Dans : Proceedings of the American Water Works Association Annual Conference, Toronto, Ontario. American Water Works Association, Denver, Colorado. pp. 287-301.
- Krasner, S.W., McGuire, M.J., Jacangelo, J.G., Patania, N.L., Reagan, K.M. et Aieta, E.M. (1989). The occurrence of disinfection by-products in US drinking water. J. Am. Water Works Assoc., 81(8): 41-53.
- Krasner, S.W., Gramith, J.T., Means, E.G., Patania, N.L., Najm, I.N. et Aieta, E.M. (1991). Formation and control of brominated ozone by-products. Dans : Proceedings of the American Water Works Association Annual Conference, Philadelphia, PA. American Water Works Association, Denver, Colorado. pp. 945-971.
- Krasner, S.W., Glaze, W.H., Weinberg, H.S., Daniel, P.A. et Najm, I.N. (1993). Formation and control of bromate during ozonation of waters containing bromide. J. Am. Water Works Assoc., 85(1): 73-81.
- Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39-51.
- Kruithof, J.C. et Meijers, R.T. (1995). Bromate formation by ozonation and advanced oxidation and potential options in drinking water treatment. Water Supply, 13(2): 93-103.
- Kurata, Y., Diwan, B.A. et Ward, J.M. (1992). Lack of renal tumour-initiating activity of a single dose of potassium bromate, a genotoxic renal carcinogen in male F344/NCr rats. Food Chem. Toxicol., 30(3): 251-259.
- Kurokawa, Y., Hayashi, Y., Maekawa, A., Takahashi, M., Kokubo, T. et Odashima, S. (1983). Carcinogenicity of potassium bromate administered orally to F344 rats. J. Natl. Cancer Inst., 71(5): 965-972.
- Kurokawa, Y., Aoki, S., Imazawa, T., Hayashi, Y., Matsushima, Y. et Takamura, N. (1985). Dose-related enhancing effect of potassium bromate on renal tumorigenesis in rats initiated with N-ethyl-N-hydroxyethyl-nitrosamine. Jpn. J. Cancer Res. (Gann), 76(7): 583-589.
- Kurokawa, Y., Aoki, S., Matsushima, Y., Takamura, N., Imazawa, T. et Hayashi, Y. (1986a). Dose-response studies on the carcinogenicity of potassium bromate in F344 rats after long-term oral administration. J. Natl. Cancer Inst., 77(4): 977-982.
- Kurokawa, Y., Takayama, S., Konishi, Y., Hiasa, Y., Asahina, S., Takahashi, M., Maekawa, A. et Hayashi, Y. (1986b). Long-term in vivo carcinogenicity tests of potassium bromate, sodium hypochlorite, and sodium chlorite conducted in Japan. Environ. Health Perspect., 69: 221-235.
- Kurokawa, Y., Matsushima, Y., Takamura, N., Imazawa, T. et Hayashi, Y. (1987). Relationship between the duration of treatment and the incidence of renal cell tumors in male F344 rats administered potassium bromate. Jpn. J. Cancer Res., 78(4): 358-364.
- Kurokawa, Y., Maekawa, A., Takahashi, M. et Hayashi, Y. (1990). Toxicity and carcinogenicity of potassium bromate…a new renal carcinogen. Environ. Health Perspect., 87: 309-335.
- Langlais, B., Reckhow, D.A. et Brink, D.R. (éd.) (1991). Ozone in water treatment: application and engineering. A cooperative research report. American Water Works Association Research Foundation and Compagnie générale des eaux; CRC Press, Lewis Publishers, Boca Raton, Florida.
- Larocque, R.L. et Eng. P. (1999). Ozone applications in Canada: a state of the art review. Ozone Sci. Eng., 21(2): 119-125.
- LeChevallier, M.W., Lowry, C.D., Lee, R.G. et Gibbon, D.L. (1993). Examining the relationship between iron corrosion and the disinfection of biofilm bacteria. J. Am. Water Works Assoc., 85(7): 111-123.
- Lefebvre, E., Racaud, P., Parpaillon, T. et Deguin, A. (1995). Results of bromide and bromate monitoring at several water treatment plants. Ozone Sci. Eng., 17(3): 311-327.
- Legube, B. (1996). A survey of bromate ion in European drinking water. Ozone Sci. Eng., 18(4): 325-348.
- Legube, B., Parinet, B., Gelinet, K., Berne, F. et Croué, J.-P. (2004). Modeling of bromate formation by ozonation of surface waters in drinking water treatment. Water Res., 38(8): 2185-2195.
- Liu, C., von Gunten, U. et Croué, J.-P. (2012). Enhanced bromate formation during chlorination of bromide-containing waters in the presence of CuO: catalytic disproportionation of hypobromous acid. Environ. Sci. Technol., 46(20): 11054-11061.
- Liu, C., von Gunten, U. et Croué, J.-P. (2013). Chlorination of bromide-containing waters: enhanced bromate formation in the presence of synthetic metal oxides and deposits formed in drinking water distribution systems. Water Res., 47(14): 5307-5315.
- Loveland, J.P., Means, E.G., III, et Chao, P.-F. (2004). Advanced techniques for bromate reduction: pilot testing chlorine dioxide, chloramination and MIEX treatment with ozonation. Dans : Water Quality Technology Conference and Exposition (WQTC) Conference Proceedings. American Water Works Association, Denver, Colorado.
- Luan, Y., Suzuki, T., Palanisamy, R., Takashima, Y., Sakamoto, H., Sakuraba, M., Koizumi, T., Saito, M., Matsufuji, H., Yamagata, K., Yamaguchi, T., Hayashi, M. et Honma, M. (2007). Potassium bromate treatment predominantly causes large deletions, but not GC>TA transversion in human cells. Mutat. Res., 619(1-2): 113-123.
- Matsushima, Y., Takamura, N., Imazawa, T., Kurokawa, Y. et Hayashi, Y. (1986). Lack of carcinogenicity of potassium bromate after subcutaneous injection to newborn mice and newborn rats. Sci. Rep. Res. Inst. Tohoku Univ. Med., 33(1-4): 22-26.
- Maxxam Analytics (2014). Communication personnelle avec H. Varma.
- McDorman, K.S., Pachkowski, B.F., Nakamura, J., Wolf, D.C. et Swenberg, J.A. (2005). Oxidative DNA damage from potassium bromate exposure in Long-Evans rats is not enhanced by a mixture of drinking water disinfection by-products. Chem. Biol. Interact., 152(2-3): 107-117.
- Meek, M.E., Bucher, J.R., Cohen, S.M., Dellarco, V., Hill, R.N., Lehman-McKeeman, L.D., Longfellow, D.G., Pastoor, T., Seed, J. et Patton, D.E. (2003). A framework for human relevance analysis of information on carcinogenic modes of action. Crit. Rev. Toxicol., 33(6): 591-653.
- Meek, M.E., Boobis, A., Cote, I., Dellarco, V., Fotakis, G., Munn, S., Seed, J. et Vickers, C. (2014a). New developments in the evolution and application of the WHO/IPCS framework on mode of action/species concordance analysis. J. Appl. Toxicol., 34(1): 1-18.
- Meek, M.E., Palermo, C.M., Bachman, A.N., North, C.M. et Lewis, R.J. (2014b). Mode of action human relevance (species concordance) framework: evolution of the Bradford Hill considerations and comparative analysis of weight of evidence. J. Appl. Toxicol., 34(6): 595-606.
- Merrill, E.A., Clewell, R.A., Robinson, P.J., Jarabek, A.M., Gearhart, J.M., Sterner, T.R. et Fisher, J.W. (2005). PBPK model for radioactive iodide and perchlorate kinetics and perchlorate-induced inhibition of iodide uptake in humans. Toxicol Sci., 83(1):25-43.
- Ministère du Développement durable, de l'Environnement et des Parcs du Québec (2011). Communication personnelle avec C. Robert.
- Ministère de l'Environnement de l'Ontario (2009). Programme de surveillance de l'eau potable, 2009 (données). Disponible à : www.ontario.ca/fr/environnement-et-energie/drinking-water-surveillance-program-dwsp-data.
- Ministère de l'Environnement de l'Ontario (2011). Communication personnelle avec S. Deshpande.
- Ministère de la Santé du Nouveau-Brunswick (2011). Communication personnelle avec K. White.
- Moore, M.M. et Chen, T. (2006). Mutagenicity of bromate: implications for cancer risk assessment. Toxicology , 221(2-3): 190-196.
- Nakajima, M., Kitazawa, M., Oba, K., Kitagawa, Y. et Toyoda, Y. (1989). Effect of route of administration in the micronucleus test with potassium bromate. Mutat. Res., 223(4): 399-402.
- Naumov, S. et von Sonntag, C. (2008). The reactions of bromide with ozone towards bromate and the hypobromite puzzle: a density functional theory study. Ozone Sci. Eng., 30(5): 339-343.
- Neemann, J., Hulsey, R., Rexing, D. et Wert, E. (2004). Controlling bromate formation during ozonation with chlorine and ammonia. J. Am. Water Works Assoc., 96(2): 26-29.
- Newfoundland and Labrador Department of Environment and Conservation (2011). Communication personnelle avec H. Khan.
- NHMRC (2011). Australian drinking water guidelines. National Health and Medical Research Council. Disponible à : www.nhmrc.gov.au/guidelines/publications/eh52.
- Nova Scotia Environment. (2011). Communication personnelle avec C. Mosher.
- NSF/ANSI (2014). NSF / ANSI 60 - Produits chimiques de traitement de l'eau potable - Effets sur la santé. NSF International, Ann Arbor, Michigan.
- NSF (2012). Occurrence of bromate in hypochlorite: summary of NSF testing experience on certified calcium hypochlorite and sodium hypochlorite under NSF/ANSI Standard 60 (2004-2011). NSF International, Ann Arbor, Michigan.
- NTP (1996). National Toxicology Program (US). Sodium bromate: short term reproductive and developmental toxicity study when administered to Sprague-Dawley rats in the drinking water. Research Triangle Park (NC): US Department of Health and Human Services, National Toxicology Program. Report No.: NTP-RDGT-94-007. NIEHS Publication No. NIEHS-N01-ES-15323. Disponible à : http://ntp.niehs.nih.gov/index.cfm?objectid=070EAFCC-E977-3861-AC7327B175DE633C.
- NTP (2001). Sodium bromate: reproductive assessment by continuous breeding when administered to Sprague-Dawley rats in drinking water. Draft final report. Prepared for the National Toxicology Program by TherImmune Research Corporation, Gaithersburg, MD (Study No. 7244-209) [cité dans NTP, 2007].
- NTP (2007). NTP report on the toxicology studies of sodium bromate (CAS NO. 7789-38-0) in genetically modified (FVB Tg.AC hemizygous) mice (dermal and drinking water studies) and carcinogenicity studies of sodium bromate in genetically modified B6.129-Trp53tm1Brd (N5) haploinsufficient] mice (drinking water studies). National Toxicology Program, National Institutes of Health, Public Health Service, U.S. Department of Health and Human Services, Research Triangle Park, NC (NTP GMM 6; NIH Publication No. 07-4423). Disponible à : http://ntp.niehs.nih.gov/ntp/htdocs/gmm_rpts/gmm6.pdf.
- OEHHA (2009). Public health goals for chemicals in drinking water bromate. Office of Environmental Health Hazard Assessment, California Environmental Protection Agency, Sacramento, California.
- Peldszus, S., Andrews, S.A., Souza, R., Smith, F., Douglas, I., Bolton, J. et Huck, P.M. (2004). Effect of medium-pressure UV irradiation on bromate concentrations in drinking water, a pilot-scale study. Water Res., 38(1): 211-217.
- Peyton, G.R., Bell, O.J., Girin, E., LeFaivre, M.H. et Sanders, J. (1998). Effect of bicarbonate alkalinity on performance of advanced oxidation processes. AWWA Research Foundation and American Water Works Association, Denver, CO.
- Pinkernell, U. et von Gunten, U. (2001). Bromate minimization during ozonation: mechanistic considerations. Environ. Sci. Technol., 35(12): 2525-2531.
- PISSC (2007). Part 1: IPCS framework for analysing the relevance of a cancer mode of action for humans and case-studies. Part 2: IPCS framework for analysing the relevance of a non-cancer mode of action for humans. Programme international sur la sécurité des substances chimiques, Organisation mondiale de la Santé, Genève, Suisse (Harmonization Project Document No. 4). Disponible à : www.who.int/ipcs/methods/harmonization/areas/cancer_mode.pdf?ua=1
- Platel, A., Nesslany, F., Gervais, V. et Marzin, D. (2009). Study of oxidative DNA damage in TK6 human lymphoblastoid cells by use of the in vitro micronucleus test: determination of no-observed-effect levels. Mutat. Res., 678(1): 30-37.
- Platel, A., Nesslany, F., Gervais, V., Claude, N. et Marzin, D. (2011). Study of oxidative DNA damage in TK6 human lymphoblastoid cells by use of the thymidine kinase gene-mutation assay and the in vitro modified comet assay: determination of no-observed-genotoxic-effect-levels. Mutat. Res., 726(2): 151-159.
- Plewa, M.J., Kargalioglu, Y., Vankerk, D., Minear, R.A. et Wagner, E.D. (2002). Mammalian cell cytotoxicity and genotoxicity analysis of drinking water disinfection by-products. Environ. Mol. Mutagen., 40(2): 134-142.
- Poul, J.M., Huet, S., Godard, T. et Sanders, P. (2004). Lack of genotoxicity of potassium iodate in the alkaline comet assay and in the cytokinesis-block micronucleus test. Comparison to potassium bromate. Food Chem. Toxicol., 42(2): 203-209.
- Priestley, C.C., Green, R.M., Fellows, M.D., Doherty, A.T., Hodges, N.J. et O'Donovan, M.R. (2010). Anomalous genotoxic responses induced in mouse lymphoma L5178Y cells by potassium bromate. Toxicology, 267(1-3): 45-53.
- Rakness, K.L., DeMers, L.D. et Blank, B.D. (1996). Ozone system fundamentals for drinking water treatment. Opflow, 22(7): 1, 4-5.
- Richardson, S.D., Fasano, F., Ellington, J.J., Crumley, F.G., Buettner, K.M., Evans, J.J., Blount, B.C., Silva, L.K., Waite, T.J., Luther, G.W., McKague, A.B., Miltner, R.J., Wagner, E.D. et Plewa, M.J. (2008). Occurrence and mammalian cell toxicity of iodinated disinfection byproducts in drinking water. Environ. Sci. Technol., 42(22): 8330-8338.
- Robbiano, L., Carrozzino, R., Puglia, C.P., Corbu, C. et Brambilla, G. (1999). Correlation between induction of DNA fragmentation and micronuclei formation in kidney cells from rats and humans and tissue-specific carcinogenic activity. Toxicol. Appl. Pharmacol., 161(2): 153-159.
- Sai, K., Hayashi, M., Takagi, A., Hasegawa, R., Sofuni, T. et Kurokawa, Y. (1992a). Effects of antioxidants on induction of micronuclei in rat peripheral blood reticulocytes by potassium bromate. Mutat. Res., 269(1): 113-118.
- Sai, K., Umemura, T., Takagi, A., Hasegawa, R. et Kurokawa, Y. (1992b). The protective role of glutathione, cysteine and vitamin C against oxidative DNA damage induced in rat kidney by potassium bromate. Jpn. J. Cancer Res., 83(1): 45-51.
- Santé Canada (1995). Étude nationale sur les sous-produits de désinfection chlorés dans l'eau potable au Canada. Direction de l'hygiène du milieu, Direction générale de la protection de la santé, Santé Canada, Ottawa (Ontario).
- Santé Canada (2006). Recommandations pour la qualité de l'eau potable au Canada : document technique - Les trihalométhanes. Bureau de qualité de l'eau et de la santé, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2008). Recommandations pour la qualité de l'eau potable au Canada : document technique - Les acides haloacétiques. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario).
- Santé Canada (2014a). Communication personnelle avec Anca-Maria Tugulea.
- Santé Canada (2014b). Mode of action and human relevance analysis for bromate - Internal report. Document fourni sur demande.
- SGS Environmental Services (2014). Communication personnelle avec D. Griffin.
- Siddiqui, M.S. et Amy, G.L. (1993). Factors affecting DBP formation during ozone-bromide reactions. J. Am. Water Works Assoc., 85(1): 63-72.
- Siddiqui, M., Amy, G.L., Ozekin, K., Zhai, W. et Westerhoff, P. (1994). Alternative strategies for removing bromate. J. Am. Water Works Assoc., 86(10): 81-96.
- Siddiqui, M.S., Amy, G.L. et Rice, R.G. (1995). Bromate ion formation: a critical review. J. Am. Water Works Assoc., 87(10): 58-70.
- Snyder, S., Vanderford, B., Snyder, E. et Rexing, D. (2004). Trace analysis of perchlorate, bromate, chlorate, and iodate in natural and bottled waters. Dans : Water Quality Technology Conference and Exposition (WQTC) Conference Proceedings. American Water Works Association, Denver, Colorado.
- Snyder, S.A., Stanford, B.D., Pisarenko, A.N., Gordon, G. et Asami, M. (2009). Hypochlorite - An assessment of factors that influence the formation of perchlorate and other contaminants. American Water Works Association, Denver, CO.
- Song, R., Donohoe, C., Minear, R., Westerhoff, P., Ozekin, K. et Amy, G. (1996). Empirical modeling of bromate formation during ozonation. Water Res., 30(5): 1161-1168.
- Song, R., Westerhoff, P., Minear, R. et Amy, G. (1997). Bromate minimization during ozonation. J. Am. Water Works Assoc., 89(6): 69-78.
- Speit, G., Haupter, S., Schütz, P. et Kreis, P. (1999). Comparative evaluation of the genotoxic properties of potassium bromate and potassium superoxide in V79 Chinese hamster cells. Mutat. Res., 439(2): 213-221.
- Speitel, G.E., Wanielista, M.M., Symons, J.M. et Davis, J.M. (1999). Advanced oxidation and biodegradation processes for the destruction of TOC and DBP precursors. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- SRC Environmental Analytical Laboratories (2014). Communication personnelle avec R. Ortmann.
- Staehelin, J. et Hoigné, J. (1982). Decomposition of ozone in water: rate of initiation by hydroxide ions and hydrogen peroxide. Environ. Sci. Technol., 16(10): 676-681.
- Stanford, B.D., Pisarenko, A.N., Snyder, S.A. et Gordon, G. (2011). Perchlorate, bromate and chlorate in hypochlorite solutions: guidelines for utilities. J. Am. Water Works Assoc., 103(6): 71-83.
- Stanford, B.D., Pisarenko, A.N., Dryer, D.J., Zeigler-Holady, J.C., Gamage, S., Quiñones, O., Vanderford, B.J. et Dickenson, E.R.V. (2013). Chlorate, perchlorate, and bromate in onsite-generated hypochlorite systems. J. Am. Water Works Assoc., 105(3): E92-E102.
- Suzuta, K., Ogawa, S., Takeda, Y., Kaneyama, K. et Arai, K. (2012). Intermolecular disulfide cross-linked structural change induced by permanent wave treatment of human hair with thioglycolic acid. J. Cosmet. Sci., 63(3): 177-196.
- Symons, J.M. et Zheng, M.C.H. (1997). Technical Note: Does hydroxyl radical oxidize bromide to bromate? J. Am. Water Works Assoc., 89(6): 106-109.
- Symons, J.M., Bradley, L.C., Jr., et Cleveland, T.C. (2000). The drinking water dictionary. American Water Works Association, Denver, Colorado.
- Takamura, N., Kurokawa, Y., Matsushima, Y., Imazawa, T., Onodera, H. et Hayashi, Y. (1985). Long-term oral administration of potassium bromate in male Syrian golden hamsters. Sci. Rep. Res. Inst. Tohoku Univ. Med., 32(1-4): 43-46 [cité dans DeAngelo et al., 1998].
- Umemura, T. et Kurokawa, Y. (2006). Etiology of bromate-induced cancer and possible modes of action - studies in Japan. Toxicology, 221(2-3): 154-157.
- Umemura, T., Sai, K., Takagi, A., Ryuichi, H. et Kurokawa, Y. (1993). A possible role for cell proliferation in potassium bromate (KBrO3) carcinogenesis. J. Cancer Res. Clin. Oncol., 119(8): 463-469.
- Umemura, T., Sai, K., Takagi, A., Hasegawa, R. et Kurokawa, Y. (1995). A possible role for oxidative stress in potassium bromate (KBrO3) carcinogenesis. Carcinogenesis, 16(3): 593-597.
- Umemura, T., Takagi, A., Sai, K., Hasegawa, R. et Kurokawa, Y. (1998). Oxidative DNA damage and cell proliferation in kidneys of male and female rats during 13-weeks exposure to potassium bromate (KBrO3). Arch. Toxicol., 72(5): 264-269.
- Umemura, T., Kitamura, Y., Kanki, K., Maruyama, S., Okazaki, K., Imazawa, T., Nishimura, T., Hasegawa, R., Nishikawa, A. et Hirose, M. (2004). Dose-related changes of oxidative stress and cell proliferation in kidneys of male and female F344 rats exposed to potassium bromate. Cancer Sci., 95(5): 393-398.
- Umemura, T., Kanki, K., Kuroiwa, Y., Ishii, Y., Okano, K., Nohmi, T., Nishikawa, A. et Hirose, M. (2006). In vivo mutagenicity and initiation following oxidative DNA lesion in the kidneys of rats given potassium bromate. Cancer Sci., 97(9): 829-835.
- Umemura, T., Tasaki, M., Kijima, A., Okamura, T., Inoue, T., Ishii, Y., Suzuki, Y., Masui, N., Nohmi, T. et Nishikawa, A. (2009). Possible participation of oxidative stress in causation of cell proliferation and in vivo mutagenicity in kidneys of gpt delta rats treated with potassium bromate. Toxicology, 257(1-2): 46-52.
- Underwriters Laboratories LLC (2012). Report on bromate in hypochlorite samples evaluated in accordance with NSF/ANSI 60 - Drinking Water Treatment Chemicals - Health Effects: Summary of Underwriters Laboratories test results from 9/13/2006 to 12/31/2011. Underwriters Laboratories LLC, Northbrook, Illinois.
- U.S. EPA (1997a). Method 300.1. Determination of inorganic anions in drinking water by ion chromatography. Revision 1.0. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio. (EPA/600/R-98-118).
- U.S. EPA (1997b). Method 321.8. Determination of bromate in drinking waters by ion chromatography inductively coupled plasma - mass spectrometry. Revision 1.0. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio.
- U.S. EPA (1998). Environmental Protection Agency, 40 CFR Parts 9, 141, and 142. National Primary Drinking Water Regulations: Disinfectants and Disinfection Byproducts; Final rule. Federal Register, 63(241): 69390-69476. Disponible à : www.gpo.gov/fdsys/pkg/FR-1998-12-16/pdf/98-32887.pdf.
- U.S. EPA (2001a). Toxicological review of bromate. U.S. Environmental Protection Agency, Washington, DC (EPA/635/R-01-002).
- U.S. EPA (2001b). Method 317.0. Determination of inorganic oxyhalide disinfection by-products in drinking water using ion chromatography with the addition of a postcolumn reagent for trace bromate analysis. Revision 2.0. Technical Support Center, Office of Ground Water and Drinking Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-01-001).
- U.S. EPA (2002). Method 326.0. Determination of inorganic oxyhalide disinfection by-products in drinking water using ion chromatography incorporating the addition of a suppressed acidified postcolumn reagent for trace bromate analysis. Revision 1.0. Technical Support Center, Office of Ground Water and Drinking Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-R-03-007).
- U.S. EPA (2003). Environmental Protection Agency, 40 CFR Parts 141, 142 and 143. National Primary Drinking Water Regulations: Stage 2 Disinfectants and Disinfection Byproducts Rule; National Primary and Secondary Drinking Water Regulations: Approval of Analytical Methods for Chemical Contaminants; Proposed rule. Federal Register, 68(159): 49548-49681. Disponible à : www.gpo.gov/fdsys/pkg/FR-2003-08-18/pdf/03-18149.pdf.
- U.S. EPA (2006). National Primary Drinking Water Regulations: Stage 2 Disinfectants and Disinfection Byproducts Rule; Final rule. U.S. Environmental Protection Agency. 40 CFR Parts 9, 141, and 142. Fed. Regist., 71(2): 388-493 Disponible à : www.gpo.gov/fdsys/pkg/FR-2006-01-04/pdf/06-3.pdf.
- U.S. EPA (2009a). Method 302.0. Determination of bromate in drinking water using two-dimensional ion chromatography with suppressed conductivity detection. Technical Support Center, Office of Ground Water and Drinking Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-09-014).
- U.S. EPA (2009b). Method 557. Determination of haloacetic acids, bromate, and dalapon in drinking water by ion chromatography electrospray ionization tandem mass spectrometry (IC-ESI-MS/MS). Version 1.0. Technical Support Center, Office of Ground Water and Drinking Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-09-012).
- U.S. EPA (2009c). Analytical feasibility support document for the second six-year review of existing National Primary Drinking Water Regulations. Office of Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-09-003).
- U.S. EPA (2009d). MSW time to tumor and supporting documentation. U.S. Environmental Protection Agency, Washington, DC.
- U.S. EPA (2013). Benchmark Dose Software (BMDS). Version 2.2 R65 [Build: 04/01/2013]. National Center for Environmental Assessment. Disponible à : www.epa.gov/NCEA/bmds/index.html.
- U.S. EPA (2014). Analytical methods approved for drinking water compliance monitoring under the Disinfection Byproduct Rule. Office of Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-14-004).
- Valero, F. and Arbós, R. (2010). Desalination of brackish water using electrodialysis reversal control of the THMs formation in Barcelona (NE Spain) area. Desalination, 253(1-3): 170-174.
- van der Hoek, J.P., Rijinbende, D.O., Lokin, C.J.A., Bonné, P.A.C., Loonen, M.T. et Hofman, J.A.M.H. (1998). Electrodialysis as an alternative for reverse osmosis in an integrated membrane system. Desalination, 117(1-3): 159-172.
- von Gunten, U. (2003). Ozonation of drinking water: Part II. Disinfection and by-product formation in presence of bromide, iodide or chlorine. Water Res., 37(7): 1469-1487.
- von Gunten, U. et Hoigné, J. (1992). Factors controlling the formation of bromate during ozonation of bromide-containing waters. J. Water Supply Res. Technol. Aqua, 41(5): 299-304.
- von Gunten, U. et Hoigné, J. (1994). Bromate formation during ozonation of bromide-containing waters: interaction of ozone and hydroxyl radical reactions. Environ. Sci. Technol., 28(7): 1234-1242.
- von Gunten, U. et Oliveras, Y. (1997). Kinetics of the reaction between hydrogen peroxide and hypobromous acid: implication on water treatment and natural systems. Water Res., 31(4): 900-906.
- von Gunten, U., Hoigné, J. et Bruchet, A. (1995). Bromate formation during ozonation of bromide-containing waters. Water Supply, 13(1): 45-50.
- Watson, K., Farre, M.J. et Knight, N. (2012). Strategies for the removal of halides from drinking water sources, and their applicability in disinfection by-product minimisation: a critical review. J. Environ. Manag., 110: 276-298.
- Wei, M., Hamoud, A.S., Yamaguchi, T., Kakehashi, A., Morimura, K., Doi, K., Kushida, M., Kitano, M., Wanibuchi, H. et Fukushima, S. (2009). Potassium bromate enhances N-ethyl-N-hydroxyethylnitrosamine-induced kidney carcinogenesis only at high doses in Wistar rats: indication of the existence of an enhancement threshold. Toxicol. Pathol., 37(7): 983-991.
- Weinberg, H.S., Delcomyn, C.A. et Unnam, V. (2003). Bromate in chlorinated drinking waters: occurrence and implications for future regulation. Environ. Sci. Technol., 37(14): 3104-3110.
- Wert, E.C. et Benotti, M. (2010). Identifying the role of bromamines in minimizing bromate formation. Dans : Water Quality Technology Conference and Exposition (WQTC) Conference Proceedings. American Water Works Association, Denver, Colorado.
- Wert, E.C., Neemann, J.J., Rexing, D.J. et Zegers, R.E. (2008). Biofiltration for removal of BOM and residual ammonia following control of bromate formation. Water Res., 42(1-2): 372-378.
- Westerhoff, P. (1995). Ozone oxidation of bromide and natural organic matter. PhD Dissertation , University of Colorado, Boulder, Colorado.
- Westerhoff, P. (2014). Communication personnelle.
- Westerhoff, P., Song, R., Amy, G. et Minear, R. (1998). NOM's role in bromine and bromate formation during ozonation. J. Am. Water Works Assoc., 90(2): 82-94.
- Westerhoff, P., Aiken, G., Amy, G. et Debroux, J. (1999). Relationships between the structure of natural organic matter and its reactivity towards molecular ozone and hydroxyl radicals. Water Res., 33(10): 2265-2276.
- Westerhoff, P., Summers, R.S., Chowdhury, Z. et Kommineni, S. (2005). Ozone-enhanced biofiltration for geosmin and MIB removal. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
- OMS (2005). Bromate in drinking-water: background document for development of WHO guidelines for drinking-water quality. Organisation mondiale de la santé. Genève, Suisse.. WHO/SDE/WSH/05.08/78. Disponible à : www.who.int/water_sanitation_health/dwq/chemicals/bromate260505.pdf
- Williams, M.D., Coffey, B.M. et Krasner, S.W. (2003). Evaluation of pH and ammonia for controlling bromate during Cryptosporidium disinfection. J. Am. Water Works Assoc., 95(10): 82-93.
- Wiśniewski, J.A. et Kabsh-Korbutowicz, M. (2010). Bromate removal in the ion-exchange process. Desalination, 261(1-2): 197-201.
- Wiśniewski, J.A., Kabsh-Korbutowicz, M. et Łakomska, S. (2011). Donnan dialysis and electrodialysis as viable options for removing bromates from natural water. Desalination, 281: 257-262.
- Wolf, D.C., Crosby, L.M., George, M.H., Kilburn, S.R., Moore, T.M., Miller, R.T. et DeAngelo, A.B. (1998). Time- and dose-dependent development of potassium bromate-induced tumors in male Fischer 344 rats. Toxicol. Pathol., 26(6): 724-729.
- Yamaguchi, T., Wei, M., Hagihara, N., Omori, M., Wanibuchi, H. et Fukushima, S. (2008). Lack of mutagenic and toxic effects of low dose potassium bromate on kidneys in the Big Blue rat. Mutat. Res., 652(1): 1-11.
- Young, Y.H., Chuu, J.J., Liu, S.H. et Lin-Shiau, S.Y. (2001). Toxic effects of potassium bromate and thioglycolate on vestibuloocular reflex systems of guinea pigs and humans. Toxicol. Appl. Pharmacol., 177(2): 103-111.
Annexe A. Liste des acronymes
- 8-OHdG
- 8-hydroxydéoxyguanosine
- 8-oxodG
- 8-oxodéoxyguanosine
- ACIA
- Agence canadienne d'inspection des aliments
- ADN
- acide désoxyribonucléique
- AHA
- acide haloacétique
- ANSI
- American National Standards Institute
- ASC
- aire sous la courbe concentration plasmatique-temps
- ASCj
- aire sous la courbe concentration plasmatique-temps - valeur quotidienne
- ASUV
- absorbance spécifique de l'ultraviolet à une longueur d'onde de 254 nm
- AWWA
- American Water Works Association
- BBNa
- barbital sodique
- BMD
- dose de référence
- BMD 10
- dose de référence pour une réponse de 10 %
- BMDL 10
- limite inférieure de l'intervalle de confiance à 95 % de la BMD 10
- BMDS
- Benchmark Dose Software
- BrdU
- bromodéoxyuridine
- CAG
- charbon actif en grains
- CAP
- charbon actif en poudre
- CAS
- Chemical Abstracts Service
- CBA
- charbon biologiquement actif
- CCN
- Conseil canadien des normes
- CEP
- Comité fédéral-provincial-territorial sur l'eau potable
- CIRC
- Centre international de recherche sur le cancer
- CMA
- concentration maximale acceptable
- C max
- concentration plasmatique maximale
- C moy
- concentration plasmatique moyenne
- COD
- carbone organique dissous
- COT
- carbone organique total
- CPPI
- concentration permissible par produit individuel
- DJT
- dose journalière tolérable
- DL 50
- dose létale moyenne
- dUTP
- 2′-déoxyuridine 5′-triphosphate
- ED
- électrodialyse
- EDI
- électrodialyse inversée
- EHEN
- N-éthyl- N-hydroxyéthylnitrosamine
- eV
- électron volt
- FA
- facteur d'attribution
- FI
- facteur d'incertitude
- GSH
- glutathion
- IISC
- Institut international des sciences de la vie
- LDM
- limite de détection de la méthode
- LOAEL
- dose minimale avec effet nocif observé
- MDT
- matières dissoutes totales
- MA
- mode d'action
- MON
- matières organiques naturelles
- MTE
- meilleure technique existante
- NMU
- niveau maximal d'utilisation
- NOAEL
- dose sans effet nocif observé
- NOEL
- dose sans effet observé
- NSF
- NSF International
- NTP
- National Toxicology Program (États-Unis)
- OD
- oxygène dissous
- OI
- osmose inverse
- POA
- processus d'oxydation avancé
- p.c.
- poids corporel
- PBPK
- [modèle] pharmacocinétique à base physiologique
- PC
- poids corporel
- PCR
- réactif postcolonne
- PISSC
- Programme international sur la sécurité des substances chimiques
- p K a
- constante de dissociation de l'acide
- ppm
- partie par million
- SMNR
- seuil minimal de niveau à rapporter
- SPD
- sous-produit de désinfection
- NPEQ
- niveau pratique d'évaluation quantitative
- SRATB
- substances réagissant avec l'acide thiobarbiturique
- T 3
- triiodothyronine
- T 4
- thyroxine
- TCFV
- temps de contact en fût vide
- THM
- trihalométhane
- TSH
- thyréostimuline
- TUNEL
- marquage de l'extrémité dUTP de la désoxyribonucléotidyle-transférase terminale
- EPA
- Environmental Protection Agency (États-Unis)
- UL
- Underwriters Laboratories
- UV
- ultraviolet
- UV/VIS
- ultraviolet/visible
- UV 254
- ultraviolet à une longueur d'onde de 254 nanomètres
- VBS
- valeur basée sur la santé
- VL
- volume de lit
Annexe B. Recommandations pour la manutention et l'entreposage des solutions d'hypochlorite
Les renseignements présentés dans cette annexe sont tirés de la norme B300 de l'AWWA, avec permission. Tous droits réservés©2011 the American Water Works Association.
Plusieurs facteurs importants influent sur la formation de perchlorate, de bromate et d'autres contaminants dans les solutions d'hypochlorite. Les principaux facteurs qui affectent la formation de perchlorate sont similaires à ceux qui affectent également la décomposition de l'hypochlorite, notamment la température, la force ionique, la concentration et le pH. D'après les renseignements tirés de l'étude mentionnée en référence ci-dessous et en appliquant le « modèle prédictif » à des scénarios hypothétiques d'entreposage de l'hypochlorite liquide, il se dégage plusieurs conseils de nature quantitative et qualitative :
- Diluer les solutions d'hypochlorite entreposées dès leur arrivée : la décomposition de l'hypochlorite et la formation subséquente de chlorate et de perchlorate dépendent de la concentration et de la force ionique de l'hypochlorite. Des niveaux plus élevés de force ionique et de concentration d'hypochlorite favoriseront la réaction menant à une production accrue de chlorate et de perchlorate, tout en augmentant le taux de décomposition de l'hypochlorite. En diluant une solution d'hypochlorite 2M par un facteur de 2, le taux de formation du perchlorate diminue par un facteur de 7, en raison de la combinaison des effets de la concentration et de la force ionique. Une dilution d'une solution d'hypochlorite par un facteur de 4 diminuera le taux de formation par un facteur de 36. Une dilution d'une solution d'hypochlorite par un facteur de 10 diminuera le taux de formation du perchlorate par un facteur de 270.
- Entreposer les solutions d'hypochlorite à faible température : les températures plus élevées accélèrent la décomposition chimique de l'hypochlorite et la formation subséquente de chlorate et de perchlorate. Chaque réduction de 5 °C (9 °F) de la température d'entreposage réduit le taux de formation du perchlorate par un facteur d'environ 2. Afin de minimiser l'augmentation de température, on devrait entreposer le produit à l'écart de la lumière solaire directe.
- Maintenir les solutions d'hypochlorite entreposées à un pH de 11 à 13, même après dilution : il n'est pas recommandé d'entreposer les solutions d'hypochlorite concentrées à des pH inférieurs à 11, en raison de la décomposition rapide de l'ion hypochlorite/acide hypochloreux, et de la formation conséquente de chlorate, même si cela réduit la quantité de perchlorate formé. À un pH supérieur à 13, la formation de perchlorate est accentuée en raison de la force ionique. Par conséquent, les services publics devraient insister que les spécifications du fabricant indiquent que le pH doit être maintenu dans la plage de 11 à 13. Compte tenu de la plage de pH (de 9 à 10) qu'on retrouve habituellement dans les solutions d'hypochlorite produites sur place, on devrait utiliser ces solutions le plus tôt possible après leur fabrication, et ne pas les entreposer pendant plus de 1 ou 2 jours.
- Contrôler l'élimination des ions métalliques de transition par l'achat de solutions d'hypochlorite filtrées et par l'emploi d'une eau d'alimentation à faible concentration en ions métalliques pour les systèmes de production sur place et la dilution de l'eau : la présence d'ions métalliques de transition accroît la dégradation de l'hypochlorite. Bien que cette dégradation soit concomitante avec la formation moindre de perchlorate, la concentration de chlore disponible libre est également réduite, ce qui oblige le service d'eau à utiliser un volume plus important de solution d'hypochlorite. Cela se traduit par une charge massique plus élevée de contaminants comme le perchlorate, le chlorate et le bromate.
- Utiliser des solutions d'hypochlorite fraîches dans la mesure du possible : les hypochlorites se décomposeront naturellement pour produire de l'oxygène, du chlorate et du perchlorate. En réduisant le temps d'entreposage, on réduit la formation de ces contaminants dans la solution d'hypochlorite. Assurer la rotation des stocks et minimiser la quantité de produits âgés dans les cuves d'entreposage avant d'y verser un nouveau produit. Une solution d'hypochlorite fraîche contiendra également une plus grande concentration d'hypochlorite, ce qui réduira la quantité de solution requise pour obtenir la valeur visée de chlore résiduel. Encore une fois, une concentration élevée d'hypochlorite dans une solution d'hypochlorite fraîche donnera lieu à des concentrations moindres de contaminants.
- Si les services publics utilisent de l'hypochlorite produit sur place, ils devraient employer un sel à faible teneur en bromure afin de réduire la quantité de bromure présent dans la saumure : la formation de bromate se produira rapidement dans les solutions d'hypochlorite en présence de bromure. En contrôlant la quantité de bromure dans le sel et l'eau d'alimentation utilisée pour la production sur place, on pourra réduire la formation de bromate.
Annexe C. Estimations des coûts par province et territoire
Aucun paragraphe concernant l'impact de la recommandation n'a été demandé ou fourni, puisque la valeur proposée pour la recommandation est la même que la CMA actuelle.
