Le diquat dans l’eau potable : Document technique pour consultation publique

Télécharger le format de rechange
(Format PDF, 420.7 KB, 12 pages)
Organisation : Santé Canada
Date publiée : 2020-07-03
Document de consultation publique
La période de consultation se termine le 2 octobre, 2020
Table des matières
- Objet de la consultation
- Recommandation proposée
- Résumé
- 1.0 Considérations relatives à l’exposition
- 2.0 Considérations relatives à la santé
- 3.0 Calcul de la valeur basée sur la santé
- 4.0 Considérations relatives à l’analyse et au traitement
- 5.0 Stratégies de gestion
- 6.0 Considérations internationales
- 7.0 Justification
- 8.0 Références
- Annexe A : Liste des acronymes
- Annexe B : Impacts provinciaux et territoriaux prévus
Objet de la consultation
Le présent document technique décrit l’évaluation de l’information disponible sur le diquat dans le but de mettre à jour la valeur de recommandation relativement à la présence du diquat dans l’eau potable. La présente consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l’élaborer et les répercussions possibles de sa mise en œuvre.
La recommandation actuelle à l’égard du diquat, établie en 1986, qui est la concentration maximale acceptable de 0,07 mg/L (70 µg/L), est fondée sur des lésions oculaires constatées chez le rat.
Le présent document propose une concentration maximale acceptable (CMA) de 0,05 mg/L (50 µg/L) pour le diquat dans l’eau potable, basée sur des lésions oculaires observées chez le beagle.
Le document fait l’objet d’une consultation publique d’une durée de 90 jours. Veuillez faire parvenir vos commentaires (avec justification, au besoin) à Santé Canada :
HC.water-eau.SC@canada.ca
ou
Bureau de la qualité de l’eau et de l’air, Santé Canada
269, avenue Laurier Ouest, indice de l’adresse 4903D
Ottawa (Ontario) K1A 0K9
Les commentaires doivent nous parvenir avant le 2 octobre 2020. Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l’affiliation de leurs auteurs, aux membres du Comité fédéral-provincial-territorial sur l’eau potable (CEP). Les personnes ne souhaitant pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il convient de noter que le présent document technique sera révisé après évaluation des commentaires reçus et que, s’il y a lieu, une recommandation pour la qualité de l’eau potable sera formulée. Ce document devrait donc être considéré strictement comme une ébauche aux fins de commentaires.
Recommandation proposée
Une concentration maximale acceptable (CMA) de 0,05 mg/L (50 µg/L) est proposée pour le diquat (sous forme de cation) dans l’eau potable.
Résumé
Le présent document technique a été préparé en collaboration avec le Comité fédéral‑provincial‑territorial sur l’eau potable, d’après les évaluations du diquat menées par l’Agence de réglementation de la lutte antiparasitaire de Santé Canada (ARLA) et sur des documents à l’appui.
Exposition
Au Canada, le diquat est un herbicide qui est appliqué intentionnellement sur des cultures vivrières et des sources d’eau pour lutter contre les mauvaises herbes. Il est donc possible que la population canadienne soit exposée au diquat par les aliments et, dans une moindre mesure, par l’eau potable. En 2016 (la plus récente année pour laquelle des données sont disponibles), plus de 500 000 kg de diquat (à titre de principe actif) ont été vendus au Canada. De très faibles concentrations de diquat ont été détectées dans les aliments. Selon les données fournies par les provinces et les territoires surveillant la présence du diquat dans les sources d’eau potable et dans l’eau potable, les concentrations de diquat sont inférieures à la limite de détection.
Effets sur la santé
Dans les études à doses répétées chez l’animal, le diquat ciblait principalement les yeux, où il provoquait des cataractes, ainsi que les reins et le foie. La CMA proposée de 0,05 mg/L (50 µg/L) est fondée sur la formation de cataractes.
Considérations analytique et de traitement
À l’heure actuelle, il existe une méthode pour analyser le diquat dans l’eau potable. La limite de la méthode de détection est environ un à deux ordres de grandeur inférieure à la CMA proposée.
Des méthodes de traitement pourraient éliminer le diquat des sources d’approvisionnement en eau potable, mais il existe peu ou pas d’études sur ce sujet, peu importe l’échelle (essais en laboratoire, études pilotes ou études à grande échelle). L’adsorption sur charbon actif en grains (CAG) constitue vraisemblablement le traitement le plus efficace; les techniques de filtration sur membrane (nanofiltration et osmose inverse) et l’oxydation peuvent également être efficaces. Étant donné l’absence d’études d’efficacité, il est recommandé de réaliser des études pilotes ou des essais en laboratoire avant une mise en œuvre à grande échelle.
Dans le cas où l’on souhaite éliminer le diquat à l’échelle résidentielle ou des petits réseaux, par exemple, lorsque l’approvisionnement en eau potable provient d’un puits privé, un dispositif résidentiel de traitement de l’eau potable peut être une option. Des techniques comme l’adsorption sur charbon actif et l’osmose inverse devraient être efficaces pour l’élimination du diquat. Lorsqu’un dispositif de traitement de l’eau potable résidentiel est utilisé, il est important de prélever des échantillons d’eau à l’entrée et à la sortie du dispositif et de les faire parvenir à un laboratoire agréé à des fins d’analyse pour assurer une bonne élimination du diquat.
Application de la recommandation
Remarque : Des conseils spécifiques concernant l’application des recommandations pour l’eau potable devraient être obtenus auprès de l’autorité appropriée en matière d’eau potable dans le secteur de compétence concerné.
La recommandation proposée vise à offrir une protection contre les effets sur la santé associée à une exposition au diquat par l’eau potable durant toute la vie. Tout dépassement de la CMA proposée devrait faire l’objet d’une enquête et être suivi des mesures correctives appropriées. En cas de dépassement dans une source d’eau qui n’est pas traitée, une enquête devrait être menée pour déterminer le moyen le plus approprié de réduire l’exposition au diquat. Les options possibles comprennent l’utilisation d’une autre source d’approvisionnement en eau ou l’installation d’un dispositif de traitement. Si un traitement est déjà en place lorsqu’un dépassement survient, une enquête devrait être menée pour vérifier le traitement et déterminer si des modifications doivent être apportées pour réduire la concentration dans l’eau traitée sous la CMA proposée.
Considérations internationales
D’autres organisations nationales et internationales utilisent des lignes directrices, des normes et des valeurs recommandées pour l’eau potable. Les valeurs varient en fonction de la date à laquelle remonte l’évaluation sur laquelle elles sont fondées, et en fonction des différences relatives aux politiques et aux démarches appliquées, y compris en ce qui concerne le choix de l’étude clé ou les taux de consommation, les poids corporels et les facteurs d’attribution liés à la source employés. Les trois valeurs internationales établies à l’égard du diquat sont fondées sur la formation de cataractes chez le rat : elles diffèrent sur le plan de l’interprétation de cette étude ainsi que des poids corporels et des facteurs d’attribution liés à la source retenus.
L’United States Environmental Protection Agency (U.S. EPA) a fixé une concentration maximale admissible (CMA) de 0,02 mg/L, tandis que le National Health and Medical Research Council (NHMRC) de l’Australie a fixé une valeur recommandée de 0,007 mg/L à l’égard du diquat dans l’eau potable. L’Organisation mondiale de la santé (OMS) a calculé une valeur non réglementaire basée sur la santé de 0,03 mg/L (30 µg/L) à l’égard du diquat.
L’Union européenne (UE) ne fixe pas de valeurs seuils propres à des pesticides. Elle a plutôt établi une valeur de 0,1 µg/L pour tout pesticide pris individuellement et une valeur de 0,5 µg/L pour les pesticides pris globalement dans l’eau potable. Pour établir ces valeurs, l’UE n’a pas pris en compte les connaissances scientifiques sur chaque pesticide, comme les effets sur la santé. Ces valeurs sont plutôt fondées sur la décision stratégique visant à écarter les pesticides de l’eau potable.
1.0 Considérations relatives à l’exposition
1.1 Sources et utilisations
Le diquat, aussi appelé 1,1’-éthylène-2,2’-dipyridinium ou 6,7-dihydrodipyrido[1,2-a:2’,1’ -c] pyrazinédiium, est un herbicide et algicide de contact non sélectif qui est utilisé comme agent de dessiccation avant la récolte sur une variété de cultures destinées à la consommation humaine ou animale, sur des cultures industrielles de graines oléagineuses et de plantes à fibres, comme défoliant (p. ex. défanage de la pomme de terre), pour le désherbage chimique de zones non cultivées, et pour la lutte contre les mauvaises herbes aquatiques et les algues (Santé Canada, 2008). Le diquat agit en produisant durant la photosynthèse des superoxydes qui endommagent les membranes et le cytoplasme des cellules (Santé Canada, 2008; OMS, 2014). Au Canada, le diquat est commercialisé sous forme de dibromure de diquat, un sel très hygroscopique en solution aqueuse (Santé Canada, 2008; Santé Canada, 2010). Plus de 500 000 kilogrammes de diquat à titre de principe actif ont été vendus au Canada en 2016 (Santé Canada, 2016).
Le diquat et le dibromure de diquat peuvent pénétrer les eaux de surface par ruissellement ou dérive de pulvérisation (Santé Canada, 2008). Une fois dans l’environnement, le dibromure de diquat se dissocie complètement en diquat dans l’eau (OMS, 2014). Le diquat se dissipe ensuite rapidement en étant adsorbé sur des particules (p. ex. matières en suspension, argile de type montmorillonite, phytoplancton) et des sédiments auxquels il peut rester fixé pendant de très longues périodes. Sa demi‑vie a été évaluée de quelques jours (p. ex. moins de 48 heures dans les eaux de surface) à plus d’un an à l’état non sorbé et sorbé, respectivement (Emmett, 2002; OMS, 2016; Magalhães et coll., 2018). Le diquat ne devrait pas être entraîné dans les eaux souterraines par lessivage, car il est fortement adsorbé sur les particules du sol, ce qui le rend immobile et persistant dans le sol (U.S. EPA, 1995a). Le diquat ne s’hydrolyse pas et il résiste à la dégradation microbienne dans des conditions aérobies et anaérobies (le taux annuel d’élimination dans le sol par dégradation microbienne est normalement de 5 à 7 %) (U.S. EPA, 1995a; Emmett, 2002; Magalhães et coll., 2018). Le diquat subit aussi une photodégradation, principalement en sel de 1,2,3,4-tétrahydro-1-oxopyrido[1,2-a]-5-pyrazinium (TOPPS); ce processus est lent, le taux de photodégradation étant évalué à 10 à 20 % par année (selon les conditions expérimentales) (AESA, 2015; Magalhães et coll., 2018). Le diquat est éliminé de la colonne d’eau par adsorption sur les sédiments au sol, les végétaux aquatiques et les matières organiques (U.S. EPA, 1995a).
Étant donné la très faible volatilité du dibromure de diquat, ses résidus dans l’air seront vraisemblablement sous la forme d’aérosols. Il est toutefois peu susceptible de persister dans l’air, car il devrait normalement être éliminé par sédimentation gravitationnelle et pénétrer dans les eaux de surface et/ou dans le sol, où il se dissociera en ion diquat (HSDB, 2010).
De nombreux facteurs peuvent intervenir dans le devenir et la persistance du diquat dans l’environnement, notamment : la température de l’eau, l’humidité du sol et la vitesse de métabolisation par les microorganismes. Par ailleurs, l’utilisation intensive d’engrais contenant d’autres cations (p. ex. Ca2+, Mg2+, NH4(2+), K+) peut accroître la désorption du diquat sur les sédiments (Emmett, 2002).
1.2 Identité de la substance
Le diquat (numéro de registre du Chemical Abstracts Service (no CAS) 2764‑72‑9; C12H12N2) est un cation (divalent) d’ammonium quaternaire qui appartient à la famille chimique des bipyridynes; sa masse moléculaire est de 184,2 g/mol (U.S. EPA, 1995a; Santé Canada, 2008; Santé Canada, 2010).
Le diquat est commercialisé sous forme de dibromure de diquat (ou 1,1’-éthylène-2,2’-dipyridinium ou 6,7-dihydrodipyrido[1,2-a:2’,1’ -c] pyrazinédiium), un solide cristallin inodore de couleur jaune pâle (U.S. EPA, 1995a; Emmett, 2002). Le dibromure de diquat, qui est très soluble dans l’eau, se dissocie rapidement en ion diquat (U.S. EPA, 1995a; Emmett, 2002). Le tableau 1 ci‑dessous résume quelques‑unes des propriétés physico‑chimiques du dibromure de diquat.
| Propriété | Dibromure de diquat | Interprétation |
|---|---|---|
| No CAS | 85-00-7 | - |
| Formule moléculaire | C12H12Br2N2 | - |
| Masse moléculaire g/mol) | 344,0 | - |
| Solubilité dans l’eau (g/L) | 700 à 25 °C | Très soluble dans l’eau |
| Pression de vapeur (volatilité) | < 0,01 mPa à 20 °C (monohydrate) |
Faible volatilité, présence peu probable dans l’air |
| Constante de la loi d’Henry | 5 ×10-9 Pa.m3.mol | Faible volatilité, présence peu probable dans l’air |
| Constante de dissociation | Sans objet | Dissociation complète |
| Coefficient de partage n‑octanol–eau (Log Koe) | ‑4,60 à 20 °C | Hydrophile |
La synthèse du dibromure de diquat peut entraîner la formation de dibromure d’éthylène, qui est une impureté issue du procédé. Toutefois, les résultats des essais ont montré que le dibromure d’éthylène, qui n’est pas utilisé à des fins pesticides, ne persiste pas sous forme d’impureté dans les produits du diquat, car il se dissipe graduellement (U.S. EPA, 1995a). Par ailleurs, comme le diquat, qui est fortement chargé, est considéré comme la forme la plus toxique pour les mammifères (Santé Canada, 2008; FAO et OMS, 2014), dans la présente évaluation, les doses et les concentrations dans l’eau sont exprimées, dans la mesure du possible, en cation diquat, ci‑après appelé diquat.
1.3 Exposition
Lorsqu’il est utilisé comme herbicide, le diquat est appliqué intentionnellement sur des cultures vivrières et des sources d’eau pour lutter contre les mauvaises herbes. Il est donc possible que la population canadienne soit exposée au diquat par les aliments et, dans une moindre mesure, par l’eau potable (Santé Canada, 2008; Santé Canada, 2010). Compte tenu du devenir de l’herbicide dans l’environnement (voir la section 1.1), aucun résidu notable de l’herbicide n’est attendu dans les sources d’eau, si bien que l’eau potable serait une source d’exposition mineure (U.S. EPA, 2002; Santé Canada, 2008; NHMRC et NRMMC, 2011; AESA, 2015; OEHHA, 2016; OMS, 2016).
Selon les données fournies par les provinces et les territoires, les concentrations de diquat étaient inférieures au seuil de déclaration de la méthode (SDM) ou à la limite de détection de la méthode (LDM) dans tous les échantillons provenant de diverses sources canadiennes d’approvisionnement en eau, à savoir des eaux de surface et des eaux souterraines ainsi que de l’eau traitée et distribuée dans des zones surveillées (ministère de la Santé de la Colombie‑Britannique, 2019; gouvernement de l’Ontario, 2019; Services aux Autochtones Canada, 2019; ministère de l’Environnement et de la Lutte contre les changements climatiques du Québec, 2019; ministère de l’Environnement de la Nouvelle‑Écosse, 2019; ministère des Communautés, des Terres et de l’Environnement de l’Île‑du‑Prince‑Édouard, 2019) (voir le tableau 2).
Le diquat ne fait l’objet d’aucune surveillance au Manitoba, au Nouveau‑Brunswick, à Terre‑Neuve‑et‑Labrador, en Saskatchewan ou au Yukon (Développement durable Manitoba, 2019; ministère de la Santé du Nouveau‑Brunswick, 2019; ministère des Affaires Municipales et de l’Environnement de Terre‑Neuve‑et‑Labrador, 2019; Agence de la sécurité de l’eau de la Saskatchewan, 2019; Services de santé environnementale du Yukon, 2019).
| Zone géographique (Limite de détection de la méthode en µg/L) |
Période de surveillance | Source municipale ou non municipale | Type d’eau (Source municipale : eaux souterraines ou de surface – brute, traitée, distribuée) |
Cas de détection du diquat/ échantillons |
|---|---|---|---|---|
| Colombie‑Britannique (7) |
De 2013 à 2018 | Municipale | De surface – brutes | 0/18 |
| Région de l’Ontario de la DGSPNINote de bas de page 1 (de 1 à 50) | De 2014 à 2018 | Réseaux d’approvisionnement en eau publics | Souterraines – brutes | 0/13 |
| Souterraines – traitées | 0/190 | |||
| Souterraines – distribuées | 0/16 | |||
| De surface – brutes | 0/33 | |||
| De surface – traitées | 0/308 | |||
| De surface – distribuées | 0/23 | |||
| Réseaux d’approvisionnement en eau semi‑publics | Souterraines – brutes | 0/3 | ||
| Souterraines – traitées | 0/16 | |||
| Souterraines – distribuées | 0/68 | |||
| De surface – brutes | 0/1 | |||
| De surface – traitées | 0/9 | |||
| De surface – distribuées | 0/2 | |||
| Réseaux d’approvisionnement en eau privés | Souterraines – traitées | 0/3 | ||
| Souterraines – distribuées | 0/50 | |||
| De surface – traitées | 0/5 | |||
| Région de l’Atlantique de la DGSPNINote de bas de page 1 (de 7 à 70) | De 2014 à 2018 | Réseaux d’approvisionnement en eau publics | Souterraines – traitées | 0/4 |
| Souterraines – distribuées | 0/4 | |||
| De surface – traitées | 0/1 | |||
| Région du Québec de la DGSPNINote de bas de page 1 (de 0,1 à 0,4) | De 2014 à 2018 | - | Système d’approvisionnement en eau potable | 0/4 |
| Nouvelle‑Écosse (de 1 à 7) |
De 2007 à 2018 | Municipale | Souterraines – brutes | 0/71 |
| Souterraines – traitées | 0/35 | |||
| Surface – brute | 0/35 | |||
| De surface – traitées | 0/39 | |||
| Distribuées | 0/1 | |||
| Ontario (0,1) |
De 2008 à 2012 | Municipale | Souterraines – brutes | 0/91 |
| Souterraines – traitées | 0/25 | |||
| Inconnu – brutes | 0/213 | |||
| Inconnu – traitées | 0/223 | |||
| Inconnu – distribuées | 0/1 | |||
| Île‑du‑Prince‑Édouard (10) |
De 2007 à 2016 | Municipale | Souterraines – brutes | 0/103 |
| Non municipale | Souterraines – brutes | 0/137 | ||
| Québec (de 0,1 à 15) |
De 2013 à 2018 | Municipale | Souterraines – distribuées | 0/574 |
| De surface – distribuées | 0/1726 | |||
| Municipale (projets spéciaux) – Projet sur la pomme de terreNote de bas de page 2 [de 2017 à 2018] | Souterraines – brutes | 0/46 | ||
| Souterraines – traitées | 0/17 | |||
| Souterraines – distribuées | 0/5 | |||
| Systèmes de petite tailleNote de bas de page 3 [de 2012 à 2018] |
Souterraines – brutes | 0/63 | ||
| Source non municipale | — | |||
| Souterraines – brutes | 0/43 | |||
Notes de bas de page
|
||||
Dans les aliments, des résidus de diquat devraient être présents uniquement si l’herbicide a été appliqué directement sur des cultures vivrières (p. ex. comme agent de dessiccation sur des plants de pomme de terre), quoique les concentrations de ces résidus devraient être faibles (U.S. EPA, 1995a; Santé Canada, 2010; NHMRC et NRMMC, 2011). Les résultats des essais sur les résidus menés au Canada en 2015 se situaient entre 0,01 et 0,35 mg/kg (n = 24) pour les haricots secs (y compris les haricots blancs et rouges, les graines de soja, les haricots adzuki et les fèves des marais); entre 0,07 et 0,58 mg/kg (n = 9) pour les pois chiches; entre 0,052 et 0,57 mg/kg (n = 8) pour les lentilles; et entre 0,15 et 2,1 mg/kg (n = 6) pour l’orge (FAO, 2019). En ce qui a trait aux denrées d’origine animale, les essais menés sur des vaches laitières ayant reçu pendant 30 jours un régime contenant 18, 50 ou 84 ppm de diquat ont révélé que les concentrations de diquat étaient inférieures à la limite de quantification (LQ) dans tous les échantillons de lait (LQ = 0,001 mg/kg), ainsi que dans les échantillons de foie, de rein, de graisse et de muscle (LQ = 0,01 mg/kg), et ce à toutes les doses. Les concentrations étaient aussi inférieures à la LQ de 0,01 mg/kg dans les œufs (FAO, 2019).
2.0 Considérations relatives à la santé
Tous les pesticides, y compris le diquat, sont réglementés par l’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada. L’ARLA réalise des évaluations approfondies et des examens cycliques concernant les pesticides, en se penchant notamment sur des renseignements exclusifs ou non publiés ainsi que sur des examens effectués à l’étranger par d’autres organismes de réglementation comme l’United States Environmental Protection Agency (U.S. EPA). La présente évaluation relative à la santé s’appuie essentiellement sur des évaluations menées par l’ARLA (Santé Canada, 2008; Santé Canada, 2010) et sur la documentation connexe. Tous les examens et tous les articles pertinents qui ont été publiés depuis les évaluations de l’ARLA ont aussi été pris en compte.
2.1 Cinétique
Absorption : S’il est ingéré, le diquat est peu absorbé (< 10 %) dans le tube digestif des animaux et de l’humain. Bien que la biodisponibilité soit couramment évaluée à moins de 10 %, un comité d’experts de l’Autorité européenne de sécurité des aliments (AESA) a conclu que les données disponibles appuient plutôt des valeurs de 3 à 4 % (U.S. EPA, 1995a; Emmett, 2002; FAO et OMS, 2014; AESA, 2015; Magalhães et coll., 2018). De plus, l’absorption du diquat varie d’une espèce à l’autre : la plus forte absorption a été observée chez le chien (Gupta et Crissman, 2013). L’absorption est grandement diminuée par la présence d’aliments dans le tube digestif et par la présence d’une microflore intestinale pouvant dégrader le diquat (Magalhães et coll., 2018).
Distribution : Une fois dans la phase aqueuse du sang, la faible quantité de diquat absorbée est rapidement (c.‑à‑d. en 6 à 18 heures) et largement diffusée à plusieurs organes et tissus (p. ex. foie, reins, surrénales), sauf le cerveau et la moelle épinière (Gupta et Crissman, 2013; Magalhães et coll., 2018). Bien qu’il soit largement diffusé dans l’organisme, le diquat hydrophile et hautement polaire ne se lie pas de façon covalente aux macromolécules. Il ne s’accumule pas non plus dans la plupart des tissus, sauf le cristallin. Malgré les fortes concentrations de diquat constatées dans le foie, les reins, le tube digestif et les poumons immédiatement après l’administration de la dose, le cristallin est resté le principal site de dépôt jusqu’à 96 heures après l’exposition (U.S. EPA, 1995a; Emmett, 2002; FAO et OMS 2014; AESA, 2015; Magalhães et coll., 2018).
Métabolisme : Les données expérimentales tant chez l’humain que chez l’animal indiquent que le catabolisme intracellulaire du diquat libre est minime et que celui‑ci est principalement métabolisé dans le foie. La métabolisation du diquat par les enzymes du cytochrome P450 entraîne la formation de diquat‑monopyridone (métabolite principal) et de diquat‑dipyridone (métabolite mineur) (Fuke et coll., 1996; Emmett, 2002; FAO et OMS, 2014; OMS, 2014). Certaines données indiquent que la biotransformation du diquat peut aussi entraîner la formation d’acide picolinique (ou acide pyridine‑2‑carboxylique), probablement avec de la picolinamide (pyridine‑2‑carboxamide) comme intermédiaire, bien que cela n’ait pas été clairement observé chez les mammifères. On a aussi émis l’hypothèse selon laquelle des composés volatils seraient produits en plus de tous les métabolites mentionnés ci‑dessus. Il existe des données (in vitro) appuyant l’existence d’un autre processus mineur de biotransformation bactérienne du diquat qui se produirait dans le tube digestif; le dérivé monopyridone serait le métabolite principal (Emmett, 2002; FAO et OMS, 2014; OMS, 2014; Magalhães et coll., 2018).
Élimination : Comme il est peu absorbé, la majorité (90 %) du diquat ingéré est éliminée sous forme inchangée dans les excréments en l’espace de 24 heures, pratiquement sans excrétion biliaire (< 0,7 % de la dose administrée). En plus du composé d’origine, deux autres métabolites, soit le diquat‑monopyridone et le diquat‑dipyridone, sont éliminés dans les excréments (Emmett, 2002; Magalhães et coll., 2018). En ce qui a trait au diquat absorbé, il est en majorité (> 90 %) éliminé en 48 heures dans l’urine, principalement sous la forme du composé d’origine, suivi de deux principaux métabolites et, dans une moindre mesure, de l’acide picolinique (U.S. EPA, 1995a; Fuke et coll., 1996; Emmett, 2002; NHMRC et NRMMC, 2011; FAO et OMS, 2014; OMS, 2014; AESA, 2015; Magalhães et coll., 2018).
2.2 Effets sur la santé
La base de données toxicologiques sur le diquat est adéquate, car elle porte sur plusieurs effets et différents types d’exposition (des évaluations approfondies sont décrites dans les publications suivantes : U.S. EPA, 1995a, 2001; FAO/OMS, 2014; OMS, 2014; AESA, 2015). En général, le diquat présente une faible toxicité aiguë. Les études à doses répétées chez l’animal ont révélé que le diquat pouvait avoir des effets toxiques dans plusieurs organes (p. ex. tube digestif, reins, foie), le plus sensible ayant été l’œil (FAO et OMS, 2014; OMS, 2014; AESA, 2015).
2.3 Effets chez l’humain
Chez l’humain, l’ingestion intentionnelle de diquat peut entraîner une intoxication et même la mort (Magalhães et coll., 2018). En général, les manifestations cliniques d’une intoxication aiguë sont les suivantes : troubles neurologiques, perturbation du tube digestif, insuffisance rénale, lésions hépatiques, et complications hémodynamiques et cardiocirculatoires (Valiante et coll., 1992; Schmidt et coll., 1999; Tanen et coll., 1999; Fuke et coll., 1996; Hantson et coll., 2000; Jones et Vale, 2000; Emmett, 2002; Jovic‑Stosic et coll., 2009; OMS, 2014).
Les données épidémiologiques propres à l’herbicide diquat sont peu nombreuses, mais elles comprennent des déclarations d’effets nocifs pour la santé des employés des usines de production (OMS, 2014).
2.4 Effets chez les animaux
Le diquat s’est révélé toxique chez les animaux de laboratoire. La dose létale médiane (DL50) par voie orale pour certaines espèces a été établie à : 215 à 235 mg de diquat/kg p.c. chez le rat; 125 mg de diquat/kg p.c. chez la souris; 100 à 200 mg de diquat/kg p.c. chez le chien; 100 mg de diquat/kg p.c. chez le lapin; et 100 à 300 mg de diquat/kg p.c. chez le singe (U.S. EPA, 1995a; FAO et OMS, 2014; OMS, 2014; OMS, 2016; Magalhães et coll., 2018). Les métabolites du diquat se sont révélés moins toxiques : la DL50 par voie orale chez le rat a été établie à > 4 000 et ≥ 2 449 mg/kg p.c. pour le diquat‑monopyridone et le TOPPS, respectivement (OMS, 2014; Magalhães et coll., 2018). Les effets indésirables touchaient le tube digestif, les reins et potentiellement le foie (U.S. EPA, 1995a; Emmett, 2002; OMS, 2014).
L’exposition tant subchronique que chronique au diquat a provoqué des lésions oculaires (p. ex. cataractes, anomalies extra‑cristalliniennes comme des adhérences du corps vitré, des décollements de la rétine et des synéchies) chez les animaux de laboratoire exposés, y compris le rat et le chien. Des lésions ont aussi été signalées au niveau des reins, du foie, des surrénales, de l’épididyme et des paramètres hématologiques (U.S. EPA, 2001; FAO et OMS, 2014; AESA, 2015; OMS, 2016).
Lésions oculaires (cataractes et opacités du cristallin) : L’exposition tant subchronique que chronique (par le régime alimentaire) au bromure de diquat a régulièrement provoqué des lésions oculaires chez la souris (étude de toxicité chronique par voie orale), le rat (études de toxicité pour la reproduction sur 2 générations, étude de toxicité subchronique par voie orale et étude de neurotoxicité subchronique, étude de toxicité chronique par voie orale) et le chien (étude de toxicité chronique) (U.S. EPA, 1995a; Emmett, 2002; OMS, 2014; AESA, 2015). Des lésions oculaires ont été observées à la suite de l’ingestion chronique de diquat (jusqu’à 48,27, 19,44 et 12,5 mg de diquat/kg par jour chez la souris, le rat et le chien, respectivement), et elles évoluaient dans la plupart des cas d’une opacité du cristallin à une opacification complète (c.‑à‑d. cataracte); l’incidence et la gravité des lésions étaient liées à la dose (Colley et coll., 1985; Hopkins, 1990; Hodge, 1992; Emmett, 2002; OMS, 2014; AESA, 2015). Chez le rat, les premières cataractes ont été observées à la semaine 13 dans l’étude de neurotoxicité subchronique (dose sans effet nocif observé (NOAEL), 8 mg/kg par jour) (Horner, 1992a) et à la semaine 10 dans l’étude de toxicité chronique (NOAEL, 0,58 mg/kg par jour) (Colley et coll., 1985). Le chien était l’espèce la plus sensible : des opacifications complètes de l’œil ont été constatées à la semaine 8 chez des femelles exposées à 2,5mg de diquat/kg p.c. par jour et à la semaine 16 chez des mâles exposés à 12,5 mg de diquat/kg p.c. par jour. Dans l’étude d’un an chez le chien, la NOAEL chronique la plus élevée était de 0,53 mg de diquat/kg p.c. par jour, à la lumière des cataractes constatées chez les femelles (Hopkins, 1990).
Néphrotoxicité : Le diquat peut entraîner des effets toxiques au niveau des reins, généralement caractérisés par une nécrose des tubules rénaux suivie d’une diminution de la clairance du diquat et de l’aggravation des lésions (Gupta et Crissman, 2013). Des lésions rénales induites par le diquat ont été signalées chez des souris (une étude de toxicité chronique), des rats (deux études sur plusieurs générations et une étude sur toute la durée de vie) et des chiens (deux études de toxicité chronique) exposés par voie orale jusqu’à 48, 19 et 12,5 mg de diquat/kg p.c. par jour, respectivement (U.S. EPA, 1995a; OMS, 2014; AESA, 2015; OEHHA, 2016).
Au bout de 104 semaines, les souris mâles et femelles ayant reçu au moins 12 à 16 mg/kg par jour de diquat, respectivement, présentaient une dilatation des tubules rénaux associée à une augmentation des gouttelettes hyalines dans les tubules rénaux (femelles) et une légère augmentation (non significative) de 6 % (p < 0,01) du poids des reins (mâles) (Hodge, 1992; Emmett, 2002; OMS, 2014). Les rats mâles et femelles exposés pendant toute la durée de vie à des concentrations alimentaires d’au moins 2,9 et 3,6 mg/kg par jour, respectivement, présentaient une diminution de la clairance rénale (les deux sexes), mais seuls les mâles dans les mêmes groupes de dose présentaient des altérations histologiques dans les reins (Colley et coll., 1985; U.S. EPA, 2001; Emmett, 2002; OEHHA, 2016). Par ailleurs, l’incidence des reins hémorragiques a augmenté dans les fœtus des rates gravides exposées à 40 mg/kg par jour dans une étude de toxicité pour le développement sur 2 générations (Wickramaratne, 1989). Les chiens ayant reçu 12,5 mg/kg p.c. par jour par le régime alimentaire pendant un an présentaient une augmentation du poids des reins, mais aucune altération histopathologique connexe n’a été constatée (Hopkins, 1990; U.S. EPA, 2001; Emmett, 2002).
Toxicité pour la reproduction et le développement : Les études sur des animaux de laboratoire n’appuient pas l’existence d’une association claire entre l’exposition par voie orale au diquat et des effets nocifs pour la reproduction et le développement (AESA, 2015; OEHHA, 2016; OMS, 2016). Aucun effet n’a été constaté sur la fonction de reproduction des rats nourris avec une diète contenant au moins 25 mg de diquat/kg par jour dans 2 études multigénérationnelles de toxicité pour la reproduction distinctes (Fletcher, 1972; Hodge, 1990). Les données des études dans lesquelles des souris (Palmer et coll., 1978), des rates (Wickramaratne, 1989) et des lapines (Hodge, 1989) gravides ont été exposées par gavage à au moins 4, 40 et 10 mg de diquat/kg par jour, respectivement, laissent entendre que le diquat a des effets tératogènes; toutefois, ces effets nocifs ont généralement été observés à la dose maximale à l’essai et aucun signe de sensibilité accrue n’a été observé chez les petits à la suite d’une exposition (in utero et/ou postnatale) au diquat. Des cas de friabilité et/ou de marbrure du foie ont été constatés dans les fœtus de lapines néo‑zélandaises gravides exposées à 10 mg de diquat/kg p.c. par jour par gavage (Hodge, 1989; U.S. EPA, 2001).
Neurotoxicité et autres effets : Aucun signe de neurotoxicité du diquat faisant suite à une exposition par voie orale n’a été constaté. Les résultats des études de neurotoxicité aiguë et subchronique dans lesquelles des rats (Horner, 1992a; Horner, 1992b) ou des souris (Minnema et coll., 2016) avaient été nourris avec des diètes contenant jusqu’à 38,5 ou 150 mg de diquat/kg p.c. par jour, respectivement, n’ont fait ressortir aucun effet neurologique nocifs (p. ex. neuropathie, effet neurodégénératif) dans des batteries de tests d’observations fonctionnelles, des mesures de l’activité motrice et des examens neurohistopathologiques (U.S. EPA, 1995a; U.S. EPA, 2001; Emmett, 2002; AESA, 2015). L’incidence de l’artérite et de la polyartérite dans les vaisseaux sanguins et de l’hyperplasie paracorticale dans les nœuds lymphatiques a augmenté chez les rats mâles ayant reçu la dose de 14,88 mg de diquat/kg p.c. par jour (Colley et coll., 1985).
2.5 Génotoxicité et cancérogénicité
Selon les données probantes actuelles, le diquat n’est ni génotoxique ni cancérogène (U.S. EPA, 2002; NHMRC et NRMMC, 2011; FAO et OMS, 2014; AESA, 2015; OEHHA, 2016; OMS, 2016).
Le dibromure de diquat s’est révélé négatif dans quatre essais de mutagénicité (c.‑à‑d. test d’Ames, test du micronoyau sur moelle osseuse de souris, test de létalité dominante et synthèse non programmée d’ADN dans les hépatocytes de rat), mais positif dans deux autres études (c.‑à‑d. test de mutation sur cellules de lymphome de souris, test d’aberration sur des lymphocytes humains – avec ou sans activation métabolique) (U.S. EPA, 1995a; OMS, 2016). Aucun signe de génotoxicité du diquat‑monopyridone ni du TOPPS n’a été relevé non plus (FAO et OMS, 2014).
Les résultats des études sur toute la durée de la vie chez la souris (Hodge, 1992) et le rat (Colley et coll., 1985) n’ont fait ressortir aucun signe de cancérogénicité du diquat (U.S. EPA, 1995a; NHMRC et NRMMC, 2011; FAO et OMS, 2014; AESA, 2015; OMS, 2016). L’U.S. EPA a classé le dibromure de diquat comme un cancérogène du groupe E (c.‑à‑d. aucune preuve d’effet cancérogène chez l’humain) (U.S. EPA, 1995a), tandis que le Centre international de recherche sur le cancer n’a pas évalué la cancérogénicité du diquat ni du dibromure de diquat.
2.6 Mode d’action
Chez les mammifères, la cytotoxicité du diquat a été associée au composé d’origine. Cela signifie que le mode d’action cytotoxique du cation fortement chargé est très semblable à celui des autres herbicides bipyridynes comme le paraquat. Un cycle d’oxydoréduction produit des dérivés réactifs de l’oxygène et/ou des dérivés réactifs de l’azote, ce qui entraîne la déplétion des nucléotides pyridine dans les cellules et, ultérieurement, un stress oxydatif, un dysfonctionnement des cellules et potentiellement une nécrose cellulaire (Gallagher et coll., 1995; Jones et Vale, 2000; Emmett, 2002; Fussell et coll., 2011; Gupta et Crissman, 2013; Gupta, 2014; Magalhaes et coll., 2018). L’existence du cycle d’oxydoréduction in vivo et la peroxydation lipidique du diquat in vitro ont été démontrées (Sandy et coll., 1986; Circu et coll., 2017).
De façon générale, bien que cela n’ait pas été démontré de façon concluante, des manifestations toxiques spécifiques survenues dans les études toxicologiques, à savoir les lésions oculaires (ou cataractes), ont été attribuées au cycle d’oxydoréduction du diquat, car le diquat s’accumule davantage dans les yeux que dans les autres tissus (Emmett, 2002; OEHHA, 2016).
2.7 Étude clé retenue
L’ARLA de Santé Canada (2008, 2010 et 2019) a identifié l’œil comme l’organe cible le plus sensible dans la base de données. L’étude d’une durée d’un an chez le chien menée par Hopkins (1990) a été retenue à titre d’étude clé pour l’évaluation des risques pour la santé humaine associés au diquat dans l’eau potable.
Des groupes de beagles (4/sexe/dose) ont été nourris avec des diètes contenant 0, 0,5, 2,5 et 12,5 mg de diquat/kg p.c. par jour sous la forme de dibromure de diquat (équivalent à 0, 0,46, 2,42 et 11,48 mg de diquat/kg par jour chez les mâles et à 0, 0,46, 2,42 et 13,21 mg de diquat/kg par jour chez les femelles) pendant 52 semaines (Hopkins, 1990; U.S. EPA, 1995a; U.S. EPA, 2001; Santé Canada, 2008; OMS, 2014; OMS, 2016). Aucun effet indésirable lié au traitement n’a été signalé sur le plan de la survie, des signes cliniques, de l’hématologie, de la biochimie clinique, de l’examen des urines ou de la pathologie clinique (sauf en ce qui concerne les yeux) à quelque dose que ce soit (U.S. EPA, 2001; OMS, 2014). La principale observation liée au traitement lors de l’étude, qui a été faite aux doses de 2,5 mg/kg et plus, était les lésions oculaires. Leur incidence et leur gravité augmentaient en fonction de la dose. Dans le groupe traité par la dose de 2,5 mg/kg, deux des quatre femelles ont présenté des cataractes unilatérales (c.‑à‑d. opacité du cristallin), qui sont apparues à la 8e semaine dans un cas et à la 40e semaine dans l’autre. Dans le groupe traité par la plus forte dose, trois des quatre femelles et tous les mâles ont présenté des opacités bilatérales du cristallin; la première opacité est apparue durant la 16e semaine chez les mâles et durant la 24e semaine chez les femelles. En plus des opacités du cristallin, d’autres altérations liées au traitement ont été constatées dans le groupe traité par la plus forte dose, à savoir des atteintes inflammatoires du tube digestif chez les deux sexes, des effets sur le plan de la reproduction chez les mâles et une augmentation statistiquement significative du poids des reins chez tous les chiens. Les mâles des groupes traités par les deux doses les plus fortes ont aussi présenté une diminution du poids des surrénales et de l’épididyme, quoique ces modifications n’étaient associées à aucune altération histopathologique dans les organes correspondants (sauf dans le tube digestif) (U.S. EPA, 1995a; U.S. EPA, 2001; OMS, 2014; OMS, 2016). Une NOAEL par voie orale de 0,5 mg de diquat/kg p.c. par jour a été établie dans cette étude, et s’appuyait sur des cataractes unilatérales chez les femelles et la diminution du poids des surrénales et de l’épididyme chez les mâles à la LOAEL la plus faible, qui était de 2,5 mg de diquat/kg p.c. par jour (U.S. EPA, 1995a; OMS, 2014).
Les résultats obtenus par Hopkins (1990) sont aussi corroborés par ceux d’une étude de 2 ans chez le rat (Colley et coll., 1985). Dans leur étude de toxicité chronique et de cancérogénicité de 2 ans, Colley et ses collaborateurs (1985), ont nourri des rats Sprague‑Dawley mâles et femelles (50/sexe/dose) avec des diètes contenant 0, 5, 15, 75 et 375 ppm de dibromure de diquat (équivalant à [mâles‑femelles]: 0‑0, 0,19‑0,24, 0,58‑0,72, 2,91‑3,64 et 14,88‑19,44 mg de diquat/kg p.c. par jour) pendant 104 semaines. Des animaux ont été sacrifiés en cours d’étude (10/sexe/dose) à la 52e semaine (Colley et coll., 1985; U.S. EPA, 1995a; U.S. EPA, 2001; Santé Canada, 2008; OMS, 2014; OMS, 2016). Aucun effet indésirable lié au traitement n’a été signalé en ce qui concerne le poids des organes, les urines et les paramètres biochimiques du sang (OMS, 2014). La plus importante observation a été la formation de cataractes. Des opacifications progressives du cristallin sont survenues tout au long de l’étude; elles étaient suivies d’opacifications complètes (c.‑à‑d. cataractes), dont les premières ont été observées chez un faible nombre d’animaux des groupes traités par les deux plus fortes doses à la semaine 11. Les examens ophtalmologiques et histopathologiques des yeux ont révélé que l’incidence des opacifications complètes du cristallin augmentait en fonction de la dose et du temps. Au moment des sacrifices en cours d’étude, quelques mâles du groupe traité par 75 ppm et jusqu’à 95 % des animaux des deux sexes du groupe traité par 375 ppm présentaient des cataractes. À la fin de l’étude, ces proportions avaient augmenté à 15 % dans le groupe traité par 75 ppm et 100 % chez les animaux des deux sexes du groupe traité par 375 ppm. Par ailleurs, les rats atteints de cataractes graves présentaient des anomalies extra‑cristalliniennes (p. ex. adhérences du corps vitré, décollements de la rétine, iritis, hémorragies intra‑oculaires) (U.S. EPA, 2001). Bien que des cataractes aient été constatées dans les groupes traités par les trois plus fortes doses à la fin de l’étude, un seul rat par sexe dans le groupe traité par 15 ppm présentait une cataracte totale. À la lumière de ces résultats et du faible taux de survie dans les groupes traités par les plus fortes doses, les données ont fait l’objet d’une réévaluation, qui a permis de conclure que l’incidence et la gravité des cataractes dans le groupe traité par 15 ppm étaient comparables à celles chez les témoins (Harling et coll., 1997; OMS, 2014; OMS, 2016). Par conséquent, une NOAEL systémique de 0,58 mg de diquat/kg p.c. par jour a été établie dans cette étude, compte tenu des effets constatés dans les yeux à la plus faible LOAEL, qui était de 2,91 mg de diquat/kg p.c. par jour (U.S. EPA, 1995a; OMS, 2014).
3.0 Calcul de la valeur basée sur la santé
Comme indiqué ci‑dessus, la NOAEL de 0,5 mg/kg p.c. par jour issue de l’étude menée chez le chien par Hopkins (1990), qui avait révélé la formation de cataractes, est la valeur sur laquelle se base la présente évaluation des risques. La NOAEL de 0,5 mg/kg p.c. par jour est fondée sur la présence de cataractes unilatérales chez les femelles et sur la diminution du poids des surrénales et de l’épididyme chez les mâles. L’apport quotidien acceptable (AQA) s’appuie aussi sur une NOAEL de 0,58 mg/kg par jour pour les femelles, qui a été établie d’après les lésions oculaires constatées dans l’étude menée par Colley et ses collaborateurs (1985).
En utilisant la NOAEL de 0,5 mg de diquat/kg par jour, l’AQA de diquat (c.‑à‑d. cation divalent de bipyridine) (Santé Canada, 2008, 2019) a été calculé comme suit :

Figure 1 - Description textuel
L’AQA pour diquat est de 0,005 mg/kg p.c. par jour. Cette valuer est calculée par divisant la NOAEL de 0,5 mg/kg p.c. par jour par le facteur d’incertitude de 100.
Où :
- 0,5 mg/kg p.c. par jour est la NOAEL, d’après la formation de cataractes constatée chez le chien;
- 100 est le facteur d’incertitude, choisi pour tenir compte des variations interspécifiques (×10) et des variations intraspécifiques (×10).
En utilisant l’AQA de 0,005 mg/kg p.c. par jour, la valeur basée sur la santé (VBS) du diquat dans l’eau potable a été calculée comme suit :
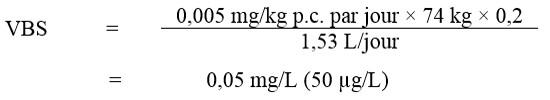
Figure 2 - Description textuel
La VBS pour diquat dans l’eau potable est de 0,05 mg/L. Cette valeur est calculée en multipliant l’AQA de diquat (0,005 mg/kg p.c. par jour) par le facteur d’attribution de l’eau potable, 0,2, puis par 74 kg, le poids corporel moyen d'un adulte, et en divisant le résultat par 1.53 L/jour, le volume quotidien d'eau consommé par un adulte.
Où :
- 0.005 mg/kg p.c. par jour est l’AQA calculé ci dessus;
- 74 kg est le poids corporel d’un adulte (Santé Canada, en cours d’élaboration);
- 0,20 est le facteur d’attribution par défaut pour l’eau potable (Krishnan et Carrier, 2013);
- 1,53 L par jour est le taux d’ingestion d’eau potable estimé chez un adulte (Santé Canada, en cours d’élaboration).
4.0 Considérations relatives à l’analyse et au traitement
4.1 Méthodes d’analyse utilisées pour la détection du diquat
Il existe une méthode d’analyse normalisée pour l’analyse du diquat dans l’eau potable. La LDM est résumée dans le tableau 3. Les LDMs, qui dépendent de la matrice de l’échantillon, des instruments et des conditions de fonctionnement choisies, varient d’un laboratoire à l’autre. Plusieurs laboratoires accrédités au Canada ont été contactés et ont indiqué que les LDMs étaient de la même ampleur que celui figurant dans le tableau 3. Les SDMs déclarés allaient de 1 à 7 μg/L (ALS Environmental, 2019; Bureau Veritas Laboratories, 2019; SGS Environmental Services, 2019).
Il est recommandé aux exploitants des stations de traitement de l’eau potable de discuter des exigences relatives aux échantillons avec le laboratoire accrédité menant les analyses, de sorte que les procédures de contrôle de la qualité soient respectées et que le SDM soit suffisamment bas pour assurer la précision de la mesure des concentrations inférieures à la CMA. Les considérations relatives à la gestion des échantillons pour l’analyse du diquat dans l’eau potable (p. ex. préservation et conservation des échantillons) se trouvent dans les références énumérées au tableau 3. Il est important de noter que la désactivation est cruciale si un oxydant est présent dans les échantillons afin de prévenir toute dégradation supplémentaire du diquat avant l’analyse.
| Méthode (référence) |
Méthodologie | LDM (µg/L) |
Interférences/commentaires (considérations opérationnelles) |
|---|---|---|---|
| Méthodes de l’U.S. EPA | |||
| EPA-NERLNote de bas de page 1: 549.2 (U.S. EPA, 1997) |
Extraction liquide‑solide et chromatographie liquide à haute performance (CLHP) avec détection UV | 0,72 | Matrice; le Ca2+ et le Mg2+ peuvent entraîner un faible taux de récupération. Le diquat s’adsorbe sur les surfaces, particulièrement le verre; il faut en tenir compte durant l’échantillonnage et l’analyse. |
Notes de bas de page
|
|||
4.2 Considérations relatives au traitement
Aucune étude portant sur l’efficacité de l’élimination du diquat dans l’eau potable par des procédés de traitement n’est disponible. Il a été affirmé que le charbon actif en grains (CAG) devrait éliminer le diquat dans l’eau (U.S. EPA, 1995b; OMS, 2017). L’osmose inverse, la nanofiltration et l’oxydation sont des technologies qui peuvent être utilisées pour éliminer le diquat.
4.2.1 Traitement à l’échelle municipale
Les procédés de traitement conventionnel de l’eau (coagulation chimique, clarification, filtration rapide sur sable), ne sont pas efficaces pour éliminer le diquat dans l’eau potable (OMS, 2017). Le diquat s’adsorbe fortement au sol, il a une masse moléculaire moyenne et il se dégrade lentement naturellement dans l’eau par photolyse; toutes ces propriétés interviennent dans l’élimination du diquat dans l’eau potable. Le choix du bon procédé de traitement pour une source donnée d’approvisionnement en eau dépend de nombreux facteurs, notamment la source d’eau brute et ses caractéristiques, les conditions d‘utilisation de la méthode de traitement choisie et les objectifs de traitement du service d’approvisionnement public. Il est recommandé de réaliser des études pilotes ou des essais en laboratoire appropriés pour s’assurer que l’eau de la source d’approvisionnement en eau pourra être traitée efficacement.
Lorsque des procédés d’oxydation ou d’oxydation avancée sont utilisés pour éliminer des pesticides dans l’eau potable, il est important de connaître le potentiel de formation de sous‑produits de dégradation du composé cible (Ikehata et Gamal El‑Din, 2006; Beduk et coll., 2012; Li et coll., 2019). Le fait que le pesticide ciblé soit éliminé ne veut pas nécessairement dire que le traitement est efficace et qu’une minéralisation complète (en dioxyde de carbone, en ions inorganiques et en eau) a été réalisée. Par ailleurs, les exploitants des stations de traitement d’eau potable doivent tenir compte du potentiel de formation de sous‑produits de désinfection, selon l’oxydant utilisé et la qualité de la source d’eau. Les études pilotes constituent une étape importante pour les stations de traitement qui envisagent le recours à des procédés d’oxydation ou d’oxydation avancée pour éliminer des pesticides dans l’eau potable.
4.2.1.1 Adsorption sur charbon actif
L’adsorption sur charbon actif est une technologie largement utilisée pour réduire les concentrations de micropolluants, y compris les pesticides, dans l’eau potable (Haist‑Gulde et Happel, 2012; van der Aa et coll., 2012). Le charbon actif peut être appliqué de deux manières : applications d’une solution en suspension de charbon actif en poudre (CAP) ou réacteur à lit fixe utilisant du charbon actif en grains (CAG) (Chowdhury et coll., 2013).
Le CAG a été recommandé à titre de technologie de traitement possible pour l’élimination du diquat dans l’eau potable (U.S. EPA, 1995b; OMS, 2017), mais les références en faveur de cette recommandation ne sont pas fournies dans ces rapports. L’U.S. EPA (2016) a indiqué que les technologies convenables pour les réseaux de petite taille sont le CAG, le CAG et le CAP, mais n’a pas fait référence à des études à grande échelle, à des études pilotes ou à des essais en laboratoire décrivant l’efficacité de ces procédés.
Il existe très peu de publications sur l’utilisation du charbon actif pour adsorber le diquat, et aucune sur la capacité d’adsorption ou à l’efficacité. Par conséquent, avant toute mise en œuvre à grande échelle, il sera essentiel de mener des études pilotes et des essais en laboratoire appropriés. L’élimination du diquat dans l’eau naturelle à l’aide de charbon actif peut être influencée par la présence d’autres contaminants qui entrent en compétition, la matière organique naturelle (MON), la formation de biofilm, la température, la concentration de diquat dans l’influent, la taille du charbon et le taux de charge hydraulique (Speth et Miltner, 1998; Haist-Gulde et Happel, 2012).
Les données produites dans les essais en laboratoire visant à déterminer les coefficients d’adsorption des pesticides sont utiles pour prédire si le charbon actif adsorbera un pesticide donné (U.S. EPA, 2011). En général, les pesticides présentant une constante d’adsorption (par exemple coefficient de Freundlich) supérieure à 200 µg/g(L/µg)1/n sont considérés aptes à être éliminés par adsorption sur charbon (Speth et Adams, 1993; Speth et Miltner, 1998, U.S. EPA, 2011). Toutefois, les auteurs ont précisé que la capacité du charbon actif dépend de nombreux facteurs, notamment le caractère ionique du composé et le pH de la solution. Les coefficients de Freundlich dans l’eau exempte de matière organique en ce qui concerne le diquat vont de 103 µg/g(L/µg)1/n à un pH de 3,0 à 2 910 µg/g(L/µg)1/n à un pH de 6,1, et ils ont atteint jusqu’à 122 000 µg/g(L/µg)1/n à un pH de 10,1 (Speth et Miltner, 1998). Ces résultats montrent l’effet considérable du pH sur l’adsorption, qui est très faible à un pH de 3,0, raisonnable à un pH presque neutre et plutôt forte à un pH plus élevé.
L’utilisation de CAP comporte l’avantage de fournir du charbon vierge selon les besoins (p. ex. durant la saison d’application du pesticide) (Miltner et coll., 1989). L’efficacité d’élimination du CAP dépend du type et de la dose de CAP, du temps de contact, des caractéristiques du CAP (type, taille des particules), de la capacité d’adsorption du contaminant et de la présence de MON (Gustafson et coll., 2003 ; Summers et coll., 2010; Haist‑Gulde et Happel, 2012; Chowdhury et coll., 2013). La capacité du CAG d’éliminer les pesticides par adsorption dépend de la vitesse de filtration, du temps de contact en lit vide, des caractéristiques du CAG (type, taille des particules, méthode de réactivation), de la capacité d’adsorption du contaminant et de la durée du cycle de filtration (Haist‑Gulde et Happel, 2012). Par ailleurs, étant donné que les adsorbeurs à lit fixe de CAG fonctionnent généralement sur une base continue, le CAG peut devenir encrassé (ou préchargé) par de la MON, ce qui le rendrait entièrement ou partiellement inefficace pour éliminer le pesticide (Knappe et coll., 1999; Summers et coll., 2010; Haist‑Gulde et Happel, 2012; Chowdhury et coll., 2013).
Plusieurs autres études ont examiné l’élimination du diquat dans les eaux usées dans des expériences en lots utilisant du CAG ou divers adsorbants rarement utilisés pour le traitement de l’eau potable (Dichiara et coll., 2015; Hao et coll., 2015; Li et coll. 2017; Duman et coll., 2019). Les concentrations initiales dans ces études étaient beaucoup plus élevées que celles couramment observées dans l’eau potable, allant de 5,43 à 80 mg/L. L’efficacité de l’élimination a varié de 72,9 à 89,3 %, la capacité d’adsorption, de 36,45 à 197,53 mg/g et les taux d’adsorption, de 0,612 à 29,1 mg/m∙min, selon l’adsorbant et les conditions expérimentales.
4.2.1.2 Filtration sur membrane
La nanofiltration et l’osmose inverse, qui sont des procédés sur membrane effectués par l’application d’une pression, sont généralement efficaces pour éliminer les pesticides dans l’eau potable. La capacité de ces deux procédés d’éliminer des pesticides dépend des caractéristiques de la membrane, des propriétés des pesticides, de la composition de l’eau d’alimentation, des conditions opérationnelles et de l’encrassement de la membrane (Van der Bruggen et Vandecasteele, 2003; Plakas et Karabelas, 2012; Bellona et coll., 2004).
Comme le principal mécanisme des membranes de nanofiltration et d’osmose inverse pour éliminer les pesticides est l’exclusion par la taille, le seuil de rétention des molécules en raison de leur poids moléculaire (MWCO) par la membrane constitue une caractéristique importante. Bien qu’aucune étude n’ait encore évalué l’utilisation de la filtration sur membrane pour éliminer le diquat, les membranes dont le seuil de rétention des molécules est inférieur à la masse moléculaire (184,2 g/mol) du diquat pourraient se révéler efficaces. Le diquat est hautement polaire et hydrophile : comme ces deux caractéristiques physico‑chimiques réduisent l’efficacité du rejet par la membrane (Plakas et Karabelas, 2012), il est probable que le diquat sera éliminé uniquement par l’exclusion par la taille.
Bellona et ses collaborateurs (2004) ont créé un organigramme utilisant les caractéristiques du pesticide dans l’eau (p. ex. masse moléculaire, log Koe, diamètre moléculaire), ainsi que celles de la membrane (p. ex. seuil de rétention des molécules, taille des pores). Cet organigramme pourrait être utilisé pour déterminer le potentiel d’élimination du diquat par filtration sur membrane. Avant toute mise en œuvre à grande échelle, il est important de mener les essais appropriés dans les conditions opérationnelles proposées avec la membrane et la source d’approvisionnement en eau afin d’assurer l’élimination adéquate du diquat.
4.2.1.3 Oxydation
L’oxydation chimique par le dioxyde de chlore peut être une méthode de traitement efficace pour éliminer le diquat dans l’eau, en fonction de plusieurs facteurs comme la dose de l’oxydant, le temps de contact, la quantité de désinfectant requise, la température et le pH.
Des essais en laboratoire ont été réalisés avec des oxydants – dioxyde de chlore, permanganate et chlore – pour évaluer la dégradation du diquat dans l’eau distillée (Gomaa et Faust, 1971). Les concentrations initiales utilisées dans cette étude étaient plusieurs ordres de grandeur plus élevés que celles normalement présentes dans la source d’approvisionnement en eau (15 à 30 mg/L) et les doses d’oxydant étaient élevées (dose de dioxyde de chlore de 6,75 mg/L). Le dioxyde de chlore a constitué le meilleur oxydant pour l’élimination du diquat : il était efficace aux pH supérieurs à 8,0 et la réaction complète prenait moins d’une minute. L’utilisation du dioxyde de chlore impliquerait d’ajuster au préalable le pH à un niveau légèrement alcalin. Le chlore s’est révélé moins efficace que le dioxyde de chlore, mais son efficacité était aussi accrue aux pH élevés. Le permanganate de potassium a aussi été étudié, mais il n’a pas éliminé le diquat adéquatement. L’étude n’a pas porté sur la formation de sous‑produits.
Des réactions relativement lentes ont été constatées avec l’ozonation du diquat (Yao et Haag, 1991; Hu et coll., 2000). Hu et ses collaborateurs (2000) ont mené un essai en laboratoire visant à mesurer les constantes de vitesse d’oxydation par l’ozone de 24 pesticides. Les analyses ont été réalisées avec de l’eau brute synthétique au pH de 7,5, une force ionique de 10-3 M et 100 μM de NaHCO3. La dose d’ozone de 1,3 mg/L a donné une constante de vitesse de 67,9 M-1s-1, ce qui représente la deuxième constante de vitesse la plus faible de tous les pesticides examinés. À titre de comparaison, l’acide 2,4‑dichlorophénoxyacétique avait une vitesse de réaction de 298 M-1s-1 et la warfarine, une vitesse de réaction supérieure à 21 000 M-1s-1.
Yao et Haag (1991) se sont penchés sur les constantes de vitesse d’oxydation par l’ozone de 45 composés organiques (Yao et Haag, 1991). Une vitesse de réaction de 0,6 M-1s-1 a été obtenue au pH de 3,1, et une demi‑vie de 15 heures a été établie à un pH de 7.
4.2.2 Traitement à l’échelle résidentielle
Dans les cas où l’on souhaite éliminer le diquat à l’échelle résidentielle, par exemple lorsque l’eau potable d’une résidence provient d’un puits privé, un dispositif de traitement résidentiel peut être une option pour réduire les concentrations de diquat dans l’eau potable. Si des conseils sont nécessaires, les consommateurs devraient communiquer avec l’autorité responsable en matière de leur eau potable. Avant l’installation du dispositif de traitement, il faut analyser l’eau pour en déterminer les caractéristiques chimiques générales, de même que la concentration de diquat dans la source d’approvisionnement en eau. Il y a un manque d’ études sur l’efficacité des technologies de traitement en ce qui concerne l’élimination du; cependant, l’adsorption (sur charbon actif) et l’osmose inverse sont des technologies de traitement qui peuvent éliminer le diquat à l’échelle résidentielle. Pour vérifier l’efficacité d’un dispositif de traitement, il faut régulièrement collecter des échantillons de l’eau qui entre dans le dispositif de traitement et de l’eau qui en sort, et envoyer ces échantillons à un laboratoire accrédité pour la réalisation d’analyses. Comme les dispositifs de traitement peuvent perdre leur capacité d’élimination avec l’usage et le temps, ils doivent être entretenus et/ou être remplacés au besoin. Les consommateurs doivent vérifier la durée de vie prévue des composantes de leur dispositif de traitement selon les recommandations du fabricant, et veiller à leur entretien au besoin. Certains systèmes résidentiels peuvent avoir une capacité nominale permettant de traiter des volumes supérieurs à ceux d’une seule résidence, de sorte qu’ils peuvent aussi être utilisés dans des systèmes de petite taille.
Santé Canada ne recommande aucune marque particulière de dispositif de traitement de l’eau potable, mais conseille fortement aux consommateurs d’utiliser des dispositifs dont la conformité aux normes pertinentes de NSF International (NSF) et de l’American National Standards Institute (ANSI) est certifiée par un organisme de certification accrédité. Ces normes visent à établir des exigences minimales relatives aux matériaux, à la conception et à la fabrication des dispositifs de traitement de l’eau potable. On s’assure ainsi que les matériaux contenus dans le dispositif ne libèrent pas de contaminants dans l’eau potable (c.-à-d. innocuité des matériaux). De plus, les normes englobent des exigences de performance qui précisent le taux d’élimination qui doit être réalisé pour certains contaminants (c.-à-d. déclaration de réduction) qui peuvent être présents dans l’eau. Les organismes de certification, qui doivent être accrédités par le Conseil canadien des normes (CCN), garantissent qu’un produit est conforme aux normes en vigueur. Voici quelques-uns des organismes accrédités au Canada (CCN, 2019) :
- CSA Group;
- NSF International;
- Water Quality Association;
- UL LLC;
- Bureau de normalisation du Québec;
- International Association of Plumbing and Mechanical Officials;
- Truesdail Laboratories Inc.
Il est possible d’obtenir une liste à jour des organismes de certification accrédités auprès du Conseil canadien des normes.
Les techniques de traitement de l’eau susceptibles d’éliminer efficacement le diquat à l’échelle résidentielle sont notamment :
- l’osmose inverse (OI);
- l’adsorption (p. ex. charbon actif).
À l’heure actuelle, le diquat n’est pas visée par les exigences de performance des normes NSF/ANSI. Toutefois, les consommateurs peuvent utiliser un dispositif de traitement qui est certifié conforme aux normes relatives à l’osmose inverse ou à l’adsorption pour s’assurer que l’innocuité des matériaux a été évaluée.
5.0 Stratégies de gestion
Tous les responsables de systèmes d’approvisionnement en eau potables devraient mettre en œuvre une approche de gestion des risques, comme l’approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l’eau, pour assurer la salubrité de l’eau (Conseil Canadien des ministres de l’environnement (CCME), 2004 ; OMS, 2011, 2012). Ces approches exigent une évaluation du système pour caractériser la source d’approvisionnement en eau, décrire les obstacles au traitement qui empêchent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. La surveillance opérationnelle est ensuite établie, et des protocoles opérationnels et de gestion sont mis en place (p. ex. procédures opérationnelles normalisées, mesures correctives et interventions en cas d’incident). La surveillance de la conformité est déterminée, et d’autres protocoles de validation du plan de salubrité de l’eau sont mis en œuvre (p.ex. tenue de dossiers, satisfaction des consommateurs). La formation des opérateurs est également nécessaire pour assurer l’efficacité en tout temps du plan de salubrité de l’eau (Smeets et coll., 2009).
5.1 Surveillance
Le diquat peut être présent dans les eaux souterraines et les eaux de surface dans les zones où il est utilisé, selon le type et l’importance de son application, des facteurs environnementaux (p. ex. quantité de précipitations, type de sol, conditions hydrogéologiques) et son devenir dans le milieu ambiant (p. ex. mobilité, potentiel de lessivage, dégradation). Les services d’approvisionnement en eau doivent évaluer la possibilité que le diquat pénètre dans les sources d’eau (p. ex. approvisionnement en eau brute d’un réseau d’eau potable) en fonction des facteurs propres au site.
Si la présence du diquat et la nécessité d’une surveillance sont confirmées, il faut caractériser les eaux souterraines et les eaux de surface afin de déterminer la concentration de diquat. Pour ce faire, on doit surveiller les sources d’eaux de surface durant les périodes de forte utilisation et les épisodes de pluie et/ou surveiller les eaux souterraines tous les ans. La surveillance peut être réduite si les données de référence n’indiquent pas la présence de diquat dans la source d’approvisionnement en eau.
Lorsqu’un traitement est nécessaire pour éliminer le diquat, il faut assurer une surveillance opérationnelle afin de déterminer si le procédé de traitement fonctionne comme prévu. La fréquence de la surveillance opérationnelle dépendra de la qualité de l’eau, de la variation des concentrations dans l’eau brute, et du procédé de traitement. Les autorités responsables devraient tenir compte de l’incidence de la MON sur les systèmes au charbon actif, car cette interaction peut avoir un effet sur les objectifs de qualité de l’eau pour ce qui est de l’élimination du diquat.
Lorsqu’un traitement est utilisé pour éliminer le diquat il faut effectuer une surveillance de conformité (c.‑à‑d. échantillons jumelés de la source d’approvisionnement en eau avec l’eau traitée afin de confirmer l’efficacité du traitement) au moins tous les ans. Lorsque la surveillance opérationnelle périodique indique un risque de propagation du contaminant, comme dans le cas du CAG, une surveillance devrait être effectuée tous les trois mois. Enfin, lorsqu’un procédé de dégradation (p. ex. oxydation) est utilisé, la formation de sous‑produits comme doit aussi être évaluée.
6.0 Considérations internationales
La présente section expose les recommandations, les normes et les conseils relatifs à l’eau potable qu’ont établis des organismes canadiens et étrangers. Les valeurs varient en fonction de la date à laquelle remonte l’évaluation sur laquelle elles sont fondées, et en fonction des différentes politiques et démarches appliquées, y compris en ce qui concerne le choix de l’étude clé ou les taux de consommation, les poids corporels et les facteurs d’attribution liés à la source employés.
L’U.S. EPA a fixé une CMA de 0,02 mg/L, tandis que le National Health and Medical Research Council (NHMRC) de l’Australie a fixé une valeur recommandée de 0,007 mg/L à l’égard du diquat dans l’eau potable (NHMRC et NRMMC, 2011). L’OMS a calculé une valeur non réglementaire basée sur la santé de 0,03 mg/L (30 µg/L) à l’égard du diquat (OMS, 2016). Ces trois valeurs sont fondées sur la formation de cataractes constatée dans une étude de 2 ans menée chez le rat en 1985, mais elles diffèrent sur le plan de l’interprétation (c.‑à‑d. NOAEL) ainsi que des poids corporels et des facteurs d’attribution liés à la source retenus (tableau 4).
L’Union européenne (UE) ne fixe pas de valeurs paramétriques chimiques propres à des pesticides. Elle a plutôt établi une valeur de 0,1 µg/L pour tout pesticide pris individuellement et une valeur de 0,5 µg/L pour les pesticides pris globalement dans l’eau potable. Pour établir ces valeurs, l’UE n’a pas pris en compte les connaissances scientifiques sur chaque pesticide, comme les effets sur la santé. Ces valeurs sont plutôt fondées sur la décision stratégique d’empêcher la présence de pesticides dans l’eau potable.
| Organisme (année) |
Valeur (mg/L) |
Effet principal (référence) |
NOAEL (mg/kg p.c./j) |
FI | AQA (mg/kg p.c./j) |
p.c. (kg) |
Ingestion d’eau potable (L/j) |
FA (%) |
Remarques |
|---|---|---|---|---|---|---|---|---|---|
| SC – CMA proposée (2019) |
0,05 | Cataractes chez le chien (Hopkins, 1990) |
0,5 | 100 | 0,005 | 74 | 1.53 | 20 | |
| U.S. EPA (1992) |
0,02 | Cataractes chez le rat (Colley et coll., 1985) | 0,22 | 100 | 0,0022 | 70 | 2 | 20 | |
| OMS (2016) |
0,03 | Cataractes chez le rat (Colley et coll., 1985) | 0,58 | 100 | 0,0058 | 60 | 2 | 20 | AQA établi par la JMPR (FAO/OMS, 2014). La JMPR a déclaré que l’étude d’un an chez le chien menée par Hopkins (1990) appuie son AQA. |
| Australie (2011) |
0,007 | Cataractes chez le rat | 0,2 | 100 | 0,002 | 70 | 2 | 10 | Aucun renvoi à une étude sur les cataractes ne figure dans la publication de la NHMRC et de la NRMMC (2011), mais la description correspond aux travaux de Colley et ses collaborateurs (1985). |
| UE (1998) |
0,1 µg/L | L’UE a établi une valeur de 0,1 µg/L pour tout pesticide pris individuellement et une valeur de 0,5 µg/L pour les pesticides pris globalement dans l’eau potable. Pour établir ces valeurs, l’UE n’a pas pris en compte les connaissances scientifiques sur chaque pesticide, comme les effets sur la santé. Ces valeurs sont plutôt fondées sur la décision stratégique d’empêcher la présence de pesticides dans l’eau potable. | |||||||
|
AQA : apport quotidien acceptable |
|||||||||
7.0 Justification
Le diquat est homologué au Canada comme agent de dessiccation sur une variété de cultures, ainsi que pour la lutte contre les mauvaises herbes aquatiques et les algues dans les eaux stagnantes et à faible courant. Bien que son usage soit courant au Canada, les données fournies par les provinces et les territoires qui surveillent le diquat dans les sources d’approvisionnement en eau et l’eau potable indiquent que les concentrations de diquat sont négligeables. L’œil (formation de cataractes) est considéré comme l’organe cible de la toxicité du diquat. Bien qu’aucune étude n’ait été effectuée chez l’humain pour déterminer les effets du diquat sur les yeux, les études menées chez plusieurs espèces animales (souris, rat, chien) ont invariablement révélé des lésions oculaires à la suite d’expositions répétées au diquat.
Santé Canada, en collaboration avec le Comité fédéral‑provincial‑territorial sur l’eau potable, propose une CMA de 0,05 mg/L (50 µg/L) pour le diquat dans l’eau potable à la lumière des considérations suivantes:
- une VBS de 0,05 mg/L (50 µg/L) basée sur la formation de cataractes chez le chien;
- le diquat peut être mesuré avec précision à des concentrations considérablement inférieures à la CMA proposée;
- le diquat devrait pouvoir être éliminé à l’échelle municipale;
La CMA proposée assure une protection contre les effets sur la santé qui peuvent survenir à la suite d’une exposition au diquat. Santé Canada continuera, dans le cadre de son processus continu de révision des recommandations, de surveiller les nouvelles recherches à ce sujet, et recommandera au besoin toute modification jugée appropriée au présent document technique.
8.0 Références
Agence de la sécurité de l’eau de la Saskatchewan (2019). Communication personnelle avec S. Ferris.
ALS Environmental (2019). Communication personnelle avec A. Ganouri-Lumsden, Waterloo, ON.
Beduk, F., Aydin, M.E., et Ozcan, S. (2012). Degradation of malathion and parathion by ozonation, photolytic ozonation, and heterogeneous catalytic ozonation processes. Clean - Soil, Air, Water, 40(2): 179-187.
Bellona, C., Drewes, J.E., Xu, P. et Amy, G. (2004). Factors affecting the rejection of organic solutes during NF/RO treatment – a literature review. Wat. Res., 38: 2795-2809.
Bureau Veritas Laboratories (2019). Communication personnelle avec C. MacDermid, Mississauga, ON.
CCME (2004). De la source au robinet : Guide d’application de l’approche à barrières multiples pour une eau potable saine. Conseil canadien des ministres de l’environnement, Winnipeg (Manitoba). Accessible en ligne à : https://www.ccme.ca/files/Resources/fr_water/fr_source_to_tap/mba_guidance_doc_f.pdf
Chowdhury, Z.K., Summers, R.S., Westerhoff, G.P., Leto, B.J., Nowack, K.O. et Corwin, C.J. (2013). Activated carbon: Solutions for improving water quality. Passantino, L. B. (ed.). American Water Works Association. Denver, Colorado.
Circu, M.L., Maloney, R.E. et Aw, T.Y. (2017). Diquat-induced cellular pyridine nucleotide redox changes and alteration of metabolic enzyme activities in colonic carcinoma cells. Chem. Biol. Interact., 264: 43-51.
Colley, J., Warren, S. et Heywood, R. (1985). Diquat dibromide: Evaluation of potential carcinogenicity and chronic toxicity by prolonged dietary administration to rats. Final Report: HRC Report No. ICI 406-83763. Unpublished study prepared by Huntington Research Center; MRID 00145855 (tel que cité dans U.S. EPA, 1995a).
Développement durable Manitoba (2019). Communication personnelle avec D. Coulibaly, Section de la gestion de la qualité de l’eau.
Dichiara, A.B., Harlander, S.F., Rogers, R.E. (2015). Fixed bed adsorption of diquat dibromide from aqueous solution using carbon nanotubes. RSC Adv., 5(76): 61508-61512.
Duman, O., Özcan, C., Gürkan Polat, T. et Tunç, S. (2019). Carbon nanotube-based magnetic and non-magnetic adsorbents for the high-efficiency removal of diquat dibromide herbicide from water: OMWCNT, OMWCNT-Fe3O4 and OMWCNT-κ-carrageenan-Fe3O4 nanocomposites. Environ.Pollut., 244: 723-732.
EFSA (2015). Conclusion on the peer review of the pesticide risk assessment of the active substance diquat. European Food Safety Authority. EFSA Journal, 13(11): 4308.
Emmett, K. (2002). Risk assessments for diquat dibromide - appendix A (publication number 00-10-046). In: Final supplemental environmental impact statement for diquat dibromide. The Water Quality Program. Washington State Department of Ecology. Report Number 02-10-052.
FAO et WHO (2014). Pesticide residues in food - 2013. Report of the joint meeting of the FAO panel of experts on pesticide residues in food and the environment and the WHO core assessment group on pesticide residues. FAO plant production and protection paper 219.World Health Organization. Food and Agriculture Organization of the United Nations. Rome. Geneva, Switzerland.
FAO (2019). Pesticides residues in food - 2018: Residues and analytical aspects. Report of the Joint Meeting of the FAO Panel of Experts on Pesticide Residues in Food and the Environment and the WHO Core Assessment Group on Pesticide Residues. FAO Plant Production and Protection Paper 234. Food and Agriculture Organization of the United Nations. Rome.
Fletcher, K. (1972). Diquat dibromide: Three-generation reproduction study in rats. ICI study no. HO/IH/R/334A. DPR vol. 226-005 # 916116 (tel que cité dans OEHHA, 2016).
Fuke, C., Ameno, K., Ameno, S., Kinoshita, H. and Ijiri, I. (1996). Detection of two metabolites of diquat in urine and serum of poisoned patients after ingestion of a combined herbicide of paraquat and diquat. Arch. Toxicol., 70(8): 504-507.
Fussell, K.C., Udasin, R.G., Gray, J.P., Mishin, V., Smith, P.J., Heck, D.E. and Laskin, J.D. (2011). Redox cycling and increased oxygen utilization contribute to diquat-induced oxidative stress and cytotoxicity in Chinese hamster ovary cells overexpressing NADPH-cytochrome P450 reductase. Free Radic. Biol. Med., 50(7): 874-882.
Gallagher, E.P., Buetler, T.M., Stapleton, P.L., Wang, C., Stahl, D.L. and Eaton, D.L. (1995). The effects of diquat and ciprofibrate on mRNA expression and catalytic activities of hepatic xenobiotic metabolizing and antioxidant enzymes in rat liver. Toxicol. Appl. Pharmacol., 134(1): 81-91.
Gomaa, H.M. and Faust, S.D. (1971). Kinetics of Chemical Oxidation of Dipyridylium Quaternary Salts. J. Agric. Food Chem., 19(2): 302-307.
Gouvernement de l’Ontario (2019). Programme de surveillance de l’eau potable. Accessible en ligne à: https://www.ontario.ca/fr/donnees/programme-de-surveillance-de-leau-potable
Gupta, P.K. (2014). Chapter 24 - Herbicides and fungicides. In: Biomarkers in toxicology. Gupta, R.C. (ed.). pp. 409-431.
Gupta, R.C. et Crissman, J.W. (2013). Chapter 42- Agricultural chemicals. In: Haschek and Rousseaux's Handbook of Toxicologic Pathology. Haschek, W.M., Rousseaux, C.G. and Wallig, M.A. (eds.). 3rd. pp. 1349-1372.
Gustafson, D.K., Carr, K.H., Carson, D.B., Fuhrman, J.D., Hackett, A.G., Hoogheem, T.J., Snoeyink, V.L., Curry, M., Heijman, B., Chen, S., Herti, P. et van Wesenbeeck, I. (2003). Activated carbon adsorption of chloroacetanilide herbicides and their degradation products from surface water supplies. J. Water Supply Res. Technol. AQUA, 52(6): 443-454.
Haist-Gulde, B. et Happel, O. (2012). Removal of pesticides and their ionic degradates by adsorptive processes. Report no. 4022. Water Research Foundation, Denver, Colorado.
Hantson, P., Wallemacq, P. et Mahieu, P. (2000). A case of fatal diquat poisoning: Toxicokinetic data and autopsy findings. J. Toxicol. Clin. Toxicol., 38(2): 149-152.
Hao, Y., Wang, Z., Gou, J. Wang, Z. (2015). Kinetics and thermodynamics of diquat removal from water using magnetic graphene oxide nanocomposite. Can.J.Chem.Eng., 93(10): 1713-1720.
Harling, R.J., Buist, D. et Gopinath, C. (1997). Diquat dibromide - Evaluation of potential carcinogenicity and chronic toxicity by prolonged dietary administration to rats: Addendum report 2: 2 year data. Report no. ICI 406/83763.Unpublished study prepared by Huntingdon Life Sciences, Huntingdon, Cambridgeshire, England (tel que cité dans WHO, 2016).
Hodge, M.C.E. (1989). Diquat: Teratogenicity study in the rabbit. ICI Study no. CTL/P/2379; MRID 41198901 (tel que cité dans U.S. EPA, 1995a and OEHHA, 2016).
Hodge, M.C.E. (1990). Diquat: Multigeneration study in the rat. ICI Study no. CTL/P/2462. DPR vol. 226-090; MRID 41531301 (tel que cité dans U.S. EPA, 1995a OEHHA, 2016).
Hodge, M.C.E. (1992). Diquat: Two year feeding study in mice. ICI Study no. CTL/P/3409; MRID 42219801 (tel que cité dans U.S. EPA, 1995a OEHHA, 2016).
Hopkins, M.N. (1990). Diquat: 1 year feeding study in dogs. ICI Study no. CTL/P/2596. DPR vol. 226-094. Unpublished study prepared by ICI Central Toxicology Laboratory; MRID 41730301 (tel que cité dans U.S. EPA, 1995a and WHO, 2016).
Horner, J.M. (1992a). Diquat: Subchronic neurotoxicity study in rats. ICI study no. CTL/P/3751.Unpublished study prepated by ICI Central Toxicology Laboratory; MRID 42616101 (tel que cité dans U.S. EPA, 1995a).
Horner, J.M. (1992b). Diquat: Acute neurotoxicity study in rats. ICI Study no. CTL/P/3789. Unpublished study prepated by ICI Central Toxicology Laboratory; MRID 42666801 (tel que cité dans U.S. EPA, 1995a and WHO, 2016).
HSDB (2010). Diquat dibromide. U.S. National Library of Medicine. National Institutes of Health, Health and Human Services, https://toxnet.nlm.nih.gov/cgi-bin/sis/search2/f?./temp/~9Eswj1:1:cpp.
Ikehata, K. et El-Din, M.G. (2006). Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type advanced oxidation processes: A review. J. Environ. Eng. Sci., 5(2): 81-135.
Jones, G.M. et Vale, J.A. (2000). Mechanisms of toxicity, clinical features, and management of diquat poisoning: A review. Clin. Toxicol., 38(2): 123-128.
Jovic-Stosic, J., Babic, G. et Todorovic, V. (2009). Fatal diquat intoxication. Vojnosanit. Pregl., 66(6): 477-481.
Knappe, D.R.U., Snoeyink, V.L., Roche, P., Prados, M.J. et Bourbigot, M-M. (1999). Atrazine removal by preloaded GAC. J. Am. Water Works Assoc., 91(10): 97-109.
Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39-51.
Li, W., Zhao, Y., Yan, X., Duan, J., Saint, C.P. et Beecham, S. (2019). Transformation Pathway and Toxicity Assessment of Malathion in Aqueous Solution during UV Photolysis and Photocatalysis. Chemosphere, 234: 204-214.
Li, Y., Zhao, R., Chao, S., Sun, B., Zhang, N., Qiu, J., Wang, C. Li, X. (2017). A flexible magnesium silicate coated electrospun fiber adsorbent for high-efficiency removal of a toxic cationic herbicide. New J. Chem., 41(24): 15601-15611.
Magalhães, N., Carvalho, F. et Dinis-Oliveira, R.J. (2018). Human and experimental toxicology of diquat poisoning: Toxicokinetics, mechanisms of toxicity, clinical features, and treatment. Hum. Exp. Toxicol., 37(11): 1131-1160.
Miltner, R.J., Baker, D.B., Speth, T.F., Fronk, C.A. (1989). Treatment of seasonal pesticides in surface waters. J. Am. Water Works Assoc., 81: 43–52. Disponible à: https://doi.org/10.1002/j.1551-8833.1989.tb03321.x
Ministère des Affaires Municipales et de l’Environnement de Terre‑Neuve‑et‑Labrador (2019). Communication personnelle avec H. Khan.
Ministère des Communautés, des Terres et de l'Environnement de l’Île‑du‑Prince‑Édouard (2019). Communication personnelle avec G. Somers.
Ministère de l’Environnement de la Nouvelle‑Écosse (2019). Communication personnelle avec A. Polegato.
Ministère de l'Environnement et des Gouvernements locaux (2019). Communication personnelle avec K. Gould.
Ministère de l’Environnement et de la Lutte contre les changements climatiques du Québec (2019). Communication personnelle avec P. Cantin.
Ministère de la Santé de la Colombie‑Britannique (2019). Communication personnelle avec D. Fishwick, directeur de l’eau potable.
Minnema, D.J., Travis, K.Z., Breckenridge, C.B., Sturgess, N.C., Butt, M., Wolf, J.C., Zadory, D., Herberth, M.T., Watson, S.L., Cook, A.R. et Botham, P.A. (2016). Dietary administration of diquat for 13 weeks does not result in a loss of dopaminergic neurons in the substantia nigra of C57BL/6J mice. Regul. Toxicol. Pharmacol., 75: 81-88.
NHMRC et NRMMC (2011). Australian drinking water guidelines Paper 6 national water quality management strategy. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra. Available at: https://Nhmrc.Gov.Au/about-Us/Publications/Australian-Drinking-Water-Guidelines.
OEHHA (2016). Public health goal for carbofuran, diquat, endrin, picloram and thiobencarb in drinking water. Office of Environmental Health Hazard Assessment, California Environmental Protection Agency, U.S.
OMS (2004). Diquat in Drinking-water: Background document for development of WHO guidelines for drinking-water Quality. Organisation mondiale de la Santé, Genève, Suisse. Disponible à: https://www.who.int/water_sanitation_health/dwq/chemicals/diquat.pdf
OMS (2011). Guidelines for drinking-water quality. Fourth edition. Organisation mondiale de la Santé, Genève, Suisse. Disponible à: http://www.who.int/water_sanitation_health/publications/2011/dwq_guidelines/en/
OMS (2012). Planifier la gestion de la sécurité sanitaire de l’eau pour l’approvisionnement en eau des petites communautés. Organisation mondiale de la Santé, Genève, Suisse. Accessible en ligne : https://www.who.int/water_sanitation_health/publications/small-comm-water_supplies/fr/
OMS (2014). Pesticide residues in food - 2013: Toxicological evaluations. Joint meeting of the FOA panel of experts on pesticide residues in food and the environment and the WHO core assessment group on pesticide residues. Sponsored jointly by the Food and Agriculture Organization of the United Nations and World Health Organization. Organisation mondiale de la Santé, Genève, Suisse.
OMS (2016). Diquat in drinking-water. Background document for development of WHO guidelines for drinking-water quality. Organisation mondiale de la Santé, WHO/FWC/WSH/16.50, Genève, Suisse.
OMS (2017). Directives de qualité pour l’eau de boisson. Quatrième édition. Intégrant le premier additif. https://apps.who.int/iris/bitstream/handle/10665/258887/9789242549959-fre.pdf?sequence=1&isAllowed=y
Palmer, A.K.; Edwards, J.A. et Woodhouse, R.N. (1978). Effect of diquat on pregnancy of the mouse. ICI Study no. 167/77642. Unpublished study prepared by Huntingdon Research Centre and submitted by Chevron Chemical Co.; MRID 00061637 (tel que cité dans U.S. EPA, 1995a).
Plakas, K.V., et Karabelas, A.J. (2012). Removal of pesticides from water by NF and RO membranes – A review. Desalination 287: 255-265.
Sandy, M.S., Moldeus, P., Ross, D. et Smith, M.T. (1986). Role of redox cycling and lipid peroxidation in bipyridyl herbicide cytotoxicity: Studies with a compromised isolated hepatocyte model system. Biochem. Pharmacol., 35(18): 3095-3101.
Santé Canada (2008). Projet de décision de réévaluation. PRVD2008-12. Dibromure de diquat. Agence de réglementation de la lutte antiparasitaire (ARLA); Santé Canada, Ottawa, Ontario.
Santé Canada (2010). Décision de réévaluation. RVD2010-03. Dibromure de diquat. Agence de réglementation de la lutte antiparasitaire (ARLA); Santé Canada, Ottawa, Ontario.
Santé Canada (2016). Rapport sur les ventes de produits antiparasitaires. ARLA, Santé Canada, Ottawa, Ontario.
Santé Canada (2019). Communication personnelle de la Direction de l’évaluation sanitaire, Agence de réglementation de la lutte antiparasitaire (ARLA).
Schmidt, D.M., Neale, J. et Olson, K.R. (1999). Clinical course of a fatal ingestion of diquat. J. Toxicol. Clin. Toxicol., 37(7): 881-884.
Services aux Autochtones Canada (2019). Communication personnelle avec X. Redhead.
Services de santé environnementale du Yukon (2019). Communication personnelle avec P. Brooks.
SGS Environmental Services (2019). Communication personnelle avec D. Griffin. Lakefield, ON.
Smeets, P.W.M.H., Medema, G.J., et van Dijk, J.C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drink. Water Eng. Sci., 2: 1-14.
Speth, T.F. et Adams J.Q. (1993). GAC and air stripping design support for the Safe Drinking Water Act, Strategies and technologies for meeting SDWA requirements. Clark, R. and S. Summers, Eds., Lewis Publishers, Ann Arbor, MI, pp. 47-89.
Speth, T.F. et Miltner, R.J. (1998). Technical note: adsorption capacity of GAC for synthetic organics. AWWA Journal, 90(4): 171.
Summers, R.S., Knappe, D.R.U., et Snoeyink, V.L. (2010). Chapter 14: Adsorption of organic compounds by activated carbon. In: Edzwald , J.K. (ed.), Water quality and treatment: A handbook on drinking water. 6th edition. McGraw-Hill, New York, NY.
Tanen, D.A., Curry, S.C. et Laney, R.F. (1999). Renal failure and corrosive airway and gastrointestinal injury after ingestion of diluted diquat solution. Ann. Emerg. Med., 34(4 Pt 1): 542-545.
U.S. EPA (1995a). Reregistration Eligibility Decision (RED). Diquat dibromide. List A. Case 0288. Office of Prevention, Pesticides and Toxic Substances. Special review and reregistration division. United States Environmental Protection Agency, EPA 738-R-95-016, Washington, D.C.
U.S. EPA (1995b). National Primary Drinking Water Regulations - Diquat. U.S. Environmental Protection Agency, EPA 811-F-95-003 m-T.
U.S. EPA (1997). Method 549.2 - Determination of Diquat and Paraquat in drinking water by liquid-solid extraction and high performance liquid chromatography with ultraviolet detection. Rev. 1.0.
U.S. EPA (2001). Diquat dibromide: Third HIARC report: Revisit/Re-evaluation of database by the HED hazard identification assessment review committee. U.S. Environmental Protection Agency, HED Doc No. 0050369, Washington, D.C.
U.S. EPA (2002). Diquat dibromide TRED facts. Office of Prevention, Pesticides and Toxic Substances. United States Environmental Protection Agency, Washington, D.C.
U.S. EPA (2011). Finalization of Guidance on Incorporation of Water Treatment Effects on Pesticide Removal and Transformation in Drinking Water Exposure Assessments.
U.S. EPA (2016). Occurrence Analysis for Potential Source Waters for the third Six-Year Review of National Primary Drinking Water Regulations. 810-R-16-008.
Valiante, F., Farinati, F., Dal Santo, P., Germana, B., Di Mario, F. et Naccarato, R. (1992). Upper gastrointestinal injury caused by diquat. Gastrointest. Endosc., 38(2): 204.
van der Aa, L.T.J., Kolpa, R.J., Rietveld, L.C. et van Dijk, J.C. (2012). Improved removal of pesticides in biological granular activated carbon filters by pre-oxidation of natural organic matter. J. Water Supply Res. Technol. AQUA, 61(3): 153-163.
Van der Bruggen, B. et Vandecasteele, C. (2003). Removal of pollutants from surface water and groundwater by nanofiltration: overview of possible applications in drinking water industry. Environ. Pollut., 122: 435-445.
Wickramaratne, G. (1989). Diquat: Teratogenicity study in the rat. ICI Study no. CTL/P/2331; Study No. RR0399. Unpublished study prepared by ICI Central Toxicology Laboratory; MRID 41198902 (tel que cité dans U.S. EPA, 1995a).
Yao, C.C. et W.R. Haag (1991). Rate constant for direct reaction of ozone with several drinking water contaminants. Wat. Res., 25(7): 761-773.
Annexe A : Liste des acronymes
- AESA
- Autorité européenne de sécurité des aliments
- AQA
- apport quotidien acceptable
- ANSI
- American National Standards Institute
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- CAG
- charbon actif en grains
- CAP
- charbon actif en poudre
- CCME
- Conseil canadien des ministres de l’Environnement
- CEP
- Comité fédéral provincial territorial sur l’eau potable
- CLHP
- chromatographie liquide à haute performance
- CMA
- concentration maximale admissible
- DGSPNI
- Direction générale de la santé des Premières nations et des Inuits
- DL50
- dose létale moyenne médiane
- FA
- facteur d’attribution
- FAO
- Organisation des Nations Unies pour l’alimentation et l’agriculture
- FI
- facteur d’incertitude
- Koe
- coefficient de partage n octanol–eau
- LDM
- limite de détection de la méthode
- LOAEL
- dose minimale avec effet nocif observé
- LQ
- limite de quantification
- MON
- matière organique naturelle
- NERL
- National Exposure Research Laboratory (États Unis)
- NHMRC
- National Health and Medical Research Council (Australie)
- No CAS
- numéro de registre du Chemical Abstracts Service
- NOAEL
- dose sans effet nocif observé
- NRMMC
- Natural Resources Management Ministerial Council (Australie)
- NSF
- NSF International
- OEHHA
- Office of Environmental Health Hazard Assessment
- OMS
- Organisation mondiale de la santé
- SDM
- seuil de déclaration de la méthode
- TOPPS
- sel de 1,2,3,4-tétrahydro-1-oxopyrido[1,2-a]-5-pyrazinium
- UE
- Union européenne
- U.S. EPA
- United States Environmental Protection Agency
- UV
- ultraviolet
- VBS
- valeur basée sur la santé
Annexe B : Impacts provinciaux et territoriaux prévus
Veuillez noter que ces renseignements ne sont pas disponibles dans les deux langues officielles parce que leur source n’est pas assujettie à la Loi sur les langues officielles.
Alberta
Aucun paragraphe n’a été soumis par la province.
British Columbia
No significant impact is expected by this change.
Manitoba
Manitoba has no data on diquat in drinking water. However, diquat is used in the province as a desiccant on seed and table potatoes. Although potatoes are typically grown on sandier soils, this is not expected to be a source of concern as diquat tends to be fixed in the soil and not leach. Therefore, the impact of the proposed lowering of the diquat in drinking water guideline to 0.05 mg/L is expected to be minimal in Manitoba.
New Brunswick
At this time, it is not anticipated that the lowering of the MAC for Diquat in drinking water (from .07 mg/L to 0.05 mg/L) will have any impacts for New Brunswick.
Newfoundland and Labrador
Newfoundland and Labrador has not conducted monitoring for diquat.
Of the 300 surface water sources in the province, 261 (87%) are protected under the Water Resources Act. Of the 179 groundwater sources in the province, 61 (34%) are protected under the Water Resources Act. This provides for an extensive source water protection program that reduces the risk of contamination for drinking water sources.
The existence of diquat within public water supplies is not common due to the 85% protection rate for drinking water supplies and the fact that herbicide spraying is not permitted in protected water supply areas.
The majority of Newfoundland and Labrador’s drinking water systems do not have any treatment other than disinfection as 64% of the systems service very small populations (fewer than 500 people). Due to this fact, the ability for the majority of communities to treat for diquat contamination would be limited. The cost would have to be assessed on a case by case basis but the risk of diquat would be low due to the 87% protection rate of public water supplies.
Action items: Consider monitoring for diquat in public drinking water supply areas that have communities within the protected water supply areas and agriculture areas which rely on groundwater public water supplies.
Northwest Territories
Aucun paragraphe n’a été soumis par le territoire.
Nova Scotia
Aucun paragraphe n’a été soumis par la province.
Nunavut
Aucun paragraphe n’a été soumis par le territoire.
Ontario
Ontario is supportive of the consultation document proposing to lower the Canadian Drinking Water Quality Guideline for diquat from 0.07 mg/L to 0.05 mg/L. Existing data indicates that the few detections of diquat in drinking water in Ontario were well below the proposed guideline value. This change will have no impact in Ontario.
Prince Edward Island
We do not expect any impact in consideration of lowering the diquat drinking water guideline from 0.07 to 0.05 mg/L within the Province of Prince Edward Island. As you will see from the exposure data, it is simply a compound we have not detected in drinking water samples, and given the detection / reporting limit for samples analyzed to date it would not appear likely that the lower value of 0.05 mg/L will change this.
Quebec
Au Québec, d’avril 2013 à mars 2018, 2319 analyses du diquat ont été réalisées dans le cadre de l’application du Règlement sur la qualité de l’eau potable, pour un total de 137 réseaux de distribution. Seuls les responsables de réseaux de distribution desservant plus de 5 000 personnes ont l’obligation de réaliser des analyses chaque trimestre pour vérifier le respect des normes pour les pesticides. Les responsables de réseaux, non visés par cette obligation, peuvent également juger pertinent de réaliser ces analyses.
Sur la période d’avril 2013 à mars 2018, aucune des analyses réalisées n’a présenté un résultat de diquat supérieur à la norme québécoise de 50 µg/L et la concentration maximale mesurée durant cette période est de 15 µg/L. Ainsi, aucune de ces analyses n’a dépassé la recommandation canadienne proposée de 50 µg/L pour le diquat dans l’eau potable. Par ailleurs, depuis 2012, dans le cadre de son Programme de surveillance de la qualité de l’eau potable, le Ministère réalise un projet de suivi des pesticides dans des installations de production d’eau potable alimentant 5 000 personnes et moins. Dans le cadre de ce projet, 157 analyses du diquat ont été réalisées pour 40 installations de production d’eau potable et ce pesticide n’a été détecté dans aucune de ces analyses. Sur la base de ces résultats, les impacts attendus de la révision de la recommandation proposée sont faibles.
Saskatchewan
The Water Security Agency (WSA) has reviewed the proposed guideline document for Diquat in drinking water and supports the proposed MAC of 0.05 mg/L (50 µg/L).
A review of the provincial water quality database revealed that there is no monitoring data for Diquat levels in raw or treated drinking water or surface water in Saskatchewan. There are no studies (bench, pilot or full-scale) available for removing diquat from drinking water, however, researchers opinioned that membrane and adsorption (activated carbon) systems represent the best potential treatment systems for diquat removal from water. Water treatment plants (WTPs) in Saskatchewan regulated by the WSA continue to adopt these and other forms of systems for treating and supplying drinking water to consumers. Given the limited use of Diquat in the province especially for weed control activities and the current/evolving water treatment processes in use in the province, WSA believes that the new MAC for diquat if eventually adopted as a drinking water standard in the province may not pose a compliance challenge. WSA may monitor or request waterworks permittees to monitor diquat levels in treated drinking water once the national guideline is adopted, particularly for systems reliant on surface water for the raw water supply.
Yukon
It is not anticipated that the draft guideline technical document for diquat in drinking water will have a significant impact on large public drinking water systems in the Yukon.