Recommandations pour la qualité de l'eau potable au Canada : Document technique pour consultation publique - malathion

Télécharger le format de rechange
(Format PDF, 1.5 Mo, 54 pages)
Organisation : Santé Canada
Date publiée : 2021-03-26
Document technique pour consultation publique
Fin de la période de consultation : 26 mai 2021
Objectif de la consultation
Le présent document technique décrit l'évaluation de l'information existante sur le malathion dans le but de mettre à jour la recommandation actuelle relative à la présence de malathion dans l'eau potable. La présente consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l'élaborer et les répercussions possibles de sa mise en œuvre.
Le document technique existant sur le malathion, élaboré en 1986, préconisait une concentration maximale acceptable (CMA) de 0,19 mg/L (190 µg/L) basée sur l'inhibition de la cholinestérase chez l'humain. Le document a été révisé pour tenir compte de la réévaluation la plus récente du malathion par l'Agence de réglementation de la lutte antiparasitaire et adopter une concentration sans effet nocif observé plus élevée. Compte tenu de la néphrotoxicité observée chez les rats, il est proposé dans le présent document de fixer à 0,29 mg/L (290 µg/L) la CMA de malathion dans l'eau potable.
Ce document est mis à la disposition du public pour une période de consultation de 60 jours. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés à Santé Canada par courrier électronique (HC.water-eau.SC@canada.ca).
Les commentaires doivent nous parvenir avant le 26 mai 2021. Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres du Comité fédéral-provincial-territorial sur l'eau potable (CEP). Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que le présent document technique sera révisé après l'analyse des commentaires reçus et qu'une recommandation pour l'eau potable sera établie, au besoin. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Valeur recommandée proposée
Une concentration maximale acceptable (CMA) de 0,29 mg/L (290 μg/L) est proposée pour le malathion dans l'eau potable.
Sommaire
Le présent document technique, qui a été préparé en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, s'appuie sur les évaluations du malathion menées par l'Agence de réglementation de la lutte antiparasitaire de Santé Canada et sur des documents connexes.
Exposition
Le malathion est un insecticide et un acaricide homologué utilisé à des endroits très divers, dans des zones agricoles et non agricoles. En 2018 (l'année la plus récente pour laquelle il existe des données), plus de 25 000 kg de malathion ont été vendus au Canada (Santé Canada, 2020a). Le malathion contenu dans les eaux de ruissellement peut être relargué dans l'eau de surface ou les sols depuis le lieu d'application.
Le malathion n'est généralement pas présent dans les sources d'eau potable au Canada. De faibles concentrations de malathion ont été décelées dans plusieurs provinces canadiennes. Les concentrations maximales mesurées sont bien inférieures à la CMA proposée. Le malathion est rarement détecté dans les aliments.
Effets sur la santé
Des études réalisées chez les animaux montrent que le rein est l'organe cible le plus sensible aux effets toxiques du malathion. Aucune étude n'a été menée sur les effets du malathion sur le rein chez l'humain. La CMA proposée de 0,29 mg/L (290 µg/L) est fondée sur une augmentation de la gravité des effets chroniques sur les reins observée dans le cadre d'une étude de deux ans sur les rats.
Considérations liées à l'analyse et au traitement
L'établissement de recommandations pour la qualité de l'eau potable tient compte de la capacité de mesurer le contaminant et de l'enlever des sources d'approvisionnement en eau potable. Il existe plusieurs méthodes d'analyse permettant de mesurer le malathion dans l'eau à des concentrations bien inférieures à la CMA proposée.
À l'échelle municipale, plusieurs techniques de traitement permettent de réduire efficacement les concentrations de malathion dans les sources d'approvisionnement en eau potable. L'adsorption sur charbon actif, la filtration sur membrane, l'oxydation et les procédés d'oxydation avancée peuvent tous être utilisés pour le traitement du malathion dans l'eau potable. Ce sont les procédés d'oxydation avancée qui permettent d'atteindre le taux d'enlèvement le plus élevé, l'oxydation seule se révélant moins efficace. Lorsqu'ils utilisent des techniques de dégradation comme l'oxydation ou les procédés d'oxydation avancée, les responsables de services de distribution d'eau potable devraient être conscients de la formation possible de sous-produits de dégradation (par example, le malaoxon). Il est recommandé de réaliser des études pilotes ou des essais au banc avant une mise en œuvre à grande échelle.
Dans les cas où l'on souhaite enlever le malathion à l'échelle des ménages ou des petits réseaux, par exemple lorsque l'approvisionnement en eau potable provient d'un puits privé, un dispositif de traitement résidentiel peut être employé. Même s'il n'existe pas encore de dispositif de traitement certifié permettant d'enlever le malathion de l'eau potable, des techniques comme l'adsorption sur charbon actif et l'osmose inverse devraient être efficaces. Lorsqu'on utilise un tel dispositif de traitement, il est important d'envoyer des échantillons de l'eau qui entre dans le dispositif et qui en sort à un laboratoire accrédité aux fins d'analyse afin de vérifier que le malathion a été adéquatement éliminé.
Application de la recommandation
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable dans le secteur de compétence concerné.
La recommandation proposée pour le malathion vise à offrir une protection contre les effets sur la santé associés à une exposition au malathion par l'eau potable toute la vie durant. Tout dépassement de la CMA proposée devrait faire l'objet d'une analyse, suivie des mesures correctives qui s'imposent, le cas échéant. Lorsqu'il y a un dépassement dans une source d'approvisionnement en l'absence de système de traitement, une surveillance supplémentaire devrait être exercée afin de confirmer ce dépassement. S'il est confirmé que les concentrations de malathion dans l'eau non traitée sont supérieures à la CMA proposée, il faudrait mener une étude afin de déterminer la meilleure façon de réduire l'exposition au malathion. On pourrait ainsi utiliser une autre source d'approvisionnement ou mettre en place une installation de traitement. Lorsqu'un système de traitement est déjà installé et qu'un dépassement est observé, il faudrait procéder à un examen afin de vérifier l'efficacité du traitement et de déterminer si des ajustements sont nécessaires pour ramener les concentrations dans l'eau traitée sous la CMA proposée.
Table des matières
- 1.0 Considérations relatives à l'exposition
- 2.0 Considérations relatives à la santé
- 3.0 Calcul de la valeur basée sur la santé
- 4.0 Considérations liées à l'analyse et au traitement
- 5.0 Stratégie de gestion
- 6.0 Considérations internationales
- 7.0 Justification
- 8.0 Références
- Annexe A : Liste des abbréviations
- Annexe B : Données sur la qualité de l'eau au Canada
1.0 Considérations relatives à l'exposition
1.1 Sources et utilisations
Le malathion, ou dithiophosphate de O,O-diméthyle et de S-(1,2-dicarboéthoxyéthyle), est un insecticide et un acaricide organophosphoré non systémique à large spectre utilisé pour lutter contre une vaste gamme d'insectes et d'arachnides nuisibles. Il agit en inhibant l'acétylcholinestérase (AChE), ce qui perturbe le fonctionnement du système nerveux. Au Canada, le malathion est utilisé à divers endroits, dans des zones agricoles et non agricoles, comme l'habitat humain et les aires de loisirs, ainsi que sur les plantes ornementales extérieures (Santé Canada, 2012). En 2018 (l'année la plus récente pour laquelle il existe des données), plus de 25 000 kg de malathion ont été vendus au Canada (Santé Canada, 2020a).
Le malathion contenu dans les eaux de ruissellement peut être relargué dans les eaux de surface ou les sols depuis le lieu d'application (ATSDR, 2003; US EPA, 2009; Santé Canada, 2012). Dans les eaux naturelles, les sols et les sédiments, la décomposition du malathion se fait principalement par dégradation microbienne et hydrolyse (Laveglia et Dahm, 1977; ATSDR, 2003; Santé Canada, 2010; Singh et coll., 2014). Le malathion est rapidement hydrolysé dans des conditions neutres à alcalines, mais il est relativement stable dans des conditions acides et à de basses températures. Les principaux produits de transformation (tels qu'identifiés dans les études de biotransformation) sont l'acide monocarboxylique (MCA), l'acide dicarboxylique (DCA), le diméthyl thiophosphate et le diméthyl dithiophosphate, qui ne devraient pas persister dans l'environnement (Santé Canada, 2010). La photolyse l'est pas une voie importante de décomposition du malathion dans l'eau ou le sol, avec des demi-vies variant de 0,67 à 42 jours dans de l'eau naturelle et de l'eau distillée et pouvant atteindre 173 jours dans un sol limoneux-sableux (ATSDR, 2003; EFSA, 2009; US EPA, 2009; Santé Canada, 2010). Cependant, dans certaines eaux naturelles contenant des agents photosensibilisants, la photolyse peut contribuer à la dissipation du malathion de la couche d'eau dans la zone photique (couche supérieure pénétrée par la lumière du soleil) (Santé Canada, 2010).
Dans les milieux aquatiques, le malathion est non persistant à légèrement persistant dans des conditions aérobies (demi-vie de 0,3 à 19 jours) et non persistant en milieu anaérobie (demi‑vie de 2,5 jours dans un sol inondé), la dissipation étant généralement plus la plus rapide dans des conditions alcalines, dont il a été démontré qu'elles favorisent l'hydrolyse (Santé Canada, 2010).
Étant donné que le malathion est très soluble dans l'eau (voir le tableau 1) et qu'il n'est pas fortement adsorbé sur les particules de sol, il est mobile dans la plupart des types de sols. Il est donc susceptible de contaminer les eaux souterraines, en particulier dans les secteurs où les sols sont perméables (par example, sol sablonneux) et où la nappe phréatique est peu profonde (Gervais et coll., 2009; Santé Canada, 2012). Il est toutefois peu probable que le malathion soit lessivé dans les eaux souterraines, car il est rapidement dégradé dans le sol par métabolisme microbien (demi-vie de 0,2 à 2 jours) et par hydrolyse dans des conditions neutres à alcalines (demi-vies de 6,2, de 1,5 et de 0,5 jours à des pH de 7, de 8 et de 9, respectivement) (ATSDR, 2003; Santé Canada, 2010). La dégradation du malathion dans le sol est plus rapide lorsque l'humidité, le pH, l'activité microbienne, la teneur en azote et la teneur en carbone sont élevés (Laveglia et Dahm, 1977; ATSDR, 2003; EFSA, 2009; US EPA, 2009; Santé Canada, 2010; Kumar et coll., 2018).
Compte tenu de ses propriétés physiques (pression de vapeur et constante de la loi de Henry), le malathion est peu susceptible de se volatiliser de façon appréciable à partir d'eaux de surface ou de sols humides ou de subir un transport atmosphérique sur de longues distances (Santé Canada, 2010). Lorsque le malathion est présent dans l'air, il peut être relargué dans les eaux de surface ou les sols par la pluie ou l'eau du brouillard ou se dégrader par oxydation photochimique (ATSDR, 2003; OMS, 2004).
Le malaoxon, le produit de transformation de l'oxydation du malathion qui est responsable de certains des effets toxiques du malathion, peut se former dans certaines conditions environnementales, mais ne devrait pas être persistant (Gervais et coll., 2009; Santé Canada, 2010). Deux études de surveillance portant sur la formation de malaoxon dans l'eau, le sable et les sols ont mesuré une conversion maximale de 10 % du malathion en malaoxon (Santé Canada, 2012). Comme le malathion, le malaoxon est rapidement détoxifié par hydrolyse dans des conditions neutres à alcalines et est peu susceptible d'être lessivé dans les eaux souterraines (ATSDR, 2003; Santé Canada, 2010).
1.2 Identité de la substance
Le malathion (C10H19O6PS2) est un liquide incolore ou ambre qui appartient à la classe chimique des organophosphates (US EPA, 2009; Santé Canada, 2010). Les préparations de malathion peuvent contenir une certaine quantité d'impuretés, à de très faibles concentrations, notamment le malaoxon et l'isomalathion. Dans le passé, en raison de procédés de fabrication et d'entreposage inadéquats, le produit pouvait contenir de l'isomalathion, un métabolite toxique qui potentialise la toxicité du malathion; on a toutefois adopté depuis des normes réglementaires afin de limiter sa présence et sa formation (Buratti et Testai, 2005; US EPA, 2009; Jensen et Whatling, 2010; Santé Canada, 2010, 2012).
| Propriété | Malathion | Interprétation |
|---|---|---|
| Numéro de registre CAS | 121-75-5 | Sans objet |
| Poids moléculaire (g/mol) | 330,4 | Sans objet |
| Hydrosolubilité (mg/L) | 145 | Très soluble dans l'eau |
| Pression de vapeur (volatilité) (mm Hg) | 3.97x10-5 at 30°CNote de bas de tableau 1 - a 1.78x10-4 at 25°CNote de bas de tableau 1 - a 1.2x10-4 à 8x10-6 à 20°CNote de bas de tableau 1 - a |
Volatilité très variable, mais généralement légère à faible et faible potentiel de contamination de l'airNote de bas de tableau 1 - a |
| Constante de la loi de Henry | 1,2 x 10-7 | Faible potentiel de volatilisation |
| coefficient de partition octanol-eau (log Koe) | 2,75-2,94 | Faible potentiel de bioaccumulation |
|
À moins d'indication contraire, l'information est tirée de Santé Canada, 2010. |
||
1.3 Exposition
La population générale canadienne peut être exposée au malathion principalement par les aliments et l'eau potable (Santé Canada, 2010, 2012), mais l'exposition au malathion est rare.
Les données de surveillance de l'eau provenant des provinces et des territoires (sources d'approvisionnement municipales et non municipales), de l'Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada et d'Environnement et Changement climatique Canada (Environnement Canada, 2011) (annexe C) étaient disponibles pour le malathion.
Les données fournies par les provinces et les territoires indiquent que les concentrations de malathion se situent sous le seuil de déclaration de la méthode (SDM) ou la limite de détection de la méthode (LDM) dans la plupart des échantillons prélevés dans diverses sources d'eau au Canada, y compris de l'eau de surface et de l'eau souterraine ainsi que de l'eau traitée et de l'eau distribuée (British Columbia Ministry of Health, 2019; Services aux Autochtones Canada, 2019; Développement durable Manitoba, 2019; Ministère de l'Environnement et de la Lutte contre les changements climatiques, 2019; Ministère de l'Environnement de la Nouvelle-Écosse, 2019; Saskatchewan Water Security Agency, 2019; Ministère de l'Environnement, de la Protection de la nature et des Parcs, 2020). Le tableau 2 résume les données de surveillance pour tous les secteurs de compétences. La concentration maximale mesurée était de 5 μg/L pour l'eau de surface traitée en Ontario, valeur qui est bien inférieure à la concentration maximale acceptable (CMA) proposée. Aucune donnée de surveillance n'était disponible pour le Nouveau-Brunswick, Terre-Neuve-et-Labrador, l'Île-du-Prince-Édouard ou le Yukon (Ministère de l'Environnement et des Gouvernements locaux du Nouveau-Brunswick, 2019; Newfoundland and Labrador Municipal Affairs and Environment, 2019; ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard, 2019; Services d'hygiène du milieu du Yukon, 2019).
| Secteur de compétence (LDM µg/L) |
Période de surveillance | Source municipale/non municipale | Type d'eau (Source municipale : eau souterraine/eau de surface – brute, traitée, distribuée) |
Nombre de détections/échantillons | Concentration maximale (µg/L) |
|---|---|---|---|---|---|
| Colombie-Britannique (2) |
2013–2018 | Source municipale | Eau de surface – brute | 0/18 | - |
| DGSPNINote de bas de tableau 2 - a Région de l'Ontario (0,1-5) | 2014–2018 | Réseaux publics d'approvisionnement en eau | Eau souterraine – brute | 0/13 | - |
| Eau souterraine – traitée | 0/190 | - | |||
| Eau souterraine – distribuée | 0/16 | - | |||
| Eau de surface – brute | 0/33 | - | |||
| Eau de surface – traitée | 0/308 | - | |||
| Eau de surface – distribuée | 0/23 | - | |||
| Réseaux semi-publics d'approvisionnement en eau | Eau souterraine – brute | 0/3 | - | ||
| Eau souterraine – traitée | 0/16 | - | |||
| Eau souterraine – distribuée | 0/68 | - | |||
| Eau de surface – brute | 0/1 | - | |||
| Eau de surface – traitée | 0/9 | - | |||
| Eau de surface – distribuée | 0/2 | - | |||
| Réseaux privés d'approvisionnement en eau | Eau souterraine – traitée | 0/3 | - | ||
| Eau souterraine – distribuée | 0/50 | - | |||
| Eau de surface – traitée | 0/5 | - | |||
| DGSPNINote de bas de tableau 2 - a Région atlantique (4-5) | 2014–2018 | Réseaux publics d'approvisionnement en eau | Eau souterraine – traitée | 0/4 | - |
| Eau souterraine – distribuée | 0/4 | - | |||
| Eau de surface – traitée | 0/1 | - | |||
| DGSPNINote de bas de tableau 2 - a Québec (0,01) | 2014–2018 | Réseau d'eau potable | Non précisé | 0/4 | - |
| Manitoba (0,1-10) |
2012–2018 | Eau ambiante | Eau de surface – ambiante | 0/431 | - |
| Nouvelle-Écosse (1-10) |
2007–2018 | Source municipale | Eau souterraine – brute | 0/72 | - |
| Eau souterraine – traitée | 0/35 | - | |||
| Eau de surface – brute | 0/35 | - | |||
| Eau de surface – traitée | 0/40 | - | |||
| Distribuée | 0/1 | - | |||
| Ontario (0,0001-9) |
2011–2020 | Source municipale | Eau souterraine – traitée | 2/3955 | 0,1 |
| Eau de surface – traitée | 2/3796 | 5 | |||
| Distribuée | 0/60 | - | |||
| Québec (0,1-15) |
2013–2018 | Source municipale | Eau souterraine – distribuée | 0/290 | - |
| Eau de surface – distribuée | 0/1032 | - | |||
| Source municipale (projets spéciaux) Projet sur la pomme de terreNote de bas de tableau 2 - b [2017-2018] | Eau souterraine – brute | 0/46 | - | ||
| Eau souterraine – traitée | 0/17 | - | |||
| Eau souterraine – distribuée | 0/5 | - | |||
| Projet sur les petits réseauxNote de bas de tableau 2 - c [2012-2018] |
Eau souterraine – brute (municipal) | 0/82 | - | ||
| Eau souterraine – brute (non municipale) | 0/132 | - | |||
| Saskatchewan (0,1-10) | 2014–2017 | Source municipale | Eau souterraine – brute | 0/84 | - |
| Eau de surface/eau souterraine – distribuée | 0/32 | - | |||
| Eau de surface/eau souterraine – traitée | 0/4 | - | |||
Dans le cadre de son évaluation, l'ARLA (2010) a résumé les données de surveillance du malathion dans l'eau potable au Canada qui avaient été recueillies jusqu'en 2005. Du malathion a été décelé dans 10 échantillons (n = 4 274) provenant de sources municipales d'eau potable canadiennes, avec une concentration maximale de 0,08 µg/L mesurée au Québec (1991-1993), et dans plus de 79 échantillons (n = plus de 6 716) d'eau ambiante canadienne pouvant servir de source d'eau potable, avec une concentration maximale de 1,54 µg/L, mesurée en Ontario (2003). La concentration maximale de malathion dans les sources d'eau peu susceptibles d'être utilisées comme sources d'eau potable était de 2,1 µg/L (11 échantillons avec détections; n = 150).
Selon les données canadiennes de surveillance de l'eau, tirées de la documentation publiée, le malathion n'est pas fréquemment décelé dans les sources d'eau potable. Lors d'un échantillonnage effectué dans des zones de culture du maïs et du soja au Québec de 2015 à 2017, on a mesuré une fréquence moyenne de détection de 2 % et une concentration maximale de malathion de 5,5 µg/L dans les rivières Chibouet, Saint-Régis, des Hurons et Saint-Zéphirin (limite de détection (LD) = 0,02 µg/L) (Giroux, 2019). La fréquence maximale de détection et la concentration maximale de malathion pour quatre cours d'eau situés dans des zones de cultures maraîchères et de vergers au Québec s'établissaient à 33,3 % et à 2,7 µg/L, respectivement, pour la période 2013 à 2014 (LD = 0,02 µg/L) (Giroux, 2017). Aucune trace de malathion n'a été décelée au Québec lors de l'échantillonnage de puits individuels situés à proximité de cultures de maïs, de soja, de légumes et de petits fruits et de vignes et de vergers (LD = 0,02 µg/L) (Giroux, 2016, 2019).
En Colombie-Britannique, aucun malathion n'a été détecté dans le cadre d'une étude (2003-2005) de l'eau de surface et de l'eau souterraine dans la région de la vallée du Bas-Fraser (seuil de déclaration = 2,22 ng/L; n = 40 échantillons) (Woudneh et coll., 2009a, 2009b).
Selon les données de surveillance et d'essai sur le terrain, la quantité de résidus de malathion dans les aliments devrait être faible et ne devrait pas présenter de risque alimentaire pour les Canadiens (Santé Canada, 2010, 2012). Au Canada, la concentration résiduelle maximale de malathion varie de 0,5 à 8 ppm pour divers produits alimentaires (par example, fruits, légumes, grains, fèves et légumineuses) (Santé Canada, 2020b). L'Agence canadienne d'inspection des aliments (ACIA) a échantillonné et analysé des produits alimentaires canadiens et importés (fruits et légumes frais, viande, noix et graines) entre le 1er avril 2015 et le 31 mars 2016. Des résidus de malathion ont été décelés dans 43 échantillons (n = 998) à une concentration maximale de 0,64000 ppm (ACIA, 2019b). Dans les aliments et les préparations pour nourrissons surveillés par l'ACIA, deux échantillons (n = 221) étaient contaminés au malathion, à des concentrations inférieures à la limite résiduelle maximale de 2 ppm (0,0195 ppm et de 0,322 ppm) (ACIA, 2019a).
Compte tenu des propriétés physiques du malathion, l'exposition atmosphérique au pesticide ne devrait pas être préoccupante pour la population canadienne, les données de surveillance de l'air indiquant que le malathion n'est présent qu'à de faibles concentrations dans les secteurs où il est utilisé (Santé Canada, 2010).
2.0 Considérations relatives à la santé
Tous les pesticides, y compris le malathion, sont réglementés par l'ARLA. L'ARLA a réalisé des évaluations exhaustives et des examens périodiques des pesticides, ce qui comprend l'étude des informations non publiées et de nature exclusive, de même que celle d'examens réalisés à l'étranger par d'autres organismes de réglementation comme l'Environmental Protection Agency des États-Unis (US EPA). Ainsi, la présente évaluation des risques pour la santé repose principalement sur les évaluations menées par l'ARLA (Santé Canada, 2003, 2010) et sur des documents d'appui. Les évaluations et documents pertinents disponibles depuis l'évaluation de l'ARLA ont également été pris en compte.
2.1 Cinétique
Absorption : Après une exposition par voie orale, le malathion est facilement et rapidement absorbé par le tractus gastro-intestinal (surtout dans l'intestin) chez les mammifères, dont l'humain (selon les données sur l'excrétion), les pics de concentration plasmatique ayant été atteints 15 minutes après l'administration de la dose chez les rats (Reddy et coll., 1989; Aston, 2000; Gillies et Dickson, 2000; Jellinek, Schwartz & Connolly Inc., 2000; ATSDR, 2003; EFSA, 2009; Santé Canada, 2010; CIRC, 2017; OMS, 2017a). Le malathion est facilement absorbé par voie cutanée, mais on s'attend à ce que cette absorption soit plus lente que par voie orale et qu'elle varie d'une espèce à l'autre, les lapins affichant une capacité considérablement plus élevée d'absorption par voie cutanée (par example, 64,6 % pour les lapins, 15,5 % pour les porcs in vitro, 6 % pour les rats et 0,2 à 8,2 % pour les humains) (ATSDR, 2003; Gervais et coll., 2009; Santé Canada, 2010; OMS, 2017a).
Distribution : Le malathion est rapidement distribué dans l'organisme, sans aucun signe de bioaccumulation (Santé Canada, 2010). Chez des volontaires humains, aucune trace de malathion ou de malaoxon n'a été détectée dans le plasma dans les 60 minutes à 12 heures suivant l'administration d'une seule dose par voie orale (LD = 100 à 102 et 99,8 à 100 ng/ml respectivement) (Aston, 2000; Gillies et Dickson, 2000; Jellinek, Schwartz & Connolly Inc., 2000). Chez les rats auxquels on avait administré par gavage du 14C-malathion, moins de 1,5 % de la dose administrée a été décelé dans les tissus après 72 heures, les plus fortes concentrations ayant été mesurées dans le foie, suivi de la peau, de la graisse, des os et du tractus gastro-intestinal (Reddy et coll., 1989).
Métabolisme : Après une exposition par voie orale chez les rats et les humains, le malathion est entièrement métabolisé, et aucune trace du composé initial n'est présente dans l'urine (Reddy, 1989; ATSDR, 2003; Santé Canada, 2010; OMS, 2017a). La principale voie de métabolisation du malathion et du malaoxon est l'hydrolyse par les carboxylestérases présents dans les tissus, le foie ou le plasma, qui entraîne la production des métabolites MCA et DCA (plus de 80 % chez les rats) (Santé Canada, 2010). Contrairement aux rats, les humains ne présentent pas de concentrations détectables de carboxylestérases dans le sérum, le plasma ou les érythrocytes, mais l'activité des carboxylestérases hépatiques pourrait être plus élevée (ATSDR, 2003; CIRC, 2017; OMS, 2017a). Le malaoxon, le métabolite actif du malathion, peut, dans une moindre mesure (4 à 6 % chez les rats) être formé au cours de la désulfuration oxydative du malathion (voie mineure) par des enzymes microsomales (ATSDR, 2003; Santé Canada, 2010). Une fois formé, le malaoxon est soit excrété dans l'urine, rapidement hydrolysé en malathion MCA et DCA, ou métabolisé par les phosphatases et les carboxylestérases. Chez les rats, aucune différence liée à la dose ou au sexe n'a été observée dans la métabolisation du malathion (Santé Canada, 2010).
Excrétion : Chez les mammifères, dont les humains, le malathion ingéré est rapidement excrété, principalement dans l'urine, et dans une moindre mesure, dans les matières fécales (Reddy et coll., 1989; Aston, 2000; Gillies et Dickson, 2000; Jellinek, Schwartz & Connolly Inc., 2000; ATSDR, 2003; Santé Canada, 2010; OMS, 2017a). Chez des volontaires ayant reçu une dose unique de malathion, environ 90 % ont été excrétés dans l'urine dans les 12 heures, la totalité de la dose ayant été excrétée au bout de 24 à 48 heures (Aston, 2000; Gillies et Dickson, 2000; Jellinek, Schwartz & Connolly Inc., 2000; OMS, 2017a). L'acide monocarboxylique (MCA) de malathion était le métabolite le plus courant, suivi du phosphorothioate de O,O-diméthyle, de l'acide dicarboxylique de malathion (DCA) et du dithiophosphate de diméthyle (US EPA, 2016; OMS, 2017a). Chez le rat, 76 à 88 % du malathion étaient éliminés dans l'urine dans les 72 heures suivant l'administration de la dose (principalement sous forme de MCA et de DCA) et 6 à 14 %, dans les matières fécales. Le profil d'excrétion était comparable pour une faible dose unique ou répétée ou une forte dose unique chez les rats, aucune différence n'étant observée entre les sexes (Santé Canada, 2010).
2.2 Effets sur la santé
La base de données toxicologiques sur le malathion est pertinente et décrit plusieurs effets et divers types d'expositions (voir ATSDR, 2003; CIRC, 2017; OMS, 2017a pour des examens plus détaillés). Les signes de toxicité aiguë consécutifs à une exposition au malathion sont compatibles avec une inhibition de la cholinestérase (ChE) (tremblements, convulsions, salivation et dyspnée) et ont été observés chez diverses espèces et pour toutes les voies d'exposition. Les jeunes animaux affichaient une plus grande sensibilité aux effets du malathion sur la cholinestérase érythrocytaire (EChE) que les adultes. Selon les études à doses répétées de malathion, l'aggravation de la néphropathie progressive chronique chez les rats est considérée comme l'effet nocif le plus sensible. Le malathion ne s'est pas révélé génotoxique ou tératogénique dans les études réalisées sur les animaux et ne devrait pas présenter de risque cancérigène pour les humains (Santé Canada, 2010).
2.3 Effets chez l'humain
Les évaluations de l'ARLA ou les documents d'appui (US EPA, 2009; Santé Canada, 2010, 2012) n'ont pas fait mention d'effets chez l'humain. Les études provenaient de publications concernant des effets cancérogènes et non cancérogènes.
Agricultural Health Study (étude sur la santé des agriculteurs) : L'Agricultural Health Study (AHS) est une vaste étude prospective en cours basée sur un questionnaire (plus de 89 000 participants) qui a examiné les effets cancérogènes et non cancérogènes auprès d'une cohorte de préposés à l'application de pesticides homologués et leurs conjoints en Iowa et en Caroline du Nord. L'étude a débuté en 1993 par la collecte de renseignements de base sur les pratiques agricoles (dont l'utilisation de pesticides), le mode de vie et la santé. Des entrevues et de questionnaires de suivi (y compris des renseignements sur le régime alimentaire) et des prélèvements d'ADN ont été effectués périodiquement. Des registres du cancer ont servi à évaluer l'incidence de cancer. Dans l'ensemble, les points forts de l'AHS sont l'envergure de l'étude, l'inclusion d'un grand nombre de femmes, la collecte de renseignements de base, de renseignements sur la santé et le mode de vie et les facteurs génétiques, l'utilisation de registres du cancer et les nombreux pesticides et maladies évalués. Ses limites sont notamment l'évaluation indirecte de l'exposition (au moyen d'un questionnaire), l'absence de mesures d'affinement de l'exposition (aucune analyse du temps d'induction ou du temps d'arrêt) et un biais de sélection lors de la prise en compte de facteurs de confusion multiples en raison de l'exclusion de nombreux sujets pour lesquels il manque des données (Sathiakumar et coll., 2011).
Effets cancérogènes : Plusieurs chercheurs ont publié des études reposant sur leur analyse des données de l'étude de cohorte AHS. Aucune association n'a été observée entre l'exposition au malathion et l'incidence de cancer colorectal (Lee et coll., 2007), de cancer du pancréas (Andreotti et coll., 2009) et de cancer infantile (Flower et coll. 2004). Lerro et coll. (2015) ont signalé une hausse importante de l'incidence de cancer de la thyroïde chez les participantes, mais ont aussi précisé qu'ils n'avaient pas réussi à contrôler l'exposition à de fortes concentrations de nitrates dans les aliments et l'eau potable, facteur qui pourrait jouer un rôle dans le développement du cancer de la thyroïde dans les régions agricoles. Bien qu'Engel et coll. (2005) n'aient pas observé un risque accru de cancer du sein chez les participantes qui avaient elles-mêmes utilisé du malathion, une association a été établie chez les femmes dont le conjoint avait utilisé le pesticide. Les écarts observés dans les résultats peuvent être attribuables à certaines limitations, comme l'exposition auto-déclarée et l'exposition potentielle à plusieurs pesticides (OMS, 2017a). Dans des analyses de cas témoins effectuées par Mills et Yang (2005, 2019), un risque élevé de cancer du sein a été observé chez les travailleurs agricoles hispaniques qui avaient utilisé le malathion. L'estimation de l'exposition au pesticide à partir des expositions écologiques plutôt qu'à partir des expositions individuelles peut avoir donné lieu à des erreurs de classification (CIRC, 2017; OMS, 2017b).
À l'examen des données de l'étude AHS recueillies entre 1993 et 2007, Koutros et coll. (2013) ont remarqué une augmentation importante du risque de cancer agressif de la prostate dans la catégorie d'exposition la plus élevée au malathion, mais n'ont établi aucune association entre l'ensemble des cancers de la prostate et l'exposition au malathion. Dans une étude de cas témoins réalisée par Mills et Yang (2003), rien n'indiquait une association entre l'ensemble des cancers de la prostate et l'exposition au malathion chez les travailleurs agricoles californiens. Cependant, les données peuvent avoir été mal répertoriées, car la classification de l'exposition était fondée sur des expositions écologiques plutôt que sur les expositions individuelles (CIRC, 2017; OMS, 2017b). En revanche, Band et coll. (2011) ont fait état d'une association entre l'utilisation de malathion et l'ensemble des cancers de la prostate chez les agriculteurs britanno-colombiens et noté des corrélations dose-réponse significatives. Les expositions au pesticide ont toutefois été évaluées à l'aide d'une « matrice emplois-expositions » susceptible d'introduire des erreurs de classification; par ailleurs, les données n'ont pas été ajustées pour tenir compte d'une exposition à plusieurs pesticides (Band et coll., 2011; CIRC, 2017; OMS, 2017b).
Selon sur les données sur la cohorte de l'étude AHS, aucune augmentation du risque de lymphome non hodgkinien (LNH) n'a été observée chez les préposés à l'application de pesticides utilisant du malathion, tandis qu'une association a été établie chez leurs conjointes (Alavanja et coll., 2014; Lerro et coll., 2015). À l'examen des données d'études menées sur des cohortes d'agriculteurs de France et de Norvège et de l'étude AHS réalisée aux États-Unis, Leon et coll. (2019) ont aussi constaté l'absence de association entre l'utilisation de malathion et le risque de LNH; l'utilisation de « matrices cultures-expositions » pour estimer les expositions aurait toutefois pu introduire une erreur de classification. En revanche, une étude de cas témoins basée sur la population, à l'échelle du Canada, a montré une association significative entre le LNH et « l'utilisation courante », la « non-utilisation » de malathion et le nombre annuel de jours d'utilisation chez les hommes occupant divers emplois (McDuffie et coll., 2001). Une association semblable ressort des données regroupées de trois études de cas témoins menées dans le Midwest américain; cependant, cette association était atténuée ou n'était plus significative lorsque les répondants substituts ont été retirés des analyses et que des ajustements plus robustes ont été apportés pour tenir compte de l'utilisation d'autres pesticides (Waddell et coll., 2001; De Roos 2003: OMS, 2017b). Koutros et coll. (2019) ont évalué plus à fond le lien potentiel entre l'exposition au malathion et le LNH à partir des données combinées de l'étude pancanadienne et des trois études réalisées dans le Midwest américain. On a observé un risque sensiblement plus élevé de LNH chez les personnes qui utilisaient « toujours » du malathion que chez celles qui n'utilisaient « jamais » le produit, après ajustement de l'exposition pour tenir compte de l'emploi d'autres pesticides, ainsi qu'une association entre l'utilisation de malathion et certains sous-types de LNH. Des analyses des données regroupées ont aussi montré une forte relation exposition-réponse en fonction du nombre d'années d'utilisation du malathion (Koutros, et coll., 2019). Bien que l'ensemble de données plus étendu examiné par Koutros et coll. (2019) ait permis une évaluation plus efficace, les limites attribuables aux études de cas témoins individuelles (par example, biais de rappel, utilisation de répondants substituts) pourraient avoir engendré un risque d'erreur de classification de l'exposition.
Dans l'ensemble, la base de données épidémiologiques ne fournit que des indications incertaines de associations entre l'exposition au malathion et le cancer, les études ayant été réalisées sur un nombre limité de populations. Certaines limites (par example, nombre limité de cas, contrôle défaillant des facteurs de confusion, utilisation de répondants substituts, biais de rappel et risque d'erreur de classification de l'exposition) pourraient expliquer la divergence des résultats des différentes études et écartent la possibilité de tirer des conclusions définitives sur la relation entre l'exposition au malathion et le risque de cancer.
Effets non cancérogènes : Lors de l'évaluation des effets non cancérogènes à partir des données sur la cohorte de l'étude AHS, les chercheurs ont rapporté des effets respiratoires, notamment une respiration sifflante, des symptômes de bronchite chronique (en présence ou en l'absence de maladies pulmonaires obstructives chroniques) et l'apparition à l'âge adulte d'asthme allergique chez les femmes et d'asthme non allergique chez les hommes à la suite d'une exposition au malathion (Hoppin et coll., 2002, 2006, 2008, 2009; Rinsky et coll., 2019). Kamel et coll. (2006) n'ont pas établi d'association étroite entre la maladie de Parkinson et l'exposition au malathion dans l'étude AHS. Dans le cadre d'études visant à évaluer les associations entre l'utilisation « courante » de malathion et l'incidence de diabète, aucune association n'a été observée chez les agriculteurs ou leurs conjointes (Montgomery et coll., 2008; Starling et coll., 2014). Goldner et coll. (2010, 2013) n'ont remarqué aucune association significative entre l'utilisation « courante » de malathion et l'hypothyroïdie chez les préposés à l'application ou leurs conjointes dans les données de l'étude AHS recueillies jusqu'en 2010. Cependant, dans des études de suivi réalisées par Shrestha et coll. (2018, 2019) à partir des données de l'AHS recueillies jusqu'en 2016, on a signalé un risque accru d'incidence d'hypothyroïdie et un risque réduit d'hyperthyroïdie après exposition au malathion.
Dans une étude par ingestion contrôlée, on a administré à des groupes de cinq volontaires mâles des capsules contenant du malathion (pureté non précisée) à des doses d'environ 0,11 mg/kg p.c. par jour pendant 32 jours et de 0,23 mg/kg p.c. par jour pendant 47 jours, ou de 0,34 mg/kg p.c. par jour pendant 56 jours (Moeller et Rider, 1962; ATSDR, 2003). L'administration de 0,11 mg/kg p.c. par jour de malathion pendant 32 jours ou de 0,23 mg/kg p.c. par jour pendant 47 jours n'a engendré aucune baisse significative de l'activité de la cholinestérase plasmatique et érythrocytaire ni changement dans la numération globulaire ou les analyses d'urine. Chez les volontaires ayant reçu 0,34 mg/kg p.c. de malathion par jour pendant 56 jours, on a observé une baisse maximale de 25 % de l'activité de la cholinestérase plasmatique (PChE) et de l' EChE en l'absence de signes cliniques (Moeller et Rider, 1962; ATSDR, 2003).
Dans une étude randomisée à double insu réalisée chez des volontaires humains, après avoir administré une dose unique de malathion variant de 0,5 à 15,0 mg/kg p.c. (groupe d'essai formé de 27 mâles et de 7 femelles et groupe témoin constitué de 11 mâles et de 3 femelles), on n'a décelé aucun effet nocif lié au traitement sur l'activité de l'AChE érythrocytaire et plasmatique ni changement dans les signes vitaux, les électrocardiogrammes, l'hématologie, les épreuves biochimiques, les analyses d'urine et les paramètres physiques, jusqu'à 24 à 48 heures après administration de la dose (Gillies et Dickson, 2000). De même, dans une autre étude menée sur des volontaires utilisant les mêmes concentrations, on n'a signalé aucun effet nocif lié au traitement sur l'activité de l'AChE (Jellinek, Schwartz and Connolly Inc., 2000).
2.4 Effets chez les animaux
Des études portant sur une exposition répétée chez les rats, les souris, les lapins et les chiens ont montré que le malathion induisait principalement des effets sur les reins et des effets neurologiques, bien que d'autres effets aient aussi été observés (Shellenberger et Billups, 1987; Daly, 1993a, 1993b, 1996; ATSDR, 2003; EFSA, 2009; US EPA, 2009 Santé Canada, 2010; Barnett Jr., 2012a, 2012b; OMS, 2017a).
Le malathion s'est révélé légèrement toxique pour les animaux de laboratoire par voie orale et cutanée et par inhalation. La toxicité du malathion dépend de son degré de pureté. On a mesuré des doses létales médianes (DL50) par voie orale de 2 382 à 8 200 mg/kg p.c. chez les rats (degré de pureté de 96,0 % à 99,1 %), de 6 100 mg/kg p.c. chez les souris femelles (degré de pureté de 95 %) et de plus de 4 000 mg/kg p.c. chez les chiens (degré de pureté de 98 %) pour le malathion. Les valeurs de la DL50 par voie cutanée étaient de plus de 2 000 mg/kg p.c. chez les rats (degré de pureté de 96 à 98 %) et de 8 900 mg/kg p.c. chez les lapins (degré de pureté de 95,6 %). Une concentration létale médiane (CL50) par inhalation de plus de 5,2 mg/L a aussi été obtenue chez les rats (degré de pureté de 96 à 98 %) pour le malathion (FAO/OMS, 1997; Decker et coll., 2003; US EPA, 2009; Santé Canada, 2010).
Effets sur les reins : Une néphrotoxicité a été observée chez les rats et les beagles après administration de malathion par voie orale (pour toutes les durées d'exposition).
Dans une étude de toxicité chronique/cancérogénicité d'une durée de 24 mois, on a administré du malathion (degré de pureté de 97,1 %) par voie alimentaire à des groupes de rats Fischer 344 (90/sexe/dose) à des doses de 0, de 100/50 (dose réduite le jour 113), de 500, de 6 000 ou de 12 000 ppm (équivalant à 0, à 2,4, à 26, à 327 ou à 677 mg/kg p.c. par jour pour les mâles et à 0, à 3,0, à 32, à 386 ou à 817 mg/kg p.c. par jour pour les femelles). On a procédé à des sacrifices en cours d'étude (10 à 15/dose/sexe) à 3, à 6 et à 12 mois (Daly, 1996). À 12 mois et lors du sacrifice en cours d'étude, le poids des reins (poids absolu et poids relatif par rapport au poids corporel ou au poids cérébral) présentait une augmentation statistiquement significative à des doses de 6 000 ppm et de 12 000 ppm tant chez les rats mâles que chez les rats femelles. Les résultats macroscopiques à la fin de l'étude comprenaient une fréquence accrue de surfaces irrégulières des reins à des doses de 500, de 6 000 et de 12 000 ppm chez les mâles et de 12 000 ppm chez les femelles (US EPA, 1997). Une aggravation de la néphropathie progressive chronique a été signalée chez les deux sexes, à savoir chez les femelles ayant reçu de doses de 500 ppm et plus de malathion et les mâles ayant reçu des doses de 6 000 ppm et plus; le sacrifice en cours d'étude a aussi révélé que la maladie apparaissait plus tôt chez les mâles (Santé Canada, 2010).
Des effets comparables ont été observés dans le cadre d'études de toxicité subchronique utilisant des doses plus élevées de malathion tant chez les beagles que chez les rats. Dans une étude de toxicité par voie orale d'une durée de 52 semaines, des beagles (6/sexe/dose) ont reçu 62,5 à 250 mg/kg p.c. par jour de malathion (degré de pureté de 95 %) sous forme de capsules. À des doses de 62,5 mg/kg p.c. par jour et plus, on a observé une diminution de la créatinine et de l'azote uréique sanguin accompagnée d'une augmentation des poids absolu et relatif des reins (Shellenberger et Billups, 1987). Dans le cadre d'une étude de toxicité alimentaire de 90 jours, on a administré à des groupes de rats F-344 rats (10/sexe/groupe) 100 à 20 000 ppm (équivalant à 6,6 à 1 190 mg/kg p.c. par jour pour les mâles et à 7,9 à 1 597 mg/kg p.c. par jour pour les femelles) de malathion (degré de pureté de 96,4 %). Une augmentation du poids relatif des reins a été mesurée à des doses de 340/384 mg/kg p.c. par jour et plus chez les mâles/femelles, et une hausse du poids absolu des reins a été mesurée à une dose 680 mg/kg p.c. par jour chez les mâles et à des doses de 1 597 mg/kg p.c. par jour et plus chez les femelles. Une aggravation de la néphropathie chronique a en outre été signalée chez les mâles à des doses de 340 mg/kg p.c. par jour et plus (Daly, 1993b). Dans deux études de toxicité par voie alimentaire (28 et 29 à 30 jours), après avoir administré du malathion à des rats (degrés de pureté de 95,8 % et de 96,4 %, respectivement), on a mesuré une augmentation du poids relatif des reins à partir d'une dose de 457,5 mg/kg p.c. par jour (Daly, 1993a; Barnett Jr., 2012a).
Des effets toxiques sur les tissus rénaux ont aussi été constatés dans le cadre d'études de toxicité à dose unique (100 mg/kg p.c. et plus) chez les rats (Alp et coll., 2011; Selmi et coll., 2017; Akbel et coll., 2018).
Neurotoxicité : Une inhibition liée à la dose de l'activité de la PChE, de l'EChE et de la cholinestérase dans le cerveau (BChE) a été signalée chez les animaux de laboratoire (rats, souris, lapins et beagles) auxquels du malathion avait été administré, et ce, pour toutes les voies d'exposition et diverses durées d'exposition (ATSDR, 2003; US EPA, 2009; Santé Canada, 2010; OMS, 2017a).
Chez les animaux exposés au malathion, les érythrocytes sont le compartiment le plus sensible à l'inhibition de la ChE, et l'inhibition de la cholinestérase érythrocytaire (EChE) se substitue adéquatement aux effets toxiques sur le système nerveux périphérique dans les études de toxicité aiguë et certaines études à court terme. Cependant, dans des études de plus longue durée, une baisse de l'activité de l'EChE n'est pas considérée comme un effet nocif sur le plan toxicologique en raison des limites liées au faible taux de resynthèse de l'AChE érythrocytaire sur des périodes prolongées. L'inhibition de la BChE survient généralement à des doses plus élevées que celle de l'EChE et de la PChE chez toutes les espèces. L'évaluation de la sensibilité relative de l'activité de la ChE à l'administration de malathion par voie orale ne montre pas de différences interspécifiques notables entre les souris, les rats et les chiens. De même, les études menées sur toutes les voies d'exposition n'indiquent pas de différences entre les sexes pour ce qui est de la sensibilité aux effets du malathion sur l'inhibition de la ChE (Santé Canada, 2010).
Cependant, la base de données actuelle sur la neurotoxicité donne à penser que les rats qui ne sont pas encore sevrés sont plus sensibles que les rats adultes aux effets neurotoxiques du malathion après une exposition par voie orale. Enfin, aucun changement neuropathologique n'a été constaté dans la plupart des études de toxicité chez les mammifères. Cependant, plusieurs cas isolés de changements neuropathologiques ont été observées dans deux études sur les rats à des doses très élevées (1 500 mg/kg p.c. par jour) chez un sexe seulement (mâles), résultats qui sont jugés équivoques (Santé Canada, 2010).
Dans l'étude réalisée par Daly (1996), des rats Fischer 344 (90/sexe/dose) ont reçu des aliments contenant 50 à 12 000 ppm de malathion (degré de pureté de 97,1 %), on a observé une baisse de l'activité de la PChE à des concentrations de 500 ppm et plus et une diminution de l'activité de l'EChE et de la BChE à des concentrations de 6 000 ppm et plus. Dans le cadre d'une étude de cancérogénicité par voie alimentaire d'une durée de 18 mois, après avoir administré du malathion (degré de pureté de 96,4 %) à des souris B6C3F1 (65/sexe/groupe), on a constaté une baisse de l'activité de la PChE et de l'EChE à des doses de 143/167 mg/kg p.c. par jour et plus (la plus faible dose d'essai) chez les mâles/femelles et une diminution de la BChE à des doses de 2 978/3 448 mg/kg p.c. par jour (la dose d'essai la plus élevée) chez les mâles/femelles (Santé Canada, 2010).
Dans des études de toxicité orale subchronique du malathion (degré de pureté de 95 % à 96,4 %), une inhibition de l'EChE, de la PChE et de la BChE a été observée à des concentrations aussi faibles que 7,9 mg/kg par jour (rats), 62,5 mg/kg p.c. par jour (chiens) et 250 mg/kg p.c. par jour (chiens), respectivement (Shellenberger et Billups, 1987; Daly, 1993a; Daly, 1993b; Barnett Jr., 2012a; Barnett Jr., 2012b). Dans une étude de toxicité par voie cutanée d'une durée de 21 jours menée sur des lapins (10/sexe/groupe), une inhibition de l'EChE est survenue à des doses de 75 mg/kg p.c. par jour et plus de malathion (degré de pureté de 96 %) (dose d'essai la plus faible) et une inhibition de la PChE et de la BChE a été signalée à 500 mg/kg par jour (dose d'essai la plus élevée) (Santé Canada, 2010).
Dans une étude de toxicité aiguë différée (par gavage) menée sur 12 poules, rien n'indiquait que l'administration de malathion avait des effets neuropathologiques différés (EFSA, 2009; Santé Canada, 2010; OMS, 2017a).
Dans une étude de neurotoxicité développementale, des doses de 0, de 5, de 50 ou de 150 mg/kg p.c. par jour de malathion (degré de pureté de 96,0 %) dans de l'huile de maïs ont été administrés par gavage à 24 mères, à partir du jour de gestation (JG) 6 au jour post-natal (JPN) 10 et aux petits aux JPN 11 à 21. À la dose la plus élevée, des signes cliniques ont été observés chez les mères (salivation consécutive à l'administration) et chez les petits (par example, tremblements, hypoactivité, posture prostrée, paupières partiellement fermées). Chez les jeunes, on a également noté une fréquence accrue de démarche basse (JPN 60; mâles) et une diminution de l'activité motrice (JPN 17 à 22; femelles) à des doses de 50 mg/kg p.c. par jour et plus. Dans une étude comparative de la ChE chez les rats, des adultes et des petits au JPN 11 (8 /sexe/groupe) ont reçu par gavage 0, 5, 50, 150 ou 450 mg/kg p.c. de malathion (degré de pureté de 96,0 %) pendant 1 jour. Dans cette étude, on a aussi évalué l'exposition répétée par gavage (11 jours) en utilisant des doses comparables chez les adultes et les petits aux JPN 11 à 21 (8/sexe/groupe), soit 19 femelles adultes (9 femelles traitées aux JG 6 à 20, 10 femelles traitées aux JG 1 à 10) et des petits (2/sexe/portée/groupe) sacrifiés 4 heures après administration de la dose maternelle au JPN 4. Les résultats de l'étude ont montré qu'à des doses semblables, les petits au JPN 11 et au JPN 21 étaient plus sensibles que les animaux adultes aux effets inhibiteurs de la ChE du malathion. Le calcul de la dose repère (à partir d'une réponse de 20 %) indique que les jeunes animaux sont environ 6,4 fois et 1,8 fois plus sensibles aux effets inhibiteurs de la ChE du malathion que les adultes après une exposition aiguë et une exposition répétée par voie orale, respectivement (Santé Canada, 2010).
Toxicité pour la reproduction et le développement : Le malathion n'avait pas d'effet toxique sur la reproduction chez les rats à la plus forte dose d'essai, tandis que des effets fœtotoxiques n'ont été décelés qu'à des doses toxiques pour la mère chez les rats et les lapins (Santé Canada, 2010).
Dans une étude de toxicité alimentaire pour la reproduction menée sur deux générations (2 portées/génération), on a administré à des rats Sprague-Dawley (25/sexe/groupe) 550 à 7 500 ppm (équivalant à 43 à 612 mg/kg p.c. par jour pour les mâles et à 51 à 703 mg/kg p.c. par jour pour les femelles) de malathion (degré de pureté de 94 %). Aucun effet sur les paramètres de reproduction et les tissus reproducteurs n'a été observé. On a toutefois remarqué une diminution du gain pondéral chez les parents (F0) (pendant la gestation et la lactation [femelles]) et dans la première génération – première portée (F1) (pendant la période de pré-accouplement) à la dose la plus élevée. Une diminution du poids a été mesurée chez certains petits de la deuxième génération (2 de 4 portées) au JPN 21 à des doses de 394/451 mg/kg p.c. par jour chez les mâles/femelles et chez tous les petits de la deuxième génération (4 portées) à la dose d'essai la plus élevée (Santé Canada, 2010). Dans des études d'administration orale de 80 semaines et de 103 semaines, on n'a observé aucun changement macroscopique ou microscopique lié au traitement dans la prostate ou les testicules des rats mâles ni changement histopathologique dans les glandes mammaires, l'utérus ou les ovaires des rats femelles après l'administration de doses allant jusqu'à 622 mg/kg par jour et jusqu'à 332 mg/kg par jour de malathion (degré de pureté de 95 %), respectivement (NCI 1978, 1979). Des résultats semblables ont été obtenus chez les souris mâles ayant reçu dans leur diète jusqu'à 2 980 mg/kg par jour de malathion (degré de pureté de 95 %) pendant 80 semaines; Cependant, chez les femelles, une fréquence accrue de l'hyperplasie kystique de l'endomètre a été observée après l'administration de 1 490 mg/kg p.c. par jour de malathion (degré de pureté de 95 %) pendant 80 semaines (NCI, 1978).
On a évalué la toxicité du malathion pour le développement chez les rats et les lapins. Après avoir administré (gavage) à des lapines gravides (20/groupe) 25 à 100 mg/kg p.c. par jour de malathion (degré de pureté de 95 %) des JG 6 à 18, on a observé une fréquence légèrement accrue de résorptions (mort de l'embryon ou du fœtus) chez les mères à des doses de 50 mg/kg par jour et plus en présence d'une toxicité chez la mère (diminution du gain pondéral pendant l'administration de la dose). Lorsque du malathion (degré de pureté de 94 %) a été administré par gavage à des rates Sprague-Dawley gravides (24 à 25/groupe; 200 à 800 mg/kg par jour; JG 6 à 15), une légère augmentation de la fréquence des foyers de résorption a aussi été observée à la dose la plus élevée en présence d'une toxicité chez la mère. La toxicité maternelle comprenait des sécrétions lacrymales rouges, des sécrétions nasales pigmentées, une fourrure abdominale tachée par l'urine et une diminution du gain pondéral et de la consommation d'aliments pendant l'administration de la dose. Aucune des études sur le développement n'a montré de signes de malformations attribuables au traitement (Santé Canada, 2010).
Autres effets : Des effets liés au traitement, notamment une augmentation du poids du foie et des glandes thyroïdes et parathyroïdes, ont été observés à une dose de 62,5 mg/kg p.c. par jour et plus chez les rats et les chiens après une exposition à long terme par voie orale, et des effets hématologiques non cholinergiques ont été signalés à des doses plus élevées (Daly, 1996; Santé Canada, 2010).
Des modifications non néoplasiques du foie ont été observées chez les animaux de laboratoire, mais elles pourraient être assimilées à des réponses adaptatives. Cependant, des lésions histopathologiques plus graves peuvent être décelées dans le foie après l'administration de doses uniques de malathion (ATSDR, 2003).
Les données probantes ne permettent pas d'établir que le malathion a un effet sur le système endocrinien, mais certains éléments indiquent que le malathion peut induire une réponse immunitaire chez les animaux de laboratoire en altérant l'immunité humorale et l'immunité cellulaire (Santé Canada, 2010).
2.5 Génotoxicité et cancérogénicité
Sur la base des preuves scientifiques disponibles, le malathion n'est pas considéré comme génotoxique (US EPA, 2009; Santé Canada, 2010, 2012).
Dans le cadre d'études in vitro, le malathion n'avait pas d'effet mutagène sur les bactéries (tests d'Ames utilisant plusieurs souches bactériennes, avec et sans activation métabolique) ou sur les levures (dosage de mutation génique sur Saccharomyces cerevisiae) et ne provoquait pas de synthèse d'ADN non programmée (UDS) dans les hépatocytes de rat en culture (US EPA, 1977; Traul, 1987; Pluth et coll., 1996; US EPA, 2009; Santé Canada, 2010; CIRC, 2017; OMS, 2017a). Dans certains essais de génotoxicité in vitro (ComET, formation de liaisons transversales entre les protéines et l'ADN, échange de chromatides sœurs), on a obtenu des résultats positifs, mais uniquement à de fortes doses de malathion (doses cytotoxiques) ou lorsque la pureté de la substance à l'essai était indéterminée (Chen et coll., 1981; Nishio et Uyeki, 1981; Santé Canada, 2010; Ojha et Srivastava, 2014; Ojha et Gupta, 2015; CIRC, 2017; OMS, 2017a).
Chez les animaux in vivo, le malathion n'a pas causé de mutations dans les spermatogonies des souris (essai de létalité dominante) ou d'aberrations chromosomiques dans la moelle osseuse des rats (Santé Canada, 2010; CIRC, 2017, OMS, 2017a). En revanche, dans d'autres études menées sur des rongeurs, on a décelé des aberrations chromosomiques et des dommages à l'ADN (selon l'essai ComET) après administration de malathion par voie orale à des doses cytotoxiques ou en utilisant une substance d'essai dont l'identité ou la pureté était indéterminée (Dulout et coll., 1983; Giri et coll., 2002; Santé Canada, 2010; Ojha et coll., 2013; CIRC, 2017).
Dans les cellules humaines, le malathion n'a pas causé d'UDS dans les fibroblastes pulmonaires, mais il a induit des mutations dans les lymphocytes T lors de l'essai HRPT et la formation de l'adduit 8-OH-dG dans les cellules mononuclées du sang périphérique chez l'humain (US EPA, 1977; Pluth et coll., 1996; Ahmed et coll., 2011). Des résultats mitigés ont été obtenus pour ce qui est de l'échange de chromatides sœurs (SCE) et des dommages à l'ADN (selon l'essai ComET), des résultats positifs ayant été observés uniquement à des doses cytotoxiques ou se rapprochant des doses cytotoxiques ou lorsque la pureté du malathion était indéterminée (Blasiak et coll., 1999; Santé Canada, 2010; Moore et coll., 2010; Olakkaran et coll., 2020). Des aberrations chromosomiques ont été observées dans les leucocytes périphériques humains, mais avec une substance d'essai de pureté indéterminée (Santé Canada, 2010). Une augmentation des cellules micronucléées a été mesurée dans les lymphocytes en culture traités avec des doses élevées de malathion; cependant, dans deux études in vivo sur des travailleurs agricoles exposés spécifiquement au malathion, on a obtenu des résultats négatifs pour la formation de micronoyaux et les mutations de la glycophorine A dans les lymphocytes périphériques chez les cohortes étudiées (Titenko-Holland et coll., 1997; Windham et coll., 1998).
Bien que de nombreuses études in vitro et in vivo menées sur divers rongeurs et des modèles humains aient donné des résultats positifs, pour bon nombre de ces études, les détails expérimentaux étaient insuffisants ou l'identité ou la pureté de la substance d'essai utilisée était indéterminée, tandis que dans d'autres cas, les résultats positifs n'étaient obtenus qu'à de fortes concentrations (doses cytotoxiques) (Santé Canada, 2010; OMS, 2017a). La pertinence de ces résultats n'est donc pas claire (Santé Canada, 2010).
Dans une étude de 18 mois, après avoir administré par voie alimentaire à des souris B6C3F1 des doses de malathion de 100 à 16 000 ppm, on a remarqué une fréquence accrue d'adénomes hépatiques chez les deux sexes à une dose de 8 000 ppm (1 476 mg/kg par jour pour les mâles; 1 707 mg/kg par jour pour les femelles) et à 16 000 ppm (2 978 mg/kg p.c. par jour pour les mâles; 3 448 mg/kg p.c. par jour pour les femelles) (Slauter, 1994). Dans une autre étude où des rats F344 avaient reçu dans leur diète 100 à 12 000 ppm de malathion pendant 24 mois, une fréquence accrue d'adénomes hépatiques a aussi été observée, mais uniquement chez les femelles à 12 000 ppm (817 mg/kg p.c. par jour) (Daly, 1996). Ces résultats sont toutefois considérés comme équivoques, compte tenu de l'apparition des tumeurs uniquement à des concentrations de malathion supérieures à la dose maximale tolérée, de l'absence de relation dose-effet, de la présence de tumeurs chez un seul sexe chez les rats, de la fréquence élevée de tumeurs hépatiques chez les souris B6C3F1 et des signes de saturation métabolique du foie (Santé Canada, 2010; OMS, 2017a). Dans une étude de 24 mois sur des rats, Daly (1996) a aussi signalé des tumeurs solitaires rares du nez et de la bouche à des concentrations de 6 000 et de 12 000 ppm, tumeurs dont il n'était pas possible de déterminer si elles étaient liées au traitement ou un effet du hasard (Santé Canada, 2010). Des évaluations plus approfondies par des pairs et certains organismes de réglementation ont conclu que les tumeurs nasales étaient causées par une irritation de l'épithélium nasal due à la volatilisation ou à l'inhalation de très hautes concentrations de malathion provenant des aliments (US EPA, 2000a; Jensen et Whatling, 2010; FAO/OMS, 2016).
À la lumière des données probantes, l'ARLA a conclu que le malathion est peu susceptible de présenter un potentiel cancérogène pour les humains (Santé Canada, 2010, 2012). L'US EPA a classé le malathion comme suit : « Indices sérieux de cancérogénicité, mais pas suffisants pour qu'on puisse estimer ce potentiel chez l'humain » (US EPA, 2009). Dans une réévaluation récente du malathion par le Centre international de recherche sur le cancer (CIRC), le malathion a été classé dans le groupe 2A, à savoir « probablement cancérogène chez l'humain » (CIRC, 2017).
2.6 Mode d'action
Le malathion augmente la quantité de marqueurs de stress oxydatif et engendre un déséquilibre de l'état d'antioxydation dans les différents tissus, ce qui cause des lésions dans les tissus, notamment une peroxydation des lipides, des dommages à l'ADN et/ou des changements dans les enzymes antioxydantes, pouvant expliquer la néphrotoxicité observée chez les rats et les chiens (Akhgari et coll., 2003; CIRC, 2017; Akbel et coll., 2018; Selmi et coll., 2018).
Dans les tissus, le foie et le plasma, le malathion subit une activation métabolique pour former du malaoxon. Le malathion et le malaoxon peuvent inhiber l'activité de la PChE, de l'EChE et de la BChE par phosphorylation du site actif de l'enzyme (ATSDR, 2003; Krstic et coll., 2008; Santé Canada, 2010; Jensen et Whatling, 2010). L'enzyme ChE est responsable de l'hydrolyse du neurotransmetteur acétylcholine (ACh). Son inhibition favorise l'accumulation d'ACh dans les synapses, causant ainsi une stimulation excessive des récepteurs nicotiniques et muscariniques du système nerveux central et/ou du système nerveux périphérique. Cette surstimulation entraîne une contraction des muscles lisses (par example, crampes abdominales, sécrétions glandulaires, contraction des muscles squelettiques et paralysie) et pourrait avoir des effets sur l'apprentissage, la mémoire et d'autres paramètres comportementaux (ATSDR, 2003; Santé Canada, 2010; Jokanovic, 2018; Naughton et Terry Jr., 2018).
2.7 Étude clé retenue
Dans sa réévaluation aux fins du maintien de l'homologation du malathion (PACR2003‑10), Santé Canada (2010, 2012, 2019) a retenu le rein comme l'organe cible le plus sensible selon les données de la littérature scientifique. L'étude de toxicité/oncogénicité par voie orale menée sur des rats par Daly (1996) a été choisie comme l'étude clé aux fins de l'évaluation des risques pour la santé humaine du malathion présent dans l'eau potable (Santé Canada, 2019).
Des groupes de rats (90/sexe/dose) ont reçu dans leur diète 0, 100/50 (dose réduite le jour 113), 500, 6 000 ou 12 000 ppm (équivalant à 0, à 2,4, à 26, à 327 ou à 677 mg/kg p.c. par jour pour les mâles et à 0, à 3,0, à 32, à 386 ou à 817 mg/kg p.c. par jour pour les femelles) de malathion (97,1 %) pendant 24 mois (Santé Canada, 2010). Après 3 mois, on a réduit la dose la plus faible de 100 ppm à 50 ppm après avoir observé une inhibition statistiquement significative de l'EChE à une dose de 100 ppm chez les femelles (US EPA, 1997; Santé Canada, 2010; OMS, 2017a). On a vérifié deux fois par jour les effets toxiques et la mortalité chez les rats et effectué des examens hebdomadaires. On a procédé à des sacrifices en cours d'étude au bout de 3, 6 et 12 mois (US EPA, 1997). Des signes cliniques liés au traitement (coloration de la région anogénitale) n’ont été observés que chez les femelles et à la dose alimentaire la plus élevée (US EPA, 1997; Santé Canada, 2010). La mortalité avait considérablement augmenté chez les mâles à 6 000 et à 12 000 ppm (à partir des mois 20 et 14, respectivement) et chez les femelles à 12 000 ppm (plus proche de la fin de l’étude), les morts étant en partie attribuables à la néphropathie chronique (US EPA, 1997; Santé Canada, 2010; OMS, 2017a). Bien qu'une incidence élevée de néphropathie chronique ait été signalée dans tous les groupes (y compris les groupes témoins), on a remarqué une aggravation de l'effet liée au traitement chez les femelles exposées à des concentrations de 500 ppm et plus et chez les mâles, à des concentrations de 6 000 ppm et plus, le sacrifice en cours d'étude montrant que la maladie apparaissait plus tôt chez les mâles (US EPA, 1997; Santé Canada, 2010). Une diminution du poids corporel et une augmentation de la consommation d'aliments ont été enregistrés chez les deux sexes à des concentrations de 6 000 ppm et plus, ainsi qu'une augmentation du poids absolu et du poids relatif du foie et des reins. Chez les deux sexes, une inhibition de l'EChE et de la BChE a été mesurée à des concentrations de 6 000 ppm, tandis qu'une inhibition de la PChE a été constatée à des concentrations de 500 ppm et plus. Des effets sur les paramètres érythrocytaires et biochimiques ont été observés chez les mâles et les femelles exposés aux deux doses les plus élevées. Des lésions de la muqueuse nasale (dégénérescence et hyperplasie de l'épithélium olfactif) et une irritation du nasopharynx (inflammation et hyperplasie de l'épithélium respiratoire) ont été signalées chez les deux sexes à des concentrations de 6 000 ppm et plus (Santé Canada, 2010).
Une augmentation de la fréquence des adénomes hépatiques a été signalée chez les femelles à 12 000 ppm, mais non chez les mâles. Chez les deux sexes, on a remarqué la présence de tumeurs orales et nasales solitaires; il n'a toutefois pas été possible de déterminer si ces tumeurs étaient liées au traitement ou aléatoires (tumeurs buccales chez les femelles à des concentrations de 6 000 ppm et plus; tumeurs nasales chez les femelles à des concentrations de 6 000 ppm et chez les mâles, à une concentration de 12 000 ppm) (Santé Canada, 2010).
Une dose orale sans effet nocif observé (NOAEL) de 3,0 mg/kg p.c. par jour a été retenue sur la base d'une aggravation liée au traitement de la néphropathie progressive chronique chez les rats femelles à la plus forte dose suivante de 32 mg/kg p.c. par jour (Santé Canada, 2010).
Bien que la sensibilité des jeunes ait été démontrée, l'effet le plus sensible après une exposition répétée (effets comportementaux) survient à des doses supérieures à la NOAEL pour la néphropathie chronique. La néphropathie chronique est une maladie liée au vieillissement qui a été observée après une exposition à long terme chez les rats adultes (Santé Canada, 2019).
3.0 Calcul de la valeur basée sur la santé
Comme il est mentionné ci-dessus, l'évaluation des risques actuelle repose sur la NOAEL de 3,0 mg/kg p.c. par jour d'après l'aggravation de la néphropathie progressive chronique chez les rats femelles. À l'aide de cette NOAEL de 3,0 mg/kg p.c. par jour, l'apport quotidien acceptable (AQA) pour le malathion (Santé Canada, 2010) est calculé comme suit :
Equation 1.

Equation 1 - Équivalent textuel
L'AQA pour malathion est de 0,03 mg/kg p.c. par jour. Cette valeur est calculée par divisant la NOAEL de 3,0 mg/kg p.c. par jour par le facteur d'incertitude de 100.
Où :
- 3,0 mg/kg p.c. par jour correspond à la NOAEL basée sur la néphropathie progressive chronique chez les rats femelles (Santé Canada, 2010); et
- 100 est le facteur d'incertitude choisi pour tenir compte de la variation interespèce (×10) et de la variation intraespèce (×10).
En utilisant l'AQA de 0,03 mg/kg p.c. par jour, la valeur basée sur la santé (VBS) pour le malathion dans l'eau potable a été calculée comme suit :
Equation 2.
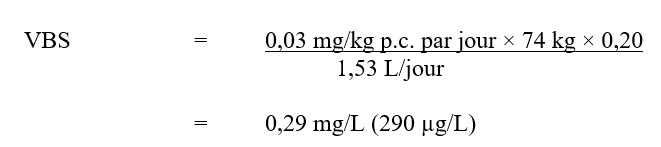
Equation 2 - Équivalent textuel
La VBS pour malathion dans l'eau potable est de 0,29 mg/L. Cette valeur est calculée en multipliant l'AQA de malathion (0,03 mg/kg p.c. par jour) par le facteur d'attribution de l'eau potable, 0,20, puis par 74 kg, le poids corporel moyen d'un adulte, et en divisant le résultat par 1.53 L/jour, le volume quotidien d'eau consommé par un adulte.
Où :
- 0,03 mg/kg p.c. par jour est l'AQA calculé à partir d'une NOAEL de 3,0 mg/kg p.c. par jour (Santé Canada, 2010);
- 74 kg est le poids corporel d'un adulte (Santé Canada, en cours d'élaboration);
- 1,53 L par jour est le volume quotidien d'eau du robinet consommé par un adulte (Santé Canada, en cours d'élaboration); et
- 0,20 est le facteur d'attribution par défaut, étant donné que l'eau potable n'est pas une source importante d'exposition au malathion et qu'il a été déterminé que le malathion était présent dans d'autres sources d'exposition (aliments) (Krishnan et Carrier, 2013).
4.0 Considérations liées à l'analyse et au traitement
4.1 Méthodes d'analyse utilisées pour déceler le malathion
Les méthodes normalisées qui permettent de déceler le malathion dans les sources d'approvisionnement en eau et dans l'eau potable et leurs limites de détection (LDM) respectives sont résumées au tableau 3. Les LDM dépendent de la matrice de l'échantillon, des instruments et des conditions de fonctionnement choisies et varient d'un laboratoire à l'autre. Ces méthodes sont tributaires de diverses interactions, qui sont décrites dans les ouvrages de référence correspondants.
On a communiqué avec plusieurs laboratoires accrédités au Canada pour déterminer les LDM et les SDM en vue de l'analyse du malathion, et les LDM étaient du même ordre de grandeur que celles figurant au tableau 3. Les SDM variaient de 0,02 à 5 μg/L pour la chromatographie en phase gazeuse couplée à une détection par spectrométrie de masse (CPG‑SM) (AGAT Laboratories Ltd., 2019; ALS Environmental, 2019; CARO Analytical Services – Laboratoire de Richmond, 2019; Element Materials Technology Canada Inc., 2019; SGS Environmental Services, 2019).
Les LDM ou les SDM tirés des données des provinces et des territoires se situaient entre 0,0001 et 15 μg/L (voir la section 1.3).
Il est recommandé aux responsables des réseaux d'approvisionnement en eau potable d'aborder les exigences en matière d'échantillonnage avec le laboratoire accrédité menant les analyses, afin de s'assurer que les procédures de contrôle de la qualité sont respectées et que les SDM sont suffisamment faibles pour garantir une surveillance précise aux concentrations inférieures à la concentration maximale acceptable (CMA). Les considérations relatives au traitement des échantillons pour l'analyse du malathion dans l'eau potable (par example, préservation et conservation des échantillons) se trouvent dans les références énumérées au tableau 3. Par ailleurs, une méthode non normalisée d'analyse du malathion dans l'eau reposant sur la chromatographie liquide haute performance couplée à la spectrométrie de masse est présentée dans Rocha et coll. (2015).
Il est important de noter que la désactivation est cruciale si un agent oxydant est présent dans les échantillons afin d'empêcher toute détérioration supplémentaire du malathion. Le malathion présente une stabilité limitée parce qu'il est rapidement hydrolysé, sa demi-vie étant réduite à des pH et des températures plus élevés (Wolfe et coll., 1977; EFSA Scientific Report, 2006). Il est donc recommandé de refroidir les échantillons et de les analyser sans délai.
| Méthode | Méthodologie | LDM (µg/L) | Interférences/commentaires |
|---|---|---|---|
| EPA 527 rév. 1.0 (US EPA, 2005) |
Chromatographie en phase gazeuse avec colonne capillaire-spectrométrie de masse (GC-SM) | 0,057Note de bas de tableau 3 - a | Interférences dues à la méthode et à la matrice; contamination entre échantillons |
| EPA 1699 (US EPA, 2007) |
CPG-SM haute résolution | 0,0003 (296 pg/L) | Interférences dues à la méthode et à la matrice |
| EPA 8141B rév. 2 (US EPA, 2000b) |
Chromatographie en phase gazeuse et détection à photométrie de flamme Detector (CPG-DPF) | 5,5 | Interférences dues à la méthode et à la matrice |
| EPA 8270D rév. 4.0 (US EPA, 1998) |
CPG-SM | 50Note de bas de tableau 3 - b | Interférences dues à la méthode et à la matrice; contamination entre échantillons |
| O-1104 (USGS, 1983) |
CPG-DPF | 0,01Note de bas de tableau 3 - c | Interférences dues à la méthode et à la matrice; interférences dues au soufre et aux composés organosulfurés |
| O-1126-95 (USGS, 1995) |
CPG-SM | 0,005 | Interférences dues à la méthode et à la matrice |
| O-1402-01 (USGS, 2001) |
CPG-DPF | 0,005 | Interférences dues à la méthode et à la matrice; interférences dues au soufre et aux composés organosulfurés inconnus |
| O-3104 (USGS, 1983) |
CPG-DPF | 0,01Note de bas de tableau 3 - c | Interférences dues à la méthode et à la matrice; interférences dues aux composés organosulfurés |
| O-3402-03 (USGS, 2003) |
Chromatographie en phase gazeuse (mode de détection non précisé) | 0,0040 | Interférences dues à la méthode et à la matrice; interférences dues au soufre et aux composés organosulfurés et organophosphatés inconnus |
4.2 Considérations liées au traitement
Les techniques de traitement offertes pour réduire efficacement les concentrations de malathion dans l'eau potable comprennent l'adsorption sur charbon actif, les procédés de filtration sur membrane, l'oxydation et les procédés d'oxydation avancée. Les données publiées sur l'enlèvement du malathion dans l'eau à l'aide de ces techniques indiquent des taux d'efficacité extrêmement variables (de moins de 50 % à environ 100 %) (Chian et coll., 1975; Roche et Prados, 1995; Kiso et coll., 2000; Duirk et coll., 2009; Zhang et Pagilla, 2010; Beduk et coll., 2012; Chamberlain et coll., 2012; Fadaei et Dehghani, 2012; Sorour et Shaalan, 2013; Jusoh et coll., 2014; Li et coll., 2016). À l'échelle résidentielle, les dispositifs de traitement certifiés qui s'appuient sur l'osmose inverse (OI) ou l'adsorption sur charbon actif devraient pouvoir enlever le malathion de manière efficace.
4.2.1 Traitement à l'échelle municipale
Le choix d'un bon procédé de traitement pour une source donnée d'approvisionnement en eau dépend de nombreux facteurs, notamment la source d'eau brute et ses caractéristiques, les conditions d'utilisation de la méthode de traitement choisie et les objectifs de traitement du responsable du réseau d'approvisionnement en eau potable. La réalisation d'essais au banc ou d'essais pilotes est recommandée pour s'assurer que l'eau de la source peut être traitée avec succès et qu'un processus optimal est établi.
Lorsque des procédés d'oxydation ou des procédés d'oxydation avancée (POA) sont utilisés pour enlever des pesticides dans l'eau potable, il est important de connaître le potentiel de formation de sous-produits de dégradation du composé cible (Ikehata et Gamal El-Din, 2006; Beduk et coll., 2012; Li et coll., 2019). L'oxydation (voir la section 4.2.1.4), ou les procédés d'oxydation avancée (voir la section 4.2.1.5) entraînent la formation de plusieurs sous-produits de dégradation du malathion, dont le malaoxon, qui présente un risque pour la santé. L'objectif principal devrait être l'enlèvement du pesticide, tandis que l'objectif secondaire devrait être la diminution au minimum de la formation de sous-produits. Par ailleurs, les responsables de réseaux d'approvisionnement en eau potable devraient tenir compte de la possibilité de formation de sous-produits de désinfection selon l'oxydant choisi et la qualité de la source d'approvisionnement en eau.
4.2.1.1 Traitement classique
Les procédés classiques de filtration (coagulation chimique, clarification et filtration rapide sur sable) et l'ajout de chlore à l'étape de la désinfection peuvent réduire les concentrations de malathion par oxydation, selon l'oxydant utilisé (Roche et Prados, 1995; Duirk et coll., 2009; Beduk et coll., 2012; Chamberlain et coll., 2012). Cependant, les processus de dégradation comme l'oxydation entraînent la formation de sous-produits, dont le malaoxon (voir la section 4.2.1.4).
Dans un essai au banc, on a évalué les techniques de coagulation chimique et de sédimentation utilisées pour l'enlèvement du malathion et du malaoxon (Matsushita et coll., 2018). Les résultats ont indiqué un taux d'enlèvement nul dans l'eau de rivière (voir le tableau 4).
| Paramètre | Concentration Initiale (μg/L) | Coagulant | Dose | Enlèvement | Description du procédé |
|---|---|---|---|---|---|
| Malation | 10 | Chlorure de polyaluminium | 1,0 et 1,4 mg/L | 0 | À l'échelle de l'essai au banc : Eau de rivière à 20 ˚C; 1 L; pH final de 7,0 Ajout d'un coagulant; agitation rapide (61 tr/min) pendant 1 min; agitation lente (13 tr/min) pendant 10 min; temps de repos de 60 min |
| Malaoxon | 10 | 0 |
On a procédé à un essai au banc pour évaluer l'enlèvement cumulative de malathion par coagulation, floculation et filtration, suivies d'une chloration (voir le tableau 5) (Costa et coll., 2018). Dans cet essai, dont la première partie se distingue de l'essai précédent par l'ajout d'une étape de filtration, on a obtenu un taux d'enlèvement du malathion de 62,21 %. Le taux d'enlèvement avait encore augmenté avec la chloration, et les auteurs ont noté la formation de malaoxon.
| Concentration Initiale (μg/L) | Type de traitement | Enlèvement cumulative | Description du procédé | Description générale |
|---|---|---|---|---|
| 0,48 mg/L | Coagulation, floculation, filtration | 62.21 ± 0.01% | Ajout de 20 mL de sulfate d'aluminium à 1 % (p/v); agitation rapide (100 tr/min) pendant 3 min; agitation lente (50 tr/min) pendant 10 min; temps de repos de 15 min; filtration par gravité avec papier-filtre de 125 mm | À l'échelle de l'essai au banc : jar tests Eau ultra-pure; 1 L à 100 NTU; pH de 10,5 Coagulation, floculation, filtration, suivies d'une chloration Remarque : après post-chloration, du malaoxon a été détecté (concentration non précisée) |
| Chloration | 73,2 ± 0,2 % | Chlore (dose = 5 mg/L) |
4.2.1.2 Adsorption sur charbon actif
L'adsorption sur charbon actif est une technique largement utilisée pour diminuer la concentration de micropolluants, dont un vaste éventail de pesticides, dans l'eau potable (Haist-Gulde et Happel, 2012; van der Aa et coll., 2012). Le charbon actif peut être appliqué de deux manières : applications d'une solution en suspension de charbon actif en poudre (CAP) ou réacteur à lit fixe utilisant du charbon actif en grains (CAG) (Chowdhury et coll., 2013).
Les données tirées des essais menés à l'échelle de l'essai au banc afin de déterminer les coefficients d'adsorption des pesticides sont utiles pour prédire si le charbon actif adsorbe un pesticide en particulier (US EPA, 2011). En général, l'enlèvement par adsorption sur charbon convient aux pesticides présentant une constante d'adsorption (c.-à-d. coefficient de Freundlich) supérieure à 200 µg/g(L/µg)1/n (Speth et Adams, 1993; Speth et Miltner, 1998; US EPA, 2011). Il convient toutefois de souligner que la présence de matière organique naturelle (MON) ajoute à la complexité du traitement au charbon actif, parce que cette matière entre directement en compétition avec le malathion pour occuper les sites d'adsorption ou encrasse le charbon en obstruant les pores (Chowdhury et coll., 2013). Comme de nombreux facteurs peuvent influer sur la capacité du charbon actif, notamment le caractère ionique du composé et le pH de la solution, des essais appropriés (par example essais de floculation, essai rapide en colonne à petite échelle, etc.) seraient nécessaires pour confirmer l'enlèvement.
Charbon actif en poudre
On a constaté que de nombreux pesticides étaient fortement adsorbés sur le CAP (Chowdhury et coll., 2013). L'utilisation de CAP présente l'avantage de fournir du charbon vierge selon les besoins (durant la saison d'application du pesticide) (Miltner et coll., 1989). L'efficacité d'enlèvement du CAP dépend du type et de la dose de CAP, du temps de contact, des caractéristiques du CAP (type, taille des particules), de la capacité d'adsorption du contaminant et de la présence de MON (Gustafson et coll., 2003; Summers et coll., 2010; Haist-Gulde et Happel, 2012; Chowdhury et coll., 2013).
On a mené une étude à l'échelle d'essai de banc afin de déterminer l'adsorption du malathion et du malaoxon sur le CAP (voir le tableau 6) (Matsushita et coll., 2018). Avec une dose de CAP de 10 mg/L, des taux comparables d'enlèvement de 69 % et de 76 % ont été observés pour le malathion et le malaoxon, respectivement. Les deux substances présentent donc une bonne adsorbabilité sur le charbon actif.
| Paramètre | Concentration initiale (μg/L) | Dose de CAP | pH | Taux résiduel | Efficacité d'enlèvement (%)a | Description du procédé |
|---|---|---|---|---|---|---|
| Malation | 10 | 10 mg/L | 7,0 | 0,24 ± 0,01 | 76 % | À l'échelle de l'essai de banc : Eau de rivière Temps de contact de 10 minutes |
| Malaoxon | 10 | 0.31 ± 0.03 | 69 % | |||
Charbon actif en grains
L'utilisation de CAG est une approche efficace pour le traitement des contaminants organiques qui sont souvent présents en concentrations préoccupantes dans les sources d'eau (Chowdhury et coll., 2013). La capacité du CAG d'enlever les pesticides par adsorption dépend de la vitesse de filtration, du temps de contact en lit vide, des caractéristiques du CAG (type, taille des particules et méthode de réactivation), de la capacité d'adsorption du contaminant et de la durée du cycle de filtration (Haist-Gulde et Happel, 2012). Par ailleurs, étant donné que les adsorbeurs à lit fixe de CAG fonctionnent généralement en continu, le CAG peut devenir encrassé (ou préchargé) par de la MON, ce qui le rendrait entièrement ou partiellement inefficace pour enlever le pesticide (Knappe et coll., 1999; Summers et coll., 2010; Haist-Gulde et Happel, 2012; Chowdhury et coll., 2013).
Des expériences en colonne ont été réalisées sur deux CAG différents (charbon actif à base de coques de noix de palmier (CA-CNP) et charbon actif à base de coquilles de noix de coco (CA-CNC) (Jusoh et coll., 2014). Les auteurs ont constaté que l'efficacité d'enlèvement du malathion du CA-CNC était plus élevée que celle du CA-CNP (voir le tableau 7). Les auteurs ont aussi conclu que la capacité d'adsorption augmentait lorsque le débit diminuait. En d'autres termes, l'efficacité de l'enlèvement augmentait avec le temps de contact en lit vide (TCLV).
| Concentration initiale (µg/L) | TCLV (min) | Enlèvement | Description du procédé | |
|---|---|---|---|---|
| CA-CNCNote de bas de tableau 7 - a | CA-CNPNote de bas de tableau 7 - b | |||
| 7 | 2,95 | 28,6 % | 18,6 % | Expériences en colonne à l'échelle d'essai de banc : Diamètre de la colonne = 1,3 cm; Hauteur de la colonne = 120 cm; Débit de 0,00012 m3/h; Taille des particules adsorbantes = 1,0 mm; Température = 30 ˚C REMARQUE : Le volume d'eau traitée n'est pas précisé. |
| 3,93 | 41,4 % | 31,4 % | ||
| 4,91 | 50,0 % | 42,9 % | ||
| 11,76 | 64,2 % | 47,1 % | ||
| 15,7 | 71,4 % | 60,0 % | ||
| 19,6 | 82,9 % | 71,4 % | ||
4.2.1.3 Filtration sur membrane
En général, la nanofiltration (NF) et OI sont des procédés efficaces de séparation par membrane sous pression pour l'enlèvement des pesticides de l'eau potable (Van der Bruggen et Vandecasteele, 2003; US EPA, 2011). L'efficacité de la NF et de l'OI à enlever les pesticides dépend des caractéristiques de la membrane, des propriétés des pesticides, de la composition de l'eau d'alimentation, des conditions opérationnelles et de l'encrassement de la membrane (Van der Bruggen et Vandecasteele, 2003; Plakas et Karabelas, 2012).
Comme le principal mécanisme des membranes de nanofiltration et d'osmose inverse pour enlever les pesticides est l'exclusion par la taille, le seuil de rétention des molécules (SRM) est une caractéristique importante de la membrane. Compte tenu du poids moléculaire du malathion (217 Da), les membranes présentant un seuil de rétention des molécules (SRM) se situant entre 200 et 400 Da sont jugées convenables pour l'enlèvement de ce pesticide. Outre l'effet de tamisage, la rétention de petites molécules de pesticide par des membranes comportant des pores de plus grande taille peut être influencée par les interactions physicochimiques entre le pesticide et la surface de la membrane (Plakas et Karabelas, 2012).
Bellona et coll. (2004) ont présenté un diagramme basé sur les caractéristiques du pesticide dans l'eau (par example, poids moléculaire, log Koe, diamètre moléculaire) et celles de la membrane (par example, SRM, taille des pores) qui peut être utilisé pour déterminer le potentiel d'enlèvement du malathion par filtration sur membrane. Avant toute mise en œuvre à grande échelle, il est important de mener les essais appropriés dans les conditions opérationnelles proposées avec la membrane et la source d'approvisionnement en eau afin d'assurer l'enlèvement adéquate du malathion.
| Concentration initiale | Rejet | Type de membrane | Description du procédé | Référence |
|---|---|---|---|---|
| 1057,8 μg dans une solution de 150 mL | 99,65 % | NS-100 | Étude à l'échelle d'essai de banc : cellule d'essai statique en acier inoxydable Solution aqueuse préparée à partir d'eau déminéralisée Température ambiante; pression = 40,8 atm (600 lb/po2) NS-100 : Membrane en polyéthylénimine réticulée; débit moyen du perméat = 49 ml/cm2/jour (12 gal/pi2/j)2/day (12 gfd) CA : Membrane en acétate de cellulose; débit moyen du perméat = 32 ml/cm2/jour (8 gal/pi2/j)2/day (8 gfd) |
Chian et coll. (1975) |
| 99,16 % | CA | |||
| 0,5 – 1,5 mg/L | 99,64 % | Memb-1 | Étude à l'échelle d'essai de banc; membranes planes Memb-1: Alcool polyvinylique/polyamide; rejet de NaCl = 92 %; Note de bas de page tableau 8 - aJw=0,988 m/j; P = 1 MPa Memb-2: Alcool polyvinylique/polyamide; rejet de NaCl = 60 %; Note de bas de page tableau 8 - aJw = 2,435 m/j; P = 1 MPa Memb-3: Polyéthersulfone sulfoné; rejet de NaCl = 51 %; Note de bas de page tableau 8 - aJw Memb-4: Polyéthersulfone sulfoné; rejet de NaCl = 15 %; Note de bas de page tableau 8 - aJw = 6,205 m/j; P = 0,5 MPa |
Kiso et coll. (2000) |
| 88,1 % | Memb-2 | |||
| 42,0 % | Memb-3 | |||
| 41,4 % | Memb-4 | |||
| 10 mg/L | 61 %Note de bas de page tableau 8 - b (P = 560 kPa) |
NF-A | À l'échelle d'essai de banc; eaux usées synthétiques NF-A: Membrane à film mince de polypipérazineamide; rétention de MgSO4 >99 %; débit d'eau traitée = 58,4 L/m2∙h |
Zhang et Pagilla (2010) |
| 98 %Note de bas de tableau 8 - b (P = 1 680 kPa) |
||||
| 78 %Note de bas de tableau 8 - b (P = 560 kPa) |
NF90 | À l'échelle d'essai de banc; eaux usées synthétiques NF90: Membrane de polyamide composite à film mince; rétention de MgSO4 >97 %; débit d'eau traitée = 40,5 L/m2∙h; taille des pores = 0,55 ± 0,13 nm; porosité = 17,1% |
||
| 98 %Note de bas de tableau 8 - b (P = 1 680 kPa) |
||||
| 55 %Note de bas de tableau 8 - b (P = 560 kPa) |
NF270 | À l'échelle d'essai de banc; eaux usées synthétiques NF270: Membrane de polyamide composite à film mince; rétention de MgSO4 >97 %; débit d'eau traitée = 53,2 L/m2∙h; taille des pores = 0,71 ± 0,14 nm; porosité = 11,7 % |
||
| 92%Note de bas de tableau 8 - b (P=1680kPa) |
||||
| 5,7 mg/L | 93,5 % | Membrane de NF tubulaire en céramique | Étude à l'échelle d'essai de banc Propriétés de la membrane : Céramique/TiO2-Al2O3; configuration tubulaire; superficie de0,245 m2; taille des pores = 1 kDa; pression = 5 bars2 surface area; 1 kDa pore size 2-Al2O3; |
Sorour et Shaalan (2013) |
| 17,1 g/L | 99,4 % | |||
4.2.1.4 Oxydation et hydrolyse
L'oxydation chimique et l'hydrolyse sont les voies de dégradation les plus importantes pour les pesticides organophosphorés dans des conditions de traitement de l'eau potable (Durik et coll., 2006; Newhart, 2006). La dégradation du malathion dans l'eau dépend du pH et est plus rapide à un pH supérieur à 7,0. La demi-vie du malathion dans l'eau varie de 0,2 semaine à un pH de 8,0 à 21 semaines à un pH de 6,0 (Newhart, 2006). Les études menées sur la dégradation du malathion à l'aide de divers agents oxydants sont présentées au tableau 9.
Les procédés courants d'oxydation-désinfection présentent une réactivité très variable pour le malathion (Roche et Prados, 1995; Durik et coll., 2009, 2010; Chamberlain et coll., 2012). Dans des essais de banc réalisés à l'aide des doses de chlore (Cl2) et d'ozone (O3) ordinairement utilisées pour la désinfection de l'eau, on a mesuré un taux modéré à élevé d'enlèvement d'une faible concentration de malathion (Chamberlain et coll., 2012) (tableau 9). Une chloration à des pH de 6,6 et de 8,6 et un procédé d'ozonation à un pH de 6,6 ont produit des taux d'enlèvement du malathion de plus de 50 %. On a constaté que l'ozonation à un pH de 8,6 produisait un taux modéré d'enlèvement variant de 20 à 50 %. Des oxydants comme la monochloramine (NH2Cl), le dioxyde de chlore (ClO2), le permanganate (MnO4) et le peroxyde d'hydrogène (H2O2) ainsi que la photolyse directe par irradiation ultraviolet (UV) à 254 nm ont éliminé moins de 20 % du malathion. Des essais d'hydrolyse réalisés à des pH de 2, de 7 et de 12 ont produit des résultats semblables (Chamberlain et coll., 2012). L'utilisation de la photolyse directe par irradiation UV s'est également révélée inefficace pour la dégradation du malathion selon Beduk et coll. (2012) et Li et coll. (2019). La photolyse directe des pesticides organophosphorés à l'aide de lampes UV à basse pression et à moyenne pression était très lente et affichait un faible rendement quantique (Wu et Linden, 2008).
Plusieurs paramètres influent sur l'efficacité de la dégradation du malathion, dont la matrice d'eau, la dose d'ozone et le temps de contact (Roche et Prados, 1995; Beduk et coll., 2012). Lors d'un essai de banc sur l'ozonation, Roche et Prados (1995) ont étudié l'effet de l'alcalinité de l'eau sur l'efficacité de l'oxydation de 11 pesticides, dont le malathion. En raison du rôle inhibiteur des espèces carbonatées, le taux d'enlèvement du malathion était plus élevé dans une eau faiblement alcaline (aucune donnée précise n'est fournie). Les essais d'ozonation menés par Beduk et coll. (2012) ont indiqué un taux accru de dégradation du malathion lorsque la dose d'ozone et le pH de l'eau étaient plus élevés. Une réaction directe avec l'ozone (ozonolyse) était responsable de la dégradation du malathion à un faible pH, tandis qu'un pH élevé de 9,0 entraînait la formation non sélective du radical hydroxyle (*OH).
Duirk et coll. (2009) ont examiné la dégradation du malathion dans de l'eau désionisée à l'aide d'acide hypochloreux (HOCl). La vitesse d'oxydation du malathion était rapide dans les conditions d'essai, et l'efficacité de l'oxydation était étroitement liée au pH de l'eau. L'acide hypochloreux est un acide faible qui se dissocie pour produire des ions hypochlorite (OCl−) avec une constante de dissociation (pKa) d'environ 7,6 à 20 °C. Les espèces chlorées présentes dans l'eau sous forme d'acide hypochloreux sont dissociées en ions hypochlorite (OCl-) lorsque le pH passe de neutre à alcalin. L'étude a démontré que l'ion OCl- n'oxydait pas le malathion en malaoxon (sous-produit de dégradation, abordé plus loin dans cette section); mais accélérait l'hydrolyse du malathion. Dans des expériences semblables, on a examiné l'oxydation du malathion par les chloramines en utilisant de l'eau désionisée et une plage de pH variant entre 3,0 et 9,0 (Duirk et coll., 2010). La concentration initiale de malathion était de 0,5 µM et la dose initiale de monochloramine était de 50 µM. L'auto-décomposition de la monochloramine est un processus qui dépend du pH et qui permet la coexistence de plusieurs oxydants chlorés à un pH neutre [(monochloramine (NH2Cl), dichloramine (NHCl2) et HOCl)] (Valentine et Jafvert, 1992). Le taux de réaction de la monochloramine pour la dégradation du malathion était faible. La dichloramine affichait un taux de réaction de deux ordres de grandeur supérieurs à la monochloramine, mais de trois ordres de grandeur plus faibles que l'acide hypochloreux. Les auteurs ont indiqué qu'une dégradation de 56 % du malathion était principalement due à l'oxydation par la dichloramine, lorsque le procédé d'oxydation se déroulait à un pH de 6,5. À un pH supérieur à 8,0, l'hydrolyse alcaline était la principale voie de dégradation du malathion, dans une proportion de 93 % (Duirk et coll., 2010).
Les pesticides organophosphorés comportent une liaison phosphore-soufre (P=S) qui est fortement réactive et facilement dégradée par oxydation, procédé qui engendre des oxons présentant des liaisons phosphore-oxygène (P=O) comme principaux sous-produits de dégradation (Magara et coll., 1994; Kamel et coll., 2009; Beduk et coll., 2012). Le malaoxon est plus persistant que le malathion et présente une cinétique de dégradation de 4,3 à 5,6 plus faible que la molécule parente (Magara et coll., 1992; Durik et coll., 2010; Beduk et coll., 2012; Li et coll., 2019). Par ailleurs, dans une étude réalisée par Aizawa et Magara, (1992) (tel que cité dans Magara et coll., 1994), on a constaté que deux autres sous-produits de dégradation, le chloromaléate de diéthyle et le maléate d'éthyle, se formaient au cours de la chloration du malathion. Newhart, (2006) a aussi fait état de plusieurs sous-produits de dégradation formés au cours de l'hydrolyse du malathion dans des conditions aérobiques alcalines, comme les formes alpha et bêta des acides monocarboxyliques du malathion, le fumarate de diéthyle, le thiomalate de diéthyle, le phosphorothioate de O,O-diméthyle, le thiomalate de diéthyle et le S-hydrogéno-phyosphorothionate de O,O-diméthyle. Aucun renseignement sur le traitement n'était fourni dans l'étude.
Beduk et coll. (2012) ont étudié la dégradation du malathion par ozonation et la formation de malaoxon. Bien qu'une concentration de malathion de 200 µg/L ait été entièrement éliminée, à une concentration de 12 µg/L, du malaoxon s'est formé à une dose d'ozone de 1,5 mg/L et à un pH de 9,5. L'augmentation de la dose d'ozone à 2 et à 2,5 mg/L a réduit la formation de malaoxon à 8 et à 7 µg/L, respectivement. Les auteurs ont conclu que même de fortes doses d'ozone n'étaient pas efficaces pour l'enlèvement complet du malaoxon. Duirk et coll. (2010) ont constaté que le malaoxon était très stable en présence de chloramine à un pH de 8,5.
| Oxydant | Concentration initiale (µg/L) |
Dose d'oxydant (mg/L) |
Enlèvement (%) ou taux de réaction (M-1h-1) | Description du procédé | Référence |
|---|---|---|---|---|---|
| Cl2 | 1,5-3 | 2-5 | >50 % (pH de 6,6 et de 8,6) | À l'échelle d'essai de banc : eau tamponnée (phosphate de sodium); 23 ± 1 °C et pH de 6,6 et de 8,6 | Chamberlain et coll. (2012) |
| O3 | 1-2 | > 50 % (pH de 6,6) 20-50 % (pH de 8,6) |
|||
| NH2Cl | 9-14 | <20 % | |||
| MnO4- | 3-5 | ||||
| ClO2 | 2-3 | ||||
| H2O2 | 100 | ||||
| UV254 | 77-97 mV·s/cm2 | ||||
| UV254 | 200 | - | 4,4 % | Réacteur à l'échelle d'essai de banc : eau désionisée; lampe UV à moyenne pression; temps de contact de 90 min | Beduk et coll. (2012) |
| O3 | 11,0 | 1 | 70,9 % | À l'échelle d'essai de banc : eau du robinet déchlorée additionnée de pesticides; COT = 2,1 mg/L; alcalinité = 240 mg/L CaCO3; pH de 8,3; demande d'ozone = 0,5 mg/L; temps de contact de 10 min | Roche et Prados (1995) |
| 2 | 89,1% | ||||
| 3 | 96,5 % | ||||
| 4 | >99 % | ||||
| 5 | >99 % | ||||
| 200 | 1,5 | ~100 % : 20 min (pH de 9,0); 30 min (pH de 6,5) |
Réacteur à l'échelle d'essai de banc : eau désionisée; pH de 6,5 et de 9,0. Formation de malaoxon |
Beduk et coll. (2012) | |
| HOCl/OCl- | 0,5 µM | 0-100 µM | 1,72 (± 0,36) x 106/ 382 (± 0,26)M-1h-1 |
À l'échelle d'essai de banc : eau désionisée; 0,5 μM de malathion, pH de 6,5, T0 25 ± 1 ˚C |
Duirk et coll. (2009) |
4.2.1.5 Procédés d'oxydation avancée
Les procédés d'oxydation avancée (POA) ont recours à des réactions chimiques pour former les radicaux hydroxyles qui servent à oxyder certains produits chimiques, dont les pesticides (Crittenden et coll., 2012). On a examiné différents procédés d'oxydation avancée utilisés pour la dégradation du malathion, notamment les procédés UV/peroxyde d'hydrogène (H2O2); O3/UV et O3/H2O2/UV (voir le tableau 10).
Dans des essais en banc, on a constaté que la présence d'ions carbonate et sulfate avait un effet nuisible sur la dégradation du malathion lorsque le procédé UV/H2O2 était utilisé, le carbonate ayant l'effet le plus marqué (Fadaei, et coll., 2012). Les auteurs ont remarqué que la dégradation du malathion était maximale dans l'eau distillée, suivie de l'eau du robinet, puis de l'eau de rivière. Cette différence dans la dégradation du malathion était due à la capacité de piégeage des radicaux hydroxyle par les ions bicarbonate et sulfate et à la présence de carbone organique dans les eaux naturelles. Un accroissement du pH et de la concentration de peroxyde d'hydrogène augmentait le taux de dégradation du malathion.
Beduk et coll. (2012) ont étudié la dégradation du malathion et la formation subséquente de malaoxon dans une solution aqueuse à l'aide de procédés d'ozonation photocatalytique (O3/UV et O3//UV/ H2O2). Dans le cas du procédé O3/H2O2/UV, le malathion et le malaoxon formé en cours de procédé ont été éliminés efficacement au bout d'un temps de réaction de 10 et de 30 minutes, respectivement.
Dans une étude à l'échelle d'essai de banc réalisée par Roche et Prados (1995), on a atteint un taux de dégradation du malathion de plus de 99 % pour toutes les doses utilisées d'O3 avec l'ajout de H2O2 à un taux constant de 0,4 g H2O2/g d'O3. Les résultats présentés au tableau 10 montrent qu'une dégradation du malathion d'environ 100 % pouvait être obtenue avec 1,0 mg d'O3/L et l'ajout de 0,4 mg H2O2/L, comparativement au procédé utilisant uniquement de l'ozone, à raison de 4,0 mg d'O3/L. Dans une étude semblable menée par Li et coll. (2019), on a atteint un taux de réaction beaucoup plus élevé (de deux ordres de grandeur) pour l'oxydation UV/H2O2 que pour la photolyse directe par irradiation UV. La réaction de dégradation par photolyse UV directe fait intervenir l'adsorption de photons, tandis que dans le procédé UV/H2O2, la réaction implique la formation d'un radical hydroxyle. Li et coll. (2019) ont aussi évalué la formation de sous-produits. Leur étude a montré que chaque POA entraînait la formation d'un groupe de sous-produits de dégradation qui lui était propre. Une analyse du carbone organique total (COT) a révélé que dans les procédés étudiés, le malathion était faiblement minéralisé. Le malathion était converti en sous-produits de dégradation plutôt que d'être minéralisé en CO2 et en eau.
Avant toute mise en œuvre à grande échelle, il faudrait mener des essais pilotes ou des essais de banc afin d'évaluer l'enlèvement du malathion ainsi que les produits de dégradation.
| Procédés | Concentration Initiale (µg/L) |
Dose initiale d'oxydant (mg/L) |
Catalyseur | Enlèvement (%) ou taux de réaction (cm2/mJ ) | Description du procédé et renseignements sur les sous-produits | Référence |
|---|---|---|---|---|---|---|
| UV/ H2O2 | 200, 400 et 600 | Lampe au mercure à moyenne pression de 150 w | 10 mg/L H2O2 | Enlèvement moyenne : 77,88 ± 23,96 % | Eau distillée : pH de 3,0, de 7,0 et de 9,0; T = 25 ± 1 ˚C; temps de contact de 180 s | Fadaei et coll. (2012) |
| 30 mg/L H2O2 | Enlèvement moyenne : 82,17 ± 24,24 % | |||||
| 30 mg/L H2O2 | ~ 45 % (en 60 s) ~ 65 % (en 180 s) |
Eau du robinet additionnée de 200 µg/L de malathion; turbidité de 1 NTU; pH de 7,44; alcalinité de 210 mg/L sous forme de CaCO3; HCO3- 256 mg/L; SO42- 79 mg/L |
||||
| 30 mg/L H2O2 | ~ 40 % (en 60 s) ~ 60 % (en 180 s) |
Eau de rivière additionnée de 200 µg/L de malathion; turbidité de 12,5 NTU; pH de 7,46; alcalinité de 290 mg/L CaCO3; HCO3- 354 mg/L; SO42- 68 mg/L | ||||
| 15 μM | 0,58 mW/cm-2 | Pas de H2O2 | 6,5 x 10- 4 cm2/mJ | Réacteur à l'échelle d'essai de banc : solution aqueuse pH de 7,0; T = 20 ± 0,5 ˚C |
Li et coll. (2019) | |
| 0,3 mM H2O2 | 133,6 x 10- 4 cm2/mJ | |||||
| O3/UV | 200 | 2,0 mg/L O3 | UV 254 nm | ~100 % (en 12 min) |
Réacteur à l'échelle d'essai de banc : Pas de dégradation complète du malaoxon : 13 µg/L en 10 min; 2 µg/L après 90 min |
Beduk et coll. (2012) |
| O3/UV/ H2O2 | UV 254 nm; H2O2 (20, 40 et 100 mg/L) | ~100 % (en 10 min) |
Réacteur à l'échelle d'essai de banc : optimum : 40 mg/L H2O2 Malaoxon : Enlèvement de 100 % (en 30 min) |
|||
| O3/H2O2 | 11,0 | 1, 2, 3, 4 et 5 mg/L O3 | 0,4, 0,8, 1,2, 1,6 et 2,0 mg/L H2O2 (H2O2/O3 = 0,4 g/g) | >99 % pour toutes les doses | À l'échelle d'essai de banc : eau du robinet déchlorée additionnée de pesticides; COT = 2,1 mg/L; alcalinité = 240 mg/L CaCO3; pH de 8,3; demande d'ozone = 0,5 mg/L | Roche et Prados (1995) |
4.2.1.6 Techniques combinées
Comme il a été abordé à la section 4.2.1.4 sur l'oxydation, des sous-produits, dont le malaoxon, peuvent être formés au cours de procédés comme la chloration. Dans un essai de banc mené par Li et coll. (2016), on a examiné l'enlèvement du malathion et la formation subséquente de malaoxon. Les auteurs ont démontré que l'efficacité d'enlèvement par coagulation et par un procédé combiné de coagulation-CAP était plus élevée pour le malathion (5 % et 38 %, respectivement) que pour le malaoxon (2 % et 24 %, respectivement). Les auteurs ont ensuite examiné les effets de diverses doses de préchloration sur le taux d'enlèvement global du malathion pendant tout le procédé de traitement en évaluant l'enlèvement brute du malathion et du malaoxon après diverses étapes. On a utilisé une chaîne de traitement comprenant des procédés de préchloration, de coagulation-sédimentation-filtration avec CAP et de post-chloration à l'aide de diverses doses de préchloration (0 à 3 mg/L) (voir le tableau 11). Le meilleur taux d'enlèvement brute totale tant pour le malathion que pour le malaoxon a été atteint dans le scénario ne comportant pas d'étape de préchloration. En l'absence de préchloration, le malathion n'est pas oxydé en malaoxon, plus difficile à enlever, ce qui permet d'obtenir un taux plus élevé d'enlèvement brute. Une plus forte dose de préchloration entraîne la formation de malaoxon et donc, une diminution de l'enlèvement globale.
| Concentration Initiale (µg/L) |
Dose de préchloration (mg/L) | Enlèvement brute du malathion et du malaoxon (%) | Rendement | |||
|---|---|---|---|---|---|---|
| Préchloration | CSF-CAPNote de bas de tableau 11 - a | Post-chloration | Total | |||
| 10 | 0 | 0,0 | 37,5 | 5,0 | 42,5 | À l'échelle d'essai de banc : eau de rivière brute (pH de 7,3; conductivité = 267 μS/cm; turbidité = 4,15 NTU; COD = 4,37 mg/L; 254= 0,127cm-1; alcalinité = 77,1 mg/L; Na+=6,3 mg/L; K+=2,2 mg/L; Ca2+=48 mg/L; Mg2+=4,6 mg/L; SO42-=30,2 mg/L; Cl-=18,6 mg/L; F-=0,7 mg/L) 10 mg/L PAC; 120 μM Al2SO4 Agitation rapide : 250 tr/min pendant 1 minute; agitation lente : 30 tr/min pendant 15 min; temps de décantation de 30 min; post-chloration : 1 mg/L pendant 30 minutes. |
| 0,25 | -0,2 | 32,0 | 7,4 | 39,2 | ||
| 0,5 | 1,0 | 27,7 | 7,1 | 35,8 | ||
| 0,75 | 2,5 | 23,3 | 7,4 | 33,2 | ||
| 1 | -0,7 | 19,9 | 7,6 | 26,8 | ||
| 1,5 | 4,7 | 16,2 | 3,3 | 24,2 | ||
| 2 | 8,4 | 16,1 | 0,4 | 24,9 | ||
| 3 | 8,5 | 15,1 | 0,2 | 23,8 | ||
4.2.2 Traitement à l'échelle résidentielle
Dans les cas où l'on souhaite enlever le malathion à l'échelle résidentielle, par exemple lorsque l'eau potable d'une maison provient d'un puits privé, un dispositif de traitement résidentiel peut être employé pour réduire les concentrations de malathion dans l'eau potable. Avant d'installer un dispositif de traitement, il faut analyser la source d'approvisionnement en eau afin d'en déterminer les propriétés chimiques générales et sa concentration en malathion.
Pour vérifier l'efficacité d'un dispositif de traitement, il faut régulièrement prélever des échantillons de l'eau qui entre dans le dispositif de traitement et qui en sort, et envoyer ceux-ci à un laboratoire accrédité à des fins d'analyses. Les appareils peuvent perdre de leur capacité d'enlèvement avec le temps et l'usure; il faut les entretenir et, parfois, les remplacer. Les consommateurs devraient vérifier la durée de vie prévue des composantes de l'appareil de traitement selon les recommandations du fabricant, et veiller à leur entretien au besoin. Certains systèmes résidentiels peuvent avoir une capacité nominale permettant de traiter des volumes supérieurs à ceux d'une seule résidence, de sorte qu'ils peuvent aussi être utilisés dans des systèmes de petite taille.
Santé Canada ne recommande aucune marque particulière d'unité de traitement de l'eau potable, mais conseille fortement aux consommateurs d'utiliser des unités de traitement de l'eau potable dont la conformité à la norme internationale (NSF) et à la norme américaine nationale (ANSI) pertinentes est attestée par un organisme de certification accrédité. Ces normes visent à établir des exigences minimales relatives aux matériaux, à la conception et à la construction des dispositifs de traitement de l'eau potable qui peuvent être vérifiées par un tiers. Elles permettent de prévenir le lessivage dans l'eau potable des contaminants présents dans les matériaux (c.-à-d. sûreté des matériaux). Par ailleurs, les normes comportent des exigences en matière d'efficacité qui établissent le degré d'enlèvement qui doit être assuré à l'égard de certains contaminants (par example, allégation de réduction) potentiellement présents dans les sources d'approvisionnement en eau. Les organismes de certification (c.-à-d. tiers), qui doivent être accrédités par le Conseil canadien des normes, garantissent qu'un produit est conforme aux normes en vigueur. Les organismes accrédités au Canada comprennent notamment :
- Groupe CSA;
- NSF International;
- Water Quality Association;
- UL LLC;
- Bureau de normalisation du Québec;
- International Association of Plumbing and Mechanical Officials; et
- Truesdail Laboratories, Inc.
On peut obtenir une liste à jour des organismes de certification accrédités auprès du Conseil canadien des normes.
Les techniques de traitement de l'eau potable susceptibles d'enlever efficacement le malathion à l'échelle résidentielle comprennent l'adsorption et l'OI. À l'heure actuelle, le malathion n'est pas visé par les exigences de rendement des normes NSF/ANSI. Toutefois, les consommateurs peuvent utiliser un dispositif de traitement qui est certifié conforme aux normes relatives à l'osmose inverse ou à l'adsorption pour s'assurer que la sûreté des matériaux a été évaluée.
L'eau qui a été traitée par OI peut être corrosive pour les éléments internes du système de plomberie. Ces dispositifs devraient donc être installés uniquement au point d'utilisation. Étant donné que de grandes quantités d'influent sont nécessaires pour obtenir le volume d'eau traitée requis, il n'est généralement pas pratique d'installer ces dispositifs au point d'entrée.
5.0 Stratégie de gestion
Tous les responsables de systèmes d'approvisionnement en eau potable devraient mettre en œuvre une approche de gestion des risques, comme l'approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l'eau, pour assurer la salubrité de l'eau (CCME, 2004; OMS, 2011, 2012). Lorsqu'on adopte ces démarches, il faut procéder à une évaluation du système afin de caractériser la source d'approvisionnement, de décrire les barrières qui préviennent ou réduisent la contamination, de recenser les conditions qui peuvent donner lieu à une contamination et de mettre en place des mécanismes de contrôle. Une surveillance opérationnelle est ensuite établie, et des protocoles de fonctionnement et de gestion sont instaurés (par example mode opératoire normalisé, mesures correctives et interventions en cas d'incident). La surveillance de la conformité est élaborée, et d'autres protocoles de validation du plan de salubrité de l'eau sont mis en œuvre (par example tenue de registres, satisfaction des consommateurs). La formation des opérateurs est également nécessaire pour assurer l'efficacité en tout temps du plan de salubrité de l'eau (Smeets et coll., 2009).
5.1 Surveillance
Le malathion peut être présent dans les eaux souterraines et les eaux de surface dans les régions où il est utilisé, selon le type et l'étendue de son application, les facteurs environnementaux (par example quantité de précipitations, type de sol, milieu hydrogéologique, etc.) et le devenir dans l'environnement (par example mobilité, potentiel de lessivage, dégradation, etc.) dans les environs. Les responsables de réseaux d'approvisionnements en eau potable devraient évaluer la possibilité que le malathion pénètre dans les sources d'eau (par example approvisionnement en eau brute d'un réseau d'eau potable) en fonction des facteurs propres au site.
S'il est déterminé que du malathion pourrait être présent et qu'une surveillance est nécessaire, il faut caractériser les eaux souterraines et les eaux de surface afin de mesurer la concentration de malathion. Cela devrait comprendre la surveillance des sources d'eau de surface pendant les périodes de pointe d'utilisation et de précipitations ou la surveillance annuelle des sources d'eau souterraine. Lorsque les données de référence indiquent que la source d'approvisionnement ne contient pas de malathion, la surveillance peut être réduite.
Lorsqu'un traitement est nécessaire pour enlever le malathion, il faudrait assurer une surveillance opérationnelle afin de déterminer si le procédé de traitement fonctionne comme prévu. La fréquence de la surveillance opérationnelle dépendra de la qualité de l'eau, de la fluctuation des concentrations dans l'eau brute et du procédé de traitement. Les autorités responsables devraient être conscientes de l'incidence de la matière organique naturelle sur les systèmes au charbon actif, car cette interaction peut avoir un effet sur les objectifs de qualité de l'eau pour ce qui est de l'enlèvement du malathion.
Lorsqu'un traitement est utilisé pour enlever le malathion, il faudrait effectuer une surveillance de conformité (échantillons appariés de la source d'approvisionnement et d'eau traitée afin de confirmer l'efficacité du traitement) au moins tous les ans. Lorsque la surveillance opérationnelle périodique indique un risque de pénétration du contaminant, comme avec le CAG, la surveillance devrait être exercée chaque trimestre afin qu'on puisse planifier la régénération ou le remplacement du matériau. Lorsqu'on a recours à un procédé de dégradation, comme l'oxydation, la surveillance de la formation de sous-produits devrait aussi être envisagée.
6.0 Considérations internationales
D'autres organismes nationaux et internationaux ont adopté des recommandations, des normes ou des valeurs guides pour le malathion dans l'eau potable. Les valeurs varient en fonction de la date à laquelle remonte l'évaluation sur laquelle elles sont fondées et des différentes politiques et approches, notamment le choix de l'étude principale et les taux de consommation, les poids corporels et les facteurs d'attribution liés à la source d'approvisionnement en eau employés (tableau 12).
Le National Health and Medical Research Council (NHMRC) de l'Australie a établi une valeur guide de 0,07 mg/L pour le malathion dans l'eau potable en se fondant sur l'inhibition de l'EChE chez le rat (NHMRC et NRMMC, 2011). L'US EPA n'a pas fixé de Maximum Contaminant Level (MCL; concentration maximale de contaminants) pour le malathion (US EPA, 2009). L'Organisation mondiale de la santé (OMS) a conclu que les concentrations de malathion dans l'eau potable étaient bien inférieures aux concentrations préoccupantes pour la santé et n'a donc pas établi de valeur guide officielle pour le malathion (2004, 2017b).
L'Union européenne (UE) ne fixe pas de valeurs paramétriques chimiques propres à des pesticides. Elle établit plutôt une valeur de 0,1 µg/L pour chaque pesticide (unique) et une valeur de 0,5 µg/L pour l'ensemble des pesticides présents dans l'eau potable. En établissant ces valeurs, l'UE n'a pas tenu compte des données scientifiques sur chaque pesticide, dont les effets sur la santé. Les valeurs reposent plutôt sur une décision politique de retirer les pesticides de l'eau potable (UE, 1998).
| Organisme (année) |
Valeur (mg/L) | Principal effet (Référence) | NO(A)EL (mg/kg p.c. par jour) | FI | AQA (mg/kg p.c./jour) | P.c. (kg) | Apport d'EP (L/jour) |
FA (%) | Commentaires |
|---|---|---|---|---|---|---|---|---|---|
| Santé Canada – CMA proposée | 0,29 | Aggravation de la néphropathie chronique observée lors d'une étude de toxicité et de cancérogénicité de 2 ans sur les rats (Daly, 1996) | 3 (NOAEL) | 100 | 0,030 | 74 | 1,53 | 20 | aucune donnée disponible |
| US EPA (2009; 2018) | 0,5 (seuil sanitaire non réglementaire sur la durée de la vie) | Inhibition de l'EChE chez les petits, selon l'étude comparative à doses orales multiples de la ChE chez le rat (US EPA, 2009) | 7,1 (BMDL10) | 100 | 0,07 (DRf) |
70 | 2 | 20 | L'US EPA a adopté un seuil sanitaire non réglementaire sur la durée de la vie plutôt qu'un MCL pour le malathion dans l'eau potable, qui est fondé sur la concentration équivalente dans l'eau potable (DWEL) de 2 mg/L, obtenue à partir de la DRf (US EPA, 2018). |
| OMS (2004; 2017b) | 0,9 (VBS non réglementaire) | Diminution du taux de survie, du poids corporel et de l'activité de l'AChE dans une étude de toxicité et de cancérogénicité de 2 ans sur le rat (Daly, 1996). | 29 (NOAEL) | 500 | 0,3 | 60 | 2 | 10 | L'OMS a établi une VBS non réglementaire plutôt qu'une recommandation officielle pour le malathion dans l'eau potable (OMS, 2017b). |
| Australie (NHMRC et NRMMC, 2011) | 0,07 | Inhibition de la ChE érythrocytaire observée dans une étude de 2 ans sur le rat (Daly, 1996) |
2 (NOEL) | 100 | 0,02 | 70 | 2 | 10 | Aucune référence n'est fournie pour l'étude de 2 ans sur le rat dans NHMRC et NRMMC, 2011, mais la description est cohérente avec Daly, 1996. |
| EU (1998) | 0,1 µg/L | L'UE a une valeur de 0,1 µg/L pour chaque pesticide (unique) et une valeur de 0,5 µg/L pour l'ensemble des pesticides présents dans l'eau potable. Lors de l'établissement de ces valeurs, l'UE n'a pas tenu compte des données scientifiques relatives à chaque pesticide, y compris les effets sur la santé. Les valeurs reposent plutôt sur une décision stratégique visant à écarter les pesticides des sources d'eau potable. | |||||||
|
FA – Facteur d'attribution BMDL10 – Limite inférieure de l'intervalle de confiance pour une réponse de 10 % p.c. – Poids corporel EP – Eau potable DWEL – Concentration équivalente dans l'eau potable (Drinking water equivalent level) NOEL – Dose sans effet observé (No observed effect level) DRf – Dose de référence FI – Facteur d'incertitude |
|||||||||
7.0 Justification
Le malathion est un insecticide et un acaricide homologué utilisé dans une grande variété de sites, dans les zones agricoles et non agricoles. Même si ce produit est largement utilisé au Canada, les données fournies par les provinces et les territoires qui assurent la surveillance du malathion dans les sources d'approvisionnement en eau et dans l'eau potable indiquent que les concentrations détectées, le cas échéant, sont bien inférieures à la CMA proposée. Le rein est considéré comme l'organe cible le plus sensible aux effets toxiques du malathion. Bien qu'aucune étude réalisée chez l'humain n'ait porté sur les effets du malathion sur le rein, des études menées sur des rats et des chiens ont montré de façon systématique une néphrotoxicité à la suite d'une exposition au malathion.
Santé Canada, en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, propose une CMA de 0,29 mg/L (290 µg/L) pour le malathion dans l'eau potable en se fondant sur les considérations suivantes :
- Une VBS de 0,29 mg/L (290 µg/L) a été adoptée, compte tenu de l'aggravation de la néphropathie chronique chez les rats femelles.
- Il existe des méthodes d'analyse qui permettent de mesurer le malathion avec précision à des concentrations bien inférieures à la CMA proposée.
- Il existe des techniques de traitement qui permettent de ramener efficacement les concentrations de malathion en deçà de la CMA proposée.
La CMA proposée vise à offrir une protection contre les effets potentiels sur la santé. Dans le cadre de son processus d'examen continu des recommandations, Santé Canada continuera de surveiller les nouvelles recherches dans ce domaine, y compris les résultats d'évaluation de l'ARLA, et recommandera des changements dans le présent document technique, au besoin.
8.0 Références
- ACIA. (2019a). Projet sur les aliments destinés aux enfants – Rapport final – 2014 à 2015. Agence canadienne d'inspection des aliments, Ottawa (Canada).
- ACIA. (2019b). Rapport annuel du Programme national de surveillance des résidus chimiques et Programme de surveillance de la salubrité des aliments 2015-2016. Agence canadienne d'inspection des aliments, Ottawa (Ontario).
- AGAT Laboratories Ltd. (2019). Communication personnelle avec N. Boulton. Waterloo, ON.
- Ahmed, T., Pathak, R., Mustafa, M. D., Kar, R., Tripathi, A. K., Ahmed, R. S. et Banerjee, B.D. (2011). Ameliorating effect of N-acetylcysteine and curcumin on pesticide-induced oxidative DNA damage in human peripheral blood mononuclear cells. Environ. Monit. Assess., 179: 293–299.
- Aizawa, T. et Magara, Y. (1992). Behavior of pesticides in drinking water purification system. Water Malaysia. '92, 8th. Aspac-IWSA regional water supply conference and exhibition. Technical paper 3 10D2-1-10D2-9.
- Akbel, E., Arslan-Acaroz, D., Demirel, H. H., Kucukkurt, I. et Ince, S. (2018). The subchronic exposure to malathion, an organophosphate pesticide, causes lipid peroxidation, oxidative stress, and tissue damage in rats: the protective role of resveratrol. Toxicol. Res., 7(2018): 503-512.
- Akhgari, M., Abdollahi, M., Kebryaeezadeh, A., Hosseini, R. et Sabzevari, O. (2003). Biochemical evidence for free radical-induced lipid peroxidation as a mechanism for subchronic toxicity of malathion in blood and liver of rats. Hum. Exp. Toxicol., 22(2003): 205-211.
- Alavanja, M. C., Hofmann, J. N., Lynch, C. F., Hines, C. J., Barry, K. H., Barker, J., Buckman, D. W., Thomas, K., Sandler, D. P., Hoppin, J. A., Koutros, S., Andreotti, G., Lubin, J. H., Blair, A. et Beane Freeman, L. E. (2014). Non-Hodgkin lymphoma risk and insecticide, fungicide and fumigant use in the Agricultural Health Study. PLoS One, 9(10): e109332.
- Alp, H. Aytekin, I., Esen, H., Alp, A., Buyukbas, S., Basarali, K., Hatipoglu, N. K. et Kul, S. (2011). Protective effects of caffeic acid phenethyl ester, ellagic acid, sulforaphan and curcuma on malathion induced damage in lungs, liver and kidneys in an acute toxicity rat model. Revue Méd. Vét., 162(7): 333-340.
- ALS Environmental. (2019). Communication personnelle avec A. Ganouri-Lumsden. Waterloo, ON.
- Andreotti, G., Freeman, L. E., Hou, L., Coble, J., Rusiecki, J., Hoppin, J. A., Silverman, D. T. et Alavanja, M. C. (2009). Agricultural pesticide use and pancreatic cancer risk in the Agricultural Health Study Cohort. Int. J. Cancer, 124(10): 2495-500.
- Aston, L. S. (2000). Determination of residues of malathion dicarboxylic acid (DCA), malathion monocarboxylic acid (MCA), dimethyl phosphate (DMP), dimethyl thiophosphate (DMTP), and dimethyl dithiophosphate (DMDTP) in human urine. Étude non publiée réalisée par Pacific Toxicology Laboratories. Californie, États-Unis [tel que cité dans U.S EPA, 2016; OMS, 2017a].
- ATSDR. (2003). Toxicological profile for malathion. Agency for Toxic Substances and Disease Registry, United States Department of Health and Human Services, Public Health Service, Atlanta, Géorgie.
- Baker Jr, E. L., Warren, M., Zack, M., Dobbin, R. D., Miles, J. W., Miller, S., Alderman, L. et Teeters, W. R. (1978). Epidemic malathion poisoning in Pakistan malaria workers. Lancet, 1(8054): 31-34.
- Band, P. R., Abanto, Z., Bert, J., Lang, B., Fang, R., Gallagher, R. P. et Le, N. D. (2011). Prostate cancer risk and exposure to pesticides in British Columbia farmers. Prostate, 71(2): 168-183.
- Barnett Jr, J. F. (2012). Oral (diet) repeated dose 28-day toxicity study of malathion technical in rats. Study no. TQC00065 by Charles River Laboratories Preclinical Services. Rapport non publié, Cheminova A/S, CHA Doc. No.: 1108 FYF. [tel que cité dans OMS, 2017]
- Beduk, F., Aydin, M. E. et Ozcan, S. (2012). Degradation of malathion and parathion by ozonation, photolytic ozonation, and heterogeneous catalytic ozonation processes. Clean - Soil, Air, Water 40 (2): 179-87.
- Bellona, C., Drewes, J. E., Xu, P. et Amy, G. (2004). Factors affecting the rejection of organic solutes during NF/RO treatment – a literature review. Water Res., 38: 279502809.
- Blasiak, J., Jaloszynski, P., Trzeciak, A. et Szyfter, K. (1999). In vitro studies on the genotoxicity of the organophosphorus insecticide malathion and its two analogues. Mutat. Res., 445(2): 275-283.
- British Columbia Ministry of Health. (2019). Communication personnelle avec D. Fishwick.
- Buratti, F. M. et Testai, E. (2005). Malathion detoxification by human hepatic carboxylesterases and its inhibition by isomalathion and other pesticides. J. Biochem. Mol. Toxicol., 19(6): 406-414.
- CARO Analytical Services. (2019). Communication personnelle avec K. Fyffe.
- CCME. (2004). De la source au robinet : guide d'application de l'approche à barrières multiples pour une eau potable saine. Conseil canadien des ministres de l'Environnement, Winnipeg (Manitoba). Disponible à l'adresse https://www.ccme.ca/files/Resources/fr_water/fr_source_to_tap/mba_guidance_doc_f.pdf.
- Chamberlain, E., Shi, H., Wang, T., Ma, Y., Fulmer, A. et Adams, C. 2012. Comprehensive screening study of pesticide degradation via oxidation and hydrolysis. J Agr Food Chem 60 (1): 354-63.
- Chen, H. H., Hsueh, J. L., Sirianni, S. R. et Huang, C. C. (1981). Induction of sister-chromatid exchanges and cell cycle delay in cultured mammalian cells treated with eight organophosphorus pesticides. Mutat Res., 88(3): 307–16.
- Chian, E. S. K., Bruce, W. N. et Fang, H. H. P. (1975). Removal of Pesticides by Reverse Osmosis. Environ.Sci.Technol., 9(1): 52-59.
- Chowdhury, Z. K., Summers, R. S., Westerhoff, G. P., Leto, B. J., Nowack, K.O. et Corwin, C.J. (2013). Activated carbon: Solutions for improving water quality. Passantino, L. B.(ed.). American Water Works Association. Denver, Colorado.
- CIRC. (2017). Monographies du CIRC sur l'évaluation des risques de concérogénicité pour l'homme: Some organophosphate insecticides and herbicides. Volume 112. Working Group on the Evaluation of Carcinogenic Risks to Humans. Centre international de recherche sur le cancer, Organisation mondiale de la santé, Lyon, France. Disponible à l'adresse https://publications.iarc.fr/549.
- Crittenden, J. C., Rhodes Trussell, R., Hand, D. W., Howe, K. J. et Tchobanoglous, G. (2012). MWH's Water Treatment Principles and Design. Troisième édition. John Wiley & Sons, Inc. 1901 p.
- Daly, I. W. (1993a). A 28-day study of malathion in the rat via dietary administration. Study no. 92-3806 by Bio/Dynamics Inc. Rapport non publié. Cheminova A/S, CHA Doc. No.: 68 FYF. [tel que cité dans OMS, 2017]
- Daly, I. W. (1993b). A subchronic (3-month) oral toxicity study of malathion in the rat via dietary administration. Study no. 92-3843 by Bio/Dynamics Inc. Rapport non publié. Cheminova A/S, CHA Doc. No.: 70 FYF. [tel que cité dans OMS, 2017]
- Daly, I. W. (1996). A 24-month oral toxicity/oncogenicity study of malathion in the rat via dietary administration. Huntingdon Life Sciences, East Millstone, NJ. Study No. 90-3641, MRID 43942901. Non publié [tel que cité dans US EPA, 1997; Santé Canada, 2010)
- Decker, U., Knuppe, C. et Ulrich, A. (2003). Malathion technical (fortified): 4-hour acute inhalation toxicity study in rats. RCC Ltd report 846761. Cheminova report No. 443 FYF. Pas de résumé ni rapport. Non publié [tel que cité dans FAO, 2004]
- De Roos, A. J., Zahm, S. H., Cantor, K. P., Weisenburger, D. D., Holmes, F. F., Burmeister, L.F. et Blair, A. (2003). Integrative assessment of multiple pesticides as risk factors for non-Hodgkin's lymphoma among men. Occup. Environ. Med., 60(9): E11.
- Développement durable Manitoba. (2019). Communication personnelle avec Dr H. D. Coulibaly.
- Duirk, S. E. et Collette, T. W. (2006). Degradation of chlorpyrifos in aqueous chlorine solutions: Pathways, kinetics, and modeling. Environ Sci Technol 40 (2): 546-51.
- Duirk, S. E., Desetto, L. M. et Davis, G. M. (2009). Transformation of organophosphorus pesticides in the presence of aqueous chlorine: Kinetics, pathways, and structure - activity relationships. Environ Sci Technol 43 (7): 2335-40.
- Duirk, S. E., Desetto, L. M., Davis, G. M., Lindell, C. et Cornelison, C. T. (2010). Chloramination of organophosphorus pesticides found in drinking water sources. Water Res. 44 (3): 761-8.
- Dulout, F. N., Pastori, M. C. et Olivero, O. A. (1983). Malathion-induced chromosomal aberrations in bone-marrow cells of mice: dose-response relationships. Mutat. Res., 122(2): 163–167.
- EFSA. (2006). Conclusions regarding the peer review of the pesticide risk assessment of the active substance – malathion. EFSA Scientific Report, 63: 1-87. Disponible à l'adresse https://efsa.onlinelibrary.wiley.com/doi/epdf/10.2903/j.efsa.2006.63r.
- EFSA. (2009). Conclusion on pesticide peer review regarding the risk assessment of the active substance malathion. EFSA Scientific Report, 333: 1-118.
- Element Materials Technology Canada Inc. (2019). Communication personnelle avec H. Du.
- Environnement Canada. (2011). Présence et concentrations des pesticides prioritaires dans certains écosystèmes aquatiques canadiens. Direction des sciences et de la technologie de l'eau. No de cat. : En14-40/2011F-PD.
- Fadaei, A. M. et Dehghani, M. H. (2012). Photocatalytic oxidation of organophosphorus pesticides using zinc oxide. Res.J.Chem.Environ., 16(3): 104-109.
- FAO/OMS. (1997). Pesticide residues in food 1997. Evaluations 1997. Part II - Toxicological and Environmental. Malathion, 189-219. IPCS, PMS/PCS/98.6.
- FAO. (2004). FAO specifications and evaluations for agricultural pesticides: Malathion: S-1,2-bis(ethoxycarbonyl)ethyl O,O-dimethyl phosphorodithioate. Food and Agriculture Organisation of the United States. Disponible à l'adresse http://www.fao.org/fileadmin/templates/agphome/documents/Pests_Pesticides/Specs/Malathion2004.pdf.
- FAO/OMS. (2016). Pesticides residues in food 2016. Report of the special session of the joint meeting of the FAO panel of experts on pesticide residues in food and the environment and the WHO core assessment group on pesticide residues, Genève, Suisse.
- Flower, K. B., Hoppin, J. A., Lynch, C. F., Blair, A., Knott, C., Shore, D. L. et Sandler, D.P. (2004). Cancer risk and parental pesticide application in children of agricultural health study participants. Environ. Health Perspect., 112(5): 631-635.
- Gervais, J. A., Luukinen, B., Buhl, K. et Stone, D. (2009). Malathion technical fact sheet. National Pesticides Information Centre, Oregon State University Extension Services. Disponible à l'adresse at http://npic.orst.edu/factsheets/archive/malatech.html.
- Gillies, D. et Dickson, J. (2000). A randomized double blind ascending single oral dose study with malathion to determine the no effect level on plasma and RBC cholinesterase activity (3 volumes). Étude non publiée réalisée par Inveresk Research. Tranent, Écosse [tel que cité dans US EPA, 2016; OMS, 2017a]
- Giri, S., Prasad, S. B., Giri, A. et Sharma, G. D. (2002). Genotoxic effects of malathion: An organophosphorus insecticide, using three mammalian bioassays in vivo. Mutat. Res., 514(1-2): 223-231.
- Giroux, I. (2016). Portrait de la présence de pesticides dans l'eau souterraine près de secteurs maraîchers, vergers, vignes et petits fruits – échantillonnage 2012 à 2014. Direction générale du suivi de l'état de l'environnement, ministère de l'Environnement et de la Lutte contre les changements climatiques, Gouvernement du Québec. Disponible à l'adresse http://www.environnement.gouv.qc.ca/eau/flrivlac/pesticides.htm.
- Giroux, I. (2017). Présence de pesticides dans l'eau de surface au Québec- Zones de vergers et de cultures maraîchères, 2013 à 2016. Direction de l'information sur les milieux aquatiques, ministère de l'Environnement et de la Lutte contre les changements climatiques, Gouvernement du Québec. Disponible à l'adresse http://www.environnement.gouv.qc.ca/eau/flrivlac/pesticides.htm.
- Giroux, I. (2019). Présence de pesticides dans l'eau au Québec : Portrait et tendances dans les zones de maïs et de soya – 2015 à 2017. Direction générale du suivi de l'état de l'environnement, ministère de l'Environnement et de la Lutte contre les changements climatiques, Gouvernement du Québec. Disponible à l'adresse http://www.environnement.gouv.qc.ca/eau/flrivlac/pesticides.htm.
- Goldner, W. S., Sandler, D. P., Yu, F., Hoppin, J. A., Kamel, F. et Levan, T.D. (2010). Pesticide use and thyroid disease among women in the Agricultural Health Study. Am. J. Epidemiol., 171(4): 455-464.
- Goldner, W. S., Sandler, D. P., Yu, F., Shostrom, V., Hoppin, J. A., Kamel, F. et LeVan, T.D. (2013). Hypothyroidism and pesticide use among male private pesticide applicators in the Agricultural Health Study. J. Occup. Environ. Med., 55(10): 1171-1178.
- Gustafson, D. K., Carr, K. H., Carson, D. B., Fuhrman, J. D., Hackett, A. G., Hoogheem, T. J., Snoeyink, V. L., Curry, M., Heijman, B., Chen, S., Herti, P. et van Wesenbeeck, I. (2003). Activated carbon adsorption of chloroacetanilide herbicides and their degradation products from surface water supplies. J. Water Supply Res. Technol. AQUA, 52(6): 443-454.
- Haist-Gulde, B. et Happel, O. (2012). Removal of pesticides and their ionic degradates by adsorptive processes. Report no. 4022. Water Research Foundation, Denver, Colorado.
- Hoppin, J. A., Umbach, D. M., London, S. J., Alavanja, M. C. et Sandler, D.P. (2002). Chemical predictors of wheeze among farmer pesticide applicators in the Agricultural Health Study. Am. J. Respir. Crit. Care Med., 165(5): 683-689.
- Hoppin, J. A., Umbach, D. M., London, S. J., Lynch, C. F., Alavanja, M. C. et Sandler, D.P. (2006). Pesticides and adult respiratory outcomes in the Agricultural Health Study. Ann. N. Y. Acad. Sci., 1076: 343-354.
- Hoppin, J. A., Umbach, D. M., London, S. J., Henneberger, P. K., Kullman, G. J., Alavanja, M. C. et Sandler, D. P. (2008). Pesticides and atopic and nonatopic asthma among farm women in the Agricultural Health Study. Am. J.
- Respir. Crit. Care Med., 177(1): 11-18.
- Hoppin, J. A., Umbach, D. M., London, S. J., Henneberger, P. K., Kullman, G. J., Coble, J., Alavanja, M. C., Beane Freeman, L. E. et Sandler, D.P. (2009). Pesticide use and adult-onset asthma among male farmers in the Agricultural Health Study. Eur. Respir. J., 34(6): 1296-1303.
- Ikahata, K. et El-Din, M. G. (2006). Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type oxidation processes: A review. J. Environ. Eng. Sci. 5(2): 81-135.
- Jellinek, Schwartz & Connolly Inc (2000). The effects and pharmacological disposition of a single oral dose of malathion administered to human volunteers. Étude non publiée commanditée et soumise par Cheminova Agro A/S. [tel que cité dans OMS, 2017a]
- Jensen, I. M. et Whatling, P. (2010). Chapter 71- malathion: A review of toxicology. In: Hayes' handbook of pesticide toxicology. Krieger, R. (éd.). 3e édition, p. 1527-1542.
- Jokanovic, M. (2018). Neurotoxic effects of organophosphorus pesticides and possible association with neurodegenerative diseases in man: A review. Toxicology, 410(2018): 125-131.
- Jusoh, A., Lam, S. S., Hartini, W. J. H. et Ali, N. (2014). Removal of pesticide in agricultural runoff using granular-activated carbon: A simulation study using a fixed-bed column approach. Desalin. Water Treat. 52(4-6): 861-866.
- Kamel, F., Tanner, C., Umbach, D., Hoppin, J., Alavanja, M., Blair, A., Comyns, K., Goldman, S., Korell, M., Langston, J., Ross, G. et Sandler, D. (2007). Pesticide exposure and self-reported Parkinson's disease in the agricultural health study. Am. J. Epidemiol., 165(4): 364-374.
- Kamel, A., Byrne, C., Vigo, C., Ferrario, J., Stafford, C., Verdin, G., Siegelman, F., Knizner, S. et Hetrick, J. (2009). Oxidation of selected organophosphate pesticides during chlorination of simulated drinking water. Water Res. 43 (2): 522-34.
- Kiso, Y., Nishimura, Y., Kitao et T. Nishimura, K. (2000). Rejection properties of non-phenylic pesticides with nanofiltration membranes. J.Membr.Sci., 171(2): 229-237.
- Knappe, D. R. U., Snoeyink, V. L., Roche, P., Prados, M. J. et Bourbigot, M-M. (1999). Atrazine removal by preloaded GAC. J. Am. Water Works Assoc., 91(10): 97-109.
- Koutros, S., Beane Freeman, L. E., Lubin, J. H., Heltshe, S. L., Andreotti, G., Barry, K. H., DellaValle, C. T., Hoppin, J. A., Sandler, D. P., Lynch, C. F., Blair, A. et Alavanja, M.C. (2013). Risk of total and aggressive prostate cancer and pesticide use in the Agricultural Health Study. Am. J. Epidemiol., 177(1): 59-74.
- Koutros, S., Harris, S. A., Spinelli, J. J., Blair, A., McLaughlin, J. R., Zahm, S. H., Kim, S., Albert, P.S., Kachuri, L., Pahwa, M., Cantor, K. P., Weisenburger, D. D., Pahwa, P., Pardo, L. A., Dosman, J. A., Demers, P. A. et Beane Freeman, L. E. (2019). Non-Hodgkin lymphoma risk and organophosphate and carbamate insecticide use in the North American pooled project. Environ. Int., 127: 199-205.
- Krstic. D. Z., Colovic, M., Bavcon kralj, M., Franco, M., Krinulovic, K., Trebse, P. et Vasic, V. (2008). Inhibition of AChE by malathion and some structurally similar compounds. J Enzyme Inhib Med Chem, 23(4): 562-573. Disponible à l'adresse https://doi.org/10.1080/14756360701632031.
- Kumar, S. S., Ghosh, P., Malyan, S. K., Sharma, J. et Kumar, V. (2019). A comprehensive review on enzymatic degradation of the organophosphate pesticide malathion in the environment. J. Environ. Sci. Health. C. Environ. Carcinog. Ecotoxicol. Rev., Part C, 37: 1-42.
- Laveglia, J. et Dahm, P.A. (1977). Degradation of organophosphorus and carbamate insecticides in the soil and by soil microorganisms. Annu. Rev. Entomol., 22: 483-513.
- Lee, W. J., Sandler, D. P., Blair, A., Samanic, C., Cross, A. J. et Alavanja, M.C. (2007). Pesticide use and colorectal cancer risk in the Agricultural Health Study. Int. J. Cancer, 121(2): 339-346.
- Leon, M. E., Schinasi, L. H., Lebailly, P., Beane Freeman, L. E., Nordby, K. C., Ferro, G., Monnereau, A., Brouwer, M., Tual, S., Baldi, I., Kjaerheim, K., Hofmann, J. N., Kristensen, P., Koutros, S., Straif, K., Kromhout, H. et
- Schuz, J. (2019). Pesticide use and risk of non-Hodgkin lymphoid malignancies in agricultural cohorts from France, Norway and the USA: A pooled analysis from the AGRICOH consortium. Int. J. Epidemiol., 48(5): 1519-1535.
- Lerro, C. C., Koutros, S., Andreotti, G., Friesen, M. C., Alavanja, M. C., Blair, A., Hoppin, J. A., Sandler, D. P., Lubin, J. H., Ma, X., Zhang, Y. et Beane Freeman, L. E. (2015). Organophosphate insecticide use and cancer incidence among spouses of pesticide applicators in the agricultural health study. Occup. Environ. Med., 72(10): 736-744.
- Li, W., Wu, R., Duan, J., Saint, C. P. et van Leeuwen, J. (2016). Impact of prechlorination on organophosphorus pesticides during drinking water treatment: Removal and transformation to toxic oxon byproducts. Water Res. 105: 1-10.
- Li, W., Zhao, Y., Yan, X., Duan, J., Saint, C. P. et Beecham, S. (2019). Transformation pathway and toxicity assessment of malathion in aqueous solution during UV photolysis and photocatalysis. Chemosphere, 234: 204-214.
- Magara, Y., Aizawa, T., Matumoto, N. et Souna, F. (1994). Degradation of pesticides by chlorination during water purification. Water Sci Technol 30 (7 pt 7): 119-28.
- McDuffie, H. H., Pahwa, P., McLaughlin, J. R., Spinelli, J. J., Fincham, S., Dosman, J. A., Robson, D., Skinnider, L. F. et Choi, N. W. (2001). Non-Hodgkin's lymphoma and specific pesticide exposures in men: Cross-Canada study of pesticides and health. Cancer Epidemiol. Biomarkers Prev., 10(11): 1155-1163.
- Mills, P. K. et Yang, R. (2003). Prostate cancer risk in California farm workers. J. Occup. Environ. Med., 45(3): 249-258.
- Mills, P. K. et Yang, R. (2005). Breast cancer risk in Hispanic agricultural workers in California. Int. J. Occup. Environ. Health, 11(2): 123-131.
- Mills, P. K., Dodge, J. L., Bush, J., Thompson, Y. et Shah, P. (2019). Agricultural exposures and breast cancer among Latina in the San Joaquin Valley of California. J. Occup. Environ. Med., 61(7): 552-558.
- Miltner, R. J., Baker, D. B., Speth, T. F. et Fronk, C.A. (1989). Treatment of Seasonal Pesticides in Surface Waters. J. Am. Water Works Assoc. 81, 43–52. https://doi.org/10.1002/j.1551-8833.1989.tb03321.x.
- Ministère de l'Environnement de la Nouvelle-Écosse. (2019). Communication personnelle avec A. Polegato.
- Ministère de l'Environnement et des Gouvernements locaux du Nouveau-Brunswick (2019). Communication personnelle avec K. Gould.
- Ministère de l'Environnement et de la Lutte contre les changements climatiques. (2019). Communication personnelle avec P. Cantin.Ministère des Communautés, des Terres et de l'Environnement de l'Île-du-Prince-Édouard. (2019). Communication personnelle avec G. Somers.
- Moeller, H. C. et Rider, J. A. (1962). Plasma and red blood cell cholinesterase activity as indications of the threshold of incipient toxicity of ethyl-p-nitrophenyl thionobenzenephosphonate (EPN) and malathion in human beings. Toxicology and applied pharmacology. Toxicol. Appl. Pharmacol., 4(1): 123-130.
- Montgomery, M. P., Kamel, F., Saldana, T. M., Alavanja, M. C. et Sandler, D.P. (2008). Incident diabetes and pesticide exposure among licensed pesticide applicators: Agricultural health study, 1993-2003. Am. J. Epidemiol., 167(10): 1235-1246.
- Moore, P. D., Yedjou, C. G. et Tchounwou, P. B. (2010). Malathion-induced oxidative stress, cytotoxicity, and genotoxicity in human liver carcinoma (HepG2) cells. Environ. Toxicol., 25(3): 221-226.
- NCI. (1978). Bioassay of malathion for possible carcinogenicity. Technical report series no. 24. US Department of Health. Education and Welfare. Public Health Service. National Institute of Health. National Cancer Institute [tel que cité dans ATSDR, 2003]
- NCI. (1979). Bioassay of malathion for possible carcinogenicity. National Cancer Institute. National Cancer Inst Carcinog Tech Rep Ser, Vol 192. [tel que cité dans ATSDR, 2003]
- Naughton, S. X. et Terry Jr., A. V. (2018). Neurotoxicity in acute and repeated organophosphate exposure. Toxicology, 408(2018): 101-112.
- Newfoundland and Labrador Department of Municipal Affairs and Environment. (2019). Communication personnelle avec H. Khan.
- Newhart, K. L. (2006). Environmental fate of malathion. California Environmental Protection Agency Department of Pesticide Regulation. Environmental Monitoring Branch.
- NHMRC et NRMMC. (2011). Australian drinking water guidelines Paper 6 National Water Quality Management Strategy. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra. Disponible à l'adresse https://www.Nhmrc.Gov.Au/about-us/Publications/Australian-Drinking-Water-Guidelines.
- Nishio, A. et Uyeki, E.M. (1981). Induction of sister chromatid exchanges in Chinese hamster ovary cells by organophosphate insecticides and their oxygen analogs. J. Toxicol. Environ. Health, 8(5-6): 939-946. [tel que cité dans Santé Canada, 2010; OMS, 2017a]
- Ojha, A., Yaduvanshi, S. K., Pant, S. C., Lomash, V. et Srivastava, N. (2013). Evaluation of DNA damage and cytotoxicity induced by three commonly used organophosphate pesticides individually and in mixture, in rat tissues. Environ. Toxicol., 28(10): 543-552.Ojha, A. et Srivastava, N. (2014). In vitro studies on organophosphate pesticides induced oxidative DNA damage in rat lymphocytes. Mutat. Res. Genet. Toxicol. Environ. Mutagen., 761: 10-17.
- Ojha, A. et Gupta, Y.K. (2015). Evaluation of genotoxic potential of commonly used organophosphate pesticides in peripheral blood lymphocytes of rats. Hum. Exp. Toxicol., 34(4): 390-400.
- Olakkaran, S., Kizhakke Purayil, A., Antony, A., Mallikarjunaiah, S. et Hunasanahally Puttaswamygowda, G. (2020). Oxidative stress-mediated genotoxicity of malathion in human lymphocytes. Mutation research - genetic toxicology and environmental mutagenesis. Mutat. Res. Genet. Toxicol. Environ. Mutagen., 849.
- OMS. (2004). Malathion in drinking-water. Background document for development of WHO guidelines for drinking-water quality. Organisation mondiale de la santé, Genève (Suisse). Disponible à l'adresse at https://www.who.int/water_sanitation_health/water-quality/guidelines/chemicals/malathion/en/.
- OMS. (2011). Guidelines for drinking-water quality. Quatrième édition. Organisation mondiale de la santé, Genève (Suisse). Disponible à l'adresse http://www.who.int/water_sanitation_health/publications/2011/dwq_guidelines/en/.
- OMS. (2012). Planifier la gestion de la sécurité sanitaire de l'eau pour l'approvisionnement en eau des petites communautés. Organisation mondiale de la Santé, Genève (Suisse). Disponible à l'adresse https://www.who.int/water_sanitation_health/publications/small-comm-water_supplies/fr/.
- OMS. (2017a). Pesticide residues in food – 2017: Toxicological evaluations. Joint Meeting of the FAO Panel of Experts on Pesticide Residues in Food and the Environment and the WHO Core Assessment Group on Pesticide Residues, Genève (Suisse).
- OMS. (2017b). Directives de qualité pour l'eau de boisson. Quatrième édition intégrant le premier additif. Organisation mondiale de la Santé, Genève (Suisse). Disponible à l'adresse https://apps.who.int/iris/handle/10665/258887.
- Ministère de l'Environnement, de la Protection de la nature et des Parcs. (2020). Communication personnelle avec S. Deshpande.
- Plakas, K. V. et Karabelas, A. J (2012). Removal of pesticides from water by NF and RO membranes – a review. Desalination, 287:255-265.
- Pluth, J. M., Nicklas, J. A., O'Neill, J. P. et Albertini, R. J. (1996). Increased frequency of specific genomic deletions resulting from in vitro malathion exposure. Cancer Res., 56(10): 2393-2399.
- Reddy, V., Freeman, T. et Cannon, M. (1989). Disposition and metabolism of 14C-labeled malathion in rats (preliminary and definitive study). Study no: 9354-B. Étude non publiée réalisée par le Midwest Research Institute. Soumise par FMC/Cheminova [tel que cité dans Santé Canada, 2010; OMS, 2017a]
- Rinsky, J. L., Richardson, D. B., Kreiss, K., Nylander-French, L., Beane Freeman, L. E., London, S. J., Henneberger, P. K. et Hoppin, J. A. (2019). Animal production, insecticide use and self-reported symptoms and diagnoses of COPD, including chronic bronchitis, in the Agricultural Health Study. Environ. Int., 127: 764-772.
- Rocha, A. A., Monteiro, S. H., Andrade, G. C. R. M., Vilca, F. Z. et Tornisielo, V. L. (2015). Monitoring of pesticide residues in surface and subsurface waters, sediments, and fish in center-pivot irrigation areas. J. Braz. Chem. Soc., 26(11): 2269-2278.
- Roche, P. et Prados, M. (1995). Removal of pesticides by use of ozone or hydrogen Peroxide/Ozone. Ozone-Sci Eng. 17 (6): 657-72.
- Santé Canada. (2003). Projet d'acceptabilité d'homologation continue. PACR2003-10. Réévaluation du malathion. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa (Canada).
- Santé Canada. (2010). Projet de décision de réévaluation. PRVD2010-18. Malathion. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa (Canada).
- Santé Canada. (2012). Décision de réévaluation. RVD2012-10. Malathion. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa (Canada).
- Santé Canada. (2019). Communication personnelle avec l'Agence de réglementation de la lutte antiparasitaire (ARLA), Direction de l'évaluation sanitaire.
- Santé Canada. (2020a). Rapport sur les ventes de produits antiparasitaires en 2018. Agence de réglementation de la lutte antiparasitaire (ARLA), Santé Canada, Ottawa (Canada).
- Santé Canada. (2020b). Base de données des limites maximales de résidus (MRL) pour pesticides : malathion. Santé Canada, Sécurité des produits de consommation, Pesticides et lutte antiparasitaire. Disponible à l'adresse https://pr-rp.hc-sc.gc.ca/mrl-lrm/index-fra.php.
- Santé Canada. (en cours d'élaboration). Les facteurs d'exposition canadiens utilisés dans les évaluations du risque pour la santé humaine. Santé Canada, Ottawa, Ontario.
- Saskatchewan Water Security Agency. (2019). Communication personnelle avec S. Ferris.
- Sathiakumar, N., MacLennan, P. A., Mandel, J. et Delzell, E. (2011). A review of epidemiologic studies of triazine herbicides and cancer. Crit. Rev. Toxicol., 41 Suppl 1: 1-34.
- Services aux Autochtones Canada. (2019). Communication personnelle avec X. Redhead.
- Services d'hygiène du milieu du Yukon. (2019). Communication personnelle avec P. Brooks.
- Selmi, S., Rtibi, K., Grami, D., Sebai, H. et Marzouki, L. (2018). Malathion, an organophosphate insecticide, provokes metabolic, histopathologic and molecular disorder in liver and kidney in prepubertal male mice. Toxicol. Rep. 5(2018): 189-195.
- SGS Environmental Services. (2019). Communication personnelle avec D. Griffin. Lakefield, Ontario.
- Shellenberger, T. E. et Billups, L. H. (1980). One-year oral toxicity study in purebred beagle dogs with AC 6,601. Étude no 85010 par Tegeris Laboratories Inc. Rapport non publié. Cheminova A/S, CHA Doc. No.: 9 FYF. [tel que cité dans OMS, 2017]
- Shrestha, S., Parks, C. G., Goldner, W. S., Kamel, F., Umbach, D. M., Ward, M. H., Lerro, C. C., Koutros, S., Hofmann, J. N., Beane Freeman, L. E. et Sandler, D. P. (2018). Pesticide use and incident hypothyroidism in pesticide applicators in the Agricultural Health Study. Environ. Health Perspect., 126(9): 97008.
- Shrestha, S., Parks, C. G., Goldner, W. S., Kamel, F., Umbach, D. M., Ward, M. H., Lerro, C. C., Koutros, S., Hofmann, J. N., Beane Freeman, L. E. et Sandler, D. P. (2019). Pesticide use and incident hyperthyroidism in farmers in the Agricultural Health Study. Occup. Environ. Med., 76(5): 332-335.
- Singh, B., Kaur, J. et Singh, K. (2014). Microbial degradation of an organophosphate pesticide, malathion. Crit. Rev. Microbiol., 40(2): 146-154.
- Slauter, R. W. (1994). 18-month oral (dietary) oncogenicity study in mice, test substance malathion. Study no. 668-001 by International Research and Development Corp. Rapport non publié. Cheminova A/S, CHA Doc. No.: 94 FYF. [tel que cité dans OMS, 2017a]
- Smeets, P. W. M. H., Medema, G. J. et van Dijk, J. C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drink. Water Eng. Sci., 2: 1-14.
- Sorour, M. H. et Shaalan, H. F. (2013). Removal of malathion using ceramic nanofiltration/adsorption system. Desalin.Water Treat., 51(25-27): 5009-5013.
- Speth, T. F. et Adams, J. Q. (1993). GAC and Air Stripping Design Support for the Safe Drinking Water Act, Strategies and Technologies for Meeting SDWA Requirements. Clark, R. and S. Summers, éd., Lewis Publishers, Ann Arbor, MI, p. 47-89.
- Speth, T. F. et Miltner, R. J. (1998). Technical note: adsorption capacity of GAC for synthetic organics. J. Am. Water Works Assoc. 90(4): 171-174.
- Starling, A. P., Umbach, D. M., Kamel, F., Long, S., Sandler, D. P. et Hoppin, J.A. (2014). Pesticide use and incident diabetes among wives of farmers in the Agricultural Health Study. Occup. Environ. Med., 71(9): 629-635.
- Summers, R. S., Knappe, D. R. U. et Snoeyink, V.L. (2010). Chapter 14: Adsorption of organic compounds by activated carbon. In: Edzwald , J.K. (ed.), Water quality and treatment: A handbook on drinking water. 6e édition. McGraw-Hill, New York, NY.
- Titenko-Holland, N., Windham, G., Kolachana, P., Reinisch, F., Parvatham, S., Osorio, A. M. et Smith, M. T. (1997). Genotoxicity of malathion in human lymphocytes assessed using the micronucleus assay in vitro and in vivo: A study of malathion-exposed workers. Mutat. Res., 388(1): 85-95.
- Traul, K. A. (1987). Evaluation of CL 6601 in the bacterial/microsome mutagenicity test. Study no. 114 by American Cyanamid Company. Rapport non publié. Cheminova A/S, CHA Doc. No.: 15 FYF [tel que cité dans OMS, 2017a]
- UE. (1998). Union européenne – Directive 98/83/CE du Conseil du 3 novembre 1998 relative à la qualité des eaux destinées à la consommation humaine. Journal officiel des Communautés européennes, L 330 du 05/12/1998 : 32‑54.
- US EPA. (1977). Evaluation of selected pesticides as chemical mutagens in vitro and in vivo studies. United States Environmental Protection Agency, EPA-600/1-77-028, Research Triangle Park, NC.
- US EPA. (1997). Malathion: 2-year chronic feeding/carcinogenicity study in Fischer 344 rats. Huntingdon Life Sciences. 1996. MRID 43942901. Washington, D.C: Office of Pesticides and Toxic Substances, United States Environmental Protection Agency. Disponible à l'adresse https://archive.epa.gov/pesticides/chemicalsearch/chemical/foia/web/pdf/057701/057701-114.pdf.
- US EPA. (1998). EPA Method 8270D Semivolatile organic compounds by gas chromatography/mass spectrometry (GC/MS). Rev. 4.
- US EPA. (2000a). Final cancer assessment document, evaluation of the carcinogenic potential of malathion. United States Environmental Protection Agency, Cancer Assessment Review Committee, Health Effects Division, Office of Pesticide Programs, MRID 43975201, Tox review 013991.
- US EPA. (2000b). EPA Method 8141B Organophosphorus Compounds by Gas Chromatography. Rev 2.0.
- US EPA. (2005). EPA Method 527 Determination of selected pesticides and flame retardants in drinking water by solid phase extraction and capillary column gas chromatography/mass spectrometry (GC/MS). Rev 1.0.
- US EPA. (2007) EPA Method 1699: Pesticides in Water, Soil, Sediment, Biosolids, and Tissue by HRGC/HRMS.
- US EPA. (2009). Reregistration eligibility decision (RED) for malathion. United States Environmental Protection Agency, Office of Pesticide Programs, EPA 738-R-06-030, Washington, D.C.
- US EPA. (2011). Finalization of Guidance on Incorporation of Water Treatment Effects on Pesticide Removal and Transformation in Drinking Water Exposure Assessments.
- US EPA. (2016). Evaluation of carbaryl and malathion human studies for their proposed application in a physiologically based pharmacokinetic model for risk assessment. United States Environmental Protection Agency, Office of Pesticide Programs.
- US EPA. (2018). 2018 edition of the drinking water standards and health advisories tables. United States Environmental Protection Agency, Office of Water, EPA 822-F-18-001, Washington, D.C. Disponible à l'adresse https://www.epa.gov/sites/production/files/2018-03/documents/dwtable2018.pdf.
- Valentine, R. L. et Jafvert, C. T. (1992). Reaction scheme for the chlorination of ammoniacal water. Environ Sci. Technol. 26 (3): 577-86.
- van der Aa, L. T. J., Kolpa, R. J., Rietveld, L. C. et van Dijk, J. C. (2012). Improved removal of pesticides in biological granular activated carbon filters by pre-oxidation of natural organic matter. J. Water Supply Res. Technol. AQUA, 61(3): 153-163.
- Van der Bruggen, B. et Vandecasteele, C. (2003). Removal of pollutants from surface water and groundwater by nanofiltration: overview of possible applications in drinking water industry. Environ Pollut, 122: 435-445.
- Waddell, B. L., Zahm, S. H., Baris, D., Weisenburger, D.D., Holmes, F., Burmeister, L. F., Cantor, K. P. et Blair, A. (2001). Agricultural use of organophosphate pesticides and the risk of non-Hodgkin's lymphoma among male farmers (United States). Cancer Causes Control, 12(6): 509-517.
- Windham, G. C., Titenko-Holland, N., Osorio, A. M., Gettner, S., Reinisch, F., Haas, R. et Smith, M. (1998). Genetic monitoring of malathion-exposed agricultural workers. American journal of industrial medicine. Am. J. Ind. Med., 33(2): 164-174.
- Wolfe, N. L., Zepp, R. G., Gordon, J. A., Baughman, G. L. et Cline, D. M. (1977). Kinetics of chemical degradation of malathion in water. Environmental science and technology. Environ. Sci. Technol., 11(1): 88-93.
- Woudneh, B. M., Ou, Z., Sekela, M., Tuominen, T. et Gledhill, M. (2009a). Pesticides multiresidues in waters of the lower Fraser Valley, British Columbia, Canada. Part I. Surface Water. J. Environ. Qual. 38: 940-947.
- Woudneh, B. M., Ou, Z., Sekela, M., Tuominen, T. et Gledhill, M. (2009b). Pesticides multiresidues in waters of the lower Fraser Valley, British Columbia, Canada. Part II. Groundwater. J. Environ. Qual. 38: 948-954.
- Zhang, Y. et Pagilla, K. (2010). Treatment of malathion pesticide wastewater with nanofiltration and photo-Fenton oxidation. Desalination, 263(1-3): 36-44.
Annexe A : Liste des abréviations
- ACh
- Acétylcholine
- AChE
- Acétylcholinestérase
- ACIA
- Agence canadienne d'inspection des aliments
- AHS
- Agricultural Health Study
- AQA
- Apport quotidien acceptable
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- ATSDR
- Agency for Toxic Substances and Disease Registry
- BChE
- Cholinestérase dans le cerveau
- CA-CNC
- Charbon actif à base de coquilles de noix de coco
- CA-CNP
- Charbon actif à base de coques de noix de palmier
- CAG
- Charbon actif en grains
- CAP
- Charbon actif en poudre
- CAS
- Chemical Abstracts Service
- CEP
- Comité sur l'eau potable
- ChE
- Cholinestérase
- CIRC
- Centre international de recherche sur le cancer
- CMA
- Concentration maximale admissible
- COT
- Carbone organique total
- DCA
- Acide dicarboxylique (Dicarboxylic acid)
- DL50
- Dose létale médiane
- EChE
- Cholinestérase érythrocytaire (Erythrocyte cholinesterase)
- EFSA
- Autorité européenne de sécurité des aliments
- F1
- Première génération
- FAO
- Organisation des Nations Unies pour l'alimentation et l'agriculture
- GC-DPF
- Chromatographie en phase gazeuse et détection à photométrie de flamme
- GC-SM
- Chromatographie en phase gazeuse et spectrométrie de masse
- JG
- Jour de gestation
- JPN
- Jour post-natal
- LD
- Limite de détection
- LDM
- Limite de détection de la méthode
- LNH
- Lymphome non hodgkinien
- MCA
- Acide monocarboxylique (Monocarboxylic acid)
- MCL
- Concentration maximale de contaminants (Maximum Contaminant Level)
- MON
- Matière organique naturelle
- NCI
- National Cancer Institute
- NF
- Nanofiltration
- NHMRC
- National Health and Medical Research Council (Australie)
- NOAEL
- Dose sans effet nocif observé (No-observed-adverse-effect level)
- NOEL
- Dose sans effet observé (No-observed-effect level)
- NRMMC
- National Resource Management Ministerial Council (Australie)
- NSF
- NSF International
- OI
- Osmose inverse
- OMS
- Organisation mondiale de la santé
- PACR
- Projet d'acceptabilité d'homologation continue
- p.c.
- Poids corporel
- PChE
- Cholinestérase plasmatique
- POA
- Procédés d'oxydation avancée
- SDM
- Seuil de déclaration de la méthode
- SRM
- Seuil de rétention des molécules
- TCLV
- Temps de contact en lit vide
- UDS
- Synthèse d'ADN non programmée (Unscheduled DNA synthesis)
- UE
- Union européenne
- US EPA
- United States Environmental Protection Agency
- USGS
- United States Geological Survey
- UV
- Ultraviolet
- VBS
- Valeur basée sur la santé
Annexe B : Données sur la qualité de l'eau au Canada
| Secteur de compétence (Période d'échantillonnage) | Nombre de détections/ échantillons | LDM (ng/L) | Plage (ng/L) | |
|---|---|---|---|---|
| Min | Max | |||
| CB – Vallée du Bas-Fraser et bassin de l'Okanagan (2003-2005) | 7/96 | 0,062 | < 0,062 | 75,1 |
| ON (2003) | 1/162 | 14,7 | 143 | 143 |
| ON (2004) | 2/228 | 14,7 | 31,7 | 449 |
| ON (2005) | 3/160 | 14,7 | 10,4 | 611 |
| ON – 10 lacs isolés (2003-2005) | 3/163 | 0,001 | < 0,001 | 2,20 |
| QC (2003) | 0/49 | 20 | n. d. | n. d. |
| QC (2004) | 0/69 | 4-20 | n. d. | n. d. |
| QC (2005) | 0/62 | 20 | n. d. | n. d. |
| AB, SK, MB – 8 sites (2003) | 0/13 | 14,7 | n. d. | n. d. |
| AB, SK, MB – 15 sites (2003-2004) | 0/30 | 14,70 | < 14,70 | < 14,70 |
| ON – 4 sites (2004-2005) | 0/12 | 0,000 | < 0,000 | n. d. |
|
Remarque : Tiré d'Environnement Canada, 2011 LDM – Limite de détection de la méthode n. d. – non-disponible |
||||