Acide (4-chloro-2-méthylphénoxy)acétique (MCPA) dans l’eau potable : Document technique pour consultation publique
De : Santé Canada
Objectif de la consultation
Le présent document technique décrit l’évaluation de l’information disponible sur l’acide (4-chloro-2-méthylphénoxy)acétique (MCPA) dans le but de mettre à jour les recommandations relatives à la présence de MCPA dans l’eau potable. La présente consultation vise à solliciter des commentaires sur les recommandations proposées, la démarche suivie pour l’élaborer et les répercussions possibles de sa mise en œuvre.
Le document technique existant sur le MCPA, élaboré en 2010, établissait une concentration maximale acceptable (CMA) de 0,1 mg/L (100 µg/L) en fonction des effets sur les reins observés chez le rat. Le présent document propose une CMA de 0,4 mg/L (400 µg/L) pour le MCPA dans l’eau potable, sur la base de la même étude clé que celle utilisée pour élaborer la CMA actuelle, dans laquelle sont décrits les effets observés sur les reins des rats. Dans sa dernière évaluation du MCPA, l’Agence de réglementation de la lutte antiparasitaire a supprimé le facteur d’incertitude lié aux lacunes de la base de données, ce qui a contribué à une augmentation de la CMA proposée.
Ce document est mis à la disposition du public pour une période de consultation de 60 jours. Veuillez faire parvenir vos commentaires (avec justification, au besoin) à Santé Canada par courriel : HC.water-eau.SC@canada.ca
Tous les commentaires doivent nous parvenir avant le 12 mai 2021. Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l’affiliation de leurs auteurs, aux membres du Comité fédéral-provincial-territorial sur l’eau potable (CEP). Les personnes qui ne souhaitent pas que leur nom et leur affiliation soient communiqués aux membres du comité doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que le présent document technique pourrait être révisé après l’analyse des commentaires reçus et qu’une recommandation pour l’eau potable sera établie, s’il y a lieu. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Recommandation proposée
Une concentration maximale acceptable (CMA) de 0,4 mg/L (400 µg/L) est proposée pour l’acide (4-chloro-2-méthylphénoxy)acétique dans l’eau potable.
Sommaire
Le présent document technique, qui a été préparé en collaboration avec le Comité fédéral-provincial-territorial sur l’eau potable, s’appuie sur des évaluations du MCPA menées par l’Agence de réglementation de la lutte antiparasitaire (ARLA) de Santé Canada et sur des documents connexes.
Exposition
L’acide (4-chloro-2-méthylphénoxy)acétique (MCPA) est un herbicide à base d’acide phénoxyacétique, homologué au Canada pour une utilisation sur les sites agricoles, les gazons fins et les pelouses, en foresterie et sur les sites industriels. Il figure parmi les dix pesticides les plus vendus au Canada, avec plus de 1 000 000 kg de principe actif vendu en 2018, et est utilisé dans tout le pays, principalement dans les provinces des Prairies. Les formulations d’herbicide peuvent renfermer différentes formes de MCPA, y compris l’acide libre, les sels et les esters, mais toutes libèrent l’acide qui est le principe actif de l’herbicide. Les Canadiens peuvent être exposés au MCPA par l’eau potable, l’air et les aliments. Certains segments de la population peuvent être exposés dans des contextes professionnels liés à l’utilisation et à l’application de pesticides.
Les données fournies par les provinces et territoires qui surveillent le MCPA indiquent que les concentrations de MCPA dans l’eau potable sont pour la plupart inférieures aux limites de détection.
Effets sur la santé
Certaines études ont été menées sur les effets des herbicides chlorophénoxy, y compris le MCPA, sur la santé humaine. Cependant, comme les sujets ont été exposés à plusieurs pesticides, ainsi qu’à d’autres composés organiques, ces études ne peuvent pas être utilisées pour évaluer la toxicité du MCPA chez l’humain. La CMA de 0,4 mg/L (400 µg/L) a été établie d’après les effets sur le rein observés chez le rat.
Le MCPA est considéré par les agences internationales comme étant soit inclassable en ce qui concerne la cancérogénicité, soit probablement non cancérogène chez l’humain, en raison de l’absence d’indications de cancérogénicité dans les études sur les animaux.
Considérations liées à l’analyse et au traitement
Pour établir de une recommandation sur la qualité de l’eau potable, il faut tenir compte de la capacité de mesurer le contaminant et de l’éliminer des sources d’approvisionnement d’eau potable. Plusieurs méthodes d’analyse existent pour mesurer le MCPA dans l’eau à des concentrations bien inférieures à la CMA proposée. À l’échelle municipale, le charbon actif, la filtration sur membrane, l’oxydation, les procédés d’oxydation avancée et la filtration biologique ont permis d’obtenir des rendements d’enlèvement très variables. Bien que le MCPA puisse être éliminé par oxydation, les responsables des réseaux d’approvisionnement en eau potable devraient être conscients de la formation possible de sous-produits de dégradation. Il est recommandé de réaliser des études pilotes ou à l’échelle de banc d’essai avant une mise en œuvre à grande échelle.
Dans les cas où l’on souhaite éliminer le MCPA à l’échelle résidentielle ou des petits systèmes, par exemple lorsque l’approvisionnement en eau potable provient d’un puits privé, l’utilisation d’un dispositif de traitement d’eau potable résidentiel peut être envisagée. Même s’il n’existe pas encore de dispositif de traitement certifié permettant d’éliminer le MCPA de l’eau potable, des techniques comme l’adsorption sur charbon actif et l’osmose inverse devraient être efficaces. Lorsqu’un tel dispositif de traitement d’eau potable est utilisé, il est important de
Le fonctionnement et l’entretien courants des dispositifs de traitement, y compris le remplacement des composantes filtrantes, doivent être effectués conformément aux spécifications du fabricant.
Application de la recommandation
Remarque : Des conseils spécifiques concernant l’application des recommandations pour l’eau potable devraient être obtenus auprès de l’autorité appropriée en matière d’eau potable.
La recommandation proposée vise à offrir une protection contre les effets sur la santé associés à une exposition au MCPA par l’eau potable toute la vie durant. Tout dépassement de la CMA proposée devrait faire l’objet d’une enquête suivie par des mesures correctives appropriées, au besoin. Efn cas de dépassement dans une source d’approvisionnement d’eau qui n’est pas traitée, une surveillance accrue devrait être mise en place afin de confirmer le dépassement. S’il est confirmé que les concentrations de MCPA dans la source d’approvisionnement d’eau dépassent la CMA proposée, une enquête devrait être menée pour déterminer le moyen le plus approprié de réduire l’exposition au MCPA. Les options possibles comprennent l’utilisation d’une autre source d’approvisionnement en eau ou l’installation d’un dispositif de traitement. Si un traitement est déjà en place lorsqu’un dépassement survient, une enquête devrait être menée pour vérifier le traitement et déterminer si des modifications doivent être apportées pour ramener la concentration dans l’eau traitée sous la CMA proposée.
Considérations internationales
D’autres organisations nationales et internationales disposent de lignes directrices, de normes et de valeurs recommandées en ce qui concerne le MCPA dans l’eau potable. Les valeurs varient selon les territoires de compétence en fonction de la date à laquelle remonte l’évaluation sur laquelle elles sont fondées, et en fonction des différentes politiques et approches, y compris en ce qui concerne le choix de l’étude clé ou les taux de consommation, les poids corporels et les facteurs d’attribution liés à la source employés.
L’Environmental Protection Agency des États-Unis (US EPA) n’a pas établi de concentration maximale de contaminant (MCL, pour maximum contaminant level,à savoir l’équivalent d’une CMA) pour le MCPA dans l’eau potable. L’US EPA a établi, dans un avis sanitaire non exécutoire, une valeur à vie de 0,03 mg/L (30 µg/L) pour cette substance. Les avis sanitaires servent de guide technique informel pour les contaminants de l’eau potable non réglementés aux États-Unis. L’Organisation mondiale de la Santé (OMS) a établi une valeur basée sur la santé (VBS) de 0,7 mg/L (700 µg/L) pour le MCPA, mais a indiqué qu’une recommandation n’est pas nécessaire, car la substance est généralement présente dans les sources d’eau potable ou l’eau potable à des concentrations bien inférieures à celles qui sont préoccupantes pour la santé.
L’Union européenne (UE) ne dispose d’aucune valeur paramétrique précise pour chaque pesticide. Elle a plutôt établi une valeur de 0,1 µg/L pour tout pesticide pris individuellement et une valeur de 0,5 µg/L pour l’ensemble des pesticides décelés dans l’eau potable. Lors de l’établissement de ces valeurs, l’UE n’a pas tenu compte des données scientifiques relatives à chaque pesticide, y compris les effets sur la santé. Ces valeurs reposent plutôt sur une décision stratégique visant à écarter les pesticides des sources d’eau potable.
Table des matières
- 1.0 Considérations relatives à l’exposition
- 2.0 Considérations relatives à la santé
- 3.0 Calcul de la valeur basée sur la santé
- 4.0 Considérations relatives à l’analyse et au traitement
- 5.0 Stratégies de gestion
- 6.0 Considérations internationales
- 7.0 Justification
- 8.0 Bibliographie
- Annexe A : Liste des abréviations
- Annexe B : Données sur la qualité des eaux au Canada
1.0 Considérations relatives à l’exposition
1.1 Sources et utilisations
L’acide (4-chloro-2-méthylphénoxy)acétique(MCPA) est un herbicide de type chlorophénoxy de postlevée utilisé pour lutter contre les mauvaises herbes à feuilles larges et les plantes ligneuses. Il est homologué au Canada en vue de l’utilisation sur les terres agricoles, les gazons fins (parcs, terrains de jeu, de golf et d’athlétisme, jardins zoologiques et botaniques), les pelouses (terrains publics et commerciaux et le gazon en plaques (cultivé dans les gazonnières et destiné à être transplanté), ainsi qu’en foresterie (jeunes plants d’épinette pour le reboisement) et sur des sites industriels (désherbage) (Santé Canada, 2005). Le MCPA figure parmi les dix premiers principes actifs vendus au Canada pour des utilisations agricoles; en 2018, plus de 1 000 000 kg de MCPA (principe actif) ont été vendus (Santé Canada, 2018).
Le MCPA est un régulateur de croissance des plantes; il est utilisé contre les mauvaises herbes à feuilles larges en postlevée en agriculture et en foresterie, ainsi qu’en milieu urbain et aquatique (CIRC, 1983; Weed Science Society of America, 1989; HSDB, 2010). Les pesticides comme le MCPA éliminent les mauvaises herbes émergées en étant absorbés par les feuilles et les racines puis distribués dans toute la plante. En stimulant la synthèse des acides nucléiques et des protéines, le MCPA entrave les activités enzymatiques, la respiration et la division cellulaire. Ainsi, les plantes traitées présentent des malformations des feuilles, des tiges et des racines (US EPA, 1990).
Les données sur le devenir dans l’environnement indiquent que toutes les formes de MCPA retournent à la forme acide, de sorte que les caractéristiques physico-chimiques des différentes formes de MCPA dans l’environnement seront celles associées à l’acide (US EPA, 2004a).
Le MCPA a été détecté dans des lacs, des rivières et des mares artificielles, qui peuvent servir de sources d’eau potable. La migration du sol jusque dans les eaux est due à des mécanismes de transport directs ou indirects, notamment la dérive vers des zones non ciblées pendant les pulvérisations aériennes ou au sol au moyen de rampes (vaporisation dans l’air), les dépôts d’origine atmosphérique, l’érosion du sol par le vent ou l’eau, le ruissellement et le lessivage. Le MCPA peut également se retrouver dans l’eau par suite de déversements, du rejet délibéré de résidus de réservoirs ou du lavage de pièces d’équipement (Caux et coll., 1995; Murray et coll., 2004). Étant donné sa pression de vapeur et sa constante de la loi d’Henry, le MCPA ne devrait pas se volatiliser à partir de l’eau (voir le tableau 1). Par contre, l’ester 2-éthylhexyle du MCPA (MCPA-EHE) devrait se volatiliser à partir de l’eau (Santé Canada, 2007). Dans l’eau, la dégradation biologique (en conditions aérobies) est un processus important qui influe sur le devenir du MCPA dans l’environnement (Soderquist et Crosby, 1975; Sattar et Paasivirta, 1980; Smith et Hayden, 1981; Santé Canada, 2006). Cependant, dans les systèmes aquatiques anaérobies (sédiments/eau), la biodégradation du MCPA est négligeable (Santé Canada, 2006). L’hydrolyse et la photodégradation ne sont pas des voies de dégradation importantes du MCPA dans l’eau (Santé Canada, 2006). Pendant les périodes de temps froid et de faible luminosité, la dégradation du MCPA par biodégradation ou photolyse est plutôt limitée (Byrtus et coll., 2004). Le MCPA ne se lierait pas dans une mesure significative aux sédiments (Caux et coll., 1995). Il a été établi que les dérivés du MCPA se dissociaient dans l’eau et donnaient du MCPA sous forme acide.
Le MCPA n’est pas persistant dans le sol (US EPA, 2004a), sa demi-vie variant entre 15 et 50 jours (Soderquist et Crosby, 1975; Sattar et Paasivirta, 1980). La vitesse de dégradation dépend de plusieurs facteurs comme le type de sol, le pH et le degré d’humidité du sol, la concentration de MCPA, les conditions climatiques et la teneur en matière organique (Sattar etPaasivirta, 1980). Le 2-méthyl-4-chlorophénol a été déterminécomme étant le principal produit de dégradation dans le sol (University of Hertfordshire, 2019). La dégradation du MCPA a pris de cinq à neuf semaines dans un sol acide, alors qu’elle était terminée au bout d’une semaine dans un sol neutre (pH d’au moins 6,3) (Sattaret et Paasivirta, 1980). La dégradation microbienne constitue le principal processus de transformation du MCPA dans le sol (Caux et coll., 1995), la présence d’oxygène et d’une humidité adéquate étant importante (Sattar et Paasivirta, 1980). En l’absence d’oxygène, la biotransformation du MCPA dans le sol est négligeable (Santé Canada, 2006). La photodécomposition et l’hydrolyse dans le sol ne constituent pas des processus importants de dégradation du MCPA (US EPA, 2004a, 2004b; Santé Canada, 2006).
Des études sur le terrain indiquent que le potentiel de lessivage du MCPA dans le sol était faible à une profondeur de plus de 15 cm (Santé Canada, 2007). Il semble que la mobilité du MCPA soit liée à la teneur du sol en matière organique et qu’elle augmente avec la diminution de cette dernière (OMS, 2003). La contamination des eaux de surface peut se produire par la dérive de pulvérisation et le ruissellement, tandis que les eaux souterraines peuvent être contaminées par lessivage (US EPA, 2004a). La mobilité et le lessivage des formes de MCPA autres que l’acide (c.-à-d., sels d’amine et de sodium, esters) n’ont pas été déterminés. Des études sur le terrain ayant porté sur le MCPA-EHE ont montré que, dans des conditions normales, une proportion importante de ce produit était convertie en MCPA sous forme acide le jour de l’application et que la conversion était pratiquement complète au jour 3 (US EPA, 2004a). Dans des conditions sèches, le MCPA-EHE persiste pendant des jours, et il en reste encore plus de 90 % après 48 heures (Smith et Hayden, 1980).
Peu de renseignements sont disponibles sur le devenir atmosphérique du MCPA. Waite et coll. (2005) ont démontré, par l’analyse de grands volumes d’air échantillonnés à des hauteurs variées au-dessus du niveau du sol dans les Prairies canadiennes, que les concentrations atmosphériques de MCPA étaient fortement influencées par le transport atmosphérique régional et que l’adsorption aux particules solides de l’atmosphère constituait le principal mécanisme de transport. La demi-vie de photooxydation du MCPA a été estimée à 2,2 jours (Caux et coll., 1995).
1.2 Identité de la substance
Le MCPA est un herbicide de type chlorophénoxy qui est offert en diverses formulations, notamment l’acide libre, un sel de diméthylamine (MCPA-DMAS), un sel de sodium et un ester (MCPA-EHE) (US EPA, 2004b, 2004d). Bien que le MCPA puisse être appliqué sous différentes formes, son effet herbicide provient d’un seul groupement fonctionnel commun (composé d’origine) (US EPA, 2004c, 2004e; Santé Canada, 2006). Il a été signalé que certains herbicides phénoxy, comme l’acide 2,4,5-trichlorophénoxyacétique (2,4,5-T), peuvent être contaminés par des dioxines et des furanes pendant leur production, mais il n’a pas été démontré que le MCPA était contaminé par des dioxines (Wiklund et coll., 1988; Eriksson et coll., 1990; Mannetje et coll., 2005).
Les propriétés physico-chimiques pertinentes du MCPA, en ce qui concerne sa présence dans l’eau potable, sont résumées dans le tableau 1.
| Propriété | MCPA | Interprétation |
|---|---|---|
| N° CAS | 94-74-6 | Sans objet |
| Poids moléculaire (g/mol) | 200,6 | Sans objet |
| Solubilité dans l’eau (g/L)Tableau 1 Note de bas de page b | 26,2 à pH 5; 293 à pH 7; 320 à pH 9 | Solubilité variable |
| Pression de vapeur (volatilité) | 8,18 × 10-5 à 1,36 × 10-4 Pa à 20 °C | Faible potentiel de volatilisation |
| Constante de la loi d’Henry | 7.46 × 10-5 Pa∙m3/mol | Ne devrait pas se volatiliser à partir de l’eau ou des surfaces humides |
| Coefficient de partage octanol-eau (log Kow) | 1.43–2.82 | Faible potentiel de bioaccumulation |
|
||
1.3 Exposition
Il se peut que les Canadiens soient exposés au MCPA par l’eau potable, l’air et les aliments. En outre, certains segments de la population peuvent être exposés dans des contextes professionnels liés à l’utilisation et à l’application de pesticides. Des données sont disponibles sur l’exposition attribuable exclusivement à l’eau (de surface et de consommation), à l’air ou aux aliments.
Les données de surveillance de l’eau au Canada peuvent être obtenues auprès des provinces et des territoires (approvisionnements municipaux et non municipaux), dans la documentation publiée et auprès d’Environnement Canada (Environnement Canada, 2011) (annexe C).
Les données fournies par les provinces et territoires indiquent que les concentrations de MCPA sont inférieures à la limite de déclaration de la méthode (SDM) ou à la limite de détection de la méthode (LDM) dans la plupart des échantillons prélevés. Les échantillons prélevés provenaient de diverses sources d’approvisionnement en eau au Canada, notamment des eaux de surface et des eaux souterraines, ainsi que de l’eau traitée et distribuée là où la surveillance a eu lieu (British Columbia Ministry of Health, 2019; ministère de l’Environnement, de la Protection de la nature et des Parcs de l’Ontario, 2020; Services aux Autochtones Canada, 2019; Développement durable Manitoba, 2019; ministère de l’Environnement et de la Lutte contre les changements climatiques, 2019; ministère de l’Environnement de la Nouvelle-Écosse, 2019; Saskatchewan Water Security Agency, 2019; ministère des Communautés, des Terres et de l’Environnement de l’Île-du-Prince-Édouard, 2019). Le tableau 2 résume les données de surveillance des admistrations où les échantillons déclarés étaient inférieurs à la LDM. Le tableau 3, quant à lui, résume les données des admistrations où des détections de MCPA ont été signalées. Aucune donnée de surveillance n’était disponible pour le Nouveau-Brunswick, Terre-Neuve-et-Labrador ou le Yukon (ministère de l’Environnement et des Gouvernements locaux du Nouveau-Brunswick, 2019; Newfoundland and Labrador Municipal Affairs and Environment, 2019; Service d’hygiène du milieu du Yukon, 2019).
| Région (LDM µg/L) | Période de surveillance | Municipal / non municipal |
Type d’eau (source municipale : eau souterraine/de surface – brute, traitée, distribuée | Nbre de détections / échantillons |
|---|---|---|---|---|
| Colombie-Britannique (2) | 2015–2017 | Municipal | Surface – brute | 0/9 |
| DGSPNI – Région de l’Ontario (0,12 à 0,2) | 2004–2018 | Réseaux publics | Eau souterraine – brute | 0/1 |
| Eau souterraine – traitée | 0/35 | |||
| Eau souterraine – distribution | 0/1 | |||
| Eau de surface – traitée | 0/65 | |||
| Eau de surface – distribution | 0/4 | |||
| Réseaux semi-publics | Eau souterraine – brute | 0/1 | ||
| Eau souterraine – traitée | 0/1 | |||
| Eau souterraine – distribution | 0/14 | |||
| Eau de surface – traitée | 0/2 | |||
| Eau de surface – distribution | 0/1 | |||
| Réseaux privés | Eau de surface – traitée | 0/1 | ||
| DGSPNI – Région de l’Atlantique (2.0) |
2004–2018 | Réseaux publics | Eau souterraine – traitée | 0/3 |
| Eau souterraine – distribution | 0/4 | |||
| Eau de surface – traitée | 0/1 | |||
| DGSPNI – Région du Québec (0,05 à 0,5) | 2004–2018 | Non-disponible | Puits communautaire | 0/13 |
| Puits privé | 0/24 | |||
| Système, eau potable | 0/32 | |||
| Nouvelle-Écosse (0,5 à 5,0) | 2012–2018 | Municipal | Eau souterraine – brute | 0/53 |
| Eau souterraine – traitée | 0/24 | |||
| Eau de surface – brute | 0/19 | |||
| Eau de surface – traitée | 0/22 | |||
| Saskatchewan (0,0001 à 1,0) | 2014–2019 | Municipal | Eau souterraine – brute (municipale) | 0/9 |
| Eau souterraine et de surface – traitée (municipale) | 0/4 | |||
| Eau souterraine et de surface – distribuée (municipale) | 0/29 | |||
| Île-du-Prince-Édouard (0,5 à 1,0) | 2004–2017 | Municipal | Eau souterraine – brute | 0/362 |
| DGSPNI - Direction générale de la santé des Premières Nations et des Inuits | ||||
| Province (LDM µg/L) | Période de surveillance | Type d’eau (Source municipale : eau souterraine ou de surface – brute, traitée, distribuée et source non municipale : eau souterraine ou de surface non précisée) | Nbre de détections / échantillons | Valeur max. (µg/L) |
|---|---|---|---|---|
| Ontario (0,0015 à 0,01) | 2016-2020 | Eau de surface – traitée (municipale) | 8/1698 | 69 |
| Eau souterraine – traitée (municipale) | 6/1728 | 401 | ||
| Distribution (municipale) | 0/51 | N/D | ||
| Québec (0,1 à 3,0) | 2012-2018 | Eau souterraine – distribution (municipale) | 1/322 | 2,4 |
| Eau de surface – distribution (municipale) | 0/1005 | N/D | ||
| Eau souterraine – bruteTableau 3 Note de bas de page a(municipale) | 0/46 | N/D | ||
| Eau souterraine – traitéeTableau 3 Note de bas de page a (municipale) | 0/17 | n.d. MDT - matières dissoutes totales |
||
| Eau souterraine – distributionTableau 3 Note de bas de page a (municipale) | 0/5 | COT - carbone organique total
gal/pi2/jour - gallons par pied carré par jour n.d. |
||
| Eau souterraine – bruteTableau 3 Note de bas de page b (municipale) | 0/83 | n.d. | ||
| Eau souterraine – bruteTableau 3 Note de bas de page b (non municipale) | 0/19 | n.d. | ||
| Manitoba (0,025) | 2012-2018 | Eau de surface – ambiante | 75/428 | 1,1 |
n.d. – non-disponible |
||||
Les publications scientifiques faisaient état d’autres données de surveillance des eaux canadiennes. En Colombie-Britannique, le MCPA a été détecté dans l’un des 13 échantillons d’eau de ruissellement prélevés dans la vallée du Bas-Fraser en 2003, avec une concentration maximale déclarée de 110 ng/L (Tuominen et coll., 2005).
En Alberta, des échantillons d’eau souterraine ont été prélevés sur une période de trois ans (2013 à 2015) dans des régions où l’agriculture est pratiquée sur des terres irriguées ou non, afin d’examiner la présence de mélanges de pesticides, dont le MCPA (Munira et coll., 2018). Le MCPA a été le plus fréquemment détecté (n = 436 échantillons) pendant l’été (85 % des détections), avec des détections moins fréquentes au printemps et à l’automne (15 %). Les concentrations de MCPA variaient de 26 à 1 293 ng/L dans le sud de l’Alberta et de 32 à 42 ng/L dans le centre de l’Alberta. En Alberta, à part une détection de 1 293 ng/L, le MCPA a été détecté à des concentrations ≤ 342 ng/L.
Dans une étude réalisée par Environnement et Changement climatique Canada (2015), la surveillance de 47 pesticides dans trois rivières des Prairies entre 2006 et 2011 a révélé que le MCPA était l’un des trois principaux pesticides détectés. Du MCPA a été détecté dans 39 échantillons sur 74 (53 %) de la rivière Carrot à une concentration médiane de 1,5 ng/L, dans 57 échantillons sur 74 (77 %) de la rivière Assiniboine à une concentration médiane de 10,45 ng/L, et dans 53 échantillons sur 77 (69 %) de la rivière Rouge à une concentration médiane de 5,07 ng/L.
Une étude portant sur 15 réservoirs d’eau potable approvisionnés en eau de surface (alimentés principalement par la fonte des neiges des terres cultivées et le ruissellement occasionnel des pluies) en Alberta, au Manitoba et en Saskatchewan a permis de détecter du MCPA dans 99 % des 206 échantillons de réservoirs prélevés entre 2003 et 2004, avec des concentrations moyennes et maximales de 57 ng/L et 374 ng/L, respectivement (limite de détection de 0,58 ng/L) (Donald et coll., 2007). Les auteurs ont observé que le MCPA était constamment présent dans les échantillons d’eau des 15 réservoirs d’eau. Le MCPA a été détecté à des concentrations moyennes plus élevées dans les échantillons de juillet (89,1 ± 13,8 ng/L) après l’application d’herbicide (de mai au début juillet) que dans les échantillons d’avril et mai (36,5 ± 8,7 ng/L) après le ruissellement de la fonte des neiges. Dans le centre de la Saskatchewan, Donald et coll. (2018) ont effectué la surveillance de 29 herbicides, dont le MCPA, pendant cinq ans dans 16 milieux humides sur des fermes à travail minimum du sol et dans 7 milieux humides sur des fermes biologiques. Le MCPA a été détecté à une fréquence supérieure à 50 % dans les milieux humides, tant dans les fermes à travail minimum du sol que dans les fermes biologiques. Du MCPA a été détecté dans les 96 échantillons, avec une concentration maximale de 5 980 ng/L pour les fermes à travail minimum du sol et de 257 ng/L pour les fermes biologiques. Les concentrations moyennes étaient de 276 ng/L (70 échantillons) pour les 16 milieux humides sur les fermes à travail minimum du sol et de 119 ng/L (26 échantillons) pour les 7 milieux humides sur les fermes biologiques.
Une étude de surveillance des pesticides réalisée au printemps et à l’été 2003 a signalé la présence de MCPA dans 15 petites mares artificielles échantillonnées dans les trois provinces des Prairies (Murray et coll., 2004). Les concentrations moyennes de MCPA variaient de 13 à 108 ng/L dans la plupart des mares artificielles, deux d’entre elles présentant des concentrations moyennes allant de 200 à 320 ng/L, éventuellement en raison de l’application de formulations commerciales (qui comprennent du MCPA) dans le bassin versant.
En Ontario, le Programme de surveillance de l’eau potable (PSEP) examine la qualité de l’eau dans certains systèmes municipaux d’approvisionnement en eau potable à des fins scientifiques et de recherche. Le PSEP surveille les paramètres inorganiques, organiques et radiologiques, dont les pesticides. Les résultats pour le MCPA dans les échantillons d’eau brute (n = 273), traitée (n = 218) et du réseau de distribution (n = 1) au cours de la période 2010-2012 n’ont révélé aucune détection supérieure à la LDM de 0,05 µ/L.
Au Québec, du MCPA a été détecté dans 12,6 % (en moyenne) des échantillons d’eau de surface prélevés dans quatre rivières des zones de culture du maïs et du soja de la province (rivières Chibouet, des Hurons, Saint-Régis et Saint-Zéphirin) entre 2015 et 2017 (concentration maximale de 0,97 µg/L) (Giroux, 2019). Pendant la même période, Giroux (2019) a rapporté les fréquences de détection du MCPA (sans les concentrations) dans d’autres réseaux hydrographiques du Québec, soit de 10 % à 11,1 % dans deux rivières de la Montérégie, de 36,4 % à 54,5 % dans sept rivières de la région de Chaudières-Appalaches, et de 9,1 % à 18,2 % dans six rivières du Saguenay-Lac-Saint-Jean.
Dans les provinces maritimes, le MCPA n’a été détecté dans aucun des 60 échantillons d’eau de surface prélevés au Nouveau-Brunswick (2003 et 2004), en Nouvelle-Écosse (2004) ou à l’Île-du-Prince-Édouard (2003 et 2004) sur la base d’une limite de détection de 1 µg/L (Murphy et Mutch, 2005). Le MCPA n’a pas été détecté dans les rivières de huit municipalités ayant des activités agricoles ou urbaines au Nouveau-Brunswick en 2004 (ministère de la Santé du Nouveau-Brunswick, 2005).
En Saskatchewan, des échantillons d’air prélevés en 2003 du 12 mai au 13 août à Bratt’s Lake, Hafford et Waskesiu ont révélé une fréquence de détection de 94 % pour le MCPA (Yao et coll., 2006). Les concentrations atmosphériques moyennes (un mètre au-dessus du sol) pour les trois zones d’étude étaient de 513 pg/m3 (Bratt’s Lake), 82 pg/m3 (Hafford) et 32,8 pg/m3 (Waskesiu). La présence dans l’atmosphère reflétait l’application locale de pesticides, la volatilisation depuis le sol et le transport atmosphérique.
Messing et coll. (2014) ont étudié les concentrations atmosphériques de pesticides au cours des étés 2005 et 2007 pendant 90 jours à quatre endroits de la région agricole des Prairies canadiennes (Lethbridge, Swift Current, Indian Head et Brandon) et à cinq endroits des régions subarctique et arctique canadiennes (parc national Nahanni, Fort Simpson, Yellowknife, Arviat, Coral Harbour). Le MCPA a été détecté dans tous les sites des Prairies (variant de 0,05 à 0,47 µg/échantillon) au cours de ces deux années, ce qui est conforme à son utilisation dans les systèmes de production agricole. Du MCPA a également été détecté à Arviat en 2007 à une concentration de 0,01 µg/échantillon.
L’Agence canadienne d’inspection des aliments de Santé Canada a analysé des produits alimentaires canadiens et importés (c.-à-d., des fruits et légumes frais et des produits de fruits et légumes transformés) pour y déceler la présence de MCPA entre le 1er avril 2015 et le 31 mars 2016. Du MCPA a été détecté dans le seul échantillon (0,0015 ppm) de baies d’amélanche canadiennes congelées et dans un échantillon sur 4 (0,0006 ppm) de bleuets importés (Santé Canada, 2015-2016).
2.0 Considérations relatives à la santé
Tous les pesticides, y compris le MCPA, sont réglementés par l’Agence de réglementation de la lutte antiparasitaire (ARLA). L’ARLA réalise des évaluations approfondies et des examens cycliques concernant les pesticides, en se penchant notamment sur des renseignements exclusifs ou non publiés ainsi que sur des examens effectués à l’étranger par d’autres organismes de réglementation comme l’US EPA. Ainsi, la présente évaluation des risques pour la santé repose principalement sur les évaluations de l’ARLA (Santé Canada, 2006; 2007) et la documentation à l’appui. De plus, les examens et la documentation pertinente qui ont suivi la réalisation des évaluations de l’ARLA ont été pris en compte.
2.1 Cinétique
Des études de la toxicité chronique et subchronique ont montré que le chien est plus sensible que le rat ou la souris aux effets du MCPA et des composés apparentés, les effets étant observés à des doses au moins 10 fois plus faibles chez le chien que chez le rat ou la souris. La mise à l’échelle allométrique des données sur le rat, le chien et l’être humain indique que la clairance rénale du MCPA chez le chien est 10 fois plus lente que chez l’être humain (Timchalk, 2004). La sensibilité particulière du chien aux effets du MCPA soulignée dans la littérature peut être attribuée à la clairance rénale réduite des acides organiques (p. ex., le MCPA), qui entraîne des concentrations sanguines plus élevées que chez l’humain et les autres espèces. À la lumière de ces données, le chien ne semble pas être une espèce indicatrice appropriée pour l’évaluation de la toxicité du MCPA chez l’humain (Timchalk, 2004).
Absorption : Chez les rats, les chiens et les humains, le MCPA est facilement absorbé dans le tube digestif (par gavage et après intubation gastrique directe) (Elo, 1976; Fjeldstad et Wannag, 1977; Kolmodin-Hedman et coll., 1983a, 1983b; Jahanshahi et Stow, 1995; Hardwick, 1999, 2000; Lappin et coll., 2002). Les concentrations plasmatiques maximales ont été atteintes dans les 2 à 4 heures qui ont suivi l’administration orale d’une dose unique de 5 ou de 100 mg/kg poids corporel (p.c.) de MCPA chez les rats et dans les 4,5 à 7 heures chez les chiens beagle (Lappin et coll., 2002). Des concentrations plasmatiques maximales similaires ont été obtenues chez les rats dans les 2 à 3 heures suivant l’administration d’une seule dose de 5 mg/kg p.c. de MCPA-DMAS ou de MCPA-EHE (van Ravenzwaay et coll., 2004). Les volontaires humains qui ont reçu une dose de MCPA de 0,015 mg/kg p.c. par jour ont présenté une concentration plasmatique maximale après 1 heure (Kolmodin-Hedman et coll., 1983a). Un examen comparatif de ces études sur le métabolisme a montré que la demi-vie plasmatique chez le chien (63 heures) était beaucoup plus longue que chez le rat (6 heures) et les humains (11 heures) à une dose de 5 mg/kg p.c. de MCPA (Timchalk, 2004).
Distribution : Chez le rat, le MCPA est largement distribué dans divers tissus et organes (Elo, 1976). Cependant, aucune accumulation significative de MCPA n’est observée dans les tissus (Jahanshahi et Stow, 1995; van Ravenzwaay et coll., 2004).
Chez les rats auxquels on a administré du [14C]MCPA par intubation gastrique directe à raison d’une dose unique de 11,5 mg/kg p.c., la concentration maximale dans les tissus a été atteinte entre 2 et 8 heures après l’administration de la dose, puis les concentrations ont chuté rapidement (Elo, 1976). Les tissus ou organes où l’on retrouvait les concentrations les plus fortes étaient le sang, le rein, la surrénale, le poumon, le cœur, le foie, la glande thyroïde et la moelle osseuse.
Chez les rats qui ont reçu du [14C]MCPA à raison d’une seule dose orale de 5 ou de 100 mg/kg p.c., la radioactivité dans les tissus et les carcasses représentait ≤ 2,3 % de la dose au moment où les sujets ont été sacrifiés (Jahanshahi et Stow, 1995; van Ravenzwaay et coll., 2004). Chez les rats qui avaient reçu la dose plus faible (sacrifiés le jour 4), le MCPA n’était pas détectable dans la plupart des tissus, sauf dans la graisse, la peau et les reins. Chez les rats qui avaient reçu la dose élevée (sacrifiés le jour 7), la radioactivité se concentrait principalement dans la graisse, la peau et les reins, et des concentrations élevées ont été détectées dans davantage d’organes que pour la faible dose. En outre, les femelles présentaient des niveaux de radioactivité plus élevés que les mâles et de petites quantités de radioactivité résiduelle détectées dans les reins étaient compatibles avec une excrétion continue du composé (van Ravenzwaay et coll., 2004).
Métabolisme : À la suite de l’intoxication mortelle d’un homme de 23 ans, l’autopsie médico-légale a révélé la présence de 4-chloro-2-méthylphénol dans les liquides corporels et les tissus des organes, suggérant un métabolite du MCPA (Takayasu et coll., 2008). Dans une étude où l’on a injecté 15 μg/kg p.c. de MCPA à cinq volontaires en santé, l’analyse approfondie du MCPA sous forme d’acide libre ou de conjugué chez l’un des individus a montré que la conjugaison variait de 56 à 73 % sur une période de prélèvement de 72 heures (Kolmodin-Hedman et coll., 1983b).
La toxicocinétique et le métabolisme du MCPA-DMAS et du MCPA-EHE ne sont pas distinguables de ceux du MCPA (van Ravenzwaay et coll., 2004). Le MCPA, le MCPA-DMAS et le MCPA-EHE n’ont pas été largement métabolisés chez les rats après l’administration orale. Lappin et coll. (2002) ont rapporté que des rats exposés par voie orale à 5 et 10 mg/kg/j de MCPA excrétaient le composé d’origine principalement dans l’urine (environ 65 % de la dose). Le seul métabolite présent en quantités importantes dans l’urine des rats était l’acide hydroxyméthylphénoxyacétique (HMCPA). Le conjugué du MCPA avec la glycine a également été détecté, bien qu’en quantité trop faible pour qu’il soit quantifié de manière fiable. L’urine contenait moins de MCPA (2 à 29 %) chez les chiens que chez les rats; par contre, elle contenait des concentrations beaucoup plus élevées du conjugué du MCPA avec la glycine (jusqu’à 37 % de la dose). Le conjugué avec la taurine, absent dans l’urine des rats, a également été détecté (jusqu’à 7 % de la dose).
Élimination: Chez des volontaires humains ayant reçu 0,015 mg/kg p.c. de MCPA, 40 % en moyenne de la dose administrée a été excrétée dans l’urine au cours des 24 premières heures (Kolmodin-Hedman et coll., 1983b). Dans une autre étude, des volontaires ayant reçu 5 mg de MCPA ont excrété 50 % de la dose dans l’urine en l’espace de 48 heures et 55 % en l’espace de 96 heures; au cinquième jour, la concentration urinaire était inférieure à la limite de détection (Fjeldstad et Wannag, 1977). Aucune analyse des métabolites n’a été entreprise dans les deux études sur les humains, et les doses de MCPA n’étaient pas radiomarquées au 14C.
Selon des rapports, l’excrétion rénale serait la principale voie d’élimination du MCPA chez les rats et les chiens ayant reçu une dose orale de MCPA (Elo, 1976; Jahanshahi et Stow, 1995; Lappin et coll., 2002; van Ravenzwaay et coll., 2004). Les chiens et les rats présentent des profils de rétablissement différents. Des études ont montré que la clairance rénale chez les chiens était plus lente et moins importante que chez les rats (Lappin et coll., 2002) ou les humains (Fjeldstad et Wannag, 1977; Kolmodin-Hedman et coll., 1983a, 1983b).
Chez les rats, de 75 à 80 % de la dose administrée était excrétée dans l’urine en l’espace de 24 heures, peu importe la dose. Chez les chiens, l’élimination n’était pas complète 120 heures après l’administration orale de doses uniques de 5 ou de 100 mg/kg p.c. de MCPA (Lappin et coll., 2002).
Chez les rats, le composé d’origine (MCPA) était le principal composé excrété dans l’urine, avec des quantités plus faibles d’un produit d’oxydation (HMCPA) et des quantités infimes d’un conjugué avec la glycine (Lappin et coll., 2002). Chez les chiens, le composé d’origine était également présent dans l’urine, mais à de plus faibles concentrations que chez le rat. En outre, trois métabolites ont été récupérés dans l’urine : le conjugué avec la glycine, à des concentrations plus élevées que chez le rat, et, en quantité moindre, le HMCPA et un conjugué avec la taurine (Lappin et coll., 2002).
L’élimination fécale était une voie d’élimination négligeable chez les deux espèces, mais on retrouvait une plus forte proportion de MCPA dans les excréments des chiens que dans ceux des rats. Aucune radioactivité n’a été détectée dans l’air expiré par des rats ayant reçu par voie orale une dose de 5 mg/kg p.c. de [14C]MCPA (van Ravenzwaay et coll., 2004).
Dans une recension comparative des études métaboliques chez les rats, les chiens et les humains, Timchalk (2004) a montré que la demi-vie plasmatique était plus longue et l’élimination plus lente chez les chiens que chez les rats et les humains, ce qui entraînait, pour des doses comparables, une charge corporelle de MCPA beaucoup plus grande chez les chiens que chez les autres espèces. Dans des études antérieures portant sur des acides organiques aux propriétés pharmacocinétiques similaires, les chiens avaient une capacité plus limitée que d’autres espèces d’excréter les acides organiques par le rein. Selon les auteurs, cette diminution de la clairance rénale pourrait être causée par la saturation de la sécrétion rénale et l’augmentation de la réabsorption par les tubules rénaux. Ces différences dans la pharmacocinétique du MCPA et d’autres acides organiques apparentés chez les chiens et d’autres espèces semblent indiquer qu’il peut ne pas être approprié d’utiliser les données de toxicité chez les chiens pour déterminer le risque pour la santé humaine. Par conséquent, l’ARLA a choisi de ne pas utiliser les données relatives aux chiens dans son évaluation des risques pour la santé.
2.2 Effets sur la santé
Les quelques études épidémiologiques existantes sur les effets du MCPA indiquent que les signes de cancérogénicité et d’effets sur la reproduction restent peu concluants. Chez les animaux, les études subchroniques et chroniques font état d’effets systémiques, ainsi que sur les reins, le foie, les testicules, la reproduction/le développement et le système nerveux, le rein étant indiqué comme l’organe cible le plus sensible. Les études à long terme n’ont montré aucune indication de cancérogénicité (bien que les doses maximales tolérées n’aient pas été atteintes) et les tests visant à mesurer la génotoxicité et la mutagénicité étaient en grande partie négatifs.
2.3 Effets chez les humains
Effets aigus : Les symptômes d’une exposition aiguë à de fortes doses de MCPA à la suite d’une intoxication comprennent la fatigue, la faiblesse, l’anoxie, les nausées, les vomissements, la diarrhée, la baisse de la pression artérielle, les troubles de la régulation de la température corporelle, l’hypotension progressive, l’ataxie, l’irritabilité neuromusculaire et les convulsions (Popham et Davis, 1964; Johnson et Koumides, 1965; Jones et coll., 1967; Palva et coll., 1975; Bovey, 1980; Timonen et Palva, 1980; US EPA, 1984; Bradberry et coll., 2000; Roberts et coll., 2005).
Cancer : Les études épidémiologiques sur les herbicides phénoxy au Canada, aux États-Unis, en Australie, en Nouvelle-Zélande et dans plusieurs pays européens comportent surtout des expositions multiples à divers herbicides chlorophénoxy (dont l’acide 2,4-dichlorophénoxyacétique (2,4-D) et le 2,4,5-T), ainsi que d’autres pesticides, matières premières, produits intermédiaires et produits chimiques de transformation. Des cas de sarcome des tissus mous, de lymphome non hodgkiniens (LNH) et de maladie de Hodgkin ont été associés à des herbicides phénoxy, y compris ceux contaminés à la dioxine (ce qui peut augmenter le risque de certains cancers). Toutefois, les résultats n’ont pas été constants (Mannetje et coll., 2005). Certaines études épidémiologiques ont inclus le MCPA parmi les herbicides examinés (Hardell et Sandström, 1979; Eriksson et coll., 1981; Hardell et coll., 1981; Coggon et coll., 1986; Vineis et coll., 1986, 1991; Wiklund et coll., 1987, 1988, 1989; Eriksson et coll., 1990; Saracci et coll., 1991; Bueno de Mesquito et coll., 1993; Lynge, 1993; Kogevinas et coll., 1995; Becher et coll., 1996; Lynge, 1998; Hardell et Eriksson, 1999; Eriksson et coll., 2008); toutefois, très peu de ces études ont fait état de résultats propres au MCPA.
L’étude pancanadienne sur les pesticides et la santé (CCSPH), une étude cas-témoins en population, menée auprès d’hommes canadiens âgés de 19 ans et plus dans six provinces (Québec, Ontario, Manitoba, Saskatchewan, Alberta et Colombie-Britannique), a évalué les risques de cancer liés à l’exposition à plusieurs pesticides différents, avec la possibilitéd’une modification des effets découlant de l’asthme, des allergies, du rhume des foins ou de l’asthme avec allergies et du rhume des foins combinés (Pahwa et coll., 2012). La CCSPH comprenait, pour un total de 2 019 sujets, 513 cas incidents de LNH diagnostiqués entre le 1er septembre 1991 et le 31 décembre 1994 et 1 506 témoins représentatifs de la population sélectionnés au hasard dans ces mêmes provinces. Le risque de LNH associé à l’exposition au MCPA était élevé chez les personnes souffrant d’asthme, d’allergies ou du rhume des foins par rapport à celles qui ne souffraient d’aucune de ces affections. Une augmentation du risque a également été observée pour l’exposition au MCPA par les asthmatiques par rapport aux non-asthmatiques; et les personnes allergiques présentaient un risque plus élevé de LNH avec l’exposition au MCPA que les personnes non allergiques. Les auteurs ont déclaré que les résultats pourraient représenter de nouvelles pistes ou des événements fortuits et ont recommandé que des recherches supplémentaires soient entreprises.
Les limites des études susmentionnées, y compris la petite taille de l’échantillon, la co-exposition à d’autres pesticides, un éventuel biais de rappel, une erreur de mesure et un manque d’informations détaillées sur la dose utilisée et le temps passé à appliquer les pesticides, rendent difficile l’interprétation des résultats de ces études. Des études plus définitives avec une évaluation précise des expositions au MCPA exclusivement sont nécessaires.
Toxicité pour le développement et la reproduction : Peu d’études épidémiologiques ont exploré les effets de l’exposition au MCPA sur la reproduction et le développement. Arbuckle et coll. (1999) ont étudié l’effet de l’exposition aux herbicides phénoxy sur le risque d’avortement spontané chez une population agricole de l’Ontario comprenant 2 110 femmes et plus de 3 936 grossesses, dont 395 avortements spontanés. Des fenêtres d’exposition avant la conception et après la conception ont été examinées séparément, avec une différenciation entre un avortement spontané précoce (< 12 semaines) et tardif (12 à 19 semaines) pour chaque fenêtre d’exposition. En limitant l’analyse à l’exposition au MCPA, aucun risque accru d’avortement spontané n’a été observé à la suite d’une exposition avant la conception pour tous les âges gestationnels; toutefois, si l’on examine séparément les avortements spontanés précoces et tardifs, le risque d’avortement précoce augmente, alors que le risque d’avortement tardif diminue. Une analyse supplémentaire donne à penser que si l’exposition au MCPA se produisait pendant un mois ou plus avant la conception, le risque d’avortement précoce augmentait davantage, mais le risque d’avortement tardif était faible. Selon les auteurs, les résultats montrent que l’exposition au MCPA (et aux herbicides phénoxy) avant la conception pourrait influer sur les issues défavorables de la grossesse, en particulier les avortements spontanés précoces (ce qui pourrait indiquer un effet à médiation masculine, le risque augmentant en l’absence d’utilisation d’équipements ou de vêtements de protection). Les limites de l’étude comprennent la petite taille de l’échantillon, le recours au rappel de mémoireet le manque d’informations détaillées sur la dose utilisée et le temps passé à appliquer les pesticides. Par conséquent, une étude plus approfondie est nécessaire pour confirmer ces résultats.
2.4 Effets sur les animaux
Toxicité aiguë : Les données sur la toxicité orale aiguë du MCPA chez les animaux sont résumées dans le tableau 4.
| Formes de MCPA | Dose létale médiane (DL50) par voie orale (mg/kg p.c.) | ||
|---|---|---|---|
| Rat | Souris | Cobaye | |
| MCPA, forme acide | 700-1 383Tableau 4 Note de bas de page a,Tableau 4 Note de bas de page b,Tableau 4 Note de bas de page c,Tableau 4 Note de bas de page d | 439-800Tableau 4 Note de bas de page e,Tableau 4 Note de bas de page f | 700Tableau 4 Note de bas de page e |
Références :
|
|||
Les études sur les effets de l’exposition à court et à long terme au MCPA, au MCPA-DMAS et au MCPA-EHE chez les souris et les rats indiquent des effets sur la santé principalement au niveau des reins et du foie. Des effets sur d’autres organes, des effets hématologiques et neurologiques, ainsi que des effets sur les organes reproducteurs ont également été signalés. Chez les rats, des effets sur le développement ont été signalés en présence d’une toxicité maternelle. Cependant, aucun effet sur le développement n’a été observé chez les lapins, bien qu’une toxicité maternelle ait été constatée. Enfin, aucun effet sur la reproduction n’a été observé dans une étude sur deux générations de rats. Le tableau 5 présente un résumé des études pertinentes disponibles sur la toxicité du MCPA chez les animaux.
| Espèce, nombre | Exposition durée | Composé et dose(s) | Effets critiques et autres | Références |
|---|---|---|---|---|
| Rats Charles River (10/sexe/dose) | 90 jours | MCPA dans le régime alimentaire : 0, 4, 8 ou 16 mg/kg p.c. par jour | Effets sur les reins : augmentation modérée à importante du poids relatif/absolu des reins (mâles). | Holsing et Kundzin (1970) |
| Rats (15/sexe/dose) | 90 jours | MCPA dans le régime alimentaire : 0, 50, 150 ou 450 ppm (correspondant à des doses de 0, 3,6, 10,9 et 32,6 mg/kg p.c. par jour pour les mâles et de 0, 4,0, 12,1 et 35,8 mg/kg p.c. par jour pour les femelles | Effets sur les reins : insuffisance rénale (liée aux modifications du taux de calcium et du poids des reins) | Kirsch (1985 b) |
| Souris B6C3F1 (50/sexe/dose); + un groupe satellite (10/sexe/dose) | Deux ans | MCPA dans le régime alimentaire : 0, 20, 100 ou 500 ppm (correspondant à 0, 3,2, 15,7 ou 79,5 mg/kg p.c. par jour chez les mâles et à 0, 3,9, 19,5 ou 97,2 mg/kg p.c. par jour chez les femelles) | Effets sur les reins : augmentation importante du poids des reins; lésions rénales (dose élevée); hyperplasie rénale accrue non liée à la dose (femelles); incidence accrue de l’hyperplasie focale de l’épithélium tubulaire rénal (mâles). Autres effets : toxicité systémique. |
Kuhborth et coll. (1988) |
| Souris (4-6/sexe/dose) | 28 jours | MCPA dans le régime alimentaire; 0, 100, 300, 900 ou 2 700 ppm (correspondant à des doses de 0, 19,1-22,0, 56,3-67,7, 173,4-184,8 et 453,7-820,1 mg/kg p.c. par jour pour les mâles, et de 0, 20,7-26,2, 69,2-73,9, 193,4-223,9 et 442,3-956,3 mg/kg p.c. par jour pour les femelles) | Effets sur le foie : dégénérescence albumineuse dans le foie d’une femelle ayant reçu une dose moyenne. Autres effets : troubles moteurs, perte de poids importante, effets sur la rate, diminution du poids des reins et effets sur la reproduction chez les mâles. |
Kirsch (1985a) |
| Rats Wistar (15/sexe/dose) | 3 mois | MCPA dans le régime alimentaire : 0, 50, 500 ou 2 500 ppm (correspondant à des doses de 0, 3, 34 ou 177 mg/kg p.c. par jour pour les mâles et de 0, 4, 42 ou 188 mg/kg p.c. par jour pour les femelles) | Effets sur le foie : pathologie hépatique Autres effets : diminution du poids corporel et de la prise de poids; modification des paramètres biochimiques et hématologiques, atrophie testiculaire et modifications de l’activité motrice. |
Mullins et coll. (1994b) |
| Rats Wistar (50/sexe/dose); + 2 groupes satellites (10-15/sexe/dose) | Deux ans | MCPA dans le régime alimentaire : 0, 20, 80 ou 320 ppm (correspondant à 0, 1,1, 4,4 ou 17,6 mg/kg p.c. par jour chez les mâles et à 0, 1,4, 5,7 ou 23 mg/kg p.c. par jour chez les femelles) | Effets sur le foie et les reins : hépatotoxicité (augmentation des taux d’alanine aminotransferase (ALT) chez les femelles; effets sur les reins (changements pathologiques) chez les mâles. Autres effets : toxicité systémique; modification des paramètres biochimiques; faible diminution du poids corporel des mâles et augmentation faible/sporadique du poids corporel des femelles; dose maximale tolérée (DMT) non atteinte. |
Kirsch (1988) |
| Rats Wistar : étude intermédiaire (10/sexe/dose); étude clé (50/sexe/dose) | Deux ans | MCPA-2-EHE dans le régime alimentaire : étude intermédiaire : 0, 11, 35, 106 mg/kg p.c. par jour pour les mâles et 0, 13, 40, 128 mg/kg p.c./jour pour les femelles; étude clé : 0, 10, 29, 91 mg/kg p.c. par jour pour les mâles et 0, 12, 38, 125 mg/kg p.c. par jour pour les femelles | Effets sur le foie et les reins : augmentation de la créatinine et de l’urée; diminution du taux de protéines et du nombre de plaquettes (mâles seulement); augmentation de l’hyperplasie du canal cholédoque (mâles seulement); augmentation du temps de prothrombine (femelles seulement). Autres effets : diminution du poids corporel et de la prise de poids corporel |
Buesen et coll. (2012) |
| Rats albinos (25/sexe/dose/ génération) | 2 générations | MCPA dans le régime alimentaire : 0, 50, 150 ou 450 ppm (correspondant à 0, 2,5, 7,5 ou 22,5 mg/kg p.c. par jour) | Effets sur le développement : différences statistiquement significatives dans la prise de poids corporel des chiots mâles (F1a) et des chiots femelles (F1a et F1b) et dans le poids corporel et la prise de poids chez les mâles et les femelles F2a et F2b. Autre : Santé Canada (2006) a déterminé que la DMT n’était pas atteinte; deux autres études de confirmation confidentielles sur une génération n’ont indiqué aucun effet nocif sur le poids corporel des petits, ce qui indique que les petits ne présentaient pas une sensibilité accrue par rapport aux mères. |
MacKenzie (1986) |
| Rates Wistar gravides (nombre non précisé) | Jours 6 à 15 de la gestation | MCPA par gavage : 0, 15, 60 ou 120 mg/kg p.c. par jour | Effets sur la reproduction : toxicité maternelle (diminution liée au traitement du poids corporel, de la prise de poids et de la consommation alimentaire). Effets sur le développement : diminution du poids du placenta et du fœtus, augmentation de l’incidence du retard de formation du squelette du fœtus. |
Hellwig et Hildebrand (1993a) |
| Lapines himalayennes gravides (nombre non précisé) | Jours 7 à 19 de la gestation | MCPA par gavage : 0, 15, 30 ou 60 mg/kg p.c. par jour | Effets sur la reproduction : toxicité maternelle (diminution du poids corporel, de la prise de poids et de la consommation alimentaire). | Hellwig et Hildebrand (1993b) |
| Rates CD gravides (25/dose) | Jours 6 à 19 de la gestation | MCPA-EHE par gavage : 0, 23,5, 62,7 ou 188 mg/kg p.c. par jour (correspondant à 0, 15, 40 et 120 mg/kg p.c. par jour de MCPA sous forme acide) | Effets sur la reproduction : toxicité maternelle (réduction de la prise de poids corporel/consommation alimentaire). Effets sur le développement : résorption de la portée, diminution du poids des fœtus et perturbation de la croissance. |
Cappon (1999a) |
| Rates CD gravides (17-25/dose) | Jours 6 à 19 de la gestation | MCPA-DMAS par gavage : 0, 18,5, 62 ou 185 mg/kg p.c. par jour (correspondant à 0, 15, 50 et 150 mg d’acide libre de MCPA/kg p.c. par jour) | Effets sur la reproduction : toxicité maternelle (signes cliniques et mortalité). Effets sur le développement : réduction du poids corporel moyen des fœtus; malformations externes et/ou du squelette des fœtus; variations du squelette des fœtus. |
Cappon (1999b) |
2.5 Génotoxicité et cancérogénicité
Le Centre international de recherche sur le cancer(CIRC, 1983) a évalué le MCPA et a conclu qu’« aucune donnée adéquate n’était disponible pour évaluer la cancérogénicité du MCPA chez les animaux de laboratoire ». L’US EPA (2003, 2004c, 2004e) a classé le MCPA parmi les substances « qui ne sont probablement pas cancérogènes pour l’humain », en raison du manque de données relatives à sa cancérogénicité chez les souris et les rats.
D’après les données connues, le MCPA sous sa forme acide et ses autres formes n’est pas considéré comme génotoxique in vivo. Les essais de génotoxicité ont fourni des résultats équivoques pour l’induction de l’échange de chromatides sœurs, et des résultats positifs ont été obtenus pour les trois formes de MCPA dans des essais in vitro sur les lymphocytes de mammifères (Santé Canada, 2006). Cette absence générale de génotoxicité après l’exposition au MCPA concorde avec l’absence de cancérogénicité chez les animaux (Elliott, 2005). Le MCPA n’était pas mutagène dans la majorité des essais signalés de mutation des gènes sur des bactéries et des cellules de mammifères, pas plus qu’il ne provoquait de lésions de l’ADN dans le chromotest SOS. Par ailleurs, aucune donnée in vivo ne laisse supposer une clastogénicité dans la moelle osseuse, et les essais d’échange de chromatides sœurs ont donné des résultats négatifs ou faiblement positifs (Räsänen et coll., 1977; Zetterberg, 1978, 1979; Nishimura et coll., 1982; Moriya et coll., 1983; Linnainmaa, 1984; Gelbke et Engelhardt, 1985a, 1985b, 1985c, 1985d; Kappas, 1988; Mersch-Sundermann et coll., 1989; Mustonen et coll., 1989; Jones et coll., 1992; Adams et coll., 1993a, 1993b, 1993c; Akhurst et coll., 1993a, 1993b, 1993c; Jones et coll., 1993a, 1993b; Proudlock et coll., 1993a,1993b, 1993c; Elliott, 2005).
Des études sur l’exposition de longue durée au MCPA et/ou sur sa cancérogénicité ont été menées chez le rat (jusqu’à 23 mg/kg p.c. par jour pendant 2 ans; Kirsch, 1988) et la souris (jusqu’à 97,2 mg/kg p.c. par jour pendant 2 ans; Kuhborth et coll., 1988). Aucun signe de cancérogénicité n’a été observé chez ces deux espèces.
2.6 Mode d’action
Peu de données sur le mode d’action rendent compte des effets du MCPA sur les reins. Des mécanismes ont été suggérés pour expliquer la toxicité rénale à partir de données d’études sur les lésions rénales aiguës découlant d’auto-empoisonnements par le MCPA (Flanagan et coll., 1990; Bradberry et coll., 2000; Roberts et coll., 2005, 2011). Mohamed et coll. (2015) ont suggéré que le MCPA peut induire une toxicité rénale par l’entremise de lésions épithéliales et vasculaires, entraînant un dysfonctionnement cellulaire, une nécrose et une apoptose, et provoquant une réduction du taux de filtration glomérulaire et des lésions rénales aiguës. D’après les données de Zychlinski et Zolnierowicz (1990) et de Bradberry et coll. (2000), Mohamed et coll. (2015) ont proposé que l’atteinte épithéliale puisse découler d’une déplétion de l’adénosine triphosphate (ATP) (par découplage de la phosphorylation) menant à une activation de la voie des caspases et à une altération du cytosquelette; pour sa part, l’atteinte vasculaire surviendrait à la suite d’une augmentation de l’activité du thromboxane A2, menant à une congestion vasculaire par agrégation microvasculaire et agrégation des leucocytes.
La survenue de lésions épithéliales à la suite d’une exposition au MCPA est corroborée par les conclusions de Wunnapuk et coll. (2014), qui ont mesuré divers biomarqueurs urinaires de lésions rénales chez des rats exposés à 40, 80, 200 et 400 mg/kg de MCPA (sel de diméthylamine) dans l’eau. Les biomarqueurs mesurés comprenaient l’albumine, la β2-microglobuline et la cystatine C, qui indiquent une atteinte tubulaire proximale et glomérulaire; la molécule 1 de lésion rénale ( kidney Injury Molecule 1 [KIM-1]), un biomarqueur spécifique de l’atteinte tubulaire proximale; et la lipocaline associée à la gélatinase des neutrophiles, qui indique une atteinte tubulaire proximale et distale.
2.7 Étude clé sélectionnée
L’ARLA (Santé Canada, 2006; 2007; 2008) considère le rein comme l’organe cible le plus sensible dans la base de données. L’étude de Kirsch (1985b) sur 90 jours chez les rats a été établie comme l’étude clé pour l’évaluation des risques pour la santé humaine du MCPA dans l’eau potable.
Kirsch (1985b) a administré du MCPA de qualité technique (94,8 %) à des rats (15/sexe/dose) à des concentrations alimentaires de 0, 50, 150 ou 450 ppm (ce qui équivaut à des doses de 0, 3,6, 10,9 et 32,6 mg/kg p.c. par jour pour les mâles et de 0, 4,0, 12,1 et 35,8 mg/kg p.c. par jour pour les femelles). À 450 ppm, les taux de créatinine étaient augmentés dans le plasma des femelles. À 450 ppm également, les taux de cholestérol et de calcium accusaient une baisse chez les mâles (l’auteur a indiqué que ces effets étaient difficiles à évaluer, étant donné qu’ils ne survenaient que chez les mâles). Une augmentation du poids absolu et relatif des reins a en outre été observée chez les mâles. À 150 ppm, le poids absolu des reins était accru (108 % par rapport aux témoins) (p < 0,05). Aucun changement n’a été observé à la dose la plus faible (50 ppm). Sur la base de l’atteinte rénale correspondant aux modifications du taux de calcium et du poids des reins, il a été conclu que la dose sans effet nocif observé (NOAEL) se situe entre 50 et 150 ppm; toutefois, aucune altération histopathologique n’a été détectée en corrélation avec cette augmentation du poids des reins (Kirsch, 1985b). D’après cette même étude, Santé Canada (2007) a établi une NOAEL de 3,6 mg/kg p.c. par jour et une dose minimale avec effet nocif observé de 10,9 mg/kg p.c. par jour en fonction des effets sur les reins (augmentation des poids absolu et relatif; bilirubine, cristaux et pH urinaires).
3.0 Calcul de la valeur basée sur la santé
Santé Canada (2006; 2007; 2008) a établi un apport quotidien acceptable (AQA) chronique (à vie) de MCPA de 0,04 mg/kg p.c. par jour en utilisant la NOAEL de 3,6 mg/kg p.c. par jour à partir de l’étude de 90 jours sur des rats effectuée par Kirsch (1985b). La NOAEL était basée sur les effets sur les reins (augmentation des poids absolu et relatif; bilirubine, cristaux et pH urinaires). L’AQA a été calculé comme suit :
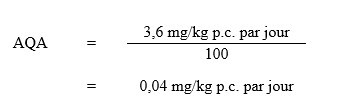
Équivalent textuel
Équation VBS :
L’AQA pour MCPA est de 0,04 mg/kg p.c. par jour. Cette valeur est calculée par divisant la NOAEL de 3,6 mg/kg p.c. par jour par le facteur d’incertitude de 100.
où :
- 3,6 mg/kg p.c. par jour est la NOAEL de l’étude de 90 jours chez le rat effectuée par Kirsch (1985b);
- 100 est le facteur d’incertitude qui tient compte de la variabilité interspécifique (×10) et intraspécifique (×10); l’ARLA a récemment conclu qu’un facteur d’incertitude pour les lacunes de la base de données n’est plus nécessaire, car l’étude de cancérogénicité sur 2 ans de Buesen et coll. (2012) complète la base de données scientifiques pour le MCPA, qui est maintenant considérée comme adéquate (Santé Canada, 2020)
En utilisant l’AQA de 0,04 mg/kg p.c. par jour, la valeur basée sur la santé (VBS) du MCPA dans l’eau potable a été calculée comme suit :
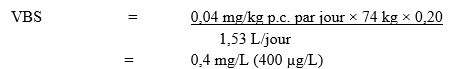
Équivalent textuel
Équation VBS :
La VBS pour MCPA dans l’eau potable est de 0,4 mg/L. Cette valeur est calculée en multipliant l’AQA de MCPA (0,04 mg/kg p.c. par jour) par le facteur d’attribution de l’eau potable, 0,20, puis par 74 kg, le poids corporel moyen d'un adulte, et en divisant le résultat par 1.53 L/jour, le volume quotidien d'eau consommé par un adulte.
où :
- 0,04 mg/kg p.c. par jour est l’AQA calculé par Santé Canada (2006);
- 74 kg est le poids corporel moyen d’un adulte (Santé Canada, en cours d’élaboration);
- 1,53 L par jour est le volume quotidien d’eau du robinet consommé par un adulte (Santé Canada, en cours d’élaboration);
- 0,20 est le facteur d’attribution par défaut puisque l’eau potable n’est pas une source majeure d’exposition au MCPA et qu’il existe des indications de la présence de MCPA dans d’autres sources d’exposition (c.-à-d., la nourriture) (Krishnan et Carrier, 2013).
4.0 Considérations liées à l’analyse et au traitement
4.1 Méthodes d’analyse pour détecter le MCPA
Des méthodes normalisées pour l’analyse du MCPA dans les sources d’approvisionnement en eau et l’eau potable et leurs limites de détection (LDM) respectives sont résumées au tableau 6. Les LDM dépendent de la matrice de l’échantillon, de l’instrumentation et des conditions de fonctionnement choisies et varient d’un laboratoire à l’autre. Ces méthodes sont sujettes à diverses interférences (générales ou particulières) qui sont décrites dans les ouvrages de référence respectifs.
Les responsables de systèmes d’approvisionnement en eau potable devraient discuter des exigences d’échantillonnage avec le laboratoire accrédité qui effectue l’analyse, afin de s’assurer que les procédures de contrôle de la qualité sont respectées et que les SDM sont suffisamment basses pour permettre une surveillance précise à des concentrations inférieures à la CMA. Les facteurs à considérer pour l’analyse du MCPA dans les échantillons d’eau potable (p. ex., préservation et conservation des échantillons) sont décrits dans les documents de référence présentés au tableau 6. Il est important de noter qu’une inactivation est essentielle si un oxydant est présent dans les échantillons, afin de prévenir toute dégradation supplémentaire du MCPA avant l’analyse.
| Méthode (référence) |
Méthodologie | Interférences/Commentaires | LDM (µg/L) |
|---|---|---|---|
| EPA 555 rev. 1.0 (US EPA, 1992) |
Chromatographie liquide à haute performance avec détection par ultraviolets (CLHP-UV) | Rincer la verrerie à l’acide et acidifier le réactif au sulfate de sodium pour éviter la perte d’acides organiques | 0,8 |
| EPA-RCA:8151A (US EPA, 1996) |
Chromatographie en phase gazeuse avec détecteur à capture d’électrons (GC-DCE) | Assurer une estérification complète pour garantir une récupération adéquate | Tableau 6 Note de bas de page a 0,056 |
| USGS-NWQL : O-1131-95 (USGS, 1996) |
Chromatographie liquide à haute performance avec détection par ultraviolets (CLHP-UV) | Aucune indication dans la méthode | 0,050 |
| USGS-NWQL : O–2060-01 (USGS, 2001) |
Chromatographie liquide à haute performance avec détection par spectrométrie de masse (CLHP-SM) | Aucune indication dans la méthode | 0,0155 |
| ISO 15913 (ISO 2000) |
Chromatographie en phase gazeuse avec spectrométrie de masse (CG-SM) | Veiller à ce que les échantillons soient prélevés selon la méthode prévue pour éviter les interférences | Non disponible |
|
|||
4.2 Considérations liées au traitement
Les technologies de traitement disponibles pour diminuer efficacement les concentrations de MCPA dans l’eau potable comprennent le charbon actif, la filtration sur membrane, l’oxydation et les procédés d’oxydation avancée (POA), ainsi que la filtration biologique. Les taux d’enlèvement signalés varient en fonction des conditions d’exploitation et vont de > 65 % à 100 % pour la nanofiltration (NF) et l’osmose inverse (OI); de 60 % à > 90 % pour l’oxydation et les POA; et de 40 % à 100 % pour la filtration biologique. Le charbon actif a produit des résultats variables en ce qui concerne l’enlèvement du MCPA, mais peut offrir des options de traitement viables en fonction des conditions d’exploitation. La filtration conventionnelle s’est révélée inefficace pour enlever le MCPA de l’eau.
À l’échelle résidentielle, les dispositifs de traitement certifiés qui reposent sur l’osmose inverse ou l’adsorption sur charbon actif devraient pouvoir enlever le MCPA de manière efficace.
4.2.1 Traitement à l’échelle municipale
Le choix d’un procédé de traitement approprié dépend de nombreux facteurs, notamment la source d’eau brute et ses caractéristiques, les conditions d’utilisation de la méthode de traitement choisie et les objectifs de traitement du service d’eau. Il est recommandé de procéder à des études à l’échelle de banc d’essaiou à l’échelle pilote pour s’assurer que l’eau de la source d’approvisionnement peut être traitée correctement et eque la conception du processus est optimale.
L’étude sur les eaux de surface réalisée par Donald et coll. (2007), dont il est question à la section 1.3, a permis d’examiner les concentrations de MCPA dans l’eau traitée provenant de 15 réservoirs d’eau potable. Les procédés de traitement variaient selon la source d’approvisionnement en eau potable, mais tous comprenaient la chloration, et la plupart d’entre eux comprenaient la floculation (alun) et la décantation, le charbon actif et/ou la filtration sur sable. L’étude n’a fourni que des statistiques générales : les données brutes n’ont pas été fournies pour déterminer le rendement des procédés de traitement individuels. Les concentrations moyennes de MCPA dans le réservoir et l’eau traitée étaient respectivement de 57 ng/L et de 31 ng/L (n = 163), la concentration maximale de MCPA dans l’eau traitée étant de 865 ng/L. Une réduction moyenne de 45 % de la concentration de MCPA a été calculée à partir de 26 échantillons appariés, avec une fourchette de 0 % à 93 %.
Lorsque des procédés d’oxydation, des POA ou des procédés biologiques sont utilisés pour enlever les pesticides de l’eau potable, il faut être conscient du potentiel de formation de sous-produits de dégradation du composé cible (Ikehata et Gamal El-Din, 2006; Beduk et coll., 2012; Li et coll., 2019). L’objectif premier doit être l’enlèvement du pesticide, l’objectif secondaire étant de réduire au minimum la formation de sous-produits préoccupants pour la santé. Par ailleurs, les responsables des systèmes d’approvisionnement en eau doivent tenir compte du potentiel de formation de sous-produits de désinfection, selon l’oxydant utilisé et la qualité de l’eau de la source d’approvisionnement.
4.2.1.1 Traitement conventionnel
S’il est peu probable que les procédés conventionnels de filtration (coagulation chimique, clarification et filtration rapide sur sable), utilisés seuls, soient efficaces, l’ajout de chlore pendant l’étape de désinfection peut réduire les concentrations de MCPA par oxydation (voir la section 4.2.1.4). On trouve dans les publications un petit nombre d’études sur l’enlèvement du MCPA par filtration conventionnelle. Les concentrations de composés organiques, comme les pesticides, peuvent être réduites par coagulation/floculation si ces composés sont hydrophobes ou s’ils ont un poids moléculaire élevé et des groupes fonctionnels acides (Randtke, 1988). Les propriétés chimiques du MCPA (modérément lipophile; acide acétique substitué) laissent supposer un enlèvement limité par un traitement conventionnel de l’eau.
Les données opérationnelles recueillies dans des installations de traitement de l’eau conventionnelles à Lethbridge et à Carmangay, en Alberta, ont montré des réductions de 50 % et de 0 % du MCPA dans l’eau traitée, respectivement (Byrtus et coll., 2004).
4.2.1.2 Adsorption sur charbon actif
L’adsorption sur charbon actif est un procédé largement utilisé pour réduire les concentrations de micropolluants, y compris les pesticides, dans l’eau potable (Petrie et coll., 1993; Ignatowicz, 2009; Haist-Gulde et Happel, 2012; van der Aa et coll., 2012; Abdel daiem et coll., 2015). Le charbon actif peut être appliqué de deux manières : applications d’une solution en suspension de charbon actif en poudre (CAP) ou réacteur à lit fixe utilisant du charbon actif en grains (CAG) (Chowdhury et coll., 2013).
Les données tirées d’études à l’échelle de banc d’essai visant à déterminer les coefficients d’adsorption des pesticides sont utiles pour prédire si le charbon actif adsorbera un pesticide donné (US EPA, 2011). En général, les pesticides présentant une constante d’adsorption (c.-à-d. coefficient de Freundlich [K]) supérieure à 200 µg/g (L/µg)1/n sont considérés comme appropriés pour l’enlèvement par adsorption sur charbon (Speth et Adams, 1993; Speth et Miltner, 1998; US EPA, 2011). Il importe toutefois de noter que la présence de matière organique naturelle (MON) ajoute à la complexité du traitement au charbon actif, parce que cette matière entre directement en compétition pour occuper les sites d’adsorption ou encrasse le charbon en obstruant les pores (Chowdhury et coll., 2013). Dans le cas du MCPA, la présence de chlorure de sodium peut réduire l’adsorption par un effet d’écran (Abdel daiem et coll., 2015). En outre, la capacité d’adsorption dépend du pH, de sorte que l’enlèvement du MCPA augmente lorsque le pH diminue (voir le tableau 7) (Kim et coll., 2008).
Les tests d’isothermes d’adsorption montrent que le charbon actif a une capacité d’adsorption élevée pour le MCPA en raison d’interactions électrostatiques attractives (voir le tableau 7) et qu’il a une capacité d’adsorption supérieure à celle du 2,4-D (Abdel daiem et coll., 2015). Par rapport à l’atrazine, il a été constaté que le MCPA est faiblement adsorbé sur le lit de charbon actif dans une mini-colonne et peut réduire sensiblement la durée de vie du lit de charbon actif (Gérard et Barthélemy, 2003).
L’utilisation de CAG est une approche efficace pour le traitement des contaminants organiques qui sont souvent présents en concentrations préoccupantes dans les sources d’eau (Chowdhury et coll., 2013). La capacité du CAG d’éliminer les pesticides par adsorption dépend de la vitesse de filtration, du temps de contact en fût vide (TCFV), des caractéristiques du CAG (type, taille des particules et méthode de réactivation), de la capacité d’adsorption du contaminant et de la durée du cycle de filtration (Haist-Gulde et Happel, 2012).
Les données opérationnelles d’une installation de traitement à l’échelle municipale à Atlanta, en Géorgie, utilisant un prétraitement conventionnel avec un filtre adsorbeur au CAG ont montré que ce type de système de traitement peut faire passer une faible concentration de MCPA dans l’eau brute de 0,47 µg/L à moins de 0,02 µg/L (Frick et Dalton, 2005). Aucun renseignement n’a été fourni sur les conditions de fonctionnement de l’adsorbeur au CAG dans cette étude.
L’utilisation de CAP présente l’avantage de fournir du charbon vierge selon les besoins (p. ex., durant la saison d’application du pesticide) (Miltner et coll., 1989). L’efficacité de l’enlèvement dépend des caractéristiques du CAP (type et taille des particules), de la dose, du temps de contact, de la capacité d’adsorption des contaminants et de la présence de MON (Gustafson et coll., 2003; Summers et coll., 2010; Haist-Gulde et Happel, 2012; Chowdhury et coll., 2013).
D’après les quelques études disponibles, le MCPA est faiblement adsorbé. Comme de nombreux facteurs peuvent influer sur la capacité du charbon actif, notamment le caractère ionique du composé et le pH de la solution, des tests appropriés (p. ex., essais de floculation, (Jar-Tests), essai rapide en colonne à petite échelle (Rapid Small-Scale Column Test [RSSCT]), etc.) seraient nécessaires pour confirmer l’élimination.
| Concentration initiale (μg/L) | Charbon actif | VD specTableau 7 Note de bas de page a (m3/kg) |
VpTableau 7 Note de bas de page b (m3/m3) | Description générale | Référence |
|---|---|---|---|---|---|
| 500 | F400 | 51 | 23 460 | Échelle de banc d’essai . Eau minérale reconstituée avec des acides humiques ajoutés. CA : Masse : 200 ± 5 mg; ρ : 425 kg/m3 Micro-colonne : H : 25 cm, D : 0,5 cm, hauteur du lit de carbone : ± 2,4 cm; débit : 3 mL/min; TCFV : 0,16 min. | Gérard et Barthélemy (2003) |
| 100 | 54 | 15 610 | |||
| Concentration initiale | Charbon actif | pH | K (mol/kg)/ (mol/m3)-1/n | Description générale | Référence |
| 0,45 mol/m3 | F400 | 3,5 | 2,89 | Échelle de banc d’essai . Eau distillée. Test de floculation ( Jar-Tests)– masse de CA : 0,001 à 0,25 g dans une solution de 200 mL; particule ρ : 682 kg/m 3 | Kim et coll. (2008) |
| 7,0 | 0,61 | ||||
| 10,0 | 0,62 | ||||
| Concentration initiale (μg/L) | Charbon actif | K F (L/g) | Description générale | Référence | |
| 50-500 mg/L | Sorbo Norit | 3,29 | Échelle de banc d’essai. Eau distillée, 100 mg de CA dans 100 mL de solution aqueuse d’adsorbat de concentration variable. CA : taille des particules : 0,45 à 1,0 mm. | Abdel daiem et coll. (2015) | |
| Ceca AC40 | 2,0 | ||||
CA - charbon actif D - diamètre H - hauteur |
|||||
| Concentration initiale (μg/L) | Charbon actif | Effluent (μg/L) | Description générale | Référence | |
|---|---|---|---|---|---|
| 0,42 | Aucun détail | 0,06 | TCFV = 5 min | Échelle pilote Colonne : D : 300 mm; H : 2 m Eau ozonée/désozonée Débit : 750 L/h; pH 7,2; 16,9 à 17,7 °C La concentration reste la même pendant 3 jours | Boucherie et coll. (2010) |
| > 0,05 | TCFV = 10 min | ||||
4.2.1.3 Filtration sur membrane
En général, la NF et l’OI sont des procédés efficaces de séparation par membrane sous pression pour l’enlèvement des pesticides de l’eau potable (Van der Bruggen et Vandecasteele, 2003; US EPA, 2011). L’efficacité de la NF et de l’OI pour l’enlèvement des pesticides dépend des caractéristiques de la membrane, des propriétés des pesticides, de la composition de l’eau d’alimentation, des conditions de fonctionnement et de l’encrassement de la membrane (Hofman et coll., 1997; Taylor et coll., 2000; Košutić et Kunst, 2002; Van der Bruggen et Vandecasteele, 2003; Schippers et coll., 2004; Plakas et Karabelas, 2012; Fini et coll., 2019).
Comme le principal mécanisme des membranes de NF et d’OI pour enlever les pesticides est l’exclusion par la taille, le seuil de rétention des molécules en raison de leur poids moléculaire (molecular weight cut-off [MWCO]) est une caractéristique importante de la membrane. Lors du choix d’une membrane, il faut tenir compte du poids moléculaire du MCPA (200,62 Da). Outre l’effet de tamisage, la rétention de petites molécules de pesticide par des membranes dont la taille des pores est plus grande peut être influencée par les interactions physico-chimiques entre le pesticide et la surface de la membrane (Plakas et Karabelas, 2012). Bellona et coll. (2004) présentent un organigramme qui peut être utilisé pour évaluer le potentiel d’enlèvement par filtration sur membrane en tenant compte des caractéristiques du pesticide dans l’eau (p. ex., poids moléculaire, log Kow, diamètre moléculaire) et de celles de la membrane (p. ex., MWCO, taille des pores). Le MCPA est quelque peu hydrophobe (log Kow > 2) et a un pKa assez faible, ce qui indique un potentiel d’enlèvement supplémentaire par liaison hydrophobe à la surface de la membrane et par exclusion électrostatique (Bellona et coll., 2004; Plakas et Karabelas, 2012).
Une étude pilote sur l’utilisation de membranes de NF avec de l’eau prétraitée par filtration conventionnelle a révélé une enlèvement moyenne de 99 % du MCPA jusqu’à des concentrations dans les effluents inférieures à 0,1 µg/L (voir le tableau 9) (Schippers et coll., 2004). Une étude sur l’utilisation de membranes OI à pression ultra faible a permis d’atteindre un taux de rétention > 97 % pour le MCPA, et après 3 ans, aucune diminution de la rétention des pesticides, y compris le MCPA, n’a été observée (Bonné et coll., 2000).
Des études pilotes et à l’échelle de banc d’essai ont montré que la NF et l’OI sont efficaces pour éliminer le MCPA de l’eau potable (Hofman et coll., 1997; Bonné et coll., 2000; Taylor 2000; Schippers et coll., 2004; Fini et coll., 2019). Les études portant sur divers types de membranes et diverses conditions de fonctionnement pour l’élimination du MCPA sont indiquées au tableau 9. Ces données montrent que des taux d’enlèvement du MCPA allant de plus de 65 % à 100 % peuvent être atteints.
Košutić et Kunst (2002) ont montré que l’enlèvement par les membranes de NF et OI est principalement régi par le mécanisme de tamisage et par les effets physico-chimiques (p. ex., les répulsions électrostatiques).
Une étude en laboratoire de Fini et coll. (2019) a constaté que les membranes de NF présentaient des taux d’enlèvement plus faibles (MWCO > poids moléculaire du MCPA) que ceux des membranes d’OI et OI basse pression (BP). Une corrélation a été constatée entre le taux d’enlèvement des membranes d’OI-BP et la récupération de l’alimentation, le taux d’enlèvement passant de 94,5 % à 99 % lorsque la récupération passait de 10 % à 90 %. L’étude a également révélé que l’adsorption du pesticide à la surface des membranes était plus importante pour l’OI que pour la NF. Une augmentation de la concentration dans l’eau d’alimentation a augmenté l’adsorption sur toutes les membranes et n’a pas modifié le taux d’enlèvement.
| Concentration dans l’influent | Taux d’enlèvement | Type de membrane | Description du procédé | Référence | |
|---|---|---|---|---|---|
| 2 µg/L | 99 % | NF | À l’échelle pilote : Configuration à trois étages avec cinq, trois et deux
caissons pressurisés par étage. Chaque caisson contient
trois modules (4 po par 40 po). Dosé avec 2 µg/L de pesticides; flux moyen : 13,0 gal/pi 2/jour (L/m2h); taux de récupération : 80 % |
Schippers et coll. (2004) | |
| 5 µg/L | 97–99 % | OI à pression ultra faible |
À l’échelle pilote : Débit d’alimentation : 9 m3/h; taux de récupération : 85 %. |
Bonné et coll. (2000) | |
| 9,6 µg/L (ppb) | 100 % | OI, polyamide-urée MWCO : 200-300 Da |
Flux : 7,65 gal/pi2/jour; Taux de écupération : 49,3 %; Pression d’alimentation : 117 psi |
À l’échelle pilote : Système à deux étages, composé de trois modules par caisson pressurisé. Eau souterraine provenant d’un puits de 196 pieds. CaCo3 : 120 mg; MDTd : 250 mg/L; COT e : 3 mg/L. | Taylor (2000) |
| 6,3 µg/L (ppb) | 100 % | Flux : 4,06 gal/pi2/jour; Taux de récupération : 75,7 %; Pression d’alimentation : 120 psi |
|||
| 12,2 µg/L (ppb) | 92,4 % | Flux : 7,3 gal/pi2/jour; Taux de récupération : 72,0 %; Pression d’alimentation : 135 psi |
|||
| 1 mg/L | > 65 %Tableau 9 Note de bas de page a | NF, membrane composite à couche mince (TFC) de polyamide MWCO : 200-400 Da |
À l’échelle de banc d’essai : eau ultrapure Milli-Q Filtration frontale avec un disque à membrane de 50 mm de diamètre. Conditions d’essai : P : 10 bar; 22 °C; terminée à 50 % de récupération | Fini et coll. (2019) | |
| > 70 %Tableau 9 Note de bas de page a | NF, membrane TFC de polyamide MWCO : > 200 Da | ||||
| > 90 %Tableau 9 Note de bas de page a | OI-BP MWCO : > 100 Da | ||||
| > 95 %Tableau 9 Note de bas de page a | OI MWCO > 100 Da | ||||
| 2-4 mg/L (ppm) | 82,3-93,6 % | OI, composite à couche mince | À l’échelle de banc d’essai : Conditions d’essai : P : 17 bars; essai court de 3 h. | Košutić et Kunst (2002) | |
| 91,2 % | NF, polyamide | ||||
| 4,5 µg/L | 95 %Tableau 9 Note de bas de page b | OI, acétate de cellulose | À l’échelle de banc d’essai : Eau de surface prétraitée par coagulation, sédimentation, filtration et ultrafiltration. Conditions d’essai : Toutes les membranes sont enroulées en spirales de 4 × 40; récupération de 9 %. Avec 80 % de récupération, une concentration initiale de 1,4 µg/L et une membrane d’OI composite de polyamide : 93 % d’élimination estimée à partir des données de modélisation. | Hofman et coll. (1997)Tableau 9 Note de bas de page c | |
| 97 %Tableau 9 Note de bas de page b | OI, composite de polyamide | ||||
| 97 %Tableau 9 Note de bas de page b | OI à pression ultra faible | ||||
MDT - matières dissoutes totales COT - carbone organique total gal/pi2/jour : gallons par pied carré par jour. |
|||||
4.2.1.4 Oxydation et hydrolyse
L’hydrolyse est la principale réaction chimique qui déclenche la dégradation des esters d’acides phénoxy dans les systèmes aqueux. Lors de l’hydrolyse, l’acide phénoxy est généré à partir des esters du MCPA. La vitesse de la réaction est déterminée par le pH et la température de l’eau. Le MCPA-EHE ne s’hydrolyse pas dans une plage de pH de 5 à 7 et sa demi-vie (DT50) à un pH 9 est de < 117 h (Muszynski et coll., 2020).
Des études pilotes et à l’échelle de banc d’essai sur l’oxydation du MCPA par l’ozone (O3) et par photolyse à rayons ultraviolets (UV) ont montré que les deux procédés peuvent enlever le MCPA de l’eau, avec une efficacité d’enlèvement allant de 83 % à > 90 %. L’efficacité de l’oxydation dépend de divers facteurs, dont la dose d’oxydant, la demande de désinfectant, la température et le pH (voir le tableau 10) (Meijers et coll., 1995; Bourgine et coll., 1997; Benitez, 2004; Hollender et coll., 2009; Boucherie et coll., 2010). Hu et coll. (2000) ont calculé la constante de vitesse d’ozonation pour le MCPA et ont confirmé que l’ozone présente un niveau de réactivité relativement élevé à l’égard du MCPA.
Une étude pilote a évalué l’efficacité de l’ozonation et de l’adsorption au CAG pour l’enlèvement de 36 pesticides, dont le MCPA, dans les eaux de surface. Les procédés de traitement ont été évalués séparément et se sont révélés d’une efficacité similaire pour l’enlèvement du MCPA. À la suite de l’ozonation, les concentrations de MCPA dans l’eau traitée se situaiententre une valeur inférieure à la limite de détection de 0,05 µg/L et 0,06 µg/L (86 % à > 88 % d’enlèvement). Les auteurs ont conclu que l’effet synergique des deux procédés était nécessaire pour enlever d’autres pesticides, quel’ozonation enlevait partiellement ou faiblement (à savoir dans une proportion de 10 à 70 %) (Boucherie et coll., 2010). Une autre étude pilote a rapporté que l’oxydation du MCPA augmentait lorsque la dose d’O3 augmentait (Halevy et coll., 2013). Des résultats similaires ont été rapportés par Meijers et coll. (1995), indiquant que le MCPA se dégradait facilement dans l’eau de rivière à une dose d’ozone légèrement supérieure à celle requise pour la désinfection de l’eau potable (indiqué comme le rapport O3/carbone organique dissous [COD]). Les résultats ont indiqué que l’enlèvement augmentait lorsque le pH et la température augmentaient.
Bourgine et coll. (1997) ont fait état de données limitées provenant d’un essai pilote utilisant la photolyse UV pour réduire les concentrations de plusieurs pesticides, dont le MCPA, dans les eaux souterraines. Le MCPA a été facilement dégradé par la photolyse UV, avec un taux d’enlèvement de plus de 85 %. Une étude à l’échelle de banc d’essai a fait état d’une dégradation efficace du MCPA à l’aide d’une lampe UV à basse pression. Une dégradation d’environ 90 % du MCPA a été signalée à des niveaux de pH variant de 5,0 à 9,0, par rapport à seulement 6 % de dégradation à un pH de 3,0. Les auteurs ont attribué cette hausse de la dégradation à la réactivité accrue de la forme dissociée du MCPA à un pH > 5,0 (pKa 3,7 [pour cette étude]). Toutefois, il convient de noter que la concentration initiale de MCPA était relativement élevée (Benitez et coll., 2004).
Des processus comme l’oxydation, l’hydrolyse et la biodégradation du MCPA peuvent entraîner la formation de sous-produits de dégradation comme l’acide phénoxyacétique et le 2-méthyl-4-chlorophénol (2-M4CP) (Zertal et coll., 2001; McManus et coll., 2017; Kelly et coll., 2019; Muszynski et coll., 2019; Morton et coll., 2019). La formation d’acides oxalique et glycolique a été signalée après l’oxydation de 18,3 µg/L de MCPA avec une dose d’ozone de 4,3 mg/L et un pH de 8,0 en solution aqueuse (Struif et coll., 1978).
| Oxydant | Concentration initiale | Dose d’oxydant (mg/L), rapport O3/COD (g/g) ou énergie (Wh/m3) |
Taux d’enlèvement | Description du procédé | Références | |
|---|---|---|---|---|---|---|
| O3 | 0,42 µg/L | 1,2-2,3 mg/L | 86 % à > 88 % | Échelle pilote : Eau filtrée sur sable dopée au MCPA; Tableau 10 Note de bas de page aCT = 1,1-5,4 mg min/L; O3 résiduel dissous : 0,13-0,68 mg/L; pH 7,3; débit d’eau : 12 m 3/h. |
Boucherie et coll. (2010) |
|
| 10 µg/L | 0,75 mg/L | 14 % | Échelle pilote : Eau de surface prétraitée (adsorption sur CAP, coagulation, floculation/ sédimentation/filtration) dopée au MCPA; 3 contacteurs d’ozone en série avec un temps de contact total de 30 min; débit d’eau 7,89 L/min; pH 7,3-7,6; turbidité 0,11-0,15 UTN; 13-19 °C; OD 9,0-11,2 mg/L. | Halevy et coll. (2013) |
||
| 1,5 mg/L | 74 % | |||||
| 2,25 mg/L | 86 % | |||||
| 0,9-6,4 µg/L | 1,0 g/g | 83 % | Tableau 10 Note de bas de page a CT = 7,3; pH 7,2; 5 °C |
À l’échelle de banc d’essai : Eau de rivière prétraitée (coagulation et flottation); COD 2,2 mg C/L; Br - 100 μg/L, HCO3- 1,6 mM; 23 pesticides. | Meijers et coll. (1995) |
|
| 1,0 g/g | 87 % | Tableau 10 Note de bas de page a CT = 3,3; pH 7,2; 20 °C | ||||
| 1,0 g/g | 90 % | Tableau 10 Note de bas de page a CT = 1,1; pH 8,3; 20 °C | ||||
| UV | n.d. | Énergie 100-500 Wh/m3 | 62,5 % - 100 Wh/m3 86 % - 200 Wh/m3 94 % - 300 Wh/m3 |
Échelle pilote : eaux souterraines; pH 7,1-7,2; turbidité 0,1-0,2 UTN; COT 0,5-1,54 mg/L; nitrate 35-40 mg/L; sulfate 50-60 mg/L; lampe au mercure à pression moyenne (PM). | Bourgine et coll. (1997) |
|
| 50 mg/L | Tableau 10 Note de bas de page c n.d. | 90 % (en 20 min) |
À l’échelle de banc d’essai : eau ultrapure; pH 3, 5, 7 et 9; lampe basse pression (BP) avec intensité de rayonnement de 2,03 x 10-6 Eins/s | Benitez et coll. (2004) |
||
n.d. - non disponible OD - oxygène dissous. |
||||||
4.2.1.5 Procédés d’oxydation avancée
En général, la dose d’UV appliquée pour la dégradation des micropolluants dans l’eau dépend de la puissance UV (kW), de la transmittance UV de l’eau et du débit dans le réacteur UV. Un système d’oxydation avancée UV/peroxyde d’hydrogène (H2O2) à l’échelle pilote a servi à comparer la performance de lampes UV à moyenne et basse pression en matière de dégradation des micropolluants organiques, dont le MCPA. Le tableau 11 présente les efficacités d’enlèvement pour les lampes PM et BP dans les mêmes conditions expérimentales. La lampe PM utilisée dans l’étude n’était pas équipée d’un écran pour filtrer les longueurs d’onde UV inférieures qui peuvent induire la formation de nitrites dans l’eau; par conséquent, une augmentation de la concentration de nitrites a été mesurée dans l’eau traitée (environ 0,5 mg N/L). Cette augmentation n’a pas été observée dans l’eau traitée avec la lampe BP (< 0,05 mg N/L) (Lekkerkerker-Teunissen et coll., 2013).
Benitez et coll. (2004) ont signalé une augmentation de l’efficacité du procédé UV/H2O2 pour la dégradation du MCPA par rapport à la photodégradation seule. Une constante de vitesse de réaction plus élevée a été observée pour le procédé UV/H2O2 par rapport à la vitesse de réaction du procédé de photodégradation seul : 0,154 (min-1) avec une dose de H2O2 de 1 × 103 M; 0,212 (min-1) avec une dose >de H2O2 de 2 × 103 M; et 0,128 (min-1) pour le procédé de rayonnement UV seulement.
Selon Camel et Bermond (1998), la minéralisation des pesticides par ozonation ou par des techniques d’oxydation avancée est généralement incomplète. Par conséquent, les responsables de systèmes d’approvisionnement en eau potable utilisant ces méthodes devraient inclure une filtration sur sable ou au CAG après l’oxydation. Il a été observé que l’utilisation de l’ozonation avant l’adsorption au CAG ou la filtration sur sable augmente l’activité biologique du lit filtrant et peut prolonger la durée de vie du lit pour l’enlèvement des pesticides (Lambert et Graham, 1995; Hollender et coll., 2009).
| Procédé | Concentration initiale (µg/L) | Dose de H2O2 (mg/L) | Dose d’UV (mJ/cm2) | Taux d’enlèvement | Description du procédé |
|---|---|---|---|---|---|
| UV/H2O2 | 5–10 | 5 | 875 | > 90 % (PM) | À l’échelle pilote : 2 réacteurs - PM (puissance : 4,4 kW), BP (puissance :
1,32 kW);
Conditions expérimentales : Ballast 100 % UV (sortie), transmission UV 72,5 %, débit nominal 5 m3/h par réacteur. Eau d’alimentation : eau traitée provenant d’une ITEP classique dopée au MCPA; teneurs moyennes : COD 4,7 mg/L; nitrates 3,64 mg N/L; bicarbonate 170 mg/L; transmission UV 73-83 % UV-T. |
| 741 | > 60 % (BP) | ||||
ITEP - installation de traitement d’eau potable |
|||||
4.2.1.6 Filtration biologique
Les procédés de filtration biologique comprennent la filtration lente sur sable, la filtration biologique (biofiltration) modifiée et la filtration sur berge. Pour la filtration lente sur sable, la biodégradation est le principal mécanisme d’enlèvement. La biofiltration modifiée comporte l’utilisation de filtres à matériaux granulaires rapides (c.-à-d. anthracite/sable ou CAG), sans le maintien d’un résidu de désinfectant à travers le lit filtrant (Symons et coll., 2000). La filtration sur berge consiste à placer des puits d’approvisionnement en eau verticaux ou horizontaux près d’une rivière afin d’utiliser la rive et l’aquifère adjacent comme filtre naturel pour éliminer les contaminants. Comme l’eau se déplace vers la nappe souterraine, la concentration des contaminants diminue par adsorption, biodégradation et dilution avec les eaux souterraines (Piet et Zoeteman, 1980; Bize et coll., 1981; Kuehn et Mueller, 2000; Ray et coll., 2002). L’atténuation naturelle par une filtration sur berge est l’une des méthodes les plus élémentaires de traitement de l’eau (Verstraeten et Heberer, 2002; Sørensen et coll., 2006). Cependant, l’adsorption ne joue qu’un rôle mineur dans le cas des composés organiques polaires comme le MCPA (Huntscha et coll., 2013).
Des études à l’échelle réelle, à l’échelle pilote et à l’échelle de banc d’essai ont montré que la biodégradation du MCPA peut être une méthode de traitement efficace, permettant d’enlever de 40 à 100 % du MCPA dans l’eau (Woudneh et coll., 1996; Gonzalez et coll., 2006, 2017; Huntscha et coll., 2013; Halevy, 2013; Kruger et coll., 2015; Samuelsen et coll., 2017; Matamoros et Franco, 2018; Vandermaesen et coll., 2019; Oberleitner et coll., 2020).
En général, les pesticides de type phénoxyacides peuvent se dégrader dans des conditions aérobies et anaérobies (Muszynski et coll., 2020). Toutefois, les données publiées indiquent qu’un taux élevé de dégradation du MCPA est atteint dans des conditions aérobies (voir les tableaux 12 à 16), mais que la dégradation est négligeable en milieu anaérobie (Harrison et coll., 1998; Albrechtsen et coll., 2001; Gonzalez et coll., 2017; Matamoros et Franco, 2018; Morton et coll., 2019). Une étude sur le terrain a mis en évidence une biodégradation de plus de 99 % du MCPA après 14 jours en conditions aérobies. Aucune biodégradation n’a été observée dans les tests anaérobies (Harrison et coll., 1998).
Filtration lente sur sable
Une étude échelle réelle a examiné la capacité des filtres à sable biologiquement actifs à minéraliser le MCPA dans onze installations de traitement de l’eau potable (ITEP) (voir le tableau 12). Cependant, toutes les installations de traitement, sauf une, comprenaient une filtration rapide sur sable dans différentes chaînes de traitement. Les auteurs ont observé que le MCPA était minéralisé dans tous les filtres à sable. En général, la minéralisation du MCPA à travers les filtres à sable était constante dans le temps et dans les échantillons prélevés sur les différents filtres de la même installation de traitement. En outre, on a constaté que la minéralisation du MCPA était positivement corrélée avec le pH de l’eau, la disponibilité de l’ammoniac, les sources de carbone et les concentrations en fer et en oxygène, et négativement corrélée avec la concentration en sulfate (Vandermaesen et coll., 2019).
Une étude pilote a montré que deux filtres lents à sable présentaient une grande capacité à enlever le MCPA pour atteindre une concentration inférieure à la limite de détection de 0,1 µg/L (voir le tableau 13). Un enlèvement constant du MCPA a été observé pendant une période de 18 jours. Les auteurs ont conclu que l’enlèvement du MCPA comportait un procédé continu de biodégradation et que son efficacité n’était pas perturbée par les variations de débit et de profondeur du lit dans les conditions testées (Woudneh et coll., 1996).
Une autre étude a examiné la capacité de trois matériaux différents de biofiltration, dont le sable, à éliminer plusieurs herbicides de type phénoxyacides des eaux de ruissellement agricoles (voir le tableau 12). La dégradation moyenne de tous les pesticides de type phénoxyacides testés dans la colonne de sable était de 77 %. L’enlèvement du MCPA a diminué avec l’augmentation du taux de charge hydraulique (TCH) de la colonne. Le TCH était assez faible, ce qui indique que les résultats seraient représentatifs d’un filtre lent à sable ou d’un filtre sur berge (Matamoros et Franco, 2018).
Samuelsen et coll. (2017) ont signalé qu’une souche microbiologique sélectionnée, non mobile et hydrophobe (provenant d’un aquifère souterrain), avec un fort degré d’adhérence au sable, présentait un taux de minéralisation élevé (> 50 %) à toutes les concentrations de MCPA testées (0,016-25,0 mg/L) (voir le tableau 12). Ces résultats démontrent que l’hydrophobie de surface et les capacités d’adhérence de l’activité biologique sont les paramètres contrôlant la biodégradation soutenue dans les colonnes de sable à flux continu et qu’ils doivent être pris en compte lors du choix de la filtration biologique.
| Concentration initiale (µg/L) | Taux d’enlèvement | TCFV (min) ou TCH (m/jour) | Description du procédé | Références |
|---|---|---|---|---|
| 0,008–0,18 | 37,0-55,5 % | n.d. | Grande échelle : 11 ITEP; prise d’eau : eaux de surface, eaux souterraines et eaux mélangées; pH 6,3-8,4; NH4+ 0,2-3,1 mg/L; NO3- 0,0-10 mg/L; PO43->0,01-1,6 mg/L; SO 42- 2,0-180,3 mg/L; carbone organique non purgeable 0,7-12,8 mg/L; 11,2-13,9 °C; (le taux d’enlèvement est exprimé sous la forme 8 échantillons de filtres à sable). | Vandermaesen et coll. (2019) |
| 10 | 93 % | 0,3 m/jour | Échelle de banc d’essai : Acclimatation de 30 jours; eau de ruissellement agricole dopée au MCPA; colonne : 100 cm de sable; 10 µg/L de mélange de pesticides; Période d’essai de 20 jours; pH 6,8; OD 3,4 ± 0,9 mg/L; MTSTableau 12 Note de bas de page b 76 mg/L; ammoniac 0,79 ± 0,91 mg/L; nitrates 0,9 ± 0,1 mg/L. | Matamoros et Franco (2018) |
| 57 % | 1,4 m/jour | |||
| 1 000 | ~100 % | Tableau 12 Note de bas de page a n.d. | Échelle de banc d’essai : Colonnes de sable inoculées avec quatre souches microbiologiques; qualité de l’eau non fournie; débit de 0,08 mL/min. (les résultats sont fournis pour une souche hydrophobe non mobile) | Samuelsen et coll. (2017) |
|
||||
| Concentration initiale (µg/L) | Taux d’enlèvement | Profondeur du lit (mm) | Débit (m/h) | Temps de contact (h) |
Description du procédé |
|---|---|---|---|---|---|
| 6-10 | 100 % | 300 | 0,06 | Tableau 13 Note de bas de page a 4,3 | À l’échelle pilote : 3 filtres à gravier en série et 2 filtres biologiques en parallèle. Les résultats sont présentés uniquement pour les filtres biologiques. |
| 0,12 | Tableau 13 Note de bas de page b 2,15 | ||||
| 500 | 0,06 | Tableau 13 Note de bas de page a 7,16 | |||
| 0,12 | Tableau 13 Note de bas de page b 3,58 | ||||
|
|||||
Filtration biologique modifiée
González et coll. (2006) ont étudié la dégradation du MCPA dans un bioréacteur à lit fixe (FBBR) à l’échelle de banc d’essai par des micro-organismes isolés d’un cours d’eau douce. La dégradation du MCPA a commencé après 10 jours et la concentration a atteint la moitié de la concentration initiale après 13 jours (voir le tableau 14). Le système pouvait dégrader le MCPA; cependant, une phase de latence était nécessaire pour amorcer la dégradation. Les auteurs ont indiqué que le FBBR était considéré comme un bon modèle de système puisqu’il pouvait simuler la dégradation biologique dans différentes qualités d’eau. Bien que le 2-M4CP ait été identifié comme un des principaux sous-produits de dégradation du MCPA en conditions aérobies (Juhler et coll., 2001; Muszynski et coll., 2020), il n’a pas été détecté dans l’eau traitée (González et coll. 2006).
| Concentration initiale (µg/L) | Taux d’enlèvement | TCFV (min) ou débit (mL/min) | Description du procédé | Référence | |
|---|---|---|---|---|---|
| 10 | ~100 % (en 24 jours) | FBBR | 15 ml/min | FBBR à l’échelle de banc d’essai : Colonne : verre fritté poreux dans lequel on a cultivé un biofilm (90 jours); Eau d’alimentation : eaux usées ayant subi un traitement primaire et dopées au MCPA. | Gonzales et coll., (2006) |
Filtration sur berge
Quatre sites de filtration sur berge, deux anoxiques (sable limoneux) et deux oxiques (gravier), avec des distances de parcours différentes (42 et 633 m) ont été étudiés pour l’enlèvement de 194 micropolluants, dont le MCPA. Le MCPA n’a été détecté que deux fois dans les eaux de surface à des concentrations supérieures à la limite de quantification (LQ de 16,2 ng/L) (voir le tableau 15). Les concentrations de MCPA détectées correspondaient à une application saisonnière de pesticides de mars à mai. Dans l’ensemble, les auteurs ont observé que l’efficacité de la filtration sur berge pour enlever les micropolluants, y compris le MCPA, dépendait de la distance parcourue. En outre, la concentration totale de tous les micropolluants a diminué d’environ 50 % de la rivière au premier puits (B1) sur tous les sites de filtration sur berge, ce qui démontre le principe général de fonctionnement de la filtration sur berge comme méthode de purification de l’eau (Oberleitner et coll., 2020).
Huntscha et coll. (2013) ont réalisé des essais sur le terrain pour quantifier les concentrations de MCPA sur lessites de filtration sur berge ayant des temps de parcours courts (de quelques heures à quelques jours). L’échantillonnage spatio-temporel a été effectué lors d’un événement à forts débits pendant la saison d’application des pesticides. Bien que la concentration de MCPA dans l’eau de la rivière ait été multipliée par 10 après la pointe de débit, elle n’a pu être quantifiée qu’à l’aide de deux piézomètres ayant le temps de parcours le plus court (voir le tableau 16). Les auteurs ont conclu que le MCPA s’était dégradé, avec des demi-vies estimées dans la plage de quelques heures (0,2 à 38 heures).
| Concentration initiale (ng/L) | Taux d’enlèvement | Puits | Description du procédé |
|---|---|---|---|
| 23 | 100 % (printemps 2018) | Ea-B1 | Quatre sites de filtration sur berge : rivère Ems (Ea et Eb) et rivière Ruhr (Ra et Rb). Sur chaque site, 3 puits (B1, B2 et B3) et un puits de captage (W) ont été échantillonnés. Distance (temps) à parcourir pour atteindre les puits de captage : 633 m (Ea) et 89 m (Eb) (50-60 jours); 72 m (Ra), 42 m (Rb) (2 jours). Trois campagnes d’échantillonnage : été 2017, automne 2017 et printemps 2018. Débits élevés : Décembre 2017 à février 2018; faibles débits : avril 2017 à juillet 2017. (Les résultats sont présentés pour les puits B1 et W pour les deux sites, Ea et Eb, pour lesquels du MCPA a été détecté dans l’eau de la rivière). |
| Ea-W | |||
| 19 | Eb-B1 | ||
| Eb-W |
| Concentration initiale (ng/L) | Filtration sur berge (ng/L) | Temps de parcours (h) | Transect/ piézomètre | Date | Description du procédé |
|---|---|---|---|---|---|
| 70-410 | 50 | 6,5–28 | B/R042 | 3 mai 2010 | Essai sur le terrain : Courts temps de parcours des eaux souterraines (conditions oxiques), de l’infiltration des eaux de surface jusqu’à l’extraction des eaux souterraines (quelques jours). Événement à déversement élevé, le 3 mai 2010 (159 m 3/s). Échantillonnage : transect A (2 piézomètres) et transect B (3 piézomètres). (Les résultats sont présentés uniquement pour 2 piézomètres [transect B] avec une concentration détectable). |
| 410-651 | 20 | 6,5–28 | B/R042 | 4 mai 2010 | |
| 130-245 | 27 | 0,5–6,5 | B/R050 | 4 mai 2010 |
4.2.2 Traitement à l’échelle résidentielle
Dans les cas où l’on souhaite enlever le MCPA à l’échelle résidentielle, par exemple, lorsque l’eau potable d’une résidence provient d’un puits privé, un dispositif de traitement résidentiel de l’eau potable peut être une option pour réduire les concentrations de MCPA dans l’eau potable. Avant l’installation du dispositif de traitement, il faut analyser l’eau pour en déterminer les caractéristiques chimiques générales, de même que la concentration de MCPA dans la source d’approvisionnement en eau.
Pour vérifier l’efficacité d’un dispositif de traitement, il faut régulièrement prélever des échantillons de l’eau qui entre dans le dispositif de traitement et de l’eau qui en sort, et envoyer ces échantillons à un laboratoire accrédité pour analyse. Comme les dispositifs de traitement peuvent perdre leur capacité d’enlèvement avec l’usage et le temps, ils doivent être entretenus et/ou remplacés au besoin. Les consommateurs doivent vérifier la durée de vie prévue des composants de leur dispositif de traitement selon les recommandations du fabricant et veiller à leur entretien. Les systèmes résidentiels peuvent avoir une capacité nominale qui dépasse les volumes nécessaires pour une seule résidence et peuvent donc également être utilisés dans de petits systèmes.
Santé Canada ne recommande pas de marques particulières de dispositifs de traitement de l’eau potable, mais conseille vivement aux consommateurs de n’utiliser que les dispositifs certifiés par un organisme de certification accrédité comme étant conformes aux normes appropriées de NSF International (NSF) et de l’American National Standards Institute (ANSI). Ces normes visent à établir des exigences minimales relatives aux matériaux, à la conception et à la construction des dispositifs de traitement de l’eau potable qui peuvent être vérifiées par un tiers. Elles permettent de prévenir le relargage dans l’eau potable des contaminants présents dans les matériaux du dispositif (c.-à-d. sûreté des matériaux). Par ailleurs, les normes comportent des exigences en matière d’efficacité qui établissent le degré d’élimination qui doit être assuré à l’égard de certains contaminants (p. ex., allégation de réduction) potentiellement présents dans les sources d’approvisionnement en eau. Les organismes de certification (c.-à-d., tiers), qui doivent être accrédités par le Conseil canadien des normes, garantissent qu’un produit est conforme aux normes en vigueur. Les organismes accrédités au Canada comprennent notamment :
- Groupe CSA;
- NSF International;
- Water Quality Association;
- UL LLC;
- Bureau de normalisation du Québec;
- International Association of Plumbing and Mechanical Officials; et
- Truesdail Laboratories Inc.
On peut obtenir une liste à jour des organismes de certification accrédités en s’adressant au Conseil canadien des normes.
Les techniques de traitement de l’eau potable susceptibles d’enlever efficacement le MCPA à l’échelle résidentielle comprennent l’adsorption et l’OI. À l’heure actuelle, le MCPA n’est pas visé par les exigences de performance des normes NSF/ANSI. Toutefois, les consommateurs peuvent utiliser un dispositif de traitement qui est certifié conforme aux normes relatives à l’OI ou à l’adsorption pour s’assurer que l’innocuité des matériaux a été évaluée. En outre, les unités qui ont été certifiées pour l’enlèvement d’autres herbicides phénoxycarboxyliques comme le 2,4-D sont susceptibles d’être efficaces pour l’enlèvement du MCPA.
L’eau qui a été traitée par OI peut être corrosive pour les éléments internes de plomberie. Ces dispositifs devraient donc être installés uniquement au point d’utilisation. De plus, comme il faut de grandes quantités d’influent pour obtenir le volume requis d’eau traitée, ils ne sont généralement pas pratiques si on les installe au point d’entrée de l’eau.
5.0 Stratégies de gestion
Tous les responsables de systèmes d’approvisionnement en eau potable devraient mettre en œuvre une approche de gestion des risques, comme l’approche de la source au robinet ou du plan de gestion de la sécurité sanitaire de l’eau pour assurer la salubrité de l’eau (CCME, 2004; OMS, 2011, 2012). Ces approches exigent une évaluation du réseau pour caractériser la source d’approvisionnement en eau, décrire les procédés de traitement qui empêchent ou réduisent la contamination, déterminer les conditions pouvant entraîner une contamination et mettre en œuvre des mesures de contrôle. La surveillance opérationnelle est ensuite établie, et des protocoles opérationnels et de gestion sont mis en place (p. ex., procédures opérationnelles normalisées, mesures correctives et interventions en cas d’incident). La surveillance de la conformité est déterminée, et d’autres protocoles de validation du plan de salubrité de l’eau sont mis en œuvre (p. ex., tenue de dossiers, satisfaction des consommateurs). La formation des opérateurs est également nécessaire pour assurer l’efficacité en tout temps du plan de salubrité de l’eau (Smeets et coll., 2009).
5.1 Surveillance
Le MCPA peut être présent dans les eaux souterraines et les eaux de surface dans les régions où il est utilisé, selon le type et l’étendue de son application, les facteurs environnementaux (p. ex., quantité de précipitations, type de sol, milieu hydrogéologique, etc.) et le devenir dans l’environnement (p. ex., mobilité, potentiel de lessivage, dégradation, etc.) dans les zones à proximité. Les responsables des systèmes d’approvisionnement en eau potable devraient tenir compte de la possibilité que le MCPA entre dans les sources d’eau (p. ex., approvisionnement en eau brute d’un système d’eau potable) en fonction des caractéristiques propres à chaque site.
Une fois qu’on a déterminé que le MCPA peut être présent et qu’une surveillance est nécessaire, il faudrait ensuite caractériser les sources d’eau de surface et d’eau souterraine afin d’établir la concentration de MCPA. Cela devrait comprendre la surveillance des sources d’eau de surface pendant les périodes de pointe d’utilisation et de précipitations ou la surveillance annuelle des sources d’eau souterraine. Lorsque les données de référence indiquent que la source d’approvisionnement ne contient pas de MCPA, la surveillance peut être réduite.
Lorsqu’un traitement est nécessaire pour éliminer le MCPA, il faudrait assurer une surveillance opérationnelle afin de déterminer si le procédé de traitement fonctionne comme prévu. La fréquence de la surveillance opérationnelle dépendra de la qualité de l’eau, de la fluctuation des concentrations d’eau brute et du procédé de traitement. Les autorités responsables devraient être conscientes de l’incidence de la MON sur les systèmes au charbon actif, car cette interaction peut avoir un effet sur les objectifs de qualité de l’eau pour ce qui est de l’enlèvement du MCPA.
Lorsqu’un traitement est utilisé pour éliminer le MCPA, il faudrait effectuer une surveillance de conformité (c.-à-d., échantillons appariés de la source d’approvisionnement et d’eau traitée pour confirmer l’efficacité du traitement) au moins annuellement. Lorsque la surveillance opérationnelle périodique indique un risque de pénétration du contaminant, comme avec le CAG, la surveillance devrait être exercée au moins trimestriellement pour prévoir la régénération ou le remplacement des matériaux. Lorsqu’on a recours à un procédé de dégradation, comme l’oxydation, la surveillance de la formation de sous-produits devrait aussi être envisagée.
6.0 Considérations internationales
D’autres organisations nationales et internationales disposent de lignes directrices, de normes et/ou de valeurs recommandées en ce qui concerne le MCPA dans l’eau potable. Les valeurs varient en fonction de la date à laquelle remonte l’évaluation sur laquelle elles sont fondées, et en fonction des différentes politiques et approches, notamment le choix de l’étude clé et les taux de consommation, les poids corporels et les facteurs d’attribution liés à la source employés (tableau 17).
| Agence (année) | Valeur (mg/L) | Effet principal (référence) | NO(A)EL (mg/kg p.c . par jour ) | FI | AQA (mg/kg p.c. par jour) | PC (kg) | Apport EP (L/j) | FA (%) | Commentaires |
|---|---|---|---|---|---|---|---|---|---|
| Santé Canada - CMA proposée (2020) | 0,4 | Effets sur les reins (augmentation des poids absolu et relatif, bilirubine, cristaux et pH urinaires) (Kirsch (1985b) | 3,6 (NOAEL) | 100 | 0,04 | 74 | 1,53 | 20 | - |
| US EPA (2004d; 2018) | 0,03 (AS à vie non réglementaire) | Hépatotoxicité et néphrotoxicité (Kirsch, 1986) | 4,4 (NOAEL) | 1 000 | 0,004 (DRf) | 70 | 2 | 20 | Les avis sanitaires sont des conseils techniques informels pour les contaminants de l’eau potable non réglementés. |
| OMS (2016) | 0,7 mg/L (VBS non réglementaire) | Modification des paramètres biochimique indiquant des effets sur les reins (Kirsch et coll., 1985; Mellert et coll., 1994a,b,c) | 12 (NOAEL) | 100 | 0,12 | 60 | 2 | 20 | L’OMS a estimé qu’une recommandation n’était pas nécessaire, car le MCPA est généralement présent dans l’eau potable ou les sources d’eau à des concentrations bien inférieures à celles qui sont préoccupantes pour la santé. La VBS peut être utilisée pour interpréter les données de surveillance. |
| NHMRC and NRMMC, 2011 (Australie) | 0,04 mg/L | Diminution de la prise de poids, hémosidérose de la rate, augmentation du poids absolu des reins (mâles) et signes de néphropathie chronique (Kirsch, 1988). | 1,1 (NOEL) | 100 | 0,01 | 70 | 2 | 10 | - |
| UE (1998) | 0,1 µg/L | L’UE a une valeur de 0,1 µg/L pour chaque pesticide (unique) et une valeur de 0,5 µg/L pour l’ensemble des pesticides présents dans l’eau potable. En établissant ces valeurs, l’UE n’a pas tenu compte des éléments scientifiques liés à chaque pesticide, dont les effets sur la santé. Ces valeurs reposent plutôt sur une décision stratégique visant à écarter les pesticides des sources d’eau potable. | |||||||
AQA - apport quotidien acceptable FA - facteur d’attribution p.c. - poids corporel EP - eau potable AS - avis sanitaire MCL - concentration maximale de contaminant NOEL - concentration sans effet observé NOAEL - concentration sans effet nocif observé DRf - dose de référence FI - facteur d’incertitude |
|||||||||
7.0 Justification
Le MCPA est un herbicide couramment utilisé au Canada. Il est homologué au Canada pour une utilisation sur les sites agricoles, sur les gazons fins, les pelouses et la tourbe, dans la foresterie et sur les sites industriels. Le MCPA est largement utilisé au Canada, en particulier dans les Prairies, et figure parmi les dix premiers pesticides vendus au Canada. Bien que le MCPA soit largement utilisé au Canada, les données d’exposition n’indiquent pas de niveaux significatifs dans l’eau potable.
Le MCPA est considéré comme inclassable en ce qui concerne la cancérogénicité pour l’humain, vu l’absence de données adéquates provenant d’études épidémiologiques et le manque d’études adéquates chez les animaux. La CMA proposée pour le MCPA dans l’eau potable a été établie sur la base des effets sur les reins des rats.
Santé Canada, conjointement avec le Comité fédéral-provincial-territorial sur l’eau potable, propose une CMA de 0,4 mg/L (400 µg/L), en se fondant sur les considérations suivantes :
- Une VBS de 0,4 mg/L (400 µg/L) d’après les effets sur les reins chez le rat;
- Le MCPA peut être mesuré avec précision à des concentrations bien inférieures à la CMA proposée;
- Des techniques de traitement de l’eau potable sont offertes pour éliminer le MCPA à des concentrations inférieures à la CMA proposée.
La CMA proposée assure une protection contre les effets sur la santé qui peuvent survenir à la suite d’une exposition au MCPA. Santé Canada continuera, dans le cadre de son processus continu de révision des recommandations, de suivre les nouvelles recherches à ce sujet, y compris les résultats d’évaluations de l’ARLA, et recommandera au besoin toute modification jugée appropriée au présent document technique.
8.0 Bibliographie
Abdel daiem, M.M., Rivera-Utrilla, J., Sánchez-Polo, M. et Ocampo-Pérez, R. (2015). Single, competitive, and dynamic adsorption on activated carbon of compounds used as plasticizers and herbicides. Science of the Total Environment, 537, 335–342.
Adams, K., Kirkpatrick, D., Godfrey, A., Anderson, A. et Dawe, I.S. (1993a). Chinese hamster ovary/HGPRT locus assay: MCPA acid: Final report: Lab Project No.: JEL 29/921115. Étude non publiée préparée par Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni). 42 p. (citée dans EPA de Californie, 2000; US EPA, 2003).
Adams, K., Ransome, S., Anderson, A. et Dawe, I.S. (1993b). Chinese hamster ovary/HGPRT locus assay: MCPA DMAS: Final report: Lab Project No.: JEL 27/921113. Étude non publiée préparée par Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni). 42 p. (citée dans EPA de Californie, 2000; US EPA, 2003).
Adams, K., Henly, S., Anderson, A. et coll. (1993c). Chinese hamster ovary/HGPRT locus assay: MCPA 2-EHE: Lab Project No.: JEL 28/921114. Étude non publiée préparée par Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni) (citée dans US EPA, 2003).
Akhurst, L.C., King, J., Anderson, A. et Dawe, I.S. (1993a). MCPA DMAS: Metaphase chromosome analysis of human lymphocytes cultured in vitro: Lab Project No.: JEL 30/921176. Étude non publiée préparée par Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni) (citée dans EPA de Californie, 2000; US EPA, 2003).
Akhurst, L.C., King, J., Anderson, A. et Dawe, I.S. (1993b). MCPA acid: Metaphase chromosome analysis of human lymphocytes cultured in vitro: Lab Project No.: JEL 32/921190. Étude non publiée préparée par Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni) (citée dans EPA de Californie, 2000; US EPA, 2003).
Akhurst, L.C., King, J., Anderson, A., Dawe, I.S. et coll. (1993c). MCPA 2-EHE: Metaphase chromosome analysis of human lymphocytes cultured in vitro: Lab Project No.: JEL 31/921188. Étude non publiée préparée par Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni) (citée dans US EPA, 2003).
Albrechtsen, H., Mills, M.S., Aamand, J. et Bjerg, P.L. (2001). Degradation of herbicides in shallow Danish aquifers: An integrated laboratory and field study. Pest Manag. Sci., 57(4): 341–350.
Arbuckle, T.E., Savitz, D.A., Mery, L.S. et Curtis, K.M. (1999). Exposure to phenoxy herbicides and the risk of spontaneous abortion. Epidemiology, 10(6): 752–760.
Becher, H., Flesch-Janys, D., Kauppinen, T., Steindorf, K., Manz, A. et Wahrendorf, J. (1996). Cancer mortality in German male workers exposed to phenoxy herbicides and dioxins. Cancer Causes Control, 7: 312–321.
Beduk, F., Aydin, M. E. et Ozcan, S. (2012). Degradation of malathion and parathion by ozonation, photolytic ozonation, and heterogeneous catalytic ozonation processes. Clean - Soil, Air, Water 40 (2): 179-87.
Bellet, E.M., van Ravenzwaay, B., Pigott, G. et Leemings, N. (1999). Chronic dietary toxicity and oncogenicity evaluations of MCPA (4-chloro-2-methylphenoxyacetic acid) in rodents. Regul. Toxicol. Pharmacol., 30: 223–232.
Bellet, E.M., van Ravenzwaay, B., Hellwig, J. et Pigott, G. (2001). Reproductive toxicity of MCPA (4-chloro-2-methylphenoxyacetic acid) in the rat. Int. J. Toxicol., 20: 29–38.
Bellona, C., Drewes, J.E., Xu, P. et Amy, G. (2004). Factors affecting the rejection of organic solutes during NF/RO treatment—a literature review. Wat. Res., 38(12): 2795–2809.
Ben-Dyke, R., Sanderson, D.M. et Noakes, D.N. (1979). Acute toxicity data for pesticides. World Rev. Pestic. Control, 9: 119–127.
Benitez, F.J., Acero, J.L., Real, F.J. et Roman, S. (2004). Oxidation of MCPA and 2,4-D by UV radiation, ozone, and the combinations UV/H 2O2 and O3/H2O2. J. Environ. Sci. Health, B39(3): 393–409.
Bize, J., Grenet, B. et Maneglier, H. (1981). Purifying capacity of the alluvial complex bordering a river. Tech. Sci. Munic., 76(7): 393–401.
Bonné, P.A.C., Beerendonk, E.F., van der Hoek, J.O. et Hofman, J.A.M.H. (2000). Retention of herbicides and pesticides in relation to aging of RO membranes. Desalination, 132: 189–193.
Boucherie, C., Lecarpentier, C., Fauchon, N., Djafer, M. et Heim, V. (2010). "Ozone" and "GAC filtration" synergy for removal of emerging micropollutants in a drinking water treatment plant? Water Sci. Tech-W Sup, 10(5): 860–868.
Bourgine, F., Chapman, J. et Martin, S. (1997). Traitement des pesticides par photolyse UV : les aspects scientifiques du traitement de l'eau en vue de sa potabilisation. TSM. Techniques sciences méthodes, génie urbain génie rural, 7–8 : 23–29.
Bovey, R.W. (1980). Toxicology of phenoxy herbicides in animals and man -- General considerations. Dans : The science of 2,4,5-T and associated herbicides. John Wiley and Sons, New York, NY. p. 71–132.
Bradberry, S.M., Watt, B.E., Proudfoot, A.T. et Vale, J.A. (2000) Mechanisms of toxicity, clinical features, and management of acute chlorophenoxy herbicide poisoning: a review. J. Toxicol. Clin. Toxicol. 38: 111–22.
British Columbia Ministry of Health (2019). Communication personnelle avec D. Fishwick.
Bueno de Mesquito, H.B., Doornbos, G., van der Kuip, D.A.M., Kogevinas, M. et Winkelmann, R. (1993). Occupational exposure to phenoxy herbicides and chlorophenols and cancer mortality in The Netherlands. Am. J. Ind. Med., 23: 289–300.
Buesen, R., Strauss, V., Küttler, K., Becker, M. et van Ravenzwaay, B. (2012). MCPA-2-EHECombined Chronic Toxicity/Carcinogenicity Study in Wistar Rats Administration via the diet up to 24 Months. Rapport non publié. BASF, Ludwigshafen, Germany (projet n o 80S0351/07128; no ARLA 2224379).
Byrtus, G., Pongar, K., Browning, C., Burland, R., McGuinness, E. et Humphries, D. (2004). A summary of pesticide residue data from Alberta Treated Water Survey, 1995–2003. Environmental Assurance Service, Alberta Environment, Edmonton, Alberta. 57 p.
Camel, V. et Bermond, A. (1998). The use of ozone and associated oxidation processes in drinking water treatment. Water Res., 32(11): 3208–3222.
Cappon, G.D. (1999a). A prenatal developmental toxicity study of MCPA-EHE in rats. Rapport non publié, WIL Research Laboratories, Ashland, OH, October 12 (étude de laboratoire no WIL-325004; MRID 44954101) (citée dans US EPA, 2003).
Cappon, G.D. (1999b). A prenatal developmental toxicity study of MCPA-DMA in rats. Rapport non publié, WIL Research Laboratories, Ashland, OH, 12 octobre (étude de laboratoire no WIL-325003; MRID 44954102) (citée dans US EPA, 2003).
Caux, P.-Y., Kent, R.A., Bergeron, V., Fan, G.T. et Macdonald, D.D. (1995). Environmental fate and effects of MCPA: a Canadian perspective. Crit. Rev. Environ. Sci. Technol., 25(4): 313–376.
CCME. (2004). De la source au robinet : Guide d’application de l’approche à barrières multiples pour une eau potable saine. Conseil canadien des ministres de l’environnement, Winnipeg, Manitoba. Disponible à https://www.ccme.ca/files/Resources/fr_water/fr_source_to_tap/mba_guidance_doc_f.pdf (2004).
Chowdhury, Z.K., Summers, R.S., Westerhoff, G.P., Leto, B.J., Nowack, K.O.
et Corwin, C.J. (2013). Activated carbon: Solutions for improving water
quality. Passantino, L.B. (éd.). American Water Works Association. Denver,
Colorado.
CIRC. (1983). (4-Chloro-2-methylphenoxy)acetic acid (MCPA). Dans : Miscellaneous pesticides. Centre international de recherche sur le cancer, Lyon (France). Monographies du CIRC sur l’évaluation des risques de cancérogénicité pour l’homme, 30 : 255-269.
Coggon, D., Pannett, B., Winter, P., Acheson, E.D. et Bonsall, J. (1986). Mortality of workers exposed to 2-methyl-4-chlorophenoxyacetic acid. Scand. J. Work Environ. Health, 12: 448–454.
Elliott, B. (2005). Review of the genotoxicity of 4-chloro-2-methylphenoxyacetic acid. Mutagenesis, 20(1): 3–13.
Développement durable Manitoba. (2019). Communication personnelle avec D. Coulibaly, Section de la gestion de la qualité de l’eau.
Donald, D.B., Cessna, A.J., Sverko, E. et Glozier, N.E. (2007). Pesticides in surface drinking-water supplies of the northern great plains. Environ. Health Perspect., 115(8): 1183–1191.
Donald, D.B., Cessna, A.J. et Farenhorst, A. (2018). Concentrations of
Herbicides in Wetlands on Organic and
Minimum-Tillage Farms. J. Environ. Qual. 47:1554–1563.
Elo, H. (1976). Distribution and elimination of 2-methyl-4-chlorophenoxyacetic acid (MCPA) in male rats. Acta Pharmacol. Toxicol., 39(1): 58–64.
Environnement Canada. (2011). Présence et concentrations des pesticides prioritaires dans certains écosystèmes aquatiques canadiens. Direction des sciences et de la technologie de l’eau. No de cat. : En14-40/2011F-PDF.
Environnement et Changement climatique Canada. (2015). Présence de pesticides dans le bassin du fleuve Nelson de 2006 à 2011. Disponible à https://www.canada.ca/fr/environnement-changement-climatique/services/surveillance-qualite-eaux-douces/pesticides-recherche/presence-bassin-fleuve-nerlson-2006-2011.html
Eriksson, M., Hardell, L., Berg, N.O., Möller, T. et Axelson, O. (1981). Soft-tissue sarcomas and exposure to chemical substances: a case-referent study. Br. J. Ind. Med., 38: 27–33.
Eriksson, M., Hardell, L. et Adami, H.-O. (1990). Exposure to dioxins as a risk factor for soft tissue sarcoma: a population-based case-control study. J. Natl. Cancer Inst., 82(6): 486–490.
Eriksson, M., Hardell, L., Carlberg, M. et Akerman, M. (2008). Pesticide exposure as risk factor for non-Hodgkin lymphoma including histopathological subgroup analysis. Int. J. Cancer: 123, 1657–1663.
Fini, M.N., Madsen, H. T. et Muff, J. (2019). The effect of water matrix, feed concentration and recovery on the rejection of pesticides using NF/RO membranes in water treatment. Sep. Purif. Technol., 215:521–527.
Fjeldstad, P. et Wannag, A. (1977). Human urinary excretion of the herbicide 2-methyl-4-chlorophenoxyacetic acid. Scand. J. Work Environ. Health, 3: 100–103.
Flanagan, R.J., Meredith, T.J., Ruprah, M., Onyon, L.J. et Liddle, A. (1990). Alkaline diuresis for acute poisoning with chlorophenoxy herbicides and ioxynil. Lancet 335: 454–8.
Frick, E.A. et Dalton, M.S. (2005). Characterization of anthropogenic organic compounds in the source water and finished water for the City of Atlanta, October 2002–September 2004. Proceedings of the 2005 Georgia Water Resources Conference, April 25–27, 2005, University of Georgia, Athens, GA.
Gelbke, H.P. et Engelhardt, G. (1985a). Cytogenetic investigations in Chinese hamsters after a single oral administration of MCPA: bone marrow chromosome analysis. BASF Aktiengesellschaft, Ludwigshafen (Allemagne) (Rapport no 10M0046/8304) (citée dans Elliott, 2005).
Gelbke, H.P. et Engelhardt, G. (1985b). Cytogenetic investigations in Chinese hamsters after a single oral administration of MCPA: sister chromatid exchange (SCE). BASF Aktiengesellschaft, Ludwigshafen (Allemagne) (Rapport no 16M0046/8305) (citée dans Elliott, 2005).
Gelbke, H.P. et Engelhardt, G. (1985c). Cytogenetic investigations in Chinese hamsters after a single oral administration of MCPA: sister chromatid exchange (SCE). BASF Aktiengesellschaft, Ludwigshafen (Allemagne) (Rapport no 16M0046/8356) (citée dans Elliott, 2005).
Gelbke, H.P., and Engelhardt, G. (1985d). Cytogenetic investigations in Chinese hamsters after a single oral administration of MCPA: bone marrow chromosome analysis. BASF Aktiengesellschaft, Ludwigshafen (Allemagne) (Rapport no 10M0046/8367) (citée dans Elliott, 2005).
Gérard, M. C. et Barthélemy, J. P. (2003). An assessment methodology for determining pesticides adsorption on granulated activated carbon. BASE.
Giroux, I. (2019). Présence de pesticides dans l’eau au Québec : Portrait et tendances dans les zones de maïs et de soya — 2015 à 2017, Québec. Ministère de l’Environnement et de la Lutte contre les changements climatiques, Direction générale du suivi de l’état de l’environnement, 64 p. + 6 ann. Disponible à :
http://www.environnement.gouv.qc.ca/pesticides/mais_soya/portrait2015-2017/rapport-2015-2017.pdf
Gonzalez, S., Müller, J., Petrovic, M., Barceló, D. et Knepper, T.P. (2006). Biodegradation studies of selected priority acidic pesticides and diclofenac in different bioreactors. Environ. Pollut., 144(3): 926–932.
Gonzalez, A.J., Fortunato, M.S., Gallego, A. et Korol, S.E. (2017). Simultaneous biodegradation and detoxification of the herbicides 2,4-dichlorophenoxyacetic acid and 4-chloro-2-methylphenoxyacetic acid in a continuous biofilm reactor. Water Air Soil Pollut., 228(8).
Gustafson, D.K., Carr, K.H., Carson, D.B., Fuhrman, J.D., Hackett, A.G., Hoogheem, T.J., Snoeyink, V.L., Curry, M., Heijman, B., Chen, S., Herti, P. et van Wesenbeeck, I. (2003). Activated carbon adsorption of chloroacetanilide herbicides and their degradation products from surface water supplies. J. Water Supply Res. Technol. AQUA, 52(6): 443–454.
Haist-Gulde, B. et Happel, O. (2012). Removal of pesticides and their ionic degradates by adsorptive processes. Report no. 4022. Water Research Foundation, Denver, Colorado.
Halevy, P., Anderson, W.B. et Huck, P.M (2013). Pilot-scale investigation of advanced water treatment technologies in a eutrophic river in Southern Ontario. Dans : Proceedings of the American Water Works Association Water Quality Technology Conference, Long Beach, California. American Water Works Association, Denver, Colorado.
Hardell, L. et Eriksson, M. (1999). A case-control study of non-Hodgkin lymphoma and exposure to pesticides. Cancer, 85(6): 1353–1360.
Hardell, L. et Sandström, A. (1979). Case-control study: soft tissue sarcomas and exposure to phenoxyacetic acids or chlorophenols. Br. J. Cancer, 39: 711–717.
Hardell, L., Eriksson, M., Lenner, P. et Lundgren, E. (1981). Malignant lymphoma and exposure to chemicals, especially organic solvents, chlorophenols and phenoxy acids: a case-control study. Br. J. Cancer, 43: 169–176.
Hardwick, T. (1999). 14C-MCPA: Absorption and excretion in the beagle dog. Rapport non publié, Covenance Laboratories Ltd., North Yorkshire (Royaume-Uni), décembre (Rapport final no 729/D1141; MRID 4559301) [citée dans US EPA, 2003].
Hardwick, T. (2000). 14C-MCPA: Metabolite profiles in the beagle dog. Unpublished report, Covenance Laboratories Ltd., North Yorkshire (Royaume-Uni), juin (Rapport final modifié no 729/201-D1141; MRID 4559302) [cité dans US EPA, 2003].
Harrison, I., Leader, R.U., Higgo, J.J.W. et Williams, G.M. (1998). A study of the degradation of phenoxyacid herbicides at different sites in a limestone aquifer. Chemosphere, 36(6): 1211–1232.
Hellwig, J. et Hildebrand, B. (1993a). Study of the prenatal toxicity of MCPA-acid in rats after oral administration (gavage): Lab Project No. 30R0374/91096. Étude inédite préparée par BASF Aktiengesellshaft, Ludwigshafen, (Allemagne). 302 p. (cité dans US EPA, 2003).
Hellwig, J., et Hildebrand, B. (1993b). Study of the prenatal toxicity of MCPA-acid in rabbits after oral administration (gavage): Lab Project No. 40R0374/91095. Étude inédite préparée par BASF Aktiengesellshaft, Ludwigshafen (Allemagne). 230 p. (cité dans US EPA, 2003).
Hofman, J.A.M.H., Beerendonk, E.F., Folmer, H.C. et Kruithof, J.C. (1997). Removal of pesticides and other micropollutants with cellulose-acetate, polyamide and ultra-low pressure reverse osmosis membranes. Desalination, 113: 209–214.
Holsing, G.C. et Kundzin, M. (1970). Final report: three-months dietary administration -- rats. BASF Aktiengesellschaft, Ludwigshafen, RFA (citée dans US EPA, 1984; OMS, 2003).
HSDB. (2010). Hazardous Substances Data Bank Number 1127. MCPA CAS # 94-74-6. US National Library of Medicine, Bethesda, MD. Dernière révision : 20 030 214. Disponible à https://pubchem.ncbi.nlm.nih.gov/source/hsdb/1127
Huntscha, S., Rodriguez Velosa, D.M., Schroth, M.H. et Hollender, J. (2013). Degradation of polar organic micropollutants during riverbank filtration: Complementary results from spatiotemporal sampling and push-pull tests. Environ. Sci. Technol., 47(20): 11512–11521.
Hollender, J., Zimmermann, S.G., Koepke, S., Krauss, M., McArdell, C.S., Ort, C., Singer, H., von Gunten, U., et Siegrist, H. (2009). Elimination of organic micropollutants in a municipal wastewater treatment plant upgraded with a full-scale post-ozonation followed by sand filtration. Environ. Sci. Technol. 43, 7862–7869.
Hu, J., Morita, T., Magara, Y. et Aizawa, T. (2000). Evaluation of reactivity of pesticides with ozone in water using the energies of frontier molecular orbitals. Wat. Res., 34(8): 2215–2222.
Ignatowicz, K. (2009). Selection of sorbent for removing pesticides during water treatment.J. Hazard. Mater, 169(1-3), 953-957.
Ikahata, K. et El-Din, M.G. (2006). Aqueous pesticide degradation by hydrogen peroxide/ultraviolet irradiation and Fenton-type oxidation processes: A review. J. Environ. Eng. Sci. 5(2): 81-135.
ISO. (2000). Qualité de l’eau – Dosage de certains herbicides phénoxyalcanoïques, y compris bentazones et hydroxybenzonitriles, par chromatographie en phase gazeuse et spectrométrie de masse après extraction en phase solide et dérivatisation. ISO 15913:2000(F). Organisation internationale de normalisation. Genève (Suisse).
Jahanshahi, M. et Stow, R. (1995). 14C-MCPA: absorption, distribution, metabolism, and excretion in the rats. Unpublished report, Corning Hazelton (Europe), North Yorkshire, UK, June 20 (Laboratory Report No. 1149/5-1011; MRID 43755202) (citée dans US EPA, 2003).
Johnson, J.R.M. et Koumides, O. (1965). A further case of MCPA poisoning. Br. Med. J., 2: 629–630.
Jones, D.J.R., Knight, A.G. et Smith, A.J. (1967). Attempted suicide with herbicide containing MCPA. Arch. Environ. Health, 14: 363–367.
Jones, E., Kitching, J., Anderson, A. et Dawe, I.S. (1992). Ames Salmonella typhimurium bacterial reverse mutation assay on MCPA-DMAS. Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni) (Étude HRC no JEL/26/921053) (citée dans EPA de Californie, 2000).
Jones, E., Kitching, J., Anderson, A. et Dawe, I.S. (1993a). Ames Salmonella typhimurium bacterial reverse mutation assay on MCPA acid. Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni) (Étude HRC n o JEL 26/920957) (citée dans EPA de Californie, 2000).
Jones, E., Kitching, J., Anderson, A. et Dawe, I.S. (1993b). Ames Salmonella typhimurium bacterial reverse mutation assay on MCPA-2-EHE. Unpublished study prepared by Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni) (Rapport no JEL 25/921054) (citée dans US EPA, 2003).
Juhler, R.K., Sorensen, S.R. et Larsen, L. (2001). Analysing transformation products of herbicide residues in environmental samples. Water Res., 35(6): 1371–1378.
Kappas, A. (1988). On the mutagenic and recombinogenic activity of certain herbicides in Salmonella typhimurium and in Aspergillus nidulans. Mutat. Res., 204: 615–621 (citée dans Elliott, 2005).
Kelly, J., Morrison, G., Skillen, N., Manesiotis, P. et Robertson, P.K.J. (2019). An investigation of the role of pH in the rapid photocatalytic degradation of MCPA and its primary intermediate by low-power UV LED irradiation. Chem. Eng. J., 359: 112–118.
Kim, T.Y., Park, S.S., Kim, S.J. et Cho, S.Y. (2008). Separation characteristics of some phenoxy herbicides from aqueous solution. Adsorption, 14(4–5), 611.
Kirsch, P. (1985a). Study of the toxicity of MCPA in mice after 4 weeks administration in the diet. Rapport non publié, Department of Toxicology, BASF Aktiengesellschaft, Ludwigshafen, RFA, 4 avirl (Étude de laboratoire n o 50S0046; MRID 00165470) (citée dans US EPA, 2003).
Kirsch, P. (1985b). Report on the study of the toxicity of MCPA in rats after 3-months administration in the diet. Department of Toxicology, BASF Aktiengesellschaft, Ludwigshafen, RFA, 1er avril (Étude de laboratoire no 3150046/8302; MRID 00165471; microfiche) (citée dans US EPA, 2003).
Kirsch, P. (1986). Report: Study on the Chronic Toxicity and Oncogenic Potential of MCPA in Rats: Final Report: Project No. 71S0046/8345. Étude non publiée de BASF Ag. 2026 p. (citée dans US EPA, 2004d).
Kirsch, P. (1988). Study on the chronic toxicity and oncogenic potential of MCPA in rats. Rapport non publié, Department of Toxicology, BASF Aktiengesellschaft, Ludwigshafen/Rhein, RFA, 18 mai (Étude no 71S0045/8345; MRID 40634101) (citée dans Bellet et coll., 1999 et US EPA, 2003).
Kolmodin-Hedman, B., Höglund, S. et Åkerblom, M. (1983a). Studies on phenoxy acid herbicides. I. Field study. Occupational exposure to phenoxy acid herbicides (MCPA, dichlorprop, mecoprop and 2,4-D) in agriculture. Arch. Toxicol., 54(4): 257–265.
Kolmodin-Hedman, B., Hoglund, S., Swensson, A., Akerblom, M. (1983b), Studies on phenoxy acid herbicides. II. Oral and dermal uptake and elimination in urine of MCPA in humans, Arch. Toxicol., 54(4), 267–273.
Kogevinas, M., Kauppinen, T., Winkelmann, R., Becher, H., Bertazzi, P.A., Bueno-de-Mesquita, H.B., Coggon, D., Green, L., Johnson, E., Littorin, M., Lynge, E., Marlow, D.A., Mathews, J.D., Neuberger, M., Benn, T., Pannett, B., Pearce, N. et Saracci, R. (1995). Soft tissue sarcoma and non-Hodgkin's lymphoma in workers exposed to phenoxy herbicides, chlorophenols, and dioxins: 2 nested case-control studies. Epidemiology, 6: 396–402.
Košutić, K. et Kunst, B. (2002). Removal of organics from aqueous solutions by commercial RO and NF membranes of characterized porosities. Desalination, 142(1), 47–56.
Krishnan, K., Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1):39–51.
Kruger, US, Johnsen, A.R., Burmolle, M., Aamand, J. et Sorensen, S.R. (2015). The potential for bioaugmentation of sand filter materials from waterworks using bacterial cultures degrading 4-chloro-2-methylphenoxyacetic acid. Pest Manag. Sci., 71(2): 257–265.
Kuehn, W. et Mueller, U. (2000). Riverbank filtration: an overview. J. Am. Water Works Assoc., 92(12): 60–69.
Kuhborth, B., Deckaidt, K., Mirea, D., Schilling, K. et Hildebrand, B. (1988). Study on the oncogenic potential of MCPA in mice. Unpublished report, BASF Aktiengesellschaft, Ludwigshafen, RFA, 26 juillet (Projet n o 80S0046/8358; MRID 40792301) (citeé dans Bellet et coll., 1999 et US EPA, 2003).
Lambert, S.D. et Graham, N.J. (1995). A comparative evaluation of the effectiveness of potable water filtration processes. Aqua London, 44(1): 38–51.
Lappin, G.J., Hardwick, T.D., Stow, R., Pigott, G.H. et van Ravenzwaay, B. (2002). Absorption, metabolism and excretion of 4-chloro-2-methylphenoxyacetic acid (MCPA) in rat and dog. Xenobiotica, 32(2): 153–163.
Lekkerkerker-Teunissen, K., Knol, A.H., Derks, J.G., Heringa, M.B., Houtman, C.J., Hofman-Caris, C.H.M., Beerendonk, E.F., Reus, A., Verberk, J.Q.J.C. et van Dijk, J.C. (2013). Pilot plant results with three different types of UV lamps for advanced oxidation. Ozone Sci. Eng., 35(1):38–48.
Li, W., Zhao, Y., Yan, X., Duan, J., Saint, C.P. Beecham, S. (2019). Transformation pathway and toxicity assessment of glyphosate in aqueous solution during UV photolysis and photocatalysis. Chemosphere, 234: 204-214.
Linnainmaa, K. (1984). Induction of sister chromatid exchanges among workers occupationally exposed to phenoxy acid herbicides 2,4-D and MCPA. Teratog. Carcinog. Mutagen., 3: 269–279.
Lynge, E. (1993). Cancer in phenoxy herbicide manufacturing workers in Denmark, 1947–87-- an update. Cancer Causes Control, 4: 261–272.
Lynge, E. (1998). Cancer incidence in Danish phenoxy herbicide workers, 1947–1993. Environ. Health Perspect., 106(2): 683–688.
MacKenzie, K.M. (1986). Two-generation reproductive study with MCPA in rats. Final report. Étude non publiée, Hazelton Laboratories America Inc., Madison, WI, 3 novembre (Étude de laboratoire no 6148-100; MRID 40041701) (citée dans Bellet et coll., 2001 et US EPA, 2003).
Mannetje, A.'t., McLean, D., Cheng, S., Boffetta, P., Colin, D. et Pearce, N. (2005). Mortality in New Zealand workers exposed to phenoxy herbicides and dioxins. Occup. Environ. Med., 62: 34–40.
Matamoros, V. et Franco, J. (2018). Assessing the use of sand, peat soil, and pine bark for the attenuation of polar pesticides from agricultural run-off: A bench-scale column experiment. Environ. Sci. Pollut. Research, 25(21): 20640–20647.
McManus, S.L., Coxon, C.E., Mellander, P.E., Danaher, M. et Richards, K.G. (2017). Hydrogeological characteristics influencing the occurrence of pesticides and pesticide metabolites in groundwater across the republic of Ireland. Sci. Total Environ., (601–602): 594–602.
Meijers, R.T., Oderwald-Muller, E.J., Nuhn, P.A.N.M. et Kruithof, J.C. (1995). Degradation of pesticides by ozonation and advanced oxidation. Ozone Sci. Eng., 17(6): 673–686.
Mellert W. et coll. (1994a). MCPA-DMA salt – Subchronic oral dietary toxicity and neurotoxicity study in Wistar rats. Rapport non publié n o 50C0189/91140 de BASF Aktiengesellschaft, Ludwigshafen (Allemagne). Soumis à l’OMS par le groupe MCPA Task Force Three (citée dans OMS, 2013).
Mellert W. et coll. (1994b). MCPA-acid – Subchronic oral dietary toxicity and neurotoxicity study in Wistar rats. Rapport non publié no 50C0374/91 133 by BASF Aktiengesellschaft, Ludwigshafen (Allemagne). Soumis à l’OMS par le groupe MCPA Task Force Three (citée dans US EPA, 2003; OMS, 2013).
Mellert W. et coll. (1994c). MCPA-2-EH-ester – Subchronic oral dietary toxicity and neurotoxicity study in Wistar rats. Rapport non publié n o 50C0385/91 141 by BASF Aktiengesellschaft, Ludwigshafen (Allemagne). Soumis à l’OMS par le groupe MCPA Task Force Three (citée dans OMS, 2013).
Mersch-Sundermann, V., Hofmeister, A., Mueller, G. et Hof, H. (1989). [Étude de la mutagénicité des
microcontaminations organiques de l’environnement. III. Communication : La mutagénicité de certains herbicides et insecticides soumis au SOS chromotest.] Zentrabl. Hyg., 189 : 135-146 (en allemand).
Miltner, R.J., Baker, D.B., Speth, T.F. et Fronk, C.A. (1989). Treatment of Seasonal Pesticides in Surface Waters. J. Am. Water Works Assoc., 81(1): 43–52.
Ministère des Communautés, des Terres et de l’Environnement de l’Î.-P.-É. (2019). Communication personnelle avec G. Somers.
Ministère de l’Environnement de la Nouvelle-Écosse. (2019). Communication personnelle avec A. Polegato.
Ministère de l’Environnement, de la Protection de la nature et des Parcs de l’Ontario. (2020). Communication personnelle avec S. Deshpande.
Ministère de l’Environnement et de la Lutte contre les changements climatiques (2019). Communication personnelle avec P. Cantin.
Ministère de l’Environnement et des Gouvernements locaux du Nouveau-Brunswick. (2019). Communication personnelle avec K. Gould.
Ministère de la Santé du Nouveau-Brunswick (2005). Communication personnelle avec R. Albert.
Mohamed, F., Endre, Z.H. et Buckley, N.A. (2015). Role of biomarkers of nephrotoxic acute kidney injury in deliberate poisoning and envenomation in less developed countries. Br J Clin Pharmacol. 80(1): 3-19.
Moriya, M., Ohta, T., Watanabe, K., Miyazawa, T., Kato, K. et Shirasu, Y. (1983). Further mutagenicity studies on pesticides in bacterial reversion assay system. Mutat. Res., 116: 185–216.
Morton, P.A., Fenell, C., Cassidy, R., Doody, D., Fenton, O., Mellander, P-E. et Jordan, P. (2019). A review of the pesticide MCPA in the land-water environment and emerging research needs. WIREs Water. Disponible à https://onlinelibrary.wiley.com/doi/abs/10.1002/wat2.1402
Munira, S., Farenhorst, A., Sapkota, K., Nilsson, D. et Sheedy, C. (2018). Auxin Herbicides and Pesticide Mixtures in Groundwater of a Canadian Prairie Province. J. Environ. Qual. 47:1462–1467.
Murphy, C. et Mutch, J. (2005). Unpublished water monitoring data from the Environment Canada Atlantic Region. Données recueilles dans le cadre du Fonds sur les pesticides d’Environnement Canada (citée dans ARLA, 2005d).
Murray, J., Andersen, D. et Kent, R. (2004). Presence, levels and relative risks of priority pesticides in selected Canadian aquatic ecosystems. Projet du Fonds sur les pesticides d’Environnement Canada. Rapport annuel (2003- 2004) - Année 1. Institut national de recherche sur les eaux, Environnement Canada, Burlington (Ontario)
Mustonen, R., Elovaara, E., Zitting, A., Linnainmaa, A. et Vainio, H. (1989). Effects of commercial chlorophenolate, 2,3,7,8-TCDD, and pure phenoxyacetic acids on hepatic peroxisome proliferation, xenobiotic metabolism and sister chromatid exchange in the rat. Arch. Toxicol., 63: 203–208.
Muszynski, P., Brodowska, M.S. et Paszko, T. (2020). Occurrence and transformation of phenoxy acids in aquatic environment and photochemical methods of their removal: A review. Environ. Sci. Pollut. R. 27:1276–1293.
Newfoundland and Labrador Municipal Affairs and Environment. (2019). Communication personnelle avec H. Khan.
NHMRC and NRMMC (2011). Australian Drinking Water Guidelines Paper 6 National Water Quality Management Strategy. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra. Disponible à https://www.Nhmrc.Gov.Au/about-us/Publications/Australian-Drinking-Water-Guidelines.
Nishimura, N., Nishimura, H. et Oshima, H. (1982). Survey on mutagenicity of pesticides by the Salmonella-microsome test. J. Aichi Med. Univ. Assoc., 10: 305–312 (citée dans Elliott, 2005).
Oberleitner, D., Schulz, W., Bergmann, A. et Achten, C. (2020). Impact of seasonality, redox conditions, travel distances and initial concentrations on micropollutant removal during riverbank filtration at four sites. Chemosphere, 250: 1–10.
OMS. (2011) [version en français publiée en 2017]. Directives de qualité pour l’eau de boisson. Quatrième édition. Organisation mondiale de la Santé, Genève (Suisse). Disponible à https://www.who.int/water_sanitation_health/publications/drinking-water-quality-guidelines-4-including-1st-addendum/fr/
OMS. (2012) [version en français publiée en 2017]. Planifier la gestion de la sécurité sanitaire de l’eau pour l’approvisionnement en eau des petites communautés. Organisation mondiale de la Santé, Genève (Suisse). Disponible à https://www.who.int/water_sanitation_health/publications/small-comm-water_supplies/fr/
OMS. (2016). MCPA in drinking-water. Background document for development of WHO Guidelines for drinking-water quality. Organisation mondiale de la Santé, Genève (Suisse). Disponible à https://www.who.int/water_sanitation_health/water-quality/guidelines/chemicals/mcpa-background-jan17.pdf
Pahwa, M., Harris, S.A., Hohenadel, K., McLaughlin, J.R., Spinelli, J.J., Pahwa, P., Dosman, J.A. et Blair, A. (2012). Pesticide use, immunologic conditions, and risk of non-Hodgkin lymphoma in Canadian men in six provinces. Int. J. Cancer: 131, 2650–2659.
Palva, H.L.A., Koivisto, O. et Palva, I.P. (1975). Aplastic anaemia after exposure to a weed killer, 2-methyl-4-chlorophenoxyacetic acid. Acta Haematol., 53: 105–108.
Petrie, A.J., Melvin, M.A., Plane, N.H. et Littlejohn, J.W. (1993). The effectiveness of water treatment processes for removal of herbicides. Sci. Total Environ., 135(1–3), 161–169.
Piet, G.J. et Zoeteman, B.C.J. (1980). Organic water quality changes during sand bank and dune filtration of surface waters in the Netherlands. J. Am. Water Works Assoc., 72(7): 400–404.
Plakas, K.V. et Karabelas, A.J. (2012). Removal of pesticides from water by NF and RO membranes – a review. Desalination, 287: 255–265.
Popham, R.D. et Davis, D.M. (1964). A case of MCPA poisoning. Br. Med. J., 1: 677–678.
Proudlock, R.J., Taylor, K., Anderson, A. et Dawe, I.S. (1993a). MCPA DMAS micronucleus test. Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni), 2 avril. (Étude HRC no JEL 33/921197) (citée dans EPA de Californie, 2000; Elliott, 2005).
Proudlock, R.J., Elmore, E.A., Anderson, A. et Dawe, I.S. (1993b). MCPA acid micronucleus test. Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni), 23 avril (Étude HRC no JEL 35/921198) (citée dans EPA de Californie, 2000; Elliott, 2005).
Proudlock, R.J., Goodenough, A.J., Anderson, A. et Dawe, I.S. (1993c). MCPA 2-EHE micronucleus test. Huntingdon Research Centre Ltd., Huntingdon (Royaume-Uni), 22 avril (Étude HRC no JEL 33/921197) (citée dans Elliott, 2005).
Randtke, S.J. (1988). Organic contaminant removal by coagulation and related process combinations. J. Am. Water Works Assoc., 80(5): 40–56.
Räsänen, L., Hattula, M.L. et Arstila, A.U. (1977). The mutagenicity of MCPA and it soil metabolites, chlorinated phenols, catechols and some widely used slimicides in Finland. Bull. Environ. Contam. Toxicol., 18(5): 565–571.
Ray, C., Grischek, T., Schubert, J., Wang, J.Z. et Speth, T.F. (2002). A perspective of riverbank filtration. J. Am. Water Works Assoc., 94(4): 149–160.
Reynolds, G., Graham, N. et Perry, R. (1989). Aqueous ozonation of pesticides: A review. Ozone: Sci. Eng., 11(4): 339–382.
Roberts, D.M., Seneviratne, R., Mohammed, F., Patel, R., Senarathna, L., Hittarage, A., Buckley, N.A., Dawson, A.H., et Eddleston, M. (2005). Intentional self-poisoning with the chlorophenoxy herbicide 4-chloro-2-methylphenoxyacetic acid (MCPA). Ann. Emerg. Med. 46: 275–84.)
Roberts, D.M., Dawson, A.H., Senarathna, L., Mohamed, F., Cheng, R., Eaglesham, G. et Buckley, N.A. (2011). Toxicokinetics, including saturable protein binding, of 4-chloro-2-methyl phenoxyacetic acid (MCPA) in patients with acute poisoning. Toxicol. Lett. 2011; 201: 270–6.
Rowe, V.K. et Hymas, T.A. (1954). Summary of toxicological information on
2,4-D and 2,4,5-T type herbicides and an evaluation of the hazards to
livestock associated with their use. Am. J. Vet. Res., 15: 622–629.
RTECS. (2005). Registry of Toxic Effects of Chemical Substances: MCPA. CAS # 94–74-6. No RTECS : AG1575000. Profils chimiques établis par le Centre canadien d’hygiène et de sécurité au travail, Hamilton (Ontario).
Samuelsen, E.D., Badawi, N., Nybroe, O., Sørensen, S.R. et Aamand, J. (2017). Adhesion to sand and ability to mineralise low pesticide concentrations are required for efficient bioaugmentation of flow-through sand filters. Appl. Microbiol. Biotechnol., 101(1): 411–421.
Santé Canada. (2005). Rapport interne. MCPA use profile for Water Quality and Health Bureau, Health Canada. Agence de réglementation de la lutte antiparasitaire, Santé Canada, Ottawa, Ontario, 7 septembre.
Santé Canada (2006). Réévaluation des utilisations de l’acide (4-chloro-2-méthylphénoxy) acétique (MCPA) comme herbicide sur les pelouses et le gazon en plaques. Agence de réglementation de la lutte antiparasitaire, Santé Canada, Ottawa (Ontario), 28 avril (PACR2006-05). Disponible à https://www.canada.ca/fr/sante-canada/services/securite-produits-consommation/pesticides-lutte-antiparasitaire.html
Santé Canada. (2007). Projet de décision de réévaluation. Les utilisations de l’herbicide acide (4-chloro-2-méthylphénoxy) acétique (MCPA) en agriculture, en foresterie et sur des sites industriels. Agence de réglementation de la lutte antiparasitaire, Santé Canada, Ottawa (Ontario). Consultation du document en juillet 2007 (PRVD2007-01). Disponible à https://www.canada.ca/fr/sante-canada/services/securite-produits-consommation/pesticides-lutte-antiparasitaire.html
Santé Canada. (2008). Décision de réévaluation. Acide (4-chloro-2-méthylphénoxy) acétique (MCPA). Agence de réglementation de la lutte antiparasitaire, Santé Canada, Ottawa (Ontario). (RVD2008-20). Disponible à https://www.canada.ca/fr/sante-canada/services/securite-produits-consommation/rapports-publications/pesticides-lutte-antiparasitaire/decisions-mises-jour.html#rvd-drv
Santé Canada. (2015-2016). Rapport annuel du Programme national de surveillance des résidus chimiques et Programme de surveillance de la salubrité des aliments. Agence canadienne d’inspection des aliments, Santé Canada, Ottawa (Ontario).
Santé Canada. (2018). Rapport sur les ventes de produits antiparasitaires en 2018. Agence de réglementation de la lutte antiparasitaire, Santé Canada, Ottawa (Ontario). Disponible à https://www.canada.ca/fr/sante-canada/services/securite-produits-consommation/rapports-publications/pesticides-lutte-antiparasitaire/plans-rapports/rapport-concernant-ventes-produits-anitparasitaires.html
Santé Canada. (2020). Communication personnelle avec la Direction de l’évaluation sanitaire, Agence de réglementation de la lutte antiparasitaire (ARLA).
Saracci, R., Kogevinas, M., Bertazzi, P.-A., Bueno de Mesquita, B.H., Coggon, D., Green, L.M., Kauppinen, T., L'Abbé, K.A., Littorin, M., Lynge, E., Mathews, J.D., Neuberger, M., Osman, J., Pearce, N. et Winkelmann, R. (1991). Cancer mortality in workers exposed to chlorophenoxy herbicides and chlorophenols. Lancet, 338(8774): 1027–1032.
Saskatchewan Water Security Agency (2019). Communication personnelle avec S. Ferris.
Sattar, M.A. et Paasivirta, J. (1980). Fate of chlorophenoxy acetic acids in acid soil. Chemosphere, 9: 745–752.
Schippers, J.C., Kruithof, J.C., Nederlof, M.M., Hofman, J.A.M.H. et
Taylor, J.S. (2004). Integrated membrane systems. American Water Works
Association Research Foundation and American Water Works Association,
Denver, CO (Rapport no 90899).
Services aux Autochtones Canada. (2019). Communication personnelle avec X. Redhead.
Service d’hygiène du milieu du Yukon (2019). Communication personnelle avec P. Brooks
Smeets, P.W.M.H., Medema, G.J. et van Dijk, J.C. (2009). The Dutch secret: how to provide safe drinking water without chlorine in the Netherlands. Drinking Water Engineering and Science, 2: 1-14.
Smith, A.E. et Hayden, B.J. (1981). Relative persistence of MCPA, MCPB and mecoprop in Saskatchewan soils, and the identification of MCPA in MCPB-treated soils. Weed Sci., 21: 179–183.
Soderquist, C.J. et Crosby, D.G. (1975). Dissipation of 4-chloro-2-methylphenoxyacetic acid (MCPA) in a rice field. Pestic. Sci., 6: 17–33.
Speth, T.F. et Adams, J.Q. (1993). GAC and air stripping design support for the Safe Drinking Water Act, strategies and technologies for meeting SDWA requirements. Clark, R. et S. Summers, éds., Lewis Publishers, Ann Arbor, MI, p. 47–89.
Speth, T.F. et Miltner, R.J. (1998). Technical note: adsorption capacity of GAC for synthetic organics. Jour. AWWA. 90(4): 171–174.
Sørensen, S.R., Schultz, A., Jacogsen, O.S., Aamand, J. (2006). Sorption, desorption and mineralisation of the herbicides glyphosate and MCPA in samples from two Danish soil and subsurface profiles. Environ. Pollut. 141, 184–194.
Struger, J., Fletcher, T., Martos, P., Ripley, B. et Gris, G. (2002). Pesticide concentrations in the Don and Humber river watersheds (1998–2000). Rapport intérimaire. Environnement Canada et le ministère de l’Environnement de l’Ontario, décembre (citée dans ARLA, 2005c).
Struger, J., L’Italien, S. et Sverko, E. (2004). In-use pesticide concentrations in surface waters of the Laurentian Great Lakes, 1994–2000. J. Great Lakes Res., 30(3): 435–450.
Struger, J., Marvin, C., Sveko, E., Dove, A., Palace, V., Todd, A. et Fletcher, T. (2005). Unpublished water monitoring data from the Environment Canada Ontario Region. Données recueillies dans le cadre du Fonds sur les pesticides d’Environnement Canada (citée dans ARLA, 2005d).
Struif, B., Weil, L. et Quentin, K. (1978). Verhalten herbizider Phenoxy-alkan-carbonsäuren bei der Wasseraufbereitung mit Ozon. Z.f. Wasser- und Abwasserforschung 11. Jahrgang Nr.3/4/78 (citée dans Reynolds et coll. (1989))
Summers, R.S., Knappe, D.R.U. et Snoeyink, V.L. (2010). Chapter 14: Adsorption of organic compounds by activated carbon. Dans : Edzwald, J.K. (éd.), Water quality and treatment: A handbook on drinking water. 6th edition. McGraw-Hill, New York, NY.
Symons, J.M., Bradley Jr., L.C. et Cleveland, T.C. (2000). The drinking water dictionary. American Water Works Association, Denver, Colorado.
Takayasu, T., Hayashi, T., Ishida, Y., Nosaka, M., Mizunuma, S., Miyashita, T., Kawaguchi, M., Kimura, A. et Kondo, T. (2008). A fatal intoxication from ingestion of 2-methyl-4-chlorophenoxyacetic acid (MCPA). J Anal Toxicol., 32(2):187–91.
Taylor, J.S. (éd.). (2000). Flat sheet, bench and pilot testing for pesticide removal using reverse osmosis. American Water Works Association, Denver, CO.
Timchalk, C. (2004). Comparative inter-species pharmacokinetics of phenoxyacetic acid herbicides and related organic acids. Evidence that the dog is not a relevant species for evaluation of human health risk. Toxicology, 200(1): 1–19.
Timonen, T.T. et Palva, I.P. (1980). Acute leukemia after exposure to a weed killer, 2-methyl-4-chlorophenoxyacetic acid. Acta Haematol., 63: 170–171.
Tuominen, T., Pasternak, J., Sekela, M., Ryan, A., Hii, B., Strub, R., McPherson, B., Wan, M., Kuo, J. et Hamilton, C. (2005). Unpublished water monitoring data from the Environment Canada Pacific and Yukon Region. Données recueillies dans le cadre du Fonds sur les pesticides d’Environnement Canada (citée dans ARLA, 2005d).
University of Hertfordshire. (2019). MCPA. Pesticide Properties Database (PPDB). Disponible à http://sitem.herts.ac.uk/aeru/ppdb/en/Reports/427.htm
USDA. (2001). Agricultural Research Service (ARS) Pesticide Properties Database on MCPA (94-74-6). US Department of Agriculture. MCPA, dernière mise à jour en mai 1999.
US EPA. (1984). Health and environmental effects profile for MCPA and MCPB. Environmental Criteria and Assessment Office, Office of Research and Development, US Environmental Protection Agency (NTIS/PB88-162391; microfiche).
US EPA. (1990). Registration on standard for pesticide products containing MCPA as the active ingredient. Government Reports Announcement and Index (GRA & I), Issue 07. US Environmental Protection Agency (NTIS/PB90-146556).
US EPA. (1992). Method 555: Determination of chlorinated acids in water by high performance liquid chromatography with a photodiode array ultraviolet detector, revision 1.0. Environmental Monitoring Systems Laboratory, Office of Research and Development, United States Environmental Protection Agency, Cincinnati, OH.
US EPA. (2003). MCPA: Toxicology chapter for RED (Reregistration Eligibility Decision). Office of Prevention, Pesticides, and Toxic Substances, US Environmental Protection Agency, Washington, DC, 1 er juillet (ID document : EPA-HQ-OPP-2004-0239-0019).
US EPA. (2004a). Environmental Fate and Effects Division’s risk assessment for the reregistration eligibility document for 2-methyl-4-chlorophenoxyacetic acid (MCPA). US Environmental Protection Agency (ID document: EPA-HQ-OPP-2004-0239-0006).
US EPA. (2004b). R.E.D. Facts: MCPA. Office of Prevention, Pesticides and Toxic Substances, US Environmental Protection Agency, September (7508C; ID document: EPA-HQ-OPP-2004-0239-0002).
US EPA. (2004c). MCPA summary. US Environmental Protection Agency (ID document: EPA-HQ-OPP-2004- 0156-0003).
US EPA. (2004d). Reregistration Eligibility Decision for MCPA (2-methyl-4-chlorophenoxyacetic acid). List A Case 0017. Office of Prevention, Pesticides, and Toxic Substances, US Environmental Protection Agency, Washington, DC, 30 septembre (ID document : EPA-HQ-OPP-2004-0239-0003).
US EPA. (2004e). MCPA — Corrected first report of the Hazard Identification Assessment Review Committee. Office of Prevention, Pesticides, and Toxic Substances, US Environmental Protection Agency, Washington, DC (ID document: EPA-HQ-OPP-2004-0239-0018).
US EPA. (2011). Finalization of guidance on incorporation of water treatment effects on pesticide removal and transformation in drinking water exposure assessments.
US EPA. (2018). 2018 Edition of the Drinking Water Standards and Health Advisories. Office of Water US Environmental Protection Agency Washington, DC. Disponible à https://www.epa.gov/sites/production/files/2018-03/documents/dwtable2018.pdf
USGS. (1996). Method O-1131-95 - Determination of pesticides in water by CarboPak-B solid-phase extraction and HPLC. United States Geological Survey, National Water Quality Laboratory.
USGS. (2001). Method O-2060-01 - Determination of pesticides in water by graphitized carbon-based solid-phase extraction and HPLC-MS. United States Geological Survey, National Water Quality Laboratory.
Van der Aa, L.T.J., Kolpa, R.J., Rietveld, L.C. et van Dijk, J.C. (2012). Improved removal of pesticides in biological granular activated carbon filters by pre-oxidation of natural organic matter. J. Water Supply Res. Technol. AQUA, 61(3): 153–163.
Van der Bruggen, B. et Vandecasteele, C. (2003). Removal of pollutants from surface water and groundwater by nanofiltration: overview of possible applications in drinking water industry. Environ. Pollut., 122(3): 435–445.
Vandermaesen, J., Horemans, B., Degryse, J., Boonen, J., Walravens, E. et Springael, D. (2019). The pesticide mineralization capacity in sand filter units of drinking water treatment plants (DWTP): Consistency in time and relationship with intake water and sand filter characteristics. Chemosphere, 228: 427–436.
van Ravenzwaay, B., Pigott, G. et Leibold, E. (2004). Absorption, distribution, metabolism and excretion of 4-chloro-2-methylphenoxyacetic acid (MCPA) in rats. Food Chem. Toxicol., 42(1): 115–125.
Verstraeten, I.M. et Heberer, T. (2002). Organic chemical removal issues. Chapter 17 in: Riverbank filtration: Improving source-water quality. Ray, C., Melin, G. and Linsky, R.B. (éd.). Springer, Kluwer Academic Publishers. Netherlands. pp. 321–330.
Vineis, P., Terracini, B., Ciccone, G., Cignetti, A., Colombo, E., Donna, A., Maffi, D.A., Pisa, R., Ricci, P., Zanini, E. et Comba, P. (1986). Phenoxy herbicides and soft-tissue sarcomas in female rice-weeders: a population-based case control study. Scand. J. Work Environ. Health, 13(1): 9–17.
Vineis, P., Faggiano, F., Tedeschi, M. et Ciccone, G. (1991). Incidence rates of lymphomas and soft-tissue sarcomas and environmental measurements of phenoxy herbicides. J. Natl. Cancer Inst., 83(5): 362–363.
Waite, D.T., Bailey, P., Sproull, J.F., Quiring, D.V., Chau, D.F., Bailey, J. et Cessna, A.J. (2005). Atmospheric concentrations and dry and wet deposits of some herbicides currently used on the Canadian Prairies. Chemosphere, 58: 693–703.
Weed Science Society of America. (1989). Herbicide handbook. 6th edition. Weed Science Society of America, Champaign, IL. p. 171–173.
Wiklund, K., Dich, J. et Holm, L.-E. (1987). Risk of malignant lymphoma in Swedish pesticide appliers. Br. J. Cancer, 56: 505–508.
Wiklund, K., Dich, J. et Holm, L.-E. (1988). Soft tissue sarcoma risk in Swedish licensed pesticide applicators. J. Occup. Med., 30(10): 801–804.
Wiklund, K., Dich, J. et Holm, L.-E. (1989). Risk of soft tissue sarcoma, Hodgkin's disease and non-Hodgkin lymphoma among Swedish licensed pesticide applicators. Chemosphere, 18(1–6): 395–400.
Worthing, C.R. et Hance, R.J. (eds.). (1991). The pesticide manual. 9th edition. British Crop Protection Council, Farnham (Royaume-Uni).
Woudneh, M.B., Lloyd, B.J. et Stevenson, D. (1996). Removal of herbicides by biological filters. Dans : Advances in slow sand/alternative biofiltration. Graham, N. and Collins, M.R. (éd.). John Wiley & Sons. Chichester (Royaume-Uni). p. 211–221.
Wunnapuk, K., Liu, X., Gobe, G.C., Endre, Z.H., Peake, P.W., Grice, J.E., Roberts, M.S. et Buckley, N.A. (2014). Kidney biomarkers in MCPA-induced acute kidney injury in rats: Reduced clearance enhances early biomarker performance. Toxicol Lett. 225: 467–78.
Yao, Y., Tuduri, L., Harner, T., Blanchard, P., Waite, D., Poissant, L., Murphy, C., Belzer, W., Aulagnier, F., Li, Y.-F. et Sverko, E. (2006). Spatial and temporal distribution of pesticide air concentrations in Canadian agricultural regions. Atmos Env 40: 4339–4351.
Zertal, A., Sehili, T. et Boule, P. (2001). Photochemical behaviour of 4-chloro-2-methylphenoxyacetic acid: Influence of pH and irradiation wavelength. J. Photochem. Photobiol. A., 146(1–2): 37–48.
Zetterberg, G. (1978). Genetic effects of phenoxy acids on microorganisms. Ecol. Bull., 27: 193–204.
Zetterberg, G. (1979). Mechanism of the lethal and mutagenic effects of phenoxyacetic acids in Saccharomyces cerevisiae. Mutat. Res., 60: 291–300.
Zychlinski, L. et Zolnierowicz, S (1990). Comparison of uncoupling activities of chlorophenoxy herbicides in rat liver mitochondria. Toxicol. Lett. 52: 25–34.
Annexe A : Liste des abréviations
- 2,4,5-T acide
- 2,4,5-trichlorophénoxyacétique
- 2,4-D acide
- 2,4-dichlorophénoxyacétique
- 2-M4CP
- 2-méthyl-4-chlorophénol
- ADN
- acide désoxyribonucléique
- ANSI
- American National Standards Institute
- AQA
- apport quotidien acceptable
- ARLA
- Agence de réglementation de la lutte antiparasitaire
- BP
- basse pression
- CA
- charbon actif
- CAG
- charbon actif granulé
- CAP
- charbon actif en poudre
- CCME
- Conseil canadien des ministres de l’Environnement
- CCN
- Conseil canadien des normes
- CCSPH
- Étude pancanadienne sur les pesticides et la santé
- CEP
- Comité fédéral-provincial-territorial sur l’eau potable
- CG
- chromatographie en phase gazeuse
- CIRC
- Centre international de recherche sur le cancer
- CLHP
- chromatographie liquide à haute performance
- CMA
- concentration maximale acceptable
- COD
- carbone organique dissous
- COT
- carbone organique total
- DGSPNI
- Direction générale de la santé des Premières Nations et des Inuits
- DMT
- dose maximale tolérée
- EPA
- Environmental Protection Agency (États-Unis)
- FA
- facteur d’attribution
- FBBR
- bioréacteur à lit fixe
- FI
- facteur d’incertitude
- FSB
- filtration sur berge
- HMCPA
- acide 4-chloro-2-hydroxyméthylphénoxyacétique
- Î.-P.-É.
- Île-du-Prince-Édouard
- ITEP
- installation de traitement de l’eau potable
- K
- coefficient de Freundlich
- LDM
- limite de détection de la méthode
- LNH
- lymphome non hodgkinien
- Log Kow
- coefficient de partage octanol-eau
- MCL
- concentration maximale de contaminant
- MCPA
- acide (4-chloro-2-méthylphénoxy)acétique
- MCPA-DMAS
- sel diméthylamine de MCPA
- MCPA-EHE
- ester 2-éthylhexylique du MCPA
- MON
- matière organique naturelle
- MWCO
- seuil de poids moléculaire
- NF
- nanofiltration
- no CAS
- numéro de registre du Chemical Abstracts Service
- NOAEL
- concentration sans effet nocif observé
- NOEL
- concentration sans effet observé
- NSF
- NSF International
- OI
- osmose inverse
- OMS
- Organisation mondiale de la Santé
- p.c.
- poids corporel
- PM
- pression moyenne
- POA
- procédé d’oxydation avancée
- PSEP
- Programme de surveillance de l’eau potable
- SDM
- seuil de déclaration de la méthode
- SM
- spectrométrie de masse
- TCFV
- temps de contact en fût vide
- TCH
- taux de charge hydraulique
- TFC
- composite à couche mince
- UE
- Union européenne
- US EPA
- United States Environmental Protection Agency
- UTN
- unité de turbidité néphélémétrique
- UV
- ultraviolet
- V spec
- débit spécifique
- VBS
- valeur basée sur la santé
Annexe B : Données sur la qualité des eaux au Canada
| Province (année d’échantillonnage) | Nbre de détections/ échantillons | LDM (ng/L) | Plage (ng/L) | 25e percentile (ng/L) | Moyenne (ng/L) | Médiane (ng/L) | 75e percentile (ng/L) | |
|---|---|---|---|---|---|---|---|---|
| Min | Max | |||||||
| Eau du robinet | ||||||||
| Alb. Sask., Man. – communautés rurales (2004-2005) | n.d./28 | n.d. | 0,58 | 865,00 | n.d. | 96,50 | n.d. | n.d. |
| Eau de surface | ||||||||
| C.-B. – Vallée du Bas-Fraser et bassin de l’Okanagan (2003-2005) | 83/92 | 0,05 | < 0,05 | 789 | 0,520 | n.d. | 1,290 | 12,7 |
| C.-B. – Vallée du Bas-Fraser (2003-2005) | n.d. | n.d. | 0,08 | 789 | n.d. | n.d. | n.d. | n.d. |
| Ont. (2003) | 116/162 | 0,58 | 0,66 | 1230 | 0,29 | n.d. | 1,94 | 4,69 |
| Ont. (2004) | 128/228 | 0,58 | 0,58 | 350 | 0,29 | n.d. | 1,09 | 6,51 |
| Ont. (2005) | 71/183 | 0,58 | 1,04 | 69,1 | n.d. | n.d. | n.d. | n.d. |
| Qc (2003) | 6/51 | 10 | < 10 | 120 | n.d. | n.d. | n.d. | n.d. |
| Qc (2004) | 11/70 | 6-10 | < 6 | 110 | n.d. | n.d. | n.d. | n.d. |
| Qc (2005) | 12/59 | 10 | < 10 | 1200 | n.d. | n.d. | n.d. | n.d. |
| N.-B. (2003-2005) | 1/57 | 100 | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| Î.-P.-É. (2003-2005) | 0/82 | 100 | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| N.-É. (2003-2005) | 1/48 | 100-200 | n.d. | n.d. | n.d. | n.d. | n.d. | n.d. |
| Rivières | ||||||||
| Alb. Sask., Man. – 8 sites (2003) | 59/64 | 0,58 | < 0,58 | 176 | 5,74 | n.d. | 11,95 | 23,85 |
| Eau de réservoirs | ||||||||
| Alb., Sask., Man. – 15 sites (2003–2004) | 204/206 | 0,58 | <0,58 | 374 | 13,80 | n.d. | 27,45 | 68,10 |
| Eau souterraine | ||||||||
| C.-B. – bassin de l’Okanagan (2003–2005) | n.d. | n.d. | 0,11 | 0,31 | n.d. | n.d. | n.d. | n.d. |
LDM = limite de détection de la méthode n.d. - non disponible. Remarque : Adapté d’Environnement Canada (2011) |
||||||||
