Le plomb dans l'eau potable

Télécharger le rapport complet
(Format PDF, 1 Mo, 118 pages)
Organisation : Santé Canada
Type : Consultation
Date publiée : 2017-01-11
Sujets connexes
Table des matières
- But de la consultation
- Partie I. Vue d'ensemble et application
- 1.0 Recommandation proposée
- 2.0 Sommaire
- 3.0 Application de la recommandation
- Partie II. Science et considérations techniques
- 4.0 Propriétés, utilisations et sources dans l’environnement
- 5.0 Exposition
- 6.0 Méthodes d’analyse
- 7.0 Techniques de traitement et considérations liées aux réseaux de distribution
- 7.1 Échelle municipale
- 7.1.1 Considérations relatives au traitement
- 7.1.2 Considérations relatives aux réseaux de distribution
- 7.1.2.1 Entrées de service en plomb
- 7.1.2.2 Corrélation entre le plomb particulaire et le fer
- 7.1.2.3 Alliages en laiton
- 7.1.2.4 Stratégie d’atténuation pour les entrées de service en plomb
- 7.1.2.5 Stratégie d’atténuation pour les réseaux de distribution et les installations de plomberie
- 7.1.2.6 Stratégie d’atténuation des effets causés par le traitement
- 7.2 Échelle résidentielle
- 7.1 Échelle municipale
- 8.0 Cinétique et métabolisme
- 9.0 Effets sur la santé
- 9.1 Effets chez l’humain
- 9.2 Effets chez les animaux de laboratoire
- 9.3 Mode d’action
- 10.0 Classification et évaluation
- 11.0 Justification
- 12.0 Références
- Annexe A : Liste des acronymes
- Annexe B : Répercussions prévues par province et territoire
But de la consultation
Le Comité fédéral-provincial-territorial sur l’eau potable (CEP) a évalué l’information disponible sur le plomb dans le but de mettre à jour la recommandation pour la qualité de l’eau potable. La présente consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l’élaborer et les coûts possibles de sa mise en œuvre, ainsi que pour déterminer la disponibilité d’autres données sur l’exposition.
La recommandation actuelle pour le plomb, dont la dernière mise à jour remonte à 1992, était une concentration maximale acceptable (CMA) de 0,01 mg/L (10 µg/L) établie à partir d’un apport hebdomadaire tolérable provisoire de plomb établi par l’Organisation mondiale de la Santé (OMS) à un niveau auquel on ne voyait aucune augmentation de plombémie et donc n’anticipait pas d’augmentation des risques à la santé. Ce nouveau document identifie l’effet critique du plomb comme étant une diminution du quotient intellectuel, et propose une CMA de 0,005 mg/L (5 µg/L) qui tient compte des capacités d’analyse. Il fournit des données et de l’information à jour concernant l’exposition au plomb au Canada, les méthodes d’analyse et les approches en matière de traitement disponibles aux échelles municipale et résidentielle. Compte tenu de ces considérations, le document propose une CMA de 0,005 mg/L de plomb total dans l’eau potable.
Le CEP a demandé que ce document soit rendu public aux fins de consultation. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés au Secrétariat du CEP par courrier électronique (water_eau@hc-sc.gc.ca) ou au besoin par la poste au Secrétariat du CEP, Bureau de la qualité de l’eau et de l’air, Santé Canada, 3e étage, 269, avenue Laurier Ouest, IA 4903D, Ottawa (Ontario) K1A 0K9. Tous les commentaires doivent être reçus avant le 15 mars 2017.
Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l’affiliation de leurs auteurs, aux membres compétents du CEP. Les personnes qui ne souhaitent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que le présent document technique sera révisé après l’analyse des commentaires reçus et qu’une recommandation pour l’eau potable sera établie s’il y a lieu. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires
Partie I. Vue d’ensemble et application
1.0 Recommandation proposée
Une concentration maximale acceptable (CMA) de 0,005 mg/L (5 µg/L) est proposée pour le plomb total dans l’eau potable, mesurée dans un échantillon d’eau prélevé au robinet et selon le protocole d’échantillonnage approprié au type d’immeuble. Tout doit être mis en œuvre pour maintenir les concentrations de plomb dans l’eau potable au niveau le plus bas qu’il soit raisonnablement possible d’atteindre (ou ALARA).
2.0 Sommaire
Le plomb est habituellement présent dans l’eau potable en raison de son relargage par les éléments du réseau de distribution ou de la plomberie. Par le passé, le plomb était fréquemment utilisé dans les entrées de service, les soudures et les raccords, ce qui rend sa présence dans l’eau potable plus probable dans les vieilles maisons et les vieux quartiers.
Le présent document technique contient un examen et une évaluation de tous les risques pour la santé connus qui sont associés à la présence du plomb dans l’eau potable. On y évalue les études et les approches nouvelles, en plus de tenir compte de la disponibilité et des limites des technologies de traitement appropriées. Les renseignements contenus dans ce document sont complémentaires à ceux qui figurent dans le Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d’eau potable.
À sa réunion du printemps 2015, le Comité fédéral-provincial-territorial sur l'eau potable a examiné le présent document technique et a approuvé sa publication à des fins de consultation publique.
2.1 Effets sur la santé
Les composés inorganiques du plomb ont été classés comme étant probablement cancérogènes pour l’humain, en fonctions des études réalisées sur des animaux. Toutefois, chez l’humain, les effets cancérogènes ne sont pas les principaux effets préoccupants sur la santé.
La toxicité du plomb a été amplement documentée chez l’humain, en fonction de la concentration sanguine de plomb (appelée plombémie). Parmi les effets étudiés, mentionnons une diminution de la cognition, une élévation de la pression artérielle et une dysfonction rénale chez les adultes, de même que des effets sur le comportement et sur le développement neurologique des enfants. La plus forte association observée à ce jour est l’augmentation de la plombémie chez les enfants et la diminution des scores de quotient intellectuel (QI). Il est impossible de déterminer un seuil sous lequel le plomb n’est plus associé à des effets indésirables sur le développement neurologique.
2.2 Exposition
Le plomb est normalement présent dans l’environnement, tant sous sa forme naturelle qu’issu de l’activité humaine. Les Canadiens sont exposés à de petites quantités de plomb dans l’eau, la nourriture, l’air, le sol et les produits de consommation. Le plomb a longtemps été utilisé dans les réseaux de distribution d’eau potable et les installations de plomberie, ainsi que dans la peinture et comme additif dans l’essence. Des réductions importantes de la teneur en plomb dans les produits comme l’essence et la peinture signifient que les aliments et l’eau potable constituent maintenant les principales sources d’exposition au plomb dans les populations adultes moyennes. L’inhalation peut aussi être une source importante pour les personnes qui vivent à proximité de sources ponctuelles, comme les hippodromes et les aéroports.
2.3 Analyse et traitement
Lorsque l'on établit une recommandation pour la qualité de l’eau potable, il faut tenir compte de la capacité de mesurer le contaminant. Il existe plusieurs méthodes d’analyse de la teneur totale en plomb dans l’eau potable. Selon la capacité des laboratoires commerciaux au Canada, on dispose de méthodes d’analyse permettant de mesurer de manière fiable la teneur totale en plomb dans l’eau potable à la CMA proposée. Ces méthodes nécessitent une préparation des échantillons qui assure la détection du plomb dissous et du plomb particulaire.
Le processus d’élaboration de la recommandation tient également compte de la capacité d’enlever le contaminant de l’approvisionnement d’eau potable en vue de respecter la CMA proposée. Même s’il existe des techniques de traitement capables d’éliminer efficacement le plomb à l’usine de traitement, le traitement municipal ne constitue pas généralement une stratégie efficace. En effet, les matériaux utilisés dans les réseaux de distribution et les systèmes de plomberie, comme les entrées de service, les soudures et les raccords, peuvent contenir du plomb qui peut être libéré dans l’eau et se retrouver dans l'eau du robinet en raison de la corrosion. La meilleure approche à adopter pour minimiser l’exposition au plomb provenant de l’eau potable à l’échelle municipale consiste donc à enlever complètement la conduite de branchement et de contrôler la corrosion dans les systèmes de distribution et de traitement.
Comme la principale source de plomb dans l’eau potable est le relargage de celui-ci à partir des éléments des réseaux de distribution et des installations de plomberie, les dispositifs de traitement de l’eau potable s’avèrent une option efficace à l’échelle résidentielle, même si leur utilisation ne devrait pas être considérée comme une solution permanente. De nombreux dispositifs de traitement à usage résidentiel certifiés capables d’enlever le plomb de l’eau potable sont disponibles.
3.0 Application de la recommandation
Remarque : Des conseils spécifiques concernant l’application des recommandations pour l’eau potable devraient être obtenues auprès de l’autorité appropriée en matière d’eau potable dans le secteur de compétence concerné.
La CMA proposée pour le plomb est établie en fonction des limites analytiques et de la faisabilité. Comme la science ne peut déterminer un niveau sous lequel le plomb n’est plus associé à des effets indésirables sur la santé, les concentrations de plomb dans l’eau potable doivent être maintenues au niveau le plus faible qu’il soit raisonnablement possible d’atteindre (ALARA). Étant donné que les concentrations de plomb au robinet du consommateur peuvent être considérablement plus élevées qu'à l’usine de traitement ou que dans le réseau de distribution, les stratégies visant à réduire l’exposition au plomb devront être axées sur le contrôle de la corrosion dans les réseaux de distribution et les systèmes de plomberie et sur l’enlèvement des éléments renfermant du plomb de ces systèmes, comme les entrées de service en plomb. La surveillance du plomb doit se faire surtout dans les endroits qui disposent ou sont susceptibles de disposer d’entrées de service en plomb ou dans lesquels se trouvent de vieux immeubles, et devrait comprendre les zones alimentées par de l’eau potentiellement corrosive (p. ex. cul-de-sac dans les réseaux chloraminés) et des systèmes consécutifs. Un dépassement de la CMA proposée devrait faire l’objet d’une enquête et de l’adoption de mesures correctives appropriées. Ces mesures englobent notamment le rééchantillonnage, l’éducation du public, l’enlèvement de conduites de branchement en plomb et des mesures de contrôle de la corrosion. Toutefois, ces actions doivent être fondées sur une évaluation de la cause du dépassement au moyen de protocoles adéquats, comme ceux qui figurent dans le Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d’eau potable.
3.1 Surveillance
Les protocoles d’échantillonnage varieront selon l’objectif souhaité (c.-à-d. détection des sources de plomb, contrôle de la corrosion, évaluation de la conformité, estimation de l’exposition au plomb, etc.). Comme la surveillance du plomb au robinet peut se faire au moyen de différents protocoles d’échantillonnage, il est important que le protocole choisi soit le bon pour atteindre l’objectif visé.
L’objectif des protocoles d’échantillonnage dans ce document est la surveillance de l’exposition typique au plomb total dans une collectivité, afin de déterminer si cette exposition pourrait entrainer des inquiétudes par rapport aux effets sur la santé humaine. La surveillance de la conformité devrait être effectuée au robinet du consommateur en accordant la priorité auxà l’identification des résidences ayant une entrée de service en plomb, puisqu’elles sont susceptibles de présenter les concentrations de plomb les plus élevées.
Si l’objectif est de déterminer si l’eau distribuée est corrosive aux matériaux présents dans le réseau de distribution et dans la plomberie, il faudrait consulter le Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d’eau potable. La surveillance des écoles et des garderies doit également être prioritaire afin de capturer l'exposition de la population la plus sensible (c.-à-d. les jeunes enfants). Toutefois, un protocole d’échantillonnage différent devrait peut-être être envisagé pour les écoles, les garderies et les grands immeubles ou grandes habitations. Il est difficile d’évaluer l’exposition dans ces bâtiments en raison des configurations de plomberie particulières et complexes et du grand nombre de tuyaux et d’éléments de plomberie. L’échantillonnage doit être effectué au moins une fois par année, le nombre de sites à surveiller étant déterminé en fonction de la taille du réseau d’eau potable et du type d’immeuble, comme nous le verrons ci-après.
3.1.1 Surveillance dans les habitations résidentielles
Deux protocoles d’échantillonnage, soit l’échantillonnage aléatoire (RDT) et l’échantillonnage après une période de stagnation de 30 minutes (30MS), sont capables de capturer l’exposition typique au plomb, y compris l’exposition possible au plomb particulaire, et peuvent donc être utilisés pour les sites résidentiels. Ces protocoles sont appropriés pour identifier les endroits prioritaires pour agir afin de réduire les concentrations de plomb et d’évaluer la conformité. Bien que ces deux protocoles soient aussi aptes à évaluer l’efficacité des stratégies de contrôle de la corrosion, l’échantillonnage aléatoire peut être utilisé à la grandeur du système alors que l’échantillonnage 30MS est normalement utilisé aux sites sentinelles. En comparaison avec l’échantillonnage 30MS, de 2 à 5 fois plus d’échantillons doivent être prélevés par l’échantillonnage aléatoire pour avoir des résultats robustes. Alors que l’échantillonnage aléatoire est relativement peu coûteux, plus pratique à mettre en application et généralement mieux accepté par les résidents que l’échantillonnage 30MS, ce dernier offre l’avantage de pouvoir être utilisé pour déterminer la cause des niveaux élevés de plomb et pour identifier des mesures correctives appropriées.
L’échantillonnage devrait être effectué tout au long de l’année pour pouvoir tenir compte de la variabilité du plomb en fonction des effets saisonniers. L’échantillonnage devrait être effectué au robinet d’eau froide de la cuisine ou d’un autre endroit approprié où l’eau est recueillie pour la consommation ou la préparation d’aliments. Quel que soit le protocole utilisé, tous les échantillons devraient être prélevés dans des flacons à échantillons à grande ouverture sans retirer l’aérateur. Les échantillons doivent être acidifiés avec une solution d’acide nitrique à 2 %, et un délai d’attente d’au moins 16 heures est ensuite requis avant de procéder à l’analyse. Chaque échantillon doit être bien mélangé avant l’analyse à l’aide d’une méthode appropriée (voir la section 6.0).
Pour l’échantillonnage aléatoire, la création d’un inventaire des entrées de service en plomb aidera à identifier les zones d’approvisionnement en eau (des secteurs géographiques dans lesquels la qualité de l’eau potable est considérée être à peu près uniforme) dans lesquelles les concentrations de plomb sont probablement élevées. Les programmes d’échantillonnages sont effectués à l’intérieur de ces zones d’approvisionnement en eau qui sont de tailles variées mais dont aucune ne devraient dépasser 50 000 habitants. On recommande de mesurer le plomb total dans chaque zone d’approvisionnement en eau au moins une fois par année au robinet de 20 résidences (ou plus) choisies au hasard.
Échantillonnage aléatoire : Recueillir un échantillon de 1 L à n’importe quel moment de la journée d’un robinet d’eau potable de chacune des résidences. Les échantillons doivent être prélevés sans purge préalable ni période de stagnation, afin de mieux correspondre à l’utilisation typique du consommateur.
Échantillonnage 30MS : Purger le robinet pendant 5 minutes, puis attendre pendant une période de stagnation de 30 minutes pendant laquelle il ne faut laisser couler l’eau d’aucun robinet et ne tirer aucune chasse d’eau. Recueillir ensuite deux échantillons de 1 L à une vitesse de débit moyenne ou élevée (plus de 5 L à la minute). La concentration de plomb est déterminée par la moyenne des résultats obtenus des deux échantillons.
3.1.2 Surveillance des écoles, des résidences à logements multiples et des grands immeubles
Dans les écoles et les garderies, il est recommandé de surveiller la teneur en plomb total au moins une fois par année, à chaque fontaine d’eau potable ou à chaque robinet d’eau froide où l’eau est utilisée pour la consommation ou la préparation d’aliments. L’échantillonnage devrait être fait entre les mois de juin et d’octobre, lorsque les immeubles sont pleinement occupés et fonctionnels; afin de mesurer les niveaux d’exposition typique, il est recommandé de le faire soit en juin, soit en octobre dans les écoles. La fréquence d’échantillonnage pourrait être diminuée si les sources de plomb ont été identifiées et résolues.
Dans des immeubles à logements multiples (c.-à-d. .plus de six résidences) ou les grands édifices, il est recommandé de surveiller la teneur en plomb total au moins une fois par année, à chaque fontaine d’eau potable ou à chaque robinet d’eau froide où l’eau est utilisée pour la consommation ou la préparation d’aliments. Dans le cas de l’échantillonnage des immeubles à logements multiples, la priorité doit être accordée aux sites dont la présence de plomb dans les entrées de service, en partie ou en totalité, est connue ou soupçonnée. Le protocole d’échantillonnage qui suit est recommandé pour ces sites de façon à recenser les expositions typiques, notamment l’exposition possible au plomb particulaire.
Il convient de procéder à un échantillonnage aléatoire en prélevant un échantillon aux fontaines d’eau potable ou aux robinets d’eau froide où l’eau est utilisée pour la consommation ou la préparation des aliments, sans purge préalable ni période de stagnation. On prélève deux échantillons de 125 mL, de préférence dans des flacons à échantillons à grande ouverture, à un débit moyen à élevé, sans retirer l’aérateur. Un délai d’attente d’au moins 16 heures après acidification par une solution d’acide nitrique à 2 % est requis avant de pouvoir procéder à l’analyse. Chaque échantillon doit être bien mélangé avant l’analyse à l’aide d’une méthode appropriée (voir la section 6.0). La concentration de plomb est déterminée par la moyenne des résultats obtenus des deux échantillons.
Le plan d’échantillonnage destiné aux écoles et aux garderies doit tenir compte du fait qu’un grand nombre d’occupants de ces immeubles sont les plus vulnérables aux effets indésirables de l’exposition au plomb sur la santé. Par conséquent, les plans d’échantillonnage de ces installations doivent accorder la priorité aux fontaines d’eau potable et aux robinets d’eau froide utilisés pour la consommation ou la préparation des aliments plutôt qu’aux sorties d’eau moins souvent utilisées. Dans d’autres types d’immeubles, les plans d’échantillonnage devraient également cibler les fontaines et les sorties d’eau froide utilisées pour la consommation ou la préparation des aliments, mais le nombre de sites échantillonnés devrait être fondé sur la taille de l’immeuble et le nombre de personnes qui l’occupent.
Partie II. Science et considérations techniques
4.0 Propriétés, utilisations et sources dans l’environnement
Le plomb (Pb) est un métal gris bleuté, lustré, dense et inodore, qui est malléable, insoluble et résistant à la corrosion chimique. Le plomb (numéro de registre du Chemical Abstracts Service : 7439-92-1) a un poids moléculaire de 207,2 g/mol, un point de fusion de 327,4 °C, un point d’ébullition de 1 740 °C et une densité de 11,34 g/cm3 à la température ambiante. Il n'existe pas de données relatives aux coefficients de partage ou aux constantes de la loi de Henry pour le plomb. Le plomb est un métal de post-transition du groupe IVA (14) du tableau périodique. Il compte trois états d’oxydation : Pb0 (plomb élémentaire), Pb2+ (composés plombeux) et Pb4+ (composés plombiques). La forme plombeuse (Pb2+) et, dans une moindre mesure, la forme plombique (Pb4+) sont celles qui prédominent dans l’environnement. Si le plomb élémentaire est insoluble dans l’eau, les sels de la forme plombeuse peuvent être fortement hydrosolubles (p. ex. nitrate de plomb [II]) (ATSDR, 2007). Le plomb est très réactif et s’allie facilement à d’autres métaux comme l’étain, l’antimoine, le cuivre et le zinc pour former des produits plus stables. L’évaluation des concentrations de plomb dans l’environnement n’est pas généralement centrée sur la forme du métal, mais plutôt sur la fraction de plomb que contient une substance donnée.
Le Canada est un important producteur et fournisseur de plomb. En 2009, il se classait au sixième rang mondial quant à la production (estimée à 101 484 tonnes) (Panagapko, 2009). En raison de son point de fusion bas et de son excellente résistance à la corrosion, le plomb a été utilisé abondamment dans diverses applications. L’exposition du plomb à l’air et à l’eau entraîne la formation d’une pellicule protectrice composée de sulfate de plomb, d’oxydes de plomb et de carbonates de plomb, ce qui en fait un matériau de construction idéal pour le gainage de câbles, les cartes de circuit imprimé, le revêtement de récipients d’entreposage de produits chimiques, les tuyaux de transport de produits chimiques, les composants électriques et la protection contre le rayonnement.
Les composés de plomb solubles et insolubles peuvent être utilisés, entre autres, comme produits ignifuges (chlorure de plomb), stabilisants thermiques du nylon (nitrate de plomb), pigments dans la peinture, le plastique et le caoutchouc (chromate de plomb) et catalyseurs pour diverses réactions chimiques (carbonate de plomb, fluorure de plomb et fluoborate de plomb). Ils entrent également dans la fabrication de vernis et de pigments de chrome (acétate de plomb trihydraté), de dispositifs d’embrayage ou de garnitures de frein en amiante (chlorure de plomb), d’allumettes et d’explosifs (nitrate de plomb), de munitions (azoture de plomb et styphnate de plomb) et de piles galvaniques (sulfate de plomb),ainsi que de nombreux autres procédés de fabrication (Santé Canada, 2013c).
Des entrées de service en plomb ont été installées dans les réseaux d’eau potable de nombreux pays, dont le Canada. Au Canada, le plomb a été largement utilisé dans les conduites jusqu’en 1975. De plus, l’utilisation de soudures à base de plomb dans la nouvelle plomberie et la réparation des conduites d’eau potable s’est poursuivie jusqu’en 1986. En conséquence, les matériaux utilisés dans les réseaux de distribution et le systèmes de plomberie peuvent constituer une importante source de plomb dans l’eau du robinet des maisons construites avant 1990 (Santé Canada, 2009b). En plus d’être présent dans les raccords en laiton et en bronze comme les robinets et les valves, le plomb peut se retrouver dans des appareils comme les refroidisseurs d’eau et les fontaines à jet vertical couramment utilisés dans les écoles et les autres immeubles non résidentiels. Certains composants des refroidisseurs d’eau, tels que les joints soudés se trouvant dans les appareils ou le revêtement du réservoir, peuvent contenir des alliages à base de plomb (U.S. EPA, 2006b). Jusqu'à récemment, la plupart des laitons renfermaient de 2 à 8 % de plomb (Santé Canada, 2009b). Aux États-Unis, une loi limitant la teneur moyenne pondérée en plomb des tuyaux, des raccords de tuyaux et des raccords de plomberie à 0,25 % est entrée en vigueur en janvier 2014 (U.S. EPA, 2011b). Le Code national de la plomberie – Canada (CNP) a été modifié en novembre 2013 pour harmoniser les normes de plomberie aux exigences de la limite de 0,25 % (CNRC, 2013).
Jusqu’aux années 1960, d’importantes quantités de plomb (chromate de plomb [II]) étaient ajoutées, dans une proportion de 10 à 50 %, dans les peintures pour usages domestique et industriel comme pigment et agent de séchage. Même si la teneur en plomb dans la peinture intérieure et les peintures appliquées sur les meubles ou les produits destinés aux enfants a par la suite été abaissée à 90 mg/kg (0,009 %) en 2010 (Gouvernement du Canada, 2010a; Santé Canada, 2010a, 2010b), les vieilles maisons et les vieux immeubles demeurent une source d’exposition au plomb.
Des composés de plomb organique (p. ex. le plomb tétraéthyle et le plomb tétraméthyle) étaient également ajoutés au carburant de véhicules automobiles jusqu’à ce que leur usage soit interdit au Canada en 1993, sauf pour les carburants utilisés dans les avions à moteurs à piston et dans les véhicules de compétition. Les réductions de la teneur en plomb dans les carburants à l’échelle mondiale ont commencé au début des années 1970 et ont été suivies dans les années 1990 d’une élimination complète des carburants avec plomb pour usage dans les véhicules routiers dans de nombreux pays (OCDE/PNUE, 1999). On trouve également du plomb dans certains produits utilisés lors d’activités récréatives, notamment dans les poids pour la pêche et la plongée, dans les balles de plomb pour la chasse, dans les peintures et glaçures utilisées en poterie, de même que dans les fournitures de soufflage du verre et de sérigraphie. Par contre, l’utilisation du plomb est interdite dans les aliments et les cosmétiques au Canada (Santé Canada, 2012a).
Depuis l'interdiction de carburants au plomb, la principale source de plomb dans l’environnement est l’extraction et la fusion du minerai de plomb et d’autres minerais dans lesquels le plomb est un sous-produit ou un contaminant (ATSDR, 2007). Des rejets de plomb proviennent également des usines qui utilisent du plomb, des alliages de plomb ou d’autres composés de plomb. Les voyages par avion, à cause de l’utilisation de carburants au plomb dans les petits avions, et les services d’électricité qui rejettent le plomb issu de la combustion du charbon et d’autres carburants contaminés par le plomb constituent d’autres sources importantes. Les rejets de plomb dans l’environnement font l’objet d’une surveillance par l’Inventaire national des rejets de polluants (INRP) d’Environnement Canada. On estime qu'environ 436 000 kg de plomb ont été rejetés dans l’environnement en 2009, soit 260 000 kg dans l’atmosphère, 16 000 kg dans l’eau et 160 000 kg dans le sol (Santé Canada, 2013a). On suppose toutefois que ces chiffres sont une sous-estimation du nombre de rejets totaux, car bon nombre d’établissements ne sont pas tenus de déclarer leurs rejets à l’INRP, de même que d’autres sources de plomb. Malgré les mesures de réduction de la teneur en plomb, les expositions au plomb demeurent une préoccupation en raison de la présence dans l’environnement de vieux matériaux contenant du plomb et de l’utilisation courante du plomb.
4.1 Devenir dans l’environnement
Le plomb rejeté dans l’atmosphère existe surtout sous la forme de particules. Les petites particules de plomb peuvent se déplacer sur des distances considérables, tandis que les grosses particules (c.-à-dire > 2,5 μm) ont tendance à quitter rapidement l’atmosphère et à se déposer relativement près de la source d’émission. Le plomb est éliminé de l’atmosphère principalement par la pluie, mais il peut également se précipiter par dépôt sec. Divers composés de plomb sont rejetés dans l’atmosphère en raison des nombreuses sources d’émission. Les principales formes sont le sulfate de plomb (II) et le carbonate de plomb (II) (ATSDR, 2007).
Le plomb provenant des écailles de peinture et de la dégradation des revêtements de maisons, d’immeubles et autres structures peut également se déposer dans le sol. L’association entre le plomb et les particules de sol est très forte. C’est pourquoi les usages antérieurs du plomb, notamment son ajout dans l’essence, contribuent grandement aux concentrations de plomb mesurées dans les sols aujourd’hui (ATSDR, 2007). La mobilité du plomb dans le sol est généralement limitée; par conséquent, le plomb déposé aura tendance à demeurer dans la couche supérieure du sol, ce qui restreint son lessivage dans les eaux souterraines. Toutefois, le devenir du plomb dépendra de plusieurs facteurs, entre autres, du pH du sol, du type de sol, de la teneur du sol en matières organiques et de la concentration de plomb dans le sol (NSF, 1977; Reddy et coll., 1995). L’acidité augmente sensiblement la solubilité du plomb et est considérée comme le facteur le plus important qui permet de déterminer la mobilisation du plomb. La solubilisation peut se produire à des pH inférieurs à 6 et augmenter considérablement dans des conditions plus acides (U.S. EPA, 1986). Outre les conditions acides, une diminution des matières organiques sur lesquelles le plomb peut être adsorbé et la présence de plomb à des concentrations qui approchent ou dépassent la capacité d’échange cationique du sol augmenteront aussi la mobilité du plomb, ce qui peut entraîner un ruissellement dans les eaux de surface, un lessivage dans les eaux souterraines ou une absorption par les plantes. De telles conditions environnementales sont plus susceptibles de se manifester à proximité des installations de fusion du plomb.
Le plomb peut être présent dans les eaux de surface, mais à de faibles concentrations en général. Les concentrations de plomb soluble augmentent habituellement dans des conditions acides (c.-à-d. à un faible pH). La teneur en sels dissous est un autre facteur important pour déterminer la solubilité du plomb et, ce faisant, la concentration de plomb dans les eaux de surface. Au-delà d’un pH de 5,4, la solubilité du plomb est d’environ 500 μg/L dans l’eau douce, tandis qu’elle n’est que de 30 μg/L dans l’eau dure (ATSDR, 2007). Toutefois, une partie considérable du plomb présent dans les eaux de surface consiste en des particules insolubles de composés de plomb ou de particules de terre contenant du plomb résultant de l’érosion. Les concentrations de plomb dans les eaux de ruissellement des montagnes se sont avérées similaires à celles de la dégradation du substrat rocheux et du sol par les intempéries. On sait que les particules de plomb coprécipitent et s’adsorbent sur la surface des particules riches en fer comme les oxydes de fer. Le ratio fer/plomb qui en résulte s’est avéré relativement constant dans le substrat rocheux, le sol, les lixiviats du sol et des roches, les eaux souterraines non filtrées et filtrées, ainsi que dans les eaux de ruisseaux filtrées et non filtrées (Erel et coll., 1991; Erel et Morgan, 1992).
Les composés de plomb peuvent se dégrader et se transformer chimiquement dans l’air, le sol et l’eau. Toutefois, le plomb élémentaire présent dans ces composés ne se décompose pas.
Le plomb ne se bioamplifie pas dans les chaînes alimentaires aquatiques ou terrestres. Une bioconcentration peut toutefois se produire chez les plantes et les animaux, surtout dans les zones contaminées par le plomb. Les organismes plus âgés ont tendance à avoir une charge corporelle en plomb plus élevée. Les organismes qui sont en contact avec le sol et les sédiments, comme les invertébrés aquatiques benthiques et les algues, contiennent généralement les concentrations de plomb les plus élevées.
4.2 Sources de plomb dans l’eau potable
La présence de plomb dans l’eau du robinet est principalement attribuable à la dissolution (corrosion) des éléments de réseaux de distribution et de systèmes de plomberie domestique qui renferment du plomb comme les tuyaux, les raccords, les soudures ou les branchements de service aux domiciles. La corrosion peut être causée par plusieurs facteurs, notamment le type de matériau utilisé, l’âge des tuyaux et des raccords, le temps de séjour de l’eau dans les tuyaux et la qualité de l’eau (p. ex. pH et alcalinité) dans le système (Santé Canada, 2009b).
Il a été démontré que les entrées de service en plomb demeurent une source élevée de plomb, et ce, bien des années après leur installation dans diverses conditions (Britton et Richards, 1981; Schock et coll., 1996; Sandvig et coll., 2008; Cartier et coll., 2011, 2012a; Xie et Giammar, 2011). Elles peuvent représenter de 50 à 75 % de la teneur totale en plomb au robinet après une période de stagnation prolongée (Sandvig et coll., 2008). On croyait que les concentrations de plomb au robinet provenant des soudures au plomb et des raccords en laiton diminuaient au fil du temps, avec les concentrations les plus élevées au cours de la première année suivant l’installation (Birden et coll., 1985; Boffardi, 1988, 1990; Schock et Neff, 1988; Boyd et coll., 2008a). Des études plus récentes, menées dans des conditions d’écoulement continu, ont révélé que lorsque le plomb est libéré des soudures et des raccords sous la forme dissoute, les concentrations diminuent avec le temps (Kirmeyer et coll., 2007; Zhang et Edwards, 2011; Boyd et coll., 2012). De nombreuses études ont cerné plusieurs facteurs susceptibles d’entraîner la libération du plomb en concentrations élevées dans l’eau longtemps après l’installation d’entrées de service, de soudures et de raccords en laiton renfermant du plomb, notamment les caractéristiques de la qualité de l’eau (p. ex. température, pH, alcalinité, teneur en chlorure), la durée de stagnation, le débit, la teneur en plomb et la surface des raccords en plomb et en laiton (Lee et coll., 1989; Maas et coll., 1991; Dodrill et Edwards, 1995; Lytle et Schock, 1996, 2000; Oliphant et Schock, 1996; Schock et coll., 1996; Reiber et coll., 1997; Kimbrough, 2001, 2007, 2009; Sandvig et coll., 2007, 2008; Elfland et coll., 2010; Schock et Lytle, 2011; Deshommes et coll., 2012b; Clark et coll., 2014).
La libération du plomb peut être considérable lorsque des matières particulaires sont présentes dans l’eau ou qu’elles sont ultérieurement piégées dans l’aérateur de robinetterie. Les sources de ces particules comprennent les particules de soudure au plomb, les dépôts de solides dans les tuyaux, la dézincification des laitons et l’adsorption sur des particules de fer ou de manganèse provenant du réseau de distribution (Hulsmann, 1990; Lytle et coll., 1993; Triantafyllidou et coll., 2007;Deshommes et coll., 2010a; Zhang et Edwards, 2011; Cartier et coll., 2012c; Schock et coll., 2014).
La contribution relative du plomb sous les formes dissoute et particulaire n’est pas clairement comprise et varie probablement selon la chimie de l’eau, la configuration de la plomberie, la durée de stagnation, le régime d’écoulement, l’âge des matériaux de plomberie contenant le plomb et les habitudes d’utilisation (Hulsmann, 1990; Deshommes et coll., 2010a, 2012b; Schock et Lytle, 2011; Xie et Giammar, 2011; Cartier et coll., 2012a, 2013; Wang et coll., 2012; Welter et coll., 2013; Clark et coll., 2014). La présence de plomb particulaire dans l’eau potable est sporadique, imprévisible et souvent associée à des perturbations mécaniques du réseau; on a récemment découvert qu’elle était aussi causée par la corrosion galvanique (Sandvig et coll., 2008; Deshommes et coll., 2010, 2012b; Triantafyllidou et Edwards, 2010; Schock et Lytle, 2011; Cartier et coll., 2012a, 2013; Wang et coll., 2012, 2013; Clark et coll., 2014).
Il a été démontré que la corrosion galvanique des soudures résultant d’un changement de désinfectant ou de coagulant est un facteur important qui entraîne des concentrations élevées de plomb (Edwards et Dudi, 2004; Edwards et Triantafyllidou, 2007; Nguyen et coll., 2010). Dans plusieurs études, on a observé que des modifications du ratio chlorure/sulfate résultant d’un changement de coagulant induisaient la libération de plomb issue du laiton en raison de la corrosion galvanique (Edwards et Triantafyllidou, 2007; Nguyen et coll., 2010; Triantafyllidou et Edwards, 2010; Cartier et coll., 2012c, 2013). On sait également que la corrosion galvanique causée par le remplacement partiel d’une entrée de service en plomb augmente les concentrations de plomb dissous et particulaire (Sandvig et coll., 2008; Deshommes et coll., 2010a, 2012b; Triantafyllidou et Edwards, 2010; Schock et Lytle, 2011; Cartier et coll., 2012a, 2013; Wang et coll., 2012, 2013; Clark et coll., 2014).
De temps à autre, on trouve aussi du plomb dans l’eau potable en raison de l’altération climatique de certaines formations rocheuses dans les eaux souterraines (Services de santé et services sociaux de Hamilton, 2006). En 2006, un avis de santé publique a été communiqué à tous les résidants des parties rurales de la ville de Hamilton situées au-dessus de l’escarpement du Niagara dont l’alimentation en eau potable provenait d’un puits foré. Les résidants avaient été informés d’un risque de concentrations de plomb élevées dans certains puits à cause de la présence de plomb à l’état naturel dans le substrat rocheux (Richardson, 2006).
5.0 Exposition
Le plomb est omniprésent dans l’environnement en raison de son utilisation anthropique généralisée sur une très longue période et de sa présence naturelle. Les Canadiens sont exposés à de petites quantités de plomb présentes dans divers milieux environnementaux, notamment l’eau, les aliments, l’air et le sol, de même que les produits de consommation. On a toujours supposé que l’eau comptait pour 14 à 20 % des expositions au plomb (U.S. EPA, 1991, 2005). Toutefois, les réductions importantes de la teneur en plomb dans des produits comme l’essence et la peinture font en sorte que les aliments et l’eau potable constituent maintenant les principales sources d’exposition au plomb chez les populations adultes moyennes. L’inhalation peut également être une voie d’exposition importante pour les personnes qui vivent à proximité de sources ponctuelles.
5.1 Eau
L’exposition au plomb dans l’eau potable ne peut être évaluée correctement que si on surveille les concentrations de plomb au robinet. En effet, la présence de plomb dans l’eau du robinet est surtout attribuable à la dissolution (corrosion) des composants de réseaux de distribution et de systèmes de plomberie domestique qui renferment du plomb. Toutefois, la concentration de plomb peut varier considérablement d’un réseau à l’autre et au sein d’un même établissement (Karalekas et coll., 1978; Bailey et Russell, 1981; AwwaRF, 1990; Schock, 1990; U.S. EPA, 1991; Schock et Lemieux, 2010), ce qui rend l’évaluation de l’exposition difficile. La surveillance du plomb au robinet peut se faire au moyen de divers protocoles d’échantillonnage; le choix d’un protocole approprié doit tenir compte de l’objectif souhaité, par exemple, repérer les sources de plomb, contrôler efficacement la corrosion ou estimer l’exposition au plomb.
5.1.1 Exposition des Canadiens au plomb provenant de l’eau potable
Dans le cadre de l’Enquête nationale sur les sous-produits de désinfection et certains contaminants émergents dans l’eau potable au Canada (2009-2010), on a analysé la teneur en plomb d’échantillons prélevés à 65 endroits représentant toutes les provinces et tous les territoires, au cours de l’été et de l’hiver 2009-2010, (Santé Canada, 2014). Les résultats ne sont toutefois pas statistiquement représentatifs de l’exposition de la population canadienne. Des échantillons ont été prélevés du réseau de distribution après avoir fait couler l’eau pendant 10 minutes, dans le cas de l’eau traitée et de l’eau du réseau de distribution, et analysés après une digestion thermique en milieu acide par spectrométrie de masse avec plasma à couplage inductif (ICP-MS), à une limite de détection de la méthode (LDM) de 0,5 µg/L. La concentration moyenne en hiver était de 0,9 μg/L, les valeurs mesurées allant de < 0,5 à 8,2 μg/L. La concentration moyenne pour les échantillons prélevés en été était de 1,27 μg/L, les valeurs mesurées allant de < 0,5 à 24 μg/L.
Il est possible de consulter les bases de données provinciales, territoriales et municipales qui contiennent les concentrations de plomb dans les sources d’eau potable. Ces bases de données sur la conformité contiennent les résultats d’analyse de la qualité de l’eau, notamment la teneur en plomb. Il faut reconnaître que plusieurs provinces et territoires évaluent la conformité du plomb en fonction d’un échantillon prélevé après une purge.
La base de données du Programme de surveillance de l’eau potable de l’Ontario comprend les concentrations de plomb dans l’eau brute et l’eau traitée, de même que les concentrations de plomb au robinet (OMOE, 2014). De 2000 à 2007, les concentrations médianes annuelles de plomb mesurées dans 5 947 échantillons d’eau traitée et d’eau distribuée variaient de < 0,01 à 0,32 μg/L (OMOE, 2014). Les concentrations de plomb se situaient entre des valeurs inférieures à 0,01 μg/L et 359 μg/L. Toutefois, lorsque le seul site d’échantillonnage affichant une concentration de plomb de 359 μg/L a été rééchantillonné trois fois, les concentrations de plomb se sont toutes avérées inférieures à 1,68 μg/L. En juin 2007, l’Ontario a modifié ses exigences réglementaires relatives à l’échantillonnage du plomb et exige maintenant que les échantillons soient prélevés après une période de stagnation de 30 minutes dans les résidences dotées d’une entrée de service en plomb ou soupçonnées de l’être (Gouvernement de l’Ontario, 2014). Dans le cadre d’un programme communautaire d’analyse du plomb réalisé en 2007-2008, des concentrations de plomb ont été évaluées dans plus de 37 000 échantillons prélevés lors de deux campagnes d’échantillonnage. Au cours de ces campagnes, il a été déterminé que ≤ 3,1 % des échantillons dépassaient le niveau réglementaire de 10 µg/L. Huit communautés ont ensuite été désignées pour une autre ronde d’échantillonnage en 2009. Sur 3 159 échantillons prélevés, les concentrations de plomb pouvaient varier de < 0,02 à 1 320 μg/L (OMOE, 2014).
À l’Île-du-Prince-Édouard, plus de 10 000 échantillons ont été prélevés de puits privés entre 2005 et 2010. Les échantillons recueillis durant cette période affichaient des concentrations de plomb allant de < 2 à 335 μg/L, et 88 % de tous les échantillons renfermaient du plomb à des concentrations inférieures à la LDM de 2 μg/L (Prince Edward Island Department of Environment, Energy and Forestry, 2011).
À Edmonton, en Alberta, la concentration médiane de plomb signalée était inférieure à 0,5 μg/L (Alberta Department of Environment and Sustainable Resource Development, 2011). À Portage la Prairie, au Manitoba, 159 échantillons ont été prélevés entre 2008 et 2009,et les concentrations de plomb se situaient entre 0,1 et 36 µg/L, la concentration moyenne étant de 0,7 µg/L (Conservation et Gestion des ressources hydriques du Manitoba, 2013). En Saskatchewan, la concentration médiane de plomb pour 176 échantillons analysés était de 6,7 μg/L, les valeurs mesurées variant de < 0,1 à 60 μg/L (Saskatchewan Ministry of Environment, 2011). Selon les données du Québec de 2005 à 2010, la concentration médiane annuelle de plomb évaluée dans plus de 13 000 échantillons se situait entre 2 et 5 μg/L (les concentrations de plomb dans l’eau du robinet variaient de 0,06 à 530 μg/L) (Ministère du Développement durable, de l’Environnement et des Parcs du Québec, 2011). À Terre-Neuve-et-Labrador, 5 331 échantillons d’eau du robinet prélevés entre 2005 et 2010 ont révélé des concentrations de plomb allant de < 0,1 à 60 μg/L (Newfoundland and Labrador Department of Environment and Conservation, 2011). Au Yukon, des concentrations de plomb se situant entre < 0,1 et 7,6 μg/L ont été détectées dans 125 échantillons d’eau du robinet prélevés entre 2005 et 2010 (Yukon Environmental Health Services, 2011).
Un certain nombre d’études sur la corrosion ont été réalisées depuis 2007. Ces études ont fait appel à divers protocoles d’échantillonnage qui ont produit des résultats très variables en ce qui concerne le plomb dans l’eau potable (Hayes et Croft, 2012; Santé Canada, 2013c; Hayes et coll., 2014).
En Alberta, une étude d’optimisation sur la corrosion a permis d’analyser des concentrations de plomb dans 12 échantillons séquentiels de 1 L prélevés dans 12 maisons dotées d’une entrée de service d’eau en plomb à Edmonton et à Calgary (six maisons dans chaque ville)après 30 minutes et 6 heures de stagnation. Les concentrations de plomb maximales pour Edmonton variaient de 1,3 à 31,8 µg/L et de 3,0 à 62,7 µg/ après 30 minutes et 6 heures de stagnation, respectivement. Les concentrations de plomb maximales pour Calgary variaient de 5,7 à 39,6 µg/L et de 9,1 à 96,5 µg/L après 30 minutes et 6 heures de stagnation, respectivement (Hayes et coll., 2014).
Au Manitoba, une étude a permis d’évaluer les niveaux de plomb dans les cas les plus défavorables dans l’eau des maisons et des écoles situées dans les villes de Brandon et de Portage la Prairie. Des échantillons provenant des maisons ayant une entrée de service en plomb ont été prélevés après 6 heures de stagnation à raison de quatre échantillons consécutifs de 1 L et ensuite, après 5 minutes d’écoulement de l’eau. Pour la ville de Brandon, les concentrations moyennes de plomb étaient de 39,2 µg/L (avec une variation de non décelé à 280 µg/L, n=80) pour les quatre échantillons de 1 L prélevés après stagnation et de 22,76 µg/L (avec une variation de non décelé à 79 µg/L, n=20) pour les échantillons prélevés après la purge. Pour la ville de Portage la Prairie, les concentrations moyennes de plomb étaient de19,3 µg/L (avec une variation de 0,61 à 140 µg/L, n=72) pour les quatre échantillons de 1 L prélevés après stagnation et de 3,62 µg/L (avec une variation de 0,55 à 21 µg/L, n=14) pour les échantillons prélevés après la purge (Conservation et Gestion des ressources hydriques du Manitoba, 2013). Cette étude comprenait également des échantillons prélevés au premier jet d’eau, après 30 secondes d’écoulement et après 5 minutes d’écoulement dans les écoles de Brandon et de Portage la Prairie (cinq écoles dans chaque ville). En ce qui concerne les écoles de Brandon, les concentrations moyennes de plomb étaient de 11 µg/L (variation : 2,7 à 27 µg/L), de 3,4 µg/L (variation : 0,54 à 13 µg/L) et de 1,33 µg/L (variation; 0,59 à 2 µg/L) pour les échantillons prélevés au premier jet, après 30 secondes d’écoulement et après 5 minutes d’écoulement, respectivement. Dans le cas des écoles de Portage la Prairie, les concentrations moyennes de plomb étaient de 9,14 µg/L (variation : 0,5 à 36 µg/L), de 0,93 µg/L (variation : 0,5 à 2,2 µg/L) et de 0,55 µg/L (variation : 0,5 à 0,75 µg/L) pour les échantillons prélevés au premier jet, après 30 secondes d’écoulement et après 5 minutes d’écoulement, respectivement. Dans 9 écoles sur 10, les concentrations totales de plomb avaient diminué après 30 secondes d’écoulement de l’eau et dans toutes les écoles, elles avaient considérablement diminué après 5 minutes d’écoulement (Conservation et Gestion des ressources hydriques du Manitoba, 2013).
Sept écoles élémentaires et une école secondaire canadiennes construites avant 1970 ont fait l’objet d’un échantillonnage en vue d’évaluer l’exposition humaine au plomb et d’élaborer un protocole d’échantillonnage destiné aux grands immeubles (Doré et coll., 2014). Des échantillons ont été prélevés aux fontaines et aux robinets dans les classes (6 à 10 sites par immeuble) après 30 secondes et 5 minutes d’écoulement et après 30 minutes et 8 heures de stagnation. Il est ressorti de cette étude que 72,7 % des 356 échantillons présentaient des concentrations de plomb inférieures à 5 µg/L et que celles-ci variaient de < 0,15 à 851 µg/L (moyenne de 11 µg/L). On a observé une contribution importante du plomb particulaire à la concentration totale de plomb lorsqu’on a laissé l’eau stagner pendant aussi peu que 30 minutes. Toutefois, les auteurs ont également constaté que le fait de laisser couler l’eau pendant aussi peu que 30 secondes avant de la boire réduisait considérablement la concentration totale de plomb.
5.1.2 Échantillonnage visant à évaluer l’exposition au plomb provenant de l’eau potable
La surveillance du plomb au robinet peut se faire au moyen de différents protocoles d’échantillonnage, mais le protocole choisi doit tenir compte de l’objectif souhaité. Ces protocoles peuvent servir à repérer les sources de plomb, à contrôler efficacement la corrosion ou à estimer l’exposition au plomb. Ils varieront selon des facteurs comme la durée de stagnation, le volume d’échantillon, les sites d’échantillonnage et la fréquence d’échantillonnage voulus (Schock, 1990; van den Hoven et Slaats, 2006; Schock et Lemieux, 2010). La variabilité des concentrations de plomb dans un réseau et dans un même site représente la portée des expositions pouvant survenir dans la population et elle doit être prise en compte dans la conception d’un mécanisme de surveillance qui fournit des renseignements fiables permettant d’évaluer l’exposition (Schock et Lytle, 2011).
Aux fins du présent document, l’objectif du protocole d’échantillonnage est de représenter l’exposition moyenne ou typique au plomb dans l’eau potable pour une population (c.-à-d., à l’intérieur de la même zone d’approvisionnement en eau). Il importe de souligner qu’un protocole d’échantillonnage qui évalue l’apport moyen en plomb ne permettra pas de déterminer les concentrations de plomb les plus élevées ni la contribution de l’entrée de service en plomb à la concentration totale de plomb. À l’heure actuelle, les protocoles d’échantillonnage américains établis dans le cadre de la Lead and Copper Rule (règle fédérale relative au plomb et au cuivre) servent à des fins de traitement, avec pour objectif d’utiliser de longues périodes de stagnation pour recenser les concentrations de plomb les plus élevées (U.S. EPA, 1991). Un protocole similaire est proposé dans le document de conseil sur le contrôle de la corrosion publié par Santé Canada (2009b). Ces concentrations élevées permettent d’évaluer sur l’ensemble du système l’efficacité du traitement de contrôle de la corrosion avant et après la mise en place du programme de contrôle, l’objectif étant de minimiser les concentrations de plomb dans l’eau potable et, ainsi, de réduire indirectement l’exposition au plomb. Au Royaume Uni, on a documenté l’efficacité d’un programme d’échantillonnage aléatoire effectué à la grandeur du système pour surveiller la conformité et pour évaluer la performance et l’optimisation du contrôle de la corrosion (Cardew, 2000, 2003; Hayes et Croft, 2012; Hayes et coll., 2014).
L’apport moyen en plomb chez une personne varie considérablement en raison de plusieurs facteurs, notamment le comportement du consommateur, la configuration de la plomberie (p. ex. habitation unifamiliale, immeuble à logements, immeuble à bureaux, école), les profils d’utilisation de l’eau (c.-à-d. le régime d’écoulement), le temps de contact de l’eau avec la plomberie, les effets saisonniers et la chimie de l’eau (Cardew, 2000, 2003; van den Hoven et Slaats, 2006; Schock et Lytle, 2011; Deshommes et coll., 2016). Les méthodes d’échantillonnage servant à évaluer l’exposition devraient idéalement tenir compte de ces variations. Des études ont montré que la méthode d’échantillonnage proportionnel composite permet de saisir la variabilité inhérente de l’exposition au plomb provenant de l’eau potable et qu’elle est représentative de cette exposition (Anjou Recherche, 1994; van den Hoven et Slaats, 2006; Schock et Lytle, 2011). L’échantillonnage composite proportionnel est réalisé au moyen d’un dispositif que le consommateur raccorde au robinet d’eau potable; ce dispositif détourne une petite proportion constante de chaque volume d’eau prélevé, généralement pendant une semaine. Ce type d’échantillonnage requiert un équipement qui est peu pratique pour la surveillance courante et qui convient mieux pour l’échantillonnage à long terme.
Dans un certain nombre d’études, on a évalué différents protocoles d’échantillonnage –échantillonnage aléatoire, échantillonnage après une purge complète (PC) et échantillonnage 30MS, afin de cerner les méthodes adéquates pour estimer la concentration hebdomadaire moyenne de plomb au robinet du consommateur (c.-à-d. l’échantillonnage composite proportionnel) (Baron, 1997, 2001; Commission européenne, 1999; van den Hoven et Slaats, 2006). Dans ces études, l’échantillonnage aléatoire, un échantillon de 1 L était prélevé d’un robinet d’eau potable sans purge préalable, l’échantillonnage PC incluait une purge équivalant à environ trois volumes d’eau de la plomberie(c.-à-d. 5 minutes) avant de prélever un échantillon de 1 L et le protocole 30MS consistait à prélever deux échantillons de 1 L après une purge de trois volumes d’eau de la plomberie et après avoir laissé l’eau reposer pendant 30 minutes avant l’échantillonnage.
L’étude de la Commission européenne (1999) visait à déterminer lequel de ces trois protocoles d’échantillonnage courants était le plus représentatif de la quantité hebdomadaire moyenne de plomb ingéré par les consommateurs. La performance de chacun de ces protocoles était évaluée en fonction de sa représentativité (c.-à-d. à estimer la concentration moyenne de plomb au robinet du consommateur), de son coût, de sa reproductibilité, de son aspect pratique et de son acceptabilité par les consommateurs. Elle a été réalisée dans cinq pays membres et comprenait diverses qualités de l’eau (corrosivité faible, moyenne ou élevée). Chaque pays a effectué un échantillonnage à au moins deux endroits, où au moins 50 % des sites d’échantillonnage devaient être dans des résidences équipées d’une entrée de service en plomb.
L’étude a déterminé que l’échantillonnage aléatoire était représentatif et permettait de déceler une grande proportion des sites ayant des problèmes de plomb. Elle a aussi trouvé que l’échantillonnage aléatoire était relativement peu coûteux, pratique à mettre en œuvre et acceptable du point de vue du consommateur. On a trouvé que l’échantillonnage aléatoire avait un temps de stagnation près ou supérieur à la moyenne de temps de stagnation entre les utilisations (c.-à-d. qu’il tient compte des caractéristiques de consommation d’eau des consommateurs) et qu’il surestime l’exposition au plomb. L’étude a trouvé que l’échantillonnage 30MS était représentatif et qu’il reflétait mieux l’exposition typique en utilisant la moyenne des concentrations de plomb mesurées dans les deux échantillons prélevés. L’échantillonnage 30MS permettait d’identifier presqu’autant de sites problématiques que l’échantillonnage aléatoire et ce, tout en étant plus reproductible que ce dernier. Cependant, l’échantillonnage 30MS a aussi été trouvé plus coûteux, moins pratique à mettre en application et moins pratiques pour les consommateurs. L’échantillonnage PC n’a pas été trouvé représentatif et ne permettait pas d’identifier suffisamment de sites problématiques (Commission européenne, 1999). Dans d’autres études (Bailey et coll., 1986; van den Hoven et Slaats, 2006), l’échantillonnage aléatoire a aussi été trouvé représentatif du temps de stagnation entre les utilisations de l’eau dans un contexte résidentiel.
Baron (2001) a de ménages. Il a été établi que la sélection aléatoire des propriétés semblait être une bonne solution pour évaluer la situation dans une zone et pour pouvoir déterminer et hiérarchiser les types de mesures à mettre en place. L’échantillonnage aléatoire a été jugé plus pratique et plus acceptable pour les consommateurs, tandis que l’échantillonnage 30MS s’est avéré davantage reproductible et tout aussi représentatif. On a déterminé que l’échantillonnage PC n’était pas représentatif des concentrations moyennes et qu’il ne fournissait qu’une indication des teneurs minimales en plomb au robinet (Baron, 2001; van den Hoven et Slaats, 2006). Les protocoles ayant recours au prélèvement d’un échantillon après une purge complète ne sont donc pas appropriés pour évaluer l’exposition moyenne au plomb dans l’eau potable, mais sont peut-être appropriés pour atteindre d’autres objectifs, comme pour identifier l’emplacement ou la présence d’entrées de service en plomb (Cartier et coll., 2012b). La Commission européenne (1999) a recommandé l’utilisation d’échantillonnage soit aléatoire ou 30MS pour la surveillance de conformité et l’évaluation de zones et l’utilisation de l’échantillonnage aléatoire pour la vérification du contrôle de la corrosion. Cardew (2003) a conclu que l’échantillonnage aléatoire avait une meilleure corrélation avec l’exposition réelle que l’échantillonnage aléatoire 30MS et que l’échantillonnage aléatoire avait tendance à indiquer des résultats d’exposition au plomb faussement positifs (c.-à-d. plus conservateur). L’étude a aussi trouvé que l’efficacité des mesures de contrôle de la corrosion pouvait être évaluée avec les données de conformité de l’échantillonnage aléatoire, ce qui le rend utile pour surveiller les changements dans les niveaux de plomb au fil du temps et pour évaluer l’efficacité des mesures correctives de traitement au niveau du système.
La reproductibilité des échantillons 30MS en fait un bon outil pour surveiller les changements dans la teneur en plomb au fil du temps et pour évaluer l’efficacité d’un traitement correctif aux sites sentinelles (Jackson, 2000). Toutefois, le protocole a tendance à sous-estimer l’exposition au plomb. L’échantillonnage 30MS est représentatif des niveaux d’exposition dans les résidences (Cardew, 2000) et peut être utiliser à des fins d’investigation dans des résidences lorsque des échantillons séquentiels sont prélevés (Cartier et coll., 2011). Les résultats de l’échantillonnage aléatoire sont plus variables que ceux obtenus par l’échantillonnage 30MS. On sait qu’une purge effectuée avant la stagnation permet d’éliminer les particules accumulées (van den Hoven et Slaats, 2006; Deshommes et coll., 2010a, 2012b). Toutefois, un écoulement turbulent accru observé à des débits plus élevés est associé à la présence de plomb particulaire (Cartier et coll., 2012a; Clark et coll., 2014). À la lumière de ces observations, l’échantillonnage devrait être réalisé à un débit moyen à élevé (> 5 L/minute) pour capter le rejet de plomb particulaire dans le cadre du protocole.
De nombreux facteurs contribuent à la variabilité des concentrations de plomb, y compris la méthode d’échantillonnage utilisée et les fluctuations de qualité de l’eau (p.ex. : pH, matière organique naturelle, température). En utilisant une simulation Monte Carlo pour évaluer les fluctuations de qualité de l’eau et leur impact sur l’ensemble de la variabilité des niveaux de plomb, Cardew (2003) a déterminé que les fluctuations de qualité de l’eau augmentaient les coefficient de variation pour les échantillonnages aléatoire et 30MS. Il est généralement nécessaire de prélever plus d’échantillons pour le protocole d’échantillonnage aléatoire que pour le protocole 30 MS. Cependant, le nombre d’échantillons requis peut augmenter de façon importante pour le protocole 30MS, ce qui fait que le nombre d’échantillons requis pour l’échantillonnage aléatoire est seulement deux fois plus élevé que pour le protocole 30MS. L’auteur a aussi déterminé que, en l’absence de fluctuation de qualité de l’eau, il fallait 10 fois plus d’échantillons avec le protocole d’échantillonnage aléatoire qu’avec le protocole 30MS. Jackson (2000) a déterminé que l’échantillonnage aléatoire demandait de 3 à 5 fois plus d’échantillons que le protocole 30MS pour obtenir de l’information équivalente. Par conséquent, le bénéfice de prélever des échantillons en utilisant le protocole 30MS est moins important que perçu. L’échantillonnage de conformité exige qu’un nombre précis d’échantillons soient prélevés, selon la taille de la population desservie par la zone d’approvisionnement en eau. Cette fréquence peut être diminuée si il n’arrive aucune défaillance pendant la période identifiée par l’agence de réglementation. Le nombre d’échantillons dépend du niveau réel de non-conformité dans la zone d’approvisionnement en eau et la variabilité observée des concentrations de plomb. Il faudrait augmenter le nombre d’échantillons lorsque le niveau de conformité est élevé (c.-à-d., 90 %) pour s’assurer que la zone a bien été caractérisée (Commission européenne, 1999; Baron, 2001).
On demande typiquement au moins 20 échantillons par zone d’approvisionnement en eau, quelle que soit la méthodologie utilisée. Cependant, pour les petits systèmes, un plus petit nombre d’échantillons peut être approprié, selon les conditions locales. Hayes et coll. (2012) ont trouvé que l’échantillonnage aléatoire était suffisamment représentatif si au moins 100 échantillons étaient prélevés annuellement pendant plusieurs années et regroupés.
Les écoles présentent des défis d’échantillonnage particulièrement difficiles pour diverses raisons : la complexité des profils d’utilisation, la variabilité de l’âge des conduites, les différences de configuration de la plomberie d’une pièce à l’autre et l’absence d’un inventaire détaillé des produits de plomberie installés dans les immeubles. Dans une étude effectuée dans quatre provinces canadiennes, on a utilisé différents protocoles pour prélever dans des écoles élémentaires, des garderies et autre grands édifices des échantillons d’eau qui ont ensuite été analysés pour en établir la teneur en plomb (Deshommes et coll., 2016). Les auteurs ont trouvé que les niveaux de plomb élevés étaient très variables (les concentration de plomb variaient entre les robinets par un facteur entre 10 et 2000) dans les grands édifices et dans l’ensemble du système. Ils ont aussi confirmé que les concentrations de plomb mesurées à un robinet précis ne sont pas une indication des concentrations de plomb aux autres robinets de l’immeuble, ce qui renforce le besoin de prélever des échantillons à tous les robinets dans les écoles et les garderies. Il est impossible d’établir un site d’échantillonnage représentatif pour la plupart des écoles, ce qui nécessite l’échantillonnage de chaque site d’eau potable pour évaluer l’exposition des enfants dans les écoles. Selon le type de site d’échantillonnage, des volumes d’échantillon plus petits et des volumes totaux plus faibles peuvent être nécessaires (U.S. EPA, 2006a; Santé Canada, 2009b; Schock et Lytle, 2011).
Il peut être très difficile de maintenir une stagnation dans les grands immeubles. Selon de récentes études, les concentrations de plomb au robinet varient considérablement même après un contrôle minutieux de l’utilisation de l’eau par toutes les unités connectées à l’entrée de service, peu importe le type d’habitation multifamiliale – maison en rangées, duplex, triplex ou grand immeuble (Deshommes et coll., 2013; Ngueta et coll., 2014). Les concentrations de plomb dans l’eau potable provenant de ces habitations étaient aussi élevées que celles observées dans les maisons unifamiliales dont la configuration des entrées de service en plomb était similaire. Ces études démontrent clairement les difficultés à évaluer l’exposition à l’aide d’échantillons stagnants et de soutenir le recours au protocole d’échantillonnage AD lorsque le bassin d’échantillonnage comprend des habitations multifamiliales ou de grands immeubles.
5.2 Aliments
L’utilisation de plomb dans les produits alimentaires est interdite au Canada. On peut toutefois détecter de petites quantités de plomb dans les aliments en raison de sa présence à l’état de traces dans les plantes et les animaux, de l’incorporation de plomb durant le transport des aliments, de l’utilisation par le passé de l’arséniate de plomb comme pesticide, de la transformation et de la préparation, ainsi que de l’utilisation de balles en plomb pour chasser le gibier sauvage. Dans l’Étude canadienne sur l’alimentation totale de Santé Canada, on a estimé les concentrations de divers produits chimiques dans les aliments, y compris le plomb, dans le cadre de six études qui ont eu lieu de 1969 à 1973, de 1976 à 1978, de 1985 à 1988, de 1992 à 1999, de 2000 à 2004 et de 2005 à aujourd’hui (étude en cours; les données antérieures à 2007 sont disponibles) (Santé Canada, 2009a). Les résultats de ces études révèlent une diminution importante des concentrations en plomb dans les aliments depuis 1981. À l’heure actuelle, l’apport alimentaire estimatif en plomb chez les Canadiens de tous les âges est d’environ 0,1 μg/kg de poids corporel par jour. L’exposition est généralement plus élevée chez les enfants et diminue avec l’âge (Santé Canada, 2011). Pour la période de 2003 à 2007, la concentration de plomb était la plus élevée dans les herbes et les épices (c.-à-d. 292 à 392 μg/kg), même si les groupes d’aliments qui contribuent le plus à l’apport alimentaire en plomb sont les boissons, notamment la bière, le vin, le café, le thé et les boissons gazeuses, les aliments à base de céréales et les légumes. Les aliments traditionnels consommés par les peuples des Premières Nations habitant dans les réserves en Colombie-Britannique ne contenaient que des concentrations normales de plomb, à l’exception du cœur de castor, de la bernache du Canada, du chevreuil et de la viande de gélinotte, qui contenaient des concentrations de plomb plus élevées (jusqu’à 61 μg/kg) (Chan et coll., 2011). On a également mesuré la teneur en plomb dans les aliments canadiens par l’intermédiaire du Projet sur les aliments destinés aux enfants et du Programme national de surveillance des résidus chimiques (PNSRC) de l’Agence canadienne d’inspection des aliments (ACIA). Les données tirées du Projet sur les aliments destinés aux enfants (2007-2008), dans lequel 836 aliments transformés différents ont fait l’objet d’analyses de la teneur en plomb, indiquent que les produits à base de céréales sont ceux qui contiennent le plus de plomb. Sur les 365 produits à base de céréales testés, 162 présentaient des concentrations décelables de plomb, la concentration moyenne étant de 25 μg/kg dans ces échantillons. Dans l’évaluation précédente réalisée en 2006-2007, seulement 11 des 350 échantillons d’aliments analysés présentaient des concentrations décelables de plomb. La plus forte concentration de plomb a été signalée dans des produits de légumes biologiques pour bébés (140 μg/kg). Dans le cadre du PNSRC, on a détecté des concentrations de plomb allant jusqu’à 2 040 μg/kg dans des échantillons de muscles de poulet, même si le plomb n’était pas présent à des concentrations détectables dans 80 autres échantillons (ACIA, 2010). Des concentrations mesurables de plomb ont aussi été relevées dans des fruits et des légumes, de même que dans le miel.
Le lait maternel peut constituer une source d’exposition importante au plomb chez les nourrissons. Dans une enquête réalisée en 1981 sur la présence de produits chimiques dans le lait de 210 mères canadiennes, les concentrations de plomb variaient d’une concentration non détectable à 15,8 μg/L, avec une concentration moyenne géométrique de 0,566 μg/L (Dabeka et coll., 1986). Chez 25 mères cries, les concentrations de plomb dans le lait maternel se situaient entre 0,41 et 8,33 μg/L, la concentration moyenne étant de 2,08 μg/L (Hanning et coll., 2003). Des données plus à jour sur les concentrations de plomb dans le lait maternel devraient être disponibles au moment de la publication finale de l’Étude mère-enfant sur les composés chimiques de l’environnement (MIREC), une étude nationale d’une durée de cinq ans à laquelle participent environ 2 000 femmes de dix villes canadiennes. Le lait maternisé reconstitué avec de l’eau du robinet représente également une source importante d’exposition au plomb chez les nourrissons, puisque cette eau peut composer jusqu’à 90 % de leur alimentation en poids, selon la façon dont le lait maternisé est reconstitué (Shannon et Graef, 1989; Edwards et coll., 2009; Triantafyllidou et Edwards, 2012). On estime que l’alimentation au lait maternisé peut représenter plus de 50 % de l’exposition au plomb total chez les nourrissons (Triantafyllidou et Edwards, 2012).
En outre, il a été établi que les aliments préparés avec de l’eau contenant des concentrations élevées de plomb avaient une incidence importante sur la plombémie. À Greenville, en Caroline du Nord, une étude a été entreprise pour enquêter sur une source d’intoxication par le plomb chez des enfants alors qu’il n’y avait aucune source apparente de plomb dans la maison. Il a été déterminé que des pâtes préparées avec de l’eau provenant d’un robinet dont l’aérateur contenait des particules de plomb piégées constituaient la source la plus probable de plomb. Au cours de l’étude approfondie, les auteurs ont mesuré une concentration de plomb de l’ordre de 535 µg/L dans l’eau servant à la cuisson des pâtes. Ils ont par la suite démontré que 95 % des petites particules de plomb insolubles étaient demeurées sur les pâtes après qu’on a retiré l’eau, avec pour résultat une masse de 381 µg de plomb dans une seule portion de pâtes (Triantafyllidou et coll., 2007). Il est intéressant de noter que cette masse dépasse largement le seuil de la Consumer Product Safety Commission (CPSC) des États-Unis en ce qui concerne les problèmes de santé liés à une exposition aiguë de 175 µg de plomb dans les bijoux pour enfants, seuil sur lequel se fonde la CPSC pour rappeler des produits ou apporter des mesures correctives (CPSC, 2005). Deshommes et coll. (2012a) ont étudié les répercussions de l’eau du robinet comme source de plomb dans les aliments préparés consommés par les enfants, notamment les boissons préparées, le riz ou les pâtes. Parmi les sources de plomb dans l’eau du robinet, mentionnons les soudures, les incrustations dans les tuyaux en plomb (II) et (IV), de même que le plomb issu du laiton jaune et du laiton rouge. Il a été déterminé que le plomb particulaire et le plomb soluble provenant de l’eau du robinet peuvent favoriser l’augmentation de la concentration de plomb dans les boissons et les aliments préparés à la maison. Les auteurs ont constaté que l’eau du robinet contribuait à des concentrations de 0,01 à 1 mg/L de plomb soluble et à 4 à 40 mg/L de plomb particulaire, avec pour résultat une charge moyenne de 25 µg de plomb par 100 g de pâtes cuites ou de riz cuit. La bioaccessibilité du plomb provenant d’aliments cuits avec de l’eau dépendait de la forme du plomb. Les particules de plomb provenant de l’eau du robinet se dissolvaient peu durant la cuisson, mais le plomb issu des particules (dissoutes)de même que le plomb dissous des sources de plomb étaient concentrés dans les aliments. De plus, les auteurs ont constaté que les petites particules de plomb seraient probablement ingérées et qu’elles deviendraient bioaccessibles une fois dans l’estomac.
5.3 Air
5.3.1 Air ambiant
Dans le cadre du programme du Réseau national de surveillance de la pollution atmosphérique (RNSPA) d’Environnement Canada, établi en 1969, des concentrations de plomb dans l’air ambiant recueilli sur des matières particulaires filtrées d’un diamètre aérodynamique inférieur à 2,5 μm (MP2,5) ont été mesurées annuellement dans 26 endroits au Canada. À la suite de restrictions majeures sur l’utilisation des carburants au plomb dans le monde instaurées dans les années 1970, les concentrations atmosphériques de plomb ont considérablement diminué. Au Canada, les concentrations moyennes de plomb dans l’air ambiant ont chuté de plus de 99 % entre 1984 (0,1600 μg/m3) et 2008 (< 0,0015 μg/m3) (Environnement Canada, 2010b). Les mesures effectuées de 2000 à 2009 indiquent que les concentrations de plomb dans l’air ambiant ont été plutôt stables, les concentrations de plomb dans les MP2,5 se situant entre 0,0004 μg/m3 (5e percentile) et 0,014 μg/m3(95e percentile) (Environnement Canada, 2010a). L’essence d’aviation utilisée dans les petits avions constitue toujours une source importante de plomb dans l’air ambiant. On sait qu’en Caroline du Nord, les enfants de 9 mois à 7 ans vivant à une distance de 1 000 m d’un aéroport présentent une plombémie statistiquement plus élevée que celle des enfants qui habitent plus loin, l’impact étant le plus marqué chez les enfants vivant à une distance de 500 m d’un aéroport (plombémie moyenne de 3,88 μg/dL dans la population à l’étude) (Miranda et coll., 2011).
5.3.2 Air intérieur et poussière
L’ingestion de poussière domestique déposée peut constituer une source importante d’exposition au plomb chez les enfants, surtout dans les vieilles maisons qui renferment de la peinture au plomb (Lanphear et coll., 1998). Les comportements observés chez les enfants, comme les déplacements au sol et les contacts main-bouche fréquents, peuvent favoriser leur exposition au plomb par l’ingestion d’écailles de peinture et de poussière domestique. Un lien important existe entre la poussière domestique et la plombémie chez les enfants (Dixon et coll., 2009). D’autres sources de plomb intérieur comprennent la contamination par un sol extérieur, l’exposition à la fumée de cigarette et des passe-temps comme la soudure, la poterie et la fabrication de vitraux (HUD, 2001). En 2002, les concentrations médianes de plomb dans les MP2,5 prélevées à l’intérieur de maisons de non-fumeurs à Ottawa étaient de 0,0023 μg/m3 (0,0004 à 0,0027 μg/m3, n = 10) et de 0,0015 μg/m3 (0,0010 à 0,0051 μg/m3, n = 10) pour les résidences en milieu rural et les résidences en milieu urbain, respectivement (Rasmussen et coll., 2006). À Windsor, en Ontario, la concentration médiane en plomb des MP2,5 provenant d’échantillons d’air personnel, intérieur et extérieur appariés se situait entre 0,001 et 0,010 μg/m3 (n = 8 en 2004 et n = 37 en 2005-2006); c’est dans l’air extérieur que les concentrations de plomb les plus élevées ont été mesurées (Rasmussen et coll., 2007, 2009). Plusieurs études se sont penchées sur la teneur en plomb de la poussière domestique grâce à un examen des échantillons recueillis dans des sacs d’aspirateurs. Les concentrations médianes de plomb dans la poussière domestique étaient de 63 mg/kg (7,9 à 3 916 mg/kg de 2007 à 2010) et de 93 mg/kg (2,9 à 6 898 mg/kg de 2010 à 2011) dans 1 025 maisons au Canada et dans 201 maisons de quatre quartiers de Montréal (Québec), respectivement(Gauvin et coll., 2011; Rasmussen et coll., 2011). Dans d’autres études canadiennes, on a mesuré les concentrations de plomb dans la poussière domestique au moyen d’un échantillonnage par frottis sur différentes zones dans les maisons. Dans l’ensemble, les concentrations médianes de plomb mesurées à l’aide de la méthode d’échantillonnage par frottis allaient d’une concentration non détectable à 190 µg/m2(McDonald et coll., 2010; Bell et coll., 2011; INSPQ, 2011; Richardson et coll., 2011).
5.4 Produits de consommation
Les produits de consommation contenant du plomb englobent les bijoux bon marché, le matériel d’artiste de qualité professionnelle, le cristal au plomb et les glaçures appliquées sur la céramique et la poterie. La concentration de plomb dans les produits de consommation est strictement limitée en vertu de la Loi canadienne sur la sécurité des produits de consommation (LCSPC), en particulier dans les produits destinés aux enfants. Depuis novembre 2010, la teneur en plomb total des revêtements appliqués sur les jouets, les bijoux, les meubles et autres produits destinés aux enfants, ainsi que sur les crayons et pinceaux d’artiste a été réduite à 90 mg/kg, même si certains revêtements appliqués sur d’anciens produits vendus entre 2005 et 2010 pourraient avoir contenu jusqu’à 600 mg/kg de plomb total, et que ceux vendus entre 1976 et 2005 pourraient avoir contenu jusqu’à 5 000 mg/kg de plomb. De plus, la limite en plomb total est fixée 90 mg/kg pour tous les jouets destinés aux enfants de moins de trois ans et tous les produits dont le profil d’utilisation normale concerne un contact avec la bouche. La teneur en plomb total de tous les articles de bijouterie destinés aux enfants de moins de 15 ans est limitée à 600 mg/kg et la teneur en plomb lixiviable à 90 mg/kg (Santé Canada, 2010b, 2012b). Il existe également des limites strictes de libération de plomb des bouilloires, des glaçures sur les produits céramiques et des produits de verre destinés à l’alimentation (Gouvernement du Canada, 2010a). Le Règlement sur les produits dangereux (bouilloires), qui relève de la LCSPC, limite à 0,010 mg/L la quantité de plomb pouvant être libérée lorsqu’on fait bouillir de l’eau dans une bouilloire ou un produit similaire (Gouvernement du Canada, 2010b).
Des codes de pratique sont en place pour diverses autres catégories de produits. Le CNP, établi par le Conseil national de recherches du Canada, a autorisé l’utilisation du plomb comme matériau acceptable pour les conduites d’eau potable jusqu’en 1975,ainsi que l’utilisation de soudures au plomb dans les réseaux de distribution et les installations de plomberie jusqu’en 1986. Depuis 1990, le CNP interdit l’emploi de soudures au plomb dans les nouvelles tuyauteries et pour la réparation des conduites d’alimentation en eau potable (CNRC, 2010).De récentes modifications apportées au CNP comportent une exigence selon laquelle les raccords de plomberie doivent respecter la teneur moyenne pondérée en plomb de 0,25 % (CNRC, 2013).
5.5 Sol
Les concentrations de plomb dans le sol ont tendance à être plus élevées dans les villes, près des chaussées et autour de sources industrielles, près des champs de tir et autour des immeubles où la peinture au plomb se détériore. Les concentrations de plomb dans les sols des secteurs résidentiels et de parcs du Canada ont fait l’objet de plusieurs études de 2003 à 2010. Les concentrations moyennes de plomb variaient de 35,6 à 766 mg/kg (Rasmussen et coll., 2001; Bowman et Bobrowsky, 2003; Ndzangou et coll., 2006; Bell et coll., 2010, 2011; Heidary-Monfard, 2011; Richardson et coll., 2011), bien que dans la plupart des échantillons, les concentrations de plomb étaient inférieures à la recommandation actuelle pour la qualité des sols en fonction de la santé humaine du Conseil canadien des ministres de l’environnement (CCME), soit 140 mg/kg (CCME, 1999). Les concentrations moyennes de plomb dans les sols situés près des sources ponctuelles au Canada allaient de 13 à 750 mg/kg, même si les échantillons renfermaient généralement plus de plomb que ceux prélevés dans les sols des secteurs résidentiels et de parcs (MEO, 2001; Hilts, 2003; Centre de surveillance de l’environnement, 2004; Recherche et Développement pour la défense Canada, 2004; Lambert et Lane, 2004; Conservation Manitoba, 2007; Aqua Terre Solutions Inc., 2009; Conestoga-Rovers and Associates, 2010; Fisher Environmental Ltd., 2010; Laird, 2010; Saint-Laurent et coll., 2010). Sur les 106 sites analysés à Flin Flon et à Creighton (Manitoba), 41 % excédaient la recommandation pour la qualité du sol établie par le CCME (Conservation Manitoba, 2007). On estime à 9,65 mg/kg la concentration naturelle de plomb dans le sol, qui correspond à la concentration moyenne de 7 398 échantillons de till glaciaire prélevés un peu partout au Canada (Rencz et coll., 2006).
5.6 Plombémie au Canada
La biosurveillance de l’exposition au plomb au sein de la population est principalement évaluée par la mesure du plomb dans des échantillons de sang. On a évalué la plombémie dans la population canadienne dans le cadre de l’Enquête canadienne sur les mesures de la santé, composée de 5 319 participants âgés de 6 à 79 ans dans le premier cycle (cycle 1) (2007 à 2009) et de 5 575 participants âgés de 3 à 79 ans dans le deuxième cycle (cycle 2) (2009 à 2011). La moyenne géométrique de plombémie de tous les participants était de 1,3 µg/dL dans le cycle 1 et de 1,2 µg/dL dans le cycle 2. En général, la plombémie diminuait légèrement entre 3 et 19 ans, puis augmentaient avec l’âge, les plombémies les plus élevées étant détectées dans le groupe d’âge de 60 à 79 ans. Pour les cycles 1 et 2, respectivement, la moyenne géométrique des plombémies pour chaque groupe d’âge était la suivante : non disponible/0,93 µg/dL chez les 3-5 ans, 0,89/0,79 µg/dL chez les 6–11 ans, 0,79/0,71 µg/dL chez les 12–19 ans, 1,1/0,98 µg/dL chez les 20-39 ans, 1,6/1,4 µg/dL chez les 40-59 ans et 2,1/1,9 µg/dL chez les 60-79 ans. Dans l’ensemble, la plombémie était légèrement plus élevés chez les hommes que chez les femmes (Bushnik et coll., 2010; Santé Canada, 2013b).
Des plombémies élevées peuvent être détectées chez des personnes vivant dans des collectivités où les sources d’exposition sont atypiques, comme les fonderies, ou dans des collectivités rurales où l’on consomme des quantités importantes de gibier tué à l’aide de balles en plomb. Dans ces circonstances particulières, la moyenne géométrique des plombémies variait de 1 à 5,6 µg/dL chez les enfants (2000-2010) et de 1,7 à 3,9 µg/dL chez les adultes (2001-2005). Des plombémies maximales d’environ 40 et 50 µg/dL ont été observées chez des enfants et des adultes, respectivement (SENES Consultants Ltd., 2012).
On sait que l’ingestion de plomb par l’eau potable a une incidence directe sur les plombémies. Toutefois, les données tirées des études portant sur cet effet peuvent être difficiles à interpréter en raison des différents protocoles d’échantillonnage de l’eau utilisés, de la variabilité de la consommation individuelle d’eau du robinet, des différentes pratiques suivies, comme l’utilisation d’eau filtrée ou l’écoulement de l’eau du robinet avant sa consommation, et les facteurs de sensibilité individuelle qui influent sur la bioaccessibilité du plomb tels que l’âge, l’alimentation et la génétique. Des facteurs comme les fluctuations saisonnières des concentrations de plomb dans l’eau (p. ex. des concentrations plus élevées durant les mois d’été) ou les diminutions importantes des concentrations de plomb dans l’eau ont été associés à des changements concomitants des plombémies (Sherlock et coll., 1984; Deshommes et coll., 2013; Ngueta et coll., 2014). Triantafyllidou et Edwards (2012) ont souligné la nécessité de procéder à des recherches supplémentaires sur les associations entre les concentrations de plomb dans l’eau et les plombémies afin de mieux caractériser les risques pour la santé associés à ce type d’exposition. Des simulations faisant appel au modèle IEUBK (Integrated Exposure Uptake Biokinetic Model for Lead in Children) (voir la section 8.5.3) ont été réalisées dans le but d’évaluer l’incidence des différentes concentrations de plomb dans l’eau potable sur la plombémie chez les enfants de 0 à 7 ans. Des données issues d’études antérieures ont été versées dans le modèle, et les pourcentages de la moyenne géométrique obtenus (échelle de pourcentage) chez les enfants dont la plombémie excédait 5 µg/dL ont été estimés à 33,8 % (6,8 à 55,1%), à 9,4 % (1,9 à 24,5 %) et à 2,2 % (0,4 à 9,3 %) lorsque les concentrations de plomb dans l’eau potable étaient de 20, de 10 et de 5 µg/L, respectivement (Deshommes et coll., 2013). Les enfants vivant dans des maisons équipées d’une entrée de service en plomb affichaient des plombémies plus élevées que ceux vivant dans des maisons avec entrée de service sans plomb (Brown et coll., 2011). Il a été démontré que même de très faibles concentrations de plomb dans l’eau potable peuvent avoir une incidence marquée. Dans un groupe de 306 enfants âgés entre 1 et 5 ans, Levallois et coll. (2014) ont démontré une association entre des plombémies élevées et des concentrations de plomb dans l’eau du robinet après un ajustement pour tenir compte des facteurs de risque liés à une plombémie élevée, notamment l’origine ethnique, la saison et la consommation d’eau, de même que les autres variables d’exposition au plomb étudiées (c.-à-d. la poussière du plancher, la poussière des appuis de fenêtre et la peinture). Les auteurs ont constaté que les plombémies étaient élevées (> 1,78 µg/dL, ce qui correspond au 75e percentile) lorsque les concentrations de plomb dans l’eau potable dépassaient 3,3 µg/L.
Il est important de souligner que les plombémies ont chuté considérablement au fil des années. Des diminutions de plus de 70 % ont été observées depuis 1978-1979, alors que la plombémie moyenne était d’environ 4,79 µg/dL chez les personnes de 6 à 79 ans (Bushnik et coll., 2010). Cette baisse est attribuable à des réductions marquées de plomb dans l’essence, les peintures, les soudures et les conserves alimentaires, de même qu’à la prise de mesures additionnelles visant à réduire l’exposition au plomb.
5.7 Exposition par voies multiples associée à l'eau potable
Étant donné que le plomb ne possède pas les propriétés physico-chimiques requises (p. ex. coefficient de partage octanol-eau, constante de la loi de Henry), il a été impossible d’évaluer l’exposition par des voies multiples selon la méthode de Krishnan et Carrier (2008).
Comme les composés du plomb ne sont pas volatils, l’inhalation du plomb se limite au plomb lié aux particules, un scénario d’exposition qui n’est pas applicable à l’eau potable. En outre, on retrouve le plomb principalement sous sa forme inorganique dans l’eau potable, et le plomb inorganique n’est pas facilement absorbé par la peau. Par conséquent, l’exposition au plomb dans l’eau potable par voie cutanée et par inhalation n’a pas été jugée significative lors de l’évaluation.
6.0 Méthodes d’analyse
L’Environmental Protection Agency (EPA) des États-Unis dispose de deux méthodes approuvées (la méthode 200.8 Rev. 5.4, et la méthode 200.9 Rev. 2.2) d’analyse du plomb total dans l’eau potable. Les méthodes suivantes, établies par des organismes d’élaboration de normes consensuelles et un fabricant commercial, sont également approuvées par l’EPA pour l’analyse du plomb : la méthode normalisée SM (Standard Method) 3113B (APHA et coll., 2005); la méthode D3559-96 et D3559-03 (ASTM, 1996, 2003); et la méthode Palintest 1001 (U.S. EPA, 1994c, 2009a, 2014). Il s’agit de méthodes générales servant à déterminer la teneur en métaux et qui font appel à la spectrométrie de masse avec plasma à couplage inductif (ICP-MS) suivi de la chromatographie en phase gazeuse couplée à la spectrométrie de masse (GC-MS), à la spectrométrie d’absorption atomique en four graphite (GFAAS) ou à la voltamétrie par strippage anodique (VSA) à impulsion différentielle pour l’analyse du plomb. Les méthodes 200.8 Rev. 5.4 et 200.9 Rev. 2.2 de l’EPA fournissent un protocole permettant de mesurer le plomb dissous et le plomb total récupérable. Elles comportent les mêmes étapes de conservation ou de prétraitement, notamment un prétraitement à l’acide nitrique et/ou à l’acide chlorhydrique. Une digestion thermique peut s’avérer nécessaire, selon les caractéristiques des échantillons prélevés. Ces méthodes se distinguent cependant par les appareils de mesure qu’elles requièrent.
La méthode 200.8 Rev. 5.4 (U.S. EPA, 2009a), qui fait appel à l’ICP-MS, présente une LDM se situant entre 0,02 et 0,6 µg/L. L’échantillon est atomisé et ionisé par un plasma induit par radiofréquence. Les ions extraits du plasma par une interface à pression négative sont séparés par un spectromètre de masse en fonction de leur ratio masse/charge. Un multiplicateur d’électrons ou un détecteur Faraday détecte les ions séparés (U.S. EPA, 1994).
La méthode 200.9 Rev. 2.2 (U.S. EPA, 2009a), qui fait appel à la GFAAS avec une plateforme maintenue à température constante, présente une LDM de 0,7 µg/L. La technique comprend une série de trois étapes de chauffage pour sécher, carboniser (afin de réduire les interférences causées par d’autres ions) et atomiser le plomb sur la surface en graphite pyrolytique. L’atomisation élève le plomb dans une atmosphère d’argon d’une grande pureté et la lumière d’une longueur d’onde donnée traverse le nuage atomique. On mesure alors la diminution de l’intensité lumineuse (U.S. EPA, 1994).
Les méthodes internationales de l’ASTM approuvées par l’EPA pour l’analyse du plomb dans l’eau potable sont les versions de l’ASTM D3559 de 1996 et de 2003 (U.S. EPA, 2014a). Les méthodes font appel à la spectrophotométrie d’absorption atomique et à la VSA à impulsion différentielle. Ces méthodes (D3559-96 et D3559-03) sont des méthodes propriétaires; aucune LDM n’était disponible (ASTM, 1996, 2003; U.S. EPA, 2014a).
La méthode normalisée SM 3113B a aussi été approuvée pour l’analyse du plomb par la GFAAS, et sa LDM est de 1 µg/L (APHA et coll., 2005). On a signalé un intervalle de concentrations optimales de plomb allant de 5 à 100 µg/L. Dans la version la plus récente de cette méthode, le seuil de détection est estimé à 0,7 µg/L (APHA et coll., 2012).
La méthode Palintest 1001 est une méthode exclusive d’analyse du plomb dans l’eau potable fondée sur la VSA à impulsion différentielle. Cette technique électrochimique permet d’électroplaquer les métaux lorsque l’électrode est immergée dans l’échantillon et qu’une tension est appliquée à l’électrode. Cette étape induit un faible courant électrique à travers l’échantillon, et les ions métalliques dissous (c.-à-d. le plomb) se déposent à la surface de l’électrode. Une fois que la phase de placage est terminée, une tension inverse croissante est appliquée à l’électrode pour éliminer les métaux déposés. Chaque métal est éliminé de l’électrode selon un ordre défini et une tension connue avec précision, ce qui permet de l’identifier. Un analyseur à balayage capte les lectures de signal et un processeur les interprète en vue d’identifier et de quantifier le métal recherché. Une LDM a été établie à 2 µg/L pour le plomb lors des essais de validation de l’EPA effectués par trois laboratoires (U.S. EPA, 1996) et confirmée dans la documentation récente sur le produit (Palintest, 2014).
Le seuil pratique d’évaluation quantitative (SPEQ) associé aux méthodes approuvées par l’EPA est de 0,005 mg/L (5 µg/L); il est fondé sur la capacité des laboratoires de mesurer le plomb dans des limites raisonnables de précision et d’exactitude, au moment de l’adoption de la réglementation (U.S. EPA, 1991). Les évaluations actuelles du SPEQ reposent sur l’un ou l’autre de deux éléments : 1) la concentration la plus faible que 75 % des laboratoires sont en mesure de quantifier dans les limites prescrites de précision, d’après des données réelles sur le rendement, si les données sont suffisantes; 2) la multiplication de la limite supérieure de la LDM pour prendre en compte la variabilité inhérente aux méthodes d’essai et aux instruments utilisés pour les analyses, lorsque les données sont insuffisantes. Pour établir le SPEQ, l’EPA considère et privilégie les données sur le rendement des laboratoires en ce qui concerne les méthodes approuvées au moment de l’examen, plutôt que la multiplication de la LDM.
L’EPA réexamine les National Primary Drinking Water Regulations une fois tous les six ans; lors du second examen, elle a déterminé qu’elle ne pouvait pas abaisser le SPEQ pour le plomb. Même si des données sur le plomb avaient été recueillies au cours du premier examen, elles n’avaient pas été analysées à ce moment-là. L’analyse des ensembles de données pour ces deux examens a révélé un manque de données et une tendance à la baisse des taux de réussite des laboratoires en deçà de l’actuel SPEQ, dans les deux examens, ainsi qu’un manque de données en deçà de l’actuel SPEQ pour les résultats des tests de rendement, dans le second examen. On a donc conclu qu’il n’était pas approprié de recommander la diminution du SPEQ (U.S. EPA, 2009b).
Il n’existe pas de programme centralisé équivalent pour la collecte et l’analyse statistique rigoureuse des données analytiques au Canada. Il n’est donc pas possible d’établir un SPEQ pour les laboratoires au Canada. De plus, les données dont on dispose actuellement au Canada ne permettent pas aux laboratoires canadiens d’atteindre un SPEQ plus bas.
6.1 Préparation des échantillons
L’analyse du plomb total exige une préparation des échantillons de manière à pouvoir détecter les fractions particulaire et dissoute du plomb. En général, toutes les méthodes susmentionnées observent les mêmes étapes de conservation, notamment l’utilisation d’une solution d’acide nitrique à 0,15 %, un délai d’attente de 16 heures et l’ajout d’acide chlorhydrique pour la digestion thermique lorsque la turbidité des échantillons est supérieure à 1 unité de turbidité néphélométrique (UTN). On sait que la conservation normalisée à l’acide (pH < 2) permet de quantifier le plomb total dans des échantillons d’eau où le plomb se trouve principalement sous sa forme dissoute ou qu’il provient de soudure au plomb très fine (Lytle et coll., 1993; Deshommes et coll., 2012b; Haas et coll., 2013; Triantafyllidou et coll., 2013). Toutefois, lorsque des particules de plomb sont présentes dans un échantillon, il est possible qu’elles soient mal dispersées et qu’elles se déposent au fond du flacon à échantillon, entraînant ainsi une turbidité inférieure à 1 UTN. Par conséquent, le protocole actuel pourrait sous-estimer la quantité totale de plomb dans l’eau potable en présence de plomb particulaire, et il faut alors utiliser une autre méthode de conservation (Triantafyllidou et coll., 2007, 2013; Deshommes et coll., 2010a; Haas et coll., 2013; Clark et coll., 2014). L’augmentation de la concentration d’acide nitrique à 2 % à l’étape de conservation s’est traduite par une bien meilleure récupération de la plupart des formes de plomb particulaire (Haas et coll., 2013; Triantafyllidou et coll., 2013; Clark et coll., 2014). Toutefois, Haas et coll. (2013) ont constaté que lorsqu’il y avait présence de particules de plomb tétravalent, une étape de conservation plus rigoureuse (c.-à-d. une digestion thermique avec acide nitrique à 2 % et acide chlorhydrique à 1 %) était nécessaire.
Les pratiques exemplaires menant à une meilleure estimation du plomb total consistent notamment à garantir qu’aucun transfert d’aliquote ou de volume ne survient avant l’étape de conservation ou d’analyse (conservation des échantillons in situ dans la mesure du possible), à maintenir un délai d’attente minimal de 16 heures après l’étape de conservation, à bien mélanger l’échantillon avant de procéder à l’analyse et à prélever l’aliquote directement du flacon à échantillon d’origine (Cartier et coll., 2013; Haas et coll., 2013; Triantafyllidou et coll., 2013). Comme on l’a déjà mentionné, il a été démontré qu’une solution d’acide nitrique à 2 % améliore grandement la récupération du plomb particulaire, mais la technique exige l’ajout de plus grandes quantités d’acide nitrique (c.-à-c. 20 mL d’acide nitrique) à l’échantillon d’eau de 1 L.
Puisque l’utilisation d’acide nitrique à 0,15 % ne permet pas de capter adéquatement le plomb particulaire, il est recommandé d’utiliser l’acide nitrique à 2 % à l’étape de conservation ou de procéder à la digestion thermique, indiquée dans la méthode EPA 200.8, pour analyser la teneur en plomb dans des échantillons d’eau potable. Cela est d’autant plus important que le critère de 1 UTN n’est pas suffisant pour capter le plomb colloïdal ou particulaire, même si ces particules sont visibles dans le flacon à échantillon ou qu’on soupçonne la présence de particules, mais que celles-ci ne sont pas visibles (p. ex. présence de particules dans l’aérateur, perturbation de l’entrée de service en plomb). Il importe de souligner que l’ajout d’acide nitrique à 2 % doit être réalisé par du personnel qualifié qui prendra les précautions nécessaires. À cette fin, si l’échantillonnage est effectué par les propriétaires de maisons, l’échantillon ne doit être acidifié et mis en attente qu’à l’arrivée de ce dernier au laboratoire.
7.0 Techniques de traitement et considérations liées aux réseaux de distribution
La corrosion a tendance à accroître la concentration de nombreux métaux, y compris le plomb, dans l’eau du robinet. La présence de plomb dans l’eau potable est principalement attribuable à la libération de celui-ci par la corrosion des matériaux contenant du plomb et utilisés dans les réseaux de distribution et les installations de plomberie. Le contrôle de la corrosion est la méthode de traitement la plus efficace pour minimiser les concentrations de plomb au point de consommation (Santé Canada, 2009b). Même si le traitement de l’eau peut réduire considérablement les concentrations de plomb dans l’eau du robinet, ce traitement à lui seul ne suffira pas à ramener le plomb à des concentrations inférieures à la CMA si l’eau est distribuée par une entrée de service en plomb (Sandvig et coll., 2008). Par conséquent, l’enlèvement de la conduite au complet est probablement la solution la plus efficace et permanente. De plus, dans le cas où les raccords contenant du plomb contribuent largement au relargage du plomb dans l’eau potable, le remplacement des vieux raccords (p. ex. robinets) par des raccords conformes aux exigences de faible teneur en plomb peut réduire les concentrations dans l’eau potable (Sandvig et coll., 2007, 2009; Boyd et coll., 2008a; Turković et coll., 2014).
7.1 Échelle municipale
La teneur en plomb dans l’eau brute est généralement très faible. Comme le plomb est habituellement introduit dans l’eau potable après que l’eau a quitté l’usine de traitement, l’approche de traitement visant à l’éliminer est principalement axée sur le contrôle de la corrosion (Santé Canada, 2009b).
Parmi les approches de contrôle de la corrosion utilisées, mentionnons les ajustements relatifs à la qualité de l’eau (pH, alcalinité, etc.), l’emploi d’un inhibiteur de la corrosion (orthophosphate) et l’enlèvement au complet de la conduite de branchement en plomb. Il est important de caractériser les sources de plomb afin de choisir la bonne approche visant à minimiser la corrosion et, par le fait même, l’exposition au plomb. Le choix d’une stratégie appropriée pour minimiser la teneur en plomb au robinet dépendra de nombreux facteurs, notamment des caractéristiques de la source d’eau brute, de la source et de la concentration du plomb, de même que du type de corrosion (Santé Canada, 2009b). Comme il a été mentionné précédemment, le traitement de contrôle de la corrosion peut réduire considérablement les concentrations de plomb au robinet. Toutefois, ce traitement à lui seul ne suffira pas à ramener le plomb à des concentrations inférieures à la CMA si l’eau est distribuée par une entrée de service en plomb (Sandvig et coll., 2008; Camara et coll., 2013). Dans ce cas, il peut être nécessaire d’enlever complètement la conduite de branchement pour réduire la teneur en plomb.
7.1.1 Considérations relatives au traitement
Les procédés conventionels de traitement de l’eau, dont la sédimentation, la coagulation par le sulfate d’aluminium (alun) ou le sulfate ferrique et la filtration, éliminent le plomb de l’eau potable de manière raisonnablement efficace. L’adoucissement à la chaux à un pH élevé s’avère également efficace pour éliminer le plomb. En ce qui a trait aux réseaux publics d’approvisionnement en eau, l’EPA a déterminé que l’échange d’ions (à l’aide de résines cationiques) et l’osmose inverse au point d’utilisation étaient des technologies d’élimination du plomb qui assuraient la conformité des petits réseaux (c.-à-d. qui desservent moins de 10 000 personnes) (U.S. EPA, 1998). Ces technologies sont également pertinentes dans le traitement à l’échelle résidentielle (voir la section 7.2).
7.1.2 Considérations relatives aux réseaux de distribution
Différentes sources contribuent à la libération du plomb l’eau potable : entrées de service en plomb, composants en plomb utilisés pour connecter des tuyaux et des joints soudés, présence de plomb dans les raccords de plomberie en laiton et dans les cols de cygne, pièces de robinet ou joints d’étanchéité utilisés dans les usines de traitement de l’eau ou dans les conduites principales de distribution. Pendant des décennies, le plomb a été fréquemment utilisé dans les composants en laiton des réseaux de distribution et des installations de plomberie, notamment dans les entrées de service en plomb assurant l’approvisionnement en eau dans les maisons. Le CNP a autorisé l’utilisation du plomb comme matériau acceptable pour les conduites d’eau potable jusqu’en 1975 (NRCC, 2010), même si leur installation s’est poursuivie jusqu’en 1980 dans certaines provinces et dans certains territoires. Les conduites galvanisées peuvent aussi constituer une source de plomb, puisqu’il y est présent sous forme d’impureté (Leroy et coll., 1996). Jusqu’en 1980, le CNP a permis l’utilisation de conduites en acier galvanisé dans les installations de plomberie (NRCC, 2010). La réglementation mise en œuvre par chaque province et territoire repose sur le CNP.
7.1.2.1 Entrées de service en plomb
On sait que depuis de nombreuses années, les entrées de service en plomb demeurent une source très élevée de plomb et qu’elles contribuent à 50 à 75 % du plomb total au robinet après des périodes de stagnation prolongées. La majorité du plomb libéré dans des conditions stagnantes est du plomb dissous (van den Hoven et Slaats, 2006; Sandvig et coll., 2008; Xie et Giammar, 2011; Cartier et coll., 2012a). Toutefois, le débit de l’eau peut accroître la libération du plomb dissous et du plomb particulaire par le transfert de masse du plomb hors des incrustations des tuyaux et en délogeant physiquement ces incrustations (Xie et Giammar, 2011).
Le remplacement complet des entrées de service en plomb (c.-à-d. la portion appartenant aux services publics et celle appartenant au propriétaire de la résidence) peut réduire considérablement les concentrations de plomb dans l’eau du robinet du consommateur. Le remplacement partiel de ces conduites (c.-à-d. la portion des services publics ou celle des consommateurs) peut également réduire les concentrations de plomb, mais cette réduction n’est pas proportionnelle par rapport à un remplacement complet (U.S. EPA, 2011; Camara et coll., 2013; Cartier et coll., 2013). Le remplacement d’une entrée de service en plomb peut perturber ou déloger les incrustations de plomb existantes ou les sédiments contenant du plomb et entraîner une augmentation importante de la teneur en plomb au robinet. Cette augmentation peut durer trois mois ou plus (Renner, 2007; Sandvig et coll., 2008; U.S. EPA, 2011; Cartier et coll., 2013; Del Toral et coll., 2013). Dans une étude réalisée à Providence, au Rhode Island, on a observé un déclin important et constant de la masse totale de plomb libéré (concentration ajustée en fonction du volume actuel) après le remplacement partiel des entrées de service. La réduction moyenne de la masse totale de plomb était de 62 % (210 μg). L’étude a également révélé le pic attendu ayant immédiatement suivi le remplacement partiel, mais la teneur en plomb a diminué après trois jours et après deux semaines. Après quatre mois, des échantillons prélevés au premier jet d’eau et après une période de purge ont révélé une réduction notable et constante des concentrations de plomb et du temps nécessaire pour débarrasser la plomberie interne de l’eau contenant du plomb (Commons, 2011). Del Toral et coll. (2013) ont constaté que les perturbations dans l’entrée de service en plomb augmentaient les concentrations de plomb dans l’eau de 11 sites sur 13. Ces perturbations englobaient notamment l’installation ou le remplacement de compteurs, l’installation de compteurs automatisés, les fuites d’entrées de service ou la réparation de robinets d’arrêt de la conduite externe, ainsi que d’importants travaux d’excavation dans la rue à proximité de la résidence.
On sait que la période de stagnation, le régime d’écoulement et la chimie de l’eau influent sur la libération du plomb particulaire provenant des incrustations formées dans les entrées de service en plomb. On a observé que la teneur en plomb particulaire augmentait dans des conditions d’eau en mouvement (Kim et coll., 2011; McFadden et coll., 2011; Xie et Giammar, 2011) et d’eau stagnante (Triantafyllidou et Edwards, 2010; Cartier et coll., 2013), de même que dans des conditions de faible débit (Del Toral et coll., 2013; Welter et coll., 2013); en présence d’orthophosphate (McFadden et coll., 2011); en présence d’orthophosphate avec une période de stagnation constante (Xie et Giammar, 2011); et à un pH élevé dans des conditions d’eau en mouvement (Kim et coll., 2011). Fait particulièrement intéressant, ces études ont invariablement montré que les débits modérés à élevés typiques d’un écoulement turbulent ou de perturbations d’écoulement peuvent accroître la mobilisation du plomb et entraîner des contributions importantes du plomb particulaire à la concentration totale de plomb (Triantafyllidou et coll., 2007; Deshommes, 2010a; Cartier et coll., 2011, 2012a; Schock et Lytle, 2011; Wang et coll., 2012, 2013; Del Toral et coll., 2013; Clark et coll., 2014). Il s’agit d’un élément important à prendre en compte au moment de l’échantillonnage, puisque l’utilisation de faibles débits n’est pas considérée comme faisant partie du comportement typique des propriétaires et qu’elle n’est pas, par conséquent, représentative des profils d’utilisation typiques.
De récentes études ont également établi une corrélation entre des concentrations accrues de plomb et la corrosion galvanique découlant du remplacement partiel d’une entrée de service en plomb à l’endroit où la nouvelle tuyauterie en cuivre est rattachée à la tuyauterie restante en plomb (Triantafyllidou et Edwards, 2010; Schock et Lytle, 2011; Xie et Giammar, 2011; Cartier et coll., 2012a, 2013; Wang et coll., 2012; Welter et coll., 2013; Clark et coll., 2014). Cependant, une fois la connexion galvanique retirée (c.-à-d. aucun contact entre les métaux, utilisation d’un raccord non métallique pour raccorder les tuyaux), on a observé une diminution de la teneur en plomb (Triantafyllidou et Edwards, 2010; Wang et coll., 2013; Welter et coll., 2013). On a également noté une hausse de la quantité de plomb lorsqu’une connexion galvanique entre des tuyaux en cuivre et des tuyaux en plomb était soumise à un ratio massique chlorure/sulfate élevé (Edwards et Triantafyllidou, 2007).
La corrosion galvanique peut entraîner une hausse des concentrations de plomb dissous et particulaire (Sandvig et coll., 2008; Deshommes et coll., 2010a, 2012b; Triantafyllidou et Edwards, 2010; Schock et Lytle, 2011; Xie et Giammar, 2011; Cartier et coll., 2012a, 2012c; Wang et coll., 2012; Welter et coll., 2013; Clark et coll., 2014). Des travaux de recherche montrent que dans des conditions d’écoulement continu, le plomb dissous prédomine (Welter et coll., 2013), mais que le plomb particulaire est plus répandu dans des conditions stagnantes, les concentrations pouvant augmenter de plus de 50 % après une période de stagnation de 6 heures (Triantafyllidou et Edwards, 2010; Wang et coll., 2012, 2013).
Des données probantes indiquent qu’un usage réduit de l’eau découlant d’initiatives d’efficacité et de conservation de l’eau fait augmenter les concentrations de plomb dans l’eau potable (Elfland et coll., 2010). L’utilisation réduite de l’eau est associée à une durée de stagnation accrue de l’eau dans la tuyauterie et est corrélée à une hausse des concentrations de plomb.
7.1.2.2 Corrélation entre le plomb particulaire et le fer
Des contaminants peuvent s’accumuler dans les produits de corrosion du fer et du plomb et les incrustations de calcaire dans les réseaux de distribution en plus de ceux-ci (Lytle et coll., 2004; Schock, 2005; Schock et coll., 2008, 2014; Friedman et coll., 2009). Ultérieurement, les incrustations peuvent se déloger et être relarguées dans l’eau des réseaux de distribution avec ces contaminants accumulés (Schock, 2005; U.S. EPA, 2006b). Selon des recherches récentes, les incrustations constituées de fer et de manganèse peuvent agir comme un puits pour le plomb dans l’eau potable, et en être une source persistante (Friedman et coll., 2009; Schock et coll., 2014). On a observé une libération du fer après le remplacement partiel ou complet d’entrées de service en plomb (Deshommes et coll., 2010a; McFadden et coll., 2011; Camara et coll., 2013). Ces études ont permis d’établir une corrélation entre le plomb particulaire au robinet et des métaux comme le fer, le zinc, l’étain et le cuivre.
Grâce à une analyse des incrustations et à des données historiques, Schock et coll. (2014) ont réussi à élucider le mécanisme de libération de concentrations élevées de plomb après le remplacement complet d’entrées de service en plomb à Madison, au Wisconsin. L’hypothèse formulée était que l’accumulation de manganèse et de fer sur les parois des tuyaux de la plomberie en place servait de puits pour le plomb. L’analyse des incrustations a fourni une explication plausible des observations historiques liées au plomb particulaire, dont la libération s’est poursuivie quatre ans après l’enlèvement complet des entrées de service en plomb. Ces observations étaient également compatibles avec la réduction subséquente de la libération du plomb une fois qu’on a procédé à un meilleur contrôle du manganèse (particulaire et dissous) entrant dans la plomberie domestique. Deshommes et coll. (2010a) ont constaté que le plomb particulaire était fortement corrélé au fer en raison de l’adsorption du plomb dissous sur les dépôts de fer dans l’entrée de service en plomb et dans la plomberie en place. Des pics de concentrations de plomb particulaire ont été observés en même temps que des pics de concentrations de zinc, d’étain de fer et de cuivre particulaires, seuls ou en combinaison. Une enquête sur la libération persistante du plomb après le remplacement complet des entrées de service en plomb a révélé que cette libération pourrait être attribuée à l’adsorption du plomb sur les incrustations de corrosion du fer provenant d’une vieille installation de plomberie en fer galvanisé. On a constaté que l’ampleur de la libération variait en fonction de l’histoire particulière de la maison, mais aussi selon certains facteurs comme la vitesse d’écoulement et la stagnation (McFadden et coll., 2011). Selon une étude de cas, les conduites principales en fonte exacerbent la libération du plomb lors du remplacement des entrées de service. Camara et coll. (2013) on observé que les entrées de service en plomb connectées à des tuyaux en fer tuberculés (c.-à-d. corrodés) augmentaient les concentrations de plomb après le remplacement partiel ou complet des entrées de service. Les auteurs ont déterminé que les incrustations de fer se détachaient de la conduite principale en fonte et qu’elles adsorbaient le plomb provenant de l’entrée de service et des composants à base de plomb de l’installation de plomberie. Finalement, le plomb était libéré dans l’eau potable du consommateur par désorption ou par dissolution des incrustations de fer. Il a été démontré que le remplacement complet de l’entrée de service libérait constamment moins de plomb qu’un remplacement partiel.
Il est important de souligner que des épisodes d’altération de la couleur (eau rouge) pourraient vraisemblablement être accompagnés de la libération de contaminants accumulés, y compris le plomb. Par conséquent, de tels événements ne doivent pas être considérés uniquement comme un problème d’ordre esthétique, mais devraient nécessiter un échantillonnage en vue de détecter la présence de métaux et peut-être de procéder à un entretien supplémentaire du réseau de distribution.
7.1.2.3 Alliages en laiton
Au Canada, les tuyauteries en cuivre avec soudures plomb-étain (d’utilisation courante jusqu’en 1989) et les robinets et raccords en laiton sont prédominants dans les installations de plomberie résidentielles (Churchill et coll., 2000). La version de 1990 du CNP interdit officiellement l’utilisation de soudures à base de plomb pour réaliser ou réparer des installations de plomberie servant à distribuer l’eau potable (CNRC, 2010). En vertu du CPN, tous les raccords doivent être conformes à la norme 112.18.1 de l’American Society of Mechanical Engineers (ASME) / B125.1 de l’Association canadienne de normalisation (CSA) visant les robinets. Selon la dernière version de cette norme, les raccords doivent contenir moins de 0,25 % de plomb sous forme de moyenne pondérée.
En général, les alliages de laiton sans plomb ajouté présentent une teneur en plomb allant de 0,1 à 0,25 % par poids (sous forme d’impuretés provenant de matériaux recyclés ou de minerais utilisés comme métaux sources). Le bismuth ou une combinaison de bismuth et de sélénium a remplacé le plomb dans ces alliages pour améliorer les caractéristiques mécaniques (Sandvig et coll., 2007). Les alliages de laiton contenant aussi peu que 0,25 % de plomb servent désormais à la fabrication des raccords et des éléments de plomberie en ligne.
Des expériences ont été menées en laboratoire pour quantifier la teneur en plomb relargué de sept alliages de laiton à faible teneur en plomb vendus sur le marché et contenant 25 % de plomb ou moins. Les essais ont été menés sur deux sources d’eau différentes, notamment une eau analysée au moyen du protocole d’essai de la norme 61 (paragraphe 9) de la NSF International (NSF) et de l’American National Standards Institute (ANSI) et une eau traitée aux chloramines de faible pH et de faible alcalinité susceptible de relarguer fortement le plomb. Les concentrations de plomb relargué par tous les alliages à faible teneur en plomb étaient inférieures à 1 µg/L dans les deux conditions de relargage pendant la durée de l’expérience, soit quatre semaines (Triantafyllidou et Edwards, 2010).
Une étude a été entreprise pour évaluer l’effet de divers paramètres de la qualité de l’eau (c.-à-d. pH, alcalinité, chlore, chloramines) sur la performance de ces laitons à faible teneur en plomb, notamment le potentiel de libération des métaux. Les concentrations de plomb normalisées obtenues par le protocole d’essai de la norme 61 (paragraphe 8) de la NSF/de l’ANSI indiquaient des concentrations très faibles de plomb pour les éléments ayant une teneur en plomb de 0,25 % ou moins (Sandvig et coll., 2012).
Une autre étude a permis d’évaluer l’effet des changements de certains paramètres clés de la qualité de l’eau (c.-à-d. eau douce et eau dure; teneur élevée en chlore; pH faible, moyen et élevé; alcalinité faible, modérée ou élevée) sur la performance et le largage des laitons sans plomb (teneur en plomb de 0,25 % ou moins). De faibles concentrations de plomb ont été observées pour tous les laitons sans plomb, dans toutes les conditions d’analyse de l’eau, pour les essais de relargage à court terme et à long terme. Les concentrations de plomb mesurées étaient toutes inférieures à 1 μg/L, la majorité des résultats étant inférieurs à la LDM de 0,16 μg/L (Turković et coll., 2014).
7.1.2.4 Stratégie d’atténuation pour les entrées de service en plomb
En règle générale, les services publics devraient encourager les consommateurs à remplacer leur portion des entrées de service en plomb afin de minimiser l’exposition au plomb (Renner, 2007; Sandvig et coll., 2008; U.S. EPA, 2011; Camara et coll., 2013; Cartier et coll., 2013). Les mesures de contrôle de la corrosion qui comprennent le remplacement partiel ou complet des entrées de service doivent prévoir une purge appropriée après le remplacement et un nettoyage des grilles ou des aérateurs des sorties d’eau afin d’en déloger les débris (Triantafyllidou et coll., 2007; Sandvig et coll., 2008; Deshommes et coll., 2010a; Cartier et coll., 2013; Del Toral et coll., 2013). Il faut encourager le consommateur à faire une purge initiale complète et à effectuer un échantillonnage une ou deux fois par semaine jusqu’à ce que le niveau de plomb se stabilise. La qualité de l’eau au robinet du consommateur doit être étroitement surveillée à la suite d’un remplacement complet ou partiel, et ce, pendant plusieurs mois après le remplacement. Les consommateurs doivent être informés de l’importance de procéder à un nettoyage régulier des aérateurs de sorties d’eau pour s’assurer qu’on élimine les particules de plomb dans le cadre de l’entretien continu (Triantafyllidou et coll., 2007; Sandvig et coll., 2008; Deshommes et coll., 2010a; Cartier et coll., 2013; Del Toral et coll., 2013). Les variations saisonnières influent sur les concentrations de plomb, ces dernières étant souvent les plus élevées au cours des mois d’été (Britton et Richards, 1981; Karalekas et coll., 1983; Colling et coll., 1987, 1992; Douglas et coll., 2004). Douglas et coll. (2004) ont fait état d’une importante variation saisonnière des concentrations de plomb, les valeurs les plus élevées s’observant de mai à novembre. Toutefois, des données plus récentes indiquent qu’un échantillonnage de routine devrait être réalisé tous les ans à la même période, de juin à octobre, surtout pour surveiller les résidences dotées d’une entrée de service en plomb, parce ce qu’on s’attend à ce que les concentrations de plomb soient les plus élevées au cours de ces mois (INSPQ, 2011; Del Toral et coll., 2013; Ngueta et coll., 2014 ).
La corrosion galvanique provoquée par le remplacement partiel des entrées de service en plomb peut être atténuée par l’utilisation de raccords en plastique qui connectent la vieille entrée de service à la nouvelle tuyauterie en cuivre (Wang et coll., 2013; Clark et coll., 2014). De la même manière, on suppose que le branchement d’une conduite en polychlorure de vinyle à l’entrée de service en plomb lors d’un remplacement partiel empêcherait également la corrosion galvanique.
Il est aussi possible de réduire provisoirement l’exposition au plomb en utilisant des dispositifs de traitement de l’eau potable. Il importe cependant de signaler que dans les situations où le remplacement d’entrées de service peut entraîner des teneurs élevées en plomb, la capacité des dispositifs de traitement est susceptible de diminuer, et il est parfois nécessaire de remplacer ces dispositifs plus fréquemment.
7.1.2.5 Stratégie d’atténuation pour les réseaux de distribution et les installations de plomberie
Comme les épisodes d’altération de la couleur (eau rouge) peuvent s’accompagner d’une libération de contaminants accumulés, y compris le plomb, ils devraient déclencher des mesures d’entretien, comme le rinçage unidirectionnel systématique du réseau de distribution, pour s’assurer que toutes les particules sont éliminées avant que l’eau ne parvienne au consommateur (Vreeburg, 2010).
La teneur en métaux-traces augmente avec la stagnation de l’eau. Étant donné que la purge de la plomberie peut réduire de façon importante les concentrations de plomb, elle est donc considérée comme une stratégie d’atténuation. Toutefois, la purge des robinets d’eau froide dans les immeubles risque de ne pas suffire pour abaisser les teneurs de l’eau en plomb (Singh et Mavinic, 1991; Murphy, 1993). Il a été démontré que la concentration de plomb dans des échantillons prélevés aux fontaines et aux robinets d’eau potable dans les écoles avait augmenté sensiblement quelques heures après une purge de 10 minutes. L’étude a conclu à la nécessité de procéder à des purges périodiques durant la journée afin de réduire les concentrations de plomb (Murphy, 1993).
Bon nombre d’études ont révélé que les diffuseurs de bulles d’air, les refroidisseurs et les robinets constituaient les sources de plomb dans l’eau potable (Gnaedinger, 1993; Bryant, 2004; Sathyanarayana et coll., 2006; Boyd et coll., 2008a, b). Les fontaines ou les composants de robinet et de plomberie peuvent contribuer grandement aux concentrations élevées de plomb aux sorties d’eau des immeubles non résidentiels (Bryant, 2004; Boyd et coll., 2008b). Ainsi, l’identification des composants problématiques et leur remplacement par des éléments sans plomb peuvent constituer la stratégie d’atténuation la plus efficace dans les écoles et les immeubles, de même que dans les résidences.
7.1.2.6 Stratégie d’atténuation des effets causés par le traitement
Certaines techniques de traitement peuvent augmenter les niveaux de plomb dans l’eau potable en changeant les caractéristiques de l’eau qui affectent le rejet de plomb. Dans le processus d’échange d’anions, utilisé pour l’enlèvement de contaminants comme l’uranium, la résine échangeuse d’ions récemment régénérée enlève les ions bicarbonate, ce qui diminue le pH et l’alcalinité totale pendant les 100 premiers volumes de lit (VL) d’un cycle. Il peut être nécessaire d’augmenter le pH de l’eau traitée au début d’un cycle (100-400 VL) afin d’éviter la corrosion (Clifford, 1999; Wang et coll., 2010; Clifford et coll., 2011). La régénération fréquente d’une résine échangeuse d’ion peut aussi avoir un impact sur la corrosion. Dans une étude de cas effectuée dans l’état du Maine, on a effectué des régénérations fréquentes de la résine échangeuse d’ion afin de diminuer les niveaux d’uranium dans les flux de déchets (résidus). Ces actions ont entrainé une diminution important et continue du pH suivie de la libération de cuivre et de plomb dans l’eau potable (Lowry, 2009, 2010). Puisque l’osmose inverse (OI) enlève continuellement et complètement l’alcalinité de l’eau, elle entrainera toujours une diminution du pH et une augmentation de la corrosivité de l’eau traitée. Par conséquent, le pH de l’eau dans le produit doit être ajusté pour éviter les problèmes de corrosion, comme la libération de plomb et de cuivre, dans le réseau de distribution (Schock et Lytle, 2011; U.S. EPA, 2012).
7.2 Échelle résidentielle
Il n’est généralement pas recommandé d’utiliser des dispositifs de traitement de l’eau potable pour un traitement additionnel des eaux déjà traitées par une municipalité. Cependant, comme la première source de plomb dans l’eau potable est le lessivage provenant des éléments de plomberie et du réseau de distribution, un dispositif résidentiel privé de traitement de l’eau potable est la meilleure option pour réduire les concentrations de plomb au robinet. Par contre, l’utilisation de tels dispositifs ne devrait pas être considérée comme une solution permanente.
Avant d’installer un dispositif de traitement, il convient de faire analyser l’eau afin d’en caractériser la chimie générale et d’en vérifier la concentration en plomb. Il faut faire analyser régulièrement par un laboratoire accrédité l’eau à son entrée et à sa sortie du dispositif de traitement pour vérifier l’efficacité de ce dernier. Les dispositifs fonctionnant par adsorption peuvent devenir moins efficaces avec l’usage et le temps et doivent donc être entretenus ou remplacés. Les consommateurs doivent suivre les instructions du fabricant en ce qui concerne la durée de vie prévue du milieu absorbant de leur dispositif de traitement.
Santé Canada ne recommande pas de marques particulières de dispositifs de traitement de l’eau potable, mais conseille vivement aux consommateurs de n’utiliser que les dispositifs certifiés par un organisme de certification accrédité comme étant conformes aux normes appropriées de la NSF International (NSF) et de l’American National Standards Institute (ANSI). Ces normes visent à préserver la qualité de l’eau potable en aidant à assurer l’innocuité des matériaux et l’efficacité des produits qui entrent en contact avec elle Les organismes de certification qui garantissent qu’un produit est conforme aux normes en vigueur doivent être accrédités par le Conseil canadien des normes (CCN). Au Canada, les organismes suivants ont été accrédités par le CCN pour pouvoir certifier que les dispositifs et les matières respectent les normes de la NSF/ANSI (SCC, 2015) :
- Groupe CSA (en anglais seulement);
- NSF International (en anglais seulement);
- Water Quality Association (en anglais seulement);
- UL LLC (en anglais seulement);
- Bureau de normalisation du Québec; et
- International Association of Plumbing and Mechanical Officials (en anglais seulement).
On peut obtenir une liste à jour des organismes de certification accrédités auprès du Conseil canadien des normes (CCN (2015).
En milieu résidentiel, les dispositifs de traitement de l’eau potable peuvent être installés au robinet (point d’utilisation) ou à l’endroit où l’eau entre dans la maison (point d’entrée) pour réduire les concentrations de contaminants. Il est préférable d’utiliser des systèmes au point d’utilisation pour éliminer le plomb, car les concentrations de plomb peuvent augmenter dans la plomberie et l’exposition à ces contaminants présents dans l’eau potable ne constitue un problème que s’ils sont ingérés (c.-à-d. que l’absorption par contact cutanée ou par inhalation ne sont pas des voies d’exposition importantes). Ainsi, ces dispositifs de traitement installés sur chaque robinet d’eau potable sont considérés comme étant le meilleur moyen de réduire les concentrations à des niveaux sécuritaires immédiatement avant la consommation d’eau ou la préparation d’aliments et de boissons.
Un certain nombre de dispositifs à usage résidentiel sont capables d’éliminer le plomb de l’eau potable. L’adsorption (c.-à-d. charbon en bloc/résine), l’osmose inverse et la distillation sont des techniques de traitement efficaces à l’échelle résidentielle pour éliminer le plomb au robinet. Il existe à l’heure actuelle des dispositifs résidentiels certifiés pour la réduction du plomb (dissous et particulaire) dans l’eau potable par un traitement d’adsorption et d’osmose inverse. Par contre, il n’y a aucun système de distillation certifié.
Pour qu’un dispositif de traitement de l’eau potable soit certifié conforme à la norme NSF/ANSI 53 (Drinking Water Treatment Units – Health Effects) pour l’élimination du plomb, il doit être en mesure de réduire une concentration de plomb de 150 µg/L dans l’influent à une concentration finale maximale (effluent) de moins de 10 µg/L (NSF/ANSI, 2013a). Ces dispositifs de traitement certifiés reposent généralement sur une technique d’adsorption sur charbon actif.
Les systèmes d’osmose inverse certifiés conformes à la norme NSF/ANSI 58 (Reverse Osmosis Drinking Water Treatment Systems) peuvent également être certifiés pour réduire le plomb à une concentration finale inférieure à 10 µg/L (NSF/ANSI, 2013b). Les systèmes d’osmose inverse certifiés conformes à cette norme sont conçus pour une installation au point d’utilisation seulement, car l’eau traitée par ceux-ci peut avoir un effet corrosif sur la plomberie. L’osmose inverse nécessite des quantités considérables d’eau de l’influent pour obtenir le volume souhaité d’eau potable, car ces systèmes rejettent une partie de l’eau de l’influent. Il arrive parfois que le consommateur doive prétraiter l’eau de l’influent afin de réduire l’encrassement et prolonger la durée de vie de la membrane.
Les systèmes de distillation certifiés conformes à la norme NSF/ANSI 62 (Distillation Drinking Water Treatment Systems) peuvent également être certifiés pour réduire le plomb à une concentration finale inférieure à 10 µg/L (NSF/ANSI, 2013c). Les systèmes de distillation qui seraient certifiés conformes à cette norme sont également conçus pour une installation au point d’utilisation seulement, pour les mêmes raisons que celles évoquées précédemment. La distillation est efficace pour réduire la quantité de contaminants inorganiques, mais elle nécessite une alimentation en énergie électrique.
En général, toutes les techniques susmentionnées devraient pouvoir réduire la teneur en plomb à des concentrations bien inférieures à 10 µg/L et atteindre la CMA proposée. Deshommes et coll. (2012b) ont étudié l’élimination du plomb à l’aide de dispositifs de filtration au point d’utilisation certifiés conformes à la norme NSF/ANSI 53 dans un grand immeuble. Les auteurs ont constaté que les dispositifs éliminaient le plomb particulaire et dissous à une concentration bien inférieure à celle pour laquelle ils étaient certifiés. Tous les dispositifs avaient permis de réduire les concentrations totales de plomb à 2,2 µg/L ou moins, même avec une concentration totale de plomb dans l’influent aussi élevée que 270 µg/L (concentration médiane de 111 µg/L) sur le terrain et sous différents profils d’utilisation.
Comme il a été mentionné précédemment, le plomb peut s’échapper de matériaux utilisés dans les réseaux d’eau potable, tels que des raccords et des éléments de plomberie. Un aspect important dont il faut tenir compte pour réduire l’exposition au plomb est de régler ce problème de relargage en exigeant que ces matériaux soient conformes aux normes sanitaires et aux normes relatives à la plomberie. La norme NSF/ANSI 61 (Drinking Water System Components – Health Effects) limite le relargage du plomb dans l’eau potable. Elle garantit que les matériaux respectent les normes de relargage établies en fonction de critères sanitaires et que leur utilisation ne présente aucun danger dans des applications servant à l’eau potable. Lorsque les matériaux sont certifiés conformes à la norme, la concentration de plomb ne doit pas dépasser la concentration permise dans le produit unitaire, qui est de 5 µg/L (NSF/ANSI, 2014). La norme NSF/ANSI 372 (Drinking Water System Components – Lead Content) évalue la teneur en plomb de composants comme les raccords de plomberie (NSF/ANSI, 2011). Pour être conformes à cette norme, les composants et les matériaux ne doivent pas contenir plus de 0,25 % de plomb, sous forme de moyenne pondérée. De nombreuses études ont démontré que l’utilisation de composants comme des robinets et autres raccords à faible teneur en plomb peut entraîner une réduction de la concentration de plomb au robinet (Sandvig et coll., 2007, 2009; Boyd et coll., 2008b; Turković et coll., 2014).
À l’heure actuelle, le CNP exige que les composants (c.-à-d. les raccords) utilisés dans des applications servant à l’eau potable respectent les normes pertinentes relatives aux raccords de plomberie (CNRC, 2010). Ces normes, soit la norme ASME A112.18.1/CSA B125.1 et la norme CSA B125.3, englobent l’obligation de se conformer aux normes NSF/ANSI 61 et 372 (CSA, 2012a, 2012b).
8.0 Cinétique et métabolisme
8.1 Absorption
L’absorption du plomb par le tractus gastro-intestinal après une exposition par voie orale dépend de l’état physiologique des personnes exposées (p. ex. âge, état de jeûne, apport de calcium et de fer) ainsi que des caractéristiques physicochimiques du plomb ingéré (p. ex. taille des particules, solubilité et espèces de plomb) (ATSDR, 2007). Deux études ont examiné l’absorption du plomb qu’on retrouve dans l’eau potable. Dans la première étude, on a administré 0,37 MBq de chlorure de plomb marqué par l’isotope 203Pb dans 100 mL d’eau à 10 hommes volontaires en bonne santé, âgés de 25 à 35 ans, qui avaient pris un déjeuner léger deux heures avant l’exposition. La rétention corporelle moyenne 96 heures après l’exposition était d’environ 21 % et variait entre 10 et 65 % (comme la mesure a été répétée, le pourcentage le plus élevé représente une moyenne de deux échantillons) (Blake, 1976). Dans la seconde étude, trois participants à l’étude de Blake (1976) se sont vu administrer 0,37 MBq de chlorure de plomb marqué par l’isotope 203Pb avec 300 μg de chlorure de plomb non marqué dans 100 mL d’eau distillée après un jeûne de 18 heures et un autre jeûne de 6 heures suivant l’exposition (Blake et coll., 1983). La rétention du plomb dans l’organisme 96 heures après l’exposition a démontré que le jeûne augmentait considérablement l’absorption du plomb, comme le montrent les niveaux moyens d’absorption d’environ 70 % (67 à 76 %) et de 15 % (11 à 23 %) des sujets à jeun et des sujets non à jeun, respectivement (Blake, 1976; Blake et coll., 1983). Chez deux sujets à qui on a administré du 203Pb et un substrat dans un repas témoin préparé avec de l’eau distillée avec et sans minéraux (qui étaient aussi à jeun 18 heures avant et 6 heures après l’exposition), on a constaté que la teneur en minéraux avait des effets importants sur l’absorption. Avec minéraux, la rétention corporelle du plomb après 96 heures chez les deux sujets était de 0,94 % et de 1,5 %, tandis qu’elle était de 65,4 % et de 71,6 % sans minéraux (Blake et coll., 1983). D’autres essais ont révélé qu’une diminution de la consommation alimentaire de calcium et de phosphore augmentait la rétention du plomb (Blake et Mann, 1983). Une étude portant sur l’exposition de xérès contenu dans un récipient en cristal de plomb a montré que 70 % de la dose était absorbée chez des sujets à jeun (Graziano et coll., 1996). L’absorption de plomb provenant des aliments a été évaluée en fonction de l’âge. Chez les adultes, la teneur en plomb absorbé variait énormément (9,7 % et jusqu’à 61 %) et augmentait avec le jeûne et un faible apport alimentaire en calcium et en phosphate (Rabinowitz et coll., 1976, 1980; James et coll., 1985). Certaines données laissent croire que le plomb est plus facilement absorbé par les nourrissons et les enfants que par les adultes. Sans jeûne, l’absorption de plomb chez des nourrissons et des enfants âgés de 3 mois à 8 ans et de 14 à 746 jours était de 41,5 % et de 53 %, avec une rétention estimée de 31,7 % et de 18 %, respectivement (Alexander, 1974; Ziegler et coll., 1978).
Un essai in vitro a permis de déterminer la bioaccessibilité des particules de plomb provenant de l’eau du robinet, selon une procédure de lixiviation visant à déterminer la bioaccessibilité relative, utilisée pour les sols, afin d’évaluer le danger associé à l’ingestion de divers types de plomb particulaire. On a évalué la bioaccessibilité des particules représentatives de celles présentes dans les réseaux de distribution d’eau potable. Les particules étaient soit générées au laboratoire, soit recueillies dans des aérateurs lors de l’échantillonnage sur le terrain. Les particules prélevées aux robinets contenaient des quantités importantes de plomb (0,003 à 71 %, médiane de 4,7 %). La bioaccessibilité des particules générées au laboratoire variait entre 2 et 96 %, selon le type de particule (plomb(II) > laiton > plomb(IV) > soudure), tandis que celle des particules recueillies sur le terrain était répartie de façon homogène entre 1,5 et 100 % (médiane de 41 %). On a constaté que le risque lié à l’ingestion de particules dépendait de la quantité et de la concentration ingérée, de même que de la bioaccessibilité des formes particulaires du plomb. L’impact du plomb particulaire sur l’exposition d’enfants de 0,5 à 7 ans a été estimé à l’aide du modèle IEUBK. Ce modèle a permis de déterminer que l’exposition était plus importante pour les particules de plomb provenant de grands immeubles dans le réseau de distribution à l’étude (Deshommes et coll., 2012c). Dans une autre étude, Deshommes et coll. (2012a) ont évalué l’impact de l’eau du robinet comme source de plomb dans les aliments préparés consommés par les enfants, notamment les boissons préparées, le riz ou les pâtes. Les auteurs ont constaté que les valeurs de bioaccessibilité du plomb provenant des aliments cuits dans l’eau variaient selon la forme du plomb. Même si les particules de plomb ne se dissolvaient pas durant la cuisson, on a constaté que le plomb dissous provenant des sources de plomb et libéré de ces particules se concentrait dans les aliments. Il a été déterminé en outre que de petites particules de plomb seraient probablement ingérées et deviendraient bioaccessibles une fois dans l’estomac.
Les données sur l’absorption après une exposition par voie orale chez l’humain sont confirmées par les observations faites chez des animaux de laboratoire. L’absorption d’acétate de plomb marqué par l’isotope 210Pb administré par gavage (6,37 mg/kg de poids corporel) était d’environ 38 % chez les macaques rhésus juvéniles, tandis qu’elle n’était que de 26 % chez les femelles adultes (Pounds et coll., 1978; ATSDR, 2007). Les ratons ont aussi absorbé plus de plomb par leur alimentation que leurs homologues adultes (Forbes et Reina, 1972; Kostial et coll., 1978). L’absorption gastro-intestinale du plomb après l’ingestion de plomb provenant du sol est généralement moindre que l’absorption de plomb dissous en raison de certains facteurs qui s’ajoutent au jeûne et à l’état nutritionnel, y compris ceux qui ont une incidence sur la mobilité du plomb dans le sol (p. ex. pH, teneur en carbone organique et capacité d’échange cationique) (ATSDR, 2007).
Comme le plomb particulaire peut être inhalé à diverses profondeurs respiratoires, l’absorption dépendra donc du dépôt de plomb dans les poumons. Le plomb associé à des particules de plus grande taille se déposera dans les voies respiratoires supérieures, ce qui déclenchera la clairance mucociliaire menant à la déglutition, puis à l’absorption gastro-intestinale du plomb. Les petites particules (c.-à-d. < 1 μm de diamètre) peuvent atteindre les voies respiratoires inférieures, où elles peuvent pénétrer dans la circulation ou être englouties par des macrophages phagocytaires. Pratiquement tout le plomb particulaire qui atteint le poumon profond est absorbé. Chez les adultes, le dépôt dans le poumon profond se situait entre 14 et 40 %, accompagné d’une rétention quasi complète de la dose déposée dans le sang (Chamberlain et coll., 1975; Wells et coll., 1975).
L’absorption par voie cutanée du plomb est beaucoup moins importante que l’absorption par voie orale et par inhalation. L’application d’une préparation cosmétique contenant de l’acétate de plomb marqué par l’isotope 203Pb sur la peau de huit hommes volontaires pendant 12 heures a révélé que le taux d’absorption était inférieur à 0,3 %, selon un comptage du corps entier et une mesure de la radioactivité urinaire normalisée en fonction du chlorure de plomb marqué par l’isotope 203Pb administré dans le sang (Moore et coll., 1980). Selon une autre étude, certaines formes solubles du plomb, comme le nitrate de plomb et l’acétate de plomb, peuvent être absorbées de façon superficielle dans la peau et potentiellement par la peau après l’application cutanée d’un papier filtre imbibé de plomb pendant 6 heures sur l’avant-bras, à des niveaux pouvant aller jusqu’à 29,5 % (Stauber et coll., 1994). Des essais in vitro réalisés sur la peau humaine indiquent que l’absorption de plomb organique dépend du composé de plomb. Le tétrabutylplomb était le plus facilement absorbé, suivi du nuolate de plomb (mélange d’oléate et de linoléate de plomb), du naphténate de plomb et de l’acétate de plomb. Les composés organiques du plomb semblent être plus facilement absorbés que les composés inorganiques du plomb. Des observations similaires ont été faites dans des essais in vitro réalisés sur du tissu cutané de cobayes (Bress et Bidanset, 1991). L’application de plomb inorganique et organique (c.-à-d. naphténate de plomb, nitrate de plomb, stéarate de plomb, sulfate de plomb, oxyde de plomb et poudre métallique de plomb) sur le dos rasé de rats a entraîné une absorption à des taux variant de 0,002 à 0,17 %, d’après la dose mesurée dans l’urine. Bien que l’absorption était faible pour tous les composés, elle l’était particulièrement pour les composés inorganiques du plomb (Sun et coll., 2002; ATSDR, 2007).
8.2 Répartition
La répartition du plomb ressemble beaucoup à celle du calcium en raison des similarités moléculaires des deux éléments. La répartition du plomb est essentiellement la même, peu importe la voie d’exposition. Une fois dans l’organisme, le plomb se retrouvera principalement dans le sang, les tissus mous et les os. La demi-vie du plomb dans le sang est d’environ 35 jours (Rabinowitz et coll., 1976). Toutefois, les os servent de réservoir au plomb, et la demi-vie biologique de celui-ci est de 20 à 30 ans environ (Patrick, 2006). Les os représentent donc 80 à 95 % du plomb total retenu chez les adultes et approximativement 70 % du plomb total retenu chez les enfants (Patrick, 2006). C’est pourquoi la mesure du plomb dans les os, qui peut se faire au moyen d’une intervention non effractive (p. ex. par radiographie), est une excellente méthode pour déterminer la charge corporelle en plomb. L’absorption et la libération du plomb par les os peuvent influer considérablement sur les plombémies.
Dans des conditions normales, la majeure partie du plomb (> 98 %) est liée aux protéines cellulaires situées dans les érythrocytes. Ce plomb non accessible ne peut donc pas passer à d’autres tissus (Schütz et coll., 1996; Bergdahl et coll., 1997, 1999; Hernández-Avila et coll., 1998; Manton et coll., 2001; Smith et coll., 2002). Le plomb qui reste peut être présent sous forme de complexes avec des composés sulfhydryles de faible poids moléculaire (p. ex. cystéine et homocystéine) dans le sérum et sous forme de plomb lié à des protéines (p. ex. albumine et γ-globulines) dans le plasma. Même s’il n’est présent qu’en petite quantité, le plomb dans le plasma est la source la plus biologiquement accessible pour absorption par d’autres tissus (Ambrose et coll., 2000). On a constaté que de petites quantités de plomb étaient capables de pénétrer les tissus de plusieurs organes, notamment le foie, les reins, les muscles squelettiques, le pancréas, les ovaires, la rate, la prostate, les glandes surrénales, le cerveau, la graisse, les testicules et le cœur, des concentrations plus élevées ayant été observées dans les os, les cheveux et les ongles. Parmi les tissus mous, l’aorte, le foie et le rein ont retenu le plus de plomb, comme l’ont montré des cadavres humains (Barry et Mossman, 1970; Barry, 1975; Gross et coll., 1975). Chez les adultes, les concentrations de plomb dans les tissus mous sont relativement constantes, il n’y a aucune accumulation au fil du temps (Gross et coll., 1975).
L’accumulation du plomb se fera dans les os, généralement dans les régions soumises à une calcification active au moment de l’exposition. En raison de l’accumulation du plomb dans les os, la biocinétique des os jouera un rôle important dans la détermination des plombémies. La résorption osseuse qui survient avec le vieillissement peut avoir des effets importants sur les plombémies, comme le suggèrent les liens significatifs établis entre l’indice de plombémie (moyenne pondérée dans le temps correspondant à l’exposition totale) et les concentrations de plomb dans les os (Fleming et coll., 1997; Chettle, 2005). On estime que le plomb stocké dans les os contribuerait jusqu’à 70 % des plombémies totales chez les adultes (Smith et coll., 1996; Gulson et coll., 1997). Le plomb osseux endogène peut également s’avérer une source importante de plomb dans le sang des enfants. On a établi que la contribution estimée du plomb osseux endogène aux plombémies chez les enfants variait entre 12 et 66 % (Gulson et coll., 1997), et des contributions allant jusqu’à 96 % ont été observées chez un enfant de 46 mois (Gwiazda et coll., 2005). Les faits montrent également que l’exposition au plomb dans la petite enfance peut aboutir à des plombémies élevées à l’âge de 19 et de 29 ans (McNeill et coll., 2000).
La ménopause et la grossesse, deux stades de la vie chez les femmes, peuvent modifier de façon importante les plombémies. Cela est attribuable à une augmentation de la résorption osseuse chez les femmes ménopausées et à une hausse des besoins en calcium chez les femmes enceintes ou qui allaitent, deux situations qui entraînent la libération du plomb stocké dans le squelette. Chez des anciennes employées de fonderie, les femmes ménopausées présentaient des plombémies beaucoup plus élevées que les femmes préménopausées (Popovic et coll., 2005). Les plombémies moyennes faisaient état d’une augmentation de 20 % chez les femmes enceintes et ayant récemment accouché (Gulson et coll., 2003). On estime que 79 à 90 % du plomb mobilisé chez les femmes enceintes peut atteindre le fœtus par l’intermédiaire du sang de cordon (Mahaffey, 1991; Gulson et coll., 2003). Le plomb s’accumule surtout dans les os du fœtus, mais il peut également atteindre les tissus mous fœtaux, notamment le foie, le cœur et le cerveau, plus tard au cours de la gestation (Mahaffey, 1991). Les plombémies après l’accouchement peuvent être particulièrement élevées. On sait qu’elles se sont accrues de 30 à 95 % (moyenne de 65 %) chez les nouvelles mères comparativement à la valeur minimale observée durant la fin de la grossesse (Gulson et coll., 2004). La teneur en plomb dans le lait et le sang maternels est en étroite corrélation avec les plombémies chez les nourrissons (Ettinger et coll., 2004; Koyashiki et coll., 2010). Les concentrations de plomb dans le lait maternel auront des effets importants sur les plombémies des nourrissons. Par conséquent, l’exposition maternelle à long terme avant la grossesse ou l’allaitement peut accroître l’exposition au plomb chez les enfants (Gulson et coll., 1998; Ettinger et coll., 2004).
8.3 Métabolisme
Le plomb inorganique forme surtout des complexes avec des protéines et des ligands non protéiques. La majorité du plomb passe dans le sérum, où le ligand principal formé est l’acide γ-aminolévulinique déshydratase (ALAD), suivi de composés sulfhydryles de faible poids moléculaire, comme la cystéine et l’homocystéine (Gonick, 2011). Quant au reste du plomb présent dans le plasma, 90 % est lié à la fraction de l’albumine (Gonick, 2011). Des protéines ayant une haute affinité pour le plomb ont été détectées dans les tissus mous (protéines cytosoliques liant le plomb à haute affinité). Elles comprennent la protéine de liaison à l’acyl-coenzyme A dans le cerveau en plus de la thymosine β4 dans le rein des humains exposés (Quintanilla-Vega et coll., 1995; Smith et coll., 1998), de même qu’un produit de clivage de la microglobuline dans le rein des rats mâles (Fowler et DuVal, 1991).
Le métabolisme des composés organiques du plomb n’a pas fait l’objet d’autant d’études. Les composés d’alkylplomb sont métabolisés par désalkylation oxydative par les enzymes du cytochrome P450 dans le foie (ATSDR, 2007). Plusieurs métabolites ont été détectés dans l’urine de travailleurs exposés au plomb tétraéthyle, notamment le plomb triéthyle, le plomb diéthyle, le plomb éthyle et le plomb inorganique (Turlakiewicz et Chmielnicka, 1985; Zhang et coll., 1994; Vural et Duydu, 1995). Des concentrations accrues de plomb triéthyle ont été mesurées dans le foie, le rein, le pancréas, le cerveau et le cœur chez trois personnes qui sont mortes d’intoxication aiguë par le plomb tétraéthyle (Bolanowska et coll., 1967).
8.4 Excrétion
Le plomb est principalement excrété par l’urine et les fèces. De petites quantités sont également éliminées dans les cheveux, les ongles et le lait maternel. Les proportions de plomb excrétées par chacune de ces voies varient selon la voie d’exposition.
L’injection intraveineuse de plomb chez l’humain, qui représente le plomb internalisé, montre qu’environ un tiers et deux tiers du plomb en circulation sont excrétés par les voies urinaire et fécale, respectivement (Chamberlain et coll., 1978). Les voies mineures d’excrétion sont notamment la sueur, la salive, les cheveux, les ongles et le lait maternel (Hursh et Suomela, 1968; Hursh et coll., 1969; Griffin et coll., 1975; Rabinowitz et coll., 1976; Chamberlain et coll., 1978, 1979; Kehoe, 1987; Stauber et coll., 1994; ATSDR, 2007).
Après exposition par voie orale, la majeure partie du plomb est éliminée par la voie fécale. Chez cinq hommes, l’excrétion du plomb après une exposition quotidienne par voie orale à du plomb marqué par un isotope stable à raison de 210 à 360 μg/jour approximativement (jusqu’à un maximum de 210 jours) était de 12 % dans l’urine (7 à 17 %) et de 90 % dans les matières fécales (87 à 94 %) (Rabinowitz et coll., 1976; ATSDR, 2007). L’ingestion de 1 à 3 mg de plomb par jour durant 208 semaines était associée à une excrétion du plomb par la voie urinaire, représentant 5 % de la dose totale ingérée (Kehoe, 1987; ATSDR, 2007).
Le ratio d’excrétion fécale/urinaire de particules de plomb inhalées dépend en grande partie de la taille des particules. On estime que les deux tiers des particules submicrométriques qui atteignent les régions bronchiolaires et alvéolaires des voies respiratoires sont excrétés dans l’urine, tandis qu’environ le tiers est excrété dans les matières fécales (Hursh et coll., 1969; Chamberlain et coll., 1978; ATSDR, 2007). La proportion de plomb éliminée dans les fèces devrait augmenter en fonction de la taille des particules en raison de l’ingestion de mucosités contenant du plomb. Le plomb qui est associé au plomb tétraéthyle et tétraméthyle peut être éliminé par l’air expiré, l’urine et les fèces. L’inhalation de plomb tétraéthyle et de plomb tétraméthyle marqués par l’isotope 203Pb a entraîné un dépôt dans les voies respiratoires de 37 % et de 51 %, respectivement; 20 % et 40 % de ces types de plomb ont été expirés dans les 48 heures qui ont suivi (ATSDR, 2007). Le reste du plomb a été éliminé dans l’urine et les fèces. L’exposition cutanée à l’acétate de plomb et au nitrate de plomb a été associée à des concentrations de plomb détectables dans la sueur et l’urine (Kehoe, 1987), bien que l’absorption du plomb par la peau soit généralement négligeable.
8.5 Modèles PBPK
La majorité des études ayant porté sur la toxicité du plomb chez l’humain ont fait appel à la plombémie comme mesure de l’exposition. Toutefois, les doses par voie orale fournissent une valeur toxicologique de référence plus flexible pour établir des recommandations pour la qualité de l’environnement relatives à l’eau potable. Trois modèles pharmacocinétiques fondés sur la physiologie (PBPK), établis et validés, permettent d’estimer la dose orale chronique de plomb qui entraînerait des CSP précises (c.-à-d. modèles d’O’Flaherty, de Leggett et IEUBK). Tous ces modèles ont été pris en compte dans l’évaluation du plomb. Ils sont donc décrits plus loin et accompagnés de détails plus précis concernant les méthodes utilisées. Il convient de souligner qu’il existe également des modèles plus simples avec facteurs de pente fondés sur des relations épidémiologiques linéaires entre la plombémie et l’absorption ou l’ingestion de plomb pour estimer les doses par voies orales à partir des CSP (JECFA, 2011; EFSA, 2013).
8.5.1 Modèle d’O’Flaherty
Le modèle d’O’Flaherty simule l’absorption et l’élimination du plomb, de la naissance à l’âge adulte (O’Flaherty, 1993, 1995b). Calibré à l’origine pour prédire les concentrations de plomb dans le sang, les os et les tissus chez le rat (O’Flaherty, 1991), ce modèle a par la suite été modifié pour tenir compte des caractéristiques anatomiques et physiologiques des enfants (O’Flaherty, 1995b) et des adultes (O’Flaherty, 1993, 1998). On a observé que les modèles pertinents pour les adultes et les enfants reproduisaient avec précision les observations sur la plombémie, sauf dans les cas où le plomb était ingéré à des concentrations très élevées (O’Flaherty, 1993, 1995b). Le modèle d’O’Flaherty prend en compte l’absorption du plomb par le tractus gastro-intestinal après ingestion et l’absorption par les voies respiratoires après inhalation, de même que les échanges de plomb entre les divers compartiments, notamment le plasma sanguin, les tissus bien perfusés (p. ex. tissus du tractus gastro-intestinal), les tissus peu perfusés (muscles, tissus adipeux), les os (os cortical et trabéculaire), le foie et les reins. L’élimination par l’urine et les matières fécales est également considérée. Plusieurs volets du modèle dépendent de différences pharmacocinétiques basées sur l’âge, notamment les taux d’absorption du plomb par le tractus gastro-intestinal, la formation et la résorption des os, la croissance des tissus et le poids corporel. L’absorption gastro-intestinale du plomb provenant de l’eau potable ou de l’alimentation diminue, passant d’un taux d’ingestion de 58 % à la naissance à 8 % après l’âge de 8 ans. Le modèle peut être modifié pour simuler la pharmacocinétique du plomb dans l’organisme des personnes sensibles, comme les femmes enceintes et les fœtus.
Le modèle d’O’Flaherty utilisé dans cette évaluation était une version C++ 1997 du code source ACSL pour les humains (O’Flaherty, 1993, 1995a, 1995b, 2000). Seul un nombre restreint de paramètres d’entrée peut être ajusté dans le modèle C++. Les données de sortie de la version C++ du modèle d’O’Flaherty se limitent à la concentration de plomb dans le sang et les os et ne comprennent pas de valeurs intermédiaires, comme l’ingestion ou l’absorption du plomb liée à des expositions environnementales. Les paramètres d’entrée du modèle d’O’Flaherty ont été réglés de façon à modéliser l’exposition au plomb et la cinétique de ce dernier de 0 à 5 ans. Les paramètres d’entrée du modèle d’O’Flaherty C++ liés à l’exposition au plomb sont limités aux concentrations dans l’environnement. Afin de déterminer la dose orale correspondante qui servira de point de départ aux fins de l’évaluation des risques, les concentrations de plomb dans tous les milieux d’exposition dans l’environnement, à l’exception de l’eau potable, ont été réglées à zéro. La concentration dans l’eau potable variait d’un passage de modèle itératif à l’autre jusqu’à ce que le résultat du modèle pour la plombémie chez un enfant de 5 ans soit égal à la plombémie cible. Des exercices de modélisation distincts ont été calculés à l’aide des versions pour hommes et pour femmes du modèle d’O’Flaherty. Les poids corporels de 18,8 kg et de 18,9 kg, les débits d’eau potable de 0,80 et de 0,95 L/jour et les biodisponibilités par voie orale de 17 % et de 17 % pour les hommes et les femmes, respectivement, ont été calculés au moyen des codes modèles décrits dans l’étude d’O’Flaherty (2000). Des paramètres d’entrée et de sortie précis, ainsi que des valeurs intermédiaires calculées par le modèle d’O’Flaherty C++ sont présentés dans un rapport technique à l’appui (Healey, 2014).
8.5.2 Modèle de Leggett
Le modèle de Leggett a été élaboré à partir d’un modèle biocinétique déployé par la Commission internationale de protection radiologique pour calculer les doses de rayonnement émises par les radionucléides présents dans l’environnement, notamment les radio-isotopes du plomb (ICRP, 1993). Des paramètres supplémentaires spécifiques pour le plomb ont servi à adapter le modèle en fonction des applications de modélisation PBPK du plomb chez les enfants et les adultes (Leggett, 1993). Le modèle peut simuler les apports de plomb par ingestion, inhalation et injection intraveineuse. Il est composé d’un compartiment central pour le plasma diffusible, ainsi que ses interactions avec le squelette (os cortical et trabéculaire), le foie, le rein, le cerveau et autres tissus mous (renouvellement intermédiaire, renouvellement rapide, rétention tenace). Les parties osseuses du modèle contiennent chacune un compartiment de surface et un compartiment de non-échange/d’échange. Le plomb pénètre dans la fraction échangeable du volume osseux par la surface de l’os, duquel il peut soit se déplacer à la fraction non échangeable de l’os (plomb stocké) soit retourner à la surface, où il peut retourner dans la circulation sanguine après résorption osseuse. En outre, le foie et le rein sont ensuite compartimentalisés pour tenir compte du transfert et de l’absorption rapides du plomb et du transfert et de l’accumulation plus progressifs. Dans le modèle de Leggett, les constantes de vitesse de transfert entre les compartiments varient selon l’âge et la plombémie. On tient compte de l’élimination par l’urine, les fèces et la sueur, de même que par les cheveux, les ongles et la peau. Dans ce modèle, l’absorption du plomb ingéré avec l’eau potable change avec l’âge; en effet, les taux d’ingestion diminuent pour passer de 0,45 L/jour à la naissance à 0,3 L/jour à l’âge d’un an et à 0,15 L/jour après l’âge de 25 ans. La validation du modèle semblait prédire les CSP chez les adultes, mais il n’y a pas suffisamment de données pour évaluer l’exactitude du modèle à prédire les CSP chez les enfants exposés (ATSDR, 2007). À faibles doses, le modèle de Leggett a tendance à surestimer les CSP (Pounds et Leggett, 1998; U.S. EPA, 2007). Le modèle permet de simuler les expositions au plomb durant toute une vie.
Pour les besoins de la présente évaluation, on a utilisé un modèle de Leggett amélioré, élaboré par le Dr Joel Pounds. Ce modèle correspond au modèle de Leggett (1993), mais comprend certains changements dans le code source FORTRAN du modèle pour faciliter la chélation de modélisation. Le modèle de Leggett est écrit en FORTRAN et distribué sous forme de programme DOS exécutable. Les données d’entrée du modèle sont définies dans un fichier d’entrée ASCII et lues dans le programme exécutable DOS. Contrairement aux autres modèles PBPK, le modèle de Leggett ne comprend pas les concentrations de plomb dans l’environnement comme paramètres d’entrée. Ainsi, la voie d’exposition par ingestion a été précisée dans les paramètres d’entrée. L’absorption du plomb provenant du tractus gastro-intestinal dans le sang est déterminée par des valeurs d’entrée pour la fraction d’absorption gastro-intestinale. La vitesse d’entrée de l’ingestion chronique du plomb variait d’un passage de modèle itératif à l’autre jusqu’à ce que la moyenne des résultats du modèle pour les CSP chez un enfant de 5 ans soit égale à la plombémie ciblée. La valeur d’entrée de la fraction d’absorption gastro-intestinale était de 100 % pour toutes les exécutions du modèle. Le poids corporel ne fait pas partie des paramètres du modèle de Leggett; par conséquent, on utilise le poids corporel par défaut pour un enfant de 4 ou 5 ans du modèle IEUBK (18,2 kg). Des paramètres d’entrée et de sortie précis ayant recours au modèle amélioré de Leggett sont présentés dans un rapport technique à l’appui (Healey, 2014).
8.5.3 Modèle IEUBK
Le modèle IEUBK a été élaboré pour les enfants de 0 à 7 ans afin de prédire la probabilité de plombémie élevées (U.S. EPA, 1994a, 1994b; White et coll., 1998). Le modèle se divise en quatre sous-modèles : un modèle d’exposition, un modèle d’absorption, un modèle biocinétique et un modèle de probabilité de plombémie. Le modèle d’exposition simule l’absorption du plomb provenant de l’eau potable, de l’air, de l’alimentation ou de la poussière du sol, tandis que le modèle d’absorption simule l’absorption par les voies gastro-intestinales et respiratoires. On suppose que le taux d’absorption du plomb provenant de l’eau potable et de l’alimentation à l’âge de 30 mois est de 0,5 % et qu’il diminue ensuite à 0,11 %. Le modèle biocinétique inclut un compartiment plasmatique central et ses interactions avec les os (os cortical et trabéculaire), les érythrocytes, le rein, le foie et autres tissus mous, de même que trois voies d’élimination (urine, fèces, peau/cheveux/ongles). Le modèle, qui varie en fonction de l’âge, simule la croissance des tissus corporels, les volumes des compartiments et les concentrations de plomb dans chaque compartiment. On suppose que la plombémie à la naissance équivaut à 85 % de la plombémie maternelle. Le modèle de probabilité de plombémie permet d’estimer les plombémies des enfants exposés dans des conditions précises. Comme les plombémies peuvent varier considérablement chez les enfants qui présentent une exposition similaire, le modèle simule les effets combinés des sources de variabilité en tant que distribution log-normale de la plombémie de laquelle la moyenne géométrique est appliquée dans la dérivation du modèle de probabilité de plombémie. Par ailleurs, une extension du modèle IEUBK qui inclut des simulations de Monte Carlo peut être utilisée pour simuler la variabilité et l’incertitude de l’exposition et de l’absorption (Goodrum et coll., 1996). Des efforts considérables ont été déployés pour valider le modèle IEUBK. On a comparé les prévisions modélisées des CSP chez les enfants aux observations tirées d’études épidémiologiques menées sur quatre sites d’enfouissement de déchets dangereux (Hogan et coll., 1998). La moyenne géométrique prévue des CSP se situait à plus ou moins 0,7 µg/dL de la moyenne géométrique des CSP observée pour chacun des sites. De plus, la prédiction du pourcentage d’enfants ayant une plombémie supérieure à 10 µg/dL se situait à plus ou moins 4 % du pourcentage observé pour chaque site. Une autre étude ayant comparé les concentrations de plomb dans l’eau aux données sur les CSP et aux estimations IEUBK réelles a également permis de confirmer la validité du modèle, avec un certain degré de surestimation pour les enfants qui habitaient dans des logements équipés d’une entrée de service en plomb (Deshommes et coll., 2013). De nombreux facteurs peuvent influer sur la concordance entre les CSP prévues par le modèle et les CSP réelles, notamment l’étendue dans laquelle les mesures d’exposition au plomb et de plombémie correspondent adéquatement et les facteurs propres au site pouvant avoir une incidence sur l’ingestion ou l’absorption de plomb (Bowers et Mattuck, 2001). On sait que le code informatisé du modèle IEUBK (IEUBK version 0.99d) met en œuvre de façon précise le modèle conceptuel, comme le montrent la validation et la vérification indépendantes (Zaragoza et Hogan, 1998).
La version du modèle IEUBK utilisée dans cette évaluation était la version pour Windows (version 1.1, sous-version 11). Afin de déterminer la dose par voie orale correspondante à utiliser comme point de départ aux fins de l’évaluation des risques, la concentration de plomb dans tous les milieux d’exposition environnementaux, à l’exception de l’eau potable, était fixée à zéro. La concentration de plomb dans l’eau potable variait d’un passage de modèle itératif à l’autre jusqu’à ce que le résultat du modèle pour la moyenne géométrique de la plombémie chez des enfants de 4 à 5 ans et des enfants de 5 à 6 ans soit égal à la plombémie ciblée. Dans le modèle IEUBK, on a utilisé le débit de consommation d’eau potable par défaut de 0,55 L/jour et la biodisponibilité du plomb dans l’eau potable par défaut de 50 %. Le poids corporel supposé du modèle des enfants de 4 à 5 était de 18,2 kg. Les valeurs d’absorption du plomb déclarées dans les données d’entrée du modèle IEUBK correspondaient, de façon uniforme, à environ 93 à 97 % des valeurs d’absorption du plomb calculées comme valeurs intermédiaires tirées des paramètres d’entrée du modèle. On ne sait pas exactement si les valeurs de 3 à 7 % ont été prises en compte pour le modèle; il est donc possible que la dose orale équivalente pour atteindre la plombémie ciblée soit en réalité légèrement supérieure. Des paramètres d’entrée et de sortie précis de même que les valeurs intermédiaires calculées à l’aide du modèle IEUBK sont présentés dans un rapport technique à l’appui (Healey, 2014).
9.0 Effets sur la santé
On sait depuis longtemps que le plomb est la cause de divers problèmes de santé. Ainsi, de nombreuses études ont documenté les effets indésirables sur la santé chez les humains et les animaux de laboratoire exposés. Comme les concentrations de plomb dans l’environnement ont chuté considérablement depuis quelques années, davantage de données épidémiologiques sur les effets du plomb à faible dose sont devenues accessibles. Ces données ont démontré que des effets toxiques liés au plomb peuvent survenir à des niveaux d’exposition beaucoup plus faibles que prévu. Dans bien des cas, on peut observer les effets toxiques du plomb à des CSP inférieures à 10 µg/dL (ce qui correspond à des niveaux d’intervention qui font actuellement l’objet d’une révision; Santé Canada, 2013a). À la lumière de ces nouveaux éléments, le survol de la documentation présentée dans ce rapport porte surtout sur les effets du plomb à faible dose chez l’humain et les animaux de laboratoire. Dans le cas des études épidémiologiques, l’accent a été mis sur les études longitudinales et les méta-analyses, dans la mesure du possible, puisque ces études ont davantage de poids quant à l’interprétation de la toxicité du plomb. La toxicité du plomb chez l’humain et les animaux de laboratoire a également été examinée en détail (CIRC, 2006; ATSDR, 2007; Santé Canada, 2013c).
9.1 Effets chez l’humain
9.1.1 Toxicité aiguë
Les signes d’intoxication par le plomb se manifestent surtout par des effets neurologiques et gastro-intestinaux divers : apathie, irritabilité, faible capacité d’attention, céphalées, étourdissements, faiblesse, perte de mémoire, douleur épigastrique, constipation, vomissements, anorexie, paresthésie, anémie et convulsions (ATSDR, 2007). Dans les cas graves, l’encéphalopathie, le coma et la mort peuvent survenir (ATSDR, 2007). On a signalé des cas d’encéphalopathie à des CSP relativement élevées, soit 100 à 120 μg/dL chez les adultes et 80 à 100 μg/dL chez les enfants (Smith et coll., 1938; NAS, 1972; OMS, 2011). Cependant, des symptômes neurologiques, gastro-intestinaux et musculosquelettiques aigus peuvent se manifester à des CSP inférieures à 40 μg/dL (Baker et coll., 1979; Hänninen et coll., 1979; Awad El Karim et coll., 1986; Holness et Nethercott, 1988; Marino et coll., 1989; Matte et coll., 1989; Rosenman et coll., 2003). Des effets gastro-intestinaux et musculosquelettiques aigus ont été observés à des CSP aussi faibles que 30 à 39 μg/dL et peut-être à des concentrations aussi basses que 25 à 30 μg/dL en ce qui concerne les effets neurologiques (Rosenman et coll., 2003). Une toxicité aiguë grave liée au plomb est également associée à des effets sur les tubules proximaux du rein, comme l’ont montré les symptômes apparentés au syndrome de Fanconi chez les enfants et les adultes, notamment l’excrétion d’acides aminés, de glucose et de phosphates dans l’urine (Chisolm et coll., 1955; Goyer et coll., 1972; Loghman-Adham, 1998).
9.1.2 Toxicité subchronique, toxicité chronique et cancérogénicité
9.1.2.1 Effets neurologiques
Les données épidémiologiques suggèrent fortement l’existence d’un lien entre l’exposition au plomb et divers effets neurologiques indésirables chez les adultes. De tels effets ont été observés dans le cadre d’études transversales portant sur des travailleurs du plomb qui présentaient des CSP élevées variant entre 40 et 80 μg/dL. Parmi les effets observés, mentionnons des mouvements oculaires saccadés (Baloh et coll., 1979; Glickman et coll., 1984), des changements du potentiel évoqué sensoriel (Araki et coll., 1987; Counter et Buchanan, 2002), des signes de diminution de la performance cognitive, dont la perte de mémoire, un temps de réaction plus lent et des problèmes de conceptualisation verbale (Haenninen et coll., 1978; Arnvig et coll., 1980; Mantere et coll., 1982; Baker et coll., 1983; Hogstedt et coll., 1983; Campara et coll., 1984; Stollery et coll., 1989, 1991; Stollery, 1996), de même que l’altération de l’état psychologique, comme une humeur dépressive et la fatigue (Baker et coll., 1983; Maizlish et coll., 1995). La fonction des nerfs périphériques, mesurée par la vitesse de conduction des nerfs stimulés électriquement, a été touchée à des CSP aussi faibles que 30 μg/dL (Seppalainen et coll., 1983; Chia et coll., 1996), tandis que d’autres études n’ont révélé aucun lien important entre la fonction nerveuse et la plombémie (Spivey et coll., 1980; Ishida et coll., 1996).
En ce qui concerne les effets neurologiques indésirables induits par le plomb, l’appui le plus solide provient d’études prospectives qui ont suivi des populations pendant de nombreuses années, de même que d’études sur le plomb dans les os qui révèlent le stockage du plomb au fil du temps. Dans une étude menée auprès de travailleurs du plomb canadiens exposés pendant 17,1 ans en moyenne (les valeurs variant de 0,2 à 26 ans) et dont la plombémie a été évaluée plusieurs fois par année, la plombémie cumulative (moyenne = 728,2 ± 434,36 [μg/dL]·année) et la plombémie moyenne au cours de la période d’emploi (moyenne = 39,0 ± 12,32 μg/dL) ont été associées à des difficultés d’apprentissage auditif et verbal; ces résultats englobaient les effets sur le stockage de la mémoire et la remémoration, mais non sur l’apprentissage, l’attention ou l’empan de mémoire immédiats (Bleecker et coll., 2005). De plus, on a démontré chez 54 travailleurs finlandais du domaine des batteries d’accumulateurs présentant une exposition au plomb à long terme bien documentée (1 à 30 années d’emploi) que les CSP dépassant environ 50 μg/dL pouvaient entraîner des effets indésirables de longue durée sur les fonctions du système nerveux central (Hänninen et coll., 1998). Certaines données semblent indiquer que ces effets neurologiques indésirables peuvent être réversibles dans une certaine mesure lorsqu’on réduit l’exposition au plomb. La preuve en a été faite chez des travailleurs d’usines de production de glacis à base de plomb, chez qui les CSP sont passées de 26,3 à 8,3 μg/dL sur une période de quatre ans, et chez des fondeurs de plomb présentant des CSP qui dépassaient 40 μg/dL avant 1980, mais qui étaient inférieures à ce niveau par la suite (Lindgren et coll., 2003; Chuang et coll., 2005). Des études sur les concentrations de plomb dans le tibia, un indicateur de l’exposition au plomb à long terme, ont été constamment associées à des effets neurologiques indésirables à des concentrations se situant entre 10,5 et 57,0 μg/g (Khalil-Manesh et coll., 1993; Shih et coll., 2006; Weuve et coll., 2009). Une corrélation a même été établie entre les concentrations de plomb dans le tibia et une baisse de la fonction cognitive ainsi qu’une réduction du volume cérébral total, de la matière grise frontale et totale, de même que de la matière blanche pariétale chez les travailleurs du plomb (Stewart et coll., 2006).
Plusieurs études ont exploré les effets du plomb à de très faibles plombémies (p. ex. < 10 μg/dL) (Muldoon, 1996; Nordberg et coll., 2000; Louis et coll., 2003; Wright et coll., 2003; Krieg et coll., 2005). Une faible corrélation entre la plombémie et un diagnostic de tremblement essentiel a été observée dans le cadre d’une étude cas-témoin réalisée auprès de patients atteints de tremblement essentiel (100 patients, plombémie moyenne = 3,3 ± 2,4 μg/dL, âge moyen = 70,7 ans) et d’un groupe témoin (143 témoins, plombémie moyenne = 2,6 ± 1,6 μg/dL, âge moyen = 66,2 ans) (Louis et coll., 2003). L’exposition professionnelle au plomb au cours de la vie était similaire chez les patients et le groupe témoin, et l’association était significative après ajustement pour tenir compte des effets de confusion potentiels (rapport des cotes [RC] = 1,19, intervalle de confiance [IC] à 95 % = 1,03-1,37). Les effets sur le tremblement essentiel sont corroborés dans deux études cas-témoin réalisées auprès de populations distinctes exposées dans leur milieu de vie, qui ont révélé un lien entre les plombémies et les incidences de tremblement essentiel (Louis et coll., 2005; Dogu et coll., 2007). De plus, il a été démontré que les individus porteurs de l’allèle ALAD-2 seraient plus vulnérables au tremblement essentiel induit par le plomb (Louis et coll., 2005). On ne sait pas tout à fait si les plombémies élevées ont précédé ou suivi le diagnostic. Ce point nécessiterait une évaluation plus approfondie en ce qui concerne les atteintes cérébrales causées par le plomb dans le temps et l’apparition du tremblement essentiel. Toutefois, la prévalence du tremblement essentiel serait probablement supérieure à 1 à 6 % si une plombémie de 3,3 μg/dL était associée à elle seule à cet effet neurologique indésirable.
Deux études ont fait appel à une batterie de tests neurocomportementaux et neuropsychologiques en vue d’examiner les effets cognitifs indésirables chez les adultes lorsque la plombémie était inférieure à 10 μg/dL (Muldoon, 1996; Krieg et coll., 2005). Dans le cadre d’une étude sur les fractures ostéoporotiques, Muldoon (1996) a procédé un large éventail de tests neurologiques visant à mesurer la mémoire, le langage, l’aptitude visuo-spatiale, l’état intellectuel et l’action sensori-motrice auprès de 325 femmes habitant en région rurale (âge moyen = 71,1 ans) et de 205 femmes habitant en région urbaine (âge moyen = 69,4 ans). Les femmes des régions rurales et des régions urbaines présentaient des plombémies moyennes de 4,5 μg/dL et de 5,4 μg/dL, respectivement. Un lien significatif n’a été établi que chez les femmes habitant en région rurale à des concentrations de 4 à 7 μg/dL pour le test des tracés et le test de substitution de chiffres et de symboles, et à des concentrations supérieures à 7 μg/dL pour les tests de temps de réaction. Toutefois, les femmes habitant en région urbaine n’ont présenté aucun effet neurologique indésirable, même à des plombémies de 8 μg/dL et plus. L’étude a tenu compte des effets de confusion importants comme l’âge, la scolarité, ainsi que la consommation de tabac et d’alcool, chez des personnes soumises à des expositions non liées au travail. Les raisons qui expliquent l’absence d’effets chez les femmes en milieu urbain sont peut-être liées à d’autres facteurs inconnus. Contrairement aux résultats observés chez les femmes en milieu rural, aucun effet important n’est ressorti lors des tests de temps de réaction simple, des tests de substitution de chiffres et de symboles et des tests d’apprentissage de séries de chiffres dans une population âgée de 20 à 59 et dont les plombémies variaient de 0,7 à 41,8 μg/dL (plombémie moyenne = 3,30 μg/dL) (4 937 participants, données tirées de la troisième enquête américaine NHANES [National Health and Nutrition Examination Survey]) (Krieg et coll., 2005). On a constaté que ces résultats étaient probablement liés à l’absence d’effets à faible dose chez les adultes ou, au contraire, que des tests précis ou la taille de l’échantillon n’ont pas permis de détecter de tels effets subtils à faible dose.
Deux autres études ont permis d’examiner la performance de personnes âgées au mini-examen de l’état mental (MMSE). Le MMSE évalue divers critères relatifs à l’orientation dans le temps et dans l’espace, à la mémoire, à l’attention, au langage et au raisonnement. Les scores faibles, généralement 23 ou moins sur une échelle de 30, sont associés à une baisse de la fonction cognitive et à un risque accru de démence (Folstein et coll., 1975; Santacruz et Swagerty, 2001). Wright et coll. (2003) ont examiné une population de personnes âgées dans le cadre de l’Étude normative du vieillissement, au cours de laquelle le MMSE a été administré à 1 031 personnes en même temps que la prise de mesure de la plombémie. On a observé un lien important entre la plombémie et les scores du MMSE inférieurs à 24 (RC = 1,21, IC à 95 % = 1,07-1,36), après ajustement pour tenir compte des covariables, dans le groupe d’étude qui affichait une plombémie moyenne de 4,5 μg/dL. Des interactions significatives entre la plombémie et l’âge semblent indiquer que des plombémies moyennes de 5,9 μg/dL et plus peuvent accélérer la neurodégénérescence liée à l’âge. Par contre, le plomb osseux n’était pas étroitement associé aux résultats défavorables du MMSE ou à la neurodégénérescence liée à l’âge, à l’exception d’une interaction importante liée à l’âge avec la teneur en plomb dans la patella dans le groupe affichant un résultat de 57,6 μg/g. Cependant, dans une autre étude, aucune association n’a été observée entre la plombémie et le score du MMSE dans une population composée de 762 hommes âgés (âge moyen = 88,4 ans) avec une plombémie moyenne de 3,7 μg/dL (Nordberg et coll., 2000). Ainsi, certaines données laissent entendre que les plombémies inférieures à 10 μg/dL peuvent accélérer la neurodégénérescence et la démence dans une population vieillissante. Néanmoins, il convient de souligner que les cas de dégénérescence progressive survenant plus tôt dans la vie en raison d’une exposition au plomb antérieure n’ont pas été complètement examinés dans le cadre de ces études.
Ainsi, des éléments de preuve confirment que des plombémies inférieures à 10 μg/dL entraînent des effets neurologiques indésirables. Par contre, l’association entre les plombémies faibles et les critères d’effets neurologiques indésirables était généralement équivoque, et un nombre important de données n’étayent pas les effets neurologiques indésirables induits par le plomb. En outre, les analyses étaient fondées sur des mesures uniques des plombémies au moment de l’examen, ce qui limite notre compréhension des répercussions des plombémies faibles sur les effets neurologiques indésirables à long terme.
9.1.2.2 Effets cardiovasculaires
Des données épidémiologiques tirées d’études sur le plomb dans le sang et les os semblent établir un lien entre l’exposition au plomb et plusieurs effets cardiovasculaires indésirables, notamment l’élévation de la pression artérielle et le risque d’hypertension, l’apparition d’une maladie artérielle périphérique de même qu’un risque accru de morbidité et de mortalité par maladies coronariennes et cérébrovasculaires (Navas-Acien et coll., 2007; Vaziri et Gonick, 2008).
Parmi les effets cardiovasculaires examinés, l’élévation de la pression artérielle systolique est le critère d’évaluation le plus étudié et représente la valeur probante la plus forte en faveur d’une relation de cause à effet. Des associations statistiquement significatives, bien que généralement faibles, ont été observées dans les trois méta-analyses examinant les effets du plomb dans le sang sur la pression artérielle (Staessen et coll., 1994a; Schwartz, 1995; Nawrot et coll., 2002) ainsi que dans une autre méta-analyse des effets du plomb osseux sur la pression artérielle (Navas-Acien et coll., 2008). Cinq études longitudinales importantes ont également permis d’examiner le lien entre la plombémie et la pression artérielle systolique (Weiss et coll., 1986; Moller et Kristensen, 1992; Staessen et coll., 1996; Glenn et coll., 2003, 2006). Dans trois des cinq études, ce lien serait significativement positif après un ajustement tenant compte de covariables, même si ces études concernaient des populations soumises ou ayant été soumises à des expositions professionnelles au plomb. Glenn et coll. (2006) ont examiné la teneur en plomb dans le sang et le tibia de 575 travailleurs affichant une plombémie moyenne de départ de 31,4 μg/dL et suivis pendant trois ans. Chaque hausse de 10 μg/dL de la plombémie était associée à une augmentation annuelle de la pression artérielle systolique de 0,9 mm Hg (0,12 kPa), même si aucune association n’a été observée avec le plomb dans le tibia. Une autre étude longitudinale menée auprès de 70 policiers exposés professionnellement et suivis pendant cinq ans a révélé un lien important avec la pression systolique, mais uniquement à des plombémies dépassant 30 μg/dL (Weiss et coll., 1986). L’étude de Glenn et coll. (2003) était considérée comme la plus pertinente, parce que l’exposition est survenue 18 ans auparavant en moyenne et que les concentrations moyennes de plomb dans le sang et le tibia de 496 individus étaient jugées normales, soit 4,6 μg/dL (début de l’étude) et 14,7 μg/g (la troisième année), respectivement. Les mesures ont été prises trois ou quatre fois pour chaque participant et corrigées en fonctions des divers effets de confusion, notamment l’âge, l’indice de masse corporelle, la consommation d’alcool, le tabagisme et la scolarité. Une augmentation annuelle moyenne de la pression systolique de 0,64 mm Hg (0,085 kPa) a été signalée pour chaque accroissement d’un écart-type de plombémie (2,6 μg/dL) par rapport à la plombémie au début de l’étude. L’association significative entre la plombémie de départ et les changements annuels de la pression systolique était plus forte chez les personnes ayant une concentration de plomb antérieure dans le tibia plus faible, ce qui semble indiquer que la relation observée est moins susceptible d’être liée à une exposition professionnelle antérieure.
Sur les deux études qui n’ont pas permis de conclure à une association significative entre la plombémie et la pression artérielle systolique, l’une portait sur une population exposée dans son milieu de vie (Staessen et coll., 1996). Dans cette étude, on a examiné la pression artérielle systolique et diastolique, de même que l’hypertension auprès de 339 hommes et de 345 femmes. Les plombémies et de nombreuses mesures de la pression artérielle ont été prises au début de l’étude (plombémie moyenne = 8,7 μg/dL) et après une période médiane de suivi de 5,2 ans, au cours de laquelle la plombémie moyenne a chuté à 2,9 μg/dL. Lors du suivi, la pression artérielle a été également mesurée au moyen d’un système de surveillance ambulatoire sur 24 heures pour recueillir les renseignements les plus exacts possible. Il s’est avéré que la plombémie n’avait aucun effet constant sur la pression artérielle et qu’elle n’augmentait pas non plus le risque d’hypertension aux concentrations étudiées (< 30 μg/dL). Dans une autre étude longitudinale portant sur l’hypertension (mais pas la pression artérielle) chez les hommes vieillissants (de l’Étude normative du vieillissement), les plombémies élevées n’étaient pas associées à une incidence accrue d’hypertension, même si la relation entre le plomb osseux et l’hypertension était importante (Cheng et coll., 2001). Dans la seconde étude longitudinale non liée au travail, aucun effet important sur la pression systolique n’a été observé chez les personnes qui présentaient, au début de l’étude, des CSP de 13,6 μg/dL pour les hommes et de 9,6 μg/dL pour les femmes après des examens de suivi à 5 et à 11 ans, respectivement, une fois les ajustements faits pour tenir compte des covariables (Moller et Kristensen, 1992).
Des données probantes tendent à démontrer que certaines sous-populations, notamment les Afro-Américains, les femmes enceintes et ménopausées, ainsi que les enfants, seraient davantage sensibles aux effets cardiovasculaires indésirables induits par le plomb. Dans une étude, on a examiné les plombémies et la pression artérielle chez 10 548 personnes de race blanche et 4 404 Afro-Américains (Vupputuri et coll., 2003). Après les ajustements apportés pour tenir compte des divers effets de confusion possibles, on a mesuré une augmentation du RC de 1,39 (IC à 95 % = 1,21-1,61) chez les femmes afro-américaines. Aucun effet sur la pression artérielle n’a été attribué à la plombémie chez les personnes de race blanche. Les plombémies égales ou supérieures à 5 μg/dL étaient étroitement liées à une pression artérielle systolique et diastolique plus élevée chez les Afro-Américains, hommes et femmes. Des effets importants sur la pression systolique chez les Afro-Américains, mais pas chez les Blancs, ont été signalés dans l’étude de Den Hond et coll. (2002) qui ont utilisé la même cohorte, de même que dans l’étude de Scinicariello et coll. (2011). Le plomb a également été associé à des hausses de la pression artérielle liées à la grossesse. Les plombémies étaient beaucoup élevées chez les femmes atteintes d’hypertension gravidique que chez les femmes enceintes non hypertendues durant les deuxième et troisième trimestres de grossesse (les plombémies moyennes étaient de 2,2 μg/dL chez les sujets hypertendus et de 1,9 μg/dL chez les sujets non hypertendus). Une autre étude a montré une association importante entre la pression artérielle de la mère et la plombémie dans le cordon ombilical à de très faibles concentrations (on a estimé la plombémie maternelle moyenne à 0,86 μg/dL d’après des données sur le cordon ombilical) (Wells et coll., 2011). On ne peut toutefois tirer de conclusions définitives de ces données, parce que les mesures de la pression artérielle ont été prises durant le travail et l’accouchement, un moment de stress important, avec les effets prévus sur la pression artérielle. Nash et coll. (2003) ont examiné la pression artérielle et la prévalence de l’hypertension chez 2 165 femmes périménopausées et ménopausées, et déterminé que l’hypertension avait nettement augmenté chez les femmes dont la plombémie variait entre 4,0 et 31,1 μg/dL, des associations plus étroites ayant été observées chez les femmes ménopausées. En outre, une étude menée auprès de 122 enfants (tous âgés de 9,5 ans) pour lesquels on disposait de données sur le sang de cordon et la plombémie mesurée dans la petite enfance a démontré qu’une plombémie dépassant 2,9 μg/dL peut accroître les réactions au stress par la résistance vasculaire chez les enfants (Gump et coll., 2005) et que l’exposition au plomb est associée à la dysrégulation cardiovasculaire et du système nerveux autonome chez les enfants (Gump et coll., 2011).
Peu d’études ont examiné avec attention la morbidité et la mortalité liées aux maladies cardiovasculaires à la suite d’une exposition prolongée au plomb. La mortalité découlant d’une maladie cardiovasculaire, d’un accident vasculaire cérébral ou de toutes causes confondues était nettement augmentée à des plombémies de 3,6 μg/dL et plus dans une importante étude prospective menée auprès de 13 946 adultes dans le cadre de l’étude américaine NHANES dont la supervision s’est échelonnée sur 12 ans (Menke et coll., 2006). Après un ajustement multivariable tenant compte de l’âge, du sexe, de l’indice de masse corporelle, du tabagisme, de la consommation d’alcool, du statut socioéconomique et d’autres indicateurs de la santé générale, les rapports des risques étaient de 1,25 (IC à 95 % = 1,04-1,51) et de 1,55 (IC à 95 % = 1,08-2,24) pour la mortalité toutes causes confondues et la mortalité cardiovasculaire, respectivement. Dans un sous-ensemble de la même cohorte (2 125 participants de plus de 40 ans au début de l’étude), les RC de la maladie artérielle périphérique n’avaient que légèrement augmenté à une plombémie de 2,9 μg/dL et plus (RC = 2,88, IC à 95 % = 0,87-9,47) après ajustements pour tenir compte des facteurs démographiques et de risque de maladie cardiovasculaire (Navas-Acien et coll., 2004). Schober et coll. (2006) ont en outre démontré chez 9 757 participants de la même cohorte âgés de plus de 40 ans que les plombémies dépassant 10 μg/dL étaient associées à la mortalité causée par des maladies cardiovasculaires (risque relatif [RR] = 1,55; IC à 95 % = 1,16-2,07).
Bien que les données épidémiologiques soient plus ou moins uniformes, la preuve est suffisante pour conclure que l’exposition au plomb est liée à des effets cardiovasculaires indésirables et pour étayer un lien de cause à effet entre la plombémie et la pression artérielle systolique. Même si les hausses de la pression artérielle déclarées étaient relativement faibles, elles risquent toutefois d’entraîner des répercussions considérables sur la santé des populations. À l’aide de distributions de la pression artérielle systolique chez les Canadiens, on a estimé qu’une augmentation de 1 % de la pression systolique dans l’ensemble de la population entraînerait un risque additionnel, ajusté selon le sexe et l’âge, de mortalité par coronaropathie de 1 sur 2000 chez les adultes de 35 à 74 ans (bien que les hommes présentent une plus grande susceptibilité, représentant environ 80 % des décès) (Healey et coll., 2010). Par conséquent, même une hausse subtile de la pression artérielle devrait être considérée comme un effet indésirable pour la santé lié au plomb potentiellement important.
9.1.2.3 Effets rénaux
Il existe des données probantes sur les effets rénaux indésirables de l’exposition au plomb. Des déficiences fonctionnelles graves et des modifications pathologiques peuvent être observées à des plombémies excédant 50 µg/dL (ATSDR, 2007), bien que des plombémies beaucoup plus faibles soient associées à une dysfonction rénale. Un examen de la documentation épidémiologique a permis de conclure que le plomb contribue à la néphrotoxicité, même à des plombémies inférieures à 5 µg/dL, surtout chez les populations vulnérables comme les hypertendus et les diabétiques, et les personnes qui sont déjà atteintes d’une maladie rénale chronique (Ekong et coll., 2006).
Des marqueurs de la dysfonction rénale, notamment la réduction du débit de filtration glomérulaire, la réduction de la clairance de la créatinine (estimée d’après l’analyse de la créatinine dans le sérum et dans l’urine recueillie durant 24 heures) et l’augmentation de la créatinine sérique, ont été signalés à des plombémies observées dans l’environnement. Parmi ces marqueurs, le débit de filtration glomérulaire est considéré comme étant le plus fiable, et il a été étudié chez 820 femmes suédoises qui présentaient une plombémie médiane de 2,2 µg/dL (Åkesson et coll., 2005). Même si l’étude était en fait axée sur l’exposition au cadmium, l’utilisation du plomb comme variable de confusion a révélé des liens importants entre la hausse de la plombémie et la réduction du débit de filtration glomérulaire, de même que la clairance de la créatinine. Aucune interaction significative entre la teneur en plomb dans le sang et la teneur en cadmium dans le sang n’a été observée.
D’autres études épidémiologiques portant sur les plombémies observées dans l’environnement se sont concentrées exclusivement sur les taux de créatinine. Dans l’étude de Kim et coll. (1996), des échantillons de sang congelé prélevés auprès de 459 participants masculins de l’Étude normative du vieillissement tous les 3 à 5 ans, de 1979 à 1994, ont servi à déterminer le lien entre la plombémie et la créatinine sérique au fil du temps. On a constaté une association significative parmi les sujets dont la plombémie n’avait jamais dépassé 9,9 µg/dL tout au long de l’étude. Une augmentation de la plombémie par un facteur de 10 a également permis de prédire une augmentation de la créatinine sérique de 0,08 mg/dL, ce qui correspond à un vieillissement d’environ 20 ans. Deux études supplémentaires ont fait état de réductions notables de la clairance de la créatinine après une exposition au plomb dans l’environnement, même si les taux de créatinine n’ont pas été étudiés au fil des années (Staessen et coll., 1992; Payton et coll., 1994). Ces résultats ont été relevés dans une population de 965 hommes et de 1 016 femmes présentant des plombémies moyennes de 11,4 µg/dL et de 7,5 µg/L, respectivement, et pour lesquelles les données ont été ajustées pour tenir compte de l’exposition simultanée au cadmium et d’autres covariables. Une augmentation de la plombémie par un facteur de 10 était associée à une réduction de la clairance de la créatinine, de l’ordre de 10 à 13 mL/minute (Staessen et coll., 1992). Dans la seconde cohorte (la même que celle de l’étude Kim et coll., 1996), dans laquelle une association positive a été établie, on a examiné 744 hommes affichant une plombémie moyenne de 8,1 µg/dL (Payton et coll., 1994).
D’après certaines données probantes, les populations sensibles peuvent être particulièrement vulnérables aux effets rénaux indésirables. Muntner et coll. (2003) ont étudié les effets rénaux auprès de 4 813 adultes hypertendus (plombémie moyenne = 4,21 µg/dL) et de 10 398 adultes non hypertendus (plombémie moyenne = 3,30 µg/dL). Bien qu’aucune association n’ait été établie chez les personnes non hypertendues, les hypertendus présentaient une augmentation significative ou peu significative des RC pour un taux élevé de créatinine sérique (RC = 1,47, IC à 95 % = 1,03-2,10) et les maladies rénales chroniques (RC = 1,44, IC à 95 % = 1,00-2,09) après ajustements pour tenir compte des effets de confusion appropriés à des plombémies aussi faibles que 2,5 à 3,8 µg/dL. Des RC ajustés plus élevés pour la créatinine sérique et les maladies rénales chroniques ont été signalés dans deux autres groupes présentant des plombémies plus élevées (3,9 à 5,9 µg/dL et 6,0 à 56,0 µg/dL), l’effet étant proportionnel à la dose. Des données laissant entendre que certains sous-groupes risquent davantage de manifester des effets rénaux indésirables à la suite d’une exposition au plomb ont également été mentionnées dans Tsaih et coll. (2004) par des liens importants entre les concentrations de plomb (dans le sang et dans les os) et le taux de créatinine sérique chez les diabétiques et les hypertendus, mais pas dans l’ensemble de la population à l’étude. On ne sait pas avec certitude si les enfants sont plus vulnérables que les adultes aux effets rénaux indésirables. Une réduction du débit de filtration glomérulaire a été signalée au sein d’une population de 769 adolescents en bonne santé présentant une plombémie médiane de 1,5 µg/dL (Fadrowski et coll., 2010).
Il existe donc des preuves cohérentes que des effets rénaux indésirables se manifestent à de faibles plombémies, certaines démontrant que les plombémies chroniquement inférieures à 10 µg/dL peuvent entraîner une dysfonction rénale. Les populations sensibles, notamment les personnes hypertendues ou diabétiques, peuvent être particulièrement vulnérables aux effets rénaux indésirables induits par le plomb. La plombémie la plus faible associée à un effet était de 2,5 à 3,8 µg/dL dans une population hypertendue, et des données probantes laissent croire que certains effets surviennent à des plombémies aussi faibles que 2,2 µg/dL. Il faut savoir qu’il est possible qu’une insuffisance rénale se traduise par une altération de la clairance de la créatinine et, ainsi, à une hausse des plombémies. Bien que cette situation soit plus susceptible de se produire à la suite de lésions rénales considérables, on ne peut pas exclure ce facteur de confusion possible des études sur la toxicité rénale.
9.1.2.4 Cancer
Les études épidémiologiques qui ont évalué le lien entre l’exposition à long terme et l’incidence de cancer et la mortalité par cancer ont mené à des constatations à la fois positives et négatives. D’après ces études, le plomb est probablement cancérogène à de fortes doses.
Un certain nombre d’études ont examiné la survenue de cancers dans des populations exposées en milieu de travail. Deux méta-analyses ont été effectuées. Dans l’une d’elles, on a passé en revue toutes les études disponibles sur le cancer dans lesquelles une exposition professionnelle au plomb inorganique avait eu lieu, y compris les études pour lesquelles l’exposition était connue, mais non quantifiable (Fu et Boffetta, 1995). Les RR étaient de 1,1 (IC à 95 % = 1,05-1,17), de 1,33 (IC à 95 % = 1,18-1,49), de 1,29 (IC à 95 % = 1,10-1,50) et de 1,41 (IC à 95 % = 1,16-1,71) pour l’ensemble des cancers, le cancer de l’estomac, le cancer du poumon et le cancer de la vessie, respectivement. Si on limite les méta-analyses aux études sur les expositions intenses au plomb (les travailleurs de fonderie et d’usines de batteries seulement), on constate une augmentation des RR pour les cancers de l’estomac (RR = 1,50, IC à 95 % = 1,23 à 1,83) et du poumon (RR = 1,44, IC à 95 % = 1,29-1,62). Ces résultats démontrent une augmentation de l’incidence de cancer liée à la dose en ce qui concerne l’exposition à des composés de plomb inorganiques. La seconde méta-analyse s’est attardée uniquement à huit études faisant état de mesures précises du degré d’exposition ou de la plombémie (plombémie moyenne située entre 26 et 80 µg/L) (Steenland et Boffetta, 2000). Des éléments corroborent l’incidence accrue de cancer du poumon (RR = 1,30, IC à 95 % = 1,15-1,46) et de cancer de l’estomac (RR = 1,34, IC à 95 % = 1,14-1,57). Dans le cas du cancer du poumon, l’association est demeurée importante après l’exclusion d’une étude qui peut avoir été faussée par l’exposition à l’arsenic (RR = 1,14, IC à 95 % = 1,04-1,73). L’augmentation du nombre de cancers à d’autres sièges, notamment le rein et le cerveau, n’était pas significative. Il faut savoir que ces études ne pouvaient pas tenir compte des facteurs de confusion possibles, dont le tabagisme, les habitudes alimentaires et l’exposition à certains produits chimiques. Par conséquent, les conclusions de ces études doivent être interprétées avec prudence.
Des études qui ont examiné la survenue de cancers après l’exposition de travailleurs dans des sites industriels à forte présence en plomb ou par des mesures de la plombémie ont fait état d’associations positives et négatives. Parmi les études qui ont signalé des associations positives, des effets significatifs ont été observés pour les cancers du poumon, du système nerveux central, du cerveau, du rein, de l’estomac et tous sièges confondus (CIRC, 2006). Des preuves plus fortes et constantes de causalité ont été présentées pour le cancer du poumon (Sheffet et coll., 1982; Gerhardsson et coll., 1986; Ades et Kazantzis, 1988; Anttila et coll., 1995; Lundström et coll., 1997; Wong et Harris, 2000; Englyst et coll., 2001), le cancer de l’estomac (Sheffet et coll., 1982; Gerhardsson et coll., 1986; Wong et Harris, 2000) et les cancers tous sièges confondus (Jemal et coll., 2002; Lustberg et Silbergeld, 2002; Schober et coll., 2006) que pour d’autres cancers. Toutefois, les associations établies étaient souvent équivoques et mettaient en cause une exposition concomitante à d’autres substances chimiques, notamment le chromate de zinc, l’arsenic, le cadmium ou d’autres cancérogènes potentiels. En outre, l’absence d’information disponible dans la plupart des études n’a pas permis de bien tenir compte de covariables additionnelles.
Parmi les études susmentionnées, peu ont démontré un lien étroit entre le risque de cancer et l’exposition au plomb à des doses présentes dans l’environnement. Schober et coll. (2006) ont étudié 9 757 membres de la population générale participant à l’étude américaine NHANES et chez qui une seule mesure de la plombémie a été prise. Tous les groupes d’âge étant pris en compte (≥ 40 ans), le RR de la mortalité pour tous les types de cancer était de 1,44 (IC à 95 % = 1,12-1,86) et de 1,69 (IC à 95 % = 1,14-2,52) pour ceux qui présentaient des plombémies de 5 à 9 µg/dL et des CPS ≥ 10 µg/dL, respectivement, par rapport au groupe de référence (plombémie < 5 µg/dL). L’étude, une large cohorte, a été ajustée en fonction du sexe, de la race/l’origine ethnique, de la scolarité et du tabagisme. Il convient de noter qu’une analyse de la même cohorte composée d’adultes âgés de 20 ans et plus, au lieu de 40 ans et plus, n’a révélé aucune association significative entre la mortalité par cancer et la plombémie à des plombémies inférieures à 10 µg/dL (Menke et coll., 2006). Étant donné que l’étude Schober et coll. (2006) a examiné un plus grand intervalle de plombémie, et que la mortalité par cancer liée à l’exposition au plomb est peu probable dans les groupes d’âge inférieurs, cette étude a été jugée plus sensible que l’étude de Menke et coll. (2006). Pourtant, une seule mesure de la plombémie a été prise, et cette absence de suivi au fil des années réduit notre capacité de déterminer de façon concluante que les cancers sont liés à l’exposition au plomb. Une étude a porté sur le cancer du poumon après un suivi à long terme de la plombémie (plombémies cumulatives après des mesures annuelles chez des travailleurs de fonderie) (Englyst et coll., 2001). Même si un nombre important de cas de cancer du poumon a été observé chez les travailleurs exposés au plomb, l’étude est faussée par une exposition substantielle à l’arsenic.
Bon nombre de ces études ont fait état d’effets négatifs liés au cancer, et l’interprétation des études associées à un résultat positif était souvent minée par une exposition concomitante à d’autres substances et par l’omission de tenir compte d’autres facteurs de confusion. Toutefois, la mortalité par cancer était légèrement accrue dans une étude pertinente sur le plan environnemental qui a évalué la relation dose-réponse et qui a tenu compte d’importants facteurs de confusion. Comme il est peu probable que toutes les constatations positives aient été attribuables à des variables de confusion seulement, les données relatives au cancer chez l’humain semblent indiquer que l’exposition au plomb est associée à des effets cancérogènes, surtout lors d’expositions plus intenses, comme en milieu professionnel.
9.1.3 Toxicité pour la reproduction et le développement
9.1.3.1 Effets sur la reproduction
Parmi les effets indésirables de l’exposition au plomb sur la reproduction, mentionnons les retards de maturation sexuelle chez l’homme et la femme, une augmentation des avortements spontanés et des naissances prématurées, une réduction du poids à la naissance, ainsi qu’une diminution de la concentration de spermatozoïdes.
Des éléments de preuve cohérents existent relativement au retard de la puberté chez les femmes à la suite d’une exposition au plomb dans l’environnement. Les effets de l’exposition environnementale au plomb sur la maturation sexuelle ont été étudiés chez 600 Blanches, 805 Afro-Américaines et 781 Mexicano-Américaines âgées de 8 à 18 ans. Des retards importants dans le développement des seins et des poils pubiens de même que dans l’apparition des premières règles ont été observés chez les filles afro-américaines à une plombémie moyenne de 3 µg/dL, par rapport à une plombémie de 1 µg/dL. Ces mêmes plombémies ont également retardé le développement des seins et des poils pubiens chez les Mexicano-Américaines, bien que les filles de race blanche n’aient pas été touchées de façon significative (Selevan et coll., 2003). Dans une autre étude portant sur la même population de filles, les plombémies supérieures à 2,1 µg/dL étaient associées à des retards de développement des poils pubiens et d’apparition des premières règles, mais pas à des retards de développement des seins (Wu et coll., 2008). L’importance de ces retards a augmenté proportionnellement à la hausse des concentrations, et les deux études ont été ajustées pour tenir compte des effets de confusion importants. Le développement des seins et des poils pubiens, de même que l’apparition des premières règles à l’âge de 13 ans ont été considérablement perturbés chez des filles africaines présentant une plombémie supérieure à 5 µg/dL par rapport à celles dont la plombémie était inférieure à 5 µg/dL (la plombémie moyenne chez les 1 683 filles participantes était de 4,9 µg/dL) (Naicker et coll., 2010). Dans une étude de moindre envergure portant sur l’exposition à plusieurs substances chimiques, notamment le plomb, le mercure, l’hexachlorobenzène et les biphényles polychlorés, les filles dont la plombémie était supérieure à la médiane, soit 1,2 µg/dL, avaient leurs premières règles 10,5 mois plus tard que celles dont la plombémie se situait sous la médiane (Denham et coll., 2005). L’augmentation de la plombémie n’était pas associée à un retard de développement des seins dans une étude urbaine réalisée auprès de 192 filles âgées de 9 ans présentant une plombémie moyenne de 2,4 µg/dL, bien que l’absence d’association puisse être liée à la taille de la population de cette étude restreinte (Wolff et coll., 2008).
D’autres données laissent entendre que l’exposition au plomb pourrait être associée à la ménopause précoce. Des plombémies plus élevées ont été mesurées chez des femmes ménopausées par rapport à celles qui avaient encore leurs règles, après ajustement pour tenir compte du renouvellement de la masse osseuse, de l’âge et d’autres covariables, à des concentrations aussi faibles que 1,4-2,1 µg/dL (Mendola et coll., 2013). Dans une étude sur le plomb osseux, en tant que mesure de l’exposition cumulative au plomb, les concentrations de plomb dans le tibia dépassant 13 µg/g étaient associées à une diminution de 1,21 an de l’âge à la ménopause. Aucune association n’a été établie pour la teneur en plomb dans la patella ou la teneur en plomb dans le sang (la plombémie médiane était de 3 µg/dL) (Eum et coll., 2012). Ensemble, les effets signalés pour la puberté et la ménopause donnent à penser que l’exposition au plomb peut écourter la durée de vie reproductive de la femme.
Des concentrations accrues de plomb chez les femmes enceintes ont été associées à une augmentation des avortements spontanés et des naissances prématurées, de même qu’à une diminution du poids à la naissance. Toutefois, les données épidémiologiques obtenues pour ces paramètres sont uniformes. Une étude bien menée a porté sur des avortements spontanés chez 668 femmes enceintes ayant participé à l’étude durant leur premier trimestre. Après de multiples ajustements pour tenir compte de covariables, on a constaté que chaque hausse de 5 µg/dL de la plombémie était associée à un RC de 1,8 pour l’avortement spontané (IC à 95 % = 1,1-3,1) (Borja-Aburto et coll., 1999). Dans une autre étude, on a estimé qu’une augmentation de 0,1 % du ratio de plomb plasma/sang (le plasma contenant la fraction toxicologiquement active du plomb) était associée à une incidence accrue d’avortement spontané de l’ordre de 12 % (Lamadrid-Figueroa et coll., 2007). Vigeh et coll. (2010) ont toutefois constaté qu’il n’y avait aucune différence significative entre les plombémies des femmes qui avaient subi un avortement spontané et celles des femmes qui poursuivaient leur grossesse (3,51 µg/dL et 3,83 µg/dL, respectivement). Une hausse de la teneur en plomb dans les os a été associée à une diminution du poids et de la taille à la naissance (González-Cossío et coll., 1997; Hernandez-Avila et coll., 2002). Une augmentation de la plombémie maternelle au cours des premier et deuxième trimestres de grossesse (moyennes de 7,2 µg/dL et de 6,3 µg/dL, respectivement) était associée à un accouchement prématuré (Cantonwine et coll., 2010).
Des effets sur la reproduction masculine, notamment la baisse de la fécondité après une exposition paternelle et la diminution de la concentration des spermatozoïdes, ont également été signalés, mais généralement à des plombémies plus élevées (> 30 µg/dL) (Alexander et coll., 1996; Sallmén et coll., 2000; Shiau et coll., 2004). La relation dose-réponse a été examinée dans les trois études, mais n’a été démontrée que dans deux populations. Il est à noter que ces études n’ont pas toujours mesuré les effets de confusion importants ni effectué les ajustements nécessaires pour en tenir compte. Une étude portant sur l’exposition environnementale a permis d’examiner la puberté chez 489 garçons de 8 à 9 ans. Des plombémies supérieures à 5 µg/dL ont été associées à des marqueurs tardifs du développement pubertaire basé sur le stade de maturité des organes génitaux et du volume des testicules (Hauser et coll., 2008; Williams et coll., 2010).
L’exposition au plomb peut donc nuire au système reproducteur masculin et féminin. Une puberté tardive chez les femmes semble être le critère d’effet traduisant la plus grande sensibilité, des preuves indiquant des effets à des plombémies aussi faibles que 1,2 µg/dL. Toutefois, la force de cette association est limitée par les rares études qui se sont penchées sur cet effet. Les deux études ayant mis en évidence un effet significatif ont été menées auprès de la même population, et il existe une autre étude à résultat négatif chez les filles vivant en milieu urbain.
9.1.3.2 Effets sur le développement neurologique
Les effets sur le développement neurologique, ou effets neurodéveloppementaux, liés à une diminution de l’intelligence, de l’attention et de la performance sont signalés depuis longtemps chez les nourrissons et les enfants exposés au plomb tôt dans la vie et même avant la naissance. Un nombre considérable de données mettent en cause de faibles niveaux d’exposition (plombémie < 10 µg/dL) dans ces effets indésirables. Les effets délétères de l’exposition au plomb qui se manifestent chez les enfants en développement peuvent avoir des répercussions sanitaires et socioéconomiques permanentes.
Des études épidémiologiques ont associé la plombémie, la teneur en plomb dans les dents et la dentine et, dans certain cas, la plombémie dans le cordon ombilical et la plombémie maternelle à des effets neurodéveloppementaux indésirables chez les nourrissons et les enfants, notamment une diminution de la fonction neuromotrice (Dietrich et coll., 1993b; Wasserman et coll., 2000; Ris et coll., 2004; Després et coll., 2005; Fraser et coll., 2006; Boucher et coll., 2012), de mauvais résultats scolaires et des difficultés de lecture et de calcul (Needleman et Gatsonis, 1990; Fergusson et coll., 1997; Lanphear et coll., 2000; Al-Saleh et coll., 2001; Wang et coll., 2002; Miranda et coll., 2007; Chandramouli et coll., 2009; Huang et coll., 2012), un comportement anormal (Fergusson et coll., 1993; Bellinger et coll., 1994a; Needleman et coll., 1996; Dietrich et coll., 2001; Parajuli et coll., 2013, 2014), une diminution de l’attention ou des fonctions exécutives (Bellinger et coll., 1994b; Canfield et coll. 2003b; Chiodo et coll., 2004, 2007; Braun et coll., 2006; Nigg et coll., 2008; Wang et coll., 2008; Bouchard et coll., 2009; Froehlich et coll., 2009; Ha et coll., 2009; Cho et coll., 2010; Kim et coll., 2010; Nicolescu et coll., 2010) de même que des déficiences de la fonction visuelle et de la fonction auditive (Schwartz et Otto, 1991; Dietrich et coll., 1992; Fox et coll., 1997; Osman et coll., 1999; Rothenberg et coll., 2002; Canfield et coll., 2004; Fox et coll., 2008). Dans la plupart des cas, ces associations ont été signalées à des plombémies inférieures à 10 µg/dL après ajustement pour tenir compte des effets de confusion (Osman et coll., 1999; Lanphear et coll., 2000, 2005; Canfield et coll., 2003a; Chiodo et coll., 2004, 2007; Després et coll., 2005; Fraser et coll., 2006; Téllez-Rojo et coll., 2006; Miranda et coll., 2007; Chandramouli et coll., 2009).
Des données probantes semblent indiquer qu’un lien existe entre l’exposition au plomb et des changements de comportement liés à l’attention, comme le trouble d’hyperactivité avec déficit de l’attention (THADA), dans des études menées auprès d’enfants âgés de 3 à 18 ans, à des plombémies inférieures à 5 µg/dL (Chiodo et coll., 2004, 2007; Braun et coll., 2006; Nigg et coll., 2008, 2010; Wang et coll., 2008; Froehlich et coll., 2009; Ha et coll., 2009; Cho et coll., 2010; Kim et coll., 2010; Boucher et coll., 2012). Selon une méta-analyse, il existe une association modeste mais significative entre l’exposition au plomb, mesurée par les concentrations de plomb dans le sang, les dents et les cheveux, et les symptômes du THADA, dont l’inattention et l’hyperactivité/impulsivité (Goodlad et coll., 2013). Au terme d’une étude sur la prévalence du THADA menée chez 4 704 enfants âgés de 4 à 15 ans, Braun et coll. (2006) ont déterminé que les plombémies excédant 2 µg/dL étaient corrélées à un risque 4,1 fois plus élevé de THADA (IC à 95 % = 1,2-14,0), avec une association qui est demeurée importante lorsque les plombémies utilisées pour l’analyse étaient restreintes à moins de 5 µg/dL. Dans la même cohorte d’enfants, mais uniquement ceux âgés entre 8 et 15 ans, les plombémies supérieures à 1,3 µg/dL étaient associées à un risque 2,3 fois plus élevé de THADA (IC à 95 % = 1,5-3,8) (Froehlich et coll., 2009). Une association entre la plombémie et le THADA (de type mixte, mais pas de type inattentif prédominant) a été établi chez 236 enfants âgés de 6 à 17 ans qui affichaient de très faibles plombémies (plombémie maximale de 2,2 µg/dL) après le contrôle des effets de confusion (Nigg et coll., 2010). Une étude de cohorte a démontré qu’une hausse de la plombémie de 1 µg/dL chez des enfants âgés de 3 à 5 ans (plombémie moyenne = 6,4 µg/dL) entraînait une augmentation du score de comportement déclaré par les enseignants de 0,32 pour la réactivité émotionnelle (IC à 95 % = 0,058-0,587), de 0,25 pour les problèmes d’anxiété (IC à 95 % = 0,016-0,500) et de 0,30 pour les troubles envahissants du développement (IC à 95 % = 0,046-0,560) (Liu et coll., 2014). Il est possible que les effets sur l’attention puissent être la cause sous-jacente des effets du plomb sur le quotient intellectuel (QI). Des études longitudinales supplémentaires seront utiles pour déterminer les effets réels du plomb sur l’attention.
La performance aux tests psychométriques d’intelligence (c.-à-d. les tests de QI) est de loin le critère d’effet neurodéveloppemental le plus documenté et qui présente le poids de la preuve le plus important en ce qui concerne les effets à des niveaux d’exposition faibles. La baisse du QI est nettement associée à des limitations sur le plan de la réussite scolaire et des perspectives d’emploi; le QI peut donc être utilisé comme substitut pour les nombreuses autres conséquences neurologiques indésirables au-delà des répercussions immédiates d’une performance réduite sur les tests d’intelligence. Des études portant sur 12 cohortes ont permis d’examiner les effets de la plombémie sur le QI des enfants après la prise de multiples mesures de la plombémie, de la naissance jusqu’au moment de l’évaluation. Les données tirées de quatre de ces cohortes fournissent les preuves solides d’une baisse du QI à la suite d’une exposition précoce au plomb, même si ces preuves concernent en général des personnes très exposées ou des enfants ayant été exposés à des concentrations élevées et faibles de plomb tout au long de leur vie (Baghurst et coll., 1992; Tong et coll., 1996; Factor-Litvak et coll., 1999; Wasserman et coll., 2000; Canfield et coll., 2003a; Chen et coll., 2005; Jusko et coll., 2008). Toutefois, dans une de ces cohortes, on a clairement démontré la présence d’effets à des plombémies inférieures à 10 µg/dL. Dans une étude réalisée auprès de 172 enfants, pour la plupart afro-américains, la plombémie concomitante, la plombémie moyenne à vie, la plombémie moyenne durant la petite enfance et la plombémie maximale étaient liées de près à une diminution des scores de QI après ajustement pour tenir compte des effets de confusion et elles sont demeurées importantes lorsque la population était limitée aux personnes dont la plombémie maximale n’avait jamais dépassé 10 µg/dL (Canfield et coll., 2003a). Dans la même cohorte, des impacts indésirables sur le QI ont été mesurés à la plombémie maximale, soit 2,1 µg/dL (Jusko et coll., 2008). Six des autres cohortes ont étayé l’association entre la plombémie et la baisse du QI chez les enfants, sans atteindre la signification statistique (Bellinger et coll., 1992; Dietrich et coll., 1993a; Shen et coll., 1998; Schnaas et coll., 2000; Gomaa et coll., 2002; Ris et coll., 2004; Téllez-Rojo et coll., 2006), tandis que seulement deux cohortes n’ont montré aucune association (Ernhart et coll., 1987, 1989; Cooney et coll., 1989a, 1989b). Néanmoins, l’ensemble des données probantes confirmant des effets sur une diminution du QI s’avère solide lorsqu’on tient compte de la persistance de l’effet durant l’enfance et le début de l’âge adulte. Même si une étude a confirmé que l’exposition au plomb durant l’enfance entraînait des scores de QI inférieurs chez les adultes de 28 à 30 ans (Mazumdar et coll., 2011), des études longitudinales ultérieures qui se prolongent à l’âge adulte seraient nécessaires pour conclure de façon catégorique qu’une baisse du QI subsiste au cours de la vie.
Dans l’ensemble, quatre méta-analyses ont permis d’étudier la relation entre les plombémies avant et après la naissance et la performance aux tests psychométriques au moyen des données provenant des études longitudinales susmentionnées et d’autres études transversales (Needleman et Gatsonis, 1990; Thacker et coll., 1992; Pocock et coll., 1994; Schwartz, 1994a). Ces méta-analyses concluent à l’unanimité que les données épidémiologiques penchent en faveur d’un lien entre une augmentation de la plombémie et une baisse du QI. Une étude en particulier a examiné les effets de l’exposition au plomb sur la baisse du QI à l’aide de données longitudinales exclusivement (Lanphear et coll., 2005). L’ensemble de données regroupées comprenait 1 333 sujets de différents horizons, soit quatre cohortes d’Américains – Boston (Massachusetts) (Bellinger et coll., 1992), Cincinnati et Cleveland (Ohio) (Ernhart et coll., 1989; Dietrich et coll., 1993a) et Rochester (New York) (Canfield et coll., 2003a) –, ainsi que trois autres cohortes de Mexico (Mexique) (Schnaas et coll., 2000), de Port Pirie (Australie) (Baghurst et coll., 1992) et du Kosovo (Yougoslavie) (Wasserman et coll., 2000). Dans toutes les études, on a mesuré le QI à l’aide de la même méthode (c.-à-d. les échelles d’intelligence de Wechsler pour enfants), et on disposait de données sur les mêmes covariables (c.-à-d. QI et état matrimonial de la mère, consommation d’alcool et de tabac durant la grossesse, qualité de l’environnement familial mesurée par les résultats à l’entrevue HOME [Home Observation for Measurement of the Environment], sexe, rang de naissance et poids du sujet à la naissance). Les données américaines disposaient de renseignements sur l’origine ethnique; toutefois, le statut socioéconomique, l’état nutritionnel et le QI du père n’ont pas évalués. L’analyse portait sur des enfants présentant des plombémies inférieures à 10 µg/dL (chez environ 18 % des enfants, les plombémies n’ont jamais dépassé 10 µg/dL) et sur diverses mesures de la plombémie, notamment la plombémie concomitante (plombémie mesurée le plus près possible dans le temps de l’administration des tests de QI, médiane = 9,7 µg/dL), la plombémie maximale (médiane = 12,7 µg/dL), la plombémie moyenne à vie (moyenne de 6 mois à la plombémie concomitante, médiane = 12,4 µg/dL) et la plombémie durant la petite enfance (plombémie moyenne chez les enfants âgés de 6 à 24 mois, médiane = 12,7 µg/dL). Globalement, la plombémie concomitante était la plus fortement associée à une baisse du QI, et la gravité de l’effet a augmenté plus fortement à de faibles plombémies qu’à des plombémies élevées. Des hausses de la plombémie de 2,4 à 10 µg/dL et de 10 à 20 µg/dL se sont traduites par des baisses de 3,9 (IC à 95 % = 2,4-5,3) et de 1,9 (IC à 95 % = 1,2-2,6) points au test de QI, respectivement (entre 20 et 30 µg/dL, les changements de QI n’étaient pas significatifs). De plus, le QI était nettement plus touché par une augmentation de la plombémie chez les enfants présentant des plombémies maximales < 7,5 µg/dL que chez ceux présentant des plombémies maximales ≥ 7,5 µg/dL, ce qui indique que la relation dose-réponse pour l’exposition au plomb est probablement plus sensible à de faibles doses et confirme que les effets sur le QI peuvent survenir à de très faibles plombémies. L’Autorité européenne de sécurité des aliments (EFSA) et le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) ont utilisé les données de Lanphear et coll. (2005) pour établir des doses de référence (BMD) correspondant à un changement de 1 % de la réponse (BMD01), soit 1,2 et 0,8 µg/dL, respectivement (JECFA, 2011; EFSA, 2013). Crump et coll. (2012) ont procédé à une réévaluation statistique des données. Même si les auteurs ont observé des problèmes possibles liés à certaines des hypothèses principales et à de petites erreurs, la nouvelle analyse confirme la validité des conclusions avancées par Lanphear et coll. (2005).
Des éléments de preuve montrent également un lien entre l’exposition au plomb in utero, mesurée par la plombémie de la mère ou la plombémie du cordon ombilical, et des effets sur le développement neurologique des enfants, même si ces associations ne sont pas aussi fortes que les éléments de preuve mesurés pour les plombémies postnatales. Des plombémies de la mère et des plombémies du cordon ombilical inférieures à 5 µg/dL ont été toutes deux associées à des effets indésirables sur l’intelligence, la mémoire et les fonctions cognitives chez les nourrissons âgés de 7 à 36 mois (Emory et coll., 2003; Jedrychowski et coll., 2009; Parajuli et coll., 2013). Toutefois, des associations négatives ont été signalées dans bon nombre des études ayant examiné les plombémies maternelles inférieures à 10 µg/dL (Baghurst et coll., 1992; Bellinger et coll., 1992; Dietrich et coll., 1993b; Parajuli et coll., 2014). Selon une étude, une plombémie maternelle moyenne de 7,8 µg/dL entre 28 et 36 semaines de grossesse était associée à une baisse de la performance aux tests de QI chez les enfants de 6 à 10 ans (Schnaas et coll., 2006). La force de l’association est toutefois limitée par des plombémies moyennes postnatales qui dépassaient 10 µg/dL chez les enfants. Même si certaines données laissent croire que le fœtus en développement n’est peut-être pas touché à de très faibles doses auxquelles des effets ont été observés chez des enfants, rien ne permet de déterminer que le fœtus est moins sensible aux effets du plomb que l’enfant en développement.
Ainsi, des plombémies aussi faibles que 0,8 µg/dL ont été associées à des effets neurodéveloppementaux indésirables chez les enfants. Ces effets sont surtout liés à une baisse de l’intelligence, et peuvent également comprendre des changements dans l’attention et le comportement. Même si les données disponibles qui permettent d’évaluer la réversibilité de ces effets sont insuffisantes, certaines études semblent indiquer la possibilité de changements permanents dans le cerveau des adultes exposés au plomb durant la petite enfance et l’enfance (Yuan et coll., 2006; Cecil et coll., 2008, 2011; Brubaker et coll., 2009). La plupart des études qui se sont penchées sur les effets des plombémies inférieures à 5 µg/dL sur le QI des enfants ne permettent pas d’établir un seuil sous lequel le plomb ne provoque pas d’effets indésirables. Il faut savoir qu’une étude ayant examiné les effets sur le QI auprès du plus grand nombre d’enfants présentant une plombémie inférieure à 5 µg/dL n’a relevé aucune relation inverse significative entre plombémie et QI à des concentrations inférieures à 5 µg/dL, et n’a fait état d’un effet significatif sur le QI qu’à une concentration de 5 à 10 µg/dL, en utilisant comme groupe de référence des enfants présentant des plombémies de 1 à 2 µg/dL (Surkan et coll., 2007). Toutefois, si on tient compte de toutes les études disponibles, le poids de la preuve suggère que la plombémie considérée comme ne causant pas de préjudice est inconnue.
Des variations relativement faibles du QI peuvent entraîner des répercussions notables sur la santé de la population. On estime qu’une baisse de 1 % du QI de la population (ce qui correspond à une perte d’un point de QI) est associée à un risque supplémentaire de léger retard mental chez une personne sur 250 (Healey et coll., 2010). Par conséquent, tout changement, même minime, du QI dans la population doit être considéré comme un important effet indésirable pour la santé lié au plomb.
9.2 Effets chez les animaux de laboratoire
9.2.1 Toxicité aiguë
On dispose de très peu d’information sur la toxicité aiguë du plomb chez l’animal. Les doses orales les plus faibles de plomb capables de causer la mort et qui ont été signalées étaient de 191 à 1 366 mg/kg de poids corporel chez le chien, de 313 à 20 500 mg/kg de poids corporel chez le cobaye et de 160 mg/kg de poids corporel chez le pigeon (Sax et Lewis, 1989; ATSDR, 1999). La dose la plus faible administrée par injection intrapéritonéale et qui aurait provoqué la mort chez le rat est de 1 000 mg/kg de poids corporel (Sax et Lewis, 1989).
9.2.2 Exposition de courte durée
9.2.2.1 Effets neurologiques
Les effets neurologiques de l’exposition au plomb ont été abordés dans quelques études sur le singe et le rat. Il s’est avéré que des singes adultes présentaient des déficiences neurologiques liées à l’apprentissage spatial et des déficits de la mémoire à court terme lorsqu’ils étaient exposés dès la naissance à l’acétate de plomb à des doses de 50 et de 100 μg/kg de poids corporel par jour (Rice et Karpinski, 1988). Il en est résulté des plombémies à l’état d’équilibre de 11 et de 13 μg/dL à 50 et 100 μg/kg de poids corporel par jour, respectivement (les animaux non exposés présentaient une plombémie de 3 μg/dL). Une série de tests supplémentaires ont été menés sur des singes exposés par voie orale à un véhicule ou à l’acétate de plomb à raison de 2,1 mg/kg de poids corporel par jour, 5 jours par semaine, selon trois scénarios d’exposition : exposition à une dose de plomb dès la naissance; exposition à une dose de plomb de la naissance jusqu’à l’âge de 400 jours, suivie d’une exposition à un véhicule; et exposition à une dose de véhicule de la naissance jusqu’à l’âge de 300 jours, suivie d’une exposition au plomb (Rice, 1990, 1992b, 1992c; Rice et Gilbert, 1990a, 1990b). Les animaux ont présenté des plombémies se situant entre 19 et 26 μg/dL durant la période d’exposition et jusqu’à 32 à 36 μg/dL lorsque le traitement était administré en plus d’une préparation pour nourrissons (les plombémies des témoins variaient entre 3 et 6 μg/dL). Divers tests neurocomportementaux portant sur la discrimination spatiale et non spatiale, de même que des épreuves à intervalles fixes au cours desquelles l’obtention d’une récompense pour une réponse est retardée pendant une période de temps précise ont été menés chez les animaux âgés de 6 à 9 ans. En grande partie, les tests se sont avérés significatifs pour tous les scénarios d’exposition (Rice, 1990, 1992b; Rice et Gilbert, 1990a), à l’exception d’un test de discrimination non spatiale au cours duquel aucun effet n’a été observé lorsque l’exposition survenait dans la petite enfance seulement (Rice et Gilbert, 1990b). Ces résultats portent à croire que les expositions qui surviennent exclusivement à l’âge adulte ou durant la petite enfance suffisent à produire des effets neurocomportementaux indésirables persistants chez les primates non humains. Des marqueurs de la maladie d’Alzheimer, notamment la modification de l’expression des gènes liés à la maladie (protéine précurseur amyloïde [APP], enzyme de clivage du site bêta de l’APP et facteur de transcription Sp1 [protéine de spécificité 1]) et la production accrue de protéines et de plaques bêta-amyloïdes dans le cortex d’association frontal, ont été observés chez les mêmes animaux exposés de la naissance jusqu’à l’âge de 400 jours et analysés à l’âge de 23 ans (plombémie = 19 à 26 μg/dL) (Wu et coll., 2008). Ces données laissent entendre que l’exposition en début de vie peut entraîner des effets neurologiques latents à l’âge adulte.
Des effets neurocomportementaux indésirables de l’exposition au plomb ont également été observés chez le rat. Des rats âgés de 21 jours, de 8 mois et de 16 mois, qui représentent des animaux jeunes, adultes et âgés, respectivement, ont été exposés à 0, à 2 ou à 10 mg d’acétate de plomb par jour dans de l’eau à boire (Cory-Slechta et Pokora, 1991; Cory-Slechta et coll., 1991). Les plombémies étaient relativement constantes à 3, 6 et 9 mois et similaires chez tous les animaux en ce qui concerne les doses d’acétate de plomb de 2 mg/jour (plombémie se situant entre 10,8 et 18,3 μg/dL) et de 10 mg/jour (plombémie se situant entre 22,6 et 45,2 μg/dL). Les animaux jeunes et âgés ont présenté une hausse du taux de réponse, tandis que les rats adultes ont montré une diminution du taux de réponse à l’épreuve comportementale à intervalles fixes (Cory-Slechta et Pokora, 1991). Cependant, on a en fait démontré que les tâches d’alternance spatiale différée s’amélioraient chez les rats jeunes et âgés exposés au plomb, mais que les effets observés chez les adultes n’étaient pas significatifs (Cory-Slechta et coll., 1991). Dans une autre étude, les niveaux d’expression génique de l’APP-bêta, un marqueur de l’évolution de la maladie d’Alzheimer, ont fait l’objet d’un suivi tout au long de la vie des rats exposés à l’acétate de plomb uniquement durant la petite enfance (plombémie moyenne de 46,43 μg/dL durant l’exposition et réduite aux concentrations de référence par la suite). Il a été établi que l’expression s’était accrue 20 mois après la fin de l’exposition, ce qui donne à penser que les effets observés plus tard à l’âge adulte peuvent être liés à une exposition antérieure (Basha et coll., 2005).
Il y a donc suffisamment de preuves chez les animaux de laboratoire indiquant que l’exposition au plomb cause des effets neurologiques indésirables. Des effets nocifs à l’âge adulte ont été observés chez des animaux matures exposés, de même que chez des animaux plus âgés exposés durant la petite enfance après une période de latence considérable. Aucune de ces études n’a abordé la neurotoxicité du plomb à des plombémies inférieures à 10 μg/dL et, de ce fait, on ignore si ces effets demeurent à des expositions plus faibles.
9.2.2.2 Effets cardiovasculaires
Chez les animaux de laboratoire, il existe des preuves solides et cohérentes que l’exposition chronique et subchronique au plomb entraîne une augmentation soutenue de la pression artérielle, même à des doses observées dans l’environnement. Ces effets ont été observés chez plusieurs espèces, notamment le rat, le chien, et le pigeon (Staessen et coll., 1994b). Des données anciennes publiées dans ce domaine ont fait l’objet de critiques en raison de problèmes méthodologiques, notamment le fait que le stress peut faire augmenter la pression artérielle des animaux, de même que l’utilisation de modèles animaux génétiquement sensibles. Toutefois, ces problèmes ont été abordés dans le cadre d’études de toxicité subchronique plus récentes menées chez les rats au cours desquelles on a observé des élévations statistiquement significatives de la pression artérielle à des plombémies inférieures à 20 μg/dL (Khalil-Manesh et coll., 1994; Gonick et coll., 1997; Vaziri et coll., 1997, 1999a, 1999b; Ding et coll., 1998, 2001; Attri et coll., 2003; Fiorim et coll., 2011; Silveira et coll., 2014).
Des études ont fait état d’une hausse de la pression artérielle chez le rat à de très faibles plombémies (< 5 μg/dL). Attri et coll. (2003) ont étudié des rats à qui on a administré de l’acétate de plomb à une concentration de 100 mg/L d’eau (par voie orale à l’aide d’une seringue) pendant trois mois. Des plombémies moyennes de 2,4 μg/dL et de 4,1 μg/dL mesurées après 2 et 3 mois d’exposition, respectivement, ont été associées à une augmentation importante de la pression artérielle systolique, et les rats ont manifesté des signes de stress oxydatif évident. Dans une autre étude portant sur des rats exposés à des solutions d’acétate de plomb à 0,01 %, 0,05 %, 0,1 %, 0,5 %, 1 % et 2 % dans de l’eau à boire, en parallèle avec des témoins, pendant 60 jours, on a observé des effets sur la pression artérielle systolique et diastolique au niveau d’exposition le plus faible (qui correspond à une plombémie de 2,15 μg/dL), et ces effets ont augmenté en fonction de la dose (Tsao et coll., 2000). Ding et coll. (1998) ont montré que l’exposition de rats à de l’eau potable contenant 0,01 % d’acétate de plomb pendant 12 semaines a entraîné une augmentation importante de la pression artérielle à la semaine 8, augmentation qui s’est poursuivie jusqu’à la fin de la période d’exposition, à la semaine 12. L’interruption de l’exposition pendant deux autres semaines s’est traduite par une élévation soutenue de la pression artérielle. La plombémie moyenne, mesurée à 14 semaines, était de 3,2 μg/dL chez les animaux traités.
Une hausse de la pression artérielle induite par le plomb est donc fortement étayée par les modèles expérimentaux animaux à des plombémies inférieures à 5 μg/dL.
9.2.2.3 Effets rénaux
Des études réalisées sur des animaux de laboratoire dont la plombémie dépasse 45 μg/dL ont signalé une diminution du débit de filtration glomérulaire, une augmentation de la concentration de la créatinine sérique, une augmentation du poids des reins, de même qu’une altération de l’histopathologie rénale (Khalil-Manesh, 1992a, 1992b). Par contre, peu d’études ont examiné les effets sur la fonction rénale des expositions au plomb comparables à ce qu’on retrouve dans l’environnement.
Des rats à qui on a administré de l’acétate de plomb à une concentration de 150 mg/L d’eau potable pendant 16 semaines (la plombémie à 16 semaines était de 26,4 μg/dL et une chirurgie du rein restant a été pratiquée à la quatrième semaine) ont développé des lésions microvasculaires et tubulaires et présenté une diminution de la clairance de la créatinine (Roncal, 2007). Dans une autre étude portant sur les rats, l’administration d’acétate de plomb à une concentration de 100 mg/L d’eau potable pendant 12 mois a entraîné une atrophie tubulaire et une fibrose interstitielle modérées (Khalil-Manesh et coll., 1993). La plombémie moyenne la plus élevée observée au cours de l’étude était de 29,4 μg/dL; elle a été observée 3 mois après l’exposition (la plombémie moyenne se situait un peu au-dessus de 20 μg/dL après 12 mois).
9.2.3 Exposition de longue durée et cancérogénicité
Les études sur les animaux de laboratoire faisant appel à diverses espèces et voies d’exposition démontrent de façon constante que l’exposition au plomb inorganique est associée à la formation de tumeurs et de cancers, même s’il n’y a pas suffisamment de données pour évaluer la cancérogénicité du plomb inorganique (CIRC, 2006). En ce qui concerne les formes inorganiques du plomb (p. ex. acétate de plomb, sous-acétate de plomb, chromate de plomb, phosphate de plomb), certaines données probantes font état de cancers du poumon, des glandes surrénales, des testicules, de la prostate et du cerveau (CIRC, 2006). Toutefois, le siège le plus sensible et pour lequel l’association entre l’exposition au plomb et la cancérogenèse est la plus étroite et la plus constante est sans aucun doute le rein.
De nombreuses études effectuées sur la souris et le rat ont révélé que le plomb était associé à une incidence accrue de lésions rénales prolifératives, d’adénomes ou de carcinomes à la suite d’une exposition par voie orale. Cela comprend des études sur l’acétate de plomb (Boyland et coll., 1962; Zawirska, 1968, 1981; Azar et coll., 1972; Zawirska et Medras, 1972; Waszynski, 1977; Fears et coll., 1989; Waalkes et coll., 1995, 2004) et le sous-acétate de plomb (van Esch et coll., 1962; Mao et Molnar, 1967; van Esch et Kroes, 1969; Oyasu et coll., 1970; Ito et coll., 1971; Ito, 1973; Kasprzak et coll., 1985) à des concentrations aussi faibles que 0,05 % dans l’alimentation pour l’acétate de plomb et de 0,1% dans l’eau pour le sous-acétate de plomb. L’injection (intramusculaire, sous-cutanée et intrapéritonéale) de chromate de plomb et de phosphate de plomb chez le rat a également induit des tumeurs rénales lorsque des doses totales excédant 70 mg de chromate de plomb et 120 mg de phosphate de plomb avaient été administrées (Zollinger, 1953; Tonz, 1957; Baló et coll., 1965; Roe et coll., 1965; Furst et coll., 1976).
Les quelques études ayant permis d’examiner plusieurs niveaux d’exposition ont dégagé des tendances dose-réponse quant aux lésions rénales prolifératives. Waalkes et coll. (2004) ont examiné l’histopathologie du rein chez des souris mâles exposées à l’acétate de plomb à des concentrations de 0, de 1 000, de 2 000 et de 4 000 mg/L dans l’eau potable (ce qui correspond à environ 0, 200, 400 et 800 mg/kg de poids corporel par jour). Les expositions ont eu lieu à l’âge de 8 semaines et se sont poursuivies jusqu’à l’âge de 122 semaines. On a établi les incidences de lésions rénales prolifératives chez les souris mâles adultes, y compris les tumeurs et l’hyperplasie des tubules rénaux atypiques, à 0 % pour le groupe témoin, et à 4 %, à 12 % et à 21 % pour les groupes de traitement ayant reçu une dose de 1 000, de 2 000 et de 4 000 mg/L, respectivement. La signification statistique a été atteinte seulement dans le groupe ayant reçu la dose de 4 000 mg/L. Des souris mâles double knock-out pour les métallothionéines I/II ont également été testées à l’aide du même schéma d’exposition. Les lésions rénales prolifératives étaient plus courantes et plus graves chez ces souris (0 % pour le groupe témoin, 40 %, 52 % et 60 % pour les groupes ayant reçu une dose de 1 000, de 2 000 et de 4 000 mg/L, respectivement). Selon une autre étude menée sur des souris, l’exposition des souris mères à l’acétate de plomb à des concentrations de 0, de 500, de 750 et de 1 000 mg/L dans l’eau potable (ce qui correspond à environ 0, 100, 150 et 200 mg/kg de poids corporel par jour) à compter du 12e jour de gestation et jusqu’à 4 semaines après la naissance pendant la lactation a entraîné une incidence accrue de lésions rénales prolifératives chez les petits âgés de 112 semaines. Chez les mâles, les augmentations étaient de 4 % pour le groupe témoin, et de 16 %, de 24 % et de 48 % pour les groupes de traitement ayant reçu une dose de 500, de 750 et de 1 000 mg/L, respectivement (chez les femelles, les augmentations étaient de 0 %, de 0 %, de 4 % et de 16 % pour les mêmes groupes). Les tumeurs rénales observées sont apparues en l’absence de néphropathie chronique importante induite par le plomb, ce qui semble indiquer que les lésions rénales chroniques ne sont peut-être pas la cause du développement des tumeurs (Waalkes et coll., 1995).
Il existe donc dans les modèles d’animaux de laboratoire des données qui appuient la tumorigenèse et la cancérogenèse du rein induites par le plomb inorganique. Les données recueillies chez les souris suggèrent également que l’exposition in utero et en début de vie peut causer des cancers du rein à l’âge adulte. Des données supplémentaires semblent indiquer que le cancer induit par le plomb peut se déclarer à d’autres sièges, même si le critère d’effet le plus sensible et le plus constant est, de loin, le cancer du rein. Bien qu’aucune de ces études ne respecte les lignes directrices strictes recommandées pour les essais biologiques sur le cancer chronique chez les rongeurs (deux espèces, deux sexes, trois groupes de traitement plus un groupe témoin et un minimum de 50 animaux par groupe de traitement) (U.S. Department of Health and Human Services, 2006), les études de Waalkes et coll. (1995, 2004) fournissent la preuve adéquate que la tumorigenèse survient chez les souris après une exposition au plomb et que l’incidence augmente proportionnellement à la dose.
9.2.4 Génotoxicité
Il existe suffisamment de données attestant que le plomb inorganique cause des dommages à l’acide désoxyribonucléique (ADN), mais on ne sait pas au juste si ces dommages sont la conséquence de la génotoxicité directe ou indirecte ou qu’ils sont peut-être liés à des modifications des processus de réparation de l’ADN. La génotoxicité et la mutagénicité du plomb ont été examinées en profondeur par le Centre international de recherche sur le cancer (CIRC) (2006) et sont brièvement décrites plus loin.
9.2.4.1 Résultats in vitro
La génotoxicité et la mutagénicité de plusieurs composés de plomb ont été évaluées dans divers systèmes d’essai in vitro.
Lors d’essais sur des bactéries, la mutagénicité n’a été observée qu’après un traitement par le chromate de plomb et le bromure de plomb, et il est difficile de dire si le composé plombé de la substance est même intervenu dans l’induction de mutations (Nestmann et coll., 1979; Maslat et Haas, 1989). Toutefois, la plupart des tests effectués sur les lignées cellulaires de mammifères a révélé que divers composés de plomb (acétate de plomb, bromure de plomb, chlorure de plomb, nitrate de plomb et sulfure de plomb) avaient en effet induit des mutations génétiques, même si les concentrations auxquelles la mutagénicité s’est produite variaient considérablement selon les différents types de cellules et les différentes approches expérimentales utilisées (Zelikoff et coll., 1988; Roy et Rossman, 1992; Yang et coll., 1996; Ariza et coll., 1998; Ariza et Williams, 1999).
L’acétate de plomb, le chromate de plomb et le nitrate de plomb ont été mis à l’essai en vue de déterminer leur capacité d’induire des ruptures de brins d’ADN. Ces essais réalisés sur diverses cellules traitées dérivées des humains et des animaux de laboratoire ont donné des résultats invariablement positifs (Robison et coll., 1984; Hartwig et coll., 1990; Roy et Rossman, 1992; Xu et coll., 1992; Robbiano et coll., 1999; Wozniak et Blasiak, 2003). Des micronoyaux se sont formés à la suite d’un traitement de cellules de mammifères provenant de hamsters chinois (cellules ovariennes et fibroblastes) par l’acétate de plomb, le chlorure de plomb et le nitrate de plomb, généralement à des concentrations plus faibles par rapport aux ruptures de brins d’ADN (Lin et coll., 1994; Thier et coll., 2003). Les résultats des échanges de chromatides sœurs et des aberrations chromosomiques, toutefois, étaient beaucoup plus variés (CIRC, 2006).
9.2.4.2 Résultats in vivo
Nous disposons de données sur la génotoxicité in vivo provenant d’études réalisées chez l’humain et les animaux de laboratoire. Les constatations découlant des études de génotoxicité chez les animaux étaient diverses et variaient considérablement selon le composé de plomb étudié, la voie d’exposition, la dose et le critère d’effet toxicologique. Dans une étude multigénérationnelle au cours de laquelle on a fait boire à des souris de l’eau contenant de l’acétate de plomb à une concentration de 1 µg/mL, des dommages importants à l’ADN des lymphocytes ont été signalés dans les deuxième et troisième générations, ce qui suppose un effet cumulatif de l’exposition d’une génération à l’autre (Yuan et Tang, 2001). Le dommage à l’ADN et l’induction de micronoyaux ont été observés dans les reins des rats exposés à trois doses orales successives d’acétate de plomb, à raison de 78 mg/kg de poids corporel (Robbiano et coll., 1999). On a également signalé une induction de micronoyaux dans la moelle osseuse et les leucocytes à la suite de l’administration de fortes doses d’acétate de plomb par voie orale et par injection intrapéritonéale (Muro et Goyer, 1969; Deknudt et Gerber, 1979; Tachi et coll., 1985). Des études portant sur l’exposition de souris au nitrate de plomb par injection intraveineuse ou intrapéritonéale ont permis d’observer des échanges de chromatides sœurs dans la moelle osseuse de même que des aberrations chromosomiques et de l’aneuploïdie dans la moelle osseuse maternelle et les cellules hépatiques fœtales à des doses aussi faibles que 10 mg/kg de poids corporel (Nayak et coll., 1989; Dhir et coll., 1993). Aucune des études n’a tenu compte de la plombémie de ces animaux.
Les résultats des études de génotoxicité in vivo ayant trait aux expositions d’êtres humains étaient majoritairement positifs. Il est toutefois difficile de tirer des conclusions fermes au sujet des études réalisées chez l’humain en raison de l’exposition simultanée à d’autres substances chimiques. Les cinq études ayant examiné les ruptures de brins d’ADN au moyen du test des comètes dans les leucocytes de travailleurs exposés au plomb ont produit des résultats positifs; les plombémies de ces travailleurs se situaient entre 13 et 98,5 µg/dL (Ye et coll., 1999; De Restrepo et coll., 2000; Fracasso et coll., 2002; Danadevi et coll., 2003; Palus et coll., 2003). De façon similaire, l’induction de micronoyaux dans les lymphocytes sanguins de travailleurs exposés était importante à des plombémies variant de 40 à 61 µg/dL (Vaglenov et coll., 1998, 2001; Hamurcu et coll., 2001; Palus et coll., 2003). Les données relatives aux échanges de chromatides sœurs et aux aberrations chromosomiques sont elles aussi surtout positives, bien que dans certaines études, les résultats se sont révélés négatifs (CIRC, 2006). L’absence de corrélation ne semble pas être liée à la dose. Aucune génotoxicité significative n’a été signalée dans les études qui ont examiné des populations soumises à des expositions non liées au travail (CIRC, 2006).
9.2.5 Toxicité pour la reproduction et le développement
9.2.5.1 Effets sur la reproduction
Chez les animaux de laboratoire, le retard de la maturation sexuelle constitue la preuve la plus solide quant aux effets indésirables sur la reproduction. En outre, des données semblent indiquer que l’exposition au plomb durant la gestation peut induire des malformations chez les petits et que l’exposition des mâles peut perturber le système reproducteur.
De nombreuses études montrent que l’exposition au plomb peut retarder la maturation sexuelle des animaux de laboratoire. Dans une étude, on a examiné l’exposition par voie alimentaire de souris femelles à l’acétate de plomb à plusieurs doses variant de 0,02 à 40 mg/kg (ce qui correspond à des plombémies entre 0,7 et 13,2 μg/dL). L’exposition au plomb a considérablement retardé la puberté chez les souris femelles selon une tendance dose-réponse, comme le montrent les retards liés à l’âge de l’ouverture vaginale, de l’œstrus, de la formation du bouchon vaginal et de la première mise bas. Par rapport au niveau d’exposition de 0,2 mg/kg (plombémie = 1,9 μg/dL), la dose censée représenter la plombémie de référence type, seuls les niveaux d’exposition les plus élevés, correspondant à des plombémies de 8,4 et de 13,2 μg/dL, étaient statistiquement significatifs (Iavicoli et coll., 2004). Des constatations très semblables ont été faites dans les deuxième et troisième générations des mêmes souris exposées aux mêmes concentrations pendant toute la durée de la gestation et de la lactation, l’exposition subséquente de la progéniture femelle par voie alimentaire se faisant aux mêmes concentrations. Dans les deux groupes ayant reçu les doses les plus élevées (8,1/12,7 μg/dL et 8,1/12,9 μg/dL dans la deuxième génération et la troisième génération, respectivement), les plombémies étaient significatives sur le plan statistique pour le niveau d’exposition de 0,2 mg/kg (plombémie = 0,7 μg/dL pour les deuxième et troisième générations). Il semble que l’exposition additionnelle in utero et en début de vie n’augmente pas le risque de retard de puberté chez les souris exposées (Iavicoli et coll., 2006). Par contre, une puberté tardive de même qu’une baisse des hormones liées à la puberté (facteur de croissance 1 analogue à l’insuline, hormone lutéinisante et œstradiol) ont été observées chez des rates exposées à l’acétate de plomb in utero exclusivement, de même que chez des rates exposées durant la gestation/lactation et durant la lactation seulement (Dearth et coll., 2002).
Plusieurs effets ont en outre été observés chez les mâles. Barratt et coll. (1989) ont examiné la concentration et les anomalies des spermatozoïdes chez des rats ayant reçu de l’acétate de plomb à raison de 0,3 à 300 mg/kg de poids corporel par jour pendant 9 semaines, les plombémies variant de 2 à 80 μg/dL. Un effet important sur l’anomalie des spermatozoïdes a été observé à la dose la plus élevée, qui correspond à une plombémie de 80 μg/dL (Barratt et coll., 1989). La numération et la motilité des spermatozoïdes n’ont pas été touchées chez les rats ayant reçu une dose de 5 mg/kg de poids corporel par injection intrapéritonéale (plombémie = 7 μg/dL), même si des changements dans la structure des spermatides et des cellules de Sertoli étaient évidents (Murthy et coll., 1995). L’exposition pendant la gestation a également produit des effets sur le système reproducteur masculin, comme le montrent les lésions causées à la structure des tubes séminifères, en plus de réduire la prospermatogonie chez les rats mâles, bien que des plombémies élevées (17,8 à 31,6 μg/dL) chez les ratons aient pu être directement responsables de ces effets (Corpas et coll., 1995).
Il n’existe pas suffisamment de données probantes pour indiquer que le plomb est tératogène chez les animaux de laboratoire. Des plombémies maternelles aussi faibles que 10 μg/dL chez des rates enceintes ont entraîné une augmentation de malformations externes, et une fréquence accrue de résorption fœtale a été observée à des plombémies maternelles de 14 μg/dL et plus (Flora et Tandon, 1987).
Selon des études réalisées sur des animaux de laboratoire, le plomb peut induire des effets sur la reproduction, en particulier en ce qui concerne la maturation sexuelle des animaux femelles. Ces effets peuvent se produire à des plombémies inférieures à 2 μg/dL.
9.2.5.2 Effets sur le développement neurologique
Même si aucun test ne permet d’évaluer le QI des animaux de laboratoire, plusieurs critères d’effets neurodéveloppementaux, notamment la capacité d’apprendre des tâches précises, les habiletés de coordination motrice et les changements de comportement, ont été étudiés chez plusieurs espèces. La majeure partie des données probantes indique que l’exposition au plomb par voie orale est associée à des effets neurodéveloppementaux indésirables et que leur gravité augmente en fonction de la dose administrée. De plus, dans la plupart des cas, la fin de l’exposition n’était pas associée au retour à un état de santé de santé normal, même longtemps après l’exposition, ce qui suppose que les effets neurodéveloppementaux du plomb sont permanents et subsistent à l’âge adulte. Il y a toutefois une possibilité que la remobilisation du plomb stocké dans les os survienne à un moment ultérieur après la fin de l’exposition et qu’elle soit associée aux effets observés.
Les preuves les plus probantes des effets neurodéveloppementaux indésirables proviennent d’études sur les primates non humains. Au moins 17 études se sont penchées sur les effets neurocomportementaux indésirables de l’exposition au plomb chez les primates non humains, et une seule d’entre elles a produit des résultats principalement négatifs (Laughlin et coll., 1999). Les études ayant fait état d’effets indésirables aux doses les plus faibles ont été réalisées chez des macaques de Buffon exposés par voie orale à de l’acétate de plomb à raison de 0, de 50 et de 100 µg/kg de poids corporel par jour, 5 jours par semaine, dès la naissance. Cela a eu pour résultat des plombémies maximales de 3,5, de 15,4 et de 25,3 µg/dL, avec des plombémies subséquentes à l’état d’équilibre de 2,9, de 10,9 et de 13,1 µg/dL pour les doses de 0, de 50 et de 100 µg/kg de poids corporel par jour, respectivement. Les singes traités ont présenté des retards dans l’apprentissage de tâches précises à la dose d’exposition la plus faible (plombémie de 10,9 à 15,9 µg/dL) lors d’une série de tests effectués entre l’âge de 3 et 10 ans (Rice, 1984, 1985; Gilbert et Rice, 1987; Rice et Karpinski, 1988). Chez les singes exposés continuellement ou durant la petite enfance exclusivement à de l’acétate de plomb à une concentration de 1,5 mg/kg de poids corporel par jour, des déficiences considérables ont été observées au cours de certains tests neurocomportementaux dans les deux groupes par rapport aux groupes témoins, et ce, jusqu’à l’âge de 9 ans, la gravité s’étant accrue dans le groupe exposé continuellement. Ces résultats montrent que l’exposition au plomb en début de vie peut entraîner des effets neurocomportementaux qui persistent à l’âge adulte, même après la fin de l’exposition (Rice, 1990, 1992b). L’exposition continuelle de singes à de fortes doses de plomb (2 000 µg/kg par poids corporel par jour, ce qui a donné lieu à une plombémie maximale de 115 µg/dL et une plombémie à l’état d’équilibre de 33 µg/dL), puis leur évaluation en tant que nourrissons, jeunes et adultes, ont aussi eu une incidence sur leur performance à une série de tests neurocomportementaux (Rice, 1992a). Les effets des plombémies inférieures à 10 µg/dL n’ont pas fait l’objet d’un examen chez les primates non humains.
Il existe un vaste corpus de données probantes sur les effets neurodéveloppementaux indésirables chez différentes souches de rats. Les expositions au plomb par voie orale avant et après la naissance qui entraînent des plombémies aussi faibles que 10 µg/dL ont provoqué une diminution de la capacité d’apprendre, comme le montre la mauvaise performance lors de l’apprentissage de tâches précises, une diminution de la mémoire, comme l’indique l’évitement de stress répétés tels que les chocs administrés au pied, et la conduite altérée, notamment les changements de comportement liés à l’élevage (Cory-Slechta et Thompson, 1979; Cory-Slechta et coll., 1981, 1983, 1985, 2013; Cory-Slechta, 1986; Chen et coll., 1997, 2001; Gong et Evans, 1997; Morgan et coll., 2000; Stangle et coll., 2007). D’autres éléments de preuve attestent l’existence d’effets neurocomportementaux modifiés chez de nombreuses autres espèces : déficit d’apprentissage et de coordination motrice chez les poussins des goélands argentés (Burger et Gochfeld, 1997, 2005), déficit d’apprentissage chez les agneaux exposés avant la naissance (Carson et coll., 1974), déficit de l’exploration spatiale chez la progéniture de lapins mâles exposés (Nelson et coll., 1997) et comportement agressif chez la progéniture de souris femelles exposées (Donald et coll., 1987).
Dans l’ensemble, il existe suffisamment de preuve pour conclure que les expositions prénatales et postnatales au plomb provoquent des effets neurocomportementaux indésirables chez les animaux de laboratoire de différentes espèces, y compris les primates non humains. Les données tirées d’un bon nombre de ces études font état de variations interindividuelles importantes, ce qui donne à penser que certains animaux peuvent être particulièrement vulnérables aux effets du plomb, alors que d’autres sont plus tolérants. Nous manquons de données pour évaluer les effets des plombémies inférieures à 10 µg/dL chez les animaux de laboratoire. Il est impossible d’établir avec certitude le plus faible niveau d’exposition associé à des effets neurocomportementaux chez ces animaux.
9.3 Mode d’action
On sait que le plomb perturbe de nombreux processus biologiques qui, à leur tour, peuvent induire plusieurs effets néfastes. Le mimétisme du calcium, la mort cellulaire, le stress oxydatif et la perturbation des processus biochimiques vitaux en sont des exemples. Comme il n’existe aucun mécanisme d’unification de la toxicité du plomb, il est probable que plusieurs de ces mécanismes fonctionnent à l’unisson pour induire les effets indésirables observés à la suite d’une exposition chronique. Cela dit, il convient de noter que les modes d’action entraînant les divers effets indésirables du plomb sont généralement mal compris.
La plupart des effets indésirables connus du plomb sur la santé, autres que les tumeurs rénales, ont été clairement établis chez l’humain. Comme la pertinence chez l’humain a déjà été solidement établie pour la plupart des critères d’effets, les renseignements sur le mode d’action présentés ci-dessous sont fournis uniquement pour renforcer la preuve des effets toxiques induits par le plomb. Les modes d’action ont été examinés pour déterminer les critères d’effets jugés critiques dans le cadre de cette évaluation (c.-à-d. neurotoxicité développementale et cancer), de même que les élévations de la pression artérielle, puisqu’on disposait d’une grande quantité de renseignements pour ce critère. Des renseignements supplémentaires concernant la pertinence des tumeurs rénales chez l’humain sont brièvement décrits.
9.3.1 Effets sur le développement neurologique
En ce moment, on ne dispose pas de données suffisantes pour établir clairement le mode d’action impliqué dans la baisse du QI et les autres effets neurodéveloppementaux. Des éléments de preuve montrent cependant que la neurotoxicité développementale peut faire intervenir des altérations du fonctionnement et de la signalisation cellulaires, de même que des dommages directs au cerveau et au système nerveux central, conformément à l’étude de Lidsky et Schneider (2003).
Il a été démontré que le plomb interagit avec tous les types de cellules du système nerveux central, et on sait qu’il provoque un stress oxydatif cellulaire et l’apoptose. L’épuisement des enzymes antioxydantes a été observé chez des souris à la suite d’une exposition au plomb in utero (Wang et coll., 2006). En outre, l’apoptose neuronale a été observée dans le cerveau en développement de souris après deux injections intrapéritonéales de 350 mg/kg de poids corporel (Dribben et coll., 2011). Il est donc plausible que le plomb puisse causer une atteinte directe des tissus qui peut perturber les fonctions neurodéveloppementales et cognitives.
Toutefois, le plomb peut aussi provoquer une série de changements biochimiques susceptibles d’entraver le développement ou le fonctionnement du système nerveux central. On sait depuis longtemps que le plomb perturbe le fonctionnement cellulaire par mimétisme du calcium et du zinc. La capacité du plomb d’imiter le calcium peut perturber l’homéostasie des ions Ca2+ et entraîner la stimulation de kinases, d’adénosine monophosphate cyclique et de la phosphodiestérase, ce qui a une incidence sur le fonctionnement des canaux calciques dépendant d’un potentiel d’action (Gu et coll., 2005). Cette capacité d’imiter le calcium permet également au plomb de traverser la barrière hémato-encéphalique et d’atteindre ainsi les tissus critiques associés à la neurotoxicité développementale (Kerper et Hinkle, 1997a, 1997b). On suppose que les modifications de l’homéostasie calcique perturbent la synthèse, la libération, le renouvellement et la recapture des neurotransmetteurs (Lidsky et Schneider, 2003). Il a été démontré que le plomb modifie la libération de la dopamine, de l’acide γ-aminobutyrique et d’autres neurotransmetteurs (Lasley et coll., 1999; Devoto et coll., 2001), en plus d’altérer les synaptosomes (Regunathan et Sundaresan, 1985; Jablonska et coll., 1994) et les récepteurs de neurotransmetteurs (McCoy et coll., 1997; Lasley et coll., 2001) capables d’entraver les processus de neurotransmission normaux. Toutefois, ces réponses peuvent dépendre de la dose, puisqu’à faibles doses, le plomb stimulerait l’exocytose des neurotransmetteurs (Bressler et Goldstein, 1991). On a également démontré que le mimétisme du zinc perturbait la liaison des facteurs de transcription à l’ADN, notamment le facteur de transcription Sp1, le facteur de transcription IIIA et la protéine de réponse de croissance précoce 1, entraînant également des changements connexes dans l’expression des gènes (Zawia et coll., 1998; Hanas et coll., 1999; Reddy et Zawia, 2000; Zawia, 2003). On ne sait pas exactement comment le mimétisme du calcium et du zinc se traduit par des effets indésirables. Par contre, des processus cruciaux intervenant dans le développement neurologique, notamment la croissance cellulaire, la différenciation et la structure des chromosomes, sont probablement touchés.
D’autres changements biochimiques pourraient également jouer un rôle dans la baisse du QI et autres effets neurodéveloppementaux. Il a été établi que le plomb avait une incidence sur la potentialisation à long terme (PLT) en modifiant la libération de glutamate, l’activation postsynaptique du N-méthyl-D-aspartate et la neurogenèse. L’exposition prénatale et postnatale de rats au plomb a entraîné une augmentation du seuil d’induction de la PLT, une diminution de l’amplitude de la PLT et une accélération du déclin de la PLT dans certaines régions de l’hippocampe (Gilbert et Rice, 1987; Gutowski et coll., 1997, 1998; Gilbert et Mack, 1998; Gilbert et coll., 1999a, 1999b). De plus, le plomb peut retarder la différentiation des progéniteurs gliaux et causer une hypomyélinisation et une démyélinisation des cellules gliales, ce qui peut nuire à leur capacité de soutenir et de protéger les neurones (Sauer et coll., 1970; Coria et coll., 1984; Deng et coll., 2001). L’axe hypothalamo-hypophyso-surrénalien, qui peut altérer la fonction cognitive par la régulation des glucocorticoïdes, peut également être fortement touché par le plomb. Chez le rat, des expositions prénatales et par le lait maternel ont modifié de façon importante les concentrations de corticostérone dans le sang à l’âge adulte (Cory-Slechta et coll., 2004). Enfin, les preuves attestent que le plomb peut agir par un mécanisme épigénétique. L’exposition au plomb chez le singe et le rat en début de vie a montré une hausse de l’expression génique cérébrale de la β-APP et de la production de protéines qui y sont associées plus tard dans la vie (Basha et coll., 2005; Wu et coll., 2008). L’effet s’est produit en même temps qu’une réduction de l’activité méthyltransférase, ce qui semble indiquer qu’une déméthylation épigénétique de la région du promoteur de l’APP peut être responsable.
Des données probantes montrent que les effets neurodéveloppementaux du plomb chez les enfants persistent, comme le révèlent les études à long terme réalisées chez les primates non humains, ainsi que les déficits d’intelligence et les déficits liés à la réussite scolaire qui s’étendent au moins jusqu’à l’âge de 17 ans chez l’humain. Il est important de souligner qu’aucun seuil ne peut être établi pour cet effet.
9.3.2 Cancer
On connaît mal les mécanismes exacts qui établissent un lien entre le plomb et le cancer. En général, on ne s’attend pas à ce que le plomb induise des dommages directs à l’ADN aux mêmes concentrations que celles observées dans l’environnement. Toutefois, des éléments de preuve laissent croire que le plomb peut entraîner une génotoxicité indirecte causée par un stress oxydatif et que ce plomb peut accroître la susceptibilité au cancer par l’intermédiaire de mécanismes non génotoxiques. Les mécanismes potentiels ont été décrits dans les études de Silbergeld et coll. (2000) et de Silbergeld (2003).
Il existe suffisamment d’éléments de preuve pour déterminer que le plomb entraîne une génotoxicité et une clastogénicité, comme le révèle l’induction de ruptures des brins d’ADN, de micronoyaux, d’aberrations chromosomiques et d’échanges de chromatides sœurs dans des cellules cultivées et chez des animaux de laboratoire exposés, de même que dans les leucocytes d’humains soumis à une exposition en milieu de travail (voir la section 9.2.4). De tels événements génotoxiques sont considérés comme essentiels au développement de cancers induits par le plomb. À des concentrations très élevées, le plomb peut causer des dommages directs à l’ADN par réticulation de ce dernier (Silbergeld, 2003). Toutefois, ces doses sont généralement cytotoxiques et beaucoup plus élevées que celles requises pour induire un cancer (Silbergeld, 2003). En outre, il a été établi que le plomb induisait des tumeurs rénales en l’absence de lésions tissulaires importantes (Waalkes et al., 1995). Ainsi, il est peu probable que la génotoxicité directe soit associée à la formation de tumeurs observée chez les animaux de laboratoire. Par contre, il existe des preuves plus concrètes que la génotoxicité indirecte causée par un stress oxydatif peut être responsable de dommages à l’ADN à des doses plus pertinentes. Il a été démontré que l’exposition au plomb à des doses non cytotoxiques entraînait un appauvrissement en glutathion dans le foie des rats (Daggett et coll., 1998) et une régulation à la hausse de la glutathion S-transférase dans le rein et le foie des rats (Columbano et coll., 1988; Suzuki et coll., 1996; Daggett et coll., 1998), ce qui rend ainsi les cellules plus sensibles au stress oxydatif. Ces réponses s’accompagnent souvent d’une peroxydation lipidique, mesurée par une augmentation du malondialdéhyde (Daggett et coll., 1998). En situation in vitro, le plomb fait augmenter la concentration de peroxyde d’hydrogène (Ariza et coll., 1998). À l’instar de nombreux autres métaux, il est prouvé que le plomb peut renforcer les conditions de stress en participant à des réactions de Fenton, au cours desquelles le peroxyde d’hydrogène est converti en ion superoxyde plus réactif. Les cellules traitées uniquement par le peroxyde d’hydrogène ou l’acétate de plomb n’ont pas présenté de dommages substantiels à l’ADN. Toutefois, l’exposition concomitante au plomb et au peroxyde d’hydrogène a provoqué des coupures dans l’ADN et des ruptures des brins d’ADN, de même que des adduits à l’ADN liés à un stress oxydatif, notamment la 8-hydroxyguanine (Roy et Rossman, 1992; Yang et coll., 1999). Par conséquent, il est probable que les réactions de Fenton médiées par le plomb sont responsables des dommages oxydatifs à l’ADN induits par le plomb.
Certaines données probantes semblent indiquer que les modes d’action non génotoxiques pourraient assurer la médiation des cancers induits par le plomb. Toutefois, seule une information limitée était disponible. Dans des conditions in vitro, on a constaté que les co-expositions au plomb et au rayonnement ultraviolet, au peroxyde d’hydrogène, aux rayons X et à la plupart des produits chimiques génotoxiques augmentaient les effets dommageables de ces agents sur l’ADN (Silbergeld, 2003). Chez les animaux, la co-exposition alimentaire au plomb et au 2-acétylaminofluorène, à la N-éthyl-N-hydroxyéthylnitrosamine ou au N-(4′-fluoro-4-biphényl)acétamide a accru l’incidence de tumeurs rénales chez le rat, et une étude réalisée chez l’humain suggère que l’exposition au plomb augmente le risque de cancer du poumon chez les fumeurs (Lustberg et Silbergeld, 2002; Healey, 2014). Prises ensemble, ces données portent à croire que le plomb peut inhiber les mécanismes de réparation de l’ADN, rendant ainsi le matériel génétique plus vulnérable aux dommages provenant d’autres sources. Cela peut être attribuable à la capacité du plomb de se substituer au zinc dans les protéines de liaison au zinc, notamment les protéines de liaison à l’ADN, les histones, les protamines et les régulateurs de la transcription. En se fixant aux protéines de liaison au zinc, le plomb peut également altérer leur structure conformationnelle et leur fonction. Le plomb a donc une incidence sur les protéines; il peut altérer les voies de signalisation cellulaire, ce qui peut entraîner une inhibition de la réparation de l’ADN, des erreurs de réparation et autres réponses liées à l’évolution du cancer. En effet, le plomb modifierait l’expression des oncogènes et des gènes suppresseurs de tumeurs (Silbergeld, 2003). Des éléments probants montrent aussi que les changements épigénétiques à l’ADN (modifications du statut de méthylation de l’ADN) peuvent influer sur l’altération des voies de signalisation cellulaire (Senut et coll., 2014). D’autres recherches devront être menées pour élucider davantage les rôles possibles de ces modes d’action non génotoxiques dans la cancérogenèse induite par le plomb. Selon certaines hypothèses, l’exposition au plomb peut mener au cancer par l’accroissement de la prolifération cellulaire dans certains tissus. On croit toutefois que cela ne survient qu’à des niveaux élevés d’exposition et que, par conséquent, une prolifération cellulaire accrue menant à des fréquences de mutation élevées n’est pas susceptible d’être associée à des cancers induits par le plomb.
Comparativement aux cancers d’autres sièges (p. ex. poumon et cerveau), le développement de tumeurs rénales a été le plus souvent observé chez des animaux de laboratoire exposés au plomb et à des doses d’exposition plus faibles. Il y a toutefois des questions concernant la pertinence des tumeurs rénales chez l’humain, dans la mesure où seulement quelques études ont établi une association positive entre l’exposition au plomb et les cancers du rein, et que ces études sont limitées par des questions de méthodologie, comme le manque de surveillance appropriée de l’exposition et l’omission de tenir compte des effets de confusion (Steenland et coll., 1992; Pesch et coll., 2000). Certains soutiennent que seules des doses cytotoxiques élevées peuvent être à l’origine de la formation de tumeurs rénales. On a toutefois constaté que les lésions rénales prolifératives, notamment les carcinomes tubulaires, se produisaient chez la progéniture mâle de souris exposées à l’acétate de plomb en l’absence de néphropathie chronique grave et de corps d’inclusion à base de plomb (Waalkes et coll., 1995). En outre, l’induction d’α2u-globuline, qui entraîne une néphropathie par hyalinisation, un processus couramment observé chez le rat mâle exposé à des produits chimiques, a été proposée comme le facteur principal d’induction des tumeurs rénales. Toutefois, puisque ce type de tumeur se développe également chez les souris mâles et femelles, qui elles ne produisent pas d’α2u-globuline, ce mécanisme d’induction n’est pas pertinent (Waalkes et coll., 1995, 2004).
En conclusion, il existe plusieurs modes d’action possibles de cancers induits par le plomb. Toutefois, les renseignements disponibles sont insuffisants pour identifier clairement un seul mode d’action responsable de l’induction de tumeurs. D’après les renseignements à notre disposition à l’heure actuelle, les mécanismes à l’origine des tumeurs rénales chez les animaux sont considérés comme fonctionnels chez les humains.
9.3.3 Élévation de la pression artérielle
De nombreux mécanismes biologiques ont été associés aux élévations de la pression artérielle induites par le plomb et observées chez les humains et les animaux de laboratoire. Parmi ces mécanismes figurent le stress oxydatif, les modifications des concentrations de monoxyde d’azote ou des voies de signalisation du monoxyde d’azote, de même que les effets sur les systèmes adrénergique et paracrine. Ces mécanismes sont décrits en détail dans l’étude de Vaziri (2008) et brièvement présentés ci-dessous.
La désactivation, l’épuisement ou la séquestration du monoxyde d’azote, un vasodilatateur qui joue un rôle important dans la régulation de la pression artérielle, sont les mécanismes les plus susceptibles de provoquer une élévation de la pression artérielle et l’hypertension. Il a été établi que l’hypertension induite par le plomb chez des rats exposés à une concentration de 100 mg/L de plomb dans l’eau potable était accompagnée d’une diminution du monoxyde d’azote disponible dans le plasma et d’une augmentation de l’excrétion urinaire de ses métabolites (Vaziri et coll., 1997, 1999b; Dursun et coll., 2005). Cette situation était probablement causée par l’induction d’un stress oxydatif associé au plomb. L’induction de l’hypertension chez les rats exposés au plomb à une concentration de 100 mg/L dans l’eau potable est associée à une augmentation de la concentration de malondialdéhyde dans le plasma et les tissus, un marqueur de la peroxydation lipidique, et à une augmentation de la concentration de nitrotyrosine, un marqueur de l’oxydation du monoxyde d’azote (Gonick et coll., 1997; Vaziri et coll., 1999a; Attri et coll., 2003). De plus, les rats hypertendus exposés au plomb présentent une régulation à la hausse compensatoire de la monoxyde d’azote synthase endothéliale et inductible (Gonick et coll., 1997; Vaziri et coll., 1997, 1999a, 2001), et le traitement par des antioxydants (p. ex. vitamine E, vitamine C) réduirait la pression artérielle et augmenterait la disponibilité du monoxyde d’azote (Vaziri et coll., 1997, 1999b; Attri et coll., 2003). L’exposition au plomb est également attribuée à des changements dans les voies de signalisation du monoxyde d’azote. Il a été prouvé que l’exposition au plomb par l’alimentation diminue la concentration de guanosine monophosphate cyclique, une molécule importante dans la vasodilatation médiée par le monoxyde d’azote, dans le plasma et l’urine des rats (Khalil-Manesh et coll., 1993). Le stress oxydatif peut en outre déclencher des réponses inflammatoires reconnues pour contribuer à la pathogenèse de l’hypertension.
Les faits indiquent également que le plomb peut avoir une incidence sur le système adrénergique, soit directement ou par les effets médiés par le stress oxydatif sur le monoxyde d’azote. La stimulation du système nerveux sympathique peut provoquer une réaction de combat ou de fuite qui, comme on le sait, influe sur la pression artérielle. Les humains exposés en contexte professionnel et les rats exposés ont présenté une concentration élevée de noradrénaline plasmatique, qui est associée à une augmentation du tonus vasculaire (Chang et coll., 1996; Tsao et coll., 2000). L’augmentation des concentrations de catécholamines plasmatiques et la diminution de la densité des récepteurs β-adrénergiques des tissus vasculaires et cardiaques comptent parmi les autres effets adrénergiques liés à la pression artérielle observés chez les rats (Chang et coll., 1997; Carmignani et coll., 2000; Tsao et coll., 2000). Des éléments probants indiquent que les réponses adrénergiques provoquant la contraction vasculaire des muscles lisses peuvent être relayées par la protéine kinase C (Watts et coll., 1995).
D’autres mécanismes associés à une hausse de l’hypertension induite par le plomb comprennent les concentrations modifiées de prostaglandines et d’endothélines, les lésions endothéliales, de même que l’inhibition de la sodium-potassium adénosine triphosphatase des membranes érythrocytaires (Vaziri, 2008). Il est probable que plusieurs mécanismes fonctionnant simultanément entraînent une augmentation de la pression artérielle observée chez les humains et les animaux de laboratoire exposés.
10.0 Classification et évaluation
De nombreux faits montrent une association entre une faible plombémie et, à la fois, les effets neurodéveloppementaux indésirables chez les enfants et l’élévation de la pression artérielle chez les adultes; les données recueillies auprès des animaux de laboratoire étayent ces résultats. En outre, il a été démontré que le plomb provoquait des tumeurs chez les animaux de laboratoire. Par conséquent, on a procédé à des évaluations des risques de cancer et d’effets autres que le cancer.
10.1 Évaluation des risques de cancer
Les composés de plomb inorganiques ont été classés dans la catégorie des agents probablement cancérogènes pour l’humain (groupe 2A) par le CIRC (2006), selon des preuves concluantes chez les animaux de laboratoire et des preuves suggestives chez l’humain (voir les sections 9.1.2.4 et 9.2.3). Comme le plomb dans l’eau potable est surtout présent sous sa forme inorganique, une évaluation des risques de cancer a été jugée appropriée.
Aucune étude réalisée chez l’humain n’a permis d’établir une valeur basée sur la santé (VBS). Les deux meilleures études animales disponibles ont été menées sur des souris mâles adultes exposées de façon chronique à l’acétate de plomb (Waalkes et coll., 2004) et sur la progéniture mâle et femelle de souris femelles exposées à l’acétate de plomb durant la gestation et la lactation (Waalkes et coll., 1995) (voir la section 9.2.3). On a eu recours à une modélisation de la BMD en utilisant le nombre total de cas d’adénomes et de carcinomes rénaux comme critère d’effet préoccupant pour estimer la dose de référence correspondant à un changement de 10 % de la réponse (BMD10) et sa limite inférieure de l’intervalle de confiance à 95 % (BMDI10) pour chaque étude. Sur les deux études, la BMD10 et la BMDI10 plus prudentes, soit 159,6 mg/kg de poids corporel par jour et 103,8 mg/kg de poids corporel (p.c.) par jour, respectivement, ont été calculées à partir des données tirées de l’étude de Waalkes et coll. (1995) sur les tumeurs rénales chez la progéniture mâle, selon le modèle le mieux ajusté (cancer à plusieurs stades, deuxième degré). La BMD10 a servi de point de départ.
Il n’existe à l’heure actuelle aucun modèle PBPK pour estimer correctement les plombémies chez la souris après une exposition au plomb et les doses internes et externes correspondantes chez l’humain. Par conséquent, nous avons ajusté le point de départ par mise à l’échelle allométrique afin de représenter de manière plus juste l’exposition humaine :
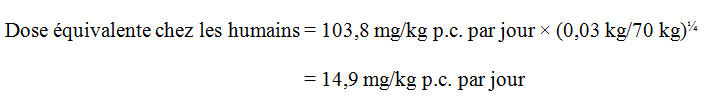
Figure 1 - Equivalent Textuel
La dose équivalente chez les humains est de 14,9 mg/kg p.c. par jour. Elle est obtenue en multipliant la BMDL10 associée à l’adénome rénal et au carcinome rénal chez les souris mâles exposées à l’acétate de plomb (soit 103,8 mg/kg p.c. par jour) par le facteur d’ajustement allométrique de (0,03 kg / 70 kg)1/4.
où :
- 103,8 mg/kg p.c. par jour est la BMDI10 associée à l’adénome rénal et au carcinome rénal chez les souris mâles exposées à l’acétate de plomb (Waalkes et coll., 1995);
- 0,03 kg est le poids corporel moyen d’une souris (Santé Canada, 1994);
- 70 kg est le poids corporel moyen d’un humain adulte;
- l’exposant ¼ est le facteur d’ajustement allométrique prenant en compte les différences toxicocinétiques entre la souris et l’humain.
Le mode d’action de la cancérogenèse induite par le plomb est peu compris (voir la section 9.3.2). C’est pourquoi on a utilisé l’approche sans seuil par défaut pour déterminer les critères d’effets liés au cancer. Si on utilise une réponse de référence de 10 %, la dose orale ajustée de 14,9 mg/kg de poids corporel par jour correspondrait à la dose associée à un risque à vie d’être atteint d’un cancer de 10−1. À l’aide d’une extrapolation linéaire aux faibles doses, un facteur de pente de 0,0067 (mg/kg p.c. par jour)−1 a été calculé et a servi à déterminer les doses orales de 1,5 × 10−2, de 1,5 × 10−3 et de 1,5 × 10–4 mg/kg de poids corporel par jour, qui sont associées aux niveaux de risque respectifs de 10−4, de 10−5 et de 10−6. On peut ensuite utiliser ces doses par voie orale pour calculer les concentrations correspondantes dans l’eau potable à l’aide de l’équation suivante :

Figure 2 - Equivalent Textuel
La concentration dans l’eau potable, exprimée en mg/L, est calculée en multipliant la dose exprimée en mg/kg p.c. par jour par 70 kg (soit le poids corporel par défaut d’un humain adulte). Le produit obtenu est ensuite divisé par 1,5 L/jour (la consommation moyenne quotidienne d’eau d’un adulte).
où :
- les doses de 1,5 × 10−2, de 1,5 × 10−3 et de 1,5 × 10–4 mg/kg p.c. par jour sont associées à un risque à vie d’être atteint d’un cancer de 10−4, de 10−5 et de 10−6, respectivement;
- 70 kg est le poids corporel moyen d’un adulte;
- 1,5 L est le volume quotidien d’eau consommé par un adulte.
On peut estimer à 700, à 70 et à 7 µg/L les concentrations qui correspondent à un risque de cancer à vie de 10−4, de 10−5 et de 10−6 pour les humains, respectivement. Un excès de risque de cancer à vie de 10−6 ou moins est utilisé lorsque l’absorption par d’autres sources est importante (Krishnan et Carrier, 2013). Comme il existe d’autres sources d’exposition significatives au plomb (air ambiant, air intérieur, poussière domestique, sol, nourriture), on a employé un excès de risque de cancer à vie de 10−6 pour établir une concentration de 7 µg/L. Toutefois, il n’est pas jugé approprié d’établir une VBS par cette évaluation, en raison des restrictions suivantes :
- Même si les renseignements sur les animaux de laboratoire sont suffisants, les données épidémiologiques sont limitées.
- Le type de tumeur observé chez les animaux exposés n’a été mentionné que dans quelques études sur la santé au travail présentant des limites méthodologiques connues. La pertinence des tumeurs rénales chez les humains exposés au plomb reste à être élucidée.
- Une étude périnatale (Waalkes et coll., 1995) a été utilisée au lieu d’une étude à plus long terme sur des animaux âgés parce qu’elle produisait des résultats plus prudents. Les répercussions exactes sont inconnues.
- En outre, l’effet observé dans l’étude de Waalkes et coll. (1995) était subtil et a nécessité le regroupement des cas d’adénome et de carcinome pour la réalisation de l’analyse. Par conséquent, il existe certaines questions quant à savoir si l’étude a permis d’observer un réel effet ou non.
Néanmoins, cette évaluation donne une indication des niveaux auxquels les effets du cancer deviendraient un élément à prendre en compte dans l’évaluation de l’exposition au plomb dans l’eau potable.
10.2 Évaluation des risques autres que les risques de cancer
Des plombémies inférieures au niveau d’intervention actuel de 10 µg/dL ont été associées à plusieurs effets indésirables sur la santé, notamment une diminution de la cognition chez les adultes, surtout les personnes âgées (voir la section 9.1.2.1); une élévation de la pression artérielle systolique chez les adultes, surtout les Afro-Américains et les femmes ménopausées (voir la section 9.1.2.2); une diminution de la fonction rénale, surtout chez les diabétiques et les hypertendus (voir la section 9.1.2.3); des effets sur la reproduction, dont une puberté tardive et une ménopause précoce chez les femmes (voir la section 9.1.3.1); et une neurotoxicité développementale, notamment une baisse de l’intelligence et de l’attention chez les nourrissons et les enfants (voir la section 9.1.3.2). Une quantité importante de données recueillies auprès d’animaux de laboratoire permet d’appuyer les observations faites chez les humains (voir la section 9.2). Parmi les critères d’effets examinés, la neurotoxicité développementale s’est avérée l’effet le plus étudié de l’exposition au plomb. La relation entre le QI et la plombémie chez les enfants d’âge scolaire en particulier a été le critère d’effet le plus sensible, et elle peut être caractérisée avec la plus grande certitude grâce à la base de données volumineuse de renseignements pertinents. Les effets sur le QI représentent un déterminant social important de la santé puisque chez les enfants, un faible QI a été lié de façon concluante à de faibles résultats scolaires et à des perspectives d’emploi limitées plus tard dans la vie (Herrnstein et Murray, 1994; Schwartz, 1994b; Nevin et coll., 2000). Il convient toutefois de souligner que l’utilisation du QI comme point de départ pour l’évaluation des risques présente certaines limites, étant donné que les scores de QI peuvent varier considérablement dans des délais très courts. Il est difficile de tenir compte de cette variabilité dans les études épidémiologiques. Vu le poids de la preuve solide concernant les diminutions de QI induites par le plomb et l’absence d’un seuil de toxicité connu pour ce critère d’effet, on a choisi le QI comme le critère d’effet sur lequel repose l’évaluation des risques autres que les risques de cancer.
L’étude déterminante choisie pour réaliser cette évaluation consiste en une analyse groupée de données provenant de sept études longitudinales prospectives entreprises avant 1995, qui a suivi des enfants depuis la naissance ou la petite enfance jusqu’à l’âge de 5 à 10 ans (Lanphear et coll., 2005). Cette étude a porté sur 1 333 enfants originaires de Boston (Massachusetts), de Cincinnati et de Cleveland (Ohio), de Rochester (New York), de Mexico (Mexique), de Port Pirie (Australie) et du Kosovo (Yougoslavie). Parmi les études existantes sur la baisse des scores de QI chez les enfants (voir la section 9.1.3.2), la méta-analyse réalisée par Lanphear et coll. (2005) compte le nombre le plus élevé de personnes et la plus grande diversité de sujets. On a évalué le QI global à l’aide des versions des échelles d’intelligence de Wechsler pour enfants adaptées à l’âge et à la langue. Dix covariables ont été examinées de manière globale; elles étaient disponibles pour la plupart des sujets, notamment le QI, la scolarité et l’état matrimonial de la mère, la consommation d’alcool pendant la grossesse, la consommation de tabac pendant la grossesse, le score d’inventaire de l’entrevue HOME, le sexe, le rang de naissance, le poids à la naissance et l’origine ethnique du sujet. L’analyse a eu recours à quatre indices de plombémie :
- la plombémie concomitante (mesurée le plus près possible dans le temps de l’administration des tests);
- la plombémie maximale;
- la plombémie moyenne à vie; et
- la plombémie durant la petite enfance (plombémie moyenne entre 6 mois et 2 ans).
Lanphear et coll. (2005) ont choisi la plombémie concomitante comme indice principal d’exposition au plomb en raison de son rapport le plus étroit avec le QI. Santé Canada est d’accord avec ce choix comme mesure que la dose en vue d’une analyse approfondie.
Les données individuelles tirées des plombémies concomitantes de l’étude de Lanphear et coll. (2005) ont été acquises par l’EFSA (2013) et le JECFA (2011) pour établir des BMD correspondant à un changement de QI de 1 %. Nous avons retenu une réponse de référence de 1 %, parce qu’elle correspond à un changement de QI dans la population égal à un changement d’un point de QI (les tests de QI sont normalisés de sorte que la moyenne est de 100 points). Dans une population de 100,000 personnes, une réduction d’un point de QI serait associée à une augmentation du nombre d’enfants présentant un QI de moins de 70 (retard mental léger) de 2275 à 2660 et une diminution du nombre d’enfants présentant un QI de plus de 130 (enfants surdoués) de 2275 à 1938 (Healey et coll., 2010). Les enfants dont le score de QI est à peine supérieur à 70 sont les plus susceptibles de développer un retard mental léger découlant d’une exposition au plomb. L’EFSA a estimé la BMD01 à 1,2 µg/dL et le JECFA, à 0,8 µg/dL. Dans l’ensemble, l’EFSA a fourni de nombreux détails concernant ses analyses de la BMD ainsi qu’une justification approfondie expliquant le choix du modèle pas-à-pas comme modèle le mieux ajusté associé au degré d’incertitude le plus faible (Budtz-Jorgensen et coll., 2013). C’est pourquoi on a utilisé la BMDI01 de 1,2 µg/dL pour estimer la dose orale correspondante.
En vue de déterminer les doses orales externes correspondantes associées à l’exposition par l’eau potable, une modélisation PBPK a été effectuée en utilisant l’ensemble des trois modèles disponibles (c.-à-d. les modèles IEUBK, de Leggett et d’O’Flaherty) (voir la section 8.5). On a déterminé que les doses orales administrées équivalentes étaient de 0,4, de 0,2 et de 08 µg/kg de poids corporel par jour pour les modèles IEUBK, de Leggett et d’O’Flaherty, respectivement. Comme il est établi que le modèle de Leggett surestime les plombémies à de faibles niveaux d’exposition (Pounds et Leggett, 1998), il n’a pas été retenu dans le cadre de notre analyse. Le modèle IEUBK, toutefois, a été considéré comme un excellent modèle, puisqu’il est adapté aux enfants et qu’il a été plus largement validé que d’autres modèles; la dose orale externe de 0,4 µg/kg de poids corporel par jour (ou 0,0004 mg/kg p.c. par jour) a donc servi de point de départ pour cette évaluation.
Comment il est mentionné à la section 9.1.3.2, il est impossible de déterminer la plus faible plombémie associée à des effets neurodéveloppementaux indésirables. Par conséquent, même si le plomb peut être considéré comme une substance avec seuil d’effet, une approche sans seuil est utilisée pour estimer correctement le risque associé à l’exposition au plomb. Le recours à une approche sans seuil comprend le calcul des niveaux de certains degrés de risque au moyen d’extrapolations linéaires aux faibles doses et, par conséquent, l’utilisation de facteurs d’incertitude n’est pas requise. Lorsqu’on utilise une réponse de référence de 1 %, la dose orale externe de 0,4 µg/kg de poids corporel par jour correspond à la dose associée à un risque de 10−2, ce qui équivaut à une perte d’un point de QI dans la population à l’étude. Une extrapolation linéaire aux faibles doses permet de déterminer les doses orales externes de 0,004 et de 0,0004 µg/kg de poids corporel par jour, lesquelles sont associées à des niveaux de risque respectifs de 10−4 et de 10−5. Ces doses orales peuvent ensuite servir à calculer les concentrations correspondantes dans l’eau potable à l’aide de l’équation suivante :

Figure 3 - Equivalent Textuel
La concentration dans l’eau potable, exprimée en mg/L, est calculée en multipliant la dose exprimée en mg/kg p.c. par jour par 18,2 kg (le poids corporel moyen d’un enfant de 5 ans). Le produit obtenu est ensuite divisé par 0,9 L/jour (le volume d’eau consommé quotidiennement par un enfant de 5 à 11).
où :
- les doses de 0,004 et de 0,0004 µg/kg p.c. par jour sont associées à des risques d’une baisse du QI de 10−4 et 10−5;
- 18,2 kg est le poids corporel moyen d’un enfant de 5 ans, déterminé selon les données du modèle IEUBK PBPK (U.S. EPA, 1994a, 1994b; White et coll., 1998);
- 0,9 L est le volume d’eau consommé quotidiennement par un enfant de 5 à 11 ans (Santé Canada, 1994).
La prochaine étape de cette approche sans seuil consisterait à établir une VBS fondée sur un niveau de risque acceptable (ou négligeable). Bien qu’il soit généralement admis que les effets neurodéveloppementaux sont le principal critère d’effet associé à l’exposition au plomb, la question de savoir si la perte d’un point de QI peut être considérée ou non comme « indésirable » suscite encore des débats. Même s’il est impossible d’établir un seuil pour le plomb, étendre le concept d’extrapolation linéaire, généralement limité aux cancérogènes génotoxiques, est la seule approche appropriée à l’heure actuelle dans le cadre de cette évaluation. Les seuls niveaux de risques acceptables de 10−5 à 10−6 largement adoptés s’appliquent aux critères d’effets génotoxiques liés au cancer. Étant donné que ces niveaux de risque seraient considérés comme trop prudents pour un critère d’effet comme une légère perte de QI, un niveau de risque acceptable variant de 10−4 à 10−5 serait jugé approprié dans le cadre de l’évaluation des risques d’effets du plomb autres que le cancer. Cela correspondrait à des concentrations se situant entre 0,008 et 0,08 µg/L pour le plomb dans l’eau potable, pour ce qui est des enfants de 5 à 11 ans, qui sont considérés comme étant la population la plus sensible.
Même si cette évaluation est extrêmement prudente, en partie en raison du taux d’erreur approximatif de ± 3 pour les tests de QI des enfants (Sattler, 2001), elle permet de se faire une idée des niveaux auxquels les effets neurodéveloppementaux deviendraient un élément à prendre en considération dans l’évaluation de l’exposition au plomb dans l’eau potable.
10.3 Comparaison des évaluations des risques de cancer et d’effets autres que le cancer
Même si les évaluations des risques de cancer et d’effets autres que le cancer ne sont pas jugées appropriées pour permettre le calcul d’une VBS pour le plomb dans l’eau potable, elles donnent une indication des niveaux auxquels ces effets deviendraient un élément à prendre en compte dans l’évaluation de l’exposition au plomb dans l’eau potable.
Il a été établi que des effets neurodéveloppementaux sont associés à des concentrations beaucoup plus faibles dans l’eau potable que les effets cancérogènes, ce qui met en relief la nécessité de réduire l’exposition au plomb en deçà des niveaux actuels.
10.4 Considérations internationales
On indique dans la présente section les diverses recommandations et normes pour la qualité de l’eau potable fixées par d’autres organisations internationales. Les limites varient en fonction de la date à laquelle remonte l’évaluation sur laquelle elles sont fondées, et en fonction des différences relatives aux politiques et aux démarches appliquées, y compris en ce qui concerne le choix de l’étude principale ou les taux de consommation, les poids corporels et les facteurs d’attribution employés.
L’U.S. EPA n’a pas établi de concentration maximale de contaminant dans le cas du plomb dans l’eau potable, mais son objectif est de la réduire à zéro (U.S. EPA, 2014b). Cette agence réglemente les concentrations de plomb dans le cadre de la Lead and Copper Rule (U.S. EPA, 1991, 2000), une règle fondée sur le traitement, qui a établi un seuil d’intervention de 0,015 mg/L (15 µg/L) pour le plomb dans l’eau potable. Sauf s’il a été déterminé qu’ils ne causaient pas de corrosion, les grands réseaux de distribution d’eau (dotés de plus de 50 000 branchements) sont tenus d’installer un « traitement optimal de contrôle de la corrosion » et de respecter les exigences précises des limites de fonctionnement relatives à la qualité de l’eau. Si le 90e percentile des concentrations de plomb dans les échantillons prélevés au robinet des consommateurs dans les sites répartis selon un ordre de priorité précis (échantillons de premier jet qui ont reposé pendant au moins 6 heures) excède le seuil d’intervention de 0,015 mg/L, les responsables du réseau doivent entreprendre un certain nombre d’interventions additionnelles pour contrôler la corrosion et sensibiliser le public. Le nombre de sites, la fréquence de la surveillance et l’étendue des interventions requises varient selon la taille du réseau. La Lead and Copper Rule fait actuellement l’objet d’une révision majeure, qui devrait être finalisée après 2015.
En 2011, l’OMS a révisé sa directive de qualité de l’eau de boisson pour le plomb et l’a maintenue à 10 µg/L. Cette directive est considérée provisoire, en fonction de la performance du traitement et des capacités d’analyse (OMS, 2011). Par le passé, les VBS pour le plomb des organismes comme l’OMS étaient fondées sur l’apport hebdomadaire tolérable provisoire (AHTP) de 0,025 mg/kg de poids corporel établie par le JECFA. Toutefois, en 2011, le JECFA a révisé les données sur le plomb et retiré le AHTP, concluant qu’il n’était pas possible établir une valeur qui permettrait de protéger la santé (JECFA, 2011).
La California Environmental Protection Agency (OEHHA, 2009) a établi un objectif de santé publique de 0,2 ppb (µg/L) pour le plomb dans l’eau potable, d’après de nouvelles études ayant établi un lien entre des déficits neurocomportementaux et des concentrations de plomb dans le sang plus faibles que ce qui a déjà été signalé. Cet objectif a été calculé en utilisant un faible niveau de préoccupation de 2,86 μg/jour, reposant principalement sur la revue et le calcul d’un facteur de pente de Carlisle et Dowling (2006), ainsi que sur leur analyse de l’étude de Lanphear et coll. (2005) (OEHHA, 2007), au moyen d’un apport relatif des diverses sources de 0,2, d’un facteur d’incertitude de 3 et d’un taux de consommation d’eau potable de 1 L/jour. En 1995, la California Department of Public Health (OEHHA, 2009) a établi un seuil d’intervention de 15 ppb pour le plomb dans l’eau potable d’après le seuil d’intervention fixé par l’EPA (1991).
11.0 Justification
Le plomb est omniprésent dans notre environnement. Les réductions importantes de la teneur en plomb dans des produits de consommation comme la peinture et l’essence au cours des dernières années font en sorte que la nourriture et l’eau constituent maintenant les principales sources d’exposition au plomb. Sa présence dans l’eau potable varie énormément et elle est davantage probable dans les vieilles maisons et les vieux quartiers construits à l’époque où les matériaux à base de plomb étaient couramment utilisés dans les réseaux de distribution et les installations de plomberie.
La toxicité du plomb a été amplement documentée chez l’humain au moyen de la concentration sanguine de plomb (plombémie) comme mesure de l’exposition. Les études épidémiologiques laissent entrevoir une vaste gamme d’effets toxiques, notamment un déclin de la cognition, une élévation de la pression artérielle et une dysfonction rénale chez les adultes, de même que des effets neurodéveloppementaux et comportementaux indésirables chez les enfants. L’association la plus forte observée à ce jour est celle entre des plombémies élevées chez les enfants et une diminution des scores de QI. Il est impossible de déterminer le seuil sous lequel le plomb n’est pas associé à des effets neurodéveloppementaux néfastes.
Les données sur les animaux de laboratoire corroborent les résultats obtenus chez les humains et font également état d’un risque de cancer à la suite d’une exposition au plomb inorganique. D’après les résultats chez les animaux, le CIRC a classé les composés de plomb inorganiques dans la catégorie des agents probablement cancérogènes pour l’humain (groupe 2A). Toutefois, une recommandation fondée sur la diminution du QI serait plus prudente et assurerait une protection contre tous les effets de l’exposition au plomb liés au cancer et à des affections autres que le cancer. Comme l’absorption cutanée et l’inhalation du plomb dans l’eau potable ne sont pas préoccupantes, aucune évaluation de l’exposition par des voies multiples n’a été effectuée.
Une CMA de 0,005 mg/L (5 µg/L) est proposée pour le plomb dans l’eau potable, en fonction des éléments suivants :
- La CMA doit être mesurable. L’U.S EPA a fixé un SPEQ de 0,005 mg/L, d’après la capacité des laboratoires de mesurer le plomb dans des limites raisonnables de précision et d’exactitude à l’aide des méthodes approuvées. Aucun processus similaire n’existe pour une établir un SPEQ propre au Canada.
- La CMA doit pouvoir être atteinte à un coût raisonnable. Les techniques de traitement à l’échelle municipale peuvent éliminer le plomb de l’eau potable, mais sa présence s’explique surtout par sa libération dans les réseaux de distribution et les installations de plomberie. Par conséquent, les stratégies visant à réduire au minimum le plomb au robinet devraient être axées sur le contrôle de la corrosion et le retrait des composants contenant du plomb. L’utilisation de matériaux certifiés conformes aux normes NSF/ANSI applicables, comme la norme 61 (Drinking Water System Components – Health Effects) et la norme 372 (Drinking Water System Components – Lead Content), permet de réduire la concentration de plomb au robinet.
- La CMA proposée aura une incidence importante sur les plombémies des enfants, la population la plus vulnérable. On estime qu’une CMA passant de 0,01 à 0,005 mg/L diminuera la moyenne géométrique des enfants présentant des plombémies supérieures à 5 µg/dL de 7,2 points de pourcentage (de 9,4 % à 2,2 %).
- Comme la principale source de plomb dans l’eau potable est le relargage de celui-ci à partir des composants des réseaux de distribution et des installations de plomberie, les dispositifs de traitement de l’eau potable à usage résidentiel, certifiés conformes à la norme NSF/ANSI applicable, s’avèrent la meilleure option pour réduire les concentrations de plomb au robinet. Par contre, leur utilisation ne devrait pas être considérée comme une solution permanente.
Après un examen du traitement et des capacités d’analyse, ainsi que des risques pour la santé associés à l’exposition au plomb provenant de l’eau potable, le Comité fédéral-provincial-territorial sur l’eau potable propose une CMA de 0,005 mg/L (5 µg/L) pour le plomb total dans l’eau potable, selon un échantillon d’eau prélevé au robinet du consommateur et selon le protocole d’échantillonnage approprié au type d’immeuble. Étant donné que cette valeur dépasse la concentration dans l’eau potable associée à des effets neurodéveloppementaux indésirables chez les enfants, tout doit être mis en œuvre pour maintenir les concentrations de plomb dans l’eau potable au niveau le plus faible qu’il soit raisonnablement possible d’atteindre (principe ALARA).
Santé Canada continuera, dans le cadre de son processus continu de révision des recommandations, à suivre les nouvelles recherches à ce sujet, et recommandera au besoin toute modification jugée appropriée.
12.0 Références
ACIA (2010). Projet sur les aliments destinés aux enfants - Rapport sur l'échantillonnage 2007-2008. Agence canadienne d’inspection des aliments. Disponible de : http://www.inspection.gc.ca/aliments/residus-chimiques-microbiologie/residus-chimiques/projet-sur-les-aliments-destines-aux-enfants/fra/1389125104073/1389125105323
Ades, A.E. et Kazantzis, G. (1988). Lung cancer in a non-ferrous smelter: the role of cadmium. Br. J. Ind. Med., 45(7): 435–442.
Åkesson, A., Lundh, T., Vahter, M., Bjellerup, P., Lidfeldt, J., Nerbrand, C., Samsioe, G., Strömberg, U. et Skerfving, S. (2005). Tubular and glomerular kidney effects in Swedish women with low environmental cadmium exposure. Environ. Health Perspect., 113(11): 1627–1631.
Alberta Department of Environment and Sustainable Resource Development (2011). Communication personnelle avec D. Reid.
Alexander, B.H., Checkoway, H., van Netten, C., Muller, C.H., Ewers, T.G., Kaufman, J.D., Mueller, B.A., Vaughan, T.L.and Faustman, E.M. (1996). Semen quality of men employed at a lead smelter. Occup. Environ. Med., 53(6): 411–416.
Alexander, F.W. (1974). The uptake of lead by children in differing environments. Environ. Health Perspect., 7: 155–159.
Al-Saleh, I., Nester, M., Devol, E., Shinwari, N., Munchari, L. et Al-Shahria, S. (2001). Relationships between blood lead concentrations, intelligence, and academic achievement of Saudi Arabian schoolgirls. Int. J.Hyg. Environ. Health, 204(2–3): 165–174.
Ambrose, T.M., Al-Lozi, M. et Scott, M.G. (2000). Bone lead concentrations assessed by in vivo X-ray fluorescence.Clin. Chem., 46(8 Pt. 1): 1171–1178.
Anjou Recherche (1994). Étude des phénomènes de solubilisation du plomb par l’eau distribuée et des moyens pour les limiter. Rapport de synthèse. Paris, France.
Anttila, A., Heikkila, P., Pukkala, E., Nykyri, E., Kauppinen, T., Hernberg, S. et Hemminki, K. (1995). Excess lung cancer among workers exposed to lead.Scand. J. Work Environ. Health, 21(6): 460–469.
APHA, AWWA et WEF (2005). Standard methods for the examination of water and wastewater. 21e édition. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, D.C.
APHA, AWWA et WEF (2012). Standard methods for the examination of water and wastewater. 22e édition. American Public Health Association, American Water Works Association et Water Environment Federation, Washington, D.C.
Aqua Terre Solutions Inc. (2009). Soil and groundwater sampling, Lakeshore Boulevard East, Toronto, Ontario. Prepared for City of Toronto, Toronto, Ontario.
Araki, S., Murata, K. et Aono, H. (1987). Central and peripheral nervous system dysfunction in workers exposed to lead, zinc and copper. A follow-up study of visual and somatosensory evoked potentials.Int. Arch.Occup. Environ. Health, 59(2): 177–187.
Ariza, M.E. et Williams, M.V. (1999). Lead and mercury mutagenesis: type of mutation dependent upon metal concentration. J. Biochem. Mol. Toxicol., 13(2): 107–112.
Ariza, M.E., Bijur, G.N. et Williams, M.V. (1998). Lead and mercury mutagenesis: role of H2O2, superoxide dismutase, and xanthine oxidase. Environ. Mol. Mutagen., 31(4): 352–361.
Arnvig, E., Grandjean, P. et Beckmann, J. (1980). Neurotoxic effects of heavy lead exposure determined with psychological tests. Toxicol. Lett., 5(6): 399–404.
ASTM (1996). Standard test methods for lead in water D3559-96. Dans : 1996 Annual book of ASTM standards. Vol. 11.01. ASTM International, West Conshohocken, Pennsylvania.
ASTM (2003). Standard test methods for lead in water D3559-03. Dans : 2003 Annual book of ASTM standards.Vol. 11.01. ASTM International, West Conshohocken, Pennsylvania.
ATSDR (1999). Toxicological profile for lead. Agency for Toxic Substances and Disease Registry, Public Health Service, U.S. Department of Health and Human Services, Atlanta, Georgia.
ATSDR (2007). Toxicological profile for lead. Agency for Toxic Substances and Disease Registry, Public Health Service, U.S. Department of Health and Human Services, Atlanta, Georgia. Disponible à : www.atsdr.cdc.gov/ToxProfiles/tp13.pdf
Attri, J., Dhawan, V., Mahmood, S., Pandhi, P., Parwana, H.K. et Nath, R. (2003). Effect of vitamin C supplementation on oxidative DNA damage in an experimental model of lead-induced hypertension. Ann.Nutr.Metab., 47(6): 294–301.
Awad El Karim, M.A., Hamed, S., Elhaimi, Y.A.A. et Osman, Y. (1986). Effects of exposure to lead among lead-acid battery factory workers in Sudan.Arch. Environ. Health, 41(4): 261–265.
AwwaRF (1990). Lead control strategies. AWWA Research Foundation et American Water Works Association, Denver, Colorado.
Azar, A., Trochimowicz, H. et Maxfield, M. (1972). Review of lead studies in animals carried out at Haskell laboratory—two year feeding study and response to hemorrhage study. Dans : Environmental health aspects of lead: proceedings of an international symposium, October 2–6, 1972. Commission of European Communities, Luxembourg.
Baghurst, P.A., McMichael, A.J., Wigg, N.R., Vimpani, G.V., Robertson, E.F., Roberts, R.J. et Tong, S.L. (1992). Environmental exposure to lead and children’s intelligence at the age of seven years—the Port Pirie cohort study.N. Engl. J.Med., 327(18): 1279–1284.
Bailey, R.J. et Russell, P.F. (1981). Predicting drinking water lead levels. Sci. Technol. Lett., 2: 57–66.
Bailey, R.J., Holmes, D., Jolly, P.K. et Lacey, R.F. (1986). Lead concentration and stagnation time in water drawn through lead domestic pipes. Water Research Centre, Medmenham, UK (Environment Report TR 243).
Baker, E.L., Jr., Landrigan, P.J., Barbour, A.G., Cox, D.H., Folland, D.S., Ligo, R.N. et Throckmorton, J. (1979). Occupational lead poisoning in the United States: clinical and biochemical findings related to blood lead levels.Br. J.Ind. Med., 36(4): 314–322.
Baker, E.L., Feldman, R.G., White, R.F. et Harley, J.P. (1983). The role of occupational lead exposure in the genesis of psychiatric and behavioral disturbances. Acta Psychiatr. Scand.Suppl., 303: 38–48.
Baló, J., Bajtai, A. et Szende, B. (1965). [Experimental adenomas of the kidney produced by chronic administration of lead phosphate.] Skagyar Onkol., 9: 144–151(in Hungarian) [cité dans IARC, 2006].
Baloh, R.W., Spivey, G.H., Brown, C.P., Morgan, D., Campion, D.S., Browdy, B.L., Valentine, J.L., Gonick, H.C., Massey, F.J., Jr.and Culver, B.D. (1979). Subclinical effects of chronic increased lead absorption—a prospective study. II. Results of baseline neurologic testing.J.Occup. Med., 21(7): 490–496.
Baron, J. (1997).La mesure du plomb au robinet de l’usager. Étude des méthodes d’échantillonage. Tech. Sci. Meth.Gen. Urbain Gen. Rural, 92(5): 47–54.
Baron, J. (2001). Monitoring strategy for lead in drinking water at consumer’s tap: field experiments in France. Water Sci. Technol. Water Supply, 1(4): 193–200.
Barratt, C.L.R., Davies, A.G., Bansal, M.R. et Williams, M.E. (1989). The effects of lead on the male rat reproductive system. Andrologia, 21(2): 161–166.
Barry, P.S. (1975). A comparison of concentrations of lead in human tissues. Br. J. Ind. Med., 32(2): 119–139.
Barry, P.S. et Mossman, D.B. (1970). Lead concentrations in human tissues. Br.J. Ind.Med., 27(4): 339–351.
Basha, M.R., Wei, W., Bakheet, S.A., Benitez, N., Siddiqi, H.K., Ge, Y.W., Lahiri, D.K.and Zawia, N.H. (2005). The fetal basis of amyloidogenesis: exposure to lead and latent overexpression of amyloid precursor protein and β-amyloid in the aging brain. J.Neurosci., 25(4): 823–829.
Bell, T., Campbell, S., Liverman, D.G.E., Allison, D. et Sylvester, P. (2010). Environmental and potential human health legacies of non-industrial sources of lead in a Canadian urban landscape—the case study of St John’s, Newfoundland. Int. Geol. Rev., 52(7–8): 771–800.
Bell, T., Allison, D.J., David, J., Foley, R., Kawaja, M., Mackey, S., Parewick, K., Pickard, F., Stares, J. et Valcour, J. (2011). Biomonitoring for environmental lead exposure in children from pre-1970s housing in St. John’s, Newfoundland and Labrador. Memorial University of Newfoundland, Eastern Health and Health Canada,St. John’s, Newfoundland and Labrador.
Bellinger, D.C., Stiles, K.M. et Needleman, H.L. (1992). Low-level lead exposure, intelligence and academic achievement: a long-term follow-up study. Pediatrics, 90(6): 855–861.
Bellinger, D., Hu, H., Titlebaum, L. et Needleman, H.L. (1994a). Attentional correlates of dentin and bone lead levels in adolescents. Arch. Environ. Health, 49(2): 98–105.
Bellinger, D., Leviton, A., Allred, E. et Rabinowitz, M. (1994b). Pre- and postnatal lead exposure and behavior problems in school-aged children. Environ. Res., 66(1): 12–30.
Bergdahl, I.A., Grubb, A., Schütz, A., Desnick, R.J., Wetmur, J.G., Sassa, S. et Skerfving, S. (1997). Lead binding to d-aminolevulinic acid dehydratase (ALAD) in human erythrocytes. Pharmacol. Toxicol., 81(4): 153–158.
Bergdahl, I.A., Vahter, M., Counter, S.A., Schütz, A., Buchanan, L.H., Ortega, F., Laurell, G. et Skerfving, S. (1999). Lead in plasma and whole blood from lead-exposed children. Environ. Res., 80(1): 25–33.
Birden, H.H., Calabrese, E.J. et Stoddard, A. (1985). Lead dissolution from soldered joints. J. Am. Water Works Assoc., 77(11): 66–70.
Blake, K.C.H. (1976). Absorption of 203Pb from gastrointestinal tract of man.Environ. Res., 11(1): 1–4.
Blake, K.C.H. et Mann, M. (1983). Effect of calcium and phosphorus on the gastrointestinal absorption of 203Pb in man. Environ. Res., 30(1): 188–194.
Blake, K.C.H., Barbezat, G.O. et Mann, M. (1983). Effect of dietary constituents on the gastrointestinal absorption of 203Pb in man. Environ.Res., 30(1): 182–187.
Bleecker, M.L., Ford, D.P., Lindgren, K.N., Hoese, V.M., Walsh, K.S. et Vaughan, C.G. (2005). Differential effects of lead exposure on components of verbal memory.Occup. Environ.Med., 62(3): 181–187.
Boffardi, B.P. (1988). Lead in drinking water—causes and cures. Public Works, 119(11): 67–70.
Boffardi, B.P. (1990). Minimization of lead corrosion in drinking water. Mater. Perform., 29(8): 45–49.
Bolanowska, W., Piotrowski, J. et Garczynski, H. (1967). Triethyllead in the biological material in cases of acute tetraethyllead poisoning. Archiv. Toxikol., 22(4): 278–282.
Borja-Aburto, V.H., Hertz-Picciotto, I., Lopez, M.R., Farias, P., Rios, C. et Blanco, J. (1999). Blood lead levels measured prospectively and risk of spontaneous abortion. Am. J.Epidemiol., 150(6): 590–597.
Bouchard, M.F., Bellinger, D.C., Weuve, J., Matthews-Bellinger, J., Gilman, S.E., Wright, R.O., Schwarz, J. et Weisskopf, M.G. (2009). Blood lead levels and major depressive disorder, panic disorder, and generalized anxiety disorder in US young adults. Arch.Gen. Psychiatry, 66(12): 1313–1319.
Boucher, O., Burden, M.J., Muckle, G., Saint-Amour, D., Ayotte, P., Dewailly, E., Nelson, C.A., Jacobson, S.W. et Jacobson, J.L. (2012). Response inhibition and error monitoring during a visual go/no-go task in Inuit children exposed to lead, polychlorinated biphenyls, and methylmercury. Environ. Health Perspect., 120(4): 608–615.
Bowers, T.S. et Mattuck, R.L. (2001). Further comparisons of empirical and epidemiological data with predictions of the Integrated Exposure Uptake Biokinetic Model for Lead in Children. Hum. Ecol. Risk Assess., 7(6): 1699–1713.
Bowman, C. et Bobrowsky, P.T. (2003). Health and the urban geochemical environment, Victoria, BC. Dans : Proceedings of the International Symposium on Environmental Geochemistry, Edinburgh, UK. p. 140 [cité dans Bell et coll., 2010].
Boyd, G.R., Pierson, G.L., Kirmeyer, G.J. et English, R.J. (2008a). Lead variability testing in Seattle public schools. J. Am. Water Works Assoc., 100(2): 53–64.
Boyd, G.R., Pierson, G.L., Kirmeyer, G.J., Britton, M.D. et English, R.J. (2008b). Lead release from new end-use plumbing components in Seattle public schools. J. Am. Water Works Assoc., 100(3): 105–114.
Boyd, G.R., McFadden, M.S., Reiber, S.H., Sandvig, A.M., Korshin, G.V., Giani, R. et Frenkel, A.I.(2010). Effects of changing disinfectants on distribution system lead and copper release: Part 2—research results. Water Research Foundation, Denver, Colorado.
Boyd, G.R., Reiber, S.H.,McFadden,M.S. et Korshin,G.V. (2012). Effects of changing water quality on galvanic coupling. J. Am.Water Works Assoc., 104(3): E136–E149.
Boyland, E., Dukes, C.E., Grover, P.L. et Mitchley, B.C. (1962). The induction of renal tumors by feeding lead acetate to rats. Br. J. Cancer, 16: 283–288.
Braun, J.M., Kahn, R.S., Froehlich, T., Auinger, P. et Lanphear, B.P. (2006). Exposures to environmental toxicants and attention deficit hyperactivity disorder in U.S. children. Environ. Health Perspect., 114(12): 1904–1909.
Bress, W.C. et Bidanset, J.H. (1991). Percutaneous in vivo and in vitro absorption of lead. Vet. Hum.Toxicol., 33(3): 212–214.
Bressler, J.P. et Goldstein, G.W. (1991). Mechanisms of lead neurotoxicity. Biochem. Pharmacol., 41(4): 479–484.
Britton, A. et Richards, W.N. (1981). Factors influencing plumbosolvency in Scotland. J. Inst. Water Eng. Sci., 35(4): 349–364.
Brown, M.J., Raymond, J., Homa, D., Kennedy, C. et Sinks, T. (2011). Association between children’s blood lead levels, lead service lines, and water disinfection, Washington, DC, 1998–2006. Environ. Res., 111(1):67–74.
Brubaker, C.J., Schmithorst, V.J., Haynes, E.N., Dietrich, K.N., Egelhoff, J.C., Lindquist, D.M., Lanphear, B.P. et Cecil, K.M. (2009). Altered myelination and axonal integrity in adults with childhood lead exposure: a diffusion tensor imaging study. Neurotoxicology, 30(6): 867–875.
Bryant, S.D. (2004). Lead contaminated drinking waters in the public schools of Philadelphia. J. Toxicol., 42(3): 287–294.
Budtz-Jorgensen, E., Bellinger, D., Lanphear, B. et Grandjean, P. (2013). An international pooled analysis for obtaining a benchmark dose for environmental lead exposure in children. Risk Anal., 33(3): 450–461.
Burger, J. et Gochfeld, M. (1997). Lead and neurobehavioral development in gulls: a model for understanding effects in the laboratory and the field. Neurotoxicology, 18(2): 495–506.
Burger, J. et Gochfeld, M. (2005). Effects of lead on learning in herring gulls: an avian wildlife model for neurobehavioral deficits. Neurotoxicology, 26(4): 615–624.
Bushnik, T., Haines, D., Levallois, P., Levesque, J., Van Oostdam, J. et Viau, C. (2010). Concentrations de plomb et de bisphénol A pour la population canadienne. Division de l’analyse de la santé, Statistique Canada, Ottawa, Ontario (Rapports sur la santé 21(3); n° de catalogue de Statistique Canada 82-003-XPE). Disponible à : www.statcan.gc.ca/pub/82-003-x/2010003/article/11324-fra.htm
Camara, E., Montreuil, K.R., Knowles, A.K. et Gagnon, G.A. (2013).Role of the water main in lead service line replacement:a utility case study. J. Am. Water Works Assoc., 105(8): E423–E431.
Campara, P., D’Andrea, F., Micciolo, R., Savonitto, C., Tansella, M. et Zimmermann-Tansella, C. (1984). Psychological performance of workers with blood-lead concentration below the current threshold limit value. Int. Arch. Occup. Environ. Health, 53(3): 233–246.
Canfield, R.L., Henderson, C.R., Jr., Cory-Slechta, D.A., Cox, C., Jusko, T.A. et Lanphear, B. (2003a). Intellectual impairment in children with blood lead concentrations below 10 µg per deciliter. N. Engl. J.Med., 348(16): 1517–1526.
Canfield, R.L., Kreher, D.A., Cornwell, C. et Henderson, C.R., Jr. (2003b). Low-level lead exposure, executive functioning, and learning in early childhood. Child Neuropsychol., 9(1): 35–53.
Canfield, R.L., Gendle, M.H. et Cory-Sletcha, D.A. (2004). Impaired neuropsychological functioning in lead-exposed children. Dev. Neuropsychol., 25(1):513–540.
Cantonwine, D., Hu, H., Sánchez, B.N., Lamadrid-Figueroa, H., Smith, D., Ettinger, A.S., Mercado-García, A., Hernández-Avila, M., Wright, R.O. et Téllez-Rojo, M.M. (2010). Critical windows of fetal lead exposure: adverse impacts on length of gestation and risk of premature delivery. J. Occup. Environ.Med., 52(11): 1106–1111.
Cardew, P. (2000). Simulation of lead compliance data. Water Res., 34(8): 2241–2252.
Cardew, P. (2003). A method for assessing the effect of water quality changes on plumbosolvency using random daytime sampling. Water Res., 37(12): 2821–2823.
Carlisle, J.C. et Dowling, K. (2006). Child-specific health guidance for lead. Presented at the Annual Meeting of the Society of Toxicology, March 2006. Toxicologist, 90(1):449 (Abstract 2191). Disponible à : www.toxicology.org/AI/Pub/Tox/2006Tox.pdf
Carmignani, M., Volpe, A.R., Boscolo, P., Qiao, N., Di Gioacchino, M., Grilli, A. et Felaco, M. (2000). Catecholamine and nitric oxide systems as targets of chronic lead exposure in inducing selective functional impairment. Life Sci., 68(4): 401–415.
Carson, T.L., Van Gelder, G.A., Karas, G.C. et Buck, W.B. (1974). Slowed learning in lambs prenatally exposed to lead. Arch. Environ. Health, 29(3): 154–156.
Cartier, C., Laroche, L., Deshommes, E., Nour, S., Richard, G., Edwards, M. et Prévost, M. (2011). Investigating dissolved lead at the tap using various sampling protocols. J. Am. Water Works Assoc., 103(3): 53–67.
Cartier, C., Arnold, R., Triantafyllidou, S., Prévost, M. et Edwards, M. (2012a). Effect of flow rate and lead/copper pipe sequence on lead release from service lines. Water Res., 46(13): 4142–4152.
Cartier, C., Bannier, A., Pirog, M., Nour, S. et Prévost, M. (2012b). A rapid method for lead service line detection.J. Am. Water Works Assoc., 104(11): E596–E607.
Cartier, C., Nour, S., Richer, B., Deshommes, E. et Prévost, M. (2012c). Impact of water treatment on the contribution of faucets to dissolved and particulate lead release at the tap. Water Res., 46(16): 5205–5216.
Cartier, C., Doré, E., Laroche, L., Nour, S., Edwards, M. et Prévost, M. (2013). Impact of treatment on Pb release from full and partially replaced lead service lines (LSLs). Water Res., 47(2): 661–671.
CCME (1999). Recommandations canadiennes pour la qualité des sols : Environnement et santé humaine: Plomb. Dans : Recommandations canadiennes pour la qualité de l'environnement. Conseil canadien des ministres de l'environnement, Winnipeg, Manitoba. Disponible à : http://ceqg-rcqe.ccme.ca/download/fr/181
CCN (2015). Répertoire des organismes de certification accrédités de produits, de processus et de services. Conseil canadien des normes, Ottawa, Ontario. Disponible à : www.scc.ca/fr/accreditation/product-process-and-service-certification/directory-of-accredited-clients
Cecil, K.M., Brubaker, C.J., Adler, C.M., Dietrich, K.N., Altaye, M., Egelhoff, J.C., Wessel, S., Elangovan, I., Hornung, R., Jarvis, K. et Lanphear, B.P. (2008). Decreased brain volume in adults with childhood lead exposure. PLoS Med., 5(5): e112. Disponible à : www.ncbi.nlm.nih.gov/pmc/articles/PMC2689675/
Cecil, K.M., Dietrich, K.N., Altaye, M., Egelhoff, J.C., Lindquist, D.M., Brubaker, C.J. et Lanphear, B.P. (2011). Proton magnetic resonance spectroscopy in adults with childhood lead exposure.Environ. Health Perspect., 119(3): 403–408.
Centre for Environmental Monitoring (2004). Metal levels in the soils of the Sudbury smelter footprint. A report to INCO Ltd., Copper Cliff, Ontario, et Falconbridge Ltd., Falconbridge, Ontario. Disponible à : www.sudburysoilsstudy.com/EN/media/Volume_I/SSS_Vol_I_b_App_C%20_CEM.pdf
Chamberlain, A.C., Clough, W.S., Heard, M.J., Newton, D., Stott, A.N. et Wells, A.C. (1975). Uptake of lead by inhalation of motor exhaust. Proc. R. Soc. Lond. Biol. Sci., 192(1106): 77–110.
Chamberlain, A.C., Heard, M.J., Little, P., Newton, D., Wells, A.C. et Wiffen, R.D. (1978). Investigations into lead from motor vehicles. United Kingdom Atomic Energy Research Establishment, Harwell, UK(AERE-9198).
Chamberlain, A.C., Heard, M.J., Little, P., Wiffen, R.D., Harrison, R.M., Megaw, W.J. et Butler, J.D. (1979). The dispersion of lead from motor exhausts [and discussion]. Philos. Trans. R. Soc. Lond. Ser. A Math. Phys. Eng. Sci., 290: 557–589.
Chan, L., Reveveur, O., Sharp, D., Schwartz, H., Ing, I. et Tikhonov, C. (2011). First NationsFood, Nutrition & Environment Study (FNFNES): results from British Columbia (2008/2009). University of Northern British Columbia, Prince George, B.C. Disponible à : www.fnfnes.ca/docs/BC%20Reports/FNFNES_Report_BC_FINAL_PRINT_v2.pdf
Chandramouli, K., Steer, C.D., Ellis, M. et Emond, A.M. (2009). Effects of early childhood lead exposure on academic performance and behaviour of school age children. Arch. Dis. Child., 94(11): 844–848.
Chang, H.R., Chen, S.S., Chen, T.J., Ho, C.H., Chiang, H.C. et Yu, H.S. (1996). Lymphocyte β2-adrenergic receptors and plasma catecholamine levels in lead-exposed workers. Toxicol. Appl. Pharmacol., 139(1): 1–5.
Chang, H.R., Chen, S.S., Tsao, D.A., Cheng, J.T., Ho, C.K. et Yu, H.S. (1997). Change of cardiac β-adrenoceptors in lead-exposed rats. Toxicology, 123(1–2): 27–32.
Chen, A., Dietrich, K.N., Ware, J.H., Radcliffe, J. et Rogan, W.J. (2005). IQ and blood lead from 2 to 7 years of age: are the effects in older children the residual of high blood lead concentrations in 2-year-olds? Environ. Health Perspect., 113(5): 597–601.
Chen, H.H., Ma, T., Paul, I.A., Spencer, J.L. et Ho, I.K. (1997). Developmental lead exposure and two-way active avoidance training alter the distribution of protein kinase C activity in the rat hippocampus. Neurochem. Res., 22(9): 1119–1125.
Chen, H.H., Ma, T. et Ho, I.K. (2001). Effects of developmental lead exposure on inhibitory avoidance learning and glutamate receptors in rats.Environ. Toxicol. Pharmacol., 9(4): 185–191.
Cheng, Y., Schwartz, J., Sparrow, D., Aro, A., Weiss, S.T. et Hu, H. (2001). Bone lead and blood lead levels in relation to baseline blood pressure and the prospective development of hypertension. The Normative Aging Study. Am. J. Epidemiol., 153(2): 164–171.
Chettle, D.R. (2005). Three decades of in vivo x-ray fluorescence of lead in bone. X-Ray Spectrom., 34(5): 446–450.
Chia, S.E., Chia, K.S., Chia, H.P., Ong, C.N. et Jeyaratnam, J. (1996). Three-year follow-up of serial nerve conduction among lead-exposed workers.Scand. J. Work Environ. Health, 22(5): 374–380.
Chiodo, L.M., Jacobson, S.W. et Jacobson, J.L. (2004). Neurodevelopmental effects of postnatal lead exposure at very low levels. Neurotoxicol. Teratol., 26(3): 359–371.
Chiodo, L.M., Covington, C., Sokol, R.J., Hannigan, J.H., Jannise, J., Ager, J., Greenwald, M. et Delaney-Black, V. (2007). Blood lead levels and specific attention effects in young children. Neurotoxicol. Teratol., 29(5): 538–546.
Chisolm, J.J., Jr., Harrison, H.C., Eberlein, W.R. et Harrison, H.E. (1955). Amino-aciduria, hypophosphatemia and rickets in lead poisoning. Arch. Pediatr. Adolesc. Med., 89(2): 159–168.
Cho, S.C., Kim, B.N., Hong, Y.C., Shin, M.S., Yoo, H.J., Kim, J.W., Bhang, S.Y., Cho, I.H. et Kim, H.W. (2010). Effect of environmental exposure to lead and tobacco smoke on inattentive and hyperactive symptoms and neurocognitive performance in children. J. Child Psychol. Psychiatry, 51(9): 1050–1057.
Chuang, H.Y., Chao, K.Y. et Tsai, S.Y. (2005). Reversible neurobehavioral performance with reductions in blood lead levels—A prospective study on lead workers. Neurotoxicol. Teratol., 27(3): 497–504.
Churchill, D.M., Mavinic, D.S., Neden, D.G. et MacQuarrie, D.M. (2000). The effect of zinc orthophosphate and pH–alkalinity adjustment on metal levels leached into drinking water. Can. J. Civil Eng., 27(6): 33–43.
Clark, B., Masters, S. et Edward, M. (2014). Profile sampling to characterize particulate lead risks in potable water. Environ. Sci. Technol., 48(12): 6836–6843. doi: 10.1021/es501342j
Clifford, D.A. (1999). Ion exchange and inorganic adsorption. Chapter 9 in: Letterman, R.D.(ed). Water quality and treatment: a handbook of community water supplies, 5th edition American Water Works Association. Denver, Colorado. McGraw-Hill, New York, New York.
Clifford, D., Sorg, T. and Ghurye, G. (2011). Ion exchange and adsorption of inorganic contaminants. Chapter 12 in: Edzwald, J.K. (ed.).Water quality and treatment: a handbook of community water supplies. 6th edition. American Water Works Association,Denver, Colorado. McGraw-Hill, New York, New York.
CNRC (2010). Code national de la plomberie – Canada. Conseil national de recherches du Canada, Ottawa, Ontario.
CNRC (2013). Code national de la plomberie – Canada 2010. Conseil national de recherches du Canada, Ottawa, Ontario.Version anglaise disponible à : www.nrc-cnrc.gc.ca/obj/doc/2010_npc_revisions_november2013.pdf
Colling, J.H., Whincup, P.A.E. et Hayes, C.R. (1987). The measurement of plumbosolvency propensity to guide the control of lead in tapwaters. J. Inst. Water Environ. Manage., 1(3): 263–269.
Colling, J.H., Croll, B.T., Whincup, P.A.E. et Harward, C. (1992) Plumbosolvency effects and control in hard waters. J. Inst. Water Environ. Manage., 6(6): 259–269.
Columbano, A., Ledda-Columbano, G.M., Ennas, M.G., Curto, M., De Montis, M.G., Roomi, M.W., Pani, P. et Sarma, D.S.R. (1988). Modulation of the activity of hepatic γ-glutamyl transpeptidase, adenosine triphosphatase, placental glutathione S-transferase and adenylate cyclase by acute administration of lead nitrate. Basic Appl. Histochem., 32(4): 501–510.
Commons, C. (2011). Effect of partial lead service line replacement on total lead at the tap. Office of Drinking Water Quality, Rhode Island Department of Health. Disponible à : www.health.ri.gov/publications/projectreports/EffectOfPartialLeadServiceLineReplacementOnTotalLeadAtTheTap.pdf
Commission Européenne (1999). Developing a new protocol for the monitoring of lead in drinking water. Directorate General for Science, Research and Development, European Commission, Brussels (Report No. REPORTER 19087 EN).
Conestoga-Rovers and Associates (2010). Human health risk assessment,Town of Buchans, Newfoundland and Labrador. Conestoga-Rovers and Associates, Waterloo, Ontario.
Conservation et Gestion des ressources hydriques du Manitoba (2013). Communication personnelle de K.Philip.
Cooney, G.H., Bell, A., McBride, W. et Carter, C. (1989a). Low-level exposures to lead: the Sydney Lead Study.Dev. Med. Child Neurol., 31(5): 640–649.
Cooney, G.H., Bell, A., McBride, W. et Carter, C. (1989b). Neurobehavioural consequences of prenatal low level exposures to lead. Neurotoxicol. Teratol., 11(2): 95–104.
Coria, F., Berciano, M.T., Berciano, J. et Lafarga, M. (1984). Axon membrane remodeling in the lead-induced demyelinating neuropathy of the rat. Brain Res., 291(2): 369–372.
Corpas, I., Gaspar, I., Martinez, S., Codesal, J., Candelas, S. et Antonio, M.T. (1995). Testicular alterations in rats due to gestational and early lactational administration of lead. Reprod. Toxicol., 9(3): 307–313.
Cory-Slechta, D.A. (1986). Prolonged lead exposure and fixed ratio performance. Neurobehav. Toxicol. Teratol., 8(3): 237–244.
Cory-Slechta, D.A. et Pokora, M.J. (1991). Behavioral manifestations of prolonged lead exposure initiated at different stages of the life cycle: I. Schedule-controlled responding. Neurotoxicology, 12(4): 745–760.
Cory-Slechta, D.A. et Thompson, T. (1979). Behavioral toxicity of chronic postweaning lead exposure in the rat. Toxicol. Appl. Pharmacol., 47(1): 151–159.
Cory-Slechta, D.A., Bissen, S.T., Young, A.M. et Thompson, T. (1981). Chronic postweaning lead exposure and response duration performance.Toxicol. Appl.Pharmacol., 60(1): 78–84.
Cory-Slechta, D.A., Weiss, B. et Cox, C. (1983). Delayed behavioral toxicity of lead with increasing exposure concentration. Toxicol. Appl. Pharmacol., 71(3): 342–352.
Cory-Slechta, D.A., Weiss, B. et Cox, C. (1985). Performance and exposure indices of rats exposed to low concentrations of lead. Toxicol. Appl. Pharmacol., 78(2): 291–299.
Cory-Slechta, D.A., Pokora, M.J. et Widzowski, D.V. (1991). Behavioral manifestations of prolonged lead exposure initiated at different stages of the life cycle: II. Delayed spatial alternation. Neurotoxicology, 12(4): 761–776.
Cory-Slechta, D.A., Virgolini, M.B., Thiruchelvam, M., Weston, D.D. et Bauter, M.R. (2004). Maternal stress modulates the effects of developmental lead exposure. Environ. Health Perspect., 112: 717–733.
Cory-Slechta, D.A., Merchant-Borna, K., Allen, J.L., Liu, S., Weston, D. et Conrad, K. (2013). Variations in the nature of behavioral experience can differentially alter the consequences of developmental exposures to lead, prenatal stress, and the combination. Toxicol. Sci., 131(1): 194–205.
Counter, S.A. et Buchanan, L.H. (2002). Neuro-ototoxicity in Andean adults with chronic lead and noise exposure.J. Occup. Environ.Med., 44(1): 30–38.
CPSC (2005). Interim enforcement policy for children’s metal jewelry containing lead. Office of Compliance, U.S. Consumer Product Safety Commission, Washington, D.C. Disponible à : www.cpsc.gov/PageFiles/64485/pbjewelgd.pdf
Crump, K.S., van Landingham, C., Bowers, T.S., Cahoy, D. et Chandalia, J.K. (2013). A statistical reevaluation of the data used in the Lanphear et al. (2005) pooled-analysis that related low levels of blood lead to intellectual deficits in children. Crit. Rev. Toxicol., 43(9): 785–799.
CSA (2012a). American Society of Mechanical Engineers/Canadian Standards Association ASME A112.18.1-2012/CSA B125.1-12—Plumbing supply fittings. Canadian Standards Association, Mississauga, Ontario.
CSA (2012b). Canadian Standards Association CSA B125.3-12—Plumbing supply fittings. Canadian Standards Association, Mississauga, Ontario.
Dabeka, R.W., Karpinski, K.F., McKenzie, A.D. et Bajdik, C.D. (1986). Survey of lead, cadmium and fluoride in human milk and correlation of levels with environmental and food factors. Food Chem.Toxicol., 24(9): 913–921.
Daggett, D.A., Oberley, T.D., Nelson, S.A., Wright, L.S., Kornguth, S.E. et Siegel, F.L. (1998). Effects of lead on rat kidney and liver: GST expression and oxidative stress. Toxicology, 128(3): 191–206.
Danadevi, K., Rozati, R., Saleha Banu, B., Hanumanth Rao, P. et Grover, P. (2003). DNA damage in workers exposed to lead using comet assay. Toxicology, 187(2–3): 183–193.
Dearth, R.K., Hiney, J.K., Srivastava, V., Burdick, S.B., Bratton, G.R. et Dees, W.L. (2002). Effects of lead (Pb) exposure during gestation and lactation on female pubertal development in the rat.Reprod. Toxicol., 16(4): 343–352.
Defence Research and Development Canada (2004). Evaluation of the contamination by explosives and metals in soils, vegetation, surface water and sediment at Cold Lake Air Weapons Range (CLAWR), Alberta, Phase II final report. Defence Research and Development Canada, Valcartier, Quebec (TR 2004-204).
Deknudt, G. et Gerber, G.B. (1979). Chromosomal aberrations in bone-marrow cells of mice given a normal or a calcium-deficient diet supplemented with various heavy metals.Mutat. Res., 68(2): 163–168.
Del Toral, M.A., Porter, A. et Schock, M.R. (2013). Detection and evaluation of elevated lead release from service lines: a field study. Environ. Sci. Technol., 47(16): 9300–9307.
Deng, W., McKinnon, R.D. et Poretz, R.D. (2001). Lead exposure delays the differentiation of oligodendroglial progenitors in vitro.Toxicol. Appl.Pharmacol., 174(3): 235–244.
Denham, M., Schell, L.M., Deane, G., Gallo, M.V., Ravenscroft, J. et DeCaprio, A.P. (2005). Relationship of lead, mercury, mirex, dichlorodiphenyldichloroethylene, hexachlorobenzene, and polychlorinated biphenyls to timing of menarche among Akwesasne Mohawk girls. Pediatrics, 115(2): e127–e134.
Den Hond, E., Nawrot, T. et Staessen, J.A. (2002). The relationship between blood pressure and blood lead in NHANES III. J. Hum. Hypertens., 16(8): 563–568.
De Restrepo, H.G., Sicard, D. et Torres, M.M. (2000). DNA damage and repair in cells of lead exposed people. Am. J. Ind. Med., 38(3): 330–334.
Deshommes, E., Laroche, L., Nour, S., Cartier, C. et Prévost, M. (2010a). Source and occurrence of particulate lead in tap water. Water Res., 44(12): 3734–3744.
Deshommes, E., Zhang, Y., Gendron, K.,Sauvé, S., Edwards, M., Nour, S. et Prévost, M. (2010b). Lead removal from tap water using POU devices. J. Am. Water Works Assoc., 102(10): 91–105.
Deshommes, E., Tachet, A. et Prévost, M. (2012a). Does food prepared with tap water contribute more than tap water to children’s exposure to lead? Dans : Proceedings of the American Water Works Association Water Quality Technology Conference, Toronto, Ontario, November 4–8, 2012. American Water Works Association, Denver, Colorado.
Deshommes, E., Nour, S., Richer, B., Cartier, C. et Prévost, M. (2012b). POU devices in large buildings: lead removal and water quality. J. Am. Water Works Assoc., 104(4): E282–E297.
Deshommes, E., Tardif, R., Edwards, M., Sauvé, S. et Prévost, M. (2012c). Experimental determination of the oral bioavailability and bioaccessibility of lead particles. Chem. Cent. J.,6(1): 138. doi: 10.1186/1752-153X-6-138
Deshommes, E., Prévost, M., Levallois, P., Lemieux, F. et Nour, S. (2013).Application of lead monitoring results to predict 0–7 year old children’s exposure at the tap. Water Res., 47: 2409–2420.
Deshommes, E., Andrews, R., Gagnon, G., McCluskey, T., McIlwain, Doré, E., Nour, S. and Prévost, M. (2016). Evaluation of exposure to lead from drinking water in large buildings. Water Res., 99: 46–55.
Després, C., Beuter, A., Richer, F., Poitras, K., Veilleux, A., Ayotte, P., Dewailly, E., Saint-Amour, D.and Muckle, G. (2005). Neuromotor functions in Inuit preschool children exposed to Pb, PCBs, and Hg. Neurotoxicol. Teratol., 27(2): 245–257.
Devoto, P., Flore, G., Ibba, A., Fratta, W. et Pani, L. (2001). Lead intoxication during intrauterine life and lactation but not during adulthood reduces nucleus accumbens dopamine release as studied by brain microdialysis.Toxicol. Lett., 121(3): 199–206.
Dhir, H., Roy, A.K. et Sharma, A. (1993). Relative efficiency of Phyllanthus emblica fruit extract and ascorbic acid in modifying lead and aluminium-induced sister-chromatid exchanges in mouse bone marrow. Environ. Mol. Mutagen., 21(3): 229–236.
Dietrich, K.N., Succop, P.A., Berger, O.G. et Keith, R.W. (1992). Lead exposure and the central auditory processing abilities and cognitive development of urban children: the Cincinnati Lead Study cohort at age 5 years. Neurotoxicol. Teratol., 14(1): 51–56.
Dietrich, K.N., Berger, O.G. et Succop, P.A. (1993a). Lead exposure and the motor developmental status of urban six-year-old children in the Cincinnati Prospective Study. Pediatrics, 91(2): 301–307.
Dietrich, K.N., Berger, O.G., Succop, P.A., Hammond, P.B. et Bornschein, R.L. (1993b). The developmental consequences of low to moderate prenatal and postnatal lead exposure: intellectual attainment in the Cincinnati Lead Study cohort following school entry. Neurotoxicol. Teratol., 15(1): 37–44.
Dietrich, K.N., Douglas, R.M., Succop, P.A., Berger, O.G. et Bornschein, R.L. (2001). Early exposure to lead and juvenile delinquency. Neurotoxicol. Teratol., 23(6): 511–518.
Ding, Y., Vaziri, N.D. et Gonick, H.C. (1998). Lead-induced hypertension: II. Response to sequential infusions of L-arginine, superoxide dismutase, and nitroprusside. Environ. Res., 76(2): 107–113.
Ding, Y., Gonick, H.C., Vaziri, N.D., Liang, K. et Wei, L. (2001). Lead-induced hypertension. III. Increased hydroxyl radical production.Am. J. Hypertens., 14(2): 169–173.
Dixon, S.L., Gaitens, J.M., Jacobs, D.E., Strauss, W., Nagaraja, J., Pivetz, T., Wilson, J.W. et Ashley, P.J. (2009). Exposure of U.S. children to residential dust lead, 1999–2004: II. The contribution of lead-contaminated dust to children’s blood lead levels. Environ. Health Perspect., 117(3): 468–474.
Dodrill, D.M. et Edwards, M. (1995). Corrosion control on the basis of utility experience. J. Am. Water Works Assoc., 87(7): 74–85.
Dogu, O., Louis, E.D., Tamer, L., Unal, O., Yilmaz, A. et Kaleagasi, H. (2007). Elevated blood lead concentrations in essential tremor: a case–control study in Mersin, Turkey. Environ. Health Perspect., 115(11): 1564–1568.
Donald, J.M., Cutler, M.G. et Moore, M.R. (1987). Effects of lead in the laboratory mouse. Development and social behaviour after lifelong exposure to 12 µM lead in drinking fluid.Neuropharmacology, 26(4): 391–399.
Doré, E., Deshommes, E., Nour, S. et Prévost, M. (2013). Measuring Lead Levels at the Tap of Canadian Schools : the Importanceof Consideringparticulate Lead. 2013 Water Quality Technology Conference and Exposition, WQTC 2013.
Douglas, I., Guthmann, J., Muylwyk, Q. et Snoeyink, V. (2004) Corrosion control in the City of Ottawa-Comparison of alternatives and case study for lead reduction in drinking water. Dans : W. Robertson et T. Brooks (eds.), 11th Canadian National Drinking Water Conference and 2nd Policy Forum, April 3-6, Calgary, Alberta. Canadian Water and Wastewater Association, Ottawa, Ontario.
Dribben, W.H., Creeley, C.E. et Farber, N. (2011). Low-level lead exposure triggers neuronal apoptosis in the developing mouse brain.Neurotoxicol. Teratol., 33(4): 473–480.
Dursun, N., Arifoglu, C., Süer, C. et Keskinol, L. (2005). Blood pressure relationship to nitric oxide, lipid peroxidation, renal function, and renal blood flow in rats exposed to low lead levels.Biol. Trace Elem.Res., 104(2): 141–149.
Edwards, M. et Dudi, A. (2004). Role of chlorine and chloramine in corrosion of lead-bearing plumbing materials. J. Am. Water Works Assoc., 96(10): 69–81.
Edwards, M. et Triantafyllidou, S. (2007). Chloride-to-sulfate mass ratio and lead leaching to water. J. Am. Water Works Assoc., 99(7): 96–109.
Edwards, M., Triantafyllidou, S. et Best, D. (2009). Elevated blood lead in young children due to lead-contaminated drinking water: Washington, DC, 2001–2004. Environ. Sci. Technol., 43: 1618–1623.
EFSA (2013). Scientific opinion on lead in food. EFSA Panel on Contaminants in the Food Chain (CONTAM), European Food Safety Authority, Parma, Italy. EFSA J., 8(4): 1570. Disponible à : www.efsa.europa.eu/en/efsajournal/doc/1570.pdf
Ekong, E.B., Jaar, B.G. et Weaver, V.M. (2006). Lead-related nephrotoxicity: a review of the epidemiologic evidence. Kidney Int., 70(12): 2074–2084.
Elfland, C., Scardina, P. et Edwards, M. (2010).Lead-contaminated water from brass plumbing devices in new buildings. J. Am. Water Works Assoc., 102(11): 66–76.
Emory, E., Ansari, Z., Pattillo, R., Archibold, E. et Chevalier, J. (2003). Maternal blood lead effects on infant intelligence at age 7 months.Am. J. Obstet. Gynecol., 188(4): S26–S32.
Englyst, V., Lundström, N.G., Gerhardsson, L., Rylander, L. et Nordberg, G. (2001). Lung cancer risks among lead smelter workers also exposed to arsenic.Sci. Total Environ., 273(1–3): 77–82.
Environnement Canada (2010a). Réseau national de la surveillance de la pollution de l'air (NSPA), données de surveillance pour les années 2000 à 2009 (base de données interne de prépublication des données NSPA).Données de surveillance de l’air, Environnement Canada, Ottawa, Ontario.
Environnement Canada (2010b). Réseau national de la surveillance de la pollution de l'air (NSPA). Section de l’analyse et de la qualité de l’air, Environment Canada, Ottawa, Ontario. Disponible à : www.ec.gc.ca/rnspa-naps/Default.asp?lang=Enandn=5C0D33CF-1
Ernhart, C.B., Morrow-Tlucak, M., Marler, M.R. et Wolf, A.W. (1987). Low level lead exposure in the prenatal and early preschool periods: early preschool development.Neurotoxicol. Teratol., 9(3): 259–270.
Ernhart, C.B., Morrow-Tlucak, M., Wolf, A.W., Super, D. et Drotar, D. (1989). Low level lead exposure in the prenatal and early preschool periods: intelligence prior to school entry.Neurotoxicol. Teratol., 11(2): 161–170.
Erel, Y. et Morgan, J.J. (1992). The relationships between rock-derived lead and iron in natural waters. Geochim. Cosmochim. Acta, 56(12): 4157–4167.
Erel, Y., Morgan, J.J. et Patterson, C.C. (1991). Natural levels of lead and cadmium in a remote mountain stream. Geochim. Cosmochim. Acta, 55(3): 707–719.
Ettinger, A.S., Téllez-Rojo, M.M., Amarasiriwardena, C., Bellinger, D., Peterson, K., Schwartz, J., Hu, H. et Hernández-Avila, M. (2004). Effect of breast milk lead on infant blood lead levels at 1 month of age. Environ. Health Perspect., 112(14): 1381–1385.
Eum, K.D., Korrick, S.A., Weuve, J., Okereke, O., Kubzansky, L.D., Hu, H. et Weisskopf, M.G. (2012). Relation of cumulative low-level lead exposure to depressive and phobic anxiety symptom scores in middle-age and elderly women. Environ. Health Perspect., 120(6): 817–823.
Factor-Litvak, P., Wasserman, G., Kline, J.K. et Graziano, J. (1999). The Yugoslavia Prospective Study of Environmental Lead Exposure. Environ. Health Perspect., 107(1): 9–15.
Fadrowski, J.J., Navas-Acien, A., Tellez-Plaza, M., Guallar, E., Weaver, V.M. et Furth, S.L. (2010). Blood lead level and kidney function in US adolescents: the third National Health and Nutrition Examination Survey. Arch.Intern. Med., 170(1): 75–82.
Fears, T.R., Elashoff, R.M. et Schneiderman, M.A. (1989). The statistical analysis of a carcinogen mixture experiment. III. Carcinogens with different target systems, aflatoxin B1, N-butyl-N-(4-hydroxybutyl)nitrosamine, lead acetate, and thiouracil. Toxicol. Ind. Health, 5(1): 1–23.
Fergusson, D.M., Horwood, L.J. et Lynskey, M.T. (1993). Early dentine lead levels and subsequent cognitive and behavioural development. J. Child Psychol. Psychiatry, 34(2): 215–227.
Fergusson, D.M., Horwood, L.J. et Lynskey, M.T. (1997). Early dentine lead levels and educational outcomes at 18 years. J. Child Psychol. Psychiatry, 38(4): 471–478.
Fiorim, J., Ribeiro, R.F., Jr., Silveira, E.A., Padilha, A.S., Vescovi, M.V.A., de Jesus, H.C., Stefanon, I., Salaices, M. et Vassallo, D.V. (2011). Low-level lead exposure increases systolic arterial pressure and endothelium-derived vasodilator factors in rat aortas. PLoS One, 6(2):e17117. doi: 10.1371/journal.pone.0017117
Fisher Environmental Ltd. (2010). Phase II environmental site assessment, 60 Shepard Road, Oakville, Ontario.
Fleming, D.E.B., Boulay, D., Richard, N.S., Robin, J.P., Gordon, C.L., Webber, C.E. et Chettle, D.R. (1997). Accumulated body burden and endogenous release of lead in employees of a lead smelter. Environ. Health Perspect., 105(2): 224–233.
Flora, S.J.S. et Tandon, S.K. (1987). Influence of calcium disodium edetate on the toxic effects of lead administration in pregnant rats. Indian J. Physiol. Pharmacol., 31(4): 267–272.
Folstein, M.F., Folstein, S.E. et McHugh, P.R. (1975). “Mini-mental state”. A practical method for grading the cognitive state of patients for the clinician.J.Psychiatr. Res., 12(3): 189–198.
Forbes, G.B. et Reina, J.C. (1972). Effect of age on gastrointestinal absorption (Fe, Sr, Pb) in the rat. J. Nutr., 102: 647–652.
Fowler, B.A. et DuVal, G. (1991). Effects of lead on the kidney: roles of high-affinity lead-binding proteins. Environ. Health Perspect., 91: 77–80.
Fox, D.A., Campbell, M.L. et Blocker, Y.S. (1997). Functional alterations and apoptotic cell death in the retina following developmental or adult lead exposure. Neurotoxicology, 18(3): 645–664.
Fox, D.A., Kala, S.V., Hamilton, W.R., Johnson, J.E. et O’Callaghan, J.P. (2008). Low-level human equivalent gestational lead exposure produces supernormal scotopic electroretinograms, increased retinal neurogenesis and decreased retinal dopamine utilization in rats. Environ. Health Perspect., 116(5): 618–625.
Fracasso, M.E., Perbellini, L., Soldà, S., Talamini, G. et Franceschetti, P. (2002). Lead induced DNA strand breaks in lymphocytes of exposed workers: role of reactive oxygen species and protein kinase C. Mutat. Res., 515(1–2): 159–169.
Fraser, S., Muckle, G. et Després, C. (2006). The relationship between lead exposure, motor function and behaviour in Inuit preschool children. Neurotoxicol. Teratol., 28(1): 18–27.
Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L. et Korshin, G.V. (2009). Assessment of inorganics accumulation in drinking water system scales and sediments. Water Research Foundation, Denver, Colorado (Project No. 3118).
Froehlich, T.E., Lanphear, B.P., Auinger, P., Hornung, R., Epstein, J.N., Braun, J. et Kahn, R.S. (2009). Association of tobacco and lead exposures with attention-deficit/hyperactivity disorder. Pediatrics, 124(6): e1054–e1063.
Fu, H. et Boffetta, P. (1995). Cancer and occupational exposure to inorganic lead compounds: a meta-analysis of published data.Occup. Environ.Med., 52(2): 73–81.
Furst, A., Schlauder, M. et Sasmore, D.P. (1976). Tumorigenic activity of lead chromate. Cancer Res., 36(5): 1779–1783.
Gauvin, D., Rasmussen, P., Levallois, P., St-Laurent, J., Corteau, M., Lemieux, F., Leblanc, A. et Beaudet, A. (2011). Dust and paint lead levels in homes of old districts of Montreal. Abstract presented at the 21st Annual International Society for Exposure Science Conference, Baltimore, Maryland.
Gerhardsson, L., Lundstrom, N.G., Nordberg, G. et Wall, S. (1986). Mortality and lead exposure: a retrospective cohort study of Swedish smelter workers. Br. J. Ind.Med., 43(10): 707–712.
Gilbert, M.E. et Mack, C.M. (1998). Chronic lead exposure accelerates decay of long-term potentiation in rat dentate gyrus in vivo. Brain Res., 789(1): 139–149.
Gilbert, M.E., Mack, C.M. et Lasley, S.M. (1999a). Chronic developmental lead exposure and hippocampal long-term potentiation: biphasic dose–response relationship. Neurotoxicology, 20(1): 71–82.
Gilbert, M.E., Mack, C.M. et Lasley, S.M. (1999b). The influence of developmental period of lead exposure on long-term potentiation in the adult rat dentate gyrus in vivo. Neurotoxicology, 20(1): 57–70.
Gilbert, S.G. et Rice, D.C. (1987). Low-level lifetime lead exposure produces behavioral toxicity (spatial discrimination reversal) in adult monkeys. Toxicol. Appl.Pharmacol., 91(3): 484–490.
Glenn, B.S., Stewart, W F., Links, J.M., Todd, A.C. et Schwartz, B.S. (2003). The longitudinal association of lead with blood pressure. Epidemiology, 14(1): 30–36.
Glenn, B.S., Bandeen-Roche, K., Lee, B.K., Weaver, V.M., Todd, A.C. et Schwartz, B.S. (2006). Changes in systolic blood pressure associated with lead in blood and bone. Epidemiology, 17(5): 538–544.
Glickman, L., Valciukas, J.A., Lilis, R. et Weisman, I. (1984). Occupational lead exposure. Effects of saccadic eye movements.Int. Arch.Occup. Environ. Health, 54(2): 115–125.
Gnaedinger, R.H. (1993). Lead in school drinking water. J. Environ. Health, 55(6): 15–18.
Gomaa, A., Hu, H., Bellinger, D., Schwartz, J., Tsaih, S.W., Gonzalez-Cossio, T., Schnaas, L., Peterson, K., Aro, A. et Hernandez-Avila, M. (2002). Maternal bone lead as an independent risk factor for fetal neurotoxicity: a prospective study. Pediatrics, 110(1 Pt. 1): 110–118.
Gong, Z. et Evans, H.L. (1997). Effect of chelation with meso-dimercaptosuccinic acid (DMSA) before and after the appearance of lead-induced neurotoxicity in the rat.Toxicol. Appl.Pharmacol., 144(2): 205–214.
Gonick, H.C. (2011). Lead-binding proteins: a review.J. Toxicol., 2011:686050.doi: 10.1155/2011/686050
Gonick, H.C., Ding, Y., Bondy, S.C., Ni, Z. et Vaziri, N.D. (1997). Lead-induced hypertension: interplay of nitric oxide and reactive oxygen species. Hypertension, 30(6): 1487–1492.
González-Cossío, T., Peterson, K.E., Sanín, L.H., Fishbein, E., Palazuelos, E., Aro, A., Hernández-Avila, M. et Hu, H. (1997). Decrease in birth weight in relation to maternal bone-lead burden. Pediatrics, 100(5): 856–862.
Goodlad, J.K., Marcus, D.K. et Fulton, J.J. (2013). Lead and attention-deficit/hyperactivity disorder (ADHD) symptoms: a meta-analysis.Clin. Psychol. Rev., 33(3): 417–425.
Goodrum, P.E., Diamond, G.L., Hassett, J.M. et Johnson, D.L. (1996). Monte Carlo modeling of childhood lead exposure: development of a probabilistic methodology for use with the USEPA IEUBK Model for Lead in Children. Hum. Ecol. Risk Assess., 2(4): 681–708.
Gouvernement du Canada (2010a). Loi canadienne sur la sécurité des produits de consommation (L.C. 2010, ch. 21). Disponible à : http://laws-lois.justice.gc.ca/fra/acts/C-1.68/page-1.html
Gouvernement du Canada (2010b). Règlement sur les produits dangereux (bouilloires). C.R.C., ch. 927. Disponible à : http://laws-lois.justice.gc.ca/fra/regulations/C.R.C.,_c._927/page-1.html
Government of Ontario (2014). Safe Drinking Water Act, 2002.Ontario Regulation 170/03. Drinking Water Systems. Available at: www.e-laws.gov.on.ca/html/regs/english/elaws_regs_030170_e.htm
Goyer, R.A., Tsuchiya, K., Leonard, D.L. et Kahyo, H. (1972). Aminoaciduria in Japanese workers in the lead and cadmium industries.Am. J. Clin.Pathol., 57(5): 635–642.
Graziano, J.H. et Blum, C. (1991). Lead exposure from lead crystal. Lancet, 337(8734): 141–142.
Graziano, J.H., Blum, C.B., Lolacono, N.J., Slavkovich, V., Manton, W.I., Pond, S. et Moore, M.R. (1996). A human in vivo model for the determination of lead bioavailability using stable isotope dilution.Environ. Health Perspect., 104(2): 176–179.
Griffin, T.B., Coulston, F. et Wills, H. (1975). Biological and clinical effects of continuous exposure to airborne particulate lead. Arh. Hig. Rada Toksikol., 26(Suppl.): 191–208.
Gross, S.B., Pfitzer, E.A., Yeager, D.W. et Kehoe, R.A. (1975). Lead in human tissues.Toxicol. Appl.Pharmacol., 32(3): 638–651.
Gu, Y., Wang, L., Xiao, C., Guo, F. et Ruan, D.Y. (2005). Effects of lead on voltage-gated sodium channels in rat hippocampal CA1 neurons. Neuroscience, 133(3): 679–690.
Gulson, B.L., Mahaffey, K.R., Jameson, C.W., Vidal, M., Law, A.J., Mizon, K.J., Smith, A.J. et Korsch, M.J. (1997). Dietary lead intakes for mother/child pairs and relevance to pharmacokinetic models. Environ. Health Perspect., 105(12): 1334–1342.
Gulson, B.L., Jameson, C.W., Mahaffey, K.R., Mizon, K.J., Patison, N., Law, A.J., Korsch, M.J. et Salter, M.A. (1998). Relationships of lead in breast milk to lead in blood, urine, and diet of the infant and mother.Environ. Health Perspect., 106(10): 667–674.
Gulson, B.L., Mizon, K.J., Korsch, M.J., Palmer, J.M. et Donnelly, J.B. (2003). Mobilization of lead from human bone tissue during pregnancy and lactation—A summary of long-term research.Sci. Total Environ., 303(1–2): 79–104.
Gulson, B.L., Mizon, K.J., Palmer, J.M., Korsch, M.J., Taylor, A.J. et Mahaffey, K.R. (2004). Blood lead changes during pregnancy and postpartum with calcium supplementation.Environ. Health Perspect., 112(15): 1499–1507.
Gump, B.B., Stewart, P., Reihman, J., Lonky, E., Darvill, T., Matthews, K.A. et Parsons, P.J. (2005). Prenatal and early childhood blood lead levels and cardiovascular functioning in 9½ year old children. Neurotoxicol. Teratol., 27(4): 655–665.
Gump, B.B., MacKenzie, J.A., Bendinskas, K., Morgan, R., Dumas, A.K., Palmer, C.D. et Parsons, P.J. (2011). Low-level Pb and cardiovascular responses to acute stress in children: the role of cardiac autonomic regulation.Neurotoxicol. Teratol., 33(2): 212–219.
Gutowski, M., Altmann, L., Sveinsson, K. et Wiegand, H. (1997). Postnatal development of synaptic plasticity in the CA3 hippocampal region of control and lead-exposed Wistar rats.Dev. Brain Res., 98(1): 82–90.
Gutowski, M., Altmann, L., Sveinsson, K. et Wiegand, H. (1998). Synaptic plasticity in the CA1 and CA3 hippocampal region of pre- and postnatally lead-exposed rats.Toxicol. Lett., 95(3): 195–203.
Gwiazda, R., Campbell, C. et Smith, D. (2005). A noninvasive isotopic approach to estimate the bone lead contribution to blood in children: implications for assessing the efficacy of lead abatement.Environ. Health Perspect., 113(1): 104–110.
Ha, M., Kwon, H.J., Lim, M.H., Jee, Y.K., Hong, Y.C., Leem, J.H., Sakong, J., Bae, J.M., Hong, S.J., Roh, Y.M. et Jo, S.J. (2009). Low blood levels of lead and mercury and symptoms of attention deficit hyperactivity in children: a report of the Children’s Health and Environment Research (CHEER). Neurotoxicology, 30(1): 31–36.
Haas, C., Koch, L., Kelty, K., Lytle,D. et Triantafyllidou, S. (2013). Effectiveness of the preservation protocol within the Environmental Protection Agency (EPA) Method 200.8 for soluble and particulate lead recovery in drinking water. U.S. Environmental Protection Agency, Washington, D.C. (EPA/600/R-13/222).
Haenninen, H., Hernberg, S., Mantere, P., Vesanto, R. et Jalkanen, M. (1978). Psychological performance of subjects with low exposure to lead.J. Occup.Med., 20(10): 683–689.
Hamilton Health and Social Services (2006). Private well water supplies: naturally occurring lead in bedrock. Hamilton Public Health Services, Hamilton, Ontario. Disponible à : www.hamilton.ca/HealthandSocialServices/PublicHealth/SafeWater/PrivateWellWaterSupply.htm
Hamurcu, Z., Donmez, H., Saraymen, R. et Demirtas, H. (2001). Micronucleus frequencies in workers exposed to lead, zinc, and cadmium.Biol. Trace Elem. Res., 83(2): 97–102.
Hanas, J.S., Rodgers, J.S., Bantle, J.A. et Cheng, Y.G. (1999). Lead inhibition of DNA-binding mechanism of Cys2His2 zinc finger proteins.Mol. Pharmacol., 56(5): 982–988.
Hänninen, H., Mantere, P., Hernberg, S.,Seppäläinen, A.M. et Kock, B.(1979). Subjective symptoms in low-level exposure to lead. Neurotoxicology, 1(2): 333–347.
Hänninen, H., Aitio, A., Kovala, T., Luukkonen, R., Matikainen, E., Mannelin, T., Erkkilä, J. et Riihimäki, V. (1998). Occupational exposure to lead and neuropsychological dysfunction.Occup. Environ.Med., 55(3): 202–209.
Hanning, R.M., Sandhu, R., MacMillan, A., Moss, L., Tsuji, L.J.S. et Nieboer, E. (2003). Impact on blood Pb levels of maternal and early infant feeding practices of First Nation Cree in the Mushkegowuk Territory of northern Ontario, Canada.J.Environ. Monit., 5(2): 241–245.
Hartwig, A., Schlepegrell, R. et Beyersmann, D. (1990). Indirect mechanism of lead-induced genotoxicity in cultured mammalian cells.Mutat. Res., 241(1): 75–82.
Hauser, R., Sergeyev, O., Korrick, S., Lee, M.M., Revich, B., Gitin, E., Burns, J.S. et Williams, P.L. (2008). Association of blood lead levels with onset of puberty in Russian boys.Environ. Health Perspect., 116(7): 976–980.
Hayes, C.R. et Croft, T.N. (2012). An investigation into the representativeness of random daytime sampling for lead in drinking water, using computational modelling. . J. Water Supply Res. Technol. – Aqua, 61( 3): 142-152.
Hayes, C.R., Croft, T.N., Phillips, E., Craik, S. and Schock, M. (2014). Optimisation of plumbosolvency control using computation modelling techniques: a demonstration project for the Government of Alberta, working with the City of Calgary and EPCOR (Edmonton). WQM Associates, Pembrokeshire, United Kingdom
Healey, N. (2014). Toxicokinetic modeling to estimate oral equivalent doses for a reference blood lead concentration. Azimuth Consulting Group Partnership, Vancouver, B.C.
Healey, N., Jones-Otazo, H., Walker, M. et Knafla, A. (2010). Toxicological review and recommended toxicological reference values for environmental lead exposure in Canada. Prepared for Contaminated Sites Division, Environmental Health Bureau,Safe Environments Directorate, Healthy Environments and Consumer Safety Branch, Health Canada,Ottawa, Ontario.
Heidary-Monfard, S. (2011). Community Garden Heavy Metal Study, Ecology Action Centre,Halifax, Nova Scotia. Disponible à : www.ecologyaction.ca/files/images-documents/file/Community%20Garden%20Heavy%20Metal%20Contamination%20Study.pdf
Hernández-Avila, M., Smith, D., Meneses, F., Sanin, L.H. et Hu, H. (1998). The influence of bone and blood lead on plasma lead levels in environmentally exposed adults. Environ. Health Perspect., 106(8): 473–477.
Hernandez-Avila, M., Peterson, K.E., Gonzalez-Cossio, T., Sanin, L.H., Aro, A., Schnaas, L. et Hu, H. (2002). Effect of maternal bone lead on length and head circumference of newborns and 1-month-old infants.Arch. Environ. Health, 57(5): 482–488.
Herrnstein, R. et Murray, C. (1994). The bell curve: intelligence and class structure in American life. Free Press, New York, New York.
Hilts, S.R. (2003). Effect of smelter emission reductions on children’s blood lead levels.Sci. Total Environ., 303(1–2): 51–58.
Hogan, K., Marcus, A., Smith, R. et White, P. (1998). Integrated Exposure Uptake Biokinetic Model for Lead in Children: empirical comparisons with epidemiologic data.Environ. Health Perspect., 106(Suppl. 6): 1557–1567.
Hogstedt, C., Hane, M., Agrell, A. et Bodin, L. (1983). Neuropsychological test results and symptoms among workers with well-defined long-term exposure to lead. Br.J. Ind.Med., 40(1): 99–105.
Holness, D.L. et Nethercott, J.R. (1988). Acute lead intoxication in a group of demolition workers. Appl.Ind. Hyg., 3(12): 338–341.
Huang, P.C., Su, P.H., Chen, H.Y., Huang, H.B., Tsai, J.L., Huang, H.I. et Wang, S.L. (2012). Childhood blood lead levels and intellectual development after ban of leaded gasoline in Taiwan: a 9-year prospective study.Environ. Int., 40(1): 88–96.
HUD (2001). National survey of lead and allergens in housing. Final report. Vol.I. Analysis of lead hazards, revision 6.0.Office of Lead Hazard Control, U.S. Department of Housing and Urban Development,Washington, D.C.
Hulsmann, A.D. (1990). Particulate lead in water supplies. J. Inst.Water Environ. Manage., 4(2): 19–25.
Hursh, J.B. et Suomela, J. (1968). Absorption of 212Pb from the gastrointestinal tract of man. Acta Radiol.Ther. Phys. Biol., 7(2): 108–120.
Hursh, J.B., Schraub, A., Sattler, E.L. et Hofmann, H.P. (1969). Fate of 212Pb inhaled by human subjects. Health Phys., 16(3): 257–267.
IARC (2006). Inorganic and organic lead compounds. International Agency for Research on Cancer, Lyon, France (IARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Vol. 87).
Iavicoli, I., Carelli, G., Stanek, E.J., III, Castellino, N. et Calabrese, E.J. (2004). Effects of low doses of dietary lead on puberty onset in female mice.Reprod. Toxicol., 19(1): 35–41.
Iavicoli, I., Carelli, G., Stanek, E.J., Castellino, N., Li, Z. et Calabrese, E.J. (2006). Low doses of dietary lead are associated with a profound reduction in the time to the onset of puberty in female mice.Reprod. Toxicol., 22(4): 586–590.
ICRP (1993). Age-dependent doses to members of the public from intake of radionuclides. Part 2. Ingestion dose coefficients. Ann. ICRP, 23(3–4).Pergamon Press, Oxford, UK (International Commission on Radiological Protection Publication 67).
INSPQ (2011).Étude de l’impact de la contamination par le plomb de l’environnement résidentiel sur la plombémie des jeunes enfants—rapport présenté par P. Levallois, J. St-Laurent, D. Gauvin, M. Courteau à Santé Canada.Direction de la santé environnementale et de la toxicologie, Institut national de santé publique du Québec, Québec.
Ishida, M., Ishizaki, M. et Yamada, Y. (1996). Decreases in postural change of finger blood flow in ceramic painters chronically exposed to low level lead.Am. J. Ind.Med., 29(5): 547–553.
Ito, N. (1973). Experimental studies on tumors of the urinary system of rats induced by chemical carcinogens. Acta Pathol. Jpn., 23(1): 87–109.
Ito, N., Hiasa, Y., Kamakoto, Y., Makiura, S. et Sugihara, S. (1971). Histopathological analysis of kidney tumors in rats induced by chemical carcinogens. Gann, 62(6): 435–444.
Jablonska, L., Walski, M. et Rafalowska, U. (1994). Lead as an inductor of some morphological and functional changes in synaptosomes from rat brain. Cell. Mol. Neurobiol., 14(6): 701–709.
Jackson, P. (2000). Monitoring the performance of corrective treatment methods. WRc-NSF Ltd.,Oakdale, Gwent, UK.
James, H.M., Hilburn, M.E. et Blair, J.A. (1985). Effects of meals and meal times on uptake of lead from the gastrointestinal tract in humans. Hum. Toxicol., 4(4): 401–407.
JECFA (2011). Safety evaluation of certain food additives and contaminants. Prepared by the seventy-third meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). Organisation mondiale de la Santé, Genève, Suisse (WHO Food Additives Series, No. 64). Disponible à : http://whqlibdoc.who.int/publications/2011/9789241660648_eng.pdf?ua=1
Jedrychowski, W., Perera, F.P., Jankowski, J., Mrozek-Budzyn, D., Mroz, E., Flak, E., Edwards, S., Skarupa, A. et Lisowska-Miszczyk, I. (2009). Very low prenatal exposure to lead and mental development of children in infancy and early childhood. Neuroepidemiology, 32(4): 270–278.
Jemal, A., Graubard, B.I., Devesa, S.S. et Flegal, K.M. (2002). The association of blood lead level and cancer mortality among whites in the United States.Environ. Health Perspect., 110(4): 325–329.
Jusko, T.A., Henderson, C.R., Jr., Lanphear, B.P., Cory-Slechta, D.A., Parsons, P.J. et Canfield, R.L. (2008). Blood lead concentration <10 µg/dL and child intelligence at 6 years of age.Environ. Health Perspect., 116(2): 243–248.
Karalekas, P.C., Ryan, C.R., Larson, C.D. et Taylor, F.B. (1978). Alternative methods for controlling the corrosionof lead pipes. J. N. Engl. Water Works Assoc., 92(2): 159–178.
Kasprzak, K.S., Hoover, K.L. et Poirier, L.A. (1985). Effects of dietary calcium acetate on lead subacetate carcinogenicity in kidney of male Sprague-Dawley rats. Carcinogenesis, 6(2): 279–282.
Kehoe, R.A. (1987). Studies of lead administration and elimination in adult volunteers under natural and experimentally induced conditions over extended periods of time. Food Chem. Toxicol., 25(6): 421–493.
Kerper, L.E. et Hinkle, P.M. (1997a). Cellular uptake of lead is activated by depletion of intracellular calcium stores.J. Biol.Chem., 272(13): 8346–8352.
Kerper, L.E. et Hinkle, P.M. (1997b). Lead uptake in brain capillary endothelial cells: activation by calcium store depletion.Toxicol. Appl.Pharmacol., 146(1): 127–133.
Khalil-Manesh, F., Gonick, H.C., Cohen, A.H., Alinovi, R., Bergamaschi, E., Mutti, A. et Rosen, V.J. (1992a). Experimental model of lead nephropathy. I. Continuous high-dose lead administration. Kidney Int., 41(5): 1192–1203.
Khalil-Manesh, F., Gonick, H.C., Cohen, A., Bergamaschi, E. et Mutti, A. (1992b). Experimental model of lead nephropathy. II. Effect of removal from lead exposure and chelation treatment with dimercaptosuccinic acid (DMSA). Environ. Res., 58(1): 35–54.
Khalil-Manesh, F., Gonick, H.C. et Cohen, A.H. (1993a). Experimental model of lead nephropathy. III. Continuous low-level lead administration. Arch. Environ. Health, 48(4): 271–278.
Khalil-Manesh, F., Gonick, H.C., Weiler, E.W.J., Prins, B., Weber, M.A. et Purdy, R.E. (1993b). Lead-induced hypertension: possible role of endothelial factors. Am. J. Hypertens., 6(9): 723–729.
Khalil-Manesh, F., Gonick, H.C., Weiler, E.W.J., Prins, B., Weber, M.A., Purdy, R. et Ren, Q. (1994). Effect of chelation treatment with dimercaptosuccinic acid (DMSA) on lead-related blood pressure changes.Environ. Res., 65(1): 86–99.
Kim, D.S., Yu, S.D. et Lee, E.H. (2010). Effects of blood lead concentration on intelligence and personality in school children.Mol. Cell.Toxicol., 6(1): 19–23.
Kim, E.J., Herrera, J.E., Huggins, D., Braam, J. et Koshowski, S. (2011). Effect of pH on the concentrations of lead and trace contaminants in drinking water: a combined batch, pipe loop and sentinel home study. Water Res., 45(9):2763–2774.
Kim, R., Rotnitzky, A., Sparrow, D., Weiss, S.T., Wager, C. et Hu, H. (1996). A longitudinal study of low-level lead exposure and impairment of renal function: the Normative Aging Study.J. Am.Med. Assoc., 275(15): 1177–1181.
Kimbrough, D.E. (2001). Brass corrosion and the LCR monitoring program. J. Am. Water Works Assoc., 93(2): 81–91.
Kimbrough, D.E. (2007). Brass corrosion as a source of lead and copper in traditional and all plastic distribution systems. J. Am. Water Works Assoc., 98(8): 70–76.
Kimbrough, D.E. (2009).Source identification of copper, lead, nickel, and zinc loading in wastewater reclamation plant influents from corrosion of brass in plumbing fixtures. Environ. Pollut., 157(4): 1310–1316.
Kirmeyer, G., Edwards, M., Triantafyllidou, S. et Murphy, B. (2007). Performance and metal release of non-leaded brass meters, components and fittings.Water Research Foundation, Denver, Colorado (Awwa Research Foundation Project No. 91174).
Kostial, K., Kello, D. et Jugo, S. (1978). Influence of age on metal metabolism and toxicity.Environ. Health Perspect., 25: 81–86.
Koyashiki, G.A.K., Paoliello, M.M.B. et Tchounwou, P.B. (2010). Lead levels in human milk and children’s health risk: a systematic review.Rev. Environ. Health, 25(3): 243–253.
Krieg, E.F., Jr., Chrislip, D.W., Crespo, C.J., Brightwell, W.S., Ehrenberg, R.L. et Otto, D.A. (2005). The relationship between blood lead levels and neurobehavioral test performance in NHANES III and related occupational studies. Public Health Rep., 120(3): 240–251.
Krishnan, K. et Carrier, R. (2008). Approaches for evaluating the relevance of multiroute exposures in establishing guideline values for drinking water contaminants.J. Environ.Sci. Health C Environ. Carcinog. Ecotoxicol.Rev., 26(3): 300–316.
Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39–51.
Laird, B.D. (2010). Evaluating metal bioaccessibility of soils and foods using the SHIME. PhD thesis, University of Saskatchewan, Saskatoon, Saskatchewan. Disponible à : http://ecommons.usask.ca/bitstream/handle/10388/etd-11292010-165216/Laird_CGSR_Approved_Thesis.pdf?sequence=1
Lamadrid-Figueroa, H., Téllez-Rojo, M.M., Hernández-Avila, M., Trejo-Valdivia, B., Solano-González, M., Mercado-Garcia, A., Smith, D., Hu, H. et Wright, R.O. (2007). Association between the plasma/whole blood lead ratio and history of spontaneous abortion: a nested cross-sectional study. BMC Pregnancy Childbirth, 7:22. doi: 10.1186/1471-2393-7-22
Lambert, T.W. et Lane, S. (2004). Lead, arsenic and polycyclic aromatic hydrocarbons in soil and house dust in the communities surrounding the Sydney, Nova Scotia, tar ponds.Environ. Health Perspect., 112(1): 35–41.
Lanphear, B.P., Matte, T.D., Rogers, J., Clickner, R.P., Dietz, B., Bornschein, R.L., Succop, P., Mahaffey, K.R., Dixon, S., Galke, W., Rabinowitz, M., Farfel, M., Rohde, C., Schwartz, J., Ashley, P. et Jacobs, D.E. (1998). The contribution of lead-contaminated house dust and residential soil to children’s blood lead levels: a pooled analysis of 12 epidemiologic studies. Environ. Res., 79(1): 51–68.
Lanphear, B.P., Dietrich, K., Auinger, P. et Cox, C. (2000). Cognitive deficits associated with blood lead concentrations < 10 µg/dL in US children and adolescents. Public Health Rep., 115(6): 521–529.
Lanphear, B.P., Hornung, R., Khoury, J., Yolton, K., Baghurst, P., Bellinger, D.C., Canfield, R.L., Dietrich, K.N., Bornschein, R., Greene, T., Rothenberg, S.J., Needleman, H.L., Schnaas, L., Wasserman, G., Graziano, J. et Roberts, R. (2005). Low-level environmental lead exposure and children’s intellectual function: an international pooled analysis.Environ. Health Perspect., 113(7): 894–899.
Lasley, S.M., Green, M.C. et Gilbert, M.E. (1999). Influence of exposure period on in vivo hippocampal glutamate and GABA release in rats chronically exposed to lead. Neurotoxicology, 20(4): 619–629.
Lasley, S.M., Green, M.C. et Gilbert, M.E. (2001). Rat hippocampal NMDA receptor binding as a function of chronic lead exposure level.Neurotoxicol. Teratol., 23(2): 185–189.
Laughlin, N.K., Lasky, R.E., Giles, N.L. et Luck, M.L. (1999). Lead effects on neurobehavioral development in the neonatal rhesus monkey (Macaca mulatta).Neurotoxicol. Teratol., 21(6): 627–638.
Lee, R.G., Becker, W.C. et Collins, D.W. (1989). Lead at the tap: sources and control. J. Am. Water Works Assoc., 81(7): 52–62.
Leggett, R.W. (1993). Research advances: an age-specific kinetic model of lead metabolism in humans.Environ. Health Perspect., 101(7): 598–616.
Leroy, P., Schock, M.R., Wagner, I. et Holtschulte, H. (1996). Internal corrosion of water distribution systems. 2nd edition. American Water Works Association Research Foundation, Denver, Colorado.
Levallois, P., St-Laurent, J., Gauvin, D., Courteau, M., Prévost, M., Campagna, C., Lemieux, F., Nour, S., D’Amour, M. et Rasmussen, P.E. (2014). The impact of drinking water, indoor dust and paint on blood lead levels of children aged 1-5 years in Montréal (Québec, Canada). J. Expo. Sci. Environ. Epidemiol., 24: 185–191.
Lidsky, T.I. et Schneider, J.S. (2003). Lead neurotoxicity in children: basic mechanisms and clinical correlates. Brain, 126(1): 5–19.
Lin, R.H., Lee, C.H., Chen, W.K. et Lin-Shiau, S.Y. (1994). Studies on cytotoxic and genotoxic effects of cadmium nitrate and lead nitrate in Chinese hamster ovary cells. Environ.Mol. Mutagen., 23(2): 143–149.
Lindgren, K.N., Ford, D.P. et Bleecker, M.L. (2003). Pattern of blood lead levels over working lifetime and neuropsychological performance.Arch. Environ. Health, 58(6): 373–379.
Liu, J., Liu, X., Wang, W., McCauley, L., Pinto-Martin, J., Wang, Y., Li, L., Yan, C. et Rogan, W. (2014). Blood lead concentrations and children’s behavioral and emotional problems: a cohort study. JAMA Pediatr., 168(8): 737–745.
Loghman-Adham, M. (1998). Aminoaciduria and glycosuria following severe childhood lead poisoning. Pediatr. Nephrol., 12(3): 218–221.
Louis, E.D., Jurewicz, E.C., Applegate, L., Factor-Litvak, P., Parides, M., Andrews, L., Slavkovich, V., Graziano, J.H., Carroll, S. et Todd, A. (2003). Association between essential tremor and blood lead concentration.Environ. Health Perspect., 111(14): 1707–1711.
Louis, E.D., Applegate, L., Graziano, J.H., Parides, M., Slavkovich, V. et Bhat, H. (2005). Interaction between blood lead concentration and δ-amino-levulinic acid dehydratase gene polymorphism increases the odds of essential tremor. Mov. Disord., 20(9): 1170–1177.
Lowry, J., (2009). Lakhurst Acres, ME: Compliance issues engineering problems and solutions. U.S. EPA Sixth annual drinking water workshop: Small drinking water system challenges and solutions. 4-6 août. Cincinatti, Ohio.
Lowry, J., (2010). Corrosion control with air stripping. American water work association. Inorganic contaminants workshop, Denver, Colorado.
Lundström, N.G., Nordberg, G., Englyst, V., Gerhardsson, L., Hagmar, L., Jin, T., Rylander, L.and Wall, S. (1997). Cumulative lead exposure in relation to mortality and lung cancer morbidity in a cohort of primary smelter workers.Scand. J. Work Environ. Health, 23(1): 24–30.
Lustberg, M. et Silbergeld, E. (2002). Blood lead levels and mortality.Arch. Intern.Med., 162(21): 2443–2449.
Lytle, D.A. et Schock, M.R. (1996). Stagnation time, composition, pH and orthophosphate effects on metal leaching from brass. Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA/600/R-96/103).
Lytle, D.A. et Schock, M.R. (2000). Impact of stagnation time on metal dissolution from plumbing materials in drinking water. J. Water Supply Res. Technol. – Aqua, 49(5): 243–257.
Lytle, D.A., Schock, M.R., Dues, N.R. et Clark, P.J. (1993). Investigating the preferential dissolution of lead from solder particulates. J. Am. Water Works Assoc., 85(7): 104–110.
Lytle, D.A., Sorg, T.J. et Frietch, C. (2004). Accumulation of arsenic in drinking water distribution systems. Environ. Sci. Technol., 38(20): 5365–5372.
Maas, R.P., Patch, S.C., Kucken, D.J. et Peek, B.T. (1991) A multi-state study of the effectiveness of various corrosion inhibitors in reducing residential lead levels. Dans : Proceedings of the 1991 AWWA Annual Conference, Philadelphia, PA. American Water Works Association, Denver, Colorado.
Maas, R.P., Patch, S.C. et Gagnon, A.M. (1994). The dynamics of lead in drinking water in U.S. workplaces and schools. J. Am. Ind. Hyg. Assoc., 55: 829–832.
Maas, R.P., Patch, S.C., Pandolfo, T.J., Druhan, J.L. et Gandy, N.F. (2005). Lead content and exposure from children’s and adult’s jewelry products.Bull. Environ.Contam. Toxicol., 74(3): 437–444.
Mahaffey, K.R. (1991). Biokinetics of lead during pregnancy.Fundam. Appl.Toxicol., 16(1): 15–16.
Maizlish, N.A., Parra, G. et Feo, O. (1995). Neurobehavioural evaluation of Venezuelan workers exposed to inorganic lead. Occup. Environ.Med., 52(6): 408–414.
Manitoba Conservation (2007). Concentrations of metals and other elements in surface soils of Flin Flon, Manitoba and Creighton, Saskatchewan, 2006. Manitoba Conservation, Winnipeg, Manitoba(No. 2007-01).
Mantere, P., Hänninen, H. et Hernberg, S. (1982). Subclinical neurotoxic lead effects: two-year follow-up studies with psychological test methods.Neurobehav. Toxicol. Teratol., 4(6): 725–727.
Manton, W.I., Rothenberg, S.J. et Manalo, M. (2001). The lead content of blood serum.Environ. Res., 86(3): 263–273.
Mao, P. et Molnar, J.J. (1967). The fine structure and histochemistry of lead-induced renal tumors in rats.Am. J. Pathol., 50(4): 571–603.
Marino, P.E., Franzblau, A., Lilis, R. et Landrigan, P.J. (1989). Acute lead poisoning in construction workers: the failure of current protective standards.Arch. Environ. Health, 44(3): 140–145.
Maslat, A.O. et Haas, H.J. (1989). Mutagenic effects of lead (II) bromide.J. Trace Elem. Electrolytes Health Dis., 3(4): 187–191.
Matte, T.D., Figueroa, J.P., Burr, G., Flesch, J.P., Keenlyside, R.A. et Baker, E.L. (1989). Lead exposure among lead-acid battery workers in Jamaica.Am. J. Ind.Med., 16(2): 167–177.
Mazumdar, M., Bellinger, D.C., Gregas, M., Abanilla, K., Bacic, J. et Needleman, H.L. (2011). Low-level environmental lead exposure in childhood and adult intellectual function: a follow-up study.Environ. Health, 10(1):24.
McCoy, L., Richfield, E.K. et Cory-Slechta, D.A. (1997). Regional decreases in α-[3H]amino-3-hydroxy-5-methylisoxazole-4-propionic acid ([3H]AMPA) and 6-[3H] cyano-7-nitroquinoxaline-2,3-dione ([3H]CNQX) binding in response to chronic low-level lead exposure: reversal versus potentiation by chronic dopamine agonist treatment. J.Neurochem., 69(6): 2466–2476.
McDonald, L.T., Rasmussen, P.E., Chenier, M. et Levesque, C. (2010). Wipe sampling methodologies to assess exposures to lead and cadmium in urban Canadian homes. Dans : Proceedings of the Annual International Conference on Soils, Sediments, Water and Energy. Vol. 15, Article 6. Disponible à : http://scholarworks.umass.edu/soilsproceedings/vol15/iss1/6/
McFadden, M., Giani, R., Kwan, P. et Reiber, S.H. (2011). Contributions to drinking water lead from galvanized iron corrosion scales. Journal AWWA, 103:4:76.
McNeill, F.E., Stokes, L., Brito, J.A.A., Chettle, D.R. et Kaye, W.E. (2000). 109Cd K x ray fluorescence measurements of tibial lead content in young adults exposed to lead in early childhood.Occup. Environ.Med., 57(7): 465–471.
Mendola, P., Brett, K., DiBari, J.N., Pollack, A.Z., Tandon, R. et Shenassa, E.D. (2013). Menopause and lead body burden among US women aged 45–55, NHANES 1999–2010.Environ. Res., 121: 110–113.
Menke, A., Muntner, P., Batuman, V., Silbergeld, E.K. et Guallar, E. (2006). Blood lead below 0.48 µmol/L (10 µg/dL) and mortality among US adults.Circulation, 114(13): 1388–1394.
Ministère du Développement durable, de l’Environnement et des Parcs du Québec (2011). Personal communication with C. Robert.
Miranda, M.L., Kim, D., Galeano, M.A.O., Paul, C.J., Hull, A.P. et Morgan, S.P. (2007). The relationship between early childhood blood lead levels and performance on end-of-grade tests. Environ. Health Perspect., 115(8): 1242–1247.
Miranda, M.L., Anthopolos, R. et Hastings, D. (2011). A geospatial analysis of the effects of aviation gasoline on childhood blood lead levels.Environ. Health Perspect., 119(10): 1513–1516.
Moller, L. et Kristensen, T.S. (1992). Blood lead as a cardiovascular risk factor.Am. J. Epidemiol., 136(9): 1091–1100.
Moore, M.R., Meredith, P.A., Watson, W.S., Sumner, D.J., Taylor, M.K. et Goldberg, A. (1980). The percutaneous absorption of lead-203 in humans from cosmetic preparations containing lead acetate, as assessed by whole-body counting and other techniques. Food Cosmet.Toxicol., 18(4): 399–405.
Morgan, R.E., Levitsky, D.A. et Strupp, B.J. (2000). Effects of chronic lead exposure on learning and reaction time in a visual discrimination task.Neurotoxicol. Teratol., 22(3): 337–345.
Muldoon, S.B. (1996). Effects of blood lead levels on cognitive function of older women. Neuroepidemiology, 15(2): 62–72.
Muntner, P., He, J., Vupputuri, S., Coresh, J. et Batuman, V. (2003). Blood lead and chronic kidney disease in the general United States population: results from NHANES III. Kidney Int., 63(3): 1044–1050.
Muro, L.A. et Goyer, R.A. (1969). Chromosome damage in experimental lead poisoning.Arch. Pathol., 87(6): 660–663.
Murphy, E.A. (1993). Effectiveness of flushing on reducing lead and copper levels in school drinking water. Environ. Health Perspect., 101(3): 240–241.
Murthy, R.C., Gupta, S.K. et Saxena, D.K. (1995). Nuclear alterations during acrosomal cap formation in spermatids of lead-treated rats.Reprod. Toxicol., 9(5): 483–489.
Naicker, N., Norris, S.A., Mathee, A., Becker, P. et Richter, L. (2010). Lead exposure is associated with a delay in the onset of puberty in South African adolescent females: findings from the birth to twenty cohort.Sci. Total Environ., 408(21): 4949–4954.
NAS (1972). Lead: airborne lead in perspective. National Academy of Sciences, Washington, D.C.(No. 71177).
Nash, D., Magder, L., Lustberg, M., Sherwin, R.W., Rubin, R.J., Kaufmann, R.B. et Silbergeld, E.K. (2003). Blood lead, blood pressure, and hypertension in perimenopausal and postmenopausal women.J. Am. Med. Assoc., 289(12): 1523–1532.
Navas-Acien, A., Selvin, E., Sharrett, A.R., Calderon-Aranda, E., Silbergeld, E. et Guallar, E. (2004). Lead, cadmium, smoking, and increased risk of peripheral arterial disease. Circulation, 109(25): 3196–3201.
Navas-Acien, A., Guallar, E., Silbergeld, E.K. et Rothenberg, S.J. (2007). Lead exposure and cardiovascular disease—A systematic review.Environ. Health Perspect., 115(3): 472–482.
Navas-Acien, A., Schwartz, B.S., Rothenberg, S.J., Hu, H., Silbergeld, E.K. et Guallar, E. (2008). Bone lead levels and blood pressure endpoints: a meta-analysis. Epidemiology, 19(3): 496–504.
Nawrot, T.S., Thijs, L., Den Hond, E.M., Roels, H.A. et Staessen, J.A. (2002). An epidemiological re-appraisal of the association between blood pressure and blood lead: a meta-analysis.J.Hum. Hypertens., 16(2): 123–131.
Nayak, B.N., Ray, M., Persaud, T.V.N. et Nigli, M. (1989). Relationship of embryotoxicity to genotoxicity of lead nitrate in mice.Exp. Pathol., 36(2): 65–73.
Ndzangou, S.O., Richer-LaFlèche, M. et Houle, D. (2006). Anthropogenic Pb accumulation in forest soils from Lake Clair watershed: Duchesnay Experimental Forest (Québec, Canada). Appl. Geochem., 21(12): 2135–2147.
Needleman, H.L. et Gatsonis, C.A. (1990). Low-level lead exposure and the IQ of children. A meta-analysis of modern studies.J. Am.Med. Assoc., 263(5): 673–678.
Needleman, H.L., Riess, J.A., Tobin, M.J., Biesecker, G.E. et Greenhouse, J.B. (1996). Bone lead levels and delinquent behavior.J. Am.Med. Assoc., 275(5): 363–369.
Nelson, B.K., Moorman, W.J., Schrader, S.M., Shaw, P.B. et Krieg, E.F.,Jr. (1997). Paternal exposure of rabbits to lead: behavioral deficits in offspring.Neurotoxicol. Teratol., 19(3): 191–198.
Nestmann, E.R., Matula, T.I., Douglas, G.R., Bora, K.C. et Kowbel, D.J. (1979). Detection of the mutagenic activity of lead chromate using a battery of microbial tests. Mutat. Res., 66(4): 357–365.
Neuman, W.E. (1995). AWWC experience with zinc orthophosphate treatment.J. N. Engl. Water Works Assoc., 109: 57–60.
Nevin, R. (2000). How lead exposure relates to temporal changes in IQ, violent crime, and unwed pregnancy. Environ. Res., 83: 1–22.
Newfoundland and Labrador Department of Environment and Conservation (2011). Communication personnelle avec H. Khan.
Ngueta, G., Prévost, M., Deshomme, E., Abdous, B., Gauvin, D. et Levallois, P. (2014). Exposure of young children to household water lead in the Montreal area (Canada): the potential influence of winter-to-summer changes in water lead levels on children’s blood lead concentration. Environ. Int., 73: 57–65.
Nguyen, C., Edwards, M., Stone, K., Clark, B., Gagnon, G. et Knowles, A. (2010). Impact of chloride:sulfate mass ratio (CSMR) changes on lead leaching in potable water. Water Research Foundation and U.S. Environmental Protection Agency, Denver, Colorado.
Nicolescu, R., Petcu, C., Cordeanu, A., Fabritius, K., Schlumpf, M., Krebs, R., Krämer, U. et Winneke, G. (2010). Environmental exposure to lead, but not other neurotoxic metals, relates to core elements of ADHD in Romanian children: performance and questionnaire data.Environ. Res., 110(5): 476–483.
Nigg, J.T., Knottnerus, G.M., Martel, M.M., Nikolas, M., Cavanagh, K., Karmaus, W. et Rappley, M.D. (2008). Low blood lead levels associated with clinically diagnosed attention-deficit/hyperactivity disorder and mediated by weak cognitive control.Biol. Psychiatry, 63(3): 325–331.
Nigg, J.T., Nikolas, M., Knottnerus, G.M., Cavanagh, K. et Friderici, K. (2010). Confirmation and extension of association of blood lead with attention-deficit/hyperactivity disorder (ADHD) and ADHD symptom domains at population-typical exposure levels.J. Child Psychol. Psychiatry, 51(1): 58–65.
Nordberg, M., Winblad, B., Fratiglioni, L. et Basun, H. (2000). Lead concentrations in elderly urban people related to blood pressure and mental performance: results from a population-based study.Am. J. Ind.Med., 38(3): 290–294.
NSF (1977). Transport and distribution in a watershed ecosystem. Dans : W.R. Boggess (ed.), Lead in the environment.National Science Foundation, Washington, D.C. p. 105–133.
NSF/ANSI (2011). NSF International/American National Standards Institute Standard 372: Drinking water system components—lead content. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2013a). NSF International/American National Standards Institute Standard 53: Drinking water treatments units—Health effects. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2013b). NSF International/American National Standards Institute Standard 58: Reverse osmosis drinking water treatment systems. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2013c). NSF International/American National Standards Institute Standard 62: Drinking water distillation system. NSF International, Ann Arbor, Michigan.
NSF/ANSI (2014). NSF International/American National Standards Institute Standard 61: Drinking water system components—health effects. NSF International, Ann Arbor, Michigan.
OCDE/PNUE (1999). Phasing lead out of gasoline: an examination of policy approaches in different countries. Organisation de coopération et de développement économiques / Programme des Nations unies pour l'environnement, Paris, France.
OEHHA (2007). Development of health criteria for school site risk assessment pursuant to Health and Safety Code 901(g): child-specific benchmark change in blood lead concentration for school site risk assessment. Office of Environmental Health Hazard Assessment, California Environmental Protection Agency, Sacramento, California. Disponible à : www.oehha.ca.gov/public_info/public/kids/schools041707.html
OEHHA (2009). Public health goals for chemicals in drinking water—lead. Office of Environmental Health Hazard Assessment, California Environmental Protection Agency, Sacramento, California. Disponible à : www.oehha.org/water/phg/pdf/LeadfinalPHG042409.pdf
O’Flaherty, E.J. (1991). Physiologically based models for bone-seeking elements: II. Kinetics of lead disposition in rats.Toxicol. Appl.Pharmacol., 111(2): 313–331.
O’Flaherty, E.J. (1993). Physiologically based models for bone-seeking elements. IV. Kinetics of lead disposition in humans.Toxicol. Appl.Pharmacol., 118(1): 16–29.
O’Flaherty, E.J. (1995a). PBK modeling for metals. Examples with lead, uranium, and chromium.Toxicol. Lett., 82–83: 367–372.
O’Flaherty, E.J. (1995b). Physiologically based models for bone-seeking elements. V. Lead absorption and disposition in childhood.Toxicol. Appl.Pharmacol., 131(2): 297–308.
O’Flaherty, E.J. (2000). Modeling normal aging bone loss, with consideration of bone loss in osteoporosis.Toxicol. Sci., 55(1): 171–188.
O’Flaherty, E.J., Inskip, M.J., Franklin, C.A., Durbin, P.W., Manton, W.I. et Baccanale, C.L. (1998). Evaluation and modification of a physiologically based model of lead kinetics using data from a sequential isotope study in cynomolgus monkeys.Toxicol. Appl.Pharmacol., 149(1): 1–16.
Oliphant, R.J. et Schock,M.R. (1996). Copper alloys and solder. Dans : Internal corrosion of water distribution systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, Colorado. p. 269–312.
OMOE (2001). Soil investigation and human health risk assessment for the Rodney Street community, Port Colborne (2001). Standards Development Branch, Ontario Ministry of the Environment (Report No. SDB-01 0-351 1-2001). Disponible à : www.archive.org/stream/soilinvesitgatio00ontauoft/soilinvesitgatio00ontauoft_djvu.txt
OMOE (2014). Drinking water surveillance program. Years 2000–2009. Ontario Ministry of the Environment. Disponible à : www.ontario.ca/environment-and-energy/drinking-water-surveillance-program-dwsp-data
OMS (1977). Lead. Programme international sur la sécurité des substances chimiques, Organisation mondiale de la Santé, Genève, Suisse (Environmental Health Criteria 3). Disponible à : www.inchem.org/documents/ehc/ehc/ehc003.htm
OMS (2011). Lead in drinking-water: background document for development of WHO Guidelines for Drinking-water Quality. Organisation mondiale de la Santé, Genève, Suisse. Disponible à : www.who.int/water_sanitation_health/dwq/chemicals/lead.pdf
Osman, K., Pawlas, K., Schütz, A., Gazdzik, M., Sokal, J.A. et Vahter, M. (1999). Lead exposure and hearing effects in children in Katowice, Poland.Environ. Res., 80(1): 1–8.
Oyasu, R., Battifora, H.A., Clasen, R.A., McDonald, J.H. et Hass, G.M. (1970). Induction of cerebral gliomas in rats with dietary lead subacetate and 2-acetylaminofluorene. Cancer Res., 30(5): 1248–1261.
Palintest (2014). Palintest SA1100 scanning analyzer instruction manual; V05/09. Palintest Ltd., Gateshead, UK. Disponible à : www.palintest.com/products/sa1100-scanning-analyzer/
Palus, J., Rydzynski, K., Dziubaltowska, E., Wyszynska, K., Natarajan, A.T. et Nilsson, R. (2003). Genotoxic effects of occupational exposure to lead and cadmium.Mutat. Res., 540(1): 19–28.
Panagapko, D. (2009). Canadian minerals yearbook 2009—lead. Mineral and Metal Commodity Reviews,Minerals and Metals Sector, Natural Resources Canada, Ottawa, Ontario.
Parajuli, R.P., Fujiwara, T., Umezaki, M. et Watanabe, C. (2013). Association of cord blood levels of lead, arsenic, and zinc with neurodevelopmental indicators in newborns: a birth cohort study in Chitwan Valley, Nepal.Environ. Res., 121: 45–51.
Parajuli, R.P., Fujiwara, T., Umezaki, M., Furusawa, H. et Watanabe, C. (2014). Home environment and prenatal exposure to lead, arsenic and zinc on the neurodevelopment of six-month-old infants living in Chitwan Valley, Nepal. Neurotoxicol. Teratol., 41: 89–95.
Patrick, L. (2006). Lead toxicity, a review of the literature. Part I: Exposure, evaluation, and treatment.Altern. Med. Rev., 11(1): 2–22.
Payton, M., Hu, H., Sparrow, D. et Weiss, S.T. (1994). Low-level lead exposure and renal function in the Normative Aging Study.Am. J. Epidemiol., 140(9): 821–829.
Pesch, B., Haerting, J., Ranft, U., Klimpel, A., Oelschlägel, B. et Schill, W. (2000). Occupational risk factors for renal cell carcinoma: agent-specific results from a case–control study in Germany. MURC Study Group. Multicenter Urothelial and Renal Cancer Study.Int. J. Epidemiol., 29(6): 1014–1024.
Pocock, S.J., Smith, M. et Baghurst, P. (1994). Environmental lead and children’s intelligence: a systematic review of the epidemiological evidence.Br. Med. J., 309(6963): 1189–1197.
Popovic, M., McNeill, F.E., Chettle, D.R., Webber, C.E., Lee, C.V. et Kaye, W.E. (2005). Impact of occupational exposure on lead levels in women.Environ. Health Perspect., 113(4): 478–484.
Pounds, J.G. et Leggett, R.W. (1998). The ICRP age-specific biokinetic model for lead: validations, empirical comparisons, and explorations.Environ. Health Perspect., 106(Suppl. 6): 1505–1511.
Pounds, J.G., Marlar, R.J. et Allen, J.R. (1978). Metabolism of lead-210 in juvenile and adult rhesus monkeys (Macaca mulatta).Bull. Environ. Contam. Toxicol., 19(6): 684–691.
Prince Edward Island Department of Environment, Energy and Forestry (2011). Communication personnelle avec G. Somers.
Quintanilla-Vega, B., Smith, D.R., Kahng, M.W., Hernandez, J.M., Albores, A. et Fowler, B.A. (1995). Lead-binding proteins in brain tissue of environmentally lead-exposed humans. Chem. Biol.Interact., 98(3): 193–209.
Rabinowitz, M.B., Wetherill, G.W. et Kopple, J.D. (1976). Kinetic analysis of lead metabolism in healthy humans. J. Clin. Invest., 58(2): 260–270.
Rabinowitz, M.B., Kopple, J.D. et Wetherill, G.W. (1980). Effect of food intake and fasting on gastrointestinal lead absorption in humans.Am. J. Clin.Nutr., 33(8): 1784–1788.
Rasmussen, P.E., Subramanian, K.S. et Jessiman, B.J. (2001). A multi-element profile of house dust in relation to exterior dust and soils in the city of Ottawa, Canada.Sci. Total Environ., 267(1–3): 125–140.
Rasmussen, P.E., Dugandzic, R., Hassan, N., Murimboh, J. et Grégoire, D.C. (2006). Challenges in quantifying airborne metal concentrations in residential environments. Can. J. Anal. Sci. Spectrosc., 51(1): 1–8.
Rasmussen, P.E., Wheeler, A.J., Hassan, N.M., Filiatreault, A. et Lanouette, M. (2007). Monitoring personal, indoor, and outdoor exposures to metals in airborne particulate matter: risk of contamination during sampling, handling and analysis. Atmos. Environ., 41(28): 5897–5907.
Rasmussen, P.E., Niu, J., Chenier, M., Wheeler, A.J., Nugent, M. et Gardner, H. (2009). Project (II) refined analysis and characterization methods for metals in urban residential air. NSERC Metals in the Human Environment Strategic Network (MITHE-SN) Annual Symposium, Aylmer, Quebec, January 20–21.
Rasmussen, P.E., Beauchemin, S., Chénier, M., Levesque, C., MacLean, L.C.W., Marro, L., Jones-Otazo, H., Petrovic, S., McDonald, L.T. et Gardner, H.D. (2011). Canadian House Dust Study: lead bioaccessibility and speciation.Environ. Sci. Technol., 45(11): 4959–4965.
Reddy, G.R. et Zawia, N.H. (2000). Lead exposure alters egr-1 DNA-binding in the neonatal rat brain. Int. J. Dev. Neurosci., 18(8): 791–795.
Reddy, K.J., Wang, L. et Gloss, S.P. (1995). Solubility and mobility of copper, zinc and lead in acidic environments. Plant Soil, 171: 53–58.
Regunathan, S. et Sundaresan, R. (1985). Effects of organic and inorganic lead on synaptosomal uptake, release, and receptor binding of glutamate in young rats.J. Neurochem., 44(5): 1642–1646.
Reiber, S., Poulsam, S., Perry, S.A.L., Edwards, M.A., Patel, S. et Dodrill, D.M. (1997). A general framework for corrosion control based on utility experience. Awwa Research Foundation, Denver, Colorado.
Rencz, A.N., Garrett, R.G., Adcok, S.W. et Bonham-Carter, G.F. (2006). Geochemical background in soil and till. Geological Survey of Canada, Ottawa, Ontario (Open File No. 5084).
Renner, R. (2007). Lead pipe replacement should go all the way. Environ. Sci. Technol. Online News, p. 6637, October 1, 2007. Disponible à : http://pubs.acs.org/doi/pdf/10.1021/es0726198
Rice, D.C. (1984). Effect of lead on schedule-controlled behaviour in monkeys. Dans : L.S. Seiden et R.L. Balster (eds.),Behavioral pharmacology: the current status.Alan R. Liss, New York, N.Y.p. 473–486.
Rice, D.C. (1985). Chronic low-lead exposure from birth produces deficits in discrimination reversal in monkeys.Toxicol. Appl.Pharmacol., 77(2): 201–210.
Rice, D.C. (1990). Lead-induced behavioral impairment on a spatial discrimination reversal task in monkeys exposed during different periods of development.Toxicol. Appl.Pharmacol., 106(2): 327–333.
Rice, D.C. (1992a). Behavioral effects of lead in monkeys tested during infancy and adulthood.Neurotoxicol. Teratol., 14(4): 235–245.
Rice, D.C. (1992b). Effect of lead during different developmental periods in the monkey on concurrent discrimination performance. Neurotoxicology, 13(3): 583–592.
Rice, D.C. (1992c). Lead exposure during different developmental periods produces different effects on FI performance in monkeys tested as juveniles and adults. Neurotoxicology, 13(4): 757–770.
Rice, D.C. et Gilbert, S.G. (1990a). Lack of sensitive period for lead-induced behavioral impairment on a spatial delayed alternation task in monkeys.Toxicol. Appl. Pharmacol., 103(2): 364–373.
Rice, D.C. et Gilbert, S.G. (1990b). Sensitive periods for lead-induced behavioral impairment (nonspatial discrimination reversal) in monkeys.Toxicol. Appl. Pharmacol., 102(1): 101–109.
Rice, D.C. et Karpinski, K.F. (1988). Lifetime low-level lead exposure produces deficits in delayed alternation in adult monkeys.Neurotoxicol. Teratol., 10(3): 207–214.
Richardson, E. (2006). Public health advisory. Hamilton Public Health Services, Hamilton, Ontario. Disponible à : www.hamilton.ca/NR/rdonlyres/BC070C3A-C54F-49D0-A664-F7F07372C434/0/PublicHealthAdvisorySafeWaterLead.pdf
Richardson, E., Pigott, W., Craig, C., Lawson, M. et Mackie, C. (2011). North Hamilton child blood lead study public health report. Hamilton Public Health Services, Hamilton, Ontario.
Ris, M.D., Dietrich, K.N., Succop, P.A., Berger, O.G. et Bornschein, R.L. (2004). Early exposure to lead and neuropsychological outcome in adolescence.J. Int.Neuropsychol. Soc., 10(2): 261–270.
Robbiano, L., Carrozzino, R., Puglia, C.P., Corbu, C. et Brambilla, G. (1999). Correlation between induction of DNA fragmentation and micronuclei formation in kidney cells from rats and humans and tissue-specific carcinogenic activity.Toxicol. Appl.Pharmacol., 161(2): 153–159.
Robison, S.H., Cantoni, O. et Costa, M. (1984). Analysis of metal-induced DNA lesions and DNA-repair replication in mammalian cells.Mutat. Res., 131(3–4): 173–181.
Roe, F.J., Boyland, E., Dukes, C.E. et Mitchley, B.C. (1965). Failure of testosterone or xanthopterin to influence the induction of renal neoplasms by lead in rats.Br. J. Cancer, 19(4): 860–866.
Roncal, C., Mu, W., Reungjui, S., Kim, K.M., Henderson, G.N., Ouyang, X., Nakagawa, T. et Johnson, R.J. (2007). Lead, at low levels, accelerates arteriolopathy and tubulointerstitial injury in chronic kidney disease. Am. J. Physiol. Renal Physiol., 293: F1391–F1396.
Rosenman, K.D., Sims, A., Luo, Z. et Gardiner, J. (2003). Occurrence of lead-related symptoms below the current Occupational Safety and Health Actallowable blood lead levels.J. Occup. Environ.Med., 45(5): 546–555.
Rothenberg, S.J., Schnaas, L., Salgado-Valladares, M., Casanueva, E., Geller, A.M., Hudnell, H.K. et Fox, D.A. (2002). Increased ERG a- and b-wave amplitudes in 7- to 10-year-old children resulting from prenatal lead exposure.Invest. Ophthalmol. Vis.Sci., 43(6): 2036–2044.
Roy, N.K. et Rossman, T.G. (1992). Mutagenesis and comutagenesis by lead compounds.Mutat. Res., 298(2): 97–103.
Saint-Laurent, D., St-Laurent, J., Duplessis, P. et Lavoie, L. (2010). Isotopic record of lead contamination in alluvial soils and tree rings on recent floodplains (southern Quebec, Canada). Water Air Soil Pollut., 209(1–4): 451–466.
Sallmén, M., Lindbohm, M.L., Anttila, A., Taskinen, H. et Hemminki, K. (2000). Time to pregnancy among the wives of men occupationally exposed to lead. Epidemiology, 11(2): 141–147.
Sandvig, A., Boyd, G., Kirmeyer, G., Edwards, M., Triantafyllidou, S. et Murphy,B. (2007). Performance and metal release of non-leaded brass meters, components and fittings. Water Research Foundation, Denver, Colorado (Awwa Research Foundation Project No. 91174).
Sandvig, A., Kwan, P., Kirmeyer, G., Maynard, B., Mast, D., Trussell, R.R., Trussell, S., Cantor, A. et Prescott, A. (2008). Contribution of service line and plumbing fixtures to lead and copper rule compliance issues. Water Research Foundation, Denver, Colorado (Awwa Research Foundation Project No. 90721).
Sandvig, A.M., Triantafyllidou, S., Edwards, M., Heumann, D., Boyd, G. et Kirmeyer, G. (2009). Nonleaded brass—A summary of performance and costs. J. Am. Water Works Assoc., 101(7): 83–94.
Sandvig, A., Martel, K., Beggs, K., Jaffe Murray, A., Greiner, P., Kneen, K., McLellan, C., Bennet, D. et Terrell, J. (2012). Is NSF 61 relevant for chloraminating utilities? Water Research Foundation, Denver, Colorado (Water Research Foundation Project No. 4243).
Santacruz, K.S. et Swagerty, D. (2001). Early diagnosis of dementia.Am. Fam. Physician, 63(4): 703–714.
Santé Canada (1994). Loi canadienne sur la protection de l’environnement. L’évaluation du risque à la santé humaine des substances d’intérêt prioritaire. Health Canada, Ottawa, Ontario. Disponible à : www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/approach/approach-fra.pdf
Santé Canada (2009a). Étude Canadienne sur l'alimentation totale. Bureau d'innocuité des produits chimiques, Direction générale des produits de santé et des aliments, Santé Canada, Ottawa, Ontario. Disponible à : www.hc-sc.gc.ca/fn-an/surveill/total-diet/index-fra.php
Santé Canada (2009b). Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d'eau potable Bureau de l’eau, de l’air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Disponible à : http://canadiensensante.gc.ca/publications/healthy-living-vie-saine/water-corrosion-eau/index-fra.php
Santé Canada (2010a). Règlement sur les produits de consommation contenant du plomb (contact avec la bouche): feuillet d’information, Novembre. Santé Canada, Ottawa, Ontario.
Santé Canada (2010b). Feuillet d’information concernant la stratégie de gestion des risques pour le plomb dans les produits de consommation. Novembre. Santé Canada, Ottawa, Ontario.
Santé Canada (2011). Apports alimentaires en contaminants et en autres produits chimiques chez les Canadiens, selon les groupes d'âge et de sexe. Santé Canada, Ottawa, Ontario. Disponible à: www.hc-sc.gc.ca/fn-an/surveill/total-diet/intake-apport/index-fra.php
Santé Canada (2012a). Directives sur les impuretés des métaux lourds contenues dans les cosmétiques. Disponible à : www.hc-sc.gc.ca/cps-spc/pubs/indust/heavy_metals-metaux_lourds/index-fra.php
Santé Canada (2012b). Guide destiné à l'industrie sur les exigences de Santé Canada en matière de sécurité des jouets pour enfants et des produits connexes. Sécurité des produits de consommation, Santé Canada, Ottawa, Ontario. Disponible à : www.hc-sc.gc.ca/cps-spc/pubs/indust/toys-jouets/index-fra.php
Santé Canada (2013a). Stratégie de gestion des risques pour le plomb. Santé Canada, Ottawa, Ontario. Disponible à : www.hc-sc.gc.ca/ewh-semt/pubs/contaminants/prms_lead-psgr_plomb/index-fra.php
Santé Canada (2013b). Deuxième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada : résultats du cycle 2 de l’Enquête canadienne sur les mesures de santé (2009–2011). Santé Canada, Ottawa, Ontario.
Santé Canada (2013c). Rapport final sur l'état des connaissances scientifiques concernant les effets du plomb sur la santé humaine. Santé Canada, Ottawa, Ontario. Disponible à : www.hc-sc.gc.ca/ewh-semt/pubs/contaminants/dhhssrl-rpecscepsh/index-fra.php
Santé Canada (2014). Communication personnelle avec A.-M.Tugulea.
Saskatchewan Ministry of Environment (2011). Communication personnelle avec S. Ferris.
Sathyanarayana, S., Beaudet, N., Omri, K. et Karr, K. (2006). Predicting children’s blood lead levels from exposureto school drinking water in Seattle, Washington, USA. Ambul. Pediatr., 6(5): 288–292.
Sattler, J.M. (2001). Assessment of children: Cognitive applications. 4e édition. Jerome M. Sattler, San Diego, California.
Sauer, R.M., Zook, B.C. et Garner, F.M. (1970). Demyelinating encephalomyelopathy associated with lead poisoning in nonhuman primates. Science, 169(3950): 1091–1093.
Sax, N.I. et Lewis, R.J. (eds.). (1989). Dangerous properties of industrial materials. 7e édition. van Nostrand Reinhold, New York, N.Y.[cité dans ATSDR, 1999].
Schnaas, L., Rothenberg, S.J., Perroni, E., Martínez, S., Hernández, C. et Hernández, R.M. (2000). Temporal pattern in the effect of postnatal blood lead level on intellectual development of young children. Neurotoxicol. Teratol., 22(6): 805–810.
Schnaas, L., Rothenberg, S.J., Flores, M.F., Martinez, S., Hernandez, C., Osorio, E., Velasco, S.R. et Perroni, E. (2006). Reduced intellectual development in children with prenatal lead exposure.Environ. Health Perspect., 114(5): 791–797.
Schober, S.E., Mirel, L.B., Graubard, B.I., Brody, D.J. et Flegal, K.M. (2006). Blood lead levels and death from all causes, cardiovascular disease, and cancer: results from the NHANES III mortality study.Environ. Health Perspect., 114(10): 1538–1541.
Schock, M.R. (1990). Causes of temporal variability of lead in domestic plumbing systems. Environ. Monit. Assess.,15(1): 59–82.
Schock, M.R. (2005). Distribution systems as reservoirs and reactors for inorganic contaminants. Dans : Distributionsystem water quality challenges in the 21st century: a strategic guide. American Water Works Association, Denver, Colorado.
Schock, M. R., et Lemieux, F. G. (2010). Challenges in addressing variability of lead in domestic plumbing. Water Science & Technology: Water Supply-WSTWS, 10(5), 793–799.
Schock, M. et Lytle, D. (2011). Chapter 20: Internal corrosion and deposition control. Dans : J.K. Edzwald (ed.), Water quality and treatment: a handbook on drinking water. 6th edition. McGraw Hill and American Water Works Association, Denver, Colorado.
Schock, M.R. et Neff, C.H. (1988). Trace metal contamination from brass fittings. J. Am. Water Works Assoc., 80(11): 47–56.
Schock, M.R., Wagner, I. et Oliphant, R.J. (1996). Corrosion and solubility of lead in drinking water. Dans : Internal corrosion of water distribution systems. 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, Colorado. p. 131–230.
Schock, M.R., Hyland, R.N. et Welch, M.M. (2008). Occurrence of contaminant accumulation in lead pipe scales from domestic drinking-water distribution systems. Environ. Sci. Technol., 42(12): 4285–4291.
Schock, M.R., Cantor, A., Triantafyllidou, S., Desantis, M.K. et Scheckel, K.G. (2014). Importance of pipe deposits to Lead and Copper Rule compliance. J. Am. Water Works Assoc., 106(7): E336–E349.
Schütz, A., Bergdahl, I.A., Ekholm, A. et Skerfving, S. (1996). Measurement by ICP-MS of lead in plasma and whole blood of lead workers and controls.Occup. Environ.Med., 53(11): 736–740.
Schwartz, J. (1994a). Low-level lead exposure and children’s IQ: a meta-analysis and search for a threshold.Environ. Res., 65(1): 42–55.
Schwartz, J. (1994b). Societal benefits of reducing lead exposure. Environ. Res., 66: 105–124.
Schwartz, J. (1995). Lead, blood pressure, and cardiovascular disease in men.Arch. Environ. Health, 50(1): 31–37.
Schwartz, J. et Otto, D. (1991). Lead and minor hearing impairment.Arch. Environ. Health, 46(5): 300–305.
Scinicariello, F., Abadin, H.G. et Edward Murray, H. (2011). Association of low-level blood lead and blood pressure in NHANES 1999–2006.Environ. Res., 111(8): 1249–1257.
Selevan, S.G., Rice, D.C., Hogan, K.A., Euling, S.Y., Pfahles-Hutchens, A. et Bethel, J. (2003). Blood lead concentration and delayed puberty in girls.N. Engl. J. Med., 348(16): 1527–1536.
SENES Consultants Ltd. (2012). Blood lead action levels: information for physicians and public health practitioners on the measurement, interpretation and follow-up of blood lead concentrations.SENES Consultants Ltd., Richmond Hill, Ontario.
Senut, M.C., Sen, A., Cingolani, P., Shaik, A., Land, S.J. et Ruden, D.M. (2014). Lead exposure disrupts global DNA methylation in human embryonic stem cells and alters their neuronal differentiation.Toxicol. Sci., 139(1): 142–161.
Seppalainen, A.M., Hernberg, S., Vesanto, R. et Kock, B. (1983). Early neurotoxic effects of occupational lead exposure: a prospective study. Neurotoxicology, 4(2): 181–192.
Shannon, M. et Graef, J.W. (1989). Lead intoxication from lead-contaminated water used to reconstitute infant formula. Clin. Pediatr., 28: 380–382.
Sharrett, A.R., Carter, A.P., Orheim, R.M. et Feinleib, M. (1982). Daily intake of lead, cadmium, copper, and zincfrom drinking water: the Seattle study of trace metal exposure. Environ. Res., 28: 456–475.
Sheffet, A., Thind, I., Miller, A.M. et Louria, D.B. (1982). Cancer mortality in a pigment plant utilizing lead and zinc chromates.Arch. Environ. Health, 37(1): 44–52.
Shen, X.M., Yan, C.H., Guo, D., Wu, S.M., Li, R.Q., Huang, H., Ao, L.M., Zhou, J.D., Hong, Z.Y., Xu, J.D., Jin, X.M. et Tang, J.M. (1998). Low-level prenatal lead exposure and neurobehavioral development of children in the first year of life: a prospective study in Shanghai.Environ. Res., 79(1): 1–8.
Sherlock, J.C., Ashby, D., Delves, H.T., Forbes, G.I., Moore, M.R., Patterson, W.J., Pocock, S.J., Quinn, M.J., Richards, W.N. et Wilson, T.S. (1984). Reduction in exposure to lead from drinking water and its effect on blood lead concentrations. Hum. Toxicol., 3(5): 383–392.
Shiau, C.Y., Wang, J.D. et Chen, P.C. (2004). Decreased fecundity among male lead workers.Occup. Environ.Med., 61(11): 915–923.
Shih, R.A., Glass, T.A., Bandeen-Roche, K., Carlson, M.C., Bolla, K.I., Todd, A.C. et Schwartz, B.S. (2006). Environmental lead exposure and cognitive function in community-dwelling older adults. Neurology, 67(9): 1556–1562.
Silbergeld, E.K. (2003). Facilitative mechanisms of lead as a carcinogen.Mutat. Res., 533(1–2): 121–133.
Silbergeld, E.K., Waalkes, M. et Rice, J.M. (2000). Lead as a carcinogen: experimental evidence and mechanisms of action.Am. J. Ind.Med., 38(3): 316–323.
Silveira, E.A., Siman, F.D.M., De Oliveira Faria, T., Vescovi, M.V.A., Furieri, L.B., Lizardo, J.H.F., Stefanon, I., Padilha, A.S. et Vassallo, D.V. (2014). Low-dose chronic lead exposure increases systolic arterial pressure and vascular reactivity of rat aortas. Free Radic. Biol.Med., 67: 366–376.
Singh, I. et Mavinic, D.S. (1991). Significance of building and plumbing specifics on trace metal concentrations in drinking water. Can. J. Civil Eng., 18(6): 893–903.
Smith, D., Hernandez-Avila, M., Téllez-Rojo, M.M., Mercado, A. et Hu, H. (2002). The relationship between lead in plasma and whole blood in women. Environ. Health Perspect., 110(3): 263–268.
Smith, D.R., Osterloh, J.D. et Russell Flegal, A. (1996). Use of endogenous, stable lead isotopes to determine release of lead from the skeleton. Environ. Health Perspect., 104(1): 60–66.
Smith, D.R., Kahng, M.W., Quintanilla-Vega, B. et Fowler, B.A. (1998). High-affinity renal lead-binding proteins in environmentally-exposed humans. Chem. Biol. Interact., 115(1): 39–52.
Smith, F.L.I., Rathmell, T.K. et Marcil, G.E. (1938). The early diagnosis of acute and latent plumbism. Am. J. Clin. Pathol., 8: 471–508.
Spivey, G.H., Baloh, R.W., Brown, C.P., Browdy, B.L., Campion, D.S., Valentine, J.L., Morgan, D.E. et Culver, B.D. (1980). Subclinical effects of chronic increased lead absorption—A prospective study. III. Neurologic findings at follow-up examination.J. Occup.Med., 22(9): 607–612.
Staessen, J.A., Lauwerys, R.R., Buchet, J.P., Bulpitt, C.J., Rondia, D., Vanrenterghem, Y., Amery, A. et the Cadmibel Study Group (1992). Impairment of renal function with increasing blood lead concentrations in the general population. N. Engl. J. Med., 327(3): 151–156.
Staessen, J.A., Bulpitt, C.J., Fagard, R., Lauwerys, R.R., Roels, H., Thijs, L. et Amery, A. (1994a). Hypertension caused by low-level lead exposure: myth or fact?J.Cardiovasc. Risk, 1(1): 87–97.
Staessen, J.A., Lauwerys, R.R., Bulpitt, C.J., Fagard, R., Lijnen, P., Roels, H., Thijs, L.and Amery, A. (1994b). Is a positive association between lead exposure and blood pressure supported by animal experiments?Curr. Opin. Nephrol. Hypertens., 3(3): 257–263.
Staessen, J.A., Roels, H. et Fagard, R. (1996). Lead exposure and conventional and ambulatory blood pressure: a prospective population study.J. Am.Med. Assoc., 275(20): 1563–1570.
Stangle, D.E., Smith, D.R., Beaudin, S.A., Strawderman, M.S., Levitsky, D.A. et Strupp, B.J. (2007). Succimer chelation improves learning, attention, and arousal regulation in lead-exposed rats but produces lasting cognitive impairment in the absence of lead exposure.Environ. Health Perspect., 115(2): 201–209.
Stauber, J.L., Florence, T.M., Gulson, B.L. et Dale, L.S. (1994). Percutaneous absorption of inorganic lead compounds.Sci. Total Environ., 145(1–2): 55–70.
Steenland, K. et Boffetta, P. (2000). Lead and cancer in humans: where are we now?Am. J. Ind.Med., 38(3): 295–299.
Steenland, K., Selevan, S. et Landrigan, P. (1992). The mortality of lead smelter workers: an update.Am. J. Public Health, 82(12): 1641–1644.
Stewart, W.F., Schwartz, B.S., Davatzikos, C., Shen, D., Liu, D., Wu, X., Todd, A.C., Shi, W., Bassett, S. et Youssem, D. (2006). Past adult lead exposure is linked to neurodegeneration measured by brain MRI. Neurology, 66(10): 1476–1484.
Stollery, B.T. (1996). Reaction time changes in workers exposed to lead.Neurotoxicol. Teratol., 18(4): 477–483.
Stollery, B.T., Banks, H.A., Broadbent, D.E. et Lee, W.R. (1989). Cognitive functioning in lead workers.Br. J. Ind.Med., 46(10): 698–707.
Stollery, B.T., Broadbent, D.E., Banks, H.A. et Lee, W.R. (1991). Short term prospective study of cognitive functioning in lead workers.Br. J. Ind.Med., 48(11): 739–749.
Sun, C.C., Wong, T.T., Hwang, Y.H., Chao, K.Y., Jee, S.H. et Wang, J.D. (2002). Percutaneous absorption of inorganic lead compounds.Am. Ind. Hyg. Assoc. J., 63(5): 641–646.
Surkan, P.J., Zhang, A., Trachtenberg, F., Daniel, D.B., McKinlay, S. et Bellinger, D.C., (2007). Neuropsychological function in children with blood lead levels <10 mg/dL.Neurotoxicology 28 (2007) 1170–1177
Suzuki, T., Morimura, S., Diccianni, M.B., Yamada, R., Hochi, S., Hirabayashi, M., Yuki, A., Nomura, K., Kitagawa, T., Imagawa, M. et Muramatsu, M. (1996). Activation of glutathione transferase P gene by lead requires glutathione transferase P enhancer I.J. Biol.Chem., 271(3): 1626–1632.
Tachi, K., Nishimae, S. et Saito, K. (1985). Cytogenic effects of lead acetate on rat bone marrow cells.Arch. Environ. Health, 40(3): 144–147.
Téllez-Rojo, M.M., Bellinger, D.C., Arroyo-Quiroz, C., Lamadrid-Figueroa, H., Mercado-García, A., Schnaas-Arrieta, L., Wright, R.O., Hernández-Avila, M. et Hu, H. (2006). Longitudinal associations between blood lead concentrations lower than 10 µg/dL and neurobehavioral development in environmentally exposed children in Mexico City. Pediatrics, 118(2): e323–e330.
Thacker, S.B., Hoffman, D.A., Smith, J., Steinberg, K. et Zack, M. (1992). Effect of low-level body burdens of lead on the mental development of children: limitations of meta-analysis in a review of longitudinal data.Arch. Environ. Health, 47(5): 336–346.
Thier, R., Bonacker, D., Stoiber, T., Böhm, K.J., Wang, M., Unger, E., Bolt, H.M.et Degen, G. (2003). Interaction of metal salts with cytoskeletal motor protein systems.Toxicol. Lett., 140–141: 75–81.
Tong, S., Baghurst, P., McMichael, A., Sawyer, M. et Mudge, J. (1996). Lifetime exposure to environmental lead and children’s intelligence at 11–13 years: the Port Pirie cohort study.Br. Med. J., 312(7046): 1569–1575.
Tonz, O. (1957). Changes in the kidney of rats after chronic experimental exposure to lead.Z. Ges. Exp.Med., 128: 361–377[cité dans IARC, 2006].
Triantafyllidou, S. et Edwards, M. (2010). Contribution of galvanic corrosion to lead in water after partial lead service line replacements. Water Research Foundation, Denver, Colorado (Water Research Foundation Project No. 4088b).
Triantafyllidou, S. et Edwards, M. (2012). Lead (Pb) in tap water and in blood: implications for lead exposure in the United States. Crit. Rev. Environ.Sci. Technol., 42: 1297–1352.
Triantafyllidou, S., Parks, J. et Edwards, M. (2007). Lead particles in potable water. J. Am. Water Works Assoc., 99(6): 107–117.
Triantafyllidou, S., Nguyen, K., Zhang, Y. et Edwards, M. (2013). Lead (Pb) quantification in potable water samples: implications for regulatory compliance and assessment of human exposure. Environ. Monit. Assess., 185:1355–1365. doi: 10.1007/s10661-012-2637-6
Tsaih, S.W., Korrick, S., Schwartz, J., Amarasiriwardena, C., Aro, A., Sparrow, D. et Hu, H. (2004). Lead, diabetes, hypertension, and renal function: the Normative Aging Study.Environ. Health Perspect., 112(11): 1178–1182.
Tsao, D.A., Yu, H.S., Cheng, J.T., Ho, C.K. et Chang, H.R. (2000). The change of β-adrenergic system in lead-induced hypertension.Toxicol. Appl.Pharmacol., 164(2): 127–133.
Turković, R., Werner, W. et Klinger, J.(2014).The performance of nonleaded brass materials. Water Research Foundation, Denver, Colorado (Water Research Foundation Project No. 9171).
Turlakiewicz, Z. et Chmielnicka, J. (1985). Diethyllead as a specific indicator of occupational exposure to tetraethyllead.Br. J. Ind.Med., 42(10): 682–685.
U.S. Department of Health and Human Services (2006). Specifications for the conduct of studies to evaluate the toxic and carcinogenic potential of chemical, biological, and physical agents in laboratory animals for the National Toxicology Program (NTP).National Toxicology Program,Public Health Service, U.S. Department of Health and Human Services, Research Triangle Park, North Carolina.
U.S. EPA (1986). Air quality criteria for lead.Environmental Criteria and Assessment Office, Office of Health and Environmental Assessment, Office of Research and Development, U.S. Environmental Protection Agency, Research Triangle Park, North Carolina(EPA-600/8-83/028F).
U.S. EPA (1991). 40 CFR Parts 141 and 142, Maximum Contaminant Level Goals and National Primary Drinking Water Regulations for lead and copper: final rule. U.S. Environmental Protection Agency, Washington, D.C.
U.S. EPA (1992) Lead and Copper Rule guidance manual. U.S. Environmental Protection Agency, Washington, DC (Report No. EPA/811/B-92/002).U.S. EPA (1994a). Guidance manual for the Integrated Exposure Uptake Biokinetic Model for Lead in Children.U.S. Environmental Protection Agency, Research Triangle Park, North Carolina(EPA540-R-93-081; PB93-963510).
U.S. EPA (1994b). Technical support document: parameters and equations used in Integrated Exposure Uptake Biokinetic Model for Lead in Children (v0.99d).U.S. Environmental Protection Agency, Research Triangle Park, North Carolina (EPA 540-R-94-040; PB94-963505).
U.S. EPA (1994c). Determination of trace elements by stabilized temperature graphite furnace atomic absorption.Dans : Methods for the determination of metals in environmental samples, Supplement I. National Exposure Research Laboratory, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA/600/R-94/111).
U.S. EPA (1996). Three laboratory study: SA-1000 EPA Study. U.S. Environmental Protection Agency. Washington, D.C. Disponible à : http://www.palintest.com/wp-content/uploads/2014/07/TSI01003-The-EPA-Validation-report-for-the-Scanning-Analyzer.pdf
U.S. EPA (1998). Small system compliance technology list for the non-microbial contaminants regulated before 1996. Office of Water,U.S. Environmental Protection Agency, Washington, D.C. (EPA 815-R-98-002).
U.S. EPA (2000). 40 CFR Parts 141 and 142, National Primary Drinking Water Regulations for lead and copper: final rule. U.S. Environmental Protection Agency, Washington, D.C.
U.S. EPA (2005). Lead and Copper Rule: a quick reference guide for schools and child care facilities that are regulated under the Safe Drinking Water Act. U.S. Environmental Protection Agency, Washington, D.C. (EPA 816-F-05-030).
U.S. EPA (2006a). 3Ts for reducing lead in drinking water in schools: revised technical guidance. U.S. Environmental Protection Agency, Washington, D.C.
U.S. EPA (2006b). Inorganic contaminant accumulation in potable water distribution system. Prepared by HDR Engineering Inc. for the U.S. Environmental Protection Agency, Washington, D.C. (Contract No. 68-C-02-042; Work Assignment No. 1-06).
U.S. EPA (2007). Lead: human exposure and health risk assessment for selected case studies. Vol. I. Human exposure and health risk assessment—full-scale. Office of Air Quality Planning and Standards, U.S. Environmental Protection Agency, Research Triangle Park, North Carolina(EPA-452/R-07-014a).
U.S. EPA (2009a). Analytical feasibility support document for the second six-year review of existing National Primary Drinking Water Regulations. Office of Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-09-003).
U.S. EPA (2009b). Development of estimated quantitation levels for the second six-year review of National Primary Drinking Water Regulations. Office of Water, U.S. Environmental Protection Agency, Cincinnati, Ohio (EPA 815-B-09-005).
U.S. EPA (2011a). Science Advisory Board evaluation of the effectiveness of partial lead service line replacements. U.S. Environmental Protection Agency, Washington, D.C. Disponible à :http://yosemite.epa.gov/sab/sabproduct.nsf/964CCDB94F4E6216852579190072606F/$File/EPA-SAB-11-015-unsigned.pdf
U.S. EPA (2011b). Reduction of Lead in Drinking Water Act, Safe Drinking Water Act (SDWA), Section 1417. U.S. Environmental Protection Agency, Washington, D.C. Disponible à : www.gpo.gov/fdsys/pkg/BILLS-111s3874enr/pdf/BILLS-111s3874enr.pdf
U.S. EPA (2012). Radionuclides in drinking water, compliance options: Treatment technology descriptions. http://cfpub.epa.gov/safewater/radionuclides/radionuclides.cfm
U.S. EPA (2014a). Analytical methods approved for drinking water compliance monitoring of inorganic contaminants and other inorganic constituents. Disponible à : http://water.epa.gov/scitech/drinkingwater/labcert/upload/815b14001.pdf
U.S. EPA (2014b). National Primary Drinking Water Regulations. U.S. Environmental Protection Agency, Washington, D.C. Disponible à :http://water.epa.gov/drink/contaminants/index.cfm#List
Vaglenov, A., Carbonell, E. et Marcos, R. (1998). Biomonitoring of workers exposed to lead. Genotoxic effects, its modulation by polyvitamin treatment and evaluation of the induced radioresistance. Mutat. Res., 418(2–3): 79–92.
Vaglenov, A., Creus, A., Laltchev, S., Petkova, V., Pavlova, S. et Marcos, R. (2001). Occupational exposure to lead and induction of genetic damage. Environ. Health Perspect., 109(3): 295–298.
van den Hoven, T. et Slaats, N. (2006). Lead monitoring. Dans : P. Quevaiviller and K.C. Thompson (eds.), Analytical methods for drinking water: advances in sampling and analysis. John Wiley & Sons, Ltd., New York, New York.
van Esch, G.J. et Kroes, R. (1969). The induction of renal tumours by feeding basic lead acetate to mice and hamsters. Br. J. Cancer, 23(4): 765–771.
van Esch, G.J., van Genderen, H. et Vink, H.H. (1962). The induction of renal tumours by feeding of basic lead acetate to rats.Br. J. Cancer, 16: 289–297.
Vaziri, N.D. (2008). Mechanisms of lead-induced hypertension and cardiovascular disease. Am. J. Physiol. Heart Circ. Physiol., 295(2): H454–H465.
Vaziri, N.D. et Gonick, H. C. (2008). Cardiovascular effects of lead exposure. Indian J. Med. Res., 128(4): 426–435.
Vaziri, N.D., Ding, Y., Ni, Z. et Gonick, H.C. (1997). Altered nitric oxide metabolism and increased oxygen free radical activity in lead-induced hypertension: effect of lazaroid therapy. Kidney Int., 52(4): 1042–1046.
Vaziri, N.D., Ding, Y. et Ni, Z. (1999a). Nitric oxide synthase expression in the course of lead-induced hypertension. Hypertension, 34(4 Pt. 1): 558–562.
Vaziri, N.D., Liang, K. et Ding, Y. (1999b). Increased nitric oxide inactivation by reactive oxygen species in lead- induced hypertension. Kidney Int., 56(4): 1492–1498.
Vaziri, N.D., Ding, Y. et Ni, Z. (2001). Compensatory up-regulation of nitric-oxide synthase isoforms in lead-induced hypertension; reversal by a superoxide dismutase-mimetic drug. J. Pharmacol. Exp. Ther., 298(2): 679–685.
Vigeh, M., Yokoyama, K., Kitamura, F., Afshinrokh, M., Beygi, A. et Niroomanesh, S. (2010). Early pregnancy blood lead and spontaneous abortion. Women Health, 50(8): 756–766.
Vreeburg, J. (2010). Discolouration in drinking water systems: the role of particles clarified. IWA Publishing, London, UK.
Vupputuri, S., He, J., Muntner, P., Bazzano, L.A., Whelton, P.K. et Batuman, V. (2003). Blood lead level is associated with elevated blood pressure in blacks. Hypertension, 41(3 Pt. 1): 463–468.
Vural, N. et Duydu, Y. (1995). Biological monitoring of lead in workers exposed to tetraethyllead.Sci. Total Environ., 171(1–3): 183–187.
Waalkes, M.P., Diwan, B.A., Ward, J.M., Devor, D.E. et Goyer, R.A. (1995). Renal tubular tumors and atypical hyperplasias in B6C3F1 mice exposed to lead acetate during gestation and lactation occur with minimal chronic nephropathy. Cancer Res., 55(22): 5265–5271.
Waalkes, M.P., Liu, J., Goyer, R.A. et Diwan, B.A. (2004). Metallothionein-I/II double knockout mice are hypersensitive to lead-induced kidney carcinogenesis: role of inclusion body formation. Cancer Res., 64(21): 7766–7772.
Wang, C.L., Chuang, H.Y., Ho, C.K., Yang, C.Y., Tsai, J.L., Wu, T.S. et Wu, T.N. (2002). Relationship between blood lead concentrations and learning achievement among primary school children in Taiwan.Environ. Res., 89(1): 12–18.
Wang, H.L., Chen, X.T., Yang, B., Ma, F.L., Wang, S., Tang, M.L., Hao, M.G. et Ruan, D.Y. (2008). Case–control study of blood lead levels and attention deficit hyperactivity disorder in Chinese children.Environ. Health Perspect., 116(10): 1401–1406.
Wang, J., Wu, J. et Zhang, Z. (2006). Oxidative stress in mouse brain exposed to lead.Ann. Occup.Hyg., 50(4): 405–409.
Wang, L., Chen, A.S.C. and Wang, A. (2010). Arsenic removal from drinking water by ion exchange. U.S. EPA demonstration project at Fruitland, ID. Final performance evaluation report. Cincinnati, Ohio. EPA/600/R-10/152.
Wang, Y., Jing, H., Mehta, V., Welter, G.J. et Giammar, D.E. (2012). Impact of galvanic corrosion on lead release fromaged lead service lines. Water Res., 46: 5049–5060.
Wang, Y., Mehta, V., Welter, G.J. et Giammar, D.E. (2013). Effect of connection methods on lead release from galvanic corrosion.J. Am. Water Works Assoc., 105(7): E337–E351.
Wasserman, G.A., Musabegovic, A., Liu, X., Kline, J., Factor-Litvak, P. et Graziano, J.H. (2000). Lead exposure and motor functioning in 4½-year-old children: the Yugoslavia Prospective Study.J. Pediatr., 137(4): 555–561.
Waszynski, E. (1977). [Nonneoplastic and neoplastic changes in the kidneys and other organs in rodents fed lead acetate and sulfathiazole chronically.] Patol. Pol., 28(1): 101–111 (in Polish).
Watts, S.W., Chai, S. et Clinton Webb, R. (1995). Lead acetate–induced contraction in rabbit mesenteric artery: interaction with calcium and protein kinase C. Toxicology, 99(1–2): 55–65.
Weiss, S.T., Munoz, A., Stein, A., Sparrow, D. et Speizer, F.E. (1986). The relationship of blood lead to blood pressure in a longitudinal study of working men.Am. J. Epidemiol., 123(5): 800–808.
Wells, A.C., Venn, J.B. et Heard, M.J. (1975). Deposition in the lung and uptake to blood of motor exhaust labelled with 203Pb. Inhaled Part., 4(Pt. 1): 175–189.
Wells, E.M., Navas-Acien, A., Herbstman, J.B., Apelberg, B.J., Silbergeld, E.K., Caldwell, K.L., Jones, R.L., Halden, R.U., Witter, F.R. et Goldman, L.R. (2011). Low-level lead exposure and elevations in blood pressure during pregnancy.Environ. Health Perspect., 119(5): 664–669.
Welter, G., Giammar, D., Wang, Y. et Cantor, A. (2013). Galvanic corrosion following partial lead service line replacement. Water Research Foundation, Denver, Colorado (Water Research Foundation Project No. 4349).
Weuve, J., Korrick, S.A., Weisskopf, M.A., Ryan, L.M., Schwartz, J., Nie, H., Grodstein, F. et Hu, H. (2009). Cumulative exposure to lead in relation to cognitive function in older women.Environ. Health Perspect., 117(4): 574–580.
White, P.D., van Leeuwen, P., Davis, B.D., Maddaloni, M., Hogan, K.A., Marcus, A.H. et Elias, R.W. (1998). The conceptual structure of the Integrated Exposure Uptake Biokinetic Model for Lead in Children.Environ. Health Perspect., 106(Suppl. 6): 1513–1530.
Williams, P.L., Sergeyev, O., Lee, M.M., Korrick, S.A., Burns, J.S., Humblet, O., DelPrato, J., Revich, B. et Hauser, R. (2010). Blood lead levels and delayed onset of puberty in a longitudinal study of Russian boys. Pediatrics, 125(5): e1088–e1096.
Wolff, M.S., Britton, J.A., Boguski, L., Hochman, S., Maloney, N., Serra, N., Liu, Z., Berkowitz, G., Larson, S. et Forman, J. (2008). Environmental exposures and puberty in inner-city girls.Environ. Res., 107(3): 393–400.
Wong, O. et Harris, F. (2000). Cancer mortality study of employees at lead battery plants and lead smelters, 1947–1995.Am. J. Ind.Med., 38(3): 255–270.
Wozniak, K. et Blasiak, J. (2003). In vitro genotoxicity of lead acetate: induction of single and double DNA strand breaks and DNA–protein cross-links.Mutat. Res.,535(2): 127–139.
Wright, R.O., Tsaih, S.W., Schwartz, J., Spiro, A., III, McDonald, K., Weiss, S.T. et Hu, H. (2003). Lead exposure biomarkers and mini-mental status exam scores in older men. Epidemiology, 14(6): 713–718.
Wu, J., Basha, M.R., Brock, B., Cox, D.P., Cardozo-Pelaez, F., McPherson, C.A., Harry, J., Rice, D.C., Maloney, B., Chen, D., Lahiri, D.K. et Zawia, N.H. (2008). Alzheimer’s disease (AD)–like pathology in aged monkeys after infantile exposure to environmental metal lead (Pb): evidence for a developmental origin and environmental link for AD.J. Neurosci., 28(1): 3–9.
Xie, Y. et Giammar, D.E. (2011). Effects of flow and water chemistry on lead release rates from pipe scales. Water Res., 45(19): 6525–6534.
Xu, J., Wise, J.P. et Patierno, S.R. (1992). DNA damage induced by carcinogenic lead chromate particles in cultured mammalian cells. Mutat. Res., 280(2): 129–136.
Yang, J.L., Yeh, S.C. et Chang, C.Y. (1996). Lead acetate mutagenicity and mutational spectrum in the hypoxanthine guanine phosphoribosyltransferase gene of Chinese hamster ovary K1 cells. Mol. Carcinogen., 17(4): 181–191.
Yang, J.L., Wang, L.C., Chang, C.Y. et Liu, T.Y. (1999). Singlet oxygen is the major species participating in the induction of DNA strand breakage and 8-hydroxydeoxyguanosine adduct by lead acetate.Environ. Mol.Mutagen., 33(3): 194–201.
Ye, X.B., Fu, H., Zhu, J.L., Ni, W.M., Lu, Y.W., Kuang, X.Y., Yang, S.L. et Shu, B.X. (1999). A study on oxidative stress in lead-exposed workers.J. Toxicol. Environ. Health A, 57(3): 161–172.
Yuan, W., Holland, S.K., Cecil, K.M., Dietrich, K.N., Wessel, S.D., Altaye, M., Hornung, R.W., Ris, M.D., Egelhoff, J.C. et Lanphear, B.P. (2006). The impact of early childhood lead exposure on brain organization: a functional magnetic resonance imaging study of language function. Pediatrics, 118(3): 971–977.
Yuan, X. et Tang, C. (2001). The accumulation effect of lead on DNA damage in mice blood cells of three generations and the protection of selenium.J. Environ. Sci. Health A Tox. Hazard. Subst. Environ. Eng., 36(4): 501–508.
Yukon Environmental Health Services (2011). Communication personnelle de P. Brooks.
Zaragoza, L. et Hogan, K. (1998). The Integrated Exposure Uptake Biokinetic Model for Lead in Children: independent validation and verification.Environ. Health Perspect., 106(Suppl. 6): 1551–1556.
Zawia, N.H. (2003). Transcriptional involvement in neurotoxicity.Toxicol. Appl.Pharmacol., 190(2): 177–188.
Zawia, N.H., Sharan, R., Brydie, M., Oyama, T. et Crumpton, T. (1998). Sp1 as a target site for metal-induced perturbations of transcriptional regulation of developmental brain gene expression.Dev. Brain Res., 107(2): 291–298.
Zawirska, B. (1968). [Tumours and disorders of porphyrin metabolism in rats with chronic experimental lead poisoning.I. Morphological studies.] Zentralbl. Allg. Pathol., 111(1): 1–12 (in German).
Zawirska, B. (1981). The role of the kidneys in disorders of porphyrin metabolism during carcinogenesis induced with lead acetate.Environ. Res., 24(2): 391–408.
Zawirska, B. et Medras, K. (1972). The role of the kidneys in disorders of porphyrin metabolism during carcinogenesis induced with lead acetate.Arch. Immunol. Ther.Exp., 20(2): 257–272.
Zelikoff, J.T., Li, J.H., Hartwig, A., Wang, X.W., Costa, M. et Rossman, T.G. (1988). Genetic toxicology of lead compounds. Carcinogenesis, 9(10): 1727–1732.
Zhang, W., Zhang, G.G., He, H.Z. et Bolt, H.M. (1994). Early health effects and biological monitoring in persons occupationally exposed to tetraethyl lead.Int. Arch. Occup.Environ. Health, 65(6): 395–399.
Zhang, Y. et Edwards, M. (2011). Zinc content in brass and its influence on lead leaching. J. Am. Water Works Assoc., 103(7): 76–83.
Ziegler, E.E., Edwards, B.B., Jensen, R.L., Mahaffey, K.R. et Fomon, S.J. (1978). Absorption and retention of lead by infants.Pediatr. Res., 12(1): 29–34.
Zollinger, H.U. (1953). Renal adenomas and carcinomas induced in rats after chronic lead exposure, and their relationship with corresponding neoplasia in humans.Virchows Arch., 323: 697–710 [cité dans IARC, 2006].
Annexe A : Liste des acronymes
- 30MS
- période de stagnation de 30 minutes
- ACSL
- Advanced Continuous Simulation Language
- AD
- (échantillonnage) aléatoire diurne
- ADN
- acide désoxyribonucléique
- AHTP
- apport hebdomadaire tolérable provisoire
- ALAD
- acide γ-aminolévulinique déshydratase
- ALARA
- niveau le plus faible qu’il soit raisonnablement possible d’atteindre
- ANSI
- American National Standards Institute
- APP
- protéine précurseur amyloïde
- ASCII
- American Standard Code for Information Interchange
- ASME
- American Society of Mechanical Engineers
- BMD
- dose de référence
- BMD 01
- dose de référence correspondant à un changement de 1 % de la réponse
- BMD 10
- dose de référence correspondant à un changement de 10 % de la réponse
- BMDI 01
- limite inférieure de l’intervalle de confiance à 95 % sur la BMD 01
- BMDI 10
- limite inférieure de l’intervalle de confiance à 95 % sur la BMD 10
- CCME
- Conseil canadien des ministres de l’environnement
- CCN
- Conseil canadien des normes
- CIRC
- Centre international de recherche sur le cancer
- CPSC
- Consumer Product Safety Commission (États-Unis)
- CMA
- concentration maximale acceptable
- CNP
- Code national de la plomberie – Canada
- CSA
- Association canadienne de normalisation
- DOS
- Disk Operating System (système d’exploitation)
- EFSA
- Autorité européenne de sécurité des aliments
- EPA
- Environmental Protection Agency (États-Unis)
- FAO
- Organisation des Nations Unies pour l’alimentation et l’agriculture
- GC-MS
- chromatographie en phase gazeuse couplée à la spectrométrie de masse
- GFAAS
- spectrométrie d’absorption atomique en four graphite
- HOME
- Home Observation for Measurement of the Environment (observations destinées à mesurer l’environnement familial)
- IC
- intervalle de confiance
- ICP
- plasma à couplage inductif
- IEUBK
- Integrated Exposure Uptake Biokinetic Model for Lead in Children
- INRP
- Inventaire national des rejets de polluants
- JECFA
- Comité mixte FAO/OMS d’experts des additifs alimentaires
- LCSPC
- Loi canadienne sur la sécurité des produits de consommation
- LDM
- limite de détection de la méthode
- MEO
- Ministère de l’Environnement de l’Ontario
- MMSE
- mini-examen de l’état mental
- MP 2,5
- matières particulaires d’un diamètre aérodynamique inférieur à 2,5 μm
- MS
- spectrométrie de masse
- NHANES
- National Health and Nutrition Examination Survey (États-Unis)
- NSF
- NSF International
- SPEQ
- seuil pratique d’évaluation quantitative
- OMS
- Organisation mondiale de la Santé
- Pb
- plomb
- PBPK
- (modèle) pharmacocinétique fondé sur la physiologie
- PC
- purge complète
- p.c.
- poids corporel
- PLT
- potentialisation à long terme
- PNSRC
- Programme national de surveillance des résidus chimiques
- QI
- quotient intellectuel
- RC
- rapport des cotes
- RR
- risque relatif
- SM
- Standard Method (méthode normalisée)
- Sp1
- protéine de spécificité 1
- THADA
- trouble d’hyperactivité avec déficit de l’attention
- UTN
- unité de turbidité néphélométrique
- VBS
- valeur basée sur la santé
- VSA
- voltamétrie par strippage anodique
Annexe B : Répercussions prévues par province et territoire
Veuillez noter que l'information suivante n'est pas dans les deux langues officielles puisque la source de l'information n'est pas assujettie à la Loi sur les langues officielles.
Île-du-Prince-Édouard
Aucun paragraphe n’a été soumis par la province.
Terre-Neuve-et-Labrador
The Province of Newfoundland and Labrador is responsible for extensive monitoring for inorganic parameters, including lead, in the province. Lead monitoring is conducted semi-annually for all public water supplies in the province, and quarterly for populations larger than 5,000. pH is also included in the extensive monitoring program conducted in the province. pH in the province is typically low and below the guideline of 6.5-8.5. There are typically greater than 300 pH exceedances in the province annually. As discussed in the technical document, the low pH in the province causes issues with corrosion in distribution systems and affects the lead concentration levels in drinking water. In recent years, there have been increasing numbers of lead exceedances during summer months from service line/water fixtures in buildings at the existing guideline levels.
There could be a high cost of implementing the proposed guideline for lead in Newfoundland and Labrador. Due to naturally low pH issues experienced by many water systems in the province, prevention of corrosion in distribution systems would require new treatment systems and/or significant upgrades to existing systems. Many smaller systems would have to consider changing from gas chlorination to hypo-chlorination to avoid decreasing pH levels. Many systems would also have to install pH adjustment systems or upgrade their existing pH adjustment systems to maintain appropriate pH levels within the distribution system. Water pH in some communities is so low, that even with treatment, it would be difficult to dose enough chemical to meet both pH and lead guidelines.
There are two public groundwater systems that have naturally occurring lead in the province. One system has a lead removal system which may not have the capability to reduce the levels below the proposed guideline as a number of recent results are above 0.005 mg/L. The other system has no removal system and has been on a non-consumption advisory since 2002.
The province will continue to monitor for lead and pH at the current frequency, and continue to assist communities in ensuring their pH adjustment systems are working effectively to increase pH levels and keep corrosion control measure in place.
Nouvelle-Écosse
The revised guideline proposes a reduction to the maximum acceptable concentration (MAC) for lead from 10 µg/L to 5 µg/L. The proposed reduction is likely to result in moderate to significant impacts for Nova Scotia.
Available data suggests that utilities will not be impacted as a result of the proposed reduction; however, this data represents flushed samples collected from the distribution system and is not representative of lead concentrations at the consumer's tap. Existing data prevents an accurate determination of the true impact. The known presence of lead service lines, solders, and fittings in utility distribution systems and plumbing of older homes coupled with the lack of enforceable corrosion control requirements likely result in consumer exposures to lead levels that are higher than what is reported.
For Nova Scotia, the revised guideline will require the development and enforcement of lead sampling protocols for residential/non-residential sites. This will likely result in challenges for the utilities and the Compliance Division of Nova Scotia Environment. Specific challenges are likely to include: lack of willing participants; access for sample collection; costs associated with lead service line replacement ; and increased costs for laboratory analysis, etc.
Nouveau-Brunswick
New Brunswick is supportive of minimizing exposure to lead from drinking water. At this time we are unable to quantify the impact of the proposed guideline, but anticipate that it will likely be substantial.
Additional discussion is required with stakeholders to discuss how to proceed with implementation of the proposed guideline and how to manage compliance, monitoring and enforcement. Mitigative efforts, and the associated costs, could be substantial. It is reasonable to assume that systems owners will resist feeling responsible for water quality within buildings (which will vary from building to building) particularly those that have many internal plumbing issues. New Brunswick has many systems with aggressive water - particularly those that use surface water. Corrosion control will need to be part of this discussion. Replacement of lead service lines and some internal plumbing will be required. The cost associated with these measures could be immense and will be different for every system depending on a variety of factors. This will have to be reviewed on a case-by-case basis.
Based on drinking water data that we currently have, changing the current MAC from 10 µg/L to 5 µg/L will result in the percentage of regulated municipal water systems with a historical exceedance of the guideline to increase from 15% (10 of 67 systems) with at least one result ≥10 µg/L to 22% (15 systems) with at least one result ≥5 µg/L; and crown systems with at least one historical exceedance of the guideline will increase from 13% (27 of 202 systems) to 17% (35 systems).
However, the true impact will very likely be much greater. New Brunswick’s historical monitoring data for lead has been obtained based on flushed samples as is recommended in the current guideline. It is impossible to know at this time the lead concentrations that will be found at individual taps once sampling is completed at recommended locations and in accordance the newly introduced sampling protocols of the proposed guideline, but it is reasonable to assume that lead results will increase.
For private wells, historical water quality data suggest that the changed MAC will result in an increase in exceedance from 3% to 7%. This could result in increased costs associated with analytical testing and treatment.
Québec
Au Québec, de janvier 2013 à décembre 2014, 23 158 analyses du plomb ont été réalisées dans le cadre du Règlement sur la qualité de l’eau potable, dans un total de 3022 réseaux de distribution. Tous les réseaux assujettis au Règlement doivent réaliser annuellement le contrôle du plomb dans l’eau qu’ils distribuent et le nombre d’échantillons à prélever par année est en fonction du nombre de personnes desservies.
Sur la période de janvier 2013 à décembre 2014, 393 (1,7 %) des analyses réalisées ont présenté un résultat supérieur à la norme actuelle de 10 µg/L, ce qui a touché 85 réseaux de distribution (2,8 %). La concentration maximale mesurée a atteint 977 μg/L, tandis que la médiane des résultats dépassant la norme était de 16 µg/L. À titre comparatif, 845 résultats d’analyse de plomb (3,6 %) auraient dépassé la recommandation canadienne proposée de 5 µg/L durant cette période, pour un total de 177 réseaux touchés (5,9 %).
Considérant les résultats d'analyse disponibles, les impacts attendus d'une éventuelle réduction de la norme de plomb dans la réglementation québécoise en fonction de la révision de la recommandation proposée seraient importants. En effet, cela pourrait faire doubler le nombre de réseaux de distribution devant mettre en place des mesures correctrices, celles-ci pouvant varier selon la taille du réseau et l’ampleur du problème observé.
Ontario
A reduction in the Canadian Drinking Water Quality Guideline for lead proposed in this document will have an impact in Ontario as the province typically adopts federal guidelines as enforceable standards.
In the case of lead, the main source is associated with water delivery, particularly the isolated components (i.e., pipes and fittings) within buildings and homes. The drinking water system owners/operators have little control over these components as their obligation is to deliver water that is not corrosive.
Ontario recognizes that the impact of lead can be mitigated by appropriate flushing practices and replacement of components such as lead service lines that contribute to lead levels in the drinking water over time.
Manitoba
A review conducted by the Manitoba Office of Drinking Water in 2012 found that some of the largest public water systems in the province have lead service lines in their distribution systems. This includes many of the largest urban centres and some old towns. In some of those systems, total lead levels remained above the current (i.e., 10 µg/L) lead guideline even after flushing the taps for 5 minutes. The water was left to sit in service lines for at least 6 hours but no more than 24 hours before sampling. The overall number of lead service lines in public water distribution systems across the province is estimated at 30,000 to 50,000. Immediate full replacement is not an option as it would be prohibitively expensive. However, many of the concerned large public water systems have established lead service line replacement programs in their respective communities, providing incentives for homeowners to replace the portion of lead service line going from the curb stop into individual properties. This process is slow and many homeowners find the financial contribution required from them to be too high. Annual lead service line replacement costs are expected to remain significant on a province-wide basis for the next several years. In addition, based on the monitoring strategy recommended by Health Canada, monitoring for total lead at the consumer’s tap in residential dwellings, as well as monitoring at drinking water fountains and cold water taps in schools, multi-dwelling residences, and large buildings would cost several hundred thousand dollars annually. Based on the foregoing, we anticipate the impact of revisions to the lead guideline - including lowering the guideline for lead in drinking water to 5 µg/L and proposed monitoring recommendations - to be significant in Manitoba.
Saskatchewan
The Water Security Agency (WSA) has reviewed the proposed guideline document for Lead in Drinking Water and agrees with the proposed MAC of 5 microgram/L for total lead in drinking water. Drinking water quality data for 2,760 samples collected in the last 5 years (2010 to present) from the distribution systems of municipalities regulated by the WSA showed that total lead levels exceeded the proposed MAC only in few locations in the province. Some of the municipalities in Saskatchewan continue to replace lead service lines in the distribution system, and others have some form of replacement programs including providing an incentive to home owners to replace their lead service lines from the curb stop to the building entry. The Water Security Agency follows the corrosion control guidance document of Health Canada in dealing with lead exceedences in the distribution system and encourages the waterworks owner to replace the lead service lines where related exceedences occur. Since studies showed that many of the water treatment systems, including conventional water treatment filtration systems and RO systems, are effective in removing lead, and since these type of treatment systems are in existence and/or are being increasingly adopted for use in WTPs in the province, the WSA believes and expects that the new standard for total lead will have minimal or no impacts including cost to municipal and other regulated waterworks in the province. Further, since lead is present mostly in drinking water due to many factors including age of the pipeline/components and from leaching in the distribution and plumbing systems, the WSA continues to work with municipalities and the Ministry of Health/Health Regions in Saskatchewan in monitoring lead levels in the distribution systems.
Alberta
Aucun paragraphe n’a été soumis par la province.
Colombie-Britannique
Given the developmental risks to children from lead, BC supports minimizing lead intake from drinking water as much as reasonably achievable, preferably below the existing and the proposed maximum in the Guidelines for Canadian Drinking Water Quality.
The proposed change in the guideline will cause the water delivered by a small number of water supply systems to exceed the new, more stringent MAC. However, leaching from fixtures within individual buildings is likely the most significant contributor to lead concentration in water, and therefore exceedance of the guideline at the tap. Drinking water in many water systems in BC is soft (low in hardness), and slightly acidic (low pH and alkalinity). When soft water stagnates in building piping, lead and other metals can leach out from the plumbing into the water. This is particularly true in older facilities and homes that may have lead and copper or brass plumbing, fixtures, fittings, or used solder containing lead.
It is therefore difficult for water suppliers to know lead concentrations delivered at individual taps, as this will vary from building to building, depending on plumbing. Sampling for buildings, particularly high risk institutions such as schools and daycares, will remain a cost pressure. Questions of whether this is responsibility of water suppliers or building owners will also still remain.
Water suppliers do not have direct control over water once it leaves their distribution system, however in areas where water is aggressive, effective mitigation measures can be taken at either the individual or the community level. Individual building owners may reduce lead concentration in water by regular flushing of taps, retrofitting plumbing, installing corrosion control, or installing other point of use treatment. At a community level, water suppliers may adopt corrosion control measures to reduce the corrosiveness of water before it enters the distribution system. None of these measures are without significant expense, and the most cost effective of these options would likely depend on the size of the water supply system.
Yukon
It is not possible to quantify any potential impact of the guideline technical document for lead in Yukon for large public drinking water systems (LPDWS) with piped distribution systems due to a lack of exposure data. Currently, LPDWS are required to routinely monitor treated water for chemical parameters including lead prior to entry into the distribution system. All systems produce water below the proposed MAC. There is no requirement for routine monitoring of chemical parameters in the distribution system.
Territoires du Nord-Ouest
Aucun paragraphe n’a été soumis par le territoire.
Nunavut
Aucun paragraphe n’a été soumis par le territoire.