Le sulfonate de perfluorooctane (SPFO) dans l'eau potable

Télécharger le format de rechange (Format PDF, 899 Ko, 114 pages)
Organisation : Santé Canada
Type: Consultation
Publiée : Juin 2016
Document de consultation publique
Préparé par le Comité fédéral-provincial-territorial sur l'eau potable
La période de consultation se termine le 2 septembre 2016
Table des matières
- Objet de la consultation
- Partie I : Vue d'ensemble et application
- 1.0 Recommandation proposée
- 2.0 Sommaire
- 3.0 Application de la recommandation
- Partie II. Science et considérations techniques
- 4.0 Propriétés, utilisation et sources dans l'environnement
- 5.0 Exposition
- 6.0 Méthodes d'analyse
- 7.0 Techniques de traitement
- 7.1 Échelle municipale
- 7.1.1 Traitement conventionnel
- 7.1.2 Adsorption
- 7.1.3 Filtration sur membrane
- 7.1.4 Échange d'ions
- 7.1.5 Oxydation, irradiation d'ultraviolets et processus d'oxydation avancée
- 7.1.6 Aération/strippage à l'air
- 7.1.7 Filtration par les berges (traitement par l'aquifère du sol)
- 7.1.8 Nouvelles techniques
- 7.2 Échelle résidentielle
- 7.1 Échelle municipale
- 8.0 Cinétique et métabolisme
- 9.0 Effets sur la santé
- 9.1 Effets sur la santé humaine
- 9.2 Effets sur les animaux de laboratoire
- 9.3 Mode d'action
- 10.0 Classification et évaluation
- 11.0 Justification
- 12.0 Références
- Annexe A : Élimination du SPFO dans les usines de traitement d'eau potable de pleine grandeur – données rapportées
- Annexe B : Liste des acronymes
- Annexe C : Répercussions prévues par province et territoire
Objet de la consultation
Le Comité fédéral-provincial-territorial sur l'eau potable (CEP) a évalué l'information disponible sur le sulfonate de perfluorooctane (SPFO) dans le but d'élaborer une recommandation pour la qualité de l'eau potable et un document technique pour le SPFO dans l'eau potable. La présente consultation vise à solliciter des commentaires sur la recommandation proposée, la démarche suivie pour l'élaborer et les coûts possibles de sa mise en œuvre, ainsi que pour déterminer la disponibilité d'autres données d'exposition.
Le présent document propose une concentration maximale acceptable (CMA) de 0,0006 mg/L (0,6 µg/L) pour le SPFO dans l'eau potable, fondée sur les effets sur le foie chez les rats. Le document s'appuie sur les études et approches scientifiques présentement disponibles. Il incorpore une analyse détaillée du mode d'action en vue d'établir une recommandation proposée pour le SPFO. Il renferme des renseignements relatifs à l'exposition ainsi que des méthodes d'analyse et des techniques de traitement qui pourraient être efficaces pour l'enlèvement du SPFO aux échelles municipale et résidentielle.
Le CEP a demandé que le document soit rendu public aux fins de consultation. Les commentaires, avec justification pertinente le cas échéant, sont les bienvenus. Ils peuvent être envoyés au Secrétariat du CEP par courrier électronique (water_eau@hc-sc.gc.ca) ou au besoin par la poste au Secrétariat du CEP, Bureau de la qualité de l'eau et de l'air, Santé Canada, 3e étage, 269, avenue Laurier Ouest, IA 4903D, Ottawa (Ontario) K1A 0K9. Les commentaires doivent nous parvenir avant le le 2 septembre 2016.
Les commentaires reçus dans le cadre de la consultation seront transmis, avec le nom et l'affiliation de leurs auteurs, aux membres concernés du CEP. Les personnes qui ne veulent pas que leur nom et leur affiliation soient communiqués aux membres du CEP doivent joindre à leurs commentaires une déclaration à cet égard.
Il est à noter que le présent document technique sera révisé après l'analyse des commentaires reçus et qu'une recommandation pour l'eau potable sera établie s'il y a lieu. Ce document devrait donc être considéré strictement comme une ébauche pour commentaires.
Partie I : Vue d'ensemble et application
1.0 Recommandation proposée
Une concentration maximale acceptable (CMA) de 0,0006 mg/L (0,6 µg/L) est proposée pour le sulfonate de perfluorooctane dans l'eau potable.
2.0 Sommaire
Le SPFO est un composé artificiel qui ne se trouve pas naturellement dans l'environnement. Il n'est plus fabriqué, importé, vendu, offert à la vente ou utilisé au Canada, mais se trouve encore dans l'environnement en raison de sa nature extrêmement persistante. Le SPFO était utilisé pour rendre des surfaces et des applications en papier – comme les moquettes et les tapis, les tissus et le rembourrage – hydrofuges, antisalissantes ou imperméables aux graisses. Il était également utilisé dans des applications chimiques spécialisées, notamment dans les mousses extinctrices, les fluides hydrauliques et les détachants pour tapis.
Ce document technique passe en revue et évalue tous les risques connus pour la santé qui sont associés à la présence de SPFO dans l'eau potable. Il tient compte des études et approches disponibles, ainsi que des limites des méthodes d'analyse et des techniques de traitement. D'après cet examen, la recommandation proposée pour le SPFO dans l'eau potable est une concentration maximale acceptable de 0,0006 mg/L (0,6 µg/L).
À sa réunion de l'automne 2015, le Comité fédéral-provincial-territorial sur l'eau potable a examiné le document technique sur le SPFO dans l'eau potable et en a approuvé sa publication aux fins de consultation publique.
2.1 Effets sur la santé
La cancérogénicité du SPFO n'a pas été évaluée par le Centre international de recherche sur le cancer (CIRC). Des effets cancérogènes ont été observés chez des humains après avoir été exposés au SPFO, mais aucun lien clair n'a pu être établi en raison de différentes limites des études. Des tumeurs ont été observées dans le foie, la thyroïde et les glandes mammaires de rats après une exposition à long terme au SPFO. Les effets non cancérogènes qui surviennent au plus faible niveau d'exposition au SPFO chez les animaux comprennent des effets sur le système immunitaire, sur le foie et sur la thyroïde, ainsi que des changements dans les taux sériques de lipides.
Les effets cancérogènes et non cancérogènes ont tous deux été pris en considération dans l'établissement de la CMA proposée pour le SPFO dans l'eau potable. L'approche basée sur les effets non cancer, fondée sur la base des effets sur le foie chez le rat, a servi à calculer une CMA proposée qui protège la santé humaine à la fois des effets cancérogènes et non cancérogènes.
2.2 Exposition
Les Canadiens peuvent être exposés au SPFO dans les aliments, les produits de consommation, la poussière et l'eau potable. L'exposition est principalement liée aux aliments et aux produits de consommation, mais la proportion provenant de l'eau potable peut être plus élevée pour les individus résidant dans des régions où l'eau potable est contaminée. Bien que la présence de SPFO ne soit pas régulièrement surveillée dans les usines de traitement de l'eau potable au Canada, une analyse a été effectuée à quelques endroits. Lorsque le SPFO est détecté dans l'eau potable, sa concentration est habituellement inférieure à 1 ng/L.
2.3 Analyse et traitement
À ce jour, l'U.S. Environmental Protection Agency n'a approuvé aucune méthode pour l'analyse du SPFO dans l'eau potable. Il existe certaines méthodes permettant de mesurer les niveaux de SPFO présents dans l'eau potable à des niveaux bien inférieurs à la CMA proposée. Elles nécessitent cependant des procédures rigoureuses de contrôle de la qualité pour donner des résultats justes.
Le choix et l'efficacité d'une stratégie pour l'enlèvement du SPFO sont déterminés par plusieurs facteurs, tels que la composition chimique de l'eau brute, la concentration de SPFO et/ou d'autres substances perfluoroalkylées ainsi que les procédés de traitement déjà en place. Le traitement conventionnel n'est pas efficace pour enlever leu SPFO. D'autres méthodes de traitement se montrent prometteuses, mais les études à pleine échelle sont limitées. La méthode d'adsorption sur du charbon actif en grains (CAG) peut permettre d'obtenir des concentrations de SPFO inférieures à la CMA proposée. Cependant, l'opération appropriée du système est essentielle pour faire en sorte que le rendement du CAG ne soit pas entravé par la présence de matière organique naturelle dans l'eau brute. Les techniques de filtration sur membrane (osmose inverse et nanofiltration) et d'échange d'anions pourraient aussi s'avérer efficaces. Bien qu'il n'existe aucun dispositif de traitement à résidentiel certifié pour éliminer le SPFO, les mêmes techniques de traitement devraient être efficaces à l'échelle résidentielle.
3.0 Application de la recommandation
Remarque : Des conseils spécifiques concernant l'application des recommandations pour l'eau potable devraient être obtenus auprès de l'autorité appropriée en matière d'eau potable dans le secteur de compétence concerné.
3.1 Surveillance
On retrouve habituellement le SPFO dans les eaux souterraines et de surface contaminées par des rejets d'installations industrielles, des rejets issus d'usines de traitement des eaux usées domestiques et industrielles, des eaux pluviales d'orage ou de l'application de sols modifiés par des biosolides. ainsi que les sources d'eaux souterraines et d'eaux de surface qui sont ou auraient pu être touchées par des mousses à formation de pellicule aqueuse (AFFF) (c.à-d. des mousses extinctrices). Comme d'autres contaminants des eaux souterraines, le SPFO peut atteindre les puits d'eau potable par la migration d'un panache d'eau souterraine contaminée. Il peut également atteindre les eaux souterraines à partir des émissions atmosphériques provenant d'installations industrielles. Les substances perfluoroalkyliques volatiles liées aux particules peuvent être transportées par les vents à partir de lieux d'élimination et déposées sur le sol ou dans les eaux de surface, ce qui explique la présence de ces produits chimiques anthropiques dans les emplacements éloignés et dans les eaux non contaminées par une source ponctuelle. Le SPFO migre très lentement du sol vers les eaux souterraines, et pourrait ne pas être détecté dans la source d'eau pendant des années.
Les services publics devraient caractériser leur source d'eau pour évaluer les concentrations de SPFO. Dans les sources d'eau dans lesquelles on retrouve un niveau de SPFO supérieur à la CMA proposée, il conviendrait d'effectuer une surveillance trimestrielle pour l'eau de surface, ou une surveillance semestrielle pour l'eau souterraine.
La fréquence de surveillance de l'eau traitée dépend de la technique de traitement utilisée par le service public. Les services publics qui utilisent un système à base de CAG pour éliminer le SPFO voudront probablement renforcer la surveillance de l'eau traitée en vue d'évaluer le rendement du système de CAG et de déterminer le moment propice pour la régénération. Un service public peut envisager de diminuer sa surveillance lorsqu'il dispose de données indiquant que la source d'eau est exempte de SPFO. Néanmoins, si l'on soupçonne que la contamination provient d'une mousse AFFF, le service public pourrait envisager de surveiller la présence d'autres acides perfluoroalkyliques (APFA; c.-à-d. les composés à chaîne plus courte tels que l'acide perfluorobutanoïque et le sulfonate de perfluorobutane). Il est probable que ces autres APFA soient aussi présents sur des sites affectés par des mousses AFFF et sont généralement plus mobiles. Par conséquent, ils peuvent servir de signe avant-coureur d'une contamination de la source d'eau souterraine par l'APFO et le SPFO. Les services publics devraient savoir que l'ozone ou d'autres processus d'oxydation avancée peuvent oxyder les produits chimiques polyfluorés précurseurs qui se trouvent dans l'eau brute, ce qui pourrait augmenter la concentration de SPFO dans l'eau traitée.
Partie II. Science et considérations techniques
4.0 Propriétés, utilisation et sources dans l'environnement
Le sulfonate de perfluorooctane (SPFO) est un composé anthropique avec une longueur de chaîne de huit carbones perfluorés. Le SPFO, ses sels et ses précurseurs font partie d'une plus grande classe chimique de composés fluorés habituellement appelés acides perfluoroalkyliques (APFA). Le SPFO peut survenir sous plusieurs formes, y compris l'acide (C8HF17SO3; 500,03 g/mol; numéro de registre CAS 1763-23-1), le sel de potassium (K+SPFO; 538,23 g/mol; numéro de registre CAS 2795-39-3), le sel d'ammonium (NH4+ SPFO; numéro de registre CAS 29081-56-9), le sel de diéthanolamine (C8F17SO3NH; numéro de registre CAS 70225148), et le sel de lithium (Li+SPFO; 29457-72-5). Les synonymes principaux du SPFO sont 1-acide perfluorooctanesulfonique, acide heptadécafluoro-1-octanesulfonique, acide heptadécafluorooctane-1-sulfonique, sulfonate de perfluorooctane, acide sulfonique perfluorooctyle et acide 1-octanesulfonique (ATSDR, 2009).
Le SPFO est soluble dans l'eau; on a signalé des valeurs de solubilité à 570 mg/L et à 519 mg/L (à 20°C) dans l'eau pure (OCDE, 2002; Brooke et coll., 2004) et à 370 mg/L dans l'eau douce (OCDE, 2002). La solubilité diminue lorsque la teneur en sel dans l'eau augmente (OCDE, 2002). La solubilité est fonction de la constante de dissociation acide (pKa) de la forme acide; la valeur pKa du SPFO a été estimée à -3,27 (aucune mesure directe du pKa n'a été relevée). On considère que le SPFO est un acide fort, ce qui suggère que la répartition dans l'environnement du SPFO sera dominée par la forme anionique (Brooke et coll., 2004).
Le SPFO contient les groupes fonctionnels hydrophobes et hydrophiles; on s'attend donc à ce qu'il ait un comportement différent des produits chimiques hydrophobes classiques. En raison de ses propriétés tensioactives, le coefficient de partage octanol:eau (logKoe) ne peut pas être déterminé directement car plusieurs couches se forment dans l'octanol/eau. De plus, les paramètres habituellement estimés à partir du Koe (p. ex., Koc, Kd, facteur de bioconcentration) ne peuvent pas être calculés au moyen de cette méthode (OCDE, 2002), ni au moyen de modèles de relations quantitatives structure-activité (RQSA) classiques (Beach et coll., 2006).
Le SPFO est essentiellement non volatil; sa pression de vapeur est de 3,27 × 10-9 atm à 20 °C (OCDE, 2002; Brooke et coll., 2004; ATSDR, 2009). Sa constante de loi de Henry est estimée à environ 3,1 × 10-9 atm-m3/mol. Les tentatives de mesure du coefficient de partage air-eau au moyen du sel de potassium ne révèlent aucune volatilisation mesurable; le coefficient de partage air-eau a donc été considéré comme étant de < 2 × 10-6, et d'être essentiellement de zéro (OCDE, 2002; Brooke et coll., 2004). Néanmoins, certaines des substances contenant du SPFO ont une pression de vapeur considérablement plus élevée et sont plus susceptibles d'être volatiles dans une certaine mesure. Cela peut permettre un transport plus large de précurseurs possibles du SPFO par l'air qu'il serait possible pour le SPFO même (Brooke et coll., 2004).
Le SPFO était principalement utilisé pour rendre hydrofuges, antisalissantes ou imperméables aux graisses des surfaces et des applications en papier – comme les moquettes et les tapis, les tissus et le rembourrage. Le SPFO était également utilisé pour des applications chimiques spécialisées, notamment les mousses extinctrices, les fluides hydrauliques, les détachants pour tapis, les surfactants de l'exploitation minière et des puits de pétrole, et d'autres formulations chimiques spécialisées (OCDE, 2002; Santé Canada, 2006). Le SPFO a été produit aux États-Unis jusqu'en 2002, lorsque la 3M Company a éliminé progressivement sa production (ATSDR, 2009). Malgré qu'il n'y ait pas de fabricants canadiens connus d'APFA, y compris le SPFO, presque 600 000 kg d'APFA ont été importés au Canada entre 1997 et 2000 (le SPFO représentait une très petite partie de ce total) (Santé Canada, 2006). En 2009, le SPFO et ses sels ont été ajoutés à la liste canadienne de quasi-élimination compilée en vertu du paragraphe 65(2) de la LCPE (1999), conformément aux exigences du paragraphe 3(1) de la Loi (DORS/2009-15) (Gouvernement du Canada, 2009). Les règlements du Canada interdisent la fabrication, l'importation, la vente, la mise en vente et l'utilisation du SPFO ou des produits qui en contiennent, à moins que la substance y soit présente fortuitement. Il existe certaines exemptions pour des fluides hydrauliques utilisés dans le domaine de l'aviation sous certaines conditions, et certains produits utilisés dans le cadre de procédés photographiques ou photolithographiques (Gouvernement du Canada, 2008).
4.1 Sources dans l'eau
Une source d'APFA dans l'eau est le rejet de mousses à formation de pellicule aqueuse (AFFF) pour l'extinction des incendies. On a supposé que le rejet de ces mousses avait provoqué des concentrations accrues de SPFO dans l'eau à proximité de l'aéroport international de Toronto, d'après les tendances spatiales et temporelles d'APFA dans l'eau (Awad et coll., 2011). Toutefois, depuis 2013, la plupart des utilisations de mousses à formation de pellicule aqueuse contenant du SPFO à des concentrations supérieures à 0,5 ppm ont été interdites (Gouvernement du Canada, 2008). Des données à l'appui de la possibilité de contamination dans les environs des zones de formation des pompiers comprennent des mesures de concentrations élevées de SPFO dans l'eau souterraine près d'une base aérienne du Michigan (Moody et coll., 2003), à un terrain d'entraînement des pompiers en Australie (Baduel et coll., 2015), et dans des puits d'eau potable privés près d'un site industriel à Cologne, en Allemagne (Weiß et coll., 2012).
Des concentrations élevées de SPFO mesurées dans l'eau de surface en aval des fabriques de composés fluorés ont également été utilisées comme des indications du potentiel de sources industrielles de SPFO dans l'eau (Hansen et coll., 2002).
Des études du bilan massique des APFA à des usines de traitement des eaux usées rapportent couramment des concentrations semblables ou plus élevées de SPFO dans l'effluent par rapport aux affluents bruts, ce qui suggère que la dégradation d'autres composés organiques fluorés (p. ex. fluoropolymères) en SPFO peut se produire pendant le traitement des eaux usées (Clarke et Smith, 2011). Cela indique également que les usines de traitement des eaux usées conventionnelles ne réussissent pas à éliminer efficacement les APFA (Ahrens, 2011).
Malgré que des mesures soient en place en Amérique du Nord et en Europe pour limiter la production ou l'utilisation du SPFO, ainsi que les risques d'exposition importante à cette substance, l'utilisation omniprésente des APFA dans l'environnement bâti cause encore son transfert aux biosolides (boues) (Clarke et Smith, 2011). L'utilisation de biosolides en tant qu'engrais peut donc représenter une source de contamination des sols et de l'eau par SPFO (Clarke et Smith, 2011). La contamination de l'eau potable a été signalée après l'utilisation répandue de conditionneur de sol mélangé à des déchets industriels contenant des APFA (p. ex. 8 600 ng de SPFO/g p.s.) dans la ville d'Arnsberg, dans la région de la Rhénanie du NordWestphalie, en Allemagne (Hölzer et coll., 2008). On a également détecté du SPFO dans l'eau de surface et l'eau de puits à Decatur, en Alabama, après que des biosolides d'une usine municipale de traitement des eaux usées (à laquelle des déchets d'installations locales de composés fluorés étaient reçus) ont été épandus sur les sols agricoles (Lindstrom et coll., 2011).
4.2 Devenir dans l'environnement
L'hydrosolubilité élevée du SPFO et la volatilité négligeable de ses espèces ionisées laissent croire que les espèces chimiques du SPFO se logeront principalement dans le milieu aquatique.Le SPFO est un acide fort et il est plus que probable qu'il forme des liaisons solides dans le sol, les sédiments et les boues par mécanisme de chimisorption (3M Company, 2001; Brooke et coll., 2004; Beach et coll., 2006), avec une plus grande adsorption dans des conditions anaérobies que dans des conditions aérobies (Beach et coll., 2006). Le SPFO ne se répartit pas dans les lipides mais se lie plutôt à certaines protéines chez les animaux (Beach et coll., 2006). Le SPFO se bioaccumule dans les tissus des organismes vivants aquatiques et terrestres, y compris les humains. Les données pour le réseau trophique marin de l'est de l'Arctique canadien (de 1996 à 2002) indiquent que le SPFO subit une bioamplification dans l'ensemble du réseau trophique et a un facteur d'amplification trophique de 3,1 (Butt et coll., 2010).
Dans des conditions environnementales, le SPFO ne subit pas d'hydrolyse, de photolyse ou de biodégradation, et est considéré comme étant extrêmement persistant dans l'environnement (OCDE, 2002; Beach et coll., 2006; Santé Canada, 2011a). Les demi-vies estimées pour le SPFO (sous forme du sel de potassium) sont de > 41 ans dans l'eau (ATSDR, 2009) et de 114 jours dans l'atmosphère (Brooke et coll., 2004); la demi-vie indirecte du SPFO a été estimée (au moyen d'un modèle de photo-initiateur d'oxyde de fer) à ≥ 3,7 ans (OCDE, 2002; Beach et coll., 2006). Aucune étude n'a réussi à démontrer la biodégradation du SPFO dans des conditions aérobies ou anaérobies (Beach et coll., 2006), et le SPFO est considéré comme étant résistant à la dégradation microbienne (Santé Canada, 2006). De plus, la dégradation abiotique de certaines molécules de précurseurs du SPFO peut mener au SPFO sous forme du produit métabolite de stade final (Martin et coll., 2010). Les taux d'hydrolyse (variant de quelques jours à quelques semaines) pour les précurseurs du SPFO sont fournis dans les études de la 3M Company (Mendel, 1977; 3M Company, 1996; Hatfield, 1999).
5.0 Exposition
Les Canadiens peuvent être exposés aux composés perfluorés par leur présence dans les aliments, les produits de consommation, la poussière et l'eau potable. Les sources importantes d'APFA devraient être les aliments et les produits de consommation, y compris les tapis traités par solution et les vêtements traités (Tittlemier et coll., 2007); toutefois, la proportion d'exposition provenant de l'eau potable peut être plus élevée chez les personnes vivant dans des régions où l'eau potable est contaminée.
D'après les rapports, la dose journalière totale estimée pour les APFA (estimations non fournies pour les APFA individuels) chez les Canadiens était de 410 ng/jour pour la population générale du Canada (Tittlemier et coll., 2007). L'ingestion d'eau potable contribuait seulement une petite quantité de l'exposition estimée globale (estimée à 0,3 ng/jour). Des données d'exposition sont disponibles, mais elles sont considérées comme étant insuffisantes pour justifier la modification du facteur d'attribution par défaut pour l'eau potable de 20 %. Vingt pour cent est le facteur d'attribution par défaut relatif à l'eau potable utilisé comme valeur seuil lorsque l'eau potable n'est pas une source d'exposition importante (Krishnan et Carrier, 2013); par conséquent, cette valeur s'applique au SPFO, même s'il est attendu que l'eau ne contribuera pas de manière significative à l'exposition au SPFO pour la population générale.
5.1 Eau
Le SPFO ne fait pas régulièrement l'objet de contrôle dans les usines de traitement de l'eau potable au Canada, mais l'analyse a été effectuée à quelques emplacements. Le SPFO n'a pas été détecté (limite de détection de la méthode [LDM]= 0,85 ng/L) dans l'eau brute ou traitée dans des échantillons obtenus en 2012 auprès de deux usines de traitement de l'eau potable à Calgary (Alberta Environment and Water, 2013). Au Québec, des échantillons d'eau brute ou traitée ont été obtenus mensuellement entre avril 2007 et mars 2008 à partir de sept sites (un total de 84 échantillons chacun d'eau brute et d'eau traitée). Le SPFO a été détecté dans 52 % des échantillons traités (LDM de 0,3 à 0,6 ng/L), à une valeur médiane de 1,0 ng/L. Le taux de détection et les concentrations médianes étaient plus élevés dans l'eau traitée que dans l'eau brute, pour laquelle le taux de détection et la valeur médiane étaient de 40 % et de < 1 ng/L, respectivement (Ministère du Développement durable, de l'Environnement, de la Faune et des Parcs, 2012). La concentration de SPFO signalée dans cinq échantillons d'eau du robinet à Niagara-on-the-Lake, en Ontario était de 3,3 ng/L (Mak et coll., 2009).
Dans le cadre d'une enquête nationale de nouveaux contaminants dans l'eau potable (y compris le SPFO) menée par Santé Canada, l'eau traitée et l'eau brute ont fait l'objet de surveillance pendant l'hiver et l'été à 35 endroits en 2009 et à 30 endroits en 2010. Pendant les quatre périodes d'échantillonnage, seul un échantillon contenait du SPFO à une concentration supérieure à la limite de détection de la méthode de 0,077 ng/L; la concentration de SPFO dans cet échantillon était de 0,082 ng/L, et l'échantillon a été obtenu à l'hiver 2009 (Santé Canada, 2013a).
5.2 Aliments
Les aliments sont généralement considérés comme étant la source principale d'exposition au SPFO pour la majorité de la population canadienne, mais l'exposition par les aliments est encore bien inférieure à ce qui est considéré comme étant dangereux pour les humains. On a mesuré le SPFO dans une sélection d'échantillons d'aliments composites canadiens (échantillons provenant de l'Étude sur l'alimentation totale (EAT) canadienne menée en 2004 et échantillons supplémentaires recueillis entre 1992 et 2001) pour estimer l'absorption par l'alimentation (Tittlemier et coll., 2007). Le SPFO a été détecté dans sept aliments composites sur 54 (limite de détection moyenne : 0,5 ng/g). Les concentrations quantifiées variaient de 2,0 à 2,7 ng/g poids humide (p.h.) (dans les poissons marins et les poissons d'eau douce, le bœuf haché et le bifteck). Des concentrations inférieures à la limite de quantification (LQ) ont été signalées pour le maïs à éclater au micro-ondes, les viandes à sandwich et les viandes froides, ainsi que les poissons d'eau douce. Les valeurs ont été utilisées pour estimer l'exposition alimentaire quotidienne moyenne des Canadiens; il a été estimé que les aliments contribuaient 250 ng/jour de composés perfluorés, dont environ 110 ng étaient attribués au SPFO (Tittlemier et coll., 2007).
Des aliments procurés au magasin et au restaurant couramment consommés par les Canadiens ont été recueillis à Whitehorse (territoire du Yukon, au Canada) en 1998, et analysés pour détecter la présence d'APFA (Ostertag et coll., 2009a). Le SPFO a été détecté dans seulement deux échantillons (fromage régulier et fromage fondu) et était quantifiable dans un échantillon (fromage fondu : 1,14 ng/g p.h.; Ostertag et coll., 2009a).
L'écosystème marin de l'est de l'Arctique canadien représente une source de nourriture pour la population locale. Dans cette région, on a indiqué que les concentrations de SPFO (en poids humide) variaient de 0,28 à 1,8 ng/g p.h. dans le zooplancton et les invertébrés, de 1,3 à 1,4 ng/g p.h. dans le poisson, et de 2,4 à 122 ng/g dans les mammifères marins (baleines et pinnipèdes) (Butt et coll., 2010). Les concentrations d'APFA dans les aliments traditionnels des Inuits dans le Nord du Canada ont été mesurées afin d'estimer leur exposition alimentaire (Ostertag et coll., 2009b). Le SPFO a été détecté dans 39 % des 68 échantillons alimentaires traditionnels recueillis à Chesterfield Inlet, à Igloolik, à Pond Inlet et à Qiqiktarjuak au Nunavut, entre 1997 et 1999. Le SPFO a été détecté dans des aliments d'origine marine (de 0,1 à 7,6 ng/g chez le phoque annelé, l'ours polaire [viande], le béluga, le narval, le phoque barbu, le morse, l'eider et le canard noir, ou le touladi) et les aliments d'origine terrestre (5,0 ng/g dans le foie de caribou cuit au four, et de 0,1 à 0,2 ng/g dans la moelle osseuse, le cœur, le sang, les reins, l'estomac, la langue ou la viande de caribou). Les concentrations de SPFO dans les autres échantillons (omble chevalier, algues, myes, lagopèdes, lièvre arctique, oie des neiges, baies) étaient inférieures à la limite de détection (˂ 0,1 à ˂ 0,5 ng/g) (Ostertag et coll., 2009b).
Une étude australienne a quantifié les APFA dans les emballages d'aliments et le ruban scellant de polytétrafluoréthylène (PEFT). Le SPFO n'a pas été détecté dans aucun de ces échantillons, y compris dans les sacs de maïs à éclater au micro-ondes (Dolman et Pelzing, 2011).
5.3 Air
Dans le cadre d'une évaluation conçue pour estimer l'absorption quotidienne totale de composés perfluorés chez les Canadiens, l'absorption par inhalation du SPFO était considérée comme étant négligeable en raison de sa faible volatilité (Tittlemier et coll., 2007).
Les concentrations d'APFA dans l'air extérieur ont été déterminées dans une étude canadienne menée en 2007 à Vancouver (Shoeib et coll., 2011). Les échantillons de SPFO ont été prélevés au moyen d'échantillonneurs passifs extérieurs mis en place dans des cours résidentielles pendant environ trois mois. Les concentrations de SPFO étaient inférieures à la limite de détection (< 0,02 pg/m3) dans tous les échantillons (n = 6) (Shoeib et coll., 2011). Dans une autre étude, le SPFO a été détecté dans quatre échantillons d'air sur huit (phase particulaire) prélevés au-dessus du lac Ontario, à des concentrations variant entre 2,5 et 8,1 pg/m3 (le SPFO est demeuré indétectable dans les échantillons de la phase gazeuse) (Boulanger et coll., 2005). On a également détecté du SPFO dans l'Arctique Canadien (Resolute Bay, au Nunavut), à une concentration moyenne de 5,9 pg/m3 dans les phases gazeuse et particulaire de l'air atmosphérique (échantillons prélevés en 2004) (Fromme et coll., 2009; Butt et coll., 2010).
Dans l'air intérieur, les concentrations de SPFO dépendent en grande partie des concentrations de SPFO dans les particules d'air; elles sont donc liées aux concentrations de SPFO dans la poussière intérieure, et fonction du nombre, du type et de l'âge des sources possibles (p. ex. tapis, meubles et peinture) (Fraser et coll., 2012). Jusqu'à maintenant, les données sur les concentrations de SPFO dans l'air intérieur sont restreintes à celles déclarées dans l'étude résidentielle susmentionnée (Shoeib et coll., 2011). Les auteurs ont recueilli le SPFO dans l'air intérieur au moyen d'échantillonneurs passifs mis en place pendant environ quatre semaines dans les chambres à coucher de 59 participants. Les concentrations de SPFO (disponibles pour 39 maisons) étaient inférieures à la limite de détection (< 0,02 pg/m3) dans tous les échantillons (Shoeib et coll., 2011).
5.4 Produits de consommation
En raison de l'utilisation des produits contenant du SPFO, l'exposition humaine au SPFO découlerait probablement du contact avec certains produits de consommation, ou de leur utilisation (Santé Canada, 2006). Les estimations de la contribution de tapis traités par solution et des vêtements traités aux absorptions quotidiennes canadiennes de composés perfluorés étaient de 120 ng/jour et de 12 ng/jour, respectivement (Tittlemier et coll., 2007). On a mesuré le SPFO dans différents produits de consommation, y compris la peinture, les plaquettes de circuits imprimés, les tapis, le cuir, les batteries de cuisine antiadhésives et les mousses extinctrices à formation de pellicule aqueuse (Herzke et coll., 2012).
5.5 Sol et poussières
La contribution estimée de la poussière aux absorptions quotidiennes canadiennes de composés perfluorés était de 28 ng/jour (Tittlemier et coll., 2007). L'étude n'a pas estimé la contribution quotidienne totale du sol à l'exposition aux composés perfluorés.
Les concentrations de SPFO dans la poussière de 67 résidences à Ottawa se situaient entre < 4,6 et 5,065 ng/g, avec une valeur médiane de 38 ng/g et une valeur moyenne de 444 ng/g (Kubwabo et coll., 2005). On a constaté une forte corrélation entre l'âge de la résidence et la partie recouverte du plancher et la concentration d'APFA dans la poussière – les maisons plus anciennes et celles où seulement une petite superficie du plancher était recouverte par du tapis étaient caractérisées par des plus faibles concentrations d'APFA (Kubwabo et coll., 2005). Dans le cadre d'une autre étude canadienne menée dans la ville de Vancouver, on a détecté du SPFO dans tous les échantillons de poussière domestique analysés pour ce composé (n = 132). Les concentrations de SPFO variaient de 1,5 à 4,661 ng/g (médiane : 71 ng/g; moyenne : 280 ng/g) (Shoeib et coll., 2011).
Aucune étude rapportant des concentrations de fond de SPFO dans les sols n'a été relevée. Quelques données sont disponibles pour les sols à proximité d'installations industrielles de produits chimiques perfluorés (selon l'examen de l'ATSDR, 2009).
5.6 Données de biosurveillance des êtres humains
Le cycle 1 (de 2007 à 2009) de l'Enquête canadienne sur les mesures de la santé (ECMS) indique que les concentrations de SPFO dans le plasma des mâles adultes (moyenne géométrique [MG] : 11,13 ng/mL; IC à 95 % : de 10,03 à 12,36, 95e centile : 31,31 ng/mL, n = 1 376) sont plus élevées que celles des femelles adultes (MG : 7,07 ng/mL; IC à 95 % : 6,30 à 7,93; 95e centile : 20,05 ng/mL, n = 1 504) (Santé Canada, 2010). Cet effet a persisté pendant le deuxième cycle de l'étude (de 2009 à 2011), pendant lequel on a observé un déclin des concentrations dans le plasma, par rapport au premier cycle (hommes — MG : 8,3 ng/mL, IC à 95 % : de 7,4 à 9,3, 95e centile : 19 ng/mL, n = 511; femmes — MG : 5,7 ng/mL, IC à 95 % : de 4,9 à 6,6; 95e centile : 19 ng/mL, n = 506) (Santé Canada, 2013b).
Le SPFO était détectable dans tous les échantillons de sérum (n = 86) prélevés entre 2006 et 2008 dans une étude d'enfants inuits qui fréquentaient des garderies au Nunavik (Turgeon O'Brien et coll., 2012). La moyenne géométrique de SPFO dans le sérum était de 3,369 ng/mL, avec des valeurs variant de 0,93 à 31 ng/mL. Une étude distincte de 621 adultes inuits de Nunavik a rapporté des concentrations sériques de SPFO variant de 0,480 à 470 ng/mL (MG : 18,28 ng/mL; IC à 95 % : 17,19 à 19,44 ng/mL) (Dallaire et coll., 2009). D'autres études canadiennes ont signalé des concentrations semblables de SPFO dans le sérum, c'est-à-dire entre 3,7 et 63,1 ng/mL (Tittlemier et coll., 2004; Kubwabo et coll., 2004). Des résultats semblables ont été obtenus ailleurs – la fourchette globale de concentrations moyennes de SPFO (chez les mâles et les femelles) se situait entre 1,7 et 73,2 ng/mL dans les échantillons de sérum prélevés dans 10 pays (Kannan et coll., 2004). Les concentrations moyennes de SPFO dans le sérum ou le plasma humain relevées dans des échantillons prélevés à l'échelle mondiale (Amérique, Asie, Australie et Europe) au cours de la période de 1998 à 2007 variaient de 2,1 à 62 ng/mL (Ingelido et coll., 2010). Aux États-Unis, les données de l'enquête National Health and Nutrition Examination Survey (NHANES) pour la période 2007-2008 indiquent une concentration sérique médiane de SPFO de 13,6 ng/mL dans la population générale (≥ 12 ans); une tendance temporelle à la baisse a été observée pour la période de 1999 à 2008 par Kato et ses collègues (2011).
5.7 Exposition multi-voies par l'eau potable
Le processus d'évaluation de l'exposition par des voies multiples ne s'applique pas au SPFO, en raison du poids moléculaire élevé et de la faible volatilité du composé (Krishnan et Carrier, 2008); par conséquent, les contributions relatives de l'exposition au SPFO par inhalation et par voie cutanée pendant les douches et les bains n'ont pas été estimées. D'après le poids moléculaire élevé de 500,03 g/mol et les propriétés ioniques du SPFO à des niveaux de pH habituels dans l'eau potable, on s'attend à ce que la volatilité et la pénétration cutanée soient faibles. De plus, les coefficients de perméabilité dermique estimés dans les études in vitro prévoient que le SPFO soit imperméable à la peau dans des conditions normales (Fasano et coll., 2005; Franko et coll., 2012). Par conséquent, l'exposition au SPFO par inhalation et par voie cutanée pendant les douches ou les bains devrait être négligeable.
6.0 Méthodes d'analyse
Jusqu'à maintenant, l'Environmental Protection Agency des États-Unis (U.S. EPA) n'a pas approuvé de méthodes d'analyse pour le SPFO dans l'eau potable. Il existe des méthodes qui peuvent servir à mesurer le SPFO dans l'eau potable à des concentrations bien inférieures à la CMA proposée. Toutefois, ces méthodes exigent de bonnes procédures de contrôle de la qualité pour obtenir des résultats exacts.
6.1 Méthodes disponibles
La méthode 537, version 1.1. de l'U.S. EPA, la méthode 25101 de l'Organisation internationale de normalisation (ISO, 2009), et la méthode ETS-8-154.3 de la 3M Company (3M Company, 2008) peuvent toutes être utilisées pour analyser le SPFO dans l'eau potable (3M Company, 2008; ISO, 2009; U.S. EPA, 2009). Toutes les méthodes utilisent une technique d'extraction en phase solide (EPS), suivie par une chromatographie liquide (CL) associée à une spectrométrie de masse en tandem (SM/SM) à ionisation par électronébulisation (ESI) exploitée en mode d'ionisation négative. Aux fins de quantification trace de SPFO dans l'eau potable, les conditions chromatographiques sont sélectionnées de sorte que tous les isomères (linéaires et ramifiés) soient co-élués ensemble.
Dans la méthode de l'U.S. EPA, un échantillon d'eau est enrichi au moyen d'étalons internes marqués et passé dans une cartouche d'extraction en phase solide pour extraire les analytes cibles en plus de leurs étalons internes correspondants. Les composés sont élués de la cartouche d'EPS, concentrés puis injectés dans un système CL-SM/SM. La masse spectrométrique et les temps de rétention des analytes sont déterminés en comparaison aux normes internes. La limite de détection de la méthode (LDM) du SPFO est de 1,4 ng/L (0,0014 µg/L) et la plus faible concentration du seuil minimal de niveau à rapporter est de 6,5 ng/L (0,0065 µg/L) (U.S. EPA, 2009a). Le SPFO a été inclus dans la troisième règle de surveillance des contaminants non réglementés (UCMR3), qui stipule que lors de l'utilisation de la version 1.1 de la méthode 537, le seuil minimal de niveau à rapporter de 40 ng/L (0,04 µg/L) pour le SPFO doit être atteint et déclaré par les services publics pendant la surveillance (U.S. EPA, 2012b).
Les résultats d'un essai interlaboratoires (Taniyasu et coll., 2013), mené en 2006, ont été utilisés pour établir si la méthode 25101 de l'ISO était fiable pour l'analyse du SPFO et de l'APFO dans les échantillons d'eau prélevés dans l'environnement, y compris dans l'eau potable. Les précisions intra-laboratoires et inter-laboratoires se situaient entre 3 et 4 % et entre 16 et 27 % respectivement pour le SPFO dans les échantillons d'eaux naturelles analysés. La récupération des étalons internes pour le SPFO variait de 90 à 96 %. Ces résultats ont confirmé que cette méthode d'analyse est fiable et peut être utilisée pour l'analyse
du SPFO dans les échantillons d'eaux naturelles. La méthode utilise une technique d'EPS avec CL-SM/SM, et s'applique pour la quantification des isomères linéaires et ramifiés du SPFO et de l'APFO. Les isomères ramifiés peuvent être séparés des isomères linéaires au moyen d'une colonne chromatographique précise dans des conditions optimisées. La méthode 25101 ISO s'est avérée convenable pour déterminer les concentrations de SPFO dans les échantillons non filtrés d'eau potable, d'eau souterraine et d'eau de surface avec des concentrations entre 2 et 10 000 ng/L (entre 0,002 et 10 µg/L) (ISO, 2009).
La méthode (ETS8-154.3) a été élaborée et validée par la 3M Company pour l'analyse du SPFO dans les échantillons d'eau potable, d'eau souterraine et d'eau de surface. Les étapes d'analyse sont semblables à celle de la version 1.1 de la méthode 537 de l'Environmental Protection Agency. La limite de quantification de la méthode est de 25 ng/L (0,025 µg/L) pour le SPFO (3M Company, 2008).
6.2 Défis de l'analyse
En dépit du fait que des améliorations importantes ont été apportées aux méthodes d'analyse pour la détection de substances perfluoroalkyliques dans les échantillons d'eaux naturelles, il reste encore des défis, des incertitudes et des inconvénients. Les défis importants associés à la quantification trace de substances perfluoroalkyliques comprenaient les effets de la matrice et une contamination de fonds dans les échantillons-témoins soumis aux analyses. Afin de produire des données exactes, des procédures de contrôle de la qualité (CQ) (matrices enrichies, échantillons répétés, essais de récupération avec échantillons enrichis, vérifications de la récupération des analogues) sont essentielles. De plus, l'utilisation d'étalons internes marqués avec des isotopes est une pratique normalisée qui doit être utilisée pour l'analyse des substances perfluoroalkyliques.
6.2.1 Les effets de matrice
La méthode CL-SM/SM est une technique très sélective et précise, mais qui est sensible aux effets de matrice, une des incertitudes importantes dans la quantification trace du SPFO dans les échantillons d'eau prélevés dans l'environnement (Martin et coll., 2004; Yamashita et coll., 2004; Taniyasu et coll., 2005; van Leeuwen et coll., 2006; Arsenault et coll., 2008). Les effets de matrice découlent des composantes coextraites de l'échantillon, qui influencent l'intensité du signal de l'analyte cible et réprime ou augmente le signal spectral. L'ampleur des interférences de matrice varie, selon la nature des échantillons. bien que les interférences de matrice soient négligeables pour l'eau potable et l'eau souterraine (ISO, 2009), la quantification du SPFO nécessite une extraction et des procédures de nettoyage efficaces. L'objectif de ces procédures est de séparer les composés dans l'échantillon selon leurs propriétés physiques et chimiques, de concentrer l'analyte cible et de purifier l'extrait avant la détermination instrumentale. La technique la plus souvent utilisée pour extraire les substances perfluoroalkyliques des échantillons d'eau potable comprend les cartouches d'extraction en phase solide avec différents matériaux d'emballage, comme une cartouche d'extraction en phase inversée (C18) (Loewen et coll., 2005; Wolf et Reagen, 2011; Zainuddin et coll., 2012), des cartouches hydrophobes/polaires mixtes (Oasis HLB) (Yamashita et coll., 2004; Taniyasu et coll., 2005; Villaverde-de-Saa et coll., 2015) et des cartouches à faible échange d'anions (Taniyasy et coll., 2005; 2013). Plusieurs études ont eu recours à une technique d'extraction liquide-liquide (ELL) pour extraire et concentrer les substances perfluoroalkyliques dans différentes matrices aqueuses dans l'environnement avant d'utiliser la méthode CL-SM/SM (Gonzales-Barreiro et coll., 2006; Szostek et coll., 2006; Backe et coll., 2013). Une étude en laboratoire (Gonzales-Barreiro et coll., 2006) a eu recours à l'extraction liquide-liquide (ELL) pour extraire sept substances perfluoroalkyliques (de C6 à C12) de l'eau du robinet. La récupération des substances perfluoroalkyliques avec une chaîne carbonée supérieure à C7 se trouvait dans la fourchette de 80 à 93 %. Les auteurs ont indiqué que la méthode était moins efficace pour extraire les substances perfluoroalkyliques à chaînes courtes par rapport à la technique d'extraction en phase solide (Gonzales-Barreiro et coll., 2006).
Les procédures de nettoyage comprenaient une étape de lavage après l'enrichissement de l'échantillon sur la cartouche d'EPS et une étape de filtration pour retirer les solides de l'extrait final (Yamashita et coll., 2004; Larsen et Kaiser, 2007; van Leeuwen et Boer, 2007). Il faut prendre soin d'éviter la contamination de l'extrait ou les pertes de substances perfluoroalkyliques pendant les périodes de nettoyage. Avant l'EPS, un pré-traitement (filtration) de l'échantillon peut être nécessaire pour faciliter l'extraction ou retirer de la matrice un composant qui pourrait nuire aux analyses (van Leeuwen et Boer, 2007; Ding et coll., 2012).
L'approche qui convient le mieux pour aider à la quantification des substances perfluoroalkyliques consiste à utiliser les étalons internes marqués avec des isotopes (dilution isotopique) Il est important que les étalons internes marqués avec des isotopes appropriés soient utilisés pour la quantification du composé à l'état natif correspondant. Les étalons internes marqués avec des isotopes auront le même temps de rétention que les analytes cibles (à l'exception de la séparation isomérique) et la surveillance de leurs signaux déterminera si le signal des analytes est réprimé ou augmenté. L'application des substances de remplacement ou des étalons internes marqués avec des isotopes tôt dans les étapes d'échantillonnage ou de préparation des échantillons compensera les inefficacités ou les pertes dans l'étape d'extraction et les autres étapes de préparation d'échantillon (Martin et coll., 2004; Villagrassa et coll., 2006; Larsen et Kaiser, 2007). Wolf et Reagen (2011) ont indiqué que l'ajout d'étalons internes marqués avec des isotopes avant le prélèvement des échantillons simplifiait les procédures de préparation des échantillons. Cette méthode s'est révélée exacte à 109 % et précise à 10 % en ce qui concerne le SPFO, selon les échantillons d'eau Milli-Q analysés en laboratoire (Wolf et Reagen, 2012). Si des étalons internes marqués avec des isotopes ne sont pas disponibles, la quantification d'additions connues, qui consiste entre autres à ajouter des quantités connues d'un étalon dans l'échantillon, est une solution de rechange qui peut être utilisée lorsque les effets de matrice sont inévitables (Weremiuk et coll., 2006; Furdui et coll., 2007; van Leeuwen et coll., 2009).
L'utilisation de la méthode SM/SM pour l'analyse du SPFO permet la détection d'ions produits (éléments de filiation). Alors que la transition m/z 80 (ion produit SO3-) est l'ion produit le plus abondant utilisé pour la détermination du SPFO, la transition m/z 99 (ion produit FSO3-) est également utilisée pour l'identification de SPFO (ISO, 2009; U.S. EPA, 2009a).
6.2.2 La contamination de fond des blancs analytiques
Une source connue de contamination de fonds est la présence de fluoropolymères, comme le polytétrafluoréthylène (PEFT) et les composés de perfluoroalkoxy dans différents consommables de laboratoire. Le perfluorooctanoate d'ammonium et le perfluorononanoate d'ammonium sont utilisés comme des agents technologiques des fluoropolymères et sont des composants communs dans les produits de laboratoire. Ces fluoropolymères peuvent mener à des concentrations de fond quantifiables dans les échantillons-témoins, surtout pendant la quantification des quantités traces dans les échantillons d'eau. Il faut éviter les contacts avec ces produits et ce matériel de laboratoire pendant l'analyse du SPFO (Martin et coll., 2004; Yamashita et coll., 2004; ISO, 2009).
Yamashita et coll. (2004) ont étudié les sources de contamination de fonds à différentes étapes d'analyse, y compris le prélèvement d'échantillons, l'extraction et le nettoyage d'échantillons avant l'analyse instrumentale. Il a été observé que les bouteilles en polypropylène utilisées pour le prélèvement et l'entreposage d'échantillons, ainsi que les différents types de cartouches d'extraction en phase solide et d'eau purifiée contenant des agents réactifs, étaient des sources de contamination des substances perfluoroalkyliques dans les échantillons-témoins soumis aux analyses. Taniyasu et coll. (2005) ainsi que Berger et coll. (2011) ont trouvé que les contenants en polypropylène ne convenaient pas à la collecte et à l'entreposage d'échantillons d'eau qui seront utilisés aux fins d'analyse des acides perfluorocarboxyliques (APFC) à chaîne longue, comme les acides perfluorononanoïque et perfluorododécanoïque, en raison de l'adsorption des composés sur la surface des contenants. Les auteurs ont recommandé l'utilisation de contenants en polyéthylène haute densité ou en verre. Toutefois, selon la méthode 25101 de l'ISO et la méthode 537 de l'Environmental Protection Agency, il est recommandé de ne pas utiliser de verre pour l'échantillonnage en raison de l'adsorption possible du SPFO sur les parois (ISO, 2009; U.S. EPA, 2009a). Les étapes d'entreposage et de préservation de l'échantillon avant l'analyse instrumentale devraient prévenir les changements dans la composition de la matrice d'échantillons et la concentration de l'analyte (van Leeuwen et coll., 2007).
Les cartouches d'EPS peuvent également être une source de contamination et l'Environmental Protection Agency des États-Unis (2009a) recommande que les dispositifs d'EPS soient vérifiés avant l'analyse afin de garantir qu'il n'y a pas contamination de l'échantillon. Différentes études ont été menées sur l'injection directe des échantillons d'eau dans un système CL-SM/SM. La méthode évite l'utilisation de matériel supplémentaire et les processus de préparation des échantillons, ce qui peut limiter la contamination possible et les pertes du composé cible (Schultz et coll., 2006; Furdui et coll., 2008; Dickenson et Higgins, 2013).
Les tubes de la CHLP, les filtres en nylon, les bouchons de fioles en Teflon ou fluoropolymères Viton, les sceaux des soupapes et les dégazeurs ont été relevés comme des sources possibles de contamination des échantillons-témoins instrumentaux en ce qui concerne l'APFO (Yamashita et coll., 2004; Taniyasu et coll., 2005; Schultz et coll., 2006; Larsen et Kaiser, 2007) et dans une moindre mesure, le SPFO (Yamashita et coll., 2004). La contamination de fond instrumentale peut être réduite en remplaçant ou en évitant les parties en fluoropolymère, comme un dégazeur (Arbuckle et coll., 2013) avec dégazage hors ligne des phases mobiles; en remplaçant les composants en fluoropolymère par des composants en acier inoxydable, et en utilisant des tubes en poly(étheréthercétone) (PEEK), en installant une colonne de protection en amont, en lavant de façon complète le système CL, ou en réduisant la durée d'équilibration de la colonne CL (Martin et coll., 2004; Yamashita et coll., 2004; Villagrassa et coll., 2006; Larsen et Kaiser, 2007; Nakayama et coll., 2007; Shoemaker et coll., 2009; Arbuckle et coll., 2013).
6.3 Performance analytique
La méthode d'analyse privilégiée pour la détection de SPFO dans les échantillons d'eaux naturelles, y compris l'eau potable, a recours à l'EPS suivi par la méthode CL-SM/SM avec ionisation par électronébulisation exploitée en mode d'ionisation négative (Martin et coll., 2004; Yamashita et coll., 2004; Villagrassa et coll., 2006; Larsen et coll., 2007; van Leeuwen et Boer, 2007; Furdui et coll., 2008; Hansen et coll., 2010; Sun et coll., 2011; Wolf et Reagen, 2011; Post et coll., 2013; Villaverde-de-Saa, 2015). Des améliorations ont été apportées aux analyses récemment grâce à la disponibilité et à l'utilisation d'étalons de grande qualité et des étalons internes marqués avec des isotopes stables pour compenser les effets de la matrice et les inefficacités de la procédure d'extraction ou des autres étapes de préparation des échantillons (Yamashita et coll., 2004; Lowen et coll., 2005; Taniyasu et coll., 2005; Nakayama et coll., 2007; Zainuddin et coll., 2012; Villaverde-de-Saa et coll., 2015). Il y a actuellement plusieurs étalons de grande qualité analytique disponibles sur le marché, et la liste de ces étalons continue de s'allonger (van Leeuwen et coll., 2009, Berger et coll., 2011).
Au début des années 2000, la quantification des substances perfluoroalkyliques était biaisée par le manque de normes d'analyse appropriées, d'analogues marqués aux isotopes et de matériel de référence, et il y avait une variabilité analytique importante d'un laboratoire à un autre. Deux études interlaboratoires ont été menées pour analyser les substances perfluoroalkyliques, y compris le SPFO et l'APFO, dans les échantillons d'eaux naturelles; ces études ont relevé divers degrés d'exactitude. Dans la première étude (van Leeuwen et coll., 2006), menée en 2004-2005, des facteurs menant à une mauvaise entente entre les laboratoires participants ont été identifiés comme des faibles concentrations (inférieures à 20 ng/L) d'APFO et de SPFO dans les échantillons d'eau, l'utilisation d'étalons ayant un faible degré de pureté, et une contamination de fonds élevée dans les échantillons-témoins soumis aux analyses. L'écart-type relatif (ETR) relevé pour le SPFO dans l'étude était de 95 % (van Leeuwen et coll., 2006). Dans la deuxième étude interlaboratoire, le rendement des laboratoires participants s'est amélioré en raison de la minimisation des effets de la matrice, l'utilisation d'étalons partagés (fournis par une source unique) de plus grande qualité (pureté et composition isomérique), et l'utilisation d'étalons internes avec un marqueur de masse. La valeur de l'écart-type relatif déclaré pour cette étude était de 29 % pour le SPFO.
Les méthodes qui utilisent l'EPS et l'injection directe suivies par un système CL/ESI/SM/SM ont été signalées dans la documentation pour l'identification d'APFA, y compris le SPFO, dans les échantillons d'eau (Yamashita et coll., 2004; 2005; Taniyasu et coll., 2005; 2013; Furdui et coll., 2008; Hansen et coll., 2010; Berryman et coll., 2012; Zainuddin et coll., 2012; Villaverde-de-Saa et coll., 2015). Les détails concernant les procédures de préparation préliminaire des cartouches d'EPS, les éluants, les procédures de nettoyage, les paramètres de quantification SM et les procédures de contrôle de la qualité propres à chaque méthode sont disponibles dans la référence citée.
Une étude a signalé une limite de détection (LD) (rapport signal/bruit = 3:1) de 0,2 ng/L et une limite de quantification (LQ) (rapport signal/bruit = 10:1) de 0,66 ng/L au moyen de l'EPS, et ensuite d'un système CL-SM/SM pour analyser le SPFO dans l'eau de surface. Un échantillon d'eau de 500 mL a été placé dans une cartouche Oasis Wax et une fraction cible a été éluée, puis séchée sous azote gazeux. Les échantillons ont ensuite été filtrés avant l'analyse. La valeur de récupération de 109±4 % pour le SPFO a été calculée par le calibrage des étalons internes marqués avec des isotopes (Sun et coll., 2011; Li et coll., 2011).
Villaverde-de-Saa et coll. (2015), qui a eu recours à l'EPS et ensuite à un système CL-SM/SM, a développé une méthode pour la détermination de sept APFC (de C6 à C12) et de SPFO dans les échantillons d'eaux naturelles. Un échantillon d'eau de 1,0 litre, enrichi avec des étalons internes, a été placé dans une cartouche Oasis HLB. Une limite de détection de 0,04 ng/L et une limite de quantification de 0,12 ng/L pour le SPFO ont été déclarées pour cette méthode (la limite de détection et la limite de quantification ont été calculées comme correspondant à trois fois et à dix fois l'écart-type, respectivement). La valeur de récupération de 99±7 % pour le SPFO a été calculée par le calibrage des étalons internes marqués avec des isotopes.
Furdui et coll. (2008) ont étudié la concentration de substances perfluoroalkyliques dans des échantillons d'eau prélevés dans les Grands Lacs. L'analyse de neuf contaminants cibles, y compris le SPFO, a été effectuée en injectant directement les échantillons dans un système CL-SM/SM. La quantification a été effectuée au moyen de la correction de l'étalon interne et de l'ajout d'un étalon. Les résultats les plus exacts et précis sont obtenus grâce à une dilution isotopique. La méthode avait une limite de quantification (rapport signal/bruit = 10:1) de 0,5 ng/L pour le SPFO (Furdui et coll., 2008).
La province de Québec a déclaré les résultats de contrôles des substances perfluoroalkyliques à 16 emplacements, y compris sept usines de traitement de l'eau potable. Un total de 226 échantillons d'eau (84 échantillons d'eau brute, 84 échantillons d'eau traitée et 58 échantillons d'eau de surface) ont été analysés. Des échantillons d'eau brute et d'eau traitée ont été prélevés mensuellement pendant une période d'un an. L'échantillonnage de l'eau de surface était limité tout au long de l'année. Les échantillons ont été analysés au moyen de cartouches C18 et d'un système CL-SM/SM en mode d'ionisation positive. Les limites de détection signalées variaient de 0,5 à 1,0 ng/L et de 0,3 à 0,6 ng/L pour l'eau non traitée (analyse d'un échantillon de 250 mL) et l'eau traitée (échantillon de 500 mL), respectivement. Afin de compenser et de corriger les variations instrumentales et les effets de la matrice, des étalons internes marqués avec des isotopes ont été ajoutés avant la chromatographie en phase liquide (Berryman et coll., 2012). La technique de photoionisation est moins précise que celle d'ionisation par électronébulisation, mais elle est aussi moins sensible aux effets de la matrice (Martin et coll., 2004).
Berger et coll. (2004) ont comparé différentes techniques de spectrométrie de masse (SM à temps de vol et à résolution élevée, SM en tandem à triple quadripôle, et SM avec piégeage ionique) associées à une chromatographie en phase liquide à haute performance (CPLHP) aux fins d'analyse des substances perfluoroalkyliques, y compris l'APFO. Les paramètres de l'instrument, par exemple la température du vaporisateur, l'énergie de collision, et la fragmentation de la tension du cône, ont été optimisés pour chaque technique de spectrométrie de masse. L'ionisation négative par électronébulisation a été sélectionnée comme mode d'ionisation pour tous les instruments. L'étude a indiqué que les méthodes de SM à temps de vol et à résolution élevée et de SM en tandem à triple quadripôle étaient plus précises que la méthode de SM avec piégeage ionique pour toutes les substances perfluoroalkyliques analysées. La méthode de SM avec piégeage ionique avait une limite de détection plus élevée et une plus petite plage linéaire, mais elle donnait les meilleurs résultats pour l'élucidation structurelle tentative et l'analyse qualitative d'isomères ramifiés de substances perfluoroalkyliques (Berger et coll., 2004; Jahnke et Berger, 2009).
L'analyse des substances perfluoroalkyliques dans les échantillons d'eaux naturelles se fait principalement par une CL associée à un système SM ou SM/SM, mais d'autres techniques, comme la résonance magnétique nucléaire (RMN) 19F et la chromatographie en phase gazeuse (CG) associée à un système SM, ont également été explorées. L'analyse par RMN 19F est une méthode moins sensible et moins précise en raison de la détermination de la présence des groupes caractéristiques CF2 et CF3 dans l'échantillon. La chromatographie en phase gazeuse (CG) peut être utilisée pour détecter les substances perfluoroalkyliques neutres et volatiles ainsi que les alcools fluorotélomériques. Les APFA sont dérivatisés afin de pouvoir faire l'objet de l'analyse par CG. Toutefois, l'utilisation de techniques de dérivatisation est limitée pour l'analyse du SPFO en raison de l'instabilité de ses dérivés (Moody et coll., 2001; Villagrassa et coll., 2006).
7.0 Techniques de traitement
Les données disponibles et les valeurs pKa calculées (-3,27) indiquent que le SPFO est un acide fort qui se dissocie principalement pour former des anions chargés négativement à des valeurs de pH pertinentes sur le plan environnemental (Brooke et coll., 2004). En raison de la nature hydrophobe et oléophobe de la chaîne d'alkyles fluorés et de la nature hydrophile du groupe sulfonique, les effets hydrophobes et électrostatiques influencent probablement l'adsorption du SPFO (Higgins et Luthy, 2006; Xiao et coll., 2011). En raison de la liaison carbone-fluor plus courte et de l'électronégativité élevée des atomes de fluor dans la structure du SPFO, Senevirathna et coll. (2010) ont suggéré qu'une adsorption plus élevée du SPFO pourrait survenir sur les résines échangeuses d'anions. La nature de la structure chimique du SPFO (p. ex. fortes liaisons carbone-fluor) fait en sorte que la substance est résistante à l'hydrolyse et à la biodégradation, ainsi qu'à la photolyse et à plusieurs processus de traitement chimiques (3M, 1999; Lange et coll., 2006; ATSDR, 2009).
7.1 Échelle municipale
Dickenson et Higgins (2013) ont évalué la capacité d'un large éventail de techniques de traitement complet pour éliminer les substances perfluoroalkyliques, y compris le SPFO et l'APFO, de l'eau brute et de l'eau potable d'installations pour le recyclage d'eau. Les chaînes de traitement variaient, mais comprenaient généralement la coagulation, suivie par une séparation physique, l'aération, l'oxydation chimique, l'irradiation d'ultraviolets, et la désinfection. Peu importe la chaîne de traitement utilisée, la diminution des concentrations de SPFO et d'APFO était faible ou inexistante; les auteurs ont donc conclu que ces méthodes de traitement ne sont pas efficaces pour éliminer les substances perfluoroalkyliques.
Les techniques d'adsorption sur le CAG et de filtration sur membrane semblent prometteuses pour éliminer le SPFO de l'eau potable, permettant d'atteindre des concentrations inférieures à 0,6 µg/L dans l'eau traitée (Tang et coll., 2006; Lampert et coll., 2007; Deng et coll., 2010; Takagi et coll., 2011; Appleman et coll., 2014). Afin d'atteindre une concentration de SPFO inférieure à 0,6 µg/L, le système de CAG doit avoir été conçu spécialement à cette fin et bien exploité pour l'élimination du SPFO dans l'eau potable. La présence de matière organique naturelle (MON) dans l'eau à la source peut nuire au rendement du CAG en luttant directement pour les sites d'adsorption et en préchargeant (engorgement) les lits de charbon actif en grains. Par conséquent, l'efficacité du CAG pour éliminer le SPFO de l'eau potable semble dépendre sur la fréquence de régénération ou de remplacement du carbone (Kolstad, 2010; Takagi et coll., 2011; Appleman et coll., 2014). Les études à l'échelle de banc d'essai concernant la filtration sur membrane – par exemple l'osmose inverse (OI) et la nanofiltration (NF) – ont démontré l'élimination efficace de toutes les substances perfluoroalkyliques à chaîne longue et courte, y compris le SPFO, de l'eau potable. Bien que le processus d'OI soit efficace, il est probable que ce soit une méthode de traitement coûteuse (Steinle-Darling et coll., 2008; Quinones et Snyder, 2009; Appleman et coll., 2013; Flores et coll., 2013). Les résines échangeuses d'anions peuvent également être efficaces pour éliminer le SPFO. Toutefois, cette technologie n'a pas été évaluée de façon complète précisément pour l'élimination du SPFO dans l'eau potable.
La sélection et l'efficacité de chaque stratégie de traitement reposent sur différents facteurs, y compris la composition chimique de l'eau à la source, la concentration de SPFO ou d'autres substances perfluoroalkyliques ainsi que les procédés de traitement préexistants. Si des substances perfluoroalkyliques à chaîne longue étaient détectées dans les sources d'eau potable, le service d'alimentation en eau pourrait envisager la mise en place de traitements comme le CAG. Toutefois, les services publics qui ont des substances perfluoroalkyliques à chaîne plus courte dans leur source d'eau brute pourraient plutôt choisir de mettre en place un processus d'osmose inverse. Les méthodes de traitement doivent être conçues précisément pour le retrait des substances perfluoroalkyliques et bien utilisées afin d'atteindre les objectifs d'élimination des contaminants dans l'eau potable (Dickenson et Higgins, 2013).
Dickenson et Higgins (2013) ainsi que Rahman et coll. (2014) ont résumé la capacité de différents procédés de traitement de l'eau potable et de chaînes de traitement pour éliminer le SPFO.
L'annexe A résume le pourcentage de SPFO éliminé dans les usines pleine échelle de traitement où les concentrations dans l'eau brute et l'eau traitée ont été déclarées (Rahman et coll., 2014). Les données montrent que les technologies de traitement utilisées par ces usines (à l'exception du CAG, de l'OI et de la NF) n'ont pas retiré une quantité notable de SPFO. Elles montrent également que dans certains cas, les concentrations dans l'eau traitée étaient plus élevées que dans l'eau brute, probablement en raison de la rupture des composés précurseurs pour former du SPFO pendant le traitement (Takagi et coll., 2008; Shivakoti et coll., 2010). Takagi et coll. (2011) ont également avancé que les concentrations plus élevées dans l'eau traitée pourraient également découler de la désorption à partir des filtres de CAG utilisés pendant de longues périodes de temps sans réactivation.
7.1.1 Traitement conventionnel
Les procédés conventionnels de traitement de l'eau potable comprennent habituellement la coagulation, la floculation, la sédimentation et la filtration, suivies par un processus de désinfection primaire et secondaire. Les coagulants courants utilisés dans l'eau potable comprennent le sulfate d'aluminium, l'hydroxyde ferrique, le chlorure ferrique, le chlorure de polyaluminium et les polymères qui agissent comme agents coagulants. Les milieux de filtration peuvent être composés de sable (un seul milieu); de sable et d'anthracite (milieu double), ou de sable, d'anthracite et de grenat (milieu multiple ou mixte de grenat). Le CAG peut également être utilisé comme milieu de filtration.
Les techniques de traitement complet de l'eau potable conventionnelles se sont avérées inefficaces pour éliminer le SPFO des sources d'eau. Les échantillons prélevés auprès de plusieurs usines de traitement conventionnel à pleine échelle ont permis de déterminer qu'il n'y avait essentiellement aucune différence entre les concentrations de SPFO dans les influents des usines et celles dans l'eau après les étapes de coagulation, de sédimentation et de filtration sur sable (Loos et coll., 2007; Shivakoti et coll., 2009; Takagi et coll., 2011; Thompson et coll., 2011). De même, Eschauzier et coll. (2012) ont déclaré que les filtrations lentes et rapides sur sable n'étaient pas efficaces pour éliminer l'APFO et le SPFO. Le fait que les traitements de l'eau conventionnels ne réussissent pas à éliminer le SPFO et l'APFO pourrait s'expliquer par les concentrations extrêmement faibles de ces substances dans l'eau et par leur hydrophilicité, qui fait en sorte qu'elles ne soient pas susceptibles à l'élimination par les procédés de traitement conventionnels (Rahman et coll., 2014). Ces résultats sont conformes à ceux des études à l'échelle de banc d'essai menées récemment sur l'élimination du SPFO dans l'eau (Deng et coll., 2011; Xiao et coll., 2013).
Des essais de floculation (Xiao et coll., 2013) ont donné un taux d'élimination de 3 % du SPFO, dans un échantillon où la concentration dans l'influent était de 0,1 µg/L (100 ng/L), avec une dose d'alun de 30 mg/L et un pH de 7,9. Une efficacité d'élimination inférieure à 10 % a été déclarée pour une fourchette de doses d'alun variant de 10 à 60 mg/L et des niveaux de pH variant de 6,5 à 8,0. Des taux d'élimination d'environ 25 % ont été observés au moyen d'une coagulation améliorée avec des doses d'alun supérieures à 60 mg/L et un pH variant de 4,5 à 6,5. En général, les efficacités d'élimination étaient inférieures à 35 % sous les conditions de coagulation examinées (doses d'alun entre 3 et 110 mg/L et un pH variant de 4,5 à 8,0). La coagulation par chlorure de fer a présenté des résultats semblables. Les auteurs ont indiqué que les taux d'élimination étaient plus élevés pour le SPFO que pour l'APFO dans les conditions de coagulation conventionnelles et renforcées, possiblement parce que le SPFO a une taille moléculaire plus élevée, et un potentiel hydrophobe plus important.
7.1.2 Adsorption
Les adsorbants habituellement utilisés dans le traitement de l'eau potable comprennent le charbon actif, les résines, l'alumine activée, les zéolites, les argiles, les oxydes métalliques, les hydroxydes et les carbonates (AWWA, 2011; U.S. EPA, 2012a). Le charbon actif en grains (CAG) est utilisé dans un lit fixe, alors que le charbon actif en poudre (CAP) est habituellement ajouté directement à l'eau brute, ou mélangé à de l'eau pour former une boue liquide.
Plusieurs études en laboratoire portant sur la cinématique d'adsorption du SPFO et de l'APFO ont indiqué que le CAP a permis d'atteindre l'équilibre de sorption en quatre heures alors que le CAG a mis 168 heures (Yu et coll., 2009). Ces études ont également déterminé que les pourcentages d'élimination des substances perfluoroalkyliques étaient généralement plus élevés pour le CAP que le CAG (60 à 90 % par rapport à 20 à 40 %, respectivement) pour un temps d'adsorption de 10 minutes (Hansen et coll., 2010). Ces résultats peuvent s'expliquer par la plus petite taille des particules du CAP, et une surface de contact précise plus grande par volume de carbone par rapport au CAG (Yu et coll., 2009; Hansen et coll., 2010). Si les substances perfluoroalkyliques se trouvent dans l'eau brute toute l'année, Rahman et coll. (2014) ont suggéré que l'adsorption sur CAG serait la méthode à privilégier pour le retrait des substances perfluoroalkyliques. En revanche, le CAP pourrait être plus indiqué pour l'assainissement à court terme en réponse à un déversement.
7.1.2.1 CAG
Les résultats des évaluations complètes de l'efficacité de l'adsorption sur CAG pour l'élimination du SPFO dans les sources d'eau potable sont mixtes. Plusieurs études complètes, conçues et menées précisément pour l'élimination des substances perfluoroalkyliques dans l'eau potable, ont permis d'observer l'élimination efficace du SPFO par CAG avec un long temps de contact en fût vide (TCFV) et un régime de régénération approprié (MDH, 2008a; Takagi et coll., 2011; Appleman et coll., 2014). D'autres usines de traitement de l'eau ont relevé des concentrations semblables de SPFO dans l'eau brute et l'eau traitée, ce qui suggère que le traitement par CAG élimine seulement en partie ce contaminant, voire pas du tout. Ces usines de traitement n'étaient pas spécifiquement conçues pour le retrait de substances perfluoroalkyliques dans l'eau potable. Comme le traitement par CAG était en place pendant une période de temps variable, il est probable que le préchargement de matière organique naturelle avait détérioré le rendement du CAG, ce qui s'est traduit par des contrations semblables de SPFO dans l'influent et dans l'eau traitée (Shivakoti et coll., 2010; Takagi et coll., 2011; Eschauzier et coll., 2012, Flores et coll., 2013).
Un système de traitement complet par CAG avec un débit de 1,5 m3/minute a été expressément conçu pour éliminer les substances perfluoroalkyliques dans l'eau souterraine. Le système a utilisé deux contacteurs au CAG selon une configuration avance-retard avec un temps de contact en fût vide (TCFV) de 13 minutes chacun. Le réservoir principal a fonctionné pendant environ 18 mois et a traité environ 59 483 volumes de lit (VL) avant que la concentration de SPFO dépasse 0,05 µg/L. L'unité de CAG pouvait faire passer une concentration de SPFO variant de 0,53 à 1,38 µg/L dans l'influent à moins de 0,05 µg/L dans l'eau traitée à partir du réservoir secondaire, pour 72 775 VL (environ 22 mois). À ce stade, l'eau du réservoir principal a atteint une concentration de 0,11 µg/L de SPFO, le charbon du système a été remplacé par un milieu vierge et le réservoir a été placé à la position secondaire (Appleman et coll., 2014).
Une enquête de surveillance menée au Royaume-Uni indiquait qu'une concentration de SPFO variant de 1,7 à 3,8 µg/L dans l'influent de l'eau souterraine contaminée a été réduite à moins de 0,2 µg/L au moyen du traitement CAG. Les cinq contacteurs au CAG ont été utilisés en mode d'étalement parallèle avec un TCFV de 110 minutes et une fréquence de régénération de 12 mois. Une concentration de SPFO de 0,3 µg/L (fuite) a été relevée entre 8 000 et 9 000 VL. Toutefois, la concentration de fuite a été déclarée pour la période de temps avant l'augmentation de la fréquence de régénération (tous les 12 mois au lieu de tous les 24 mois) (Rumsby et coll., 2009).
Le comportement et le devenir des substances perfluoroalkyliques, y compris le SPFO et l'APFO, ont été évaluées en analysant l'influent et l'eau traitée de plusieurs usines de traitement de l'eau potable qui incluaient le CAG dans la chaîne de traitement. Ces usines n'étaient pas expressément conçues pour l'élimination de substances perfluoroalkyliques dans l'eau potable. Le temps de rétention hydraulique des étapes de traitement individuelles a été pris en considération pour l'évaluation de l'efficacité de chacune de ces étapes (Shivakoti et coll., 2010; Takagi et coll., 2011; Eschauzier et coll., 2012; Flores et coll., 2013). Les études ont trouvé que seule l'étape de CAG permettait d'éliminer les substances perfluoroalkyliques de l'eau potable. Un taux d'élimination du SPFO variant de 63 % à 97 % a été rapporté lorsqu'un procédé de traitement par CAG était inclus dans la chaîne de traitement (Shivakoti et coll., 2010; Flores et coll., 2013; Appleman et coll., 2014). Les paragraphes ci-après fournissent plus de détails sur certaines de ces études.
Une usine pleine échelle de traitement pleine échelle de 5 millions de gallons par jour (mgd), conçue pour éliminer les quantités traces (ng/L) de contaminants organiques dans l'eau de surface, consistait en la filtration par les berges, l'adoucissement, UV/H2O2, la filtration CAG bioactive et six contacteurs au CAG. Le système au CAG fonctionnait en mode parallèle avec un TCFV de 10,5 minutes. Les échantillons d'eau analysés avant et après le traitement par CAG démontraient une diminution de la concentration de SPFO dans l'influent de 2,3 ng/L à 0,25 ng/L (élimination de 89 %) (Appleman et coll., 2014).
Eschauzier et coll. (2012) ont étudié les concentrations de SPFO et d'APFO dans une chaîne de traitement de l'eau potable qui comprenait les processus de coagulation, de filtration rapide sur sable, de passage dans les dunes (l'eau passait lentement dans les dunes de sable), d'adoucissement, d'ozonisation et de traitement sur CAG. Seule l'étape du CAG était efficace pour l'élimination des substances perfluoroalkyliques. Le système a utilisé des contacteurs au CAG en deux étapes selon une configuration avance-retard. Parmi les 40 filtres, 20 étaient utilisés en mode parallèle à la première étape, et les 20 autres étaient utilisés comme filtration de deuxième étape. Chaque filtre CAG fonctionnait à un débit de 348 m3/heure et un TCFV de 20 minutes, ce qui donnait un TCFV total de 40 minutes. Chaque filtre CAG vierge a été installé à titre de filtre de deuxième étape, et a été transféré à la première étape après 15 mois d'utilisation. Après un autre 15 mois, le charbon était réactivé et remis en service à titre de filtre de deuxième étape. Le système CAG a éliminé efficacement l'acide perfluorononanoïque (PFNA), le SPFO et l'acide de sulfonate de perfluorohexane (PFHxS). L'étape de CAG était capable de réduire une concentration moyenne de SPFO dans l'influent de 11 ng/L dans l'eau d'alimentation à la première étape du CAG à une concentration inférieure à la LQ de 0,23 ng/L (élimination d'environ 98 %) après le filtre CAG de deuxième étape (Eschauzier et coll. 2012). Flores et coll. (2013) ont signalé une élimination du SPFO de 64 % dans une usine de traitement de l'eau, où 24 contacteurs au CAG étaient installés et régénérés environ une fois par année.
Takagi et coll. (2008, 2011) ont examiné le comportement, le devenir et l'efficacité d'élimination du SPFO et de l'APFO dans les procédés de traitement de l'eau potable de différentes usines de traitement de l'eau potable qui incluaient le CAG dans la chaîne de traitement. L'efficacité d'élimination du SPFO et de l'APFO était inférieure à 50 % dans de nombreuses usines de traitement de l'eau. Un taux d'élimination négatif observé dans certaines usines pourrait possiblement s'expliquer par la désorption de filtres CAG, utilisés pendant de longues périodes de temps sans réactivation. Les taux d'élimination négatifs pourraient aussi être attribuables à la formation de SPFO et d'APFO à la suite de la dégradation des composés précurseurs qui se trouvent dans l'eau brute (Takagi et coll., 2011). Toutefois, le SPFO a été éliminé efficacement pendant huit mois dans une usine de traitement de l'eau de 1,5 million de litres par jour après le remplacement du charbon actif dans l'unité de CAG. La chaîne de traitement comprenait la coagulation/sédimentation, la filtration rapide sur sable et deux contacteurs au CAG (charbon actif fabriqué à partir de charbon et d'écorce de noix de coco) en mode parallèle. Les deux contacteurs au CAG pouvaient faire passer des concentrations de SPFO variant de 2,3 à 3,9 ng/L à une concentration inférieure à la LQ de 0,5 ng/L pendant la période d'étude de huit mois.
Les essais RSSCT (« Rapid Small-Scale Column Test ») sont des essais courants à l'échelle de banc d'essai utilisés pour évaluer le CAG. Au moyen de l'essai RSSCT, Appleman et coll. (2013) ont comparé l'efficacité de trois différents types de CAG pour l'élimination de plusieurs substances perfluoroalkyliques, y compris le SPFO et l'APFO. Les expériences de la colonne ont été effectuées avec un TCFV de 0,38 minute au moyen d'eau désionisée et d'eau de surface (carbone organique dissous [COD] de 1,7 mg/L), auxquelles on avait ajouté 1,0 µg/L de chaque substance perfluoroalkylique. Les tests ont été réalisés pour un total de 125 000 VL (environ 33 jours). Le rendement du charbon variait selon le type de charbon et la composition chimique de l'eau; le CAG était plus efficace à éliminer les substances perfluoroalkyliques dans l'eau désionisée. Parmi les trois carbones, le F300 a donné les meilleurs résultats. Dans les expériences menées avec de l'eau désionisée, la concentration de SPFO dans l'eau filtrée était inférieure à 0,02 µg/L (moins de 2 % de C0 dans l'influent), après 98 000 VL. Toutefois, la concentration dans l'eau filtrée a atteint 0,2 µg/L (20 % de C0) après 11 000 VL (trois jours) dans l'eau de surface enrichie. Les essais RSSCT ne conviennent pas à l'évaluation des effets du préchargement ou de l'engorgement des colonnes CAG par COD, mais la pénétration rapide observée dans l'eau naturelle enrichie a démontré que la présence de COD nuit au rendement du CAG en ce qui concerne l'élimination des substances perfluoroalkyliques en luttant directement pour les sites d'adsorption (Appleman et coll., 2013).
L'efficacité de l'élimination du SPFO par adsorption sur CAG est affectée par la matière organique naturelle (MON) dans l'eau à la source, qui lutte pour le site d'adsorption sur charbon et qui s'adsorbera aux matières de façon irréversible, réduisant ainsi la capacité du charbon d'éliminer le composé cible. Lorsque la capacité d'adsorption sur CAG est épuisée, le charbon doit être retiré du contacteur et remplacé par du nouveau charbon ou du charbon réactivé. Le CAG est utilisé dans un réacteur en lit fixe, pour remplacer le milieu de filtration existant (p. ex. du sable) dans un filtre conventionnel, comme couche dans un filtre rapide à milieux multiples, ou dans un contacteur distinct. Le réacteur peut être situé au début de la chaîne de traitement dans un mode à double couche ou dans un mode avec remplacement du sable, ou plus loin dans la chaîne de traitement en tant que contacteur de deuxième étape. Le taux d'épuisement du CAG variera considérablement pour la même source d'eau selon la configuration de CAG utilisée. Un milieu à deux couches (CAG et sable) est utilisé lorsque la réduction de la turbidité et l'adsorption et l'élimination des contaminants sont regroupées dans un processus à une seule unité. Le filtre à deux couches (habituellement situé après la sédimentation) sera probablement exposé à de plus fortes concentrations de COD, et ce filtre sera épuisé plus rapidement. Un contacteur au CAG situé à la fin d'une chaîne de traitement aura sans doute un préchargement ou un engorgement plus lent, car les étapes de traitement avant l'arrivée de l'eau au contacteur au CAG réduiront les concentrations de COD dans l'influent. Cette stratégie de traitement aidera à utiliser entièrement toute la capacité de traitement sur CAG et réduira les coûts d'exploitation (p. ex. les coûts de remplacement du charbon) (Crittenden et coll., 2012).
Une surveillance étroite de la fuite de SPFO (objectif du traitement) est nécessaire pour l'exploitation efficace de l'unité de CAG. Les études ont indiqué que le SPFO était efficacement éliminé de l'eau potable lorsqu'il y avait une régénération fréquente ou lorsque le remplacement du CAG était effectué (p. ex. Wilhelm et coll., 2008; Rumsby et coll., 2009; Takagi et coll., 2011). Takagi et coll. (2011) ont observé que le SPFO et l'APFO n'étaient pas éliminés efficacement lorsque le CAG était régénéré sur des périodes supérieures à un an, et ont suggéré de régénérer le charbon deux ou trois fois par année. Une étude à une usine de traitement pleine échelle sur CAG à 2 500 gpm, au moyen de deux contacteurs au CAG fonctionnant en série a observé une fuite d'APFO et de SPFO après 286 jours et 550 jours, respectivement. Avec le remplacement du CAG au moment le plus tôt de la fuite d'APFO, le système a réussi à traiter 1,9 million de gallons d'eau pendant 23 mois (MDH, 2008a; Kolstad, 2010).
Eschauzier et coll. (2012) ont observé que les efficacités d'élimination des substances perfluoroalkyliques par CAG augmentaient plus la longueur de la chaîne de carbone augmentait, et que les composés de sulfonate étaient éliminés pendant une plus longue période de temps que les composés de carboxylate. Les substances perfluoroalkyliques à chaîne plus courte (surtout l'acide perfluorobutanoïque [PFBA] et le sulfonate de perfluorobutane [PFBS]) n'étaient pas éliminés par le CAG. Ces résultats concordaient à ceux d'expériences de lot antérieures qui démontraient que la sorption des substances perfluoroalkyliques sur du charbon actif diminuait lorsque la longueur de la chaîne de carbone diminuait, et que les perfluorosulfonates avaient une plus forte adsorption que les perfluorocarboxylates lorsque la longueur de la chaîne de carbone était la même (Ochoa-Herrera et Sierra-Alvarez, 2008; Hansen et coll., 2010; Dudley et coll., 2012; Appleman et coll., 2014). Il a été déterminé que les isomères ramifiés de SPFO et d'APFO étaient moins adsorbés au CAG que les isomères ramifiés. La désorption de substances perfluoroalkyliques à chaîne plus courte en raison de la concurrence pour des sites de sorption avec des substances perfluoroalkyliques à chaîne plus longue ou de la MON (p. ex. COD) peut se traduire par des concentrations plus élevées de substances perfluoroalkyliques à chaîne plus courte dans l'eau traitée (Eschauzier et coll., 2012).
7.1.2.2 CAP
Aucune donnée complète n'a été déclarée concernant le retrait de SPFO au moyen de charbon actif en poudre. La plupart des études publiées sur l'efficacité du charbon actif en poudre ont été menées à l'échelle de banc d'essai. Les concentrations de SPFO dans certaines de ces études menées à l'échelle de banc d'essai étaient d'un ordre de grandeur supérieur à la concentration observée dans les eaux naturelles. Toutefois, les tendances observées pour le CAP en ce qui concerne l'adsorption préférentielle (selon la longueur de la chaîne) et la réaction compétitive avec la matière organique naturelle (MON) étaient semblables à celles consignées pour le CAG (Hansen et coll., 2010; Dudley et coll., 2012).
Dudley et coll. (2012) ont évalué l'absorbabilité de dix substances perfluoroalkyliques ayant différentes longueurs de chaîne de carbone (de C4 à C10) sur différents types de CAP disponibles sur le marché (noix de coco, lignite, bois et houille bitumineuse) et du CAP superfin obtenu par le concassage humide du CAP acheté sur le marché. Les substances de sulfonate se sont avérées plus adsorbables que les substances carboxylates, et la cinétique de la sorption était plus rapide avec le charbon actif en poudre superfin par rapport au charbon actif en poudre régulier. L'efficacité d'élimination des acides perfluoroalkylique augmentait lorsque la longueur de la chaîne de carbone augmentait (p. ex. élimination négligeable des composés C4 mais élimination supérieure à 90 % des composés C7 à C10). On a déterminé que la présence de MON diminuait l'efficacité de l'élimination des substances perfluoroalkyliques par le CAP dans les études de lots. Les auteurs ont également conclu qu'il ne serait peut-être pas possible d'éliminer de façon importante les substances perfluoroalkyliques à des doses pratiques de CAP (Dudley et coll., 2012).
Yu et coll. (2009) ont étudié la cinétique et les isothermes de sorption du SPFO et de l'APFO après traitement sur CAP ou CAG, ou par résines échangeuses d'anions. Les résines échangeuses d'anions avaient la capacité de sorption la plus élevée pour l'APFO alors que le CAP était l'adsorbant de choix pour le SPFO. Dans le cadre d'un autre essai en laboratoire, on a relevé des taux d'élimination de 97 % et de 24 % du SPFO par CAP et CAG, respectivement, selon une concentration initiale de 1,4 µg/L dans l'eau souterraine. L'étude a également permis d'observer que la sorption du SPFO sur le CAP était plus rapide que sur le CAG, ce qui suggère que la cinétique de la sorption serait influencée par la taille du charbon actif (Hansen et coll., 2010).
7.1.3 Filtration sur membrane
Il y a quatre principaux types de procédés de filtration sur membrane en ce qui concerne le traitement de l'eau potable : microfiltration (MF), ultrafiltration (UF), nanofiltration (NF) et osmose inverse (OI). Les membranes à faible pression, comme la MF et l'UF, ne sont pas capables de rejeter les substances perfluoroalkyliques comme la taille de leurs pores est plus grande que le diamètre effectif des molécules des substances perfluoroalkyliques (~1 nm) (Tsai et coll., 2010; Rahman et coll., 2014). Des études menées à l'échelle de banc d'essai ont déterminé que le seuil de rétention des molécules (SRM) des membranes de la nanofiltration ou de l'osmose inverse est probablement le facteur le plus important pour l'élimination des substances perfluoroalkyliques pour ces technologies. En général, les membranes de nanofiltration ont un plus faible rejet (95 %) que l'osmose inverse (rejet supérieur à 99 %), ce qui concorde avec le fait que les membranes de nanofiltration ont des pores plus grands (Tang et coll., 2006, 2007; Steinle-Darling et Reinhard, 2008; Lipp et coll., 2010; Appleman et coll., 2013; Rahman et coll., 2014).
Les renseignements scientifiques disponibles sur l'élimination du SPFO et de l'APFO des approvisionnements en eau potable par filtration sur membrane sont limités à une seule usine de traitement pleine échelle par osmose inverse (Flores et coll., 2013) et plusieurs installations de réutilisation indirecte à titre d'eau potable (Quinones et Snyder, 2009; Appleman et coll., 2014). En raison de l'emplacement physique de ces installations de réutilisation indirecte à titre d'eau potable, elles ont été estimées comme étant des principaux contributeurs potentiels à l'eau brute des usines d'eau potable dans les études effectuées (Quinones et Snyder, 2009).
Un traitement conventionnel complet a été déclaré comme étant inefficace pour l'élimination du SPFO dans l'eau de surface, mais un taux d'élimination supérieur à 99 % a été obtenu pour cette substance lorsque l'osmose inverse a été mise en application après la chaîne de traitement conventionnel (Flores et coll., 2013). Des échantillons ont été prélevés pour évaluer l'efficacité de chaque étape de la chaîne de traitement, en tenant compte du temps de rétention hydraulique de chaque étape. L'eau d'alimentation du système d'OI était filtrée par le procédé de traitement conventionnel et mélangée à des eaux souterraines non contaminées. La concentration de SPFO dans l'eau d'alimentation variait de 61 à 86 ng/L et le système d'OI a réussi à réduire ces concentrations à une concentration moyenne de 0,7 ng/L (Flores et coll., 2013).
Deux installations de réutilisation indirecte à titre d'eau potable avec des unités d'OI dans leurs chaînes de traitement ont pu réduire la concentration de SPFO à une quantité inférieure à 0,25 ng/L dans l'eau traitée par OI. Les deux systèmes d'OI avaient un taux de débit de 12 gallons par pied carré par jour (gfd) (20 L/m2/h) et un taux de récupération de l'eau se situant entre 80 et 85 %. Les concentrations de SPFO dans l'eau d'alimentation des unités d'OI variaient de 3 à 18 ng/L (Dickenson et Higgins, 2013; Appleman et coll., 2014). Une étude de plusieurs services publics et d'installations de réutilisation indirecte à titre d'eau potable a révélé que les concentrations de SPFO dans l'eau traitée étaient comparables à celles relevées dans les échantillons d'eau brute dans presque tous les cas. Toutefois, l'élimination a seulement été observée dans une installation de réutilisation d'eau potable prévue lorsqu'un traitement de membrane intégré composé de MF et d'OI a été utilisé. Le système de membrane pouvait faire passer la concentration de SPFO dans l'eau d'alimentation de 41 ng/L à moins de 1 ng/L dans l'eau traitée (Quinones et Snyder, 2009).
Des expériences à l'échelle de banc d'essai ont évalué le comportement de rejet de membranes de NF encrassées et non pour l'élimination des substances perfluoroalkyliques, y compris le SPFO (Appleman et coll., 2013). L'étude a permis d'établir qu'une membrane plane composite de NF à couche mince en polyamide pouvait éliminer de 93 à 99 % de tous les composés évalués. Un taux d'élimination supérieur à 99 % d'une concentration moyenne de SPFO dans l'eau d'arrivée de 866 ng/L (LOQ de 10 ng/L) a été observé dans toutes les expériences où on a utilisé des membranes vierges et de l'eau désionisée enrichie, des membranes vierges et de l'eau souterraine enrichie, et des membranes encrassées et de l'eau souterraine enrichie. La couche d'encrassement de la membrane de NF n'a démontré aucun effet négatif sur le rejet de SPFO (Appleman et coll., 2013). Une autre étude à petite échelle a été menée sur une membrane d'OI (SRM de 100 Da) et trois membranes de NF (fourchette de SRM variant de 200 à 360 Da) pour le retrait de SPFO dans l'eau. La membrane d'OI a atteint un taux d'élimination de 99,9 % du SPFO de la concentration dans l'eau d'alimentation de 2 100 ng/L avec une concentration de SPFO dans le perméat variant de 2 à 3 ng/L. Le système d'OI fonctionnait à un taux de débit de 30 à 40 L/m2/h sous une pression de huit bars (116 psi). Toutes les membranes de NF mises à l'essai ont réussi à éliminer de 99,8 à 100 % d'une concentration moyenne de SPFO dans l'eau d'arrivée de 3 000 ng/L, avec un taux de débit allant jusqu'à 70 L/m2/h et une pression d'utilisation variant de 4 à 7 bar (de 58 à 101 psi) (Lipp et coll., 2010).
Bien qu'il y ait très peu de données sur un système d'OI complet et seulement des renseignements à l'échelle de banc d'essai pour le traitement par NF, les deux technologies sont estimées efficaces pour éliminer le SPFO dans l'eau potable (Appleman et coll., 2013; 2014). Les résultats de l'étude sur la NF sont prometteurs, comme la NF est un processus moins énergivore que l'OI. La mise à l'essai de la membrane de NF sélectionnée pour l'élimination du SPFO à l'échelle pilote et à l'échelle réelle est une étape importante pour les installations lorsqu'elles envisagent ce procédé de traitement. Comme l'exclusion selon la taille est un mécanisme important pour le rejet des substances perfluoroalkyliques par les membranes de NF, il faut s'assurer de sélectionner des membranes avec un SRM plus petit que la taille du SPFO.
Les points à considérer pour le traitement par OI comprennent l'élimination de l'eau de rejet ainsi que la possible augmentation de la corrosivité de l'eau traitée. L'osmose inverse rejette une portion considérable de l'eau d'arrivée sous forme de saumure riche en contaminants, et les rejets concentrés doivent être éliminés de manière adéquate. Le retrait des contaminants peut causer un déséquilibre des minéraux, lequel peut entraîner une augmentation de la corrosivité de l'eau traitée. Dans la plupart des cas, il faut recourir à des mesures de réduction de la corrosivité après le traitement.
7.1.4 Échange d'ions
Les acides perfluoroalkyliques sont à l'état anionique à des valeurs de pH ambiantes; par conséquent, on s'attendrait à ce qu'ils soient réceptifs à l'élimination par des résines échangeuses d'anions (Senevirathna et coll., 2010). Deux principaux mécanismes, les interactions hydrophobes et électrostatiques, ont été proposés pour l'élimination des acides perfluoroakyliques par des résines échangeuses d'anions (Carter et coll., 2010; Deng et coll., 2010; Xiao et coll., 2012).
Appleman et coll. (2014) ont présenté les résultats de la seule application pleine échelle connue d'échange d'ions pour le retrait de substances perfluoroalkylique. Toutefois, ce système n'était pas expressément conçu pour le retrait de substances perfluoroalkyliques dans l'eau potable. Une usine pleine échelle de 350 gpm ayant recours à l'échange d'ions a réussi à faire passer des concentrations de SPFO variant de 2,6 à 4,5 ng/L dans l'eau souterraine à une concentration inférieure à la limite de détection de 0,25 ng/L. Une résine échangeuse d'anions fortement basique imbibée d'un oxyde de fer utilisé pour l'élimination de l'arsenic a été évaluée pour l'élimination de SPFO après que la résine avait été utilisée pendant cinq et neuf mois. La résine échangeuse d'anions fortement basique très poreuse a éliminé plus de 75 % de l'APFO, a éliminé partiellement l'acide perfluoroheptanoïque (PFHpA) (46 %), et a grandement éliminé le SPFO (> 92 %) et le perfluorohexanesulfonate (PFHxS) (97 %). On n'a relevé qu'une faible élimination, voire aucune, chez les composés à chaîne de carbone plus courte, comme le PFBA et l'acide perfluorohexanoïque (PFHxA). Les résultats ont également révélé que les acides perfluorosulfoniques réagissaient davantage à l'élimination par résine échangeuse d'anions que les acides perfluorocarboxyliques (Appleman et coll., 2014).
Les résines échangeuses démontrent une certaine sélectivité pour différents ions, selon la concentration d'ions dans la solution et le type de résine sélectionné. Des évaluations à l'échelle laboratoire de différents types de résines (p. ex. résines échangeuses d'ions, résines non-échangeuses d'ions) pour le retrait de substances perfluoroalkyliques dans l'eau ont été recensées dans les publications (Lampert et coll., 2007; Carter et coll., 2010; Deng et coll., 2010; Senevirathna et coll., 2011; Xiao et coll., 2012; Chularueangaksorn et coll., 2013). Des essais cinétiques de lot menés avec une concentration initiale élevée de SPFO (mg/L) ont démontré une élimination de plus de 99 % du SPFO au cours d'une période de 25 heures de contact au moyen d'une résine échangeuse d'anions commerciale; toutefois, une autre résine échangeuse d'anions a seulement éliminé 32 % de la substance. L'étude a également relevé que les anions de SPFO étaient plus susceptibles à l'élimination par le procédé d'échange d'ions que les anions d'APFO (Lampert et coll., 2007). Dans des essais en laboratoire, les résines échangeuses d'anions ont démontré une capacité élevée pour l'élimination de SPFO dans l'eau (Senevirathna et coll., 2010; Chularueangaksorn et coll., 2013; 2014). Des colonnes à lit fixe de laboratoire avec un TCFV de 1,3 minute ont été évaluées pour l'élimination du SPFO au moyen de cinq résines échangeuses d'anions commerciales et de CAG. L'objectif de fuite a été fixé à un taux d'efficacité d'élimination de 90 % et les essais ont été menés pendant 122 jours. La plupart des résines échangeuses d'anions ont démontré une plus grande capacité que le CAG. Une résine pouvait faire passer la concentration de SPFO dans l'influent de 5 µg/L à 0,05 µg/L (élimination de 99 %); elle a atteint une durée d'exécution de 56 000 VL (52 jours) et a démontré une capacité d'adsorption de 455 mg/g. Le CAG a atteint la concentration de fuite de 0,5 µg/L plus rapidement (40 jours) que les résines échangeuses d'anions (Chularueangaksorn et coll., 2014). Senevirathna et coll. (2010) ont étudié le comportement de sorption du SPFO sur deux polymères échangeurs d'ions, trois polymères non-échangeurs d'ions et le CAG. Les essais cinétiques ont démontré que les polymères échangeurs d'ions et le CAG pouvaient atteindre une concentration à l'équilibre après quatre heures d'exécution, alors que les polymères non-échangeurs d'ions avaient besoin de 10 à 90 heures. À une concentration à l'équilibre de 1 µg/L de SPFO, la capacité de sorption du matériel mis à l'essai diminuait selon l'ordre suivant : polymère échangeur d'ions > polymère non échangeur d'ions > CAG. Toutefois, pour la concentration à l'équilibre la plus faible de 0,1 µg/L, les polymères non-échangeurs d'ions ont donné de meilleurs résultats que les polymères échangeurs d'ions et le CAG (Senevirathna et coll., 2010).
Les résines échangeuses d'anions (sous forme de chlorure) avec une différente matrice polymère et une différente porosité ont également été étudiées pour l'élimination du SPFO dans l'eau (Deng et coll., 2010). L'étude a été menée avec une concentration initiale de SPFO élevée (mg/L). Les expériences ont démontré que la matrice polymère était un facteur critique inflençant le taux de sorption du SPFO. Les résines macroporeuses et les résines polyacryliques de type gel ont démontré une sorption plus rapide et une plus grande capacité que les résines polystyrènes macroporeuses, et encore plus que les résines polystyrènes de type gel. Comme la matrice polyacrylique est plus hydrophile que la matrice polystyrène, le SPFO se propageait facilement dans les pores de résines polyacryliques. Les résines macroporeuses et les résines polyacryliques de type gel ont démontré un profil cinétique semblable et ont atteint une concentration à l'équilibre après 48 heures. Toutefois, les résines macroporeuses et les résines polystyrènes de type gel ont pris plus de 168 heures pour atteindre un équilibre de sorption. Alors que la porosité des résines polyacryliques avait peu d'influence sur la cinétique de sorption et la capacité, les résines polystyrènes macroporeuses ont démontré une sorption plus rapide et une capacité plus élevée que les résines polystyrènes de type gel. La faible sorption du SPFO sur les résines polystyrènes de type gel a démontré un effet d'exclusion de la taille. Comme la quantité de SPFO qui s'est adsorbée aux deux résines polyacriliques était plus importante que les anions de chlorure libérés à partir des résines, les auteurs ont conclu qu'une interaction autre que l'échange d'anions était aussi en cause dans le procédé (Deng et coll., 2010). Alors que les résultats ont révélé que les résines anioniques avaient une plus grande capacité pour le SPFO que les résines non échangeuses d'ions (Deng et coll., 2010; Senevirathna et coll., 2010; Chularueangaksorn et coll., 2013, 2014), il a également été observé que les résines non ioniques modérément polaires donnaient de meilleurs résultats que les résines non ioniques et non polaires en ce qui concerne l'élimination du SPFO de l'eau (Xiao et coll., 2012).
Les études indiquent que le procédé d'échange d'ions est une technologie prometteuse (Dickenson et Higgins, 2013) pour éliminer les acides perfluoroakyliques, y compris le SPFO, de l'eau potable. Toutefois, il faut des études supplémentaires concernant la sélectivité des résines, les limitations cinétiques, l'incidence du COD, les taux de régénération et la présence d'ions en compétition, comme le sulfate et le nitrate, par rapport à l'efficacité d'élimination (Dickenson et Higgins, 2013; Rahman et coll., 2013).
7.1.5 Oxydation, irradiation d'ultraviolets et processus d'oxydation avancée
Des processus d'oxydation avancée (AOP) ont été élaborés pour l'élimination de contaminants qui résistent à des procédés de traitement par oxydation chimique plus typiques. Ils comprennent l'utilisation de combinaisons pertinentes de rayons ultraviolets (UV), d'oxydants chimiques et de catalyseurs (p. ex. ozone, peroxyde d'hydrogène, dioxyde de titane) pour produire des radicaux hautement réactifs, comme des radicaux hydroxyles, qui sont des oxydants puissants qui réagissent rapidement et de façon non sélective avec les contaminants organiques.
Rahman et coll. (2014) ont résumé des études qui ont démontré que les composés des substances perfluoroalkyliques, comme le SPFO, résisteront probablement à l'oxydation, même par ozone moléculaire et radicaux hydroxyles. En raison de la faible réactivité du SPFO avec l'ozone et d'autres processus d'oxydation avancée, les processus d'oxydation à base de chlorure ne permettront probablement pas d'oxyder le SPFO dans des conditions habituelles d'eau potable. La résistance du SPFO à l'oxydation s'explique par l'effet de blindage des atomes de fluor et la force des liaisons carbone-fluor (3M Company, 1999; ATSDR, 2009). Ces conclusions ont été confirmées par des études de usines de traitement à pleine échelle (Quinones et Snyder, 2009; Shivakoti et coll., 2010; Takagi et coll., 2011; Eschauzier et coll., 2012; Flores et coll., 2013) décrites ci-après.
Dans le cadre d'une étude de plusieurs services publics, Quinones et Snyder (2009) ont observé que le SPFO résistait à la chloration, à la chloramination et à l'ozonisation, même en combinaison avec d'autres processus de traitement comme la coagulation ou la floculation, la filtration à travers un lit épais et l'irradiation d'ultraviolets. Dans des usines de traitement de l'eau potable au Japon, on a relevé des concentrations semblables de SPFO dans les échantillons d'eau traités par un processus d'ozonisation que dans les échantillons d'eau brute (Shivakoti et coll., 2010; Takagi et coll., 2011). À des doses d'ozone dans la fourchette de 0,37 à 0,85 mg/L et à un temps de contact aussi long que 120 minutes, le processus d'ozonisation était inefficace pour dégrader les concentrations de SPFO à quatre usines (Takagi et coll., 2011). Thompson et coll. (2011) ont observé qu'une dose d'ozone de 5 mg/L et un temps de contact de 15 minutes dans l'eau recyclée n'étaient pas efficaces à réduire les concentrations de SPFO dans la fourchette de 0,9 à 1,4 ng/L.
Dans une usine de traitement de l'eau à pleine échelle de 5 mgd qui a appliqué une dose UV de 500 MJ/cm2 en combinaison avec 4 mg/L de H2O2, aucune dégradation de 11 ng/L de SPFO dans l'eau de surface n'a été observée (Appleman et coll., 2014). Une seule installation a signalé une diminution partielle (environ 35 %) de la concentration de SPFO dans l'influent, dans la fourchette de 18 à 27 ng/L. L'installation a utilisé deux réacteurs UV qui pouvaient chacun traiter 3 mgd d'eau souterraine avec une dose UV de 80 mJ/cm2 et un facteur de transmission des ultraviolets de 95 % (Appleman et coll., 2014). Malgré qu'on ait observé une élimination partielle du SPFO dans cette usine de traitement de l'eau, l'oxydation et les autres processus d'oxydation avancée semblent être inefficaces pour l'élimination du SPFO dans l'eau potable (Appleman et coll., 2014). Toutefois, l'ozone ou d'autres processus d'oxydation avancée pourraient oxydiser les produits chimiques polyfluorés précurseurs qui peuvent se trouver dans l'eau brute, ce qui peut entraîner une concentration accrue de SPFO et d'APFO dans l'eau traitée (Rahman et coll., 2014).
7.1.6 Aération/strippage à l'air
L'élimination des composés au moyen du stripage à l'air est basée sur le partage à l'équilibre des substances chimiques entre l'air et l'eau, qui est déterminé par la surface de contact entre l'air et l'eau, ainsi que la température, la pression de vapeur, la force ionique et le pH de l'eau. Dickenson et Higgins (2013) ont évalué 23 substances perfluoroalkyliques (y compris le SPFO et l'APFO) dans l'eau brute et l'eau potable traitée, et à différentes étapes de la chaîne de traitement. Ils ont trouvé que l'aération était inefficace pour éliminer le SPFO et l'APFO (taux d'élimination de 10 %).
7.1.7 Filtration par les berges (traitement par l'aquifère du sol)
La filtration par les berges est une méthode de traitement de l'eau potable où l'eau de surface s'écoule dans le sable en subsurface et dans les couches en gravier des berges ou du lit d'une rivière vers des puits d'extraction; les contaminants sont éliminés par les processus de filtration, de sorption, de dilution et de biodégradation.
Une étude effectuée à un service d'alimentation en eau potable ayant recours à la filtration par les berges avec un temps de séjour hydraulique d'environ 10 jours a permis d'observer un taux d'élimination d'environ 20 % pour le SPFO, une élimination variable de certaines substances perfluoroalkyliques, et une augmentation des concentrations d'autres substances perfluoroalkyliques (Appleman et coll., 2014). Les auteurs ont avancé que cette variation s'expliquait possiblement par la variabilité des concentrations dans l'eau d'arrivée provenant des effluents d'eaux usées qui avaient une incidence sur les sources d'eau potable, ou par la décomposition des composés précurseurs dans les berges de la rivière. Dickenson et Higgins (2013) ont conclu qu'il n'était pas probable que la filtration par les berges puisse éliminer considérablement les substances perfluoroalkyliques.
7.1.8 Nouvelles techniques
D'autres technologies de traitement possibles pour l'élimination du SPFO et de l'APFO sont prometteuses, mais font encore activement l'objet de recherches. Elles n'ont pas encore toutes fait l'objet d'évaluations sur l'eau potable dans le cadre d'essais en laboratoire, d'essais pilotes, ou d'études à pleines échelles, mais ont été mentionnées dans des récapitulations d'études à petite échelle de l'élimination de certaines substances perfluoroalkyliques de l'eau potable et des eaux usées (Vecitis et coll., 2009; Eschauzier et coll., 2012).
Des nanomatériaux sont en cours d'élaboration à des fins de traitement de l'eau potable, y compris pour l'échange d'ions, les procédés de sorption et d'oxydation, et la réduction abiotique (p. ex. fer nano-zéro-valent) (Boyd et coll., 2013). Différents nanomatériaux et nanotechnologies sont prometteurs pour l'élimination du SPFO, y compris les nanotubes de carbone (CNT), les polymères à empreinte moléculaire (PEM) à base de chitosane, les membranes nanofibreuses électrofilées, et la photocatalyse assistée du dioxyde de titane (TiO2) (Yu et coll., 2008; Deng et coll., 2012; Dai et coll., 2013). Les nanotubes de carbone sont des molécules de carbone composées de réseaux de carbone qui peuvent prendre la forme de tubes. Le chitosane est un polysaccharide naturel basé sur les coquilles des crustacés. Il peut être préparé en tant que nanoparticule ou électrofilé en nanofibres (Sonia et Sharma, 2011; Zhao et coll., 2011; Boyd et coll., 2013). Les empreintes moléculaires sont une technique où des sites précis des composés cibles sont construits sur un polymère de sorte que des adsorbats précis soient reconnus pendant le processus de sorption. Les membranes nanofibreuses électrofilées sont préparées par l'électrofilage de nanofibres de polymère ou de matériaux composites polymères pour créer des membranes de fibres non tissées avec des diamètres variant de plusieurs centaines à des dizaines de nanomètres (Greiner et Wendorff, 2007; Dai et coll., 2013; Boyd et coll., 2013).
Deng et coll. (2012) ont démontré l'efficacité des nanotubes de carbone pour l'élimination des contaminants perfluorés, y compris le SPFO, des milieux aquatiques lorsque les interactions hydrophobes jouent un rôle dans la sorption des contaminants perfluorés aux nanotubes de carbone. La sorption des contaminants perfluorés a augmenté avec l'augmentation de la longueur de la chaîne carbone-fluor avec le même groupe fonctionnel. Yu et coll. (2008) ont étudié un polymère à empreinte moléculaire (PEM) à base de chitosane pour la sorption du SPFO et ont conclu que le sorbant PEM avait une capacité de sorption et une sélectivité élevée en ce qui concerne le SPFO, et que ce polymère pourrait être utilisé pour l'élimination du SPFO dans l'eau et les eaux usées. L'interaction électrostatique a joué un rôle important dans le procédé d'adsorption.
Dai et coll. (2013) ont étudié la morphologie, la structure et les propriétés physicochimiques de membranes nanofibreuses électrofilées remplies de nanotubes de carbone multiparois pour la sorption du SPFO. Les auteurs ont conclu que ces membranes semblaient prometteuses à titre de sorbants pour l'élimination du SPFO dans des solutions aqueuses. La cinétique de sorption et les résultats isothermes montraient des taux de sorption plus rapides et une capacité de sorption plus élevée sur les membranes nanofibreuses électrofilées remplies de nanotubes de carbone multiparois que sur les membranes nanofibreuses électrofilées pures en ce qui concerne l'élimination du SPFO. Les auteurs ont également conclu qu'il serait possible d'optimiser davantage les membranes nanofibreuses électrofilées remplies de nanotubes de carbone multiparois pour augmenter leurs capacités de sorption tout en empêchant la libération de nanotubes de carbone multiparois dans l'eau (Dai et coll., 2013).
7.2 Échelle résidentielle
Il n'est généralement pas recommandé d'utiliser les dispositifs de traitement de l'eau potable pour un traitement additionnel des eaux déjà traitées par une municipalité. Dans les cas où l'eau potable d'une résidence provient d'un puits privé, un dispositif résidentiel privé de traitement de l'eau potable peut être une option pour diminuer les concentrations de SPFO dans l'eau potable.
À l'échelle résidentielle, même s'il n'existe aucun dispositif de traitement certifié pour réduire les concentrations de SPFO dans l'eau potable, les données disponibles suggèrent que les dispositifs résidentiels de charbon actif et d'osmose inverse peuvent permettre d'atteindre des concentrations de SPFO dans l'eau traitée de 0,2 µg/L et des concentrations inférieures à 0,05 µg/L, respectivement. De plus, les dispositifs de traitement faisant appel à l'échange d'ions peuvent être efficaces pour réduire le SPFO.
Le ministère de la santé du Minnesota (Minnesota Department of Health [MDH], 2008b) a mené une étude sur l'efficacité des dispositifs de traitement de l'eau au point d'utilisation pour éliminer l'APFO, le SPFO et le PFBA; cette étude a démontré que l'OI et les filtres de charbon actif pouvaient réduire les concentrations de SPFO qu'on retrouve habituellement dans l'eau potable. Des essais d'évaluation en laboratoire et des évaluations sur le terrain de dispositifs installés dans les réseaux municipaux d'alimentation en eau ont été effectués. Pour les essais en laboratoire, les eaux de départ avaient une concentration de SPFO de 3,0 µg/L; l'objectif de rendement visé était une diminution à 0,2 µg/L. Dans le cadre des essais sur le terrain, on a surveillé quatre dispositifs à charbon actif, et sept dispositifs à OI installés au point d'utilisation à deux puits municipaux, en plus de prélever des échantillons. Un des puits avait une concentration de 0,6 µg/L d'APFO, de 0,9 µg/L de SPFO, et de 1,4 µg/L de PFBA, alors que le deuxième puits contenait seulement du PFBA (1,5 µg/L). Tous les dispositifs d'OI étaient munis d'un pré-filtre (avant la membrane d'OI) à charbon actif et un filtre de polissage à charbon actif (après la membrane d'OI). Les résultats ont indiqué que les dispositifs à charbon actif et d'OI étaient efficaces pour éliminer le SPFO à une quantité inférieure à la limite de quantification de 0,2 µg/L et inférieure à la limite de détection de 0,05 µg/L, respectivement. D'après ces résultats, on s'attend à ce que le charbon actif et l'OI soient efficaces à diminuer les concentrations de SPFO dans l'eau potable à des concentrations inférieures à la CMA proposée de 0,6 µg/L.
Santé Canada ne recommande pas de marques particulières de dispositifs de traitement de l'eau potable, mais conseille vivement aux consommateurs de n'utiliser que les dispositifs certifiés par un organisme de certification accrédité comme étant conformes aux normes appropriées de la NSF International (NSF) et de l'American National Standards Institute (ANSI). Ces normes visent à préserver la qualité de l'eau potable en aidant à assurer l'innocuité des matériaux et l'efficacité des produits qui entrent en contact avec elle. Les organismes de certification garantissent qu'un produit est conforme aux normes en vigueur et doivent être accrédités par le Conseil canadien des normes (CCN). Au Canada, les organisations suivantes ont été accréditées par le CCN pour pouvoir certifier que les dispositifs et les matières respectent les normes de la NSF/ANSI (CCN, 2015) :
- Groupe CSA (www.csagroup.org);
- NSF International (www.nsf.org);
- Water Quality Association (www.wqa.org);
- UL LLC (www.ul.com);
- Bureau de normalisation du Québec (www.bnq.qc.ca);
- International Association of Plumbing & Mechanical Officials (www.iapmo.org).
On peut obtenir une liste à jour des organismes de certification accrédités auprès du Conseil canadien des normes (www.scc.ca).
Les systèmes de filtration sur charbon actif peuvent être installés au robinet (point d'utilisation) ou à l'emplacement où l'eau entre dans la résidence (point d'entrée [PE]). Les systèmes d'osmose inverse (OI) sont conçus pour être installés au point d'utilisation, car de grandes quantités d'eau d'arrivée sont nécessaires pour obtenir le volume requis d'eau traitée, ce qui n'est pas pratique en général pour des systèmes de traitement résidentiels destinés au point d'entrée. Les systèmes d'OI doivent être installés au point d'utilisation seulement, car l'eau traitée peut être corrosive pour la plomberie. Il est possible que les consommateurs doivent prétraiter l'eau influente pour réduire l'encrassement de la membrane et en prolonger l'utilisation.
Des techniques d'échange d'ions au moyen de résines anioniques peuvent aussi être employées pour l'élimination résidentielle de SPFO. Les dispositifs d'échange d'ions à usage résidentiel sont habituellement conçus et construits par des fournisseurs de systèmes de traitement de l'eau potable. Santé Canada recommande fortement aux propriétaires de résidence de s'assurer que leur système est construit au moyen de matériaux certifiés conformes à la norme 61 de NSF/ANSI (NSF/ANSI, 2014). Si on utilise un système d'échange d'ions, l'eau doit passer à travers un filtre au CAG pour être débarrassée du chlore et des chloramines (s'il y a connexion à une source d'eau traitée) qu'elle peut contenir avant d'atteindre la résine.
Avant d'installer un dispositif de traitement, il est important de faire analyser l'eau pour en établir les propriétés chimiques, ainsi que détecter la présence et la concentration de SPFO. Tant l'eau pénétrant dans le dispositif de traitement que l'eau traitée devraient faire l'objet d'analyses régulières par un laboratoire certifié visant à vérifier l'efficacité du dispositif en question. La capacité d'élimination des dispositifs peut diminuer au fil de leur utilisation et du temps, et il faut les maintenir ou les remplacer au besoin.
8.0 Cinétique et métabolisme
Le SPFO est considéré comme n'étant pas chimiquement réactif, et n'est pas métabolisé. L'absorption orale du SPFO est rapide et complète (Kemper, 2003; Hundley et coll., 2006; Lau et coll., 2007). Une fois absorbé, le SPFO est principalement restreint au plasma et aux fluides extracellulaires (Chang et coll., 2012), et excrété dans l'urine.
8.1 Absorption
Le SPFO est absorbé rapidement et presque complètement dans le tractus gastro-intestinal. Chez les rats, les études ont estimé systématiquement les taux d'absorption par voie orale du SPFO à plus de 95 % après une seule dose (de 4,2 à 20 mg/kg) par gavage (Johnson et Ober, 1979; 1999; Cui et coll., 2010).
Aucune étude contrôlée portant sur la disponibilité orale du SPFO n'a été menée chez les humains, mais des preuves d'absorption orale de l'APFO ont été relevées dans le cadre d'études menées chez des personnes vivant dans des régions où l'eau potable est contaminée (Emmett et coll., 2006; Hölzer et coll., 2008; le SPFO n'a pas été examiné dans ces études). Emmett et coll. (2006) ont constaté une corrélation entre le nombre de verres d'eau du robinet bus par jour et les concentrations d'APFO dans le sang, ce qui indique qu'il s'agit de la voie d'exposition principale. Hölzer et coll. (2008) ont relevé une corrélation entre les litres d'eau potable consommés par jour et les taux sériques d'APFO. Aucun lien n'a été signalé entre la consommation d'eau potable et les concentrations de SPFO dans les deux études, mais ces communautés étaient principalement exposées à l'APFO.
Aucune étude par inhalation ou par voie cutanée n'a signalé des données sur la cinétique du SPFO; toutefois, les propriétés physicochimiques de ce composé semblent indiquer que ces voies d'exposition ne sont pas importantes lorsqu'il y a du SPFO dans l'eau potable (voir la section 5.7).
8.2 Distribution
Les concentrations de SPFO les plus élevées relevées chez les rats ont été mesurées dans le foie après une seule dose orale par gavage de 400 mg/kg (Benskin et coll., 2009) et deux semaines d'exposition alimentaire à 400 mg/kg p.c. par jour (De Silva et coll., 2009). Cela pourrait être dû à la liaison du SPFO aux protéines du foie du rat, y compris à la protéine de liaison d'acide gras dans le foie (L-FABP) (Luebeker et coll., 2002). De même, les concentrations les plus élevées de SPFO ont été relevées dans le foie et le sérum après l'injection intrapéritonéale de SPFO chez les rates femelles (1 ou 10 mg/kg p.c. par jour pendant deux semaines) (Austin et coll., 2003). Le SPFO s'est également accumulé principalement dans les foies des souris après une exposition alimentaire à 0,031 ou à 23 mg/kg p.c. par jour pendant d'un à cinq jours (Bogdanska et coll., 2011) ou après une seule dose orale de 1 ou de 20 mg/kg p.c. (Chang et coll., 2012); les rapports entre le foie et le sang variaient entre 2 et 6 (Bogdanska et coll., 2011). Une des études menées sur les doses orales chez les souris a également permis de relever que du SPFO était demeuré dans les poumons (rapports entre les poumons et le sang variant de 1,5 à 2; Bogdanska et coll., 2011). Les rapports moyens de concentrations de SPFO entre le foie et le sérum chez les singes variaient de 0,9 à 2,7, après l'administration de bolus par voie orale de 0,03, de 0,15 ou de 0,75 mg/kg p.c. par jour pour 183 jours (Seacat et coll., 2002). Le pourcentage moyen de la dose de SPFO détectée dans les foies de ces singes variait de 4,4 ± 1,6 % à 8,7 ± 1,0 %.
Peu de données ont été recueillies sur les tissus humains auxquels le SPFO est normalement réparti. Dans des tissus prélevés de cadavres humains aux États-Unis, le rapport moyen de la concentration foie-sérum était de 1,3, ce qui laisse supposer qu'il n'y a pas de liaison importante aux protéines du foie chez l'humain, comme celle mesurée chez le rat (Olsen et coll., 2003a). Maestri et coll. (2006) ont mesuré un rapport entre les poumons et le sang de 1,5 à partir d'échantillons humains combinés. Selon les observations, le liquide céphalorachidien (Harada et coll., 2007) et la thyroïde (Pirali et coll., 2009) ne seraient pas des sites de répartition pertinents pour le SPFO.
Le SPFO, comme d'autres composés perfluoroalkyliques, se lie à l'albumine sérique, et dans une moindre mesure, aux globulines γ et α, à l'α-2-macroglobuline, à la transferrine et aux lipoprotéines β (ATSDR, 2009; Butenhoff et coll., 2012a). La liaison du SPFO aux fractions plasmatiques contenant de la lipoprotéine semble être limitée (≤ 9 %) chez l'humain, comme il a été observé dans le cadre d'un examen in vitro du plasma d'un donneur humain (Butenhoff et coll., 2012a). Il a également été démontré que le SPFO se lie de façon compétitive à la transthyrétine, une protéine de transport des hormones thyroïdiennes de l'humain, avec moins d'un dixième de l'affinité de T4 (Weiss et coll., 2009).
Il a été démontré que le sexe et l'âge influençaient la répartition du SPFO chez les rongeurs et les humains. Des différences liées au sexe ont été observées dans les concentrations sériques maximales de SPFO mesurées chez les rats Sprague-Dawley (dose orale unique de 2 mg/kg); en effet, la concentration était 2,5 fois plus élevée chez les femelles que chez les mâles. Toutefois, aucune différence n'a été relevée à une dose de 15 mg/kg. Chang et coll. (2012) ont également signalé une élimination un peu plus lente du SPFO chez les rates. Après une exposition alimentaire d'une durée de quatre à 14 semaines (0,5, 2,0, 5,0 et 20 ppm dans les aliments), les concentrations de SPFO ont augmenté proportionnellement aux doses cumulatives chez les deux sexes (Seacat et coll., 2003). Les concentrations moyennes dans le sérum des femelles étaient plus élevées d'environ 31 à 42 % que dans celui des mâles, alors que les concentrations dans le foie étaient égales. Liu et coll. (2011) ont signalé différentes répartitions du SPFO selon l'âge chez des souris auxquelles on a administré une seule dose subcutanée (50 mg/kg) au jour postnatal (JPN) 7, 14, 21, 28 ou 35. Les concentrations de SPFO dans le foie ont augmenté selon l'âge d'exposition, alors que les concentrations de SPFO dans le cerveau ont diminué; en effet, les concentrations au JPN 7 étaient deux fois plus élevées que celles au JPN 35. En revanche, les concentrations de SPFO dans le sang ne variaient pas selon l'âge postnatal. Comme il a été décrit précédemment à la section 5.6, l'ECMS a relevé que l'âge et le sexe semblaient influencer les concentrations sériques de SPFO chez les humains. L'effet a également été observé dans des études menées aux États-Unis. On a rapporté que les concentrations sériques de SPFO étaient considérablement plus élevées chez les mâles que chez les femmes, peu importe l'âge, dans la population générale des États-Unis (données du NHANES pour 1999 à 2008). À mesure que l'âge augmentait, la concentration de SPFO augmentait chez les deux sexes; cette augmentation était plus prononcée chez les femmes que chez les hommes (Kato et coll., 2011). Il a été démontré que l'âge et le sexe influençaient les concentrations sanguines de SPFO (concentration sérique de SPFO plus faible chez les femmes que chez les hommes dans le groupe d'âge de 20 à 50 ans). Les saignements menstruaux, ainsi que la gestation et le transfert pendant la lactation, sont une explication plausible (Harada et coll., 2004; Ingelido et coll., 2010). L'analyse des données mère-enfant ont révélé que les concentrations de SPFO étaient en moyenne 42 % plus élevées chez les enfants que chez les mères, et que cette tendance se maintenait jusqu'au moins 19 ans. Les rapports enfant:mère pour le SPFO étaient plus élevés chez les garçons de 5 ans que chez les filles (Mondal et coll., 2012).
L'exposition au SPFO peut se faire par voie transplacentaire et par lactation. Les concentrations de SPFO chez les fœtus et les petits dans le sérum et le cerveau étaient plus élevées que les concentrations maternelles correspondantes dans les rats exposés à une concentration variant de 0,1 à 1,0 mg/kg p.c. par jour, à partir du jour de gestation 20 jusqu'au jour postnatal 21 (Chang et coll., 2009). Les concentrations sériques chez les rats nouveau-nés exposés in utero à une concentration entre 1 et 10 mg/kg p.c. par jour entre les jours de gestation 2 et 21 reflètent la dose administrée aux mères et étaient semblables à celles relevées dans la circulation maternelle au jour de gestation 21 (Lau et coll., 2003). Les concentrations sériques de SPFO chez les souriceaux auxquels on a administré un bolus quotidien par voie orale, à partir du jour de gestation 1 jusqu'au jour 17 (1, 5, 10, 15 ou 20 mg/kg/jour) étaient conformes aux données relevées pour les rats (Thibodeaux et coll., 2003). Chez les humains, il a été observé qu'il y avait une corrélation entre les concentrations de SPFO dans le sang du cordon et celles dans le sérum de la mère (Inoue et coll., 2004; Midasch et coll., 2007; Needham et coll., 2011; Gützkow et coll., 2012a); de plus, il a été remarqué que les concentrations sériques de SPFO de la mère diminuaient tout au long de la grossesse (Fei et coll., 2007). Le SPFO a été mesuré dans des échantillons de lait maternel prélevés à l'échelle mondiale (So et coll., 2006; Kärrman et coll., 2010; Roosens et coll., 2010; Kadar et coll., 2011; Sundström et coll., 2011). Une corrélation a été signalée entre les concentrations de SPFO dans le lait humain et le sérum maternel; les rapports moyens de concentrations entre le lait et le sérum maternels se situaient entre 0,01 et 0,03 (Liu et coll., 2011). Les concentrations de SPFO dans le lait maternel diminuaient lorsque le nombre de bébés allaités par la mère augmentait (Tao et coll., 2008; Kadar et coll., 2011). La plupart des études ont relevé une diminution du SPFO dans le lait maternel (Thomsen et coll., 2010) ou le sérum maternel (von Ehrenstein et coll., 2009; Monroy et coll., 2008) pendant la période de lactation; toutefois, Tao et coll. (2008) ont signalé une tendance à la hausse des concentrations de SPFO dans le lait pendant six mois de lactation.
8.3 Métabolisme
Les données disponibles indiquent que le SPFO n'est pas métabolisé. D'après les données disponibles sur l'APFO, on ne s'attend pas à ce que le métabolisme joue un rôle dans l'élimination du SPFO (Kemper et Nabb, 2005; EFSA, 2008; ATSDR, 2009).
8.4 Excrétion
Des différences remarquables selon l'espèce ont été observées par rapport à la demi-vie d'élimination; le SPFO demeure dans les corps humains pendant une période de temps beaucoup plus importante que dans les autres espèces, y compris les primates non humains, les rats et les souris. Les différences liées à l'espèce et au sexe sont principalement attribuées à la cinétique d'élimination, où, à des doses plus élevées, la cinétique du SPFO chez les rongeurs et les primates ne suit pas un modèle à un compartiment ou un modèle de premier ordre simple (Andersen et coll., 2006). La valeur de demi-vie moyenne arithmétique pour l'élimination du SPFO chez les humains a été calculée à 5,4 ans (IC à 95 % = de 3,9 à 6,9 ans; fourchette = 2,4 à 21,7 ans) d'après des données obtenues à partir de travailleurs retraités (Olsen et coll., 2007); aucune demi-vie ne pouvait être trouvée à partir des études menées sur la population générale. La demi-vie du SPFO chez les animaux varie selon les protocoles expérimentaux, y compris la durée pendant laquelle les animaux ont été suivis, mais se mesure en jours ou en semaines chez les rongeurs, et en mois chez les singes (voir le tableau 1).
Les excrétions urinaires et fécales sont les voies principales d'élimination du SPFO chez les rats (Cui et coll., 2010; Chang et coll., 2012) et les souris (Chang et coll., 2012); la plupart des données indiquent que l'urine est une voie d'excrétion plus importante que les matières fécales. Une exception était la mesure d'une excrétion légèrement plus élevée par la voie fécale que par la voie urinaire chez les rats dans les 48 heures après l'exposition à une seule dose orale de 4,2 mg/kg p.c.; toutefois, l'excrétion était presque trois fois plus élevée dans l'urine dans les 89 jours après une seule dose de 4,2 mg/kg p.c. par voie intraveineuse dans la même étude (Chang et coll., 2012). Le SPFO pourrait faire l'objet d'une recirculation entérohépatique importante avant l'excrétion biliaire et fécale (Harada et coll., 2007; Chang et coll., 2012). La pertinence de la clairance urinaire chez l'humain a été remise en question, comme la clairance rénale du SPFO était considérablement plus faible que chez les animaux (Harada et coll., 2005).
Chez les humains, la perte de sang pendant les menstruations peut contribuer grandement à l'excrétion chez les femmes (Harada et coll., 2005). La lactation peut également être une voie d'excrétion importante chez les femmes (von Ehrenstein, 2009; Kim et coll., 2011a).
| Espèce | Régime de dosage | Demi-vie moyenne (jours) | Référence |
|---|---|---|---|
| Rats | Dose orale unique de 2 mg/kg p.c.; suivi de 24 heures | 3,10Note de bas de page a (M) 1,94 ± 0,13Note de bas de page b (F) |
Chang et coll., 2012 |
| Dose orale unique de 4,2 mg/kg p.c.; suivi de 144 heures | 8,23Note de bas de page a (M) | ||
| Dose unique de 2 mg/kg p.c. par voie intraveineuse; suivi de 24 heures | 7,99 ± 4,94Note de bas de page b (M) 5,62Note de bas de page a (F) |
||
| Dose orale unique de 2 mg/kg p.c.; suivi de ≥ 10 semaines | 38,31 ± 2,32Note de bas de page b (M) 62,30 ± 2,09Note de bas de page b (F) |
||
| Souris | Dose orale unique de 1 mg/kg p.c.; suivi de 20 semaines | 42,81Note de bas de page c (M) 37,80Note de bas de page c (F) |
Chang et coll., 2012 |
| Dose orale unique de 20 mg/kg p.c.; suivi de 20 semaines | 36,42Note de bas de page c (M) 30,45Note de bas de page c (F) |
||
| Singes | Dose unique de 2 mg/kg p.c. par voie intraveineuse; suivi d'un maximum de 161 jours | 132 ± 7Note de bas de page b (M) 110 ± 15Note de bas de page b (F) |
Chang et coll., 2012 |
| Dose orale de 0,15 ou de 0,75 mg/kg p.c. par jour pendant 182 jours | ~200c (M et F) | Seacat et coll., 2002 | |
| Humain | 26 anciens travailleurs, avec une moyenne de 31 années de travail et de 2,6 années de retraite; données sur l'exposition externe non fournies | 1971 (de 1 424 à 2 517)Note de bas de page d | Olsen et coll., 2007 |
8.5 Modèles pharmacocinétiques à base physiologique (PBPK)
Plusieurs modèles avec différentes complexités ont été élaborés pour décrire la cinétique du SPFO chez les animaux de laboratoire et les humains (Andersen et coll., 2006; Tan et coll., 2008; Loccisano et coll., 2011; 2012a; 2012b; 2013). En raison de la nature non linéaire de la pharmacocinétique du SPFO, où une clairance plus rapide est observée à des doses élevées de bolus, des modèles physiologiques peuvent fournir des meilleurs moyens pour évaluer les voies croisées et la dosimétrie d'autres espèces aux fins d'évaluation des risques.
Le premier modèle élaboré pour le SPFO était un modèle pharmacocinétique compartimenté biologique pour les singes, qui comprenait une résorption rénale saturable de SPFO filtré (Andersen et coll., 2006). Des travaux subséquents pour améliorer le modèle comprenaient l'ajout d'un compartiment pour le foie et des caractéristiques temporelles pour la liaison de protéine et le volume de répartition pour correspondre aux donnée cinétiques concernant les doses élevées administrées aux singes et aux rats par voie orale et intraveineuse, ainsi qu'aux données cinétiques concernant l'urine et les selles (Tan et coll., 2008). Des modèles pharmacocinétiques physiologiques (modèles PBPK) pour le SPFO ont été développés pour les rats adultes (Loccisano et coll., 2012a), les singes (Loccisano et coll., 2011) et les humains (Loccisano et coll., 2011) à partir des modèles compartimentés; toutefois, la caractéristique pour la liaison temporelle par rapport au volume de répartition a été enlevée. D'autres modèles de lactation et de grossesse ont été élaborés pour les rats (Loccisano et coll., 2012b) et les humains (Loccisano et coll., 2013). Aucun modèle n'a été élaboré pour les souris, et aucun modèle de grossesse et de lactation n'a été élaboré pour les singes. La structure de base du modèle PBPK était la même pour toutes les trois espèces; toutefois, des modifications temporelles à la physiologie ont été effectuées pour décrire la grossesse et la lactation, et on a ajouté une caractéristique temporelle pour le plasma et la fixation tissulaire. Les modèles comprenaient des compartiments tissulaires pour les intestins (pour les doses orales et alimentaires), pour la peau (modèles pour les humains et les singes seulement; pour les doses orales), le foie, les tissus adipeux, les reins, et les autres tissus du corps regroupés (et non séparés en compartiments abondamment et faiblement perfusés). L'excrétion biliaire et l'élimination fécale de la dose de bolus orale non absorbée ou l'exposition alimentaire ont été ajoutées au modèle du rat; de plus, la version du rat ne comprenait pas un compartiment adipeux (qui a été regroupé au reste du corps) ni un compartiment physiologique pour les intestins, qui été décrit comme un compartiment non physiologique. Le modèle PBPK suppose que seule la fraction sans plasma du SPFO est disponible pour absorption dans les tissus, les excrétions ou la résorption. L'élimination à partir du plasma est décrite comme une filtration glomérulaire de la fraction libre dans un compartiment de filtrat. Le SPFO filtré peut soit être éliminé dans l'urine ou résorbé dans les reins, où il peut retourner à la circulation systémique. Finalement, le modèle du SPFO pour le rat comprenait une liaison aux protéines dans le foie, qui était décrit comme étant saturable. La capacité des modèles à reproduire les données de dosage contrôlées pour les rats (exposition par l'alimentation, par gavage oral et par voie intraveineuse; Loccisano et coll., 2012a) et les singes (exposition par voie intraveineuse et par gavage oral; Loccisano et coll., 2011) était relativement bonne. Aucune donnée de dosage contrôlée n'était disponible pour les humains, mais des données de biosurveillance (pour habituellement une seule occasion) se situaient dans les fourchettes semblables de simulations du modèle (au moyen de concentrations d'eau mesurées pour la population biosurveillée, ainsi que des hypothèses sur les tendances d'ingestion; Loccisano et coll., 2011).
Les modèles de Loccisano pour les humains (2011), les singes (2011) et les rats (2012a) ont été pris en considération aux fins d'utilisation dans la présente évaluation (voir la section 10); de plus, un modèle pour les souris (dérivé du modèle pour les rats, mais qui n'a pas pu être validé) a été utilisé. Des détails supplémentaires sur les modèles utilisés pour cette évaluation, y compris les valeurs utilisées pour chacun des paramètres physiologiques et propres au composé chimique, sont décrits dans l'étude de Campbell et Clewell (2013). L'exposition a été décrite comme une absorption constante de SPFO chez les humains (consommation de 1,5 L d'eau par jour) et le modèle a pu atteindre des conditions d'état stable avant de déterminer la concentration prévue dans l'eau potable, conforme à la mesure de la dose interne. On a utilisé un adulte de 70 kg pour la simulation d'un humain.
Le modèle pharmacocinétique de Andersen et coll. (2006) a été modifié par Wambauh et ses collègues (2013) en ajoutant un compartiment pour les intestins pour l'absorption orale et en précisant une limite supérieure par rapport à la répartition dans les tissus. Les auteurs se sont servis du modèle pour traduire les régimes de doses pour les valeurs LOEL et NOEL ainsi que les valeurs de référence disponibles à partir de 13 études in vivo menées sur le SPFO en mesures de dose interne (surface sous la courbe, moyenne, et concentrations sériques maximales). Les données ont été modélisées pour les macaques de Buffon, les rats Sprague-Dawley et les souris CD-1. Les méthodes bayésiennes ont été utilisées pour modéliser les fourchettes de différents paramètres physiologiques. Wambaugh et coll. (2013) ont relevé une assez bonne concordance entre les concentrations sériques prévues et mesurées (à la fin de l'étude), à l'exception de quelques valeurs aberrantes, et ont observé qu'aucune mesure de dose individuelle ne semblait être préférable pour tous les paramètres néfastes. Les paramètres des doses pour les points de départ (PDD) avaient tendance à être semblables (à l'exception des études immunitaires, qui avaient des PDD plus faibles que les autres paramètres), ce qui indique une uniformité entre les espèces et la plupart des effets néfastes.
L'exposition par inhalation et par voie cutanée découlant du contact avec l'eau potable ne faisait pas partie des voies d'exposition potentielles dans cet effet, comme leur contribution à l'exposition est considérée comme étant négligeable (voir la section 5.7).
8.6 Extrapolation des animaux aux humains
Les extrapolations de l'animal à l'humain sont habituellement traitées après la sélection de PDD possibles, mais on a pris en considération cette extrapolation plus tôt dans l'évaluation du SPFO, comme la grande variabilité entre les espèces peut avoir une incidence sur la sélection de PDD. Les grandes différences par rapport à la clairance du SPFO par les humains et les autres espèces doivent être prises en considération lorsqu'on utilise des études menées chez des animaux comme base pour les évaluations des risques pour la santé humaine. L'application d'approches par défaut pour l'extrapolation de l'animal à l'humain - comme l'utilisation d'un facteur d'incertitude interespèce de 10 ou d'une échelle allométrique – peut ne pas être suffisamment protectrice des humains, qui ont une exposition interne des tissus cibles plus longue. Pour cette raison, des approches propres au composé chimique qui peuvent tenir compte des différences pharmacocinétiques interespèces et du comportement non linéaire du SPFO ont été prises en considération pour l'évaluation des risques. Ces approches comprennent l'application de facteur d'ajustement propre aux substances chimiques (FASC) et des modèles PBPK. Une discussion et l'application de chacune de ces approches sont présentées ci-après, et des renseignements supplémentaires peuvent être consultés dans un rapport préparé pour Santé Canada par Summit Technology (2015).
8.6.1 Calcul des FASC
Un grand avantage de l'application de FASC par rapport à des facteurs d'incertitude ou d'échelle allométrique par défaut est que l'approche incorpore des données propres à l'espèce ainsi que des données propres au composé chimique. En dépit de cette force, cette approche se fie à des valeurs uniques représentatives des éléments pharmacocinétiques chez les espèces, et ne tient pas nécessairement compte des éléments pharmacocinétiques non linéaires.
Les lignes directrices du PISSC pour le calcul des FASC (PISSC, 2005) ont été appliquées pour déterminer la partie toxicocinétique du facteur d'incertitude interespèce (CAFI). Le PISSC recommande que le facteur d'incertitude interespèce par défaut de 10 soit divisé par des valeurs de 4,0 (100,6) pour la partie toxicocinétique (CAFI) et de 2,5 (100,4) pour la composante toxicodynamique (DAFI). La valeur par défaut CAFI de 4,0 est remplacée par toute valeur CAFI calculée selon des données propres aux produits chimiques (PISSC, 2005). Comme aucune donnée n'était disponible pour évaluer de manière quantitative les différences toxicodynamiques entre les espèces, aucune valeur DAFI n'a été calculée.
Pour calculer la valeur CAFI (p. ex. pour refléter les différences toxicocinétiques interespèces), l'équation suivante a été utilisée :
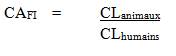
Figure 1 - Équivalent textuel
Le CAFI pour le SPFO est calculé en divisant la clairance chez les animaux (CLanimal) par la clairance chez les humains (CLhumain).
où :
- CAFI est la composante toxicocinétique du facteur d'incertitude interespèce;
- CL est la clairance chez les animaux et les humains (p. ex. mL/kg p.c. par jour).
Toutes les valeurs de clairance des animaux ont été obtenues à partir d'une étude par Chang et coll. (2012). Dans cette étude, des rats Sprague-Dawley, des souris CD-1 et des macaques de Buffon (de 3 à 5 par sexe) ont reçu une seule dose de 1 à 2 mg/kg p.c. (par voie orale pour les rats et les souris, et par voie intraveineuse pour les singes), et ont été suivis pendant ≥ 70 jours. La clairance était beaucoup plus élevée chez les rats mâles que chez les femelles (et diffère de la variabilité sexuelle de l'APFO, où les femelles avaient toujours une clairance plus élevée et une demi-vie plus faible que les mâles); par conséquent, les taux de clairance sont présentés séparément pour chaque sexe. Les taux de clairance pour les singes, les souris, les rats mâles et les rats femelles étaient de 1,38, de 4,72, de 22,24 et de 5,39 mL/j-kg, respectivement.
La clairance n'a pas été mesurée directement chez les humains et doit être calculée selon les estimations de demi-vie, au moyen de l'équation suivante :
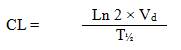
Figure 2 - Équivalent textuel
La CL est calculée en multipliant le logarithme naturel de 2 par le volume de distribution (Vd) et en divisant le résultat par la demi-vie (T1/2) du composé.
où :
- CL est la clairance chez les animaux et les humains (L/kg p.c. par jour).
- ln 2 est le log naturel de 2;
- Vd est le volume de répartition, qui correspond au volume théorique de sang dans lequel une quantité du produit chimique devrait être répartie uniformément pour produire la concentration sanguine observée;
- T½ est la demi-vie d'un composé.
Une demi-vie de 1 971 jours (5,4 ans) a été calculée à partir des diminutions des concentrations sériques de 26 travailleurs précédemment exposés au SPFO au travail, avec une moyenne de 31 ans de travail et de 2,6 ans de retraite (Olsen et coll., 2007). Aucune valeur de demi-vie n'a pu être relevée pour l'exposition de la population générale exposée au SPFO dans l'environnement. Les volumes des valeurs de répartition du SPFO sont habituellement relativement constants parmi les espèces (Thompson et coll., 2010), et une valeur de 200 mL/kg p.c. a été utilisée pour représenter un composé chimique qui se répartit principalement de façon extracellulaire. La clairance obtenue pour les humains, au moyen de l'équation ci-dessus, est de 0,07 mL/j-kg. À l'aide des rapports des valeurs de clairance pour les humains:animaux décrits cidessus, les valeurs CAFI calculées pour le SPFO pour les singes, les souris, les rats mâles et les rats femelles étaient de 19, de 67, de 318 et de 77, respectivement. La clairance a été sélectionnée comme le paramètre de dose pour le calcul des valeurs CAFI car les valeurs pour ces données étaient facilement disponibles pour la plupart des espèces, et pouvait être calculée à partir des données de demi-vie chez les humains. De plus, l'utilisation de la clairance comme paramètre de dose est une hypothèse raisonnable pour les produits chimiques ayant de longues demi-vies. Les analyses préliminaires laissent entendre que les concentrations de pointe pourraient mieux prévoir la toxicité pour certains paramètres nocifs (Haber et coll., 2013). Cette hypothèse n'a pas été étudiée davantage aux fins de la présente analyse, mais l'utilisation de la clairance est considérée comme étant une solution de rechange plus conservatrice que l'utilisation de concentrations de pointe en tant que paramètre de dose pour le calcul de la valeur CAFI. Finalement, on considère habituellement que les rapports des niveaux de clairance sont un point de départ approprié pour le calcul de la valeur CAFI seulement si on suppose que la cinétique de premier ordre s'applique. Toutefois, comme la clairance urinaire du SPFO est complexe, cette hypothèse pourrait ne pas être indiquée.
8.6.2 Modélisation pharmacocinétique physiologique
Une approche typique pour la modélisation pharmacocinétique physiologique consiste à utiliser le modèle pour calculer des PDD pertinents aux humains, qui sont calculés en appliquant un modèle PBPK humain aux paramètres de doses internes (p. ex. concentrations de SPFO dans le plasma) qui ont été calculés ou mesurés dans les animaux. Avec suffisamment de modèles validés, cette approche est considérée comme étant la plus fiable pour effectuer des extrapolations de l'animal à l'humain. Toutefois, seule une confiance moyenne est accordée aux modèles pour les humains, les singes et les rats, car différents codes de modèle ont été utilisés pour différentes espèces, et l'adaptation du modèle à certaines séries de données n'était pas optimale. De plus, la compréhension limitée des raisons pour les différences observées entre les sexes par rapport à la clairance chez les rats signifie qu'il y a des faiblesses concernant la façon dont cette situation sera abordée dans le modèle. Finalement, un inconvénient important de l'utilisation de la démarche axée sur la modélisation pharmacocinétique physiologique est que les modèles humains n'ont pas été entièrement vérifiés. Les données humaines disponibles pour la vérification sont limitées aux études de biosurveillance qui permettent seulement des estimations approximatives des scénarios d'exposition, et pour lesquels les mesures des concentrations sériques étaient habituellement effectuées qu'une seule fois (des mesures ont été effectuées deux fois pour quelques populations). Loccisano et ses collègues n'ont pas élaboré de modèles PBPK pour les souris, mais les démarches axées sur la modélisation de Santé Canada au moyen d'études menées sur les souris ont permis d'adapter les modèles pour les rats au moyen des données sur les souris. Comme les données toxicocinétiques sont insuffisantes pour vérifier si le modèle des souris est approprié, la confiance dans ce modèle est faible. Par conséquent, il n'y a pas suffisamment de confiance pour utiliser des résultats précis découlant du modèle PBPK comme PDD pour les évaluations des risques.
Comme approche alternative à l'utilisation du modèle PBPK pour les calculs des PDD, les rapports des paramètres de doses prévus par le modèle PBPK ont été utilisés pour calculer les valeurs CAFI pour les doses pertinentes. On croit que cette approche donne des estimations plus fiables des valeurs CAFI que les calculs traditionnels décrits à la section 8.6.1, comme elle peut tenir compte de la cinétique non linéaire du SPFO et relever les différentes valeurs à l'état stable pour différentes concentrations de doses orales. En comparaison, les valeurs CAFI calculées ci-dessus dépendent des doses précises et des régimes de doses utilisés dans les études pharmacocinétiques; des incertitudes surviennent par rapport aux valeurs obtenues de ces études, comme les animaux reçoivent seulement des doses uniques, et que les données humaines ne proviennent pas d'études à doses contrôlées. De plus, les valeurs CAFI basées sur la clairance sont des rapports entre de faibles doses chez les humains et des doses élevées chez les animaux, et par conséquent les expositions entre les espèces ne sont pas du même ordre; utiliser le modèle PBPK pour calculer les valeurs CAFI permet une comparaison plus appropriée des doses pour le même ordre d'importance.
Le paramètre de dose sélectionné pour les valeurs CAFI obtenues à partir du modèle PBPK correspondait à des concentrations de SPFO à l'état stable. La concentration à l'état stable a été sélectionnée comme elle est habituellement pertinente pour les produits chimiques ayant des longues demi-vies, et qu'il s'agit d'une hypothèse prudente. Alors que d'autres paramètres de dose – y compris les concentrations de pointe (Haber et coll., 2013) – pourraient mieux permettre de prévoir la toxicité du SPFO pour certains paramètres relatifs aux effets néfastes, des travaux supplémentaires n'ont pas été effectués pour étudier davantage le paramètre de dose le plus indiqué. Le plasma a été sélectionné comme le tissu pertinent pour les concentrations à l'état stable, comme il s'agit d'un paramètre qui agit comme une approximation pertinente pour plusieurs différents organes, car le sang circule dans ces organes. Les concentrations à l'état stable dans le foie ont également été intégrées dans l'évaluation des comparaisons pour les valeurs CAFI basées sur le plasma, comme le foie a été relevé comme un organe principal pour la répartition du SPFO dans les études pharmacocinétiques, et qu'il s'agit également d'un organe cible potentiel pour la toxicité. Toutefois, il y a moins de confiance dans les valeurs basées sur le foie que celles du plasma, comme très peu de données pharmacocinétiques existent pour pouvoir effectuer des vérifications du modèle PBPK quant aux concentrations dans le foie. Les concentrations dans le foie ne pouvaient pas être vérifiées pour les humains, les souris et les singes. Une vérification minime pouvait être effectuée pour les rats, mais comme il y avait seulement des données pour un des deux moments de chaque étude, les comparaisons ne sont pas fiables. De plus, l'utilisation des concentrations dans le plasma comme approximation pour différents organes simplifie l'application des valeurs CAFI dans l'évaluation, qui est déjà complexe en raison de l'utilisation des valeurs CAFI qui sont propres aux espèces et à la dose.
Au moyen des modèles PBPK de Loccisano décrits dans la section 8.5, les concentrations à l'état stable dans le plasma et le foie ont été calculées à différentes doses dans chacune des espèces. Les mêmes doses ont été utilisées pour chacune des espèces. Pour chaque dose exécutée sur le modèle PBPK, les rapports des concentrations de SPFO à l'état stable chez les humains par rapport aux autres espèces ont été calculés pour obtenir les valeurs CAFI propres à la dose et à l'espèce (Summit Toxicology, 2015). Les concentrations à l'état stable et les valeurs CAFI pour le plasma et le foie à des doses potentiellement pertinentes sont présentées dans le tableau 2.
| Mesure | Espèce | Dose orale (mg/kg p.c. par jour) | |||
|---|---|---|---|---|---|
| 0,001 | 0,01 | 0,1 | 1 | ||
| Prévisions de SPFO dans le plasma à l'état stable (µg/mL) | Humain | 5,40 | 53,0 | 360 | 530 |
| Singes | 2,85 | 26,6 | 140 | 239 | |
| Souris | NC Note de bas de page a | NC | 17,1 | 170 | |
| Rats | 0,349 | 3,69 | 36,9 | 368 | |
| Prévisions de SPFO dans le foie à l'état stable (µg/mL) | Humain | 20,1 | 197 | 1 340 | 1 977 |
| Singes | 10,6 | 98,8 | 521 | 894 | |
| Souris | NC | NC | NC | NC | |
| Rats | 4,45 | 20,7 | 195 | 1 935 | |
| Valeurs CAFI calculées à partir des prévisions liées au plasma | SingesNote de bas de page b | 2 | 2 | 3 | 2 |
| SourisNote de bas de page c | NC | NC | 21 | 3 | |
| Rats | 16 | 14 | 10 | 1 | |
| Valeurs CAFI calculées à partir des prévisions liées au foie | SingesNote de bas de page b | 2 | 2 | 3 | 2 |
| SourisNote de bas de page c | NC | NC | NC | NC | |
| Rats | 5 | 10 | 7 | 1 | |
Pour sélectionner la valeur CAFI appropriée pour chaque PDD, le PDD est arrondi à la baisse selon la valeur la plus proche dans la colonne des doses orales (c.-à-d. les valeurs dans le même ordre d'importance sont utilisées). Comme il a été mentionné ci-dessus, il y a un faible niveau de confiance à l'égard du modèle PBPK élaboré pour les souris. Jusqu'à ce qu'un modèle PBPK soit élaboré basé sur les données concernant les souris, il est recommandé d'utiliser les valeurs CAFI établies pour les rats pour les souris (Summit Toxicology, 2015).
8.6.3 Approche recommandée pour l'extrapolation interespèce
L'approche recommandée pour l'extrapolation interespèce est l'utilisation d'un modèle PBPK pour le calcul de la composante CAFI des FASC, au moyen des concentrations plasmatiques à l'état stable comme mesure de dose. L'utilisation de concentrations plasmatiques garantit la pertinence du paramètre de dose par rapport aux effets nocifs qui surviennent dans différents organes. Des paramètres de dose propres à l'organe sont normalement privilégiés par rapport aux valeurs basées sur le sang, lorsqu'ils sont disponibles; toutefois, utiliser les paramètres liés au plasma pour cette évaluation permet une uniformité dans l'application des valeurs CAFI par rapport à une grande variété de paramètres nocifs. Les valeurs CAFI ont été calculées pour les paramètres du foie aux fins de comparaison avec les valeurs du plasma; le comportement du SPFO dans le foie était semblable à celui dans le plasma, et les estimations liées aux valeurs CAFI étaient du même ordre dans les deux compartiments. Ces résultats indiquent que les valeurs plasmatiques sont des indicateurs appropriés à utiliser pour des effets hépatiques nocifs. Les valeurs basées sur le foie chez les rats étaient légèrement plus faibles que les valeurs basées sur le plasma; toutefois, plus de confiance est accordée aux valeurs basées sur le plasma car il y avait plus de données disponibles pour vérifier ce compartiment du modèle PBPK. Les valeurs CAFI propres à la dose et à l'espèce (pour les concentrations dans le plasma à l'état stable) dans le tableau 3 sont appliquées dans les sections 10.1 et 10.2.
Des valeurs CAFI calculées à l'aide du modèle PBPK ont été sélectionnées comme approche recommandée pour cette évaluation, mais plusieurs faiblesses ont été relevées. Tel qu'il est décrit ci-dessus, les valeurs CAFI sont basées sur le plasma plutôt que d'être propres à l'organe. Des concentrations à l'état stable ont également été sélectionnées à titre de paramètres de dose, comme hypothèse prudente pertinente à la nature du composé; des travaux détaillés n'ont pas été effectués pour déterminer si d'autres paramètres de dose (p. ex. des concentrations de pointe) seraient plus appropriés pour les différents paramètres liés aux effets néfastes. Un état stable n'a pas été atteint dans le modèle humain non plus, à des doses inférieures à 0,1 mg/kg p.c. par jour. De plus, aucun modèle PBPK n'a été élaboré précisément pour les souris; les modèles ont plutôt été dérivés de ceux développés pour les rats, sans avoir d'autres données pharmacocinétiques pour les souris aux fins de vérification. Il est donc recommandé d'appliquer les valeurs CAFI établies pour les rats pour les souris, comme il n'y a pas de données solides pour l'espèce. Les valeurs CAFI ont également été calculées à partir des rats mâles seulement, malgré les différences observées entre les sexes pour l'espèce.
En dépit de ces faiblesses, utiliser le modèle PBPK pour calculer la valeur CAFI était jugé comme étant d'une fiabilité égale ou supérieure à d'autres approches d'extrapolation interespèces potentielles. L'approche sélectionnée intègre de manière quantitative les différences pharmacocinétiques entre les espèces, d'une manière qui tient compte de la cinétique non linéaire du SPFO, ce qui ne peut pas être effectué au moyen de l'approche d'établissement des valeurs CAFI par défaut. De plus, les valeurs CAFI calculées au moyen du modèle PBPK ne dépendent pas d'études pharmacocinétiques individuelles qui sont souvent des études à doses uniques qui ne permettent pas une comparaison facile entre les espèces. Une approche idéale pour tenir compte des différences entre les espèces serait d'utiliser les concentrations de SPFO dans le sang – soit en utilisant les modèles pharmacocinétiques pour estimer les concentrations, comme l'ont fait Wambaugh et coll. (2013), soit en utilisant les valeurs précisément mesurées dans les études individuelles – comme PDD pour l'évaluation. Toutefois, les modèles PBPK humains qui seraient utilisés pour l'extrapolation à partir de cette concentration sérique ne peuvent pas être entièrement vérifiés selon les données pharmacocinétiques humaines existantes, ce qui diminue le niveau de confort par rapport à l'utilisation de cette approche pour estimer des PDD précis. L'approche recommandée a été sélectionnée comme une façon de quantifier les différences interespèces tout en tenant compte de la cinétique non linéaire du SPFO, sans se fier sur des estimations précises calculées au moyen du modèle PBPK pour les PDD.
9.0 Effets sur la santé
De nombreuses études ont été menées pour étudier les effets du SPFO sur la santé. Le résumé des publications concernant les effets sur la santé du SPFO est basé sur un examen exhaustif mené par un conseiller (Sanexen Services environnementaux Inc., 2013) et comprend seulement les études directement pertinentes à l'établissement de la valeur basée sur la santé.
9.1 Effets sur la santé humaine
9.1.1 Toxicité aiguë
Aucune donnée épidémiologique concernant la toxicité aiguë ou à court terme du SPFO n'a été relevée.
9.1.2 Toxicité subchronique et chronique
De nombreuses études épidémiologiques de qualité ont été effectuées. De grandes cohortes de travailleurs et de populations exposées à la substance dans l'environnement ont fait l'objet de suivis; on a observé des corrélations importantes entre l'exposition au SPFO et les taux de lipides, les fonctions hépatique et thyroïde, la santé reproductive (fécondité, âge de puberté, et qualité du sperme), ainsi que des effets immunologiques et des effets sur le développement (poids de naissance). En dépit du fait que toutes ces études ont des limites dans une certaine mesure, y compris par rapport à la conception de l'étude, et aux facteurs de biais et de confusion, le poids de la preuve en ce qui concerne les humains fournit un argument solide selon lequel le composé aurait des effets néfastes sur la santé. Cette information devrait appuyer le choix d'un paramètre de santé; toutefois, établir une dose d'exposition sécuritaire selon les études chez les humains demeure problématique en raison de la difficulté à caractériser une tendance dose-réponse au moyen des études actuelles. Leur utilisation dans la présente évaluation est importante pour vérifier la pertinence de l'extrapolation de l'animal à l'humain, et la surveillance des études futures aidera à déterminer l'exactitude des associations observées.
La plupart des études environnementales parmi les populations exposées aux APFA ont été menées dans la Mid-Ohio River Valley, dans le cadre de l'initiative C8 Science Project. Le C8 Science Panel a été mis en place à la suite du règlement d'un recours collectif contre DuPont, et est composé d'épidémiologistes indépendants choisis conjointement par les avocats de la communauté et de DuPont. Le C8 Health Project est la plus grande étude d'une population exposée aux acides perfluoroalkyliques (APFA) dans l'eau potable, et comprend les résidents des communautés d'Ohio et de la Virginie-Occidentale à proximité de l'établissement Washington Works de l'entreprise DuPont. L'enquête sur la santé a été menée en 2005-2006, sur environ 69 000 individus, y compris des enfants et des adultes. Parmi les différents APFA, la communauté avait principalement été exposée à l'APFO – les concentrations sériques médianes de SPFO dans cette population étaient de 20,2 ng/mL par rapport à 17,5 ng/mL dans la population générale aux États-Unis pendant la même période (Frisbee et coll., 2009). Des études longitudinales et prospectives ont également été menées auprès de cette population après une période de suivi. Certaines données récentes du projet qui n'ont pas encore été publiées dans des publications évaluées par les pairs – ainsi que des conclusions du groupe d'experts et des renseignements supplémentaires sur les membres du groupe – sont disponibles sur le site Web du C8 Science Panel (www.c8sciencepanel.org/panel.html).
9.1.2.1 Effets sur le foie
Une certaine corrélation entre l'exposition au SPFO et une altération des enzymes hépatiques a été observée, mais aucune tendance claire n'a été définie. Une étude transversale n'a relevé aucun lien entre les concentrations sériques de SPFO (fourchette de 20 à 2 110 ng/mL) chez les employés de 3M à Cottage Grove (Minnesota) qui ont participé à l'examen de surveillance médicale (70 % d'entre eux étaient admissibles à l'étude) et les paramètres hépatiques (les données n'étaient pas présentées dans le rapport; Olsen et coll., 2003b). Dans une autre étude transversale, un faible lien linéaire a été observé entre les concentrations de SPFO et celles d'alanine aminotransférase (ALT) chez les participants du projet C8 (Gallo et coll., 2012). Toutefois, l'importance clinique de la faible magnitude de l'augmentation de l'ALT n'est pas connue. Une étude d'exposition professionnelle a comparé les enzymes hépatiques avant et après la démolition des installations de fabrication. Une association importante a été relevée entre le SPFO et une diminution des concentrations d'ALT chez les travailleurs ayant des concentrations de SPFO de base semblables à celle de la population générale. Aucun lien n'a été relevé entre le SPFO et la bilirubine totale, l'AP ou l'AST (Olsen et coll., 2012). Dans l'ensemble, on ne peut pas tirer de conclusion définitive sur la toxicité hépatique en raison des limites de l'étude et de la faible magnitude des modifications enzymatiques.
9.1.2.2 Effet immunosuppresseur
Les études dans les populations exposées à la substance dans l'environnement ont relevé des liens entre les concentrations de SPFO et la diminution des anticorps contre différentes maladies, mais l'influence de l'exposition au SPFO sur l'immunosuppression clinique (c.-à-d. l'incidence de maladies) semble être plus vague. Une étude chez les enfants a trouvé une relation inverse dans la réponse immunitaire après l'exposition aux APFA (Grandjean et coll., 2012; Grandjean et Budtz-Jørgensen, 2013), et les concentrations de SPFO dans le cordon maternel étaient corrélées négativement avec les concentrations d'anticorps contre la diphtérie à l'âge de cinq ans. De plus, on a observé que les enfants de cette population avaient des risques accrus de ne pas atteindre les niveaux protecteurs d'anticorps contre la diphtérie après la vaccination à sept ans (Grandjean et coll., 2012). La nature prospective de l'étude, la taille de l'échantillon, le faible risque de biais quant à la sélection des participants et les objectifs définis font en sorte que les résultats soient pertinents à la population étudiée; toutefois, la pertinence à d'autres populations est douteuse, comme l'exposition accrue à d'autres agents immunosuppresseurs qui existe dans cette région (îles Féroé) n'a pas été considérée dans l'étude. Une exposition accrue au SPFO a également été associée à une diminution des anticorps contre la rubéole chez les enfants selon une cohorte prospective d'enfants de femmes enceintes de la Norvège (2007-2008; Granum et coll., 2013). En revanche, l'exposition prénatale au SPFO n'a pas été associée à des hospitalisations pour des infections dans une cohorte danoise (1996-2002; Fei et coll., 2010a), ni à des épisodes du rhume, de la gastroentérite, d'eczéma ou d'asthme dans la cohorte norvégienne susmentionnée (Granum et coll., 2013). Dans une étude menée sur une cohorte taïwanaise, la concentration sérique médiane du SPFO était considérablement plus élevée chez les enfants asthmatiques (Dong et coll., 2013), et une corrélation positive a été établie entre l'exposition prénatale au SPFO et les niveaux d'IgE dans le sang du cordon, particulièrement chez les garçons; toutefois, il n'y avait aucune association avec les dermatites atopiques (Wang et coll., 2011b). Les niveaux d'IgE dans le sang du cordon, les allergies alimentaires, l'eczéma, la respiration sifflante ou les otites moyennes n'étaient pas associés aux concentrations maternelles de SPFO chez les nourrissons de sexe féminin dans une étude de cohorte prospective de femmes enceintes menée de 2002 à 2005 au Japon (Okada et coll., 2012).
Des effets sur la réponse des anticorps ont été observés, mais des résultats contradictoires étaient courants dans l'ensemble de données, qui demeure relativement petit. L'uniformité était faible à l'échelle des études; on a relevé notamment des écarts entre les sexes, les immunoglobulines microbiennes précises, les infections, l'exposition de la mère par rapport à l'enfant, et l'âge des enfants. De plus, les risques de confusion résiduelle, de biais et de chance ne peuvent pas être éliminés. Ces défauts entravent l'établissement d'une conclusion quant au mécanisme de causalité et la nature de l'association demeure floue.
9.1.2.3 Lipidémie
Des associations importantes entre le SPFO, l'augmentation du cholestérol total, et la modification des autres paramètres lipidiques ont été signalées. Une étude transversale n'a relevé aucun lien entre les concentrations sériques de SPFO (fourchette de 20 à 2 110 ng/mL) chez les employés de 3M à Cottage Grove (Minnesota) qui ont participé à l'examen de surveillance médicale (70 % d'entre eux étaient admissibles à l'étude) et les paramètres lipidiques (les données n'étaient pas présentées dans le rapport; Olsen et coll., 2003b). Une interprétation prudente est nécessaire, car les données pour ces résultats n'ont pas été publiées. Une étude longitudinale menée chez des travailleurs qui ont pris part à la démolition d'installations de fabrication de substances perfluoroalkyliques n'a trouvé aucun lien évident entre les concentrations de SPFO et les lipides sériques, alors qu'un certain lien a été relevé entre le SPFO et un taux de cholestérol HDL accru (Olsen et coll., 2012). Les limites comprennent entre autres l'auto-déclaration des caractéristiques des employés, le faible taux de participation, la possibilité d'exposition à d'autres contaminants, et les temps de suivi relativement courts. En revanche, une étude transversale non publiée a relevé des taux de cholestérol HDL plus faibles chez les employés mâles ayant les concentrations sériques de SPFO les plus élevées. Une autre étude longitudinale menée sur 560 adultes (en 2005-2006, avec un suivi effectué en 2010) a relevé une diminution des taux du cholestérol LDL et du cholestérol total lorsque les concentrations sériques de SPFO étaient moins élevées (aucun changement pour les taux HDL ou TG) (FitzSimon et coll., 2013). L'importance clinique est incertaine, en raison du faible nombre de participants passant des catégories de cholestérol élevé à normal, le mode d'action inconnu, et la faible magnitude des changements. Des études transversales effectuées dans le cadre du C8 Health Projet ont trouvé des tendances à la hausse pour le cholestérol total, le cholestérol LDL et les triglycérides, ainsi que pour le rapport entre le cholestérol total et le cholestérol HDL à une concentration de SPFO plus élevée (Steenland et coll., 2009; Frisbee et coll., 2010). Une étude transversale de la population générale des États-Unis a indiqué que les adultes dans le quartile le plus élevé pour les concentrations sériques de SPFO avaient des taux TC plus élevés que ceux dans le quartile le plus faible (aucun lien pour le taux LDL sérique) (Nelson et coll., 2010). Dans une autre étude transversale menée auprès d'Inuits du Nunavik, une association négative a été observée entre les concentrations de SPFO dans le plasma et les triglycérides et le rapport entre le cholestérol total et le cholestérol HDL, alors qu'une association positive a été relevée avec les taux HDL (Château-Degat et coll., 2010). L'importance clinique de très petites modifications des taux de cholestérol est floue. Une exposition accrue au SPFO a également entraîné une augmentation de l'acide urique dans deux études d'exposition professionnelle et une étude auprès de la population générale (examiné par Steenland et coll., 2010). En général, des liens ont été relevés entre le SPFO et des modifications des paramètres lipidiques; toutefois, les conclusions sont limitées par le manque d'uniformité à l'échelle des études, la conception des études, la possibilité de biais quant à la sélection des participants, et les découvertes accidentelles découlant du nombre élevé de tests effectués.
9.1.2.4 Perturbation thyroïdale
Des effets non uniformes sur les concentrations d'hormones thyroïdales ont été observés dans les populations exposées au SPFO. Une étude transversale n'a relevé aucun lien entre les concentrations sériques de SPFO (fourchette de 20 à 2 110 ng/mL) chez les employés de 3M à Cottage Grove (Minnesota) qui ont participé à l'examen de surveillance médicale (70 % d'entre eux étaient admissibles à l'étude) et les paramètres thyroïdiens (les données n'étaient pas présentées dans le rapport; Olsen et coll., 2003b). Une étude transversale de la population générale (C8 Health Project) a indiqué que le SPFO était associé à une augmentation des concentrations sériques de T4 total (TT4) et une diminution de l'absorption de T3 chez les deux sexes (Knox et coll., 2011a). L'association entre le SPFO, la concentration sérique de TT4 et l'absorption de T3 était plus forte chez les femmes, mais plus faible chez les hommes pour l'albumine sérique. Une autre étude transversale menée chez les enfants inscrits au C8 Health Project a relevé une association positive entre les concentrations sériques de SPFO et une augmentation des taux de TT4 (LopezEspinosa et coll., 2012). Les concentrations sériques de SPFO n'étaient pas associées à une prévalence de troubles thyroïdiens dans une analyse transversale de la population générale des États-Unis (Melzer et coll., 2010). Toutefois, il était plus probable que les hommes du quartile supérieur de concentration de SPFO signalent un trouble thyroïden (traité) actuel. Une étude transversale menée auprès de la population inuite du Nunavik a trouvé des associations négatives entre les taux sériques de SPFO et les taux sériques de TSH, T3 et de globulines fixant la thyroxine, et une association positive entre les taux sériques de SPFO et les concentrations sériques de T4 libres (Dallaire et coll., 2009). Une étude cas/témoins appariée n'a trouvé aucun lien entre l'exposition environnementale au SPFO et l'hypothyroïdie (concentrations de TSH et de T4 libres) chez des femmes enceintes à Edmonton, au Canada (Chan et coll., 2011). Une corrélation négative a été trouvée entre les concentrations de SPFO dans le sérum fœtal et maternel, et les taux de T3 dans la population générale en Corée du Sud (Kim et coll., 2011a). Aucun lien n'a été trouvé entre le SPFO et les taux de TSH dans une petite population de baudroies à New York (Bloom et coll., 2010).
Des liens ont été observés entre les concentrations sériques de SPFO et les taux de TT4, de T4 libres, de T3 et de TSH, mais aucune tendance claire pour les modifications à l'hormone thyroïdale liée à l'exposition au SPFO ne peut être établie car les résultats sont équivoques, il n'était pas possible de calculer l'exposition cumulative, les individus ayant des troubles thyroïdaux étaient exclus, ce qui a possible créé un biais au niveau des résultats, et la temporalité ne peut pas être établie avec la conception de l'étude transversale.
9.1.2.5 Effets sur les reins
Un risque accru de maladie du rein chronique (diminution du taux de filtration glomérulaire estimé) a été signalé dans une étude transversale de la population générale des ÉtatsUnis (Shankar et coll., 2011). Il sera difficile d'établir la causalité pour les effets néfastes sur les reins, comme une modification de la fonction rénale pourrait entraîner une augmentation des concentrations sériques de SPFO.
9.1.3 Cancérogénicité
Certaines associations ont été observées entre le SPFO et le risque de cancer de la vessie, du sein, des organes reproducteurs mâles, et de l'ensemble des cancers; toutefois, les données n'appuient pas la cancérogénicité du SPFO. Dans le cadre d'une étude occupationnelle, il a été trouvé que des travailleurs exposés aux acides perfluoroalkyliques (n = 2 083) étaient plus à risque de mourir d'un cancer de la vessie, dans la ville de Decatur, en Alabama (Alexander et coll., 2003). Toutefois, les auteurs ont signalé qu'il était difficile de tirer des conclusions définitives comme il y avait seulement trois cas de cancer de la vessie et que les travailleurs étaient exposés à plusieurs composés simultanément (tous les trois cas étaient des travailleurs de production considérés comme ayant une forte exposition au SPFO, et qui avaient aussi travaillé à l'incinérateur de l'installation ou à la usine de traitement de l'eau). De plus, aucun ajustement n'a été effectué pour la race, la consommation de tabac et d'autres contaminants. L'exposition était basée sur les catégories d'emploi. Les personnes atteintes du cancer de vessie n'étaient pas celles ayant l'exposition la plus élevée. De plus, il y avait un risque de biais quant à la sélection des participants, ce qui diminuait la crédibilité des résultats. Dans une étude de suivi, aucun lien n'a été relevé entre l'exposition au SPFO et un risque accru de cancer de la vessie (Alexander and Olsen, 2007). Dans une analyse antérieure de la même cohorte, les risques d'épisodes de soins médicaux pour l'ensemble des cancers et les cancers des organes reproducteurs mâles étaient plus élevés chez le groupe d'employés ayant les expositions les plus élevées et les plus longues aux produits chimiques fluorés (Olsen et coll., 2001). Une étude prospective de cohorte a été menée auprès de la population générale du Danemark pour étudier un lien possible entre l'exposition au SPFO et le risque de cancer (Eriksen et coll., 2009). Aucune corrélation importante n'a été relevée entre les concentrations sériques de SPFO et l'incidence de cancer de la prostate, de la vessie, du pancréas et de foie à l'échelle de quartiles de SPFO sérique. Des preuves d'un lien entre le SPFO et le cancer du sein ont été trouvées dans une petite étude cas-témoin menée chez des femmes inuites du Groenland. Toutefois, compte tenu du fait qu'il y avait une augmentation du risque du cancer du sein en lien avec plusieurs produits chimiques, la confusion par d'autres composés ou groupes chimiques peut avoir joué un rôle dans l'association observée (Bonefeld-Jorgensen et coll., 2011).
Même si certaines indications d'un lien entre le SPFO et le risque du cancer ont été observées, les effets étaient équivoques, et aucune tendance évidente ne pouvait être relevée en raison des limitations des études (petit nombre de cas, facteur de confusion et biais quant à la sélection des participants).
9.1.4 Toxicité pour le développement et la reproduction
Des études épidémiologiques récentes ont observé des effets sur le poids de naissance, les étapes du développement, les hormones thyroïdales, le système immunitaire, la fécondité, et l'âge de puberté, ce qui indique que le fœtus, les nouveau-nés et les jeunes enfants peuvent être perçus comme des sous-populations vulnérables à l'exposition prénatale et en début de vie au SPFO (Apelberg et coll., 2007; Stein et coll., 2009; Washino et coll., 2009; Andersen et coll., 2010; Hoffman et coll., 2010; Gump et coll., 2011; Stein and Savitz, 2011; Maisonet et coll., 2012).
9.1.4.1 Toxicité pour le développement
Des associations inverses entre l'exposition au SPFO en début de grossesse et le poids de naissance ont été signalées dans différentes études auprès d'une population générale. Une étude transversale menée par le C8 Science Panel a trouvé un lien entre les concentrations sériques de SPFO et un faible poids de naissance à des concentrations de SPFO au-delà de la valeur médiane (Stein et coll., 2009). Un poids de naissance plus faible et un poids plus élevé à 20 mois ont été observés chez les filles nées de mères ayant une concentration de SPFO prénatale plus élevée (les mères étaient sélectionnées au départ pour une étude cas-témoins hiérarchique de développement pubère chez des mères inscrites à l'étude Avon Longitudinal study of Parents and Children in Great Britain [ALSPAC]) (Maisonet et coll., 2012). Toutefois, les résultats étaient peu précis
(–140 g, CI de 95 %: –238 à –42). De plus, l'analyse d'une étude de cohorte prospective au Japon (n = 230) a indiqué que le poids de naissance de femelles nouveau-nées présentait une corrélation négative avec l'exposition prénatale au SPFO après l'ajustement de plusieurs covariables (Washino et coll., 2009). Encore une fois, les résultats étaient peu précis en raison de la grande variabilité de l'ensemble de données (il a été estimé que le poids des nouveau-nés était inférieur de 269 g, avec un IC de 95 % variant de 73 à 466), d'un faible taux de participation (29 %) et de la possibilité d'erreurs de mesure (comme il a été suggéré par les auteurs). Des associations négatives faibles mais significatives ont été observées par rapport à la circonférence de la tête, à l'index pondéral, et au poids de naissance dans une étude transversale de la population générale à Baltimore, au Maryland (Apelberg et coll., 2007). En revanche, aucune association n'a été relevée entre les concentrations maternelles de SPFO et les indicateurs de croissance fœtale mesurés (poids placentaire, longueur à la naissance et circonférences de la tête et de l'abdomen) dans un échantillon aléatoire de femmes et de leurs enfants dans la cohorte de naissance nationale du Danemark. (Fei et coll., 2008b). D'autres études sur la population générale au Canada et au Danemark n'ont relevé aucun lien entre les concentrations sériques maternelles de SPFO et le poids de naissance (Fei et coll., 2007; Monroy et coll., 2008; Hamm et coll., 2010). Les acides perfluoroalkyliques (y compris le SPFO) n'étaient pas associés à l'IMC ni à la circonférence de la taille dans une étude de cohorte prospective ayant un suivi à long terme (20 ans) chez des femmes enceintes recrutées dans le cadre de la cohorte de naissance nationale du Danemark, ainsi que chez leurs enfants des deux sexes (Halldorsson et coll., 2012).
Les effets sur le développement provoqués par le SPFO sur la thyroïde et le comportement neurologique ont également été étudiés. Une corrélation négative entre les concentrations maternelles sériques de SPFO et les concentrations fœtale de T3 a été relevée dans une petite étude transversale de la Corée du Sud (mais aucun lien n'a été trouvé par rapport aux taux de TSH et de TT4, ni au poids de naissance) (Kim et coll., 2011a). Dans la population générale des ÉtatsUnis, il y avait un plus grand risque de déclaration parentale d'un diagnostic d'un trouble déficitaire de l'attention avec hyperactivité (TDAH) à des concentrations plus élevées de SPFO chez les enfants de 12 à 15 ans (Hoffman et coll., 2010). Dans une étude transversale menée dans le cadre du C8 Health Project, aucun lien n'a été trouvé entre le SPFO et la prévalence de parents qui ont signalé que leur médecin avait diagnostiqué leur enfant avec un TDAH ou qu'un enseignant leur avait dit que leur enfant avait un trouble d'apprentissage (Stein and Savitz, 2011). Aucune association n'a été trouvée entre les concentrations maternelles sériques de SPFO et les étapes de motricité ou de développement (motricité fine et globale, attention, cognition et langage) chez les enfants âgés de 18 mois (Fei et coll., 2008a), ou les problèmes de comportement ou de coordination motrice chez les enfants âgés de sept ans (Fei and Olsen, 2011).
Des effets sur le développement ont été observés dans les études sur la population, mais les preuves qui soutiennent un lien entre l'exposition au SPFO en début de vie et la toxicité développementale sont équivoques car la plupart des études n'étaient pas conçues pour permettre une inférence causale. Les preuves les plus préoccupantes proviennent des études prospectives démontrant un risque accru de modification du poids de naissance en Grande-Bretagne et au Japon; toutefois, l'importance clinique de ces résultats n'est pas claire, et d'autres études de plus grande portée seraient nécessaires pour appuyer les résultats compte tenu de la faible précision de l'estimation ponctuelle, la taille relativement petite des études et les risques de confusion et de biais.
9.1.4.2 Toxicité pour la reproduction
Les résultats principaux des études de cohorte et des études cas-témoins laissent supposer un lien possible entre l'exposition au SPFO et une fécondité réduite ainsi qu'une puberté tardive; toutefois, la qualité des preuves est limitée et insuffisante pour définir la nature de la relation.
Un retard par rapport à l'âge médian de puberté chez les deux sexes a été associé aux concentrations de SPFO dans une étude transversale de personnes âgées de huit à dix-huit ans dans le cadre du C8 Health Project (Lopez-Espinosa et coll., 2011). Les auteurs ont mis en doute l'importance clinique des résultats car l'âge médian de la puberté dans cette étude était semblable à l'âge médian signalé pour la population générale des États-Unis (12,5 par rapport à 12,9 ans), et les mécanismes à l'origine de la puberté tardive ne sont pas clairs. Il a été trouvé que l'exposition in utero au SPFO était légèrement (mais non significativement) associée à des risques accrus de puberté précoce chez les filles participant à la cohorte de l'étude ALSPAC susmentionnée (Christensen et coll., 2011). Les auteurs ont mentionné que les résultats pouvaient être biaisés par la mauvaise classification de l'exposition et la sélection de participants.
Les observations concernant les effets de l'exposition au SPFO sur les paramètres associés aux spermatozoïdes sont contradictoires. Une étude transversale a permis d'observer que les concentrations sériques de SPFO étaient associées à un nombre moins élevé de spermatozoïdes normaux chez des jeunes hommes danois âgés de 18,2 à 25,2 ans (Joensen et coll., 2009). Une tendance vers des concentrations réduites de tous les paramètres associés aux spermatozoïdes (testostérone, androgènes libres, etc.) a également été relevée dans le quartile le plus élevé. Toutefois, il y avait un risque élevé de biais quant à la sélection et de découvertes accidentelles. Une association positive entre les concentrations sériques de SPFO et une faible proportion de spermatozoïdes normaux sur le plan morphologique chez les partenaires de grossesse a été relevée dans les groupes combinés de trois populations du Groenland, de la Pologne et de l'Ukraine (Toft et coll., 2012). Quelques associations positives entre la concentration des spermatozoïdes et le nombre total de spermatozoïdes ont été trouvées dans les analyses basées sur les pays individuels; toutefois, il n'y avait pas de dose-effet global, les résultats sont assujettis au sophisme écologique, et les auteurs ont mentionné qu'il était probable que les résultats étaient attribuables à des découvertes accidentelles. Dans une étude transversale menée chez des hommes de Durham, en Caroline du Nord, une corrélation positive a été trouvée entre les concentrations de SPFO dans le plasma et les taux LH sériques, mais il n'y avait aucune association avec une modification de la qualité du sperme (Raymer et coll., 2012). La concentration maternelle de SPFO à la trentième semaine de grossesse (exposition in utero) n'était pas associée à la qualité du sperme ni aux hormones reproductives sériques chez les enfants mâles de 19 à 21 ans dans une cohorte de femmes enceintes au Danemark (Vested et coll., 2013). En conclusion, aucune tendance évidente d'associations entre les concentrations maternelles de SPFO et la qualité du sperme ne peut être établie en raison des incohérences des études, des limites de la conception, et du risque élevé de biais quant à la sélection de participants.
Un lien entre l'exposition au SPFO et une diminution de la fécondité a été observé; toutefois, les études n'étaient pas fiables et les résultats ne sont pas concluants. Une association a été trouvée entre une diminution de la fécondité (augmentation du délai de conception et menstruations irrégulières) et les concentrations de SPFO dans le plasma de 1 240 femmes primipares ou nullipares de la cohorte de naissance nationale du Danemark; toutefois, l'information pour plusieurs facteurs de confusion a été omise de l'analyse (qualité du sperme, fréquence des relations sexuelles, etc.) (Fei et coll., 2009). Une augmentation des risques relatifs de subfertilité (délai de conception supérieur à 12 mois) a également été signalée dans une étude cas-témoin menée chez des femmes primipares inscrites dans une étude de cohorte norvégienne de mères et d'enfants (aucune association chez les femmes nullipares) (Whitworth et coll., 2012). Le manque d'ajustement pour les facteurs de confusion crée un doute sur la validité de leur observation. Aucune association entre la concentration sérique de SPFO et le délai de conception ou la fécondité n'a été trouvée chez des femmes nullipares dans une étude de cohorte longitudinale au Danemark (Vestergaard et coll., 2012). Dans une étude cas-témoin italienne, les couples touchés par l'infertilité avaient tendance à avoir des concentrations de SPFO plus élevées et à avoir une expression génétique plus élevée de récepteurs nucléaires impliqués dans les métabolismes stéroïdien et xénobiotique; toutefois, le mécanisme d'action demeure incertain (La Rocca et coll., 2012).
L'occurrence de prééclampsie auto-déclarée dans la région de la Mid-Ohio River Valley était associée à une exposition au SPFO au-delà de la valeur médiane; toutefois, les résultats étaient peu précis (Stein et coll., 2009). Une association inverse significative a été trouvée entre le SPFO et les concentrations d'estradiol dans le sérum chez les groupes de femmes en période de périménopause et en ménopause du C8 Health Project; toutefois, la conception de l'étude ne permet pas d'établir la temporalité (Knox et coll., 2011b).
Une étude de cohorte prospective a recruté 1 400 femmes enceintes (de façon aléatoire sur un total de 43 045 femmes) dans la cohorte de naissance nationale du Danemark (DNBC, 1988-1989) et a mesuré la concentration de SPFO dans leur plasma (Fei et coll., 2010b). On a déclaré la durée de l'allaitement six et 18 mois après la naissance par entrevues téléphoniques. Les risques de l'allaitement pendant une plus courte période étaient plus élevés avec des concentrations croissantes de SPFO dans le plasma. Par exemple, les risques (rapport de risque rajusté) d'une durée d'allaitement plus courte (semaines) pour les femmes ayant une concentration de SPFO dans le plasma supérieure à 43,3 ng/mL étaient de 1,4 fois plus élevé (CI de 95 % variant de 1,2 à 1,6) que ceux dont la concentration de SPFO dans le plasma variait de 6,4 à 26,6 ng/mL, après avoir ajusté pour l'âge maternel à l'accouchement, l'IMC avant la grossesse, le statut socioéconomique maternel, la consommation d'alcool et le tabagisme (la tendance pour une augmentation du risque avec une comparaison croissante au quatrième quartile était aussi importante). De plus, les risques (ratio d'incidence rajusté) de sevrage avant l'âge de six mois étaient 1,20 fois plus élevé (CI de 95 % variant de 1,1 à 1,4) pour chaque augmentation de 10 ng/mL de la concentration de SPFO dans le plasma, lorsqu'on limitait le modèle aux femmes multipares (aucune différence significative chez les femmes primipares), après ajustements statistiques. Une association semblable a été observée avec le sevrage avant l'âge de trois mois. Toutefois, des études supplémentaires seraient nécessaires pour appuyer ces résultats, pour plusieurs raisons : les concentrations de SPFO dans le plasma ont été mesurées une seule fois, seulement 18 % des femmes admissibles ont participé à l'étude DNBC, il y avait un risque de biais quant au souvenir du résultat (les mères pourraient ne pas avoir indiqué la bonne date de sevrage), et les auteurs n'ont pas exclu la possibilité qu'une causalité inverse puisse expliquer l'association (compte tenu du fait qu'il est plus probable que les femmes qui ont allaité plus longtemps allaitent plus longtemps leurs prochains bébés, et que le SPFO est excrété dans le lait maternel, ce qui diminue la concentration dans le plasma).
Des corrélations et des associations ont été observées entre le SPFO et une modification du poids de naissance, de la fécondité, de la fertilité, de la qualité du sperme, de la prééclampsie, ainsi qu'une durée d'allaitement plus courte et une modification des hormones thyroïdales. Toutefois, les preuves demeurent insuffisantes pour clarifier la nature de la relation en raison du manque d'uniformité à l'échelle des études, des limites importantes dans la conception de l'étude, et des risques de biais et de confusion.
9.2 Effets sur les animaux de laboratoire
La grande majorité des études sur les animaux ont indiqué que l'exposition au SPFO a été effectuée au moyen du SPFO sous forme de son sel de potassium (K+SPFO), à l'exception des études de Qazi et coll., où on a utilisé le sel de tétraéthylammonium (Qazi et coll., 2010b) ou le sel de tétrabutylammonium (Qazi et coll., 2009b, 2010a) du SPFO. Lorsque le sel précis utilisé dans une étude n'était pas indiqué, on a supposé qu'il s'agissait du sel de potassium, comme c'était le composé le plus couramment utilisé. La plupart des études n'ont pas indiqué si la dose administrée faisait référence au composé K+SPFO ou précisément à l'ion du SPFO; seule une étude (Peden-Adams et coll., 2008) a indiqué que les doses reflétaient la concentration d'ions du SPFO, séparément du sel de potassium. Les résumés mentionnés dans le présent document utilisent les concentrations et les doses indiquées par les auteurs. Cette approche est également utilisée pour les évaluations quantitatives; toutefois, comme l'ion du SPFO contribue à 93 % du poids moléculaire du K+SPFO et est seulement libéré du composé sur exposition, seules des différences quantitatives mineures pourraient découler de l'utilisation du K+SPFO et des doses de SPFO de façon interchangeable.
9.2.1 Toxicité aiguë
Une valeur DL50 orale moyenne de 251 mg/kg p.c. a été calculée pour les rats CD mâles et femelles d'après l'administration d'une seule dose de SPFO (de 100 à 1 000 mg/kg p.c.) par gavage (5/sexe/groupe) (Dean et Jessup, 1978). Une CL50 par inhalation de 5 200 mg/m3 a été déterminée chez les rats Sprague-Dawley (5/sexe/groupe) exposés à la poussière du SPFO dans l'air (de 1 890 à 45 970 mg/m3) pendant une heure (Bio/Dynamics, 1979; Rusch, 1979).
Il a été démontré qu'une exposition orale unique des rongeurs (rats et souris) au SPFO à ≥ 250 mg/kg p.c. causait des convulsions toniques lorsqu'un stimulus ultrasonique était appliqué aux animaux (Sato et coll., 2009). Le SPFO par lui-même n'a pas provoqué de symptômes neurotoxiques, de changements morphologiques ou de modifications physiologiques (concentration d'hormones). L'effet convulsif a été observé à des doses très élevées, mais était considéré comme une neurotoxicité provoquée par le SPFO car le même stimulus ultrasonique n'a pas provoqué de convulsions chez les animaux de contrôle ni chez les animaux traités par APFO.
Aucune irritation de la peau n'a été observée chez des lapins blancs néo-zélandais albinos exposés par voie cutanée au SPFO (Biesemeier et Harris, 1974). Une grave irritation ophtalmologique a été signalée chez les lapins (application occulaire de 0,1 mL, lavage après cinq ou trente secondes) (Riker Laboratories Inc., 1981). D'autres études ont signalé une irritation faible à modérée des yeux après l'exposition oculaire au SPFO (Biesemeier et Harris, 1974; Warf Institute Inc., 1975; Hazleton Laboratories America Inc., 1987; Hazleton Wisconsin Inc., 1994; Corning Hazleton Inc., 1997).
Les études de toxicité aiguë sur les effets concernant le développement du neurocomportement sont abordées dans la section 9.2.5.
9.2.2 Exposition de courte durée
Les études consignant la toxicité du SPFO après une exposition orale de courte durée ont établi quatre cibles principales, c'est-à-dire le système immunitaire, le foie, les lipides sériques et la thyroïde. Le système immunitaire semble être la cible la plus sensible; en effet, il a une LOAEL de 0,00166 mg/kg p.c. par jour et une NOAEL de 0,000166 mg/kg p.c. par jour chez les souris (Peden-Adams et coll., 2008). Les LOAEL les plus faibles pour les effets hépatiques, lipidiques et thyroïdaux étaient de 0,024 mg/kg p.c. par jour (Butenhoff et coll., 2012b), de 0,03 mg/kg p.c. par jour (Seacat et coll., 2002), et de 0,15 mg/kg p.c. par jour (Seacat et coll., 2002), respectivement. Cette section portera principalement sur ces effets clés observés aux plus faibles concentrations, et discutera seulement brièvement des autres types de modifications observées chez les animaux.
9.2.2.1 Effets sur le système immunitaire
Les effets sur le système immunitaire observés aux concentrations les plus faibles tendent à indiquer que l'immunosuppression est l'effet le plus préoccupant. Les études conçues pour déterminer les effets du SPFO sur le système immunitaire ont mesuré la mortalité en raison d'une infection, les changements des niveaux d'immunoglobuline et de cytokine, les niveaux d'activité des cellules immunitaires ainsi que la prolifération et le phénotype des lymphocytes. Dans les études qui n'étaient pas conçues expressément pour étudier les effets immunologiques (c.-à-d. des essais biologiques à doses plus élevées), une diminution du nombre de globules blancs, des modifications du poids des organes et des changements histologiques dans la rate et le thymus étaient les effets néfastes plus généraux relevés par rapport au système immunitaire. Les différents effets sur le système immunitaire ont été déclarés seulement chez les souris et les rats; aucune étude d'immunotoxicité n'a été conçue pour d'autres espèces.
Le PISSC (2012) a présenté un continuum de la solidité de la preuve fourni pour différents types de données qui pourrait laisser supposer l'occurrence d'immunosuppression. Dans les études sur les animaux, les données sur la résistance de l'hôte et la fonction immunitaire (y compris la production d'anticorps et la fonction des cellules tueuses naturelles) fournissent le poids de la preuve le plus solide quant à l'immunotoxicité. Les données provenant des essais d'observation sur le système immunitaire (y compris la prolifération et le phénotype des lymphocytes, et les changements des niveaux de cytokine), ainsi que des preuves de modifications à l'hématologie et à l'histopathologie et au poids des organes, sont toutes classées comme offrant des preuves équivoques d'immunosuppression. Cette section discutera des effets dans l'ordre du poids de la preuve le plus solide au plus faible pour l'immunosuppression. Comme plusieurs études pour le SPFO fournissent des preuves d'une diminution de la résistance de l'hôte et de la fonction immunitaire, l'accent sera principalement mis sur ces études dans cette section.
Une seule étude a examiné les effets du SPFO sur la résistance de l'hôte (c.-à-d. le premier niveau du cadre du PISSC) aux infections. Dans cette étude, les souris B6C3F1 femelles étaient exposées au SPFO à des doses de 0, de 0,005 ou de 0,025 mg/kg p.c. par jour administrées par gavage pendant 21 jours, et étaient ensuite inoculées avec le virus de l'influenza de type A (Guruge et coll., 2009). Une mortalité accrue à la suite du virus de l'influenza de type A a été observée chez les souris exposées à 0,025 mg/kg p.c. par jour. Les souris B6C3F1 semblent être une souche de souris qui est sensible aux effets du SPFO, mais il a été démontré que les souris femelles étaient moins sensibles que les mâles aux autres résultats immunitaires découlant de l'exposition au SPFO.
Le critère d'effet le plus sensible observé dans les études menées chez les animaux dans la catégorie du PISSC concernant les données de la fonction immunitaire était la répression de la réaction de l'antigène thymodépendant pour IgM, en utilisant les globules rouges de mouton comme antigène. La LOAEL la plus faible pour cet effet était de 0,00166 mg/kg p.c. par jour (NOAEL de 0,000166 mg/kg p.c. par jour; Peden-Adams et coll., 2008), et les diminutions semblaient avoir une dépendance évidente à la dose dans la plupart des études. L'effet a été observé aux concentrations les plus faibles chez les souris adultes dans trois études décrites ciaprès :
- À ≥ 0,00166 mg/kg p.c. par jour chez les mâles et à ≥ 0,0166 mg/kg p.c. par jour chez les souris B6C3F1 femelles (n = 5/dose) exposées par gavage oral (doses de K+SPFO : 0, 0,000166, 0,00166, 0,00331, 0,0166, 0,0331 ou 0,166 mg/kg p.c. par jour) pendant 28 jours (Peden-Adams et coll., 2008).
- À ≥ 0,083 mg/kg p.c. par jour chez les souris C57BL/6 mâles (n = 10/dose) exposées par gavage oral (à des doses de 0, de 0,00833, de 0,0833, de 0,417, de 0,833 et de 2,083 mg/kg p.c. par jour) pendant 60 jours (Dong et coll., 2009).
- À ≥ 0,083 mg/kg p.c. par jour chez les souris C57BL/6 mâles (n = 6/dose) exposées par gavage oral (à des doses de 0, de 0,00833, de 0,0167, de 0,0833, de 0,417 et de 0,833 mg/kg p.c. par jour) pendant 60 jours (Dong et coll., 2011).
Des diminutions des anticorps IgM propres aux globules rouges de mouton ont également été observées à 5 mg/kg p.c. par jour (mais non à 1 mg/kg p.c. par jour) chez les souris B6C3F1 mâles exposées au SPFO avant leur naissance, pendant les 17 premiers jours de gestation (Keil et coll., 2008). De plus, des diminutions des concentrations sériques d'IgM non spécifiques ont été observées à ≥ 5 mg/kg p.c. par jour chez les souris C57BL/6 mâles exposées à 5 ou à 20 mg/kg p.c. par jour pendant sept jours (Zheng et coll., 2011).
En revanche, une étude exposant des souris C57BL/6 mâles à 0,25 mg/kg p.c. par jour (au moyen du sel de tétraéthylammonium de SPFO; aucune autre dose n'a été utilisée dans l'étude) pendant 28 jours n'a pas révélé de changements aux niveaux sériques d'IgM contre les globules rouges de mouton ou le TNP–LPS, ni au nombre de cellules spléniques qui secrètent des anticorps IgM contre les globules rouges de mouton (Qazi et coll., 2010b).
Des changements provoqués par le SPFO aux niveaux sériques d'autres immunoglobulines – qui se situent également dans la catégorie des données sur la fonction immunitaire du PISSC – ont été observés à des niveaux d'exposition plus élevés. Contrairement aux taux d'anticorps IgM, les taux IgG et IgE avaient tendance à augmenter après l'exposition au SPFO. Chez les souris C57BL/6 mâles, une augmentation des taux IgE et IgG propres aux globules rouges de mouton a été observée à la dose la plus élevée (0,833 mg/kg p.c. par jour; voir la description plus détaillée de l'étude ci-dessus) (Dong et coll., 2011). Des augmentations du taux sérique IgG total non spécifique ont été observées à 5 mg/kg p.c. par jour – mais non à 20 mg/kg p.c. par jour – chez les souris C57BL/6 mâles exposées au SPFO pendant sept jours (Zheng et coll., 2011). Une étude de rats mâles exposés à des concentrations variant de 0,14 à 6,34 mg/kg p.c. par jour (Lefebvre et coll., 2008) a étudié les effets du SPFO sur différents sous-types IgG; l'étude a relevé une tendance significative à l'égard d'une augmentation des taux sériques IgG2a et IgG2c totaux et une réponse secondaire de l'anticorps IgG thymodépendant (en se servant de l'hémocyanine de patelle [KLH] comme antigène). Le taux IgG1 sérique total était plus faible chez les rats mâles exposés seulement aux deux doses les plus faibles (0,14 et 1,33 mg/kg p.c. par jour).
Le dernier effet de la catégorie des données de la fonction immunitaire du PISSC concernait les modifications de l'activité des cellules tueuses naturelles (NK) spléniques; on a observé une modification de cette activité chez des souris dans les études décrites ci-dessus. Il y avait tendance à avoir une augmentation de l'activité à des faibles doses, et une diminution à des doses élevées. Une diminution de l'activité des cellules tueuses naturelles a été observée chez les souris B6C3F1 mâles exposées à des doses allant de 0,0166 à 0,166 mg/kg p.c. par jour (Peden-Adams et coll., 2008). Dans l'étude de Dong et coll. (2009), des changements non monotones à l'activité ont été observés chez les souris C57BL/6 mâles; on a relevé des augmentations à 0,083 mg/kg p.c. par jour, aucun effet à 0,417 mg/kg p.c. par jour, et des diminutions à 0,833 et à 2,083 mg/kg p.c. par jour. L'activité des cellules tueuses naturelles spléniques était moins élevée chez les souris mâles exposées avant la naissance à ≥ 1 mg/kg p.c. par jour (Keil et coll., 2008) et chez les souris mâles adultes exposées à ≥ 20 mg/kg p.c. par jour pendant sept jours (Zheng et coll., 2009). Chez les souris femelles, aucun changement d'activité n'a été observé à des doses allant jusqu'à 0,166 mg/kg p.c. par jour (Peden-Adams et coll., 2008), mais une diminution de l'activité des cellules tueuses naturelles a été observée chez celles exposées avant la naissance à 5 mg/kg p.c. par jour (Keil et coll., 2008).
Des effets immunologiques supplémentaires observés dans des études sur l'exposition au SPFO ont été décrits par le PISSC comme des types de données qui fournissent seulement des preuves équivoques d'immunosuppression. Bien que les données appuient la suppression immunitaire provoquée par le SPFO décrites ci-dessus, elles sont seulement présentées brièvement car elles ne sont pas suffisamment fiables pour être utilisées comme base pour l'établissement d'une recommandation sur la qualité de l'eau potable. Les effets observés étaient les suivants (les classifications du PISSC sont indiquées entre parenthèses) :
- Modifications des sous-populations des cellules B et T, et présence de cellules antigènes dans la rate et le thymus des souris mâles et femelles, à la LOAEL la plus faible de 0,00331 mg/kg p.c. par jour (Keil et coll., 2008; Peden-Adams et coll., 2008; Dong et coll., 2009; Qazi et coll., 2009b; Zheng et coll., 2009). Aucun effet sur le phénotype sanguin des lymphocytes n'a été observé chez les rats exposés à ≤ 7,58 mg/kg p.c. par jour (Lefebvre et coll., 2008) (essais observationnels sur le système immunitaire).
- Modifications des concentrations de différentes cytokines dans les souris mâles et femelles, à une plus faible LOAEL de 0,0031 mg/kg p.c. par jour (Qazi et coll., 2010a; Dong et coll., 2011, 2012b; Fair et coll., 2011; Mollenhauer et coll., 2011; Zheng et coll., 2011). Selon la description de Zheng et coll. (2011) et de Dong et coll. (2011) concernant la nature des effets, il semblerait que la substance crée une réaction excessive de Type 1 et une réaction insuffisante de Type 2 (c.-à-d. une prépondérance d'immunité humorale et une lacune de l'immunité à médiation cellulaire, ce qui peut diminuer la capacité à lutter contre les pathogènes intracellulaires et les cellules cancéreuses [Guruge et coll., 2009; Zheng et coll., 2011]) (essais observationnels sur le système immunitaire)
- Diminution de la cellularité et prolifération des lymphocytes chez les souris mâles, à une LOAEL la plus faible de 0,417 mg/kg p.c. par jour (Dong et coll., 2009, 2012b; Qazi et coll., 2009b) (essais observationnels sur le système immunitaire).
- Diminution du nombre de leucocytes chez les rats à ≥ 6 mg/kg p.c. par jour (Goldenthal et coll., 1978a) (données hématologiques).
- Preuves d'une augmentation de l'apoptose dans la rate et le thymus, à ≥ 0,0833 mg/kg p.c. par jour chez les souris (Wang et coll., 2011b; Dong et coll., 2012a; Zhang et coll., 2013) et à ≥ 3,21 mg/kg p.c. par jour chez les rats (Lefebvre et coll., 2008) (données histopathologiques).
- Effets histologiques dans le thymus et la rate à ≥ 5 mg/kg p.c. par jour chez les souris (Qazi et coll., 2009b; Wang et coll., 2011b; Zhang et coll., 2013) et à ≥ 18 mg/kg p.c. par jour chez les rats (Goldenthal et coll., 1978a; Cui et coll., 2009) (données histopathologiques).
- Diminution du poids absolu ou relatif du thymus et de la rate à ≥ 0,417 mg/kg p.c. par jour chez les souris mâles (Dong et coll., 2009, 2012a; Qazi et coll., 2009b; Zheng et coll., 2009, 2011) et à 0,984 mg/kg p.c. par jour chez les rats mâles (Butenhoff et coll., 2012b) (données sur le poids des organes).
- Augmentation de la corticostérone sérique chez les souris mâles à 0,25 mg/kg p.c. par jour (Qazi et coll., 2010b) et à ≥ 20 mg/kg p.c. par jour (Zheng et coll., 2009, 2011), mais pas à ≤ 0,833 mg/kg p.c. par jour (Dong et coll., 2011) (données à l'appui, mais non classifiées par le PISSC).
La sensibilité aux effets immunologiques semble dépendre de plusieurs facteurs. L'influence des espèces sur les effets est difficile à déterminer, comme une seule étude chez les rats était précisément conçue pour mesurer les effets immunitaires (Lefebvre et coll., 2008); toutefois, la NOAEL dans l'étude était de plusieurs ordres de magnitude plus élevée que certaines des LOAEL des études menées sur des souris (PedenAdams et coll., 2008; Dong et coll., 2009, 2011). Même au sein d'une même espèce, des différences de sensibilité peuvent survenir entre les souches – des effets sur les taux IgM propres aux globules rouges de mouton et sur l'activité des cellules tueuses naturelles spléniques ont été observés à des plus faibles concentrations chez les souris B6C3F1 (Peden-Adams et coll., 2008) que chez les souris C57BL/6 (Dong et coll., 2009, 2011), même après une durée d'exposition plus courte (28 jours par rapport à 60 jours). De plus, ces effets ont été observés à des concentrations moins élevées chez les mâles que chez les femelles (Peden-Adams et coll., 2008). Toutefois, rien n'indique que les souris exposées avant la naissance sont plus sensibles aux effets immunologiques que les adultes, comme les modifications de la réponse IgM propre aux globules rouges de mouton et de l'activité des cellules tueuses naturelles spléniques n'ont pas été observées à ≤ 1 mg/kg p.c. par jour chez les souris mâles exposées in utero au SPFO pendant les 17 premiers jours de gestation (Keil et coll., 2008), alors que la LOAEL pour ces effets était de < 0,1 mg/kg p.c. par jour chez les souris adultes (Peden-Adams et coll., 2008; Dong et coll., 2009, 2011).
9.2.2.2 Effets hépatiques
Les effets hépatiques qui sont survenus aux concentrations les plus faibles dans les études à court terme étaient des augmentations du poids du foie. Des modifications histologiques dans le foie et des augmentations des enzymes sériques qui indiquent des effets hépatiques néfastes ont également été observés à des concentrations plus élevées.
Une augmentation du poids du foie (absolu ou relatif) a été observée dans des études de différentes durées; les plus faibles LOAEL étaient :
- 0,0833 mg/kg p.c. par jour chez des souris C57Bl/6 (10/dose) exposées par gavage pendant 60 jours à 0,00833, à 0,0833, à 0,417, à 0,833 et à 2,083 mg/kg p.c. par jour (Dong et coll., 2009). L'effet a également été observé à des doses plus élevées dans plusieurs autres études menées chez les souris (Thibodeaux et coll., 2003; Yahia et coll., 2008; Era et coll., 2009; Qazi et coll., 2009b, 2010a, 2010b; Zheng et coll., 2009, 2011; Dong et coll., 2011, 2012a; Wan et coll., 2011; Wang et coll., 2011b; Zhang et coll., 2013). En revanche, aucune augmentation du poids du foie n'a été observée chez des souris exposées à une dose allant jusqu'à 0,166 mg/kg p.c. par jour pendant 28 jours (Fair et coll., 2011), à 10 mg/kg p.c. par jour pendant sept jours (Wan et coll., 2011); ou à 10,5 mg/kg p.c. par jour pendant quatre jours (Abbott et coll., 2009);
- à 0,15 mg/kg p.c. par jour chez les rats femelles Sprague-Dawley et à 1,33 mg/kg p.c. par jour chez les rats mâles Sprague-Dawley (15/groupe) avec une exposition à 2, à 20, à 50 ou à 100 ppm de SPFO dans les aliments (0,14, 1,33, 3,21 et 6,34 mg/kg p.c. par jour chez les mâles et 0,15, 1,43, 3,73 et 7,58 mg/kg p.c. par jour chez les femelles) pendant 28 jours (Lefebvre et coll., 2008). L'effet a également été observé à des doses plus élevées dans plusieurs autres études menées chez des rats (Goldenthal et coll., 1978a; NOTOX, 1999; Seacat et coll., 2003; Thibodeaux et coll., 2003; Cui et coll., 2009; Yu et coll., 2009a; Elcombe et coll., 2012a);
- 0,75 mg/kg p.c. par jour chez les singes (n = 6) avec une exposition à 0,03, à 0,15,et à 0,75 mg/kg p.c. par jour par administration d'un bolus par voie orale (Seacat et coll., 2002).
Une augmentation du poids du foie des fœtus a également été observée dans des études sur le développement; cet effet est décrit dans la section 9.2.5.
Des augmentations des effets histologiques ont été observées dans des études à court terme. L'étude dans laquelle des effets ont été observés aux plus faibles concentrations (Seacat et coll., 2003) a été menée chez des rats euthanasiés tôt à 4 et à 14 semaines dans le cadre d'une étude alimentaire de deux ans (Butenhoff et coll., 2012b; les effets histologiques au niveau du foie relevés au cours de cette étude sont résumés à la section 9.2.3). Les LOAEL dans l'étude de quatre semaines étaient de 0,37 mg/kg p.c. par jour chez les mâles et de 1,77 mg/kg p.c. par jour chez les femelles; dans l'étude de 14 semaines, les valeurs étaient de 0,34 mg/kg p.c. par jour chez les mâles et de 1,56 mg/kg p.c. par jour chez les femelles. On a observé une hypertrophie hépatique et une vacuolisation cytoplasmique dans les groupes à ces doses. Des effets semblables ont été observés à des doses plus élevées dans d'autres études menées sur des rats (Elcombe et coll., 2012a; Goldenthal et coll., 1978a; NOTOX, 1999; Cui et coll., 2009), et sur des singes (Seacat et coll., 2002). D'autres effets hépatiques macroscopiques et histologiques observés à des doses plus élevées comprenaient :
- foie brun chez les rats mâles exposés à 3,2 mg/kg p.c. par jour (Christian et coll., 1999);
- altération des tissus adipeux chez les rats mâles exposés à ≥ 5 mg/kg p.c. par jour (Kim et coll., 2011b);
- nécrose focale ou en flocon à ≥ 5 mg/kg p.c. par jour et une hémorragie focale, une transsudation érythrocytaire, une dégénération hépatocytaire focale accompagnée par une infiltration cellulaire inflammatoire à 20 mg/kg p.c. par jour chez des rats mâles (Cui et coll., 2009).
Plusieurs études ont relevé une augmentation des enzymes sériques, qui sont des indicateurs possibles d'effets néfastes sur le foie. Le taux d'ALT était plus élevé chez les rats mâles exposés à 1,33 mg/kg p.c. par jour pendant 14 semaines dans l'alimentation (Seacat et coll., 2003). Une augmentation des taux d'AST et d'ALT a également été observée chez les rats exposés à 6 mg/kg p.c. par jour (Goldenthal et coll., 1978a). À l'inverse, aucune augmentation importante des taux sériques d'ALT ou d'AST n'a été observée chez des rats exposés à une dose allant jusqu'à 9,65 mg/kg p.c. par jour pendant sept jours (Elcombe et coll., 2012a). Une diminution de la bilirubine sérique et une augmentation des acides biliaires sériques ont également été observées chez les singes mâles exposés à 0,75 mg/kg p.c. par jour (Seacat et coll., 2002). On a aussi observé une augmentation de la phosphatase alcaline sérique chez les souris mâles exposées à 0,005 % de SPFO dans l'alimentation (environ 6,5 mg/kg p.c. par jour, d'après l'hypothèse par défaut de Santé Canada selon laquelle 1 ppm dans l'alimentation correspond à 0,13 mg/kg p.c. par jour chez les souris [Santé Canada, 1994]) (Qazi et coll., 2010a). Une légère diminution de la phosphatase alcaline sérique a été observée chez les singes mâles exposés à 0,5 mg/kg p.c. par jour (mais non à 1,5 ou à 4,5 mg/kg p.c. par jour) pendant 90 jours (Goldenthal et coll., 1978b).
9.2.2.3 Effets sur les lipides sériques
Une diminution du cholestérol total et du cholestérol HDL étaient les effets sur les lipides sériques observés aux concentrations les plus faibles dans les études à court terme; les différentes mesures de lipides sériques étaient plus faibles chez les singes, les souris et les rats dans la grande majorité des études qui ont examiné ces paramètres. Une diminution du taux LDL et des triglycérides a également été mesurée dans différentes études. La LOAEL la plus faible pour ce paramètre était de 0,03 mg/kg p.c. par jour.
La LOAEL de 0,03 mg/kg p.c. par jour pour ce paramètre a été observée dans une étude de plus longue durée (26 semaines) menée chez des macaques de Buffon mâles et femelles (de quatre à six animaux par groupe) auxquels on a administré du SPFO (0, 0,03, 0,15 ou 0,75 mg/kg p.c. par jour) par intubation orale du SPFO dans une capsule (Seacat et coll., 2002). Les concentrations sériques de cholestérol et de triglycérides ont été mesurées avant le traitement et à plusieurs moments pendant le traitement (jours 37, 62, 91, 153 et 182); les taux de cholestérol HDL ont seulement été analysés aux jours 153 et 182. Les changements qui ont été considérés comme étant uniformes ainsi que statistiquement et biologiquement significatifs par les auteurs étaient une diminution du cholestérol total et du cholestérol HDL chez les deux sexes à 0,75 mg/kg p.c. par jour (à 0,03 et à 0,75 mg/kg p.c. par jour chez les mâles, et à 0,15 et à 0,75 mg/kg p.c. par jour chez les femelles). À différents moments après le traitement à la plus faible dose (0,03 mg/kg p.c. par jour), on a observé des diminutions statistiquement significatives des niveaux de cholestérol par rapport aux contrôles chez les singes mâles et femelles, et des diminutions des taux de cholestérol HDL chez les singes mâles, avec aucune relation claire par rapport à la dose ou au temps. Des taux de cholestérol HDL moins élevés (femelles) ont été observés à des doses de 0,15 mg/kg p.c. par jour. Selon leurs analyses statistiques, les chercheurs ont conclu que la NOAEL dans cette étude était de 0,15 mg/kg p.c. par jour (LOAEL de 0,75 mg/kg p.c. par jour) (Seacat et coll., 2002).
Toutefois, l'Autorité européenne de sécurité des aliments (EFSA) et Santé Canada ont proposé différentes interprétations des résultats de Seacat et coll. (2002). L'EFSA (2008) a estimé que les modifications des taux de cholestérol HDL observées à cette dose étaient liées au traitement, et a donc conclu qu'il était justifié de considérer la dose de 0,03 mg/kg p.c. par jour comme une NOAEL (LOAEL de 0,15 mg/kg p.c. par jour). Santé Canada (2013c) a considéré que l'approche statistique utilisée dans l'étude d'origine (Seacat et coll., 2002) était inadéquate pour interpréter les mesures effectuées tout au long de l'étude et a plutôt utilisé des modèles linéaires mixtes pour évaluer les effets de la dose sur ces paramètres (TG, HDL et cholestérol). D'après ces modèles, Santé Canada a évalué l'effet de la dose et des jours sur chaque paramètre et a trouvé un effet important (p = 0,0003 à p < 0,0001) de la dose sur le cholestérol et le taux HDL chez les deux sexes. Il n'y avait pas d'effet lié à la dose par rapport au paramètre TG chez les mâles et les femelles, mais lorsqu'une valeur aberrante pour le paramètre TG chez les mâles a été supprimée, une importance globale entre les groupes de dose a été observée (p = 0,0213). Des différences entre les jours étaient généralement observées dans tous les paramètres chez les mâles et les femelles. Les résultats de l'essai d'estimation en paires de Dunnett, qui compare les groupes de traitement au groupe de contrôle, indiquent une différence statistiquement significative à ≥ 0,03 mg/kg p.c. par jour pour le taux HDL chez les mâles, à ≥ 0,15 mg/kg p.c. par jour pour une diminution du cholestérol (femelles) et à 0,75 mg/kg p.c. par jour pour une diminution du cholestérol chez les mâles (pour le TG, seul le groupe le plus faible était différent du groupe de contrôle lorsque le point de donnée extérieur était supprimé). L'interaction temps-dose était importante pour le cholestérol chez les femelles (Santé Canada, 2013c). D'après cette analyse statistique, la LOAEL devrait être de 0,03 mg/kg p.c. par jour pour la réduction des taux HDL chez les mâles (aucune NOAEL) et de 0,15 mg/kg p.c. par jour pour la réduction du cholestérol total (NOAEL : 0,03 mg/kg p.c. par jour).
L'autre étude concernant le SPFO menée chez les singes (Goldenthal et coll., 1978b) a également relevé une diminution importante du cholestérol sérique, à 4,5 mg/kg p.c. par jour après 90 jours d'exposition. Dans un groupe à plus faible dose (1,5 mg/kg p.c. par jour), un des singes femelles (c.-à-d. la moitié des femelles dans le groupe de la dose) avait un très faible taux de cholestérol sérique.
Des diminutions des paramètres sériques de lipides ont également été observées chez d'autres espèces. La LOAEL chez les souris était de 0,166 mg/kg p.c. par jour pour le cholestérol total chez les animaux exposés pendant 28 jours, avec une NOAEL de 0,0331 mg/kg p.c. par jour (Fair et coll., 2011). Une diminution des triglycérides a été observée à ≥ 5 mg/kg p.c. par jour chez les souris mères exposées au SPFO aux jours de gestation 1 à 17 (Thibodeaux et coll., 2003). On a également relevé une diminution du cholestérol total et des triglycérides chez les souris exposées à 0,005 % de SPFO dans l'alimentation (un seul groupe de traitement; environ 6,5 mg/kg p.c. par jour, au moyen de l'hypothèse par défaut de Santé Canada selon laquelle 1 ppm dans l'alimentation correspond à 0,13 mg/kg p.c. par jour chez les souris [Santé Canada, 1994]) (Qazi et coll., 2010a).
Chez les rats, la LOAEL la plus faible de 0,4 mg/kg p.c. par jour a été observée chez les mères exposées à la substance à partir de 42 jours avant l'accouplement, jusqu'au jour de gestation 20 (pour les rates qui ont eu une césarienne) ou jusqu'au jour de lactation 4 (pour les rates qui ont accouché par voie naturelle; Luebker et coll., 2005b). À cette dose, il y avait une diminution du cholestérol sérique total; les triglycérides sériques ont seulement diminué à ≥ 1,6 mg/kg p.c. par jour. Ces effets ont été appuyés par une diminution du cholestérol sérique (Seacat et coll., 2003; Thibodeaux et coll., 2003; Elcombe et coll., 2012a) et des triglycérides (Thibodeaux et coll., 2003; Elcombe et coll., 2012a) chez les rats exposés à des doses plus élevées de SPFO.
Une diminution des triglycérides et du cholestérol dans le foie a également été observée à la dose la plus faible à laquelle ce paramètre a été étudié (1,6 mg/kg p.c. par jour chez les rates mères dans le cadre d'une étude sur le développement; Luebker et coll., 2005b).
9.2.2.4 Effets sur la thyroïde
Une LOAEL de 0,15 mg/kg p.c. par jour pour des concentrations d'hormones thyroïdales modifiées a été observées chez les macaques de Buffon mâles et femelles (de quatre à six animaux par groupe) auxquels on a administré du SPFO potassique (0, 0,03, 0,15 ou 0,75 mg/kg p.c. par jour) pendant 26 semaines par intubation orale du SPFO dans une capsule (Seacat et coll., 2002). Les concentrations sériques de TSH ainsi que de T3 et de T4 libres et totaux ont été mesurées avant le traitement et à différents moments pendant celui-ci (jours 37, 62, 91 et 182). Les modifications des hormones thyroïdales estimées comme étant uniformes et statistiquement et biologiquement significatives par les auteurs étaient une augmentation des hormones TSH et une diminution des hormones TT3 chez les mâles et les femelles à 0,75 mg/kg p.c. par jour. À des doses de 0,15 mg/kg p.c. par jour, les modifications observées comprenaient des taux accrus de TSH (mâles) et des plus faibles concentrations de T3 (mâles et femelles). Des modifications des taux de T4 ont également été observées, mais n'étaient pas uniformes (y compris des incohérences par rapport au sens). D'après l'analyse statistique des auteurs, ils ont indiqué que la LOAEL pour les modifications des hormones thyroïdales était de 0,75 mg/kg p.c. par jour (NOAEL = 0,15 mg/kg p.c. par jour).
Toutefois, comme il a été décrit pour les effets liés aux lipides sériques, Santé Canada et l'EFSA ont réinterprété les résultats de Seacat et coll. (2002). L'EFSA a estimé que les modifications des hormones thyroïdales observées à 15 mg/kg p.c. par jour étaient liées au traitement, et a donc conclu qu'il était justifié de considérer la dose de 0,03 mg/kg p.c. par jour comme une NOAEL (LOAEL de 0,15 mg/kg p.c. par jour) (EFSA, 2008). La réanalyse de Santé Canada (2013c) était semblable à celle décrite pour les paramètres sériques de lipides (section 9.2.2.3). Les résultats de l'essai d'estimation en paires de Dunnett, qui compare les groupes de traitement au groupe de contrôle, indiquent une différence statistiquement significative à ≥ 0,15 mg/kg p.c. par jour par rapport à une diminution de TT3 (les deux sexes) et de TT4 (femelles seulement). L'interaction temps-dose était significative pour le T3, le T4 et le TSH chez les mâles et pour le T4 chez les femelles (Santé Canada, 2013c). D'après cette analyse statistique, la LOAEL est considérée comme étant de 0,15 mg/kg p.c. par jour pour une diminution de TT3 et de TT4 (NOAEL : 0,03 mg/kg p.c. par jour).
La LOAEL pour les changements au niveau des hormones thyroïdales chez les rats était semblable à celle des singes. Dans le cadre d'une étude sur le développement (Wang et coll., 2011a), des effets ont été observés chez les rates mères exposées à partir du jour de gestation 1 jusqu'au jour postnatal 14 à 3,2 ppm de SPFO dans l'alimentation (0,16 mg/kg p.c. par jour, selon l'hypothèse par défaut de Santé Canada selon laquelle 1 ppm dans l'alimentation correspond à 0,05 mg/kg p.c. par jour chez les rats [Santé Canada, 1994], une hypothèse qui n'est pas nécessairement pertinente chez les rates gravides). La LOAEL concernait les diminutions de T4 liées à la dose; on a seulement observé la réduction de T3 à une dose plus élevée. Dans d'autres études menées chez des rats d'une durée de cinq à 91 jours, des diminutions de T4 et de T3 ont été observées, l'effet étant particulièrement prononcé pour le T4 (Yu et coll., 2009a, 2011; Luebker et coll., 2005b; Thibodeaux et coll., 2003). Les effets ont été principalement mesurés sur les quantités totales d'hormones; certaines études ont également mesuré les effets sur les concentrations d'hormones T4 et T3 libres. Aucun effet sur le taux TSH n'a été relevé pendant les études sur les rats.
Quelques études sur les souris ont mesuré les changements aux hormones thyroïdales. Une diminution en fonction de la dose mais transitoire du taux de T4 total considérée comme étant significative a été observée à 20 mg/kg p.c. par jour chez les mères exposées à la substance pendant les 17 premiers jours de gestation (Thibodeaux et coll., 2003), mais aucun effet n'a été observé par rapport aux taux T3 ou T4 sériques chez les souris exposées à des doses allant jusqu'à 0,166 mg/kg p.c. par jour pendant 28 jours (Fair et coll., 2011).
Des modifications aux concentrations d'hormones thyroïdales ont été observées chez les petits des rats et des souris exposés in utero au SPFO; ces effets sont décrits à la section 9.2.5.
Aucun changement à l'index de prolifération des cellules folliculaires de la glande thyroïde n'a été observé chez les rats Sprague-Dawley mâles exposés au K+SPFO (20 ou 100 ppm dans l'alimentation) pendant sept jours (1,9 ou 9,6 mg/kg p.c. par jour), après avoir été mesuré à différents moments (une journée après l'arrêt de l'exposition ou après des périodes de récupération de 28, de 56 ou de 84 jours) (Elcombe et coll., 2012a).
9.2.2.5 Autres effets à court terme
Une grande variété d'autres effets à court terme ont été observés pour le SPFO. Ces effets sont décrits ci-après, mais seulement brièvement, comme ils sont survenus à des concentrations plus élevées que les effets immunitaires, hépatiques, lipidiques sériques ou thyroïdaux.
Une diminution du poids corporel (ou un gain de poids corporel) était une observation courante dans une grande variété d'études. L'effet a été observé chez les rats à ≥ 0,4 mg/kg p.c. par jour (Goldenthal et coll., 1978a; Gortner, 1980; Wetzel, 1983; Christian et coll., 1999; NOTOX, 1999; Grasty et coll., 2003; Thibodeaux et coll., 2003; Luebker et coll., 2005a; Butenhoff et coll., 2009; Cui et coll., 2009; Kawamoto et coll., 2011; Xia et coll., 2011; Elcombeet coll., 2012a); chez les souris à ≥ 0,4167 mg/kg p.c. par jour (Yahia et coll., 2008; Dong et coll., 2009, 2011, 2012b; Era et coll., 2009; Wan et coll., 2011); et chez les lapins à ≥ 1 mg/kg p.c. par jour (Case et coll., 2001). Une diminution de la consommation alimentaire, qui a été observée à ≥ 0,4 mg/kg p.c. par jour chez les rats (Goldenthal et coll., 1978a; Wetzel, 1983; Christian et coll., 1999; Thibodeaux et coll., 2003; Cui et coll., 2009), à ≥ 0,4167 mg/kg p.c. par jour chez les souris (Yahia et coll., 2008; Dong et coll., 2011, 2012b), et à ≥ 5 mg/kg p.c. par jour chez les lapins (Case et coll., 2001) peut avoir contribué à cet effet.
Peu d'études ont démontré une augmentation de la mortalité chez les animaux adultes. Chez les singes, des décès ont été observés chez tous les mâles dans le groupe de 4,5 mg/kg p.c. par jour dans une étude de 90 jours (Goldenthal et coll., 1978b), et chez deux (sur six) mâles exposés à 0,75 mg/kg p.c. par jour pendant six mois (Seacat et coll., 2002). Une mortalité accrue a également été observée chez les rats à ≥ 6 mg/kg p.c. par jour (Goldenthal et coll., 1978a; Wetzel, 1983; Grasty et coll., 2005b; Cui et coll., 2009), et chez les lapins à ≥ 20 mg/kg p.c. par jour (Case et coll., 2001).
D'autres effets généraux observés comprenaient une alopécie localisée chez les rats (Christian et coll., 1999), et des selles molles, de la diarrhée, de l'anorexie, des vomissements ainsi que des contractions, des tremblements et des convulsions chez les singes (Goldenthal et coll., 1978b).
Quelques paramètres de neurotoxicité ont été observés chez les souris exposées au SPFO. Une détérioration du rendement a été observée dans des tests neurocomportementaux, y compris le labyrinthe aquatique (à ≥ 2,15 mg/kg p.c. par jour [Long et coll., 2013], et à 3 mg/kg p.c. par jour, mais non à 6 mg/kg p.c. par jour [Fuentes et coll., 2007c]), et des effets transitoires dans le test du champ dégagé (3 mg/kg p.c. par jour) et le nombre d'élevages (6 mg/kg p.c. par jour) (Fuentes et coll., 2007c). Toutefois, dans les deux cas, les effets transitoires ont seulement été observés le même jour; les auteurs ont donc conclu que les effets pouvaient être liés à une anxiété accrue. Une augmentation de l'apoptose (à ≥ 2,15 mg/kg p.c. par jour) et des concentrations de glutamate (à 10,75 mg/kg p.c. par jour) a été observée dans l'hippocampe (Long et coll., 2013). Une expression accrue de CaM-KIIα, de pCREB, de gènes c-fos et de gènes c-jun a également été observée dans le cortex et l'hippocampe des rats à ≥ 1,7 mg/L dans l'eau potable (dose de 0,238 mg/kg p.c. par jour calculée selon l'hypothèse par défaut de Santé Canada selon laquelle 1 ppm dans l'eau correspond à 0,14 mg/kg p.c. par jour chez les rats [Santé Canada, 1994]) (Liu et coll., 2010a).
On a également relevé une neurotoxicité chez les rats. Des réductions de l'activité et de la léthargie a été observée à ≥ 5 mg/kg p.c. par jour (Cui et coll., 2009). Des effets histologiques dans le cerveau ont également été observés à ≥ 20 mg/kg p.c. par jour (Cui et coll., 2009), mais pas à des concentrations allant jusqu'à environ 7 mg/kg p.c. par jour (Kawamoto et coll., 2011). Une co-exposition avec une stimulation ultrasonique a provoqué des convulsions toniques (aucune convulsion tonique n'a été provoquée par le SPFO seulement), après exposition à environ 7 mg/kg p.c. par jour (Kawamoto et coll., 2011).
Les effets rénaux découlant de l'exposition au SPFO étaient limités à une augmentation de l'azote uréique du sang chez les rats mâles et femelles (avec une LOAEL de 1,33 mg/kg p.c. par jour; Seacat et coll., 2003) et une augmentation du poids relatif des reins à ≥ 5 mg/kg p.c. par jour chez les rats (Goldenthal et coll., 1978a; Cui et coll., 2009).
Des effets sur les voies respiratoires – notamment congestion pulmonaire, épaississement des parois épithéliales, infiltration cellulaire et vasodilatation – ont été observés à 5 et à 20 mg/kg p.c. par jour, avec une gravité plus importante à la dose élevée (Cui et coll., 2009). Une respiration laborieuse et des taches de sang autour du museau ont également été signalées pour la dose élevée de l'étude.
9.2.3 Exposition à long terme et cancérogénicité
Seul un essai biologique chronique a été effectué pour le SPFO. L'étude a exposé des rats Sprague-Dawley au K+ SPFO par voie alimentaire (0, 0,5, 2, 5 et 20 ppm dans de la nourriture) pendant deux ans (doses journalières moyennes : 0, 0,024, 0,098, 0,242 et 0,984 mg/kg p.c. par jour pour les mâles; 0, 0,029, 0,120, 0,299 et 1,251 mg/kg p.c. par jour pour les femelles) (Butenhoff et coll., 2012b). Un groupe de récupération (récupération de 20 ppm) a également été exposé au régime de la dose élevée pendant les 52 premières semaines, avant d'être nourri avec le régime de contrôle (doses journalières moyennes : 1,144 et 1,385 mg/kg p.c. par jour pour les mâles et les femelles, respectivement). Des sacrifices précipités ont également été effectués aux semaines 4 et 14; les observations notées à ces moments sont présentées tout au long de la section 9.2 (dans le cadre de l'étude Seacat et coll., 2003).
Le foie a été désigné comme le site cible principal chez les mâles (LOAEL de 0,5 ppm ou de 0,024 mg/kg p.c. par jour; aucune NOAEL recensée). La LOAEL a été établie en raison d'une incidence significativement plus élevée de dégénérescence kystique du foie dans tous les groupes de doses. D'autres effets dans le foie des mâles à des doses plus élevées (≥ 0,098 mg/kg par jour) comprennent une incidence et une gravité significativement accrues de l'hypertrophie des hépatocytes centrolobulaires, des granules éosinophiles hépatocytaires, de la pigmentation des hépatocytes centrolobulaires, de la nécrose des hépatocytes, et vacuolisation des hépatocytes centro-lobulaires ou à mi-zone. Il a été observé que la plupart des effets étaient réversibles, comme ils ont été observés à des concentrations semblables à des témoins dans le groupe de récupération; toutefois, l'incidence de dégénérescence kystique et de nécrose hétapocyte était semblable dans le groupe de récupération, ce qui indique que l'effet persistait même après que les expositions étaient arrêtées depuis un an. Une diminution de la mortalité (statistiquement significative à 5 et à 20 ppm) et des modifications des poids absolus et relatifs des organes dans le groupe à dose élevée (augmentation du poids du foie et diminution du poids de la rate et de la thyroïde gauche/parathyroïde) ont aussi été observées. Une incidence accrue d'infiltration de tissus adipeux interstitiels a été signalée chez les mâles à 0,098 mg/kg p.c. par jour (aucune donnée disponible pour les autres doses).
Chez les rates femelles, aucun lien dose-réponse uniforme n'a été observé pour les lésions non néoplasiques dans le foie; une augmentation statistiquement significative de l'incidence de plusieurs lésions hépatiques a été observée à ≥ 0,120 mg/kg p.c. par jour pour l'infiltration lymphohistiocytaire, l'hypertrophie des hépatocytes centrolobulaires, les granules éosinophiles hépatocytaires, la pigmentation des hépatocytes centrolobulaires, la nécrose des hépatocytes, la vacuolisation hépatocytique périportale, l'infiltration de macrophages pigmentés, et une diminution de l'hypertrophie des hépatocytes périportaux. Une augmentation relative du poids (par rapport au poids corporel) du cerveau, des reins, du foie et de la rate a également été observée, ainsi qu'une diminution du poids absolu des glandes surrénales gauches, et du poids relatif (par rapport au poids du cerveau) des glandes surrénales gauches et droites.
Une diminution du cholestérol total sérique a été observée à plusieurs différents moments chez les mâles (14, 17 et 53 semaines), mais cette diminution était seulement significative à la dose élevée (NOAEL de 0,242 mg/kg p.c. par jour, et LOAEL de 0,984 mg/kg p.c. par jour). L'effet chez les femelles était limité à une diminution transitoire, et les diminutions ont seulement été relevées dans les trois groupes recevant les doses les plus élevées, et à la semaine 27 seulement.
Des observations macroscopiques des foies à la fin de l'étude ont relevé des foies agrandis, tachetés, noircis de manière diffuse ou éclaircis de manière focale chez les rats mâles et femelles auxquels on avait administré 5 ou 20 ppm. Aucune donnée n'était disponible pour les autres groupes (Butenhoff et coll., 2012b).
Les effets cancérogènes observés pendant l'étude comprenaient des tumeurs dans le foie, la thyroïde et les glandes mammaires. Une incidence accrue d'adénomes hétapocellulaires totaux, statistiquement significative à 20 ppm, a été observée chez les deux sexes dans des rats exposés pendant deux ans, mais non à 52 semaines. Les tumeurs des cellules folliculaires de la glande thyroïde (adénomes chez les mâles, et combinaison d'adénomes et de carcinomes chez les femelles) étaient significativement accrues dans les groupes de récupération mâles et dans le groupe de femelles exposées à la deuxième dose la plus élevée (5 ppm ou 0,299 mg/kg p.c. par jour). Chez les femelles, les fibroadénomes des glandes mammaires et les cas combinés de fibroadénomes et d'adénomes étaient plus élevés par rapport aux groupes de contrôle seulement dans le groupe recevant la dose la plus faible, et montraient une tendance négative significative.
Les auteurs ont noté que les concentrations de SPFO dans le sérum et le foie à la fin de l'étude étaient beaucoup plus faibles qu'après 14 semaines d'exposition chez les deux sexes. Chez les mâles, les niveaux sériques au sacrifice terminal étaient de 33 %, de 44 %, de 51 % et de 47 % des valeurs mesurées à la semaine 14 dans les groupes recevant 0,5, 2, 5 et 20 ppm, et les niveaux hépatiques étaient de 33 %, de 36 %, de 19 % et de 33 % des valeurs mesurées à la semaine 14 dans les mêmes groupes de dose, respectivement. Les auteurs ont suggéré que ce déclin était probablement dû à une néphropathie chronique progressive menant à une excrétion urinaire accrue du SPFO à l'échelle de tous les groupes de traitement. Les données sur la néphropathie n'étaient pas fournies par les auteurs, qui ont décrit que l'effet survenait dans tous les groupes de traitement; toutefois, ils ont indiqué que des associations significatives avaient été observées entre l'incidence et la gravité de la néphropatie chez les mâles (mais seulement à une dose chez les femelles). Les concentrations sériques de SPFO ont également augmenté en proportion approximative à la durée des doses entre les semaines 4 et 14; toutefois, les concentrations à la semaine 53 dans le groupe de 20 ppm étaient semblables à celles mesurées à la semaine 14, ce qui semble indiquer que les sujets se sont approchés de l'état stable après 14 semaines dans le groupe recevant la dose de 20 ppm. Les concentrations sériques de SPFO correspondant à la LOAEL (0,5 ppm dans l'alimentation) étaient de 4,040 ng/mL à 14 semaines et de 1,310 ng/mL à 105 semaines (Butenhoff et coll., 2012b).
9.2.4 Génotoxicité
D'après les résultats négatifs d'une grande série d'essais in vitro et in vivo à court terme sur les gènes, les chromosomes ou la réparation de l'ADN, l'EFSA (2008) et Santé Canada (2006) ont conclu que le SPFO et ses sels n'étaient pas génotoxiques. Des données publiées plus récemment (voir les sous-sections suivantes) concordent avec cette conclusion.
9.2.4.1 Résultats in vitro
Des résultats négatifs ont été obtenus dans de nombreux essais in vitro effectués pour le SPFO sur des procaryotes, notamment l'essai sur la mutation génétique inverse sur des souches de Salmonella typhimurium (souches TA100, TA1535, TA1537, TA1538 et TA09; deux études) et de Escherichia coli (WP2uvrA; une étude) menés avec/sans activation métabolique (S9) et l'essai de recombinaison mitotique dans les Saccharomyces cerevisiae (souche D4; une étude) (examen par l'EFSA, 2008). Le SPFO (testé jusqu'à 1 000 µM) n'avait aucune activité mutagénique dans l'essai umu (Oda et coll., 2007).
Dans les cellules d'hépatomes humains HepG2, le SPFO (jusqu'à 400 µM pendant 24 heures) n'a pas provoqué de génération d'espèces réactives de l'oxygène, de ruptures de l'ADN simple brin ou de micronoyaux (Florentin et coll., 2011). Dans une autre étude des cellules humaines HepG2, le SPFO a provoqué une légère génération d'espèces réactives de l'oxygène (de 0,4 à 2 000 µM) sans provoquer de dommage détectable de l'ADN (200 µM) (Eriksen et coll., 2010).
Le SPFO n'a pas entraîné d'aberrations chromosomiques dans les lymphocytes humains en culture, avec et sans activation métabolique, et n'a pas provoqué de synthèse d'ADN non programmée dans des cultures primaires de cellules hépatiques de rats (examen par EFSA, 2008).
Dans des cellules d'embryons de hamsters de Syrie, le SPFO a provoqué la transformation des cellules à des concentrations non cytotoxiques (de 0,2 à 2 µg/mL) et a augmenté l'expression de PPARβ/δ (0,2 µg/mL pour une et sept journées; 2 µg/mL pour sept journées); de PPARγ (de 0,02 à 2 µg/mL pour sept journées) et de PPARα (20 µg/mL pour sept journées). Le SPFO n'a pas provoqué de dommage à l'ADN dans le cadre de l'essai de Comet (Jacquet et coll., 2012).
Des résultats négatifs ont également été relevés dans différents essais in vitro menés avec plusieurs précurseurs du SPFO (examen par l'EFSA, 2008).
9.2.4.2 Résultats in vivo
Le SPFO a obtenu des résultats négatifs dans l'essai du micronoyau in vivo sur des cellules de moelle osseuse de souris à des doses orales uniques de 237,5, de 450 et de 950 mg/kg p.c. (avec prélèvement d'échantillons à 24, à 48 et à 72 heures), et plusieurs précurseurs du SPFO ont obtenu des résultats négatifs dans différents tests in vivo (examen par l'EFSA, 2008).
Les résultats d'un essai de Comet mené chez des paramecium caudatum étaient négatifs (Kawamoto et coll., 2010).
9.2.5 Toxicité pour la reproduction et le développement
La base de données pour la reproduction et le développement par rapport au SPFO est robuste. Une étude bigénérationnelle a été élaborée chez des rats (Christian et coll., 1999; Luebker et coll., 2005a), et les paramètres de reproduction et de développement ont été examinés dans de nombreuses études à une génération menée sur les rats, les souris et les lapins. Les effets qui sont survenus aux concentrations les plus faibles aux animaux exposés in utero comprenaient des changements à la structure du cerveau (≥ 0,1 mg/kg p.c. par jour), au neurocomportement (≥ 0,3 mg/kg p.c. par jour), aux niveaux d'hormones thyroïdales (≥ 0,16 mg/kg p.c. par jour), et au poids corporel fœtal (≥ 0,1 mg/kg p.c. par jour). La majorité des autres effets ont été observés à ≥ 1 mg/kg p.c. par jour. Les doses décrites dans cette section font référence aux doses maternelles pour les animaux exposés in utero, à moins d'indication contraire.
Des changements à la structure et aux concentrations de différents neurotransmetteurs et protéines dans le cerveau ont été observés chez les souris et les rats. Dans des rats Sprague-Dawley exposés pendant les jours de gestation 0 à 20 à des doses de 0, de 0,1, de 0,6 et de 2 mg/kg p.c. par jour par gavage, des modifications structurelles des synapses dans l'hippocampe ont été observées à toutes les doses (Zeng et coll., 2011b). Cette étude a également relevé une diminution des niveaux ARNm de synapsine I et de synapsine II, et de synaptophysine dans le cerveau à toutes les doses. Des changements de transcription au niveau du cerveau – avec plusieurs gènes liés à la dépression et à la potentialisation à long terme, à la transmission synaptique, à la transduction de signal qui dépend du calcium, et aux voies de signalisation du phosphatidylinosol – ont été observés chez les rats exposés à 3,2 ppm de SPFO dans l'alimentation (l'équivalent d'environ 0,16 mg/kg p.c. par jour d'après l'hypothèse par défaut de Santé Canada selon laquelle 1 ppm dans l'alimentation correspond à 0,05 mg/kg p.c. par jour chez les rats [Santé Canada, 1994]) (Wang et coll., 2010, 2012). Une étude complémentaire dans le cadre de laquelle les rats ont été exposés aux mêmes doses pendant les jours de gestation 2 à 21 a également relevé des augmentations de GFAP dans l'hippocampe et le cortex (à ≥ 0,1 mg/kg p.c. par jour) et d'IL-1β et de TNF-α dans l'hippocampe (à ≥ 0,6 mg/kg p.c. par jour) (Zeng et coll., 2011a). Des modifications ont été observées dans les concentrations de protéines qui sont importantes au développement du cerveau (CamKII, GAP-43, synaptophysine et de taux dans le cortex cérébral et l'hippocampe) chez les souris exposées à une seule dose de 8,7 mg/kg (Johansson et coll., 2009). À des doses plus élevées (> 1 mg/kg p.c. par jour) chez les rats, des changements ont été observés dans l'activité de choline-acétylase dans le cortex préfrontal (Lau et coll., 2003) et les molécules de signalisation liées au calcium (Liu et coll., 2010b).
En plus de changements au cerveau, les effets néfastes découlant du SPFO se sont manifestés pour la forme de changements dans le comportement neurologique à ≥ 0,3 mg/kg p.c. par jour. L'effet le plus courant observé était des changements aux niveaux des activités chez les souris (Onishchenko et coll., 2011; Johansson et coll., 2008; Fuentes et coll., 2007a) et chez les rats (Butenhoff et coll., 2009); certaines données indiquaient que l'effet était plus prononcé chez les mâles (Onishchenko et coll., 2011). Parmi les autres effets observés, on relève notamment des diminutions de l'activité neuromotrice (moins bonne capacité à grimper et à se tirer sur la grille et diminution de la préhension des pattes antérieures chez les souris [Fuentes et coll., 2007b] et diminution de la force des pattes postérieures chez les rats [Butenhoff et coll., 2009]), retard des réflexes chez les rats (Christian et coll., 1999; Luebker et coll., 2005a), et diminution de l'apprentissage spatial et de la mémoire dans l'essai de labyrinthe aquatique (Liu et coll., 2009b) et l'essai de plateforme cachée (Wang et coll., 2015) chez les rats.
L'exposition au SPFO pendant le développement a entraîné des modifications aux hormones thyroïdales à des concentrations d'exposition semblables à celles des animaux adultes. Les rats nouveau-nés dont les mères ont été exposées pendant la gestation et la lactation à ≥ 3,2 ppm dans l'alimentation (l'équivalent de ≥ 0,16 mg/kg p.c. par jour, d'après l'hypothèse par défaut de Santé Canada selon laquelle 1 ppm dans l'alimentation correspond à 0,05 mg/kg p.c. par jour (Santé Canada, 1994), une hypothèse qui n'est pas nécessairement pertinente chez les rates gravides et les rats nouveau-nés) avaient des diminutions des taux de T4 total en fonction de la dose (Wang et coll., 2011a; Yu et coll., 2009b; Lau et coll., 2003). Aucune modification des taux T3 n'a été observée dans deux études menées sur des rats (Yu et coll., 2009; Lau et coll., 2003) mais de telles modifications sont survenues à des concentrations plus élevées dans une autre étude (Wang et coll., 2011a). Une autre étude néonatale décrivant les effets sur la thyroïde n'a pas révélé de changement à la concentration sérique de TSH, mais des augmentations de la prolifération des cellules épithéliales folliculaires de la glande thyroïde ont été observées à 1 mg/kg p.c. par jour (Chang et coll., 2009). Le seul effet relevé dans les études sur le développement des souris était une diminution du taux T4 total à ≥ 5 mg/kg p.c. par jour, mais l'effet était moins uniforme chez les rats (Lau et coll., 2003).
Les effets sur le système immunitaire et les effets sur les lipides sériques étaient des effets principaux qui ont été beaucoup étudiés chez les souris, les rats et les singes adultes, mais très peu d'études ont examiné ces effets pendant l'exposition prénatale. Chez les souris adultes exposées in utero au SPFO à des concentrations de 0, de 0,1, de 1 ou de 5 mg/kg p.c. par jour, on a observé des diminutions de l'activité des cellules tueuses naturelles (à ≥ 1 mg/kg p.c. par jour chez les mâles et à 5 mg/kg p.c. par jour chez les femelles), des diminutions de la réponse SRBC-IgM (chez les mâles à 5 mg/kg p.c. par jour), et des changements dans les sous-populations lymphocytaire du thymus (à 5 mg/kg p.c. par jour) (Keil et coll., 2008). Les taux de cholestérol sérique et LDL étaient plus élevés au jour de gestation 21 chez les fœtus de rat exposés in utero à ≥ 1,6 mg/kg p.c. jour, la dose la plus faible à laquelle cet effet a été étudié (Luebker et coll., 2005b). Au jour de lactation 5, la même étude n'a trouvé aucun effet sur les paramètres lipidiques sériques chez les petits, mais a observé une diminution des concentrations de triglycéride dans le foie.
Une augmentation du poids hépatique fœtal absolu ou relatif a été observée chez les souris à ≥ 5 mg/kg p.c. par jour (Keil et coll., 2008; Lau et coll., 2003; Abbott et coll., 2009). L'effet a également été observé chez les rats (Lau et coll., 2003), mais l'espèce était moins sensible que les souris (les effets ont seulement été observés à 20 mg/kg p.c. par jour).
Des lésions mitochondriales cardiaques et une augmentation du poids relatif du cœur ont été observées à 2 mg/kg p.c. par jour chez les rats exposés in utero (Xia et coll., 2011). Ces effets n'étaient pas accompagnés de changements à la fréquence cardiaque ni à la tension artérielle; toutefois, la tension artérielle systolique était plus élevée chez les rats exposés avant la naissance à 18,75 mg/kg p.c. par jour (Rogers et coll., 2014). L'effet sur la tension artérielle dans l'étude de Rogers et coll. (2014) présentait une corrélation avec une diminution du potentiel du néphron. Le seul autre effet qui a été relevé en lien avec le développement des reins était une diminution du poids des reins chez des souris exposées à 5 mg/kg p.c. par jour (Keil et coll., 2008).
Des changements laissant supposer l'immaturité des poumons ont été notés chez les rats exposés in utero au SPFO à ≥ 2 mg/kg p.c. par jour. Les changements histologiques observés comprenaient des hémorragies, un épaississement du septum interalvéolaire et des parois alvéolaires, une hépatisation focale, une infiltration cellulaire inflammatoire et des cellules apoptotiques (Chen et coll., 2012; Grasty et coll., 2003, 2005). De l'atélectasie et un développement anormal des poumons ont également été observés (Grasty et coll., 2003, 2005) Comme le profil de surfactant pulmonaire chez les petits et les agents de secours (accélérateurs de maturation pulmonaire) n'ont pas amélioré la respiration difficile et la mortalité, les auteurs étaient d'avis que ces derniers effets n'étaient pas attribuables à l'immaturité des poumons (Grasty et coll., 2005). La seule preuve d'effets néfastes potentiels sur les poumons chez les petits des souris était l'observation de cyanose après l'accouchement chez certains petits exposés à 12,5 mg/kg p.c. par jour (Borg et coll., 2010).
Différents effets néfastes ont été notés par rapport à l'état de santé général des animaux exposés au SPFO avant leur naissance. Une diminution de la survie ou de la viabilité, ou une mortalité accrue ont été observées dans les fœtus ou les petits à ≥ 1,6 mg/kg p.c. par jour chez les rats (Christian et coll., 1999; Lau et coll., 2003; Luebker et coll., 2005a, 2005b; Xia et coll., 2011) et à ≥ 4,5 mg/kg p.c. par jour chez les souris (Lau et coll., 2003; Yahia et coll., 2008; Abbott et coll., 2009). Une diminution du poids corporel des petits ou du poids des fœtus a été observée aux plus faibles concentrations, à ≥ 0,1 mg/kg p.c. par jour dans une étude menée sur des rats (Christian et coll., 1999; Luebker et coll., 2005a, 2005b). D'autres études ont relevé des effets à des concentrations plus élevées chez des rats (à ≥ 1,6 mg/kg p.c. par jour; Wetzel, 1983; Lau et coll., 2003; Wang et coll., 2011a; Xia et coll., 2011; Chen et coll., 2012; Rogers et coll., 2014), des souris (à 6 mg/kg p.c. par jour; Fuentes et coll., 2007b; Era et coll., 2009), et des lapins (à ≥ 2,5 mg/kg p.c. par jour; Case et coll., 2001). Un manque de croissance non significatif a également été observé chez les souris à 10 mg/kg p.c. par jour (Lau et coll., 2003). Les petits des rats semblaient pâles et délicats à 1,6 mg/kg p.c. par jour (Wang et coll., 2011a).
L'exposition au SPFO avant la naissance causait des retards par rapport aux étapes clés du développement ainsi que des anomalies structurelles. Un retard des réflexes d'ouverture des yeux a été observé à ≥ 1 mg/kg p.c. par jour chez les souris (Lau et coll., 2003; Fuentes et coll., 2007b; Abbott et coll., 2009) et à ≥ 1,6 mg/kg p.c. par jour chez les rats (Christian et coll., 1999; Lau et coll., 2003; Luebker et coll., 2005a); de plus, des anomalies ont été observées dans le cristallin des yeux des rats à ≥ 1 mg/kg p.c. par jour (Gortner, 1980). D'autres retards des étapes clés du développement sont survenus dans le déploiement du pavillon de l'oreille chez les rats (Christian et coll., 1999; Luebker et coll., 2005a) et chez les souris (Fuentes et coll., 2007b), et dans la poussée des incisives chez les souris (Fuentes et coll., 2007b; Yahia et coll., 2008). Des anomalies squelettiques ont également été observées à ≥ 1 mg/kg p.c. par jour. Les effets observés aux plus faibles concentrations étaient des malformations sternales chez les souris (Lau et coll., 2003; Yahia et coll., 2008) et chez les rats (Wetzel, 1983; Lau et coll., 2003) et une fermeture incomplète du crâne chez les rats (Wetzel, 1983). D'autres effets observés comprenaient notamment : fente palatine chez les souris (Lau et coll., 2003; Yahia et coll., 2008; Era et coll., 2009) et les rats (Wetzel, 1983; Lau et coll., 2003); anomalies au niveau des côtes chez les souris (Yahia et coll., 2008) et les rats (Wetzel, 1983); retard dans l'ossification chez les souris (Yahia et coll., 2008), les rats (Wetzel, 1983) et les lapins (Case et coll., 2001); fœtus courbé, spina bifida occulta, et anomalies de la queue chez les souris (Yahia et coll., 2008); et œdème sous-cutané et cryptorchidie chez les rats (Wetzel, 1983).
Des diminutions des poids des organes reproducteurs ont été observées chez les animaux. Une tendance liée à la dose d'une diminution du poids de l'utérus a été observée chez les souris, et était significative à ≥ 0,166 mg/kg p.c. par jour (Fair et coll., 2011). Une diminution du poids moyen de l'utérus gravide a également été observée à 10 mg/kg p.c. par jour chez les rats (Wetzel, 1983). Ces effets sont survenus en l'absence d'effets histologiques. D'autres diminutions du poids des organes reproducteurs ont été observées chez les rats mâles, notamment le poids absolu des vésicules séminales (Christian et coll., 1999) et le poids relatif des gonades (Cui et coll., 2009).
L'exposition au SPFO a également eu des effets sur la reproduction. L'effet à la concentration la plus faible était une diminution de la période de gestation à ≥ 0,8 mg/kg p.c. par jour chez les rats (Christian et coll., 1999; Luebker et coll., 2005a, 2005b). D'autres effets observés aux concentrations plus élevées étaient une diminution des sites d'implantations chez les rats (Luebker et coll., 2005a; Christian et coll., 1999), une taille réduite des portées chez les rats (Christian et coll., 1999; Xia et coll., 2011) et les lapins (Case et coll., 2001), et une augmentation des résorptions fœtales, des fœtus morts et des avortements spontanés chez les rats (Luebker et coll., 2005a; Wetzel, 1983), les lapins (Case et coll., 2001) et les souris (Lau et coll., 2003; Yahia et coll., 2008). Un indice de lactation significativement réduit a également été observé chez les petits des rats exposés à 1,6 mg/kg p.c. par jour (Christian et coll., 1999; Luebker et coll., 2005a).
Les effets sur la reproduction observés chez les mâles étaient limités à une baisse des taux d'estradiol chez les singes mâles à 0,75 mg/kg p.c. par jour (Seacat et coll., 2002) et une diminution des taux de testostérone sériques et du nombre de spermatozoïdes épididymaires chez les rats mâles exposés à 10 mg/kg p.c. par jour (Wan et coll., 2011).
Comparer les observations entre les générations dans les études à deux générations peut aider à relever les tendances émergentes par rapport aux effets sur le développement et la reproduction. Les effets chez les petits des rats relevés dans l'étude sur deux générations (Christian et coll., 1999; Luebker et coll., 2005a) qui sont décrits dans cette section sont survenus principalement dans les petits de première génération (F1). Les mères F0 étaient exposées à quatre différentes doses de SPFO — 0,1, 0,4, 1,6 ou 3,2 mg/kg p.c. par jour — pendant 42 jours avant l'accouplement, pendant la période d'accouplement (maximum de 14 jours), et jusqu'au jour 9 de gestation pour les rats qui ont accouché par césarienne, ou jusqu'au jour 20 de lactation pour les rats qui ont accouché par voie naturelle. Une viabilité significativement diminuée des petits F1 a été observée aux deux doses les plus élevées. À 3,2 mg/kg p.c. par jour, il y avait un plus grand nombre de mort-nés que de nouveau-nés vivants. De plus, le nombre de petits qui ont survécu leurs premiers jours de vie était plus faible dans le groupe ayant reçu 1,6 mg/kg p.c. par jour. À la dose élevée, 0 % des petits ont survécu, et à 1,6 mg/kg p.c. par jour, la survie était de seulement 66,1 % (par rapport à > 98 % chez les animaux témoins et les groupes recevant des doses plus faibles). Des retards dans les points repères du développement — réflexe d'ouverture des yeux, déploiement du pavillon de l'oreille, redressement en fonction de la surface et redressement en situation de chute — ont également été observés à 1,6 mg/kg p.c. par jour chez les petits F1. La toxicité maternelle était évidente dans les groupes à ces doses, comme des diminutions de la consommation alimentaire et du gain de poids corporel avaient été observées chez les mères F0 à ≥ 0,4 mg/kg p.c. par jour. En raison de diminutions importantes de la survie aux deux doses les plus élevées, l'exposition des mères F1 était limitée à 0,1 et à 0,4 mg/kg p.c. par jour. Aucun effet sur les résultats de la reproduction (y compris le nombre de naissances vivantes et de survie des petits) n'a été observé chez les mères F1 ni chez les petits F2; de plus, aucune toxicité maternelle n'a été observée. Le seul effet observé dans la génération F2 était une diminution du poids des petits et une modification du poids à 0,4 mg/kg p.c. par jour, pour deux moments seulement (jours 7 et 14). Donc, la diminution du poids des petits a d'abord été observée à une plus faible concentration chez les petits F2 (0,4 mg/kg p.c. par jour) que chez les petits F1 (1,6 mg/kg p.c. par jour); toutefois, l'effet était moins important ou plus transitoire chez les petits F1, où l'effet a été observé systématiquement à tous les moments (jours 1 à 21). Il ne semblait pas y avoir d'effet sur l'accouplement et la fertilité chez les deux générations.
9.3 Mode d'action
L'analyse du mode d'action a été étudié pour les effets survenant aux plus faibles concentrations du SPFO (c.-à-d. effets immunitaires chez les souris, effets lipidiques chez singes et les souris, augmentation du poids du foie chez les rats et les souris, changements histologiques du foie chez les rats, tumeurs hépatocellulaires chez les rats, et changements des hormones thyroïdales chez les singes, les rats et les souris). Seule une évaluation préliminaire des données pouvait être effectuée pour la plupart des modes d'action; une analyse du mode d'action effectuée au moyen des directives les plus récentes (Meek et coll., 2014) pouvait seulement être effectuée pour les effets de prolifération des peroxysomes sur les paramètres hépatiques. D'après l'analyse du mode d'action, aucun paramètre n'a été jugé comme n'étant pas pertinent aux humains, et les résultats laissent croire que l'approche de l'AQT est la méthode la plus appropriée pour l'évaluation des risques cancérogènes. Les résultats des évaluations du mode d'action sont résumés dans cette section.
9.3.1 Mutagénicité à action directe
La mutagénicité à action directe a été envisagée comme mode d'action potentiel pour le développement de tumeurs hépatocellulaires chez les rats. Comme il a été discuté dans la section 9.2.4, les données indiquent clairement que le SPFO n'est pas un composé mutagène, peu importe s'il y a activation métabolique ou non. Les résultats d'une grande variété d'essais in vitro et in vivo concernant la génotoxicité du SPFO étaient négatifs. Le profil des tumeurs provoquées par le SPFO ne correspondait pas non plus à celui des mutagènes typiques. Par exemple, on s'attend généralement à ce que les mutagènes provoquent des tumeurs dans plusieurs différents organes, mais le SPFO a seulement causé des tumeurs dans la glande thyroïde et le foie des rats (Butenhoff et coll., 2012b), qui étaient des organes qui ont également subi des effets indésirables non cancéreux chez les rats et d'autres espèces. De plus, les mutagènes produisent souvent une incidence élevée de tumeurs, qui surviennent à des moments précoces. Chez les animaux exposés au SPFO, des tumeurs hépatocellulaires ont été observées seulement après une durée de vie (et non chez les rats exposés pendant un an puis maintenus en vie pendant une autre année), et à faible incidence (de 8 à 12 %) (Butenhoff et coll., 2012b). Des incohérences ont été relevées dans l'étude par rapport aux tumeurs de la glande thyroïde et des liens entre le temps et la dose, et entre la dose et la réponse (une augmentation significative a seulement été observée dans le groupe à dose élevée exposé pendant un an et non dans le groupe exposé pendant deux ans chez les mâles, et dans le groupe recevant la dose intermédiaire chez les femelles). L'incidence des tumeurs était encore relativement faible dans la plupart des groupes, variant de 7 à 10 % chez les rats exposés pendant deux ans (de 6 à 10 %); l'incidence était légèrement plus élevée chez le groupe de récupération mâle (23 %). Ces données donnent à penser que l'extrapolation linéaire à faible dose n'est pas appropriée pour les tumeurs provoquées par le SPFO. Aucune analyse supplémentaire du mode d'action n'est nécessaire pour la mutagénicité à action directe, à moins que des données contradictoires ne soient publiées.
9.3.2 Prolifération des peroxysomes
La prolifération des peroxysomes était considérée comme étant un mode d'action potentiel pour les tumeurs hépatocellulaires chez les rats, la dégénération kystique hépatique chez les rats, l'augmentation du poids du foie chez les souris, et une augmentation des lipides sériques chez les singes et les souris. Des données existent concernant l'activité du récepteur activé par les proliférateurs de peroxysomes (PPAR) hépatique chez les rats; toutefois, aucune étude n'a mesuré directement les répercussions du PPAR sur d'autres résultats. Comme il n'y avait pas suffisamment de données disponibles pour appliquer complètement les facteurs évolués Bradford-Hill pour l'évaluation du mode d'action, l'analyse du poids de la preuve est limitée à l'évaluation de la dose-réponse des phénomènes clés pour la prolifération des peroxysomes dans le foie du rat.
Trois phénomènes clés dans le mode d'action de la prolifération des peroxysomes sont considérés comme menant à des effets histologiques sur le foie et à des tumeurs hépatocellulaires. Ces phénomènes clés sont : 1) l'activation des récepteurs PPARα hépatiques, ce qui mène à 2) des voies pour la modification de la croissance des cellules, ce qui inhibe l'apoptose ou encourage la réplication des cellules, ce qui mène finalement à 3) la prolifération d'hépatocytes (Corton et coll., 2014).
9.3.2.1 Phénomène clé no 1 – activation PPARα
Les doses les plus faibles auxquelles l'activation PPARα a été étudiée variaient de 0,024 à 1,25 mg/kg p.c. par jour, chez des rats exposés pendant 4, 14 ou 104 semaines (Seacat et coll., 2003; Butenhoff et coll., 2012b). L'activation PPARα n'a pas été observée à aucune dose, d'après l'absence de l'augmentation de l'activité d'oxydase de la palmitoyl-coenzyme A. Une augmentation de l'activité PPARα a été mesurée après une semaine d'exposition à des doses plus élevées chez les rats, avec une régulation positive en fonction de la dose des gènes cibles PPARα après l'exposition à 5 ou à 20 mg/kg p.c. par jour (Ye et coll., 2012), et une augmentation de ACOX et de 12-OH LAH à 9,65 mg/kg p.c. par jour (Elcombe et coll., 2012b). Toutefois, ces derniers effets n'ont pas été observés après une semaine d'exposition à 1,93 mg/kg p.c. par jour (Elcombe et coll., 2012b). L'activation PPAR survient seulement à des concentrations plus élevées pour le SPFO que l'APFO dans les études sur l'expression génétique in vitro (Takacs et Abbott, 2007; Rosen et coll., 2013) et in vivo (Rosen et coll., 2010). De plus, les études avec des souris dont l'expression du gène PPARα a été inhibée (PPARα-KO) ont révélé des effets histologiques et des changements dans l'expression des gènes hépatiques qui étaient semblables aux souris avec une activité PPAR active, ce qui indique des effets indépendants du gène PPAR (Rosen et coll., 2010).
9.3.2.2 Phénomène clé no 2 – modification de la croissance des cellules
Aucune étude n'a pu être relevée sur les marqueurs des voies pour la modification de la croissance des cellules.
9.3.2.3 Phénomène clé no 3 – prolifération d'hépatocytes
La prolifération d'hépatocytes n'a pas été observée aux doses les plus faibles étudiées (de 0,024 à 1,25 mg/kg p.c. par jour, pendant 4, 14 ou 104 semaines; Seacat et coll., 2003; Butenhoff et coll., 2012b). L'indice prolifératif du foie était plus élevé, mais cette hausse n'était pas maintenue, après l'exposition à 1,93 ou à 9,65 mg/kg p.c. par jour pendant une semaine (Elcombe et coll., 2012b).
9.3.2.4 Comparaison de la dose-réponse des phénomènes clés et des résultats
Pour que les modes d'action soient jugés pertinents pour un effet néfaste, une concordance entre la dose et la réaction – c'est-à-dire l'observation de phénomènes clés précoces à des doses plus faibles ou égales à celles de phénomènes clés survenant plus tard et l'effet néfaste – est nécessaire. Toutefois, pour le SPFO, les doses les plus faibles pour lesquelles on a observé des résultats néfastes chez les rats (dégénérescence kystique : 0,024 mg/kg p.c. par jour, adénomes hépatocellulaires : 0,984 et 1,251 mg/kg p.c. par jour chez les mâles et les femelles, respectivement) étaient plus faibles que celles auxquelles on a observé une prolifération d'hépatocytes (≥ 1,93 mg/kg p.c. par jour). Cette prolifération d'hépatocytes n'est peut-être pas non plus associée à l'activation PPARα, qui a seulement été observée à ≥ 5 mg/kg p.c. par jour. Finalement, l'activation PPARα et la prolifération d'hépatocytes n'ont pas été observées simultanément avec la dégénérescence kystique et les adénomes hépatocellulaires dans l'étude où ces effets ont été observés. Comme il semble que la prolifération hépatique, les adénomes hépatocellulaires, et la dégénérescence kystique précèdent l'activation PPARα, les effets hépatiques néfastes observés chez les rats exposés pendant deux ans au SPFO ne semblent pas être provoqués par un mode d'action de prolifération des peroxysomes. Pour cette raison, la pertinence humaine des effets hépatiques provoqués par le SPFO ne peut pas être éliminée. De plus, les effets hépatiques ne semblent pas être spécifiques aux rongeurs – la LOAEL pour l'hypertrophie hépatocellulaire accompagnée de vacuolisation cytoplasmique chez les singes (0,75 mg/kg p.c. par jour; Seacat et coll., 2002) est du même ordre d'importance que chez les rats (0,242 mg/kg p.c. par jour; Butenhoff et coll., 2012b).
Il n'existe pas suffisamment de données pour examiner les répercussions de l'activation PPAR sur les changements aux lipides sériques, à la glande thyroïde et aux paramètres immunitaires, mais la prolifération des peroxysomes est plausible pour tous les paramètres. Il est connu que les activateurs PPAR produisent des effets hypolipémiants (Corton et coll., 2014), et le SPFO a une structure semblable aux acides gras. Chez les rats, les modifications provoquées par le SPFO de l'expression génétique liée au métabolisme des acides gras ainsi qu'à la synthèse et à la libération des hormones thyroïdales ressemblaient à celles d'activateurs PPARα connus (Martin et coll., 2007). Certains effets immunitaires (modifications au poids et à la cellularité dans la rate et le thymus) étaient tempérés chez les souris PPAR-KO (par rapport aux souris de type sauvage) exposées à l'APFO; toutefois, aucune donnée semblable n'existe pour le SPFO, qui ne semble pas être un activateur PPAR aussi solide que l'APFO. Le mode d'action par prolifération des peroxysomes pour ces paramètres ne peut pas être entièrement examiné jusqu'à ce que des données plus approfondies soient produites sur les répercussions de l'activation PPAR provoquée par le SPFO sur les voies immunitaires et lipides sériques.
9.3.3 Perturbation des hormones sexuelles
Des différences entre les sexes ont été observées quant à la réponse immunitaire; en effet, les mâles étaient plus sensibles que les femmes. Toutefois, aucune étude n'a été élaborée pour déterminer si cet effet est associé aux hormones sexuelles; par conséquent, il n'y a pas suffisamment de données pour évaluer le mode d'action. Par contre, le SPFO semble avoir une incidence sur la perturbation des hormones sexuelles – dans différents essais in vitro de l'œstrogénicité, le SPFO n'a pas démontré une activité œstrogénique directe, mais il a augmenté les effets de 17βestradiol dans plusieurs essais (Sonthithai et coll., 2015). Si plus d'études approfondies sur l'effet du SPFO sur la perturbation des hormones sexuelles sont menées, ce mode d'action potentiel pourrait être étudié davantage.
9.3.4 Effet immunosuppresseur
Un effet immunosuppresseur (diminution du nombre de cellules IgM et de cellules tueuses naturelles) a été observé chez les rats à des doses plus faibles que les doses tumorigènes. Les cellules tueuses naturelles prennent part à l'élimination des cellules cancéreuses, mais aucune étude examinant le rôle de l'immunosuppression du développement des tumeurs provoquées par le SPFO n'a été menée. Aucune analyse détaillée de ce mode d'action potentiel ne peut être effectuée au moyen des données actuelles. Si plus d'études approfondies sur l'association entre l'immunosuppression provoquée par le SPFO et le développement de tumeurs sont effectuées, ce mode d'action potentiel pourrait être étudié davantage.
9.3.5 Autres modes d'action
Il n'existe pas suffisamment de données pour permettre l'évaluation d'autres modes d'action potentiels envisagés dans l'analyse des modes d'action. Certaines données – particulièrement concernant l'activation PPAR et la prolifération des peroxysomes – existent pour d'autres paramètres qui n'étaient pas inclus dans l'analyse des modes d'action (c.-à-d. des effets qui ont seulement été observés à des concentrations d'exposition au SPFO plus élevées).
10.0 Classification et évaluation
L'approche de dose de référence (BMD) a été utilisée lorsque possible pour calculer des points de départ potentiels, comme elle est obtenue en fonction de données tirées de la courbe dose-réponse totale pour l'effet critique plutôt que du groupe de dose unique à la NOAEL (PISSC, 1994). Une limite de confiance inférieure de la dose de référence (BMDL) a été suggérée comme substitut approprié pour la NOAEL (Crump, 1984). On définit plus précisément une BMDL appropriée comme une estimation de la limite de confiance inférieure à 95 % dans le cas de la dose qui correspond à un niveau de risque de 1 à 10 % de plus que les niveaux de référence. La définition de la BMD comme limite de confiance inférieure tient compte de la puissance statistique et de la qualité des données (PISSC, 1994). Pour les données dichotomiques (c.-à-d. présence ou absence d'effet), des valeurs de la dose de référence représentent une augmentation de 10 % des effets néfastes par rapport aux taux de référence (BMD10) et leurs limites de confiance inférieures à 95 % (BMDL10) ont été calculées à l'aide du logiciel Benchmark Dose Software de l'U.S. EPA (BMDS, version 2.6.0.86; U.S. EPA, 2015).
Des différences pharmacocinétiques importantes existent entre les animaux et les humains; notamment, la clairance est plus faible (c.-à-d. valeurs de demi-vie plus élevées) chez les humains que chez les rats, les souris et les singes. Ces différences donnent lieu à des doses plus élevées dans les tissus cibles des humains lorsqu'ils sont exposés aux mêmes doses externes que les animaux. Les approches par défaut pour l'extrapolation interespèce (p. ex. utiliser un facteur d'incertitude interespèce de 10 ou un ajustement allométrique) ne sont pas considérées comme étant suffisamment protectrices des humains. Comme il est décrit dans la section 8.6, les valeurs CAFI (c.-à-d. la composante des FASC qui reflète les différences toxicocinétiques interespèces) ont été calculées au moyen d'un modèle PBPK pour tenir compte des différences pharmacocinétiques entre les animaux et les humains. Comme différentes valeurs CAFI ont été calculées pour différentes doses, les valeurs peuvent également tenir compte des non-linéarités des modèles pharmacocinétiques. Cette approche a encore des faiblesses, qui sont présentées en détail à la section 8.6, y compris l'utilisation de concentration plasmatique à l'état stable comme paramètre de dose, plutôt que de sélectionner des valeurs basées sur les organes ou d'examiner si d'autres paramètres de dose (p. ex. concentrations de pointe) sont plus appropriés. Toutefois, malgré les faiblesses, cette approche est considérée la meilleure des options disponibles. Cette approche a été choisie plutôt que l'utilisation des concentrations sériques comme PDD, car il a été déterminé que les modèles PBPK humains n'étaient pas suffisamment fiables pour estimer avec précision les niveaux d'exposition humaine correspondant aux PDD basés sur les valeurs sériques.
10.1 Évaluation des risques de cancer
La cancérogénicité du SPFO n'a pas été évaluée par le CIRC. Des observations uniformes d'associations entre l'exposition au SPFO et les cancers n'ont pas été relevées dans les études épidémiologiques. Certaines associations ont été observées entre le SPFO et le risque de cancer de la vessie, du sein, des organes reproducteurs mâles, et de l'ensemble des cancers; toutefois, les données n'appuient pas la cancérogénicité du SPFO. L'association entre le SPFO et le cancer de la vessie a été rétractée après un suivi ultérieur, alors que la population démontrant un lien entre la substance et le cancer du sein avait également été exposée à plusieurs autres produits chimiques, et les liens avec les cancers des organes reproducteurs mâles n'étaient pas appuyés par des études d'autres populations. Par conséquent même si certaines indications d'un lien entre le SPFO et le risque du cancer ont été observées, les effets étaient équivoques, et aucune tendance évidente ne pouvait être relevée en raison des limitations des études (y compris un petit nombre de cas, des facteurs de confusion et un biais quant à la sélection des participants).
Dans le seul bioessai chronique effectué pour le SPFO, des tumeurs ont été observées dans le foie, la glande thyroïde et les glandes mammaires de rats Sprague-Dawley (Butenhoff et coll., 2012b). Une augmentation importante des adénomes hépatocellulaires a été observée chez les mâles et les femelles soumis à la dose élevée (0,984 et 1,251 mg/kg p.c. par jour, respectivement) après deux ans d'exposition. Les données sur la relation dose-réponse et les tendances temporelles pour les tumeurs de la glande thyroïde et des glandes mammaires étaient moins uniformes. Il y a eu une augmentation des adénomes folliculaires de la thyroïde chez les mâles du groupe de récupération (exposés à 1,144 mg/kg p.c. par jour pendant 52 semaines) mais non chez ceux exposés pendant toute la durée de l'étude. Une augmentation des cas combinés d'adénomes folliculaires de la thyroïde et de carcinomes a été observée seulement chez les femelles du groupe exposé à la deuxième dose la plus élevée (0,299 mg/kg p.c. par jour) mais non chez les femelles recevant la dose élevée. Finalement, l'incidence de fibroadénomes des glandes mammaires et de cas combinés de fibroadénomes et d'adénomes était plus élevée seulement chez les femelles recevant la dose la plus faible (0,029 mg/kg p.c. par jour), mais non chez les autres groupes.
Alors qu'on n'a pas encore élucidé le mode d'action pour les tumeurs provoquées par le SPFO, le poids de la preuve suggère plus fortement que le SPFO est un composé non mutagène (voir les sections 9.2.4 et 9.3). Pour cette raison, l'approche de l'apport quotidien tolérable (AQT) est la méthode la plus appropriée pour établir une valeur basée sur la santé (VBS) pour le cancer.
Les tumeurs hépatocellulaires ont été sélectionnées comme l'effet critique pour l'évaluation des risques cancérogènes, comme il s'agit du paramètre cancérogène ayant le lien dose-réponse le plus uniforme. Chez les mâles, les tumeurs étaient seulement classifiées comme des adénomes hépatocellulaires; chez les femelles, les tumeurs étaient principalement des adénomes hépatocellulaires, mais il y a également eu une incidence de carcinome hépatocellulaire dans le groupe exposé à la dose élevée pendant deux ans. L'incidence de ces tumeurs chez les rats mâles et femelles est présentée dans le tableau 3.
| Groupe de traitement (ppm) |
Mâles – Adénomes hépatocellulaires seulement | Femelles – Combinaison d'adénomes hépatocellulaires et de carcinome | ||
|---|---|---|---|---|
| Dose (mg/kg p.c. par jour) | Incidence (%) | Dose (mg/kg p.c. par jour) | Incidence (%) | |
| 0 | 0 | 0/60 (0 %) | 0 | 0/60 (0 %) |
| 0,5 | 0,024 | 3/50 (6 %) | 0,029 | 1/50 (2 %) |
| 2 | 0,098 | 3/50 (6 %) | 0,12 | 1/49 (2 %) |
| 5 | 0,242 | 1/50 (2 %) | 0,299 | 1/50 (2 %) |
| 20 | 0,984 | 7/60 (12 %)Note de bas de page * | 1,251 | 5/60 (8 %)Note de bas de page * |
| récupération de 20 ppm | 1,144 | 0/40 (0 %) | 1,385 | 2/40 (5 %) |
La modélisation de la BMD a été effectuée séparément pour les mâles et les femelles. Le modèle logistique de type log était le plus indiqué (c.-à-d. la plus faible valeur du critère d'information d'Akaike corrigé) pour les mâles et les femelles. Chez les mâles, on a estimé les valeurs BMD suivantes : BMD10 de 2,25 mg/kg p.c. par jour et BMDL10 de 0,318 mg/kg p.c. par jour. Chez les femelles, on a estimé les valeurs suivantes : BMD10 de 1,81 mg/kg p.c. par jour et BMDL10 de 0,732 mg/kg p.c. par jour. En raison des courbes dose-réponse qui étaient moins qu'idéales (c.-à-d. que l'incidence n'a pas augmenté progressivement en fonction de l'augmentation de la dose), les adaptations du modèle étaient assez faibles, particulièrement chez les mâles (les valeurs prédictives pour les modèles logistiques de type log étaient de 0,44 chez les mâles et de 0,77 chez les femelles). Toutefois, l'adaptation du modèle a été considérée comme étant suffisante selon les critères recommandés (p. ex. valeur prédictive > 0,10) (U.S. EPA, 2012a) Comme la valeur BMDL10 de 0,318 mg/kg p.c. par jour pour les mâles est plus prudente que la valeur correspondante pour les femelles, cette valeur a été sélectionnée comme point de départ pour le calcul de la VBS par rapport au cancer. Comme le matériel d'essai utilisé dans l'étude était seulement pur à 86,9 %, la valeur BMDL10 ajustée pour tenir compte de la concentration réelle de SPFO est de 0,276 mg/kg p.c. par jour.
Pour tenir compte des différences interespèces importantes par rapport aux paramètres pharmacocinétiques, le point de départ équivalent chez l'humain (PDDEQH) peut être calculé en divisant la valeur BMDL10 par la valeur CAFI, comme suit :
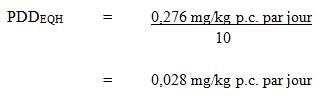
Figure 3 - Équivalent textuel
Le PDDEQH est de 0,028 mg/kg p.c. par jour. Cette valeur est calculée en divisant la BMD10 associée aux tumeurs hépatocellulaires chez les rats mâles, de 0,276 mg/kg p.c par jour, par la valeur de CAFI propre à la dose des rats d'environ 0,1 mg/kg p.c. par jour, 10.
où :
- 0,276 mg/kg p.c. par jour est la valeur BMDL10 pour les tumeurs hépatocellulaires chez les rats mâles (Butenhoff et coll., 2012b);
- 10 est la valeur CAFI propre à la dose pour les rats dans la fourchette de 0,1 mg/kg p.c. par jour (voir la section 8.6.2).
Au moyen de la valeur PDDEQH calculée, l'AQT pour les effets cancer est calculé comme suit :
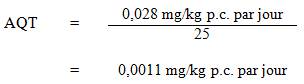
Figure 4 - Équivalent textuel
L'AQT pour le SPFO est de 0,0011 mg/kg p.c. par jour. Cette valeur est calculée en divisant le PDDEQH de 0,028 mg/kg p.c. par jour par le facteur d'incertitude composite, 25.
où :
- 0,028 mg/kg p.c. par jour est le PDDEQH calculé ci-dessus;
- 25 est le facteur d'incertitude composite, comme il est décrit ci-dessous.
Le facteur d'incertitude composite de 25 est établi à partir de deux composantes : le facteur d'incertitude interespèce (×2,5) et le facteur d'incertitude intraespèce (×10). Une valeur de 2,5 est utilisée pour refléter seulement la composante toxicodynamique du facteur d'incertitude interespèce par défaut, car les différences toxicocinétiques entre les rats et les humains étaient déjà intégrées au moment du calcul du PDDEQH. Une valeur par défaut de 10 a été appliquée au facteur d'incertitude intraespèce. La valeur par défaut a été considérée comme étant suffisante en l'absence de données sur les différences intraespèces. On sait qu'il y a des différences importantes pharmacocinétiques entre les espèces, mais un manque de données sur le mécanisme d'excrétion du SPFO exclut les études établissant si les variabilités pharmacocinétiques seraient également larges au sein de la population humaine. Dans la seule étude de demi-vie humaine de SPFO, la différence entre les valeurs les plus faibles et les plus élevées est de l'ordre de 10. Si d'autres études du SPFO indiquent systématiquement une différence de l'ordre de dix dans les paramètres pharmacocinétiques au sein de la population, un facteur d'incertitude intraespèce plus élevé pourrait être justifié pour garantir que les différences pharmacodynamiques entre les humains soient également prises en compte de façon quantitative.
À partir de cet AQT, on peut calculer la VBS pour l'eau potable comme suit :
Figure 5 - Équivalent textuel
La VBS pour le SPFO dans l'eau potable est de 0,010 mg/L. Cette valeur est calculée en multipliant l'AQT de le SPFO pour le cancer, soit 0,0011 mg/kg p.c. par jour, par 70 kg, le poids corporel moyen d'un adulte puis par le facteur d'attribution de l'eau potable, 0,2, et en divisant le résultat par 1.5 L/jour, le volume quotidien d'eau consommé par un adulte.
où :
- 0,0011 mg/kg p.c. par jour correspond à l'AQT calculé ci-dessus;
- 70 kg correspond au poids corporel moyen d'un adulte;
- 0,2 est le facteur d'attribution par défaut pour l'eau potable, utilisé en tant que valeur seuil, comme l'eau potable n'est pas une source importante d'exposition et qu'il y a des preuves de présence généralisée dans au moins un autre milieu (air, aliments, sol ou produits de consommation) (Krishnan et Carrier, 2013).
- 1,5 L/jour correspond au volume quotidien d'eau consommée par un adulte; on ne considère pas que l'exposition par voie cutanée et par inhalation pendant les bains et les douches soit importante (comme il est décrit à la section 5.7).
10.2 Évaluation des risques d'effets autres que le cancer
Les données épidémiologiques ont révélé une association entre l'exposition au SPFO et un risque accru de résultats multiples sur la santé, comme des effets sur la reproduction, le développement et les effets immunologiques (voir la section 9.1.3), mais il n'est pas possible d'établir un point de départ (PDD) à partir des études, en raison de leurs limitations, y compris leur conception et les facteurs de biais et de confusion.
On a observé une immunosuppression chez les souris aux plus faibles niveaux d'exposition. La LOAEL la plus faible pour les données d'immunosuppression classifiées par le PISSC (2012) comme fournissant le poids de la preuve le plus solide quant à l'immunotoxicité était la suppression de taux IgM propres aux globules rouges de mouton chez les souris à ≥ 0,00166 mg/kg p.c. par jour (Peden-Adams et coll., 2008). Les effets sur le système immunitaire étaient exclus de l'évaluation quantitative des risques en raison des données contradictoires par rapport aux NOAEL et aux LOAEL entre les études et l'incertitude de l'importance des effets observés pour la santé humaine. Des explications supplémentaires seront fournies sur ces facteurs dans cette section. Des incohérences ont été observées dans les doses de SPFO efficaces pour les paramètres de la fonction immunitaire : la suppression des taux IgM propres aux globules rouges de mouton chez les souris B6C3F1 dans l'étude de PedenAdams et coll. (2008) a été observée à ≥ 0,00166 mg/kg p.c. par jour, alors que la LOAEL chez les souris C57Bl/6 était de 0,0833 mg/kg p.c. par jour, avec aucun changement significatif observé à 0,0083 mg/kg p.c. par jour (Dong et coll., 2009) ou à 0,0167 mg/kg p.c. par jour (Dong et coll., 2011). De plus, l'activité des cellules tueuses naturelles a en fait augmenté à 0,0166 mg/kg p.c. par jour chez les souris B6C3F1 (PedenAdams et coll., 2008), alors que l'effet était non monotone chez les souris C57Bl/6; en effet, chez ces souris, il y a eu une augmentation de l'activité à des faibles doses (augmentation significative à 0,0833 mg/kg p.c. par jour), et des diminutions significatives à des doses plus élevées (0,833 et 2,083 mg/kg p.c. par jour) (Dong et coll., 2009). Une autre étude a relevé une mortalité accrue à la suite d'une infection par le virus de l'influenza de type A chez les souris à 0,025 mg/kg p.c. par jour (Guruge et coll., 2009); toutefois, cet effet n'a pas été étudié chez les autres espèces. L'adversité de la suppression des IgM et les changements à l'activité des cellules tueuses naturelles sont également discutables – ces effets démontrent des changements au système immunitaire, mais il n'est pas clair si des petites variations de ces mesures sont suffisantes pour provoquer des effets néfastes sur la santé des humains. L'étude de Grandjean et coll. (2012) est à considérer aux fins de discussions de l'importance clinique chez les humains; en effet, cette étude a démontré que malgré une réponse atténuée des immunoglobulines propres au vaccin chez les enfants exposés au SPFO, le nombre d'enfants dont les taux d'immunoglobulines étaient inférieurs au niveau protecteur clinique était faible. De plus, les souris semblent être plus sensibles que les autres espèces, comme la LOAEL pour l'immunosuppression était de plusieurs ordres d'importance plus élevée que dans la seule étude chez les rats, à 3,21 mg/kg p.c. par jour (Lefebvre et coll., 2008). Chez les humains, les indications d'immunosuppression ne sont pas uniformes – des associations sont observées entre les concentrations de SPFO et les diminutions des anticorps contre certaines maladies (mais pas contre toutes les maladies), et l'influence de l'exposition au SPFO sur l'immunosuppression (c.-à-d. l'incidence de maladies) semble être plus vague. Par conséquent, même si de faibles doses de SPFO semblent être associées à l'immunosuppression, les données ne sont pas jugées comme étant actuellement suffisamment fiables pour être utilisées comme une étude principale aux fins d'évaluation du SPFO. D'autres essais devraient être effectués pour examiner la différence de presque deux ordres d'importance entre les LOAEL des études avant que ces paramètres puissent être considérés comme fiables pour la base d'une évaluation des risques.
L'effet néfaste observé à la plus faible concentration (à l'exception des effets sur les taux IgM et les cellules tueuses naturelles dans l'étude de Peden-Adams et coll., 2008) était une dégénérescence kystique du foie observée chez les rats Crl:CD(SD)IGS BR mâles exposés à la substance pendant 104 semaines dans l'alimentation (Butenhoff et coll., 2012b). Cet effet a été observé dans une étude rigoureuse, avec quatre groupes de traitement (n ≥ 55) et un autre groupe de récupération à dose élevée (n = 40); toutefois, il n'est pas proposé comme effet critique pour l'évaluation des risques. Le paramètre est une lésion spontanée courante bénigne chez les rats âgés, particulièrement les mâles (Bannasch et Zerban, 1997; Karbe et Kerlin, 2002), qui a été classifiée par certains pathologistes comme un néoplasme bénin (Bannasch, 2003). La dégénérescence kystique survient seulement rarement dans d'autres mammifères, y compris les humains (Bannasch et Zerban, 1997; Karbe et Kerlin, 2002). La dégénérescence kystique peut être associée à des foyers d'altérations cellulaires ou à des tumeurs (Karbe et Kerlin, 2002), mais la progression dans les animaux exposés au SPFO ne suit pas celle de changements histologiques plus graves. De plus, l'incidence de dégénérescence kystique était semblable parmi les groupes d'exposition, variant de 27 à 38 % avec aucune augmentation liée à la dose, et survenant à des niveaux semblables à des rats exposés à des doses élevées pendant deux ans par rapport aux rats du groupe de récupération (33 par rapport à 38 %). La fréquence de la dégénérescence kystique dans la plupart des groupes se situe dans la fourchette de développement spontané chez les rats mâles, qui peut s'élever jusqu'à 34 % (Karbe et Kerlin, 2002).
L'hypertrophie hépatocellulaire a d'abord été observée à une dose plus élevée que la LOAEL pour la dégénérescence kystique (0,098 mg/kg p.c. par jour) dans l'étude de Butenhoff, et l'incidence augmente en fonction de la dose. L'hypertrophie hépatocellulaire peut parfois être perçue comme un effet qui est adaptif plutôt que néfaste à part entière, mais des preuves d'autres effets histologiques dans le foie à des concentrations plus élevées fournissent une indication de leur progression lors d'une exposition continue (ECETOC, 2002; Hall et coll., 2012). Des effets histologiques clairement néfastes (y compris la vacuolisation cytoplasmique) ont été observés dans le foie des rats mâles à partir du prochain niveau de dose (0,242 mg/kg p.c. par jour) de l'étude. Bien que l'hypertrophie hépatocellulaire survient à un niveau de dose inférieur que les effets histologiques clairement néfastes, l'effet est proposé comme un effet critique pour cette évaluation, comme il pourrait être un indicateur sensible du potentiel pour la progression d'effets histologiques néfastes. De plus, les LOAEL étaient les mêmes pour l'hypertrophie hépatocellulaire et la vacuolisation cytoplasmique chez les rats de l'étude Butenhoff qui ont été euthanasiés tôt (après 4 ou 14 semaines, à des LOAEL de 0,34 à 0,37 mg/kg p.c. par jour; Seacat et coll., 2003) et chez les rates femelles exposées pendant deux ans (0,299 mg/kg p.c. par jour; Butenhoff et coll., 2012b). Une hypertrophie hépatocellulaire accompagnée de vacuolisation cytoplasmique a également été observée chez les singes, avec une NOAEL et une LOAEL de 0,15 et de 0,75 mg/kg p.c. par jour, respectivement. Par conséquent, une augmentation du poids du foie et l'hypertrophie hépatocellulaire ont été prises en compte dans l'évaluation dose-réponse – malgré leur potentiel d'être des effets adaptifs plutôt que néfastes – comme moyen de prévenir les effets histologiques plus graves observés dans d'autres études ou à des doses plus élevées. La NOAEL de 0,024 mg/kg p.c. par jour a été ajustée à une valeur de 0,021 mg/kg p.c. par jour pour tenir compte de la pureté diminuée (86,9 %) du matériel d'essai.
Les études épidémiologiques ne contredisent pas l'utilisation de paramètres prudents pour les effets hépatiques. Les études sur les humains ont démontré des indications faibles et contradictoires de modifications des enzymes hépatiques en raison de l'exposition au SPFO, avec des associations positives, négatives et absentes pour les paramètres hépatiques, selon l'étude. Des associations entre les changements des taux d'ALT de personnes qui travaillaient auparavant avec des substances perfluoroalkyliques (établissement 3M) et de personnes exposées géographiquement (sujets du projet C8) et des concentrations sériques médianes du SPFO variant de 18 à 366 ng/mL ont été signalées (Gallo et coll., 2012; Olsen et coll., 2012); les taux d'ALT étaient plus élevés dans la population exposée à la substance dans l'environnement et moins élevée chez les personnes exposées à la substance au travail. Aucun effet sur les taux d'enzymes hépatiques n'a été observé dans une étude transversale de travailleurs exposés au SPFO avec des concentrations sériques variant de 20 à 2 110 ng/mL (Olsen et coll., 2003b). Les valeurs sériques dans l'étude avec les résultats positifs sont d'un ou de deux ordres d'importance plus faibles que les valeurs sériques de NOAEL et de LOAEL de l'étude de Butenhoff (1 310 et 7 600 ng/mL, respectivement).
Des modifications aux concentrations d'hormones thyroïdales – qui ont été observées chez les singes, les rats et les souris – sont également proposées comme un effet critique de cette analyse. Les effets observés étaient habituellement des diminutions des taux T3 et T4, qui étaient souvent observés aux plus faibles doses des études. Des augmentations correspondantes du taux TSH ont été observées dans le cadre d'une étude de 26 semaines menée sur des macaques de Buffon, mais non dans les études sur des rongeurs. Les auteurs d'une étude de 26 semaines sur des macaques de Buffon (Seacat et coll., 2002) sont arrivés à une LOAEL de 0,75 mg/kg p.c. par jour pour les changements des hormones thyroïdales. Toutefois, Santé Canada (2013c) a effectué une réanalyse statistique des données de Seacat et coll. (2002) qui a permis une meilleure interprétation des mesures effectuées à différents moments. La réanalyse a relevé des effets liés à la dose pour des diminutions du taux T3 total chez les deux sexes et du taux T4 total chez les femelles seulement, ainsi que des effets dose-temps pour les taux de T3 total, de T4 total et de TSH. Les valeurs LOAEL et NOAEL pour les changements des concentrations d'hormones thyroïdales établies par la réanalyse étaient de 0,15 et de 0,03 mg/kg p.c. par jour, respectivement. La plupart des études sur les rats n'avaient pas de NOAEL; les LOAEL les plus faibles étaient dans une fourchette semblable à celle des singes, comme il est indiqué à la section 9.2.2.4. Comme la NOAEL de 0,03 mg/kg p.c. par jour de l'étude de 26 semaines menée sur les singes est plus faible que la NOAEL pour l'hypertrophie hépatocellulaire, les changements aux hormones thyroïdales sont considérés comme un effet critique potentiel pour cette évaluation. Les effets sur les concentrations d'hormones thyroïdales n'ont pas étudiés dans plusieurs études sur les souris, mais les diminutions des taux T4 ont seulement été observés à des concentrations plus élevées (la LOAEL la plus faible est de 5 mg/kg p.c. par jour chez des petits exposés in utero (Lau et coll., 2003]). L'étude chronique des rats (Butenhoff et coll., 2012b) n'a pas relevé de changements histologiques à la glande thyroïde; toutefois, l'étude n'a pas examiné les changements aux concentrations d'hormones thyroïdales, qui peuvent avoir des incidences sur différents systèmes dans le corps, même en l'absence de changements structurels à la glande thyroïde. Les études épidémiologiques n'indiquent pas de tendance claire par rapport à des changements aux hormones thyroïdales provoqués par le SPFO – toutefois, des diminutions des taux T3 et T4 ont été observés en association avec une augmentation des concentrations de SPFO, alors que d'autres études ont indiqué des associations positives ou absentes.
Plusieurs des études qui ont relevé des diminutions des taux de T3 et de T4 étaient des études d'une génération (principalement sur des rats), et les changements aux concentrations d'hormones thyroïdales ont été observés chez les mères et les petits. Ces hormones thyroïdales exercent un rôle important dans le développement des organes fœtaux, y compris ceux du système nerveux central; il a été observé qu'un manque de ces hormones provoquait une détérioration des résultats neurocomportementaux chez les animaux et les humains (Pop et coll., 1999; Koibuchi et Chen, 2000; Morreale de Escobar, 2004; Williams, 2008; Delahunty et coll., 2010; Gilbert et coll., 2012; Schroeder et Privalsky, 2014). Plusieurs études ont relevé des preuves d'effets sur le développement neurologique découlant de l'exposition au SPFO (y compris des changements à l'ultrastructure du cerveau, à l'expression des gènes et des protéines, aux capacités d'apprentissage chez les rats, et au comportement moteur chez les rats et les souris), avec plusieurs LOAEL dans une fourchette semblable à celle observée pour les effets sur les hormones thyroïdales (voir la section 9.2.5). Dans la seule étude (sur des rats) qui a examiné les effets sur les hormones thyroïdales et le développement neurologique (Lau et coll., 2003), des taux T4 plus faibles ont été observés conjointement avec des légères diminutions des niveaux de choline-acétylase dans le cortex préfrontal (qui est sensible au statut des hormones thyroïdales); par contre, aucun changement dans les comportements d'apprentissage et de mémoire n'ont été notés. Bien que plusieurs études indiquent des changements au comportement moteur chez les rats et les souris à des doses entre 0,3 et 0,75 mg/kg p.c. par jour (Johansson et coll., 2008; Butenhoff et coll., 2009; Onishchenko et coll., 2011; Wang et coll., 2015), des faiblesses dans chacune des études excluent leur utilisation comme des études essentielles pour ces faibles doses. La conception a nui aux études sur les souris, comme Johansson et coll. (2008) ont seulement administré la dose pendant une seule journée, et Onischenko et coll. (2011) avaient seulement un groupe à une seule dose. Des résultats contradictoires sont resssortis des études chez les rats. Dans l'étude de Butenhoff et coll. (2009), les changements à l'activité motrice ont seulement été observés pendant une seule journée, et cette dernière était différente chez les mâles et les femelles (seulement au JPN 17 chez les mâles exposés à 0,3 et à 1 mg/kg p.c. par jour, et au JPN 21 chez les femelles exposées à 1 mg/kg p.c. par jour, alors qu'aucun effet n'a été observé aux JPN 13 ou 61 et ce, chez les deux sexes). Dans l'étude de Wang et coll. (2015), les petits des rats ont été exposés in utero, par lactation, ou par les deux voies, à 5 et à 15 mg/L dans l'eau potable (équivalent à 0,7 et à 2,1 mg/kg p.c. par jour au moyen de l'hypothèse de Santé Canada (1994) selon laquelle 1 ppm dans l'eau = 0,14 mg/kg p.c. par jour chez les rats, une hypothèse qui n'est peut-être pas pertinente pour les rates gravides ou allaitantes). Les effets sur la capacité d'apprentissage ont été observés dans les deux groupes de doses, mais plus uniformément à la dose élevée; à la faible dose, les changements étaient observés à moins de jours de mesure et dans les groupes exposés seulement in utero ou par la lactation, et non dans le groupe exposé pendant les deux périodes. Dans des études épidémiologiques transversales, alors qu'une étude a signalé une association positive entre des concentrations de SPFO accrues et des effets sur le développement neurologique (TDAH déclarés), aucun lien évident n'a été observé pour ce paramètre dans les preuves épidémiologiques limitées et équivoques; aucune association n'a été observée pour d'autres étapes clés du développement neurologique. Si d'autres études démontrent l'uniformité des effets à des faibles concentrations, le paramètre pourrait être considéré comme un effet critique potentiel pour les expositions au SPFO; en l'absence d'effets uniformes à des faibles concentrations, un AQT basé sur les effets sur le foie et la glande thyroïde est estimé comme étant suffisant pour protéger contre les changements au comportement neurologique.
Des changements aux concentrations sériques des lipides ont également été observés à des concentrations semblables à celles où on a observé des effets thyroïdaux. Les changements généralement observés étaient des diminutions du cholestérol total, du HDL et des triglycérides. La dose la plus faible à laquelle des changements sériques aux lipides ont été observés provenait de l'étude de 26 semaines menée sur des macaques de Buffon, où des diminutions du taux HDL ont été observés à 0,03 mg/kg p.c. par jour (c.-à-d. la NOAEL pour les effets sur la thyroïde décrits précédemment). La LOAEL la plus faible pour les souris était de 0,166 mg/kg p.c. par jour (Fair et coll., 2011) et de 0,4 mg/kg p.c. par jour pour les rats (Luebker et coll., 2005b). Il est important de tenir compte de ces effets pendant l'évaluation des risques du SPFO, comme les études épidémiologiques ont tendance à démontrer des associations positives mineures (mais contradictoires, et d'importance clinique douteuse) entre le SPFO et les taux de cholestérol sériques. Comme des données contradictoires sur les effets ont été relevées entre les deux bases de données, et dans la base de données épidémiologiques, et comme des liens évidents dose-réponse étaient absents des études animales, des évaluations quantitatives n'ont pas été effectuées pour les effets sur les lipides sériques. D'après la base de données actuelles, un AQT basé sur les effets hépatiques ou sériques est estimé comme étant suffisamment protecteur des changements lipidiques.
Pour refléter les différences interespèces importantes par rapport aux paramètres pharmacocinétiques, les valeurs PDDEQH sont calculées pour les deux effets critiques proposés, comme suit :
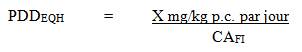
Figure 6 - Équivalent textuel
Le PDDEQH est calculée en divisant de X mg/kg p.c. par jour, correspondant au point de départ associé à la NOAEL pour soit l'hypertrophie hépatocellulaire, soit les changements au niveau des hormones thyroïdales, par le facteur d'ajustement propre à la dose et à l’espèce approprié.
où :
- X mg/kg p.c. par jour est le point de départ associé à la NOAEL pour l'hypertrophie hépatocellulaire ou les changements au niveau des hormones thyroïdales décrits ci-dessus;
- CAFI est le facteur d'ajustement propre à la dose et à l'espèce approprié (comme il est décrit à la section 8.6.2).
Deux différentes valeurs CAFI ont été appliquées pour les évaluations. Les deux LOAEL étaient de < 0,1 mg/kg p.c. par jour; par conséquent, la valeur CAFI correspondante a été appliquée pour chaque espèce. Une valeur CAFI de 14 a été utilisée pour les rats, et une valeur de 4 a été utilisée pour les singes, conformément à la description à la section 8.6.
Au moyen de la valeur PDDEQH calculée, les AQT non cancérogènes sont calculés comme suit :
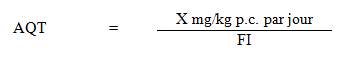
Figure 7 - Équivalent textuel
L'AQT est calculée en divisant le PDDEQH de X mg/kg p.c. par jour, par le facteur d'incertitude composite, FI.
où :
- X mg/kg p.c. par jour est le PDDEQH calculé pour chaque effet critiqué, comme il est décrit ci-dessus;
- FI est le facteur d'incertitude composite, comme il est décrit ci-dessous.
Le facteur d'incertitude composite variait selon l'effet. Pour tous les PDD, un facteur d'incertitude interespèce de 2,5 a été utilisé pour refléter seulement la composante toxicodynamique du facteur d'incertitude interespèce par défaut, car les différences toxicocinétiques entre les animaux et les humains étaient déjà intégrées au moment du calcul du PDDEQH. De même, des valeurs par défaut de 10 ont été appliquées au facteur d'incertitude intraespèce pour tous les PDD. La valeur par défaut a été considérée comme étant suffisante en l'absence de données sur les différences intraespèces. On sait qu'il y a des différences importantes pharmacocinétiques entre les espèces, mais un manque de données sur le mécanisme d'excrétion du SPFO exclut les études établissant si les variabilités pharmacocinétiques seraient également larges au sein de la population humaine. Dans la seule étude de demi-vie humaine de SPFO, la différence entre les valeurs les plus faibles et les plus élevées est de l'ordre de 10. Si d'autres études du SPFO indiquent systématiquement une différence de l'ordre de dix dans les paramètres pharmacocinétiques au sein de la population, un facteur d'incertitude intraespèce plus élevé pourrait être justifié pour garantir que les différences pharmacodynamiques entre les humains sont également prises en compte de façon quantitative. Un facteur d'incertitude de 3 a également été appliqué pour refléter que la plus longue durée à laquelle des effets sur les concentrations d'hormones thyroïdales ont été étudiées étaient pendant une étude de 26 semaines sur les singes (Seacat et coll., 2002) ce qui correspond seulement à une partie de la durée de vie de l'animal. Une valeur de 3 a été sélectionnée plutôt que la valeur complète de 10 car les LOAEL pour les études sur les rats de plus courte durée étaient semblables à celles des études subchroniques; toutefois, un facteur d'incertitude subchronique à chronique était encore nécessaire, malgré cette observation, comme la réanalyse des données par Santé Canada a relevé un effet temps-dose significatif pour les paramètres thyroïdaux. Le facteur d'incertitude n'était pas nécessaire pour l'hypertrophie hépatocellulaire, qui a été observée dans une étude chronique.
Les PDDEQH et les AQT pour chaque effet critique sur la santé ont été calculés et sont présentés dans le tableau 4 ci-dessous :
| Étude | Hypertrophie hépatocellulaire Butenhoff et coll., 2012b |
Modifications des hormones thyroïdiennes Seacat et coll., 2002 |
|---|---|---|
| NOAEL (mg/kg p.c. par jour) | 0,021 | 0,03 |
| CAFI | 14 | 4 |
| PDDEQH (mg/kg p.c. par jour) | 0,0015 | 0,0075 |
| FI composite | 25 | 75 |
| AQT (mg/kg p.c. par jour) | 0,00006 | 0,0001 |
Les AQT calculés pour les deux effets critiques sont semblables, mais la valeur pour l'hypertrophie hépatocellulaire chez les rats est légèrement plus faible. Pour cette raison, l'hypertrophie hépatocellulaire est utilisée comme la base de l'AQT, qui est confirmé de manière quantitative par l'AQT pour les effets sur la glande thyroïde chez les singes. À partir de cet AQT, on peut calculer la VBS pour l'eau potable comme suit :

Figure 8 - Équivalent textuel
La VBS pour le SPFO dans l'eau potable est de 0,0006 mg/L (arrondie). Cette valeur est calculée en multipliant l'AQT non cancérogène pour le SPFO de 0,00006 mg/kg p.c. par jour, par 70 kg, le poids corporel moyen d'un adulte, puis par 0,2, le facteur d'attribution par défaut pour l'eau potable, et en divisant le résultat par 1.5 L/jour, le volume quotidien d'eau consommé par un adulte.
où :
- 0,00006 mg/kg p.c. par jour correspond à l'AQT calculé ci-dessus;
- 70 kg correspond au poids corporel moyen d'un adulte;
- 0,2 est le facteur d'attribution par défaut pour l'eau potable, utilisé en tant que valeur seuil, comme l'eau potable n'est pas une source importante d'exposition et qu'il y a des preuves de présence généralisée dans au moins un autre milieu (air, aliments, sol ou produit de consommation) (Krishnan et Carrier, 2013).
- 1,5 L/jour correspond au volume quotidien d'eau consommée par un adulte; on ne considère pas que l'exposition par voie cutanée et par inhalation pendant les bains et les douches soit importante (comme il est décrit à la section 5.7).
10.3 Comparaison des évaluations de risques de cancer et d'effets autres que le cancer
La VBS pour l'évaluation des effets non cancérogènes, qui était de 0,0006 mg/L et qui avait été établie en fonction de changements histologiques dans le foie des rats, est plus conservatrice que la VBS pour les tumeurs hépatocellulaires de 0,01 mg/L. La VBS proposée de 0,0006 mg/L qui a été calculée pour les effets non cancérogènes est donc estimée comme étant suffisante pour protéger contre les effets cancérogènes du SPFO
10.4 Considérations internationales
Un mémoire publié par l'Office of Water de l'U.S. EPA indique un avis provisoire pour la santé de 0,2 μg/L (0,0002 mg/L) pour le SPFO (U.S. EPA, 2009b). Cet avis a été établi en fonction d'une NOAEL de 0,03 mg/kg p.c. par jour des taux de TSH accrus chez les mâles, des taux de T3 total réduits chez les mâles et les femelles, et des concentrations réduites de lipoprotéines de densité élevée (HDL) chez des macaques de Buffon femelles exposées au SPFO par voie orale pendant 183 jours (Seacat et coll., 2002). Un facteur d'incertitude de 390 (×10 pour les différences intraespèces, ×3 pour les différences toxicodynamiques interespèces ×13 pour les différences toxicocinétiques interespèces) a été appliqué, ce qui a donné lieu à une dose de référence (RfD) arrondie à 80 ng/kg p.c. par jour (U.S. EPA, 2009b). Cette dose de référence était également indiquée dans une note émise par le Office of Solid Waste and Emergency Response de l'U.S. EPA (2009c). D'après la politique de l'U.S. EPA, l'avis provisoire pour la santé (0,2 μg/L) a ensuite été calculé pour un enfant de 10 kg qui consomme un litre d'eau par jour et en utilisant l'hypothèse par défaut selon laquelle l'eau potable contribue 20 % de l'exposition totale au SPFO (U.S. EPA, 2009b).
Le Minnesota Department of Health (MDH, 2008c; 2008d) a calculé une limite de risque sanitaire de 0,3 μg/L (0,0003 mg/L). Cette valeur était basée sur la diminution du taux de cholestérol HDL et du taux de T3, et sur l'augmentation du taux TSH observées chez les singes exposés à ≥ 0,03 mg/kg p.c. par jour (Seacat et coll., 2002; Thomford, 2002). Plus précisément, la dose de référence (BMDL; niveau de réponse non précisé) pour ces effets était estimée à 35 000 ng/mL de SPFO dans le sérum des singes. Une dose équivalente chez l'humain (HED) de 2 500 ng/kg p.c. par jour (2,5 μg/kg p.c. par jour, ou 0,0025 mg/kg p.c. par jour) a été calculée selon l'élimination du SPFO chez les humains (au moyen des données sur la demi-vie chez les humains pour estimer la clairance). Un facteur d'incertitude de 30 (×10 pour la variabilité humaine et ×3 pour les différences toxicodynamiques interespèces) a été appliqué à la dose équivalente chez l'humain, ce qui a donné une dose de référence arrondie à 80 ng/kg p.c. par jour (0,08 μg/kg p.c. par jour, ou 0,00008 mg/kg p.c. par jour). Il a été estimé qu'une absorption ou une élimination à l'état d'équilibre avait lieu après 27 ans d'exposition; par conséquent l'absorption du 95e percentile pondérée par un coefficient temps pour les 27 premières années de vie (0,049 L/kg p.c. par jour) a été utilisée pour l'ingestion d'eau quotidienne. Ce calcul, ainsi qu'une attribution à l'eau potable de 20 %, a donné lieu à une limite pour les risques à la santé arrondie à 0,3 μg/L (MDH, 2008c; 2008d).
Une recommandation pour l'eau potable de 0,3 μg/L (0,0003 mg/L) a été calculée par la UK Health Protection Agency (UK HPA, 2007; 2009) d'après un AQT de 300 ng/kg p.c. par jour (0,3 μg/kg p.c. par jour) auparavant calculée par le UK Committee on Toxicity of Chemicals in Food, Consumer Products and the Environment (UK COT, 2006). Cet AQT a été établi selon un point de départ (0,03 mg/kg p.c. par jour) correspondant à une NOAEL pour des concentrations sériques de T3 plus faibles chez des singes exposés pendant 26 semaines (Thomford, 2002; Seacat et coll., 2002), divisé par un facteur d'incertitude de 100 (pour les écarts intraespèces et interespèces). La recommandation relative à l'eau potable (0,3 μg/L) a été calculée à partir de cet AQT; on a appliqué un facteur d'attribution de 10 %, un poids corporel de 10 kg et un taux d'ingestion d'eau d'un litre par jour pour un enfant d'un an (UK HPA, 2007).
Dans leur document d'opinion scientifique sur les contaminants dans la chaîne alimentaire, le groupe scientifique sur les contaminants de la chaîne alimentaire (CONTAM) de l'Autorité européenne de sécurité des aliments a établi un AQT de 150 ng/kg p.c. par jour (0,15 μg/kg p.c. par jour) d'après une NOAEL de 0,03 mg/kg p.c. par jour (associée à une concentration plasmatique de 13 200 ng/mL chez les femelles) (EFSA, 2008). Cette NOAEL a été prélevée dans le cadre d'une étude par voie alimentaire chez des macaques de Buffon; des changements au niveau des lipides et des hormones thyroïdales ont été observés à la plus forte dose suivante (0,15 mg/kg p.c. par jour) (Seacat et coll., 2002). La NOAEL a été divisée par un facteur d'incertitude de 200 (×10 pour les différences interespèces, ×10 pour les différences intraespèces et ×2 pour tenir compte d'incertitudes liées à la durée relativement courte de l'étude principale et la cinétique de la dose interne).
11.0 Justification
Le SPFO est un composé anthropogène qui était utilisé pour rendre des surfaces et des applications en papier – comme les moquettes et les tapis, les tissus et le rembourrage–hydrofuges, antisalissantes ou imperméables aux graisses. Il était également utilisé dans des applications chimiques spécialisées, notamment dans les mousses extinctrices, les fluides hydrauliques et les détachants pour tapis. Le SPFO n'est plus fabriqué, importé, vendu, offert à la vente ou utilisé au Canada, à moins d'être présent fortuitement. Il existe certaines exemptions (p. ex. fluides hydrauliques utilisés dans le domaine de l'aviation) sous certaines conditions. En raison de sa nature extrêmement persistante, le SPFO se trouve encore dans l'environnement. Les Canadiens peuvent être exposés aux SPFO par leur présence dans les aliments, les produits de consommation, la poussière et l'eau potable. Les sources les plus importantes de SPFO devraient être les aliments et les produits de consommation; toutefois, la proportion d'exposition découlant de l'eau potable peut augmenter chez les personnes vivant dans des régions où l'eau potable est contaminée. En raison de ses propriétés physico-chimiques, l'exposition au SPFO par inhalation et par voie cutanée pendant les douches ou les bains devrait être négligeable.
La cancérogénicité du SPFO n'a pas été évaluée par le CIRC. L'exposition chronique au SPFO a été associée à des effets cancérogènes et non cancérogènes chez les animaux et les humains. On a calculé les VBS pour les deux effets, et les effets non cancérogènes ont donné une VBS plus faible et plus prudente.
Les études épidémiologiques ont montré des associations entre l'exposition au SPFO et différents effets non cancérogènes sur la santé, comme des effets sur la reproduction, le développement, et le système immunitaire. Toutefois, ces études ne peuvent pas être utilisées pour établir la VBS non cancérogène pour le SPFO en raison de leurs limites, y compris la conception des études, et les risques de biais et de confusion. Chez les animaux, les effets non cancérogènes observés aux plus faibles niveaux d'exposition comprennent des effets sur le système immunitaire, le foie et la glande thyroïde ainsi que des changements aux concentrations sériques de lipides. Pour différentes raisons décrites à la section 10.2, le paramètre le plus approprié pour établir une VBS pour le SPFO est l'hypertrophie hépatocellulaire (effets sur le foie) chez les rats, appuyé de façon quantitative par la valeur estimée pour les effets sur la thyroïde chez les singes. Selon l'approche de l'apport quotidien tolérable (AQT), une VBS de 0,0006 mg/L (0,6 µg/L) a été calculée pour les effets non cancérogènes du SPFO d'après les effets observés dans le foie des rats. On considère que cette VBS est suffisante pour protéger contre les effets cancérogènes et non cancérogènes du SPFO.
Une concentration maximale acceptable (CMA) de 0,0006 mg/L (0,6 µg/L) est proposée pour le SPFO dans l'eau potable. La CMA proposée pour le SPFO peut être mesurée par les méthodes d'analyse disponibles et peut être atteinte par les technologies de traitement municipales et résidentielles actuelles. Dans le cadre de son processus continu de révision des recommandations, Santé Canada continuera à suivre les nouvelles recherches à ce sujet, et recommandera au besoin toute modification jugée appropriée.
12.0 Références
3M Company (1996). Determination of physico-chemical properties of sample D-1. AR226-0973. [Cité dans Martin et coll. (2010)].
3M Company (1999). The science of organic fluorochemistry. Letter of Frank D. Kover, Chief, Chemical Information and Testing Branch, Chemical Control Division, Office of Pollution Prevention and Toxics, U.S. EPA. Disponible à :www.fluoridealert.org/wp-content/pesticides/pfos.fr.final.docket.0006.pdf
3M Company (2001). Soil adsorption/desorption study of potassium perfluorooctanesulfonate (PFOS). Laboratory project number E00-1311. EPA Docket AR226-1030a030. 3M Environmental Laboratory, St. Paul, Minnesota. [Cité dans Beach et coll. (2006)].
3M Company (2008). Interim report #17-Analysis of Woodbury waste site water samples. Maplewood, Minnesota.
Abbott, B.D., Wolf, C.J., Das, K.P., Zehr, R.D., Schmid, J.E., Lindstrom, A.B., et coll. (2009). Developmental toxicity of perfluorooctane sulfonate (PFOS) is not dependent on expression of peroxisome proliferator activated receptor-alpha (PPAR alpha) in the mouse. Reprod Toxicol, 27(3–4): 258–265.
Abe, T., Baba, H., Itoh, E. and Tanaka, K. (2001). Separation of perfluoroalkylsulfinic acids and perfluoroalkylsulfonic acids by ion-exclusion chromatioography. J. Chromatogr. A, 920:173–180.
Ahrens, L. (2011). Polyfluoroalkyl compounds in the aquatic environment: a review of their occurrence and fate. J. Environ. Monit., 13(1): 20–31.
Alberta Environment and Water (2013). Communication personnelle de D. Reid.
Alexander, B.H. et Olsen, G.W. (2007). Bladder cancer in perfluorooctanesulfonyl fluoride manufacturing workers. Ann. Epidemiol., 17(6): 471–478.
Alexander, B.H., Olsen, G.W., Burris, J.M., Mandel, J.H. et Mandel, J.S. (2003). Mortality of employees of a perfluorooctanesulphonyl fluoride manufacturing facility. Occup. Environ. Med., 60(10): 722–729.
Andersen, C.S., Fei, C., Gamborg, M., Nohr, E.A., Sørensen, T.I. et Olsen, J. (2010). Prenatal exposures to perfluorinated chemicals and anthropometric measures in infancy. Am. J. Epidemiol., 172(11): 1230–1237. Erratum Dans : Am. J. Epidemiol., 173(12):1475.
Andersen, M.E., Clewell, H.J., 3rd, Tan, Y.M., Butenhoff, J.L. et Olsen, G.W. (2006). Pharmacokinetic modeling of saturable, renal resorption of perfluoroalkylacids in monkeys—probing the determinants of long plasma half-lives. Toxicology, 227(1–2): 156–164.
Apelberg, B.J., Witter, F.R., Herbstman, J.B., Calafat, A.M., Halden, R.U., Needham, L.L. et coll. (2007). Cord serum concentrations of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in relation to weight and size at birth. Environ. Health Perspect, 115(11): 1670–1676.
Appleman, T.D., Dickenson, E.R.V., Bellona, C. et Higgins, C.P. (2013). Nanofiltration and granular activated carbon treatment of perfluoroalkyl acids. J. Hazard. Mater., 260(15): 740-746.
Appleman, T.D., Higgins, C.P., Quiñones, O., Vanderford, B.J., Kolstad, C., Zeigler-Holady, J.C. et Dickenson, E.R.V. (2014). Treatment of poly- and perfluoroalkyl substances in U.S. full-scale water treatment systems. Water Res. 51:246–255.
Arbuckle, T., Kubwabo, C., Walker, M., Davis, K., Lalonde, K. Kosarac, I., Wen, S. et Arnold, D. (2013). Umbilical cord blood levels of perfluoroalkyl acids and polybrominated flame retardants. Int. J. Hyg. Envir. Health, 216:184–194.
Arsenault, G., Chittim, B., McAlees, A., McCrindle, R., Riddell, N. et Yeo, B. (2008). Some issue relating to the use of perfluorooctane sulfonate (PFOS) samples as reference standard. Chemosphere, 70:620-625.
Atkinson, C., Blake, S., Hall, T., Kanda, R. et Rumsby, P. (2008). Survey of the prevalence of perfluorooctane sulphonate (PFOS), perfluorooctanoic acid (PFOA) and related compounds in drinking water and their sources. WRc Ref: DEFRA 7585, February. Disponible à :http://dwi.defra.gov.uk/research/completed-research/reports/DWI70_2_212PFOS.pdf.
ATSDR (2009). Toxicological profile for perfluoroalkyls, draft for public comment. Agency for Toxic Substances and Disease Registry. Disponible à :www.atsdr.cdc.gov/toxprofiles/tp.asp?id=1117&tid=237
Austin, M.E., Kasturi, B.S., Barber, M., Kannan, K., MohanKumar, P.S. et MohanKumar, S.M. (2003). Neuroendocrine effects of perfluorooctane sulfonate in rats. Environ. Health Perspect., 111(12): 1485–1489.
Awad, E., Zhang, X., Bhavsar, S.P., Petro, S., Crozier, P.W., Reiner, E.J., Fletcher, R., Tittlemier, S.A. et Braekevelt, E. (2011). Long-term environmental fate of perfluorinated compounds after accidental release at Toronto airport. Environ. Sci. Technol., 45(19): 8081–8089.
AWWA. (2011). Water quality and treatment, a handbook of community water supplies. Sixième édition. James K. Edzwald, Éditeur. American Water Works Association and McGraw-Hill. Denver, Colorado.
Backe, W., Thomas, J., Day, C. et Field, J.A. (2013). Zwitterionic, cationic, and anionic fluorinated chemicals in aqueous film forming foam formulations and groundwater from U.S. military bases by non-aqueous large-volume injection HPLCMS/ MS. Environ. Sci. Technol., 47 (10): 5226–5234.
Baduel, C., Paxman, C.J. et Mueller J.F. (2015). Perfluoroalkyl substances in a firefighting training ground (FTG), distribution and potential future release. J. Hazard. Mater., 296: 46–53.
Bannasch, P. (2003). Comments on R. Karbe and R.L. Kerlin (2002). Cystic degeneration/spongiosis hepatis (Toxicol. Pathol., 30(2), 216–227). Toxicol. Pathol., 31: 566–570.
Bannasch, P. et Zerban, H. (1997). Spongiosis hepatis and spongiotic pericytoma, rat. Dans : Jones, T.C., Popp, J.A. et Mohr, U. (eds.) Digestive System. Deuxième édition. Monographs on Pathology of Laboratory Animals. Springer-Verlag, Berlin.
Beach, S.A., Newsted, J.L., Coady, K. et Giesy, J.P. (2006). Ecotoxicological evaluation of Perfluorooctanesulfonate (PFOS). Rev. Environ. Contam. Toxicol., 186: 133–174.
Benskin, J.P., De Silva, A.O., Martin, L.J., Arsenault, G., McCrindle, R., Riddell, N. et coll. (2009). Disposition of perfluorinated acid isomers in Sprague-Dawley rats; part 1: single dose. Environ. Toxicol. Chem., 28(3):542–554.
Benskin, J.P., De Silva, A.O. et Martin, J.W. (2010), Isomer profiling of perfluorinated substances as a tool for source tracking: a review of early findings and future application. Reviews of Environmental Contamination and Toxicology. P. de Voogt (ed.). Springer Science+Business Media, LLC.
Berger, U., Kaiser, M., Karrman, A., Barber, J. et van Leeuwen, S. (2011). Recent developments in trace analysis of poly-and perfluoroalkyl substances. Anal. Bional. Chem., 4000:1625–1635.
Berger, U., Langlois, I., Oehme, M. et Kallenborn, R. (2004). Comparison of three types of mass spectrometer for high-performance liquid chromatography/mass spectrometry analysis of perfluoroalkylated substances and fluorotelomer alcohol. Eur. J. Mass Spectrom. 10:579–588.
Berryman, D., Salhi, C., Bolduc, A., Deblois, C. et Tremblay, H. (2012). Les composés perfluorés dans les cours d'eau et l'eau potable du Québec méridional. Québec, Ministère du Développement durable, de l'Environnement, de la Faune et des Parcs, Direction du suivi de l'état de l'environnement.
Biesemeier, J.A. et Harris, D.L. (1974). Eye and skin irritation report on sample T-1117. Report. Project No. 4102871, WARF Institute Inc. [Cité dans OCDE (2002); EFSA (2008)].
Bio/Dynamics, Inc. (1979). An acute inhalation toxicity study of T-2306 CoC in the rat. # 78-7185. [Cité dans Santé Canada (2006)].
Bloom, M.S., Kannan, K., Spliethoff, H.M., Tao, L., Aldous, K.M. et Vena, J.E. (2010). Exploratory assessment of perfluorinated compounds and human thyroid function. Physiol. Behav., 99(2): 240–245.
Bogdanska, J., Borg, D., Sundström, M., Bergström, U., Halldin, K., Abedi-Valugerdi, M., Bergman, A., Nelson, B., Depierre, J. et Nobel, S. (2011). Tissue distribution of 35S-labelled perfluorooctane sulfonate in adult mice after oral exposure to a low environmentally relevant dose or a high experimental dose. Toxicology, 284(1–3):54–62.
Bonefeld-Jorgensen, E., Long, M., Bossi, R., Ayotte, P., Asmund, G., Kruger, T., et coll. (2011). Perfluorinated compounds are related to breast cancer risk in greenlandic inuit: A case control study. Environ. Health, 10(1): 88. Disponible à :www.ehjournal.net/content/10/1/88.
Borg, D., Bogdanska, J., Sundström, M., Nobel, S., Hakansson, H., Bergman, Å., DePierre, J.W., Halldin, K. et Bergström, U. (2010). Tissue distribution of (35)S-labelled perfluorooctane sulfonate (PFOS) in C57Bl/6 mice following late gestational exposure. Reprod Toxicol, 30(4): 558–65.
Boulanger, B., Peck, A.M., Schnoor, J.L. et Hornbuckle, K.C. (2005). Mass budget of perfluorooctane surfactants in Lake Ontario. Environ Sci Technol, 39: 74–79. Cité dans EFSA (2008).
Boyd, G., Tucillo, M.E., Sandvig, A., Pelaez, M., Han, C. et Dionysious, D.D. (2013). Nanomaterials: Removal processes and beneficial applications in treatment. J. Am. Water Works Assoc.,105(12): 699–708.
Brooke, D., Footitt, A. et Nwaogu, T.A. (2004). Environmental risk evaluation report: Perfluorooctanesulphonate (PFOS). Disponible à : www.pops.int/documents/meetings/poprc/submissions/Comments_2006/sia/pfos.uk.risk.eval.report.2004.pdf
Buck, R. C., Franklin, J., Berger, U., Conder, J. M., Cousins, I. T., de Voogt, P., Jensen, A. A.,Kannan, K., Mabury, S. A. et van Leeuwen, S. P. J. (2011). Perfluoroalkyl and polyfluoroalkylsubstances in the environment: terminology, classification, and origins. Integr. Environ. Assess. Manag., 7(4), 513–541.
Butenhoff, J.L., Ehresman, D.J., Chang, S.C., Parker, G.A. et Stump, D.G. (2009). Gestational and lactational exposure to potassium perfluorooctanesulfonate (K+PFOS) in rats: developmental neurotoxicity. Reprod Toxicol., 27(3–4): 319–330.
Butenhoff, J.L., Pieterman, E., Ehresman, D.J., Gorman, G.S., Olsen, G.W., Chang, S.C. et Princen, H.M. (2012a). Distribution of perfluorooctanesulfonate and perfluorooctanoate into human plasma lipoprotein fractions. Toxicol. Lett., 210(3):360–365.
Butenhoff, J.L., Chang, S.C., Olsen, G.W. et Thomford, P.J. (2012b). Chronic dietary toxicity and carcinogenicity study with potassium perfluorooctanesulfonate in Sprague Dawley rats. Toxicology, 293(1–3): 1–15.
Butt, C.M., Berger, U., Bossi, R. et Tomy, G.T. (2010). Levels and trends of poly- and perfluorinated compounds in the arctic environment. Sci. Total Environ., 408(15): 2936–2965.
Campbell, J.L., Jr. et Clewell, H.J., III. (2013). Report on the perfluorooctanesulfonic acid (PFOS) kinetic models and dosimetry. Rapport final soumis à Santé Canada.
Cao, M.H., Wang, B.B., Yu, H.S., Wang, L.L., Yuan, S.H., et Chen, J. (2010). Photochemical decomposition of perfluorooctanoic acid in aqueous periodate with VUV and UV light irradiation. J. Hazard. Mater., 179:1143–1146.
Carter, K.E. et Farrell, J. (2010). Removal of perfluorooctane and perfluorobutane sulfonate from water via carbon adsorption and ion exchange. Sep. Sci. Technol., 45:762-767.
Case, M.T., York, R.G. et Christian, M.S. (2001). Rat and rabbit oral developmental toxicology studies with two perfluorinated compounds. Int. J. Toxicol., 20(2): 101–109.[ Cité dans EFSA (2008)].
CCN (2015). Répertoire des organismes de certification accrédités. Conseil canadien des normes. Disponible à : www.scc.ca/fr/accreditation/product-process-and-service-certification/directory-of-accredited-clients
Chan, E., Burstyn, I., Cherry, N., Bamforth, F. et Martin, J.W. (2011). Perfluorinated acids and hypothyroxinemia in pregnant women. Environ. Res., 111(4): 559–564.
Chang, S.C., Ehresman, D.J., Bjork, J.A., Wallace, K.B., Parker, G.A., Stump, D.G. et Butenhoff, J.L. (2009). Gestational and lactational exposure to potassium perfluorooctanesulfonate (K+PFOS) in rats: toxicokinetics, thyroid hormone status, and related gene expression. Reprod. Toxicol., 27(3–4):387–399.
Chang, S.C., Noker, P.E., Gorman, G.S., Gibson, S.J., Hart, J.A., Ehresman, D.J. et Butenhoff, J.L. (2012). Comparative pharmacokinetics of perfluorooctanesulfonate (PFOS) in rats, mice, and monkeys. Reprod. Toxicol., 33(4):428–440.
Château-Degat, M.L., Pereg, D., Dallaire, R., Ayotte, P., Dery, S. et Dewailly, E. (2010). Effects of perfluorooctanesulfonate exposure on plasma lipid levels in the Inuit population of Nunavik (Northern Quebec). Environl Resl, 110(7): 710–717.
Chen, J. et Zhang, P. (2006). Photodegradation of perfluorooctanoic acid in water under irradiation of 254 nm and 185 nm light by use of persulfate. Water Sci. Technol., 54(11–12):317–325.
Chen, J., Zhang, P-Y. et Liu, J. (2007). Photodegradation of perfluorooctanoic acid by 185 nm vacuum ultraviolet light. J. Environ. Sci., 19:387–390.
Chen, T., Zhang, L., Yue, J.Q., Lv, Z.Q., Xia, W., Wan, Y.J., et coll. (2012). Prenatal PFOS exposure induces oxidative stress and apoptosis in the lung of rat off-spring. Reprod Toxicol., 33(4): 538–45.
Christensen, K.Y., Maisonet, M., Rubin, C., Holmes, A., Calafat, A.M., Kato, K. et coll. (2011). Exposure to polyfluoroalkyl chemicals during pregnancy is not associated with offspring age at menarche in a contemporary British cohort. Environ. Int., 37(1): 129–135.
Christian, M.S., Hoberman, A.M. et York, R.G. (1999). combined oral (gavage) fertility, developmental and perinatal/postnatal reproduction toxicity study of pfos in rats. Sponsor Study No. 6295-.9. Protocol number 418-008. Argus Research Laboratories, Inc., Horsham, PA U.S EPA. Docket 8EHQ-0200-00374. (aussi cité sous Argus Research Laboratories, Inc.). [Cité dans OCDE (2002); Santé Canada (2006); EFSA (2008)].
Chularueangaksorn, P., Tanaka, S., Fujii, S. et Kunacheva, C. (2013). Adsorption of perfluorooctanoic acid (PFOA) onto anion exchange resin, non-ion exchange resin, and granular activated carbon by batch and column. Desalination Water Treat., 52:6542–6548.
Chularueangaksorn, P., Tanaka, S., Fujii, S. et Kunacheva, C. (2014). Batch and column adsorption of perfluorooctane sulfonate on anion exchange resins and granular activated carbon. J. Appl. Polym. Sci., 131:39782–39788.
Clarke, B.O. et Smith, S.R. (2011). Review of ‘emerging' organic contaminants in biosolids and assessment of international research priorities for the agricultural use of biosolids. Environ. Int., 37(1): 226–247.
Corning Hazleton Inc. (1997). Final report: Primary eye irritation/corrosion study of T-6684 in rabbits (OCDE Guidelines). # 61101151. [Cité dans Santé Canada (2006)].
Corton, J.C., Cunningham, M.L., Hummer, B.T., Lau, C., Meek, B., Peters, J.M., Popp, J.A., Rhomberg, L., Seed, J. et Klaunig, J.E. (2014). Mode of action framework analysis for receptor-mediated toxicity: the peroxisome proliferator-activated receptor alpha (PPARα) as a case study. Crit. Rev. Toxicol., 44(1):1–49.
Crump, K.S. (1984). A new method for determining allowable daily intakes. Fundam. Appl. Toxicol., 4: 854-871.
Cui, L., Zhou, Q.F., Liao, C.Y., Fu, J.J. et Jiang, G.B. (2009). Studies on the toxicological effects of PFOA and PFOS on rats using histological observation and chemical analysis. Arch. Environ. Contam. Toxicol., 56(2): 338–349.
Cui, L., Liao, C.Y., Zhou, Q.F., Xia, T.M., Yun, Z.J. et Jiang, G.B. (2010). Excretion of PFOA and PFOS in male rats during a subchronic exposure. Arch. Environ. Contam. Toxicol., 58(1): 205–13.
Dai, Y., Niu, J., Yin, L., Xu, J. et Sun, K. (2013). Enhanced sorption of perfluorooctane sulfonate (PFOS) on carbon nanotube-filled electrospunnanofibrous membranes. Chemosphere, 93(8):1593–1599.
Dallaire, R., Dewailly, E., Pereg, D., Dery, S. et Ayotte, P. (2009). Thyroid function and plasma concentrations of polyhalogenated compounds in Inuit adults. Environ. Health Perspect., 117(9):1380–1386.
De Silva, A.O., Benskin, J.P., Martin, L.J., Arsenault, G., McCrindle, R., Riddell, N., Martin, J.W. et Mabury, S.A. (2009). Disposition of perfluorinated acid isomers in Sprague-Dawley rats; Part 2: Subchronic dose. Environ. Toxicol. Chem., 28(3): 555–567.
Dean, W.P. et Jessup, D.C. (1978). Acute oral toxicity (LD50) study in rats. International Research and Development Corporation, Study No. 137-091, May 5, 1978. U.S. Environmental Protection Agency Administrative Record 226-0419. [Cité dans OCDE (2008)].
Delahunty, C., Falconer, S., Hume, R., Jackson, L., Midgley, P., Mirfield, M., Ogston, S., Perra, O., Simpson, J., Watson, J., Willatts, P., Williams, F. et the Scottish Preterm Thyroid Group. (2010). Levels of neonatal thyroid hormone in preterm infants and neurodevelopmental outcome at 5 1/2 years: millennium cohort study. J. Clin. Endocrinol. Metab., 95(11): 4898–4908.
Deng, S., Yu, Q., Huang, J. et Yu, G. (2010). Removal of perfluorooctane sulfonate from wastewater by anion exchange resins: Effects of resin properties and solution chemistry. Water Res. 44(18):5188–5195.
Deng, S., Zhou, Q., Yu, G., Huang, J. et Fan, Q. (2011). Removal of perfluorooctanoate from surface water by polyaluminium chloride coagulation. Water Res., 45:1774–1780.
Deng, S., Zhang, Q., Nie, Y., Wei, H., Wang, B., Huang, J., Yu, G. et Xing, B., (2012). Sorption mechanisms of perfluorinated compounds on carbon nanotubes. Environ. Pollut. 168:138–144.
Dickenson, E.R.V. et Higgins, C. (2013). The removal of perfluoroalklyl and polyfluoroalkly substances by North American water treatment practices. Water Research Foundation, Denver, Colorado. Ébauche de rapport. (sous presse)
Dillert, R., Bahnemann, D. et Hidaka, H.(2007). Light-induced degradation of perfluorocarboxylic acids in the presence of titanium dioxide. Chemosphere, 67:785–792.
Dolman, S. et Pelzing, M. (2011). An optimized method for the determination of perfluorooctanoic acid, perfluorooctane sulfonate and other perfluorochemicals in different matrices using liquid chromatography/ion-trap mass spectrometry. J. Chromatogr. B Analyt. Technol. Biomed. Life Sci., 879(22): 2043–2050.
Dong, G.H., Zhang, Y.H., Zheng, L., Liu, W., Jin, Y.H. et He, Q.C. (2009). Chronic effects of perfluorooctanesulfonate exposure on immunotoxicity in adult male C57BL/6 mice. Arch Toxicol., 83(9): 805–815.
Dong, G.H., Liu, M.M., Wang, D., Zheng, L., Liang, Z.F. et Jin, Y.H. (2011). Sub-chronic effect of perfluorooctanesulfonate (PFOS) on the balance of type 1 and type 2 cytokine in adult C57BL6 mice. Arch Toxicol., 85(10): 1235–1244.
Dong, G.H., Wang, J., Zhang, Y.H., Liu, M.M., Wang, D., Zheng, L. et coll. (2012a). Induction of p53-mediated apoptosis in splenocytes and thymocytes of C57BL/6 mice exposed to perfluorooctane sulfonate (PFOS). Toxicol. Appl. Pharmacol., 264(2): 292–299.
Dong, G.H., Zhang, Y.H., Zheng, L., Liang, Z.F., Jin, Y.H. et He, Q.C. (2012b). Subchronic effects of perfluorooctanesulfonate exposure on inflammation in adult male C57BL/6 mice. Environ. Toxicol., 27(5): 285–296.
Dong, G.H., Tung, K.Y., Tsai, C.H., Liu, M.M., Wang, D., Liu, W. et coll. (2013). Serum polyfluoroalkyl concentrations, asthma outcomes, and immunological markers in a case–control study of taiwanese children. Environ. Health Perspect., 121(4): 507–513.
Dudley, L.-A., Lindstrom, A., Strynar, M., McMillan, L. et Knappe, D. (2012). Removal of perfluorinated compounds by powdered activated carbon: effects of adsorbent and background water characteristics. Présenté dans le cadre de la 2012 AWWA Annual Conference in Dallas, TX, June 10 -14, 2012. 2012 Annual Conference Proceedings.American Water Works Association, Catalog No. ACE_0076609.
EFSA (2008). Opinion of the scientific panel on contaminants in the food chain on perfluorooctane sulfonate (PFOS), perfluorooctanoic acid (PFOA) and their salts. European Food Safety Authority. EFSA Journal 653: 1–131. Disponible à :www.efsa.europa.eu/en/efsajournal/pub/653.htm
Elcombe, C.R., Elcombe, B.M., Foster, J.R., Chang, S.C., Ehresman, D.J., Noker, P.E., et coll. (2012a). Evaluation of hepatic and thyroid responses in male Sprague Dawley rats for up to eighty-four days following seven days of dietary exposure to potassium perfluorooctanesulfonate. Toxicology, 293(1–3): 30–40.
Elcombe, C.R., Elcombe, B.M., Foster, J.R., Chang, S.C., Ehresman, D.J. et Butenhoff, J.L. (2012b). Hepatocellular hypertrophy and cell proliferation in Sprague-Dawley rats from dietary exposure to potassium perfluorooctanesulfonate results from increased expression of xenosensor nuclear receptors PPARα and CAR/PXR. Toxicology, 293(1–3): 16–29.
Emmett, E.A., Shofer, F.S., Zhang, H., Freeman, D., Desai, C. et Shaw, L.M. (2006). Community exposure to perfluorooctanoate: Relationships between serum concentrations and exposure sources. J. Occup. Environ. Med., 48: 759–770.
Environnement Canada et Santé Canada (2012). Rapport d'évaluation préalable. Acide pentadécafluorooctanoïque, ses sels et ses précurseurs. Disponible à : www.ec.gc.ca/ese-ees/370AB133-3972-454F-A03A-F18890B58277/PFOA_FR.pdf.
Era, S., Harada, K.H., Toyoshima, M., Inoue, K., Minata, M., Saito, N., et coll. (2009). Cleft palate caused by perfluorooctane sulfonate is caused mainly by extrinsic factors. Toxicology, 256(1–2): 42–47.
Eriksen, K.T., Sørensen, M., McLaughlin, J.K., Lipworth, L., Tjønneland, A., Overvad, K. et coll. (2009). Perfluorooctanoate and perfluorooctanesulfonate plasma levels and risk of cancer in the general Danish population. J. Natl. Cancer Inst., 101(8): 605–609.
Eriksen, K.T., Raaschou-Nielsen, O., Sørensen, M., Roursgaard, M., Loft, S. et Møller, P. (2010). Genotoxic potential of the perfluorinated chemicals PFOA, PFOS, PFBS, PFNA and PFHxA in human HepG2 cells. Mutat.. Res., 700(1–2): 39–43.
Eschauzier, C., Beerendonk, E., Scholte-Veenendaal, P. et De Voogt, P. (2012). Impact of treatment processes on the removal of perfluoroalkyl acids from the drinking water production chain. Environ. Sci. Technol., 46 (3):1708–1715.
Fair, P.A., Driscoll, E., Mollenhauer, M.A., Bradshaw, S.G., Yun, S.H., Kannan, K., et coll. (2011). Effects of environmentally-relevant levels of perfluorooctane sulfonate on clinical parameters and immunological functions in B6C3F1 mice. J. Immunotoxicol., 8(1): 17–29.
Fasano, W.J., Kennedy, G.L., Szostek, B., Farrar, D.G., Ward, R.J., Haroun, L. et coll. (2005). Penetration of ammonium perfluorooctanoate through rat and human skin in vitro. Drug. Chem. Toxicol 28(1):79–90. [Cité dans ATSDR (2009).]
Fei, C. et Olsen, J. (2011). Prenatal exposure to perfluorinated chemicals and behavioral or coordination problems at age 7 years. Environ. Health Perspect., 119(4): 573–578.
Fei, C., McLaughlin, J.K., Tarone, R.E. et Olsen, J. (2007). Perfluorinated chemicals and fetal growth: a study within the Danish National Birth Cohort. Environ. Health Perspect., 115(11): 16777–16782.
Fei, C., McLaughlin, J.K., Lipworth, L. et Olsen, J. (2008a). Prenatal exposure to perfluorooctanoate (PFOA) and perfluorooctanesulfonate (PFOS) and maternally reported developmental milestones in infancy. Environ. Health Perspect., 116(10): 1391–1395.
Fei, C., McLaughlin, J.K., Tarone, R.E. et Olsen, J. (2008b). Fetal growth indicators and perfluorinated chemicals: a study in the Danish National Birth Cohort. Am. J. Epidemiol., 168(1): 66–72.
Fei, C., McLaughlin, J.K., Lipworth, L. et Olsen, J. (2009). Maternal levels of perfluorinated chemicals and subfecundity. Hum. Reprod., 24(5): 1200–1205.
Fei, C., McLaughlin, J.K., Lipworth, L. et Olsen, J. (2010a). Prenatal exposure to PFOA and PFOS and risk of hospitalization for infectious diseases in early childhood. Environ. Res., 110: 773–777.
Fei, C., McLaughlin, J.K., Lipworth, L. et Olsen, J. (2010b). Maternal concentrations of perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) and duration of breastfeeding. Scand. J. Work Environ. Health, 36(5): 413–421.
Fitz-Simon, N., Fletcher, T., Luster, M.I., Steenland, K., Calafat, A.M., Kato, K. et coll. (2013). Reductions in serum lipids with a 4-year decline in serum perfluorooctanoic acid and perfluorooctanesulfonic acid. Epidemiology, 24(4): 569–576. Erratum Dans : Epidemiology, 24(6):941.
Florentin, A., Deblonde, T., Diguio, N., Hautemaniere, A. et Hartemann, P. (2011). Impacts of two perfluorinated compounds (PFOS and PFOA) on human hepatoma cells: cytotoxicity but no genotoxicity? Int. J. Hyg. Environ. Health., 214(6): 493–499.
Flores, C., Ventura, F., Martin-Alonso, J. et Caixach, J. (2013). Occurrence of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) in N.E. Spanish surface water and their removal in a drinking water treatment plant that combines conventional and advanced treatment in parallel lines. Sci. Tot. Environ. 461: 618–626.
Franko, J., Meade, B.J., Frasch, H.F., Barbero, A.M. et Anderson, S.E. (2012). Dermal penetration potential of perfluorooctanoic acid (PFOA) in human and mouse skin. J. Toxicol. Environ. Health A., 75(1): 50–62
Fraser, A.J., Webster, T.F., Watkins, D.J., Nelson, J.W., Stapleton, H.M., Calafat, A.M. et coll. (2012). Polyfluorinated compounds in serum linked to indoor air in office environments. Environ. Sci. Technol.., 46(2): 1209–1215.
Frisbee, S.J., Brooks, A.P., Jr., Maher, A., Flensborg, P., Arnold, S., Fletcher, T. et coll. (2009). The C8 health project: design, methods, and participants. Environ. Health Perspect, 117(12): 1873–1882.
Frisbee, S.J., Shankar, A., Knox, S.S., Steenland, K., Savitz, D.A., Fletcher, T. et coll. (2010). Perfluorooctanoic acid, perfluorooctanesulfonate, and serum lipids in children and adolescents: results from the C8 Health Project. Arch. Pediatr. Adolesc. Med., 164(9): 860–869.
Fromme, H., Tittlemier, S.A., Völkel, W., Wilhelm, M. et Twardella, D. (2009). Perfluorinated compounds—exposure assessment for the general population in Western countries. Int. J. Hyg. Environ. Health, 212(3): 239–270.
Fuentes, S., Colomina, M.T., Vicens, P. et Domingo, J.L. (2007a). Influence of maternal restraint stress on the long-lasting effects induced by prenatal exposure to perfluorooctane sulfonate (PFOS) in mice. Toxicol. Lett., 171(3): 162–170.
Fuentes, S., Colomina, M.T., Vicens, P., Franco-Pons, N. et Domingo, J.L. (2007b). Concurrent exposure to perfluorooctane sulfonate and restraint stress during pregnancy in mice: effects on postnatal development and behavior of the offspring. Toxicol. Sci., 98(2): 589–598.
Fuentes, S., Vicens, P., Colomina, M.T. et Domingo, J.L. (2007c). Behavioral effects in adult mice exposed to perfluorooctane sulfonate (PFOS). Toxicology, 242(1–3): 123–129.
Fujii, S., Polprasert, C., Tanaka, S. et Lien, N.P.H. (2007). New POPs in the water environment: distribution, bioaccumulation and treatment of perfluorinated compounds - a review paper. J. Water Supply Res. T, 56(5): 313–326.
Furdui, V., Crozier, P., Reiner, E. et Mabury, S. (2008). Trace level determination of perfluorinated compounds in water by direct injection. Chemosphere, 73:S24-S530.
Gallo, V., Leonardi, G., Genser, B., Lopez-Espinosa, M.J., Frisbee, S.J., Karlsson, L. et coll. (2012). Serum perfluorooctanoate (PFOA) and perfluorooctane sulfonate (PFOS) concentrations and liver function biomarkers in a population with elevated PFOA exposure. Environ. Health Perspect., 120(5): 655–660.
Gilbert, M.E., Rovet, J., Chen, Z. et Koibuchi, N. (2012). Developmental thyroid hormone disruption: prevalence, environmental contaminants and neurodevelopmental consequences. Neurotoxicology, 33: 842–852.
Giri, R.R., Ozaki, H., Morigaki, T., Taniguchi, S. et Takanami, R. (2011). UV photolysis of perfluorooctanoic acid (PFOA) in dilute aqueous solution. Water Sci. Technol., 63(2): 276–282.
Giri, R.R, Ozaki, H., Okada, T., Taniguchi, S. et Takanami, R. (2012). Factors influencing UV photodecomposition of perfluorooctanoic acid in water. Chemi. Eng. J., 180: 197–203.
Giri, R. R., Ozaki, H., Guo, X., Takanami, R. et Taniguchi, S. (2013). Oxidative–reductive photodecomposition of perfluorooctanoic acid in water. Int. J. Environ. Sci. Te., DOI 10.1007/s13762-013-0312-2.
Goldenthal, E.I., Jessup, D.C., Geil, R.G. et Mehring, J.S. (1978a). Ninety-day subacute rat toxicity study. Study No. 137-085. International Research and Development Corporation. [Cité dans OCDE (2002); EFSA (2008); Santé Canada (2012)].
Goldenthal, E.I., Jessup, D.C., Geil, R.G. et Mehring, J.S. (1978b). Ninety-day subacute rhesus monkey toxicity study. Study No. 137-092. International Research and Development Corporation. [Cité dans OCDE (2002); EFSA (2008); Santé Canada (2012)].
González-Barreiro, C., Elena Martínez-Carballo, E., Sitka, A., Scharf, S. et Gans, O., (2006). Method optimization for determination of selected perfluorinated alkylated substances in water samples. Anal. Bioanal. Chem., 386:2123–2132.
Gortner, E.G. (1980). Oral teratology study of FC-95 in rats. Safety Evaluation Laboratory and Riker Laboratories, Inc. Experiment Number: 0680TR0008, December. [Cité dans OCDE (2002); EFSA (2008); Santé Canada (2012)].
Gouvernement du Canada (2008). Règlement sur le sulfonate de perfluorooctane et ses sels et certains autres composés. DORS/2008-178. Disponible à : http://laws-lois.justice.gc.ca/fra/reglements/DORS-2008-178/page-1.html.
Gouvernement du Canada (2009). Règlement inscrivant le sulfonate de perfluorooctane et ses sels sur la Liste de quasi-élimination. DORS /2009-15. Disponible à : http://laws-lois.justice.gc.ca/fra/reglements/DORS-2009-15/page-1.html.
Grandjean, P. et Budtz-Jørgensen, E. (2013). Immunotoxicity of perfluorinated alkylates: calculation of benchmark doses based on serum concentrations in children. Environ. Health, 12:35.
Grandjean, P., Andersen, E.W., Budtz-Jørgensen, E., Nielsen, F., Mølbak, K., Weihe, P. et Heilmann, C. (2012). Serum vaccine antibody concentrations in children exposed to perfluorinated compounds. JAMA, 307(4): 391–397. Commentaire dans : JAMA, 307(18):1910; réponse de l'auteur 1910–1. Erratum dans : JAMA, 307(11):1142.
Granum, B., Haug, L.S., Namork, E., Stølevik, S.B., Thomsen, C., Aaberge, I.S., van Loveren, H., Løvik, M. et Nygaard, U.C. (2013). Pre-natal exposure to perfluoroalkyl substances may be associated with altered vaccine antibody levels and immune-related health outcomes in early childhood. J. Immunotoxicol., 10(4): 373–379.
Grasty, R.C., Bjork, J.A., Wallace, K.B., Wolf, D.C., Lau, C.S. et Rogers, J.M. (2005). Effects of prenatal perfluorooctane sulfonate (PFOS) exposure on lung maturation in the perinatal rat. Birth Defects Res. B Dev. Reprod. Toxicol., 74(5): 405–416. Erratum dans : Birth Defects Res. B Dev. Reprod. Toxicol., 77(1):87: Wolf, DC [added].
Grasty, R.C., Grey, B.E., Lau, C.S. et Rogers, J.M. (2003). Window of susceptibility to perfluoroctane sulfonate (PFOS)-induced neonatal mortality in the rat. Birth Defects Res. B Dev. Reprod. Toxicol., 67(5): 315. Meeting abstract.
Greiner, A. et Wendorff, J. (2007). Electrospinning: a fascinating method for the preparation of ultrathin fibers. Angew. Chem. Int. Ed., 46: 5670–5703.
Gump, B.B., Wu, Q., Dumas, A.K. et Kannan, K. (2011). Perfluorochemical (PFC) exposure in children: associations with impaired response inhibition. Environ. Sci. Technol., 45(19): 8151–8159.
Guruge, K.S., Hikono, H., Shimada, N., Murakami, K., Hasegawa, J., Yeung, L.W., et coll. (2009). Effect of perfluorooctane sulfonate (PFOS) on influenza A virus-induced mortality in female B6C3F1 mice. J. Toxicol. Sci., 34(6): 687–691.
Gützkow, K.B., Haug, L.S., Thomsen, C., Sabaredzovic, A., Becher, G. et Brunborg, G. (2012). Placental transfer of perfluorinated compounds is selective—a Norwegian Mother and Child sub-cohort study. Int. J. Hyg. Environ. Health, 215(2): 216–219.
Haber, L.T., Dourson, M.L. et Mohapatra A. (2013). Development of chemical-specific adjustment factors for long-lived chemicals: PFOS as a model chemical. Poster presented at Society for Risk Analysis Annual Meeting, Baltimore, MD, December 8–11.
Halldorsson, T.I., Rytter, D., Haug, L.S., Bech, B.H., Danielsen, I., Becher, G. et coll. (2012). Prenatal exposure to perfluorooctanoate and risk of overweight at 20 years of age: a prospective cohort study. Environ. Health Perspect., 120(5): 668–673.
Hamm, M.P., Cherry, N.M., Chan, E., Martin, J.W. et Burstyn, I. (2010). Maternal exposure to perfluorinated acids and fetal growth. J. Expo. Sci. Environ. Epidemiol., 20(7): 589–597.
Hansen, K.J., Johnson, H.O., Eldridge, J.S., Butenhoff, J.L. et Dick, L.A. (2002). Quantitative characterization of trace levels of PFOS and PFOA in the Tennessee River. Environ. Sci. Technol.., 36(8): 1681–1685.
Hansen, M.C., Børresen, M.H., Schlabach, M. et Cornelissen, G. (2010). Sorption of perfluorinated compounds from contaminated water to activated carbon. J. Soils Sediments, 10: 179–185.
Harada, K., Saito, N., Sasaki, K., Inoue, K. et Koizumi, A. (2003). Perfluoroocatne sulfonate contamination of drinking water in the Tama river, Japan: Estimated effects on resident serum levels. Environ. Contam. Toxicol. 71:31–36.
Harada, K., Saito, N., Inoue, K., Yoshinaga, T., Watanabe, T., Sasaki, S. et coll. (2004). The influence of time, sex and geographic factors on levels of perfluorooctane sulfonate and perfluorooctanoate in human serum over the last 25 years. J. Occup. Health, 46(2): 141–147.
Harada, K., Inoue, K., Morikawa, A., Yoshinaga, T. et Saito, N. (2005). Renal clearance of perfluorooctane sulfonate and perfluorooctanoate in humans and their species-specific excretion. Env. Res, 99: 653–261.
Harada, K.H., Hashida, S., Kaneko, T., Takenaka, K., Minata, M., Inoue, K. et coll. (2007). Biliary excretion and cerebrospinal fluid partition of perfluorooctanoate and perfluorooctane sulfonate in humans. Environ. Toxicol. Pharmacol, 24(2): 134–139.
Hatfield, T.L. (1999). Study of the stability of MeFOSEA in aqueous buffers using gas chomatography with atomic emission detection. AR226-0380. [Cité dans Martin et coll. (2010)].
Hazleton Laboratories America Inc. (1987). Primary eye irritation study in rabbits — method, summary, raw data appendix. # 70100355, sample T-4016. [Cité dans Santé Canada (2006)].
Hazleton Wisconsin Inc. (1994). Final report: Primary eye irritation/corrosion study of PFOS (T-5898) in rabbits (OCDE Guidelines). # 40200470. [Cité dans Santé Canada (2006)].
Herzke, D., Olsson, E. et Posner, S. (2012). Perfluoroalkyl and polyfluoroalkyl substances (PFASs) in consumer products in Norway—a pilot study. Chemosphere, 88(8): 980–987.
Higgins, C.P. et Luthy, R.G. (2006). Sorption of perfluorinated surfactants on sediments. Environ. Sci. Technol. 40: 7251–7256.
Hoffman, K., Webster, T.F., Weisskopf, M.G., Weinberg, J. et Vieira, V.M. (2010). Exposure to polyfluoroalkyl chemicals and attention deficit/hyperactivity disorder in U.S. children 12–15 years of age. Environ. Health Perspect., 118(12): 1762–1767.
Hölzer, J., Midasch, O., Rauchfuss, K., Kraft, M., Reupert, R., Angerer, J., Kleeschulte, P., Marschall, N. et Wilhelm, M. (2008). Biomonitoring of perfluorinated compounds in children and adults exposed to perfluorooctanoate-contaminated drinking water. Environ. Health Perspect.., 116(5): 651–657.
Hori, H., Hayakawa, E., Einaga, H., Kutsuna, S., Koike, K., Ibusuki, T., Kiatagawa, H. et Arakawa, R. (2004a). Decomposition of environmentally persistent pefluorooctanoic acid in water by photochemical approaches. Environ. Sci. Technol., 38: 6118–6124.
Hori, H., Hayakawa, E., Yamashita, N., Taniyasu, S., Nacata, F. et Kobayashi, Y. (2004b). High performance liquid chromatography with conductimetric detection of perfluorocarboxilic acids and perfluorosulfonates. Chemosphere 57:273–282.
Hori, H., Yamamoto, A., Hayakawa, E., Einaga, H., Taniyasu, S., Yamashita, N. et Kutsuna, S. (2005). Efficient decomposition of environmentally persistent pefluorocarboxylic acids by use of persulfate as a photochemical oxidant. Environ. Sci. Technol., 39: 2383–2388.
Hori, H., Yamamoto, A., Koike, K., Kutsuna, S., Osaka, I. et Arakawa, R. (2007). Photochemical decomposition of environmentally persistent short-chain perfluorocarboxylic acids in water mediated by iron(II)/(III) redox reactions. Chemosphere, 68: 572–578.
Hundley, S.G., Sarrif, A.M. et Kennedy, G.L. (2006). Absorption, distribution, and excretion of ammonium perfluorooctanoate (APFO) after oral administration to various species. Drug Chem. Toxicol., 29(2): 137–145.
Ingelido, A.M., Marra, V., Abballe, A., Valentini, S., Iacovella, N., Barbieri, P., Porpora, M.G., di Domenico, A. et De Felip, E. (2010). Perfluorooctanesulfonate and perfluorooctanoic acid exposures of the Italian general population. Chemosphere, 80(10): 1125–1130.
Inoue, K., Okada, F., Ito, R., Kato, S., Sasaki, S., Nakajima, S. et coll. (2004). Perfluorooctane sulfonate (PFOS) and related perfluorinated compounds in human maternal and cord blood samples: assessment of PFOS exposure in a susceptible population during pregnancy. Environ. Health Perspect, 112(11): 1204–1207. [Cité dans EFSA (2008)].
ISO (2009). ISO 25101 Water quality – Determination of perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) – Method for unfiltered water samples using solid phase extraction and liquid chromatography with mass spectrometry. Organisation internationale de normalisation.
Jacquet, N., Maire, M.A., Landkocz, Y. et Vasseur, P. (2012). Carcinogenic potency of perfluorooctane sulfonate (PFOS) on Syrian hamster embryo (SHE) cells. Arch. Toxicol., 86(2): 305–314.
Jahnke, A. et Berger, U. (2009). Trace analysis of per- and polyfluorinated alkyl substances in various matrices-How do current method perform? J. Chromatogr. A 1216:410–421.
Japanese Industrial Standard (2011). JIS K 0450-70-10, Testing methods for perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) in industrial water and wastewater.
Joensen, U.N., Bossi, R., Leffers, H., Jensen, A.A., Skakkebaek, N.E. et Jørgensen, N. (2009). Do perfluoroalkyl compounds impair human semen quality? Environ. Health Perspect., 117(6): 923–927.
Johansson, N., Fredriksson, A. et Eriksson, P. (2008). Neonatal exposure to perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) causes neurobehavioural defects in adult mice. Neurotoxicology, 29(1): 160–169.
Johansson, N., Eriksson, P. et Viberg, H. (2009). Neonatal exposure to PFOS and PFOA in mice results in changes in proteins which are important for neuronal growth and synaptogenesis in the developing brain. Toxicol. Sci., 108(2): 412–418.
Johnson, J. D. et Ober, R. E. (1979). Absorption of FC-95-14C in rats after a single oral dose. 3M. Submitted to the U.S. Environmental Protection Agency's Administrative Record. AR226-0007. [Cité dans ATSDR (2009), EFSA (2008)].
Johnson, J.D. et Ober, R.E. (1999). Absorption of FC-143-14C in rats after a single oral dose. Dans : Exploratory 28-day oral toxicity study with telomer alcohol, telomer acrylate, PFHS, and PFOS (POS control) by daily gavage in the rat, w/CVR LTR DTD, 051500 (Sanitized) 3M. Submitted to the U.S. Environmental Protection Agency under TSCA Section FYI. OTS05001378S. [Cité dans ATSDR (2009)].
Kadar, H., Veyrand, B., Barbarossa, A., Pagliuca, G., Legrand, A., Bosher, C. et coll. (2011). Development of an analytical strategy based on liquid chromatography-high resolution mass spectrometry for measuring perfluorinated compounds in human breast milk: application to the generation of preliminary data regarding perinatal exposure in France. Chemosphere, 85(3): 473–480.
Kannan, K., Corsolini, S., Falandysz, J., Fillmann, G., Kumar, K.S., Loganathan, B.G. et coll. (2004). Perfluorooctanesulfonate and related fluorochemicals in human blood from several countries. Environ. Sci. Technol., 38(17):4489–4495. [Cité dans Santé Canada (2006)].
Karbe, E. et Kerlin, R.L. (2002). Cystic degeneration/spongiosis hepatis in rats. Toxicol. Pathol., 30(2): 216–227.
Kärrman, A., Domingo, J.L., Llebaria, X., Nadal, M., Bigas, E., van Bavel, B. et Lindström G. (2010). Biomonitoring perfluorinated compounds in Catalonia, Spain: concentrations and trends in human liver and milk samples. Environ. Sci. Pollut. Res. Int., 17(3): 750–758.
Kato, K., Wong, L.Y., Jia, L.T., Kuklenyik, Z. et Calafat, A.M. (2011). Trends in exposure to polyfluoroalkyl chemicals in the U.S. Population: 1999–2008. Environ. Sci. Technol., 45(19): 8037–8045.
Kawamoto, K., Oashi, T., Oami, K., Liu, W., Jin, Y., Saito, N. et coll. (2010). Perfluorooctanoic acid (PFOA) but not perfluorooctane sulfonate (PFOS) showed DNA damage in comet assay on Paramecium caudatum. J. Toxicol. Sci., 35(6): 835–841.
Kawamoto, K., Sato, I., Tsuda, S., Yoshida, M., Yaegashi, K., Saito, N., et coll. (2011). Ultrasonic-induced tonic convulsion in rats after subchronic exposure to perfluorooctane sulfonate (PFOS). J. Toxicol. Sci., 36(1): 55–62.
Keil, D.E., Mehlmann, T., Butterworth, L. et Peden-Adams, M.M. (2008). Gestational exposure to perfluorooctane sulfonate suppresses immune function in B6C3F1 mice. Toxicol. Sci., 103(1): 77–85.
Kemper, R.A. (2003). Perfluorooctanoic acid: Toxicokinetics in the rat. Association of Plastics Manufactures of Europe. Project ID: DuPont 7473. U.S. EPA public docket, administrative record. AR226-1499.
Kemper, R.A. et Nabb, D.L. (2005). In vitro studies in microsomes from rat and human liver, kidney, and intestine suggest that perfluorooctanoic acid is not a substrate for microsomal UDPglucuronosyltransferases. Drug Chem. Toxicol., 28(3): 281–287.
Kim, S., Choi, K., Ji, K., Seo, J., Kho, Y., Park, J., Hwang, I., Jeon, J., Yang, H. et Giesy, J.P. (2011a). Trans-placental transfer of thirteen perfluorinated compounds and relations with fetal thyroid hormones. Environ. Sci. Technol., 45(17): 7465–7472.
Kim, H.S., Jun Kwack, S., Sik Han, E., Seok Kang, T., Hee Kim, S. et Young Han, S. (2011b). Induction of apoptosis and CYP4A1 expression in Sprague-Dawley rats exposed to low doses of perfluorooctane sulfonate. J. Toxicol. Sci., 36(2): 201–210.
Knox, S.S., Jackson, T., Javins, B., Frisbee, S.J., Shankar, A. et Ducatman, A.M. (2011a). Implications of early menopause in women exposed to perfluorocarbons. J. Clin. Endocrinol. Metab., 96(6): 1747–1753.
Knox, S.S., Jackson, T., Frisbee, S.J., Javins, B. et Ducatman, A.M. (2011b). Perfluorocarbon exposure, gender and thyroid function in the C8 Health Project. J. Toxicol. Sci., 36(4): 403–410.
Koibuchi, N. et Chin, W.W. (2000). Thyroid hormone action and brain development. Trends Endocrinol. Metab., 11(4): 123–128.
Kolstad, C. (2010). GAC treatment for PFCs in Oakdale. Breeze, 143, 14-15.
Krishnan, K. et Carrier, R. (2008). Approaches for evaluating the relevance of multiroute exposures in establishing guideline values for drinking water contaminants. J. Environ. Sci. Health C Environ. Carcinog. Ecotoxicol. Rev., 26(3): 300–316.
Krishnan, K. et Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39–51.
Kubwabo, C., Vais, N. et Benoit, F.M. (2004). A pilot study on the determination of perfluorooctanesulfonate and other perfluorinated compounds in blood of Canadians. J. Environ. Monit., 6(6): 540–545.
Kubwabo, C., Stewart, B., Zhu, J. et Marro, L. (2005). Occurrence of perfluorosulfonates and other perfluorochemicals in dust from selected homes in the city of Ottawa, Canada. J. Environ. Monit., 7(11): 1074–1078. [Cité dans EFSA (2008); ATSDR (2009); Environnement Canada et Santé Canada (2012)].
La Rocca, C., Alessi, E., Bergamasco, B., Caserta, D., Ciardo, F., Fanello, E., Focardi, S., Guerranti, C., Stecca, L., Moscarini, M., Perra, G., Tait, S., Zaghi, C. et Mantovani, A. (2012). Exposure and effective dose biomarkers for perfluorooctane sulfonic acid (PFOS) and perfluorooctanoic acid (PFOA) in infertile subjects: preliminary results of the PREVIENI project. Int. J. Hyg. Environ. Health, 215(2): 206–211.
Lampert, D.J., Frisch, M.A. et Speitel.Jr, G.E. (2007). Removal of perfluorooctanoic acid and perfluorooctanesulfonate from wastewater by ion exchange. Practice Periodical of Hazardous, Toxic, and Radioactive Waste Management. 11: 60–68.
Lange, F.T., Schmidt, C. et Brauch, H-J.(2006). Perfluoroalkyl carboxylates and sulfonates, Rhine Water Works, The Netherlands, Association of River Waterworks - RIWA.
Larsen, B.S. et Kaiser, M.A., 2007. Challenges in perfluorocarboxylic acid measurement. Anal. Chem., 79: 3966–3973.
Lau, C., Thibodeaux, J.R., Hanson, R.G., Rogers, J.M., Grey, B.E., Stanton, M.E., Butenhoff, J.L. et Stevenson, L.A. (2003). Exposure to perfluorooctane sulfonate during pregnancy in rat and mouse. II: postnatal evaluation. Toxicol. Sci., 74(2):382–392.
Lau, C., Anitole, K., Hodes, C., Lai, D., Pfahles-Hutchens, A. et Seed, J. (2007). Perfluoroalkyl acids: a review of monitoring and toxicological findings. Toxicol. Sci., 99: 366–394.
Lefebvre, D.E., Curran, I., Armstrong, C., Coady, L., Parenteau, M., Liston, V., et coll. (2008). Immunomodulatory effects of dietary potassium perfluorooctane sulfonate (PFOS) exposure in adult Sprague–Dawley rats. J. Toxicol. Environ. Health A., 71(23): 1516–1525.
Lindstrom, A.B., Strynar, M.J., Delinsky, A.D., Nakayama, S.F., McMillan, L., Libelo, E.L., Neill, M. et Thomas, L. (2011). Application of WWTP biosolids and resulting perfluorinated compound contamination of surface and well water in Decatur, Alabama, USA. Environ. Sci. Technol., 45(19): 8015–8021.
Lipp, P., Sacher, F. et Baldauf, G. (2010). Removal of organic micro-pollutants during drinking water treatment by nanofiltration and reverse osmosis. Desalination Water Treat., 13(13): 226–237.
Little Hocking Water Association (2010). GAC filter C-8 sampling result summary. Disponible à :http://littlehockingwater.org/newsite/?cat=8
Liu, L., Liu, W., Song, J., Yu, H., Jin, Y., Oami, K. et coll. (2009a). A comparative study on oxidative damage and distributions of perfluorooctane sulfonate (PFOS) in mice at different postnatal developmental stages. J. Toxicol. Sci., 34(3): 245–254.
Liu, L., Jin, Y.H., Wang, L., Yu, H.Y., Liu, W., Yu, Q.L. et coll. (2009b). [Effects of perfluorooctane sulfonate on learning and memory of rat pups]. Zhonghua Yu Fang Yi Xue Za Zhi [Chinese journal of preventive medicine], 43(7): 622–627. Chinese paper. Abstract only.
Liu, X., Liu, W., Jin, Y., Yu, W., Liu, L. et Yu, H. (2010a). Effects of subchronic perfluorooctane sulfonate exposure of rats on calcium-dependent signaling molecules in the brain tissue. Arch. Toxicol., 84(6): 471–479.
Liu, X., Liu, W., Jin, Y., Yu, W., Wang, F. et Liu, L. (2010b). Effect of gestational and lactational exposure to perfluorooctanesulfonate on calcium-dependent signaling molecules gene expression in rats' hippocampus. Arch. Toxicol., 84(1): 71–79.
Liu, J., Li, J., Liu, Y., Chan, H.M., Zhao, Y., Cai, Z. et Wu, Y. (2011). Comparison on gestation and lactation exposure of perfluorinated compounds for newborns. Environ. Int., 37(7): 1206–1212.
Loccisano, A.E., Campbell, J.L., Jr., Andersen, M.E. et Clewell, H.J., 3rd. (2011). Evaluation and prediction of pharmacokinetics of PFOA and PFOS in the monkey and human using a PBPK model. Regul. Toxicol. Pharmacol., 59(1): 157–175.
Loccisano, A.E., Campbell, J.L., Jr., Butenhoff, J.L., Andersen, M.E. et Clewell, H.J., 3rd. (2012a). Comparison and evaluation of pharmacokinetics of PFOA and PFOS in the adult rat using a physiologically based pharmacokinetic model. Reprod. Toxicol., 33(4): 452–467.
Loccisano, A.E., Campbell, J.L., Jr., Butenhoff, J.L., Andersen, M.E. et Clewell, H.J., 3rd. (2012b). Evaluation of placental and lactational pharmacokinetics of PFOA and PFOS in the pregnant, lactating, fetal and neonatal rat using a physiologically based pharmacokinetic model. Reprod. Toxicol., 33(4): 468–90.
Loccisano, A.E., Longnecker, M.P., Campbell, J.L., Jr., Andersen, M.E. et Clewell, H.J., 3rd. (2013). Development of PBPK models for PFOA and PFOS for human pregnancy and lactation life stages. J. Toxicol. Environ. Health A, 76(1): 25–57.
Long, Y., Wang, Y., Ji, G., Yan, L., Hu, F. et Gu, A. (2013). Neurotoxicity of perfluorooctane sulfonate to hippocampal cells in adult mice. PLoS One, 8(1): e54176.
Loos.R., Wollgast, J., Huber, T. et Hanke, G. (2007). Polar herbicides, pharmaceutical products, perfluorooctanesulfonate (PFOS), perfluorooctanoate (PFOA), and nonylphenol and its carboxylates and ethoxylates in surface and tap waters around Lake Maggiore in Northern Italy. Anal. Bioanal. Chem., 387:1469–1478.
Lopez-Espinosa, M.J., Fletcher, T., Armstrong, B., Genser, B., Dhatariya, K., Mondal, D. et coll. (2011). Association of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) with age of puberty among children living near a chemical plant. Environ. Sci. Technol.., 45(19): 8160–8166.
Lopez-Espinosa, M.J., Mondal, D., Armstrong, B., Bloom, M.S. et Fletcher, T. (2012). Thyroid function and perfluoroalkyl acids in children living near a chemical plant. Environ. Health Perspect., 120(7): 1036–1041.
Lowen, M., Halldorson, T., Wang, F, et Tomy, Gregg. (2005). Fluorotelomer carboxylic acids and PFOS in rainwater from urban center in Canada. Environ. Sci. Technol. 39: 2944-2951.
Luebker, D.J., Hansen, K.J., Bass, N.M., Butenhoff, J.L. et Seacat, A.M. (2002). Interactions of fluorochemicals with rat liver fatty acid-binding protein. Toxicology, 176(3): 175–185.
Luebker, D.J., Case, M.T., York, R.G., Moore, J.A., Hansen, K.J. et Butenhoff, J.L. (2005a). Two-generation reproduction and cross-foster studies of perfluorooctanesulfonate (PFOS) in rats. Toxicology, 215(1–2): 126–148.
Luebker, D.J., York, R.G., Hansen, K.J., Moore, J.A. et Butenhoff, J.L. (2005b). Neonatal mortality from in utero exposure to perfluorooctanesulfonate (PFOS) in Sprague-Dawley rats: dose–response, and biochemical and pharamacokinetic parameters. Toxicology, 215(1–2): 149–169.
Maestri, L., Negri, S., Ferrari, M., Ghittori, S., Fabris, F., Danesino, P. et Imbriani, M. (2006). Determination of perfluorooctanoic acid and perfluorooctanesulfonate in human tissues by liquid chromatography/single quadrupole mass spectrometry. Rapid Commun. Mass Spectrom., 20(18):2728–2734.
Maisonet, M., Terrell, M.L., McGeehin, M.A., Christensen, K.Y., Holmes, A., Calafat, A.M. et Marcus, M. (2012). Maternal concentrations of polyfluoroalkyl compounds during pregnancy and fetal and postnatal growth in British girls. Environ. Health Perspect., 120(10): 1432–1437.
Mak, Y.L., Taniyasu, S., Yeung, L.W.Y., Lu, G.H., Jin, L., Yang, Y.L., Lam, P.K.S., Kannan, K. et Yamashita, N. (2009). Perfluorinated compounds in tap water from China and several other countries. Environ. Sci. Technol. 43(13): 4824–4829.
Martin, J., Kannan, K., Berser, U., deVoogt, P., Field, J., Franklin, J., Giesy, J., Harner, T., Muir, D., Scott, B., Kaiser, M., Jarnberg, U., Jones, K., Mabury, S., Schroeder, H., Simcik, M., Sottani, C., Van Bavel., B., Karrmane, A., Lindstrom, G. et Van Leeuwen, S. (2004). Analytical challenges hamper perfluoroalkyl research. Environ. Sci. Technol., 38(13): 248A–255A.
Martin, M.T., Brennan, R.J., Hu, W., Ayanoglu, E., Lau, C., Ren, H., Wood, C.R., Corton, J.C., Kavlock, R.J. et Dix, D.J. (2007). Toxicogenomic study of triazole fungicides and perfluoroalkyl acids in rat livers predicts toxicity and categorizes chemicals based on mechanisms of toxicity. Toxicol. Sci., 97(2): 595–613.
Martin, J. W., Asher, B. J., Beesoon, S., Benskin, J. P. et Ross, M. S. (2010). PFOS or PreFOS? Are perfluorooctanesulfonate precursors (PreFOS) important determinants of human and environmental perfluorooctanesulfonate (PFOS) exposure? J. Environ. Monitor., 12(11), 1979–2004.
MDH (2008a). Public 1071 health assessment: perfluorochemical 1072 contamination in Lake Elmo and Oakdale, Washington County, Minnesota. Minnesota Department of Health. Disponible à : www.health.state.mn.us/divs/eh/wells/waterquality/poudevicefinal.pdf
MDH (2008b). Performance evaluation: Removal of perfluorochemicals (PFC's) with point-of-use (POU) water treatment devices. Raport final, préparé par by Philip C. Olsen and David J. Paulson, Water Science & Marketing, LLC pour le Minnesota Department of Health. Mai. Disponible à : www.health.state.mn.us/divs/eh/wells/waterquality/poudevicefinal.pdf
MDH (2008c). Health risk limits for perfluorochemicals. Report to the Minnesota legislature. Final report. Minnesota Department of Health. Janvier.
MDH (2008d). Health risk limits for groundwater 2008 rule revision. Perfluorooctanate sulfonate. Minnesota Department of Health.
Meek, M.E., Palermo, C.M., Bachman, A.N., North, C.M. et Lewis, J.R. (2014). Mode of action human relevance (species concordance) framework: Evolution of the Bradford Hill considerations and comparative analysis of weight of evidence. J. Appl. Toxicol., 34(6): 595–606.
Melzer, D., Rice, N., Depledge, M.H., Henley, W.E. et Galloway, T.S. (2010). Association between serum perfluorooctanoic acid (PFOA) and thyroid disease in the U.S. National Health and Nutrition Examination Survey. Environ. Health Perspect, 118(5): 686–692.
Mendel, A. (1977). Technical report: Analytical methodology on FM 3422. AR226-0364. [Cité dans Martin et coll. (2010)].
Midasch, O., Drexler, H., Hart, N., Beckmann, M.W. et Angerer, J. (2007). Transplacental exposure of neonates to perfluorooctanesulfonate and perfluorooctanoate: a pilot study. Int. Arch. Occup. Environ. Health, 80(7): 643–648.
Ministère du Développement durable, de l'Environnement, de la Faune et des Parcs. (2012). Les composés perfluorés dans les cours d'eau et l'eau potable du Québec méridonal. Gouvernement du Québec, Québec, Québec.
Mollenhauer, M.A., Bradshaw, S.G., Fair, P.A., McGuinn, W.D. et Peden-Adams, M.M. (2011). Effects of perfluorooctane sulfonate (PFOS) exposure on markers of inflammation in female B6C3F1 mice. J. Environ. Sci. Health A Tox. Hazard Subst. Environ. Eng., 46(2): 97–108.
Mondal, D., Lopez-Espinosa, M.J., Armstrong, B., Stein, C.R. et Fletcher, T. (2012). Relationships of perfluorooctanoate and perfluorooctane sulfonate serum concentrations between mother–child pairs in a population with perfluorooctanoate exposure from drinking water. Environ. Health Perspect., 120(5): 752–757.
Monroy, R., Morrison, K., Teo, K., Atkinson, S., Kubwabo, C., Stewart, B. et Foster, W.G. (2008). Serum levels of perfluoroalkyl compounds in human maternal and umbilical cord blood samples. Environ. Res., 108(1): 56–62.
Moody, C.A., Kwan, W.C., Martin, J.W., Muir, D.C.G. et Mabury, S.A. (2001). Determination of perfluorinated surfactants in surface water samples by two independent analytical techniques: liquid chromatography/ tandem mass spectrometry and 19F NMR. Anal. Chem., 73: 2200-2206.
Moody, C.A., Hebert, G.N., Strauss, S.H. et Field, J.A. (2003). Occurrence and persistence of perfluorooctanesulfonate and other perfluorinated surfactants in groundwater at a fire-training area at Wurtsmith Air Force Base, Michigan, USA. J. Environ. Monit., 5(2): 341–345.
Morreale de Escobar, G., Jesús Obregón, M. et Escobar del Rey, F. (2004). Role of thyroid hormone during early brain development. Eur. J. Endocrinol., 151: U25–U37.
Nakayama, S., Strynar, M.., Helfant, L., Egeghy, P., Ye, X. et Lindstrom, A. (2007). Perfluorinated compounds in the Cape Fear Drainage basin in North Carolina. Environ. Sci. Technol. 41:5271–5276.
Needham, L. L., Grandjean, P., Heinzow, B., Jørgensen, P.J., Nielsen, F., Patterson, D. G., Jr., Sjödin, A., Turner, W.E. et Weihe, P. 2011. Partition of environmental chemicals between maternal and fetal blood and tissues. Environ. Sci. Technol., 45(3): 1121–1126.
Nelson, J.W., Hatch, E.E. et Webster, T.F. (2010). Exposure to polyfluoroalkyl chemicals and cholesterol, body weight, and insulin resistance in the general U.S. population. Environ. Health Perspect., 118(2): 197–202.
NOTOX (1999). Exploratory 28-day oral toxicity study with telomer alcohol, telomer acrylate, [redacted confidential business information], PFHS and PFOS (positive control) by daily gavage in the rat followed by a 14/28-day recovery period. # 242933. [Cité dans Santé Canada (2006)].
NSF/ANSI (2014). NSF International/American National Standards Institute Standard 61: Drinking water system components—health effects. NSF International, Ann Arbor, Michigan.
OCDE (2002). Co-operation on existing chemicals hazard assessment of perfluorooctane sulfonate (PFOS) and its salts. Environment directorate joint meeting of the chemicals committee and the working party on chemicals, pesticides and biotechnology. Disponible à :www.OECD.org/chemicalsafety/risk-assessment/2382880.pdf.
Ochoa-Herrera, V. et Sierra-Alvarez, R. (2008). Removal of perfluorinated surfactants by sorption onto granular activated carbon, zeolite and sludge. Chemosphere, 72: 1588–1593.
Oda, Y., Nakayama, S., Harada, K.H. et Koizumi, A. (2007). Negative results ofumu genotoxicity test of fluorotelomer alcohols and perfluorinated alkyl acids. Environ. Health Prev. Med., 12(5): 217–219.
Okada, E., Sasaki, S., Saijo, Y., Washino, N., Miyashita, C., Kobayashi, S. et coll. (2012). Prenatal exposure to perfluorinated chemicals and relationship with allergies and infectious diseases in infants. Environ. Res., 112: 118–125.
Olsen, G.W., Burlew, M.M., Hocking, B.B., Skratt, J.C., Burris, J.M. et Mandel, J.H. (2001). An epidemiologic analysis of episodes of care of 3M Decatur chemical and film plant employees, 1993–1998. Final Report May 18. [Cité dans EFSA (2008)].
Olsen, G.W., Hansen, K.J., Stevenson, L.A., Burris, J.M. et Mandel, J.H. (2003a). Human donor liver and serum concentrations of perfluorooctanesulfonate and other perfluorochemicals. Environ. Sci. Technol., 37:888–891.
Olsen, G.W., Butenhoff, J.L. et Mandel, J.N. (2003b). Assessment of lipid, hepatic and thyroid function in relation to an occupational biologic limit value for perfluorooctanoate. 3M Company. Final Report. June 9. U.S. EPA AR226-1351.
Olsen, G.W., Burris, J.M., Ehresman, D.J., Froehlich, J.W., Seacat, A.M., Butenhoff, J.L. et coll. (2007). Half-life of serum elimination of perfluorooctanesulfonate, perfluorohexanesulfonate, and perfluorooctanoate in retired fluorochemical production workers. Environ. Health Perspect., 115(9): 1298–1305.
Olsen, G., Ehresman, D.J., Buehrer, B.D., Gibson, B.A., Butenhoff, J.L. et Zobel, L.R. (2012). Longitudinal assessment of lipid and hepatic clinical parameters in workers involved with the demolition of perfluoroalkyl manufacturing facilities. J. Occup. Environ. Med., 54(8): 974–983.
Onishchenko, N., Fischer, C., Wan Ibrahim, W.N., Negri, S., Spulber, S., Cottica, D. et Ceccatelli, S. (2011). Prenatal exposure to PFOS or PFOA alters motor function in mice in a sex-related manner. Neurotox. Res., 19(3): 452–461.
Ostertag, S.K., Chan, H.M., Moisey, J., Dabeka, R. et Tittlemier, S.A. (2009a). Historic dietary exposure to perfluorooctane sulfonate, perfluorinated carboxylates, and fluorotelomer unsaturated carboxylates from the consumption of store-bought and restaurant foods for the Canadian population. J. Agric. Food Chem., 57(18): 8534–8544.
Ostertag, S.K., Tague, B.A., Humphries, M.M., Tittlemier, S.A. et Chan, H.M. (2009b). Estimated dietary exposure to fluorinated compounds from traditional foods among Inuit in Nunavut, Canada. Chemosphere, 75(9): 1165–1172.
Panchangam, S. C., Yu-Chen Lin, A., Shaik, K.L. et Lin, C-F.(2009). Decomposition of perfluorocarboxylic acids (PFCAs) by heterogeneous photocatalysis in acidic aqueous medium. Chemosphere 77: 242–248.
Peden-Adams, M.M., Keller, J.M., Eudaly, J.G., Berger, J., Gilkeson, G.S. et Keil, D.E. (2008). Suppression of humoral immunity in mice following exposure to perfluorooctane sulfonate. Toxicol. Sci., 104(1): 144–154.
Pirali, B., Negri, S., Chytiris, S., Perissi, A., Villani, L., La Manna, L., Cottica, D., Ferrari, M., Imbriani, M., Rotondi, M. et Chiovato, L. (2009). Perfluorooctane sulfonate and perfluorooctanoic acid in surgical thyroid specimens of patients with thyroid diseases. Thyroid, 19(12): 1407–1412.
PISSC (1994). Assessing human health risks of chemicals: derivation of guidance values for health-based exposure limits. Environmental Health Criteria 170. Programme international sur la sécurité des substances chimiques, Organisation mondiale de la Santé, Genève, Suisse.
PISSC (2005). Chemical-specific adjustment factors for interspecies differences and human variability: guidance document for use of data in dose/concentration–response assessment. Harmonization Project Document No. 2. Programme international sur la sécurité des substances chimiques, Organisation mondiale de la Santé, Genève, Suisse.
PISSC (2012). Guidance for immunotoxicity risk assessment for chemicals. Harmonization Project Document No. 10. Programme international sur la sécurité des substances chimiques, Organisation mondiale de la Santé, Genève, Suisse.
Pop, V.J., Kuijpens, J.L., van Baar, A.L., Verkerk, G., van Son, M.M., de Vijlder, J.J., Vulsma, T., Wiersinga, W.M., Drexhage, H.A. et Vader, H.L. (1999). Low maternal free thyroxine concentrations during early pregnancy are associated with impaired psychomotor development in infancy. Clin. Endocrinol., 50(2): 149–155.
Post, G., Louis, J., Lippincott, L. et Procopio, N. (2013). Occurrence of perfluorinated compounds in raw water from New Jersey public drinking water system. Environ. Sci. Technol. 47:13266–13275.
Prevedouros, K., Cousins, I.T., Buck, R.C. et Korzeniowski, S.H. (2006). Sources, fate and transport of perfluorocarboxylates. Environ. Sci. Technol. 40 (1): 32–44.
Qazi, M.R., Bogdanska, J., Butenhoff, J.L., Nelson, B.D., DePierre, J.W. et Abedi-Valugerdi, M. (2009a). High-dose, short-term exposure of mice to perfluorooctanesulfonate (PFOS) or perfluorooctanoate (PFOA) affects the number of circulating neutrophils differently, but enhances the inflammatory responses of macrophages to lipopolysaccharide (LPS) in a similar fashion. Toxicology, 262(3): 207–214.
Qazi, M.R., Xia, Z., Bogdanska, J., Chang, S.C., Ehresman, D.J., Butenhoff, J.L., et coll. (2009b). The atrophy and changes in the cellular compositions of the thymus and spleen observed in mice subjected to short-term exposure to perfluorooctanesulfonate are high-dose phenomena mediated in part by peroxisome proliferator-activated receptor-alpha (PPARalpha). Toxicology., 260(1–3):68–76.
Qazi, M.R., Abedi, M.R., Nelson, B.D., DePierre, J.W. et Abedi-Valugerdi, M. (2010a). Dietary exposure to perfluorooctanoate or perfluorooctane sulfonate induces hypertrophy in centrilobular hepatocytes and alters the hepatic immune status in mice. Int Immunopharmacol., 10(11): 1420–1427.
Qazi, M.R., Nelson, B.D., Depierre, J.W. et Abedi-Valugerdi, M. (2010b). 28-Day dietary exposure of mice to a low total dose (7 mg/kg) of perfluorooctanesulfonate (PFOS) alters neither the cellular compositions of the thymus and spleen nor humoral immune responses: does the route of administration play a pivotal role in PFOS-induced immunotoxicity? Toxicology, 267(1–3): 132–139.
Quinones, O. et Snyder, S. (2009). Occurrence of perfluoroalkyl carboxylates and sulfonates in drinking water utilities and related waters from the United States. Environ. Sci. Technol., 43(24): 9089-9095.
Rahman, M.F., Peldszus, S. et Anderson, W.B. (2014). Behaviour and fate of perfluoroalkyl and polyfluoroalkyl substances (PFASs) in drinking water treatment: A review. Water Res. 50:318–340.
Raymer, J.H., Michael, L.C., Studabaker, W.B., Olsen, G.W., Sloan, C.S., Wilcosky, T. et coll. (2012). Concentrations of perfluorooctane sulfonate (PFOS) and perfluorooctanoate (PFOA) and their associations with human semen quality measurements. Reprod. Toxicol., 33(4): 419–427.
Riker Laboratories Inc. (1981). Acute ocular irritation test with T-2997CoC in albino rabbits. # 0882EB0009. [Cité dans Santé Canada (2006)].
Ritter, L., Totman, C., Krishnan, K., Carrier, R., Vézina, A. et Morisset, V. (2007). Deriving uncertainty factors for threshold chemical contaminants in drinking water. J. Toxicol. Environ. Health B Crit. Rev., 10(7): 527–557.
Rogers, J.M., Ellis-Hutchings, R.G., Grey, B.E., Zucker, R.M., Norwood, J., Jr, Grace, C.E., Gordon, C.J. et Lau, C. (2014). Elevated blood pressure in offspring of rats exposed to diverse chemicals during pregnancy. Toxicol. Sci., 137(2): 436–446.
Roosens, L., D'Hollander, W., Bervoets, L., Reynders, H., Van Campenhout, K., Cornelis, C., Reynders, H., Campenhout, K.V., Voogt, P.D. et Bervoets, L. (2010). Brominated flame retardants and perfluorinated chemicals, two groups of persistent contaminants in Belgian human blood and milk. Environ Pollut., 158(8): 2546–2552.
Rosen, M.B., Schmid, J.R., Corton, J.C., Zehr, R.D., Das, K.P., Abbott, B.D. et Lau, C. (2010). Gene expression profiling in Wild-Type and PPARα-null mice exposed to perfluorooctane sulfonate reveals PPARα-independent effects. PPAR Res. 2010: 1–13.
Rosen, M.B., Das, K.P., Wood, C.R., Wolf, C.J., Abbott, B.D. et Lau, C. (2013). Evaluation of perfluoroalkyl acid activity using primary mouse and human hepatocytes. Toxicology, 308: 129–137.
Rumsby, P., McLaughlin, C. et Hall, T.(2009). Perfluorooctane sulphonate and perfluorooctanoic acid in drinking and environmental waters. Phil. Trans. Royal. Soc. 367:4119–4136.
Rusch, G. (1979). An acute inhalation study of T-2305 CoC in the rat. Bio/dynamics, Inc., Study No. 78-7184, May 3, 1979. U.S. Environmental Protection Agency Administrative Record 226-0417. [Cité dans OCDE (2002); EFSA (2008)].
Sanexen Environmental Services Inc. (2013). Review of toxicological information on perfluorooctane sulfonate (PFOS) to be used in the technical document for drinking water guidelines. Rapport final soumis à Santé Canada.
Santé Canada. (1994). L'évaluation du risque à la santé humaine des substances d'intérêt prioritaire. Santé Canada, Ottawa, Ontario. Disponible à : www.hc-sc.gc.ca/ewh-semt/alt_formats/hecs-sesc/pdf/pubs/contaminants/approach/approach-fra.pdf
Santé Canada (2006). Rapport sur l'état des connaissances scientifiques - Le sulfonate de perfluorooctane, ses sels et ses précurseurs contenant la fraction C8F17SO2 ou C8F17SO3. Disponible à : http://www.hc-sc.gc.ca/ewh-semt/pubs/contaminants/pfos-spfo/index-fra.php
Santé Canada (2010). Rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada : Résultats de l'Enquête canadienne sur les mesures de la santé Cycle 1 (2007 à 2009). Disponible à : www.hc-sc.gc.ca/ewh-semt/pubs/contaminants/chms-ecms/index-fra.php
Santé Canada. (2013a). Recherche de l'Enquête national APFO–SPFO 2009 et 2010. Chiffrier Excel. Santé Canada, Ottawa, Ontario.
Santé Canada. (2013b). Deuxième rapport sur la biosurveillance humaine des substances chimiques de l'environnement au Canada: Résultats de l'Enquête canadienne sur les mesures de la santé Cycle 2 (2009 à 2011). Disponible de : www.hc-sc.gc.ca/ewh-semt/pubs/contaminants/chms-ecms-cycle2/index-fra.php
Santé Canada. (2013c). Seacat reanalysis—statistical analysis of cynomolgus monkey data. Internal report. Santé Canada, Ottawa, Ontario.
Sato, I., Kawamoto, K., Nishikawa, Y., Tsuda, S., Yoshida, M., Yaegashi, K. et coll. (2009). Neurotoxicity of perfluorooctane sulfonate (PFOS) in rats and mice after single oral exposure. J. Toxicol. Sci., 34(5): 569–574.
Schroeder, A.C. et Privalsky, M.L. (2014). Thyroid hormones, T3 and T4, in the brain. Front. Endocrin., 5(40), 1–6.
Schultz, M., Barofsky, D. et Field, J. (2006). Quantitative determination of fluorinated alkyl substances by large-volume-injection liquid chromatography tandem mass spectrometryscharacterization of municipal wastewaters. Environ. Sci. Technol. 40:289–295.
Seacat, A.M., Thomford, P.J., Hansen, K.J., Clemen, L.A., Eldridge, S.R., Elcombe, C.R. et Butenhoff, J.L. (2003). Sub-chronic dietary toxicity of potassium perfluorooctane sulfonate in rats. Toxicology, 183(1–3): 117–131. Erratum dans : Toxicology, 192(2–3):263–264.
Seacat, A.M., Thomford, P.J., Hansen, K.J., Olsen, G.W., Case, M.T. et Butenhoff, J.L. (2002). Subchronic toxicity studies on perfluorooctanesulfonate potassium salt in Cynomolgus monkeys. Toxicol. Sci., 68(1): 249–264.
Senevirathna, S.T.M.L.D, Tanaka, S., Fujii, S., Kunacheva, C., Harada, H., Shivakoti, B.R. et Okamoto, R. (2010). A comparative study of adsorption of perfluorooctanesulfonate (PFOS) onto granular activated carbon, ion-exchange polymers and non-ion-exchange polymers. Chemosphere 80: 647–651.
Senevirathna, S.T.M.L.D, Tanaka, S., Fujii, S., Kunacheva, C., Harada, H., Shivacoti, B., Dinh, H. et Ariadas, T. (2011). Adsorption of four perfluorinated acids on non-ion exchange polymers sorbents. Water Sci. Technol., 63(10): 2106.
Shankar, A., Xiao, J. et Ducatman, A. (2011). Perfluoroalkyl chemicals and chronic kidney disease in US adults. Am. J. Epidemiol., 174(8): 893–900.
Shivakoti, B.R., Fujii, S., Nozoe, M., Tanaka, S. et Kunacheva, C. (2010). Perfluorinated chemicals (PFCs) in water purification plants (WPPs) with advanced treatment processes. Wa. Sci. Technol, 10(1): 87–95.
Shoeib, M., Harner, T., G, M.W. et Lee, S.C. (2011). Indoor sources of poly- and perfluorinated compounds (PFCS) in Vancouver, Canada: implications for human exposure. Environ. Sci. Technol., 45(19): 7999–8005.
Shoemaker, J., Boutin, B. et Grimmett, P. (2009). Development of a U.S. EPA drinking water method for the analysis of selected perfluoroalkyl acids by solid-phase extraction and LC–MS–MS. J. Chromatogr. Sci., 47(1):3–11.
So, M.K., Yamashita, N., Taniyasu, S., Jiang, Q., Giesy, J.P., Chen, K. et Lam, P.K. (2006). Health risks in infants associated with exposure to perfluorinated compounds in human breast milk from Zhoushan, China. Environ. Sci. Technol., 40(9): 2924–2929. Comment dans : Environ. Sci. Technol., 40(9): 2866–2867.
Sonia, T.A. et Sharma, C.P. (2011). Chitosan and its derivatives for drug delivery perspective. Adv. Polym. Sci., 243: 23–54.
Sonthithai, P., Suriyo, T., Thiantanawat, A., Watcharasit, P., Ruchirawat, M. et Satayavivad, J. (2015). Perfluorinated chemicals, PFOS and PFOA, enhance the estrogenic effects of 17β-estradiol in T47D human breast cancer cells. J. Appl. Toxicol. Accepted for publication. DOI: 10.1002/jat.3210.
Steenland, K., Tinker, S., Frisbee, S., Ducatman, A. et Vaccarino, V. (2009). Association of perfluorooctanoic acid and perfluorooctane sulfonate with serum lipids among adults living near a chemical plant. Am. J. Epidemiol., 170(10): 1268–1278.
Steenland, K., Tinker, S., Shankar, A. et Ducatman, A. (2010). Association of perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS) with uric acid among adults with elevated community exposure to PFOA. Environ. Health Perspect., 118(2): 229–233.
Stein, C.R. et Savitz, D.A. (2011). Serum perfluorinated compound concentration and attention deficit/hyperactivity disorder in children 5–18 years of age. Environ. Health Perspect., 119(10): 1466–1471.
Stein, C.R., Savitz, D.A. et Dougan, M. (2009). Serum levels of perfluorooctanoic acid and perfluorooctane sulfonate and pregnancy outcome. Am. J. Epidemiol., 170(7): 837–846. Comment dans : Am. J. Epidemiol., 171(1):131–132; author reply 132–133.
Steinle-Darling, E. et Reinhard, M. (2008). Nanofiltration for trace organic contaminant removal: structure, solution, and membrane fouling effects on the rejection of perfluorochemicals. Environ. Sci. Technol., 42, 5292–5297.
Summit Toxicology (2015). Interspecies extrapolation for perfluorooctyl sulfonate (PFOS) and perfluorooctanoic acid (PFOA). Summit Toxicology, L.L.P. Rapport soumis à Santé Canada.
Sun., H., LI, F., Zhang, T., Zhang, X., He., N., Song, Q., Zhao, L., Sun, L. et Sun, T. (2011). Perfluorinated compounds in surface waters and WWTPs in Shenyang, China: Mass flows and source analysis. Water Res., 45:4483-4490.
Sundström, M., Ehresman, D.J., Bignert, A., Butenhoff, J.L., Olsen, G.W., Chang, S.C. et Bergman, A. (2011). A temporal trend study (1972–2008) of perfluorooctanesulfonate, perfluorohexanesulfonate, and perfluorooctanoate in pooled human milk samples from Stockholm, Sweden. Environ. Int., 37(1):178–183.
Szostek, B., Prickett, K.B. et Buck, R.C.(2006). Determination of fluorotelomer alcohol by liquid chromatography/tandem mass spectrometry in water. Rapid Commun. Mass Spectrom., 20: 2837.
Takacs, M.L. et Abbott, B.D. (2007). Activation of mouse and human peroxisome proliferator-activated receptors (α, β/δ, γ) by perfluorooctanoic acid and perfluorooctane sulfonate. Toxicol. Sci., 95(1): 108–117.
Takagi, S., Adachi, F., Miyano, K., Koizumi, Y., Tanaka, H., Watanabe, I., Tanabe, S. et Kannan, K. (2011). Fate of perfluorooctanesulfonate and perfluorooctanoate in drinking water treatment processes. Water Res., 45( 13): 3925–3932.
Takagi,S., Adachi, F., Miyano, K., Koizumi Ya, Tanaka, H., Mimura, M., Watanabe, I., Tanabe, S. et Kannan, K. (2008). Perfluorooctanesulfonate and perfluorooctanoate in raw and treated tap water from Osaka, Japan. Chemosphere, 72: 1409–1412.
Tan, Y.M., Clewell, H.J., 3rd et Andersen, M.E. (2008). Time dependencies in perfluorooctylacids disposition in rat and monkeys: a kinetic analysis. Toxicol. Lett., 177(1): 38–47.
Tang, C.Y., Fu, Q.S., Robertson, A.P., Criddle, C.S. et Leckie, J.O. (2006). Use of reverse osmosis membranes to remove perfluorooctanesulfonate (PFOS) from semiconductor wastewater. Environ. Sci. Technol., 40: 7343–7349.
Tang, C.Y., Shiangfu, Q., Criddle, C.S. et Leckie, J.O. (2007). Effect of flux (transmembrane pressure) and membrane properties on fouling and rejection of reverse osmosis and nanofiltration membranes treating perfluorooctanesulfonate containing wastewater. Environ. Sci. Technol., 41: 2008–2014.
Tang, C., Kwon, Y-N. et Leckie, J. (2009a). Effect of membrane chemistry and coating layer on physiochemical properties of thin film composite polyamide RO and NF membranes I. FTIR and XPS characterization of polyamide and coating layer chemistry. Desalination, 242: 149–167.
Tang, C., Kwon, Y-N. et Leckie, J. (2009b). Effect of membrane chemistry and coating layer on physiochemical properties of thin film composite polyamide RO and NF membranes II. Membrane physiochemical properties and their dependence on polyamide and coating layers. Desalination, 242: 168–182.
Tang, H., Xiang, Q., Lei, M., Yan, J., Zhu, L. et Zou, J. (2012). Efficient degradation of perfluorooctanoic acid by UV–Fenton process. Chem. Eng. J., 184: 156–162.
Taniyasu, S., Kannan, K., So, M.K., Gulkowska, A., Sinclair, E., Okazawa, T. et Yamashita, N. (2005). Analysis of fluorotelomer alcohols, fluorotelomer acids, and short- and long-chain perfluorinated acids in water and biota. J. Chromatogr. A, 1093: 89–97.
Taniyasu, S., Kannan, K., Wu, Q., Kwok, K.Y., Yeung, L.W.Y., Lam, P.K.S., Chittin, B., Kida, T., Takasagu, T., Tsuchiya, Y. et Yamashita, N. (2013). Inter-laboratory trials for analysis of perfluooroocatanesulfonate and perfluorooctanoate in water samples: Performance and recommendations. Anal. Chim. Acta, 770: 111–120.
Tao, L., Kannan, K., Wong, C.M., Arcaro, K.F. et Butenhoff, J.L. (2008). Perfluorinated compounds in human milk from Massachusetts, U.S.A. Environ. Sci. Technol., 42(8): 3096–3101.
Thibodeaux, J.R., Hanson, R.G., Rogers, J.M., Grey, B.E., Barbee, B.D., Richards, J.H., Butenhoff,J.L., Stevenson, L.A. et Lau, C. (2003). Exposure to perfluorooctane sulfonate during pregnancy in rat and mouse. I: maternal and prenatal evaluations. Toxicol. Sci., 74(2): 369–381.
Thomford, P. (2002). Final report: 104 week dietary chronic toxicity and carcinogenicity study with perfluorooctane sulfonic acid potassium salt (PFOS: T-6295) in rats. Cité dans EFSA (2008), Santé Canada (2012).
Thompson, J., Lorber, M., Toms, L.M., Kato, K., Calafat, A.M. et Mueller, J.F. (2010). Use of simple pharmacokinetic modeling to characterize exposure of Australians to perfluorooctanoic acid and perfluorooctane sulfonic acid. Environ Int., 36(4): 390–397. Erratum dans : Environ Int. 36(6): 647–648.
Thompson, J., Eaglesham, G., Reungoat, J., Poussade, Y., Bartkow, M., Lawrence, M. et Mueller, J. F. (2011). Removal of PFOS, PFOA and other perfluoroalkyl acids at water reclamation plants in South East Queensland Australia. Chemosphere 82(1), 9–17.
Thomsen, C., Haug, L.S., Stigum, H., Frøshaug, M., Broadwell, S.L. et Becher, G. (2010). Changes in concentrations of perfluorinated compounds, polybrominated diphenyl ethers, and polychlorinated biphenyls in Norwegian breast-milk during twelve months of lactation. Environ. Sci. Technol.., 44(24): 9550–9556. Erratum dans : Environ. Sci. Technol.., 45(7):3192.
Tittlemier, S., Ryan, J.J. et VanOostdam, J. (2004). Presence of anionic perfluorinated organic compounds in serum collected from Northern Canadian populations. Organohalogen Compd 66: 4009–4014. [Cité dans Santé Canada (2006, 2012)].
Tittlemier, S.A., Pepper, K., Seymour, C., Moisey, J., Bronson, R., Cao, X.L. et coll. (2007). Dietary exposure of Canadians to perfluorinated carboxylates and perfluorooctane sulfonate via consumption of meat, fish, fast foods, and food items prepared in their packaging. J. Agric. Food Chem., 55(8): 3203–3210.
Toft, G., Jönsson, B.A., Lindh, C.H., Giwercman, A., Spano, M., Heederik, D. et coll. (2012). Exposure to perfluorinated compounds and human semen quality in Arctic and European populations. Hum. Reprod., 27(8): 2532–2540.
Tsai, Y., Yu-Chen Lin, A., Weng, Y. et Li, K. (2010). Treatment of perfluorinated chemicals by electro-microfiltration. Environ. Sci. Technol., 44(20): 7914–7920.
Tucker, D.K., Macon, M.B., Strynar, M.J., Dagnino, S., Andersen, E. et Fenton, S.E. (2015). The mammary gland is a sensitive pubertal target in CD-1 and C57Bl/6 mice following perinatal perfluorooctanoic acid (PFOA) exposure. Reprod. Toxicol., 54: 26–36.
Turgeon O'Brien, H., Blanchet, R., Gagné, D., Lauzière, J., Vézina, C., Vaissière, E., Ayotte, P. et Déry, S. (2012). Exposure to toxic metals and persistent organic pollutants in Inuit children attending childcare centers in Nunavik, Canada. Environ. Sci. Technol., 46(8): 4614–23. Erratum dans : Environ. Sci. Technol., 46(14): 7926.
UK COT (2006). COT statement on the tolerable daily intake for perfluorooctanoic acid. UK Committee on Toxicity of Chemicals in Food, Consumer Products and the Environment. Disponible à : www.food.gov.uk/multimedia/pdfs/cotstatementpfoa200610.pdf
UK HPA (2007). Maximum acceptable concentrations of perfluorooctane sulfonate (PFOS) and perfluorooctanoic acid (PFOA) in drinking water. Disponible à : www.hpa.org.uk/webc/HPAwebFile/HPAweb_C/1194947397222
UK HPA (2009). HPA Compendium of chemical hazards. PFOS + PFOA. Version 1.
U.S.EPA (2005). Draft risk assessment of the potential human health effects associated with exposure to perfluorooctanoic acid and its salts. Office of Pollution Prevention and Toxics Risk Assessment Division. Disponible à : www.epa.gov/oppt/pfoa/pubs/pfoarisk.html
U.S. EPA (2009a). EPA Method 537, Determination of selected perfluorinated alkyl acids in drinking water by solid phase extraction and liquid chromatography/tandem mass spectrometry (LC/MS/MS). Version 1.1. September 2009. EPA/600/R-08/092.
U.S. EPA (2009b). Provisional health advisories for perfluorooctanoic acid (PFOA) and perfluorooctane sulfonate (PFOS). 1–5. US EPA Office of Water.
U.S. EPA (2009c). The toxicity of perfluoroactanoic acid (PFOA) and of percfluorooctanate sulfonate (PFOS). Memorandum. Office of Solid Waste and Emergency Response.
U.S. EPA (2012a). Benchmark dose technical guidance. Report No. EPA/100/R-12/001. Risk Assessment Forum, U.S. Environmental Protection Agency, Washington, DC.
U.S. EPA (2012b). UCMR3 laboratory approval requirements and information document. Version 2. Technical support center. Standards and Risk Management Division. Office of Groundwater and Drinking Water. U.S. Environmental Protection Agency, Cincinnati, Ohio 45268.
U.S. EPA (2015). Benchmark dose software (BMDS) Version 2.6.0.86 [Build: 2/4/2015]. National Center for Environmental Assessment. U.S. Environmental Protection Agency, Washington, DC. Disponible à : http://bmds.epa.gov.
van Leeuwen, S. P. et de Boer, J. (2007). Extraction and clean-up strategies for the analysis of poly-and perfluoroalkyl substances in environmental and human matrices. J. Chromatogr. A, 1153(1–2):172–185.
van Leeuwen, S.P., Karrman, A., van Bevel, B., de Boer, J. et Lindstrom, G. (2006). Struggle of quality in determination of perfluorinated contaminants in environmental and human samples. Environ. Sci. Technol. 40:7854-7860.
van Leeuwen, S.P.J., Stewart, C.P., van der Veen, I. et de Boer, J., (2009). Significant improvements in the analysis of perfluorinated compounds in water and fish: Results from an interlaboratory method evaluation study. J. Chromatogr. A, 1216: 401–409.
Vanden Heuvel, J.P., Thompson, J.T., Frame, S.R. et Gillies, P.J. (2006). Differential activation of nuclear receptors by perfluorinated fatty acid analogs and natural fatty acids: a comparison of human, mouse, and rat peroxisome proliferator-activated receptor-α, -β, and –γ, liver X receptor-β, and retinoid X receptor-α. Toxicol. Sci., 92(2): 476–489.
Vecitis, C.D., Park, H., Cheng, J., Mader, B.T. et Hoffmann, M.R. (2009). Treatment technologies for aqueous perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA). Front. Environ. Sci. Engin. China 2009, 3(2): 129–151.
Vested, A., Ramlau-Hansen, C.H., Olsen, S.F., Bonde, J.P., Kristensen, S.L., Halldorsson, T.I. et coll. (2013). Associations of in utero exposure to perfluorinated alkyl acids with human semen quality and reproductive hormones in adult men. Environ. Health Perspect., 121(4): 453–458.
Vestergaard, S., Nielsen, F., Andersson, A.M., Hjøllund, N.H., Grandjean, P., Andersen, H.R. et coll. (2012). Association between perfluorinated compounds and time to pregnancy in a prospective cohort of Danish couples attempting to conceive. Hum. Reprod., 27(3): 873–880.
Villagrasa, M., deAlda, M.L. et Barcelo, D. (2006). Environmental analysis of fluorinated alkyl substances by liquid chromatography-(tandem) mass spectrometry: a review. Anal. Bioanal. Chem., 386: 953-972.
Villaverde-de-Saa, E., Fernandez-Lopez, M., Rodil, R., Quintana, J., Racamonde, I. et Cela, R. (2015). Solid phase extraction of perfluoroalkylated compounds from sea water. J. Sep. Sci. 38:1942-1950.
von Ehrenstein, O.S., Fenton, S.E., Kato, K., Kuklenyik, Z., Calafat, A.M. et Hines, E.P. (2009). Polyfluoroalkyl chemicals in the serum and milk of breastfeeding women. Reprod. Toxicol., 27(3–4):239–245.
Wambaugh, J.F., Setzer, R.W., Pitruzzello, A.M., Liu, J., Reif, D.M., Kleinstreuer, N.C., Wang, N.C., Sipes, N., Martin, M., Das, K., DeWitt, J.C., Strynar, M., Judson, R., Houck, K.A. et Lau C. (2013). Dosimetric anchoring of in vivo and in vitro studies for perfluorooctanoate and perfluorooctanesulfonate. Toxicol. Sci., 136(2): 308–327.
Wan, H.T., Zhao, Y.G., Wong, M.H., Lee, K.F., Yeung, W.S., Giesy, J.P. et coll. (2011). Testicular signaling is the potential target of perfluorooctanesulfonate-mediated subfertility in male mice. Biol. Reprod., 84(5): 1016–1023.
Wang, F., Liu, W., Jin, Y., Dai, J., Yu, W., Liu, X. et coll. (2010). Transcriptional effects of prenatal and neonatal exposure to PFOS in developing rat brain. Environ. Sci. Technol., 44(5): 1847–1853.
Wang, F., Liu, W., Jin, Y., Dai, J., Zhao, H., Xie, Q. et coll. (2011a). Interaction of PFOS and BDE-47 co-exposure on thyroid hormone levels and TH-related gene and protein expression in developing rat brains. Toxicol. Sci., 121(2): 279–291.
Wang, F., Liu, W., Ma, J., Yu, M., Jin, Y. et Dai, J. (2012). Prenatal and neonatal exposure to perfluorooctane sulfonic acid results in changes in miRNA expression profiles and synapse associated proteins in developing rat brains. Environ. Sci. Technol., 46(12): 6822–6829.
Wang, Y., Liu, W., Zhang, Q., Zhao, H. et Quan, X. (2015). Effects of developmental perfluorooctane sulfonate exposure on spatial learning and memory ability of rats and mechanism associated with synaptic plasticity. Food Chem. Toxicol., 76: 70–76.
Wang, Y., Wang, L., Liang, Y., Qiu, W., Zhang, J., Zhou, Q., et coll. (2011b). Modulation of dietary fat on the toxicological effects in thymus and spleen in BALB/c mice exposed to perfluorooctane sulfonate. Toxicol. Lett., 204(2–3): 174–182.
Warf Institute Inc. (1975). Dermal and ocular irritation of PFOS (T-1166) in rabbits. # 5011023. [Cité dans Santé Canada (2006)].
Washino, N., Saijo, Y., Sasaki, S., Kato, S., Ban, S., Konishi, K. et coll. (2009). Correlations between prenatal exposure to perfluorinated chemicals and reduced fetal growth. Environ. Health Perspect., 1117(4): 660–667.
Weiss, J.M., Andersson, P.L., Lamoree, M.H., Leonards, P.E., van Leeuwen, S.P. et Hamers, T. (2009). Competitive binding of poly- and perfluorinated compounds to the thyroid hormone transport protein transthyretin. Toxicol. Sci., 109(2): 206–216.
Weiß, O., Wiesmüller, G.A., Bunte, A., Göen, T., Schmidt, C.K., Wilhelm, M. et coll. (2012). Perfluorinated compounds in the vicinity of a fire training area—human biomonitoring among 10 persons drinking water from contaminated private wells in Cologne, Germany. Int. J. Hyg. Environ. Health, 215(2): 212–215.
Weremiuk, A. M., Gerstmann, S. et Frank, H. (2006). Quantitative determination of perfluorinated surfactants in water by LC-MS/MS. J. Sep. Sci., 29:2251–2255.
Wetzel, L.T. (1983). Rat teratology study, T-3351, final report. Hazelton Laboratories America, Inc. Project Number: 154–160, December 19, 1983. US EPA AR-226 226-0014. (also cited as Hazleton Laboratories America, Inc.). [Cité dans OCDE (2002); EFSA (2008): Santé Canada (2012)].
Whitworth, K.W., Haug, L.S., Baird, D.D., Becher, G., Hoppin, J.A., Skjaerven, R. et coll. (2012). Perfluorinated compounds and subfecundity in pregnant women. Epidemiology, 23(2): 257–63. Comment dans : Epidemiology. 23(2): 264–266.
Wilhelm, M., Kraft, M., Rauchfuss, K. et Holzer, J. (2008). Assessment and management of the first German case of a contamination with perfluorinated compounds (PFC) in the region Sauerland, North Rhine Westphalia. J. Toxicol. Environ. Health A,71(11–12): 725–733.
Williams, G.R. (2008). Neurodevelopmental and neurophysiological actions of thyroid hormone. J. Neuroendocrinol., 20: 784–794.
Wolf, S. et Reagen, W. (2011). Method for the determination of perfluotrinated compounds (PFCs) in water by solid-phase extraction and liquid chromatography/tandem mass spectrometry (LC/MS/MS). Anal. Methods, 3:1485–1493.
Xia, W., Wan, Y., Li, Y.Y., Zeng, H., Lv, Z., Li, G. et coll. (2011). PFOS prenatal exposure induce mitochondrial injury and gene expression change in hearts of weaned SD rats. Toxicology, 282(1–2): 23–29.
Xiao, F., Davidsavor, K.J., Park, S., Nakayama, M. et Phillips, B.R. (2012). Batch and column study: sorption of perfluorinated surfactants from water and co-solvent systems by Amberlite XAD resins. J. Colloid Interface Sci., 368: 505–511.
Xiao, F., Simcik, M.F. et Gulliver, J.S. (2013). Mechanisms for removal of perfluorooctanesulfonate (PFOS) and perfluorooctanoate (PFOA) from drinking water by conventional and enhanced coagulation. Water Res., 47: 49–56.
Yahia, D., Tsukuba, C., Yoshida, M., Sato, I. et Tsuda, S. (2008). Neonatal death of mice treated with perfluorooctane sulfonate. J. Toxicol. Sci., 33(2): 219–226.
Yamashita, N., Kannan, K., Taniyasu, S., Horii, Y., Okazawa, T., Petrick, C. et Gamo, T. (2004). Analysis of perflulorinated acids at parts per quadrillion levels in seawater using liquid chromatograph tandem mass spectrometry. Environ. Sci. Technol. 38: 5522–5528.
Ye, L., Zhao, B., Yuan, K., Chu, Y., Li, C., Zhao, C. et coll. (2012). Gene expression profiling in fetal rat lung during gestational perfluorooctane sulfonate exposure. Toxicol. Lett., 209(3): 270–276.
Yu, Q., Deng, S. et Yu, G. (2008). Selective removal of perfluorooctanesulfonate from aqueous solution using chitosan-based molecularly imprinted polymer adsorbents. Water Res.,.42(12): 3089–3097.
Yu, W.G., Liu, W. et Jin, Y.H. (2009a). Effects of perfluorooctane sulfonate on rat thyroid hormone biosynthesis and metabolism. Environ. Toxicol. Chem., 28(5): 990–996.
Yu, W.G., Liu, W., Jin, Y.H., Liu, X.H., Wang, F.Q., Liu, L. et coll. (2009b). Prenatal and postnatal impact of perfluorooctane sulfonate (PFOS) on rat development: a cross-foster study on chemical burden and thyroid hormone system. Environ. Sci. Technol., 43(21): 8416–8422.
Yu, W.G., Liu, W., Liu, L. et Jin, Y.H. (2011). Perfluorooctane sulfonate increased hepatic expression of OAPT2 and MRP2 in rats. Arch. Toxicol., 85(6): 613–521.
Yu, Q., Zhang, R., Deng, S., Huanga, J. et Yu, G. (2009). Sorption of perfluorooctane sulfonate and perfluorooctanoate on activated carbons and resin: Kinetic and isotherm study. Water Res., 43(4): 1150–1158.
Zainuddin, K., Zakaria, M. P., Al-Odaini, N., Bakhtiari, A.R et Latif, P.A.,(2012). Perfluorooctanoic acid (PFOA) and perfluorooctan sulfonate (PFOS) in surface water from the Langat river, Peninsular Malaysia. Environ. Forensic, 13:82–92.
Zeng, H.C., Li, Y.Y., Zhang, L., Wang, Y.J., Chen, J., Xia, W. et coll. (2011b). Prenatal exposure to perfluorooctanesulfonate in rat resulted in long-lasting changes of expression of synapsins and synaptophysin. Synapse, 65(3): 225–233.
Zeng, H.C., Zhang, L., Li, Y.Y., Wang, Y.J., Xia, W., Lin, Y. et coll. (2011a). Inflammation-like glial response in rat brain induced by prenatal PFOS exposure. Neurotoxicology, 32(1): 130–139.
Zhang, Y.H., Wang, J., Dong, G.H., Liu, M.M., Wang, D., Zheng, L. et coll. (2013). Mechanism of perfluorooctanesulfonate (PFOS)-induced apoptosis in the immunocyte. J. Immunotoxicol., 10(1): 49–58.
Zhao, L-M., Shi, L-E., Zhang, J-L., Chen, J-M., Shi, D-D., Yang, J. et Tang, Z-X. (2011). Preparation and application of chitosan nanoparticles and nanofibers. Braz. J. Chem. Eng., 28(3):353.
Zheng, L., Dong, G.H., Jin, Y.H. et He, Q.C. (2009). Immunotoxic changes associated with a 7-day oral exposure to perfluorooctanesulfonate (PFOS) in adult male C57BL/6 mice. Arch. Toxicol., 83(7): 679–689.
Zheng, L., Dong, G.H., Zhang, Y.H., Liang, Z.F., Jin, Y.H. et He, Q.C. (2011). Type 1 and Type 2 cytokines imbalance in adult male C57BL/6 mice following a 7-day oral exposure to perfluorooctanesulfonate (PFOS). J. Immunotoxicol, 8(1): 30–38.
Annexe A : Élimination du SPFO dans les usines de traitement d'eau potable de pleine grandeur – données rapportées
| Source d'eau | Chaîne de traitementNote de bas de page 1 | Concentration dans l'influentNote de bas de page 2 (ng/L) | Concentration dand l'eau traitée2 (ng/L) | % d'élimination du SPFO | Référence |
|---|---|---|---|---|---|
| Eau souterraine | DBF, UV, Cl2 | 10 | 9,4 | 6 | Quinones et Snyder, 2009 |
| Eau de surface | O3, COA/FLOC, DBF, Cl2 | 1,4 | 1,4 | 0 | Quinones et Snyder, 2009 |
| Eau de surface | PAC, CHLM, DBF | 1,7 | 1.9 | -12 | Quinones et Snyder, 2009 |
| Eau de surface | Cl2, COA/FLOC, DBF, UV | 22 | 22 | 0 | Quinones et Snyder, 2009 |
| Installation de réutilisation indirecte à titre d'eau potable | MF/OI, UV/H2O2, BF | 41 | ND | 100 | Quinones et Snyder, 2009 |
| Installation de réutilisation indirecte à titre d'eau potable | Cl2, DL, BF | 29 | 57 | -97 | Quinones et Snyder, 2009 |
| Eau fluviale | FRS, O3, CAG, Cl2 | 1,0 (été) | 0,93 (été) | 7 | Takagi et coll., 2008 |
| Eau fluviale | FRS, O3, CAG, Cl2 | 0,87 (été) 3,2 (hiver) |
2,8 (été) 1,6 (hiver) |
-222 (été) 50 (hiver) |
Takagi et coll., 2008 |
| Eau fluviale | FRS, O3, CAG, Cl2 | Takagi et coll., 2008 | |||
| Eau de lac | FRS, CAG, Cl2 | 4,6 (été) 4,5 (hiver) |
0,16 (été) <0,1 (hiver) |
97 (été) >98 (hiver) |
Takagi et coll., 2008 |
| Eau fluviale, de lac, souterraine (7 usines) | FRS, Cl2 | 0,56 – 22 (été) 0,54 – 4.2 (hiver) |
0,45 – 22 (été) 0,37 – 4.5 (hiver) |
20 – 0 (été) 31 à -7 (hiver) |
Takagi et coll., 2008 |
| Eau fluviale | Membranes, Cl2 | 0,37 (été) 0,26 (hiver) |
0,29 (été) 0,20 (hiver) |
22 (été) 23 (hiver) |
Takagi et coll., 2008 |
| Eau de lac | FLS, Cl2 | 2,7 (été) 1,8 (hiver) |
2.3 (été) 1,9 (hiver) |
15 (été) -6 (hiver) |
Takagi et coll., 2008 |
| Eau fluviale | COA/FLOC/SED, FS, O3, CAG, Cl2 | 1,3 (été) 3,3 (hiver) |
3,7 (été) 1,3 (hiver) |
-185 (été) 60 (hiver) |
Takagi et coll., 2011 |
| Eau fluviale | COA/FLOC/SED, FS, O3, CAG, Cl2 | 1,6 (été) 3,3 (hiver) |
2,3 (été) 1,7 (hiver) |
44 (été) 48 (hiver) |
Takagi et coll., 2011 |
| Eau fluviale | COA/FLOC/SED, FS, O3, CAG, Cl2 | 1,2 (été) 2,8 (hiver) |
1,6 (été) 1,9 (hiver) |
-33 (été) 32 (hiver) |
Takagi et coll., 2011 |
| Eau fluviale | SED, O3, CAG, Cl2, FS | 1.4 (été) 3,3 (hiver) |
2,2 (été) 2,0 (hiver) |
-57 (été) 39 (hiver) |
Takagi et coll., 2011 |
| Eau de lac | COA/FLOC/SED, FS, CAG (réactivé), Cl2 | 4,4 (été) 4,1 (hiver) |
<0,5 (été) <0,5 (hiver) |
>89 (été) >88 (hiver) |
Takagi et coll., 2011 |
| Eau souterraine | UF, Cl2 | 16 | 16 | 0 | Atkinson et coll., 2008 |
| Eau souterraine | CAG (pas en activité), super chloration et déchloration | 135 | 130 | 3 | Atkinson et coll., 2008 |
| Eau souterraine | CAG (2 chaînes des CAG parallèles comportant chacune 6 fûts; les contacteurs sont matures et agissent comme des contacteurs biologiques; n'ont pas été regénérés pendant quelques années), Cl2 | 42 | 45 | -7 | Atkinson et coll., 2008 |
| Eau souterraine et de surface (60:40) | FLS, O3, CAG (6 fûts-aucune regénération pendant plusieurs années), Cl2 à l'aide de NaOCl- | 20, 6 | 25 | -21 | Atkinson et coll., 2008 |
| Eau souterraine | Cl2 à l'aide de NaOCl | Atkinson et coll., 2008 | |||
| Eau fluviale | COA/FLOC/SED, O3, CAG, FRS | 5,3 (août) 5,8 (oct.) |
9,4 (août) 6,4 (oct.) |
-77 (août) -10 (oct.) |
Shivakoti et coll., 2010) |
| Eau fluviale | COA/FLOC/SED, O3, CAG, FRS | 5,8 (août) 8,8 (oct.) |
3,9 (août) 4,2 (oct.) |
33 (août) 53 (oct.) |
Shivakoti et coll., 2010) |
| Eaux usées traitées | Dénitrification, pre-O3, COA/FLOC/SED, FAD, O3, CAG (agit comme un disque biologique), O3 | 2,2 (oct.) 3,7 (nov.) 3,6 (nov.) |
<NR (0,3) (oct.) 0,6 (nov.) 0,7 (nov.) |
100 (oct.) 84 (nov.) 81 (nov.) |
Thompson et coll., 2011 b |
| Eau fluviale | COA/FLOC/SED, FRS, Cl2 | 5,02 | 0,73 | 85 | Kunacheva et coll., 2010) |
| Eaux usées traitées | Clarificateur/ décanteur laminaire (FeCl3&(NH4)2SO4, ajout de NaOCl), UF, OI, UV+H2O2, stabilisation/ désinfection (ajout de chaux, CO2, NaOCl) |
38 39 23 | <NR (0,5) ND <NR (0,2) | 100 100 100 | Thompson et coll., 2011 |
| Eau fluviale | COA/FLOC, FRS, O3, CAG, FLS | 8,2 | <0,23 | <97 | Eschauzer et coll., 2012 |
| Eau fluviale | Cl2, COA/FLOC, FRS, O3, CAG | 116 | 33 | 69 | Flores et coll., 2013 |
| Eau fluviale | Cl2, COA/FLOC, FRS, O3, CAG, UF, OI | 86 | 13 | 86 | Flores et coll., 2013 |
Annexe B : Liste des acronymes
- AFFF
- mousses à formation de pellicule aqueuse
- ALT
- alanine transaminase
- APFA
- acide perfluoroalkylique
- APFC
- acides perfluorocarboxyliques à longue chaîne
- APFO
- acide perfluorooctanoïque
- AQT
- apport quotidien tolérable
- BMD
- dose de référence
- BMDL
- limite de confiance inférieure de la dose de référence
- BMDL 10
- limite inférieure de l'intervalle de confiance de 95 % de la dose repère pour une incidence accrue de 10 %
- CAG
- charbon actif en grains
- CAP
- charbon activé en poudre
- CAS
- Chemical Abstracts Service
- CHLP
- chromatographie liquide à haute performance
- CMA
- concentration maximale acceptable
- CPL
- chromatographie en phase liquide
- EAT
- étude sur l'alimentation totale
- ELL
- extraction liquide-liquide
- EPS
- extraction en phase solide
- ESI
- ionisation par électronébulisation
- FASC
- facteur d'ajustement propre aux substances chimiques
- IC
- intervalle de confiance
- ID
- injection directe
- JG
- jour de gestation
- JPN
- jour postnatal
- LD
- limite de détection
- LDM
- limite de détection de la méthode
- LOAEL
- dose minimale avec effet nocif observé
- MA
- mode d'action
- MG
- moyenne géométrique
- mgd
- millions de gallons par jour
- MON
- matière organique naturelle
- NF
- nanofiltration
- NOAEL
- dose sans effet nocif observé
- OI
- osmose inverse
- PBPK
- modèle pharmacocinétique à base physiologique
- PDD
- point de départ
- PDD EQH
- points de départ équivalents chez l'humain
- PEFT
- polytétrafluoréthylène
- SPFA
- substances perfluoroalkyliques
- PTFE
- polytétrafluoréthylène
- SM/SM
- spectrométrie de masse en tandem
- SMNR
- seuil minimal de niveau à rapporter
- SPFO
- sulfonate de perfluorooctane
- TCFV
- temps de contact en fût vide
- UCMR3
- Third Unregulated Contaminant Monitoring Rule (É.U.)
- VBS
- valeur basée sur la santé
- VL
- volume de lit
Annexe C : Répercussions prévues par province et territoire
Veuillez noter que l'information suivante n'est pas dans les deux langues officielles puisque la source de l'information n'est pas assujettie à la Loi sur les langues officielles.
Île-du-Prince-Édouard
No impact paragraph has been provided by the province.
Terre-Neuve-et-Labrador
Newfoundland and Labrador has not conducted monitoring for PFOS. Of the 305 surface water sources in the province, 258 (85%) are protected under the Water Resources Act. Of the 198 groundwater sources in the province, 59 (30%) are protected under the Water Resources Act. This provides for an extensive source water protection program that reduces the risk of contamination for drinking water sources.
As noted in the Technical Document, PFOS does not naturally occur in the environment and would only be relevant to areas that are subjected to industrial activities. The main cause for concern in NL would be the short-term use of fire-fighting foams for either property or forest fires.
The majority of Newfoundland and Labrador's drinking water systems do not have any treatment other than disinfection as 68% of the systems service very small populations (less than 500 people). Due to this fact, the ability for the majority of communities to treat for PFOS contamination would be limited. The cost would have to be assessed on a case by case basis but the risk of PFOS formation would be low to the protection of public water supplies.
The province will consider monitoring for PFOS if/when fire-fighting foams are utilized in public drinking water supply areas and is deemed relevant and if/when fire-fighting foams are utilized in single-dwelling homes on private wells when deemed relevant.
Nouvelle-Écosse
No impact paragraph has been provided by the province.
Nouveau-Brunswick
PFOS is not monitored in New Brunswick and it is not anticipated that this Guideline would have any impact on regulated drinking water facilities. However, we would have to consult with stakeholders to determine if source water characterization would be necessary and the associated impacts related to costs and the availability of analytical testing. If it was found in source waters this could result in an impact to that facility in terms of additional monitoring or treatment requirements.
Québec
Au Québec, étant donné que le PFOS ne fait pas l'objet d'une norme au Règlement sur la qualité de l'eau potable, les résultats disponibles découlent des campagnes d'échantillonnage réalisées par le Ministère dans le cadre Programme de surveillance de la qualité de l'eau potable.
Les résultats disponibles indiquent de très faibles concentrations mesurées de ce paramètre, très en-deçà de la CMA proposée. Plus précisément, en 2007 et 2008, 84 analyses de PFOS ont été réalisées à l'eau traitée de 7 installations de production d'eau potable alimentées en eau de surface. Ces installations avaient été sélectionnées puisqu'elles étaient localisées à des endroits où l'on était susceptible de détecter ces substances (ex. : villes d'importance en amont, présence d'industries de textiles). Les résultats indiquent que 52 % des échantillons prélevés ont présenté un résultat supérieur à la limite de détection et le PFOS a été détecté dans 86 % des installations échantillonnées. La concentration maximale mesurée était de 0,012 µg/L, ce qui est bien inférieur à la CMA proposée de 0,6 µg/L.
Considérant les résultats d'analyse disponibles, les impacts attendus de l'ajout d'une norme pour le PFOS à la réglementation, en fonction de la recommandation publiée par Santé Canada, seraient faibles.
Ontario
No impact paragraph has been provided by the province.
Manitoba
No impact paragraph has been provided by the province.
Saskatchewan
The Water Security Agency (WSA) has reviewed the proposed guideline document for perfluorooctane sulfonate (PFOS) in drinking water and agrees with the proposed MAC of 0.6 micrograms/L for PFOS in drinking water. A review of exposure data in drinking water/surface water in our database showed that there is no data for this compound in raw/treated water of the municipalities regulated by the WSA. Although, PFOS does not occur naturally in the environment and since its use is limited only to specialized applications, as noted in the guidelines Canadians can be exposed to PFOS in food, consumer products, dust and drinking water. The WSA notes that there are many challenges in analyzing for PFOS including the need for selection of an appropriate analytical method, appropriate analytical QA/QC measures, potentially high analytical cost, and no routine analytical laboratory capacity in Saskatchewan for PFOS, although some specialized research facilities with analytical capability does exist within the province. Since research has shown that treatment systems such as GAC filtration systems, membrane filtration systems are promising and effective in removing PFOS (some studies showed that the removal efficiency ranged between 95% and 99% for GAC and membrane systems) from drinking water, and since these types of treatment systems are in existence or are increasingly being adopted by the water treatment plants (WTPs) in the province, the WSA believes and expects that the new drinking water standard for PFOS can be achieved. Cost to some waterworks owners in the province where appropriate treatment technology does not already exist is anticipated if the guideline is adopted as a standard in Saskatchewan. Before adoption of a drinking water standard for PFOS in the province, local data collection is needed to fully assess the impact on waterworks in the province.
Alberta
No impact paragraph has been provided by the province.
Colombie-Britannique
No impact paragraph has been provided by the province.
Yukon
It is not anticipated that the proposed Guideline Technical Document for PFOS for consultation will have a significant impact on Yukon large public drinking water systems.
Territoires du Nord-Ouest
No impact paragraph has been provided by the territory.
Nunavut
No impact paragraph has been provided by the territory.