ARCHIVÉE - Résumé : atelier consultatif sur les noms de produits de santé à présentation et à consonance semblables (PSPCS)
Date 2003-10-20
Contact Division de la politique et de la promotion
Un atelier consultatif sur les noms de produits de santé à présentation et à consonance semblables (PSPCS) s'est tenu les 20 et 21 octobre 2003, auquel ont participé 38 intervenants représentant différents secteurs, soit les associations de l'industrie, le gouvernement, les professionnels de la santé et les organismes nongouvernementaux, y compris les groupes de défense des patients et des consommateurs.
Les objectifs de cet atelier étaient les suivants :
- informer et sensibiliser les parties intéressés et concernées au sujet des noms de PSPCS et du processus actuel d'élaboration de politiques;
- s'assurer que les questions déterminées soient précises et complètes;
- offrir la possibilité aux parties intéressées et concernées de formuler des commentaires à propos des options stratégiques et des recommandations proposées;
- manifester un engagement continu envers l'établissement de relations avec les parties concernées.
Après le discours d'ouverture de Mme Diane Gorman (sous-ministre adjointe, Direction générale des produits de santé et des aliments) et le mot de bienvenue de Mme Julia Hill (directrice générale, Direction des produits biologiques et des thérapies génétiques), les présentations cidessous ont eu lieu au cours des deux journées.
- Les noms de produits de santé à présentation et à consonance semblables (PSPCS) : Établir des points de vue communs
Michèle Chadwick, Direction des produits biologiques et des thérapies génétiques, Direction générale des produits de santé et des aliments, Santé Canada. - Évaluation de la domination spéciale par la Food and Drug Administration (FDA)
Capitaine Thomas Phillips, Office of Drug Safety, Centre for Drug Evaluation and Research, FDA, États-Unis - Les noms de produits de santé à présentation et à consonance semblables (PSPCS) : Élaboration d'une politique globale
Michèle Chadwick, Direction des produits biologiques et des thérapies génétiques, Direction générale des produits de santé et des aliments, Santé Canada. - Analyse décisionnelle de la détermination du nom des médicaments assistée par ordinateur
Dr Bruce L. Lambert, Département de gestion pharmaceutique, Département de pharmacie, University of Illinois et University of Chicago - Détection automatiques des noms de médicaments pouvant porter à confusion
Dr Greg Kondrak, Département des sciences informatiques, University of Alberta - Système d'analyse informatique phonétique et orthographique
Dr Rick Shangraw, la Project Performance Corporation - Le processus d'examen des noms selon la Med-E.R.R.S.
Susan M. Proulx, Ph.D. pharm, Med-E.R.R.S. - Le Risk MonitorProTM et les erreurs liées aux présentations et aux consonances semblables
Jerry Seibert, rL Solutions
Veuillez consulter les présentations PowerPoint affichées dans ce site Web pour de plus amples renseignements au sujet de ces présentations.
Pour tenter de s'assurer que la détermination des questions était précise et complète et pour donner la possibilité aux intervenants de formuler des commentaires au sujet des options stratégiques et des recommandations proposées, de nombreuses questions ont été posées aux intervenants. (annexe A)
Les commentaires formulés lors de cette consultation et ceux du Comité consultatif sur la gestion de la Direction des produits thérapeutiques (DPT) seront examinés ainsi que les commentaires reçus concernant l'ébauche du résumé analytique de la question des PSPCS, qui ont été affichées dans le site Web de la Direction des produits biologiques et des thérapies génétiques (DPBTG). Les résultats de ces consultations seront considérés comme faisant partie des orientations recommandées par les cadres supérieurs de la Direction générale des produits de santé et des aliments lors de leur discussion et de leur prise de décision.
La question
L'énoncé du problème proposé
- Les produits de santé à présentation et à consonance semblables (PSPCS) désignent les noms de différents produits de santé qui ont des similitudes orthographiques ou une phonétique semblable. Ces similitudes peuvent constituer un risque pour la santé en contribuant aux erreurs médicales lors de la prescription, du dosage ou de l'administration d'un produit.
- Ces erreurs de médication pourraient être plus susceptibles de survenir en raison de facteurs contributifs tels que des posologies identiques, des formes dosifiées ou des voies d'administration, un emballage ou un étiquetage similaires, une connaissance imparfaite des noms de médicaments, une écriture illisible, une erreur verbale lors de la commande, et même un manque de connaissance de base pertinente.
- Un problème précis de sécurité, relativement à la possibilité de confusion entre deux produits biologiques approuvés ainsi que les problèmes irrésolues liées aux PSPCS, a incité la Direction des produits biologiques et des thérapies génétiques à demander un examen et l'analyse des enjeux liés aux produits de santé et la recommandation de mesures appropriées.
L'autre énoncé de problème
- Les produits de santé à présentation et à consonance semblables (PSPCS) désignent les noms de différents produits de santé qui ont des similitudes orthographiques ou une phonétique semblable (c.-à-d. semblables lorsqu'ils sont écris ou parlés).
- Ces similitudes peuvent constituer un risque pour la santé en contribuant aux erreurs médicales lors de la prescription, du dosage ou de l'administration du produit.
- Ces erreurs de médication pourraient être plus susceptibles de survenir en raison de facteurs contributifs liés aux produits de santé eux-mêmes ou à des erreurs médicales de système.
Questions
-
- Selon votre expérience, et selon l'énoncé de problème tel qu'il est présentement rédigé, quelles sont les éléments auxquels vous apportiez des modifications en vue d'améliorer sa clarté et sa précision? Avez-vous l'impression qu'il manque certains détails?
- Selon votre expérience, et en vous basant sur l'autre énoncé de problème tel qu'il est rédigé, quelles sont les éléments auxquels vous apportiez des modifications en vue d'améliorer sa clarté et sa précision? Avez-vous l'impression qu'il manque certains détails?
- La portée de la question proposée touchent les éléments suivants :
- les marques nominatives similaires
- les ressemblances entre les marques nominatives et les noms génériques
- élargissement des gammes de produits.
Selon votre point de vue, est-ce que cela comprend la majorité des erreurs liées aux produits à présentation et à consonance semblables? Quels sont les exemples d'erreurs liées aux produits à présentation et à consonance semblables qui vous viennent à l'esprit lorsque vous réfléchissez à cette question?
- Selon vous, quelle serait l'importance à accorder (1 est égal à la plus haute priorité) à la mise en oeuvre du projet des noms de PSPCS, parmi les produits suivants (présentement en ordre alphabétique) :
- matériels médicaux,
- produits de santé naturels,
- médicaments en vente libre à usage humain,
- médicaments d'ordonnance à usage humain,
- médicaments à usage vétérinaire.
Veuillez expliquer pourquoi vous avez établi les priorités de cette façon?
- Santé Canada a mis au point des critères d'évaluation pour vous aider à choisir les recommandations. Veuillez consulter cette liste (Résumé analytique de la question des médicaments à présentation et à consonance semblables, p. 19) Est-ce qu'il y a d'autres critères dont il faudrait tenir compte?
- Quelles sont les recommandations que vous préférez (Résumé analytique de la question des médicaments à présentation et à consonance semblables, p. 25)? Qu'est-ce que vous aimez le moins? Selon vous, est-ce qu'il y a une autre recommandation dont il faudrait tenir compte?
- Après avoir examiné les mesures que Santé Canada pourrait prendre avant et après la mise en marché pour aborder les questions des noms de PSPCS, quelles recommandations feriez-vous? Veuillez inscrire Oui à côté des éléments que vous appuyez, inscrire Non à côté des éléments que vous n'appuyer pas et Peut-être à côté des éléments sur lesquels vous aimeriez avoir plus de discussions. Si vous avez inscris Non ou Peut-être, veuillez expliquer pourquoi cela n'est pas le plan d'action le plus pertinent.
Précommercialisation
Politique de Santé Canada
Entreprise ou promoteur fournit une analyse de noms
Entreprise ou promoteur fournit une liste classée par ordre de priorités
Sélection d'application informatique complexe
Examen des noms par Santé Canada
Comité d'examen des noms de Santé Canada
Postcommercialisation
Politique de Santé Canada
Surveillance
Promotion des PSPCS connus
Noms de produits de santé à présentation et à consonance semblables : Dégager une compréhension commune
Date 2003-10-20
Contact Division de la politique et de la promotion
Le 20 octobre 2003
Michèle Chadwick
Division de la politique et de la promotion
Centre des politiques et des affaires réglementaires
Direction des produits biologiques et des thérapies génétiques
Objectifs de la première journée
- Informer et éduquer les parties intéressées et concernées à l'égard des noms de produits de santé à présentation et à consonance semblables et du processus actuel d'élaboration de politiques
- S'assurer de l'exactitude et de l'exhaustivité des problèmes déterminés
Erreurs causées par les médicaments à présentation et à consonance semblables
- La recherche a permis de déterminer que 29 p. 100 des erreurs de délivrance des médicaments à la pharmacie sont causées par la mauvaise identification des médicaments en raison des noms des médicaments à présentation et à consonance semblables.
- Les noms de médicaments qui portent à confusion sont responsables de 10 000 incidents chaque année aux États-Unis.
- Plus de 770 000 personnes subissent les préjudices d'une erreur liée aux médicaments, à raison de 177 milliards de dollars par année.
Premier exemple
- Confusion entre Seroquel et Serzone
- Des ordonnances verbales et écrites ont été mal interprétées, étiquetées ou exécutées à cause de la ressemblance entre les noms
- Certains éléments ont contribué à ces erreurs :
- Points communs entre les teneurs (100 mg et 200 mg)
- Espacement des doses (b.i.d.)
- Entreposage des produits près l'un de l'autre dans les pharmacies
- Trois patients ont été hospitalisés et quatre ont dû se rendre à l'urgence
- Une femme de 25 ans a fait de la fièvre et un arrêt respiratoire après avoir pris du Seroquel pendant trois jours au lieu du Serzone et est décédée.
Deuxième exemple
- Lisa, une Montréalaise de 40 ans atteinte du trouble bipolaire
- Prescription de Lamisil au lieu de Lamictal
- Élément ayant contribué à l'erreur :
- Apparence du médicament (comprimé rond et blanc)
- Manque d'efficacité
Troisième exemple
- Prescription de Vincristine au lieu de Vinblastine
- Élément ayant contribué à l'erreur :
- Les deux médicaments sont contre le cancer
- Décès par suite d'une surdose (plusieurs cas)
Autres exemples
- Primaxin I.V. et Primacor
- (décès)
- Taxotere et Taxol
- décès)
- Lamictal et Lamisil
- (hospitalisation)
- Serzone et Seroquel
- (incident antipsychotique)
- Tobradex et Tobrex
- (glaucome)
Les noms de produits à présentation et à consonance semblables qui sont la source d'erreurs ne se limitent pas aux médicaments
- Diovan (valsartan) et Diavan (remède à base de plantes médicinales contre le diabète)
- Essai laboratoire (anti-facteur Xa connu sous le nom de Anti-Xa) et Arixtra (inhibiteur spécifique du facteur Xa)
- Lamisil (chlorhydrate de terbinafine) et le matériel médical Limicel (dilatateur cervical osmotique)
Membres du GT de la DGPSA Membres du GT de la DGPSA produits à présentation et à consonance semblables
- Gloria Mah Cawthorn, CEPBR, DPBTG
- Julie Clare, DGP, CPAR, DPBTG
- Basanti Ghosh, DGP, CPAR, DPBTG
- Michèle Chadwick. DPP, CPAR, DPBTG (présidence)
- Ruth Hansson, DPP, CPAR, DPBTG (secrétariat)
- Supriya Sharma, DPSC
- Bill Leslie, DPSC
- Micheline Ho, DIP, BCMP, DPT
- Marilyn Schwartz, DPPR, BSO, DPT
- Michael Wood, DPPR, BSO, DPT
- Stephanie Pereira, DPSN
- Kerry Reinhard, DPSN
- Vicky Butz, DMV, DGPSA
- Michelle L. Boudreau, Services juridiques
- Catherine Yen, Inspectorat de la DGPSA
- Julie Desrosiers, Direction générale de la politique de la santé et des communications
Plan d'action relatif aux noms de produits à présentation et à consonance semblables
Étape I
- Constituer un GT, élaborer une ébauche de mandat, définir le problème et l'étendue, rédaction d'un document sur la détermination du problème
Étape II
- Élaborer un plan d'action, obtenir l'approbation du plan d'action, faire l'ébauche d'un plan de révision ou d'évaluation du processus des politiques, faire l'ébauche d'un plan de participation du public (PPP), analyser le problème, déterminer les options potentielles, faire l'ébauche d'un résumé analytique, mettre à exécution les étapes I et II du PPP, choisir une stratégie, élaborer une étude de faisabilité (options informatisées) et DP
Étape III
- Élaborer une stratégie de mise en oeuvre, mettre à exécution l'étape III du PPP et effectuer un rapport d'évaluation
Énoncé du problème (ébauche)
- Les noms de produits de santé à présentation et à consonance semblables désignent les produits de santé dont les noms ont une orthographe ou une phonétique semblable
- Ces similarités peuvent représenter un risque pour la santé en contribuant à des erreurs médicales liées à la prescription, à la délivrance ou à l'administration d'un produit.
- Ces erreurs liées aux médicaments peuvent vraisemblablement survenir plus souvent en raison de facteurs contributifs tels que les doses identiques, les formes posologiques ou les voies d'administration, l'étiquetage ou l'emballage semblables, la connaissance incomplète des noms des médicaments, l'écriture illisible, les erreurs d'ordres verbales, voire le défaut d'une base de connaissances appropriée.
Processus actuel
- Au cas par cas
- Aucun processus conséquent ou officiel en place pour examiner les noms des produits de santé à présentation et à consonance semblables
- Les systèmes informatiques actuels ne sont pas programmés pour mettre en évidence les noms identiques ou semblables
- Subjectivité
- Perception du pouvoir sujet à caution (Peut-on avoir recours à la Loi sur les aliments et drogues en appui d'une demande de modification de nom?)
- Les promoteurs sont encouragés à tenir compte de la possibilité de modifier le nom de leur produit lorsqu'un médicament dont le nom est semblable au nom de leur produit est identifié (la réussite n'est pas totale)
Loi et règlement (avant la mise en marché)
- L'article C.08.002 et l'article C.01.014.1 du Règlement sur les aliments et drogues stipulent que le nom de la drogue doit être fourni dans la présentation de la drogue dans le cadre des renseignements exigés pour évaluer l'innocuité et l'efficacité d'un produit.
- Ces articles permettent à la DGPSA de fixer une exigence pour que le nom ne porte pas à confusion avec un autre nom.
- Si la DGPSA considère qu'une confusion pourrait vraisemblablement entraîner des problèmes de sécurité, elle n'est pas tenue d'émettre un DIN (drogues existantes et nouvelles drogues) et un avis de conformité (AC) (nouvelles drogues seulement).
Loi et règlement (après la mise en marché)
- L'article C.01.013 du Règlement sur les aliments et drogues permet au Directeur de demander au fabricant de lui fournir, à ou avant une date donnée, des preuves suffisantes servant à établir l'innocuité d'une drogue lorsqu'elle est utilisée dans les conditions d'emploi recommandées et son efficacité pour les indications recommandées.
- Lorsque les preuves ne sont pas fournies ou sont insuffisantes, le Directeur peut, en avisant le fabricant, ordonner au fabricant la suspension de la vente de ladite drogue.
Risques d'inaction
- La morbidité et la mortalité chez les Canadiens et les Canadiennes causées par les erreurs liées aux médicaments
- Le risque de perdre la confiance du public
- Si les décisions sont prises de manière incompatible, la DGPSA risque de s'exposer à une contestation judiciaire fondée sur l'arbitraire au moment où elle voudra agir conformément à son mandat.
- Le risque potentiel de la DGPSA d'être reconnue responsable pour l'omission de s'acquitter de ses responsabilités aux termes de son mandat si des bénéficiaires du programme sont victimes de morbidité ou de mortalité en raison d'erreurs liées aux médicaments.
Objectifs
- Un processus conséquent et officiel doit être mis en place au sein de la DGPSA pour qu'elle puisse réagir efficacement au problème des noms de produits de santé à présentation et à consonance semblables. Des processus avant et après la mise en marché doivent être élaborés pour que la DGPSA puisse réagir aux problèmes de noms à l'égard des médicaments brevetés dont les noms sont semblables, des produits brevetés dont les noms sont semblables aux noms des produits génériques et des ajouts aux gammes de produits.
Domaine du GT
Priorités
- Les similarités dans les noms des produits brevetés, y compris le problème secondaire de l'utilisation d'abréviations dans les noms de produits brevetés
- Les noms de produits brevetés qui sont semblables à ceux des produits génériques
- Les ajouts aux gammes de produits, y compris le problème secondaire de la commercialisation des produits ayant le même nom que celui du produit breveté, mais des ingrédients actifs différents
Priorités moindres
- Noms de produits génériques semblables - mesures préventives seulement (c.-à-d. changements d'étiquetage)
- Problème secondaire de noms de produits brevetés semblables - création de noms de produits brevetés avec l'ajout d'abréviations de la société (APO)
N'est pas du domaine du groupe de travail
- Similarités dans l'étiquetage ou l'emballage
N'est pas un problème
- Noms des produits brevetés différents pour le même ingrédient actif dans la même société
Établissement des priorités à l'égard des noms de produits à présentation et à consonance semblables
- médicaments sur ordonnance
- médicaments en vente libre
- produits de santé naturels, médicaments à usage vétérinaire et matériels médicaux
Évaluation des noms de marques à la FDA
Date 2003-10-20
Contact Division de la politique et de la promotion
Jerry Phillips, RPh
Directeur associé de la Medication Error Prevention
Office of Drug Safety
Le 20 octobre 2003
Qu'est ce qu'une erreur de médication?
- Tout événement ÉVITABLE qui peut causer ou entraîner une utilisation inappropriée d'un médicament ou un préjudice à un malade, pendant que le médicament est sous le contrôle d'un professionnel de la santé, du patient ou du consommateur.
- La FDA se penche particulièrement sur les erreurs de médication liées à l'utilisation sécuritaire d'un produit pharmaceutique. Cela comprend la dénomination, l'étiquetage et/ou l'emballage d'un produit pharmaceutique.
Qu'est-ce qu'un nom de marque?
- Un nom qui est la propriété d'une entreprise ou d'une personne et qui est utilisé pour décrire la marque d'un produit particulier.
- Aussi connu sous l'appellation «marque nominale» ou «marque de commerce»
Quelle est la sévérité du problème lié aux noms?

- 700 paires de noms (noms de marques déposées et génériques) ont été soulignées à la USP et à la FDA concernant des confusions entre des produits à présentation et apparence semblables
- 25 000 erreurs de médication reçues par la FDA
- 12,5 % des erreurs sont liées aux noms
Données sur la mortalité de 1993 à 1998
AJHP - vol. 58, Phillips, et coll., 1er octobre 2001

- 469 décès dus à une erreur médicale
- 16 % des décès étaient dus à la prescription d'une mauvaise médication
- 5 % des décès ont été causés par une confusion quant au nom de marque
- 4 % ont été causés par une confusion quant au nom générique
Causes ?
Étiquetage et étiquettes semblables



Avandia et Coumadin

Que cherche la FDA?
- Des propriétés de présentation et consonance semblables
- Relativement à des noms de médicaments en vente à l'heure actuelle et à ceux non-approuvés
- Relativement à d'autres produits médicinaux
- Relativement aux abréviations médicales couramment utilisées, aux procédures médicales et/ou aux tests en laboratoire
- Publicités mensongères ou trompeuses
Quels renseignements sont nécessaires à l'évaluation du risque de la FDA?

- Noms de marques et les noms établis
- Concentrations
- Schéma posologique
- Utilisation et indications
- Étiquettes et étiquetage
- Modèle sur l'utilisation d'un appareil
- Formulations et emballages proposés

Analyse d'un nom de propriétaire par DMETS
- Groupe d'experts
- Analyse informatique
- Orthographe et phonétique
- Recherche d'autres bases de données externes
- Études d'ordonnances (Simulation)
- Ordonnances verbales
- Ordonnances pour les patients externes - Écrites
- Ordonnances pour les patients hospitalisés - Écrites
- Évaluation globale des risques et des avantages
Groupe d'experts de la FDA
- Environ 12 évaluateurs de sécurité de la DMETS (médecins, pharmaciens, infirmières)
- Un représentant du Comité consultatif en questions morales au sein de la Direction des médicaments (pharmacien)
- À tour de rôle, un facilitateur est choisi de façon aléatoire
- Chaque membre expert révise les documents de référence et fournit une évaluation relative du risque pour chaque nom AVANT la réunion
- Groupe de discussion générale et un consensus est atteint pour chaque nom
Études d'ordonnances
- Ordonnances pour les patients externes - Écrites
- Ordonnances pour les patients hospitalisés - Écrites
- Ordonnances verbales (patients externes ou hospitalisés)
La conception de l'étude d'une ordonnance
- Des ordonnances d'étude sont conçues pour aboutir à un échec suite aux discussions et aux préoccupations du groupe d'experts relativement aux noms semblables identifiés
- On demande à différents employés d'écrire des exemples d'ordonnances pour chaque nom
- Un médicament commercialisé ou un contrôle d'ordonnance est inclus
- L'ordonnance est numérisée et transmise par courriel à un sous-ensemble de travailleurs en soins de santé de la FDA
- Les résultats et les interprétations sont retransmis par courriel
Taille de l'échantillon
- Environ 130 médecins, infirmiers et pharmaciens bénévoles de la FDA transmettent leur commentaires et leurs interprétations par courriel
- Pour éviter qu'un examinateur effectue l'examen d'un nom plus d'une fois, nous divisons le groupe par tiers (n = 43) pour examiner chaque ordonnance verbale et chaque ordonnance écrite à des patients externes et des patients hospitalisés. Le taux de réponse est d'environ 70 %.
Exemples d'écriture à la main


Ordonnances verbales

- On demande à des employés de la DMETS choisis au hasard d'enregistrer une ordonnance verbale
- Exemple : Je suis le Dr Jean Tremblay et j'appelle concernant une ordonnance de Novicar 40 mg par jour pour Mme Unetelle. Donnezlui le no 30 avec deux renouvellements.
- Les ordonnances verbales sont enregistrées par la DMETS à l'aide d'un système de messagerie vocale et envoyées aux examinateurs attitrés de la FDA pour une interprétation
- Les résultats sont retransmis par courriel à la DMETS
Analyse informatique de la phonétique et de l'orthographe (AIPO)

- Série d'algorithmes phonétiques et orthographiques utilisée dans une méthode automatisée et informatisée d'évaluation des noms de propriétaire relativement aux propriétés d'apparence et de consonance semblables
- Prototype achevé en juillet 2003 - devrait être en opération en octobre et utilisé régulièrement dans le cadre de tous les examens futurs de la DMETS
- AIPO fournit les pourcentages des similarités liées à la phonétique et à l'orthographe entre le nom proposé et les bases de données de noms de marques déjà existants
- AIPO prend aussi en considération les concentrations et les formes posologiques lorsqu'ils examinent un nom
Évaluateur d'analyse des risques liés à la sécurité
- Examine les données recueillies par le groupe d'experts, les études d'ordonnances, les recherches informatisées et AIPO pour déterminer tout risque de confusion
- Évalue le risque potentiel lié à la sécurité associé à deux médicaments dont on a fait la preuve qu'ils portent à confusion en raison de leurs similarités
- Examine aussi les données appropriées sur les événements iatrogènes médicamenteux potentiels après commercialisation, les expériences cliniques et réglementaires et les données tirées d'une revue de la littérature
Certains facteurs qui contribuent à la confusion relative à des noms de médicaments
- Indications semblables
- Même groupe de patients
- Formulations identiques
- Chevauchement de concentrations ou de directives
- Entreposage dans un même endroit
Quels sont les dangers possibles?
- Quelles sont les conséquences si un patient ne prend pas l'action pharmacologique du médicament prescrit?
- Quelles sont les actions pharmacologiques et la toxicité du médicament non prescrit?
Examen final
- Le nom de la marque est ré-évalué 90 jours avant la prise de décision relative à une demande.
- L'évaluation approfondie n'est pas répétée. Un examen supplémentaire n'est effectué que s'il y a confusion avec les noms qui sont sur le marché suivant l'examen initial.
Noms de produits de santé à présentation et à consonance semblables : Élaboration d'une recommandation à l'égard de politiques exhaustives
Date 2003-10-20
Contact Division de la politique et de la promotion
Le 21 octobre 2003
Michèle Chadwick
Division de la politique et de la promotion
Centre des politiques et des affaires réglementaires
Direction des produits biologiques et des thérapies génétiques
Objectifs de la deuxième journée
- Informer et éduquer les parties intéressées et concernées à l'égard des noms de produits de santé à présentation et à consonance semblables et du processus actuel d'élaboration de politiques
- Offrir l'occasion aux parties intéressées et concernées d'exprimer leurs inquiétudes ou de donner leur appui à l'égard des options stratégiques et des recommandations proposées pour résoudre le problème lié aux noms de produits de santé à présentation et à consonance semblables
Examen de la dénomination spéciale à la FDA

Agence européenne pour l'évaluation des médicaments (AEEM)
- Ligne directrice intitulée «Guidelines on the Acceptability of Invented Names for Human Medicinal Products Processed Through the Centralized Procedure» [Lignes directrices pour l'acceptabilité des noms inventés pour les produits médicaux à usage humain traités selon la procédure centralisé]
- L'AEEM tente de s'assurer qu'un médicament ne porte pas un nom inventé qui pourrait être confus avec celui d'un autre médicament (question d'innocuité)
- L'AEEM croit qu'il est essentiel que des critères conséquents et non arbitraires soient appliqués au cours processus d'examen de l'acceptabilité des dénominations spéciales proposées.
- Le nom inventé ne doit comprendre qu'un seul mot et doit éviter une qualification par lettres et chiffres, y compris l'utilisation de formulations abrégées et d'abréviations.
- Le promoteur peut soumettre à l'AEEM jusqu'à trois noms proposés par demande d'autorisation de mise le marché.
- Le groupe d'examen des noms examine les noms inventés proposés
Options proposées avant la mise en marché
- Général
- Statu quo
- Politique
- SOP, politique et ligne directrice
- Règlement et lois
- Informatique
- Utilisation du Système de suivi des présentations des drogues (SSPD)
- Utilisation du Système de gestion des dossiers et de l'information intégrés actuels
- Développement d'un nouveau logiciel interne
- Logiciel de base
- Logiciel complexe spécifique pour les noms de produits à présentation et à consonance semblables comportant des caractéristiques ajoutées
- Examen
- Examen étranger (FDA/AEEM, etc.)
- Examen par un tiers
- Examen du nom (SC)
- Comité d'examen des noms
- Exigences devant être satisfaites par le promoteur
- Le promoteur fournit une liste de choix de noms en ordre de priorité
- Le promoteur effectue une recherche et une analyse des produits à présentation et à consonance semblables
- Demande de marques de commerce
- Autre
- Combinaison des options
Options après la mise en marché
- Général
- Statu quo
- Politique
- SOP, politique et ligne directrice
- Règlement et lois
- Informatique
- codage par code à barres - identification et vérification du produit
- prescriptions électroniques (messages informatisés imprimés)
- Exigences de l'industrie
- Demande à la société de changer le nom du produit de santé
- Demande à la société de modifier l'étiquette (c.-à-d. le lettrage sur l'étiquette)
- Contrôle (analyses du contexte)
- Intégrer les erreurs liées à des noms de produits à présentation et à consonance semblables aux rapports EIM
- Rapports d'erreurs liées à des noms de produits à présentation et à consonance semblables (d'autres compétences) - rétrospective (c.-à-d. Rapports de la FDA-MedWatch anonymes)
- Examens étrangers
- ISMP - suivi de près
- Utiliser un système avant la mise en marché pour rechercher des produits de santé approuvés à présentation et à consonance semblables
- Promotion de la santé et sensibilisation des intéressés
- Accroître le niveau de sensibilisation des intéressés à l'égard des produits de santé documentés à présentation et à consonance semblables (p. ex., ligne d'information, fiches de renseignements, lettres aux professionnels de la santé, commentaires dans des bulletins relatifs aux EIM, site Web sur les produits à présentation et à consonance semblables, éducation portant sur les noms de produits de santé à présentation et à consonance semblables dans les écoles de médecine)
- Autre
- Combinaison d'options
Critères utilisés pour évaluer les options
- Le GT a convenu d'avoir recours à une méthode quantitative et à une méthode qualitative pour évaluer les options.
- L'analyse quantitative prévoyait le recours à une technique d'analyse de décisions pour les besoins de l'examen des options aux termes selon laquelle les critères utilisés pour l'évaluation des options étaient regroupés par critères de présélection (obligatoires) ou par critères comparatifs (atout).
L'option qui ne satisfaisait pas aux critères de présélection, elle était éliminée d'office. Après avoir affecté une pondération à un critère comparatif (de un à dix), l'option était classée en fonction du niveau de satisfaction qu'elle offrait par rapport aux autres critères comparatifs (sur une échelle de dix points). - La technique qualitative nécessitait que les membres du GT sur les noms de produits à présentation et à consonance semblables votent pour les options qu'ils privilégiaient.
Recommendations
Avant la mise en marché
- 1er choix : Politique, logiciel complexe, examen du nom, comité d'examen des noms, analyse de nom et liste par ordre de priorité fournies par la société
- 2e choix : Politique, logiciel, examen du nom, comité d'examen des noms, analyse de nom et liste par ordre de priorité fournies par la société
- 3e choix : Politique, système interne intégré et examen du nom et comité d'examen des noms, analyse de nom et liste par ordre de priorité fournies par la société
- 4e choix : Politique, Système SSPD (amélioré et comprenant une BDPP) et examen du nom et comité d'examen des noms, analyse de nom et liste par ordre de priorité fournies par la société
Après la mise en marché
- 1er choix Politique, promotion et surveillance
- 2e choix Politique et promotion
Prochaines étapes
- Un rapport suivant l'atelier de travail sera affiché sur le site Web de Santé Canada et envoyé à tous les intervenants.
- Le GT sur les noms des produits à présentation et à consonance semblable examinera et analysera tous les commentaires fournis pendant la période de consultation et passera en revue le Résumé analytique de la question (RAQ), s'il y a lieu.
- Approbation du RAQ révisé et recommandations de la haute direction et du GT
- Procéder à l'étude de faisabilité informatique, à la DP et à l'étape III du projet
Analyse assistée par ordinateur des décisions relatives à la détermination du nom des médicaments
Date 2003-10-20
Division de la politique et de la promotion
Bruce L. Lambert, Ph.D.
Department of Pharmacy Administration
Department of Pharmacy Practice
University of Illinois at Chicago
lambertb@uic.edu
Aperçu
- Comment peut-on mesurer les similarités et les différences de manière objective entre les paires de noms à l'aide d'un ordinateur?
- Quelles preuves existe-t-il pour dire que ces mesures sont valides?
- Comment doit-on évaluer un système de repérage de noms?
- Quelles sont les prochaines étapes, les enjeux et les limitations?
Préface : Il faut mettre l'accent ailleurs!
- Les noms ne sont pas suffisants : Il faut se concentrer sur les produits pharmaceutiques et non sur le nom des médicaments
- La similarité n'est pas suffisante : Il faut se concentrer sur la similarité et sur la fréquence (de prescription)
- La réduction des erreurs n'est pas suffisante : Il faut se concentrer sur la réduction des préjudices
- Les paires ne sont pas suffisantes : Il faut se concentrer sur la clarté et l'intelligibilité des noms particuliers
- Comment trouver un équilibre entre les risques pour le public et les avantages pour l'entreprise?
Comment ces erreurs surviennent-elles?
- Similarité et erreurs fondées sur la fréquence dans le traitement cognitif
- Mémoire (rappel et reconnaissance)
- Perception (visuelle et auditive)
- Commande des moteurs (choisir le mauvais médicament du menu déroulant)
- Systèmes à conception faible (par exemple, commandes manuscrites, commandes verbales, aucun système informatisé de commandes pour médecins (SCIM))
Les décisions relatives à la détermination du nom doivent être fondées sur les meilleures preuves scientifiques disponibles
- Les décisions en matière de politiques gouvernementales doivent être fondées sur des preuves scientifiques valides et non sur des allégations de nature commerciale.
- Publications révisées par les paires
- Preuves pertinentes
- Mesures validées
- Transparence, communication de toutes les méthodes, reproductibilité, objectivité
Types de similarité différents
- Similarité des noms
- Orthographique (orthographe)
- Prévoit les erreurs de perception visuelle et certaines erreurs de commande de moteur.
- Phonétique ou phonologique (prononciation)
- Prévoit les erreurs de perception auditive et les erreurs de mémoire à court terme.
- Besoin de tenir compte du dialecte et de l'accent de langue étrangère.
- Orthographique (orthographe)
- Similarités des produits
- Représentation composite du nom et de caractéristiques non liées au nom (par exemple, force, forme dosifiée, voie d'administration, posologie, couleur, forme).
- Prévoit la variété des confusions pratiques et des effets modérés d'autres types de similarités.
Similarités phonologiques ne sont pas suffisantes

Avandia 4mg per os?
Coumadin 4mg per os?

Tequin 400mg per os?
Tegretol 4mg per os?
http://www.ismp.org/msaarticles/a072600safety.html

http://www.medmal-law.com/illegibl.htm
Plendil ou Isordil?
- IsordilMD prescrit
- PlendilMD délivré
- Cardiologue reconnu négligeant
- Jugement en dommages-intérêts qui s'élèvent à 450 000 $
- Premier jugement pour mauvaise Calligraphie!
Différents types de similarité
- Différents types de similarité sont associés à différents types d'erreurs.
- Nous tenons à prévenir tous les types d'erreurs.
- Donc, le processus de dépistage doit utiliser une mesure valide des trois types de similarité.
- Des produits, orthographique, phonétique
- Manuscrite (écriture cursive, en caractères d'imprimerie), parlée (dialecte, accent de langue étrangère).
Mesures objectives de la similarité des noms
- N-gram : fondé sur une proportion de sous-séquences à n-lettres que deux noms ont en commun.
- Bigram : sous-séquences à deux lettres (par exemple, Premarin = Pr, re, em, ma, ar, ri, in).
- Trigram : sous-séquences à trois lettres (Pre, rem, etc.).
- Coefficient de Dice : proportion de n-grams en commun.
- Distance d'édition : le nombre d'insertions, de suppressions ou de substitutions nécessaires pour transformer un nom en un autre.
- Méthodes d'alignement de la distance
- ALINE de Kondrak
- AL-DIST de Fisher
- N-gram et les mesures de distance d'édition peuvent servir dans toute représentation officielle du nom (orthographique ou phonologique).
- Utiliser l'alphabet phonétique (par exemple, l'Alphabet phonétique international ou ARPAbet)
- ARPAbet : Zyprexa: z ay p r eh k s ax
- Bigrams par phonèmes : z ay, ay p. p r, r eh, eh k, k s, s ax
- Il existe beaucoup de variables fondées sur ces mesures fondamentales
- Ajouter des espaces avant ou après afin d'accentuer le début ou la fin d'un nom.
- Utiliser des poids différents selon la position des lettres.
- Utiliser des équations différentes afin de calculer les similarités numériques (Dice, Hamming et autres).
- Permettre des appariements approximatifs entre les lettres (par exemple, m=n, a=e=i=o=u).
- Pouvoir des analyses descriptives simples
- Les dix préfixes à trois lettres les plus communs dans les noms de marque américains
- Pro-, Bio-, Car-, Tri-, Vit-, Pre-, Nut-, Ult-, Con-, Per-
- B. L. Lambert, K. Y. Chang et S. J. Lin, «Descriptive analysis of the drug name lexicon», Drug Inf J., vol. 35, 2001, p. 163-172.
- Les dix préfixes à trois lettres les plus communs dans les noms de marque américains
Répartition des cotes de distance

B. L. Lambert, K. Y. Chang et S. J. Lin, «Descriptive analysis of the drug name lexicon», Drug Inf J., vol. 35, 2001, p. 163-172.
Répartition des cotes de similarité
B. L. Lambert, K. Y. Chang et S. J. Lin, «Descriptive analysis of the drug name lexicon», Drug Inf J., vol. 35, 2001, p. 163-172.

Les mesures objectives prévoient la probabilité des erreurs humaines
- La similarité permet de distinguer précisément entre les paires d'erreurs connues et les paires non erronées.
- Corrélation d'une meilleure similarité objective avec des taux d'erreurs de mémoire de reconnaissance plus élevés par les profanes et les pharmaciens.
- Corrélation d'une meilleure similarité avec des taux plus faibles d'erreurs de rappel libre
- Corrélation d'une similarité objective avec des similitudes subjectives (pour les experts et les profanes).
- Les voisinages de similarité prévoient des erreurs de perception visuelle.
La similarité permet de distinguer de manière concise entre les paires d'erreurs connues et les paires non erronées
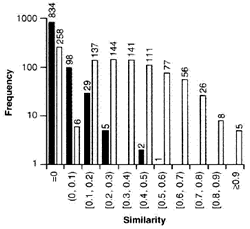
Histogramme de similarités entre les chaînes de caractères trigram pour 969 paires d'erreurs et 969 paires de contrôle. L'axe vertical est divisé sur une échelle logarithmique. Les barres blanches représentent les paires d'erreurs. Les barres noires représentent les paires de contrôle. Les valeurs figurant au bout des barres sont les fréquences. Les valeurs sur l'axe horizontal représentent les intervalles de similarités de l'histogramme. Par exemple, (0; 0,1) signifie «plus que 0 et moins que 0,1» et (0,1; 0,2) signifie «plus que 0,1 ou égal et moins que 0,2». Par : Lambert, Am J Health Syst Pharm, vol. 54, no 10, le 15 mai 1997, p. 1161-1171.
Frequency = Fréquence
Similarity = Similarité

Figure 1. Incidence de la similarité de l'orthographe sur les erreurs dans la mémoire de reconnaissance des pharmaciens
B. L. Lambert, K. Y. Chang et S. J. Lin, «Effect of orthographic and phonological similarity on false recognition of drug names», Soc Sci Med., vol. 52, 2001, p. 1843-1857.

Figure 2. Incidence de la similarité de l'orthographe sur les erreurs de rappel libre des pharmaciens
B. L. Lambert, K. Y. Chang et S. J. Lin, «Immediate free recall of drug names: effects of similarity and availability», Am J Health-Syst Pharm, vol. 60, 2003, p. 156-168.

Figure 3. Incidence des similarités phonologiques sur les erreurs de rappel libre des pharmaciens.
B. L. Lambert, K. Y. Chang et S. J. Lin, «Immediate free recall of drug names: effects of similarity and availability», Am J Health-Syst Pharm., vol. 60, 2003, p. 156-168.

Figure 4. Relation entre les similarités objectives et les similarités subjectives des profanes
B. L. Lambert, D. Donderi et J. Senders, «Similarity of drug names: Objective and subjective measures», Psychology and Marketing, vol. 19, nos 7-8, 2002, p. 641-661.
Les voisinages sont importants
- Le concept du «voisinage» des similarités est une composante essentielle des théories modernes de la perception visuelle et auditive.
- Caractéristiques du voisinage
- Fréquence (des prescriptions)
- Densité
- Rayon (c'est-à-dire, quelle est la distance acceptable entre le voisinage de deux noms?)
Illustration de voisinage

Voisinages denses : Fréquences élevée et faible


Exemples
- Noms ayant un log de fréquence de similarités (FS) élevé (log FS > 7) : VentolinMD, DyazideMD, ProveraMD.
- Noms ayant un log de FS faible (log FS < 3) : VistazineMD, AntispasMD, ProtaphaneMD.
- Nom d'un voisinage à densité faible : FlexerilMD (aucun voisin dans NAMCS-NHAMCS).
- Nom d'un voisinage dense : DynabacMD, SynalarMD, RynatanMD, DynapenMD, DynacircMD, DynacinMD, CynobacMD.

Figure 5. Incidence du voisinage de similarité sur la perception visuelle des noms de médicaments des pharmaciens certifiés
B. L. Lambert, K. Y. Chang et P. Gupta, «Effects of frequency and similarity neighborhoods on pharmacists' visual perception of drug names», Soc Sci Med. à l'impression.
Mesures objectives : Conclusions
- Elles fonctionnent.
- Elles ne sont pas parfaites.
- Mieux sur le plan de la population que sur le plan individuel.
- Mieux pour la santé publique que pour les disputes juridiques.
- Nous devrions les employer.
Présentation du logiciel
- Recherche du nom
- Orthographe
- N-gram, distance d'édition
- Prononciation
- N-gram, distance d'édition
- Orthographe
- Recherche de produits
- Nom, forme dosifiée, force, voie d'administration
- Chacun pesé pour l'importance
- B. L. Lambert et C. Yu, «Thirumalai M. A system for multi-attribute drug product comparison», Journal of Medical Systems, à l'impression.
- B. L. Lambert, inventeur, «Apparatus, method, and product for multi-attribute drug comparison», brevet américain 6,529,892, le 4 mars 2003.
Comment les ressources informatiques peuvent-elles servir à calculer le poids de plusieurs éléments de similarité dans les noms?
- Un moyen consiste à calculer une cote de similarité composite en utilisant de nombreuses mesures de similarité distinctes
- Employer de nombreuses mesures pour prévoir les probabilités d'erreurs ou un autre résultat.
- Expert = 0,69 - 0,01*Editex - 0,30*NED + 0,22*Trigram2b - 0,02*EditSoundex

Figure 6. Employer le modèle de régression à multiples mesures pour prévoir les jugements de similarité des experts
B. L. Lambert, C. Yu et M. Thirumalai, «A system for multi-attribute drug product comparison», Journal of Medical Systems, à l'impression.
Résultats de repérage du nom actuel pour le nom de requête : CurosurfMD
| Modèle combiné | Cotes d'experts |
|---|---|
| Curasorb | Curasorb |
| Curasore | Curasore |
| Exosurf | Curasilk |
| Virosure | Exosurf |
| Urocur | Curasol |
| Atrosulf | Curisone |
| Curagard | Curasalt |
| Curasol | Infasurf |
| Curasalt | Curafil |
| Curasilk | Curecal |
Voir : B. L. Lambert, C. Yu et M. Thirumulai, «A system for multiattribute drug product comparison», Journal of Medical Systems, vol. 28, no 1, 2004, p. 29-54.
Évaluer un système de recherche et de repérage de médicaments
- D'après l'appel d'offres 223-02-5618 de la Food and Drug Administration (FDA) : comparaisons empiriques de la capacité du système à définir au moins 75 p. 100 des noms qui sont susceptibles de prêter à confusion, qui ont été déterminés par tous les évaluateurs de la sécurité et qui sont inclus dans l'examen de dénomination spéciale proposée. Ces comparaisons se réaliseront avec les examens des 100 dénominations spéciales proposées récemment.
- Il ne s'agit pas du test approprié. Il est facile de déterminer 75 p. 100 des noms qui prêtent à confusion, il faut simplement retourner une liste de tous les noms et il est garanti que toute la liste comprendra tous les noms qui sont susceptibles de prêter à confusion.
- Le système de recherche doit repérer les noms qui prêtent à confusion en donnant peu de faux positifs.
- D'après l'appel d'offres 223-02-5618 de la FDA :
- Capacité du système à déterminer 95 p. 100 des paires de noms de médicaments connus et publiés (qui font probablement allusion aux paires d'erreurs).
- Les paires peuvent représenter une unité d'analyse permettant d'évaluer le lien entre la similarité et le risque, mais non l'unité d'analyse correcte lorsqu'il s'agit d'évaluer le rendement du repérage.
- Les listes publiées ne permettent pas de distinguer entre les erreurs produites et les incidents évités ou les paires qui ont simplement soulevé des préoccupations. Ces listes contiennent des rapports volontaires qui sont reconnus pour éviter plus de 99 p. 100 des erreurs produites.
- Les organismes de réglementation doivent approuver les noms individuels et non les paires de noms.
- N paires de noms donne [N(N-1)]/2 paires. La valeur prédictive positive des tests fondée sur les événements rares des grandes populations est très faible.
- Les mesures appropriées consistent en un rappel et une précision.
- Rappel : le nombre de noms pertinents repérés divisé par le nombre total de noms pertinents dans la base de données.
- Précision : le nombre de noms pertinents repérés divisé par le nombre total de noms repérés.
- Noms pertinents déterminés en fonction de la méthode des jugements en commun pertinents (voir http://trec.nist.gov).
- Voir : B. L. Lambert, C. Yu et M. Thirumulai, «A system for multiattribute drug product comparison», Journal of Medical Systems, vol. 28, no 1, 2004, p. 29-54.
Exemple de la courbe de rappel et de la courbe de précision

Precision = Précision
Recall = Rappel
http://www.itl.nist.gov/iaui/894.02/works/presentations/bcs-irsg/sld012.htm
À quel niveau de rendement peut-on s'attendre? Variété des tâches

http://www.itl.nist.gov/iaui/894.02/works/presentations/bcs-irsg/sld014.htm
À quel niveau de rendement peut-on s'attendre?

Figure 9. Précision de la méthode de repérage editex à 11 niveaux de rappel (précision moyenne = 17,4 p. 100)
Voir : B. L. Lambert, C. Yu et M. Thirumulai, «A system for multiattribute drug product comparison», Journal of Medical Systems, vol. 28, no 1, 2004, p. 29-54.
Quel est le rendement des experts?

Figure 13. Précision de la méthode d'extraction des cotes d'experts à 11 niveaux de rappel (précision moyenne = 26,7 p. 100)
Voir : B. L. Lambert, C. Yu et M. Thirumulai, «A system for multiattribute drug product comparison», Journal of Medical Systems, vol. 28, no 1, 2004, p. 29-54.
Dans quelle mesure les ressources informatiques peuvent-elles servir à calculer le poids de plusieurs éléments quant à similarité des noms?
- Calculer la cote de similarité distincte pour chaque attribut des produits.
- Nom, forme dosifiée, force, voie d'administration, posologie.
- Indication, forme, couleur et autres.
- Employer les catégories d'équivalence pour l'appariement approximatif des valeurs d'attributs (par exemple, comprimé et gélule).
- Employer la régression ou d'autres techniques de modélisation afin d'assigner des poids à plusieurs attributs.
- Employer le schéma directeur des systèmes d'information et les données sur les erreurs en vertu du Droit du matériel, de l'environnement et de l'immobilier (DMEI) afin d'estimer l'importance des nombreux attributs.
L'analyse typologique assistée par ordinateur peut-elle appuyer le processus de prise des décisions en vue de déterminer les noms et les similarités entre les noms?
- Oui, mais.
- Problèmes
- Faux positifs
- Faux négatifs
- Fiabilité des données pour la modélisation (trop souvent fondée sur des rapports volontaires).
- Détermination d'une limite qui dépasse le niveau où un nom «porte trop à confusion pour être approuvé».
- Validation de modèles prévisibles.
- Quelle base de données doit-on consulter?
Résumé
- Les ordinateurs peuvent servir à mesurer de manière objective les différences entre les paires de noms, mais ils doivent évaluer toutes les dimensions des similarités.
- Les ordinateurs peuvent servir à calculer le poids de plusieurs éléments dont le nom est similaire, mais ils ne fournissent pas des preuves solides de l'importance relative des attributs non liés au nom.
- Veuillez communiquer avec moi afin d'en discuter davantage.
- lambertb@uic.edu
- Merci
Détection automatique des noms de drogues équivoques
Date : 2003-10-20
Contact : Division de la politique et de la promotion
Greg Kondrak, University of Alberta
Bonnie Dorr, University of Maryland
Le 21 octobre 2003
Aperçu : Comparaison de noms de médicaments
Méthode
Orthographique
Phonétique
Distance
Distance d'édition
Soundex
Similarité
DICE, LCSR
ALINE
Coéfficient DICE
Doubler le nombre de bigrammes communs et les diviser par le nombre total de bigrammes de chaque séquence.
Exemples :
- Similarité entre {za,an,nt,ta,ac} et {co,on,nt,ta,ac} est (2 · 3)/(5+5) = 6/10 = 0,6
- Similarité entre {za,an,nt,ta,ac} et {xa,an,na,ax} est (2 · 1)/(5+4) = 1/9 = 0,22
LCSR
Doubler la longueur de la plus longue sous-séquence commune et diviser par le nombre total de charactères de chaque séquence.
Exemples :
- Similarité entre zantac et contac : (2 · 4)/12 = 8/12 = 0,67
- Similarité entre zantac et xanax : (2 · 3)/11 = 6/11 = 0,55
Distance d'édition
Compter le nombre d'étapes sont nécessaires pour transformer une séquence en une autre.
Exemples:
- La distance entre zantac et contac est 2.
- La distance entre zantac et xanax est 3.
Soundex
- Transformer toutes les lettres, sauf la première, par des codes numériques et tronquer à un maximum de quatre caractères.
- Conversion de caractères : 0= (a,e,h,i,o,u,w,y) 3=(d,t) 1=(b,f,p,v) 2=(c,g,j,k,q,s,x,z); 4=(l) 5=(m,n) 6=(r)
- king et khyngge: d(k52,k52) = 1,00
- knight et night: d(k523,n23) = 2/4 = 0,50
Similarité phonétique
Exemple: Osmitrol et Esmolol

- Reconnaître la prononciation identique de lettres différentes.
- Reconnaître les sons non identiques mais semblables.
Alignement ADN
CG-CACAT-AGTC-CGAGA-GA-TAGGCAAG
CGGCACATTCGTCTCGAGATGACTAGGC-AG
Modèle de calcul des protéines
| A | R | N | D | C | Q | E | G | H | I | L | K | M | F | P | S | T | W | Y | V | |
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| A | 2 | -2 | 0 | 0 | -2 | 0 | 0 | 1 | -1 | -1 | -2 | -1 | -1 | -4 | 1 | 1 | 1 | -6 | -3 | 0 |
| R | -2 | 6 | 0 | -1 | -4 | 1 | -1 | -3 | 2 | -2 | -3 | 3 | 0 | -4 | 0 | 0 | -1 | 2 | -4 | -2 |
| N | 0 | 0 | 2 | 2 | -4 | 1 | 1 | 0 | 2 | -2 | -3 | 1 | -2 | -4 | -1 | 1 | 0 | -4 | -2 | -2 |
| D | 0 | -1 | 2 | 4 | -5 | 2 | 3 | 1 | 1 | -2 | -4 | 0 | -3 | -6 | -1 | 0 | 0 | -7 | -4 | -2 |
| C | -2 | -4 | -4 | -5 | 12 | -5 | -5 | -3 | -3 | -2 | -6 | -5 | -5 | -4 | -3 | 0 | -2 | -8 | 0 | -2 |
| Q | 0 | 1 | 1 | 2 | -5 | 4 | 2 | -1 | 3 | -2 | -2 | 1 | -1 | -5 | 0 | -1 | -1 | -5 | -4 | -2 |
| E | 0 | -1 | 1 | 3 | -5 | 2 | 4 | 0 | 1 | -2 | -3 | 0 | -2 | -5 | -1 | 0 | 0 | -7 | -4 | -2 |
| G | 1 | -3 | 0 | 1 | -3 | -1 | 0 | 5 | -2 | -3 | -4 | -2 | -3 | -5 | -1 | 1 | 0 | -7 | -5 | -1 |
| H | -1 | 2 | 2 | 1 | -3 | 3 | 1 | -2 | 6 | -2 | -2 | 0 | -2 | -2 | 0 | -1 | -1 | -3 | 0 | -2 |
| I | -1 | -2 | -2 | -2 | -2 | -2 | -2 | -3 | -2 | 5 | 2 | -2 | 2 | 1 | -2 | -1 | 0 | -5 | -1 | 4 |
| L | -2 | -3 | -3 | -4 | -6 | -2 | -3 | -4 | -2 | 2 | 6 | -3 | 4 | 2 | -3 | -3 | -2 | -2 | -1 | 2 |
| K | -1 | 3 | 1 | 0 | -5 | 1 | 0 | -2 | 0 | -2 | -3 | 5 | 0 | -5 | -1 | 0 | 0 | -3 | -4 | 2 |
| M | -1 | 0 | -2 | -3 | -5 | -1 | -2 | -3 | -2 | 2 | 4 | 0 | 6 | 0 | -2 | -2 | -1 | -4 | -2 | 2 |
| F | -4 | -4 | -4 | 6 | -4 | -5 | -5 | -5 | -2 | 1 | 2 | -5 | 0 | 9 | -5 | -3 | -3 | 0 | 7 | -1 |
| P | 1 | 0 | -1 | -1 | -3 | 0 | -1 | -1 | 0 | -2 | -3 | -1 | -2 | -5 | 6 | 1 | 0 | -6 | -5 | -1 |
| S | 1 | 0 | 1 | 0 | 0 | -1 | 0 | 1 | -1 | -1 | -3 | 0 | -2 | -3 | 1 | 2 | 1 | -2 | -3 | -1 |
| T | 1 | -1 | 0 | 0 | -2 | -1 | 0 | 0 | -1 | 0 | -2 | 0 | -1 | -3 | 0 | 1 | 3 | -5 | -3 | 0 |
| W | -6 | 2 | -4 | -7 | -8 | -5 | -7 | -7 | -3 | -5 | -2 | -3 | -4 | 0 | -6 | -2 | -5 | 17 | 0 | -6 |
| Y | -3 | -4 | -2 | -4 | 0 | -4 | -4 | -5 | 0 | -1 | -1 | -4 | -2 | 7 | -5 | -3 | -3 | 0 | 10 | -2 |
| V | 0 | -2 | -2 | -2 | -2 | -2 | -2 | -1 | -2 | 4 | 2 | -2 | 2 | -1 | -1 | -1 | 0 | -6 | -2 | 4 |
Fonction de similarité élémentaire
| a | i | y | n | p | r | s | |
|---|---|---|---|---|---|---|---|
| a | 1 | 0 | 0 | 0 | 0 | 0 | 0 |
| i | 0 | 1 | 0 | 0 | 0 | 0 | 0 |
| y | 0 | 0 | 1 | 0 | 0 | 0 | 0 |
| n | 0 | 0 | 0 | 1 | 0 | 0 | 0 |
| p | 0 | 0 | 0 | 0 | 1 | 0 | 0 |
| r | 0 | 0 | 0 | 0 | 0 | 1 | 0 |
| s | 0 | 0 | 0 | 0 | 0 | 0 | 1 |
Modèle de similarité fondé sur les caractéristiques phonétiques multivaluées
| a | i | y | n | p | r | s | |
|---|---|---|---|---|---|---|---|
| a | 15 | 8 | 2 | -50 | -56 | -28 | -40 |
| i | 8 | 15 | 10 | -26 | -32 | -4 | -16 |
| y | 2 | 10 | 15 | -21 | -27 | 1 | -11 |
| n | -50 | -26 | -21 | 35 | 9 | -7 | 5 |
| p | -56 | -32 | -27 | 9 | 35 | -13 | 19 |
| r | -28 | -4 | 1 | -7 | -13 | 35 | 3 |
| s | -40 | -16 | -1 | 5 | 19 | 3 | 35 |
Le tractus vocal

Lieux de l'articulation

Certaines dimensions des sons
| Noms | Pondération | Valeurs |
|---|---|---|
| Lieu de l'articulation | 40 | dentaire, vélaire, palatal |
| Mode d'articulation | 50 | plosive, fricative, |
| Voisement | 10 | voisé, non voisé |
| Aspiration | 5 | aspiré, non aspiré |
| Longueur | 5 | long, court |
| Hauteur | 5 | haut, médian, bas |
Validation : Comparaison de résultats
| ALINE : | 0,792 | zantac | xanax |
|---|---|---|---|
| 0,639 | zantac | contac | |
| 0,486 | xanax | contac | |
| ÉDITION : | 0,667 | zantac | contac |
| 0,500 | zantac | xanax | |
| 0,333 | xanax | contac | |
| LCSR : | 0,667 | zantac | contac |
| 0,545 | zantac | xanax | |
| 0,364 | xanax | contac | |
| DICE : | 0,600 | zantac | contac |
| 0,222 | zantac | xanax | |
| 0,000 | xanax | contac |
Validation : Précision et rappel
- Précision et rappel en vertu de l'étalon-or : USP Quality Review, mars 2001.
- 582 noms de drogues uniques, 399 paires portant réellement à confusion, 169 071 paires possibles (créées par combinaisons)
- Exemple (au moyen de DICE) :
| + | 0,889 | atgam | ratgam |
| + | 0,875 | herceptin | perceptin |
| - | 0,870 | zolmitriptan | zolomitriptan |
| + | 0,857 | quinidine | quinine |
| - | 0,857 | cytosar | cytosar-u |
| + | 0,842 | amantadine | rimantadine |
| : | : | : | : |
| - | 0,800 | erythrocin | erythromycin |
Validation : Précision des techniques avec transcription phonétique

Conclusion
- ALINE : Plus haute précision interpolée; facilement accordé à la tâche
- DICE, LCSR, ÉDITION : Combine les noms avec les lettres et bigrammes communs
- Solution : Démarche combinée qui tire parti des points forts de tous les algorithmes.
Système d'analyse informatique de la phonétique et de l'orthographe (AIPO)
Date 2003-10-20
Contact Division de la politique et de la promotion
Présentation de
Rick Shangraw, Ph.D.
Project Performance Corporation
Aperçu
- Concept général du système
- Le dépôt de données médicales
- Démonstration du système
Objectifs du système
- Accessibilité
- Application Web
- Degrés divers d'autorisation pour des tâches diverses
- Facilité d'utilisation
- Utilisation efficace du temps des experts
- Réduction de la production sur papier
- Augmentation du temps consacré à l'analyse tout en réduisant le temps nécessaire à la recherche
- Analyse fondée sur les données scientifiques
- Fiabilité des algorithmes (rappel)
- Validité prédictive des algorithmes (précision)
Histoire du système
- Conception du système pilote financée par la Food and Drug Administration (FDA) des États-Unis
- Équipe de développement
- Project Performance Corporation
- Bonnie Dorr, University of Maryland
- Greg Kondrak, University of Alberta
- Système pilote va être éprouvé par la FDA
Processus d'évaluation de l'innocuité - Avant
Avant l'analyse informatique :

Architecture du système

Processus d'évaluation de l'innocuité - Assisté par ordinateur
Avec l'analyse informatique :

Dépôt de données médicales
- Base de données Oracle
- Caractéristiques
- Données provenant de la base de données d'entreprise de la FDA
- Noms de marque approuvés et non approuvés
- Autres facteurs (force du médicament, espacement des doses, forme posologique et voies d'administration)
- Capacité d'importer et de mettre le dépôt à jour manuellement
- Données provenant de la base de données d'entreprise de la FDA
- Prochaines étapes
- Produits biologiques
- Suppléments et produits à base d'herbes médicinales
- Terminologie médicale
Démonstration du système
- Ouverture de session et sécurité
- Capacités de recherche
- Phonétique
- Orthographique
- Autres facteurs
- Flux du travail
- Recherches sauvegardées
- Liste de surveillance
- Administration du système
Med-E.R.R.S. Processus d'examen des noms de médicaments
Date 2003-10-20
Contact Division de la politique et de la promotion
Susan M. Proulx, Pharm.D.
Présidente, Med-E.R.R.S.
Le 21 octobre2003
Med-E.R.R.S.
- Filiale en propriété exclusive du Institute for Safe Medication Practices (ISMP), incorporée en 1997
- Conseil d'administration de la Med-E.R.R.S.
- Travaille avec l'industrie pharmaceutique pendant la phase de pré-commercialisation pour évaluer l'étiquetage, l'emballage et la nomenclature des produits pour garantir leur sécurité
- Travaille pendant la phase de postcommercialisation pour aider à surveiller et à évaluer toutes erreurs de médication possible ou réelle ayant été déclarées
Environ 45 % à 50 % des erreurs de médication déclarées au USP-ISMP Medication Error Reporting Program (MERP) et au MEDWatch Program de la FDA sont liées à l'étiquetage, à l'emballage ou à la nomenclature d'un produit.
Le processus de la Med-E.R.R.S.
- Un processus en deux étapes utilisant le modèle ERRSMC, une variante de l'analyse des modes de défaillance et de leurs effets (AMDE)
- Prise en considération des commentaires et de l'expertise du personnel praticien de la Med-E.R.R.S.

Commentaires du client
- Les évaluations de la sécurité sont effectués à des étapes avancées de la conception de la marque de commerce
- Les données cliniques devraient être disponibles
- Le nombre de noms devrait être réduit par des recherches dans les bases de données
- Dix «finalistes»
- Données cliniques sur le produit
- indications, posologie, voie, etc.
- Marques de commerces proposées
- Prononciation (coupures entre les syllabes, accents)

Coordination du projet
- Aux É.-U. et ailleurs
- Personnes touchées par le projet
- Pharmaciens (groupe le plus souvent utilisé)
- Infirmiers et infirmières
- Médecins et autres professionnels autorisés à prescrire des médicaments
- Autres, selon le cas
- Pour les études américaines, tous les aspects sont coordonnés par le personnel de la Med-E.R.R.S.
- Les coordonnateurs de projet de l'Europe, du Moyen-Orient, de l'Amérique du Sud, de l'Australie et de l'Asie aident à la coordination des examens internationaux
Outil de collecte des données
- Les données sur les clients sont compilées dans un outil de collecte des données
- Les noms proposés sont scriptés et numérisés dans des fichiers graphiques
- Des guides de prononciation sont inclus s'ils sont disponibles
- L'outil de collecte des données est envoyé par courriel ou par télécopieur, ou complété via Internet

Commentaires du praticien
- Examen des marques de commerces relatifs aux aspects visuels et phonétiques
- Similarités entre les produits pharmaceutiques
- Similarités entre les termes médicaux ou les abréviations de termes médicaux
- Probabilité de confusion (contexte clinique)
- Probabilité de danger pour les patients (contexte clinique)
Analyse des modes de défaillance et de leurs effets (AMDE)
- Une évaluation systématique de la façon dont, ou des raisons selon lesquelles, un produit ou un système peut être vulnérable aux défaillances
- Établissement de l'enchaînement des opérations
- Détermination des modes de défaillance
- Classement selon la probabilité de défaillance et la gravité de la situation
- Dans le cas où les erreurs sont jugées inacceptables, des mesures peuvent être entreprises pour réduire au minimum la possibilité d'erreur
Le modèle ERRSMC
- Une application de l'AMDE à l'évaluation de marques de commerce de produits pharmaceutiques
- Différents environnements cliniques dans lesquels un produit sera vraisemblablement utilisé (entreposé, prescrit, transcrit, préparé, etc.) sont pris en considération
- L'objectif est de faire ressortir les problèmes afin que des mesures puissent être prises pour réduire au minimum ou éliminer la possibilité d'erreur
Tenir compte de l'enchaînement des opérations, dont :
- Qui effectue l'achat?
- Où est entreposé le produit?
- Qui prescrit?
- Quel est le processus d'ordonnance?
- Écrite à la main, oralement, par téléphone, par ordinateur.
- Où le médicament sera-t-il utilisé?
- Comment se rend-il sur place?
- Qui l'administre?
- Qui assure la surveillance et comment?
- Qui ajuste le traitement?
- Qui assure l'administration du dossier?
- Y a-t-il lieu de répéter l'ordonnance?

Analyse par la Med-E.R.R.S.
- Regrouper les renseignements tirés de l'outil de collecte des données
- Effectuer une AMDE complète
- Confusion liée à une apparence et/ou à une consonance semblables avec :
- d'autres médicaments
- des termes médicaux
- des abréviations
- Probabilité d'erreur
- Contexte clinique
- Facilité de prononciation, caractère choquant d'un nom, inquiétudes générales liées à la vulnérabilité
- Les marques de commerce candidates sont examinées selon la perspective de la FDA, en se fondant sur les renseignements rendus publics par la FDA
- Les marques de commerce sont évaluées à l'aide des critères de la dénomination commune américaine (USAN)
- En ce qui concerne les projets internationaux, les exigences des autres responsables mondiaux (EMEA, OMS) doivent être prises en considération

Rapport au client
- En moyenne, les projets américains sont réalisés en 15 jours ouvrables
- Les projets américains, à l'aide d'un processus accéléré, sont achevés en 10 jours ouvrables
- Des délais de six à huit semaines sont nécessaires pour les projets internationaux
- Résumé accompagné de tableaux
- Méthodes de pointage
- Chaque nom est noté sur une échelle de cinq points
5 = «peu vulnérable»
1 = «très vulnérable» - Tout pointage de 2 ou moins est considéré comme non sécuritaire en raison de la possibilité de confusion
- Chaque nom est noté sur une échelle de cinq points
Points clés concernant le processus d'évaluation de la sécurité des marques de commerce
- Importance des praticiens et des experts
- Analyse d'un produit dans son environnement clinique à l'aide de l'analyse des mode de défaillances et de leurs effets (MADE)
- Examen de la documentation sur l'erreur médicale
- Processus qualitatif
À notre sujet
Date 2003-10-20
Contact Division de la politique et de la promotion

Sanjay Malaviya
Président et Directeur général
rL Solutions
77, rue Peter, 3e étage, Toronto, Ontario M5V 2G4
www.rL-Solutions.com
Notre vision
Un monde où l'expérience du client des soins de santé est incomparable
- Fournisseur de solution depuis 1993
- Appartenant à des intérêts canadiens
- Bureaux à Toronto, en Floride et en Australie
- Spécialisé dans la gestion des risques en soins de santé et dans le service à la clientèle
- Plus de 200 mises en oeuvre

- Exemples d'incidents réels signalés au moyen de Risk MonitorProTM

- Comment les employés en contact direct déclare les incidents
- Gestion de la situation
- Analyse
Incident 1669 : un presque exemple
| Classification de l'incident | |
|---|---|
| Classification de la personne touchée | Malade hospitalisé |
| Genre d'incident général | Médicament, intraveineux ou sang |
| Blessure | Non |
| Défaillance du matériel | Non |
| Détails généraux de l'incident | |
|---|---|
| Date de l'incident | 25 août 2002 à 10 h |
| Equipe de l'incident | 0700-1059 |
| Programme | Médecine interne |
| Service (autre que l'infirmerie) de pharmacie | |
| Localisation particulière | sans objet |
| Date signalée | 29 août 2002 à 14 h 26 |

| Détails précis de l'incident | |
|---|---|
| Gravité de l'incident | Niveau 0 - Ministériel |
| Type d'incident des médicaments | Mauvais médicament |
| Produit médical commandé | Neoral |
| Produit générique médical commandé | Cyclosporine |
| Administration du produit générique | Cyclophosphamide |
| Dose ou taux de médicament commandé | 50 mg à 1030 à 2200 |
| Dose ou taux de médicament administré | 50 mg |
| Forme pharmaceutique de médicament commandée | Capsule |
| Forme pharmaceutique de médicament administrée | Comprimé |
| Voie d'administration du médicament commandé | Par voie orale |
| Voie d'administration du médicament administré | Par voie orale |
| Le patient a reçu son médicament | Non |

Incident 2663 : un presque exemple

| Détails généraux de l'incident | |
|---|---|
| Date de l'incident | 29 octobre 2002 à 9 h 16 |
| Equipe de l'incident | 1100-1459 |
| Programme | RÉNAL |
| Service (autre que l'infirmerie) de pharmacie | |
| Localisation | Rénal 2 |

| Détails précis de l'incident | |
|---|---|
| Gravité de l'incident | Niveau 1 - Manqué de peu |
| Type d'incident du médicament | Mauvais médicament |
| Produit médical commandé | Cyclophosphamide |
| Administration du produit médical | Aucun |
| Le patient a reçu son médicament | Non |

| Mesures immédiates prises |
|---|
| Erreur ou omission corrigée |
| Révision de la commande |
| Remarques |
|---|
| Médicament non délivré au patient, commande seulement entrée dans le dossier du profil du malade externe. |
Incident 2340
| Classification de l'incident | |
|---|---|
| Classification de la personne touchée | MALADE EXTERNE |
| Genre d'incident général | Médicament, intraveineux ou sang |
| Blessure | Non |
| Défaillance du matériel | Non |
| Détails généraux de l'incident | |
|---|---|
| Date de l'incident | 12 septembre 2002 à 8 h 15 |
| Equipe de l'incident | 0700-1059 |
| Programme | CARD |
| Service (autre que le nursage) de Cardio-Diagnostic | |
| Localisation | Soins ambulatoires |
| Localisation particulière | Salle de traitement ou salle d'examen |
| Brève description des faits |
|---|
| Chlorpromazine administrée, hydrate de chloral commandé |
| Détails spécifiques de l'incident | |
|---|---|
| Gravité de l'incident | Niveau 3 - Sérieux |
| Type d'incident du médicament | Mauvais médicament |
| Produit médical commandé | Hydrate de chloral |
| Administration du produit médical | Chlorpromazine |
| Dose ou taux de médicament commandé | 300mg |
| Dose ou taux de médicament administré | 60mg |
| Voie d'administration du médicament commandé | Par voie orale |
| Voie d'administration du médicament administré | Par voie orale |
| Le patient a reçu sont médicament | Oui |

| Mesures immédiates prises |
|---|
| Documents sous forme graphique |
Demo





Avantages
- Améliore la réactivité
- présentation en ligne, avis d'alerte et courriel
- Améliore la productivité
- entrée de données uniques, lettres types et auto-éditions
- Favorise une déclaration d'incident efficace
- formulaires - simples et personnalisés
- Renforce l'analyse et la communication
- forer vers le bas et balayage
- Facilite la conformité aux règlements
Structure
