Cancer chez les jeunes au Canada: Rapport du système de surveillance accrue du cancer chez les enfants
Pour obtenir les plus récentes données du système de surveillance Cancer chez les jeunes au Canada, veuillez consulter l’outil de données sur le Cancer chez les jeunes au Canada

Télécharger le rapport complet (Format PDF, 2 743 ko, 62 pages)
Organisation : Santé Canada
Type : [Publication Type]
Publiée : 2017-10-23
Table des matières
Remerciements
Nous tenons tout d'abord à remercier les patients et leur famille d'avoir fourni des renseignements au programme Cancer chez les jeunes au Canada (CCJC). Ces précieux renseignements tirés de leur expérience contribuent à réduire le fardeau du cancer infantile au Canada.
Nous souhaitons souligner l'apport des centres et organismes d'oncologie pédiatrique participants : Alberta Children's Hospital, Allan Blair Cancer Centre, British Columbia Children's Hospital, ActionCancer Manitoba, Centre hospitalier universitaire de Sherbrooke, Centre hospitalier pour enfants de l'est de l'Ontario, Children's Hospital - London Health Sciences Centre, Centre hospitalier universitaire de Québec - Université Laval, Centre hospitalier universitaire Sainte-Justine, The Hospital for Sick Children, Izaak Walton Killam (IWK) Health Centre, Janeway Children's Health and Rehabilitation Centre, Hôpital général de Kingston, McMaster Children's Hospital, Hôpital de Montréal pour enfants, Saskatoon Cancer Centre, Stollery Children's Hospital et le Pediatric Oncology Group of Ontario (POGO).
Nous sommes particulièrement reconnaissants envers les nombreux assistants de recherche clinique qui ont travaillé avec diligence à l'extraction des données du CCJC en assurant leur qualité et en donnant des commentaires constructifs pendant le processus d'épuration des données.
Le personnel de l'Agence de la santé publique du Canada (ASPC) a largement contribué au programme. Nous remercions Kimberley Hutchings pour les nombreuses années de travail assidu passées à mettre en œuvre la base de données du CCJC. Nous remercions Maggie Stewart, Yong Jun Gao et Shiyi Chen, qui ont facilité l'intégration des éléments de données du système électronique d'information en réseau du POGO (POGONIS) au CCJC. Nous remercions Jocelyn Rouleau, qui a préparé les données du CCJC. Nous remercions également Robert Semenciw, autrefois de l'Agence de la santé publique du Canada, de nous avoir fourni des conseils statistiques.
Le système de surveillance du CCJC, entièrement financé par l'Agence de la santé publique du Canada, est créé en partenariat entre l'ASPC et le C17 Council, réseau des 17 centres d'oncologie pédiatrique au Canada.
Nous sommes sincèrement reconnaissants envers les registres provinciaux et territoriaux du cancer et la Division de la statistique de la santé de Statistique Canada, dont la collaboration nous a permis d'obtenir les données provenant du Registre canadien du cancer (RCC).
Équipe d'analyse et de rédaction
Debjani Mitra, Agence de la santé publique du Canada, Ottawa (Ontario)
Lin Xie, Agence de la santé publique du Canada, Ottawa (Ontario)
Jay Onysko, Agence de la santé publique du Canada, Ottawa (Ontario)
Membres du Comité directeur du CCJC
Jay Onysko (coprésident), Agence de la santé publique du Canada, Ottawa (Ontario)
Dr James A. Whitlock (coprésident), C17 Council et The Hospital for Sick Children, Toronto (Ontario)
Kathy Brodeur-Robb, C17 Council, Edmonton (Alberta)
Jonathan Ellison, Statistique Canada, Ottawa (Ontario)
Dr Mark Greenberg, Paediatric Oncology Group of Ontario (POGO), Toronto, Ontario
Dre Nada Jabado, Réseau de recherche C17 et Université McGill, Montréal (Québec)
Dre Melanie Keats, Université Dalhousie, Halifax (Nouvelle-Écosse)
Maureen MacIntyre, Conseil canadien des registres du cancer (CCRC) et Cancer Care Nova Scotia, Halifax (Nouvelle-Écosse)
Antonia Palmer, Neuroblastoma Canada, Ontario
Rami Rahal, Partenariat canadien contre le cancer (PCCC), Toronto (Ontario)
Dre Lillian Sung, The Hospital for Sick Children, Toronto (Ontario)
Comité de gestion du CCJC
Dre Lillian Sung (présidente actuelle), The Hospital for Sick Children, Toronto (Ontario)
Dr Mark Bernstein (ancien président), IWK Health Centre, Halifax (Nouvelle-Écosse)
Randy Barber, C17 Council, Edmonton (Alberta)
Rose-Émilie Bergeron, Centre universitaire de santé McGill, Montréal (Québec)
Samuel Ileka-Priouzeau, Agence de la santé publique du Canada, Ottawa (Ontario)
Émilie Martineau, Centre de recherche du CHU de Québec, Université Laval, Québec (Québec)
Debjani Mitra, Agence de la santé publique du Canada, Ottawa (Ontario)
Jay Onysko, Agence de la santé publique du Canada, Ottawa (Ontario)
Dr Jason Pole, Pediatric Oncology Group of Ontario (POGO), Toronto (Ontario)
Alicia Randall, IWK Health Centre, Halifax (Nouvelle-Écosse)
Dr David Stammers, Saskatoon Cancer Centre, Saskatoon (Saskatchewan)
Dre Caron Strahlendorf, British Columbia's Children's Hospital, Vancouver (Colombie-Britannique)
Dr Tony Truong, Alberta Children's Hospital, Calgary (Alberta)
Lin Xie, Agence de la santé publique du Canada, Ottawa (Ontario)
Chercheurs principaux du CCJC
Riaz Alvi, Saskatoon Cancer Centre, Saskatoon (Saskatchewan)
Dr Mark Bernstein, IWK Health Centre, Halifax (Nouvelle-Écosse)
Dre Lynette Bowes, Janeway Child Health Centre, St. John's (Terre-Neuve)
Dre Josée Brossard, Centre hospitalier universitaire de Sherbrooke, Sherbrooke (Québec)
Dr Henrique Bittencourt, Centre hospitalier universitaire Sainte-Justine, Montréal (Québec)
Dr David Eisenstat, Stollery Children's Hospital, Edmonton (Alberta)
Dre Sara Israels, ActionCancer Manitoba, Winnipeg (Manitoba)
Dr Ketan Kulkarni, IWK Health Centre, Halifax (Nouvelle-Écosse)
Dr Victor Lewis, Alberta Children's Hospital, Calgary (Alberta)
Dr Bruno Michon, CHU de Québec, Québec (Québec)
Dre Caron Strahlendorf, British Columbia Children's Hospital, Vancouver (Colombie-Britannique)
Dr Blair Whittemore, Hôpital de Montréal pour enfants, Montréal (Québec)
Nous aimerions également souligner la contribution des anciens membres du comité de gestion et du comité directeur du CCJC et les remercier de leurs vision, orientation et soutien : Victor Barbaros, Rose-Émilie Bergeron, Dre Anne-Sophie Carret, Val Figliuzzi, Dr Paul Grundy, Rebekah Hiebert, Kathy Hjalmarsson, Kimberley Hutchings, Heather Logan, Dr David Malkin, Dre Mary McBride, Les Mery, Dre Louise Parker, Amanda Shaw et Dre Donna Turner.
De plus amples renseignements sur le présent rapport sont disponibles auprès de :
Cancer chez les jeunes au Canada
Centre de surveillance et de recherche appliquée
Agence de la santé publique du Canada
785, avenue Carling, Ottawa (Ontario) K1A 0K9
Courriel : cypc-ccjc@phac-aspc.gc.ca
Site Web : http://www.phac-aspc.gc.ca/cd-mc/cancer/cancer_enfants-childhood_cancer-fra.php
Faits saillants du rapport
Les cancers infantiles sont relativement rares, mais contribuent de façon disproportionnée à la mortalité liée à la maladie et peuvent entraîner une morbidité chronique et des effets tardifs chez les survivantsNote de bas de page 1, Note de bas de page 2. Les cancers chez les enfants englobent un groupe hétérogène de tumeurs malignes dont la répartition diffère de chez l'adulte atteint. Pour la plupart des cancers pédiatriques, on en sait très peu sur l'étiologie des tumeurs chez les enfants, ce qui limite la possibilité de prévention primaire. Le système de surveillance de Cancer chez les jeunes au Canada (CCJC), qui est en cours d'élaboration depuis 2009, offre désormais la possibilité d'étudier des affections rares, comme les cancers infantiles, et de jeter les bases de la planification de programmes et de politiques de lutte contre le cancerNote de bas de page 3. Le système de surveillance de CCJC permet de recueillir des données approfondies sur le diagnostic, le traitement et l'issue concernant presque tous les cas de cancer chez les enfants de moins de 15 ans au Canada. Le CCJC est mené en étroite collaboration entre l'ensemble des 17 centres d'oncologie pédiatrique au Canada, le C17 Council, les registres provinciaux et territoriaux du cancer, Statistique Canada et les organismes non gouvernementaux qui luttent contre le cancer chez les enfants au Canada. Les chercheurs de l'extérieur peuvent aussi demander l'accès aux données du CCJC. Ce premier rapport présente un éventail de mesures de surveillance de base utilisant le CCJC et d'autres sources de données pertinentes pour donner un aperçu du potentiel du programme. Pour consulter les plus récentes données de surveillance concernant les cancers infantiles et d'autres affections chroniques, visitez l'Infobase de la santé publique en ligne de l'Agence de la santé publique du Canada (https://sante-infobase.canada.ca/).
Incidence du cancer chez les enfants
- Le présent rapport porte sur les données concernant 5 125 enfants ayant reçu un diagnostic de cancer au Canada entre le 1er janvier 2001 et le 31 décembre 2006 et qui ont été suivis pendant une période atteignant jusqu'à cinq ans. Durant cette période, 152 nouveaux cas de cancer infantile par million d'enfants ont été diagnostiqués, soit une moyenne d'environ 855 cas par année.
- Les taux d'incidence du cancer chez les enfants âgés de 0 à 4 ans (240 et 222 cas par million d'enfants de moins de 1 an et d'enfants de 1 à 4 ans, respectivement) sont presque deux fois plus élevés que chez les enfants âgés de 5 à 14 ans (118 et 112 cas par million d'enfants âgés de 5 à 9 ans et de 10 à 14 ans, respectivement).
- Les tendances liées au diagnostic varient grandement entre les groupes d'âge. Chez les nourrissons de moins d'un an, le neuroblastome représente près du tiers de tous les cas diagnostiqués (28,2 %), suivi des leucémies (17,5 %) et des tumeurs du système nerveux central (SNC) [16,0 %]. Chez les enfants de 1 à 4 ans, les leucémies représentent 41,7 % de tous les cas diagnostiqués, alors que, chez les 5 à 9 ans et les 10 à 14 ans, les lymphomes et les tumeurs osseuses sont de plus en plus fréquents.
- Les garçons ayant reçu un diagnostic de cancer sont plus nombreux que les filles pour la majorité des types de cancer. Cependant, le rétinoblastome, les tumeurs rénales, les tumeurs des cellules germinales et les carcinomes sont plus souvent diagnostiqués chez les filles que chez les garçons.
- Une tendance à la hausse de l'incidence des cancers infantiles observée dans les données du CCJC correspond aux tendances observées dans le Registre canadien du cancer.
Moment du diagnostic et traitement
- En moyenne, les enfants souffrant de cancer sont diagnostiqués et traités dans des délais relativement courts. À l'extérieur de l'Ontario :
- Le temps d'attente médian entre la première consultation médicale et le début du traitement contre le cancer est de 12 jours, à quelques variations près, selon l'âge et le diagnostic.
- Les enfants âgés de 1 à 4 ans sont ceux qui attendent le moins entre la première consultation et le traitement (9 jours), par rapport aux enfants plus vieux âgés de 10 à 14 ans (17 jours).
- Le temps d'attente médian entre la première consultation médicale et le début du traitement contre le cancer varie selon le diagnostic : c'est la leucémie qui est traitée le plus rapidement (5 jours), contrairement aux cancers moins fréquents comme les carcinomes et les autres néoplasmes (68 et 43 jours, respectivement).
Tendances de la planification initiale du traitement
- Au Canada, 26 % de tous les enfants sont inscrits à un essai clinique approuvé par un comité d'éthique de la recherche, mais cette participation varie selon le diagnostic.
- Parmi les enfants atteints du cancer, 44 % suivent un protocole d'essai clinique sans être inscrits à un tel essai.
Survie des enfants ayant reçu un diagnostic de cancer
- Pour les enfants chez qui un cancer a été diagnostiqué entre le 1er janvier 2001 et le 31 décembre 2006, le taux de survie général à 5 ans était de 81,5 %.
- La survie semble différer selon l'âge et le diagnostic. Les nourrissons de moins d'un an ayant reçu un diagnostic présentent le taux de survie à 5 ans le plus bas de tous les groupes d'âge (77,4 %).
- Les plus importants taux de survie à 5 ans selon le diagnostic se constatent chez les cas de rétinoblastome (97,0 %), de carcinomes (91,3 %) et de lymphomes (91,3 %), alors que le plus faible taux de survie à 5 ans se trouve dans les cas de tumeurs osseuses malignes (62,0 %) et de sarcomes des tissus mous (71,0 %).
Maladie métastatique au moment du diagnostic
- La présence d'une maladie métastatique lors du diagnostic, un indice de l'ampleur de la propagation du cancer, a une incidence sur le pronostic et détermine le plan de traitement à suivre. Des métastases ont été trouvées chez le quart des enfants atteints de cancer.
- Ainsi, les enfants atteints d'un neuroblastome, d'un lymphome, d'un carcinome et de tumeurs rénales ont plus de métastases au moment du diagnostic.
Rechute après le diagnostic
- Puisque plus d'enfants atteints du cancer survivent, il est encore plus important de mettre l'accent sur les soins aux survivants et leur vie à long terme. Les résultats du CCJC démontrent qu'environ 14,6 % des enfants vivent une récidive dans les 5 ans suivant un diagnostic.
- Parmi tous les patients souffrant de cancer infantile, ceux chez qui l'on diagnostique des tumeurs osseuses malignes et des sarcomes des tissus mous connaissent une rechute dans les cinq ans suivant leur diagnostic plus souvent que ceux dont le diagnostic est différent (24,9 % et 20,4 %, respectivement).
Présentation
Bien que le cancer infantile soit rare et représente moins de 1 % de tous les cancers diagnostiqués au Canada, il a de lourdes conséquences sur la santé des enfants et leur famille. Malgré une meilleure survie constatée au cours des trente dernières années, le cancer infantile demeure la principale cause de mortalité par maladie chez les enfants de plus d'un mois au CanadaNote de bas de page 3, Note de bas de page 4. Les traitements du cancer chez les enfants peuvent également créer un lourd fardeau en raison de l'invalidité grave et chronique qu'ils entraînent. Les répercussions médicales, psychosociales et financières à vie du cancer infantile sont bien documentées; on constate diverses séquelles, notamment des déficiences cognitives, des dommages aux principaux organes, comme le cœur, les reins, les poumons et le système nerveux central, une infertilité et un risque que le traitement cause des cancers secondairesNote de bas de page 1. On estime que plus de 60 % des survivants à un cancer infantile souffrent d'au moins une affection chronique et près de 30 % présentent une affection grave ou mettant la vie en dangerNote de bas de page 2.
Les cancers chez les enfants tendent à être différents de ceux dont sont atteints les adultes. Les enfants sont atteints de cancers embryonnaires ou hématopoïétiques (cancers du sang et des cellules et tissus lymphatiques) dans une grande proportionNote de bas de page 1. Chez les enfants, les principaux types de cancers sont les leucémies, les cancers du cerveau et du système nerveux et les lymphomes. Les cancers qui proviennent des cellules embryonnaires sont également assez fréquents chez les enfants; il s'agit des nephroblastomes, des neuroblastomes, des médulloblastomes, des rhabdomyosarcomes et des rétinoblastomes. Ces cancers ont habituellement une période de latence plus courte et peuvent croître avec rapidité et agressivité, mais ils réagissent généralement mieux à la chimiothérapie, de ce fait.
Comparativement aux cancers chez les adultes, seule une petite proportion de cancers infantiles a des causes connues, ce qui limite la possibilité d'assurer une prévention primaire et secondaireNote de bas de page 1. La rareté de la maladie, ses conséquences à vie et ses facteurs de risques généralement inconnus plaident en faveur d'un système national de surveillance spécialement conçu pour nous donner l'occasion d'étudier les affections rares, comme les cancers infantiles, et de jeter les bases de la planification de programmes et de politiques de lutte contre le cancer.
Pour compléter et consolider les données de base fournies par le Registre canadien du cancer (RCC), l'Agence de la santé publique du Canada a donc instauré, en 2009, un système pancanadien spécialisé de surveillance du cancer infantile qui permet le suivi actif des enfants de moins de 15 ans qui sont traités à l'un des 17 centres d'oncologie pédiatrique du paysNote de bas de page 3. Ce système est le renouvellement du Programme canadien de surveillance et de lutte contre le cancer chez les enfants (PCSLCE)Note de bas de page 5 du gouvernement fédéral. Créé en 1992 dans le cadre de l'initiative Grandir ensemble, le PCSLCE renfermait des données détaillées sur le diagnostic, les traitements, l'issue de la maladie et l'utilisation des services de soins de santé de chaque enfant atteint d'un cancer. Le CCJC a commencé à recueillir des données de surveillance nationales en 2009 et couvre les cas de cancer nouvellement diagnostiqués à partir de 2001. Le système de surveillance permet de recueillir des données démographiques (date de naissance, groupe ethnique, province et code postal de la résidence au moment du diagnostic), des détails sur le diagnostic (date du diagnostic, type de diagnostic, site, stade et présence de métastases au moment du diagnostic), des renseignements sur les traitements reçus (participation à un essai clinique, détails du plan de traitement), lieu et moment des soins et l'issue de la maladie (hospitalisations, interventions chirurgicales, complications, rechute, survie)Note de bas de page 3. Ces données peuvent être consultées dans le cadre de recherches liées aux cancers infantiles (voir ANNEXE A pour plus de détails). Ce premier rapport présente un éventail de mesures de surveillance de base utilisant le CCJC et d'autres sources de données pertinentes pour donner un aperçu du potentiel du programme.
| Centre | Lieu |
|---|---|
| Hôpital pour enfants de la C.-B. | Vancouver (Colombie-Britannique) |
| Hôpital pour enfants de l'Alberta | Calgary (Alberta) |
| Hôpital Stollery pour enfants | Edmonton (Alberta) |
| Saskatoon Cancer Centre | Saskatoon (Saskatchewan) |
| Allan Blair Cancer Centre | Régina (Saskatchewan) |
| ActionCancer Manitoba | Winnipeg (Manitoba) |
| Children's Hospital, London Health Sciences Centre | London (Ontario)Note de bas de page * |
| McMaster Children's Hospital | Hamilton (Ontario)Note de bas de page * |
| The Hospital for Sick Children | Toronto (Ontario)Note de bas de page * |
| Kingston General Hospital | Kingston (Ontario)Note de bas de page * |
| Centre hospitalier pour enfants de l'est de l'Ontario | Ottawa (Ontario)Note de bas de page * |
| Centre hospitalier universitaire Sainte-Justine | Montréal (Québec) |
| Hôpital pour les enfants de Montréal | Montréal (Québec) |
| Centre hospitalier universitaire de Sherbrooke | Sherbrooke (Québec) |
| Centre hospitalier universitaire de Québec - Université Laval | Québec (Québec) |
| Izaak Walton Killam Health Centre | Halifax (Nouvelle-Écosse) |
| Janeway Children's Health and Rehabilitation Centre | St. John's (Terre-Neuve) |
|
|
Objectifs et bien-fondé du programme
Le système de surveillance du CCJC a été conçu pour combler le manque de connaissances liées à la lutte contre le cancer en recueillant des données sur le diagnostic, le traitement et les issues à court et à moyen terme de tous les enfants du Canada ayant reçu un diagnostic de cancer. Il permet d'examiner les variations dans les tendances relatives au diagnostic et au traitement ainsi que les résultats dans tout le pays et sert de fondement à l'examen de la santé et du fonctionnement à long terme, ainsi qu'aux investigations étiologiques. Le système de surveillance a plusieurs objectifs, notamment :
- fournir des données nationales et régionales fondées sur la population concernant le cancer infantile en matière d'incidence, de mortalité et de survie;
- décrire les caractéristiques et les tendances de l'incidence, de la mortalité et de la survie relativement au cancer infantile selon le sexe, l'âge au moment du diagnostic, l'année ainsi que le lieu du diagnostic, le type de cancer, le stade, la catégorie de risque et la portée de la maladie;
- évaluer l'issue de la maladie à court et à moyen terme, tel que les rechutes, les toxicités et les complications liées au traitement;
- fournir des données sur le moment, le lieu et l'utilisation des soins de santé pour des besoins d'évaluation et de planification;
- servir de ressource pour soulever des hypothèses et effectuer des recherches sur le cancer chez les enfants.
Portée du rapport
Le présent rapport vise à fournir aux cliniciens, aux chercheurs et aux décideurs des données de surveillance pertinentes sur le cancer infantile au Canada, ainsi que des renseignements qui serviront à élaborer de nouvelles questions de recherche et investigations étiologiques. Il est le tout premier rapport du système de surveillance du CCJC. Il rend compte de l'analyse des données de surveillance sur les enfants âgés de 0 à 14 ans qui ont reçu un diagnostic de cancer au Canada entre le 1er janvier 2001 et le 31 décembre 2006, ainsi que des données de suivi sur l'issue de la maladie jusqu'au 31 décembre 2011, période pour laquelle toutes les données ont été vérifiées.
Sources de données
Collecte de données du CCJC et critères d'inclusion
Il vise à inclure tous les enfants de moins de 15 ans qui ont reçu un diagnostic et qui ont été traités à l'un des centres d'oncologie pédiatrique au Canada; ce diagnostic doit figurer dans la Classification internationale du cancer chez les enfants, 3e édition (CICE-3)Note de bas de page 6. Seuls les diagnostics posés en 2001 ou plus tard, chez un enfant résidant au Canada depuis au moins un mois avant le diagnostic, sont inclus. Selon des comparaisons faites entre les cas d'incidence du CCJC et ceux du RCCNote de bas de page 7, très peu de cas de cancer infantile (de 0 à 14 ans) sont traités à l'extérieur de ces centresNote de bas de page 3. Pour chaque enfant, des données sont recueillies pendant au plus cinq ans après le diagnostic (ou jusqu'au décès). Cela dit, si une tumeur maligne subséquente répondant aux critères d'admissibilité du CCJC est diagnostiquée chez un enfant, des données sont recueillies pendant cinq autres années après ce second diagnostic.
Il existe deux grandes méthodes de collecte de données. Les centres de l'Ontario n'utilisent pas la même méthode que les centres situés à l'extérieur de cette province. En Ontario, le Pediatric Oncology Group of Ontario (POGO) tient à jour un registre des nouveaux cas de cancer fondé sur la population depuis 1985 qui ont été diagnostiqués ou traités à l'un des cinq centres d'oncologie pédiatrique de la province. Les données sont ensuite communiquées à l'Agence de la santé publique du Canada dans le cadre d'une entente d'échange de données. Dans toutes les autres provinces et territoires canadiens, les données sont extraites directement des dossiers médicaux des patients par des assistants de recherche clinique et saisies dans un outil électronique de gestion et de saisie de données sécurisé. Elles sont ensuite colligées à l'Agence de la santé publique du Canada à Ottawa, en Ontario (voir l'ANNEXE B pour une explication détaillée quant à l'intégration des données).
Les comités d'éthique de la recherche à l'Agence de la santé publique du Canada et à tous les centres d'oncologie pédiatrique situés à l'extérieur de l'Ontario et effectuant une collecte directe de données ont permis au CCJC de recueillir des données détaillées sur tout enfant admissible, créant ainsi un véritable système de surveillance fondé sur la populationNote de bas de page 3. Les chercheurs à l'extérieur des 17 centres d'oncologie pédiatrique participants peuvent aussi demander à consulter les données du CCJC (voir l'ANNEXE A).
Base de données du Registre canadien du cancer pour les tendances de l'incidence du cancer
Les tendances de l'incidence du cancer à long terme ont également été examinées à partir de la base de données du RCCNote de bas de page 7 (de 1992 à 2010). Les données du Québec de 2008 à 2010 étaient incomplètes dans le RCC, par conséquent, les données pour ces années ont été obtenues sous forme de résumé auprès de l'Institut national de santé publique du Québec. Les données sur l'incidence sont recueillies par les registres provinciaux et territoriaux du cancer, qui les communiquent chaque année au RCC de Statistique Canada. Le RCC est une base de données dynamique axée sur les personnes et fondée sur la population qui contient les nouveaux cas diagnostiqués à partir de 1992.
Base de données sur les décès - Statistique de l'état civil (BCDECD) pour les tendances de la mortalité par cancer
Les tendances de la mortalité par cancer à long terme ont été examinées à l'aide de la Base de données sur les décès - Statistique de l'état civil (BCDECD, de 1992 à 2010) Note de bas de page 8, Note de bas de page 9. Les registres des décès proviennent des registraires provinciaux et territoriaux des statistiques de l'état civil et sont fournis régulièrement à Statistique Canada pour être inclus dans la BCDECD. Les décès par cancer sont ceux qui ont pour cause sous-jacente une certaine forme de cancer, telle que certifiée par un médecin.
Données démographiques pour calculer les taux d'incidence du cancer
Les estimations sur la population du Canada et des provinces et territoires reposent sur les recensements quinquennaux menés entre 1991 et 2011. Nous avons utilisé les estimations intercensitaires établies par Statistique Canada pour les années entre chaque recensementNote de bas de page 10.
Validation et intégralité des données
Le nombre de cas saisis dans le cadre du CCJC combiné aux données saisies dans le système électronique d'information en réseau du Pediatric Oncology Group of Ontario (POGONIS) représente près de 95 % des cas de tumeurs malignes saisis dans le RCC. En plus des cas de tumeurs malignes, le CCJC et le POGONIS capturent les cas de tumeurs bénignes ou à la limite de la malignité (non malignes) que le RCC ne saisit pas systématiquement dans toutes les provinces et tous les territoires ou tous les ansNote de bas de page 4. Les tumeurs non malignes constituent environ 8 % de tous les cas saisis dans le cadre du CCJC et dans le POGONIS de 2001 à 2006. Voir le tableau A1 (de l'ANNEXE B) pour obtenir une comparaison annuelle des cas saisis dans le RCC et dans le système du CCJC et du POGONIS.
Alors que le POGONIS saisit des données régulièrement depuis 1985, le système de surveillance du CCJC est alimenté par un processus de capture de données historiques qui a débuté en 2009. Il est toujours possible que d'autres cas antérieurs soient ajoutés à l'avenir. L'ensemble des figures et des tableaux présentés dans ce rapport peuvent donc faire l'objet d'une révision.
Méthodes
Les données utilisées pour toutes les analyses du CCJC ont été extraites du système le 1er décembre 2016. Les taux d'incidence standardisés selon l'âge (TISA), les proportions selon le sexe de tous les cancers combinés et selon le type de cancer, ainsi que les proportions de survie observées (PSO) ont été calculés pour les enfants âgés de moins de 15 ans au moment du diagnostic et ayant reçu un diagnostic de cancer figurant dans la CICE-3 (y compris les histiocytoses à cellules de Langerhans et les autres histiocytoses) entre le 1er janvier 2001 et le 31 décembre 2006 (N = 5125). Chacun des cas inscrits dans le CCJC a fait l'objet d'un suivi pendant cinq ans après la date du diagnostic.
Les données démographiques et cliniques utilisées pour élaborer le présent rapport sont notamment la date du diagnostic, la date de naissance, l'âge au moment du diagnostic, le sexe, le groupe ethnique, la province ou la région au moment du diagnostic, le type de diagnostic, le caractère malin ou bénin du cancer dès le départ, la présence ou l'absence de métastases au moment du diagnostic, le plan de traitement suivi, les délais entre le diagnostic et le traitement, la date du décès ainsi que le statut vital lors de la dernière période de suivi, laquelle s'est échelonnée sur cinq ans à partir de la date du diagnostic (rechute ou décès, et dates connexes).
Il est important de noter que les décès survenus dans la cohorte n'ont pas été confirmés et que le nombre de décès peut, de ce fait, être légèrement sous-estimé. Les totalisations personnalisées tirées du RCC indiquent que les cas fondés sur un certificat de décès seulement (CDS) parmi les enfants ayant reçu un diagnostic de cancer avant l'âge de 15 ans sont très rares et que moins de 0,25 % de tous les cancers infantiles sont des cas de CDS. L'âge au moment du diagnostic a servi à répartir les cas dans les groupes d'âge suivants : moins de 1 an, de 1 à 4 ans, de 5 à 9 ans et de 10 à 14 ans. Les régions utilisées dans le présent rapport se fondent sur les renseignements les plus exacts quant au lieu de résidence du patient qui étaient disponibles au moment du diagnostic. Voici les catégories régionales utilisées : Atlantique (Nouvelle-Écosse, Nouveau-Brunswick, Île-du-Prince-Édouard et Terre-Neuve-et-Labrador); Prairies (Manitoba, Saskatchewan et Alberta); Territoires (Yukon, Territoires du Nord-Ouest et Nunavut); Colombie-Britannique, Ontario et Québec.
Les TISA calculés à l'aide de la méthode directeNote de bas de page 12 représentent le nombre annuel moyen de cas par million d'enfants. La méthode directe a recours aux taux d'incidence pondérés selon l'âge pour quatre groupes d'âge (moins de 1 an, de 1 à 4 ans, de 5 à 9 ans et de 10 à 14 ans) selon la population canadienne type de 1991. Les taux d'incidence sont calculés en fonction du nombre de néoplasmes primaires, qui peuvent être observés plus d'une fois sur un seul patient.
Le logiciel de régression Joinpoint a été utilisé pour déterminer les changements quant aux tendances liées aux taux annuels standardisés selon l'âge pour les cancers sélectionnés au cours de la période s'échelonnant de 2001 à 2010, tant pour l'incidence que pour la mortalitéNote de bas de page 13. La variation annuelle en pourcentage (VAP) des taux d'incidence du cancer et de mortalité par cancer a été calculée en ajustant un modèle de régression linéaire par morceaux en présumant que le taux de variation du logarithme des TISA et des TMSA annuels dans chaque segment est constantNote de bas de page 14. Enfin, la pente estimée au moyen de ce modèle a été de nouveau transformée pour exprimer un pourcentage d'augmentation ou de diminution annuelle de ces taux. Les modèles prévoyaient les erreurs types estimées des TISA et des TMSA. Afin de réduire les probabilités que de faux changements soient signalés sur le plan des tendances, nous avons utilisé au moins cinq observations à partir d'un point de jonction à l'une ou l'autre des extrémités de la série de données et au moins quatre observations entre les points de jonction. La signification statistique a été déterminée à l'aide de la méthode de permutation de Monte Carlo, en appliquant la correction de Bonferroni et un seuil de signification de 0,05. La VAP est jugée statistiquement significative lorsque l'intervalle de confiance (IC) à 95 % ne comprend pas la valeur zéro (p < 0,05).
Les intervalles diagnostiques et de traitement ont été examinés pour les cancers diagnostiqués de 2001 à 2006, notamment : 1) le temps d'attente entre la première consultation médicale et la date du diagnostic définitif; 2) le temps d'attente entre la date du diagnostic définitif et le début du traitement contre le cancer et 3) le temps d'attente entre la première consultation médicale et le début du traitement contre le cancer. Les cas de l'Ontario ont été exclus de l'analyse en raison des différences dans la détermination des dates servant à calculer les intervalles de tempsNote de bas de page 15. La médiane et l'intervalle interquartile (entre le 25e et le 75e centile) pour le temps d'attente ont été calculés selon le sexe, l'âge au moment du diagnostic, la région de résidence au moment du diagnostic et le type de cancer. Le test de WilcoxonNote de bas de page 16 a été utilisé pour tester les écarts entre les médianes. Un test de signification bilatéral (p < 0,05) a été utilisé pour trouver la signification statistique.
La méthode actuarielle a servi à calculer les PSO après un, trois et cinq ans. Cette méthode d'analyse a été utilisée puisque les cas ont été diagnostiqués à l'intérieur d'une période bien définie (entre 2001 et 2006) et ont fait l'objet d'un suivi sur le statut vital au cours de toute la période concernée (cinq ans). Les IC asymétriques à 95 % ont été calculés au moyen d'une transformation logarithmique.
Pour assurer la confidentialité et éviter toute déduction par recoupements possible, tous les chiffres ont été arrondis de façon aléatoire, à l'unité inférieure ou supérieure selon un multiple de 5. Par conséquent, si ces chiffres sont additionnés, il est possible qu'ils ne correspondent pas aux totaux et aux pourcentages présentés dans les tableaux. Le taux d'incidence par groupe d'âge a été calculé à l'aide du numérateur arrondi de façon aléatoire, alors que le taux d'incidence standardisé selon l'âge a été calculé à partir du vrai chiffre. Ces deux types de taux ne sont pas présentés lorsque les chiffres réels sont inférieurs à trois.
Exclusions
Les enfants qui ne résident pas au Canada, mais qui ont été diagnostiqués ou traités temporairement au Canada ont été exclus des analyses. En outre, les cas d'évolution authentique de la maladie (12 cas), où la maladie diagnostiquée au départ a ensuite évolué pour adopter une morphologie différente ou devenir une tumeur de grade plus élevé, ont aussi été exclus, tout comme les cas pour lesquels il n'y avait pas de renseignements dans la CICE (80 cas). Les cas de l'Ontario dont le diagnostic et le traitement subséquent n'ont pas été faits dans un emplacement participant au programme du POGO, ou les enfants qui ont été soignés dans un emplacement participant au programme du POGO, mais qui ne résidaient pas en Ontario (240 cas) ont aussi été exclus.
Limites
Les analyses descriptives présentées dans le présent rapport ne tiennent pas compte des facteurs confusionnels autres que ceux décrits. Les taux ont été calculés, quel que soit le nombre de cas regroupés, sauf indication contraire. Étant donné la rareté relative de certains cancers, les taux présentés dans ce rapport doivent être interprétés avec prudence, car il peut être difficile de distinguer les différences fondées sur une fluctuation aléatoire des véritables différences liées au taux sous-jacent lorsque le nombre de cas est petit (p. ex. moins de 20 cas).
Résultats
Incidence du cancer chez les enfants
En tout, ce sont 5 125 nouveaux cas de cancer chez les enfants (de 0 à 14 ans) qui ont été inclus dans le système de surveillance du CCJC entre 2001 et 2006. En moyenne, 855 enfants ont donc reçu un diagnostic de cancer chaque année. La plupart des enfants sont atteints d'une seule tumeur maligne (99,6 %). Le CCJC recueille des données sur les premiers diagnostics qui ont ensuite été modifiées en raison de nouvelles constatations cliniques, pathologiques ou radiologiques. Un diagnostic révisé a été donné à 51 enfants (environ 1,7 % des cas) ayant reçu un diagnostic de cancer entre 2001 et 2006.
Le tableau 1 présente une description de la cohorte présentée dans ce rapport. Les enfants de moins de 5 ans reçoivent plus fréquemment un diagnostic de cancer (45,5 %) que ceux âgés de 5 à 9 ans ou de 10 à 14 ans, et un peu plus de la moitié de ces enfants sont des garçons (54,8 %). La majorité des enfants habitaient l'Ontario (41,1 %) ou le Québec (23,0 %) au moment du diagnostic. Très peu d'enfants vivaient dans les Territoires du Nord-Ouest, au Yukon ou au Nunavut (moins de 0,5 %) et tous les résultats concernant les territoires doivent donc être interprétés avec prudence. Le principal groupe ethnique touché est celui des Blancs ou Caucasiens (71,8 %), suivi des Asiatiques (10,3 %). Environ 7,7 % des cas sont considérés comme étant Noirs, Arabes ou originaires de l'Asie occidentale, ou d'origine ethnique mixte, alors que 2,4 % sont considérés comme étant de descendance autochtone et 1,1 %, de descendance latino-américaine (tableau 1). Ces proportions reflètent la diversité des enfants au Canada pour la plupart des groupes ethniques, à l'exception des enfants autochtones issus des Premières Nations, des Inuits et des Métis qui, selon le Recensement de 2006, représentent 6,3 %Note de bas de page 17 de la population canadienne totale des enfants âgés de 0 à 14 ans, et des enfants noirs qui représentent 4,0 % de la population canadienne totale des enfants du même âgeNote de bas de page 18. La sous-représentation de ces groupes ethnoculturels peut rendre compte des limites de l'utilisation des dossiers médicaux pour préciser les construits ethniques et culturels, telles que prescrites par les procédures de collecte de données du CCJC, par rapport à la collecte de données dans le cadre du Recensement, qui dépend de la déclaration volontaire. L'importance d'explorer les différences dans l'incidence du cancer infantile selon le groupe ethnique au Canada est donc également mise en évidence, puisque des tendances d'ordre géographique et ethnique de l'incidence du cancer chez les enfants ont été observées dans le monde entierNote de bas de page 19.
| Nombre de diagnostics | Pourcentage (%) | |
|---|---|---|
| Nombre total de diagnostics | 5125 | |
| Âge au moment du diagnostic (en années) | ||
| <1 | 490 | 9,5 % |
| 1 à 4 | 1845 | 36,0 % |
| 5 à 9 | 1365 | 26,7 % |
| 10 à 14 | 1420 | 27,8 % |
| Sexe | ||
| Garçon | 2810 | 54,8 % |
| Fille | 2315 | 45,2 % |
| Origine ethnique | ||
| Autochtone | 125 | 2,4 % |
| Arabe/Asiatique occidental | 95 | 1,9 % |
| Asiatique | 530 | 10,3 % |
| Noir | 145 | 2,8 % |
| Latino-Américain | 60 | 1,1 % |
| Blanc | 3675 | 71,8 % |
| Autre/origine ethnique mixte | 150 | 3,0 % |
| Inconnu/manquant | 345 | 6,7 % |
| Année du diagnostic | ||
| 2001 | 840 | 16,4 % |
| 2002 | 855 | 16,6 % |
| 2003 | 860 | 16,8 % |
| 2004 | 820 | 16,0 % |
| 2005 | 885 | 17,3 % |
| 2006 | 865 | 16,9 % |
| Région | ||
| Atlantique | 360 | 7,0 % |
| Québec | 1180 | 23,0 % |
| Ontario | 2105 | 41,1 % |
| Prairies | 865 | 16,9 % |
| Colombie-Britannique | 590 | 11,6 % |
| Territoires | 15 | 0,3 % |
| Tumeurs malignes primaires | ||
| Une seule tumeur maligne | 5105 | 99,6 % |
| Au moins deux tumeurs malignes | 20 | 0,4 % |
Sources de données :
Remarque :
|
||
Cancers les plus courants
Dans l'ensemble, les leucémies (31,4 %), les tumeurs du système nerveux central (SNC) [23,7 %] et les lymphomes (13,4 %) représentent les groupes de diagnostics du CICE-3 les plus fréquents (figure 1). Contrairement aux adultes, chez qui ils dominent, les carcinomes sont très rares chez les enfants et représentent 2,9 % de toutes les tumeurs malignes diagnostiquées. Chez les enfants, ce sont les tumeurs embryonnaires qui sont observées, et elles constituent environ le quart de tous les diagnostics (tableau 2).
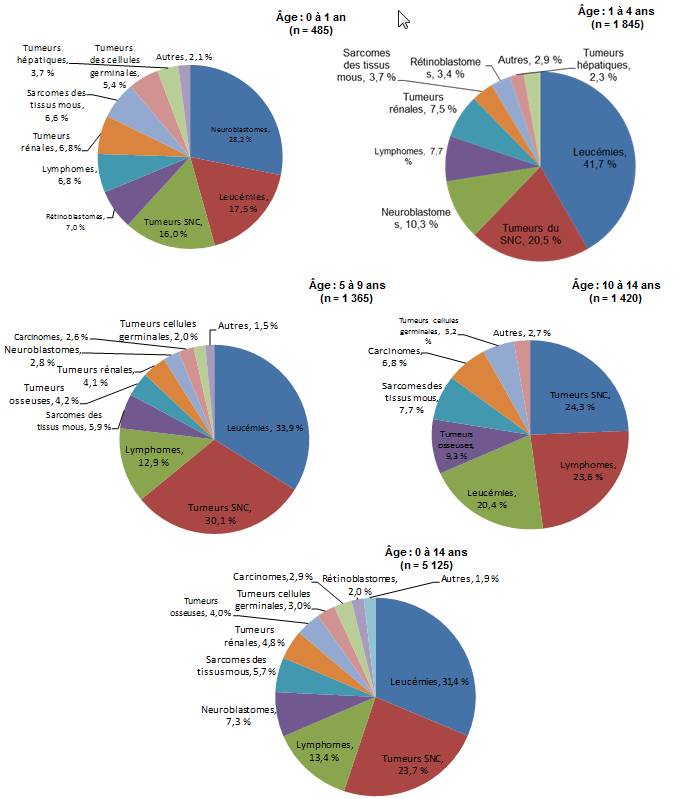
Figure 1 - Équivalent du texte
La figure 1 présente une série de cinq diagrammes à secteurs, chacun d’eux représentant l’un des cinq groupes d’âge d’enfants. Chaque diagramme à secteurs indique la proportion de nouveaux cas de cancer diagnostiqués de 2001 à 2006 par type de cancer en pourcentage du total de tous les diagnostics de cancer établis pendant cette période chez les enfants de ce groupe d’âge. Les groupes d’âge comprennent les enfants de 0 à 14 ans, de moins d’un an, de 1 à 4 ans, de 5 à 9 ans et de 10 à 14 ans. Les types de cancer dans chaque diagramme comprennent les grandes catégories de diagnostic résumées comme suit : leucémies, tumeurs du système nerveux central, lymphomes, neuroblastomes, sarcomes des tissus mous, tumeurs rénales, tumeurs osseuses, tumeurs des cellules germinales, carcinome, rétinoblastome et autres cancers. Seules les catégories représentant au moins 2 % de tous les diagnostics pour chaque groupe d’âge ont été représentées dans chacun des diagrammes à secteurs.
Le tableau de la figure 1 ci-dessous comprend les pourcentages représentés dans les diagrammes à secteurs. Pour chaque groupe d’âge, les trois cancers les plus fréquemment diagnostiqués se distinguent nettement dans la mesure où ils représentent au moins deux tiers de tous les diagnostics. Les types des trois cancers les plus fréquemment diagnostiqués diffèrent selon les groupes d’âge. Les neuroblastomes (28,2 %) suivis des leucémies (17,5 %) et des tumeurs du système nerveux central (16 %) sont les cancers les plus fréquents chez les enfants de moins d’un an. Chez les enfants de 1 à 4 ans, les leucémies (41,7 %) sont plus fréquentes que les tumeurs du système nerveux central (20,5 %) et les neuroblastomes (10,3 %), tandis que chez les enfants de 5 à 9 ans, les leucémies sont les plus fréquentes (33,9 %) suivies par les tumeurs du système nerveux central (30,1 %) et les lymphomes (12,9 %). Collectivement, les cancers les plus fréquemment diagnostiqués chez les enfants de 0 à 14 ans sont les leucémies (31,4 %), les tumeurs du système nerveux central (23,7 %) et les lymphomes (13,4 %).
| Type de cancer | Enfants de 0 à 14 ans | Enfants de moins d’un an | Enfants de 1 à 4 ans | Enfants de 5 à 9 ans | Enfants de 10 à 14 ans |
|---|---|---|---|---|---|
| Leucémies | 31,4 % | 17,5 % | 41,7 % | 33,9 % | 20,4 % |
| Tumeurs du système nerveux central | 23,7 % | 16,0 % | 20,5 % | 30,1 % | 24,3 % |
| Lymphomes | 13,4 % | 6,8 % | 7,7 % | 12,9 % | 23,6 % |
| Neuroblastomes | 7,3 % | 28,2 % | 10,3 % | 2,8 % | |
| Sarcomes des tissus mous | 5,7 % | 6,6 % | 3,7 % | 5,9 % | 7,7 % |
| Tumeurs rénales | 4,8 % | 6,8 % | 7,5 % | 4,1 % | |
| Tumeurs aux os | 4,0 % | 4,2 % | 9,3 % | ||
| Tumeurs des cellules germinales | 3,0 % | 5,4 % | 2,0 % | 5,2 % | |
| Carcinome | 2,9 % | 2,6 % | 6,8 % | ||
| Rétinoblastome | 2,0 % | 7,0 % | 3,4 % | ||
| Autres cancers | 1,9 % | 2,1 % | 2,9 % | 1,5 % | 2,7 % |
| Tumeurs hépatiques | 3,7 % | 2,3 % |
Sources des données : Programme Cancer chez les jeunes au Canada et système d’information en réseau du Pediatric Oncology Group of Ontario
Remarque :
Sources de données : Programme Cancer chez les jeunes au Canada (CCJC)/système électronique d'information en réseau du Pediatric Oncology Group of Ontario
| Type de cancer | Nouveaux cas | TISA (pour 1 000 000 d'enfants) | |||||
|---|---|---|---|---|---|---|---|
| Garçons | Filles | Total | G/FNote de bas de page * | Garçons | Filles | Total | |
| Tous les cancers combinés | 2810 | 2320 | 5125 | 1,2 | 163 | 141,2 | 152,4 |
| I Leucémies, syndromes myéloprolifératifs et syndromes myélodysplasiques | 895 | 710 | 1610 | 1,3 | 53 | 43,9 | 48,6 |
| I a) Leucémies lymphoïdes | 750 | 550 | 1300 | 1,4 | 44,2 | 34,3 | 39,4 |
| I b) Leucémies myéloïdes aiguës | 105 | 100 | 205 | 1,0 | 5,9 | 6,2 | 6 |
| I c) Syndromes myéloprolifératifs chroniques | 10 | 20 | 30 | 0,7 | 0,6 | 0,9 | 0,8 |
| I d) Syndromes myélodysplasiques et autres syndromes myéloprolifératifs | 25 | 30 | 55 | 0,9 | 1,6 | 1,9 | 1,8 |
| I e) Leucémies non précisées et autres leucémies précisées | 10 | 10 | 20 | 1,1 | 0,6 | 0,6 | 0,6 |
| II Lymphomes et tumeurs réticuloendothéliales | 440 | 245 | 685 | 1,8 | 24,5 | 14,2 | 19,5 |
| II a) Lymphome de Hodgkin | 125 | 95 | 220 | 1,3 | 6,5 | 5 | 5,8 |
| II b) Lymphomes non hodgkiniens (sauf le lymphome de Burkitt) | 130 | 65 | 195 | 2,0 | 7,1 | 3,7 | 5,5 |
| II c) Lymphome de Burkitt | 80 | 15 | 95 | 5,3 | 4,4 | 0,9 | 2,7 |
| II d) Tumeurs lymphoréticulaires diverses | 105 | 75 | 175 | 1,5 | 6,4 | 4,5 | 5,5 |
| II e) Lymphomes non précisés | <5 | <5 | <5 | 3,0 | 0,2 | ‒ | 0,1 |
| III Tumeurs du SNC et diverses tumeurs intracrâniennes et intramédullaires | 660 | 555 | 1210 | 1,2 | 38 | 33,3 | 35,7 |
| III a) Épendymomes et tumeurs des plexus choroïdes | 70 | 50 | 120 | 1,4 | 4 | 3,1 | 3,6 |
| III b) Astrocytomes | 265 | 255 | 525 | 1,1 | 15,5 | 15,4 | 15,4 |
| III c) Tumeurs embryonnaires intracrâniennes et intramédullaires | 160 | 95 | 255 | 1,7 | 9,3 | 5,9 | 7,6 |
| III d) Autres gliomes | 70 | 55 | 120 | 1,2 | 3,8 | 3,2 | 3,5 |
| III e) Autres tumeurs intracrâniennes et intramédullaires précisées | 95 | 90 | 185 | 1,0 | 5,1 | 5,3 | 5,2 |
| III f) Tumeurs intracrâniennes et intramédullaires non précisées | <5 | 5 | 10 | 0,6 | 0,2 | 0,4 | 0,3 |
| IV Neuroblastomes et autres tumeurs du système nerveux périphérique | 205 | 165 | 375 | 1,3 | 13,2 | 10,9 | 12,1 |
| IV a) Neuroblastome et ganglioneuroblastome | 210 | 165 | 370 | 1,3 | 13,1 | 10,8 | 12 |
| IV b) Autres tumeurs du système nerveux périphérique | <5 | <5 | <5 | 2,0 | ‒ | ‒ | 0,1 |
| V Rétinoblastome | 40 | 55 | 100 | 0,7 | 2,7 | 3,9 | 3,3 |
| VI Tumeurs rénales | 115 | 130 | 245 | 0,9 | 7,1 | 8,2 | 7,6 |
| VI a) Néphroblastome et autres tumeurs rénales non épithéliales | 110 | 120 | 235 | 0,9 | 6,8 | 7,8 | 7,3 |
| VI b) Carcinomes rénaux | 5 | 5 | 10 | 1,0 | 0,3 | 0,3 | 0,3 |
| VII Tumeurs hépatiques | 45 | 35 | 80 | 1,2 | 2,6 | 2,3 | 2,5 |
| VII a) Hépatoblastome | 35 | 35 | 65 | 1,2 | 2,3 | 2,1 | 2,2 |
| VII b) Carcinomes hépatiques | 5 | <5 | 10 | 1,7 | 0,3 | 0,2 | 0,2 |
| VII c) Tumeurs hépatiques malignes non précisées | <5 | 0 | <5 | ‒ | ‒ | ‒ | |
| VIII Tumeurs osseuses malignes | 105 | 105 | 210 | 1,0 | 5,6 | 5,7 | 5,7 |
| VIII a) Ostéosarcomes | 55 | 50 | 105 | 1,1 | 2,9 | 2,8 | 2,8 |
| VIII b) Chondrosarcomes | 0 | <5 | <5 | 0,0 | ‒ | ‒ | ‒ |
| VIII c) Sarcome d'Ewing et ostéosarcomes apparentés | 45 | 45 | 85 | 1,0 | 2,4 | 2,4 | 2,4 |
| VIII d) Autres tumeurs osseuses malignes précisées | <5 | 10 | 10 | 0,4 | 0,2 | 0,4 | 0,3 |
| VIII e) Tumeurs osseuses malignes non précisées | <5 | <5 | <5 | 3,0 | 0,2 | ‒ | 0,1 |
| IX Sarcomes des tissus mous et autres sarcomes extra-osseux | 150 | 135 | 290 | 1,1 | 8,6 | 8,3 | 8,5 |
| IX a) Rhabdomyosarcomes | 75 | 65 | 140 | 1,2 | 4,3 | 3,7 | 4 |
| IX b) Fibrosarcomes, tumeurs de la gaine des nerfs périphériques et autres tumeurs fibromateuses | 10 | 25 | 35 | 0,4 | 0,7 | 1,6 | 1,1 |
| IX d) Autres sarcomes des tissus mous précisés | 50 | 45 | 100 | 1,2 | 2,9 | 2,7 | 2,8 |
| IX e) Sarcomes des tissus mous non précisés | 15 | 10 | 20 | 1,9 | 0,7 | 0,4 | 0,6 |
| X Tumeurs germinales, trophoblastiques et gonadiques | 70 | 85 | 150 | 0,8 | 3,9 | 4,9 | 4,4 |
| X a) Tumeurs germinales intracrâniennes et intramédullaires | 30 | 15 | 45 | 2,1 | 1,6 | 0,8 | 1,2 |
| X b) Tumeurs germinales extragonadiques et extracrâniennes malignes | 15 | 25 | 40 | 0,6 | 0,8 | 1,5 | 1,2 |
| X c) Tumeurs germinales gonadiques malignes | 20 | 45 | 60 | 0,4 | 1,1 | 2,4 | 1,7 |
| X d) Carcinomes gonadiques | 0 | <5 | <5 | 0,0 | ‒ | ‒ | ‒ |
| X e) Autres tumeurs gonadiques malignes et tumeurs gonadiques malignes non précisées | 5 | <5 | 10 | 1,7 | 0,3 | 0,2 | 0,2 |
| XI Autres tumeurs épithéliales malignes et mélanomes malins | 60 | 90 | 150 | 0,7 | 3,2 | 5 | 4,1 |
| XI a) Carcinomes corticosurrénaliens | <5 | 10 | 15 | 0,5 | 0,3 | 0,5 | 0,4 |
| XI b) Carcinomes thyroïdiens | 10 | 40 | 55 | 0,4 | 0,8 | 2,2 | 1,5 |
| XI c) Carcinomes nasopharyngés | <5 | <5 | 5 | 0,8 | 0,2 | 0,2 | 0,2 |
| XI d) Mélanomes malins | 10 | 10 | 25 | 0,9 | 0,6 | 0,7 | 0,6 |
| XI e) Carcinomes de la peau | <5 | <5 | <5 | 1,0 | ‒ | ‒ | 0,1 |
| XI f) Autres carcinomes et carcinomes non précisés | 25 | 20 | 50 | 1,0 | 1,3 | 1,3 | 1,3 |
| XII Tumeurs malignes autres et non précisées | 10 | 10 | 20 | 1,1 | 0,6 | 0,5 | 0,6 |
| XII a) Autres tumeurs malignes précisées | <5 | <5 | 10 | 2,0 | 0,2 | ‒ | 0,2 |
| XII b) Autres tumeurs malignes non précisées | 10 | 10 | 10 | 0,9 | 0,3 | 0,4 | 0,4 |
Remarque : Pour assurer la confidentialité, le nombre de cas a été arrondi de façon aléatoire, à l'unité inférieure ou supérieure selon un multiple de 5. Les nombres et les totaux étant arrondis, leur somme peut ne pas correspondre au total indiqué.
Sources de données : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario
|
|||||||
Les tendances en matière de diagnostic varient considérablement selon le groupe d'âge.Chez les nourrissons de moins de 1 an, le neuroblastome représente plus du quart de tous les cas diagnostiqués (28,2 %), suivi des leucémies (17,5 %) et des tumeurs du système nerveux central (SNC) [16,0 %], alors que les tumeurs embryonnaires (neuroblastomes, rétinoblastomes et néphroblastomes) combinées représentent 42,0 % de tous les cas diagnostiqués. Les leucémies sont prédominantes chez les enfants de 1 à 4 ans, constituant 41,7 % de tous les diagnostics, alors que les lymphomes et les tumeurs osseuses sont de plus en plus courants chez les enfants de 5 à 9 ans et de 10 à 14 ans (lymphomes chez les 5 à 9 ans et les 10 à 14 ans, respectivement : 12,9 % et 23,6 %; tumeurs osseuses chez les 5 à 9 ans et les 10 à 14 ans, respectivement : 4,2 % et 9,3 %). Les tumeurs embryonnaires comme les rétinoblastomes, les néphroblastomes, les neuroblastomes, les tumeurs embryonnaires intracrâniennes et intramédullaires, les rhabdomyosarcomes et les tumeurs des cellules germinales sont extrêmement rares chez les enfants de 10 ans et plus. Dans ce groupe d'âge, ce sont les tumeurs du SNC (24,3 %) et les lymphomes (23,6 %) qui prédominent (figure 1).
En général, la fréquence observée des cancers plus courants et les tendances par groupe d'âge correspondent aux tendances de l'incidence observées dans d'autres pays industrialisésNote de bas de page 20.
Nombre de nouveaux cancers et taux d'incidence selon le sexe
Dans l'ensemble, la proportion garçons-filles observée pour l'incidence du cancer est de 1,2 garçon pour 1 fille. Les différences selon le sexe dans l'incidence du cancer chez les enfants sont bien établies et uniformes dans le monde. Pour tous les types de cancer, cette proportion est d'environ 1,2 garçon pour 1 filleNote de bas de page 21, Note de bas de page 22. Pour les nouveaux cas, la proportion garçons-filles varie selon le diagnostic, mais à quelques exceptions près, les garçons reçoivent plus souvent un diagnostic de cancer que les filles (tableau 2).
Selon le TISA, il y a 163 nouveaux cas de cancer par million de garçons âgés de 0 à 14 ans et 141 cas par million de filles du même groupe d'âge. En tenant compte des types de cancers, le TISA des lymphomes est 73 % plus élevé chez les garçons que chez les filles. Ce taux est également plus élevé chez les garçons de 21 % pour la leucémie, de 14 % pour les tumeurs du SNC et de 21 % pour les neuroblastomes. Les TISA par sexe sont semblables en ce qui concerne les sarcomes des tissus mous. Alors que le cancer est généralement diagnostiqué plus souvent chez les garçons que les filles, on note une incidence plus élevée des rétinoblastomes, des tumeurs rénales, des tumeurs des cellules germinales et des carcinomes (surtout le carcinome de la thyroïde) chez les filles que chez les garçons.
Plusieurs facteurs peuvent contribuer aux écarts d'incidence selon le sexe, notamment les hormones sexuelles, les différences génétiques et les facteurs environnementaux; cela dit, on en connaît toujours très peu la ou les causes exactesNote de bas de page 21, Note de bas de page 23, Note de bas de page 24, Note de bas de page 25.
Incidence du cancer selon l'âge et la région
Le tableau 3 présente le nombre de nouveaux cas et les taux par âge selon le type de cancer et le groupe d'âge. Entre 2001 et 2006, le taux d'incidence du cancer chez les enfants âgés de 0 à 4 ans (240 et 222 par million d'enfants pour les moins de 1 an et les 1 à 4 ans, respectivement) était environ le double de celui chez les enfants âgés de 5 à 14 ans (118 et 112 par million d'enfants pour les 5 à 9 ans et les 10 à 14 ans, respectivement). Cette tendance varie grandement selon le type de tumeur.
Les TISA pour tous les cancers combinés sont généralement moins élevés dans l'ouest du Canada que dans l'est (tableau 4) et comportent de légères variations géographiques selon le type de cancer.
| Type de cancer | Groupe d'âge (en années) | |||||||
|---|---|---|---|---|---|---|---|---|
| <1 | 1 à 4 | 5 à 9 | 10 à 14 | |||||
| Nouveaux cas | Taux | Nouveaux cas | Taux | Nouveaux cas | Taux | Nouveaux cas | Taux | |
| Tous les cancers combinés | 485 | 240,4 | 1845 | 221,6 | 1365 | 118,2 | 1420 | 111,8 |
| I Leucémies, syndromes myéloprolifératifs et syndromes myélodysplasiques | 85 | 42,1 | 770 | 92,5 | 460 | 39,8 | 290 | 22,8 |
| I a) Leucémies lymphoïdes | 35 | 17,3 | 680 | 81,7 | 390 | 33,8 | 195 | 15,4 |
| I b) Leucémies myéloïdes aiguës | 25 | 12,4 | 70 | 8,4 | 45 | 3,9 | 65 | 5,1 |
| I c) Syndromes myéloprolifératifs chroniques | 0 | ‒ | <5 | ‒ | 10 | 0,9 | 20 | 1,6 |
| I d) Syndromes myélodysplasiques et autres syndromes myéloprolifératifs | 20 | 9,9 | 20 | 2,4 | 15 | 1,3 | <5 | ‒ |
| I e) Leucémies non précisées et autres leucémies précisées | <5 | 0 | <5 | ‒ | 5 | 0,4 | 10 | 0,8 |
| II Lymphomes et tumeurs réticuloendothéliales | 35 | 17,3 | 145 | 17,4 | 175 | 15,2 | 335 | 26,4 |
| II a) Lymphome de Hodgkin | 0 | ‒ | 5 | 0,6 | 35 | 3 | 175 | 13,8 |
| II b) Lymphomes non hodgkiniens (sauf le lymphome de Burkitt) | <5 | 2,5 | 35 | 4,2 | 60 | 5,2 | 90 | 7,1 |
| II c) Lymphome de Burkitt | 0 | ‒ | 15 | 1,8 | 35 | 3 | 40 | 3,2 |
| II d) Tumeurs lymphoréticulaires diverses | 30 | 14,9 | 80 | 9,6 | 45 | 3,9 | 25 | 2 |
| II e) Lymphomes non précisés | 0 | ‒ | 0 | ‒ | <5 | ‒ | <5 | 0 |
| III Tumeurs du SNC et diverses tumeurs intracrâniennes et intramédullaires | 75 | 37,2 | 380 | 45,6 | 410 | 35,5 | 345 | 27,2 |
| III a) Épendymomes et tumeurs des plexus choroïdes | 10 | 5 | 55 | 6,6 | 15 | 1,3 | 35 | 2,8 |
| III b) Astrocytomes | 35 | 17,3 | 160 | 19,2 | 180 | 15,6 | 155 | 12,2 |
| III c) Tumeurs embryonnaires intracrâniennes et intramédullaires | 25 | 12,4 | 85 | 10,2 | 95 | 8,2 | 55 | 4,3 |
| III d) Autres gliomes | <5 | 2,5 | 40 | 4,8 | 50 | 4,3 | 30 | 2,4 |
| III e) Autres tumeurs intracrâniennes et intramédullaires précisées | 5 | 2,5 | 35 | 4,2 | 75 | 6,5 | 70 | 5,5 |
| III f) Tumeurs intracrâniennes et intramédullaires non précisées | <5 | ‒ | <5 | 0,6 | <5 | ‒ | 5 | 0,4 |
| IV Neuroblastomes et autres tumeurs du système nerveux périphérique | 140 | 69,4 | 190 | 22,8 | 35 | 3 | 5 | 0,4 |
| IV a) Neuroblastome et ganglioneuroblastome | 140 | 69,4 | 190 | 22,8 | 35 | 3 | 10 | 0,8 |
| IVb) Autres tumeurs du système nerveux périphérique | <5 | ‒ | <5 | ‒ | <5 | ‒ | 0 | ‒ |
| V Rétinoblastome | 35 | 17,3 | 60 | 7,2 | <5 | 0,4 | 0 | ‒ |
| VI Tumeurs rénales | 35 | 17,3 | 140 | 16,8 | 60 | 5,2 | 20 | 1,6 |
| VI a) Néphroblastome et autres tumeurs rénales non épithéliales | 30 | 14,9 | 140 | 16,8 | 55 | 4,8 | 10 | 0,8 |
| VI b) Carcinomes rénaux | 0 | ‒ | <5 | ‒ | <5 | 0 | 10 | 0,8 |
| VII Tumeurs hépatiques | 15 | 7,4 | 45 | 5,4 | 10 | 0,9 | 10 | 0,8 |
| VII a) Hépatoblastome | 20 | 9,9 | 40 | 4,8 | 10 | 0,9 | <5 | 0,4 |
| VII b) Carcinomes hépatiques | <5 | ‒ | <5 | ‒ | <5 | ‒ | 5 | 0,4 |
| VII c) Tumeurs hépatiques malignes non précisées | 0 | ‒ | <5 | ‒ | 0 | ‒ | 0 | ‒ |
| VIII Tumeurs osseuses malignes | <5 | 2,5 | 15 | 1,8 | 55 | 4,8 | 130 | 10,2 |
| VIII a) Ostéosarcomes | <5 | ‒ | 5 | 0,6 | 30 | 2,6 | 70 | 5,5 |
| VIII b) Chondrosarcomes | 0 | ‒ | 0 | ‒ | 0 | ‒ | <5 | ‒ |
| VIII c) Sarcome d'Ewing et ostéosarcomes apparentés | <5 | 2,5 | 5 | 0,6 | 25 | 2,2 | 55 | 4,3 |
| VIII d) Autres tumeurs osseuses malignes précisées | 0 | ‒ | <5 | ‒ | 5 | 0,4 | <5 | 0,4 |
| VIII e) Tumeurs osseuses malignes non précisées | 0 | ‒ | 0 | ‒ | 0 | ‒ | <5 | 0,4 |
| IX Sarcomes des tissus mous et autres sarcomes extra-osseux | 35 | 17,3 | 70 | 8,4 | 80 | 6,9 | 105 | 8,3 |
| IX a) Rhabdomyosarcomes | <5 | 2,5 | 45 | 5,4 | 50 | 4,3 | 30 | 2,4 |
| IX b) Fibrosarcomes, tumeurs de la gaine des nerfs périphériques et autres tumeurs fibromateuses | 15 | 7,4 | <5 | 0,6 | <5 | 0,4 | 15 | 1,2 |
| IX d) Autres sarcomes des tissus mous précisés | 10 | 5 | 15 | 1,8 | 20 | 1,7 | 45 | 3,5 |
| IX e) Sarcomes des tissus mous non précisés | <5 | ‒ | <5 | 0 | <5 | ‒ | 15 | 1,2 |
| X Tumeurs germinales, trophoblastiques et gonadiques | 25 | 12,4 | 25 | 3 | 25 | 2,2 | 75 | 5,9 |
| X a) Tumeurs germinales intracrâniennes et intramédullaires | <5 | 2,5 | <5 | 0,6 | 15 | 1,3 | 25 | 2 |
| X b) Tumeurs germinales extragonadiques et extracrâniennes malignes | 15 | 7,4 | 10 | 1,2 | 0 | ‒ | 10 | 0,8 |
| X c) Tumeurs germinales gonadiques malignes | 5 | 2,5 | 5 | 0,6 | 15 | 1,3 | 35 | 2,8 |
| X d) Carcinomes gonadiques | 0 | ‒ | 0 | ‒ | 0 | ‒ | <5 | ‒ |
| X e) Autres tumeurs gonadiques malignes et tumeurs gonadiques malignes non précisées | <5 | ‒ | <5 | ‒ | <5 | ‒ | <5 | ‒ |
| XI Autres tumeurs épithéliales malignes et mélanomes malins | <5 | 2,5 | 10 | 1,2 | 35 | 3 | 95 | 7,5 |
| XI a) Carcinomes corticosurrénaliens | <5 | 0 | <5 | 0,6 | <5 | ‒ | <5 | 0,4 |
| XI b) Carcinomes thyroïdiens | 0 | ‒ | <5 | ‒ | 20 | 1,7 | 35 | 2,8 |
| XI c) Carcinomes nasopharyngés | 0 | ‒ | 0 | ‒ | 0 | ‒ | 10 | 0,8 |
| XI d) Mélanomes malins | 0 | ‒ | <5 | 0,6 | 10 | 0,9 | 10 | 0,8 |
| XI e) Carcinomes de la peau | 0 | ‒ | 0 | ‒ | <5 | ‒ | <5 | ‒ |
| XI f) Autres carcinomes et carcinomes non précisés | 0 | ‒ | <5 | 0 | 10 | 0,9 | 40 | 3,2 |
| XII Tumeurs malignes autres et non précisées | <5 | ‒ | <5 | 0 | 10 | 0,9 | 5 | 0,4 |
| XII a) Autres tumeurs malignes précisées | 0 | ‒ | <5 | ‒ | <5 | ‒ | <5 | 0,4 |
| XII b) Autres tumeurs malignes non précisées | <5 | ‒ | <5 | ‒ | 10 | 0,9 | <5 | 0,4 |
Remarque : Pour assurer la confidentialité, le nombre de cas a été arrondi de façon aléatoire, à l'unité inférieure ou supérieure selon un multiple de 5. Les nombres et les totaux étant arrondis, leur somme peut ne pas correspondre au total indiqué.
|
||||||||
| Type de cancer | Nouveaux cas | TISA (pour 1 000 000 d'enfants) | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Canada | C.-B. | Prairies | Ontario | Québec | Atlantique | Territoires | Canada | C.-B. | Prairies | Ontario | Québec | Atlantique | Territoires | |
| Tous les cancers combinés | 5125 | 590 | 870 | 2110 | 1180 | 365 | 15 | 152,4 | 144,7 | 138 | 157,1 | 159,4 | 159,8 | 107,7 |
| I Leucémies, syndromes myéloprolifératifs et syndromes myélodysplasiques | 1605 | 200 | 310 | 615 | 370 | 115 | 5 | 48,6 | 49,8 | 50,1 | 46,1 | 50,4 | 51,6 | 32,4 |
| II Lymphomes et tumeurs réticuloendothéliales | 690 | 85 | 105 | 300 | 145 | 50 | 0 | 19,5 | 20 | 16,1 | 21,5 | 18,8 | 19,6 | ‒ |
| III Tumeurs du SNC et diverses tumeurs intracrâniennes et intramédullaires | 1215 | 140 | 190 | 510 | 280 | 90 | <5 | 35,7 | 33,7 | 30 | 37,9 | 37,2 | 38,2 | 24,5 |
| IV Neuroblastomes et autres tumeurs du système nerveux périphérique | 370 | 40 | 65 | 145 | 105 | 15 | 0 | 12,1 | 10,3 | 10,5 | 12,1 | 15,7 | 9,1 | ‒ |
| V Rétinoblastome | 100 | 15 | 5 | 55 | 15 | 5 | 0 | 3,3 | 3,5 | 1,3 | 4,7 | 2,7 | 2,6 | ‒ |
| VI Tumeurs rénales | 245 | 25 | 45 | 90 | 55 | 15 | <5 | 7,6 | 6,4 | 7,8 | 7,2 | 8,3 | 9,1 | 19 |
| VII Tumeurs hépatiques | 80 | 10 | 20 | 35 | 15 | 5 | <5 | 2,5 | 2,3 | 2,8 | 2,6 | 1,7 | 3,3 | ‒ |
| VIII Tumeurs osseuses malignes | 210 | 25 | 35 | 70 | 45 | 20 | 0 | 5,7 | 6,2 | 5,4 | 5 | 5,7 | 9,5 | ‒ |
| IX Sarcomes des tissus mous et autres sarcomes extra-osseux | 295 | 30 | 50 | 125 | 65 | 20 | <5 | 8,5 | 7,2 | 7,5 | 9,2 | 8,5 | 9 | ‒ |
| X Tumeurs germinales, trophoblastiques et gonadiques | 150 | 15 | 25 | 65 | 35 | 15 | <5 | 4,4 | 3,7 | 3,6 | 4,8 | 4,5 | 4,8 | ‒ |
| XI Autres tumeurs épithéliales malignes et mélanomes malins | 150 | 5 | 15 | 75 | 40 | 10 | <5 | 4,1 | 1,4 | 2,7 | 5,2 | 5,1 | 2,4 | ‒ |
| XII Tumeurs malignes autres et non précisées | 15 | <5 | <5 | 10 | 5 | <5 | 0 | 0,6 | ‒ | ‒ | 0,8 | 0,7 | ‒ | ‒ |
Remarque :
Sources de données : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
||||||||||||||
Tendances de l'incidence du cancer
Auparavant, le RCC était la seule source de données disponible pour examiner les tendances nationales de l'incidence du cancer chez les enfants. Grâce à la mise en œuvre du CCJC, nous avons dorénavant une source indépendante pour effectuer des analyses. Malgré les différences de ces deux programmes de surveillance et de leurs données, les tendances qu'ils dégagent de 2001 à 2006 (et plus tard) en ce qui concerne les taux d'incidence semblent très comparables (figures 2 et 3). Les taux d'incidence étaient semblables entre les deux sources de données pour tous les cancers combinés, les leucémies, les neuroblastomes et les sarcomes des tissus mous. Le taux d'incidence plus élevé des lymphomes indiqué par les données du CCJC peut s'expliquer par l'inclusion des cas de lymphomes non hodgkiniens bénins (Classification internationale des maladies pour l'oncologie ou CIM-O-3, type histologique 9970) et de lymphomes divers à la limite de la malignité et localisés (CIM-O-3, types histologiques 9751 et 9753). Les taux d'incidence légèrement plus élevés des leucémies et de tous les cancers combinés reflétés dans les données du RCC peuvent indiquer que certains enfants plus âgés ont été traités à l'extérieur des centres d'oncologie pédiatriques.
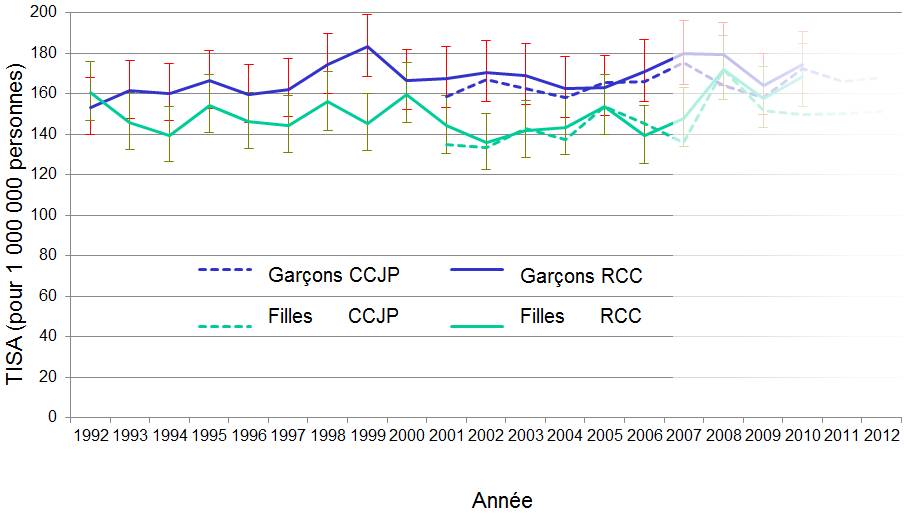
Figure 2 - Équivalent du texte
La figure 2 présente un graphique linéaire des taux d'incidence annuels standardisés selon l'âge (TISA) de tous les cancers combinés, par sexe, chez les enfants de 0 à 14 ans. Les sources de données sont comparées en utilisant les taux d'incidence pour 1 million de personnes calculés à partir du Registre canadien du cancer (RCC) de 1992 à 2010 avec des intervalles de confiance (IC) à 95 % et les taux d'incidence calculés à partir du programme Cancer chez les jeunes au Canada (CCJC) de 2001 à 2012 - bien que les données du programme Cancer chez les jeunes au Canada de 2007 à 2012 n'aient pas encore été validées comme nous l'avons mentionné. La figure 2 montre que les données du Registre canadien du cancer et les données du programme CCJC sont généralement comparables en ce qui a trait aux variations de l'incidence au fil du temps, même si les taux du Registre canadien du cancer sont légèrement supérieurs que ceux du programme Cancer chez les jeunes pour la plupart des années. Les taux semblent demeurer relativement stables au fil du temps et varient de 153,2 en 1992 à 183,2 en 1999 chez les garçons et de 135,8 en 2002 à 172,3 en 2008 chez les filles.
Le tableau de la figure 2 ci-dessous comprend chacun des points de données représentés dans la figure 2.
| Année | Garçons | Filles | ||||||
|---|---|---|---|---|---|---|---|---|
| RCC | CCJC TISA |
RCC | CCJC TISA |
|||||
| TISA | IC inférieur | IC supérieur | TISA | IC inférieur | IC supérieur | |||
| 1992 | 153,2 | 139,9 | 167,9 | 160,7 | 146,7 | 176 | ||
| 1993 | 161,6 | 147,9 | 176,6 | 145,8 | 132,6 | 160,4 | ||
| 1994 | 160,4 | 146,8 | 175,2 | 139,4 | 126,5 | 153,7 | ||
| 1995 | 166,4 | 152,5 | 181,5 | 154,5 | 140,8 | 169,4 | ||
| 1996 | 159,5 | 145,9 | 174,3 | 146,2 | 132,9 | 160,8 | ||
| 1997 | 162,4 | 148,6 | 177,4 | 144,4 | 131,2 | 159 | ||
| 1998 | 174,3 | 160 | 189,9 | 156 | 142,1 | 171,3 | ||
| 1999 | 183,2 | 168,4 | 199,3 | 145,6 | 132,1 | 160,4 | ||
| 2000 | 166,6 | 152,5 | 182,1 | 159,9 | 145,8 | 175,4 | ||
| 2001 | 167,6 | 153,3 | 183,2 | 158,5 | 144,2 | 130,7 | 159 | 135 |
| 2002 | 170,5 | 156,1 | 186,2 | 167,3 | 135,8 | 122,7 | 150,4 | 133,4 |
| 2003 | 169 | 154,6 | 184,8 | 162,6 | 142 | 128,5 | 156,8 | 143,1 |
| 2004 | 162,7 | 148,5 | 178,2 | 158,1 | 143,5 | 129,8 | 158,6 | 137,3 |
| 2005 | 163,3 | 149,1 | 178,9 | 165,8 | 154 | 139,9 | 169,5 | 153,9 |
| 2006 | 170,9 | 156,4 | 186,8 | 166,1 | 139,2 | 125,8 | 154,1 | 145,1 |
| 2007 | 179,8 | 164,8 | 196,2 | 175,7 | 147,8 | 134 | 163,1 | 136,1 |
| 2008 | 179,2 | 164,4 | 195,5 | 164,2 | 172,3 | 157,3 | 188,7 | 171,9 |
| 2009 | 164,2 | 150 | 179,7 | 158 | 157,6 | 143,4 | 173,3 | 151,6 |
| 2010 | 174,7 | 160,1 | 190,7 | 172,7 | 168,7 | 154 | 184,8 | 149,8 |
| 2011 | 166,2 | 150,5 | ||||||
| 2012 | 168,1 | 151,5 | ||||||
Remarque :
Les taux sont standardisés en fonction de la répartition par âge de la population canadienne de 1991.
Les données du CCJC pour 2007 à 2012 n'ont pas été validées et sont probablement incomplètes.
Sources de données : Base de données du Registre canadien du cancer (RCC) de Statistique Canada ainsi que Registre des cancers du Québec (2008 à 2010) et programme Cancer chez les jeunes au Canada (CCJC)/système électronique d'information en réseau du Pediatric Oncology Group of Ontario
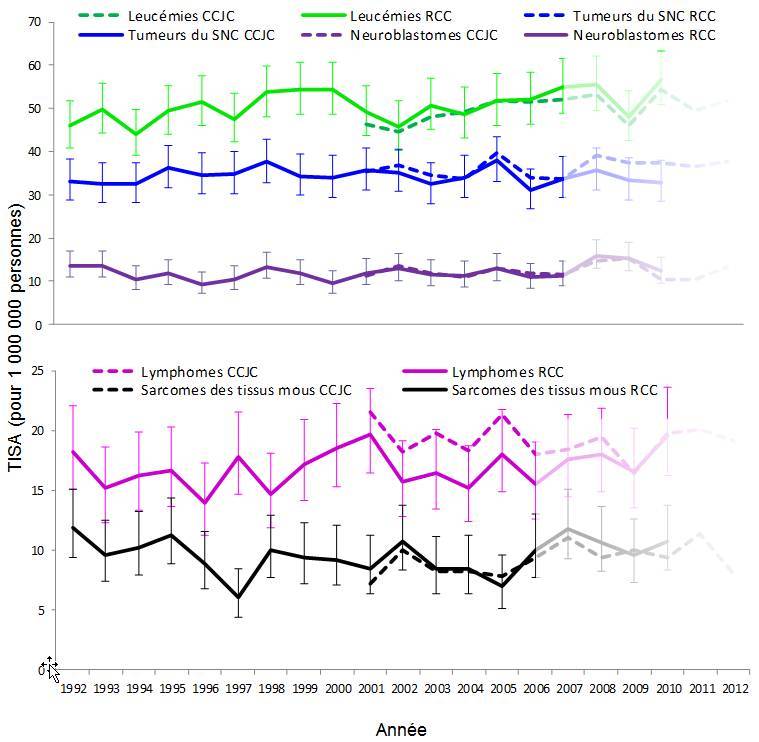
Figure 3 - Équivalent du texte
La figure 3 présente les graphiques linéaires des taux d'incidence annuels standardisés selon l'âge des cinq cancers les plus fréquents (leucémies, tumeurs du système nerveux central, lymphomes, neuroblastomes et sarcomes des tissus mous) chez les enfants de 0 à 14 ans. Les sources de données sont comparées en utilisant les taux d'incidence pour 1 million de personnes calculés à partir du Registre canadien du cancer de 1992 à 2010 avec des intervalles de confiance à 95 % et les taux d'incidence calculés à partir du programme Cancer chez les jeunes au Canada de 2001 à 2012 - bien que les données du programme Cancer chez les jeunes au Canada de 2007 à 2012 n'aient pas encore été validées comme nous l'avons mentionné. L'incidence de la leucémie affiche une tendance à la hausse au fil du temps avec des taux variant de 44,1 en 1994 à 56,7 en 2010. Les taux d'incidence des autres cancers varient au fil du temps, mais ne présentent pas de tendance générale à la hausse ou à la baisse.
Le tableau de la figure 3 ci-dessous comprend chacun des points de données représentés dans la figure 3.
| Année | Leucémies | Lymphomes | Tumeurs du système nerveux central | Neuroblastomes | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| RCC | CCJC TIA |
RCC | CCJC TIA |
RCC | CCJC TIA |
RCC | CCJC TIA |
|||||||||
| TIA | IC inférieur | IC supérieur | TIA | IC inférieur | IC supérieur | TIA | IC inférieur | IC supérieur | TIA | IC inférieur | IC supérieur | |||||
| 1992 | 46,1 | 40,9 | 51,9 | 18,3 | 15,1 | 22,1 | 33,2 | 28,9 | 38,2 | 13,6 | 10,9 | 17 | ||||
| 1993 | 49,7 | 44,3 | 55,7 | 15,2 | 12,3 | 18,6 | 32,4 | 28,1 | 37,3 | 13,6 | 10,9 | 16,9 | ||||
| 1994 | 44,1 | 39,1 | 49,8 | 16,3 | 13,3 | 19,8 | 32,4 | 28,2 | 37,4 | 10,5 | 8,2 | 13,5 | ||||
| 1995 | 49,4 | 44,1 | 55,4 | 16,7 | 13,7 | 20,3 | 36,3 | 31,7 | 41,4 | 11,8 | 9,3 | 15 | ||||
| 1996 | 51,4 | 45,9 | 57,4 | 13,9 | 11,2 | 17,2 | 34,7 | 30,3 | 39,7 | 9,4 | 7,2 | 12,2 | ||||
| 1997 | 47,6 | 42,3 | 53,4 | 17,8 | 14,7 | 21,5 | 34,8 | 30,4 | 39,9 | 10,5 | 8,2 | 13,6 | ||||
| 1998 | 53,7 | 48 | 59,9 | 14,7 | 11,9 | 18,1 | 37,6 | 33 | 42,9 | 13,3 | 10,6 | 16,7 | ||||
| 1999 | 54,4 | 48,7 | 60,8 | 17,2 | 14,2 | 20,9 | 34,3 | 29,9 | 39,3 | 11,7 | 9,2 | 15 | ||||
| 2000 | 54,4 | 48,7 | 60,8 | 18,5 | 15,3 | 22,3 | 33,9 | 29,5 | 39 | 9,4 | 7,2 | 12,4 | ||||
| 2001 | 49,2 | 43,7 | 55,3 | 46,4 | 19,7 | 16,4 | 23,5 | 21,5 | 35,6 | 31,1 | 40,9 | 35,4 | 11,8 | 9,2 | 15,2 | 11,3 |
| 2002 | 45,7 | 40,4 | 51,7 | 44,5 | 15,7 | 12,8 | 19,2 | 18,2 | 35,2 | 30,7 | 40,4 | 36,8 | 12,9 | 10,2 | 16,5 | 13,7 |
| 2003 | 50,7 | 45,1 | 57 | 48,1 | 16,4 | 13,5 | 20,1 | 19,8 | 32,4 | 28,1 | 37,4 | 34,6 | 11,6 | 9 | 15 | 11,9 |
| 2004 | 48,6 | 43,1 | 54,8 | 49,3 | 15,2 | 12,4 | 18,7 | 18,3 | 33,9 | 29,4 | 39,1 | 33,7 | 11,4 | 8,8 | 14,7 | 11 |
| 2005 | 51,7 | 46 | 58,1 | 51,9 | 18 | 14,9 | 21,8 | 21,3 | 38 | 33,2 | 43,5 | 39,6 | 12,9 | 10,1 | 16,4 | 12,9 |
| 2006 | 51,9 | 46,2 | 58,4 | 51,5 | 15,5 | 12,6 | 19 | 18 | 31 | 26,7 | 35,9 | 34 | 10,9 | 8,4 | 14,1 | 11,7 |
| 2007 | 54,8 | 48,9 | 61,4 | 52,1 | 17,6 | 14,4 | 21,4 | 18,4 | 33,8 | 29,3 | 39 | 33,8 | 11,4 | 8,8 | 14,6 | 11,4 |
| 2008 | 55,5 | 49,6 | 62,1 | 53,1 | 18 | 14,9 | 21,8 | 19,4 | 35,6 | 31 | 41 | 39,3 | 16 | 12,9 | 19,7 | 14,7 |
| 2009 | 48 | 42,6 | 54,2 | 46,1 | 16,5 | 13,5 | 20,2 | 16,4 | 33,4 | 28,9 | 38,6 | 37,5 | 15,4 | 12,4 | 19 | 15,4 |
| 2010 | 56,7 | 50,8 | 63,3 | 54,4 | 19,6 | 16,2 | 23,6 | 19,8 | 32,8 | 28,4 | 37,9 | 37,3 | 12,3 | 9,7 | 15,6 | 10,5 |
| 2011 | 49,4 | 20,1 | 36,6 | 10,5 | ||||||||||||
| 2012 | 51,8 | 19,1 | 37,7 | 13,2 | ||||||||||||
Sources de données : Programme Cancer chez les jeunes au Canada et système d'information en réseau du Pediatric Oncology Group of Ontario (les données de ces deux sources sont présentées ensemble comme les données du programme Cancer chez les jeunes au Canada) et base de données du Registre canadien du cancer.
Remarque :
Les taux sont standardisés en fonction de la répartition par âge de la population canadienne de 1991.
Les données du CCJC pour 2007 à 2012 n'ont pas été validées et sont probablement incomplètes.
Sources de données : Base de données du Registre canadien du cancer (RCC) de Statistique Canada ainsi que Registre des cancers du Québec (2008 à 2010) et programme Cancer chez les jeunes au Canada (CCJC)/système électronique d'information en réseau du Pediatric Oncology Group of Ontario
Les données du CCJC montrent que le TISA pour tous les cancers combinés augmente. Bien qu'il semble que les données du CCJC après 2006 soient incomplètes, on observe tout de même une augmentation moyenne de 1 % par année de 2001 à 2010 (p = 0,02) [figure 2]. Cette augmentation est comparable à celle de 1,2 % par année observée dans le RCC pendant la même période, comme le rapporte Statistique CanadaNote de bas de page 26. Il sera possible de comparer les tendances par type de cancer entre le CCJC et le RCC lorsque les données traitées par le CCJC après 2006 auront été validées.
Des tendances à la hausse de l'incidence du cancer infantile ont été observées aux États-UnisNote de bas de page 27, Note de bas de page 28, Note de bas de page 29, en AutralieNote de bas de page 30 et en EuropeNote de bas de page 20, Note de bas de page 22. Ce changement est difficile à expliquer, puisque seule une petite proportion de cancers infantiles a des causes connuesNote de bas de page 1. Il est possible que ces tendances à la hausse découlent de modifications sous-jacentes aux facteurs de risque génétiques et environnementauxNote de bas de page 20, Note de bas de page 24. L'amélioration des diagnostics, des méthodes d'inscription et de la détermination des cas ainsi qu'un meilleur accès aux soins médicaux peuvent aussi expliquer ces tendances.
Moment du diagnostic et traitement
Ces analyses des intervalles diagnostiques et de traitement sont présentées pour illustrer la future valeur potentielle du CCJC quant à l'évaluation du rendement du système de soins de santé à mesure que les données disponibles sont mises à jour. Le tableau 5 présente : le temps d'attente médian écoulé (en jours) entre la première consultation médicale et la date du diagnostic définitif (l'intervalle diagnostique); le temps d'attente médian écoulé (en jours) entre la date du diagnostic définitif et la date de début du traitement contre le cancer (l'intervalle de traitement); et le temps d'attente médian entre la première consultation médicale et le début du traitement contre le cancer (l'intervalle entre le diagnostic et le traitement). Les cas de l'Ontario ont été exclus de l'analyse en raison des différences dans la détermination des événements et des dates servant à calculer les intervalles de tempsNote de bas de page 15.
| Intervalle diagnostic : Nombre de jours écoulés entre la première consultation médicale et la date du diagnostic définitif | Intervalle de traitement : Nombre de jours écoulés entre la date du diagnostic définitif et le début du traitement contre le cancer | Intervalle entre le diagnostic et le traitement : Nombre de jours écoulés entre la première consultation médicale et le début du traitement contre le cancer | |||||||
|---|---|---|---|---|---|---|---|---|---|
| Médiane | Entre les 25e et 75e centiles | Valeur pNote de bas de page ** | Médiane | Entre les 25e et 75e centiles | Valeur pNote de bas de page ** | Médiane | Entre les 25e et 75e centiles | Valeur pNote de bas de page ** | |
| Global | 8,0 | 3,0 à 27,0 | 1,0 | 0,0 à 4,0 | 12,0 | 4,0 à 34,0 | |||
| Sexe | |||||||||
| Garçon | 7,0 | 2,0 à 25,0 | 0,09 | 1,0 | 0,0 à 4,0 | 0,69 | 10,0 | 4,0 à 32,0 | 0,04 |
| Fille | 8,0 | 3,0 à 29,0 | 1,0 | 0,0 à 4,0 | 13,0 | 5,0 à 35,0 | |||
| Âge au moment du diagnostic (en années) | |||||||||
| <1 | 8,0 | 3,0 à 19,0 | <0,01 | 0,0 | 0,0 à 4,0 | <0,01 | 10,0 | 4,0 à 26,0 | <0,01 |
| 1 à 4 | 7,0 | 2,0 à 22,0 | 1,0 | 0,0 à 3,0 | 9,0 | 4,0 à 26,5 | |||
| 5 à 9 | 7,0 | 2,0 à 25,0 | 0,0 | 0,0 à 4,0 | 10,0 | 4,0 à 35,0 | |||
| 10 à 14 | 10,0 | 3,0 à 38,0 | 1,0 | 0,0 à 8,0 | 17,0 | 6,0 à 48,0 | |||
| Région de résidenceNote de bas de page * | |||||||||
| Atlantique | 9,0 | 3,0 à 36,0 | 0,23 | 1,0 | 0,0 à 4,0 | 0,78 | 14,0 | 5,0 à 41,0 | 0,07 |
| Québec | 8,0 | 3,0 à 27,0 | 1,0 | 0,0 à 4,0 | 11,0 | 5,0 à 33,0 | |||
| Prairies | 7,0 | 3,0 à 22,0 | 1,0 | 0,0 à 4,0 | 10,0 | 4,0 à 30,0 | |||
| Colombie-Britannique | 8,0 | 2,0 à 31,0 | 0,0 | 0,0 à 5,0 | 13,0 | 4,0 à 36,0 | |||
| TerritoiresNote de bas de page *** | 10,0 | 4,0 à 19,0 | 0,0 | 0,0 à 7,0 | 17,0 | 8,0 à 46,0 | |||
| Diagnostic | |||||||||
| I Leucémies, syndromes myéloprolifératifs et syndromes myélodysplasiques | 3,0 | 1,0 à 11,0 | <0,01 | 1,0 | 0,0 à 3,0 | <0,01 | 5,0 | 3,0 à 14,0 | <0,01 |
| II Lymphomes et tumeurs réticuloendothéliales | 14,0 | 5,0 à 42,5 | 4,0 | 0,0 à 13,0 | 22,0 | 9,0 à 53,5 | |||
| III Tumeurs du SNC et diverses tumeurs intracrâniennes et intramédullaires | 10,0 | 3,0 à 37,0 | 0,0 | 0,0 à 0,0 | 12,0 | 4,0 à 42,0 | |||
| IV Neuroblastomes et autres tumeurs du système nerveux périphérique | 14,0 | 6,0 à 32,0 | 0,0 | 0,0 à 6,0 | 18,0 | 10,0 à 36,0 | |||
| V Tumeurs rénales | 9,0 | 5,0 à 23,0 | 0,0 | 0,0 à 1,0 | 10,0 | 5,0 à 24,0 | |||
| VI Rétinoblastome | 7,0 | 4,0 à 13,0 | 0,0 | 0,0 à 2,0 | 8,0 | 5,0 à 14,0 | |||
| VII Tumeurs hépatiques | 7,0 | 3,0 à 11,0 | 4,0 | 0,0 à 7,0 | 12,0 | 8,0 à 24,0 | |||
| VIII Tumeurs osseuses malignes | 21,0 | 8,0 à 51,0 | 8,0 | 4,0 à 14,0 | 33,0 | 16,0 à 59,0 | |||
| IX Sarcomes des tissus mous et autres sarcomes extra-osseux | 17,0 | 5,0 à 43,0 | 4,0 | 0,0 à 11,0 | 23,0 | 10,0 à 49,0 | |||
| X Tumeurs germinales, trophoblastiques et gonadiques | 13,5 | 5,0 à 38,5 | 0,0 | 0,0 à 2,5 | 15,0 | 6,0 à 38,5 | |||
| XI Autres tumeurs épithéliales malignes et mélanomes malins | 54,5 | 12,0 à 133,0 | 0,0 | 0,0 à 8,0 | 68,0 | 21,0 à 138,0 | |||
| XII Tumeurs malignes autres et non précisées | 41,0 | 13,5 à 77,0 | 0,5 | 0,0 à 8,0 | 43,0 | 20,5 à 102,0 | |||
Remarque :
Source : Programme Cancer chez les jeunes au Canada (CCJC) |
|||||||||
L'intervalle diagnostique médian est de 8 jours. Des écarts statistiquement significatifs quant à l'intervalle diagnostique sont observés selon l'âge et le type de diagnostic (p < 0,01 pour les deux), mais pas le sexe ni la région de résidence. Selon l'âge, le plus court intervalle diagnostique médian est observé chez les enfants âgés de 1 à 4 ans et de 5 à 9 ans (7 jours pour les deux), suivis des enfants de moins de 1 an (8 jours). Le plus long intervalle diagnostique médian est observé chez les enfants âgés de 10 à 14 ans (10 jours). Selon le type de cancer, les patients atteints de leucémie sont ceux pour qui l'intervalle médian entre le diagnostic et le traitement est le plus court à 3 jours, suivis des patients atteints de rétinoblastome et de tumeurs hépatiques (7 jours pour les deux). Le plus long intervalle diagnostique médian est constaté chez les patients atteints de carcinomes (54,5 jours) et autres néoplasmes (41 jours).
Bien que des écarts statistiquement significatifs quant aux intervalles de traitement soient aussi observés selon l'âge et le diagnostic (p < 0,01 pour les deux), la tendance générale consiste à commencer le traitement immédiatement après l'établissement du diagnostic. Le plus long intervalle de traitement médian est observé chez les enfants atteints de tumeurs osseuses malignes (8 jours), suivis des lymphomes, des tumeurs hépatiques et des sarcomes (4 jours chacun).
Des différences statistiquement significatives selon le sexe et l'âge ont été observées pour les intervalles diagnostiques et de traitement médians en général, les intervalles étant légèrement plus longs pour les filles et les enfants âgés de 10 à 14 ans. Le fait que ces différences soient principalement associées à l'intervalle diagnostique est peut-être lié aux observations à savoir que les cancers infantiles sont plus rares chez les filles et les enfants plus vieux. Des écarts significatifs en ce qui a trait à l'intervalle médian entre le diagnostic et le traitement en général selon le type de cancer reflètent en grande partie les écarts observés relativement aux intervalles diagnostiques. Pour interpréter les écarts entre les intervalles diagnostiques observés selon le sexe, l'âge et le type de cancer, il faut prendre en considération la rareté (ou la fréquence) du type de cancer chez les garçons et les filles ou pour un groupe d'âge donné (voir les tableaux 2 et 3). Les cancers rarement diagnostiqués ne sont pas toujours soupçonnés immédiatement à la première consultation médicale et par conséquent, il arrive que l'établissement du diagnostic soit plus long.
Aucune différence statistiquement significative n'a été observée pour les intervalles diagnostiques ou de traitement selon la région.
Tendances liées aux plans de traitement initiaux
Les essais cliniques visent à améliorer les traitements, et certains permettent aux enfants atteints de cancer d'avoir accès à de nouveaux traitements qui ne sont pas nécessairement offertsNote de bas de page 31, Note de bas de page 32. Les enfants prenant part à des protocoles d'essai clinique dans des centres spécialisés peuvent jouir d'un avantage en matière de survie à court terme; cependant, cela peut s'expliquer par un biais de sélection qui vient favoriser l'exclusion d'enfants plus malades ou présentant plus de comorbidités du volet « traitement », ou encore par l'effet Hawthorne, qui soulève une perspective et un comportement altérés chez les patients qui savent quel type de traitement ils reçoiventNote de bas de page 33. En outre, en raison de considérations éthiques et pratiques, de nombreuses études qui traitent de l'incidence de la participation à un essai clinique sur la survie sont de nature observationnelle et donc sujettes à des problèmes d'ordre méthodologique qui limitent la possibilité de généralisation des constatationsNote de bas de page 33. Parallèlement, certains essais cliniques sont axés sur des résultats autres que la survie, comme l'amélioration de la qualité de vie.
Les données sur le plan de traitement initial par type de diagnostic et région du diagnostic sont présentées en fonction de la participation à des essais cliniques et l'utilisation de protocoles d'essai. À l'échelle nationale, pour tous les cancers, 26 % des enfants ont pris part à un essai clinique approuvé par un comité d'éthique de la recherche (tableau 6). Les nombreuses raisons qui expliquent qu'un enfant ne participe pas à un essai clinique sont entre autres la non-disponibilité d'un essai sur un cancer en particulier et l'admissibilité de l'enfant à un essai en cours.| Type de cancer | Enfants qui ont pris part à un essai clinique approuvé par un comité d'éthique de la recherche (CER) | Enfants qui suivent un protocole d'essai clinique sans être inscrits à un tel essai | Autre | Total | |||
|---|---|---|---|---|---|---|---|
| Nombre de cas | Pourcentage (%) | Nombre de cas | Pourcentage (%) | Nombre de cas | Pourcentage (%) | ||
| Leucémies | 765 | 48,5 | 740 | 46,7 | 75 | 4,8 | 1580 |
| Lymphomes | 105 | 15,6 | 415 | 62,9 | 145 | 21,5 | 660 |
| Tumeurs du SNC | 110 | 9,4 | 280 | 24 | 775 | 66,5 | 1165 |
| Neuroblastomes | 100 | 27,7 | 170 | 47 | 95 | 25,3 | 370 |
| Rétinoblastome | 5 | 3 | 30 | 26 | 75 | 71 | 100 |
| Tumeurs rénales | 45 | 19,5 | 170 | 69,7 | 25 | 10,8 | 240 |
| Tumeurs hépatiques | 15 | 18,2 | 45 | 61 | 15 | 20,8 | 80 |
| Tumeurs osseuses malignes | 50 | 24 | 130 | 64,7 | 20 | 11,3 | 205 |
| Sarcomes des tissus mous | 70 | 24,2 | 130 | 47 | 80 | 28,8 | 280 |
| Tumeurs germinales | 15 | 8,7 | 70 | 47,3 | 65 | 44 | 150 |
| Autres tumeurs épithéliales malignes | <5 | 0,7 | 15 | 11,3 | 125 | 88 | 140 |
| Tumeurs malignes autres et non précisées | 0 | 0 | 5 | 26,3 | 15 | 73,7 | 20 |
| Tous les cancers | 1275 | 25,6 | 2200 | 44,2 | 1510 | 30,3 | 4985 |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||||||
Les enfants atteints de leucémie sont plus souvent inscrits à un essai clinique (48,5 %), suivis des enfants atteints d'un neuroblastome (27,7 %), de tumeurs osseuses malignes (24,0 %) et d'un sarcome des tissus mous (24,2 %). En revanche, les enfants atteints de rétinoblastomes (3,0 %), d'un cancer du SNC (9,4 %) et d'un carcinome (0,7 %) sont le moins souvent inscrits à un essai clinique (tableau 6).
Tendances liées aux plans de traitement initiaux
Selon l'âge, la participation à un essai clinique est la plus fréquente chez les enfants âgés de 1 à 4 ans 32,3 %) et la moins fréquente chez les enfants âgés de 10 à 14 ans (18,8 %) [tableau 7]. Aucune différence significative selon le type de cancer n'est observée à l'exception des tumeurs rénales où il y avait deux fois plus de filles inscrites à un essai clinique (p = 0,03). Cependant, le nombre total d'enfants atteints de tumeurs rénales inscrites à un essai clique était petit, moins de 50 cas (données non présentées). On constate certaines différences selon la région du diagnostic. Parmi des régions, plus de 25 % des enfants atteints d'un cancer sont inscrits à un essai clinique approuvé par un comité d'éthique de la recherche, mais on constate une proportion plus élevée au Québec (34,7 %) et en Colombie-Britannique (26,9 %), et une proportion plus faible dans la région de l'Atlantique et au Québec (22,5 % et 20,4 % respectivement) [tableau 8].
| Groupe d'âge (en années) | Enfants qui ont pris part à un essai clinique approuvé par un comité d'éthique de la recherche (CER) | Enfants qui suivent un protocole d'essai clinique sans être inscrits à un tel essai | Autre | Total | |||
|---|---|---|---|---|---|---|---|
| Nombre de cas | Pourcentage (%) | Nombre de cas | Pourcentage (%) | Nombre de cas | Pourcentage (%) | ||
| <1 | 100 | 20,3 | 200 | 42,4 | 175 | 37,3 | 475 |
| 1 à 4 | 585 | 32,3 | 805 | 44,5 | 420 | 23,2 | 1805 |
| 5 à 9 | 335 | 25,3 | 580 | 43,7 | 410 | 31 | 1325 |
| 10 à 14 | 255 | 18,8 | 615 | 44,7 | 505 | 36,5 | 1375 |
| Tous les enfants | 1275 | 25,6 | 2200 | 44,2 | 1505 | 30,3 | 4985 |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||||||
| Région du diagnostic | Enfants qui ont pris part à un essai clinique approuvé par un comité d'éthique de la recherche (CER) | Enfants qui suivent un protocole d'essai clinique sans être inscrits à un tel essai | Autre | Total | |||
|---|---|---|---|---|---|---|---|
| Nombre de cas | Pourcentage (%) | Nombre de cas | Pourcentage (%) | Nombre de cas | Pourcentage (%) | ||
| Colombie-Britannique | 160 | 26,9 | 285 | 49 | 145 | 24,1 | 590 |
| Prairies | 220 | 25,9 | 375 | 44,3 | 250 | 29,8 | 855 |
| Ontario | 410 | 20,4 | 910 | 45,5 | 685 | 34,1 | 2005 |
| Québec | 405 | 34,7 | 430 | 37,1 | 330 | 28,3 | 1160 |
| Atlantique | 80 | 22,5 | 185 | 50,8 | 95 | 26,7 | 360 |
| Territoires | 5 | 12,5 | 5 | 56,3 | 5 | 31,3 | 15 |
| Canada | 1275 | 25,6 | 2200 | 44,2 | 1505 | 30,3 | 4985 |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||||||
Survie des enfants ayant reçu un diagnostic de cancer
Les proportions de survie observées (PSO) à 1, 3 et 5 ans évaluées pour les enfants (de 0 à 14 ans) ayant reçu un diagnostic de cancer entre le 1er janvier 2001 et le 31 décembre 2006 sont présentées aux tableaux 9 à 11. Pour tous les cancers infantiles combinés, les PSO à cinq ans sont de 81,5 %. Les PSO à 1 et 3 ans correspondantes sont de 91,8 % et de 85,1 % respectivement (tableau 9). Les nourrissons de moins d'un an présentent la plus faible PSO à cinq ans de tous les groupes d'âge (77,4 %) et une survie beaucoup plus courte dans l'année suivant le diagnostic par rapport aux autres groupes d'âge. Les enfants ayant reçu un diagnostic de cancer entre l'âge de 1 an et 4 ans affichent le meilleur taux de survie à 5 ans de tous les groupes d'âge (82,1 % chez les garçons et 85,0 % chez les filles), suivis des enfants ayant reçu un diagnostic de cancer entre l'âge de 5 et 9 ans (80,8 % chez les garçons et 82,3 % chez les filles).
| Groupe d'âge (en années) | Temps (en mois) | Les deux sexes | Garçons | Filles | ||||||
|---|---|---|---|---|---|---|---|---|---|---|
| PSO | IC inférieur | IC supérieur | PSO | IC inférieur | IC supérieur | PSO | IC inférieur | IC supérieur | ||
| <1 | 12 | 82,9 % | 79,3 % | 86,0 % | 85,4 % | 80,4 % | 89,3 % | 80,3 % | 74,7 % | 84,8 % |
| 36 | 79,0 % | 75,1 % | 82,4 % | 81,4 % | 75,9 % | 85,7 % | 76,6 % | 70,7 % | 81,4 % | |
| 60 | 77,4 % | 73,3 % | 80,9 % | 79,4 % | 73,6 % | 84,0 % | 75,3 % | 69,2 % | 80,4 % | |
| 1 à 4 | 12 | 92,8 % | 91,5 % | 93,9 % | 92,3 % | 90,5 % | 93,8 % | 93,4 % | 91,5 % | 94,9 % |
| 36 | 86,9 % | 85,3 % | 88,4 % | 86,8 % | 84,6 % | 88,7 % | 87,0 % | 84,5 % | 89,1 % | |
| 60 | 83,4 % | 81,5 % | 85,1 % | 82,1 % | 79,4 % | 84,6 % | 85,0 % | 82,2 % | 87,3 % | |
| 5 à 9 | 12 | 92,7 % | 91,2 % | 94,0 % | 93,1 % | 91,0 % | 94,6 % | 92,2 % | 89,7 % | 94,1 % |
| 36 | 85,5 % | 83,5 % | 87,2 % | 85,3 % | 82,7 % | 87,6 % | 85,6 % | 82,5 % | 88,2 % | |
| 60 | 81,4 % | 79,1 % | 83,5 % | 80,8 % | 77,7 % | 83,6 % | 82,3 % | 78,7 % | 85,3 % | |
| 10 à 14 | 12 | 92,6 % | 91,1 % | 93,8 % | 92,3 % | 90,1 % | 94,0 % | 92,8 % | 90,6 % | 94,6 % |
| 36 | 84,5 % | 82,6 % | 86,3 % | 84,4 % | 81,6 % | 86,8 % | 84,7 % | 81,7 % | 87,2 % | |
| 60 | 80,6 % | 78,3 % | 82,7 % | 80,5 % | 77,3 % | 83,3 % | 80,7 % | 77,3 % | 83,6 % | |
| Tous les âges (0 à 14 ans) | 12 | 91,8 % | 91,0 % | 92,5 % | 91,9 % | 90,8 % | 92,9 % | 91,6 % | 90,4 % | 92,6 % |
| 36 | 85,1 % | 84,1 % | 86,1 % | 85,3 % | 83,9 % | 86,5 % | 84,9 % | 83,4 % | 86,3 % | |
| 60 | 81,5 % | 80,4 % | 82,6 % | 81,1 % | 79,5 % | 82,6 % | 82,0 % | 80,3 % | 83,6 % | |
Remarque : Estimations actuarielles présentées |
||||||||||
Dans les principaux groupes de diagnostics de la CICE-3, les PSO à 5 ans les plus élevées sont remarqués dans les cas de rétinoblastome (97,0 %), suivis des carcinomes et des lymphomes (91,3 % pour les deux). La plus faible survie à 5 ans se constate en présence de tumeurs osseuses malignes (62,0 %) et de sarcomes des tissus mous (71,0 %). La survie à 5 ans des enfants atteints de leucémies myéloïdes aiguës (69,2 %) est considérablement moins élevée que celle des enfants atteints d'une leucémie lymphoïde (90,2 %) [tableau 10]. Quant aux enfants souffrant d'un lymphome hodgkinien, ils ont une meilleure survie à 5 ans (96,3 %) que les enfants atteints d'un lymphome non hodgkinien (83,5 %) et d'un lymphome de Burkitt (91,5 %). En présence de tumeurs du SNC, le pronostic de survie à 5 ans pour les enfants atteints d'astrocytome (83,6 %) est meilleur que celui des enfants atteints d'épendymome ou de tumeurs du plexus choroïde (70,4 %) et considérablement meilleur que celui des enfants souffrant de tumeurs intracrâniennes et intramédullaires (52,8 %). Les PSO à 5 ans pour les cas de neuroblastome sont de 75,3 %. Quant aux tumeurs rénales, la survie à 5 ans en présence de néphroblastomes est de 89,7 %. Les enfants présentant des tumeurs osseuses malignes ont une meilleure survie à 5 ans s'ils souffrent d'un ostéosarcome (66,1 %) que de tumeurs d'Ewing (59,5 %). La survie à 5 ans des enfants chez qui l'on a diagnostiqué un rhabdomyosarcome est de 73,9 %.
| Groupes et sous-groupes de diagnostics de la CICE-3 | PSO | IC inférieur | IC supérieur |
|---|---|---|---|
| Tous les cancers combinés | 81,5 % | 80,4 % | 82,6 % |
| I Leucémies, syndromes myéloprolifératifs et syndromes myélodysplasiques | 85,7 % | 83,8 % | 87,4 % |
| I a) Leucémies lymphoïdes | 90,2 % | 88,3 % | 91,8 % |
| I b) Leucémies myéloïdes aiguës | 69,2 % | 62,0 % | 75,4 % |
| I c) Syndromes myéloprolifératifs chroniques | 86,5 % | 61,4 % | 95,7 % |
| I d) Syndromes myélodysplasiques et autres syndromes myéloprolifératifs | 54,5 % | 40,6 % | 66,6 % |
| I e) Leucémies non précisées et autres leucémies précisées | 52,4 % | 29,7 % | 70,9 % |
| II Lymphomes et tumeurs réticuloendothéliales | 91,3 % | 88,8 % | 93,2 % |
| II a) Lymphome de Hodgkin | 96,3 % | 92,8 % | 98,1 % |
| II b) Lymphomes non hodgkiniens (sauf le lymphome de Burkitt) | 83,5 % | 77,1 % | 88,3 % |
| II c) Lymphome de Burkitt | 91,5 % | 83,7 % | 95,7 % |
| II d) Tumeurs lymphoréticulaires diverses | 93,2 % | 87,9 % | 96,3 % |
| III Tumeurs du SNC et diverses tumeurs intracrâniennes et intramédullaires | 73,3 % | 70,6 % | 75,8 % |
| III a) Épendymomes et tumeurs des plexus choroïdes | 70,4 % | 60,3 % | 78,4 % |
| III b) Astrocytomes | 83,6 % | 80,0 % | 86,6 % |
| III c) Tumeurs embryonnaires intracrâniennes et intramédullaires | 52,8 % | 46,0 % | 59,1 % |
| III d) Autres gliomes | 43,0 % | 34,1 % | 51,6 % |
| III e) Autres tumeurs intracrâniennes et intramédullaires précisées | 94,5 % | 90,0 % | 97,0 % |
| IV Neuroblastomes et autres tumeurs du système nerveux périphérique | 75,3 % | 70,1 % | 79,7 % |
| IV a) Neuroblastome et ganglioneuroblastome | 75,9 % | 70,7 % | 80,3 % |
| V Rétinoblastome | 97,0 % | 87,9 % | 99,3 % |
| VI Tumeurs rénales | 88,9 % | 84,3 % | 92,3 % |
| VI a) Néphroblastome et autres tumeurs rénales non épithéliales | 89,7 % | 85,0 % | 92,9 % |
| VII Tumeurs hépatiques | 77,0 % | 65,1 % | 85,2 % |
| VII a) Hépatoblastome | 81,2 % | 68,7 % | 89,1 % |
| VIII Tumeurs osseuses malignes | 62,0 % | 54,2 % | 68,8 % |
| VIII a) Ostéosarcomes | 66,1 % | 55,0 % | 75,1 % |
| VIII c) Sarcome d'Ewing et ostéosarcomes apparentés | 59,5 % | 47,4 % | 69,8 % |
| IX Sarcomes des tissus mous et autres sarcomes extra-osseux | 71,0 % | 65,0 % | 76,1 % |
| IX a) Rhabdomyosarcomes | 73,9 % | 65,1 % | 80,8 % |
| IX b) Fibrosarcomes, tumeurs de la gaine des nerfs périphériques et autres tumeurs fibromateuses | 91,7 % | 76,3 % | 97,2 % |
| IX d) Autres sarcomes des tissus mous précisés | 65,5 % | 54,8 % | 74,2 % |
| IX e) Sarcomes des tissus mous non précisés | 42,9 % | 18,3 % | 65,5 % |
| X Tumeurs germinales, trophoblastiques et gonadiques | 90,8 % | 84,9 % | 94,4 % |
| X a) Tumeurs germinales intracrâniennes et intramédullaires | 88,4 % | 74,3 % | 95,0 % |
| X b) Tumeurs germinales extragonadiques et extracrâniennes malignes | 91,9 % | 76,9 % | 97,3 % |
| X c) Tumeurs germinales gonadiques malignes | 95,2 % | 85,7 % | 98,4 % |
| XI Autres tumeurs épithéliales malignes et mélanomes malins | 91,3 % | 85,0 % | 95,1 % |
| XI b) Carcinomes thyroïdiens | 100,0 % | . | . |
| XI d) Mélanomes malins | 95,7 % | 72,9 % | 99,4 % |
| XI f) Autres carcinomes et carcinomes non précisés | 79,8 % | 63,9 % | 89,2 % |
| XII Tumeurs malignes autres et non précisées | 89,5 % | 64,1 % | 97,3 % |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||
Malgré une certaine variation du taux de survie à 5 ans par région du diagnostic, aucun de ces écarts n'est statistiquement significatif (tableau 11). Les proportions de survie à 5 ans étaient semblables pour les différents plans de traitement initiaux, bien que les enfants inscrits à un essai clinique connaissent une amélioration petite mais statistiquement significative de la survie (tableau 12).
| Région | Temps (en mois) | PSO | IC inférieur | IC supérieur |
|---|---|---|---|---|
| Canada | 12 | 91,8 % | 91,0 % | 92,5 % |
| 36 | 85,1 % | 84,1 % | 86,1 % | |
| 60 | 81,5 % | 80,4 % | 82,6 % | |
| Colombie-Britannique | 12 | 94,1 % | 91,9 % | 95,7 % |
| 36 | 87,5 % | 84,6 % | 89,9 % | |
| 60 | 83,3 % | 79,8 % | 86,3 % | |
| Prairies | 12 | 91,3 % | 89,3 % | 93,0 % |
| 36 | 83,9 % | 81,2 % | 86,1 % | |
| 60 | 81,3 % | 78,5 % | 83,9 % | |
| Ontario | 12 | 91,5 % | 90,2 % | 92,6 % |
| 36 | 85,3 % | 83,7 % | 86,7 % | |
| 60 | 81,1 % | 79,2 % | 82,8 % | |
| Québec | 12 | 92,0 % | 90,3 % | 93,4 % |
| 36 | 84,9 % | 82,7 % | 86,8 % | |
| 60 | 82,7 % | 80,3 % | 84,8 % | |
| Atlantique | 12 | 90,3 % | 86,8 % | 92,9 % |
| 36 | 84,5 % | 80,3 % | 87,8 % | |
| 60 | 78,8 % | 73,8 % | 83,0 % | |
| Territoires | 12 | 82,4 % | 54,7 % | 93,9 % |
| 36 | 70,6 % | 43,1 % | 86,6 % | |
| 60 | 64,7 % | 37,7 % | 82,3 % | |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
||||
| Type de plan de traitement initial | Temps (en mois) | PSO | IC inférieur | IC supérieur |
|---|---|---|---|---|
| Enfants inscrits à un essai clinique qui est approuvé par le CER | 12 | 94,9% | 93,6% | 96,0% |
| 36 | 88,9% | 87,1% | 90,5% | |
| 60 | 85,8% | 83,6% | 87,7% | |
| Enfants qui suivent un essai clinique qui est approuvé par le CER sans être inscrits à un tel essai | 12 | 92,1% | 90,9% | 93,2% |
| 36 | 84,0% | 82,4% | 85,4% | |
| 60 | 79,5% | 77,6% | 81,2% | |
| Autre | 12 | 89,8% | 88,2% | 91,2% |
| 36 | 84,7% | 82,8% | 86,4% | |
| 60 | 82,1% | 80,0% | 84,1% | |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
||||
En termes absolus, le taux de survie général chez les enfants atteints d'un cancer s'améliore au Canada. La figure 4 indique que les TMSA pour tous les cancers combinés ont diminué au fil des ans. Ils ont chuté de 2,0 % par année entre 1992 et 2010 (p < 0,01).
Figure 4 - Équivalent du texte
La figure 4 présente les graphiques linéaires des taux de mortalité normalisés selon l'âge pour 1 million de personnes de tous les cancers combinés, par sexe et pour les deux sexes combinés, chez les enfants de 0 à 14 ans, de 1992 à 2012. Chez les garçons et les filles, les tendances varient même si, dans l'ensemble, la mortalité décline d'un taux élevé X en 1992 à un taux faible Y en 2012 pour les deux sexes combinés. Les taux présentés reposent sur les données de la Base de données sur les décès de la Statistique de l'état civil, et seule la mortalité découlant de tumeurs malignes est prise en compte.
Le tableau de la figure 4 ci-dessous comprend chacun des points de données représentés dans la figure 4.
| Année | |||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 1992 | 1993 | 1994 | 1995 | 1996 | 1997 | 1998 | 1999 | 2000 | 2001 | 2002 | 2003 | 2004 | 2005 | 2006 | 2007 | 2008 | 2009 | 2010 | 2011 | 2012 | |
| Garçons | 35,5 | 34,2 | 30,8 | 23,5 | 32,2 | 30,7 | 24,1 | 29,8 | 26,4 | 31,1 | 23,2 | 25,9 | 25,3 | 23,2 | 26,7 | 25,7 | 26,6 | 24 | 19,5 | 22,9 | 19,4 |
| Filles | 29 | 29,2 | 25,8 | 27,3 | 30,6 | 26,2 | 26,9 | 24,4 | 19,8 | 21,3 | 21,3 | 15,8 | 23,7 | 19,1 | 19,4 | 25,1 | 17,4 | 22 | 23,6 | 17,9 | 19 |
| Les deux sexes | 32,4 | 31,7 | 28,3 | 25,4 | 31,4 | 28,5 | 25,5 | 27,2 | 23,2 | 26,3 | 22,3 | 21 | 24,6 | 21,2 | 23,1 | 25,4 | 22,1 | 23 | 21,5 | 20,5 | 19,2 |
Source de données : Statistique de l'état civil : Base de données sur les décès
Remarque :
Les taux sont standardisés en fonction de la répartition par âge de la population canadienne de 1991.
* Comprend les décès découlant de tumeurs malignes seulement.
Source de données : Statistique de l'état civil - Base de données sur les décès
Maladie métastatique au moment du diagnostic
La maladie métastatique survient lorsque le cancer se propage de son emplacement original (tumeur primitive) vers une nouvelle partie du corps. Il est un important indicateur pour déterminer l'ampleur de la maladie. Chez les enfants pour lesquels nous avions accès à des renseignements sur la portée de la maladie au moment du diagnostic (environ 61 % des cas), on constate la présence d'un cancer métastatique au moment du diagnostic chez environ le cinquième des cas. Quelque 27 % des garçons et 25 % des filles ayant reçu un diagnostic de cancer présentent déjà des métastases au moment du diagnostic. Chez les deux sexes, ce sont les enfants plus âgés de 10 à 14 ans qui présentaient le plus fréquemment une maladie métastatique lors du diagnostic (27,2 % pour les deux) [tableau 13].
| Sexe et Âge (en années) | Nombre de cas présentant des métastases au moment du diagnostic | Nombre de cas où il y a de l'information sur les métastases | Pourcentage des cas présentant des métastases (%) |
|---|---|---|---|
| Garçons | |||
| <1 | 35 | 185 | 18,9 |
| 1 à 4 | 155 | 540 | 29,4 |
| 5 à 9 | 130 | 450 | 29,2 |
| 10 à 14 | 140 | 515 | 27,2 |
| Filles | |||
| <1 | 45 | 180 | 23,2 |
| 1 à 4 | 110 | 445 | 24,5 |
| 5 à 9 | 75 | 345 | 21,7 |
| 10 à 14 | 130 | 470 | 27,2 |
| Les deux | |||
| <1 | 80 | 365 | 21,0 |
| 1 à 4 | 270 | 980 | 27,2 |
| 5 à 9 | 205 | 795 | 26,0 |
| 10 à 14 | 265 | 985 | 27,2 |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||
Le tableau 14 présente le pourcentage des cas présentant des métastases au moment du diagnostic, selon le type de cancer. Ainsi, les enfants atteints d'un neuroblastome (51,2 %), de tumeurs rénales (29,9 %), d'un carcinome (38,3 %) présentent des métastases au moment du diagnostic plus souvent que ceux dont le diagnostic est différent. À l'opposé, les enfants présentant le moins souvent des métastases au moment du diagnostic sont ceux atteints d'un rétinoblastome ou de néoplasmes du SNC. La proportion d'enfants chez qui un cancer métastatique a été diagnostiqué est semblable d'une région à l'autre, variant de 21,5 % à 32,0 % pour toutes les régions, sauf les territoires (tableau 15). Dans les territoires, la proportion de cas présentant des métastases au moment du diagnostic doit être interprétée avec prudence en raison du très petit nombre d'enfants pour lesquels des renseignements sur les métastases étaient disponibles (N = 10).
| Nombre de cas présentant des métastases au moment du diagnostic | Pourcentage des cas présentant des métastases (%) | |
|---|---|---|
| II Lymphomes | 250 | 36,4 |
| III Tumeurs du SNC | 90 | 9 |
| IV Neuroblastomes | 190 | 51,2 |
| V Rétinoblastome | <5 | 1 |
| VI Tumeurs rénales | 70 | 29,9 |
| VII Tumeurs hépatiques | 10 | 16,7 |
| VIII Tumeurs osseuses | 50 | 23,7 |
| IX Sarcomes des tissus mous | 60 | 21,3 |
| X Tumeurs germinales | 30 | 19,7 |
| XI Carcinomes | 60 | 38,3 |
| XII Autres | <5 | 15,8 |
| Tous les cancers susmentionnés combinés | 820 | 24,9 |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
||
| Nombre de cas présentant des métastases au moment du diagnostic | Nombre de cas où il y a de l'information sur les métastases | Pourcentage des cas présentant des métastases (%) | |
|---|---|---|---|
| Canada | 820 | 3130 | 26,2 |
| Colombie-Britannique | 75 | 360 | 21,5 |
| Prairies | 155 | 520 | 29,5 |
| Ontario | 315 | 1255 | 25,1 |
| Québec | 190 | 750 | 25,7 |
| Atlantique | 70 | 225 | 32,0 |
| Territoires* | 5 | 10 | 50 |
Remarque :
*Dans les territoires, la proportion de cas présentant des métastases au moment du diagnostic doit être interprétée avec prudence en raison du très petit comptage cellulaire. Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||
Rechute après le diagnostic
Le risque de rechute dans les cinq ans suivant le diagnostic est examiné selon l'âge, le sexe et le type de cancer. Par rechute, on entend la réapparition d'une tumeur primitive à son siège original (rechute locale ou récurrence) ou à un site éloigné (métastases). La rechute est associée à un pronostic plus défavorable pour les patients, en particulier pour ceux présentant un risque élevé de rechuteNote de bas de page 34, Note de bas de page 35. Il existe plusieurs facteurs de prédiction du décès après une rechute, soit le moment de la rechute (moins bon pronostic en cas de rechute hâtive), l'envahissement de la moelle osseuse, l'âge (moins de 1 an ou plus de 10 ans au moment du diagnostic primaire), immunophénotypage des lymphocytes T avec hyperleucocytose, facteurs de risque génétiques et syndrome de DownNote de bas de page 32, Note de bas de page 34, Note de bas de page 35.
Parmi les enfants ayant reçu un diagnostic de cancer entre 2001 et 2006, 14,6 % ont connu une rechute dans les cinq ans suivant le diagnostic initial (tableau 16). En fonction du sexe et de l'âge, le risque de rechute dans les cinq ans suivant le diagnostic est particulièrement élevé chez les garçons âgés de 5 à 9 ans au moment du diagnostic (16,8 %). Chez les filles, celles âgées de 5 à 9 ans et de 10 à 14 ans connaissent le plus fréquemment une rechute (15,4 % et 15,5 % respectivement). En fonction du diagnostic, les enfants qui présentent des tumeurs osseuses malignes (24,9 %) et des sarcomes des tissus mous (20,4 %) connaissent très souvent une rechute en général (tableau 17). Le risque de rechute dans les cinq ans suivant le diagnostic varie quelque peu selon la région, la proportion de rechutes étant plus faible au Québec (12,4 %) et plus élevée dans les Prairies (17,9 %) [tableau 18]. Toutefois, les analyses dont sont tirés ces résultats ne tenaient pas compte des facteurs confusionnels.
| Sexe et Âge (en années) | Nombre d'enfants qui ont fait une rechute | Nombre d'enfants atteints d'un cancer | Pourcentage (%) |
|---|---|---|---|
| Garçons | |||
| <1 | 40 | 250 | 15,0 |
| 1 à 4 | 140 | 1025 | 13,7 |
| 5 à 9 | 130 | 775 | 16,8 |
| 10 à 14 | 110 | 745 | 14,7 |
| Filles | |||
| <1 | 30 | 240 | 13,1 |
| 1 à 4 | 105 | 815 | 12,5 |
| 5 à 9 | 90 | 590 | 15,4 |
| 10 à 14 | 100 | 665 | 15,5 |
| Les deux | |||
| <1 | 65 | 480 | 14,0 |
| 1 à 4 | 240 | 1840 | 13,2 |
| 5 à 9 | 220 | 1365 | 16,2 |
| 10 à 14 | 215 | 1410 | 15,1 |
| Tous les âges | 745 | 5100 | 14,6 |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||
| Nombre d'enfants qui ont fait une rechute | Nombre d'enfants atteints d'un cancer | Pourcentage (%) | |
|---|---|---|---|
| I Leucémies | 255 | 1605 | 15,6 |
| II Lymphomes | 80 | 680 | 12,3 |
| III Tumeurs du SNC | 165 | 1210 | 13,6 |
| IV Neuroblastomes | 60 | 375 | 16,4 |
| V Rétinoblastome | 5 | 100 | 5,0 |
| VI Tumeurs rénales | 35 | 240 | 13,1 |
| VII Tumeurs hépatiques | 10 | 75 | 12,8 |
| VIII Tumeurs osseuses | 50 | 205 | 24,9 |
| IX Sarcomes des tissus mous | 55 | 290 | 20,4 |
| X Tumeurs germinales | 10 | 150 | 7,9 |
| XI Carcinomes | 15 | 150 | 8,7 |
| XII Autres | 5 | 20 | 5,3 |
| Tous les cancers combinés | 745 | 5100 | 14,6 |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||
| Nombre d'enfants qui ont fait une rechute | Nombre d'enfants atteints d'un cancer | Pourcentage (%) | |
|---|---|---|---|
| Canada | 745 | 5105 | 14,6 |
| Colombie-Britannique | 90 | 590 | 15,9 |
| Prairies | 155 | 860 | 17,9 |
| Ontario | 300 | 2100 | 14,3 |
| Québec | 145 | 1180 | 12,4 |
| Atlantique | 45 | 360 | 13,3 |
| Territoires | <5 | 15 | 5,9 |
Remarque :
Source : Programme Cancer chez les jeunes au Canada/système électronique d'information en réseau du Pediatric Oncology Group of Ontario |
|||
Conclusion
Le programme CCJC a été créé dans le but de fournir des données de surveillance pancanadiennes fondées sur la population concernant le cancer chez les enfants afin de créer des occasions d'étudier les cancers infantiles et de jeter les bases de la planification de programmes et de politiques de lutte contre le cancer. Le CCJC offre la possibilité d'évaluer un large éventail de questions concernant la santé publique et le rendement du système de santé en matière de traitement du cancer chez les enfants, comme la relation entre les données démographiques, la participation à des essais cliniques et le temps d'attente avant le traitement et entre les traitements et leur incidence sur les résultats cliniques. Par ailleurs, on examine la possibilité de publier régulièrement les résultats du CCJC dans une perspective de surveillance de la santé publique. Pour consulter les plus récentes données de surveillance concernant les cancers infantiles et d'autres affections chroniques, visitez l'Infobase de la santé publique en ligne de l'Agence de la santé publique du Canada ( https://sante-infobase.canada.ca/ ).
Afin d'étendre l'incidence potentielle du CCJC, une procédure a été mise en œuvre pour permettre aux chercheurs ne faisant pas partie du programme de demander l'accès aux données du CCJC (voir l'ANNEXE A). Pour favoriser l'utilisation des données du CCJC et renforcer la collaboration dans le milieu général de la recherche, un programme de champions de la recherche du CCJC a été créé. Plus de 40 champions appartenant à divers milieux professionnels participent dans l'ensemble du pays et nous serions heureux d'en accueillir d'autres. Une série de webinaires de formation a été lancée pour favoriser le perfectionnement des champions de la recherche du CCJC. Elle traite de sujets comme l'élaboration des questions de recherche applicables, le processus de demande d'accès aux données et les fondements de l'analyse des données du CCJC.
En plus de générer des statistiques de base, le regroupement des données sur les cancers infantiles a des avantages à l'échelle nationale que nous commençons à réaliser à mesure que les chercheurs au sein des centres d'oncologie pédiatrique et entre ceux-ci utilisent les données du CCJC (voir l'ANNEXE C). De plus amples renseignements concernant l'accès aux données, les demandes d'accès aux données du CCJC déjà approuvées et le programme des champions de la recherche du CCJC peuvent être obtenus en écrivant à l'adresse cypc-ccjc@phac-aspc.gc.ca ou en visitant le site Web du C17 Council (http://www.c17.ca/) [en anglais seulement].
Références
- Note de bas de page 1
-
Pizzo PA, Poplack DG, editors. Principles and practice of pediatric oncology, 6th ed. Philadelphia (PA) : Lippincott Williams & Wilkins; 2010.
- Note de bas de page 2
-
Oeffinger KC, Mertens AC, Sklar CA, et al. Chronic health conditions in adult survivors of childhood cancer. N Engl J Med. 2006; 355(15):1572-82.
- Note de bas de page 3
-
Mitra D, Hutchings K, Shaw A, Barber R, Sung L, Bernstein M, Carret AS, Barbaros V, McBride M, Parker L, Stewart M, Strahlendorf C. Status report: the Cancer in Young People in Canada surveillance system. Health Promot Chronic Dis Prev Can. 2015 Jun;35(4):73-6.
- Note de bas de page 4
-
Canadian Cancer Society's Advisory Committee on Cancer Statistics. Canadian Cancer Statistics 2015. Toronto, ON : Canadian Cancer Society; 2015.
- Note de bas de page 5
-
Barr RD, Greenberg ML, Shaw AK, Mery L. The Canadian Childhood Cancer Surveillance and Control Program (CCCSCP): A status report. Pediatr Blood Cancer. 2008;50:518-9.
- Note de bas de page 6
-
Steliarova-Foucher E, Stiller C, Lacour B, Kaatsch P. International Classification of Childhood Cancer, third edition. Cancer. 2005;103 (7):1457–67.
- Note de bas de page 7
-
Statistics Canada. Canadian Cancer Registry. Available at : http://www23.statcan.gc.ca/imdb/p2SV.pl?Function=getSurvey&SDDS=3207 (accessed May 15, 2016).
- Note de bas de page 8
-
Statistics Canada. Table 102-0522 - Deaths, by cause, Chapter II: Neoplasms (C00 to D48), age group and sex, Canada, annual (number), CANSIM (database). Available at : http://www5.statcan.gc.ca/cansim/a26?lang=eng&id=1020522 (accessed May 15, 2016).
- Note de bas de page 9
-
Statistics Canada. Table 102-0552 - Deaths and mortality rate, by selected grouped causes and sex, Canada, provinces and territories, annual, CANSIM (database). Available at : http://www5.statcan.gc.ca/cansim/a26?lang=eng&id=1020552 (accessed May 15, 2016).
- Note de bas de page 10
-
Statistics Canada. Annual Demographic Estimates: Canada, Provinces and Territories, 2016 (Catalogue no. 91-215-X). Ottawa : Minister of Industry; 2016. CANSIM Table 051-0001 released in September 2016. Available at : http://www.statcan.gc.ca/pub/91-215-x/91-215-x2016000-eng.pdf (accessed February 6, 2017).
- Note de bas de page 11
-
Custom tabulation of DCO Cases, Canadian Cancer Registry, 2001–2006.
- Note de bas de page 12
-
Breslow N, Day N. Statistical methods in cancer research. Volume 2 : The design and analysis of cohort studies. Lyon (FR) : IARC Scientific Publications no. 82; 1987.
- Note de bas de page 13
-
Joinpoint Regression Program, Version 4.3.1.0 - April 2016; Statistical Methodology and Applications Branch, Surveillance Research Program, National Cancer Institute.
- Note de bas de page 14
-
Kim HJ, Fay MP, Feuer EJ, Midthune DN. Permutation tests for joinpoint regression with applications to cancer rates. Statistics in Medicine. 2000;19:335-51: (correction : 2001; 20:655).
- Note de bas de page 15
-
Gupta S, Gibson P, Pole JD, Sutradhar R, Sung L, Guttmann A. Predictors of diagnostic interval and associations with outcome in acute lymphoblastic leukemia. Pediatr Blood Cancer. 2015;62 (6):957-63.
- Note de bas de page 16
-
Pagano M, Gauvreau K. Principles of Biostatistics. Second Edition. Pacific Grove, CA: Duxbury Press. 2000 ISBN-10 : 0534229026.
- Note de bas de page 17
-
Statistics Canada. 2006 Census of Population – Aboriginal Peoples. Ottawa (ON) : Statistics Canada. Available at : http://www12.statcan.gc.ca/census-recensement/index-eng.cfm?HPA=1.
- Note de bas de page 18
-
Statistics Canada. 2006 Census of Population – Ethnic Origin and visible minorities. Ottawa (ON) : Statistics Canada. Available at : http://www12.statcan.gc.ca/census-recensement/index-eng.cfm?HPA=1.
- Note de bas de page 19
-
Parkin DM, Stiller CA, Draper GJ, Bieber CA. The international incidence of childhood cancer. Int J Cancer. 1988 Oct 15;42 (4):511-20.
- Note de bas de page 20
-
Kaatsch P. Epidemiology of childhood cancer. Cancer Treat Rev. 2010;36(4):277-85.
- Note de bas de page 21
-
Dorak MT, Karpuzoglu E. Gender differences in cancer susceptibility: an inadequately addressed issue. Front Genet. 2012 Nov 28;3:268.
- Note de bas de page 22
-
Cancer Research in UK. Children's cancers incidence statistics. Available at : http://www.cancerresearchuk.org/health-professional/cancer-statistics/childrens-cancers/incidence#heading-Fifteen.
- Note de bas de page 23
-
World Health Organization. Children and Cancer. http://www.who.int/ceh.
- Note de bas de page 24
-
Linet MS, Wacholder S, Zahm SH. Interpreting epidemiologic research: lessons from studies of childhood cancer. Pediatrics. 2003 Jul;112 (1 Pt 2):218-32.
- Note de bas de page 25
-
Ries LAG, Smith MA, Gurney JG, et al. Cancer Incidence and Survival among Children and Adolescents: United States SEER Program 1975-1995, National Cancer Institute, SEER Program. NIH Pub. No. 99-4649. Bethesda, MD, 1999.
- Note de bas de page 26
-
Lawrence Ellison, Teresa Janz. Childhood cancer incidence and mortality in Canada. Statistics Canada Catalogue no. 82-624-X. Available at : http://www.statcan.gc.ca/pub/82-624-x/2015001/article/14213-eng.htm (accessed May 27, 2016).
- Note de bas de page 27
-
Gittleman HR, Ostrom QT, Rouse CD, Dowling JA, de Blank PM, Kruchko CA, Elder JB, Rosenfeld SS, Selman WR, Sloan AE, Barnholtz-Sloan JS. Trends in central nervous system tumour incidence relative to other common cancers in adults, adolescents, and children in the United States, 2000 to 2010. Cancer. 2015 Jan 1;121 (1):102-12.
- Note de bas de page 28
-
Siegel DA, King J, Tai E, Buchanan N, Ajani UA, Li J. Cancer incidence rates and trends among children and adolescents in the United States, 2001–2009. Pediatrics. 2014 Oct;134 (4):e945-55.
- Note de bas de page 29
-
Linabery AM, Ross JA. Trends in childhood cancer incidence in the U.S. (19922004). Cancer. 2008 Jan 15;112 (2):416-32.
- Note de bas de page 30
-
Baade PD, Youlden DR, Valery PC, et al. Trends in incidence of childhood cancer in Australia, 1983–2006. Br J Cancer. 2010;102:620-6.
- Note de bas de page 31
-
Bleyer WA, Tejeda H, Murphy SB, Robison LL, Ross JA, Pollock BH, Severson RK, Brawley OW, Smith MA, Ungerleider RS. National cancer clinical trials : children have equal access; adolescents do not. J Adolesc Health. 1997;(6):366-73.
- Note de bas de page 32
-
Wasilewski-Masker K, Liu Q, Yasui Y, et al. Late recurrence in pediatric cancer: a report from the childhood cancer survivor study. JNCI J Natl Cancer Inst. 2009;101(24):1709-20.
- Note de bas de page 33
-
Unger JM, Barlow WE, Martin DP, et al. Comparison of survival outcomes among cancer patients treated in and out of clinical trials. J Natl Cancer Inst. 2014;106(3):1-13.
- Note de bas de page 34
-
Teachey DT, Hunger SP. Predicting relapse risk in childhood acute lymphoblastic leukaemia. Br J Haematol. 2013;162(5):606-620.
- Note de bas de page 35
-
Oskarsson T, Söderhäll S, Arvidson J, Forestier E, et al. Relapsed childhood acute lymphoblastic leukemia in the nordic countries: prognostic factors, treatment and outcome. Haematologica 2016;101:68-76.
ANNEXE A : Accès aux données
Les chercheurs peuvent désormais demander l'accès aux données du CCJC. Pour accéder aux données, un chercheur ou une équipe de recherche doit :
- présenter une demande qui comprend un projet de recherche décrivant les objectifs et le bien-fondé, les méthodes, les justifications pour chaque élément de données demandé, le plan d'application des connaissances et l'échéancier pour l'achèvement du projet ainsi que la conservation des données;
- obtenir l'approbation (ou les approbations) du comité d'éthique de la recherche de leur établissement;
- recevoir l'approbation du comité chargé de l'utilisation et de la publication des données du CCJC;
- recevoir l'approbation du programme de l'Agence de la santé publique du Canada et des autorités de protection des renseignements personnels;
- conclure une entente de confidentialité concernant les données du CCJC.
Les demandes sont évaluées en fonction du mérite scientifique (y compris l'harmonisation de la méthode d'étude avec les objectifs de la recherche), de la faisabilité, de la pertinence pour le cancer chez les enfants, des échéanciers et des mesures précises proposées pour assurer la protection des renseignements personnels. L'accès aux données ne peut se faire qu'au Canada; cela dit, les demandes des chercheurs ayant une affiliation internationale seront examinées pourvu qu'elles n'occasionnent pas le retrait de données du Canada.
Il est possible d'obtenir des instructions détaillées sur la procédure d'accès aux données en écrivant à cypc-ccjc@phac-aspc.gc.ca ou en consultant le site Web du C17 Council : http://www.c17.ca/ [en anglais seulement].
ANNEXE B : Intégration des données
Le Pediatric Oncology Group of Ontario (POGO) est un registre provincial du cancer pédiatrique qui recueille des données sur les nouveaux cas de cancer en Ontario depuis 1985. Il regroupe cinq centres d'oncologie pédiatrique en Ontario : l'Hospital for Sick Children de Toronto, le McMaster Children's Hospital d'Hamilton, le Centre hospitalier pour enfants de l'est de l'Ontario de London, l'Hôpital général de Kingston et le Centre hospitalier pour enfants de l'est de l'Ontario d'Ottawa. Depuis 1985, tout enfant qui habite l'Ontario et chez qui l'on diagnostique un cancer à l'un de ces cinq centres a été inscrit dans la base de données du POGO, appelée POGONIS. Le POGO vise à surveiller : 1) l'incidence et la prévalence du cancer chez les enfants en Ontario; 2) la demande de soins contre le cancer en Ontario; 3) la nature et les caractéristiques du traitement contre le cancer; 4) l'issue pour le patient et 5) les séquelles à long terme du cancer et du traitement contre le cancer chez les enfants.
Le POGO a un modèle unique pour classifier les cancers infantiles. Les cancers saisis dans POGONIS sont classifiés selon le POGO Pediatric Cancer Diagnostic Nomenclature and Classification System (système de classification et de nomenclature des diagnostics de cancer infantile du POGO), qui ressemble à la Classification internationale du cancer chez les enfants et inclut, pour encore plus de précision, la classification des tumeurs cérébrales de l'Organisation mondiale de la Santé. Au départ, POGONIS a adopté le système de classification et de nomenclature informel élaboré à l'interne par l'ancien Childhood Cancer Study Group. Le modèle compte 10 groupes de diagnostics et attribue un code de diagnostic à quatre chiffres à chaque diagnostic particulier. Ce système de classification a ensuite été intégré à d'autres modèles de diagnostic, comme celui adopté par le Centre international de recherche sur le cancer et la Classification internationale du cancer chez les enfants, 3e édition (CICE-3) élaborée subséquemment. Pour la cohorte d'enfants incluse dans le présent rapport (cancer diagnostiqué entre le 1er janvier 2001 et le 31 décembre 2006), le code de diagnostic à quatre chiffres pour les patients inscrits dans POGONIS a été intégré à la CICE-3. Puisque le POGO et le CCJC ne visent pas les mêmes objectifs, les éléments de données contenus dans ces deux bases de données ne sont pas tous comparables. Selon l'examen critique des définitions et de l'exhaustivité des données, seul un sous-ensemble d'éléments de données du POGO pouvait être intégré à la base de données du CCJC. Les éléments de données pris en considération pour le présent rapport sont les suivants.
| Section | Élément de données |
|---|---|
| Inscription | Sexe |
| Date de naissance | |
| Âge au moment du diagnostic | |
| Province de résidence au moment du diagnostic | |
| Code postal de la résidence au moment du diagnostic | |
| Origine ethnique | |
| Centre d'affiliation | |
| Moment du traitement | Professionnel de la santé contacté ce jour-là |
| Documentation du diagnostic | Primaire ordinal |
| Date du diagnostic définitif | |
| Méthode de diagnostic définitif | |
| Code morphologique CIM-O | |
| Code topographique CIM-O | |
| Code de comportement | |
| Présence ou absence de métastases au moment du diagnostic | |
| Données sur le protocole ou le plan de traitement | Plan de traitement suivi |
| Détails des rechutes | Date de la rechute |
| Décès | Date du décès |
| Cause du décès |
| Année | Enfants âgés de 0 à 14 ans | Enfants âgés de moins de 1 an | Enfants âgés de 1 à 4 ans | Enfants âgés de 5 à 9 ans | Enfants âgés de 10 à 14 ans | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| RCC | CCJC | CCJC exprimé en pourcentage du RCC | RCC | CCJC | CCJC exprimé en pourcentage du RCC | RCC | CCJC | CCJC exprimé en pourcentage du RCC | RCC | CCJC | CCJC exprimé en pourcentage du RCC | RCC | CCJC | CCJC exprimé en pourcentage du RCC | |
| Tumeurs malignes et non malignes | |||||||||||||||
| 2001 | 895 | 840 | 94,06 | 75 | 70 | 90,67 | 320 | 310 | 96,30 | 230 | 220 | 96,52 | 265 | 235 | 90,15 |
| 2002 | 870 | 855 | 97,60 | 70 | 80 | 111,59 | 310 | 310 | 100,98 | 235 | 225 | 95,73 | 265 | 240 | 91,67 |
| 2003 | 880 | 860 | 98,07 | 80 | 85 | 105,00 | 300 | 290 | 97,98 | 240 | 235 | 97,50 | 260 | 250 | 96,56 |
| 2004 | 855 | 820 | 96,13 | 90 | 80 | 94,38 | 300 | 305 | 100,33 | 240 | 235 | 98,75 | 220 | 195 | 88,34 |
| 2005 | 885 | 885 | 99,89 | 75 | 90 | 117,33 | 305 | 315 | 104,26 | 235 | 240 | 103,43 | 275 | 240 | 87,18 |
| 2006 | 865 | 865 | 99,77 | 75 | 85 | 111,84 | 300 | 310 | 103,63 | 210 | 210 | 99,06 | 275 | 255 | 92,73 |
| 2007 | 910 | 865 | 95,15 | 100 | 95 | 95,00 | 335 | 315 | 93,75 | 215 | 220 | 100,46 | 255 | 235 | 92,52 |
| 2008 | 980 | 930 | 95,11 | 110 | 100 | 90,18 | 350 | 355 | 100,00 | 220 | 225 | 102,29 | 300 | 260 | 85,95 |
| 2009 | 900 | 860 | 96,00 | 100 | 105 | 100,00 | 310 | 315 | 100,64 | 230 | 220 | 95,69 | 255 | 225 | 88,98 |
| 2010 | 965 | 905 | 93,99 | 90 | 75 | 86,21 | 395 | 380 | 96,45 | 230 | 220 | 97,36 | 255 | 230 | 89,88 |
| Tumeurs malignes seulement | |||||||||||||||
| 2001 | 865 | 785 | 91,20 | 75 | 65 | 83,78 | 320 | 300 | 93,44 | 220 | 205 | 94,09 | 250 | 220 | 88,00 |
| 2002 | 850 | 795 | 93,29 | 70 | 75 | 104,35 | 300 | 285 | 95,67 | 225 | 200 | 91,48 | 255 | 230 | 89,11 |
| 2003 | 855 | 805 | 93,80 | 80 | 75 | 96,20 | 295 | 275 | 94,18 | 235 | 220 | 93,59 | 250 | 235 | 92,80 |
| 2004 | 810 | 750 | 92,14 | 85 | 75 | 89,41 | 295 | 280 | 95,25 | 225 | 220 | 95,58 | 210 | 175 | 85,10 |
| 2005 | 860 | 810 | 94,19 | 75 | 80 | 105,41 | 300 | 300 | 98,68 | 225 | 215 | 94,64 | 260 | 225 | 85,38 |
| 2006 | 850 | 800 | 94,92 | 75 | 80 | 108,00 | 300 | 300 | 100,00 | 205 | 195 | 92,75 | 270 | 235 | 87,22 |
| 2007 | 885 | 795 | 89,54 | 95 | 85 | 84,69 | 335 | 300 | 89,79 | 210 | 200 | 94,86 | 245 | 210 | 86,48 |
| 2008 | 965 | 870 | 90,37 | 110 | 95 | 82,73 | 345 | 335 | 96,81 | 220 | 205 | 94,04 | 290 | 245 | 82,94 |
| 2009 | 895 | 810 | 90,51 | 100 | 95 | 95,10 | 310 | 295 | 94,87 | 230 | 210 | 91,30 | 250 | 210 | 82,54 |
| 2010 | 955 | 840 | 88,54 | 85 | 70 | 81,18 | 390 | 360 | 92,09 | 220 | 200 | 89,24 | 255 | 215 | 84,86 |
Remarque : Les données du RCC présentées comprennent les tumeurs non malignes pour les tumeurs du SNC seulement Sources de données :
|
|||||||||||||||
ANNEXE C : Publications connexes
Voici des publications récentes ou prévues qui contiennent des données du CCJC.
Publications dans des revues à comité de lecture
Stammers DM, Israels SJ, Lambert PJ,Cuvelier GD. « Cancer incidence, morbidity, and survival in Canadian First Nation children: a Manitoba population-based study from the Cancer in Young People in Canada (CYP-C) registry ». Pediatr Blood Cancer, 2014, vol. 61 (12):2164-9.
Mitra D , Hutchings K, Shaw A, Barber R, Sung L, Bernstein M, Carret AS, Barbaros V, McBride M, Parker L, Stewart M, Strahlendorf C. « Rapport d'étape - le système de surveillance Cancer chez les jeunes au Canada ». Promotion de la santé et prévention des maladies chroniques au Canada, juin 2015, vol. 35 (4):73-6.
Pole JD, Barber R, Bergeron R-E, Carret AS, Dix D, Kulkarni K, Martineau E, Randall A, Stammers D, Strahlendorf C, Strother D, Truoung TH, Sung L. Most children with cancer are not enrolled on a clinical trial in Canada: a population-based study. BMC Cancer (à paraître).
Publications non examinées par des pairs
Agence de la santé publique du Canada. Le cancer chez les enfants (de 0 à 14 ans) au Canada. Disponible en ligne à : http://www.phac-aspc.gc.ca/cd-mc/cancer/fs-fi/cancer-child-enfant/index-fra.php .
Agence de la santé publique du Canada. Le cancer chez les adolescents (de 15 à 19 ans) au Canada. Disponible en ligne à : http://www.phac-aspc.gc.ca/cd-mc/cancer/fs-fi/cancer-adol/index-fra.php.
Publication à venir dans une revue à comité de lecture
Mitra D, L. Xie, K. Hutchings. The incidence and survival of childhood cancer in Canada: results from the Cancer in Young People in Canada (CYP-C) surveillance system.