Conseils sur les agents pathogènes d’origine hydrique dans l’eau potable
Télécharger en format PDF
(1,27 Mo, 112 pages)
Organisation : Santé Canada
Date publiée : septembre 2022
Renseignements généraux sur les documents de conseils
Santé Canada collabore avec les provinces, les territoires et d’autres organismes fédéraux à l’élaboration des Recommandations pour la qualité de l’eau potable au Canada. Au fil des ans, de nouvelles méthodologies et approches ont mené Santé Canada, en collaboration avec le Comité fédéral-provincial-territorial sur l’eau potable (CEP), à élaborer un nouveau type de document, les documents de conseils, pour fournir des conseils et des recommandations sur les questions liées à la qualité de l’eau potable pour les paramètres qui ne nécessitent pas de recommandation officielle dans le cadre des Recommandations pour la qualité de l’eau potable au Canada.
Les documents de conseils sont élaborés pour fournir des conseils en matière d’exploitation ou de gestion sur des questions précises liées à l’eau potable (p. ex. les avis d’ébullition de l’eau), afin de rendre disponibles des renseignements sur l’évaluation des risques pour la santé lorsqu’une valeur de recommandation n’est pas jugée nécessaire.
Des recommandations sont formulées dans le cadre des Recommandations pour la qualité de l’eau potable au Canada, en particulier pour les contaminants qui satisfont à tous les critères suivants :
- l’exposition au contaminant pourrait entraîner des effets nocifs sur la santé;
- le contaminant est fréquemment détecté, ou pourrait l’être, dans un grand nombre de systèmes d’approvisionnement en eau potable du Canada;
- le contaminant est détecté, ou pourrait l’être, à une concentration possiblement nocive pour la santé.
Si un contaminant visé ne satisfait pas à tous ces critères, Santé Canada, en collaboration avec le CEP, peut décider de ne pas créer de document technique. Dans ce cas, un document de conseils peut être rédigé.
Le processus d’élaboration des documents de conseils est sensiblement le même que celui des documents techniques de la recommandation et comprend également des consultations publiques sur le site Web de Santé Canada. Ces documents permettent de fournir des renseignements aux autorités en matière d’eau potable et peuvent aider à orienter les interventions en cas de déversement ou d’autres situations d’urgence.
La partie A du présent document fournit des conseils sur la gestion des risques associés aux agents pathogènes dont il est question ici; la partie B fournit des renseignements scientifiques et techniques à l’appui de ces conseils; la partie C présente les documents de référence; et la partie D contient les annexes.
Résumé
De nombreux types de microorganismes pathogènes peuvent se propager par l’eau potable, ce qui peut entraîner des maladies chez l’humain. Certains d’entre eux sont présents dans les matières fécales humaines ou animales et peuvent entraîner des maladies gastro-intestinales quand de l’eau contaminée par ces matières est consommée. D’autres microorganismes pathogènes sont naturellement présents dans les milieux aquatiques et peuvent causer des infections opportunistes, surtout chez les personnes sensibles aux infections, quand les conditions dans les réseaux conçues pour la distribution de l’eau (p. ex. réseaux de distribution d’eau potable et plomberie des bâtiments) permettent leur prolifération. Les effets sur la santé provoqués par ces agents pathogènes opportunistes sont variés et peuvent se manifester par des maladies respiratoires ou des infections des yeux, de la peau, du système nerveux central ou du tube digestif. Dans les cas graves, les maladies causées par des agents pathogènes opportunistes peuvent être mortelles.
Il est nécessaire d’avoir des connaissances de base sur les différents types d’agents pathogènes d’origine hydrique – leurs origines, les mesures importantes à effectuer pour réduire leur nombre et les personnes les plus à risque de tomber malade – pour pouvoir gérer efficacement la distribution de l’eau potable et prévenir les maladies d’origine hydrique. Santé Canada a terminé son examen des agents pathogènes d’origine hydrique pouvant présenter des risques pour la santé humaine et qui ne sont pas expressément mentionnés dans les Recommandations pour la qualité de l’eau potable au Canada. Le présent document d’orientation a été préparé en collaboration avec le Comité fédéral-provincial-territorial sur l’eau potable (CEP) et décrit ces microorganismes, leurs effets sur la santé, leur mode de transmission et les pratiques exemplaires à adopter pour garantir la salubrité de l’eau potable.
Évaluation
La fixation de concentrations maximales acceptables pour les agents pathogènes décrits dans ce document n’est pas pratique ni nécessaire, car elle n’aide pas les fournisseurs d’eau potable à gérer adéquatement les risques. La mise en œuvre d’une approche de gestion des risques « de la source au robinet » est une stratégie universellement recommandée pour réduire au minimum le développement et la transmission d’agents pathogènes d’origine hydrique dans l’eau potable et limiter les risques possibles auxquels ils sont associés. Les principaux éléments de cette stratégie sont : la protection des sources d’approvisionnent en eau, les exigences de traitement qui s’appuient sur les objectifs sanitaires de traitement pour les protozoaires (Giardia et Cryptosporidium) et les virus entériques, et la réduction de la survie et du développement des microorganismes dans les réseaux de distribution d’eau potable. Le maintien d’une lutte antimicrobienne dans les réseaux de distribution des bâtiments et des maisons est également un élément essentiel de l’approvisionnement en eau potable salubre chez les consommateurs.
Le présent document vise à fournir aux intervenants, notamment les organismes de réglementation provinciaux et territoriaux, les décideurs, les propriétaires et exploitants de réseaux de distribution d’eau, les propriétaires et les gestionnaires d’immeubles et les consultants, des conseils sur les agents pathogènes d’origine hydrique dans l’eau potable qui ne sont pas mentionnés dans les Recommandations pour la qualité de l’eau potable au Canada, dans le but de réduire au minimum les risques pour la santé publique associés aux réseaux de distribution canadiens.
Table des matières
- Partie A
- Partie B. Renseignements techniques
- B.1 Bactéries d’origine gastro-intestinale
- B.2 Agents pathogènes présents dans la nature
- Partie C. Bibliographie
- Partie D. Annexes
- Annexe A : Listes d’abréviations
- Annexe B : Tableau B1 ― Présentation sommaire des agents pathogènes d’origine gastro-intestinale présents dans l’eau
- Annexe C : Tableau C1 ― Présentation sommaire des agents pathogènes naturellement présents dans l’eau
- Annexe D : Figure D1 ― Valeurs relatives de CT pour divers agents pathogènes d’origine hydrique et pour le chlore libre (inactivation de 2 log, de 5 à 25 °C, pH de 6 à 9)
- Annexe E : Figure E1 ― Exigences en matière de dose relative d’UV pour divers agents pathogènes (inactivation de 4 log)
Partie A
A.1 Objectif et portée
Le présent document a pour objectif de fournir aux provinces, territoires et autres ministères fédéraux et intervenants des conseils sur les agents pathogènes d’origine hydrique potentiellement préoccupants pour la santé humaine et qui ne sont pas expressément mentionnés dans les Recommandations pour la qualité de l’eau potable au Canada.
Un grand nombre de travaux de recherche majeurs ont permis de mieux comprendre l’enjeu de santé publique que représentent ces agents pathogènes d’origine hydrique présents dans les réseaux d’eau potable. Les stratégies de gestion de l’eau potable sont principalement axées sur les usines de traitement et les réseaux de distribution. Cependant, certains conseils visent la protection des sources d’approvisionnement en eau et les installations de plomberie des bâtiments et des maisons.
A.2 Introduction
Les microorganismes décrits dans le présent document sont énumérés dans le tableau 1. Ce document traite des bactéries pathogènes d’origine gastro-intestinale présentes dans l’eau, lesquelles sont réputées responsables de maladies lorsque de l’eau potable inadéquatement traitée est contaminée par des matières fécales. En outre, le document décrit les agents pathogènes naturellement présents dans l’eau. Ces derniers étant souvent associés à des infections et, dans des cas extrêmes, à des décès chez les personnes vulnérables (telles que les nourrissons, les personnes âgées et les personnes immunodéprimées), ils sont qualifiés d’agents pathogènes opportunistes. Les réseaux conçues pour la distribution de l’eau (p. ex. réseaux de distribution d’eau potable et plomberie des bâtiments) sont des milieux favorables au développement d’agents pathogènes naturellement présents dans l’eau. Nombre de ces agents pathogènes présentent des caractéristiques qui posent problème aux fournisseurs d’eau ainsi qu’aux propriétaires et aux gestionnaires d’immeubles, comme une importante résistance à la désinfection, un développement de ces microorganismes malgré la faible disponibilité de nutriments et d’oxygène et la formation de biofilms. Pour gérer efficacement ces microorganismes, il faut une collaboration entre les responsables qui assurent la gestion des réseaux de distribution d’eau potable et les responsables des installations de plomberie de bâtiments.
Les stratégies globales de gestion sont résumées dans la partie A.3. Dans la partie B figurent des renseignements techniques succincts sur chaque agent pathogène (voir tableau 1) et leurs effets sur la santé humaine ainsi que sur les sources de ces organismes et l’exposition à ces derniers. Un résumé des traitements et analyses effectuées est également fourni.
Agents pathogènes d’origine gastro-intestinale présents dans l’eau
Campylobacter spp.
Escherichia coli (E. coli) pathogènes entériques et Shigella spp.
Helicobacter pylori
Salmonella spp.
Yersinia spp.
Agents pathogènes naturellement présents dans l’eau
Bactéries :
Aeromonas spp.
Legionella spp.
Mycobacterium spp.
Pseudomonas spp.
Protozoaires :
Acanthamoeba spp.
Naegleria fowleri
A.3 Stratégies de gestion des risques
La fixation de concentrations maximales acceptables pour ces microorganismes n’est pas pratique ni nécessaire, car elle n’aide pas les fournisseurs d’eau potable ou les propriétaires ou gestionnaires d’immeubles à gérer adéquatement les risques. La stratégie recommandée de gestion des risques possibles pour les fournisseurs d’eau consiste plutôt à mettre l’accent en priorité sur la gestion des procédés de traitement de l’eau potable, par la mise en œuvre d’une approche « de la source au robinet » et d’un plan de salubrité de l’eau. Les responsables de systèmes de distribution d’eau potable devraient aussi avoir des programmes de formation et de sensibilisation pour sensibiliser les consommateurs à la façon dont la qualité de l’eau peut se détériorer dans les installations de plomberie des bâtiments et des maisons. Des plans de gestion de l’eau des immeubles constituent la pratique exemplaire recommandée pour les propriétaires ou gestionnaires d’immeubles.
Il est important que les responsables de la gestion de la qualité de l’eau potable sachent que l’absence de bactéries indicatrices (p. ex. Escherichia coli, coliformes totaux) ne signifie pas qu’il y a absence d’agents pathogènes opportunistes tels que Legionella et Mycobacterium. Ces derniers résistent davantage à la désinfection. Les responsables de systèmes de distribution d’eau potable et les propriétaires ou gestionnaires d’immeubles devraient donc disposer de stratégies de gestion des risques appropriées ayant recours à plusieurs paramètres pour évaluer la performance des activités de traitement et/ou de distribution de l’eau potable.
A.3.1 Protection des sources d’approvisionnement en eau
La protection des sources d’approvisionnement en eau constitue la première étape d’une approche « de la source au robinet » ou d’un plan de salubrité de l’eau. Les évaluations des sources d’eau devraient inclure l’identification des sources éventuelles de contamination microbiologique dans le bassin versant ou l’aquifère, des voies et/ou phénomènes potentiels (risque faible à élevé) qui permettraient aux microorganismes préoccupants d’atteindre la source et de nuire à la qualité de l’eau, et des conditions susceptibles de favoriser des pics de concentrations. Les évaluations des sources souterraines devraient inclure, au minimum, une évaluation hydrogéologique, une évaluation de l’intégrité du puits et un relevé des caractéristiques physiques de la région et des activités qui y sont menées (voir Santé Canada, 2019b, 2019c). Il est important de tenir compte des risques liés aux activités terrestres et à celles qui génèrent des aérosols (p. ex. l’irrigation par aspersion, les nettoyeurs à haute pression) dans l’évaluation des sources d’approvisionnement en eau.
Les nutriments sont essentiels à la survie, au développement et à la propagation des microorganismes. Les sources d’eau de surface et d’eau souterraine devraient donc être caractérisées en fonction des concentrations de nutriments organiques et inorganiques (Cantor, 2017).
La température de l’eau est également un facteur important dont il faut tenir compte (Santé Canada, 2021). Les bactéries entériques (voir B.1) survivent plus longtemps à de basses températures, tandis que les agents pathogènes opportunistes (voir B.2) prolifèrent à des températures plus chaudes.
A.3.2 Station de traitement de l’eau
Lorsqu’elles sont correctement conçues et exploitées, les techniques d’élimination et de désinfection couramment utilisées dans le traitement de l’eau potable devraient permettre de contrôler les risques associés aux microorganismes abordés dans le présent document de conseils. Il faut toutefois bien comprendre que l’eau potable traitée n’est pas stérile et que des bactéries pathogènes naturellement présentes (voir B.2.1) ont été détectées dans l’eau traitée. On ne s’attend pas à ce que ces agents pathogènes opportunistes aient des effets nocifs sur la santé aux concentrations mesurées dans l’eau traitée (Le Dantec et coll., 2002), mais ces microorganismes peuvent se propager et proliférer dans les biofilms en aval (Brooks et coll., 2004). Les responsables de systèmes de distribution d’eau potable devraient ainsi s’employer à produire de l’eau biologiquement stable afin de réduire au minimum les problèmes susceptibles de survenir dans les réseaux de distribution et les installations de plomberie des bâtiments (voir les sections A.3.3 et A.3.4) (Santé Canada, 2022). Voici quelques éléments importants liés au traitement de l’eau potable :
- l’optimisation de la performance du traitement pour éliminer la turbidité et enlever les matières organiques naturelles;
- l’application adéquate des technologies de désinfection primaire afin de répondre aux exigences appropriées relatives à la valeur CT (concentration de désinfectant en mg/L × temps en minutes) lors de l’utilisation d’oxydants chimiques (c.-à-d. chlore libre, ozone, dioxyde de chlore) ou à la valeur IT (intensité mesurée en mW/cm2 ou en W/m2 × temps exprimé en secondes, ce qui donne une fluence calculée en mJ/cm2) lors d’une désinfection aux ultraviolets (UV);
- la réduction des concentrations de nutriments dans l’eau traitée et une bonne compréhension de leurs concentrations dans le réseau de distribution;
- l’optimisation du traitement afin de réduire au minimum l’entartrage et/ou la corrosion dans le réseau de distribution;
- l’application adéquate des technologies de désinfection secondaire (c.-à-d. chlore libre ou monochloramine) pour le maintien d’une concentration résiduelle de désinfectant dans le réseau de distribution;
- la réalisation d’essais de performance à l’aide de plusieurs paramètres (p. ex. désinfectant résiduel, indicateurs microbiologiques, pH, turbidité);
- la formation des opérateurs pour garantir l’efficacité du plan de salubrité de l’eau en tout temps.
Il est important de noter que la monochloramine est recommandée uniquement pour la désinfection secondaire et le maintien d’une concentration résiduelle de désinfectant dans le réseau de distribution (Santé Canada, 2019b).
A.3.3 Réseau de distribution d’eau potable
Les microorganismes peuvent pénétrer dans les réseaux de distribution d’eau potable en raison d’un traitement inadéquat, d’un franchissement des barrières de traitement ou d’une contamination par intrusion après traitement, dans les interconnexions ou durant des travaux de construction ou de réparation. Les biofilms et les dépôts non fixés présents dans les réseaux de distribution d’eau potable offrent des milieux favorables à la survie, au développement et à la dissémination de microorganismes pathogènes, notamment les agents pathogènes présents naturellement (p. ex. Legionella). Malgré la détection de bactéries pathogènes naturellement présentes dans les réseaux de distribution d’eau potable, ceux-ci ne devraient pas être une source d’exposition majeure (LeChevallier, 2020). Le maintien d’une concentration résiduelle efficace de désinfectant est crucial pour la gestion des risques. On reconnaît de plus en plus qu’une concentration minimale de désinfectant résiduel supérieure à 0,2 mg/L est nécessaire pour contrôler la croissance ou la revivification microbiologique dans le réseau de distribution. Des études indiquent que des concentrations résiduelles de désinfectant de l’ordre de 1,0 mg/L de chlore libre (pour les réseaux qui utilisent le chlore) et de 1,8 mg/L de chlore total (pour les réseaux qui utilisent la chloramine) sont nécessaires pour contrôler la formation de biofilms (Gagnon et coll., 2008; Gillespie et coll., 2014; Rand et coll., 2014; LeChevallier et coll., 2015a, 2015b). Il est possible que les responsables de systèmes de distribution d’eau potable qui enlèvent régulièrement les biofilms et les dépôts non fixés de leurs réseaux de distribution aient besoin de concentrations plus faibles. Cantor (2017) a insisté sur l’importance d’enlever les matières accumulées pour atteindre les objectifs de qualité de l’eau. Il est recommandé de mettre en place des programmes de surveillance multiparamétrique complets (p. ex. désinfectant résiduel jumelé à la température et à la vitesse de formation de biofilms) pour confirmer les exigences propres au réseau (Santé Canada, 2022).
Le choix d’un désinfectant secondaire pour maintenir une concentration résiduelle dans le réseau de distribution est une décision complexe. Le chlore libre et la monochloramine possèdent des capacités différentes en termes de pouvoir désinfectant, de réactivité avec les matières organiques et inorganiques et de pénétration des biofilms. De plus, les bactéries du genre Legionella et les mycobactéries ont une sensibilité différente au chlore libre et à la monochloramine. Ainsi, le choix d’un désinfectant résiduel devrait être un juste équilibre entre les objectifs concomitants de qualité de l’eau liés : 1) à l’espèce microbienne (p. ex. Legionella, mycobactéries); 2) aux propriétés chimiques de l’eau; 3) à la concentration des sous-produits de désinfection; et 4) à la complexité du réseau de distribution (Donohue et coll., 2019a). Roth et Cornwell (2018) ont évalué l’incidence d’une augmentation de la concentration de chlore libre résiduel de 0,2 mg/L à 1,2 mg/L sur les concentrations de sous-produits de désinfection de 21 fournisseurs d’eau. Les auteurs sont arrivés à la conclusion que les effets attendus étaient minimes, mais que des évaluations propres au réseau étaient recommandées pour éviter des répercussions inattendues.
Des renseignements supplémentaires sur la gestion de la survie et du développement des microorganismes dans les réseaux de distribution d’eau potable et sur l’instauration de programmes de surveillance multiparamétrique figurent dans les publications de Santé Canada intitulées Conseils sur la surveillance de la stabilité biologique de l’eau potable dans les réseaux de distribution (Santé Canada, 2022) et Document de conseils sur la matière organique naturelle dans l’eau potable (Santé Canada, 2020a). Les pratiques clés d’exploitation et d’entretien des réseaux de distribution sont :
- l’emploi de matériaux de construction appropriés;
- le maintien d’une concentration résiduelle efficace de désinfectant et la prise de mesures préventives ou correctives lorsque les concentrations résiduelles de désinfectant sont faibles, notamment lorsque la température de l’eau est chaude et que la croissance du biofilm s’accélère;
- le contrôle du temps de séjour de l’eau et des effets de la température;
- la réduction au minimum de l’entrée de contaminants provenant de sources externes (p. ex. maintien d’une pression positive, mise en œuvre de programmes de contrôle des raccordements croisés et des refoulements et adoption de pratiques hygiéniques rigoureuses durant la construction ou la réparation des conduites d’eau principales);
- le maintien de la propreté des réseaux de distribution par l’enlèvement des biofilms, des dépôts non fixés et des sédiments des conduites principales et des installations d’entreposage (p. ex. utilisation de techniques appropriées de rinçage et de nettoyage);
- la réalisation d’essais de performance à l’aide de plusieurs paramètres (p. ex. désinfectant résiduel, indicateurs microbiologiques, indicateurs de la stabilité biologique, pH, pression, température, turbidité);
- la formation des opérateurs pour assurer l’efficacité du plan de salubrité de l’eau en tout temps.
A.3.4 Plomberie des bâtiments
Dans les installations de plomberie des bâtiments, des conditions telles que : 1) un petit diamètre de canalisation; 2) une augmentation de la température; 3) une augmentation du temps de rétention; et 4) le relargage d’une quantité importante de nutriments (p. ex. le carbone) de certains matériaux de tuyauterie peut favoriser le développement de microorganismes, en particulier d’agents pathogènes opportunistes (p. ex. Legionella) (Neu et Hammes, 2020). Les responsables de systèmes de distribution d’eau potable devraient donc informer leurs clients du potentiel de détérioration de la qualité de l’eau dans la plomberie des bâtiments.
Le maintien d’une lutte antimicrobienne dans les installations de plomberie des bâtiments est un élément essentiel de l’approvisionnement d’une eau potable salubre destinée aux consommateurs, tout particulièrement dans les grands immeubles. Les propriétaires ou gestionnaires d’immeubles sont responsables de la gestion de la qualité de l’eau dans leurs bâtiments et devraient donc connaître les pratiques qui permettent de réduire le risque de développement des microorganismes. Les stratégies de lutte antimicrobienne dans les installations de plomberie consistent principalement à :
- limiter la quantité de nutriments disponibles, en accordant une attention particulière à la conception des systèmes et aux matériaux utilisés pour les construire;
- réduire au minimum le nombre de zones de faible débit ou de stagnation de l’eau;
- maintenir les températures des réseaux d’eau froide et d’eau chaude en dehors des intervalles optimaux pour le développement de microorganismes (p. ex. température de l’eau froide inférieure à 20 °C et température dans les réservoirs d’eau chaude supérieure à 60 °C; température supérieure à 55 °C idéalement dans les conduites d’eau chaude des points distaux);
- limiter la formation et la transmission d’aérosols contaminés provenant de composants du système comme les tours de refroidissement, les douches, les robinets, les spas et les humidificateurs.
Les besoins croissants d’économie d’énergie, d’eau et de matériaux peuvent avoir des conséquences imprévues sur la présence et le développement de microorganismes. Il s’agit d’un aspect important dans le cas de Legionella, mais aussi pour les autres agents pathogènes opportunistes pouvant poser problème dans la plomberie des bâtiments. Des changements dans l’exploitation ou les caractéristiques des installations de plomberie requérant l’utilisation d’autres sources d’eau (p. ex. récupération d’eau, collecte d’eau de pluie), une augmentation du temps de séjour de l’eau, une diminution des débits d’eau et des variations de température dans les réseaux d’eau chaude ou froide des bâtiments peuvent accroître inopinément le risque de développement de ces agents pathogènes (Bédard et coll., 2016; Rhoads et coll., 2016; NASEM, 2020).
Des ressources existent pour aider les propriétaires et les gestionnaires d’immeubles à élaborer un plan de gestion de l’eau (OMS, 2007, 2011; HSE, 2013a, 2013b, 2014; TPSGC, 2016; CDC, 2017; ASHRAE, 2018). D’autres documents de conseils fournissent des normes et des spécifications techniques pour la conception et l’installation de systèmes de plomberie dans les bâtiments (CNRC, 2015a, 2015b; ASHRAE, 2018). Par ailleurs, les propriétaires et les gestionnaires d’immeubles devraient communiquer avec l’autorité responsable pour vérifier si des exigences particulières s’appliqueront à leur réseau (p. ex. un registre des tours de refroidissement).
A.3.5 Rôles et responsabilités
Les responsables de systèmes de distribution d’eau potable ainsi que les propriétaires et les gestionnaires d’immeubles ont tous un rôle à jouer dans la gestion efficace des risques. Le tableau 2 résume les principaux rôles et responsabilités des intervenants. Des conseils sont mis à disposition pour aider les responsables de systèmes de distribution d’eau potable à élaborer des programmes de formation et de sensibilisation (Masters et coll., 2019).
| Responsable de système de distribution d’eau potable | Propriétaire ou gestionnaire d’immeubles | |||
|---|---|---|---|---|
| Section | Source | Traitement | Réseau de distribution | Installations de plomberie des bâtiments |
| Exigences | Plan de protection des sources d’approvisionnement en eau | Traitement approprié | Plan de gestion des réseaux de distribution | Plan de gestion des réseaux d’eau potable des bâtiments |
| Objectif | Protéger la source pour réduire au minimum les risques pour la santé publique et réduire les coûts de traitement de l’eau. | Produire une eau d’une qualité microbiologiquement acceptable et biologiquement stable afin de réduire au minimum la détérioration de la qualité de l’eau dans les réseaux de distribution et les installations de plomberie des bâtiments. | Établir des politiques et des objectifs opérationnels visant à protéger la qualité de l’eau dans le réseau de distribution. | Établir des politiques et des objectifs opérationnels visant à protéger la qualité de l’eau dans les installations de plomberie des bâtiments. |
| Formation et sensibilisation | Instaurer des programmes de formation et de sensibilisation pour informer les consommateurs des risques que présente la détérioration de la qualité de l’eau, de la source au robinet. | s/o | ||
A.3.6 Répercussions des changements climatiques
Les phénomènes météorologiques comme les pluies fortes et intenses, les tempêtes violentes, les inondations, les sécheresses et les températures élevées peuvent contribuer à accroître l’exposition des humains aux agents pathogènes d’origine hydrique par divers mécanismes (Levy et coll., 2016; Nichols et coll., 2018; Walker, 2018; Semenza, 2020; Calero Preciado et coll., 2021), notamment en :
- assurant le transport d’agents pathogènes et de nutriments jusque dans les sources d’approvisionnement en eau potable;
- encombrant ou en endommageant les infrastructures d’eau potable;
- influant sur la survie et le développement d’agents pathogènes dans les sources d’eau et les réseaux de distribution d’eau potable et installations de plomberie;
- prolongeant les saisons de transmission ou en augmentant l’ampleur géographique des agents pathogènes;
- diminuant la disponibilité des ressources hydriques;
- influant sur les activités ou les comportements humains (p. ex. hausse de la consommation d’eau et de l’utilisation des systèmes de chauffage, de ventilation et de climatisation).
La fréquence et la gravité de ces phénomènes devraient augmenter avec les changements climatiques (Levy et coll., 2016; Nichols et coll., 2018; Walker, 2018). Les Recommandations pour la qualité de l’eau potable au Canada n’abordent pas tous les scénarios climatiques éventuels qui pourraient nuire aux systèmes de distribution d’eau potable et aux réseaux d’eau potable des bâtiments. L’autorité responsable devrait être consultée pour discuter des scénarios de prévision pertinents. Les répercussions des changements climatiques accentueront l’importance de la surveillance de la qualité de l’eau, de la sélection appropriée des procédés de traitement, de la vérification quotidienne des procédés, de l’exploitation du réseau de distribution, de la gestion des réseaux d’eau potable des bâtiments ainsi que des programmes de formation et de sensibilisation. C’est pourquoi les responsables de systèmes de distribution d’eau potable ainsi que les propriétaires et les gestionnaires d’immeubles devraient intégrer les risques associés aux changements climatiques dans leurs stratégies de gestion afin d’optimiser la fiabilité, la robustesse et la résilience de leurs systèmes d’approvisionnement en eau. Des recommandations sont disponibles pour aider les responsables de systèmes de distribution d’eau potable (AWWA, 2021).
Partie B. Renseignements techniques
B.1 Bactéries d’origine gastro-intestinale
B.1.1 Campylobacter spp.
B.1.1.1 Description
Campylobacter (classe : Epsilonproteobacteria) est un genre bactérien qui rassemble plus de 30 espèces identifiées, dont seules quelques-unes présentent un danger pour la santé humaine (Wagenaar et coll., 2015; Backert et coll., 2017; LPSN, 2019). Campylobacter jejuni ( C. jejuni) et Campylobacter coli (C. coli) sont les espèces primaires et secondaires qui ont le plus d’intérêt comme agents de maladies gastro-intestinales humaines, car elles sont responsables de 90 % des cas de campylobactériose humaine dans le monde (Huang et coll., 2015; Wagenaar et coll., 2015). D’autres espèces sont également identifiées comme agents de maladies gastro‑intestinales, mais leur fréquence est faible ou associée à certains groupes à risque (p. ex. les personnes immunodéprimées) ou à des zones géographiques particulières (Wagenaar et coll., 2015). Certaines espèces de Campylobacter (spp.) ont été associées à des infections prénatales et néonatales et à des parodontites humaines (Backert et coll., 2017; Huang et coll., 2015).
Campylobacter spp. sont des bactéries à Gram négatif motiles, en forme de bâtonnets incurvés ou spiralés (Percival et Williams, 2014b). Ce sont des bactéries exigeantes et microaérophiles (faibles besoins en oxygène), qui se développent à des températures comprises entre 30 et 45 °C (températures optimales de 40 à 42 °C) (Percival et Williams, 2014b; Wagenaar et coll., 2015; Zautner et Masanta, 2016).
B.1.1.2 Effets sur la santé
La gastroentérite causée par Campylobacter spp. se traduit par une diarrhée aqueuse et abondante, parfois mêlée de sang, et s’accompagnant parfois de fièvre et de douleurs abdominales (Backert et coll., 2017; Percival et Williams, 2014b). Certaines infections graves peuvent nécessiter une hospitalisation et être létales, bien que les cas de décès s’observent habituellement chez les patients très jeunes, très vieux, atteints d’une maladie sous-jacente ou immunodéprimés (Kvalsvig et coll., 2014). Les symptômes se déclarent généralement entre un et cinq jours après l’infection et la maladie dure moins de sept à dix jours (Backert et coll., 2017). L’élimination des microorganismes par les selles peut se poursuivre pendant des semaines après un épisode de diarrhée; dans la plupart des cas, elle cesse au bout de quatre semaines (Percival et Williams, 2014b; Lee et coll., 2013). Des infections asymptomatiques par Campylobacter spp. sont également possibles (Percival et Williams, 2014b). Bien que les Campylobacter spp. puissent causer la maladie chez des personnes en bonne santé de tout âge, dans les pays développés, les infections touchent davantage les jeunes enfants, les jeunes adultes et les personnes âgées (Kaakoush et coll., 2015; ASPC, 2018c). Les doses de C. jejuni nécessaires pour provoquer l’infection et la maladie n’est pas tout à fait connue (Black et coll., 1988). Les études de provocation chez l’humain ont révélé que, pour certaines souches, l’ingestion de plusieurs centaines de bactéries peut suffire à provoquer l’infection (Black et coll., 1988). Les méta-analyses des données sur la pathogénicité de C. jejuni tirées d’études de provocation et d’éclosions d’origine alimentaire montrent que les doses nécessaires pour provoquer l’infection et la maladie peuvent être inférieures de plusieurs ordres de grandeur (Teunis et coll., 2005; 2018).
Des complications post-infectieuses causées par Campylobacter spp. peuvent se produire, telles que le syndrome de Guillain-Barré et de l’arthrite réactionnelle, bien que celles-ci soient relativement rares (Backert et coll., 2017; Percival et Williams, 2014b). Une infection par Campylobacter spp. peut être associée à l’apparition de maladies inflammatoires chroniques de l’intestin, comme la maladie de Crohn, la colite ulcéreuse et le syndrome du côlon irritable (Backert et coll., 2017; Huang et coll., 2015). Une méta-analyse a montré que les patients infectés par Campylobacter spp. présentaient des complications à long terme dans les proportions suivantes : Syndrome de Guillain–Barré, 0,07 % (intervalle de confiance [IC] à 95 % : 0,03 à 0,15 %); arthrite réactionnelle, 2,86 % (IC à 95 % : 1,40 à 5,61 %); et syndrome du côlon irritable, 4,01 % (IC à 95 % : 1,41 à 10,88 %) (Keithlin et coll., 2014b). Les Campylobacter spp. sont la principale cause de maladies gastro-intestinales bactériennes au Canada et dans d’autres pays développés du monde (Backert et coll., 2017; Huang et coll., 2015). Les cas de campylobactériose au Canada et dans le monde sont essentiellement sporadiques, la plupart des maladies étant provoquées par la consommation d’aliments contaminés (Huang et coll., 2015; Wagenaar et coll., 2015). Au Canada, les taux d’incidence annuels observés (toutes causes confondues) sur la période 2013-2017 variaient entre 25,4 et 29,2 (taux médian de 28,4) cas pour 100 000 habitants (ASPC, 2019). Les infections (toutes sources confondues) sont plus courantes durant les mois d’été (Fleury et coll., 2006; Lal et coll., 2012; Kaakoush et coll., 2015).
La maladie causée par Campylobacter spp. est habituellement spontanément résolutive. Des antibiotiques ne devrait prescrits que dans les cas graves (Wagenaar et coll., 2015). Les Campylobacter spp. sont résistants à la ciprofloxacine et à l'azithromycine et ont été classés comme une « Menace Grave » par les Centres de contrôle et de prévention des maladies (Centers for Disease Control and Prevention ou CDC) (CDC, 2019a). L’OMS et l’Agence de la santé publique du Canada (ASPC) considèrent comme moyennement à très prioritaires la surveillance, l’étude et l’évaluation des risques pour la santé publique de ces microorganismes (Garner et coll., 2015; OMS, 2017b, ASPC, 2018a). Aucun vaccin contre Campylobacter n'est actuellement disponible (Wagenaar et coll., 2015)
B.1.1.3 Sources et exposition
Les Campylobacter spp. sont des agents pathogènes zoonotiques (c.-à-d. transmis des animaux à l’humain), qui sont naturellement présents dans le tube digestif d’un grand nombre d’oiseaux et de mammifères sauvages et domestiques (Wagenaar et coll., 2015; Backert et coll., 2017). La volaille est considérée comme le principal réservoir de ces microorganismes (Wagenaar et coll., 2015; Backert et coll., 2017). Les bovins, les ovins et les animaux de compagnie en sont aussi d’importants réservoirs (Wagenaar et coll., 2015; Backert et coll., 2017). Les Campylobacter spp. se transmettent par voie oro-fécale, les principales voies d’exposition étant la nourriture ou l’eau contaminée et le contact direct avec des animaux (Percival et Williams, 2014b; Wagenaar et coll., 2015). La transmission entre personnes est rare (Percival et Williams, 2014b; Wagenaar et coll., 2015). L’eau de ruissellement de surface contenant des déchets d’élevage et les apports d’eaux usées (p. ex. le rejet d’eaux usées et les égouts sanitaires qui fuient) sont d’importants mécanismes de contamination fécale des sources d’eau potable (eaux souterraines et eaux de surface) (Whiley et coll., 2013). L’introduction de matières fécales animales dans l’eau à la suite de fortes pluies ou de la fonte des neiges est une cause particulièrement importante de contamination des puits d’eau souterraine vulnérables (Moreira et Bondelind, 2017).
Il a été déterminé que les Campylobacter spp. étaient les agents pathogènes bactériens d’origine hydrique les plus souvent à l’origine d’éclosions liées à l’eau potable dans les pays industrialisés (Moreira et Bondelind, 2017). Des données publiées aux États-Unis montrent que les Campylobacter spp. sont partiellement ou entièrement responsables de 11 % des éclosions liées à l’eau potable dénombrées entre 2001 et 2014 (année de publication des données les plus récentes). Ces éclosions surviennent tous les mois de l’année, les plus graves durant les mois de printemps et d’été (CDC, 2004, 2006, 2008, 2011, 2013, 2015b, 2017d). Les périodes à risque élevé d’éclosion d’origine hydrique coïncident avec les périodes de pics de précipitations pluvieuses (p. ex. en raison du lessivage des terres agricoles provoqué par des chutes de pluie ou la fonte des neiges) (Sterk et coll., 2013, Galanis et coll., 2014).
L’éclosion survenue à Walkerton en mai 2000 est l’éclosion d’eau potable la plus importante au Canada mettant en cause Campylobacter spp., avec 105 cas confirmés, ainsi que les E. coli pathogènes (163 cas confirmés) (O’Connor, 2002a, 2002b). La gravité de cette éclosion (plus de 2 300 cas estimés, 7 décès) a mené à une réforme substantielle de la politique de réglementation de l’eau potable au Canada (O’Connor, 2002b; Holme, 2003). Après Walkerton, d’autres grandes éclosions liées à la contamination de l’eau potable par Campylobacter spp. sont survenues dans le monde, notamment en Nouvelle-Zélande (2016 : plus de 1 000 cas), au Danemark (2010 : 409 cas), en Ohio, aux États-Unis (2004 : 1 450 cas) et en Finlande (2001 : 1 000 cas) (Hrudey et Hrudey, 2004, Government Inquiry into Havelock North Drinking Water, 2017; Moreira et Bondelind, 2017). Les éclosions liées à l’eau potable ont été très souvent associées à de petites sources d’approvisionnement en eau potable (c.-à-d. des puits privés ou de petites sources locales), la contamination ayant été causée la plupart du temps par l’infiltration de matières fécales animales ou d’eaux usées dans la source ou par une désinfection inadéquate (Moreira et Bondelind, 2017). Les réseaux de distribution d’eau privés ou appartenant à de petites communautés sont considérés comme plus susceptibles de favoriser les maladies entériques humaines que les réseaux municipaux (Hrudey et Hrudey, 2004; Murphy et coll., 2016; Butler et coll., 2016). À l’aide d’une évaluation quantitative du risque microbien, Murphy et ses collaborateurs (2016) ont estimé qu’environ 5 % du nombre total annuel de cas canadiens de contamination par des Campylobacter spp. pourraient être attribuables à la consommation d’eau provenant de petits réseaux de distribution d’eau potable contaminés. Dans les réseaux municipaux, une désinfection inadéquate et une contamination après traitement par intrusion ou dans les interconnexions sont les causes les plus fréquentes d’éclosions liées à des Campylobacter spp. (Moreira et Bondelind, 2017).
B.1.2 Escherichia coli et Shigella spp. (souches pathogènes)
B.1.2.1 Description
Les Escherichia coli (classe : Gammaproteobacteria; famille : Enterobacteriaceae) sont des bactéries à Gram négatif, qui font partie de la flore microbienne intestinale naturelle des humains et des animaux. Ces bactéries sont anaérobies facultatives, motiles ou non, et en forme de bâtonnets et peuvent se développer dans un grand intervalle de températures (entre 7 et 45 °C), la température optimale de croissance étant de 37 °C (Ishii et Sadowsky, 2008, Percival et Williams, 2014c). La plupart des souches (c.-à-d. des variants) d’E. coli sont inoffensives et servent d’indicateurs de la contamination fécale, mais certaines d’entre elles deviennent virulentes par gain ou perte de matériel génétique (Croxen et coll., 2013). Ces E. coli pathogènes peuvent causer de nombreuses maladies humaines, dont de graves infections du tube digestif, des voies urinaires et du sang et des méningites néonatales (Croxen et coll., 2013; Percival et Williams, 2014c). Les souches non pathogènes d’E. coli et leur rôle dans la gestion des risques liés à l’eau potable sont traités dans le document de Santé Canada intitulé Document technique – Escherichia coli (Santé Canada, 2019e).
Les E. coli pathogènes sont très souvent classées en groupes fonctionnels, selon les mécanismes par lesquels elles interagissent avec leurs cellules cibles et provoquent des symptômes. Différents types d’E. Coli peuvent se fixer aux cellules, y pénétrer ou modifier leur structure et produire certains types de toxines. Il existe six grands groupes d’E. Coli pathogènes responsables d’infections gastro-intestinales : les E. coli entérohémorragiques (ECEH), les E. coli entérotoxinogènes (ECET), les E. coli entéroinvasives (ECEI), les E. coli entéropathogènes (ECEP), les E. coli entéroagrégatives (ECEA) et les E. coli à adhésion diffuse (ECAD) (Croxen et coll., 2013; Percival et Williams, 2014c). La catégorisation des souches pathogènes d’E. coli a déjà été réalisée par analyse biochimique et par sérogroupage, à partir du système de classification classique de Kauffmann et White basé sur les antigènes de surface O et H (Croxen et coll., 2013; Robins-Browne et coll., 2016). Des méthodes moléculaires ont été mises au point, qui permettent une détection et une identification rapides des différentes souches pathogènes (Croxen et coll., 2013; Robins-Browne et coll., 2016). Les données issues du sérogroupage s’avèrent néanmoins utiles en épidémiologie et en surveillance des maladies (Robins-Browne et coll., 2016). D’autres groupes d’E. coli pathogènes ont été proposés, mais ils n’ont pas été complètement caractérisés. Des études génomiques comparatives ont montré que ces groupes n’étaient pas clairement distincts les uns des autres et qu’ils se chevauchaient énormément en ce qui a trait aux mécanismes de virulence mis en œuvre par les différentes souches d’E. coli (Croxen et coll., 2013).
Les Shigella spp. sont très proches des E. coli, mais ont été autrefois considérées comme des espèces distinctes. Shigella et les souches d’ECEI sont pratiquement impossibles à distinguer d’après leurs propriétés biochimiques et sérologiques (Croxen et coll., 2013). Des analyses poussées par typage et séquençage moléculaire ont mis en évidence que les Shigella spp. faisaient clairement partie des espèces d’E. coliet formaient un groupe unique avec les ECEI (Croxen et coll., 2013, Robins-Browne et coll., 2016). Une réévaluation de la classification des Shigella spp. pourrait être nécessaire pour tenir compte de son lien génétique avec le genre Escherichia. Le genre Shigella et la shigellose (soit la maladie causée par les Shigella spp.) sont encore nommés ainsi pour des raisons historiques (Croxen et coll., 2013). Par convention, il est admis qu’il existe quatre grandes espèces de Shigella spp. (S. dysenteriae, S. flexneri, S. boydii etS. sonnei), Shigella sonnei et Shigella flexneri étant les plus courantes dans les pays développés (Percival et Williams, 2014h).
Parmi les E. coli pathogènes, les ECEH (synonymes : Escherichia coli productrices de shigatoxines, ou ECST, et Escherichia coli vérotoxinogènes, ou ECVT) préoccupent beaucoup le secteur de l’approvisionnement en eau potable (Percival et Williams, 2014c; Saxena et coll., 2015). Les ECEH sont un sous-type d’E. coli pouvant produire une ou plusieurs des puissantes shigatoxines et sont considérées comme très pathogènes pour l’humain. E. coli O157:H7 est le sérotype d’EHEC le plus fréquent. Cependant, d’autres sérotypes, soit O26, O45, O103, O111, O121 et O145 sont d’importantes causes de maladies humaines (Croxen et coll., 2013, Saxena et coll., 2015; ASPC, 2018c).
B.1.2.2 Effets sur la santé
Dans les pays développés, la plupart des maladies liées à E. coli surviennent sous la forme de cas ou d’éclosions sporadiques, causés par des aliments ou de l’eau contaminés ou associés à des voyages (Croxen et coll., 2013; Saxena et coll., 2015). Dans les pays en voie de développement, les E. coli pathogènes entériques représentent une cause importante de morbidité et de mortalité, particulièrement chez les enfants.
Les E. coli et Shigella spp. pathogènes entériques provoquent des maladies diarrhéiques moyennement graves et spontanément résolutives à très graves et potentiellement mortelles, selon le groupe et la souche incriminés. Le premier symptôme est une diarrhée aqueuse. Elle peut être suivie d’une diarrhée mêlée de sang dans le cas d’infections à ECEH, et parfois lors d’infections à ECEI et Shigella spp. ou à ECEA (Croxen et coll., 2013, Percival et Williams 2014c; 2014h). D’autres symptômes peuvent consister en des nausées, des vomissements, des douleurs abdominales, de la fièvre, des maux de tête et des douleurs musculaires. Les symptômes apparaissent habituellement un à trois jours après l’infection. Les diarrhées durent généralement une à deux semaines, mais peuvent persister pour certaines souches (Croxen et coll., 2013; Percival et Williams, 2014c, 2014h). Les personnes infectées peuvent être des porteurs asymptomatiques susceptibles d’éliminer les microorganismes dans leurs matières fécales durant des semaines, voire des mois, après l’infection (Croxen et coll., 2013; Percival et Williams, 2014c, 2014h). Les doses causant une infection sont estimées à moins de 100 à 1 000 organismes pour les ECEH et les ECEI et Shigella spp. et à plus d’un million à dix milliards pour les autres groupes (Kothary et Babu, 2001; Croxen et coll., 2013, Percival et Williams, 2014c; 2014h).
Les maladies causées par les ECEH sont particulièrement préoccupantes, car elles peuvent mener au grave syndrome hémolytique et urémique (SHU), potentiellement mortel, qui se traduit par une diminution des numérations globulaire et plaquettaire et une insuffisance rénale aigüe. Une méta-analyse a montré que le SHU était la complication à long terme la plus fréquente après des infections par E. coli O157 et que sa prévalence était comprise entre 4 et 17 % (Keithlin et coll., 2014a). Le SHU peut aussi entraîner des effets à long terme sur le pancréas, l’appareil digestif et le système nerveux central (Spinale et coll., 2013). Les complications résultant d’infections non liées aux ECEH sont rares (Croxen et coll., 2013). Il a été suggéré qu’il existait un lien entre les infections par certains types d’E. coli pathogènes (soit des ECAD et certaines E. coli invasives) et des troubles digestifs chroniques, tels que le syndrome du côlon irritable et la maladie de Crohn (Croxen et coll., 2013). Dans les pays développés, les E. coli entéropathogènes peuvent causer des infections gastro-intestinales chez les personnes en bonne santé de tous les âges. Les jeunes enfants et les personnes âgées ont plus de risques de contracter une maladie et de présenter des complications à la suite d’une infection (Percival et Williams, 2014c, 2014h; Gargano et coll., 2017).
Les ECEH et les Shigella spp. figurent parmi les principales causes des maladies gastro-intestinales bactériennes au Canada et en Europe (Scallan et coll., 2011; CDC, 2018; ECDC, 2018a; ASPC, 2019b). Les cas dénombrés et les éclosions de maladies diarrhéiques liées à E. coli et de shigellose en Amérique du Nord ont été en grande partie attribués à des contaminations par la nourriture ou par des voyageurs, bien que l’exposition à de l’eau contaminée demeure une importante cause d’infections (Croxen et coll., 2013; ASPC, 2018c). Les taux d’incidence annuels des infections observées au Canada pour l’E. coli vérocytotoxique et la shigellose (toutes causes confondues) sur la période 2013-2017 étaient : compris entre 1,78 et 2,24 (taux médian : 1,82) cas pour 100 000 personnes; compris entre 1,94 et 2,53 (taux médian : 2,28) pour 100 000 personnes respectivement (ASPC, 2019b). Des variations saisonnières des infections à ECHC et à Shigella spp. (toutes sources confondues) ont été généralement observées dans le monde, un plus grand nombre de cas survenant en été et au début de l’automne (Fleury et coll., 2006; ASPC, 2010; Lal, 2012).
Dans la plupart des cas, les maladies diarrhéiques causées par E. coli sont spontanément résolutives. Le traitement consiste habituellement en une réhydratation par voie orale, pour préserver l’équilibre des liquides et des électrolytes. Des antibiotiques peuvent être prescrits dans les cas graves d’infections par certaines souches d’E. coli, mais ils ne sont normalement pas recommandés pour les infections par des ECEH, car ils peuvent stimuler la production de shigatoxines, ce qui augmente le risque de SHU (Croxen et coll., 2013).
Les CDC, l’OMS et l’ASPC ont déterminé que les E. coli résistantes aux carbapénèmes et les E. coli productrices de β-lactamases à spectre élargi (BLSE) constituaient des menaces graves à très graves pour la santé publique (CDC 2019a; OMS, 2017b, ASPC, 2018a). Les E. coli productrices de β-lactamases à spectre élargi sont habituellement résistantes à de nombreux médicaments antibactériens. Pour les personnes gravement infectées par ces souches, les carbapénèmes sont l’un des principaux traitements possibles. La résistance aux carbapénèmes implique une résistance à l’un des derniers traitements disponibles (CDC 2019a, OMS, 2017b). Des souches d’ E. coli pathogènes résistantes aux antibiotiques à large spectre et aux carbapénèmes ont été découvertes chez l’humain et les animaux (Mir et Kudva, 2018). De plus, les CDC ont déterminé que les Shigella spp. résistantes à la ciprofloxacine et à l’azithromycine représentaient des « Menaces Graves », et l’ASPC et l’OMS ont considéré comme faiblement à moyennement prioritaire leur étude et leur surveillance (CDC, 2019a, Garner et coll., 2015; OMS, 2017b). Vu l’augmentation de la résistance des Shigella spp. aux médicaments de première ligne, le traitement des infections résistantes repose désormais sur les antibiotiques à large spectre et les carbapénèmes (CDC, 2019a; OMS, 2017b). Un vaccin à base de toxine cholérique (dont la structure est similaire à la toxine thermolabile des ECET) a été homologué pour être utilisé comme traitement contre la diarrhée du voyageur associée aux ECET (Croxen et coll., 2013; O’Ryan et coll., 2015). Il est nécessaire d’obtenir davantage de données pour déterminer l’efficacité de ce vaccin et d’autres vaccins candidats contre les ECET (O’Ryan et coll., 2015). Aucun vaccin n’est actuellement disponible pour les autres groupes d’E. Coli (Croxen et coll., 2013).
B.1.2.3 Sources et exposition
Les humains constituent le principal réservoir des groupes ECEP, ECET et ECEA et le seul réservoir d’ECEI et de Shigella spp. (Croxen et coll., 2013). Les ECEH sont d’importants agents pathogènes zoonotiques. Les ruminants, en particulier les bovins, sont le premier réservoir des ECEH. Les humains constituent un réservoir secondaire de ce groupe (Croxen et coll., 2013, Percival et Williams, 2014c). Les animaux (p. ex. les bovins, les chiens, les ovins et les lapins) constituent aussi le réservoir de certaines souches d’ECEP (Croxen et coll., 2013). Les E. coli pathogènes se transmettent par voie oro-fécale et les principaux vecteurs d’infection sont la nourriture ou l’eau contaminée, la transmission entre personnes et le contact direct avec les animaux. L’eau de ruissellement de surface et les apports d’eaux usées sont d’importants mécanismes de contamination fécale des sources d’eau potable, sensiblement les mêmes que celles décrites dans le cas des Campylobacter spp. (voir B.1.1) (Hrudey et Hrudey, 2004; Moreira et Bondelind, 2017).
Aux États-Unis, des E. Coli pathogènes (essentiellement E. coli O157:H7) ont été reconnues comme étant les agents responsables ou coresponsables de 4 % des éclosions liées à l’eau potable dénombrées entre 2001 et 2014 (année de publication des données les plus récentes) (CDC, 2004, 2006, 2008, 2011, 2013, 2015b, 2017d). La plupart des éclosions dues à la contamination de l’eau potable par E. coli ont été associées à de petites sources d’approvisionnement (c.-à-d. des puits privés ou de petites sources locales) (Craun et coll., 2010; CDC, 2011, 2013, 2015b, 2017d). Les résultats de l’évaluation quantitative du risque microbien semblent indiquer que la consommation d’eau non traitée ou inadéquatement traitée provenant de petites sources d’eau potable pourrait être responsable de 4 % des tous les cas de maladies causées par E. coli O157 au Canada (Murphy et coll., 2016). L’éclosion survenue à Walkerton en mai 2000 est l’éclosion d’eau potable la plus importante au Canada mettant en cause les E. coli pathogènes (et Campylobacter [voir B.1.1.3]), qui s’est traduite par un nombre total de cas estimé à 2 300, 163 cas confirmés d’infection à E. coli O157, 27 cas de SHU et sept décès (O’Connor 2002a, 2002b). Depuis l’éclosion de Walkerton, d’importantes éclosions liées à la contamination de l’eau potable par des E. coli pathogènes ont touché le Missouri, aux États-Unis (2010 : 28 cas, 0 décès), et la Corée (2015 : 188 cas, 0 décès) (Hrudey et Hrudey, 2004; Missouri Department of Health and Senior Services, 2011; Park et coll., 2018). Les Shigella spp. sont rarement associées à des éclosions liées à l’eau potable (Hrudey et Hrudey, 2004; Craun et coll., 2010). Trois éclosions dues à la contamination de l’eau potable par des Shigella spp. ont été dénombrées aux États-Unis entre 2001 et 2014, toutes associées à des sources d’eau potable non conformes aux règlementations (eau d’étang ou de lac et eau embouteillée) (CDC, 2006, 2011, 2015b).
Des enquêtes sur les maladies liées à l’eau potable au Canada ont révélé que la majorité des éclosions de maladies d’origine hydrique survenaient au printemps et en été (Schuster et coll., 2005; Thomas et coll., 2006; Wilson et coll., 2009). Des variables météorologiques (p. ex. la fonte des neiges, des températures chaudes, une alternance entre des conditions sèches et des épisodes de pluie intenses) et des activités humaines et animales accrues dans le bassin versant (p. ex. animaux au pâturage et épandage de déchets fécaux sur les terres agricoles) ont été avancées en tant que facteurs contribuant à ces tendances (Tyrell et Quinton, 2003; Thomas et coll., 2006; Wilson et coll., 2009; Quilliam et coll., 2011). De fortes pluies ayant entraîné des inondations ont ainsi contribué à l’éclosion d’infections par E. coli O157:H7 et par Campylobacter spp. à Walkerton (Ontario) en 2000 (O’Connor, 2002a).
B.1.3 Helicobacter pylori
B.1.3.1 Description
Helicobacter pylori (H. pylori; classe : Epsilonproteobacteria) est une bactérie pathogène qui peut coloniser l’estomac humain et causer des maladies gastro-intestinales, comme la gastrite, les ulcères gastroduodénaux et le cancer de l’estomac (Percival et Williams, 2014d; Posteraro et coll., 2015). Les bactéries du genre Helicobacter sont étroitement apparentées au genre Campylobacter (Percival et Williams, 2014 d). Plus de 20 espèces différentes d’ Helicobacter ont été identifiées par séquençage génétique (Percival et Williams, 2014d; Posteraro et coll., 2015).H. pylori est l’espèce pathogène prédominante du genre Helicobacter, responsable de la vaste majorité des infections humaines. D’autres espèces d’Helicobacter ont parfois été associées à des maladies gastro-intestinales humaines (Percival et Williams, 2014 d).
H. pylori sont des bactéries à Gram négatif, motiles, exigeantes et microaérophiles (faibles besoins en oxygène), qui se développement à des températures comprises entre 30 et 42 °C (température optimale de 37 °C) (Mégraud et Lehours, 2007; Posteraro et coll., 2015). Elles ne sont pas acidophiles (qui aiment les milieux acides), mais mettent en œuvre des mécanismes qui lui permettent de tolérer les conditions acides de l’estomac humain. H. pylori présentent deux morphologies différentes : une forme en bâtonnet spiralé (décrivant un S) et une forme sphérique, viable, mais non cultivable (VNC), adoptée lorsque la bactérie subit un stress environnemental. La forme VNC constitue un élément clé de la stratégie de survie de l’organisme. Toutefois, son rôle dans la pathogenèse demeure inconnu (Percival et Williams, 2014 d).
B.1.3.2 Effets sur la santé
L’immense majorité des infections causées par H. pylori sont asymptomatiques (Percival et Williams, 2014 d). Une infection par H. pylori peut provoquer une gastrite chronique et superficielle et certaines infections évoluent en ulcères duodénaux ou gastriques (Posteraro et coll., 2015). Les symptômes de la gastrite et des ulcères sont des nausées, des douleurs abdominales, des brulures d’estomac et des saignements (Percival et Williams, 2014d; Posteraro et coll., 2015). Pour une petite proportion de la population infectée, les infections peuvent évoluer en cancer de l’estomac. H. pylori a été classifiée par le Centre international de recherche sur le cancer (CIRC) comme cancérogène pour l’humain (CIRC, 2014) et cet organisme est considéré comme la seule cause la plus fréquente de cancer de l’estomac dans le monde (Percival et Williams, 2014d; Posteraro et coll., 2015). La dose infectante d’H. pylori reste inconnue. Des études contradictoires laissent croire qu’elle est inférieure à 10 000 cellules (Solnick et coll., 2001; Graham et coll., 2004). Cependant, des données tirées de déclarations de cas montrent que la dose infectante pourrait être plusieurs ordres de grandeur en dessous de cette valeur (Langenberg et coll., 1990; Matysiak-Budnik et coll., 1995).
Les effets variables sur la santé des infections par H. pylori semblent s’expliquer par la variabilité de la génétique humaine, des facteurs environnementaux et diététiques et des différences de virulence entre souches (Brown, 2000; Posteraro et coll., 2015). Vu que la majorité des personnes infectées ne contractent pas de maladie clinique, il peut s’avérer difficile de déterminer quand l’infection survient (Brown, 2000). Les personnes de statut socioéconomique peu élevé ou vivant dans des conditions hygiéniques et sanitaires médiocres et dans des zones densément peuplées sont plus largement infectées par H. pylori (Brown, 2000). Les taux d’infection sont plus élevés dans les pays en voie de développement et dans les populations à risque, la plupart des infections étant contractées durant l’enfance dans ces zones (Brown, 2000, Posteraro et coll., 2015). Les taux d’infection durant l’enfance dans les pays développés sont faibles et peuvent diminuer lorsque les pratiques sanitaires s’améliorent (Brown, 2000). Il a été dit qu’H. pyloriétait l’agent pathogène le plus fréquent chez l’humain (Posteraro et coll., 2015). Environ la moitié de la population mondiale est infectée par H. pylori (Percival et Williams, 2014 d). Les taux d’infection asymptomatique par H. pylori varient beaucoup selon les zones géographiques. Cependant, il est estimé qu’ils diminuent pour se situer entre 20 et 50 % dans les régions développées et entre 50 à plus de 70 % dans les pays en voie de développement (Brown, 2000; Hooi et coll., 2017; Zamani et coll., 2018). Les taux d’infections par H. pylori au Canada ne sont pas bien connus, car ce ne sont pas des maladies à déclaration obligatoire. Des études portant sur les infections par H. pylori chez des adultes de l’Ontario âgés de 50 à 80 ans et des enfants canadiens présentant des symptômes dans la partie supérieure de l’appareil digestif ont mis en évidence des taux d’infection respectifs de 23,1 % et 7,1 % dans ces deux groupes d’individus (Naja et coll., 2007; Segal et coll., 2008). Des taux plus élevés (> 40 %) ont été observés au sein des populations autochtones du Canada (Bernstein et coll., 1999; Sethi et coll., 2013; Fagan-Garcia et coll., 2019).
Une fois que les personnes ont été contaminées par H. pylori, les infections peuvent durer toute une vie à moins que des thérapies antimicrobiennes intensives ne soient entreprises (Percival et Williams, 2014 d). Il a été montré que l’éradication d’ H. Pylori permettait une guérison complète des ulcères duodénaux et de la plupart des ulcères gastriques (Percival et Williams, 2014 d). L’ASPC et l’OMS ont considéré comme moyennement à hautement prioritaires l’étude des Helicobacter résistants à la clarithromycine et multirésistants et la mise au point de nouveaux traitements antibiotiques contre ces organismes (Garner et coll., 2015; OMS, 2017b). Aucun vaccin efficace contre les infections par H. pylori n’a été encore été conçu (Posteraro et coll., 2015).
B.1.3.3 Sources et exposition
H. pylori est présent chez l’humain, le chat domestique et les primates non humains (p. ex. les Catarrhiniens) (Percival et Williams, 2014 d). L’estomac humain est considéré comme un réservoir important de cet organisme (Percival et Williams, 2014 d). Les chats domestiques sont suspectés d’être des vecteurs probables d’infection de l’humain (Percival et Williams, 2014 d).
Le processus d’infection par H. pylori est mal connu. Une transmission entre personnes, par voie oro-fécale, oro-gastrique ou oro-orale, est censée être le mode de contamination le plus probable (Percival et Williams, 2014d; Posteraro et coll., 2015). Les contacts directs entre chats domestiques sont également suspectés d’être des modes d’infection. Cependant, il n’existe aucune donnée probante sur la transmission des animaux aux humains (Brown, 2000). La consommation d’eau potable contaminée est présumée être une possible source d’infection. Des infections survenant par l’intermédiaire de multiples voies de transmission sont envisageables (Percival et Williams, 2014 d). Des tentatives de culture d’H. Pylori à partir d’échantillons environnementaux ont échoué pour la plupart et l’absence de donnée sur la culture de cet organisme a limité les études épidémiologiques et les évaluations des risques (Percival et Williams, 2014 d). La preuve d’une transmission par l’eau provient en grande partie d’études épidémiologiques menées dans des pays en voie de développement (Percival et Williams, 2014 d). D’autres preuves de ce mode de transmission ont été apportées grâce à la culture H. pylori dans des matières fécales de personnes infectées, à la détection d’H. Pylori par des méthodes moléculaires dans des sources d’eau potable et à la découverte d’un lien entre la présence d’H. Pylori dans des sources d’eau souterraine non traitée et l’infection clinique de personnes ayant bu cette eau (Baker et Hagerty, 2001). Dans les pays disposant de moyens de traitement de l’eau potable adéquats, celle-ci risque peu de constituer un vecteur d’infection important (Percival et Williams, 2014 d). Néanmoins, il est nécessaire d’approfondir les travaux de recherche menés sur le rôle de l’eau dans la propagation des infections par H. pylori. Les études sur la détection d’H. pylori dans les sources d’eau potable municipales sont peu nombreuses. Des enquêtes sur la présence d’H. pylori dans des échantillons d’eau et de biofilm prélevés dans la plomberie de résidences privées et d’installations publiques approvisionnées en eau municipale ont permis de détecter le microorganisme par réaction en chaine de la polymérase (PCR) sur 4 à 64 % des endroits échantillonnés (Watson et coll., 2004; Santiago et coll., 2015; Richards et coll., 2018). H. pylori n’est pas considérée comme une cause d’éclosions liées à la contamination de l’eau (Percival et Williams, 2014 d).
B.1.4 Salmonella spp.
B.1.4.1 Description
Salmonella (classe : Gammaproteobacteria; famille : Enterobacteriaceae) est un grand groupe de bactéries variées pouvant causer des infections gastro-intestinales chez les animaux et l’humain. Des méthodes moléculaires ont montré que le genre Salmonella comporte seulement deux espèces, Salmonella enterica et Salmonella bongori (Percival et Williams, 2014g; Graziani et coll., 2017). Salmonella enterica se divise à son tour en six sous-espèces et regroupe la majorité des 2 500 sérotypes et plus qui ont été identifiés (Grimont et Weill, 2007; Percival et Williams, 2014g). Lors des premières identifications des Salmonella, les sérotypes étaient traités comme des espèces et des noms leur étaient donnés, qui reflétaient l’organisme infecté ou la maladie auxquels ils étaient associés ou, plus tard, les localisations géographiques où ils étaient découverts (Grimont et Weill, 2007). Lorsque la taxonomie actuelle des Salmonella a été mise en place, ces noms étaient devenus tellement familiers qu’ils ont été conservés, remplaçant la nomenclature basée sur les antigènes de surface O et H plus couramment utilisée pour les autres espèces bactériennes (Grimont et Weill, 2007).
Les Salmonella présentant un risque pour l’humain sont généralement réparties en deux groupes principaux selon le type de maladie qu’elles causent. Les Salmonella typhoïdiques ( S. enterica de sérotype Typhi et S. enterica de sérotype Paratyphi) sont les agents responsables de la fièvre entérique (également connue sous le nom de fièvre typhoïde ou paratyphoïde), une maladie grave et potentiellement mortelle (Sanchez-Vargas et coll., 2011). Les Salmonella non typhoïdiques sont un grand groupe qui comporte tous les autres sérotypes de S. enterica pouvant entraîner des maladies gastro-intestinales de gravité variable (Sanchez-Vargas et coll., 2011). Dans les pays industrialisés, les Salmonella non typhoïdiques sont les agents pathogènes d’origine alimentaire et hydrique les plus fréquents (Sanchez-Vargas et coll., 2011; Percival et Williams, 2014g). Les Salmonella de sérotype Enteritidis (S. Enteritidis) et Salmonella de sérotype Typhimurium (S. Typhimurium) sont les sérotypes qui causent des infections humaines les plus couramment rencontrés (Sanchez-Vargas et coll., 2011).
Les Salmonellasont des bactéries à Gram négatif, anaérobies facultatives et la plupart du temps motiles et en forme de bâtonnets qui peuvent se développer à des températures comprises entre 5 et 47 °C, et optimalement entre 35 et 37 °C (Graziani et coll., 2017).
B.1.4.2 Effets sur la santé
Les infections par les Salmonella évoluent en différentes maladies, selon que leur sérotype est typhoïdique ou non (Sanchez-Vargas et coll., 2011). Les Salmonella non typhoïdiques causent une gastroentérite caractérisée par de la diarrhée, de la fièvre et des douleurs abdominales (Percival et Williams, 2014g, Graziani et coll., 2017). Les symptômes apparaissent 12 à 72 heures après l’infection et la maladie peut durer quatre à sept jours. Dans les cas graves, l’infection peut se répandre à d’autres parties du corps (p. ex. le sang, l’urine, les articulations et le cerveau) et s’avérer mortelle (Percival et Williams, 2014g; Sanchez-Vargas et coll., 2011). Les enfants présentent le taux d’incidence le plus élevé d’infections à Salmonella (Christenson, 2013; ASPC, 2018c). Les infections graves et mortelles sont rares et sont plus fréquemment observées chez les très jeunes enfants, les personnes très âgées et les sujets immunodéprimés ou atteints d’une maladie sous-jacente (Sanchez-Vargas et coll., 2011; Dekker et Frank, 2015). Une méta-analyse des cas d’infections à Salmonella non typhoïdiques suivies de complications à long terme a produit les estimations suivantes : 5,8 % ont été suivies d’une arthrite réactionnelle (IC à 95 % : 3,2 à 10,3 %) et 3,3 % (IC à 95 % : 1,6 à 6,6 %) d’un syndrome du côlon irritable (Keithlin et coll., 2015). Il a été impossible d’évaluer d’autres types de complications (p. ex. SHU et syndrome de Guillain-Barré) en raison du manque de données disponibles (Keithlin et coll., 2015). Les Salmonella typhoïdiques provoquent la fièvre entérique, une maladie invasive et générale qui se manifeste par de fortes fièvres, des vomissements, des maux de tête et de nombreuses complications potentiellement mortelles (Sanchez-Vargas et coll., 2011). La fièvre entérique s’observe surtout dans les pays à faible revenu. Dans les pays industrialisés, cette maladie est peu fréquente et essentiellement rencontrée chez les voyageurs (Sanchez-Vargas et coll., 2011). La dose infectante varie selon le sérotype incriminé et la sensibilité du sujet contaminé. Des données laissent croire que cette dose (dans le cas des Salmonella non typhoïdiques) peut varier entre moins de 100 organismes et un maximum de 100 000 à 10 milliards de microorganismes (Kothary et Babu, 2001).
Les Salmonella sont la deuxième cause de maladies gastro-intestinales bactériennes au Canada, aux États-Unis et en Europe (Scallan et coll., 2011; CDC, 2018; ECDC, 2019; ASPC, 2019). Au Canada, les taux d’incidence annuels observés pour la salmonellose (toutes sources confondues) sur la période 2013-2017 variaient entre 17,6 et 21,7 (taux médian de 21,38) cas pour 100 000 habitants (ASPC, 2019b). Les cas de maladies sont essentiellement sporadiques, la plupart étant associés à la consommation d’aliments contaminés. Le pic d’incidence de la maladie (toutes sources confondues) survient en été et en automne (Fleury et coll., 2006; Lal et coll., 2012).
Les infections à Salmonella non typhoïdiques sont généralement spontanément résolutives et le traitement consiste à remplacer les liquides et électrolytes perdus (Percival et Williams, 2014g). Des antibiotiques peuvent être prescrits dans les cas graves, lorsque le risque de propagation de l’infection est élevé (Sanchez-Vargas et coll., 2011; Percival et Williams, 2014g). Aucun vaccin humain n’est actuellement disponible contre les infections à Salmonella non typhoïdiques (Sanchez-Vargas et coll., 2011). Les CDC, l’OMS et l’ASPC ont catégorisé les Salmonella non typhoïdiques résistantes à la ciprofloxacine, à la ceftriaxone ou à plusieurs classes (soit plus de trois) de médicaments comme des « Menaces prioritaires à Élevées » (CDC 2019a; OMS, 2017b, ASPC, 2018a). Dans les pays développés, la résistance de Salmonella aux antibiotiques suit généralement les tendances de l’utilisation d’antimicrobiens chez les animaux destinés à la consommation humaine (McDermott et coll., 2018). Les types de résistance les plus souvent observés concernent les anciennes générations d’antimicrobiens (p. ex. tétracycline, sulfamides, streptomycine) (McDermott et coll., 2018). Une diminution des taux de résistance aux médicaments essentiels pour les animaux et les humains (bêta-lactamines et ciprofloxacine de troisième génération) a été observée aux États-Unis et au Canada et coïncide avec les politiques limitant leur usage en agriculture (McDermott et coll., 2018; ASPC, 2018a).
B.1.4.3 Sources et exposition
Les Salmonella non typhoïdiques sont des agents pathogènes zoonotiques. Les poules, les cochons, les dindes et les bovins sont considérés comme les réservoirs les plus importants de Salmonella (Graziani et coll., 2017). D’autres animaux (les chiens, les oiseaux, les rongeurs et les reptiles) et les humains (personnes infectées et porteurs asymptomatiques) sont aussi connus comme étant des sources de Salmonella (Percival et Williams, 2014g; Graziani et coll., 2017). Les humains constituent le seul réservoir connu de sérotypes de Salmonella typhoïdiques (Percival et Williams, 2014g).
Ces microorganismes se transmettent par voie oro-fécale. Dans le cas des sérotypes non typhoïdiques, la nourriture contaminée est le vecteur d’infection le plus fréquent. Les contacts entre personnes et le contact direct avec des animaux sont d’importantes voies d’exposition (Percival et Williams, 2014g; Graziani et coll., 2017). L’ingestion d’eau contaminée est aussi un mode d’infection connu pour les Salmonella non typhoïdiques. (Graziani et coll., 2017). La section consacrée aux Campylobacter spp. (voir B.1.1) contient des renseignements sur les principales sources de contamination de l’eau potable. Les Salmonella non typhoïdiques sont très rarement associées à des éclosions liées à l’eau potable (CDC, 2004, 2006, 2008, 2011, 2013, 2015b, 2017d; Hrudey et Hrudey, 2004).
B.1.5 Yersinia spp.
B.1.5.1 Description
Le genre Yersinia (classe : Gammaproteobacteria; famille : Enterobacteriaceae) regroupe environ 20 espèces bactériennes, dont seulement trois sont connues comme étant des agents pathogènes humains. Deux espèces (Yersinia enterocolitica et Yersinia paratuberculosis) sont considérées comme des entéropathogènes d’origine alimentaire ou hydrique, pouvant causer des gastroentérites aigües de gravité légère à élevée (Percival et Williams, 2014i; Fredriksson-Ahomaa, 2015). Yersinia enterocolitica peut se diviser en six biotypes différentiables par des analyses physicochimiques et biochimiques et en plus de 30 sérotypes, selon la variation de leurs antigènes de surface O (Sabina et coll., 2011; Fredriksson-Ahomaa, 2015). Les infections humaines ont traditionnellement été attribuées à certaines combinaisons de biotypes et sérotypes. Les types 1b:O8, 2:O5,27, 2:O9, 3:O3 et 4:O3 sont le plus souvent associés à des maladies humaines observées dans le monde entier (Todd, 2014; Fredriksson-Ahomaa, 2015, 2017). Y. paratuberculosis, plus étroitement apparentée à la bactérie responsable de la peste (Yersinia pestis) qu’ Y. enterocolitica, cause moins fréquemment des infections chez l’humain (Todd, 2014). Concernant Y. paratuberculosis, il existe plus de 20 sérotypes basés sur les variations des antigènes O, tous pathogènes (Percival et Williams, 2014i).
Les membres du genre Yersinia sont des cellules à Gram négatif, motiles, anaérobies facultatives et en forme de bâtonnets ou de coccobacilles, capables de se développer à des températures comprises entre 4 et 43 °C (températures optimales : entre 28 et 30 °C) (Todd, 2014; Fredriksson-Ahomaa, 2015).
B.1.5.2 Effets sur la santé
Les Yersinia entéropathogènes sont des microorganismes entéroinvasifs qui colonisent et envahissent les cellules épithéliales du colon, provoquant des diarrhées et des réactions inflammatoires (Percival et Williams, 2014i; Todd, 2014). La maladie causée par Y. enterocolitica ou par Y. paratuberculosis est communément appelée « yersiniose » (Fredriksson-Ahomaa, 2015). Les symptômes d’une yersiniose peuvent varier en fonction de l’âge et de l’immunité de la personne contaminée, de la souche incriminée et de la dose infectante (Todd, 2014). La diarrhée (souvent mêlée de sang), la fièvre et des douleurs abdominales sont les symptômes les plus fréquents chez les nourrissons et les enfants de moins de cinq ans (Fredriksson-Ahomaa, 2015). Chez les enfants plus âgés et les adultes, les symptômes prédominants sont la fièvre et des douleurs abdominales du côté droit, qui peuvent être confondus avec ceux de l’appendicite (Todd, 2014; Fredriksson-Ahomaa, 2015). Les symptômes se déclarent un à 11 jours après la contamination et peuvent persister durant un à trois jours, voire plus longtemps (Todd, 2014; Fredriksson-Ahomaa, 2015). Des infections asymptomatiques par Y. enterocolitica et Y. paratuberculosis ont été observées et ces agents pathogènes peuvent continuer à être éliminés par les matières fécales pendant des semaines après que les symptômes ont disparu (Todd, 2014). Parfois, dans les cas graves, les bactéries peuvent pénétrer dans les ganglions lymphatiques et l’infection peut se répandre davantage par la circulation sanguine (Percival et Williams, 2014i; Fredriksson-Ahomaa, 2015). Les complications à la suite d’infections sont rares et peuvent consister en des douleurs articulaires (arthrite réactionnelle) et des éruptions cutanées (Percival et Williams, 2014i; Fredriksson-Ahomaa, 2015). D’autres symptômes moins fréquents peuvent être associés à une infection par des Yersinia entéropathogènes, comme des réactions inflammatoires variées résultant d’une propagation de l’infection à d’autres parties du corps (p. ex. le foie, la rate, les poumons, le cœur, le cerveau et les os) (Percival et Williams, 2014i, Todd, 2014). Les jeunes enfants risquent davantage de tomber malades s’ils sont infectés par des Yersinia entéropathogènes (Todd, 2014; ASPC, 2018c). Les infections graves ou mortelles sont rares et habituellement observées chez les personnes âgées ou immunodéprimées (Todd, 2014). La dose infectante d’Y. enterocolitica et d’ Y. paratuberculosis est estimée à 10 000 à un milliard d’organismes (Todd, 2014). Cependant, elle est susceptible de diminuer dans le cas de personnes immunodéprimées (Fredriksson-Ahomaa, 2017).
Les Yersinia entéropathogènes sont une cause majeure de maladies gastro-intestinales bactériennes au Canada, aux États-Unis et en Europe (PHAC 2019a; CDC 2018; ECDC, 2018b). Aucune donnée sur l’incidence des infections par les Yersinia n’est disponible au Canada, car la yersiniose est une maladie à déclaration obligatoire uniquement dans la province de l’Alberta. Cependant, les données de la surveillance sentinelle canadienne provenant de trois endroits (BC, AB et ON), ont rapporté des taux d'incidence endémique de 10,16, 1,77 et 0,00 pour 100 000 habitants respectivement en 2018 (ASPC, 2019a). La majorité des cas de maladies liées aux Yersinia sont causés par Y. enterocolitica et sont associés à la consommation d’aliments contaminés (Todd, 2014; Fredriksson-Ahomaa, 2015; ASPC, 2018c). En général, les infections à Yersinia sont plus fréquemment observées durant les mois d’hiver (Todd, 2014; Fredriksson-Ahomaa, 2015).
Comme les infections par Y. enterocolitica ou Y. paratuberculosis sont normalement spontanément résolutives, un traitement est administré uniquement dans les cas graves s’accompagnant d’une infection généralisée ou une bactériémie (Todd, 2014; Fredriksson‑Ahomaa, 2015). Aucun vaccin humain n’est actuellement disponible.
B.1.5.3 Sources et exposition
Les Yersinia spp. pathogènes ou non peuvent être présentes dans le tube digestif de nombreux animaux sauvages et domestiques (Percival et Williams, 2014i; Fredriksson-Ahomaa, 2015). Les cochons constituent le plus gros réservoir de souches pathogènes d’ Y. enterocolitica. Les ruminants (p. ex. les bovins, les moutons et les chèvres), les chiens et les chats sont aussi d’importantes sources de ce pathogène (Todd, 2014; Fredriksson-Ahomaa, 2015). Les rongeurs et les oiseaux sont considérés comme d’importants réservoirs d’Y. paratuberculosis (Todd, 2014; Fredriksson-Ahomaa, 2015). Les Yersinia spp. pathogènes sont zoonotiques et peuvent donc se transmettre des animaux à l’humain par voie oro-fécale (Fredriksson-Ahomaa, 2015). Les sources de nourriture contaminées sont les vecteurs d’infection les plus courants (Todd, 2014; Fredriksson-Ahomaa, 2015). La consommation d’eau contaminée ou le contact direct avec des animaux sont également d’importantes voies d’infection (Todd, 2014; Fredriksson-Ahomaa, 2015). La transmission entre personnes est possible, mais rare (Todd, 2014; Fredriksson-Ahomaa, 2015).
Dans la plupart des études, ce sont les espèces ou souches non pathogènes qui sont les plus fréquemment isolées (Brennhovd et coll., 1992; Cheyne et coll., 2009; Schaffter et Parriaux, 2002). La faible fréquence d’isolement dans les échantillons environnementaux peut s’expliquer par la sensibilité limitée des méthodes d’isolement par culture (Fredriksson-Ahomaa et Korkeala, 2003). Cheyne et ses collègues (2010) ont pu détecter, à l’aide de méthodes PCR, des gènes de virulence de Yersinia dans 21 à 38 % des échantillons prélevés dans un bassin hydrologique fortement contaminé, qui était utilisé comme source alimentant un réseau d’approvisionnement en eau potable.
Les Yersinia spp. ont rarement été associées à des éclosions liées à la contamination de l’eau potable. Selon des données publiées aux États-Unis entre 2001 et 2014 (année de publication des données les plus récentes), les Yersinia enterocolitica, apparaissant de façon concomitante avec des Campylobacter jejuni, ont entraîné une seule éclosion liée à la contamination de l’eau potable (CDC, 2004, 2006, 2008, 2011, 2013, 2015b, 2017d). Il a été déterminé que la cause de cette éclosion était une source d’eau souterraine non communautaire, contaminée et non traitée (CDC, 2004).
B.1.6 Méthodes d’analyse
Des méthodes standards permettent de détecter les Campylobacter spp., les E. coli et Shigella spp. pathogènes, les Salmonella spp. et les Yersinia spp. dans l’eau potable (APHA et coll., 2017; ISO, 2019). Les protocoles d’isolement et d’identification de ces bactéries procèdent habituellement en étapes, par exemple l’enrichissement ou la séparation, l’étalement sur plaque, le tri des colonies et l’identification à l’aide d’analyses biochimiques, de techniques sérologiques, de méthodes moléculaires ou de trousses d’analyse commerciales (p. ex. pour identifier les toxines) (APHA et coll., 2017; ISO 2019).
Aucune méthode standard de détection d’Helicobacter spp. viables dans l’eau n’a encore été mise au point (Percival et Williams, 2014 d, APHA et coll., 2017). Les méthodes de détection d’ H. pylori dans les environnements aqueux consistent en l’utilisation de techniques moléculaires indépendantes de la culture, telles que la PCR ou l’hybridation in situ en fluorescence (Watson et coll., 2004; Percival et Williams, 2014d; Santiago et coll., 2015; Richards et coll., 2018).
Pour un examen des méthodes utilisées dans les contextes de recherche, il est possible de consulter les études suivantes : Ramírez-Castillo et coll., 2015; Kennedy et Wilkinson, 2017; Gorski et coll., 2019; Li et coll., 2020.
B.1.7 Traitements
Lorsqu’elles sont correctement conçues et utilisées, les techniques d’élimination physique – filtration avec procédé chimique, filtration lente sur sable, sur terre de diatomées ou sur membrane ou toute autre technologie éprouvée – et les méthodes de désinfection primaire – basées sur l’utilisation de chlore, de dioxyde de chlore, d’ozone ou de lumière ultraviolette (UV) – couramment utilisées dans le traitement de l’eau potable s’avèrent très efficaces pour réduire ou inactiver les bactéries entériques décrites dans les sections précédentes (LeChevallier, 2004). La monochloramine ne devrait pas être utilisée pour la désinfection primaire, en raison de son faible potentiel d’oxydation; elle est recommandée uniquement pour la désinfection secondaire (c.-à-d. pour maintenir une concentration résiduelle de désinfectant dans le réseau de distribution) (Santé Canada, 2019b).
Les exigences relatives à la valeur CT (concentration x temps) pour l’inactivation de ces bactéries à l’aide de désinfectants chimiques sont comparables à celles applicables à E. coli et inférieures à celles fixées pour les protozoaires et virus entériques (Sobsey, 1989; Lund, 1996; Johnson et coll., 1997; Rice et coll., 1999; Baker et coll., 2002; LeChevallier et Au, 2004; Rose et coll., 2007; Wojcicka et coll., 2007; Chauret et coll., 2008; Rasheed et coll., 2016; Jamil et coll., 2017; Santé Canada, 2019b, 2019c, 2020c). Les exigences relatives à les doses de rayons UV (intensité x temps) pour l’inactivation de ces microorganismes sont similaires à celles applicables à E. coli et aux protozoaires entériques et inférieures à celles requises pour de nombreux virus entériques (Sommer et coll., 2000; Zimmer et Slawson, 2002; Smeets et coll., 2006; Hayes et coll., 2006; Zimmer-Thomas et coll., 2007; Hijnen et coll., 2011; Santé Canada, 2019b, 2019c, 2020c).
Les pratiques d’exploitation et de maintenance visant à réduire le développement et la survie des bactéries généralement appliquées aux réseaux de distribution d’eau potable et aux installations de plomberie sont décrites dans la partie A (LeChevallier et Au, 2004; Friedman et coll., 2017). Ces pratiques permettent de lutter contre les biofilms, lesquels offrent un milieu favorable à la survie des agents pathogènes fécaux, qui peuvent avoir franchi les différentes barrières de traitement de l’eau potable ou s’être directement infiltrés dans le réseau de distribution en raison de défaillances touchant l’intégrité des procédés (Leclerc, 2003).
Pour les systèmes résidentiels et les puits privés, il est important d’effectuer régulièrement des inspections physiques, pour repérer les défaillances éventuelles, et des analyses sur le réseau de distribution d’eau (p. ex. des mesures des concentrations d’E. Coli et des coliformes totaux), afin de valider la bonne qualité microbiologique de l’eau. Les autorités provinciales et territoriales fournissent habituellement des conseils généraux sur la construction, l’entretien et la protection des puits et l’analyse de l’eau qu’ils contiennent. Les propriétaires de puits peuvent aussi consulter la série de documents intitulée Parlons d’eau pour en savoir davantage (Santé Canada, 2019a). Lorsqu’un traitement s’impose, Santé Canada recommande aux consommateurs d’utiliser des appareils certifiés conformes, par un organisme de certification accrédité, aux normes appropriées de NSF International (NSF) et de l’American National Standards Institute (ANSI) en matière de procédés de traitement de l’eau potable (NSF/ANSI, 2018, 2019, 2020). Les organismes de certification garantissent qu’un produit est conforme aux normes applicables et doivent être accrédités par le Conseil canadien des normes (CCN). Une liste à jour des organismes de certification accrédités peut être obtenue auprès du CCN (2020).
B.1.8 Contexte international
L’OMS, l’UE, l’EPA des États-Unis (US EPA) ou l’Australian National Health and Medical Research Council n’ont émis aucune recommandation en ce qui a trait à la présence des bactéries pathogènes entériques suivantes dans l’eau potable : Campylobacter spp.,E. coli et Shigella pathogènes entériques, Helicobacter pylori, Salmonella spp. et Yersinia spp. (NHMRC, NRMMC, 2011; OMS, 2017a; Commission européenne, 2020; US EPA, 2021a). Tout comme les documents d’orientation publiés par Santé Canada, les recommandations en matière d’eau potable de l’OMS et de l’Australie comportent des fiches techniques qui fournissent des renseignements sur les agents pathogènes d’origine hydrique préoccupants.
B.2 Agents pathogènes présents dans la nature
B.2.1 Bactéries
B.2.1.1 Aeromonas spp.
B.2.1.1.1 Description
Le genre bactérien Aeromonas (classe : Gammaproteobacteria) présente une structure taxonomique complexe. Environ 30 espèces ont été associées à ce genre et de nouvelles espèces potentielles continuent d’être décrites, bien qu’elles n’aient pas toutes été universellement acceptées (Janda et Abbott, 2010; Percival et Williams, 2014a; LPSN, 2019). Les difficultés que pose l’identification des Aeromonas viennent du manque de caractéristiques phénotypiques clairement distinctes et de l’absence d’un profil de typage cohérent permettant de distinguer différentes espèces. Par conséquent, il est nécessaire de recourir à des méthodes biochimiques et moléculaires pour effectuer une classification précise. Les Aeromonas spp. ayant une pertinence d’un point de vue clinique sont des agents pathogènes opportunistes qui ont été associés à des maladies et syndromes intestinaux et extra-intestinaux variées (Janda et Abbott, 2010, Liu, 2015). Quatorze espèces ont causé des maladies chez l’humain, mais la majorité des infections humaines (85 %) sont provoquées par les souches de quatre espèces : A. hydrophila, A. caviae, A. veronii (biotype A. sobria) et A. trota (Percival et Williams, 2014a; Liu, 2015; Bhowmick et Battacharjee, 2018).
Les aéromonades sont des bactéries à Gram négatif, anaérobies facultatives en forme de bâtonnets et ne formant pas de spores (Janda et Abbott, 2010; Percival et Williams, 2014a). Les souches associées à des infections humaines se développent optimalement à des températures comprises entre 35 et 37 °C, bien que de nombreuses souches puissent croitre entre 4 et 42 °C (Janda et Abbott, 2010; Percival et Williams, 2014a; Liu, 2015).
B.2.1.1.2 Effets sur la santé
La gastroentérite est la maladie la plus fréquente causée par une infection à Aeromonas (Janda et Abbott, 2010). Les formes de la maladie vont d’une entérite caractérisée par des diarrhées aqueuses, accompagnées de fièvre légère, de vomissements et de douleurs abdominales (le plus souvent), à une maladie semblable au choléra (très rare), en passant par une forme dysentérique s’accompagnant de selles sanglantes (rare) (Janda et Abbott, 2010, Liu, 2015). Les Aeromonas spp. sont très rarement responsables de la diarrhée du voyageur. En outre, ils peuvent être associés avec une infection intestinale subaigüe ou chronique (Janda et Abbott, 2010, Liu, 2015).
Le temps qui s’écoule entre l’infection et l’apparition des symptômes est d’un ou deux jours dans le cas de la diarrhée du voyageur causée par des Aeromonas (Janda et Abbott, 2010). Par définition, les cas subaigus de diarrhée durent deux semaines à deux mois, tandis que les cas chroniques persistent plus longtemps (Janda et Abbot, 2010). Les complications qui ont été associées à des cas plus graves de gastroentérite causée par des Aeromonas sont la colite ulcéreuse, le syndrome hémolytique et urémique et des maladies inflammatoires de l’intestin (Janda et Abbott, 2010, Liu, 2015). La dose d’Aeromonas spp. minimale causant une infection gastro-intestinale n’est pas clairement définie. La seule étude de provocation publiée a montré que seulement 2 souches sur 5 provoquaient une infection (14 sujets sur 57) et des diarrhées (2 personnes sur 57) à des concentrations bactériennes élevées (dix milles à dix-milliards d’unités formant colonie ou UFC) (Morgan et coll., 1985). Des données provenant de l’observation d’éclosions d’origine alimentaire indiquent que la concentration minimale causant une infection pourrait être plusieurs ordres de grandeur en dessous de ces valeurs pour certaines souches d’Aeromonas (Teunis et Figueras, 2016).
Les infections de la peau et des tissus mous sont les secondes formes les plus fréquentes de maladies liées aux Aeromonas. Les Aeromonas spp. peuvent être associées à des infections variées, allant d’irritations bénignes (p. ex. des lésions purulentes) à des infections graves ou mortelles, comme la cellulite ou la fasciite nécrosante (Janda et Abbott, 2010; Bhowmick et Battacharjee, 2018). Les aéromonades ont souvent été la cause d’infections transmissibles par le sang, lesquelles surviennent la plupart du temps par transfert de bactéries issues du tube digestif ou de plaies infectées. Les symptômes associés à ces infections sont la fièvre, la jaunisse, des douleurs abdominales et un choc septique (Janda et Abbott, 2010). Plus rarement, les Aeromonas entraînent des maladies caractérisées par des infections des voies respiratoires, de l’appareil urogénital ou des yeux (Janda et Abbott, 2010). Des taux de mortalité élevés ont été observés chez des sujets très vulnérables atteints de sepsis et d’infections de plaies graves causées par des Aeromonas (Janda et Abbot, 2010; Liu, 2015).
Des diarrhées provoquées par des Aeromonas ont été observées chez des personnes en bonne santé de tous groupes d’âge (Janda et Abbot, 2010; Percival et Williams, 2014a; Teunis et Figueras, 2016). Cependant, bien que les Aeromonas spp. soient très présentes dans la nourriture et l’eau, relativement peu de cas de maladie ont été dénombrés chez les personnes exposées à ces bactéries (Janda et Abbott, 2010). Les infections gastro-intestinales sont plus fréquentes dans les pays en voie de développement (Ghenghesh et coll., 2008). Les groupes à risque sont les nourrissons, les jeunes enfants, les personnes âgées et les personnes immunodéprimées ou atteintes d’une maladie sous-jacente, comme une hépatopathie ou des maladies malignes (Ghenghesh et coll., 2008; Liu, 2015). Les infections de la peau et des tissus mous sont souvent le résultat d’un trauma ou d’une blessure pénétrante et surviennent habituellement plus souvent chez les adultes que chez les enfants (Janda et Abbot, 2010). En ce qui concerne les bactériémies causées par des Aeromonas, la vaste majorité des cas s’observent chez les sujets immunodéprimés (Janda et Abbot, 2010). Des antibiotiques peuvent être prescrits dans les cas graves, lorsque le risque de propagation de l’infection est élevé (Percival et Williams, 2014a; Liu et coll., 2015). L’ASPC a catégorisé l’étude et la surveillance des Aeromonas spp. résistants aux médicaments comme une faible priorité par rapport aux autres agents pathogènes résistants aux antimicrobiens (Garner et coll., 2015). Aucun vaccin humain n’est actuellement disponible contre les infections à Aeromonas (Liu et coll., 2015). Ces infections ne sont pas des maladies à déclaration obligatoire en Amérique du Nord et dans la plupart des pays du monde. Les cas observés et les éclosions de maladies ont pour la plupart été associés à de la nourriture, à des expositions à l’hôpital, à des voyageurs, à des milieux non aqueux ou à des causes inconnues (Teunis et Figueras, 2016). Les infections sont le plus souvent observées durant les saisons chaudes (Janda et Abbot, 2010; Bhowmick et Battacharjee, 2018).
B.2.1.1.3 Sources et exposition
Les Aeromonas spp. peuvent vivre dans presque toutes les niches écologiques, dont les habitats aquatiques, le sol, les espèces animales vertébrées et invertébrées, les insectes et la nourriture (Janda et Abbot, 2010; Percival et Williams, 2014a). Elles sont présentes dans les milieux aqueux et aquatiques (p. ex. les lacs, les rivières, les eaux souterraines, l’eau de mer, les sources d’eau potable, les eaux usées et les égouts) et supportent toutes les conditions de pH, de température et de salinité, sauf les plus extrêmes (Janda et Abbot, 2010). Les membres du genre Aeromonas sont présents dans le tube digestif des animaux à sang froid et à sang chaud, dont les poissons, les oiseaux, les reptiles et le bétail. Les Aeromonasspp. peuvent être isolées à partir des matières fécales de personnes en bonne santé ayant consommé des aliments ou de l’eau contenant ces microorganismes (Percival et Williams, 2014a). Elles peuvent aussi être présentes en fortes concentrations dans les eaux usées (Janda et Abbott, 2010; Percival et Williams, 2014a). Les aéromonades se développent optimalement à des températures élevées, leur concentration dans l’eau étant donc maximale durant les saisons chaudes (LeChevallier et coll., 1982; Gavriel et coll., 2008; Chauret et coll., 2001; Egorov et coll., 2011).
L’ingestion de nourriture ou d’eau contaminée est considérée comme le principal mode de transmission de la gastroentérite causée par des Aeromonas. Le contact corporel direct avec de l’eau contaminée est le premier mode de contamination par les Aeromonas spp. responsables d’infections de la peau et des tissus mous liées à l’eau. Il a été déterminé que les eaux de crue contaminées dans des contextes de catastrophes naturelles étaient d’importants vecteurs de ces types de maladies (Tempark et coll., 2013). La transmission entre personnes n’est pas considérée comme un risque d’infections à Aeromonas.
Les aéromonades ne sont pas fréquemment détectées dans l’eau libre qui circule dans les réseaux de distribution municipaux contenant un désinfectant résiduel (Chauret et coll., 2001; Egorov et coll., 2011). Dans une étude portant sur 293 réseaux publics de distribution d’eau menée aux États-Unis, des Aeromonas spp. ont été détectées par des méthodes de culture dans 42 réseaux (14,3 %), à des concentrations comprises entre 0,2 et 880 (valeur médiane égale à 1,6) UFC par 100 ml (Egorov et coll., 2011). Les eaux souterraines sont censées contenir de moins grandes quantités d’aéromonades que les eaux de surface, mais les puits d’eau potable peuvent être colonisés par ces bactéries (Borchardt et coll., 2003; Percival et Williams, 2014a; Katz et coll., 2015). Les aéromonades sont capables de se développer et de subsister dans les biofilms des réseaux de distribution et cela peut contribuer à l’augmentation de leur concentration dans les sources d’eau potable (Gavriel et coll., 1998; Chauret et coll., 2001).
L’importance de l’eau potable comme vecteur de transmission des maladies gastro-intestinales causées par des Aeromonas n’est pas encore bien comprise. Des espèces d’Aeromonas possédant de multiples gènes de virulence ont été détectées dans des sources d’eau potable en Amérique du Nord et dans d’autres pays (Handfield et coll., 1996; Kühn et coll., 1997; Sen et Rogers, 2004; Robertson et coll., 2014b). Des études tentant de relier des souches découvertes dans des sources d’eau potable et des isolats de patients se sont avérées infructueuses (Havelaar et coll., 1992; Borchardt et coll., 2003). D’autres études ont mis en évidence un lien épidémiologique entre les Aeromonas d’échantillons cliniques et l’eau potable comme source d’infection (Khajanchi et coll., 2010; Katz et coll., 2015). Il est généralement admis que seul un sous-ensemble de souches d’ Aeromonas peut provoquer des maladies gastro-intestinales chez l’humain (Teunis et Figueras, 2016). En outre, il semblerait que l’infection soit un processus complexe mettant en jeu la virulence de la souche d’Aeromonas, son interaction avec d’autres microorganismes présents dans le tube digestif (constituant des agents pathogènes co-infectieux ou faisant partie du microbiote intestinal naturel) et l’état de santé du sujet contaminé (Teunis et Figueras, 2016). Par conséquent, la présence seule d’Aeromonas spp. dans l’eau potable ne prouve pas qu’il existe un risque pour la santé (Edberg et coll., 2007). Des travaux plus approfondis sont nécessaires pour déterminer la combinaison spécifique des facteurs liés au sujet contaminé, à l’environnement et aux agents pathogènes, qui entraîne l’apparition de maladies gastro-intestinales à la suite d’infections à Aeromonas (Teunis et Figueras, 2016). Aucune éclosion liée à la contamination de l’eau potable par des Aeromonas n’a encore été observée (Janda et Abbot, 2010; Teunis et Figueras, 2016).
B.2.1.1.4 Méthodes d’analyse
Des méthodes standards de détection des bactéries Aeromonas dans l’eau potable sont disponibles (US EPA, 2001; APHA et coll., 2017). Cependant, il n’existe aucune méthode d’isolement par culture universellement acceptée permettant de détecter toutes les aéromonades présentes dans des échantillons d’eau (APHA et coll., 2017). Les Aeromonas spp. sont des bactéries hétérotrophes détectées par numération sur plaque des bactéries hétérotrophes (NPBH). Cependant, il n’existe aucune corrélation directe entre les résultats de la NPBH et les concentrations d’Aeromonas.
B.2.1.1.5 Traitements
Lorsqu’elles sont correctement conçues et utilisées, les méthodes d’élimination physique – filtration avec procédé chimique, filtration lente sur sable, sur terre de diatomées ou sur membrane ou toute autre technologie éprouvée – et de désinfection primaire – basées sur l’utilisation de chlore, de dioxyde de chlore, d’ozone ou d’UV – couramment utilisées dans le traitement de l’eau potable s’avèrent très efficaces pour réduire ou inactiver les Aeromonas spp. (Chauret et coll., 2001; OMS, 2002; US EPA, 2006a; Yu et coll., 2008). La monochloramine ne devrait pas être utilisée pour la désinfection primaire, en raison de son faible potentiel d’oxydation; elle est recommandée uniquement pour la désinfection secondaire (c.-à-d. pour maintenir une concentration résiduelle de désinfectant dans le réseau de distribution) (Santé Canada, 2019b). L’emploi de charbon actif en granulés (CAG) dans le traitement de l’eau peut fournir des sources de nutriments aux aéromonades, ce qui peut favoriser leur présence et leur survie dans les réseaux de distribution d’eau potable (OMS, 2002; US EPA, 2006a).
Les Aeromonas sont aussi sensibles aux désinfectants chimiques qu’E. coli et d’autres bactéries d’origine hydrique (Knøchel, 1991; Medema et coll., 1991; Sisti et coll., 1998; OMS, 2002; US EPA, 2006a). Les exigences en matière de CT pour l’inactivation des Aeromonas spp. par les désinfectants chimiques sont inférieures à celles applicables à de nombreux virus entériques. Les exigences en matière de dose d’UV sont comparables à celles requises pour d’autres bactéries pathogènes entériques et pour les protozoaires entériques Giardia et Cryptosporidium et sont inférieures à celles applicables à de nombreux virus entériques (Massa et coll., 1999; Gerba et coll., 2003; US EPA, 2006a; Santé Canada, 2019b, 2019c).
Les pratiques générales d’exploitation et de maintenance visant à limiter la survie et le développement de microbes dans les réseaux de distribution d’eau potable et les installations de plomberie, telles qu’elles sont décrites dans la partie A, sont essentielles pour contrôler la présence d’Aeromonasspp. (Chauret et coll., 2001; OMS, 2002; Percival et Williams, 2014a).
Pour les systèmes résidentiels et les puits privés, il est important d’effectuer régulièrement des inspections physiques, pour repérer les défaillances éventuelles, et des analyses sur le réseau de distribution d’eau (p. ex. des mesures des concentrations d’E. Coli et des coliformes totaux), afin de valider la bonne qualité microbiologique de l’eau. Si des problèmes de qualité microbiologique de l’eau potable sont suspectés, il peut s’avérer utile d’ajouter des paramètres d’analyse, par exemple une NPBH (OMS et OCDE, 2003; Santé Canada, 2020c). L’autorité responsable de la gestion de l’eau potable sur le territoire administratif concerné devrait fournir des conseils précis en matière de construction, d’exploitation et de maintenance des réseaux et d’analyses des eaux qu’ils contiennent.
B.2.1.1.6 Contexte international
L’OMS, l’UE, l’US EPA ou l’Australian National Health and Medical Research Council n’ont émis aucune recommandation en ce qui a trait à la présence des Aeromonas spp. dans l’eau potable (NHMRC, NRMMC, 2011; OMS, 2017a; Commission européenne, 2020; US EPA, 2021a). Aux Pays-Bas, la règlementation spécifie une exigence de surveillance des Aeromonas, sous la forme d’un paramètre d’exploitation dont la limite cible est inférieure à 1 000 UFC/100 ml (Smeets et coll., 2009). Cette limite se base sur les capacités de traitement et non sur des critères de santé publique (OMS, 2002).
B.2.1.2 Legionella spp.
B.2.1.2.1 Description
Le genre bactérien Legionella (classe : Gammaproteobacteria) comporte 61 espèces et trois sous-espèces (LPSN, 2019). Au moins 30 espèces sont connues comme responsables d’infections humaines (Cuhna et coll., 2016; Burillo et coll., 2017). Les Legionella spp. pathogènes sont des agents infectieux opportunistes qui causent des maladies respiratoires sous deux formes principales : la maladie du légionnaire et la fièvre de Pontiac (Percival et Williams, 2014e, NASEM, 2020). Les bactéries du genre Legionella ont également été associées à des infections extrapulmonaires, bien que celles-ci soient beaucoup plus rares (NASEM, 2020; CDC, 2021a). Les maladies provoquées par Legionella spp. sont toutes nommées légionelloses. Legionella pneumophila (essentiellement le sérogroupe 1), l’agent pathogène le plus commun et le plus virulent du genre Legionella, est responsable de 65 à 90 % de tous les cas de maladie du légionnaire (Fields et coll., 2002; Edelstein et Roy, 2015; Percival et Williams, 2014e, Prussin II et coll., 2017). Les tests cliniques de diagnostic sont optimisés pour détecter cette espèce et ce sérogroupe, de sorte que la proportion des maladies causées par d’autres espèces et sérogroupes est probablement sous-estimée (NASEM, 2020). D’autres espèces de bactéries du genre Legionella peuvent entraîner des maladies, notamment L. micdadei, L. bozmanae, L. dumoffii et L. longbeachae (Edelstein et Roy, 2015; Percival et Williams, 2014e; Cuhna et coll., 2016).
Les Legionella spp. sont des cellules à Gram négatif, aérobies strictes, motiles pour la plupart et en forme de bâtonnets courts et ont besoin de nutriments particuliers (L-cystine et fer) pour se développer (Percival et Williams, 2014e). Durant leur cycle de vie, les Legionella peuvent s’adapter à des conditions changeantes en formant différents types de cellules d’infectivité et de résistance variables à la désinfection (Robertson et coll., 2014a; NASEM, 2020).
B.2.1.2.2 Effets sur la santé
La maladie du légionnaire est une maladie respiratoire grave qui provoque une pneumonie et qui s’accompagne de symptômes comme la fièvre, la toux, des frissons, des troubles neurologiques (confusion), des douleurs musculaires, des maux de tête et des problèmes gastro-intestinaux (diarrhée, nausées et vomissements) (Castillo et coll., 2016, Cunha et coll., 2016; Edelstein et Roy, 2015). Les symptômes apparaissent généralement deux à 14 jours après l’infection (NASEM, 2020), et la maladie peut persister des semaines voire des mois (Palusińska-Szysz et Cendrowska-Pinkosz, 2009). Bien que beaucoup de gens soient exposés à Legionella, peu contractent la maladie (Castillo et coll., 2016). La maladie du légionnaire présente un taux d’attaque faible et touche moins de 1 à 5 % de la population générale et moins de 1 à 14 % des patients hospitalisés et exposés aux bactéries lors d’éclosions (Hornei et coll., 2007; Edelstein et Roy, 2015; Leoni et coll., 2018). La légionellose survient davantage chez les adultes âgés ou les personnes immunodéprimées. Toutefois, les sujets sains peuvent contracter la maladie s’ils sont exposés à une concentration suffisamment élevée de bactéries (Springston et Yocavitch, 2017). Les cas de maladie du légionnaire chez les enfants sains sont extrêmement rares (McDonough et coll., 2007, Greenberg et coll., 2006). La sensibilité à la légionellose après exposition aux bactéries est plus élevée chez les personnes de sexe masculin, âgées de 40 à 50 ans, fumeuses, atteintes de maladies cardiaques ou pulmonaires chroniques, de diabète ou d’insuffisance rénale, immunodéprimées, transplantées ou souffrant de certains types de cancer (Fields et coll., 2002; Edelstein et Roy, 2015, Castillo et coll., 2016; Cuhna et coll., 2016; NASEM, 2020). Le taux de mortalité des patients atteints de la maladie du légionnaire dépend de leur état de santé et de la rapidité avec laquelle un traitement leur est administré et varie selon que les cas sont sporadiques, nosocomiaux ou liés à une éclosion (Edelstein et Roy, 2015). La mortalité est estimée à moins de 10 à 15 % des cas d’origine communautaire, mais à plus de 25 % des cas nosocomiaux (Benin et coll., 2002; Howden et coll., 2003; Dominguez et coll., 2009; Soda et coll., 2017; Leoni et coll., 2018).
La fièvre de Pontiac est une maladie plus bénigne, d’allure grippale, spontanément résolutive et non pulmonaire, associée à une exposition à Legionella. Cette maladie a été principalement diagnostiquée lors d’éclosions où les personnes atteintes présentaient des symptômes d’allure grippale et avaient été exposées à une même source d’aérosols (Lüttichau et coll., 1998). Le mode d’apparition de la fièvre du légionnaire est mal compris et la raison pour laquelle des personnes contractent cette maladie et d’autres la légionellose demeure inconnue (Fields et coll., 2001; Edelstein, 2007). Il a été suggéré que la fièvre de Pontiac pourrait être due à une exposition à certaines combinaisons de microorganismes vivants et morts (soit des espèces de Legionella, soit des microorganismes coexistants) et de leurs produits (notamment des endotoxines) (Edelstein, 2007). La fièvre de Pontiac présente un taux d’attaque élevé et touche 80 à 90 % des personnes exposées durant des éclosions (Leoni et coll., 2018). Les symptômes de la maladie se déclarent cinq heures à trois jours après l’infection et persistent deux à sept jours. Aucune complication à long terme n’a été observée et la maladie n’est pas mortelle (Tossa et coll., 2006; Edelstein et Roy, 2015). Il ne semble y avoir aucun facteur de prédisposition à la maladie chez les personnes infectées (Edelstein et Roy, 2015). Des cas de fièvre de Pontiac ont été observés chez des enfants lors d’éclosions de la maladie (Lüttichau et coll., 1998; Goldberg et coll., 1989, Jones et coll., 2003; Burnsed et coll., 2007).
La maladie du légionnaire et la fièvre de Pontiac sont les manifestations les plus courantes de la légionellose; la maladie extrapulmonaire causée par Legionella est extrêmement rare (NASEM, 2020, CDC, 2021a). La peau, les articulations et les tissus mous qui entourent le cœur comptent parmi les sièges déclarés d’infections extrapulmonaires (Padrnos et coll., 2014; Ibranosyan et coll., 2019; CDC, 2021a). Ces infections ont été le plus fréquemment observées chez les personnes immunodéprimées ou présentant des infections pulmonaires à Legionella concomitantes (Padrnos et coll., 2014; Ibranosyan et coll., 2019). Les infections extrapulmonaires sont principalement causées par des espèces et des souches de Legionella autres que L. pneumophila et que le sérogroupe 1 de L. pneumophila (Padrnos et coll., 2014; Ibranosyan et coll., 2019).
Des modèles dose-réponse ont été élaborés pour quelques souches particulières de Legionella, à partir d’expériences réalisées sur des animaux (NASEM, 2020). Aucun consensus entre spécialistes ne permet d’affirmer qu’il existe un seuil détectable de concentration de Legionella en dessous duquel il n’y aurait aucun risque d’infection (NASEM, 2020).
Les bactéries du genre Legionella sont une cause majeure d’éclosions de maladies d’origine hydrique aux États-Unis (Neil et Berkleman, 2008; CDC, 2017d; Friedman et coll., 2017). Les éclosions d’envergure de Legionella sont l’objet de la plus grande attention étant donné leurs importantes répercussions sur la santé. Cependant, il est estimé que moins de 20 % de tous les cas observés de légionellose sont liés à des éclosions (Fields et coll., 2002; Neil et Berkleman, 2008; Burillo et coll., 2017). Au Canada, le nombre de cas de la légionellose observés sur la période 2006-2016 (année de publication des données les plus récentes) était compris entre 0,37 et 1,39 (taux médian : 0,71) pour 100 000 habitants (ASPC, 2019b). Les taux observés aux États-Unis se situaient entre 1,0 et 1,89 (taux médian : 1,18) pour 100 000 habitants pendant la même période (Adams et coll., 2016, 2017). Étant donné que la légionellose est sous‑diagnostiquée et sous-déclarée, celui-ci devrait être beaucoup plus élevé (Castillo et coll., 2016; ASPC, 2018d). Selon une étude multicentrique pancanadienne menée pendant 22 mois, 3,2 % des patients ayant reçu un diagnostic de pneumonie d’origine communautaire (28/850) étaient atteints de la maladie du légionnaire (Marrie et coll., 2003). Une autre étude canadienne ayant examiné la fréquence de la maladie du légionnaire pendant les mois d’été (de mai à octobre) a révélé que 28 % (9/33) des patients chez qui une pneumonie avait été diagnostiquée avaient reçu un résultat positif pour Legionella (Spiegelman et coll., 2020). La légionellose suit un cycle saisonnier particulier, le plus grand nombre de cas étant observé durant l’été et l’automne (Prussin II et coll., 2017, Cuhna et coll., 2016). Les taux d’incidence annuelle de légionellose au Canada et aux États-Unis sont en augmentation (Adams et coll., 2016, 2017; ASPC, 2019b). Les facteurs contribuant à cette augmentation sont un accroissement réel du nombre de cas, la plus grande utilisation des épreuves diagnostiques et une meilleure déclaration des cas (Burillo et coll., 2017).
Vu que les Legionella sont des agents pathogènes intracellulaires, le traitement de la maladie du légionnaire requiert l’utilisation d’antibiotiques capables d’atteindre des concentrations thérapeutiques à l’intérieur des cellules humaines (Fields et coll., 2002; Edelstein et Roy, 2015, Castillo et coll., 2016; Wilson et coll., 2018). Il n’existe aucun vaccin humain contre la maladie (Edelstein et Roy, 2015). La plupart des sujets atteints de fièvre de Pontiac ne tombent pas suffisamment malades pour nécessiter des soins médicaux et aucun traitement antibiotique n’est habituellement requis (Edelstein et Roy, 2015, Castillo et coll., 2016). Les variations d’antibiorésistance des Legionella spp. ne sont pas bien comprises (Wilson et coll., 2018). Les données sur la résistance d’isolats cliniques aux antibiotiques ne sont pas bien documentées en raison de l’absence d’épreuves faciles à réaliser (Wilson et coll., 2018).
B.2.1.2.3 Sources et exposition
Les bactéries du genre Legionella ont deux habitats – un réservoir primaire dans le milieu naturel et un habitat secondaire dans les réseaux conçues pour la distribution de l'eau (NASEM, 2020). Leur développement dans ces habitats a lieu principalement à l’intérieur de protozoaires libres vivant dans les biofilms (Devos et coll., 2005; NASEM, 2020). Des Legionella ont été décelées dans l’eau douce et le sol, y compris les lacs, les rivières, les sédiments et les eaux souterraines dans le monde entier (Fields et coll., 2002; Percival et Williams, 2014e, Burillo et coll., 2017; NASEM, 2020). Les matières fécales humaines et animales ne sont pas considérées comme des sources de Legionella, bien que ces bactéries puissent être détectées dans les selles de personnes infectées présentant des symptômes diarrhéiques. Les animaux peuvent être infectés par Legionella, mais la transmission zoonotique de ces bactéries n’a pas encore été documentée (Surman-Lee et coll., 2007; Edelstein et Roy, 2015).
Comme il a été mentionné précédemment, les bactéries du genre Legionella se multiplient dans les protozoaires (p. ex. les amibes et les ciliés) présents dans les biofilms formés dans les eaux naturelles et les réseaux de distribution d’eau. Parmi ces protozoaires figurent Acanthamoeba (voir B.3.2.1), Hartmanella, Naegleria(voir B.3.2.2), Valkampfia, Vermamoeba (anciennement Hartmanella), Echinamoeba et Tetrahymena (Fields et coll., 2002; Lau et Ashbolt, 2009; Buse et coll., 2012, Percival et Williams, 2014e; NASEM, 2020). Les Legionella peuvent survivre dans ces protozoaires, qui leur offrent une source de nutriments, un milieu protecteur contre les désinfectants et d’autres conditions hostiles (comme des températures élevées) et un moyen de transport (Percival et Williams, 2014e, Buse et coll., 2012; NASEM, 2020). Les Legionella sont aussi capables de survivre dans les biofilms en l’absence de protozoaires hôtes (NASEM, 2020).
Les bactéries Legionella peuvent être présentes dans les réseaux conçues pour la distribution de l'eau et les équipements techniques qui favorisent la croissance des biofilms, notamment les réseaux de distribution d’eau potable, les installations de plomberie des bâtiments et des résidences et les tours de refroidissement (NASEM, 2020). Elles peuvent, en faibles quantités, franchir les barrières de traitement et se développer dans les biofilms des réseaux de distribution, là où les conditions sont favorables. Même si les bactéries Legionella sont rarement détectées dans l’eau potable traitée à la sortie de la station de traitement (King et coll., 2016; Hull et coll., 2017), elles le sont à l’occasion dans les réseaux de distribution d’eau potable (Brooks et coll., 2004; Pryor et coll., 2004; Wang et coll., 2012a; Lu et coll., 2016; Hull et coll., 2017; Waak et coll., 2018; Dias et coll., 2019; LeChevallier, 2019a,b). Cependant, les réseaux de distribution d’eau potable municipaux ne constitueraient pas un réservoir important de Legionella (NASEM, 2020). Il importe de noter qu’il a été démontré que les sédiments des installations de stockage abritent des agents pathogènes opportunistes, notamment Legionella (Lu et coll., 2015; Qin et coll., 2017). Une éclosion de légionellose a été attribuée à une installation de stockage qui présentait une faible concentration de chlore libre résiduel (˂ 0,2 mg/L) (Cohn et coll., 2015).
Les installations de plomberie des bâtiments ainsi que les équipements alimentés par ces celles-ci (p. ex. tours de refroidissement, spas) constituent une préoccupation prioritaire en ce qui concerne le développement de Legionella. Les installations de plomberie de grands complexes, comme celles des hôpitaux, des hôtels, des immeubles d’appartements, des centres communautaires, des bâtiments industriels et des bateaux de croisière, sont d’importantes sources de Legionella. Les installations de plomberie possèdent des caractéristiques particulières pouvant contribuer au développement de Legionella à des concentrations élevées, entre autres, des températures de l’eau plus élevées, des rapports surface/volume plus importants, de longues périodes de stagnation, des pertes de désinfectant résiduel et la présence de nutriments. Des bactéries Legionella ont été détectées dans des bâtiments résidentiels et non résidentiels, dans l’eau froide et l’eau chaude, à des fréquences variables (Alary et Joly, 1991; Stout et coll., 1992; Bates et coll., 2000; Mathys et coll., 2008; Donohue et coll., 2014, 2019b; Bédard et coll., 2015; Dilger et coll., 2016; Collins et coll. transmission entre personnes, par voie oro-fécale, oro-gastrique ou . En général, le système d’approvisionnement en eau chaude, en raison de ses concentrations résiduelles de désinfectant généralement plus faibles et de ses températures plus élevées, tend à favoriser le développement de Legionella. De plus, les sources d’eau froide maintenues à une température supérieure à 25 °C peuvent présenter un risque élevé de colonisation par des bactéries Legionella (Donohue et coll., 2014; Schwake et coll., 2016).
Les tours de refroidissement ou les condenseurs évaporatifs dans les bâtiments et l’industrie représentent aussi une source de préoccupation importante pour le développement de Legionella. Des taux élevés de détection de Legionella, notamment L. pneumophila, ont été signalés dans des tours de refroidissement (Llewellyn et coll., 2017). Les lave-autos, les fontaines décoratives et les brumisateurs pour étalages de supermarché constituent également des sources possibles de Legionella (NASEM, 2020).
Développement
Les Legionella se développent généralement à des températures comprises entre 25 et 45 °C, la plage optimale se situant entre 25 et 35 °C. Les températures de l’eau situées dans cet intervalle sont donc celles qui favorisent le développement optimal du microorganisme (NASEM, 2020). Par ailleurs, les Legionella sont thermotolérantes, c’est-à-dire capables de survivre à des températures élevées comprises entre 55 et 70 °C (Allegra et coll., 2008; Cervero-Aragó, 2015; 2019). Il a été démontré que les Legionella survivaient dans les kystes de protozoaires après une exposition à une température de 80 °C (NASEM, 2020). Les changements climatiques et l’augmentation des températures qui y est associée pourraient être des facteurs propices au développement de Legionella (Cuhna and Cuhna, 2017; MacIntyre et coll., 2018).
Transmission
Les bactéries Legionella se transmettent de l’eau à l’air, c’est-à-dire que l’inhalation d’aérosols (taille des particules entre 2 et 10 µm) contenant les bactéries est le principal mode de transmission (Percival et Williams, 2014e; Castillo et coll., 2016). En général, la consommation d’eau potable n’est pas considérée comme un mode de transmission de Legionella (Percival et Williams, 2014e; Prussin II et coll., 2017). Il est supposé que la microaspiration produite durant l’ingestion d’eau ou associée à certaines conditions ou interventions cliniques constitue une source d’exposition possible (NASEM, 2020). L’inoculation de plaies chirurgicales est une autre voie d’infection moins fréquente (Cuhna et coll., 2016; Burillo et coll., 2017). Les Legionella ne se transmettent habituellement pas entre personnes (Percival et Williams, 2014e; Edelstein et Roy, 2015), bien qu’un cas probable ait été observé (Correia et coll., 2016).
Compte tenu du mode de transmission, les accessoires de tuyauterie et l’équipement (p. ex. pommeaux de douche, robinets, tours de refroidissement, spas, humidificateurs et nébuliseurs, fontaines intérieures) capables de développer des biofilms et de générer des aérosols, représentent des sources potentielles d’exposition à Legionella (NASEM, 2020).
Maladies d’origine hydrique
Les données sur les concentrations de Legionella tirées d’enquêtes épidémiologiques et d’études sur sa présence sont peu nombreuses, ce qui rend difficile l’évaluation de l’étendue du risque lié à Legionella provenant de diverses sources (NASEM, 2020). Les enquêtes épidémiologiques sur la maladie du légionnaire montrent que les éclosions sont le plus souvent liées aux systèmes d’approvisionnement en eau des bâtiments, aux tours de refroidissement et aux installations récréatives telles que les spas (NASEM, 2020). Les catégories de bâtiments les plus fréquemment visées sont les hôtels et les centres de villégiature, les hôpitaux, les établissements de soins de longue durée et les bâtiments industriels (Walser et coll., 2013; Garrison et coll., 2016; Beauté, 2017). Voici quelques éclosions remarquables de la maladie du légionnaire qui ont eu lieu en Amérique du Nord : Brooklyn, New York (2015 : 138 cas, 16 décès), Quincy, Illinois (2015 : 58 cas, 12 décès); comté de Genesee, Michigan (2014-2015 : 87 cas, 12 décès), Québec, Québec (2012 : 182 cas, 13 décès) et Scarborough, Ontario (2005 : 112 cas, 23 décès) (Gilmour et coll., 2007; Levesque et coll., 2014; CDC, 2015a; MDHHS, 2016; Weiss et coll., 2017). La compréhension collective des origines des cas sporadiques de légionellose est limitée. Les systèmes d’approvisionnement en eau des bâtiments résidentiels et non résidentiels semblent contribuer à une proportion substantielle de maladies sporadiques, et les tours de refroidissement sont aussi une source éventuellement importante (Orkis et coll., 2018). Il est toutefois difficile d’établir un lien définitif entre les cas et des sources précises (Orkis et coll., 2018). L’importance des systèmes d’approvisionnement en eau domestique comme source d’infection par Legionella n’est pas claire (Bates et coll., 2000; Prussin II et coll., 2017). Les personnes immunodéprimées présentent un risque plus élevé de contracter la légionellose à partir des installations de plomberie résidentielles contaminées (NASEM, 2020).
Même si le nombre de cas de légionellose atteint son sommet en été et en automne, la déclaration d’une éclosion communautaire de la maladie du légionnaire à Calgary, en Alberta, en novembre et décembre 2012 semble indiquer que la transmission de Legionella peut se produire à la fin de l’automne et en hiver au Canada (Knox et coll., 2017). Les précipitations et l’humidité ont été associées à un risque accru de maladie (Fisman et coll., 2005; Beauté et coll., 2016). D’autres changements dans la saisonnalité pourraient être observés en raison des changements climatiques.
Une revue et une méta-analyse exhaustives des données sur la présence de Legionella tirées d’éclosions, de cas sporadiques et de programmes d’échantillonnage systématique dans divers systèmes d’approvisionnement en eau (tours de refroidissement, stations de traitement des eaux usées, installations récréatives, bâtiments et résidences) ont permis de conclure qu’une concentration de Legionella de 50 000 UFC/L soulève des préoccupations et devrait être considérée comme un seuil d’intervention justifiant le déclenchement de mesures correctives. Un seuil d’intervention plus bas peut être nécessaire pour protéger les personnes présentant un risque plus élevé de légionellose, comme les patients hospitalisés (NASEM, 2020). Les documents de conseils produits par de nombreux organismes varient dans leurs recommandations en matière de seuils d’intervention pour Legionella ou L. pneumophila dans l’eau, notamment pour les tours de refroidissement (plage : > 1 000 à > 1 000 000 UFC/L) et les réseaux d’eau potable (plage : > 1 000 à > 10 000 UFC/L) (NASEM, 2020). Il est nécessaire d’obtenir davantage de données sur les expositions environnementales qui entraînent des maladies afin d’établir des valeurs numériques fondées sur les risques sanitaires liés à Legionella dans l’eau.
B.2.1.2.4 Méthodes d’analyse
Des méthodes standards de détection des Legionella dans l’eau potable sont disponibles (APHA et coll., 2017; ISO 2019; AFNOR, 2021). Le recours à d’autres méthodes pourrait être autorisé dans d’autres administrations. La littérature fournit aussi des renseignements détaillés sur certaines méthodes (Mercante et Winchell, 2015; Wang et coll., 2017, Petricek et Hall, 2018). Les systèmes d’approvisionnement en eau des bâtiments varient considérablement sur le plan de la conception, de la complexité et de la propension à transmettre Legionella. C’est pourquoi la surveillance environnementale de chacune des installations devrait être guidée par une évaluation des risques propres au site dans le cadre d’un plan de gestion de l’eau (HSE, 2013b; CDC, 2017a; ASHRAE, 2018). En général, les programmes de surveillance consistent à surveiller périodiquement la qualité microbiologique générale de l’eau, un indicateur de contrôle du réseau, et à détecter en parallèle la présence de Legionella à intervalles réguliers (HSE 2013a; 2014; 2019; TPSGC, 2016). Jusqu’à présent, la surveillance reposait sur des méthodes fondées sur les cultures (NASEM, 2020). Ces méthodes fournissent une mesure acceptable de la viabilité, mais elles prennent du temps et ne permettent pas de détecter les cellules viables, mais non cultivables (VNC) (Wang et coll., 2017; NASEM, 2020). Les méthodes de PCR quantitative offrent une plus grande spécificité et une plus grande sensibilité, ainsi qu’un délai d’exécution plus court par rapport aux méthodes basées sur les cultures; elles peuvent en outre détecter les cellules VNC (Wang et coll., 2017; NASEM, 2020). L’inconvénient de ces méthodes, c’est qu’elles considèrent tout l’ADN, même celui des cellules mortes (NASEM, 2020). La méthode basée sur les cultures et la méthode de PCR quantitative peuvent toutes deux être appliquées pour établir les valeurs de référence de Legionella, signaler les préoccupations et fournir des informations indiquant le développement, la mort ou les changements de microorganismes dans le système (Wang et coll., 2017; NASEM, 2020). L’électrophorèse sur gel en champ pulsé (EGCP) et le typage par séquençage sont deux approches courantes du sous‑typage moléculaire de Legionella (Raphael et coll., 2016; Mercante et Winchell, 2015). Dans le cas des études épidémiologiques, les méthodes de typage par séquençage sont actuellement les épreuves de référence servant à comparer des isolats de Legionella prélevés dans l’environnement et chez des patients (Gaia et coll., 2005; Mercante et Winchell, 2015; APHA et coll., 2017).
B.2.1.2.5 Traitements
Les conseils généraux décrits dans la partie A sont importants pour la lutte contre Legionella spp. de la source au robinet (Falkinham et coll., 2015b). Les conseils figurant dans la partie A devraient être consultés parallèlement aux renseignements fournis ci-dessous.
Traitement : Lorsqu’elles sont correctement conçues et utilisées, les techniques d’élimination physique – filtration avec procédé chimique, filtration lente sur sable, sur terre de diatomées ou sur membrane ou toute autre technologie éprouvée – permettent de réduire le nombre de bactéries Legionella présentes dans l’eau potable (US EPA, 1989, 2006b; Hijnen et Medema, 2010). Les données d’une étude de l’US EPA réalisée en 2019 semblent indiquer que les Legionella planctoniques (c.-à-d. qui flottent librement) devraient être facilement inactivées par le chlore libre aux valeurs de CT couramment appliquées au cours du traitement de l’eau (voir l’annexe D). Une étude fait état de la détection de Legionella par la méthode PCR quantitative à une installation qui traitait l’eau par la chloramine (King et coll., 2016). Cette détection est un important rappel que la monochloramine ne devrait pas servir à la désinfection primaire, en raison de son faible potentiel d’oxydation (Santé Canada, 2019b). Les bactéries Legionella associées aux films biologiques sont beaucoup plus résistantes à la désinfection (voir la section Réseau de distribution d’eau potable, ci-après). Les données de recherche indiquent que les exigences en matière de dose d’UV sont plus élevées que celles applicables à Giardia et à Cryptosporidium, mais inférieures à celles requises pour de nombreux virus entériques (Hijnen et coll., 2011; Santé Canada, 2019b, 2019c). Il est également nécessaire de limiter efficacement la quantité de protozoaires libres dans l’eau potable (p. ex. Acanthamoeba, Naegleria – voir B.2.2), afin de réduire les populations de Legionella (Loret et Greub, 2010; Thomas et Ashbolt, 2011; NASEM, 2020).
Réseau de distribution d’eau potable : Buse et ses collègues (2019) ont évalué l’effet protecteur que peuvent avoir les biolfilms sur la résistance de Legionella pneumophila aux désinfectants secondaires. Des valeurs de CT ont été déterminées pour Legionella pneumophila souche Philadelphia-1 de sérogroupe 1 lorsque le microorganisme est associé aux biofilms sur un matériau en PVC (voir tableau 3). Comme le montre le tableau 3, le chlore libre est un oxydant plus puissant que la monochloramine. Cependant, les responsables de systèmes de distribution d’eau potable maintiennent habituellement des concentrations résiduelles plus basses avec le chlore libre, ce qui a une incidence considérable sur le temps nécessaire pour inactiver les bactéries Legionella lorsqu’elles sont associées aux biofilms comme l’illustre le tableau 4. Il est donc crucial de maintenir une concentration efficace de désinfectant résiduel dans le réseau de distribution pour réduire le développement de la bactérie Legionella.
| Inactivation logarithmique | Chlore libre (mg∙min/L) | Monochloramine (mg∙min/L) |
|---|---|---|
| 2 log | 8,86 | 17,16 |
| 3 log | 36,11 | 62,80 |
| 4 log | 63,67 | 108,44 |
| Type de désinfectant résiduel | Concentration résiduelle (mg/L) | Temps requis pour obtenir une inactivation de 2 log (minutes) |
|---|---|---|
| Chlore libre | 0,2 | 44,3 |
| Chlore libre | 0,5 | 17,7 |
| Chlore libre | 1,0Note de bas de page a | 8,9 |
| Monochloramine | 1,0 | 17,2 |
| Monochloramine | 1,5 | 11,4 |
| Monochloramine | 1,8Note de bas de page a | 9,5 |
|
||
Les éléments de preuve se contredisent quant à savoir si le chlore libre ou la monochloramine permet de mieux lutter contre Legionella (Donohue et coll., 2019a; LeChevallier, 2019a,b). La monochloramine peut déclencher la formation de kystes par des trophozoïtes d’amibes libres qui ne peuvent pas abriter Legionella et favoriser son développement (Bukhari et coll., 2018). Toutefois, l’utilisation de monochloramine peut augmenter les détections de Mycobacterium spp. (Donohue et coll., 2019a). Il faut poursuivre les recherches afin de déterminer les stratégies optimales pour réduire au minimum les risques liés aux agents pathogènes opportunistes dans les réseaux de distribution d’eau potable et les installations de plomberie des bâtiments (NASEM, 2020). Idéalement, les contrôles sélectionnés pour Legionella devraient présenter des avantages pour l’élimination d’autres agents pathogènes dans les systèmes d’approvisionnement en eau (NASEM, 2020). Les exigences relatives aux désinfectants résiduels nécessaires pour contrôler Legionella dans les réseaux d’eau potable sont en cours d’examen par l’US EPA (US EPA, 2021b).
Les éclosions de légionellose de 2014-15 survenues dans le comté de Genesee, au Michigan, qui ont coïncidé avec la crise de l’eau à Flint, offrent un exemple des conséquences involontaires des changements apportés à l’exploitation de réseaux d’eau potable sur la qualité de l’eau des réseaux de distribution. Un changement de la source d’approvisionnement en eau potable du réseau municipal de Flint a modifié la composition de l’eau et les conditions du réseau de distribution, ce qui a finalement entraîné une réduction du chlore résiduel libre (Zahran et coll., 2018). On a formulé l’hypothèse que cette perturbation de la qualité de l’eau avait stimulé le développement de L. pneumophila dans les systèmes de distribution et de plomberie de Flint et contribué aux éclosions (Zahran et coll., 2018; Garner et coll., 2019).
Plomberie des bâtiments : De nombreuses ressources existent qui décrivent les mesures à prendre pour réduire le risque d’exposition aux Legionella dans les réseaux de distribution des bâtiments. Le Code national du bâtiment du Canada (CNB) (CNRC, 2015a) et le Code national de la plomberie du Canada (CNP) (CNRC, 2015b) énoncent des normes et des dispositions techniques en matière de conception et d’installation respectivement de systèmes de CVC et de circuits de plomberie dans les bâtiments. Tous deux contiennent des dispositions sur la présence des Legionella dans les réseaux et installations des bâtiments. La norme 188 de l’American National Standards Institute et de l’American Society of Heating, Refrigerating, and Air-Conditioning Engineers (ANSI et ASHRAE) (ASHRAE, 2018) fixe des exigences minimales en matière de gestion des risques liés aux Legionella pour les réseaux de distribution d’eau des bâtiments, à l’intention des personnes participant à la conception, à la construction, à l’installation, à la mise en route, à l’exploitation, à la maintenance et à l’entretien de réseaux de distribution d’eau centralisés de bâtiments et de leurs composants. Des documents d’orientation recommandent l’utilisation de plans de gestion de l’eau et de sécurité sanitaire de l’eau pour la gestion des Legionella dans les réseaux de distribution d’eau des bâtiments. Les établissements de soins de santé et de soins de longue durée équipés de tours de refroidissement sont considérés comme des infrastructures nécessitant particulièrement des programmes de gestion de l’eau visant à réduire les risques de développement et de propagation de Legionella (OMS, 2007, HSE 2013a, CDC, 2017a). Des publications destinées à aider les gestionnaires de bâtiments à élaborer des plans de gestion de l’eau et de la sécurité sanitaire de l’eau sont disponibles (OMS, 2007, 2011; HSE, 2013a, 2014; TPSGC, 2016; CDC, 2017a; ASHRAE, 2018). En général, le Comité de gestion de la Legionella dans les réseaux de distribution d’eau de la NASEM recommande d’exiger la mise en place de plans de gestion de l’eau dans tous les édifices publics et de créer des registres associés aux tours de refroidissements, deux mesures stratégiques, qui peuvent améliorer la protection de la santé publique contre l’exposition aux Legionella (NASEM, 2020).
Le Québec a adopté son Code de sécurité des bâtiments en 2013, lequel comprend des règlements en matière de maintenance et d’exploitation des tours de refroidissement (gouvernement du Québec, 2020). Ces règlements décrivent les exigences imposées aux propriétaires, qui doivent déclarer leur réseau auprès de l’autorité de règlementation, mettre en œuvre un plan de gestion de l’eau et effectuer régulièrement des analyses pour détecter la présence de Legionella pneumophila. La ville de Vancouver a également mis à jour ses règlements de bâtiments, ce qui a nécessité des permis d’exploitation, des registres d’entretien et des analyses de détection de Legionella pour les tours de refroidissement, les condenseurs évaporatifs, les pièces d’eau décoratives, les systèmes de collecte d’eau de pluie et autres systèmes d’approvisionnement en eau (Ville de Vancouver, 2021). Des exigences obligatoires pour l’enregistrement des tours de refroidissement sont en place dans la ville de Hamilton depuis 2011 (Ville de Hamilton, 2019).
Pour les installations de plomberie, la gestion de la température, c’est-à-dire l’utilisation de mesures de contrôle visant à maintenir les températures des réseaux de distribution d’eau chaude ou froide en dehors de l’intervalle compris entre 25 et 43 °C, favorable au développement bactérien, est un aspect essentiel de la stratégie de lutte contre Legionella (Bédard et coll., 2016a; Boppe et coll., 2016; NASEM, 2020). Le maintien des réservoirs d’eau chaude à une température minimale de 60 °C est un critère essentiel permettant de réduire la détection de Legionella dans les immeubles (OMS, 2011; HSE, 2014; CNRC 2015b, NASEM, 2020). Le CNP spécifie que le stockage de l’eau à des températures inférieures à 60 °C dans des réservoirs et des réseaux de distribution d’eau chaude peut entraîner le développement de Legionella. Le CNP précise par ailleurs que les chauffe-eaux électriques de type réservoir devraient être préréglés à une température de 60 °C en raison du phénomène de stratification qui se produit dans ce type de chauffe-eau. Ce genre de problème ne touche pas les autres types de chauffe-eaux de conception différente qui utilisent divers combustibles (CNRC, 2015b). Il a été aussi recommandé d’ajuster les régimes thermiques pour atteindre une température supérieure à 55 °C aux extrémités des réseaux, afin de réduire efficacement la prolifération de Legionella dans ces derniers (OMS, 2011; HSE, 2014, NASEM, 2020). Les températures de l’eau chaude exigées pour empêcher le développement de Legionella sont associées à des risques élevés de brulures (CNRC, 2015b; NASEM, 2020). La mise en œuvre de stratégies de gestion de la température de l’eau devrait respecter la règlementation en vigueur en matière de températures maximales acceptables au robinet. Le Code national de la plomberie précise que les robinets d’eau alimentant les pommeaux de douche et les bains à remous devraient être capable de maintenir une température de sortie d’eau ne dépassant pas 49 °C, de manière à limiter les risques de brulures (CNRC, 2015b). Pour respecter les exigences de température, les codes de plomberie imposent l’utilisation de dispositifs comme des robinets mélangeurs thermostatiques pour garantir des températures de l’eau appropriées (NASEM, 2020). Ces dispositifs permettent d’élever la température des chauffe-eau tout en protégeant contre le risque d’ébouillantage au robinet, mais ils offrent également des surfaces sur lesquelles les bactéries Legionella peuvent se fixer et entraîner des températures propices à leur croissance s’ils sont situés trop loin des robinets et des sorties (NASEM, 2020; Singh et coll., 2020). L’impact global de ces dispositifs sur les stratégies de lutte n’est pas clair (NASEM, 2020; Singh et coll., 2020). Les robinets mélangeurs devraient être placés aussi près que possible du point d’utilisation et permettre un accès pour l’entretien et le nettoyage (OMS, 2007, NASEM, 2020). L’élévation temporaire de la température de l’eau, ou choc thermique (p. ex. un choc thermique intense à 70 °C pendant 30 minutes), a été utilisé comme mesure de contrôle dans les réseaux de distribution d’eau de bâtiments. Toutefois, l’efficacité de cette procédure est controversée et celle-ci est considérée comme une mesure d’assainissement extrême (NASEM, 2020).
Pour lutter efficacement contre Legionella, il est également essentiel d’éviter la stagnation de l’eau grâce à une bonne conception du système et à l’utilisation de régimes de rinçage (OMS, 2007, 2011; TPSGC, 2016; ASHRAE, 2018; NASEM, 2020). Il n’existe pas de consensus sur la fréquence de rinçage optimale requise pour atténuer les risques liés à Legionnella (NASEM, 2020; Singh et coll., 2020). L’évaluation des sites dans le cadre d’un plan de gestion de l’eau est recommandée pour orienter et élaborer des stratégies de lutte précises. Les risques de stagnation dans les parties périphériques des installations de plomberie peuvent être réduits au minimum par une utilisation régulière des sorties d’eau (HSE, 2014). Les documents de conseils pour les systèmes d’approvisionnement en eau des bâtiments recommandent de rincer au moins une fois par semaine les canalisations à faible débit, les culs-de-sac/tronçons morts et les raccords ou les sorties d’eau peu utilisés (ECDC, 2017; HSE 2014; CDC, 2021b). Pour les bâtiments comptant un grand nombre de personnes à risque, un rinçage plus fréquent peut être nécessaire, selon l’évaluation du risque (OMS, 2007; HSE, 2014). La prudence est de mise pendant les procédures de rinçage de la plomberie. Le rinçage peut perturber les biofilms et générer des aérosols contaminés contenant des bactéries Legionella (OMS, 2007; Singh et coll., 2020). Il existe des ressources pour élaborer des programmes de rinçage dans les bâtiments (Purdue University, 2020).
L’utilisation de techniques de désinfection sur place peut également être un élément important de la stratégie de lutte contre Legionella appliquée aux réseaux de distribution d’eau des grands immeubles (Bartram et coll., 2007; US EPA, 2016; NASEM, 2020). Diverses techniques de désinfection (chlore libre, monochloramine, dioxyde de chlore, ionisation du cuivre et de l’argent, lumière UV, ozone, techniques de filtration au point d’utilisation [PU] ou au point d’entrée [PE]) se sont montrées relativement efficaces contre Legionella (Bentham et coll., 2007; Exner et coll., 2007; US EPA, 2016; Springston et Yocavitch, 2017; NASEM, 2020). Il est recommandé de demander conseil à un professionnel du traitement de l’eau avant de procéder à une désinfection supplémentaire. Dans les documents de conseils sur la lutte contre Legionella dans les installations de plomberie des établissements de santé, on recommande des cibles minimales de concentrations résiduelles de chlore libre de 0,3 mg/L (Moore et Shelton, 2004; OMS, 2007) à 0,5 mg/L (Gouvernement de l’Australie, 2015) et de monochloramine de 1,5 mg/L (Moore et Shelton, 2004). Des données probantes indiquent que la monochloramine résiduelle est plus efficace que le chlore libre contre Legionella dans les systèmes d’approvisionnement en eau des bâtiments, bien que les raisons de cette performance améliorée ne soient pas totalement claires (NASEM, 2020).
Le choix de toute autre stratégie de lutte requiert une connaissance détaillée de la complexité du système ainsi que de la composition de l’eau et des matériaux dont il est constitué (Bartram et coll., 2007; US EPA, 2016; NASEM, 2020). Les progrès réalisés dans l’équipement de surveillance (p. ex. capteurs de température à moindre coût, potentiel d’oxydoréduction) et dans l’acquisition et l’analyse de données facilitent la mise en œuvre d’un contrôle fondé sur l’état en temps réel des installations de plomberie complexes en vue de cerner et de gérer les risques (Bédard et coll., 2015; Saetta et coll., 2021). Les compteurs d’eau « intelligents » peuvent également fournir des données utiles (p. ex. la consommation d’eau, la température, la direction du débit, la pression).
Pour les propriétaires de maison, les recommandations en matière de lutte contre Legionella dans les habitats individuels préconisent de maintenir une température minimale dans les réservoirs d’eau chaude de 60 °C, conformément aux spécifications du CNP (CNRC 2015b; OMS, 2007; NASEM, 2020). Il est utile de sensibiliser les personnes immunodéprimées aux risques possibles présentés par les équipements domestiques générant des aérosols et favorisant le développement de Legionella (p. ex. les humidificateurs et les nébuliseurs) pour les aider à gérer les risques domestiques associés à ces bactéries (NASEM, 2020).
B.2.1.2.6 Contexte international
L’OMS et l’Australian National Health and Medical Research Council n’ont pas établi de limites pour Legionella dans l’eau potable (OMS, 2017a; NHMRC, NRMMC, 2011). L’US EPA a fixé un objectif de « Maximum Contaminant Level » (MCL ou concentration maximale de contaminants, une recommandation non exécutoire) de zéro Legionella dans l’eau potable dans sa Surface Water Treatment Rule (règlement sur le traitement des eaux de surface) de 1989 (US EPA, 1989). La directive sur l’eau potable de 2020 de l’Union européenne prévoit un seuil d’intervention de 1 000 UFC/L pour Legionella dans les installations de plomberie des bâtiments (Commission européenne, 2020). D’autres recommandations ou normes visant Legionella spp. ont été élaborées au Canada, aux États-Unis et dans d’autres pays en ce qui a trait à l’exploitation et à l’entretien de la plomberie des bâtiments.
B.2.1.3 Mycobacterium spp.
B.2.1.3.1 Description
Le genre Mycobacterium (classe : Actinobacteria) comporte plus de 200 espèces connues. Les bactéries appartenant à ce genre sont variées dans leur capacité à causer des maladies humaines. Certaines sont des agents pathogènes stricts, tandis que d’autres sont non pathogènes ou responsables d’infections non opportunistes. La tuberculose et la lèpre sont deux maladies causées par des espèces de Mycobacterium. Cependant, ces espèces ne présentent pas de risques pour l’eau potable. Les mycobactéries qui préoccupent les fournisseurs d’eau potable sont des espèces communément appelées mycobactéries non tuberculeuses (MNT).
Les MNT regroupent plus de 150 espèces distinctes, considérées comme des agents pathogènes humains opportunistes (Falkinham, 2016a, 2016b). Les membres du complexe Mycobacterium avium – qui englobe M. avium et ses sous-espèces, M. intracellulare et M. chimaera – sont les microorganismes le plus souvent associés à des maladies humaines. D’autres espèces pertinentes sur le plan médical sont M. abscessus, M. chelonae, M. fortuitum, M. gordonae, M. kansasii, M. malmoense et M. xenopi (Nichols et coll., 2004; Hoefsloot et coll., 2013; Falkinham, 2016a).
Les mycobactéries sont des bactéries à Gram négatif, aérobies ou microaérophiles, non motiles, en forme de bâtonnets et ne formant pas de spores. Les espèces sont regroupées en bactéries à croissance rapide et à croissance lente, selon le temps qu’elles mettent à former des colonies en milieu de culture (Cangelosi et coll., 2004; Falkinham, 2015b). En général, les mycobactéries se développent à des températures comprises entre 15 et 45 °C (George et coll., 1980; Cangelosi et coll., 2004). Les températures de développement optimales de chaque espèce varient entre 30 et 45 °C (De Groote, 2004a; Stinear et coll., 2004). Ces bactéries sont relativement résistantes à la chaleur et capables de survivre à des températures supérieures à 50 °C (Schulze-Robbecke et Buchholtz, 1992; Falkinham, 2016a). Les mycobactéries peuvent utiliser de nombreuses substances comme sources de nutriments et survivre sur des substrats très simples (Kaur, 2014). Toutes les mycobactéries possèdent une paroi cellulaire épaisse et riche en lipides qui les rend relativement imperméables aux composés hydrophiles. Cette paroi confère aussi à ces bactéries une résistance accrue aux milieux acides ou alcalins, aux désinfectants et aux antibiotiques.
B.2.1.3.2 Effets sur la santé
Les espèces de MNT causent un large spectre de maladies chez l’humain (Whiley et coll., 2012), mais ces maladies sont rares chez les personnes en bonne santé. Les infections à MNT surviennent surtout chez les sujets immunodéprimés ou atteints d’affections respiratoires sous‑jacentes. Les facteurs de risque des maladies à MNT varient selon le type de maladie.
La maladie pulmonaire est la forme la plus courante de maladie associée à la MNT (Griffith et coll., 2007; Sharma et Upadhyay, 2020). Il existe deux formes de maladie pulmonaire à MNT. La première forme, plus classique, se manifeste par des lésions cavitaires chez les adultes atteints d’une affection pulmonaire sous-jacente (De Groote, 2004b). La maladie a tendance à se déclarer plus fréquemment chez les hommes âgés fumeurs ou alcooliques de longue date ou présentant des lésions pulmonaires associées à une exposition professionnelle à des poussières, ainsi que chez les personnes atteintes d’affections pulmonaires chroniques (p. ex. la mucoviscidose, le cancer du poumon ou la maladie pulmonaire obstructive chronique) (De Groote, 2004b; Falkinham, 2015c). La deuxième forme de la maladie se caractérise par une inflammation des bronches accompagnée de nodules et s’observe chez les personnes qui ne présentent pas de facteurs de risque classiques ni d’affection sous-jacente (De Groote, 2004b). La maladie a tendance à survenir plus fréquemment chez les femmes âgées non fumeuses (De Groote, 2004b; Falkinham, 2015c). Les caractéristiques communes aux deux maladies sont la toux persistante, une asthénie et des sueurs nocturnes (De Groote, 2004b; Falkinham, 2015c). Les taux d’attaque et le délai d’apparition des symptômes de la maladie pulmonaire demeurent inconnus. Au diagnostic, les infections peuvent être difficiles à distinguer d’une maladie respiratoire générale et les patients peuvent présenter un long historique de symptômes (p. ex. des mois à des années) avant de recevoir un diagnostic de maladie causée par des mycobactéries (Falkinham et coll., 2015b). La pneumopathie d’hypersensibilité, une forme de maladie pulmonaire qui se caractérise par une inflammation du poumon attribuable à la réponse immunitaire de l’organisme aux antigènes de mycobactéries, a également été associée à l’exposition aux MNT (Whiley et coll., 2012; Adjemian et coll., 2018).
Les MNT peuvent aussi provoquer des infections touchant des foyers extrapulmonaires, comme les ganglions lymphatiques, la peau et les tissus mous, la circulation sanguine et d’autres régions du corps (Whiley et coll., 2012; Sherma et Upadhyay, 2020). La lymphadénite cervicale causée par les MNT est une maladie infantile, qui se traduit par un gonflement des ganglions lymphatiques de la tête ou du cou (Bayazit et coll., 2004; von Reyn et coll., 2004). La majorité des cas sont observés chez les enfants de 18 mois à 5 ans par ailleurs en bonne santé (von Reyn et coll., 2004; Falkinham, 2015c). Il semble que l’éruption des dents jouerait un rôle dans l’acquisition de la maladie par ce groupe d’âge (Bayazit et coll., 2004; Falkinham, 2015c). Les facteurs de risque particuliers de la maladie chez les enfants ne sont pas clairs (von Reyn et coll., 2004). Les infections de la peau et des tissus mous provoquées par les MNT vont de simples lésions ou nodules cutanés localisés à des ulcérations ou des nécroses généralisées (Percival et Williams, 2014f). Les infections du tractus gastro-intestinal sont courantes chez les personnes atteintes du syndrome d’immunodéficience acquise (SIDA) (von Reyn et coll., 2004). Chez les personnes immunodéprimées, les infections liées aux MNT peuvent se propager à diverses parties du corps, comme les articulations, la peau, le sang, le foie et le cerveau (Percival et Williams, 2014f). La bactériémie associée aux MNT est une infection fréquente et potentiellement mortelle chez les individus infectés par le virus de l’immunodéficience humaine (VIH) ou atteints du SIDA (Falkinham, 2015c). M. paratuberculosis, une sous-espèce de M. avium appartenant aux MNT, est suspectée comme étant une des causes de la maladie de Crohn, bien qu’aucune donnée concluante ne le prouve (Waddell et coll., 2015; 2016). Parmi les facteurs de risque des maladies non pulmonaires liées aux MNT figurent d’autres comorbidités résultant d’une insuffisance immunitaire, comme des troubles immunologiques sous-jacents et l’infection par le VIH, de même que des lésions ou des interventions susceptibles de provoquer une infection par trauma (Adjemian et coll., 2018). Les doses infectantes des espèces de MNT restent inconnues (Stout et coll., 2016; Hamilton et coll., 2017; Adjemian et coll., 2018). Les taux de mortalité associés à des cas de maladies causées par les MNT sont mal connus (Adjemian et coll., 2018). Aux États-Unis, le taux de mortalité global associé aux maladies causées par les MNT a été estimé à 2,3 décès pour 1 million d’habitants par année (Vinnard et coll., 2016).
L’incidence des maladies associées aux MNT au Canada est inconnue, car ce ne sont pas des maladies à déclaration obligatoire. En Ontario, les taux annuels de maladies pulmonaires liées aux MNT ont été estimés à 9,7 à 10,7 cas pour 100 000 habitants sur la période 2006-2010 (Marras et coll., 2013). Aux États-Unis, les infections à MNT ne sont des maladies à déclaration obligatoire que dans un petit nombre d’États (Donohue et Wymer, 2016; Adjemian et coll., 2018). Donohue et Wymer (2016) ont signalé que, dans cinq États (Maryland, Mississippi, Missouri, Ohio et Wisconsin), le taux annuel moyen de cas d’infection par les MNT de tout type (pulmonaire et extrapulmonaire) variait de 8,7 à 13,9 cas pour 100 000 habitants sur la période 2008-2013. Des études populationnelles ont révélé que les cas d’infection pulmonaire peuvent représenter environ 77 à 93 % des cas d’infection à MNT déclarés (Cassidy et coll., 2009; Donahue et Wymer, 2016). Des données semblent indiquer que la prévalence des maladies pulmonaires liées aux MNT est en constante augmentation en Amérique du Nord et dans d’autres pays du monde (Marras et coll., 2013; Donohue et Wymer, 2016; Stout et coll., 2016, Adjemian et coll., 2018). Il existe peu de données sur la prévalence de maladies extrapulmonaires associées aux MNT en Amérique du Nord. Dans des études américaines, on estime que le taux d’incidence des maladies extrapulmonaires varie entre 1,5 et 1,9 cas pour 100 000 habitants (Cassidy et coll., 2009; Henkle et coll., 2017, Adjemian et coll., 2018). Il existe peu de données sur les répercussions des facteurs saisonniers ou climatiques sur les infections à MNT (Falkinham, 2004; Adjemian et coll., 2018).
Les MNT résistent à de nombreux antibiotiques couramment utilisés. Le traitement habituel de ces maladies nécessite une combinaison d’antibiotiques, parmi lesquels la clarithromycine, l’arithromycine et la rifampine (Percival et Williams, 2014f; Falkinham, 2015c, Halstrom et coll., 2015).
B.2.1.3.3 Sources et exposition
Les MNT sont naturellement présentes dans le sol et les habitats aquatiques, tels que les eaux marines, les lacs, les rivières, les ruisseaux, les eaux souterraines et les marais. Les sols, en particulier les sols acides et riches en tourbe sont les principaux réservoirs de ces bactéries (Falkinham, 2016b). Les MNT sont généralement présentes en moins grande quantité dans les eaux souterraines que dans les eaux de surface (Falkinham, 2015c). Les boues d’eaux usées et d’égouts peuvent en contenir d’importantes quantités de MNT (Radomski et coll., 2011; Percival et Williams, 2014f). Les réseaux conçues pour la distribution de l'eau (p. ex. réseaux de distribution d’eau potable et plomberie des bâtiments) et les équipements alimentés par les installations de plomberie (p. ex. humidificateurs, spas, piscines) sont d’importantes sources de MNT. Ces systèmes et équipements fournissent aux bactéries des nutriments, des températures optimales et des conditions de protection contre les désinfectants leur permettant de se proliférer. Les mycobactéries sont parfaitement adaptées pour vivre dans ces environnements en raison de leur capacité à se développer en présence de faibles quantités de nutriments et d’oxygène, de leur résistance aux désinfectants, de leur thermorésistance et de leur capacité à survivre et à se développer dans des biofilms et des protozoaires libres (Falkinham, 2015a).
Les bactéries Mycobacterium spp. ont été souvent détectées, par culture ou par la méthode PCR quantitative, dans l’eau potable traitée et, à des fréquences variables, dans les réseaux de distribution d’eau potable (Le Dantec et coll., 2002; Hilborn et coll., 2006; Wang et coll., 2012a; Thomson et coll., 2013; Holinger et coll., 2014; Whiley et coll., 2014; Lu et coll., 2016; King et coll., 2016; Hull et coll., 2017; Dias et coll., 2019; Gora et coll., 2020). Les mycobactéries peuvent être aussi présentes et en concentrations similaires dans les réseaux de distribution municipaux utilisant de l’eau souterraine ou de surface, malgré des concentrations généralement différentes à la source (voir ci-dessus) (Covert et coll., 1999; Lu et coll., 2015). Les sédiments dans les installations de stockage de l’eau potable sont également connus pour abriter Mycobacterium spp. (Lu et coll., 2015; Qin et coll., 2017).
Les installations de plomberie des bâtiments constituent un milieu préoccupant pour le développement des MNT. Ces microorganismes ont été détectés dans des immeubles résidentiels et non résidentiels, dans l’eau froide et l’eau chaude du robinet, à des fréquences variables (Hilborn et coll., 2006; Feazel et coll., 2009; Wang et coll., 2012a; Holinger et coll., 2014; Dias et coll., 2019; Donohue et coll., 2019b; Lande et coll., 2019; Gora et coll., 2020). Les taux de contamination par des MNT sont plus élevés dans les bâtiments dotés de boucles de recirculation d’eau chaude (p. ex. les hôpitaux, les condominiums et les immeubles d’appartements) que dans les résidences privées (Falkinham, 2015b; Li et coll., 2017). Des MNT ont été isolées de raccords de plomberie de bâtiments et d’équipement alimenté par des installations de plomberie, notamment des robinets, des pommeaux de douche, des cuves thermales/spas, des distributrices de glace, des piscines, des bains de pied et des nébuliseurs médicaux (Percival et Williams, 2014f; Nichols et coll., 2004). Gebert et ses collègues (2018) ont signalé que les mycobactéries étaient beaucoup moins abondantes dans les pommeaux de douche des maisons américaines dont l’eau provenait de puits privés par rapport à celles approvisionnées en eau municipale.
Transmission
L’inhalation d’aérosols est la principale voie de transmission des maladies pulmonaires à MNT (De Groote, 2004b; Halstrom et coll., 2015). Les installations de plomberie des bâtiments sont la source la plus crédible d’exposition aux aérosols (De Groote et coll., 2004b; Halstrom et coll., 2015). Les sols et la poussière ont également été identifiés comme des sources potentielles d’aérosols (Adjemian et coll., 2018; Halstrom et coll., 2015). L’ingestion d’eau contaminée est considérée comme une voie de transmission possible qui est à l’origine d’infections gastro‑intestinales chez les patients infectés par le VIH ou atteints du SIDA (von Reyn et coll., 2004; Corti et Palmero, 2008) et de la lymphadénite cervicale chez les enfants (Bayazit et coll., 2004; Falkinham, 2015c). Dans le cas des infections à MNT touchant la peau, les tissus mous et d’autres parties du corps (p. ex. le sang, les articulations, les os, les organes), la transmission se produit à la suite de lésions ou d’interventions (médicales, cosmétiques) qui exposent la partie du corps à de l’eau, du sol ou des dispositifs médicaux contaminés, ou elle résulte d’infections disséminées chez des sujets immunodéprimés (De Groote et Johnson, 2004; von Reyn et coll., 2004; Piersimoni et Scarparo, 2009; Falkinham, 2015b; Sharma et Upadhyay, 2020). La transmission indirecte entre personnes (par l’intermédiaire d’objets contaminés) peut constituer un mode de contamination présentant un risque pour les personnes atteintes de mucoviscidose (Bryant et coll., 2013; Bryant et coll., 2016, Sood et Parrish, 2017). M. avium ssp.paratuberculosis se transmet par voie oro‑fécale chez les bovins. Cependant, le rôle pathogène de cet organisme dans les maladies humaines et les sources possibles de contamination font l’objet d’un débat considérable (Harris et Barrletta, 2001; Waddell et coll., 2016). En général, la transmission de l’animal à l’humain n’est pas considérée comme une voie d’exposition importante (Whiley et coll., 2012; Falkinham, 2015c).
Maladies d’origine hydrique
Il est difficile de déterminer les voies de transmission et les sources d’infections précises des MNT, car ces microorganismes sont omniprésents dans les milieux aqueux et les maladies qui leur sont associées ont de longues périodes d’incubation (Nishiuchi et coll., 2017; Adjemian et coll., 2018). La vérification des sources d’infection requiert l’identification d’un génotype identique entre des isolats cliniques et environnementaux (Halstrom et coll., 2015; Nishiuchi et coll., 2017; Ratnatunga et coll., 2020). Les infections à MNT sont généralement sporadiques. La plupart des éclosions associées aux MNT ont été liées à des installations de loisirs aquatiques traitées (piscines, spas) ou à des interventions médicales ou cosmétiques (De Groote et coll., 2004; De Groote et Johnson, 2004). Aucune éclosion de maladies liées à la consommation de l’eau potable par des MNT n’a été observée au Canada ou aux États-Unis (CDC, 2013, 2015b, 2017d).
Les MNT sont particulièrement problématiques dans les systèmes d’approvisionnement en eau des établissements de santé, car elles provoquent diverses maladies. Li et ses collègues (2017) ont procédé à une revue systématique des infections à MNT d’origine hydrique dans les établissements de soins de santé. Des éclosions d’infections à mycobactéries ont été observées dans divers milieux, notamment dans des unités d’hôpital réservées aux personnes hospitalisées, des cliniques de soins ambulatoires, des centres d’hémodialyse et des salles d’opération. Les types de maladies mycobactériennes variaient selon la voie d’exposition. La circulation sanguine, les voies respiratoires, les tissus mous et d’autres foyers précis liés aux interventions chirurgicales faisaient partie des foyers d’infection signalés (Li et coll., 2017). Les voies de transmission les plus fréquentes étaient l’exposition de cathéters ou de plaies chirurgicales à des approvisionnements en eau contaminée et les expositions à de l’eau non stérile lors d’interventions médicales (Li et coll., 2017).
Les installations de plomberie résidentielles ont aussi été proposées comme une source importante d’exposition aux MNT (Whiley et coll., 2012; Halstrom et coll., 2015). Des infections pulmonaires à MNT ont été associées à une exposition à des aérosols provenant d’approvisionnements domestiques en eau potable et de spas résidentiels (Halstrom et coll., 2015). Des infections cutanées à MNT liées à l’utilisation de spas résidentiels ont également été signalées (Whiley et coll., 2012). Des cas d’infection extrapulmonaire à MNT liés à l’utilisation d’eau ont été déclarés dans d’autres milieux : bains de pieds dans un salon de manucure, nettoyage d’aquarium à domicile et salons de tatouage (Halstrom et coll., 2015; Griffin et coll., 2019). Les résultats de surveillance des installations de plomberie dans les bâtiments résidentiels et non résidentiels montrent qu’il existe des possibilités d’exposition humaine aux MNT, mais que d’autres facteurs (p. ex. aérosols et hôte) sont nécessaires pour que la maladie se transmette (Donohue et coll., 2019b).
B.2.1.3.4 Méthodes d’analyse
Des méthodes d’isolement et de détection basée sur la culture de Mycobacterium spp. prélevés dans l’eau potable ont été décrites. Cependant, il n’existe actuellement aucune méthode d’analyse normalisée (APHA et coll., 2017). Les genres et espèces des isolats peuvent être identifiés à l’aide de méthodes PCR ou par séquençage de l’ADN (Stinear et coll., 2004; Falkinham, 2015c). L’identification des sous-espèces et des souches nécessite l’utilisation de techniques moléculaires plus avancées (Stinear et coll., 2004; Falkinham, 2015c). La littérature fournit des renseignements détaillés sur des méthodes spécifiques (Stinear et coll., 2004; Thomson et coll., 2008; Wang et coll., 2017).
B.2.1.3.5 Traitements
Les conseils généraux décrits dans la partie A sont importants pour la lutte contre Mycobacterium spp. de la source au robinet (Falkinham et coll., 2015b). Les conseils figurant dans la partie A devraient être consultés parallèlement aux renseignements fournis ci-dessous.
Traitement : Lorsqu’elles sont correctement conçues et utilisées, les techniques d’élimination physique – filtration avec procédé chimique, filtration lente sur sable, sur terre de diatomées ou sur membrane ou toute autre technologie éprouvée – permettent de réduire le nombre de mycobactéries présentes dans l’eau potable (LeChevallier et coll., 2001; Le Dantec et coll., 2002; LeChevallier, 2004). Cependant, des caractéristiques spécifiques des mycobactéries, telles que leur hydrophobie et leur charge superficielle, influent de différentes manières sur les procédés de traitement (LeChevallier, 2004; Wong et Shin, 2015). En raison de leur paroi cellulaire très hydrophobe, les mycobactéries ont une forte tendance à se fixer à des particules (LeChevallier, 2004). Des corrélations entre l’abaissement de la turbidité et l’élimination des mycobactéries ont été mises en évidence (Falkinham et coll., 2001; Wong et Shin, 2015). L’utilisation de filtres à CAG peut offrir des conditions (accumulation de nutriments et neutralisation des désinfectants résiduels) favorisant le développement des mycobactéries (Le Dantec et coll., 2002; LeChevallier, 2004).
Les mycobactéries sont très résistantes aux désinfectants chimiques couramment utilisés. Les différentes espèces et souches présentent des sensibilités aux désinfectantes très variables (Taylor et coll., 2000; OMS, 2004) et les valeurs de CT observées diffèrent selon les chercheurs (OMS, 2004). Les valeurs de CT relevées par Taylor et ses collègues (2000) pour le chlore libre (51 à 1 552 mg∙min/L, voir l’annexe D) seraient techniquement difficiles à atteindre dans une station de traitement. Jacangelo et ses collègues (2002) ont observé que l’inactivation de Mycobacterium fortuitum nécessitait des valeurs de CT pour l’ozone égales ou supérieures à celles requises pour Cryptosporidium.
Les doses d’UV nécessaires pour inactiver les microorganismes du complexe Mycobacterium avium peuvent s’avérer supérieures à celles exigées pour Giardia et Cryptosporidium et comparables à celles applicables à certains virus entériques. Il a été constaté que l’inactivation de certaines souches de M. avium et M. fortuitum nécessitait des doses d’UV comparables à celles requises pour les adénovirus (Gerba et coll., 2003; Schiavano et coll., 2018).
Même en présence d’un traitement et d’une désinfection efficaces, les MNT présentent une forte tolérance à la désinfection et peuvent s’infiltrer dans les réseaux de distribution et les circuits de plomberie en faibles quantités.
Réseau de distribution d’eau potable : Des études à échelle réelle laissent croire que le chlore libre est plus efficace que la monochloramine comme désinfectant secondaire pour lutter contre les mycobactéries (Pryor et coll., 2004; Wang et coll., 2012a; Rhoads et coll., 2017; Donohue et coll., 2019b). La monochloramine peut permettre de limiter davantage la formation de biofilms sur certains matériaux constituant les canalisations, comme les surfaces en fer rouillées (Norton et coll., 2004).
Plomberie des bâtiments : Des documents d’orientation recommandent l’utilisation de plans de gestion de l’eau et de sécurité sanitaire de l’eau pour prévenir le développement de mycobactéries dans les réseaux de distribution d’eau des bâtiments (OMS, 2007). Des ressources offrant des renseignements à l’intention des gestionnaires d’édifices sont disponibles (OMS, 2007; 2011). Dans les établissements de soins de santé, la lutte contre les mycobactéries s’insèrera dans des plans de gestion visant à réduire les risques associés aux Legionella (Ford et coll., 2004). Cependant, il faut reconnaître que les mycobactéries et les Legionella présentent des sensibilités différentes aux désinfectants utilisés dans l’eau potable (Jacangelo et coll., 2002, Pryor et coll., 2004; Moore et coll., 2006b).
Des stratégies supplémentaires de lutte contre les mycobactéries ont été décrites et ont consisté en des désinfections par surébullition et rinçage à l’eau chaude à des températures supérieures à 50 à 70 °C, en l’application de diverses méthodes de désinfection (hyperchloration au chlore libre et emploi du dioxyde de chlore) et en l’utilisation de techniques de filtration sur membrane au point d’utilisation (LeChevallier, 2004; Sebakova et coll., 2008; Williams et coll., 2011; Hsu et coll., 2016). Entre autres mesures s’inscrivant dans un plan de gestion de la sécurité sanitaire de l’eau, il est aussi recommandé de procéder au nettoyage et à l’entretien réguliers des raccords de plomberie et de l’équipement pouvant favoriser le développement de biofilms et la formation d’aérosols (robinets, pommeaux de douche, cuves thermales/spas et tours de refroidissement) (Ford et coll., 2004).
Pour les propriétaires de maisons, il a été recommandé de maintenir la température des réservoirs d’eau chaude à des valeurs conformes aux spécifications du CNP en matière de lutte contre les Legionella (c.-à-d. 60 °C minimum) (CNRC, 2015b) dans le cadre d’une stratégie générale visant à réduire au minimum les risques d’exposition à des agents pathogènes opportunistes dans les installations de plomberie domestiques (OMS, 2011; Falkinham et coll., 2015a, 2015b; NASEM, 2020).
B.2.1.3.6 Contexte international
L’OMS, l’UE, l’US EPA ou l’Australian National Health and Medical Research Council n’ont émis aucune recommandation en ce qui a trait à la présence de Mycobacterium spp. dans l’eau potable (NHMRC, NRMMC, 2011; OMS, 2017a; Commission européenne, 2020; US EPA, 2021a).
B.2.1.4 Pseudomonas spp.
B.2.1.4.1 Description
Le genre Pseudomonas (classe : Gammaproteobacteria) comprend plus de 30 espèces (Chakravarty et Anderson, 2015). Pseudomonas aeruginosa, l’espèce la plus pertinente sur le plan clinique, est un agent pathogène opportuniste pouvant causer diverses infections chez l’humain (Chakravarty et Anderson, 2015; Daniels et Gregory, 2015). D’autres espèces ( P. fluorescens, P. putida et P. stutzeri) ont été rarement observées dans des infections humaines (Chakravarty et Anderson, 2015).
Les Pseudomonas spp. sont des bactéries à Gram négatif, aérobies strictes, motiles en forme de bâtonnets droits ou légèrement incurvés, qui se développent à des températures comprises entre 4 et 42 °C (températures optimales : 28 à 37 °C) (Moore et coll., 2006a; Chakravarty et Anderson, 2015). Elles possèdent un métabolisme polyvalent et sont capables d’utiliser de nombreuses substances comme sources de nutriments et de survivre avec peu de nutriments (Chakravarty et Anderson, 2015; Falkinham et coll., 2015a). Les Pseudomonas spp. sont également remarquables par leur capacité à se fixer à des biofilms ou à en former dans les milieux aqueux (Bédard et coll., 2016b).
B.2.1.4.2 Effets sur la santé
P. aeruginosa cause des maladies à la suite de leur prolifération dans l’organisme de patients présentant des facteurs de prédisposition (p. ex. immunodépression, maladie sous-jacente, lésion traumatique ou intervention médicale) les rendant plus vulnérables aux infections (Chakravarty et Anderson, 2015). Les voies respiratoires sont les sites les plus fréquents d’infection humaine. Les symptômes de l’infection à P. aeruginosa sont la fièvre, des frissons, de la toux et une respiration difficile. Leur apparition peut être soudaine et grave (Daniels et Gregory, 2015). Les patients atteints de mucoviscidose sont particulièrement à risque d’infection respiratoire par P. aeruginosa et celles-ci sont une cause majeure de morbidité et de mortalité chez ces individus (Chakravarty et Anderson, 2015). P. aeruginosa est une cause principale d’infections touchant la peau, les yeux, les oreilles et l’appareil urinaire (Chakravarty et Anderson, 2015; Daniels et Gregory, 2015). Les bactériémies résultant d’infections des poumons, de la peau ou de l’appareil urinaire peuvent se traduire par une propagation des bactéries à d’autres parties du corps. Des taux de mortalité élevés ont été observés chez des individus très vulnérables atteints d’une septicémie liée à P. aeruginosa (Chakravarty et Anderson, 2015; Daniels et Gregory, 2015). Les individus à risque élevé d’infections sont les personnes : immunodéprimées (p. ex. les patients atteints de neutropénie ou du VIH ou du SIDA); présentant des maladies sous-jacentes (mucoviscidose, diabètes, maladie pulmonaire chronique); recevant des soins utilisant des dispositifs médicaux effractifs (cathéters vasculaires et urinaires, respirateur artificiel, tubes endotrachéaux); ou ayant des défenses immunitaires affaiblies à la suite de brulures ou de traumatismes par pénétration (incisions chirurgicales, plaies) (Daniels et Gregory, 2015). Les doses de P. aeruginosa pouvant provoquer une infection par les différentes voies de transmission sont mal connues (Roser et coll., 2014). Les infections par P. aeruginosa chez les personnes en bonne santé sont rares.
Les infections par Pseudomonas ne sont pas des maladies à déclaration obligatoire en Amérique du Nord et dans la plupart des pays du monde. Un examen des éclosions associées aux systèmes d’approvisionnement en eau dans des établissements de soins de santé a permis de déterminer que les types d’infection le plus souvent attribués à Pseudomonas sont les infections du sang, des poumons et des voies urinaires (Kanamori et coll., 2016). Les infections cutanées sont responsables de la vaste majorité des éclosions à Pseudomonas liées à des installations de loisirs aquatiques qui utilisent de l’eau traitée aux États-Unis, les hôtels étant les principaux établissements (Hlavsa et coll., 2018).
Le traitement des infections par P. aeruginosa est difficile en raison de l’antibiorésistance accrue de ces bactéries (Falkinham et coll., 2015a). Certaines souches se sont avérées résistantes à tous ou presque tous les antibiotiques, notamment les bêta-lactamines, les fluoroquinolones et les carbapénèmes de dernière génération (CDC, 2019a). P. aeruginosa multirésistante a été classée comme étant des « Menaces Graves » par les CDC et comme devant faire l’objet d’une gestion prioritaire des risques par l’ASPC (CDC, 2019a; Garner et coll., 2015). P. aeruginosa résistante aux carbapénèmes en particulier a été considérée par l’OMS comme des cibles prioritaires dans la conception de nouveaux traitements antibiotiques (OMS, 2017b).
B.2.1.4.3 Sources et exposition
Les Pseudomonas spp. sont des bactéries ubiquitaires, présentes dans une grande variété d’habitats, notamment le sol, les milieux aquatiques (eau de surface douce ou marine, eaux souterraines, sources d’eau potable) et la végétation (Falkinham et coll., 2015a; Degnan, 2006). Les matières fécales humaines et animales ne sont pas des sources importantes de ces bactéries. Cependant, celles-ci sont présentes en grand nombre dans les eaux d’égout et les eaux usées (Degnan, 2006). La plomberie des bâtiments et l’équipement alimenté par celle-ci fournissent aux bactéries P. aeruginosa des habitats aux conditions propices (nutriments, température optimale, protection contre les désinfectants) leur permettant de proliférer (Bédard et coll., 2016b). Les systèmes d’approvisionnement en eau des hôpitaux et d’autres établissements de soins de santé sont des sources importantes de P. aeruginosa (Bédard et coll., 2016b). Des réservoirs confirmés situés dans ces établissements sont les robinets d’eau potable, les conduits d’évacuation des lavabos et douches, les humidificateurs, les bains chauds et les bassins d’hydrothérapie et de baignade (Falkinham, 2015a; Bédard et coll., 2016b). Dans les établissements communautaires, les spas et les piscines peuvent aussi constituer d’importantes sources d’infection (Bédard et coll., 2016b).
P. aeruginosa peut se transmettre par contact entre personnes ou contact direct avec des objets ou de l’eau contaminés (Falkinham, 2015a; Bédard et coll., 2016b). La consommation d’eau potable n’est pas considérée comme un mode d’infection (Bédard et coll., 2016b).
Des études utilisant des méthodes de détection moléculaires et basées sur la culture des bactéries ont permis de découvrir que P. aeruginosa était détectée sporadiquement dans de l’eau traitée à sa sortie de la station de traitement et dans des échantillons d’eau et de sédiments prélevés sur des réseaux de distribution d’eau potable (Wingender et Flemming, 2004; Van der Wielen et Van der Kooij, 2013; Lu et coll., 2015, 2016; Dias et coll., 2019) et pouvait être plus fréquemment détectée dans des échantillons provenant d’installations de plomberie domestiques (Reuter et coll., 2002; Rogues et coll., 2007; Lavenir et coll., 2008; Van der Wielen et Van der Kooij, 2013; Charron et coll., 2015). Il est suggéré que le développement de populations de P. aeruginosa dans des biofilms se formant dans les circuits de plomberie domestiques ou les raccords de plomberie explique la détection de plus grandes quantités de ces bactéries dans ces échantillons (Bédard et coll., 2016b). Dans les biofilms, les bactéries Pseudomonas peuvent survivre et se développer après l’ingestion par des amibes libres, telles que Acanthamoeba spp. (voir B.3.2.1) (Thomas et Ashbolt, 2011; Bédard et coll., 2016b). L’environnement protecteur et les nutriments fournis par cette interaction peuvent contribuer à la survie et à la dispersion accrues de P. aeruginosa dans les réseaux de distribution d’eau potable et les installations de plomberie domestiques (Thomas et Ashbolt, 2011). Aucune éclosion liée à la contamination de l’eau potable par des P. aeruginosa n’a encore été consignée (CDC, 2004, 2006, 2008, 2011, 2013, 2015b, 2017d).
B.2.1.4.4 Méthodes d’analyse
Des méthodes standards de détection des Pseudomonas spp. dans l’eau potable sont disponibles (APHA et coll., 2017; ISO, 2019). La littérature fournit aussi des renseignements détaillés sur certaines méthodes (Wang et coll., 2017). Les Pseudomonasspp. sont des bactéries hétérotrophes détectées par NPBH. Cependant, il n’existe aucune corrélation directe entre les résultats de la NPBH et les concentrations de Pseudomonas aeruginosa.
B.2.1.4.5 Traitements
Les conseils généraux décrits dans la partie A sont importants pour la lutte contre Pseudomonas spp. de la source au robinet (Falkinham et coll., 2015a; Bédard et coll., 2016b). Les conseils figurant dans la partie A devraient être consultés parallèlement aux renseignements fournis ci-dessous.
Traitement : Lorsqu’elles sont correctement conçues et utilisées, les méthodes d’élimination physique – filtration avec procédé chimique, filtration lente sur sable, sur terre de diatomées ou sur membrane ou toute autre technologie éprouvée – et de désinfection primaire – basées sur l’utilisation de chlore, de dioxyde de chlore, d’ozone ou d’UV – couramment utilisées dans le traitement de l’eau potable s’avèrent très efficaces pour éliminer ou inactiver P. aeruginosa (LeChevallier et Au., 2004; Clauβ, 2006; Xue et coll., 2013; Behnke et Camper, 2012, Zuma et coll., 2009; Garvey et coll., 2014; Zhang et coll., 2015). Pour l’inactivation de P. aeruginosa, les exigences en matière de CT pour le chlore sont inférieures à celles requises pour l’inactivation des nombreux virus entériques et les exigences concernant les doses d’UV sont inférieures à celles applicables aux protozoaires entériques Giardia et Cryptosporidium (Clauβ, 2006; Xue et coll., 2013; Santé Canada, 2019b, 2019c). La monochloramine ne devrait pas être utilisée pour la désinfection primaire, en raison de son faible potentiel d’oxydation; elle est recommandée uniquement pour la désinfection secondaire (c.-à-d. pour maintenir une concentration résiduelle de désinfectant dans le réseau de distribution) (Santé Canada, 2019b).
Réseau de distribution d’eau potable : La résistance à la chloration varie selon les souches et les effets protecteurs offerts par les biofilms (Bédard et coll., 2016; Mao et coll., 2018). Des études de laboratoire et pilotes semblent indiquer que le maintien de concentrations de chlore libre résiduel au-dessus de 0,3 mg/l est utile pour empêcher le développement de Pseudomonas spp. dans l’eau libre (Wang et coll., 2012b; Mao et coll., 2018). Mao et ses collègues (2018) ont mis en évidence qu’une exposition continue et de longue durée à une concentration efficace de chlore résiduel libre est importante pour prévenir la réapparition de Pseudomonas et le développement de nouvelles souches résistantes. Il est nécessaire d’étudier davantage les effets des désinfectants à base de chlore sur P. aeruginosa dans l’eau des circuits de plomberie domestiques et les biofilms (Bédard et coll., 2016).
Plomberie des bâtiments : Des plans de gestion de l’eau et de la sécurité sanitaire de l’eau sont recommandés pour limiter l’apparition de Pseudomonas aeruginosa dans les réseaux de distribution d’eau des bâtiments (OMS, 2011). D’autres stratégies reposant sur des mesures de préventions applicables aux hôpitaux et établissements de soins de santé ont été décrites, qui consistent en des désinfections par surébullition et rinçage à l’eau chaude à des températures supérieures à 50 à 70 °C et en l’utilisation de techniques de filtration sur membrane au PU (Falkinham et coll., 2015a; Bédard et coll., 2016b).
Pour les propriétaires de maisons, aucune mesure n’est considérée comme nécessaire pour réduire leurs risques d’être infectés par P. aeruginosa. Toutefois, ces personnes peuvent réduire au minimum leur risque d’exposition aux agents pathogènes opportunistes d’origine hydrique en maintenant la température de leur réservoir d’eau chaude à 60 °C minimum (OMS, 2011; Falkinham et coll., 2015a, 2015b).
B.2.1.4.6 Contexte international
L’OMS, l’UE, l’US EPA ou l’Australian National Health and Medical Research Council n’ont émis aucune recommandation en ce qui a trait à la présence de P. aeruginosa dans l’eau potable (NHMRC, NRMMC, 2011; OMS, 2017a; Commission européenne, 2020; US EPA, 2021a). Des recommandations et normes visant les Pseudomonas spp. ont été élaborées au Canada et aux États-Unis en ce qui a trait à la lutte contre ces organismes dans les réseaux de distribution d’eau des bâtiments, hormis les réseaux municipaux.
B.2.2 Protozoaires
B.2.2.1 Acanthamoeba spp.
B.2.2.1.1 Description
Les Acanthamoeba spp. sont des amibes libres souvent présentes dans le sol et les milieux aquatiques. Ce sont des agents pathogènes opportunistes qui peuvent provoquer des maladies rares, mais graves touchant les yeux, la peau, les poumons, le cerveau et le système nerveux central (Visvesvara et coll., 2007; Chalmers, 2014a). Les espèces d’Acanthamoeba ont été classées à l’origine selon leur morphologie à différents stades du développement (p. ex. les kystes – voir ci-dessous). Néanmoins, le génotypage est fréquemment utilisé pour classer les différents membres du genre (Visvesvara et coll., 2007; Juárez et coll., 2018). Environ 20 génotypes différents d’ Acanthamoeba ont été identifiés en fonction des différences de séquence (Juárez et coll., 2018). Le génotype d’Acanthamoeba T4 est le plus fréquent dans les cas de maladie et dans l’environnement. Cependant, d’autres génotypes ont été associés à des maladies (Chalmers, 2014a; Juárez et coll., 2018). Les Acanthamoeba spp. sont pertinentes d’un point de vue microbiologique en raison de leur capacité à héberger certains microorganismes pathogènes dans les réseaux de distribution d’eau potable.
Les Acanthamoeba spp. ont de faibles besoins en nutriments et se développent à des températures comprises entre 12 et 45 °C (température optimale : 30°C) (Chalmers, 2014a). Leur cycle de vie comprend deux étapes : un stade d’alimentation appelé trophozoïte (25 à 40 µm) et un stade de kyste résistant (10-30 µm) qui peut supporter des températures comprises entre -20 et 56 °C et résister à la dessiccation et à la désinfection (Chalmers, 2014a; Juárez et coll., 2018).
B.2.2.1.2 Effets sur la santé
Les infections par les Acanthamoeba sont rares dans la population générale (Visvesvara et coll., 2007; Juárez et coll., 2018). La kératite à Acanthamoeba (KA) est la forme pathologique la plus commune (Juárez et coll., 2018) associée à cet organisme. Les premiers symptômes de la KA sont une vision floue, une douleur intense et photosensibilité touchant habituellement un seul œil (Chalmers, 2014a; Juárez et coll., 2018). Dans les cas avancés et graves de la maladie, les symptômes comportent également une ulcération de la cornée, un gonflement de l’œil, une cataracte et la cécité (Juárez et coll., 2018). La KA apparait lentement, prenant des jours voire des semaines à se développer à la suite d’une infection, et évoluant lentement vers une forme plus gave (Köhsler et coll., 2016, Juárez et coll., 2018). Dans les pays industrialisés, la KA touche principalement les individus porteurs de lentilles de contact (Chalmers, 2014a). Les personnes à risque d’exposition élevée sont celles qui conservent, nettoient ou désinfectent leurs lentilles avec de l’eau du robinet non stérile et celles qui nagent et utilisent des bains à remous ou des douches en portant des lentilles de contact (Chalmers, 2014a; Juárez et coll., 2018). Dans une minorité des cas de KA non associés au port de lentilles de contact, les infections sont généralement dues à un traumatisme oculaire ou à une contamination dans l’environnement (Chalmers, 2014a).
D’autres manifestations de maladies associées à l’Acanthamoeba sont les infections disséminées touchant d’abord la peau ou les poumons et pouvant se propager ensuite à d’autres parties du corps, comme les reins et les glandes surrénales et l’encéphalite amibienne granulomateuse (EAG), une maladie mortelle qui survient quand l’infection atteint le cerveau et le système nerveux central (Visvesvara et coll., 2007; Chalmers, 2014a). Il s’agit de formes très rares de maladie, qui touchent principalement les individus immunodéprimés ou atteints de maladies sous-jacentes (p. ex. les personnes atteintes du VIH ou du SIDA, de cancer, de diabètes, d’hépatopathie ou subissant une chimiothérapie ou une transplantation d’organe) (Visvesvara et coll., 2007; Chalmers, 2014a; Guimaraes et coll., 2016). La dose d’Aeromonas spp. minimale causant une infection demeure inconnue.
Bien que l’organisme soit très répandu dans les milieux aquatiques, le nombre de cas de maladie liés aux Acanthamoeba spp. est faible. Le taux d’incidence estimé de la KA dans les pays développés est d’un à 33 cas pour un million de personnes porteuses de lentilles de contact (CDC, 2017b). Le traitement de la KA est compliqué, car les kystes sont résistants à la plupart des antimicrobiens aux concentrations tolérées par l’œil humain (Juárez et coll., 2018). Un traitement prolongé combinant plusieurs médicaments est nécessaire (Visvesvara et coll., 2007).
B.2.2.1.3 Sources et exposition
Les Acanthamoeba spp. sont ubiquitaires dans le sol et dans l’eau partout dans le monde. Elles sont l’une des amibes libres les plus communes présentes dans l’environnement (Visvesvara et coll., 2007; Juárez et coll., 2018). Les amibes ont été isolées dans un très grand nombre de milieux naturels et artificiels, dont le sol, la boue, les eaux douces et saumâtres, les piscines, les bains à remous, les tours de refroidissement, les humidificateurs, les appareils de chauffage, de ventilation et de climatisation, l’eau potable et les poussières en suspension dans l’air (Visvesvara et coll., 2007; Chalmers, 2014a).
L’importance relative de l’eau comme mode d’infection n’est pas claire. La présence ubiquitaire d’Acanthamoeba dans l’environnement rend difficile la détermination des sources d’infection. L’ingestion ou l’inhalation d’eau contaminée ne sont pas considérées comme des voies de contamination (Chalmers, 2014a). Aucune éclosion de KA survenue à la suite d’une exposition à de l’eau potable n’a été observée en Amérique du Nord (Kilvington et coll., 2004; Craun et coll., 2010; Yoder et coll., 2012b). Des cas de KA ont été associés à l’utilisation d’eau du robinet non stérile dans la préparation de solutions pour lentilles de contact (Visvesvara et coll., 2007). Il semblerait que les infections disséminées et l’EAG causés par les Acanthamoeba spp. ne soient pas d’origine hydrique (Chalmers, 2014a).
Les Acanthamoeba spp. peuvent être fréquemment détectées dans les réseaux de distribution d’eau potable en Amérique du Nord et dans le monde (Magnet et coll., 2012; Lu et coll., 2016; Qin et coll., 2017). La multiplication de Acanthamoeba spp. peut se produire dans les biofilms et les dépôts non fixés dans les réseaux de distribution d’eau potable et les circuits de plomberie domestiques (Thomas et Ashbolt, 2011; Wang et coll., 2012a; Qin et coll., 2017). Aux États-Unis, des Acanthamoeba spp. ont été détectées par PCR dans 40 à 63 % d’échantillons de sédiments de réservoir d’eau municipaux (Lu et coll., 2015; Qin et coll., 2017).
Les Acanthamoeba spp. peuvent servir d’hôtes à des microorganismes pathogènes résistants aux amibes, en offrant à ces derniers des conditions (nutriments, protection contre les stress environnementaux) essentielles à leur survie, leur prolifération et leur transport (Thomas et Ashbolt, 2011). Il a été suggéré que le passage dans les protozoaires libres augmentait la virulence des microorganismes résistants aux amibes (Visvesvara et coll., 2007; Thomas et Ashbolt, 2011; Chalmers, 2014a). Les bactéries pathogènes isolées à partir des Acanthamoeba spp. sont Legionella pneumophila, Mycobacterium avium,Helicobacter pylori, les sérotypes O157 d’Escherichia coli, Listeria monocytogenes, les Pseudomonas spp. et Vibrio cholerae (Visvesvara et coll., 2007; Juárez et coll., 2018). Les Acanthamoeba spp. peuvent aussi héberger des protozoaires, des mycètes et des virus (Köhsler et coll., 2016; Juárez et coll., 2018). Il est nécessaire d’investiguer davantage sur les conséquences des interactions entre les espèces d’amibes libres et les microorganismes pathogènes résistants aux amibes dans l’eau potable (Thomas et Ashbolt, 2011).
B.2.2.1.4 Méthodes d’analyse
Aucune méthode normalisée n’a été mise au point pour détecter et identifier les Acanthamoeba spp. présentes dans l’eau potable. Les procédures d’isolation des Acanthamoeba dans des échantillons d’eau consistent en une concentration par filtration sur membrane ou centrifugation, un tri sur plaque et une identification à l’aide de méthodes moléculaires (Chalmers, 2014a). La littérature fournit des renseignements détaillés sur certaines méthodes (Wang et coll., 2017).
B.2.2.1.5 Traitements
Les kystes d’Acanthamoeba sont plus gros que ceux des Giardia et que les oocystes de Cryptosporidium (Chalmers, 2014a; Santé Canada, 2019b). Les mécanismes d’élimination physique utilisés durant le traitement de l’eau potable sont donc censés éliminer ces kystes. Les kystes sont très résistants aux désinfectants fréquemment utilisés et aux UV (Loret et coll., 2008; Hijnen et coll., 2011). Pour l’inactivation des kystes de Acanthamoeba spp., la valeur de CT relevée par Loret et ses collègues (2008) pour le chlore libre (1 300 mg·min/L, voir annexe D) serait techniquement difficile à atteindre dans une station de traitement. Les valeurs de CT pour le dioxyde de chlore et l’ozone sont supérieures à celles observées pour Giardia et Cryptosporidium (Loret et coll., 2008). Les exigences en matière de dose d’UV pour l’inactivation des kystes d’ Acanthamoeba spp. sont similaires à celles requises pour les adénovirus (Hijnen et coll., 2011; Santé Canada, 2019b).
Les pratiques générales d’exploitation et de maintenance essentielles pour limiter la survie et le développement d’agents pathogènes d’origine hydrique, dont les Acanthamoeba spp., dans les réseaux distribution d’eau potable et les installations de plomberie sont décrites dans la partie A (Chalmers, 2014a; Ashbolt, 2015). Dans le cadre d’un plan général de gestion de l’eau dans les bâtiments généraux, les gestionnaires de réseaux d’eau de bâtiments peuvent mettre en œuvre des opérations de nettoyage et maintenance réguliers des raccords de plomberie et de l’équipement pouvant favoriser le développement de biofilms et la formation d’aérosols (p. ex. robinets, pommeaux de douche, cuves thermales/spas et tours de refroidissement). La prévention du développement des Acanthamoeba spp. peut s’avérer particulièrement importante dans certaines utilisations de l’eau comme les douches oculaires d’urgence (Chalmers, 2014a)
Aucune mesure spécifique de la part des propriétaires de maison n’est nécessaire. Toutefois, ces personnes peuvent réduire au minimum les risques d’exposition aux agents pathogènes opportunistes d’origine hydrique en maintenant la température de leur réservoir d’eau chaude à 60 °C minimum (OMS, 2011). Les habitants d’une maison qui portent des lentilles de contact devraient aussi suivre les recommandations des spécialistes en soin des yeux en matière de manipulation, de nettoyage et de port de lentilles de contact (CDC, 2017b).
B.2.2.1.6 Contexte international
L’OMS, l’UE, l’US EPA ou l’Australian National Health and Medical Research Council n’ont émis aucune recommandation en ce qui a trait à la présence d’Acanthamoeba spp. dans l’eau potable (NHMRC, NRMMC, 2011; OMS, 2017a; Commission européenne, 2020; US EPA, 2021a).
B.2.2.2 Naegleria fowleri
B.2.2.2.1 Description
Les Naegleria fowleri sont des amibes libres pathogènes qui causent la méningoencéphalite amibienne primitive (MAP) chez l’humain, une maladie rare, mais presque toujours mortelle. Plus de 40 espèces de Naegleria spp. ont été identifiées. Cependant, il a été prouvé que seule l’espèce N. fowleri est pathogène pour l’humain (Marciano‐Cabral et Cabral et coll. 2007; Yoder et coll. 2010). Huit génotypes de N. fowleri connus ont été découverts dans le monde et tous sont suspectés d’être pathogènes pour l’humain (Bartrand et coll., 2014; Chalmers, 2014b). Les N. fowleri sont thermophiles, se développent bien à des températures comprises entre 25 et 40 °C (température optimale : 37 °C) et peuvent tolérer des températures supérieures à 50 à 60 °C (Hallenbeck et Brenniman, 1989; Visvesvara et coll., 2007; Zaongo et coll., 2018). Il existe trois stades distincts dans le cycle de vie des N. fowleri : un stade de trophozoïte, un stade intermédiaire flagellé et un stade de kyste résistant (Bartrand et coll., 2014, Chalmers, 2014b). Les kystes peuvent survivre longtemps à des températures bien inférieures à celles favorisant la croissance, en plus d’être fortement résistants aux désinfectants (Bartrand et coll., 2014).
B.2.2.2.2 Effets sur la santé
Les symptômes de la MAP sont cliniquement similaires à ceux d’une méningite bactérienne ou virale et commencent par des maux de tête, de la fièvre, des nausées et des vomissements, pour évoluer ensuite en une raideur de la nuque, une altération des facultés mentales, des hallucinations occasionnelles, des crises d’épilepsie et le coma (Visvesvara et coll., 2007; Chalmers, 2014b). Les symptômes apparaissent un à sept jours après l’exposition et la maladie progresse rapidement, la mort survenant généralement au bout de cinq jours (Visvesvara et coll., 2007; Chalmers, 2014b). La MAP a un taux de mortalité extrêmement élevé (supérieur à 97 %) (De Jonckheere, 2011; Capewell et coll., 2015). Parmi les cas documentés aux États-Unis, seuls cinq patients atteints par la maladie y ont survécu (Capewell et coll., 2015). Les infections surviennent lorsque de l’eau contenant N. fowleri pénètre dans les fosses nasales. Les amibes envahissent ensuite les tissus muqueux et se propagent le long du nerf olfactif jusqu’au cerveau, où elles se nourrissent des cellules nerveuses et sanguines, causant une inflammation et des lésions aux cellules, ce qui entraîne la mort (Chalmers, 2014b; Siddiqui et coll., 2016). La dose minimale de N. fowleri causant une infection n’est pas bien connue (Bartrand et coll., 2014).
La MAP survient chez des personnes par ailleurs en bonne santé qui sont exposées à de l’eau chaude non traitée ou mal désinfectée (Yoder et coll., 2010). Elle touche principalement les enfants et les jeunes adultes ayant déjà été en contact avec de l’eau douce chaude, utilisée à des fins récréatives. Les raisons expliquant cette répartition de l’âge ne sont pas claires, mais il est proposé que les personnes de ces groupes d’âge pratiquent plus souvent des activités aquatiques (p. ex. plongée, immersion de la tête) qui augmentent le risque que l’eau remonte avec force dans le nez (Visvesvara et coll., 2007; Yoder et coll., 2010). Malgré la présence fréquente de N. fowleri dans les milieux aqueux, la MAP est rare. À partir de 2011, seulement 235 cas de MAP ont été observés dans le monde, la majorité aux États-Unis (De Jonckheere, 2011). Les cas surviennent le plus souvent durant les saisons chaudes.
La MAP est difficile à détecter, la plupart des cas progressant si rapidement que le diagnostic n’est établi qu’après la mort des patients (Chalmers, 2014b). Plusieurs médicaments se sont avérés efficaces contre N. fowleri (Capewell et coll., 2015; Siddiqui et al., 2016) en laboratoire. Cependant, leur efficacité dans le cadre d’un traitement clinique est mal connue (Capewell et coll., 2015; Siddiqui et coll., 2016). Une persistance de l’infection a été mise en évidence chez deux patients qui s’étaient vus administrer des agents microbiens en association et un traitement énergique de leur œdème cérébral (CDC, 2019b). L’essai continu de nouvelles thérapies reste nécessaire (Capewell et coll., 2015; Siddiqui et coll., 2016). Il n’existe actuellement aucun vaccin contre la MAP (Siddiqui et coll., 2016).
B.2.2.2.3 Sources et exposition
N. fowleri se retrouve naturellement dans les milieux d’eau douce et les sols chauds partout dans le monde (Chalmers, 2014b). Ces microorganismes ont été isolés à partir d’une grande variété de sources d’eau chaude naturelles et artificielles, dont les lacs, les rivières, les étangs, les sources thermales, les eaux souterraines géothermiques, les eaux mélangées à des rejets d’eau chaude de centrales électriques ou d’usines et les piscines mal entretenues (Chalmers, 2014b, Bartrand et coll., 2014). Aux États-Unis, l’amibe N. fowleri a souvent été décelée dans des eaux naturelles des États du sud. Toutefois, des cas de MAP ont également été signalés dans des États américains plus septentrionaux, notamment le Kansas, l’Indiana et le Minnesota (Yoder et coll., 2010, 2012a; Cope et Ali, 2016). L’espèce N. fowleri a été isolée dans des sources d’eau potable et des circuits de plomberie domestiques en Australie ainsi qu’en Arizona, en Louisiane et au Texas, aux États-Unis (Bartrand et coll., 2014; Villegas, 2020). Une augmentation de la température ambiante résultant des changements climatiques peut étendre l’aire de répartition de N. fowleri (Bartrand et coll., 2014; Chalmers, 2014b).
N. fowleri se transmet par la voie intranasale. Même si des cas de MAP ont été signalés dans plusieurs pays, les données les plus complètes proviennent des États-Unis (Cope et Ali, 2016). Dans ce pays, la plupart des infections ont été associées à des activités de loisir (p. ex. la natation, la plongée, le saut et les jeux sous l’eau) dans des eaux récréatives douces et chaudes ou des piscines (Yoder et coll., 2010). La majorité des expositions ont eu lieu dans des lacs et des étangs; les expositions dans des rivières ou des ruisseaux ont été signalées moins fréquemment (Yoder et coll., 2010). Des cas de maladie ont également été documentés en lien avec des piscines mal entretenues comme source probable de l’exposition (Yoder et coll., 2010; Cope et Ali, 2016). Dans de très rares cas, les infections ont été reliées à des sources d’eau potable contaminées par des facteurs tels que l’irrigation nasale, la baignade ou les usages récréatifs de l’eau (Yoder et coll., 2010, 2012a, Bartrand et coll., 2014). L’eau potable contaminée n’est pas une voie d’infection.
Il existe très peu de données sur la contamination de réseaux de distribution d’eau potable ou de circuits de plomberie domestiques par N. fowleri en Amérique du Nord (Bartrand et coll., 2014). Ces dernières sont répandues dans les réservoirs naturels, mais en faible quantité, à moins que l’environnement offre des conditions propices à leur prolifération, comme des températures optimales de développement, la disponibilité de nutriments et l’absence de désinfectants résiduels (Bartrand et coll., 2014). Les réseaux de distribution d’eau potable vulnérables aux contaminations par N. fowleri sont ceux dans lesquels la température de l’eau dépasse constamment 25 °C et une concentration efficace de désinfectants résiduels n’est pas maintenue (Bartrand et coll., 2014). La survie à long terme des kystes à des températures inférieures aux valeurs optimales de développement microbien est possible et N. fowleri est capable de survivre à l’hiver dans des lacs situés dans des régions subtropicales et tempérées (Bartrand et coll., 2014). Des études de laboratoire et à échelle réelle ont montré que N. fowleri pouvait persister et se développer dans les biofilms des réseaux de distribution et des installations de plomberie domestiques (Bartrand et coll., 2014).
N. fowleri peut servir de réservoir aux microorganismes résistants aux amibes (Thomas et Ashbolt, 2011; Bartrand et coll., 2014). Les espèces deNaegleria sont considérées comme des hôtes de L. pneumophila et peuvent offrir à ces bactéries des conditions leur permettant de se multiplier, de se protéger et de se répandre dans l’environnement (Thomas et Ashbolt, 2011; Bartrand et coll., 2014; Siddiqui et coll., 2016). Il est nécessaire de mener des études approfondies pour comprendre les interactions entre les espèces d’amibes libres et les microorganismes pathogènes résistants aux amibes et pouvoir ainsi mesurer les risques pour la santé humaine (Thomas et Ashbolt, 2011). Seuls six des 132 cas d’infection par N. fowleri recensés aux États-Unis entre 1962 et 2013 étaient le résultat d’expositions à de l’eau potable contaminée (Yoder et coll. 2010; CDC, 2017c). Trois de ces cas étaient liés à des gestes d’irrigation nasale (Louisiane (2), 2011, Îles Vierges, États-Unis (1), 2012), deux à des activités de baignade (Arizona, 2002) et un à une exposition à de l’eau du robinet sur une glissade d’eau extérieure (Louisiane, 2013) (Yoder et coll. 2010, 2012a; Bartrand et coll., 2014). Dans les deux cas survenus en Louisiane, c’était la première fois que de l’eau du robinet désinfectée était associée à une infection à N. fowleri aux États-Unis (Yoder et coll., 2012a). À ce jour, il n’y a eu aucun cas confirmé de MAP au Canada.
B.2.2.2.4 Méthodes d’analyse
La détection et l’identification de N. fowleri dans l’eau potable requièrent des laboratoires hautement spécialisés (Bartrand et coll., 2014, Chalmers, 2014b). Aucune méthode normalisée n’existe. Les procédures d’isolement de N. fowleri consistent en une concentration (par filtration sur membrane ou centrifugation) ou une séparation, un tri sur plaque et une identification à l’aide de l’immunofluorescence ou de méthodes moléculaires (Bartrand et coll., 2014; Chalmers, 2014b, Wang et coll., 2017). La littérature fournit des renseignements détaillés sur certaines méthodes (Bartrand et coll., 2017; Wang et coll., 2017).
B.2.2.2.5 Traitements
Lorsqu’elles sont correctement conçues et utilisées, les techniques d’élimination physique – filtration avec procédé chimique, filtration lente sur sable, sur terre de diatomées ou sur membrane ou toute autre technologie éprouvée – couramment utilisées dans le traitement de l’eau potable sont censées détruire N. fowleri. Les kystes sont très résistants aux désinfectants primaires fréquemment utilisés – chlore et UV. Les kystes de N. fowlerisont très similaires en taille à ceux de Giardia (Chalmers, 2014b, Santé Canada, 2019b). Pour l’inactivation des kystes des Naegleria spp., les exigences en matière de CT pour le chlore libre sont similaires à celles requises pour Giardia, tandis que les exigences en matière de dose d’UV sont supérieures à celles applicables aux protozoaires entériques, mais inférieures à celles requises pour les adénovirus (Sarkar et Gerba, 2012; Goudot et coll., 2014; Santé Canada, 2019b, 2019c). La monochloramine ne devrait pas être utilisée pour la désinfection primaire, en raison de son faible potentiel d’oxydation; elle est recommandée uniquement pour la désinfection secondaire (c.-à-d. pour maintenir une concentration résiduelle de désinfectant dans le réseau de distribution) (Santé Canada, 2019b).
Les pratiques générales d’exploitation et de maintenance essentielles pour limiter la survie et le développement d’agents pathogènes d’origine hydrique, dont les Naegleriaspp., dans les réseaux distribution d’eau potable et les installations de plomberie sont décrites dans la partie A (Bartrand et coll., 2014). Le maintien d’une concentration minimale de chlore libre résiduel à 0,5 mg/l dans l’ensemble du réseau de distribution est recommandé pour limiter le développement de N. fowleri dans les réseaux d’eau potable vulnérables (NHMRC, NRMMC, 2011; Louisiana Department of Health and Hospitals, 2013; Bartrand et coll., 2014). La pratique exemplaire proposée pour obtenir une concentration de chloramine résiduelle supérieure à 1,5 mg/L dans l’ensemble du réseau de distribution (Santé Canada, 2020b) est suffisante pour contrôler le développement de N. fowleri (NHMRC, NRMMC, 2011).
N. fowleri ne constitue pas un risque immédiat pour les réseaux de distribution d’eau potable au Canada. Cependant, les particuliers devraient s’assurer de procéder à des rinçages nasaux avec de l’eau préalablement portée à ébullition ou refroidie ou de l’eau distillée.
B.2.2.2.6 Contexte international
L’OMS, l’UE, l’US EPA ou l’Australian National Health and Medical Research Council n’ont émis aucune recommandation en ce qui a trait à la présence de N. fowleri dans l’eau potable (NHMRC, NRMMC, 2011; OMS, 2017a; Commission européenne, 2020; US EPA, 2021a).
Partie C. Bibliographie
Adams, D.A., Thomas, K.R., Jajosky, R.A., Foster, L., Sharp, P., Onweh, D.H., Schley, A.W. and Anderson, W.J. (2016). Summary of notifiable infectious diseases and conditions—United States, 2014. MMWR Morb. Mortal. Wkly. Rep., 63(54): 1-152.
Adams, D.A., Thomas, K.R., Jajosky, R.A., Foster, L., Baroi, G., Sharp, P., Onweh, D.H., Schley, A.W. and Anderson, W.J. (2017). Summary of notifiable infectious diseases and conditions—United States, 2015. MMWR Morb. Mortal. Wkly. Rep., 64(53): 1-143.
Adjemian, J., Daniel-Wayman, S., Ricotta, E. and Prevots, D.R. (2018). Epidemiology of nontuberculous mycobacteriosis. Seminars in Respiratory and Critical Care Medicine, 39(3): 325-335.
AFNOR (2021). Analyse de l’eau. AFNOR Certification. La Plaine–Saint-Denis, France. Consulté en juillet 2021 à l’adresse : https://nf-validation.afnor.org/domaine-eau/
Alary, M. and Joly, J.R. (1991). Risk factors for contamination of domestic hot water systems by Legionellae. Appl. Environ. Microbiol., 57(8): 2360-2367.
Allegra, S., Berger, F., Berthelot, P., Grattard, F., Pozzetto, B. and Riffard, S. (2008). Use of flow cytometry to monitor Legionella viability. Appl. Environ. Microbiol., 74 (24):7813-7816.
APHA, AWWA and WEF. (2017). Standard methods for the examination of water and wastewater. 23rd edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
Ashbolt, N.J. (2015). Environmental (saprozoic) pathogens of engineered water systems: Understanding their ecology for risk assessment and management. Pathogens, 4(2): 390-405.
ASHRAE. (2018). ANSI/ASHRAE Standard 188-2018, Legionellosis: Risk Management for Building Water Systems. American Society of Heating, Refridgerating and Air Conditioning Engineers. Atlanta, GA. www.ashrae.org.
ASPC. (2010). Fiche Technique Santé-Sécurité : Agents Pathogènes – Shigella spp. Agence de la santé publique du Canada, Ottawa, Canada. Consulté en septembre 2019 à l’adresse : https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/fiches-techniques-sante-securite-agents-pathogenes-evaluation-risques/shigella.html
ASPC. (2011). Fiche Technique Santé-Sécurité : Agents Pathogènes – Salmonella enterica spp. Agence de la santé publique du Canada, Ottawa, Canada. Consulté en septembre 2019 à l’adresse : https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/fiches-techniques-sante-securite-agents-pathogenes-evaluation-risques/salmonella-enterica.html
ASPC. (2018a). Système canadien de surveillance de la résistance aux antimicrobiens. Mise à jour 2018. Agence de la santé publique du Canada. Ottawa, Canada. Consulté en octobre 2019 à l’adresse : https://www.canada.ca/fr/services/sante/publications/medicaments-et-produits-sante.html
ASPC. (2018b). FoodNet Canada rapport annuel 2016. Agence de la santé publique du Canada, Ottawa, Canada.
ASPC. (2018c). FoodNet Canada rapport annuel 2017. Agence de la santé publique du Canada, Ottawa, Canada.
ASPC. (2018d). Legionella. Agence de la santé publique du Canada, Ottawa, Canada. Consulté en juin 2019 à l’adresse : https://www.canada.ca/fr/sante-publique/services/maladies-infectieuses/legionella.html
ASPC. (2019a). FoodNet Canada rapport annuel 2018. Agence de la santé publique du Canada, Ottawa, Canada.
ASPC. (2019b). Maladies à déclaration obligatoire en direct. Nombre de cas signalés de maladies de 1924 à 2016 au Canada. Agence de la santé publique du Canada, Ottawa, Canada. Consulté en septembre 2019 à l’adresse : https://maladies.canada.ca/declaration-obligatoire/liste-graphiques
Australian Government (2015). Guidelines for Legionella control in the operation and maintenance of water distribution systems in health and aged care facilities. Australian Government, Canberra. Consulté en juillet 2021 à l’adresse : https://www.health.gov.au/
AWWA (2021). Climate action plans—Adaptive management strategies for utilities. Manual of water supply practices—M71. 1st edition. American Water Works Association, Denver, Colorado.
Backert, S., Tegtmeyer, N., Cróinín, T.Ó, Boehm, M. and Heimesaat, M.M. (2016). Human campylobacteriosis. In Campylobacter: Features, detection, and prevention of foodborne disease. Klein, G (ed.). Academic Press. Cambridge, USA. p. 1-25.
Baker, K.H. and Hegarty, J.P. (2001). Presence of Helicobacter pylori in drinking water is associated with clinical infection (2001) Scand. J. Infect. Dis., 33 (10):744-746.
Baker, K.H., Hegarty, J.P., Redmond, B., Reed, N.A. and Herson, D.S. (2002). Effect of oxidizing disinfectants (chlorine, monochloramine, and ozone) on Helicobacter pylori. Appl. Environ. Microbiol., 68(2) : 981-984.
Bartram, J., Bentham, R., Briand, E., Callan, P., Crespi, S., Lee, J.V. and Surman-Lee, S. (2007). Chapter 3 approaches to risk management. In Legionella and the prevention of legionellosis. Bartram, J. (ed.). World Health Organization, Geneva, Switzerland. p. 39-56.
Bartrand, T.A., Causey, J.J. and Clancy, J.L. (2014). Naegleria fowleri: An emerging drinking water pathogen. J. Am. Water Works Assoc., 106(10): E418-E432.
Bates, M.N., Maas, E., Martin, T., Harte, D., Grubner, M. and Margolin, T. (2000). Investigation of the prevalence of Legionella species in domestic hot water systems. New Zealand Med. J., 113(1111): 218-220.
Bayazit, Y.A., Bayazit, N. and Namiduru, M. (2004). Mycobacterial cervical lymphadenitis. Orl, 66(5): 275-280.
Beauté, J., Sandin, S., Uldum, S.A., Rota, M.C., Brandsema, P., Giesecke, J. and Sparén, P. (2016). Short-term effects of atmospheric pressure, temperature, and rainfall on notification rate of community-acquired Legionnaires' disease in four European countries. Epidemiol. Infect., 144(16): 3483-3493.
Beauté J, on behalf of the European Legionnaires’ Disease Surveillance Network. Legionnaires’ disease in Europe, 2011 to 2015. Euro Surveill. 2017; 22(27):30566.
Bédard, E., Fey, S., Charron, D., Lalancette, C., Cantin, P., Dolcé, P., Laferrière, C., Déziel, E. and Prévost, M. (2015). Temperature diagnostic to identify high risk areas and optimize Legionella pneumophila surveillance in hot water distribution systems. Wat. Res., 71:244-256.
Bédard, E., Boppe, I., Kouamé, S., Martin, P., Pinsonneault, L., Valiquette, L., Racine, J. and Prévost, M. (2016a). Combination of heat shock and enhanced thermal regime to control the growth of a persistent Legionella pneumophila strain. Pathogens, 5(2): 35.
Bédard, E., Prévost, M. and Déziel, E. (2016b). Pseudomonas aeruginosa in premise plumbing of large buildings. MicrobiologyOpen, 5(6): 937-956.
Behnke, S. and Camper, A.K. (2012). Chlorine dioxide disinfection of single and dual species biofilms, Benin, A.L., Benson, R.F. and Besser, R.E. (2002). Trends in Legionnaires’ disease, 1980–1998: Declining mortality and new patterns of diagnosis. Clin. Infect. Dis., 35(9): 1039-1046.
Bentham, R., Surman-Lee, S., Lee, J.V., Briand, E. and Van de Kooj, D. (2007). Chapter 4: Potable water and in-building distribution systems. In Legionella and the prevention of legionellosis. Bartram, J. et al. (eds.). World Health Organization, Geneva, Switzerland. p. 57-68.
Bernstein, C.N., McKeown, I., Embil, J.M., Blanchard, J.F., Dawood, M., Kabani, A., Kliewer, E., Smart, G., Coghlan, G., MacDonald, S., Cook, C., Orr, P. (1999). Seroprevalence of Helicobacter pylori, incidence of gastric cancer, and peptic ulcer-associated hospitalizations in a Canadian Indian population. Digest. Dis. Sci., 44 (4): 668-674.
Bhowmick, U.D. and Bhattacharjee, S. (2018). Bacteriological, clinical and virulence aspects of Aeromonas-associated diseases in humans. Pol. J. Microbiol., 67(2): 137-149.
Black, R.E., Levine, M.M., Clements, M.L., Highes, T.P. and Blaser, M.J. (1988). Experimental Campylobacter jejuni infection in humans. J. Infect. Dis. 157, 472-479.
Boppe, I., Bédard, E., Taillandier, C., Lecellier, D., Nantel-Gauvin, M. A., Villion, M., Laferrière, C. and Prevost, M. (2016). Investigative approach to improve hot water system hydraulics through temperature monitoring to reduce building environmental quality hazard associated to Legionella. Build. Environ., 108, 230-239.
Borchardt, M.A., Stemper, M.E. and Standridge, J.H. (2003). Aeromonas isolates from human diarrheic stool and groundwater compared by pulsed-field gel electrophoresis. Emerg. Infect. Dis., 9(2): 224-228.
Bragança, S.M., Azevedo, N.F., Simöes, L.C., Keevil, C.W. and Vieira, M.J. (2007). Use of fluorescent in situ hybridisation for the visualisation of Helicobacter pylori in real drinking water biofilms. Water Sci. Technol., 55(8-9):387-393.
Brennhovd, O., Kapperud, G. and Langeland, G. (1992). Survey of thermotolerant Campylobacter spp. and Yersinia spp. in three surface water sources in Norway. Int. J. Food Microbiol., 15(3-4): 327-338.
Brooks, T., Osicki, R.A., Springthorpe, S., Sattar, S.A., Filion, L. Abrial, D. and Riffard, S. (2004). Detection and identification of Legionella species from groundwaters. J. Toxicol. Environ. Health Part A, 67:1845–1859.
Brown, L.M. (2000). Helicobacter pylori: Epidemiology and routes of transmission. Epidemiol. Rev., 22 (2): 283-297.
Bryant, J.M. et al. (2016). Population-level genomics identifies the emergence and global spread of a human transmissible multidrug-resistant nontuberculous Mycobacterium. Science, 354(6313): 751-757.
Bryant, J.M., Grogono, D.M., Greaves, D., Foweraker, J., Roddick, I., Inns, T., Reacher, M., Haworth, C.S., Curran, M.D., Harris, S.R., Peacock, S.J., Parkhill, J. and Floto, R.A. (2013). Whole-genome sequencing to identify transmission of Mycobacterium abscessus between patients with cystic fibrosis: A retrospective cohort study. Lancet, 381(9877): 1551-1560.
Bukhari, Z., LeChevallier, M.W, Jjemba, P., Johnson, W., Haas, C. and Hamilton, K. (2018). Development of a risk management strategy for Legionella in reclaimed water systems. Project Reuse-12-05. Water Research Foundation, Denver, Colorado.
Burillo, A., Pedro-Botet, M.L. and Bouza, E. (2017). Microbiology and epidemiology of Legionnaires’ disease. Infect. Dis. Clin. North Am., 31(1): 7-27.
Burnsed, L.J., Hicks, L.A., Smithee, L.M.K., Fields, B.S., Bradley, K.K., Pascoe, N., Richards, S.M., Mallonee, S., Littrell, L., Benson, R.F. and Moore, M.R. (2007). A large, travel-associated outbreak of legionellosis among hotel guests: Utility of the urine antigen assay in confirming Pontiac fever. Clin Infect Dis, 44(2) : 222-228.
Buse, H.Y., Schoen, M.E. and Ashbolt, N.J. (2012). Legionellae in engineered systems and use of quantitative microbial risk assessment to predict exposure. Water Res., 46 (4): 921-933.
Buse, H.Y., Morris, B.J., Struewing, I.T. and Szabo, J.G. (2019). Chlorine and monochloramine disinfection of Legionella pneumophila colonizing copper and polyvinyl chloride drinking water biofilms. Appl. Environ. Microbiol., 85(7): e02956-18.
Butler, A.J., Pintar, K.D.M. and Thomas, M.K. (2016). Estimating the Relative Role of Various Subcategories of Food, Water, and Animal Contact Transmission of 28 Enteric Diseases in Canada. Foodborne Pathog. Dis., 13 (2): 57-64.
Calero Preciado, C., Boxall, J., Soria-Carrasco, V., Martínez, S. and Douterelo, I. (2021). Implications of climate change: How does increased water temperature influence biofilm and water quality of chlorinated drinking water distribution systems? Front. Microbiol., 12.
Cangelosi, G., Clark-Curtiss, J., Behr, M., Bull, T. and Stinear, T. (2004). Biology of waterborne pathogenic mycobacteria. In Pathogenic mycobacteria in water—A guide to public health consequences, monitoring and management. IWA Publishing. World Health Organization. Geneva, Switzerland. p. 39-54.
Cantor, A.F. (2017). Optimization of phosphorus-based corrosion control chemicals using a comprehensive perspective of water quality. Report #4586. Water Research Foundation, Denver, Colorado.
Capewell, L.G., Harris, A.M., Yoder, J.S., Cope, J.R., Eddy, B.A., Roy, S.L., Visvesvara, G.S., Fox, L.M. and Beach, M.J. (2015). Diagnosis, clinical course, and treatment of primary amoebic meningoencephalitis in the United States, 1937-2013. J. Pediatric Infect. Dis. Soc., 4(4) : e68-e75.
Cassidy, P.M., Hedberg, K., Saulson, A., McNelly, E. and Winthrop, K.L. (2009). Nontuberculous mycobacterial disease prevalence and risk factors: A changing epidemiology. Clin. Infect. Dis. 49 (12):e124-e129.
Castillo, N.E., Rajasekaran, A. and Ali, S.K. (2016). Legionnaires' disease: A review. Infect. Dis. Clin. Pract., 24(5): 248-253.
CCN. (2019). Répertoire des organismes de certification accrédités de produits, de processus et de services. Conseil canadien des normes, Ottawa (Ontario). Disponible à l’adresse : https://www.scc.ca/fr/accreditation/certification-de-produits-procedes-et-services/repertoire-des-organismes-de-certification-accredites
CDC. (2004). Surveillance for Waterborne-Disease Outbreaks Associated with Recreational Water—United States, 2001–2002 and Surveillance for Waterborne Disease Outbreaks Associated with Drinking Water—United States, 2001–2002. In Surveillance Summaries, October 22, 2004. MMWR 2004:53(no. SS-8).
CDC. (2006). Surveillance for waterborne disease and outbreaks associated with drinking water and water not intended for drinking--United States, 2003-2004. MMWR Surveill Summ, 55(12): 31-65.
CDC. (2008). Surveillance for Waterborne Disease and Outbreaks Associated with Recreational Water use and Other Aquatic Facility-Associated Health Events—United States, 2005–2006 and Surveillance for Waterborne Disease and Outbreaks Associated with Drinking Water and Water Not Intended for Drinking—United States, 2005–2006. Surveillance Summaries. MMWR 2008;57(no. SS-9).
CDC. (2011). Surveillance for waterborne disease outbreaks associated with drinking water---United States, 2007--2008. MMWR Surveill. Summ., 60(12): 38-68.
CDC. (2013). Surveillance for Waterborne Disease Outbreaks Associated with Drinking Water and Other Nonrecreational Water—United States, 2009–2010. Surveillance Summaries. MMWR 2013;62(no. 35).
CDC. (2015a). Epi-Aid 2015-037 Trip Report: “Undetermined source of an healthcare-associated outbreak of Legionnaire’s disease—Illinois, 2015”. Centres for Disease Control and Prevention, Atlanta, GA. Consulté en juillet 2021 à l’adresse : http://www.dph. illinois.gov/sites/default/files/publications/cdc-trip-reportquincyil12. 31.15.pdf.
CDC. (2015b). Surveillance for Waterborne Disease Outbreaks Associated with Drinking Water—United States, 2011–2012. Surveillance Summaries. MMWR 2015;64 (no. 31).
CDC. (2017a). Developing a water management program to reduce Legionella growth & spread in buildings. A practical guide to implementing industry standards. Version 1.1. Centers for Disease Control and Prevention. Atlanta, GA. Consulté en novembre 2019 à l’adresse : https://www.cdc.gov/legionella/wmp/toolkit/index.html
CDC. (2017b). Parasites—Acanthamoeba—Granulomatous Amebic Encephalitis (GAE); Keratitis. Centers for Disease Control and Prevention. Atlanta, GA. Consulté en juillet 2019 à l’adresse : https://www.cdc.gov/parasites/acanthamoeba/index.html
CDC. (2017c). Parasites—Naegleria fowleri—Primary Amebic Meningoencephalitis (PAM)—Amebic Encephalitis. Naegleria fowleri in Louisiana Public Water Systems. Centers for Disease Control and Prevention. Atlanta, GA. Consulté en juillet 2019 à l’adresse : https://www.cdc.gov/parasites/naegleria/public-water-systems-louisiana.html
CDC. (2017d). Surveillance for waterborne disease outbreaks associated with drinking water -United States, 2013-2014. MMWR., 2017; 66(44): 1216-1221.
CDC. (2018). Centers for Disease Control and Prevention. National Notifiable Diseases Surveillance System, 2017 Annual Tables of Infectious Disease Data. Atlanta, GA. CDC Division of Health Informatics and Surveillance, 2018. Disposible à l’adresse : https://wonder.cdc.gov/nndss/nndss_annual_tables_menu.asp
CDC. (2019a). Antibiotic Resistance Threats in the United States, 2019. Atlanta, GA: U.S. Department of Health and Human Services, CDC; 2019. Accessed March 2022 from: https://www.cdc.gov/drugresistance/Biggest-Threats.html
CDC. (2019b). Parasites—Naegleria fowleri—Primary Amebic Meningoencephalitis (PAM)—Amebic Encephalitis. General Information. Centers for Disease Control and Prevention. Atlanta, GA. Consulté en juillet 2019 à l’adresse : https://www.cdc.gov/parasites/naegleria/general.html
CDC. (2021a). Legionella (Legionnaires' Disease and Pontiac Fever) - Clinical Features. Centers for Disease Control and Prevention. Atlanta, GA. Consulté en juin 2021 à l’adresse : https://www.cdc.gov/legionella/clinicians/clinical-features.html
CDC. (2021b). Toolkit for controlling Legionella in common sources of exposure (Legionella Control Toolkit). Centers for Disease Control and Prevention. Atlanta, GA. Consulté en mai 2021 à l’adresse : https://www.cdc.gov/legionella/wmp/control-toolkit/index.html
Cervero-Aragó, S., Rodríguez-Martínez, S., Puertas-Bennasar, A. and Araujo, R.M. (2015). Effect of common drinking water disinfectants, chlorine and heat, on free Legionella and amoebae-associated Legionella. PLoS ONE, 10 (8), art. no. e0134726.
Cervero-Aragó, S., Schrammel, B., Dietersdorfer, E., Sommer, R., Lück, C., Walochnik, J. and Kirschner, A. (2019). Viability and infectivity of viable but nonculturable Legionella pneumophila strains induced at high temperatures. Water Res., 158: 268-279.
Chakravarty, S. and Anderson, G.G. (2015). The genus Pseudomonas. In Practical handbook of microbiology. Goldman, E. and Green, L.H. (eds.). Third. CRC Press, Taylor & Francis Group, Boca Raton, p. 321-343.
Chalmers, R.M. (2014a). Acanthamoeba. In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK p. 263-276.
Chalmers, R.M. (2014b). Naegleria. In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK p. 407-416.
Charron, D., Bédard, E., Lalancette, C., Laferrière, C. and Prévost, M. (2015). Impact of electronic faucets and water quality on the occurrence of Pseudomonas aeruginosa in water: A multi-hospital study. Infect. Control Hosp. Epidemiol., 36(3): 311-319.
Chauret, C., Volk, C., Creason, R., Jarosh, J., Robinson, J. and Warnes, C. (2001). Detection of Aeromonas hydrophila in a drinking-water distribution system: A field and pilot study. Can. J. Microbiol., 47(8): 782-786.
Chauret, C., Smith, C. and Baribeau, H. (2008). Inactivation of Nitrosomonas europaea and pathogenic Escherichia coli by chlorine and monochloramine. J. Water Health, 6(3): 315-322.
Cheyne, B.M., Van Dyke, M.I., Anderson, W.B. and Huck, P.M. (2009). An evaluation of methods for the isolation of Yersinia enterocolitica from surface waters in the grand river watershed. J. Water Health, 7(3): 392-403.
Cheyne, B.M., Van Dyke, M.I., Anderson, W.B. and Huck, P.M. (2010). The detection of Yersinia enterocolitica in surface water by quantitative PCR amplification of the ail and yadA genes. J. Water Health, 8(3): 487-499.
Christenson, J.C. (2013). Salmonella infections. Pediatr Rev, 34(9): 375-383.
City of Hamilton. (2019). Consulté en février 2020 à l’adresse : https://www.hamilton.ca/operating-business/health-requirements-inspections/cooling-towers
City of Vancouver (2021). Get a water systems operating permit. Vancouver, Canada. Consulté en juillet 2021 à l’adresse : https://vancouver.ca/home-property-development/operating-permit.aspx
Clauß, M. (2006). Higher effectiveness of photoinactivation of bacterial spores, UV resistant vegetative bacteria and mold spores with 222 nm compared to 254 nm wavelength. Acta Hydrochim. Hydrobiol., 34(6): 525-532.
CNRC. (2015a). Code national du bâtiment. Conseil national de recherches Canada, Ottawa (Ontario). Disponible à l’adresse : https://nrc.canada.ca/fr/certifications-evaluations-normes/codes-canada/publications-codes-canada/code-national-batiment-canada-2015
CNRC. (2015b). Code national de la plomberie – Canada. Conseil national de recherches Canada, Ottawa (Ontario). Disponible à l’adresse : https://nrc.canada.ca/fr/certifications-evaluations-normes/codes-canada/publications-codes-canada/code-national-plomberie-canada-2015
Cohn, P.D., Gleason, J.A., Rudowski, E, Tsai, S.M., Genese, C.A. and Faglianon, J.A. (2015). Community outbreak of legionellosis and an environmental investigation into a community water system. Epidemiol. Infect., 143(6): 1322–1331.
Collins, S., Stevenson, D., Bennett, A. and Walker, J. (2017). Occurrence of Legionella in UK household showers. Int. J. Hyg. Environ. Health, 220(2): 401-406.
Commission européenne (2020). Directive (UE) 2020/2184 du Parlement européen et du Conseil du 16 décembre 2020 relative à la qualité des eaux destinées à la consommation humaine (refonte). Journal officiel de l’Union européenne. Décembre 2020. Consulté en août 2021 à l’adresse : https://eur-lex.europa.eu/eli/dir/2020/2184/oj?locale=fr
Cope, J.R. and Ali, I.K. (2016). Primary amebic meningoencephalitis: What have we learned in the last 5 years? Curr. Infect. Dis. Rep., 18(10).
Correia, A.M., Gonçalves, J. and Gomes, J.P. (2016). Probable person-to-person transmission of legionnaires' disease. New Engl. J. Med., 374(5): 497-498.
Corti, M. and Palmero, D.J. (2008). Mycobacterium avium complex infection in HIV/AIDS patients. Expert Rev. Anti-Infect. Ther., 6(3): 351-363.
Covert, T.C., Rodgers, M.R., Reyes, A.L. and Stelma Jr., G.N. (1999). Occurrence of nontuberculous mycobacteria in environmental samples. Appl. Environ. Microbiol., 65(6): 2492-2496.
Craun, G.F., Brunkard, J.M., Yoder, J.S., Roberts, V.A., Carpenter, J., Wade, T., Calderon, R.L., Roberts, J.M., Beach, M.J. and Roy, S.L. (2010). Causes of outbreaks associated with drinking water in the United States from 1971 to 2006. Clin. Microbiol. Rev., 23(3): 507-528.
Croxen, M.A., Law, R.J., Scholz, R., Keeney, K.M., Wlodarska, M. and Finlay, B.B. (2013). Recent advances in understanding enteric pathogenic Escherichia coli. Clin. Microbiol. Rev., 26(4): 822-880.
Cunha, B.A., Burillo, A. and Bouza, E. (2016). Legionnaires' disease. Lancet, 387(10016): 376-385.
Cunha, C.B. and Cunha, B.A. (2017). Legionnaires’ disease since Philadelphia: Lessons learned and continued progress. Infect. Dis. Clin. North Am., 31(1): 1-5.
Daniels, T.L. and Gregory, D.W. (2015). Pseudomonas, Stenotrophomonas and Burkholderia. In Clinical infectious disease. Schlossberg, D. (ed.). Second edition. Cambridge University Press, Cambridge, p. 966-974.
De Groote, M.A. (2004a). Disease resulting from contaminated equipment and invasive procedures. In Pathogenic mycobacteria in water—A guide to public health consequences, monitoring and management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland. pp: 131-142.
De Groote, M.A. (2004b). Pulmonary infection in non-HIV infected individuals. In Pathogenic mycobacteria in water—A guide to public health consequences, monitoring and management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland. pp: 115-130.
De Groote, M.A. and Johnson, P. (2004). Skin, bone and soft tissue infections. In Pathogenic mycobacteria in water—A guide to public health consequences, monitoring and management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland. pp: 104-114.
De Jonckheere, J.F. (2011). Origin and evolution of the worldwide distributed pathogenic amoeboflagellate Naegleria fowleri. Infect. Genet. Evol., 11(7): 1520-1528.
Degnan, A.J. (2006). Chapter 16. Pseudomonas. In AWWA manual of water supply practices—M48: Waterborne pathogens. 2nd edition. American Water Works Association, Denver, CO, p. 131-134.
Dekker, J.P. and Frank, K.M. (2015). Salmonella, Shigella, and Yersinia. Clin. Lab. Med., 35(2): 225-246.
Devos, L., Boon, N. and Verstraete, W. (2005). Legionella pneumophila in the environment: The occurrence of a fastidious bacterium in oligotrophic conditions. Rev. Environ. Sci. Bio., 4 (1-2): 61-74.
Dias, V.C.F., Durand A-A., Constant P., Prévost M. and Bédard E. (2019). Identification of factors affecting bacterial abundance and community structures in a full-scale chlorinated drinking water distribution system. Water. 11(3): 627.
Dilger, T., Melzl, H. and Gessner, A. (2016). Legionella contamination in warm water systems in Germany—influence of maximal temperature and temperature during sampling. GWF Wasser Abwasser, 157(3): 262-271.
Dominguez, A., Alvarez, J., Sabria, M., Carmona, G., Torner, N., Oviedo, M., Cayla, J., Minguell, S., Barrabeig, I., Sala, M., Godoy, P. and Camps, N. (2009). Factors influencing the case-fatality rate of Legionnaires' disease. Int. J. Tuberc. Lung Dis., 13(3): 407-412.
Donohue, M.J., O'Connell, K., Vesper, S.J., Mistry, J.H., King, D., Kostich, M. and Pfaller, S. (2014). Widespread molecular detection of Legionella pneumophila serogroup 1 in cold water taps across the United States. Environ. Sci. Technol., 48(6): 3145-3152.
Donohue, M.J., Mistry, J.H., Donohue, J.M., Oconnell, K., King, D., Byran, J., Covert, T. and Pfaller, S. (2015). Increased frequency of nontuberculous mycobacteria detection at potable water taps within the United States. Environ. Sci. Technol., 49(10): 6127-6133.
Donohue, M.J. and Wymer, L. (2016). Increasing prevalence rate of nontuberculous mycobacteria infections in five states, 2008-2013. Annals of the American Thoracic Society, 13(12): 2143-2150.
Donohue, M.J., Vesper, S., Mistry, J. and Donohue, J.M. (2019a). Impact of chlorine and chloramine on the detection and quantification of Legionella pneumophila and Mycobacterium species. Appl. Environ. Microbiol., 85(24): e01942-19.
Donohue, M.J., King, D., Pfaller, S. and Mistry, J.H. (2019b). The sporadic nature of Legionella pneumophila, Legionella pneumophila Sg1 and Mycobacterium avium occurrence within residences and office buildings across 36 states in the United States. J. Appl. Microbiol., 126(5): 1568–1579.
ECDC (2017). European technical guidelines for the prevention, control and investigation, of infections caused by Legionella species. European Centre for Disease Prevention and Control (ECDC) and European Working Group for Legionella Infections (EWGLI). 125 pages. Consulté en mai 2021 à l’adresse : https://www.ecdc.europa.eu/en/publications-data/european-technical-guidelines-prevention-control-and-investigation-infections.
ECDC. (2018a). European Centre for Disease Prevention and Control. Shigellosis. In ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2018.
ECDC. (2018b). European Centre for Disease Prevention and Control. Yersiniosis. In ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2018.
ECDC. (2019). European Centre for Disease Prevention and Control. Salmonellosis. In ECDC. Annual epidemiological report for 2016. Stockholm: ECDC; 2019.
Edberg, S.C., Browne, F.A. and Allen, M.J. (2007). Issues for microbial regulation: Aeromonas as a model. Crit. Rev. Microbiol., 33(1): 89-100.
Edelstein, P.H. and Roy, C.R. (2015). Legionnaires' disease and Pontiac fever. In Mandell, Douglas, and Bennett's principles and practice of infectious diseases. Bennett, J.E. et al. (eds.). Saunders. Philadelphia, USA. p. 2633-2644.
Edelstein, P.H. (2007). Urine antigen tests positive for Pontiac fever: Implications for diagnosis and pathogenesis. Clin Infect Dis, 44(2) : 229-231.
Egorov, A.I., Best, J.M., Frebis, C.P. and Karapondo, M.S. (2011). Occurrence of Aeromonas spp. in a random sample of drinking water distribution systems in the USA. J. Water. Health., 9(4): 785-798.
Exner, M., Hartemann, P. and Lajoie, L (2007). Chapter 6. Health-care facilities. In Legionella and the prevention of legionellosis. Bartram, J. et al. (eds.). World Health Organization, Geneva, Switzerland. p. 89-102.
Fagan-Garcia, K., Geary, J., Chang, H.-J., McAlpine, L., Walker, E., Colquhoun, A., Van Zanten, S.V., Girgis, S., Archie, B., Hanley, B., Corriveau, A., Morse, J., Munday, R., Goodman, K.J. (2019). Burden of disease from Helicobacter pylori infection in western Canadian Arctic communities. BMC Public Health, 19 (1), art. no. 730.
Falkinham, J.O. (2004). Environmental sources of Mycobacterium avium linked to routes of exposure. In Pathogenic mycobacteria in water A guide to public health consequences, monitoring and management. Pedley, S. et al (eds.). IWA Publishing. World Health Organization, Geneva, Switzerland. p. 26-38.
Falkinham, J.O.,3rd (2015a). Common features of opportunistic premise plumbing pathogens. Int. J. Environ. Res. Public. Health., 12(5): 4533-4545.
Falkinham, J.O., III (2015b). Environmental sources of nontuberculous mycobacteria. Clinics in Chest Medicine, 36(1): 35-41.
Falkinham, J.O. (2015c). The Mycobacterium avium complex and slowly growing mycobacteria. In Molecular medical microbiology: Second edition. Elsevier Ltd, London, UK. p. 1669-1678.
Falkinham, J.O.,3rd (2016a). Current epidemiologic trends of the nontuberculous mycobacteria (NTM). Curr Environ Health Rep, 3(2): 161-167.
Falkinham, J.O. (2016b). Nontuberculous mycobacteria: Community and nosocomial waterborne opportunistic pathogens. Clin. Microbiol. Newsl., 38(1): 1-7.
Falkinham III, J.O., Norton, C.D. and Lechevallier, M.W. (2001). Factors influencing numbers of Mycobacterium avium, Mycobacterium intracellulare, and other mycobacteria in drinking water distribution systems. Appl. Environ. Microbiol., 67(3): 1225-1231.
Falkinham, J.O. III, Hilborn, E.D., Arduino, M.J., Pruden, A. and Edwards, M.A. (2015a). Epidemiology and ecology of opportunistic premise plumbing pathogens: Legionella pneumophila, Mycobacterium avium, and Pseudomonas aeruginosa. Environ. Health Perspect., 123(8): 749-758.
Falkinham, J.O., Pruden, A. and Edwards, M. (2015b). Opportunistic premise plumbing pathogens: Increasingly important pathogens in drinking water. Pathogens, 4(2): 373-386.
Feazel, L.M., Baumgartner, L.K., Peterson, K.L., Frank, D.N., Harris, J.K. and Pace, N.R. (2009). Opportunistic pathogens enriched in showerhead biofilms. Proceedings of the National Academy of Sciences of the United States of America, 106(38): 16393-16398.
Fields, B.S., Haupt, T., Davis, J.P., Arduino, M.J., Miller, P.H. and Butler, J.C. (2001). Pontiac fever due to Legionella micdadei from a whirlpool spa: Possible role of bacterial endotoxin. J. Infect. Dis., 184(10): 1289-1292.
Fields, B.S., Benson, R.F. and Besser, R.E. (2002). Legionella and Legionnaires' disease: 25 years of investigation. Clin. Microbiol. Rev., 15(3): 506-526.
Fisman, D.N., Lim, S., Wellenius, G.A., Johnson, C., Britz, P., Gaskins, M., Maher, J., Mittleman, M.A., Spain, C.V., Haas, C.N. and Newbern, C. (2005). It's not the heat, it's the humidity: Wet weather increases legionellosis risk in the greater Philadelphia metropolitan area. J. Infect. Dis., 192(12): 2066-2073.
Fleury, M., Charron, D.F., Holt, J.D., Allen, O.B. and Maarouf, A.R. (2006). A time series analysis of the relationship of ambient temperature and common bacterial enteric infections in two Canadian provinces. Int. J. Biometeorol., 50 (6): 385-391.
Ford, T., Hermon-Taylor, J., Nichols, G., Cangelosi, G. and Bartram, J. (2004). Approaches to risk management in priority setting. In Pathogenic mycobacteria in Water—A guide to public health consequences, monitoring and management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland. p. 169-178.
Fredriksson-Ahomaa, M. and Korkeala, H. (2003). Low occurrence of pathogenic Yersinia enterocolitica in clinical, food, and environmental samples: A methodological problem. Clin. Microbiol. Rev., 16(2): 220-229.
Fredriksson-Ahomaa, M. (2015). Enteropathogenic Yersinia spp. In Zoonoses-infections affecting humans and animals: Focus on public health aspects. Sing, A. (ed.). Springer. Dordrecht. p. 213-234.
Fredriksson-Ahomaa, M. (2017). Yersinia enterocolitica. In Foodborne diseases: Third edition. Yersinia enterocolitica. Dodd, C. et al. (eds.). Academic Press. Cambridge, USA. p. 223-233.
Friedman, M., Ashbolt, J., Hanson, A., Meteer, L. and Ureta, A. (2017). Chapter 3: Understanding and managing biofilm, coliform occurrence, and the microbial community. Manual of water supply practices M68– Water quality in distribution systems. American Water Works Association, Denver, CO., p. 39-80.
Gagnon, G.A., Baribeau, H., Rutledge, S.O., Dumancic, R., Oehmen, A., Chauret, C. and Andrews, S. (2008). Disinfectant efficacy in distribution systems: a pilot-scale assessment. J. Water Supply Res. Technol. AQUA, 57(7): 507–518.
Gaia, V., Fry, N.K., Afshar, B., Lück, P.C., Meugnier, H., Etienne, J., Peduzzi, R. and Harrison, T.G. (2005). Consensus sequence-based scheme for epidemiological typing of clinical and environmental isolates of Legionella pneumophila. J. Clin. Microbiol., 43 (5):2047-2052.
Galanis, E., Mak, S., Otterstatter, M., Taylor, M., Zubel, M., Takaro, T.K., Kuo, M. and Michel, P. (2014). The association between campylobacteriosis, agriculture and drinking water: A case-case study in a region of British Columbia, Canada, 2005-2009. Epidemiol. Infect., 142 (10): 2075-2084.
Gargano, J.W., Adam, E.A., Collier, S.A., Fullerton, K.E., Feinman, S.J. and Beach, M.J. (2017). Mortality from selected diseases that can be transmitted by water—United States, 2003-2009. J. Water Health, 15(3): 438-450.
Garner, E., Brown, C.L., Schwake, D.O., Rhoads, W.J., Arango-Argoty, G., Zhang, L., Jospin, G., Coil, D.A., Eisen, J.A., Edwards, M.A. and Pruden, A. (2019). Comparison of whole-genome sequences of Legionella pneumophila in tap water and in clinical strains, Flint, Michigan, USA, 2016. Emerg. Infect. Dis., 25(11): 2013-2020.
Garrison, L.E., Kunz, J.M., Cooley, L.A., Moore, M.R., Lucas, C., Schrag, S., Sarisky, J. and Whitney, C.G. (2016). Vital signs: Deficiencies in environmental control identified in outbreaks of Legionnaires’ disease—North America, 2000–2014. Am. J. Transplant., 16 (10): 3049-3058.
Garvey, M., Thokala, N. and Rowan, N. (2014). A comparative study on the pulsed UV and the low-pressure UV inactivation of a range of microbial species in water. Water Environ. Res., 86(12): 2317-2324.
Gavriel, A.A., Landre, J.P.B. and Lamb, A.J. (1998). Incidence of mesophilic Aeromonas within a public drinking water supply in north-east Scotland. J. Appl. Microbiol., 84(3): 383-392.
Gebert, M.J., Delgado-Baquerizo, M., Oliverio, A.M., Webster, T.M., Nichols, L.M., Honda, J.R., Chan, E.D., Adjemian, J., Dunn, R.R. and Fierer, N. (2018). Ecological analyses of mycobacteria in showerhead biofilms and their relevance to human health. mBio, 9(5).
George, K.L., Parker, B.C., Gruft, H. and Falkinham III, J.O. (1980). Epidemiology of infection by nontuberculous mycobacteria. II. Growth and survival in natural waters. Am. Rev. Respir. Dis., 122 (1): 89-94.
Gerba, C.P., Nwachuku, N. and Riley, K.R. (2003). Disinfection resistance of waterborne pathogens on the United States Environmental Protection Agency's Contaminant candidate list (CCL). J. Water Supply Res. T., 52(2): 81-94.
Ghenghesh, K.S., Ahmed, S.F., El-Khalek, R.A., Al-Gendy, A. and Klena, J. (2008). Aeromonas-associated infections in developing countries. J. Infect. Dev. Countr., 2(2): 81-98.
Gillespie, S., Lipphaus, P., Green, J., Parsons, S., Weir, P., Juskowiak, K., Jefferson, B., Jarvis, P. and Nocker, A. (2014). Assessing microbiological water quality in drinking water distribution systems with disinfectant residual using flow cytometry. Water Res., 65: 224–234.
Gilmour, M.W., Bernard, K., Tracz, D.M., Olson, A.B., Corbett, C.R., Burdz, T., Ng, B., Wiebe, D., Broukhanski, G., Boleszczuk, P., Tang, P., Jamieson, F., Van Domselaar, G., Plummer, F.A. and Berry, J.D. (2007). Molecular typing of a Legionella pneumophila outbreak in Ontario, Canada. J. Med. Microbiol., 56(3): 336-341.
Goldberg, D., Collier, P., Fallon, R., Mckay, T., Markwick, T., Wrench, J., Emslie, J., Forbes, G., Macpherson, A. and Reid, D. (1989). Lochgoilhead fever: Outbreak of non-pneumonic legionellosis due to Legionella micdadei. Lancet, 333(8633): 316-318.
Gora, S.L., Anaviapik Soucie, T., McCormick, N.E., Ontiveros, C.C., L’Hérault, V., Gavin, M., Trueman, B.F., Campbell, J. Stoddard, A.K. and Gagnon, G.A. (2020). Microbiological water quality in a decentralized Arctic drinking water system. Environ. Sci.: Water Res. Technol., 6(7): 1855–1868.
Gorski, L., Rivadeneira, P. and Cooley, M.B. (2019). New strategies for the enumeration of enteric pathogens in water. Env. Microbiol. Rep., 11 (6): 765-776.
Goudot, S., Herbelin, P., Mathieu, L., Soreau, S., Banas, S. and Jorand, F.P.A. (2014). Biocidal efficacy of monochloramine against planktonic and biofilm-associated Naegleria fowleri cells. J. Appl. Microbiol., 116(4): 1055-1065.
Gouvernement du Québec. (2020). Régie du Bâtiment Québec. Québec, Canada. Consulté en février 2020 à l’adresse : https://www.rbq.gouv.qc.ca/domaines-dintervention/batiment/interpretation-directives-techniques-et-administratives/chapitre-batiment-du-code-de-securite/tours-de-refroidissement-a-leau-obligations-du-proprietaire.html
Government Inquiry into Havelock North Drinking Water. (2017). Havelock North drinking water inquiry: Stage 2. May 2017, Auckland, New Zealand. ISBN: 978-0-473-39743-2. Disponible à l’adresse : https://www.dia.govt.nz/stage-1-of-the-water-inquiry.
Graham, D.Y., Opekun, A.R., Osato, M.S., El-Zimaity, H.M.T., Lee, C.K., Yamaoka, Y., Qureshi, W.A., Cadoz, M. and Monath, T.P. (2004). Challenge model for Helicobacter pylori infection in human volunteers. Gut, 53(9): 1235-1243.
Graziani, C., Losasso, C., Luzzi, I., Ricci, A., Scavia, G. and Pasquali, P. (2017). Salmonella. In Foodborne diseases: Third edition. Dodd, C. et al. (eds.). Academic Press. Cambridge, USA. p. 133-169.
Greenberg, D., Chiou, C.C., Famigilleti, R., Lee, T.C. and Yu, V.L. (2006). Problem pathogens: Paediatric legionellosis-implications for improved diagnosis. Lancet Infect. Dis., 6(8): 529-535.
Griffin, I. Schmitz, A., Oliver, C., Pritchard, S., Zhang, G., Rico, E., Davenport, E., Llau, A., Moore, E., Fernandez, D., Mejia-Echeverry, A., Suarez, J., Noya-Chaveco, P., Elmir, S., Jean, R., Pettengill, J.B., Hollinger, K.A., Chou, K., Williams-Hill, D., .… and L. Rivera, L. (2019). Outbreak of Tattoo-associated nontuberculous mycobacterial skin infections. Clin Infect Dis. 69(6):949-955.
Griffith, D.E., Aksamit, T., Brown-Elliott, B.A., Catanzaro, A., Daley, C., Gordin, F., Holland, S.M., Horsburgh, R., Huitt, G., Iademarco, M.F., Iseman, M., Olivier, K., Ruoss, S., Von Reyn, C.F., Wallace Jr., R.J. and Winthrop, K. (2007). An official ATS/IDSA statement: Diagnosis, treatment, and prevention of nontuberculous mycobacterial diseases. Am. J. Resp. Crit. Care, 175 (4):367-416.
Grimont, P.A.D. and Weill, F-X. (2007). Antigenic formulae of the Salmonella serovars. 9th edition. WHO Collaborating Centre for Reference and Research on Salmonella. Institut Pasteur, Paris, France. Consulté en janvier 2020 à l’adresse : https://www.pasteur.fr/sites/default/files/veng_0.pdf
Guimaraes, A.J., Gomes, K.X., Cortines, J.R., Peralta, J.M. and Peralta, R.H.S. (2016). Acanthamoeba spp. as a universal host for pathogenic microorganisms: One bridge from environment to host virulence. Microbiol. Res., 193: 30-38.
Hallenbeck, W.H. and Brenniman, G.R. (1989). Risk of fatal amebic meningoencephalitis from waterborne Naegleria fowleri. Environ. Manage., 13(2): 227-232.
Halstrom, S., Price, P. and Thomson, R. (2015). Review: Environmental mycobacteria as a cause of human infection. Int. J. Mycobacteriology, 4(2): 81-91.
Hamilton, K.A., Weir, M.H. and Haas, C.N. (2017). Dose response models and a quantitative microbial risk assessment framework for the Mycobacterium avium complex that account for recent developments in molecular biology, taxonomy, and epidemiology. Water Res., 109: 310-326.
Handfield, M., Simard, P., Couillard, M. and Letarte, R. (1996). Aeromonas hydrophila isolated from food and drinking water: Hemagglutination, hemolysis, and cytotoxicity for a human intestinal cell line (HT-29). Appl. Environ. Microbiol., 62(9): 3459-3461.
Harris, N.B. and Barletta, R.G. (2001). Mycobacterium avium subsp. paratuberculosis in Veterinary Medicine. Clin. Microbiol. Rev., 14 (3):489-512
Havelaar, A.H., Schets, F.M., van Silfhout, A., Jansen, W.H., Wieten, G. and van der Kooij, D. (1992). Typing of Aeromonas strains from patients with diarrhoea and from drinking water. J. Appl. Bacteriol., 72(5): 435-444.
Hayes, S.L., White, K.M. and Rodgers, M.R. (2006). Assessment of the effectiveness of low-pressure UV light for inactivation of Helicobacter pylori. Appl. Environ. Microbiol., 72(5): 3763-3765.
Hayes, S.L., Sivaganesan, M., White, K.M. and Pfaller, S.L. (2008). Assessing the effectiveness of low-pressure ultraviolet light for inactivating Mycobacterium avium complex (MAC) micro-organisms. Lett. Appl. Microbiol., 47(5): 386-392.
Henkle, E., Hedberg, K., Schafer, S.D. and Winthrop, K.L. (2017). Surveillance of extrapulmonary nontuberculous mycobacteria infections, Oregon, USA, 2007–2012. Emerg. Infect. Dis., 23(10): 1627-1630.
Hermon-Taylor., J. and El-Zaatari, F.A.K. (2004). The Mycobacterium avium subspecies paratuberculosis problem and its relation to the causation of Crohn’s disease. In Pathogenic mycobacteria in Water—A guide to public health consequences, monitoring and management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland. p. 74-94.
Hijnen, W.A.M. and Medema, G.J. (2010). Elimination of micro-organisms by drinking water treatment processes. KWR Watercycle Research Institute. IWA Publishing, London, United Kingdom. p. 1-102.
Hijnen, W.A.M., Beerendonk, E.F. and Medema, G.J. (2011). Inactivation credit of UV radiation for viruses, bacteria and protozoan (oo)cysts in water: A review.). In Quantitative methods to assess capacity of water treatment to eliminate microorganisms. Hijnen, W.A.M ed.; KWR Watercycle Research Institute. IWA Publishing., London, United Kingdom.
Hilborn, E.D., Covert, T.C., Yakrus, M.A., Harris, S.I., Donnelly, S.F., Rice, E.W., Toney, S., Bailey, S.A. and Stelma Jr., G.N. (2006). Persistence of nontuberculous mycobacteria in a drinking water system after addition of filtration treatment. Appl. Environ. Microbiol., 72(9): 5864-5869.
Hlavsa, M.C., Cikesh, B.L., Roberts, V.A., Kahler, A.M., Vigar, M., Hilborn, E.D., Wade, T.J., Roellig, D.M., Murphy, J.L., Xiao, L., Yates, K.M., Kunz, J.M., Arduino, M.J., Reddy, S.C., Fullerton, K.E., Cooley, L.A., Beach, M.J., Hill, V.R. and Yoder, J.S. (2018). Outbreaks associated with treated recreational water—United States, 2000–2014. Am. J. Transplant., 18(7): 1815-1819.
Hoefsloot, W. et al. (2013). The geographic diversity of nontuberculous mycobacteria isolated from pulmonary samples: An NTM-NET collaborative study. European Respiratory Journal, 42(6): 1604-1613.
Holinger, E.P., Ross, K.A., Robertson, C.E., Stevens, M.J., Harris, J.K. and Pace, N.R. (2014). Molecular analysis of point-of-use municipal drinking water microbiology. Water Res., 49: 225-235.
Holme, R. (2003). Drinking water contamination in Walkerton, Ontario: Positive resolutions from a tragic event. Wat. Sci. Technol. 47 (3):1-6.
Hooi, J.K.Y., Lai, W.Y., Ng, W.K., Suen, M.M.Y., Underwood, F.E., Tanyingoh, D., Malfertheiner, P., Graham, D.Y., Wong, V.W.S., Wu, J.C.Y., Chan, F.K.L., Sung, J.J.Y., Kaplan, G.G. and Ng, S.C. (2017). Global Prevalence of Helicobacter pylori Infection: Systematic Review and Meta-Analysis. Gastroenterology, 153 (2): 420-429.
Hornei, B., Ewig, S., Exner, M., Tartakovsky, I., Lajoie, L., Dangendorf, F., Surman-Lee, S. and Fields, B. (2007). Chapter 1: Legionellosis. In Legionella and the prevention of legionellosis. Bartram, J. et. al. (eds.). World Health Organization, Geneva, Switzerland. p. 1-27.
Howden, B.P., Stuart, R.L., Tallis, G., Bailey, M. and Johnson, P.D.R. (2003). Treatment and outcome of 104 hospitalized patients with legionnaires’ disease. Internal Medicine Journal, 33(11): 484-488.
Hrudey, S. E. and Hrudey, E. (2004). Safe drinking water: Lessons from recent outbreaks in affluent nations. Safe drinking water: Lessons from recent outbreaks in affluent nations. IWA Publishing, London.
HSE. (2013a). Legionnaires’ Disease: Technical Guidance. HSG274 Part 1: The Control of Legionella Bacteria in Evaporative Cooling Systems. Health and Safety Executive, Government of the United Kingdom. London, UK. p. 1-57. Consulté en décembre 2018 à l’adresse : http://www.hse.gov.uk/pubns/books/hsg274.htm
HSE. (2013b). Legionnaires' Disease. The Control of Legionella Bacteria in Water Systems—Approved Code of Practice and Guidance. L8 (Fourth Edition). Health and Safety Executive, Government of the United Kingdom. London, UK. p. 1-28. Consulté en novembre 2018 à l’adresse : http://www.hse.gov.uk/pubns/books/l8.htm
HSE. (2014). Legionnaires’ Disease: Technical Guidance. HSG274 Part 2: The Control of Legionella Bacteria in Hot and Cold Water Systems. Health and Safety Executive, Government of the United Kingdom. London, UK. p. 1‑65. Consulté en décembre 2018 à l’adresse : http://www.hse.gov.uk/pubns/books/hsg274.htm
HSE. (2019). Legionella and Legionnaires' Disease – Frequently asked questions. Health and Safety Executive, Government of the United Kingdom. London, UK. Consulté en novembre 2018 à l’adresse : http://www.hse.gov.uk/legionnaires/faqs.htm#Testing-monitoring
Hsu, M.-S., Wu, M.-Y., Huang, Y.-T. and Liao, C.-H. (2016). Efficacy of chlorine dioxide disinfection to non-fermentative gram-negative bacilli and non-tuberculous mycobacteria in a hospital water system. Journal of Hospital Infection, 93(1): 22-28.
Huang, H., Brooks, B.W., Lowman, R. and Carrillo, C.D. (2015). Campylobacter species in animal, food, and environmental sources, and relevant testing programs in Canada. Can. J. Microbiol., 61(10): 701-721.
Hull, N.M., Holinger, E.P., Ross, K.A., Robertson, C.E., Harris, J.K, Stevens, M.J. and Pace, N.R. (2017). Longitudinal and Source-to-Tap New Orleans, LA, U.S.A. Drinking Water Microbiology. Environ. Sci. Technol., 51(8) : 4220–4229.
IARC Helicobacter pylori Working Group. (2014). Helicobacter pylori eradication as a strategy for preventing gastric cancer. International Agency for Research on Cancer, IARC Working Group Reports, No. 8, Lyon, France.
Ibranosyan, M., Beraud, L., Lemaire, H., Ranc, A-G., Ginevra, C., Jarraud, S. and Descours, G. (2019). The clinical presentation of Legionella arthritis reveals the mode of infection and the bacterial species: Case report and literature review. BMC Infect. Dis., 19(1) art. no. 864.
Ishii, S. and Sadowsky, M.J. (2008). Escherichia coli in the environment: Implications for water quality and human health. Microbes Environ., 23(2) : 101-108.
ISO. (2019). ISO ICS 07.100.20 – Microbiologie de l’eau. Organisation internationale de normalisation. Genève (Suisse). Consulté à l’adresse : https://www.iso.org/fr/ics/07.100.20/x/
Jacangelo, J.G., Patania, N.L., Trussell, R.R., Haas, C.N. and Gerba, C. (2002). Inactivation of waterborne emerging pathogens by selected disinfectants. AWWA Research Foundation and American Water Works Association, Denver, CO.
Jamil, A., Farooq, S. and Hashmi, I. (2017). Ozone disinfection efficiency for indicator microorganisms at different pH values and temperatures. Ozone Sci. Eng., 39(6): 407-416.
Janda, J.M. and Abbott, S.L. (2010). The genus Aeromonas: Taxonomy, pathogenicity, and infection. Clinical Microbiology Reviews, 23(1): 35-73.
Johnson, C.H., Rice, E.W. and Reasoner, D.J. (1997). Inactivation of Helicobacter pylori by chlorination. Appl. Environ. Microbiol., 63(12): 4969-4970.
Jones, T.F., Benson, R.F., Brown, E.W., Rowland, J.R., Crosier, S.C. and Schaffner, W. (2003). Epidemiologic investigation of a restaurant-associated outbreak of pontiac fever. Clin Infect Dis, 37(10) : 1292-1297.
Juárez, M.M., Tártara, L.I., Cid, A.G., Real, J.P., Bermúdez, J.M., Rajal, V.B. and Palma, S.D. (2018). Acanthamoeba in the eye, can the parasite hide even more? latest developments on the disease. Contact Lens and Anterior Eye, 41(3): 245-251.
Kaakoush, N.O., Castaño-Rodríguez, N., Mitchell, H.M. and Man, S.M. (2015). Global epidemiology of Campylobacter infection. Clinical Microbiology Reviews, 28(3): 687-720.
Kanamori, H., Weber, D.J. and Rutala, W.A. (2016). Healthcare outbreaks associated with a water reservoir and infection prevention strategies. Clin. Infect. Dis., 62(11): 1423-1435.
Katz, M.J., Parrish, N.M., Belani, A. and Shah, M. (2015). Recurrent Aeromonas bacteremia due to contaminated well water. Open Forum Infectious Diseases, 2(4).
Kaur, S. (2014). Chapter 9: Pathogenic mycobacteria and water. In Water and health. Singh, P.P. and Sharma, V. (eds.) Springer. India. p. 137-153.
Keithlin, J., Sargeant, J., Thomas, M.K. and Fazil, A. (2014a). Chronic sequelae of E. coli O157: Systematic review and meta-analysis of the proportion of E. coli O157 cases that develop chronic sequelae. Foodborne Pathog. Dis., 11 (2): 79-95.
Keithlin, J., Sargeant, J., Thomas, M.K. and Fazil, A. (2014b). Systematic review and meta-analysis of the proportion of Campylobacter cases that develop chronic sequelae. BMC Public Health, 14 (1), art. no. 1203: 1-19.
Keithlin, J., Sargeant, J.M., Thomas, M.K. and Fazil, A. (2015). Systematic review and meta-analysis of the proportion of non-typhoidal Salmonella cases that develop chronic sequelae. Epidemiol. Infect., 143: 1333–1351.
Kennedy, D. and Wilkinson, M.G. (2017). Application of flow cytometry to the detection of pathogenic bacteria. Curr. Issues Mol. Biol., 23 : 21-38.
Khajanchi, B.K., Fadl, A.A., Borchardt, M.A., Berg, R.L., Horneman, A.J., Stemper, M.E., Joseph, S.W., Moyer, N.P., Sha, J. and Chopra, A.K. (2010). Distribution of virulence factors and molecular fingerprinting of Aeromonas species isolates from water and clinical samples: Suggestive evidence of water-to-human transmission. Appl. Environ. Microbiol., 76(7): 2313-2325.
Kilvington, S., Gray, T., Dart, J., Morlet, N., Beeching, J.R., Frazer, D.G. and Matheson, M. (2004). Acanthamoeba keratitis: The role of domestic tap water contamination in the United Kingdom. Invest. Ophth. Vis. Sci., 45(1): 165-169.
King, D.N., Donohue, M.J., Vesper, S.J., Villegas, E.N., Ware, M.W., Vogel, M.E., Furlong, E.F., Kolpin, D.W., Glassmeyer, S.T. and Pfaller, S. (2016). Microbial pathogens in source and treated waters from drinking water treatment plants in the United States and implications for human health. Sci. Total Environ., 562: 987–995.
Knøchel, S. (1991). Chlorine resistance of motile Aeromonas spp. Water Sci. Technol., 24(2): 327-330.
Knox, N.C., Weedmark, K.A., Conly, J., Ensminger, A.W., Hosein, F.S. and Drews, S.J. (2017). Unusual Legionnaires' outbreak in cool, dry western Canada: An investigation using genomic epidemiology. Epidemiol. Infect., 145(2): 254-265.
Köhsler, M., Mrva, M. and Walochnik, J. (2016). Acanthamoeba. In Molecular parasitology: Protozoan parasites and their molecules. Walochnik, J. and Duchêne, M. (eds.). Springer. Vienna. p. 285-324.
Kothary, M.H. and Babu, U.S. (2001). Infective dose of foodborne pathogens in volunteers: A review. J. Food Safety, 21(1): 49-73.
Kuchta J.M., States S.J., McNamara A.M., Wadowsky R.M., and Yee R.B. (1983). Susceptibility of Legionella pneumophila to chlorine in tap water. Appl. Environ. Microbiol., 46:1134–1139
Kühn, I., Allestam, G., Huys, G., Janssen, P., Kersters, K., Krovacek, K. and Stenström, T-A. (1997). Diversity, persistence, and virulence of Aeromonas strains isolated from drinking water distribution systems in Sweden. Appl. Environ. Microbiol., 63(7): 2708-2715.
Kvalsvig, A., Baker, M.G., Sears, A. and French, N. (2013). Bacteria: Campylobacter. In Encyclopedia of food safety. Motarjemi, Y., Moy, G. and Todd, E. (eds.). Academic Press. Cambridge, USA. p. 369-380.
Lal, A., Hales, S., French, N., and Baker, M.G. (2012). Seasonality in human zoonotic enteric diseases: A systematic review. PLoS ONE, 7 (4), art. no. e31883.
Lande, L., Alexander, D.C., Wallace, R.J., Jr., Kwait, R., Iakhiaeva, E., Williams, M., Cameron, A.D.S., Olshefsky, S., Devon, R., Vasireddy, R., Peterson, D.D. and Falkinham, J.O., III (2019). Mycobacterium avium in community and household water, suburban Philadelphia, Pennsylvania, USA, 2010-2012. Emerg. Infect. Dis., 25(3): 473-481.
Langenberg, W., Rauws, E.A.J., Oudbier, J.H. and Tytgat, G.N.J. (1990). Patient-to-patient transmission of Campylobacter pylori infection by fiber optic gastroduodenoscopy and biopsy. J. Infect. Dis., 161(3) : 507-511.
Lau, H.Y. and Ashbolt, N.J. (2009). The role of biofilms and protozoa in Legionella pathogenesis: Implications for drinking water. J. Appl. Microbiol., 107 (2): 368-378.
Lavenir, R., Sanroma, M., Gibert, S., Crouzet, O., Laurent, F., Kravtsoff, J., Mazoyer, M-A. and Cournoyer, B. (2008). Spatio-temporal analysis of infra-specific genetic variations among a Pseudomonas aeruginosa water network hospital population: Invasion and selection of clonal complexes. J. Appl. Microbiol., 105(5):1491-1501.
Le Dantec, C., Duguet, J-P., Montiel, A., Dumoutier, N., Dubrou, S. and Vincent, V. (2002). Occurrence of mycobacteria in water treatment lines and in water distribution systems. Appl. Environ. Microbiol., 68(11): 5318-5325.
LeChevallier, M.W. (2004). Control, treatment and disinfection of Mycobacterium avium complex in drinking water. In Pathogenic mycobacteria in water—A guide to public health consequences, monitoring and management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland. pp: 143-168.
LeChevallier, M.W. (2019a). Monitoring distribution systems for Legionella pneumophila using Legiolert. AWWA Wat Sci., 1(1): e1122.
LeChevallier, M.W. (2019b). Occurrence of culturable Legionella pneumophila in drinking water distribution systems. AWWA Wat Sci., 1(3): e1139.
LeChevallier, M.W. (2020). Managing Legionella pneumophila in water systems. J. Am. Water Works Assoc., 112(2): 10–23.
LeChevallier, M.W. and Au, K.K. (2004). Water treatment and pathogen control: Process efficiency in achieving safe drinking water. IWA Publishing, London, UK, on behalf of the World Health Organization, Geneva, Switzerland.
LeChevallier, M.W., Evans, T.M., Seidler, R.J., Daily, O.P., Merrell, B.R., Rollins, D.M. and Joseph, S.W. (1982). Aeromonas sobria in chlorinated drinking water supplies. Microb. Ecol., 8(4): 325-333.
LeChevallier, M.W., Norton, C.D., Falkinham, III, J.O., Williams, M.D., Taylor, R.H. and Cowan, H.E. (2001). Occurrence and control of Mycobacterium avium complex. AWWA Research Foundation and American Water Works Association., Denver. CO.
LeChevallier, M.W., Schneider, O.D., Weinrich, L.A., Jjemba, P.K., Evans, P.J., Hooper, J.L. and Chappell, R.W. (2015a). An operational definition of biostability in drinking water. Water Research Foundation, Denver, Colorado.
LeChevallier, M.W., Schneider, O.D., Weinrich, L.A., Jjemba, P.K., Evans, P.J., Hooper, J.L. and Chappell, R.W. (2015b). Guidance manual for control of biostability in drinking water. Water Research Foundation, Denver, Colorado.
Leclerc, H. (2003). Relationships between common water bacteria and pathogens in drinking-water. In Heterotrophic plate counts and drinking-water safety. The significance of HPCs for water quality and human health. Bartram, J., Cotruvo, J., Exner, M., Fricker, C. and Glasmacher, A. (eds.). IWA Publishing, London, UK. p. 80–118.
Lee, G., Pan, W., Peñataro Yori, P., Paredes Olortegui, M., Tilley, D., Gregory, M., Oberhelman, R., Burga, R., Chavez, C.B. and Kosek, M. (2013). Symptomatic and asymptomatic Campylobacter infections associated with reduced growth in Peruvian children. PLoS Neglect. Trop. D., 7 (1), art. no. e2036.
Leoni, E., Catalani, F., Marini, S. and Dallolio, L. (2018). Legionellosis associated with recreational waters: A systematic review of cases and outbreaks in swimming pools, spa pools, and similar environments. Int. J. Env. Res. Pub. He., 15 (8), art. no. 1612.
Lévesque, S., Plante, P-L., Mendis, N., Cantin, P., Marchand, G., Charest, H., Raymond, F., Huot, C., Goupil-Sormany, I., Desbiens, F., Faucher, S.P., Corbeil, J. and Tremblay, C. (2014). Genomic characterization of a large outbreak of Legionella pneumophila serogroup 1 strains in Quebec City, 2012. PLoS ONE, 9(8).
Levy, K., Woster, A.P., Goldstein, R.S. and Carlton, E.J. (2016). Untangling the impacts of climate change on waterborne diseases: A systematic review of relationships between diarrheal diseases and temperature, rainfall, flooding, and drought. Environ. Sci. Technol., 50(10): 4905-4922.
Li, T., Abebe, L.S., Cronk, R. and Bartram, J. (2017). A systematic review of waterborne infections from nontuberculous mycobacteria in health care facility water systems. Int. J. Hyg. Envir. Heal., 220(3): 611-620.
Li, J., Zhu, Y., Wu, X. and Hoffmann, M.R. (2020). Rapid detection methods for bacterial pathogens in ambient waters at the point of sample collection: A brief review. Clin. Infect. Dis., 71:S84-S90.
Liu, D. (2014). Aeromonas. In Molecular medical microbiology: Second edition. Tang, Y-W. et al., eds. Elsevier Ltd. London, UK. p. 1099-1110.
Llewellyn, A.C., Lucas, C.E., Roberts, S.E., Brown, E.W., Nayak, B.S., Raphael, B.H. and Winchell, J.M. (2017). Distribution of Legionella and bacterial community composition among regionally diverse U.S. cooling towers. PLoS ONE, 12 (12).
Loret, J-F. and Greub, G. (2010). Free-living amoebae: Biological by-passes in water treatment. Int. J. Hyg. Envir. Heal., 213(3): 167-175.
Loret, J-F., Jousset, M., Robert, S., Anselme, C., Saucedo, G., Ribas, F., Martinez, L. et Catalan, V. (2008). Élimination des amibes libres par les procédés de traitement de l’eau potable. Journal Européen d’Hydrologie, 39(1) : 37-50.
Louisiana Department of Health and Hospitals (2013). Declaration of emergency: Minimum disinfectant residual in public water systems. Office of Public Health, State of Louisiana. Consulté en décembre 2021 à l’adresse : https://ldh.la.gov/assets/oph/EmergencyRule/EmergencyRule-MinimumDisinfectantResidualLevels.pdf
LPSN. (2019). List of prokaryote names with standing in nomenclature. Consulté en juin 2021 à l’adresse : www.bacterio.net.
Lu, J., Struewing, I., Yelton, S. and Ashbolt, N. (2015). Molecular survey of occurrence and quantity of Legionella spp., Mycobacterium spp., Pseudomonas aeruginosa and amoeba hosts in municipal drinking water storage tank sediments. J. Appl. Microbiol., 119(1): 278-288.
Lu, J., Struewing, I., Vereen, E., Kirby, A.E., Levy, K., Moe, C. and Ashbolt, N. (2016). Molecular detection of Legionella spp. and their associations with Mycobacterium spp., Pseudomonas aeruginosa and amoeba hosts in a drinking water distribution system. J. Appl. Microbiol., 120(2): 509-521.
Lund, V. (1996). Evaluation of E. coli as an indicator for the presence of Campylobacter jejuni and Yersinia enterocolitica in chlorinated and untreated oligotrophic lake water. Water Res., 30(6): 1528-1534.
Lüttichau, H.R., Vinther, C., Uldum, S.A., Møller, J., Faber, M. and Jensen, J.S. (1998). An outbreak of Pontiac fever among children following use of a whirlpool. Clin. Infect. Dis., 26(6): 1374-1378.
MacIntyre, C.R., Dyda, A., Bui, C.M. and Chughtai, A.A. (2018). Rolling epidemic of Legionnaires' disease outbreaks in small geographic areas. Emerg. Microbes Infect., 7(1): 36.
Magnet, A., Galván, A.L., Fenoy, S., Izquierdo, F., Rueda, C., Fernandez Vadillo, C., Pérez-Irezábal, J., Bandyopadhyay, K., Visvesvara, G.S., Da Silva, A.J. and Del Aguila, C. (2012). Molecular characterization of Acanthamoeba isolated in water treatment plants and comparison with clinical isolates. Parasitol. Res., 111(1): 383-392.
Mao, G., Song, Y., Bartlam, M. and Wang, Y. (2018). Long-term effects of residual chlorine on Pseudomonas aeruginosa in simulated drinking water fed with low AOC medium. Front. Microbiol., 9(MAY).
Marciano-Cabral, F. and Cabral, G.A. (2007). The immune response to Naegleria fowleri amebae and pathogenesis of infection. FEMS Immunol. Med. Mic., 51(2): 243-259.
Marras, T.K., Mendelson, D., Marchand-Austin, A., May, K. and Jamieson, F.B. (2013). Pulmonary nontuberculous mycobacterial disease, Ontario, Canada, 1998-2010. Emerg. Infect. Dis., 19(11): 1889-1891.
Marrie, T.J., De Carolis, E., Yu, V.L. and Stout, J. (2003). Legionnaires' disease - results of a multicentre Canadian study. Can. J. Infect. Dis., 14(3): 154-158.
Massa, S., Armuzzi, R., Tosques, M., Canganella, F. and Trovatelli, L.D. (1999). Note: Susceptibility to chlorine of Aeromonas hydrophila strains. J. Appl. Microbiol. 86 (1):169-173.
Masters, S., Clancy, J., Villegas, S., LeChevallier, M. and Bukhari, Z (2019). Customer Messaging on Plumbing System Issues. Project #4664. Water Research Foundation Denver, Colo.
Mathys, W., Stanke, J., Harmuth, M. and Junge-Mathys, E. (2008). Occurrence of Legionella in hot water systems of single-family residences in suburbs of two German cities with special reference to solar and district heating. Int. J. Hyg. Environ. Heal., 211 (1-2): 179-185.
Matysiak-Budnik, T., Briet, F., Heyman, M. and Mégraud, F. (1995). Laboratory-acquired Helicobacter pylori infection. Lancet, 346(8988): 1489-1490.
McDermott, P.F., Zhao, S. and Tate, H. (2018). Antimicrobial Resistance in Nontyphoidal Salmonella. Microbiology spectrum, American Society for Microbiology. 6(4):1-26.
McDonough, E.A., Metzgar, D., Hansen, C.J., Myers, C.A. and Russell, K.L. (2007). A cluster of Legionella-associated pneumonia cases in a population of military recruits. J. Clin. Microbiol., 45(6): 2075-2077.
MDHHS. (2016). Legionellosis outbreak-Genesee County, June, 2014 – March, 2015. Full analysis. Michigan Department of Health and Human Services, MI. Consulté en novembre 2018 à l’adresse : www.michigan.gov.
Medema, G.J., Wondergem, E., Van Dijk-Looyaard, A.M. and Havelaar, A.H. (1991). Effectivity of chlorine dioxide to control Aeromonas in drinking water distribution systems. Water Sci. Technol., 24(2): 325-326.Mégraud, F. and Lehours, P. (2007). Helicobacter pylori detection and antimicrobial susceptibility testing (2007) Clin. Microbiol. Rev., 20 (2): 280-322.
Mercante, J.W. and Winchell, J.M. (2015). Current and emerging Legionella diagnostics for laboratory and outbreak investigations. Clin. Microbiol. Rev., 28(1): 95-133.
Mir, R.A. and Kudva, I.T. (2019). Antibiotic-resistant Shiga toxin-producing Escherichia coli: An overview of prevalence and intervention strategies. Zoonoses Public Hlth., 66 (1): 1-13.
Missouri Department of Health and Senior Services (2010). Communicable Disease Surveillance 2010 Annual Report.
Moore, M., and Shelton, S. 2014. Updated guidelines for the control of Legionella in Western Pennsylvania. Allegheny County Health Department Pittsburgh Regional Health Initiative. https://www.rand.org/content/dam/rand/pubs/external_publications/EP60000/EP66197/RAND_EP66197.pdf.
Moore, E.R.B., Tindall, B.J., Martins Dos Santos, V.A.P., Pieper, D.H., Ramos, J-L. and Palleroni, N.J. (2006a). Nonmedical: Pseudomonas. In The Prokaryotes—A handbook on the biology of bacteria. Third edition. Volume 4: Bacteria: Firmicutes, Cyanobacteria. Dworkin, M. et al., eds. Springer, Singapore. p. 646-703.
Moore, M.R., Pryor, M., Fields, B., Lucas, C., Phelan, M. and Besser, R.E. (2006b). Introduction of monochloramine into a municipal water system: Impact on colonization of buildings by Legionella spp. Appl. Env. Microbiol. 72 (1):378-383.
Moreira, N.A. and Bondelind, M. (2017). Safe drinking water and waterborne outbreaks. J. Water. Health., 15(1): 83-96.
Moreno, Y., Piqueres, P., Alonso, J.L., Jiménez, A., González, A. and Ferrús, M.A. (2007). Survival and viability of Helicobacter pylori after inoculation into chlorinated drinking water. Water Res., 41(15): 3490-3496.
Morgan, D.R., Johnson, P.C., DuPont, H.L., Satterwhite, T.K. and Wood, L.V. (1985). Lack of correlation between known virulence properties of Aeromonas hydrophila and enteropathogenicity for humans. Infect. Immun., 50(1) : 62-65.
Mraz, A.L. and Weir, M.H. (2018). Knowledge to predict pathogens: Legionella pneumophila lifecycle critical review Part I Uptake into host cells. Water (Switzerland), 10(2), 132.
Murphy, H.M., Thomas, M.K., Schmidt, P.J., Medeiros, D.T., McFadyen, S. and Pintar, K.D.M. (2016). Estimating the burden of acute gastrointestinal illness due to Giardia, Cryptosporidium, Campylobacter, E. coli O157 and norovirus associated with private wells and small water systems in Canada. Epidemiol. Infect., 144 (7): 1355-1370.
Naja, F., Kreiger, N. and Sullivan, T. (2007). Helicobacter pylori infection in Ontario: Prevalence and risk factors. Can. J. Gastroenterol., 21 (8):501-506.
NASEM. (2020). Management of Legionella in Water Systems. National Academies of Sciences, Engineering, and Medicine. Washington, DC. The National Academies Press. https://doi.org/10.17226/25474.
Neil, K. and Berkelman, R. (2008). Increasing incidence of legionellosis in the United States, 1990-2005: Changing epidemiologic trends. Clin. Infect. Dis., 47(5): 591-599.
Neu, L. and Hammes, F. (2020). Feeding the building plumbing microbiome: The importance of synthetic polymeric materials for biofilm formation and management. Water, 12(64): 1774.
NHMRC, NRMMC. (2011). Australian drinking water guidelines 6—national water quality management strategy. National Health and Medical Research Council, National Resource Management Ministerial Council, Commonwealth of Australia, Canberra.
Nichols, G., Ford, T., Bartram, J., Dufour, A. and Portaels, F. (2004). Introduction. In Pathogenic mycobacteria in water—A guide to public health consequences, monitoring and management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland. p. 1-14.
Nichols, G., Lake, I. and Heaviside, C. (2018). Climate change and water-related infectious diseases. Atmosphere, 9(10).
Nishiuchi, Y., Iwamoto, T. and Maruyama, F. (2017). Infection sources of a common non-tuberculous mycobacterial pathogen, Mycobacterium avium complex. Front. Med., 4(MAR).
Norton, C.D., LeChevallier, M.W. and Falkinham III, J.O. (2004). Survival of Mycobacterium avium in a model distribution system. Water Res., 38(6): 1457-1466.
NSF/ANSI. (2018). Standard 244—Drinking Water Treatment Units-Supplemental Microbiological Water Treatment Systems-Filtration. NSF International, Ann Arbor, Michigan
NSF/ANSI. (2019). Standard 55—Ultraviolet microbiological water treatment systems. NSF International, Ann Arbor, Michigan.
NSF/ANSI. (2020). Standard 60- Drinking water treatment chemicals: Health effects. NSF International, Ann Arbor, Michigan.
O’Connor, D.R. (2002a). Report of the Walkerton inquiry, Part one: The events of May 2000 and related issues. Ontario Ministry of the Attorney General (ISBN: 0-7794-2559-6).
O’Connor, D.R. (2002b). Report of the Walkerton inquiry, Part two report: A strategy for safe drinking water. Ontario Ministry of the Attorney General (ISBN: 0-7794-2621-5)
OMS. (2011). Sécurité sanitaire de l’eau dans les bâtiments. Genève (Suisse).
OMS. (2017a). Directives de qualité pour l’eau de boisson : quatrième édition intégrant le premier additif. Genève, Organisation mondiale de la Santé, 2017.
Orkis, L.T., Harrison, L.H., Mertz, K.J., Brooks, M.M., Bibby, K.J. and Stout, J.E. (2018). Environmental sources of community-acquired Legionnaires’ disease: A review. Int. J. Hyg. Environ. Heal., 221 (5):764-774.
Orta de Velásquez, M. T., Yáñez Noguez, I., Casasola Rodríguez, B. and Román Román, P.I. (2017). Effects of ozone and chlorine disinfection on VBNC Helicobacter pylori by molecular techniques and FESEM images. Environ. Technol., 38(6) : 744-753.
O'Ryan, M., Vidal, R., Del Canto, F., Salazar, J.C. and Montero, D. (2015). Vaccines for viral and bacterial pathogens causing acute gastroenteritis: Part II: Vaccines for Shigella, Salmonella, enterotoxigenic E. coli (ETEC) enterohemorragic E. coli (EHEC) and Campylobacter jejuni. Hum. Vacc. and Immunother., 11(3): 601-619.
Padrnos, L.J., Blair, J.E., Kusne, S., Dicaudo, D.J. and Mikhael, J.R. (2014). Cutaneous legionellosis: Case report and review of the medical literature. Transplant Infect. Dis., 16(2): 307-314.
Palusińska-Szysz, M. and Cendrowska-Pinkosz, M. (2009). Pathogenicity of the family Legionellaceae. Arch. Immunol. Ther. Ex., 57(4): 279-290.
Park, J., Kim, J.S., Kim, S., Shin, E., Oh, K-H., Kim, Y., Kim, C.H., Hwang, M.A., Jin, C.M., Na, K., Lee, J., Cho, E., Kang, B-K., Kwak, H-S., Seong, W.K. and Kim, J. (2018). A waterborne outbreak of multiple diarrhoeagenic Escherichia coli infections associated with drinking water at a school camp. Int. J. Infect. Dis., 66: 45-50.
Park, S.R., Mackay, W.G. and Reid, D.C. (2001). Helicobacter sp. recovered from drinking water biofilm sampled from a water distribution system. Water Res., 35(6): 1624-1626.
Percival, S.L. and Williams, D.W. (2014a). Aeromonas. In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK, p. 49-64.
Percival, S.L. and Williams, D.W. (2014b). Campylobacter. In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK, p. 65-78.
Percival, S.L. and Williams, D.W. (2014c). Escherichia coli. In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK, p. 89-117.
Percival, S.L. and Williams, D.W. (2014d). Helicobacter pylori . In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd., Oxford, UK, p. 119-154.
Percival, S.L. and Williams, D.W. (2014e). Legionella. In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK, p. 155-175.
Percival, S.L. and Williams, D.W. (2014f). Mycobacterium. In Microbiology of waterborne diseases. Second edition. Elsevier Ltd., Oxford, UK, p. 177-207.
Percival, S.L. and Williams, D.W. (2014g). Salmonella. In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK, p. 209-222.
Percival, S.L. and Williams, D.W. (2014h). Shigella. In Microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK, p. 223-236.
Percival, S.L. and Williams, D.W. (2014i). Yersinia. In Microbiology of waterborne diseases. Second edition. Elsevier Ltd., Oxford, UK, p. 249-259.
Petrisek, R. and Hall, J. (2018). Evaluation of a most probable number method for the enumeration of Legionella pneumophila from North American potable and nonpotable water samples. J. Water Health, 16 (1), p. 57-69.
Piersimoni, C. and Scarparo, C. (2009). Extrapulmonary infections associated with nontuberculous mycobacteria in immunocompetent persons. Emerg. Infect. Dis., 15(9): 1351-1358.
Posteraro, B., Posteraro, P. and Sanguinetti, M. (2015). Helicobacter pylori. In Molecular medical microbiology: Second edition. Elsevier Ltd, London, UK. p. 1237-1258.
Prussin, A.J., II, Schwake, D.O. and Marr, L.C. (2017). Ten questions concerning the aerosolization and transmission of Legionella in the built environment. Build. Environ., 123 : 684-695.
Pryor, M., Springthorpe, S., Riffard, S., Brooks, T., Huo, Y., Davis, G. and Sattar, S.A. (2004). Investigation of opportunistic pathogens in municipal drinking water under different supply and treatment regimes. Water Sci. Technol., 50(1): 83-90.
Purdue University. (2020). Flushing Plans. Centre for Plumbing Safety, Purdue University. West Lafayette, Indiana. Consulté en mai 2021 à l’adresse : https://engineering.purdue.edu/PlumbingSafety/resources/flushing-plans
Qin, K., Struewing, I., Domingo, J.S., Lytle, D. and Lu, J. (2017). Opportunistic pathogens and microbial communities and their associations with sediment physical parameters in drinking water storage tank sediments. Pathogens, 6(4): 54.
Quilliam, R.S., Williams, A.P., Avery, L.M., Malham, S.K. and Jones, D.L. (2011). Unearthing human pathogens at the agricultural-environment interface: A review of current methods for the detection of Escherichia coli O157 in freshwater ecosystems. Agric. Ecosyst. Environ., 140(3-4) : 354-360.
Radomski, N., Betelli, L., Moilleron, R., Haenn, S., Moulin, L., Cambau, E., Rocher, V., Gonçalves, A. and Lucas, F.S. (2011). Mycobacterium behavior in wastewater treatment plant, a bacterial model distinct from Escherichia coli and enterococci. Environ. Sci. Technol., 45(12): 5380-5386.
Ramírez-Castillo, F.Y., Loera-Muro, A., Jacques, M., Garneau, P., Avelar-González, F.J., Harel, J. and Guerrero-Barrera, A.L. (2015). Waterborne pathogens: Detection methods and challenges. Pathogens, 4 (2): 307-334.
Rand, J.L., Gagnon, G.A. and Knowles, A. (2014). Establishing minimum free chlorine residual concentration for microbial control in a municipal drinking water distribution system. Water Pract. Technol., 9(4): 491–501.
Raphael, B.H., Baker, D.J., Nazarian, E., Lapierre, P., Bopp, D., Kozak-Muiznieks, N.A., Morrison, S.S., Lucas, C.E., Mercante, J.W., Musser, K.A. and Winchell, J.M. (2016). Genomic resolution of outbreak-associated Legionella pneumophila serogroup 1 isolates from New York State. Appl. Environ. Microbiol., 82(12): 3582-3590.
Rasheed, S., Hashmi, I. and Campos, L. (2016). Inactivation of Escherichia coli and Salmonella with chlorine in drinking waters at various pH and temperature levels. Proc. Pak. Acad. Sci., 53(2B): 83-92.
Ratnatunga, C.N., Lutzky, V.P., Kupz, A., Doolan, D.L., Reid, D.W., Field, M., Bell, S.C., Thomson, R.M. and Miles, J.J. (2020). The rise of non-tuberculosis mycobacterial lung disease. Front. Immunol., 11. no. 303.
Reuter, S., Sigge, A., Wiedeck, H. and Trautmann, M. (2002). Analysis of transmission pathways of Pseudomonas aeruginosa between patients and tap water outlets. Crit. Care Med., 30(10): 2222-2228.
Rhoads, W.J., Pruden, A. and Edwards, M.A. (2016). Survey of green building water systems reveals elevated water age and water quality concerns. Environ. Sci.: Wat. Res., 2 (1): 164-173.
Rhoads, W.J., Garner, E., Ji, P., Zhu, N., Parks, J., Schwake, D.O., Pruden, A. and Edwards, M.A. (2017). Distribution system operational deficiencies coincide with reported Legionnaires' disease clusters in Flint, Michigan. Environ. Sci. Technol., 51(20): 11986-11995.
Rice, E.W., Clark, R.M. and Johnson, C.H. (1999). Chlorine inactivation of Escherichia coli O157:H7. Emerg. Infect. Dis., 5(3): 461-463.
Richards, C.L., Broadaway, S.C., Eggers, M.J., Doyle, J., Pyle, B.H., Camper, A.K. and Ford, T.E. (2018). Detection of pathogenic and non-pathogenic bacteria in drinking water and associated biofilms on the Crow Reservation, Montana, USA. Microb. Ecol., 76(1): 52-63.
Robertson, P., Abdelhady, H. and Garduño, R.A. (2014a). The many forms of a pleomorphic bacterial pathogen-the developmental network of Legionella pneumophila. Front. Microbiol. 5, art. no. 670: 1-20.
Robertson, B.K., Harden, C., Selvaraju, S.B., Pradhan, S. and Yadav, J.S. (2014b). Molecular detection, quantification, and toxigenicity profiling of Aeromonas spp. in source- and drinking-water. Open Microbiol. J., 8(1): 32-39.
Robins-Browne, R.M., Holt, K.E., Ingle, D.J., Hocking, D.M., Yang, J. and Tauschek, M. (2016). Are Escherichia coli pathotypes still relevant in the era of whole-genome sequencing? Front. Cell. Infect. Mi., 6 (NOV), art. no. 141.
Rogues, A-M., Boulestreau, H., Lashéras, A., Boyer, A., Gruson, D., Merle, C., Castaing, Y., Bébear, C.M. and Gachie, J-P. (2007). Contribution of tap water to patient colonisation with Pseudomonas aeruginosa in a medical intensive care unit. J. Hosp. Infect., 67(1): 72-78.
Rohr, U., Weber, S., Michel, R., Selenka, F. and Wilhelm, M. (1998). Comparison of free-living amoebae in hot water systems of hospitals with isolates from moist sanitary areas by identifying genera and determining temperature tolerance. Appl. Environ. Microbiol., 64 (5), p. 1822-1824.
Rose, L.J., Rice, E.W., Hodges, L., Peterson, A. and Arduino, M.J. (2007). Monochloramine inactivation of bacterial select agents. Appl. Environ. Microbiol., 73(10): 3437-3439.
Roser, D.J., Van Den Akker, B., Boase, S., Haas, C.N., Ashbolt, N.J. and Rice, S.A. (2014). Pseudomonas aeruginosa dose response and bathing water infection. Epidemiol. Infect., 142(3): 449-462.
Roth, D.K. and Cornwell, D.A. (2018). DBP impacts from increased chlorine residual requirements. J. Am. Water Works Assoc., 110(2): 13–28.
Sabina, Y., Rahman, A., Ray, R.C. and Montet D. (2011). Yersinia enterocolitica: Mode of transmission, molecular insights of virulence, and pathogenesis of infection. J. Pathog. 2011. Article ID 429069.
Saetta, D., Richard, R., Leyva, C., Westerhoff, P. and Boyer, T.H. (2021). Data-mining methods predict chlorine-residuals in premise plumbing using low-cost sensors. AWWA Wat. Sci. 3(1), e1214.
Sanchez-Vargas, F.M., Abu-El-Haija, M.A. and Gomez-Duarte, O.G. (2011). Salmonella infections: An update on epidemiology, management, and prevention. Travel Med. Infect. Dis., 9(6): 263-277.
Santé Canada. (2019a). Parlons d’eau - Et puis, votre puits? Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada. Ottawa (Ontario). Disponible à l’adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/parlons-eau-puits.html
Santé Canada. (2019b). Recommandation pour la qualité de l’eau potable au Canada : document technique — Les protozoaires entériques : Giardia et Cryptosporidium. Bureau de la qualité de l’eau et de l’air, Direction générale de la santé environnementale et de la sécurité des consommateurs Santé Canada, Ottawa (Ontario). Disponible à l’adresse : https://www.canada.ca/fr/sante-canada/services/sante-environnement-milieu-travail/rapports-publications/qualite-eau/protozoaires-enteriques-giardia-cryptosporidium.html
Santé Canada. (2019c). Recommandations pour la qualité de l’eau potable au Canada : document technique – Les virus entériques. Bureau de la qualité de l’eau et de l’air, Direction générale de la santé environnementale et de la sécurité des consommateurs Santé Canada, Ottawa (Ontario). Disponible à l’adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-virus-enteriques.html
Santé Canada (2020a). Conseils sur la matière organique naturelle dans l’eau potable. Bureau de la qualité de l’eau et de l’air, Direction générale de la santé environnementale et de la sécurité des consommateurs Santé Canada, Ottawa (Ontario). Disponible à l’adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/conseils-matiere-organique-naturelle-eau-potable.html
Santé Canada (2020b). Recommandations pour la qualité de l’eau potable au Canada : document technique – chloramines. Bureau de la qualité de l’eau et de l’air, Direction générale de la santé environnementale et de la sécurité des consommateurs Santé Canada, Ottawa (Ontario). Disponible à l’adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-chloramines.html
Santé Canada. (2020c). Recommandations pour la qualité de l’eau potable au Canada : document technique – Escherichia coli. Bureau de la qualité de l’eau et de l’air, Direction générale de la santé environnementale et de la sécurité des consommateurs Santé Canada, Ottawa (Ontario). Disponible à l’adresse : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-escherichia-coli.html
Santé Canada (2021). Document conseil sur les aspects liés à la température de l’eau potable. Bureau de la qualité de l’eau et de l’air, Direction générale de la santé environnementale et de la sécurité des consommateurs Santé Canada, Ottawa (Ontario).
Santé Canada (2022). Conseils sur la surveillance de la stabilité biologique de l’eau potable dans les réseaux de distribution. Bureau de la qualité de l’eau et de l’air, Direction générale de la santé environnementale et de la sécurité des consommateurs Santé Canada, Ottawa (Ontario).
Santiago, P., Moreno, Y. and Ferrús, M.A. (2015). Identification of viable Helicobacter pylori in drinking water supplies by cultural and molecular techniques. Helicobacter, 20(4): 252-259.
Sarkar, P. and Gerba, C.P. (2012). Inactivation of Naegleria fowleri by chlorine and ultraviolet light. J. Am. Water Works Assoc., 104(3): 51-52.
Saxena, G., Bharagava, R.N., Kaithwas, G. and Raj, A. (2015). Microbial indicators, pathogens and methods for their monitoring in water environment. J. Water Health, 13(2): 319-339.
Scallan, E., Hoekstra, R. M., Angulo, F. J., Tauxe, R. V., Widdowson, M., Roy, S. L. and Griffin, P. M. (2011). Foodborne Illness Acquired in the United States—Major Pathogens. Emerg. Infect. Dis., 17(1), 7-15. https://dx.doi.org/10.3201/eid1701.p11101.
Schaffter, N. and Parriaux, A. (2002). Pathogenic-bacterial water contamination in mountainous catchments. Water Res., 36(1): 131-139.
Schiavano, G.F., De Santi, M., Sisti, M., Amagliani, G. and Brandi, G. (2018). Disinfection of Mycobacterium avium subspecies hominissuis in drinking tap water using ultraviolet germicidal irradiation. Environ.Technol. (United Kingdom), 39(24): 3221-3227.
Schulze-Robbecke, R. and Buchholtz, K. (1992). Heat susceptibility of aquatic mycobacteria. Appl. Environ. Microbiol., 58(6): 1869-1873.
Schwake, D.O., Garner, E., Strom, O.R., Pruden, A. and Edwards, M.A. (2016). Legionella DNA markers in tap water coincident with a spike in Legionnaires' disease in Flint, MI. Environ. Sci. Technol. Let., 3(9): 311-315.
Sebakova, H., Kozisek, F., Mudra, R., Kaustova, J., Fiedorova, M., Hanslikova, D., Nachtmannova, H., Kubina, J., Vraspir, P. and Sasek, J. (2008). Incidence of nontuberculous mycobacteria in four hot water systems using various types of disinfection. Can. J. Microbiol., 54(11): 891-898.
Segal, I., Otley, A., Issenman, R., Armstrong, D., Espinosa, V., Cawdron, R., Morshed, M.G. and Jacobson, K. (2008). Low prevalence of Helicobacter pylori infection in Canadian children: A cross-sectional analysis. Can. J. Gastroenterol., 22 (5):485-489.
Semenza, J.C. (2020). Cascading risks of waterborne diseases from climate change. Nat. Immunol., 21(5): 484-487.
Sen, K. and Rodgers, M. (2004). Distribution of six virulence factors in Aeromonas species isolated from US drinking water utilities: A PCR identification. J. Appl. Microbiol., 97(5): 1077-1086.
Sethi, A., Chaudhuri, M., Kelly, L. and Hopman, W. (2013). Prevalence of Helicobacter pylori in a First Nations population in northwestern Ontario. Can. Fam. Physician, 59 (4): e182-e187.
Schuster, C.J., Ellis, A.G., Robertson, W.J., Charron, D.F., Aramini, J.J., Marshall, B.J. and Medeiros, D.T. (2005). Infectious disease outbreaks related to drinking water in Canada, 1974-2001. Can. J. Public Health, 96(4): 254-255.
Sharma, S. and Upadhyay, V. (2020). Epidemiology, diagnosis & treatment of non-tuberculous mycobacterial diseases. Indian J. Med. Res., 152(3): 185-226.
Siddiqui, R., Ali, I.K.M., Cope, J.R. and Khan, N.A. (2016). Biology and pathogenesis of Naegleria fowleri. Acta Trop., 164 : 375-394.
Singh, R., Hamilton, K.A., Rasheduzzaman, M., Yang, Z., Kar, S., Fasnacht, A., Masters, S.V. and Gurian, P.L. (2020). Managing water quality in premise plumbing: Subject matter experts' perspectives and a systematic review of guidance documents. Water (Switzerland), 12 (2), art. no. 347.
Sisti, M., Albano, A. and Brandi, G. (1998). Bactericidal effect of chlorine on motile Aeromonas spp. in drinking water supplies and influence of temperature on disinfection efficacy. Lett. Appl. Microbiol., 26(5): 347-351.
Smeets, P., Rietveld, L., Hijnen, W., Medema, G. and Stenstrom, T. (2006). Efficacy of water treatment processes. In MicroRisk—microbiological risk assessment: A scientific basis for managing drinking water safety from source to tap. Avril 2006. Consulté en juin 2019 à l’adresse : www.kwrwater.nl
Smeets, P. W. M. H., Medema, G.J. and Van Dijk, J.C. (2009). The Dutch secret: How to provide safe drinking water without chlorine in the Netherlands. Drink. Water Eng. Sci., 2(1): 1-14.
Sobsey, M.D. (1989). Inactivation of health-related microorganisms in water by disinfection processes. Water Sci. Technol., 21(3): 179-195.
Soda, E.A. (2017). Vital signs: Health Care–Associated Legionnaires’ disease surveillance data from 20 states and a large metropolitan area—United States, 2015. MMWR Morb Mortal Wkly Rep, 66.
Solnick, J.V., Hansen, L.M., Canfield, D.R. and Parsonnet, J. (2001). Determination of the infectious dose of Helicobacter pylori during primary and secondary infection in rhesus monkeys (Macaca mulatta). Infect. Immun., 69(11) : 6887-6892.
Sommer, R., Lhotsky, M., Haider, T. and Cabaj, A. (2000). UV inactivation, liquid-holding recovery, and photoreactivation of Escherichia coli O157 and other pathogenic Escherichia coli strains in water. J. Food Prot., 63(8): 1015-1020.
Sood, G. and Parrish, N. (2017). Outbreaks of nontuberculous mycobacteria. Curr. Opin. Infect. Dis., 30(4): 404-409.
Spiegelman, J., Pedutem, T. and Francisco, M.J. (2020). Legionnaires’ disease cases at a large community hospital—common and underdiagnosed. Int. J. Environ. Res. Public Health, 17(1).
Spinale, J.M., Ruebner, R.L., Copelovitch, L. and Kaplan, B.S. (2013). Long-term outcomes of Shiga toxin hemolytic uremic syndrome. Pediatr. Nephrol., 28 (11):2097-2105.
Springston, J.P. and Yocavitch, L. (2017). Existence and control of Legionella bacteria in building water systems: A review. J. Occup. Environ. Hyg., 14(2): 124-134.
Sterk, A., Schijven, J., De Nijs, T. and De Roda Husman, A.M. (2013). Direct and indirect effects of climate change on the risk of infection by water-transmitted pathogens. Environ. Sci. Technol., 47 (22):12648-12660.
Stinear, T., Ford, T. and Vincent, V. (2004). Analytical methods for the detection of waterborne and environmental pathogenic mycobacteria. In Pathogenic mycobacteria in water. A guide to public health consequences, monitoring and management. Pedley, S. (ed.). IWA Publishing. World Health Organization., Geneva, Switzerland. p. 55-73.
Stout, J.E., YU, V.L., Yee, Y.C., Vaccarello, S., Diven, W. and Lee, T.C. (1992). Legionella pneumophila in residential water supplies: Environmental surveillance with clinical assessment for Legionnaires' disease. Epidemiol. Infect., 109(1): 49-57.
Stout, J.E., Koh, W-J. and Yew, W.W. (2016). Update on pulmonary disease due to non-tuberculous mycobacteria. Int. J. Infect. Dis., 45 : 123-134.
Surman-Lee, S., Fields, B., Hornei, B., Ewig, S., Exner, M., Tartakovsky, I., Lajoie, L., Dangendorf, F., Bentham, R., Cabanes, P.A., Fourrier, P., Trouvet, T. and France Wallet, F. (2007). Chapter 2: Ecology and environmental sources of Legionella. In Legionella and the prevention of legionellosis. Bartram, J. et.al. (eds.). World Health Organization, Geneva, Switzerland. p. 29-38.
Taylor, R.H., Falkinham III, J.O., Norton, C.D. and LeChevallier, M.W. (2000). Chlorine, chloramine, chlorine dioxide, and ozone susceptibility of Mycobacterium avium. Appl. Environ. Microbiol., 66(4): 1702-1705.
Tempark, T., Lueangarun, S., Chatproedprai, S. and Wananukul, S. (2013). Flood-related skin diseases: A literature review. Int. J. Dermatol., 52(10): 1168-1176.
Teunis, P. and Figueras, M.J. (2016). Reassessment of the enteropathogenicity of mesophilic Aeromonas species. Front. Microbiol., 7(Article 1395):1-12.
Teunis, P.F.M., van den Brandhof, W., Nauta, M., Wagenaar, J., van den Kerkhof, H. and van Pelt, W. (2005). A reconsideration of the Campylobacter dose - Response relation. Epidemiol. Infect., 133 (4): 583-592.
Teunis, P.F.M., Bonačić Marinović, A., Tribble, D.R., Porter, C.K. and Swart, A. (2018). Acute illness from Campylobacter jejuni may require high doses while infection occurs at low doses. Epidemics, 24:1-20.
Thomas, M.K., Charron, D.F., Waltner-Toews, D., Schuster, C., Maarouf, A.R. and Holt, J.D. (2006). A role of high impact weather events in waterborne disease outbreaks in Canada, 1975-2001. Int. J. Environ. Heal. R., 16 (3): 167-180.
Thomas, J.M. and Ashbolt, N.J. (2011). Do free-living amoebae in treated drinking water systems present an emerging health risk? Environ. Sci. Technol., 45(3): 860-869.
Thomson, R., Carter, R., Gilpin, C., Coulter, C. and Hargreaves, M. (2008) Comparison of methods for processing drinking water samples for the isolation of Mycobacterium avium and Mycobacterium intracellulare. Appl. Environ. Microbiol., 74, 3094–3098.
Thomson, R.M., Carter, R., Tolson, C., Coulter, C., Huygens, F. and Hargreaves, M. (2013). Factors associated with the isolation of nontuberculous mycobacteria (NTM) from a large municipal water system in Brisbane, Australia. BMC Microbiol., 13(1).
Todd, E.C.D. (2014). Bacteria: Yersinia enterocolitica and Yersinia pseudotuberculosis. In Encyclopedia of food safety. Volume 1. Academic Press, Cambridge, USA, p. 574-580.
Tossa, P., Deloge-Abarkan, M., Zmirou-Navier, D., Hartemann, P. and Mathieu, L. (2006). Pontiac fever: An operational definition for epidemiological studies. BMC Public Health, 6(1): 112.
TPSGC. (2016). Ingénierie mécanique 15161 – 2013 Lutte contre la Legionella dans les systèmes mécaniques. Norme destinée aux propriétaires d’immeubles, aux professionnels de la conception et au personnel d’exploitation des bâtiments. Travaux publics et Services gouvernementaux Canada. Gatineau (Québec). Consulté en juin 2019 à l’adresse : https://www.tpsgc-pwgsc.gc.ca/biens-property/legionella/index-fra.html
Tyrrel, S.F. and Quinton, J.N. (2003). Overland flow transport of pathogens from agricultural land receiving faecal wastes. J. Appl. Microbiol. Symp. Suppl., 94(32) : 87S-93S.
US EPA. (1989). National Primary Drinking Water Regulations; Filtration, Disinfection; Turbidity, Giardia lamblia, Viruses, Legionella, and Heterotrophic Bacteria; Final Rule. Part III. Federal Register, 54:124:27486. (29 juin 1989).
US EPA. (2001). Method 1605: Aeromonas in Finished Water by Membrane Filtration using Ampicillin-Dextrin Agar with Vancomycin (ADA-V). United States Environmental Protection Agency, Office of Water. Washington, DC. EPA-821-R-01-034.
US EPA. (2006a). Aeromonas: Human Health Criteria Document. United States Environmental Protection Agency, Office of Water. Washington, D.C. March 2006.
US EPA. (2006b). National primary drinking water regulations: Long term 2 enhanced surface water treatment rule. Final rule. Fed. regist., 71(3): 653–702.
US EPA. (2016). Technologies for Legionella control in premise plumbing systems: Scientific literature review. United States Environmental Protection Agency, Office of Water. Washington, DC. EPA 810-R-16-001. September 2016.
US EPA (2021a). Drinking water regulations. Drinking water requirements for states and public water systems. United States Environmental Protection Agency, Office of Water. Washington, DC. Consulté en août 2021 à l’adresse : https://www.epa.gov/dwreginfo/drinking-water-regulations
US EPA. (2021b). Public Engagements: Potential Revisions of the Microbial and Disinfection Byproducts Rules. United States Environmental Protection Agency, Office of Water. Washington, DC. Consulté en août 2021 à l’adresse : https://www.epa.gov/dwsixyearreview/public-engagements-potential-revisions-microbial-and-disinfection-byproducts-rules
van der Wielen, P. W. J. J. and van der Kooij, D. (2013). Nontuberculous mycobacteria, fungi, and opportunistic pathogens in unchlorinated drinking water in the Netherlands. Appl. Environ. Microbiol., 79(3): 825-834.
Vicuña-Reyes, J.P., Luh, J. and Mariñas, B.J. (2008). Inactivation of Mycobacterium avium with chlorine dioxide. Water Res., 42(6-7): 1531-1538.
Villegas, P. (2020). Brain-eating amoeba in city’s water supply kills 6-year-old, leads Texas to declare a disaster. The Washington Post. https://www.washingtonpost.com/
Vinnard, C., Longworth, S., Mezochow, A., Patrawalla, A., Kreiswirth, B.N. and Hamilton, K. (2016). Deaths related to nontuberculous mycobacterial infections in the United States, 1999-2014. Annals of the American Thoracic Society, 13(11): 1951-1955.
Visvesvara, G.S., Moura, H. and Schuster, F.L. (2007). Pathogenic and opportunistic free-living amoebae: Acanthamoeba spp.,Balamuthia mandrillaris, Naegleria fowleri, and Sappinia diploidea. FEMS Immunol. Med. Mic., 50(1): 1-26.
von Reyn, C.F., Pozniak, A., Haas, W. and Nichols, G. (2004). Disseminated infection, cervical adenitis and other MAC infections. In Pathogenic mycobacteria in water—A guide to public health consequences, monitoring and management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland, p. 95-103.
Waak, M.B., LaPara, T.M., Hallé, C. and Hozalski, R.M. (2018). Occurrence of Legionella spp. in water-main biofilms from two drinking water distribution systems. Environ. Sci. Technol., 52(14): 7630–7639.
Waddell, L.A., Rajic, A., Stärk, K.D.C. and McEwen, S.A. (2015). The zoonotic potential of Mycobacterium avium ssp. paratuberculosis: A systematic review and meta-analyses of the evidence. Epidemiol. Infect., 143 (15):3135-3157.
Waddell, L., Rajić, A., Stärk, K. and McEwen, S.A. (2016). Mycobacterium avium ssp. paratuberculosis detection in animals, food, water and other sources or vehicles of human exposure: A scoping review of the existing evidence. Prev. Vet. Med., 132:32-48.
Wagenaar, J.A., Newell, D.G., Kalupahana, R.S. and Lapo Mughini-Gras, L. (2015). Campylobacter: Animal reservoirs, human infections, and options for control. In Zoonoses-infections affecting humans and animals: Focus on public health aspects. Sing, A. (ed.). Springer. Dordrecht, Netherlands. p. 159-177.
Walker, J.T. (2018). The influence of climate change on waterborne disease and Legionella: A review. Perspect. Public Health, 138(5): 282-286.
Walser, S.M., Gerstner, D.G., Brenner, B., Höller, C., Liebl, B. and Herr, C.E.W (2014). Assessing the environmental health relevance of cooling towers - A systematic review of legionellosis outbreaks. Int. J. Hyg. Environ. Heal., 217 (2-3):145-154.
Wang, H., Edwards, M., Falkinham, J.O. and Pruden, A. (2012a). Molecular survey of the occurrence of Legionella spp., Mycobacterium spp., Pseudomonas aeruginosa, and amoeba hosts in two chloraminated drinking water distribution systems. Appl. Environ. Microbiol., 78(17): 6285-6294.
Wang, H., Masters, S., Hong, Y., Stallings, J., Falkinham, J.O.,3rd, Edwards, M.A. and Pruden, A. (2012b). Effect of disinfectant, water age, and pipe material on occurrence and persistence of Legionella, mycobacteria, Pseudomonas aeruginosa, and two amoebas. Environ. Sci. Technol., 46(21): 11566-11574.
Wang, H., Bédard, E., Prévost, M., Camper, A.K., Hill, V.R. and Pruden, A. (2017). Methodological approaches for monitoring opportunistic pathogens in premise plumbing: A review. Water Res., 117: 68-86.
Watson, C.L., Owen, R.J., Said, B., Lai, S., Lee, J.V., Surman-Lee, S. and Nichols, G. (2004). Detection of Helicobacter pylori by PCR but not culture in water and biofilm samples from drinking water distribution systems in England. J. Appl. Microbiol., 97(4): 690-698.
Weigel, K.M., Nguyen, F.K., Kearney, M.R., Meschke, J.S. and Cangelosi, G.A. (2017). Molecular viability testing of UV-inactivated bacteria. Appl. Environ. Microbiol., 83(10).
Weiss, D., Boyd, C., Rakeman, J.L., Greene, S.K., Fitzhenry, R., McProud, T., … and Varma, J.K. (2017). A large community outbreak of Legionnaires’ disease associated with a cooling tower in New York City, 2015. Public Health Rep., 132(2): 241-250.
Whiley, H., Keegan, A., Giglio, S. and Bentham, R. (2012). Mycobacterium avium complex - the role of potable water in disease transmission. J. Appl. Microbiol., 113(2): 223-232.
Whiley, H., van den Akker, B., Giglio, S. and Bentham, R. (2013). The role of environmental reservoirs in human campylobacteriosis. Int. J. Environ. Res. Public Health, 10(11): 5886-5907.
Whiley, H., Keegan, A., Fallowfield, H. and Bentham, R. (2014). Detection of Legionella, L. pneumophila and Mycobacterium avium complex (MAC) along potable water distribution pipelines. Int. J. Env. Res. Pub. He., 11(7): 7393-7405.
WHO. (2002). Guidelines for drinking-water quality Second Edition. Addendum: Microbiological agents in drinking water. World Health Organization, Geneva, Switzerland.
WHO. (2004). Pathogenic Mycobacteria in Water—A Guide to Public Health Consequences, Monitoring and Management. Pedley, S. et al., (eds). World Health Organization, Geneva, Switzerland.
WHO. (2007). Legionella and the prevention of legionellosis. Bartram, J. (ed.). World Health Organization, Geneva, Switzerland.
WHO. (2017b). Prioritization of pathogens to guide discovery, research and development of new antibiotics for drug-resistant bacterial infections, including tuberculosis. World Health Organization. Geneva, Switzerland. Consulté en octobre 2019 à l’adresse : https://www.who.int/medicines/areas/rational_use/prioritization-of-pathogens/en/
WHO and OECD (2003). Assessing Microbial Safety of Drinking Water – Improving approaches and methods. World Health Organization and Organisation for Economic Co-operation and Development. IWA Publishing, London UK. pp 1-295.
Williams, M.M., Chen, T., Keane, T., Toney, N., Toney, S., Armbruster, C.R., Ray Butler, R. and Arduino, M.J. (2011). Point-of-use membrane filtration and hyperchlorination to prevent patient exposure to rapidly growing mycobacteria in the potable water supply of a skilled nursing facility. Infect. Con. Hosp. Ep., 32(9) : 837-844.
Wilson, J., Aramini, J., Clarke, S., Novotny, M., Quist, M. et Keegan, V. (2009). Centre de collaboration nationale en santé environnementale Surveillance rétrospective des maladies reliées à l’eau potable au Canada, 1993-2008 : rapport final. Novometrix Research Inc. Moffat, Ontario. Consulté en juillet 2021 à l’adresse : https://ccnse.ca/sites/default/files/Surveillance_maladies_eau_potable_aout_2009.pdf
Wilson, R.E., Hill, R.L.R., Chalker, V.J., Mentasti, M., and Ready, D. (2018). Antibiotic susceptibility of Legionella pneumophila strains isolated in England and Wales 2007–17. J. Antimicrob. Chemoth., 73 (10): 2757-2761.
Wingender, J. and Flemming, H-C. (2004). Contamination potential of drinking water distribution network biofilms. Water Sci. Technol., 49(11-12): 277-286.
Winiecka-Krusnell, J., Wreiber, K., Von Euler, A., Engstrand, L. and Linder, E. (2002). Free-living amoebae promote growth and survival of Helicobacter pylori. Scand. J. Infect. Dis., 34(4): 253-256.
Wojcicka, L., Hofmann, R., Baxter, C., Andrews, R.C., Auvray, I., Lière, J., Miller, T., Chauret, C. and Baribeau, H. (2007). Inactivation of environmental and reference strains of heterotrophic bacteria and Escherichia coli O157:H7 by free chlorine and monochloramine. J. Water Supply Res. Technol. Aqua, 56(2): 137-150.
Wong, E.A. and Shin, G-A. (2015). Removal of Mycobacterium avium subspecies hominissuis (MAH) from drinking water by coagulation, flocculation and sedimentation processes. Lett. Appl. Microbiol., 60(3): 273-278.
Xue, Z., Hessler, C.M., Panmanee, W., Hassett, D.J. and Seo, Y. (2013). Pseudomonas aeruginosa inactivation mechanism is affected by capsular extracellular polymeric substances reactivity with chlorine and monochloramine. FEMS Microbiol. Ecol., 83(1): 101-111.
Yoder, J., Roberts, V., Craun, G.F., Hill, V., Hicks, L.A., Alexander, N.T., Radke, V., Calderon, R.L., Hlavsa, M.C., Beach, M.J. and Roy, S.L. (2008). Surveillance for waterborne disease and outbreaks associated with drinking water and water not intended for drinking—United States, 2005-2006. MMWR Surveill. Summ., 57(9): 39-62.
Yoder, J.S., Eddy, B.A., Visvesvara, G.S., Capewell, L. and Beach, M.J. (2010). The epidemiology of primary amoebic meningoencephalitis in the USA, 1962-2008. Epidemiol. Infect., 138(7): 968-975.
Yoder, J.S., Straif-Bourgeois, S., Roy, S.L., Moore, T.A., Visvesvara, G.S., Ratard, R.C., Hill, V.R., Wilson, J.D., Linscott, A.J., Crager, R., Kozak, N.A., Sriram, R., Narayanan, J., Mull, B., Kahler, A.M., Schneeberger, C., Da Silva, A.J., Poudel, M., Baumgarten, K.L., Xiao, L. and Beach, M.J. (2012a). Primary amebic meningoencephalitis deaths associated with sinus irrigation using contaminated tap water. Clin. Infect. Dis., 55(9): e7-e85.
Yoder, J.S., Verani, J., Heidman, N., Hoppe-Bauer, J., Alfonso, E.C., Miller, D., Jones, D.B., Bruckner, D., Langston, R., Jeng, B.H., Joslin, C.E., Tu, E., Colby, K., Vetter, E., Ritterband, D., Mathers, W., Kowalski, R.P., Acharya, N.R., Limaye, A.P., Leiter, C., Roy, S., Lorick, S., Roberts, J. and Beach, M.J. (2012b). Acanthamoeba keratitis: The persistence of cases following a multistate outbreak. Ophthalmic Epidemiology, 19(4): 221-225.
Yu, C.-P., Farrell, S.K., Robinson, B. and Chu, K.-H. (2008). Development and application of real-time PCR assays for quantifying total and aerolysin gene-containing Aeromonas in source, intermediate, and finished drinking water. Environ. Sci. Technol., 42(4): 1191-1200.
Zahran, S., McElmurry, S.P., Kilgore, P.E., Mushinski, D., Press, J., Love, N.G., Sadler, R.C. and Swanson, M.S. (2018). Assessment of the Legionnaires’ disease outbreak in Flint, Michigan. Proceedings of the National Academy of Sciences of the United States of America, 115(8): E1730-E1739.
Zamani, M., Ebrahimtabar, F., Zamani, V., Miller, W.H., Alizadeh-Navaei, R., Shokri-Shirvani, J. and Derakhshan, M.H. (2018). Systematic review with meta-analysis: the worldwide prevalence of Helicobacter pylori infection. Aliment. Pharm. Therap., 47 (7):868-876.
Zaongo, S.D., Shaio, M.-F. and Ji, D.-D. (2018). Effects of culture media on Naegleria fowleri growth at different temperatures. J. Parasitol., 104 (5):451-456.
Zautner, A.E., Masanta, W.O. (2016). Campylobacter: Health Effects and Toxicity. In Encyclopedia of Food and Health. Caballero, B. et al. (eds.). Academic Press, Cambridge, USA. p. 596-601.
Zhang, Y.Q., Wu, Q.P., Zhang, J.M., Yang, X.H. (2015). Effects of ozone on the cytomembrane and ultrastructure of Pseudomonas aeruginosa. Food Sci. Biotechnol., 24(3): 987-993.
Zimmer, J.L. and Slawson, R.M. (2002). Potential repair of Escherichia coli DNA following exposure to UV radiation from both medium- and low-pressure UV sources used in drinking water treatment. Appl. Environ. Microbiol., 68 (7): 3293-3299.
Zimmer-Thomas, J.L., Slawson, R.M. and Huck, P.M. (2007). A comparison of DNA repair and survival of Escherichia coli O157:H7 following exposure to both low- and medium- pressure UV irradiation. J. Water Health, 5(3): 407-415.
Zuma, F.N., Lin, J. and Jonnalagadda, S.B. (2009). Kinetics of inactivation of Pseudomonas aeruginosa in aqueous solutions by ozone aeration. J. Environ. Sci. Health Part A Toxic Hazard. Subst. Environ. Eng., 44(10): 929-935.
Partie D. Annexes
Annexe A : Listes d’abréviations
- ADN
- acide désoxyribonucléique
- ANSI
- American National Standards Institute
- ASHRAE
- American Society of Heating, Refrigerating, and Air-Conditioning Engineers
- ASPC
- Agence de la santé publique du Canada
- BLSE
- β-lactamases à spectre élargi
- CAG
- charbon actif en granulés
- CCN
- Conseil canadien des normes
- CDC
- Centers for Disease Control and Prevention
- CEP
- Comité (fédéral-provincial-territorial) sur l’eau potable
- CIRC
- Centre international de recherche sur le cancer
- CNP
- Code national de la plomberie (Canada)
- CT
- concentration (C) x temps (T)
- CVC
- chauffage, ventilation et climatisation
- EAG
- encéphalite amibienne granulomateuse
- E. coli
- Escherichia coli
- ECAD
- Escherichia coli à adhésion diffuse
- ECEA
- Escherichia coli entéroagrégative
- ECEH
- Escherichia coli entérohémorragique
- ECEI
- Escherichia coli entéroinvasive
- ECEP
- Escherichia coli entéropathogène
- ECET
- Escherichia coli entérotoxinogène
- ECST
- Escherichia coli productrice de shigatoxines
- ECVT
- Escherichia coli vérotoxinogène
- EPA
- Environmental Protection Agency (États-Unis)
- EQMR
- Évaluation quantitative du risque microbien
- ISO
- Organisation internationale de normalisation
- KA
- kératite à Acanthamoeba
- MAP
- méningoencéphalite amibienne primitive
- MNT
- mycobactérie non tuberculeuse
- NASEM
- National Academies of Sciences, Engineering and Medicine
- NPBH
- numération sur plaque des bactéries hétérotrophes
- NSF
- NSF International
- OMS
- Organisation mondiale de la Santé
- PCR
- réaction en chaine de la polymérase
- PE
- point d’entrée
- PU
- point d’utilisation
- SHU
- syndrome hémolytique et urémique
- SIDA
- syndrome d’immunodéficience acquise
- spp.
- espèces
- UE
- Union européenne
- UFC
- unité formant colonie
- UV
- ultraviolet
- VIH
- virus de l’immunodéficience humaine
- VNC
- viable, mais non cultivable
| Agent pathogène | Espèces les plus fréquemment associées à une maladie humaine | Effets sur la santé | Groupes à risque élevé de maladie | Principaux réservoirs | Principal mode de transmission hydrique | Importance en tant qu’agent pathogène présent dans l’eau potable |
|---|---|---|---|---|---|---|
| Campylobacter spp. | C. jejuni et C. coli | Gastroentérite (symptômes : diarrhée aqueuse, abondante et parfois mêlée de sang; fièvre et douleurs abdominales). | Jeunes enfants, jeunes adultes et personnes âgées | Volaille, bovins, ovins et animaux de compagnie | Ingestion d’eau contaminée par des matières fécales | Bien documenté comme cause d’éclosions liées à de l’eau potable contaminée |
| Escherichia coli et Shigellaspp. pathogènes | Groupe des E. colientérohémorragiques (ECEH) Le sérotype O157:H7 d’E. Coli est prédominant. | Gastroentérite (symptômes : diarrhée aqueuse qui peut s’accompagner de pertes de sang, de nausées, de vomissements, de douleurs abdominales et de fièvre) Les maladies causées par les ECEH peuvent évoluer en syndrome hémolytique et urémique (SHU), potentiellement mortel, qui se traduit par une diminution des numérations globulaire et plaquettaire et une insuffisance rénale aigüe. |
Jeunes enfants et personnes âgées | Bovins et autres ruminants et humains | Ingestion d’eau potable contaminée par des matières fécales. | Bien documenté comme cause d’éclosions liées à de l’eau potable contaminée. |
| Shigella spp. : S. sonnei et S. flexneri | Gastroentérite (symptômes : diarrhée aqueuse qui peut s’accompagner de pertes de sang, de douleurs abdominales et de fièvre) | Jeunes enfants | Humains | Ingestion d’eau contaminée par des matières fécales | Rarement associés à des éclosions liées à la contamination de l’eau potable | |
| Helicobacter pylori | H. pylori | Gastrite superficielle asymptomatique Certaines infections évoluent en ulcères gastriques ou duodénaux. | Personnes vivant dans des zones densément peuplées ou dans des conditions d’hygiène médiocres. | Humains | L’ingestion d’eau contaminée par des matières fécales est suspectée comme étant un mode de transmission possible. | Il est nécessaire d’investiguer davantage sur l’importance de l’eau potable comme source d’infection. |
| Salmonella spp. | Les groupes de Salmonella non typhoïdiquesNote de bas de page a, notamment : les sérotypes S. Enteritidis et S. Typhimurium. | Gastroentérite (diarrhée, fièvre et douleurs abdominales). Cas graves chez les personnes immunodéprimées : l’Infection peut se répandre à d’autres parties du corps (p. ex. le sang, l’urine, les articulations et le cerveau) |
Jeunes enfants, personnes âgées et individus immunodéprimés | Poules, cochons, dinde et bovins | Ingestion d’eau contaminée par des matières fécales | Rarement associés à des éclosions liées à la contamination de l’eau potable |
| Yersinia spp. | Y. enterocolitica et Y. paratuberculosis | Gastroentérite de gravité variable selon la souche incriminée (symptômes : diarrhée qui peut s’accompagner de pertes de sang, de fièvre et de douleurs abdominales chez les enfants; symptômes similaires à ceux de l’appendicite chez les adultes) | Jeunes enfants, personnes âgées et individus immunodéprimés | Y. enterocolitica : Cochons, ruminants, chiens et chats Y. paratuberculosis : rongeurs et oiseaux |
Ingestion d’eau contaminée par des matières fécales | Rarement associés à des éclosions liées à la contamination de l’eau potable |
|
||||||
| Agent pathogène | Espèces les plus fréquemment associées à une maladie humaine | Effets sur la santé | Groupes à risque élevé de maladie | Principaux réservoirs | Principal mode de transmission hydrique | Importance en tant qu’agent pathogène présent dans l’eau potable |
|---|---|---|---|---|---|---|
| Aeromonas spp. | A. hydrophila , A. caviae, A. veronii (biotype sobria) et A. trota | Associées à des maladies et syndromes intestinaux et extra-intestinaux variés La gastroentérite est la maladie la plus commune (symptômes : diarrhée aqueuse accompagnée de fièvre légère, de vomissements et de douleurs abdominales). |
Jeunes enfants, personnes âgées et individus immunodéprimés | Bactéries ubiquitaires, présentes dans des habitats très variés, dont les milieux aquatiques, les sols, les espèces animales vertébrées et invertébrées, les insectes et la nourriture | Ingestion d’eau contaminée | Il est nécessaire d’investiguer davantage sur l’importance de l’eau potable comme source d’infection. |
| Legionella spp. | L. pneumophila (principalement le sérogroupe 1) | La maladie du légionnaire : maladie respiratoire grave provoquant une pneumonie Fièvre de Pontiac : maladie bénigne, similaire à la grippe, spontanément résolutive et non pulmonaire Autres maladies (extrêmement rares) : infections extrapulmonaires touchant la peau et les tissus mous |
Adultes à partir de 40 50 ans, fumeurs, personnes immunodéprimées ou atteintes de maladies sous-jacentes | Protozoaire libre potentiellement présent dans les biofilms dans la nature et dans les réseaux conçues pour la distribution de l'eau et les équipements (grandes installations de plomberie, tours de refroidissement, réseaux de distribution d’eau potable) | Inhalation d’aérosols contaminés générés par des raccords et des équipements associés à des installations de plomberie, des systèmes de CVC et des dispositifs d’humidification. | Bien documenté comme une cause d’éclosions liées à des réseaux de distribution d’eau (tours de refroidissement, installations de plomberie) de grands édifices (le plus souvent des hôpitaux, des établissements de soins de longue durée, des hôtels et des complexes touristiques) |
| Mycobacterium spp. | Groupe des mycobactéries non tuberculeuses (MNT), en particulier : le complexe M. avium (CMA) : M. avium et ses sous-espèces, M. intracellulare et M. chimaera |
Maladie pulmonaire Symptômes : toux persistante, asthénie et sueurs nocturnes. Dans les cas graves, chez les personnes immunodéprimées, l’infection peut se répandre à d’autres parties du corps (p. ex. les articulations, le foie et le cerveau) Autres maladies : adénopathie cervicale et infections de la peau et des tissus mous |
Individus immunodéprimés ou atteints de troubles respiratoires sous-jacents | Sols, habitats aquatiques, biofilms se formant dans les réseaux conçues pour la distribution de l'eau (installations de plomberie, réseaux de distribution d’eau potable) | Inhalation d’aérosols contaminés générés par des raccords et des équipements associés à des installations de plomberie et des dispositifs d’humidification | Aucune éclosion rapportée en lien avec la contamination de l’eau potable L’eau contaminée peut constituer une importante source d’infection dans des conditions spécifiques (p. ex. des établissements de soins de santé) pour les groupes de personnes à risque |
| Pseudomonas spp. | P. aeruginosa | Infections respiratoires (symptômes : fièvre, frissons, toux et respiration difficile); infections touchant la peau, les yeux, les oreilles et l’appareil urinaire | Personnes immunodéprimées ou atteintes de maladies sous-jacentes (en particulier la mucoviscidose), patients qui reçoivent des soins utilisant des dispositifs invasifs ou qui présentent des brulures ou des traumatismes pénétrants (incisions chirurgicales, plaies) | Bactérie ubiquitaire présente dans des habitats très variés, dont le sol, les milieux aquatiques, la végétation et les biofilms qui se forment dans lréseaux conçues pour la distribution de l'eau (circuits de plomberie) | Contact corporel direct avec de l’eau contaminée ou des instruments médicaux en contact avec de l’eau contaminée provenant de réseaux conçues pour la distribution de l'eau | Aucune éclosion rapportée en lien avec la contamination de l’eau potable L’eau contaminée peut constituer une importante source d’infection dans des conditions spécifiques (p. ex. des établissements de soins de santé) pour les groupes de personnes à risque |
| Acanthamoeba spp. | Génotype T4 d’Acanthamoeba | Kératite à Acanthamoeba (KA), une maladie menaçant la vision (symptômes : vision floue, fortes douleurs et photosensibilité élevée; évolution en cas graves : ulcération de la cornée, gonflement de l’œil, glaucome, cataractes et cécité) | Porteurs de lentilles de contact | Ubiquitaires dans le sol et l’eau; présent également dans les biofilms se formant dans les réseaux conçues pour la distribution de l'eau et les équipements (circuits de plomberie, réseaux de distribution d’eau potable, tours de refroidissement) et dans les poussières en suspension dans l’air | Contact des yeux avec des lentilles exposées à de l’eau contenant des bactéries durant le nettoyage, l’entreposage ou le port de ces lentilles | L’incidence de la maladie est très faible Peuvent servir d’hôtes à des bactéries pathogènes, comme les Legionella et les mycobactéries non tuberculeuses |
| Naegleria spp. | N. fowleri | Méningoencéphalite amibienne primitive (symptômes similaires à ceux d’une méningite virale ou bactérienne : maux de tête, fièvre, nausées et vomissements; évolution : raideur de la nuque, altération des facultés mentales, hallucinations occasionnelles, coma); infections presque toujours mortelles. | Enfants et jeunes adultes participant à des activités de loisir aquatiques, lors desquelles les bactéries sont présentes; personnes procédant à des irrigations nasales avec de l’eau non stérile | Milieux d’eau douce chaude (lacs, rivières, sources thermales) et sols Peuvent s’adapter pour croitre dans des biofilms se formant dans les réseaux de distribution d’eau et les installations de plomberie, si les conditions sont favorables (températureoptimale de développement, absence de désinfectants) |
Contact intranasal avec de l’eau contaminée durant des activités de plongée, de natation, de baignade ou de pataugeage ou lors d’irrigations nasales | L’incidence de la maladie est très faible Les bactéries ont causé des infections et ont été isolés à partir de réseaux de canalisations d’eau essentiellement dans des zones climatiques subtropicales. Peuvent servir d’hôtes à des bactéries pathogènes, comme les Legionella et les mycobactéries non tuberculeuses |
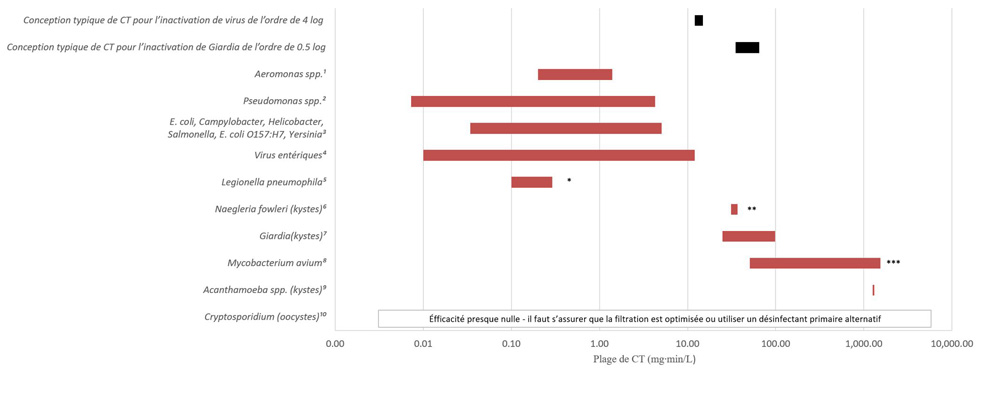
Équivalent textuel
1Massa et coll., 1999, Gerba et coll., 2003
2Perez-Recuerda et coll., 1998; Xue et coll., 2013
3Hoff, 1986; Lund et coll., 1996; Johnson et coll., 1997; Perez-Recuerda et coll., 1998; Rice et coll., 1999; Baker et coll., 2002; Wojcicka et coll., 2007; Rasheed et coll., 2016
4Santé Canada, 2019c
5Buse et coll., 2019
6Sakar et Gerba, 2012
7Santé Canada, 2019b
8Taylor et coll., 2000
9Loret et coll., 2008
10Santé Canada, 2019b
*inactivation de 3-4 log
**inactivation de 4 log
***inactivation de 3 log
Un graphique qui montre les valeurs CT requises pour une inactivation de 2 log de divers agents pathogènes d’origine hydrique utilisant le chlore libre. L’axe des X du graphique représente les valeurs CT exprimées en milligramme minutes par litre. Il est sur une échelle logarithmique et les valeurs de l’axe vont de 0,001 à 10 000. L’axe des ordonnées du graphique affiche différents agents pathogènes. Chaque agent pathogène est marqué avec une note de bas de page qui correspond aux références citées. Dans le graphique, les valeurs CT sont affichées sous forme de barres qui s’étendent de la valeur la plus basse à la valeur la plus élevée. En haut de l’axe des y, les conceptions typiques de CT pour l’inactivation de virus de l’ordre de 4 log et pour l’inactivation de Giardia de l’ordre de 0,5 log sont affichés. Les valeurs CT affichées sont 12-15 et 35-65, respectivement. Les valeurs CT affichées pour les agents pathogènes sont les suivantes : les espèces d’Aeromonas: 0,2 à 1,4; les espèces de Pseudomonas : 0,0073 à 4,3; E. coli, Campylobacter, Helicobacter, Salmonella, E. coli O157:H7 et Yersinia : 0,034 à 5,1; Les virus entériques : 0,01 à 12; Legionella pneumophila: 0,1 to 0,3; Les kystes de Naegleria fowleri : 31 à 37; Les kystes de Giardia : 25 à 99; Mycobacterium avium : 51 à 1 552; Les kystes d’espèces d’Acanthamoeba : 1 300; 10. Les oocystes de Cryptosporidium : Éfficacité presque nulle - il faut s’assurer que la filtration est optimisée ou utiliser un désinfectant primaire alternatif . Il y a un marqueur de note de bas de page à côté de la barre pour Legionella pneumophila pour indiquer que ces valeurs sont pour une inactivation de 3 à 4 log. Il y un marqueur de note de bas de page à côté de la barre pour les kystes de Naegleria fowleri pour indiquer que ces valeurs sont pour une inactivation de 4 log. Il y un marqueur de note de bas de page à côté de la barre pour Mycobacterium avium pour indiquer que ces valeurs sont pour une inactivation de 3 log. Les marqueurs de note de bas de page qui se trouve en dessous du graphique liste les références citées.
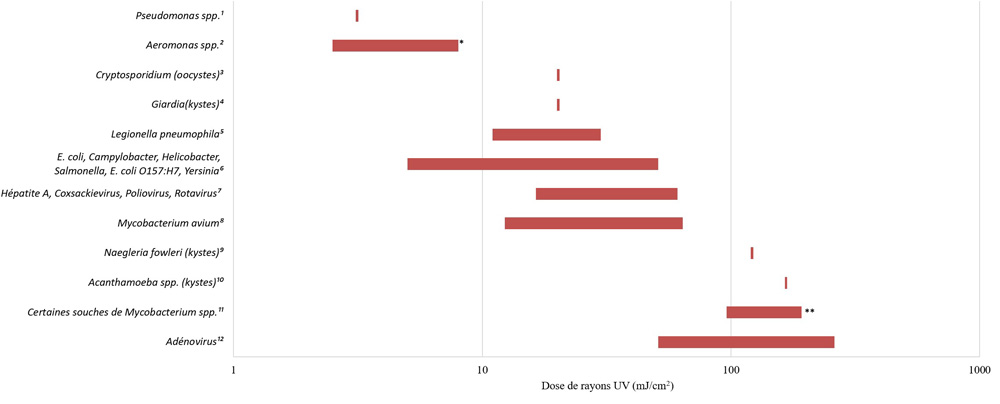
Équivalent textuel
1Clauβ, 2006
2Gerba et coll., 2003
3Santé Canada, 2019b
4Santé Canada, 2019b
5Hijnen et coll., 2011
6Zimmer et Slawson, 2002; Hayes et coll., 2006; Zimmer-Thomas et coll., 2007; Hijnen et coll., 2011
7Santé Canada, 2019c
8Hayes et coll., 2008; Schiavano et coll., 2018
9Sakar et Gerba, 2012
10Hijnen et coll., 2011
11Gerba et coll., 2003, Schiavano et coll., 2018
12Santé Canada, 2019c
*inactivation de 2 log
**inactivation de 2-5 log
Un graphique qui montre les doses d’UV requissent pour une inactivation de 4 log de divers agents pathogènes d’origine hydrique. L’axe des X du graphique représente la dose d’UV exprimées en millijoules par centimètre carré. Il est sur une échelle logarithmique et les valeurs de l’axe vont de 1 à 1 000. L’axe des ordonnées du graphique affiche différents agents pathogènes. Chaque agent pathogène est marqué avec une note de bas de page qui correspond aux références citées. Dans le graphique, les doses d’UV sont affichées sous forme de barres qui s’étendent de la valeur la plus basse à la valeur la plus élevée. Les doses d’UV affichées pour les agents pathogènes sont les suivantes : les espèces de Pseudomonas : 3,1; les espèces d’Aeromonas: 2,5 à 8; Les oocystes de Cryptosporidium : 22; Les kystes de Giardia : 22; Legionella pneumophila : 11 à 30; Le groupe de : E. coli, Campylobacter, Helicobacter, Salmonella, E. coli O157:H7 et Yersinia : 5 à 51; le virus de l’hépatite A, le virus Coxsackie, le poliovirus et le rotavirus 16,4 à 61; Mycobacterium avium : 12,3 à 64; les kystes de Naegleria fowleri : 121; Les kystes d’espèces d’Acanthamoeba: 167; Certaines souches d’espèces de Mycobacterium: 96 à 192; L’ Adenovirus : 51 à 261. Il y a un marqueur de notes de bas de page à côté de la barre pour les espèces d’Aeromonas pour montrer que ces valeurs sont pour une inactivation de 2 log. Il y a un marqueur de notes de bas de page à côté de la barre pour certaines souches des espèces de Mycobacterium pour montrer que ces valeurs sont pour une inactivation de 2 à 5 log. Les marqueurs de note de bas de page qui se trouve en dessous du graphique liste les références citées.
