Conseils sur la surveillance de la stabilité biologique de l’eau potable dans les réseaux de distribution

Télécharger le format de rechange
(Format PDF, 1.3 Mo, 45 pages)
Organisation :Santé Canada
Publiée : 2022-02-25
Renseignements généraux sur les documents de conseils
Santé Canada collabore avec les provinces, les territoires et les organismes fédéraux dans l'établissement des Recommandations pour la qualité de l'eau potable au Canada. Au fil des ans, de nouvelles méthodologies et approches ont mené Santé Canada, en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, à élaborer un nouveau type de document, les documents de conseils, pour fournir des conseils et des recommandations sur les questions liées à la qualité de l'eau potable, pour les paramètres qui ne nécessitent pas de recommandation officielle dans le cadre des Recommandations pour la qualité de l'eau potable au Canada.
Les documents de conseils sont élaborés afin de fournir des recommandations sur les activités ou les mesures de gestion liées à des questions précises qui concernent l'eau potable (p. ex. avis d'ébullition de l'eau), et rendre disponibles des renseignements sur l'évaluation des risques pour la santé lorsqu'une recommandation n'est pas jugée nécessaire.
Des recommandations sont formulées dans le cadre des Recommandations pour la qualité de l'eau potable au Canada expressément pour les contaminants qui satisfont à tous les critères suivants :
- l'exposition au contaminant pourrait mener à des effets nocifs pour la santé;
- le contaminant est fréquemment détecté dans un grand nombre de sources d'eau potable au Canada ou on pourrait s'attendre à ce qu'il le soit;
- le contaminant est détecté à une concentration pouvant avoir une importance sanitaire ou à laquelle on pourrait s'attendre à ce qu'il l'est.
Si un contaminant d'intérêt ne satisfait pas à tous ces critères, Santé Canada, en collaboration avec le Comité fédéral-provincial-territorial sur l'eau potable, peut décider de ne pas établir de recommandation chiffrée ou d'élaborer un document technique. Dans ce cas, un document de conseils peut être rédigé.
Les documents de conseils passent par un processus similaire à celui des documents techniques de recommandation, y compris des consultations publiques affichées dans le site Web de Santé Canada. Ils sont proposés à titre d'information pour les autorités responsables en matière d'eau potable et, dans certains cas, pour fournir des conseils en cas de déversement ou d'autres situations d'urgence.
La partie A de ce document fournit des conseils sur la surveillance de la stabilité biologique de l'eau potable dans les réseaux de distribution; la partie B fournit les informations scientifiques et techniques à l'appui de ces conseils; et la partie C fournit les références.
Résumé
Le réseau de distribution de l'eau potable est la dernière barrière de protection avant le robinet des consommateurs. Un réseau de distribution bien entretenu et bien exploité est donc un élément essentiel de l'approvisionnement en eau potable. Afin de maintenir la qualité de l'eau potable dans le réseau de distribution, il est essentiel de comprendre quand des changements se produisent. On doit recourir à une surveillance visant à évaluer la stabilité biologique de l'eau dans les réseaux de distribution.
Santé Canada a récemment terminé son examen de la stabilité biologique de l'eau potable dans les réseaux de distribution. Le présent document de conseil a été préparé en collaboration avec le CEP et décrit l'importance de la stabilité biologique dans les réseaux de distribution de l'eau potable, ainsi que les méthodes de surveillance et les pratiques exemplaires établies pour assurer une eau potable saine.
Évaluation
Les réseaux de distribution représentent un environnement complexe et dynamique, où peuvent se produire de nombreuses interactions et réactions physiques, chimiques et biologiques susceptibles d'avoir une incidence importante sur la qualité de l'eau. Par conséquent, diverses maladies, y compris les éclosions d'origine hydrique, ont été liées à la dégradation de la qualité de l'eau dans les réseaux de distribution. Malgré cela, les réseaux de distribution de l'eau potable et les changements de la stabilité biologique en leur sein ne sont généralement pas caractérisés ou bien compris. Le présent document vise à fournir aux intervenants, notamment les organismes de réglementation provinciaux et territoriaux, les décideurs, les propriétaires exploitants de réseau de distribution d'eau et les consultants, des conseils sur l'utilisation des méthodes de surveillance visant à évaluer la stabilité biologique de l'eau dans les réseaux de distribution. Le but est de réduire au minimum les risques pour la santé publique liés aux réseaux de distribution au Canada.
Table des matières
- Partie A. Orientation concernant la stabilité biologique de la qualité de l'eau potable dans les réseaux de distribution d'eau
- Partie B. Renseignements à l'appui
- B.1 Réseaux de distribution d'eau potable
- B.2 Causes de la détérioration de la qualité de l'eau
- B.3 Méthodes de surveillance et paramètres
- B.3.1 Surveillance de base
- B.3.2 Surveillance opérationnelle
- B.3.3 Méthodes avancées
- B.4 Programme de surveillance
- B.5 Stratégies de gestion
- B.6 Objectifs relatifs à la qualité de l'eau
- B.7 Risque microbien dans la plomberie des bâtiments
- B.8 Considérations internationales
- Partie C. Références
- Annexe A. Liste des acronymes
- Annexe B. Exemples d'éclosions de maladies infectieuses attribuables aux réseaux de distribution d'eau potablea
Partie A. Conseils sur la stabilité biologique de la qualité de l'eau potable de distribution d'eau dans les réseaux
A.1 Introduction
L'eau sortant d'une installation de traitement entre dans un vaste réseau de tuyaux (ou « conduites principales »), de vannes, de bornes d'incendie, de entrées de service et d'installations de stockage, le tout formant un réseau de distribution d'eau potable, avant d'atteindre le robinet des consommateurs. Idéalement, la qualité de l'eau dans un réseau de distribution devrait à peine changer. Cela se produit lorsque l'eau est « biologiquement stable ». Aux fins du présent document, la stabilité biologique (ou « biostabilité ») fait référence au fait de fournir aux consommateurs de l'eau potable qui est peu susceptible de soutenirune importante croissance microbienne, de sorte que la sécurité des consommateurs et l'aspect esthétique de l'eau ne sont pas affectés.
Les réseaux de distribution constituent un environnement complexe et dynamique, parfois désigné comme un « réacteur », où se produisent de nombreuses interactions et réactions physiques, chimiques et biologiques auxquelles participent des microorganismes, des nutriments et des particules. Ce mélange forme des biofilms et des dépôts mobiles qui peuvent entraîner une détérioration de la qualité de l'eau et causer divers problèmes, notamment des risques directs (p. ex. éclosions d'origine hydrique) ou autres (p. ex. exposition aux métaux) pour la santé et des problèmes esthétiques (p. ex. couleur, turbidité et goût ou odeur désagréable). Or, la détérioration de la qualité de l'eau qui se produit pendant sa distribution n'est généralement pas caractérisée ni bien comprise.
A.2 Portée et objectif
Le présent document vise à fournir aux autorités responsables, notamment les municipalités et les opérateurs de systèmes d'approvisionnement en eau potable, un aperçu des éléments suivants : 1) les causes de la détérioration de la qualité microbienne de l'eau dans les réseaux de distribution; 2) les outils de surveillance pouvant être utilisés pour évaluer la stabilité biologique; 3) les stratégies de gestion des réseaux de distribution. Bien que le présent document porte principalement sur les réseaux de distribution qui acheminent l'eau jusqu'aux bâtiments, nous traitons brièvement de la plomberie des bâtiments. Il est reconnu que la responsabilité d'un service de distribution d'eau n'inclut généralement pas les installations de plomberie.
La présente orientation remplace le document Conseils sur l'utilisation de la numération des bactéries hétérotrophes dans les approvisionnements d'eau potable au Canada (Santé Canada, 2012).
A.3 Causes de la détérioration de la qualité de l'eau
La détérioration de la qualité de l'eau dans les réseaux de distribution est due à une multitude de facteurs et de mécanismes. Le tableau 1 présente quelques-uns des facteurs et des mécanismes pouvant entraîner une détérioration de la qualité microbienne de l'eau.
| Facteur | Influence sur la qualité microbienne de l'eau dans les réseaux de distribution |
|---|---|
| Présence de microorganismes | Des microorganismes sont présents dans tous les réseaux de distribution d'eau potable, et la plupart d'entre eux se fixent aux parois internes des tuyaux, sous forme de biofilms et de dépôts mobiles, où ils sont protégés contre les désinfectants et d'autres menaces. |
| Type et disponibilité des nutriments | Un certain nombre de nutriments sont présents dans les réseaux de distribution d'eau potable et peuvent favoriser la croissance microbienne, soit en servant de combustible aux microorganismes, soit en consommant les résidus de désinfectant. Les biofilms et les dépôts mobiles constituent un grand réservoir de nutriments organiques dont les concentrations dépassent largement celles observées dans l'eau. |
| Température | La température de l'eau est l'un des facteurs les plus importants qui influent sur la dynamique microbienne dans les réseaux de distribution. Lorsque la température de l'eau est élevée, cela peut entraîner une augmentation de la croissance microbienne, soit directement, soit par l'entremise de la décomposition accélérée du désinfectant résiduel. En outre, les variations de température peuvent avoir une incidence sur la fixation microbienne. |
| Matériau et état de la tuyauterie | Des biofilms et des dépôts mobiles s'accumulent dans tous les réseaux de distribution, quel que soit le matériau dont sont faites les conduites. Cependant, la biomasse des biofilms est généralement plus faible dans les tuyaux en plastique que dans ceux en fer. Outre le matériau de la tuyauterie, l'état de celle ci peut avoir une incidence considérable sur la qualité de l'eau dans les réseaux de distribution. À mesure que les conduites vieillissent, elles deviennent sujettes aux fuites et aux bris et sont plus vulnérables à l'intrusion de contaminants. |
| Type et concentration du désinfectant résiduel | Le désinfectant résiduel possède des capacités différentes en matière de pouvoir désinfectant, de réactivité avec les matières organiques et inorganiques, de pénétration des biofilms et de potentiel de formation de sous-produits de désinfection. Quel que soit le type de désinfectant résiduel utilisé, la diminution de la concentration dans les réseaux de distribution d'eau potable est associée une croissance ou une revivification accrue. |
A.4 Méthodes et paramètres de surveillance
Comme les réseaux de distribution d’eau potable constituent en quelque sorte des « réacteurs », il est essentiel de surveiller l’évolution de la stabilité biologique, afin de réduire au minimum les risques potentiels pour les consommateurs. Cela a traditionnellement été fait en utilisant des indicateurs bactériens (p. ex. coliformes totaux et E. coli) et en surveillant la numération sur plaque des bactéries hétérotrophes (NPBH). Bien que ces méthodes soient utiles et fournissent des renseignements sur les variations de la qualité de l’eau qui peuvent avoir une incidence sur la stabilité biologique, elles comportent des limites importantes. Divers autres outils de surveillance peuvent être utilisés. Dans le présent document d’orientation, la surveillance est classée en trois catégories, c’est-à-dire : 1) de base; 2) opérationnelle; 3) de nature avancée. La surveillance de base correspond à la surveillance minimale recommandée pour les systèmes d’approvisionnement en eau potable, tandis que la surveillance opérationnelle fournit une compréhension de la dynamique des réseaux de distribution et des facteurs qui contribuent à la détérioration de la qualité de l’eau. Quant aux méthodes avancées, elles sont destinées aux services d’eau qui disposent des ressources nécessaires pour étudier la qualité de l’eau de façon plus détaillée; ces méthodes peuvent nécessiter l’établissement de partenariats entre les services d’eau et les universités ou les laboratoires commerciaux de pointe.
Les systèmes d'approvisionnement en eau potable devraient utiliser les mesures les plus appropriées, en fonction des ressources dont ils disposent, pour établir les conditions de référence, surveiller les changements et détecter les cas potentiels ou réels de contamination. Les plans de surveillance devraient être fondés sur une évaluation propre à chaque réseau et satisfaire aux exigences des autorités responsables de l'eau potable. Le tableau 2 présente les paramètres et les méthodes à prendre en considération.
Il est important que les services d'eau reconnaissent que bon nombre des paramètres énumérés (p. ex. désinfectant résiduel et turbidité) devraient déjà faire l'objet d'une surveillance dans le cadre d'une approche de type « de la source au robinet », pour produire une eau potable salubre. D'autres paramètres sont relativement faciles à utiliser et donnent des résultats rapides. Certaines méthodes sont avancées et seuls les grands services d'eau auront les ressources nécessaires pour les utiliser (p. ex. la cytométrie en flux). Une fois les données recueillies, il faut les analyser pour déterminer si la qualité de l'eau dans les réseaux de distribution varie et, le cas échéant, de quelle façon. Des objectifs relatifs à la qualité de l'eau peuvent alors être établis. Le plan de surveillance devrait également préciser les mesures à prendre si les objectifs relatifs à la qualité de l'eau ne sont pas atteints (p. ex. augmenter la concentration résiduelle de désinfectant).
| Type | Méthodes et paramètres suggérés |
|---|---|
| De base | Indicateurs bactériens (coliformes totaux et E. coli) |
| Désinfectant résiduel | |
| Turbidité | |
| Conductivité | |
| Pression | |
| De nature opérationnelle | Température |
| Activité microbiologique – numération sur plaque des bactéries hétérotrophes ou adénosine triphosphate | |
| pH | |
| Potentiel d'oxydoréduction | |
| Couleur (apparente et réelle) | |
| Concentration de nutriments | |
| Métaux (sous forme dissoute ou de particules) | |
| Taux de formation de biofilms | |
| Taux de corrosion | |
| De nature avancée | Cytométrie en flux |
| Méthodes moléculaires | |
| Autopsies de la tuyauterie et caractérisation des matières accumulées | |
| Modèles de réseaux de distribution d'eau |
A.5 Stratégies de gestion
Un réseau de distribution bien entretenu et bien exploité est un élément essentiel de l'approvisionnement en eau potable. Il est recommandé que les services d'eau établissent un plan de gestion pour comprendre l'incidence des réactions et des interactions biologiques et physico-chimiques complexes qui se produisent dans les réseaux de distribution sur la stabilité biologique et, par conséquent, la salubrité de l'eau potable. Les services d'eau peuvent avoir besoin d'une approche multidimensionnelle pour trouver un bon équilibre entre divers objectifs concomitants (p. ex. la qualité de l'eau et l'intégrité physique). Les stratégies de gestion seront propres à chaque réseau, en fonction de leur conception, de leur taille et de leur degré de complexité, ainsi que des exigences réglementaires. Les services d'eau sont responsables de déterminer et de gérer tous les risques pouvant être associés à chacun de leurs systèmes d'approvisionnement en eau potable. La partie B du présent document contient une orientation ayant pour but d'aider les services d'eau.
Partie B. Renseignements à l'appui
B.1 Réseaux de distribution d'eau potable
L'eau sortant d'une installation de traitement entre dans un vaste réseau de tuyaux (ou « conduites principales »), de vannes, de bornes d'incendie, de entrées de service et d'installations de stockage, le tout formant un réseau de distribution d'eau potable, avant d'atteindre le robinet des consommateurs. Idéalement, la qualité de l'eau devrait changer le moins possible pendant son trajet jusqu'au point de consommation. Cela se produit lorsque l'eau est « biologiquement stable ». Le concept de la stabilité biologique a été introduit pour la toute première fois dans les années 1980 (Rittmann et Snoeyink, 1984), et sa définition a été modifiée conformément à l'évolution des nouvelles approches de surveillance (Sibile, 1998; van der Kooij, 2000, 2003; Lautenschlager et coll., 2013; Prest et coll., 2016a). Aux fins du présent document, la stabilité biologique fait référence au fait de fournir aux consommateurs de l'eau potable qui est peu susceptible de soutenir une importante croissance microbienne, de sorte que la sécurité des consommateurs et l'aspect esthétique de l'eau ne sont pas affectés.
Pour atteindre la stabilité biologique, les services d'eau doivent produire une eau « biologiquement stable », et les réseaux de distribution doivent être exploités et entretenus de façon à réduire au minimum la détérioration de la qualité de l'eau. Il est important de reconnaître que l'eau traitée n'est pas stérile et contient des particules, des nutriments et une charge microbienne (figure 1) (Liu et coll., 2013a, 2013b). Lorsque cette eau entre dans les réseaux de distribution, diverses interactions et réactions biologiques et physico-chimiques ont lieu, auxquelles participent des microorganismes, des nutriments et des particules (figure 1). C'est pourquoi les réseaux de distribution sont parfois qualifiés de « réacteurs ». Ces interactions dynamiques et complexes entraînent la formation de biofilms et de dépôts mobiles, lesquels contiennent des microorganismes (figure 1). Par conséquent, cela peut entraîner une détérioration de la qualité de l'eau et causer divers problèmes, notamment des risques directs et autres pour la santé ainsi que des problèmes esthétiques, comme la couleur, la turbidité et un goût ou une odeur désagréable.
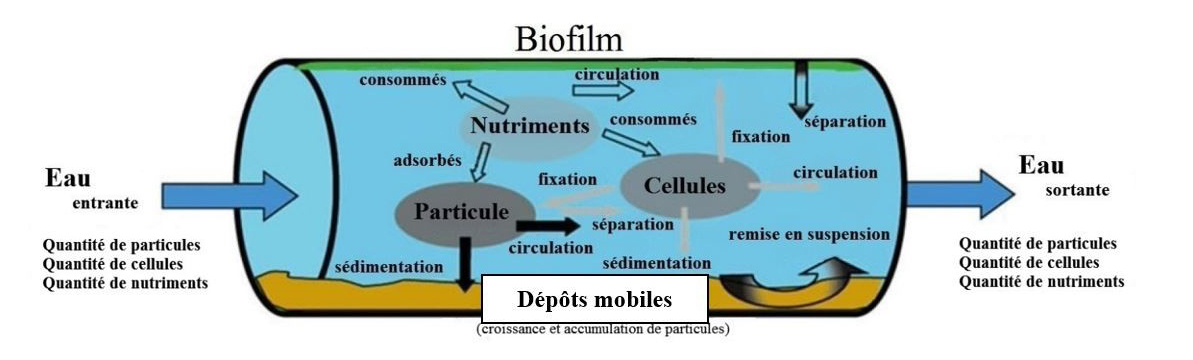
Figure 1 : Texte descriptif
Une illustration montrant les interactions et réactions biologiques et physico-chimiques dans le réseau de distribution de l'eau potable. L'illustration montre une section de tuyau du réseau de distribution de l'eau potable à travers laquelle l'eau coule de gauche à droite. L'eau qui coule dans le tuyau transporte une quantité de particules, de cellules et de nutriments. Une fois dans le tuyau, ces particules, cellules et nutriments interagissent entre eux et avec les composants du tuyau lui-même. Les particules sont montrées tombant au fond du tuyau pour rejoindre une couche de dépôts lâches (alias sédimentation). D'autres particules sont montrées se détachant de la paroi du tuyau (alias remise en suspension), tandis que d'autres sont montrées s'écoulant à travers le tuyau et sortant du tuyau pour rejoindre les particules quittant le côté droit du tuyau. Les nutriments sont représentés comme étant consommés par la couche de biofilm fixée au sommet de la paroi du tuyau, ainsi que par les cellules et les particules. Les cellules sont attachées aux particules et au fond du tuyau, ainsi qu'à la sortie du tuyau. Le biofilm se détache de la paroi du tuyau.
B.1.1 Risques directs pour la santé
Il est difficile de quantifier la mesure dans laquelle la détérioration de la qualité de l'eau dans les réseaux de distribution contribue aux maladies humaines, car de nombreux événements ne sont pas détectés ou reconnus. De plus, les taux de maladies infectieuses endémiques – y compris les maladies d'origine hydrique – sont considérablement sous-déclarés et sous-diagnostiqués pour un certain nombre de raisons (Majowicz et coll., 2004; MacDougall et coll., 2008; Gibbons et coll., 2014). Cette situation est davantage compliquée au Canada, car il n'existe pas de système national de surveillance visant expressément les maladies d'origine hydrique ni d'approche normalisée pour la collecte de données sur les cas sporadiques ou les éclosions de maladies d'origine hydrique (Pons et coll., 2015). Les provinces et les territoires déclarent des données sur les maladies devant faire l'objet d'un avis au gouvernement fédéral (Agence de la santé publique du Canada, 2021), ce qu'ils font sur la base de la maladie (p. ex. campylobactériose), et non de la voie de transmission (p. ex. d'origine hydrique). Par conséquent, il existe très peu de renseignements sur les sources et l'ampleur des maladies d'origine hydrique au Canada, y compris celles attribuables à l'eau potable.
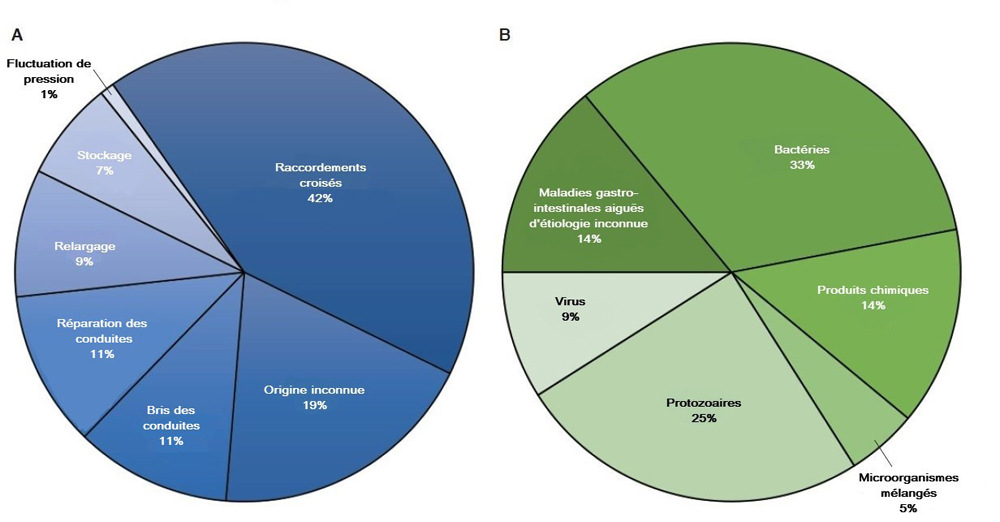
Bien qu'il y ait peu de données sur la surveillance au Canada, les données des États-Unis (É.-U.) en la matière montrent clairement l'existence d'un lien entre la contamination des réseaux de distribution et les maladies humaines. Entre 1995 et 2014, plus de 40 éclosions de maladies d'origine hydrique attribuables aux défaillances des réseaux de distribution ont été signalées aux É.-U. (Levy et coll., 1998; Barwick et coll., 2000; Craun et Calderon, 2001; Lee et coll., 2002; Blackburn et coll. 2004; Liang et coll. 2006; Yoder et coll., 2008; Brunkard et coll. 2011; Hilborn et coll., 2013; Beer et coll., 2015; Benedict et coll., 2017). Il en a résulté plus de 4 800 cas de maladie. Une méta-analyse des données des É.-U., réalisée par l'Organisation mondiale de la Santé (OMS), a montré que la majorité des éclosions de maladies d'origine hydrique attribuables aux réseaux de distribution sont liées à des raccordements croisés (figure 2) et que les bactéries constituent le type d'agent étiologique le plus courant (OMS, 2014; Renwick et coll., 2019). La libération de biofilms et de dépôts dans les réseaux de distribution, en raison d'un changement relatif à la source d'eau, a été mis en cause dans l'éclosion de Legionellasurvenue à Flint, au Michigan (É.-U.), entre 2014 et 2015 (Rhoads et coll., 2017; Zahran et coll., 2018).
a – Éclosions associées au chlore, au cuivre et au plomb.
Figure 2 : Texte descriptif
Une illustration montrant deux graphiques circulaires, A et B. Le graphique circulaire A illustre le pourcentage des éclosions associées aux réseaux de distribution en raison d'une défectuosité du système. Les raccordements croisés constituent le plus gros secteur (42 %) du graphique, suivies par les causes d'origine inconnues (19 %), les bris et réparations des conduites d'eau (chacun 11 %), le relargage (9 %), le stockage (7 %) et les fluctuations de pression (1 %). Le graphique circulaire B illustre le pourcentage des éclosions associées aux réseaux de distribution en raison d'un agent étiologique. Les bactéries représentent le plus gros secteur (33 %) du graphique, suivies des protozoaires (25 %), des produits chimiques et des maladies gastro-intestinales aiguës d'étiologie inconnus (chacun 14 %), des virus (9 %) et des micro-organismes mélangés (5 %).
Plusieurs éclosions internationales d'origine hydrique attribuables aux réseaux de distribution ont également été signalées (Nygård et coll., 2004; Jakopanec et coll., 2008; Moreira et Bondelind, 2017; Viñas et coll., 2019); elles sont présentées à l'annexe B. Ces éclosions, comme celles survenues aux É.-U., montrent que les raccordements croisés sont la principale cause des éclosions dans les réseaux de distribution, en plus de démontrer l'incidence considérable de la détérioration de la qualité de l'eau dans les réseaux de distribution sur la santé (Moreira et Bondelind, 2017). L'importante éclosion survenue en 2007 à Nokia, en Finlande, en est un bon exemple : plus de 8 400 personnes ont eu une gastro-entérite en raison de la contamination de l'eau distribuée par des effluents d'égout, dont l'entrée est attribuable à un raccordement croisé (à l'usine de traitement des eaux usées) (Laine et coll., 2011; Hrudey et Hrudey, 2014; Moreira et Bondelind, 2017). En plus des raccordements croisés, les éclosions attribuables aux réseaux de distribution ont été associées à des travaux d'entretien ou de réparation des conduites principales, à la contamination des installations de stockage et à l'intrusion d'eaux usées en raison de fuites (annexe B; Hrudey et Hrudey, 2004, 2014; Moreira et Bondelind, 2017).
Certaines études épidémiologiques ont également fait état d'un lien entre les réseaux de distribution et les maladies (Hunter et coll. 2005; NRC, 2006; Nygård et coll., 2007; Córdoba et coll., 2010; Lambertini et coll., 2012; Ercumen et coll., 2014; Säve-Söderbergh et coll., 2017; Viñas et coll., 2019). Par exemple, Nygård et ses collaborateurs (2007) ont signalé que les bris et les travaux d'entretien dans les réseaux de distribution ont entraîné une augmentation du risque de maladie gastro-intestinale chez les consommateurs. De même, Säve-Söderbergh et ses collaborateurs (2017) ont noté une hausse importante du taux de maladies gastro-intestinales chez les consommateurs des zones où des incidents liés aux réseaux de distribution se sont produits, incidents qui sont définis comme des changements temporaires relatifs à la pression hydraulique et à l'intégrité physique. Les variations de pression (c.-à-d. transitoires) constituent un risque grave pour la santé publique, puisqu'une pression faible ou négative peut permettre à des contaminants d'entrer dans les réseaux de distribution (Kirmeyer et coll., 2001; Besner et coll., 2010, 2011).
Les modèles utilisés pour étudier les effets sur la santé publique estiment qu'entre 15 et 50 % des maladies gastro-intestinales d'origine hydrique sont attribuables aux risques liés aux réseaux de distribution (Payment et coll., 1991, 1997; Messner et coll., 2006; Nygård et coll., 2004, 2007; Murphy et coll., 2016). En 2021, les Centers for Disease Control and Prevention des É.-U. (US CDC) ont estimé que les agents pathogènes associés aux biofilms, y compris Legionella, les mycobactéries non tuberculeuses et Pseudomonas, comptent pour moins de 1,5 % de tous les cas de maladie d'origine hydrique. Pourtant, ces pathogènes comptent pour une grande partie du fardeau découlant des maladies d'origine hydrique (c.-à-d. plus de 70 % des hospitalisations et 90 % des décès attribuables aux pathogènes d'origine hydrique), ainsi que pour près de 80 % des 3,3 milliards de dollars américains par année en dépenses de santé directes (Collier et coll., 2021). Cette étude souligne le rôle potentiel de ces microorganismes dans le fardeau découlant des maladies infectieuses d'origine hydrique.
B.1.2 Autres risques pour la santé
Les précipités métalliques (voir la figure 1, accumulation de particules), dont l'aluminium, le fer ou le manganèse, peuvent servir de puits d'accumulation pour d'autres contaminants (p. ex. arsenic, chrome, cuivre et plomb) (Cantor, 2017). Ces matières peuvent être « dérangées et libérées » de manière incontrôlée en raison de perturbations hydrauliques (p. ex. les activités de lutte contre les incendies, les bris de conduite et le fonctionnement de la station de pompage) ou à cause des activités de rinçage. Le tableau 3 présente un résumé des concentrations de matières biologiques (biomasse) et de précipités métalliques mesurées dans les matières extraites de deux systèmes à grande échelle utilisant de l'eau de surface, et ce, selon différentes vitesses de rinçage. Des concentrations élevées de microorganismes et de métaux ont été mesurées. D'autres chercheurs ont signalé des conclusions similaires pour des systèmes alimenter par une eau souterraine, de l'eau de surface et un mélange d'eau souterraine et de surface (Lytle et coll., 2004; Seth et coll., 2004; Friedman et coll., 2010a; Douterelo et coll., 2016a; Li et coll., 2018). Ensemble, ces études montrent que d'importantes quantités de précipités métalliques et de biomasse peuvent s'accumuler et causer la détérioration de la qualité de l'eau. À son tour, cette détérioration peut entraîner des maladies chez les humains.
En outre, la libération de microorganismes ou de métaux est généralement associée à des phénomènes de coloration ou de turbidité (Prince et coll., 2003; Seth et coll., 2004; Besner et coll., 2008; Husband et coll., 2016). Husband et Boxall (2010) ont signalé que l'eau dans les conduites principales en fonte présentait systématiquement une turbidité plus élevée associée à la libération de matières accumulées, en comparaison avec les conduites principales en polyéthylène ou en polychlorure de vinyle (PVC). Burlingame et ses collaborateurs (2006) ont signalé un lien direct entre la turbidité et la libération de matières accumulées dans les tuyaux en fer renfermant des tubercules. Seth et ses collaborateurs (2004) ont observé une turbidité et des concentrations de métaux élevées dans les matières rejetées lors du rinçage des conduites principales en fonte, en PVC et en polyéthylène. Les plaintes des consommateurs concernant une couleur, un goût ou une odeur désagréable peuvent donc servir d'indicateur de la détérioration de la qualité de l'eau dans un réseau de distribution (Hrudey et Hrudey, 2014).
| Communauté bactérienne et matériau de la tuyauterie | Vitesse (pi/s)Tableau 3 Notea |
NPBH-R2ATableau 3 Noteb (ufc/mL) |
Biomasse viable totaleTableau 3 Notec (pg/mL) |
Bactéries viablesTableau 3 Noted (cellules/mL) |
Fer (µg/L) |
Manganèse (µg/L) |
|---|---|---|---|---|---|---|
| Portland, Oregon – avec revêtement de ciment | 4 | 930 | 9,3 | 89 200 | 4 000 | 800 |
| 6 | 750 | 2,7 | 28 700Tableau 3 Notee | 4 400 | 180 | |
| 6 | 3 300 | 5,9 | 54 500Tableau 3 Notee | 6 400 | 200 | |
| Portland, Oregon – avec revêtement de ciment, et quelques sections sans revêtement | 6 | 380 | 4,0 | 34 000 | 4 300 | 330 |
| Portland, Oregon – fonte sans revêtement | 3,0 | 130 | 1,2 | 20 700 | 3 700 | 140 |
| 4,8 | 2 400 | 19 | 28 100 | 26 400 | 870 | |
| 6,0 | 430 | 2,0 | 37 900 | 15 100 | 300 | |
| 6,0 | 2 900 | 54 | 61 400 | 16 500 | 800 | |
| 6,4 | 1 030 | 4,7 | 31 300 | 7 500 | 210 | |
| Seattle, Washington – fonte sans revêtement | 3,0 | 1 470 | 270 | 590 700 | 193 100 | 20 600 |
| 4,2 | 15 500 | 807 | 689 100e | 139 000 | 30 100 | |
| 5,4 | 3 300 | 430 | 577 300 | 155 700 | 18 400 | |
| 6,0 | 1 500 | 280 | 601 500 | 199 000 | 20 900 | |
| 6,0 | 10 400 | 325 | 788 300Tableau 3 Notee | 153 300 | 11 300 | |
|
||||||
B.1.3 Événements ou défaillances dans les réseaux de distribution
Entre 2013 et 2019, les bris de conduite et les pertes de pression dans les réseaux de distribution ont été les principales raisons pour lesquelles des avis d'ébullition de l'eau ont été émis au Canada, comptant pour 72 % des avis (figure 3). Ces données sont fondées sur l'analyse de 5 578 dossiers d'avis d'ébullition de l'eau, émis par 7 des 14 autorités compétentes (Santé Canada, 2019). Une importante éclosion de campylobactériose d'origine hydrique en Norvège a été attribuée à une perte de pression et à la piètre intégrité des réseaux de distribution (Jakopanec et coll., 2008). L'absence de désinfection après la réparation de la conduite a également été un facteur contributif.
Fox et coll. (2016) ont démontré que des contaminants qui se trouvent à l'extérieur d'une petite fuite (diamètre de 5 mm) dans une conduite sous pression pouvaient pénétrer dans cette conduite et être transportés dans le réseau lorsque des pressions transitoires négatives apparaissaient. Des pressions transitoires faibles et négatives peuvent survenir à la suite de l'exploitation ou de l'entretien d'un réseau de distribution ou d'événements imprévus tels que des pannes d'électricité ou des bris de conduite. Les pressions transitoires faibles et négatives permettent également aux contaminants d'entrer dans les réseaux de distribution par les raccordements croisés ou par le refoulement provenant des installations domestiques, industrielles ou institutionnelles (Gullick et coll., 2004).
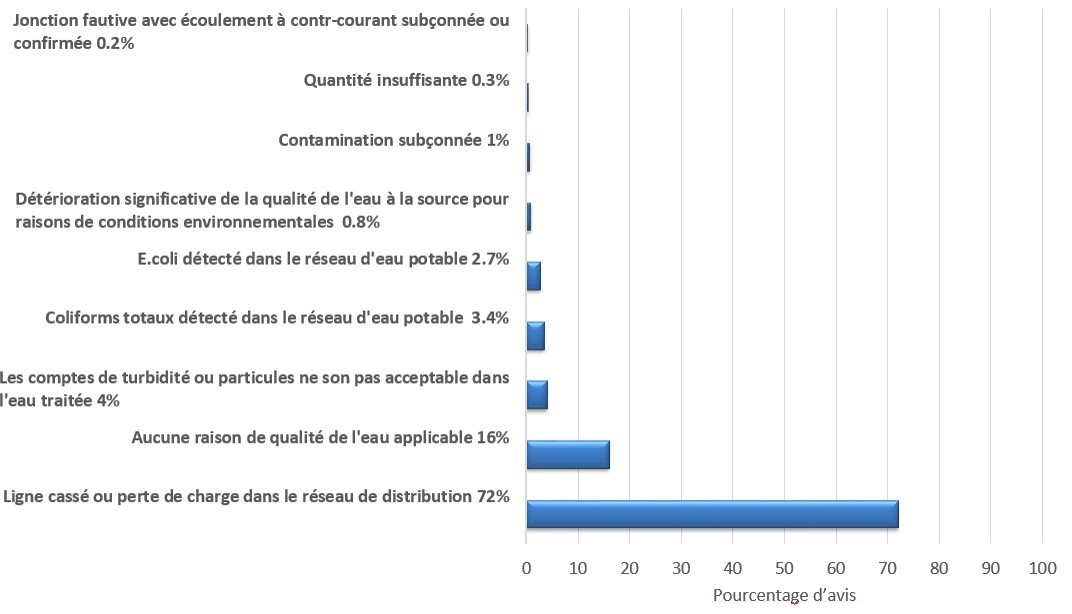
Figure 3 : Texte descriptif
La figure 3 est un graphique à barres montrant que les principales raisons de l'émission d'avis d'ébullition de l'eau sur les réseaux publics étaient; Ligne cassé ou perte de charge dans le système de distribution (72 %), Aucune raison de qualité de l'eau applicable (16 %), Les comptes de turbidité ou particule ne son pas acceptable dans l'eau traitée (4 %), Coliforms totaux détecté dans le réseau d'eau potable (3.4 %), E.coli détecté dans le réseau d'eau potable (2.7 %), Détérioration significative de l'eau à la source pour raisons de conditions environnementales (0.8 %), Contamination subçonnée (0.6 %), Quantité insuffissante (0.3 %), Jonction fautive avec écoulment à contre-courant subçonnée ou confirmé (0.2 %).
B.2 Causes de la détérioration de la qualité de l'eau
Étant donné la nature dite de « réacteur » des réseaux de distribution d'eau potable et du potentiel de détérioration de la qualité de l'eau qui en découle, il est important de comprendre les causes de cette détérioration. La détérioration de la qualité de l'eau dans les réseaux de distribution est complexe, et une multitude de facteurs et de mécanismes entrent en jeu (figures 4 et 5). Nous décrivons brièvement certains facteurs et mécanismes menant à la détérioration de la qualité microbienne de l'eau. Pour de plus amples renseignements, veuillez consulter les documents suivants : LeChevallier, 1999; van der Kooij et van der Wielen, 2014; OMS, 2014; LeChevallier et coll., 2015a, 2015b; Prest et coll., 2016a, 2016b, 2016c.
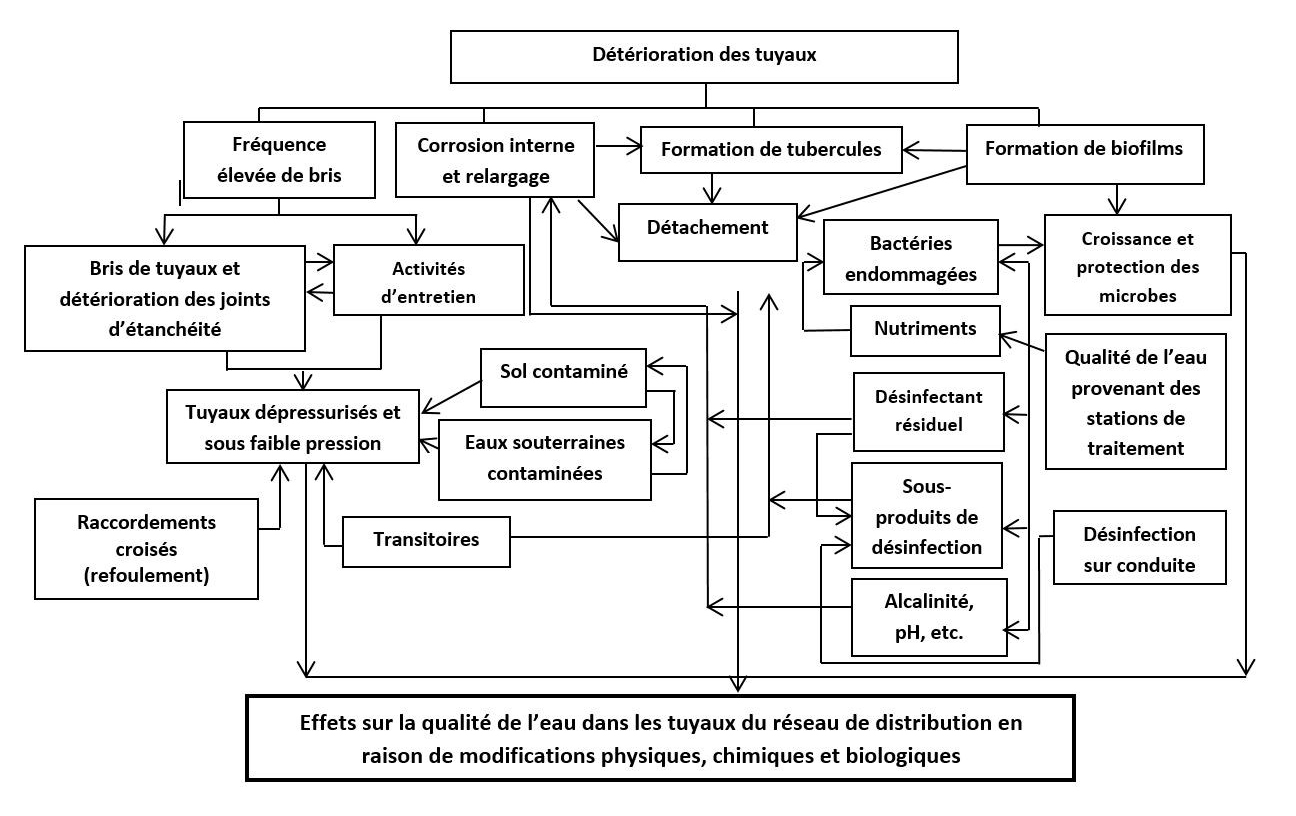
Figure 4 : Texte descriptif
Un organigramme illustrant la complexité des facteurs et des interactions au sein du réseau de distribution de l'eau potable qui entraînent une détérioration de la qualité de l'eau. Plusieurs zones de texte sont incluses qui représentant un large éventail de facteurs et leurs interactions sont souligner pas des flèches. Une gamme de types de facteurs est illustrée, y compris ceux liés à l'état des tuyaux, l'intrusion, les conditions générales du système (par exemple, pH, alcalinité) et la présence de micro-organismes, de désinfectant résiduel et de nutriments. Par exemple, la détérioration des tuyaux est liée à la fréquence élevée de bris, à la corrosion interne et le relargage, et à la formation de tubercules et de biofilm. La formation de biofilm, à son tour, est liée à la croissance et protection des micro-organismes, au détachement et aux bactéries endommagées. Ces facteurs sont liés à divers autres facteurs, et ainsi de suite.
B.2.1 Présence de microorganismes
Des microorganismes sont présents dans tous les réseaux de distribution d'eau potable, et ce, pour deux principales raisons : 1) ils sont introduits dans les réseaux de distribution; 2) les conditions dans les réseaux de distribution favorisent la croissance ou la revivification des microorganismes déjà présents. Les microorganismes peuvent pénétrer dans les réseaux de distribution en survivant au processus de traitement de l'eau ou en s'y introduisant. Une telle intrusion se produit lorsque l'intégrité des réseaux est compromise, notamment en raison d'un bris de conduite, d'une fuite ou de transitoires de pression (LeChevallier et coll., 2011). Plusieurs études ont démontré que les contaminants microbiens peuvent pénétrer dans les réseaux de distribution (Karim et coll., 2003; LeChevallier et coll., 2003; Besner et coll., 2010, 2011; Yang et coll., 2011; Ebacher et coll., 2012; Fontanazza et coll., 2015; Fox et coll., 2016). De multiples facteurs et mécanismes peuvent favoriser la croissance microbienne ou sa revivification; ils sont décrits dans les sections suivantes (Besner et coll., 2012; Lee, 2013; LeChevallier et coll., 2015a; Prest et coll., 2016a, 2016b, 2016c; AWWA, 2017a).
La majorité des microorganismes présents dans les réseaux de distribution d'eau potable se fixent aux surfaces internes des conduites (Flemming et coll., 2002), formant des biofilms et des dépôts mobiles. Les autres microorganismes existent en tant que populations transitoires dans l'eau (Liu et coll., 2013a, 2013b, 2014, 2016, 2017; Proctor et Hammes, 2015) (figures 1 et 5). Les microorganismes fixés peuvent être conservés pendant une plus longue période que les microorganismes transitoires (c.-à-d. des années par rapport au temps nécessaire à l'écoulement de l'eau) (Liu et coll., 2017). Le matériel génétique combiné de ces populations microbiennes est appelé « microbiome ». Les microbiomes sont très hétérogènes, et leur composition varie dans le temps, entre les réseaux de distribution et dans un même réseau de distribution (Gomez-Alvarez et coll., 2012; Chao et coll., 2013, 2015; Delafont et coll., 2013; Wang et coll., 2014a, 2014b; Zhang et coll., 2017).
Les microorganismes fixés (dans les biofilms et les dépôts mobiles) sont généralement enfermés dans une matrice de substances polymères extracellulaires (SPE), laquelle contient des matières organiques et inorganiques (Prest et coll., 2016a; Liu et coll., 2016; WRF, 2017). La matrice de SPE comprend un large éventail de composés – polysaccharides, protéines, acides nucléiques et lipides – et peut compter pour plus de 90 % des matières organiques totales dans les biofilms et les dépôts mobiles (Christensen et Characklis, 1990; Flemming et Wingender, 2010; Liu et coll., 2017). La composition des SPE détermine d'importantes propriétés des biofilms, comme la mesure dans laquelle ils adhèrent à la paroi d'une conduite, la façon dont ils réagissent aux forces de cisaillement, s'érodent ou se détachent, ainsi que la mesure dans laquelle ils absorbent les substances dissoutes et particulaires provenant de l'eau (Nielsen et coll., 1997; Wingender et coll., 1999). La structure formée par les SPE offre une protection contre les prédateurs et les désinfectants, en plus de faciliter l'absorption et l'utilisation des nutriments (LeChevallier et coll., 1988; Flemming et Wingender, 2010; Prest et coll., 2016a). En outre, les protéines et les polysaccharides présents dans les SPE sont d'importants précurseurs de la formation de sous-produits de désinfection (Wang et coll., 2013).
Les biofilms fournissent un habitat pour la survie et la croissance des microorganismes, y compris les agents pathogènes (Santé Canada, 2021a). Divers agents pathogènes entériques ont été détectés dans les biofilms (Park et coll., 2001; Howe et coll., 2002; LeChevallier et coll., 2003; Chang et Jung, 2004; Berry et coll., 2006; September et coll., 2007; Gomez-Alvarez et coll., 2015; Revetta et coll., 2016), où ils peuvent s'accumuler et en être libérés sur une longue période (Howe et coll., 2002; Warnecke, 2006; Wingender et Flemming, 2011). Des agents pathogènes non entériques ont également été détectés dans les biofilms, y compris des agents pathogènes opportunistes dans la plomberie des bâtiments, notamment Legionella pneumophila et les mycobactéries non tuberculeuses (p. ex. M. avium, M. intracellulare) (Norton et coll., 2004; Pryor et coll., 2004; Vaerewijck et coll., 2005; Feazel et coll., 2009; Falkinham et coll., 2015; Wang et coll., 2017). Ces organismes se sont adaptés pour croître et persister dans les biofilms des réseaux de distribution et des installations de plomberie et ont été associés à plusieurs éclosions (Pruden et coll., 2013; Beer et coll., 2015; Falkinham et coll., 2015; Benedict et coll., 2017), y compris l'éclosion de la maladie du légionnaire à Flint, au Michigan (É.-U.) (Zahran et coll., 2018), en 2014-2015. Ces organismes représentent un défi de taille pour l'industrie de l'eau potable et les gestionnaires de bâtiments (voir la section B.7).
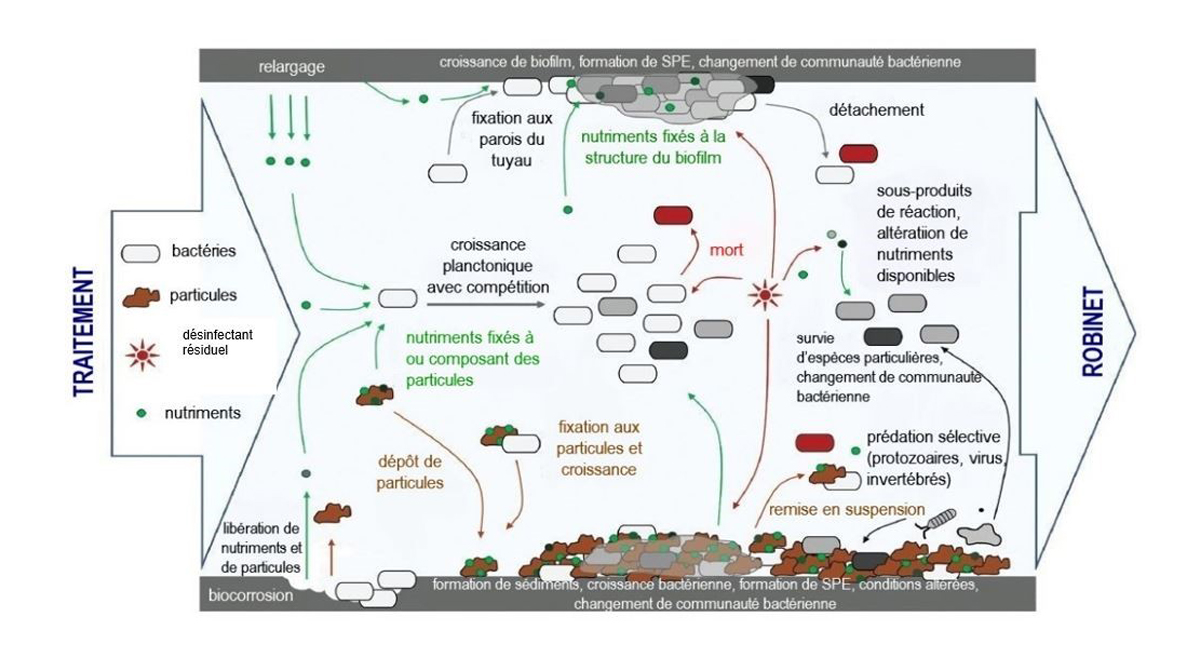
Figure 5 : Texte descriptif
Une illustration montrant la dynamique microbienne dans un tuyau du réseau de distribution de l'eau potable. L'illustration montre de l'eau traitée entrant dans une section de tuyau du réseau de distribution et sortant au robinet. L'eau traitée qui coule dans le tuyau transporte des bactéries, des particules, des résidus de désinfectant et de nutriment et interagit avec les composants du tuyau. Les bactéries sont montrées consommant des nutriments, se fixant et se détachant du / sur le biofilm sur la paroi du tuyau, entrant en compétition avec d'autres cellules microbiennes, se fixant aux particules et / ou mourant. Les particules tombent au fond du tuyau pour rejoindre une couche de sédiments, de SPE et de croissance bactérienne. D'autres particules se détachent de la paroi du tuyau, se lient aux nutriments et sont remises en suspension. Les nutriments sont montrés consommés par la couche de biofilm-SPE-sédiments attachés à la paroi du tuyau et libérés de la paroi du tuyau (alias relargage). Le résidu de désinfectant interagit avec les bactéries, entraînant la mort et / ou un changement de communauté microbienne et interagir avec la couche de la paroi du tuyau et avec les particules en suspension.
B.2.2 Type et disponibilité des nutriments
Plusieurs nutriments peuvent être présents dans les réseaux de distribution d'eau potable et favoriser la croissance microbienne, soit en servant de combustible aux microorganismes, soit en consommant le désinfectant résiduel (NRC, 2006). La partie biodégradable de la matière organique naturelle, appelée matière organique biodégradable (MOB), par exemple, a des effets sur la qualité de l'eau dans les réseaux de distribution, car elle constitue une source de nutriments qui contribue à la croissance microbienne et au développement de biofilms (Huck, 1990). Les concentrations de MOB (p. ex. carbone organique assimilable et carbone organique biodégradable) ne sont qu'un des éléments qui influent sur les changements relatifs à la qualité de l'eau dans les réseaux de distribution (Prest et coll., 2016a, 2016b, 2016c). D'autres nutriments jouent un rôle dans le contrôle de la croissance microbienne dans les réseaux de distribution, notamment le phosphore, l'azote, l'ammoniac, le manganèse, le sulfate, le fer et les substances humiques (Camper, 2004, 2014; Coetser et coll., 2005; Prest et coll., 2016a, 2016b, 2016c). Par exemple, les bactéries Legionella ont besoin de nutriments précis pour se développer, notamment du fer (Percival et Williams, 2014). Elles peuvent s'adapter à des conditions changeantes en matière de nutriments en se différenciant en types de cellules dont l'infectivité et la résistance à la désinfection varient (Robertson et coll., 2014; NAS, 2019).
Il est également important de reconnaître que les biofilms et les dépôts mobiles (figure 1) forment un grand réservoir de nutriments organiques (Zacheus et coll., 2001; Liu et coll., 2013a, 2013b) dont les concentrations sont de 200 à 2 000 fois supérieures à celles que l'on retrouve dans l'eau (Gauthier et coll., 1999). Cette matière est disponible pour stimuler la croissance ou la revivification et entraîner une demande importante de désinfectant résiduel (Chandy et Angles, 2001).
B.2.3 Température
La qualité de l'eau dans les réseaux de distribution peut diminuer considérablement en raison de la température de l'eau. En fait, la température de l'eau est l'un des facteurs les plus importants qui influent sur la croissance microbienne (LeChevallier et coll., 1990, 1996; Camper et coll., 2000; van der Kooij et coll., 2003; Baribeau et coll., 2005; LeChevallier et coll., 2015a, 2015b; Santé Canada, 2021b). Dans une étude de 18 mois portant sur 31 réseaux à pleine échelle (dont 17 utilisant la chloration et 14, la chloramination), des taux plus élevés de détection de bactéries coliformes ont été signalés pendant la saison chaude (LeChevallier et coll., 1996). De même, Schleich et ses collaborateurs (2019) ont signalé que la numération des cellules totales (mesurée au moyen de la cytométrie en flux – voir la section B.3.3.1) a augmenté jusqu'à être multipliée par 5,24 pendant l'été au cours d'une étude de 12 mois portant sur un système à grande échelle utilisant la chloramination.
L'augmentation de la température de l'eau peut également avoir une incidence sur la croissance microbienne par l'entremise de ses effets sur le désinfectant résiduel. En outre, une telle augmentation peut entraîner deux effets contradictoires : 1) l'efficacité accrue de l'oxydation chimique; 2) la décomposition accélérée du désinfectant résiduel (Li et coll., 2003; van der Wielen et van der Kooij, 2010). Par conséquent, l'augmentation de la température de l'eau entraîne généralement une diminution des effets biocides du désinfectant résiduel (Baribeau et coll., 2005). LeChevallier et ses collaborateurs (2015a, 2015b) ont noté que le taux de formation de biofilms était 25 fois plus élevé lorsque la température était supérieure à 15 °C, en comparaison avec une température inférieure à 15 °C, dans le cadre d'une étude de 14 mois portant sur six réseaux à grande échelle, dont trois utilisant la chloration et trois utilisant la chloramination (voir B.3.2.7). Les températures élevées peuvent aussi avoir une incidence sur la solubilité des métaux (p. ex. le cuivre) présents dans les réseaux de distribution et entraîner une augmentation du relargage et de la corrosion (Singh et Mavinic, 1991; Boulay et Edwards, 2001; Sarver et Edwards, 2011). De plus, les variations de température peuvent influer sur la fixation des biofilms en raison de la modification de la production de SPE (Liu et coll., 2016).
On s'attend à ce que les changements climatiques fassent augmenter la température de l'eau, ce qui pourrait exacerber d'autres changements prévus liés au climat, comme l'augmentation de la charge de nutriments. À son tour, cette augmentation pourrait promouvoir la croissance microbienne et la survie des pathogènes dans les biofilms présents dans les réseaux de distribution. En outre, cela peut donner lieu à de plus longues périodes à des températures qui provoquent la détérioration de la qualité de l'eau (Levin et coll., 2002).
B.2.4 Matériau et état des conduites
Le matériau de la tuyauterie peut influer sur la croissance microbienne, ainsi que sur la formation de biofilms et la composition de ces derniers. Alors que des biofilms peuvent se former sur tous les matériaux de la tuyauterie, la biomasse des biofilms est généralement plus élevée sur les conduites en fer rouillées que sur les conduites en plastique non recouvertes, comme celles en PVC ou en polyéthylène (Niquette et coll., 2000; Baribeau et coll., 2005; Wang e coll., 2012; Douterelo et coll., 2014b; Wang et coll., 2014a; Fish et coll., 2016). Les différences dans les caractéristiques des surfaces (p. ex. la rugosité et la zone) ainsi que les propriétés chimiques de la tuyauterie influent sur l'adhérence microbienne. En ce qui concerne la rugosité, par exemple, les surfaces plus rugueuses permettent aux microorganismes d'adhérer plus rapidement (Fish et coll., 2016). Le matériau des conduites semble également influer sur la diversité (ou « richesse ») microbienne, ainsi que sur la stabilité microbienne, bien qu'il existe un débat à savoir quel matériau a la plus grande incidence sur ces paramètres.
Outre le matériau des conduites, l'état de celles-ci peut avoir une grande incidence sur la qualité microbienne de l'eau potable dans les réseaux de distribution. La corrosion des tuyaux peut entraîner une demande importante de désinfectant, ce qui rend difficile le maintien des concentrations de désinfectant résiduel (Santé Canada, 2009a). Dans le cas des conduites en fer, par exemple, la corrosion peut être exacerbée par la présence de bactéries ferro-oxydantes. Ces bactéries sont responsables de la formation d'une corrosion microbienne, ce qui entraîne la formation d'excroissances surélevées d'oxyde de fer, appelées tubercules. Ces derniers peuvent contenir des microorganismes, y compris des agents pathogènes opportunistes (Emde et coll., 1992; US EPA, 2002; Batté et coll., 2003; NRC, 2006; Teng et coll., 2008), en plus d'entraîner une demande importante de désinfectant. Les tubercules peuvent également produire une couleur, une turbidité, un goût et une odeur, et peuvent réduire le rendement hydraulique (Husband et Boxall, 2010).
À mesure que les conduites vieillissent, elles peuvent devenir plus sujettes aux fuites et aux bris, et plus vulnérables à l'intrusion de contaminants (O'Connor, 2002; Moe et Rheingans, 2006; Qureshi et Shah, 2014). Au cours des événements de pression faible ou négative, les contaminants qui se trouvent à proximité des conduites peuvent entrer dans celles-ci par les fuites présentes dans un réseau, le cas échéant (voir la section B.1.3). Le vieillissement de l'infrastructure de l'eau constitue une menace importante pour la salubrité de l'eau au Canada (Bulletin de rendement des infrastructures canadiennes, 2016). En Ontario, par exemple, de nombreux réseaux de distribution d'eau ont été construits dans les années 1960 et 1970 (MacDonald, 2001) et approchent donc de la fin de leur durée de vie utile, qui est en moyenne de 50 à 70 ans (Tafuri et Field, 2010). Les conduites installées dans les années 1960 et 1970 ont également été associées à une probabilité accrue de défaillance en raison des matériaux utilisés et des mauvaises pratiques d'installation employées à l'époque (Besner et coll., 2001; MacDonald, 2001). Dans d'autres régions du Canada, certaines conduites datent même d'avant 1867 (Besner et coll., 2001; Saint John Water, 2018).
B.2.5 Type et concentration de désinfectant résiduel
Le type et la concentration de désinfectant résiduel influent également sur la qualité microbienne de l'eau dans les réseaux de distribution. Au Canada, la majorité des services d'eau utilisent le chlore libre comme désinfectant résiduel, tandis que les autres utilisent les chloramines (Santé Canada, 2009b). Ces désinfectants possèdent des capacités différentes en matière de pouvoir désinfectant, de réactivité avec les matières organiques et inorganiques et de pénétration des biofilms. Ces différences signifient que le désinfectant résiduel est généralement épuisé en trois jours quand le chlore est utilisé ou en sept jours quand les chloramines sont utilisées (Baribeau et coll., 2005). Dans le cas des chloramines, de l'ammoniac libre est liberé pendant l'absorption (ou la décomposition) du désinfectant résiduel, ce qui peut mener à la nitrification, c'est-à-dire le processus microbiologique par lequel l'ammoniac est oxydé séquentiellement en nitrites et en nitrates par les bactéries oxydant l'ammoniac et les bactéries oxydant les nitrites, respectivement (Wilczak, 2006). Cela peut entraîner la croissance de bactéries nitrifiantes et, par conséquent, une perte de désinfectant résiduel et une production accrue de biofilms, ce qui fait augmenter davantage la demande de chlore, la libération d'ammoniac et la croissance microbienne (Wilczak et coll., 1996; Pintar et Slawson, 2003; Strickhouse et coll., 2006; Wilczak, 2006; Scott et coll. 2015; Bradley et coll., 2020; Tolofari et coll., 2020).
Peu importe le type de désinfectant résiduel utilisé, les diminutions de la concentration dans les réseaux de distribution d'eau potable sont associées à une croissance accrue (Codony et coll., 2005). Il est de plus en plus reconnu que des concentrations résiduelles de désinfectant minimales plus élevées sont nécessaires pour contrôler la croissance (Gagnon et coll., 2008; Gillespie et coll., 2014; Rand et coll., 2014; LeChevallier et coll., 2015a, 2015b). Ensemble, ces études montrent que les concentrations résiduelles de désinfectant suivantes sont requises pour contrôler la croissance ou la revivification : concentration de chlore libre de 1,0 mg/L (pour les systèmes qui utilisent la chloration) et concentration de chlore total de 1,8 mg/L (pour les systèmesqui utilisent la chloramination). LeChevallier et ses collaborateurs (2015b) ont déclaré que la différence entre un fonctionnement supérieur et inférieur à ces seuils est frappante, puisque le taux de formation de biofilms (voir la section B.3.2.7) était six et 23 fois plus élevé lorsque le fonctionnement était inférieur aux concentrations de chlore libre résiduel et de chlore total énoncées ci-dessus, respectivement.
B.3 Méthodes de surveillance et paramètres
Les réseaux de distribution d'eau potable constituent un environnement complexe et dynamique. Afin de comprendre les changements relatifs à la stabilité biologique de l'eau, on devrait établir et mettre en œuvre un programme de surveillance (voir la section B.4) pour établir les conditions de base, surveiller les changements et détecter les événements de contamination en cours ou potentiels. Il est recommandé d'établir des programmes exhaustifs de surveillance (Cantor, 2017, 2018; Hill et coll., 2018) pour mieux connaître la dynamique dans les réseaux de distribution d'eau potable, ce qui augmenterait la probabilité de déceler les périodes où le risque est élevé. La documentation sur le sujet appuie les approches multiparamètres visant à surveiller la qualité de l'eau dans les réseaux de distribution (Escobar et Randall, 2001; Hammes et Egli, 2005; van der Kooij, 2000; Berney et coll., 2008; Vital et coll., 2010, 2012; Hammes et coll., 2011; Lautenschlager et coll., 2013; Douterelo et coll., 2014a; van der Kooij et van der Wielen, 2014; LeChevallier et coll., 2015a, 2015b; van der Kooij et coll., 2015; Van Nevel et coll., 2017).
Dans les sections qui suivent, les méthodes et les analyses de paramètres potentielles ont été classées en trois catégories : 1) de base, 2) de nature opérationnelle et 3) de nature avancée.
B.3.1 Surveillance de base
Conformément aux Recommandations pour la qualité de l'eau potable au Canada : documents techniques pour la bactérie Escherichia coli (E. coli) et les coliformes totaux (Santé Canada, 2020a, 2020b), il est recommandé que les indicateurs bactériens soient surveillés parallèlement à d'autres paramètres, comme le désinfectant résiduel, la turbidité et la pression. La surveillance de la conductivité est recommandée en complément de la turbidité (Santé Canada, 2021c). Les paramètres décrits dans cette section devraient à tout le moins faire l'objet d'une surveillance dans le cadre d'une approche de type « de la source au robinet » afin de produire une eau potable salubre. Une fois les données recueillies, celles-ci devraient être analysées afin de déterminer leur variabilité, conformément à ce qui précède.
B.3.1.1 Indicateurs bactériens
La surveillance régulière des coliformes totaux et de la bactérie E. coli est un aspect essentiel de l'approche de type « de la source au robinet » pour assurer la production d'une eau potable saine. En outre, elle constitue le fondement de la plupart des activités de surveillance de la conformité réglementaire au Canada (CCME, 2004). Ces indicateurs sont utilisés pour indiquer la croissance ou la revivification, les problèmes d'intégrité physique et les conditions insalubres potentiels dans les réseaux de distribution (Santé Canada, 2020a, 2020b). Cependant, compte tenu du fait qu'ils sont rarement détectés, ces indicateurs fournissent très peu de renseignements sur le microbiome (Hargesheimer, 2001; US EPA, 2016a). Il est donc recommandé de les jumeler à d'autres paramètres.
B.3.1.2 Concentration résiduelle de désinfectant, turbidité et conductivité
La mesure de la concentration du désinfectant résiduel et de la turbidité dans le réseau de distribution d'eau potable est importante et devrait être effectuée lorsque des échantillons d'indicateurs bactériens sont prélevés (Santé Canada, 2020a, 2020b). La concentration résiduelle de désinfectant est une mesure indirecte de l'abondance microbienne dans les réseaux qui utilisent la chloration et ceux qui utilisent la chloramination. Les diminutions sont un indicateur essentiel des changements relatifs à la qualité de l'eau, comme une augmentation de l'activité microbienne ou des problèmes d'intégrité physique (LeChevallier et coll., 1996, 1998; Haas, 1999; NRC, 2006; Nescerecka et coll., 2014; Prest et coll., 2016a; Santé Canada, 2020a, 2020b; Kennedy et coll., 2021). La turbidité donne une indication de la présence de solides particulaires dans l'eau. Un corollaire pertinent est la conductivité, puisqu'elle donne une indication de la présence de solides dissous dans l'eau (US EPA, 2009, 2018a; Santé Canada, 2021c). Ces paramètres doivent être analysés sur le terrain. Des capteurs en ligne ou des capteurs en ligne multiparamètres peuvent être utilisés pour assurer une surveillance en temps réel de ces indicateurs et d'autres paramètres dans les réseaux de distribution (Frey et Sullivan, 2004; LeChevallier et coll., 2011; Durand et coll., 2016; AWWA, 2017a; US EPA, 2018a).
Une fois les données recueillies, il convient de les analyser afin de déterminer leur variabilité. Cette dernière, mesurée en termes de coefficient de variation (c.-à-d. l'écart-type divisé par la moyenne pour un ensemble de données), est un indicateur utile de la stabilité de la qualité de l'eau (LeChevallier et coll., 2015b). Les valeurs plus faibles indiquent une variabilité moindre. La variabilité peut également faire l'objet d'une évaluation visuelle. Pour ce faire, il faut créer un graphique à partir des données sur la qualité de l'eau pour chaque site d'échantillonnage, conformément à la figure 6. Ce graphique montre une concentration résiduelle de chlore libre dans huit sites de surveillance à Flint, au Michigan, avant et après la modification de la source d'eau. Il montre également une augmentation de la variabilité dans les concentrations de chlore libre après la modification de la source d'eau, ainsi que des conditions plus stables après le retour à l'ancienne source d'eau (Zahran et coll., 2018). Les services d'eau peuvent utiliser leurs données pour illustrer des tendances, fixer des objectifs et établir des limites de contrôle au moyen de « graphiques de contrôle » (Cantor et Cantor, 2009).

Figure 6 : Texte descriptif
Un diagramme de dispersion montrant les concentrations de chlore libre mesurées dans huit sites de surveillance à Flint, au Michigan, avant et après la modification de la source d'eau. Le long de l'axe des X se trouve le temps de l'échantillonnage qui se compose de points de données hebdomadaires entre 2013 et 2016. L'axe des X est divisé par des lignes verticales en pointillés qui apparaissent autour de la marque des 16 semaines de 2014, et autour de la marque des 40 semaines de 2015, pour indiquer quand la source d'eau a été changée. Ces périodes sont étiquetées « avant la modification », « après la modification » et « retour à l'ancienne source ». Les données de huit stations de surveillance sont illustrées de M1 à M8. L'axe des ordonnées montre la concentration de chlore libre, mesurée en mg/L. Le graphique montre des fluctuations importantes des concentrations de chlore libre après la modification de la source d'eau et un retour à des conditions plus stables avec le retour à l'ancienne source.
B.3.1.3 Pression
La pression de l'eau est une exigence essentielle pour prévenir l'entrée de contaminants dans les réseaux de distribution (Kirmeyer et coll., 2001; AWWA, 2017a). Par conséquent, les recommandations et les normes de conception des provinces, des territoires et des associations de l'industrie énoncent des exigences minimales en la matière (ACWWA, 2004; GLUMRB, 2012; AWWA, 2017a, 2018). Il est impossible d'éviter les variations de pression (c.-à-d. transitoires), puisqu'elles découlent des activités courantes telles que l'activation ou l'arrêt des pompes, de l'ouverture et de la fermeture rapides des valves et des bornes, des bris de conduite et des pannes d'électricité (Kirmeyer et coll., 2001). En outre, un transitoire de pression modéré de 50 à 200 kPa (ou de 7 à 29 psi) peut provoquer la défaillance d'une conduite principale (Rathnayaka et coll., 2016).
À la lumière des risques associés aux transitoires, l'American Water Works Association (AWWA, 2017a) recommande une surveillance continue dans l'ensemble des réseaux de distribution pour confirmer que la pression de l'eau est conforme aux plages cibles. L'AWWA (2018) recommande au moins deux sites de surveillance par district de pression - un au site représentant la pression la plus faible et l'autre au site représentant la pression la plus élevée. Pour les grands districts de pression, un plus grand nombre de sites de surveillance pourrait s'avérer nécessaire (LeChevallier et coll., 2011, 2014). Les progrès liés à l'équipement de mesure à grande vitesse de la pression (p. ex. de multiples lectures par seconde) ont facilité une surveillance plus complète et une compréhension améliorée des transitoires de pression (Friedman et coll. 2004; Besner et coll., 2010; Ebacher et coll., 2011; Rathnayaka et coll., 2016). En outre, l'équipement portatif permet une surveillance améliorée des réseaux (Sutherns, 2020; Hamilton et Nikolica, 2021).
B.3.2 Surveillance opérationnelle
Il est important que les services d'eau intègrent la surveillance opérationnelle dans leurs programmes afin de définir les conditions de base (p. ex. les variations habituelles qui ne nécessitent aucune mesure), de fixer des objectifs et d'établir des limites de contrôle. Par conséquent, la surveillance opérationnelle est généralement plus complète que la surveillance basée sur la réglementation (Hill et coll., 2018). Les paramètres énoncés ci-dessous sont considérés comme des mesures pertinentes de la stabilité biologique (LeChevallier et coll., 2015a, 2015b; Cantor, 2017, 2018; Hill et coll., 2018). Les services d'eau sont responsables de déterminer la gamme complète des exigences de surveillance opérationnelle qui s'appliquent à chaque réseau.
B.3.2.1 Température
Sur la base du large éventail d'impacts que la température peut avoir (voir la section B.2.3) et compte tenu du fait qu'on s'attend à ce que les changements climatiques fassent augmenter la température de l'eau, les services d'eau potable doivent surveiller la température de l'eau dans le réseau de distribution (Santé Canada, 2021b). Par conséquent, les relations propres à chaque réseau entre la température et d'autres paramètres peuvent être utilisées pour établir des stratégies de gestion (LeChevallier et coll., 2015a, 2015b). La température doit être mesurée sur le terrain. Des instruments en ligne sont également disponibles (Buchberger et coll., 2003).
B.3.2.2 Activité microbiologique
Numération sur plaque des bactéries hétérotrophes (NPBH)
La détection des bactéries hétérotrophes a traditionnellement été utilisée pour évaluer la qualité bactériologique générale de l'eau, y compris dans les réseaux de distribution (Chowdhury, 2012; Santé Canada, 2012). Ces bactéries sont naturellement présentes dans l'environnement, y compris dans l'eau, et ne sont pas associées à la contamination fécale. On peut les mesurer à l'aide des méthodes de NPBH (APHA et coll., 2017). Les méthodes normalisées de NPBH utilisent la formation de colonies sur des milieux de culture pour estimer la concentration de bactéries hétérotrophes dans un échantillon d'eau potable (Lillis et Bissonette, 2001; Reasoner, 2004; APHA et coll., 2017). Bien qu'aucun milieu de croissance, aucune température ni aucun temps d'incubation n'assure à lui seul la récupération de toutes les bactéries hétérotrophes, y compris celles qui pourraient être endommagées, l'utilisation de la gélose R2A s'est avérée la plus performante à cet égard (Deininger et Lee, 2001; Uhl et Schaule, 2004; Gagnon et coll., 2007; Rand et coll., 2014, AWWA, 2017a).
La NPBH peut être mise en corrélation avec des changements relatifs à la qualité de l'eau dans un réseau de distribution (Hargesheimer, 2001; Gagnon et coll., 2007; Rand et coll., 2014). Des augmentations imprévues dans la gamme de référence de la NPBH peuvent indiquer une perturbation ou une contamination dans un réseau de distribution. Par exemple, une diminution du désinfectant résiduel est généralement associée à une augmentation de la NPBH. Malgré le fait que la NPBH est simple, peu coûteuse et utilisée depuis longtemps, elle compte plusieurs désavantages, dont l'exigence de ne pas dépasser un temps de rétention de huit heures ainsi que le temps nécessaire pour obtenir les résultats (c.-à-d. de deux à sept jours). Un autre inconvénient important est le fait que les bactéries hétérotrophes ne représentent ni l'abondance ni la composition des bactéries présentes dans l'eau potable (Van Nevel et coll., 2017). En fait, le consensus dans la documentation est le suivant : la fraction des cellules bactériennes détectées au moyen de la NPBH est inférieure à 1 % de la concentration bactérienne totale dans l'eau potable (OMS, 2003; Prest et coll., 2016a; Van Nevel et coll., 2017). Cela signifie que cette méthode sous-estime grandement la concentration et la diversité des bactéries présentes dans les réseaux de distribution d'eau potable. Compte tenu des limites de la NPBH, l'industrie de l'eau potable étudie des méthodes de rechange.
Analyse par adénosine triphosphate (ATP)
Le test de l'adénosine triphosphate gagne en popularité comme indicateur de la biomasse viable totale dans un réseau de distribution (Bourbigot et coll., 1982; Ochromowicz et Hoekstra, 2005; Whalen et coll., 2006; Siebel et coll., 2008; Hammes et coll., 2010; van der Wielen et van der Kooij, 2010; Nescerecka et coll., 2016; Whalen et coll., 2018). Cette analyse est peu coûteuse et facile à réaliser, en plus de donner des résultats en quelques minutes. L'adénosine triphosphate est une molécule qui libère de l'énergie, et elle est produite par tous les organismes vivants. Elle peut être utilisée comme indicateur de l'activité microbienne. Il existe une méthode d'essai standard pour détecter la teneur en ATP des microorganismes dans l'eau (ASTM International, 2015), et on trouve sur le commerce des trousses conformes à cette méthode.
Il s'agit de filtrer les échantillons d'eau, puis d'ajouter un réactif de lyse afin de libérer l'ATP cellulaire (cATP) des cellules microbiennes capturées sur le filtre (ASTM International, 2015). On ajoute ensuite de la luciférine-luciférase, une enzyme bioluminescente, et on mesure l'intensité lumineuse obtenue à l'aide d'un luminomètre. Les unités relatives de lumière émise sont converties par comparaison avec un étalon d'ATP, ce qui donne la concentration de cATP dans l'échantillon (en pg ATP/mL) (ASTM International, 2015). Cette concentration est proportionnelle au nombre de cellules microbiennes viables présentes dans l'échantillon. La méthode détecte normalement des concentrations de cATP allant de 0,1 pg cATP/mL (c.-à-d. la limite de détection) à 4 x 106 pg cATP/mL (c.-à-d. la limite supérieure) dans des échantillons d'eau de 50 mL (ASTM International, 2015). Kennedy et ses collaborateurs (2021) ont signalé qu'il existe un lien étroit entre l'ATP cellulaire et la numération des cellules intactes (ce qui est mesuré au moyen de la cytométrie en flux - voir la section B.3.3.1) pour les réseaux utilisant la chloration et ceux utilisant la chloramination. D'autres chercheurs ont obtenu des résultats similaires (Nescerecka et coll., 2014; Prest et coll., 2016c; Van Nevel et coll., 2017).
On peut représenter graphiquement les mesures de l'ATP, déceler les tendances et interpréter tous ces résultats conjointement avec les autres résultats en matière de surveillance (Siebel et coll., 2008; Hammes et coll., 2010; Douterelo et coll., 2014a; Nescerecka et coll., 2014; Van Nevel et coll., 2017). Par exemple, des mesures de l'ATP ainsi que des tendances relatives aux résidus de désinfectant (p. ex. si ceux-ci diminuent) peuvent très rapidement fournir une indication de l'augmentation de l'activité microbienne, ce qui nécessite des mesures de suivi. Les concentrations de base de l'ATP cellulaire seront uniques à chaque réseau (Stoddart, 2020).
Des concentrations de l'ATP cellulaire supérieures à 1 pg/mL constituent un seuil de déclenchement de mesures visant à prévenir l'accroissement de l'activité microbienne dans les réseaux de distribution à grande échelle qui utilisent la chloration (Hill et coll., 2018) et la chloramination (Ballantyne et Meteer, 2018). D'autres ont publié des applications à grande échelle des mesures de l'ATP (Bourbigot et coll., 1982; Delahaye et coll., 2003; Cantor et coll., 2012; LeChevallier et coll., 2015a, 2015b; Skadsen et coll., 2015; Shurtz et coll., 2017; McIlwain, 2020).
B.3.2.3 pH et potentiel d'oxydoréduction
Le pH et le potentiel d'oxydoréduction sont des paramètres critiques qui influent sur le cycle de vie des microorganismes et la solubilité des métaux dans les réseaux de distribution. Les valeurs de ces paramètres permettent de comprendre les tendances et les variations de la qualité de l'eau dans un réseau de distribution. Par exemple, un état d'oxydation (potentiel d'oxydoréduction supérieur à 100 mV) appuiera l'activité microbienne de type aérobie, tandis qu'un état de réduction (potentiel d'oxydoréduction inférieur à 0 mV) favorisera l'activité microbienne de type anaérobie (AWWA, 2015a). Un état d'oxydation indique la présence d'agents oxydants tels que l'oxygène dissous. Lorsque la valeur du potentiel d'oxydoréduction est élevée, cela indique la présence de désinfectants chimiques tels que le chlore (Goncharuk et coll., 2010; AWWA, 2015a). Un fort potentiel d'oxydoréduction indique une qualité de l'eau peu propice à la croissance microbienne (Cantor, 2018).
L'activité microbienne peut faire baisser le pH dans un réseau de distribution en raison de la respiration des biofilms, laquelle produit du dioxyde de carbone. À son tour, le dioxyde de carbone peut favoriser la corrosion et le relargage de métaux (p. ex. plomb et cuivre) (AWWA, 2011). En revanche, un pH élevé donne lieu à un potentiel d'oxydoréduction plus faible. Copeland et Lytle (2014) ont présenté le potentiel d'oxydoréduction des agents oxydants couramment utilisés dans différentes conditions de pH. Pour le chlore libre, une concentration d'environ 0,2 mg/L était associée à un potentiel d'oxydoréduction de 600 mV à un pH de 7 ou 8, tandis que pour un pH de 9, une concentration de 0,5 à 0,8 mg/L était nécessaire (valeurs interprétées à partir d'un graphique). Les auteurs ont également comparé les valeurs du potentiel d'oxydoréduction à un pH de 8; pour obtenir un potentiel d'oxydoréduction de 600 mV, une concentration de monochloramine de 1,1 à 1,7 mg/L était nécessaire, en comparaison avec une concentration de chlore libre d'environ 0,2 mg/L (valeurs interprétées à partir d'un graphique). Par conséquent, le potentiel d'oxydoréduction fournit un résultat rapide à valeur unique qui est comparable entre les réseaux de distribution, peu importe la concentration résiduelle de désinfectant ou le pH.
Une stagnation nocturne peut provoquer un changement dans le potentiel d'oxydoréduction, puisque les biofilms et les dépôts mobiles entraînent une demande d'oxydant chimique (voir la section B.2.2), laquelle peut donner lieu à une augmentation des concentrations de métaux (Blain, 2014; Blain et Friedman, 2014; Friedman, 2014). Les auteurs ont constaté qu'après 15 heures de stagnation, la concentration de fer était passée de moins de 0,1 mg/L à 1,1 mg/L, tandis que la concentration de manganèse était passée de moins de 0,02 mg/L à 0,07 mg/L. Un potentiel d'oxydoréduction de 700 à 900 mV a été requis pour contrôler les concentrations de métaux, ce qui correspondait à une concentration résiduelle de chlore libre de 0,6 à 0,8 mg/L. Les liens entre le potentiel d'oxydoréduction et le pH (qu'on appelle « diagrammes de Pourbaix ») aident à prévoir la spéciation des métaux afin de mieux contrôler les processus chimiques dans les réseaux de distribution (c.-à-d. corrosion et adsorption/désorption) (Copeland et Lytle, 2014). L'OMS (2011a) recommande que le potentiel d'oxydoréduction requis afin d'assurer l'efficacité de l'oxydation soit déterminé pour chaque réseau.
Ces paramètres doivent être analysés sur le terrain, car des changements peuvent survenir très rapidement si les échantillons d'eau sont en contact avec l'air. Des instruments en ligne sont également disponibles (Frey et Sullivan, US EPA, 2009, 2018a).
B.3.2.4 Couleur
La couleur peut indiquer la libération de biofilms ou de métaux (Husband et Boxall, 2010) et être un indicateur utile des changements relatifs à la qualité de l'eau. La présence de particules en suspension (p. ex. argile ou oxydes de fer et de manganèse) peut donner à l'eau une couleur dite apparente. La couleur apparente s'applique aux échantillons non filtrés et est une mesure utile pour évaluer la présence d'oxydes de fer et de manganèse dans un réseau de distribution (Reiber et Dostal, 2000). Un échantillon filtré est défini, sur le plan opérationnel, comme une « couleur réelle » (APHA et coll., 2017) et mesure la couleur qui est attribuable à la présence de matières organiques dissoutes. La comparaison de la couleur apparente et de la couleur réelle peut aider les services d'eau à déterminer si les plaintes relatives à la couleur de l'eau sont dues à des particules en suspension ou à des matières organiques dissoutes (Santé Canada, 2020c).
Des analyseurs en ligne, portatifs et de laboratoire peuvent être utilisés pour mesurer la couleur de façon continue, que ce soit sur le terrain ou en laboratoire.
B.3.2.5 Concentrations de nutriments
Comme les nutriments contribuent à la croissance ou à la revivification microbienne et au développement des biofilms, les services d'eau devraient chercher à réduire au minimum leurs concentrations dans l'eau traitée et bien connaître leurs concentrations dans les réseaux de distribution. Les services d'eau qui ont recours à la chloramination devraient être particulièrement vigilants, puisque de l'ammoniac libre est relâché dans les réseaux de distribution et les installations de plomberie à mesure que le désinfectant résiduel se décompose, ce qui peut entraîner une croissance ou une revivification importante (Strickhouser et coll., 2006; Bradley et coll., 2020; Tolofari et coll., 2020).
Il est recommandé de surveiller le carbone organique total ou dissous (LeChevallier et coll., 2015a, 2015b; Cantor, 2017; Hill et coll., 2018). Dans le cas des systèmes d'approvisionnement en eau potable qui ont recours à la chloramination, il est important de surveiller les événements de nitrification (p. ex. l'ammoniac total et libre, les nitrites, les nitrates). Quant aux systèmes d'approvisionnement en eau potable qui utilisent des inhibiteurs de corrosion à base de phosphate, une surveillance de l'ensemble du réseau de distribution s'impose afin d'assurer une concentration constante de l'inhibiteur de corrosion. Des analyseurs en ligne et portatifs peuvent être utilisés pour obtenir des résultats rapides.
B.3.2.6 Métaux
L'environnement complexe et dynamique qui existe à l'intérieur des réseaux de distribution fait en sorte que les précipités métalliques sont liés aux biofilms et aux dépôts mobiles. Des changements relatifs à la qualité de l'eau (p. ex. résidus de désinfectant, potentiel d'oxydoréduction et pH) ainsi que des perturbations hydrauliques (p. ex. rinçage des bornes d'incendie, bris de conduite, réparation de fuites et activité de lutte contre les incendies) peuvent entraîner une augmentation des concentrations de métaux.
À tout le moins, on devrait assurer la surveillance des métaux qui sont des puits d'accumulation majeurs (p. ex. l'aluminium, le fer et le manganèse) pour d'autres contaminants liés à la santé. En outre, il est recommandé de surveiller les principaux contaminants qui peuvent avoir un effet sur la santé et dont on sait qu'ils s'accumulent (p. ex. l'arsenic, le plomb et tout autre paramètre propre à un réseau donné et pour lequel un traitement est en place). Certains laboratoires peuvent détecter un nombre important de métaux pour un prix forfaitaire par échantillon. Dans un tel cas, il est recommandé de faire une analyse complète des métaux pour obtenir des renseignements utiles concernant la formation et la dissolution d'incrustations (Cantor, 2017). Des analyseurs en ligne et portatifs peuvent également être utilisés pour obtenir des résultats rapides.
La détermination de la concentration de métaux dissous et de la concentration de métaux particulaires est recommandée (Cantor, 2017). Il est pertinent de savoir quels sont les métaux présents sous forme dissoute ou particulaires afin d'évaluer le devenir et le transport des métaux au sein des réseaux de distribution et de déterminer les mécanismes pouvant entraîner des perturbations ou à la libération. Par exemple, une augmentation des concentrations de métaux sous forme particulaires suggère un besoin de nettoyer les conduites principales (p. ex. rinçage unidirectionnel) afin d'enlever les matières mobiles dans l'eau. Une augmentation des concentrations de métaux dissous peut nécessiter le renforcement du contrôle de la qualité de l'eau traitée (p. ex. pH et phosphate).
Afin de déterminer les concentrations de métaux dissous, les échantillons doivent être filtrés au moment où ils sont prélevés (et non en laboratoire). S'il n'est pas possible de procéder ainsi, les échantillons doivent être prélevés et livrés au laboratoire sans délai à des fins de filtrage et d'acidification (APHA et coll., 2017). En ce qui concerne la surveillance des réseaux de distribution, il est acceptable de considérer que la concentration de métaux particulaires représente la différence entre la concentration de métaux totaux et la concentration de métaux dissous.
B.3.2.7 Taux de formation de biofilms et taux de corrosion
Le taux de formation de biofilms évalue le taux et la portée de la croissance ou de la revivification de type aérobie ou anaérobie qui a lieu sur les coupons placés dans un appareil à passage unique, comme celui présenté dans la figure 7 (van der Kooij, 1999; van Lieverloo et coll., 2012; LeChevallier et coll., 2015b; Hooper et coll., 2019). Les coupons de métal peuvent être utilisés pour mesurer simultanément le taux de corrosion, puisque le contrôle de la corrosion est requis afin de réduire au minimum la détérioration de la qualité de l'eau (LeChevallier et coll., 2015b; Cantor, 2017). En revanche, les coupons faits en verre (van der Kooij, 1999) ou en polycarbonate (Hooper et coll., 2019) peuvent uniquement être utilisés pour mesurer le taux de formation de biofilms.
L'appareil présenté dans la figure 7 fournit un moyen simple, facile et rentable de comparer la croissance ou la revivification et le taux de corrosion aux différents endroits dans un réseau de distribution où il peut être installé (p. ex. station de pompage et bâtiments publics). L'eau est en contact avec le coupon et circule selon un débit contrôlé et pendant une période prédéterminée afin d'établir des comparaisons entre les sites. Les microorganismes se fixent, forment un biofilm et entraînent des changements dans la qualité de l'eau. En ce qui concerne le taux de formation de biofilms, les coupons sont récupérés après deux semaines et la quantité d'ATP est mesurée (Hooper et coll., 2019). Pour le taux de corrosion, les options de mesure incluent la perte de poids mensuelle des coupons et la résistance à la polarisation rectiligne par l'entremise d'électrodes en acier doux (LeChevallier, 2015a, 2016b). Le taux de corrosion devrait être évalué sur une période prolongée, et non pour des changements à court terme (AWWA, 2017b).
Les liens propres à chaque réseau entre le taux de formation de biofilms et le taux de corrosion peuvent ensuite être établis à l'aide de la concentration résiduelle de désinfectant et de la température (LeChevallier et coll., 2015a, 2015b).
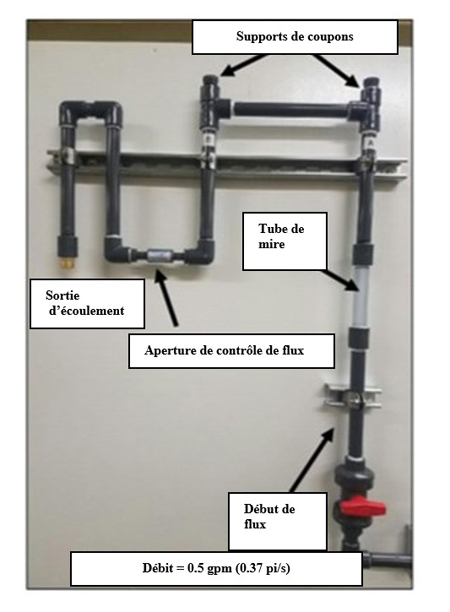
Figure 7 : Texte descriptif
Une photographie d'un appareil à circulation simple pouvant être installé à divers endroits dans un réseau de distribution, afin de mesurer la croissance ou la revivification microbienne et le taux de corrosion. L'appareil consiste en un tuyau de petit diamètre avec une boucle. En bas à droite de l'appareil, il y a un début de flux. En remontant le tuyau, il y a une partie claire, étiquetée "tube de mire". Plus haut à partir du tube de mire se trouve une section de tuyau de raccordement étiquetés « supports de coupons ». Immédiatement à gauche de cette section de connecteur, le tuyau plonge pour créer une forme en U. Il y a une aperture de contrôle de flux au milieu de la boucle. Au sommet de la boucle se trouve un petit connecteur étiqueté « sortie d'écoulement ». Le débit est de 0,5 gpm (0,37 pi/s).
B.3.3 Méthodes avancées
B.3.3.1 Cytométrie en flux (CMF)
La cytométrie en flux est la méthode de recherche la mieux établie pour la surveillance de la qualité microbienne de l'eau dans les réseaux de distribution (Douterelo et coll., 2014a; Van Nevel et coll., 2017; Safford et Bischel, 2019), et elle a été utilisée pour étudier de multiples réseaux à grande échelle (Lautenschlager et coll., 2013; El-Chakhtoura et coll., 2015; Prest et coll., 2016c; Nescerecka et coll., 2018; Schleich et coll., 2019; Favere et coll., 2020; Kennedy et coll., 2021). Cette méthode caractérise et quantifie les particules en suspension, y compris les cellules microbiennes, à l'aide d'un instrument appelé « cytomètre en flux ». En bref, les particules, y compris les cellules microbiennes, présentes dans un échantillon sont colorées par l'ajout d'un colorant fluorescent (p. ex. SYBR Green I). Par la suite, l'échantillon en question est injecté dans le cytomètre en flux. Une fois dans le cytomètre en flux, les particules passent, une à la fois, dans un faisceau laser (Shapiro, 2003; McKinnon, 2018; figure 8). Le faisceau laser excite les particules fluorescentes qui émettent ensuite de la lumière à une longueur d'onde supérieure.
Les données de cytométrie en flux peuvent être analysées de diverses façons, et ce, à l'aide de différentes stratégies de « points de contrôle ». Ces points de contrôle sont placés autour des populations de cellules qui possèdent des caractéristiques similaires, afin de les étudier et de les quantifier. La numération des cellules obtenue par la cytométrie en flux est signalée comme étant la numération des cellules totales ou la numération des cellules intactes. La numération des cellules intactes est déterminée lorsqu'une coloration supplémentaire est effectuée à l'aide de colorants qui se fixent sur les acides nucléiques, comme l'iodure de propidium, afin de faire la distinction entre les cellules intactes et les cellules dont la membrane est endommagée (Ramseier et coll., 2011).
Bien que l'utilisation de la cytométrie en flux semble comporter plusieurs avantages, y compris le fait qu'elle fournit la représentation la plus exacte du microbiome (Van Nevel et coll., 2017; Kennedy et coll., 2021), elle est également associée à un certain nombre d'inconvénients (tableau 4). Par exemple, l'interprétation des résultats de la cytométrie en flux est compliquée en raison de la surabondance des données générées et du manque de méthodes d'analyse normalisées (Hammes et Egli, 2010; Van Nevel et coll., 2017). Un autre inconvénient est le besoin d'établir une numération de référence (p. ex. celle obtenue dans les conditions normales) (Besmer et coll., 2014). Cela nécessite une surveillance généralisée et à long terme des réseaux de distribution d'eau potable pour déterminer la numération des cellules obtenue par cytométrie en flux dans diverses conditions et pendant différentes saisons (Besmer et coll., 2014, 2016). Par conséquent, le recours à la cytométrie en flux pour la surveillance de routine des réseaux de distribution d'eau potable nécessite au moins quelques années de collecte de données, de concert avec d'autres méthodes de surveillance microbienne, afin de bien pouvoir interpréter les résultats (Van Nevel et coll., 2017). En outre, la cytométrie en flux est coûteuse, en comparaison avec d'autres méthodes de surveillance, surtout en raison du coût de l'instrument.
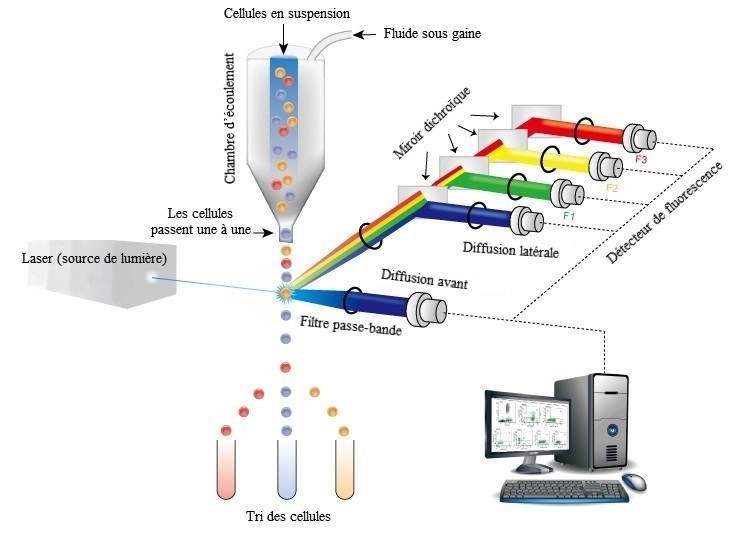
Figure 8 : Texte descriptif
Une illustration montrant les principes de la cytométrie en flux. L'illustration montre une suspension de cellules (colorées), représentée par un liquide composé d'un mélange de petites sphères rouges, jaunes et bleues, entrant dans un appareil en forme d'entonnoir, appelé chambre d'écoulement. Les sphères (cellules) sortent de la chambre en une seule file, c'est-à-dire une à la fois. Lorsque chaque sphère (cellule) sort, elle est représentée passant à travers un faisceau de lumière provenant d'un laser, représenté sous la forme d'une boîte intitulée « source de lumière ». La sphère (cellule) est montrée excitée, représentée par un éclat de lumière et émettant de la fluorescence - un arc-en-ciel de rouge, jaune, vert et bleu. Ce processus est agrandi sur le côté droit de l'illustration, où les couleurs sont représentées comme des faisceaux de lumière séparés qui se relient à un détecteur de fluorescence, représenté par un cylindre mince (pour chaque couleur) avec un chapeau haut de forme gris, et séparés par des miroirs. Des sphères (cellules) de même couleur sont montrées entrant dans le même tube à essai après l'enregistrement de leur fluorescence par un ordinateur.
| Avantages | Références |
|---|---|
| Capacité de mesurer une variation de la numération des cellules bactériennes. | Lautenschlager et coll., 2013; Prest et coll., 2013, 2016a, 2016b, 2016c; Nescerecka et coll., 2014; Kennedy et coll., 2021 |
| Méthode rapide (~ 15 minutes), précise et quantitative. | Van Nevel et coll., 2017 |
| Très reproductible (p. ex. les écarts-types relatifs sont inférieurs à 2,5 pour un seul utilisateur et un seul appareil). | Hammes et coll., 2008; Wang et coll., 2010; Prest et coll., 2013; Kennedy et coll., 2021 |
| Capacité de déterminer la viabilité en utilisant des colorants qui se fixent aux acides nucléiques | Ramseier et coll., 2011 |
| Se prête à l'automatisation, ce qui permet un débit élevé (la fonction d'analyse des plaques avec puits multiples permet d'analyser jusqu'à 500 échantillons en une journée). | Van Nevel et coll., 2013 |
| La technologie de surveillance en ligne permet des mesures de cytométrie en flux en continu pendant plusieurs semaines de suite. | Hammes et coll., 2012; Brognaux et coll., 2013; Besmer et coll., 2014; Prest et coll., 2013, 2016a, 2016b, 2016c |
| Caractérisation détaillée des communautés bactériennes à l'aide des profils de cytométrie. | De Roy et coll., 2012; Prest et coll., 2013; Koch et coll., 2014; Van Nevel et coll., 2017; Favere et coll., 2020 |
| Les profils de cytométrie offrent une sensibilité accrue pour détecter les petits changements et petites variations au sein d'une communauté bactérienne, et sont conformes à l'analyse de l'ARNr 16S. | De Roy et coll., 2012; Prest et coll., 2013; Koch et coll., 2014; Props et coll., 2016 |
| Inconvénients | Références |
| Exigences considérables en matière d'équipement, de formation des utilisateurs et de traitement des données. | Hammes et Egli, 2010 |
| Processus de dénombrement subjectif (c. à d. synchronisation manuelle). | Hammes et Egli, 2010; De Roy et coll., 2012; Aghaeepour et coll., 2013; Prest et coll., 2013 |
| Ne fait pas la distinction entre les cellules isolées ou les amas (p. ex. biofilms boueux), ce qui pourrait entraîner un sous-dénombrement. | Shapiro, 2003; van der Kooij et van der Wielen, 2014 |
| Des méthodes normalisées n'ont pas encore été élaborées pour les applications concernant l'eau potable. | Hammes et Egli, 2010; Lautenschlager et coll., 2013; Prest et coll., 2013 |
B.3.3.2 Méthodes moléculaires
Il existe plusieurs méthodes moléculaires permettant d'évaluer la diversité des communautés microbiennes dans les réseaux de distribution de l'eau potable (Norton et LeChevallier 2000; Eichler et coll. 2006; Henne et coll. 2012; Pinto et coll. 2012; Liu et coll., 2013c, 2014, 2018; Prest et coll., 2013, 2014, 2016a, 2016b, 2016c; Vierheilig et coll., 2015; Ling et coll., 2016; Van Nevel et coll., 2017; Douterelo et coll., 2018; Garner et coll.2021). Ces méthodes reposent généralement sur la détection, la quantification et la comparaison des acides nucléiques (acide désoxyribonucléique [ADN] ou acide ribonucléique [ARN]). L'amplification en chaîne par polymerase (PCR) quantitative (q) aussi appelée « PCR en temps réel », est largement utilisée pour énumérer les gènes cibles au sein des microorganismes présents dans un réseau de distribution. Cette méthode comprend le traitement d'échantillons d'eau ou de biofilms afin d'isoler l'ADN ou l'ARN. Dans le cas des biofilms, des échantillons sont prélevés de différentes façons, notamment : des segments de tuyaux découpés (LeChevallier et coll., 1998; Wingender et Flemming, 2004, 2011), des coupons insérés dans les tuyaux (Douterelo et coll., 2016b), les matières entraînées par l'eau après le rinçage des tuyaux (Douterelo et coll., 2014b, 2016a), des compteurs d'eau domestiques (Hong et coll., 2010; Ling et coll., 2016) ou des coupons placés dans un appareil à renouvellement continu (voir la section B.3.2.7).
Le matériel nucléique extrait est ensuite amplifié par des amorces qui ciblent des gènes marqueurs précis. Dans le cas des bactéries et d'autres procaryotes, l'ARNr 16S est le gène marqueur le plus couramment utilisé, tandis que l'ARNr 18S et les espaceurs internes transcrits sont utilisés pour les champignons et d'autres eucaryotes (Bokulich et Mills, 2013; Bradley et coll., 2016; Lan et coll., 2016). Des sondes oligonucléotidiques fluorescentes sont également ajoutées. Lorsque ces sondes se lient à l'ADN bicaténaire, elles émettent de la fluorescence. Par conséquent, à mesure que la région cible est amplifiée, la fluorescence émise est mesurée en temps réel, ce qui permet la quantification des produits de PCR.
Le séquençage, qu'il soit question de régions associées aux gènes marqueurs ou de génomes entiers, peut fournir des renseignements pertinents sur la composition des communautés microbiennes dans les réseaux de distribution. Une variété de technologies et de plateformes de séquençage de nouvelle génération existe, ce qui permet un séquençage rapide et, par conséquent, une identification plus opportune et précise des microorganismes (Garner et coll., 2021). Bien que ces méthodes et d'autres méthodes moléculaires offrent plusieurs avantages, elles comportent également quelques lacunes importantes (tableau 5), dont leur incapacité à faire la distinction entre les microorganismes viables et non viables.
| Avantages | Références |
|---|---|
| Ne dépendent pas de la culture. | S.O. |
| Permettent des analyses supplémentaires (futures), grâce à la congélation des acides nucléiques isolés. | Van Nevel et coll., 2017 |
| Les technologies de séquençage de nouvelle génération permettent un séquençage en temps réel. | Tan et coll., 2015; Goordial et coll., 2017; Garner et coll., 2021 |
| Peuvent être utilisées pour la recherche des sources (c.-à-d. détermination de l'origine de la contamination). | Liu et coll., 2018 |
| Inconvénients | Références |
| Limite de détection inadéquate (c.-à-d. dépendent du gène ciblé et de la longueur de la séquence) et difficultés d'évaluation de la viabilité. | Nocker et coll., 2007, 2017 |
| L'extraction des acides nucléiques prend beaucoup de temps. | Nocker et coll., 2007, 2017; Hwang et coll., 2011, 2012; Salter et coll., 2014 |
| Biais de l'amplification par PCR (c.-à-d. choix de la cible et des amorces). | Nocker et coll., 2007, 2017; Hwang et coll., 2011, 2012; Salter et coll., 2014 |
| Hypothèses et approches variables en matière d'extraction, d'analyse et d'interprétation des profils et des séquences. | S.O. |
| Méthodes coûteuses, nécessitant une formation spécialisée en biologie moléculaire. | S.O. |
B.3.3.3 Autopsies des conduites et caractérisation des matières accumulées
Des renseignements sur la nature et la quantité des matières qui s'accumulent dans les réseaux de distribution peuvent être obtenus en prélevant des échantillons pendant les autopsies des conduites ou le nettoyage des réseaux de distribution (p. ex. rinçage unidirectionnel) (Carrière et coll., 2005; Poças et coll., 2013; Friedman et coll., 2016). L'analyse des échantillons dépendra de la source d'eau et des objectifs de l'étude. Les zones à étudier peuvent être sélectionnées en fonction des plaintes des consommateurs, des préoccupations relatives à la qualité de l'eau, de la concentration désinfectant résiduel, des caractéristiques de la conduite principale (p. ex. matériel, taille, en circuit ou en cul-de-sac), de la fréquence des bris de conduite ou de l'endroit où l'infrastructure doit être remplacée (Halton, 2001; Friedman et coll., 2003; Meteer, 2018).
Une telle autopsie suppose le retrait d'une partie de la conduite principale d'un réseau de distribution ainsi que la caractérisation des matières accumulées (Halton, 2001; Muylwyk et MacDonald, 2001; Meteer, 2018). Meteer (2018) recommande de faire une série de prélèvements, d'abord en grattant avec un doigt (protégé par un gant en silicone), puis en utilisant des grattoirs en silicone, en plastique et en métal (dans cet ordre). Des observations devraient être consignées et des photos devraient être prises. Par la suite, des échantillons de matières accumulées devraient être prélevés. Les dépôts mobiles dans l'eau peuvent être recueillis pendant le rinçage unidirectionnel ou à l'aide d'une autre technique de nettoyage qui comprend un écoulement d'eau. Les filets des bornes d'incendie sont généralement utilisés pour recueillir les matières mobiles dans l'eau au point d'écoulement (Friedman et coll., 2003).
Les matières recueillies peuvent être caractérisées selon une multitude de paramètres (Halton, 2001; Friedman et coll., 2010a, 2016; Poças et coll., 2013; Douterelo et coll., 2014b; Hill et coll., 2018; Meteer, 2018). En voici quelques exemples :
- la composition physique (p. ex. la densité et la taille des particules, les solides totaux en suspension et les solides volatils);
- la composition chimique (p. ex. métaux, ions et nutriments);
- la composition biologique, au moyen de méthodes courantes (p. ex. l'ATP, la NPBH-R2A, les coliformes totaux, les bactéries réductrices du fer et les bactéries réductrices du soufre);
- la composition biologique, au moyen de méthodes avancées (p. ex. les bactéries viables au moyen de la cytométrie en flux – voir la section B.3.2.1, et l'analyse de la communauté microbienne – voir la section B.3.4.2).
Carrière et ses collaborateurs (2005) recommandent de calculer le taux d'accumulation de dépôts afin d'établir les fréquences de nettoyage optimales et de trouver des options de rechange pour limiter l'accumulation de dépôts dans les réseaux de distribution (p. ex. l'amélioration de l'élimination des matières dans les installations de traitement, l'optimisation de la coagulation/floculation pour réduire au minimum la post-précipitation dans les réseaux de distribution, ainsi que le contrôle de la corrosion).
B.3.3.4 Modèles de réseaux de distribution d'eau
Des modèles physiques à petite échelle, comme des bancs d'essai de tuyaux ou des tuyaux en boucle, peuvent être utilisés pour étudier l'incidence des changements relatifs à la chimie de l'eau sur la qualité de l'eau ainsi que pour évaluer les mesures d'atténuation (Santé Canada, 2009b; Cantor, 2012, 2017, 2021; Friedman, 2014). Ces modèles fournissent généralement des renseignements sur une multitude de facteurs liés à la stabilité biologique, comme la coloration de l'eau, la formation et la dissolution d'incrustations, la corrosion influencée par les microorganismes, ainsi que les effets des opérations.
Les modèles informatiques des réseaux de distribution d'eau peuvent aider à comprendre les changements relatifs à la qualité de l'eau, ainsi qu'à établir des méthodes de surveillance et d'échantillonnage (Skadsen et coll., 2008). Ces modèles informatiques tiennent compte des paramètres hydrauliques des réseaux de distribution, ainsi que d'autres caractéristiques, afin de stimuler la dynamique des réseaux de distribution (p. ex. la pression dans les réseaux, la vitesse de passage dans les conduites, la direction de l'écoulement, le temps de séjour de l'eau et les ratios des mélanges d'eau) (Kirmeyer et coll., 2000; Powell et coll., 2004; Friedman, 2020; Hatam et coll., 2020). Les modèles informatiques permettent aussi aux services d'eau de prévoir le comportement d'un réseau dans des conditions particulières ou d'évaluer des options de rechange pour remédier aux problèmes relatifs à la qualité de l'eau (Powell et coll., 2004; Speight et Khanal, 2009). Un certain nombre de modèles existent, dont le modèle EPANET (US EPA, 2018b) de l'Environmental Protection Agency (EPA) des É.-U., qui est un modèle de source ouverte pour l'étude des réseaux de distribution d'eau potable. Un module EPANET, appelé EPANET-MSX (où « MSX » signifie « Multi-Species Extension », c.-à-d. « extension multiespèces »), permet d'étudier les interactions entre les substances présentes dans l'eau et sur les parois des conduites (p. ex. désinfectant et microorganismes). De nos jours, la modélisation hydraulique est relativement courante (Shurtz et coll., 2017), mais il est essentiel que les services d'eau maintiennent un programme d'étalonnage lorsqu'ils utilisent des modèles informatiques (Clark et coll., 2010). La modélisation de la qualité de l'eau demeure compliquée et difficile à mettre en œuvre (Speight, 2021).
Les modèles d'évaluation quantitative des risques microbiologiques (QMRA) peuvent également être utilisés conjointement avec les modèles hydrauliques pour mieux comprendre les risques associés à la détérioration de la qualité microbienne de l'eau dans les réseaux de distribution (Blokker et coll., 2014, 2018). Cependant, l'obtention de données d'entrée exactes pour rendre les résultats plus significatifs demeure difficile (Besner et coll., 2011; Viñas et coll., 2019).
B.4 Programme de surveillance
B.4.1 Programme exhaustif de surveillance
Il est important de reconnaître que les réseaux de distribution varient grandement selon leur conception, leur taille et leur complexité. Aucun programme de surveillance ne peut à lui seul répondre aux besoins de tous les réseaux en raison des différences relatives aux aspects spatiaux (p. ex. point d'entrée, points médians/éloignés et zones de pression), aux aspects temporels (p. ex. variations diurnes ou saisonnières) et aux sites vulnérables (p. ex. vulnérabilité aux intrusions, grande population, population à risque ou zones visées par un grand nombre de plaintes des consommateurs) (Lindley et Buchberger, 2002; Hill et coll., 2018). Par conséquent, les services d'eau devraient plutôt concevoir un programme de surveillance basé sur une évaluation propre à chaque réseau, en plus de tenir compte du coût et de la facilité d'utilisation des méthodes de surveillance ainsi que des exigences des autorités responsables de l'eau potable.
L'évaluation propre à chaque réseau devrait établir des objectifs en matière de surveillance et confirmer ce qui doit faire l'objet d'une surveillance (AWWA, 2005). Ces éléments auront une incidence sur d'autres considérations relatives au prélèvement, à l'emplacement et à la fréquence des échantillons. Par exemple, il est peu probable que des événements de courte durée soient pris en compte au moyen d'échantillons instantanés quotidiens. Une surveillance continue de la qualité de l'eau augmente la probabilité que ces événements soient détectés, à condition que ces derniers aient lieu dans des zones associées à des variations temporelles; les installations de stockage peuvent notamment jouer un rôle important dans la variabilité temporelle de la qualité de l'eau (Speight, 2010).
B.4.2 Prélèvement d'échantillons
Une variété de méthodes d'échantillonnage existe (voir le tableau 6). Selon les objectifs de la surveillance, un équipement en ligne en continu ou des échantillons instantanés peuvent être utilisés (EPA, 2018a).
| Paramètre | Enregistreur de données/en ligne | Échantillons instantanés – sur le terrain | Échantillons instantanés – en laboratoire | Autre |
|---|---|---|---|---|
| Indicateurs bactériens | Non | Non | Oui | Non |
| Résidus de désinfectant | Oui | Oui | Non | Non |
| Turbidité | Oui | Oui | Non | Non |
| Conductivité | Oui | Oui | Non | Non |
| Pression | Oui | Non | Non | Non |
| Température | Oui | Oui | Non | Non |
| NPBH | Non | Non | Oui | Non |
| cATP | Oui | Oui | Oui | Non |
| pH | Oui | Oui | Non | Non |
| Potentiel d'oxydoréduction | Oui | Oui | Non | Non |
| Couleur | Oui | Oui | Oui | Non |
| Nutriments | Oui | Oui | Oui | Non |
| Métaux | OuiTableau 6 Note b | OuiTableau 6 Note b | OuiTableau 6 Note b | Non |
| Taux de formation de biofilms | Non | Non | Non | Oui – appareil à renouvellement continu et coupons |
| Taux de corrosion | Non | Non | Non | Oui – appareil à renouvellement continu et coupons en métal; résistance à la polarisation rectiligne par l'entremise d'électrodes en acier doux |
|
||||
B.4.3 Fréquence d'échantillonnage
La fréquence d'échantillonnage dépend en fin de compte d'une évaluation propre à chaque réseau de distribution, notamment en ce qui concerne sa taille, sa complexité et sa variabilité temporelle, et tient compte de toute exigence formulée par les autorités responsables de l'eau potable. Par exemple, si le but est de détecter rapidement un changement dans la qualité de l'eau, la fréquence d'échantillonnage doit être élevée (Buchberger et coll., 2003). De plus, lorsque la température de l'eau dans un réseau de distribution atteint 15 °C, cela peut entraîner une augmentation de la fréquence d'échantillonnage, passant notamment de chaque semaine à chaque jour pour certains paramètres (Santé Canada, 2021b).
Des conseils sur l'échantillonnage des indicateurs bactériens (c.-à-d. E. coli et coliformes totaux) dans les réseaux de distribution existent au Canada (Santé Canada, 2020a, 2020b) et ailleurs dans le monde (US EPA, 2013; OMS, 2011a, 2014). Les services d'eau devraient évaluer quels paramètres peuvent être mesurés sur le terrain ou échantillonnés pendant la collecte d'échantillons d'indicateurs bactériens. Pour établir des conditions de référence, un échantillonnage hebdomadaire (Cantor, 2017; Hill et coll., 2018) ou quotidien, si possible, est recommandé (Friedman et Slabaugh, 2020).
Une surveillance fondée sur les événements devrait également être réalisée suivant des perturbations hydrauliques (p. ex. bris, réparation ou rinçage des conduites principales) ou des changements relatifs à la chimie de l'eau (p. ex. changements liés au pH, au type de résidus de désinfectant ou au type de source d'eau), ainsi que lorsqu'une coloration de l'eau a été signalée (Friedman et coll., 2016). Des échantillons devraient être prélevés dans les sites qui font partie du réseau de distribution (p. ex. bornes d'incendie ou valves), ainsi qu'à partir des robinets d'eau potable dans les bâtiments publics ou privés, afin d'aider à déterminer la cause de l'événement et les concentrations au robinet.
Cantor (2018) présente des conseils pratiques concernant la surveillance et l'évaluation de la qualité de l'eau dans les réseaux de distribution.
B.4.4 Lieux d'échantillonnage
Il convient d'accorder une attention particulière afin de bien choisir les endroits où, dans un réseau de distribution, le risque de détérioration de la qualité de l'eau est probablement le plus élevé. Pour ce faire, il faut connaître le réseau de distribution, grâce à une description détaillée de l'emplacement des conduites principales et secondaires. Il faut également tenir compte de l'emplacement des installations de stockage, des pompes, des vannes, des compteurs et des raccordements aux consommateurs. D'autres attributs du réseau, y compris le matériau, l'âge et l'historique des bris de conduite, sont des facteurs importants qui doivent être pris en compte dans le choix des lieux d'échantillonnage. Les données historiques sur la qualité de l'eau font également partie intégrante des éléments à considérer lors du choix des lieux de surveillance (p. ex. les sites contaminés par le passé). Il est également important de tenir compte des caractéristiques hydrauliques du réseau (p. ex. le temps de séjour de l'eau moyen, en comparaison avec les culs-de-sac et le temps de séjour de l'eau élevé). Les usages de bâtiments (p. ex. écoles et hôpitaux) desservis par le réseau de distribution devraient également être pris en considération, car ils représentent un plus grand nombre d'expositions potentielles.
En plus des données sur la qualité de l'eau et les caractéristiques du réseau de distribution, le choix des lieux de surveillance dépendra également des exigences des autorités responsables de l'eau potable. C'est pourquoi on devrait consulter ces dernières avant de déterminer les lieux d'échantillonnage.
En règle générale, le point d'entrée du réseau de distribution et les points situés près des zones mortes et des endroits présentant de faibles vitesses hydrauliques ou de temps de séjour élevés devraient être ciblés pour la surveillance (Islam et coll., 2015; Cantor, 2017). En ce qui concerne les métaux, les zones où la turbidité (p. ex. solides particulaires dans l'eau) et la conductivité (p. ex. solides dissous dans l'eau) varient devraient être ciblées. En l'absence de données sur la turbidité et la conductivité, les sites où les échantillons d'indicateurs bactériens sont prélevés peuvent être utilisés en attendant que de telles données soient recueillies. Lorsque les lieux d'échantillonnage ont été établis, il est important de s'assurer qu'ils sont spatialement représentatifs (Vital et coll., 2012; Nescerecka et coll., 2014; Hill et coll., 2018). En outre, les lieux d'échantillonnage peuvent être modifiés à mesure que les données sur la qualité de l'eau sont recueillies et que les tendances sont évaluées.
B.4.5 Analyses des données et réponse
Les données générées devraient faire l'objet d'un suivi afin d'évaluer les tendances et la variabilité. Cela permettra aux responsables de déterminer les conditions de base relatives à la qualité de l'eau (p. ex. les variations normales qui ne nécessitent aucune mesure), et donc de savoir si, et comment, la stabilité biologique varie dans les réseaux de distribution. Les services d'eau peuvent alors établir des objectifs relatifs à la qualité de l'eau pour chaque réseau. Des seuils d'intervention et d'alerte propres à chaque réseau devraient également être établis afin que des mesures préventives ou correctives puissent être prises, au besoin (AWWA, 2005; Cantor et Cantor, 2009). Des procédures opérationnelles normalisées doivent clairement définir quelles sont les mesures nécessaires pour éviter une détérioration de la qualité de l'eau (c.-à-d. mesure préventive) ainsi que pour gérer des conditions potentiellement néfastes en lien avec la qualité de l'eau (c.-à-d. mesure corrective). L'objectif des protocoles d'intervention à volets multiples est d'éviter le besoin de prendre des mesures d'urgence, lesquelles sont souvent beaucoup plus complexes et associées à une forte intensité de main-d'œuvre (AWWA, 2005). Dans l'éventualité où les objectifs relatifs à la qualité de l'eau ne sont pas atteints, des mesures correctives ou préventives propres à chaque réseau devraient être prises (Ballantyne et Meteer, 2018).
De plus amples renseignements sur la gestion et l'analyse des données de surveillance de la qualité de l'eau figurent dans divers documents (AwwaRF, 2002; Cantor et Cantor, 2009; AWWA, 2017a; Cantor, 2018).
B.5 Stratégies de gestion
Les réseaux de distribution d'eau potable constituent la dernière barrière de protection avant le robinet du consommateur. Un réseau de distribution bien entretenu et bien exploité est donc un élément essentiel pour assurer un approvisionnement en eau potable saine. Bien que les réseaux de distribution d'eau potable varient considérablement, ils ont des enjeux communs, dont la détérioration de la qualité de l'eau (voir la section B.2). Afin d'assurer la distribution d'une eau potable saine aux consommateurs, les causes de cette détérioration doivent être connues. Il est recommandé que les responsables des services d'eau établissent un plan de surveillance du réseau de distribution afin de déterminer les sources de contamination et les causes de croissance et de revivification des microorganismes.
Les résultats de la surveillance orientent la sélection de stratégies de gestion appropriées. Certaines stratégies sont présentées ci-dessous; les services d'eau sont responsables de déterminer et de gérer la gamme complète des risques pouvant s'appliquer à chaque réseau. Des examens complets existent ailleurs (NRC, 2006; Kirmeyer et coll., 2014; Mosse et Murray, 2015; Cantor, 2017, 2018).
B.5.1 Eau entrant dans les réseaux de distribution
Les services d'eau doivent connaître l'incidence de la qualité de la source d'eau et des processus de traitement sur la stabilité biologique de l'eau qui entre dans les réseaux de distribution. Par exemple, l'eau souterraine comporte généralement moins de cellules et de nutriments organiques que l'eau de surface (Najm et coll., 2000; Prest et coll., 2016b). Cependant, l'eau souterraine peut avoir de plus grandes concentrations de nutriments organiques (p. ex. fer, manganèse, azote ou soufre) (AWWA, 2011), et des sédiments peuvent s'accumuler dans les réseaux de distribution, les installations de stockage et autres (Lotimer, 2012). En outre, l'eau souterraine anaérobie peut être associée à des taux de formation de biofilms plus élevés (c.-à-d. plus de 80 pg ATP/cm2-d) (van Lieverloo et coll., 2012), probablement en raison de concentrations élevées de méthane, de fer, d'ammonium ou de manganèse (de Vet, 2011). Les sources d'eau de surface et souterraine devraient être caractérisées en ce qui concerne les concentrations de nutriments (Cantor, 2017).
Les procédés de traitement peuvent également avoir une grande incidence sur la qualité de l'eau qui entre dans les réseaux de distribution (AWWA, 2011). Par exemple, les procédés d'oxydation produisent des nutriments biodégradables lors de la réaction avec les matières organiques (Alarcon-Herrera et coll., 1993; Bursill, 2001; Reckhow et coll., 2007). Par conséquent, une filtration bioactive pourrait être nécessaire à la stabilisation de l'eau traitée (GLUMRB, 2012). Dans certains pays européens, l'approche adoptée aux fins de la stabilité biologique consiste à produire de l'eau potable avec un carbone organique assimilable inférieur à 10 μg/L afin de contrôler ou de limiter l'activité microbienne en l'absence de concentration résiduelle de désinfectant (van der Kooij, 2000; Smeets et coll., 2009; Lautenschlager et coll., 2013). En Amérique du Nord, des concentrations minimales de désinfectant résiduel sont habituellement recommandées pour lutter efficacement contre la croissance ou la revivification dans les réseaux de distribution (LeChevallier et coll., 1996; LeChevallier et Au, 2004) (voir la section B.5.2).
En outre, la sélection du pH de l'eau traitée devrait être faite en tenant compte des processus chimiques dans les réseaux de distribution (c.-à-d. corrosion et adsorption/désorption). Pour assurer la stabilité biologique, la variabilité du pH doit être maintenue à ±0,2 unité partout dans le réseau de distribution (Muylwyk et MacDonald, 2001; Friedman et coll., 2010a; Santé Canada, 2015).
B.5.2 Désinfectant résiduel
Il est important de s'assurer que les désinfectant résiduel qui quitte l'installation de traitement sont stables; autrement, il pourrait être difficile de maintenir une concentration résiduelle partout dans le réseau de distribution (Alexander et coll., 2019; US EPA, 2019). Une « étude de conservation » est une façon simple et rentable d'évaluer la période pendant laquelle le désinfectant résiduel peut être maintenu efficacement dans les réseaux de distribution. Cette étude consiste à prélever des échantillons et à les « garder » pendant une durée représentative du temps de rétention dans les réseaux afin de mesurer la décomposition du désinfectant résiduel. Une telle étude peut être réalisée pour une eau froide (moins de 10 °C) et chaude (plus de 10 °C) afin d'évaluer l'incidence de la température. Les résultats de cette étude permettent de déterminer ce sur quoi les services d'eau devraient concentrer leurs efforts (p. ex. les installations de traitement ou les réseaux de distribution). Un exemple de changement lié aux installations de traitement consiste à améliorer l'élimination du carbone organique, ce qui a de multiples avantages, notamment en réduisant la demande de désinfectant et, par conséquent, en augmentant la stabilité du désinfectant résiduel et en réduisant le potentiel de formation de biofilms dans les réseaux de distribution, ce qui a pour effet d'augmenter la persistance du désinfectant résiduel (Chandy et Angles, 2001). Une orientation pratique existe pour aider les responsables des services d'eau à mener une telle étude (Alexander et coll., 2019; US EPA, 2019). D'autres méthodes visant à maintenir une concentration résiduelle de désinfectant efficace dans les réseaux de distribution sont notamment axées sur la gestion du temps de séjour de l'eau (voir les sections B.5.3 et B.5.4) et la réduction de la demande de désinfectant associées aux dépôts mobiles (voir la section B.5.5).
B.5.3 Installations de stockage
Les installations de stockage sont des infrastructures importantes pour maintenir la pression des réseaux de distribution et répondre aux demandes de pointe en eau. Cependant, elles peuvent entraîner une détérioration de la qualité de l'eau si elles ne sont pas exploitées et maintenues adéquatement (voir la section B.1). La stagnation et un temps de rétention excessif peuvent donner lieu à une stratification thermique, à une perte de résidus de désinfectant ou à une croissance ou revivification microbienne (US EPA, 2002b; Delahaye et coll., 2003). Pour les réseaux qui utilisent la chloramination, la nitrification est souvent associée aux installations de stockage (US EPA, 2002b; Baribeau et coll., 2005). Il a également été démontré que les sédiments des installations de stockage abritent des agents pathogènes opportunistes dans la plomberie des bâtiments, tels que Legionella spp. et Mycobacterium spp. (Lu et coll., 2015; Qin et coll., 2017).
À la lumière des risques associés aux installations de stockage, une orientation ou des normes de conception pour éviter la stagnation et réduire au minimum les temps de rétention sont disponibles auprès des provinces, des territoires et des associations de l'industrie (p. ex. AWWA). Il est également important d'élaborer un programme de surveillance unique pour chaque installation de stockage (p. ex. données opérationnelles, échantillonnage de sédiments et de biofilms) afin d'établir :
- un taux de roulement pour maintenir les concentrations résiduelles cibles de désinfectant et gérer le temps de séjour de l'eau pour des températures inférieures et supérieures à 15 °C;
- un calendrier d'inspection, de nettoyage et d'entretien pour détecter les éventuels points d'entrée de contaminants et procéder à l'élimination des matières accumulées.
Une orientation pratique concernant la gestion des risques associés aux installations de stockage est disponible (Kirmeyer et coll., 1999; Martel et coll., 2002; US EPA, 2002b). En outre, des renseignements sur la désinfection des installations de stockage et la déchloration sur le terrain sont disponibles auprès de l'ANSI et de l'AWWA (2019 et 2018), respectivement.
B.5.4 Temps de séjour de l'eau et intégrité hydraulique
Pour gérer l'âge de l'eau, les services de distribution d'eau devraient s'efforcer de réduire au minimum le temps de rétention dans les conduites principales et les installations de stockage (voir la section B.5.3). Pour réduire le temps de séjour de l'eau dans les conduites principales, une attention particulière doit être portée à la conception des réseaux. Les conduites principales surdimensionnées ou en cul-de-sac peuvent faire en sorte que le temps de séjour de l'eau soit excessivement élevé; par conséquent, des procédures devraient être en place pour gérer la détérioration de la qualité de l'eau (Kirmeyer et coll., 2000; AWWA, 2011). Par exemple, des bornes d'incendie peuvent être installées pour procéder au rinçage des conduites en cul-de-sac (Locco et Alberton, 2021). Des précautions particulières peuvent être nécessaires pour les longues conduites maîtresses qui relient au moins deux collectivités (p. ex. réseaux régionaux et conduites en milieu rural). Il est recommandé de confirmer les exigences applicables auprès des autorités responsables de l'eau potable.
Les services d'eau devraient également avoir des stratégies en place pour réduire au minimum : 1) les variations de pression (c.-à-d. transitoires); 2) les fluctuations rapides ou extrêmes des vitesses d'écoulement; et 3) la fréquence de l'inversion du sens d'écoulement. Ces types d'activités peuvent entraîner des bris de conduite (Rathnayaka et coll., 2016) ou provoquer l'agitation et la libération des matières accumulées dans les réseaux de distribution. En outre, l'agitation et la libération de ces matières peuvent entraîner une coloration de l'eau (Prince et coll., 2003; AWWA, 2011) ainsi qu'une augmentation des concentrations au robinet au-delà des concentrations maximales acceptables (Friedman et coll., 2016). Des systèmes de contrôle intelligentsNote de bas de page 1 peuvent atténuer les effets des transitoires de pression (p. ex. ralentissement du démarrage/arrêt des pompes), ce qui permet de réduire au minimum les perturbations physiques et hydrauliques (Blake, 2019; Steger et Pierce, 2019). Les progrès réalisés relativement à l'équipement de mesure à grande vitesse de la pression (p. ex. de multiples lectures par seconde) ont également facilité la mise en œuvre de programmes visant à réduire les fuites d'eau et les bris de conduite (Chapman et Ziemann, 2019; Sutherns, 2019; Ginn et Smither, 2020; Hamilton et Nikolica, 2021). Une coordination avec les organismes qui effectuent des essais relatifs au débit en cas d'incendie peut également prévenir les fluctuations hydrauliques (AWWA, 2011).
B.5.5 Nettoyage des conduites principales
Un nettoyage proactif des conduites principales peut atténuer les risques associés aux matières accumulées dans les réseaux de distribution. Il existe diverses techniques de nettoyage des conduites permettant d'éliminer les biofilms, les dépôts mobiles ainsi que les sédiments, y compris le rinçage unidirectionnel (Ellison, 2003; Bellas et Tassou, 2005; Quarini et coll., 2010; Vreeburg et coll., 2010; Dang et coll., 2014; Friedman et coll., 2016; Liu et coll., 2017). Cantor (2017) a souligné l'importance de l'élimination des matières accumulées, puisque cette mesure a été mieux corrélée avec une faible libération de plomb et de cuivre que le contrôle classique de la corrosion, et ce, dans 12 réseaux de distribution d'eau municipaux et non municipaux qui utilisent l'eau souterraine et l'eau de surface. Selon une étude portant sur 41 réseaux à grande échelle, l'intervalle de nettoyage le plus courant est chaque année, quel que soit le type de désinfectant résiduel (Baribeau et coll., 2005). La fréquence de nettoyage optimale peut être déterminée à partir du taux d'accumulation de dépôts (voir la section B.6) (Carrière et coll., 2005).
La prudence est de mise lors des activités de rinçage. Il est important que les responsables des services de distribution d'eau déterminent et utilisent les techniques de rinçage les plus appropriées pour ne pas perturber ni libérer les dépôts déjà présents dans l'eau. Des techniques de rinçage inadéquates peuvent remuer et potentiellement répandre des contaminants à proximité de la zone rincée ou encore plus loin dans le réseau de distribution, ce qui accroît les risques pour la santé publique. Les conditions suivantes peuvent perturber les dépôts déjà en place : une vitesse ou un débit de rinçage excessif, une vitesse ou un débit de rinçage insuffisant, l'absence d'une maîtrise de la direction, ou encore une durée de rinçage insuffisante (Hill et coll., 2018). Il est recommandé d'établir des stations automatiques de rinçage si l'objectif est de renouveler l'eau dans une zone donnée en raison du temps de séjour de l'eau ou de sa faible vitesse de circulation (Hill et coll., 2018).
B.5.6 Intégrité de l'infrastructure
L'intégrité de l'infrastructure fait référence à la capacité d'un réseau de distribution à agir comme barrière physique contre la contamination (NRC, 2006). Les contaminants qui entrent dans les réseaux de distribution en provenance de sources externes, comme des raccordements croisés, des bris de conduite principale ou des fuites, peuvent compromettre la qualité de l'eau et entraîner des maladies (voir la section B.1). Par conséquent, il incombe aux services de distribution d'eau d'établir des procédures et des programmes appropriés pour gérer ces risques, conformément à ce qui est brièvement décrit ci-dessous.
Les besoins relatifs à la prévention des refoulements et au contrôle des raccordements croisés sont bien établis, et des appareils existent pour atténuer ces risques (NRC, 2006; AWWA, 2015b). Les données montrent que les services de distribution d'eau dont la pression est faible font face à un plus grand nombre de refoulements (Lee et coll., 2003). Schneider et ses collaborateurs (2016) ont établi un taux d'occurrence mensuel moyen de refoulement égal à 1,6 % en utilisant des appareils de détection des inversions de débit. Les zones sensibles aux refoulements peuvent être déterminées au moyen de la modélisation hydraulique des réseaux de distribution d'eau (Lindley et Buchberger, 2002; Lee et coll., 2003; Schneider et coll., 2016). Une orientation existe pour aider les responsables des services de distribution d'eau à établir un programme de prévention des refoulements et de contrôle des raccordements croisés (AWWA, 2015b).
En ce qui a trait aux bris de conduite principale, il est de plus en plus reconnu que les procédures d'intervention doivent être améliorées afin de protéger la santé publique (Besner et coll., 2008; Kirmeyer et coll., 2014; Hatam et coll., 2020). Kirmeyer et ses collaborateurs (2014) ont évalué le risque de contamination microbienne et ont modifié les procédures d'intervention (p. ex. avis de faire bouillir l'eau et prélèvement d'échantillons microbiologiques) selon la possibilité de maintenir une pression positive. Hatam et ses collaborateurs (2020) ont constaté qu'un échantillonnage de grands volumes pour la recherche d'indicateurs bactériens (dans le cadre des procédures d'intervention) pourrait être approprié à certains moments. En outre, un contrôle sanitaire rigoureux devrait être effectué tout au long de lors de l'installation, de la réparation ou de l'entretien des conduites principales pour veiller à ce que l'eau potable soit acheminée aux consommateurs en conservant le plus possible sa qualité (Kirmeyer et coll., 2001, 2014). Des renseignements sur la désinfection des conduites principales et la déchloration sur le terrain sont disponibles auprès de l'ANSI/AWWA (2014 et 2018), respectivement.
Un programme proactif de détection des fuites comporte de multiples avantages, notamment : la réduction de la fréquence des fuites et des bris de conduite, la réduction des fuites et du risque de contamination, ainsi que le prolongement de la durée de vie des biens (Kachani et coll., 2020). Une orientation existe pour aider les responsables des services d'eau à établir un programme permettant de contrôler les pertes d'eau (AWWA, 2016). En outre, les progrès relatifs à l'équipement de mesure à grande vitesse de la pression et à l'apprentissage automatique ont amélioré la capacité de prévoir les défaillances des conduites principales (Fitchett et coll., 2020; Sutherns, 2020). Des compteurs d'eau « intelligents » peuvent également fournir des données sur le sens d'écoulement, la pression et la température.
B.5.7 Plaintes des consommateurs
Les services de distribution d'eau devraient avoir des programmes en place pour saisir, suivre, analyser et résoudre les plaintes des consommateurs (Friedman et coll., 2010b). Les plaintes des consommateurs en lien avec une couleur ou un goût et une odeur désagréables peuvent être un indicateur important de la détérioration de la qualité de l'eau dans les réseaux de distribution (Hrudey et Hrudey, 2014). Les consommateurs devraient être informés du fait qu'une eau colorée ne devrait pas être considérée comme salubre, à moins d'avoir été soumise à des analyses pour métaux et d'avoir été jugée salubre (Friedman et coll., 2016). En cas de bris de conduite ou pendant les activités de rinçage, les services de distribution d'eau devraient avoir des procédures en place pour informer les résidents des risques potentiels associés à la coloration de l'eau (c.-à-d. concentrations élevées de métaux). Les consommateurs devraient être avisés de réduire au minimum leur consommation d'eau afin d'éviter l'entrée de sédiments dans les conduites de branchement. Une fois les travaux terminés, les propriétaires de maison devraient être avisés d'ouvrir un robinet d'eau froide à l'étage le plus bas de leur résidence et de laisser couler l'eau pendant cinq à dix minutes afin d'éliminer toute eau colorée, le cas échéant (Locco et coll., 2018). D'autres précautions peuvent être nécessaires pour les propriétaires et les gestionnaires de bâtiments (voir la section B.7).
B.6 Objectifs relatifs à la qualité de l'eau
Les services d'eau devraient s'efforcer de maintenir la stabilité biologique de la qualité de l'eau en tenant compte des éléments suivants :
- les processus microbiologiques (Cantor, 2017);
- les processus chimiques tels que la corrosion ou l'adsorption et la désorption sur des matériaux ou des dépôts présents dans les réseaux de distribution (AWWA, 2011);
- les changements physiques ou hydrauliques (Besner et coll., 2010; Friedman et coll., 2010a, 2010b; Cantor, 2017, 2018; Hill et coll., 2018).
Pour ce faire, il est important que les services d'eau disposent d'un programme de surveillance complet. Les mesures pour certains paramètres sont résumées dans le tableau 7. Ce tableau est fourni à titre d'orientation et est uniquement basé sur l'analyse documentaire qui a été réalisée aux fins de la rédaction du présent document. Par conséquent, il se peut que certains des paramètres mentionnés dans la section B.3 ne figurent pas dans le tableau.
Il incombe aux services d'eau de s'assurer que les réseaux de distribution sont caractérisés et qu'un plan de gestion approprié est établi afin d'atteindre les objectifs relatifs à la qualité de l'eau. Les services d'eau peuvent choisir d'utiliser ces mesures en tant que cibles initiales de la qualité de l'eau, jusqu'à ce qu'ils aient assez de données pour établir des valeurs propres à chaque réseau.
| Paramètre | Unités | Approvisionnement en eau potable utilisant la chloration | Approvisionnement en eau potable utilisant la chloramination | Références |
|---|---|---|---|---|
| Désinfectant résiduel | mg/L | ≥ 1,0 et atténuation de la variabilité | ≥ 1,8 et atténuation de la variabilité | Gagnon et coll., 2008 Gillespie et coll., 2014 Rand et coll., 2014 LeChevallier et coll., 2015a, 2015b |
| TempératureTableau 7 Note a | °C | 15 – taux de formation de biofilms 20 – taux de corrosion 20 – variabilité des concentrations résiduelles de désinfectant |
15 – taux de formation de biofilms 20 – taux de corrosion 22 – variabilité des concentrations résiduelles de désinfectant |
LeChevallier et coll., 2015a, 2015b |
| cATP | pg/mL | < 1 – bon contrôle 1 à 10 – mesure préventive > 10 – mesure corrective |
< 1 – bon contrôle 1 à 10 – mesure préventive > 10 – mesure corrective |
McIlwain, 2020 |
| pH | Aucune unité | Minimum 7,0 et maintien de la variabilité à ±0,2 | Minimum 7,0 et maintien de la variabilité à ±0,2 | Muylwyk et MacDonald, 2001 Friedman et coll., 2010a Santé Canada, 2015 |
| Potentiel d'oxydoréduction | mV | > 400 | > 400 | Friedman, 2020 |
| Carbone organique dissousTableau 7 Note b | mg/L | < 1,8 | < 1,8 | LeChevallier et coll., 2015a, 2015b |
| Taux de formation de biofilmsTableau 7 Note c | pg/mm2-d | 0,090 | 0,017 | LeChevallier et coll., 2015a, 2015b |
| Taux d'accumulation de dépôts | g/m/année | < 1 – rinçage au besoin 1 à 10 – rinçage annuel > 10 – mesure corrective |
< 1 – rinçage au besoin 1 à 10 – rinçage annuel > 10 – mesure corrective |
Carrière et coll., 2005 |
|
||||
B.7 Risque microbien dans la plomberie des bâtiments
La plomberie des bâtiments désigne la partie des réseaux de distribution d'eau potable qui est à l'intérieur des limites d'une propriété et qui dessert les écoles, les hôpitaux, les logements publics et privés, les bureaux et autres bâtiments (NRC, 2006; US EPA, 2016b). Dans les bâtiments, l'eau est utilisée à diverses fins : consommation d'eau potable, préparation des aliments, lavage et douche, systèmes de refroidissement et divers usages décoratifs (p. ex. fontaines ornementales).
La qualité de l'eau peut diminuer considérablement dans la plomberie des bâtiments et est tributaire des mêmes facteurs que dans les réseaux de distribution d'eau potable (voir la section B.2). Cependant, les installations de plomberie des bâtiments ont leurs propres enjeux, à savoir : 1) des temps de séjour plus longs (c.-à-d. stagnation accrue de l'eau); 2) des températures de l'eau plus élevées; 3) des composants et des matériaux de plomberie très variables; 4) des tuyaux de petit diamètre; et 5) l'utilisation de dispositifs de traitement de l'eau pouvant accroître la corrosion, comme des systèmes d'osmose inverse. De longs temps de séjour dans la plomberie des bâtiments ont été liés à des concentrations beaucoup plus élevées de populations microbiennes et à des changements dans la composition des communautés microbiennes (Pepper et coll., 2004; Lautenschlager et coll., 2010; Manuel et coll., 2010; Lipphaus et coll., 2014; Bédard et coll., 2018). Des températures d'eau plus élevées, dues à l'installation de tuyaux dans les pièces chauffées ou à proximité de sources de chaleur, favorisent la croissance ou la revivification microbienne (Lautenschlager et coll., 2010; Lipphaus et coll., 2014). Cette croissance est également influencée par l'interaction avec divers matériaux de plomberie, dont les tuyaux en plastique et les raccords en caoutchouc, qui présentent un potentiel considérable de croissance microbienne (Bucheli-Witschel et coll., 2012). L'utilisation de tuyaux de petit diamètre entraîne un contact accru entre les microorganismes et les tuyaux, ce qui accroît les effets de ces matériaux (voir la section B.2.3), y compris la formation de biofilms et la diminution des concentrations résiduelles de désinfectant (Servais et coll., 1992; Rossman et coll., 1994; Prévost et coll., 1998). Comme nous l'avons mentionné précédemment (voir la section B.2.1), ces biofilms peuvent contenir des agents pathogènes, y compris ceux persistant dans la plomberie du bâtiment. Les installations de plomberie des bâtiments peuvent contribuer à induire de manière spectaculaire la croissance de Legionella spp. et d'autres agents pathogènespersistants, notamment Pseudomonas aeruginosa et des mycobactéries non tuberculeuses, et il s'agit là d'une préoccupation majeure pour la santé publique, particulièrement dans les hôpitaux (OMS, 2011b).
La plomberie des bâtiments peut aussi avoir un effet sur la qualité de l'eau dans les réseaux de distribution. Le principal mécanisme par lequel la contamination microbienne peut entrer dans les réseaux de distribution d'eau potable à partir de la plomberie des bâtiments est le refoulement, c'est-à-dire le siphonnage ou une contre-pression (OMS, 2011b, 2014). Il est donc important que des programmes appropriés visant à contrôler le refoulement et les raccordements croisés soient en place (AWWA, 2017a).
Étant donné les défis particuliers pour la qualité de l'eau dans les bâtiments, on doit recourir à des stratégies supplémentaires de gestion. Il est important de noter que les services d'eau ne sont généralement pas responsables de la qualité de l'eau de la limite de la propriété aux points d'utilisation individuels dans les bâtiments. Les propriétaires ou les gestionnaires de bâtiments doivent surveiller et gérer leurs réseaux d'eau afin de s'assurer qu'ils fournissent une eau salubre au robinet. La gestion de la qualité de l'eau dans les bâtiments commence par l'établissement de cartes et de schémas exacts et à jour des conduites d'eau, ainsi que par l'étiquetage des tuyaux, en particulier dans les grands bâtiments. Ce sont des outils importants pour éviter les raccordements croisés et indiquer les zones où l'eau peut stagner.
Bien que l'objet du présent document ne soit pas d'indiquer où, quand et comment surveiller la plomberie des bâtiments, nous présentons néanmoins quelques principes directeurs :
- l'échantillonnage environnemental des bactéries ne devrait pas se faire de façon isolée, mais dans le cadre d'un programme exhaustif de gestion de l'eau des bâtiments;
- les plans d'échantillonnage sont propres à chaque bâtiment et devraient être basés sur ses caractéristiques (p. ex. taille, âge, disposition et population desservie), ainsi que sur les données historiques concernant la qualité de l'eau (p. ex. analyse des tendances concernant les résultats des analyses bactériennes antérieures et paramètres de qualité de l'eau, y compris la concentration résiduelle de désinfectant et la température);
- la qualité de l'eau peut varier d'un étage à l'autre, d'un robinet à l'autre et même entre les robinets d'eau chaude et d'eau froide. On devrait également échantillonner les endroits où l'eau est produite sous forme d'aérosols;
- la stratégie d'échantillonnage peut être adaptée selon les tendances et les changements dans le réseau;
- si on détecte des indicateurs d'une croissance microbienne potentielle ou d'autres enjeux potentiels (p. ex. eau colorée, goût ou odeur désagréable et boue dans les appareils consommant de l'eau), des mesures correctives telles que le rinçage ou la désinfection du réseau d'eau du bâtiment peuvent s'avérer nécessaires.
De plus amples renseignements sur la gestion de la salubrité de l'eau dans les bâtiments figurent dans divers documents (OMS, 2011b; Santé Canada, 2013; Travaux publics et Services gouvernementaux Canada, 2013; ASHRAE, 2000, 2015, 2018).
B.8 Considérations internationales
D'autres organisations nationales et internationales ont établi des orientations, des lignes directrices et des normes sur l'eau potable concernant la surveillance de la qualité de l'eau et de la stabilité biologique dans les réseaux de distribution. Le contenu de ces documents diffère en raison du moment auquel les évaluations ont été faites ainsi que des différentes politiques et approches sur lesquelles ils sont basés. L'OMS préconise une approche fondée sur un plan de salubrité de l'eau comprenant un programme de surveillance opérationnelle dans les réseaux de distribution et les bâtiments. L'OMS suggère également d'optimiser l'élimination des matières organiques naturelles afin de réduire au minimum la croissance des biofilms dans les réseaux de distribution. En Australie, on a défini des paramètres de surveillance opérationnelle et de qualité de l'eau potable afin d'évaluer les risques de stagnation, de formation de biofilms et d'infiltration de contaminants dans les réseaux de distribution. Aux États-Unis, la Revised Total Coliform Rule (règle sur les coliformes totaux révisée) de l'EPA prescrit un échantillonnage périodique sur les sites faisant partie d'un réseau de distribution, et exige que les lacunes des réseaux de distribution pouvant nuire à la santé soient « décelées et corrigées ». L'EPA fournit également des conseils sur la surveillance de la qualité de l'eau dans les réseaux de distribution sous forme de livres blancs et de rapports divers. La Directive sur l'eau potable de l'Union européenne prescrit une fréquence minimale d'échantillonnage dans les réseaux de distribution, selon le volume d'eau distribué ou produit chaque jour dans une zone d'approvisionnement donnée, et définit une série de paramètres dits de « surveillance et contrôle ».
Partie C. Références
ACWWA (2004). Atlantic Canada guidelines for the supply, treatment, storage, distribution and operation of drinking water supply systems. Coordinated by the Atlantic Canada Water Works Association (ACWWA) in association with the four Atlantic Canada Provinces. Halifax, Nova Scotia.
Agence de la santé publique du Canada. (2021). Maladies à déclaration obligatoire en direct. Consultable en ligne à la page : https://maladies.canada.ca/declaration-obligatoire/
Aghaeepour, N., Finak, G., Hoos, H., Mosmann, T.R., Brinkman, R., Gottardo, R., Scheuermann, R.H., Dougall, D., Khodabakhshi, A.H., Mah, P., Obermoser, G., Spidlen, J., Taylor, I., Wuensch, S.A., Bramson, J., Eaves, C., Weng, A.P., Fortuno III, E.S., Ho, K., Kollmann, T.R. and Vilar, J.M.G. (2013). Critical assessment of automated flow cytometry data analysis techniques. Nat. Methods, 10(3): 228-238.
Alarcon-Herrera, M.T., Bewtra, J.K. and Biswas, N. (1994). Seasonal variations in humic substances and their reduction through water treatment processes. Can. J. Civ. Eng., 21(2): 173-179.
Alexander, M.T., Dugan, A.G. and Wahman, D.G. (2019). Use a Hold Study to Assess Distribution System Influent Water Quality. Opflow, 45(5): 16-19.
ANSI/AWWA (2014). American National Standards Institute/American Water Works Association Standard C651: Disinfecting water mains. American Water Works Association, Denver, Colorado.
ANSI/AWWA (2018). American National Standards Institute/American Water Works Association Standard C655: Field dechlorination. American Water Works Association, Denver, Colorado.
ANSI/AWWA (2019). American National Standards Institute/American Water Works Association Standard C652: Disinfection of water-storage facilities. American Water Works Association, Denver, Colorado.
APHA, AWWA, WEF (2017). Standard methods for the examination of water and wastewater. 23rd edition. American Public Health Association, American Water Works Association and Water Environment Federation, Washington, DC.
ASHRAE (2000). Guideline 12-2000: Minimizing risk of legionellosis associated with building water systems.
ASHRAE (2015). Standard 188-2015: Legionellosis risk management for building water systems (ANSI approved).
ASHRAE (2018). Standard 188-2018 : Legionellosis risk management for building water systems (ANSI approved).
ASTM International. (2015). ASTM D4012 – 15: standard test method for adenosine triphosphate (ATP) content of microorganisms in water. In Annual book of ASTM standards. West Conshohocken, PA.
AWWA (2005). Contamination warning systems for water: An approach for providing actionable information to decision-makers. American Water Works Association, Denver, Colorado.
AWWA (2011). Water quality and treatment: a handbook of community water supplies. 6th edition. J.K. Edzwald (ed.). McGraw-Hill, New York, New York.
AWWA (2015a). Iron and manganese removal handbook, 2nd ed. American Water Works Association, Denver, Colorado.
AWWA (2015b). Backflow prevention and cross-connection control. AWWA manual of water supply practices M14, 4th ed. American Water Works Association, Denver, Colorado.
AWWA (2016). Water audits and loss control programs. AWWA manual of water supply practices M36. 4th ed. American Water Works Association, Denver, Colorado.
AWWA (2017a). Water quality in distribution systems. AWWA manual of water supply practices M68. American Water Works Association, Denver, Colorado.
AWWA (2017b). Internal corrosion control in water distribution systems. AWWA manual of water supply practices M58. Second edition. American Water Works Association, Denver, Colorado.
AWWA (2018). Self-assessment for distribution system optimization. American Water Works Association, Denver, Colorado.
AwwaRF (2002). Online monitoring for drinking water utilities. Awwa Research Foundation and American Water Works Association, Denver, Colorado.
Ballantyne, L. and Meteer, L. (2018). Nitrifying nightmares and how to avoid them. Ontario Water Works Association Annual Water Conference, Niagara Falls, ON.
Baribeau, H., Pozos, N.L., Boulos, L., Crozes, G.F., Gagnon, G.A., Rutledge, S., Skinner, D., Hu, Z., Hofmann, R., Andrews, R.C., Wojcicka, L., Alam, Z., Chauret, C., Andrews, S.A., Dumancic, R. and Warn., E. (2005). Impact of Distribution System Water Quality on Disinfection Efficacy. Report #2771. Water Research Foundation, Denver, Colorado.
Barwick, R.S., Levy, D.A., Craun, G.F., Beach, M.J. and Calderon, R. (2000). Surveillance for Waterborne-Disease Outbreaks – United States 1997-1998. Morb. Mortal. Wkly. Rep., 49:4:1.7:5:1.
Batté, M., Appenzeller, B.M.R., Grandjean, D., Fass, S., Gauthier, V., Jorand, F., Mathieu, L., Boualam, M., Saby, S. and Block, J.C. (2003). Biofilms in drinking water distribution systems. Rev. Environ. Sci. Biotechnol., 2(2-4): 147-168.
Bédard, E., Laferrière, C., Déziel, E. and Prévost, M. (2018). Impact of stagnation and sampling volume on water microbial quality monitoring in large buildings. Plos One, 13(6).
Beer, K.D., Gargano, J.W., Roberts, V.A., Hill, V.R., Garrison, L.E., Kutty, P.K., Hilborn, E.D., Wade, T.J., Fullerton, K.E. and Yoder, J.S. (2015). Surveillance for waterborne disease outbreaks associated with drinking water – United States, 2011-2012. MMWR Morb. Mortal. Wkly. Rep., 64(31): 842-848.
Bellas, I. and Tassou, S.A. (2005). Present and future applications of ice slurries. Int. J. Refrigeration 28, 115-121.
Benedict, K.M., Reses, H., Vigar, M., Roth, D.M., Roberts, V.A., Mattioli, M., Cooley, L.A., Hilborn, E.D., Wade, T.J., Fullerton, K.E., Yoder, J.S. and Hill, V.R. (2017). Surveillance for waterborne disease outbreaks associated with drinking water – United States, 2013-2014. Morb. Mortal. Wkly. Rep., 66(44): 1216-1221.
Berney, M., Vital, M., Hulshoff, I., Weilenmann, H.U., Egli, T. and Hammes, F. (2008). Rapid, cultivation-independent assessment of microbial viability in drinking water. Water Res., 42(14): 4010-4018.
Berry, D., Xi, C. and Raskin, L. (2006). Microbial ecology of drinking water distribution systems. Curr. Opin. Biotechnol., 17(3): 297-302.
Besmer, M.D., Weissbrodt, D.G., Kratochvil, B.E., Sigrist, J.A., Weyland, M.S. and Hammes, F. (2014). The feasibility of automated online flow cytometry for in-situ monitoring of microbial dynamics in aquatic ecosystems. Frontiers in Microbiology, 5.
Besmer, M.D., Epting, J., Page, R.M., Sigrist, J.A., Huggenberger, P. and Hammes, F. (2016). Online flow cytometry reveals microbial dynamics influenced by concurrent natural and operational events in groundwater used for drinking water treatment. Sci. Rep., 6: 38462.
Besner, M-C., Gauthier, V., Barbeau, B., Millette, R., Chapleau, R. and Prévost, M. (2001). Understanding distribution system water quality. J. Am. Water Works Assoc., 93(7): 101-114.
Besner, M-C., Lavoie, J., Morissette, C., Payment, P. and Prévost, M. (2008). Effect of water main repairs on water quality. J. Am. Water Works Assoc., 100(7): 95-109.
Besner, M-C., Broséus, R., Lavoie, J., Di Giovanni, G., Payment, P. and Prévost, M. (2010). Pressure monitoring and characterization of external sources of contamination at the site of the Payment drinking water epidemiological studies. Environ. Sci. Technol., 44(1): 269-277.
Besner, M-C., Prevost, M. and Regli, S. (2011). Assessing the public health risk of microbial intrusion events in distribution systems: Conceptual model, available data, and challenges. Water Res., 45(3): 961-979.
Besner, M-C., Modak, P.R. and Glauser, N. (2012). Extensive sediment characterization during unidirectional flushing in a distribution system. 14th Water Distribution System Analysis Conference, v. 2, pp. 871-876.
Blackburn, B.G., Craun, G.F., Yoder, J.S., Hill, V., Calderon, R.L., Chen, N., Lee, S.H., Levy, D.A. and Beach, M.J. (2004). Surveillance for waterborne-disease outbreaks associated with drinking water – United States, 2001-2002. MMWR Surveill. Summ., 53(8): 23-45.
Blain, A. (2014). Water quality update. Prepared for City of Longview, Washington.
Blain, A. and Friedman, M. (2014). Water quality update. Prepared for the City of Longview, Washington.
Blake, M. (2019). Protect pipes through transient control. Opflow, 45(8): 26-28.
Blokker, M., Smeets, P. and Medema, G. (2014). QMRA in the drinking water distribution system. Procedia Eng., 89: 151-159.
Blokker, M., Smeets, P. and Medema, G. (2018). Quantitative microbial risk assessment of repairs of the drinking water distribution system. Microb. Risk Anal., 8: 22-31.
Bokulich, N.A. and Mills, D.A. (2013). Improved selection of internal transcribed spacer-specific primers enables quantitative, ultra-high-throughput profiling of fungal communities. Appl Environ Microbiol., 79(8): 2519-26.
Boulay, N. and Edwards, M. (2001). Role of temperature, chlorine, and organic matter in copper corrosion byproduct release in soft water. Water Res., 35(3): 683-690.
Bourbigot, M.M., Dodin, A. and Lhértier, R. (1982). Limiting bacterial aftergrowth in distribution systems by removing biodegradable organics. Proceedings from the 1982 AWWA Annual Conference and Exhibit. American Water Works Association, Denver, Colorado, 871-886.
Bradley, I.M., Pinto, A.J. and Guest, J.S. (2016). Design and Evaluation of Illumina MiSeq-Compatible, 18S rRNA Gene-Specific Primers for Improved Characterization of Mixed Phototrophic Communities. Appl Environ Microbiol., 82(19): 5878-91.
Bradley, T.C., Haas, C.N. and Sales, C.M. (2020). Nitrification in premise plumbing: A review. Water, 12(3): 830.
Brognaux, A., Han, S., Sørensen, S.J., Lebeau, F., Thonart, P. and Delvigne, F. (2013). A low-cost, multiplexable, automated flow cytometry procedure for the characterization of microbial stress dynamics in bioreactors. Microb. Cell Fact.,12(1).
Brunkard, J.M., Ailes, E., Roberts, V.A., Hill, V., Hilborn, E., Craun, G.F. and Rajasingham, A, Kahler, A., Garrison, L., Hicks, L., Carpenter, J., Wade, T.J., Beach, M.J. and Yoder, J.S. (2011). Surveillance for Waterborne Disease Outbreaks Associated With Drinking Water – United States, 2007-2008. Morb. Mortal. Wkly. Rep., Surveill Summ, 60:12:38-68.
Buchberger, S.G., Carter, J.T., Lee, Y. and Schade, T.G. (2003). Random demands, travel times, and water quality in deadends. AwwaRF, Denver, Colorado.
Bucheli-Witschel, M., Kötzsch, S., Darr, S., Widler, R. and Egli, T. (2012). A new method to assess the influence of migration from polymeric materials on the biostability of drinking water. Water Res., 46(13): 4246-4260.
Bulletin de rendement des infrastructures canadiennes. (2016). Bulletin de rendement des infrastructures canadiennes – Éclairer l'avenir. Association canadienne de la construction, Association canadienne des travaux publics, Société canadienne de génie civil et la Fédération canadienne des municipalités. Consultable en ligne à la page : http://canadianinfrastructure.ca/downloads/Bulletin_de_rendement_des_infrastructures_canadiennes_2016.pdf
Burlingame, G.A. Lytle, D.A. and Snoeyink, V.L. (2006). Why red water? Understanding iron release in distribution systems. Opflow, 32(12): 12-16.
Bursill, D. (2001). Drinking water treatment-understanding the processes and meeting the challenges. Water Sci. Technol. Water Supply, 1(1): 1-7.
Camper, A.K. (2004). Involvement of humic substances in regrowth. Int. J. Food Microbiol., 92(3): 355-364.
Camper, A. (2014). Organic matter, pipe materials, disinfectants and biofilms in distribution systems. In: Microbial growth in drinking-water supplies: Problems, causes, control and research needs. van der Kooij, D. and van der Wielen, P.W.J.J. (eds.). IWA Publishing, London, UK, pp. 73-94.
Camper, A.K., Butterfield, P., Ellis, B., Jones, W.L., Anderson, W.B., Huck, P.M., Slawson, R., Volk, C., Welch, N. and LeChevallier, M. (2000). Investigation of the biological stability of water in treatment plants and distribution
systems. Awwa Research Foundation and American Water Works Association, Denver, Colorado.
Cantor, A.F. (2017). Optimization of phosphorus-based corrosion control chemicals using a comprehensive perspective of water quality. Report #4586. Water Research Foundation, Denver, Colorado.
Cantor, A.F. (2018). Water distribution system monitoring: A practical approach for evaluating drinking water quality. 2nd ed. CRC Press, Boca Raton.
Cantor, A.F. (2021). Insights for a distribution system water sentinel. Virtual Summit AWWA: Lead & Water Quality. April 7-8, 2021. American Water Works Association, Denver, Colorado.
Cantor, A.F. and Cantor, J. (2009). In Dr. Deming's footsteps: Distribution system water quality control and process improvement. Proceedings from the 2009 AWWA water quality technology conference. American Water Works Association (AWWA), Denver, Colorado, 724-741.
Cantor, A.F., Kiefer, E., Little, K.,Jacque, A., Degnan, A., Maynard, B., Mast, D. and Cantor., J. (2012). Distribution system water quality control demonstration. Water Research Foundation, Denver, Colorado.
Carrière, A., Gauthier, V., Desjardins, R., & Barbeau, B. (2005). Evaluation of loose deposits in distribution systems through unidirectional flushing. J. Am. Water Works Assoc., 97(9), 82-92.
CCME (2004). De la source au robinet : Guide d'application de l'approche à barrières multiples pour une eau potable saine, Conseil canadien des ministres de l'environnement, Winnipeg (Manitoba).
Chandy, J.P and Angles, M.L. (2001). Determination of nutrients limiting biofilm formation and the subsequent impact on disinfectant decay. Water Res., 35(11): 2677-2682.
Chang, Y. and Jung, K. (2004). Effect of distribution system materials and water quality on heterotrophic plate counts and biofilm proliferation. J Microbiol Biotechnol, 14(6): 1114-1119.
Chao, Y., Ma, L., Yang, Y., Ju, F., Zhang, X.X., Wu, W.M. and Zhang, T. (2013). Metagenomic analysis reveals significant changes of microbial compositions and protective functions during drinking water treatment. Sci. Rep., 3: 3550.
Chao, Y., Mao, Y., Wang, Z. and Zhang, T. (2015). Diversity and functions of bacterial community in drinking water biofilms revealed by high-throughput sequencing. Sci. Rep., 5: 10044.
Chapman, T. and Ziemann, S. (2019). Watermain monitoring system. Presented at Canadian Water and Wastewater Conference, Banff, Alberta, November 4.
Chowdhury, S. (2012). Heterotrophic bacteria in drinking water distribution system: a review. Environ. Monit. Assess., 184(10): 6087-6137.
Christensen, B.E. and Characklis, W.G. (1990). Physical and chemical properties of biofilms. Chapter 4 in: Biofilm. Characklis, W.G. and Marshall, K.C. (eds). Wiley, New York, 93-130.
Clark, R.M., Yang, Y.J, Impellitteri, C.A., Haught, R.C., Schupp, D.A.S., Panguluri, S. and Krishnan, E.R. (2010). Chlorine fate and transport in distribution systems: Experimental and modelling studies. J. Am. Water Works Assoc., 102(5): 144-155. Codony, F., Morató, J. and Mas, J. (2005). Role of discontinuous chlorination on microbial production by drinking water biofilms. Water Res., 39(9):1896-1906.
Coetser, S. E. and Cloete, T. E. (2005). Biofouling and biocorrosion in industrial water systems. Crit. Rev. Microbiol. 31, 213-232.
Collier, S.A., Deng, L., Adam, E.A., Benedict, K.M., Beshearse, E.M., Blackstock, A.J., Bruce, B.B., Derado, G., Edens, C., Fullerton, K.E., Gargano, J.W., Geissler, A.L., Hall, A.J., Havelaar, A.H., Hill, V.R., Hoekstra, R.M., Reddy, S.C., Scallan, E., Stokes, E.K., Yoder, J.S. and Beach, M.J. (2021). Estimate of burden and direct healthcare cost of infectious waterborne disease in the United States. Emerg Infect Dis., 27(1): 140-149.
Copeland, A. and Lytle, D.A. (2014). Measuring the oxidation-reduction potential of important oxidants in drinking water. J. Am. Water Works Assoc., 106(1): E10-E20.
Córdoba, M.A., Del Coco, V.F., Minvielle, M.C. and Basualdo, J.Á. (2010). Influencing factors in the occurrence of injured coliforms in the drinking water distribution system in the city of La Plata, Argentina. J Water Health, 8(2): 205-211.
Craun, G.F. and Calderon, R.L. (2001). Waterborne disease outbreaks caused by distribution system deficiencies. J. Am. Water Works Assoc., 93(9): 64-75.
Dang, P., Jayaratne, A., and Wilson, G. (2014). Ice pigging – a better way to clean water mains. Yarra Valley Water, Australia.
De Roy, K., Clement, L., Thas, O., Wang, Y. and Boon, N. (2012). Flow cytometry for fast microbial community fingerprinting. Water Res., 46(3): 907-919.
de Vet, W.W.J.M. (2011). Biological drinking water treatment of anaerobic groundwater in trickling filters. Ph. D. dissertation, Technical University Delft, The Netherlands.
Deininger, R.A. and Lee, J. (2001). Rapid determination of bacteria in drinking water using an ATP assay. Field Anal. Chem. Technol., 5(4): 185-189.
Delafont, V., Brouke, A., Bouchon, D., Moulin, L. and Hechard, Y. (2013). Microbiome of free-living amoebae isolated from drinking water. Water Res., 47(19): 6958-6965.
Delahaye E., Welté B., Levi Y., Leblon G. and Montiel A. (2003). An ATP-based method for monitoring the microbiological drinking water quality in a distribution network. Water Res., 37(15): 3689-3696.
Douterelo, I., Boxall, J.B., Deines, P., Sekar, R., Fish, K.E. and Biggs, C.A. (2014a). Methodological approaches for studying the microbial ecology of drinking water distribution systems. Water Res., 65: 134-156.
Douterelo, I., Husband, S. and Boxall, J. B. (2014b). The bacteriological composition of biomass recovered by flushing an operational drinking water distribution system. Water Res 54, 100-114.
Douterelo, I., Husband, S., Loza, V. and Boxall, J. (2016a). Dynamics of biofilm regrowth in drinking water distribution systems. Appl. Environ. Microbiol., 82(14): 4155-4168.
Douterelo, I., Jackson, M., Solomon, C. and Boxall, J. (2016b). Microbial analysis of in situ biofilm formation in drinking water distribution systems: implications for monitoring and control of drinking water quality. Appl Microbiol Biot 100, 3301-3311.
Douterelo, I., Calero-Preciado, C., Soria-Carrasco, V. and Boxall, J.B. (2018). Whole metagenome sequencing of chlorinated drinking water distribution systems. Environ. Sci.: Water Res. Technol., 4: 2080.
Durand, J., Deshommes, E., Nour, S., and Prévost, M. (2016). Monitoring water quality in distribution systems: laboratory and field validation of on-line multi-parameter probes. Paper presented at the 17th Canadian National Conference on Drinking Water, Ottawa, ON.
Ebacher, G., Besner, M-C., Lavoie, J., Jung, B.S. Karney, B.W. and Prévost, M. (2011). Transient modeling of a full-scale distribution system: Comparison with field data. J. Water Resour. Plan. Manag., 137(2): 173-182.
Ebacher, G., Besner, M.C., Clement, B. and Prevost, M. (2012). Sensitivity analysis of some critical factors affecting simulated intrusion volumes during a low pressure transient event in a full-scale water distribution system. Water Res., 46(13): 4017-4030.
Eichler, S., Christen, R., Höltje, C., Westphal, P., Bötel, J., Brettar, I., Mehling, A. and Höfle, M.G. (2006). Composition and dynamics of bacterial communities of a drinking water supply system as assessed by RNA- and DNA-based 16S rRNA gene fingerprinting. Appl. Environ. Microbiol., 72(3): 1858-1872.
El-Chakhtoura, J., Prest, E., Saikaly, P., van Loosdrecht, M., Hammes, F. and Vrouwenvelder, H. (2015). Dynamics of bacterial communities before and after distribution in a full-scale drinking water network. Water Res., 74: 180-90.
Ellison, D., Duranceau, S.J., Ancel, S. Deagle, G. and McCoy, R. (2003). Investigation of pipe cleaning methods. AwwaRF, Denver, Colorado.
Emde, K.M.E., Smith, D.W. and Facey, R. (1992). Initial investigation of microbially influenced corrosion (MIC) in a low temperature water distribution system. Water Res., 26(2): 169-175.
Ercumen, A., Gruber, J.S. and Colford, J.M. Jr. (2014). Water distribution system deficiencies and gastrointestinal illness: a systematic review and meta-analysis. Environ Health Perspect., 122(7):651-60.
Escobar, I.C. and Randall, A.A. (2001). Assimilable organic carbon (AOC) and biodegradable dissolved organic carbon (BDOC): Complementary measurements. Water Res., 35(18): 4444-4454.
Falkinham, J.O., Pruden, A. and Edwards, M. (2015). Opportunistic premise plumbing pathogens: Increasingly important pathogens in drinking water. Pathogens, 4(2): 373-386.
Favere, J., Buysschaert, B., Boon, N. and De Gusseme, B. (2020). Online microbial fingerprinting for quality management of drinking water: Full-scale event detection. Water Res., 170: 115353.
Feazel, L.M., Baumgartner, L.K., Peterson, K.L., Frank, D.N., Harris, J.K. and Pace, N.R. (2009). Opportunistic pathogens enriched in showerhead biofilms. Proc Natl Acad Sci USA, 106(38): 16393-9.
Fish, K.E., Osborn, A.M. and Boxall, J. (2016). Characterising and understanding the impact of microbial biofilms and the extracellular polymeric substance (EPS) matrix in drinking water distribution systems. Environ. Sci. Water Res. Technol., 2 (4): 614-630.
Fitchett, J.C., Karadimitriou, K., West, Z. and Hughes, D.M. (2020). Machine learning for pipe condution assessments. J. Am. Water Works Assoc., 112(5): 50-55.
Flemming, H-C. and Wingender, J. (2001). Relevance of microbial extracellular polymeric substances (EPSs) – Part I: Structural and ecological aspects. Water Sci Technol. 43(6):1-8.
Flemming, H. and Wingender, J. (2010). The biofilm matrix. Nat. Rev. Microbiol., 8(9): 623-633.
Flemming, H., Percival, S.L. and Walker, J.T. (2002). Contamination potential of biofilms in water distribution systems. Water Sc. Technol. Water Supply, 2(1): 271-280.
Fontanazza, C.M., Notaro, V., Puleo, V., Nicolosi, P. and Freni, G. (2015). Contaminant intrusion through leaks in water distribution system: Experimental analysis. Procedia Eng., 119(1): 426-433.
Fox, S., Shepherd, W., Collins, R., and Boxall., J. (2016). Experimental quantification of contaminant ingress into a buried leaking pipe during transient events. J. Hydraul. Eng., 142(1): 04015036.
Frey, M.M. and Sullivan, L. (2004). Practical application of online monitoring. Awwa Research Foundation, Denver, Colorado.
Friedman, M. (2014). Use of monitoring, bench-scale and pipe rig studies to solve a pipe destabilization mystery. City of Longview, WA. In: Proceedings of the American Water Works Association Water Quality Technology Conference, New Orleans, Louisiana. American Water Works Association, Denver, Colorado.
Friedman, M. (2020). Planning for source water and treatment changes. Presented at the US EPA 17th annual drinking water workshop: Small systems challenges and solutions. September 2.
Friedman, M. and Slabaugh, R. (2020). Selecting and implementing CCT. Presented at the US EPA 17th annual drinking water workshop: Small systems challenges and solutions. August 31.
Friedman, M., Martel, K. Hill, A., Holt, D., Smith, S., Ta, T., Sherwin, C., Hiltebrand, D., Pommerenk, P., Hinedi, Z. and Camper, A. (2003). Establishing site-specific flushing velocities. Awwa Research Foundation, Denver, Colorado and Kiwa, N.V., Nieuwegein, The Netherlands.
Friedman, M., Radder, L., Harrison, S., Howie, D., Britton, M. Boyd, G., Wang, H., Gullick, R., LeChevallier, M., Wood, D. and Funk, J. (2004). Verification and control of pressure transients and intrusion in distribution systems. Awwa Research Foundation, Denver, Colorado and US Environmental Protection Agency, Washington, DC.
Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L. and Korshin, G.V. (2010a). Assessment of inorganics accumulation in drinking water system scales and sediments. Water Research Foundation, Denver, Colorado.
Friedman, M., Kirmeyer, G., Lemieux, J., LeChevalllier, M., Seidl, S. and Routt, J. (2010b). Criteria for optimized distribution systems. Water Research Foundation, Denver, Colorado.
Friedman, M., Hill, A., Booth, S., Hallett, M., McNeill, L., McLean, J., Sorensen, D., Hammer, T., De Haan, M., MacArthur, K. and Mitchell, K. (2016). Metals accumulation and release within the distribution system: Evaluation and mitigation. Report #4509. Water Research Foundation, Denver, Colorado.
Gagnon, G.A., Murphy, H.M., Rand, J.L., Payne, S.J., Springthorpe, S., Matias, F., Nokbeh, R. and Sattar, S.S. (2007). Coliforms in distribution systems; integrated disinfection and antimicrobial resistance. AWWA, AWWA Research Foundation, IWA, Denver, Colorado.
Gagnon, G.A., Baribeau, H., Rutledge, S.O., Dumancic, R., Oehmen, A., Chauret, C. and Andrews, S. (2008). Disinfectant efficacy in distribution systems: a pilot-scale assessment. J. Water Supply Res. Technol. AQUA, 57(7): 507-518.
Garner, E., Davis, B.C., Milligan, E., Blair, M.F., Keenum, I., Maile-Moskowitz, A., Pan, J., Gnegy, M., Liguori, K., Gupta, S., Prussin, J. 2nd, Marr, L.C., Heath, L.S., Vikesland, P.J., Zhang, L. and Pruden A. (2021). Next generation sequencing approaches to evaluate water and wastewater quality. Water Res., 194: 116907.
Gauthier, V., Gérard, B., Portal, J-M., Block, J.C., and Gatel, D. (1999). Organic matter as loose deposits in a drinking water distribution system. Water Res. 33, 1014-1026.
Gibbons, C.L., Mangen, M.-.J., Plass, D., Havelaar, A.H., Brooke, R.J., Kramarz, P., Peterson, K.L., Stuurman, A.L., Cassini, A., Fèvre, E.M. and Kretzschmar, M.E. (2014). Measuring underreporting and under-ascertainment in infectious disease datasets: A comparison of methods. BMC Public Health, 14(1).
Gillespie, S., Lipphaus, P., Green, J., Parsons, S., Weir, P., Juskowiak, K., Jefferson, B., Jarvis, P. and Nocker, A. (2014). Assessing microbiological water quality in drinking water distribution systems with disinfectant residual using flow cytometry. Water Res., 65: 224-234.
Ginn, T. and Smither, B. (2020). Pressure-transient monitoring supports asset management. Opflow, 46(12): 28-30.
GLUMRB (2012). Recommended standards for water works. Health Education Services, Great Lakes – Upper Mississippi River Board of State and Provincial Public Health and Environmental Managers, Albany, New York.
Gomez-Alvarez, V., Revetta, R.P. and Santo Domingo, J.W. (2012). Metagenomic analyses of drinking water receiving different disinfection treatments. Appl. Environ. Microbiol., 78(17): 6095-6102.
Gomez-Alvarez, V., Humrighouse, B.W., Revetta, R.P. and Santo Domingo, J.W. (2015). Bacterial composition in a metropolitan drinking water distribution system utilizing different source waters. J. Water Health, 13(1): 140-151.
Goncharuk, V.V., Bagrii, V.A., Mel'nik, L.A., Chebotareva, R.D. and Bashtan, S.Y. (2010). The use of redox potential in water treatment processes. J. Water Chem. Technol. 32(1): 1-9.
Goordial, J., Altshuler, I., Hindson, K., Chan-Yam, K., Marcolefas, E. and Whyte, L.G. (2017). In situ field sequencing and life detection in remote (79◦26′N) Canadian high arctic permafrost ice wedge microbial communities. Front Microbiol, 8: 2594.
Gullick, R.W., LeChevallier, M.W., Svindland, R.C. and Friedman, M.J. (2004). Occurrence of transient low and negative pressures in distribution systems. J. Am. Water Works Assoc., 96(11): 52-66.
Haas, C.N. (1999). Benefits of using a disinfectant residual. J. Am. Water Works Assoc., 91(1): 65-69.
Halton (2001). Investigation of material deposits in the Burlington distribution system. Regional Municipality of Halton, Oakville, Ontario.
Hamilton, D. and Kikolica, P. (2021) The City of Hamilton reduces non-revenue water loss with proactive leak detection program. Ontario Pipeline, Spring 2021.
Hammes, F.A. and Egli, T. (2005). New method for assimilable organic carbon determination using flow-cytometric enumeration and a natural microbial consortium as inoculum. Environ. Sci. Technol., 39(9): 3289-3294.
Hammes, F. and Egli, T. (2010). Cytometric methods for measuring bacteria in water: Advantages, pitfalls and applications. Anal. Bioanal Chem., 397(3): 1083-1095.
Hammes, F., Berney, M., Wang, Y., Vital, M., Koster, O. and Egli, T. (2008). Flow-cytometric total bacterial cell counts as a descriptive microbiological parameter for drinking water treatment processes. Water Res., 42(1-2): 269-277.
Hammes, F., Goldschmidt, F., Vital, M., Wang, Y. and Egli, T. (2010). Measurement and interpretation of microbial adenosine tri-phosphate (ATP) in aquatic environments. Water Res., 44(13): 3915-3923.
Hammes, F., Boon, N., Vital, M., Ross, P., Magic-Knezev, A. and Dignum, M. (2011). Bacterial colonization of pellet softening reactors used during drinking water treatment. Appl. Environ. Microbiol., 77(3): 1041-1048.
Hammes, F., Broger, T., Weilenmann, H.U., Vital, M., Helbing, J., Bosshart, U., Huber, P., Odermatt, R.P. and Sonnleitner, B. (2012). Development and laboratory-scale testing of a fully automated online flow cytometer for drinking water analysis. Cytometry A., 81(6): 508-516.
Hargesheimer, E. (2001). Walkerton Inquiry Part II: review of issue #7 : Measurement of source and finished water quality. Prepared on behalf of the Ontario Water Works Association and the Ontario Municipal Water Association. Consultable en ligne à la page : http://www.archives.gov.on.ca/en/e_records/walkerton/part2info/partieswithstanding/pdf/OWWA7.pdf.
Hatam, F., Besner, M-C., Ebacher, G. and Prévost, M. (2020). Limitations of E. coli monitoring for confirmation of contamination in distribution systems due to intrusion under low pressure condition in the presence of disinfectants. J. Water Resour. Plann. Manage. 146(8): 04020056.
Henne, K., Kahlisch, L., Brettar, I. and Höfle, M.G. (2012). Analysis of structure and composition of bacterial core communities in mature drinking water biofilms and bulk water of a citywide network in Germany. Appl. Environ. Microbiol., 78(10): 3530-3538.
Hilborn, E. D., Wade, T., Hicks, L., Garrison, L. and Gargano, J. (2013). Surveillance for waterborne disease outbreaks associated with drinking water and other nonrecreational water – United States, 2009-2010. Morb. Mortal. Wkly. Rep., 62(35): 714-720.
Hill, A.S., Friedman, M., Hallett, M., Salo-Zieman, V., Booth, S., Hanson, A., Gupta, K., Akagi, Y., Kochiss, C., Koperski, L., Igoe, P., Kirby, L. and Harper, W. (2018). Use of flushing as a corrective action under the revised total coliform rule. Report #4653. Water Research Foundation, Denver, Colorado.
Hooper, J., Vickstrom, K., Evans, P., Alito, C., Black, S. and Lauderdale, C. (2019). Guidance manual for monitoring biological filtration of drinking water. Report #4620. Water Research Foundation, Denver, Colorado.
Hong, P., Hwang, C., Ling, F., Andersen, G.L., LeChevallier, M.W. and Liu, W. (2010). Pyrosequencing analysis of bacterial biofilm communities in water meters of a drinking water distribution system. Appl. Environ. Microbiol., 76(16): 5631-5635.
Howe, A.D., Forster, S., Morton, S., Marshall, R., Osborn, K.S., Wright, P. and Hunter, P.R. (2002). Cryptosporidium oocysts in a water supply associated with a cryptosporidiosis outbreak. Emerg. Infect. Dis., 8(6): 619-624.
Hrudey, S.E. and Hrudey, E.J. (2004). Safe drinking water: Lessons from recent outbreaks in affluent nations. IWA Publishing, London, England.
Hrudey, S.E. and Hrudey, E.J. (2014). Ensuring safe drinking water: Learning from frontline experience with contamination. American Water Works Association, Denver, Colorado.
Huck, P. M. (1990). Measurement of biodegradable organic matter and bacterial growth potential in drinking water. J. Am. Water Works Assoc., 82: 78-86.
Hunter, P.R., Chalmers, R.M., Hughes, S. and Syed, Q. (2005). Self-reported diarrhea in a control group: A strong association with reporting of low-pressure events in tap water. Clin. Infect. Dis., 40(4): e32-34.
Husband, S. and Boxall, J.B. (2010). Field studies of discoloration in water distribution systems: Model verification and practical implications. J. Environ. Eng., 136(1): 86-94.
Husband, S., Fish, K.E., Douterelo, I. and Boxall, J. (2016). Linking discolouration modelling and biofilm behaviour within drinking water distribution systems. pp. 942-950.
Hwang, C., Ling, F., Andersen, G.L., LeChevallier, M.W. and Liu, W. (2011). Evaluation of methods for the extraction of DNA from drinking water distribution system biofilms. Microbes and Environments, 27(1): 9-18.
Hwang, C., Ling, F., Andersen, G.L., LeChevallier, M.W. and Liu, W. (2012). Microbial community dynamics of an urban drinking water distribution system subjected to phases of chloramination and chlorination treatments. Appl. Environ. Microbiol., 78(22): 7856-7865.
Islam, N., Al-Zahrani, M.A.M., Sadiq, R., Farahat, A. and Rodriguez, M.J. (2015). Contaminant intrusion in water distribution networks: Review and proposal of an integrated model for decision making. Env. Rev., 23(3): 337-352.
Jakopanec, I., Borgen, K., Vold, L., Lund, H., Forseth, T., Hannula, R. and Nygård, K. (2008). A large waterborne outbreak of Campylobacteriosis in Norway: The need to focus on distribution system safety. BMC Infect. Dis., 8.
Kachani, Y., Laneuville, M. and Jernigan, W. (2020). Developing Quebec's water efficiency strategy. J. Am. Water Works Assoc., 112(6): 56-64.
Karim, M.R., Abbaszadegan, M. and Lechevallier, M. (2003). Potential for pathogen intrusion during pressure transients. J. Am. Water Works Assoc., 95(5): 134-146.
Kennedy, L.C., Miller, S.E., Kantor, R.S. and Nelson, K.L. (2021). Effect of disinfectant residual, pH, and temperature on microbial abundance in disinfected drinking water distribution systems. Environ. Sci.: Water Res. Technol., 7: 78-92
Kirmeyer, G.J., Kirby, L., Murphy, B.M., Noran, P.F., Martel, K.D., Lund, T.W., Anderson, J.L. and Medhurst, R. (1999). Maintaining water quality in finished water storage facilities. Awwa Research Foundation and American Water Works Association, Denver, Colorado.
Kirmeyer, G.J., Friedman, M., Clement, J., Sandvig, A., Noran, P.F, Martel, K.D., Smith, D., LeChevallier, M.W., Volk, C., Antoun, E., Hiltebrand, D., Dyksen, J. and Cushing. R.S. (2000). Guidance manual for maintaining distribution system water quality. Awwa Research Foundation and American Water Works Association, Denver, Colorado.
Kirmeyer, G.J., Friedman, M., Martel, K., Howie, D., LeChevallier, M., Abbaszadegan, M., Karim, M., Funk, J. and Harbour, J. (2001). Pathogen intrusion into the distribution system. AWWA Research Foundation and American Water Works Association, Denver, Colorado.
Kirmeyer, G.J., Thomure, T.M., Rahman, R., Marie, J.L., LeChevallier, M.W., Yang, J., Hughes, D.M. and Schneider, O. (2014). Effective microbial control strategies for main breaks and depressurization. Water Research Foundation, Denver, Colorado.
Koch, C., Harnisch, F., Schröder, U. and Müller, S. (2014). Cytometric fingerprints: Evaluation of new tools for analyzing microbial community dynamics. Front. Microbiol., 5.
Laine, J., Huovinen, E., Virtanen, M.J., Snellman, M., Lumio, J., Ruutu, P., Kujansuu, E., Vuento, R., Pitkänen, T., Miettinen, I., Herrala, J., Lepistö, O., Antonen, J., Helenius, J., Hänninen, M., Maunula, L., Mustonen, J., Kuusi, M., Collin, P., Korpela, M., Kuusela, A., Mustajoki, S., Oksa, H., Räsänen, S., Uotila, T. and Katto, T. (2011). An extensive gastroenteritis outbreak after drinking-water contamination by sewage effluent, Finland. Epidemiol. Infect., 139(7): 1105-1113.
Lambertini, E., Borchardt, M.A., Kieke, B.A., Spencer, S.K. and Loge, F.J. (2012). Risk of viral acute gastrointestinal illness from nondisinfected drinking water distribution systems. Environ. Sci. Technol., 46(17): 9299-9307.
Lan, Y., Rosen, G. and Hershberg, R. (2016). Marker genes that are less conserved in their sequences are useful for predicting genome-wide similarity levels between closely related prokaryotic strains. Microbiome, 4(1): 18.
Lautenschlager, K., Boon, N., Wang, Y., Egli, T. and Hammes, F. (2010). Overnight stagnation of drinking water in household taps induces microbial growth and changes in community composition. Water Res., 44(17): 4868-4877.
Lautenschlager, K., Hwang, C., Liu, W.T., Boon, N., Koster, O., Vrouwenvelder, H., Egli, T. and Hammes, F. (2013). A microbiology-based multi-parametric approach towards assessing biological stability in drinking water distribution networks. Water Res., 47(9): 3015-3025.
LeChevallier, M.W. (1999). Biofilms in drinking water distribution systems: Significance and control. In: Identifying future drinking water contaminants: 1998 workshop on emerging drinking water contaminants. National Research Council (ed.). The National Academies Press, Washington, DC, pp. 206-219.
LeChevallier, M.W. and Au, K-K. (2004). Water treatment and pathogen control. Process efficiency in achieving safe drinking water. World Health Organization, 2004. IWA Publishing. London.
LeChevallier, M.W., Cawthorn, C.D. and Lee, R.G. (1988). Mechanisms of bacterial survival in chlorinated drinking water. Water Sci. Technol., 20(11-12): 145-151.
LeChevallier, M.W., Olson, B.H. and McFeters, G.A. (1990). Assessing and controlling bacterial regrowth in distribution systems. Awwa Research Foundation, Denver, Colorado.
LeChevallier, M.W., Welch, N.J. and Smith, D.B. (1996). Full-scale studies of factors related to coliform regrowth in drinking water. Applied and Environmental Microbiology, 62 (7), pp. 2201-2211.
LeChevallier, M.W., Gullick, R.W., Karim, M.R., Friedman, M. and Funk, J.E. (2003). The potential for health risks from intrusion of contaminants into the distribution system from pressure transients. J. Water Health, 1(1): 3-14.
LeChevallier, M. W., M. Xu, J. Yang, P. Teunis, and Fleming, K. (2011). Managing distribution system low transient pressures for water quality. Water Research Foundation, Denver, Colorado.
LeChevallier, M. W., M. Xu, J. Yang, P. Teunis, and Fleming, K. (2014). Pressure management: Industry practices and monitoring procedures. Water Research Foundation, Denver, Colorado.
LeChevallier, M.W., Schneider, O.D., Weinrich, L.A., Jjemba, P.K., Evans, P.J., Hooper, J.L. and Chappell, R.W. (2015a). An operational definition of biostability in drinking water. Water Research Foundation, Denver, Colorado.
LeChevallier, M.W., Schneider, O.D., Weinrich, L.A., Jjemba, P.K., Evans, P.J., Hooper, J.L. and Chappell, R.W. (2015b). Guidance manual for control of biostability in drinking water. Water Research Foundation, Denver, Colorado.
Lee, Y. (2013). Factors controlling bacterial growth in drinking water distribution pipes. Asian J Chem, 25(3): 1629-1634.
Lee, S.H., Levy, D.A., Craun, G.F., Beach, M.J. and Calderon, R.L. (2002). Surveillance for waterborne-disease outbreaks – United States, 1999-2000. MMWR Surveill Summ, 51(8): 1-47.
Lee, J.J., Schwartz, P., Sylvester, P., Crane, L., Haw, J., Chang, H. and Kwon, H.J. (2003). Impacts of cross-connections in North American water supplies. Water Research Foundation, Denver, Colorado.Lehtola, M. J.,
Levin, R.B., Epstein, P.R., Ford, T.E., Harrington, W., Olson, E. and Reichard, E.G. (2002). US drinking water challenges in the twenty-first century. Environ. Health Perspect., 110: 43-52.
Levy, D.A., Bens, M.S., Craun, G.F., Calderon, R.L. and Herwaldt, B.L. (1998). Surveillance for Waterborne-Disease Outbreaks – United States 1995-1996. Morb. Mortal. Wkly. Rep., 4
Li, G., Ding, Y., Xu, H., Jin, J. and Shi, B. (2018). Characterization and release profile of (Mn, Al)-bearing deposits in drinking water distribution systems. Chemosphere, 197: 73-80.
Liang, J.L., Dziuban, E.J., Craun, G.F., Hill, V., Moore, M.R., Gelting, R.J., Calderon, R.L., Beach, M.J. and Roy, S.L. (2006). Surveillance for waterborne disease and outbreaks associated with drinking water and water not intended for drinking – United States, 2003-2004. MMWR Surveill Summ, 55(12): 31-65.
Lillis, T.O. and Bissonnette, G.K. (2001). Detection and characterization of filterable heterotrophic bacteria from rural groundwater supplies. Lett. Appl. Microbiol., 32(4): 268-272.
Lindley, T.R. and Buchberger, S.G. (2002). Assessing intrusion susceptibility in distribution systems. J. Am. Water Works Assoc., 94(6): 66-79.
Ling, F., Hwang, C., LeChevallier, M.W., Andersen, G.L. and Liu, W-T. (2016). Core-satellite populations and seasonality of water meter biofilms in a metropolitan drinking water distribution system. ISME Journal, 10(3): 582-595.
Lipphaus, P., Hammes, F., Kötzsch, S., Green, J., Gillespie, S. and Nocker, A. (2014). Microbiological tap water profile of a medium-sized building and effect of water stagnation. Environmental Technology (United Kingdom), 35(5): 620-628.
Liu, G., Verberk, J.Q.J.C. and Van Dijk, J.C. (2013a). Bacteriology of drinking water distribution systems: An integral and multidimensional review. Appl Microbiol Biotechnol., 97: 9265-9276.
Liu, G., Lut, M.C., Verberk, J.Q.J.C. and Van Dijk, J.C. (2013b). A comparison of additional treatment processes to limit particle accumulation and microbial growth during drinking water distribution. Water Res., 47(8): 2719-2728.
Liu, G., Ling, F.Q., Magic-Knezev, A., Liu, W.T., Verberk, J.Q.J.C. and Van Dijk, J.C. (2013c). Quantification and identification of particle-associated bacteria in unchlorinated drinking water from three treatment plants by cultivation-independent methods. Water Res., 47(10): 3523-3533.
Liu, G., Bakker, G.L., Li, S., Vreeburg, J.H.G., Verberk, J.Q.J.C., Medema, G.J., Liu, W.T. and Van Dijk, J.C. (2014). Pyrosequencing reveals bacterial communities in unchlorinated drinking water distribution system: An integral study of bulk water, suspended solids, loose deposits, and pipe wall biofilm. Environ. Sci.Technol., 48(10): 5467-5476.
Liu, G., Liu, W., Zhang, Y., Knibbe, W., Feng, C., Medema, G. and van der Meer, W. (2017). Potential impacts of changing supply-water quality on drinking water distribution: A review. Water Res., 116: 135-148.
Liu, G., Zhang, Y., van der Mark, E., Magic-Knezev, A., Pinto, A., van den Bogert, B., Liu, W., van der Meer, W. and Medema, G. (2018). Assessing the origin of bacteria in tap water and distribution system in an unchlorinated drinking water system by SourceTracker using microbial community fingerprints. Water Res., 138: 86-96.
Liu, S., Gunawan, C., Barraud, N., Rice, S.A., Harry, E.J. and Amal, R. (2016). Understanding, monitoring, and controlling biofilm growth in drinking water distribution systems. Environ. Sci. Technol., 50(17): 8954-8976.
Locco, D. and Alberton, D. (2021) Hamilton conducts dead-end watermain flushing program using post hydrants. Envrionmental Science & Engineering, February 2021.
Locco, D., Waller, M., Giani, R., Nikolica, P., Hill, A. and Friedman, M. (2018). Pilot testing for optimized unidirectional flushing in the Hamilton distribution system. In: Proceedings of the American Water Works Association Annual Conference and Exposition, Las Vegas, Nevada. American Water Works Association, Denver, Colorado.
Lotimer, T. (2012). The role of well integrity in reducing pathogen contamination of public groundwater supplies. Canadian Water Network Conference: Assessing pathogen fate, transport and risk in natural and engineered water treatment. Banff, Alberta, Canada, September 23-26, 2012.
Lu, J., Struewing, I., Yelton, S. and Ashbolt, N. (2015). Molecular survey of occurrence and quantity of Legionella spp., Mycobacterium spp., Pseudomonas aeruginosa and amoeba hosts in municipal drinking water storage tanks. J. Appl. Microbiol. 119(1): 278-288.
MacDonald, J. (2001). Walkerton Inquiry Part II: review of issue #8: Production and distribution of drinking water. Prepared on behalf of the Ontario Water Works Association and the Ontario Municipal Water Association. Consultable en ligne à la page : http://www.ontla.on.ca/library/repository/mon/2000/10297945.pdf
MacDougall, L., Majowicz, S., Doré, K., Flint, J., Thomas, K., Kovacs, S. and Sockett, P. (2008). Under-reporting of infectious gastrointestinal illness in British Columbia, Canada: Who is counted in provincial communicable disease statistics? Epidemiol. Infect., 136(2): 248-256.
Majowicz, S.E., Doré, K., Flint, J.A., Edge, V.L., Read, S., Buffett, M.C., McEwen, S., McNab, W.B., Stacey, D., Sockett, P. and Wilson, J.B. (2004). Magnitude and distribution of acute, self-reported gastrointestinal illness in a Canadian community. Epidemiol. Infect., 132(4): 607-617.
Manuel, C.M., Nunes, O.C. and Melo, L.F. (2010). Unsteady state flow and stagnation in distribution systems affect the biological stability of drinking water. Biofouling, 26(2): 129-139.
Martel, K.D., Kirmeyer, G.J., Murphy, B.M., Noran, P.F., Kirby, L., Lund, T.W., Anderson, J.L., Medhurst, R. and Caprara, M. (2002). Preventing water quality deterioration in finished water storage facilities. J. Am. Water Works Assoc., 94(4): 139-148.
McIlwain, B. (2020). Microbial monitoring in drinking water distribution systems using ATP. Proceedings of AWWA webinar: Investigating ATP analysis for infrastructure release for service. American Water Works Association, Denver, Colorado.
McKinnon, K.M. (2018). Flow cytometry: an overview. Curr Protoc Immunol., 120: 5.1.1-5.1.11.
Messner, M., Shaw, S., Regli, S., Rotert, K., Blank, V. and Soller, J. (2006). An approach for developing a national estimate of waterborne disease due to drinking water and a national estimate model application. J Water Health, 4(SUPPL. 2): 201-240.
Meteer, L. (2018). The distribution trifecta: theory, measurement and impacts to drinking water. York Region.
Moe, C.L and Rheingans, R.D. (2006). Global challenges in water, sanitation and health. J Water Health, 4 (Suppl 1): 41-57.
Moreira, N.A. and Bondelind, M. (2017). Safe drinking water and waterborne outbreaks. J Water Health, 15(1): 83-96.
Mosse, P. and Murray, B. (2015). Good practice guide to the operation of drinking water supply systems for the management of microbial risk. Water for the wellbeing of all Australians. Water Research Australia. Project 1074.
Murphy, H.M., Thomas, M.K., Medeiros, D.T., McFadyen, S. and Pintar, K.D. (2016). Estimating the number of cases of acute gastrointestinal illness (AGI) associated with Canadian municipal drinking water systems. Epidemiol. Infect., 144(7): 1371-1385.
Muylwyk, Q. and MacDonald, J. (2001). Aluminum deposits in the distribution system: What can you do? In: Proceedings of the American Water Works Association Water Quality Technology Conference, Nashville, Tennessee. American Water Works Association, Denver, Colorado.
Najm, I.N., Bouls, L., LeChevallier, M., Norton, C., Volk, C., Randall, A., Escobar, I., Klene, L. and Campos, C. (2000). Case studies of the impacts of treatment changes on biostability in full scale distribution systems. Awwa Research Foundation and American Water Works Association, Denver, Colorado.
NAS. (2019). Management of Legionella in water systems. National Academies of Sciences, Engineering, and Medicine. Washington, DC. The National Academies Press.
Nescerecka, A., Rubulis, J., Vital, M., Juhna, T. and Hammes, F. (2014). Biological instability in a chlorinated drinking water distribution network. PLoS One, 9(5): e96354.
Nescerecka, A., Juhna, T. and Hammes, F. (2016). Behavior and stability of adenosine triphosphate (ATP) during chlorine disinfection. Water Res., 101: 490-497.
Nescerecka, A., Juhna, T. and Hammes, F. (2018). Identifying the underlying causes of biological instability in a full-scale drinking water supply system. Water Res., 135: 11-21.
Nielsen, P.H., Jahn, A. and Palmgren, R. (1997). Conceptual model for production and composition of exopolymers in biofilms. Water Sci. Technol., 36(1): 11-19.
Niquette, P., Servais, P. and Savoir, R. (2000). Impacts of pipe materials on densities of fixed bacterial biomass in a drinking water distribution system. Water Res., 34(6): 1952-1956.
Nocker, A., Sossa, K.E. and Camper, A.K. (2007). Molecular monitoring of disinfection efficacy using propidium monoazide in combination with quantitative PCR. J. Microbiol. Methods, 70(2): 252-260.
Nocker, A., Cheswick, R., Dutheil de la Rochere, P.M., Denis, M., Leziart, T. and Jarvis, P. (2017). When are bacteria dead? A step towards interpreting flow cytometry profiles after chlorine disinfection and membrane integrity staining. Environ. Technol., 38(7): 891-900.
Norton, C.D. and LeChevallier, M.W. (2000). A pilot study of bacteriological population changes through potable water treatment and distribution. Appl. Environ. Microbiol., 66(1): 268-276.
Norton, C.D., LeChevallier, M.W. and Falkinham, J.O. III. (2004). Survival of Mycobacterium avium in a model distribution system. Water Res., 38: 1457-1466.
NRC (2006). Drinking water distribution systems: Assessing and reducing risks. National Research Council. The National Academies Press, Washington, DC.
Nygård, K., Vold, L., Halvorsen, E., Bringeland, E., Røttingen, J.A. and Aavitsland, P. (2004). Waterborne outbreak of gastroenteritis in a religious summer camp in Norway, 2002. Epidemiol. Infect., 132(2): 223-229.
Nygård, K., Wahl, E., Krogh, T., Tveit, O.A., Bøhleng, E., Tverdal, A. and Aavitsland, P. (2007). Breaks and maintenance work in the water distribution systems and gastrointestinal illness: A cohort study. Int. J. Epidemiol., 36(4): 873-880.
Ochromowicz, K. and Hoekstra, E.J. (2005). ATP as an indicator of microbiological activity in tap water. European Commission, DG Joint Research Centre. Report no. EUR 22157 EN.
O'Connor, D.R. (2002). Report of the Walkerton inquiry, Part Two: a strategy for safe drinking water. The Walkerton Inquiry. Toronto, ON. Consultable en ligne à la page : http://www.archives.gov.on.ca/en/e_records/walkerton/report2/index.html
Park, S.R., Mackay, W.G. and Reid, D.C. (2001). Helicobacter sp. recovered from drinking water biofilm sampled from a water distribution system. Water Res., 35(6): 1624-1626.
Payment, P., Richardson, L., Siemiatycki, J., Dewar, R., Edwardes, M., and Franco, E. (1991). A randomized trial to evaluate the risk of gastrointestinal disease due to consumption of drinking water meeting current microbiological standards. Am J Public Health, 81(6): 703-8.
Payment, P., Siemiatycki, J., Richardson, L., Renaud, G., Franco, E. and Prévost, M. (1997). A prospective epidemiological study of gastrointestinal health effects due to the consumption of drinking water. Int. J. Environ. Health Res., 7(1): 5-31.
Pepper, I.L., Rusin, P., Quintanar, D.R., Haney, C., Josephson, K.L. and Gerba, C.P. (2004). Tracking the concentration of heterotrophic plate count bacteria from the source to the consumer tap. Int. J. Food Microbiol., 92: 289-295.
Percival, S.L. and Williams, D.W. (2014). Legionella. In microbiology of waterborne diseases: Microbiological aspects and risks: Second edition. Elsevier Ltd. Oxford, UK. pp. 155-175.
Pintar, K.D.M. and Slawson, R.M. (2003). Effect of temperature and disinfection strategies on ammonia-oxidizing bacteria in a bench-scale drinking water distribution system. Water Res., 37(8): 1805-1817.
Pinto, A.J., Xi, C. and Raskin, L. (2012). Bacterial community structure in the drinking water microbiome is governed by filtration processes. Environ. Sci. Technol., 46(16): 8851-8859.
Poças, A., Rebola, N., Cordeiro, B., Rodrigues, S., Benoliel, M.J., Vreeburg, J. and Menaia, J. (2013). Methodology for sampling drinking water discolouration loose deposits at low velocities. Water Sci. Technol. Water Supply, 13(4): 1116-1122.
Pons, W., Young, I., Truong, J., Jones-Bitton, A., McEwen, S., Pintar, K. and Papadopoulos, A. (2015). A systematic review of waterborne disease outbreaks associated with small non-community drinking water systems in Canada and the United States. Plos One, 10(10).
Powell, J., J. Clement, M. Brandt, R. Casey, D. Holt, W. Grayman, and M. LeChevallier. (2004). Predictive models for water quality in distribution systems. AwwaRF, Denver, Colorado.
Prest, E.I., Hammes, F., Kötzsch, S., van Loosdrecht, M.C.M. and Vrouwenvelder, J.S. (2013). Monitoring microbiological changes in drinking water systems using a fast and reproducible flow cytometric method. Water Res., 47(19): 7131-7142.
Prest, E.I., Hammes, F., van Loosdrecht, M.C.M. and Vrouwenvelder, J.S. (2016a). Biological stability of drinking water: Controlling factors, methods, and challenges. Front. Microbiol., 7: 45.
Prest, E.I., Hammes, F., Kötzsch, S., Van Loosdrecht, M.C.M. and Vrouwenvelder, J.S. (2016b). A systematic approach for the assessment of bacterial growth-controlling factors linked to biological stability of drinking water in distribution systems. Water Sci. Technol. Water Supply, 16(4): 865-880.
Prest, E.I., Weissbrodt, D.G., Hammes, F., Van Loosdrecht, M.C.M. and Vrouwenvelder, J.S. (2016c). Long-term bacterial dynamics in a full-scale drinking water distribution system. Plos One, 11(10).
Prévost, M., Rompré, A., Coallier, J., Servais, P., Laurent, P., Clément, B. and Lafrance, P. (1998). Suspended bacterial biomass and activity in full-scale drinking water distribution systems: Impact of water treatment. Water Res., 32(5): 1393-1406.
Prince, R.A., Goulter, I. and Ryan, G. (2003). What causes customer complaints about discoloured drinking water? Correlating customer complaints with online monitoring of flow rate and turbidity. Water, 30(2): 62-67.
Proctor, C.R. and Hammes, F. (2015). Drinking water microbiology-from measurement to management. Curr. Opin. Biotechnol., 33: 87-94.
Props, R., Monsieurs, P., Mysara, M., Clement, L. and Boon, N. (2016). Measuring the biodiversity of microbial communities by flow cytometry. Methods in Ecology and Evolution, 7(11): 1376-1385.
Pruden A, Edwards M, Falkinham JO., III (2013). State of the science and research needs for opportunistic pathogens in premise plumbing. Report #4379. Water Research Foundation, Denver, Colorado.
Pryor, M., Springthorpe, S., Riffard, S., Brooks, T., Huo, Y., Davis, G. and Sattar, S.A. (2004). Investigation of opportunistic pathogens in municipal drinking water under different supply and treatment regimes. Water Sci Technol., 50(1): 83-90.
Quarini, G., Ainslie, E., Herbert, M., Deans, T., Ash, D., Rhys, D., Haskins, N., Norton, G., Andrews, S. and Smith, M. (2010). Investigation and development of an innovative pigging technique for the water-supply industry. Proc. Inst. Mech. Eng. Part E J. Process Mech. Eng., 224(2): 79-89.
Qureshi, N. and Shah, J. (2014). Aging infrastructure and decreasing demand: A dilemma for water utilities. J AWWA, 106 (1): 51-61.
Qin, K., Struewing, I., Domingo, J.S., Lytle, D. and Lu, J. (2017). Opportunistic pathogens and microbial communities and their associations with sediment physical parameters in drinking water storage tank sediments. Pathogens, 6(4): 54.
Ramseier, M.K., von Gunten, U., Freihofer, P. and Hammes, F. (2011). Kinetics of membrane damage to high (HNA) and low (LNA) nucleic acid bacterial clusters in drinking water by ozone, chlorine, chlorine dioxide, monochloramine, ferrate(VI), and permanganate. Water Res., 45(3): 1490-1500.
Rand, J.L., Gagnon, G.A. and Knowles, A. (2014). Establishing minimum free chlorine residual concentration for microbial control in a municipal drinking water distribution system. Water Pract. Technol., 9(4): 491-501.
Rathnayaka, S., Shannon, B., Rajeev, P. and Kodikara, J. (2016). Monitoring of pressure transients in water supply networks. Water Resour. Manage., 30(2): 471-485.
Reasoner, D.J. (2004). Heterotrophic plate count methodology in the United States. Int. J. Food Microbiol., 92(3): 307-315.
Reckhow, D.A., Rees, P.L., Nüsslein, K., Makdissy, G., Devine, G., Conneely, T., Boutin, A. and Bryan, D. (2007). Long-term variability of BDOM and NOM as precursors in watershed sources. Awwa Research Foundation, Denver, Colorado.
Renwick, D.V., Heinrich, A., Weisman, R., Arvanaghi, H. and Rotert, K. (2019). Potential public health impacts of deteriorating distribution system infrastructure. J. Am. Water Works Assoc., 111(2): 42-53.
Revetta, R.P., Gomez-Alvarez, V., Gerke, T.L., Santo Domingo, J.W. and Ashbolt, N.J. (2016). Changes in bacterial composition of biofilm in a metropolitan drinking water distribution system. J. Appl. Microbiol., 121(1): 294-305.
Rhoads, W.J., Garner, E., Ji, P., Zhu, N., Parks, J., Schwake, D.O., Pruden, A. and Edwards, M.A. (2017). Distribution system operational deficiencies coincide with reported legionnaires' disease clusters in Flint, Michigan. Environ. Sci. Technol., 51(20): 11986-11995.
Rittmann, B. E., and Snoeyink, V. L. (1984). Achieving biologically stable drinking water. J. Am. Water Works Assoc., 76: 106-114.
Robertson, P., Abdelhady, H. and Garduño, R.A. (2014). The many forms of a pleomorphic bacterial pathogen-the developmental network of Legionella pneumophila. Front. Microbiol. 5, art. no. 670: 1-20.
Rossman, L.A., Clark, R.M. and Grayman, W.M. (1994). Modeling chlorine residuals in drinking-water distribution systems. J. Environ. Eng., 120(4): 803-820.
Sadiq, R., Kleiner. Y. and Rajani, B. (2009). Proof-of-concept model to predict water quality changes in distribution pipe networks (Q-WARP). Report #2970. AwwaRF, Denver, Colorado.
Safford, H.R. and Bischel, H.N. (2019). Flow cytometry applications in water treatment, distribution, and reuse: A review. Water Res., 151: 110-133.
Saint John Water. (2018). Facts about Saint John's water system. Consultable en ligne à la page : http://www.saintjohn.ca/site/media/SaintJohn/CSJ_SJW_Backgrounder_SCDWP.pdf
Salter, S.J., Cox, M.J., Turek, E.M., Calus, S.T., Cookson, W.O., Moffatt, M.F., Turner, P., Parkhill, J., Loman, N.J. and Walker, A.W. (2014). Reagent and laboratory contamination can critically impact sequence-based microbiome analyses. BMC Biol., 12(1).
Santé Canada. (2009a). Document de conseils sur le contrôle de la corrosion dans les réseaux de distribution d'eau potable. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/document-conseils-controle-corrosion-reseaux-distribution-eau-potable.html
Santé Canada. (2009b) Recommandations pour la qualité de l'eau potable au Canada – Document technique – Le chlore. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-chlore-document-technique.html
Santé Canada. (2012). Conseils sur l'utilisation de la numération des bactéries hétérotrophes dans les approvisionnements d'eau potable au Canada. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/conseils-utilisation-numeration-bacteries-heterotrophes-approvisionnements-eau-potable-canada.html
Santé Canada. (2013). Conseils pour un approvisionnement en eau potable salubre dans les secteurs de compétence fédérale, version 2. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/conseils-pour-approvisionnement-eau-potable-salubre-secteurs-competence-federale-version-2.html
Santé Canada. (2015). Recommandations pour la qualité de l'eau potable au Canada – Document technique – le pH. Bureau de la qualité de l'eau et de l'air, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-ph-eau-potable.html
Santé Canada. (2019). Communication personnelle avec T. Beattie. Analyse fondée sur les données de l'application des avis concernant l'eau potable (AAEP) du Réseau canadien de renseignements sur la santé publique (RCRSP).
Santé Canada. (2020a). Recommandations pour la qualité de l'eau potable au Canada – Document technique – Escherichia coli. Bureau de la qualité de l'eau et de l'air. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-escherichia-coli.html
Santé Canada. (2020b). G Recommandations pour la qualité de l'eau potable au Canada – Document technique – Les coliformes totaux. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-coliformes-totaux.html
Santé Canada. (2020c). Conseils sur la matière organique naturelle dans l'eau potable. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/conseils-matiere-organique-naturelle-eau-potable.html
Santé Canada. (2021a). Conseils sur les agents pathogènes d'origine hydrique – Document d'orientation à des fins de consultation. Bureau de la qualité de l'eau et de l'air. Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/programmes/consultation-conseils-pathogenes-origine-hydrique/document.html
Santé Canada. (2021b) Document de conseils sur les aspects liés à la température de l'eau potable. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-temperature.html
Santé Canada. (2021c). Recommandations pour la qualité de l'eau potable au Canada : document technique – aluminium. Bureau de l'eau, de l'air et des changements climatiques, Direction générale de la santé environnementale et de la sécurité des consommateurs, Santé Canada, Ottawa (Ontario). Consultable en ligne à la page : https://www.canada.ca/fr/sante-canada/services/publications/vie-saine/recommandations-pour-qualite-eau-potable-canada-document-technique-aluminium.html
Sarver, E., Zhang, Y. and Edwards, M. (2011). Copper pitting and brass dezincification: chemical and physical effects. Water Research Foundation, Denver, Colorado.
Säve-Söderbergh, M., Bylund, J., Malm, A., Simonsson, M. and Toljander, J. (2017). Gastrointestinal illness linked to incidents in drinking water distribution networks in Sweden. Water Res., 122: 503-511.
Schleich, C., Chan, S., Pullerits, K., Besmer, M.D., Paul, C.J., Rådström, P. and Keucken, A. (2019). Mapping dynamics of bacterial communities in a full-scale drinking water distribution systems using flow cytometry. Water, 11(10): 2137.
Schneider, O.D., Hughes, D.M., Xu, M. and Barfuss, S.L. (2016). Case studies to identify occurrence, accuracy and cause of reverse flow using meter systems. Water Research Foundation, Denver, Colorado.
Scott, D.B., Van Dyke, M.I., Anderson, W.B. and Huck, P.M. (2015). Influence of water quality on nitrifier regrowth in two full-scale drinking water distribution systems. Can. J. Microbiol., 61(12): 965-976.
September, S.M., Els, F.A., Venter, S.N. and Brözel, V.S. (2007). Prevalence of bacterial pathogens in biofilms of drinking water distribution systems. J Water Health, 5(2): 219-227.
Servais, P., Billen, G., Laurent, P., Levi, Y. and Randon, G. (1992). Studies of BDOC and bacterial dynamics in the drinking water distribution system of the northern Parisian suburbs. Revue Des Sciences De l'Eau, 5(Suppl.): 69-89.
Seth, A., Bachmann, R.T., Boxall, J.B., Saul, A.J. and Edyvean, R. (2004). Characterisation of materials causing discolouration in potable water systems. Water Science and Technology, 49(2): 27-32.
Shapiro, H.M. (2003). Practical flow cytometry, fourth ed. Wiley-Liss, New York.
Siebel, E., Wang, Y., Egli, T. and Hammes, F. (2008). Correlations between total cell concentration, total adenosine tri-phosphate concentration and heterotrophic plate counts during microbial monitoring of drinking water. Drinking Water Engineering and Science, 1(1): 1-6.
Singh, I. and Mavinic, D.S. (1991). Significance of building and plumbing specifics on trace metal concentrations in drinking water. Can. J. Civil Eng., 18(6): 893-903.
Skadsen, J., Janke, R., Grayman, W., Samuels, W., Tenbroek, M., Steglitz, B. and Bahl, S. (2008). Distribution system on-line monitoring for detecting contamination and water quality changes. J. Amer. Water Works Assoc. 100(7): 81-94.
Skadsen, J., Reilley, B., Gupta, K., Fiske, P. and Moore, R. (2015). Nitrification control strategies: What is nitrification and how is it managed? Opflow, 41(1): 10-12.
Shurtz, K.M., Jones, S.C., Sowby, R.B., Hill, D.S. and Woodbury, D.K. (2017). Hydraulic modeling finds, fixes chlorine residual gaps. Opflow, 43(6): 28-30.
Smeets, P.W.M.H., Medema, G.J. and Van Dijk, J.C. (2009). The Dutch secret: How to provide safe drinking water without chlorine in the Netherlands. Drink. Water Eng. Sci., 2(1): 1-14.
Speight, V. (2010). Trade-offs between continuous and grab samples for water quality in distribution systems. In: Integrating water systems. Boxall & Maksimovic (eds). Taylor and Francis, London, UK. Pp. 447-451.
Speight, V. (2021). Personal communication. University of Sheffield, Department of Civil and Structural Engineering, Professor of Integrated Water Systems, Sheffield, UK.
Speight, V. and Khanal, N. (2009). Model calibration and current usage in practice. Urban Water J., 6(1): 23-28.
Steger, P. and Pierce, D. (2019). Optimal pump station operation is important, but it isn't easy. Opflow, 45(2): 14-16.
Stoddart, A. (2020). ATP dynamics in drinking water distribution systems. Proceedings of AWWA webinar: Investigating ATP analysis for infrastructure release for service. American Water Works Association, Denver, Colorado.
Strickhouser, A., Falkinham, J. and Edwards, M. (2006). The effects of nutrients and microbial re-growth during storage in domestic water heaters. Proceedings from the AWWA Annual Conference and Exhibit. American Water Works Association, Denver, Colorado.
Sutherns, T. (2019). What's happening underground? Finding leaks & transients in real-time year round. Presented at Ontario Water Works Association Annual Conference and Trade Show, Ottawa, Ontario, May 7.
Sutherns, T. (2020). Gaining visibility into the water distribution system: Predicting leaks + bursts. Presented at American Water Works Association webinar, November 3.
Tafuri, A.N. and Field, R.I. (2010). Aging water infrastructure. Presented at International Workshop on Sustainable Water Environment, Taipei, Taiwan, June 30 – July 1.
Tan, B., Ng, C., Nshimyimana, J.P., Loh, L.L., Gin, K.Y. and Thompson, J.R. (2015). Next-generation sequencing (NGS) for assessment of microbial water quality: Current progress, challenges, and future opportunities. Front. Microbiol., 6(SEP).
Teng, F., Guan, Y.T. and Zhu, W.P. (2008). Effect of biofilm on cast iron pipe corrosion in drinking water distribution system: Corrosion scales characterization and microbial community structure investigation. Corros. Sci., 50(10): 2816-2823.
Tolofari, D.L., Masters S.V., Bartrand, T., Hamilton, K.A., Haas, C.N., Olson, M., Summers, R.S., Rasheduzzaman, M., Young, A., Singh, R. and Gurian, P.L. (2020). Full factorial study of pipe characteristics, stagnation times, and water quality. AWWA Wat. Sci. 2(5), e1204.
Travaux publics et Services gouvernementaux Canada. (2013). IM 15161 – 2013 – Lutte contre la Legionella dans les systèmes mécaniques – Norme destinée aux propriétaires d'immeubles, aux professionnels de la conception et au personnel d'exploitation des bâtiments. Consultable en ligne à la page : https://www.tpsgc-pwgsc.gc.ca/biens-property/documents/legionella-fra.pdf
Uhl, W. and Schaule, G. (2004). Establishment of HPC(R2A) for regrowth control in non-chlorinated distribution systems. Int. J. Food Microbiol., 92(3): 317-325.
US EPA (2002a). Health risks from microbial growth and biofilms in drinking water distribution systems. Office of Ground Water and Drinking Water, Washington, DC.
US EPA (2002b). Finished water storage facilities. Office of Ground Water and Drinking Water, Washington, DC.
US EPA (2009). Distribution system water quality monitoring: Sensor technology evaluation methodology and results. A guide for sensor manufacturers and water utilities. EPA 600/R-09/076.
US EPA (2013). National primary drinking water standards: Revisions to the total coliform rule. Final rule. Fed. Regist., 78(30): 10269.
US EPA (2016a). Six-year review 3 technical support document for microbial contaminant regulations. Office of Water, Washington, DC. EPA 810-R-16-010. Consultable en ligne à la page : https://www.epa.gov/sites/production/files/2016-12/documents/810r16010.pdf.
US EPA (2016b). Technologies for Legionella control in premise plumbing systems: Scientific literature review. Office of Ground Water and Drinking Water, Washington, DC. EPA 810-R-16-001
US EPA (2018a). Online water quality monitoring in distribution systems for water quality surveillance and response systems. Office of Ground Water and Drinking Water, Washington, DC. EPA 817-B-18-001.
US EPA (2018b). EPANET: Application for modifying drinking water distribution systems. Consultable en ligne à la page : www.epa.gov/water-research/epanet
US EPA (2019). Free Chlorine Distribution System Influent Hold Study Protocol. Office of Ground Water and Drinking Water, Washington, DC. EPA 815-B-19-013.
Vaerewijck, M.J.M., Huys, G., Palomino, J.C., Swings, J., and Portaels, F. (2005). Mycobacteria in drinking water distribution systems: ecology and significance for human health. FEMS Microbiol. Rev., 29: 911-934.
van der Kooij, D. (1999). Potential for biofilm development in drinking water distribution systems. J Appl Microbiol., 85: 39S-44S.
van der Kooij, D. (2000). Biological stability: A multidimensional quality aspect of treated water. Water Air Soil Pollut., 123(1-4): 25-34.
van der Kooij, D. (2003). "Managing regrowth in drinking water distribution systems," in Heterotrophic Plate Counts and Drinking Water Safety, eds J. Bartman, J. Cotruvo, M. Exner, C. Fricker, and A. Glasmacher (London: IWA Publishing), 199-232.
van der Kooij, D. and van der Wielen, P.W.J.J. (2014). Microbial growth in drinking-water supplies: Problems, causes, control and research needs. IWA Publishing, London, UK.
van der Kooij, D., Vrouwenvelder, J.S. and Veenendaal, H.R. (2003). Elucidation and control of biofilm formation processes in water treatment and distribution using the unified biofilm approach. pp. 83-90.
van der Kooij, D., Martijn, B., Schaap, P.G., Hoogenboezem, W., Veenendaal, H.R. and van der Wielen, P.W.J.J. (2015). Improved biostability assessment of drinking water with a suite of test methods at a water supply treating eutrophic lake water. Water Res., 87: 347-355.
van der Wielen, P.W.J.J. and van der Kooij, D. (2010). Effect of water composition, distance and season on the adenosine triphosphate concentration in unchlorinated drinking water in the Netherlands. Water Res., 44(17): 4860-4867.
van Lieverloo, J.H.M., Hoogenboezem, W., Veenendaal, G. and van der Kooij, D. (2012). Variability of invertebrate abundance in drinking water distribution systems in the Netherland in relation to biostability and sediment volumes. Water Res., 46(16): 4918-4932.
Van Nevel, S., Koetzsch, S., Weilenmann, H., Boon, N. and Hammes, F. (2013). Routine bacterial analysis with automated flow cytometry. J. Microbiol. Methods, 94(2): 73-76.
Van Nevel, S., Koetzsch, S., Proctor, C.R., Besmer, M.D., Prest, E.I., Vrouwenvelder, J.S., Knezev, A., Boon, N. and Hammes, F. (2017). Flow cytometric bacterial cell counts challenge conventional heterotrophic plate counts for routine microbiological drinking water monitoring. Water Res., 113: 191-206.
Vierheilig, J., Savio, D., Farnleitner, A.H., Reischer, G.H., Ley, R.E., Mach, R.L., Farnleitner, A.H. and Reischer, G.H. (2015). Potential applications of next generation DNA sequencing of 16S rRNA gene amplicons in microbial water quality monitoring. Water Science and Technology, 72(11): 1962-1972.
Viñas, V., Halm, A. and Pettersson, T.J.R. (2019). Overview of microbial risks in water distribution networks and their health consequences: quantification, modelling, trends, and future implications. Can. J. Civ. Eng., 46(3): 149-159.
Vital, M., Stucki, D., Egli, T. and Hammes, F. (2010). Evaluating the growth potential of pathogenic bacteria in water. Appl. Environ. Microbiol., 76(19): 6477-6484.
Vital, M., Dignum, M., Magic-Knezev, A., Ross, P., Rietveld, L. and Hammes, F. (2012). Flow cytometry and adenosine tri-phosphate analysis: Alternative possibilities to evaluate major bacteriological changes in drinking water treatment and distribution systems. Water Res., 46(15): 4665-4676.
Vreeburg, J.H.G., Arsnio, A. and Leijssen, H. (2010). Origin and behavior of particles in drinking water transport networks. Anonymous pp. 453-458.
Wang, Y., Hammes, F., De Roy, K., Verstraete, W. and Boon, N. (2010). Past, present and future applications of flow cytometry in aquatic microbiology. Trends Biotechnol., 28(8): 416-424.
Wang, H., Hu, C., Hu, X., Yang, M. and Qu, J. (2012). Effects of disinfectant and biofilm on the corrosion of cast iron pipes in a reclaimed water distribution system. Water Res., 46(4): 1070-8.
Wang, Z., Choi, O. and Seo, Y. (2013). Relative contribution of biomolecules in bacterial extracellular polymeric substances to disinfection byproduct formation. Environ. Sci. Technol., 47(17): 9764-9773.
Wang, H., Masters, S., Edwards, M.A., Falkinham, J.O. and Pruden, A. (2014a). Effect of disinfectant, water age, and pipe materials on bacterial and eukaryotic community structure in drinking water biofilm. Environ. Sci. Technol., 48(3): 1426-1435.
Wang, H., Proctor, C.R., Edwards, M.A., Pryor, M., Domingo, J.W.S., Ryu, H., Camper, A.K., Olson, A. and Pruden, A. (2014b). Microbial community response to chlorine conversion in a chloraminated drinking water distribution system. Environ. Sci. Technol., 48(18): 10624-10633.
Wang, H., Bédard, E., Prévost, M., Camper, A.K., Hill, V.R. and Pruden, A. (2017). Methodological approaches for monitoring opportunistic pathogens in premise plumbing: A review. Water Res., 117: 68-86.
Warnecke, M. (2006). Cryptosporidium oocyst interactions with drinking water pipe biofilms. Cooperative Research Center for Water Quality and Treatment, Research report 5, Adelaide, AUS.
Whalen, P.A., Whalen, P.J., and Cairns, J.E. (2006). ATP monitoring technology for microbial growth control in potable water systems. In Proceedings of the Conference on Optics and Photonics in Global Homeland Security II, Kissimmee, FL, May 9, Proceedings of SPIE, 6203: 2030N.
Whalen, P.A., Tracey, D.R. and Duguay, J. (2018) Chapter 8: Adenosine triphosphate (ATP) measurement technology. Microbiological Sensors for the Drinking Water Industry, Torben Lund Skovhus and Bo Højris (eds.).
WHO (2003). Heterotrophic plate counts and drinking-water safety: The significance of HPCs for water quality and human health. Published on behalf of the World Health Organization by IWA Pub, London.
WHO (2011a). Guidelines for drinking-water quality. Fourth edition. World Health Organization, Geneva, Switzerland. Consultable en ligne à la page : https://www.who.int/publications/i/item/9789241549950
WHO (2011b). Water safety in buildings. WHO Press. Geneva, Switzerland. Consultable en ligne à la page : https://www.who.int/water_sanitation_health/publications/2011/9789241548106/en/
WHO (2014). Water safety in distribution systems. Cunliffe, D. (ed.). World Health Organization, Geneva, Switzerland. Consultable en ligne à la page : https://www.who.int/water_sanitation_health/publications/water-safety-in-distribution-system/en/
Wilczak, A. (2006). Nitrification in drinking water distribution systems. In: Fundamentals and control of nitrification in chloraminated drinking water distribution systems. Manual of water supply practices – M56. Nitrification in drinking water distribution systems. 1st edition. American Water Works Association, Denver, Colorado, pp. 21-48.
Wilczak, A., Jacangelo, J.G., Marcinko, J.P., Odell, L.H., Kirmeyer, G.J. and Wolfe, R.L. (1996). Occurrence of nitrification in chloraminated distribution systems. J.Am. Water Works Assoc., 88(7): 74-85.
Wingender, J. and Flemming, H. (2004). Contamination potential of drinking water distribution network biofilms. Water Sci. Technol., 49(11-12): 277-286.
Wingender, J. and Flemming, H. (2011). Biofilms in drinking water and their role as reservoir for pathogens. Int. J. Hyg. Environ. Health, 214(6): 417-423.
Wingender J., Neu T.R. and Flemming H-C. (1999). What are Bacterial Extracellular Polymeric Substances? Chapter 1 in: Microbial extracellular polymeric substances. Wingender J., Neu T.R., Flemming H-C. (eds). Springer, Berlin, Heidelberg.
WRF (2017). Distribution system management: Understanding and controlling biofilms. Fact sheet, updated July 2017. Consultable en ligne à la page : http://www.waterrf.org/knowledge/distribution-system-management/FactSheets/DistributionSystemMgmt_Biofilms_FactSheet.pdf
Yang, J., LeChevallier, M.W., Teunis, P.F.M. and Xu, M. (2011). Managing risks from virus intrusion into water distribution systems due to pressure transients. J. Water Health, 9(2): 291-305.
Yoder, J., Roberts, V., Craun, G.F., Hill, V., Hicks, L.A., Alexander, N.T. and Radke, V. (2008). Surveillance for Waterborne Disease Outbreaks Associated With Drinking Water and Water Not Intended for Drinking – United States 2005-2006. Morb. Mortal. Wkly. Rep., 57:9:39.
Zacheus, O. M.,Lehtola, M.J.,Korhonen, L.K., and Martikainen, P.J. (2001). Soft deposits, the key site for microbial growth in drinking water distribution networks. Water Res. 35, 1757-1765.
Zahran, S., McElmurry, S.P., Kilgore, P.E., Mushinski, D., Press, J., Love, N.G., Sadler, R.C. and Swanson, M.S. (2018). Assessment of the Legionnaires' disease outbreak in Flint, Michigan. Proc. Natl. Acad. Sci. U. S. A., 115(8): E1730-E1739.
Zhang, Y., Oh, S. and Liu, W.T. (2017). Impact of drinking water treatment and distribution on the microbiome continuum: An ecological disturbance's perspective. Environ. Microbiol., 19(8): 3163-3174.
Annexe A.
Liste des acronymes
- ADN
- Acide désoxyribonucléique
- ARN
- Acide ribonucléique
- ARNr
- acide ribonucléique ribosomique
- ASTM
- ASTM International
- ATP
- Adénosine triphosphate
- AWWA
- American Water Works Association
- cATP
- Adénosine triphosphate cellulaire
- CMF
- Cytométrie en flux
- E. coli
- Escherichia coli
- É.-U.
- États-Unis
- EQRM
- Évaluation quantitative des risques microbiologiques
- MOB
- Matière organique biodégradable
- NPBH
- Numération sur plaque des bactéries hétérotrophes
- NRC
- National Research Council
- OMS
- Organisation mondiale de la Santé
- PVC
- Polychlorure de vinyle
- q
- Quantitatif/quantitative
- PCR
- Réaction en chaîne de la polymérase
- SPE
- Substances polymères extracellulaires
- US CDC
- United States Centers for Disease Control and Prevention
- US EPA
- United States Environmental Protection Agency
Annexe B.
| Date | Lieu, pays | Estimation du nombre de cas (confirmés) | Population desservie | Agent responsable | Causes possibles |
|---|---|---|---|---|---|
| Oct. 1980AppB Note b | Grums et Vålberg, Vårmland, Suède | 2 000 (221) | ~15 000 | Campylobacter jejuni | Raccordements croisés avec le réseau de l'usine; entrée d'eau de rivière non traitée dans le réseau de distribution |
| De déc. 1989 à janv. 1990AppB Note b | Cabool, Missouri, É.-U. | 243 4 décès | ~2 100 | E. coli O157:H7 | Infiltration d'eaux usées pendant la réparation des conduites principales ou le remplacement des compteurs d'eau |
| De nov. à déc. 1993AppB Note b | Gideon, Missouri, É.-U. | 650 (31) 7 décès | ~1 100 | Salmonella typhimurium | Contamination soupçonnée des réservoirs de stockage par des excréments d'oiseaux; entrée de l'eau des réservoirs dans le réseau pendant le rinçage du système |
| 1995 | Freuchie, Fife, Écosse | 633 | 1 100 | E. coli O157:H7 | Raccordements croisés avec une entreprise de transformation de légumes; entrée d'eau de ruisseau non traitée dans le réseau de distribution |
| 2000 | Strasbourg, France | 53 | 60 000 | Inconnu (symptômes de gastro-entérite) | Réparation de conduites principales dans le réseau |
| 2000 | Bari, Italie | 344 | 1 000 | Norovirus | Bris dans la conduite de branchement au réservoir aux fins de l'approvisionnement du public |
| 2000 | Belfast, Royaume-Uni | 117 | Inconnu | Cryptosporidium | Infiltration d'eaux d'égout brutes provenant d'une fosse septique dans le réseau de distribution d'eau |
| 2000 | South Wales, Royaume-Uni | 281 | Inconnu | Campylobacter | Infiltration d'eau de surface contaminée par des déchets agricoles dans le réservoir d'eau potable suivant de fortes pluies |
| 2000 | Ohio, É.-U. | 29 | Inconnu | E. coli | Siphonnage possible en provenance d'une grange pour animaux |
| 2001 | Dracy-le-Fort, France | 563 | 1 100 | Cryptosporidium, rotavirus, Campylobacter et E. coli | Contamination du réseau de distribution par des eaux usées, en amont de la ville |
| 2001 | Lleida, Espagne | 96 | 293 | Norovirus | Contamination du réservoir en raison d'un manque d'entretien et de lacunes structurelles |
| 2001 | Utrecht, Pays-Bas | 37 | 1 866 | Norovirus | Branchement du réseau de distribution d'eau potable au système d'eaux usées pendant des travaux d'entretien; raccordement croisé non éliminé |
| 2001 | Belfast, Royaume-Uni | 230 | Inconnu | Cryptosporidium | Entrée d'eaux usées dans l'approvisionnement en eau potable en raison d'un drain obstrué |
| 2002 | Vicence, Italie | 670 | 3 006 | Inconnu (symptômes de gastro-entérite) | Entrée d'eau de rivière non traitée dans l'aqueduc de la ville en raison d'un tuyau d'égout brisé |
| 2002 | Suisse | 125 | Inconnu | Norovirus | Contamination fécale due à une fuite d'eaux usées |
| 2004 | Ohio, É.-U. | 1 450 | Inconnu | Campylobacter, norovirus et Giardia | Défaillance non précisée du réseau de distribution en lien avec de l'eau souterraine non traitée |
| 2007 | Køge, Danemark | 140 | 5 802 | Campylobacter, E. coli et norovirus | Entrée d'eaux usées partiellement filtrées dans le réseau de distribution en raison d'une erreur technique et humaine à l'usine de traitement des eaux usées |
| 2007 | Nokia, Finlande | 8 453 2 décès | 30 016 | Pathogènes multiples Norovirus, Campylobacter et Giardia | Contamination du réseau d'eau potable par des effluents d'eaux usées traitées en raison d'un raccordement croisé |
| 2008 | Zurich (Adliswil), Suisse | 126 | 2 000 | Pathogènes multiples Campylobacter et norovirus | Entrée d'eau de lavage à haute pression en provenance de l'usine de traitement des eaux usées dans le réseau de distribution en raison d'un raccordement croisé |
| 2008 | Northampton, Royaume-Uni | > 422 | 250 000 | Cryptosporidium | Lapin mort trouvé dans un réservoir de stockage |
| 2008 | Alamosa, Colorado, É.-U. | 1 300 1 décès | Inconnu | Salmonella | Possible contamination animale d'un réseau de stockage |
| 2009 | Utah, É.-U. | 8 | Inconnu | Giardia | Refoulement causé par un raccordement croisé entre des sources d'eau potable et non potable |
| 2010 | Køge, Danemark | 409 | 20 000 | Campylobacter | Contamination du réseau d'approvisionnement central en eau potable par un mécanisme inconnu |
| 2010 | Öland, Suède | 200 | Inconnu | Norovirus | Entrée d'eau de puits non traitée dans le réseau de distribution |
| 2010 | Saratoga Springs, Utah, É.-U. | 628 | Inconnu | Campylobacter | Refoulement causé par un raccordement croisé entre des sources d'eau potable et non potable |
| 2012 | Kilkis, Grèce | 79 | 1 538 | Norovirus | Augmentation de la charge microbienne due à des chutes de neige et des ruissellements importants, à de basses températures et à la non-utilisation de l'approvisionnement public en eau de l'école pendant 15 jours |
| 2012 | Kalundborg, Danemark | 187 | Inconnu | Norovirus | Contamination par un tuyau d'égout en raison d'une baisse de pression pendant des travaux de réparation |
| 2012 | Vuorela, Finlande | 800 | 2 931 | Sapovirus et E. coli | Bris accidentel de la conduite principale pendant des travaux de construction routière; le rinçage effectué après la réparation du bris ne s'est pas avéré suffisant et le réservoir de stockage a été contaminé |
| 2013 | Guipuzko, Espagne | 238 | 650 | Norovirus et rotavirus | Raccordement croisé entre les réserves d'eau potable et l'eau industrielle provenant d'une rivière |
|
|||||
Note de bas de page
- Note de bas de page 1
-
Un ensemble de capteurs, d'instruments et d'autres appareils interconnectés, une structure de base de données et des analyses de données qui fournissent l'état en temps réel des opérations et permettent de contrôler ces dernières.