Recommandations pour la qualité de l'eau potable au Canada : document technique – cadmium

Télécharger le format de rechange
(Format PDF, 982 Ko, 55 pages)
Organisation : Santé Canada
Type : Recommandation
Publiée : 2020-07-10
Cat. : H144-13/17-2020F-PDF
ISBN : 978-0-660-34297-9
Pub. : 190621
Sujets connexes
Table des matières
- Partie I. Vue d’ensemble et application
- Partie II. Facteurs scientifiques et techniques
- 5.0 Exposition
- 6.0 Méthodes d’analyse
- 7.0 Considérations liées aux techniques de traitement et aux réseaux de distribution
- 7.1 Échelle municipale
- 7.2 Traitement résidentiel
- 8.0 Cinétique et métabolisme
- 9.0 Effets sur la santé
- 9.2 Effets chez les animaux de laboratoire
- 9.3 Mode d’action
- 10.0 Classification et évaluation
- Justification
- Références
- Annexe A : Liste des acronymes
Partie I. Vue d’ensemble et application
1.0 Recommandation
Une concentration maximale acceptable (CMA) de 0,007 mg/L (7 µg/L) est établie à l’égard du cadmium total dans l’eau potable mesurée dans un échantillon d'eau prélevé au robinet.
2.0 Sommaire
Ce document technique a été élaboré en collaboration avec le Comité fédéral-provincial-territorial sur l’eau potable et tient compte de tous les renseignements disponibles sur le cadmium.
Le cadmium est un métal qui est présent dans l’environnement sous sa forme élémentaire ou dans différents sels. Il est souvent associé aux minerais de plomb, de cuivre et de zinc. Le cadmium peut pénétrer dans les sources d’eau potable de façon naturelle (lessivage du sol), du fait de l’activité humaine (sous forme de sous-produit de raffinage ou en raison de son utilisation dans des applications technologiques) ou par lessivage de certains types de conduites et de composants de puits.
Le présent document technique contient un examen et une évaluation de tous les risques pour la santé connus qui sont associés à la présence du cadmium dans l’eau potable. On y examine les études, les évaluations et les approches nouvelles ainsi que les technologies de traitement disponibles. À la lumière de cet examen, on a établi une CMA de 0,007 mg/L (7 µg/L) pour le cadmium dans l’eau potable.
2.1 Effets sur la santé
Bien qu’on considère que l’exposition au cadmium par inhalation est associée à des effets cancérogènes chez les humains, une exposition par l’eau potable ne suscite pas les mêmes craintes. Une exposition par voie orale à des concentrations élevées de cadmium pendant une période prolongée peut avoir des effets nocifs sur les reins ou les os. La recommandation est fondée sur les effets nocifs sur les reins bien caractérisés qui ont été observés après une exposition à de faibles concentrations.
2.2 Exposition
Les Canadiens peuvent être exposés au cadmium par les aliments, l’eau, les produits de consommation, le sol et l’air. Les aliments sont la principale source d’exposition au cadmium pour les Canadiens, sauf les fumeurs et les personnes qui sont exposées à cette substance dans leur milieu de travail. L’exposition au cadmium dans l’eau potable est principalement attribuable au lessivage de l’acier /fer galvanisé utilisé dans les conduites de branchement, les tuyaux et les composants de puits et, dans une moindre mesure, au lessivage des raccords en laiton et des revêtements en mortier de ciment. Les conduites en acier galvanisé étaient largement installées dans les habitations et les bâtiments avant les années 1960, mais le Code national de la plomberie du Canada a permis leur utilisation jusqu’en 1980. L’acier galvanisé était par ailleurs utilisé dans la production de composants de puits, comme les tubages et les colonnes descendantes. Les concentrations de cadmium dans l’eau de la source d’approvisionnement sont généralement très basses, et on s’attend aussi à ce que l’exposition au cadmium par l’eau potable soit également faible. Il ne devrait pas y avoir d’absorption de cadmium par l’eau potable par contact cutané ou par inhalation.
2.3 Considérations relatives à l’analyse et au traitement
Pour établir une recommandation sur la qualité de l’eau potable, il faut tenir compte de la capacité de mesurer le contaminant. Il existe plusieurs méthodes qui permettent de mesurer de façon fiable le cadmium total dans l’eau potable, à des concentrations inférieures à la CMA.
La concentration de cadmium dans l’eau de la source d’approvisionnement est généralement très faible. Même s’il existe des technologies capables d’éliminer efficacement le cadmium à l’usine de traitement, le traitement municipal ne constitue généralement pas une stratégie efficace. La stratégie qui consiste à réduire l’exposition au cadmium par l’eau potable vise le plus souvent à l’enlèvement des composants en acier galvanisé et/ou à prévenir la corrosion en ajustant la qualité de l’eau ou en utilisant des inhibiteurs de corrosion. Étant donné que la présence de cadmium est corrélée à des concentrations élevées de plomb, les mesures de contrôle de la corrosion devraient également porter sur le plomb.
Comme la présence de cadmium dans l’eau potable est principalement attribuable au lessivage de l’acier galvanisé utilisé dans la fabrication des conduites de branchement, des tuyaux et des composants de puits, les dispositifs de traitement de l’eau potable constituent une option efficace à l’échelle résidentielle, même si leur utilisation ne doit pas être considérée comme une solution permanente. Il existe de nombreux dispositifs de traitement à usage résidentiel certifiés capables de faire passer la concentration de cadmium de l’eau potable sous la CMA.
2.4 Considérations internationales
Les recommandations, normes et/ou directives relatives à la qualité de l’eau potable établies par des organisations canadiennes et étrangères peuvent varier en fonction de la date à laquelle remonte l’évaluation sur laquelle elles sont fondées, et en fonction des différences relatives aux politiques et aux démarches appliquées, y compris en ce qui concerne le choix de l’étude principale ou les taux de consommation, les poids corporels et les facteurs d’attribution liés à la source employés.
Divers organismes ont établi des valeurs pour le cadmium dans l’eau potable. La recommandation établie par Santé Canada est comparable aux valeurs établies dans d’autres pays et organismes. L’L’Environmental Protection Agency des États-Unis (U.S. EPA) a fixé un maximum contaminant level (niveau maximal de contaminant) de 0,005 mg/L, la recommandation pour l’eau potable de l’Australian National Health and Medical Research Council est de 0,002 mg/L, l’Organisation mondiale de la santé (OMS) a une recommandation de 0,003 mg/L, et la directive de l’Union européenne comporte une valeur paramétrique de 0,005 mg/L pour le cadmium dans l’eau potable.
3.0 Application de la recommandation
Remarque : Il est conseillé de demander des indications précises concernant la mise en œuvre des recommandations pour l’eau potable auprès des autorités compétentes de la province ou du territoire visé.
Les principales sources de cadmium dans les réseaux de distribution et les installations de plomberie résidentielles comprennent la détérioration des tuyaux en acier galvanisé et, dans une moindre mesure, le lessivage des matériaux à base de laiton et des revêtements en mortier de ciment. Les tuyaux galvanisés peuvent libérer du cadmium, ce qui peut donner lieu à des concentrations plus élevées au robinet du consommateur qu’à l’usine de traitement ou que dans le réseau de distribution. La corrosivité de l’eau, la quantité de cadmium présent dans les composants de l’installation de plomberie, la stagnation de l’eau (profil d’utilisation) et le protocole d’échantillonnage ont tous une incidence sur les concentrations de cadmium mesurées dans l’eau potable. Les facteurs de qualité de l’eau qui ont le plus d’effets sur la corrosion libérant le cadmium sont le pH et l’alcalinité.
Étant donné que les concentrations de cadmium au robinet du consommateur peuvent être plus élevées que celles observées à l’usine de traitement ou dans le réseau de distribution, les stratégies visant à réduire l’exposition au cadmium devront être axées sur le contrôle de la corrosion dans les réseaux de distribution et les installations de plomberie et sur l’élimination des conduites et des composants en acier galvanisé utilisés dans ces systèmes. L’analyse du cadmium devrait donc faire partie de tout programme de surveillance et de contrôle de la corrosion. Bien qu’il soit reconnu que la plomberie des habitations ne relève pas du service public, la plupart des recommandations établies sont conçues de manière à s’appliquer au niveau du robinet du consommateur. La surveillance du cadmium devrait être axée sur les zones dont on sait ou soupçonne qu’elles comportent des conduites de branchement, des tuyaux ou des composants en acier galvanisé et comprendre les secteurs qui reçoivent une eau potentiellement corrosive (p. ex., à pH faible) et qui sont desservis par des réseaux successifs (réseau public d’alimentation en eau dont l’eau potable est fournie par un autre réseau public).
Un dépassement de la CMA doit faire l’objet d’une enquête, et des correctifs appropriés doivent être apportés au besoin. Si elles sont nécessaires, les mesures prises doivent reposer sur la cause de la concentration élevée de cadmium de sorte qu’elle n’engendre pas de conséquences imprévues (p. ex. modification de la qualité de l’eau potable). Les correctifs peuvent comprendre, sans toutefois s’y limiter, un ré échantillonnage, l’enlèvement des composants en acier galvanisé, l’éducation du public et des mesures de contrôle de la corrosion qui traitent aussi le relargage du plomb.
Les dispositifs résidentiels privés de traitement de l’eau potable sont un moyen possible de réduire les concentrations de cadmium dans l’eau potable du robinet. Il est probable que les épisodes de coloration soient accompagnés d’un relargage de contaminants accumulés, dont le cadmium, parce que le cadmium dissous est adsorbé sur le fer dans l’acier et sur les dépôts de manganèse présents dans les réseaux de distribution et les installations de plomberie. Il ne faut donc pas considérer de tels événements uniquement comme un problème d’ordre esthétique, mais procéder à un échantillonnage en vue de détecter la présence de métaux et, le cas échéant, effectuer des travaux d’entretien du réseau de distribution.
3.1 Surveillance
Les protocoles d’échantillonnage varient en fonction de l’objectif souhaité (p. ex. détection des sources de cadmium, limitation de la corrosion, évaluation de la conformité, estimation de l’exposition au cadmium). Comme la surveillance du cadmium au robinet peut se faire au moyen de différents protocoles d’échantillonnage, il est important que le protocole choisi permette d’atteindre l’objectif fixé. Les conduites en acier galvanisé peuvent être à la fois une source de cadmium et de plomb, surtout pour les réseaux sans programme de contrôle de la corrosion. Ainsi, dans les secteurs ou les zones où sont installées des conduites en acier galvanisé, les sites et protocoles d’échantillonnage pour le cadmium devraient être les mêmes que pour le plomb. Veuillez consulter le document technique sur le plomb pour obtenir une information détaillée sur les sites et les protocoles d’échantillonnage (Santé Canada, 2019).
L’objectif des protocoles d’échantillonnage présentés dans ce document est de surveiller l’exposition type d’une collectivité au cadmium total afin de déterminer s’il y a lieu de craindre des effets sur la santé humaine. Des vérifications de conformité devraient être effectuées au robinet des consommateurs et aux endroits où la présence de conduites ou de composants en acier galvanisé est connue ou probable. Elles devraient comprendre les secteurs ou les zones (régions géographiques dans lesquelles la qualité de l’eau potable est considérée à peu près uniforme) qui reçoivent une eau potable potentiellement corrosive (p. ex., pH ou alcalinité faible). Plus particulièrement, il faudrait accorder la priorité aux endroits desservis par des conduites de branchement ou des installations de plomberie en acier galvanisé ou aux endroits où le pH de l’alimentation en eau est inférieur à 7.
L’échantillonnage devrait être effectué au moins une fois par année, le nombre d’emplacements à surveiller étant fonction de la taille du réseau d’eau potable. La fréquence d’échantillonnage peut être réduite si aucun test n’a échoué pendant une période déterminée par l’organisme de réglementation compétent ou si les conditions de qualité de l’eau ne favorisent pas la corrosion libérant du cadmium.
Si du cadmium est présent dans la source d’approvisionnement en eau et un traitement est effectué, il est recommandé de procéder à une surveillance annuelle de l’eau traitée. Les échantillons devraient être prélevés après le traitement, avant la distribution (c.-à-d. au point d’entrée dans le réseau de distribution). Il faudrait recueillir des échantillons d’eau traitée et les jumeler à ceux de la source d’eau afin de confirmer l’efficacité du traitement.
Partie II. Facteurs scientifiques et techniques
4.0 Propriétés, utilisation et sources dans l’environnement
Le cadmium (Cd), (numéro de CAS 7440-43-9) est un métal mou blanc-argenté dont l’état de valence est de +2. Il est souvent associé aux minerais de plomb, de cuivre et de zinc et se présente sous forme de différents sels, dont bon nombre sont solubles dans l’eau (notamment le chlorure de cadmium et le sulfate de cadmium). Le cadmium existe aussi sous sa forme élémentaire (ATSDR, 2012). Les composés de cadmium sont présents à l’état naturel dans la croûte terrestre (0,1 à 0,5 ppm). Les propriétés physicochimiques de ces composés sont présentées au tableau 1.
| Substance |
Formule chimique | Description physique | Masse moléculaire (g/mol) | Pression de vapeur (mm Hg) | Solubilité dans l’eau à 20 °C |
|---|---|---|---|---|---|
| Cadmium | Cd | Métal blanc-argenté | 112,41 | 7,5 × 10-3 à 257 °C | Insoluble |
| Carbonate de cadmium | CdCO3 | Poudre ou feuillets blancs | 172,42 | Pas de données | Insoluble |
| Chlorure de cadmium | CdCl2 | Cristaux blancs | 183,32 | 10 à 656 °C | Soluble |
| Oxyde de cadmium | CdO | Poudre ou cristaux brun foncé | 128,41 | 1 à 1000 °C | Insoluble |
| Cadmium sulphate | CdSO4 | Cristaux incolores | 208,47 | Pas de données | Soluble |
| Sulfate de cadmium | CdS | Jaune clair, orange ou brun; structure cubique ou hexagonale | 144,48 | Pas de données | Soluble à 1,3 mg/L à 18 °C |
Le cadmium est souvent un sous-produit du raffinage et est utilisé dans de nombreuses applications technologiques. Il est considéré comme un élément non essentiel et n’a pas de fonction biologique connue (AESA, 2009b, Santé Canada, 2018a).
4.1 Devenir dans l’environnement
Le cadmium peut être adsorbé sur les particules de sol, mais dans une mesure moindre que d’autres métaux lourds (Jalali et Moradi, 2013; HSDB, 2017). L’adsorption sur des particules de sol augmente avec la teneur en matière organique et le pH, et un lessivage dans l’eau souterraine est plus fréquent dans des sols sableux acides. La présence de cations bivalents dans le sol aura aussi une influence positive sur l’adsorption du cadmium, en offrant des possibilités d’échange de cations et en favorisant la formation de complexes de cadmium.
Le cadmium qui pénètre dans l’eau à partir de sources industrielles sera adsorbé sur la matière particulaire et se déposera. Le cadmium est présent dans l’eau sous diverses formes, notamment des complexes métalliques inorganiques et organiques (Tableau 1). Dans l’eau douce, des hydrates et la forme ionique du cadmium sont les formes prédominantes, et on peut prédire que les espèces de composés de cadmium seront le Cd+2, le Cd(OH)+, le Cd(HCO3)+ et le Cd(OH)2, compte tenu des constantes de stabilité (Section 1, Figure 1) (HSDB, 2017).
5.0 Exposure
Un résumé de la contribution des diverses sources d’exposition est présenté ci-dessous. Dans l’ensemble, les aliments constituent la principale source d’exposition totale au cadmium, et l’eau potable semble contribuer de façon peu importante à l’exposition totale.
5.1 Eau
Les concentrations de cadmium dans l’eau potable peuvent varier considérablement, selon les formations géologiques qui avoisinent la source d’eau et certains facteurs environnementaux qui influent sur la mobilité du cadmium. Du cadmium peut être libéré dans l’eau par les processus naturels d’altération, les rejets des installations industrielles ou les usines de traitement des eaux usées, les dépôts atmosphériques, le lessivage des décharges ou du sol ou les engrais phosphatés (ATSDR, 2012). Les matériaux utilisés dans les installations de plomberie résidentielles et les réseaux de distribution d’eau potable peuvent constituer une autre source d’exposition au cadmium. Les principales sources de cadmium comprennent la détérioration des tuyaux et des composants des puits en acier galvanisé et, dans une moindre mesure, le lessivage des matériaux à base de laiton et des revêtements en mortier de ciment. Un résumé des données canadiennes sur le cadmium dans l’eau potable ou la source d’eau (eau brute) est présenté au tableau 2; le nombre d’échantillons dont les concentrations se situaient au-dessus de la limite de détection (LD), les valeurs minimales et maximales mesurées et la moyenne et la médiane des valeurs supérieures à la LD sont également indiqués. Aucun échantillon n'a été fourni pour le Nunavut et les Territoires du Nord-Ouest.
| Province ou territoire | Type d’eau | % d’échantillons au-dessus de la LD (nbre total d’échantillons) | Min.–max. (µg/L) | Moyenne (médiane) des valeurs supérieures à la LD (µg/L) | Années d’échantillonnage |
|---|---|---|---|---|---|
| Terre-Neuve-et-LabradorNote de bas de tableau 2 1 | Robinet | 3,5 (4 858) | 0,01–0,35 | 0,034 (0,02)) | 2011–2016 |
| Terre-Neuve-et-LabradorNote de bas de tableau 2 2 | Source | 3,5 (782) | 0,01–3,5 | 0,40 (0,02) | 2011–2016 |
| Nouvelle-ÉcosseNote de bas de tableau 2 3 | Eau brute | 16,0 (489) | 0,01–4,0 | 0,19 (0,02) | 2002–2016 |
| Nouvelle-ÉcosseNote de bas de tableau 2 4 | Eau traitée, distribuée | 12,0 (595) | 0,01–0,54 | 0,06 (0,02) | 2002–2016 |
| Nouveau-BrunswickNote de bas de tableau 2 5 | Eau brute | 13,0 (2 551) | 0,01–2,9 | 0,12 (0,02) | 2007–2017 |
| Nouveau-BrunswickNote de bas de tableau 2 6 | Eau traitée, distribuée | 3,6 (3 002) | 0,01–3,5 | 0,16 (0,03) | 2007–2017 |
| QuébecNote de bas de tableau 2 6 | Eau distribuée | 4,2 (14 483) | 0,002–3,4 | 0,20 (0,01) | 2013–2017 |
| OntarioNote de bas de tableau 2 7 | Eau brute | 14,0 (1 132) | 0,003–5,0 | 0,09 (0,01) | 2013-2019 |
| OntarioNote de bas de tableau 2 8 | Eau traitée, distribuée | 15,0 (8 251) | 0,003–10,0 | 0,16 (0,10) | 2013-2019 |
| ManitobaNote de bas de tableau 2 9 | Eau brute | 29,0 (1 495) | 0,01–1,0 | 0,04 (0,02) | 2009-2017 |
| ManitobaNote de bas de tableau 2 10 | Eau traitée, distribuée | 19,0 (2 071) | 0,01–1,0 | 0,04 (0,02) | 2009-2017 |
| SaskatchewanNote de bas de tableau 2 11 | Eau brute, traitée, distribuée | 14,0 (4 083) | 0,01–5,9 | 0,07 (0,02) | 2007–2017 |
| AlbertaNote de bas de tableau 2 12 | Eau brute | 19,0 (273) | 0, 1–2,0 | 1,2 (1,00) | 2007–2017 |
| AlbertaNote de bas de tableau 2 13 | Réseau de distribution | 2,0 (807) | 0,01–0,3 | 0,03 (0,01) | 2007–2017 |
| AlbertaNote de bas de tableau 2 14 | Puits | 0,30 (1 686) | 1,0–31 | 13,4 (15,0) | 2012–2017 |
| BC Interior HealthNote de bas de tableau 2 15 | Eau brute et traitée | 97,0 (1 180) | 0,005–100,0 | 0,56 (0,02) | 2007–2017 |
| BC Northern HealthNote de bas de tableau 2 16 | Eau brute | 39,0 (1 067) | 0,005–5,0 | 0,06 (0,02) | 2007–2017 |
| YukonNote de bas de tableau 2 17 | Eau brute et traitée | 32,0 (370) | 0,003–3,41 | 0,08 (0,03) | 2009–2017 |
| l’Île-du-Prince-ÉdouardNote de bas de tableau 2 18 | Eau du robinet et distribuée | 0,3 (2 917) | 2,0-6,0 | 3,4 (3,0) | 2013-2015 |
| CanadaNote de bas de tableau 2 19 | Eau brute | 85,6 (18 998) | 0,001–95,4 | 0,07 (0,01) | 2000–2016 |
|
|||||
5.2 Aliments
Selon l’évaluation détaillée des risques pour la santé d’une exposition par voie alimentaire au cadmium (Santé Canada, 2018a), les aliments sont la principale source d’exposition au cadmium pour la population générale non fumeuse au Canada. On estime que le cadmium dans les aliments représente la plus grande partie de l’exposition totale chez les Canadiens, à l’exception des fumeurs et des personnes qui sont exposées dans leur milieu de travail. Les légumes-feuilles, les pommes de terre, les céréales et les grains, les noix et les légumineuses sont tous des sources alimentaires importantes de cadmium. La consommation d’animaux terrestres et de crustacés peut aussi constituer une source d’exposition au cadmium (EFSA, 2009b; JECFA, 2011). On a estimé l’apport alimentaire du cadmium des Canadiens (Santé Canada, 2017a) à partir de diverses sources de données sur la présence de cadmium dans les aliments vendus au Canada entre 2009 et 2015. L’exposition alimentaire médiane estimative au cadmium variait de 0,30 µg/kg de poids corporel (p.c.) par jour, chez les mâles âgés de 51 à plus de 71 ans, à 0,83 µg/kg p.c. par jour, chez les sujets des deux sexes âgés de 4 à 8 ans.
5.3 Air
L’exposition non professionnelle au cadmium par l’air est généralement faible. Selon les données du programme du Réseau national de surveillance de la pollution atmosphérique, les concentrations de cadmium dans l’air extérieur ambiant (mesurés à partir d’échantillons de particules fines 2,5) se situaient entre 0,02 ng/m3 et 14,89 ng/m3 (médiane de 0,04 ng/m3) pour sept stations de surveillance au Canada (Abbotsford, Edmonton, Halifax, Ottawa, Saint John, Vancouver et Windsor) entre 2012 et 2016 (Environnement et Changement climatique Canada, 2017; Santé Canada, 2017b). Les valeurs de la qualité de l’air intérieur mesurées à Edmonton variaient entre 0,005 ng/m3 et 1,30 ng/m3 (médiane de 0,03 ng/m3), selon l’Étude sur la qualité de l’air intérieur à Edmonton (Bari et coll., 2015; Santé Canada, 2017b).
Au Canada, les émissions atmosphériques de cadmium attribuables à l’activité humaine totalisaient 7,6 tonnes en 2016. En 2014, les principales sources de cadmium atmosphérique au pays étaient les fonderies et affineries de métaux non ferreux, qui représentent au total 60 % des émissions. Venaient ensuite d’autres industries (16 %) et le combustible utilisé pour la production d’électricité et le chauffage (14 %) (Environnement et Changement climatique Canada, 2016).
5.4 Produits de consommation
Les fumeurs sont exposés à des concentrations très élevées de cadmium provenant du tabac, et la fumée de tabac est reconnue pour augmenter la charge corporelle de cadmium. On a estimé que les concentrations sanguines de cadmium sont de 4 à 5 fois plus élevés chez les fumeurs que chez les non-fumeurs (Jarup et coll., 1998; Adams et Newcomb, 2014). De nombreuses expositions professionnelles par inhalation ont été signalées, car le cadmium est utilisé dans le secteur industriel, notamment les fonderies et la production d’alliages et de composés de cadmium (ATSDR, 2016; HSDB, 2017). Le cadmium entre aussi dans la fabrication des pigments, des placages de cadmium, du chlorure de polyvinyle (PVC) et des piles (HSDB, 2017). Le Canada a élaboré un règlement pour le cadmium dans les bijoux pour enfants, compte tenu de l’exposition potentielle des enfants par ingestion de bijoux contenant du cadmium (LCSPC, 2018).
5.5 Sol
Les concentrations de cadmium dans le sol sont généralement faibles, mais elles varient selon la géologie et le type de sol. Les concentrations de cadmium dans le sol canadien se situent entre une valeur inférieure à la LD et 8,1 mg/kg (CCME, 1996), selon l’activité anthropique et la composition géologique. Les 98e centiles de cadmium dans les sols de surface non touchés par une source ponctuelle de pollution en Ontario seraient de 0,71 mg·kg-1 et de 0,84 mg·kg-1 pour les sols en milieu rural et les sols d’anciens parcs urbains, respectivement (CCME, 1996).
Les ions métalliques comme le cadmium peuvent former des complexes avec d’autres ligands organiques et inorganiques, qui ont un effet sur leur mobilité et leur adsorption dans le sol. La formation de complexes de cadmium avec des ions inorganiques, comme Cl-, freinerait l’adsorption et augmenterait la mobilité dans le sol. Le pH du sol est aussi un facteur qui influe sur la mobilité du cadmium, et une plus grande mobilité a été observée dans des conditions acides (McLean et Bledsoe, 1992).
5.6 Biosurveillance
5.6.1 Biomarqueurs de l’exposition
Afin de rendre compte le plus précisément possible des expositions au cadmium, on a réalisé des études épidémiologiques faisant appel à des biomarqueurs. Les concentrations sanguines de cadmium renseignent sur les expositions récentes tandis que les concentrations urinaires de cadmium fournissent une indication sur la dose cumulative et la charge corporelle et en particulier, sur l’accumulation de cadmium dans les reins (EFSA, 2009b). Il convient toutefois de souligner que les concentrations urinaires peuvent varier en fonction de plusieurs facteurs, dont les atteintes rénales et l’efficacité des reins. La fonction rénale doit donc être prise en compte dans l’interprétation des concentrations urinaires, car ces valeurs seront plus élevées en cas d’atteinte des tubules rénaux (Santé Canada, 2018a).
5.6.2 Données de biosurveillance
Dans le cadre de l’Enquête canadienne sur les mesures de la santé (ECMS), on a mesuré le cadmium dans le sang total de tous les participants, âgés de 6 à 79 ans du cycle 1 (2007-2009) et de 3 à 79 ans du cycle 2 (2009-2011) et du cycle 3 (2012-2013) (Santé Canada, 2015). On a aussi mesuré le cadmium dans l’urine de tous les participants au cours des cycles 1 et 2 de l’ECMS (Santé Canada, 2013).
La moyenne géométrique (MG) des concentrations sanguines de cadmium au cours des cycles 1, 2 et 3 pour les participants âgés de 6 à 79 ans était de 0,34 µg/L (intervalle de confiance (IC) à 95 % = 0,31-0,37, n = 5 319), de 0,30 µg/L (IC à 95 % = 0,27-0,33, n = 5 575) et de 0,34 µg/L (IC à 95 % = 0,31-0,37, n = 5 067), respectivement. Les concentrations sanguines de cadmium étaient généralement plus élevées chez les femelles que chez les mâles (MG : 0,38, 0,33 et 0,39 µg/L chez les femelles comparativement à 0,30, 0,27 et 0,31 µg/L chez les mâles, dans les cycles 1, 2 et 3, respectivement) (Garner et Levallois, 2016). Cette différence pourrait s’expliquer par une absorption variable selon le sexe; d’après un rapport national des Centers for Disease Control (CDC), l’absorption gastro-intestinale moyenne du cadmium alimentaire est estimée à 5 % chez les hommes et à 10 % ou plus chez les femmes (CDC, 2009). Les concentrations sanguines de cadmium augmentaient avec l’âge dans les trois cycles (Santé Canada, 2015). Certaines des hausses liées à l’âge étaient statistiquement significatives : des analyses combinées des ensembles de données du cycle 1 et du cycle 2 par Garner et Levallois (2016) ont indiqué des concentrations sanguines de cadmium considérablement plus élevées dans le groupe des 40 à 59 ans (MG, 0,44 µg/L) que dans le groupe des 20 à 39 ans (MG, 0,31 µg/L); une analyse des données du cycle 3 par Statistique Canada (2015) a montré des concentrations sanguines de cadmium sensiblement plus élevées (MG, 0,42 µg/L) chez les adultes âgés de 20 à 79 ans que chez les participants plus jeunes, âgés de 3 à 19 ans (MG, 0,12 µg/L) (Statistique Canada, 2015).
La moyenne géométrique des concentrations urinaires de cadmium chez les participants âgés de 6 à 79 ans était de 0,34 µg/L (IC à 95 % = 0,31-0,38, n = 5,491) pour le cycle 1 et de 0,40 µg/L (IC à 95 % = 0,36-0,44, n = 5,738) pour le cycle 2. Après ajustement en fonction de la créatinine, les concentrations urinaires de cadmium étaient de 0,42 µg/g de créatinine (IC à 95 % = 0,40-0,44, n = 5,478) pour le cycle 1 et de 0,37 µg/g de créatinine (IC à 95 % = 0,34-0,41, n = 5,719) pour le cycle 2. Comme dans le cas des concentrations sanguines, les concentrations urinaires de cadmium étaient plus élevés chez les femmes que chez les hommes, mais seulement après ajustement en fonction de la créatine urinaire. Une analyse combinée des données du cycle 1 et du cycle 2 (Garner et Levallois, 2016) pour des adultes canadiens âgés de 20 à 79 ans a montré des concentrations beaucoup plus élevées de cadmium urinaire ajustées en fonction de la créatinine chez les femmes (0,53 µg/g de créatinine) que chez les hommes (0,35 µg/g de créatinine). Comme il a été observé dans les concentrations sanguines de cadmium, les concentrations urinaires augmentaient aussi avec l’âge. Une hausse importante liée à l’âge des concentrations urinaires de cadmium, ajustés ou non en fonction de la créatinine (60 à 79 ans > 40-59 ans > 20 à 39 ans) a été observée par Garner et Levallois (2016).
5.7 Exposition par voies multiples par l’eau potable
Le cadmium peut être absorbé par inhalation, mais une exposition à des vapeurs de cadmium pendant la douche ou le bain est peu probable puisque le cadmium n’est pas volatil, étant donné sa faible pression de vapeur (tableau 1). L’absorption de cadmium par voie cutanée pendant la douche ou le bain est considérée négligeable en raison de la faible constante de perméabilité de la peau, soit 1 × 10-3 cm/h, ce qui indique que l’exposition par voie cutanée représenterait moins de 10 % de la consommation d’eau potable (U.S. EPA, 2004; Krishnan et Carrier, 2008). Par conséquent, il est peu probable que l’exposition par inhalation et par voie cutanée pendant la douche et le bain contribuent de façon importante à l’exposition totale.
6.0 Méthodes d’analyse
Les méthodes normalisées pouvant servir à l’analyse du cadmium total dans l’eau potable et leurs limites de détection (LD) respectives sont résumées dans le tableau 3. Les limites de détection de méthode (LDM) dépendent de la matrice de l’échantillon, des instruments et des conditions de fonctionnement choisies et varient d’un laboratoire à l’autre. Il est important que les analyses soient effectuées par un laboratoire accrédité pour garantir des résultats précis et une assurance et un contrôle de la qualité appropriés, et que les seuils minimaux de niveau à déclarer (SMND) soient suffisamment bas pour assurer une surveillance précise à des concentrations inférieures à la CMA.
La limite pratique de quantification (LPQ) actuellement fixée par l’U.S. EPA tient compte de la capacité des laboratoires de mesurer le cadmium dans des limites raisonnables de précision et d’exactitude (U.S. EPA, 2009). L’U.S. EPA réexamine les National Primary Drinking Water Regulations une fois tous les six ans; lors du second examen, l’U.S. EPA (2009) a indiqué qu’à la lumière des données d’évaluation de l’efficacité, elle ne pouvait appuyer une réduction supplémentaire de la LPQ pour le cadmium.
| Méthode (référence) | Méthodologie | LDM (µg/L) | Interférences et commentaires |
|---|---|---|---|
| EPA 200.5 Rev. 4.2 (U.S. EPA, 2003) | Spectroscopie d’émission avec plasma induit par haute fréquence avec signaux vus en direction axiale (AVICP-AES) | 0,1 | Sujette à des interférences spectrales, physiques, chimiques et attribuables à la mémoire. Interférences dues à la matrice : Ca, Mg et Na > 125 mg/L et SiO2 > 250 mg/L |
| EPA 200.7 Rev. 4.4 (U.S EPA, 1994Note de bas de tableau 3 - a) | Spectrométrie d’émission atomique à source plasma couplée par induction (ICP-AES) | 1,0 | Sujette à des interférences spectrales, physiques, chimiques et attribuables à la mémoire. Interférences dues à la matrice : MDTc > 0,2 % (p/v) |
| EPA 200.8 ver. 5.4 (U.S. EPA, 1994Note de bas de tableau 3 - b) | Spectrométrie de masse avec plasma à couplage inductif (ICP-MS) | 0,03Note de bas de tableau 3 - a-0,5Note de bas de tableau 3 - b | Sujette à des interférences isobariques dues à des éléments et à des ions polyatomiques et à des interférences physiques. Interférences dues à la matrice : MDT > 0,2 % (p/v) |
| EPA 200.9 ver. 2.2 (U.S. EPA, 1994Note de bas de tableau 3 - c) | Spectrométrie d’absorption atomique au four graphique à température stabilisée | 0,05 | Sujette à des interférences spectrales, attribuables à la mémoire et dues à la matrice; l’acide chlorhydrique produit lors de la digestion peut influer sur la sensibilité. |
| SM 3113B (APHA et coll.,2017) | Spectrométrie d’absorption atomique électrothermique | 0,05 | Sujette à des absorptions moléculaires et à interférences chimiques et dues à la matrice |
|
|||
6.1 Préparation et préservation des échantillons
Les considérations opérationnelles liées à l’analyse du cadmium dans l’eau potable (collecte, préservation et conservation des échantillons) sont décrites dans les documents de référence présentés au tableau 3. Pour quantifier précisément le cadmium dissous, particulaire (en suspension) et total dans les échantillons, il faut s’assurer de préserver et de préparer correctement les échantillons. La méthode normalisée SM 3030B fournit des directives sur les étapes de filtration et de préservation à effectuer pour le dosage des métaux dissous ou particulaires (APHA et coll., 2017).
Dans les méthodes EPA 200.7 et 200.8 et la méthode SM 3113B, il n’est nécessaire de digérer de manière en milieu acide les échantillons pour l’analyse des métaux extractibles totaux que si la turbidité d’un échantillon préservé dans l’acide est supérieure à une (1) unité de turbidité néphélémétrique (uTN). Cependant, la recherche effectuée sur d’autres métaux (p. ex., le plomb et le chrome) a révélé que cette façon de procéder ne permettait pas de quantifier précisément la concentration totale d’un métal dans un échantillon d’eau potable; ce protocole pourrait sous-estimer le cadmium total dans l’eau potable en présence de cadmium particulaire. Les exigences en matière d’analyse de la troisième règle de surveillance des contaminants non réglementés (third Unregulated Contaminant Monitoring Rule, UCMR3) prescrivent de solubiliser l’échantillon préservé dans l’acide par chauffage léger à l’aide d’acide nitrique, peu importe la turbidité de l’échantillon ou la méthode utilisée (U.S. EPA, 2012). La détection de cadmium particulaire et de fractions dissoutes est considérée comme une pratique exemplaire pour la détermination de la concentration en cadmium. Une digestion thermique en milieu acide est décrite dans les méthodes EPA 200.7 et 200.8 (U.S. EPA, 1994a, 1994b). Il est également possible d’effectuer une digestion par micro-ondes, décrite dans la méthode SM 3030 K (APHA et coll., 2017), lorsque l’analyse des métaux récupérables totaux est réalisée à l’aide d’une méthode qui fait appel à l’ICP-MS.
7.0 Considérations liées aux techniques de traitement et aux réseaux de distribution
Les réactions chimiques du cadmium dans l’eau sont complexes et déterminées par le pH de l’eau et la présence d’autres ions organiques et inorganiques dans la solution (Gardiner, 1974a; Yeats et Brewers, 1982; McComish et Ong, 1988; Stephenson et Mackie, 1988; Powell et coll., 2011; Crea et coll., 2013).
Dans l’eau, le cadmium se présente généralement sous forme de cation libre bivalent (Cd2+) ou sous l’une de ses formes hydratées (p. ex., hexahydrate). Il peut former des précipités minéraux avec un oxyde, un hydroxyde, un carbonate ou un phosphate et peut aussi former des complexes avec divers ligands, comme l’acide humique. Même en contexte de sous-saturation, dans sa phase précipitée, il peut s’associer à des particules solides, en raison de la charge des cations cadmium et des complexes de cadmium. La solubilité du cadmium est influencée par l’acidité de l’eau (Gardiner, 1974b; Crea et coll., 2013); les milieux acides peuvent entraîner une dissolution du cadmium en suspension ou lié à des sédiments (Evans et coll., 1983; Stephenson et Mackie, 1988). Les réactions de précipitation-dissolution et d’adsorption-désorption déterminent les concentrations de cadmium dans l’eau (Rei, 1984; Smedley et Kinniburgh, 2002; Friedman et coll., 2010).
Figure 1. Spéciation du cadmium en fonction du pH dans une solution contenant du chlorure (100 mg/L), du sulfate (100 mg/L) et du carbone inorganique (100 mg/L). Le cadmium total est égal à 1 mg/L (Ford et coll., 2007).
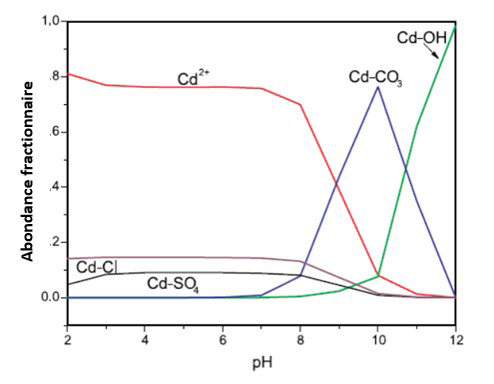
Légende :
Cd-Cl comprend le CdCl+ et le CdCl20
Cd-SO4 comprend le CdSO40 et le Cd(SO4)22-
Cd-CO3 comprend le CdCO30, CdHCO3+, et le Cd(CO3)22‑
Cd-OH comprend le CdOH+, Cd(OH)20, et le Cd(OH)3 -
Description textuelle
Un graphique linéaire montrant l'abondance fractionnaire du cadmium en fonction du pH, l'axe vertical montrant des concentrations allant de 0,0 à 1,0 mg/L et l'axe horizontal montrant un pH allant de 2 à 12.
D'un pH de 2 à un pH de 7 ; le Cd2+ est l'espèce prédominante à une concentration restant constamment proche de 0,8 mg/L ; le Cd-Cl reste constant à une concentration proche de 0,15 mg/L ; le Cd-SO4 commence à une concentration de 0,05 mg/L à un pH de 2, augmente légèrement à 0,1 mg/L à un pH de 3 et reste constant lorsque le pH augmente dans cette plage, et le Cd-CO3 et le Cd-OH restent tous deux constants à une concentration de 0,0 mg/L dans cette plage.
D'un pH de 7 à un pH de 12, la concentration de Cd2+ diminue jusqu'à 0,7 mg/L à un pH de 8, puis diminue fortement jusqu'à une concentration de 0,1 mg/L à un pH de 10, diminuant encore à près de 0,0 à un pH de 11 et restant à 0.0 mg/L à un pH de 12 ; la concentration de Cd-Cl diminue très légèrement à l'approche d'un pH de 8, puis diminue régulièrement jusqu'à 0,0 mg/L à un pH de 10, qui continue à un pH de 12 ; la concentration de Cd-SO4 commence à diminuer après un pH de 7, pour atteindre 0.0 mg/L à un pH de 10 qui reste constant jusqu'à un pH de 12 ; la concentration de Cd-CO3 commence à augmenter au-delà d'un pH de 7, atteignant environ 0,08 mg/L à un pH de 8, puis augmente régulièrement jusqu'à un maximum de près de 0,8 mg/L à un pH de 10, puis diminue fortement jusqu'à une concentration de 0.0 mg/L à un pH de 12 ; la concentration de Cd-OH commence à augmenter légèrement à partir de 0,0 mg/L à un pH de 8, pour atteindre environ 0,05 mg/L à un pH de 10, puis augmente fortement jusqu'à une concentration de près de 1,0 mg/L à un pH de 12.
Des expériences en laboratoire ont montré qu’en présence de phosphate, le phosphate de cadmium précipite principalement sous forme de Cd5H2(PO4)4.4H2O, indépendamment des concentrations de phosphate dans la solution (Ayati et coll., 2008). Aucune publication n’a toutefois été répertoriée sur la capacité de cette espèce de phosphate de cadmium à former des incrustations protectrices dans le réseau de distribution.
7.1 Échelle municipale
L’U.S. EPA (1998) considère que la coagulation-filtration, l’adoucissement à la chaux, l’échange d’ions et l’osmose inverse (OI) sont les procédés de traitement les plus efficaces pour éliminer le cadmium de l’eau potable.
Le choix et l’efficacité de chaque stratégie de traitement sont dictés par plusieurs facteurs, dont les caractéristiques chimiques de l’eau de la source d’approvisionnement, la concentration de cadmium, les procédés de traitement préexistants, les conditions d’utilisation de la méthode de traitement, les objectifs de traitement du service public et les enjeux et coûts liés au traitement des résidus.
7.1.1 Coagulation classique
Les principales sources d’information sur les procédés de coagulation classique et d’adoucissement à la chaux sont les essais de floculation préliminaires et les études pilotes réalisés par Sorg et coll. (1978). Les études ont révélé que les traitements classiques dépendaient du pH, le taux d’élimination du cadmium augmente avec le pH dans la plage de 7,0 à 9,0. Bien que l’alun et le sulfate de fer utilisés comme coagulants affichent des tendances comparables pour ce qui est de l’élimination, le sulfate de fer produit des taux d’élimination plus importants que l’alun à un pH donné. Dans un essai pilote réalisé à l’aide d’une eau de surface faiblement alcaline (50-60 mg/L de CaCO3) traitée avec une dose de sulfate de fer de 30 mg/L et dont les concentrations de cadmium de départ étaient de 0,028 mg/L et de 0,048 mg/L, on a obtenu des taux d’élimination du cadmium de 99 % (pH de 8,8) et de 96 % (pH de 8,7), respectivement. Lorsque le pH était ramené à moins de 7,0, les taux d’élimination chutaient à 30 % et à 25 %, respectivement. À des pH de 8,0, 7,9 et 6,9, une dose d’alun de 30 mg/L a permis de réduire une concentration moyenne de cadmium de 0,04 mg/L de 73 %, 65 % et 36 %, respectivement.
Dans des essais de floculation, on a constaté que des doses croissantes d’alun augmentent de façon linéaire les taux d’élimination du cadmium. À un pH de 8,3, en faisant passer la dose d’alun de 20 mg/L à 60 mg/L, on a augmenté le taux d’élimination d’environ 20 % pour atteindre une élimination maximale d’environ 60 %. Cependant, une augmentation de la dose de sulfate de fer n’améliorait que légèrement l’élimination du cadmium. Les essais de floculation ont aussi montré qu’une dose d’alun de 30 mg/L permettait d’obtenir une concentration de cadmium de 0,01 mg/L dans de l’eau de surface traitée lorsque la concentration initiale était d’environ 0,02 mg/L ou moins. Le sulfate de fer était plus efficace que l’alun, une dose de 20 mg/L permettant de réduire une concentration initiale de cadmium de 0,1 mg/L à 0,01 mg/L à un pH de 8,7 (Sorg et coll., 1978). Dans une étude en banc d’essai, Najm et coll. (2017) ont indiqué qu’une concentration de cadmium de départ de 2,3 µg/L avait été ramenée à moins de 0,4 µg/L à l’aide d’une dose de chlorure de fer de 5 mg/L à un pH de 9,0 et que le cadmium ne pouvait être éliminé à de faibles valeurs de pH.
7.1.2 Précipitation
Pour le traitement des métaux présents dans l’eau, on utilise un procédé de précipitation, suivi d’une décantation et d’une filtration. Patterson et coll. (1977) ont mesuré et comparé la solubilité minimale de précipités d’hydroxyde de cadmium et de carbonate de cadmium dans une plage de pH de 6,0 à 13,0. Les données ont indiqué que les concentrations résiduelles de cadmium soluble étaient de 126 mg/L et de 0,2 mg/L à des pH de 8,6 et de 10,4, respectivement, dans une solution à base d’hydroxyde de cadmium. De faibles concentrations de cadmium soluble de 1,2 mg/L et de 0,25 mg/L ont été mesurées à des pH de 8,4 et de 10,8, respectivement, pour une solution de carbonate affichant une concentration totale de carbonate de 10-1,2 mol/L. Dans un autre type de solution de carbonate (concentration totale de carbonate de 10-2,7 mol/L), une concentration résiduelle de cadmium soluble de 0,6 mg/L a été mesurée à un pH de 9,5. Une solution d’hydroxyde de cadmium présentait toutefois une concentration résiduelle de cadmium de 0,2 mg/L à un pH de 10,4. Les auteurs ont conclu que la solution de carbonate de cadmium donnait à un pH de 9,5 à peu près les mêmes résultats que la solution d’hydroxyde de cadmium à un pH de 10,5.
Des essais pilotes préliminaires ont indiqué que le cadmium était efficacement éliminé par un adoucissement à la chaux et un adoucissement avec excès de chaux. Une concentration d’environ 0,03 mg/L de cadmium dans de l’eau souterraine enrichie a été réduite de plus de 93 % et de plus de 95 % à des pH de 9,5 et de 11,3, respectivement. Lors d’essais de floculation, on a obtenu une réduction de près de 100 % de concentrations initiales de cadmium de 0,03 à 10,0 mg/L à un pH de 11,3, avec une forte concentration de magnésium (21 mg/L). On a avancé que l’adsorption des précipités de cadmium sur les flocs de carbonate de calcium et d’hydroxyde de magnésium jouait un rôle dans le taux élevé d’élimination du cadmium (Sorg et coll., 1978). Ce procédé est relativement coûteux et peut être difficile à utiliser pour éliminer le cadmium à moins qu’une réduction de la dureté constitue un objectif de traitement complémentaire.
7.1.3 Échange d’ions
Bien qu’un examen général des publications scientifiques n’ait recensé aucune étude sur l’utilisation de l’échange d’ions éliminer le cadmium dans l’eau potable, plusieurs auteurs ont indiqué que des résines échangeuses de cations fortement acides (SAC) pourraient se révéler efficaces (Linstedt et coll., 1971; Calmon, 1974; Kocaoba, 2003; Dabrowski et coll., 2004; Demirbas et coll., 2005; Kocaoba et Akcin, 2005; Pehlivan et coll., 2006). Calmon (1974) a observé que la sélectivité de ces résines (sous forme H+) pour le cadmium était plus forte que pour le cuivre, le zinc et le magnésium et plus faible que pour le calcium, l’argent et le baryum. De même, Demirbas et coll. (2005) ont remarqué que la capacité d’adsorption de ce type de résine (sous forme H+) était plus élevée pour le cadmium que pour le cuivre et le plomb. Le coefficient de distribution du cadmium, défini comme le rapport de la concentration des ions cadmium sur la résine sur la concentration d’ions dans la solution aqueuse, augmentait dans la plage de pH de 4,0 à 9,0. Pehlivan et coll. (2006) ont utilisé ce type de résine pour récupérer des métaux contenus dans une solution aqueuse et constaté que le coefficient maximal de distribution du cadmium (récupération de 97 %) était obtenu dans la plage de pH de 8,0 à 9,0. On a calculé que la capacité maximale de la résine pour le cadmium était de 4,7 mEq/g de résine sèche (264 mg/g).
Les résines échangeuses d’anions faiblement basiques sous leur forme non protonée affichent une forte sélectivité pour les métaux lourds. Les atomes d’azote des groupes fonctionnels amine ne sont pas protonés à un pH neutre et peuvent former des liaisons de coordination en cédant des paires d’électrons libres aux métaux lourds (Höll et coll., 2002; Zhao et coll., 2002). Dans une étude en laboratoire, une colonne de résine échangeuse d’anions faiblement basique a permis de réduire une concentration de départ de cadmium d’environ 92,0 µg/L dans de l’eau du robinet enrichie à une concentration inférieure à 1,0 µg/L pour 6 000 volumes de lit et avoisinant 5 µg/L à 7 000 volumes de lit (Zhao et coll., 2002). La mise à l’essai à l’échelle pilote des résines échangeuses d’ions pour éliminer le cadmium constitue une étape importante pour les services publics qui envisagent d’utiliser cette technique comme procédé de traitement.
7.1.4 Filtration sur membrane
On a peu étudié l’élimination du cadmium par osmose inverse. Une étude préliminaire présentait les résultats d’expériences menées dans une installation pilote par l’U.S. EPA portant sur le rejet du cadmium par plusieurs types de membranes d’OI. Les membranes avaient un taux de récupération variant de 9,8 % à 59 % et ont été utilisées à des pressions d’alimentation de 191 à 283 lb/po2. L’étude a montré que l’élimination du cadmium par les diverses membranes (acétate de cellulose, triacétate de cellulose, acétate de cellulose modifié et composite de film mince) variait de 96 % à 99 % pour une concentration de départ se situant entre 0,18 mg/L et 3,7 mg/L (Clifford et Sorg, 1986).
Le procédé d’osmose inverse comporte certaines limites, notamment l’entartrage, l’encrassement et la défaillance possibles des membranes ainsi qu’une forte consommation d’énergie et des coûts d’investissement élevés. Le calcium, le baryum et la silice peuvent causer un entartrage de la membrane et en réduire l’efficacité. Le pH de l’eau produite doit être ajusté pour prévenir les problèmes de corrosion dans le réseau de distribution (Schock et Lytle, 2011).
7.1.5 Autres techniques
D’autres techniques de traitement permettant d’éliminer le cadmium ont été mises au point. Les services publics qui mettent à l’essai une technique devraient déterminer l’efficacité du procédé choisi d’élimination du cadmium en fonction de la qualité de leur eau.
7.1.5.1 Adsorption
Dioxyde de titane : Un milieu granulaire adsorbant à base de dioxyde de titane, utilisé pour éliminer l’arsenic, s’est également révélé efficace pour d’autres métaux lourds, dont le cadmium, de l’eau potable (Swaim et coll., 2017; Graver Technologies, 2015).
Alumine activée : Dans une étude en laboratoire, Naiya et coll. (2009) ont constaté que de l’alumine activée neuve permettait de réduire de 97 % une concentration initiale de cadmium de 10 mg/L dans une plage de pH variant de 5,0 à 6,0 et présentait une capacité d’adsorption maximale de 35 mg Cd2+/g d’adsorbant. L’hydroxyde de cadmium commençait à précipiter à un pH supérieur à 7,0. Une élimination du cadmium de plus de 90 % a été observée après trois cycles de régénération.
Milieu filtrant enrobé de fer : On a étudié l’efficacité du sable enrobé de fer pour l’adsorption des ions métalliques et de la matière organique naturelle présents dans l’eau (Edwards et Benjamin, 1989; Ahmedzeki, 2013). Edwards et Benjamin (1989) ont utilisé une colonne remplie de sable enrobé de fer et observé un taux d’élimination de 89 % pour une concentration initiale de cadmium de 2,8 mg/L à un pH de 8,5. De même, Ahmedzeki (2013) a obtenu un taux d’élimination de 97 % pour une concentration initiale de 15 mg/L, à un pH de 9,0 lors d’expériences par lots.
D’autres techniques de traitement en cours d’évaluation ou faisant l’objet de recherche font appel à des zéolites (Sheta et coll., 2003; Baker et coll., 2009; Batjargal et coll., 2011), à des membranes d’ultrafiltration à polyélectrolytes (Ennigrou et coll., 2015) et à des résines échangeuses d’ions chélatrices (Kawamura et coll., 1993; Kosaoba et coll., 2003; Fernández et coll., 2005; Amara-Rekkab et Didi, 2015).
7.1.6 Considérations relatives aux réseaux de distribution
Les principales sources de cadmium dans les réseaux de distribution et les installations de plomberie résidentielles comprennent la détérioration des tuyaux en acier galvanisé et, dans une moindre mesure, le lessivage des revêtements en mortier de ciment et des matériaux contenant du laiton (Sharrett et coll., 1982; Benjamin et coll., 1996; Guo et coll., 1998; Berend et Trouborst, 1999; Viraraghavan et coll., 2000; Barton, 2005; Friedman et coll., 2010). Les tuyaux galvanisés étaient largement utilisés dans les installations de plomberie jusque dans les années 1960 (Trussell et Wagner, 1996). Le Code national de la plomberie a autorisé l’utilisation de tuyaux en acier galvanisé dans les réseaux de distribution et les installations de plomberie jusqu’en 1980 (CNRC, 2010). La réglementation sur les installations de plomberie mise en œuvre dans chaque province et chaque territoire repose sur le Code national de la plomberie.
L’accumulation de contaminants inorganiques à l’état de traces dans les réseaux de distribution d’eau potable résulte de l’interaction complexe de nombreux facteurs, dont la concentration de contaminants dans l’eau traitée, le pH, les conditions d’oxydoréduction dans le réseau de distribution et le matériau des conduites. Les cations métalliques (p. ex., le baryum, le plomb et le cadmium) s’accumulent dans le réseau de distribution par des mécanismes d’adsorption/coprécipitation. L’accumulation augmente à des pH élevés et lorsque des cations potentiellement concurrentiels (p. ex., le calcium et le magnésium) sont présents en faibles concentrations. Le cadmium a notamment une forte affinité pour les oxydes de manganèse hydratés et les oxydes de fer hydratés (Zasoski et Burau, 1988; Grey et coll., 1999; Friedman et coll., 2010; Hill et coll., 2010; Peng et coll., 2012). Le phosphate, un élément clé de nombreux programmes de contrôle de la corrosion, est reconnu pour précipiter en présence de métaux, y compris le cadmium (Ayati et Lundager Madsen, 2000; Snoeyink et coll., 2003). Les oxydes d’aluminium et les alumino-silicates ont aussi affiché une capacité importante d’adsorption des métaux traces, des radionucléides, des anions et des oxyanions (Kim et coll., 2003; Bell et Saunders, 2005). Tous ces oxydes, hydroxydes, oxyhydroxydes, phosphates et alumino-silicates constituent des réservoirs pour l’accumulation de contaminants inorganiques à l’état de traces dans les réseaux de distribution et sont considérés comme des facteurs importants dans le contrôle de la solubilité et de la distribution des métaux traces (Chao, 1976; Bunn et coll., 2002; Schock, M., 2005). Des perturbations physiques ou hydrauliques ou les caractéristiques chimiques instables de l’eau peuvent remobiliser des contaminants comme le cadmium dans l’eau libre.
Dans une étude menée sur des échantillons d’incrustation et de sédiments prélevés dans les réseaux de distribution d’eau potable de 20 services publics américains alimentés par des eaux souterraines, des eaux de surface et des sources d’eau mélangée, le cadmium était la neuvième substance la plus concentrée parmi les12 substances inorganiques analysées (Friedman et coll., 2010; Peng et coll., 2012). Les auteurs ont non seulement indiqué que du cadmium était présent dans tous les solides, mais aussi que sa concentration était beaucoup plus faible que celle des autres métaux. La concentration médiane de cadmium de tous les échantillons d’incrustation et de sédiments combinés était de 0,26 µg/g (2,6 × 10-05 % en poids), le 10e et le 90e centile s’établissant à 0,06 µg/g (6,0 × 10-06 % en poids) et à 2,8 µg/g (2,8 × 10-04 % en poids), respectivement. La concentration médiane de cadmium dans les incrustations et les solides mobilisés lors de la purge des bornes d’incendie était de 0,5 µg/g et de 0,17 µg/g (5,0 × 10-05 % en poids et de 1,7 × 10-05 % en poids), respectivement. Six des échantillons d’incrustation présentant de fortes concentrations de cadmium (>3 µg/g) affichaient aussi une teneur élevée en manganèse concomitant (0,3 à 23,2 % en poids). Il a été démontré que le manganèse était extrêmement efficace pour adsorber les espèces cationiques semblables au cadmium (Zasoski et Burau, 1988; Friedman et coll., 2010). Friedman et coll. (2016) ont mesuré de faibles concentrations de cadmium dans les solides prélevés dans les échantillons provenant de la purge des bornes d’incendie. Le cadmium total mesuré dans ces solides variait de 44,9 µg à 704 µg (de 3,0 × 10-04 à 0,01 % en poids). Friedman et coll. (2010) ont calculé une masse estimative de cadmium de 0,17 lb accumulée sur un tronçon de conduite de 100 milles de longueur (diamètre de 12 po). Les auteurs ont remarqué qu’en théorie, 16 % à 26 % des incrustations devraient être mobilisés pour obtenir une concentration de cadmium supérieure à 0,005 mg/L. Compte tenu de ces résultats, l’accumulation de cadmium (et son relargage potentiel) dans les réseaux de distribution n’est pas considérée importante en regard des autres contaminants inorganiques.
Schock et coll. (2008) ont indiqué que les incrustations sur les conduites en plomb agit aussi comme réservoir pour le cadmium. Les échantillons d’incrustation prélevés sur 91 spécimens de tuyauteries de service en plomb et revêtues de plomb de 26 réseaux de distribution d’eau aux États-Unis présentaient une concentration moyenne de cadmium de 6,4 µg/g (6,4 × 10-4 % en poids), variant de 2,0 µg/g (2 × 10-4 % en poids) à 308,0 µg/g (3,08 × 10-2 % en poids).
Matériaux à base de ciment : Le cadmium peut aussi pénétrer dans l’eau du réseau de distribution à la suite du lessivage des matériaux et des revêtements à base de ciment. Guo et coll. (1998) ont réalisé des essais en laboratoire afin de déterminer l’ampleur du lessivage des tuyaux en fonte ductile revêtus sur place de mortier de ciment Portland (type I). Les tuyaux ont été revêtus, durcis puis désinfectés conformément aux normes d’American National Standards Institute (ANSI)/American Water Works Association (AWWA) (AWWA, 2016). On a mené les essais en se servant de l’eau du robinet provenant d’un réseau de distribution du New Jersey. Dans des conditions statiques, on a progressivement augmenté la concentration de cadmium jusqu’à 1,1 µg/L pendant les 5 premiers jours de stagnation de l’eau. Le ciment utilisé pour revêtir les tuyaux d’essai contenait toutefois une quantité de métaux moins importante que la plupart des ciments vendus dans le commerce.
Dans des essais à pleine échelle, on a remarqué que le lessivage du cadmium après l’application d’un revêtement de mortier de ciment à l’intérieur d’une conduite d’eau de 615 m était peu important (inférieur à 1,0 µg/L). Des échantillons ont été prélevés de 0,5 h à 11 h après la mise en service de la conduite (Zielina et coll., 2015). Mlynska et Zielina (2017) ont mesuré de faibles concentrations de cadmium lessivé de deux spécimens de conduites comportant différents revêtements de ciment : revêtement de conduite en ciment préfabriqué et revêtement préparé sur place pendant la rénovation des conduites. Les deux spécimens de conduites étaient remplis d’eau prélevée à la sortie d’une usine de traitement de l’eau (concentration de cadmium non précisée). On a prélevé des échantillons en parallèle de chaque spécimen de conduite à des moments précis pendant 56 jours. L’eau contenue dans les conduites a été remplacée par de l’eau fraîche après chaque analyse. Tous les échantillons d’eau exposés aux deux revêtements de ciment présentaient des concentrations de cadmium dix fois plus élevées que la concentration cible de 5 µg/L.
7.1.6.1 Installations de plomberie des bâtiments
Comme il a été mentionné précédemment, la détérioration des conduites galvanisées et des matériaux à base de laiton compte parmi les sources potentielles de cadmium dans l’eau potable. La corrosivité de l’eau, la quantité de cadmium présent dans les matériaux de plomberie et le profil d’utilisation de l’eau auront une incidence sur les concentrations observées de cadmium dans l’eau potable.
Conduites galvanisées : L’acier galvanisé est un alliage couramment utilisé pour conférer aux installations de plomberie une résistance à la corrosion grâce à un revêtement en acier zingué (galvanisé). La dissolution éventuelle du zinc contenu dans le revêtement intérieur des conduites galvanisées constitue une source potentielle de plomb et de cadmium, puisqu’ils sont présents dans le minerai de zinc sous forme d’impureté (Hill et coll., 2010; AWWA, 2011; Pawlowski et coll., 2014). Le pH, la faible alcalinité et le débit de l’eau sont les propriétés qui influent le plus sur la corrosion des conduites galvanisées (Benjamin et coll., 1996; Hill et coll., 2010). Des études illustrent l’influence éventuelle du pH sur la corrosion des conduites galvanisées et la libération éventuelle de métaux à l’état de traces, comme le cadmium, dans le réseau de distribution d’eau potable. Kodama et coll. (1980) ont mesuré la vitesse de corrosion de conduites galvanisées exposées aux eaux municipales de Tokyo et constaté que la solubilité des incrustations de carbonate de zinc et de silicate de zinc formées sur les surfaces internes des conduites était minime à un pH supérieur à 8,0. Dans le cadre d’un programme d’essai de dix ans sur la corrosion de conduites en acier galvanisé exposées à l’eau potable de Berlin, on a remarqué que le pH de l’eau avait une influence sur la durée de vie du revêtement en zinc appliqué sur la surface interne des conduites. On a observé une perte totale de revêtement en zinc dans les 2 ans à un pH de 7,0, tandis que le revêtement était toujours présent après 10 ans à un pH de 8,0 (Ruckert et Sturzbecher, 1988). On a remarqué que l’alcalinité freinait la corrosion des métaux et qu’en milieu alcalin, les variations localisées du pH à la surface du métal sont atténuées dans les réseaux de distribution. Dans des expériences en laboratoire, la vitesse de corrosion de coupons d’acier galvanisé exposés à de l’eau désionisée (alcalinité négligeable) était plus élevée que dans le cas des coupons exposés à une eau présentant une alcalinité de 56 mg/L sous forme de CaCO3 (Pisigan et Singley, 1985). Une forte concentration de MDT peut aussi avoir une incidence sur la corrosion galvanique (Hill et Giani, 2011).
Sharrett et coll. (1982) ont constaté que des échantillons d’eau prélevés dans des habitations dotées de conduites en acier galvanisé présentaient des concentrations de cadmium au moins dix fois plus élevées que les échantillons recueillis dans des habitations desservies par des conduites en cuivre. Les concentrations de cadmium mesurées au 50e centile dans les échantillons d’eau ayant stagné toute la nuit, prélevés dans des habitations comportant des conduites en acier galvanisé et en cuivre étaient de 0,63 µg/L et de 0,06 µg/L, respectivement. Bien que l’âge des installations de plomberie n’ait pas été précisé, les concentrations médianes de cadmium étaient plus élevées (0,8 µg/L) dans les échantillons d’eau stagnante provenant d’anciennes conduites galvanisées que dans ceux qui provenaient de conduites plus récentes (0,51 µg/L).
El-Rahaili et Misbahuddin (1995) ont recueilli des échantillons d’eau provenant de 40 habitations de différentes localités, représentatifs de différents matériaux de plomberie et de différents âges de conduites. L’eau fournie aux habitations provenait d’un aquifère profond présentant une dureté élevée et une forte teneur en matières dissoutes totales. L’eau a subi un adoucissement à la chaux, suivi d’une désalinisation par osmose inverse. Le réseau de distribution était constitué de conduites d’adduction en fonte ductile, de conduites principales en PVC et de conduites de raccordement en polyéthylène haute densité. La concentration de cadmium dans toutes les sources d’approvisionnement en eau était inférieure à la LD (non précisée). Les matériaux de plomberie étaient des conduites en acier galvanisée (88 %), des conduites en PVC (10 %) et des conduites en cuivre (2 %). Quatre échantillons d’eau ont été prélevés dans chaque habitation selon un protocole d’échantillonnage précis. Pour toutes les habitations dotées d’installations de plomberie galvanisées, des concentrations moyennes de cadmium de 1,4 µg/L, de 0,8 µg/L, de 0,6 µg/L et de 1,2 µg/L ont été mesurées, respectivement, dans 1) un échantillon de 250 mL prélevé au robinet d’eau froide de la cuisine tôt le matin, 2) un échantillon de 250 mL prélevé immédiatement après, 3) un échantillon de 500 mL recueilli après que l’eau ait coulé pendant 5 minutes et 4) un échantillon provenant du robinet du jardin. Les auteurs ont conclu que les concentrations élevées de cadmium étaient attribuables à la corrosion et au lessivage des composants de l’installation de plomberie.
Pieper (2015) a analysé 2 144 échantillons prélevés au premier jet (un échantillon de 250 mL prélevé après une stagnation d’au moins 6 heures), soumis par des propriétaires de réseaux privés dont les installations de plomberie comportaient divers matériaux (p. ex., laiton, soudures) et composants de puits (p. ex., acier galvanisé, laiton). L’auteur a constaté que les concentrations moyennes, médiane et au 90e centile étaient bien inférieures à la LD (< 0,1 µg/L) et qu’à peine 0,6 % des échantillons soumis présentaient des concentrations de cadmium supérieures à 5 μg/L.
Des échantillons prélevés dans une école dotée de conduites et de raccords en acier galvanisé installés entre 1950 et 2008 ont été séparés en deux groupes, selon la LDM pour le cadmium (0,1 µg/L) (Clark et coll., 2015). Les auteurs ont découvert que les échantillons (n = 44) dont les concentrations en cadmium étaient supérieures à 0,1 µg/L présentaient aussi une concentration moyenne de plomb de 194 µg/L, tandis que les échantillons dans lesquels on n’avait pas détecté de cadmium (n = 48) affichaient une concentration moyenne de plomb de 18 µg/L. Ces résultats signifient que la présence de cadmium pourrait être une indication que les conduites en acier galvanisé sont une source de plomb.
Dans une étude récente, on a mesuré des concentrations moyennes de cadmium de 434 mg/kg (0,04 % en poids) et de 299 mg/kg (0,03 % en poids) dans des incrustations prélevées dans une installation de plomberie en cuivre (maison unifamiliale) et dans quatre installations de plomberie galvanisées avec raccords en laiton, respectivement. À l’origine, la maison unifamiliale était desservie par une installation galvanisée (installée vers 1923), qui a été remplacée par des conduites en cuivre en 1965. Les deux échantillons présentaient aussi des concentrations moyennes élevées de plomb, soit 2 549 mg/kg (0,25 % en poids) et 3 901 mg/kg (0,4 % en poids) (Maynard et Wasserstrom, 2017).
Tuyaux en plomb : Deshommes et coll. (2010) ont utilisé deux protocoles d’échantillonnage pour évaluer, dans 45 habitations desservies par des conduites en plomb, la source, les paramètres et les corrélations entre le lessivage de plomb dissous et particulaire et d’autres métaux, dont le cadmium, en présence de divers matériaux de plomberie résidentiel (cuivre, n = 42; galvanisé, n = 1; mélange de plomb et de cuivre, n = 2). Les auteurs ont constaté que, quel que soit le protocole d’échantillonnage utilisé, il était impossible de calculer les concentrations moyennes et médianes des espèces de cadmium particulaires (n = 135) et dissoutes (n = 45), car dans la majorité des échantillons, les concentrations étaient inférieures à la LD (0,03 µg/L).
Tuyaux en cuivre : Dans une étude réalisée par Viraraghavan et coll. (2000), les chercheurs ont examiné l’effet des matériaux de plomberie sur la qualité de l’eau potable à Regina, en Saskatchewan. La ville de Regina a été divisée en cinq zones, et les résidences ont été classées par âge et par type de logement ainsi qu’en fonction des matériaux de plomberie (cuivre et plastique). Trois échantillons ont été prélevés dans chaque résidence au cours de trois cycles mensuels d’échantillonnage effectuées pendant trois mois consécutifs (novembre à janvier). Le premier échantillon (125 mL) représentait l’eau demeurée stagnante pendant toute la nuit dans le robinet; le deuxième échantillon (500 mL), l’eau demeurée stagnante pendant toute la nuit dans l’installation de plomberie, et le troisième échantillon (125 mL), l’eau provenant de la conduite principale. La concentration moyenne de cadmium était supérieure à 5 µg/L au cours du premier cycle et inférieure à 5 µg/L au cours des deux cycles suivants. Plus précisément, dans les échantillons recueillis au cours du premier cycle dans tous les logements dotés d’une installation de plomberie en cuivre, les concentrations de cadmium se situaient entre une valeur inférieure à la LD (non précisée) et 171 µg/L, une valeur inférieure à la LD et 39 µg/L et une valeur inférieure à la LD et 102 µg/L dans le premier, le deuxième et le troisième échantillon, respectivement. Des concentrations maximales de 133 µg/L et de 101 µg/L ont été mesurées au cours du deuxième et du troisième cycle, respectivement. Des concentrations de cadmium de 8 à 38 µg/L ont été mesurées dans les premiers échantillons recueillis au cours du premier cycle dans les logements desservis par une installation de plomberie en plastique, et les concentrations étaient inférieures à 10 µg/L dans tous les échantillons prélevés au cours du deuxième et du troisième cycle. La plupart des échantillons dans lesquels les concentrations de cadmium étaient supérieures à 5 µg/L avaient été prélevés lors du premier échantillonnage de chaque cycle et correspondaient à un lessivage au niveau du robinet. Les auteurs ont observé que la concentration moyenne de cadmium était supérieure à 5 µg/L dans les installations en cuivre datant de moins de 5 ans. Des concentrations de cadmium de plus de 5 µg/L ont aussi été observées pour les installations datant de plus de 40 ans (Viraraghavan et coll., 2000).
7.1.6.2 Laiton
Les matériaux de plomberie, comme le laiton et le bronze présents dans la robinetterie, les compteurs, les soudures et autres raccords utilisés dans les réseaux de distribution et les installations de plomberie sont des facteurs importants qui ont une incidence sur la qualité de l’eau potable (Viraraghavan et coll., 1999). Les laitons sont particulièrement vulnérables à la dézincification dans une eau faiblement alcaline à forte teneur en chlorure (Sarver et coll., 2011). Plusieurs études ont évalué la corrosion des matériaux à base de laiton (Samuels et Meranger, 1984; Neff et coll., 1987; Schock et Neff, 1988; Gardels et Sorg, 1989) et des soudures sans plomb (Subramanian et coll., 1991) en tant que source potentielle de cadmium dans l’eau potable. On a mis à l’essai huit robinets neufs en laiton chromé offerts dans le commerce afin d’évaluer la lixiviation de métaux lourds, dont le cadmium. Pour l’essai de chaque robinet, on a utilisé de l’eau de surface brute avant le traitement (pH de 7,4), de l’eau filtrée (pH de 6,3), de l’eau traitée (pH de 8,6), de l’eau souterraine (pH de 8,1) et une solution aqueuse d’acide fulvique (pH de 6,2). Des concentrations de cadmium variant entre moins de 0,05 et 10 µg/L et entre moins de 0,05 et 4 µg/L ont été mesurées dans tous les échantillons d’eau recueillis après une première et une deuxième période de stagnation de 24 h, respectivement. La plus forte concentration de cadmium, qui était de 10 µg/L, provenait d’un robinet rempli d’eau traitée. Les auteurs ont conclu que les concentrations de métal dans l’eau potable pouvaient être plus importantes dans les nouveaux bâtiments ou lorsque des robinets neufs sont installés (Samuels et Meranger, 1984). De même, une étude en laboratoire de deux semaines a été réalisée sur six robinets neufs en laiton chromé. Trois des robinets étaient remplis d’eau municipale traitée (pH de 8,1 à 9,1, alcalinité de 82 à 126 mg CaCO3/L) tandis que les trois autres étaient remplis d’eau désionisée; les échantillons ont été analysés tous les deux jours. Une concentration de cadmium d’environ 3,0 µg/L a été mesurée dans les premiers échantillons (deuxième jour de l’essai) provenant des robinets contenant de l’eau municipale traitée, mais aucune trace de cadmium n’a été décelée dans les échantillons suivants. Du cadmium a néanmoins été décelé dans tous les échantillons d’eau désionisée à la fin de la période d’essai (LD = 2,0 µg/L). Bien que les concentrations de cadmium soient faibles, les auteurs ont conclu que les robinets en laiton chromé pouvaient être une source de métaux lourds dans l’eau potable, en particulier lorsque l’eau stagnait dans la conduite (Schock et Neff, 1988).
Dans une étude pilote, on a évalué le lessivage des métaux contenus dans des conduites en cuivre comportant des soudures sans plomb (étain-antimoine, étain-argent et étain-cuivre-argent). Des échantillons d’eau ont été prélevés après 0,17, 0,5, 1, 3, 5, 7 et 24 h et 3, 7, 28 et 90 jours. Après chaque période d’exposition, l’eau a été évacuée, et les conduites ont été de nouveau remplies. Les auteurs ont remarqué que les concentrations de cadmium étaient inférieures à la LDM de 0,03 µg/L dans tous les échantillons d’eau pendant 28 jours (Subramanian et coll., 1991).
7.1.7 Stratégie d’atténuation pour les réseaux de distribution et les installations de plomberie
Comme les épisodes de coloration (eau rouge) peuvent s’accompagner d’une libération de contaminants accumulés (métaux), ils devraient déclencher des mesures d’entretien, comme le rinçage unidirectionnel systématique du réseau de distribution, pour s’assurer que toutes les particules sont éliminées avant que l’eau ne parvienne au consommateur (Vreeburg, 2010; Friedman et coll., 2016). Cependant, un rinçage unidirectionnel pourrait ne pas être efficace dans le cas de certains types de conduites, comme les conduites en fonte revêtues de ciment et les conduites en plastique, parce que les contaminants forment alors des films minces et des couches cohésives à base de manganèse plutôt que des incrustations. Dans ces cas, des techniques de nettoyage plus radicales peuvent être justifiées (Friedman et coll., 2016).
Friedman et coll. (2010) ont recensé plusieurs conditions essentielles de la qualité de l’eau qui devraient être contrôlées afin de maintenir la stabilité de l’eau et ne pas remobiliser les contaminants inorganiques à l’état de traces dans les dépôts. Parmi elles se trouvent le pH, le potentiel d’oxydoréduction et les mesures de contrôle de la corrosion. Il est également important d’éviter le mélange non contrôlé des eaux de surface avec les eaux souterraines et de l’eau chlorée avec l’eau chloraminée. Le maintien de la stabilité de l’eau potable dans le réseau de distribution et la mise en œuvre d’un programme de nettoyage approprié du réseau devraient permettre de réduire les occurrences de coloration et les concentrations de métaux, et de fournir une eau de grande qualité aux consommateurs.
En général, la concentration de métaux à l’état de traces augmente quand l’eau stagne, mais elle peut varier en fonction de la qualité de l’eau. Ainsi, une purge de l’eau présente dans l’installation de plomberie peut réduire les concentrations de métaux, ce qui est considéré comme une stratégie d’atténuation. Il peut donc être conseillé d’effectuer une purge de longue durée après de longues périodes de stagnation (périodes de vacances, fins de semaine) afin d’obtenir une qualité d’eau adéquate.
En outre, si les matériaux en acier galvanisé ou en laiton contribuent à la présence de cadmium dans l’eau potable, il est recommandé de les remplacer par des matériaux qui ont été certifiés, par un organisme de certification accrédité, comme étant conformes aux normes pertinentes de NSF International (NSF)/de l’American National Standards Institute (ANSI) (voir la section 7.2).
7.2 Traitement résidentiel
Santé Canada ne recommande pas de marques particulières de dispositifs de traitement de l’eau potable, mais conseille vivement aux consommateurs de n’utiliser que les dispositifs certifiés par un organisme de certification accrédité comme étant conformes aux normes appropriées de la NSF International (NSF) et de l’American National Standards Institute (ANSI). Ces normes ont été conçues en vue de préserver l’eau potable en s’assurant de l’innocuité et de l’efficacité des produits avec lesquelles l’eau entre en contact. Les organismes de certification donnent l’assurance qu’un produit est conforme aux normes applicables; ils doivent être accrédités par le Conseil canadien des normes (CCN). Au Canada, les organismes qui suivent ont été accrédités par le CCN pour homologuer les appareils et matières servant à l’eau potable qui sont conformes aux normes NSF/ANSI (CCN, 2018) :
- CSA Group;
- NSF International;
- Water Quality Association;
- UL LLC;
- Bureau de normalisation du Québec;
- Truesdail Laboratories; et
- International Association of Plumbing and Mechanical Officials.
On peut obtenir une liste à jour des organismes de certification accrédités sur le site Web du CCN.
L’adsorption, l’osmose inverse et la distillation comptent parmi les techniques de traitement de l’eau certifiées conformes aux normes NSF pour la réduction du cadmium. Les normes pertinentes sont les normes NSF/ANSI 53 (NSF/ANSI, 2016a), les normes NSF/ANSI 58 (NSF/ANSI, 2017a) et les normes NSF/ANSI 62 (NSF/ANSI, 2016b). Ces normes exigent que les dispositifs conçus pour réduire le cadmium total soient mis à l’essai et permettent de ramener une concentration moyenne de départ de 0,03 mg/L à au plus 0,005 mg/L.
Afin de limiter l’exposition au cadmium, les matériaux qui entrent en contact avec l’eau potable (composants et produits chimiques de traitement) doivent répondre aux normes en matière de santé. Ces normes garantissent que les matériaux respectent les exigences relatives à la santé et que leur utilisation ne présente aucun danger dans des applications servant à l’eau potable. Les normes NSF/ANSI 61 (NSF/ANSI, 2017b) et 60 (NSF/ANSI, 2017c) exigent que la concentration de cadmium ne dépasse pas la concentration permissible par produit individuel (CPPI) de 0,0005 mg/L dans les matériaux et les produits chimiques de traitement qui entrent en contact avec l’eau potable, respectivement.
8.0 Cinétique et métabolisme
8.1 Absorption
On a étudié l’absorption de cadmium radioactif après ingestion chez des sujets humains et mesuré une adsorption variant d’environ 4,6 % à 10,6 % (Nordberg et coll., 2007). L’absorption de cadmium par ingestion a récemment été examinée dans le cadre d’une évaluation des risques liés au cadmium dans les aliments réalisée par Santé Canada (2018a), et la biodisponibilité du cadmium dans l’eau potable et les aliments serait comparable (Ruoff et coll., 1994). On a souligné qu’en général, la biodisponibilité du cadmium alimentaire était légèrement plus faible chez les animaux de laboratoire (0,5 à 3,0 %) que chez les humains (1 à 10 %) (JECFA, 2011). Selon les études effectuées sur des animaux, l’absorption de cadmium ingéré dépend d’un certain nombre de facteurs, notamment le type de composé de cadmium, la dose, la fréquence d’exposition, les concentrations d’autres composants alimentaires et l’âge de l’animal. L’absorption de cadmium peut être plus importante si les concentrations d’autres métaux dans l’organisme (calcium, fer et/ou zinc) sont faibles (Reeves et Chaney, 2008; Nawrot et coll., 2010; ATSDR, 2012). De plus, la composition du régime alimentaire et l’état du tube digestif sont susceptibles d’avoir une plus grande influence sur la biodisponibilité que le milieu d’exposition au cadmium (Ruoff et coll., 1994).
Après ingestion, l’absorption suit un processus en deux étapes : le cadmium est d’abord absorbé dans le tractus gastro-intestinal (ce qui produit une accumulation rapide de cadmium dans la muqueuse), puis lentement libéré dans la circulation générale (Zalups et Ahmad, 2003).
8.2 Distribution
Après l’absorption, on a suggéré que différents mécanismes jouaient un rôle dans le transport subséquent du cadmium dans l’organisme, notamment les protéines servant au transport des métaux, les canaux calciques et les transporteurs d’aminoacides. L’endocytose des complexes métallothionéine-cadmium (Cd-MT) est aussi possible (Zalups et Ahmad, 2003). Le cadmium est d’abord transporté vers le foie, où il est capté dans les hépatocytes et induit une synthèse des MT. Par la suite, la plus grande partie des complexes Cd-MT se dirigent vers les reins, où ils sont filtrés par les membranes glomérulaires des néphrons et rapidement et presque complètement captés par les cellules des tubules proximaux (Nordberg et coll., 2007). Bien que le cadmium soit distribué dans tout le corps, des examens réalisés dans le cadre d’autopsies ont révélé que la plus grande partie de la charge corporelle de cadmium était concentrée dans le rein, suivi du foie et des muscles (JECFA, 2011). Bien que la charge de cadmium dans le rein soit presque nulle à la naissance, il est établi que la concentration augmente de façon linéaire avec l’âge et culmine vers 50 ou 60 ans (ASTDR, 2012).
8.3 Métabolisation
Le cadmium n’est pas métabolisé par le corps humain. L’ion bivalent n’est pas susceptible d’être modifié à l’état d’oxydation. Le cadmium peut toutefois se fixer à des groupes anioniques (dont l’albumine et les métallothionéines) et être ainsi transporté dans le plasma (Roberts et Clark, 1988; ASTDR, 2012).
8.4 Excrétion
Le cadmium est excrété dans l’urine et les selles. L’excrétion du cadmium dans l’urine est proportionnelle à la charge corporelle, laquelle augmente avec l’âge (Nordberg et coll., 2007). L’excrétion dans l’urine peut varier considérablement d’une personne à l’autre, selon que les reins sont ou non endommagés. Étant donné que le cadmium est peu absorbé, l’excrétion fécale se rapproche de la dose ingérée. On a par ailleurs remarqué que l’excrétion lente du cadmium absorbé se traduisait par une longue demi-vie biologique. On a estimé que la demi-vie du cadmium chez les humains variait de10 à 30 ans, avec une accumulation importante dans le rein (Nordberg et coll., 2007).
8.5 Modèles pharmacocinétiques à base physiologique
Un certain nombre de ces modèles ont été mis au point pour décrire la toxicocinétique du cadmium chez les mammifères (ATSDR, 2012). Le modèle Nordberg-Kjellström est le plus largement utilisé pour l’évaluation des risques pour la santé humaine, car il est fondé sur des données recueillies chez les humains, alors que d’autres modèles décrivent la toxicocinétique chez des animaux de laboratoire (Nordberg et Kjellström, 1979). Ce modèle linéaire multi-compartimental décrit la toxicocinétique du cadmium chez les humains lors d’une exposition par voie orale et par inhalation et pose comme hypothèse que le rein et le foie sont les principaux organes dans lesquels s’accumule le cadmium. Comme il est indiqué dans un résumé détaillé présenté par l’ATSDR (2012), de nombreuses variantes de ce modèle ont été mises au point.
En 2011, le Comité mixte FAO/OMS d’experts des additifs alimentaires (JECFA) a utilisé un modèle toxicocinétique à un compartiment d’Amzal et coll. (2009) pour estimer l’exposition au cadmium par voie alimentaire (débit de dose) qui se traduirait par une concentration urinaire de cadmium correspondant au point de rupture pour un dysfonctionnement des tubules rénaux (JECFA, 2011; Santé Canada, 2018a). Le JECFA a utilisé une version modifiée du modèle de Nordberg-Kjellström et quantifié la variabilité interindividuelle de la demi-vie du cadmium au sein de la population. Les simulations bidimensionnelles de Monte Carlo ont permis d’établir les intervalles de confiance au 95e centile. Une analyse de sensibilité a été réalisée afin de montrer la robustesse du modèle simplifié à un compartiment aux fins de l’évaluation des risques liés au cadmium (Amzal et coll., 2009).
9.0 Effets sur la santé
Les effets sur la santé d’une exposition au cadmium par voie orale ont été examinés dans d’autres évaluations (EFSA, 2009b; JECFA, 2011; ATSDR, 2012; Santé Canada, 2018a). Santé Canada (2018a) a effectué une évaluation du cadmium dans les aliments; le lecteur est invité à consulter ce document comme source complémentaire à la présente évaluation du cadmium dans l’eau potable. Pour cette évaluation des dangers de 2018, les données existantes, y compris les évaluations des risques complètes et les analyses complémentaires (AESA, 2009b, 2009b, 2011; JECFA, 2011; ATSDR, 2012), et les sources principales qui ont été publiées ont été examinées. Plus précisément, les études concernant le devenir métabolique, les effets toxiques évalués dans les études sur le régime alimentaire menées sur des animaux de laboratoire et in vitro (y compris les effets sur les reins, les effets sur les os et le métabolisme du calcium, la cancérogénicité et la génotoxicité) et les études menées chez les humains qui examinent les associations entre l’exposition au cadmium et les effets sur les reins, les os et le métabolisme du calcium, ainsi que l’apparition du cancer ont été prises en compte. Comme il est indiqué ci-dessous, le rein et les os semblent être les cibles les plus sensibles de la toxicité induite par le cadmium.
9.1 Effets chez les humains
9.1.1 Toxicité aiguë
Une gastroentérite aiguë a été signalée après des expositions par voie orale à de fortes concentrations de cadmium utilisé pour le plaquage de contenants et d’ustensiles de cuisine (Nordberg et al, 2007). Bernard et Lauwerys (1984) ont indiqué que les doses létales de cadmium se situaient entre 350 et 8 900 mg/personne.
9.1.2 Toxicité subchronique et chronique et cancérogénicité
9.1.2.1 Effets rénaux
Le développement d’une toxicité rénale à la suite d’une exposition au cadmium par voie orale a été étudié et examiné en détail dans les publications spécialisées et considéré comme un effet sur la santé sensible et stratégique pour une exposition par voie orale dans de nombreuses évaluations publiées des risques (EFSA, 2009b, 2011; JECFA, 2011; Santé Canada, 2018a). Ces évaluations des risques sont fondées sur de grands ensembles d’études épidémiologiques qui ont été publiées et résumées dans une méta-analyse (EFSA, 2009b).
Il est reconnu que l’exposition au cadmium cause des lésions dans le tubule proximal du néphron, altérant ainsi la réabsorption des molécules de faible poids moléculaire et des enzymes par le foie (EFSA, 2009b). Dans des circonstances normales, les protéines sont filtrées par le glomérule du néphron et réabsorbées par le tubule proximal. La présence dans l’urine de protéines de faible poids moléculaire, comme la β2-microglobuline (B2M) et la protéine se liant au rétinol (RBP), constitue l’un des premiers signes de toxicité rénale induite par le cadmium et reflète une altération de la réabsorption par le tubule proximal (EFSA, 2009b; Santé Canada, 2018a). Il convient de souligner que l’Autorité européenne de sécurité des aliments (EFSA,2009b) estime que la B2M constituait le biomarqueur le plus sensible et le plus fiable d’une dysfonction rénale. Une excrétion urinaire accrue de ces protéines (plus de 300 µg/g de créatinine de B2M) est une indication d’atteinte rénale et est considérée comme un effet nocif dans les évaluations des risques pour la santé (EFSA, 2009b; JECFA, 2011).
Un autre biomarqueur qui a été employé en tant qu’indicateur fiable d’une atteinte est la N acétyl-ß-D-glucosaminidase (NAG). La NAG est une enzyme lysosomiale qui est souvent utilisée pour évaluer les lésions des cellules tubulaires induites par le cadmium (Prozialeck et Edwards, 2010). La NAG est présente en fortes concentrations dans le tubule proximal, et sa présence dans l’urine est une indication de libération du contenu intracellulaire.
Les études épidémiologiques actuelles sur les effets sur les reins d’une exposition au cadmium par voie orale ont été résumées et analysées en profondeur par le JECFA et l’EFSA. L’exposition au cadmium par voie orale serait responsable de la présence de protéines de faible poids moléculaire dans l’urine. Un certain nombre d’études épidémiologiques se sont penchées sur la concentration urinaire de cadmium et la présence de protéines de faible poids moléculaire, comme la B2M, en tant que biomarqueurs présentant un intérêt pour l’évaluation des risques d’une exposition au cadmium (EFSA, 2009b; JECFA, 2011). Les analyses de ces études épidémiologiques sont examinées en profondeur et comparées dans l’évaluation des risques liés au cadmium dans les aliments (Santé Canada, 2018a).
En 2011, le JECFA a examiné les données épidémiologiques relatives aux effets sur la santé d’une exposition au cadmium et conclu qu’une méta-analyse réalisée par l’EFSA constituait la meilleure façon de définir une gamme de biomarqueurs de la dysfonction rénale (EFSA, 2009b; JECFA, 2011). Dans les deux rapports, on a examiné les données épidémiologiques afin de déterminer les associations entre les biomarqueurs d’exposition (conc. urinaire de cadmium) et l’effet (la B2M pour la protéinurie tubulaire et la NAG pour les lésions cellulaires). On a ensuite utilisé un modèle de toxicocinétique pour prédire la relation entre la concentration urinaire de cadmium et l’apport alimentaire (Amzal et coll., 2009; EFSA, 2009b; JECFA, 2011).
Le rapport de l’EFSA consistait en un examen exhaustif et systématique des publications relatives sur des études épidémiologiques et cliniques portant sur la relation entre la présence de cadmium dans l’urine (concentrations ajustées en fonction de la créatine) et les biomarqueurs d’effet indicateurs d’une toxicité rénale. On a répertorié au total 35 études épidémiologiques dans cet examen, et regroupé les données dans un ensemble de 165 échantillons appariés permettant de comparer les moyennes de groupe pour ce qui est de la concentration urinaire de cadmium et de la B2M à l’aide de la méthode de Cochrane. La plupart des plus de 30 000 sujets inclus dans le jeu de données, était des femmes d’origine asiatique, dont la répartition par âge se situait autour de 50 ans (EFSA, 2009b; Santé Canada, 2018a). On a réalisé l’analyse des données moyennes du groupe à l’aide du modèle de Hill et établi une limite inférieure de l’intervalle de confiance de 95 % de la dose repère (BMD) pour une incidence accrue de 5 % (BMDL05) pour une concentration urinaire de cadmium de 4,0 µg/g de créatinine en se fondant sur un seuil de 300 µg/g de créatinine pour la B2M (EFSA, 2009b).
Bien que les moyennes de groupe aient été utilisées pour tenir compte de la variabilité interindividuelle et inter-étude des concentrations de B2M et des concentrations urinaires de cadmium, l’EFSA a conclu qu’il subsistait une variabilité des concentrations urinaires de cadmium qui n’était pas prise en compte parce qu’on avait utilisé les moyennes de groupe dans le calcul de plages au lieu de chaque point de donnée. C’est pourquoi l’EFSA a jugé approprié d’appliquer un facteur d’ajustement de 3,9, fondé sur les recommandations de l’OMS (OMS, 2005). Enfin, la BMDL05 a été divisée par le facteur d’ajustement pour obtenir la valeur de référence de 1 µg/g de créatinine, pouvant être utilisée comme valeur basée sur la santé (EFSA, 2009b).
Dans son évaluation de 2011, le JECFA a utilisé une approche différente de celle de l’EFSA pour analyser les données épidémiologiques de la méta-analyse. Les données individuelles n’ayant pas été utilisées, on a estimé que la variation observée dans les concentrations de B2M pouvait être attribuable à la variation de la concentration urinaire de cadmium au sein d’un groupe et que l’approche fondée sur la BMD qui avait été utilisée ne permettait pas de modéliser correctement la variation dans la relation cause-effet. Un modèle biexponentiel a été utilisé pour montrer le point de rupture pour une augmentation de la pente de la concentration urinaire de cadmium et de la B2M. Le point de rupture, caractérisé par une nette augmentation de la B2M, était considéré représentatif de l’apparition de changements pathologiques symptomatiques d’une atteinte des tubules rénaux. Ce point de rupture a été établi à 5,24 µg/g de créatinine (4,95 µg/g et 5,57 µg/g pour les 5e et 95e centiles, respectivement) pour la population âgée de 50 ans et plus (JECFA, 2011).
Afin de convertir en dose la concentration urinaire de cadmium associée à l’effet, le JECFA et l’EFSA ont utilisé un modèle de toxicocinétique. Un modèle à un compartiment mis au point par Amzal et coll. (2009) (voir la section 8.5) a servi à cette fin (EFSA, 2009b; JECFA, 2011). JECFA a aussi utilisé un modèle de simulation de Monte Carlo pour estimer les IC des 5e et 95e centiles au point de rupture déterminé. Afin de tenir compte de la variabilité interindividuelle de la réaction toxique au cadmium dans le rein (variation de la concentration urinaire de B2M), le JECFA a introduit une variable toxicodynamique de 3 dans le modèle toxicocinétique. On a calculé qu’une exposition par voie alimentaire à raison de 1,2 µg/kg p.c. par jour (0,8 µg/kg p.c. par jour pour le 5e centile) correspondait à une concentration urinaire de cadmium de 5,24 µg/g de créatinine. On a reconnu que cette valeur pouvait être assimilée à une dose mensuelle tolérable de 25 µg/kg p.c.(JECFA, 2011).
Dans son évaluation de l’approche de l’EFSA (2009b) et de celle du JECFA (2011), Santé Canada a recommandé l’adoption de la dose mensuelle tolérable de 25 µg/kg p.c. fixée par le JECFA (Santé Canada, 2018a). Bien que ces approches soient semblables, leur différence tenait surtout à la façon dont les évaluations prenaient en compte l’utilisation des données sommaires de la méta-analyse. Santé Canada (2018a) a effectué une analyse de sensibilité indépendante en appliquant un facteur d’incertitude classique pour tenir compte de la variabilité interindividuelle et obtenu une valeur de référence comparable à la valeur utilisée par le JECFA pour établir sa valeur toxicologique de référence.
Dans l’ensemble, Santé Canada a retenu la valeur toxicologique de référence du JECFA parce qu’elle s’appuie sur l’approche méthodologique qui reflète le mieux les données disponibles. On a toutefois noté que les résultats de l’une et l’autre méthode étaient statistiquement très semblables et se situaient dans la plage (variant approximativement du simple au double) pouvant être considérée négligeable dans le contexte des autres incertitudes déjà prises en compte dans les analyses (Santé Canada, 2018a, 2018b).
9.1.2.2 Effets sur les os
L’exposition au cadmium est depuis longtemps associée à une densité minérale osseuse réduite, à de l’ostéoporose et à des fractures. Les rapports préliminaires sur cet effet étaient fondés sur des études épidémiologiques réalisées au Japon, dans des régions limitrophes de la rivière Jinzu, contaminée par le cadmium. Plusieurs femmes auraient développé la maladie Itai-Itai, qui se manifeste à la fois par une atteinte rénale (dysfonction tubulaire et glomérulaire) et des lésions osseuses (ostéomalacie et ostéoporose) (Nordberg, 2009). Un certain nombre d’études épidémiologiques ont depuis fait état d’associations entre une exposition chronique à de faibles concentrations de cadmium et divers effets, dont l’ostéoporose, le risque de fracture et une densité minérale osseuse réduite. Santé Canada (2018a) a examiné ces études et conclu que les résultats étaient contradictoires. Compte de tenu de la complexité liée à l’évaluation du risque de fracture ostéoporotique et à la détermination exacte des expositions au cadmium au sein de la population âgée à partir uniquement du taux urinaire de cadmium, on a jugé prématuré de fonder une évaluation des risques sur ces effets (Santé Canada, 2018a).
De même, l’EFSA (2009c) a conclu que, bien que l’exposition au cadmium puisse être responsable d’une altération de la minéralisation osseuse et associée à un risque accru d’ostéoporose, la relation dose-réponse est difficile à caractériser. C’est pourquoi l’EFSA n’a pas inclus ces effets dans sa méta-analyse des études épidémiologiques.
Les études réalisées après la méta-analyse de l’EFSA de 2009 ont été examinées. Bien que des corrélations aient été établies, les études ne justifiaient pas l’utilisation des effets sur les os comme effet clé aux fins de l’évaluation des risques (Santé Canada, 2018a). Chen et coll. (2013) ont calculé une BMDL05 pour un taux urinaire de cadmium de 2,14 µg/g de créatinine chez les femmes chinoises qui présentaient une densité osseuse réduite, une indication de risque accru d’ostéoporose. En revanche, une étude menée au Japon sur 429 femmes de plus de 39 ans n’a pas permis d’établir une corrélation significative entre les paramètres d’évaluation par ultrasons de la densité et des concentrations urinaires moyens de cadmium de 1,93 µg/g de créatinine (Osada et coll., 2011). Une étude a été menée par Suwazono et coll. (2010) sur les effets sur les os dans un groupe de 794 femmes suédoises âgées de 53 à 64 ans. Les auteurs ont établi un certain nombre de BMDL (limite inférieure de l’intervalle de confiance de 95 % de la dose repère), dont la plus faible correspondait à un taux urinaire de cadmium de 1,0 µg/g de créatinine, pour le risque de faible densité minérale osseuse. Plus récemment, une étude longitudinale sur des enfants au Bangladesh a signalé une corrélation entre l’exposition au cadmium et plusieurs biomarqueurs liés aux os, bien que cette étude n’ait pas mesuré la densité osseuse pour déterminer si l’exposition entraînerait des altérations fonctionnelles de la santé des os (Malin et coll., 2019). Les auteurs ont indiqué que des recherches supplémentaires sont nécessaires dans d’autres populations pour caractériser le caractère généralisable des résultats.
Malgré l’incohérence des résultats épidémiologiques et les limites qui font obstacle à l’utilisation des effets sur les os comme effet clé dans cette évaluation des risques, il faut souligner que les effets signalés dans les études qui établissent une corrélation positive entre l’exposition au cadmium et des effets sur les os reposaient sur une gamme d’expositions comparables à celles qui produisaient des effets sur les reins. Bien qu’on ait remarqué qu’une exposition chronique à de faibles concentrations de cadmium produisait des effets sur les os à des doses plus faibles que les doses utilisées dans les études sur la dysfonction rénale chez les animaux, les résultats des études épidémiologiques sont contradictoires (Santé Canada, 2018a). Les concentrations urinaires de cadmium associés à des effets potentiels sur les os provenant des études épidémiologiques variaient d’environ 0,5 µg/g de créatinine à environ 2 µg/g de créatinine, quoique certaines études fassent état de doses sans effet observé à ces concentrations (Santé Canada, 2012).
9.1.2.3 Cancérogénicité
Le cadmium et ses composés ont été classés dans le groupe 1 par le Centre international de recherche sur le cancer (CIRC) et sont considérés comme « cancérogènes pour l’homme » (2012). Cette classification est fondée sur une preuve suffisante de cancérogénicité chez les humains (cancers du poumon, du rein et de la prostate chez des travailleurs exposés par inhalation dans le cadre de leur travail) et une preuve suffisante de cancérogénicité chez les animaux. En dépit de cette classification du cadmium, qui s’appuie sur une exposition par inhalation, les données épidémiologiques établissant un lien entre l’exposition au cadmium par voie orale et le cancer sont limitées. À ce jour, la preuve épidémiologique qui met en relation l’exposition par voie alimentaire à de faibles concentrations de cadmium et les cancers chez l’humain est préliminaire, et les données sur la relation dose-réponse ne sont pas considérées comme une base suffisante pour une évaluation quantitative des risques. Il faudra mener d’autres recherches pour préciser la contribution d’une exposition alimentaire au cadmium au risque global de cancer lié à cette substance (Santé Canada, 2018a). Bien qu’aucune étude portant expressément sur l’exposition au cadmium par voie orale n’ait été réalisée, certaines études environnementales ont été menées dans des secteurs pollués qui ont mesuré les biomarqueurs d’une exposition au cadmium dans le sang et l’urine. Dans certains cas, ces études étaient représentatives d’une exposition à la fois par inhalation et par ingestion, et les conclusions ne sont donc pas nécessairement le reflet de la toxicité par voie orale uniquement.
Comme l’a fait remarquer le CITC, certaines études portant sur le cancer de la prostate se sont révélées peu concluantes. Bien qu’une exposition environnementale au cadmium ait été associée à une incidence accrue du cancer de la prostate (Zeng et coll., 2004; Vinceti et coll., 2007), ces études ne mesuraient ou ne quantifiaient pas exclusivement les expositions par voie orale et n’établissent pas de lien de causalité. D’autres études n’ont pas permis de conclure à un lien entre l’exposition environnementale au cadmium et le cancer de la prostate (Platz et coll., 2002; Chen et coll., 2009). Lors de l’évaluation du taux d’antigène prostatique spécifique chez 1 320 hommes de plus de 40 ans réalisée dans le cadre de l’enquête NHANES (U.S. National Health and Nutrition Examination Survey), on a trouvé peu d’éléments indiquant une corrélation avec des concentrations élevées de cadmium (van Wijngaarden et coll., 2008).
D’autres études ont fait état d’incidences ou de risques accrus de cancer de la vessie, du pancréas et de l’endomètre liés à des concentrations sanguines ou urinaires élevés de cadmium (Kriegel et coll., 2006; Kellen et coll., 2007; Akesson et coll., 2008). Des études épidémiologiques qui portaient sur les associations entre une exposition environnementale au cadmium et le cancer ont été examinées (Satarug et coll., 2010). Dans les études réalisées dans des secteurs pollués du Japon, on a constaté un risque plus élevé de mortalité par cancer chez les personnes qui présentaient des concentrations urinaires de B2M de 1000 µg/g de créatinine et plus, bien que cette hausse de la B2M ne soit pas nécessairement associée à une plus forte incidence de cancer. Les auteurs ont souligné qu’il faudrait mener une étude plus poussée avant de conclure à une association entre le risque de cancer et une exposition environnementale au cadmium (Nishijo et coll., 2006; Arisawa et coll., 2007). Dans une étude portant sur les participants de l’enquête NHANES, on a découvert une association entre une exposition au cadmium et la mortalité due au cancer du poumon, au lymphome non hodgkinien et au cancer du pancréas chez les hommes, mais non chez les femmes (Adams et coll., 2012). Il faut souligner que la moyenne géométrique des concentrations urinaires de cadmium dans l’enquête NHANES était de 0,252 µg/g de créatinine chez les hommes et de 0,352 µg/g de créatinine chez les femmes.
9.1.2.4 Autres effets
Le JECFA considère qu’aucun autre effet non rénal n’est aussi sensible que l’effet sur le rein pour ce qui est de la toxicité induite par le cadmium. Santé Canada (2018a) a examiné la sensibilité des effets sur les reins d’une exposition à des concentrations élevées de cadmium dans les aliments. Outre la réduction de la densité minérale osseuse et l’augmentation de l’ostéoporose et la cancérogénicité décrite aux sections précédentes, les études épidémiologiques ont signalé d’autres effets, notamment le diabète, la neurotoxicité, la maladie cardiovasculaire et l’hypertension (JECFA, 2004, 2011; EFSA 2009b; Santé Canada, 2018a). Dans sa méta-analyse de 2009 des effets épidémiologiques, l’EFSA (2009c) a remarqué que les résultats de ces études étaient trop préliminaires pour servir de point de départ à son évaluation.
Un certain nombre de ces autres effets sur la santé ont été examinés par Satarug et coll. (2010). Un risque accru de prédiabète et de diabète a été signalé chez des personnes présentant des concentrations urinaires de cadmium supérieurs à 2 µg/g de créatinine, comparativement à des sujets affichant des taux inférieurs à 1 µg/g de créatinine (Schwartz et coll., 2003). Dans une autre étude portant sur la néphrose tubulaire chez des patients chinois diabétiques, on a rapporté un risque accru d’altération tubulaire chez les personnes présentant des concentrations urinaires de cadmium de 1 µg/g de créatinine et plus, comparativement à celles dont les taux étaient inférieurs à 1 µg/g de créatinine (Chen et coll., 2006). Une exposition à de fortes concentrations de cadmium a également été associée à une toxicité cardiovasculaire accrue (Satarug et coll., 2010). Dans un secteur pollué du Japon, un risque beaucoup plus important de mortalité par infarctus cérébral a été observé chez les hommes à des concentrations urinaires de cadmium de 1000 µg/g de créatinine et plus (Nishijo et coll., 2006). Le tabagisme est un important facteur de confusion lorsqu’il s’agit de mesurer l’effet du cadmium sur le système cardiovasculaire parce que les concentrations de cadmium sont particulièrement élevées dans la fumée de tabac. Des études épidémiologiques qui ont examiné cet effet possible ont donné des résultats divergents (ATSDR, 2012).
9.1.3 Toxicité pour le développement et la reproduction
On dispose de données limitées sur les effets d’une exposition au cadmium pour le développement et la reproduction chez les humains. Certaines études se sont penchées sur la relation entre une exposition au cadmium et une diminution du poids à la naissance, mais n’ont pas permis de dégager une association significative (ATSDR, 2012). Aucune corrélation n’a été observée entre les concentrations de référence de cadmium dans le sang (de 0,21 µg/L en moyenne) et les effets neurologiques du développement chez des enfants de 2 ans (Cao et coll., 2009).
Des études épidémiologiques ont souligné la modification possible des niveaux d’hormones et de la qualité du sperme chez les hommes exposés à de fortes concentrations de cadmium. Chez les femmes, une étude a établi une corrélation entre des concentrations sanguines élevés de cadmium (0,5 à 8,5 µg/L) et une incidence accrue d’endométriose, alors que dans une autre étude, aucun lien n’a été observé (ATSDR, 2012). Cependant, les résultats de ces études étaient contradictoires et comportaient un certain nombre de facteurs de confusion, et les niveaux d’exposition associés à ces effets dépassent de loin les doses qui produiraient une dysfonction rénale.
9.2 Effets chez les animaux de laboratoire
9.2.1 Toxicité aiguë
Le JECFA (2001) a établi que les valeurs de la dose létale par voie orale 50 (DL50) se situaient entre 100 et 300 mg/kg pour une exposition au cadmium chez les rats et les souris. Une exposition par voie orale à de fortes doses a provoqué une desquamation épithéliale et la nécrose des muqueuses de l’estomac et de l’intestin en plus des effets observés sur le rein, le foie et le cœur (ATSDR, 2012). Chez les très jeunes animaux, les valeurs de la DL50 sont plus faibles que chez les adultes, probablement parce que les organismes en développement présentent une plus grande absorption fractionnelle; les valeurs de la DL50 pour les rats âgés de 2 semaines et de 54 semaines étaient de 47 mg/kg p.c. et de 109 mg/kg p.c., respectivement (ATSDR, 2012).
9.2.2 Exposition de courte durée
Dans des études sur l’exposition subchronique par voie orale chez les animaux, on a essentiellement constaté que la toxicité rénale et les effets sur les os étaient les effets les plus sensibles de la toxicité du cadmium. Les autres effets d’une exposition de moins longue durée n’ayant pas entraîné de mortalité comprennent les effets sur le développement (diminution de la croissance et du poids corporel des nouveau-nés et des fœtus) et sur la reproduction (atrophie testiculaire, modification des niveaux d’hormones), une hémorragie du foie, une irritation du tractus intestinal et de l’estomac et des effets immunologiques, neurologiques et hématologiques (ATSDR, 2012).
9.2.3 Exposition de longue durée et cancérogénicité
9.2.3.1 Effets sur les reins
Le rein est considéré comme un organe critique pour ce qui est de la toxicité du cadmium, et des effets sur les reins ont été observés chez différentes espèces, dont des souris, des rats, des lapins, des chiens et des singes (OMS, 1992; ATSDR, 2012). Le premier signe de toxicité rénale induite par le cadmium est la présence dans l’urine de protéines de faible poids moléculaire, comme la B2M, et d’enzymes. Cet effet, appelé protéinurie, est symptomatique d’une altération de la réabsorption tubulaire et d’une atteinte rénale (Prozialeck et Edwards, 2010; ATSDR, 2012; Santé Canada, 2018a). Les études menées sur des animaux exposés par voie orale au cadmium dans l’eau potable ou les aliments ont signalé une augmentation progressive du taux de cadmium dans le cortex rénal. Un examen des dommages induits a révélé une lésion tubulaire. Les plages mesurées de doses sans effet nocif observé (no observed adverse effect level ou NOAEL) et de doses minimales avec effet nocif observé (lowest-observed-adverse-effect ou LOAEL) pour les effets sur les reins du chlorure de cadmium administré à divers animaux dans l’eau potable étaient de 0,4 à 2,6 mg/kg p.c. par jour et de 1,5 à 15 mg/kg p.c. par jour, respectivement (JECFA, 2011). On a remarqué que, chez les animaux, des effets étaient généralement observés lorsque les taux de cadmium dans le cortex rénal se situaient entre 200 et 300 µg/kg de poids humide et que ces concentrations étaient attribuables à une exposition à des doses de 1 à 10 mg/kg p.c. par jour (JECFA, 2011).
L’exposition de rats Sprague-Dawley femelles à 200 ppm de cadmium dans l’eau potable pendant une période de 11 mois a induit une protéinurie, mesurée par la présence de protéines de faible poids moléculaire dans l’urine (Bernard et coll., 1981). L’effet observé coïncidait avec la stabilisation des concentrations de cadmium dans le cortex rénal et le foie. L’hypercalciurie observée après une exposition au cadmium serait aussi un indicateur d’une capacité réduite de réabsorption rénale (Prozialeck et Edwards, 2010).
Une exposition supplémentaire ou subséquente au cadmium a aussi déterminé une altération de la filtration glomérulaire, ce qui a produit une augmentation des concentrations de créatinine sérique et d’azote uréique sanguin. Une sclérose des glomérules a aussi été signalée, en plus de divers changements dans les cellules du tubule proximal (JECFA, 2011; Santé Canada, 2018a). Il est à noter que les modifications constatées dans la fonction rénale après une exposition au cadmium étaient accompagnées de changements morphologiques dans la structure du néphron (fibrose interstitielle et épaississement de la membrane basale des cellules du tubule proximal, sclérose des glomérules) (JECFA, 2011).
9.2.3.2 Effets sur les os
L’effet du cadmium sur les os serait un effet toxique sensible. Dans certaines études, on a observé des effets dans la plage de doses associées à une toxicité rénale et à des doses plus faibles (Jarup et coll., 1998; JECFA, 2011; Santé Canada, 2018a). Il est établi que le cadmium a une incidence directe sur la minéralisation des os en causant une homéostasie anormale du calcium (Jarup et coll., 1998; Yokota et Tonami, 2008). Le cadmium a aussi un effet indirect sur la solidité des os, l’hydroxylation de la vitamine D empêchant l’absorption du calcium (Jarup et coll., 1998). Une augmentation de l’excrétion urinaire de calcium a été constatée chez les rats au début de l’atteinte rénale, ce qui peut se traduire par une diminution de la densité osseuse, une ostéopénie et de l’ostéoporose chez les femelles au fil du temps (Brzóska et Moniuszko-Jakoniuk, 2005; Brzóska et coll., 2005; Bhattacharyya, 2009).
Des rats exposés à 1 µg/mL de cadmium dans l’eau potable (apport de 0,059–0,219 mg/kg p.c. par jour) depuis leur sevrage jusqu’à l’âge de 24 mois auraient présenté une déminéralisation des vertèbres et un affaiblissement osseux. La densité minérale osseuse était plus faible chez les femelles, et l’excrétion du calcium avait à peu près doublé au cours d’une période de 3 mois (Bhattacharyya, 2009). On a également remarqué que l’âge était un facteur pouvant influer sur la gravité des effets observés chez les animaux. Les atteintes au squelette résultant d’une exposition au cadmium chez les rats étaient beaucoup plus importantes lorsque les sujets étaient exposés pendant la phase de croissance rapide qu’à l’âge adulte (Brzóska et coll., 2005; Bhattacharyya, 2009).
Il a été montré qu’une exposition au cadmium donnait lieu à une réduction de l’activité de formation des os, et une culture d’organes a révélé des changements dans la déminéralisation osseuse. Une excrétion accrue du calcium chez les rats a aussi été signalée dans les heures qui ont suivi l’exposition (Bhattacharyya, 2009).
9.2.3.3 Cancérogénicité
La plupart des données toxicologiques disponibles sont dérivées d’expositions par inhalation, et l’information sur la cancérogénicité par voie orale est limitée. Des études d’exposition par voie orale ont révélé une augmentation de l’incidence des tumeurs de la prostate à des doses élevées. Une incidence accrue de leucémie et de tumeurs de la prostate et des testicules a été observée chez les rats qui avait été exposés à environ 1,75 à 14 mg Cd/kg p.c. par jour (25 à 200 ppm dans les aliments) pendant 77 jours, bien qu’aucune relation dose-réponse claire n’ait été établie (Waalkes et Rehm, 1992). Des tumeurs de la prostate ont été observées à des doses qui ne sont pas réputées causer de toxicité testiculaire ou lorsqu’on avait prévenu cette toxicité par l’administration concomitante de zinc. On a postulé qu’une réduction de la production d’androgènes pouvait être responsable d’une plus faible incidence de tumeurs de la prostate à de fortes doses de cadmium, car les tumeurs de la prostate sont souvent testostérono-dépendantes (Jarup et coll., 1998). Cependant, la pertinence de cet effet chez les humains a été remise en question dans d’autres évaluations, compte tenu des différences anatomiques entre la prostate du rat et celle de l’humain (JECFA, 2011).
9.2.3.4 Autres effets
Une exposition au cadmium par voie orale a été aussi associée à un certain nombre d’autres effets moins sensibles chez les animaux de laboratoire, notamment des effets sur les systèmes immunitaire, cardiovasculaire et nerveux (OMS, 1992). Des effets sur la reproduction et le développement ont été observés dans un certain nombre d’études et sont résumés à la section 9.2.5.
9.2.4 Génotoxicité
9.2.4.1 Résultats in vitro
Des études menées à partir d’essais bactériologiques et d’essais normalisés sur des mammifères ont indiqué que le cadmium n’est généralement pas mutagène et que les effets observés étaient faibles ou n’étaient présents qu’à de fortes concentrations. Plutôt que de présupposer une génotoxicité directe, on a postulé que d’autres mécanismes secondaires seraient responsables des effets cancérogènes signalés (EFSA 2009b; Hartwig, 2010; JECFA, 2011). On a résumé les études portant sur la génotoxicité in vitro du cadmium dans des expérimentations animales afin de mettre en lumière les effets clastogènes, dont la formation de micronoyaux et les aberrations chromosomiques, l’échange de chromatides sœurs et l’induction de dommages à l’ADN dans divers types de cellules humaines et animales (Waalkes, 2003; Joseph, 2009; ATSDR, 2012).
9.2.4.2 Résultats in vivo
Les études in vivo effectuées chez des humains exposés en milieu de travail, des souris, des rats et des hamsters semblent toutes indiquer des effets clastogènes. Bien qu’ils ne soient pas toujours uniformes, les rapports faisaient généralement état de résultats positifs pour ce qui est de la formation de micronoyaux et des aberrations chromosomiques et de l’échange de chromatides sœurs (ATSDR, 2012).
9.2.5 Toxicité pour la reproduction et le développement
Divers effets sur le développement ont été observés chez les animaux de laboratoire. Ces effets comprennent une diminution du poids fœtal, une hausse de la mortalité fœtale et des malformations du squelette et surviennent à des doses qui sont toxiques pour la mère. Des effets sur le développement neurocomportemental ont été signalés à des concentrations n’ayant pas produit d’effets toxiques sur la mère, ce qui donne à penser que ces effets constituent un paramètre sensible (JECFA, 2004). Parmi les effets neurocomportementaux mentionnés dans la documentation, mentionnons une diminution de l’activité locomotrice exploratoire et des altérations neurocomportentales et neurochimiques (ATSDR, 2012). Ces effets ont généralement été observés chez des rats à des doses plus élevées que celles auxquelles des effets sont signalés dans le rein.
9.3 Mode d’action
9.3.1 Effets sur les reins
Le rein est une cible sensible de la toxicité induite par le cadmium lors d’une exposition par voie orale. Le cadmium s’accumule dans les cellules du tubule proximal, dans le cortex rénal, et produit des changements morphologiques et fonctionnels dans le rein. La réabsorption des protéines de faible poids moléculaire et des enzymes est entravée, comme en témoigne leur présence dans l’urine (Prozialeck et Edwards, 2010).
Le mécanisme précis par lequel le cadmium induit une néphrotoxicité demeure obscur, mais on pense que les protéines qui se lient aux métaux, à savoir les métallothionéines (MT) pourraient jouer un rôle important dans la modulation de la toxicité. La toxicité du cadmium dans le rein survient lorsqu’un certain seuil est atteint dans le cortex rénal. On postule que les MT endogènes retiennent le cadmium dans les cellules des tubules et qu’une fois que la capacité du rein à neutraliser le cadmium lié aux MT est dépassée (au-delà d’une concentration critique de cadmium), les niveaux d’ions cadmium libres augmentent et des dommages sont causés au rein (Sabolić et coll., 2010). Ces dommages entraînent une perturbation de l’homéostasie et du transport ionique, de la régulation des cations biologiques et des voies de signalisation cellulaires. Dans les mitochondries, le cadmium inhibe la chaîne respiratoire, et la production de dérivés réactifs de l’oxygène cause un stress oxydatif (Cuypers et coll., 2010).
9.3.2 Effets sur les os
L’exposition au cadmium a aussi été associée à l’ostéomalacie, une pathologie caractérisée par une minéralisation déficiente des os. On pensait à l’origine qu’après une exposition à de fortes concentrations de cadmium, cette pathologie était secondaire aux effets observés dans le rein, notamment une production réduite de vitamine D et une diminution de la réabsorption du calcium. Des études effectuées sur des animaux ont toutefois montré une accélération de la perte osseuse avant l’apparition de la dysfonction rénale. Ce résultat soulève la possibilité que le cadmium ait une incidence directe sur la minéralisation osseuse; des incertitudes subsistent quant au mécanisme par lequel le cadmium produit des effets sur les os (Bharracharyya, 2009; Santé Canada, 2018a). Plus récemment, on a montré que le chlorure de cadmium supprime l’ostéogenèse des cellules souches mésenchymateuses de la moelle osseuse en inhibant la voie de signalisation Wnt/β-caténine, ce qui indique un autre mécanisme possible de lésion osseuse induite par le cadmium (Wu et coll., 2019).
10.0 Classification et évaluation
Le Centre international de recherche sur le cancer a classé le cadmium parmi les substances du groupe 1, c’est-à-dire les substances cancérogènes pour les humains, en se fondant sur une preuve suffisante de sa cancérogénicité chez les animaux et les humains (cancer du poumon, du rein et de la prostate chez les travailleurs exposés par inhalation dans le cadre de leur travail). Cette classification s’appuie sur une exposition par inhalation, et les données épidémiologiques établissant un lien entre l’exposition au cadmium par voie orale et le cancer sont limitées (Santé Canada, 2018a). Comme le souligne la récente évaluation de Santé Canada, les données épidémiologiques actuelles établissant un lien entre l’exposition alimentaire à de faibles concentrations de cadmium et les cancers chez les humains ne sont que préliminaires, et les données existantes sur la relation dose-réponse ne sont pas considérées comme un fondement acceptable pour une évaluation quantitative des risques. Des recherches supplémentaires sont nécessaires pour déterminer si l’exposition alimentaire au cadmium contribue au risque global (Santé Canada, 2018a). Bien que la base de données sur la cancérogénicité par voie orale présente des lacunes, les données concernant les animaux et les humains donnent à penser que le cadmium n’est pas génotoxique à action directe et qu’il existerait donc un seuil.
À l’heure actuelle, la toxicité rénale est l’effet sensible le mieux caractérisé et le plus préoccupant pour ce qui est de l’exposition au cadmium par voie orale. Une exposition à de fortes concentrations de cadmium aurait causé des effets sur les os, notamment de l’ostéomalacie et de l’ostéoporose. Ces effets peuvent toutefois être consécutifs aux effets du cadmium sur le rein (notamment une diminution de la conversion de la vitamine D et de la réabsorption du calcium par le tubule proximal), et une incertitude subsiste pour ce qui est du mécanisme par lequel le cadmium produit ces effets. Des effets sur les os ont été signalés après une exposition à des doses de cadmium plus faibles que les doses associées à des effets sur les reins dans les études sur des animaux, mais les résultats des études épidémiologiques étaient contradictoires. L’interprétation des résultats de ces études épidémiologiques transversales pose un certain nombre de difficultés, notamment le moment où survient la perte de densité osseuse type. La perte de densité osseuse augmente avec l’âge et coïncide avec le moment où les concentrations urinaires de cadmium augmentent avec la charge corporelle dans des conditions d’exposition chronique à de faibles doses (Santé Canada, 2018a). Il est prématuré de considérer ces effets comme un effet critique aux fins de l’établissement d’une dose toxicologique de référence pour le cadmium, compte tenu de la complexité liée à l’évaluation du risque de fracture et des défis associés à la détermination des expositions au cadmium à partir de l’urine uniquement au sein de la population âgée (Santé Canada, 2018a, 2018b).
La toxicité rénale a été retenue en tant qu’effet critique pour un certain nombre d’évaluations des risques (EFSA, 2009b; JECFA, 2011; Santé Canada, 2018a). Cette relation dose-réponse a été étudiée en profondeur et analysée dans des études épidémiologiques et toxicologiques. Santé Canada (2018a) a examiné les données disponibles et conclu que l’évaluation du JECFA (2011) était celle qu’il convenait d’utiliser pour l’établissement d’une valeur de référence pour le cadmium. Cette évaluation est fondée sur une méta-analyse de grande envergure des études épidémiologiques qui ont mesuré la relation dose-réponse pour les biomarqueurs urinaires : concentration urinaire de cadmium (biomarqueur d’exposition) et B2M (biomarqueur d’effet). On a établi une concentration urinaire de cadmium (point de rupture) en deçà de laquelle aucune augmentation correspondante de la B2M n’a été observée. L’exposition alimentaire qui produirait une concentration de cadmium au point de rupture a été déterminée à l’aide d’un modèle toxicocinétique (JECFA, 2011). Cette analyse a permis d’établir pour une exposition alimentaire au cadmium une dose mensuelle tolérable de 25 µg/kg p.c. Une dose correspondante de 0,8 µg/kg p.c. par jour peut être adoptée comme apport quotidien tolérable (AQT) aux fins du calcul d’une valeur basée sur la santé (VBS) pour le cadmium dans l’eau potable.

Description textuelle
La VBS pour le cadmium dans l’eau potable est de 0,007 mg/L (arrondie). Cette valeur est calculée en multipliant l’AQT de cadmium, soit 0,0008 mg/kg p.c. par jour, par 70 kg, le poids corporel moyen d'un adulte puis par le facteur d’attribution de l’eau potable, 0,2, et en divisant le résultat par 1.5 L/jour, le volume quotidien d'eau consommé par un adulte.
Où :
- 0,0008 mg/kg par jour correspond à l’AQT calculé ci-dessus;
- 70 kg est le poids corporel moyen d’un adulte (Santé Canada, 1994);
- 0,2 est le facteur d’attribution par défaut pour l’eau potable, utilisé comme « valeur plancher », étant donné que les aliments constituent la principale source d’exposition et que l’eau potable ne contribue pas de façon importante à l’exposition totale (Krishnan et Carrier, 2013); et
- 1,5 L est la quantité d’eau consommée quotidiennement par un adulte.
10.1 Considérations internationales
Les recommandations, normes et/ou directives relatives à la qualité de l’eau potable établies par des organisations canadiennes et étrangères peuvent varier en fonction de la date à laquelle remonte l’évaluation sur laquelle elles sont fondées, et en fonction des différences relatives aux politiques et aux démarches appliquées, y compris en ce qui concerne le choix de l’étude principale ou les taux de consommation, les poids corporels et les facteurs d’attribution liés à la source employés.
Divers organismes ont établi des valeurs pour le cadmium dans l’eau potable en se fondant sur sa toxicité pour les reins. La recommandation établie par Santé Canada est comparable aux valeurs établies dans d’autres pays et organismes. L’U.S. EPA (1995) a fixé un niveau maximal de contaminant de 0,005 mg/L en s’appuyant sur les effets sur les reins. La recommandation australienne pour l’eau potable (NHMRC, 2011) de 0,002 mg/L pour le cadmium, adoptée en 1996, est fondée sur les travaux du JECFA (2000). L’OMS (2011) a retenu une recommandation pour la qualité de l’eau potable de 0,003 mg/L, en se basant sur les effets sur les reins observés dans l’évaluation du JECFA (2000), car le calcul de la valeur de la recommandation est demeuré inchangé dans l’évaluation du JECFA (2011). La directive de l’Union européenne (1998) comporte une valeur paramétrique de 0,005 mg/L pour le cadmium dans l’eau potable. Les variations de ces valeurs peuvent être attribuées aux hypothèses implicites utilisées par les différents organismes aux fins du calcul du risque.
11.0 Justification
Les aliments sont la principale source d’absorption de cadmium au sein de la population générale. De petites quantités de cadmium d’origine naturelle sont libérées dans l’eau par les roches et les sols. Le cadmium pénètre aussi dans l’environnement du fait de l’activité humaine. L’exposition au cadmium par l’eau potable est généralement faible et se limite à une exposition par ingestion.
Bien que le CIRC ait classé le cadmium parmi les carcinogènes du groupe 1, cette classification se fonde sur une exposition par inhalation, et les données probantes établissant un lien entre une exposition par voie orale au cadmium et le cancer chez les humains sont limitées.
Une VBS de 0,007 mg/L (7 µg/L) pour le cadmium dans l’eau potable est fondée sur les effets sur les reins chez les humains.
Une CMA de 0,007 mg/L (7 µg/L) est établie pour le cadmium dans l’eau potable. La CMA protège contre les effets potentiels sur la santé, peut être mesurée de façon fiable au moyen des méthodes analytiques existantes et est atteignable au moyen de technologies de traitement municipales et résidentielles relatives aux incrustations.
Dans le cadre de son processus d’examen continu des lignes directrices, Santé Canada continuera de surveiller les nouvelles recherches dans ce domaine et recommandera des changements à ce document technique si le Ministère le juge nécessaire.
12.0 Références
Adams, S.V. and Newcomb, P.A. (2014). Cadmium blood and urine concentrations as measures of exposure: NHANES 1999–2010. J. Expo. Sci. Environ. Epidemiol., 24(2): 163–70.
Adams, S.V., Passarelli, M.N. and Newcomb, P.A. (2012). Cadmium exposure and cancer mortality in the Third National Health and Nutrition Examination Survey cohort. Occup. Environ. Med., 69(2): 153–6.
Ahmedzeki, N.S. (2013). Adsorption filtration technology using iron-coated sand for the removal of lead and cadmium ions from aquatic solutions. Desal. Water Treat., 51(28–30): 5559–5565.
Akesson, A., Julin, B. and Wolk, A. (2008). Long-term dietary cadmium intake and postmenopausal endometrial cancer incidence: a population-based prospective cohort study. Cancer Res., 68(15): 6435–6441.
Alberta Environment and Parks (2017). Personal communication with D. Reid, Operations Division.
Amara-Rekkab, A. and Didi, M.A. (2015). Removal of Cd(II) and Hg(II) by chelating resin chelex-100. Orient. J. Chem., 31(1): 205.
Amzal, B., Julin, B., Vahter, M., Wolk, A., Johanson, G. and Akesson, A. (2009). Population toxicokinetic modeling of cadmium for health risk assessment. Environ. Health Perspect., 117(8): 1293–1301.
APHA, American Water Works Association and Water Environment Federation (2017). Standard methods for the examination of water and wastewater, 23nd edition. American Public Health Association, Washington, DC.
Arisawa, K., Uemura, H., Hiyoshi, M., Dakeshita, S., Kitayama, A., Saito, H. and Soda, M. (2007). Cause-specific mortality and cancer incidence rates in relation to urinary beta2-microglobulin: 23-year follow-up study in a cadmium-polluted area. Toxicol. Lett., 173(3): 168–174.
ATSDR (2012) Toxicological profile for cadmium. Agency for Toxic Substances and Disease Registry. Public Health Service, U.S. Department of Health and Human Services, Atlanta, Georgia.
AWWA, (2011). Internal corrosion control in water distribution systems. Manual of Water Supply Practices – M58. American Water Works Association, Denver, Colorado
AWWA (2016). Cement-mortar lining for ductile-iron pipe and fittings ANSI/AWWA Standard C104/A21.4-16. American Water Works Association, Denver, Colorado.
Ayati, M. and Lundager Madsen, H.E. (2000). Crystallization of some heavy-metal phosphates alone and in the presence of calcium ion. J. Cryst. Growth, 208(1): 579–591.
Baker, H.M., Massadeh, A.M. and Younes, H.A. (2009). Natural Jordanian zeolite: Removal of heavy metal ions from water samples using column and batch methods. Environ. Monit. Assess., 157(1): 319–330.
Bari, M.A, Kindzierski, W.B., Wallace, L.A., Wheeler, A.J., MacNeill, M. and Héroux, M.È. (2015). Indoor and outdoor levels and sources of submicron particles (PM1) at homes in Edmonton, Canada. Environ. Sci. Technol., 49(11): 6419–6429.
Barton, H. (2005). Predicted intake of trace elements and minerals via household drinking water by 6-year-old children from Kraków, Poland. Part 2: Cadmium, 1997–2001. Food Addit. Contam., 22(9): 816–828.
Batjargal, T., Yang, J., Kim, D. and Baek, K. (2011). Removal characteristics of Cd(II), Cu(II), Pb(II), and Zn(II) by natural Mongolian zeolite through batch and column experiments. Sep. Sci. Technol., 46(8): 1313–1320.
Bell, R.R. and Saunders, G.C. (2005). Cadmium adsorption on hydrous aluminium (III) oxide: Effect of adsorbed polyelectrolyte. Appl. Geochem., 20(3): 529–536.
Benjamin, M., Sontheimer, H. and Leroy, P. (1996). Corrosion of iron and steel. Chapter 2 in: Internal corrosion of water distribution systems, 2nd edition. American Water Works Association Research Foundation, Denver, Colorado.
Berend, K. and Trouwborst, T. (1999). Cement-mortar pipes as a source of aluminum. J. Am. Water Works Assoc., 91(7): 91–100.
Bernard, A., Lauwerys, R. and Gengoux, P. (1982). Characterization of the proteinuria induced by prolonged oral administration of cadmium in female rats. Toxicology, 20(4): 345–357.
Bhattacharyya, M.H. (2009). Cadmium osteotoxicity in experimental animals: mechanisms and relationship to human exposures. Toxicol. Appl. Pharmacol., 238(3): 258–265.
British Columbia Ministry of Health (2017). Personal communication with D. Fishwick.
Brzóska, M.M. and Moniuszko-Jakoniuk, J. (2005). Bone metabolism of male rats chronically exposed to cadmium. Toxicol. Appl. Pharmacol., 207(3): 195–211.
Brzóska, M.M., Majewska, K. and Moniuszko-Jakoniuk, J. (2005). Bone mineral density, chemical composition and biomechanical properties of the tibia of female rats exposed to cadmium since weaning up to skeletal maturity. Food Chem. Toxicol., 43(10): 1507–1519.
Bunn, R.A., Magelky, R.D., Ryan, J.N. and Elimelech, M. (2002). Mobilization of natural colloids from an iron oxide-coated sand aquifer: Effect of pH and ionic strength. Environ. Sci. Technol., 36(3): 314–322.
Calmon, C. (1974). Trace heavy metals in water: removal processes by ion-exchange. Chapter 1 in Traces of heavy metals in water removal processes and monitoring. Sabadell, J.E., (ed.) Proceedings of a symposium conducted by the Center for Environmental Studies and the Water Resources Program, Princeton University, in cooperation with the U.S. EPA and the American Institute of Chemical Engineers. (EPA Report No. EPA–902/9–74–001).
Cao, Y., Chen, A., Radcliffe, J., Dietrich, K.N., Jones, R.L., Caldwell, K. and Rogan, W.J. (2009). Postnatal cadmium exposure, neurodevelopment, and blood pressure in children at 2, 5, and 7 years of age. Environ. Health Perspect., 17(10): 1580–1586.
CCME (1996). Canadian soil quality guidelines for the protection of environmental and human health: cadmium. Canadian Council of Ministers of the Environment. Available at: www.ccme.ca/files/ceqg/en/backup/261.pdf.
CCPSA (2018). Canada Consumer Product Safety Act, Children’s Jewellery Regulations. SOR/2018-82. Available at: https://laws-lois.justice.gc.ca/eng/regulations/SOR-2018-82/index.html.
CDC (Centers for Disease Control and Prevention). (2009). Fourth national report on human exposure to environmental chemicals. Department of Health and Human Services, Atlanta, GA. Retrieved July 11, 2011, available from www.cdc.gov/exposurereport/.
Chao, T.T. (1976). The significance of secondary iron and manganese oxides in geochemical exploration. Econ. Geol. Bull. Soc. Econ. Geol., 71(8): 1560–1569.
Chen, L., Lei, L., Jin, T., Nordberg, M. and Nordberg, G.F. (2006). Plasma metallothionein antibody, urinary cadmium, and renal dysfunction in a Chinese type 2 diabetic population. Diabetes Care, 29(12): 2682–2687.
Chen, Y.C., Pu, Y.S., Wu, H.C., Wu, T.T., Lai, M.K., Yang, C.Y. and Sung, F.C. (2009). Cadmium burden and the risk and phenotype of prostate cancer. BMC Cancer, 9: 429.
Chen, X., Gan, C., Zhu, G. and Jin, T. (2013). Benchmark dose for estimation of cadmium reference level for osteoporosis in a Chinese female population. Food Chem. Toxicol., 55: 592–595.
Clark, B.N., Masters, S.V. and Edwards, M.A. (2015). Lead release to drinking water from galvanized steel pipe coatings. Environ. Eng. Sci., 32(8): 713–721.
Clifford, D. and Sorg, T.J. (1986). Removing dissolved inorganic contaminants from water. Environ. Sci. Technol., 30(11): 1072–1080.
Crea, F., Foti, C., Milea, D. and Sammartano, S. (2013). Speciation of cadmium in the environment. Chapter 3 in: Cadmium: From toxicity to essentiality. Sigel, H. (ed.). Met. Ions Life. Sci., 11: 63–83.
Cuypers, A., Plusquin, M., Remans, T., Jozefczak, M., Keunen, E., Gielen, H., Opdenakker, K., Nair, A.R., Munters, E., Artois, T.J., Nawrot, T., Vangronsveld, J. and Smeets, K. (2010). Cadmium stress: an oxidative challenge. Biometals, 23(5): 927–940.
Dabrowski, A., Hubicki, Z., Podkoscielny, P. and Robens, E. (2004). Selective removal of the heavy metal ions from waters and industrial wastewaters by ion-exchange method. Chemosphere, 56(2): 91–106.
Demirbas, A., Pehlivan, E., Gode, F., Altun, T. and Arslan, G. (2005). Adsorption of Cu(II), Zn(II), Ni(II), Pb(II), and Cd(II) from aqueous solution on Amberlite IR-120 synthetic resin. J. Colloid Interf. Sci., 282(1): 20–25.
Deshommes, E., Laroche, L., Nour, S., Cartier, C. and Prévost, M. (2010). Source and occurrence of particulate lead in tap water. Water Res., 44(12): 3734–3744.
Edwards, M. and Benjamin, M.M. (1989). Adsorptive filtration using coated sand: A new approach for treatment of metal-bearing wastes. Res. J. Water Pollut. Control Fed., 61(9): 1523–1533.
EFSA (2009b). Technical report of EFSA prepared by the Assessment Methodology Unit on meta-analysis of dose–effect relationship of cadmium for benchmark dose evaluation. European Food Safety Authority. EFSA Scientific Report, 254: 1–62.
EFSA (2009b). Scientific opinion of the Panel on Contaminants in the Food Chain on request from the European Commission on cadmium in food. European Food Safety Authority. EFSA Journal, 980: 1–139. Available at: www.efsa.europa.eu/sites/default/files/scientific_output/files/main_documents/980.pdf.
EFSA (2009c). Meta-analysis of dose–effect relationship of cadmium for benchmark dose evaluation. European Food Safety Authority. EFSA Scientific Report, 254: 1–162. Available at: www.efsa.europa.eu/en/efsajournal/pub/rn-254.
EFSA (2011). Comparison of the approaches taken by EFSA and JECFA to establish a HBGV for cadmium. European Food Safety Authority. EFSA Journal, 9(2): 2006. Available at: http://onlinelibrary.wiley.com/doi/10.2903/j.efsa.2011.2006/abstract.
El-Rahaili, A. and Misbahuddin, M. (1995). Levels of trace metals in Riyadh drinking water at the consumer taps. J. King Saud Univ. – Eng. Sci., 7(1): 1.
Ennigrou, D.J., Sik Ali, M.B., Dhahbi, M. and Ferid, M. (2015). Removal of heavy metals from aqueous solution by polyacrylic acid enhanced ultrafiltration. Desal. Water Treat., 56(10): 2682–2688.
Environment and Climate Change Canada (2016). Releases of harmful substances to the environment. Canadian environmental sustainability indicators. Available at: www.ec.gc.ca/indicateurs-indicators/default.asp?lang =en&n=3C4C1124-1.
Environment and Climate Change Canada (2017). National long-term water quality monitoring data. Available at: http://donnees.ec.gc.ca/data/substances/monitor/national-long-term-water-quality-monitoring-data/ .
Environment and Climate Change Canada (2017). Data from the National Air Pollution Survey Program (NAPS). Available at: www.canada.ca/en/environment-climate-change/services/air-pollution/monitoring-networks-data/national-air-pollution-program.html.
Evans, H.E., Smith, P.J. and Dillon, P.J. (1983). Anthropogenic zinc and cadmium burdens in sediments of selected southern Ontario lakes. Can. J. Fish. Aquat. Sci., 40(5): 570–579.
Ford, R., Wilkin, R., and Puls, R. (2007). Monitored natural attenuation of inorganic contaminants in ground water. Volume 2. Assessment for non-radionuclides including arsenic, cadmium, chromium, copper, lead, nickel, nitrate, perchlorate and selenium. EPA/600/R-07/140.
Friedman, M.J., Hill, A.S., Reiber, S.H., Valentine, R.L., Larsen, G., Young, A., Korshin, G.V. and Peng, C-Y. (2010). Assessment of inorganics accumulation in drinking water system scales and sediments. Report No.3118. Water Research Foundation, Denver, Colorado.
Friedman, M., Hill, A., Booth, S., Hallett, M., McNeill, L., McLean, J., Stevens, D., Sorensen, D., Hammer, T., Kent, W., De Haan, M., MacArthur, U. and Mitchell, K. (2016). Metals accumulation and release within the distribution system: Evaluation and mitigation. Report No.4509. Water Research Foundation, Denver, Colorado.
Gardels, M.C. and Sorg, T.J. (1989). A laboratory study of the leaching of lead from water faucets. J. Am. Water Works Assoc., 81(7): 101–113.
Gardiner, J. (1974a). The chemistry of cadmium in natural water—I. A study of cadmium complex formation using the cadmium specific-ion electrode. Water Res., 8(1): 23–30.
Gardiner, J. (1974b). The chemistry of cadmium in natural water—II. The adsorption of cadmium on river muds and naturally occurring solids. Water Res., 8(3): 157–164.
Garner, R. and Levallois, P. (2016). Cadmium levels and sources of exposure among Canadian adults. Health Rep., 27(2): 10–18.
Graver Technologies (2015). Technical fact sheet. MetSorb®. Arsenic, lead and heavy metal adsorption media. Available at: www.gravertech.com/product-lines/adsorbents/metsorb/heavy-metal-removal-granules.
Grey, C.W., McLaren, R.G., Roberts, A.H. and Condron, L.M. (1999). Solubility, sorption and desorption of native and added cadmium in relation to properties of soils in New Zealand. Europ. J. Soil Sci., 50: 127–137.
Guo, Q., Toomuluri, P. and Eckert, J. (1998). Leachability of regulated metals from cement-mortar linings. J. Am. Water Works Assoc., 90(3): 62–73.
Hahne, H.C.H. and Kroontje, W. (1973). Significance of pH and chloride concentration on behavior of heavy metal pollutants: Mercury(II), Cadmium(II), Zinc(II), and Lead(II)1. J. Environ. Qual., 2(4): 444–450.
Hartwig, A. (2010). Mechanisms in cadmium-induced carcinogenicity: recent insights. Biometals, 23(5): 951–960.
Health Canada (1994). Human health risk assessment for priority substances. Canadian Environmental Protection Act. Human health risk assessment for priority substances. Minister of Supply and Services Canada, Ottawa, Ontario.
Health Canada (2011). Draft proposal for cadmium guidelines in children's jewellery. Consumer Product Safety Directorate, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: www.canada.ca/content/dam/hc-sc/migration/hc-sc/cps-spc/alt_formats/hecs-sesc/pdf/legislation/consultation/_2011cadmium/cadmium-eng.pdf. Accessed on November 28, 2017.
Health Canada (2012). Updated hazard characterization for cadmium. Personal communication from Health Products and Food Branch, Health Canada, Ottawa, Ontario.
Health Canada (2013). Second report on human biomonitoring of environmental chemicals in Canada. Results of the Canadian Health Measures Survey Cycle 2 (2009–2011). Available at: www.canada.ca/en/health-canada/services/environmental-workplace-health/reports-publications/environmental-contaminants/second-report-human-biomonitoring-environmental-chemicals-canada-health-canada-2013.html.
Health Canada (2015). Third report on human biomonitoring of environmental chemicals in Canada. Results of the Canadian Health Measures Survey Cycle 3 (2012–2013). Available at: www.canada.ca/en/health-canada/services/environmental-workplace-health/reports-publications/environmental-contaminants/third-report-human-biomonitoring-environmental-chemicals-canada.html.
Health Canada (2017a). Usual dietary cadmium exposure estimates for various age–gender groups in Canada (2016). Health Products and Food Branch, Health Canada, Ottawa, Ontario.
Health Canada (2017b). Aggregated statistics for cadmium in indoor and outdoor air from the National Pollution Monitoring Surveillance Program and the Edmonton Indoor Air Quality Study. Personal communication from T. Shin, Healthy Environments and Consumer Safety Branch, Ottawa, Ontario.
Health Canada (2018a). Health risk assessment of dietary exposure to cadmium. Health Products and Food Branch, Ottawa, Ontario.
Health Canada (2018b). Personal communication, Health Products and Food Branch, Ottawa, Ontario.
Health Canada (2019). Guidelines for Canadian Drinking Water Quality: Guideline Technical Document – Lead. Water and Air Quality Bureau, Healthy Environments and Consumer Safety Branch, Health Canada, Ottawa, Ontario. Available at: https://www.canada.ca/en/health-canada/services/publications/healthy-living/guidelines-canadian-drinking-water-quality-guideline-technical-document-lead/guidance-document.html
Hem, J.D. (1972). Chemistry and occurrence of cadmium and zinc in surface water and groundwater. Water Resour. Res., 8(3): 661–679.
Hill, C. and Giani, R. (2011). Water quality monitoring and assessment of internal corrosion and increased metals concentrations. In: Internal corrosion control in water distribution systems. American Water Works Association. Manual of water supply practices. Manual 58, 1st edition. Denver, Colorado.
Hill, A., Friedman, M., Reiber, S., Korshin, G. and Valentine, R. (2010). Behavior of trace inorganic contaminants in drinking water distribution systems. J. Am. Water Works Assoc., 102(7): 107–118.
Höll, W.H., Bartosch, C., Zhao, X. and He, S. (2002). Elimination of trace heavy metals from drinking water by means of weakly basic anion exchangers. J. Water Supply Res. Technol. Aqua, 51(3): 165–172.
HSDB (2017). Cadmium compounds. Hazardous Substances Data Bank, U.S. National Library of Medicine. Available at: https://toxnet.nlm.nih.gov/cgi-bin/sis/search2/r?dbs+hsdb:@term+@DOCNO+6922.
IARC (2012). IARC monographs on the evaluation of carcinogenic risks to humans. Cadmium and cadmium compounds. Monograph 100C. International Agency for Research on Cancer, Lyon, France. Available at: http://monographs.iarc.fr/ENG/Monographs/vol100C/mono100C-8.pdf.
Jalali, M. and Moradi, F. (2013). Competitive sorption of Cd, Cu, Mn, Ni, Pb and Zn in polluted and unpolluted calcareous soils. Environ. Monit. Assess., 185(11): 8831–8846.
Järup, L., Berglund, M., Elinder, C.G., Nordberg, G. and Vahter, M. (1998). Health effects of cadmium exposure—a review of the literature and a risk estimate. Scand. J. Work Environ. Health, 24 (Suppl 1): 1–51.
JECFA (2000). Evaluation of certain food additives and contaminants. Fifty-third report of the Joint FAO/WHO Expert Committee on Food Additives. WHO Technical Report Series, No. 896. World Health Organization, Geneva, Switzerland.
JECFA (2004). Safety evaluation of certain food additives and contaminants. Report of the sixty-first meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). WHO Food Additive Series, 52: 505–563. Available at: http://apps.who.int/iris/bitstream/10665/42849/1/WHO_TRS_922.pdf.
JECFA (2011). Safety evaluation of certain food additives and contaminants. Report of the seventy-third meeting of the Joint FAO/WHO Expert Committee on Food Additives (JECFA). WHO Food Additive Series, 64: 305–380.
Joseph, P. (2009). Mechanisms of cadmium carcinogenesis. Toxicol. Appl. Pharmacol., 238(3): 272–279.
Kawamura, Y., Mitsuhashi, M., Tanibe, H. and Yoshida, H. (1993). Adsorption of metal ions on polyaminated highly porous chitosan chelating resin. Int. Eng. Chem. Res., 32(2): 386–391.
Kellen, E., Zeegers, M.P., Hond, E.D. and Buntinx, F. (2007). Blood cadmium may be associated with bladder carcinogenesis: the Belgian case–control study on bladder cancer. Cancer Detect. Prev., 31(1): 77–82.
Kim, M.A., Panak, P.J., Yun, J.I., Kim, J.I., Klenze, R. and Kohler, K. (2003). Interaction of actinides with aluminosilicate colloids in statu nascendi. Part I: Generation and characterization of actinide (III)/pseudocolloids. Colloids Surf, A: Physicochem. Eng. Aspects, 216(1): 97–108.
Kocaoba, S. (2003). Behaviour of cadmium (II) ions on cation-exchange resins. Adsorp. Sci. Tech., 21(9): 831–840.
Kocaoba, S.A. and Akcin, G. (2005). Removal of chromium (III) and cadmium (II) from aqueous solutions. Desalination, 180: 151–156.
Kodama, T., Fujii, T. and Baba, H. (1980). Effect of water quality on the zinc products and corrosion rate of galvanized layer in fresh waters. Boshoku Gijutsu, 29(11): 551–557.
Kriegel, A.M., Soliman, A.S., Zhang, Q., El-Ghawalby, N., Ezzat, F., Soultan, A., Abdel-Wahab, M., Fathy, O., Ebidi, G., Bassiouni, N., Hamilton, S.R., Abbruzzese, J.L., Lacey, M.R. and Blake, D.A. (2006). Serum cadmium levels in pancreatic cancer patients from the East Nile Delta region of Egypt. Environ. Health Perspect., 114(1): 113–119.
Krishnan, K. and Carrier, R. (2008). Approaches for evaluating the relevance of multiroute exposures in establishing guideline values for drinking water contaminants. J. Environ. Sci. Health, C, 26: 300–316.
Krishnan, K. and Carrier, R. (2013). The use of exposure source allocation factor in the risk assessment of drinking-water contaminants. J. Toxicol. Environ. Health B Crit. Rev., 16(1): 39–51.
Linstedt, K.D., Houck, C.P. and O'Connor, J.T. (1971). Trace element removals in advanced wastewater treatment processes. Wat. Poll. Control Fed., 43(7): 1507–1513.
Malin Igra, A., Vahter, M., Raqib, R., Kippler, M. (2019). Early-Life Cadmium Exposure and Bone-Related Biomarkers: A Longitudinal Study in Children. Environ Health Perspect. 127(3):37003.
Manitoba Sustainable Development (2017). Personal communication with K. Philip, Office of Drinking Water.
Maynard, B. and Wasserstrom, L. (2017). Premise plumbing scales that can release lead after a lead service line replacement. Proceedings of the American Water Works Association Annual Conference and Exposition. June 11–14, 2017, Philadelphia, Pennsylvania. American Water Works Association, Denver, Colorado.
McComish, M.F. and Ong, J.H. (1988). Trace metals. Chapter 7 in: Environmental inorganic chemistry. Bodek, I., Lyman, W.J., Reehl, W.F. and Rosenblatt, D.H. (eds.). Pergamon, Amsterdam, pp. 71-7.15-11.
McLean, J.E. and Bledsoe, B.E. (1992). Behavior of metals in soils, ground water issue. Report No. EPA/540/S-92/018. United States Environmental Protection Agency, Washington, DC. Available at: https://nepis.epa.gov.
Ministère du Développement durable, de l’Environnement et de la Lutte contre les changements climatiques (2017). Personal communication with C. Robert, Direction de l'eau potable et des eaux souterraines.
Mlynska, A. and Zielina, M. (2017). The influence of prefabricated pipe cement coatings and those made during pipe renovation on drinking water quality. Proceedings of the 9th Conference on Interdisciplinary Problems in Environmental Protection and Engineering EKO-DOK 2017, April 23–25, 2017. Boguszów-Gorce, Poland. E3S Web Conf.17: 00061.
Naiya, T.K., Bhattacharya, A.K. and Das, S.K. (2009). Adsorption of Cd(II) and Pb(II) from aqueous solutions on activated alumina. J. Colloid Interface Sci., 333(1): 14–26.
Najm, I., Romero, O., Gallagher, B., DeHaan, M. and Busch, C. (2017). Removal of heavy metals to ultra-low levels with conventional treatment technologies: A bench scale study. Proceedings of the American Water Works Association Annual Conference and Exposition, June 11–14, 2017, Philadelphia, Pennsylvania. American Water Works Association, Denver, Colorado.
Nawrot, T.S., Staessen, J.A., Roels, H.A., Munters, E., Cuypers, A., Richart, T., Ruttens, A., Smeets, K., Clijsters, H. and Vangronsveld, J. (2010). Cadmium exposure in the population: from health risks to strategies of prevention. Biometals, 23(5): 769–782.
Neff, C., Schock, M. and Marden, J. (1987). Relationship between water quality and corrosion materials in buildings. Volume I, Galvanized steel and copper plumbing systems. Illinois state water survey division. Aquatic chemistry section at the University of Illinois. SMS contract report 416-I.
New Brunswick Department of Environment and Local Government (2017). Personal communication with K. Gould, Healthy Environment Branch.
Newfoundland and Labrador Department of Municipal Affairs and Environment (2017). Personal communication with H. Khan, Water Resources Management Division.
NHMRC (2011). Australian drinking water guidelines. National Health and Medical Research Council: 442–443. Available at: www.nhmrc.gov.au/_files_nhmrc/file/publications/nhmrc_adwg_6_version_3.4_final.pdf.
Nishijo, M., Morikawa, Y., Nakagawa, H., Tawara, K., Miura, K., Kido, T., Ikawa, A., Kobayashi, E. and Nogawa, K.(2006). Causes of death and renal tubular dysfunction in residents exposed to cadmium in the environment. Occup. Environ. Med., 63(8): 545–550.
Nordberg, G.F. (2009). Historical perspectives on cadmium toxicology. Toxicol. Appl. Pharmacol., 238(3): 192–200.
Nordberg, G.F. and Kjellström, T. (1979). Metabolic model for cadmium in man. Environ. Health Perspect., 28: 211–217.
Nordberg, G.F., Nogawa, K., Nordberg, M. and Friberg, L. (2007). Cadmium. Chapter 23. In: Handbook on the toxicology of metals, 3rd edition. Academic Press/Elsevier, Cambridge, Massachusetts. pp. 446–486.
Nova Scotia Environment (2017). Personal communication with A. Polegato, Drinking Water Management Unit.
NSF/ANSI (2016a). Standard 53: Drinking water treatment units—health effects. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NSF/ANSI (2016b). Standard 62: Drinking water distillation systems. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NSF/ANSI (2017a). Standard 58: Reverse osmosis drinking water treatment systems. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NSF/ANSI (2017b). Standard 61: Drinking water system components—health effects. NSF International/American National Standards Institute, Ann Arbor, Michigan
NSF/ANSI (2017c). Standard 60: Drinking water treatment chemicals—health effects. NSF International/American National Standards Institute, Ann Arbor, Michigan.
NRC (2010). National Plumbing Code. National Research Council, Ottawa, Ontario.
Ontario Ministry of the Environment, Conservation and Parks (2019). Personal communication with S. Deshpande, Standards Development Branch.
Osada, M., Izuno, T., Kobayashi, M. and Sugita, M. (2011). Relationship between environmental exposure to cadmium and bone metabolism in a non-polluted area of Japan. Environ. Health Prev. Med., 16(6): 341–349.
Patterson, J.W., Allen, H.E. and Scala, J.J. (1977). Carbonate precipitation for heavy metals pollutants. J. Water Pollut. Control Fed., 49(12): 2397–2410.
Pawlowski, B. Krawczyk, J. Bala, P. (2014). The premature deterioration of Zinc‐coated steel pipes in water distribution system. International Journal of Material and Mechanical Engineering (IJMME), 2(4): 43-47.
Pehlivan, E. and Altun, T. (2006). The study of various parameters affecting the ion exchange of Cu2+, Zn2+, Ni2+, Cd2+, and Pb2+ from aqueous solution on Dowex 50W synthetic resin. J. Hazard. Mater, 134(1-3): 149–156.
PEI Department of Communities, Land and Environment (2020). Personal communication with G. Somers.
Peng, C.Y., Hill, A.S., Friedman, M.J., Valentine, R.L., Larson, G.S., Romero, A.M.Y., Reiber, S.H. and Korshin, G.V. (2012). Occurrence of trace inorganic contaminants in drinking water distribution systems. J. Am. Water Works Assoc., 104(3): 53–54.
Pieper, K. J. (2015). Characterizing waterborne lead in private water systems: PhD Dissertation, Virginia Polytechnic Institute and State University, Blacksburg, Virgina. Available at: https://vtechworks.lib.vt.edu/bitstream/handle/10919/74273/Pieper_KJ_D_2015.pdf?sequence=1&isAllowed=y .
Pisigan Jr., R.A. and Singley, J.E. (1985). Effects of water quality parameters on the corrosion of galvanized steel. J. Am. Water Works Assoc., 77(11): 76–82.
Platz, E.A., Helzlsouer, K.J., Hoffman, S.C., Morris, J.S., Baskett, C.K. and Comstock, G.W. (2002). Prediagnostic toenail cadmium and zinc and subsequent prostate cancer risk. Prostate, 52(4): 288–296.
Powell, K., Brown, P., Byrne, R., Gajda, T., Hefter, G., Leuz, A-K., Sjoberg, S. and Wanner, H. (2011). Chemical speciation of environmentally significant metals with inorganic ligands. Part 4: The Cd2+ + OH–, Cl–, CO32–, SO42–, and PO4 3– systems (IUPAC technical report). Pure Appl. Chem., 83(5): 1163–1214.
Prozialeck, W.C. and Edwards, J.R. (2010). Early biomarkers of cadmium exposure and nephrotoxicity. Biometals, 23(5): 793–809.
Reeves, P.G. and Chaney, R.L. (2008). Bioavailability as an issue in risk assessment and management of food cadmium: a review. Sci. Total Environ., 398(1-3): 13–19.
Rei, D., Zahara, J., Schwab, A., Schmidt, R., Girvin, D. and Rogers, J. (1984). Chemical attenuation rates, coefficients and constants in leachate migration. Vol I: A critical review. Pacific Northwest Laboratories, Richland, Washington.
Roberts, C.A. and Clark, J.M. (1988). In vivo depression of reserve albumin binding capacity by cadmium: a preliminary evaluation. Life Sci., 42(14): 1369–1373.
Ruoff, W.L., Diamond, G.L., Velazquez, S.F., Stiteler, W.M. and Gefell, D.J. (1994). Bioavailability of cadmium in food and water: a case study on the derivation of relative bioavailability factors for inorganics and their relevance to the reference dose. Regul. Toxicol. Pharmacol., 20(2): 139–160.
Sabolić, I., Breljak, D., Skarica, M. and Herak-Kramberger, C.M. (2010). Role of metallothionein in cadmium traffic and toxicity in kidneys and other mammalian organs. Biometals, 23(5): 897–926.
Samuels, E.R. and Méranger, J.C. (1984). Preliminary studies on the leaching of some trace metals from kitchen faucets. Water Res., 18(1): 75–80.
Saskatchewan Water Security Agency (2017). Personal communication with S. Ferris, Environmental and Municipal Management Services Division.
Satarug, S., Garrett, S.H., Sens, M.A. and Sens, D.A. (2010). Cadmium, environmental exposure, and health outcomes. Environ. Health Perspect., 118(2): 182–190.
SCC (2020). Directory of accredited product, process and service certification bodies. Standards Council of Canada, Ottawa, Ontario. Available at: www.scc.ca/en/accreditation/product-process-and-service-certification/directory-of-accredited-clients.
Schock, M. and Neff, C. (1988). Trace metal contamination from brass fittings. J. Am. Water Works Assoc., 80(11): 47–56.
Schock, M. (2005). Chapter 6: Distribution system as reservoirs and reactors for inorganic contaminants. In: Distribution system water quality challenges in the 21st century: A strategic guide. 5th edition. M. J. MacPhee (ed.). American Water Works Association, Denver, Colorado.
Schock, M. Hyland, R. and Welch, M. (2008). Occurrence of contaminant accumulation in lead pipe scales from domestic drinking-water distribution systems. Environ. Sci. Technol., 42(12): 4285–4291.
Schock, M. and Lytle, D. (2011). Chapter 20: Internal corrosion and deposition control. In: Water quality and treatment: a handbook on drinking water, 6th edition. J.K. Edzwald (ed.). McGraw Hill and American Water Works Association, Denver, Colorado.
Sharrett, A.R., Carter, A.P., Orheimt, R.M. and Feinleib, M. (1982). Daily intake of lead, cadmium, copper, and zinc from drinking water: The Seattle study of trace metal exposure. Environ. Res., 28(2): 456–475.
Sheta, A.S., Falatah, A.M., Al-Sewailem, M.S., Khaled, E.M. and Sallam, A.S.H. (2003). Sorption characteristics of zinc and iron by natural zeolite and bentonite. Microporous and mesoporous materials. Micropor. Mesopor. Mater., 61(1-3): 127–136.
Smedley, P.L. and Kinniburgh, D.G. (2002). A review of the source, behaviour and distribution of arsenic in natural waters. Appl. Geochem., 17(5): 517–568.
Snoeyink, V.L., Schock, M.R., Sarin, P., Wang, L., Chen, A.S. and Harmon, S.M. (2003). Aluminium-containing scales in water distribution systems: Prevalence and composition. J. Water Supply Res. Technol. Aqua, 52(7): 455–74.
Sorg, T.J., Csanady, M. and Logsdon, G.S. (1978). Treatment technology to meet the interim primary drinking water regulations for inorganics —3. J. Am. Water Works Assoc., 70(12): 680–691.
Statistics Canada (2015). Fact sheet on lead, mercury and cadmium concentrations in Canadians, 2012 and 2013. Available at: www.statcan.gc.ca/pub/82-625-x/2015001/article/14209-eng.htm.
Stephenson, M. and Mackie, G.L. (1988). Total cadmium concentrations in the water and littoral sediments of central Ontario lakes. Water, air, and soil pollution. Water Air Soil Pollut., 38(1-2): 121–136.
Subramanian, K.S., Connor, J.W. and Meranger, J.C. (1991). Leaching of antimony, cadmium, copper, lead, silver, tin and zinc from copper piping with non-lead-based soldered joints. J. Environ. Sci. Health A, 26(6): 911–929.
Suwazono, Y., Sand, S., Vahter, M., Skerfving, S., Lidfeldt, J. and Akesson, A. (2010). Benchmark dose for cadmium-induced osteoporosis in women. Toxicol. Lett., 197(2): 123–127.
Swaim, P., Busch, C. and De Haan, M. (2017). Removal of heavy metals to ultra-low levels with conventional treatment technologies: Pilot scale demonstration. Proceedings of the American Water Works Association Annual Conference and Exposition, June 11–14, 2017, Philadelphia, Pennsylvania. American Water Works Association, Denver, Colorado.
Trussell, R.R. and Wagner, I. (1996). Corrosion of galvanized pipe. In: Internal corrosion of water distribution systems, 2nd edition. American Water Works Association Research Foundation and DVGW Technologiezentrum Wasser, Denver, Colorado.
U.S. EPA (1991). National primary drinking water regulations; Final rule. Fed. Register, 56: 3526–3597.
U.S. EPA (1994a). Method 200.7 Revision 4.4. Determination of metals and trace elements in water and wastes by inductively coupled plasma-atomic emission spectrometry. Environment monitoring systems laboratories. Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (1994b). Method 200.8 Revision 5.4. Determination of trace elements in waters and wastes by inductively coupled plasma-mass spectrometry. Environment monitoring systems laboratories. Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (1994c). Method 200.9 Revision 2.2. Determination of trace elements by stabilized temperature graphite furnace atomic absorption. Environment monitoring systems laboratories. Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (1998). Small system compliance technology list for the non-microbial contaminants regulated before 1996. Report No. EPA 815-R-98-002. Office of Water, U.S. Environmental Protection Agency, Washington, DC.
U.S. EPA (2003). Method 200.5 Revision 4.2. Determination of trace elements in drinking water by axially viewed inductively coupled plasma - atomic emission spectrometry. Report No. EPA 600-R-06-115. National Exposure Research Laboratory, Office of Research and Development, U.S. Environmental Protection Agency, Cincinnati, Ohio.
U.S. EPA (2004). Risk assessment guidance for superfund. Volume I: Human health evaluation manual (Part E, Supplemental guidance for dermal risk assessment). Report No. EPA/540/R/99/005. Office of Superfund Remediation and Technology Innovation, U.S. Environmental Protection Agency, Washington, DC.
U.S. EPA (2009). Analytical feasibility support document for the second six-year review of existing national primary drinking water regulations. Report No. EPA 815-B-09-003. Office of Water, U.S. Environmental Protection Agency, Washington, DC. Available at: www.epa.gov/sites/production/files/2014-12/documents/815b09003.pdf
U.S. EPA (2012). Federal Register. Part II. Revisions of the unregulated contaminant monitoring regulation (UCMR 3) for public water systems; final rule. Vol 77, No 85. May 2, 2012. U.S. Environmental Protection Agency, Washington, DC.
U.S. EPA (2016). Analytical methods approved for drinking water compliance. Monitoring of inorganic contaminants and other inorganic constituents. Report No. EPA 815-B-16-014. Office of Water, U.S. Environmental Protection Agency Washington, DC.
van Wijngaarden, E., Singer, E.A. and Palapattu, G.S. (2008). Prostate-specific antigen levels in relation to cadmium exposure and zinc intake: results from the 2001–2002 National Health and Nutrition Examination Survey. Prostate, 68(2): 122–128.
Viraraghavan, T., Subramanian, K.S. and Rao, B.V. (1999). Impact of household plumbing fixtures on drinking water quality—A review. Inter. J. Environ. Studies, (56): 717–743.
Viraraghavan, T., Subramanian, K.S. and Tanjore, S. (2000). Impact of household plumbing materials on trace metal levels in drinking water in Regina, Canada. Proceedings of the National Conference on Environmental and Pipeline Engineering. July 23–26, 2000, Kansas City, Missouri. American Society of Civil Engineers. Reston, Virgina. pp. 561–570.
Vreeburg, J. (2010). Discolouration in drinking water systems: the role of particles clarified. IWA Publishing, London, U.K.
Vinceti, M., Venturelli, M., Sighinolfi, C., Trerotoli, P., Bonvicini, F., Ferrari, A., Bianchi, G., Serio, G., Bergomi, M. and Vivoli, G. (2007). Case–control study of toenail cadmium and prostate cancer risk in Italy. Sci. Total Environ., 373(1): 77–81.
Waalkes, M.P. and Rehm, S. (1992). Carcinogenicity of oral cadmium in the male Wistar (WF/NCr) rat: effect of chronic dietary zinc deficiency. Fundam. Appl. Toxicol., 19(4): 512–520.
Waalkes, M.P. (2003). Cadmium carcinogenesis. Mutat Res. 533(1-2): 107–120.
WHO (1992). Environmental health criteria No. 134. Cadmium. International Programme on Chemical Safety, World Health Organization. Geneva, Switzerland. Available at: www.inchem.org/documents/ehc/ehc/ehc134.htm
WHO (2011). Cadmium in drinking-water. Background document for development of WHO guidelines for drinking water quality. World Health Organization, Geneva, Switzerland. Available at: www.who.int/water_sanitation_health/dwq/chemicals/cadmium.pdf
Wu, L., Wei, Q., Lv, Y., Xue, J., Zhang, B., Sun, Q., Xiao, T., Huang, R., Wang, P., Dai, X., Xia, H., Li, J., Yang, X., Liu, Q. (2019). Wnt/β-Catenin Pathway Is Involved in Cadmium-Induced Inhibition of Osteoblast Differentiation of Bone Marrow Mesenchymal Stem Cells. Int J Mol Sci., 20(6).
Yeats, P.A. and Bewers, J.M. (1982). Discharge of metals from the St. Lawrence River. Canadian J. Earth Sci., 19(5): 982–992.
Yokota, H. and Tonami, H. (2008). Experimental studies on the bone metabolism of male rats chronically exposed to cadmium intoxication using dual-energy X-ray absorptiometry. Toxicol. Ind. Health, 24(3): 161–170.
Yukon Health and Social Services (2017). Personal communication with P. Brooks, Health and Social Services.
Zalups, R.K. and Ahmad, S. (2003). Molecular handling of cadmium in transporting epithelia. Toxicol. Appl. Pharmacol., 186(3): 163–188.
Zasoski, R.J. and Burau, R.G. (1988). Sorption and sorptive interaction of cadmium and zinc on hydrous manganese oxide. Soil Sci. Soc. Am. J., 52(1): 81–87.
Zeng, X., Jin, T., Jiang, X., Kong, Q., Ye, T. and Nordberg, G.F. (2004). Effects on the prostate of environmental cadmium exposure—a cross-sectional population study in China. Biometals, 17(5): 559–565.
Zhao, X., Höll, W.H. and Yun, G. (2002). Elimination of cadmium trace contaminations from drinking water. Water Res., 36(4): 851–858.
Zielina, M., Mlynska, A. and Zaba, T. (2015). Experimental research on deterioration of drinking water quality after cement mortar pipe lining. Tech. Trans., (28): Civil Engineering. 4-B: 145–152.
Annexe A : Liste des acronymes
- ANSI
- American National Standards Institute
- AWWA
- American Water Works Association
- B2M
- β2-microglobuline
- BMD
- dose de référence
- BMDL
- limite inférieure de l’intervalle de confiance à 95 % de la dose de référence
- BMDL05
- limite inférieure de l’intervalle de confiance de 95 % de la dose repère pour une incidence accrue de 5 %
- Cd
- cadmium
- Cd-MT
- Cd-metallothionein
- CIRC
- Centre International de Recherche sur le cancer
- CMA
- concentration maximale admissible
- CCN
- le Conseil canadien des normes
- EFSA
- Autorité européenne de sécurité des aliments
- FAO
- Organisation pour l’alimentation et l’agriculture
- IC
- intervalle de confiance
- ICP-MS
- Spectrométrie de masse avec plasma à couplage inductif
- JECFA
- Comité mixte FAO/OMS d’experts des additifs alimentaires
- LD
- limite de détection
- LDM
- limite de détection de la méthode
- MDT
- matières dissoutes totales
- MG
- moyenne géométrique
- MT
- métallothionéine
- NHANES
- National Health and Nutrition Examination Survey
- NSF
- NSF International
- OI
- osmose inverse
- OMS
- Organisation mondiale de la santé
- p.c.
- poids corporel
- PVC
- chlorure de polyvinyle
- SAC
- cations fortement acides
- SM
- méthode standard
- UCd
- cadmium urinaire
- U.S. EPA
- Environmental Protection Agency (États-Unis)
- VBS
- valeur basée sur la santé