Page 4 - Recommandations pour la qualité de l'eau potable au Canada : Document technique : N-nitrosodiméthylamine (NDMA)
Bien qu'on ne dispose d'aucune donnée quantitative relative aux humains, des études réalisées sur des animaux de laboratoire indiquent que la NDMA ingérée est rapidement et largement absorbée (c.-à-d. plus de 90 %) (Daugherty et Clapp, 1976; Diaz Gomez et coll., 1977; Kunisaki et coll., 1978) principalement au niveau du tube digestif inférieur (Phillips et coll., 1975; Hashimoto et coll., 1976; Agrelo et coll., 1978; Pegg et Perry, 1981). La détection de la NDMA dans l'urine de rats et de chiens exposés par inhalation indique que la nitrosamine est absorbée par les poumons; on ne possède toutefois aucune donnée quantitative fiable sur l'absorption de la NDMA après inhalation. Malgré l'absence de donnée quantitative, il est possible de tirer des conclusions sur l'absorption cutanée d'après les résultats d'une étude dans laquelle de faibles quantités (0,03 %) de NDMA ont été décelées dans l'urine de rats auxquels une solution contenant 350 µg de NDMA avait été administrée par voie cutanée (Spiegelhalder et coll., 1982).
Une fois absorbée, la NDMA et ses métabolites sont largement distribués (Daugherty et Clapp, 1976; Anderson et coll., 1986) et la progéniture y est sans doute exposée par le lait maternel (Diaz Gomez et coll., 1986). La nitrosamine et ses métabolites ont été décelés dans les foetus de rongeurs gravides auxquels la substance avait été injectée (Althoff et coll., 1977; Johansson-Brittebo et Tjäve, 1979). Les analyses pharmacocinétiques de la NDMA injectée par voie intraveineuse à un certain nombre d'animaux de laboratoire ont indiqué que la nitrosamine est rapidement éliminée du sang, son métabolisme faisant intervenir à la fois des composantes hépatiques et extrahépatiques. La NDMA et ses métabolites peuvent être excrétés dans l'urine ou exhalés sous forme de dioxyde de carbone.
On ne dispose pas de données quantitatives provenant d'études menées sur le métabolisme de la NDMA chez les humains. Il semble toutefois exister des différences de taux de métabolisme de la NDMA entre les espèces (Jeong-Sook et coll., 1987; Gombar et coll., 1990). Malgré les différences quantitatives possibles, il semble y avoir peu de différences qualitatives de métabolisme de la NDMA entre les humains et les animaux de laboratoire. Le métabolisme de la NDMA se fait par alpha-hydroxylation ou par dénitrosation de la nitrosamine (figure 1). Dans les deux cas, on croit que le métabolisme fait intervenir un radical intermédiaire commun [CH3(CH2)NBN=O] produit par l'action du système d'oxydase à fonction mixte dépendant du cytochrome CYP2E1 (Haggerty et Holsapple, 1990; Lee et coll., 1996). Lors du métabolisme par alphahydroxylation, l'hydroxyméthylnitrosamine (HOCH2CH3HBN=O), qui se forme à partir du radical intermédiaire, se décompose en formaldéhyde (lui-même ensuite transformé en dioxyde de carbone) et en monométhylnitrosamine (CH3NHN=O). À cause de son instabilité, la monométhylnitrosamine est transformée en un ion fortement méthylé, le méthyldiazonium (CH3N+≡N), qui provoque l'alkylation des macromolécules biologiques comme l'ADN, l'ARN et les protéines. On croit que c'est l'alpha-hydroxylation qui forme les métabolites actifs responsables de la génotoxicité et de la cancérogénicité de la NDMA (Lee et coll., 1996). La conversion métabolique du radical intermédiaire par dénitrosation mène à la formation de méthylamine (CH3NH2) et de formaldéhyde (figure 4).
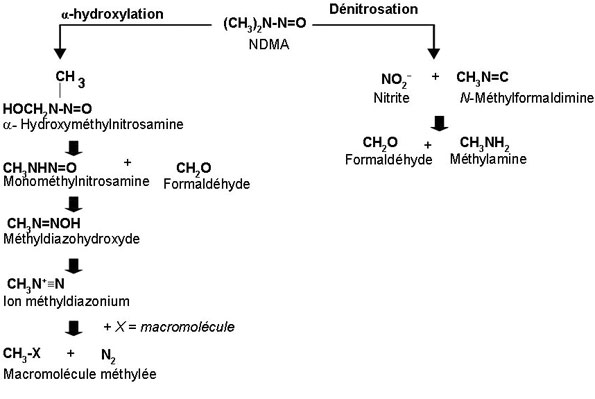
Figure 4 - Description textuel
Les décès d'un adulte et d'un enfant liés à l'ingestion aiguë d'une quantité inconnue de NDMA dans une limonade contaminée et celui d'un adulte, attribué à la consommation d'au moins quatre doses d'environ 250 à 300 mg de NDMA sur une période de deux ans ont été signalés (Cooper et Kimbrough, 1980; Fussgänger et Ditschuneit, 1980; Pedal et coll., 1982). Une insuffisance hépatique a été observée dans les trois cas; les deux personnes décédées à la suite d'une exposition aiguë ont aussi souffert d'une hémorragie cérébrale.
Les études épidémiologiques pertinentes incluent des études cas-témoins dans lesquelles les risques potentiels de cancer de l'estomac (Risch et coll., 1985; González et coll., 1994; La Vecchia et coll., 1995; Pobel et coll., 1995), du tube digestif supérieur (Rogers et coll., 1995) et du poumon (Goodman et coll., 1992; De Stefani et coll., 1996) associés à l'ingestion de NDMA ont été évalués. Certains rapports ont estimé la dose de NDMA à partir de la reconstitution (de mémoire) du régime alimentaire d'une personne l'année précédant le début de la maladie et les concentrations de cette nitrosamine signalées dans les aliments consommés (Goodman et coll., 1992; González et coll., 1994; Pobel et coll., 1995). Dans d'autres études (Rogers et coll., 1995; De Stefani et coll., 1996), les sujets devaient se remémorer leur régime alimentaire normal des cinq et dix ans précédant le début de la maladie.
Trois des quatre études cas-témoins ont prouvé l'existence d'une relation expositionréponse entre l'absorption de NDMA et le cancer de l'estomac (González et coll., 1994; La Vecchia et coll., 1995; Pobel et coll., 1995); cette relation n'a toutefois pas été observée dans une autre étude où les cancers de la bouche, du larynx et de l'oesophage ont été étudiés séparément (Rogers et coll., 1995). Dans deux études cas-témoin où l'appariement ou le contrôle des facteurs de confusion a été plus systématique que celui des études précitées sur le cancer de l'estomac, il existait une relation exposition-réponse claire entre la NDMA et le cancer du poumon (Goodman et coll., 1992; De Stefani et coll., 1996). Dans presque toutes les études, les liens entre les cancers à l'étude et les nitrates, les nitrites et la NDMA ont été examinés.
Selon une étude de cohorte basée sur une population de 9 985 hommes et femmes adultes finlandais suivis sur une période de 24 ans, le risque relatif de cancer colorectal associé à l'absorption de la NDMA était de 2,12 (l'intervalle de confiance à 95 % se situait entre 1,04 et 4,33) (Knekt et coll., 1999). Les cancers de la tête, du cou et de l'estomac ont aussi été étudiés, mais les risques relatifs n'étaient pas statistiquement significatifs. Aucune association significative n'a été observée entre l'absorption de nitrates ou de nitrites et les cancers du tractus gastro-intestinal. Il semble n'y avoir aucune différence qualitative entre les rongeurs et les humains en ce qui a trait à la formation d'adduits à l'ADN après une exposition à la NDMA. Dans un cas présumé d'intoxication à la NDMA chez un homme, la méthylation de l'ADN hépatique a été observée aux deux positions N7 et O6 de la guanine (Herron et Shank, 1980). À l'aide d'une technique immunohistochimique, Parsa et coll. (1987) ont décelé la formation de O6-méthylguanine dans des explants de pancréas humain incubés in vitro avec de la NDMA.
La NDMA a une forte toxicité aiguë après son administration orale chez des rats, sa dose létale (DL50) variant de 23 à 40 mg/kg p.c. (ATSDR, 1989). Elle présente également une forte toxicité aiguë par inhalation, les concentrations létales médianes (CL50) après quatre heures étant de 240 mg/m³ (78 parties par million [ppm]) chez le rat et de 176 mg/m³ (57 ppm) chez la souris (ATSDR, 1989). Une concentration minimale avec effet observé (LOEC) de 49 mg/m³ (16 ppm) a été observée chez des chiens exposés à la NDMA par inhalation durant quatre heures (ATSDR, 1989). Chez ces trois espèces, l'exposition aiguë par inhalation a provoqué une nécrose hémorragique du foie. Chez les chiens, l'exposition à la NDMA a aussi entraîné une augmentation du temps de coagulation sanguine (ATSDR, 1989). On a fait état d'une DL50 de 43 et de 20 mg/kg p.c. respectivement chez le rat et la souris après une exposition par voie intrapéritonéale (CIRC, 1978). Chez d'autres animaux de laboratoire, l'exposition aiguë à des concentrations de NDMA variant de 30 à 60 mg/kg p.c. a eu des effets sur le foie (hépatotoxicité), les reins (tumeurs) et les testicules (nécrose de l'épithélium séminifère) (Magee et Barnes, 1962; Schmidt et Murphy, 1966; Hard et Butler, 1970a,b; McLean et Magee, 1970; MEO, 1991).
Des effets sur le foie (c.-à-d. vacuolisation des hépatocytes, veinopathie portale, nécrose et hémorragie), souvent associés à une réduction de la survie, ont été observés chez un certain nombre d'espèces de mammifères exposées à la NDMA par voie orale (par gavage, sauf indication contraire) dans diverses conditions (p. ex., des rats recevant 1, 3,8 ou 5 mg/kg p.c. par jour de NDMA pendant 30, 7 à 28 ou 5 à 11 jours respectivement; des souris recevant 5 mg/kg p.c. par jour dans l'eau potable pendant 7 à 28 jours; des hamsters recevant 4 mg/kg p.c. par jour dans l'eau potable pendant 1 à 28 jours; des cobayes, des chats et des singes recevant 1 mg/kg p.c. par jour pendant 30 ou 5 mg/kg p.c. par jour pendant 5 à 11 jours; des chiens recevant 2,5 mg/kg p.c. par jour, à raison de deux jours par semaine, pendant trois semaines; et des visons recevant 0,32 mg/kg p.c. par jour pendant 23 à 34 jours) (données révisées par CIRC, 1978; ATSDR, 1989).
En plus de ces effets sur le foie, une congestion (excès de sang ou de liquide) de divers organes (dont les reins, les poumons, la rate et le myocarde) a été observée chez des rats ayant reçu 3,8 mg de NDMA/kg p.c. par jour, incorporées à leur régime alimentaire, pendant 1 à 12 semaines (Khanna et Puri, 1966). Des hémorragies gastro-intestinales ont été observées chez des rats ayant reçu dans leurs aliments des doses de NDMA de 10 mg/kg p.c. par jour pendant 34 à 37 jours (Barnes et Magee, 1954) et des visons recevant 0,3 ou 0,6 mg/kg p.c. par jour de NDMA dans leurs aliments pendant 23 à 34 jours (Carter et coll., 1969). Des effets sur les reins (incluant une dilatation des glomérules et un léger épaississement de la capsule de Bowman) ont été observés chez des visons ayant reçu des doses de NDMA de 0,2 mg/kg p.c. par jour, incorporées à leur régime alimentaire (période non précisée) (Martino et coll., 1988).
Toutes les études menées sur des animaux de laboratoire ont invariablement démontré le fort pouvoir cancérogène de la NDMA. Par conséquent, peu d'études ont porté sur ses autres effets toxiques, et les données ne permettent donc pas de faire une évaluation approfondie des effets autres que le cancer.
Bien que la plupart des études puissent être considérées comme limitées selon les normes actuelles (p. ex., la petite taille des groupes, l'administration de doses uniques et les lacunes en matière d'analyse histopathologique), la cancérogénicité de la NDMA a été clairement démontrée dans les études au cours desquelles des rongeurs (rats, souris et hamsters) y ont été exposés par voie orale, par inhalation ou par instillation intratrachéale. Ainsi, la NDMA a augmenté l'incidence des tumeurs du foie et des cellules de Leydig chez des rats exposés à cette nitrosamine dans l'eau potable ou les aliments (Terao et coll., 1978; Arai et coll., 1979; Ito et coll., 1982; Lijinsky et Reuber, 1984); cette incidence accrue de tumeurs a été observée à des concentrations de NDMA d'environ 5 mg/L dans l'eau potable et de 10 mg/kg dans les aliments. Un pouvoir cancérogène sur le foie, les poumons et les reins a été observé chez des souris exposées à la NDMA par l'eau potable (Terracini et coll., 1966; Clapp et Toya, 1970; Anderson et coll., 1979, 1986, 1992) ou par inhalation (Moiseev et Benemanskii, 1975); une incidence accrue des tumeurs a été observée à des concentrations de NDMA dans l'eau potable variant de 0,01 à 5 mg/L. De plus, dans certains cas (p. ex., Terracini et coll., 1966), la période d'exposition à la NDMA était relativement courte (c.-à-d. trois semaines). La NDMA a accru l'incidence des tumeurs du foie chez les hamsters exposés par voie intratrachéale (Tanaka et coll., 1988). L'administration de NDMA à des rates (par injection intrapéritonéale) ou à des souris gravides (par un tube dans l'estomac) a augmenté la fréquence des tumeurs hépatiques et rénales chez leur progéniture (Alexandrov, 1968; Anderson et coll., 1989).
Une étude en particulier ressort comme étant la plus complète à utiliser pour effectuer une évaluation quantitative des risques en raison de la très grande taille de la population étudiée (2 040 rats) et de la large plage de concentrations utilisée. Lors de cet essai biologique de cancérogénicité (conçu dans le but de fournir des données détaillées sur la relation exposition-réponse) concernant l'exposition à vie, 15 groupes formés de 60 rats mâles et de 60 rats femelles Colworth- Wistar ont ingéré de l'eau potable contenant une large plage de 15 concentrations de NDMA allant de 33 à 16 896 µg/L (Brantom, 1983; Peto et coll., 1991a,b). Les doses journalières estimées de NDMA variaient de 0,001 à 0,697 mg/kg p.c. chez les mâles et de 0,002 à 1,224 mg/kg p.c. chez les femelles. Un groupe témoin formé de 120 mâles et 120 femelles a consommé de l'eau potable exempte de NDMA. On a procédé en cours d'étude au sacrifice de groupes d'animaux après 12 et 18 mois. La survie des animaux diminuait en fonction de l'augmentation de la dose; les animaux du groupe recevant la dose la plus élevée n'ont pas survécu plus d'un an. La survie des animaux du groupe recevant de faibles doses était bonne (jusqu'à 3,5 ans). Le nombre de tumeurs du foie était proportionnel à la dose dans le cas des doses faibles, sans indication d'un seuil. De plus, plusieurs anormalités non-neoplastiques, notamment des nodules hyperplastiques et un rétrécissement des hépatocytes, ont été observées dans le foie à faibles doses.
Il existe une abondance de preuves démontrant le pouvoir mutagène et clastogène de la NDMA (données révisées par CIRC, 1978; ATSDR, 1989). Une fréquence accrue de mutations géniques, d'altérations chromosomiques, d'échanges de chromatides soeurs et de synthèse non programmée d'ADN a été observée pour une grande variété de types de cellules lors d'essais réalisés en présence ou en l'absence d'activation métabolique. Des résultats positifs ont été observés pour des cellules d'humains et de rongeurs. Deux études menées par Hakura et coll. (1999, 2003) ont indiqué que les fractions S9 des sources humaines produisaient une réaction mutagène à la NDMA beaucoup plus forte que celles des rats dans un test d'Ames, le taux de mutation étant jusqu'à huit fois plus élevé avec certaines fractions S9 humaines.
L'existence d'effets génétiques a été clairement démontrée lors d'études in vivo. On a ainsi observé des effets clastogènes (p. ex., micronucleus, échanges de chromatides soeurs, berrations chromosomiques) dans les cellules hépatiques (Tates et coll., 1980, 1983, 1986; Mehta et coll., 1987; Braithwaite et Ashby, 1988; Cliet et coll., 1989; Neft et Conner, 1989; Sawada et coll., 1991), les cellules médullaires (Bauknecht et coll., 1977; Wild, 1978; Neal et Probst, 1983; Collaborative Study Group for the Micronucleus Test, 1986; Neft et Conner, 1989; Krishna et coll., 1990; Sato et coll., 1992; Morrison et Ashby, 1994), les cellules spléniques (Neft et Conner, 1989; Krishna et coll., 1990), les lymphocytes du sang périphérique (Tates et coll., 1983; Sato et coll., 1992) de même que dans les cellules de l'oesophage (Mehta et coll., 1987) et du rein (Robbiano et coll., 1997) de rongeurs (rats, souris ou hamsters) exposés à la NDMA par voie orale ou par injection intrapéritonéale. Une fréquence accrue de cellules micronucléées a été observée chez des rats recevant des doses aussi faibles que 5 mg/kg p.c. (Trzos et coll., 1978; Mehta et coll., 1987). On a constaté des effets dans les cellules germinales (c.-à-d. les spermatides) de souris ayant reçu 6 ou 9 mg/kg p.c. de NDMA par injection intrapéritonéale (Cliet et coll., 1993). L'exposition par inhalation de souris femelles à 1 030 mg/m³ de NDMA a accru la fréquence des cellules médullaires micronucléées (Odagiri et coll., 1986). Des preuves de génotoxicité (p. ex., aberrations chromosomiques, micronucleus, mutations géniques, rupture de brins d'ADN) ont aussi été observées chez la progéniture de hamsters (Inui et coll., 1979) et de souris (Bolognesi et coll., 1988) exposée à la NDMA durant la gestation. Chez des rongeurs (rats, souris ou hamsters) auxquels de la NDMA avait été administrée par voie orale ou par injection intrapéritonéale, des dommages à l'ADN ont été observés dans le foie, les reins et les poumons (Laishes et coll., 1975; Petzold et Swenberg, 1978; Abanobi et coll., 1979; Mirsalis et Butterworth, 1980; Brambilla et coll., 1981, 1987; Bermudez et coll., 1982; Cesarone et coll., 1982; Barbin et coll., 1983; Doolittle et coll., 1984; Kornbrust et Dietz, 1985; Loury et coll., 1987; Mirsalis et coll., 1989; Pool et coll., 1990; Brendler et coll., 1992; Jorquera et coll., 1993; Asakura et coll., 1994; Tinwell et coll., 1994; Webster et coll., 1996). Des dommages à l'ADN des cellules thymiques (Petzold et Swenberg, 1978), spermatiques (Cesarone et coll., 1979) ainsi que nasales et trachéales (Doolittle et coll., 1984) ont aussi été observés. La NDMA s'est également révélée mutagène au locus lacI (dans le foie) lors d'essais in vivo sur des souris transgéniques (Mirsalis et coll., 1993; Tinwell et coll., 1994; Butterworth et coll., 1998). De plus, une augmentation de la synthèse non programmée de l'ADN hépatique a été observée chez les rats ayant été exposés à des doses aussi faibles que 0,1 mg/kg p.c. (Mirsalis et Butterworth, 1980).
Les données disponibles ne peuvent servir de base à l'évaluation de la toxicité de la NDMA pour la reproduction ou le développement. L'interprétation des résultats des études les plus souvent mentionnées est compliquée par le fait que des doses élevées ont été administrées, ce qui a probablement provoqué la toxicité aiguë ou à doses répétées pour l'organe. Dans leur rapport, Anderson et coll. (1978) ont indiqué que le temps de conception était repoussé d'environ trois jours chez les souris femelles ayant ingéré de l'eau potable contenant 0,1 mg de NDMA par litre pendant 75 jours avant l'accouplement, par comparaison aux témoins non exposés; aucun autre effet sur la reproduction n'a été évalué durant cette étude. Dans une autre étude réalisée cette fois sur des rats mâles, une injection intrapéritonéale unique de NDMA de 30 ou 60 mg/kg p.c. a provoqué des lésions testiculaires (nécrose ou dégénérescence de l'épithélium séminifère) (Hard et Butler, 1970b).
Dans le cadre d'une étude réalisée sur une seule génération (Anderson et coll., 1978) ayant pour but d'examiner les effets d'un certain nombre de substances sur la reproduction, des groupes de 20 souris femelles ont ingéré de l'eau potable contenant 0 ou 0,1 mg de NDMA par litre pendant 75 jours avant l'accouplement, puis tout au long de la gestation et de la lactation (absorptions journalière et totale estimées respectivement à 0,02 mg/kg p.c. par jour et 2 mg/kg p.c.). La proportion de décès (établie en fonction du nombre total de mort-nés et de décès néonatals) était deux fois plus élevée chez les animaux exposés à la NDMA que chez les témoins (proportions respectives de 20 % et 9,9 %), en raison surtout de l'augmentation du nombre d'animaux mort-nés. L'exposition à la NDMA n'a eu aucun effet sur la consommation de liquide de la mère, la taille de la portée ou le poids moyen des animaux sevrés; aucune anomalie grossière ou histopathologique, qui puisse expliquer cette hausse de la mortalité, n'a été observée chez les foetus mort-nés ou les nouveau-nés morts.
Les effets de la NDMA sur les rats gravides ont été étudiés par Nishie (1983). Des doses orales uniques de 15 et 20 mg/kg p.c. de NDMA administrées le 18e jour de la gestation ont entraîné une létalité respective de 9,4 % et 35,3 % chez les rats gravides, mais aucune létalité n'a été constatée chez les rats non gravides. On a aussi noté une augmentation des taux sériques d'alpha-hydroxybutyrique-déshydrogénase chez les rats gravides le 20e jour et une diminution du poids foetal des rats traités les 13e et 18e jours.
Des données probantes démontrent que les effets toxicologiques de la NDMA sont directement fonction de la transformation métabolique dépendante du CYP2E1 de cette nitrosamine en des espèces chimiques hautement réactives. Lee et coll. (1996) ont attribué l'hépatotoxicité de la NDMA à l'ion méthyldiazonium qui se forme par alpha-hydroxylation; la dénitrosation, par contre, contribuerait peu à l'effet hépatotoxique global de cette nitrosamine chez les rats. Le principal adduit à l'ADN qui se forme après une exposition à la NDMA est la N7-méthylguanine (qui représente environ 65 % de tous les adduits se formant initialement au moment de l'exposition); la O6-méthylguanine est un adduit secondaire (qui représente environ 7 % de tous les adduits formés initialement). Parmi les autres adduits à l'ADN qui se forment en plus faibles quantités, mentionnons la N3-méthyladénine et la O4-méthylthymine.
La N7-méthylguanine peut subir une dépurination, entraînant la formation de sites apuriniques pouvant provoquer la transversion de la guanine en thymine (c.-à-d. G → T) s'ils ne sont pas réparés avant la réplication de l'ADN (Swenberg et coll., 1991). Les deux adduits formés en petites quantités, soit la O6-méthylguanine et la O4-méthylthymine (qui représente environ 1 % de la quantité de la O6-méthylguanine), sont fortement promutagènes, car ils provoquent un mésappariement direct des bases. Ainsi, la O6 -méthylguanine provoque des transitions où la paire guanine-cytosine est remplacée par la paire adénine-thymine (c.-à-d. GC → AT), alors que la O4-méthylthymine provoque des transitions AT → GC (Swenberg et coll., 1991; Souliotis et coll., 1995).
Les données disponibles démontrent systématiquement un lien entre la formation et la persistance de l'adduit secondaire, la O6-méthylguanine, et la cancérogénicité et la mutagénicité de la NDMA (Haggerty et Holsapple, 1990; Swenberg et coll., 1991; Souliotis et coll., 1995). La capacité des cellules de réparer les adduits à l'ADN (en éliminant la O6-méthylguanine par l'action d'une enzyme particulière, la O6-méthylguanine ADN-méthyltransférase) avant la division cellulaire joue sans doute un rôle déterminant dans la sensibilité des tissus à la formation de tumeurs.
La O6-méthylguanine a été décelée dans 32 tissus de singes auxquels une dose orale de 0,1 mg/kg p.c. de NDMA a été administrée (Anderson et coll., 1996). Les concentrations les plus élevées ont été observées dans la muqueuse gastrique et le foie, et des concentrations élevées dans les leucocytes, l'oesophage, les ovaires, le pancréas, la vessie et l'utérus. L'activité de la O6-méthylguanine ADN-méthyltransférase pouvait varier d'un facteur de 30. L'activité la plus forte a été détectée dans la muqueuse gastrique, le foie, les reins et les poumons. La formation de O6-méthylguanine a été décelée dans le foie, les poumons, les reins, la rate et le cerveau de foetus lors d'une étude où des singes patas gravides ont reçu, par voie gastrique, une dose unique de 1 mg/kg p.c. de NDMA (Chhabra et coll., 1995).
Le fait que les adduits à l'ADN, comme la O6-méthylguanine, persistent plus longtemps dans les reins que dans le foie de rats ayant reçu une dose orale unique de 20 mg/kg p.c. de NDMA vient corroborer des résultats antérieurs selon lesquels l'administration aiguë de telles doses de NDMA par voie orale ou intrapéritonéale augmente l'incidence de tumeurs rénales et non hépatiques chez les rats (Magee et Barnes, 1962; Schmidt et Murphy, 1966; Hard et Butler, 1970a; McLean et Magee, 1970). En revanche, l'administration orale à long terme de faibles doses de NDMA (c.-à-d. < 2 mg/kg p.c. par jour) augmente l'incidence de tumeurs hépatiques et non rénales chez ces mêmes animaux (Brantom, 1983; Lijinsky et Reuber, 1984; Peto et coll., 1991a,b), un phénomène que l'on attribue au métabolisme de premier passage de la NDMA dans le foie (Swenberg et coll., 1991).
Des différences quantitatives, possiblement liées aux variations de l'activité de la transférase, existent en fonction de l'âge et de l'espèce au niveau de la formation de O6-méthylguanine dans le foie, ce qui est en accord avec les variations observées de la cancérogénicité de ce composé parmi les espèces et les souches exposées à diverses conditions. Ces différences incluent une plus grande activité hépatique chez les souris adultes que chez les souris nouveau-nées (Coccia et coll., 1988), chez les rats que chez les souris et entre les souches de souris (plus importante pour la C3H que la C57BL) (Lindamood et coll., 1984).
Les données établissant un lien entre la formation de O6-méthylguanine et le développement de tumeurs après une exposition à la NDMA ont récemment été passées en revue par Souliotis et coll. (1995). Des transitions GC → AT ont été observées dans l'oncogène ras trouvé dans les tumeurs du poumon provoquées par la NDMA chez les souris (Devereux et coll., 1991), dans le foie de souris transgéniques lacI ayant reçu une dose unique de 4 mg/kg p.c. de NDMA (Mirsalis et coll., 1993), et dans le foie, les reins et les poumons de souris transgéniques lacI ayant reçu cinq doses journalières de 1 mg/kg p.c. de NDMA (Wang et coll., 1998). De plus, les souris transgéniques chez lesquelles de fortes concentrations de O6-méthylguanine ADNméthyltransférase ont été observées dans le foie ont été moins sensibles que les témoins à l'hépatocancérogenèse provoquée par la NDMA (Nakatsuru et coll., 1993). Cependant, Souliotis et coll. (1995) ont également souligné que la relation dose-réponse liée à l'accumulation de O6-méthylguanine dans l'ADN hépatique de rats ayant consommé pendant 28 jours de l'eau potable contenant des concentrations de NDMA similaires à celles de l'étude de BIBRA Toxicology International (Brantom, 1983; Peto et coll., 1991a,b) ne correspondait pas tout à fait à celle liée au développement de tumeurs du foie dans les essais biologiques de cancérogénicité.
Il a été démontré que la NDMA est un cancérogène puissant chez les animaux de laboratoire. La NDMA a été classée par le Centre international de Recherche sur le Cancer dans le groupe 2A comme étant « probablement cancérogène pour l'homme », ce qui indique qu'il existe suffisamment de preuves chez les animaux, mais des données insuffisantes chez l'homme (CIRC, 1987). Selon le poids de la preuve actuel, qui inclut des études chez les animaux plus récentes, la NDMA est considérée comme étant fort probablement cancérogène pour l'homme, tel que déterminé par Environnement Canada et Santé Canada (2001). Il est bien compris que le mécanisme par lequel la NDMA cause un cancer inclut la biotransformation de la NDMA par les enzymes microsomales du foie, formant ainsi l'ion méthyldiazonium.
La cancérogénicité de la NDMA ayant été clairement démontrée, peu d'études ont porté sur ses autres effets toxiques possibles, et les données existantes ne permettent pas de quantifier les effets autres que le cancer.
La génotoxicité in vivo et in vitro de la NDMA a également été démontrée. L'activation par les fractions S9 microsomales du foie est nécessaire pour obtenir un résultat in vitro positif. La récente observation faite à la suite d'un test d'Ames, selon laquelle les fractions S9 humaines provoquent une génotoxicité beaucoup plus forte que les fractions S9 du rat, semble indiquer que les humains peuvent être particulièrement sensibles à la cancérogénicité de la NDMA.
Plusieurs études cas-témoins et une étude de cohorte portant sur la NDMA ont été menées chez les humains. Bien qu'aucune de ces études ne puisse être utilisée pour quantifier le risque de cancer, les résultats confirment l'existence d'un lien entre l'exposition à la NDMA et le cancer colorectal ou de l'estomac. Il faut toutefois noter que ces études n'ont pas considéré l'eau potable comme voie d'exposition; elles ont plutôt utilisé des estimations de l'apport alimentaire total en NDMA.
Bien que plusieurs essais biologiques sur le cancer aient été menés sur des rongeurs, une étude en particulier ressort comme étant celle à utiliser pour effectuer une évaluation quantitative des risques en raison de sa plage exceptionnellement large de concentrations administrées (15 groupes dont les doses varient de 33 à 16 896 µg/L) (Brantom, 1983; Peto et coll., 1991a,b). La taille des groupes était également grande, chaque groupe étant constitué de 60 rats mâles et 60 rats femelles Colworth-Wistar. Le PISSC (2002) de même qu'Environnement Canada et Santé Canada (2001) ont utilisé cette étude, dans le cadre d'évaluations des risques, pour calculer la DT05 (c.-à-d. la dose qui entraîne une augmentation de 5 % de l'incidence des tumeurs par rapport au niveau de fond) causant un cancer du foie chez divers types de rats mâles et femelles.
Après avoir éliminé les groupes exposés aux doses les plus élevées afin de supprimer le repli dans la courbe dose-réponse, les valeurs de la DT05 ont été calculées en ajustant le modèle à degrés multiples aux données, puis en déterminant la dose à laquelle le risque excédentaire augmentait de 5 % par rapport au niveau de fond. Pour les rats femelles, les valeurs de la DT05 variaient de 34 à 82 µg/kg p.c. par jour (les limites inférieures de l'intervalle de confiance - LIIC - à 95 % variaient de 18 à 61 µg/kg p.c. par jour). Pour les rats mâles, les valeurs de la DT05 variaient de 35 à 78 µg/kg p.c. par jour (les LIIC à 95 % variaient de 29 à 48 µg/kg p.c. par jour) (Santé Canada, 2008).
Ces valeurs de la DT05 ont été utilisées pour calculer les risques unitaires de la présente évaluation. Les risques unitaires ont été calculés en divisant 0,05 par la DT05 ou la LIIC à 95 % par la DT05 (DTI05). Un facteur d'ajustement allométrique permettant de passer de l'animal à l'homme de (0,35/70)¼ a été appliqué aux risques unitaires obtenus. On utilise ce facteur d'ajustement allométrique pour tenir compte des différences de sensibilité à la NDMA entre les espèces. Bien que le mécanisme d'action chez les animaux et les humains semble qualitativement similaire, on ne dispose pas de données quantitatives permettant de conclure à l'absence de différences entre les espèces. De plus, il est possible que les humains soient plus sensibles que les animaux de laboratoire à la cancérogénicité des composés N-nitroso (Lijinsky, 1999).
Les risques unitaires variaient de 2,28 × 10-3 (µg/kg p.c. par jour)-1 (limite supérieure de l'intervalle de confiance à 95 % de 3,09 × 10-3 [µg/kg p.c. par jour]-1, selon la DTI05) pour les cystadénomes biliaires à 5,57 × 10-3 (µg/kg p.c. par jour)-1 (limite supérieure de l'intervalle de confiance à 95 % de 1,04 × 10-2 [µg/kg p.c. par jour]-1) pour les carcinomes.
Les risques unitaires peuvent servir à déterminer une plage de concentrations causant des risques de 10-4, 10-5 et 10-6. Les doses exprimées en µg/kg p.c. par jour ont été converties en concentrations dans l'eau potable en supposant une exposition humaine moyenne par l'eau potable de 1,9 L/jour (comme l'indique l'évaluation de l'exposition par voies multiples) et un poids corporel adulte humain moyen de 70 kg. La formule permettant de convertir les doses en concentrations est la suivante :
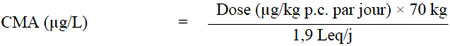
Figure 5 - Description textuel
La concentration acceptable maximum pour la NDMA est calculée en divisant le produit de la dose et 70 kilogrammes par 1,9 litre-équivalents par jour.Les concentrations estimées, déterminées à partir des risques unitaires calculés, qui correspondent aux risques à vie de cancer de 10-4, 10-5 et 10-6 chez l'humain sont les suivantes :
| Risque | Concentration dans l'eau potable (µg/L) |
|---|---|
| 10-4 | 0,4 à 1,0 µg/L |
| 10-5 | 0,04 à 0,1 µg/L |
| 10-6 | 0,004 à 0,01 µg/L |
La concentration maximale acceptable (CMA) pour la NDMA dans l'eau potable associée à un risque excédentaire à vie de cancer de 10-5 est de 0,000 04 mg/L (0,04 µg/L).
D'autres organismes ont établi des lignes directrices ou des règlements ayant trait à la concentration de NDMA dans l'eau potable. Toutes les estimations de risques sont fondées sur les effets cancérogènes et s'appuient sur la même étude clé pour établir les concentrations acceptables de NDMA dans l'eau potable.
L'OMS a fixé à 0,1 µg/L la ligne directrice pour la NDMA dans l'eau potable. Cette concentration correspond au risque à vie de cancer de 10-5 d'un adulte ayant un poids corporel moyen de 60 kg et consommant deux litres d'eau par jour. Contrairement à Santé Canada, l'OMS n'a pas utilisé de facteur d'ajustement allométrique pour calculer sa ligne directrice.
La California Environmental Protection Agency s'est également appuyée sur les études de Peto et coll. (1991a,b) pour établir un objectif de santé publique de 0,003 µg/L (3 ng/L) de NDMA dans l'eau potable, ce qui correspond à un risque à vie additionnel théorique de cancer de 10-6, en supposant un poids moyen de 70 kg et une consommation d'eau potable de 2 L/jour. Les risques à vie additionnels théoriques de cancer de 10-4 et de 10-5 ont été établis respectivement à 0,3 et 0,03 µg/L (OEHHA, 2006). La California EPA a fixé le niveau de déclaration de la NDMA dans l'eau potable à 0,01 µg/L.
Plus récemment, des chercheurs australiens se sont basés sur les études de Peto et coll. (1991a,b) portant sur les tumeurs hépatiques de rats pour déterminer la dose admissible de NDMA à l'aide de la méthode modifiée de la dose de référence (Fitzgerald et Robinson, 2007). Plusieurs modèles mathématiques ont été utilisés pour évaluer les données d'incidence et établir une plage de doses journalières tolérables (DJT) allant de 4,0 à 9,3 ng/kg p.c.
Le potentiel de cancérogénicité de la NDMA a également été évalué dans la Liste des substances d'intérêt prioritaire - Rapport d'évaluation sur la NDMA rédigé par Environnement Canada et Santé Canada (2001), qui décrit plusieurs sources possibles d'exposition à la NDMA. Bien que l'eau potable ne soit pas identifiée comme étant la source d'exposition à la NDMA la plus importante, il est recommandé de surveiller l'exposition par cette source.
Bien qu'elle ne soit plus utilisée au Canada à des fins industrielles, la NDMA est un sousproduit des procédés industriels qui utilisent des nitrates ou des nitrites et des amines à différents pH. Elle peut être présente dans les eaux de surface et les eaux souterraines, mais elle se retrouve essentiellement dans l'eau potable parce qu'elle se forme durant le processus de traitement de l'eau, en particulier le traitement aux chloramines. Au Canada, l'eau potable est considérée comme une source mineure d'exposition à la NDMA comparativement aux autres sources comme les aliments. Une évaluation de l'exposition par voies multiples a permis de déterminer que, bien que l'inhalation de la NDMA dans l'eau potable soit négligeable, l'exposition par absorption cutanée est importante. Celle-ci a donc été incluse dans le calcul de la CMA.
Toutes les études menées sur des animaux de laboratoire ont invariablement démontré le fort pouvoir cancérogène de la NDMA. Par conséquent, peu d'études ont porté sur ses autres effets toxiques, et les données ne permettent donc pas de faire une évaluation approfondie des effets autres que le cancer. Un facteur d'ajustement allométrique permettant de passer de l'animal à l'homme a été inclus dans l'évaluation pour tenir compte des différences de sensibilité à la NDMA entre les espèces.
Le risque à vie estimé de cancer associé à l'exposition à la NDMA dans l'eau potable à des concentrations variant de 0,004 à 0,04 µg/L (4 à 40 ng/L) est considéré comme étant essentiellement négligeable. La CMA pour un cancérogène est généralement établie à une concentration correspondant à un risque accru de cancer essentiellement négligeable lorsqu'une personne y est exposée à vie. Dans le cadre des recommandations pour la qualité de l'eau potable, Santé Canada entend par « essentiellement négligeable » une plage allant d'un nouveau cas de cancer de plus que le niveau de fond pour 100 000 personnes à un nouveau cas de cancer de plus que le niveau de fond pour un million de personnes (c.-à-d. 10-5 à 10-6) exposées à un contaminant à la CMA pendant toute une vie. Dans le cas de la NDMA, la CMA est établie à une concentration qui aurait un risque « essentiellement négligeable » d'un nouveau cas de cancer de plus que le niveau de fond pour 100 000 personnes exposées à la NDMA à la CMA pendant toute une vie, et tient compte des limites du traitement.
La NDMA peut être décelée et mesurée à de très faibles concentrations dans l'eau potable. Sa présence dans l'eau potable est généralement associée à sa formation durant le traitement de l'eau plutôt qu'à sa présence dans la source d'eau. Par conséquent, on suggère d'éliminer les précurseurs organiques azotés ou de modifier la méthode de désinfection utilisée afin d'en minimiser la formation sans compromettre l'efficacité du procédé de désinfection. Il est techniquement possible de réduire la quantité de NMDA dans l'eau potable à l'aide de l'irradiation aux UV, mais ce procédé peut se révéler coûteux et complexe pour les petites installations de service public.
On estime qu'en règle générale les concentrations de NDMA dans l'eau potable au Canada sont inférieures ou égales à 5 ng/L (0,005 µg/L), bien que des concentrations plus élevées aient été déclarées dans certaines collectivités.
En résumé, la CMA de 0,000 04 mg/L (0,04 µg/L) proposée pour la NDMA a été basée sur les considérations suivantes :
- Elle se situe dans la plage considérée comme présentant un risque essentiellement négligeable.
- Elle est décelable et mesurable, avec une limite de détection pour la méthode beaucoup plus basse que la CMA..
- Elle est réalisable à un coût raisonnable, en mettant en oeuvre des méthodes permettant de réduire la formation de la NDMA.
Dans le cadre de son processus continu de révision des recommandations, Santé Canada continuera à suivre les nouvelles recherches dans ce domaine et recommandera au besoin les modifications jugées appropriées.