Dosage des alcaloïdes associés à la nicotine dans le tabac entier par le CPG-DTS : T-301
1 Portée
1.1
Cette méthode permet de déterminer la teneur en nicotine, en nornicotine, en anabasine, en myosmine et en anatabine (alcaloïdes) dans le tabac entier. Elle est conçue pour le dosage direct de la nicotine au moyen d'un étalonnage, et sert également à déterminer la quantité de chacun des autres alcaloïdes, en supposant un facteur de réponse semblable.
1.2
La nornicotine, l'anabasine, la myosmine et l'anatabine (s'il y a lieu) peuvent aussi être dosées au moyen d'un étalonnage préparé à partir d'étalons disponibles commercialement. Si de l'anatabine pure n'est pas disponible, il faut doser cette substance en utilisant le facteur de réponse obtenu avec l'étalon d'anabasine.
1.3
La teneur totale en alcaloïdes est la somme des teneurs en nicotine, en nornicotine, en anabasine, en myosmine et en anatabine.
2 Normes applicables
2.1
Méthode officielle T-115 de Santé Canada, Dosage du goudron, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 2016.
2.2
Organisation internationale de normalisation, ISO 8243, Cigarettes - Échantillonnage, 2013.
2.3
Organisation internationale de normalisation, ISO 15592-1, Tabac à rouler et objets confectionnés à partir de ce type de tabac - Méthodes d'échantillonnage, de conditionnement et d'analyse - Partie 1 : Échantillonnage, 2001.
2.4
Méthode officielle T-402 de Santé Canada. Préparation de cigarettes, de bâtonnets de tabac, de tabac à cigarette, de cigares, de petits cigares, de kreteks, de bidis, de tabac en feuille, de tabac à pipe ou de tabac sans fumée aux fins d'essais, 2016.
2.5
AOAC INTERNATIONAL, Méthode officielle de l'AOAC 966.02, Loss on Drying (Moisture) in Tobacco, Official Methods of Analysis of AOAC INTERNATIONAL, 20ème édition, 2016.
3 Définitions
3.1
Le tabac entier est utilisé pour représenter le tabac non brûlé présent dans un produit donné du tabac.
4 Résumé de la méthode
4.1
L'analyse est réalisée par chromatographie en phase gazeuse (CPG), à l'aide d'une colonne capillaire en silice fondue et d'un détecteur thermoïonique spécifique (DTS). Le tabac lyophilisé et moulu est extrait avec une solution méthanolique de KOH (contenant du dichlorhydrate de 4,4'-dipyridyle comme étalon interne), dans un bain ultrasonique. Le mélange est ensuite centrifugé à faible vitesse pour séparer le tabac solide de la solution. Le surnageant est transvasé dans un contenant pour échantillonneur automatique, puis analysé par CG.
4.2
Les alcaloïdes sont analysés sur une colonne capillaire en silice fondue CAM renfermant une phase stationnaire constituée de polyéthylèneglycol (PEG) spécifiquement désactivé en milieu basique pour permettre l'analyse des amines volatiles. Le dosage est réalisé à l'aide d'un étalon interne, en comparant la réponse du DTS obtenue avec les analytes de l'échantillon à un étalonnage en plusieurs points de la nicotine dans les étalons.
Avertissement : L'analyse et l'évaluation de certains produits à l'aide de cette méthode peuvent nécessiter l'utilisation de substances et/ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte de tous les règlements en vigueur.
5 Appareillage et équipement
5.1
Lyophilisateur ou appareil équivalent.
5.2
Tubes pour culture, jetables, en verre borosilicaté, 10 mm × 125 mm.
Remarque : Les tubes à paroi mince permettent d'obtenir un meilleur extrait, car ce type de paroi absorbe moins d'énergie ultrasonique.
5.3
Balance analytique précise à au moins quatre décimales.
5.4
Fioles jaugées de 10 mL, de 1000 mL et de 2000 mL.
5.5
Pipettes Pasteur en verre.
5.6
Micropipettes ou seringues étanches aux gaz.
5.7
Pipettes distributrices de 1 - 5 mL et bouteille.
5.8
Parafilm®.
5.9
Contenant à scintillation de 20 mL, avec bouchon revêtu d'aluminium.
5.10
Broyeur de laboratoire avec tamis no 40.
5.11
Coton-tiges.
5.12
Système de chromatographie en phase gazeuse, avec détecteur DTS ou l'équivalent.
5.13
Échantillonneur automatique ou l'équivalent.
5.14
Flacons pour échantillonneur automatique, avec bouchons et septums doublés intérieurement de téflon.
5.15
Colonne capillaire en silice fondue CAM – 30 m × 0,25 mm × 0,25 µm, ou l'équivalent.
5.16
Bain à ultrasons.
5.17
Centrifugeuse.
5.18
Mélangeur rotatif (à vortex).
6 Réactifs et matériel
6.1
Tous les réactifs doivent être, au minimum, de qualité pure pour analyses.
Remarque : lorsque cela était possible, le numéro de registre des Chemical Abstracts [numéro CAS] a été ajouté entre crochets à la suite de chaque réactif.
6.2
Dichlorhydrate de 4,4'-dipyridyle – [27926-72-3] utilisé comme étalon interne.
6.3
Méthanol - [67-56-1] distillé en verre.
6.4
(-)-Nicotine6 Réactifs et matériel : Note de bas de page * - [54-11-5].e
6.5
Hydroxyde de potassium - [1310-58-3].
6.6
Eau de type I, tel que stipulé dans le tableau 1 de la méthode D1193 de l'ASTM, Processes for Reagent Water Production, Note A.
6.7
Dans le cas où le dosage des alcaloïdes mineurs est spécifiquement requis :
- (+/-)-anabasine – (néonicotine)6 Réactifs et matériel : Note de bas de page * - [13078-04-1].
- (+/-)-nornicotine – (2-[pyrid-3-yl]-pyrrolidine)6 Réactifs et matériel : Note de bas de page * - [5746-86-1].
- myosmine – (3-[1-pyrrolin-2-yl]pyridine)6 Réactifs et matériel : Note de bas de page * - [532-12-7].
- (R,S)-anatabine6 Réactifs et matériel : Note de bas de page * - [2743-90-0].
6 Réactifs et matériel : Notes de bas de page
- 6 Réactifs et matériel : Note de bas de page *
-
Remarque : la pureté de tous ces composés doit être connue et le plus proche possible de 100 %.
6 Réactifs et matériel : Retour à la référence de la note de bas de page *
7 Préparation de la verrerie
7.1
Nettoyer et sécher la verrerie de manière à s'assurer qu'il n'y ait aucune contamination découlant de la présence de résidus.
8 Préparation des solutions
8.1
Solution d'extraction - (0,25 mg/mL de dichlorhydrate de 4,4'-dipyridyle dans du KOH méthanolique)
8.1.1
Peser 5,6 g (± 0,05 g) d'hydroxyde de potassium (KOH) dans une fiole jaugée de 2000 mL et compléter avec du méthanol (MeOH).
Remarque : il faut avoir recours à une sonication pour dissoudre les pastilles.
8.1.2
Apposer une étiquette sur la fiole indiquant « KOH 0,05N dans MeOH », ainsi que la date de préparation.
8.1.3
Peser 0,25 ± 0,005 g de dichlorhydrate de 4,4-dipyridyle dans une fiole jaugée de 1000 mL, puis compléter avec la solution méthanolique de KOH 0,05N.
8.1.4
Bien mélanger et transvaser le contenu dans une bouteille distributrice de 1250 mL. Apposer une étiquette indiquant « Solution pour extraction des alcaloïdes », ainsi que la date de préparation.
Remarque : lorsqu'une nouvelle solution d'extraction est préparée, il faut préparer une nouvelle série d'étalons de travail pour s'assurer que la concentration d'étalon interne sera la même dans les échantillons et dans les étalons.
9 Préparation des étalons
9.1
Solution mère primaire de nicotine (concentration approximative : 5 mg/mL)
9.1.1
Peser exactement 0,05 g (± 0,005 g) de nicotine dans une fiole jaugée de 10 mL et compléter avec la solution d'extraction.
Remarque : la nicotine est très hygroscopique; la pesée doit donc être faite avec soin et rapidement pour prévenir toute absorption d'humidité.
Remarque : les solutions mères primaires des alcaloïdes mineurs (au besoin) sont préparées de la même manière. Bien que leurs concentrations soient considérablement moindres que la concentration de nicotine, il n'est pas recommandé de peser une quantité moindre d'étalon, mais plutôt de préparer une solution mère secondaire qui servira à la préparation des étalons dilués.
9.2
Étalons de travail
9.2.1
Préparer tous les étalons dans des fioles jaugées, en utilisant les dilutions mentionnées au tableau suivant :
| Étalon no |
Volume d'étalon mère primaire (µL) |
Volume (mL) |
Nicotine [µg/mL] |
Rapport Nicotine/ étalon interne |
|---|---|---|---|---|
| 1 | 2000 | 10 | 1000 | 4 |
| 2 | 1000 | 10 | 500 | 2 |
| 3 | 500 | 10 | 250 | 1 |
| 4 | 250 | 10 | 125 | 0,5 |
| 5 | 100 | 10 | 50 | 0,2 |
9.2.2
Compléter les fioles jaugées avec la solution d'extraction contenant l'étalon interne.
Remarque : les concentrations d'analyse peuvent varier selon la concentration de la solution mère primaire et doivent être calculées afin d'obtenir un étalonnage exact.
Remarque : pour obtenir un intervalle d'étalonnage plus étroit pour le dosage des alcaloïdes mineurs, on peut préparer un étalon dont la concentration est égale au dixième de la concentration de l'étalon de nicotine le moins concentré. Pour calculer la concentration des alcaloïdes mineurs, on peut établir un autre facteur de réponse distinct (ou une autre courbe d'étalonnage distincte) à partir des trois étalons les moins concentrés.
Remarque : il peut être nécessaire de préparer d'autres étalons pour couvrir l'intervalle de réponses prévues avec les échantillons.
10 Échantillonnage
10.1
L'échantillonnage des cigarettes aux fins des tests doit être effectué conformément à la norme ISO 8243.
10.2
L'échantillonnage des kreteks, des petits cigares, des bidis, des bâtonnets de tabac aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par kreteks, petits cigares, bidis ou bâtonnets de tabac, pour lesquels le terme carton est équivalent à 200 unités.
10.3
L'échantillonnage des cigares aux fins des tests doit être effectué conformément à la norme ISO 8243, mais modifié en remplaçant le terme cigarettes par cigares, pour lesquels 200 unités de cigarettes est équivalent à 200 grammes de cigare.
10.4
L'échantillonnage du tabac à cigarette aux fins des tests doit être effectué conformément à la norme ISO 15592-1
10.5
L'échantillonnage des feuilles de tabac, du tabac à pipe et du tabac sans fumée aux fins des tests doit être effectué conformément à la norme ISO 15592-1, mais modifié en remplaçant le terme tabac à rouler par le terme feuilles de tabac, tabac à pipe ou tabac sans fumée.
11 Préparation des produits du tabac
11.1
La préparation des produits du tabac à analyser doit être effectuée conformément à la méthode T-402.
12 Préparation des échantillons
12.1
Lyophilisation des échantillons de tabac
12.1.1
Peser avec précision un contenant à scintillation sec de 20 mL, portant une étiquette appropriée, avec son bouchon doublé intérieurement d'aluminium, puis noter le poids.
12.1.2
Transférer le tabac, soit environ 2 g, dans un flacon à scintillation de 20 mL muni d'un bouchon doublé intérieurement d'aluminium.
12.1.3
Peser exactement et noter le poids total (tabac témoin seulement) avec le bouchon sur le contenant et le tabac.
12.1.4
Lyophiliser, peser exactement et noter le poids total (tabac témoin seulement) avec le bouchon sur le contenant et le tabac, puis calculer la teneur en pourcentage d'humidité.
Remarque : la teneur en humidité du tabac témoin est déterminée uniquement pour vérifier la performance du lyophilisateur.
12.2
Broyage des échantillons
12.2.1
Broyer le tabac avec un broyeur de laboratoire muni d'un tamis no 40 (40 mailles au pouce carré).
12.2.2
Après broyage, récupérer les particules restantes de tabac de l'échantillon avec un coton-tige, puis passer l'aspirateur dans le broyeur pour éliminer toutes les poussières de tabac.
12.2.3
Démonter le broyeur et le nettoyer avec du méthanol.
12.2.4
Le remonter et passer de nouveau l'aspirateur pour évaporer tout résidu de méthanol.
12.2.5
Répéter ce nettoyage entre les échantillons.
12.3
Extraction des échantillons
12.3.1
Peser 25 mg (± 5 mg) de tabac broyé dans un tube pour culture, jetable, en verre borosilicaté, de 10 mm × 125 mm.
12.3.2
Ajouter 1 mL de la solution d'extraction à l'échantillon.
12.3.3
Sceller le tube pour culture avec quatre couches de Parafilm®et le placer dans un support métallique adapté au bain à ultrasons.
12.3.4
Retirer les échantillons du bain après une heure, puis les mélanger dans le mélangeur rotatif (à vortex). Agiter le tube pour mélanger tout le tabac au solvant, puis le remettre dans le bain à ultrasons.
12.3.5
Procéder à la sonication des échantillons pendant trois heures.
Remarque : la sonication produit de la chaleur; il faut donc surveiller la température du bain pour s'assurer qu'elle ne dépasse pas 40 °C On obtient de meilleurs résultats en remplaçant l'eau du bain par de l'eau froide à chaque heure.
Remarque : il faut examiner de près l'échantillon pendant la sonication. On doit être capable d'observer la vibration des morceaux de tabac, et la solution doit présenter une couleur homogène une fois la sonication terminée.
12.3.6
Une fois la sonication terminée, agiter les échantillons sur un agitateur à mouvement oscillant pendant 30 minutes.
12.3.7
Une fois l'agitation terminée, centrifuger les tubes à faible vitesse pendant 5 minutes, pour séparer le tabac du solvant.
12.3.8
Transvaser le surnageant dans un contenant pour échantillonneur automatique en vue de l'analyse par CG.
13 Analyse des échantillons
13.1
Paramètres pour le système de chromatographie en phase gazeuse
- Injecteur :
- à débit divisé
- Colonne :
- CAM – 30 m × 0,25 mm × 0,25 µm
- Détecteur :
- thermionique spécifique (DTS)
- Gaz vecteur :
- hélium, 15,0 lb/po2, vitesse linéaire d'environ 30 cm/s
Remarque : régler les débits d'H2, d'air anhydre et de N2 d'appoint du détecteur conformément aux spécifications du fabricant.
13.1.1
Programmation de température
- Injecteur :
- 220 °C
- Détecteur
- 300 °C
- Température de départ :
- 110 °C, maintenir une minute
- Gradient :
- 5 °C/min jusqu'à 225 °C, maintenir deux minutes
- Temps total d'analyse :
- 26,00 minutes
13.1.2
Paramètres pour l'échantillonneur automatique
Volume injecté : 1,0 µL
Remarque : il sera peut-être nécessaire de régler les paramètres d'analyse, selon l'appareil et la colonne utilisés et la résolution du pic de l'analyte.
Remarque : au départ, le premier étalon doit être injecté au moins trois fois pour conditionner la colonne.
Remarque : avant de commencer, installer un nouveau tube pré-silanisé pour minimiser la réactivité de l'injecteur. Le remplacer après l'analyse de 40 échantillons « réels » à cause de l'accumulation d'impuretés. La nornicotine est particulièrement sensible à la dégradation.
14 Calculs
14.1
Établir une courbe d'étalonnage interne de la surface des pics en fonction de la concentration des solutions étalons. Ces facteurs d'étalonnage sont utilisés pour calculer la concentration de chaque analyte dans chaque échantillon. En entrant les coefficients appropriés de multiplication (volume total de dilution de l'échantillon d'origine, en mL-1) et de division (poids de l'échantillon d'origine, en g, précis à la quatrième décimale), on obtient automatiquement la teneur de chacun des alcaloïdes, calculée en µg/g.
Résultats d'analyse (en « matière sèche »)
Analyte [µg/g] = (Aireéchant. analyte./Aireétalon interne) × FR(µg/mL) × (Multiplicateur(mL)/Diviseur(g))
où le facteur de réponse (FR) est défini à partir de la courbe d’étalonnage.
14.2
Tous les résultats sont exprimés en poids de « matière sèche ». Ils peuvent être exprimés en poids de tabac « tel que reçu », en utilisant le degré d'humidité approprié.
Conversion en poids de tabac « tel que reçu » :
Analyte [µg/g]« tel que reçu » = Analyte [µg/g]« matière sèche » × {1-(Humidité (%)/100)}
où le degré d'humidité (%) est déterminé par la méthode officielle 966.02 de l'AOAC INTERNATIONAL.
15 Contrôle de la qualité
15.1
15.2
Paramètres de contrôle typiques
Remarque : si les mesures de contrôle sont hors des limites de tolérance des valeurs prévues, il faut procéder à une étude appropriée et prendre les mesures qui s'imposent.
15.2.1
Blanc de réactifs (BR)
Chaque série d'analyse doit comprendre un blanc de réactif (BR) afin de détecter toute contamination pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BR est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin. Le BR est analysé comme s'il s'agissait d'un échantillon.
15.2.2
Blanc fortifié (BF)
Chaque série d'analyse doit comprendre un blanc fortifié (BF) afin de détecter toute perte d'analytes pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BF est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin, et doit avoir été fortifié par l'addition d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. Le BF est analysé comme s'il s'agissait d'un échantillon.
15.2.3
Matrice fortifiée (MF)
Chaque série d'analyse doit comprendre une matrice fortifiée (MF) afin de détecter toute interférence provenant de la matrice. Lors de la préparation des échantillons et/ou pendant l'exécution des analyses, diviser un échantillon et fortifier une des portions par l'addition d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. La MF est analysée comme s'il s'agissait d'un échantillon.
15.2.4
Échantillon de contrôle
Pour évaluer la performance globale d'une méthode d'analyse, procéder à l'analyse d'un échantillon témoin. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux « valeurs prévues » obtenues dans le laboratoire ou, en l'absence de tels résultats, aux valeurs publiées dans la littérature. Le laboratoire obtiendra ainsi des données sur l'exactitude et la précision de la méthode d'analyse.
15.2.5
Échantillon étalon
Pour évaluer la stabilité du système d'analyse, analyser un étalon comme s'il s'agissait d'un échantillon. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux concentrations prévues.
15.3
Taux de récupération et niveaux de contamination
15.3.1
Voici les valeurs du BR (basées sur la moyenne ± l'écart-type) :
| N/A | BR (µg/g) |
|---|---|
| Anabasine | 0.3 ± 1,1 |
| Anatabine | 1.0 ± 2,6 |
| Myosmine | 4.6 ± 5,3 |
| Nornicotine | 15 ± 14 |
| Nicotine | 108 ± 167 |
15.3.2
Les taux de récupération du BF et de la MF se situent habituellement dans un intervalle de 70 - 120 %.
15.4
Limite de détection (LD) et limite de quantification (LQ)
15.4.1
La limite de détection (LD) est égale à trois fois l'écart-type des résultats obtenus en analysant l'étalon le moins concentré au moins 10 fois sur une période de plusieurs jours.
15.4.2
La limite de quantification (LQ) est égale à 10 fois l'écart-type des résultats obtenus en analysant l'étalon le moins concentré au moins 10 fois sur une période de plusieurs jours.
15.4.3
Voici une liste des valeurs typiques obtenues pour les alcaloïdes :
| N/A | LD (μg/g) |
LQ (μg/g) |
|---|---|---|
| Nicotine | 75 | 250 |
| Alcaloïdes mineurs | 15 | 50 |
15.5
Stabilité des réactifs et des échantillons
15.5.1
La colonne CAM renferme une phase stationnaire constituée de polyéthylèneglycol qui a été désactivé avec un milieu basique pour permettre l'analyse des amines volatiles. Toutefois, les effets de traînée de pic peuvent influer sur le dosage des alcaloïdes mineurs, car ils sont présents en quantité plus faibles et produisent donc un rapport signal/bruit plus faible. Ces effets de traînée de pic sont dus à deux sources autres que la réactivité des composés :
- effet de solvant.
- réactivité dans l'injecteur.
15.5.2
Le méthanol est, en général, un mauvais choix de solvant pour l'injection dans une colonne de CG, car il produit une énorme traînée. On peut minimiser cet effet en choisissant un important rapport de division pour le débit et une vitesse linéaire élevée dans la colonne, en utilisant une épaisse couche de phase stationnaire et en insérant un tube en verre désactivé dans l'injecteur.
15.5.3
La réactivité dans l'injecteur est minimisée par l'insertion de tubes en verre désactivé. Il faut changer ce tube après chaque série d'échantillons (en gros, après 40 « véritables » échantillons), car la solution injectée est relativement sale et crée des sites actifs sur le tube après l'injection de plusieurs échantillons.
15.5.4
Il ne semble pas y avoir de problème de stabilité des échantillons et des étalons, s'ils sont conservés à 4 °C.
16 Références
16.1
Severson, R. F. et al., 1981. Rapid method for the analysis of tobacco nicotine alkaloids, J. Chromatog. 211: 111 121.
16.2
ASTM International, Méthode ASTM D1193-06(2011), Standard Specifications for Reagent Water.
16.3
Annexe 1 :
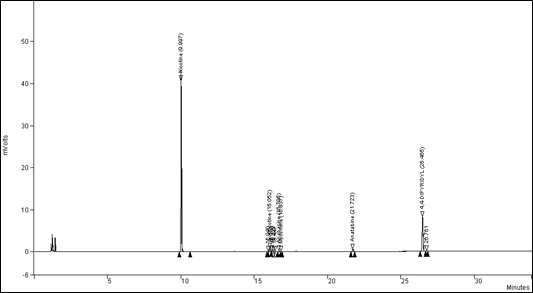
Figure 1 : Chromatogramme typique des alcaloïdes mineurs : Équivalent textuel
Figure 1: La figure suivante présente un exemple de chromatogramme pour la cigarette Monitor 7 de l'industrie canadienne montrant la concentration de nicotine par rapport à celle des alcaloïdes mineurs.
Chromatogramme typique obtenu avec une cigarette Monitor 7 de l'industrie canadienne
Temps de rétention typiques :
- Nicotine :
- 9,997 min
- Nornicotine :
- 16,052 min
- Anabasine :
- 16,705 min
- Myosmine :
- 16,837 min
- Anatabine :
- 21,723 min
- Dichlorhydrate de 4,4'-dipyridyle (étalon interne) :
- 26,465 min
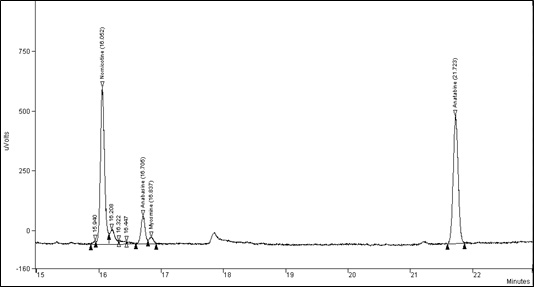
Figure 2 : Agrandissement d'un chromatogramme typique des alcaloïdes mineurs : Équivalent textuel
Figure 2 : La figure suivante présente une vue détaillée des composants des alcaloïdes mineurs de la figure 1.