Dosage des nitrosamines spécifiques au tabac dans le tabac entier par CL/SM/SM : T-309B
1 Portée
1.1
La présente méthode convient au dosage de 4 N-nitrosamines spécifiques au tabac (NAST) dans le tabac entier et les produits du tabac :
La N-nitrosonornicotine (NNN), la 4-(méthylnitrosamino)-1-(pyrid-3-yl)butan-1-one (NNK), la N-nitrosoanatabine (NAT) et la N-nitrosoanabasine (NAB). Le dosage est réalisé par chromatographie en phase liquide et spectrométrie de masse en tandem (CL/SM/SM).
2 Normes applicables
2.1
Méthode officielle T-402 de Santé Canada. Préparation des cigarettes, du tabac à cigarettes, des cigares, des kreteks, des bidis, du tabac en feuille, du tabac à pipe et du tabac sans fumée aux fins d'essais, 2016.
2.2
Méthode officielle T-115 de Santé Canada. Dosage du goudron, de l'eau, de la nicotine et du monoxyde de carbone dans la fumée principale de tabac, 2016.
2.3
Organisation internationale de normalisation, ISO 8243 Cigarettes-Échantillonnage, 2013.
2.4
Organisation internationale de normalisation, ISO 15592-1 Tabac à rouler et objets confectionnés à partir de ce type de tabac - Méthodes d'échantillonnage, de conditionnement et d'analyse - Partie 1 : Échantillonnage, 2001.
2.5
AOAC INTERNATIONAL, AOAC Official Method 966.02 Moisture in Tobacco, Gravimetric Method. Official Methods of Analysis of AOAC INTERNATIONAL, 20ème édition, 2016.
3 Définitions
3.1
Pour une définition des termes utilisés dans le présent document, se reporter à la méthode T-115.
4 Résumé de la méthode
4.1
Une aliquote d'une solution d'étalon interne (p. ex. 300 µL), contenant quatre analogues des NAST marqués au deutérium (à savoir 5 000 ng/mL pour NNN-d4, NAT-d4 et NNK-d4 et 2 000 ng/mL pour NAB-d4), est déposée sur le produit du tabac visé (p. ex., 0,75 g).
4.2
Les NAST sont extraites du produit du tabac sur un agitateur oscillant grâce à une solution aqueuse d'acétate d'ammonium.
4.3
L'extrait est ensuite filtré et analysé par chromatographie en phase liquide haute performance et spectrométrie de masse en tandem (CL/SM/SM) avec ionisation par électropulvérisation (ESI) en mode positif. Le spectromètre de masse à triple quadrupôle, exploité en mode de suivi de plusieurs réactions (MRM), permet la détermination spécifique en fonction de la masse des analytes ciblés en suivant des réactions de fragmentation spécifiques parent/produit (transitions MRM).
4.4
On peut utiliser deux paires de transitions pour chaque analyte pour le dosage et la confirmation de l'analyte. On utilise normalement les paires dont le signal est le plus intense pour le dosage, les paires dont le signal est moins intense sont utilisées comme déterminants pour la confirmation du composé.
Avertissement : L'analyse et l'évaluation de certains produits à l'aide de cette méthode peuvent nécessiter l'utilisation de substances et/ou d'équipement potentiellement dangereux. Le présent document n'entend pas répondre à tous les aspects concernant la sécurité de son utilisation. Avant d'utiliser cette méthode normalisée, toute personne a la responsabilité de consulter les autorités compétentes et de prendre des mesures de protection de la santé et des mesures de sécurité qui tiennent compte de tous les règlements en vigueur.
Avertissement : Ces quatre NAST sont des substances cancérogènes chez plusieurs espèces d'animaux de laboratoire. Il faut faire extrêmement attention lorsqu'on manipule ces composés (consulter le document intitulé Guidelines for Laboratory Use of Chemical Carcinogens [16.7]).
Les 4 NAST sont sensibles à la lumière UV. Toutes les préparations, le fumage et les analyses devraient être réalisés dans un environnement exempt de rayonnement UV.
5 Appareillage et équipement
5.1
Équipement nécessaire pour préparer le tabac tel que défini dans la méthode T-402.
5.2
Balance d'analyse pour des mesures avec quatre chiffres après la virgule
5.3
Agitateur oscillant Burrell ou l'équivalent
5.4
Éclairage non ultraviolet (non UV) ou l'équivalent
5.5
Gants (partie de l'équipement de protection personnel – EPP)
5.6
Erlenmeyer de 100 mL (verre) ou contenant d'extraction équivalent.
5.7
Filtres pour seringue en nylon de 25 mm × 0,45 µm GD/X (Whatman®6870-2504) ou l'équivalent
5.8
Seringue jetable de 5 mL
5.9
Flacons en verre ambré de 1,5 mL à bouchon à vis ou l'équivalent
5.10
Septums bleus recouverts de téflon ou l'équivalent
5.11
Fioles jaugées : 10, 50, 100, 200 et 2 000 mL
5.12
Pipettes de transfert en verre jetables
5.13
Cylindres gradués en verre : 25 et 2 000 mL
5.14
Filtres à membrane de nylon de 47 mm × 0,45 µm ou l'équivalent
5.15
Pipettes volumétriques ou l'équivalent : 2 mL
5.16
Micropipettes volumétriques ou l'équivalent : gamme de 100 à 1 000 µL
5.17
Système de CL/SM/SM – système de chromatographie en phase liquide muni d'un échantillonneur automatisé, d'une pompe binaire et d'un four à colonne – spectromètre de masse à triple quadrupôle avec dispositif d'ionisation par électropulvérisation (ESI). Le système doit être muni d'un système informatisé de commande et d'acquisition et de traitement des données. Le système doit permettre d'obtenir des données en mode de suivi de plusieurs réactions (MRM).
5.18
Colonne d'analyse : Agilent Zorbax Eclipse XDB-C18 (petite ouverture, 2,1 × 150 mm, taille de particule de 3,5 µm) ou l'équivalent.
5.19
Colonne de garde : OPTI-GUARD RP C18 (1 mm, Violet) ou l'équivalent
6 Réactifs et matériel
6.1
Tous les réactifs doivent être, au minimum, de qualité réactif pour analyses.
Remarque : lorsque cela était possible, le numéro de registre des Chemical Abstracts [numéro CAS] a été ajouté entre crochets à la suite de chaque réactif.
6.2
N-Nitrosonornicotine (NNN) ≥ 98 %
6.3
N-Nitrosonornicotine marquée au deutérium (NNN-d4) ≥ 98 %
6.4
N-Nitrosoanatabine (NAT) ≥ 98 %
6.5
N-Nitrosoanatabine marquée au deutérium (NAT-d4) ≥ 98 %
6.6
N-Nitrosoanabasine (NAB) ≥ 98 %
6.7
N-Nitrosoanabasine marquée au deutérium (NAB-d4) ≥ 98 %
6.8
4-(Méthylnitrosamino)-1-(pyrid-3-yl)butan-1-one (NNK) ≥ 98 %
6.9
4-(Méthylnitrosamino)-1-(pyrid-3-yl)butan-1-one marquée au deutérium (NNK-d4) ≥ 98 %
6.10
Acétate d'ammonium - [631-61-8]
6.11
Acide acétique glacial – [64-19-7]
6.12
Acétonitrile – [75-05-8] qualité CLHP
6.13
Méthanol - [67-56-1] qualité CLHP
6.14
Eau de type I, tel que spécifié dans le tableau 1 de la méthode D1193 de l'ASTM, Processes for Reagent Water Production, Note A.
7 Préparation de la verrerie
7.1
Nettoyer et sécher la verrerie de manière à s'assurer qu'il n'y ait aucune contamination découlant de la présence de résidus.
8 Préparation des solutions
8.1
Préparation de la solution d'extraction d'acétate d'ammonium 100 mM
8.1.1
Peser 7,70 g d'acétate d'ammonium solide dans une fiole jaugée de 1 L.
8.1.2
Dissoudre l'acétate d'ammonium avec de l'eau de type I, puis compléter le volume.
8.1.3
Filtrer la solution tampon au moyen d'un filtre à membrane de nylon de 0,45 µm (ou l'équivalent).
8.2
Préparation d'une solution d'acide acétique à 0,1 % dans le méthanol (v/v) (phase mobile)
8.2.1
Mettre environ 1 400 mL de méthanol dans une fiole jaugée de 2 L.
8.2.2
Mettre 2 mL d'acide acétique glacial dans la fiole.
8.2.3
Mélanger, puis compléter le volume avec du méthanol.
8.2.4
Filtrer la solution au moyen d'un filtre à membrane de nylon de 0,45 µm ou l'équivalent.
8.3
Préparation d'une solution d'acide acétique à 0,1 % dans de l'eau (v/v) (phase mobile)
8.3.1
Mettre environ 1 400 mL d'eau de type I dans une fiole jaugée de 2 L.
8.3.2
Mettre 2 mL d'acide acétique glacial dans la fiole.
8.3.3
Mélanger, puis compléter le volume avec de l'eau de type I.
8.3.4
Filtrer la solution au moyen d'un filtre à membrane de nylon de 0,45 µm ou l'équivalent.
9 Préparation des étalons
9.1
Préparation des solutions mères d'étalon interne (EI)
9.1.1
Préparer des solutions mères séparées d'EI à environ 1 mg/mL dans l'acétonitrile en mettant 10 mg de chacune des NAST marquées isotopiquement dans des fioles jaugées de 10 mL, en utilisant une balance d'analyse (noter le poids à 0,1 mg près) et compléter le volume avec de l'acétonitrile.
9.1.2
Préparer une solution combinée de dopage d'EI en mettant 0,5 mL de chacune des solutions mères de NNN-d4, NNK-d4, NAT-d4 et 0,2 mL de solution mère de NAB-d4 dans une fiole jaugée de 100 mL, compléter le volume avec de l'acétonitrile.
9.1.3
Les solutions mères d'EI peuvent être conservées jusqu'à 12 mois à - 20 ° C (± 5 ° C) et à l'abri de la lumière.
Remarque : toutes les solutions étalons doivent être évaluées après une durée de stockage de plus de 12 mois afin de s'assurer de leur intégrité.
9.2
Préparation des solutions mères des NAST
9.2.1
Préparer des solutions mères primaires distinctes à 1 mg/mL de NNN, NNK et NAT et à 0,5 mg/mL de NAB en mettant 10 mg de NNN, NNK et de NAT et 5 mg de NAB dans des fioles jaugées de 10 mL, en utilisant une balance d'analyse (noter le poids à 0,1 mg près). Compléter le volume avec de l'acétonitrile.
9.2.2
Préparer une solution mère secondaire combinée des NAST (solution mère secondaire 1) à environ 40 µg/mL de NNN, NAT et NNK et à environ 10 µg/mL de NAB dans l'acétonitrile.
9.2.3
Préparer une solution mère diluée des NAST (solution mère secondaire 2) à environ 400 ng/mL de NNN, NAT et NNK et à environ 100 ng/mL de NAB dans un mélange de 30 % d'acétonitrile et de 70 % d'eau de type I.
9.3
Préparation des solutions étalons de travail (solutions d'étalonnage)
9.3.1
Préparer des solutions étalons de travail en mettant le volume prescrit de solution mère secondaire 2 de NAST dans 9 fioles jaugées de 10 mL (voir le tableau 1 pour plus de détails).
9.3.2
Ajouter 100 µL de la solution de dopage combinée dans chaque fiole.
9.3.3
Ajouter le volume prescrit d'acétonitrile dans chaque fiole.
9.3.4
Compléter le volume avec de la solution d'acétate d'ammonium 100 mM.
Tableau 1 : Préparation des étalons de travail de NAST (volume final de 10 mL pour toutes les solutions)
| Niveau d'étalon de travail | Volume de solution mère secondaire 2 de NAST (μL) |
Volume d'acétonitrile (μL) |
|---|---|---|
| S0 | 0 | 1000 |
| Étalon le plus faible | 10 | 1000 |
| S1 | 20 | 1000 |
| S2 | 100 | 1000 |
| S3 | 200 | 1000 |
| S4 | 500 | 800 |
| S5 | 1000 | 700 |
| S6 | 2500 | 250 |
| S7 | 5000 | 0 |
9.3.5
Les solutions étalons de travail devraient être stables pendant 6 mois si elles sont conservées à 4 ° C (± 1 ° C) et à l'abri de la lumière.
Remarque : La gamme des solutions d'étalonnage de 0,1 à 220 ng/mL dépend de l'analyte (voir l'annexe 1 pour plus de détails). L'étalon de concentration la plus faible peut être utilisé pour déterminer la limite de détection (LD) et la limite de dosage (LQ).
Remarque : il peut être nécessaire de préparer d'autres solutions d'étalonnage pour couvrir l'intervalle des réponses prévues avec les échantillons.
Remarque : Toutes les solutions étalons peuvent être conservées jusqu'à 6 mois si elles sont réfrigérées à 4 ° C (± 1 ° C) ou jusqu'à 12 mois si elles le sont à - 20 ° C (± 5 ° C) et si elles sont mises à l'abri de la lumière.
10 Échantillonnage
10.1
L'échantillonnage des cigarettes à analyser doit être effectué conformément à la méthode ISO 8243.
10.2
L'échantillonnage des kreteks, des petits cigares, des bidis ou du tabac aux fins d'essais doit être réalisé en suivant la méthode ISO 8243, mais modifié de manière à ce que le terme cigarettes soit remplacé par kreteks, petits cigares, bidis ou tabac. Pour cette méthode, le terme carton signifie 200 unités.
10.3
L'échantillonnage des cigares aux fins d'essais doit être réalisé en suivant la méthode ISO 8243, mais modifié de manière à ce que le terme cigarettes soit remplacé par cigare. Pour cette méthode, 200 unités de cigarette sont équivalentes à 200 grammes de cigare.
10.4
L'échantillonnage du tabac à cigarettes aux fins d'essais doit être effectué conformément à la méthode ISO 15592-1.
10.5
L'échantillonnage du tabac en feuille, du tabac à pipe ou du tabac sans fumée doit être réalisé en suivant la méthode ISO 15592-1, mais modifié de manière à ce que le terme tabac à rouler soit remplacé par tabac en en feuille, tabac à pipe ou tabac sans fumée.
11 Préparation des produits du tabac
11.1
Préparation des produits du tabac aux fins d'essais
11.1.1
Retirer le produit de son emballage afin de réaliser un échantillon composite.
11.1.2
La préparation des produits du tabac aux fins d'essai doit être effectuée conformément à la méthode T-402.
Remarque : une partie distincte de 5,000 g (par répétition) de l'échantillon à analyser doit être utilisée pour déterminer la teneur en humidité et ainsi présenter les résultats sur une base de matière sèche (si nécessaire).
12 Préparation des échantillons
12.1
Extraction du tabac et des produits du tabac
12.1.1
N'utiliser que de l'éclairage sans UV dans la ou les pièces où sera faite l'analyse.
12.1.2
Au moyen d'une balance d'analyse, peser environ 0,750 g (noter le poids exact, 3 chiffres après la virgule) de l'échantillon à analyser dans un contenant d'extraction de 100 mL (en verre).
12.1.3
Ajouter 300 µL de solution de dopage d'étalon interne (EI) à l'échantillon.
12.1.4
Ajouter 30 mL de solution d'acétate d'ammonium 100 mM à l'échantillon dans le contenant d'extraction.
12.1.5
Placer l'échantillon sur un agitateur oscillant pendant 30 minutes afin d'extraire les NAST.
12.2
Épuration des échantillons
12.2.1
Mettre l'extrait dans deux flacons d'échantillonneur automatisé en verre ambré en utilisant une seringue à filtre (permet d'avoir un échantillon de remplacement).
12.2.2
Conserver les flacons à 4 ° C (± 1 ° C) jusqu'au moment de l'analyse.
Remarque : les échantillons sont stables dans ces conditions de stockage au maximum 6 jours.
13 Analyse des échantillons
13.1
Conditions expérimentales pour la CLHP (exemple) :
13.1.1
Colonne : Agilent Zorbax Eclipse XDB-C18 (2,1 × 150 mm, taille de particule de 3,5 μm)
13.1.2
Four à colonne : 40 ° C
13.1.3
Phase mobile :
- A : acide acétique à 0,1 % dans H2O
- B : acide acétique à 0,1 % dans MeOH
13.1.4
Gradient pour la phase mobile : exemple
| S / O | Temps (min) |
Composition de la phase mobile | Débit (µL/min) |
|
|---|---|---|---|---|
| A (%) | B (%) | |||
| Équilibre | 6 | 50 | 50 | 200 |
| 3 | 10 | 90 | 200 | |
| 4 | 0 | 100 | 200 | |
| 5 | 0 | 100 | 200 | |
| 5,5 | 50 | 50 | 200 | |
| 6 | 50 | 50 | 200 | |
Remarque : des ajustements peuvent être nécessaires selon les paramètres de l'instrument et de la colonne et la résolution du pic correspondant à l'analyte.
13.1.5
Volume injecté : 5 µL
13.1.6
Liquide de rinçage : méthanol
13.1.7
Durée de l'analyse : 12 min (y compris l'équilibrage de la colonne)
13.2
Conditions expérimentales pour l'interface ESI (exemple) :
13.2.1
Ionisation/mode : ESI+/MRM
13.2.2
Tension de l'électroplulvérisateur : 1500 V
13.2.3
Température de pulvérisation TurboIon : 450 ° C
13.2.4
Type de gaz de contrecourant : Azote Réglage : 10
13.2.5
Type de gaz de DIC : Azote Réglage : 10
13.2.6
Type de gaz de nébulisation : Azote Réglage : 10
13.3
Conditions expérimentales pour le spectromètre de masse (exemple) :
| Analyte | Quad1 (m/z) |
Quad3 (m/z) |
|---|---|---|
| NNN1 | 178,2 | 148 |
| NNN2 | 178,2 | 120 |
| NNN-d4 | 182,2 | 152 |
| NNK1 | 208,2 | 122 |
| NNK2 | 208,2 | 106 |
| NNK-d4 | 212,2 | 126 |
| NAT1 | 190,1 | 160 |
| NAT2 | 190,1 | 106 |
| NAT-d4 | 194,1 | 164 |
| NAB1 | 192,2 | 162 |
| NAB2 | 192,2 | 133 |
| NAB-d4 | 196,2 | 166 |
13.4
Étalonnage du système de CL/SM/SM :
13.4.1
Injecter chacune des solutions étalons en utilisant des conditions optimisées et déterminer les surfaces de pic pour chacune des transitions de masse primaires et des transitions des EI correspondants (analogues deutérés).
13.4.2
Calculer le rapport de réponse de l'analyte et de l'étalon interne correspondant afin de construire une courbe d'étalonnage.
13.5
Dosage des NAST :
13.5.1
Injecter chacun des extraits en utilisant les conditions optimisées et déterminer la surface des pics pour chacune des transitions de masse primaires et des transitions des EI correspondants (analogues deutérés).
14 Calculs
14.1
La teneur M (ng/g) d'une NAST donnée est calculée au moyen de la formule suivante :
- M (ng/g) = CVs/N
- dans laquelle :
- C = concentration de la NAST donnée, déterminée par étalonnage avec un étalon interne.
- Vs = volume d'extrait (p. ex. 30 mL).
- N = poids (en g) de tabac extrait (p. ex. 0,75 g).
14.2
Afin de convertir le résultat en ng/g de matière sèche, pour tenir compte de la teneur en humidité, utiliser la formule suivante :
M (ng/g)matière sèche = M (ng/g)tel quel/ (1 - (% humidité/100))
dans laquelle le % d'humidité est déterminé avec le même échantillon « tel que reçu » en suivant la méthode officielle 966.02 de l'AOAC.
15 Contrôle de la qualité
15.1
Pour un chromatogramme typique, consulter l'annexe 2.
15.2
Paramètres de contrôle typiques
Remarque : si les mesures de contrôle dépassent les limites de tolérance des valeurs prévues, il faut procéder à une étude appropriée et prendre les mesures qui s'imposent.
15.2.1
Blanc de réactifs (BR)
Chaque série d'analyse doit comprendre un blanc de réactifs (BR) afin de détecter toute contamination pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BR est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin. Le BR est analysé comme s'il s'agissait d'un échantillon.
15.2.2
Blanc fortifié (BF)
Chaque série d'analyse doit comprendre un blanc fortifié (BF) afin de détecter toute perte d'analytes pouvant s'être produite lors de la préparation et de l'analyse des échantillons. Le BF est constitué de tous les réactifs utilisés pour exécuter l'analyse des échantillons, manipulés avec tout le matériel employé à cette fin, et doit avoir été fortifié par l'addition d'une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. Le BF est analysé comme s'il s'agissait d'un échantillon.
15.2.3
Matrice fortifiée (MF)
Chaque série d'analyse doit comprendre une matrice fortifiée (MF) afin de détecter tout effet perturbant de la matrice. Lors de la préparation des échantillons et/ou pendant l'exécution des analyses, diviser un échantillon et fortifier une des portions avec une quantité connue d'au moins un des analytes d'intérêt. Le degré de fortification doit refléter l'intervalle de résultats caractéristiques de l'échantillon. La MF est analysée comme s'il s'agissait d'un échantillon.
15.2.4
Échantillon de contrôle
Afin d'évaluer la performance globale d'une méthode d'analyse, procéder à l'analyse d'un échantillon de contrôle. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux « valeurs prévues » obtenues dans le laboratoire ou, en l'absence de tels résultats, aux valeurs publiées dans la littérature. Le laboratoire obtiendra ainsi des données sur l'exactitude et la précision de la méthode d'analyse.
15.2.5
Échantillon-étalon
Pour évaluer la stabilité du système d'analyse, analyser un étalon comme s'il s'agissait d'un échantillon. En utilisant des méthodes statistiques appropriées, comparer les résultats ainsi obtenus aux concentrations prévues.
15.3
Taux de récupération et niveaux de contamination
15.3.1
Un BR typique devrait donner un résultat inférieur à la LD.
15.3.2
Les taux de récupération du BF et de la MF se situent habituellement dans un intervalle de 85 à 115 %.
15.4
Limite de détection (LD) et limite de quantification (LQ)
15.4.1
La limite de détection est égale à trois fois l'écart-type obtenu en analysant l'étalon le moins concentré au moins 10 fois sur une période de plusieurs jours. Voir le tableau 2 pour des valeurs typiques.
15.4.2
La limite de quantification (LQ) est égale à 10 fois l'écart-type des résultats obtenus en analysant le mélange étalon le moins concentré au moins 10 fois sur une période de plusieurs jours. Voir le tableau 2 pour des valeurs typiques.
Tableau 2 : valeurs typiques pour la limite de détection (LD) et la limite de quantification (LQ)
| Compounds | Appareil | Tabac entier | ||
|---|---|---|---|---|
| LD (ng/mL) |
LQ (ng/mL) |
LD (ng/mL) |
LQ (ng/mL) |
|
| NNN | 0,120 | 0,400 | 4,80 | 16,00 |
| NAT | 0,120 | 0,400 | 4,80 | 16,00 |
| NAB | 0,030 | 0,100 | 1,20 | 4,00 |
| NNK | 0,120 | 0,400 | 4,80 | 16,00 |
Remarque : Pour les calculs dans le tableau, le volume d'extraction est 30 mL et le poids de tabac extrait est 0,75 g.
Remarque : Les LD et LQ dans le tableau ne tiennent pas en considération la neutralisation du signal.
Remarque : pour certains échantillons la LD/LQ peut aussi être affectée par la matrice de l'échantillon qui peut réduire de manière significative le signal de l'analyte comparativement à celui de la solution étalon en raison de la neutralisation d'ions. La matrice de l'échantillon peut donc avoir une influence sur la LD et la LQ et dans ce cas il faudra peut-être les calculer en utilisant le rapport signal/bruit : S/B = 3 pour la LD et S/B = 10 pour la LQ.
15.5
Stabilité des réactifs et des échantillons
15.5.1
Toutes les solutions étalons peuvent être conservées jusqu'à 6 mois si elles sont réfrigérées à 4 ° C (± 1 ° C) ou jusqu'à 12 mois si elles le sont à -20 ° C (± 5 ° C) et si elles sont à l'abri de la lumière.
Remarque : La solution d'étalon interne (NG) secondaire devrait être conservée en petites portions dans des fioles à scintillations avec bouchons à vis, afin de réduire au minimum toute évaporation potentielle.
15.5.2
Tous les échantillons sont stables un maximum de 6 jours s'ils sont conservés à 4 ° C (± 1 ° C) ou un maximum de 2 mois s'ils le sont à -20 ° C (± 5 ° C) et s'ils sont conservés à l'abri de la lumière.
16 Références
16.1
Wu W., Ashley D. L. et Watson C. H.; Anal. Chem. 2003, 75, p. 4827-4832.
16.2
Wagner K. A., Finkel N. H., Fossett J. E. et Gillman I. G.; Anal. Chem. 2005, 77, p. 1001-1006.
16.3
Lee J-M., Shin J-W., Oh I-H., Lee U-C. et Rhee M-S.; 2004; CORESTA Congress Kyoto, article SS20; texte complet disponible sur le CD-ROM CORESTA vol. 22; résumé disponible sur le Web à l'adresse suivante : http://www.coresta.org/Past_Abstracts/Kyoto2004-SmokeTech.pdf (Format PDF) (consulté le 29 décembre 2006).
16.4
Chwojdak C. A., Self D. A. et Wheeler H. R.; A Collaborative, Harmonized LC-MS/MS Method for the Determination of Tobacco Specific Nitrosamines (TSNA) in Tobacco and Tobacco Related Materials; 61st Tobacco Science Research Conference, Charlotte, NC, É.-U., 24 septembre 2007.
16.5
Risner C. H. et Wendelboe F. N.; 1994; Quantification of tobacco specific nitrosamines in tobacco; Tob. Sci. 38, p. 1-6.
16.6
United States. Protocol to Measure the Quantity of Nicotine Contained in Smokeless Tobacco Products Manufactured, Imported, or Packaged in the United States. Federal Registrar. 62: 85. 1997.
16.7
NIH Guidelines for the Laboratory Use of Chemical Carcinogens; NIH Publication 81-2385, 1981.
16.8
ASTM International, Méthode ASTM D1193-06(2011), Standard Specifications for Reagent Water.
Annexe 1 : Concentrations ciblées pour les étalons de travail et les solutions d'étalon interne
| Étalon analysé | NNN (ng/mL) |
NNK (ng/mL) |
NAT (ng/mL) |
NAB (ng/mL) |
|---|---|---|---|---|
| 0 | 0,0 | 0,0 | 0,0 | 0,0 |
| Étalon le plus faible | 0,4 | 0,4 | 0,4 | 0,1 |
| 1 | 0,8 | 0,8 | 0,8 | 0,2 |
| 2 | 4,0 | 4,0 | 4,0 | 1,0 |
| 3 | 8,0 | 8,0 | 8,0 | 2,0 |
| 4 | 20,0 | 20,0 | 20,0 | 5,0 |
| 5 | 40,0 | 40,0 | 40,0 | 10,0 |
| 6 | 100,0 | 100,0 | 100,0 | 25,0 |
| 7 | 200,0 | 200,0 | 200,0 | 50,0 |
| Étalon interne | NNN-d4 | NNK-d4 | NAT-d4 | NAB-d4 |
| Conc. (ng/mL) | 50 | 50 | 50 | 20 |
Annexe 2 : Chromatogramme typique d'un étalon
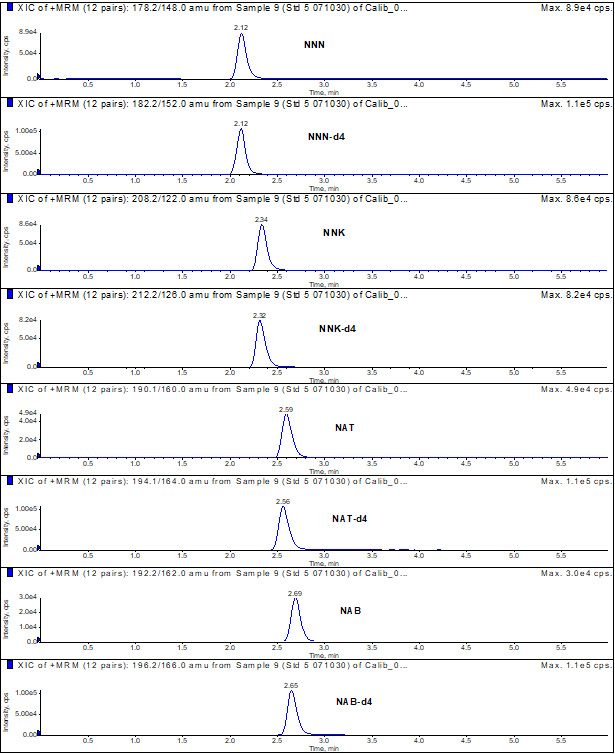
Chromatogramme typique d'un étalon : Équivalent textuel
Cette figure montre le chromatogramme typique des solutions étalons. Les temps de rétention sont présentés pour les nitrosamines spécifiques du tabac : NNN (2,12), NNN-d4 (2,12), NNK (2,34), NNK-d4 (2,32), NAT (2,59), NAT-d4 (2,56), NAB (2,69), NAB-d4 (2,65).