Exigences de l’industrie en matière d’étiquetage des médicaments vendus sans ordonnance
Les entreprises qui produisent et vendent des médicaments vendus sans ordonnance sont responsables de veiller à ce que les étiquettes sur leurs produits aident les Canadiens à prendre des décisions éclairées.
Sur cette page
- À propos du Tableau canadien d’information sur le médicament
- Flexibilités du Tableau canadien d’information sur le médicament
- Cadre pour les produits d’autosoins
À propos du Tableau canadien d’information sur le médicament
L’étiquette et l’emballage d’un produit de santé permettent aux consommateurs de repérer de l’information clé à propos de l’utilisation sécuritaire et appropriée du produit. La capacité d’identifier, de choisir et d’administrer de façon sécuritaire un produit dépend de la capacité des consommateurs à lire et à comprendre l’information qui apparaît sur l’étiquette.
Le Canada a mis à jour son règlement et ses exigences en matière d’étiquetage des médicaments vendus sans ordonnance afin de les rendre faciles à lire et à comprendre, et de normaliser l’information. Les entreprises qui produisent et vendent des produits doivent s’assurer que les étiquettes des produits disponibles sur les tablettes des magasins satisferont aux exigences relatives à l’étiquetage en langage clair (ELC) des médicaments vendus sans ordonnance d’ici le 30 juin 2021.
Parmi ces exigences, notons un Tableau canadien d’information sur le médicament (TCIM) normalisé. Ce tableau doit présenter des renseignements précis sur les étiquettes de sorte que les consommateurs puissent les voir et les lire lorsqu’ils achètent le produit. Cette information contribue à veiller à ce que les Canadiens choisissent les médicaments qui conviennent le mieux à leurs besoins.
Le TCIM doit respecter un format particulier afin d’être normalisé et prévisible pour tous les médicaments vendus sans ordonnance. Il doit :
- avoir des rubriques communes;
- respecter des polices et des tailles définies; et,
- utiliser la voix active et des verbes d’action comme « demander », « arrêter », « garder ».
Ces changements visent à faire ce qui suit :
- aider les Canadiens à trouver plus vite et plus facilement les renseignements recherchés
- accroître la lisibilité de l’information; et
- aider à diminuer la confusion
Le Tableau canadien d’information sur le médicament
Figure 1.

Figure 1 - Équivalent textuel
échantillon unilingue d'un tableau Canadien d’information sur le médicament qui présente les spécifications de mise en forme. Il y a deux panneaux : le premier panneau a pour titre Info-médicament et le second, Info-médicament (suite). Le tableau comporte les rubriques suivantes : Ingrédients actifs (dans chaque comprimé), Utilité, Usages, Mises en garde, Mode d’emploi, Autres renseignements, Ingrédients inactifs et Questions avec un point d’interrogation. Toutes les rubriques sont en caractères gras et commencent par une majuscule.
Sous la rubrique Mises en garde figurent les sous-titres suivants : Alerte aux allergies, Ne pas utiliser, Consultez un médecin ou un pharmacien avant l’utilisation si vous, Lorsque vous utilisez ce produit, Cessez d’utiliser et consultez un médecin si, et Garder hors de la portée des enfants. Les rubriques sont séparées les unes des autres par une ligne horizontale grasse, et les sous-titres de la section Mises en garde sont séparés par des filets horizontaux maigres. Chaque rubrique ou sous-titre commence sur une nouvelle ligne. Après chaque rubrique et sous-titre figure un texte type, sous forme de phrases courtes ou de liste à puces, à l’exception de la section Mode d’emploi qui se présente sous la forme d’un tableau intégré.
Flexibilités du Tableau canadien d’information sur le médicament
Étant donné les différentes formes et tailles existantes des médicaments vendus sans ordonnance, il peut s’avérer difficile de centraliser toute l’information importante sur le produit dans le TCIM. Pour cette raison, Santé Canada a mené des consultations exhaustives avec de nombreux intervenants afin d’établir un ensemble des flexibilités progressives permettant d’assurer la conformité avec ces dispositions. Ces flexibilités permettent aux entreprises d’apporter des changements au TCIM afin de réduire l’espace nécessaire pour afficher l’information de façon claire et précise, tout en respectant les objectifs de l’ELC.
Les flexibilités sont appliquées de manière consécutive. Les exigences de chacun des niveaux doivent être remplies avant de passer au prochain niveau.
Tableau canadien d’information sur le médicament normalisé
Figure 2.

Figure 2 - Équivalent textuel
Échantillon d’un tableau Canadien d’information sur le médicament (TCIM) bilingue présentant l’application des flexibilités de formatage pour l’ingrédient actif Dimenhydrinate est présenté, sans l’usage des flexibilités de formatage (c-à-d le format standard est présenté).
Niveau 1
Niveau permet de modifier les spécifications de formatage du TCIM ou déplacer certains renseignements du TCIM au panneau d’affichage principal du produit.
Figure 3.
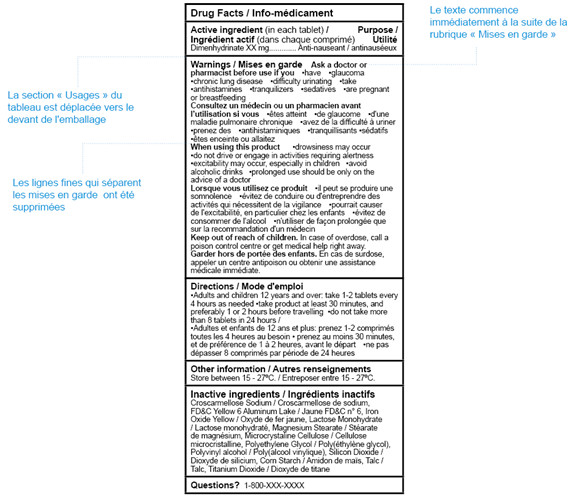
Figure 3 - Équivalent textuel
Échantillon d’un tableau Canadien d’information sur le médicament (TCIM) bilingue présentant l’application des flexibilités de formatage. Le TCIM montre l’application des flexibilités de niveau 1 : la section Usages du TCIM a été déplacée sur l’espace principal; les lignes fines de la section Mises en garde ont été supprimées; l’épaisseur de trait des lignes horizontales a été réduite à 1.0 point; le texte de la section Mises en garde commence immédiatement après la rubrique Mises en garde. L'entête identifie d'autres flexibilités de niveau 1 qui ne figurent pas dans la figure, incluant: suppression de la rubrique Informations sur le médicament (suite); et l’utilisation d'un encadré continu.
Niveau 2
Niveau 2 permet l’utilisation, dans le TCIM, d’une police de caractères condensés alternative et approuvée.
Figure 4.
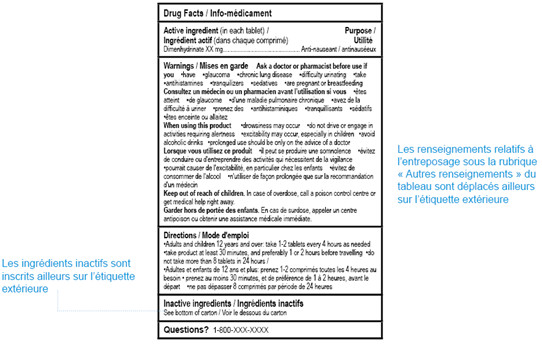
Figure 4 - Équivalent textuel
Échantillon d’un tableau Canadien d’information sur le médicament (TCIM) bilingue présentant l’application des flexibilités de formatage. Le TCIM montre l'application des flexibilités de niveau 2: utilisation d'une police de caractères condensée et utilisation d’une échelle horizontale de texte à 90% de la largeur d'origine.
Niveau 3
Niveau 3 permet de déplacer l’information liée à l’entreposage adéquate du produit en dehors du TCIM et ailleurs sur l’étiquette. Les ingrédients inactifs peuvent également être inscrits ailleurs sur l’étiquette.
Figure 5.

Figure 5 - Équivalent textuel
Échantillon d’un tableau Canadien d’information sur le médicament (TCIM) bilingue présentant l’application des flexibilités de formatage. Le TCIM montre l’application des flexibilités de niveau 3: les informations relatives à l’entreposage sont transférées du TCIM vers un autre emplacement sur l’étiquette externe; et la liste des ingrédients inactifs est transférée du TCIM sur un autre emplacement sur l’étiquette extérieure.
Niveau 4
Niveau 4 permet de déplacer certaines mises en garde vers un dépliant d’accompagnement ou une brochuse incluse avec le produit. Dans ce cas, les mises en garde qui sont plus importantes au moment d’utiliser le produit sont déplacées de l’étiguette vers un dépliant d’accompagnement ou une brochure.
Figure 6.

Figure 6 - Équivalent textuel
Échantillon d’un tableau Canadien d’information sur le médicament (TCIM) bilingue présentant l’application des flexibilités de formatage. Le TCIM montre l’application des flexibilités de niveau 4: les renseignements relatifs à l’utilisation de produit sont déplacés du TCIM vers un dépliant d’accompagnement.
Pour comprendre comment et quand utiliser ces flexibilités, reportez-vous à ce document complet : Document d'orientation : Exigences en matière d'étiquetage pour les médicaments sans ordonnance.
Médicaments de Catégorie IV
D’autres flexibilités sont disponibles pour les produits qui posent des risques plus faibles pour la santé des Canadiens. Parmi ceux-ci, se retrouvent les produits de Catégorie IV, les bains de bouche et les dentifrices. Pour ces produits particuliers, les flexibilités de format décrites aux niveaux 1 et 2 s’appliquent, tout comme l’option de déplacer de l’information vers un dépliant d’accompagnement ou une adresse URL. Le TCIM ressemblera à l’exemple ci-dessous.
Figure 7.

Figure 7 - Équivalent textuel
Un échantillon bilingue d'un tableau Canadien d'information sur le médicament (TCIM) qui montre l'application de flexibilités de formatage spécifiques aux produits attestant à une monographie de catégorie IV, de dentifrices et de bains de bouche. Le titre du TCIM, Drug Facts / Info-médicament, figure en haut du TCIM. Directement sous le titre, une note aux consommateurs est incluse fournissant une adresse Web où les consommateurs peuvent trouver des informations supplémentaires (c.-à-d. un TCIM complet sans utilisation de flexibilités). L’échantillon du TCIM montre l’application de flexibilités adaptées pour les produits de catégorie IV, les bains de bouche et les dentifrices, incluant: : la section Usages du TCIM a été déplacée sur l’espace principal; les lignes fines de la section Mises en garde ont été supprimées; l’épaisseur de trait des lignes horizontales a été réduite à 1.0 point; le texte de la section Mises en garde commence immédiatement après la rubrique Mises en garde: utilisation d'une police de caractères condensée ; la liste des ingrédients inactifs est transférée du TCIM vers le panneau inférieur du carton; et les renseignements relatifs à l’utilisation de produit sont déplacés du TCIM vers un site web. La ligne de pliage sépare un panneau du carton de l'autre.
Cadre pour les produits d’autosoins
Nous sommes en voie d’adopter un nouveau cadre réglementaire pour les produits d'autosoins. En vertu du cadre pour les produits d’autosoins, les promoteurs seront en mesure d’étiqueter les produits présentant le moins de risques pour la santé sans utiliser le format tableau. Pour les produits qui s’inscrivent dans la Catégorie I du Cadre pour les produits d’autosoins, les promoteurs seront en mesure d’adopter un format qui s’apparente à ce qui suit :
Figure 8.

Figure 8 - Équivalent textuel
Un échantillon bilingue d'un tableau Canadien d'information sur le médicament (TCIM) qui montre l'application des flexibilités de formatage spécifiques aux produits à faible risque qui entrent dans la catégorie I sous le cadre des produits d'autosoins. L'échantillon de TCIM montre l'application des éléments de flexibilité pour les produits de catégorie I sous le cadre d'autosoins, notamment: Le titre du TCIM, Drug Facts / Info-médicament, est supprimé; les lignes horizontales, les lignes fines et l’encadré du tableau sont supprimés; l’utilité des ingrédients actifs est supprimé; la section Usage du TCIM est déplacée vers l’espace principal; le texte commence immédiatement après les rubriques du TCIM; la séquence des renseignements est modifiée par rapport au format TCIM standard; la liste des ingrédients inactifs est déplacée du TCIM vers un site Web avec une note demandant aux consommateurs où trouver la liste des ingrédients inactifs; et les renseignements relatifs à l’utilisation de produit sont transférées du TCIM vers un site Web. La ligne de pliage sépare un panneau du carton de l'autre.
Ces flexibilités seront en vigueur à compter du 1er décembre 2018, comme énoncé dans le Document d'orientation : Exigences en matière d'étiquetage pour les médicaments sans ordonnance.
Renseignements supplémentaires
De l’information détaillée sur l’étiquetage des médicaments vendus sans ordonnance est accessible dans le Document d'orientation : Exigences en matière d'étiquetage pour les médicaments sans ordonnance.