Les exigences d’étiquetage pour les médicaments vendus sans ordonnance document d’orientation
Avant-propos
Les documents d'orientation sont des documents destinés à guider l'industrie et les professionnels de la santé sur la façon de se conformer aux lois et aux règlements qui régissent leurs activités. Elles servent également de guide au personnel en vue d'appliquer les mandats et les objectifs de Santé Canada d'une façon équitable, uniforme et efficace.
Les documents d'orientation sont des outils administratifs n'ayant pas force de loi, ce qui permet une certaine souplesse d'approche. Les principes et les pratiques énoncés dans le présent document pourraient être remplacés par d'autres approches, à condition que celles-ci s'appuient sur une justification adéquate. Afin de supporter l'uniformité des renseignements sur les étiquettes, les promoteurs sont fortement encouragés à adopté le contenu et format décrit dans ce document d'orientation. Il convient d'en discuter à l'avance avec les responsables du secteur de programme pertinent afin de ne pas aboutir à la conclusion que les exigences législatives ou réglementaires applicables ne sont pas satisfaites.
Corollairement à ce qui précède, il importe également de mentionner que Santé Canada se réserve le droit de demander des renseignements ou du matériel supplémentaire, ou de définir des conditions dont il n'est pas explicitement question dans du document d'orientation, et ce, afin que le ministère puisse être en mesure d'évaluer adéquatement l'innocuité, l'efficacité ou la qualité d'un produit thérapeutique donné. Santé Canada s'engage à justifier de telles demandes et à documenter clairement ses décisions.
Ce document devrait être lu en parallèle avec l'avis d'accompagnement et les sections pertinentes des autres documents d'orientation qui s'appliquent.
Veuillez noter, Santé Canada a pris une première mesure pour simplifier l'accès au marché des médicaments vendus sans ordonnance. Pour plus d'information, visitez le site Plan d'action pour les médicaments vendus sans ordonnance.
Santé Canada reconnait la contribution importante apportée par l'Institut pour la sécurité des médicaments aux patients au développement de plusieurs lignes directrices essentielles reliées à l'usage sécuritaire et efficace des produits de soins personnels, p. ex., le Guide des bonnes pratiques d'étiquetage et d'emballage pour les médicaments sans ordonnance et les produits de santé naturels.
Table des matières
- Les exigences d'étiquetage pour les médicaments vendus sans ordonnance
- Tableau canadien d'information sur le médicament pour les médicaments vendus sans ordonnance
- 2.1 Principes généraux
- 2.2 Contenu
- 2.3 Conception et format
- 2.4 Utilisation de flexibilités progressives
- 2.5 Flexibilités adaptées pour les produits de catégorie IV, bains de bouche et dentifrices
- 2.6 L'étiquetage pour les produits de catégorie 1 sous le cadre des produits d'autosoins
- 2.7 Étiquettes innovantes
- Tableau canadien d'information sur le médicament pour les ingrédients actifs
1. Les exigences d'étiquetage pour les médicaments vendus sans ordonnance
1.1 Contexte
L'usage sécuritaire des médicaments vendus sans ordonnance dépend de la capacité du consommateur à identifier le produit désiré ainsi qu'à comprendre et agir en fonction de information présentée. L'étiquette et l'emballage constituent les premiers points d'interaction entre un produit de santé et un consommateur ou un professionnel de la santé. Avant l'implantation de l'étiquetage en langage clair (ELC) au Canada, la pratique consistait à présenter l'information clé dans des blocs de texte sur l'étiquette du produit. Par conséquence, il était parfois difficile pour le consommateur de trouver l'information dont nécessaire pour bien choisir et utiliser le produit en question. Dans certains cas, l'information était en petits caractères, et il y avait peu de contraste entre le texte de l'étiquette et l'arrière-plan.
Tous ces facteurs peuvent empêcher le consommateur de trouver l'information dont il a besoin pour prendre rapidement des décisions éclairées, surtout au moment de choisir le produit. Les renseignements importants relatifs à un produit nécessaire lors de la sélection devraient toujours se trouver au même endroit sur l'étiquette et être faciles à lire et à comprendre. Compte tenu du vieillissement de la population et de la forte augmentation du nombre de médicaments en vente libre sur le marché, il est encore plus important de régler ces problèmes.
Dans le cadre de l’initiative sur l’ELC de Santé Canada, l’étiquette extérieure des médicaments sans ordonnance doit afficher un tableau contenant des renseignements sur le médicament en vertu du Règlement sur les aliments et drogues (ci-après « le Règlement »), conformément à l’article C.01.004.02 (1). Le « Tableau canadien d'information sur le médicament » (TCIM) vise à afficher les renseignements devant figurer sur l'emballage sous une forme normalisée et facile à lire pour favoriser un usage plus sécuritaire et plus efficace des médicaments sans ordonnance. Le concept est semblable à celui du tableau de la valeur nutritive utilisé pour les aliments au Canada et de l'encadré Drug Facts exigé par la FDA pour les médicaments vendus sans ordonnance aux États-Unis.
Le TCIM permettra aux consommateurs et professionnels de la santé:
- de comparer différents produits, surtout s'il y a des similitudes en ce qui concerne le nom, l'emballage ou les ingrédients, afin de choisir le produit qui convient le mieux à leurs besoins et symptômes;
- d'identifier le même ingrédient médicinal dans plusieurs produits, afin d'éviter le risque de surdosage involontaire;
- de trouver rapidement le mode d'emploi et les avertissements connexes;
- de trouver rapidement la liste des ingrédients du produit, afin d'éviter d'éventuelles réactions allergiques.
Ce document d'orientation fournit des renseignements normatifs sur les spécifications de conception, les sections exigées du TCIM, et le contenu d'étiquetage. Les promoteurs visant l'approbation de médicaments vendus sans ordonnance doivent respecter les principes, spécifications de format, et contenu indiqués dans ce guide. Bien que des énoncés autres que ceux qui sont indiqués dans ce document d'orientation pourraient être envisager, le texte des étiquettes doit être conforme aux principes de l'étiquetage en langage clair qui sont identifiés dans le Guide des bonnes pratiques d'étiquetage et d'emballage pour les médicaments sans ordonnance et les produits de santé naturels et ce document d'orientation.
1.2 Portée
Le TCIM s'applique à tous les médicaments sans ordonnance et pouvant être auto sélectionnés par un consommateur. Les quatre catégories de produits suivantes sont exclues de cette exigence:
- les médicaments qui figurent sur la Liste des drogues sur ordonnance;
- les produits biologiques et radiopharmaceutiques;
- les médicaments qui peuvent être vendus sans ordonnance, mais qui ne sont administrés que sous la direction d'un professionnel de la santé (p. ex., les préparations de codéine non assujetties au Règlement sur les stupéfiants 36(1), la nitroglycérine, l'insuline, l'épinéphrine injectable en cas de réaction allergique); et
- les médicaments présentés comme étant destinés uniquement à la désinfection des surfaces dures non poreuses.
1.3 Exigences et règlementations associées à l'information figurant sur les étiquettes
Cette section offre un résumer des exigences d'étiquetage pour les médicaments sans ordonnance; de plus amples renseignements se trouve dans la Ligne directrice : Étiquetage des médicaments pharmaceutiques destinés à l'usage des humains
- 1.3.1 L'espace principal (c'est-à-dire (c.-à-d.), la principale surface) désigne la partie exposée ou visible dans les conditions normales ou habituelles de vente ou d'utilisation. En vertu des articles du Règlement, les étiquettes intérieure et extérieure doivent porter dans l'espace principal l'information suivante :
- 1.3.1.1 La marque nominative du produit pharmaceutique, ou à défaut de cette marque, le nom propre ou usuel du produit, le cas échéant, conformément au sous-alinéa C.01.004 (1)(a)(i);
- 1.3.1.2 Le nom propre ou usuel du produit pharmaceutique, le cas échéant, utilisant une taille supérieure ou égale à la moitié de la marque nominative, jusqu'une taille minimale de 6 points (selon l'interprétation par Santé Canada des alinéas A.01.017 (a) et (b)), qui précède ou suit immédiatement la marque nominative, conformément aux sous-alinéas C.01.004 (1)(a)(i) et C.01.004 (1)(a)(ii);
- 1.3.1.3 La norme s'appliquant au produit pharmaceutique, le cas échéant, conformément aux sous-alinéas C.01.004 (1)(a)(iii-iv);
- 1.3.1.4 La mention « stérile » (sterile en anglais) s'il s'agit d'une drogue dont l'état stérile est exigé par le Règlement, conformément au sous-alinéa C.01.004 (1)(a)(v);
- 1.3.1.5 Le symbole renvoyant à l'annexe correspondante ou à une drogue contenant un ingrédient figurant dans la Liste des drogues sur ordonnance, le cas échéant, conformément à l'alinéa C.01.004 (1)(b); et
- 1.3.1.6 L'identification numérique de drogue (DIN), conformément au paragraphe C.01.005 (1).
- 1.3.2 En vertu des articles du Règlement, l'information suivante doit apparaître dans un espace quelconque des étiquettes intérieure et extérieure:
- 1.3.2.1 Le nom et l'adresse du fabricant ou promoteur, conformément au sous-alinéa C.01.004 (1)(c)(i), et du distributeur si le fabricant ou promoteur n'est pas Canadien, conformément au paragraphe C.01.004.01 (2);
- 1.3.2.2 Le numéro de lot, conformément au sous-alinéa C.01.004 (1)(c)(ii);
- 1.3.2.3 La date limite d'utilisation, conformément au sous-alinéa C.01.004 (1)(c)(v);
- 1.3.2.4 Le mode d'emploi approprié du produit pharmaceutique, conformément au sous-alinéa C.01.004 (1)(c)(iii); et
- 1.3.2.5 La liste quantitative des ingrédients médicinaux contenus dans le produit pharmaceutique, conformément au sous-alinéa C.01.004 (1)(c)(iv).
- 1.3.3 Les renseignements suivants doivent apparaître sur un espace quelconque de l'étiquette extérieure:
- 1.3.3.1 La quantité nette de produit pharmaceutique dans le contenant : poids, volume ou nombre (de comprimés, par exemple [p. ex.]), conformément à l'alinéa C.01.004 (2)(a);
- 1.3.3.2 Une liste quantitative de tous les agents de conservation dans le cas des préparations à usage parentéral, et une liste quantitative de tous les agents de conservation mercuriels pour les produits pharmaceutiques qui contiennent du mercure ou bien un sel ou un dérivé de mercure comme agent de conservation, conformément aux alinéas C.01.004 (2)(b) et C.01.004 (2)(c); et
- 1.3.3.3 Un tableau bilingue, ou un tableau en anglais et un autre en français, conformément au paragraphe C.01.004.02 (1), qui ne contiennent que les renseignements suivants:
- 1.3.3.3.1 Le mode d'emploi approprié du produit pharmaceutique, conformément au sous-alinéa C.01.004.02 (1)(a);
- 1.3.3.3.2 Les quantités de tous les ingrédients médicinaux répertoriés par leur nom propre ou, à défaut, par leur nom usuel, conformément au sous-alinéa C.01.004.02 (1)(b);
- 1.3.3.3.3 La liste qualitative des ingrédients non-médicinaux contenus dans le produit pharmaceutique, par ordre alphabétique ou par ordre décroissant de leurs proportions respectives dans la drogue et un libellé qui les distingue clairement des ingrédients médicinaux précède cette liste, conformément au sous-alinéa C.01.004.02 (1)(c); et
- 1.3.3.3.4 Les coordonnées d'une personne-ressource au Canada (p. ex., son numéro de téléphone, son adresse de courriel, l'adresse de son site Web, son adresse postale ou d'autres renseignements permettant de la joindre), et
un énoncé indiquant que les effets nuisibles associés à l'utilisation du médicament peuvent être signalés à cette personne, conformément à l'alinéa C.01.004.02 (1)(d).
- 1.3.4 L'information suivante doit aussi apparaître dans un espace quelconque des étiquettes intérieure:
- 1.3.4.1 Le mode d'emploi approprié du produit pharmaceutique, conformément au sous-alinéa C.01.004.03 (a);
- 1.3.4.2 La liste quantitative des ingrédients médicinaux contenus dans le produit pharmaceutique, par le nom propre ou usuel du produit, le cas échéant, conformément au sous-alinéa C.01.004.03 (b); et
- 1.3.4.3 Les coordonnées d'une personne-ressource au Canada (p. ex., son numéro de téléphone, son adresse de courriel, l'adresse de son site Web, son adresse postale ou d'autres renseignements permettant de la joindre), et un énoncé indiquant que les effets nuisibles associés à l'utilisation du médicament peuvent être signalés à cette personne, conformément au sous-alinéa C.01.004.03 (c).
- 1.3.5 Dans certains cas, il ne peut y avoir qu'une seule étiquette associée avec un médicament sans ordonnance (p. ex., lorsqu'il n'y a pas de carton extérieure). Lorsque l'emballage du produit pharmaceutique ne comporte qu'une seule étiquette, celle-ci doit présenter tous les renseignements requis sur les étiquettes intérieure et extérieure, conformément à l'article C.01.006.
1.4 Considérations d'étiquetage et l'interprétation du Règlement sur l'étiquetage en langage clair
Le Règlement modifiant le Règlement sur les aliments et drogues (appelé communément le Règlement sur l'étiquetage en langage clair), instauré en 2014, impose certaines exigences quant au format et la présentation des renseignements requis. Cette section du guide décrit l'interprétation de la conformité à la Règlementation d'ELC selon Santé Canada.
- 1.4.1 Tout renseignement exigé par le Règlement doit être présenté également en anglais et en français, conformément aux paragraphes A.01.015 (1) et A.01.015 (2).
En vertu des paragraphes A.01.017 (a) and A.01.017 (b) du Règlement, les éléments des étiquettes doivent être représentées de façon par la suite:
- 1.4.2 Tout renseignement exigé par le Règlement des étiquettes intérieure et extérieure doit comprendre :
- 1.4.2.1 Une police non-décorative, sans empattement (« sans serif »)(Le nom de marque, la date limite d'utilisation et le numéro de lot peuvent utiliser une police à empattement non-décorative qui ne nuit pas à la lisibilité de l'information)
- 1.4.2.2 Une taille de police minimale de 6 points
- 1.4.2.3 Un contraste optimal pour présenter les renseignements obligatoires de manière proéminant
- 1.4.2.4 Du langage clair
Veuillez-vous référer aux instructions spécifiques pour le format du TCIM (section 2), date limite d'utilisation (section 1.4.3), et numéro de lot (section 1.4.4).
- 1.4.3 La date limite d'utilisation:
La date limite d'utilisation doit apparaître dans un espace quelconque des étiquettes intérieure et extérieure, respectant un des formats suivant :
EXP 2020-JA-11
EXP 11-JA-2020
EXP 2020-JA
EXP JA-2020
EXP 2020-01
EXP 01-2020
EXP 01-31-2020 (seulement lorsque la dernière journée du mois correspondant est employée)
EXP 31-01-2020 (seulement lorsque la dernière journée du mois correspondant est employée)
EXP 2020-01-31 (seulement lorsque la dernière journée du mois correspondant est employée)NB : Les tirets (-), les barres-obliques (/), ou les espaces sont acceptables pour séparer l'information de la date limite d'utilisation.
Les formats pour la date limite d'utilisation inacceptables incluent:
EXP JA-20
EXP 20-JA
EXP 2020-01-11(lorsque la dernière journée du mois correspondant n'est pas employée)
EXP 11-01-2020 (lorsque la dernière journée du mois correspondant n'est pas employée)Les dates limites d'utilisation doivent être présentées en utilisant une police non-décorative d'une taille minimale de 6 points (1/12 de pouce).
- 1.4.4 Le numéro de lot:
Le numéro de lot doit apparaître dans un espace quelconque des étiquettes intérieure et extérieure, précédé par l'indicateur : « Lot number », « Lot No. », « Lot », « LOT », ou « (L) », conformément à l'article A.01.014. - 1.4.5 Autres considérations concernant l'étiquetage
- 1.4.5.1 Un contraste maximal doit être utilisé pour tout renseignements; une matière réfléchissant n'est pas permise dans l'espace où paraît des renseignements exigés par le Règlement.
- 1.4.5.2 Les films argentés sont acceptables pour les emballages spécifiques (p.ex., des plaquettes alvéolaires et pochettes), mais les fabricants doivent assurer que la lisibilité des renseignements est maximisée (c.-à-d., une encre foncée doit être employée, les films argentés sont lisible et complet après que l'alvéole soit percer, etc.). Les fabricants sont encouragés à employer une matière qui ne nuira pas à la lisibilité de l'information.
- 1.4.5.3 Les produits emballés dans des contenants sous pressions doivent suivre les exigences d'étiquetage conformément aux articles A.01.061, A.01.062, et A.01.063 du Règlement.
- 1.4.5.4 L'emballage et l'étiquetage des produits doit être conforme à l'article A.01.065 du Règlement concernant l'emballage de sécurité et l'étiquetage de ceux-ci.
- 1.4.5.5 La formulation, l'emballage, et l'étiquetage des produits doivent être conforme aux articles C.01.021 à C.01.027 du Règlement concernant les doses limites des drogues
- 1.4.5.6 L'emballage et l'étiquetage des produits doit être conforme aux articles C.01.028 à C.01.035 concernant les mises en garde et emballage protège-enfants.
2. Tableau canadien d'information sur le médicament pour les médicaments vendus sans ordonnance
Cette partie de la ligne directrice définit la conception et le format du TCIM normalisé et décrit les flexibilités pouvant être appliquées pour réduire la nécessité d’augmenter la taille des emballages ou d’utiliser des étiquettes innovantes tout en respectant le Règlement sur l’ELC. Des spécifications sont présentées pour le format des éléments suivants :
- format normalisé du TCIM;
- TCIM avec flexibilités progressives;
- TCIM avec flexibilités adaptés pour les produits de catégorie IV, bains de bouche et dentifrices;
- L'étiquetage pour les produits de catégorie 1 sous le cadre des produits d'autosoins, disponible en décembre 2018 (consulter section 2.6 de ce document d'orientation); et
- TCIM pour les produits utilisant des étiquettes innovantes.
Conjointement avec ce document d'orientation, les promoteurs devraient consulter le Guide des bonnes pratiques d'étiquetage et d'emballage pour les médicaments sans ordonnance et les produits de santé naturels et le document Ligne directrice: Normes techniques sur le Tableau électronique canadien d'information sur le médicament (eTCIM).
2.1 Principes généraux
L'ordre de présentation et le format des renseignements doivent être uniformes dans tout le TCIM. L'information doit être rédigée de façon à être comprise par une personne ayant un niveau de compétence en lecture équivalent à celui d'un élève de la 6e à la 8e année. Il faut éviter le langage technique et utiliser des phrases courtes ou des énoncés à puces lorsque c'est possible.
Au moment où le consommateur choisit le produit et l'achète, le TCIM doit être visible sur l'étiquette extérieure de l'emballage de vente au détail ou, en l'absence d'une telle étiquette, sur l'étiquette du contenant immédiat. Si le TCIM est affiché sur une étiquette innovante, l'étiquette doit être accessible au consommateur avant l'achat.
2.2 Contenu
Le tableau 1 décrit les éléments à inclure sous chaque rubrique et sous-titre du TCIM. Le titre, les rubriques et les sous-titres doivent apparaitre tel qu'indiqués dans le tableau 1. L'ordre de présentation du contenu, décrit ci-dessous, doit être respecté. Cependant, si une rubrique ou un sous-titre ne sont pas pertinents, ils devraient être omis.
- 2.2.1 Le libellé promotionnel doit être évité afin d'assurer un espace suffisant pour les informations (p. ex., « soulagement rapide et efficace de la douleur » peut être remplacé par « soulagement de la douleur »).
- 2.2.2 Aucun pictogramme ni élément graphique (dont le code CUP) ne doit figurer dans le TCIM, à l'exception des symboles exigés par la réglementation (p. ex., l'octogone rouge précédant des mises en garde spécifiques) et le symbole d'un téléphone ou d'un récepteur téléphonique avant la rubrique « Questions? ». Note : il est acceptable de modifier la forme du TCIM pour accommoder des éléments d'étiquetage autres que le TCIM (p.ex., le code CUP), à condition de ne pas réduire la lisibilité du TCIM.
Le contenu du TCIM doit être rempli selon les exigences d'étiquetage identifiées dans la section 3 de ce document d'orientation, qui aligne l'information sur la sécurité existante avec les principes de l'étiquetage en langage clair. Un énoncé à l'effet du contenu inclut dans la section 3 peut être acceptable.
L'utilisation de flexibilités progressives ne modifie pas l'ordre de présentation des renseignements dans le TCIM. Cependant, pour certains produits, le TCIM complet se trouvera sur l'étiquette extérieure ou l'emballage tandis que pour d'autres produits, certains renseignements figureront sur un dépliant d'accompagnement (et/ou sous forme d'une URL). Dans tous les cas, il est exigé que l'information importante pour le choix approprié du produit apparaisse sur l'étiquette extérieure ou sur l'emballage.
Titre / Rubrique / Sous-titre |
Description et commentaires sur le contenu |
|
|---|---|---|
1.a |
Info-médicament |
Le titre à utiliser est 'Info-médicament' et 'Drug Facts'. Si le tableau est segmenté, chaque volet subséquent du tableau doit porter le titre 'Info- médicament (suite)' ou 'Drug Facts (continued)'. |
1.b |
Les instructions menant à une eTCIM doivent apparaitre en-dessous du titre; l’énoncé « Pour le tableau (canadien Info-médicament) complet, visitez/ For full (Canadian Drug Facts) table, visit www.websitename.com » doit être utilisé (voir la figure 4). Si tous les renseignements du produit figurent sur l’étiquette extérieure, l’énoncé « Pour la version électronique, visitez / For electronic version, visit : www.websitename.com » peut être employé. |
|
1.c |
Ingrédient(s) actif(s) |
Dans cette section, fournir une liste quantitative des ingrédients actifs du produit par leur nom propre ou, s'ils n'en n'ont pas, par leur nom usuel. La rubrique doit aussi inclure l'unité posologique (p. ex., « dans chaque comprimé », « w/w », etc.) |
1.d |
Utilité(s) |
Indiquer dans cette section la ou les catégories pharmacologiques générales ou les principales actions prévues du produit ou, si le produit contient plusieurs ingrédients actifs, les catégories pharmacologiques générales ou les principales actions prévues de chacun de ces ingrédients. |
1.e |
Usage(s) |
Dans cette section, énumérer les indication(s) du produit. |
1.f |
Mises en garde |
Les mises en garde doivent être incluses dans cette section dans l'ordre (séquence) suggéré ici. Seuls les sous-titres qui s'appliquent au produit devraient être utilisés. Les mises en garde doivent être conformes à la réglementation pertinente (voir section 1) et aux autres directives d'étiquetage de Santé Canada, et pourrait nécessiter l'usage de symboles octogonaux. |
1.f.1 |
Pour usage externe seulement |
Inclure des avertissements relatifs à la voie d'administration, s'il y a lieu. Aucun autre texte que l'avertissement n'est exigé. |
1.f.2 |
Syndrome de Reye |
Inclure dans cette section l'énoncé relatif au syndrome de Reye, s'il y a lieu. |
1.f.3 |
Alerte aux allergies |
Inscrire dans cette section tout avertissement relatif aux réactions allergiques (p. ex., œufs, lait, moutarde, arachides, poissons et fruits de mer [crustacés et mollusques]), sésame, soja, sulfites, noix de pin, blé), des allergies croisées connues avec autres médicaments (p.ex., ASA avec les autres salicylates) ou relatif à l'asthme. |
1.f.4 |
Avertissement - inflammabilité |
S'il y a lieu, inclure dans cette section l'avertissement d'inflammabilité avec les mots indicateurs appropriés. |
1.f.5 |
Étouffement |
Inclure dans cette section les avertissements relatifs à la suffocation (p. ex., gomme soluble dans l'eau), s'il y a lieu. |
1.f.6 |
Avertissement - l'alcool |
Inclure dans cette section ces types d'avertissements, s'il y a lieu. |
1.f.7 |
Avertissement - maux de gorge |
Inclure dans cette section ce type d'avertissement, s'il y a lieu. |
1.f.8 |
Avertissement - posologie |
S'il y a lieu, inclure dans cette section l'avertissement relatif à la posologie, par exemple « Il peut être dangereux de prendre plus que la dose recommandée pour 24 heures ». |
1.f.9 |
Avertissement - maladies transmissibles sexuellement (MTS) |
S'il y a lieu, inclure dans cette section des avertissements comme : « Ce produit ne protège pas contre l'infection par le VIH/sida ou d'autres MTS ». |
1.f.10 |
Ne pas utiliser |
Dans cette section, inscrire toutes les contre-indications du produit. Elle est réservée aux cas où les consommateurs ne devraient pas utiliser le produit à moins qu'un diagnostic ait été posé par un médecin, ou aux cas où certains consommateurs ne devraient utiliser le produit dans aucune circonstance, même s'ils ont consulté un médecin ou un professionnel de la santé. |
1.f.11 |
Consultez un médecin ou un pharmacien avant l'utilisation si vous |
Dans cette section, inscrire tous les avertissements destinés aux personnes qui ont un problème de santé préexistant ou qui présentent des symptômes particuliers. Inscrire tous les avertissements relatifs aux interactions médicament-médicament, médicament-PSN ou médicament-aliment. Inclure un avertissement destiné aux femmes enceintes ou allaitantes. Pour les produits pour la santé bucco-dentaire, le sous-titre peut être « Consultez un dentiste ou un pharmacien avant l'utilisation si vous » et « Ask a dentist or pharmacist before use if you » |
1.f.12 |
Lorsque vous utilisez ce produit |
Dans cette section, inscrire les effets secondaires que le consommateur pourrait ressentir et désigner les substances (p. ex., alcool, sédatifs) ou les activités (p. ex., faire fonctionner des machines, conduire un véhicule) à éviter quand on prend ce produit. |
1.f.13 |
Cessez d'utiliser et consultez un médecin si |
Dans cette section, inscrire tous les signes de toxicité ou toute autre réaction indésirable qui nécessiteraient l'interruption immédiate de l'utilisation du produit. Pour les produits pour la santé bucco-dentaire, le sous-titre peut être « Cessez d'utiliser et consultez un dentiste si » et « Stop use and ask a dentist if » |
1.f.14 |
Autres avertissements |
Inclure ici tout autre avertissement requis qui ne correspond pas aux sous-titres précédents. Inclure un énoncé indiquant qu'on trouvera des renseignements supplémentaires dans d'autres sections de l'étiquette et le dépliant d'accompagnement. |
1.f.15 |
Garder hors de la portée des enfants. |
Inclure dans cette section cet avertissement général et l'avertissement relatif à une surdose ou à une ingestion accidentelle, par exemple « En cas de surdosage, obtenez de l'aide médicale ou communiquez avec un centre antipoison ». |
1.g |
Mode d'emploi |
Fournir dans cette section le mode d'emploi, lequel peut comprendre la dose, la durée, la voie d'administration et la dose maximale quotidienne. |
1.h |
Autres renseignements |
Ces renseignements devraient se limiter aux instructions d'entreposage, aux instructions spéciales (p. ex., pour l'élimination) et à une liste de certains ingrédients (p. ex., teneur en calcium, magnésium, potassium et sodium). |
1.i |
Ingrédients inactifs |
Fournir dans cette section une liste qualitative des ingrédients inactifs par ordre alphabétique ou par ordre d'importance décroissante selon leur proportion dans le produit. Cette section devrait également servir à fournir des renseignements à propos d'éventuels agents de conservation (p. ex., le mercure), comme l'exige la réglementation. S'il y a lieu, on peut aussi indiquer dans cette section si le produit est sans gluten, sans lactose, etc. Pour les produits de catégorie IV, les bains de bouche, et les dentifrices : les ingrédients inactifs peuvent être représentés sur des étiquettes en utilisant la nomenclature internationale d'ingrédients cosmétiques (INCI), si l'ingrédient est présent dans la Base de données d'ingrédients de produits de santé naturels (BDIPSN). |
1.j |
Questions? |
Indiquer dans cette section les coordonnées du promoteur pour les personnes qui souhaiteraient obtenir des réponses à leurs questions au sujet du produit, faire état de leurs préoccupations ou signaler des événements indésirables (réactions indésirables ou incidents liés au médicament). Les coordonnées pourraient être le numéro de téléphone (représentation numérique complète), une adresse électronique, l'adresse du site Web ou l'adresse postale d'une personne-ressource au Canada, ou tout autre renseignement permettant de contacter cette dernière. Cette section peut aussi inclure un symbole d'un receveur de téléphone (téléphonique) ( or ), par contre le symbole ne pourrait pas remplacer la rubrique « Questions? ». |
2.3 Conception et format
Le tableau 2 présente le format du TCIM. Il est permis d'apporter certaines modifications au format normalisé, tel qu'indiqué à la section 2.4, « Utilisation de flexibilités progressives ».
Veuillez référer à la figure 1 pour un exemple du TCIM standard, étiqueté avec les spécifications de conception.
| Élément de l'étiquette ou de communication graphique | Présentation du Tableau canadien normalisé d'information sur le médicament | |
|---|---|---|
| 2.a | Espace principal (« Panneau de marque nominative ») |
Si l'espace le permet, deux panneaux de marque nominative peuvent être utilisée (c.-à-d., un en anglais et un en français). |
| 2.b | Style de la police |
|
| 2.c | Graisse | Des caractères gras sont exigés pour le titre du tableau « Info-médicament », les rubriques et les sous-titres. Aucun autre caractère gras n'est permis sauf aux endroits exigés par la réglementation. Se reporter aux polices permises ci-dessus pour obtenir des détails sur les graisses acceptables pour les caractères réguliers et gras. |
| 2.d | Taille de la police |
*Si la police Helvetica Neue n'est pas disponible, elle doit être remplacée par une des polices jugées acceptables au point « Styles de la police » ci-dessus. |
| 2.e | Couleurs d'impression |
|
| 2.f | Titre : Info-médicament |
|
| 2.g | Titre : Info-médicament (suite) |
|
| 2.h | Rubriques (p. ex., Usages, Mises en garde, Mode d'emploi) |
|
| 2.i | Sous-titres (p. ex., Ne pas utiliser, Avertissement alcool) |
|
| 2.j | Puces | Les puces constituées de carrés ou de cercles pleins sont acceptables. Elles doivent être réglées à une largeur d'au moins 3 points ou suivre un format cohérent avec celui du texte du TCIM. |
| 2.k | Texte à puces |
|
| 2.l | Encadré (boîte à cadre ou bordure extérieure du tableau), lignes horizontales et lignes fines |
|
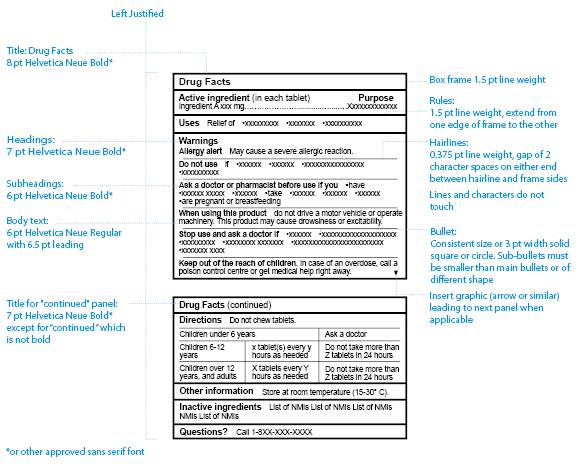
Figure 1: Spécifications relatives à la présentation d'un TCIM standard - Équivalent du texte
La figure 1, Spécifications relatives à la présentation d'un TCIM standard, est un modèle unilingue d'un tableau canadien d'information sur le médicament qui présente les spécifications relatives à la mise en forme.
Il y a deux panneaux : le premier panneau a pour titre Info-médicament et le second, Info-médicament (suite).
Le tableau comporte les rubriques suivantes : Ingrédients actifs (dans chaque comprimé), Utilité, Usages, Mises en garde, Mode d'emploi, Autres renseignements, Ingrédients inactifs et Questions avec un point d'interrogation. Toutes les rubriques sont en caractères gras et commencent par une majuscule.
Sous la rubrique Mises en garde figurent les sous-titres suivants : Alerte aux allergies, Ne pas utiliser, Consultez un médecin ou un pharmacien avant l'utilisation si vous, Lorsque vous utilisez ce produit, Cessez d'utiliser et consultez un médecin si, et Garder hors de la portée des enfants. Tous les sous-titres sont en caractères gras et commencent par une majuscule.
Les rubriques sont séparées les unes des autres par une ligne horizontale grasse, et les sous-titres de la section Mises en garde sont séparés par des lignes fines. Chaque rubrique ou sous-titre commence sur une nouvelle ligne.
Après chaque rubrique et sous-titre figure un texte type, sous forme de phrases courtes ou de liste à puces, à l'exception de la section Mode d'emploi qui se présente sous la forme d'un tableau intégré.
Les spécifications quant au type et à la taille de la police, à la largeur du trait et à l'alignement du texte sont présentées autour du modèle; chaque élément de conception est relié par une ligne pointillée à la partie pertinente du tableau.
Note: Figure 1 n'est pas à l'échelle.
2.3.1 Recommandations concernant le format du TCIM
2.3.1.1 Exigences générales
2.3.1.1.1 Les renseignements relatifs aux ingrédients actifs et à l'utilité doivent apparaître sur la même ligne horizontale (sous réserve des flexibilités applicables aux produits de catégorie IV, aux bains de bouche et aux dentifrices, auquel cas la rubrique 'Utilité' peut être supprimée). Dans les circonstances où ce n'est pas réalisable, ces rubriques doivent être présentées en blocs de texte pour organiser l'information de façon claire. Par exemple :
Recommandé :

Équivalent du texte
Cette image montre la disposition des rubriques bilingues sur une seule ligne. Le texte est le suivant (dans l’ordre) : la rubrique Active ingredient (in each tablet), barre oblique, Ingrédient actif (dans chaque comprimé), suivi par la rubrique Purpose, barre oblique, Utilité, à droite sur la même ligne. Sur la ligne suivante, l’ingrédient (Dimenhydrinate XX mg) est présenté avec son utilité (Anti-nauseant/ antinauséeux) à droite sur la même ligne.
Accepté :

Équivalent du texte
Cette image montre la disposition des rubriques bilingues sur des multiples lignes. Le texte est le suivant (dans l’ordre) : la rubrique Active ingredient (in each tablet), barre oblique, suivi par la rubrique Purpose et une barre oblique à droite. Sur la ligne suivante, la rubrique Ingrédient actif (dans chaque comprimé) se présente, suivi par la rubrique Utilité à droite sur la même ligne. Sur la ligne suivante, l’ingrédient (Dimenhydrinate XX mg) est présenté avec son utilité (Anti-nauseant/ antinauséeux) à droite sur la même ligne.
2.3.1.1.2 Quand plusieurs ingrédients actifs ont la même utilité, l'information doit être présentée d'une façon qui permet d'associer facilement chaque ingrédient actif à son utilité (à l'aide de parenthèses, de lignes en pointillé ou d'autres éléments graphiques). Par exemple :

Équivalent du texte
Cette image montre une section d’une maquette bilingue du tableau Drug Facts / Info-médicament, présentant plusieurs ingrédients actifs ayant la même utilité. Ces ingrédients sont liés à cette utilité commune par une accolade.
2.3.1.1.3 Similairement, quand l'espace disponible ne permet pas de mettre l'utilité ou le nom d'un ingrédient actif sur une seule ligne, elle peut continuer sur une deuxième ligne si elle reste lisible. Par exemple :

Équivalent du texte
Cette image montre une section d’une maquette bilingue du tableau Drug Facts / Info-médicament, qui présente plusieurs ingrédients actifs ayant la même utilité. Ces ingrédients sont liés à cette utilité commune par une accolade. L’utilité est disposée sur deux lignes.

Équivalent du texte
Cette image montre une section d’une maquette bilingue du tableau Drug Facts / Info-médicament, qui présente plusieurs ingrédients actifs ayant la même utilité. Ces ingrédients sont liés à cette utilité commune par une accolade. L’utilité, ainsi que le nom d’un ingrédient en anglais et en français, sont disposés sur deux lignes.
2.3.1.1.4 Pour ajouter du texte à un énoncé comportant déjà une puce, utiliser des puces subsidiaires. Les puces subsidiaires devraient être clairement différentiables de la puce principale (c.à.d. d'une forme ou d'un épaisse différente de la puce principale, et ne doivent pas être creuses). Par exemple :

Équivalent du texte
Cette image donne un exemple de la manière de traiter une liste à puces complexe.
Le premier élément de la liste d'utilisations, soit la phrase « soulage temporairement la douleur et les démangeaisons causées par » est précédée d’une puce ronde pleine. Les deux sous-puces suivantes sont des carrés pleins placés en retrait devant « piqûres d'insectes » et « irritation cutanée mineure ». Ces deux éléments viennent compléter l’idée exprimée dans la puce ronde.
La deuxième idée, « assèche le suintement causé par » est également précédée d’une puce ronde. Les 3 sous-puces suivantes sont des carrés pleins placés en retrait « herbe à puce », « sumac de l’Ouest » et « sumac à vernis ». Ces trois éléments viennent compléter l’idée exprimée dans la puce ronde.
2.3.1.1.5 Le mode d'emploi peut être présenté sous forme de tableau, sous forme d'énoncés à puces ou sous forme de tableau combiné à des énoncés à puces. Pour les produits comportant un mode d'emploi pour plus de deux groupes d'âges ou populations, ces directives devraient figurer dans un tableau intégré; elles seraient ainsi plus faciles à lire pour le consommateur (se reporter à la figure 1, « Spécifications relatives à la présentation d'un TCIM standard »).
2.3.1.1.6 Les fractions peuvent être exprimées en notation numérique ou sous forme de texte (p. ex., « ½ » ou « un demi »). Le style et la taille des caractères employés pour les fractions doivent être les mêmes que dans le reste du texte du TCIM.
2.3.1.2 Renseignements bilingues
2.3.1.2.1 Le profil des caractères (p. ex., leur taille et leur style) doit être le même dans les deux langues.
2.3.1.2.2 Dans la mesure du possible, les renseignements devraient être organisés par langue pour une meilleure lisibilité (se reporter à la figure 2, « Tableaux canadiens d'information sur le médicament [présentation unilingue : anglais et français] »).

Figure 2: Tableaux canadiens d'information sur le médicament (présentation unilingue : anglais et français) - Équivalent du texte
La figure 2, Tableaux canadiens d'information sur le médicament (présentation unilingue : anglais et français), présente deux modèles du même tableau d'information sur le médicament côté à côté. Il y a donc un tableau unilingue anglais intitulé Drug Facts à gauche et un tableau unilingue français intitulé Info-médicament à droite.
La version anglaise du tableau comporte les rubriques suivantes : Active ingredients (in each xx mL), Purpose, Uses, Warnings, Directions, Other Information, Inactive ingredients et Questions avec un point d'interrogation.
Sous la rubrique Warnings figurent les sous-titres suivants: Ask a doctor or pharmacist before use if you, When using this product, et Keep out of the reach of children. Tous les rubriques et les sous-titres sont en caractères gras et commencent par une majuscule.
La version française du tableau comporte les rubriques suivantes : Ingrédients actifs (dans chaque xx mL), Utilité, Usages, Mises en garde, Mode d'emploi, Autres renseignements, Ingrédients inactifs et Questions avec un point d'interrogation.
Sous la rubrique Mises en garde figurent les sous-titres suivants : Consultez un médecin ou un pharmacien avant l'utilisation si vous, Lorsque vous utilisez ce produit, et Garder hors de la portée des enfants. Tous les sous-titres sont en caractères gras et commencent par une majuscule.
Chaque rubrique ou sous-titre commence sur une nouvelle ligne. Les rubriques sont séparées les unes des autres par une ligne horizontale grasse, et les sous-titres de la section Mises en garde sont séparés par des lignes fines.
Après chaque rubrique et sous-titre figure un texte type, sous forme de phrases courtes ou de liste à puces.
Note: Figure 2 n'est pas à l'échelle.
2.3.1.2.3 Un TCIM bilingue peut constituer le meilleur format lorsque l'espace disponible sur l'étiquette est limité. Des blocs distincts de renseignements en anglais et en français peuvent être présentés en alternance (comme à la figure 3, « Tableau canadien d'information sur le médicament [présentation bilingue : alternance de l'anglais et du français] » ou combinés (comme à la figure 4, « Tableau canadien d'information sur le médicament [présentation combinée : anglais et français] ») dans le même tableau.
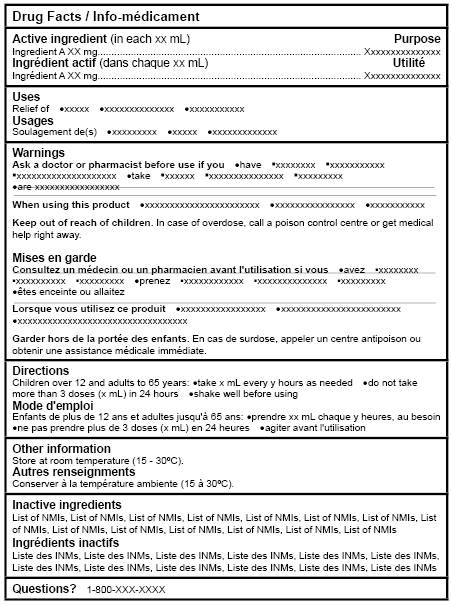
Figure 3: Tableau canadien d'information sur le médicament (présentation bilingue : alternance de l'anglais et le français) - Équivalent du texte
La figure 3, Tableau canadien d'information sur le médicament (présentation bilingue : alternance de l'anglais et le français), est un modèle d'un tableau d'information sur le médicament qui présente des renseignements dans une disposition bilingue dans laquelle des blocs de texte en anglais et en français sont affichés en alternance.
Le titre Drug Facts / Info-médicament est affiché au début du tableau d'information sur le médicament.
Les rubriques sont les suivantes (dans l'ordre) : Active ingredient (in each xx mL), Ingrédient actif (dans chaque xx mL), Purpose, Utilité, Uses, Usages, Warnings, Mises en garde, Directions, Mode d'emploi, Other information, Autres renseignements, Inactive ingredients, Ingrédients inactifs, et Questions avec un point d'interrogation. Chaque rubrique est en caractères gras et commence par une majuscule.
Chaque rubrique en anglais est suivie d'un texte type en anglais. Immédiatement en-dessous se trouvent la rubrique et le texte correspondants en français. Chaque paire bilingue de rubriques est séparée l'une de l'autre par une ligne horizontale grasse.
Sous la rubrique Warnings se trouvent les sous-titres et le texte type, séparés par deslignes fines. Les sous-titres sont : Ask a doctor or pharmacist before use if you, When using this product, et Keep out of the reach of children. Tous les sous-titres sont en caractères gras et commencent par une majuscule. Les sous-titres sont séparés un de l'autre par des lignes fines.
Immédiatement après le dernier sous-titre en anglais de la section Warnings se trouvent la rubrique correspondante en français, Mises en garde, ainsi que les sous-titres et le texte type qui s'y rattachent, séparés par des lignes fines. Les sous-titres en français sont : Consultez un médecin ou un pharmacien avant l'utilisation si vous, Lorsque vous utilisez ce produit, et Garder hors de la portée des enfants.
Tous les textes types se présentent sous forme de phrases courtes ou de liste à puces. Toutes les rubriques et tous les sous-titres commencent sur une nouvelle ligne.
Note: Figure 3 n'est pas à l'échelle.

Figure 4: Tableau canadien d'information sur le médicament (présentation combinée : anglais et français) - Équivalent du texte
La figure 4, Tableau canadien d'information sur le médicament (présentation combinée : anglais et français), est un modèle de tableau d'information sur le médicament qui présente des renseignements dans une disposition bilingue dans laquelle les textes en anglais et en français sont combinés.
Le titre Drug Facts / Info-médicament est affiché au début du tableau d'information sur le médicament.
Les rubriques sont les suivantes (dans l'ordre) : Active ingredient (in each xx mL) / Ingrédient actif (dans chaque xx mL), Purpose / Utilité, Uses / Usages, Warnings / Mises en garde, Directions / Mode d'emploi, Other information / Autres renseignements, Inactive ingredients / Ingrédients inactifs et Questions avec un point d'interrogation. Chaque rubrique est en caractères gras et commence par une majuscule.
Chaque rubrique commence par une majuscule. Chaque paire de rubriques bilingue est en caractères gras, et commence sur une nouvelle ligne. Chaque paire de rubriques bilingue est séparée l'une de l'autre par une ligne horizontale grasse.
Sous la rubrique Warnings / Mises en garde se trouvent les sous-titres et le texte type.
D'abord, le premier sous-titre en anglais est affiché avec le texte type correspondant, suivi immédiatement par le sous-titre en français avec le texte type correspondant. Les sous-titres sont les suivants (dans l'ordre): Ask a doctor or pharmacist before use if you, Consultez un médecin ou un pharmacien avant l'utilisation si vous, When using this product, Lorsque vous utilisez ce produit, Keep out of the reach of children, et Garder hors de la portée des enfants.
Chaque sous-titre est en caractères gras, commence par une majuscule et commence sur une nouvelle ligne. Chaque paire de sous-titres est séparées l'une de l'autre par des lignes fines.
Tous les textes types se présentent sous forme de phrases courtes ou de liste à puces.
Note: Figure 4 n'est pas à l'échelle.
2.3.1.2.4 Le texte en anglais et en français doit être organisé de manière à faciliter la lecture dans la langue choisie. Les mises en garde comprenant plusieurs énoncés à puces sont plus lisibles s'ils sont regroupés par langue plutôt que présentés en alternance pour chaque puce. Par exemple :

Équivalent du texte
Cette image montre une section d’une maquette bilingue du tableau Drug Facts / Info-médicament, qui présente deux façons de disposer l’information dans les deux langues. La rubrique affichée est Warnings / Mises en garde; une barre oblique sépare les éléments de chaque langue. Le premier sous-titre, Allergy alert / Alerte aux allergies, est disposé de la même façon. Le sous titre suivant, Do not use, est suivi d’un texte type en anglais. Le sous-titre en français Ne pas utiliser est situé sur une nouvelle ligne et suivi de son texte correspondant en français.
2.3.1.3 Considérations relatives à l'affichage
2.3.1.3.1 Orientation :
De façon générale, il est recommandé de présenter le tableau verticalement, ce qui facilite la lecture et la comparaison de différents produits. Cependant, une autre orientation (se reporter à la figure 6 « Tableau canadien d'information sur le médicament [présentation bilingue : autre orientation] ») pourrait permettre de maximiser l'espace disponible sur l'étiquette et, dans certains cas, d'améliorer la lisibilité (p. ex., emballages longs, comme ceux des tubes d'onguents topiques).
2.3.1.3.2 Segmentation du tableau :
S'il n'y a pas assez de place sur un seul côté de l'emballage, le TCIM peut être segmenté entre plusieurs côtés. Toutefois, la présentation globale et la séquence de l'information doivent demeurer les mêmes. Selon la présentation, les sections peuvent continuer sur les panneaux suivants. Vérifier si l'insertion du TCIM sur un panneau latéral permet de suivre plus facilement le contenu (se reporter à la figure 5 « Tableau canadien d'information sur le médicament [présentation bilingue : multiples panneaux] » et à la figure 6 « Tableau canadien d'information sur le médicament [présentation bilingue : autre orientation] »). La séquence des panneaux du TCIM ne peut pas être interrompue par l’image de marque/d’autres panneaux, à l’exception des étiquettes qui emploient des TCIMs unilingues séparés disposé sur des panneaux opposés (c.-à.-d., un TCIM en anglais et un TCIM en français peut être présentés avec un panneau principale entre les deux).
Si le tableau est segmenté, il faut offrir au consommateur un moyen d'en suivre facilement le contenu du TCIM, du début à la fin (p. ex., le début et la fin du tableau doivent être faciles à repérer). Un symbole graphique, comme une flèche, devrait être utilisé pour indiquer que le TCIM se poursuit sur le côté suivant. Le titre « Info-médicament (suite) » doit apparaître en haut du panneau suivant, mais certaines flexibilités progressives autorisent l'omission de cet élément.

Figure 5: Tableau canadien d'information sur le médicament (présentation bilingue : multiples panneaux) - Équivalent du texte
La figure 5, Tableau canadien d'information sur le médicament (présentation bilingue : multiples panneaux), est un modèle de tableau d'information sur le médicament disposé sur 3 panneaux adjacents. Le texte est orienté à l'horizontal (format « paysage »). Il y a un panneau rectangulaire. Il est entouré d'un second rectangle légèrement plus grand où les côtés sont en pointillés. Il y a 2 lignes horizontales en pointillés qui traversent les deux rectangles, situées à environ 1,5 pouce du haut et à 1,5 pouce du bas. Les lignes pointillées sont destinées à simuler les lignes de pliage d'une boîte en trois dimensions.
Le titre du tableau est Drug Facts, barre oblique, Info-médicament.
Les renseignements bilingues sont présentés dans un format combiné.
Les rubriques sont les suivantes (dans l'ordre) :, Active ingredients (in each tablet) / Ingrédients actifs (dans chaque comprimé), Purpose / Utilité, Uses / Usages, Warnings/ Mises en garde, Directions/ Mode d'emploi, Other information / Autres renseignements, Inactive ingredients/ Ingrédients inactifs, et Questions avec un point d'interrogation. Chaque paire de rubriques est en caractères gras et commence sur une nouvelle ligne. Chaque rubrique commence par une majuscule.
Sous la rubrique Warnings / Mises en garde se trouvent les sous-titres en anglais et en français, en alternance. Les sous-titres sont les suivants (dans l'ordre): Allergy alert / Alerte aux allergies, Do not use, Ne pas utiliser, Ask a doctor or pharmacist before use if you, Consultez un médecin ou un pharmacien avant l'utilisation si vous, When using this product, Lorsque vous utilisez ce produit, Stop use and ask a doctor if, Cessez d'utiliser et consultez un médecin si, Keep out of reach of children, et Garder hors de la portée des enfants.
Immédiatement après chaque sous-titre se trouvent le texte type correspondant. Tous les sous-titres sont en caractères gras, commencent avec une majuscule, et commencent sur une nouvelle ligne. Une flexibilité progressive du niveau 1 est employée pour supprimer les lignes fines.
Tous les textes types se présentent sous forme de phrases courtes ou de liste à puces.
Note: Figure 5 n'est pas à l'échelle.
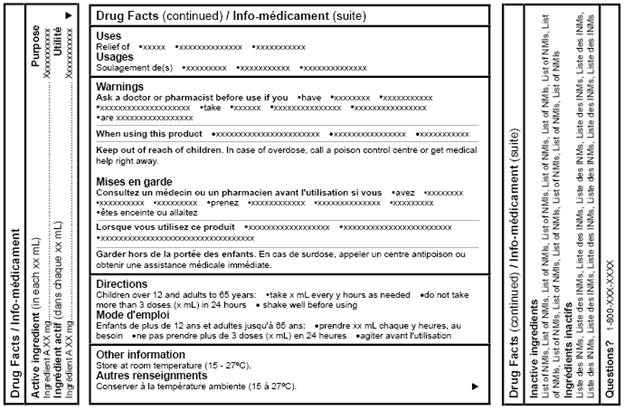
Figure 6: Tableau canadien d'information sur le médicament (présentation bilingue : autre orientation) - Équivalent du texte
Le figure 6, Tableau canadien d'information sur le médicament (présentation bilingue : autre orientation), est un modèle de tableau d'information sur le médicament qui présente des renseignements dans une disposition bilingue dans laquelle des blocs de texte en anglais et en français sont affichés en alternance. Il y a 3 panneaux, un panneau central et deux panneaux étroits. Les panneaux représentent les côtés d'un emballage rectangulaire. Les deux panneaux étroits sont orientés à un angle de 90 degrés par rapport au grand panneau.
Le panneau de gauche a pour titre Drug Facts / Info-médicament. Le panneau du centre et celui de droite sont intitulés Drug Facts (continued) / Info-médicament (suite).
Les rubriques, en alternance, sont les suivantes (dans l'ordre) : Active ingredient (in each xx mL), Ingrédient actif (dans chaque xx mL), Purpose, Utilité, Uses, Usages, Warnings, Mises en garde, Directions, Mode d'emploi, Other information, Autres renseignements, Inactive ingredients, Ingrédients inactifs, et Questions avec un point d'interrogation. Chaque rubrique est en caractères gras, commence par une majuscule et commence sur une nouvelle ligne.
Sous la rubrique Warnings / Mises en garde se trouvent les sous-titres en anglais et en français, en alternance. Les sous-titres sont (dans l'ordre): Ask a doctor or pharmacist before use if you, When using this product, and Keep out of reach of children, suivi par les sous-titres en français, Consultez un médecin ou un pharmacien avant l'utilisation si vous, Lorsque vous utilisez ce produit, et Garder hors de la portée des enfants.
Immédiatement après chaque sous-titre suivent les texte types qui s'y rattachent.
Tous les textes types se présentent sous forme de phrases courtes ou de liste à puces.
Note: Figure 6 n'est pas à l'échelle.
2.3.1.3.3 Utilisation de colonnes :
Si deux colonnes ou plus sont du même côté d'un emballage, la première colonne devrait se trouver à gauche de la deuxième colonne, et ainsi de suite. Les colonnes doivent être à peu près de la même taille. Si deux colonnes ou plus se trouvent du même côté de l'emballage, le côté droit de la première colonne et le côté gauche de la deuxième colonne peuvent partager une ligne de bordure verticale qui va d'une extrémité à l'autre du TCIM (voir l'exemple ci-dessous). Cela s'applique aussi au côté droit de la deuxième colonne et au côté gauche de la troisième colonne, le cas échéant.

Équivalent du texte
Cet exemple montre une section d'une maquette du tableau d'information sur le médicament dont les renseignements sont présentés sur deux colonnes. La colonne de gauche contient le titre anglais Drug Facts, les rubriques Active Ingredients, Purpose, Uses et Warnings, et sous la rubrique Warnings, les sous-titres Ask a doctor or pharmacist before use if you, When using this products, et Keep out of reach of children. Chaque rubrique ou sous-titre est suivi d'un texte type.
La colonne de droite contient le titre français Info-médicament, les rubriques Ingrédients actifs, Utilité, Usages et Mises en garde, et sous la rubrique Mises en garde, les sous-titres Consultez un médecin ou un pharmacien avant l'utilisation si vous, Lorsque vous utilisez ce produit, et Gardez hors de la portée des enfants. Chaque rubrique ou sous-titre est suivi d'un texte type.
Tous les rubriques et sous-titres sont en caractères gras et commencent par une majuscule. Chaque rubrique ou sous-titre commence sur une nouvelle ligne.
Un symbole graphique (p. ex., une flèche) devrait être utilisé au bas de la première colonne (et au bas des colonnes subséquentes ou des autres côtés de l'emballage, au besoin) pour indiquer que le TCIM se poursuit dans la prochaine colonne. Le titre « Info-médicament (suite) » doit apparaître en haut de chacune des colonnes suivantes, mais avec l'application de flexibilités progressives, l'omission de cet élément est autorisée.
2.4 Utilisation de flexibilités progressives
Tous les produits assujettis à la réglementation doivent utiliser le format normalisé du Tableau canadien d'information sur le médicament. Toutefois, certains produits et formats d'emballage peuvent ne pas présenter suffisamment d'espace pour accueillir le format normalisé du tableau d'information sur l'étiquette.
Dans certains cas, une étiquette innovante peut être le moyen le plus efficace pour répondre aux besoins d'espace du TCIM. Cette décision doit être prise au début du processus de création de l'étiquette et de l'emballage. Dans d'autres cas, un format modifié avec des flexibilités progressives peut être pris en considération en fonction des critères énoncés au tableau 3, « Format du Tableau canadien d'information sur le médicament avec flexibilités progressives », et au tableau 4, « Flexibilités adaptées pour les produits de catégorie IV, bains de bouche et dentifrices ». Le but des modifications proposées est de gagner de l'espace sur l'étiquette, et dans certains cas, peut éviter la nécessité d'utiliser des étiquettes innovantes ou d'augmenter la taille des emballages.
L’ajout d’une URL dirigeant les consommateurs vers un eTCIM est optionnel pour tous les produits.
2.4.1 Marque nominative
Les promoteurs qui utilisent deux espaces principaux (panneaux de marque nominative) peuvent appliquer une ou plusieurs des flexibilités de niveau 1 indiquées au tableau 3. Ils ne doivent pas appliquer de flexibilités au-delà du niveau 1 s'ils décident de conserver deux panneaux pour la marque nominative dans la conception de leur emballage, c'est-à-dire qu'il leur est interdit d'utiliser des caractères condensés.
Lorsqu'un seul espace principal (panneau de marque nominative) est utilisé, les promoteurs peuvent appliquer des flexibilités supplémentaires (niveaux 2 à 4). Les promoteurs ne sont pas tenus d'appliquer toutes les flexibilités de niveau 1 avant de passer au niveau 2 (modification de la police de caractère).
2.4.2 Transfert des renseignements du TCIM
A l’exception des produits de catégorie IV, et dès décembre 2018, uniquement pour les produits de catégorie 1 sous le cadre des produits d’autosoins, toute information retirée du TCIM (après l’application de flexibilités progressives) doit apparaître sur un dépliant d’accompagnement et doit respecter les spécifications applicables au TCIM normalisé. Ceci ne s’applique pas aux renseignements relatifs aux « usages », aux « ingrédients actifs » ou à l’entreposage du produit faisant partie des « Autres renseignements » puisque la réglementation exige que ces éléments figurent sur l’étiquette extérieure.
Les produits de catégorie IV ainsi que bains de bouche et dentifrices, pour lesquels tous les renseignements du TCIM ne figurent pas sur l'étiquette physique (conformément aux Exigences minimales en matière d'information, se reporter au tableau 4), doivent inclure soit un dépliant destiné au patient (respectant les spécifications du TCIM normalisé) ou une URL qui dirige les consommateurs à un site Web contenant un TCIM complet (tel qu'indiqué dans le document Lignes directrices : Normes techniques pour le Tableau électronique canadien d'information sur le médicament).
Pour les médicaments de la division 8, le TCIM doit figurer sur l'étiquette extérieure. Cependant, si le format d'emballage n'offre pas suffisamment d'espace pour le TCIM normalisé, l'application des flexibilités disponibles ou l'usage d'une étiquette innovante devraient être envisagé. Un feuillet de renseignements pour le consommateur (partie III de la monographie du produit) doit être inclus dans l'emballage de tous les médicaments de la division 8. Si la partie III de la monographie du produit inclue les renseignements qui ont été enlevés du TCIM, il n'est pas nécessaire de fournir le TCIM complet sur le dépliant d'accompagnement.
Veuillez consulter la section 2.6 de ce document pour les détails sur les nouvelles flexibilités disponibles pour produits de catégorie 1 sous le cadre des produits d’autosoins.
Tableau 3 : Format du Tableau canadien d'information sur le médicament avec flexibilités progressives
Flexibilités de niveau 1 disponibles pour les produits comportant deux espaces principaux (panneaux de marque nominative) unilingues
- Transférer les usages du produit dans l'espace principal (avec certaines conditions, voir ci-dessous)
- Supprimer les lignes fines de la section « Mises en garde »
- Supprimer le titre « Info-médicament (suite) » (avec certaines conditions, voir ci-dessous)
- Commencer le texte immédiatement à la suite de la rubrique « Mises en garde »
- Réduire l'épaisseur de trait des lignes horizontales à 1,0 point
- Avoir un encadré continu (avec certaines conditions, voir ci-dessous)
Les promoteurs ne sont pas tenus d'appliquer conjointement toutes les flexibilités. En ce qui concerne les produits comportant deux espaces principaux (panneaux de marque nominative) unilingues, les promoteurs ne peuvent appliquer que les flexibilités décrites ci-dessus.
Niveau 1 |
Les promoteurs ne sont pas tenus d’appliquer conjointement toutes les flexibilités de niveau 1, ni d’appliquer toutes les flexibilités de niveau 1 avant d’accéder auxflexibilités de niveau 2. |
|---|---|
Niveau 2 - |
|
Niveau 3 - |
|
Niveau 4 - Transfert des mises en garde relatives à l'utilisation du produit |
Une déclaration indiquant que les renseignements complets concernant les mises en garde sont accessibles sur un dépliant d'accompagnement (et eTCIM si applicable) doit être incluse. Pour les médicaments vendus sans ordonnance du titre 1, l’information qui figure sur un dépliant d’accompagnement doit respecter les spécifications applicables au TCIM normalisé. Pour les médicaments vendus sans ordonnance du titre 8, le dépliant d’accompagnement doit suivre le format existant de la partie III de la monographie de produit. L’eTCIM doit présenter les renseignements de sécurité complets, suivant les spécifications de la Ligne directrice: Normes techniques sur le Tableau électronique canadien d’information sur le médicament. |
Conditions
- Le contenu de la rubrique « Usages » peut être transféré du TCIM vers l'espace principal. Les usages ne peuvent cependant pas être combinés à des énoncés non approuvés qui sont de nature promotionnelle.
- La suppression du titre « Info-médicament (suite) » doit être accompagnée d'une stratégie qui guide le consommateur vers la suite des renseignements (p. ex., flèche).
- Lorsque plusieurs panneaux se suivent, les promoteurs peuvent utiliser un seul encadré continu plutôt qu'un encadré autour de chaque panneau. Il ne doit pas y avoir de texte à moins de 3,175 mm (1/8 po) d'une ligne de pli. Il est à noter que, lorsqu'un encadré continu est utilisé, l'orientation doit demeurer constante dans tous les panneaux du TCIM.
- Déplacer les mises en garde relatives à l'utilisation du produit de l'étiquette extérieure vers un dépliant d'accompagnement est permis seulement après avoir appliqué les flexibilités incluses dans les niveaux 1 à 3. Les promoteurs peuvent utiliser les flexibilités de niveaux 4 tout en conservant la liste des ingrédients inactifs dans le TCIM si le déplacement de ceci ne permet pas la création d'espace additionnel sur l'étiquette, assujettis à l'examen.
2.5 Flexibilités adaptées pour les produits de catégorie IV, bains de bouche et dentifrices
Les produits de catégorie IV ainsi que bains de bouche et dentifrices pour lesquels tous les renseignements du TCIM ne figurent pas sur l'étiquette physique (conformément aux Exigences minimales en matière d'information ci-dessous) doivent être accompagnés d'un dépliant destiné au patient (respectant les spécifications applicables au TCIM normalisé) ou d'un lien vers une URL qui dirige les consommateurs vers un TCIM complet. L'ajout d'une URL est facultatif dans le cas des produits pour lesquels le TCIM complet figure sur l'étiquette physique ou un dépliant d'accompagnement. Les renseignements sur les normes utilisés à être pour la mise en place d'une URL dans le but de permettre aux consommateurs d'avoir accès à une version électronique complète du TCIM peuvent être consultés dans la Ligne directrice: Normes techniques sur le Tableau électronique canadien d'information sur le médicament (eTCIM).
Les promoteurs peuvent appliquer n'importe laquelle des flexibilités décrites au tableau 4 au TCIM qui figure sur l'étiquette extérieure. Il est à noter que les conditions d'utilisation d’une police de caractères condensés sont les mêmes que pour le format TCIM avec flexibilités progressives, de sorte que les promoteurs doivent combiner les deux espaces principaux unilingues en un seul espace principal bilingue avant de pouvoir appliquer une police de caractères condensés. Les promoteurs peuvent aussi utiliser les flexibilités décrites dans le tableau 4 lors de l’utilisation d’étiquettes innovantes, mais les mises en garde relatives à l’utilisation du produit ne peuvent pas être supprimées.
Les flexibilités présentées dans le tableau 4 : Flexibilités adaptées pour les produits de catégorie IV, bains de bouche et dentifrices, seront supplantées par celles présentées dans le tableau 5: L’étiquetage pour les médicaments vendus sans ordonnance à faible risque (c.-à-d., produits de catégorie 1 sous le cadre des produits d’autosoins), et ce à partir du 1er décembre 2018.
Tableau 4: Flexibilités adaptées pour les produits de catégorie IV, bains de bouche et dentifrices
Flexibilités disponibles pour la présentation (URL/ dépliant d'accompagnement optionnel)
- Supprimer les lignes fines de la section « Mises en garde »
- Supprimer le titre « Info-médicament (suite) » (avec certaines conditions, voir ci- dessous)
- Commencer le texte immédiatement à la suite de la rubrique « Mises en garde »
- Réduire l'épaisseur de trait des lignes horizontales à 1,0 point
- Avoir un encadré continu (avec certaines conditions, voir ci-dessous)
- L'utilisation d'une police de caractères condensée est autorisée (voir le tableau 3 : Flexibilités de niveau 2)
- La largeur de caractère peut être réduite d'au plus 10 % horizontalement (échelle horizontale de 90 %).
- Placer la liste des ingrédients inactifs ailleurs sur l'étiquette extérieure ou sur une étiquette fixée à l'emballage. La rubrique « Ingrédients inactifs » doit être conservée dans le TCIM, accompagnée d'une note dirigeant le consommateur vers l'endroit où il peut trouver ces renseignements
Exigences minimales en matière d'information (URL/ dépliant d'accompagnement requis)
Le TCIM qui figure sur l'étiquette extérieure des produits de catégorie IV, des bains de bouche et des dentifrices doit contenir au moins les renseignements suivants :
- « Ingrédients actifs » (la rubrique « Utilités » n'est pas exigée)
- « Usages » (si l'information n'apparaît pas dans l'espace principal)
- Mises en garde relatives à la sélection du produit sont des renseignements dont le consommateur a besoin au moment de choisir le produit à acheter, par exemple :
- Mises en garde relatives à la voie d'administration
- Sous-section « Ne pas utiliser »
- Sous-section « Consultez un médecin ou un pharmacien avant l'utilisation si vous »
- Mises en garde relatives à la somnolence et à l'excitabilité
- « Mode d'emploi »
- « Ingrédients inactifs »
- « Questions? » et coordonnées
- Un énoncé dirigeant les consommateurs vers une URL ou un dépliant d'accompagnement où ils auront accès au TCIM complet
Les promoteurs peuvent choisir d'inclure la mise en garde « Gardez hors de la portée des enfants » dans le TCIM ou de le placer ailleurs sur l'étiquette extérieure. Si un promoteur désire inclure n'importe quelle autre mise en garde relative à l'utilisation du produit sur l'étiquette extérieure (p. ex., « Lorsque vous utilisez ce produit »), l'information doit être présentée dans le format normalisé du TCIM.
Conditions
- La suppression du titre « Info-médicament (suite) » doit être accompagnée d'une stratégie pour guider le consommateur vers la suite des renseignements (p. ex., flèche).
- Lorsque plusieurs panneaux se suivent, les flexibilités permettent l'utilisation d'un seul encadré continu plutôt qu'un encadré autour de chaque panneau. Il ne doit pas y avoir de texte à moins de 3,175 mm (1/8 po) d'une ligne de pli. Il est à noter que, lorsqu'un encadré continu est utilisé, l'orientation doit demeurer constante dans tous les panneaux du TCIM.
- Le contenu de la rubrique « Usages » peut être transféré du TCIM vers l'espace principal. Les usages ne peuvent cependant pas être combinés à des déclarations non approuvées qui sont de nature promotionnelle.
- L’exclusion de la section « Utilité » et/ou le déplacement des « Usages » vers le panneau principal n’exige pas l’utilisation d’un URL/ dépliant d’accompagnement.
2.6 L’étiquetage pour les médicaments vendus sans ordonnance à faible risque (c.-à-d., produits de catégorie 1 sous le cadre des produits d’autosoins)
Des mises à jour concernant le Règlement, incluant des changements aux exigences d’étiquetage, seront effectuées lors de l’implantation du cadre réglementaire pour les produits d’autosoins. Un des changements sera l’utilisation volontaire du TCIM pour les produits à faible risque et qui présentent des allégations de type cosmétique.
Dès décembre, 2018, certains produits de catégorie IV, bains de bouche, et dentifrices qui sont considérés comme à faible risque et qui s’alignent avec la monographie applicable seront considérés comme des produits de catégorie I sous le cadre des produits d’autosoins. Ces produits ne seront plus obligés de présenter une étiquette de renseignements en format tabulaire et auront accès aux flexibilités présentées au tableau 5.
Seulement les produits suivants, qui s'alignent complètement avec les monographies ou combinaisons de celles-ci (qui seront mises à jour pour décembre 2018) sont sujets aux flexibilités décrites dans le tableau 5 :
- Traitement de l'acné
- Produits antipelliculaires
- Nettoyants antiseptiques pour la peau (à usage domestique personnel)
- Produits de traitement du pied d’athlète
- Produits de traitement de l'érythème fessier
- Produits pour la santé bucco-dentaire
- Produits médicamenteux pour le soin de la peau
- Écrans solaires primaires
- Écrans solaires secondaires
Tout autre produit de catégorie IV qui ne s’aligne pas complètement avec les monographies ou combinaisons de celles-ci n’aura pas accès aux flexibilités permises pour la catégorie I, telles que présentées au tableau 5, ni aux flexibilités adaptées pour les produits de catégorie IV, bains de bouche et dentifrices, telles que présentées au tableau 4, et ce à partir du 1er décembre 2018.
Tableau 5 : L’étiquetage pour les médicaments vendus sans ordonnance à faible risque (c.-à-d., produits de catégorie 1 sous le cadre des produits d’autosoins)
Flexibilités disponibles pour la présentation
- Supprimer le titre « Info-médicament » et le titre « Info-médicament (suite) »
- Supprimer les lignes horizontales, les lignes fines, et/ou la bordure du tableau
- Supprimer l'utilité des ingrédients actifs
- Placer le contenu de la rubrique « Usages » dans l'espace principal
- Commencer le texte immédiatement à la suite des rubriques et sous-titres de la section
- L'utilisation d'une police de caractères condensée est autorisée (voir le tableau 3 : Flexibilités de niveau 2)
- La largeur de caractère peut être réduite d'au plus 10 % horizontalement (échelle horizontale de 90 %).
- La séquence des renseignements peut être altérée.
- Les sections peuvent continuer sur des panneaux subséquents, cependant la section « Mises en garde » doit être continue, (c.-à.-d., les mises en garde doivent rester ensemble)
- Placer la liste des ingrédients inactifs ailleurs sur une étiquette fixée à l'emballage ou un URL avec un dépliant d’accompagnement optionnel. La rubrique « Ingrédients inactifs » doit être conservée sur l’étiquette extérieure, accompagnée immédiatement d'une note dirigeant le consommateur vers l'endroit où il peut trouver le TCIM complet.
- Déplacer les mises en garde relatives à l'utilisation de produit vers un URL avec un dépliant d'accompagnement optionnel, accompagnée d'une note à l'effet de « Pour toutes les mises en garde, visitez … » qui dirige le consommateur vers l'endroit où il peut trouver le TCIM complet (cet énoncé doit précéder immédiatement les mises en garde restantes, et doit rester avec son texte associé). Les mises en garde relatives à la voie d'administration, la somnolence et à l'excitabilité pouvant survenir à l'utilisation du produit, et celles suivantes des sous-titres « Ne pas utiliser » et « Consultez un médecin ou un pharmacien avant l'utilisation si vous » ne peuvent être supprimées de l'étiquette extérieure.
Exigences minimales pour la présentation
- Texte: police 6 point sans serif, interlignage d'au moins 6,5 points
- Rubriques et sous-titres alignés à gauche dans un style de police gras
- « Mises en garde » doivent rester ensemble
- Pour un contraste optimal, l'ensemble du texte doivent être imprimés en 100 % noir sur fond blanc. Si cela n'est pas possible, il faut employer la couleur qui contraste le plus (le 100 % noir, le bleu foncé, le brun foncé, le vert foncé et le mauve foncé sont acceptables).
L'inclusion d'un URL dirigeant les consommateurs vers un eTCIM est optionnelle pour les produits présentant les renseignements de produit complets. Si l'espace est limité, les promoteurs peuvent déplacer certaines mises en garde relatives à l'usage du produit et/ou la liste des ingrédients inactifs vers un eTCIM, à condition que des énoncés soient inclus pour diriger les consommateurs vers les renseignements de produit complets (dans le format d'un eTCIM) sur une URL et un dépliant d'accompagnement optionnel. Ces énoncés doivent rester avec leurs rubriques respectives et leur texte associé. Lorsque les ingrédients inactifs et les mises en garde apparaissent sur le même panneau de l'étiquette, les promoteurs peuvent combiner ces déclarations tout en se conformant aux exigences de chacun (voir exemple ci-dessous).

Équivalent du texte
Cet exemple montre une section d’une maquette du tableau d’information sur le médicament pour les produits de catégorie 1 sous le cadre des produits d’autosoins. Cet exemple montre des échantillons du texte qui a pour but de diriger les consommateurs vers des renseignements additionnels. La rubrique bilingue Inactive ingredients / Ingrédients inactifs apparait, suivie par le texte For a list of inactive ingredients and complete warnings, visit / Pour la liste des ingrédients inactifs et toutes les mises en garde, visiter : www.URL.com .
Sur la ligne suivante, la rubrique Warnings / Mises en garde apparait, suivie par la mise en garde For external use only/ Pour usage externe seulement.
2.7 Étiquettes innovantes
Le choix d'utiliser une étiquette innovante peut être fait au début du processus d'élaboration de l'emballage et de l'étiquette, ou lorsque les flexibilités progressives ont été appliquées et que l'espace fait toujours défaut. Les étiquettes pelables ainsi que les étiquettes dépliantes, etc., sont des exemples d’étiquettes innovantes. Ces types d’étiquettes devraient être conformes aux Règlements et aux lignes directrices applicables. Les adresses URL ou des codes QR ne sont pas considérés comme étant des étiquettes innovantes.
2.7.1 Principes généraux
2.7.1.1 Le consommateur doit pouvoir lire cette étiquette innovatrice au moment où il choisit un produit, avant l'achat. Le TCIM doit pouvoir être consulté sans détruire l'étiquette ou l'emballage ou en compromettre l'intégrité.
2.7.1.2 Le titre « Info-médicament » et les sections « Ingrédient(s) actif(s) » et « Usage(s) » du tableau d'information doivent être visibles au moment de la sélection des produits, avant la manipulation de l'étiquette innovante.
2.7.1.3 Pour les produits de catégorie IV, bains de bouche, et dentifrices, les flexibilités adaptées peuvent être combinées avec l'utilisation d'étiquettes innovantes; dans ces cas, le titre « Info-médicament » et la section « Ingrédients actifs » du TCIM doivent être visibles au moment de la sélection du produit, avant la manipulation de l'étiquette innovante.
2.7.1.4 Un énoncé indiquant au consommateur la suite du tableau sur l'étiquette innovante doit également être visible.
2.7.2 Flexibilités permises
Les promoteurs peuvent appliquer les flexibilités indiquées aux tableaux 3,4, et 5 à leurs étiquettes innovantes, cependant, les flexibilités permettant d’enlever la liste des ingrédients inactifs ou les mises en garde relatives à la sélection du produit du TCIM ne sont pas permises.
Tableau 6 : Flexibilités disponibles pour les étiquettes innovantes
Les promoteurs ne sont pas tenus d'utiliser un seul espace principal (panneau de marque nominative) avant d'appliquer ces flexibilités
- Placer le contenu de la rubrique « Usages » dans l'espace principal (avec certaines conditions, voir ci-dessous)
- Supprimer les lignes fines de la section « Mises en garde »
- Supprimer le titre « Info-médicament (suite) » (avec certaines conditions, voir ci-dessous)
- Commencer le texte immédiatement à la suite de la rubrique « Mises en garde »
- Réduire l'épaisseur de trait des lignes horizontales à 1,0 point
- Avoir un encadré continu (avec certaines conditions, voir ci-dessous)
- L'utilisation d'une police de caractères condensée est autorisée (voir les flexibilités de niveau 2 au tableau 3)
- La largeur de caractère peut être réduite d'au plus 10 % horizontalement (échelle horizontale de 90 %).
Conditions
- Le contenu de la rubrique « Usages » peut être transféré du TCIM à l'espace principal. Les usages ne peuvent cependant pas être combinés à des déclarations non approuvées qui sont de nature promotionnelle.
- La suppression du titre « Info-médicament (suite) » doit être accompagnée d'une stratégie pour guider le consommateur vers la suite des renseignements (p. ex., flèche).
- Lorsque plusieurs panneaux se suivent, les flexibilités permettent l'utilisation d'un seul encadré continu plutôt qu'un encadré autour de chaque panneau. Il ne doit pas y avoir de texte à moins de 3,175 mm (1/8 po) d'une ligne de pli. L'orientation doit être constante dans tous les panneaux du TCIM.
3. Tableau canadien d'information sur le médicament pour les ingrédients actifs
Document d'orientation : Tableau d'information sur les médicaments vendus sans ordonnance
Détails de la page
- Date de modification :