Ligne directrice canadienne sur la biosécurité - Niveau de confinement 1 : Conception physique et pratiques opérationnelles

Téléchargez en format PDF
(2,8 Mo, 62 pages)
Organisation : Agence de la santé publique du Canada
Cat. : HP45-16/2024F-PDF
ISBN : 978-0-660-70547-7
Pub. : 230824
Date Publiée : 2024-04-18
Table des matières
- Préface
- Abréviations et sigles
- 1. Introduction
- 2. Éléments de conception physique
- 3. Pratiques opérationnelles
- 4. Glossaire
- 5. Références et ressources
Préface
Au Canada, la manipulation ou l'entreposage des agents pathogènes humains et des toxines de groupe de risque 2 (GR2), GR3 et GR4 est réglementé par l'Agence de la santé publique du Canada (ASPC) en vertu de la Loi sur les agents pathogènes humains et les toxines (LAPHT) et du Règlement sur les agents pathogènes humains et les toxines (RAPHT). La manipulation et l'entreposage d'agents zoopathogènes importés du GR2, GR3 et GR4, ou d'une partie de ceux-ci (p. ex. une toxine), ou d'animaux, de produits ou sous-produits animaux (p. ex. des tissus, du sérum), ou d'autres organismes porteurs d'un agent zoopathogène ou d'une partie de celui-ci (p. ex. une toxine) sont réglementés en vertu de la Loi sur la santé des animaux (LSA) et du Règlement sur la santé des animaux (RSA). En vertu de la LSA et du RSA, l'ASPC est aussi responsable de l'importation ou du transfert d'agents pathogènes d'animaux terrestres ou d'une partie de ceux-ci (p. ex. une toxine) en culture pure ou dans des matrices ne provenant pas d'animaux (p. ex. un échantillon humain, de plante, alimentaire ou environnemental).
L'Agence canadienne d'inspection des aliments (ACIA) est responsable de la réglementation de l'importation ou du transfert d'agents pathogènes d'animaux terrestres désignés par l'ACIA (APAT-DA; terme collectif qui englobe les maladies animales exotiques, les maladies animales émergentes et les agents pathogènes non indigènes d'animaux sous l'autorité de l'ACIA), ainsi que d'animaux, de produits animaux et de sous-produits animaux (p. ex. des tissus, du sérum) qui sont porteurs d'un agent pathogène d'animaux terrestres ou d'une partie de celui-ci (p. ex. une toxine), en vertu de la LSA et du RSA.
La figure suivante illustre la hiérarchie des documents qu'utilisent l'ASPC et l'ACIA pour surveiller les activités de biosécurité et de biosûreté. Chaque niveau de la pyramide correspond à un type de document. Les documents sont placés en ordre de priorité du haut de la pyramide vers le bas. Les lois et les règlements se trouvent au sommet de la pyramide, car ce sont ces documents qui confèrent à l'ASPC et à l'ACIA leur autorité légale. Les outils de communication des risques et les documents techniques sont à la base de la pyramide, puisqu'ils visent seulement à résumer les recommandations et l'information scientifique.
Figure 1 : Hiérarchie des documents en matière de biosécurité et de biosûreté du gouvernement du Canada
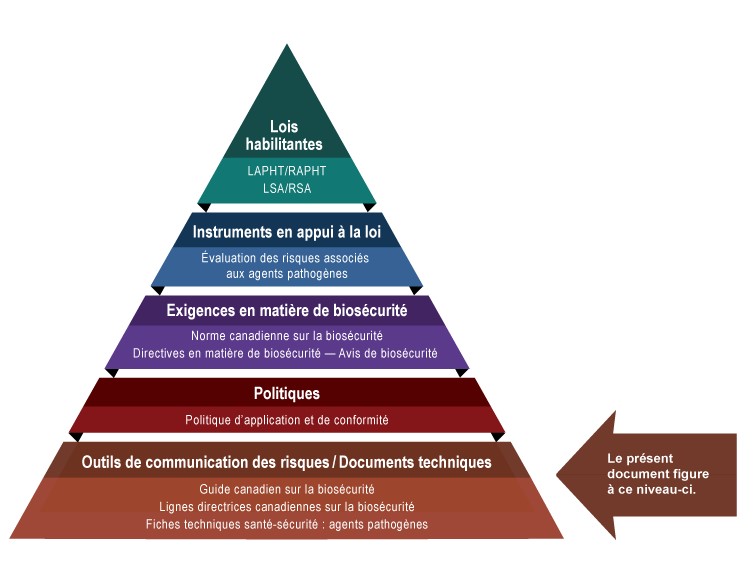
Figure 1 : Hiérarchie des documents en matière de biosécurité et de biosûreté du gouvernement du Canada - Équivalent textuel
Figure sous la forme d'une pyramide représentant la hiérarchie des documents utilisés par l'ASPC pour superviser les opérations de biosécurité et de biosûreté. Chacun des cinq niveaux de la pyramide correspond à un type de document, dont l'ordre de préséance augmente du bas vers le haut.
Au sommet se trouve la législation habilitante, c'est-à-dire la LAPHT, le RAPHT, la LSA et le RSA, qui transmet les autorités légales à l'ASPC. Au-dessous des lois et des règlements figurent les Instruments à l'appui de la législation, et ceux-ci sont les évaluations des risques associés aux agents pathogènes. La prochaine étape est intitulée les Exigences en matière de biosécurité, notamment la Norme canadienne sur la biosécurité, les Directives en matière de biosécurité et les Avis de biosécurité. Le deuxième niveau du bas est Documents de politique, soit la Politique de conformité et d'application de la loi. Le matériel d'orientation et les pièces techniques trouvés au bas de la pyramide, sous l'en-tête des Outils de communication des risques et documents techniques, visent seulement à résumer les recommandations et les informations scientifiques. Il s'agit notamment du Guide canadien sur la biosécurité, des Lignes directrices canadiennes sur la biosécurité et des Fiches techniques santé-sécurité : agents pathogènes.
La ligne directrice Niveau de confinement 1 : Conception physique et pratiques opérationnelles a été élaborée par l'ASPC et l'ACIA dans le cadre d'une série de publications électroniques qui portent sur des concepts de la biosécurité et de la biosûreté au Canada. Cette ligne directrice formule des recommandations fondées sur les risques pour les installations où sont manipulées des matières biologiques de GR1, qui sont soit incapables ou peu susceptibles de causer une maladie chez l'humain ou l'animal. La Norme canadienne sur la biosécurité (NCB) décrit les exigences fondées sur les risques pour les installations où sont manipulées des matières réglementées aux niveaux de confinement 2, 3 ou 4.
Bien que la NCB ne précise pas d'exigences s'appliquant à la manipulation et l'entreposage des matières biologiques de GR1, il est recommandé de manipuler les matières du GR1 selon des pratiques de travail sécuritaires et que les activités soient effectuées dans un laboratoire, une aire de production ou un espace de travail avec des animaux qui intègre une conception de zone de confinement de base. Cette ligne directrice vise à fournir aux intervenants et intervenantes un soutien et des conseils sur la façon d'atténuer les risques lors du travail avec des matières biologiques de GR1 qui ne sont pas assujetties à la LAPHT ou à la LSA. Les matières biologiques de GR1 pourraient présenter un risque faible pour la santé d'une personne ou d'un animal et un risque faible pour la santé publique et la population animale. Cependant, les matières biologiques de GR1 ne sont pas sans risques et pourraient entraîner des infections dans certaines circonstances (p. ex. chez des personnes dont le système immunitaire est affaibli). De ce fait, il demeure important de prendre des précautions raisonnables lors de la manipulation de ces matières. La présente ligne directrice décrit des recommandations et des éléments généraux à prendre en considération pour concevoir un laboratoire de base et manipuler en toute sécurité des matières biologiques de GR1.
Abréviations et sigles
- ACIA
- Agence canadienne d'inspection des aliments
- APAT-DA
- Agent pathogène d'animaux terrestres désigné par l'Agence canadienne d'inspection des aliments
- ASPC
- Agence de la santé publique du Canada
- ELR
- Évaluation locale des risques
- EPI
- Équipement de protection individuel
- GR
- Groupe de risque (c.-à-d. GR1, GR2, GR3, GR4)
- HEPA
- Haute efficacité pour les particules de l'air
- LAPHT
- Loi sur les agents pathogènes humains et les toxines
- LSA
- Loi sur la santé des animaux
- NC
- Niveau de confinement (c.-à-d. NC1, NC2, NC3, NC4)
- NCB
- Norme canadienne sur la biosécurité
- PIU
- Plan d'intervention d'urgence
- PON
- Procédure opératoire normalisée
- RAPHT
- Règlement sur les agents pathogènes humains et les toxines
- RSA
- Règlement sur la santé des animaux
1. Introduction
Les mots en caractères gras sont définis dans le glossaire à la section 4.
Le niveau de confinement 1 (NC1) décrit un espace de travail de base conçu pour la manipulation et l'entreposage en toute sécurité de matières biologiques de groupe de risque 1 (GR1). La conception et les pratiques du NC1 constituent la base de toutes les zones de confinement pour protéger les membres du personnel et l'environnement contre une exposition aux matières biologiques manipulées dans l'installation. La biosécurité est principalement assurée par des éléments de conception physique (p. ex. un laboratoire bien conçu et fonctionnel) et un niveau de base de pratiques opérationnelles (p. ex. de bonnes pratiques microbiologiques). Une zone de confinement pour les activités de NC1 (ci-après nommée une zone de NC1) peut comprendre les types d'espaces de travail suivants : des espaces de travail en laboratoire, des aires de production à grande échelle et des espaces de travail avec des animaux. En raison du faible risque que les matières biologiques de GR1 présentent pour la santé publique et la santé animale, la Norme canadienne sur la biosécurité (NCB) ne précise pas d'exigences applicables aux laboratoires ou aux autres installations où des activités impliquant des matières biologiques de GR1 sont menées. Une personne manipulant ou entreposant ces matières n'a pas besoin d'obtenir un permis en vertu de la Loi sur les agents pathogènes humains et les toxines (LAPHT) ou la Loi sur la santé des animaux (LSA)Note de bas de page 1.
1.1 Portée
La ligne directrice Niveau de confinement 1 : Conception physique et pratiques opérationnelles fournit des conseils détaillés sur les pratiques exemplaires pour la conception de base des espaces de travail et la manipulation en toute sécurité des matières biologiques de GR1. Ces pratiques englobent les principes de base de la biosécurité et de la biosûreté et servent de point de départ à l'élaboration des pratiques obligatoires requises à des niveaux de confinement plus élevés tel qu'énoncé dans la NCB. Les éléments fournis dans le présent document sont présentés sous forme de recommandations uniquement et peuvent être suivis sur une base volontaire, à moins qu'ils ne soient exigés en tant que condition d'un permis. Comme décrit dans cette ligne directrice, les matières biologiques de GR1 ne sont pas sans risque et peuvent causer une infection dans certaines circonstances (p. ex. chez les personnes dont la fonction immunitaire est compromise).
1.2 Matières biologiques de groupe de risque 1
Aux fins de la présente ligne directrice, les matières biologiques désignent les microorganismes, les protéines et les acides nucléiques pathogènes ou non pathogènes, ainsi que toute matière biologique (p. ex. des cellules, des tissus, d'autres échantillons) susceptible de contenir des microorganismes, des protéines, des acides nucléiques, d'autres agents infectieux ou des parties de ceux-ci. Les exemples comprennent, sans s'y limiter, les bactéries, les virus, les champignons, les prions, les toxines, les organismes génétiquement modifiés, les acides nucléiques, les échantillons de tissus, les échantillons diagnostiques, les échantillons environnementaux, les vaccins vivants et les isolats d'un agent pathogène ou d'une toxine (p. ex. une culture pure, une suspension, des spores purifiées), qu'ils soient infectieux ou toxiques ou non. Les matières biologiques de GR1 sont définies comme un microorganisme, un acide nucléique ou une protéine qui est soit :
- a) incapable de causer une maladie chez l'humain ou l'animal;
- b) capable de causer une maladie chez l'humain ou l'animal, mais est peu susceptible de le faire.
Les organismes de GR1 qui sont capables de causer des maladies sont considérés comme des agents pathogènes qui présentent un faible risque pour la santé des personnes ou des animaux, et un faible risque pour la santé publique et pour les populations animales. Cependant, les agents pathogènes du GR1 peuvent être opportunistes et menacer la santé des personnes immunodéprimées ou immunosupprimées (p. ex. en raison d'un traitement médical, d'une grossesse, du diabète ou d'autres conditions). Par exemple, Bacillus subtilis, une bactérie du GR1 largement utilisée comme probiotique (c.-à-d. une bactérie vivante ajoutée à la nourriture ou consommée comme supplément pour conférer un bienfait pour la santé de l'hôte), a également été associée à de nombreux cas d'intoxication alimentaire et à d'autres effets négatifs sur la santéNote de bas de page 2,Note de bas de page 3,Note de bas de page 4,Note de bas de page 5,Note de bas de page 6.
La classification des groupes de risque est déterminée par une évaluation des risques associés à l'agent pathogène qui évalue les caractéristiques inhérentes d'un agent biologique, y compris la pathogénicité, la virulence, la communicabilité, la gamme d'hôtes et la disponibilité de traitements prophylactiques ou thérapeutiques efficaces. Les groupes de risque varient du GR1 (risque faible pour la personne et la communauté) au GR4 (risque élevé pour la personne et la communauté). Une liste complète des facteurs de risque liés aux agents pathogènes figure dans la Ligne directrice canadienne sur la biosécurité sur L'évaluation des risques associés à l'agent pathogèneNote de bas de page 7.
Les matières biologiques de GR1 ne sont pas couvertes par la LAPHT, le Règlement sur les agents pathogènes humains et les toxines (RAPHT), la LSA et le Règlement sur la santé des animaux (RSA) en raison du faible risque qu'elles présentent pour la santé publique et la santé animale. Par conséquent, les laboratoires et les autres installations où seulement des matières biologiques de GR1 sont manipulées ou entreposées ne sont pas réglementés par l'Agence de la santé publique du Canada (ASPC) ou l'Agence canadienne d'inspection des aliments (ACIA)Note de bas de page 8,Note de bas de page 9,Note de bas de page 10,Note de bas de page 11. Néanmoins, il demeure important de prendre les précautions nécessaires (p. ex. de bonnes pratiques microbiologiques) pour manipuler ces matières biologiques. En cas de risque accru (p. ex. une personne immunodéprimée travaillant avec un agent pathogène opportuniste du GR1), il peut être envisagé d'utiliser des procédures opérationnelles de niveau de confinement 2 (NC2) ou de déplacer le travail dans une zone de NC2 pour une protection supplémentaire.
Si une matière biologique de GR1 est modifiée et pose désormais un risque plus grand pour les membres du personnel ou l'environnement (c.-à-d. une augmentation de virulence ou pathogénicité, communicabilité, résistance à un traitement préventif ou thérapeutique, ou toxicité d'une toxine), elle devient une matière réglementée et le travail doit être interrompu. La matière réglementée doit être transférée dans une installation d'un niveau de confinement approprié, titulaire d'un permis visant des agents pathogènes et des toxines valide délivré par l'ASPC en vue de la poursuite des activités. Il est également possible de suspendre le travail avec la matière réglementée et de transférer en toute sécurité la matière réglementée au niveau de confinement approprié (p. ex. un NC2 avec un permis) jusqu'à ce qu'une demande soit faite pour que l'installation obtienne un permis visant des agents pathogènes et des toxines de l'ASPC pour manipuler ou entreposer des agents pathogènes ou des toxines de groupe de risque 2, 3 ou 4.
Si une ou plusieurs modifications sont apportées à des matières biologiques de GR1 associées à un agent pathogène d'animaux terrestres désigné par l'ACIA (APAT-DA; terme collectif qui englobe les maladies animales exotiques, les maladies animales émergentes et les agents pathogènes non-indigènes d'animaux sous l'autorité de l'ACIA) ou à tout autre matière biologique entraînant un risque accru pour les animaux ou la communauté animale (c.-à-d. une augmentation de virulence ou pathogénicité, communicabilité, résistance à un traitement préventif ou thérapeutique, ou toxicité d'une toxine), le travail avec la matière doit être interrompu, la matière doit être entreposée en toute sécurité et l'ACIA doit être contactée. L'ACIA évaluera les effets des modifications et déterminera les conditions nécessaires pour permettre la poursuite des travaux avec la matière.
1.3 Comment utiliser la ligne directrice Niveau de confinement 1 : Conception physique et pratiques opérationnelles
La présente ligne directrice décrit les recommandations générales et les considérations relatives à la conception de base des espaces de travail et à la manipulation sécuritaire des matières biologiques de GR1. Ces pratiques recommandées sont fondées sur les risques et les données probantes. Les éléments de conception physique et les pratiques opérationnelles des zones de NC1 décrites dans le présent document sont considérées comme les pratiques exemplaires pour les travaux impliquant des matières biologiques de GR1. Une évaluation locale des risques (ELR), fondée sur les procédures à mettre en œuvre et la matière biologique à manipuler, peut déterminer que certaines des recommandations peuvent être modifiées ou ne s'appliquent pas, selon la situationNote de bas de page 12.
Les sections 2 et 3 décrivent respectivement les éléments de conception physique et les pratiques opérationnelles recommandées. Le format utilisé dans le présent document est semblable à celui utilisé dans la NCB. Les recommandations sont regroupées par sujet dans plusieurs matrices. Les notes explicatives, qui se trouvent sous les recommandations, fournissent des renseignements supplémentaires et des éclaircissements sur l'intention de la recommandation. Différents types d'espaces de travail pour la manipulation de matières biologiques sont décrits, notamment les espaces de travail en laboratoire, les aires de production à grande échelle et les espaces de travail avec des animaux.
Une liste détaillée de toutes les abréviations et de tous les sigles utilisés dans la présente ligne directrice se trouve au début du document. Chaque mot ou terme est écrit au long à sa première utilisation dans la ligne directrice, suivi de l'abréviation entre parenthèses. Après avoir été définie, l'abréviation est utilisée exclusivement dans le reste du document. Un glossaire complet des définitions des termes techniques se trouve à la section 4 du présent document. Les termes définis dans le glossaire apparaissent en caractères gras à leur première utilisation dans la ligne directrice. Une liste complète de références et d'autres ressources est fournie à la section 5. La série de Lignes directrices canadiennes sur la biosécurité peut être consultée pour obtenir des conseils et des détails supplémentaires sur une variété de sujets relatifs à la biosécurité et à la biosûretéNote de bas de page 13.
2. Éléments de conception physique
Pour tous les niveaux de confinement, la conception de l'installation et les mesures d'ingénierie sont établies pour limiter la propagation des matières biologiques. Dans les zones de NC1, cela peut être assez simple, et on y parvient en grande partie en séparant les espaces de travail des endroits publics et des aires administratives environnantes ainsi qu'en établissant des espaces désignés où les matières biologiques peuvent être manipulées dans un espace de travail. Les espaces de travail en laboratoire pour les activités avec des matières biologiques de GR1 ne présentent pas de caractéristiques physiques spécifiques autres que celles qui conviennent à un espace de laboratoire bien conçu et fonctionnel pour la manipulation de ces matières (p. ex. des éviers pour le lavage des mains, des panneaux). Les espaces de travail eux-mêmes sont conçus pour être faciles à nettoyer et à décontaminer. Des dispositifs de sécurité, d'urgence et de sûreté de base sont intégrés pour protéger les membres du personnel, empêcher les animaux de s'échapper et fournir un niveau de contrôle de base des insectes et des animaux nuisibles.
2.1 Éléments généraux de conception physique
Les éléments de conception physique de base recommandés ci-dessous s'appliquent à tout espace de travail de NC1. Cela comprend les espaces de travail en laboratoire, les aires de production à grande échelle et les espaces de travail avec des animaux. Les éléments de conception propres aux aires de production à grande échelle comprennent des considérations pour gérer un déversement ou une fuite provenant d'équipement à système fermé.
Veuillez noter que les éléments suivants ne sont que des recommandations et non des exigences, sauf indication contraire de l'ASPC ou l'ACIA.
Pratiques exemplaires - 2.1 Éléments généraux de conception physique
Les espaces de travail en laboratoire, les aires de production à grande échelle et les espaces de travail avec des animaux sont séparés des endroits publics et des aires administratives par une porte verrouillable.
Une porte est une barrière physique qui protège contre le rejet de matières biologiques en séparant la zone de NC1 (c.-à-d. l'espace « sale » ou contaminé) des endroits publics et des aires administratives (c.-à-d. les espaces « propres » ou non contaminés). Des portes verrouillables constituent une barrière de sûreté de base pour empêcher tout accès non autorisé à la zone de NC1 et pour protéger les matières biologiques de GR1 qui y sont entreposées. Si une porte sert de barrière physique comprenant à la fois un espace « sale » et un espace « propre », des pratiques opérationnelles peuvent être mises en œuvre pour limiter la propagation de la contamination. Lorsque de grandes ouvertures donnent accès à la zone de NC1 (p. ex. un comptoir de réception d'échantillons), des solutions de rechange fermables (p. ex. une porte à enroulement, des volets situés au-dessus du comptoir) peuvent aider à limiter l'accès et contenir le rejet de matières biologiques dans l'espace de travail en cas de déversement.
Les postes réservés au travail de bureau ou au travail à l'ordinateur sont séparés des postes de travail où sont manipulés des animaux et des matières biologiques de GR1 (p. ex. des échantillons, des spécimens). Des itinéraires pour circuler et travailler sont établis et respectés afin de prévenir la propagation de la contamination.
L'identification claire des espaces ou des surfaces moins contaminées (c.-à-d. « propres ») et des espaces plus contaminés (c.-à-d. « sales »), ainsi que la mise en œuvre de procédures pour faciliter les déplacements pendant le travail et la circulation des membres du personnel, de l'équipement, des échantillons et des animaux des espaces « propres » vers des espaces « sales » limitent la propagation de la contamination. Les procédures mises en œuvre pour faciliter les déplacements pendant le travail peuvent comprendre le fait de disposer tout le matériel propre (p. ex. les pipettes, les milieux de culture, les flacons) d'un côté du poste de travail, et les cultures et les déchets de l'autre. Cela peut comprendre la séparation des espaces « propres » réservés à la rédaction de rapports et autre paperasse des espaces ou des surfaces où la matière est manipulée au moyen d'une cloison physique (p. ex. un écran anti-éclaboussures, une salle distincte) ou en les plaçant à une distance sécuritaire afin de réduire au minimum le risque de contaminer les fournitures de bureau (p. ex. les documents, les carnets) et l'équipement (p. ex. les ordinateurs) qui ne peuvent pas être facilement décontaminés.
Les fenêtres qui peuvent être ouvertes sont équipées d'un dispositif de base de contrôle des insectes et des animaux nuisibles.
La mise en place de mesures de contrôle de base pour les insectes et les animaux nuisibles sur les fenêtres, tout particulièrement au niveau des fenêtres qui s'ouvrent directement sur l'extérieur, peut offrir une protection contre l'entrée d'animaux de petite taille et d'insectes dans la zone de NC1. Prévenir l'entrée et la sortie d'animaux et d'insectes offre une protection contre le rejet de matières biologiques à l'extérieur de la zone de NC1. Le contrôle des insectes et des animaux nuisibles peut se faire par l'installation de moustiquaires qui sont maintenus en bon état et en fermant les fenêtres. Si aucune mesure de contrôle des insectes et des animaux nuisibles n'est en place (p. ex. la moustiquaire est endommagée ou absente), la fenêtre peut être gardée fermée en permanence (p. ex. à l'aide de ruban adhésif, de vis, de clous).
Un espace est prévu pour l'entreposage de l'équipement de protection individuel (EPI) dédié qui a été porté et qui peut être réutilisé.
Le fait de disposer d'un espace réservé à l'EPI qui a été porté et qui peut être réutilisé permet de séparer physiquement cet EPI des vêtements personnels (p. ex. des manteaux, des chapeaux, des bottes) ou de l'EPI inutilisé, ce qui prévient la propagation de la contamination et le rejet de matières biologiques dans des espaces situés à l'extérieur de la zone de NC1. Il est préférable que l'espace réservé à l'EPI qui a été porté et qui peut être réutilisé soit situé près de l'endroit où cet EPI est enfilé et retiré. Les crochets, les casiers, les étagères, les compartiments de rangement, les bacs ou les espaces dans les vestiaires réservés sont des exemples d'espace d'entreposage réservé à l'EPI qui a été porté et qui peut être réutilisé. Une ELR pourrait aider à déterminer l'emplacement et la quantité d'espace réservé nécessaire pour entreposer l'EPI qui a été porté et qui peut être réutilisé, prévenir la contamination croisée et permettre aux membres du personnel de mettre en œuvre les procédures de sortie en toute sécurité (p. ex. un nombre suffisant de crochets pour empêcher l'empilement de plusieurs sarraus les uns par-dessus les autres).
Selon la fonction de la zone, les surfaces telles que les planchers, les plafonds, les murs, les portes, les cadres, les paillasses et le mobilier sont :
- a) nettoyables;
- b) non absorbants;
- c) résistants aux dommages physiques;
- d) résistants aux dommages causés par les produits et procédures de décontamination.
Pour permettre le nettoyage et la décontamination, des matériaux et des revêtements de surface nettoyables et résistants (p. ex. de la peinture, de l'époxy) qui sont compatibles avec un produit d'étanchéité résistant au rétrécissement offrent une protection contre les contraintes physiques associées aux activités menées dans la zone de NC1. Les activités peuvent comprendre des décontaminations répétées (p. ex. chimiques, gazeuses), des lavages à haute pression fréquents dans les zones réservées aux animaux, des contraintes physiques (p. ex. les impacts, la chaleur, de l'équipement reposant sur des surfaces, les cages d'animaux) et des égratignures. Le niveau de protection de surface nécessaire est déterminé par la fonction de la zone de NC1 et les activités qui y sont menées. Par exemple, les planchers d'un espace de travail en laboratoire pourraient ne nécessiter des procédures de décontamination qu'à la suite d'incidents (p. ex. un déversement). Des exemples de matériaux non absorbants comprennent l'acier inoxydable, les revêtements à base de résine époxy ou les stratifiés de plastique résistants aux produits chimiques pour les paillasses ainsi que l'uréthane ou le vinyle pour les tabourets et les chaises.
Les surfaces qui pourraient entrer en contact avec des matières biologiques de GR1 sont continues avec les matériaux adjacents et les matériaux qui se chevauchent.
La continuité des surfaces (p. ex. les surfaces de travail avec les prises électriques, l'alimentation en gaz et les autres services installés sur la surface) assure une barrière continue conçue pour empêcher le dépôt des liquides et des aérosols contaminés sur des surfaces difficiles à accéder et à décontaminer. Cela facilite également les procédures de nettoyage et de décontamination chimique après un déversement, une éclaboussure ou tout autre type d'événement qui entraîne la contamination des surfaces.
Des lavabos sont installés pour faciliter le lavage des mains.
Le lavage des mains empêche la propagation de la contamination à l'intérieur et à l'extérieur de la zone de NC1. Si les lavabos ne sont pas facilement disponibles, une ELR peut déterminer que les mains peuvent être décontaminées à l'aide d'un désinfectant pour les mains approprié et/ou les mains peuvent être lavées à un lavabo disponible à l'extérieur de la zone où les activités sont menées.
Les caractéristiques de conception des aires de production à grande échelle empêchent le rejet de fluides contenant des matières biologiques viables dans les égouts sanitaires ou toute autre voie de sortie de l'installation.
Des caractéristiques de conception, comme des siphons de sol surélevés ou munis d'un bouchon, peuvent être incorporées dans les aires de production à grande échelle afin de prévenir un rejet de matières biologiques dans les égouts sanitaires ou dans des espaces situés en dehors de la zone de NC1 en cas de fuite ou de déversement. Les caractéristiques de conception peuvent également comprendre des digues, des barrages, des bermes et des puits pour contenir le plus grand volume d'une fuite ou d'un déversement de liquides de production à grande échelle pouvant survenir de manière réaliste selon une ELR.
Là où la pièce ne sert pas de confinement primaire pour des activités de production à grande échelle avec des matières biologiques de GR1, l'équipement de procédé, les systèmes fermés et les autres dispositifs de confinement sont conçus pour empêcher le rejet de matières biologiques de GR1.
L'installation de filtres à haute efficacité pour les particules de l'air (HEPA) aux points de prélèvement et sur les évents et l'utilisation d'un boîtier ventilé dont l'air est évacué par un système de filtration HEPA pour renfermer un dispositif de confinement primaire (p. ex. une chambre de confinement primaire) sont des exemples de mécanismes qui peuvent prévenir le rejet de matières biologiques. Le fait d'avoir des mécanismes supplémentaires (p. ex. des vannes de secours) pour les dispositifs de confinement primaire, l'équipement de procédé et les systèmes fermés utilisés pour les activités de production à grande échelle assure une protection redondante contre un rejet de matières biologiques de GR1 non traitées dans la zone de NC1 ou dans le réseau d'égouts sanitaires.
2.2 Éléments de conception physique supplémentaires propres aux espaces de travail avec des animaux
Les éléments de conception physique suivants s'appliquent aux espaces de travail avec des animaux de NC1, qui comprennent les salles où les animaux sont hébergés, les box et les salles de nécropsie, et peuvent également comprendre les corridors associés. Ces pratiques exemplaires s'appuient sur les pratiques exemplaires générales pour les espaces de travail en laboratoire ainsi que sur les considérations de base en matière de conception établies par le Conseil canadien de protection des animaux dans ses Lignes directrices sur les animaleriesNote de bas de page 14.
Veuillez noter que les éléments suivants ne sont que des recommandations et non des exigences, sauf indication contraire de l'ASPC ou l'ACIA.
Pratiques exemplaires - 2.2 Éléments de conception physique supplémentaires propres aux espaces de travail avec des animaux
Les espaces de travail en laboratoire sont situés à l'extérieur des pièces où sont hébergés les animaux.
La séparation des espaces de travail en laboratoire et des espaces où sont hébergés les animaux (c.-à-d. des box, des salles animalières) permet de prévenir la contamination de matières de travail qui ne sont pas associées au travail avec des animaux. Pour ce faire, la zone de confinement d'animaux peut être conçue de manière à comprendre un espace de travail en laboratoire pour les activités qui n'impliquent pas directement les animaux (p. ex. la préparation d'échantillons ou d'inoculants).
Les cages et les pièces où sont hébergés ou manipulés les animaux sont conçus de manière à prévenir la fuite des animaux.
Il est important de prévenir la fuite des animaux pour protéger la sécurité des membres du personnel et des animaux, et pour prévenir le rejet de matières biologiques ou d'animaux potentiellement infectés.
Une aire d'entreposage au froid (p. ex. une chambre froide) ou un équipement d'entreposage au froid (p. ex. un réfrigérateur, un congélateur) sont fournis à l'intérieur ou tout près de la salle de nécropsie, là où la conception comprend une salle de nécropsie dédiée, afin de minimiser la putréfaction des carcasses d'animaux entreposées temporairement.
L'équipement d'entreposage au froid placé à l'intérieur ou tout près de la salle de nécropsie est important pour assurer une protection contre la putréfaction des carcasses d'animaux entreposées temporairement en attente de nécropsie ou d'élimination.
Selon la fonction de la zone, les planchers et les murs sont résistants aux dommages causés par de multiples décontaminations et lavages à haute pression.
Il est nécessaire de choisir des revêtements de surfaces (c.-à-d. les murs, les plafonds, les planchers) et des cabinets appropriés pour les espaces de travail avec des animaux de NC1 afin de faciliter l'entretien, le nettoyage et la décontamination des surfaces dans l'espace de travail. Les revêtements de surfaces aident également à protéger contre les contraintes physiques associées aux activités menées régulièrement dans l'espace de travail, telles que la décontamination répétée et le nettoyage à haute pression fréquent.
Selon la fonction de la zone, les planchers et les murs des espaces de travail avec des animaux, y compris les salles de nécropsie et les corridors, sont en mesure de supporter les charges prévues (p. ex. le poids lourd des animaux et de l'équipement pour les cages).
La bonne conception du plancher (y compris les solives de plancher, l'espacement et les poutres de plancher triangulées) et l'utilisation de matériaux appropriés permettent au plancher de résister aux dommages et de supporter les charges prévues par des animaux lourds ou de l'équipement pour les cages, selon le cas.
Des espaces dédiés au lavage des cages sont recommandés pour faciliter le nettoyage.
L'espace dédié au lavage des cages est assez spacieux pour contenir l'accumulation d'équipement sale tout au long de la journée de travail et a une ventilation adéquate afin de maintenir un milieu sécuritaire pour l'activité physique humaine et prévenir la propagation de vapeur et de contaminants.
3. Pratiques opérationnelles
Les pratiques opérationnelles font référence aux mesures administratives et aux procédures mises en place pour prévenir l'exposition des membres du personnel et le rejet de matières biologiques dans l'environnement.
3.1 Bonnes pratiques microbiologiques
L'expression « bonnes pratiques microbiologiques » décrit un ensemble fondamental de pratiques et de techniques sécuritaires établies dans les laboratoires de microbiologieNote de bas de page 15,Note de bas de page16. Ces pratiques visent à minimiser la propagation de la contamination générée par la matière manipulée et à protéger la matière contre la contamination provenant de l'environnement afin de préserver sa qualité ou sa pureté. En même temps, les bonnes pratiques microbiologiques offrent un niveau de protection de base pour les membres du personnel de laboratoire et l'environnement contre les matières biologiques manipulées.
Les bonnes pratiques microbiologiques constituent la base sur laquelle reposent toutes les pratiques de biosécurité à des niveaux de confinement plus élevés. En raison du faible niveau de risque associé aux matières biologiques de GR1, il est généralement considéré comme sécuritaire d'effectuer la plupart des procédures sur une paillasse.
Veuillez noter que les éléments suivants ne sont que des recommandations et non des exigences, sauf indication contraire de l'ASPC ou l'ACIA.Pratiques exemplaires - 3.1 Bonnes pratiques microbiologiques
Tout contact du visage ou des muqueuses avec des articles contaminés ou potentiellement contaminés est évité.
Des activités telles que pipetter avec la bouche, mâcher l'extrémité d'un crayon, manger, boire, se mordre les ongles, appliquer des produits cosmétiques, insérer des écouteurs dans les oreilles, insérer ou retirer des lentilles cornéennes et toute autre activité impliquant le contact possible entre un article quelconque à l'intérieur de la zone de NC1 (y compris les mains) et les muqueuses des yeux, du nez, des oreilles et de la bouche sont évitées afin de réduire le risque d'exposer les muqueuses à des articles qui sont contaminés ou possiblement contaminés par une matière biologique de GR1.
Les cheveux qui pourraient être contaminés sont retenus (p. ex. attachés ou fixés en arrière) ou recouverts (p. ex. par un couvre-chef ou couvre-barbe).
Le fait d'attacher ou de recouvrir les cheveux (y compris la barbe) réduit le risque de contamination des cheveux par un contact accidentel avec les gants, les mains, les échantillons, les contenants, l'équipement ou les surfaces, ainsi que lors d'activités dans des pièces où des matières biologiques de GR1 sont manipulées.
Les bijoux qui pourraient devenir contaminés ou qui pourraient compromettre l'EPI sont retirés ou couverts.
Les bijoux (p. ex. des bagues, de longs colliers) peuvent être contaminés ou nuire au nettoyage et à la décontamination de la peau sous les bijoux (p. ex. pendant le lavage des mains). Les bijoux peuvent également endommager l'EPI (p. ex. les bagues et les montres peuvent déchirer les gants). Le fait de retirer les bijoux et de les laisser à l'extérieur de l'espace de travail permet aussi d'éviter que les bijoux aient à être soumis à des procédures de décontamination avant leur retrait de la zone de NC1. Comme pratique exemplaire, une ELR peut être utilisée pour déterminer si certains bijoux (p. ex. un anneau à bande plate, des petites boucles d'oreille) peuvent être portés dans la zone de NC1 si le risque est minime qu'ils interfèrent avec ou endommagent l'ÉPI, qu'ils deviennent contaminés (p. ex. si ceux-ci sont couverts par l'ÉPI) ou s'ils sont peu susceptibles d'être exposés à des matières contaminées ou à des aérosols (p. ex. les bijoux se trouvent dans le nez ou la bouche).
Les lésions ouvertes, les coupures et les égratignures sont couvertes de manière à prévenir une exposition.
Une peau intacte offre une protection contre l'infection et l'intoxication. Toute rupture de l'intégrité de la peau (p. ex. une lésion, une coupure, une égratignure, une éruption cutanée) peut servir de porte d'entrée pour les matières biologiques de GR1 et donc doit être protégée à l'aide d'un bandage ou de tout autre pansement ou couverture convenable avant d'entrer dans la zone de NC1. Les lésions, les coupures et les égratignures qui surviennent à l'intérieur de la zone de NC1 constituent des incidents qui doivent être signalés à l'autorité interne appropriée. Le retrait et l'élimination du pansement ou couverture en quittant la zone de NC1 aide à prévenir la propagation involontaire de matières biologiques.
Les postes de travail et les espaces de travail, y compris les planchers, sont propres en tout temps avec les éléments suivants réduits au minimum :
- a) les encombrements et les obstructions;
- b) le matériel excédentaire ou non requis;
- c) le matériel qui est difficile à décontaminer.
Un environnement de travail propre et dégagé, avec peu d'encombrement, permet la décontamination appropriée de la zone de NC1. Cela réduit également le risque de glisser, de trébucher ou de tomber, ainsi que les risques de collision, qui pourraient possiblement mener à des incidents d'exposition ou à la propagation de la contamination. L'entreposage du matériel supplémentaire à l'extérieur de la zone de NC1 protège également celui-ci contre la contamination et le besoin de subir des procédures de décontamination.
Les portes et les autres ouvertures des espaces de travail, y compris des salles de nécropsie, sont gardées fermées.
Les portes et les autres ouvertures (p. ex. les fenêtres de réception des échantillons) sont gardées fermées pour prévenir le rejet d'air possiblement contaminé (p. ex. de toxines aérosolisées) hors de pièces qui servent de confinement primaire (p. ex. un box) ou dans l'éventualité d'un incident (p. ex. un déversement), et prévenir la fuite d'un animal. Le matériel de laboratoire est entreposé de façon sécuritaire et éloigné des portes et des espaces achalandés afin de réduire le risque d'un incident.
L'accès aux espaces de travail est accordé seulement aux membres du personnel autorisé et aux visiteurs autorisés.
Le fait de limiter ou restreindre l'accès à la zone de NC1, à la salle animalière, au box, à la salle de nécropsie, à la salle abritant un système de décontamination des effluents et aux endroits avec des services mécaniques et électriques de support (p. ex. des panneaux électriques, la cabine de machinerie, les aires de commande du système de chauffage, ventilation et air climatisé) aux personnes autorisées permet de protéger la sécurité des personnes qui entrent dans ces endroits et de garder les matières biologiques et les ressources en lieu sûr. L'autorisation d'accès offre un mécanisme permettant de vérifier que toutes les personnes qui entrent dans la zone de NC1 (p. ex. les membres du personnel, les visiteurs, les membres du personnel d'entretien et de nettoyage) satisfont aux exigences relatives à l'accès, y compris le fait d'avoir réussi la formation exigée (c.-à-d. le niveau de formation approprié selon l'évaluation des besoins en matière de formation pour les tâches effectuées).
Tous les membres du personnel, les visiteurs, les bénévoles et les stagiaires portent l'EPI approprié à l'intérieur de l'espace de travail.
L'EPI est exclusivement porté et entreposé dans l'espace de travail de NC1, y compris :
- des chaussures qui recouvrent entièrement le pied, sans talons ou à talons plat;
- de l'EPI, comme des sarraus, des tabliers, des gants ou des combinaisons;
- de l'équipement de protection pour les yeux, comme des lunettes, lorsqu'il y a un risque d'exposition aux éclaboussures;
- une protection complète du visage (p. ex. un écran facial) lorsqu'il y a un risque d'éclaboussures ou que des objets soient projetés en l'air.
Les vêtements et les effets personnels sont rangés à l'écart de l'EPI dédié et loin des espaces de travail.
Le fait d'entreposer des vêtements personnels (p. ex. des vêtements d'extérieur comme des manteaux ou des foulards, des vêtements de ville, des sous-vêtements), des effets personnels et de l'EPI propre séparément de l'EPI dédié qui a été porté dans l'espace de travail où les matières biologiques de GR1 sont manipulées (c.-à-d. potentiellement contaminé) empêche la contamination de ces articles. Les effets personnels et autres articles destinés à un usage personnel (p. ex. un sac à dos, un sac à main, un téléphone cellulaire) sont également tenus à l'écart des espaces où les matières biologiques de GR1 sont manipulées ou entreposées, ce qui protège les personnes contre l'exposition et prévient la propagation de la contamination à l'extérieur de la zone de NC1. Les vêtements personnels, les effets personnels et l'EPI propre peuvent être entreposés à l'extérieur ou à l'intérieur de la zone de NC1 dans des vestiaires réservés. Lorsque des vêtements personnels, des effets personnels, de l'EPI propre et de l'EPI utilisé sont entreposés à l'intérieur de la zone de NC1 ou dans le même sas, ils peuvent être physiquement ou spatialement séparés pour prévenir la contamination. Par exemple, l'installation de crochets ou de casiers sur des murs opposés, ou de chaque côté de la porte d'entrée peut être appropriée si les procédures opératoires normalisées (PON) décrivent comment la séparation est maintenue (p. ex. un côté est réservé aux vêtements et aux effets personnels tandis que l'autre est réservé à l'EPI utilisé) et préviennent la contamination croisée à la sortie.
Les procédures sont effectuées de manière à minimiser le risque de produire des éclaboussures et des aérosols.
Le port de l'EPI approprié (p. ex. des lunettes de sécurité) ou la modification des procédures peut minimiser le risque de produire des éclaboussures ou des aérosols. La nécessité d'utiliser un dispositif de confinement primaire peut être basée sur des ELR qui prennent en considération les activités en cours (p. ex. la probabilité de produire un aérosol infectieux), les quantités de matières manipulées (c.-à-d. les grands volumes ou les concentrations élevées) et les caractéristiques inhérentes aux matières biologiques de GR1. Une ELR pourrait également déterminer qu'une matière très volatile (p. ex. les toxines sous forme de poudre, les spores fongiques) doive être manipulée dans l'air immobile afin d'éviter la propagation de la contamination.
Les membres du personnel se lavent les mains après avoir manipulé des matières biologiques de GR1 si des gants ne sont pas portés ou immédiatement après le retrait des gants, et avant de quitter l'espace de travail.
Le lavage des mains est effectué conformément aux PON immédiatement avant de quitter l'espace de travail en laboratoire, la salle animalière, le box ou la salle de nécropsie afin d'empêcher que les mains soient contaminées en sortant. Cela comprend le lavage de toutes les surfaces de la peau qui pourraient avoir été exposées à des matières biologiques de GR1 (p. ex. les avant-bras qui ne sont pas couverts par de l'EPI). Une ELR peut déterminer qu'il est sécuritaire de retirer les gants à l'intérieur d'une salle ou d'un endroit à l'intérieur de la zone de NC1 et de se laver les mains à un lavabo à proximité de la sortie de la zone de NC1. De manière semblable, il peut être acceptable de se laver les mains à un poste de travail situé loin de la sortie. Si les lavabos ne sont pas facilement accessibles, une ELR peut déterminer que les mains peuvent être décontaminées à l'aide d'un désinfectant pour les mains (dont l'efficacité contre les matières biologiques de GR1 utilisées est confirmée) et lavées à un lavabo qui est accessible à l'extérieur de la zone de NC1.
L'EPI dédié et l'EPI propre à l'activité est retiré (c.-à-d. enlevé) de manière à réduire au minimum la contamination de la peau, des cheveux et des vêtements personnels, et est entreposé ou jeté à l'intérieur de l'espace de travail. Les gants jetables utilisés pour manipuler les matières biologiques de GR1 sont jetés après chaque utilisation.
Le retrait de l'EPI dédié et de l'EPI propre à l'activité dans un ordre particulier et de manière à prévenir la contamination de la peau, des cheveux et des vêtements personnels (comme il est décrit dans les PON) réduit la possibilité de créer des aérosols et que l'EPI contaminé entre en contact avec la peau, les cheveux ou les vêtements personnels non protégés. Le fait de réduire ces risques protège les membres du personnel contre l'exposition. Une fois retiré, l'EPI est entreposé ou jeté à l'intérieur de la zone de NC1 pour prévenir la propagation possible de contamination.
Des pratiques de travail sécuritaires pour la manipulation des objets pointus ou tranchants sont élaborées et suivies rigoureusement pour prévenir les blessures et l'exposition, et comprennent le fait :
- d'éviter activement l'utilisation d'aiguilles, de seringues, d'objets pointus ou tranchants et d'objets de verre dans la mesure du possible ou sélectionner des solutions de rechange appropriées (p. ex. des dispositifs d'objets pointus ou tranchants de conception sécuritaire);
- de s'abstenir de plier et de couper des aiguilles, de les casser, de les retirer des seringues ou de remettre le capuchon sur celles-ci;
- de recueillir et enlever des objets pointus ou tranchants (p. ex. du verre brisé) à l'aide d'une brosse et d'un porte-poussière ou de pinces;
- de jeter les objets pointus ou tranchants utilisés (p. ex. des lames de scalpel, des seringues) et les autres objets pointus ou tranchants (p. ex. du verre brisé, des embouts de pipette, des pipettes brisées) dans des contenants à déchets pour objets pointus ou tranchants étanches, résistants aux perforations et munis de couvercles.
Les aiguilles, les seringues, les objets tranchants et les objets de verre peuvent causer une perforation ou une blessure, et possiblement mener à l'inoculation d'un membre du personnel avec des matières biologiques. Les activités comme plier ou couper les aiguilles, les retirer des seringues ou remettre le capuchon sur celles-ci comportent un risque de blessure encore plus élevé et devraient être évitées. Lorsque cela n'est pas possible, le respect rigoureux des PON (p. ex. se servir de forceps pour plier l'aiguille ou remettre le capuchon) peut protéger les membres du personnel. Lors de l'élimination des objets pointus ou tranchants, les contenants à déchets doivent être adaptés à l'usage afin de prévenir la perforation du contenant, ce qui pourrait causer des fuites ou des blessures et entraîner une exposition des membres du personnel de la zone de confinement ou des personnes qui manipulent les déchets. Si les déchets pointus ou tranchants doivent être stérilisés à l'autoclave, les contenants doivent être résistants aux températures auxquelles ils seront exposés.
3.2 Gestion du programme de biosécurité
L'élaboration de programmes et de politiques de biosécurité à l'échelle de l'installation est fondamentale pour la mise en œuvre de pratiques de travail sécuritaires et l'amélioration du rendement en matière de sécurité. Un programme de biosécurité est créé pour atténuer les dangers identifiés par une évaluation globale des risques de l'installation et de ses activités générales. Les ELR, quant à elles, sont menées pour identifier les risques associés à des activités spécifiques au site, pour lesquelles des pratiques de travail sécuritaires sont développées et intégrées dans des PONNote de bas de page12. Même avec des matières biologiques de GR1, ces évaluations des risques sont recommandées afin d'identifier les dangers et d'élaborer des stratégies pour atténuer les risques. Les ELR pour les matières biologiques de GR1 peuvent être simples et, dans certains scénarios, il peut n'y avoir aucun risque significatif. Par exemple, s'il existe un risque de contamination des mains, le port de gants peut être recommandé; cependant, si la matière manipulée est considérée comme totalement sécuritaire à manipuler (p. ex. de la moisissure de pain, une culture de yogourt), le port de gants n'est pas nécessaire du point de vue de la biosécurité. En revanche, l'ELR pourrait identifier un risque spécifique à un travailleur particulier (p. ex. une personne immunodéprimée ou immunosupprimée).
La formation vise à fournir une compréhension rudimentaire de la biosécurité et de la sécurité en général. Afin de favoriser un milieu de travail sécuritaire et de protéger les travailleurs, il est également important d'établir un programme de formation et d'éducation des membres du personnel (de préférence avant de commencer à travailler avec les matières biologiques de GR1). Ce programme couvre les risques potentiels présents dans leur environnement de travail, les principes de base de la biosécurité, l'utilisation correcte de l'EPI et de l'équipement de laboratoire, ainsi que les pratiques et techniques de travail appropriées et sécuritaires. De plus, un plan d'intervention d'urgence (PIU) établit des procédures que les membres du personnel doivent suivre dans diverses situations d'urgence. Les politiques relatives aux inspections régulières de l'espace de travail par les membres du personnel sont importantes pour l'identification en temps opportun des défauts et de la détérioration des surfaces, des installations et des équipements présentant un risque d'exposition pour les membres du personnel ou un risque de rejet de matières biologiques dans l'environnement. De plus amples renseignements sur ces sujets sont disponibles dans la série de Lignes directrices canadiennes sur la biosécuritéNote de bas de page13.
La taille, la structure et la complexité d'une organisation déterminent qui est responsable de l'élaboration et de la mise en œuvre du programme de biosécurité, y compris les évaluations globales et locales des risques. Par exemple, dans une grande institution telle qu'une université, l'évaluation globale des risques est souvent effectuée par la haute direction en collaboration avec l'agent de la sécurité biologique, tandis que l'évaluation locale des risques peut être effectuée par les membres du personnel de laboratoire et/ou le chercheur principal. Dans les petites organisations travaillant avec des matières biologiques de GR1, la gestion du programme de biosécurité et des installations peut être une responsabilité partagée entre les membres du personnel de laboratoire et les membres du personnel administratif.
Veuillez noter que les éléments suivants ne sont que des recommandations et non des exigences, sauf indication contraire de l'ASPC ou l'ACIA.
Pratiques exemplaires - 3.2 Gestion du programme de biosécurité
Un programme de biosécurité répondant aux besoins particuliers de l'installation en matière de biosécurité est élaboré, documenté, mis en œuvre, tenu à jour, évalué et amélioré au besoin pour superviser les pratiques de sécurité.
Un programme de biosécurité permet la mise en œuvre efficace et l'application continue de pratiques relatives à la biosécurité conformément aux recommandations réglementaires et aux politiques de biosécurité d'une organisation. Le programme de biosécurité est conçu afin de promouvoir une culture de biosécurité, d'atténuer tous les risques identifiés au moyen d'évaluations des risques et d'élaborer des plans et des programmes (p. ex. la formation, l'enquête sur un incident, la validation et vérification, la création de PON, les documents et les registres). Le programme de biosécurité pourrait accompagner d'autres programmes de sécurité ou être intégrés dans ces derniers (p. ex. santé et sécurité au travail, sécurité chimique, sécurité radiologique).
Un manuel de biosécurité est élaboré, tenu à jour et communiqué aux membres du personnel autorisé, et comprend les éléments suivants :
- les politiques, les programmes et les plans institutionnels en matière de biosécurité;
- les stratégies d'atténuation appropriées identifiées par les évaluations globales des risques, les ELR et les évaluations des risques de biosûreté;
- un PIU;
- les PON sur les pratiques de travail sécuritaires pour chaque tâche impliquant des matières biologiques de GR1, fondées sur les dangers identifiés par les ELR.
Le manuel de biosécurité est essentiel afin de promouvoir la biosécurité et la biosûreté chez les membres du personnel qui se trouvent à l'intérieur et à l'extérieur de la zone de NC1. Il peut comprendre des informations sur les politiques de biosécurité et de biosûreté, ainsi que sur la fonction du programme, et peuvent présenter aux membres du personnel un aperçu général des objectifs de biosécurité et de biosûreté de l'organisation. Il peut également comprendre les renseignements propres à une zone de NC1, y compris une description de la conception physique et du fonctionnement de la zone de NC1 et des systèmes de confinement pour situer les PON dans leur contexte (p. ex. les procédures d'entrée et de sortie). Un plan de communication peut être mis en œuvre afin d'informer les membres du personnel au sujet de renseignements nouveaux ou mis à jour, ainsi que l'endroit où l'on puisse trouver ces derniers. Les renseignements peuvent être contenus dans un document unique en format papier ou électronique ou dans une collection de documents distincts. Lorsque des renseignements liés à plusieurs éléments du programme de biosécurité se trouvent dans des documents distincts, un document central (p. ex. une table des matières) peut permettre un accès rapide et facile à tous les renseignements essentiels.
Le choix de l'EPI approprié pour une tâche donnée, un espace de travail ou une zone de NC1 est déterminé par une ELR.
L'utilisation ou le port d'EPI dédié et d'EPI propre à l'activité protège les personnes contre une exposition et empêche le rejet de matières biologiques hors de la zone de NC1, tel que déterminé par une ELR. Des exemples d'EPI comprennent les sarraus, les tabliers, les blouses ne s'ouvrant pas à l'avant, les combinaisons (p. ex. pour l'utilisation à l'intérieur d'un espace de travail avec des gros animaux de NC1), une protection des yeux ou du visage (p. ex. des lunettes de sécurité, un écran facial) lorsqu'il y a un risque d'exposition à des éclaboussures ou à des objets projetés et les chaussures dédiées (p. ex. des bottes, des chaussures) ou les chaussures de protection supplémentaires (p. ex. des couvre-chaussures, des surchaussures) lorsque les planchers peuvent être contaminés (p. ex. dans les box, les salles de nécropsie).
Des procédures sont en place et comprennent des précautions, telles que déterminées par une ELR, pour l'entreposage ou le déplacement des matières biologiques de GR1 pour qu'elles ne soient pas échappées et pour prévenir une fuite, un déversement ou un événement semblable.
Les procédures pour prévenir les fuites, les déversements ou que des matières soient échappées, ou pour contenir les matières biologiques de GR1 lorsque ces événements surviennent, protègent les membres du personnel contre les incidents d'exposition et empêchent un rejet de matières biologiques de GR1. Ceci comprend les procédures pour l'entreposage des matières (y compris les déchets) et le déplacement des matières à l'intérieur d'un édifice. Les procédures (p. ex. l'utilisation de chariots, de contenants fermés) sont fondées sur des ELR qui prennent en considération le type de matières déplacées ou entreposées, les risques associés à ces matières (p. ex. des volumes importants de matières, qu'elles soient contenues dans un seul ou plusieurs récipients) et les endroits dans l'édifice où les incidents (p. ex. des collisions, des accrochages) sont plus susceptibles de se produire.
Un PIU, fondé sur une évaluation globale des risques et sur des ELR, est élaboré et tenu à jour. Le PIU comprend les coordonnées à utiliser en cas d'urgence et décrit les procédures pour :
- les accidents et les incidents;
- les urgences médicales;
- les déversements chimiques et biologiques;
- la fuite d'un animal (le cas échéant);
- la déclaration des incidents aux membres du personnel interne clé;
- les enquêtes et les suivis sur les incidents de biosécurité et de biosûreté;
- la mise en œuvre de mesures visant à atténuer les risques futurs.
Un PIU complet permet aux membres du personnel de réagir rapidement à des situations d'urgence. Il énonce les procédures que les membres du personnel doivent suivre pour intervenir dans diverses situations d'urgence afin de protéger leur santé et leur sécurité, empêcher le rejet ou la propagation de matières biologiques de GR1 et pour maintenir la sûreté des biens connexes (p. ex. des renseignements sensibles) entreposés à l'intérieur et à l'extérieur de la zone de NC1. Le PIU est examiné et mis à jour à une fréquence déterminée par l'organisation (p. ex. au cours d'un examen de routine du programme de biosécurité, à la suite de toute modification apportée au programme de biosécurité).
Un programme de formation, fondé sur une évaluation des besoins en matière de formation, est élaboré, documenté, tenu à jour, évalué et amélioré au besoin afin de sensibiliser les membres du personnel à tous les aspects pertinents au travail effectué et comprend :
- des PON et les éléments pertinents du manuel de biosécurité;
- les dangers possibles associés aux matières biologiques de GR1 manipulées;
- les précautions nécessaires à prévenir l'exposition aux matières biologiques ou leur rejet;
- l'utilisation et le fonctionnement adéquat de l'équipement de laboratoire;
- les techniques de contention et de manipulation pour le travail avec des animaux;
- les procédures à suivre en cas d'urgence.
Les membres du personnel sont formés et démontrent leurs connaissances et leurs compétences dans les éléments pertinents du programme de formation établi avant de travailler de manière indépendante avec des matières biologiques de GR1.
Une évaluation des besoins en matière de formation peut être utilisée au moment de l'élaboration initiale d'un programme de formation pour déterminer les principaux éléments du programme de formation, y compris les objectifs, le contenu, les groupes cibles, la stratégie de mise en œuvre et les cycles de perfectionnement. Des formations complémentaires ou des formations de perfectionnement peuvent être élaborées au fil du temps, en fonction du processus d'examen, des compétences et de l'expérience des membres du personnel, des incidents ou des modifications apportées au programme de biosécurité.
Un mécanisme est mis en œuvre pour prévenir, détecter et intervenir en cas de problème de contrôle des insectes et des animaux nuisibles.
L'entrée et la sortie des insectes et des animaux nuisibles peuvent entraîner le transfert et la propagation involontaires de matières biologiques de GR1 en dehors de la zone de NC1. Un mécanisme (p. ex. une PON, un dispositif) pour détecter la présence d'insectes et d'animaux nuisibles permet une intervention rapide afin d'empêcher leur entrée et leur sortie de la zone de NC1. Lorsque les insectes et les animaux nuisibles peuvent constituer un problème, des mesures de contrôle de base pour les insectes et les animaux nuisibles comprennent des moustiquaires en bon état qui sont bien installés dans les fenêtres, des pièges à des endroits stratégiques et des plinthes brosses au bas des portes.
Des inspections de l'espace de travail sont effectuées et documentées par les membres du personnel pour déceler tout défaut, lacune et détérioration; le cas échéant, des mesures correctives sont mises en œuvre et les registres sont conservés.
Les défauts, les lacunes ou les traces de détérioration à l'intérieur d'un espace de travail comprennent les éléments physiques (p. ex. un équipement défectueux ou un mauvais éclairage, de la peinture ou des planchers fissurés ou écorchés, des paillasses ébréchées ou usées) et les éléments opérationnels (p. ex. le non-respect des procédures d'entrée). Ces éléments peuvent ne pas être remarqués par les membres du personnel lors du fonctionnement normal (c.-à-d. lors des activités quotidiennes); par conséquent, il est de bonne pratique d'effectuer des inspections de l'espace de travail, y compris des surfaces, des planchers, des murs, des plafonds et de l'équipement. Lorsque des lacunes sont identifiées, les mesures correctives sont mises en œuvre dans un délai raisonnable. Le fait de documenter les processus utilisés (p. ex. ce qui a été vérifié et le critère réussite/échec) et les résultats sert à prouver que l'espace de travail et l'équipement fonctionnent comme prévu et tels qu'ils ont été conçus, que les essais ont été effectués lorsqu'exigés (p. ex. une validation d'autoclave) et que les mesures correctives ont été mises en œuvre dans un délai raisonnable (c.-à-d. quelles mesures correctives, quand et comment elles ont été mises en œuvre).
Les dispositifs de confinement primaire utilisés pour les activités de production à grande échelle sont inspectés visuellement afin de confirmer leur intégrité.
Les dispositifs de confinement primaire (p. ex. l'équipement de procédé, les systèmes fermés, les godets et les rotors scellés des centrifugeuses) sont mis à l'essai pour confirmer qu'ils fonctionnent comme prévu afin de prévenir le rejet de matières biologiques de GR1 et les incidents d'exposition découlant de la défaillance de l'équipement. Cette évaluation comprend des essais pour les filtres HEPA lorsque ceux-ci sont présents. Les filtres HEPA qui ne peuvent pas être soumis aux essais (p. ex. les petits filtres de conduite, les filtres HEPA inaccessibles) peuvent être remplacés régulièrement selon un calendrier de remplacement pour lequel la fréquence de remplacement est fondée sur les spécifications du fabricant et les ELR. L'inspection visuelle de l'équipement de petite taille peut être effectué plus régulièrement que celui de l'équipement de plus grande taille (p. ex. l'inspection visuelle des joints toriques dans les godets des centrifugeuses).
3.3 Décontamination et gestion des déchets
Pour limiter la propagation de contamination au-delà de l'espace de travail et de l'installation, il est crucial de décontaminer efficacement les déchets, les matières, l'équipement et les surfaces qui ont été en contact avec des matières biologiques de GR1. Pour garantir une décontamination efficace, il est important de choisir une méthode de désinfection adaptée. La littérature scientifique (p. ex. des articles de journaux évalués par des pairs) est référencée afin de déterminer les méthodes de désinfection, de décontamination et de vérification appropriées pour les matières biologiques de GR1 spécifiques présentes dans l'installation.
Au Canada, les produits chimiques utilisés comme désinfectants sur les surfaces environnementales et les objets inanimés doivent faire l'objet d'une évaluation préalable à la mise sur le marché par Santé Canada et recevoir un numéro d'identification de drogue (DIN)Note de bas de page17. Santé Canada doit avoir suffisamment d'information pour appuyer l'innocuité, l'efficacité et la qualité d'un désinfectant lorsqu'il est utilisé conformément aux conditions d'utilisation recommandées de l'étiquette avant que l'autorisation de mise en marché ne soit accordée. L'examen de l'étiquette d'un désinfectant commercial fournit des renseignements sur les matières biologiques contre lequel il est efficace et sur les instructions d'utilisation appropriée.
L'eau de javel, par exemple, est un désinfectant à large spectre (ou l'ingrédient d'un désinfectant) généralement efficace contre la majorité des matières biologiques de GR1. Une dilution d'eau de javel à 10 % (c.-à-d. une dilution 1:10 ou 5 000 parties par million [ppm] d'hypochlorite de sodium), fraîchement préparée pour maintenir l'activité désinfectante et appliquée pendant une durée de contact appropriée, est suffisante pour décontaminer les surfaces et éliminer la plupart des matières biologiques de GR1. Le fait de rincer les surfaces de travail avec de l'eau après avoir appliqué l'eau de javel (pendant une durée appropriée pour une désinfection efficace) réduira le risque de corrosion profonde de certains matériaux (p. ex. l'acier inoxydable).
Les solvants, les détergents et les alcools sont d'autres désinfectants qui pourraient être appropriés en fonction des matières biologiques et de l'activité menée. Par exemple, l'alcool (p. ex. 70 % d'éthanol ou d'isopropanol, dans l'eau) est souvent utilisé comme mesure alternative à l'eau de javel en raison de son efficacité contre les bactéries végétatives, les mycobactéries et les virus enveloppés. Cependant, il n'est pas efficace contre les spores bactériennes ou fongiquesNote de bas de page18,Note de bas de page19. La durée de contact et la concentration d'une solution d'alcool sont des facteurs primordiaux pour l'efficacité du désinfectant puisqu'il s'évapore rapidement. Par conséquent, les procédures et les conditions d'entreposage sont élaborées en tenant compte de ces élémentsNote de bas de page20. Il est essentiel de suivre les instructions autorisées de l'étiquette fournie avec le produit pour atteindre les niveaux de désinfection nécessaires.
Veuillez noter que les éléments suivants ne sont que des recommandations et non des exigences, sauf indication contraire de l'ASPC ou l'ACIA.Pratiques exemplaires - 3.3 Décontamination et gestion des déchets
Toute contamination évidente est retirée des surfaces et de l'équipement conformément aux PON avant leur décontamination.
Les matières organiques (p. ex. les fèces, le sang, la litière, la nourriture) peuvent inactiver ou limiter l'efficacité de certaines méthodes de décontamination de surface (p. ex. les désinfectants chimiques, les rayons ultraviolets). L'élimination de la contamination évidente par des moyens physiques comme le grattage, le brossage et l'essuyage des surfaces, de l'équipement et d'autres articles permet de les décontaminer de manière efficace. Il est important que les outils utilisés pour retirer la contamination évidente n'endommagent pas les surfaces ou l'équipement.
Suite au travail avec des matières biologiques de GR1, et après tout déversement ou éclaboussure, les surfaces sont nettoyées et décontaminées à l'aide de désinfectants efficaces ou de produits chimiques neutralisants à une fréquence déterminée par une ELR.
La décontamination des surfaces (p. ex. les surfaces de travail, les planchers, les murs) à l'aide de désinfectants ou de produits chimiques neutralisants efficaces contre les matières biologiques de GR1 utilisées réduit les risques d'exposition lorsque cette action est effectuée à une fréquence appropriée en fonction d'une ELR. Une ELR peut déterminer que certaines surfaces nécessitent une décontamination plus fréquente en fonction de certaines activités effectuées (c.-à-d. le risque de contamination). Par exemple, le nettoyage et la décontamination des box, des salles de nécropsie et du corridor « sale » lorsqu'ils sont contaminés de manière évidente et à la fin de chaque expérience empêche la propagation de la contamination, ce qui protège les membres du personnel contre une exposition. Des PON peuvent être élaborées afin d'établir la fréquence de décontamination de surfaces spécifiques.
Des désinfectants et des produits chimiques neutralisants efficaces contre les matières biologiques de GR1 sont accessibles, utilisés dans l'espace de travail et vérifiés régulièrement (p. ex. par des méthodes recommandées dans des publications évaluées par des pairs).
Le fait d'avoir des désinfectants et des produits chimiques neutralisants disponibles dans l'espace de travail permet de décontaminer les surfaces (p. ex. les paillasses, les contenants) et de réagir rapidement aux déversements biologiques lorsqu'ils sont utilisés conformément aux instructions autorisées sur l'étiquette. Les produits chimiques neutralisants utilisés pour une toxine particulière peuvent s'avérer inefficaces contre d'autres. De même, un désinfectant qui est efficace contre un microorganisme peut s'avérer inefficace contre d'autres. De plus, d'autres facteurs qui peuvent influer sur leur efficacité comprennent le type de matière biologique à décontaminer (p. ex. un virus, une bactérie, une toxine), son état (p. ex. sous une forme végétative, une spore), la charge organique (c.-à-d. la quantité de matière organique comme la terre, la litière, la nourriture ou le fumier présent sur une surface ou dans une suspension) et la durée de conservation du désinfectant (à la fois pour les solutions concentrées et les solutions de travail). Ainsi, il est de bonne pratique d'indiquer la date d'expiration ou la date de préparation des désinfectants sur une étiquette s'ils ne sont pas dans leur emballage d'origine, et de toujours les utiliser conformément aux instructions figurant sur l'étiquette canadienne autorisée.
Les liquides contaminés et possiblement contaminés sont décontaminés avant leur rejet dans les égouts sanitaires.
La décontamination des liquides au moyen d'une méthode validée et vérifiée régulièrement avant leur déversement dans les égouts sanitaires empêche le rejet de matières biologiques. Il est de bonne pratique de décontaminer les liquides possiblement contaminés qui quittent la zone de NC1 avant leur rejet dans les égouts sanitaires puisque les liquides manipulés à l'intérieur de la zone de NC1 sont à risque de devenir contaminés au cours des procédures expérimentales.
Les déchets solides et liquides, les vêtements, l'EPI, l'équipement et d'autres articles qui pourraient être contaminés sont :
- a) décontaminés avant d'être éliminés ou retirés de l'espace de travail et avant la mise à l'essai ou la réparation de l'équipement;
- b) placés dans des contenants secondaires fermés, étiquetés et étanches dont la surface a été décontaminée pour le déplacement ou le transport vers un autre espace pour la décontamination.
La décontamination des matières biologiques de GR1 et d'autres articles possiblement contaminés tels que l'EPI (p. ex. les gants), des déchets, des vêtements et de l'équipement avant leur élimination ou leur retrait de la zone de NC1, ou avant la mise à l'essai, l'entretien ou la réparation de l'équipement, est importante afin d'empêcher le rejet de matières biologiques de GR1 hors de la zone de NC1. Si des matières contaminées sont retirées de la zone de NC1 à l'intérieur d'un contenant secondaire fermé, étiqueté et étanche pour une décontamination ultérieure à un emplacement se trouvant à l'extérieur de la zone de NC1, il est de bonne pratique de décontaminer la surface du contenant secondaire afin de protéger la sécurité des personnes qui manipulent, nettoient et éliminent ces matières. Une ELR pourrait être utilisée pour déterminer le besoin de décontaminer la surface du contenant secondaire, en tenant compte de la probabilité que la surface externe du contenant secondaire soit contaminée. Un sac à autoclave à l'intérieur d'un contenant solide résistant aux impacts qui est étiqueté et gardé fermé est un exemple d'un contenant secondaire étanche pour les déchets.
3.4 Considérations pour le travail avec les animaux
Le travail avec les animaux soulève d'autres préoccupations en matière de biosécurité. Les animaux peuvent être porteurs de microorganismes qui font partie de leur flore normale, mais qui peuvent infecter les humains, ce qui crée des risques supplémentaires pour les membres du personnel, dont l'exposition à des agents pathogène de GR1 provenant d'animaux infectés ou de produits animaux contenant des agents pathogènes de GR1, et les blessures attribuables aux morsures, aux griffures et aux ruades. Par conséquent, il est important d'élaborer des pratiques de travail sécuritaires pour réduire au minimum le stress des animaux et protéger les membres du personnel contre l'exposition ou les blessures.
Veuillez noter que les éléments suivants ne sont que des recommandations et non des exigences, sauf indication contraire de l'ASPC ou l'ACIA.
Pratiques exemplaires - 3.4 Considérations pour le travail avec les animaux
Des procédures (p. ex. des techniques de contention et de manipulation) sont utilisées pour réduire au minimum les risques de blessure pour les membres du personnel, y compris les griffures, les morsures, les ruades, les lésions par écrasement et l'auto-inoculation accidentelle.
En raison du comportement imprévisible des animaux et de la variation des risques propres à chaque espèce, l'utilisation de techniques de contention et de manipulation appropriées aux espèces ou à l'animal (c.-à-d. en fonction d'une ELR) permet de garder les membres du personnel et les animaux en sécurité, surtout lorsque l'animal est malade ou qu'il a été exposé à une matière biologique de GR1.
Les cages et les box qui hébergent les animaux sont étiquetés de manière à identifier les matières biologiques de GR1 utilisées ou d'autres risques potentiels pour les membres du personnel.
Le fait d'identifier les matières biologiques de GR1 auxquelles un animal a été exposé sur l'étiquette de la cage de confinement primaire ou du box où il est hébergé est essentiel pour que les membres du personnel soient informés des risques associés à l'animal et pour contenir correctement la matière concernée pendant les procédures impliquant l'animal. Cette identification s'avère particulièrement importante lorsque plus d'une matière biologique de GR1 peut avoir été utilisée.
Les procédures sont conçues et effectuées de manière à réduire au minimum la production d'aérosols et sont réalisées dans un espace séparé de l'espace où les animaux sont hébergés.
Certaines procédures utilisées pour exposer des animaux à des matières biologiques de GR1 (p. ex. l'inoculation, la chirurgie, la nécropsie) ou comportant des animaux qui ont été exposés (p. ex. les techniques de collecte d'échantillons, les techniques de chirurgie et de nécropsie) pourraient possiblement produire des aérosols. Les procédures qui servent à prévenir la production d'aérosols et la dissémination de poussières et d'autres particules qui contiennent des matières biologiques de GR1 protègent les membres du personnel contre une exposition et empêchent la propagation de la contamination. Par exemple, il peut être préférable d'utiliser un jet d'eau diffusé à basse pression ou une autre méthode similaire pendant les procédures de nettoyage initiales pour les box ou les salles de nécropsie plutôt qu'un nettoyeur haute pression qui est plus susceptible de produire des aérosols contenant des matières biologiques de GR1. Les procédures peuvent également comprendre d'éviter les techniques d'inoculation, de chirurgie et de nécropsie qui pourraient possiblement produire des aérosols ou de mettre en œuvre des procédures pour atténuer les risques associés à ces techniques (p. ex. l'utilisation d'une poste ventilé par aspiration descendante ou par aspiration à l'arrière).
Les animaux et les carcasses sont déplacés dans, à l'intérieur et à l'extérieur de l'espace de travail avec des animaux de manière à prévenir la fuite d'un animal et la propagation de la contamination.
Le déplacement des animaux vivants dans, à l'intérieur et à l'extérieur de la zone de NC1 est effectué de manière sécuritaire et sûre (p. ex. en utilisant des techniques de contention) afin d'empêcher la fuite des animaux et la propagation de la contamination à l'intérieur (p. ex. dans un corridor « propre ») ou à l'extérieur de la zone de NC1. De telles procédures peuvent comprendre l'utilisation d'une cage de confinement primaire munie de filtres, ou l'utilisation de barrières et d'appareils de contention. Le retrait des carcasses animales de manière à empêcher la propagation de la contamination aide à prévenir l'exposition à des matières biologiques de GR1 ou le rejet de celles-ci. Le fait d'emballer les carcasses animales dans des contenants étiquetés, étanches et résistants aux chocs dont la surface a été décontaminée en est un exemple. Les carcasses de gros animaux peuvent également être divisées en plus petites parties avant l'emballage afin d'en faciliter le déplacement.
Les espaces de travail avec des animaux, y compris les salles de nécropsie et les corridors associés, s'il y a lieu, sont décontaminés à une fréquence déterminée par une ELR et lorsqu'ils ont été contaminés de manière évidente.
Le fait de retirer la contamination évidente, de nettoyer avec de l'eau et du savon et de décontaminer les surfaces (p. ex. les surfaces de travail, les planchers, les murs) à l'aide de désinfectants ou de produits chimiques neutralisants efficaces contre les matières biologiques de GR1 utilisées réduit les risques d'exposition lorsque ces actions sont effectuées à une fréquence appropriée, laquelle peut être fondée sur une ELR. Une ELR peut déterminer que certaines surfaces nécessitent une décontamination plus fréquente en fonction de certaines activités effectuées (c.-à-d. le risque de contamination). Par exemple, le fait de décontaminer les box, les salles de nécropsie et le corridor« sale » lorsqu'ils sont contaminés de manière évidente et à la fin de chaque expérience empêche la propagation de la contamination, ce qui protège les membres du personnel contre une exposition. Des PON peuvent être élaborées afin d'établir la fréquence de décontamination de surfaces spécifiques.
4. Glossaire
Il est important de souligner que les définitions fournies dans ce glossaire peuvent différer de celles universellement reconnues ou celles publiées dans la NCB. Les définitions des termes marqués d'un astérisque (*) ont été adaptées spécifiquement à partir de celles de la NCB pour s'appliquer au contexte de la Ligne directrice canadienne sur la biosécurité — Niveau de confinement 1 : Conception physique et pratiques opérationnelles.
- Accident
- Événement imprévu ayant causé des blessures, un préjudice ou des dommages.
- Aérosol
- Fines particules solides ou gouttelettes en suspension dans un milieu gazeux (p. ex. l'air); les aérosols peuvent se former lorsqu'une activité provoque un transfert d'énergie dans une matière liquide ou semi-liquide.
- Agent de la sécurité biologique (ASB)
- Personne désignée pour superviser les pratiques en matière de biosécurité et de biosûreté dans une installation.
- Agent pathogène
- Microorganisme, acide nucléique, protéine ou autre agent infectieux transmissible ayant la capacité de causer une maladie ou une infection chez l'humain ou l'animal. Les agents pathogènes humains et les agents zoopathogènes classés peuvent être trouvés à l'aide de la base de données sur les groupes de risque ePATHogène offerte par l'Agence de la santé publique du Canada.
- Aire administrative *
- Salle ou pièces voisines qui sont réservées pour des activités qui ne comportent pas de matières biologiques. Les aires administratives n'exigent pas d'équipement ou de systèmes de confinement, et il n'est pas nécessaire d'y mettre en œuvre des pratiques opérationnelles en matière de confinement. Les bureaux, les aires de photocopie, les salles de réunion et les salles de conférence sont des exemples d'aires administratives.
- Aire de production à grande échelle *
- Une salle ou une aire où sont effectuées des activités de production ou de pré-production, y compris des cultures in vitro, qui impliquent des volumes importants de matières biologiques. Les activités à grande échelle diffèrent des activités à l'échelle du laboratoire ou du banc d'essai selon l'équipement utilisé, puisqu'elles sont généralement effectuées dans des fermenteurs, des bioréacteurs et d'autres systèmes fermés.
- Biosécurité *
- Ensemble des principes, des technologies et des pratiques liés au confinement mis en œuvre pour empêcher l'exposition involontaire à des matières biologiques, ou leur rejet accidentel.
- Biosûreté *
- Ensemble des mesures de sûreté visant à prévenir la perte, le vol, le mésusage, le détournement ou le rejet volontaire de matières biologiques ou d'autres ressources connexes (p. ex. les membres du personnel, l'équipement, les animaux, les renseignements sensibles).
- Bonnes pratiques microbiologiques
- Code de déontologie fondamental régissant toutes les activités de laboratoire comportant des matières biologiques. Ce code sert à protéger les membres du personnel de laboratoire et à prévenir la contamination de leur milieu de travail et des échantillons utilisés.
- Box
- Salle ou espace conçu pour héberger un ou plusieurs animaux où la salle elle-même sert de confinement primaire. Ces espaces servent à héberger des gros animaux (p. ex. du bétail, des cerfs) ou des petits animaux qui sont hébergés dans des cages ouvertes (c.-à-d. pas des cages de confinement primaire).
- Cage de confinement primaire *
- Cage pour animaux qui sert de dispositif de confinement primaire et qui empêche le rejet de matières biologiques. Ce type de cage comprend les cages ventilées à couvercle filtrant et les étagères à cages de micro-isolation ventilées, avec ou sans filtre à haute efficacité pour les particules de l'air.
- Confinement
- Ensemble de paramètres de conception physique et de pratiques opérationnelles visant à protéger les membres du personnel, le milieu de travail immédiat et la communauté contre toute exposition à des matières biologiques. Dans le même contexte, le terme « bioconfinement » est aussi employé.
- Confinement primaire *
- Premier niveau de barrière physique conçu de façon à confiner des matières biologiques, et à prévenir leur rejet. On obtient le confinement primaire en se servant d'un dispositif, d'un équipement, ou d'une autre structure physique qui crée une barrière entre les matières biologiques et l'individu, le milieu de travail ou d'autres espaces à l'intérieur de la zone de confinement. Des exemples de ce type de confinement comprennent les enceintes de sécurité biologique, les boîtes à gants et les cages de micro-isolation. Dans les box, la salle elle-même sert de confinement primaire; l'équipement de protection individuel sert donc de protection primaire contre l'exposition.
- Contamination *
- Présence non désirée de matières biologiques sur une surface (p. ex. la paillasse, les mains, les gants) ou dans d'autres matières (p. ex. les échantillons de laboratoire, les cultures cellulaires).
- Contamination évidente
- Accumulation de matières organiques (p. ex. de la litière, de la nourriture, des excréments, du sang, des tissus) sur une surface qui peuvent être éliminées par des moyens physiques (p. ex. en grattant, en brossant, en essuyant avec un linge).
- Danger
- Source possible de dommage, de tort ou d'effets indésirables. Dans le contexte de la biosécurité, des objets (p. ex. des objets pointus ou tranchants, des aiguilles), des matières (p. ex. des agents pathogènes, des toxines), des animaux (p. ex. des morsures, des égratignures) et des situations (p. ex. une défaillance du système de confinement) en sont des exemples.
- Déchet
- Matière solide ou liquide produite par une installation et destinée à être éliminée.
- Décontamination
- Procédé qui consiste à traiter des matières et des surfaces pour que leur manipulation soit sécuritaire et qu'elles soient relativement exemptes de microorganismes, de toxines ou de prions. La décontamination s'effectue par désinfection, inactivation ou stérilisation.
- Déplacement *
- Fait de déplacer (p. ex. amener, apporter, conduire, relocaliser) des personnes, des matières (y compris des matières biologiques) ou des animaux entre deux emplacements du même édifice. Le déplacement peut se faire de différentes manières : à l'intérieur d'une même zone de confinement, vers une autre zone de confinement et vers un autre emplacement dans le même édifice.
- Désinfectant
- Agent chimique ayant la capacité d'éliminer le matériel biologique viable sur les surfaces ou dans les déchets liquides. L'efficacité peut varier selon les propriétés de l'agent chimique, la concentration, la durée de conservation et le temps de contact.
- Dispositif de confinement primaire *
- Appareil ou équipement conçu pour empêcher le rejet de matières biologiques et assurer le confinement primaire (c.-à-d. former une barrière physique entre les matières biologiques et la personne et/ou le milieu de travail). Les enceintes de sécurité biologique les isolateurs, les centrifugeuses munies de godets ou de rotors étanches, l'équipement de procédé, les fermenteurs, les bioréacteurs, les cages de micro-isolation et les étagères à cages ventilées en sont des exemples.
- Éléments de conception physique
- Mesures d'ingénierie et conception de l'installation visant à créer une barrière physique pour protéger les membres du personnel, l'environnement et ultimement, la communauté contre les matières biologiques.
- Équipement de procédé
- Équipement particulier servant à l'exécution d'un procédé de fabrication comportant des matières biologiques. Le terme « équipement de procédé » est généralement employé pour décrire l'équipement utilisé pour exécuter des procédés à grande échelle (p. ex. l'équipement de fermentation industrielle, les bioréacteurs).
- Équipement de protection individuel (EPI) *
- Équipement ou vêtement porté par les membres du personnel à titre de barrière afin de réduire le risque d'exposition aux matières biologiques. Des exemples d'EPI comprennent les sarraus, les blouses, les vêtements de protection couvrant toutes les parties du corps, les gants, les chaussures de sécurité, les lunettes de sécurité, les masques et les appareils de protection respiratoire.
- Espace de travail avec des animaux
- Une salle ou une aire réservée à l'hébergement des animaux ou aux activités qui comprennent des animaux.
- Espace de travail en laboratoire
- Espace à l'intérieur d'une zone de confinement conçu et équipé de façon à pouvoir y mener des activités in vitro (p. ex. à des fins de diagnostic, d'enseignement et de recherche).
- Évaluation des besoins en matière de formation
- Évaluation qui vise à cerner les besoins actuels et futurs en ce qui concerne la formation des membres du personnel de l'installation (c.-à-d. de l'organisation, de la zone de confinement), y compris la formation, la formation de perfectionnement et la requalification, et les lacunes du programme de formation existant.
- Évaluation des risques de biosûreté *
- Évaluation des risques qui consiste à définir et à classer par ordre de priorité les matières biologiques et les autres ressources connexes (p. ex. l'équipement, les animaux, les renseignements sensibles, les membres du personnel), à évaluer la probabilité des menaces, les vulnérabilités et les conséquences associées, ainsi qu'à recommander des stratégies d'atténuation appropriées afin de protéger ces ressources contre des événements de biosûreté.
- Évaluation globale des risques *
- Évaluation générale qui appuie le programme de biosécurité dans son ensemble et qui peut comprendre plusieurs zones de confinement au sein d'une organisation. L'évaluation globale des risques détermine quels sont les dangers, les risques et quelles sont les stratégies d'atténuation pour les activités proposées comportant des matières biologiques. Les stratégies d'atténuation et de gestion des risques tiennent compte du type de programme de biosécurité nécessaire pour prévenir l'exposition des membres du personnel aux matières biologiques ainsi que le rejet de celles-ci.
- Évaluation locale des risques (ELR) *
- Évaluation propre à un endroit en particulier réalisée pour repérer les dangers associés aux activités menées ainsi qu'aux matières biologiques utilisées. Cette évaluation permet d'élaborer des stratégies d'atténuation des risques et des stratégies de gestion des risques, qui doivent être intégrées aux paramètres de conception relatifs au confinement physique et aux pratiques opérationnelles de l'installation.
- Exposition *
- Contact ou proximité étroite avec les matières biologiques pouvant causer une infection ou une intoxication. Les voies d'exposition comprennent l'inhalation, l'ingestion, l'inoculation et l'absorption.
- Filtre à haute efficacité pour les particules de l'air (HEPA)
- Filtre à air mécanique plissé permettant de retenir plus de 99,97 % des particules aéroportées de 0,3 µm de diamètre, soit les particules les plus pénétrantes en raison de leur taille. Les phénomènes d'impaction, de diffusion et d'interception rehaussent la capacité des filtres HEPA à piéger et à retenir efficacement les particules dont le diamètre est inférieur ou supérieur à 0,3 µm.
- Groupe de risque (GR)
- Groupe dans lequel un agent biologique (c.-à-d. un microorganisme, une protéine, un acide nucléique ou une matière biologique contenant des parties de ceux-ci) est classé en fonction de ses caractéristiques inhérentes, comme la pathogénicité, la virulence, la transmissibilité et l'existence d'un traitement prophylactique ou thérapeutique efficace. Le groupe de risque indique quel est le risque pour la santé des personnes et du public ainsi que pour la santé des animaux et des populations animales.
- Incident
- Événement ou situation pouvant causer une blessure, du mal, une infection, une intoxication, une maladie ou un dommage. Les accidents et ceux évités de justesse sont considérés comme des incidents.
- Installation *
- Structure, édifice ou espace défini à l'intérieur d'une structure ou d'un édifice dans lesquels sont manipulées ou entreposées des matières biologiques. Il peut s'agir d'un unique laboratoire de recherche ou de diagnostic, d'une aire de production à grande échelle ou d'une zone où des animaux sont hébergés. Ce terme peut également désigner un ensemble de salles de ce type ou un édifice où se trouvent plusieurs espaces de ce type.
- Laboratoire
- Espace à l'intérieur d'une installation ou l'installation elle-même où des matières biologiques sont manipulées.
- Maladie
- Trouble structural ou fonctionnel touchant un humain ou un animal vivant, ou une partie du corps de ceux-ci. Les maladies sont causées par une infection ou une intoxication et se manifestent généralement par des signes et des symptômes caractéristiques.
- Maladie animale émergente (MAÉ)
- Nouvelle maladie infectieuse qui résulte de l'évolution ou de la modification d'un agent pathogène existant; maladie infectieuse connue se propageant à une nouvelle population ou zone géographique; ou maladie diagnostiquée pour la toute première fois ou causée par un agent pathogène auparavant inconnu qui pourrait avoir un effet important sur la santé animale, tel que déterminé par l'Agence canadienne d'inspection des aliments.
- Maladie animale exotique (MAE)
- Maladie qui apparait sur la Liste de l'Organisation mondiale de la santé animale, laquelle est modifiée de temps à autre, qui n'est pas considérée indigène au Canada, tel que déterminé par l'Agence canadienne d'inspection des aliments (ACIA); ou toute maladie à déclaration obligatoire réglementée par l'ACIA qui n'est pas présente au Canada et pour laquelle l'ACIA a une stratégie de réponse établie; ou toute autre maladie qui, après avoir été dûment examinée, est désignée comme telle par le Ministre de l'Agriculture et de l'Agroalimentaire. Les agents pathogènes causant une MAE peuvent également avoir un effet dévastateur sur la santé de la population animale canadienne.
- Manipulation ou entreposage *
- « Manipulation ou entreposage » comprend la possession, la manipulation, l'utilisation, la production, l'entreposage, le transfert, l'importation, l'exportation, le rejet, l'élimination ou l'abandon de matières biologiques, ainsi que le fait de permettre l'accès à de telles substances. Tous les temps de verbe et toutes les variations de « manipulation ou entreposage » sont également utilisés dans ce contexte.
- Matière biologique
- Microorganismes, protéines ou acides nucléiques pathogènes ou non pathogènes, ou toute autre matière biologique pouvant contenir un de ces éléments, en partie ou en entier, ou d'autres agents infectieux. Les bactéries, les virus, les champignons, les prions, les toxines, les organismes génétiquement modifiés, les acides nucléiques, les échantillons de tissus, les échantillons de diagnostic, les échantillons environnementaux, les vaccins vivants et les isolats d'un agent pathogène ou d'une toxine (p. ex. les cultures pures, les suspensions, les spores purifiées) sont tous des exemples de microorganismes.
- Matière réglementée
-
Dans le contexte de la Norme canadienne sur la biosécurité, les matières réglementées comprennent :
- les agents pathogènes humains et les toxines (en vertu de la Loi sur les agents pathogènes humains et les toxines et du Règlement sur les agents pathogènes humains et les toxines);
- les agents pathogènes d'animaux terrestres (en vertu de la Loi sur la santé des animaux [LSA] et du Règlement sur la santé des animaux [RSA]);
- les agents pathogènes d'animaux terrestres dans des animaux, des produits ou des sous-produits animaux, ou d'autres organismes (en vertu de la LSA et du RSA).
- Mécanisme
- Dispositif physique ou mesure opérationnelle.
- Membre du personnel autorisé
- Personne ayant reçu le droit de pénétrer dans une zone de confinement sans supervision par l'autorité interne responsable (p. ex. le directeur de cette zone, l'agent de la sécurité biologique, une autre personne à laquelle cette responsabilité a été confiée). Pour obtenir ce statut, il faut satisfaire à diverses exigences en matière de formation et faire preuve de compétence envers les procédures opératoires normalisées, selon ce qui est jugé nécessaire par l'installation.
- Microorganisme
- Entité microbiologique cellulaire ou non cellulaire ne pouvant pas raisonnablement être décelable à l'œil nu et ayant la capacité de se répliquer ou de transférer son matériel génétique. Les microorganismes comprennent les bactéries, les champignons, les virus et les parasites, qu'ils soient pathogènes ou non.
- Niveau de confinement (NC) *
- Exigences minimales liées au confinement physique et aux pratiques opérationnelles visant la manipulation sécuritaire des matières biologiques dans les laboratoires, les aires de production à grande échelle et les environnements de travail avec des animaux. Il existe quatre niveaux de confinement, allant du niveau de base (c.-à-d. NC1) au niveau le plus élevé (c.-à-d. NC4).
- Pathogénicité
- Capacité d'un agent pathogène de causer une maladie chez un hôte humain ou animal.
- Plan d'intervention d'urgence (PIU) *
- Document énonçant les mesures à prendre et les parties responsables en cas d'urgence, par exemple en cas : de déversement, d'exposition, ou de rejet de matières biologiques; de fuite d'un animal; de blessure ou de maladie chez un membre du personnel; de panne de courant; ou de toute autre situation d'urgence.
- Pratiques opérationnelles
- Mesures administratives et procédures respectées dans une zone de confinement pour protéger les membres du personnel, l'environnement et, ultimement, la communauté contre les matières biologiques.
- Prion
- Petite particule protéique infectieuse généralement reconnue comme étant impliquée dans le développement d'un certain groupe de maladies neurodégénératives chez l'humain et l'animal, à savoir les encéphalopathies spongiformes transmissibles.
- Procédure opératoire normalisée (PON) *
- Document qui normalise, en fonction d'une évaluation locale des risques, les procédures et les pratiques de travail sécuritaires utilisées dans le cadre d'activités réalisées avec des matières biologiques dans une zone de confinement. Les protocoles expérimentaux, les procédures d'entrée et de sortie, les protocoles de décontamination et les procédures d'intervention en cas d'urgence sont des exemples de PON.
- Programme de biosécurité *
- Programme qui décrit les politiques et les plans institutionnels qui facilitent la manipulation et l'entreposage sécuritaire des matières biologiques, et qui préviennent leur rejet hors de la zone de confinement. Les éléments fondamentaux d'un programme de biosécurité comprennent un manuel de biosécurité, un programme de formation exhaustif, un programme de surveillance médicale, un plan d'intervention d'urgence, des procédures opératoires normalisées et un plan de biosûreté.
- Rejet *
- Libération de matières biologiques hors d'un système de confinement ou d'une zone de confinement (p. ex. découlant d'une fuite, d'une pulvérisation, d'un dépôt, d'une décharge, d'une vaporisation).
- Risque
- Probabilité qu'un événement indésirable (p. ex. un accident, un incident, un bris de confinement) survienne et les conséquences de cet événement.
- Salle animalière
- Salle conçue pour héberger des animaux dans des cages de confinement primaire. Ces espaces servent seulement pour les petits animaux (p. ex. des souris, des rats, des lapins).
- Salle de nécropsie
- Salle située à l'intérieur de la zone de confinement, où sont menées des nécropsies et des dissections d'animaux à l'extérieur d'un dispositif de confinement primaire.
- Système fermé
- Équipement, appareil, ou système de traitement conçu pour contenir des matières biologiques et prévenir leur rejet dans le milieu ambiant (p. ex. la zone de confinement).
- Toxine (microbienne)
- Substance toxique produite par un microorganisme, ou dérivée de celui-ci, qui peut avoir des effets graves sur la santé humaine ou animale. Les toxines humaines sont énumérées à l'annexe 1 et à la partie 1 de l'annexe 5 de la Loi sur les agents pathogènes humains et les toxines.
- Validation
- Fait de confirmer qu'une méthode permet d'atteindre l'objectif souhaité et convient à l'usage auquel elle est destinée grâce à des données probantes objectives. La validation peut être l'observation que des conditions particulières ont été respectées (p. ex. confirmer à l'aide d'indicateurs biologiques, d'indicateurs chimiques ou de dispositifs de surveillance paramétriques situés à des endroits difficiles à décontaminer qu'un cycle précis d'autoclavage peut décontaminer une charge représentative de déchets).
- Vérification
- Surveillance régulière de l'équipement et des procédés visant à confirmer leur efficacité continue entre les validations (p. ex. une mise à l'essai de la performance d'un autoclave en utilisant des indicateurs biologiques). La comparaison de l'exactitude d'une pièce d'équipement avec celle prévue par une norme ou une procédure opératoire normalisée applicable est un exemple de vérification.
- Virulence
- Gravité ou sévérité d'une maladie causée par un agent pathogène.
- Zone de confinement *
- Espace physique qui répond aux exigences liées à un niveau de confinement donné. Il peut s'agir d'une salle unique, d'une série de salles situées dans un même endroit ou d'une série de salles adjacentes. Les espaces réservés au soutien de la zone, y compris les sas équipés de douches, les vestiaires « propres » et les vestiaires « sales », là où ils sont exigés, font partie de la zone de confinement.