Ligne directrice canadienne sur la biosécurité : Vecteurs lentiviraux

Télécharger le format de rechange
(Format PDF, 2.29 Mo, 42 pages)
Organisation : Agence de la santé publique du Canada
Date publiée : 2019-09-15
Table des matières
Préface
Au Canada, les installations où sont manipulés et entreposés des agents pathogènes humains ou des toxines des groupes de risque 2, 3 et 4 sont réglementées par l'Agence de la santé publique du Canada (ASPC) en vertu de la Loi sur les agents pathogènes humains et les toxines (LAPHT) et du Règlement sur les agents pathogènes humains et les toxines (RAPHT). L'importation d'agents zoopathogènes, d'animaux infectés, de produits ou sous-produits d'animaux (p. ex. des tissus ou du sérum) ou d'autres substances qui pourraient être porteurs d'un agent zoopathogène, d'une toxine ou d'une partie de ces derniers est réglementée par l'ASPC ou l'Agence canadienne d'inspection des aliments (ACIA) en vertu de la Loi sur la santé des animaux (LSA) et du Règlement sur la santé des animaux (RSA).
La figure suivante illustre la hiérarchie des documents qu'utilisent l'ASPC et l'ACIA pour surveiller les activités de biosécurité et de biosûreté. Chaque niveau de la pyramide correspond à un type de document. Les documents sont placés en ordre croissant de priorité, en partant du bas de la pyramide vers le haut. Les lois et règlements sont les documents qui confèrent l'autorité légale à l'ASPC et à l'ACIA, et se trouvent donc au sommet de la pyramide. Le matériel d'orientation et les documents techniques se trouvent au bas de la pyramide, car ils sont uniquement destinés à résumer les recommandations et les connaissances scientifiques.
Figure 1 : Hiérarchie des documents en matière de biosécurité et de biosûreté du Gouvernement du Canada
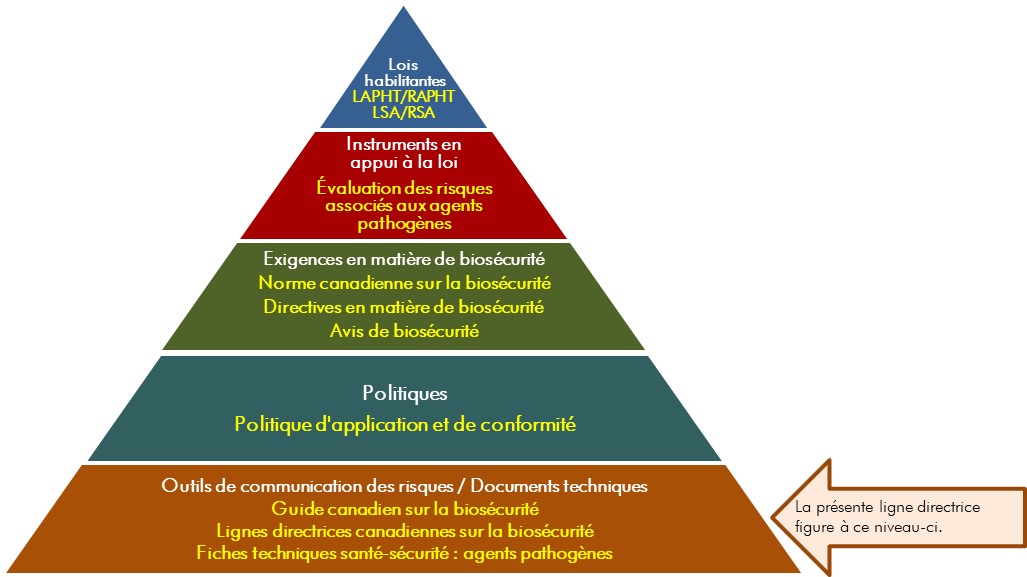
Figure 1 : Hiérarchie de la documentation en matière de biosécurité et de biosûreté de l'Agence de la santé publique du Canada - Équivalent textuel
Figure sous la forme d'une pyramide représentant la hiérarchie des documents utilisés par l'ASPC pour superviser les opérations de biosécurité et de biosûreté. Chacun des cinq niveaux de la pyramide correspond à un type de document, dont l'ordre de préséance augmente du bas vers le haut.
Au sommet, se trouve la législation habilitante, c'est-à-dire la LAPHT, le RAPHT, la LSA et RSA, qui transmet les autorités légales à l'ASPC. Au-dessous des lois et des règlements figurent les Instrument à l'appui de la législation, et ceux-ci sont les évaluations des risques liés aux agents pathogènes. La prochaine étape est intitulée les Exigences en matière de biosécurité, notamment la Norme canadienne sur la biosécurité, les Directives en matière de biosécurité et les Avis de biosécurité. Le deuxième niveau du bas est Documents de politique, soit la Politique de conformité et d'application de la loi. Le matériel d'orientation et les pièces techniques trouvés au bas de la pyramide, sous l'en-tête des Outils de communication des risques et documents techniques, visent seulement à résumer les recommandations et les informations scientifiques. Il s'agit notamment du Guide canadien sur la biosécurité, des Lignes directrices canadiennes sur la biosécurité et des Fiches techniques santé-sécurité : agents pathogènes.
La ligne directrice Vecteurs lentiviraux a été élaborée par l'ASPC et l'ACIA dans le cadre d'une série de publications électroniques qui développent les concepts de biosécurité et de biosûreté présentés dans l'édition actuelle du Guide canadien sur la biosécurité (GCB), soit le document complémentaire à la Norme canadienne sur la biosécurité (NCB). Cette ligne directrice décrit les pratiques exemplaires et fournit des recommandations pour le travail impliquant des vecteurs lentiviraux dans les laboratoires et autres zones de confinement.
Le présent document est en constante évolution et fait continuellement l'objet d'améliorations. L'ASPC et l'ACIA accueillent avec intérêt les commentaires, les clarifications et les suggestions visant l'amélioration des versions subséquentes de ce document. Veuillez envoyer toute information ou suggestion (accompagnée de ses références lorsqu'applicable) à l'adresse suivante :
- Adresse courriel de l'ASPC : PHAC.pathogens-pathogenes.ASPC@canada.ca
Abréviations et sigles
- ACIA
- Agence canadienne d'inspection des aliments
- ADN
- Acide désoxyribonucléique
- ARN
- Acide ribonucléique
- ASPC
- Agence de la santé publique du Canada
- ELR
- Évaluation locale des risques
- EPI
- Équipement de protection individuel
- ESB
- Enceinte de sécurité biologique
- GCB
- Guide canadien sur la biosécurité
- GR
- Groupe de risque (c.-à-d. GR1, GR2, GR3, GR4)
- LTR
- Séquence terminale longue répétée
- MLV
- Virus de la leucémie murine
- NC
- Niveau de confinement (c.-à-d. NC1, NC2, NC3, NC4)
- NCB
- Norme canadienne sur la biosécurité
- NC2-Ag
- Zone de confinement de gros animaux de niveau de confinement 2
- PON
- Procédures opératoires normalisées
- RCR
- Rétrovirus réplicatif (apte à se répliquer)
- VIH
- Virus de l'immunodéficience humaine
- VSV-G
- Glycoprotéines du virus de la stomatite vésiculaire
Chapitre 1 - Introduction
Les termes en caractères gras sont définis dans le glossaire du chapitre 5.
Les vecteurs lentiviraux sont des rétrovirus créés in vitro par la transfection de multiples plasmides dans des cellules mammaliennes. Les particules rétrovirales sont récoltées du milieu de culture et utilisées pour insérer de manière stable un transgène dans le génome d'une cellule cible. Ces vecteurs ont été conçus de telle sorte qu'ils peuvent infecter la cellule cible, mais ils sont incapables de se répliquer après l'infection. Par contre, puisque la plupart des vecteurs lentiviraux sont dérivés du virus de l'immunodéficience humaine (VIH), les préoccupations concernant la capacité du vecteur à revenir à un état réplicatif demeurent, tout comme celles pour les risques associés au transgène et de la mutagenèse insertionnelle (p. ex. résultant dans l'activation ou l'inactivation de gènes).
Dans certains cas, les exigences en matière de confinement applicables à un laboratoire ou une zone de confinement où des agents pathogènes sont manipulés ou entreposés peuvent devoir être modifiées en fonction de la procédure effectuée ou du fait que le risque associé à l'agent pathogène a changé (p. ex. l'agent pathogène a été modifié). Les vecteurs lentiviraux sont généralement classés comme agents pathogènes humains du groupe de risque 2 (GR2) et comme agents zoopathogènes du GR2. Cependant, certains vecteurs lentiviraux et transgènes peuvent posséder des caractéristiques particulières qui augmentent les risques, ce qui se traduit soit par des exigences en matière de biosécurité supplémentaires ou modifiées pour leur manipulation sécuritaire, ou par une classification comme agent pathogène du GR3.
1.1 Portée
La ligne directrice Vecteurs lentiviraux présente les éléments de biosécurité à considérer et les pratiques exemplaires pour effectuer une évaluation des risques associés aux agents pathogènes ou une évaluation locale des risques (ELR) pour une zone de confinement où des vecteurs lentiviraux sont manipulés ou entreposés, afin que des mesures appropriées d'atténuation des risques puissent être mises en place. Cette ligne directrice présente les facteurs de risque et les stratégies d'atténuation des risques à considérer au moment d'effectuer les évaluations de risques et d'élaborer des procédures de biosécurité. Elle est destinée à être utilisée conjointement avec la Norme canadienne sur la biosécurité (NCB) et le Guide canadien sur la biosécurité (GCB)Note de bas de page 1,Note de bas de page 2.
Les renseignements dans ce document sont présentés qu'à titre indicatif et ne devraient pas être considérés comme des exigences. Les parties réglementées peuvent choisir d'autres stratégies pour satisfaire aux exigences précisées dans la NCB.
1.2 Comment utiliser la ligne directrice Vecteurs lentiviraux
Une liste détaillée des abréviations et des sigles utilisés dans la présente ligne directrice se trouve au début du document. Chaque mot ou terme est épelé en entier à sa première apparition, suivi de son abréviation ou de son sigle entre parenthèses. Après cette définition initiale, leur abréviation ou sigle est utilisé exclusivement dans tout le reste du document. Un glossaire exhaustif des définitions des termes techniques se trouve au chapitre 5. Les termes qui y figurent apparaissent en caractères gras à leur première apparition dans la ligne directrice. Une liste de références et de ressources est présentée au chapitre 6.
Chapitre 2 Description des vecteurs lentiviraux
Les vecteurs lentiviraux sont dérivés de virus qui appartiennent au genre lentivirus de la famille des Retroviridae (Figure 2-1)Note de bas de page 3 . Les vecteurs lentiviraux sont dérivés le plus souvent du VIH de type 1 (VIH-1)Note de bas de page 4 . Toutefois, ils peuvent aussi être dérivés du VIH-2 et de lentivirus non humains, comme le virus de l'immunodéficience simienne, le virus de l'immunodéficience féline, le virus de l'anémie infectieuse des équidés et le virus de l'immunodéficience bovineNote de bas de page 4,Note de bas de page 5,Note de bas de page 6. Les lentivirus sont des véhicules pratiques pour le transport de gènes en raison de leur intégration stable dans les génomes de cellules en division ou ne se divisant pas, ainsi que de leur expression transgénique à long termeNote de bas de page 2 . Cependant, la pathogénicité potentielle des vecteurs lentiviraux est un facteur important à considérer pendant l'élaboration de stratégies de biosécurité.
Figure 2-1 : Arbre phylogénétique des Retroviridae
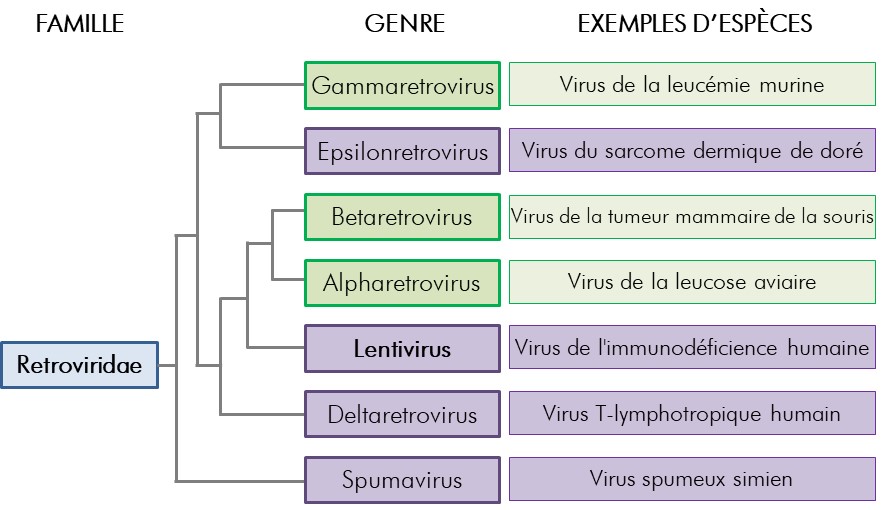
Figure 1 : Figure 2-1 : Arbre phylogénétique des Retroviridae - Équivalent textuel
Figure sous la forme d'une pyramide représentant la hiérarchie des documents utilisés par l'ASPC pour superviser les opérations de biosécurité et de biosûreté. Chacun des cinq niveaux de la pyramide correspond à un type de document, dont l'ordre de préséance augmente du bas vers le haut.
Au sommet, se trouve la législation habilitante, c'est-à-dire la LAPHT, le RAPHT, la LSA et RSA, qui transmet les autorités légales à l'ASPC. Au-dessous des lois et des règlements figurent les Instrument à l'appui de la législation, et ceux-ci sont les évaluations des risques liés aux agents pathogènes. La prochaine étape est intitulée les Exigences en matière de biosécurité, notamment la Norme canadienne sur la biosécurité, les Directives en matière de biosécurité et les Avis de biosécurité. Le deuxième niveau du bas est Documents de politique, soit la Politique de conformité et d'application de la loi. Le matériel d'orientation et les pièces techniques trouvés au bas de la pyramide, sous l'en-tête des Outils de communication des risques et documents techniques, visent seulement à résumer les recommandations et les informations scientifiques. Il s'agit notamment du Guide canadien sur la biosécurité, des Lignes directrices canadiennes sur la biosécurité et des Fiches techniques santé-sécurité : agents pathogènes.
Les sept genres de la famille des Retroviridae sont présentés; les genres de rétrovirus complexes sont indiqués en violet, tandis que les genres simples sont indiqués en vert. Un exemple d'espèce est présenté pour chacun des sept genres. La longueur des branches ne représente pas les distances phylogénétiques réelles; elles sont indiquées qu'à titre de référence générale seulement.
Le VIH est le lentivirus le plus étudié et le virus parent principal duquel sont dérivés la majorité des vecteurs lentiviraux actuellement disponibles. Afin d'atténuer le risque d'infection accidentelle, d'intégration dans le génome humain et d'infection associée à la pathogénicité du VIH qui persiste toute la vie qui est associée à la pathogénicité du VIH, les vecteurs lentiviraux sont conçus pour avoir une réplication défectueuseNote de bas de page 4. Ceci est possible en séparant ou en retirant des gènes essentiels à la réplication et à l'empaquetage (encapsidation) de virion du reste du génome du VIH. La particule virale résultante a la capacité d'infecter une cellule cible et de livrer son transgène sans être en mesure de compléter le cycle de vie virale pour former un rétrovirus capable de se répliquer (RCR), une étape essentielle à la propagation.
2.1 Les rétrovirus
La famille des Retroviridae est composée de sept genres (Figure 2-1) qui sont des rétrovirus à acide ribonucléique (ARN) à simple brin enveloppés qui sont capables de provoquer des maladies chez l'homme et les animauxNote de bas de page 3. Ils sont généralement classés comme des rétrovirus simples ou complexes, en fonction des motifs d'épissage de l'ARN et de la présence de gènes accessoiresNote de bas de page 7. L'interaction des rétrovirus avec la surface de la cellule hôte est hautement spécifique et constitue le déterminant principal de la gamme d'hôtes virauxNote de bas de page 7. Après que le rétrovirus se lie et entre dans la cellule hôte, l'ARN viral est transcrit en acide désoxyribonucléique (ADN) qui est ensuite intégré dans l'ADN de l'hôte grâce à des processus qui utilisent des protéines codées par l'hôte et par le virus; ces processus mènent éventuellement à la synthèse, à l'assemblage et à la libération de particules virales infectieuses. Pour pouvoir effectuer ces tâches, tous les rétrovirus contiennent les gènes viraux gag, pol et env; les produits de ces gènes et leurs fonctions sont résumés dans le tableau 2-1.
Le gène gag code les protéines qui forment la structure interne du virus, comme la capside, la matrice associée à la membrane et la capside nucléaire. Le gène pol code les enzymes nécessaires à la transcription, à l'intégration du génome viral dans l'ADN de la cellule hôte et à la maturation virale. Le gène env code les protéines qui forment la partie externe du virus, y compris les glycoprotéines de surface et la protéine transmembranaire, lesquelles créent un complexe qui interagit spécifiquement avec les récepteurs des cellules ciblesNote de bas de page 7. Les séquences terminales longues répétées (LTR) aux extrémités 5' et 3' des rétrovirus contiennent les éléments nécessaires à l'expression génétique, à la transcription inverse et à l'intégration dans le génome de la cellule hôte; le signal d'encapsidation de l'ARN psi (Ψ) est nécessaire pour empaqueter l'ARN dans les virionsNote de bas de page 3,Note de bas de page 8.
| Gènes | Produits | Fonction |
|---|---|---|
| gag | Capside | Protège le noyau |
| Protéines matricielles | Tapisse l'enveloppe | |
| Capside nucléaire | Protège le génome et forme le noyau | |
| pol | Protéase | Essentielle pour le clivage de la protéine Gag durant sa maturation |
| Transcriptase inverse | Effectue une transcription inverse de l'ARN génomique en ADN double brin | |
| Intégrase | Requise pour l'intégration du provirus | |
| env | Glycoprotéine de surface | Glycoprotéine de l'enveloppe externe; principal antigène viral |
| Protéine transmembranaire | Composante interne de l'enveloppe de glycoprotéines mature |
En plus des éléments essentiels retrouvés chez les rétrovirus simples, les genres de Retroviridae complexes (c.-à-d. lentivirus, epsilonretrovirus, deltaretrovirus et spumavirus) possèdent des gènes qui codent pour des protéines accessoires et régulatrices, ce qui procure aux rétrovirus un certain contrôle sur l'expression des gènes viraux et le cycle de vie viraleNote de bas de page 7. Par exemple, le lentivirus VIH-1 contient les gènes accessoires nef, vif, vpu et vpr, qui favorisent l'infectiosité et la pathogénicité du VIH, et les gènes de régulation tat et rev, qui travaillent de concert avec les LTR pour la réplication virale (tableau 2-2)Note de bas de page 7.
| Gène | Produits | Fonction |
|---|---|---|
| nef | Protéines accessoires | Accroît l'infectiosité des virions |
| vif | Influence l'infectiosité de particules virales | |
| vpu | Stimule la libération des virions | |
| vpr | Accroît l'infectiosité des virions | |
| tat | Protéines régulatrices | Active la transcription |
| rev | Régule l'épissage et le transport de l'ARN |
2.2 Évolution des systèmes de vecteurs rétroviraux
La capacité des rétrovirus à s'intégrer dans des génomes hôtes en a fait un outil potentiel pour la thérapie génique; cependant, la libération de RCR pouvant potentiellement causer une maladie demeurait une préoccupation importante en matière de biosécurité. Dans le but d'augmenter la sécurité des systèmes de vecteurs lentiviraux, plusieurs développements itératifs se sont efforcés à réduire la possibilité d'une capacité de réplication. Tel que décrit plus bas, ceci a été réalisé en remplaçant ou en éliminant les régions codantes des gènes essentiels à la réplication et à l'encapsidation du virion; les particules rétrovirales produites maintiennent la capacité d'infecter et d'apporter le transgène aux cellules cibles, mais sont incapables de compléter le reste du cycle de vie virale, y compris la formation de RCR. Un niveau de sécurité supérieur a été atteint en séparant les composantes virales nécessaires à la production d'un virion infectieux parmi plusieurs plasmidesNote de bas de page 9.
Les premiers systèmes de vecteurs rétroviraux ont été développés à partir de rétrovirus simples; leur utilité était limitée puisque les rétrovirus simples ne peuvent qu'entrer dans le noyau de l'hôte durant la mitose, et donc ils sont seulement capables de s'intégrer dans des cellules en division. Au contraire, les rétrovirus complexes peuvent s'intégrer à la fois dans des cellules qui se divisent et celles qui ne se divisent pas en raison des protéines additionnelles codées dans leur génome; de fait, les systèmes de vecteurs lentiviraux sont présentement les systèmes de vecteurs rétroviraux les plus utilisés.
2.2.1 Les premiers systèmes de vecteurs rétroviraux
Les premiers systèmes rétroviraux étaient basés sur des rétrovirus simples, comme le virus de la leucémie murine (MLV; Figure 2-2, panneau A), un gammarétrovirus. Dans ces systèmes, le vecteur était séparé en deux plasmides, soit un plasmide vecteur de transduction et un plasmide auxiliaire d'encapsidation (Figure 2-2, panneau B). Le plasmide vecteur comprenait le Ψ et les LTR, qui sont respectivement nécessaires à l'encapsidation du transgène dans le virion et à son intégration dans le génome hôte. Le plasmide auxiliaire contenait les gènes gag, pol et env qui codent pour les protéines nécessaires à l'encapsidation du virion; l'absence de Ψ dans le vecteur auxiliaire empêchait l'ADN viral transcrit d'être incorporé dans le virion. Le résultat final était un virus incapable de se répliquer qui comprenait le gène d'intérêt, mais qui était dépourvu de gènes viraux nécessaires pour compléter le cycle de vie virale au sein de la cellule hôteNote de bas de page 10. En dépit de la séparation du génome viral dans ces systèmes rétroviraux, un seul cas de recombinaison pourrait entraîner la relocalisation de Ψ du plasmide vecteur au plasmide auxiliaire, menant à la formation de RCRNote de bas de page 10. Par conséquent, l'utilisation de ces premiers systèmes de vecteurs rétroviraux nécessite des mesures de biosécurité supplémentaires.
Un système de vecteurs rétroviraux à trois plasmides basé sur le MLV a été conçu dans le but de régler le problème de relocalisation de Ψ du plasmide vecteur vers le plasmide auxiliaire (Figure 2-2, panneau C)Note de bas de page 11. Dans ce système, les composantes du plasmide auxiliaire ont été divisées en deux plasmides : un plasmide auxiliaire (encapsidation) contenant les gènes gag et pol et un deuxième plasmide (enveloppe) contenant seulement le gène env. Le système de vecteurs résultant était aussi efficace que les premiers systèmes de vecteurs pour l'intégration du transgène dans les cellules qui se divisent et pour l'expression continue du transgèneNote de bas de page 10. De plus, puisque deux évènements de recombinaison étaient nécessaires pour que Ψ, gag, pol et env se retrouvent ensemble sur le même plasmide, la formation de RCR était moins probable, ce qui rendait ce système plus sécuritaire. Cependant, l'utilisation de systèmes de vecteurs basés sur le MLV est peu efficace pour transférer des gènes dans les systèmes humains, probablement parce que ces vecteurs peuvent seulement s'intégrer à des cellules en division et qu'ils sont inactivés par le système du complément humainNote de bas de page 12,Note de bas de page 13.
Figure 2-2 : Génome du MLV et l'évolution vers un système de vecteur rétroviral à trois plasmides
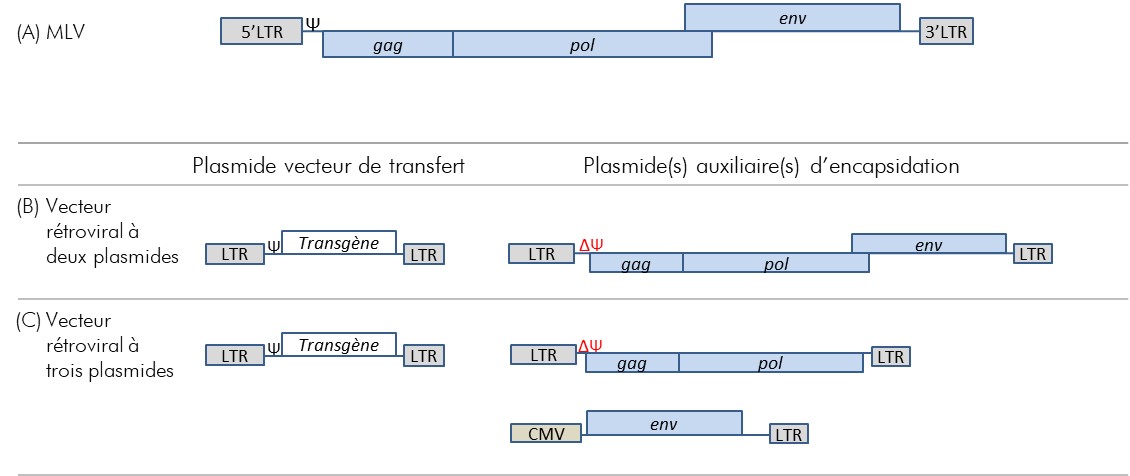
Figure 2-2 : Génome du MLV et l'évolution vers un système de vecteur rétroviral à trois plasmides - Équivalent textuel
- Figure illustrant l'organisation des gènes MLV en commençant par la LTR 5', suivis dans l'ordre par le signal psi, les gènes gag, pol et env, et en terminant par la LTR 3'. Le gène env chevauche légèrement le gène pol.
- Figure illustrant l'organisation génétique d'un système de vecteur rétroviral à deux plasmides basé sur le MLV. Ce système comprend un plasmide vecteur de transfert et un plasmide auxiliaire d'encapsidation. Le plasmide vecteur de transfert comprend, dans l'ordre, une LTR 5', suivi du signal psi, du transgène et d'une LTR 3'. Le plasmide auxiliaire d'encapsidation comprend, dans l'ordre, une LTR 5', suivi des gènes gag, pol et env et de la LTR 3'. Le signal psi a été retiré du plasmide auxiliaire d'encapsidation.
- Figure illustrant l'organisation génétique d'un vecteur rétroviral à trois plasmides basé sur le MLV. Ce système comprend un plasmide vecteur de transfert et deux plasmides auxiliaires d'encapsidation. Le plasmide vecteur de transfert est identique à celui décrit dans (B) (c'est-à-dire qu'il inclut, dans l'ordre, une LTR 5', suivi du signal psi, du transgène et d'une LTR 3'). Un des plasmides auxiliaire d'encapsidation contient, dans l'ordre, une LTR 5', suivi des gènes gag et pol, et une LTR 3'; le signal psi a été supprimé. Le second plasmide auxiliaire d'encapsidation contient, dans l'ordre, un promoteur CMV, le gène env et une LTR 3'.
2.2.2 Systèmes de vecteurs lentiviraux de première génération
Des systèmes de vecteurs lentiviraux ont été développés pour surmonter les déficits des premiers systèmes rétroviraux basés sur le MLV. Contrairement aux vecteurs rétroviraux simples, le VIH-1 et d'autres lentivirus sont capables d'infecter des cellules qui se divisent de même que des cellules qui ne se divisent pas grâce à leurs génomes complexes qui contiennent des gènes additionnels pour des protéines régulatrices et accessoires (Figure 2-3, panneau A). Cette capacité élargie a fait des lentivirus des candidats prometteurs pour des applications de thérapie génique, mais leur origine parentale soulevait de nombreuses préoccupations en matière de sécurité qui les ont empêchés d'être testés chez les humains.
Figure 2-3 : Génome du VIH-1 et l'évolution vers les systèmes de vecteur lentiviral de troisième génération

Figure 2-3 : Génome du VIH-1 et l'évolution vers les systèmes de vecteur lentiviral de troisième génération - Équivalent textuel
- (A) Figure illustrant l'organisation génétique des gènes du VIH, qui contient les gènes rétroviraux communs présentés à la figure 2-2 (A) (c'est-à-dire, LTR, signal psi et gènes gag, pol et env); cependant, le gène gag chevauche légèrement avec pol. Le gène accessoire vif spécifique au VIH chevauche la fin du gène pol, vpr chevauche la fin de vif et vpu chevauche le début d'env. Nef chevauche la fin d'env et le début de la LTR 3'. Les gènes régulateurs tat et rev sont des produits d'épissure constitués d'une première partie de la région vpr / vpu et d'une partie 3 'de la fin d'env.
- (B) Figure illustrant la séquence des gènes pour la première génération de vecteur lentiviral. Ce système comprend un plasmide vecteur de transfert et deux plasmides auxiliaires d'encapsidation. Le plasmide vecteur de transfert comprend, dans l'ordre, une LTR 5', le signal psi, le transgène et une LTR 3'. Un plasmide auxiliaire d'encapsidation est similaire au plasmide décrit en (A); cependant, le signal psi et le gène env ont été supprimés et la LTR 3' remplacé par polyA. L'autre plasmide auxiliaire d'encapsidation contient, dans l'ordre, un promoteur CMV et un gène env pseudotypés en vsv-g, ainsi qu'une polyA 3'.
- (C) Figure illustrant la séquence des gènes pour la deuxième génération de vecteur lentiviral. Ce système comprend un plasmide vecteur de transfert et deux plasmides auxiliaire d'encapsidation. Ce système est identique à celui présenté dans (B), à la différence près que les gènes accessoires du VIH (vif, vpr, vpu et nef) ont été supprimés. Le second plasmide auxiliaire d'encapsidation est identique à celui présenté en (B).
- (D) Figure illustrant la séquence des gènes pour la troisième génération de vecteur lentiviral. Ce système comprend un plasmide vecteur de transfert et trois plasmides auxiliaire d'encapsidation. Le plasmide vecteur de transfert comprend, dans l'ordre, une LTR 5' chimérique, le signal psi et le transgène. Une partie de la LTR 3' a été supprimée. Le premier plasmide auxiliaire d'encapsidation est similaire à celui décrit en (C) (c'est-à-dire qu'il consiste d'une LTR 5', gag, pol et polyA 3'); cependant, les gènes régulateurs (tat, rev) ont été supprimés. Le deuxième plasmide auxiliaire d'encapsidation est identique au deuxième plasmide décrit dans (B) (c'est-à-dire le promoteur du CMV, env / vsv-g et la polyA 3'). Le troisième plasmide est constitué d'un promoteur CMV, du gène régulateur rev et d'une polyA 3'.
(A) Le génome du VIH avec les gènes rétroviraux communs (en bleu) et les gènes spécifiques du VIH (en mauve et rose); à noter que la figure n'est pas à l'échelle et vise seulement à représenter la position relative des gènes. (B) Un système de vecteur lentiviral à trois plasmides de première génération. (C) Un système de vecteur lentiviral à trois plasmides de deuxième génération. (D) Un système de vecteur lentiviral à quatre plasmides de troisième génération.
Les systèmes de vecteurs lentiviraux de première génération étaient des systèmes à trois plasmides dérivés du VIH et ils comprenaient des gènes rétroviraux standards, ainsi que des gènes spécifiques du VIH (Figure 2-3, panneau B)Note de bas de page 14. Ces systèmes de vecteurs lentiviraux de première génération étaient composés (1) d'un plasmide de transfert contenant Ψ; (2) d'un plasmide d'encapsidation contenant gag et pol, en plus des gènes du VIH accessoires nef, vif, vpu et vpr et de régulation tat et rev; et (3) d'un plasmide d'enveloppe. Dans le but d'augmenter le tropisme, soit le nombre de cibles cellulaires, des systèmes de vecteurs lentiviraux dérivés du VIH, le gène env du VIH peut être remplacé dans le plasmide d'enveloppe par des gènes pour des glycoprotéines hétérologues, un processus appelé le pseudotypage; les vecteurs lentiviraux sont souvent pseudotypés avec des gènes codant pour des glycoprotéines du virus de la stomatite vésiculeuse (VSV-G)Note de bas de page 3,Note de bas de page 4. Bien que le pseudotypage améliore la stabilité du vecteur, modifier le tropisme des vecteurs lentiviraux afin d'inclure presque toutes les cellules mammaliennes augmente le risque inhérent associé aux vecteurs lentivirauxNote de bas de page 4. De plus, puisqu'un vecteur pseudotypé est un agent pathogène animal et un agent pathogène humain, il est réglementé par l'Agence de la santé publique du Canada (ASPC) et l'Agence canadienne d'inspection des aliments (ACIA).
2.2.3 Systèmes de vecteurs lentiviraux de deuxième génération
Dans le but d'augmenter le niveau de sécurité des systèmes de vecteurs lentiviraux, les gènes accessoires du VIH (nef, vif, vpu et vpr) qui contribuent à la pathogenèse ont été retirés du plasmide auxiliaire d'encapsidation dans les vecteurs dérivés du VIH de deuxième génération (Figure 2-3, panneau C). La réduction du nombre de gènes de lentivirus, de neuf à quatre, diminue considérablement les risques de formation de RCR, et ce, même si plusieurs évènements de recombinaison devaient se produire.
2.2.4 Systèmes de vecteurs lentiviraux de troisième génération et des générations suivantes
La mise au point des systèmes de vecteurs lentiviraux de troisième génération visait l'amélioration de la sécurité et la réduction du risque de formation de RCR. La LTR 5' a été modifiée en une LTR 5' chimérique contenant un promoteur hétérologue qui ne dépend plus de la transactivation de tat. Comme le gène tat n'est plus nécessaire, il a été retiré du plasmide d'encapsidation de troisième génération. De plus, les autres gènes d'encapsidation du VIH ont été séparés en deux plasmides d'encapsidation (un plasmide contenant les gènes gag et pol et un second contenant le gène rev). Avec les plasmides de transfert et d'enveloppe, le résultat est un système à quatre plasmides qui ne contient que trois gènes spécifiques du VIH et qui possède une capacité de formation de RCR considérablement réduite comparativement aux générations précédentes (Figure 2-3 panneau D). Par ailleurs, certains systèmes de troisième génération présentent une délétion dans la LTR 3' du plasmide de transfert, lequel est transcrit au LTR 5' durant la transcription inverse; ceci donne lieu à un vecteur qui s'inactive lui-même en raison de l'activité réduite du promoteur. Cette modification est particulièrement utile puisqu'elle règle des problèmes de biosécurité comme la recombinaison entre les plasmides de transfert et auxiliaires, l'oncogenèse par insertion causée par les LTR et la mobilisation de RCR en cas d'infection subséquente par un VIH-1 capable de se répliquerNote de bas de page 4,Note de bas de page 15.
Le développement de systèmes de vecteurs lentiviraux de quatrième génération avec une meilleure biosécurité a été l'objet de nombreuses études scientifiques. Dans l'une de ces études, un plasmide de transfert a été modifié pour empêcher la transcription de certaines composantes du VIH-1 dans le transgène transduit. Cela s'est fait en partie en retirant la LTR 5' et en plaçant les signaux d'ARN (p. ex. Ψ, élément de réponse rev) en aval d'une LTR 3' qui s'inactive elle-mêmeNote de bas de page 16. L'efficacité de transduction de ce système de vecteurs lentiviraux est présentement moindre que celle des technologies courantes, alors il n'est pas encore très utilisé sur le plan commercial. Par ailleurs, les plasmides d'encapsidation d'un système de vecteurs lentiviraux ont été divisés en cinq plasmides distincts, en partie en séparant les gènes gag et pol et aussi en réintroduisant le gène tat Note de bas de page 17. Ce dernier système, de même que plusieurs autres systèmes de deuxième et de troisième génération, sont encore utilisés et sont disponibles auprès de sources commerciales.
Même si c'est improbable (et il n'y a aucune preuve documentée d'incidences avec un système de troisième génération), le risque de formation d'un RCR persiste lorsqu'un système de vecteurs de deuxième ou troisième génération est utilisé. Un RCR qui contient des gènes du VIH pourrait arborer des caractéristiques virales du VIH s'il était introduit dans un hôte humain ou animalNote de bas de page 18. La surveillance de la formation de RCR pendant la mise au point et la fabrication des vecteurs constitue un moyen de détecter sa présence avant que les vecteurs ne soient utilisés.
Chapitre 3 - Évaluation des risques
La biosécurité implique l'application continue de mesures de sécurité (c.-à-d. les éléments de confinement physique et les pratiques opérationnelles) qui sont essentielles pour éviter de mettre en danger le personnel, la communauté ou l'environnement suite à une exposition à des agents pathogènes manipulés dans une installation ou leur libération du confinement. Les mesures d'atténuation appropriées pour un agent pathogène, une procédure, une zone de confinement, ou un espace de travail donné sont fondées sur les évaluations de risques, qui sont la base sur laquelle s'appuient toutes les composantes d'un programme de biosécurité. Ce chapitre décrit les facteurs à considérer pour effectuer une évaluation des risques associés à l'agent pathogène et une ELR qui soient propres au travail impliquant des vecteurs lentiviraux.
3.1 Évaluation des risques associés à l'agent pathogène
Le groupe de risque d'un agent pathogène est déterminé suite à une évaluation des risques associés à l'agent pathogène qui examine des caractéristiques intrinsèques contribuant aux risques associés à l'agent pathogène. Cette évaluation tient compte de facteurs comme la pathogénicité, la transmissibilité et l'existence de traitements préventifs et thérapeutiques efficaces. L'évaluation des risques associés à l'agent pathogène détermine le groupe de risque, ce qui aide à établir le niveau de confinement approprié, en plus d'être prise en compte dans les ELR.
Les voies d'infection des vecteurs lentiviraux sont semblables à celles du VIH et comprennent l'injection et l'exposition de muqueuses ou de lésions cutanées à des liquides ou des aérosols infectieux. Le risque d'infection n'est pas considéré important lorsque c'est une peau intacte qui est exposée à ces matièresNote de bas de page 18 . Il existe des traitements et des mesures préventives efficaces pour les vecteurs lentiviraux et le risque de propagation d'une maladie causée par ces agents pathogènes est faible.
L'ASPC a déterminé que les vecteurs lentiviraux correspondent aux définitions d'agent pathogène humain du GR2 et d'agent zoopathogène du GR2. Les agents pathogènes du GR2 présentent des risques modérés pour la santé des individus et des animaux et un risque faible pour la santé publique. Les agents pathogènes du GR2 peuvent causer des maladies graves chez l'humain ou l'animal, mais sont peu susceptibles de le faire. Cependant, dans certaines conditions (p. ex. l'utilisation de systèmes de vecteurs lentiviraux de première génération, une modification du vecteur, l'insertion d'un transgène oncogène ou toxique), les risques accrus associés à la manipulation de ces vecteurs lentiviraux peuvent nécessiter des procédures de biosécurité modifiées ou supplémentaires ou entraîner une classification du groupe de risque à un niveau supérieur (c.-à-d. GR3).
Les individus sont encouragés à mener leurs propres évaluations des risques associés à l'agent pathogène sur les systèmes de vecteurs lentiviraux utilisés, en particulier lorsqu'il s'agit de systèmes de première génération ou pour l'insertion de transgènes toxiques ou oncogènes. Les évaluations des risques dûment complétées peuvent être soumises à l'ASPC pour être validées. Plus de renseignements sur les évaluations des risques associés à l'agent pathogène sont présentés dans la Ligne directrice canadienne sur la biosécurité – Évaluation des risques associés à l'agent pathogène et un modèle d'évaluation des risques associés à l'agent pathogène est disponible sur le site Web du Gouvernement du CanadaNote de bas de page 19,Note de bas de page 20.
Le titulaire de permis et l'agent de la sécurité biologique (ASB) doivent être avisés par écrit lorsque le résultat d'une évaluation des risques associés à l'agent pathogène pour un système de vecteurs lentiviraux indique une augmentation au GR3 ou que des résultats d'expériences indiquent une forte probabilité d'une recombinaison du vecteurs lentiviraux menant à une production de VIH capable de se répliquer (RAPHT 5a). Dans de telles situations, un permis d'agent pathogène et de toxine du GR3 (permis GR3) est exigé. Ce permis précisera que toutes activités avec le système de vecteurs lentiviraux doivent être menées en tenant compte de la Directive en matière de biosécurité portant sur le virus de l'immunodéficience humaine (VIH), le virus T-lymphotrope humain (HTLV) et les rétrovirus simiens apparentés (c.-à-d. qu'elles peuvent être menées au niveau de confinement 2 [NC2] avec des précautions additionnelles)Note de bas de page 21.
3.1.1 Facteurs à considérer durant l'évaluation des risques associés à l'agent pathogène pour les vecteurs lentiviraux
L'évaluation des risques associés à l'agent pathogène commence par l'identification des caractéristiques intrinsèques à l'agent pathogène qui contribuent à son risque. La liste non exhaustive suivante présente des facteurs à considérer pour les vecteurs lentivirauxNote de bas de page 4,Note de bas de page 8,Note de bas de page 22,Note de bas de page 23,Note de bas de page 24,Note de bas de page 25:
- La nature du transgène inséré. Des oncogènes ou des gènes connus ayant un potentiel oncogénique ou toxique élevé peuvent nécessiter des exigences supplémentaires en matière de biosécurité.
- La possibilité de voies d'infection différentes, en fonction du vecteur lentiviral. Le pseudotypage avec les vsv-g peut faciliter l'infection par inhalation dans certaines conditions.
- La possibilité de recombinaison pendant la fabrication, ce qui peut mener à des RCR. En dépit de la faible probabilité, la surveillance de la présence de RCR dans les préparations de vecteurs permettra d'évaluer cette possibilité. Il est recommandé d'utiliser des systèmes de troisième génération (c.-à-d. avec un faible potentiel de formation de RCR).
- Après une exposition, il existe un potentiel d'oncogenèse attribuable à la mutagenèse insertionnelle ou à la transactivation de séquences génétiques adjacentes qui découle de l'intégration de l'ADN viral dans le génome hôte.
- La possibilité d'une mobilisation (c.-à-d. récupération) par un virus sauvage (p. ex. VIH) et d'une propagation de particules de vecteurs mobilisées dans des cellules ou des tissus qui ne sont pas des cibles (c.-à-d. surtout avec des vecteurs qui conservent les LTR complètes).
- La possibilité de recombinaison, suite à une exposition, avec un virus sauvage chez des personnes porteuses du VIH ou chez des animaux hôtes porteurs de lentivirus, dont le virus natif pourrait se recombiner avec le vecteur ou le compléter.
- La possibilité d'une infection productive chez des animaux de laboratoire injectés avec, ou exposés à, des vecteurs contaminés avec des RCR, ce qui pourrait entraîner l'excrétion du vecteur ou du virus.
- La possibilité que les vecteurs lentiviraux soient capables d'infecter un plus large éventail de cellules humaines et de mammifères suite au pseudotypage de particules virales ou à l'altération de séquences promotrices virales.
- En dépit d'une incapacité à se répliquer, les vecteurs lentiviraux conservent leur infectiosité. Les vecteurs lentiviraux peuvent infecter des cellules cibles, qui expriment ensuite le transgène.
Le groupe de risque de la combinaison vecteur-transgène déterminera les exigences physiques en matière de confinement et les exigences opérationnelles pour la manipulation sécuritaire du vecteur lentiviral. Même dans les cas où le vecteur lentiviral demeure un agent pathogène du GR2, l'évaluation des risques peut établir des mesures d'atténuation des risques supplémentaires pour une manipulation sécuritaire.
3.2 Évaluation locale des risques
Les ELR sont des évaluations des risques associés à des activités impliquant des agents pathogènes et des toxines qui sont propres à un endroit spécifique. Elles servent àNote de bas de page 1 :
- repérer et décrire les dangers associés aux activités (c.-à-d. les tâches et les procédés) effectuées avec des matières infectieuses ou des toxines;
- évaluer les risques que représente chaque danger, en fonction de la probabilité que des incidents se produisent (p. ex. une libération, une perte ou une exposition à des agents pathogènes et des toxines), et les répercussions de ces incidents;
- développer et mettre en œuvre des mesures d'atténuation des risques (p. ex. des procédures opératoires normalisées [PON] pour des pratiques de travail sécuritaires).
3.2.1 Facteurs à considérer durant les évaluations locales des risques pour les vecteurs lentiviraux
Puisque les voies d'exposition aux vecteurs lentiviraux les plus probables en laboratoire sont l'injection et l'exposition des muqueuses, les principales activités dangereuses à considérer lors de la conduite des ELR pour le travail impliquant des vecteurs lentiviraux comprennent18 :
- L'utilisation d'objets pointus ou tranchants : La principale voie d'infection des vecteurs lentiviraux est l'inoculation. L'injection accidentelle de vecteurs lentiviraux peut entraîner une séropositivité au VIH, une expression transgénique (le même risque vaut pour d'autres vecteurs lentiviraux ou rétrovirus) ou une mutagenèse insertionnelle.
- La manipulation de cultures cellulaires transduites avec des vecteurs lentiviraux : L'intégration de vecteurs lentiviraux dans le génome des cellules peut nuire aux cellules transduites, comme augmenter le risque de formation de tumeur, de mutagenèse insertionnelle et de transactivation de gènes voisins.
- La manipulation de vecteurs lentiviraux en suspension : La manipulation de titres élevés de vecteurs lentiviraux en suspension augmente le risque d'exposition du personnel.
- Les procédures pouvant produire des aérosols : Le contact indirect avec des gouttelettes formées pendant des procédures pouvant produire des aérosols (p. ex. la centrifugation, le pipetage) peut entraîner la transmission de gouttelettes (c.-à-d. le dépôt d'agents infectieux sur des surfaces et le transfert subséquent vers les surfaces de muqueuses exposées du receveur).
- Le travail avec des animaux : Les données disponibles indiquent que des vecteurs peuvent être excrétés par des animaux infectés pendant plus de 24 heures après l'infection, ce qui rend possible la transmission au personnel par contact direct des muqueuses avec les liquides corporels infectés.
Le tableau 3-1 présente certains facteurs à considérer pendant les évaluations des risques associés à l'utilisation de vecteurs lentiviraux et décrit comment chaque facteur contribue à augmenter ou réduire le risque global.
| Évaluation des risques associés à l’agent pathogène | ||
|---|---|---|
| Faible Risque | Risque élevé | |
| Transgène |
|
|
| Conception de vecteur |
|
|
| Évaluation locale des risques | ||
| Faible risque | Risque élevé | |
| Animaux |
|
|
| Production |
|
|
| Manipulations |
|
|
Chapitre 4 Facteurs à considérer pour le confinement
4.1 Exigences liées au niveau de confinement
Selon les évaluations des risques effectuées par l'ASPC, il a été établi que toutes les activités impliquant des systèmes de vecteurs lentiviraux, y compris les activités de culture in vitro et les activités in vivo, peuvent être menées de manière sécuritaire dans un NC2 ou une zone de confinement de gros animaux de NC2 (c.-à-d. NC2-agriculture [NC2-Ag]). Le NC2 convient également pour les zones de production à grande échelle (>10 L). La façon dont les exigences relatives aux zones de production à grande échelle sont appliquées peut être déterminée au cas par cas en consultation avec l'ASPC et l'ACIA. Cependant, dans certaines situations (p. ex. lorsque des systèmes de vecteurs lentiviraux de première ou deuxième génération sont utilisés) des exigences opérationnelles supplémentaires peuvent être nécessaires au NC2 et au NC2-Ag pour prévenir l'exposition du personnel et la propagation de la contamination à l'extérieur de la zone de confinement (p. ex. selon la Directive en matière de biosécurité portant sur le virus de l'immunodéficience humaine (VIH), le virus T-lymphotrope humain(HTLV) et les rétrovirus simiens apparentés)Note de bas de page 26.
4.2 Pratiques de travail
Les pratiques opérationnelles désignent les mesures de contrôle administratif et des procédures, y compris les PONs, mises en place pour prévenir une exposition involontaire du personnel à des matières potentiellement infectieuses ou une libération d'agents pathogènes et de toxines du confinement. Le personnel est plus susceptible de respecter les pratiques opérationnelles si celles-ci sont bien documentées dans les PONs et qu'elles font partie de la formation du personnel. Les exigences en matière de pratiques opérationnelles au NC2 et au NC2-Ag sont énoncées au chapitre 4 de la NCB.
Dans les espaces où des vecteurs lentiviraux sont manipulés ou entreposés, les pratiques de travail sécuritaires comprennent l'utilisation et l'entretien appropriés de l'équipement de laboratoire et de sécurité (p. ex. centrifugeuses, enceintes de sécurité biologique [ESBs]), ainsi que l'utilisation de bonnes pratiques microbiologiques.
L'utilisation d'une ESB ou de tout autre dispositif de confinement primaire protège le personnel contre les expositions (p. ex. un contact avec les muqueuses) en confinant les aérosols pendant les procédures qui peuvent produire des aérosols infectieux ou qui impliquent de fortes concentrations ou de grands volumes de vecteurs lentiviraux. L'utilisation de godets ou de rotors scellés qui sont déchargés dans une ESB confine les aérosols pouvant être produits pendant la centrifugation des vecteurs lentiviraux.
La transmission de vecteurs lentiviraux au personnel a le plus de risque de se produire par l'inoculation accidentelle, les coupures et les perforations par des instruments contaminés et le contact avec des plaies ouvertes. Le fait d'éviter l'utilisation d'aiguilles ou d'autres objets pointus ou tranchants réduit ces risques. Lorsque l'utilisation d'objets pointus ou tranchants ne peut être évitée, des PONs appropriées peuvent être élaborées pour limiter leur utilisation ou pour fournir des instructions sur leur manipulation adéquate afin que ces instruments soient utilisés de manière qui préviennent les inoculations accidentellesNote de bas de page 4. Il est aussi possible de se procurer des aiguilles et des objets pointus ou tranchants qui sont conçus de manière sécuritaire pour réduire ce type de risque.
Lorsqu'il est utilisé de façon appropriée, l'équipement de protection individuel (EPI), comme les gants, les sarraus et les lunettes de sécurité, protège les travailleurs des matières infectieuses avec lesquelles ils peuvent entrer en contact pendant qu'ils accomplissent leur travail. En plus de l'exigence d'EPI pour le NC2 et le NC2-Ag, telle que précisée à la matrice 4.4 de la NCB, une ELR peut révéler un besoin d'EPI supplémentaire. Par exemple, une ELR peut déterminer qu'un appareil de protection respiratoire, un dispositif de protection des yeux ou une visière doit être porté pendant les procédures susceptibles de produire des aérosolsNote de bas de page 4.
4.3 Éléments à considérer dans le travail avec les animaux
Le travail in vivo avec des agents pathogènes et des toxines (c.-à-d. sur des animaux vivants) s'effectue dans une zone de confinement d'animaux. Une zone de confinement d'animaux c'est l'ensemble de salles animalières ou de box, de même que les corridors qui les relient et les zones de soutien (p. ex. aires d'entreposage et aires de préparation) du même niveau de confinement. Des renseignements plus détaillés sur les zones de confinement d'animaux sont présentés dans la NCB et le GCBNote de bas de page 1,Note de bas de page 2.
Les vecteurs lentiviraux ou les cellules transduites avec des vecteurs lentiviraux devraient être administrés aux animaux dans un niveau de confinement approprié. Les hôtes animaux qui sont permissifs pour la réplication du VIH et ceux auxquels des cellules humaines ont été greffées sont en mesure permettre la réplication du VIH infectieux. Par conséquent, des précautions supplémentaires devraient être prises. Compte tenu du danger accru que représente l'inoculation d'animaux, il importe que le personnel de laboratoire manipule ces matières de telle sorte que le risque d'incidents soit réduit au minimum, tel que déterminé pendant l'ELR. Par exemple, afin de réduire au minimum le risque d'auto-inoculation, les consignes de sécurité (p. ex. la contention animale) peuvent être renforcées par l'ajout de précautions et d'EPI (p. ex. des gants résistants aux perforations). S'il est impossible d'effectuer des injections dans une ESB, de l'EPI supplémentaire (p. ex. des lunettes de sécurité, des appareilles de protection respiratoire) peut être nécessaire afin de réduire le risque d'exposition des muqueuses aux aérosols. Après une inoculation, la désinfection ou le nettoyage de l'animal ou du site d'inoculation éliminera les vecteurs lentiviraux qui peuvent rester à la surface de l'animalNote de bas de page 4,Note de bas de page 6.
4.3.1 Essais pour rétrovirus capables de se répliquer
Les évaluations des risques pour les systèmes de vecteurs lentiviraux effectuées par l'ASPC indiquent clairement que ces systèmes de vecteurs lentiviraux sont susceptibles de former des RCR et ont un potentiel d'oncogenèse après leur intégration. Le risque est plus élevé avec les systèmes de premières générations; jusqu'à présent, aucune formation de RCR en utilisant un système de vecteur lentiviral de troisième génération n'a été signalée. Effectuer des essais pour détecter des RCR pendant la fabrication du vecteur peut aider à confirmer la présence ou l'absence de RCR; une détection positive de RCR pourrait annuler l'utilisation subséquente des vecteursNote de bas de page 3,Note de bas de page 27. Il est possible de communiquer avec la Direction des produits biologiques et des thérapies génétiques de Santé Canada ou avec le Centre canadien des produits biologiques vétérinaires de l'ACIA pour obtenir plus de renseignements sur les exigences pour les tests de RCR sur les systèmes de vecteurs lentiviraux destinés à des applications cliniques chez l'homme ou l'animal (respectivement)Note de bas de page 28,Note de bas de page 29.
Il a aussi été déterminé qu'après l'inoculation, et ce jusqu'à la clairance virale, le vecteur pourrait être excrété par les animaux infectés et transmis aux humains via le contact direct des muqueuses avec des liquides corporels infectésNote de bas de page 30. Le personnel du laboratoire pourrait aussi être exposé via une injection accidentelle de la préparation du vecteur. Dans les deux cas, la nature du gène inséré (p. ex. oncogène) serait un facteur important à considérer pour déterminer les pratiques opérationnelles et de confinement physique efficaces pour réduire au minimum le risque d'exposition. Certains animaux sont incapables de permettre la réplication de VIH infectieux et, par conséquent, le potentiel de formation de RCR après l'injection d'un vecteur lentiviral est considéré négligeable. Ainsi, la probabilité d'excrétion de RCR est très faible dans ce cas.
Une évaluation des risques, qui prend en considération la formation et l'excrétion de RCR de même que d'autres facteurs (p. ex. le risque d'exposition de l'animal à des agents pathogènes de plus haut risque ou des agents zoopathogènes non indigènes), peut déterminer qu'il est acceptable de réduire le niveau de confinement après l'administration du vecteur. Par exemple, si une ELR détermine que la probabilité d'infection est extrêmement faible ou nulle et que le site d'inoculation a été nettoyé et la litière changée, il peut être acceptable de déplacer l'animal vers une salle de niveau de confinement inférieur quelques jours après l'inoculation (l'intervalle de temps avant ce déplacement sera déterminé par une ELR et peut varier d'un à sept jours)Note de bas de page 7. De même, les animaux dont les résultats sur la formation de RCR sont négatifs peuvent être retirés du confinement quelques jours après l'inoculation, à condition que l'évaluation des risques détermine qu'il y a peu ou pas de risque d'infection ou de réplication d'un virus infectieux et que des agents pathogènes de plus haut risque (comme des agents zoopathogènes non indigènes) ne sont pas manipulés dans la même zone de confinementNote de bas de page 4,Note de bas de page 6.
Actuellement, l'approche la plus courante pour détecter les RCR consiste en une méthode employant une culture cellulaire suivie d'une détection des composantes RCR, qui est possible suite à une réaction en chaîne par polymérase (PCR) en point final (end point PCR), par des tests détectant l'activité de la transcriptase inverse ou par des tests d'antigèneNote de bas de page 27. Il est important de noter que certains tests pour détecter les RCR utilisent un contrôle positif du GR3, ce qui augmente le risque d'incidents pour le personnel et nécessite un permis GR3.
4.4 Prophylaxie postexposition
Avant de travailler avec des vecteurs lentiviraux, un plan d'intervention en cas d'exposition qui couvre les particularités du système de vecteurs lentiviraux manipulé et des activités planifiées devrait être en place et faire partie du plan de surveillance médicaleNote de bas de page 18. En cas de blessure avec une aiguille ou un instrument pointu ou tranchant qui implique un vecteur lentiviral de première ou de deuxième génération, une administration rapide de prophylaxie post exposition (c.-à-d. en moins d'une heure) réduira au minimum le risque déjà faible d'infection au VIHNote de bas de page 18. Il n'a pas été cliniquement démontré que la prophylaxie au VIH peut prévenir la transduction avec des gènes potentiellement oncogéniques ou toxiques ou la mutagenèse insertionnelleNote de bas de page 18. Cependant, les médicaments antirétroviraux (p. ex. azidothymidine [AZT]) sont capables de complètement bloquer la transduction en culture cellulaireNote de bas de page 8 .
4.5 Décontamination et gestion des déchets
La décontamination efficace des déchets, des matières, de l'équipement et des surfaces ayant entré en contact avec des matières ou des toxines potentiellement infectieuses constitue un élément essentiel pour limiter la propagation de la contamination à l'extérieur de l'espace de travail et de l'installation. Des technologies de décontamination peuvent être fournies sur place ou les déchets contaminés peuvent être enveloppés et transportés de manière adéquate vers une installation désignée pour la décontamination.
4.5.1 Décontamination de vecteurs lentiviraux
Les vecteurs lentiviraux sont labiles, ce qui facilite la décontamination des surfaces par divers produits chimiques, comme l'hypochlorite de sodium à 5000 parties par million (ppm) (dilution d'environ 1/10 d'eau de Javel commerciale) et l'éthanol à 70 %, pendant un temps de contact suffisant. Si l'eau de Javel est utilisée, des dilutions fraîches doivent être préparées et les surfaces doivent être rincées à l'eau pour enlever les résidus afin de prévenir la corrosion des surfaces (p. ex. acier inoxydable)Note de bas de page 31. Les déchets liquides peuvent être décontaminés par autoclavage ou en les mélangeant avec de l'eau de Javel à une concentration finale de 5000 ppm d'hypochlorite de sodium et en les laissant ainsi au moins 30 minutes. Les déchets solides peuvent être autoclavés ou incinérésNote de bas de page 5 .
La décontamination (et l'étiquetage confirmant la décontamination) de toutes les matières qui ont pu être en contact avec des vecteurs lentiviraux avant leur retrait de la zone de confinement empêche les matières contaminées de sortir de cette zone. Si une matière doit être décontaminée hors site, elle peut être placée dans un contenant étanche, fermé, étiqueté et dont la surface a été décontaminée.
Chapitre 5 - Glossaire
La plupart des termes de la liste présentée ci-dessous sont tirés de la NCB et du GCB. Il est important de noter que, même si certaines définitions présentées dans ce glossaire sont universellement acceptées, un bon nombre d'entre elles ont été élaborées spécifiquement pour la NCB ou pour le GCB. Par conséquent, certaines définitions peuvent ne pas s'appliquer aux installations non assujetties à la NCB et au GCB. Une liste exhaustive de termes accompagnés de leur définition peut être consultée au glossaire du chapitre 24 du GCB.
- Agent pathogène
- Microorganisme, acide nucléique ou protéine ayant la capacité de causer une maladie ou une infection chez l'humain ou l'animal. Des exemples d'agents pathogènes humains figurent aux annexes 2 à 4 et à la partie 2 de l'annexe 5 de la Loi sur les agents pathogènes humains et les toxines, mais ils ne constituent pas une liste exhaustive.
- Agent zoopathogène
- Agent qui cause des maladies chez les animaux, qu'il soit issu de la biotechnologie ou non. Dans la Norme canadienne sur la biosécurité, le terme « agent zoopathogène » ne réfère qu'à un agent qui cause des maladies chez les animaux terrestres, y compris chez les oiseaux et les amphibiens; toutefois, ce terme ne s'applique pas aux agents qui causent des maladies chez les animaux aquatiques ou les invertébrés.
- Agent zoopathogène non indigène
- Agent pathogène qui provoque une maladie animale figurant sur la liste « Maladies, infections et infestations de la Liste de l'OIE » (révisée régulièrement) de l'Organisation mondiale de la santé animale et qui est considéré comme allogène au Canada (c.-à-d. que cet agent causant des maladies animales exotiques ne se retrouve pas au pays), ou toute autre agent zoopathogène de maladie animale qui n'est pas indigène au Canada, selon ce que l'ACIA a déterminé. Ces agents pathogènes peuvent être dévastateurs en ce qui concerne la santé de la population animale canadienne.
- Biosécurité
- Ensemble des principes, des technologies et des pratiques liés au confinement mis en œuvre pour prévenir l'exposition involontaire à des matières infectieuses et à des toxines, ou leur libération accidentelle.
- Bonnes pratiques microbiologiques
- Code de déontologie fondamental régissant toutes les activités de laboratoire comportant des matières biologiques. Ce code sert à protéger les employés de laboratoire et à prévenir la contamination de leur milieu de travail et des échantillons utilisés.
- Box
- Salle ou espace conçu pour héberger un ou plusieurs animaux et assurant le confinement primaire. Ces espaces servent à héberger des gros animaux (p. ex. bétail, cerfs) ou des petits animaux qui sont hébergés dans des cages ouvertes (c.-à-d. ils ne sont pas hébergés dans des cages de confinement primaire).
- Confinement
- Ensemble de paramètres de conception physique et de pratiques opérationnelles visant à protéger le personnel, le milieu de travail immédiat et la communauté contre toute exposition à des matières biologiques. Dans le même contexte, on utilise aussi le terme « bioconfinement ».
- Dispositif de confinement primaire
- Appareil ou équipement conçus pour empêcher la libération de matières infectieuses et de toxines et assurer le confinement primaire (c.-à-d. former une barrière physique qui sépare la personne ou le milieu de travail des matières biologiques). Les enceintes de sécurité biologique, les isolateurs, les centrifugeuses munies de godets étanches, l'équipement de procédé, les fermenteurs, les micro-isolateurs et les étagères à cages ventilées font partie des dispositifs de confinement primaire.
- Enceinte de sécurité biologique (ESB)
- Dispositif de confinement primaire qui assure la protection du personnel, de l'environnement et des produits (selon la catégorie d'ESB) lors de travaux avec des matières biologiques.
- Équipement de protection individuel (EPI)
- Équipement ou vêtements portés par le personnel à titre de barrière contre les matières infectieuses et les toxines afin de réduire le risque d'exposition à celles-ci. Sarraus, blouses, vêtements de protection couvrant toutes les parties du corps, gants, chaussures de sécurité, lunettes de sécurité, masques et appareils de protection respiratoire, tous sont des exemples d'EPI.
- Évaluation des risques associés à l'agent pathogène
- Détermination du groupe de risque et des exigences liées au confinement physique et aux pratiques opérationnelles nécessaires pour manipuler de façon sécuritaire les matières infectieuses ou les toxines concernées.
- Évaluation locale des risques (ELR)
- Évaluation des risques propre à un endroit en particulier réalisée pour repérer les dangers associés aux activités menées ainsi qu'aux matières infectieuses ou aux toxines utilisées. Cette évaluation permet d'élaborer des stratégies d'atténuation des risques et des stratégies de gestion des risques sur lesquelles on se fondera pour apporter des modifications relativement au confinement physique et aux pratiques opérationnelles dans l'installation concernée.
- Exigence opérationnelle
- Mesure ou procédure administrative appliquées dans une zone de confinement pour protéger le personnel, l'environnement et, ultimement, la communauté contre les matières infectieuses et les toxines, comme on l'énonce au chapitre 4 de la Norme canadienne sur la biosécurité.
- Exigences physiques en matière de confinement
- Mesures d'ingénierie et exigences relatives à la conception de l'installation visant à créer une barrière physique pour protéger le personnel, l'environnement et, ultimement, la communauté contre les agents pathogènes et les toxines, comme on l'énonce au chapitre 3 de la Norme canadienne sur la biosécurité.
- Groupe de risque (GR)
- Groupe dans lequel les matières biologiques sont classées en fonction de leurs caractéristiques inhérentes, comme la pathogénicité, la virulence, le risque de propagation et l'existence d'un traitement prophylactique ou thérapeutique efficace. Le groupe de risque énonce le risque pour la santé du personnel et du public ainsi que la santé des animaux et des populations animales.
- Incident
- Événement ou situation pouvant causer une blessure, du mal, une infection, une intoxication, une maladie ou un dommage. Les incidents peuvent mettre en cause des matières infectieuses, des animaux infectés ou des toxines. Le déversement, la libération et la perte de matières infectieuses ou de toxines ainsi que l'exposition à celles-ci, la fuite d'un animal, les cas où un employé se blesse ou développe une maladie, l'accès non autorisé à la zone de confinement, une panne de courant, un incendie, une explosion, une inondation ainsi que toutes les autres situations de crise (p. ex. séisme, ouragan) sont des exemples d'incidents. Les accidents et ceux évités de justesse sont considérés comme des incidents.
- In vitro
- Du latin « dans le verre »; se rapporte à une expérience menée en milieu artificiel avec des composantes d'un organisme vivant (p. ex. manipulation de cellules dans une boîte de Pétri), y compris les activités comportant des lignées cellulaires ou des œufs.
- In vivo
- Du latin « dans le vivant »; se rapporte à une expérience menée dans un organisme vivant (p. ex. étude des effets d'un traitement antibiotique sur des modèles animaux).
- Manipulation ou entreposage (manipulés ou entreposés)
- Englobent la possession, la manipulation, l'utilisation, la production, l'entreposage, le transfert, l'importation, l'exportation, la libération, le rejet ou l'abandon de toute autre manière de matières infectieuses ou de toxines, ainsi que le fait de permettre l'accès à de telles substances. La manipulation et l'entreposage englobent donc toutes les activités réglementées comportant des agents pathogènes humains ou des toxines énoncées au paragraphe 7(1) de la Loi sur les agents pathogènes humains et les toxines.
- Niveau de confinement (NC)
- Exigences minimales liées au confinement physique et aux pratiques opérationnelles visant la manipulation sécuritaire de matières infectieuses et de toxines dans les laboratoires, les zones de production à grande échelle et les environnements de travail avec des animaux. Il existe quatre niveaux de confinement, allant du niveau de base (niveau de confinement 1 [NC1]) au niveau le plus élevé (niveau de confinement 4 [NC4]).
- Oncogène
- Forme mutée d'un gène qui participe à la croissance cellulaire normale dont l'activation est associée à la transformation de cellules normales en cellules cancéreuses.
- Pathogénicité
- Capacité d'un agent pathogène de causer une maladie chez un hôte humain ou animal.
- Salle animalière
- Salle conçue pour héberger des animaux dans des cages de confinement primaire. Ces espaces servent seulement pour les petits animaux (p. ex. souris, rats, lapins).
- Zone de confinement
- Espace physique qui répond aux exigences liées à un niveau de confinement donné. Il peut s'agir d'une salle unique (p. ex. laboratoire de niveau de confinement 2 [NC2]), d'une série de salles situées dans un même endroit (p. ex. plusieurs espaces de travail en laboratoire de NC2 non adjacents, mais verrouillables) ou d'une série de salles adjacentes (p. ex. salles de niveau de confinement 3 [NC3] comprenant des aires réservées au travail en laboratoire et des salles animalières ou des box séparés). La zone de confinement peut comprendre des zones réservées au soutien, notamment des sas équipés de douches, de vestiaires « propres » et de vestiaires « sales », le cas échéant.
- Zone de confinement de gros animaux (zone GA)
- Zone de confinement d'animaux constituée de deux salles voisines ou adjacentes de niveau de confinement identique ou supérieur, où des animaux sont hébergés dans des box (c.‑à‑d. que la salle assure elle-même le confinement primaire). Une zone GA peut comprendre un box qui héberge un gros animal, comme le bétail ou les cervidés, ou des box où l'on garde, par exemple, des souris ou des ratons laveurs dans des cages ouvertes et non des cages de confinement primaire. Les salles de nécropsie, lorsqu'elles sont présentes, sont considérées comme faisant partie d'une zone GA.
Chapitre 6 - Références et ressources
- Agence canadienne d’inspection des aliments. Exigences relatives à la délivrance des permis liés aux produits biologiques vétérinaires - aperçu. Consulté le 16 mai 2019 à l’adresse http://www.inspection.gc.ca/animaux/produits-biologiques-veterinaires/lignes-directrices-formulaires/4-5f/fra/1318508906578/1318509047147
- Amado, R. G. et Chen, I. S. Y. (1999). Lentiviral vectors—the promise of gene therapy within reach?. Science, 285(5428):674-676.
- Cockrell, A. S., Ma, H., Fu, K., McCown, T. J., et Kafri, T. (2016). A trans-lentiviral packaging cell line for high-titer conditional self-inactivating HIV-1 vectors. Molecular Therapy, 14: 276–284.
- Coffin, J. M., Hughes, S. H. et Varmus, H. E. (1997). Retroviruses. Cold Spring Harbor, New York, États-Unis: Cold Spring Harbor Laboratory Press.
- Curiel, D. T. et Douglas, J. T. (2005). Cancer Gene Therapy (p. 467). Totowa, NJ, États-Unis : Humana Press.
- Debyser, Z. (2003). Biosafety of lentiviral vectors. Current Gene Therapy, 3(6):517-525.
- Escors, D. et Breckpot, K. (2010). Lentiviral vectors in gene therapy: Their current status and future potential. Archivum Immunologiae et Therapie Experimentalis, 58(2):110-119.
- Evans, J. T. et Garcia, J. V. (2000). Lentivirus vector mobilization and spread by human immunodeficiency virus. Human Gene Therapy, 11(17):2331-9.
- Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada. Disponible à l’adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite.html
- Gouvernement du Canada. (2016). Guide canadien sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada. Disponible à l’adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite.html
- Gouvernement du Canada. (2018). Ligne directrice canadienne sur la biosécurité Évaluation des risques associés à l’agent pathogène. Consulté le 22 octobre 2018 à l’adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/directrices/evaluation-risques-pathogene.html
- Gouvernement du Canada. (2019). Directive en matière de biosécurité portant sur le virus de l'immunodéficience humaine (VIH), le virus T-lymphotrope humain (HTLV) et les rétrovirus simiens apparentés. Consulté le 22 juillet 2019 à l’adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/directives-avis-avis-speciaux-matiere-biosecurite/virus-immunodeficience-humaine-vih-et-virus-t-lymphotrope-humain-htlv-et-retrovirus-simiens-apparentes.html
- Gouvernement du Canada. Direction des produits biologiques et des thérapies génétiques. Consulté le 16 mai 2019 à l’adresse https://www.canada.ca/fr/sante-canada/organisation/a-propos-sante-canada/directions-generales-agences/direction-generale-produits-sante-aliments/direction-produits-biologiques-therapies-genetiques.html
- Gouvernement du Canada. Modèle d’évaluation des risques associés à l’agent pathogène. Disponible à l’adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/fiches-techniques-sante-securite-agents-pathogenes-evaluation-risques/modele-evaluation-risques-agent-pathogene.html
- Johnson, L. G., Olsen, J. C., & Boucher, R. C. (2000). Pseudotyped human lentiviral vector-mediated gene transfer to airway epithelia in vivo. Gene Therapy, 7(7): 568-574.
- Kappes, J. C. et Wu, X. (2001). Safety considerations in vector development. Somatic Cell and Molecular Genetics, 26(1-6):147-158.
- Loi sur la santé des animaux (L.C. 1990, ch. 21). (2015).
- Loi sur les agents pathogènes humains et les toxines (L.C. 2009, ch. 24). (2015).
- Matrai, J., Chuah, M. K. et VandenDriessche, T. (2010). Recent advances in lentiviral vector development and applications. Molecular Therapy: The Journal of the American Society of Gene Therapy, 18(3):477-490.
- Miller D. G., Adam M.A. et Miller A. D. (1990). Gene transfer by retrovirus vectors occurs only in cells that are actively replicating at the time of infection. Molecular Cell Biology, 10(8):4239‑4242.
- Nakagawa, T. et Hoogenraad, C. C. (2011). Lentiviral transgenesis. Methods in Molecular Biology, 693:117-142.
- Naldini, L., Blömer, U., Gallay, P., Ory, D., Mulligan, R. et coll. (1996). In vivo gene delivery and stable transduction of nondividing cells by a lentiviral vector. Science, 272(5259):263-7.
- Oregon Health and Science University. (2010). Lentiviral Biosafety Manual. Consulté le 1er février 2018 à l’adresse http://www.ohsu.edu/xd/about/services/integrity/policies/upload/Template-Lentivirus-Biosafety-Manual.doc
- Pauwels, K., Gijsbers, R., Toelen, J., Schambach, A., Willard-Gallo, K. et coll. (2009). State‑of-the-art lentiviral vectors for research use: risk assessment and biosafety recommendations. Current Gene Therapy, 9(6):459-474.
- Règlement sur la santé des animaux (C.R.C., ch. 296). (2015).
- Règlement sur les agents pathogènes humains et les toxines (DORS/2015-44). (2015).
- Reuter, J. D., Fang, X., Ly, C. S., Suter, K. K. et Gibbs, D. (2012). Assessment of hazard risk associated with the intravenous use of viral vectors in rodents. Comparative Medicine, 62(5):361–70.
- Schlimgen, R., Howard, J., Wooley, D., Thompson, M., Baden, L.R. et coll. (2016). Risks associated with lentiviral vector exposures and prevention strategies. Journal of Occupational and Environmental Medicine, 58(12):1159-66.
- Soneoka, Y., Cannon, P. M., Ramsdale, E. E., Griffiths, J. C., Romano, G. et coll. (1995). A transient three-plasmid expression system for the production of high titer retroviral vectors. Nucleic Acids Research, 23(4):628-33.
- Takeuchi, Y., Cosset, F. L., Lachmann, P. J., Okada, H., Weiss, R. A. et Collins, M. K. (1994). Type C retrovirus inactivation by human complement is determined by both the viral genome and the producer cell. Journal of Virology, 68:8001–7.
- Templeton, N. S. (2009). Gene and Cell Therapy: Therapeutic Mechanisms and Strategies (3e éd., p. 215). Boca Raton, FL, États-Unis: CRC Press.
- United States National Institutes of Health. (2006). Recombinant DNA Advisory Committee Guidance Document – Biosafety Considerations for Research with Lentiviral Vectors. Consulté le 21 juillet 2016 à l’adresse https://osp.od.nih.gov/wp-content/uploads/2013/12/Lenti_Containment_Guidance.pdf
- United States Department of Health and Human Services, Food and Drug Administration. (2006). Guidance for industry – supplemental guidance on testing for replication competent retrovirus in retroviral vector -based gene therapy products and during follow-up of patients in clinical trials using retroviral vectors. Consulté le 24 juillet 2017 à l’adresse http://www.fda.gov/downloads/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/Guidances/CellularandGeneTherapy/ucm078723.pdf
- Vink, C. A., Counsell, J. R., Perocheau, D. P., Karda, R., Buckley, S. M. K., et coll. (2017). Eliminating HIV-1 packaging sequences from lentiviral vector proviruses enhances safety and expedites gene transfer for gene therapy. Molecular Therapy, 25(8): 1790-1804.
Notes de bas de page
- Note de bas de page 1
-
Gouvernement du Canada. (2015). Norme canadienne sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada. Consulté le 22 octobre 2018 à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite.html
- Note de bas de page 2
-
Gouvernement du Canada. (2016). Guide canadien sur la biosécurité, 2e éd., Ottawa, ON, Canada : Gouvernement du Canada. Consulté le 22 octobre 2018 à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite.html
- Note de bas de page 3
-
Escors, D. et Breckpot, K. (2010). Lentiviral Vectors in Gene Therapy: Their Current Status and Future Potential, Archivum Immunologiae et Therapiae Experimentalis, 58(2):107-119.
- Note de bas de page 4
-
Pauwels, K., Gijsbers, R., Toelen, J., Schambach, A., Willard-Gallo, K. et coll. (2009). State-of-the-art Lentiviral Vectors for Research Use: Risk Assessment and Biosafety Recommendations, Current Gene Therapy, 9(6):459-474.
- Note de bas de page 5
-
Nakagawa, T. et Hoogenraad, C. C. (2011). Lentiviral transgenesis. Methods in Molecular Biology, 693:117-142.
- Note de bas de page 6
-
United States National Institutes of Health. (2006). Biosafety Considerations for Research with Lentiviral Vectors –Recombinant DNA Advisory Committee Guidance Document. Consulté le 21 juillet 2016 à l'adresse https://osp.od.nih.gov/wp-content/uploads/2013/12/Lenti_Containment_Guidance.pdf
- Note de bas de page 7
-
Coffin, J. M., Hughes, S. H., et Varmus, H. E. (1997). Retroviruses. Cold Spring Harbor, NY, États-Unis : Cold Spring Harbor Laboratory Press.
- Note de bas de page 8
-
Debyser, Z. (2003). Biosafety of Lentiviral Vectors. Current Gene Therapy, 3(6):517-525.
- Note de bas de page 9
-
Amado, R. G. et Chen, I. S. Y. (1999). Lentiviral Vectors--the Promise of Gene Therapy Within Reach?. Science, 285(5428): 674-676.
- Note de bas de page 10
-
Templeton, N. S. (2009). Gene and Cell Therapy: Therapeutic Mechanisms and Strategies (3e éd. p. 215). Boca Raton, FL, États-Unis : CRC Press.
- Note de bas de page 11
-
Soneoka, Y., Cannon, P. M., Ramsdale, E.E., Griffiths, J. C., Romano, G. et coll. (1995). A transient three-plasmid expression system for the production of high titer retroviral vectors. Nucleic Acids Research, 23(4):628-33.
- Note de bas de page 12
-
Miller, D. G., Adam, M. A., et Miller, A. D. (1990). Gene transfer by retrovirus vectors occurs only in cells that are actively replicating at the time of infection. Molecular Cell Biology, 10(8): 4239-4242.
- Note de bas de page 13
-
Takeuchi, Y., Cosset, F. L., Lachmann, P. J., Okada, H., Weiss, R. A., et Collins, M. K. (1994). Type C retrovirus inactivation by human complement is determined by both the viral genome and the producer cell. Journal of Virology, 68: 8001-8007.
- Note de bas de page 14
-
Naldini, L., Blömer, U., Gallay, P., Ory, D., Mulligan, R. et coll. (1996). In Vivo Gene Delivery and Stable Transduction of Nondividing Cells by a Lentiviral Vector. Science, 272(5259):263-7.
- Note de bas de page 15
-
Matrai, J., Chuah, M. K. et VandenDriessche, T. (2010). Recent advances in lentiviral vector development and applications. Molecular Therapy: The Journal of the American Society of Gene Therapy, 18(3):477-490.
- Note de bas de page 16
-
Vink, C. A., Counsell, J. R., Perocheau, D. P., Karda, R., Buckley, S. M. K., Brugman, M. H., Galla, M., Schambach, A., McKay, T. R., Waddington, S. N. et Howe, S. J. (2017). Eliminating HIV-1 Packaging Sequences from Lentiviral Vector Proviruses Enhances Safety and Expedites Gene Transfer for Gene Therapy. Molecular Therapy, 25(8):1790-1804.
- Note de bas de page 17
-
Cockrell, A. S., Ma, H., Fu, K., McCown, T. J. et Kafri, T. (2006). A trans-lentiviral packaging cell line for high-titer conditional self-inactivating HIV-1 vectors. Molecular Therapy, 14:276-284.
- Note de bas de page 18
-
Schlimgen, R., Howard, J., Wooley, D., Thompson, M., Baden, L. R. et coll. (2016). Risks Associated With Lentiviral Vector Exposures and Prevention Strategies. Journal of Occupational and Environmental Medicine, 58(12):1159-66.
- Note de bas de page 19
-
Gouvernement du Canada. (2018). Ligne directrice canadienne sur la biosécurité Évaluation des risques associés à l'agent pathogène. Consulté le 22 octobre 2018 à l'adresse https://www.canada.ca/fr/sante-publique/services/normes-lignes-directrices-canadiennes-biosecurite/directrices/evaluation-risques-pathogene.html
- Note de bas de page 20
-
Gouvernement du Canada. (2018). Modèle d'évaluation des risques associés à l'agent pathogène. Consulté le 22 octobre 2018 à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/fiches-techniques-sante-securite-agents-pathogenes-evaluation-risques/modele-evaluation-risques-agent-pathogene.html
- Note de bas de page 21
-
Gouvernement du Canada. (2017). Directive en matière de biosécurité portant sur le virus de l'immunodéficience humaine (VIH), le virus T-lymphotrope humain (HTLV) et les rétrovirus simiens apparentés. Consulté le 22 juillet 2019 à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/directives-avis-avis-speciaux-matiere-biosecurite/virus-immunodeficience-humaine-vih-et-virus-t-lymphotrope-humain-htlv-et-retrovirus-simiens-apparentes.html
- Note de bas de page 22
-
Curiel, D. T. et Douglas, J. T. (2005). Cancer Gene Therapy (p. 467), Totowa, NJ, États-Unis : Humana Press.
- Note de bas de page 23
-
Kappes, J. C. et Wu, X. (2001). Safety considerations in vector development. Somatic Cell and Molecular Genetics, 26(1-6):147-158.
- Note de bas de page 24
-
Johnson, L. G., Olsen, J. C. et Boucher, R. C. (2000). Pseudotyped human lentiviral vector-mediated gene transfer to airway epithelia in vivo. Gene Therapy, 7(7): 568-574.
- Note de bas de page 25
-
Evans, J. T. et Garcia, J. V. (2000). Lentivirus vector mobilization and spread by human immunodeficiency virus. Human Gene Therapy, 11(17):2331-9.
- Note de bas de page 26
-
Gouvernement du Canada. (2017). Directive en matière de biosécurité portant sur le virus de l'immunodéficience humaine (VIH), le virus T-lymphotrope humain (HTLV) et les rétrovirus simiens apparentés. Consulté le 22 juillet 2019 à l'adresse https://www.canada.ca/fr/sante-publique/services/biosecurite-biosurete-laboratoire/directives-avis-avis-speciaux-matiere-biosecurite/virus-immunodeficience-humaine-vih-et-virus-t-lymphotrope-humain-htlv-et-retrovirus-simiens-apparentes.html
- Note de bas de page 27
-
United States Department of Health and Human Services, Food and Drug Administration. (2006). Guidance for industry – supplemental guidance on testing for replication competent retrovirus in retroviral vector -based gene therapy products and during follow-up of patients in clinical trials using retroviral vectors. Consulté le 24 juillet 2017 à l'adresse http://www.fda.gov/downloads/BiologicsBloodVaccines/GuidanceComplianceRegulatoryInformation/Guidances/CellularandGeneTherapy/ucm078723.pdf
- Note de bas de page 28
-
Gouvernement du Canada. Direction des produits biologiques et des thérapies génétiques. Consulté le 16 mai 2019 à l'adresse https://www.canada.ca/fr/sante-canada/organisation/a-propos-sante-canada/directions-generales-agences/direction-generale-produits-sante-aliments/direction-produits-biologiques-therapies-genetiques.html
- Note de bas de page 29
-
Agence canadienne d'inspection des aliments. Exigences relatives à la délivrance des permis liés aux produits biologiques vétérinaires - aperçu. Consulté le 16 mai 2019 à l'adresse http://www.inspection.gc.ca/animaux/produits-biologiques-veterinaires/lignes-directrices-formulaires/4-5f/fra/1318508906578/1318509047147
- Note de bas de page 30
-
Reuter, J. D., Fang, X., Ly, C. S., Suter, K. K., et Gibbs, D. (2012). Assessment of hazard risk associated with the intravenous use of viral vectors in rodents. Comparative Medicine, 62(5): 361-370.
- Note de bas de page 31
-
Oregon Health and Science University. (2010). Lentiviral Biosafety Manual. Consulté le 1er février 2018 à l’adresse http://www.ohsu.edu/xd/about/services/integrity/policies/upload/Template-Lentivirus-Biosafety-Manual.doc