Directives mises à jour sur la vaccination antigrippale pendant la grossesse
Télécharger en format PDF
(1,50 Mo, 83 pages)
Organisation : Agence de la santé publique du Canada
Date de publication : 2023-12-18
Sur cette page
- Préambule
- Résumé des renseignements contenus dans la présente déclaration
- Introduction
- Méthodologie
- Épidémiologie
- Vaccin
- Considérations en matière d'éthique, d'équité, de faisabilité et d'acceptabilité
- Discussion
- Recommandations
- Priorités de recherche
- Priorités de surveillance
- Tableaux
- Liste des abréviations
- Remerciements
- Annexe A : Méthodologie de mise à jour de l'examen
- Annexe B : Organigramme prisma pour la mise à jour de l'examen
- Références
Préambule
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ci-après appelée l'ASPC) des conseils continus et à jour liés à la vaccination dans le domaine de la médecine, des sciences et de la santé publique.
Outre le fardeau d'une maladie et les caractéristiques du vaccin, l'ASPC a élargi le mandat du CCNI pour inclure la prise en compte de facteurs programmatiques dans l'élaboration de recommandations fondées sur des données probantes afin de faciliter la prise de décisions opportunes concernant les programmes de vaccination financés par l'État à l'échelle provinciale et territoriale.
Les autres facteurs que le CCNI doit prendre en compte sont l'économie, l'éthique, l'équité, la faisabilité et l'acceptabilité. Au cours des prochaines années, le CCNI peaufinera ses approches méthodologiques afin d'inclure ces facteurs. Les déclarations du CCNI ne nécessiteront pas toutes une analyse approfondie de l'ensemble des facteurs programmatiques. Alors que le CCNI travaille à la mise en œuvre complète de son mandat élargi, certaines déclarations incluront des analyses programmatiques à des degrés divers pour les programmes de santé publique.
L'ASPC confirme que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d'information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait homologuer les vaccins et ont montré leur innocuité et leur efficacité potentielle lorsqu'ils sont utilisés conformément à la monographie de produit uniquement. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'ASPC régissant les conflits d'intérêts, notamment déclarer chaque année les conflits d'intérêts possibles.
Résumé des renseignements contenus dans la présente déclaration
Les principaux renseignements suivants sont destinés aux vaccinateurs. Voir le reste de la déclaration pour plus de détails.
Quoi
L'infection grippale saisonnière est une maladie respiratoire qui peut entraîner des complications graves et des issues indésirables, en particulier pour les personnes enceintes, le fœtus en développement et les nourrissons âgés de moins de 6 mois. La vaccination antigrippale est sans risque et constitue le meilleur moyen de prévenir l'infection chez les personnes enceintes et les nourrissons âgés de moins de 6 mois. Ces personnes enceintes doivent être vaccinées en priorité contre la grippe en raison des risques accrus de maladie sévère pendant la grossesse; malgré cela, le taux de vaccination antigrippale dans ce groupe demeure sous-optimal.
Les recommandations suivantes concernant la vaccination antigrippale pendant la grossesse complètent les recommandations générales du CCNI en matière de vaccination antigrippale, qui figurent dans la Déclaration sur la vaccination antigrippale saisonnière du Comité. Ce dernier recommande que les personnes, quel que soit le stade de la grossesse, reçoivent chaque saison grippale un vaccin antigrippal inactivé (VII) sans adjuvant ou recombinant (VAR) adapté à leur âge.
Qui
Cette déclaration supplémentaire fournit un résumé des données probantes sur l'innocuité et l'efficacité réelle (ER) de la vaccination antigrippale chez les personnes enceintes, ainsi que sur les avantages et les risques pour le fœtus en développement et les nourrissons âgés de moins de 6 mois.
Comment
Les VII ou VAR devraient être proposés chaque année, quel que soit l'âge gestationnel, pendant la grossesse. La vaccination antigrippale peut être administrée en même temps qu'un autre vaccin, y compris le vaccin contre la COVID-19 ou le vaccin contre la coqueluche, ou à tout moment, avant ou après l'administration de cet autre vaccin.
Pourquoi
Les personnes enceintes, leurs fœtus et les nourrissons courent un risque élevé de complications liées à la grippe. Par conséquent, la vaccination annuelle contre la grippe est fortement recommandée pendant la grossesse. La vaccination antigrippale pendant la grossesse s'est toujours révélée sans risque et est étayée par de nombreuses études. En outre, il a été démontré que la vaccination réduisait la morbidité et la mortalité associées à l'infection grippale. De plus, étant donné que les issues de la grippe pendant la grossesse peuvent avoir un impact négatif sur le développement du fœtus, la vaccination de la personne enceinte contribue à protéger le fœtus. En sus, le transfert passif des anticorps issus de la vaccination pendant la grossesse protège les nouveau-nés au cours de leurs premiers mois de vie, lorsqu'ils présentent un risque élevé de complications liées à l'infection grippale et qu'ils sont trop jeunes pour être vaccinés. Dans l'ensemble, les données probantes disponibles confirment l'innocuité et l'ER des vaccins antigrippaux pendant la grossesse.
Introduction
Contexte des vaccins antigrippaux, des programmes de vaccination et recommandations pendant la grossesse au Canada
Avant la pandémie de COVID-19, les virus grippaux étaient à l'origine d'environ 40 000 cas de grippe confirmés en laboratoire (GCL), de 12 200 hospitalisations et de 3 500 décès chaque année au CanadaNote de bas de page 1Note de bas de page 2Note de bas de page 3. À ce titre, le CCNI recommande que le vaccin antigrippal soit proposé chaque année à toute personne de 6 mois ou plus qui ne présente pas de contrindication au vaccin. Le CCNI a également identifié des groupes à risque accru de complications de la grippe pour lesquels la vaccination antigrippale est particulièrement recommandée. (Forte recommandation du CCNI)
Le CCNI a identifié les personnes enceintes comme l'un des groupes à haut risque pour lesquels la vaccination antigrippale est particulièrement importante. En raison des modifications anatomiques, immunitaires et cardiovasculaires liées à la grossesse, les personnes enceintes présentent un risque plus élevé de contracter une grippe sévère et les complications qui en découlent, telles que la pneumonie, l'hospitalisation et le décès, que celles qui ne sont pas enceintesNote de bas de page 4Note de bas de page 5Note de bas de page 6. L'infection grippale pendant la grossesse n'affecte pas seulement les personnes enceintes mais peut également avoir un impact sur le fœtus en développement et augmenter le risque d'avortement spontané (AS) en fin de grossesse, de mortinaissance, d'insuffisance pondérale à la naissance (IPN) et d'accouchement prématuréNote de bas de page 6Note de bas de page 7. Il est donc fortement recommandé de vacciner les personnes enceintes contre la grippe afin de les protéger, ainsi que leurs nourrissons, d'une maladie sévère, d'autant plus que ceux de moins de 6 mois ne sont pas admissibles à la vaccination antigrippale.
Les recommandations du CCNI concernant l'utilisation des vaccins antigrippaux pendant la grossesse et l'allaitement ont évolué au fil du temps. Avant 2007, le CCNI encourageait toutes les personnes enceintes à se faire vacciner contre la grippe mais ne considérait pas ces dernières sans comorbidité comme un groupe prioritaire pour les programmes de vaccination. En 2007, le CCNI a révisé sa recommandation visant à identifier toutes les personnes enceintes comme un groupe pour lequel le vaccin antigrippal est particulièrement recommandé en raison du risque élevé de complications liées à la grippe. Le CCNI souligne également que la vaccination antigrippale pendant la grossesse protège à la fois les personnes enceintes et leur nouveau-né grâce à une immunité passive par transfert transplacentaire d'anticorps de ces dernières jusqu'au moment où les nourrissons peuvent eux-mêmes recevoir le vaccin.
Bien que les personnes enceintes soient prioritaires pour recevoir des vaccins antigrippaux en raison des risques accrus de maladie sévère, le taux de vaccination demeure inférieur à celui de la population non enceinte. En outre, on observe un fardeau disproportionné de la maladie et un faible taux de vaccination chez les populations enceintes et racialisées, autochtones, plus jeunes et/ou ayant un faible revenu du ménageNote de bas de page 8Note de bas de page 9Note de bas de page 10Note de bas de page 11.
L'innocuité, l'efficacité potentielle (EP) et l'ER des vaccins antigrippaux pendant la grossesse font l'objet de publications de plus en plus nombreuses. La nécessité de cette déclaration supplémentaire du CCNI sur l'utilisation des vaccins antigrippaux pendant la grossesse a été déclenchée par une étude identifiant un risque potentiel de l'augmentation des AS précoces chez les personnes enceintes ayant reçu des vaccins antigrippaux en 2010 et 2011Note de bas de page 12. Depuis lors, plusieurs études ont été publiées et n'ont révélé aucun lien entre les vaccins antigrippaux administrés pendant la grossesse et les issues indésirables chez les personnes enceintes ou les nourrissonsNote de bas de page 13Note de bas de page 14Note de bas de page 15Note de bas de page 16. Le CCNI a saisi cette occasion pour examiner l'innocuité, l'EP et l'ER du vaccin antigrippal pendant la grossesse. De plus, cette déclaration vise à synthétiser les renseignements et les données probantes clés afin d'aider les programmes de vaccination provinciaux et territoriaux et les professionnels de soins primaires à proposer le vaccin antigrippal aux personnes enceintes.
Les effets bénéfiques de la vaccination pendant la grossesse pour le fœtus et le nouveau-né sont bien documentés. La vaccination pendant la grossesse s'est toujours révélée sans risque et protège la personne enceinte contre les maladies évitables par la vaccination qui pourraient autrement être contractées et transmises au fœtus ou au nourrisson. En outre, des concentrations protectrices d'anticorps sont transférées au fœtus par voie transplacentaire, ce qui se traduit généralement par une protection du nourrisson contre l'infection au cours des premiers mois de sa vie. Pour des renseignements sur les avantages et l'innocuité des vaccins recommandés pendant la grossesse et l'allaitement, voir le chapitre immunisation durant la grossesse et l'allaitement du Guide canadien d'immunisation (GCI).
Objectif des directives
La déclaration suivante du Comité consultatif sur la vaccination antigrippale pendant la grossesse complète les recommandations générales du CCNI sur la vaccination antigrippale, qui figurent dans la déclaration sur la vaccination antigrippale saisonnière du CCNI. Cette déclaration supplémentaire a pour objectif de fournir des directives actualisées sur l'utilisation de la vaccination antigrippale pendant la grossesse. La déclaration décrit le risque disproportionné de morbidité et de mortalité chez les personnes enceintes et les nourrissons âgés de moins de 6 mois qui contractent la grippe par rapport à la population générale; elle passe en revue les données probantes disponibles sur l'EP, l'ER et l'innocuité de la vaccination antigrippale pendant la grossesse; et explore les considérations d'éthique, d'équité, de faisabilité et d'acceptabilité (EEFA) de la vaccination des personnes enceintes contre la grippe. Sur la base de cet ensemble de données probantes, la déclaration supplémentaire réaffirme l'innocuité et l'importance de la vaccination antigrippale pendant la grossesse.
Allaitement
Il est reconnu que les personnes enceintes et les personnes qui allaitent sont des populations qui se recoupent étroitement; toutefois, il existe des différences dans les considérations relatives à la vaccination pour chacune d'entre elles. L'objectif de cette déclaration supplémentaire est d'examiner spécifiquement la vaccination antigrippale pendant la grossesse, compte tenu d'une préoccupation possible établie concernant son innocuité. Par conséquent, cette déclaration supplémentaire n'examine pas l'innocuité ni l'ER de la vaccination antigrippale pendant l'allaitement.
Comme il est indiqué dans la Déclaration sur la vaccination antigrippale saisonnière du CCNI, la vaccination annuelle contre la grippe est recommandée pendant l'allaitement, et des vaccins antigrippaux non vivants ou des vaccins vivants atténués contre l'influenza (VVAI) peuvent être administrés aux personnes qui allaitent. Aucun signalement en matière d'innocuité n'a été identifié pour la vaccination antigrippale pendant l'allaitement, ni aucun mécanisme biologique hypothétique pour un problème d'innocuité avec les produits actuellement autorisés. Pour de plus amples renseignements sur ce sujet, voir la Déclaration susmentionnée et le chapitre du CGI sur l'immunisation durant la grossesse et l'allaitement.
Une note sur les termes
Le CCNI reconnaît que toutes les personnes qui accouchent ou qui allaitent ne s'identifient pas nécessairement comme des femmes ou des mères. Une grande partie de la recherche disponible actuellement ne fait référence qu'aux « femmes » lorsqu'elle aborde la question de la grossesse. Lorsqu'il cite une recherche, le CCNI utilise les termes qui se trouvent dans l'étude. Dans ces cas, le terme « femme » désigne une personne à qui on a assigné de sexe féminin à la naissance et le terme « maternel » est utilisé pour identifier la personne qui est enceinte ou en post-partum. Aux fins de la présente déclaration, les termes « femme », « femmes » et « maternel » devraient être considérés comme s'appliquant également aux personnes qui ne s'identifient pas spécifiquement comme étant de sexe féminin mais qui sont les parents qui mettent le fœtus en gestation ou qui allaitent le nourrisson.
Méthodologie
En résumé, les grandes étapes de la préparation d'une déclaration du CCNI sont les suivantes :
- Synthèse des connaissances : recherche et résumé de la littérature, évaluation de la qualité des données probantes (voir le Tableau 1. Résumé des données probantes).
- Synthèse de l'ensemble des données probantes : avantages (EP et ER) et inconvénients potentiels (innocuité), en tenant compte de la qualité des données probantes synthétisées et, le cas échéant, de l'ampleur des effets observés dans l'ensemble des études.
- Utilisation d'un cadre publié et évalué par des pairs et d'outils fondés sur des données probantes pour veiller à ce que les questions liées à l'EEFA soient systématiquement évaluées et intégrées dans les directivesNote de bas de page 17. Réalisation d'analyses économiques de la santé, s'il y a lieu.
- Utilisation des données probantes pour formuler des recommandations.
De plus amples renseignements sur le processus et les procédures du CCNI sont disponibles ailleurs.
Pour répondre aux objectifs de cette déclaration, un ES de novo a été réalisé afin de recueillir des données probantes pour étayer les recommandations du CCNI concernant l'utilisation des vaccins antigrippaux pendant la grossesse. La méthodologie a été précisée a priori dans un protocole écritNote de bas de page 18. Le protocole d'examen et la synthèse des connaissances ont été élaborés et réalisés en collaboration avec le Methods and Applications Group for Indirect Comparisons (MAGIC) par l'intermédiaire du Réseau sur l'innocuité et l'efficacité des médicaments (RIEM) et supervisés par le Groupe de travail sur l'influenza (GTI) du CCNI. Une mise à jour de la recherche documentaire a été effectuée par le Secrétariat du CCNI en collaboration avec un bibliothécaire de la Bibliothèque de la santé de Santé Canada et de l'ASPC. Aucune analyse économique de la santé n'a été réalisée, car elle n'a pas été jugée comme étant nécessaire pour cette déclaration. Les données probantes et les recommandations proposées ont été présentées au CCNI pour délibération le 27 avril 2023 et approuvées après un examen approfondi des données probantes. Les considérations pertinentes, la justification des décisions particulières et les lacunes en matière de connaissances sont décrites dans les sections suivantes.
Pour une description complète de la méthodologie de l'examen, y compris des détails sur l'admissibilité des études, la recherche documentaire, la sélection des études, la collecte des données et les méthodes statistiques, voir Wolfe et al. (2020)Note de bas de page 18. La méthodologie liée à la mise à jour de l'examen effectué par le Secrétariat du CCNI est présentée à l'Annexe A.
La question de politique générale abordée dans cette déclaration est la suivante : La grossesse (quel que soit l'âge gestationnel) devrait-elle continuer à figurer parmi les catégories de risque pour lesquelles la vaccination antigrippale est prioritaire?
Pour répondre à l'objectif de cette déclaration, d'autres analyses documentaires informelles ont été réalisées au besoin afin de recueillir des données et des renseignements, notamment :
- Épidémiologie et fardeau estimé de la maladie grippale chez les personnes enceintes et les nourrissons âgés de moins de 6 mois
- Analyse environnementale des recommandations et des considérations relatives à l'utilisation des vaccins antigrippaux pendant la grossesse dans les provinces et territoires canadiens et dans d'autres pays à revenu élevé
Pour élaborer des recommandations complètes et appropriées sur les programmes de vaccination, le CCNI tient compte de plusieurs facteurs. Outre l'évaluation critique des données probantes sur le fardeau de la maladie et les caractéristiques des vaccins telles que l'innocuité, l'EP, l'immunogénicité et l'ER, le CCNI applique le cadre EEFA et les outils connexes fondés sur des données probantes (filtres intégrés en matière d'éthique, matrice d'équité, matrice de faisabilité, matrice d'acceptabilité) afin de prendre systématiquement en considération ces facteurs programmatiques pour élaborer des recommandations claires, complètes et appropriées en vue d'une prise de décision opportune et transparenteNote de bas de page 19. Pour plus de détails sur l'élaboration et l'application du cadre EEFA du CCNI et des outils connexes (y compris les filtres intégrés susmentionnés), voir Ismail et al. (2020)Note de bas de page 19.
Épidémiologie
Estimation du fardeau de la grippe chez les personnes enceintes
Les personnes enceintes sont plus susceptibles de contracter une grippe sévère tout au long de la grossesse, notamment au cours du troisième trimestreNote de bas de page 20Note de bas de page 21Note de bas de page 22Note de bas de page 23Note de bas de page 24. Une méta-analyse (MA) de 2019 sur la grippe saisonnière et pandémique H1N1 a révélé que les personnes enceintes présentaient un risque 7 fois plus élevé d'hospitalisation attribuable à la grippe que les personnes non enceintes (rapport des cotes [RC] = 6,80; intervalle de confiance [IC] à 95 % : 6,02 à 7,68 %) mais qu'elles n'étaient pas plus exposées au risque d'admission à l'unité de soins intensifs (USI) ou de décèsNote de bas de page 22. Pendant la pandémie de grippe H1N1 de 2009, un ES a toutefois démontré que les personnes enceintes présentaient un risque plus élevé d'hospitalisation, d'admission à l'USI et de décès liés à la grippe que les personnes non enceintesNote de bas de page 25. En particulier, le risque relatif médian d'infection grippale était de 6,8 (intervalle de 3,5 à 25,3) par rapport à la population générale.
Estimation de l'impact de la grippe sur les issues périnatales
L'infection grippale pendant la grossesse peut avoir des issues périnatales graves. Une MA de 2021 des études mondiales sur la grippe saisonnière et pandémique H1N1 a rapporté que les personnes enceintes présentaient un risque 3 fois plus élevé de mortinaissance après une infection grippale (rapport des risques [RR] = 3,62; IC à 95 % : 1,60 à 8,20 %)Note de bas de page 26. Des études menées en Australie, en Inde, au Pérou et en Thaïlande ont également révélé un lien significatif entre l'infection par la grippe saisonnière pendant la grossesse et un poids de naissance plus faible ainsi qu'un AS tardifNote de bas de page 6Note de bas de page 27. De plus, un ES de 2017 a fait état de données probantes limitées et mitigées lors de l'évaluation du risque d'issues défavorables à la naissance, y compris la prématurité, l'IPN ou la mort fœtale, chez les personnes atteintes d'une maladie grippale clinique ou d'une GCL pendant la grossesse, par rapport à celles qui n'ont pas été infectées par la grippeNote de bas de page 28. Bien qu'un petit sous-groupe d'études de meilleure qualité ait signalé un lien entre la grippe pandémique H1N1 (pH1N1) et les naissances prématurées (avec des RR allant de 2,4 à 4,0 pour une maladie sévère) et la mort fœtale (RR de 1,9 pour une maladie légère à modérée et de 4,2 pour une maladie sévère), aucune conclusion définitive sur l'ampleur de lien ne peut être tirée à l'heure actuelle sur la base de ces données limitées.
Estimation du fardeau de la grippe chez les nourrissons âgés de moins de six mois
Les jeunes nourrissons sont particulièrement vulnérables à l'infection grippale et à ses complications en raison de leur système immunitaire sous-développé et de leur inadmissibilité au vaccin antigrippal. La grippe est l'une des principales causes d'infection respiratoire chez les enfants de moins d'un (1) an et est à l'origine d'environ 280 000 hospitalisations pour cause respiratoire chaque année dans le monde chez les enfants de moins de 6 mois (IC à 95 % : 150 000 à 344 000)Note de bas de page 7Note de bas de page 29Note de bas de page 30Note de bas de page 31. En 2018, les admissions et décès à l'hôpital attribuables à la grippe saisonnière chez les enfants de moins de 5 ans sont survenus de manière disproportionnée chez les nourrissons âgés de moins de 6 mois (23 % et 36 %, respectivement) et principalement dans les pays à revenu faible ou intermédiaire de la tranche inférieureNote de bas de page 32. Au Canada, une étude nationale de surveillance active des admissions pour grippe pédiatrique a révélé que les nourrissons âgés de moins de 6 mois représentaient 13,5 % des enfants de moins de 16 ans admis pour grippe entre 2010-11 et 2020-21, ce qui souligne l'importance du fardeau de la grippe et des complications qui y sont associées pour ce groupe d'âgeNote de bas de page 33. En outre, les données de surveillance américaines de 2004 à 2012 ont révélé que les nourrissons âgés de moins de 3 mois étaient 40 % plus susceptibles, tandis que ceux âgés de 3 à 6 mois étaient 45 % plus susceptibles d'être admis à l'USI en raison d'une GCL, par rapport aux nourrissons âgés de 6 à 12 mois (RC = 1,40; IC à 95 % : 1,04 à 1,88 % et RC = 1,45; IC à 95 % : 1,03 à 2,04 %, respectivement)Note de bas de page 29. Le taux de mortalité associé à la grippe a été estimé à 0,66 (IC à 95 % : 0,53 à 0,82 %)Note de bas de page 34. Lors de la pandémie de grippe H1N1 de 2009, une étude américaine a fait état d'un taux d'hospitalisation attribuable à la GCL de 20,2 pour 10 000 nourrissons âgés de moins de 6 moisNote de bas de page 35.
Couverture vaccinale contre la grippe chez les personnes enceintes au Canada
Au Canada, la couverture vaccinale contre la grippe pendant la grossesse est passée de 45,0 % en 2019 à 52,7 % en 2021Note de bas de page 36. Toutefois, la couverture variait selon la province ou le territoire; en 2021, la Nouvelle-Écosse affichait le taux de vaccination le plus élevé (82,5 %) et le Québec le taux le plus faible (44,2 %). Dans l'ensemble, la couverture vaccinale a augmenté dans toutes les administrations de 2019 à 2021, à l'exception de la Saskatchewan (de 64,9 % à 64,8 %, respectivement) et des Territoires du Nord-Ouest (de 84,8 % à 71,7 %, respectivement). La couverture vaccinale variait également en fonction du statut autochtone et du revenu. L'écart de couverture vaccinale contre la grippe entre les personnes enceintes autochtones et les personnes enceintes non autochtones s'est creusé en 2021 (couverture vaccinale de 28 % contre 54 %, respectivement) par rapport à 2019 (couverture vaccinale de 35 % contre 46 %, respectivement)Note de bas de page 36. De plus, les personnes appartenant aux groupes à faible revenu (revenu des ménages inférieur à 80 000 dollars) présentaient des taux de vaccination contre la grippe inférieurs à ceux du revenu des ménages le plus élevéNote de bas de page 36.
Vaccin
Administration concomitante d'autres vaccins
Les vaccins antigrippaux peuvent être administrés de façon concomitante (c.-à-d., le même jour) ou à tout moment avant ou après d'autres vaccins recommandés pendant la grossesse. Les données probantes actuelles suggèrent que l'administration concomitante des vaccins recommandés pendant la grossesse est sans risque, malgré l'augmentation potentielle des réactions indésirables locales et systémiques, y compris la fièvre. Il n'existe aucune donnée probante à l'appui des séquelles de grossesse indésirables attribuables à la fièvre liées à la réactogénicité vaccinale. Une étude de cohorte menée en Australie auprès de 1 851 personnes participantes ayant reçu de façon simultanée le vaccin inactivé contre l'influenza trivalent (VII3) et contre la dcaT (diphtérie, coqueluche et tétanos) pendant la grossesse a révélé une faible incidence d'évènements indésirables (EI), ce qui confirme l'innocuité de l'administration concomitante de vaccins pendant la grossesseNote de bas de page 37. D'autres études n'ont pas non plus fait état de problèmes d'innocuité importants liés à l'administration concomitante de ces vaccins pendant la grossesseNote de bas de page 38Note de bas de page 39.
Efficacité potentielle et efficacité réelle
L'ES du RIEM a évalué l'effet de la vaccination contre la grippe saisonnière pendant la grossesse sur l'infection et l'hospitalisation attribuables à la grippe chez les personnes enceintes et/ou leurs nourrissons en s'appuyant sur les résultats de 4 essais contrôlés randomisés (ECR)Note de bas de page 40Note de bas de page 41Note de bas de page 42Note de bas de page 43 et de 2 études d'observationNote de bas de page 44Note de bas de page 45. D'autres études d'observation (n = 6) ont été identifiées à partir de la recherche documentaire actualisée, faisant état de données sur l'ER du vaccin antigrippal chez les personnes enceintes et/ou leurs nourrissons âgés de 6 mois ou moinsNote de bas de page 46Note de bas de page 47Note de bas de page 48Note de bas de page 49Note de bas de page 50Note de bas de page 51.
Avantages pour la personne enceinte : Issues en matière d'efficacité potentielle et d'efficacité réelle des vaccins
Résumé des caractéristiques de l'étude
Dans l'ensemble, 4 études ont rapporté des données sur la GCL et 3 sur les hospitalisations attribuables à une GCL pendant la grossesse ou jusqu'à 6 mois après l'accouchement. Parmi celles-ci, 3 ECR ont comparé l'EP de la vaccination contre la grippe saisonnière pendant la grossesse à celle d'un placebo (n = 2) Note de bas de page 40Note de bas de page 41 ou à un comparateur actif (n = 1; vaccin quadrivalent contre le méningocoque, MenactraMD, Sanofi)Note de bas de page 42 contre la GCL, à partir de l'inscription jusqu'à 6 mois après l'accouchement. Dans les 3 ECR, l'incidence de GCL chez 5 089 personnes recevant le VII a été comparée à celle de 4 985 personnes randomisées dans le groupe placebo ou dans le groupe de comparaison actif. Une étude de cohorte prospective identifiée à partir de la recherche documentaire actualisée a évalué l'ER du vaccin inactivé contre l'influenza quadrivalent (VII4) saisonnier par rapport à l'absence de vaccination antigrippale pendant la grossesse contre la GCLNote de bas de page 46. Une étude identifiée dans l'ES du RIEM, qui a utilisé un plan d'étude à test-négatif, a évalué l'ER de la vaccination contre la grippe saisonnière chez les personnes enceintes hospitalisées pour une maladie respiratoire aiguë ou une maladie fébrile contre une GCLNote de bas de page 44. Une étude de cohorte prospective, une étude cas-témoins prospective et un plan d'étude à test-négatif identifiés à partir de la recherche documentaire actualisée ont évalué l'ER de la vaccination contre la grippe saisonnière pendant la grossesse sur l'hospitalisation attribuable à la GCL chez les personnes enceintesNote de bas de page 47Note de bas de page 48Note de bas de page 52.
Résumé de l'efficacité potentielle et de l'efficacité réelle du vaccin
Une MA des 3 ECR a suggéré que la vaccination contre la grippe saisonnière pendant la grossesse réduit le risque de GCL chez les personnes enceintes avant l'accouchement et jusqu'à 6 mois après l'accouchement (ER du vaccin regroupée = 50 %, IC à 95 % : 22 à 68 %, I2 = 49,22 %). Les résultats suggèrent que l'avantage de la vaccination contre la grippe saisonnière était similaire entre l'accouchement et 6 mois après l'accouchement (ER du vaccin regroupée = 57 %, IC à 95 % : 14 à 78 %, I2 = 35,88 %) par rapport à la période entre l'inscription et l'accouchement (ER du vaccin regroupée = 54 %, IC à 95 % : -48 à 86 %, I2 = 72,28 %). Une étude de cohorte prospective menée pendant la saison grippale 2019-2020 en Grèce a également mis en évidence un effet protecteur du VII4 saisonnier contre la GCL chez les personnes enceintes (ER du vaccin ajustée [ERa] = 43,5 %, IC à 95 % : 28,4 à 55,6 %)Note de bas de page 37.
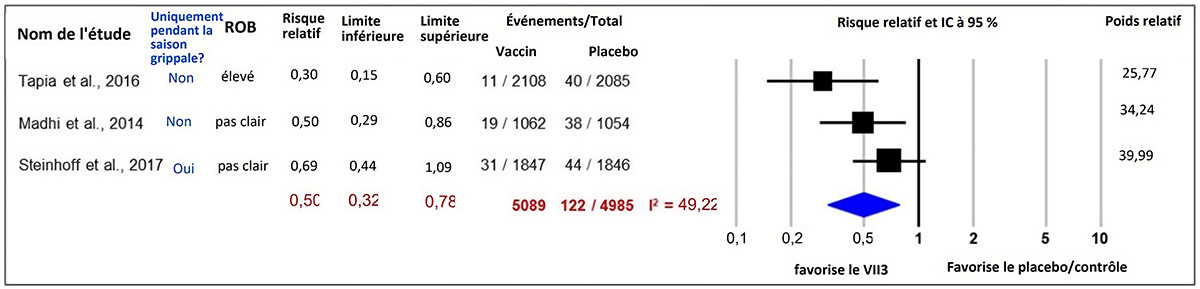
Figure 1 : Texte descriptif
Le graphique 1 est un graphique en forêt illustrant les résultats d'une méta-analyse des effets aléatoires rapportant le risque chez la mère de grippe confirmée en laboratoire, entre l'admission et six mois après l'accouchement, et comparant les vaccins inactivés trivalents contre l'influenza saisonnière à un placebo ou à un traitement de comparaison. La colonne la plus à gauche présente les trois études comprises, chacune identifiée par le nom du premier auteur ainsi que l'année de publication. Ensuite, à droite, on retrouve les renseignements suivants : que la période d'étude soit limitée à la saison grippale ou non, le risque de biais de l'étude, l'estimation ponctuelle du rapport de risque, les limites inférieures et supérieures de l'intervalle de confiance (IC) et le nombre de personnes présentant le résultat d'intérêt (activités) par rapport à la taille de l'échantillon de l'intervention (vaccins inactivés trivalents contre l'influenza saisonnière) et par rapport à la taille de l'échantillon du groupe de comparaison (placebo/contrôle). L'axe des x représentant les estimations du rapport de risque et l'IC à 95 % va de 0,1 à 10. La ligne verticale « sans effet » apparaît à la valeur 1 et sépare les résultats en faveur des vaccins inactivés trivalents contre l'influenza saisonnière (à gauche) et du placebo/contrôle (à droite). Chaque ligne horizontale du graphique en forêt représente une étude individuelle dont on représente les résultats par une boîte et l'IC à 95 % du résultat est présenté sous forme de ligne. La taille de la boîte entourant chaque estimation représente l'importance relative de cette étude dans la composition du résultat regroupé. Le losange bleu montre le résultat regroupé lorsque les études individuelles se conjuguent et font l'objet d'un calcul de la moyenne. Les points horizontaux du losange représentent la limite de l'IC à 95 % de l'estimation ponctuelle combinée.
Les renseignements suivants sont présentés dans le graphique 1.
| Auteur, année | Seulement pendant la saison de la grippe? | Risque de biais | Rapport de risques | Limite inférieure de l'IC | Limite supérieure de l'IC | Activités des vaccins inactivés trivalents contre l'influenza saisonnière. | Taille de l'échantillon des vaccins inactivés trivalents contre l'influenza saisonnière. | Activités de placebo/contrôle | Taille de l'échantillon placebo/contrôle | Poids relatif |
|---|---|---|---|---|---|---|---|---|---|---|
| Tapia et coll., 2016 | Non | Élevé | 0,30 | 0,15 | 0,60 | 11 | 2108 | 40 | 2085 | 25,77 |
| Madhi et coll., 2014 | Non | Incertain | 0,50 | 0,29 | 0,86 | 19 | 1062 | 38 | 1054 | 34,24 |
| Steinhoff et coll., 2017 | Oui | Incertain | 0,69 | 0,44 | 1,09 | 31 | 1847 | 44 | 1846 | 39,99 |
| Modèle statistique | Rapport de risques | Limite inférieure de l'IC | Limite supérieure de l'IC | Activités des vaccins inactivés trivalents contre l'influenza saisonnière. | Taille de l'échantillon des vaccins inactivés trivalents contre l'influenza saisonnière. | Activités de placebo/contrôle | Taille de l'échantillon placebo/contrôle | Hétérogénéité, I2 |
|---|---|---|---|---|---|---|---|---|
| Modèle à effet aléatoire | 0,50 | 0,32 | 0,78 | 61 | 5089 | 122 | 4985 | 49,22 |
Une MA de 2 études à tests-négatifs suggère que la vaccination contre la grippe saisonnière pendant la grossesse réduit le risque d'hospitalisation attribuable à la GCL chez les personnes enceintes avant l'accouchement et jusqu'à 42 jours après l'accouchement (ERa regroupée = 42 %, IC à 95 % : 19 à 58 %, I2 = 0 %)Note de bas de page 44Note de bas de page 47.
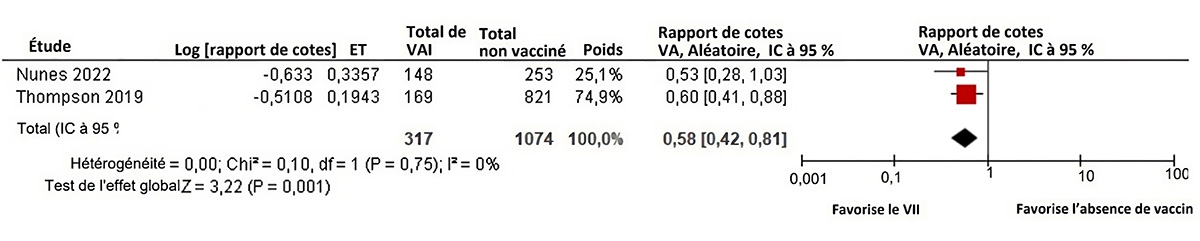
Figure 2 : Texte descriptif
Le graphique 2 est un graphique en forêt illustrant les résultats d'une méta-analyse des effets aléatoires d'études utilisant un modèle d'étude de test négatif rapportant le risque d'hospitalisation de la mère en raison de la grippe confirmée en laboratoire pendant la grossesse ou 42 jours après l'accouchement chez les personnes vaccinées avec des vaccins inactivés contre l'influenza (VII) par rapport aux personnes non vaccinées pendant la grossesse. La colonne la plus à gauche indique les deux études incluses, chacune identifiée par le nom du premier auteur ainsi que l'année de publication. Ensuite, à droite, les renseignements suivants sont présentés : le rapport des cotes (RC) logarithmiques, l'erreur type, la taille de l'échantillon de l'intervention (vaccins inactivés contre l'influenza [VII]) et du groupe de comparaison (non vaccinés), l'importance relative de l'étude et le rapport des cotes avec son intervalle de confiance (IC) correspondant à 95 %. L'axe des x représentant les estimations du rapport des cotes et l'IC à 95 % va de 0,01 à 100. La ligne verticale « sans effet » apparaît à la valeur 1 et sépare les résultats en faveur des VII (à gauche) et l'absence de vaccin (à droite). Chaque ligne horizontale du graphique en forêt représente une étude individuelle dont on représente les résultats par un encadré rouge et l'IC à 95 % du résultat est représenté sous forme de ligne. La taille de la boîte entourant chaque estimation représente l'importance relative de cette étude dans la composition du résultat regroupé. Le losange noir montre le résultat regroupé lorsque les études individuelles sont combinées et font l'objet d'un calcul de la moyenne. Les points horizontaux du losange représentent la limite de l'IC à 95 % de l'estimation ponctuelle combinée.
Les renseignements suivants sont présentés dans le graphique 2.
| Auteur, année | Logarithmiques (rapport des cotes) | Erreur type | Taille de l'échantillon des VII. | Taille de l'échantillon non vacciné. | Poids | RC (IC à 95 %) |
|---|---|---|---|---|---|---|
| Nunes, 2022 | -0,633 | 0,3357 | 148 | 253 | 25,1 % | 0,53 (0,28, 1,03) |
| Thompson, 2019 | -0,5108 | 0,1943 | 169 | 821 | 74,9 % | 0,60 (0,41, 0,88) |
| Modèle statistique | Taille de l'échantillon des vaccins inactivés trivalents contre l'influenza saisonnière. | Taille de l'échantillon pour le placebo | Poids | RC (IC à 95 %) | Hétérogénéité, Tau2, Khi2, df (valeur p), I2 | Essai de l'effet global, Z (valeur p) |
|---|---|---|---|---|---|---|
| Modèle à effet aléatoire | 317 | 1074 | 100,0 % | 0,58 (0,42, 0,81) | 0,00; 0,10; 1 (P = 0.75); 0 % | 3,22 (P = 0,001) |
Une étude de cohorte prospective a fait état d'une ER vaccinale de 38 % (IC à 95 % : 14 à 55 %) contre l'hospitalisation attribuable à la GCL pendant la grossesse ou jusqu'à 2 jours après l'accouchementNote de bas de page 48.
L'ensemble de ces études suggère que la vaccination contre la grippe saisonnière pendant la grossesse réduit le risque d'infection et d'hospitalisation attribuables à la GCL pendant la grossesse et jusqu'à 6 mois après l'accouchement.
Avantages pour les nourrissons : Issues en matière d'efficacité potentielle et d'efficacité réelle du vaccin
Résumé des caractéristiques de l'étude
Dans l'ensemble, 7 études ont rapporté des données sur la GCL. Parmi celles-ci, 4 ECR ont comparé l'EP du VII à celle d'un placebo (n = 2)Note de bas de page 40Note de bas de page 53 ou à des comparateurs actifs (n = 2; vaccin antipneumococciqueNote de bas de page 43 ou vaccin antiméningococciqueNote de bas de page 42) pendant la grossesse contre la GCL chez les nourrissons âgés de 6 mois ou moins. Trois (3) études de cohorte identifiées à partir de la recherche documentaire actualisée ont comparé l'ER de la vaccination contre la grippe saisonnière pendant la grossesse contre la GCL chez les nourrissons âgés de 6 mois ou moinsNote de bas de page 46Note de bas de page 49Note de bas de page 50.
Au total, 5 études (3 études à tests-négatifs, dont une tirée de l'ES du RIEMNote de bas de page 45Note de bas de page 47Note de bas de page 51 et 2 études de cohorteNote de bas de page 49Note de bas de page 50) ont rapporté des données sur l'ER de la vaccination antigrippale pendant la grossesse sur l'hospitalisation attribuable à une GCL chez les nourrissons âgés de 6 mois ou moins.
Résumé de l'efficacité potentielle et de l'efficacité réelle du vaccin
Une MA des 4 ECR a démontré un effet protecteur de la vaccination contre la grippe saisonnière pendant la grossesse contre la GCL chez les nourrissons âgés de 6 mois ou moins (ER du vaccin regroupée = 37 %, IC à 95 % : 22 à 49 %, I2 = 0,00 %). Les résultats des ECR suggèrent que l'effet le plus important de la vaccination contre la grippe saisonnière pendant la grossesse contre la GCL chez les nourrissons a été observé de la naissance à l'âge de 2 mois (ER du vaccin regroupée de 0 à 2 mois inclusivement = 61 %, 17 à 81 %, I2 = 39,57 %), après quoi l'effet protecteur de la vaccination pendant la grossesse s'est estompé à mesure que l'âge du nourrisson augmentait (ER du vaccin regroupée de 2 mois à 4 mois inclusivement = 42 %, IC à 95 % : 13 à 70 %, I2 = 59,67 % et ER du vaccin regroupée de 4 à 6 mois inclusivement = 24 %, IC à 95 % : -3 à 44 %, I2 = 0,00 %), une constatation biologiquement plausible attribuable à l'affaiblissement des effets du transfert passif d'anticorps chez les nouveau-nés.
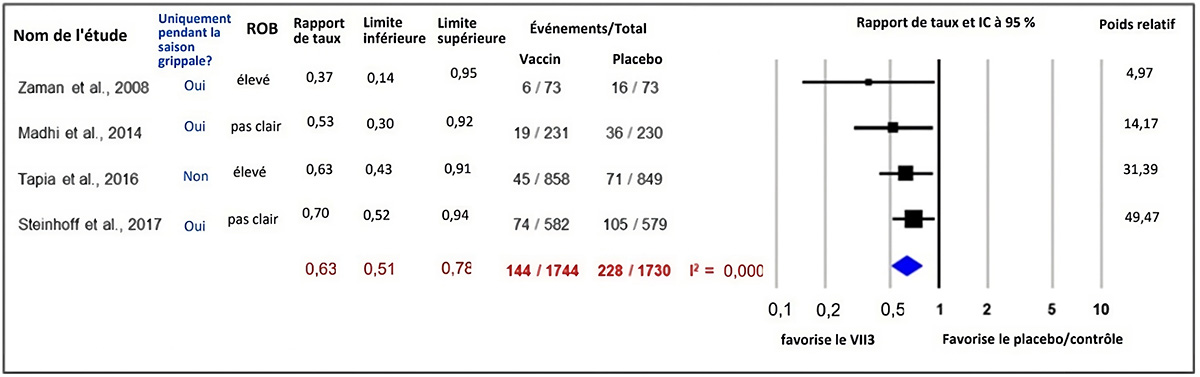
Figure 3 : Texte descriptif
Le graphique 3 présente un graphique en forêt montrant les résultats d'une méta-analyse des effets aléatoires d'essais comparatifs randomisés rapportant le risque de grippe confirmée en laboratoire chez les nourrissons nés de femmes enceintes vaccinées contre la grippe ou recevant un placebo ou un contrôle contre substance active témoin pendant la grossesse. La colonne la plus à gauche présente les quatre études incluses, identifiées par le nom du premier auteur et l'année de publication. Ensuite, à droite, les renseignements suivants sont présentés : la période d'étude était-elle limitée à la saison grippale ou non, le risque de biais de l'étude, l'estimation ponctuelle du ratio des taux, les limites inférieures et supérieures de l'intervalle de confiance (IC) et le nombre de personnes présentant le résultat d'intérêt (activités) par rapport à la taille de l'échantillon en années par personne de l'intervention (vaccins inactivés trivalents contre l'influenza saisonnière) et par rapport à la taille de l'échantillon en années par personne du groupe de comparaison (placebo/contrôle). L'axe des x représentant les estimations des ratios de taux et l'IC à 95 % va de 0,1 à 10. La ligne verticale « sans effet » apparaît à la valeur 1 et sépare les résultats en faveur des vaccins inactivés trivalents contre l'influenza saisonnière (à gauche) et du placebo/contrôle (à droite). Chaque ligne horizontale du graphique en forêt représente une étude individuelle dont on représente les résultats par une boîte et l'IC à 95 % du résultat est présenté sous forme de ligne. La taille de la boîte entourant chaque estimation représente l'importance relative de cette étude dans la composition du résultat regroupé. Le losange bleu montre le résultat regroupé lorsque les études individuelles se conjuguent et font l'objet d'un calcul de la moyenne. Les points horizontaux du losange représentent la limite de l'IC à 95 % de l'estimation ponctuelle combinée.
Les renseignements suivants sont présentés dans le graphique 3.
| Auteur, année | Seulement pendant la saison de la grippe? | Risque de biais | Ratio des taux | Limite inférieure de l'IC | Limite supérieure de l'IC | Activités des vaccins inactivés trivalents contre l'influenza saisonnière. | Taille de l'échantillon de vaccins inactivés trivalents contre l'influenza saisonnière (année par personne). | Activités de placebo/contrôle | Taille de l'échantillon placebo/contrôle (année par personne) | Poids relatif |
|---|---|---|---|---|---|---|---|---|---|---|
| Zaman et coll., 2008 | Oui | Élevé | 0,37 | 0,14 | 0,95 | 6 | 73 | 16 | 73 | 4,97 |
| Madhi et coll., 2014 | Oui | Incertain | 0,53 | 0,30 | 0,92 | 19 | 231 | 36 | 230 | 14,17 |
| Tapia et coll., 2016 | Non | Élevé | 0,63 | 0,43 | 0,91 | 45 | 858 | 71 | 849 | 31,39 |
| Steinhoff et coll., 2017 | Oui | Incertain | 0,70 | 0,52 | 0,94 | 74 | 582 | 105 | 579 | 49,47 |
| Modèle statistique | Ratio des taux | Limite inférieure de l'IC | Limite supérieure de l'IC | Activités des vaccins inactivés trivalents contre l'influenza saisonnière. | Taille de l'échantillon des vaccins inactivés trivalents contre l'influenza saisonnière. | Activités de placebo/contrôle | Taille de l'échantillon placebo/contrôle | Hétérogénéité, I2 |
|---|---|---|---|---|---|---|---|---|
| Modèle à effet aléatoire | 0,63 | 0,51 | 0,78 | 144 | 1744 | 228 | 1730 | 0,000 |
Une MA des 3 études de cohorte a démontré un effet protecteur de la vaccination contre la grippe saisonnière pendant la grossesse contre la GCL chez les nourrissons âgés de 6 mois ou moins (ERa du vaccin regroupée = 41 %, IC à 95 % : 23 à 55 %, I2 = 17 %)Note de bas de page 46Note de bas de page 49Note de bas de page 50.
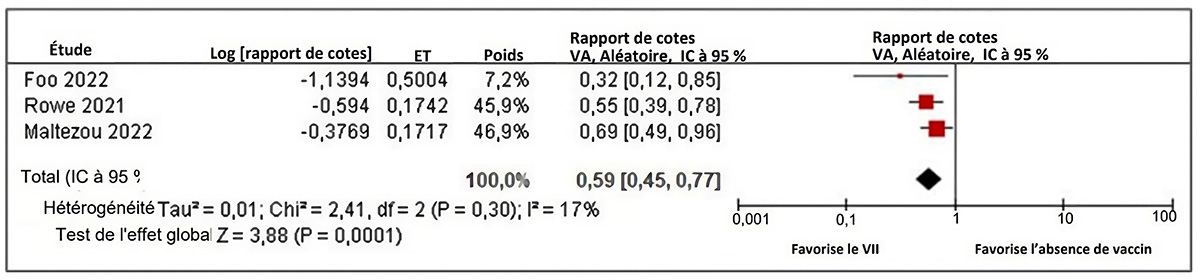
Figure 4 : Texte descriptif
Le graphique 4 est un graphique en forêt montrant les résultats d'une méta-analyse des effets aléatoires d'études de cohortes rapportant le risque de grippe confirmée en laboratoire chez les nourrissons nés de femmes enceintes vaccinées ou non contre la grippe pendant la grossesse. La colonne la plus à gauche présente les trois études comprises, chacune identifiée par le nom du premier auteur ainsi que l'année de publication. Ensuite, à droite, les renseignements suivants sont présentés : le rapport des cotes (RC) logarithmiques, l'erreur type, l'importance relative de l'étude et le RC avec son intervalle de confiance (IC) correspondant à 95 %. L'axe des x représentant les estimations du rapport des cotes et l'IC à 95 % va de 0,01 à 100. La ligne verticale « sans effet » apparaît à la valeur 1 et sépare les résultats favorables à la vaccination antigrippale (à gauche) et à l'absence de vaccin (à droite). Chaque ligne horizontale du graphique en forêt représente une étude individuelle dont on représente les résultats par un encadré rouge et l'IC à 95 % du résultat est représenté sous forme de ligne. La taille de la boîte entourant chaque estimation représente l'importance relative de cette étude dans la composition du résultat regroupé. Le losange noir montre le résultat regroupé lorsque les études individuelles sont combinées et font l'objet d'un calcul de la moyenne. Les points horizontaux du losange représentent la limite de l'IC à 95 % de l'estimation ponctuelle combinée.
Les renseignements suivants sont présentés dans le graphique 4.
| Auteur, année | Logarithmiques (rapport des cotes) | Erreur type | Poids | RC (IC à 95 %) |
|---|---|---|---|---|
| Foo, 2022 | -1,1394 | 0,5004 | 7,2 % | 0,32 (0,12, 0,85) |
| Rowe, 2021 | -0,594 | 0,1742 | 45,9 % | 0,55 (0,39, 0,78) |
| Maltezou, 2022 | -0,3769 | 0,1717 | 46,9 % | 0,69 (0,49, 0,96) |
| Modèle statistique | Poids | RC (IC à 95 %) | Hétérogénéité, Tau2, Khi2, df (valeur p), I2 | Essai de l'effet global, Z (valeur p) |
|---|---|---|---|---|
| Modèle à effet aléatoire | 100,0 % | 0,59 (0,45, 0,77) | 0,01; 2,41; 2 (P = 0.30); 17 % | 3,88 (P = 0,0001) |
Une MA des 3 études à tests-négatifs a démontré un effet protecteur de la vaccination contre la grippe saisonnière pendant la grossesse contre l'hospitalisation attribuable à une GCL chez les nourrissons âgés de 6 mois ou moins (ERa du vaccin regroupée = 42 %, IC à 95 % : 16 à 59 %, I2 = 71 %)Note de bas de page 45Note de bas de page 47Note de bas de page 51. Deux (2) études de cohorte ont rapporté des données sur l'hospitalisation attribuable à une GCL chez les nourrissons âgés de 6 mois ou moins mais une seule a démontré un effet protecteur significatif de la vaccination antigrippale pendant la grossesse (ERa du vaccin, IC à 95 % : 62 %, 9 à 84 %Note de bas de page 49 et 21 %, IC à 95 : -18 à 47 %Note de bas de page 50).
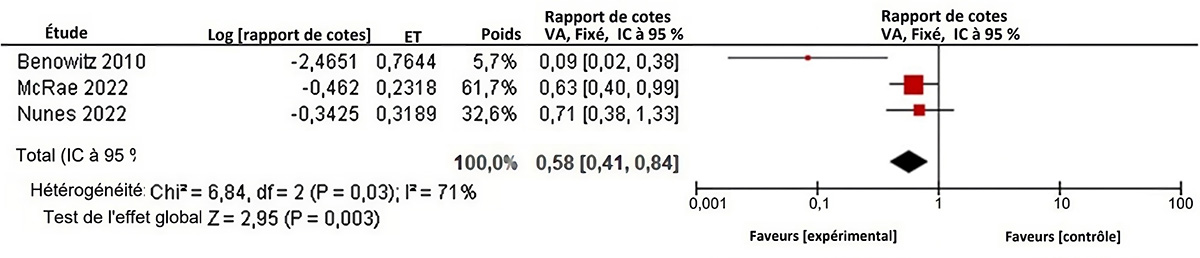
Figure 5 : Texte descriptif
Le graphique 5 présente un graphique de forêt montrant les résultats d'une méta-analyse selon un modèle à effets fixes d'études utilisant un plan d'étude test négatif et rapportant le risque d'hospitalisation pour la grippe confirmée en laboratoire chez les nourrissons jusqu'à l'âge de six mois nés de femmes enceintes vaccinées ou non contre la grippe pendant la grossesse. La colonne la plus à gauche présente les trois études comprises, chacune identifiée par le nom du premier auteur ainsi que l'année de publication. Ensuite, à droite, les renseignements suivants sont présentés : le rapport des cotes (RC) logarithmiques, l'erreur type, l'importance relative de l'étude et le RC avec son intervalle de confiance (IC) correspondant à 95 %. L'axe des x représentant les estimations du rapport des cotes et l'IC à 95 % va de 0,01 à 100. La ligne verticale « sans effet » apparaît à la valeur 1 et sépare les résultats favorables à la vaccination antigrippale (à gauche) et à l'absence de vaccin (à droite). Chaque ligne horizontale du graphique en forêt représente une étude individuelle dont on représente les résultats par un encadré rouge et l'IC à 95 % du résultat est représenté sous forme de ligne. La taille de la boîte entourant chaque estimation représente l'importance relative de cette étude dans la composition du résultat regroupé. Le losange noir montre le résultat regroupé lorsque les études individuelles sont combinées et font l'objet d'un calcul de la moyenne. Les points horizontaux du losange représentent la limite de l'IC à 95 % de l'estimation ponctuelle combinée.
Les renseignements suivants sont présentés dans le graphique 5.
| Auteur, année | Logarithmiques (rapport des cotes) | Erreur type | Poids | RC (IC à 95 %) |
|---|---|---|---|---|
| Benowitz, 2010 | -2,4651 | 0,7644 | 5,7 % | 0,09 (0,02, 0,38) |
| McRae, 2022 | -0,462 | 0,2318 | 61,7 % | 0,63 (0,40, 0,99) |
| Nunes, 2022 | -0,3425 | 0,3189 | 32,6 % | 0,71 (0,38, 1,33) |
| Modèle statistique | Poids | RC (IC à 95 %) | Hétérogénéité, Khi2, df (valeur p), I2 | Essai de l'effet global, Z (valeur p) |
|---|---|---|---|---|
| Modèle à effet fixe | 100,0 % | 0,58 (0,41, 0,84) | 6,84; 2 (P = 0,03); 71 % | 2,95 (P = 0,003) |
L'ensemble de ces études suggère que la vaccination contre la grippe saisonnière pendant la grossesse réduit le risque de GCL et les hospitalisations attribuables à une GCL chez les nourrissons âgés de 6 mois ou moins.
Innocuité des vaccins
Résumé des caractéristiques de l'étude
L'ES du RIEM sur l'innocuité de la vaccination antigrippale pendant la grossesse a évalué les évènements indésirables graves (EIG) non obstétricaux chez les personnes enceintes liés à l'administration de la vaccination contre la grippe saisonnière pendant la grossesse à partir des résultats de 3 ECR et de 3 études de cohorte. En outre, l'ES comprenait 4 ECR et 24 études d'observation, dont 20 études de cohorte et 4 études cas-témoins, portant sur d'autres issues liées à l'innocuité et/ou à la grossesse/à l'accouchement (c.-à-d., décès infantile, AS, mortinaissance, naissance prématurée, naissance d'un enfant petit pour l'âge gestationnel [PAG], IPN et anomalies congénitales). Les résultats de la vaccination contre la grippe saisonnière ont été comparés à ceux d'autres vaccins (p. ex., les vaccins antiméningococciques ou antipneumococciques), d'un placebo ou de l'absence de vaccination.
Onze (11) études d'observation supplémentaires ont été recensées à partir de la recherche documentaire actualisée, évaluant les EIG/EI non obstétricaux et d'autres issues sur l'innocuité et/ou la grossesse/naissance (c.-à-d., l'AS, la mortinaissance, la prématurité, la naissance d'un enfant PAG, l'IPN et les anomalies congénitales) liés à l'administration du vaccin antigrippal pendant la grossesse. Parmi ces études, 3 étaient des études de cohorte à bras unique et une était une série de cas dérivée de registres d'EI d'intérêt. Ces plans d'étude n'ont pas été inclus dans l'ES du RIEM mais ont été inclus dans la recherche documentaire actualisée afin de saisir les études faisant état de données sur l'innocuité de l'administration pendant la grossesse de vaccins antigrippaux plus récemment homologués qui sont fondés sur de nouvelles technologies différentes, y compris les vaccins quadrivalents à base de culture de cellules de mammifères (p. ex., VII4cc; FlucelvaxMD Quad) et les VAR (p. ex., vaccin antigrippal recombinant quadrivalent [VAR4]; SupemtekMC), compte tenu du nombre limité de données probantes sur ces vaccins publiées et évaluées par des pairs.
Résumé de l'innocuité des vaccins
Préjudices subis par la personne enceinte : Effets indésirables graves non obstétricaux chez les personnes enceintes
Réactions systémiques graves dans les sept jours suivant la vaccination
Deux (2) ECR ont évalué le risque de réactions systémiques sévères dans les 7 jours suivant la vaccination contre la grippe saisonnière chez les personnes enceintes. Un (1) ECR mené en Afrique du Sud par Madhi et al. (2014) a révélé que 27 des 181 personnes ayant reçu le vaccin antigrippal trivalent VAT (14,9 %) et 19 des 172 personnes ayant reçu un placebo salin (11,0 %) ont présenté au moins une réaction systémique sévère, qui comprenait une faiblesse ou fatigue sévère, des maux de tête, de la fièvre, des douleurs articulaires et musculaires, dans les 7 jours suivant l'administration du vaccinNote de bas de page 41. Un (1) ECR de plus grande envergure mené au Mali par Tapia et al. (2016) a révélé que 2 des 2 105 personnes ayant reçu le VAT (0,1 %) et aucune des 2 082 personnes ayant reçu le vaccin antiméningococcique (0,0 %) ont présenté une réaction indésirable systémique sévère dans les 7 jours suivant l'administration du vaccinNote de bas de page 42 les 2 réactions sévères comprenaient une sensation fébrile et des maux de tête, et il n'était pas clair si ces 2 évènements s'étaient produits chez le même participant. Aucune différence significative dans la fréquence des réactions systémiques sévères dans les 7 jours suivant la vaccination contre la grippe saisonnière n'a été observée dans chaque étude (RR 1,35 %, IC à 95 % : 0,78 à 2,34Note de bas de page 41 et RR = 4,95 %, IC à 95 % : 0,24 à 102,95 %Note de bas de page 42); les estimations regroupées n'ont pas été calculées en raison des différences substantielles entre les risques d'EIG dans les groupes d'intervention des 2 études et dans les groupes témoins. Il existait probablement des différences inconnues dans la définition des issues ou d'autres sources d'hétérogénéité.
Autres évènements indésirables graves non obstétricaux
Deux (2) ECR, 6 études de cohorte et une (1) série de cas ont rapporté des données sur d'autres EIG non obstétricaux. Un (1) ECR mené par Madhi et al. (2014) n'a révélé aucune différence dans la présence d'EIG non obstétricaux qui étaient possiblement ou probablement liés à la vaccination antigrippale dans les 30 jours suivant l'administration de la vaccination (un (1) chez 1 062 personnes vaccinées au VAT et 0 chez 1 054 personnes qui ont reçu un placebo salin; RR = 2,98 %, IC à 95 % : 0,12 à 73,01 %)Note de bas de page 41. Un (1) autre ECR mené par Zaman et al. (2008) a rapporté des données sur les hospitalisations péripartum attribuables à des causes non obstétricales, sans différence apparente entre les receveurs du VAT et du vaccin antipneumococcique (un (1) évènement sur 159 receveurs du VAT et 2 évènements sur 157 receveurs du vaccin antipneumococcique; RR = 0,49 %, IC à 95 % : 0,05 à 5,39 %)Note de bas de page 43.
Cinq (5) études de cohorte ont fait état d'EIG non obstétricaux, soit dans les 42 jours suivant la vaccination, soit dans un délai inconnu. Dans une étude américaine, Munoz et al. (2005) ont constaté 2 hospitalisations non liées à la grossesse chez 225 personnes enceintes vaccinées et 3 chez 826 personnes enceintes non vaccinées dans les 42 jours suivant l'intervention, aucune n'étant liée à la vaccination (RR = 2,45 %, IC à 95 % : 0,41 à 14,56 %)Note de bas de page 54. Les causes d'hospitalisation comprenaient la grippe avec vomissements et migraines dans le groupe vacciné, et la grippe avec vomissements, l'appendicite et le remplacement de l'endoprothèse urétérale avec calcul dans le groupe non vacciné. Enfin, 4 études de cohorte n'ont rapporté aucun EIG après l'administration du VII4 (FluzoneMD Quadrivalent)Note de bas de page 55 VII4-cc (FlucelvaxMD Quad)Note de bas de page 56 ou du VII3 pendant la grossesseNote de bas de page 57Note de bas de page 58.
Syndrome de Guillain-Barré
Une (1) étude de cohorte et une série de cas ont rapporté des données sur le syndrome de Guillain-Barré après la vaccination contre la grippe saisonnière pendant la grossesse. Dans les 42 jours suivant l'intervention, Nordin et al. (2013) n'ont identifié aucun cas hospitalisé de syndrome de Guillain-Barré chez 75 906 personnes enceintes vaccinées et qu'un (1) cas chez 147 992 personnes enceintes non vaccinées aux États-Unis [É.-U.] (RR = 0,65 %, IC à 95 % : 0,03 à 15,95 %)Note de bas de page 59. Une (1) série de cas identifiée à partir de la recherche documentaire actualisée a rapporté un (1) cas (n = 239) de syndrome de Guillain-Barré survenu 5 jours après l'administration du VII4 au cours du troisième trimestre de la grossesse chez une femme de 29 ans. La femme a donné naissance à un bébé en bonne santé pendant sa convalescence et s'est complètement rétablieNote de bas de page 60.
Ces études suggèrent que les personnes enceintes vaccinées contre la grippe saisonnière pendant la grossesse semblent présenter les mêmes taux d'EIG non obstétricaux que les personnes non enceintes vaccinées contre la grippe saisonnière, les personnes enceintes qui ont reçu un vaccin antipneumococcique ou un vaccin antiméningococcique, ainsi que les personnes enceintes non vaccinées.
Préjudices subis par les nourrissons : Décès infantile (de 0 à 6 mois)
Quatre (4) ECR ont comparé l'effet de la vaccination contre la grippe saisonnière à celui d'un placebo (n = 2)Note de bas de page 40Note de bas de page 41 ou à des comparateurs actifs (n = 2; vaccin quadrivalent antiméningococcique Note de bas de page 42 ou vaccin antipneumococcique 23-valentNote de bas de page 43) pendant la grossesse sur la mortalité de nourrissons âgés de 6 mois ou moins. Tous les ECR ont été menés dans des pays à revenu faible ou moyen, et le risque de mortalité infantile dans le groupe témoin variait de 1,1 % à 2,8 %. Une MA de ces ECR n'a pas démontré de lien entre la vaccination contre la grippe saisonnière pendant la grossesse et la mortalité infantile (RR regroupé = 1,14 %, IC à 95 % : 0,86 à 1,50 %, I2 = 9,33 %).
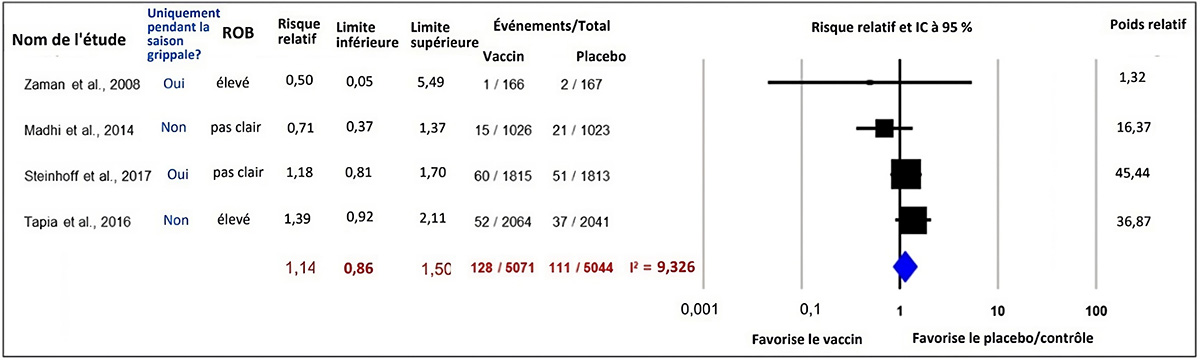
Figure 6 : Texte descriptif
Le graphique 6 présente un graphique en forêt montrant les résultats d'une méta-analyse à effets aléatoires d'essais comparatifs randomisés rapportant le risque de mort infantile jusqu'à l'âge de six mois chez les nourrissons nés de femmes enceintes vaccinées ou non vaccinées contre la grippe pendant la grossesse. La colonne la plus à gauche présente les quatre études comprises, chacune identifiée par le nom du premier auteur ainsi que l'année de publication. Ensuite, à droite, les renseignements suivants sont présentés : si la période d'étude était limitée à la saison grippale ou non, le risque de biais de l'étude, l'estimation ponctuelle du rapport de risque, les limites inférieures et les limites supérieures de l'intervalle de confiance (IC) et le nombre de personnes présentant le résultat recherché (activités) par rapport à la taille de l'échantillon de l'intervention (vaccin antigrippal) et par rapport à la taille de l'échantillon du groupe de comparaison (placebo/contrôle). L'axe des x représentant les estimations des ratios de taux et l'IC à 95 % va de 0,01 à 100. La ligne verticale « sans effet » apparaît à la valeur 1 et sépare les résultats en faveur du vaccin antigrippal (à gauche) et du placebo/contrôle (à droite). Chaque ligne horizontale du graphique en forêt représente une étude individuelle dont on représente les résultats par une boîte et l'IC à 95 % du résultat est présenté sous forme de ligne. La taille de la boîte entourant chaque estimation représente l'importance relative de cette étude dans la composition du résultat regroupé. Le losange bleu montre le résultat regroupé lorsque les études individuelles se conjuguent et font l'objet d'un calcul de la moyenne. Les points horizontaux du losange représentent la limite de l'IC à 95 % de l'estimation ponctuelle combinée.
Les renseignements suivants sont présentés dans le graphique 6.
| Auteur, année | Seulement pendant la saison de la grippe? | Risque de biais | Rapport de risques | Limite inférieure de l'IC | Limite supérieure de l'IC | Activités des VII. | Taille de l'échantillon des VII. | Activités de placebo/contrôle | Taille de l'échantillon placebo/contrôle | Poids relatif |
|---|---|---|---|---|---|---|---|---|---|---|
| Zaman et coll., 2008 | Oui | Élevé | 0,50 | 0,05 | 5,49 | 1 | 166 | 2 | 167 | 1,32 |
| Madhi et coll., 2014 | Non | Incertain | 0,71 | 0,37 | 1,37 | 15 | 1026 | 21 | 1023 | 16,37 |
| Steinhoff et coll., 2017 | Oui | Incertain | 1,18 | 0,81 | 1,70 | 60 | 1815 | 51 | 1813 | 45,44 |
| Tapia et coll., 2016 | Non | Élevé | 1,39 | 0,92 | 2,11 | 52 | 2064 | 37 | 2041 | 36,87 |
| Modèle statistique | Rapport de risques | Limite inférieure de l'IC | Limite supérieure de l'IC | Activités des VII. | Taille de l'échantillon des VII. | Activités de placebo/contrôle | Taille de l'échantillon placebo/contrôle | Hétérogénéité, I2 |
|---|---|---|---|---|---|---|---|---|
| Modèle à effet aléatoire | 1,14 | 0,86 | 1,50 | 128 | 5071 | 111 | 5044 | 9,326 |
Aucun décès infantile n'a été signalé dans le cadre d'une étude de cohorte prospective menée au Japon parmi les nourrissons âgés de 0 à 6 mois ayant reçu un diagnostic de fièvre, nés de personnes enceintes vaccinées et non vaccinées (0/36 VII3 et 0/47 non vaccinées)Note de bas de page 61.
Ces études suggèrent que la vaccination contre la grippe saisonnière pendant la grossesse n'est pas associée à la mortalité de nourrissons âgés de 6 mois ou moins.
Préjudices subis par les nourrissons : Avortement spontané
Trois (3) études de cohorte et 3 études d'observation ont évalué l'effet du VII pendant la grossesse sur les AS avant 20 et 22 semaines d'âge gestationnel. Deux (2) études de cohorte prospectives ont été incluses dans une MA et aucun lien entre le VII et les AS n'a été démontré (RR ajusté [RRa] regroupé = 0,77, IC à 95 % : 0,31 à 1,89 %, I2 = 37,51 %)Note de bas de page 62Note de bas de page 63. Une troisième étude de cohorte prospective menée au Japon a révélé le même risque d'AS en dessous de 22 semaines de gestation (0,4 %) chez les personnes enceintes non vaccinées et vaccinées (vaccination du premier trimestre)Note de bas de page 64.
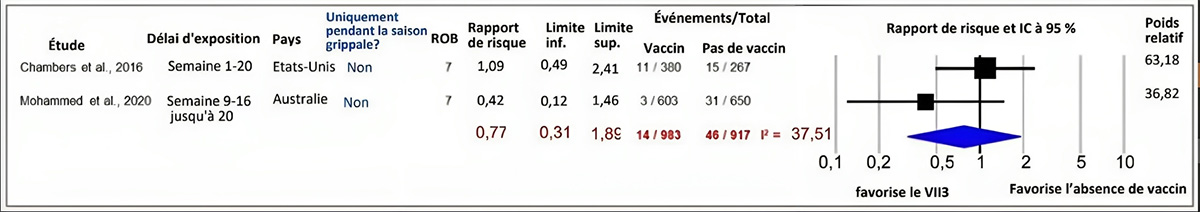
Figure 7 : Texte descriptif
Le graphique 7 présente un graphique en forêt montrant les résultats d'une méta-analyse à effets aléatoires d'études de cohortes rapportant le risque d'avortement spontané chez les femmes enceintes vaccinées et non vaccinées contre la grippe saisonnière pendant la grossesse. La colonne la plus à gauche indique les deux études incluses, chacune identifiée par le nom du premier auteur ainsi que l'année de publication. Ensuite, à droite, les renseignements suivants sont présentés : le temps d'exposition, le pays où l'étude a été menée, si la période d'étude était limitée à la saison grippale ou non, le risque de biais de l'étude, l'estimation ponctuelle du rapport de risques instantanés, les limites inférieures et les limites supérieures de l'intervalle de confiance (IC) et le nombre d'individus présentant le résultat d'intérêt (activités) par rapport à la taille de l'échantillon de l'intervention (vaccins inactivés trivalents contre l'influenza saisonnière) et par rapport à la taille de l'échantillon du groupe de comparaison (aucun vaccin). L'axe des x représentant les estimations du rapport de risque et l'intervalle de confiance (IC) à 95 % va de 0,1 à 10. La ligne verticale « sans effet » apparaît à la valeur 1 et sépare les résultats favorables aux vaccins inactivés trivalents contre l'influenza saisonnière (à gauche) et à l'absence de vaccin (à droite). Chaque ligne horizontale du graphique en forêt représente une étude individuelle dont on représente les résultats par une boîte et l'IC à 95 % du résultat est présenté sous forme de ligne. La taille de la boîte entourant chaque estimation représente l'importance relative de cette étude dans la composition du résultat regroupé. Le losange bleu montre le résultat regroupé lorsque les études individuelles se conjuguent et font l'objet d'un calcul de la moyenne. Les points horizontaux du losange représentent la limite de l'IC à 95 % de l'estimation ponctuelle combinée.
Les renseignements suivants sont présentés dans le graphique 7.
| Auteur, année | Durée d'exposition | Pays | Seulement pendant la saison de la grippe? | Risque de biais | Rapport de risques instantanés (RRI) | Limite inférieure de l'IC | Limite supérieure de l'IC | Activités des vaccins inactivés trivalents contre l'influenza saisonnière. | Taille de l'échantillon des vaccins inactivés trivalents contre l'influenza saisonnière. | Aucune activité vaccinale | Aucune taille d'échantillon de vaccin | Poids relatif |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Chambers et coll., 2016 | Semaine 1 à 20 | États-Unis | Non | 7 | 1,09 | 0,49 | 2,41 | 11 | 380 | 15 | 267 | 63,18 |
| Mohammed et coll., 2020 | Semaine 9 à 16 jusqu'à la semaine 20 | Australie | Non | 7 | 0,42 | 0,12 | 1,46 | 3 | 603 | 31 | 650 | 36,82 |
| Modèle statistique | Rapport de risques instantanés (RRI) | Limite inférieure de l'IC | Limite supérieure de l'IC | Activités des vaccins inactivés trivalents contre l'influenza saisonnière. | Taille de l'échantillon des vaccins inactivés trivalents contre l'influenza saisonnière. | Aucune activité vaccinale | Aucune taille d'échantillon de vaccin | Hétérogénéité, I2 |
|---|---|---|---|---|---|---|---|---|
| Modèle à effet aléatoire | 0,77 | 0,31 | 1,89 | 14 | 983 | 46 | 917 | 37,51 |
Deux (2) études cas-témoins rétrospectives menées par le même groupe de chercheurs aux É.-U. ont évalué le lien entre l'AS et la vaccination dans les 28 jours précédant l'AS. La première étude a été menée sur 2 saisons grippales consécutives après la pandémie de grippe H1N1 de 2009Note de bas de page 12. Les auteurs ont observé un risque accru d'AS à la suite du VII uniquement lors de la première saison postpandémique (RC ajusté [RCa] de 2010-2011 = 3,70, IC à 95 % : 1,40 à 9,40 %) mais non lors de la seconde RCa de 2011-2012 = 1,40, IC à 95% : 0,60 à 3,30 %). Des analyses a posteriori des données de 2010-2011 ont révélé que les personnes qui avaient déjà reçu au cours de la saison 2009-2010 le vaccin contre la grippe pandémique H1N1 présentaient un risque accru d'AS à la suite du VII au cours de la saison 2010-2011, ce qui n'a pas été observé chez les personnes qui n'avaient pas reçu le vaccin contre la grippe pandémique H1N1 en 2009-2010 mais qui l'avaient reçu en 2010-2011.
La deuxième étude, menée sur 3 saisons grippales consécutives (c.-à-d., 2012-2013, 2013-2014 et 2014-2015) par Donahue, et al. (2019) visait à confirmer le lien observé entre l'AS et les antécédents de vaccination antigrippaleNote de bas de page 65. Aucun lien n'a été trouvé entre la vaccination contre la grippe saisonnière pendant la grossesse et l'AS dans les 28 jours suivant la vaccination (RCa = 0,80, IC à 95 % : 0,60 à 1,10 %), y compris parmi les personnes vaccinées au cours de la saison précédente. Les auteurs affirment que le lien entre la vaccination au cours de la saison précédente constaté dans le cadre de l'étude initiale peut avoir été un résultat erroné en raison d'une confusion résiduelle ou d'une erreur aléatoire, ou peut avoir été attribuable à des différences dans les périodes de temps des 2 études. Une étude de cohorte identifiée dans le cadre de la recherche documentaire actualisée menée aux É.-U. au cours des saisons grippales 2008-2009 à 2013-2014 n'a pas établi de lien entre les antécédents de vaccination contre la grippe pandémique H1N1 et les AS dans les 28 jours suivant la vaccination (RRa = 1,19 %, IC à 95 % : 0,97 à 1,46 %)Note de bas de page 66.
Trois (3) autres études de cohorte à bras unique et une (1) série de cas identifiées à partir de la recherche documentaire actualisée ont rapporté des données sur l'AS chez des personnes ayant reçu le VII pendant la grossesse. L'étude d'un série de cas a décrit des AS après exposition au vaccin qui ont été signalés par plusieurs pays au registre de grossesse FluzoneMD Quadrivalent (VII4, Sanofi) de 2013 à 2019. Quatre (4) AS ont été saisis grâce au registre des grossesses; toutefois, la fréquence des issues indésirables néonatales présentés dans l'étude est cohérente dans l'ensemble de la littérature et ne dépasse pas les taux attendus dans la population générale. Une (1) étude de cohorte a décrit les AS identifiés parmi les grossesses exposées au VII qui ont été signalées au registre américain ou à la base de données d'innocuité mondiale de GSK. Dans les registres des É.-U., 3 AS ont été signalés sur 115 grossesses. Parmi les 3 AS déclarés, 2 ont été exposés au cours du premier trimestre, et un (1) pour lequel la date d'exposition était inconnue. D'après la base de données mondiale, 26 sur 676 rapports d'exposition au vaccin contre la grippe pendant la grossesse ont abouti à des cas d'AS; toutefois, il n'y avait aucune information sur le moment de l'exposition. Les AS apparaissent au cours des premier et deuxième trimestres de la grossesse (c.-à-d., pendant les périodes à risque), de sorte que les expositions survenant au cours du troisième trimestre ne sont pas susceptibles d'être associées de manière causale. Deux (2) études de cohorte prospectives menées pour respecter un engagement postcommercialisation auprès de la Food and Drug Administration (FDA) des É.-U. ont évalué l'innocuité du VII4 (AfluriaMD Quadrivalent) et du VII4-cc (FlucelvaxMD Quadrivalent) administrés pendant la grossesse. Les études ont rapporté 2,5 et 1,9 % d'AS après l'administration du VII4 et du VII4-cc au cours du premier trimestre de la grossesse, respectivement, ce qui n'a pas augmenté par rapport au taux dans la population générale des É.-U. Dans l'ensemble, à partir des 3 études de cohorte à bras unique et de l'étude de la série de cas, aucun signalement en matière d'innocuité n'a été identifié chez les personnes enceintes exposées au VII.
Une (1) étude de cohorte n'a pas observé de lien significatif entre la vaccination contre la grippe pandémique H1N1 avant 21 6/7 semaines de grossesse et l'AS, quel que soit le vaccin reçu au cours de la saison grippale précédente (c.-à-d., le vaccin contre la grippe pandémique H1N1 ou le vaccin contre la grippe non pandémique H1N1)Note de bas de page 66.
L'ensemble de ces études suggère que la vaccination contre la grippe saisonnière pendant la grossesse ne semble pas être associée à un risque accru d'AS.
Préjudices subis par les nourrissons : Autres issues à la naissance
Aucun problème d'innocuité n'a été identifié concernant l'administration de vaccins contre la grippe saisonnière pendant la grossesse, en ce qui a trait à d'autres issues indésirables à la naissance, y compris la mortinaissance (à 18-22 semaines de grossesse ou plus ou à 500 g ou plus), la prématurité, naissance d'un enfant PAG, IPN et les anomalies congénitales identifiées à la naissance ou jusqu'à l'âge de 6 mois. Les données probantes provenaient à la fois d'ECR et d'études d'observation, y compris des études cas-témoins et des études de cohorte. On a identifié un nombre limité de données probantes publiées et évaluées par des pairs concernant l'innocuité de l'administration pendant la grossesse de vaccins antigrippaux plus récemment homologués qui sont basés sur de nouvelles technologies différentes, y compris les VII4-cc de mammifères (p. ex., VII4-cc; FlucelvaxMD Quad) et les VAR (p. ex., VAR4; SupemtekMC). Le Tableau 1. Résumé des données probantes fournit des détails sur d'autres issues indésirables à la naissance.
Considérations en matière d'éthique, d'équité, de faisabilité et d'acceptabilité
Considérations éthiques
Le CCNI a évalué les considérations éthiques suivantes lors de l'élaboration de ses recommandations : promotion du bien-être et réduction du risque de préjudice; maintien de la confiance; respect des personnes et promotion de l'autonomie; et promotion de la justice et de l'équité. Le Comité a également cerné l'impératif éthique de protéger la santé publique et celle des plus vulnérables. Il a pris en compte les considérations éthiques soulevées tout au long du processus d'élaboration des directives sur les vaccins, et ces considérations ont été intégrées aux recommandations.
Considérations en matière d'équité
Aucune iniquité distincte pouvant résulter des recommandations n'a été identifiée. Toutefois, les facteurs intersectionnels suivants, décrits dans le cadre EEFA du CCNI, ont été pris en compte : les conditions préexistantes, les facteurs sociaux, le lieu de résidence et l'accès aux soins de santé.
Les personnes enceintes et les personnes atteintes de maladies chroniques font partie des groupes les plus exposés aux complications ou à l'hospitalisation liées à la grippeNote de bas de page 1. Les personnes racialisées et les populations autochtones peuvent également présenter un risque accru de grippe sévère en raison de divers facteurs qui se recoupent, notamment des affections médicales sous-jacentes et un accès potentiellement réduit aux ressources de soins de santé. Les Canadiens dont le revenu du ménage est faible et le logement est instable ou surpeuplé, et les personnes vivant dans des régions rurales ou éloignées peuvent être davantage exposés à la grippe et éprouver des difficultés à accéder aux soins de santéNote de bas de page 36. Les personnes enceintes issues de la diversité de genre sont plus susceptibles de faire l'objet de discrimination ou de mauvais traitement dans les établissements médicaux et peuvent être plus réticentes à se faire soigner. Les personnes comme les étudiants étrangers et les nouveaux arrivants au Canada peuvent être confrontés à des barrières linguistiques dans l'accès aux soins de santé.
Considérations en matière de faisabilité
Sur la base de la matrice de faisabilité réalisée par le CCNI dans le cadre de son analyse EEFA, aucun problème distinct et important n'a été identifié quant à la faisabilité en ce qui concerne les répercussions sur les ressources et l'intégration qui pourraient avoir une incidence sur la prise de décisions pour cette recommandation, étant donné qu'il s'agit d'un programme de vaccination existant. Des recommandations permettant la vaccination à tous les stades de la grossesse réduiraient les obstacles à la faisabilité des programmes de vaccination.
Considérations en matière d'acceptabilité
Le CCNI a évalué les considérations en matière d'acceptabilité suivantes lors de l'élaboration de ses recommandations : croyances individuelles, valeurs et connaissances, facteurs sociodémographiques et facteurs systémiques. Le refus de la vaccination pendant la grossesse est courant dans le monde, ce qui se traduit par un faible taux de couverture vaccinaleNote de bas de page 70. Le faible taux de vaccination chez les personnes enceintes a été partiellement attribué à l'hésitation vaccinale, qui est complexe et multidimensionnelle et peut être influencée par des facteurs individuels, logistiques, culturels et sociologiques.
Les croyances, les valeurs et les connaissances d'une personne enceinte sur la grippe saisonnière et la vaccination influent sur l'acceptation de la vaccination pendant la grossesseNote de bas de page 70Note de bas de page 71. Les personnes qui pensent que les vaccins sont sans risque et efficaces et les personnes qui se considèrent comme étant exposées au risque de grippe saisonnière et qui souhaitent protéger les autres contre le virus sont plus susceptibles de continuer à se faire vaccinerNote de bas de page 70Note de bas de page 71Note de bas de page 72Note de bas de page 73. Inversement, les personnes enceintes sont moins susceptibles de se faire vacciner si elles ont des croyances anti-vaccination et des préoccupations concernant les effets de la vaccination sur la santé de la personne et du fœtus, ainsi que des connaissances limitées sur les risques de la grippe et les avantages de la vaccination pendant la grossesseNote de bas de page 70Note de bas de page 71Note de bas de page 73. Dans l'Enquête canadien de 2021 sur la vaccination pendant la grossesse (EVG), 51 % des personnes participantes ont répondu que la raison pour laquelle elles n'avaient pas été vaccinées contre la grippe pendant la grossesse était qu'elles « ne voulaient pas être vaccinées pendant la grossesse »Note de bas de page 36. En outre, les données probantes d'Okoli et al. (2021) suggèrent une vulnérabilité potentielle des personnes ayant 2 enfants et plus en ce qui concerne le recours aux soins préventifsNote de bas de page 74, car elles peuvent supposer que leur grossesse actuelle se passera sans problème parce que les grossesses précédentes se sont déroulées sans problème et peuvent devenir complaisantes à l'égard de la vaccination. Ces données suggèrent que les programmes conçus pour améliorer les connaissances des personnes enceintes en matière d'information et de vaccination peuvent favoriser une plus grande acceptation du vaccin contre la grippe saisonnière pendant la grossesseNote de bas de page 74. De plus, il est important de noter qu'en 2021, l'EVG a signalé une augmentation significative (53 %) de la vaccination antigrippale chez les personnes enceintes depuis l'enquête de 2019 (45 %)Note de bas de page 36.
Les facteurs systémiques contribuent à l'acceptabilité de la vaccination contre la grippe saisonnière chez les personnes enceintes. Les systèmes et les politiques ou les modèles de prestation qui favorisent l'accès universel aux vaccins sont les plus efficaces pour améliorer le taux et la couverture dans le contexte canadienNote de bas de page 72. Les professionnels de la santé jouent également un rôle important en proposant le vaccin antigrippal et en influençant positivement les perceptions des personnes enceintes à l'égard de la vaccination contre la grippe saisonnièreNote de bas de page 70Note de bas de page 71Note de bas de page 73Note de bas de page 75Note de bas de page 76. Un meilleur accès à des professionnels de la santé de confiance qui informent les personnes enceintes des avantages et des recommandations de la vaccination contre la grippe saisonnière pendant la grossesse est associé à une acceptabilité accrueNote de bas de page 77. Les résultats de l'ES de Qiu et al. (2021), d'origine internationale, suggèrent que la recommandation d'un professionnel de la santé est le facteur déterminant de l'acceptabilité du vaccin chez les personnes enceintes, et que son absence est le principal obstacle signalé chez les personnes non vaccinéesNote de bas de page 78. Blanchard-Rohner et al. (2012) ont constaté dans leur étude menée en Suisse que la plupart des personnes ayant accouché ne se souvenaient pas qu'on leur avait recommandé la vaccination ni qu'elles avaient été informées des risques de la grippe pendant la grossesseNote de bas de page 79. Les données probantes de l'étude EVG (2021) appuient ces conclusions dans le contexte canadien, la proportion de personnes vaccinées contre la grippe pendant la grossesse étant nettement plus élevée chez celles qui ont reçu une recommandation de vaccination (70 %) que chez celles qui n'ont pas (14 %)Note de bas de page 36. Les connaissances et les croyances des professionnels sur le vaccin antigrippal, leur expérience en matière de soutien aux personnes enceintes, ainsi que leur charge de travail et leurs contraintes de temps, influent sur leurs pratiques en matière de promotion du vaccin antigrippal pendant la grossesseNote de bas de page 80. Ces résultats suggèrent qu'un meilleur accès aux professionnels de la santé bien informés et capables de communiquer sur l'importance de la grippe saisonnière pendant la grossesse est le moyen le plus probable d'accroître l'acceptabilité du vaccin.
Impact de la pandémie de COVID-19 sur la vaccination pendant la grossesse
La pandémie de COVID-19 a eu une incidence sur l'acceptabilité de la vaccination et de la vaccination contre la grippe saisonnière. L'Enquête nationale sur la couverture vaccinale des enfants (ENCVE) recueille des renseignements sur la couverture vaccinale nationale pour les vaccins administrés aux enfants et aux personnes enceintes. Les données de l'ENCVE publiées en décembre 2022 ont montré que la proportion de personnes enceintes qui étaient plus susceptibles de se faire vacciner en raison de la pandémie variait d'une province et d'un territoire à l'autre, allant d'un minimum de 9 % (Québec) à un maximum de 32 % (Yukon). Les résultats de l'enquête ont également montré que la pandémie a augmenté l'intention de se faire vacciner parmi les groupes racialisés; par exemple, une proportion nettement plus élevée de Canadiens d'origine philippine (39 %) et d'origine sud-asiatique (26 %) étaient plus enclins à se faire vacciner en raison de la pandémie que les personnes non autochtones et non racialisées (14 %)Note de bas de page 81. Par ailleurs, l'étude EVG (2021) a identifié des obstacles systématiques à la vaccination au Canada dans le contexte de la pandémie de COVID-19. Cette enquête (2021) a révélé que 11 % des personnes enceintes interrogées ont déclaré avoir rencontré un obstacle ou retardé la vaccination pendant la pandémie de COVID-19. De ce nombre, 73 % ont fait état d'un nombre limité des rendez-vous, 40 % craignaient d'être exposés à la COVID-19, 25 % ont signalé un manque de possibilités sans rendez-vous et 12 % ont reçu des recommandations d'un médecin ou d'une autorité locale de santé publique les incitant à retarder la vaccinationNote de bas de page 36.
Discussion
Le présent examen systématique et méta-analyse (ES/MA) a examiné la littérature actuelle sur l'utilisation des vaccins antigrippaux pendant la grossesse. Les résultats de cet examen suggèrent que la vaccination antigrippale pendant la grossesse est efficace pour réduire le risque d'infection et d'hospitalisation liées à la GCL chez les personnes enceintes et leurs nourrissons jusqu'à 6 mois après l'accouchement. Dans l'ensemble, les données probantes de cet examen indiquent que l'EP et l'ER du vaccin contre la grippe saisonnière chez les personnes enceintes semblent être comparables à celles de la population générale d'adultes en bonne santé et conforment aux estimations ponctuelles de l'ER du vaccin rapportées dans une précédente MA d'Osterholm, et al. (2012)Note de bas de page 82.
Les données probantes suggèrent également que la vaccination antigrippale pendant la grossesse n'augmente pas le risque d'EIG non obstétricaux chez les personnes enceintes, de mortalité infantile, d'AS, de mortinaissance, de naissance prématurée, de naissance d'un enfant PAG, d'IPN ou d'anomalies congénitales. En fait, certaines études ont suggéré un effet protecteur de la vaccination antigrippale pour la mortinaissanceNote de bas de page 83Note de bas de page 84Note de bas de page 85 et l'IPNNote de bas de page 63Note de bas de page 86Note de bas de page 87Note de bas de page 88Note de bas de page 89.
Les résultats de l'ES/MA sont conformes à ceux d'autres examens visant à évaluer l'EP/ER de la vaccination antigrippale pendant la grossesseNote de bas de page 15Note de bas de page 16Note de bas de page 90. En comparaison, l'ES/MA de Quach et al. (2020) ont fait état d'effets protecteurs similaires du vaccin contre la grippe saisonnière contre la GCL chez les personnes enceintes (RR = 0,15, IC à 95 % : 0,06 à 0,36 % et RC = 0,37, IC à 95 % : 0,23 à 0,61 %)Note de bas de page 16. De plus, Nunes et al. (2017) et Jarvis et al. (2020) ont systématiquement signalé des effets protecteurs similaires, les MA démontrant une réduction du risque de GCL chez les nourrissons nés du parent vacciné (RR = 0,52, IC à 95 % : 0,41 à 0,67 %Note de bas de page 90 et RR = 0,66, IC à 95 % : 0,50 à 0,85 %Note de bas de page 15). Les différences mineures entre les résultats regroupés et les conclusions du présent examen peuvent être attribuées à des variations dans les critères d'inclusion des études, les méthodes de MA et d'autres facteurs.
Les résultats de cet ES concordent également avec ceux des examens précédents qui ont étudié l'innocuité des vaccins antigrippaux administrés pendant la grossesse et n'ont trouvé aucun lien significatif avec un risque d'innocuité accruNote de bas de page 13Note de bas de page 14Note de bas de page 15Note de bas de page 16Note de bas de page 90Note de bas de page 91. En particulier, Minozzi et al. (2022) et Hansen et al. (2021) ont rapporté des estimations regroupées qui appuient les résultats du présent examen, démontrant l'absence de lien entre le vaccin antigrippal et la mortalité infantile (RR = 1,24, IC à 95 % : 0,96 à 1,60 %Note de bas de page 13 et RR = 1,11, IC à 95 % : 0,87 à 1,41 %)Note de bas de page 14. De plus, les données probantes actuelles suggèrent que la vaccination antigrippale pendant la grossesse n'a pas d'issues indésirables sur la santé de la petite enfanceNote de bas de page 92Note de bas de page 93Note de bas de page 94.
Malgré les similitudes dans les estimations de l'EP et de l'ER des vaccins antigrippaux pendant la grossesse, il convient de noter les limites des études incluses dans cet examen. Tout d'abord, l'ajustement pour tenir compte des facteurs de confusion n'a pas été systématiquement effectué dans les études d'observation, pas plus que la prise en compte du biais lié au temps continu pour les résultats dépendants du temps. En ce qui concerne le plan de l'étude, il y avait une grande variabilité dans les définitions des issues et les points dans le temps pour certains issues. En outre, il n'était pas clair que certains résultats des ECR puissent être généralisés au contexte canadien. Enfin, des hypothèses ont été formulées concernant l'équivalence des estimations de l'effet et des estimations de l'ER du vaccin, étant donné que la concordance des souches du vaccin antigrippal avec les souches en circulation n'a pas été prise en compte.
Au-delà de la portée de cet examen, un large éventail d'issues supplémentaires concernant l'EP/ER et l'innocuité de la vaccination antigrippale pendant la grossesse a été systématiquement étudié dans la littérature. Par exemple, Jarvis et al. (2020) et Quach et al. (2020) ont évalué l'EP/ER du vaccin antigrippal pendant la grossesse en étudiant l'incidence du syndrome grippal (SG) et d'autres maladies respiratoiresNote de bas de page 15Note de bas de page 16. Inversement, Hansen et al. (2021) ont évalué l'innocuité du vaccin contre la grippe saisonnière en signalant les EI infectieux non liés à la grippe, la mortalité toutes causes confondues et la mortalité attribuable à des causes infectieuses présuméesNote de bas de page 14, tandis que Jarvis et al. (2020) ont déclaré des affections respiratoires de longue durée (asthme)Note de bas de page 15.
Les études portant sur l'impact du moment de la vaccination antigrippale sur la protection de la personne enceinte et du fœtus/nouveau-né sont limitées. Un (1) ES/MA de 2019 sur le moment optimal de la vaccination antigrippale pendant la grossesse ont révélé que les personnes vaccinées plus tard pendant la grossesse avaient une plus grande réponse immunitaire à la vaccination et un transfert d'anticorps plus important vers le fœtusNote de bas de page 95. Toutefois, en donnant la priorité à la vaccination à un âge gestationnel plus avancé, la personne enceinte pourrait rester vulnérable à l'infection grippale pendant une grande partie de sa grossesse et il pourrait être difficile à mettre en œuvre sur le plan programmatique.
Le CCNI continuera de surveiller les données probantes et mettra à jour ses directives, si nécessaire.
Recommandations
Après l'examen des données probantes disponibles qui sont résumées ci-dessus, ainsi que l'évaluation des considérations relatives à l'EEFA du cadre EEFA, la section suivante présente les recommandations fondées sur des données probantes formulées par le CCNI en ce qui concerne la vaccination antigrippale pendant la grossesse. Le CCNI continuera à suivre de près les développements scientifiques liés aux vaccins antigrippaux, ainsi que la pharmacovigilance continue des vaccins, et mettra à jour ses recommandations, si nécessaire. Des renseignements supplémentaires sur la solidité des recommandations du CCNI sont présentés au Tableau 4.
La recommandation suivante concernant la vaccination antigrippale pendant la grossesse complète les recommandations générales du CCNI en matière de vaccination antigrippale, qui figurent dans sa Déclaration sur la vaccination contre la grippe saisonnière. La recommandation générale du CCNI concernant la vaccination antigrippale précise qu'un vaccin antigrippal adapté à l'âge devrait être proposé chaque année à toute personne de 6 mois et plus (Forte recommandation du CCNI), en tenant compte des contrindications propres au produit.
1. Le CCNI recommande de proposer le vaccin antigrippal aux personnes enceintes. Les produits recommandés sont les suivants : VII-SD, VII-cc et VAR. (Forte recommandation du CCNI)
- Aucun signalement en matière d'innocuité n'a été identifié concernant l'utilisation du VAR pendant la grossesse, bien que les données cliniques publiées soient limitées.
- Aucun signalement en matière d'innocuité n'a été identifié concernant l'utilisation du VVAI pendant la grossesse, bien qu'il y ait plus de données sur l'innocuité d'autres vaccins antigrippaux pendant la grossesse. Il existe également des données probantes montrant que le VII est plus efficace que le VVAI chez les adultes en bonne santé. Il convient de noter que la vaccination par le VVAI pendant la grossesse ne devrait pas être considérée comme étant une raison d'interrompre la grossesse.
- Le seul vaccin avec adjuvant au Canada pour la saison grippale 2023-2024 est le vaccin inactivé contre l'influenza trivalent avec adjuvant (VII3-Adj), qui est autorisé pour les nourrissons âgés de 6 à 23 mois (Fluad PediatricMD) et les adultes de 65 ans et plus (FluadMD). Aucun signalement en matière d'innocuité n'a été identifié concernant les vaccins grippaux avec adjuvant pendant la grossesse; toutefois, le VII3-Adj n'est pas autorisé chez les personnes en âge de procréer.
- Le seul vaccin à haute dose au Canada pour la saison grippale 2023-2024 est le vaccin inactivé contre l'influenza quadrivalent à haute dose (VII4-HD) (FluzoneMD Quadrivalent à haute dose) qui est autorisé pour les adultes de 65 ans et plus. Aucun signalement en matière d'innocuité n'a été identifié en ce qui concerne les vaccins antigrippaux à forte dose pendant la grossesse mais le vaccin VII4-HD n'est pas autorisé chez les personnes en âge de procréer.
Résumé des données probantes et justification :
- L'innocuité de la vaccination antigrippale pendant la grossesse est systématiquement étayée par de nombreuses études, y compris des essais cliniques et des études d'observation, ainsi que par des données de pharmacovigilance de routine provenant de systèmes de déclaration de l'innocuité.
- Les données publiées, y compris les études actuellement disponibles sur la mort fœtale, les AS et les malformations congénitales, ne font pas état de tendances inattendues ou préoccupantes. Les données probantes disponibles réaffirment que la vaccination contre la grippe saisonnière pendant la grossesse ne semble pas être associée à des problèmes d'innocuité significatifs en ce qui concerne les issues indésirables à la naissance ou les EIG non obstétricaux chez la mère.
- Les données publiées continuent de démontrer l'EP/ER de la vaccination antigrippale pendant la grossesse pour la protection contre l'infection par la GCL et l'atténuation de la sévérité de l'infection grippale.
- L'EP/ER de la vaccination contre la grippe saisonnière chez les personnes enceintes sont comparables à celles de la population adulte en général.
- Des études ont démontré que les nourrissons sont protégés par les anticorps maternels à la suite de la vaccination antigrippale pendant la grossesse, et leurs résultats suggèrent que la vaccination saisonnière pendant la grossesse réduit le risque d'infections et d'hospitalisations attribuables à la GCL chez les nourrissons âgés de 6 mois ou moins.
2. Le CCNI recommande de proposer la vaccination antigrippale à n'importe quel stade de la grossesse (c.-à-d., à n'importe quel trimestre). (Forte recommandation du CCNI)
- Si la grossesse d'une personne s'étend sur 2 saisons grippales, cette personne peut recevoir 2 doses de vaccin antigrippal (c.-à-d., une dose par saison, au cours de la grossesse).
Résumé des données probantes et justification :
- Il n'existe pas de données probantes suffisantes pour établir le moment optimal de la vaccination antigrippale en ce qui concerne les issues pour la mère, le fœtus et le nouveau-né.
- Le fait de donner la priorité à la vaccination à un stade gestationnel précis peut entraîner des défis programmatiques et des possibilités de vaccination manquées.
3. Le CCNI recommande d'inclure toutes les personnes enceintes, quel que soit le stade de la grossesse, parmi celles à qui il est particulièrement recommandé de se faire vacciner contre la grippe. (Forte recommandation du CCNI)
Résumé des données probantes et justification :
- Les données probantes disponibles montrent systématiquement un lien entre la grossesse et la sévérité accrue de la maladie en cas d'infection grippale. Cela comprend l'hospitalisation, l'admission à l'USI, la ventilation mécanique invasive et la mortalité maternelle.
- Il existe également un risque plus élevé d'issues néonatales indésirables (p. ex., accouchement prématuré, IPN, admission à l'USI) en cas d'infection grippale pendant la grossesse.
- Les risques d'accouchement prématuré, d'IPN et d'admission à l'USI néonatals augmentent avec la sévérité de la maladie chez la personne enceinte.
- Les nourrissons âgés de moins de 6 mois présentent un risque accru d'hospitalisation attribuable à l'infection grippale par rapport aux enfants d'autres âges. Toutefois, le vaccin antigrippal n'est pas efficace chez les nourrissons âgés de moins de 6 mois; par conséquent, l'immunisation passive des fœtus au moyen d'anticorps antigrippaux transmis par voie transplacentaire est actuellement la meilleure stratégie de prévention disponible.
- Malgré les risques accrus de maladie sévère, le taux de vaccination antigrippale pendant la grossesse n'est pas optimal au Canada, puisque seulement 53 % des personnes enceintes ont reçu le vaccin en 2021.
- Parmi les personnes enceintes, le fardeau de la maladie est disproportionné et le taux de vaccination est faible chez les personnes racialisées, les Autochtones, les jeunes, les personnes à faible revenu et/ou vivant en milieu rural.
4. Le CCNI réitère sa recommandation selon laquelle la vaccination antigrippale peut être administrée en même temps qu'un autre vaccin, y compris le vaccin contre la COVID-19 ou contre la coqueluche, ou à tout moment avant ou après l'administration de cet autre vaccin. (Forte recommandation du CCNI)
- Il faudrait saisir toutes les occasions de vacciner la personne enceinte pendant sa grossesse, avec tous les vaccins auxquels elle est admissible.
Résumé des données probantes et justification :
- Aucun signalement en matière d'innocuité connu n'a été identifié pour l'administration concomitante de la grippe et d'un autre vaccin pendant la grossesse.
- L'administration de plusieurs vaccins lors d'une même visite constitue une stratégie visant à augmenter le taux de vaccination.
Priorités de recherche
- Étudier les issues à long terme des nourrissons et des enfants exposés à l'infection grippale in utero.
- Recherche sur la grippe saisonnière et les taux de vaccination chez les personnes enceintes et les nourrissons en dehors du contexte de pandémie de grippe H1N1 en 2009, en particulier pendant/après la pandémie de COVID-19.
- Rassembler des données de surveillance de la grippe à l'échelle nationale chez les personnes enceintes et les nourrissons âgés de moins de 6 mois au Canada pour mieux définir le fardeau de la maladie pour les personnes enceintes et les nourrissons.
- Étudier les issues à plus long terme pour les enfants nés de personnes vaccinées pendant la grossesse.
- Rassembler des données supplémentaires sur l'innocuité des nouvelles technologies vaccinales, y compris les vaccins antigrippaux issus de la culture cellulaire et les VAR.
- Étudier le moment de la vaccination antigrippale chez les personnes enceintes du point de vue de la durée ou de l'affaiblissement de la protection contre l'infection et la maladie sévère.
- Examiner la confiance et l'acceptabilité des vaccins chez les personnes enceintes au Canada, en particulier dans les groupes racialisés.
- Éventail et interaction complexe des facteurs qui influent sur l'acceptabilité de la vaccination antigrippale en général et pour les groupes à haut risque (y compris les personnes enceintes).
- Étudier l'impact continu potentiel de la pandémie de COVID-19 sur l'hésitation à se faire vacciner et sur le taux de vaccination chez les mères.
- En savoir plus sur les obstacles à la vaccination maternelle, au niveau des patients, des professionnels et du système au Canada, notamment :
- Facteurs politiques et structurels
- Connaissances, compréhension et croyances des patient(e)s concernant la vaccination antigrippale pendant la grossesse, compte tenu notamment de l'hétérogénéité de la population canadienne (c.-à-d., différences socio-économiques et culturelles et différences du niveau de confiance dans le système médical)
Priorités de surveillance
La collecte, l'analyse et l'interprétation continues et systématiques des données, ainsi que leur diffusion en temps utile, sont essentielles à la planification, à la mise en œuvre, à l'évaluation et à la prise de décisions fondée sur des données probantes. Pour soutenir ces efforts, le CCNI encourage la surveillance permanente et l'expansion continue des détails de la surveillance de l'épidémiologie de la grippe au Canada.
Dans l'ensemble, les connaissances sur l'impact de la grippe saisonnière chez les personnes enceintes et sur les issues périnatales et postnatales au Canada et à l'échelle internationale sont insuffisantes. À ce jour, la plupart des études épidémiologiques ont porté sur la pandémie de grippe H1N1 de 2009 dans certains pays à revenu élevé (p. ex., les É.-U.) et font état de résultats contradictoires sur le lien entre la maladie grippale et les issues périnatales indésirables. Il y a également un manque d'études réalisées après la pandémie de COVID-19, à partir de fin 2019/début 2020. Par conséquent, une surveillance plus actualisée de la grippe saisonnière chez les personnes enceintes et les jeunes nourrissons dans les pays à revenu faible, moyen et élevé, y compris le Canada, est nécessaire pour mieux comprendre le fardeau de la maladie et mettre au point des campagnes de vaccination ciblées pour ces groupes à haut risque.
Au Canada, ÉpiGrippe, le système national de surveillance, suit la propagation de la grippe et du SG par province/territoire et par groupe d'âge mais ne précise pas le statut de la grossesse. Par conséquent, des initiatives sont nécessaires pour recueillir des renseignements sur la grippe (p. ex., incidence du SG, souche virale, hospitalisation) auprès des personnes enceintes afin d'orienter les efforts de santé publique appropriés, tels que les campagnes de vaccination ciblées et l'éducation.
Tableaux
| Étude | Issues | Vaccin | Plan de l'étude | Participants (n/N) | Résumé des principales conclusions | Résumé | |
|---|---|---|---|---|---|---|---|
| Niveau des données probantes | Qualité | ||||||
| Efficacité potentielle du vaccin (EP) | |||||||
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les Instituts de recherche en santé du Canada (IRSC) et le Réseau sur l'innocuité et l'efficacité des médicaments (RIEM) |
Grippe confirmée en laboratoire (GCL) et évaluée par la technique de transcription inverse suivie de réaction en chaîne de la polymérase (RT-PCR) pendant la grossesse et jusqu'à 6 mois après l'accouchement |
VII3 (VaxigripMD, Sanofi) Placebo Contrôle actif : |
Essai contrôlé randomisé (ECR)Note de bas de page 40Note de bas de page 41Note de bas de page 42 Pays : Suivi : Un ECR s'est limité aux saisons grippales 2011-2012 et 2012-2013Note de bas de page 40 Financement : |
Personnes enceintes (n = 10 074) VII3 : n = 5 089 (50,5 %) Placebo ou contrôle actif : n = 4 985 (49,5 %) |
La méta-analyse (MA) comprenait 3 ECR L'EP du vaccin regroupée était de 50 % (IC à 95 % : 22 à 68 %), I2 = 49,22 % |
Niveau I |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
GCL et évaluée par RT-PCR chez les nourrissons âgés de moins de 6 mois |
VII3 (VaxigripMD, Sanofi et Fluarix, GSK) Placebo Contrôle actif : |
ECRNote de bas de page 40Note de bas de page 42Note de bas de page 43 Pays : Suivi : Financement : |
Nourrissons de 6 mois ou moins (n = 3 474) VII3 : n = 1 744 (50,2 %) Placebo ou contrôle actif : n = 1 730 (49,8 %) |
La MA a porté sur 4 ECR L'EP du vaccin regroupée était de 37 % (IC à 95 % : 22 à 49 %), I2 = 0,00 |
Niveau I |
Passable |
| Efficacité potentielle du vaccin | |||||||
Maltezou HC, Stavros S, Asimakopoulos G et al. Effectiveness of maternal vaccination with quadrivalent inactivated influenza vaccine in pregnant women and their infants in 2019-2020. 2022Note de bas de page 46 Financée par Sanofi |
GCL et évaluée par RT-PCR pendant la grossesse |
VII4 (VaxigripTetraMD, Sanofi) |
Étude de cohorte prospective Pays : Suivi : Financement : |
Personnes enceintes de 18 à 45 ans (n = 636) VII4 : n = 406 (63,8 %) Non vaccinées : n = 230 (36,2 %) |
L'efficacité réelle du vaccin ajustée(ERa) était de 43,5 % (IC à 95 % : 28,4 à 55,6 %) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM Et étude identifiée à partir de la recherche documentaire actualisée : Financée par le National Institute for Communicable Diseases of the National Health Laboratory Service, les US Centers for Disease Control and Prevention et la Bill and Melinda Gates Foundation |
Hospitalisation attribuable à une GCL évaluée par RT-PCR pendant la grossesse ou jusqu'à 42 jours après l'accouchement |
VII (vaccin contre la grippe saisonnière) |
Plan d'étude à tests-négatifs (Thompson 2019 et Nunes 2022)Note de bas de page 44Note de bas de page 47 Pays : Suivi : Financement : |
Personnes enceintes (n = 1 391) VII : n = 317 (22,8 %) Non vaccinées : n = 1 074 (77,2 %) |
La MA comprenait 2 plans d'étude à tests-négatifs L'ERa du vaccin regroupée était de 42 % (IC à 95 % : 19 à 59 %), I2 = 0,00 % |
Niveau II-2 |
Bonne |
Vousden N, Bunch K, Knight M et al. Incidence, risk factors and impact of seasonal influenza in pregnancy: A national cohort study. 2021Note de bas de page 48 Financée par le National Institute for Health Research (NIHR) |
Hospitalisation attribuable à une GCL par un test virologique à n'importe quel stade de la grossesse ou jusqu'à 2 jours après l'accouchement |
VII (vaccin contre la grippe saisonnière) |
Étude de cohorte prospective Pays : Suivi : Financement : |
Personnes hospitalisées à n'importe quel stade de la grossesse ou jusqu'à 2 jours après l'accouchement (n = 1 099) VII : n = 320 (29,1 %) Non vaccinées : n = 466 (42,4 %) Inconnu/ manquant : n = 313 (28,5 %) |
L'ER du vaccin était de 38 % (IC à 95 % : 14 à 55 %) |
Niveau II-2 |
Passable |
Études identifiées à partir de la recherche documentaire actualisée : Financée par Sanofi Foo D, Sarna M, Pereira G et al. Longitudinal, population-based cohort study of prenatal influenza vaccination and influenza infection in childhood. 2022Note de bas de page 49 Financée par le National Health and Medical Research Council, la Curtin University Graduate Research School, le Wesfarmers Centre of Vaccines and Infectious Disease Rowe SL, Leder K, Perrett KP, et al. Maternal Vaccination and Infant Influenza and Pertussis. 2021Note de bas de page 50 Financée par le Victoria State Government Department of Health en Australie, dans le cadre de l'évaluation du programme de vaccination systématique |
GCL chez les nourrissons de 6 mois ou moins |
VII (vaccin contre la grippe saisonnière) |
Études de cohorteNote de bas de page 46Note de bas de page 49Note de bas de page 50 Pays : Suivi : Financement : |
Nourrissons de 6 mois ou moins (n = 296 611) Nourrissons nés d'un parent gestationnel vacciné : n = 100 042 (33,7 %) Nourrissons nés d'un parent gestationnel non vacciné : n = 196 569 (66,3 %) |
La MA comprenait 3 études de cohorte L'ER du vaccin regroupée était de 41 % (IC à 95 % : 23 à 55 %), I2 = 17 % |
Niveau II-2 |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM Et les études identifiées à partir de la recherche documentaire actualisée : Financée par le National Institute for Communicable Diseases of the National Health Laboratory Service, les US Centers for Disease Control and Prevention et la Bill and Melinda Gates Foundation McRae J, Blyth CC, Cheng AC et al. Preventing severe influenza in Australian infants: Maternal influenza vaccine effectiveness in the PAEDS-FluCAN networks using the test-negative design. 2022Note de bas de page 51 Financée par le National Health and Medical Research Council, le ministère de la Santé du gouvernement australien et les ministères de la Santé de la Nouvelle-Galles-du-Sud, de Victoria, de Queensland, de l'Australie-Méridionale, de l'Australie-Occidentale et du Territoire du Nord |
Hospitalisation attribuable à une GCL chez les nourrissons de 6 mois ou moins |
VII (vaccin contre la grippe saisonnière) |
Plans d'Étude à tests-négatifs (Benowitz 2010, McRae 2022, et Nunes 2022)Note de bas de page 45Note de bas de page 47Note de bas de page 51 Pays : Suivi : Financement : |
Nourrissons de 6 mois ou moins (n = 1 702) Nourrissons nés d'un parent gestationnel vacciné : n = 612 (36,0 %) Nourrissons nés d'un parent gestationnel non vacciné : n = 1 090 (64,0 %) |
La MA incluait 3 plans d'étude à tests-négatifs L'ERa du vaccin regroupée était de 42 % (IC à 95 % % 16 à 59 %), I2 = 71 % |
Niveau II-2 |
Passable |
Foo D, Sarna M, Pereira G et al. Longitudinal, population-based cohort study of prenatal influenza vaccination and influenza infection in childhood. 2022Note de bas de page 49 Financée par le National Health and Medical Research Council, la Curtin University Graduate Research School, le Wesfarmers Centre of Vaccines and Infectious Disease |
Hospitalisation attribuable à une GCL chez les nourrissons de 6 mois ou moins |
VII (vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospective basée sur la population Pays : Suivi : Financement : |
Accouchements simples, nourrissons nés vivants (n = 124 760) Nourrissons nés d'un parent gestationnel vacciné : n = 14 396 (11,5 %) Nourrissons nés d'un parent gestationnel non vacciné : n = 110 364 (88,5 %) |
L'ERa du vaccin était de 62 % (IC à 95 % : 9 à 84 %) |
Niveau II-2 |
Bonne |
Rowe SL, Leder K, Perrett KP, et al. Maternal Vaccination and Infant Influenza and Pertussis. 2021Note de bas de page 50 Financée par le Victoria State Government Department of Health en Australie, dans le cadre de l'évaluation du programme de vaccination systématique |
Hospitalisation attribuable à une GCL chez les nourrissons de 6 mois ou moins |
VII (vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospective Pays : Suivi : Financement : |
Nourrissons de 6 mois ou moins (n = 185 404) Nourrissons nés d'un parent gestationnel vacciné : n = 85 365 (46,0 %) Nourrissons nés d'un parent gestationnel non vacciné : n = 86 012 (46,4 %) Nourrissons nés de parents gestationnels dont le statut vaccinal est manquant ou inconnu : n = 14 027 (7,6 %) |
L'ERa du vaccin était de 20,85 % (IC à 95 % : -17,74 à 46,79) chez les nourrissons de moins de 6 mois L'ERa du vaccin était de 34,37 % (IC à 95 % : -14,83 à 62,49 %) chez les nourrissons de moins de 2 mois, et de 4,00 % (IC à 95 % : -66,75 à 44,73 %) chez les nourrissons de 2 mois à moins de 6 mois |
Niveau II-2 |
Passable |
| Innocuité | |||||||
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Évènements indésirables graves (EIG) non obstétricaux chez les personnes enceintes : réactions systémiques graves dans les 7 jours suivant l'intervention |
VII3 (VaxigripMD, Sanofi) Placebo Contrôle actif : Vaccin quadrivalent contre le méningocoque (MenactraMD, Sanofi) |
Deux (2) essais contrôlés randomisés (ECR)Note de bas de page 41Note de bas de page 42 Pays : Suivi : Financement : |
Personnes enceintes (n = 4 540) VII3 : n = 2 286 (50,3 %) Placebo : n = 172 (3,8 %) Contrôle actif : n = 2 082 (45,9 %) |
Aucune différence perceptible entre les groupes dans l'un ou l'autre des ECR inclus Tapia et al, 2016 : 2 sur 2 105 personnes vaccinées et 0 sur 2 082 témoinsNote de bas de page 42 Madhi et al, 2014 : 27 sur 181 personnes vaccinées et 19 sur 172 témoins (p = 0,36)Note de bas de page 41 |
Niveau I |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
EIG non obstétricaux chez les personnes enceintes : hospitalisation périnatale |
VII3 (Fluarix, GSK) Contrôle actif : Vaccin anti-pneumococcique, 23-valent (PneumovaxMD 23, Merck) |
Pays : Suivi : Financement : |
Personnes enceintes (n = 316) VII3 : n = 159 (50,3 %) Contrôle actif : n = 157 (49,7 %) |
Un seul ECR n'a pas révélé de différence apparente de risque entre le VII3 (1 évènement/159) et le contrôle actif (2 évènements/ 157) |
Niveau I |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
EIG non obstétricaux chez les personnes enceintes : évènements possiblement ou probablement liés à la vaccination dans les 30 jours suivant l'intervention |
VII3 (VaxigripMD, Sanofi) Placebo |
Pays : Suivi : Financement : |
Personnes enceintes (n = 2 116) VII3 : n = 1 062 (50,2 %) Placebo : n = 1 054 (49,8 %) |
Un seul ECR n'a pas révélé de différence apparente de risque entre le groupe VII3 (1/1 062) et le groupe placebo (0/1 054) |
Niveau I |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
EIG non obstétricaux chez les personnes enceintes : évènements non liés à la grossesse entraînant une hospitalisation dans les 42 jours suivant l'administration du vaccin |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospectiveNote de bas de page 54 Pays : Suivi : Financement : |
Personnes enceintes au deuxième ou troisième trimestre de la grossesse (n = 1 051) VII3 : n = 225 (21,4 %) Non vaccinées : n = 826 (78,6 %) |
Une seule étude de cohorte n'a pas révélé de différence apparente de risque entre les personnes ayant reçu le VII3 (2/225) et les personnes enceintes non vaccinées (3/826) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
EIG non obstétricaux chez les personnes enceintes : syndrome de Guillain-Barré chez les patients hospitalisés dans les 42 jours |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospectiveNote de bas de page 59 Pays : Suivi : Financement : |
Personnes enceintes au premier trimestre de la grossesse (n = 223 898) VII3 : n = 75 906 (33,9%) Non vaccinées : n = 147 992 (66,1 %) |
Une seule étude de cohorte n'a pas révélé de différence significative entre les personnes enceintes ayant reçu le VII3 (0/75 906) et celles non vaccinées (1/147 992) (p = 0,34) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
EIG non obstétricaux chez les personnes enceintes : non définis et moment du suivi non rapporté |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospectiveNote de bas de page 58 Pays : Suivi : Financement : |
Personnes enceintes (n = 346) VII3 : n = 288 (83,2 %) Non vaccinées : n = 58 (16,8 %) |
Aucun évènement n'a été constaté dans une étude de cohorte unique portant sur 288 personnes enceintes ayant reçu le VII3 et 58 personnes enceintes non vaccinées |
Niveau II-2 |
Passable |
Ledlie S, Gandhi-Banga S, Shrestha et al. Exposure to quadrivalent influenza vaccine during pregnancy: Results from a global pregnancy registry. 2022Note de bas de page 60 Financée par Sanofi |
Évènements indésirables (EI) non obstétricaux chez les personnes enceintes : Syndrome de Guillain-Barré |
VII4 (FluzoneMD Quadrivalent; Sanofi) |
Séries de cas rétrospectives et prospectives, multicentres Pays : Suivi : Financement : |
Personnes en âge de procréer qui ont été exposées au VII4 pendant la grossesse ou dans les 30 jours suivant leurs dernières règles (n = 239) Trimestre d'exposition, n (%) : |
Un cas (0,4 %) de syndrome de Guillain-Barré est survenu dans les 5 jours suivant la vaccination chez une femme de 29 ans qui s'est rétablie et a donné naissance à un enfant en bonne santé pendant sa convalescence |
Niveau III |
Faible Biais dans les rapports Taux élevé de perte de suivi (80 %) |
Carreras JJ, Lluch JA, Taboada JA, et al. Adverse events in pregnant women with the tetravalent influenza vaccine obtained from cell cultures. 2022Note de bas de page 56 Financée par Seqirus |
EI non obstétricaux chez les personnes enceintes à tout moment après l'administration du vaccin |
VII4-cc (FlucelvaxMD Quad, Seqirus) |
Étude de cohorte rétrospective, multicentre Pays : Suivi : Financement : |
Personnes de 18 à 64 ans ayant reçu leVII4-cc (n = 244 731) Personnes enceintes : N = 24,870 (10,2 %) Personnes non enceintes : N = 219,861 (89,8 %) |
Le taux d'EI pour 100 000 doses administrées était de 4,0 et 5,9 chez les personnes enceintes et non enceintes, respectivement Aucun EIG n'a été signalé chez les personnes enceintes |
Niveau II-2 |
Faible Biais dans les rapports Manque de cohérence dans la qualité des données Données limitées sur l'EI et le délai suivant l'administration du vaccin |
Betancourt-Cravioto M, Cervantes-Powell P, Tapia-Conyer R et al. Improved post-marketing safety surveillance of quadrivalent inactivated influenza vaccine in Mexico using a computerized, SMS-based follow-up system. 2022Note de bas de page 55 Financée par Sanofi |
EI non obstétricaux chez les personnes enceintes dans les 42 jours suivant l'administration du vaccin |
VII4 (FluzoneMD Quadrivalent; Sanofi) |
Étude de cohorte prospective, multicentre Pays : Suivi : Financement : |
Personnes de 6 mois et plus ayant reçu un vaccin antigrippal systématique dans les centres de l'étude (n = 2 013) Personnes enceintes : n = 18 (0,9 %) |
Une (1) personne enceinte (5,6 %) a signalé un EI non grave (c.-à-d. un EI qui n'a pas nécessité de visite médicale) |
Niveau II-2 |
Faible Taille réduite de l'échantillon Biais dans les rapports Aucun renseignement sur les EI signalés, y compris leur sévérité et leur durée |
Vanni T, Thomé BdC, Oliveira MMM, et al. Active pharmacovigilance of the seasonal trivalent influenza vaccine produced by Instituto Butantan: A prospective cohort study of five target groups. 2021Note de bas de page 57 Financé par la Fondation Butantan |
EI non obstétricaux chez les personnes enceintes dans les 42 jours suivant l'administration du vaccin |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte prospective, multicentre Pays : Suivi : Financement : |
Personnes de 6 mois et plus ayant reçu un vaccin antigrippal systématique dans les centres de l'étude (n = 942) Personnes enceintes : n = 108 (11,5 %) |
82 (75,9 %) personnes enceintes ont présenté un EI 78 (72,2 %) personnes enceintes ont présenté une réaction indésirable (c.-à-d. tout EI ayant une relation de cause à effet raisonnable avec le vaccin, selon le Uppsala Monitoring Centre de l'Organisation mondiale de la Santé) Aucun EIG n'a été signalé chez les personnes enceintes |
Niveau II-2 |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le REIM |
Décès de nourrissons de 6 mois ou moins |
VII3 (Vaccin contre la grippe saisonnière : VaxigripMD, Sanofi; n = 3, Fluarix, GSK; n = 1) Placebo (n = 2) Contrôle actif : Vaccin méningococcique quadrivalent (n = 1, MenactraMD, Sanofi) ou vaccin pneumococcique 23-valent (n = 1, PneumovaxMD 23, Merck) |
Quatre (4) ECR (Zaman 2006, Madhi 2014, Tapia 2016, Steinhoff 2017)Note de bas de page 40Note de bas de page 41Note de bas de page 42Note de bas de page 43 Pays : Suivi : Financement : |
Nourrissons de 6 mois ou moins (n = 10 115) VII3 : n = 5 071 (50,1 %) Placebo ou contrôle actif : n = 5 044 (49,9 %) |
La MA a porté sur 4 ECR Le rapport de risque (RR) regroupé était de 1,14 (IC à 95 % : 0,86 à 1,50), I2 = 9,33 |
Niveau I |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Décès de nourrissons de 6 mois ou moins |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte prospectiveNote de bas de page 61 Pays : Suivi : Financement : |
Nourrissons ayant reçu un diagnostic de fièvre (n = 83) Nourrissons nés d'un parent gestationnel vacciné : n = 36 (43,4 %) Nourrissons nés d'un parent gestationnel non vacciné : n = 47 (56,6 %) |
Aucun décès de nourrisson n'a été signalé parmi les nourrissons nés d'un parent gestationnel vacciné ou non vacciné |
Niveau II-2 |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Avortement spontané (AS) (moins de 20 semaines de gestation) |
VII (vaccin contre la grippe saisonnière) |
Deux (2) études de cohorteNote de bas de page 62Note de bas de page 63 Pays : Suivi : Financement : |
Personnes enceintes (n = 1 900) VII : n = 983 (51,7 %) Non vaccinées : n = 917 (48,3 %) |
Les MA comprenaient 2 études de cohorte Le RRA regroupé était de 0,77 (IC à 95 %, 0,31 à 1,89),12=37,51 |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
AS (moins de 22 semaines de gestation) |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte prospectiveNote de bas de page 64 Pays : Suivi : Financement : |
Personnes au premier trimestre de la grossesse (n = 2 826) VII3 : n = 1 121 (39,7%) Non vaccinées : n = 1 705 (60,3 %) |
Une seule étude de cohorte a rapporté des données brutes avec le même risque dans les groupes exposés et non exposés (0,4 % et 0,4 %, respectivement) |
Niveau II-2 |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
AS (moins de 20 semaines de gestation) dans les 28 jours suivant l'administration du vaccin |
VII3 (Vaccin contre la grippe saisonnière) |
Étude rétrospective cas-témoins)Note de bas de page 65 Pays : Suivi : Financement : |
Personnes enceintes de 18 à 44 ans vaccinées contre la grippe (n = 970) |
Le RCa était de 3,70 (IC à 95 %, 1,40 à 9,40) en 2010/2011 et de 1,40 (IC à 95 %, 0,60 à 3,30) en 2011/2012 Analyses a posteriori des données 2010/2011 : Parmi les personnes non vaccinées au cours de la saison précédente, le RCa était de 1,3 (IC à 95 %, 0,7 à 2,7) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
AS (moins de 20 semaines de gestation) dans les 28 jours suivant l'administration du vaccin |
VII3 (Vaccin contre la grippe saisonnière) |
Étude rétrospective cas-témoinsNote de bas de page 65 Pays : Suivi : Financement : |
Personnes enceintes de 18 à 44 ans (n = 2 472) Vaccinées au cours de la saison précédente : n = 1 254 (50,3 %) Non vaccinées au cours de la saison précédente : n = 1 218 (49,3 %) |
Globalement, le RCa était de 0,80 (IC à 95 %, 0,60 à 1,10) Le RCa était de 0,9 (IC à 95 %, 0,6 à 1,5) chez les personnes vaccinées au cours de la saison précédente et de 0,7 (IC à 95 %, 0,4 à 1,1) chez celles qui n'avaient pas été vaccinées au cours de la saison précédente |
Niveau II-2 |
Bonne |
Romano CJ, Hall C, Khodr ZG, et al. History of pandemic H1N1-containing influenza vaccination and risk of spontaneous abortion and birth defects. 2021Note de bas de page 66 Financement par la Defense Health Agency Immunization Healthcare Division et le U.S. Navy Bureau of Medicine and Surgery |
AS (moins de 22 semaines de gestation) dans les 28 jours suivant l'administration du vaccin |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospective Pays : Suivi : Financement : |
Personnes enceintes de 17 ans et plus (n = 26 264) Exposition à un vaccin contenant le virus pH1N1 au cours de la saison précédant la grossesse : n = 21 736 (82,8 %) Exposition à un vaccin ne contenant pas le virus H1N1 au cours de la saison précédant la grossesse : n = 4 528 (17,2 %) |
Le RRA était de 1,19 (IC à 95 %, 0,97 à 1,46) |
Niveau II-2 |
Bonne |
Robinson C, Oberye J, Van Boxmeer J et al. A prospective cohort study on pregnancy outcomes of persons immunized with a seasonal quadrivalent inactivated influenza vaccine during pregnancy. 2022Note de bas de page 68 Financement par Seqirus Inc |
AS (moins de 20 semaines de gestation) |
VII4 (AfluriaMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec le vaccin VII4 à tout moment de la grossesse (n = 483) Trimestre d'exposition : Vaccinées moins de 20 semaines de gestation : n = 160 (33,1 %) |
Quatre (4) évènements (2,5 %, IC à 95 %, 0,7 à 6,3) ont été signalés parmi les personnes vaccinées à moins de 20 semaines de gestation (n = 160) |
Niveau III |
Passable |
Robinson C, Van Boxmeer J, Tilson H, et al. Outcomes in pregnant persons immunized with a cell-based quadrivalent inactivated influenza vaccine: A prospective observational cohort study. 2022Note de bas de page 69 Financement par Seqirus Inc |
AS (moins de 20 semaines de gestation) |
VII4-cc (FlucelvaxMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec VII4-cc à tout moment de la grossesse (n = 665) Trimestre d'exposition : Vaccinées moins de20 semaines de gestation : n = 211 (31,7 %) |
Quatre (4) évènements (1,9 %, IC à 95 %, 0,5 à 4,8) ont été signalés parmi les personnes vaccinées à moins de 20 semaines de gestation (n = 211) |
Niveau III |
Passable |
Ledlie S, Gandhi-Banga S, Shrestha et al. Exposure to quadrivalent influenza vaccine during pregnancy: Results from a global pregnancy registry. 2022Note de bas de page 60 Financée par Sanofi |
AS |
VII4 (FluzoneMD Quadrivalent; Sanofi) |
Séries de cas rétrospectives et prospectives, multicentres Pays : Suivi : Financement : |
Personnes en âge de procréer qui ont été exposées au VII4 pendant la grossesse ou dans les 30 jours suivant leurs dernières règles (n = 239) Trimestre d'exposition, n (%) : |
Quatre (4) évènements (6,4 %, IC à 95 %, 2,08 à 15,90) ont été signalés |
Niveau III |
Faible Biais dans les rapports Taux élevé de perte de suivi (80 %) |
Nwoji U. Seasonal influenza vaccine exposure in pregnancy: 5-year results from a pregnancy registry. 2022Note de bas de page 67 Financement par GlaxoSmithKline Biologicals SA |
AS (moins de 22 semaines de gestation) |
VII3 (Fluarix et FluLaval, GSK) ou VII4 (Fluarix Quadrivalent et FluLaval Quadrivalent, GSK) |
Étude de cohorte prospective Pays : Suivi : Financement : |
Personnes vaccinées pendant la grossesse ou dans les 28 jours précédant la conception (n = 507) Trimestre d'exposition, n (%) : Aucun suivi : n = 359 (70,8 %) |
Trois (3) évènements (2,6 %) ont été signalés Deux (2) sont survenus chez des personnes vaccinées au cours du premier trimestre de la grossesse, et le trimestre d'exposition de l'une d'entre elles n'était pas connu |
Niveau III |
Faible Biais dans les rapports Taux élevé de perte de suivi (70,8 %) |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Mortinaissance (égal à ou plus de 18-22 semaines de gestation ou égal à ou plus de 500 g) |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospectiveNote de bas de page 83 Pays : Suivi : Financement : |
Personnes enceintes (n = 58 008) VII3 : n = 5 076 (8,8 %) Non vaccinées : n = 52 932 (91,2 %) |
Le RRA était de 0,49 (IC à 95 %, 0,29 à 0,83) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Mortinaissance (égal à ou plus de 18-22 semaines de gestation ou égal à ou plus de 500 g) |
VII (vaccin contre la grippe saisonnière) |
Étude rétrospective cas-témoinsNote de bas de page 96 Pays : Suivi : Financement : |
Personnes enceintes (n = 12 109) VII : n = 1 736 (14,3%) Non vaccinées : n = 10 373 (85,7 %) |
Le RCa était de 0,95 (IC à 95 %, 0,79 à 1,14) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Mortinaissance (égal à ou plus de 18-22 semaines de gestation ou égal à ou plus de 500 g) |
VII (vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospectiveNote de bas de page 97 Pays : Suivi : Financement : |
Personnes au premier trimestre de la grossesse (n = 11 955) VII : n = 2 391 (20,0%) Non vaccinées : n = 9 564 (80,0 %) |
Le RRa était de 1,18 (IC à 95 %, 0,64 à 2,18) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Mortinaissance (égal à ou plus de 18-22 semaines de gestation ou égal à ou plus de 500 g) |
VII (vaccin contre la grippe saisonnière) |
Étude de cohorte prospectiveNote de bas de page 62 Pays : Suivi : Financement : |
Personnes enceintes (n = 1 707) VII : n = 1 240 (72,6%) Non vaccinées : n = 467 (27,4 %) |
Le rapport de risque était de 0,38 (IC à 95 %, 0,05 à 2,92) Dans l'analyse restreinte à la vaccination au cours du premier trimestre de la grossesse, le rapport de risque était de 0,98 (IC à 95 %, 0,13 à 7,50) |
Niveau II-2 |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Mortinaissance (égal à ou plus de 18-22 semaines de gestation ou égal à ou plus de 500 g) |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte prospectiveNote de bas de page 84 Pays : Suivi : Financement : |
Personnes enceintes (n = 85 783) VII3 : n = 8 864 (10,3%) Non vaccinées : n = 76 919 (89,7 %) |
Le rapport de risque était de 0,60 (IC à 95 %, 0,41 à 86) Dans l'analyse restreinte à la vaccination au cours du premier trimestre de la grossesse, le rapport de risque était de 2,54 (IC à 95 %, 0,36 à 18,01) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Mortinaissance (égal à ou plus de 18-22 semaines de gestation ou égal à ou plus de 500 g) |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte prospectiveNote de bas de page 64 Pays : Suivi : Financement : |
Personnes enceintes (n = 10 330) VII3 : n = 3 943 (38,2%) Non vaccinées : n = 6 387 (61,8 %) |
Le rapport de risque était de 0,44 (IC à 95 %, 0,12 à 1,58) Dans l'analyse restreinte au premier trimestre de la grossesse, le rapport de risque était de 0,30 (IC à 95 %, 0,01 à 6,33) |
Niveau II-2 |
Passable |
Giles ML, Davey MA, Wallace EM. Associations Between Maternal Immunisation and Reduced Rates of Preterm Birth and Stillbirth: A Population Based Retrospective Cohort Study. Frontiers in immunology. 2021Note de bas de page 85 Financement : |
Mortinaissance |
VII (vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospective Pays : Suivi : Financement : |
Personnes enceintes d'une grossesse simple plus de 28 semaines de gestation (n = 269 493) VII : n = 138 698 (51,5 %) Non vaccinées : n = 112 155 (41,6 %) Non déclaré/ inconnu : n = 18 640 (6,9 %) |
Le RRa était de 0,25 (IC à 95 %, 0,20 à 0,31) |
Niveau II-2 |
Passable |
Robinson C, Oberye J, van Boxmeer J, et al. A Prospective Cohort Study on Pregnancy Outcomes of Persons Immunized with a Seasonal Quadrivalent Inactivated Influenza Vaccine during Pregnancy. Vaccines. 2022Note de bas de page 68 Financement par Seqirus Inc |
Mortinaissance (égal à ou plus de 20 semaines de gestation ou égal à ou plus de 500 g) |
VII4 (AfluriaMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec le vaccin VII4 à tout moment de la grossesse (n = 483) Trimestre d'exposition : |
Deux (2) (0,4 %, IC à 95 %, 0,1 à 1,5) évènements ont été signalés Un cas est survenu chez une personne vaccinée au cours du premier trimestre et un autre chez une personne vaccinée au cours du deuxième trimestre de la grossesse |
Niveau III |
Passable |
Robinson C, Van Boxmeer J, Tilson H, et al. Outcomes in Pregnant Persons Immunized with a Cell-Based Quadrivalent Inactivated Influenza Vaccine: A Prospective Observational Cohort Study. Vaccines. 2022Note de bas de page 69 Financement par Seqirus Inc |
Mortinaissance (égal à ou plus de 20 semaines de gestation ou égal à ou plus de 500 g) |
VII4-cc (FlucelvaxMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec VII4-cc à tout moment de la grossesse (n = 665) Trimestre d'exposition : |
Aucun évènement n'a été signalé |
Niveau III |
Passable |
Nwoji U. Seasonal influenza vaccine exposure in pregnancy: 5-year results from a pregnancy registry. Hum Vaccin Immunother. 2022Note de bas de page 67 Financement par GlaxoSmithKline Biologicals SA |
Mortinaissance (égal à ou plus de 18-22 semaines de gestation ou égal à ou plus de 500 g) |
VII3 (Fluarix et FluLaval, GSK) ou VII4 (Fluarix Quadrivalent et FluLaval Quadrivalent, GSK) |
Étude de cohorte prospective Pays : Suivi : Financement : |
Personnes vaccinées pendant la grossesse ou dans les 28 jours précédant la conception (n = 507) Trimestre d'exposition, n (%) : Aucun suivi : n = 359 (70,8 %) |
Un évènement (0,9 %) a été signalé chez une personne vaccinée au cours du premier trimestre de la grossesse Le lien de causalité avec la vaccination a été exclu |
Niveau III |
Faible Biais dans les rapports Taux élevé de perte de suivi (70,8 %) |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Naissance prématurée (moins de 37 semaines gestationnelles) |
VII3 (Vaccin contre la grippe saisonnière) |
Quinze (15) études de cohorte Pays : Suivi : Financement : |
Études prenant en compte le biais lié au temps continu (n = 152 476) VII3 : n = 66 749 (43,8 %) Non vaccinées : n = 85 727 (56,2 %) Études ne tenant pas compte du biais lié au temps continu (n = 151 032) VII3 : n = 67 558 (44,7 %) Non vaccinées : n = 83 474 (55,3 %) Lorsque la vaccination antigrippale au cours du premier trimestre de la grossesse a été prise en compte (n = 47 211) VII3 : n = 19 135 (40,5 %) Non vaccinées : n = 28 076 (59,5 %) |
La MA incluait 5 études de cohorte qui tenaient compte du biais lié au temps continu Le RRA regroupé était de 1,09 (IC à 95 % : 0,89 à 1,33), I1=28,18 pour les études qui tenaient compte du biais lié au temps continu La MA comprenait dix études de cohorte qui ne tenaient pas compte du biais lié au temps continu Le RRa regroupé était de 0,86 (IC à 95 % : 0,76 à 0,97), I2 = 71,15 pour les études qui ne tenaient pas compte du biais lié au temps continu Une MA a porté sur 6 études de cohorte limitées à la vaccination au cours du premier trimestre de la grossesse Le RRa regroupé était de 1,05 (IC à 95 % : 0,92 à 1,20), I2 = 30,46 pour les études limitées à la vaccination au cours du premier trimestre de la grossesse |
Niveau II-2 |
Bonne |
Duque J, Howe AS, Azziz-Baumgartner et al. Multi-decade national cohort identifies adverse pregnancy and birth outcomes associated with acute respiratory illness hospitalisations during the influenza season. 2022Note de bas de page 87 Financement : |
Naissance prématurée (moins de 37 semaines de gestation) |
VII (vaccin contre la grippe saisonnière) |
Cohorte rétrospective Pays : Suivi : Financement : |
Personnes de 15 à 49 ans enceintes (n = 822 391) Personnes enceintes vaccinées ayant accouché prématurément entre 2010 et 2018 : n = 3 895 (6,1 %) Personnes enceintes non vaccinées ayant accouché prématurément entre 2010 et 2018 : n = 29 825 (8,0 %) |
Le RRa était de 0,79 (IC à 95 %, 0,77 à 0,82) |
Niveau II-2 |
Bonne |
Giles ML, Davey M et Wallace EM. Associations between maternal immunisation and reduced rates of preterm birth and stillbirth: Une étude de cohorte rétrospective basée sur la population. 2021Note de bas de page 85 Financement non déclaré |
Naissance prématurée (moins de 37 semaines de gestation) |
VII (vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospective Pays : Suivi : Financement : |
Personnes enceintes d'une grossesse simple plus de 28 semaines de gestation (n = 269 493) VII : n = 138 698 (51,5 %) Non vaccinées : n = 112 155 (41,6 %) Non déclaré/inconnu : n = 18 640 (6,9 %) |
Le RRa était de 0,69 (IC à 95 %, 0,66 à 0,72) |
Niveau II-2 |
Passable |
Robinson C, Oberye J, van Boxmeer J, et al. A Prospective Cohort Study on Pregnancy Outcomes of Persons Immunized with a Seasonal Quadrivalent Inactivated Influenza Vaccine during Pregnancy. Vaccines. 2022Note de bas de page 68 Financement par Seqirus Inc |
Naissance prématurée (moins de 37 semaines de gestation) |
VII4 (AfluriaMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec le vaccin VII4 à tout moment de la grossesse (n = 483) Trimestre d'exposition : |
Au total, 31 évènements (7,2 %) ont été signalés Évènements par trimestre d'exposition, n (%) : |
Niveau III |
Passable |
Robinson C, Van Boxmeer J, Tilson H, et al. Outcomes in Pregnant Persons Immunized with a Cell-Based Quadrivalent Inactivated Influenza Vaccine: A Prospective Observational Cohort Study. Vaccines. 2022Note de bas de page 69 Financement par Seqirus Inc |
Naissance prématurée (moins de 37 semaines de gestation) |
VII4-cc (FlucelvaxMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec VII4-cc à tout moment de la grossesse (n = 665) Trimestre d'exposition : |
Au total, 52 évènements (9,2 %) ont été signalés Évènements par trimestre d'exposition, n (%) : |
Niveau III |
Passable |
Ledlie S, Gandhi-Banga S, Shrestha et al. Exposure to quadrivalent influenza vaccine during pregnancy: Results from a global pregnancy registry. 2022Note de bas de page 60 Financée par Sanofi |
Naissance prématurée (moins de 37 semaines de gestation) |
VII4 (FluzoneMD Quadrivalent; Sanofi) |
Séries de cas rétrospectives et prospectives, multicentres Pays : Suivi : Financement : |
Personnes en âge de procréer qui ont été exposées au VII4 pendant la grossesse ou dans les 30 jours suivant leurs dernières règles (n = 239) Trimestre d'exposition, n (%) : |
Un évènement (6,67 %) a été signalé parmi les rapports dont l'issue néonatale était connue (n = 15) |
Niveau III |
Faible Biais dans les rapports Taux élevé de perte de suivi (80 %) |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM Et étude identifiée lors de la mise à jour de la recherche documentaire : Giles ML, Davey M et Wallace EM. Associations between maternal immunisation and reduced rates of preterm birth and stillbirth: Une étude de cohorte rétrospective basée sur la population. 2021Note de bas de page 85 Financement non déclaré |
Naissance d'un enfant petit pour l'âge gestationnel (PAG) |
VII (vaccin contre la grippe saisonnière) |
Douze (12) études de cohorte Pays : Suivi : Financement : |
Personnes enceintes (n = 548 277) VII : n = 271 045 (n = 49,4 %) Non vaccinées : n = 277 232 (50,6 %) |
La MA a porté sur 12 études de cohorte Le RRa regroupé était de 0,97 (IC à 95 %, 0,90 à 1,04), I2 = 71 % |
Niveau II-2 |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM Et étude identifiée lors de la mise à jour de la recherche documentaire : Duque J, Howe AS, Azziz-Baumgartner et al. Multi-decade national cohort identifies adverse pregnancy and birth outcomes associated with acute respiratory illness hospitalisations during the influenza season. 2022Note de bas de page 87 Financement non déclaré |
Insuffisance pondérale à la naissance (IPN) (moins de 2 500 g) |
VII (vaccin contre la grippe saisonnière) |
Trois (3) études de cohorteNote de bas de page 63Note de bas de page 86Note de bas de page 87 Pays : Suivi : Non limité à la saison grippale entre 2010 et 2015 (n = 2) Financement : |
Personnes enceintes (n = 168 633) VII : n = 68 039 (40,3 %) Non vaccinées : n = 100 594 (59,7 %) |
La MA comprenait 3 études de cohorte Le RRa regroupé était de 0,89 (IC à 95 % : 0,83 à 0,96), I2 = 37 % |
Niveau II-2 |
Bonne |
Robinson C, Oberye J, van Boxmeer J, et al. A Prospective Cohort Study on Pregnancy Outcomes of Persons Immunized with a Seasonal Quadrivalent Inactivated Influenza Vaccine during Pregnancy. Vaccines. 2022Note de bas de page 68 Financement par Seqirus Inc |
IPN (moins de 2 500 g) |
VII4 (AfluriaMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays :É.-U Suivi : Financement : |
Personnes vaccinées avec le vaccin VII4 à tout moment de la grossesse (n = 483) Trimestre d'exposition : |
Dans l'ensemble, 25 évènements (5,4 %) se sont produits Évènements par trimestre d'exposition, n (%) : |
Niveau III |
Passable |
Robinson C, Van Boxmeer J, Tilson H, et al. Outcomes in Pregnant Persons Immunized with a Cell-Based Quadrivalent Inactivated Influenza Vaccine: A Prospective Observational Cohort Study. Vaccines. 2022Note de bas de page 69 Financement par Seqirus Inc |
IPN (moins de 2 500 g) |
VII4-cc (FlucelvaxMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec VII4-cc à tout moment de la grossesse (n = 665) Trimestre d'exposition : |
Dans l'ensemble, 37 évènements (5,8 %) se sont produits Évènements par trimestre d'exposition, n (%) : |
Niveau III |
Passable |
Ledlie S, Gandhi-Banga S, Shrestha et al. Exposure to quadrivalent influenza vaccine during pregnancy: Results from a global pregnancy registry. 2022Note de bas de page 60 Financée par Sanofi |
IPN (moins de 2 500 g) |
VII4 (FluzoneMD Quadrivalent; Sanofi) |
Séries de cas rétrospectives et prospectives, multicentres Pays : Suivi : Financement : |
Personnes en âge de procréer qui ont été exposées au VII4 pendant la grossesse ou dans les 30 jours suivant leurs dernières règles (n = 239) Trimestre d'exposition, n (%) : |
Deux (2) (10,0 %) évènements ont été signalés parmi les rapports dont l'issue néonatale était connue (n = 30) |
Niveau III |
Faible Biais dans les rapports Taux élevé de perte de suivi (80 %) |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Anomalies congénitales identifiées à la naissance |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte prospectiveNote de bas de page 63 Pays : Suivi : Financement : |
Personnes enceintes (n = 1 207) VII3 pendant le premier trimestre de la grossesse : n = 141 (11,7 %) Non vaccinées : n = 1 066 (88,3 %) |
Le RRa était de 0,33 (IC à 95 %, 0,04 à 2,73) |
Niveau II-2 |
Bonne |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Anomalies congénitales identifiées à la naissance |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte prospectiveNote de bas de page 84 Pays : Suivi : Financement : |
Personnes enceintes (n = 77 366) VII3 pendant le premier trimestre de la grossesse : n = 447 (0,6 %) Non vaccinées pendant le premier trimestre de la grossesse : n = 76 919 (99,4) |
L'OR était de 0,67 (IC à 95 %, 0,36 à 1,25) |
Niveau II-2 |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Anomalies congénitales identifiées à la naissance |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte prospectiveNote de bas de page 64 Pays : Suivi : Financement : |
Personnes enceintes (n = 2 826) VII3 pendant le premier trimestre de la grossesse : n = 1 121 (39,7 %) Non vaccinées : n = 1 705 (60,3 %) |
Une étude de cohorte unique n'a pas signalé de différence significative entre les enfants nés de parents gestationnels vaccinés avec le vaccin VII3 au cours du premier trimestre (33/1 121) et de parents gestationnels non vaccinés (55/1 705); p=0,67 |
Niveau II-2 |
Passable |
Robinson C, Oberye J, van Boxmeer J, et al. A Prospective Cohort Study on Pregnancy Outcomes of Persons Immunized with a Seasonal Quadrivalent Inactivated Influenza Vaccine during Pregnancy. Vaccines. 2022Note de bas de page 68 Financement par Seqirus Inc |
Anomalies congénitales identifiées à la naissance |
VII4 (AfluriaMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec VII4 à tout moment de la grossesse (n = 483) Trimestre d'exposition : |
Deux (2) cas (1,2 %) de malformation congénitale majeure ont été identifiés parmi les enfants nés de parents ayant reçu le vaccin VII4 au cours du premier trimestre de la grossesse |
Niveau III |
Passable |
Robinson C, Van Boxmeer J, Tilson H, et al. Outcomes in Pregnant Persons Immunized with a Cell-Based Quadrivalent Inactivated Influenza Vaccine: A Prospective Observational Cohort Study. Vaccines. 2022Note de bas de page 18 Financement par Seqirus Inc |
Anomalies congénitales identifiées à la naissance |
VII4-cc (FlucelvaxMD Quadrivalent, Seqirus) |
Étude de cohorte prospective à un volet Pays : Suivi : Financement : |
Personnes vaccinées avec VII4-cc à tout moment de la grossesse (n = 665) Trimestre d'exposition : |
Un enfant né vivant (0,6 %) présentant une malformation congénitale majeure est né d'une personne ayant reçu le VII4cc au cours du premier trimestre de la grossesse et la malformation congénitale signalée avait une cause connue autre que l'exposition au vaccin de l'étude |
Niveau III |
Passable |
Wolfe D, Garritty C, Hamel C, et al. Safety and effectiveness of influenza vaccine during pregnancy – a systematic review. 2022Note de bas de page 18 Financée par les IRSC et le RIEM |
Anomalies congénitales identifiées de la naissance à l'âge de 6 mois |
VII (vaccin contre la grippe saisonnière) |
Étude rétrospective cas-témoinsNote de bas de page 98 Pays : Suivi : Financement : |
Personnes enceintes (n = 4 277) VII au cours du premier trimestre de la grossesse : n = 711 (16,6 %) Non vaccinées : n = 3 566 (83,4 %) |
Le RCa était de 1,01 (IC à 95 %, 0,85 à 1,21) |
Niveau II-2 |
Passable |
Romano CJ, Hall C, Khodr ZG, et al. History of pandemic H1N1-containing influenza vaccination and risk of spontaneous abortion and birth defects. 2021Note de bas de page 66 Financement : |
Anomalies congénitales identifiées de la naissance à l'âge de 6 mois |
VII3 (Vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospective Pays : Suivi : Financement : |
Personnes enceintes de 17 ans et plus (n = 26 264) Exposition à un vaccin contenant le virus pH1N1 au cours de la saison précédant la grossesse : n = 21 736 (82,8 %) Exposition à un vaccin ne contenant pas le virus H1N1 au cours de la saison précédant la grossesse : n = 4 528 (17,2 %) |
Le RRA était de 1,05 (IC à 95 %, 0,83 à 1,34) |
Niveau II-2 |
Bonne |
Sarna M, Pereira GF, Foo D et al. The risk of major structural birth defects associated with seasonal influenza vaccination during pregnancy : a population-based cohort studyNote de bas de page 99 Financée par Curtin University of Technology; National Health and Medical Research Council; Norges Forskningsrad; Telethon Kids Institute, Department of Health |
Anomalies congénitales identifiées de la naissance à l'âge de 6 mois |
VII (vaccin contre la grippe saisonnière) |
Étude de cohorte rétrospective Pays : Suivi : Financement : |
Personnes enceintes (113 936) VII au cours du premier trimestre de la grossesse : n = 2 811 (2,5 %) Non vaccinées : n = 111 125 (97,5 %) |
Le taux de prévalence pondéré jusqu'à un mois de naissance était de 0,98 (IC à 95 %, 0,68 à 1,43) |
Niveau II-2 |
Bonne |
Nwoji U. Seasonal influenza vaccine exposure in pregnancy: 5-year results from a pregnancy registry. Hum Vaccin Immunother. 2022Note de bas de page 67 Financement par GlaxoSmithKline Biologicals SA |
Anomalies congénitales identifiées de la naissance à l'âge de 6 mois |
VII3 (Fluarix et FluLaval, GSK) ou VII4 (Fluarix Quadrivalent et FluLaval Quadrivalent, GSK) |
Étude de cohorte prospective Pays : Suivi : Financement : |
Personnes vaccinées pendant la grossesse ou dans les 28 jours précédant la conception (n = 507) Trimestre d'exposition, n (%) : Aucun suivi : n = 359 (70,8 %) |
Parmi ceux dont l'issue de la grossesse était connue (n = 115), 3 (2,6 %) évènements ont été jugés peu susceptibles d'être associés au VII et les renseignements pour un (0,9 %) évènement n'étaient pas suffisants pour évaluer le lien de causalité |
Niveau III |
Faible Biais dans les rapports Taux élevé de perte de suivi (70,8 %) |
Ledlie S, Gandhi-Banga S, Shrestha et al. Exposure to quadrivalent influenza vaccine during pregnancy: Results from a global pregnancy registry. 2022Note de bas de page 60 Financée par Sanofi |
Anomalies congénitales identifiées de la naissance à l'âge de 6 mois |
VII4 (FluzoneMD Quadrivalent; Sanofi) |
Séries de cas rétrospectives et prospectives, multicentres Pays : Suivi : Financement : |
Personnes en âge de procréer qui ont été exposées au VII4 pendant la grossesse ou dans les 30 jours suivant leurs dernières règles (n = 239) Trimestre d'exposition, n (%) : |
Un évènement a été signalé parmi les personnes vaccinées au cours du premier trimestre de la grossesse, avec des conséquences néonatales connues |
Niveau III |
Faible Biais dans les rapports Taux élevé de perte de suivi (80 %) |
Abréviations : |
|||||||
| Niveau | Description |
|---|---|
| I | Un essai contrôlé randomisé. |
| II-1 | Un essai contrôlé sans randomisation. |
| II-2 | Une cohorte ou des études analytiques cas-témoins, de préférence provenant de plus d'un centre ou d'un groupe de recherche, utilisant des mesures de résultats cliniques de l'efficacité potentielle du vaccin. |
| II-3 | Une série temporelle multiple avec ou sans intervention. Les résultats spectaculaires d'expériences non contrôlées (tels que les résultats de l'introduction du traitement à la pénicilline dans les années 1940) pourraient également être considérés comme ce type de donnée probante. |
| III | Expérience clinique, étude descriptive ou rapport de cas, ou rapport de comités d'experts. |
| Évaluation de la qualité | Description |
|---|---|
| Bonne | Une étude (y compris les méta-analyses ou les examens systématiques) qui répond bien à tous les critères propres à la méthodologieTableau 1 Note a. |
| Passable | Une étude (y compris les méta-analyses ou les revues systématiques) qui ne répond pas (ou ne répond pas clairement) à au moins un critère propre à la conception* mais qui ne présente pas de « défaut critique » connu. |
| Faible | Une étude (y compris les méta-analyses ou les examens systématiques) qui présente au moins unTableau 1 Note a « défaut critique » propre à la méthodologie, ou une accumulation de défauts moindres au point où les résultats de l'étude ne sont pas considérés comme pouvant servir de base à des recommandations. |
|
|
| Forte | Discrétionnaire | |
|---|---|---|
| Libellé | « devrait/ne devrait pas être proposé » | « peut/peut ne pas être proposé » |
| Justification | Les avantages connus/anticipés l'emportent sur les inconvénients connus/anticipés (« devraient »), ou Les inconvénients connus/prévus l'emportent sur les avantages connus/prévus (« ne devraient pas »). |
Les avantages connus/prévus sont étroitement équilibrés par rapport aux inconvénients connus/prévus, ou il existe une incertitude quant aux données probantes sur les avantages et les inconvénients. |
| Implications | Une recommandation forte s'applique à la majeur partie des populations/personnes et devrait être suivie, à moins qu'il n'existe une justification claire et convaincante d'utiliser une autre approche. | Une recommandation discrétionnaire peut être proposée pour certaines populations/personnes dans certaines circonstances Des solutions de rechange peuvent être raisonnables. |
Liste des abréviations
- AS
- Avortement spontané
- ASPC
- Agence de la santé publique du Canada
- CCNI
- Comité consultatif national de l'immunisation
- DCC
- Déclaration du comité consultatif
- ECR
- Essai contrôlé randomisé
- EFFA
- Éthique, équité, faisabilité et acceptabilité
- EI
- Évènement indésirable
- EIG
- Évènement indésirable grave
- EP
- Efficacité potentielle
- ER
- Efficacité réelle
- ERa
- Efficacité réelle du vaccin ajustée
- ES
- Examen systématique
- ES/MA
- Examen systématique/méta-analyse
- EVG
- Enquête canadien sur la vaccination pendant la grossesse
- GCI
- Guide canadien d'immunisation
- GCL
- Grippe confirmée en laboratoire
- IC
- Intervalle de confiance
- IPN
- Insuffisance pondérale à la naissance
- IRSC
- Instituts de recherche en santé du Canada
- MA
- Méta-analyse
- PAG
- Petit pour l'âge gestationnel
- RC
- Rapport des cotes
- RCa
- Rapport des cotes ajusté
- RIEM
- Réseau sur l'innocuité et l'efficacité des médicaments
- RR
- Rapport de risque
- RRa
- Rapport de risque ajusté
- USI
- Unité de soins intensifs
- VAR
- Vaccin antigrippal recombinant
- VAR4
- Vaccin antigrippal recombinant quadrivalent
- VAT
- Vaccin antigrippal trivalent
- VII
- Vaccin inactivé contre l'influenza
- VII3
- Vaccin inactive contre l'influenza
- VII4
- Vaccin inactivé contre l'influenza
- VII4-cc
- Vaccin inactivé contre l'influenza
- VVAI
- Vaccin vivant atténué contre l'influenza
Remerciements
Cette déclaration a été préparée par : P. Doyon-Plourde, A. Sinilaite, W. Siu et J. Papenburg, au nom du Groupe de travail sur l'influenza (GTI) du CCNI et a été approuvé par le CCNI.
Le CCNI tient à remercier les personnes suivantes pour leur contribution : F. Crane, R. Garno, A. Gil, K. Gusic, S.H. Lim, B. Pe Benito, S. Pierre, C. Tremblay, M. Tunis, C. Williams et M. Xi.
Groupe de travail sur l'influenza du CCNI
Membres : J. Papenburg (président), P. De Wals, D. Fell, I. Gemmill, R. Harrison, J. Langley, A. McGeer et D. Moore.
Anciens membres : D. Fell
Agents de liaison : L. Grohskopf (Centers for Disease Control and Prevention [CDC], États-Unis).
Représentants d'office : L. Lee (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), K. Daly (Direction générale de la santé des Premières nations et des Inuits [DGSPNI], Services aux Autochtones Canada [SAC]), B. Warshawsky (Bureau du vice-président, Direction générale de la prévention et du contrôle des maladies infectieuses [DGPCMI]) et M. Russell (Direction des produits biologiques et des thérapies génétiques [DPBTG], Santé Canada [SC]).
Experts externes (grossesse et allaitement) : T. Bogler, I. Boucoiran, K. Campbell, E. Castillo et D. Money.
CCNI
S. Deeks (Président), R. Harrison (Vice-président), M. Andrew, J. Bettinger, N. Brousseau, H. Decaluwe, P. De Wals, E. Dubé, V. Dubey, K. Hildebrand, K. Klein, M. O'Driscoll, J. Papenburg, A. Pham-Huy, B. Sander, et S. Wilson.
Agents de liaison : L. Bill/M. Nowgesic (Association des infirmières et infirmiers autochtones du Canada), L. M. Bucci (Association canadienne de santé publique), S. Buchan (Association canadienne pour la recherche et l'évaluation en immunisation), E. Castillo (Société des obstétriciens et gynécologues du Canada), J. Comeau (Association pour la microbiologie médicale et l'infectiologie Canada), M. Lavoie (Conseil des médecins hygiénistes en chef), J. MacNeil (Centers for Disease Control and Prevention, États-Unis), D. Moore (Société canadienne de pédiatrie), M. Naus (Comité canadien d'immunisation), M. Osmack (Indigenous Physicians Association of Canada), J. Potter (Collège des médecins de famille du Canada) et A. Ung (Association des pharmaciens du Canada).
Anciens agents de liaison : N Dayneka, and J Emili
Représentants d'office : V. Beswick-Escanlar (Défense nationale et Forces armées canadiennes), E. Henry (Centre pour l'immunisation et des maladies respiratoires infectieuses [CIMRI], Agence de santé publique du Canada [ASPC]), M. Lacroix (Groupe consultatif d'éthique en santé publique, ASPC), P. Fandja (Direction des produits de santé commercialisés, Santé Canada), M. Su (Épidémiologie et surveillance de COVID-19, ASPC), S. Ogunnaike-Cooke (CIMRI, ASPC), C. Pham (Direction des médicaments biologiques et radiopharmaceutiques, Santé Canada), M. Routledge (Laboratoire national de microbiologie, ASPC) et T. Wong (Direction générale de la santé des Premières Nations et des Inuits, Services aux Autochtones Canada).
Annexe A : Méthodologie de mise à jour de l'examen
La méthodologie liée à la mise à jour de l'examen réalisé par le Secrétariat du CCNI correspondait généralement à celle utilisée par Wolfe et al. (2020)Note de bas de page 18.
Questions de l'examen
Les questions de recherche suivantes ont été abordées :
Question de recherche 1 : Les vaccins antigrippaux sont-ils sans risque pour les personnes enceintes et leur nouveau-né s'ils sont administrés à n'importe quel moment de la grossesse?
Question de recherche 2 : Les vaccins antigrippaux sont-ils efficaces pour prévenir la grippe et ses complications chez les personnes enceintes et leur nouveau-né s'ils sont administrés à n'importe quel moment de la grossesse?
Critères d'admissibilité à l'étude
Les critères d'admissibilité définissant les études à inclure étaient les mêmes que ceux utilisés par Wolfe et al. (2020), à l'exception de l'inclusion d'études de cohortes à bras unique et d'études fondées sur des bases de données de déclaration volontaire ou de surveillance d'EI (Tableau 5)Note de bas de page 18. Ces études ont été incluses dans la mise à jour de l'examen réalisée par le Secrétariat du CCNI afin de recueillir des données probantes sur les vaccins antigrippaux récemment homologués qui sont basés sur de nouvelles technologies, notamment les vaccins quadrivalents à base de culture de cellules de mammifères et les VAR.
| Critères d'inclusion | Critères d'exclusion | |
|---|---|---|
| Population | Les personnes enceintes et leurs enfants à naître et les nouveau-nés de moins de 6 mois | Personnes vaccinées avant la conception ou après l'accouchement |
| Interventions | Vaccins contre la grippe saisonnière et pandémique, toutes valences confondues, indiqués pour les adultes | Vaccins contrindiqués pendant la grossesse (p. ex., vaccins vivants atténués) |
| Comparateurs | Placebo, pas de vaccin antigrippal, comparateurs actifs (p. ex., autre vaccin antigrippal, vaccins antiméningococciques ou antipneumococciques) | Aucun comparateur ou vaccin contrindiqué pendant la grossesse |
| Issues | Mesures dichotomiques des issues suivantes : Mère
Nourrisson
Issues à la naissance
|
|
| Plans d'étude | Essais contrôlés randomisés (ECR), études de cohortes prospectives et rétrospectives, études cas-témoins et à tests-négatifs, plans à plusieurs critères de classification, études de cohortes à bras unique, études fondées sur des bases de données de déclaration volontaire ou de surveillance des évènements indésirables (EI) | Examens systématiques, examens narratifs, rapports de cas, résumés |
| Langue | Publications en anglais et en français uniquement | Autres langues |
Recherche documentaire
La stratégie de recherche actualisée a été élaborée en collaboration avec les bibliothécaires de la Bibliothèque de la santé de SC et de l'ASPC (stratégie de recherche disponible sur demande). Des stratégies distinctes ont été adoptées aux ECR et aux études d'observation. La recherche d'ECR a été effectuée dans Ovid MEDLINE® ALL, Embase et le Cochrane Central Register of Controlled Trials. Les études d'observation ont été identifiées à l'aide des bases de données Ovid MEDLINE® ALL et Embase. Toutes les recherches ont été effectuées le 13 janvier 2023. Elles ont été limitées aux articles publiés en anglais et en français.
Les articles trouvés dans la Bibliothèque de santé de SC et les recherches documentaires de l'ASPC ont été chargés dans RefWorks (ProQuest LLC, Ann Arbor, MI) et téléchargés dans DistillerSR (Evidence Partners, Ottawa, Canada).
Processus de sélection des études
Deux (2) évaluateurs ont examiné indépendamment les titres et les résumés pour vérifier l'admissibilité des études. Les textes intégraux des études identifiées lors de la première phase de sélection ont été évalués indépendamment par 2 évaluateurs en vue de leur inclusion dans l'ES. Les conflits de présélection ont été résolus par la discussion ou l'arbitrage d'un troisième évaluateur.
Extraction des données
Un formulaire d'extraction des données a été élaboré pour cet ES. Le processus d'extraction a été piloté indépendamment par 2 évaluateurs afin de déterminer la qualité et la cohérence de la collecte des données. Les données ont été extraites par un évaluateur et vérifiées par un second. Les auteurs des études ont été contactés par courriel afin d'obtenir des données supplémentaires ou de confirmer les données, au besoin.
Les données suivantes ont été extraites de chaque rapport : conception de l'étude, caractéristiques de la population, définition de l'intervention et du comparateur, définition des issues, analyses statistiques et principales conclusions.
Évaluation du risque de biais
Après l'extraction des données, 2 évaluateurs ont évalué indépendamment le risque de biais (RB) au niveau des issues en utilisant l'outil révisé de Cochrane pour les essais randomisés (RoB 2.0) ou des adaptations de l'échelle de Newcastle-Ottawa (NOS) pour les études de cohorte et les études cas-témoins, comme le décrivent Wolfe et al. (2020)Note de bas de page 18. Les désaccords ont été résolus par la discussion ou l'arbitrage d'un troisième évaluateur.
Synthèse et méthodes statistiques
Les données ont été combinées avec celles de Wolfe et al. (2020) par issue afin d'évaluer la disponibilité de données probantes quantitatives, ainsi que la faisabilité et l'adéquation de la MANote de bas de page 18.
Des MA ont été réalisées lorsque 2 études ou plus ont rapporté des données probantes qui n'étaient pas cliniquement hétérogènes, comme le décrivent Wolfe et al. (2020)Note de bas de page 18. En bref, des modèles à effet aléatoire ont été utilisés et l'hétérogénéité statistique a été évaluée à l'aide de la statistique I2, un seuil de 50 % ou plus suggérant une hétérogénéité potentiellement importante. Des diagrammes en forêt ont été utilisés pour présenter les MA. Les données probantes ont été résumées de manière narrative lorsque la MA n'était pas jugée appropriée. Toutes les analyses ont été effectuées à l'aide du logiciel Review Manager (version 5.4)Note de bas de page 100.
Annexe B : Organigramme prisma pour la mise à jour de l'examen
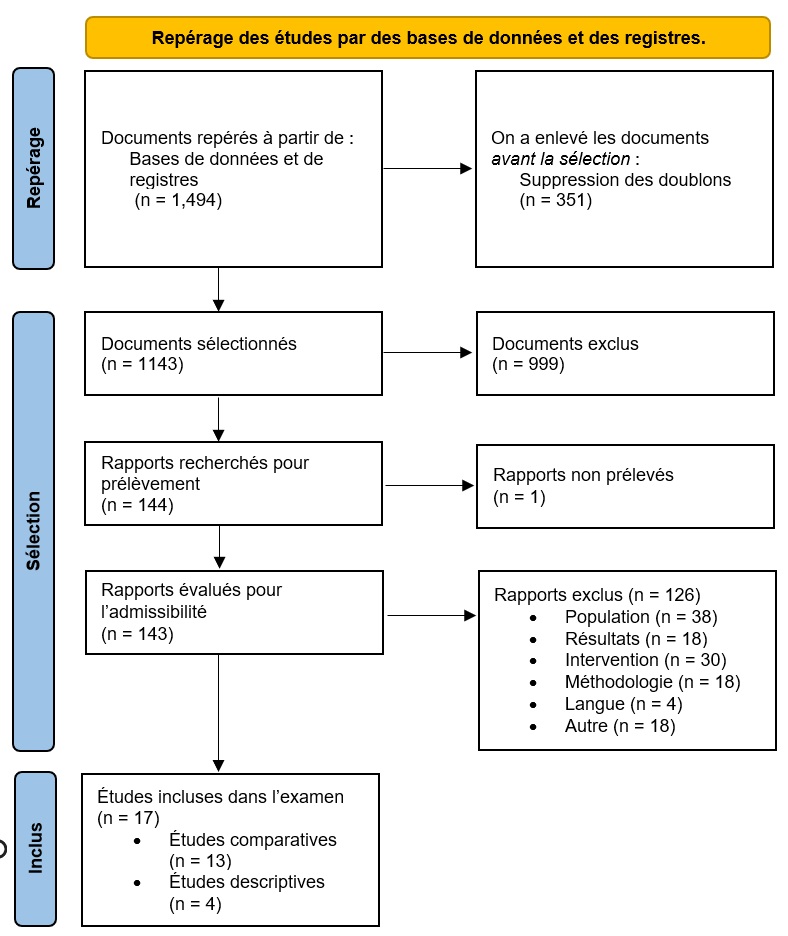
Annexe B : Texte descriptif
Le diagramme de flux PRISMA décrit le processus par lequel on a repéré et sélectionné les études ou les documents dans des bases de données et des registres. Le processus se répartit en trois étapes : Repérage, sélection et inclusion.
Première étape : Repérage
- La recherche dans les bases de données et les registres a permis de repérer 1494 documents, dont 351 doublons ont été supprimés avant la sélection.
Deuxième étape : Sélection
- On a examiné 1143 documents. Parmi ceux-ci, on a exclu 999 documents, avec un nombre restant de 144 pleins textes. Un plein texte n'a pas été prélevé et a été exclu.
- Au total, on a évalué 143 pleins textes pour déterminer s'ils étaient admissibles. Parmi ceux-ci, on a exclu 126 articles. Les raisons de leur exclusion sont les suivantes : 38 articles ne portaient pas sur la population d'intérêt, 18 articles ne présentaient pas de résultats d'intérêt, 30 articles n'impliquaient pas d'interventions pertinentes, 18 articles n'ont pas été réalisés selon le modèle d'étude souhaité, 4 articles étaient rédigés dans des langues qui n'étaient pas consultables pour l'examen, et l'on a exclu 4 articles pour d'autres raisons.
Troisième étape : Inclus
- On a inclus 17 articles dans l'examen. Parmi ceux-ci, 13 articles étaient des études comparatives et 4 articles des études descriptives.
Références
- Note de bas de page 1
-
Comité consultatif national de l'immunisation (CCNI). Déclaration sur la vaccination antigrippale pour la saison 2023–2024 [Internet]. Ottawa (ON): Agence de la santé publique du Canada; 2023 mai 31 [cité 2023 août 16]. Disponible à : https://www.canada.ca/fr/sante-publique/services/publications/vaccins-immunisation/comite-consultatif-national-immunisation-declaration-vaccination-antigrippale-2023-2024.html.
- Note de bas de page 2
-
Schanzer DL, McGeer A, Morris K. Statistical estimates of respiratory admissions attributable to seasonal and pandemic influenza for Canada. Influenza Other Respir Viruses. 2013 sep;7(5):799-808. https://doi.org/10.1111/irv.12011.
- Note de bas de page 3
-
Schanzer DL, Sevenhuysen C, Winchester B, Mersereau T. Estimating influenza deaths in Canada, 1992-2009. PLoS One. 2013 nov 27;8(11):e80481. https://doi.org/10.1371/journal.pone.0080481.
- Note de bas de page 4
-
Agence de la santé publique du Canada. Flu (influenza): For health professionals [Internet]. Ottawa (ON): Gouvernement du Canada; 2023 mar 03 [cité 2023 mai 25]. Disponible à : https://www.canada.ca/fr/sante-publique/services/maladies/grippe-influenza/professionnels-sante.html.
- Note de bas de page 5
-
Grippe (saisonnière) [Internet]. Geneva (CH): Organisation mondiale de la Santé; 2023 jan 12 [cité 2023 mai 25]. Disponible à : https://www.who.int/en/news-room/fact-sheets/detail/influenza-(seasonal).
- Note de bas de page 6
-
Dawood FS, Kittikraisak W, Patel A, Rentz Hunt D, Suntarattiwong P, Wesley MG, et al. Incidence of influenza during pregnancy and association with pregnancy and perinatal outcomes in three middle-income countries: a multisite prospective longitudinal cohort study. The Lancet Infectious Diseases. 2021 jan;21(1):97-106. https://doi.org/10.1016/S1473-3099(20)30592-2.
- Note de bas de page 7
-
MacDonald NE, McDonald JC. The benefits of influenza vaccine in pregnancy for the fetus and the infant younger than six months of age. Paediatr Child Health. 2014 nov;19(9):121.
- Note de bas de page 8
-
Rolland-Harris E, Vachon J, Kropp R, Frood J, Morris K, Pelletier L, et al. Hospitalization of pregnant women with pandemic A(H1N1) 2009 influenza in Canada. Epidemiol Infect. 2012 juil;140(7):1316-27. https://doi.org/10.1017/S0950268811001737.
- Note de bas de page 9
-
Corbeau M, Mulliez A, Chenaf C, Eschalier B, Lesens O, Vorilhon P. Trends of influenza vaccination coverage in pregnant women: a ten-year analysis from a French healthcare database. Sci Rep. 2022 mai 03;12(1):7153. https://doi.org/10.1038/s41598-022-11308-3.
- Note de bas de page 10
-
Woodcock T, Novov V, Skirrow H, Butler J, Lovett D, Adeleke Y, et al. Characteristics associated with influenza vaccination uptake in pregnancy: a retrospective cohort study. Br J Gen Pract. 2023 jan 26;73(727):e148-55. https://doi.org/10.3399/BJGP.2022.0078.
- Note de bas de page 11
-
Arnold LD, Luong L, Rebmann T, Chang JJ. Racial disparities in U.S. maternal influenza vaccine uptake: Results from analysis of Pregnancy Risk Assessment Monitoring System (PRAMS) data, 2012-2015. Vaccine. 2019 avr 24;37(18):2520-6. https://doi.org/10.1016/j.vaccine.2019.02.014.
- Note de bas de page 12
-
Donahue JG, Kieke BA, King JP, DeStefano F, Mascola MA, Irving SA, et al. Association of spontaneous abortion with receipt of inactivated influenza vaccine containing H1N1pdm09 in 2010-11 and 2011-12. Vaccine. 2017 sep 25;35(40):5314-22. https://doi.org/10.1016/j.vaccine.2017.06.069.
- Note de bas de page 13
-
Minozzi S, Lytras T, Gianola S, Gonzalez-Lorenzo M, Castellini G, Galli C, et al. Comparative efficacy, and safety of vaccines to prevent seasonal influenza: A systematic review and network meta-analysis. eClinicalMedicine. 2022 mar 24;46:101331. https://doi.org/10.1016/j.eclinm.2022.101331.
- Note de bas de page 14
-
Hansen KP, Benn CS, Aamand T, Buus M, da Silva I, Aaby P, et al. Does Influenza Vaccination during Pregnancy Have Effects on Non-Influenza Infectious Morbidity? A Systematic Review and Meta-Analysis of Randomised Controlled Trials. Vaccines. 2021 dec 08;9(12):1452. https://doi.org/10.3390/vaccines9121452.
- Note de bas de page 15
-
Jarvis JR, Dorey RB, Warricker FDM, Alwan NA, Jones CE. The effectiveness of influenza vaccination in pregnancy in relation to child health outcomes: Systematic review and meta-analysis. Vaccine. 2020 fév 11;38(7):1601-13. https://doi.org/10.1016/j.vaccine.2019.12.056.
- Note de bas de page 16
-
Quach THT, Mallis NA, Cordero JF. Influenza Vaccine Efficacy and Effectiveness in Pregnant Women: Systematic Review and Meta-analysis. Matern Child Health J. 2020 fév;24(2):229-40. https://doi.org/10.1007/s10995-019-02844-y.
- Note de bas de page 17
-
Comité consultatif national de l'immunisation (CCNI). Comité consultatif national de l'immunisation (CCNI): ignes directrices pour l'évaluation économique des programmes de vaccination au Canada [Internet]. Ottawa (ON): Agence de la santé publique du Canada; 2023 août 02 [cité 2023 août 19]. Disponible à : https://www.canada.ca/fr/sante-publique/services/immunisation/comite-consultatif-national-immunisation-ccni/methodes-processus/integration-donnees-economiques-recommandations-federales-relatives-vaccins/lignes-directrices-evaluation-programmes-vaccination-canada.html.
- Note de bas de page 18
-
Wolfe D, Garritty C, Hamel C, Thavorn K, Skidmore B, Fell D, et al. Safety and effectiveness of influenza vaccine during pregnancy—a systematic review. OSF. 2022 juin 30. https://doi.org/10.17605/OSF.IO/XEY2K.
- Note de bas de page 19
-
Ismail SJ, Hardy K, Tunis MC, Young K, Sicard N, Quach C. A framework for the systematic consideration of ethics, equity, feasibility, and acceptability in vaccine program recommendations. Vaccine. 2020 août 10;38(36):5861,5876. doi: 10.1016/j.vaccine.2020.05.051. https://doi.org/S0264-410X(20)30696-4.
- Note de bas de page 20
-
Meijer WJ, van Noortwijk AGA, Bruinse HW, Wensing AMJ. Influenza virus infection in pregnancy: a review. Acta obstetricia et gynecologica Scandinavica. 2015 août;94(8):797-819. https://doi.org/10.1111/aogs.12680.
- Note de bas de page 21
-
Mertz D, Geraci J, Winkup J, Gessner BD, Ortiz JR, Loeb M. Pregnancy as a risk factor for severe outcomes from influenza virus infection: A systematic review and meta-analysis of observational studies. Vaccine. 2017 jan 23;35(4):521-8. https://doi.org/10.1016/j.vaccine.2016.12.012.
- Note de bas de page 22
-
Mertz D, Lo CK, Lytvyn L, Ortiz JR, Loeb M. Pregnancy as a risk factor for severe influenza infection: an individual participant data meta-analysis. BMC Infectious Diseases. 2019 août 02;19(1):683. https://doi.org/10.1186/s12879-019-4318-3.
- Note de bas de page 23
-
Ohfuji S, Deguchi M, Tachibana D, Koyama M, Takagi T, Yoshioka T, et al. Estimating influenza disease burden among pregnant women: Application of self-control method. Vaccine. 2017 août 24;35(36):4811-6. https://doi.org/10.1016/j.vaccine.2017.07.006.
- Note de bas de page 24
-
Sullivan SG, Price OH, Regan AK. Burden, effectiveness, and safety of influenza vaccines in elderly, paediatric and pregnant populations. Therapeutic Advances in Vaccines and Immunotherapy. 2019 fév 07;7:2515135519826481. https://doi.org/10.1177/2515135519826481.
- Note de bas de page 25
-
Mosby LG, BA, Rasmussen, Sonja A., MD, MS, Jamieson, Denise J., MD, MPH. 2009 pandemic influenza A (H1N1) in pregnancy: a systematic review of the literature. American journal of obstetrics and gynecology. 2011 juil 01;205(1):10-8. https://doi.org/10.1016/j.ajog.2010.12.033.
- Note de bas de page 26
-
Wang R, Yan W, Du M, Tao L, Liu J. The effect of influenza virus infection on pregnancy outcomes: A systematic review and meta-analysis of cohort studies. International Journal of Infectious Diseases. 2021 avr;105:567-78. https://doi.org/10.1016/j.ijid.2021.02.095.
- Note de bas de page 27
-
Regan AK, Moore HC, Sullivan SG, De Klerk N, Effler PV. Epidemiology of seasonal influenza infection in pregnant women and its impact on birth outcomes. Epidemiology and infection. 2017 oct 01;145(14):2930-9. https://doi.org/10.1017/S0950268817001972.
- Note de bas de page 28
-
Fell D, Savitz D, Kramer M, Gessner B, Katz M, Knight M, et al. Maternal influenza, and birth outcomes: systematic review of comparative studies. BJOG : an international journal of obstetrics and gynaecology. 2017 jan;124(1):48-59. https://doi.org/10.1111/1471-0528.14143.
- Note de bas de page 29
-
Chaves SS, Perez A, Farley MM, Miller L, Schaffner W, Lindegren ML, et al. The Burden of Influenza Hospitalizations in Infants From 2003 to 2012, United States. Pediatr Infect Dis J. 2014 sep;33(9):912-9. https://doi.org/10.1097/INF.0000000000000321.
- Note de bas de page 30
-
Shi T, McLean K, Campbell H, Nair H. Aetiological role of common respiratory viruses in acute lower respiratory infections in children under five years: A systematic review and meta–analysis. Journal of Global Health. 2015 juin;5(1):010408. https://doi.org/10.7189/jogh.05.010408.
- Note de bas de page 31
-
Lafond KE, Nair H, Rasooly MH, Valente F, Booy R, Rahman M, et al. Global Role and Burden of Influenza in Pediatric Respiratory Hospitalizations, 1982-2012: A Systematic Analysis. PLoS medicine. 2016 mar 24;13(3):e1001977. https://doi.org/10.1371/journal.pmed.1001977.
- Note de bas de page 32
-
Wang X, Li Y, O'Brien KL, Madhi SA, Widdowson M, Byass P, et al. Global burden of respiratory infections associated with seasonal influenza in children under 5 years in 2018: a systematic review and modelling study. Lancet Glob Health. 2020 avr;8(4):e497-510. https://doi.org/10.1016/S2214-109X(19)30545-5.
- Note de bas de page 33
-
Schober T, Morris SK, Bettinger JA, Bancej C, Burton C, Foo C, et al. Outcomes of immunocompromised children hospitalized for Influenza, 2010-2021, the Canadian Immunization Monitoring Program Active (IMPACT). Clinical microbiology and infection. 2023 juil;29(7):924-32. https://doi.org/10.1016/j.cmi.2023.04.001.
- Note de bas de page 34
-
Shang M, Blanton L, Brammer L, Olsen SJ, Fry AM. Influenza-Associated Pediatric Deaths in the United States, 2010-2016. Pediatrics. 2018 avr;141(4):e20172918. https://doi.org/10.1542/peds.2017-2918.
- Note de bas de page 35
-
Fell DB, Johnson J, Mor Z, Katz MA, Skidmore B, Neuzil KM, et al. Incidence of laboratory-confirmed influenza disease among infants under 6 months of age: a systematic review. BMJ Open. 2017 sep 01;7(9):e016526. https://doi.org/10.1136/bmjopen-2017-016526.
- Note de bas de page 36
-
Agence de la santé publique du Canada. Résultats de l'Enquête sur la vaccination pendant la grossesse 2021 [Internet]. Ottawa (ON): Gouvernement du Canada; 2022 déc 13 [cité 2022 mai 25]. Disponible à : https://www.canada.ca/fr/sante-publique/services/publications/vaccins-immunisation/enquete-sur-vaccination-femmes-enceintes-2021.html.
- Note de bas de page 37
-
Regan AK, Tracey LE, Blyth CC, Richmond PC, Effler PV. A prospective cohort study assessing the reactogenicity of pertussis and influenza vaccines administered during pregnancy. Vaccine. 2016 avr 29;34(20):2299-304. https://doi.org/10.1016/j.vaccine.2016.03.084.
- Note de bas de page 38
-
Sukumaran L, McCarthy NL, Kharbanda EO, Weintraub ES, Vazquez-Benitez G, McNeil MM, et al. Safety of Tetanus Toxoid, Reduced Diphtheria Toxoid, and Acellular Pertussis and Influenza Vaccinations in Pregnancy. Obstet Gynecol. 2015 nov;126(5):1069-74. https://doi.org/10.1097/AOG.0000000000001066.
- Note de bas de page 39
-
Petousis-Harris H, Walls T, Watson D, Paynter J, Graham P, Turner N. Safety of Tdap vaccine in pregnant women: an observational study. BMJ Open. 2016 avr 18;6(4):e010911. https://doi.org/10.1136/bmjopen-2015-010911.
- Note de bas de page 40
-
Steinhoff MC, Katz J, Englund JA, Khatry SK, Shrestha L, Kuypers J, et al. Year-round influenza immunisation during pregnancy in Nepal: a phase 4, randomised, placebo-controlled trial. Lancet Infect Dis. 2017 sep;17(9):981-9. https://doi.org/10.1016/S1473-3099(17)30252-9.
- Note de bas de page 41
-
Madhi SA, Cutland CL, Kuwanda L, Weinberg A, Hugo A, Jones S, et al. Influenza vaccination of pregnant women and protection of their infants. N Engl J Med. 2014 sep 04;371(10):918-31. https://doi.org/10.1056/NEJMoa1401480.
- Note de bas de page 42
-
Tapia MD, Sow SO, Tamboura B, Tégueté I, Pasetti MF, Kodio M, et al. Maternal immunisation with trivalent inactivated influenza vaccine for prevention of influenza in infants in Mali: a prospective, active-controlled, observer-blind, randomised phase 4 trial. Lancet Infect Dis. 2016 sep;16(9):1026-35. https://doi.org/10.1016/S1473-3099(16)30054-8.
- Note de bas de page 43
-
Zaman K, Roy E, Arifeen SE, Rahman M, Raqib R, Wilson E, et al. Effectiveness of maternal influenza immunization in mothers and infants. N Engl J Med. 2008 oct 09;359(15):1555-64. https://doi.org/10.1056/NEJMoa0708630.
- Note de bas de page 44
-
Thompson MG, Kwong JC, Regan AK, Katz MA, Drews SJ, Azziz-Baumgartner E, et al. Influenza Vaccine Effectiveness in Preventing Influenza-associated Hospitalizations During Pregnancy: A Multi-country Retrospective Test Negative Design Study, 2010-2016. Clin Infect Dis. 2019 avr 24;68(9):1444-53. https://doi.org/10.1093/cid/ciy737.
- Note de bas de page 45
-
Benowitz I, Esposito DB, Gracey KD, Shapiro ED, Vázquez M. Influenza vaccine given to pregnant women reduces hospitalization due to influenza in their infants. Clin Infect Dis. 2010 déc 15;51(12):1355-61. https://doi.org/10.1086/657309.
- Note de bas de page 46
-
Maltezou HC, Stavros S, Asimakopoulos G, Pergialiotis V, Raftopoulos V, Talias MA, et al. Effectiveness of maternal vaccination with quadrivalent inactivated influenza vaccine in pregnant women and their infants in 2019-2020. Expert Rev Vaccines. 2022 juil;21(7):983-92. https://doi.org/10.1080/14760584.2022.2013820.
- Note de bas de page 47
-
Nunes MC, Walaza S, Meiring S, Zar HJ, Reubenson G, McMorrow M, et al. Effectiveness of Influenza Vaccination of Pregnant Women for Prevention of Maternal and Early Infant Influenza-Associated Hospitalizations in South Africa: A Prospective Test-Negative Study. Open Forum Infect Dis. 2022 oct 19;9(11):ofac552. https://doi.org/10.1093/ofid/ofac552.
- Note de bas de page 48
-
Vousden N, Bunch K, Knight M. Incidence, risk factors and impact of seasonal influenza in pregnancy: A national cohort study. PLoS One. 2021 jan 15;16(1):e0244986. https://doi.org/10.1371/journal.pone.0244986.
- Note de bas de page 49
-
Foo D, Sarna M, Pereira G, Moore HC, Regan AK. Longitudinal, population-based cohort study of prenatal influenza vaccination and influenza infection in childhood. Vaccine. 2022 jan 28;40(4):656-65. https://doi.org/10.1016/j.vaccine.2021.11.084.
- Note de bas de page 50
-
Rowe SL, Leder K, Perrett KP, Romero N, Nolan TM, Stephens N, et al. Maternal Vaccination and Infant Influenza and Pertussis. Pediatrics. 2021 sep;148(3):e2021051076. https://doi.org/10.1542/peds.2021-051076.
- Note de bas de page 51
-
McRae J, Blyth CC, Cheng AC, Quinn HE, Wood N, Macartney KK. Preventing severe influenza in Australian infants: Maternal influenza vaccine effectiveness in the PAEDS-FluCAN networks using the test-negative design. Vaccine. 2022 avr 26;40(19):2761-71. https://doi.org/10.1016/j.vaccine.2022.03.042.
- Note de bas de page 52
-
Drăgănescu AC, Miron VD, Streinu-Cercel A, Florea D, Vlaicu O, Bilaşco A, et al. Circulation of influenza A viruses among patients hospitalized for severe acute respiratory infection in a tertiary care hospital in Romania in the 2018/19 season: Results from an observational descriptive epidemiological study. Medicine (Baltimore). 2021 déc 30;100(52):e28460. https://doi.org/10.1097/MD.0000000000028460.
- Note de bas de page 53
-
Nunes MC, Cutland CL, Jones S, Hugo A, Madimabe R, Simões EAF, et al. Duration of Infant Protection Against Influenza Illness Conferred by Maternal Immunization: Secondary Analysis of a Randomized Clinical Trial. JAMA Pediatr. 2016 sep 01;170(9):840-7. https://doi.org/10.1001/jamapediatrics.2016.0921.
- Note de bas de page 54
-
Munoz FM, Greisinger AJ, Wehmanen OA, Mouzoon ME, Hoyle JC, Smith FA, et al. Safety of influenza vaccination during pregnancy. Am J Obstet Gynecol. 2005 avr;192(4):1098-106. https://doi.org/10.1016/j.ajog.2004.12.019.
- Note de bas de page 55
-
Betancourt-Cravioto M, Cervantes-Powell P, Tapia-Conyer R, Ledlie S, Gandhi-Banga S. Improved post-marketing safety surveillance of quadrivalent inactivated influenza vaccine in Mexico using a computerized, SMS-based follow-up system. Hum Vaccin Immunother. 2022 déc 31;18(1):1935170. https://doi.org/10.1080/21645515.2021.1935170.
- Note de bas de page 56
-
Carreras JJ, Lluch JA, Taboada JA, Pastor-Villalba E, Nartallo-Penas V, Díez-Domingo J. Adverse events in pregnant women with the tetravalent influenza vaccine obtained from cell cultures. Enferm Infecc Microbiol Clin (Engl Ed). 2022 nov 28:S2529-4. https://doi.org/10.1016/j.eimce.2022.11.005.
- Note de bas de page 57
-
Vanni T, Thomé BdC, Oliveira MMMd, Gattás VL, Salomão MdG, Koike ME, et al. Active pharmacovigilance of the seasonal trivalent influenza vaccine produced by Instituto Butantan: A prospective cohort study of five target groups. PLoS One. 2021 fév 11;16(2):e0246540. https://doi.org/10.1371/journal.pone.0246540.
- Note de bas de page 58
-
Singh M, Tanvir T, Nagoji D, Madan A, Gattem S, Singh H. Influenza vaccine: A viable option to protect pregnant women and infants from seasonal flu: A retrospective hospital-based study in India. Int J Clin Pract. 2019 juil;73(7):e13361. https://doi.org/10.1111/ijcp.13361.
- Note de bas de page 59
-
Nordin JD, Kharbanda EO, Benitez GV, Nichol K, Lipkind H, Naleway A, et al. Maternal safety of trivalent inactivated influenza vaccine in pregnant women. Obstet Gynecol. 2013 mar;121(3):519-25. https://doi.org/10.1097/AOG.0b013e3182831b83.
- Note de bas de page 60
-
Ledlie S, Gandhi-Banga S, Shrestha A, Mallett Moore T, Khromava A. Exposure to quadrivalent influenza vaccine during pregnancy: Results from a global pregnancy registry. Influenza Other Respir Viruses. 2022 jan;16(1):90-100. https://doi.org/10.1111/irv.12897.
- Note de bas de page 61
-
Sugimura T, Nagai T, Kobayashi H, Ozaki Y, Yamakawa R, Hirata R. Effectiveness of maternal influenza immunization in young infants in Japan. Pediatr Int. 2016 août;58(8):709-13. https://doi.org/10.1111/ped.12888.
- Note de bas de page 62
-
Chambers CD, Johnson DL, Xu R, Luo YJ, Louik C, Mitchell AA, et al. Safety of the 2010-11, 2011-12, 2012-13, and 2013-14 seasonal influenza vaccines in pregnancy: Birth defects, spontaneous abortion, preterm delivery, and small for gestational age infants, a study from the cohort arm of VAMPSS. Vaccine. 2016 août 17;34(37):4443-9. https://doi.org/10.1016/j.vaccine.2016.06.054.
- Note de bas de page 63
-
Mohammed H, Roberts CT, Grzeskowiak LE, Giles LC, Dekker GA, Marshall HS. Safety and protective effects of maternal influenza vaccination on pregnancy and birth outcomes: A prospective cohort study. EClinicalMedicine. 2020 sep 09;26:100522. https://doi.org/10.1016/j.eclinm.2020.100522.
- Note de bas de page 64
-
Ohfuji S, Deguchi M, Tachibana D, Koyama M, Takagi T, Yoshioka T, et al. Safety of influenza vaccination on adverse birth outcomes among pregnant women: A prospective cohort study in Japan. Int J Infect Dis. 2020 avr;93:68-76. https://doi.org/10.1016/j.ijid.2020.01.033.
- Note de bas de page 65
-
Donahue JG, Kieke BA, King JP, Mascola MA, Shimabukuro TT, DeStefano F, et al. Inactivated influenza vaccine and spontaneous abortion in the Vaccine Safety Datalink in 2012-13, 2013-14, and 2014-15. Vaccine. 2019 oct 16;37(44):6673-81. https://doi.org/10.1016/j.vaccine.2019.09.035.
- Note de bas de page 66
-
Romano CJ, Hall C, Khodr ZG, Bukowinski AT, Gumbs GR, Conlin AMS. History of pandemic H1N1-containing influenza vaccination and risk for spontaneous abortion and birth defects. Vaccine. 2021 oct 22;39(44):6553-62. https://doi.org/10.1016/j.vaccine.2021.09.003.
- Note de bas de page 67
-
Nwoji U. Seasonal influenza vaccine exposure in pregnancy: 5-year results from a pregnancy registry. Hum Vaccin Immunother. 2022 déc 31;18(1):1932213. https://doi.org/10.1080/21645515.2021.1932213.
- Note de bas de page 68
-
Robinson C, Oberye J, van Boxmeer J, Albano JD, Tilson H, Scialli A, et al. A Prospective Cohort Study on Pregnancy Outcomes of Persons Immunized with a Seasonal Quadrivalent Inactivated Influenza Vaccine during Pregnancy. Vaccines (Basel). 2022 sep 21;10(10):1577. https://doi.org/10.3390/vaccines10101577.
- Note de bas de page 69
-
Robinson C, Van Boxmeer J, Tilson H, Scialli A, Vanchiere JA, Ides E, et al. Outcomes in Pregnant Persons Immunized with a Cell-Based Quadrivalent Inactivated Influenza Vaccine: A Prospective Observational Cohort Study. Vaccines (Basel). 2022 sep 23;10(10):1600. https://doi.org/10.3390/vaccines10101600.
- Note de bas de page 70
-
Kilich E, Dada S, Francis MR, Tazare J, Chico RM, Paterson P, et al. Factors that influence vaccination decision-making among pregnant women: A systematic review and meta-analysis. PloS one. 2020 juil 09;15(7):e0234827. https://doi.org/10.1371/journal.pone.0234827.
- Note de bas de page 71
-
Adeyanju GC, Engel E, Koch L, Ranzinger T, Shahid IBM, Head MG, et al. Determinants of influenza vaccine hesitancy among pregnant women in Europe: a systematic review. Eur J Med Res. 2021 sep 28;26(1):116. https://doi.org/10.1186/s40001-021-00584-w.
- Note de bas de page 72
-
Gates A, Gates M, Rahman S, Guitard S, MacGregor T, Pillay J, et al. A Systematic Review of Factors that Influence the Acceptability of Vaccines among Canadians. Vaccine. 2021 jan 08;39(2):222-36. https://doi.org/10.1016/j.vaccine.2020.10.038.
- Note de bas de page 73
-
Yuen CYS, Tarrant M. Determinants of uptake of influenza vaccination among pregnant women - a systematic review. Vaccine. 2014 août 06;32(36):4602-13. https://doi.org/10.1016/j.vaccine.2014.06.067.
- Note de bas de page 74
-
Okoli GN, Reddy VK, Al‐Yousif Y, Neilson CJ, Mahmud SM, Abou‐Setta AM. Sociodemographic and health-related determinants of seasonal influenza vaccination in pregnancy: A systematic review and meta-analysis of the evidence since 2000. Acta Obstet Gynecol Scand. 2021 jan 08;100(6):997-1009. https://doi.org/10.1111/aogs.14079.
- Note de bas de page 75
-
Morales KF, Menning L, Lambach P. The faces of influenza vaccine recommendation: A Literature review of the determinants and barriers to health providers' recommendation of influenza vaccine in pregnancy. Vaccine. 2020 juin 26;38(31):4805-15. https://doi.org/10.1016/j.vaccine.2020.04.033.
- Note de bas de page 76
-
Frew PM, Randall LA, Malik F, Limaye RJ, Wilson A, O'Leary ST, et al. Clinician perspectives on strategies to improve patient maternal immunization acceptability in obstetrics and gynecology practice settings. Human vaccines andet immunotherapeutics. 2018 fév 15;14(7):1548-57. https://doi.org/10.1080/21645515.2018.1425116.
- Note de bas de page 77
-
Wong VWY, Lok KYW, Tarrant M. Interventions to increase the uptake of seasonal influenza vaccination among pregnant women: A systematic review. Vaccine. 2016 jan 02;34(1):20-32. https://doi.org/10.1016/j.vaccine.2015.11.020.
- Note de bas de page 78
-
Qiu X, Bailey H, Thorne C. Barriers and Facilitators Associated With Vaccine Acceptance and Uptake Among Pregnant Women in High Income Countries: A Mini-Review. Frontiers in immunology. 2021 avr 26;12:626717. https://doi.org/10.3389/fimmu.2021.626717.
- Note de bas de page 79
-
Blanchard-Rohner G, Meier S, Ryser J, Schaller D, Combescure C, Yudin MH, et al. Acceptability of maternal immunization against influenza: the critical role of obstetricians. The journal of maternal-fetal andet neonatal medicine : the official journal of the European Association of Perinatal Medicine, the Federation of Asia and Oceania Perinatal Societies, the International Society of Perinatal Obstetricians. 2012 mar 16;25(9):1800-9. https://doi.org/10.3109/14767058.2012.663835.
- Note de bas de page 80
-
Alhendyani F, Jolly K, Jones LL. Views, and experiences of maternal healthcare providers regarding influenza vaccine during pregnancy globally: A systematic review and qualitative evidence synthesis. PLOS ONE. 2022 fév 10;17(2):e0263234. https://doi.org/10.1371/journal.pone.0263234.
- Note de bas de page 81
-
Statistique Canada. Vaccins recommandés reçus pendant la grossesse, 2021 [Internet]. Ottawa (ON): Gouvernement du Canada; 2022 déc 13 [cité 2023 mai 25]. Disponible à : https://www150.statcan.gc.ca/n1/daily-quotidien/221213/dq221213a-fra.htm.
- Note de bas de page 82
-
Osterholm MT, Kelley NS, Sommer A, Belongia EA. Efficacy, and effectiveness of influenza vaccines: a systematic review and meta-analysis. Lancet Infect Dis. 2012 jan;12(1):36-44. https://doi.org/10.1016/S1473-3099(11)70295-X.
- Note de bas de page 83
-
Regan AK, Moore HC, de Klerk N, Omer SB, Shellam G, Mak DB, et al. Seasonal Trivalent Influenza Vaccination During Pregnancy and the Incidence of Stillbirth: Population-Based Retrospective Cohort Study. Clin Infect Dis. 2016 mai 15;62(10):1221-7. https://doi.org/10.1093/cid/ciw082.
- Note de bas de page 84
-
Sheffield JS, Greer LG, Rogers VL, Roberts SW, Lytle H, McIntire DD, et al. Effect of influenza vaccination in the first trimester of pregnancy. Obstet Gynecol. 2012 sep;120(3):532-7. https://doi.org/10.1097/AOG.0b013e318263a278.
- Note de bas de page 85
-
Giles ML, Davey M, Wallace EM. Associations Between Maternal Immunisation and Reduced Rates of Preterm Birth and Stillbirth: A Population Based Retrospective Cohort Study. Front Immunol. 2021 sep 07;12:704254. https://doi.org/10.3389/fimmu.2021.704254.
- Note de bas de page 86
-
Zerbo O, Modaressi S, Chan B, Goddard K, Lewis N, Bok K, et al. No association between influenza vaccination during pregnancy and adverse birth outcomes. Vaccine. 2017 mai 31;35(24):3186-90. https://doi.org/10.1016/j.vaccine.2017.04.074.
- Note de bas de page 87
-
Duque J, Howe AS, Azziz-Baumgartner E, Petousis-Harris H. Multi-decade national cohort identifies adverse pregnancy and birth outcomes associated with acute respiratory illness hospitalisations during the influenza season. Influenza Other Respir Viruses. 2023 jan;17(1):e13063. https://doi.org/10.1111/irv.13063.
- Note de bas de page 88
-
Dodds L, MacDonald N, Scott J, Spencer A, Allen VM, McNeil S. The association between influenza vaccine in pregnancy and adverse neonatal outcomes. J Obstet Gynaecol Can. 2012 août;34(8):714-20. https://doi.org/10.1016/S1701-2163(16)35336-1.
- Note de bas de page 89
-
Legge A, Dodds L, MacDonald NE, Scott J, McNeil S. Rates, and determinants of seasonal influenza vaccination in pregnancy and association with neonatal outcomes. CMAJ. 2014 mar 04;186(4):157. https://doi.org/10.1503/cmaj.130499.
- Note de bas de page 90
-
Nunes MC, Madhi SA. Influenza vaccination during pregnancy for prevention of influenza confirmed illness in the infants: A systematic review and meta-analysis. Human Vaccines andet Immunotherapeutics. 2018 mar 04;14(3):758-66. https://doi.org/10.1080/21645515.2017.1345385.
- Note de bas de page 91
-
Nunes MC, Aqil AR, Omer SB, Madhi SA. The Effects of Influenza Vaccination during Pregnancy on Birth Outcomes: A Systematic Review and Meta-Analysis. Am J Perinatol. 2016;33(11):1104-14. https://doi.org/10.1055/s-0036-1586101.
- Note de bas de page 92
-
Foo DYP, Sarna M, Pereira G, Moore HC, Fell DB, Regan AK. Early Childhood Health Outcomes Following In Utero Exposure to Influenza Vaccines: A Systematic Review. Pediatrics. 2020 août;146(2):e20200375. https://doi.org/10.1542/peds.2020-0375.
- Note de bas de page 93
-
Giles ML, Krishnaswamy S, Macartney K, Cheng A. The safety of inactivated influenza vaccines in pregnancy for birth outcomes: a systematic review. Hum Vaccin Immunother. 2019;15(3):687-99. https://doi.org/10.1080/21645515.2018.1540807.
- Note de bas de page 94
-
Mehrabadi A, Dodds L, MacDonald NE, Top KA, Benchimol EI, Kwong JC, et al. Association of Maternal Influenza Vaccination During Pregnancy With Early Childhood Health Outcomes. JAMA : the journal of the American Medical Association. 2021 juin 08;325(22):2285-93. https://doi.org/10.1001/jama.2021.6778.
- Note de bas de page 95
-
Cuningham W, Geard N, Fielding JE, Braat S, Madhi SA, Nunes MC, et al. Optimal timing of influenza vaccine during pregnancy: A systematic review and meta‐analysis. Influenza and Other Respiratory Viruses. 2019 sep;13(5):438-52. https://doi.org/10.1111/irv.12649.
- Note de bas de page 96
-
Panagiotakopoulos L, McCarthy NL, Tepper NK, Kharbanda EO, Lipkind HS, Vazquez-Benitez G, et al. Evaluating the Association of Stillbirths After Maternal Vaccination in the Vaccine Safety Datalink. Obstet Gynecol. 2020 dec;136(6):1086-94. https://doi.org/10.1097/AOG.0000000000004166.
- Note de bas de page 97
-
Speake HA, Pereira G, Regan AK. Risk of adverse maternal and foetal outcomes associated with inactivated influenza vaccination in first trimester of pregnancy. Paediatr Perinat Epidemiol. 2021 mar;35(2):196-205. https://doi.org/10.1111/ppe.12715.
- Note de bas de page 98
-
Louik C, Kerr S, Van Bennekom CM, Chambers C, Jones KL, Schatz M, et al. Safety of the 2011-12, 2012-13, and 2013-14 seasonal influenza vaccines in pregnancy: Preterm delivery and specific malformations, a study from the case-control arm of VAMPSS. Vaccine. 2016 août 17;34(37):4450-9. https://doi.org/10.1016/j.vaccine.2016.06.078.
- Note de bas de page 99
-
Sarna M, Pereira GF, Foo D, Baynam GS, Regan AK. The risk of major structural birth defects associated with seasonal influenza vaccination during pregnancy: A population-based cohort study. Birth Defects Res. 2022 nov 15;114(19):1244-56. https://doi.org/10.1002/bdr2.2049.
- Note de bas de page 100
-
The Cochrane Collaboration. Review Manager (RevMan). 2020;5.4.
