Conseils relatifs à l'utilisation du vaccin multicomposant contre le méningocoque du sérogroupe B (4CMenB)
Une déclaration d'un comité consultatif (DCC) Comité consultatif national de l'immunisation (CCNI) Note de bas de page †
Préambule
Le Comité consultatif national de l'immunisation (CCNI) donne à l'Agence de la santé publique du Canada (ci-après appelée l'Agence) des conseils constants et à jour liés à l'immunisation dans le domaine de la médecine, des sciences et de la santé publique. L'Agence reconnaît que les conseils et les recommandations figurant dans la présente déclaration reposent sur les connaissances scientifiques les plus récentes et diffuse ce document à des fins d'information. Les personnes qui administrent le vaccin doivent également connaître le contenu de la monographie de produit pertinente. Les recommandations d'utilisation et les autres renseignements qui figurent dans le présent document peuvent différer du contenu de la monographie de produit rédigée par le fabricant du vaccin au Canada. Les fabricants ont fait approuver les vaccins et ont démontré leur innocuité et leur efficacité uniquement lorsqu'ils sont utilisés conformément à la monographie de produit. Les membres du CCNI et les agents de liaison doivent se conformer à la politique de l'Agence régissant les conflits d'intérêts, notamment déclaré chaque année les conflits d'intérêts possibles.
Table des matières
Sommaire de l'information contenue dans la présente déclaration du CCNI
Le tableau suivant résume l'information importante pour les vaccinateurs. Veuillez consulter le reste de la Déclaration pour obtenir plus de précisions.

Télécharger le rapport complet
(PDF format, 1.82 Mo, 45 pages)
Cat. : HP40-104/2014F-PDF
ISBN : 978-0-660-22022-2
Pub. : 140013
Organization : Agence de la santé publique du Canada
Date de publication : Avril 2014
Sujets connexes
1. Quoi
Qu'est ce qu'une méningococcie invasive?
La méningococcie invasive (MI) se caractérise habituellement par une maladie fébrile aiguë d'apparition soudaine associée à des caractéristiques de méningite ou de septicémie (méningococcémie), ou les deux, et à une éruption cutanée sans blancheur caractéristique. Le taux de mortalité globale est d'environ 10 %, et jusqu'à un tiers des survivants conservent des séquelles durables, notamment une perte d'audition, diverses atteintes neurologiques et l'amputation de doigts ou de membres. En 2011, 108 des 175 (62 %) cas de MI déclarés au Canada étaient attribuables au sérogroupe B; 18.5 % des cas de MI affectait des nourrissons majoritairement âgés de moins de 6 mois. Les taux de MI attribuables à d'autres sérogroupes sont en baisse depuis l'instauration de programmes de vaccination systématique. Des renseignements supplémentaires sur la MI sont accessibles sur le site Web de l'Agence de la santé publique du Canada (l'Agence).
Qu'est ce que le vaccin multicomposant contre le méningocoque du sérogroupe B (4CMenB)?
Le vaccin multicomposant contre le méningocoque du sérogroupe B (4CMenB) est le premier vaccin permettant de lutter contre la MI du sérogroupe B offert au Canada. Il protège contre des souches qui expriment des antigènes contenus dans le vaccin à des degrés suffisants. Le 4CMenB est un vaccin immunogène. Son efficacité, ses répercussions sur le portage et sa durée de protection demeurent toutefois inconnues. Des recherches, des évaluations et une surveillance supplémentaires seront nécessaires afin d'établir la durée de la protection, l'utilité ou l'efficacité du vaccin 4CMenB, sa capacité à entraîner l'immunité collective, et le risque d'effets indésirables associés à son utilisation répandue.
2. Qui
Personnes à vacciner?
Personnes âgées d'au moins 2 mois :
- qui présentent un risque élevé de contracter une MI attribuable au sérogroupe B de Neisseria meningitidis;
- qui ont été en contact étroit avec un cas de MI attribuable au sérogroupe B de Neisseria meningitidis;
- pendant les éclosions de MI attribuable au sérogroupe B de Neisseria meningitidis ou en cas d'émergence de souches de Neisseria meningitidis hyperendémiques ou hypervirulentes qui devraient être réceptives au vaccin selon l'essai du Meningococcal Antigen Typing System (système MATS) réalisé.
3. Comment
Posologie, calendrier de vaccination et précautions, administration simultanée d'autres vaccins
La posologie des vaccins varie en fonction de l'âge de la personne au moment de l'administration. La durée de la protection après l'immunisation étant inconnue, la nécessité d'administrer une dose de rappel reste à déterminer.
Le vaccin 4CMenB a été administré en même temps qu'un vaccin hexavalent destiné aux nourrissons et contenant les composants contre le tétanos, un vaccin conjugué heptavalent contre le pneumocoque (PCV7), un vaccin contre le sérogroupe C du méningocoque et un vaccin contre la rougeole, la rubéole, les oreillons et la varicelle. On a observé des taux élevés de fièvre, particulièrement, dans le cadre de l'administration simultanée du vaccin 4CMenB et de vaccins systématiques administrés aux nourrissons. L'administration simultanée des vaccins systématiques administrés aux nourrissons et du vaccin 4CMenB ne semble pas avoir de répercussions sur la réaction immunitaire à ces derniers.
Le vaccin 4CMenB est contre-indiqué chez les personnes souffrant d'une allergie grave à tout composant du vaccin ou ayant présenté une réaction allergique grave à une dose antérieure. Aucune étude du vaccin 4CMenB n'a été réalisée sur des femmes enceintes ou qui allaitent, des nourrissons de moins de 2 mois et de plus de 55 ans, des personnes ayant des problèmes de santé chroniques et des personnes ayant déjà été infectées par le méningocoque.
Le vaccin 4CMenB doit être conservé à une température de +2 °C à +8 °C et ne doit pas être congelé.
4. Pourquoi
Pourquoi vacciner?
Afin d'éviter la MI attribuable aux souches de méningocoques du sérogroupe B contre lesquelles le vaccin est efficace.
I. Introduction
Bexsero® (Novartis Vaccines) est un nouveau vaccin conjugué contre le méningocoque du sérogroupe B (4CMenB). Il s'agit du premier vaccin créé par l'intermédiaire d'un processus de vaccinologie inverse. Dans le cadre de ce processus, on définit et on développe les cibles potentielles du vaccin (c. à d. les antigènes) au moyen du séquençage du génome du méningocoque du sérogroupe B.Note de bas de page 1 Note de bas de page 3 Le vaccin protège donc uniquement contre les souches qui expriment des antigènes contenus dans le vaccin à des degrés suffisants. De plus, une importante proportion (mais non la totalité) de souches du sérogroupe B exprime les antigènes contenus dans le vaccin; ces derniers ne sont pas propres au sérogroupe B et peuvent être exprimés par d'autres sérogroupes du méningocoque. Une description détaillée des antigènes du vaccin et du processus de mise au point des vaccins est présentée dans la revue de la littérature.
Le CCNI recommandait auparavant l'utilisation des vaccins polysaccharidiques capsulaires disponibles : trois vaccins méningococciques conjugués monovalents pour le sérogroupe C (Menjugate®, Neis Vac-C® et MeningitecMC), deux vaccins méningococciques conjugués quadrivalents pour les sérogroupes A, C, Y et W-135 (Menactra® et MenveoMC) et un vaccin méningococcique polysaccharidique quadrivalent ACYW-135 (Menomune®) pour la prévention de la MI de sérogroupes A, C, W-135 et Y. En mars 2013, Santé Canada a publié un avis de conformité pour un nouveau vaccin conjugué quadrivalent contre le méningocoque de sérogroupes A, C, Y et W-135 (NimenrixMC).
Cet énoncé :
- met à jour l'épidémiologie de la MI au Canada;
- fournit les données disponibles sur l'efficacité théorique et pratique, l'immunogénicité et l'innocuité du vaccin 4CMenB;
- cerne les lacunes en matière de données probantes et de recherche en cours, les besoins en matière d'évaluation et de surveillance;
- émet des recommandations relatives à l'utilisation du vaccin 4CMenB au Canada.
II. Méthodes
Ont été effectués une recherche et des examens documentaires exhaustifs en vue d'obtenir des données probantes au sujet du vaccin 4CMenB, notamment en matière d'innocuité, d'immunogénicité, d'utilité et d'efficacité du vaccin, de calendriers de vaccination, de populations cibles et d'autres aspects de la stratégie globale d'immunisation. En outre, le fardeau de la MI au Canada a été examiné. En prévision de l'absence de données en matière d'utilité ou d'efficacité du nouveau vaccin 4CMenB, on a mis en place un processus similaire pour le vaccin OMV NZ (MeNZBMMB, Novartis Vaccines, anciennement Chiron), un composant du vaccin 4CMenB pour lequel on dispose de données relatives à l'efficacité. Santé publique Ontario a réalisé la synthèse des connaissances, sous la supervision du Groupe de travail sur un projet pilote lié au vaccin contre le méningocoque de sérogroupe B (GTPPMB), composé de représentants du CCNI et du Comité canadien sur l'immunisation (CIC) de plus que d'experts canadiens dans le domaine de la MI. À la suite d'une évaluation critique de chacune des études, on a préparé des tableaux récapitulatifs contenant l'évaluation de la qualité des données probantes à l'aide de la hiérarchie méthodologique du CCNI. À l'issue d'un examen approfondi des données probantes et de consultations, le GTPPMB a proposé des recommandations provisoires à la réunion du 15 mars 2013, et les a présentées au CCNI le 28 mars 2013. Le CCNI a voté les recommandations lors de la réunion du 29 avril 2013. On trouvera dans le texte une description des considérations pertinentes, des justifications des décisions et des lacunes dans les connaissances. La synthèse des connaissances et son examen sont disponibles dans leur intégralité et mis à jour par l'Agence.
III. Épidemiologie
La bactérie Neisseria meningitidis (méningocoque) est un pathogène potentiellement grave qui peut causer la MI. Elle colonise jusqu'à 10 % des personnes en santé sans causer de méfaits. On peut classer les méningocoques en fonction de la réactivité immunologique au polysaccharide capsulaire dans 12 sérogroupes différents, parmi lesquels 5 (A, B, C, W-135 et Y) sont le plus souvent liés à la MI dans le monde. On peut encore les classer en sérotypes et en sous-types sérologiques en fonction de la réactivité immunologique de leurs protéines de membrane externe (OMP). On a recours à la caractérisation au moyen de méthodes axées sur la détermination des séquences nucléotidiques, comme le séquençage génétique des gènes porA et porB pour remplacer ou compléter les classifications axées sur la sérologie.
La MI se caractérise habituellement par une maladie fébrile aiguë d'apparition soudaine associée à des caractéristiques de méningite ou de septicémie (méningococcémie), ou les deux, et à une éruption cutanée sans blancheur caractéristique. Le taux de mortalité globale est d'environ 10 %, et jusqu'à un tiers des survivants conservent des séquelles durables, notamment une perte d'audition, diverses atteintes neurologiques et l'amputation de doigts ou de membres.Note de bas de page 4 Note de bas de page 5 Tous les cas probables et confirmés de MI sont signalés à l'Agence par l'intermédiaire de son Système national de surveillance améliorée des MI. Les laboratoires de santé publique ou d'hôpitaux à l'échelle provinciale/territoriale envoient tous les isolats de méningocoques au Laboratoire national de microbiologie de l'Agence aux fins de caractérisation des souches, notamment la confirmation du sérogroupe et l'établissement du sérotype, du sous type sérologique et du type de séquence ou du complexe clonal.
La MI est une maladie à déclaration obligatoire pour toutes les provinces et les territoires. Les cas de MI sont signalés aux autorités de santé locales et au système de surveillance de MI de l'Agence. Les laboratoires de santé publique ou d'hôpitaux à l'échelle provinciale/territoriale envoient tous les isolats de méningocoques au Laboratoire national de microbiologie de l'Agence aux fins de caractérisation des souches, notamment la confirmation du sérogroupe et l'établissement du sérotype, du sous-type sérologique et du type de séquence ou du complexe clonal.
Cependant, bien que la MI soit signalée à longueur d'année, il y a une grande différence d'incidence sur les plans géographique et temporel, la majorité des cas étant déclarés entre novembre et mars. Comme l'indique la Figure 1, l'incidence annuelle de la maladie au Canada s'est étendue de 0,45 à 1,18 cas pour 100 000 habitants de 1995 à 2011. Entre 2007 et 2011, 192 cas de MI ont été signalés en moyenne chaque année au Canada, soit une incidence moyenne de 0,57 cas pour 100 000 habitants par année.
Figure 1. Incidence de la MI pour 100 000 Canadiens selon le sérogroupe et l'année, de 1995 à 2011
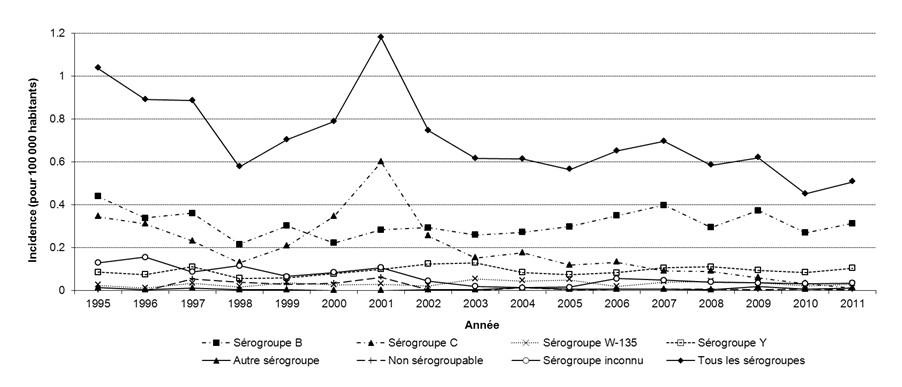
Figure 1 - Description longue
Figure 1. Incidence de la MI pour 100 000 Canadiens selon le sérogroupe et l’année, de 1995 à 2011
La figure 1 est un graphique linéaire illustrant le taux d’incidence annuel de cas signalés de méningococcie invasive au Canada pour 100 000 habitants selon le sérogroupe et l’année, de 1995 à 2011. L’axe des abscisses présente les années de 1995 à 2011. L’axe des ordonnées à gauche présente les cas signalés pour 100 000 habitants, de 0 cas (partie inférieure) à 1,2 cas (partie supérieure). Les taux d’incidence annuels des sérogroupes B, C, W-135 et Y, des autres sérogroupes, des non sérogroupables, des sérogroupes inconnus et tous les sérogroupes sont respectivement illustrés par une ligne.
L’incidence de la méningococcie invasive pour tous les sérogroupes a diminué, passant de 1,04 cas à 0,58 cas pour 100 000 habitants de 1995 à 1998, puis a augmenté pour atteindre un sommet de 1,18 cas pour 100 000 habitants en 2001. Par la suite, le taux d’incidence global a légèrement diminué, passant de 0,75 cas à 0,51 cas pour 100 000 habitants de 2002 à 2011. Pour la majorité des années, le sérogroupe B présentait le taux d’incidence le plus élevé, allant de 0,22 cas à 0,44 cas pour 100 000 habitants. L’incidence du sérogroupe C a diminué, passant de 0,35 cas à 0,13 cas pour 100 000 habitants de 1995 à 1998, puis a augmenté pour atteindre un pic de 0,60 cas pour 100 000 habitants en 2001, pour diminuer encore au cours des dix années suivantes, atteignant son niveau le plus bas, soit de 0,01 cas pour 100 000 habitants en 2011. L’incidence des sérogroupes W-135 et Y était relativement stable, variant de 0,01 cas à 0,05 cas pour 100 000 habitants pour le sérogroupe W-135 et de 0,06 cas à 0,13 cas pour 100 000 habitants pour le sérogroupe Y. De 1995 à 2001, les cas de méningococcie invasive attribuables aux autres sérogroupes variaient de 0 cas à 0,02 cas pour 100 000 habitants. Au cours de la même période, l’incidence des cas attribuables aux non sérogroupables variait de 0 cas à 0,06 cas pour 100 000 habitants et l’incidence des cas attribuables aux sérogroupes inconnus variait de 0,01 cas à 0,16 cas pour 100 000 habitants.
| Province/ territoire | Année de mise en œuvre initiale du programme systématique conjugué contre le méningocoque C | Calendrier actuel de vaccination des nourrissons au moyen du vaccin conjugué contre le méningocoque C | Calendrier actuel de vaccination des adolescents au moyen du vaccin conjugué contre le méningocoque C (C) ou du vaccin conjugué contre le méningocoque ACYW 135 (Q)Note de bas de page * |
|---|---|---|---|
| C.-B | 2003 | 2, 12 mois (depuis 2005) | (C) 6e année (depuis 2003) |
| Alb. | 2002 | 2, 4, 12 mois (depuis 2007) | (Q) 9e année (depuis 2011) |
| Sask | 2003 | 12 mois (depuis 2004) | (Q) 6e année (depuis 2011) |
| Man. | 2004 | 12 mois (depuis 2009) | (C) 4e année (depuis 2004) |
| Ont. | 2004 | 12 mois (depuis 2004) | (Q) 7e année(depuis 2009) |
| Qc | 2002 | 12 mois (depuis 2002) | (C) 6e année (depuis 2003) |
| T.-N.-L. | 2005 | 12 mois (depuis 2005) | (Q) 4e année (depuis 2007) |
| N.-B. | 2004 | 12 mois (depuis 2004) | (Q) 9e année (depuis 2007) |
| N.-É. | 2005 | 12 mois (depuis 2005) | (C) 7e année (depuis 2010) |
| Î.-P.-É. | 2003 | 12 mois (depuis 2003) | (Q) 9e année (depuis 2006) |
| Yn | 2005 | 2, 12 mois (depuis 2009) | (C) 6e année (depuis 2006) |
| T.N.-O. | 2004 | 2, 12 mois (depuis 2004) | (C) 9e année (depuis 2008) |
| Nt | 2007 | 12 mois (depuis 2007) | (C) 9e année (depuis 2006) |
|
|||
Le Tableau 2 présente le nombre de cas signalés et l'incidence de la MI par sérogroupe en 2011, ainsi que le nombre de cas moyen entre 2007 et 2011. Il indique également l'âge médian et le rapport de létalité de la MI par sérogroupe de 2007 à 2011.
| Sérogroupe | 2011 | 2007 to 2011 | ||||
|---|---|---|---|---|---|---|
| Nombre de cas | Incidence (cas pour 100 000 habitants | Moyenne annuelle du nombre de cas (étendue) | Incidence annuelle moyenne (cas pour 100 000 habitants) | Âge médian (années) | Rapport de létalité | |
| A | 0 | 0 | 0,2 (de 0 à 1) | 0 | 16 | 0,0 % |
| B | 108 | 0,31 | 111 (de 92 à 131) | 0,33 | 16 | 6,0 % |
| xx | 4 | 0,01 | 19 (de 4 à 30) | 0,06 | 44,5 | 15,3 % |
| W-135 | 10 | 0,03 | 11,2 (de 7 à 14) | 0,03 | 38 | 8,5 % |
| Y | 36 | 0,10 | 33,8 (de 29 à 37) | 0,10 | 47 | 12,1 % |
| Autre | 4 | 0,01 | 3 (de 1 à 6) | 0,01 | 34 | 0 % |
| Non sérogroupable | 1 | 0 | 1,6 (de 1 à 2) | 0 | 28 | 10,0 % |
| Inconnu | 12 | 0,04 | 12,8 (de 11 à 16) | 0,04 | 12,8 (de 11 à 16) | 8,2 % |
| Tous les sérogroupes | 175 | 0,51 | 192,4 (de 154 à 229) | 0,57 | 20 | 8,2 % |
Comme l'indique la Figure 2, il existe des différences géographiques en matière de répartition des sérogroupes de la MI dans l'ensemble du Canada. L'incidence de MI la plus élevée et la MI propre au sérogroupe B sont visibles au Québec, où 77 % des cas en moyenne étaient attribuables au sérogroupe B de 2007 à 2011. Dans les autres provinces, la répartition des sérogroupes était variable. Le sérogroupe B représentait de 25 à 77 % des cas en moyenne entre 2007 et 2011, selon la région.
Très peu de cas ont été signalés dans les trois territoires et à l'Île-du-Prince-Édouard (de zéro à deux cas par an) de 2007 à 2011, ce qui entraîne parfois des taux élevés qu'il faut interpréter avec précaution.
Figure 2. Moyenne des cas de méningococcie invasive signalés au Canada par sérogroupe et province/territoire de 2007 à 2011

Figure 2 - Description longue
Figure 2. Moyenne des cas de méningococcie invasive signalés au Canada par sérogroupe et province ou territoire de 2007 à 2011
La figure 2 est un graphique à barres empilées illustrant le nombre moyen de cas de méningococcie invasive signalés au Canada de 2007 à 2011, par sérogroupe et par province ou territoire. L’axe des abscisses présente chaque province et territoire, de la Colombie-Britannique au Nunavut. L’axe des ordonnées à gauche affiche le nombre moyen de cas signalés au cours de la période de cinq ans s’échelonnant de 2007 à 2011. L’axe des ordonnées va de 0 cas (partie inférieure) à 90 cas (partie supérieure). Chaque barre empilée illustre le nombre moyen de cas attribuables aux sérogroupes B, C, W-135 et Y, aux non sérogroupables, aux autres sérogroupes et aux sérogroupes inconnus pour chaque province ou territoire.
Au Canada, le sérogroupe B représente la plus grande proportion du nombre moyen de cas signalés dans l’ensemble.
Très peu de cas de méningococcie invasive ont été signalés en moyenne dans les trois territoires et à l’Île-du-Prince-Édouard (0 à 2 cas par année) de 2007 à 2011. Dans le territoire du Yukon, le seul cas signalé était du sérogroupe C, tandis que les cas dans les Territoires du Nord-Ouest et le Nunavut étaient du sérogroupe B. Pendant cette période, 0,6 cas a été signalé en moyenne chaque année à l’Île-du-Prince-Édouard. En revanche, le Québec a déclaré le nombre le plus élevé de cas par rapport à l’ensemble des provinces et territoires du Canada, soit 76,6 cas signalés en moyenne (répartition des sérogroupes : 59,2 cas pour B, 4 cas pour C, 3,4 cas pour W-135, 3,8 cas pour Y, 1,2 cas pour autre et 5 cas pour inconnu). L’Ontario a signalé le deuxième nombre moyen de cas le plus élevé, soit 52 cas (répartition des sérogroupes : 23,2 cas pour B, 6,8 cas pour C, 2 cas pour W-135, 16 cas pour Y, 0,8 cas pour non groupable, 0,4 cas pour autre et 2,8 cas pour inconnu).
Dans les autres provinces, 20 cas ont été signalés en moyenne en Colombie-Britannique de 2007 à 2011 (répartition des sérogroupes : 8 cas pour B, 3,8 cas pour C, 1,2 cas pour W-135, 5,2 cas pour Y, 0,2 cas pour non sérogroupable, 0,8 cas pour autre et 0,8 cas pour inconnu), 14,8 cas en moyenne en Alberta (répartition des sérogroupes : 6,2 cas pour B, 0,6 cas pour C, 2 cas pour W-135, 4 cas pour Y, 0,4 cas pour non sérogroupable, 0,4 cas pour autre et 1,2 cas pour inconnu), 7,2 cas en Saskatchewan (répartition des sérogroupes : 3 cas pour B, 1 cas pour C, 0,6 cas pour W-135 et 2,6 cas pour Y), 6,2 cas au Manitoba (répartition des sérogroupes : 2 cas pour B, 0,8 cas pour C, 1 cas pour W-135, 1,2 cas pour Y, 0,2 cas pour non sérogroupable, 0,2 cas pour autre et 0,8 cas pour inconnu), 4,2 cas à Terre-Neuve-et-Labrador (répartition des sérogroupes : 2,8 cas pour B, 0,2 cas pour C, 0,2 cas pour W-135, 0,2 cas pour Y et 0,8 cas pour inconnu), 5,6 cas au Nouveau-Brunswick (répartition des sérogroupes : 3,6 cas pour B, 0,4 cas pour C, 0,6 cas pour W-135, 0,4 cas pour Y, 0,6 cas pour inconnu) et 4,6 cas en Nouvelle-Écosse (répartition des sérogroupes : 2,4 cas pour B, 1,2 cas pour C, 0,4 cas pour Y et 0,6 cas pour inconnu).
La répartition des sérogroupes de MI varie également en fonction de l'âge. Les cas du sérogroupe Y possédaient l'âge médian le plus élevé de 2007 à 2011 (47 ans), suivis du sérogroupe C (44,5 ans) et du sérogroupe W-135 (38 ans). Comme l'indique la Figure 3, la part de cas attribuables au sérogroupe B baisse avec l'âge alors qu'à l'inverse, la part de cas attribuables aux sérogroupes C et Y a tendance à augmenter avec l'âge.
Figure 3. Moyenne des cas de méningococcie invasive signalés au Canada par sérogroupe et groupe d'âge de 2007 à 2011

Figure 3 - Description longue
Figure 3. Moyenne des cas de méningococcie invasive signalés au Canada par sérogroupe et groupe d’âge de 2007 à 2011
La figure 3 est un graphique à barres empilées illustrant le nombre moyen de cas de méningococcie invasive signalés au Canada par sérogroupe et groupe d’âge de 2007 à 2011. L’axe des abscisses présente les groupes d’âge, soit les nourrissons de moins d’un an, les enfants de 1 à 4 ans, de 5 à 9 ans, de 10 à 14 ans, de 15 à 19 ans, les adultes de 20 à 24 ans, de 25 à 29 ans, de 30 à 59 ans, et les adultes de 60 ans et plus. L’axe des ordonnées à gauche affiche le nombre moyen de cas signalés au cours de la période de cinq ans s’échelonnant de 2007 à 2011. L’axe des ordonnées va de 0 cas (partie inférieure) à 50 cas (partie supérieure). Chaque barre empilée illustre la répartition des cas attribuables aux sérogroupes B, C, W-135 et Y, aux non sérogroupables, aux autres sérogroupes et aux sérogroupes inconnus pour chaque groupe d’âge.
Le sérogroupe B représente le plus grand nombre moyen de cas signalés dans tous les groupes d’âge. La proportion de cas attribuables aux sérogroupes C et Y a tendance à augmenter avec l’âge.
Le nombre moyen de cas était de 27,2 chez les nourrissons de moins d’un an (répartition des sérogroupes : 21,6 cas pour B, 1 cas pour C, 0,6 cas pour W-135, 1,8 cas pour Y, 2,2 cas pour inconnu), 28 cas chez les 1 à 4 ans (répartition des sérogroupes : 20,6 cas pour B, 0,8 cas pour C, 3 cas pour W-135, 1,2 cas pour Y, 0,2 cas pour autre, 2,2 cas pour inconnu), 6,6 cas chez les 5 à 9 ans (répartition des sérogroupes : 4,2 cas pour B, 1 cas pour C, 0 cas pour W-135, 0,4 cas pour Y, 0,4 cas pour autre,0,6 cas pour inconnu), 7 cas chez les 10 à 14 ans (répartition des sérogroupes : 4,6 cas pour B, 0,2 cas pour C, 0,2 cas pour W-135, 1,6 cas pour Y, 0,4 cas pour inconnu), 25 cas chez les 15 à 19 ans (répartition des sérogroupes : 16,4 cas pour B, 0,8 cas pour C, 0,8 cas pour W-135, 4,6 cas pour Y, 0,4 cas pour non sérogroupable, 0,6 cas pour autre, 1,4 cas pour inconnu), 15,6 cas chez les 20 à 24 ans (répartition des sérogroupes : 10 cas pour B, 1,6 cas pour C, 0,4 cas pour W-135, 2,2 cas pour Y, 0,4 cas pour non sérogroupable, 1 cas pour inconnu), 7,6 cas chez les 25 à 29 ans (répartition des sérogroupes : 4,8 cas pour B, 1,4 cas pour C, 0,2 cas pour W-135, 0,6 cas pour Y, 0,2 cas pour autre, 0,4 cas pour inconnu), 43,2 cas chez les 30 à 59 ans (répartition des sérogroupes : 18,2 cas pour B, 7,6 cas pour C, 2,8 cas pour W-135, 10,8 cas pour Y, 0,6 cas pour non sérogroupable, 0,6 cas pour autre, 2,6 cas pour inconnu), 31,8 chez les personnes âgées de 60 ans et plus (répartition des sérogroupes : 10,6 cas pour B, 4,6 cas pour C, 3,2 cas pour W-135, 10,4 cas pour Y, 0,2 cas pour non sérogroupable, 1 cas pour autre, 1,8 cas pour inconnu).
L'incidence du sérogroupe B est faible et la plus élevée chez les nourrissons de moins d'un an, avec un taux d'incidence propre à l'âge de 5,8 cas pour 100 000 habitants en 2011, suivi des enfants âgés de 1 à 4 ans (1,4 cas pour 100 000 habitants) et des adolescents âgés de 15 à 19 ans (0,7 cas pour 100 000 habitants). Dans le Tableau 3, on peut voir que même si les taux d'incidence du sérogroupe B suivent des tendances similaires dans les provinces/territoires, l'incidence du sérogroupe B chez les adolescents âgés de 15 à 19 ans était particulièrement élevée au Québec par rapport à d'autres régions (2,6 cas pour 100 000 habitants en 2011).
| P/T | Moins de 1 an | 1 à 4 ans | 5 à 9 ans | 10 à 14 ans | 15 à 19 ans | 20 à 24 ans | 25 à 29 ans | 30 à 59 ans | 60 ans ou plus | Tous les âges |
|---|---|---|---|---|---|---|---|---|---|---|
| C.-B. | 5,02 | 0,35 | 0,18 | 0 | 0,21 | 0,33 | 0,13 | 0,1 | 0,09 | 0,18 |
| Alb. | 3,61 | 0,65 | 0,1 | 0,09 | 0,08 | 0,28 | 0,06 | 0,1 | 0 | 0,17 |
| Sask. | 10,37 | 1,19 | 0,94 | 0 | 0 | 0 | 0 | 0,05 | 0,1 | 0,29 |
| Man. | 0 | 1,34 | 0 | 0 | 0,22 | 0,22 | 0,48 | 0,08 | 0 | 0,16 |
| Ont. | 3,02 | 0,78 | 0,06 | 0,1 | 0,23 | 0,29 | 0,09 | 0,1 | 0,1 | 0,18 |
| Qc | 11,95 | 3,05 | 0,57 | 0,71 | 2,57 | 1,01 | 0,53 | 0,2 | 0,36 | 0,76 |
| T.-N.-L. | 16,38 | 6,28 | 0 | 0 | 0,6 | 0 | 0,70 | 0,09 | 0,17 | 0,55 |
| N.-B. | 5,38 | 4,16 | 0,53 | 0,5 | 0,42 | 0,43 | 0 | 0,24 | 0,24 | 0,48 |
| N.-É. | 2,3 | 0,58 | 0,42 | 0,76 | 0,34 | 0,30 | 0 | 0,15 | 0,19 | 0,26 |
| Î.-P.-É. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,65 | 0,14 |
| Yn | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| T.N.-O. | 0 | 7,51 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,45 |
| Nt | 24,66 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,6 |
| Canada | 5,78 | 1,4 | 0,23 | 0,23 | 0,73 | 0,43 | 0,21 | 0,12 | 0,16 | 0,33 |
Entre 2007 et 2011, 111 cas de MI du sérogroupe B ont été signalés en moyenne chaque année au Canada. Comme l'indique le Tableau 4, au cours de cette période, le plus grand nombre de cas a été signalé au Québec et chez les enfants âgés de moins de cinq ans.
| P/T | Moins de 1 ans | 1 à 4 ans | 5 à 9 ans | 10 à 14 ans | 15 à 19 ans | 20 à 24 ans | 25 à 29 ans | 30 à 59 ans | 60 ans ou plus | Tous les âges |
|---|---|---|---|---|---|---|---|---|---|---|
| B.-C. | 2,2 | 0,6 | 0,4 | 0 | 0,6 | 1 | 0,4 | 2 | 0,8 | 8 |
| Alb. | 1,8 | 1,2 | 0,2 | 0,2 | 0,2 | 0,8 | 0,2 | 1,6 | 0 | 6,2 |
| Sask. | 1,4 | 0,6 | 0,6 | 0 | 0 | 0 | 0 | 0,2 | 0,2 | 3 |
| Man. | 0 | 0,8 | 0 | 0 | 0,2 | 0,2 | 0,4 | 0,4 | 0 | 2 |
| Ont. | 4,2 | 4,4 | 0,4 | 0,8 | 2 | 2,6 | 0,8 | 5,6 | 2,4 | 23,2 |
| Qc | 10,4 | 10,2 | 2,2 | 3 | 12,8 | 5 | 2,8 | 6,8 | 6 | 59,2 |
| T.-N.-L. | 0,8 | 1,2 | 0 | 0 | 0,2 | 0 | 0,2 | 0,2 | 0,2 | 2,8 |
| N.-B | 0,4 | 1 | 0,2 | 0 | 0,2 | 0,2 | 0 | 0,8 | 0,4 | 3,6 |
| N.-É. | 0,2 | 0,2 | 0,2 | 0,4 | 0,2 | 0 | 0 | 0,6 | 0,4 | 2,4 |
| Î.-P.-É. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,2 | 0,2 |
| Yn | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 |
| T.N.-O. | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,2 |
| Nt | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0 | 0,2 |
| Canada | 21,6 | 20,6 | 4,2 | 4,6 | 16,4 | 10 | 4,8 | 18,2 | 10,6 | 111 |
Comme l'indique la Figure 4, de 2005 à 2011, 61 % des cas de MI du sérogroupe B chez les enfants âgés de moins d'un an survenaient au cours des 6 premiers mois de leur vie.
Figure 4. Répartition selon l'âge des cas de méningococcie invasive signalés chez les nourrissons de moins d'un an au Canada de 2005 à 2011 par sérogroupe et âge en mois

Figure 4 - Description longue
Figure 4. Répartition selon l'âge des cas de méningococcie invasive signalés chez les nourrissons de moins d'un an au Canada de 2005 à 2011 par sérogroupe et âge en mois
La figure 4 est un graphique à barres illustrant la répartition des cas de méningococcie invasive signalés selon l’âge chez les nourrissons de moins d’un an au Canada de 2005 à 2011 par sérogroupe et âge, en mois. L’axe des abscisses présente l’âge en mois, soit de 0 à 11 mois. L’axe des ordonnées à gauche affiche le nombre de cas signalés au cours de la période de sept ans s’échelonnant de 2005 à 2011. L’axe des ordonnées va de 0 cas (partie inférieure) à 25 cas (partie supérieure). Pour chaque mois, il y a deux barres qui illustrent le nombre de cas signalés pour le sérogroupe B et le nombre de cas signalés pour les autres sérogroupes.
Le sérogroupe B représentait le plus grand nombre de cas observés chez les nourrissons de moins d’un an, surtout chez les nourrissons de moins de 6 mois. De 2005 à 2011, un total de 84 cas attribuables au sérogroupe B ont été signalés chez les enfants âgés de moins de 6 mois et 15 cas attribuables à d’autres sérogroupes ont été signalés. Au cours de cette même période, 54 cas attribuables au sérogroupe B et 22 cas attribuables à d’autres sérogroupes ont été signalés chez les enfants âgés de 6 à 11 mois.
Le nombre total de cas observés était de 9 chez les enfants âgés de moins d’un mois (7 cas du sérogroupe B, 2 cas attribuables à d’autres sérogroupes), 17 chez les enfants âgés d’un mois (15 cas du sérogroupe B, 2 cas attribuables à d’autres sérogroupes), 12 chez les enfants âgés de 2 mois (12 cas du sérogroupe B), 17 cas chez les enfants âgés de 3 mois (15 cas du sérogroupe B, 2 cas attribuables à d’autres sérogroupes), 21 cas chez les enfants âgés de 4 mois (20 cas du sérogroupe B, 1 cas attribuable à un autre sérogroupe), 23 cas chez les enfants âgés de 5 mois (15 cas du sérogroupe B, 8 cas attribuables aux autres), 10 cas chez les enfants âgés de 6 mois (6 cas du sérogroupe B), 17 cas chez les enfants âgés de 7 mois (11 cas du sérogroupe B, 6 cas attribuables à d’autres sérogroupes), 15 cas chez les enfants âgés de 8 mois (10 cas du sérogroupe B, 5 cas attribuables à d’autres sérogroupes), 9 cas chez les enfants âgés de 9 mois (8 cas du sérogroupe B, 1 cas attribuable à un autre sérogroupe), 9 cas chez les enfants âgés de 10 mois (9 cas du sérogroupe B), et 16 cas chez les enfants âgés de 11 mois (10 cas du sérogroupe B, 6 cas attribuables à d’autres sérogroupes).
Caractérisation antigénique et génétique de la méningococcie invasive du sérogroupe B par les méthodes systématiques actuelles
De 2007 à 2011, parmi les cas confirmés par culture ou par réaction de polymérisation en chaîne, 85 % étaient confirmés par culture, 10 % par réaction de polymérisation en chaîne et 5 % par les deux (méthode de confirmation non établie dans 3 % des cas). Au Canada, on caractérise les isolats de méningocoque de sérogroupe B au moyen du sérotypage et du sous-typage sérologique à l'aide d'anticorps monoclonaux,Note de bas de page 27 de détermination du génotype de l'antigène PorA,Note de bas de page 28 Note de bas de page 29 et de classification du typage génomique multilocus (MLST) en type de séquence et en complexes clonaux, conformément aux méthodes élaborées sur le site Web de typage génomique multilocus de Neisseria meningitidis.
L'analyse des isolats du sérogroupe B de 2001 à 2011 a révélé une importante hétérogénéité des caractéristiques antigéniques et génétiques des souches en circulation dans l'ensemble du pays, à l'exception du Québec et du Nouveau-Brunswick.Note de bas de page 30 Note de bas de page 31 Au Nouveau-Brunswick, une augmentation de la MI de 2008 à 2011 était attribuable à un clone de la souche ST-154 de méningocoque de sérogroupe B, caractérisé comme le virus B:4:P1.4, génotype de l'antigène PorA P1.7-2,4,37 (membre du complexe clonal ST-41/44). À l'extérieur du Nouveau-Brunswick, ce clone n'était pas courant : en Ontario, il représentait seulement 5 % de l'ensemble des isolats de méningocoque invasif de sérogroupe B, entre 2001 et 2010.Note de bas de page 30 Au Québec, la majorité (76 %) des isolats du sérogroupe B appartenait à une souche très homogène du complexe clonal ST-269, dont 92 % étaient de la souche ST-269 et 86 % exprimaient le génotype de l'antigène PorA P1.19-1, 15-11, 36.Note de bas de page 21 Note de bas de page 31 À l'inverse, en Ontario, des 20 isolats qui appartenaient au complexe clonal ST-269 recueillis entre 2001 et 2010, on a recensé 7 types de séquences différentes et 11 génotypes de l'antigène PorA différents.Note de bas de page 30
Comparativement à l'antigène PorA de type P1.4 contenu dans le vaccin 4CMenB, parmi les cas du sérogroupe B déclarés de 2007 à 2011, 8,5 % étaient attribuables aux souches qui exprimaient cet antigène. On a observé des différences entre les provinces/territoires. Le type P1.4 était le plus souvent signalé dans les Provinces Maritimes (de 33 à 83 % des cas selon la province), mais rarement dans d'autres provinces comme au Québec (1 %), et jamais au Manitoba et dans les territoires. On a également remarqué des différences au sein des groupes d'âge, le type P1.4 ayant été plus souvent signalé chez les enfants âgés de 1 à 4 ans (14 % des cas du sérogroupe B) et moins souvent chez les adolescents âgés de 15 à 19 ans (4 % des cas du sérogroupe B).
Résultats concernant la méningococcie invasive du sérogroupe B
Entre 2007 et 2011, 8,2 % des cas signalés à l'échelle nationale ont été mortels. Le taux de mortalité variait en fonction du sérogroupe, le sérogroupe C affichant le taux le plus élevé, soit 15,3 %, et le sérogroupe B le taux le plus faible, soit 6 % (Tableau 2).
Une étude dirigée dans le cadre du Programme canadien de surveillance active de l'immunisation (IMPACT) a démontré que 413 cas du sérogroupe B confirmés en laboratoire avaient été hospitalisés au Canada entre 2002 et 2011.Note de bas de page 4 La durée moyenne des séjours à l'hôpital relevée dans cette étude était de 11,2 jours, et 60,5 % des cas ont dû être soignés en unité de soins intensifs (USI). Parmi les cas admis en USI, 45 % ont dû avoir recours à la ventilation assistée et 36 % à une aide liée à la tension artérielle sous forme d'inotropes. Sur 391 survivants, 19 % ont souffert d'au moins une séquelle attribuable à leur infection au moment de leur sortie ou peu après, 23 % desquels ont dû avoir recours à des mesures de réadaptation pour patients hospitalisés. Parmi les séquelles signalées le plus couramment, citons la surdité (7,2 %), des lésions cutanées cicatricielles (6,4 %), l'amputation (3,8 %), des séquelles neurologiques (3,6 %), des convulsions (2,6 %) et un dysfonctionnement des glandes surrénales (2 %). Cette étude ne comprenait aucun résultat à long terme. Toutefois, une étude cas-témoins réalisée sur 245 survivants de méningococcie du sérogroupe B, au Royaume-Uni, a fait état de déficiences majeures entraînant une incapacité dans un dixième des cas, et d'au moins une déficience des fonctions physiques, cognitives et psychologiques, outre le fardeau que représentent les déficiences de la mémoire et les problèmes de fonction exécutive chez environ un tiers des survivants.Note de bas de page 4,Note de bas de page 5
Fardeau international
Tout comme au Canada, la MI est endémique dans de nombreux pays du monde,Note de bas de page 32 la repartition des sérogroupes variant toutefois selon la region. En Europe, en Australie et en Nouvelle-Zélande, le sérogroupe le plus fréquemment signalé est le sérogroupe B, suivi du C, bien que de récentes augmentations du sérogroupe Y aient été signalées dans certaines régions d'Europe. Note de bas de page 32 Aux États-Unis, les sérogroupes B et C sont signalés le plus souvent, suivis de près par le sérogroupe Y. La répartition des sérogroupes varie en Amérique du Sud; et même si le sérogroupe B, suivi du C, prédomine dans de nombreux pays, les sérogroupes W-135 et Y comptent pour une importante part dans d'autres.Note de bas de page 32 On dispose de peu de données concernant l'épidémiologie endémique en Asie.Note de bas de page 32 La région la plus touchée d'Afrique, une zone de l'Afrique subsaharienne appelée la « ceinture de méningite » qui s'étend du Sénégal à l'Éthiopie, est touchée par d'importantes éclosions du sérogroupe A chaque année, bien que le sérogroupe W-135 prédomine également depuis quelques années.Note de bas de page 32 En 2011, plusieurs pays situés dans la ceinture de méningite ont signalé, comme dans le passé, un taux faible de cas confirmés de MI par suite de l'introduction de programmes nationaux de vaccins conjugués de type sérogroupe A.Note de bas de page 32,Note de bas de page 35
Au cours des quelques dernières décennies, des éclosions du sérogroupe B ont été signalées dans le monde, notamment aux États-Unis (Oregon), en Nouvelle-Zélande, en Norvège, au Chili, à Cuba, en France, en Uruguay, en Espagne, au Japon et au Brésil.Note de bas de page 13 Note de bas de page 32Note de bas de page 36-40 Pour répondre à des éclosions précises, plusieurs vaccins contre le méningocoque du sérogroupe B comprenant des vésicules de membrane externe (OMV) ont été produits sur mesure et utilisés dans le cadre de diverses éclosions du sérogroupe B, et ont été efficaces, notamment VA-MENGOC-BC®, utilisé à Cuba pendant les années 1980 et en Uruguay en 2001; MenBvac®, utilisé en Norvège pendant les années 1970 et 1980 et en France de 2006 à 2009; et MeNZBMD, utilisé en Nouvelle-Zélande de 2004 à 2008. En raison de l'épidémiologie de la MI, et de ses niveaux de morbidité et de mortalité, l'Organisation mondiale de la santé a conseillé une surveillance améliorée et appropriée en temps opportun de la MI afin de prévenir les éclosions de cette maladie et les souches émergentes de la Neisseria meningitidis.Note de bas de page 32 Note de bas de page 40
IV. Vaccin
IV.1 Préparations dont l'utilisation est autorisée au Canada
Le polysaccharide capsulaire constituait la base des vaccins antiméningococciques contre les sérogroupes A, C, W-135 et Y approuvés auparavant. Cependant, le polysaccharide capsulaire utilisé contre le sérogroupe B ressemble beaucoup à la molécule d'adhérence cellulaire neuronale (N-CAM) humaine et ne peut être utilisé dans le cadre de la mise au point de vaccins, principalement en raison de la possibilité de créer des auto-anticorps. C'est pourquoi, dans le cadre de la mise au point d'un vaccin contre le méningocoque du sérogroupe B, on s'est concentré sur les OMV et d'autres antigènes de protéines exposés en surface. Des vaccins contre le méningocoque du sérogroupe B comprenant des OMV et contenant un seul antigène ont été utilisés en situation d'éclosion de méningococcie attribuable au sérogroupe B et semblent être sécuritaires et efficaces.Note de bas de page 41-45
Le vaccin multicomposant contre le méningocoque (4CMenB) Bexsero® (Novartis Vaccines) dont l'utilisation est autorisée depuis le 6 décembre 2013 est le premier vaccin développé spécialement contre le méningocoque du sérogroupe B offert au Canada. Le vaccin contient 25 μg d'OMV détoxifiées contenant de la PorA P1.4 provenant du vaccin néo-zélandais MeNZBMD, plus trois antigènes de Neisseria meningitidis du sérogroupe B purifiés reconnus au moyen de la vaccinologie inverse : 50 μg de protéine de liaison au facteur H (fHbp, sous-variante 1.1) fusionnés à l'antigène de Neisseria dérivé du génome 2091 (GNA2091), 50 μg d'antigène de liaison à l'héparine de Neisseria (NHBA peptide 2) fusionnés à l'antigène de Neisseria dérivé du génome 1030 (GNA1030), et 50 μg d'adhésine A de Neisseria unique (NadA, sous-variante 3.1).Note de bas de page 26 Note de bas de page 46 Des antigènes contenus dans le vaccin sont absorbés sur 1,5 mg d'hydroxyde d'aluminium qui correspond à 0,5 mg d'aluminium élémentaire par dose. L'utilisation du vaccin 4CMenB a été autorisée chez les personnes de 2 mois à 17 ans.
Un examen détaillé des composantes du vaccin 4CMenB est accessible dans la Revue de la littérature sur la méningococcie invasive du sérogroupe B : épidémiologie, caractéristiques du vaccin multicomposant contre le méningocoque du sérogroupe B et autres facteurs à prendre en considération.
IV.2 Efficacité potentielle et efficacité réelle
La recherche documentaire effectuée n'a permis de trouver aucune étude publiée portant sur l'efficacité potentielle ou réelle du vaccin 4CMenB. À noter qu'en dehors des régions épidémiques, on ne juge pas les études sur l'efficacité pré-homologation des vaccins contre le méningocoque réalisables en raison de l'importance des défis liés à leur réalisation (c.-à-d. la relative rareté de MI endémique), et du fait que d'autres vaccins méningococciques conjugués ont été homologués en fonction de l'immunogénicité.
On a estimé que le vaccin monovalent OMV NZ a une efficacité de 33 à 84 %, selon la cohorte d'âges, le nombre de doses, les méthodes de modélisation et le temps passé depuis la vaccination (c.-à-d. affaiblissement de l'immunité). Aucune étude ne décrit de manière explicite les effets collectifs de ce vaccin, mais dans le cadre d'une éclosion en baisse, on a observé une réduction des taux de MI liée à son introduction. On ne sait pas si la réduction des cas de MI du sérogroupe B en Nouvelle-Zélande a été attribuable à des tendances séculaires, au programme d'immunisation, aux deux, ou à d'autres facteurs. Note de bas de page 40-42 Note de bas de page 47-49 On n'a pas encore établi si la combinaison de composant du vaccin OMV NZ et d'autres antigènes dans le vaccin 4CMenB assurera la même protection que le vaccin monovalent. D'un autre côté, les résultats des essais de phase II comparant l'immunogénicité du vaccin 4CMenB à celle du vaccin expérimental sans OMV NZ semblent indiquer qu'en plus d'induire la production d'anticorps précis dans l'antigène PorA P1.4, le composant du vaccin OMV NZ peut jouer un rôle d'adjuvant sur l'immunogénicité d'autres composants du vaccin 4CMenB. Note de bas de page 46 Note de bas de page 50 Note de bas de page 51
Immunité collective
Étant donné que le vaccin 4CMenB n'a pas encore été utilisé à l'échelle de la population, on ne sait pas s'il conférera une immunité collective. Les données préliminaires tirées d'une présentation effectuée dans le cadre de la 31e Réunion annuelle de la Société européenne des maladies infectieuses pédiatriques n'indiquent, selon les premières analyses, aucune réduction de portage nasopharyngé à la suite de l'administration à 932 étudiants universitaires de deux doses de vaccin 4CMenB. D'autres vaccins qui éliminent le portage, notamment le vaccin conjugué contre le méningocoque du sérogroupe C, ont conféré une immunité collective. Par exemple, si l'on compare une année (de juillet 1998 à juin 1999) antérieure à l'introduction du vaccin conjugué contre le méningocoque du sérogroupe C au calendrier de vaccination systématique des enfants au Royaume-Uni à une année (de juillet 2001 à juin 2002) postérieure à la mise en place du programme, on observe une baisse de 35 % (IC [intervalle de confiance] de 95 % : 20 %, 49 %) de l'incidence de la MI du sérogroupe C chez les adultes de plus de 25 ans. Dans ce groupe inhabile à se faire vacciner, le taux de MI du sérogroupe C est passé de 0,53/100 000 à 0,34/100 000.Note de bas de page 52 Des études qui n'ont pas été publiées examinant l'effet du vaccin 4CMenB sur le portage nasopharyngé des méningocoques devraient donner des renseignements supplémentaires concernant ses répercussions possibles sur l'immunité collective et conférer des bénéfices à l'échelle de la population.
IV.3. Immunogénicité
Les résultats en matière d'immunogénicité les plus souvent utilisés et approuvés par des organismes de réglementation afin d'établir la possibilité d'immunité à court terme à la MI sont les niveaux d'activité bactéricide du sérum humain complémentaire (ABSh) et les dosages immuno-enzymatiques (ELISA). Dans le cadre d'essais antérieurs sur les vaccins préparés à partir de vésicules de membranes externes (OMV), une corrélation a été établie entre la proportion de personnes vaccinées pour laquelle le titre d'ABSh a été multiplié par 4 et plus après la vaccination ou présentant un titre d'ABSh ≥1:4 et l'efficacité clinique du vaccin.Note de bas de page 53
On a mesuré l'immunogénicité du vaccin 4CMenB dans le cadre de 10 essais comprenant environ 5 800 participants en santé, parmi lesquels 4 000 étaient des enfants âgés de 2 à 24 mois, 84 étaient des enfants âgés de 40 à 43 mois et 1 738 étaient des adolescents ou des adultes âgés de 11 à 55 ans. Des rapports ont été présentés à ce sujet. Ces essais évaluaient la réponse immunitaire post-vaccination de chaque antigène de vaccin indépendamment, à l'aide d'un mélange de titres d'ABSh (rapport ≥1:4 ou ≥1:5) par rapport à des souches de référence sélectionnées H44/76 (fHbp de Novartis, sous-variante 1.1), 5/99 (NadA, sous variante 2.2) et NZ98/254 (PorA P1.7-2,4). Les études réalisées avant l'identification d'une souche de référence qui exprime principalement le peptide d'antigène 10 (M10713) du vaccin NHBA mesuraient la quantité d'anticorps IgG propres à l'antigène. Seulement une publication, Vesikari et al., 2013, compare le pourcentage de participants possédant des titres d'ABSh par rapport à la souche de référence M10713 chez les nourrissons âgés de 12 mois et moins.Note de bas de page 54 Note de bas de page 55 Note de bas de page 74
Chez les nourrissons âgés de 12 mois et moins, on a remarqué que le vaccin 4CMenB était immunogène après au moins deux doses. On a également noté une réponse anamnestique à une dose de rappel, administrée à l'âge de 12 mois. Les calendriers de vaccination des nourrissons visés par l'évaluation comprenaient : trois doses administrées à 2, 3 et 4 mois, trois doses administrées à 2, 4 et 6 mois avec ou sans dose de rappel à 12 mois et trois doses administrées entre 6 et 8 mois, 60 jours plus tard et à 12 mois. Au sein du groupe qui a reçu une dose de rappel à 12 mois, les titres d'ABSh ont diminué avant l'administration de cette dose : entre 34 et 89 % des nourrissons seulement atteignaient le seuil d'anticorps visé selon l'antigène donné.Note de bas de page 46 De plus, 12 mois après l'administration de la dose de rappel, à 24 mois, les titres d'ABSh étaient faibles, en particulier par rapport à la souche NZ98/254.Note de bas de page 56 On a également prouvé la non-infériorité lorsque le vaccin 4CMenB était administré en concomitance avec d'autres vaccins (Infanrix-hexa® et Prevenar®) par rapport à son administration seule; la souche NZ98/254 faisait exception, avec une part supérieure de nourrissons ayant obtenu des titres d'ABSh ≥1:5 lorsque ces vaccins étaient administrés à différentes occasions, ce qui laisse supposer que le composant du vaccin OMV NZ pourrait être touché par le calendrierNote de bas de page 57. Dans le cadre d'un autre essai, une part similaire de nourrissons a atteint le seuil d'ABSh après l'administration d'une dose de rappel avec ou sans administration du vaccin Priorix-TetraMD en concomitance.Note de bas de page 55
Chez les enfants âgés de 12 à 24 mois, on a constaté que le vaccin 4CMenB était immunogène contre les souches H44/76, 5/99 et NZ98/254 après l'administration de deux doses (à 12 et 14 ou à 13 et 15 mois),Note de bas de page 58 mais pas après l'administration d'une dose unique à 12 moisNote de bas de page 46. Les moyennes géométriques des titres (MGT) étaient comprises entre 32 et 627 un mois après l'administration de la deuxième dose de vaccin 4CMenB, plutôt qu'entre 1 et 1,2 au départ. Cependant, les titres d'ABSh diminuaient au bout de 9 ou 10 mois (lorsque la mesure était prise à l'âge de 24 mois) et étaient les plus faibles contre la souche NZ98/254Note de bas de page 56. L'administration d'une troisième dose du vaccin 4CMenB à 24 mois a stimulé les titres d'ABSh de ≥1:5 contre les souches H44/76, 5/99 et NZ98/254 chez tous les participants.
De 70 à 100 % des 84 enfants qui ont reçu deux doses du vaccin 4CMenB à l'âge de 40 et de 42 mois ont atteint une séroprotection un mois après l'administration de la deuxième dose pour chacune des souches de référence, selon la souche de référence. La part de titres d'anticorps protecteurs était la plus faible contre la souche M10713, qui mesure la réaction à l'antigène NHBA.Note de bas de page 59-62
On a constaté que, chez les adolescents et les adultes, le vaccin 4CMenB était immunogène contre les souches H44/76, 5/99 et NZ98/254 après l'administration d'au moins une dose, même si des moyennes géométriques des titres (MGT) plus élevées ont été observées après l'administration de deux doses du vaccin (comparativement à une dose); six mois plus tard, au moins 91 % des adolescents avaient des titres d'ABSh supérieurs ou égaux à 1:4 pour chacune des trois souches de référence après l'administration de deux ou trois doses, contre de 73 à 76 % après l'administration d'une dose.Note de bas de page 63 Quatre mois après l'administration de la deuxième dose, de 96 % et 100 % des adultes avaient des titres d'ABSh supérieurs ou égaux à 1:4 contre les souches H44/76 et 5/99, respectivement, tandis que 67 % des adultes avaient des titres d'ABSh supérieurs ou égaux à 1:4 contre la souche NZ98/254.Note de bas de page 64
Dans l'ensemble, par comparaison aux autres souches de référence sélectionnées, les réponses immunitaires les plus faibles étaient généralement observées contre la souche NZ98/254, qui exprime plusieurs antigènes présents dans le vaccin 4CMenB, notamment les mêmes antigènes PorA P1.4 et NHBA (peptide 2), ainsi que la variante 1 de l'antigène fHbp qui montre une réactivité croisée.Note de bas de page 65 Il a été avancé que la faible réponse du sérum sanguin de sujets vaccinés exposés à cette souche pouvait être en partie attribuable au faible niveau d'expression de ces antigènes par la souche NZ98/254.Note de bas de page 46
Les résultats des essais de phase II comparant l'immunogénicité du vaccin 4CMenB à celle d'un vaccin expérimental recombinant sans OMV contre le méningocoque B (rMenB) semblent indiquer que l'OMV joue un rôle d'adjuvant.Note de bas de page 46 Note de bas de page 50 Des études portant sur l'immunogénicité du vaccin OMV NZ administré à des nourrissons et à des enfants en Nouvelle-Zélande ont mis en évidence les effets bénéfiques de l'administration d'une troisième dose.Note de bas de page 66 Cependant, comme c'est le cas avec le vaccin 4CMenB, on a observé après l'administration de trois doses une diminution assez rapide du nombre d'anticorps bactéricides.Note de bas de page 67 L'administration d'une quatrième dose du vaccin OMV NZ à l'âge de 10 mois (5 mois après l'administration de la troisième dose) a produit une réponse anamnestique, ce qui a entraîné une augmentation du pourcentage de nourrissons, qui est passé d'un seuil d'ABSh de 48 % après la troisième dose à un seuil de 69 % après la quatrième dose.Note de bas de page 67 Selon des études réalisées après l'homologation du vaccin OMV NZ, l'efficacité du vaccin se situerait entre 53,3 % et 84 %.
Jusqu'à présent, la plus longue période sur laquelle ont porté les études mesurant l'immunogénicité du vaccin 4CMenB s'étend jusqu'à l'âge de 40 mois, soit 28 mois après l'achèvement du calendrier dit 3 + 1 concernant les nourrissons.Note de bas de page 56 Chez les tout-petits, l'immunogénicité a été mesurée 12 mois après l'administration de la dernière dose d'une série de deux doses;Note de bas de page 56 chez les adolescents, elle a été mesurée 24 mois après l'administration de la dernière dose selon un calendrier prévoyant l'administration d'une à trois doses;Note de bas de page 63 et chez les adultes un mois après l'administration de la troisième dose.Note de bas de page 64 Les données préliminaires indiquent un affaiblissement de l'immunité à l'antigène PorA. Étant donné que, en dehors de ces brèves périodes d'études, il n'existe aucune donnée concernant les concentrations d'anticorps circulants, la durée de la protection devra être traitée dans des études futures, surtout en raison du fait qu'il semble que des titres élevés d'anticorps antiméningococciques circulants sont nécessaires pour prévenir la maladie après une exposition.Note de bas de page 68
On trouvera un examen détaillé de l'immunogénicité du vaccin 4CMenB dans la Revue de la littérature sur la méningococcie invasive du sérogroupe B : épidémiologie, caractéristiques du vaccin multicomposant contre le méningocoque du sérogroupe B et autres facteurs à prendre en considération.
Meningococcal Antigen Typing System (MATS)
L'essai biologique du système MATS, mis au point par Novartis, repose sur l'utilisation du test ELISA, qui porte précisément sur les antigènes, pour mesurer la réactivité croisée immunologique et la quantité des antigènes NHBA, NadA et fHbp dans un isolat de méningocoque, ce qui permet de prévoir le niveau de protection offert par le vaccin contre une souche spécifique. Outre l'essai biologique réalisé dans le cadre du système MATS, les renseignements sur le génotypage de l'antigène PorA, obtenus à partir des souches de méningocoques soumises à des tests, sont utilisés pour prévoir la réponse immunitaire. Le système MATS permet la prévision in vitro de l'efficacité de la protection qu'offrira le vaccin 4CMenB contre les souches de méningocoques du sérogroupe B circulant actuellement. Au moment de l'examen de la documentation, cette prévision repose sur la corrélation entre le système MATS et l'ABSh, qui n'a été signalée que dans une seule étude publiée.Note de bas de page 69Note de bas de page 70 Dans le cadre de l'utilisation d'un pool de sérum sanguin de sujets âgés de 13 mois auxquels le vaccin 4CMenB avait été administré selon un calendrier dit 3 + 1, 89 % des souches soumises à des tests qui présentaient un niveau de bactéricidie supérieur au seuil positif pour l'un ou plusieurs des antigènes ont été « tuées » par l'ABSh. Par ailleurs, 77 % des souches soumises à des tests qui présentaient un niveau de bactéricidie inférieur au seuil positif n'ont « pas été tuées » par l'ABSh. Cela signifie que 11 % de ces souches ont donné des résultats faussement positifs dans le système MATS (on prévoyait qu'elles seraient tuées, mais cela n'a pas été le cas) et que 23 % des souches ont donné des résultats faussement négatifs (on prévoyait qu'elles ne seraient pas tuées, mais elles l'ont été). Parmi les raisons qui pourraient expliquer l'éventuelle sous-estimation de l'efficacité, citons l'immunogénicité contre les autres antigènes qui sont présents dans l'OMV mais qui ne sont pas pris en compte par le système MATS; le fait que l'essai biologique ne permette pas de tenir compte de l'action synergique des anticorps sur les différents antigènes; et la répression de l'expression de l'antigène NadA in vitro. L'une des raisons qui pourraient expliquer la surestimation de l'efficacité est la sur-expression des antigènes cibles in vitro.
Les chercheurs du programme IMPACT ont utilisé l'essai biologique du système MATS pour rechercher la présence de protéines de surface d'antigènes de vaccins sur des souches canadiennes obtenues dans le cadre du programme IMPACT. Note de bas de page 71 Note de bas de page 72 La sensibilité a été évaluée sur 157 souches de méningocoques du sérogroupe B recueillies dans 12 villes du Canada, dans le cadre de la surveillance, au sein d'une circonscription hospitalière représentative de la population, de plus de 17 millions d'adultes et d'enfants (soit un peu plus de la moitié de la population du Canada), de 2006 à 2009. Dans l'ensemble, la couverture des diverses souches par le vaccin 4CMenB, prévue au moyen du système MATS, était de 66 % (IC à 95 % : 46 %, 78 %), avec 26 % des souches couvertes par un antigène, 29 % couvertes par deux antigènes et 11 % couvertes par trois antigènes du vaccin. La couverture par les antigènes se présentait comme suit : 51 % par l'antigène NHBA (IC à 95 % : 21 %, 71 %), 1 % par l'antigène NadA (IC à 95 % : 0,6 %, 3 %), 52 % par l'antigène fHbp (IC à 95 % : 40 %, 59 %) et 13 % par l'antigène PorA (IC à 95 % : 8 %, 18 %). Selon les prévisions, sur les 6 isolats provenant de cas mortels, 4 (soit 67 %) auraient dû être couverts, tout comme 23 des 34 (soit 68 %) isolats provenant de cas ayant entraîné des séquelles. Les auteurs ont estimé que le vaccin 4CMenB protège contre une souche si cette souche présente l'antigène PorA P1.4 ou a une puissance bactéricide relative supérieure au seuil positif pour les antigènes fHbp, NHBA ou NadA. Sur l'ensemble des isolats provenant d'enfants de moins d'un an, 49 % (IC à 95 % : 29 %, 71 %) étaient couverts par le vaccin, tandis que ce taux de couverture s'élevait à 74 % (IC à 95 % : 61 %, 90 %) pour les isolats provenant d'enfants âgés de 1 à 4 ans, et à 81 % (IC à 95 % : 59 %, 84 %) pour les isolats provenant de sujets âgés de 5 à 19 ans. Sur l'ensemble des isolats provenant d'adultes de 20 ans et plus, 65 % (IC à 95 % : 39 %, 72 %) étaient couverts par le vaccin. Selon les prévisions, la couverture par province offerte par le 4CMenB devrait être comprise entre 43 % et 100 %, et être révélatrice des souches circulant dans chaque région et du niveau d'expression d'antigènes dans chaque isolat. Le vaccin correspondait à une très grande partie (95 %) des 37 isolats de la souche ST-269. Le complexe clonal ST-269 était le plus fréquent au Québec.Note de bas de page 72Note de bas de page 73
IV.4 Effets indésirables
À l'occasion de neuf essais étudiés des rapports sur l'innocuité réalisés sur le vaccin 4CMenB, les résultats ont fait l'objet d'évaluations et de rapports portant sur environ 4 800 nourrissons de moins de 12 mois, 1 600 enfants âgés de 12 à 24 mois, 84 enfants âgés de 40 à 43 mois et 1 738 adolescents ou adultes âgés de 11 à 55 ans. Dans le cadre de ces essais, les réactions locales et générales sollicitées ont été consignées sur une période de sept jours suivant la vaccination, et les effets graves et autres effets indésirables ont été signalés jusqu'à six mois après l'administration de la dernière dose de vaccin 4CMenB. La recherche documentaire n'a permis de trouver aucune étude portant sur l'innocuité et la réactogénicité du vaccin 4CMenB chez les enfants âgés de 4 à 10 ans ou chez les adultes de plus de 55 ans.
Chez les nourrissons et les enfants de moins de 12 mois, les effets indésirables locaux et généraux les plus souvent signalés après une vaccination avec le 4CMenB étaient notamment l'érythème, l'induration, la fièvre et la somnolence ou l'irritabilité. Chez les nourrissons, que le vaccin 4CMenB et les vaccins systématiques pour les nourrissons aient été administrés en même temps ou séparément, des réactions locales au niveau du site d'injection du 4CMenB ont été observées dans des proportions semblables, sauf en ce qui concerne la douleur, qui était plus forte en cas d'administration concomitante.Note de bas de page 57 On a observé une proportion plus élevée de nourrissons présentant des réactions générales sollicitées, notamment de la fièvre, dans les cas où le vaccin 4CMenB avait été administré en concomitance avec les vaccins Infanrix hexa® et Prevenar®. En cas d'administration concomitante, une température supérieure ou égale à 38 °C a été signalée chez un maximum de 61 % des enfants, proportion qui tombe à 38 % dans les cas où le vaccin 4CMenB a été administré seul, et à 33 % lorsque seuls des vaccins systématiques ont été administrés. Les cas de fièvre étaient plus courants après l'administration de la première ou de la deuxième dose du vaccin 4CMenB qu'après la troisième dose, et survenaient généralement dans les six heures suivant l'administration du vaccin, peu de fièvres persistant au-delà de deux jours après la vaccination.Note de bas de page 74Note de bas de page 75Note de bas de page 57 Dans le cadre de la seule étude portant sur des nourrissons auxquels Pediacel®Note de bas de page 46 avait été administré comme vaccin DCaT-VPI-Hib en concomitance avec l'administration du vaccin 4CMenB, la proportion de cas de fièvre était comparativement plus faible (9,2 % après administration de toutes les doses, 18 % après administration de la première dose). Cependant, cette étude ne prenait en compte que 46 sujets vaccinés avec le vaccin 4CMenB, et est trop limitée pour permettre de tirer des conclusions quant à l'impact des différences de préparation des vaccins systématiques pour nourrissons sur l'apparition de la fièvre, après administration simultanée du vaccin 4CMenB.
Chez les enfants de 12 à 24 mois, les réactions locales et générales sollicitées étaient courantes; il s'agissait notamment de sensibilité, d'induration, la fièvre, de somnolence ou d'irritabilité. Les réactions générales étaient la plupart du temps plus fortes chez les enfants auxquels le vaccin 4CMenB avait été administré en concomitance avec le vaccin Priorix-TetraMC. La proportion d'enfants dont la température était supérieure ou égale à 38 °C était plus grande lorsque le vaccin 4CMenB avait été administré en concomitance avec le vaccin Priorix-TetraMC. Cette situation est essentiellement attribuable au fait qu'il existe deux périodes à risque pour la fièvre, à savoir 1 à 4 jours après la vaccination (effets du vaccin 4CMenB) et 5 à 28 jours après la vaccination (effets du vaccin Priorix-TetraMC). Chez les enfants auxquels le vaccin 4CMenB avait déjà été administré à l'âge de deux, quatre et six mois, l'administration d'une dose de rappel du vaccin 4CMenB avait pour effet d'accroître le taux de cas de fièvre signalés en cas d'administration en concomitance avec le vaccin Priorix-TetraMC (48 %), par comparaison au nombre de cas signalés lorsque les vaccins avaient été administrés séparément (40 %).Note de bas de page 55Note de bas de page 58Note de bas de page 74
Le vaccin 4CMenB n'a été administré qu'à 84 enfants âgés de 40 à 42 mois. Parmi ces enfants, 18 % ont eu de la fièvre, et 7 participants ont souffert de graves arthralgies transitoires, 2 d'entre eux ont déclaré l'arthralgie après la première et deuxième vaccination. Les réactions locales signalées dans ce groupe étaient très courantes; il s'agissait notamment de douleurs (jusqu'à 92 %), d'érythème (jusqu'à 98 %), d'induration (jusqu'à 50 %) et d'œdème (jusqu'à 70 %).Note de bas de page 59Note de bas de page 76
Chez les adolescents, les proportions de réactions locales après administration du vaccin 4CMenB étaient plus ou moins semblables après chaque dose, les pourcentages diminuant légèrement après l'administration de la deuxième et de la troisième dose, par rapport aux pourcentages enregistrés après l'administration de la première dose. La proportion de réactions locales sollicitées signalées allait de 39 % (ædème) à 86 % (douleur) chez les sujets vaccinés avec le vaccin 4CMenB, tandis que la proportion de réactions générales signalées allait de 4 % (fièvre supérieure ou égale à 38 °C) à 51 % (malaise) après administration des doses du vaccin 4CMenB (toutes doses confondues).Note de bas de page 63 La fièvre était nettement plus forte après administration du vaccin 4CMenB, par comparaison aux résultats d'un contrôle après administration d'un vaccin contenant du sulfate d'aluminium (4 % contre 2 %, p < 0,01), tout comme l'était la proportion de sujets vaccinés avec le vaccin 4CMenB ayant signalé qu'ils utilisaient des médicaments antipyrétiques (4 % contre 2 %, p < 0,02). Dans le cadre de deux études réalisées sur des adultes, la proportion de réactions locales sollicitées signalées allait de 47 % (érythème) à 98 % (douleur) après administration du vaccin 4CMenB, tandis que la proportion de réactions générales sollicitées signalées allait de 2,6 % (fièvre) à 38,1 % (malaise) [toutes doses confondues]. En tout, 12 % d'adolescents et 9 % d'adultes ont signalé qu'ils avaient dû rester à la maison après avoir été vaccinés avec le vaccin 4CMenB.
Selon les auteurs, aucune augmentation des convulsions fébriles n'a été mentionnée dans les premiers rapports relatifs aux essais du vaccin 4CMenB.Note de bas de page 77-79 Selon l'étude de Vesikari et al (2013), 4 cas de convulsions (tous étaient accompagnés de fièvre, mais 2 ont été signalés comme des cas de convulsions fébriles) se sont produits sur un total de 2 478 nourrissons de moins de 12 mois, dans les 24 heures suivant l'administration du vaccin 4CMenB et des vaccins systématiques.Note de bas de page 80 Chez les enfants de 40 et 42 mois ayant reçu une série primaire de vaccin 4CMenB, un seul cas de convulsions fébriles sur 84 a été rapporté huit heures après avoir reçu la deuxième dose.Note de bas de page 59Note de bas de page 61Note de bas de page 76
En outre, sept cas soupçonnés de maladie de Kawasaki ont été signalés au cours de la deuxième et de la troisième phase des études cliniques (six cas ont été constatés chez des sujets vaccinés, et un chez un sujet témoin). Il s'agit d'un chiffre relativement élevé compte tenu de la très faible incidence de base de cette maladie. Aucune relation de cause à effet n'a été établie avec certitude par les auteurs de l'étude.
Placebo contenant de l'aluminium
Le seul essai contrôlé par placebo portant sur le vaccin 4CMenB, réalisé par Santolaya et al (2012),Note de bas de page 63 a mis en évidence une réactogénicité comparable entre ce vaccin et un vaccin témoin contenant de l'hydroxyde d'aluminium. Plutôt que d'utiliser un placebo inerte, non réactif, les auteurs ont utilisé comme témoin un placebo contenant un adjuvant, l'aluminium, car le vaccin 4CMenB contient également 1,5 mg d'hydroxyde d'aluminium. Lorsque l'on interprète les données d'innocuité de cet essai, il faut prendre en considération la possibilité d'une accentuation du profil d'effets indésirables du placebo réactinogénique et d'une augmentation artificielle conséquente du profil d'immunité du vaccin étudié.
Un examen détaillé des études portant sur l'innocuité du vaccin 4CMenB est disponible dans la Revue de la littérature sur la méningococcie invasive du sérogroupe B : épidémiologie, caractéristiques du vaccin multicomposant contre le méningocoque du sérogroupe B et autres facteurs à prendre en considération.
IV.5 Administration du vaccin et calendrier de vaccination
Le vaccin 4CMenB est fourni en seringues de 0,5 mL, préremplies en paquet de un ou dix avec ou sans aiguilles. Aucune reconstitution ni dilution n'est requise avant l'administration. Le capuchon de pointe de la séringue peut contenir du latex en caoutchouc naturel. Le vaccin doit être agité avant utilisation, afin d'assurer l'homogénéité de la suspension. Le vaccin doit être administré par injection intramusculaire dans le muscle deltoïde ou dans la partie antérolatérale de la cuisse, selon l'âge du sujet.
Le calendrier de vaccination varie selon l'âge du sujet au moment de l'administration. Dans le cas de nourrissons chez qui la primovaccination au moyen du vaccin 4CMenB commence entre deux et cinq mois, le fabricant recommande l'administration de trois doses, à des intervalles d'au moins un mois. Ces trois doses devront être suivies d'une quatrième dose de rappel, administrée aux enfants entre leur 12e et leur 23e mois. Le fabricant conseille de respecter un calendrier avec trois doses pour les nourrissons qui commencent les séries de vaccins lorsqu'ils sont âgés de 6 à 11 mois. Les deux premières doses devraient être administrées à deux mois d'intervalle (plutôt qu'à un mois d'intervalle, solution accélérée privilégiée à l'égard des très jeunes nourrissons), et il est recommandé d'administrer la troisième dose aux sujets lorsqu'ils sont âgés de 12 à 23 mois, au plus tôt 2 mois après l'administration de la deuxième dose.
Lorsque l'enfant est âgé de 12 mois à 10 ans au moment de la primovaccination, le fabricant conseille d'administrer deux doses du vaccin 4CMenB, en respectant un intervalle de 2 mois entre chaque dose.
Pour les personnes de 11 ans à 17 ans, le fabricant recommande l'administration de deux doses, à au moins un mois d'intervalle.
Même si le fabricant ne fournit pas présentement un calendrier pour adultes, dans des essais cliniques comprenant des personnes de 18 à 55 ans, deux doses administrées à un intervalle d'au moins un mois se sont avérées immunogènes et sécuritaires.
On ne connaît pas la durée de la protection qu'offre une primovaccination au moyen du vaccin 4CMenB. Par conséquent, la nécessité de procéder à l'administration d'une dose de rappel, après avoir rempli l'un des calendriers de vaccination recommandés, reste à établir.
IV.6 Conditions d'entreposage
Le vaccin 4CMenB doit être conservé dans son emballage d'origine, qui le protège de la lumière. Il doit être conservé dans un réfrigérateur à une température de + 2 °C à + 8 °C et ne doit pas être congelé.
IV.7 Administration simultanée d'autres vaccins
Le vaccin 4CMenB a été administré en même temps qu'un vaccin hexavalent destiné aux nourrissons et contenant les composants contre le tétanos et la diphtérie, un vaccin conjugué heptavalent contre le pneumocoque (PCV7), un vaccin contre le sérogroupe C du méningocoque et un vaccin contre la rougeole, la rubéole, les oreillons et la varicelle. La seule étude ayant comparé l'administration simultanée du vaccin 4CMenB et d'autres vaccins à une administration séquentielle était un essai multicentrique de phase IIB, réalisé à 60 endroits dans 6 pays européens et portant sur 1 571 nourrissons. Dans le cadre de cette étude, les titres contre certaines des souches d'épreuve utilisées pour étudier le vaccin 4CMenB étaient plus faibles lorsque le vaccin était administré en même temps que les vaccins Prevenar®et Infanrix hexa®, mais les critères de non-infériorité statistique étaient remplis dans tous les cas, sauf en cas de comparaison entre un calendrier de vaccination séquentielle et un calendrier de deux, quatre ou six mois de vaccination concomitante contre la souche NZ98/254, ce qui donne à penser que l'administration concomitante avec le DCaT-VPI-Hib-HB et le PCV7 ne modifie pas sensiblement l'immunogénicité du vaccin 4CMenB.Note de bas de page 57 Toutefois, comme il est indiqué dans la section concernant l'innocuité, les taux de fièvre observés étaient plus élevés lorsque le vaccin 4CMenB et les vaccins systématiques pour nourrissons (DCaT-VPI-Hib-HB et PCV7) avaient été administrés simultanément que lorsque ces vaccins avaient été administrés séparément. Ces données doivent être examinées dans le contexte canadien, car certaines régions utilisent tous ces vaccins dans le cadre de leurs programmes actuels financés par les deniers publics.
En ce qui concerne l'incidence du vaccin 4CMenB sur l'immunogénicité d'autres vaccins, selon les résultats d'un essai réalisé par Gossger et al. (2010)Note de bas de page 57 comparant l'immunogénicité de trois calendriers différents d'administration du vaccin 4CMenB, les critères préétablis de non-infériorité des réactions aux vaccins systématiques étaient remplis pour tous les antigènes des vaccins - sauf pour la pertactine de la coqueluche et le pneumocoque de sérotype 6B - lorsque le vaccin 4CMenB avait été administré à l'âge de deux, trois et quatre mois en même temps que les vaccins Infanrix hexa® et Prevenar®, par comparaison aux cas dans lesquels les vaccins systématiques avaient été administrés seuls. La portée clinique de ces constatations est inconnue.
Selon les résultats de l'essai réalisé par Vesikari et al (2010)Note de bas de page 54Note de bas de page 74 comparant différents lots de vaccin 4CMenB administrés en même temps que les vaccins Infanrix-hexa74 et Prevenar® à l'âge de deux, quatre et six mois, les critères préétablis de non-infériorité des réactions aux vaccins systématiques étaient remplis pour tous les antigènes des vaccins - sauf pour la polio 2 - lorsque le vaccin 4CMenB avait été administré en même temps que les vaccins Infanrix hexa®et Prevenar®, par comparaison aux cas dans lesquels Infanrix-hexa®et Prevenar® avaient été administrés seuls.
Dans le cadre de l'étude de prolongation réalisée par Vesikari et al (2011),Note de bas de page 55Note de bas de page 74 presque tous les participants (97 à 100 %) ont présenté des réponses immunitaires aux quatre composants du vaccin Priorix-TetraMC; que le vaccin Priorix-TetraMC ait été administré seul ou en concomitance avec le vaccin 4CMenB, ces réponses immunitaires ne présentaient pas de différences notables.
Un examen détaillé des données concernant l'utilisation du vaccin 4CMenB en concomitance avec d'autres vaccins est disponible dans la Revue de la littérature sur la méningococcie invasive du sérogroupe B : épidémiologie, caractéristiques du vaccin multicomposant contre le méningocoque du sérogroupe B et autres facteurs à prendre en considération.
IV.8 Contre-indications et précautions
Le vaccin 4CMenB est contre-indiqué chez les personnes souffrant d'une allergie grave à tout composant du vaccin ou ayant présenté une réaction allergique grave à une dose antérieure. Aucune étude du vaccin 4CMenB n'a été réalisée sur des femmes enceintes ou qui allaitent, ou sur des personnes de moins de 2 mois et de plus de 55 ans.
Les études réalisées jusqu'à présent concernant l'immunogénicité et l'innocuité n'ont pas pris en compte les personnes ayant des problèmes de santé chroniques, notamment les personnes présentant un risque accru de MI, par exemple en raison d'un déficit en facteurs du complexe d'attaque des membranes du complément. Par conséquent, on ne sait pas s'il existe des contre-indications ou des précautions à prendre en cas d'utilisation du vaccin 4CMenB au sein de ces groupes.
Certaines études du vaccin 4CMenB ont exclu des personnes ayant déjà contracté une MI du sérogroupe BNote de bas de page 46 Note de bas de page 50 Note de bas de page 57 tandis que d'autres études ont exclu des personnes ayant déjà contracté une MI, quel qu'en soit le sérogroupe. On ne sait donc pas s'il existe des contre-indications ou des précautions à prendre en cas d'utilisation du vaccin 4CMenB chez des personnes ayant déjà contracté une méningococcie.
IV.9 Autres considérations
Répercussions de l'acétaminophène
Prymula et al. (2011)Note de bas de page 81 ont évalué l'effet de l'acétaminophène prophylactique sur l'immunogénicité et l'innocuité des vaccins systématiques (Infanrix-hexa® et Prevenar®) administrés en même temps que le vaccin 4CMenB à l'âge de deux, trois et quatre mois. Aucune différence significative n'a été observée dans l'immunogénicité du vaccin 4CMenB par rapport aux souches de référence H44/76-SL, 5/99 et NZ98/254 lorsque le vaccin a été administré en même temps que des vaccins systématiques avec ou sans acétaminophène prophylactique. Il n'est pas clairement indiqué si l'administration d'acétaminophène par les parents, indépendamment de l'étude, était incluse dans les soins habituels dans le groupe sans acétaminophène, ou si ce groupe avait reçu la consigne de ne pas prendre d'acétaminophène. Il a été déterminé que l'acétaminophène prophylactique réduit les épisodes fébriles après la vaccination. La proportion de nouveau-nés présentant une température ≥ 38,5 °C était inférieure de près de 50 % chez les nouveau-nés ayant reçu de l'acétaminophène par rapport à ceux n'en ayant pas reçu (51 % p/r à 25 %). Même si les températures ≥ 39,5 °C étaient rares dans les deux groupes, une plus faible proportion de nouveau-nés ont eu de la fièvre (≥ 39,5 °C) parmi ceux ayant reçu de l'acétaminophène (1 % p/r à 5 %). En outre, la proportion de nouveau-nés présentant une fièvre (≥ 38,5 °C et ≥ 39,5 °C) a diminué avec chaque dose successive du vaccin 4CMenB. L'administration d'acétaminophène n'a pas eu d'effet sur l'immunogénicité du vaccin 4CMenB.
Il est intéressant de noter que, lorsque les parents du sous-groupe avec étiquetage en clair ont été informés du risque d'épisodes fébriles après la vaccination dans une étude de phase III en cours,Note de bas de page 74 la probabilité de fièvre traitée médicalement chez les nouveau-nés ayant reçu le vaccin 4CMenB en même temps que les vaccins systématiques (Infanrix hexa® et Prevenar®) était moins élevée dans le sous-groupe avec étiquetage en clair que dans le sous-groupe à l'insu de l'observateur où les parents n'étaient pas informés du risque de fièvre (1,42 % p/r à 5,27 %). Bien que 93 % des parents aient déclaré avoir utilisé des analgésiques ou des antipyrétiques après l'une des doses administrées à deux, quatre ou six mois, il n'est pas clairement indiqué s'il leur avait été conseillé ou non d'administrer ces médicaments de façon prophylactique.
Les résultats de Prymula et al. (2011)Note de bas de page 81 laissent à penser que l'administration systématique d'acétaminophène en prophylaxie peut être une stratégie appropriée pour contrer les taux élevés de fièvre chez les nouveau-nés recevant le vaccin 4CMenB. Une telle pratique s'écarterait de la pratique actuelle. Même si le Guide canadien d'immunisation ne contient pas de recommandation au sujet de l'administration prophylactique d'antipyrétiques au moment de l'immunisation, l'administration par les parents de médicaments antipyrétiques, tels que l'acétaminophène ou l'ibuprofène, est généralement recommandée par les prestataires de soins de santé pour le traitement de la fièvre spontanément résolutive qui se manifeste après la vaccination. Il n'y a pas de pratique courante parmi les prestataires de soins de santé concernant l'administration prophylactique d'antipyrétiques pour prévenir la fièvre associée au vaccin; certains peuvent la recommander, et d'autres non. De même, il n'existe pas de données relatives à l'innocuité d'une pratique d'administration systématique d'antipyrétiques avec chaque dose d'un vaccin donné, comme l'étude de Prymula semble le suggérer.
Réactivité croisée avec d'autres sérogroupes de la méningococcie
Les protéines sous-capsulaires présentes dans le vaccin 4CMenB peuvent être exprimées dans tous les sérogroupes de la MI, et il existe des données indiquant que le vaccin 4CMenB pourrait conférer une protection contre d'autres souches à l'origine de la MI.Note de bas de page 82-84 La prévalence et la diversité génétique des antigènes contenus dans le vaccin 4CMenB dans des souches autres que du sérogroupe B devront faire l'objet d'autres études au Canada, pour que l'on puisse déterminer leur sensibilité et leurs répercussions potentielles sur les programmes de vaccination existants.
V. Recommandations
Pour élaborer ces recommandations, le CCNI et le GTPPMB ont pris en considération le fardeau de la MI, l'innocuité et l'immunogénicité du vaccin 4CMenB récemment autorisé, ainsi que d'autres aspects des stratégies globales d'immunisation. Toutefois, en raison du manque de données probantes et du degré d'incertitude des hypothèses sous-jacentes, en particulier celles concernant la couverture vaccinale, l'immunité collective, l'efficacité et les effets indésirables potentiels de la vaccination à l'échelle de la population. Ces recommandations seront mises à jour lorsque de nouvelles données seront disponibles. Les provinces/territoires prendront en compte des facteurs épidémiologiques, économiques et d'autres facteurs relatifs au programme ou opérationnels locaux pour décider d'inclure les recommandations suivantes dans les programmes d'immunisation financés par l'État (des renseignements supplémentaires sont fournis dans la Déclaration d'orientation commune).
Recommandation 1
L'administration du vaccin multicomposant contre le méningocoque du sérogroupe B (4CMenB) peut être envisagée au cas par cas, pour les personnes âgées de deux mois ou plus, afin de les protéger contre la MI causée par des souches pertinentes de Neisseria meningitidis du sérogroupe B. (Recommandation du CCNI de catégorie B)
Pour la personne, il y a des données probantes préliminaires suffisantes montrant que le vaccin 4CMenB est immunogène et peut offrir une protection contre les souches exprimant les antigènes et couvertes par le vaccin, lorsqu'il est administré conformément aux calendriers utilisés pendant les essais cliniques. Le vaccin présente un profil d'innocuité acceptable avec des taux variables d'effets indésirables, décrits plus haut.
Au Canada, le vaccin 4CMenB a été autorisé pour personnes âgées de deux mois à 17 ans. Cependant, les données rapportées suite aux essais cliniques ont démontré que le vaccin 4CMenB est immunogène et sécuritaire quand il est administré aux adultes âgés de 55 ans et plus en deux doses espacées d'intervalle de deux mois. Pour prodiguer des conseils sur l'immunisation par le vaccin 4CMenB, il convient de prendre en considération les préférences individuelles, l'incidence régionale de la MI du sérogroupe B et la sensibilité des souches selon l'essai du système MATS. Dans les circonstances où les bienfaits potentiels de ce vaccin semblent l'emporter sur les risques d'effets indésirables à la suite de l'immunisation, l'administration de ce vaccin 4CMenB devrait être envisagée. Lors de l'administration du vaccin, les sujets vaccinés ou leurs parents ou personnes soignantes devraient être informés des réactions locales et générales à prévoir et recevoir des instructions pour les gérer de façon optimale. Les effets indésirables les plus fréquents sont la douleur et la fièvre.
Recommandation 2
Il existe une quantité insuffisante de données probantes à l'appui de l'utilisation du vaccin multicomposant contre le méningocoque du sérogroupe B (4CMenB) dans les programmes d'immunisation systématique des nouveau-nés, des enfants, des adolescents et des adultes au Canada. (Recommandation du CCNI de catégorie I)
Le sérogroupe B est la souche à l'origine de la MI la plus courante au Canada. Entre 2007 et 2011, il y a eu en moyenne 22 cas de MI causée par le méningocoque du sérogroupe B signalés au Canada chez des enfants de moins d'un an et 21 cas chez des enfants de un à quatre ans. La majorité des cas causés par le méningocoque du sérogroupe B se sont manifestés dans une province chez des enfants de moins de quatre ans.
Il n'existe aucune étude disponible sur l'efficacité de ce vaccin à l'échelle de la population, et la seule évaluation de la sensibilité des souches (c.-à-d. de la caractérisation des souches) au Canada provient d'une seule étude IMPACT qui a utilisé l'essai biologique du système MATS, dont la validité sur le terrain n'a pas encore été évaluée. D'après l'essai biologique du système MATS, 66 % de la proportion globale des souches de méningocoque du sérogroupe B au Canada devraient être sensibles au vaccin 4CMenB. Compte tenu de cette information et du fait que des cas se produisent trop tôt dans la vie pour permettre la prévention par un vaccin, une vaccination des nouveau-nés au Canada qui serait efficace à 100 %, couvrirait 100 % de la population et protégerait les sujets jusqu'à l'âge de quatre ans permettrait en théorie de prévenir jusqu'à 11 cas chez les nouveau-nés de moins d'un an et jusqu'à 16 cas chez les enfants de un à quatre ans par année. La vaccination permettrait d'éviter au total jusqu'à deux décès par année dans ces groupes d'âge.
Les risques liés à l'introduction du vaccin dans l'ensemble de la population canadienne demeurent inconnus. Des préoccupations subsistent quant aux taux élevés de fièvre signalés lors des essais cliniques (en particulier lors de l'administration du vaccin aux nouveau-nés en même temps que d'autres vaccins recommandés) et aux autres effets indésirables observés (convulsions fébriles, arthralgie, maladie de Kawasaki) qui pourraient se traduire par des fréquences élevées d'effets indésirables si ce vaccin était utilisé dans l'ensemble de la population.
À l'échelle de la population, il n'existe pas suffisamment de données probantes à l'appui de l'utilisation du vaccin 4CMenB dans les programmes d'immunisation systématique au Canada compte tenu des renseignements actuellement disponibles sur le fardeau de la maladie, le niveau prévisible de sensibilité des souches et l'innocuité du vaccin, ainsi que de l'incertitude concernant la durée de la protection, du manque de données relatives aux effets du vaccin 4CMenB sur le portage des méningocoques et aux bienfaits potentiels conférés par l'immunité collective. Néanmoins, dans les situations où les bienfaits potentiels du vaccin 4CMenB peuvent l'emporter sur l'incertitude liée à l'utilisation du vaccin 4CMenB au niveau de la population, l'incidence régionale de la MI du sérogroupe B et la sensibilité des souches d'après l'essai biologique du système MATS devraient être prises en consideration au sein du processus décisionnel.
Toutes les considérations décrites sont abordées en détail dans la section IV de la déclaration ainsi que dans le Document d'orientation commune.
Recommandation 3
Le vaccin multicomposant contre le méningocoque du sérogroupe B (4CMenB) devrait être envisagé pour l'immunisation active des sujets âgés de deux mois ou plus présentant un risque élevé de méningococcie afin de prévenir la MI causée par le Neisseria meningitidis du sérogroupe B. (Recommandation du CCNI de catégorie I)
Le CCNI reconnaît les groupes suivants comme présentant un risque de méningococcie supérieur à celui de l'ensemble de la population :
-
Personnes atteintes d'états pathologiques sous-jacents particuliers :
- les employés de laboratoires de recherche, de laboratoires industriels et de laboratoires cliniques exposés de façon régulière à Neisseria meningitidis;
- le personnel militaire pendant les formations de recrutement (les membres du personnel militaire peuvent présenter un risque accru d'infection lorsqu'ils doivent vivre dans des espaces restreints).
- les personnes qui présentent un déficit acquis en complément (p. ex. personnes recevant de l'éculizumab).
Le CCNI avait déclaré précédemment que les vaccins contre le méningocoque devraient être envisagés pour les personnes atteintes du VIH.Note de bas de page 85
-
Personnes présentant un risque continu d'exposition :
- les employés de laboratoires de recherche, de laboratoires industriels et de laboratoires cliniques exposés de façon régulière à Neisseria meningitidis;
- le personnel militaire pendant les formations de recrutement (les membres du personnel militaire peuvent présenter un risque accru d'infection lorsqu'ils doivent vivre dans des espaces restreints).
- pour ce qui est des voyageurs, voir la recommandation 8 ci-dessous.
Cette recommandation est conforme aux recommandations du CCNI pour les autres vaccins contre le méningocoque et se fonde sur l'opinion d'experts. Le CCNI n'a pas été en mesure de formuler une recommandation plus ferme du fait de l'insuffisance des données probantes relatives à l'innocuité et à l'immunogénicité du vaccin 4CMenB chez les personnes présentant un risque accru de MI. Le vaccin 4CMenB n'a été étudié que chez un petit nombre d'employés de laboratoires, mais dans aucun des autres groupes à haut risque mentionnés ci-dessus.
Recommandation 4
Le vaccin multicomposant contre le méningocoque du sérogroupe B (4CMenB) devrait être envisagé, en plus de la chimioprophylaxie, pour la protection des sujets âgés de deux mois ou plus en contact étroit avec un cas de MI attribuée à Neisseria meningitidis du sérogroupe B. (Recommandation du CCNI de catégorie I)
Les personnes en contact étroit avec des sujets infectés par le méningocoque courent un risque accru de contracter la MI et devraient recevoir une vaccination (immunoprophylaxie) en plus de la chimioprophylaxie. Ce risque est plus élevé pour les contacts familiaux et peut persister jusqu'à un an après la maladie du cas index. La vaccination des personnes en contact étroit avec un cas de MI du sérogroupe B devrait être effectuée indépendamment du résultat de l'essai biologique du système MATS ou d'autres essais sur la sensibilité des souches au vaccin afin d'assurer la prise en charge des contacts sans délai. L'immunoprophylaxie devrait être envisagée pour les personnes suivantes :
- les contacts familiaux d'un cas de MI;
- les personnes qui partagent la même chambre que le cas;
- les personnes dont le nez et la bouche sont directement contaminés par les sécrétions nasales ou buccales d'un sujet atteint (p. ex. baiser sur la bouche, partage de cigarettes ou de bouteilles);
- les enfants et le personnel de garderies ou de maternelles en contact avec un cas de MI.
Cette recommandation est conforme aux recommandations du CCNI pour les autres vaccins contre le méningocoque et se fonde sur l'opinion d'experts. Le CCNI n'a pas été en mesure de formuler une recommandation plus ferme en raison de l'insuffisance des données probantes relatives à l'efficacité du vaccin 4CMenB.
Recommandation 5
L'immunisation par le vaccin multicomposant contre le méningocoque du sérogroupe B (4CMenB) est recommandée pour les sujets âgés de deux mois ou plus pendant les éclosions de MI attribuée à Neisseria meningitidis du sérogroupe B ou en cas d'émergence de souches de Neisseria meningitidis hyperendémiques ou hypervirulentes qui devraient être sensibles au vaccin selon l'essai du système MATS. (Recommandation du CCNI de catégorie I)
Il a été démontré que l'utilisation précédemment répandue de vaccins contenant des OMV des sérogroupes B et C contre les souches hyperendémiques ou hypervirulentes émergentes exprimant des antigènes homologues à ceux présents dans un vaccin était une stratégie de santé publique efficace pour gérer les éclosions de MI attribuable à des souches clonales. Cette recommandation est conforme à l'approche de gestion de la santé publique adoptée pour les méningocoques des autres sérogroupes, au Canada et à l'échelle internationale, et se fonde sur l'opinion d'experts.
Il est nécessaire de consulter les responsables de la santé publique ou des experts dans le domaine des maladies transmissibles pour gérer de façon optimale les éclosions de méningococcie.
Recommandation 6
Il est possible d'envisager l'administration systématique d'acétaminophène à des fins prophylactiques et/ou l'administration du vaccin 4CMenB en dehors du calendrier de vaccination systématique pour prévenir la fièvre chez les nouveau-nés et les enfants de moins de trois ans. (Recommandation du CCNI de catégorie I)
Étant donné que la fièvre représente un effet indésirable important au vu des taux élevés observés dans les essais cliniques, différentes stratégies pour réduire ce risque devraient être envisagées lors des discussions avec les sujets vaccinés et les personnes qui les soignent. Des taux élevés de fièvre ont été signalés pendant les quatre premiers jours (jusqu'à 63 % des enfants de moins de 12 mois et 48 % des enfants de 12 à 24 mois) lorsque le vaccin a été administré en même temps que les vaccins systématiques pour les nouveau-nés. Les données préliminaires sur l'innocuité ont démontré que l'administration d'acétaminophène immédiatement avant et après la vaccination pouvait réduire les taux de fièvre jusqu'à 50 % après la première dose sans modifier l'immunogénicité du vaccin; toutefois, bien que nous puissions présumer qu'une fièvre plus légère puisse diminuer les cas fébriles de convulsions, il n'a pas été prouvé que l'administration prophylactique d'acétaminophène prévienne ces convulsions chez les enfants. L'administration prophylactique d'acétaminophène n'est pas recommandée pour les autres vaccins. L'effet de l'ibuprofène sur la fièvre et sur l'immunogénicité du vaccin 4CMenB n'a pas été évalué.
Recommandation 7
Il est recommandé de mettre en place un programme de surveillance complet et d'évaluation pour contrôler et évaluer les effets de l'immunisation par le vaccin 4CMenB, aussi bien pour l'administration systématique que pour les éclosions ou pour les groupes ou milieux présentant un risque d'infection élevé. (Recommandation du CCNI de catégorie A)
Le vaccin 4CMenB est nouveau, et il subsiste une incertitude quant aux bienfaits conséquents et aux risques potentiels d'une immunisation de l'ensemble de la population. Bien que les études de précommercialisation n'aient pas démontré à ce jour de risque accru de nombreux effets indésirables importants cliniquement graves, ces études portaient sur des échantillons de taille relativement petite et sur une courte durée de suivi (la durée maximale de suivi à ce jour est de 39 mois après l'administration initiale du vaccin 4CMenB à l'âge de deux mois). De même, il n'existe à l'heure actuelle aucune donnée sur l'utilité et l'efficacité du vaccin 4CMenB, en particulier sur son potentiel de protection contre les souches canadiennes du méningocoque. Par conséquent, il sera très important de mener des études de postcommercialisation sur l'efficacité et l'innocuité du vaccin 4CMenB après son introduction au Canada (c.-à-d. surveiller la hausse des taux de maladie de Kawasaki et de convulsions fébriles).
Il est nécessaire de poursuivre la surveillance, la recherche et l'évaluation au sujet de la validation de l'essai biologique du système MATS, du système complet de surveillance microbiologique et épidémiologique accrue, ainsi que d'autres questions associées au programme, notamment les effets potentiels de l'administration systématique d'acétaminophène à des fins prophylactiques, les répercussions de la vaccination par le 4CMenB sur la couverture des autres programmes d'immunisation systématique des nouveau-nés, la durée de la protection après la vaccination, les effets sur l'immunité collective et le portage, l'effet sur les sérogroupes autres que B et les répercussions du vaccin sur le contrôle des éclosions et des groupes de population qui n'ont pas été étudiés lors d'essais cliniques (voir la section VI ci-dessous).
Recommendation 8
Les voyageurs n'ont pas besoin de recevoir le vaccin 4CMenB, sauf s'ils voyagent dans une région présentant une souche hyperendémique ou une éclosion connue pour être causée par le sérogroupe B de Neisseria meningitidis qui peut être évitée par le vaccin. (Recommandation du CCNI de catégorie I)
Les données relatives à la durée de la protection, à la concordance de la souche du vaccin avec les souches en circulation dans différentes régions géographiques et à l'administration du vaccin 4CMenB chez les voyageurs faisant un séjour de courte ou longue durée sont actuellement inadéquates ou manquantes. Les voyageurs qui font un séjour prolongé ou ceux qui auront des contacts étroits avec la population locale dans leur milieu de vie, les transports en commun ou leur milieu de travail seront probablement exposés au même risque de MI que la population locale. Si la population locale est à risque élevé en raison d'une souche hyperendémique ou durant une éclosion connue pour être causée par le sérogroupe B de Neisseria meningitidis qui peut être évitée par le vaccin, le voyageur devrait alors être vacciné. Étant donné que les réactions indésirables graves au vaccin sont rares et que la maladie peut rapidement se conclure par un décès, il serait peut-être prudent de procéder à la vaccination lorsque le voyageur n'est pas sûr de la nature exacte de son exposition à la population locale.
VI. Priorités en matière de recherche et de surveillance
Il reste plusieurs priorités en matière de recherche et de surveillance, décrites ci-dessous, pour toutes les questions présentées dans cette déclaration. Il convient de noter que la surveillance et la recherche sont étroitement liées et qu'une recommandation suggérée dans un domaine pourrait également être traitée par des travaux menés dans l'autre. Les lacunes en matière de données probantes ont été regroupées selon les questions que le CCNI doit aborder afin de prendre une décision sur le vaccin, à savoir : la capacité potentielle du vaccin 4CMenB à protéger contre les souches canadiennes du méningocoque B et les autres sérogroupes de méningocoques, l'innocuité du vaccin, l'efficacité réelle du vaccin, la durée de la protection, l'immunité collective, les populations spéciales et les besoins de surveillance. Au vu du nombre d'incertitudes sur le vaccin 4CMenB, il sera impératif d'effectuer une surveillance et une recherche de haute qualité après la commercialisation pour évaluer les répercussions du vaccin et orienter les futures prises de décisions. Un protocole financé intégré englobant la surveillance, l'évaluation du programme et la recherche doit être une condition préalable à l'utilisation de ce vaccin dans l'ensemble de la population dans une province ou un territoire. La rareté des cas de MI signifie également qu'une approche interprovinciale coordonnée sera nécessaire pour une telle évaluation.
Encadré 1
| Domaine | Préoccupation particulière | Recommandation |
|---|---|---|
| Surveillance | Épidémiologie du méningocoque | Surveillance accrue du méningocoque avant et après la mise en œuvre du vaccin. Effets du vaccin sur les souches du sérogroupe B et des autres sérogroupes chez les vaccinés (effets directs) et les personnes non vaccinés (effets indirects/collectifs). |
| Caractéristiques microbiologiques | Les laboratoires et particulièrement les laboratoires de référence doivent être capables d'examiner les caractéristiques microbiologiques des méningocoques ainsi que de déterminer les types de NHBA, de NadA et de fHbp de tous les isolats en utilisant des méthodes d'essai standard (c.-à-d. ABSh) et nouvelle (c.-à-d. MATS). | |
| Effets secondaires suivant l'immunisation | Surveillance accrue des effets secondaires suivant l'immunisation dans le cadre d'un programme similaire au « Intensive Vaccines Monitoring Program »; sur le vaccin OMV NZ. Ainsi, s'assurer que les données de base sur les effets indésirables à prévoir (p. ex. convulsions fébriles, MK) sont recueillies. | |
| Administration du vaccin | Registres universels d'immunisation dans toutes les provinces du Canada. | |
| Efficacité directe du vaccine | Statut de vaccination de tous les cas. Surveillance accrue des échecs vaccinaux, notamment des caractéristiques microbiologiques de la MI du sérogroupe B chez les personnes vaccinées et non vaccinées. Études séro-épidémiologiques. Calcul de l'efficacité du vaccin au moyen de méthodes telles que les études cas-témoins ou la « méthode de dépistage » siun registre d'immunisation ou une autre source de données de couverture de bonne qualité est présent. Mesure de l'expression des antigènes contenus dans le vaccin 4CMenB par les souches canadiennes du méningocoque au moyen du système MATS (c.-à-d. estimation de l'efficacité potentielle du vaccin au Canada). |
|
| Effets indirects/collectifs potentiels | Répercussions de l'immunisation sur l'incidence de la maladie dans les cohortes non vaccinées. | |
| Recherche | Effets indirects/collectifs potentiels | Études du portage nasopharyngien des méningocoques avant et après la mise en œuvre du vaccin. |
| Durée de la protection | Études séro-épidémiologiques sur les personnes immunisées pour déceler un affaiblissement de l'immunité. | |
| Biologie moléculaire du méningocoque | Recherches microbiologiques décrivant les changements dans le sérogroupe, les complexes clonaux, les caractéristiques des protéines de surface avant et après la mise en œuvre du vaccin | |
| Acceptabilité du vaccin pour le grand public | Recherches étudiant la tolérance au risque et l'acceptabilité du profil d'effets indésirables du vaccin 4CMenB. Répercussions sur la couverture d'autres antigènes recommandés. |
| Niveau | Description |
|---|---|
| I | Données probantes provenant d'un ou de plusieurs essais cliniques comparatifs randomisés. |
| II-1 | Données probantes provenant d'essais contrôlés sans randomisation. |
| II-2 | Données probantes provenant d'études de cohortes ou d'études analytiques cas-témoins, réalisées de préférence dans plus d'un centre ou groupe de recherche avec des mesures des résultats cliniques de l'efficacité des vaccins. |
| II-3 | Données probantes obtenues à partir de plusieurs séries chronologiques avec ou sans intervention. Les résultats spectaculaires d'expériences non comparatives (comme les résultats de l'introduction des traitements à la pénicilline dans les années 1940) peuvent également être considérés à titre de données probantes. |
| III | Opinions d'autorités respectées fondées sur des expériences cliniques, études descriptives et rapports de cas ou rapports de comités d'experts. |
| Cote de qualité | Description |
|---|---|
| Bonne | Une étude (comprenant les méta-analyses ou les examens systématiques) qui répond bien à tous les critères relatifs à la conceptionNote de bas de page *. |
| Passable | Une étude (comprenant les méta-analyses ou les examens systématiques) qui ne répond pas (ou ne répond pas clairement) à au moins un des critères relatifs à la conceptionNote de bas de page *, mais ne comporte aucune « lacune fatale ». |
| Médiocre | Une étude (comprenant les méta-analyses ou les examens systématiques) qui comporte au moins une « lacune fatale » relative à la conceptionNote de bas de page * ou une accumulation de lacunes moins importantes faisant en sorte que les résultats de l'étude sont jugés inadéquats en vue de l'élaboration des recommandations. |
|
|
| Catégorie | Recommandation |
|---|---|
| A | Le CCNI a conclu qu'il existait des données probantes suffisantes pour recommander l'immunisation. |
| B | Le CCNI a conclu qu'il existait des données probantes acceptables pour recommander l'immunisation. |
| C | Le CCNI a conclu qu'il existait des données probantes contradictoires qui ne permettent pas de faire une recommandation pour ou contre l'immunisation; cependant, d'autres facteurs peuvent influer sur la prise de décision. |
| D | Le CCNI a conclu qu'il existait des données probantes acceptables pour déconseiller l'immunisation. |
| E | Le CCNI a conclu qu'il existait des données probantes suffisantes pour déconseiller l'immunisation. |
| F | Le CCNI a conclu qu'il existait des données probantes Le CCNI a conclu qu'il existait des données probantes insuffisantes (en quantité ou en qualité) pour formuler une recommandation; cependant, d'autres facteurs peuvent influer sur la prise de décisions. (en quantité ou en qualité) pour formuler une recommandation; cependant, d'autres facteurs peuvent influer sur la prise de décisions. |
Liste des abréviations
- 4CMenB
- Vaccin multicomposant contre le méningocoque du sérogroupe B
- ABSh
- Activité bactéricide du sérum humain
- Agence
- Agence de la santé publique du Canada
- CCI
- Comité canadien sur l'immunisation
- CCNI
- Comité consultatif national de l'immunisation
- CIMRI
- Centre de l'immunisation et des maladies respiratoires infectieuses
- CMG
- Concentration moyenne géométrique
- DCaTP-Hib
- Vaccin antidiphtérique, antitétanique, anticoquelucheux acellulaire, anti-Haemophilus influenzae de type b et antipoliomyélitique inactivé
- ECR
- Essai comparatif randomisé
- EIG
- Effet indésirable grave
- ELISA
- Essai immunoenzymatique
- ET
- Écart-type
- fHbp
- Protéine de liaison au facteur H
- GNA
- Antigène de Neisseria dérivé du génome
- GTPPMB
- Groupe de travail sur un projet pilote lié au vaccin contre le méningocoque de sérogroupe B
- IC
- Intervalle de confiance
- IgG
- Immunoglobuline G
- IM
- Intramusculaire
- IMPACT
- Programme canadien de surveillance active de l'immunisation
- LI
- Limite inférieure
- MATS
- Meningococcal Antigen Typing System (système de typage antigénique des méningocoques)
- MenACWY-CRM
- Vaccin conjugué contre les méningocoques des sérogroupes A, C, W-135 et Y
- MGT
- Moyenne géométrique des titres
- MI
- Méningococcie invasive
- MK
- Maladie de Kawasaki
- MLST
- Typage génomique multilocus
- NadA
- Adhésine A de Neisseria
- N-CAM
- Molécule d'adhérence cellulaire neuronale
- NHBA
- Antigène de liaison à l'héparine de Neisseria
- N. Meningitidis
- Neisseria Meningitidis
- NZ
- Nouvelle-Zélande
- OMP
- Protéines de membrane externe des méningocoques
- OMV
- Vésicule de membrane externe
- PorA
- Porine A
- rMenB
- Vaccin recombinant contre le méningocoque B
- ROR
- Vaccin antirougeoleux, antiourlien et antirubéoleux
- RORV
- Vaccin antirougeoleux, antiourlien, antirubéoleux et antivaricelleux
- TS
- Type de séquence
- VCMC-Hib
- Vaccin conjugué contre le méningocoque du sérogroupe C et l'Haemophilus influenzae de type b
Remerciements
Anciens membres du CCNI : Dre N. Crowcroft, Dre S. McNeil
Agents de liaison : Dre J. Blake (Société des obstétriciens et gynécologues du Canada), Dre S. Deeks (Association canadienne de santé publique), Dre A. Mawle (Centers for Disease Control and Prevention, États-Unis), Dre D. Moore (Société canadienne de pédiatrie), Dre A. Pham-Huy (Association canadienne pour la recherche et l'évaluation en immunisation).
Anciens représentants de liaison : Dre A. Corriveau (Conseil des médecins-hygiénistes en chef), Dre H. Morrison (Conseil des médecins hygénistes en chef), Dre A. Opavsky (Association pour la microbiologie médicale et l'infectiologie), Dre S. Rechner (Collège des médecins de famille du Canada).
Représentants d'office : Dre (LCol) P. Eagan (Groupe des Services de santé des Forces canadiennes, Défense nationale et les Forces armées canadiennes), Dre A. Klein (Direction des produits biologiques et des thérapies génétiques, Santé Canada), Dre B. Law (Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada), Dre B. Raymond (Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada/Comité canadien d'immunisation), Dre E. Taylor (Direction des produits de santé commercialisés, Santé Canada), Mme M. St-Laurent (Centre de l'immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada).
Anciens représentants d'office : Dre M. Carew (Direction générale de la santé des Premières Nations et des Inuits, Santé Canada), Dre C. Légaré (Bureau des produits biologiques, biotechnologiques et de santé naturels commercialises, Santé Canada).
† La présente déclaration a été rédigée par : Dre A. Wormsbecker, Dre N. Crowcroft, Mme L. Strifler, Dr O. Baclic, Dre S. Desai, Mme J. Lourenco, et approuvée par le CCNI.
Le CCNI tient à remercier le Groupe de travail sur le projet pilote lié au vaccin contre le méningocoque B : Dre N. Crowcroft (co-présidente), Dre P. De Wals (co-président), Mme H. Deehan, Dre S. Deeks, Dre S. Desai, Dre S. Halperin, Dre C. Kennedy, Dre M. Landry, Dre M. Naus, Dre R. Tsang, Dre W. Vaudry.
Le CCNI tient aussi à remercier pour leur contribution : Mme V. Dang, Dre J. Laroche, Dre B. Sander.