Normes de codes à barres pour les produits de vaccination au Canada (mise à jour de 2014-2015)
Table des matières
- Avantages du codage par code à barres
- Élaboration des normes
- Normes mondiales
- Harmonisation des normes de codes à barres des vaccins
- Normes de codes à barres pour les niveaux d'emballage
- Système d'identification des vaccins (SIV)
- État de mise en œuvre de la norme de code à barres
- Annexe A : Sommaire de l'emballage
- Annexe B : Attributs dans le SIV
Les normes de codes à barres pour les produits de vaccination au Canada ont été établies pour fournir des précisions et faire preuve d'uniformité pour ce qui est de la mise en œuvre des normes de codes à barres pour les produits de vaccination au Canada. Les produits de vaccination au Canada se servent du code d'article international (code GTIN) qui repose sur les normes mondiales GS1.
Avantages du codage par code à barres
L'utilisation des codes à barres pour les produits de vaccination au Canada présente de nombreux avantages. L'identification normalisée des produits de vaccination selon les normes mondiales GS1, à tous les niveaux d'emballage des produits de vaccination, permet au personnel responsable de l'immunisation ou de bureau de tenir des dossiers de santé électroniques complets de façon efficace. Elle permet de réduire le nombre d'erreurs d'immunisation grâce à une exhaustivité et une exactitude des dossiers améliorées et elle accélère le suivi des effets secondaires suivant l'immunisation. Parmi les autres avantages, il faut citer l'amélioration de la gestion des stocks, des analyses et des prévisions tout au long de la chaîne d'approvisionnement en vaccins. De même, l'amélioration de la tenue des dossiers permet d'obtenir des taux de couverture vaccinale précis.
Élaboration des normes
Au Canada, les normes de codes à barres pour les produits de vaccination ont été déterminées et approuvées par le Groupe de travail consultatif sur l'identification automatisée des projets de vaccins (Groupe de travail consultatif sur l'IAPV). Ce groupe, formé en 2007, est le fruit de la collaboration de tous les groupes d'intervenants dans le domaine de l'immunisation. Il est codirigé par l'Agence de la santé publique du Canada (l'Agence) et par les représentants de l'industrie des vaccins, notamment les fabricants, les provinces et les territoires, les autorités en matière de santé, les associations des professionnels de la santé, les organismes de réglementation, les agences d'établissement de normes à l'échelle internationale et les développeurs de logiciels de dossiers de santé électroniques (DSE) et de prise en charge clinique.
Le Groupe de travail consultatif sur l'IAPV relève du Réseau canadien des registres d'immunisation (RCRI) dans le cadre de l'infrastructure du Réseau pancanadien de santé publique. Le Réseau canadien des registres d'immunisation est un groupe de travail composé d'experts en immunisation des 13 provinces et territoires du Canada. Ceux-ci participent à l'élaboration des registres d'immunisation ainsi qu'à la surveillance de l'administration des vaccins dans leur province ou leur territoire respectif.
Normes mondiales
Les codes à barres des produits de vaccination se servent du système de normes GS1. Les normes GS1 sont ouvertes, mondiales et non exclusives; les organismes du monde entier peuvent s'abonner à ce système. Les codes à barres GS1 sont les seuls codes à barres non exclusifs basés sur un système ouvert de normes élaborées par l'industrie, ce qui permet aux organismes de toutes les tailles d'y participer.
Le code d'article international (code GTIN) est la norme GS1 pour l'identification des produits. Ce code d'identification de produit unique est reconnu à l'échelle mondiale. Pour les produits pharmaceutiques, dont les vaccins, le code GTIN est attribué de façon permanente par le fabricant du produit. Le code GTIN des produits de vaccination permet l'identification uniforme et fiable, de la fabrication jusqu'à l'immunisation dans un milieu de soins de santé. L'utilisation du code GTIN pour les produits de vaccination permet également de mettre à jour les dossiers de santé électroniques de façon efficace et précise, en plus de supprimer la nécessité d'un second étiquetage des vaccins à l'aide des codes d'identification exclusifs.
En plus du code GTIN, des renseignements secondaires ou variables peuvent également composer le système de normes GS1 (code d'identification de la demande). Voici un exemple de codes d'identification : GTIN (01), date de péremption (17), numéro de lot (10) et numéro de série (21). La figure 1 illustre des exemples de codes d'identification de la demande dans les codes à barres.

Remarque : Ces images sont agrandies à des fins d'illustration. En réalité, les codes à barres apposés sur les produits sont de plus petite taille.
Les renseignements sur les normes mondiales GS1 figurent sur le site GS1 Canada.
Harmonisation des normes de codes à barres des vaccins
Le Canada et les États-Unis ont harmonisé les normes de code à barres des produits de vaccination en se servant des normes mondiales GS1. Aux États-Unis cependant, on exige l'encodage de la date de péremption sur le code à barres de l'emballage primaire. Au Canada, l'usage de la date de péremption est facultatif, ces renseignements pouvant être référencés sur le numéro de lot.
Les responsables de l'initiative du code à barres des vaccins ont aussi travaillé en étroite collaboration avec les responsables du Projet canadien de codage à barres des produits pharmaceutiques. Par conséquent, les normes et les exigences pour les deux projets ont été mises en conformité.
Normes de codes à barres pour les niveaux d'emballage
Les codes à barres peuvent être attribués à n'importe quel niveau d'emballage par le fabricant du produit. La figure 2 illustre une hiérarchie d'emballage typique. Dans cet exemple, le code à barres sur l'emballage primaire ( et parfois sur l'emballage secondaire ) est saisi dans le dossier de soins de santé au moment de l'immunisation. Il peut également être utilisé aux fins de traçabilité du patient. Les codes à barres au niveau de l'emballage secondaire, de la boîte et de la palette, servent à la gestion de l'inventaire, au suivi et à la traçabilité. Des renseignements supplémentaires sur les niveaux d'emballage figurent à l'annexe A.
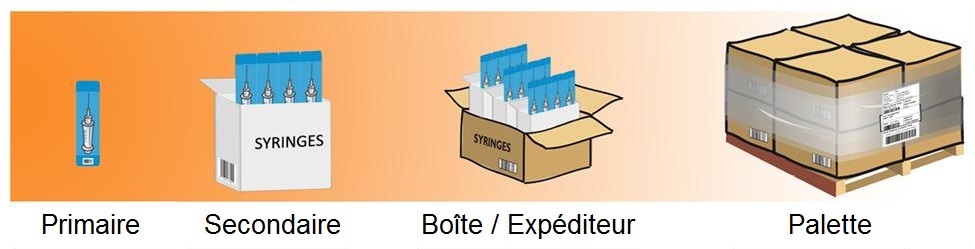
Figure 2 - Équivalent textuel
Les codes à barres peuvent être attribués à n’importe quel niveau d’emballage par le fabricant du produit. La figure 2 qui montre une hiérarchie d’emballage typique comprend quatre images distinctes. La première image, qui porte la mention «primaire», est une image d’une seringue qui contient une dose unique du vaccin dans un emballage stérile. La deuxième image, qui porte la mention « secondaire », est une image d’une petite boîte renfermant quatre seringues qui contiennent une dose unique du vaccin (emballage primaire). La troisième image, qui porte la mention « boîte/expéditeur », est une image d’une plus grande boîte de carton renfermant trois boîtes plus petites (emballage secondaire de seringues). La quatrième image, qui porte la mention « palette », est une image d’une palette en bois renfermant quatre grandes boîtes de carton (caisse) collées ensemble avec du ruban adhésif d’expédition de plastique transparent. Sur chaque image, il y a un exemple de code à barres visible, illustrant le code à barres pour chaque niveau d’emballage.
Norme de l'emballage primaire
La norme de l'emballage primaire (fiole unidose, fiole multidose, seringues préremplies ou vaporisateurs de produits d'immunisation) est décrite ci-dessous.
Norme
Un code à barres à deux dimensions (2D) figure sur l'emballage primaire. Ce code à barres comprend le code GTIN et le numéro de lot. L'utilisation de la date de péremption est recommandée, mais facultative dans le code à barres de l'emballage primaire, puisqu'elle peut être déterminée à l'aide du numéro de lot.
Conformément aux exigences canadiennes, le numéro de lot et la date de péremption seront toujours présentés en format lisible pour l'utilisateur.
Description
L'avantage principal des codes à barres 2D consiste à fournir un nombre important de renseignements sur une très petite surface (par exemple sur une fiole ou sur une seringue préremplie). En outre, ces codes à barres 2D sont plus faciles à lire sur les surfaces incurvées et sont plus résistants. Par exemple, même si on les manipule souvent, ces codes à barres conservent une grande efficacité au balayage.
Pour obtenir un exemple du code GS1 DataMatrix (code à barres 2D), consultez la figure 3.

Remarque : Cette image est agrandie à des fins d'illustration. En réalité, le code à barres apposé sur le produit est de plus petite taille.
Norme de l'emballage secondaire
La norme de l'emballage secondaire (boîte ou carton contenant les fioles ou les seringues préremplies de produits d'immunisation) est décrite ci-dessous.
Norme
Un code à barres à deux dimensions (2D) ou linéaire (aussi appelé unidimensionnel) figure sur l'emballage secondaire. Ce code à barres comprend le code GTIN, le numéro de lot et la date de péremption.
Conformément aux exigences canadiennes, le numéro de lot et la date de péremption seront toujours présentés sur l'emballage secondaire en format lisible pour l'utilisateur.
Description
Les codes à barres GS1 DataBar (désignés avant sous l'appellation de Reduced Space Symbology ou RSS) sont une famille de symboles de code à barres linéaires ou unidimensionnels compacts. Les codes à barres GS1 DataBar sont utilisés dans le cas des vaccins, puisqu'ils sont beaucoup plus petits que les codes à barres linéaires du code universel des produits (CUP) ou du International Article Number (EAN). Ils peuvent contenir des renseignements supplémentaires comme les numéros de série, les numéros de lot et les dates de péremption.
Pour obtenir un exemple du code GS1 DataMatrix (code à barres 2D), consultez la figure 3 ci-dessus. Pour obtenir un exemple du code linéaire GS1 DataBar (code à barres unidimensionnel), consultez la figure 4 ci-dessous.

Remarque : Cette image est agrandie à des fins d'illustration. En réalité, le code à barres apposé sur le produit est de plus petite taille.
Norme de l'emballage au niveau de la boîte
La norme de l'emballage au niveau de la boîte (c.-à-d. la boîte ou le contenant qui contient au moins un emballage secondaire) est décrite ci-dessous.
Norme
Un code à barres linéaire (unidimensionnel) est apposé sur la boîte. Ce code à barres comprend le code GTIN, le numéro de lot et la date de péremption.
Le numéro de série peut également figurer dans le code à barres, à la discrétion du fabricant. Les numéros de série sont mis en œuvre dans de nombreux pays pour respecter les exigences de lutte contre la contrefaçon.
Description
Le code à barres linéaire GS1-128 (unidimensionnel) sert à identifier les vaccins au niveau de la boîte. Le symbole GS1-128 peut contenir un code GTIN à 14 chiffres et des renseignements supplémentaires comme les numéros de série, les numéros de lot et les dates de péremption.
Pour obtenir un exemple du GS1-128 (code à barres 1D), consultez la figure 5.

Remarque : Cette image est agrandie à des fins d'illustration. En réalité, le code à barres apposé sur le produit est de plus petite taille.
Système d'identification des vaccins (SIV)
L'Agence a mis au point le Système d'identification des vaccins (SIV), un répertoire de renseignements sur le Web pour tous les produits de vaccination homologués aux fins d'utilisation chez les humains au Canada à l'heure actuelle. Le SIV appuie l'utilisation des codes à barres sur les produits de vaccination dans les milieux de soins de santé. Les fabricants de vaccins fournissent des données à l'Agence à l'aide du Registre ECCnet de GS1 Canada, afin de fournir les codes GTIN et les données normalisées sur les produits. L'Agence exige des renseignements précis sur les produits pour le SIV; ceux-ci sont répertoriés à l'annexe B. L'Agence réunit ensuite ces renseignements avec le numéro de lot du vaccin, la date de péremption et les renseignements sur les rappels dans le SIV, pour aider les professionnels des soins de santé de première ligne. Lorsque le code à barres de la fiole contenant le vaccin est balayé, un lien est établi avec les renseignements précis téléchargés à partir du SIV. Ces renseignements peuvent ensuite être enregistrés dans le dossier d'immunisation électronique ou le registre des stocks, supprimant ainsi la nécessité d'une saisie manuelle ou d'une consignation sur support papier. L'objet du SIV consiste à contenir des renseignements sur tous les produits de vaccination homologués et utilisés à l'heure actuelle au Canada. Il ne contient pas de données historiques ou de renseignements sur les vaccins offerts à l'échelle internationale.
Les renseignements du SIV sur un produit de vaccination sont compatibles avec ceux de la base de données sur les produits pharmaceutiques (BDPP) de Santé Canada.
Registre ECCnet
Le Registre ECCnet de GS1 Canada est le registre national des produits du Canada. Ce registre de renseignements sur le produit de l'industrie est le registre qui offre les renseignements les plus soigneusement épurés et les plus exhaustifs sur les normes au Canada. Le Registre ECCnet est un guichet unique qui regroupe les membres de l'industrie pour leur permettre d'échanger des données exactes sur les produits selon les normes GS1 comme les instruments médicaux, les produits pharmaceutiques et les renseignements sur les produits alimentaires utilisés tous les jours. En centralisant et en normalisant les données essentielles sur les produits dont se servent les organisations de soins de santé, le Registre ECCnet augmente l'exactitude et la visibilité des données pour les produits utilisés par les professionnels de la santé pour les processus opérationnels et les soins aux patients.
État de mise en œuvre de la norme de code à barres
Les normes de codes à barres pour les produits de vaccination au Canada sont adoptées volontairement par les fabricants de vaccins. La mise en place de ces normes sous-entend la participation des fabricants de vaccins à la gestion des lignes de production, ainsi que la participation des utilisateurs finaux (les milieux de soins de santé). Ils doivent assurer l'état de préparation complet des dispositifs de balayage dotés de caméras et des logiciels pour la réception des renseignements sur les codes à barres et sur la vaccination à partir du SIV. Bien que d'importants progrès aient été réalisés par les fabricants et certains milieux de soins, on prévoit d'ici 2017 une augmentation de l'offre et de l'utilisation des codes à barres sur les produits de vaccination, telle qu'elle est consignée dans le présent document. Il s'agit de l'échéance fixée par l'ensemble des intervenants pour la mise en œuvre, et ce, pour la plupart des vaccins.
En 2009, le Groupe de travail consultatif sur l'IAPV a atteint un consensus sur les normes visant les codes à barres des vaccins au Canada. Le Groupe a recommandé le placement d'un code GTIN, ainsi qu'un numéro de lot et une date de péremption facultative sur l'emballage primaire. Pour que ces renseignements soient apposés sur l'emballage primaire (la fiole ou la seringue), il faut modifier l'étiquetage des vaccins au niveau des chaînes de production et apposer un code à barres à deux dimensions (2D) sur le produit. Les fabricants canadiens se sont engagés à respecter ces normes d'ici 2017 pour la plupart de leurs produits.
À compter de l'aube de l'année 2011, les premières chaînes de production d'étiquetage des vaccins au Canada et aux États-Unis étaient à même d'imprimer des codes à barres 2D sur les étiquettes des fioles de vaccins. Plusieurs fabricants avaient adopté ces normes à la fin de 2014 et d'ici 2017, la plupart des principaux fabricants se seront conformés aux nouvelles normes, et ce, pour la plupart de leurs produits. L'Europe adoptera en dernier les codes à barres 2D pour les produits qui y sont fabriqués, puisque les normes européennes n'ont pas encore été harmonisées avec celles du Canada et des États-Unis.
Depuis 2010, pour appuyer la mise en place et l'utilisation des codes à barres au Canada, le Groupe de travail consultatif sur l'IAPV a apporté un financement et un soutien technique aux premiers fabricants qui ont adopté la technologie du code à barres. On a apporté un soutien continu – et on continue à le faire – à divers domaines de prestation des soins de santé dans le secteur privé, la santé publique et les milieux pharmaceutiques. Dans ces milieux, les codes à barres sont parvenus à réduire le nombre d'erreurs et à améliorer l'exactitude des données sur les vaccins saisis aux points de service. Malgré le succès de cette technologie au moment de sa mise en place, il existe encore des obstacles importants à son adoption sur une vaste échelle.
Seulement la moitié des registres d'immunisation sont actuellement en mesure de faire le lien avec Internet et aucun des systèmes à l'échelle des provinces et des territoires n'utilise la technologie de balayage des codes à barres. Quoi qu'il en soit, bon nombre de petites agglomérations – telles que les collectivités des Premières Nations dans le centre et dans l'Ouest canadien, ainsi que de nombreux médecins – balaient les codes à barres des vaccins au moment de les administrer. Certaines cliniques de santé publique pour la vaccination de masse et certains milieux pharmaceutiques dans l'Ouest canadien, en particulier, se servent de la technologie de balayage des codes à barres. Un quart des établissements ayant des stocks de vaccins, de même que bon nombre d'hôpitaux et de cliniques, utilisent le balayage des codes à barres pour tenir à jour leurs inventaires de vaccins. Les dispositifs de balayage sont couramment utilisés pour les produits pharmaceutiques, les fournitures médicales et l'identification des patients.
Les systèmes de surveillance de l'immunisation peuvent être reliés au SIV par l'entremise d'une liaison automatique directe; cependant, l'enthousiasme envers cette fonction est minime. Malgré cela, les utilisateurs peuvent encore accéder au SIV et télécharger un tableau Excel et du même coup utiliser ce dernier pour mettre à jour leurs systèmes. En outre, bon nombre de cliniques spécialisées dans les secteurs privé et public, ainsi que des systèmes de gestion des stocks, se servent des données du SIV pour mettre régulièrement à jour leurs catalogues.
Le Réseau canadien des registres d'immunisation a été établi dans le but de coordonner l'élaboration des normes et de faciliter la communication des connaissances et des expériences en vue d'élaborer un réseau national de registres d'immunisation. Le Groupe de travail consultatif sur l'IAPV relève toujours du Réseau canadien des registres d'immunisation et continue de travailler en étroite collaboration avec lui.
Le Groupe continue ses activités auprès des fabricants et des milieux de soins de santé dans les provinces et les territoires pour appuyer la mise en place des normes de code à barres pour les vaccins et leur adoption au Canada.
Pour obtenir plus de détails sur les normes de codes à barres pour les produits de vaccination au Canada, veuillez communiquer avec nous à l'adresse AIVP-IAPV@phac-aspc.gc.ca. Pour l'accès au SIV, veuillez consulter le site Web du SIV.
Annexe A : Sommaire de l'emballage
| Niveau d'emballage | Symbole | Renseignements dans le code à barres Date de mise en œuvre cible | Date de mise en œuvre cible | État |
|---|---|---|---|---|
| Primaire | 2D (i.e. GS1 DataMatrix) | Code GTIN, lot no Date de péremption recommandée, mais facultative Le numéro de lot et la date de péremption doivent apparaître en format lisible pour l'utilisateur, conformément aux exigences du Canada en matière d'étiquetage. |
31 décembre 2016 | À compter du 1er janvier 2017, des codes à barres 2D seront apposés sur l'emballage primaire de 80 % des produits de vaccination. |
| Secondaire | 2D ou linéaire (p. ex. GS1 DataMatrix, GS1 DataBar ou GS1-128) | Code GTIN, lot no, date de péremption Le numéro de lot et la date de péremption doivent apparaître en format lisible pour l'utilisateur, conformément aux exigences du Canada en matière d'étiquetage. |
31 décembre 2017 | À compter du 1er janvier 2018, des codes à barres 2D ou linéaires seront apposés sur l'emballage secondaire de 80 % des produits de vaccination. |
| Niveau de la boîte | Linéaire (p. ex. GS1-128) | Code GTIN, lot no, date de péremption | 31 décembre 2017 | À compter du 1er janvier 2018, le code à barres GS1-128 sera apposé sur l'emballage de 80 % des produits de vaccination au niveau de la boîte. |
Annexe B : Attributs dans le SIV
| Attributs directement à partir du Registre ECCnet | Saisie manuelle par l'Agence | |
|---|---|---|
| Nom de l'ingrédient actif | Plage de régulation thermique | Numéro de lot |
| Concentration de l'ingrédient actif | Taille | Date de péremption |
| Concentration de l'ingrédient actif | Taille de l'unité de mesure | Rappel de produit |
| Concentration de l'ingrédient actif par dose habituelle | Pharmacologie détaillée | Retenue du produit |
| Concentration de l'ingrédient actif par unité de mesure pour une dose habituelle | Précautions | Calendriers d'immunisation provinciaux et territoriaux |
| Code d'article international (code GTIN) | Code de classification ECCnet | |
| Numéro d'identification du médicament (DIN) | Code d'identification du type de médicament | |
| Nom commercial | Date d'interruption | |
| American Hospital Formulary System Code (AHFSC) | Date de reprise | |
| Code du système de classification anatomique, thérapeutique et chimique (système ATC) | Code de la Classification internationale des produits | |
| Forme posologique | Marchandises dangereuses et manipulation pendant le transport | |
| Longue description | Concentration du médicament et unité de mesure conformément à l'étiquette | |
| Nom générique | Fabricant/Fournisseur | |
| Condition d'entreposage prévue sur l'étiquette | Type | |
| Voie d'administration | Nombre total des unités | |
| Brève description | ||