Diagnostic en laboratoire de la maladie de Lyme


Téléchargez cet article en format PDF (988 Ko - 10 pages)
Publié par : L'Agence de la santé publique du Canada
Numéro : Volume 40-11 : Expression clinique de la maladie
Date de publication : 29 mai 2014
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 40-11, le 29 mai 2014 : Expression clinique de la maladie
Exposé de synthèse
Diagnostic en laboratoire de la maladie de Lyme
Lindsay LR1*, Bernat K1 et Dibernardo A1
Affiliation
1 Laboratoire national de microbiologie, Agence de la santé publique du Canada, Winnipeg (Manitoba)
Correspondance
DOI
https://doi.org/10.14745/ccdr.v40i11a02f
Résumé
Contexte : La maladie de Lyme est en expansion au Canada. C'est une maladie à déclaration obligatoire. Au stade disséminé de l'infection, les épreuves sérologiques apportent des preuves complémentaires à l'appui de la confirmation des cas.
Objectif : Décrire les tests actuellement utilisés pour le diagnostic de la maladie de Lyme, passer en revue la démarche d'analyse recommandée pour les laboratoires et cerner les priorités futures de la recherche dans le domaine du diagnostic en laboratoire de la maladie de Lyme au Canada.
Méthodes : Une recherche documentaire a été effectuée. Nous avons ensuite résumé les paramètres à prendre en compte avant d'effectuer les tests de dépistage de la maladie de Lyme, décrit la meilleure pratique actuelle qui consiste à utiliser un algorithme de diagnostic en deux temps pour la confirmation en laboratoire de la maladie au stade disséminé, et analysé les avantages et les inconvénients des tests complémentaires concernant la maladie.
Résultats : Le recours à des tests diagnostiques est indiqué chez les patients présentant des symptômes du stade disséminé de la maladie et des antécédents d'exposition aux tiques vecteurs. Afin de maximiser la sensibilité et la spécificité des épreuves, le recours à un protocole d'essai en deux temps est recommandé. Il consiste à effectuer un premier test de dépistage par dosage immunoenzymatique (EIA) suivi d'un test de confirmation par transfert Western. Un certain nombre d'autres tests diagnostiques sont disponibles; toutefois, ils sont surtout destinés à des fins de recherche.
Conclusion : L'analyse sérologique en deux temps est actuellement la meilleure démarche disponible pour faciliter la tâche des médecins lors de la pose d'un diagnostic de maladie de Lyme au stade disséminé. L'Agence de la santé publique du Canada (l'Agence) s'efforcera d'améliorer cette démarche par la normalisation des tests diagnostiques de la maladie de Lyme sur l'ensemble des laboratoires du pays, par l'évaluation des caractéristiques de performance des tests des plateformes de diagnostic actuelles et futures et par l'établissement d'un processus destiné à établir des panels sériques fiables afin d'aider à la mise au point et à l'évaluation de nouveaux tests diagnostiques pour la maladie de Lyme.
Introduction
La maladie de Lyme est une infection transmise par des tiques et causée principalement par trois espèces de spirochètes du genre Borrelia burgdorferi sensu lato : B. burgdorferi sensu stricto (en Amérique du Nord et en Europe de l'Ouest), B. afzelii (en Europe de l'Ouest, en Europe centrale et en Russie) et B. garinii (principalement en Europe, en Russie et dans le nord de l'Asie) Note de bas de page 1. Les symptômes de la maladie de Lyme se manifestent en plusieurs stades et concernent divers tissus et organes, notamment la peau, les articulations, le cœur et le système nerveux Note de bas de page 2. L'incidence de la maladie de Lyme a augmenté de façon constante dans certaines parties du centre et de l'est du Canada Note de bas de page 3 Note de bas de page 4 Note de bas de page 5en raison de l'expansion récente du territoire de la principale tique vecteur, Ixodes scapularis Note de bas de page 6.
La maladie de Lyme est une maladie à déclaration obligatoire au Canada depuis 2009 Note de bas de page 7. L'objectif de cet article est de décrire les tests diagnostiques en vigueur pour la maladie de Lyme, notamment de passer en revue les démarches recommandées pour l'analyse en laboratoire, ainsi que de cerner les priorités futures de la recherche sur le diagnostic de cette maladie au Canada.
Méthodes
Une recension approfondie des publications à comité de lecture a été effectuée. Nous avons ensuite résumé les paramètres essentiels à prendre en compte avant d'effectuer les tests de dépistage de la maladie de Lyme, décrit la meilleure pratique actuelle qui consiste à utiliser un algorithme sérologique en deux temps pour la confirmation en laboratoire de la maladie au stade disséminé et exploré les avantages et les inconvénients des tests complémentaires concernant la maladie. Nous avons également donné un aperçu des futurs projets de recherche que le Laboratoire national de microbiologie de l'Agence prévoit d'entreprendre.
Résultats
Facteurs à considérer avant d'effectuer les tests
Au stade localisé précoce de la maladie de Lyme, il n'est pas nécessaire d'effectuer des tests diagnostiques avant d'instituer une antibiothérapie. Un diagnostic de présomption peut être posé en fonction du tableau clinique et d'antécédents crédibles d'exposition à des tiques à pattes noires infectées Note de bas de page 8. En général, la réalisation de tests diagnostiques est appropriée chez les patients ayant des antécédents d'exposition à des tiques et présentant les symptômes d'une infection disséminée, puisque la sensibilité des tests augmente lorsque la bactérie touche des systèmes tissulaires autres que la peau Note de bas de page 8 Note de bas de page 9. Les tests doivent toutefois être réservés aux patients présentant des signes d'infection objectifs Note de bas de page 10 Note de bas de page 11.
Avant d'effectuer les tests, il est nécessaire d'obtenir les renseignements ci-dessous :
- Antécédents de voyage détaillés et date d'apparition des symptômes – Ces renseignements doivent être indiqués sur la demande d'analyse de laboratoire, puisqu'ils permettent au laboratoire de diagnostic d'utiliser la plateforme de test la plus appropriée. Par exemple, il existe des types de tests différents pour détecter la maladie de Lyme acquise en Europe ou en Asie et celle acquise en Amérique du Nord Note de bas de page 12. De même, des tests différents sont utilisés pour les infections précoces et les infections susceptibles d'être plus anciennes Note de bas de page 13.
- Antécédents d'antibiothérapie – Ils peuvent freiner la réponse immunitaire à l'infection et compliquer l'interprétation des résultats des tests sérologiques Note de bas de page 14.
- Autres infections ou affections préexistantes – L'infection par d'autres agents pathogènes connexes (p. ex. syphilis) et l'existence de troubles auto-immuns peuvent entraîner l'obtention de résultats faussement positifs Note de bas de page 15.
- Antécédents de cas confirmés en laboratoire de la maladie de Lyme – Ceci est important, car aucun schéma de réponse sérologique ne permet de distinguer une réinfection d'une infection initiale par B. burgdorferi Note de bas de page 16.
Dépistage de la maladie de Lyme
Bien qu'il existe plusieurs stratégies de dépistage pouvant faciliter la pose du diagnostic de maladie de Lyme (tableau 1), la sérologie est actuellement la seule technique d'analyse de laboratoire normalisée disponible. Les paragraphes qui suivent décrivent les différentes plateformes de tests utilisées pour le diagnostic en laboratoire de la maladie de Lyme. Les avantages et les limites de chaque plateforme sont présentés au tableau 2.
| Stade d'infection | Stratégie de dépistage recommandéeTableau 1 Note de bas de page * | Type d'échantillon |
|---|---|---|
Érythème migrant, phase aiguë (saison des tiques et exposition connue en région d'endémieTableau 1 Note de bas de page **) |
Diagnostic clinique et traitement empirique |
Aucun |
Érythème migrant, phase aiguë (hors saison ou aucune exposition connue en région d'endémie) |
Sérologie en deux temps Tableau 1 - Note de bas de page Tableau 1 Note de bas de page † - répéter le dosage EIA après quatre semaines en cas de résultat négatif; traitement à la discrétion du médecin; TAAN, isolement |
Sérique |
Atteintes neurologiques, cardiaques ou articulaires caractéristiques |
Sérologie en deux temps |
Sérique |
Symptômes persistants après l'administration du traitement recommandé |
Aucune |
Aucune |
|
||
Analyse sérologique
Le Réseau des laboratoires de santé publique du Canada recommande l'utilisation d'une démarche en deux temps pour le diagnostic de la maladie de Lyme, soit une épreuve immunoenzymatique d'une sensibilité élevée (EIA) suivie, en présence d'un résultat positif ou indéterminé, d'un test par transfert Western d'une spécificité élevée Note de bas de page 9. La raison du choix de cette démarche est que l'exécution en série de ces deux types de tests maximise la sensibilité et la spécificité d'ensemble de la sérologie.
La réponse immunitaire à l'infection par B. burgdorferi se traduit en premier lieu par l'apparition d'anticorps IgM, généralement dans les deux semaines suivant la morsure d'une tique Note de bas de page 17. Ces anticorps peuvent persister pendant des mois, voire des années, même après un traitement antimicrobien efficace Note de bas de page 18. Après l'apparition des IgM, des anticorps IgG sont exprimés chez la plupart des patients, habituellement un mois après la contraction de l'infection Note de bas de page 9.
La sérologie fournit un aperçu du statut immunitaire du patient tel qu'il est au moment du prélèvement de l'échantillon. Par exemple, si la présence d'une maladie de Lyme est soupçonnée au vu des symptômes, mais que les tests sérologiques initiaux sont négatifs, la réalisation de tests de suivi sur un échantillon convalescent est recommandée Note de bas de page 9. Les deux tests sérologiques les plus couramment effectués sont décrits ci-dessous.
Épreuve immunoenzymatique (EIA)
L'épreuve immunoenzymatique est utilisée à titre de test de dépistage pour détecter la présence dans le sérum d'anticorps IgM et IgG dirigés contre la bactérie responsable de la maladie de Lyme. Les trousses commerciales, notamment le test ELISA, reposent sur l'utilisation de préparations de cellules entières de B. burgdorferi Note de bas de page 1 ou d'antigènes recombinants Note de bas de page 19 (p. ex. peptide C6). La méthode d'essai autorise le dosage simultané d'un nombre relativement important d'échantillons. Bien que la plupart des tests immunoenzymatiques soient extrêmement sensibles, ils peuvent manquer de spécificité (p. ex. obtention de résultats faussement positifs due à la présence d'autres affections médicales).
Test par transfert Western
Le test par transfert Western est utilisé comme test de confirmation. Sa spécificité est supérieure à celle de l'épreuve immunoenzymatique Note de bas de page 11 Note de bas de page 20. Il détecte la présence dans le sérum d'anticorps dirigés contre des extraits antigéniques séparés par électrophorèse et des antigènes recombinants de B. burgdorferi Note de bas de page 21. Les trousses commerciales sont utilisées pour détecter la présence d'anticorps dirigés contre les génoespèces individuelles de Borrelia Note de bas de page 12 et pour différencier les anticorps IgM des anticorps IgG. Un résultat positif au test par transfert Western est nécessaire pour confirmer l'exposition à B. burgdorferi Note de bas de page 22, la séroconversion avec présence d'IgM puis d'IgG permet de confirmer l'existence d'une infection récente Note de bas de page 9.
| Test | Avantages | Limites |
|---|---|---|
Épreuve immunoenzymatique |
|
|
Transfert Western |
|
|
| TESTS DE LABORATOIRE COMPLÉMENTAIRES | ||
Isolement bactérien |
|
La collecte d'échantillons peut être invasive. Test d'une sensibilité relativement faible, coûteux, exigeant en main-d'œuvre; une longue période d'incubation est nécessaire pour obtenir des résultats. |
Test d'amplification des acides nucléiques (TAAN) |
|
|
Algorithme en deux temps pour le diagnostic en laboratoire de la maladie de Lyme
La démarche en deux temps est illustrée à la figure 1. Dans un premier temps, on effectue une épreuve immunoenzymatique. Si les résultats sont négatifs, il n'y a pas lieu d'effectuer de test par transfert Western. Si les symptômes persistent, le test immunoenzymatique peut être répété sur un échantillon convalescent prélevé 3 à 6 semaines plus tard. Si les résultats de ce test sont positifs ou indéterminés, on passe au deuxième temps pour effectuer le test de confirmation par transfert Western. Au stade précoce de l'infection (symptômes présents depuis moins de six semaines), on effectue le test par transfert Western pour détecter à la fois les IgM et les IgG; si les symptômes sont présents depuis plus de six semaines, toutefois, seule la recherche des IgG par transfert Western est effectuée.
Figure 1. Analyse sérologique en deux temps pour le dépistage de la maladie de Lyme
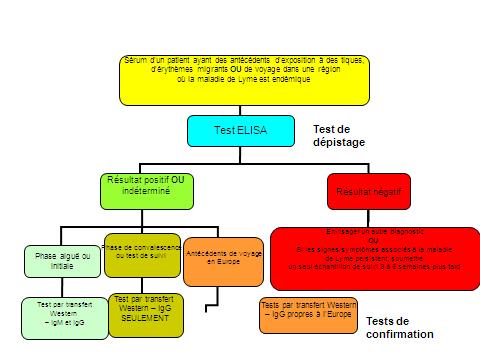
Équivalent textuel - Figure 1
Il s'agit d'un algorithme qui illustre la stratégie d'analyse sérologique en deux temps recommandée pour la maladie de Lyme. Dans la partie supérieure se trouve une case comportant le texte suivant : « Sérum d'un patient ayant des antécédents d'exposition à des tiques, d'érythèmes migrants ou de voyage dans une région où la maladie de Lyme est endémique ». Il est ensuite indiqué dans la case suivante qu'un test ELISA (essai d'immuno-absorption enzymatique - un type d'essai immuno-enzymatique) serait effectué. Il y a alors deux voies possibles; si le résultat est négatif, la prochaine case comporte le texte suivant : « Envisager un autre diagnostic OU Si les signes/symptômes associés à la maladie de Lyme persistent, soumettre un échantillon de suivi 3 à 6 semaines plus tard ». Si le résultat est positif ou indéterminé, il y a trois possibilités, chacune assortie d'une recommandation différente quant à un test de confirmation. Si le patient en est à la phase aiguë ou initiale de la maladie, il faut réaliser un test de détection des anticorps IgM et un test par transfert Western pour la détection des anticorps IgG (transfert Western - IgG). Si le patient en est à la phase de convalescence, ou s'il s'agit d'un test de suivi, seul un test par transfert Western - IgG doit être réalisé. Si le patient a des antécédents de voyage en Europe, il faut réaliser des tests par transfert Western - IgG propres à l'Europe. À l'extérieur de la case « Test ELISA » se trouve une mention indiquant qu'il s'agit d'un test de dépistage. À l'extérieur des cases présentant les options liées aux tests par transfert Western se trouve une mention indiquant qu'il s'agit de tests de confirmation.
Le résultat final des tests sérologiques est considéré comme étant positif seulement lorsque le résultat de l'épreuve immunoenzymatique (EIA) est réactif (positif ou indéterminé) et que le test par transfert Western est également positif (tableau 3). La démarche en deux temps maximise la sensibilité et la spécificité des tests et augmente la probabilité de constater la séroconversion (IgM puis IgG) caractéristique des authentiques infections à B. burgdorferi Note de bas de page 1 Note de bas de page 17 Note de bas de page 21 Note de bas de page 23.
| Résultat du test par transfert Western | Interprétation |
|---|---|
Test négatif pour IgM et IgG |
Ne correspond pas à une infection à B. burgdorferi; cependant, si les symptômes persistent, soumettre un échantillon de suivi 3 à 6 semaines plus tard. |
Positif uniquement pour IgM Tableau 3 Note de bas de page * |
Résultat potentiellement faussement positif s'il NE S'AGIT PAS d'un cas aigu (apparition des symptômes datant de moins de 6 semaines). |
Test positif uniquement pour IgG Tableau 3 Note de bas de page ** |
Résultat conforme à une infection à B. burgdorferi contractée plus de 4 semaines avant le test. |
Test positif pour IgM et IgG |
Indique une infection à B. burgdorferi récente ou des antécédents d'infection. |
|
|
Autres tests de laboratoire de détection de B. burgdorferi
Isolement bactérien
L'isolement de B. burgdorferi viable dans des échantillons cliniques nécessite l'incubation de l'échantillon dans un milieu de culture spécialisé. Bien que ce test demeure la référence pour le diagnostic de la maladie de Lyme Note de bas de page 7, la méthode est coûteuse, dénuée de sensibilité clinique et comporte des risques de contamination Note de bas de page 24. Sur le plan pratique, elle est surtout limitée par la durée d'incubation des cultures qui peut atteindre jusqu'à huit semaines en raison du petit nombre d'organismes viables présent dans de nombreux types de l'échantillon Note de bas de page 17. Pour ces raisons, ses possibilités d'application clinique sont limitées et son emploi réservé aux études de recherche Note de bas de page 9.
Test d'amplification des acides nucléiques (TAAN)
Le test d'amplification des acides nucléiques (TAAN) est utilisé pour accélérer l'obtention des résultats des tests diagnostiques de la maladie de Lyme Note de bas de page 25 Note de bas de page 26. Plusieurs techniques de réaction en chaîne de la polymérase (PCR) (c.-à-d. PCR imbriquée, en temps réel ou quantitative) sont utilisées pour amplifier diverses cibles génétiques spécifiques à Borrelia dans les échantillons cliniques Note de bas de page 27. Les résultats positifs sont plus souvent observés au stade précoce de la maladie Note de bas de page 28. La sensibilité de la réaction en chaîne de la polymérase sur le liquide céphalorachidien (LCR) est faible ou variable et, par conséquent, d'une utilité limitée dans le cadre de l'évaluation des patients atteints de signes neurologiques Note de bas de page 1 Note de bas de page 21. Bien que ce test permette une détection plus précoce de l'infection que les tests sérologiques Note de bas de page 25 Note de bas de page 27, à l'heure actuelle, son utilisation est limitée aux études de recherche Note de bas de page 8 Note de bas de page 9.
Défis associés aux tests diagnostiques de la maladie de Lyme
Les médecins et les chercheurs de laboratoire jugent préoccupante la variabilité qui existe entre les résultats obtenus par certains laboratoires privés et ceux obtenus par les laboratoires de santé publique du Canada. Il semblerait qu'un certain nombre de laboratoires privés utilisent des tests ou des critères d'interprétation qui n'ont pas été suffisamment validés. L'utilisation de tests insuffisamment validés dont l'exactitude n'a pas été adéquatement établie peut entraîner la production de résultats faussement positifs.
Parmi ces tests, citons le dosage par immunocapture des antigènes dans l'urine, la coloration par immunofluorescence, le tri cellulaire des formes kystiques et à paroi cellulaire déficiente de B. burgdorferi, les tests de transformation des lymphocytes Note de bas de page 29 et une nouvelle méthode de culture de sérum Note de bas de page 30.
À l'heure actuelle, le non-respect de l'algorithme en deux temps (p. ex. transfert Western effectué seul ou après un test EIA négatif) peut augmenter la fréquence d'obtention de résultats faussement positifs. Ce qui peut en retour entraîner des erreurs de diagnostic et l'administration inutile de traitements Note de bas de page 1. Il est impératif que les cliniciens soient conscients des idées fausses qui courent sur la maladie de Lyme Note de bas de page 31 et connaissent les meilleures pratiques de laboratoire destinées à son diagnostic Note de bas de page 1; cela leur permettrait de répondre de façon éclairée aux questions et préoccupations soulevées par leurs patients.
Évolution future
Comme il a été mentionné, il y existe une grande diversité de tests diagnostiques pour aider à diagnostiquer la maladie de Lyme Note de bas de page 21 Note de bas de page 32, l'exactitude et la fiabilité de certains de ces tests faisant l'objet d'une forte controverse Note de bas de page 32 Note de bas de page 33 Note de bas de page 34. À l'heure actuelle, aucun test diagnostique n'offre 100 % de sensibilité et de spécificité pour la confirmation de la maladie de Lyme. La grande variabilité de l'expression clinique de l'infection à B. burgdorferi chez les patients complique davantage encore la situation. L'amélioration des plateformes de tests diagnostiques est une priorité. La recherche de « biomarqueurs » de la maladie de Lyme indépendants de la réponse sérologique est en cours Note de bas de page 35. Des variantes de la démarche en deux temps, visant généralement à limiter ou éliminer le recours au test par transfert Western, sont en cours d'évaluation Note de bas de page 36 Note de bas de page 37 Note de bas de page 38 Note de bas de page 39. Elles pourraient simplifier l'interprétation des tests et améliorer leur sensibilité au stade précoce de la maladie.
L'un des plus grands défis auxquels l'évaluation de nouvelles démarches diagnostiques est confrontée Note de bas de page 40 au Canada est le manque de panels sériques ou de pools d'échantillons parfaitement caractérisés provenant de cas confirmés d'infection à B. burgdorferi. Il est également impératif de bien connaître les génotypes de B. burgdorferi responsables des infections contractées par les Canadiens Note de bas de page 41 et de déterminer la capacité des tests diagnostiques actuellement utilisés à les détecter tous avec une sensibilité comparable.
Le Laboratoire national de microbiologie de l'Agence envisage de travailler de concert avec les laboratoires de diagnostic à l'échelle du Canada afin d'examiner les pratiques de diagnostic de la maladie de Lyme et les systèmes d'assurance de la qualité actuellement en place ainsi que d'évaluer la nécessité d'améliorer les tests internes et externes de vérification des compétences. À long terme, l'Agence prévoit également les actions suivantes : 1) examiner et mettre à jour les lignes directrices actuelles des laboratoires relatives à la maladie de Lyme; 2) déterminer et comparer les caractéristiques de performance de toutes les plateformes utilisées au Canada pour les épreuves immunoenzymatiques et les tests par transfert Western; 3) accorder une attention prioritaire et continue à l'évaluation de nouvelles plateformes de diagnostic; et 4) amorcer le processus de mise au point d'un panel sérique fiable destiné à l'évaluation de nouveaux tests Note de bas de page 42. Ces actions permettront d'améliorer la qualité des tests diagnostiques pour la maladie de Lyme au Canada.
Conclusion
L'incidence de la maladie de Lyme est à la hausse au Canada. En présence d'un érythème migrant et d'antécédents fiables d'exposition à des tiques à pattes noires, le dépistage n'est pas nécessairement requis et le traitement peut être institué de façon prospective. L'évaluation clinique des patients au stade disséminé de la maladie de Lyme peut être étayée par des analyses de laboratoire.
À l'heure actuelle, il n'existe pas de test de laboratoire parfait pour la maladie de Lyme; la démarche sérologique en deux temps offre à ce jour les taux de sensibilité et de spécificité les plus élevés. Une utilisation incorrecte des tests sérologiques ou l'utilisation de tests diagnostiques ou de critères d'interprétation insuffisamment validés peuvent aboutir à un diagnostic erroné et à une antibiothérapie inutile. Les efforts futurs seront axés sur la normalisation des tests et sur la mise au point et l'évaluation de nouvelles démarches diagnostiques dans le but d'optimiser la détection de la maladie de Lyme.
Remerciements
Nous tenons à remercier nos collègues des laboratoires de diagnostic provinciaux et des laboratoires d'hôpitaux de partout au Canada pour les commentaires importants et utiles dont ils nous ont fait part sur la démarche de diagnostic en laboratoire de la maladie de Lyme du Laboratoire national de microbiologie.
Conflit d'intérêts
Les auteurs n'ont aucun conflit d'intérêts à déclarer.
Références
- Note de bas de page 1
-
Johnson BJB, Aguero-Rosenfeld ME, Wilske B. Sood SK, editor. Lyme borreliosis in Europe and North America: epidemiology and clinical practice. [Internet]. Hoboken, NJ: John Wiley & Sons, Inc.; 2011. Serodiagnosis of Lyme borreliosis; p. 185-212. [consulté le 28 novembre 2013]. DOI: 10.1002/9780470933961.ch10
- Note de bas de page 2
-
Hatchette TF, Davis I, Johnston BL. Lyme disease: clinical diagnosis and treatment. CCDR. 2014;40-11:194-208.
- Note de bas de page 3
-
Ogden NH, Lindsay LR, Morshed M, Sockett PN, Artsob H. The emergence of Lyme disease in Canada. CMAJ [Internet]. 2009 [consulté le 28 novembre 2013]; 180(12):1221-4.
- Note de bas de page 4
-
Ogden NH, Artsob H, Lindsay LR, Sockett PN. Lyme disease: A zoonotic disease of increasing importance to Canadians. Can Fam Phys [Internet]. 2008;54(10):1381-4.
- Note de bas de page 5
-
Ogden, N.H., Lindsay, L.R., Morshed, M., Sockett, P.N., Artsob, H. La borréliose de Lyme au Canada : un problème grandissant. Relevé des maladies transmissibles au Canada (Internet), vol. 34(1), p. 1-19, 2008.
- Note de bas de page 6
-
Ogden, N.H., Koffi, J.K., Pelcat, Y., Lindsay, L.R. Risque environnemental pour la maladie de Lyme dans l'est et le centre du Canada : un sommaire d'informations récentes en matière de surveillance. Relevé des maladies transmissibles au Canada, vol. 40(5), p. 74-82, 2014.
- Note de bas de page 7
-
Définitions nosologiques des maladies transmissibles faisant l'objet d'une surveillance nationale – 2009. Relevé des maladies transmissibles au Canada [Internet], vol. 35( supplément 2), p. 1-123, novembre 2009.
- Note de bas de page 8
-
Wormser GP, Dattwyler RJ, Shapiro ED, Halperin JJ, Steere AC, Klempner MS, Krause PJ, Bakken JS, Strle F, Stanek G, Bockenstedt L, Fish D, Dumler JS, Nadelman RB. The clinical assessments treatment, and prevention of Lyme disease, human granulocytic anaplasmosis, and babesiosis: Clinical practice guidelines by the Infectious Diseases Society of America. Clin Infect Dis [Internet]. 2006;43(9):1089-134.
- Note de bas de page 9
-
Canadian Public Health Laboratory Network. The laboratory diagnosis of Lyme borreliosis: Guidelines from the Canadian Public Health Laboratory Network. Can J Infect Dis Med Microbiol [Internet]. 2007 Mar;18(2):145-8.
- Note de bas de page 10
-
Seltzer EG, Shapiro ED. Misdiagnosis of Lyme disease: When not to order serologic tests. Pediatr Infect Dis J [Internet]. 1996;15(9):762-3.
- Note de bas de page 11
-
Tugwell P, Dennis DT, Weinstein A, Wells G, Shea B, Nichol G, Hayward R, Lightfoot R, Baker P, Steere AC. Laboratory evaluation in the diagnosis of Lyme disease. Ann Intern Med [Internet]. 1997 Dec 15;127(12):1109-23.
- Note de bas de page 12
-
Branda JA, Strle F, Strle K, Sikand N, Ferraro MJ, Steere AC. Performance of United States serologic assays in the diagnosis of Lyme borreliosis acquired in Europe. Clin Infect Dis [Internet]. 2013 Aug;57(3):333-40.
- Note de bas de page 13
-
Schoen RT. Better laboratory testing for Lyme disease: No more Western blot. Clin Infect Dis [Internet]. 2013 [consulté le 27 novembre 2013]; 57(3):341-3.
- Note de bas de page 14
-
Aguero-Rosenfeld ME, Nowakowski J, Bittker S, Cooper D, Nadelman RB, Wormser GP. Evolution of the serologic response to Borrelia burgdorferi in treated patients with culture-confirmed erythema migrans. J Clin Microbiol [Internet]. 1996;34(1):1-9.
- Note de bas de page 15
-
Johnson BJ, Robbins KE, Bailey RE, Cao BL, Sviat SL, Craven RB, Mayer LW, Dennis DT. Serodiagnosis of Lyme disease: accuracy of a two-step approach using a flagella-based ELISA and immunoblotting. J Infect Dis [Internet]. 1996 Aug;174(2):346-53.
- Note de bas de page 16
-
Nadelman RB, Wormser GP. Reinfection in patients with Lyme disease. Clin Infect Dis [Internet]. 2007 Oct 15;45(8):1032-8.
- Note de bas de page 17
-
Aguero-Rosenfeld ME, Wang G, Schwartz I, Wormser GP. Diagnosis of Lyme borreliosis. Clin Microbiol Rev [Internet]. 2005 Jul;18(3):484-509.
- Note de bas de page 18
-
Kalish RA, McHugh G, Granquist J, Shea B, Ruthazer R, Steere AC. Persistence of immunoglobulin M or immunoglobulin G antibody responses to Borrelia burgdorferi 10-20 years after active Lyme disease. Clin Infect Dis [Internet]. 2001;33(6):780-5.
- Note de bas de page 19
-
Liang FT, Alvarez AL, Gu Y, Nowling JM, Ramamoorthy R, Philipp MT. An immunodominant conserved region within the variable domain of VlsE, the variable surface antigen of Borrelia burgdorferi. J Immunol [Internet]. 1999;163(10):5566-73.
- Note de bas de page 20
-
Dressler F, Whalen JA, Reinhardt BN, Steere AC. Western blotting in the serodiagnosis of Lyme disease. J Infect Dis [Internet]. 1993 Feb;167(2):392-400.
- Note de bas de page 21
-
Aguero-Rosenfeld, ME. Lyme disease: laboratory issues. Infect Dis Clin North Am [Internet]. 2008 [consulté le 27 novembre 2013]; 22(2):301-13.
- Note de bas de page 22
-
Centers for Disease Control and Prevention (CDC). Recommendations for test performance and interpretation from the Second National Conference on Serologic Diagnosis of Lyme disease. MMWR Morb Mortal Wkly Rep [Internet]. 1995 Aug 11;44(31):590-1.
- Note de bas de page 23
-
Craven RB, Quan TJ, Bailey RE, Dattwyler R, Ryan RW, Sigal LH, Steere AC, Sullivan B, Johnson BJ, Dennis DT, Gubler DJ. Improved serodiagnostic testing for Lyme disease: results of a multicenter serologic evaluation. Emerg Infect Dis [Internet]. 1996 Apr-Jun;2(2):136-40.
- Note de bas de page 24
-
Nowakowski J, Schwartz I, Liveris D, Wang G, Aguero-Rosenfeld ME, Girao G, McKenna D, Nadelman RB, Cavaliere LF, Wormser GP, Lyme disease Study Group. Laboratory diagnostic techniques for patients with early Lyme disease associated with erythema migrans: a comparison of different techniques. Clin Infect Dis [Internet]. 2001 Dec 15;33(12):2023-7.
- Note de bas de page 25
-
Wormser GP, Wang G. Sood SK, editor. Lyme borreliosis in Europe and North America : epidemiology and clinical practice. [Internet]. Hoboken, N.J.: John Wiley & Sons, Inc.; 2011The role of culture and nucleic acid amplification in diagnosis of Lyme borreliosis ; p. 159-83.. DOI: 10.1002/9780470933961.ch9
- Note de bas de page 26
-
Dumler JS. Molecular diagnosis of Lyme disease: review and meta-analysis. Mol Diagn [Internet]. 2001 Mar;6(1):1-11.
- Note de bas de page 27
-
Eshoo MW, Schutzer SE, Crowder CD, Carolan HE, Ecker DJ. Achieving molecular diagnostics for Lyme disease. Expert Rev Mol Diagn [Internet]. 2013 Nov;13(8):875-83.
- Note de bas de page 28
-
Liveris D, Schwartz I, McKenna D, Nowakowski J, Nadelman R, Demarco J, Iyer R, Bittker S, Cooper D, Holmgren D, Wormser GP. Comparison of five diagnostic modalities for direct detection of Borrelia burgdorferi in patients with early Lyme disease. Diagn Microbiol Infect Dis [Internet]. 2012 Jul;73(3):243-5.
- Note de bas de page 29
-
Centers for Disease Control and Prevention (CDC). Caution regarding testing for Lyme disease. Morb Mortal Wkly Rep [Internet]. 2005;54(5):125.
- Note de bas de page 30
-
Johnson BJ, Pilgard MA, Russell TM. Assessment of New Culture Method to Detect Borrelia species in Serum of Lyme diseasePatients. J Clin Microbiol [Internet]. 2013 Aug 14
- Note de bas de page 31
-
Halperin JJ, Baker P, Wormser GP. Common misconceptions about Lyme disease. Am J Med [Internet]. 2013 [consulté le 28 novembre 2013]; 126(3):264.e1,264.e7.
- Note de bas de page 32
-
Johnson BJB. Halperin JJ, editor. Lyme disease: An Evidence-based Approach. Cambridge, MA, USA: CABI Publishing; 2011 Laboratory diagnostic testing for Borrelia burgdorferi infection ; p. 73-88.;
- Note de bas de page 33
-
Bowie WR. Guidelines for the management of Lyme disease: The controversy and the quandary. Drugs [Internet]. 2007;67(18):2661-6.
- Note de bas de page 34
-
Halperin JJ, Baker P, Wormser GP. Halperin JJ, editor. Lyme disease: An Evidence-based Approach. Cambridge, MA, USA: CABI Publishing; 2011Lyme disease: the Great Controversy ; p. 259-70.
- Note de bas de page 35
-
Cerar T, Ogrinc K, Lotric-Furlan S, Kobal J, Levicnik-Stezinar S, Strle F, Ruzic-Sabljic E. Diagnostic value of cytokines and chemokines in Lyme neuroborreliosis. Clin Vaccine Immunol [Internet]. 2013 Oct;20(10):1578-84.
- Note de bas de page 36
-
Porwancher RB, Hagerty CG, Fan J, Landsberg L, Johnson BJB, Kopnitsky M, Steere AC, Kulas K, Wong SJ. Multiplex immunoassay for Lyme disease using VlsE1-IgG and pepC10-IgM antibodies: Improving test performance through bioinformatics. Clin Vaccine Immunol [Internet]. 2011;18(5):851-9.
- Note de bas de page 37
-
Wormser GP, Schriefer M, Aguero-Rosenfe ME, Levin A, Steere AC, Nadelman RB, Nowakowski J, Marques A, Johnson BJB, Dumler JS. Single-tier testing with the C6 peptide ELISA kit compared with two-tier testing for Lyme disease. Diagn Microbiol Infect Dis [Internet]. 2013;75(1):9-15.
- Note de bas de page 38
-
Branda JA, Linskey K, Kim YA, Steere AC, Ferraro MJ. Two-tiered antibody testing for Lyme disease with use of 2 enzyme immunoassays, a whole-cell sonicate enzyme immunoassay followed by a vlse c6 peptide enzyme immunoassay. Clin Infect Dis [Internet]. 2011;53(6):541-7.
- Note de bas de page 39
-
Branda JA, Aguero-Rosenfeld ME, Ferraro MJ, Johnson BJB, Wormser GP, Steere AC. 2-Tiered antibody testing for early and late Lyme disease using only an immunoglobulin G blot with the addition of a VlsE band as the second-tier test. Clin Infect Dis [Internet]. 2010;50(1):20-6.
- Note de bas de page 40
-
Ogden NH, Lindsay LR, Morshed M, Sockett PN, Artsob H. The emergence of Lyme disease in Canada. CMAJ [Internet]. 2009 [consulté le 28 novembre 2013]; 180(12):1221-4.
- Note de bas de page 41
-
Ogden NH, Margos G, Aanensen DM, Drebot MA, Feil EJ, Hanincová K, Schwartz I, Tyler S, Lindsay LR. Investigation of genotypes of Borrelia burgdorferi in Ixodes scapularis ticks collected during surveillance in Canada. Appl Environ Microbiol [Internet]. 2011;77(10):3244-54.
- Note de bas de page 42
-
Aguero-Rosenfeld ME. Committee on Lyme disease and Other Tick-Borne Diseases: The State of the Science, Institute of Medicine, editors. Critical needs and gaps in understanding prevention, amelioration, and resolution of Lyme and other tick-borne diseases [electronic resource] : the short-term and long-term outcomes : workshop report. [Internet]. Washington, DC: National Academies Press; 2011 Diagnostics for Lyme disease: Knowledge gaps and needs ; p. 125-30.
Détails de la page
- Date de modification :