Archivée - Déclaration du CCNI sur la vaccination antigrippale pour la saison 2017 à 2018

 Téléchargez cet article en format PDF (228 Ko - 9 pages)
Téléchargez cet article en format PDF (228 Ko - 9 pages) Publié par : L’Agence de la santé publique du Canada
Numéro : Volume 43-5 : Science de la mise en œuvre
Date de publication : 4 mai 2017
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 43-5, le 4 mai 2017 : Science de la mise en œuvre
Déclaration du comité consultatif
Sommaire de la Déclaration du CCNI sur la vaccination antigrippale pour la saison 2017-2018
W Vaudry1, R Stirling2 au nom du Comité consultatif national de l’immunisation (CCNI)*
Affiliations
1 Président du Groupe de travail sur l'influenza du CCNI, Université de l'Alberta, Edmonton (Alberta)
2 Centre de l’immunisation et des maladies respiratoires infectieuses, Agence de la santé publique du Canada, Ottawa (Ontario)
Correspondance
Citation proposée
Vaudry W, Stirling R au nom du Comité consultatif national de l’immunisation (CCNI). Sommaire de la Déclaration du CCNI sur la vaccination antigrippale pour la saison 2017-2018. Relevé des maladies transmissibles au Canada. 2017;43(5):106-14. https://doi.org/10.14745/ccdr.v43i05a03f
Résumé
Contexte : La grippe est une infection respiratoire principalement causée par les virus de la grippe A et B. La vaccination est le moyen le plus efficace de prévenir la grippe et ses complications. Le Comité consultatif national de l'immunisation (CCNI) fournit chaque année à l'Agence de la santé publique du Canada (ASPC) des recommandations concernant les vaccins antigrippaux saisonniers.
Objectif : Résumer les recommandations du CCNI concernant l'utilisation des vaccins antigrippaux saisonniers pour la saison 2017-2018.
Méthodologie : Le Groupe de travail sur l'influenza (GTI) du CCNI formule les recommandations sur la vaccination antigrippale annuelle et les soumet à l'attention du CCNI pour approbation. Ces recommandations respectent le processus d'élaboration des recommandations du CCNI fondé sur des données probantes. Elles tiennent notamment compte du fardeau de la maladie et des populations cibles, de l'efficacité potentielle et réelle, de l'immunogénicité et de l'innocuité des vaccins contre la grippe, des calendriers de vaccination, ainsi que d'autres aspects de l'immunisation contre la grippe. Ces recommandations sont publiées chaque année sur le site Web de l'ASPC dans la déclaration du CCNI : Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale saisonnière (la Déclaration).
Résultats : La déclaration annuelle a été mise à jour pour la saison grippale 2017-2018 afin d'intégrer les recommandations pour l'utilisation d'un vaccin antigrippal vivant atténué (VVAI) contenues dans deux addendas publiés après la déclaration pour 2016-2017. Ces recommandations étaient les suivantes : 1) les personnes allergiques aux œufs peuvent être vaccinées contre la grippe avec le vaccin antigrippal vivant atténué (VVAI) à faible teneur en ovalbumine homologué au Canada; 2) continuer à recommander l'utilisation du VVAI chez les enfants et adolescents de 2 à 17 ans, mais éliminer la recommandation concernant son utilisation préférentielle.
Conclusion : Le CCNI continue de recommander la vaccination antigrippale annuelle pour toutes les personnes de six mois et plus, et plus particulièrement pour les personnes présentant un risque élevé de complications ou d'hospitalisation liées à la grippe, les personnes susceptibles de transmettre la grippe à des sujets à risque élevé, ainsi que les autres personnes indiquées.
Introduction
La grippe et la pneumonie font partie des dix principales causes de décès au CanadaNote de bas de page 1. Bien que le fardeau de la grippe puisse varier d'une année à l'autre, il est estimé que dans une année donnée, il y a en moyenne 12 200 hospitalisations Note de bas de page 2 et environ 3 500 décès attribuables à la grippe Note de bas de page 3. Le Comité consultatif national de l'immunisation (CCNI) fournit chaque année à l'Agence de la santé publique du Canada (ASPC) des recommandations concernant les vaccins antigrippaux saisonniers. Le présent article a pour objet de résumer les recommandations du CCNI concernant l'utilisation d'un vaccin antigrippal saisonnier pour la saison de la grippe 2017-2018. Pour obtenir des détails complets, voir la Déclaration sur la vaccination antigrippale pour la saison 2017-2018 Note de bas de page 4.
Méthodologie
Durant la préparation des recommandations sur un vaccin antigrippal saisonnier pour 2017-2018, le Groupe de travail sur l'influenza (GTI) du CCNI a relevé et examiné des données probantes concernant l'administration d'un vaccin antigrippal vivant atténué (VVAI) chez les personnes allergiques aux œufs et l'efficacité du VVAI et du vaccin antigrippal inactivé (VAI) chez les enfants et adolescents de 2 à 17 ans. Après l'examen et l'analyse de ces renseignements, le GTI a proposé au CCNI des recommandations mises à jour relatives à l'utilisation des vaccins, selon le processus d'élaboration des recommandations du CCNI fondé sur des données probantes Note de bas de page 5. Le CCNI a effectué une évaluation critique des données probantes disponibles et a approuvé les recommandations présentées. On pourra trouver des détails complets sur l'examen de la documentation, les motivations et les considérations pertinentes pour les recommandations mises à jour dans l'ADDENDA — Utilisation du VVAI chez les personnes allergiques aux œufs Note de bas de page 6 l'ADDENDA — Utilisation du VVAI chez les enfants et les adolescents Note de bas de page 7 et le Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale pour la saison 2017-2018 Note de bas de page 4.
En ce qui concerne l'examen de l'utilisation du VVAI chez les personnes allergiques aux œufs, des données ont été tirées de trois études de cohortes prospectives menées au Royaume-Uni et au Canada Note de bas de page 8Note de bas de page 9Note de bas de page 10. Les données de sécurité post-homologation tirées du Système canadien de surveillance des effets secondaires suivant l'immunisation (SCSESSI) ont été analysées afin de relever des déclarations d'effets indésirables chez les personnes ayant reçu un vaccin antigrippal et présentant des antécédents d'allergie aux œufs.
Les données sur l'efficacité du VVAI chez les enfants et adolescents proviennent principalement d'études américaines pour lesquelles la méthode de diagnostic du test négatif a été utilisée : l'étude du United States Influenza Vaccine Effectiveness Network (US Flu VE Network) (2010-2016) Note de bas de page 11Note de bas de page 12Note de bas de page 13Note de bas de page 14 l'étude Influenza Clinical Investigation for Children (ICICLE) (saisons de la grippe 2013-2014 à 2015-2016) Note de bas de page 15Note de bas de page 16Note de bas de page 17 et l'étude du ministère de la Défense des États-Unis (DoD) (saisons de la grippe 2013-2014 et 2015-2016) Note de bas de page 13Note de bas de page 18. Les données sur l'efficacité du vaccin de l'étude American Household Influenza Vaccine Effectiveness (HIVE) ont été obtenues selon une méthode différente, sur une cohorte de foyers (saisons 2012-2013 et 2013-2014) Note de bas de page 19Note de bas de page 20. Les données sur l’efficacité du VVAI provenant de l’extérieur des États-Unis ont été fournies par le Sentinel Practitioner Surveillance Network (SPSN) (saisons 2013-2014 et 2015-2016) Note de bas de page 21Note de bas de page 22 par l’Allemagne (saison 2012-2013) Note de bas de page 23 par le réseau de surveillance sentinelle du Royaume-Uni (saisons 2013-2014 à 2015-2016) Note de bas de page 24Note de bas de page 25Note de bas de page 26 et par la Finlande (saison 2015-2016) Note de bas de page 27. Ces études utilisaient la méthode de diagnostic de test négatif Note de bas de page 21Note de bas de page 22Note de bas de page 23Note de bas de page 24Note de bas de page 25Note de bas de page 26 avec une étude de cohorte prospective Note de bas de page 27 et deux essais cliniques randomisés par grappes Note de bas de page 28Note de bas de page 29.
Le présent article offre également des renseignements que ne fournissaient pas les addendas publiés ou la déclaration : chiffres résumant les données sur l'efficacité du VVAI provenant des études citées, par saison grippale et souche grippale, et données sur l'efficacité du VVAI utilisées pour éclairer la décision du CCNI qui n'étaient pas disponibles au moment de la publication des addendas, et qui ont été publiées par la suite Note de bas de page 30Note de bas de page 31.
Résultats
Nouveau pour la saison grippale 2017-2018
Il y a eu deux changements dans les recommandations du CCNI concernant l'utilisation d'un vaccin antigrippal saisonnier pour la saison de la grippe 2017-2018. Ces deux changements ont trait aux recommandations mises à jour concernant l'utilisation du VVAI.
Le VVAI est sécuritaire pour les personnes allergiques aux œufs
Tous les vaccins antigrippaux approuvés au Canada sont fabriqués selon un processus de mise en culture dans des œufs de poule et peuvent ainsi contenir une infime quantité de résidus de protéines d'œuf. La formulation des VVAI homologués au Canada contient une faible quantité d'ovalbumine résiduelle (< 0,24 µg/dose) (communication écrite d'AstraZeneca), ce qui est comparable aux quantités présentes dans les vaccins antigrippaux inactivés offerts au Canada.
Au moment de la publication du Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale pour la saison 2016-2017 Note de bas de page 32 le CCNI ne recommandait pas l'utilisation du VVAI chez les personnes allergiques aux œufs en raison du manque de données disponibles pour soutenir une telle pratique.
Toutefois, la sécurité des VVAI chez les personnes allergiques aux œufs a maintenant été étudiée chez plus de 1 100 enfants et adolescents (de 2 à 18 ans) au Royaume-Uni et au Canada Note de bas de page 8Note de bas de page 9Note de bas de page 10. Après un examen minutieux des études publiées récemment, le CCNI conclut que les personnes allergiques aux œufs peuvent être vaccinées contre la grippe avec un le VVAI à faible teneur en ovalbumine homologué au Canada. La dose complète de VVAI peut être utilisée sans test cutané au vaccin préalable et dans tous les milieux où les vaccins sont administrés régulièrement. Le VVAI semble également être bien toléré chez les personnes ayant des antécédents d'asthme stable ou de respiration sifflante récurrente; cependant, il reste contre-indiqué chez les sujets atteints d'asthme grave (c.-à-d. ceux qui reçoivent actuellement une glucocorticothérapie par voie orale ou de fortes doses de glucocorticoïdes par inhalation ou qui présentent une respiration sifflante active) ou ceux ayant une respiration sifflante qui a nécessité une intervention médicale au cours des sept jours précédant l'immunisation. L'utilisation du VVAI chez les personnes allergiques aux œufs introduit un changement par rapport aux déclarations précédentes du CCNI.
On pourra trouver des détails complets sur l'examen de la documentation, les motivations et les considérations pertinentes pour les recommandations mises à jour dans l'ADDENDA — Utilisation du VVAI chez les personnes allergiques aux œufs Note de bas de page 6 et le Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale pour la saison 2017-2018 Note de bas de page 4.
Les données actuelles appuient le maintien de l'utilisation du VVAI chez les enfants et adolescents de 2 à 17 ans, mais n'appuient pas son utilisation préférentielle.
Au moment de la publication du Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale pour la saison 2016-2017 Note de bas de page 32 le CCNI recommandait l'utilisation préférentielle du VVAI chez les enfants et adolescents de 2 à 17 ans qui ne présentaient pas de contre-indications au vaccin. Cette recommandation était fondée sur des données d’innocuité post-commercialisation et sur des études sur échantillon aléatoire contrôlées par placebo qui démontraient que le VVAI était sécuritaire, efficace et immunogène chez les enfants, et capable de fournir aux enfants une meilleure protection que le VAI trivalent contre les virus de la grippe, surtout chez les jeunes enfants (de moins de 6 ans), avec une efficacité non démontrée aussi clairement chez les enfants plus âgés Note de bas de page 33.
Les estimations ajustées de l'efficacité du VVAI et du VAI contre le virus de la grippe chez les enfants et adolescents (de 2 à 17 ans) sont résumées, pour chaque étude, pour les saisons de la grippe 2010-2011 à 2014-2015 (Annexe, Figure 1) et 2015-2016 (Annexe, Figure 2). Les sommaires des estimations de l'efficacité des vaccins par étude et par type de vaccin sont également fournis pour les virus de la grippe A(H1N1)pdm09 (Annexe, Figure 3), A(H3N2) (Annexe, Figure 4) et la grippe B (Annexe, Figure 5) pour ces mêmes saisons grippales. (Remarque : Pour certaines saisons grippales, la taille des échantillons était trop petite pour calculer des estimations de l'efficacité des vaccins pour toutes les souches de grippe.)
D’après les données du US Flu VE Network indiquant que le VVAI n’a apporté aucun bénéfice en matière de protection au cours de la saison grippale 2015-2016, dominée par la grippe A(H1N1), ni aucune preuve de son efficacité contre les souches dominantes en circulation au cours des deux saisons grippales précédentes (2013-2014 et 2014-2015), l'Advisory Committee on Immunization Practices (ACIP) des États-Unis a recommandé, lors de sa réunion de juin 2016, que le VVAI ne soit pas utilisé pendant la saison grippale 2016-2017 Note de bas de page 34. L’utilisation du VVAI continue d’être recommandée pour les enfants au Royaume-Uni et en Finlande pour la saison 2016-2017 Note de bas de page 35. Des études menées dans ces deux pays et au Canada ont révélé l’effet protecteur global statistiquement significatif du VVAI chez les enfants pendant la saison 2015-2016, même si la taille des échantillons a limité la précision des estimations Note de bas de page 22Note de bas de page 24Note de bas de page 27. Après un examen des données de fabrication et des données cliniques appuyant l’homologation du vaccin ainsi que de l’ensemble des données probantes présentées lors de la réunion de l’ACIP en juin 2016, la Food and Drug Administration (FDA) des États-Unis a déterminé qu’il n’était pas nécessaire, pour le moment, d’établir des mesures réglementaires précises pour l’administration du VVAI; elle continue d’ailleurs de trouver que les bénéfices du VVAI quadrivalent l’emportent sur tout risque éventuel Note de bas de page 36. Le VVAI quadrivalent demeure homologué aux fins d’utilisation aux États-Unis. La FDA a fait cette constatation en tenant compte des limites des études d'observation de l'estimation et de la variabilité saisonnière de l'efficacité du vaccin.
Après un examen approfondi des études disponibles provenant des dernières saisons grippales, le CCNI conclut que les données probantes actuelles confirment que le VVAI confère une protection contre la grippe comparable à celle que procure le VAI dans divers autres pays. Aussi a-t-il modifié ses recommandations concernant l'utilisation du vaccin contre la grippe chez les enfants et adolescents de 2 à 17 ans :
- 1. Chez les enfants et adolescents qui ne présentent pas de contre-indications, un des vaccins antigrippaux suivants peut être utilisé : VVAI quadrivalent, vaccin antigrippal quadrivalent inactivé (VAQ) ou vaccin antigrippal trivalent inactivé (VTI).
- 2. Les données probantes actuelles n'appuient pas une recommandation de l'utilisation préférentielle du VVAI chez les enfants et adolescents de 2 à 17 ans.
Compte tenu du fardeau du virus de la grippe B chez les enfants et du potentiel de non-concordance entre la souche prédominante du virus de la grippe B en circulation et la souche d'un vaccin trivalent, le CCNI continue à recommander qu'un vaccin quadrivalent contre la grippe soit utilisé chez les enfants et adolescents de 2 à 17 ans. En l'absence d'un vaccin quadrivalent, il faut utiliser le VTI.
Les données de l'étude d'observation examinées mettent en évidence le défi d'interpréter l'efficacité du VVAI et du VAI lorsque les estimations ponctuelles par sous-type de grippe sont calculées en fonction d'échantillons de petite taille associés à de grands intervalles de confiance. Par conséquent, dans la formulation de ses recommandations, le CCNI reconnaît la nécessité de continuer à surveiller étroitement les données sur l'efficacité du VVAI par sous-type de grippe et l'efficacité relative du VVAI par rapport à celle du VAI. Le CCNI a également établi la nécessité de poursuivre les recherches afin de combler les lacunes actuelles en matière de connaissances :
- 3. Le CCNI encourage fortement que des recherches multidisciplinaires supplémentaires (p. ex., épidémiologiques, immunologiques, virologiques) soient menées pour établir les raisons qui expliquent les estimations discordantes de l'efficacité des vaccins de 2015-2016 entre les études et la faible efficacité du VVAI par rapport au virus de la grippe A(H1N1)pdm09 signalée dans certaines études.
- 4. Le CCNI recommande vivement que suffisamment de ressources soient consacrées à l'approfondissement des recherches sur la grippe et à l'amélioration des systèmes de surveillance sentinelle au Canada afin d'améliorer l'évaluation de l'efficacité potentielle et réelle des vaccins antigrippaux et de disposer des meilleures données probantes possible pour les programmes de vaccination contre la grippe et les recommandations en la matière.
On pourra trouver des détails complets sur l'examen de la documentation, les motivations et les considérations pertinentes pour les recommandations mises à jour dans l'ADDENDA — Utilisation du VVAI chez les enfants et les adolescents Note de bas de page 7 et le Chapitre sur la grippe du Guide canadien d'immunisation et Déclaration sur la vaccination antigrippale pour la saison 2017-2018 Note de bas de page 4.
Résumé des recommandations du CCNI concernant l'utilisation des vaccins contre la grippe pour la saison grippale 2017-2018
Le CCNI continue de recommander la vaccination antigrippale pour toutes les personnes de six mois et plus ne présentant pas de contre-indications au vaccin, et plus particulièrement les personnes présentant un risque élevé de complications ou d'hospitalisation liées à la grippe, les personnes susceptibles de transmettre la grippe à des sujets à risque élevé de complications, ainsi que les autres personnes indiquées au tableau 1.
Personnes présentant un risque élevé de complications liées à la grippe ou plus susceptibles de devoir être hospitalisées
Personnes qui pourraient transmettre la grippe à des sujets à risque élevé
Autres
|
Les options de vaccination antigrippale recommandées par groupes d'âge et de risque particuliers et selon la posologie et la voie d'administration par âge sont résumées dans le tableau 2 et le tableau 3, respectivement.
| Groupes d'âge | Types de vaccins disponibles | Commentaires |
|---|---|---|
Enfants agés de 6 à 23 mois |
|
Le VTI, le VAQ et le VTIa sont autorisés pour ce groupe d'âge. Le CCNI recommande, compte tenu du fardeau présenté par la grippe de type B, d'utiliser le VAQ. Si le VAQ n'est pas offert, le VTI, avec ou sans adjuvant, doit être utilisé. |
Enfants agés de 2 à 17 ans |
|
Chez les enfants qui ne présentent pas de contre-indications, les vaccins antigrippaux suivants peuvent être utilisés : VVAI, VAQ ou VTI. Les données probantes actuelles n'appuient pas une recommandation de l'utilisation préférentielle du VVAI chez les enfants et les adolescents âgés de 2 à 17 ans. Compte tenu du fardeau du virus de la grippe B chez les enfants et du potentiel de non-concordance entre la souche prédominante du virus de la grippe B en circulation et la souche d'un vaccin trivalent, le CCNI continue à recommander qu'un vaccin quadrivalent contre la grippe soit utilisé chez les enfants et adolescents âgés de 2 à 17 ans. En l'absence d'un vaccin quadrivalent, il faut utiliser le VTI. Il n'est pas recommandé d'administrer le VVAI aux enfants immunodéprimés. Le VVAI, le VTI ou le VAQ peut être utilisé chez les enfants atteints d'affections chroniques, sans contre-indications (voir la déclaration complète pour plus de détails) Note de bas de page 4. |
Adultes âgés de 18 à 59 ans |
|
Le VTI et le VAQ sont les vaccins recommandés pour les adultes atteints d'affections chroniques. Le VTI et le VAQ, plutôt que le VVAI, sont recommandés pour les travailleurs de la santé. L'administration du VVAI n'est pas recommandée chez les adultes immunodéprimés. |
Adultes âgés de 60 à 64 ans |
|
Le VTI et le VAQ sont autorisés pour ce groupe d'âge. |
Adultes âgés de 65 ans et plus |
|
Compte tenu du fardeau de la grippe A(H3N2) et des preuves indiquant une plus grande efficacité pour ce groupe d'âge, un VTI à forte dose devrait conférer une meilleure protection chez les personnes âgées que le vaccin intramusculaire à dose normale. |
Femmes enceintes |
|
L'administration du VVAI n'est pas recommandée en raison du risque théorique que ferait encourir au fœtus l'administration d'un vaccin à virus vivants. |
Groupe d’âge |
VTI sans adjuvantTableau 3 - Note 1 Intramusculaire |
VAQ sans adjuvant Tableau 3 - Note 2 Intramusculaire |
VTI sans adjuvant, haute dose (FluzoneMC haute dose) Intramusculaire |
VTI contenant l'adjuvant MF59 (Fluad PédiatriqueMC ou FluadMC) Intramusculaire |
VVAI (FluMistMD quadrivalent) Intranasal |
Nombre de doses requises |
|---|---|---|---|---|---|---|
| 6 à 23 mois | 0,5 mLTableau 3 - Note 3 | 0,5 mLTableau 3 - Note 3 | S.O. | 0,25 mL | S.O. | 1 ou 2Tableau 3 - Note 4 |
| 2 à 8 ans | 0,5 mL | 0,5 mL | S.O. | S.O. | 0,2 mL (0,1 mL par narine) | 1 ou 2Tableau 3 - Note 4 |
| 9 à 17 ans | 0,5 mL | 0,5 mL | S.O. | S.O. | 0,2 mL (0,1 mL par narine) | 1 |
| 18 à 59 ans | 0,5 mL | 0,5 mL | S.O. | S.O. | 0,2 mL (0,1 mL par narine) | 1 |
| 60 à 64 ans | 0,5 mL | 0,5 mL | S.O. | S.O. | S.O. | 1 |
| 65 ans et plus | 0,5 mL | 0,5 mL | 0,5 mL | 0,5 mL | S.O. | 1 |
Conclusion
Le CCNI continue de recommander la vaccination antigrippale annuelle pour toutes les personnes âgées de 6 mois et plus (en tenant compte des indications et contre-indications selon l'âge propres à chaque produit), et plus particulièrement les personnes présentant un risque élevé de complications ou d'hospitalisation liées à la grippe, notamment toutes les femmes enceintes, les personnes susceptibles de transmettre la grippe à des sujets à risque élevé, ainsi que les autres personnes indiquées. Pour la saison grippale 2017-2018, le CCNI a également mis à jour ses recommandations sur l'utilisation du VVAI : 1) les personnes allergiques aux œufs peuvent être vaccinées contre la grippe avec le VVAI à faible teneur en ovalbumine homologué au Canada; 2) l'utilisation du VVAI continue d'être recommandée chez les enfants et adolescents de 2 à 17 ans, mais elle n'est plus recommandée de manière préférentielle.
Déclaration des auteurs
La présente déclaration a été préparée par le Groupe de travail sur l'influenza : W. Vaudry (président), L. Grohskopf, E. Henry, D. Kumar, J. Langley, M. Lavoie, J. McElhaney, A. McGeer, D. Moore, D. Vinh, B. Warshawsky, J. Xiong
Conflit d’intérêts
Aucun.
Remerciements
Le CCNI remercie Christina Bancej, Gina Charos, Althea House, Vanessa Meikle, Robert Stirling et Linlu Zhao pour leur contribution à cette déclaration.
Membres du CCNI : I. Gemmill (président), C. Quach (vice-présidente), N. Dayneka, S. Deeks, B. Henry, S. Marchant-Short, M. Salvadori, N. Sicard, W. Vaudry, D. Vinh, R. Warrington
Agents de liaison : J. Blake (Société des obstétriciens et gynécologues du Canada), J. Brophy (Association canadienne pour la recherche et l'évaluation en immunisation), A. Cohn (Centers for Disease Control and Prevention, États-Unis), J. Emili (Collège des médecins de famille du Canada), M. Lavoie (Conseil des médecins hygiénistes en chef), C. Mah (Association canadienne de santé publique), D. Moore (Société canadienne de pédiatrie), A. Pham-Huy (Association pour la microbiologie médicale et l'infectiologie Canada), E. Sartison (Comité canadien sur l'immunisation)
Représentants d'office : K. Barnes (Défense nationale et Forces armées canadiennes), G. Charos (Centre de l'immunisation et des maladies respiratoires infectieuses [CIMRI], ASPC), G. Coleman (Direction des produits biologiques et des thérapies génétiques [DPBTG], Santé Canada [SC]), J. Gallivan (Direction des produits de santé commercialisés [DPSC], SC), J. Pennock (CIMRI, ASPC), R. Pless (CIMRI, ASPC), T. Wong (Direction générale de la santé des Premières nations et des Inuits, SC)
Financement
Les travaux du CCNI sont appuyés par l’Agence de la santé publique du Canada.
Annexe
Figure 1 : Estimations ajustées de l'efficacité des vaccins contre tout virus de la grippe, par étude et par type de vaccin, pour les saisons grippales 2010-2011 à 2014-2015 chez les enfants etadolescents de 2 à 17 ans Figure 1 note 1
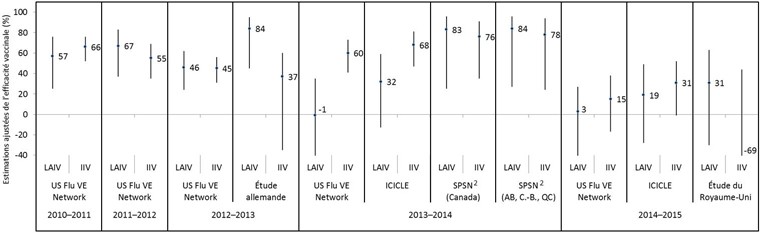
Description textuelle : Figure 1
Figure 1 : Estimations ajustées de l'efficacité des vaccins contre tout virus de la grippe, par étude et par type de vaccin, pour les saisons grippales 2010-2011 à 2014-2015 chez les enfants etadolescents de 2 à 17 ans Figure 1 note 1
| Saison grippale | Étude | Type de vaccin | Estimation ponctuelle ajustée de l’efficacité du vaccin (%) | Limite inférieure de l’intervalle de confiance à 95 % (%) | Limite supérieure de l’intervalle de confiance à 95 % (%) |
|---|---|---|---|---|---|
| 2010–2011 | US Flu VE Network | LAIV | 57 | 25 | 76 |
| 2010–2011 | US Flu VE Network | IIV | 66 | 52 | 76 |
| 2011–2012 | US Flu VE Network | LAIV | 67 | 37 | 83 |
| 2011–2012 | US Flu VE Network | IIV | 55 | 35 | 69 |
| 2012–2013 | US Flu VE Network | LAIV | 46 | 24 | 62 |
| 2012–2013 | US Flu VE Network | IIV | 45 | 31 | 56 |
| 2012–2013 | Étude allemande | LAIV | 84 | 45 | 95 |
| 2012–2013 | Étude allemande | IIV | 37 | >-35 | 60 |
| 2013–2014 | US Flu VE Network | LAIV | >-1 | >-57 | 35 |
| 2013–2014 | US Flu VE Network | IIV | 60 | 41 | 73 |
| 2013–2014 | ICICLE | LAIV | 32 | -13 | 59 |
| 2013–2014 | ICICLE | IIV | 68 | 47 | 81 |
| 2013–2014 | SPSN (Canada) | LAIV | 83 | 25 | 96 |
| 2013–2014 | SPSN (Canada) | IIV | 76 | 35 | 91 |
| 2013–2014 | SPSN (AB, C.-B., QC) | LAIV | 84 | 27 | 96 |
| 2013–2014 | SPSN (AB, C.-B., QC) | IIV | 78 | 24 | 94 |
| 2014–2015 | US Flu VE Network | LAIV | 3 | >-50 | 27 |
| 2014–2015 | US Flu VE Network | IIV | 15 | -17 | 38 |
| 2014–2015 | ICICLE | LAIV | 19 | -28 | 49 |
| 2014–2015 | ICICLE | IIV | 31 | >-1 | 52 |
| 2014–2015 | Étude du Royaume-Uni | LAIV | 31 | >-30 | 63 |
| 2014–2015 | Étude du Royaume-Uni | IIV | >-69 | >-409 | 44 |
Figure 2 : Estimations ajustées de l'efficacité des vaccins contre tout virus de la grippe, par étude et par type de vaccin, pour la saison grippale 2015-2016 chez les enfants etadolescents de 2 à 17 ans Figure 2 note 1

Description textuelle : Figure 2
Figure 2 : Estimations ajustées de l'efficacité des vaccins contre tout virus de la grippe, par étude et par type de vaccin, pour la saison grippale 2015-2016 chez les enfants etadolescents de 2 à 17 ans Figure 2 note 1
| Saison grippale | Étude | Type de vaccin | Estimation ponctuelle ajustée de l’efficacité du vaccin (%) | Limite inférieure de l’intervalle de confiance à 95 % (%) | Limite supérieure de l’intervalle de confiance à 95 % (%) |
|---|---|---|---|---|---|
| 2015–2016 | US Flu VE Network | LAIV | 3 | -49 | 37 |
| 2015–2016 | US Flu VE Network | IIV | 63 | 52 | 72 |
| 2015–2016 | DoD | LAIV | 53 | 25 | 70 |
| 2015–2016 | DoD | IIV | 66 | 50 | 75 |
| 2015–2016 | ICICLE | LAIV | 46 | 7 | 69 |
| 2015–2016 | ICICLE | IIV | 65 | 48 | 76 |
| 2015–2016 | Étude du Royaume-Uni | LAIV | 58 | 25 | 76 |
| 2015–2016 | Étude du Royaume-Uni | IIV | 78 | 7 | 95 |
| 2015–2016 | Étude finlandaise | LAIV | 51 | 29 | 66 |
| 2015–2016 | Étude finlandaise | IIV | 61 | 31 | 78 |
| 2015–2016 | SPSN | LAIV | 74 | Pas disponible | Pas disponible |
| 2015–2016 | SPSN | IIV | 63 | Pas disponible | Pas disponible |
Figure 3 : Estimations ajustées de l'efficacité des vaccins contre le virus de la grippe A(H1N1)pdm09, par saison de la grippe, par étude et par type de vaccin, chez les enfants et adolescents de 2 à 17 ans, pour les saisons grippales dominées par le virus A(H1N1)pdm09 depuis 2009 Figure 3 note 1
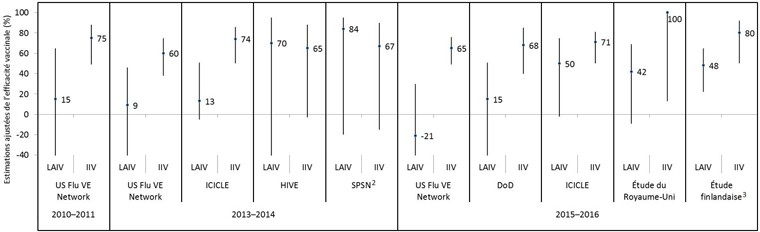
Description textuelle : Figure 3
Figure 3 : Estimations ajustées de l'efficacité des vaccins contre le virus de la grippe A(H1N1)pdm09, par saison de la grippe, par étude et par type de vaccin, chez les enfants et adolescents de 2 à 17 ans, pour les saisons grippales dominées par le virus A(H1N1)pdm09 depuis 2009 Figure 3 note 1
| Saison grippale | Étude | Type de vaccin | Estimation ponctuelle ajustée de l’efficacité du vaccin (%) | Limite inférieure de l’intervalle de confiance à 95 % (%) | Limite supérieure de l’intervalle de confiance à 95 % (%) |
|---|---|---|---|---|---|
| 2010–2011 | US Flu VE Network | LAIV | 15 | -110 | 65 |
| 2010–2011 | US Flu VE Network | IIV | 75 | 49 | 88 |
| 2013–2014 | US Flu VE Network | LAIV | 9 | -53 | 46 |
| 2013–2014 | US Flu VE Network | IIV | 60 | 38 | 75 |
| 2013–2014 | ICICLE | LAIV | 13 | -5 | 51 |
| 2013–2014 | ICICLE | IIV | 74 | 50 | 86 |
| 2013–2014 | HIVE | LAIV | 70 | -55 | 95 |
| 2013–2014 | HIVE | IIV | 65 | -3 | 88 |
| 2013–2014 | SPSN | LAIV | 84 | -20 | 95 |
| 2013–2014 | SPSN | IIV | 67 | -15 | 90 |
| 2015–2016 | US Flu VE Network | LAIV | -21 | -108 | 30 |
| 2015–2016 | US Flu VE Network | IIV | 65 | 49 | 76 |
| 2015–2016 | DoD | LAIV | 15 | -48 | 51 |
| 2015–2016 | DoD | IIV | 68 | 40 | 85 |
| 2015–2016 | ICICLE | LAIV | 50 | -2 | 75 |
| 2015–2016 | ICICLE | IIV | 71 | 50 | 81 |
| 2015–2016 | Étude du Royaume-Uni | LAIV | 42 | -9 | 69 |
| 2015–2016 | Étude du Royaume-Uni | IIV | 100 | 13 | 100 |
| 2015–2016 | Étude finlandaise | LAIV | 48 | 22 | 65 |
| 2015–2016 | Étude finlandaise | IIV | 80 | 50 | 92 |
Figure 4 : Estimations ajustées de l'efficacité des vaccins contre le virus de la grippe A(H3N2), par saison de la grippe, par étude et par type de vaccin, chez les enfants et adolescents de 2 à 17 ans, pour les saisons grippales dominées par le virus A(H3N2) depuis 2009 Figure 4 note 1

Description textuelle : Figure 4
Figure 4 : Estimations ajustées de l'efficacité des vaccins contre le virus de la grippe A(H3N2), par saison de la grippe, par étude et par type de vaccin, chez les enfants et adolescents de 2 à 17 ans, pour les saisons grippales dominées par le virus A(H3N2) depuis 2009 Figure 4 note 1
| Saison grippale | Étude | Type de vaccin | Estimation ponctuelle ajustée de l’efficacité du vaccin (%) | Limite inférieure de l’intervalle de confiance à 95 % (%) | Limite supérieure de l’intervalle de confiance à 95 % (%) |
|---|---|---|---|---|---|
| 2010–2011 | US Flu VE Network | LAIV | 67 | 16 | 87 |
| 2010–2011 | US Flu VE Network | IIV | 74 | 54 | 85 |
| 2011–2012 | US Flu VE Network | LAIV | 58 | 11 | 80 |
| 2011–2012 | US Flu VE Network | IIV | 51 | 26 | 68 |
| 2012–2013 | US Flu VE Network | LAIV | 45 | 11 | 66 |
| 2012–2013 | US Flu VE Network | IIV | 31 | 7 | 48 |
| 2012–2013 | Étude allemande | LAIV | 84 | -24 | 98 |
| 2012–2013 | Étude allemande | IIV | 63 | -67 | 92 |
| 2014–2015 | US Flu VE Network | LAIV | -5 | -50 | 21 |
| 2014–2015 | US Flu VE Network | IIV | 13 | -9 | 29 |
| 2014–2015 | ICICLE | LAIV | 16 | -33 | 47 |
| 2014–2015 | ICICLE | IIV | 33 | 1 | 54 |
Figure 5 : Estimations ajustées de l'efficacité des vaccins contre le virus de la grippe B depuis 2009, par saison de la grippe, par étude et par type de vaccin, chez les enfants etadolescents de 2 à 17 ans Figure 5 note 1
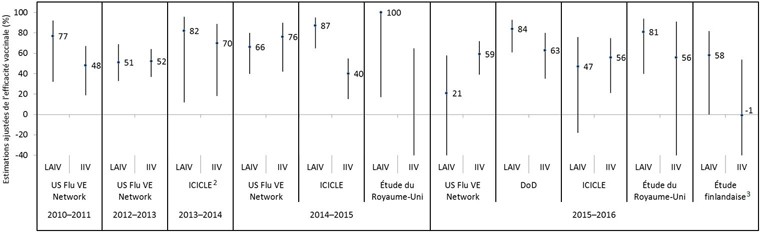
Description textuelle : Figure 5
Figure 5 : Estimations ajustées de l'efficacité des vaccins contre le virus de la grippe B depuis 2009, par saison de la grippe, par étude et par type de vaccin, chez les enfants etadolescents de 2 à 17 ans Figure 5 note 1
| Saison grippale | Étude | Type de vaccin | Estimation ponctuelle ajustée de l’efficacité du vaccin (%) | Limite inférieure de l’intervalle de confiance à 95 % (%) | Limite supérieure de l’intervalle de confiance à 95 % (%) |
|---|---|---|---|---|---|
| 2010–2011 | US Flu VE Network | LAIV | 77 | 32 | 92 |
| 2010–2011 | US Flu VE Network | IIV | 48 | 19 | 67 |
| 2012–2013 | US Flu VE Network | LAIV | 51 | 33 | 69 |
| 2012–2013 | US Flu VE Network | IIV | 52 | 37 | 64 |
| 2013–2014 | ICICLE | LAIV | 82 | 12 | 96 |
| 2013–2014 | ICICLE | IIV | 70 | 18 | 89 |
| 2014–2015 | US Flu VE Network | LAIV | 66 | 40 | 80 |
| 2014–2015 | US Flu VE Network | IIV | 76 | 42 | 90 |
| 2014–2015 | ICICLE | LAIV | 87 | 65 | 95 |
| 2014–2015 | ICICLE | IIV | 40 | 15 | 55 |
| 2014–2015 | Étude du Royaume-Uni | LAIV | 100 | 17 | 100 |
| 2014–2015 | Étude du Royaume-Uni | IIV | -124 | -1343 | 65 |
| 2015–2016 | US Flu VE Network | LAIV | 21 | -46 | 58 |
| 2015–2016 | US Flu VE Network | IIV | 59 | 39 | 72 |
| 2015–2016 | DoD | LAIV | 84 | 61 | 93 |
| 2015–2016 | DoD | IIV | 63 | 35 | 80 |
| 2015–2016 | ICICLE | LAIV | 47 | -18 | 76 |
| 2015–2016 | ICICLE | IIV | 56 | 21 | 75 |
| 2015–2016 | Étude du Royaume-Uni | LAIV | 81 | 40 | 94 |
| 2015–2016 | Étude du Royaume-Uni | IIV | 56 | -122 | 91 |
| 2015–2016 | Étude finlandaise | LAIV | 58 | 0 | 82 |
| 2015–2016 | Étude finlandaise | IIV | -1 | -123 | 54 |