Archivée - Gonorrhée multirésistante et ultrarésistante, Canada, de 2012 à 2016

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 45-2/3 : La gonorrhée multirésistante
Date de publication : 7 février 2019
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 45-2/3, le 7 février 2019 : La gonorrhée multirésistante
Surveillance
Neisseria gonorrhoeae, bactérie multirésistante et ultrarésistante, Canada, de 2012 à 2016
I Martin1, P Sawatzky1, V Allen2, B Lefebvre3, LMN Hoang4, P Naidu5, J Minion6, P Van Caeseele7, D Haldane8, RR Gad9, G Zahariadis10, A Corriveau11, G German12, K Tomas13, MR Mulvey1
Affiliations
1 Division des bactéries pathogènes, Laboratoire national de microbiologie, Agence de la santé publique du Canada, Winnipeg (Manitoba)
2 Laboratoires de la santé publique de l’Ontario, Toronto (Ontario)
3 Laboratoire de santé publique du Québec, Sainte-Anne-de-Bellevue (Québec)
4 Laboratoire de santé publique du Centre de contrôle des maladies de la Colombie-Britannique, Vancouver (Colombie-Britannique)
5 Provincial Laboratory for Public Health, Edmonton (Alberta)
6 Roy Romanow Provincial Laboratory, Regina (Saskatchewan)
7 Laboratoire provincial Cadham, Winnipeg (Manitoba)
8 Centre des sciences de la santé QEII, Halifax (Nouvelle-Écosse)
9 Ministère de la Santé du Nouveau-Brunswick, Fredericton (Nouveau-Brunswick)
10 Laboratoire de santé publique de Terre-Neuve-et-Labrador, St. John’s, T.-N.-L.
11 Ministère de la Santé et des Services sociaux, gouvernement des Territoires du Nord-Ouest, Yellowknife, T.N.-O.
12 Santé Î.-P.-É., Charlottetown (Île-du-Prince-Édouard)
13 Centre de la lutte contre les maladies transmissibles et les infections, Agence de la santé publique du Canada, Ottawa (Ontario)
Correspondance
Citation proposée
Martin I, Sawatzky P, Allen V, Lefebvre B, Hoang LMN, Naidu P, Minion J, Van Caeseele P, Haldane D, Gad RR, Zahariadis G, Corriveau A, German G, Tomas K, Mulvey MR. Neisseria gonorrhoeae, bactérie multirésistante et ultrarésistante, Canada, de 2012 à 2016. Relevé des maladies transmissibles au Canada 2019;45(2/3):45-54. https://doi.org/10.14745/ccdr.v45i23a01f
Mots-clés : Neisseria gonorrhoeae, N. gonorrhea multirésistante, résistance antimicrobienne, surveillance en laboratoire
Résumé
Contexte : La Neisseria gonorrhoeae est devenue résistante à de nombreux antimicrobiens, notamment aux céphalosporines de troisième génération et à l’azithromycine, soit la thérapie combinée pour les infections gonococciques recommandée par les Lignes directrices canadiennes sur les infections transmissibles sexuellement.
Objectif : Décrire la sensibilité aux antimicrobiens de la N. gonorrhoeae présente au Canada entre 2012 et 2016.
Méthodologie : Les profils de résistance aux antimicrobiens ont été établis au moyen de la méthode de dilution en gélose de la N. gonorrhoeae isolée au Canada de 2012 à 2016 (n = 10 167) conformément aux lignes directrices du Clinical Laboratory Standards Institute (CLSI). Les données ont été analysées en appliquant des définitions de gonocoques multirésistants et de gonocoques ultrarésistants.
Résultats : Entre 2012 et 2016, la proportion de gonocoques multirésistants est passée de 6,2 % à 8,9 % et un total de 19 cas d’infections aux gonocoques ultrarésistants ont été relevés au Canada (0,1 %, 19/18 768). La proportion d’isolats avec une sensibilité réduite aux céphalosporines a diminué entre 2012 et 2016, passant de 5,9 % à 2,0 %, tandis que la résistance à l’azithromycine a augmenté, passant de 0,8 % à 7,2 % au cours de la même période.
Conclusion : Même si les cas de gonocoques ultrarésistants sont actuellement rares au Canada, les cas de gonocoques multirésistants ont augmenté au cours des cinq dernières années. La résistance à l’azithromycine de la N. gonorrhoeae est un fait établi et elle se propage au Canada, dépassant le niveau de 5 % à partir duquel l’Organisation mondiale de la santé déclare que le traitement par un antimicrobien devrait faire l’objet d’un examen pour vérifier s’il est approprié. La surveillance continue de la sensibilité aux antimicrobiens de la N. gonorrhoeae est nécessaire pour éclairer les lignes directrices en matière de traitement et atténuer l’impact de la gonorrhée résistante.
Introduction
La gonorrhée est la deuxième infection sexuellement transmissible la plus couramment signalée au Canada, le micro-organisme causal étant la Neisseria gonorrhoeae. En 2016, 23 708 cas de gonorrhée ont été signalés à l’Agence de la santé publique du Canada (ASPC); les taux ont augmenté de 87 %, passant de 34,9 cas/100 000 habitants en 2012 à 65,4 cas/100 000 habitants en 2016Note de bas de page 1. En 2016, 82 % de tous les cas de gonorrhée signalés au Canada touchaient le groupe d’âge des 15 à 39 ans, les taux les plus élevés ayant été constatés dans la catégorie des 20 à 29 ans chez les hommes et dans celle des 15 à 24 ans chez les femmesNote de bas de page 2. À l’échelle mondiale, on estime à 78 millions les cas d’infections de gonorrhée annuellementNote de bas de page 3. Le traitement est compliqué, étant donné que la N. gonorrhoeae a acquis des mécanismes de résistance à de nombreux antimicrobiens utilisés pour le traitement au fil des ansNote de bas de page 4. Cette résistance a été documentée au moyen de programmes de surveillance devant servir à appuyer les recommandations de traitement appropriées.
Les programmes de surveillance gonococique font face à une difficulté causée par la baisse du nombre de cultures disponibles pour les tests de sensibilité aux agents antimicrobiens en raison de l’abandon des cultures bactériennes au profit du test d’amplification des acides nucléiques (TAN) dans le cadre du diagnostic de la gonorrhée. Le fait est préoccupant étant donné que les cultures de N. gonorrhoeae sont également requises pour les tests de sensibilité aux agents antimicrobiens. Actuellement, presque 80 % des infections gonococciques au Canada sont maintenant diagnostiquées au moyen du TANNote de bas de page 5. Certains territoires de compétence canadiens ont aboli la pratique de production en culture de cet organisme et, par conséquent, les données de sensibilité aux agents antimicrobiens dans ces territoires de compétence ne sont plus disponibles.
Une augmentation du nombre d’isolats présentant une sensibilité réduite aux céphalosporines, constatée grâce aux données de surveillance gonococciques au Canada de 2012, a entraîné la révision de la recommandation pour le traitement de la gonorrhée affichée dans les Lignes directrices canadiennes sur les infections transmissibles sexuellement qui prévoient maintenant une thérapie combinée avec deux antibiotiques. Dans le cas des infections anogénitales et des infections pharyngiennes non-complexes, l’administration de 250 mg de ceftriaxone par voie intramusculaire et de 1 g d’azythromycine par voie orale est actuellement recommandée à titre de traitement de première ligneNote de bas de page 6.
En plus des taux de résistance croissante aux agents antimicrobiens observés, on a également signalé des cas de N. gonorrhoeae affichant un niveau élevé de résistance et d’échecs thérapeutiques; ces cas sont préoccupants. Les échecs impliquant le traitement avec la céfixime, une céphalosporine orale puissante, ont été signalés tant au CanadaNote de bas de page 13Note de bas de page 14 qu’à l’échelle internationaleNote de bas de page 7Note de bas de page 8Note de bas de page 9Note de bas de page 10Note de bas de page 11Note de bas de page 12. La majorité de ces cas ont été traités avec succès au moyen de la ceftriaxone (250 mg par voie intramusculaire). En 2009, le Japon a identifié un isolat (H041) à la source de l’échec d’un traitement pharyngien avec la ceftriaxone. Des concentrations minimales inhibitrices (CMI) inhabituellement élevées à la ceftriaxone (2 mg/L) et à la céfixime (8 mg/L) ont été observées; le traitement avec 1 g de ceftriaxone par voie intraveineuse a permis d’éliminer l’infectionNote de bas de page 15. D’autres échecs thérapeutiques pour le traitement pharyngien à la ceftriaxone ont été signalés en SuèdeNote de bas de page 16Note de bas de page 17, en SlovénieNote de bas de page 18 et en AustralieNote de bas de page 19Note de bas de page 20, qui ont alors été traités avec succès avec une dose plus élevée de ceftriaxone (1 g par voie intramusculaire), d’azithromycine (2 g par voie orale) ou une combinaison de ceftriaxone (250 mg par voie intramusculaire) et d’azithromycine (1 g par voie orale). En 2011, la France a signalé le premier échec de traitement génital à la ceftriaxone en EuropeNote de bas de page 11. En 2014, le premier échec de traitement par double thérapie antimicrobienne a été signalé au Royaume-Uni (500 mg de ceftriaxone et 1 g d’azithromycine). La maladie a été traitée avec succès au moyen de la ceftriaxone (1 g par voie intramusculaire) et de l’azithromycine (2 g par voie orale)Note de bas de page 21. Depuis 2013, les cas de résistance à la ceftriaxone ont été signalés et caractérisés dans plusieurs pays, y compris le Canada, le Japon et l’Australie. Ces cas ont par la suite été traités avec succès au moyen de l’azithromycineNote de bas de page 22Note de bas de page 23. Le Royaume-Uni et l’Australie ont également récemment signalé des échecs thérapeutiques dans certains cas en raison de la résistance élevée à la ceftriaxone (CMI = 0,5 mg/L) et de la résistance élevée à l’azithromycine (CMI supérieure ou égale à 256 mg/L). Le cas du Royaume-Uni a été traité avec succès au moyen de l’ertapénem par voie intraveineuseNote de bas de page 24.
Des taux croissants de résistance à l’azithromycine ont également été signalés au CanadaNote de bas de page 5 et dans d’autres paysNote de bas de page 25, ce qui est préoccupant vu que l’azithromycine fait partie de la thérapie combinée recommandée. En plus de l’augmentation du niveau moyen de résistance à l’azithromycine observée, on a signalé des cas de résistance élevée à l’azithromycine (CMI supérieure ou égale à 256 mg/L) qui ont été associés à une vaste éclosion au Royaume-UniNote de bas de page 26. Même si les isolats avec cette CMI élevée d’azithromycine ont été identifiés au Canada, un total de sept cas ont été identifiés entre 2009 et 2016Note de bas de page 5; ces cas semblent être des incidents sporadiques au Canada et ne se sont pas propagés.
En 2009Note de bas de page 27, des définitions ont été établies pour les gonocoques multirésistants et les gonocoques ultrarésistants, que nous avons récemment révisées, en tenant compte des Lignes directrices canadiennes sur les infections transmissibles sexuellement et des antimicrobiens faisant l’objet de tests dans notre surveillance de routine en laboratoire (Case de texte 1).
Case de texte 1 : Définitions de gonocoques multirésistants et de gonocoques ultrarésistants
- Gonocoques multirésistants – sensibilité/résistance réduite à l’une des thérapies actuellement recommandées (céphalosporine OU azithromycine) PLUS résistance à au moins deux autres antimicrobiens (pénicilline, tétracycline, érythromycine, ciprofloxacine).
- Gonocoques ultrarésistants – sensibilité/résistance réduite aux deux thérapies actuellement recommandées (céphalosporine ET azithromycine) PLUS résistance à au moins deux autres antimicrobiens (pénicilline, tétracycline, érythromycine, ciprofloxacine).
Le Laboratoire national de microbiologie (LNM) de l’ASPC, en collaboration avec les laboratoires provinciaux, surveille les sensibilités aux agents antimicrobiens de la N. gonorrhoeae depuis 1985. Dans ce rapport, nous présentons les tendances des sensibilités aux agents antimicrobiens au niveau national de la N. gonorrhoeae recueillies entre 2012 et 2016 en appliquant les définitions révisées des gonocoques multirésistants et des gonocoques ultrarésistants.
Méthodologie
Entre 2012 et 2016, des cultures de N. gonorrhoeae ont été soumises au LNM par des laboratoires provinciaux ayant identifié un isolat résistant ou des laboratoires qui n’effectuaient pas de tests de sensibilité aux agents antimicrobiens (tableau 1). Les renseignements concernant les isolats soumis au LNM comprenaient le sexe et l’âge du patient, la province ou le territoire où l’infection a été diagnostiquée, ainsi que le site de l’infection. Chaque province ou territoire fait annuellement rapport au LNM du nombre total de cultures recueillies et testées, soit dans leur province, leur territoire ou au LNM (tableau 1). Ces totaux sont utilisés comme dénominateurs pour déterminer les proportions de résistance aux médicaments antimicrobiens.
| Année | Culture | C.-B.Note a de Tableau 1 | Alb.Note a de Tableau 1 | Sask.Note b de Tableau 1 | Man.Note b de Tableau 1 | Ont.Note a de Tableau 1 | Qué.Note a de Tableau 1 | N.-É.Note b de Tableau 1 | AutreNote b de Tableau 1Note c de Tableau 1 | Nombre total de cultures | Nombre de cas totaux signalés au Canada | % des cas totaux testés par culture |
|---|---|---|---|---|---|---|---|---|---|---|---|---|
| 2012 | Recueillies | 372 | 497 | 57 | 49 | 1 218 | 838 | 0 | 5 | 3 036 | 12 561 | 24,20 % |
| Envoyées au LNMNote d de Tableau 1 | 92 | 93 | 57 | 8 | 396 | 383 | 0 | 4 | 1 033 | |||
| 2013 | Recueillies | 454 | 514 | 69 | 29 | 1 404 | 716 | 1 | 8 | 3 195 | 13 786 | 23,20 % |
| Envoyées au LNMNote d de Tableau 1 | 170 | 135 | 67 | 7 | 498 | 298 | 1 | 8 | 1 184 | |||
| 2014 | Recueillies | 492 | 468 | 91 | 46 | 1 767 | 918 | 15 | 12 | 3 809 | 16 285 | 23,40 % |
| Envoyées au LNMNote d de Tableau 1 | 335 | 323 | 91 | 46 | 849 | 400 | 14 | 12 | 2 070 | |||
| 2015 | Recueillies | 602 | 793 | 62 | 48 | 1 673 | 986 | 13 | 13 | 4 190 | 19 845 | 21,10 % |
| Envoyées au LNMNote d de Tableau 1 | 387 | 512 | 65 | 44 | 1 076 | 531 | 13 | 10 | 2 638 | |||
| 2016 | Recueillies | 600 | 786 | 86 | 85 | 1 735 | 1 197 | 32 | 17 | 4 538 | 23 708 | 19,10 % |
| Envoyées au LNMNote d de Tableau 1 | 348 | 695 | 85 | 81 | 1 068 | 927 | 31 | 7 | 3 242 | |||
| Total | Recueillies | 2 520 | 3 058 | 365 | 257 | 7 797 | 4 655 | 61 | 55 | 18 768 | 86 185 | 21,80 % |
| Envoyées au LNMNote d de Tableau 1 | 1 332 | 1 758 | 365 | 186 | 3 887 | 2 539 | 59 | 41 | 10 167 | |||
La sensibilité antimicrobienne de la N. gonorrhoeae à l’azithromycine, à la céfixime, à la ceftriaxone, à l’érythromycine, à la pénicilline, à la spectinomycine, à la tétracycline, à la ciprofloxacine, à l’ertapénem et à la gentamicine a été déterminée au moyen de la méthode de dilution en géloseNote de bas de page 28. Les normes d’interprétation de la CMI utilisées ont été recommandées par le CLSINote de bas de page 28 à l’exception de l’érythromycine (R ≥ 2 mg/L)Note de bas de page 29, de l’azithromycine (R ≥ 2 mg/L)Note de bas de page 30, de la ceftriaxone (SR ≥ 0,125 mg/L) et de la céfixime (SR ≥ 0,25 mg/L)Note de bas de page 31, de l’ertapénem (NS ≥ 0,063 mg/L)Note de bas de page 32 et de la gentamicine (R ≥ 32 mg/L)Note de bas de page 33Note de bas de page 34. Les cultures de référence de la N. gonorrhoeae suivantes ont été utilisées à titre de témoins : ATCC49226, WHOF, WHOG, WHOK et WHOP/WHOU. L’analyse statistique a été établie en utilisant EpiCalc 2000 version 1.02 (www.brixtonhealth.com/epicalc.html).
Un test 2 × 2 χ2 a été utilisé pour comparer les proportions de résistance par année afin de repérer les différences importantes entre les années (valeurs p calculées avec des intervalles de confiance de 99 %).
Résultats
De 2012 à 2016, 21,8 % (n = 18 768) des 86 185 cas d’infections de N. gonorrhoeae signalés au Canada ont été diagnostiqués par culture. Les laboratoires provinciaux de santé publique ont soumis 10 167 isolats au LNM pour des tests (2012, n = 1 033; 2013, n = 1 184; 2014, n = 2 070; 2015, n = 2 638; 2016, n = 3 242). Les données sur le sexe et l’âge des patients étaient disponibles pour 10 104 (99,4 %) isolats. De ceux-ci, 8 649 (85,6 %) d’entre eux étaient des hommes (âge médian de 20 ans; intervalle : moins de 1 an à 83 ans) et 1 455 (14,4 %) étaient des femmes (âge médian de 26 ans; intervalle : moins de 1 an à 71 ans). La source des spécimens comprenait l’urètre (n = 4 836), le rectum (n = 2 100), le pharynx (n = 1 367), le col de l’utérus (n = 625), le vagin (n = 249) et d’autres sources (n = 209); la source pour 781 isolats n’a pas été fournie. L’orientation sexuelle des patients et l’information sur les cas d’échec de traitement n’étaient pas disponibles.
Gonorrhée multirésistante
La proportion de gonocoques multirésistants est passée de 6,2 % (n = 189/3 036) en 2012 à 8,9 % (n = 406/4 538) (p < 0,001) en 2016. Ces pourcentages représentent la proportion d’isolats ayant une sensibilité réduite aux céphalosporines ou une résistance à l’azithromycine, ainsi qu’une résistance à deux autres antimicrobiens (figure 1).
Figure 1 : Isolats de Neisseria gonorrhoeae multirésistante et ultrarésistante, Canada, de 2012 à 2016 Figure 1 footnote a
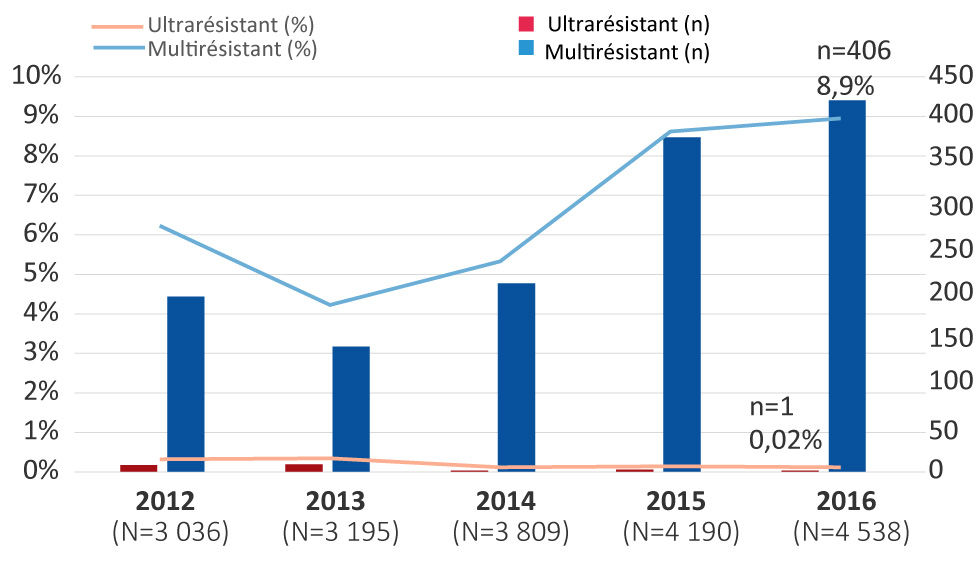
Description textuelle : Figure 1
Figure 1 : Isolats de Neisseria gonorrhoeae multirésistante et ultrarésistante, Canada, de 2012 à 2016 Figure 1 footnote a
Ce graphique est une combinaison de graphiques linéaires et à barres illustrant les pourcentages et le nombre de cas d'isolats de Neisseria gonorrhoeae multirésistants et ultraésistants, Canada, de 2012 à 2016. Les pourcentages sont fondés sur le total nombre d'isolats testés à l'échelle nationale par an.
| Type | 2012 (Nombre total de cas =3 036) |
2013 (Nombre total de cas =3 195) |
2014 (Nombre total de cas =3 809) |
2015 (Nombre total de cas =4 190) |
2016 (Nombre total de cas =4 538) |
|||||
|---|---|---|---|---|---|---|---|---|---|---|
| % | nombre de cas | % | nombre de cas | % | nombre de cas | % | nombre de cas | % | nombre de cas | |
| Ultrarésistant | 0,23 | 7 | 0,25% | 8 | 0,03% | 1 | 0,05% | 2 | 0,02% | 1 |
| Multirésistant | 6,2 | 189 | 4,2% | 135 | 5,3% | 203 | 8,6% | 361 | 8,9% | 406 |
La distribution provinciale des gonocoques multirésistants identifiés au Canada est représentée à la figure 2, avec la proportion la plus élevée identifiée au Québec (67,0 %), suivie de l’Ontario (24,9 %) en 2016. La Colombie-Britannique, l’Alberta, la Nouvelle-Écosse et la Saskatchewan ont également identifié des cas de gonocoques multirésistants en 2016.
Figure 2 : Distribution provinciale des gonocoques multirésistants par année, 2012 à 2016 Figure 2 footnote a
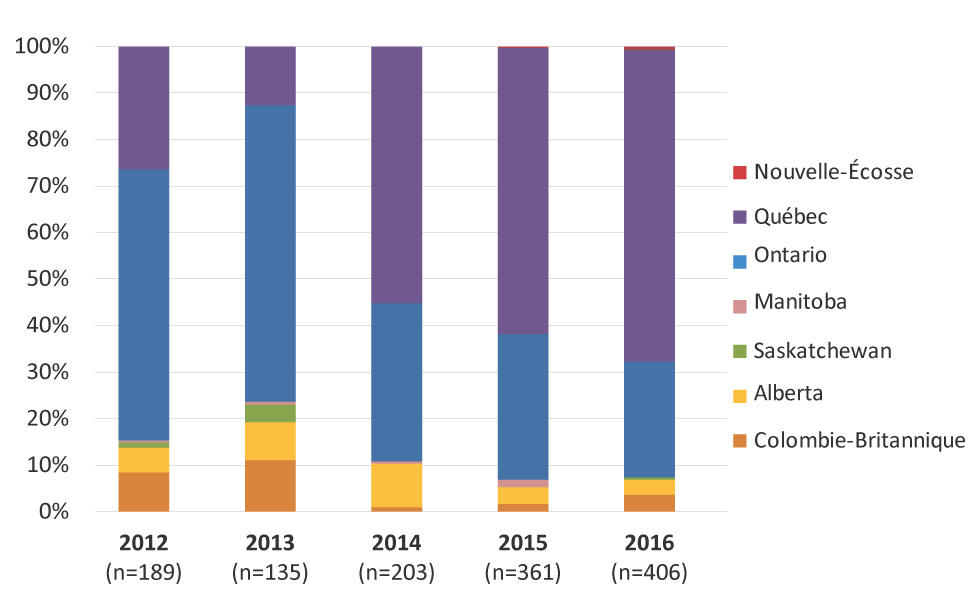
Description textuelle : Figure 2
Figure 2 : Distribution provinciale des gonocoques multirésistants par année, 2012 à 2016 Figure 2 footnote a
Ce graphique est un graphique à barres qui illustre la répartition provinciale des gonocoques multirésistants par année, de 2012 à 2016. Les pourcentages sont basés sur le nombre total de gonocoques multirésistants identifiés chaque année.
| Jurisdiction | 2012 | 2013 | 2014 | 2015 | 2016 |
|---|---|---|---|---|---|
| Nombre de cas au Canada | 189 | 135 | 203 | 361 | 406 |
| Colombie-britannique | 8,47% | 11,11% | 0,99% | 1,66% | 3,69% |
| Alberta | 5,29% | 8,15% | 9,36% | 3,60% | 3,20% |
| Saskatchewan | 1,06% | 3,70% | 0,00% | 0,00% | 0,49% |
| Manitoba | 0,53% | 0,74% | 0,49% | 1,66% | 0,00% |
| Ontario | 58,20% | 63,70% | 33,99% | 31,30% | 24,88% |
| Québec | 26,46% | 12,59% | 55,17% | 61,50% | 67,00% |
| Nouvelle-Écosse | 0,00% | 0,00% | 0,00% | 0,28% | 0,74% |
Les tendances temporelles des gonocoques multirésistants au sein de chaque province sont représentées à la figure 3; les provinces affichant les proportions les plus élevées de gonocoques multirésistants en 2016 comptaient le Québec (22,7 %) suivi de la Nouvelle-Écosse (9,4 %) et de l’Ontario (5,8 %).
Figure 3 : Proportion de gonocoques multirésistants dans chaque province de 2012 à 2016 Figure 3 footnote a
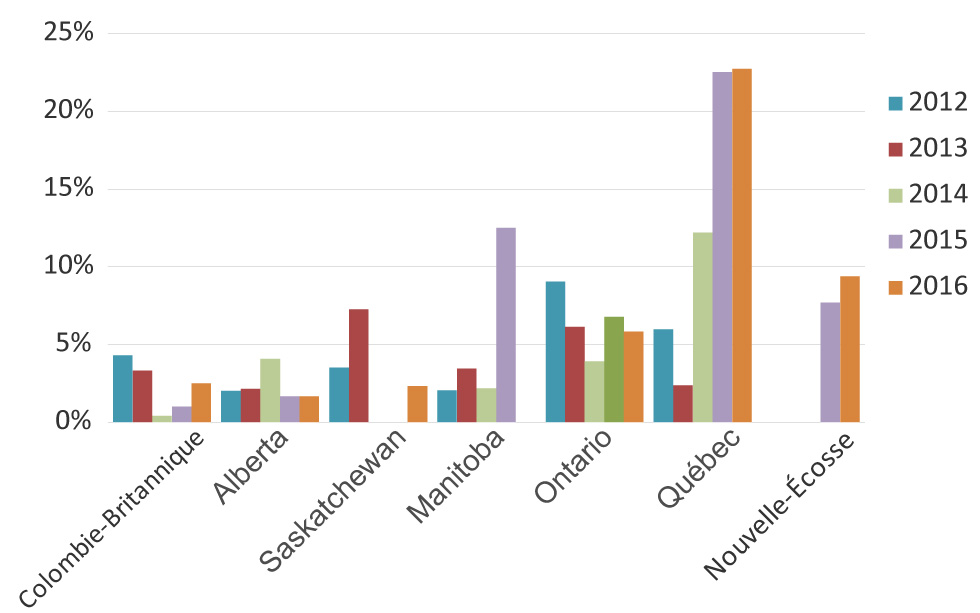
Description textuelle : Figure 3
Figure 3 : Proportion de gonocoques multirésistants dans chaque province de 2012 à 2016 Figure 3 footnote a
Ce graphique est un graphique à barres qui représente la proportion de gonocoques multirésistants dans chaque province de 2012 à 2016. Les pourcentages sont basés sur le nombre total de cultures testées dans chaque province.
| Province | 2012 | 2013 | 2014 | 2015 | 2016 |
|---|---|---|---|---|---|
| Colombie-britannique | 4,30% | 3,30% | 0,41% | 1,00% | 2,50% |
| Alberta | 2,01% | 2,14% | 4,06% | 1,64% | 1,65% |
| Saskatchewan | 3,51% | 7,25% | 0,00% | 0,00% | 2,33% |
| Manitoba | 2,04% | 3,45% | 2,17% | 12,50% | 0,00% |
| Ontario | 9,03% | 6,13% | 3,90% | 6,75% | 5,82% |
| Québec | 5,97% | 2,37% | 12,20% | 22,52% | 22,72% |
| Nouvelle-Écosse | 0,00% | 0,00% | 0,00% | 7,69% | 9,38% |
La figure 4 représente les tendances observées chez les agents antimicrobiens associés aux gonocoques multirésistants. La proportion des gonocoques multirésistants associés à la résistance à l’azithromycine a augmenté de façon importante (p < 0,001), passant de 9,5 % en 2012 à 78,3 % en 2016). À l’inverse, la proportion de gonocoques multirésistants associés à la sensibilité réduite à la céfixime et à la ceftriaxone a diminué de façon importante (p < 0,001), passant de 29,6 % en 2012 à 1,2 % en 2016.
Figure 4 : Tendances des agents antimicrobiens en présence de gonocoques multirésistants, 2012 à 2016 Figure 4 footnote a
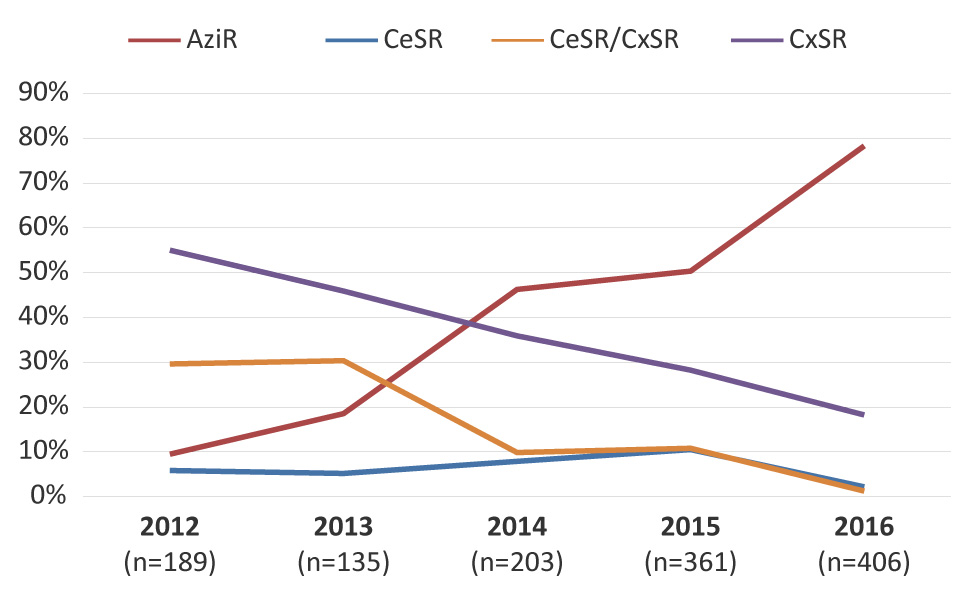
Description textuelle : Figure 4
Figure 4 : Tendances des agents antimicrobiens en présence de gonocoques multirésistants, 2012 à 2016 Figure 4 footnote a
Cette figure est un graphique linéaire qui montre les tendances des antimicrobiens associés aux gonocoques multirésistants de 2012 à 2016. Les pourcentages sont basés sur le nombre total de gonocoques multirésistants par an.
| 2012 | 2013 | 2014 | 2015 | 2016 | |
|---|---|---|---|---|---|
| Nombre de cas | 189 | 135 | 203 | 361 | 406 |
| Résistance à l’azithromycine | 9,52% | 18,52% | 46,31% | 50,42% | 78,33% |
| Sensibilité réduite à la céfixime | 5,82% | 5,19% | 7,88% | 10,53% | 2,22% |
| Sensibilité réduite à la céfixime et à la ceftriaxone | 29,63% | 30,37% | 9,85% | 10,80% | 1,23% |
| Sensibilité réduite à la ceftriaxone | 55,03% | 45,93% | 35,96% | 28,25% | 18,23% |
La figure 5 représente les tendances de gonocoques multirésistants dotés d’une résistance à deux, à trois ou à quatre antimicrobiens supplémentaires. La proportion de gonocoques multirésistants dotés d’une résistance à trois autres antimicrobiens a augmenté de façon importante, (p < 0,001) passant de 3,7 % en 2012 à 61,6 % en 2016. La ciprofloxacine, l’érythromycine et la tétracycline étaient les antimicrobiens les plus communs pour lesquels la corésistance a été observée.
Figure 5 : Tendances des gonocoques multirésistants dotés d’une résistance à deux, à trois ou à quatre antimicrobiens supplémentaires Figure 5 footnote a
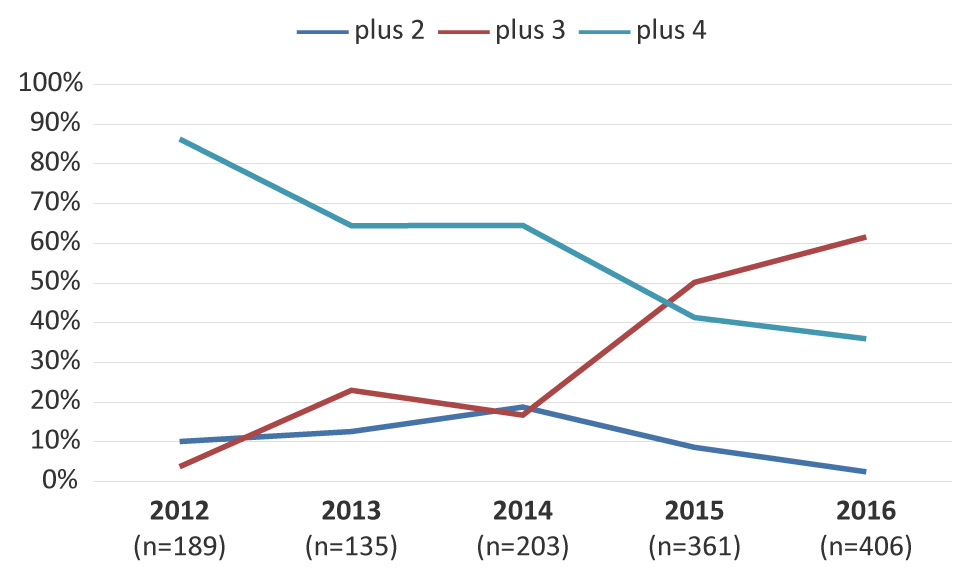
Description textuelle : Figure 5
Figure 5 : Tendances des gonocoques multirésistants dotés d’une résistance à deux, à trois ou à quatre antimicrobiens supplémentaires Figure 5 footnote a
Cette figure est un graphique linéaire illustrant les tendances des gonocoques multirésistants dotés d’une résistance à deux, à trois ou à quatre antimicrobiens supplémentaires. Les pourcentages sont basés sur le nombre total de gonocoques multirésistants par an.
| 2012 | 2013 | 2014 | 2015 | 2016 | |
|---|---|---|---|---|---|
| Nombre de cas | 189 | 135 | 203 | 361 | 406 |
| Résistance à deux antimicrobiens supplémentaires | 10,05% | 12,59% | 18,72% | 8,59% | 2,46% |
| Résistance à trois antimicrobiens supplémentaires | 3,70% | 22,96% | 16,75% | 50,14% | 61,58% |
| Résistance à quatre antimicrobiens supplémentaires | 86,24% | 64,44% | 64,53% | 41,27% | 35,96% |
Gonocoques ultrarésistants
De 2012 à 2016, seulement 19 cas de gonocoques ultrarésistants ont été identifiés au Canada (0,1 %, n = 19/18 768). En 2012, sept isolats de gonocoques ultrarésistants dotés d’une sensibilité réduite aux céphalosporines et d’une résistance à l’azithromycine ont été identifiés (0,2 %, n = 7/3 036; Ontario n = 6; Colombie-Britannique n = 1), nombre qui est passé à huit (0,3 %, n = 8/3 195; Ontario n = 5; Colombie-Britannique n = 2; Saskatchewan n = 1) en 2013. De 2014 à 2016, toutefois, le nombre de gonocoques ultrarésistants était inférieur : en 2014, un seul cas a été identifié (0,03 %, n = 1/3 809; Québec); en 2015, deux cas ont été signalés (0,05 %, n = 2/4 190; Ontario n = 1; Québec n = 1); et en 2016, un seul cas a été isolé (0,02 %, n = 1/4 538; Colombie-Britannique) (figure 1).
Tendances au niveau des modèlesde résistance
La proportion de cas de N. gonorrhoeae qui ont été identifiés comme étant sensibles à tous les antimicrobiens testés a diminué de façon importante (p < 0,001), passant de 67,5 % en 2012 à 35,4 % en 2016.
En 2012, 2,2 % (n = 68/3 036) des isolats avaient une sensibilité réduite à la céfixime. Cette proportion a diminué de façon importante (p < 0,001) à 0,3 % (n = 14/4 538) en 2016 (figure 6). De façon similaire, la sensibilité réduite à la ceftriaxone atteignait 5,5 % (n = 168/3 036) en 2012 et a diminué de façon marquée (p < 0,001) pour atteindre 1,8 % (n = 80/4 538) avant le début de 2016 (figure 6).
Figure 6 : Sensibilité réduite à la céfixime et à la ceftriaxone et résistance à l’azithromycine pour les isolats de Neisseria gonorrhoeae au Canada, 2012–2016 Figure 6 footnote a
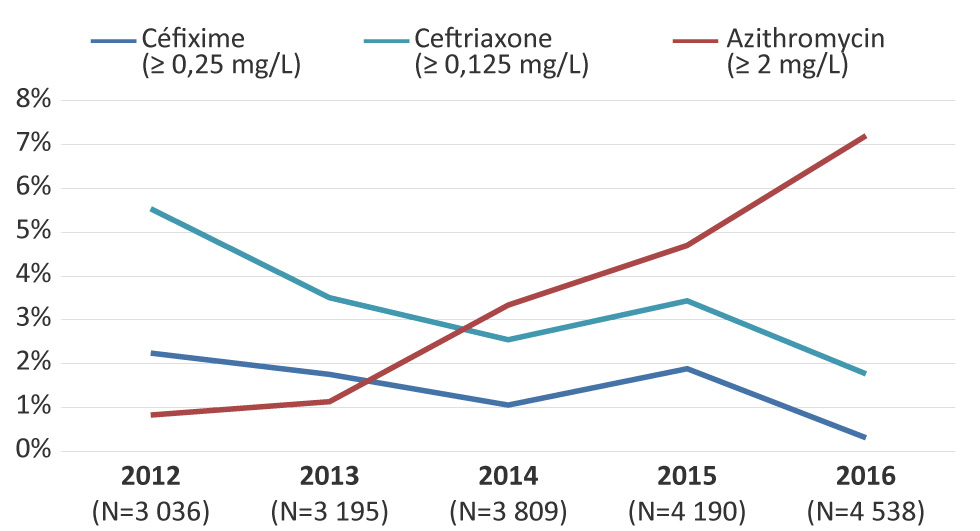
Description textuelle : Figure 6
Figure 6 : Sensibilité réduite à la céfixime et à la ceftriaxone et résistance à l’azithromycine pour les isolats de Neisseria gonorrhoeae au Canada, 2012–2016 Figure 6 footnote a
Cette figure est un graphique linéaire qui montre une sensibilité réduite à la céfixime et à la ceftriaxone ainsi qu'une résistance à l'azithromycine pour les isolats de Neisseria gonorrhoeae au Canada de 2012 à 2016. Le pourcentage basé sur le nombre total d'isolats testés à l'échelle nationale.
| Nombre total de cas | Céfixime (supérieur ou égal à 0.25 mg/L) | Ceftriaxone (supérieur ou égal 0.125 mg/L) | Azithromycine (supérieur ou égal 2 mg/L) | |
|---|---|---|---|---|
| 2012 | 3 036 | 2,2% | 5,5% | 0,8% |
| 2013 | 3 195 | 1,8% | 3,5% | 1,1% |
| 2014 | 3 809 | 1,1% | 2,5% | 3,3% |
| 2015 | 4 190 | 1,9% | 3,4% | 4,7% |
| 2016 | 4 538 | 0,3% | 1,8% | 7,2% |
La proportion de la résistance à l’azithromycine a augmenté de façon marquée (p < 0,001), passant de 0,8 % (n = 25/3 036) en 2012 à 7,2 % (n = 327/4 538) en 2016 (figure 6). Les CMI modales des isolats résistants à l’azithromycine ont diminué, passant de 8 mg/L entre 2012 et 2014 à 2 mg/L en 2015 et en 2016. La plage des valeurs des CMI variait entre 2 mg/L et 16 mg/L entre 2012 et 2015. En 2016, la plage des valeurs variait entre 2 mg/L et 32 mg/L. Huit isolats affichaient un CMI de 32 mg/L en 2016. Six de ces isolats étaient des gonocoques multirésistants tandis que les deux autres étaient seulement résistants à l’azithromycine et à l’érythromycine. Les plages ci-dessus n’incluaient pas deux isolats ayant un niveau élevé de résistance à l’azithromycine (CMI d’azithromycine supérieure ou égale à 256 mg/L), qui ont été identifiés en 2012 (n = 1) et en 2016 (n = 1). Les deux isolats très résistants à l’azithromycine ont été classés comme des gonocoques multirésistants. En 2016, la résistance à l’azithromycine a été décelée dans six provinces avec plus de 90 % des cas (n = 306/327) identifiés au Québec et en Ontario (Québec, 64,5 %; Ontario, 28,1 %; Colombie-Britannique, 2,1 %; Alberta, 3,0 %; Nouvelle-Écosse, 0,9 %; et Saskatchewan, 0,3 %).
En 2016, 47,1 % (n = 2 136/4 538) des isolats étaient résistants à la ciprofloxacine; 31,7 % (n = 1 439/4 538) à l’érythromycine; 17,4 % (n = 791/4 538) à la pénicilline; et 53,3 % (n = 2 419/4 538) à la tétracycline. La majorité de ces isolats étaient résistants à plus d’un antimicrobien. Dans aucun des isolats testés en 2016 la résistance à la spectinomycine n’a été détectée.
Discussion
La proportion d’isolats de gonocoques multirésistants au Canada a augmenté entre 2012 et 2016. Même si la proportion de N. gonorrhoeae dotée d’une sensibilité réduite aux céphalosporines a diminué, la proportion des isolats résistants à l’azithromycine a augmenté, menant à l’augmentation globale des gonocoques multirésistants. Les gonocoques ultrarésistants sont rares au Canada et la proportion cernée a diminué entre 2012 et 2016 en raison de la diminution des isolats dotés d’une sensibilité réduite aux céphalosporines.
En 2013, les lignes directrices canadiennes pour le traitement des infections gonococciques non-complexes ont remplacé la monothérapie basée sur des céphalosporines de troisième génération par une thérapie combinant la ceftriaxone et l’azithromycineNote de bas de page 6. Lorsque la thérapie combinée a été introduite, une tendance vers une baisse de sensibilité réduite à la céphalosporine a été observée. Le Royaume-Uni, l’Australie et les États-Unis ont signalé des tendances similaires. La thérapie combinée aux antimicrobiens (500 mg de ceftriaxone par voie intramusculaire et 1 g d’azithromycine par voie orale, en une seule dose) était recommandée pour le traitement des infections gonococciques non-complexes au Royaume-Uni en 2011Note de bas de page 35. Après la mise en œuvre des nouvelles lignes directrices, les isolats associés à une sensibilité réduite à la céfixime ont diminué de façon marquée, passant de 10,8 % en 2011 à 5,2 % en 2013Note de bas de page 36, puis à 0,6 % en 2015Note de bas de page 37. L’Australie a également modifié ses lignes directrices recommandées pour le traitement (à 500 mg de ceftriaxone et 1 g d’azithromycine) en 2013Note de bas de page 38. La proportion d’isolats avec une sensibilité réduite à la ceftriaxone a diminué, passant de 4,4 % en 2012Note de bas de page 39 à 1,1 % en 2017Note de bas de page 40. La thérapie recommandée pour les infections gonococciques non-complexes aux États-Unis a été révisée afin d’inclure la ceftriaxone (250 mg par voie intramusculaire) en combinaison avec l’azithromycine (1 g par voie orale) en 2012Note de bas de page 41. Aux États-Unis, la sensibilité réduite à la céfixime a diminué de 0,9 % en 2012 à 0,3 % en 2016 et la sensibilité réduite à la ceftriaxone est restée stable à 0,3 % en 2012 et en 2016Note de bas de page 42.
Même si la proportion de sensibilité réduite aux céphalosporines a diminué au Canada, la proportion d’isolats résistants à l’azithromycine a augmenté à 7,2 % en 2016Note de bas de page 5, la majorité des cas ayant été identifiés au Québec et en Ontario. Lorsque la résistance antimicrobienne est établie dans une région, il y a un risque élevé que ces isolats se propagent dans les territoires de compétence voisins en raison des échanges personnels et sociauxNote de bas de page 43. En 2016, le niveau de résistance a dépassé le niveau de 5 % où l’Organisation mondiale de la santé recommande de revoir et de modifier les lignes directrices nationales pour le traitement des infections transmissibles sexuellementNote de bas de page 25. L’Australie a signalé des niveaux semblables de résistance à l’azithromycine (9,3 % en 2017)Note de bas de page 44 au Canada; toutefois, les niveaux aux États-Unis (3,6 % en 2016)Note de bas de page 37 et au Royaume-Uni (4,7 % en 2016 [CMI supérieure ou égale à 1 mg/L])Note de bas de page 45 étaient inférieurs.
Le Royaume-Uni et l’Australie ont récemment fait rapport d’échecs thérapeutiques attribuables aux niveaux élevés de gonocoques ultrarésistants à la ceftriaxone (CMI = 0,5 mg/L) et à la résistance élevée à l’azithromycine (CMI supérieure ou égale à 256 mg/L)Note de bas de page 24. Ces souches de gonocoques ultrarésistants menacent le succès de la thérapie actuellement recommandée. Avec le risque émergent de la résistance à la ceftriaxone et le taux croissant de résistance à l’azithromycine, les Lignes directrices canadiennes sur les infections ansmissibles sexuellement ont ajouté une thérapie combinée de remplacement (gentamicine, 240 mg par voie intramusculaire plus azithromycine, 2 g par voie orale) à la liste de thérapies gonococciques recommandées.
Forces et limites
La force de cette étude repose sur un système de surveillance national axé sur les laboratoires qui peut suivre l’évolution des tendances des modèles de résistance des gonocoques aux agents antimicrobiens au fil du temps. Les limites de cette étude incluent la représentativité des isolats recueillis dans un système de surveillance passif qui peut être biaisé vers les cultures isolées des populations particulières sollicitant un traitement dans des cliniques qui fournissent des diagnostics de culture. Ces limites peuvent mener à l’absence considérable de données concernant les populations touchées. Les données épidémiologiques sont limitées et il y a un manque de données connexes aux facteurs de risque et à la démographie. Au Canada, les cultures étaient uniquement disponibles pour environ 22 % des cas déclarés pour la période de cette étude et les autres cas ont été diagnostiqués en utilisant le TANNote de bas de page 5; pour ces cas, la sensibilité aux agents antimicrobiens était inconnue. De plus, les provinces recueillent des cultures selon leurs propres lignes directrices provinciales et effectuent des tests de sensibilité aux agents antimicrobiens en utilisant différentes méthodes de tests de sensibilité.
Prochaines étapes
Pour traiter le manque de données de surveillance dans les territoires de compétence qui ont des données uniquement du TAN, le LNM a élaboré des tests qui peuvent être utilisés pour prédire la résistance aux antimicrobiens et le type de séquence directement des spécimens de TANNote de bas de page 46Note de bas de page 47Note de bas de page 48. Même si ces tests ne peuvent pas remplacer le calcul de la CMI axée sur les cultures, ils peuvent aider à la surveillance en prédisant la sensibilité antimicrobienne à la céphalosporine, à la ciprofloxacine et à l’azithromycine et ils peuvent, doublés des méthodes d’identification moléculaires, contribuer à augmenter la compréhension des types de gonorrhée circulant dans une collectivité. Ce travail n’est pas réalisé systématiquement, mais il est réservé aux régions éloignées où la culture bactérienne n’est pas possible.
Pour traiter certaines des limites associées au programme national de surveillance passive en laboratoire, l’ASPC a lancé le système de surveillance accrue de la résistance de la gonorrhée aux antimicrobiens en 2013Note de bas de page 49. Les données de laboratoire, comme les données de sensibilité aux antimicrobiens et le typage de séquence, sont liées aux données épidémiologiques améliorées, ce qui inclut les données démographiques et les renseignements cliniques, les comportements à risque, le site d’infection et les renseignements sur le traitement prescritNote de bas de page 49. Ce programme de surveillance amélioré en laboratoire lié à l’épidémiologie est actuellement réalisé dans plusieurs provinces et on prévoit l’étendre à plusieurs autres territoires de compétence. Ces données amélioreront la compréhension de la N. gonorrhoeae résistante aux antimicrobiens au Canada et fourniront de meilleures données probantes pour éclairer l’élaboration de lignes directrices pour le traitement et les interventions en matière de santé publique.
Conclusion
Même si les taux de gonocoques multirésistants ont augmenté entre 2012 et 2016, les cas de gonocoques ultrarésistants au Canada sont rares à l’heure actuelle. Les données présentées dans ce rapport soutiennent les efforts visant à limiter la propagation de la N. gonorrhoeae résistante aux antimicrobiens et à prévenir l’émergence des cas de gonocoques ultrarésistants. Dans certaines parties du Canada, les cas de gonocoques résistants à l’azithromycine ont dépassé le niveau de 5 %, soit le seuil à partir duquel l’Organisation mondiale de la santé recommande de revoir et de modifier les traitements en conséquence. La surveillance continue de la sensibilité gonococcique aux antimicrobiens est vitale afin d’éclairer les lignes directrices du traitement et d’atténuer la propagation des cas de gonocoques multirésistants et ultrarésistants.
Déclaration des auteurs
IM – Conceptualisation, Méthodologie, Validation, Visualisation, Supervision, Administration de projet, Rédaction – ébauche originale, révision et rédaction de la version définitive
PS – Enquête, Conservation des données, Analyse officielle, Visualisation, Rédaction – ébauche originale (sections originales), révision et rédaction de la version définitive
VA – Ressources, Méthodologie, Rédaction – révision et édition
BL – Ressources, Méthodologie, Rédaction – révision et édition
LMNH – Ressources, Méthodologie, Rédaction – révision et édition
PN – Ressources, Méthodologie, Rédaction – révision et édition
JM – Ressources, Méthodologie, Rédaction – révision et édition
PVC – Ressources, Méthodologie, Rédaction – révision et édition
DH – Ressources, Méthodologie, Rédaction – révision et édition
RRG – Ressources, Méthodologie, Rédaction – révision et édition
GZ – Ressources, Méthodologie, Rédaction – révision et édition
AC – Ressources, Méthodologie, Rédaction – révision et édition
GG – Ressources, Méthodologie, Rédaction – révision et édition
KT – Rédaction – révision et édition
MRM – Méthodologie, Administration de projet, Rédaction – révision et édition
Conflit d’intérêts
Aucun.
Remerciements
Les auteurs aimeraient remercier Gary Liu et Norman Barairo pour leur soutien technique.
Financement
Le présent travail a été soutenu par l’Agence de la santé publique du Canada.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International