Étude des méningococcies invasives chez les enfants

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 46–10 : Biosécurité en Laboratoire
Date de publication : 1er octobre 2020
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 46–10, le 1er octobre 2020 : Biosécurité en Laboratoire
Aperçu
Étude du Réseau collaboratif des chercheurs pédiatriques sur les infections au Canada (PICNIC) sur le paysage actuel des méningococcies invasives chez les enfants
Joan L Robinson1*, Sergio Fanella2, Alison Lopez2, Craig Frankel3, Jane McDonald4, Mohammad Alghounaim4, Robert Slinger5, Jennifer Bowes5, Sarah Khan6, Jeannette L Comeau7, Kirk Leifso8, John Gunawan1, Michelle Barton3
Affiliations
1 Service de pédiatrie, Université de l’Alberta, Edmonton, AB
2 Service de pédiatrie, Université du Manitoba, Winnipeg, MB
3 Service de pédiatrie, Université Western, London, ON
4 Service de pédiatrie, Université McGill, Montréal, QC
5 Service de pédiatrie, Université d’Ottawa, Ottawa, ON
6 Service de pédiatrie, Université McMaster, Hamilton, ON
7 Service de pédiatrie, Université Dalhousie, Halifax, NS
8 Service de pédiatrie, Université Queen’s, Kingston, ON
Correspondance
Citation proposée
Robinson JL, Fanella S, Lopez A, Frankel C, McDonald J, Alghounaim M, Slinger R, Bowes J, Khan S, Comeau JL, Leifso K, Gunawan J, Barton M. Étude du Réseau collaboratif des chercheurs pédiatriques sur les infections au Canada (PICNIC) sur le paysage actuel des méningococcies invasives chez les enfants. Relevé des maladies transmissibles au Canada 2020;46(10):383–7. https://doi.org/10.14745/ccdr.v46i10a05f
Mots-clés : immunisation, méningococcie, méningococcie invasive, sérotype W
Résumé
Contexte : La vaccination a entraîné une diminution de l’incidence de la méningococcie invasive au Canada, mais cette infection est toujours à l’origine d’un taux de morbidité et d’une mortalité important.
Objectifs : L’objectif de cette étude était de déterminer la charge de morbidité et la gestion de la méningococcie invasive dans les hôpitaux pédiatriques.
Méthodes : Des données ont été recueillies sur tous les cas de méningococcie invasive dans huit hôpitaux pédiatriques entre 2013 et 2017.
Résultats : Il y a eu 17 cas de méningococcie invasive. Trois des huit hôpitaux n’avaient aucun cas. Un peu plus de la moitié des cas étaient du sérogroupe B (n = 9); un quart (n = 4) étaient du sérogroupe W; moins d’un quart (n = 3) étaient du sérogroupe Y; et un était inconnu. Deux enfants infectés n’ont commencé à prendre des antibiotiques qu’au premier et au cinquième jour après la première hémoculture, mais leur rétablissement s’est fait sans incident. Six cas ont nécessité une admission en unité de soins intensifs; deux sont morts. Six cas de méningite probable ou avérée. La thrombocytopénie a été documentée dans sept cas. Tous les cas présentaient des taux élevés de protéine C réactive. Sept enfants ont reçu plus de sept jours d’antibiotiques; sur ces sept enfants, seuls deux présentaient des complications justifiant un traitement prolongé (empyème sous-dural et genou septique). Un cathéter veineux central a été placé dans six cas.
Conclusion : La méningococcie invasive est désormais rare chez les enfants canadiens, mais environ un tiers des cas de notre étude ont nécessité un traitement dans l’unité de soins intensifs et deux sont morts. Les cliniciens ne semblent pas toujours être conscients qu’un cours de cinq à sept jours est suffisant pour les cas simples de bactériémie ou de méningite.
Introduction
La méningococcie invasive se manifeste par une bactériémie avec ou sans ensemencement d’autres sites, y compris les méninges. Malgré les progrès notables réalisés dans le domaine des soins intensifs, la méningococcie invasive entraîne toujours une morbidité et une mortalité importantes dans le monde entier, avec des taux de plus de 200 cas pour 100 000 habitants dans certains pays au cours de certaines annéesNote de bas de page 1.
Un nombre croissant de cas dus à une souche virulente du sérogroupe C du complexe clonal (CC) de type de séquence 11 (ST-11) a été observé pour la première fois en 1986 au Canada, avec une flambée du nombre de cas entre 1999 et 2001Note de bas de page 2. En réponse à ces flambées de cas, des vaccins monovalents contre le méningocoque du sérogroupe C ont été ajoutés aux programmes de vaccination systématique des nourrissons dans tout le Canada entre 2002 et 2007Note de bas de page 2. Toutes les juridictions fournissent une dose à l’âge de 12 mois et certaines fournissent également des doses à des âges plus jeunesNote de bas de page 3. Une dose de vaccin quadrivalent est désormais fournie aux adolescents au Canada, à l’exception du Québec, où une dose de rappel du vaccin C monovalent est administréeNote de bas de page 4.
L’incidence de la méningococcie invasive au Canada a diminué en passant d’environ 1,5 cas pour 100 000 habitants entre 1990 et 1992 à 0,5 cas pour 100 000 habitants entre 2006 et 2011Note de bas de page 5, principalement en raison de la quasi-disparition de la maladie due au sérogroupe CNote de bas de page 6.
On ne dispose pas de données nationales actualisées sur l’utilisation des vaccins méningococciques pour les nourrissons ou les adolescents au Canada, mais en extrapolant à partir d’autres vaccins, il semble probable que le taux de vaccination soit d’environ 85 % pour le vaccin pour nourrissons et un peu moins pour le vaccin pour adolescentsNote de bas de page 7. L’efficacité du vaccin est difficile à étudier en raison de la rareté de la méningococcie invasive, mais une diminution des titresNote de bas de page 8 et des échecs vaccinauxNote de bas de page 9 ont été décrits dans le cas du vaccin C monovalent dans d’autres pays. À ce jour, il n’existe aucune preuve que le remplacement du sérotype ait eu lieu avec les vaccins antiméningococciques au CanadaNote de bas de page 3Note de bas de page 6 ou ailleursNote de bas de page 10.
Des données nationales sur la méningococcie invasive ont été publiées dans des publications évaluées par des pairs depuis 2011Note de bas de page 5. L’objectif de cette étude était de décrire les caractéristiques, la prise en charge et les résultats chez les enfants atteints de méningococcie invasive dans les hôpitaux pédiatriques de soins tertiaires au Canada au cours des dernières années.
Méthodes
Cette étude rétrospective d’examen des dossiers a été menée par le Réseau collaboratif des chercheurs pédiatriques sur les infections au Canada (Paediatric Investigators Collaborative Network on Infections in Canada – PICNIC) dans huit hôpitaux pédiatriques de soins tertiaires participants à Halifax, Montréal, Ottawa, Kingston, Hamilton, London, Winnipeg et Edmonton. La méningococcie invasive a été définie comme une culture sanguine positive à la bactérie Neisseria meningitidis. Sur chacun des sites, le laboratoire local a identifié des patients hospitalisés et des patients externes, âgés de 17 ans au plus, dont les hémocultures étaient positives à la bactérie N. meningitidis, du 1er janvier 2013 au 31 décembre 2017. Les cas de bactériémie avec des hémocultures positives pour des espèces autres que la N. meningitidis ont été exclus. Il n’y a pas eu d’autres exclusions.
Des examens de dossiers des cas identifiés par les laboratoires ont ensuite été effectués. Des données sur la démographie, l’évolution clinique, le traitement et le résultat des cas admissibles ont été saisies dans REDCap (Research Electronic Data Capture), une application web sécurisée pour la création et la gestion d’enquêtes et de bases de données en ligne, hébergées par l’Université de l’Alberta. Compte tenu de la petite taille de l’échantillon, l’analyse des données a été limitée à des statistiques descriptives.
L’autorisation de mener l’étude a été obtenue auprès du comité d’éthique de chaque site.
Résultats
Caractéristiques des cas de méningococcie invasive
De 2013 à 2017, cinq des huit sites participants ont signalé 17 cas de bactériémie à la N. meningitidis, dont quatre cas par an en 2013 et 2014, et trois cas par an en 2015, 2016 et 2017. Les trois autres sites n’ont pas connu de cas de bactériémie due à la N. meningitidis.
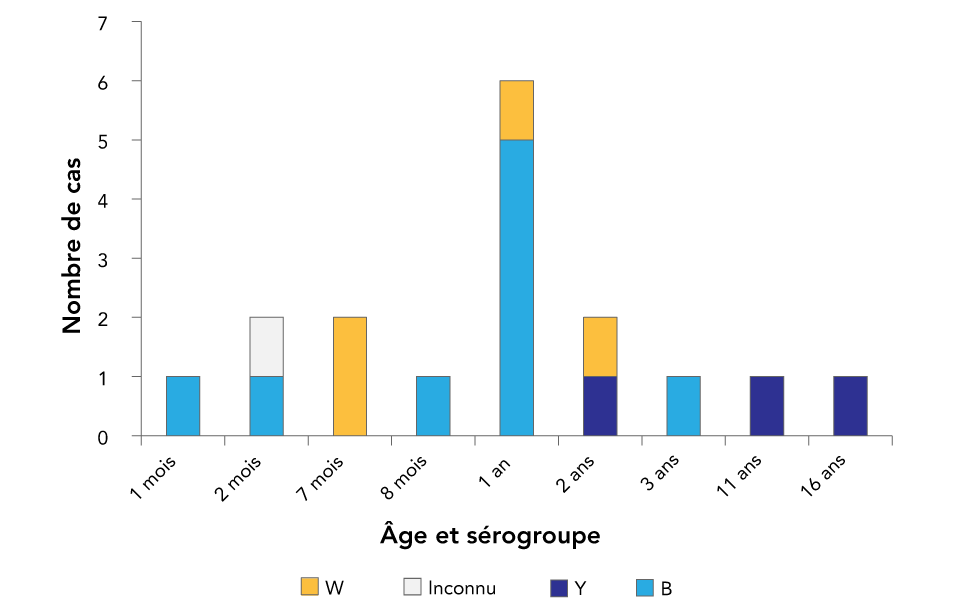
Cinq cas de bactériémie dus à d’autres espèces de Neisseria ont été exclus : deux cas de N. sicca, un cas de N. mucosa, un cas de N. gonorrhea et un cas d’une espèce non identifiée. Un peu plus de la moitié des cas (n = 9) étaient du sérogroupe B; un quart (n = 4) étaient du sérogroupe W; moins d’un quart (n = 3) étaient du sérogroupe Y; et un était d’un sérogroupe inconnu (figure 1).
Figure 1 : Âge et sérogroupe des cas de méningococcie invasive (n = 17) dans huit hôpitaux pédiatriques de soins tertiaires dans les centres urbains, Canada, de 2013 à 2017
Description textuelle : Figure 1
Figure 1 : Âge et sérogroupe des cas de méningococcie invasive (n = 17) dans huit hôpitaux pédiatriques de soins tertiaires dans les centres urbains, Canada, de 2013 à 2017
Il y a eu des cas uniques de sérogroupe B âgé d’un, de deux et de huit mois, cinq cas âgés d’un an et un autre cas unique âgé de trois ans. Pour le sérogroupe W, il y a eu deux cas âgés de sept mois et des cas uniques âgés d’un an et deux ans. Il y a eu des cas uniques de sérogroupe Y âgés de 2, 11 et 16 ans. Le sérogroupe était inconnu pour un cas unique âgé de deux mois.
Sur les 17 enfants, 13 étaient des garçons et six avaient moins de 12 mois (figure 1). Deux cas présentaient des conditions sous-jacentes majeures : un enfant de deux mois avait une gastroschisis réparée et un enfant d’un an souffrait d’une défaillance intestinale, et aucun de ces deux cas n’a été lié à la méningococcie invasive. Cependant, un cas de deux ans a été diagnostiqué par la suite comme souffrant d’une déficience du composant 8 du complément, qui augmente effectivement le risque de méningococcie invasive.
Déroulement clinique des cas
Trois patients de petits hôpitaux ont été transférés vers les sites participants pour des raisons inconnues. Tous, sauf deux, ont été admis le jour de la collecte de l’hémoculture et ont commencé une antibiothérapie empirique qui a couvert la N. meningitidis. Un patient fébrile âgé de deux mois, dont la gastroschisis avait été réparée, a été renvoyé chez lui et admis sous antibiotiques le jour suivant, lorsque l’hémoculture a révélé la présence de bacilles Gram-négatifs. Un patient de trois ans sans antécédents de fièvre a été admis cinq jours après le prélèvement d’un échantillon de sang pour une culture lorsque la croissance de N. meningitidis a été constatée; la raison de l’obtention de l’hémoculture était inconnue et l’enfant était toujours bactériémique à l’admission. Dans les deux cas, le traitement retardé s’est poursuivi sans complication.
Des données sur la fièvre étaient disponibles pour 15 cas. À l’exception de l’enfant de trois ans mentionné ci-dessus qui n’a jamais été fébrile, tous ont eu de la fièvre avant ou dans les 24 heures suivant leur admission à l’hôpital. Trois enfants sont restés fébriles pendant plus de 72 heures après avoir commencé à prendre des antibiotiques appropriés; tous avaient probablement une méningite.
Six des 17 cas ont nécessité une admission à l’unité de soins intensifs, quatre d’entre eux nécessitant une respiration mécanique. Deux des patients, un jeune de 16 ans atteint du sérogroupe Y et un autre d’un an atteint du sérogroupe B, sont morts respectivement le 5ème et le 18ème jour de leur séjour en soins intensifs; tous deux présentaient des tissus nécrotiques importants. Les quatre autres patients sont restés dans l’unité de soins intensifs pendant 1, 2, 6 et 22 jours. L’enfant qui est resté le plus longtemps a dû subir une amputation bilatérale sous le genou.
Résultats de laboratoire
On ne sait pas combien d’enfants sur 17 ont subi des ponctions lombaires pour un diagnostic définitif de méningite, mais deux cas de méningite ont été prouvés et quatre étaient des méningites probables. Les deux cas avérés, pour lesquels la N. meningitidis a été identifiée dans le liquide céphalorachidien, étaient un enfant de deux mois et un autre de deux ans.
Les deux premiers cas probables étaient un enfant de deux mois et un enfant de sept mois présentant un liquide céphalorachidien stérile avec pléocytose (obtenue après antibiotiques); l’enfant de sept mois a développé un empyème sous-dural. Les deux autres cas probables étaient le jeune de 16 ans décédé et un enfant d’un an qui a fait une crise fébrile et qui a été renvoyé à la maison sous amoxicilline trois jours avant la prise de sang positive; aucun des deux n’ayant subi de ponction lombaire. Parmi les autres sites d’infection, on peut citer l’arthrite septique du genou chez un enfant de deux ans et la cellulite circonférentielle du bras, que l’on pensait initialement être un syndrome de compartiment chez un enfant d’un mois.
Le nombre initial de globules blancs périphériques variait entre 2,0 et 36,9 × 109/L (moyenne 17,1 × 109/L), le pic de numération des globules blancs allant de 13,7 à 40,9 × 109/L (moyenne 24,3 × 109/L). Sept enfants ont eu une thrombocytopénie (< 150 × 109/L). Le pic moyen de protéine C réactive était de 121 mg/L dans les neuf cas où il a été mesuré (intervalle : de 50,7 à 189,9 mg/L).
Thérapie antimicrobienne
La durée médiane de l’antibiothérapie pour la méningococcie invasive était de sept jours (minimum de cinq jours et maximum de 17 jours). Sept enfants ont reçu un traitement antibiotique de plus de sept jours; deux seulement, les cas d’empyème subdural et d’arthrite septique, ont clairement nécessité un traitement antibiotique de plus de sept jours.
Le traitement était à la ceftriaxone dans tous les cas sauf un; ce patient était traité au céfotaxime. Les patients ont été admis pour toute la durée du traitement aux antibiotiques par voie intraveineuse, à l’exception d’un patient qui a été traité le sixième (et dernier) jour en tant que patient externe. Les antibiotiques oraux ont été utilisés uniquement pour l’enfant souffrant d’arthrite septique qui a reçu un traitement de sept jours à l’amoxicilline-clavulanate après huit jours de ceftriaxone.
Dix patients ont été pris en charge avec une canulation intraveineuse périphérique uniquement; sur les sept cas restants, un enfant avait déjà reçu un cathéter central inséré par voie périphérique pour une défaillance intestinale, trois enfants ont reçu un cathéter central traditionnel, deux enfants ont reçu un cathéter central inséré par voie périphérique et un patient qui a été admis aux soins intensifs a reçu plus d’un cathéter central.
Discussion
Sur une période de cinq ans, on a recensé 17 cas de méningococcie invasive dans huit hôpitaux pédiatriques canadiens. Bien qu’il n’y ait pas de données pour les années précédentes, de 2013 à 2017, il y a eu moins d’un cas par centre tous les deux ans, ce qui est faible si l’on considère qu’il s’agit principalement de centres de référence régionaux. Ce succès peut être attribué aux programmes d’immunisation des nourrissons et des adolescents. Néanmoins, environ un tiers des enfants ont dû être admis aux soins intensifs et deux sont morts.
Bien qu’il s’agisse d’un petit nombre de cas, un clone hypervirulent qui n’est pas bien couvert par les vaccins actuels pourrait conduire à une flambée de cas beaucoup plus importante. Par exemple, on s’inquiète de l’émergence au Canada du sérogroupe hypervirulent W ST-11 CCNote de bas de page 11. Le sérogroupe W représentait 19 % (15/80 cas) de tous les cas de méningococcie invasive en 2016Note de bas de page 11 contre 24 % des cas dans l’étude actuelle. Le ST-11 CC a été détecté pour la première fois au Canada en 2014, mais a représenté 85 des 93 cas de sérogroupe W (91 %) entre 2016 et 2018Note de bas de page 11. Ce clone semble infecter principalement les adultes; il est possible que l’immunisation des adolescents ait permis de prévenir la maladie chez les enfants immunisés et indirectement de prévenir la maladie chez les jeunes frères et sœurs en empêchant d’être un porteur.
Le sérogroupe le plus fréquent de méningococcie invasive chez les enfants au CanadaNote de bas de page 6 et aux États-UnisNote de bas de page 10 est le sérogroupe B. Un vaccin monovalent B pour les nourrissons et les adolescents est maintenant autorisé au Canada, mais il n’est pas utilisé de façon systématique en raison du grand nombre de vaccinations nécessaires pour prévenir un cas de méningococcie invasiveNote de bas de page 3. Le nombre absolu relativement faible de cas dus à une infection du sérogroupe B dans l’étude actuelle (neuf cas dans huit centres sur cinq ans) conforte cette décision. La première dose de vaccin peut être administrée à l’âge de deux mois (selon la province), mais une seule dose n’est probablement pas suffisante pour prévenir la méningococcie invasive. Contrairement aux vaccins contre le sérogroupe C, le vaccin contre le sérogroupe B autorisé pour les nourrissons n’empêche pas d’être porteur, de sorte qu’une utilisation généralisée dans la population peut ne pas prévenir la maladie chez les jeunes nourrissonsNote de bas de page 12.
La gestion de la méningococcie invasive au Canada pourrait être améliorée. Sept des 17 cas ont reçu plus de sept jours d’antibiotiques (de cinq à sept jours est recommandé pour les bactériémies ou les méningites)Note de bas de page 13; seuls deux des sept cas avaient une indication pour un traitement plus long (empyème subdural et arthrite septique). Les cliniciens partent du principe qu’une infection dont le taux de mortalité est d’environ 10 %Note de bas de page 14 justifie une antibiothérapie plus longue, mais cela prolonge le séjour à l’hôpital et nécessite souvent la pose d’un cathéter central.
Forces et faiblesses
La force de cette étude réside dans le fait qu’elle fournit des données sur la gestion et les résultats de la méningococcie invasive au Canada au cours des dernières années. La principale limite est que l’étude n’est pas basée sur la population; certains des huit sites participants n’ont pas de zone de chalandise définie.
En outre, tous les hôpitaux pédiatriques canadiens de soins tertiaires n’ont pas participé à l’étude. De plus, les enfants dont le parcours est simple ou qui sont rapidement décédés peuvent n’avoir jamais été admis dans un hôpital de soins tertiaires. Une autre limite est que les données de suivi n’ont pas été collectées; les séquelles à long terme ne sont généralement pas apparentes au moment de la sortie des patients de l’hôpital.
Certains des traitements antibiotiques de longue durée peuvent avoir été prescrits pour des indications légitimes qui n’étaient pas consignées dans le dossier du patient. Les autres limites sont que seuls huit centres étaient concernés et que le statut d’immunisation n’était pas disponible.
Conclusion
La méningococcie invasive est désormais une maladie rare dans les hôpitaux pédiatriques canadiens, bien que plus d’un tiers des cas identifiés dans huit hôpitaux pédiatriques entre 2013 et 2017 aient nécessité une admission en soins intensifs et que deux d’entre eux soient décédés. De nombreux internes en formation peuvent ne jamais voir un cas. En cette ère de gestion des antimicrobiens, il convient de rappeler aux cliniciens qu’une longue cure d’antibiotiques est rarement indiquée pour la méningococcie invasive. La surveillance continue doit être maintenue afin que les flambées de cas soient rapidement identifiées. Des études futures devraient vérifier le statut de l’immunisation.
Déclaration des auteurs
M. B. et J. R. ont eu l’idée de l’étude, ont écrit le protocole et conçu le formulaire REDCap (Research Electronic Data Capture). J. R. a rédigé la première ébauche du manuscrit. Tous les autres auteurs ont collecté des données et examiné le manuscrit.
Intérêts concurrents
Aucun.
Financement
Aucun financement n’a été reçu pour cette étude.

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International