Liste de contrôle pour laboratoire contre les éclosions de maladies infectieuses

 Téléchargez cet article en format PDF
Téléchargez cet article en format PDFPublié par : L’Agence de la santé publique du Canada
Numéro : Volume 46–10 : Biosécurité en Laboratoire
Date de publication : 1er octobre 2020
ISSN : 1719-3109
Soumettre un article
À propos du RMTC
Naviguer
Volume 46–10, le 1er octobre 2020 : Biosécurité en Laboratoire
Science de la mise en œuvre
Liste de contrôle pour laboratoires d’intervention contre les éclosions de maladie infectieuse – Considérations relatives aux mesures de préparation et interventions face aux menaces émergentes
Tracie EisBrenner1, Graham Tipples2,3, Theodore Kuschak1,3,4, Matthew Gilmour1,3,4
Affiliations
1 Laboratoire national de microbiologie, Winnipeg, MB
2 Laboratoire provincial de santé publique de l’Alberta, Alberta Precision Laboratories, Edmonton, AB
3 Réseau des laboratoires de santé publique du Canada
4 Réseau de laboratoires du Groupe de travail sur la protection de la santé mondiale
Correspondance
Citation proposée
EisBrenner T, Tipples G, Kuschak T, Gilmour M. Liste de contrôle pour laboratoires d’intervention contre les éclosions de maladie infectieuse – Considérations relatives aux mesures et interventions face aux menaces émergentes. Relevé des maladies transmissibles au Canada 2020:46(10):351–63. https://doi.org/10.14745/ccdr.v46i10a01f
Mots-clés : liste de contrôle, COVID-19, Ebola, maladie infectieuse émergente, gestion des urgences, agents pathogènes à haute conséquence, maladie infectieuse, intervention des laboratoires, préparation aux épidémies, interventions contre les épidémies, laboratoire de santé publique, SRAS, SRAS-CoV-2, Zika
Résumé
L’objectif de la Liste de contrôle pour laboratoires d’intervention contre les éclosions de maladie infectieuse (la « liste de contrôle ») est de fournir aux laboratoires de santé publique et aux réseaux de laboratoires opérant à plusieurs niveaux de juridiction un outil utile et adaptable afin d’aider à identifier rapidement les considérations importantes relatives aux interventions en cas d’éclosions, notamment lors d’une étude visant une menace de maladie infectieuse jusqu’alors inconnue. La liste de contrôle a été élaborée par le Laboratoire national de microbiologie du Canada en collaboration avec des experts de laboratoires provinciaux, territoriaux, nationaux et internationaux, dont le Réseau des laboratoires de santé publique du Canada et le Réseau des laboratoires du Groupe de travail sur la protection de la santé mondiale. Bien que la liste de contrôle ait été initialement conçue pour refléter les leçons tirées de la participation des laboratoires nationaux de microbiologie à des interventions étendues à des épidémies nationales et internationales (e.g. l’épidémie du virus Zika [2015 à 2016] et l’épidémie du virus Ebola, en Afrique de l’Ouest [2014 à 2016]), l’importance d’optimiser la coordination des interventions des laboratoires n’a été soulignée que par les défis permanents présentés par les exigences des interventions à la pandémie de COVID-19. La liste de contrôle identifie cinq thèmes d’intervention en laboratoire hautement interdépendants, dont chacun englobe de multiples considérations qui peuvent être essentielles à une intervention coordonnée et stratégique en cas d’épidémie. En tant que tel, l’examen complet des considérations de la liste de contrôle par les organisations de laboratoires intervenants peut fournir une occasion importante de détecter rapidement les principales considérations et interdépendances en matière d’intervention, et d’atténuer les risques susceptibles d’avoir une incidence sur l’action de santé publique.
Introduction
Les interventions contre les épidémies de maladies infectieuses posent des défis et des considérations uniques aux laboratoires, en particulier lorsqu’ils étudient une maladie infectieuse auparavant inconnue ou nouvellement définieNote de bas de page 1. Grâce à la participation importante du Laboratoire national de microbiologie aux interventions nationales et internationales contre les épidémies et les pandémies, un certain nombre de considérations et d’enseignements clés ont été mis en évidence. Il est notamment nécessaire que les laboratoires d’intervention 1) élaborent et déploient rapidement de nouvelles méthodes de test diagnostique spécifiques aux nouveaux agents pathogènes, 2) participent à l’élaboration collaborative et itérative de définitions de cas et de critères de test pour tenir compte de l’évolution des preuves scientifiques à mesure que l’épidémie progresse, 3) engagent stratégiquement les partenaires de la santé publique pour optimiser la capacité de réaction et la coordination, et 4) établissent des processus et des procédures de partage d’information qui permettent aux laboratoires de santé publique d’étudier, de surveiller, d’effectuer des recherches, pour transmettre des messages de santé publique et d’agir en temps utileNote de bas de page 2. L’évolution constante de la génomique de la santé publique et des autres approches « omiques » présente des défis supplémentaires et offre d’importantes possibilités d’améliorer la capacité d’intervention contre les maladies infectieusesNote de bas de page 3Note de bas de page 4. Étant donné la nature complexe et spécifique des considérations relatives aux interventions des laboratoires, une coordination efficace et en temps voulu peut s’avérer difficile en absence d’une approche stratégique et structurée.
L’utilité potentielle d’une approche par liste de contrôle pour renforcer la préparation des laboratoires et la coordination des interventions a été récemment soulignée lors de l’engagement prolongé du Laboratoire national de microbiologie dans les efforts d’intervention nationaux et internationaux, en particulier durant l’épidémie du virus Ebola en Afrique occidentale (2014 à 2016) et l’épidémie du virus Zika (2015 à 2016)Note de bas de page 5Note de bas de page 6Note de bas de page 7Note de bas de page 8. Dans ce contexte, l’élaboration d’une liste de contrôle a également été envisagée en fonction des résultats souhaités énoncés dans le Plan stratégique 2016-2020 du Réseau des laboratoires de santé publique du Canada y compris la « Priorité 2 : Renforcer la capacité d’intervention coordonnée pour faire face aux agents pathogènes établis, émergents et réémergents et aux menaces pour la santé publique »Note de bas de page 9.
Un examen de la littérature de l’époque a cependant permis de trouver peu de références accessibles au public contenant des listes de contrôle concernant les interventions contre les maladies infectieuses émergentes et à conséquence grave. Il est à noter que ces références, soit n’ont pas mis l’accent sur la composante laboratoire de la résilience de la santé publique, soit n’ont pas décrit les considérations d’intervention des laboratoires indépendamment des contextes organisationnels, juridictionnels ou spécifiques aux maladies infectieusesNote de bas de page 2Note de bas de page 10Note de bas de page 11. L’émergence récente de la nouvelle maladie infectieuse à coronavirus (maladie à coronavirus 2019, COVID-19), causée par le coronavirus du syndrome respiratoire aigu sévère 2 (SRAS-CoV-2), n’a fait que souligner l’importance cruciale d’une réponse rapide et coordonnée des laboratoires pour soutenir l’action de santé publiqueNote de bas de page 12.
La liste de contrôle pour laboratoires d’intervention contre les éclosions de maladie infectieuse (la « liste de contrôle ») a été élaborée pour fournir aux laboratoires un outil utile et adaptable leur permettant d’identifier rapidement les principales considérations relatives aux interventions en cas d’épidémie en utilisant une approche systématique, en particulier lorsqu’ils étudient une menace de maladie infectieuse jusqu’alors inconnue ou nouvellement définie. Afin d’inclure les considérations associées aux interventions prolongées des laboratoires à plus grande échelle, la liste de contrôle a été considérablement enrichie par les enseignements tirés des interventions antérieures du Laboratoire national de microbiologie contre le virus Ebola, le virus Zika et le syndrome respiratoire aigu sévère (SRAS) en 2003, et par la poursuite des efforts d’intervention contre la COVID-19Note de bas de page 5Note de bas de page 6Note de bas de page 7Note de bas de page 8Note de bas de page 13Note de bas de page 14. Comme les rôles d’intervention des laboratoires sont censés différer selon les organisations et les niveaux de juridiction, le contenu de la liste de contrôle n’a pas vocation à être prescriptif. La liste de contrôle a plutôt été conçue de manière à saisir l’étendue des considérations d’intervention qui peuvent être pertinentes à tous les niveaux, tout en soutenant la personnalisation du contenu afin de refléter les exigences spécifiques à chaque établissement. En tant que telle, la liste de contrôle est conçue comme un outil complémentaire aux plans et protocoles existants de préparation et d’intervention des laboratoires.
Méthodes
Un groupe de travail du Laboratoire national de microbiologie a été convoqué pour contribuer au développement de l’outil de la liste de contrôle afin de soutenir la coordination en temps utile des efforts d’intervention des laboratoires. Le groupe de travail était composé de plusieurs représentants de programmes ayant une expérience préalable dans l’exercice de fonctions au sein du centre des opérations d’urgence du Laboratoire national de microbiologie lors de l’activation de l’intervention contre les épidémiesNote de bas de page 15. Les membres du groupe de travail ont identifié les exigences et les défis rencontrés lors de l’intervention contre les éclosions de maladies infectieuses et aux menaces émergentes, tant au niveau national qu’international. Les informations recueillies ont été utilisées pour rédiger les considérations d’intervention afin d’obtenir une version préliminaire de la liste de contrôle. Afin de soutenir la mise en œuvre par les organisations de laboratoires opérant à différents niveaux de juridiction, l’élaboration de la liste de contrôle a été guidée par la nécessité d’intégrer les attributs clés suivants : adaptabilité, acceptabilité, évolutivité et facilité d’utilisationNote de bas de page 16.
Pour améliorer l’adaptabilité de la liste de contrôle, les considérations d’intervention ont été décrites à un niveau élevé en utilisant, dans la mesure du possible, une terminologie générique et neutre par rapport au contexte. Cette approche a été adoptée pour permettre aux utilisateurs de modifier facilement le contenu en y incorporant la terminologie et les exigences opérationnelles préférées, propres à l’organisation et à la juridiction, élargissant ainsi la portée potentielle de la mise en place d’organisations et de réseaux de laboratoires aux niveaux régional, provincial, territorial, étatique, national et international. Le contenu des considérations d’intervention proposées a été évalué, et cinq thèmes d’intervention de laboratoire ont été identifiés pour faciliter leur utilisation. Le contenu de chaque thème a été conçu de manière à être évolutif, ce qui permet aux utilisateurs d’élargir ou de modifier la portée des points de la liste de contrôle en fonction des activités d’intervention pertinentes au rôle de l’organisation de laboratoires de mise en œuvre. Le tableau d’examen de la liste de contrôle qui en résulte (supplémentaire I) est conçu pour être reproductible et adaptable à l’aide de logiciels de tableur ou de base de données préférés, offrant la possibilité de sélectionner, de trier et de surveiller avec souplesse le statut des points marqués en fonction de l’utilisateur. Afin de faciliter son utilisation, un certain nombre d’approches permettant de classer, de personnaliser et de hiérarchiser les points de la liste de contrôle ont été élaborées pour être soumises à l’examen des utilisateurs (supplémentaire II).
L’ébauche de liste de contrôle a été pilotée à l’aide d’un exercice d’examen de documents basé sur un scénario auquel ont participé le personnel du centre des opérations d’urgence du Laboratoire national de microbiologie et le personnel de liaison des laboratoires. Les données de l’exercice ont été utilisées pour affiner le contenu et examiner la meilleure façon d’opérationnaliser la liste de contrôle afin d’améliorer les protocoles d’intervention d’urgence. Une boîte à outils supplémentaire d’intervention du Laboratoire national de microbiologie, qui contient les contacts, les références et les ressources des laboratoires spécifiques au contexte canadien, a été développée simultanément pour soutenir la mise en œuvre du Laboratoire national de microbiologie, et comme modèle adaptable par d’autres (disponible sur demande). Afin de vérifier l’acceptabilité et la validité du contenu, la liste de contrôle et la « trousse d’intervention du Laboratoire national de microbiologie » ont été distribuées pour examen à des experts de laboratoires fédéraux, provinciaux et territoriaux (Laboratoire national de microbiologie, Réseau des laboratoires de santé publique du Canada) et, au niveau international, au réseau de laboratoires du Groupe d’action pour la sécurité sanitaire mondiale. La liste de contrôle a été initialement distribuée sous deux formes : un « tableau d’examen de la liste de contrôle » triable (Microsoft Excel 2010) (supplémentaire I) et un document de « liste de contrôle » conventionnel formaté en « cases à cocher » (Microsoft Word 2010) (supplémentaire III). Les contributions des examens externes ont été prises en compte pour produire une version de référence finale de la liste de contrôle, qui a ensuite été distribuée aux parties prenantes du Laboratoire national de microbiologie, du Réseau des laboratoires de santé publique du Canada et du Réseau de laboratoires du Groupe de travail sur la protection de la santé mondiale en 2018. L’examen intergouvernemental a indiqué que la liste de contrôle était bien alignée sur les fonctions essentielles des laboratoires de santé publique déjà identifiées et sur les priorités définies dans le Plan stratégique 2016-2020 du Réseau des laboratoires de santé publique du CanadaNote de bas de page 9Note de bas de page 17Note de bas de page 18. Le contenu a ensuite été mis à jour pour produire la version actuelle, qui inclut le contexte d’intervention des laboratoires contre la COVID-19.
La liste de contrôle
La liste de contrôle englobe cinq thèmes centraux : les études en laboratoire; la capacité d’intervention et la formation des laboratoires; la surveillance et la gestion des données des laboratoires; l’engagement et la communication entre les juridictions; et la recherche et l’éthique (supplémentaires I et III). Chaque thème comprend de multiples considérations identifiées comme pouvant avoir un impact sur l’intervention stratégique d’un laboratoire.
1. Études en laboratoire
Lors de la recherche d’un agent pathogène nouveau ou émergent, les considérations d’intervention rapide comprennent l’élaboration, la validation, le partage et la mise en œuvre de protocoles de test et de recommandations fondés sur des données probantes, en étroite collaboration avec les laboratoires partenaires interjuridictionnels. L’établissement de critères normalisés de confirmation des cas par les laboratoires peut également être considéré comme une priorité afin de favoriser une déclaration et une surveillance cohérente des cas dans les juridictions concernéesNote de bas de page 2. Le développement rapide des capacités de dépistage a été une considération essentielle dès le début de l’intervention nationale du Canada contre la COVID-19. En prévision de l’arrivée de la COVID-19 au Canada, le Laboratoire national de microbiologie a travaillé à la mise au point de méthodes de diagnostic moléculaire qui ont été utilisées pour confirmer avec succès le premier cas présumé positif de COVID-19 en janvier 2020. Le Laboratoire national de microbiologie a continué à fournir des tests confirmatoires de référence et un soutien en matière d’assurance qualité aux partenaires provinciaux et territoriaux des laboratoires de santé publique qui ont répondu, afin de garantir l’exactitude permanente de la détection des cas à l’échelle nationaleNote de bas de page 19.
Les efforts d’intervention peuvent également exiger un dépistage et/ou des tests de confirmation de première ligne soutenus et en grand volume, dépassant les capacités habituellement disponibles des laboratoires. Dans ces circonstances, la mise en œuvre de critères de tests et de protocoles de triage basés sur des facteurs de risque connus peut devenir une considération pour hiérarchiser les études de laboratoire de manière appropriée et pour gérer des ressources limitées. Il s’agissait là d’une considération essentielle du Laboratoire national de microbiologie lors de sa première intervention domestique contre l’épidémie de Zika, qui a posé d’importants défis de capacité, car la demande de tests de dépistage de Zika a persisté à des niveaux élevés bien au-delà de la période d’intervention initiale de 2015 à 2016Note de bas de page 6. Lors de la première intervention contre la COVID-19, les provinces et territoires canadiens ont également établi des critères de tests afin de prioriser les tests selon les capacités des laboratoires. Cette approche a été adoptée, car les demandes mondiales écrasantes sur les chaînes d’approvisionnement internationales ont eu un impact significatif sur la capacité d’obtenir rapidement les fournitures, l’équipements et les réactifs de laboratoire nécessaires, notamment l’équipement de protection individuelle, les écouvillons de prélèvement, les milieux de transport viraux, les trousses de test, les réactifs et les plateformes de testNote de bas de page 20Note de bas de page 21.
La liste de contrôle identifie diverses considérations d’intervention susceptibles d’influencer la coordination en temps utile des études de laboratoire, allant des exigences en matière de prélèvement et de transport des échantillons, aux tests de laboratoire et à la communication des résultats. Ces considérations comprennent 1) la capacité à prélever, entreposer et transporter des échantillons pour répondre aux critères d’acceptation d’échantillons pour les tests, 2) les considérations de biosécurité, de sûreté biologique et de contrôle des infections, 3) les exigences législatives et réglementaires, 4) les tests de laboratoire et les critères de confirmation des cas et 5) les protocoles de triage pour les tests prioritaires. Le contrôle de la qualité, la normalisation des méthodes de test ainsi que les processus de communication des résultats ont été jugés essentiels à tous les aspects d’une intervention coordonnée des laboratoires.
2. Capacité d’intervention des laboratoires et formation
Pour les laboratoires de santé publique intervenants, une prise en compte précoce de la capacité peut être la disponibilité de méthodes validées de dépistage en première ligne et de tests de diagnostic de confirmation spécifiques aux agents pathogènes avec des caractéristiques de performance connues. On peut s’attendre à ce que les laboratoires nationaux de référence conservent la capacité de développer et de valider rapidement de nouvelles méthodes de test lorsque les capacités externes n’existent pas, ou ne sont pas disponibles de manière fiable dans des circonstances d’épidémieNote de bas de page 2. Les laboratoires de santé publique peuvent également être tenus de participer à la recherche coordonnée et interjuridictionnelle de fournisseurs et à la validation clinique continue des méthodes, équipements et fournitures de laboratoire, en particulier lorsqu’ils ont affaire à des fournisseurs multiples et/ou changeants pour gérer les défis de continuité de la chaîne d’approvisionnement, comme lors de l’intervention contre la COVID-19Note de bas de page 21. Les exigences de cette nature, qui sont sensibles au facteur temps et exigent beaucoup de ressources, peuvent imposer des contraintes considérables au personnel scientifique et technique concerné, car il faut parallèlement maintenir les activités de programme habituelles et mandatées.
La capacité d’intervention des laboratoires peut être davantage compliquée lorsque le personnel est affecté par les mesures imposées par le gouvernement pour prévenir la transmission au niveau communautaire d’une menace de maladie infectieuse émergente ou par la contraction d’une maladie associée à une maladie infectieuse émergente. Comme on l’a vu lors de l’intervention contre la COVID-19, ces mesures peuvent inclure de longues périodes d’auto-isolement ou de quarantaine en raison d’une maladie confirmée, d’une maladie symptomatique ou d’une exposition potentielle (contact avec un cas, antécédents de voyage); ainsi que le « travail à distance » et les modalités de travail alternatives nécessaires pour gérer les problèmes de garde d’enfants et de famille résultant de la fermeture d’écoles et d’autres mesures de maintien à domicile et de distanciation physiqueNote de bas de page 22Note de bas de page 23.
L’engagement et la mobilisation de personnel possédant les compétences et l’expérience essentielle en matière d’intervention peut jouer un rôle central pour relever les défis liés à la capacité de pointe, tant à l’intérieur qu’à l’extérieur d’une organisation de laboratoires d’intervention, comme l’a démontré le Laboratoire national de microbiologie lors des interventions nationales dans le cadre de la COVID-19 et du virus Zika, ainsi que le déploiement international d’équipes d’intervention de laboratoire mobile pour soutenir le dépistage sur site du virus Ebola durant l’épidémie d’Ebola de 2014 à 2016 en Afrique occidentaleNote de bas de page 5. Le Laboratoire national de microbiologie a également déployé un laboratoire mobile sur le territoire national afin d’aider à tester les voyageurs canadiens récemment retournés au pays sur des sites de quarantaine pendant la première intervention contre la pandémie de COVID-19.
En fonction de l’ampleur et de la durée des besoins d’intervention, la décentralisation des tests de diagnostic et d’autres activités de transfert de technologie peuvent également être privilégiées pour étendre les capacités des laboratoires interjuridictionnels sur une base temporaire ou à long terme, et pour améliorer l’accès au dépistage des populations éloignées ou isoléesNote de bas de page 24. Au cours des interventions nationales canadiennes contre le virus Ebola, le virus Zika et, plus récemment, la COVID-19, le Laboratoire national de microbiologie et ses homologues provinciaux des laboratoires de santé publique ont travaillé en collaboration pour soutenir la décentralisation des tests de laboratoire de première ligne dans certaines juridictions afin d’améliorer la répartition des capacités d’intervention dans la mesure du possible, tout en maintenant une capacité nationale centralisée pour les tests de référence et de confirmationNote de bas de page 21Note de bas de page 25.
La capacité à relever avec souplesse les défis en matière de capacité et d’aptitude propres aux menaces nouvelles ou aux maladies infectieuses émergentes a été jugée essentielle aux efforts d’intervention. Les considérations connexes comprennent l’identification collaborative des capacités d’intervention des laboratoires avec les partenaires de santé publique interjuridictionnels, et l’évaluation dynamique de la capacité de pointe et des besoins de formation pour soutenir les activités essentielles à l’intervention.
La liste de contrôle met en évidence diverses considérations qui peuvent être explorées si une capacité de pointe supplémentaire est nécessaire. Il s’agit notamment d’étudier des approches alternatives pour améliorer la capacité en tests de laboratoire et le partage des informations, d’engager le soutien du site du centre des opérations d’urgence pour la coordination des interventions et d’identifier le personnel de capacité de pointe ayant les compétences requises par le biais de processus d’inventaire du personnel axé sur les interventions. Le personnel de surtension peut compléter une formation polyvalente et être mobilisé à un site de laboratoire alterne au sein ou à l’extérieur de l’organisation, ou encore être déployé sur le terrain sous la supervision de personnel scientifique de haut niveau dans le cadre d’une équipe d’intervention de laboratoire mobile.
3. Surveillance et gestion des données des laboratoires
Les données de résultats de laboratoire sont bien connues comme un apport essentiel pour soutenir les études épidémiologiques, la surveillance et les actions de santé publique liées aux maladies infectieusesNote de bas de page 26Note de bas de page 27. Les activités d’intervention du Laboratoire national de microbiologie ont souligné que les études de laboratoire dépendent souvent de la disponibilité en temps utile de données épidémiologiques pour éclairer les processus de triage des tests, la sélection d’algorithmes de diagnostic et de confirmation appropriés ainsi que l’interprétation appropriée des résultats des tests. Lors de l’intervention nationale contre le virus Zika, la capacité à trier et à acheminer les échantillons en utilisant des facteurs de risque connus reposait sur la fourniture de données épidémiologiques et cliniques dans le cadre du processus de demande de tests (e.g. état de grossesse, antécédents de voyage et date de début des cas symptomatiques). De même, le rapprochement entre les résultats des tests du Laboratoire national de microbiologie et les cas faisant l’objet d’une étude dépendait de la fourniture d’identificateurs uniques appropriésNote de bas de page 28.
Pour favoriser une surveillance et une gestion des données en laboratoire intégrées et en temps utile, les considérations d’intervention rapide peuvent inclure l’élaboration rapide, itérative et consensuelle d’une définition de cas de maladie infectieuse qui intègre les critères de confirmation des cas en laboratoire et épidémiologiques pertinents dans le contexte de l’épidémie actuelleNote de bas de page 24. L’identification des éléments de données nécessaires aux études, à la confirmation des cas et aux efforts de surveillance des laboratoires fait partie intégrante de ce processus. L’harmonisation des critères de confirmation et des exigences relatives aux éléments de données entre les juridictions rapportant les cas peut mériter d’être prise en considération pour assurer la cohérence de la détection, des rapports et de la surveillance des cas, ainsi que la comparabilité des données de surveillance infranationales, nationales et internationales dans la mesure du possible. Une considération liée à la surveillance est la capacité de relier rapidement les résultats de laboratoire aux cas faisant l’objet d’une étude, et de relier les cas confirmés à une éclosion ou à une source d’éclosion. Le rapprochement et l’intégration des données peuvent s’avérer difficiles lorsque les éléments de données de laboratoire et épidémiologiques pertinents pour les études sur les cas sont générés ou recueillis par des juridictions de santé publique distinctes.
Les activités de surveillance et d’intervention des laboratoires peuvent être encore renforcées par la mise en œuvre d’approches génomiques normalisées en matière de santé publique et d’autres outils avancés d’épidémiologie moléculaire afin d’améliorer la détection, la caractérisation, l’attribution de la source et l’identification du mode de transmission des agents pathogènes et des éclosions. L’utilisation de méthodes de séquençage du génome entier pour soutenir la surveillance en temps réel, en laboratoire, de certains agents pathogènes offre également l’avantage promis d’une nomenclature non ambiguë à des fins de comparaison entre juridictionsNote de bas de page 29.
La liste de contrôle présente un certain nombre de considérations qui peuvent avoir une incidence sur la surveillance et la gestion des données par les laboratoires. Un examen des exigences en matière de flux de données peut être utile dès le début de l’intervention contre une menace de maladie infectieuse émergente, notamment la nécessité d’adopter des approches normalisées pour documenter, surveiller et communiquer les résultats des études de laboratoire et les informations récapitulatives sur l’épidémie afin de répondre aux besoins de renseignements des diverses parties prenantes (e.g. rapports de cas confirmés en laboratoire par juridiction, pourcentage de tests positifs par rapport au total des tests effectués pour les groupes ou populations cibles). Il peut également être utile d’explorer le potentiel des systèmes existants de gestion des informations de laboratoire, des plateformes informatiques et de surveillance de la santé publique basées sur le Web, et d’autres outils permettant de répondre avec souplesse aux exigences de surveillance et d’intervention spécifiques aux agents pathogènes. Comme on l’a observé lors de la participation du Laboratoire national de microbiologie aux premières activités d’intervention contre la COVID-19, les fonctions souhaitées peuvent comprendre la collecte, le rapprochement et l’intégration de données en temps utile et en toute sécurité; la communication des résultats des tests de laboratoire et des indicateurs de surveillance, l’alerte de santé publique et la modélisation prédictiveNote de bas de page 30Note de bas de page 31Note de bas de page 32. Pour les laboratoires partenaires qui mettent en œuvre des approches « omiques » afin d’améliorer les capacités de détection et d’intervention contre les épidémies, les considérations à plus long terme peuvent inclure les besoins opérationnels et d’infrastructure pour les pipelines de transfert de données et les outils bio-informatiques utilisés pour transmettre, acquérir, analyser, interpréter et rapporter les résultats du séquençage du génome entier et autres résultats « omiques »Note de bas de page 27Note de bas de page 32Note de bas de page 33. Le partage entre juridictions des données de surveillance générées par les laboratoires peut également être envisagé dans le contexte des cadres législatifs et réglementaires pertinents et des accords de partage d’informations, conformément aux rôles établis des juridictions et des organisations en matière de santé publiqueNote de bas de page 33Note de bas de page 34Note de bas de page 35Note de bas de page 36Note de bas de page 37.
4. Engagement et communication interjuridictionnels
Pour soutenir l’élaboration, fondée sur des données probantes, de directives de laboratoire, de recommandations cliniques, de stratégies de surveillance et d’intervention en santé publique, il peut être important d’envisager le renforcement des mécanismes de partage de renseignements avec les partenaires de santé publique concernés et les réseaux interjuridictionnelsNote de bas de page 14Note de bas de page 38. Cela peut impliquer l’exploration d’autres approches collaboratives et pluridisciplinaires. Au Canada, le Réseau des laboratoires de santé publique du Canada complète une fonction essentielle en fournissant un réseau établi, soutenu par un secrétariat et des experts nationaux, provinciaux et territoriaux en matière de laboratoires de santé publique afin d’appuyer l’élaboration rapide, par consensus, de stratégies d’intervention, de recommandations et de lignes directricesNote de bas de page 9.
Les efforts d’intervention du Laboratoire national de microbiologie ont également souligné l’importance d’identifier clairement les structures de communication et de rapport spécifiques à l’événement pour soutenir un acheminement interne et externe efficace des demandes et des informations. Il s’agit notamment d’une messagerie cohérente utilisant des points de contact à « guichet unique » pour les programmes et les groupes de travail qui répondent au sein de l’organisation de laboratoires chaque fois que cela est possible. De telles considérations ne sont pas propres à l’intervention des laboratoires; la nécessité de rôles de direction et de structures de communication clairement articulés a également été identifiée dans une évaluation des considérations plus larges de résilience de la santé publique liées à l’intervention contre la maladie du virus Ebola au niveau communautaire aux États-UnisNote de bas de page 10. Pour faciliter l’acheminement des demandes externes urgentes, le Laboratoire national de microbiologie a réussi à fournir un accès à guichet unique au soutien des laboratoires via un numéro de contact d’urgence 24 heures sur 24, combiné à un soutien du centre des opérations d’urgence basé sur site pour coordonner et diriger de manière centralisée les demandes dans le contexte d’un système de commandement d’incidentsNote de bas de page 15. Le Laboratoire national de microbiologie tient également à jour un guide des services de laboratoire, accessible au public via le Web, qui sert de référence pour les demandes de test externesNote de bas de page 28.
L’augmentation de la fréquence des engagements interjuridictionnels et des exigences en matière de communication des risques, qui sont sensibles au facteur temps, peut poser des défis permanents à la coordination d’intervention, en particulier lorsqu’un événement de santé publique suscite une préoccupation du public, un intérêt médiatique et une attention politique importante durant une période prolongée. Les experts en laboratoire chargés de l’intervention organisationnelle peuvent également être ceux qui sont les plus sollicités pour répondre aux demandes d’informations provenant de sources multiples.
Comme indiqué dans la liste de contrôle, une méthode de communication stratégique peut devenir cruciale pour préserver le temps précieux du personnel d’intervention, faciliter l’engagement coordonné des parties prenantes et assurer la cohérence des messages de renseignements sur la santé publique afin de répondre aux besoins spécifiques du public. L’utilisation d’outils de médias sociaux et d’autres plateformes Web peut permettre d’améliorer l’accessibilité des conseils de laboratoire aux professionnels de la santé publique, aux médias et au public.
5. Recherche et éthique
Au Canada, l’engagement actif dans la recherche liée à la santé publique est considéré comme une fonction essentielle des laboratoires de santé publique, car le maintien continu de cette capacité scientifique fournit les bases nécessaires à une action de santé publique adaptéeNote de bas de page 13Note de bas de page 17. Comme cela a été démontré lors de l’intervention contre l’épidémie de coronavirus du SRAS en 2003, les priorités immédiates de la recherche en santé publique relatives aux laboratoires peuvent inclure l’identification et la caractérisation rapides des agents pathogènes, y compris le séquençage génomiqueNote de bas de page 39. Lancée en réponse à la pandémie de COVID-19 de 2020, l’initiative du Réseau canadien de génomique COVID permettra, avec la participation des laboratoires de santé publique, de créer une base de données génomiques « du virus au patient » par le séquençage à grande échelle des génomes de l’hôte et du virus, afin de soutenir la recherche nationale et internationale sur la pathogénicité virale, les résultats en termes d’évolution et de santé, et les vaccins et thérapeutiquesNote de bas de page 40.
D’autres priorités d’intervention immédiate peuvent inclure l’élaboration et la validation de méthodes de tests diagnostiques, et la recherche appliquée en biosécurité avec un accent sur l’application rapide des connaissances. La transmission des agents pathogènes et les études sur la compétence des vecteurs peuvent également être prioritaires pour aider à caractériser les risques et à informer les stratégies de prévention. Tout comme durant l’intervention contre le virus Zika, cela peut être particulièrement pertinent lorsque le potentiel d’introduction et de transmission soutenue d’une maladie émergente à transmission vectorielle doit encore être évalué dans des contextes non endémiquesNote de bas de page 41.
Pour réduire la morbidité et la mortalité au sein des populations à risque, les priorités nationales de recherche peuvent s’étendre à une élaboration et une mise en œuvre concertées d’interventions de santé publique, y compris des vaccins et d’autres contre-mesures médicales, comme le montre l’intervention du Laboratoire national de microbiologie contre la maladie du virus EbolaNote de bas de page 42Note de bas de page 43. La poursuite des efforts d’intervention contre la pandémie de COVID-19 a démontré la nécessité impérative de comprendre la réponse immunitaire de l’hôte à l’infection, ce qui permettra d’éclairer les stratégies de tests de laboratoire visant à déterminer le statut immunitaire au niveau des individus et de la population (e.g. par des études de séroprévalence), ainsi que les stratégies d’élaboration et de mise en œuvre de thérapies et de vaccinsNote de bas de page 44. En avril 2020, le gouvernement du Canada a lancé le groupe de travail sur l’immunité à la COVID-19, réunissant des experts nationaux du monde universitaire, hospitalier et de la santé publique pour aider à répondre aux questions en suspens liées à l’immunité à la COVID-19, notamment 1) le statut immunitaire et la durée de l’immunité après l’infection et 2) la portée de l’immunité au niveau de la population pour soutenir les efforts nationaux d’intervention contre les épidémiesNote de bas de page 45.
Face à une menace de maladie infectieuse émergente, il peut être urgent d’orienter stratégiquement les activités de recherche en santé publique afin de combler d’importantes lacunes dans les connaissances scientifiques et les capacités techniques. Les niveaux d’engagement dans la recherche peuvent varier considérablement d’un laboratoire à l’autre, en fonction du contexte juridictionnel et des responsabilités en matière de santé publique.
Comme indiqué dans la liste de contrôle, une première réaction peut consister à donner la priorité aux activités de recherche collaborative dans le cadre des ressources et des capacités existantes. Les priorités de recherche peuvent comprendre des études d’identification et de caractérisation des agents pathogènes, des études d’élaboration et de validation de méthodes de diagnostic et de tests de référence, des recherches sur l’immunité au niveau de l’hôte et de la population, des études sur la transmission et la compétence des vecteurs, l’élaboration et l’évaluation de vaccins et d’autres contre-mesures médicales, la recherche appliquée en matière de biosécurité et des études de surveillance de la santé publique. Pour rationaliser la coordination des interventions, il peut également être utile d’établir une distinction claire entre la recherche appliquée en santé publique et les activités de surveillance qui font partie intégrante des interventions de routine des laboratoires, et les autres activités de recherche ciblées qui nécessiteront un consentement préalable et l’achèvement des processus d’approbation éthique de la recherche.
Les groupes de travail et les réseaux d’intervention contre les maladies infectieuses émergentes peuvent également être convoqués pour mener des initiatives de recherche hautement prioritaires et urgentes, en faisant appel à l’expertise des laboratoires de santé publique ainsi qu’à d’autres experts scientifiques des universités, des hôpitaux et du secteur privé. Lorsque la recherche collaborative implique des partenaires interjuridictionnels ou des équipes multidisciplinaires, il peut être nécessaire de coordonner les processus d’évaluation de plusieurs comités d’éthique de la recherche et d’aborder les questions liées à la paternité et à la propriété intellectuelle d’une manière qui favorise la publication en temps voulu pour éclairer la prise de décision en matière de santé publique.
Discussion
Interdépendance des fonctions des laboratoires de santé publique
Lors de l’évaluation et de la hiérarchisation des considérations relatives à la préparation et à l’intervention des laboratoires, il est important de noter qu’il existe des interdépendances importantes entre les fonctions clés des laboratoires de santé publique, qui comprennent les éléments suivants : tests de diagnostic et de référence; surveillance des maladies infectieuses; préparation et intervention en cas d’éclosion épidémique; et recherche fondamentale et appliquée (figure 1). À l’interface de ces fonctions cycliques et adjacentes des laboratoires de santé publique, les exigences d’intervention contre les maladies infectieuses émergentes sont fortement interdépendantes. Une intervention de santé publique solide, capable de satisfaire à chacune de ces exigences mutuellement interdépendantes, dépend de la capacité disponible du système des laboratoires de santé publique à remplir chacune de ses fonctions essentielles.
Figure 1 : Interdépendances des fonctions d’intervention des laboratoires de santé publique
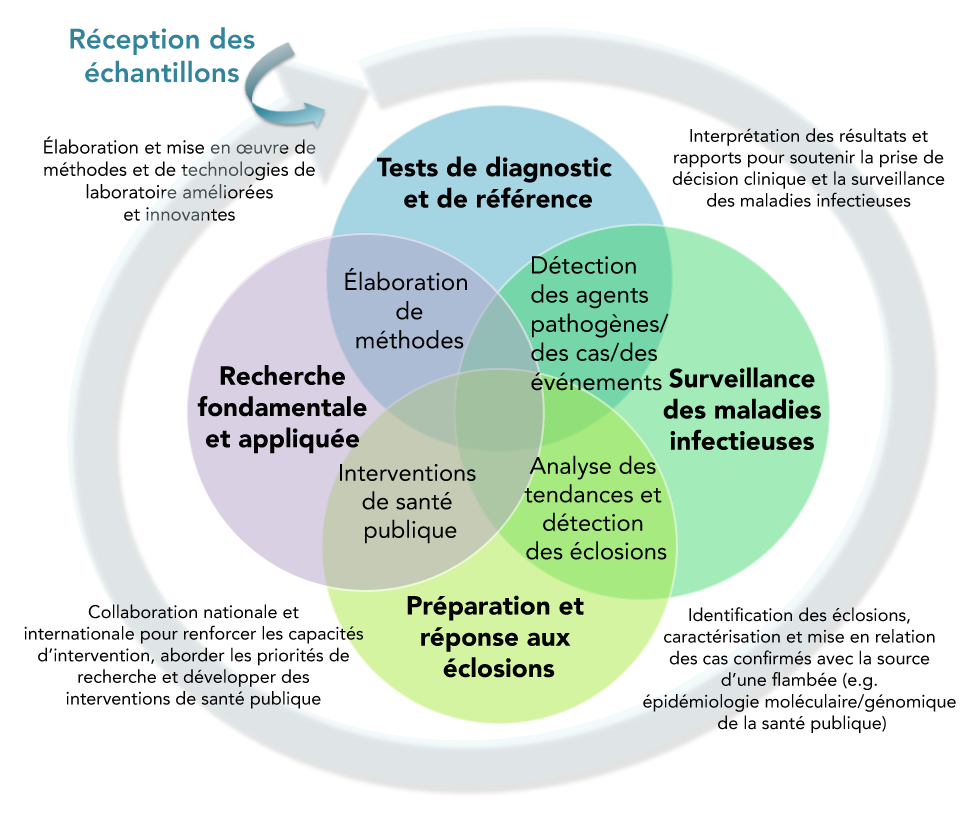
Description textuelle : Figure 1
Figure 1 : Interdépendances des fonctions d’intervention des laboratoires de santé publique
La figure 1 est un diagramme de Venn composé de quatre cercles qui se chevauchent, chaque cercle représentant une fonction distincte des laboratoires de santé publique, et chaque zone de chevauchement indiquant son interdépendance avec la fonction immédiatement adjacente. Le diagramme de Venn est circonscrit par une flèche circulaire, orientée dans le sens horaire, qui indique la nature cyclique et ordinale des quatre fonctions, en débutant avec la réception d’un échantillon à tester par le laboratoire, qui est représenté comme une entrée externe au diagramme de Venn. Les interdépendances indiquées par les domaines de chevauchement entre les quatre fonctions des laboratoires de santé publique comprennent les capacités des laboratoires pour les éléments suivants :
- La détection des agents pathogènes, des cas et des événements, y compris l’interprétation et la communication des résultats des tests pour soutenir à la fois la prise de décision clinique et les activités de surveillance des maladies infectieuses
- L’analyse des tendances et la détection des éclosions, y compris les activités de détection et de surveillance des maladies pour permettre l’identification et la caractérisation des éclosions en temps utile et le mise en relation des cas confirmés avec la source des éclosions (e.g. à l’aide de méthodes d’épidémiologie moléculaire/génomique de la santé publique)
- Les interventions de santé publique, y compris la collaboration nationale et internationale pour renforcer les capacités d’intervention et faire progresser la recherche sur les interventions de santé publique, notamment la mise au point de contre-mesures médicales telles que des vaccins et d’autres approches thérapeutiques
- L’élaboration de méthodes, y compris l’élaboration et la mise en œuvre de méthodes et de technologies de laboratoire améliorées et innovantes
La figure 1 est un diagramme de Venn composé de quatre cercles qui se chevauchent, chaque cercle représentant une fonction distincte des laboratoires de santé publique, et chaque zone de chevauchement indiquant son interdépendance avec la fonction immédiatement adjacente. Le diagramme de Venn est circonscrit par une flèche circulaire, orientée dans le sens horaire, qui indique la nature cyclique et ordinale des quatre fonctions, en débutant avec la réception d’un échantillon à tester par le laboratoire, qui est représenté comme une entrée externe au diagramme de Venn. Les interdépendances indiquées par les domaines de chevauchement entre les quatre fonctions des laboratoires de santé publique comprennent les capacités des laboratoires pour les éléments suivants :
- La détection des agents pathogènes, des cas et des événements, y compris l’interprétation et la communication des résultats des tests pour soutenir à la fois la prise de décision clinique et les activités de surveillance des maladies infectieuses
- L’analyse des tendances et la détection des éclosions y compris les activités de détection et de surveillance des maladies pour permettre l’identification et la caractérisation des éclosions en temps utile et la mise en relation des cas confirmés avec la source des éclosions (e.g. à l’aide de méthodes d’épidémiologie moléculaire/génomique de la santé publique)
- Les interventions de santé publique, y compris la collaboration nationale et internationale pour renforcer les capacités d’intervention et faire progresser la recherche sur les interventions de santé publique, notamment la mise au point de contre-mesures médicales telles que des vaccins et d’autres approches thérapeutiques
- L’élaboration de méthodes, y compris l’élaboration et la mise en œuvre de méthodes et de technologies de laboratoire améliorées et innovantes
Dans le contexte des fonctions interdépendantes des laboratoires de santé publique, il devient évident que les considérations individuelles identifiées dans chacun des cinq thèmes d’intervention de la liste de contrôle peuvent avoir des implications importantes et de grande portée sur les activités d’intervention interdépendantes dans le contexte plus large de la santé publique. Par exemple, l’utilisation de méthodes d’investigation de laboratoire normalisées pour la détection des cas (Thème 1 : Études en laboratoire) peut faciliter des mécanismes de surveillance fiables et bien intégrés qui, à leur tour, permettent la détection et le suivi interjuridictionnels des cas et des éclosions en temps opportun (Thème 3 : Surveillance et gestion des données des laboratoires). Les renseignements sur la santé publique générés grâce à des activités de surveillance de haute qualité axées sur des objectifs et partagés en temps opportun via des réseaux d’experts collaboratifs (Thème 4 : Engagement et communication interjuridictionnels) peuvent alors permettre l’identification des priorités de recherche pour éclairer les efforts de préparation et d’intervention à court et à long terme (Thème 5 : Recherche et éthique). La mobilisation stratégique et la formation des postes pour la capacité de pointe peuvent être nécessaires afin de soutenir les activités prioritaires à travers le continuum d’intervention (Thème 2 : Capacité d’intervention et formation des laboratoires).
Lorsque l’on opère dans des environnements aux ressources limitées et sous des contraintes de temps importantes, les oublis lors de la phase initiale de planification peuvent avoir un impact sur l’efficacité globale de l’intervention de diverses manières. Les conséquences peuvent comprendre un manque d’allocation de ressources pour soutenir les priorités d’intervention des laboratoires qui ont été négligées, des retards ou des perturbations dans le partage de l’intelligence scientifique ou l’acquisition et la distribution de matériel et de produits biologiques, l’absence de représentation appropriée des laboratoires aux principales tables de décision et d’autres problèmes en aval. L’importance de mécanismes de financement rapides a été soulignée par l’Organisation mondiale de la santé à la suite de l’intervention contre le virus Ebola en Afrique de l’Ouest, car « les éclosions de maladie évoluent souvent plus vite que les fonds alloués pour y faire face »Note de bas de page 46.
Un défi particulier peut être la capacité de maintenir les activités régulièrement mandatées en parallèle avec les demandes des efforts d’intervention des laboratoires en évolution, et peut nécessiter une évaluation minutieuse de la capacité d’augmentation des effectifs et de la hiérarchisation des activités. Par exemple, la réaffectation interne de personnel hautement qualifié des programmes existants pour répondre aux besoins immédiats d’intervention contre la crise peut créer d’importantes lacunes opérationnelles dans toute l’organisation qui doivent également être comblées pour maintenir la capacité d’intervention globale en matière de santé publique. À long terme, les lacunes en matière d’expertise peuvent avoir un impact cumulatif sur les capacités des laboratoires au cours d’efforts d’intervention multiples, séquentiels ou simultanés. Il n’est pas facile de remédier à ces insuffisances de capacité en utilisant des approches à court terme face à une menace émergente. Cet effet a été observé par le Laboratoire national de microbiologie peu après le début des activités d’intervention contre la COVID-19, et a été une considération permanente associée aux interventions antérieures contre les maladies infectieuses étendues. Bien que le problème ait été identifié pour la première fois dans le rapport Naylor de 2003, qui présentait en détail les leçons tirées de l’intervention du Canada en matière de santé publique contre la pandémie de SRAS, le Dr David Butler-Jones a de nouveau souligné, le 3 février 2020, les répercussions possibles des lacunes plus récentes, après 2014, en matière d’expertise et de ressources de santé publique sur la capacité globale d’intervention en santé publique au Canada, quelques jours seulement après que l’Organisation mondiale de la santé ait déclaré que l’épidémie de maladie à coronavirus 2019 (nCoV-2019) était une urgence de santé publique de portée internationale le 30 janvier 2020Note de bas de page 13Note de bas de page 47Note de bas de page 48.
Mise en œuvre de la liste de contrôle – considérations supplémentaires
La nature multidimensionnelle et interdépendante des considérations relatives à l’intervention des laboratoires pose divers défis aux efforts de coordination à haut niveau. En l’absence d’une approche stratégique, il existe un risque réel que toutes les considérations pertinentes au contexte d’intervention ne soient pas identifiées en vue d’une action en temps utile.
Dans le contexte canadien, comme dans d’autres pays, il existe de nombreux documents d’orientation qui fournissent des recommandations approfondies sur les mesures à prendre en fonction des agents pathogènes et des maladies. Celles-ci vont des méthodes d’essai, des procédures opérationnelles et des protocoles d’intervention en cas d’épidémie normalisés utilisés dans les environnements de laboratoire, aux directives de planification et d’intervention en cas d’urgence utilisées à la fois par les organisations et par les réseaux de laboratoires interjuridictionnelsNote de bas de page 28Note de bas de page 49Note de bas de page 50Note de bas de page 51. Les exigences législatives et réglementaires spécifiques à chaque juridiction définissent les paramètres dans lesquels les activités d’intervention des laboratoires sont menées pour soutenir la biosécurité, la sûreté biologique et la confidentialité des informations; tandis que d’autres réglementations et accords multilatéraux de partage d’informations (e.g. l’Entente multilatérale sur l’échange de renseignements) définissent des exigences et des principes spécifiques aux maladies permettant l’échange de renseignements entre juridictions afin de soutenir une surveillance et une intervention en temps utile en cas d’éclosion.Note de bas de page 34Note de bas de page 35Note de bas de page 52Note de bas de page 53.
Sur le plan opérationnel, l’objectif de la liste de contrôle est de remplir une fonction complémentaire par rapport à d’autres documents d’orientation de laboratoire plus normatifs et spécifiques au contexte. La mise en œuvre d’une liste de contrôle souple et non prescriptive est proposée comme moyen de faciliter la coordination globale de l’intervention en identifiant et en hiérarchisant rapidement les considérations pertinentes à travers plusieurs thèmes d’intervention.
Bien que la liste de contrôle ait été conçue pour être facile à utiliser dans sa forme de référence actuelle, il est reconnu que toutes les considérations de la liste de contrôle peuvent ne pas être pertinentes ou ne pas entrer dans le cadre normal des activités d’intervention pour une entité de laboratoire donnée (e.g. recherche ciblée, élaboration de contre-mesures médicales). Ainsi, une personnalisation supplémentaire du contenu et de la terminologie de la liste de contrôle pour refléter les rôles et les responsabilités des laboratoires spécifiques au site peut optimiser l’utilité globale. La fonctionnalité peut être encore améliorée par l’élaboration d’annexes supplémentaires afin de saisir les références et les ressources importantes propres à chaque juridiction et afin d’aider à orienter les actions futures concernant toute considération identifiée comme pertinente au cours d’un processus d’examen donné de la liste de contrôle.
Les organismes et réseaux de mise en œuvre peuvent également souhaiter examiner les approches préférées pour faire participer les participants au processus d’examen de la liste de contrôle, y compris l’équilibre entre la représentation des experts en la matière et celle des travailleurs, nécessaire pour refléter la portée des activités d’intervention potentielles. Il peut être utile d’identifier les déclencheurs opérationnels susceptibles de démarrer un examen formel de la liste de contrôle, en reconnaissant que ces déclencheurs peuvent varier pendant et entre des circonstances d’éclosions, et peuvent être internes ou externes à l’organisation d’intervention. Par exemple, l’examen complet de la liste de contrôle peut être considéré comme une priorité organisationnelle immédiate lors d’une intervention contre des menaces de maladies infectieuses pour lesquelles des protocoles d’intervention doivent toujours être élaborés. L’examen peut également être lancé en réponse à un déclencheur externe pertinent, tel que l’identification d’une menace de maladie infectieuse émergente pouvant potentiellement avoir des conséquences graves, ou la déclaration officielle d’une urgence de santé publique de portée internationale par l’Organisation mondiale de la santéNote de bas de page 36.
La mise en œuvre de la liste de contrôle peut être envisagée sur le plan opérationnel dans le contexte des outils de planification existants du programme de gestion des urgences afin d’améliorer les fonctions d’atténuation, de préparation, d’intervention et de rétablissement, conformément aux quatre phases de la gestion des urgencesNote de bas de page 15. Par exemple, un processus d’examen de la liste de contrôle peut être lancé dans le cas où les efforts d’intervention nécessitent un soutien d’urgence coordonné au niveau central, y compris l’activation officielle d’un centre des opérations d’urgence associé à l’organisation des laboratoires. L’examen par un groupe d’experts en la matière, représentatif des programmes engagés dans les activités d’intervention ou susceptibles d’être touchés par celles-ci, peut être lancé et coordonné par la direction des laboratoires ou par l’intermédiaire du centre des opérations d’urgence. Les considérations de haut niveau, les lacunes et les mesures proposées en rapport avec l’intervention actuelle peuvent être documentées à l’aide de la version électronique de l’outil de la liste de contrôle, puis distribuées pour le suivi, conformément au système de commandement des incidents actuellement en vigueurNote de bas de page 15. Sur le plan opérationnel, un document de liste de contrôle permettant de contrôler la qualité et constamment mis à jour peut être maintenu de manière centralisée pour servir de référence à la planification pendant les périodes d’éclosion et entre ces périodes.
Si chaque processus d’examen de la liste de contrôle peut identifier de nombreuses considérations pertinentes, il peut être possible de n’agir que sur un sous-ensemble de considérations sensibles au temps au milieu d’une intervention, tout en reportant les autres pour une action future durant une période entre éclosions. Il faut également considérer qu’une fois que l’intervention initiale contre une menace de maladie infectieuse émergente est terminée, les responsabilités des laboratoires mandatés peuvent ne pas revenir à leur niveau de référence d’avant l’éclosion, dans l’immédiat ou à long terme. À mesure que de nouveaux tests sont intégrés dans les menus des tests de laboratoire de routine et que les niveaux de tests restent élevés pour soutenir la détection et la surveillance des cas en cours, chaque intervention ultérieure contre la maladie infectieuse émergente peut avoir un impact cumulatif sur les activités de base des laboratoires, de sorte que des ressources supplémentaires sont nécessaires pour maintenir les activités entre les éclosions à des niveaux « nouvellement normaux ». L’examen périodique des considérations de la liste de contrôle pendant les périodes entre deux épidémies peut aider à identifier les lacunes opérationnelles qui en résultent et à éclairer les efforts à plus long terme visant à renforcer les capacités d’intervention des laboratoires.
Limites
Le contenu de la liste de contrôle reflète principalement les perspectives et les expériences des laboratoires de santé publique intervenants canadiens et internationaux qui ont participé directement au processus d’élaboration et d’examen. Bien que les considérations relatives aux organisations de laboratoires opérant aux niveaux local et régional (e.g. les laboratoires hospitaliers et les laboratoires de diagnostic de première ligne) puissent différer en termes d’orientation et de portée, elles restent très pertinentes pour la réactivité globale de l’écosystème des laboratoires de santé publique. L’une des principales limites associées à l’initiative de la liste de contrôle est la mesure dans laquelle celle-ci sera mise en œuvre et utilisée comme prévu par les organisations et réseaux de laboratoires participant à l’intervention de santé publique.
Conclusion
Face à une menace de maladie infectieuse émergente, une intervention efficace des laboratoires nécessite la coordination, en temps utile, de multiples activités interdépendantes pour soutenir l’action de santé publique. Selon les premières informations recueillies, la liste de contrôle pourrait être un outil utile afin d’identifier rapidement et systématiquement les principales considérations en matière d’intervention, mettre en évidence les besoins et les lacunes opérationnels et éclairer la planification stratégique, l’établissement des priorités et la prise de décision visant à atténuer les risques.
L’un des principaux objectifs de l’initiative de la liste de contrôle était de garantir la disponibilité d’une version de référence pouvant être utilisée sous sa forme actuelle ou adaptée par les laboratoires la mettant en œuvre afin d’améliorer sa pertinence dans son cadre d’utilisation. Après sa mise en œuvre, la liste de contrôle est destinée à servir de « document vivant » pouvant être mis à jour pour refléter l’évolution des rôles, des considérations et des enseignements tirés des futurs efforts d’intervention des laboratoires.
La mise en œuvre, l’adaptation, l’examen et la mise à jour de routine de la liste de contrôle dans le contexte des cadres de gestion des urgences existants peuvent permettre de renforcer encore la préparation et les capacités d’intervention des laboratoires contre les éclosions, et de contribuer au développement de la résilience à long terme de la santé publique. À l’avenir, toute évaluation future de l’utilité de la liste de contrôle dans les organisations et les juridictions l’utilisant devra tenir compte de ces facteurs.
Déclaration des auteurs
Les contributions des auteurs sont les suivantes :
- T. E. — Conceptualisation, développement du contenu (outil de la liste de contrôle, annexes, illustration des figures), rédaction, révision et édition
- G. T. — Conceptualisation, révision et édition
- T. K. — Conceptualisation, révision et édition
- M.G. — Conceptualisation, révision et édition
Intérêts concurrents
Les auteurs n’ont pas d’intérêts concurrents.
Remerciements
Toutes les personnes et organisations et tous les réseaux ayant participé aux discussions techniques préliminaires, à l’élaboration et à la révision du document de la liste de contrôle sont remerciés pour leurs contributions, notamment :
Laboratoire national de microbiologie (LNM) : S. Beddome, Dr C. Corbett, K. Gordon, S. Guercio, C. Jorowski, L. Kearney, K. Keith, C. Ouellette, S. Radons Arneson, C. Yoshida, R. Cole (agent technique de liaison avec les laboratoires [ATLL], Manitoba [MB]), K. Cronin (ATLL, Ontario [ON]), R. DePaulo (ATLL, Saskatchewan [SK]), L. A. Jalbert (ATLL, Nouveau-Brunswick [NB]), K. Macdonald (ATLL, Colombie-Britannique [BC]), C. Phillips (ATLL, Nouvelle-Écosse [NS]), L. Wong (ATLL, Alberta [AB])
Réseau des laboratoires de santé publique du Canada (RLSPC) : Dr M. Gilmour (coprésident fédéral, LNM), Dr P. Van Caeseele (coprésident provincial, Cadham Provincial Laboratory, Winnipeg, MB), Dr T. Kuschak (LNM, secrétariat du RLSPC), Dr M. Krajden (BC Centre for Disease Control Public Health Laboratory, Vancouver, BC), Y. Chang (BC Centre for Disease Control Public Health Laboratory, Vancouver, BC), Dr G. Tipples (Alberta Provincial Laboratory for Public Health, Alberta Precision Laboratories, Edmonton, AB), Dr P. Levett (Roy Romanow Provincial Laboratory, Regina, SK), Dr F. Jamieson (Public Health Ontario Laboratories, Toronto, ON), Dr J. Longtin (Laboratoire de santé publique du Québec, Ste-Anne-de-Bellevue, Québec [QC]), Dr G. German (Health Prince Edward Island [PEI], Charlottetown, PEI), Dr G. D. Haldane (Queen Elizabeth II Health Science Centre, Halifax, NS), Dr G. Zahariadis (Newfoundland and Labrador [NL] Public Health Laboratory, St. John’s, NL), Dr R. Garceau (Centre hospitalier universitaire Dr Georges-L.-Dumont, Moncton, NB)
Réseau de laboratoires du Groupe de travail sur la protection de la santé mondiale (GTPSM) : Dr M. Gilmour (coprésident, Winnipeg, MB, Canada), Dr J. A. Diaz Quiñonez (coprésident, Mexico City, Mexico), Dr T. Kuschak (chef du secrétariat, Winnipeg, MB, Canada), Dr A. Nitsche (Berlin, Allemagne), A. Roberts (Londres, Royaume-Uni), Dr A. Di Caro (Rome, Italie), C. Chadwick (Washington DC, États-Unis), Dr M. Saijo (Tokyo, Japon), Dr M. W, Shaw (Atlanta, États-Unis)
Financement
Ce travail a été soutenu par l’Agence de santé publique du Canada.
Matériel supplémentaire
Des documents supplémentaires pour cet article sont disponibles en ligne.
Supplément I : Liste de contrôle pour laboratoires d’intervention contre les éclosions de maladie infectieuse
| MESURE REQUISE | STATUT | PRIORITÉ | ÉLÉMENT DE LA LISTE DE CONTRÔLE |
|---|---|---|---|
| 1. ÉTUDES EN LABORATOIRE | |||
| 1.1. Prélèvement et transport des échantillons : Pour soutenir et coordonner des études menées en temps utile par les laboratoires, identifier et documenter à l’avance les besoins en matière de prélèvement et de transport des échantillons, notamment : | |||
| 1.1.1. Les types, volumes et quantités d’échantillons appropriés; à réévaluer si nécessaire | |||
| 1.1.2. Le ou les contenant(s) d’échantillons appropriés pour le transport selon la classification du groupe de risque | |||
| 1.1.3. Les instructions détaillées sur l’emballage et l’étiquetage des contenants d’échantillons | |||
| 1.1.4. Les exigences en matière de gestion de la chaîne du froid, c’est-à-dire la température et les délais d’expédition et d’arrivée | |||
| 1.1.5. Les exigences en matière de documentation du transport de matières dangereuses | |||
| 1.1.6. Les recommandations sur les services de courrier préférés en fonction de la classification des risques liés aux agents pathogènes | |||
| 1.1.7. Les considérations géographiques ayant un impact sur le transport des échantillons et des équipements et fournitures de test essentiels pour les populations isolées/éloignées | |||
| 1.1.8. Les directives, protocoles, équipements et fournitures en matière de biosécurité, de sûreté biologique et de lutte contre les infections, nécessaires à la manipulation et au traitement des échantillons dans le cadre des interventions cliniques, de laboratoire et de terrain, notamment : | |||
| 1.1.8.1. Les équipements de protection individuelle (EPI) et matériels de prélèvement et de transport des échantillons (par exemple, écouvillons, milieu de transport viral) | |||
| 1.1.8.2. Les mesures de confinement (par exemple, armoires de sécurité biologique) et méthodes de décontamination | |||
| 1.1.8.3. Les exigences en matière de conservation, de entreposage et d’élimination des échantillons | |||
| 1.1.9. Les exigences et considérations supplémentaires en matière de documentation dans les cadres législatifs et réglementaires existants, notamment : | |||
| 1.1.9.1. Les permis d’importation et d’exportation | |||
| 1.1.9.2 Les accords de transfert de matériel entre le client et les entités de laboratoire (par exemple, pour soutenir la distribution des réactifs, les contrôles, les groupes de validation/expertise) | |||
| 1.1.9.3. L’alignement des exigences en matière de prélèvement des échantillons sur les accords de partage de données existants | |||
| 1.1.9.4. Les exigences en matière de lignes directrices, d’autorisation et de certification des laboratoires concernant l’étude d’un agent infectieux nouveau ou émergent (par exemple, exigences de la formulaire de demande d’analyse, de SC, de LAPHT, et des RAPHT) | |||
| 1.1.9.5. Les plans et protocoles d’intervention d’urgence en matière de transport (par exemple, le PIU pour les agents pathogènes du groupe de risque 4, et la mobilisation des coordinateurs régionaux d’intervention) | |||
| 1.1.10. La rédaction d’un diagramme de flux d’échantillons pour guider les exigences des prélèvements et du transport | |||
| 1.2. Tests en laboratoire : Pour soutenir les efforts d’étude des laboratoires, examiner, développer, documenter et communiquer des recommandations et des protocoles de dépistage des maladies infectious (MI) fondés sur des données probantes, en collaboration avec les partenaires de la santé publique, en tenant compte des éléments suivants : | |||
| 1.2.1. Le ou les algorithmes de diagnostic à utiliser pour la confirmation en laboratoire des études de cas, pour informer et/ou s’aligner sur la définition actuelle des cas de MI (qui peut être spécifique à une éclosion) | |||
| 1.2.2. Les critères d’essai et protocoles de triage pour les essais à grand volume, en utilisant les connaissances disponibles sur les antécédents d’exposition (par exemple, contact étroit, antécédents de voyage) et d’autres informations sur les facteurs de risque (par exemple, grossesse, statut d’hospitalisation) | |||
| 1.2.3. Les exigences relatives aux champs de données du formulaire de demande d'analyse de test, conformément à la définition de cas de MI, afin de permettre une gestion de cas et une intervention de santé publique rapides et efficaces | |||
| 1.2.4. Les critères d’acceptation et de rejet des échantillons | |||
| 1.2.5. Les protocoles de conservation et d'entreposage des échantillons (à des fins de diagnostic, de surveillance et de recherche) | |||
| 1.2.6. Le contrôle de la qualité et la normalisation des méthodes de test en laboratoire et des processus de rapport dans le cadre d’un système de gestion de la qualité, notamment : | |||
| 1.2.6.1. La validation, vérification et comparaison des spécifications de performance des tests de laboratoire de diagnostic; y compris la sensibilité, la spécificité, l’exactitude et la précision | |||
| 1.2.6.2. La mise en œuvre et l’utilisation des procédures opératoires normalisées | |||
| 1.2.6.3. Le suivi et l’évaluation des délais d’exécution des tests de laboratoire, à la réception des échantillons | |||
| 1.2.7. Les exigences en matière de communication des résultats des tests, notamment : | |||
| 1.2.7.1. L’utilisation de processus de communication, de formulaires de rapport et de terminologie normalisés pour les résultats de test | |||
| 1.2.7.2. La nécessité éventuelle de communiquer les résultats « préliminaires » avant la publication d’un rapport final | |||
| 1.2.7.3. La capacité à soutenir la communication des résultats pour les échantillons soumis par rapport aux études de cas | |||
| 1.2.8. L’alignement et la normalisation des méthodes de test et des critères d’interprétation dans les sites/juridictions de test décentralisés afin de soutenir des efforts de surveillance et de rapport des cas précis et cohérents | |||
| 1.2.9. L’examen et la mise à jour de processus et protocoles liés aux tests pour soutenir les exigences d'intervention en évolution contre les éclosions, conformément aux preuves scientifiques actuelles | |||
| 2. CAPACITÉ D’INTERVENTION DES LABORATOIRES ET FORMATION | |||
| 2.1. Capacité d’intervention des laboratoires : Pour relever les défis d’intervention des laboratoires spécifiques à la menace de la MI, il convient d’évaluer en permanence les points suivants en collaboration avec les laboratoires de santé publique partenaires : | |||
| 2.1.1. Les capacités des laboratoires d’identification et de caractérisation des agents pathogènes, y compris le dépistage de première ligne et les méthodes de test de confirmation à tous les niveaux de juridiction (c’est-à-dire à l’hôpital, au niveau régional, provincial/territorial (P/T), au niveau des États, au niveau national et international) | |||
| 2.1.2. La disponibilité de méthodes de test diagnostique validées (par exemple, sérologique, moléculaire, de sous-typage, génomique, protéomique), y compris les trousses disponibles sur le marché et les tests développés en laboratoire | |||
| 2.1.3 Les caractéristiques de performance des méthodes de test diagnostique actuellement utilisées, y compris la sensibilité, la spécificité, les délais d’exécution et la capacité en test des plateformes actuelles | |||
| 2.1.4. L’obligation de développer et de valider les tests développés en laboratoire lorsque les capacités externes n’existent pas ou ne sont pas accessibles de manière fiable pendant une éclosion | |||
| 2.1.5. Les capacités de tests diagnostiques décentralisées et le potentiel de transfert de technologies pour améliorer la capacité d’intervention des laboratoires nationaux en cas d’urgence, en fonction de l’ampleur et de la durée prévue de l’intervention | |||
| 2.1.6. L’accès au dépistage par les populations à risque et mal desservies, y compris la nécessité de poursuivre d’autres stratégies de dépistage pour soutenir les populations géographiquement éloignées et/ou isolées (par exemple, utilisation de méthodes de dépistage au point de service, modèles d’engagement communautaire renforcé) | |||
| 2.1.7. La disponibilité permanente d’équipements de laboratoire, de fournitures, de réactifs et de contrôles essentiels à l’intervention par l’intermédiaire de fournisseurs et de chaînes d’approvisionnement établis | |||
| 2.1.8. La disponibilité des fournitures de laboratoire essentielles via les stocks d’urgence locaux, régionaux et nationaux (par exemple, EPI, écouvillons, réactifs) | |||
| 2.1.9. L’obligation de coordonner l’approvisionnement en fournitures de laboratoire par l’intermédiaire de plusieurs fournisseurs, en mettant l’accent sur les fournitures produites au niveau national (par exemple, dispositifs et récipients de prélèvement d’échantillons, articles consommables, produits chimiques/réactifs) | |||
| 2.1.10. La capacité à soutenir les activités de validation clinique en cours, selon les besoins, pour vérifier la qualité de toutes les fournitures de laboratoire, en particulier lorsqu’il s’agit de traiter avec des fournisseurs multiples et/ou de changer fréquemment de fournisseurs en raison de problèmes de continuité de la chaîne d’approvisionnement | |||
| 2.1.11. La capacité à acquérir des échantillons auprès de la communauté internationale afin de soutenir la mise au point d’outils de diagnostic pour détecter les nouveaux agents pathogènes émergeant dans un contexte international | |||
| 2.2 Capacité de pointe et formation : Pour permettre aux laboratoires de réagir de manière souple, évolutive et rapide aux menaces liées aux MI, il convient d’évaluer de manière dynamique les besoins liés aux considérations suivantes en matière de capacité de pointe : | |||
| 2.2.1. L’expertise scientifique et la capacité de réaction technique du personnel actuel relatives aux MI | |||
| 2.2.2. La disponibilité d’espace de laboratoire, d’installations de bioconfinement, d’équipements de test et de consommables (par exemple, des armoires de sécurité biologique, des autoclaves, des postes de travail dédiés à la RCP, des plateformes de tests, des réactifs, des kits d’extraction, des EPI, des écouvillons, milieu de transport viral) | |||
| 2.2.3. L’identification des postes de « capacité de pointe » qui peuvent être mobilisés en interne et/ou faire l’objet d’une formation polyvalente afin d’atténuer les problèmes de charge de travail dans les diverses fonctions d’intervention des laboratoires (par exemple, par le biais de processus d’inventaire du personnel et de mobilisation d’urgence axés sur l’intervention et à l’échelle de l’organisation) | |||
| 2.2.4. Les besoins et priorités en matière de formation polyvalente (par exemple, les compétences de base, les compétences en matière de tests, les compétences en matière de saisie/gestion des données pour soutenir les rapports dans les cas de grand volume de données) | |||
| 2.2.5. Les approches normalisées pour la formation et la documentation des compétences du personnel (par exemple, les méthodes de test, la collecte, l’analyse et l’interprétation des données) | |||
| 2.2.6. L’engagement du soutien d’un centre d’opérations d’urgence spécialisé pour renforcer la capacité d’intervention au sein d’un système de commandement des incidents | |||
| 2.2.7. L’identification des contraintes de financement et des possibilités d’accès aux mécanismes de financement d’urgence | |||
| 2.2.8. Les approches alternatives à l’organisation du travail en équipe pour augmenter les heures-personnes disponibles pendant les périodes d’intervention accrue | |||
| 2.2.9. L’exploration d’options de dotation stratégique à court et à long terme de postes aux compétences recherchées (soutien scientifique, technique et programmatique) afin de remédier à l’insuffisance des capacités due à l’augmentation de la charge de travail, aux modalités de travail alternatives et aux exigences anticipées relatives aux malades/à l’auto-isolement dus à la maladie infectieuse émergente | |||
| 2.2.10. La capacité de laboratoire mobile pour répondre aux exigences d’intervention sur le terrain en cas d’éclosion de MI, tant au niveau national qu’international | |||
| 2.2.11. L’évaluation de la capacité en tests des laboratoires, y compris l’identification de tout goulet d’étranglement | |||
| 2.2.12. Les technologies disponibles susceptibles de faciliter le développement des capacités de pointe, notamment : | |||
| 2.2.12.1. Les plateformes de tests alternatives pour augmenter la capacité en tests | |||
| 2.2.12.2. Les vidéos de formation, par exemple pour démontrer les exigences en matière de prélèvement des échantillons | |||
| 2.2.12.3. Les outils et plateformes d’échange d’informations et de partage de données sur le Web | |||
| 2.2.13. La planification de l’atténuation des risques pour identifier et traiter les vulnérabilités opérationnelles observées pendant toutes les phases d’intervention des laboratoires | |||
| 2.2.14. La participation à des exercices d’évaluation de la préparation (y compris des simulations conjointes) avec des partenaires de santé publique interdisciplinaires et interjuridictionnels participant à une intervention coordonnée contre les maladies infectieuses (par exemple, épidémiologistes, médecins, chercheurs sur le terrain), généralement pendant les périodes entre les flambées | |||
| 3. SURVEILLANCE ET GESTION DES DONNÉES DES LABORATOIRES | |||
| 3.1. Surveillance et gestion des données des laboratoires : Pour soutenir des activités de surveillance intégrée en temps utile des MI en laboratoire, les principales considérations sont les suivantes : | |||
| 3.1.1. Évaluer le statut de surveillance actuel des MI à tous les niveaux juridictionnels, y compris l’existence ou la nécessité de : | |||
| 3.1.1.1. Une définition de cas établie pour faciliter l’étude et la confirmation des cas à l’aide de critères de laboratoire et épidémiologiques dans le contexte de l’éclosion actuelle | |||
| 3.1.1.2. L’harmonisation des critères de confirmation des cas entre les juridictions faisant rapports afin d’assurer la cohérence nationale du nombre de cas, des rapports, de la surveillance et des efforts d’intervention | |||
| 3.1.1.3. Les procédures de signalement et de notification des cas suspects et/ou confirmés à chaque niveau juridictionnel (infranational, national, international (par exemple, obligations de signalement de l’RSI)) | |||
| 3.1.1.4. Un personnel de liaison dédié, basé sur les sites de laboratoire, pour soutenir la communication en temps réel des renseignements et des données de surveillance générés par les laboratoires, afin d’informer les activités d’intervention en matière de santé publique (par exemple, le rapport quotidien des cas confirmés par les laboratoires nationaux par juridiction; le pourcentage de tests positifs pour les populations d’intérêt; la modification des algorithmes de tests de laboratoire et des critères d’acceptation des échantillons) | |||
| 3.1.1.5. Des systèmes ou plateformes de surveillance capables de prendre en charge la détection de MI en temps utile, l’intégration des données, la génération de rapports, la surveillance des éclosions et l’élaboration de modèles de risque dans le contexte de l’intervention actuel | |||
| 3.1.1.6. Le soutien de gestion de l’information et technologies de l’information pour les pipelines de transfert de données et les outils bioinformatiques nécessaires afin d’acquérir et d’analyser les données génomiques (par exemple, le séquençage du génome entier) et autres données « omiques » | |||
| 3.1.2. Identifier les considérations de surveillance en laboratoire liées à la détection, la confirmation, la caractérisation, le suivi et le rapport des cas de MI ou de l’éclosion notamment : | |||
| 3.1.2.1. La connaissance actuelle de l’épidémiologie, de l’histoire naturelle et de l’écologie de la MI afin d’éclairer les stratégies de tests de laboratoire et les recommandations de triage | |||
| 3.1.2.2. Le suivi et la classification des études de laboratoire conformément aux critères de définition des cas établis (par exemple, cas suspect faisant l’objet d’une étude, cas probable positif, cas confirmé par le laboratoire, n’est pas un cas/éliminé) | |||
| 3.1.2.3. Les éléments clés des données de laboratoire et épidémiologiques nécessaires pour éclairer les processus d’étude en laboratoire, y compris le triage des échantillons, la sélection des algorithmes de diagnostic, l’interprétation des résultats, le rapprochement des données et les efforts de classification et de confirmation des cas (par exemple, les identificateurs de cas uniques, l’historique des tests, la date d’apparition des symptômes, les antécédents de voyage, les autres facteurs de risque, etc.) | |||
| 3.1.2.4. Les exigences en matière de rapprochement et d’intégration des données pour permettre une surveillance et une intervention rapides, par exemple : | |||
| • le lien entre les échantillons et les résultats des tests associés et le cas en cours d’étude | |||
| • le rapprochement des données de laboratoire et des données épidémiologiques sur les cas détenues par des juridictions de santé publique distinctes | |||
| • le lien entre les cas confirmés et une flambée éclosion donnée, ou la source de l'éclosion | |||
| 3.1.2.5. Le processus d’examen, de vérification, de surveillance et de rapport des cas confirmés en laboratoire | |||
| 3.1.2.6. Les approches d’épidémiologie moléculaire/génomique de la santé publique pour soutenir la surveillance des souches de la MI, la caractérisation des flambées et l’attribution de la source | |||
| 3.1.2.7. La faisabilité de l’utilisation d’outils en ligne et de plateformes informatiques de santé publique pour favoriser le partage d’informations sûres et rapides et le rapprochement de données d’études de cas provenant de sources de santé publique disparates | |||
| 3.1.2.8. La conception et l’élaboration de rapports de surveillance pour soutenir les efforts continus des laboratoires de surveillance, d’évaluation et de rapport des informations sur les éclosions de MI, par exemple : | |||
| • Le suivi du statut des processus d’étude en laboratoire (en temps réel) | |||
| • Le nombre de cas confirmés en laboratoire (par exemple, totaux cumulés, nouveaux cas/unité de temps) | |||
| • La classification finale de toutes les études en laboratoire dans les populations cibles (par exemple, pourcentage de tests positifs par rapport au nombre total de tests effectués, pourcentage de tests confirmés en laboratoire) | |||
| • La distribution des cas confirmés en laboratoire à l’aide des données disponibles (c’est-à-dire par âge, sexe, géographie, historique d’exposition, autres catégories de risques (par exemple, travailleurs de la santé, race/ethnicité)) | |||
| • L’épidémiologie moléculaire de l’éclosion (par exemple, les liens entre les cas, l’attribution de la source) | |||
| • L’estimation d’indicateurs basés sur les laboratoires pour contrôler et évaluer les performances de surveillance (par exemple, rapidité, taux d’études de MI en laboratoire, qualité et exhaustivité des données) | |||
| 3.1.2.9. Le contexte législatif et les accords relatifs au partage interjuridictionnel d’informations et de données pour soutenir les activités d’étude de la MI en laboratoire (par exemple, EMER, RSI) | |||
| 3.1.3. Aligner les champs de données du formulaire de demande d’analyse des laboratoires sur la définition de cas de MI afin de favoriser une surveillance et une intervention efficaces, en tenant compte des types de champs de données clés suivants : | |||
| 3.1.3.1. La présentation des coordonnées des laboratoires/clients pour étayer les rapports sur les résultats et d’autres communications afin d’éclairer la prise de décision clinique | |||
| 3.1.3.2. Des identificateurs uniques permettant d’établir un rapprochement non nominatif et interjuridictionnel entre les résultats de laboratoire et le cas étudié, afin de faciliter la classification, les rapports, la prise de décision clinique, la surveillance et la réponse relatifs aux cas | |||
| 3.1.3.3. Les informations de géolocalisation pour le cas étudié, si elles sont pertinentes sur le plan juridictionnel (par exemple, ville, région de santé rapportant le cas, province, territoire, état, pays, code postal, région de tri d’acheminement (c’est-à-dire code postal à trois chiffres)) | |||
| 3.1.3.4. Les champs cliniques, épidémiologiques et de laboratoire nécessaires pour soutenir le triage des échantillons hautement prioritaires, la sélection d’algorithmes de test appropriés et l’interprétation des résultats, ainsi que la confirmation des cas, la surveillance ciblée et les rapports (par exemple, historique des tests, historique des voyages ou expositions, historique des vaccinations, grossesse, statut d’hospitalisation, symptomatique vs asymptomatique, autres informations améliorées sur les groupes à risque) | |||
| 3.1.3.5. Les champs de date nécessaires pour faciliter la sélection des algorithmes de diagnostic, l’interprétation des résultats des tests et l’estimation des indicateurs de surveillance en laboratoire (c’est-à-dire l’apparition des symptômes, le prélèvement des échantillons, la réception des échantillons, les résultats des tests et les dates de signalement des cas) | |||
| 3.1.4. Évaluer les besoins en matière de flux de données du système de gestion de l’information des laboratoires (SGIL) et mettre en œuvre les processus du SGIL pour soutenir les études, la surveillance et les interventions relatives à la MI, notamment : | |||
| 3.1.4.1. Les approches normalisées de la documentation et du suivi des processus de demande de test, de suivi des échantillons, de saisie, d’examen des données, de rapprochement des données et de rapports des résultats | |||
| 3.1.4.2. La normalisation de la terminologie, la cartographie des flux de données et la définition des exigences en matière de conservation et de cycle de vie des données | |||
| 3.1.4.3. Les exigences en matière de documentation de la « chaîne de traçabilité » pour les études de laboratoire de haut niveau et les rapports sur les résultats (par exemple, la microbiologie médico-légale) | |||
| 3.1.4.4. La création de requêtes personnalisées pour soutenir la surveillance et l’intervention en cours | |||
| 3.1.4.5. La génération de rapports de synthèse pour faciliter le suivi, l’évaluation et la notification des activités de surveillance de la MI par les laboratoires et de réponse aux épidémies | |||
| 3.1.4.6. L’utilisation d’outils et de plateformes sur le Web pour soutenir les demandes de tests et la communication des résultats, ainsi que le rapprochement interjuridictionnelle en temps utile des données des études | |||
| 3.1.5. Évaluer et traiter de manière dynamique les vulnérabilités opérationnelles qui ont une incidence sur l’ensemble des efforts d’intervention et de communication des résultats, notamment : | |||
| 3.1.5.1. La communication externe et les défis en matière de rapports interjuridictionnels | |||
| 3.1.5.2. Les différences entre les juridictions en ce qui concerne les algorithmes de test en laboratoire et l’interprétation des résultats | |||
| 3.1.5.3. Les modifications des définitions de cas confirmés entre juridictions qui peuvent avoir un impact sur la surveillance | |||
| 3.1.5.4. Les problèmes de rapprochement des données ayant une incidence sur l’exactitude et la rapidité du comptage et des rapports des cas | |||
| 3.1.5.5. Les défis liés à la collecte de données améliorées sur les « groupes à risque » pour permettre des études de laboratoire en temps utile, ainsi que l’analyse épidémiologique des effets de la MI sur les populations à risque | |||
| 4. ENGAGEMENT ET COMMUNICATION INTERJURIDICTIONNELS | |||
| 4.1. Engagement et communication interjuridictionnels : Afin de soutenir l’engagement coordonné des acteurs de la santé publique et la diffusion cohérente des informations des laboratoires, élaborer une stratégie de communication stratégique intégrant les considérations suivantes : | |||
| 4.1.1. L’accessibilité des informations sur l’intervention actuelle des laboratoires contre la MI au public et aux professionnels de la santé publique via : | |||
| 4.1.1.1. Le contenu en ligne et les outils de médias sociaux | |||
| 4.1.1.2. Un numéro d’urgence 24 heures sur 24 qui permet d’accéder d’urgence aux services de soutien des laboratoires | |||
| 4.1.1.3. Un « Guide des services du laboratoire » destiné au public, comprenant les exigences relatives aux demandes d’échantillons et de tests | |||
| 4.1.1.4. Des recommandations et des documents d’orientation sur les tests en laboratoire qui aident les partenaires cliniques et de santé publique à prendre des décisions | |||
| 4.1.1.5. Des processus d’alerte et de notification qui diffusent simultanément des informations sensibles au facteur temps aux décideurs de santé publique interjuridictionnels | |||
| 4.1.2. L’engagement de partenaires de laboratoires externes, de réseaux de santé publique et de groupes de travail interjuridictionnels participant à la coordination de l’intervention de santé publique en matière d’identification, notamment : | |||
| 4.1.2.1. Les réseaux de médecins et les comités responsables de l’élaboration de lignes directrices cliniques | |||
| 4.1.2.2. Les laboratoires de santé publique et les partenaires en épidémiologie, ainsi que les réseaux interjuridictionnels chargés d’élaborer des définitions de cas consensuelles et de coordonner les activités de surveillance et d’intervention en matière de santé publique | |||
| 4.1.2.3. Les réseaux de biosécurité et partenaires impliqués dans l’élaboration de lignes directrices en matière de biosécurité | |||
| 4.1.2.4. Les décideurs politiques responsables de l’élaboration et de la mise en œuvre de politiques fondées sur des données probantes pour soutenir l’action de santé publique | |||
| 4.1.3. Le renforcement des mécanismes de collaboration et de partage d’informations avec les partenaires et les réseaux de santé publique pour permettre : | |||
| 4.1.3.1. L’élaboration, sur la base de données probantes, de recommandations et de lignes directrices cliniques et de laboratoire, ainsi que de stratégies de surveillance et d’intervention en matière de santé publique | |||
| 4.1.3.2. Des messages de santé publique cohérents concernant les lignes directrices et les recommandations en matière de prélèvement d’échantillons et de dépistage pour les groupes à risque identifiés | |||
| 4.1.3.3. L’alignement des définitions de cas de MI utilisées à plusieurs niveaux juridictionnels, y compris les définitions de cas internationaux lorsque cela est possible | |||
| 4.1.3.4. Le consensus sur les critères d’inclusion et d’exclusion des cas confirmés en laboratoire | |||
| 4.1.3.5. La classification, le comptage et le rapport précis et cohérents des cas, conformément aux exigences de surveillance des autorités provinciales et territoriales, nationales et internationales | |||
| 4.1.3.6. La mise à jour de contenus accessible au public sur le Web afin de soutenir les efforts coordonnés des laboratoires et la prise de décision en matière de santé publique fondée sur des données probantes | |||
| 4.1.4. L’examen et la révision des processus de communication externe et d’établissement de rapports pour traiter : | |||
| 4.1.4.1. Les défis ayant un impact sur la rapidité du rapport externe des cas de MI et des résultats des tests pour informer la prise de décision clinique et l’action de santé publique | |||
| 4.1.4.2. Les incohérences et les différences entre juridictions dans les algorithmes de test, l’interprétation des résultats, la confirmation des cas et les processus de surveillance | |||
| 4.1.4.3. Les modifications nécessaires pour analyser les algorithmes de rapport et les méthodes de partage des informations | |||
| 4.1.4.4. Les problèmes de partage et de rapprochement des données ayant une incidence sur la rapidité des rapports de cas confirmés | |||
| 4.1.5. Les structures et mécanismes de communication et de rapports internes spécifiques ciblés sont nécessaires pour soutenir un partage d’informations et des messages de santé publique cohérents et efficaces, notamment : | |||
| 4.1.5.1. L’identification d’un expert principal en la matière responsable de la supervision scientifique des efforts d’intervention des laboratoires spécifiques à la MI (par exemple, activités de déploiement sur le terrain, participation à des recherches ciblées et à des études de surveillance) | |||
| 4.1.5.2. Un point de contact à « guichet unique » chargé de coordonner la réception et la diffusion d’informations spécifiques ciblées au sein de l’organisation (par exemple, le soutien du centre des opérations d'urgence) | |||
| 4.1.5.3. Des mécanismes d’acheminement appropriés pour les demandes externes reçues au sein de l’organisation (par exemple, les demandes d’information des parties prenantes de la santé publique, le soutien face aux éclosions, les communications liées aux médias, etc.) | |||
| 5. RECHERCHE ET ÉTHIQUE | |||
| 5.1. Exigences en matière de recherche et considérations éthiques : Pour faire progresser la recherche scientifique à l’appui de l’action de santé publique, examiner les questions suivantes liées aux laboratoires, en collaboration avec les partenaires de santé publique : | |||
| 5.1.1. Les exigences et les priorités de la recherche appliquée et fondamentale spécifiques à la MI, par exemple : | |||
| 5.1.1.1. Les études d’identification et de caractérisation des agents pathogènes (phénotypique, génomique, protéomique) | |||
| 5.1.1.2. La mise au point de méthodes de diagnostic et de tests de confirmation de référence | |||
| 5.1.1.3. La participation à l’évaluation et validation rapide des fournitures, méthodes et plateformes de tests critiques, par exemple par le biais de collaborations entre la santé publique et l’industrie privée | |||
| 5.1.1.4. La recherche sur la MI liée à l’immunité, y compris la réponse immunitaire de l’hôte (nature et durée) et les études de séroprévalence au niveau de la population | |||
| 5.1.1.5. Les études de transmission visant à identifier et à caractériser les principales voies d’infection, en tenant particulièrement compte des groupes et des populations à risque | |||
| 5.1.1.6. L’élaboration de modèles de risque utilisant les meilleures preuves disponibles, y compris des modèles prédictifs pour informer la prise de décision en matière de santé publique | |||
| 5.1.1.7. Les études de terrain, les études sur les compétences des vecteurs | |||
| 5.1.1.8. La mise au point et l’évaluation de vaccins et d’autres contre-mesures médicales | |||
| 5.1.1.9. La recherche appliquée en matière de biosécurité, avec un accent sur l’application des connaissances en temps utile | |||
| 5.1.1.10. Les études de surveillance de la santé publique nécessitant une approbation éthique de la recherche | |||
| 5.1.2. La distinction claire entre les projets de recherche appliquée en santé publique, qui devront être approuvés au préalable sur le plan éthique, et les activités courantes de recherche, de caractérisation et de surveillance des agents pathogènes en laboratoire, qui font partie intégrante de l’action de santé publique menée en temps utile | |||
| 5.1.3. La priorisation des activités de test associées à la recherche dans le contexte des capacités et des ressources de laboratoire disponibles pour soutenir une intervention plus large en matière de santé publique (par exemple : participation aux groupes de travail, aux réseaux et à d’autres initiatives de recherche multidisciplinaire relatives à la maladie infectieuse émergente) | |||
| 5.1.4. Les exigences en matière d’éthique, de sécurité et d’environnement applicables aux études sur l’agent de la MI à l’aide des méthodes et du ou des plans d’étude proposés | |||
| 5.1.5. Les exigences relatives au consentement du patient pouvant avoir une incidence sur les tests de laboratoire à des fins de recherche en santé publique | |||
| 5.1.6. Les mécanismes disponibles pour répondre aux préoccupations liées au consentement (par exemple, élaboration ou mise à jour des formulaires de consentement des patients et de demande de tests) | |||
| 5.1.7. Les exigences en matière d’approvisionnement et de disponibilité des modèles animaux et des vecteurs pertinents | |||
| 5.1.8. Les exigences d’approbation du comité d’éthique de la recherche (CER) (sur les hommes et les animaux), y compris la coordination des processus d’approbation de plusieurs CER pour soutenir la collaboration entre les juridictions | |||
| 5.1.9. Les considérations relatives aux droits d’auteurs et à la propriété intellectuelle associées à la collaboration et à la publication interjuridictionnelles | |||
| 5.1.10. Les exigences relatives à l’analyse et à la publication en temps utile des résultats de recherche afin d’éclairer la prise de décision en matière de santé publique | |||
| 5.1.11. La révision et la réévaluation permanentes des priorités de recherche (appliquée et fondamentale) sur la maladie infectieuse dans le contexte des preuves scientifiques actuelles et de l’évolution des besoins d’intervention contre la maladie infectieuse | |||
| 5.1.12. L’identification des partenariats stratégiques et des possibilités de financement pour faire progresser les objectifs de recherche | |||
| 5.1.13. Le maintien du statut d’approbation des CER pour les projets de recherche en cours |
Supplément II : Liste de contrôle pour laboratoires d’intervention contre les éclosions de maladie infectieuse – recommandations d’utilisation
UTILISATION DE LA LISTE DE CONTRÔLE
La mise en œuvre d’une version électronique* du tableau de la liste de contrôle peut faciliter l’examen, l’identification et la hiérarchisation collaboratifs et en temps réel des points de la liste de contrôle afin de soutenir la mesure de suivi. Le contenu suivant comprend des suggestions de base pour aider les utilisateurs à personnaliser et à adapter la version de référence du tableau de la liste de contrôle afin de répondre aux exigences et préférences propres à l’organisation et à la juridiction.
*Remarque : Comme le tableau de la liste de contrôle a été créé à l’aide de Microsoft Excel 2010, les fonctions spécifiques au logiciel décrites ci-dessous peuvent ne pas fonctionner de la même manière avec d’autres logiciels de tableur.
CLASSIFICATION DES POINTS DE LA LISTE DE CONTRÔLE
À l’aide des trois colonnes de « classification » fournies à gauche de la colonne Élément de la liste de contrôle, les examinateurs peuvent indiquer le processus d’examen pour chaque point :
- Si une « Mesure requise »* est nécessaire, elle peut être indiquée en plaçant simplement un « x » dans la cellule correspondante; les cellules sont laissées vides si aucune mesure n’est requise pour soutenir les efforts d’intervention actuels.
- Le « Statut » de la mesure peut être indiqué pour les points actionnables de préférence, par exemple en utilisant des désignations de statut simples définies par l’utilisateur telles que : En attente (A), En cours (C), Différée (D) ou Terminée (T).
- La « Priorité » classe les points pour lesquels une mesure est requise en fonction de niveaux de priorité définis par l’utilisateur, par exemple : Urgente (U), Élevée (E), Moyenne (M), Faible (F), et sans objet (SO)
*Remarque : Lorsqu’un point nécessitant une mesure est marqué « x » (par exemple « 1.1.7.2. Conservation, entreposage et élimination des échantillons »), il est important de marquer également tous les points hiérarchiques dans la section du tableau par un « x » (par exemple les points 1, 1.1 et 1.1.7). Cela garantit que le contexte complet de la mesure qui vous intéresse est indiqué lorsque le tableau est trié/filtré à l’aide d’un tableur (par exemple Excel).
PERSONNALISATION DU TABLEAU DE LA LISTE DE CONTRÔLE
Les utilisateurs peuvent personnaliser le tableau des listes de contrôle pour étendre ses fonctionnalités ou modifier son contenu de plusieurs façons possibles :
- Ajout de nouveaux points à la liste de contrôle (lignes) pour saisir les exigences supplémentaires, propres à l’organisation ou à la juridiction qui ne sont pas reflétées dans la version de référence publiée.
- Pour insérer une nouvelle ligne (Excel) : Dans la marge de gauche, cliquez sur la ligne au-dessus de laquelle la nouvelle ligne doit être insérée. Dans l’onglet « Accueil », cliquez sur « Insérer » pour ajouter une ligne au tableau.
- Suppression de points de la liste de contrôle qui ne sont pas pertinents dans l’organisation ou la juridiction de l’utilisateur, par exemple : « Point 5.1.1.5. La mise au point et l’évaluation de vaccins et autres contre-mesures médicales »
- Pour supprimer une ligne (Excel) : Dans la marge de gauche, cliquez sur la ligne à supprimer.
Dans l’onglet « Accueil », cliquez sur « Supprimer » pour supprimer la ligne sélectionnée.
- Pour supprimer une ligne (Excel) : Dans la marge de gauche, cliquez sur la ligne à supprimer.
- Ajout au tableau de la liste de contrôle de nouveaux champs de données* (colonnes) afin de saisir des informations supplémentaires pertinentes pour l’examen des points de la liste de contrôle et des mesures de suivi. Parmi les champs de données supplémentaires qui peuvent être utiles, citons par exemple :
« Commentaires » – pour saisir des informations détaillées concernant les mesures spécifiques requises afin de traiter les points pertinents
« Assigné » – pour indiquer le programme individuel/de laboratoire responsable de la mesure de suivi au sein d’une organisation
« Date d’achèvement » – pour enregistrer la date d’achèvement des points de la liste de contrôle pouvant faire l’objet d’une mesure- Pour ajouter une nouvelle colonne au tableau (Excel), cliquez sur la colonne à droite de l’emplacement prévu de la nouvelle colonne. Dans l’onglet « Accueil », cliquez sur « Insérer » pour ajouter une colonne au tableau.
*Remarque : La version de référence du tableau de la liste de contrôle a été formatée pour permettre à la largeur totale du tableau d’être imprimée lisiblement en orientation « paysage » sur du papier de 8,5 x 11 po (Excel); si le tableau est personnalisé en ajoutant des colonnes supplémentaires, une reconfiguration des paramètres d’impression actuels peut être nécessaire pour garantir que toutes les données du tableau sont facilement visualisées.
PRIORISATION DES POINTS
Une fois que tous les points de la liste de contrôle ont été examinés et classés, le tableau de la liste de contrôle peut être facilement « trié » à l’aide d’un logiciel de tableur pour afficher uniquement les points d’intérêt spécifiques, par exemple : uniquement les points pour lesquels il y a une « mesure requise ».
Dans Excel, l’utilisateur peut « trier » le tableau de la liste de contrôle selon la classification des points définie par l’utilisateur, comme suit :
- Cliquez sur le bouton « flèche vers le bas » affiché en bas à droite de l’en-tête de n’importe quelle colonne, par exemple : « Mesure requise », « Statut de la mesure ».
- Dans le menu contextuel, cochez chaque case correspondant à une catégorie de classification à afficher; plusieurs catégories peuvent être affichées simultanément, par exemple :
- Sous l’en-tête « Mesure requise » en utilisant les options de « tri » suivantes :
- (Sélectionner tout)
- x (Vides);
- si vous cochez « x »,
- Sous l’en-tête « Priorité » en utilisant les options de « tri » suivantes :
- (Tout sélectionner)
- U
- E
- M
- B
- SO
- (Vides);
- Remarque : Si vous cochez la case « Tout sélectionner », le filtre de « tri » sera supprimé de la colonne sélectionnée et toutes les données du tableau seront affichées.
- Sous l’en-tête « Mesure requise » en utilisant les options de « tri » suivantes :
Une fois trié/filtré, le tableau condensé de la liste de contrôle n’affiche que les points d’intérêt, ce qui permet de mieux cibler la discussion sur la planification, la priorisation et l’attribution des points pour lesquels des mesures sont requises afin de soutenir les efforts d’intervention. Il est recommandé aux utilisateurs d’expérimenter différentes vues du tableau pour optimiser sa fonctionnalité afin de satisfaire leurs besoins spécifiques.
Supplément III : Liste de contrôle pour laboratoires d’intervention contre les éclosions de maladie infectieuse
1. Études en laboratoire
1.1. Prélèvement et transport des échantillons : Pour soutenir et coordonner des études menées en temps utile par les laboratoires, identifier et documenter à l’avance les besoins en matière de prélèvement et de transport des échantillons, notamment :
- 1.1.1. Les types, volumes et quantités d’échantillons appropriés; à réévaluer si nécessaire
- 1.1.2. Le ou les contenants d’échantillons appropriés pour le transport selon la classification du groupe de risque
- 1.1.3. Les instructions détaillées sur l’emballage et l’étiquetage des contenants d’échantillons
- 1.1.4. Les exigences en matière de gestion de la chaîne du froid, c’est-à-dire la température et les délais d’expédition et d’arrivée
- 1.1.5. Les exigences en matière de documentation du transport de matières dangereuses
- 1.1.6. Les recommandations sur les services de courrier préférés en fonction de la classification des risques liés aux agents pathogènes
- 1.1.7. Les considérations géographiques ayant un impact sur le transport des échantillons et des équipements et fournitures de test essentiels pour les populations isolées et éloignées
- 1.1.8. Les directives, protocoles, équipements et fournitures en matière de biosécurité, de sûreté biologique et de lutte contre les infections, nécessaires à la manipulation et au traitement des échantillons dans le cadre des interventions cliniques, de laboratoire et de terrain, notamment :
- 1.1.8.1. Les équipements de protection individuelle (EPI) et matériels de prélèvement et de transport des échantillons (par exemple, écouvillons, milieu de transport viral)
- 1.1.8.2. Les mesures de confinement (par exemple, armoires de sécurité biologique) et méthodes de décontamination
- 1.1.8.3. Les exigences en matière de conservation, de stockage et d’élimination des échantillons
- 1.1.9. Les exigences et considérations supplémentaires en matière de documentation dans les cadres législatifs et réglementaires existants, notamment :
- 1.1.9.1. Les permis d’importation et d’exportation
- 1.1.9.2 Les accords de transfert de matériel entre le client et les entités de laboratoire (par exemple, pour soutenir la distribution des réactifs, les contrôles, les groupes de validation/expertise)
- 1.1.9.3. L’alignement des exigences en matière de prélèvement des échantillons sur les accords de partage de données existants
- 1.1.9.4. Les exigences en matière de lignes directrices, d’autorisation et de certification des laboratoires concernant l’étude d’un agent infectieux nouveau/émergent (par exemple, exigences de la formulaire de demande d’analyse, de SC, de LAPHT, et des RAPHT)
- 1.1.9.5. Les plans et protocoles d’intervention d’urgence en matière de transport (par exemple, le plan d'intervention d'urgence pour les agents pathogènes du groupe de risque 4, et la mobilisation des coordinateurs régionaux d’intervention)
- 1.1.10. La rédaction d’un diagramme de flux d’échantillons pour guider les exigences des prélèvements et du transport
1.2. Tests en laboratoire : Pour soutenir les efforts d’étude des laboratoires, examiner, développer, documenter et communiquer des recommandations et des protocoles de dépistage de maladie infectieuse (MI) fondés sur des données probantes, en collaboration avec les partenaires de la santé publique, en tenant compte des éléments suivants :
- 1.2.1. Le ou les algorithmes de diagnostic à utiliser pour la confirmation en laboratoire des études de cas, pour informer et/ou s’aligner sur la définition actuelle des cas de MI (qui peut être spécifique à une éclosion)
- 1.2.2. Les critères d’essai et protocoles de triage pour les essais à grand volume, en utilisant les connaissances disponibles sur les antécédents d’exposition (par exemple, contact étroit, antécédents de voyage) et d’autres informations sur les facteurs de risque (par exemple, grossesse, statut d’hospitalisation)
- 1.2.3. Les exigences relatives aux champs de données du formulaire de demande d‘analyse, conformément à la définition de cas de MI, afin de permettre une gestion de cas et une intervention de santé publique rapides et efficaces
- 1.2.4. Les critères d’acceptation et de rejet des échantillons
- 1.2.5. Les protocoles de conservation et d'entreposage des échantillons (à des fins de diagnostic, de surveillance et de recherche)
- 1.2.6. Le contrôle de la qualité et la normalisation des méthodes de test en laboratoire et des processus de rapport dans le cadre d’un système de gestion de la qualité, notamment :
- 1.2.6.1. La validation, vérification et comparaison des spécifications de performance des tests de laboratoire de diagnostic; y compris la sensibilité, la spécificité, l’exactitude et la précision
- 1.2.6.2. La mise en œuvre et l’utilisation des procédures opératoires normalisées
- 1.2.6.3. Le suivi et l’évaluation des délais d’exécution des tests de laboratoire à la réception des échantillons
- 1.2.7. Les exigences en matière de communication des résultats des tests, notamment :
- 1.2.7.1. L’utilisation de processus de communication, de formulaires de rapport et de terminologie normalisés pour les résultats de test
- 1.2.7.2. La nécessité éventuelle de communiquer les résultats « préliminaires » avant la publication d’un rapport final
- 1.2.7.3. La capacité à soutenir la communication des résultats pour les échantillons soumis par rapport aux études de cas
- 1.2.8. L’alignement et la normalisation des méthodes de test et des critères d’interprétation dans les sites/juridictions de test décentralisés afin de soutenir des efforts de surveillance et de rapport des cas précis et cohérents
- 1.2.9. L’examen et la mise à jour de processus et protocoles liés aux tests pour soutenir les exigences en constant évolution d’intervention contre les éclosions, conformément aux preuves scientifiques actuelles
- EXAMEN TERMINÉ – ÉTUDES EN LABORATOIRE
2. Capacité d’intervention des laboratoires et formation
2.1. Capacité d’intervention des laboratoires : Pour relever les défis d’intervention des laboratoires spécifiques à la menace de la MI, il convient d’évaluer en permanence les points suivants en collaboration avec les laboratoires de santé publique partenaires :
- 2.1.1. Les capacités des laboratoire d’identification et de caractérisation des agents pathogènes, y compris le dépistage de première ligne et les méthodes de test de confirmation à tous les niveaux de juridiction (c’est-à-dire à l’hôpital, au niveau régional, provincial, territorial, étatique, national et international)
- 2.1.2. La disponibilité de méthodes de test diagnostique validées (par exemple, sérologique, moléculaire, de sous-typage, génomique, protéomique), y compris les trousses disponibles sur le marché et les tests développés en laboratoire
- 2.1.3 Les caractéristiques de performance des méthodes de test diagnostique actuellement utilisées, y compris la sensibilité, la spécificité, les délais d’exécution et la capacité en test des plateformes actuelles
- 2.1.4. L’obligation de développer et de valider les tests développés en laboratoire lorsque les capacités externes n’existent pas ou ne sont pas accessibles de manière fiable pendant une éclosion
- 2.1.5. Les capacités de tests diagnostiques décentralisées et le potentiel de transfert de technologies pour améliorer la capacité d’intervention des laboratoires nationaux, en fonction de l’ampleur et de la durée de l’intervention
- 2.1.6. L’accès au dépistage par les populations à risque et mal desservies, y compris la nécessité de poursuivre d’autres stratégies de dépistage pour soutenir les populations géographiquement éloignées et/ou isolées (par exemple, utilisation de méthodes de dépistage au point de service, modèles d’engagement communautaire renforcé)
- 2.1.7. La disponibilité permanente d’équipements, de fournitures, de réactifs et de contrôles essentiels à l’intervention par l’intermédiaire de fournisseurs et de chaînes d’approvisionnement établis
- 2.1.8. La disponibilité des fournitures de laboratoire essentielles via les stocks d’urgence locaux, régionaux et nationaux (par exemple, EPI, écouvillons, réactifs)
- 2.1.9. L’obligation de coordonner l’approvisionnement en fournitures de laboratoire par l’intermédiaire de plusieurs fournisseurs, en mettant l’accent sur les fournitures produites au niveau national (par exemple, dispositifs et récipients de prélèvement d’échantillons, articles consommables, produits chimiques/réactifs)
- 2.1.10. La capacité à soutenir les activités de validation clinique en cours, selon les besoins, pour vérifier la qualité de toutes les fournitures de laboratoire, en particulier lorsqu’il s’agit de traiter avec des fournisseurs multiples et/ou de changer fréquemment de fournisseurs en raison de problèmes de continuité de la chaîne d’approvisionnement
- 2.1.11. La capacité à acquérir des échantillons auprès de la communauté internationale afin de soutenir la mise au point d’outils de diagnostic pour détecter les nouveaux agents pathogènes émergeant dans un contexte international
2.2 Capacité de pointe et formation : Pour permettre aux laboratoires de réagir de manière souple, évolutive et rapide aux menaces liées aux MI, il convient d’évaluer de manière dynamique les besoins liés aux considérations suivantes en matière de capacité de pointe :
- 2.2.1. L’expertise scientifique et la capacité de réaction technique du personnel actuel relatives aux MI
- 2.2.2. La disponibilité d’espace de laboratoire, d’installations de bioconfinement, d’équipements de test et de consommables (par exemple, des armoires de sécurité biologique, des autoclaves, des postes de travail dédiés à la RCP, des plateformes de tests, des réactifs, des trousses d’extraction, des EPI, des écouvillons, MTP)
- 2.2.3. Identification des postes de « capacité de pointe » disponibles qui peuvent être mobilisés en interne et/ou faire l’objet d’une formation polyvalente afin d’atténuer les problèmes de charge de travail dans les diverses fonctions d’intervention des laboratoires (par exemple, par le biais de processus d’inventaire du personnel et de mobilisation d’urgence axés sur l’intervention et à l’échelle de l’organisation)
- 2.2.4. Les besoins et priorités en matière de formation croisée (par exemple, les compétences de base, les compétences en matière de tests, les compétences en matière de saisie et gestion es données pour soutenir les rapports dans les cas de grand volume de données)
- 2.2.5. Les approches normalisées pour la formation et la documentation des compétences du personnel (par exemple, les méthodes de test, la collecte, l’analyse et l’interprétation des données)
- 2.2.6. L’engagement du soutien d’un centre d’opérations d’urgence spécialisé pour renforcer la capacité d’intervention au sein d’un système de commandement des incidents
- 2.2.7. L’identification des contraintes de financement et des possibilités d’accès aux mécanismes de financement d’urgence
- 2.2.8. Les approches alternatives à l’organisation du travail en équipe pour augmenter les heures-personnes disponibles pendant les périodes d’intervention accrue
- 2.2.9. Étudier les options de dotation stratégique à court et à long terme de postes aux compétences recherchées (soutien scientifique, technique et programmatique) afin de remédier à l’insuffisance des capacités due à l’augmentation de la charge de travail, aux modalités de travail alternatives et aux exigences anticipées relatives aux malades et à l’autoisolement dus à la maladie infectieuse émergente
- 2.2.10. La capacité de laboratoire mobile pour répondre aux exigences d’intervention sur le terrain en cas d’éclosion de MI, tant au niveau national qu’international
- 2.2.11. L’évaluation de la capacité en tests des laboratoires, y compris l’identification de tout goulet d’étranglement
- 2.2.12. Les technologies disponibles susceptibles de faciliter le développement des capacités de pointe, notamment :
- 2.2.12.1. Les plateformes de tests alternatives pour augmenter la capacité en tests
- 2.2.12.2. Les vidéos de formation, par exemple pour démontrer les exigences en matière de prélèvement des échantillons
- 2.2.12.3. Les outils et plateformes d’échange d’informations et de partage de données sur le Web
- 2.2.13. La planification de l’atténuation des risques pour traiter les vulnérabilités opérationnelles observées pendant toutes les phases d’intervention des laboratoires
- 2.2.14. La participation à des exercices d’évaluation de la préparation (y compris des simulations conjointes) avec des partenaires de santé publique interdisciplinaires et interjuridictionnels participant à une intervention coordonnée contre les maladies infectieuses (par exemple, épidémiologistes, médecins, chercheurs sur le terrain), généralement pendant les périodes entre les éclosions
- EXAMEN TERMINÉ – Capacité d’intervention des laboratoires et formation
3. Surveillance et gestion des données des laboratoires
3.1. Surveillance et gestion des données des laboratoires : Pour soutenir des activités de surveillance intégrée en temps utile des MI en laboratoire, les principales considérations sont les suivantes :
- 3.1.1. Évaluer le statut de surveillance actuel des MI à tous les niveaux juridictionnels, y compris l’existence ou la nécessité de :
- 3.1.1.1. Une définition de cas établie pour faciliter l’étude et la confirmation des cas à l’aide de critères de laboratoire et épidémiologiques dans le contexte de l’éclosion actuelle
- 3.1.1.2. L’harmonisation des critères de confirmation des cas entre les juridictions faisant rapports afin d’assurer la cohérence nationale du nombre de cas, des rapports, de la surveillance et des efforts d’intervention
- 3.1.1.3. Les procédures de signalement et de notification des cas suspects et/ou confirmés à chaque niveau juridictionnel (infranational, national, international (par exemple, obligations de signalement de RSI))
- 3.1.1.4. Un personnel de liaison dédié, basé sur les sites de laboratoire, pour soutenir la communication en temps réel des renseignements et des données de surveillance générés par les laboratoires, afin d’informer les activités d’intervention en matière de santé publique (par exemple, le rapport quotidien des cas confirmés par les laboratoires nationaux par juridiction; le pourcentage de tests positifs pour les populations d’intérêt; la modifications des algorithmes de tests de laboratoire et des critères d’acceptation des échantillons)
- 3.1.1.5. Des systèmes ou plateformes de surveillance capables de prendre en charge la détection de MI en temps utile, la génération de rapports, la surveillance des éclosions et l’élaboration de modèles de risque dans le contexte de l’intervention actuel
- 3.1.1.6. La soutien de gestion de l’information et technologies de l’information pour les pipelines de transfert de données et les outils bioinformatiques nécessaires afin d’acquérir et d’analyser les données génomiques (par exemple, le séquençage du génome entier) et autres données « omiques »
- 3.1.2. Identifier les considérations de surveillance en laboratoire liées à la détection, la confirmation, la caractérisation, le suivi et le rapport des cas de MI et de l’éclosion notamment :
- 3.1.2.1. La connaissance actuelle de l’épidémiologie, de l’histoire naturelle et de l’écologie de la MI afin d’éclairer les stratégies de tests de laboratoire et les recommandations de triage
- 3.1.2.2. Le suivi et la classification des études de laboratoire conformément aux critères de définition des cas établis (par exemple, cas suspect faisant l’objet d’une étude, cas probable positif, cas confirmé par le laboratoire, n’est pas un cas/éliminé)
- 3.1.2.3. Les éléments clés des données de laboratoire et épidémiologiques nécessaires pour éclairer les processus d’étude en laboratoire, y compris le triage des échantillons, la sélection des algorithmes de diagnostic, l’interprétation des résultats, le rapprochement des données et les efforts de classification et de confirmation des cas (par exemple, les identificateurs de cas uniques, l’historique des tests, la date d’apparition des symptômes, les antécédents de voyage, les autres facteurs de risque, etc.)
- 3.1.2.4. Les exigences en matière de rapprochement et d’intégration des données pour permettre une surveillance et une intervention rapides, par exemple :
- le lien entre les échantillons et les résultats des tests associés et le cas en cours d’étude
- le rapprochement des données de laboratoire et des données épidémiologiques sur les cas détenues par des juridictions de santé publique distinctes
- le lien entre les cas confirmés et une éclosion donnée, ou la source de l’éclosion
- 3.1.2.5. Le processus d’examen, de vérification, de surveillance et de rapport des cas confirmés en laboratoire
- 3.1.2.6. Les approches d’épidémiologie moléculaire/génomique de la santé publique pour soutenir la surveillance des souches de la MI, la caractérisation des éclosions et l’attribution de la source
- 3.1.2.7. La faisabilité de l’utilisation d’outils en ligne et de plateformes informatiques de santé publique pour favoriser le partage d’informations sûres et rapides et le rapprochement de données d’études de cas provenant de sources de santé publique disparates
- 3.1.2.8. La conception et l’élaboration de rapports de surveillance pour soutenir les efforts continus des laboratoires de surveillance, d’évaluation et de rapport des informations sur les éclosions de MI, par exemple :
- Le suivi du statut des processus d’étude en laboratoire (en temps réel)
- Le nombre de cas confirmés en laboratoire (par exemple, totaux cumulés, nouveaux cas/unité de temps)
- La classification finale des études en laboratoire dans les populations cibles (par exemple, pourcentage de tests positifs par rapport au nombre total de tests effectués, pourcentage de tests confirmés en laboratoire)
- La distribution des cas confirmés en laboratoire à l’aide des données disponibles (c’est-à-dire par âge, sexe, géographie, historique d’exposition, autres catégories de risques (par exemple, travailleurs de la santé, race/ethnicité))
- L’épidémiologie moléculaire de l’éclosion (par exemple, les liens entre les cas, l’attribution de la source)
- L’estimation d’indicateurs basés sur les laboratoires pour contrôler et évaluer les performances de surveillance (par exemple, rapidité, taux d’études de MI en laboratoire, qualité et exhaustivité des données)
- 3.1.2.9. Le contexte législatif et les accords relatifs au partage interjuridictionnel d’informations et de données pour soutenir les activités d’étude de la MI en laboratoire (par exemple, EMER, RSI)
- 3.1.3. Aligner les champs de données du formulaire de demande d‘analyse des laboratoires sur la définition de cas de MI afin de favoriser une surveillance et une intervention efficaces, en tenant compte des types de champs de données clés suivants :
- 3.1.3.1. La présentation des coordonnées des laboratoires/clients pour étayer les rapports sur les résultats et d’autres communications afin d’éclairer la prise de décision clinique
- 3.1.3.2. Des identificateurs uniques permettant d’établir un rapprochement non nominatif et interjuridictionnel entre les résultats de laboratoire et le cas étudié, afin de faciliter la classification, les rapports, la prise de décision clinique, la surveillance et la réponse relatifs aux cas
- 3.1.3.3. Les informations de géolocalisation pour le cas étudié, si elles sont pertinentes sur le plan juridictionnel (par exemple, ville, région de santé rapportant le cas, province, territoire, état, pays, code postal, région de tri d’acheminement (c’est-à-dire code postal à trois chiffres))
- 3.1.3.4. Les champs cliniques, épidémiologiques et de laboratoire nécessaires pour soutenir le triage des échantillons hautement prioritaires, la sélection d’algorithmes de test appropriés et l’interprétation des résultats, ainsi que la confirmation des cas, la surveillance ciblée et les rapports (par exemple, historique des tests, historique des voyages, expositions, historique des vaccinations, grossesse, statut d’hospitalisation, symptomatique ou asymptomatique, autres informations améliorées sur les groupes à risque)
- 3.1.3.5. Les champs de date nécessaires pour faciliter la sélection des algorithmes de diagnostic, l’interprétation des résultats des tests et l’estimation des indicateurs de surveillance en laboratoire (c’est-à-dire l’apparition des symptômes, le prélèvement des échantillons, la réception des échantillons, les résultats des tests et les dates de signalement des cas)
- 3.1.4. Évaluer les besoins en matière de flux de données du système de gestion de l’information des laboratoires (SGIL) et mettre en œuvre les processus du SGIL pour soutenir les études, la surveillance et les interventions relatives à la MI, notamment :
- 3.1.4.1. Les approches normalisées de la documentation et du suivi des processus de demande de test, de suivi des échantillons, de saisie/d’examen des données, de rapprochement des données et de rapports des résultats
- 3.1.4.2. La normalisation de la terminologie, la cartographie des flux de données et la définition des exigences en matière de conservation et de cycle de vie des données
- 3.1.4.3. Les exigences en matière de documentation de la « chaîne de traçabilité » pour les études de laboratoire de haut niveau et les rapports sur les résultats (par exemple, la microbiologie médico-légale)
- 3.1.4.4. La création de requêtes personnalisées pour soutenir la surveillance et l’intervention en cours
- 3.1.4.5. La génération de rapports de synthèse pour faciliter le suivi, l’évaluation et la notification des activités de surveillance de la MI par les laboratoires et de réponse aux épidémies
- 3.1.4.6. L’utilisation d’outils et de plateformes sur le Web pour soutenir les demandes de tests et la communication des résultats, ainsi que le rapprochement interjuridictionnelle en temps utile des données des études
- 3.1.5. Évaluer et traiter de manière dynamique les vulnérabilités opérationnelles qui ont une incidence sur l’ensemble des efforts d’intervention et de communication des résultats, notamment :
- 3.1.5.1. La communication externe et les défis en matière de rapports interjuridictionnels
- 3.1.5.2. Les différences entre les juridictions en ce qui concerne les algorithmes de test en laboratoire et l’interprétation des résultats
- 3.1.5.3. Les modifications des définitions de cas confirmés entre juridictions qui peuvent avoir un impact sur la surveillance
- 3.1.5.4. Les problèmes de rapprochement des données ayant une incidence sur l’exactitude et la rapidité du comptage et des rapports des cas
- 3.1.5.5. Les défis liés à la collecte de données améliorées sur les « groupes à risque » pour permettre des études de laboratoire en temps utile, ainsi que l’analyse épidémiologique des effets de la MI sur les populations à risque
- EXAMEN TERMINÉ – CAPACITÉ D’INTERVENTION ET FORMATION DES LABORATOIRES
4. Engagement et communication interjuridictionnels
4.1. Engagement et communication interjuridictionnels : Afin de soutenir l’engagement coordonné des acteurs de la santé publique et la diffusion cohérente des informations des laboratoires, élaborer une stratégie de communication stratégique intégrant les considérations suivantes :
- 4.1.1. L’accessibilité des informations sur l’intervention actuelle des laboratoires contre la MI au public et aux professionnels de la santé publique via :
- 4.1.1.1. Le contenu en ligne et les outils de médias sociaux
- 4.1.1.2. Un numéro d’urgence 24 heures sur 24 qui permet d’accéder d’urgence aux services de soutien des laboratoires
- 4.1.1.3. Un « Guide des services du laboratoire » destiné au public, comprenant les exigences relatives aux demandes d’échantillons et de tests
- 4.1.1.4. Des recommandations et des documents d’orientation sur les tests en laboratoire qui aident les partenaires cliniques et de santé publique à prendre des décisions
- 4.1.1.5. Des processus d’alerte et de notification qui diffusent simultanément des informations sensibles au facteur temps aux décideurs de santé publique interjuridictionnels
- 4.1.2. L’engagement de partenaires de laboratoires externes, de réseaux de santé publique et de groupes de travail interjuridictionnels participant à la coordination de l’intervention de santé publique en matière d’identification, notamment :
- 4.1.2.1. Les réseaux de médecins et les comités responsables de l’élaboration de lignes directrices cliniques
- 4.1.2.2. Les laboratoires de santé publique et les partenaires en épidémiologie, ainsi que les réseaux interjuridictionnels chargés d’élaborer des définitions de cas consensuelles et de coordonner les activités de surveillance et d’intervention en matière de santé publique
- 4.1.2.3. Les réseaux de biosécurité et partenaires impliqués dans l’élaboration de lignes directrices en matière de biosécurité
- 4.1.2.4. Les décideurs politiques responsables de l’élaboration et de la mise en œuvre de politiques fondées sur des données probantes pour soutenir l’action de santé publique
- 4.1.3. Le renforcement des mécanismes de collaboration et de partage d’informations avec les partenaires et les réseaux de santé publique pour permettre :
- 4.1.3.1. L’élaboration, sur la base de données probantes, de recommandations et de lignes directrices cliniques et de laboratoire, ainsi que de stratégies de surveillance et d’intervention en matière de santé publique
- 4.1.3.2. Des messages de santé publique cohérents concernant les lignes directrices et les recommandations en matière de prélèvement d’échantillons et de dépistage pour les groupes à risque identifiés
- 4.1.3.3. L’alignement des définitions de cas de MI utilisées à plusieurs niveaux juridictionnels, y compris les définitions de cas internationaux lorsque cela est possible
- 4.1.3.4. Le consensus sur les critères d’inclusion et d’exclusion des cas confirmés en laboratoire
- 4.1.3.5. La classification, le comptage et le rapport précis et cohérents des cas, conformément aux exigences de surveillance des autorités provinciales et territoriales, nationales et internationales
- 4.1.3.6. La mise à jour de contenus accessible au public sur le Web afin de soutenir les efforts coordonnés des laboratoires et la prise de décision en matière de santé publique fondée sur des données probantes
- 4.1.4. L’examen et la révision des processus de communication externe et d’établissement de rapports pour traiter :
- 4.1.4.1. Les défis ayant un impact sur la rapidité du rapport externe des cas de MI et des résultats des tests pour informer la prise de décision clinique et l’action de santé publique
- 4.1.4.2. Les incohérences et les différences entre juridictions dans les algorithmes de test, l’interprétation des résultats, la confirmation des cas et les processus de surveillance
- 4.1.4.3. Les modifications nécessaires pour analyser les algorithmes de rapport et les méthodes de partage des informations
- 4.1.4.4. Les problèmes de partage et de rapprochement des données ayant une incidence sur la rapidité des rapports de cas confirmés
- 4.1.5. Les structures et mécanismes de communication et de rapports internes spécifiques ciblés sont nécessaires pour soutenir un partage d’informations et des messages de santé publique cohérents et efficaces, notamment :
- 4.1.5.1. L’identification d’un expert principal en la matière responsable de la supervision scientifique des efforts d’intervention des laboratoires spécifiques à la MI (par exemple, activités de déploiement sur le terrain, participation à des recherches ciblées et à des études de surveillance)
- 4.1.5.2. Un point de contact à « guichet unique » chargé de coordonner la réception et la diffusion d’informations spécifiques ciblées au sein de l’organisation (par exemple, le soutien du centre des opérations d'urgence)
- 4.1.5.3. Des mécanismes d’acheminement appropriés pour les demandes externes reçues au sein de l’organisation (par exemple, les demandes d’information des parties prenantes de la santé publique, le soutien face aux éclosions, les communications liées aux médias, etc.)
- EXAMEN TERMINÉ – ENGAGEMENT ET COMMUNICATION INTERJURIDICTIONNELS
5. Recherche et éthique
5.1. Exigences en matière de recherche et considérations éthiques : Pour faire progresser la recherche scientifique à l’appui de l’action de santé publique, examiner les questions suivantes liées aux laboratoires, en collaboration avec les partenaires de santé publique :
- 5.1.1. Les exigences et les priorités de la recherche appliquée et fondamentale spécifiques à la MI, par exemple :
- 5.1.1.1. Les études d’identification et de caractérisation des agents pathogènes (phénotypique, génomique, protéomique)
- 5.1.1.2. La mise au point de méthodes de diagnostic et de tests de confirmation de référence
- 5.1.1.3. La participation à l’évaluation et validation rapide des fournitures, méthodes et plateformes de tests critiques, par exemple par le biais de collaborations entre la santé publique et l’industrie privée
- 5.1.1.4. La recherche sur la MI liée à l’immunité, y compris la réponse immunitaire de l’hôte (nature et durée) et les études de séroprévalence au niveau de la population
- 5.1.1.5. Les études de transmission visant à identifier et à caractériser les principales voies d’infection, en tenant particulièrement compte des groupes et des populations à risque
- 5.1.1.6. L’élaboration de modèles de risque utilisant les meilleures preuves disponibles, y compris des modèles prédictifs pour informer la prise de décision en matière de santé publique
- 5.1.1.7. Les études de terrain, les études sur les compétences des vecteurs
- 5.1.1.8. La mise au point et l’évaluation de vaccins et d’autres contre-mesures médicales
- 5.1.1.9. La recherche appliquée en matière de biosécurité, avec un accent sur l’application des connaissances en temps utile
- 5.1.1.10. Les études de surveillance de la santé publique nécessitant une approbation éthique de la recherche
- 5.1.2. La distinction claire entre les projets de recherche appliquée en santé publique, qui devront être approuvés sur le plan éthique, et les activités courantes de recherche, de caractérisation et de surveillance des agents pathogènes en laboratoire, qui font partie intégrante de l’action de santé publique menée en temps utile
- 5.1.3. La priorisation des activités de test associées à la recherche dans le contexte des capacités et des ressources de laboratoire disponibles pour soutenir une intervention plus large en matière de santé publique (par exemple : participation aux groupes de travail, aux réseaux et à d’autres initiatives de recherche multidisciplinaire relatives à la maladie infectieuse émergente)
- 5.1.4. Les exigences en matière d’éthique, de sécurité et d’environnement applicables aux études sur l’agent de la MI à l’aide des méthodes et du ou des plans d’étude proposés
- 5.1.5. Les exigences relatives au consentement du patient pouvant avoir une incidence sur les tests de laboratoire à des fins de recherche en santé publique
- 5.1.6. Les mécanismes disponibles pour répondre aux préoccupations liées au consentement (par exemple, élaboration/mise à jour des formulaires de consentement des patients et de demande de tests)
- 5.1.7. Les exigences en matière d’approvisionnement et de disponibilité des modèles animaux et des vecteurs pertinents
- 5.1.8. Les exigences d’approbation du comité d’éthique de la recherche (sur les hommes et les animaux), y compris la coordination des processus d’approbation de plusieurs comités d'éthique de la recherche pour soutenir la collaboration entre les juridictions
- 5.1.9. Les considérations relatives aux droits d’auteurs et à la propriété intellectuelle associées à la collaboration et à la publication interjuridictionnelles
- 5.1.10. Les exigences relatives à l’analyse et à la publication en temps utile des résultats de recherche afin d’éclairer la prise de décision en matière de santé publique
- 5.1.11. La révision et la réévaluation permanentes des priorités de recherche (appliquée et fondamentale) sur la maladie infectieuse dans le contexte des preuves scientifiques actuelles et de l’évolution des besoins d’intervention contre la maladie infectieuse
- 5.1.12. L’identification des partenariats stratégiques et des possibilités de financement pour faire progresser les objectifs de recherche
- 5.1.13. Le maintien du statut d’approbation des comités d'éthique de la recherche pour les projets de recherche en cours
- EXAMEN TERMINÉ – RECHERCHE ET ÉTHIQUE

Cette œuvre est mise à disposition selon les termes de la Licence Creative Commons Attribution 4.0 International